Введение
Данное изобретение относится к штамму Bifidobacterium longum.
Ожирение представляет собой одну из самых серьезных проблем здоровья населения 21-го века. Во всем мире примерно 13% взрослых людей страдают ожирением и еще 39% обладают избыточным весом (ВОЗ, 2015). Ожирение является многофакторным расстройством, которое является результатом продолжительного дисбаланса между потреблением и расходом энергии и зависит от генетических и экологических факторов. Ожирение характеризуется резистентностью к инсулину и хроническим неспецифическим воспалением (Gregor and Hotamisligil, 2011, Kahn et al., 2006). Тесная взаимосвязь между иммунной системой, метаболизмом и кишечной микробиотой может играть важную роль в контролировании ожирения и метаболического гомеостаза. Ожирение увеличивает риск развития и обострения группы хронических метаболических расстройств, таких как диабет 2 типа (T2DM), неалкогольная жировая болезнь печени (NAFLD), гипертония, атеросклероз, дислипидемия и сердечнососудистые заболевания (Guh et al., 2009) с преобладанием метаболических сопутствующих заболеваний, увеличивающихся в соответствии с повышением BMI (индекс массы тела) (Gupta et al., 2015). Ожирение также увеличивает риск развития серьезных и потенциально опасных для жизни заболеваний, таких как аллергия и астма, остеоартрит, болезнь желчного пузыря и неалкогольный стеатогепатит (NASH), состояние, при котором жир накапливается в печени, и являющееся основной причиной цирроза печени.
Метаболический синдром, представляющий собой все более широко распространенное состояние, относится к комбинации ожирения, гиперлипидимии (высокое содержание триглицеридов), гипертензии (высокое кровяное давление) и нарушения толерантности к глюкозе (высокий уровень сахара в крови) и низкого уровня холестерина липопротеинов высокой плотности (HDL). Эти факторы риска помогают идентифицировать пациентов с высоким риском развития диабета 2 типа (T2D) и сердечнососудистых заболеваний.
Неалкогольная жировая болезнь печени (NAFLD) представляет собой очень распространенное заболевание и относится к группе состояний, при которых происходит накопление избыточного жира в печени людей, которые мало употребляют или вообще не употребляют алкоголь.
Более тяжелая форма NAFLD называется неалкогольным стеатогепатитом (NASH). NASH вызывает разбухание и повреждение печени. NASH имеет тенденцию развиваться у людей с избыточным весом или ожирением, или имеющим диабет, высокий уровень холестерина или высокий уровень триглицеридов.
Большое количество клинических и экспериментальных данных показывает, что повышенное выделение свободных жирных кислот из увеличенной висцеральной жировой ткани может привести к NAFLD, ассоциированному с резистентностью к инсулину. Таким образом, субъекты с ожирением, резистентностью к инсулину и дислипидемией подвергаются наибольшему риску развития NAFLD.
Поскольку наблюдение за тем, что безмикробные мыши оказались более стройными по сравнению с их традиционно выращиваемыми двойниками (Backhed et al., 2004), все чаще исследуют вклад микробиоты кишечника в развитие ожирения (Backhed et al., 2007, Cani et al., 2008b, Ridaura et al., 2013, Vrieze et al., 2012). Вклад микробиоты кишечника в ожирение является многофакторным и включает такие факторы, как измененные метаболические пути в отношении источника повышенной энергии и хранения жира (Turnbaugh et al., 2006) (Kotzampassi et al., 2014, Tumbaugh et al., 2009) и бактериальная транслокация, ведущая к хроническому неспецифическому воспалению (Cani et al., 2007, Cani et al., 2008a). Таким образом, воздействие на микробиоту кишечника пробиотиками является потенциальным терапевтическим инструментом, помогающим уменьшить ожирение и улучшить метаболическое здоровье. Штаммы Lactobacillus обычно использую в качестве пробиотиков, и имеется множество доказательств, подтверждающих полезные для здоровья эффекты, полученные in vivo штаммозависимым образом (Aronsson et al., 2010, Lee et al., 2006, Naito et al., 2011).
Механизм действия этих штаммов недостаточно хорошо охарактеризован. Одной группой молекул, представляющих интерес, являются бактериальные экзополисахариды (EPS). EPS представляют собой высокомолекулярные полимеры, которые состоят из сахарных остатков и секретируются бактериями в окружающую среду. Было показано, что бактерии, продуцирующие экзополисахариды (EPS), обладают иммуномодулирующим действием (Fanning et al., 2012, Hidalgo-Cantabrana et al., 2014, Vinderola et al., 2006, Volman et al., 2008, Jones et al., 2014). Многие молочнокислые бактерии (LAB) обладают способностью синтезировать EPS. Однако EPS являются гетерогенными молекулами и отличаются по составу, заряду и молекулярной структуре, что может объяснять наблюдаемую штамм-специфическую биологическую активность (Adams et al., 2008, Bland et al., 2004, Hidalgo-Cantabrana et al., 2012, Kankainen et al., 2009).
Хроническое неспецифическое воспаление, ассоциированное с ожирением и с метаболическими расстройствами (Gregor and Hotamisligil, 2011), является одним из факторов риска, который может являться целью воздействия при введении пробиотиков, для того чтобы благотворно повлиять на развитие ожирения. Ранее авторы данного изобретения показали, что другая молочнокислая бактерия - В. longum NCIMB41003 обладает противовоспалительным действием. Эта бактерия имеет оболочку, по существу состоящую из EPS. EPS-вещество также обладает противовоспалительным действием, как описано в WO 2010055499 А.
Изложение сущности изобретения
В изобретении предложен депонированный штамм NCIMB 41715. Штамм Bifidobacterium longum АН1362 депонирован в NCIMB (Национальные коллекции промышленных, пищевых и морских бактерий) под регистрационным номером NCIMB 41715.
Согласно одному аспекту изобретения предлагается композиция для применения в предупреждении или лечении ожирения и ассоциированного с ожирением метаболического синдрома, содержащая эффективное количество этого штамма. Штамм продуцирует полисахарид и увеличивает выделение энергии. Штамм был выделен из образца фекалий здорового взрослого добровольца, получавшего плацебо.
Выделенный штамм по изобретению можно использовать для уменьшения накопления телесного жира у субъекта. Этот штамм можно использовать для прекращения накопления веса или уменьшения веса. Этот штамм можно использовать для лечения, профилактики или облегчения состояния, вызванного чрезмерным накоплением телесного жира.
В изобретении также предложен способ предупреждения или лечения ожирения, включающий введение композиции, содержащей штамм, депонированный в NCIMB под учетным номером NCIMB 41715, субъекту, нуждающемуся в предупреждении или лечении ожирения.
В изобретении также предложен способ предупреждения или лечения ассоциированного с ожирением метаболического синдрома, включающий введение композиции, содержащей штамм, депонированный в NCIMB под учетным номером NCIMB 41715, субъекту, нуждающемуся в предупреждении или лечении ассоциированного с ожирением метаболического синдрома.
В изобретении также предложен способ предупреждения или лечения неалкогольной жировой болезни печени (NAFLD), включающий введение композиции, содержащей штамм Bifidobacterium longum АН1362, депонированный в NCIMB под учетным номером NCIMB 41715, субъекту, нуждающемуся в предупреждении или лечении неалкогольной жировой болезни печени (NAFLD).
Этот штамм может находиться в форме жизнеспособных клеток. Этот штамм может находиться в форме нежизнеспособных клеток. Пробиотические бактерии в основном применяют в форме жизнеспособных клеток. Однако применение также может распространяться на нежизнеспособные клетки, такие как убитые культуры клеток, смеси жизнеспособных и нежизнеспособных культур, или композиции, содержащие полезные факторы, экспрессируемые пробиотическими бактериями. Это может включать термически убитые микроорганизмы или микроорганизмы, убитые посредством воздействия измененного рН или посредством воздействия давления или гамма-излучения. Получение препарата нежизнеспособных клеток является более простым, клетки могут быть легко включены в лекарственные средства, и требования к их хранению являются намного менее ограниченными, чем для жизнеспособных клеток. Lactobacillus casei YIT 9018 является примером эффективного использования термически убитых клеток в качестве способ лечения и/или предупреждения роста опухоли, как описано в патенте США 4347240.
В изобретении также предложена композиция, которая содержит штамм, описанный здесь. Композиция может дополнительно содержать пробиотическое вещество. Композиция может, кроме того, содержать пребиотическое вещество. Композиция может дополнительно содержать носитель. Носителем может представлять собой принимаемый внутрь носитель, может представлять собой фармацевтически приемлемый носитель, такой как капсула, таблетка или порошок. Принимаемым внутрь носителем может быть пищевой продукт, такой как сквашенное молоко, йогурт, замороженный йогурт, сухое молоко, концентрированное молоко, плавленые сыры, соусы или напитки. Некоторые примеры включают ферментированный пищевой продукт, такой как ферментированный молочный продукт. Композиция может дополнительно содержать белки и/или пептиды, в частности белки и/или пептиды, которые богаты глутамином/глутаматом, липиды, углеводы, витамины, минералы и/или микроэлементы. Штамм Bifidobacterium может присутствовать в количестве более 106 КОЕ на грамм композиции. Композиция может дополнительно содержать адъювант. Композиция может дополнительно содержать бактериальный компонент. Композиция может дополнительно содержать лекарственное средство. Композиция может дополнительно содержать биологическое соединение. Во всех случаях композиция содержит штамм, как описанный здесь, и может включать носитель или другой агент. Такой носитель или другой агент в некоторых случаях не встречается в природе. Композицию в некоторых случаях можно использовать для протоколов иммунизации и вакцинации.
В изобретении также предложена лиофилизированная композиция, содержащая штамм по изобретению или композицию по изобретению.
В изобретении также предложен штамм или композиция, описанные здесь, для использования в пищевых продуктах.
В изобретении также предложен штамм или композиция, описанные здесь, для использования в качестве лекарственного средства.
В изобретении также предложен штамм или композиция, описанные здесь, для применения в профилактике и/или лечении ожирения и ассоциированных заболеваний.
В изобретении также предложен штамм или композиция, описанные здесь, для применения в профилактике и/или лечении неалкогольной жировой болезни печени (NAFLD).
Штаммы, описанные здесь, можно использовать в изготовлении панели биотерапевтических агентов для модификации уровней IL-10.
В изобретении также предложен штамм или композиция, описанные здесь, для применения в профилактике и/или лечении ассоциированного воспаления.
В изобретении также предложен штамм или композиция, описанные здесь, для применения в профилактике и/или лечении ассоциированного с ожирением метаболического расстройства.
Очевидно, что конкретный штамм по изобретению можно вводить животным (включая людей) в перорально принимаемой форме в обычном препарате, таком как капсулы, микрокапсулы, таблетки, гранулы, порошок, пастилки, пилюли, суппозитории, суспензии и сиропы. Подходящие композиции могут быть получены обычно используемыми способами, с применением обычных органических и неорганических добавок. Количество активного ингредиента в лекарственной композиции может находиться на уровне, который оказывает нужное терапевтическое действие.
Композиция также может включать бактериальный компонент, лекарственное средство или биологическое соединение.
Кроме того, вакцина, содержащая штаммы по изобретению, может быть получена с использованием любого подходящего известного способа и может включать фармацевтически приемлемый носитель или адъювант.
Данное изобретение также включать мутанты и варианты, происходящие от штамма по изобретению, при сохранении активности депонированного штамма. Мутанты и варианты включают штамм, генетические и/или фенотипические свойства которого изменены по сравнению с родительским штаммом. Природный вариант включает селективно выбранные спонтанные изменения целевых свойств. Целенаправленное изменение свойств родительского штамма осуществляют с помощью традиционных (in vitro) технологий генетических воздействий, таких как разрушение гена, конъюгационный перенос и т.д. Генетические модификации включают введение экзогенных и/или эндогенных последовательностей ДНК в геном штамма, например посредством вставки в геном бактериального штамма с помощью векторов, включающих плазмидную ДНК, или бактериофагов.
Естественные или индуцированные мутации включают по меньшей мере изменения одного основания, такие как делеция, вставка, трансверсия или другие модификации ДНК, которые могут приводить к изменению аминокислотной последовательности, кодируемой последовательностью ДНК.
Термины мутант, вариант и генетически модифицированный мутант также включают штамм, который подвергался генетическим изменениям, которые накапливаются в геноме со скоростью, которая соответствует естественной скорости для всех микроорганизмов, и/или генетическим изменениям, которые происходят в результате спонтанной мутации, и/или приобретения генов, и/или потери генов, которые не достигаются посредством целенаправленного (in vitro) воздействия на геном, но достигаются посредством естественной селекции вариантов и/или мутантов, которые обеспечивают селективное преимущество для поддержания выживаемости бактерий при воздействии селективного давления с помощью, например, антибиотиков. Мутант может быть создан путем преднамеренной (in vitro) вставки определенных генов в геном, которые радикально не изменяют биохимическую функциональность организма, но продукты которых можно использовать для идентификации или отбора бактерий, например по устойчивости к антибиотикам.
Специалисту в данной области понятно, что мутантные или вариантные штаммы можно идентифицировать посредством анализа гомологии последовательности ДНК с родительским штаммом. Штаммы, имеющие близкую идентичность последовательности с родительским штаммом, без очевидных фенотипических или измеряемых функциональных различий считаются мутантными или вариантными штаммами. Штамм с идентичностью последовательности (гомологией) 99,5% или более с последовательностью ДНК родительского штамма может считаться мутантом или вариантом. Гомологию последовательности можно определить, используя он-лайн алгоритм программы "BLAST", общедоступной на http://www.ncbi.nlm.nih.gov/BLAST/.
Мутанты родительского штамма также включают производные штаммы, имеющие гомологию последовательности по меньшей мере 95,5% с полинуклеотидной последовательностью 16s-23s межгенного спейсера родительского штамма. Эти мутанты могут дополнительно содержать мутации ДНК в других последовательностях ДНК в бактериальном геноме.
Краткое описание графических материалов
Изобретение будет более понятным из нижеследующего описания некоторых его воплощений, приведенных только в качестве примера со ссылкой на прилагаемые графические материалы, где:
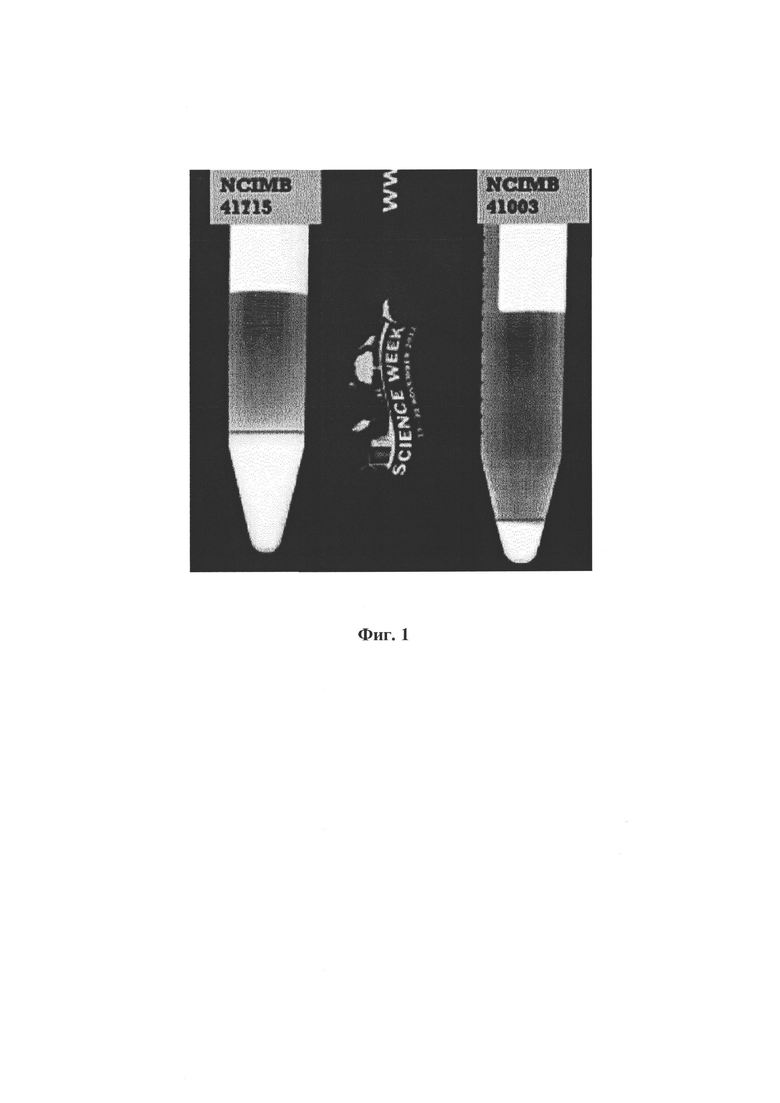
На Фиг. 1 показана объемность В. longum NCIMB 41715 и В. longum NCIMB 41003, определенная по высоте рыхлого осадка EPS после центрифугирования;
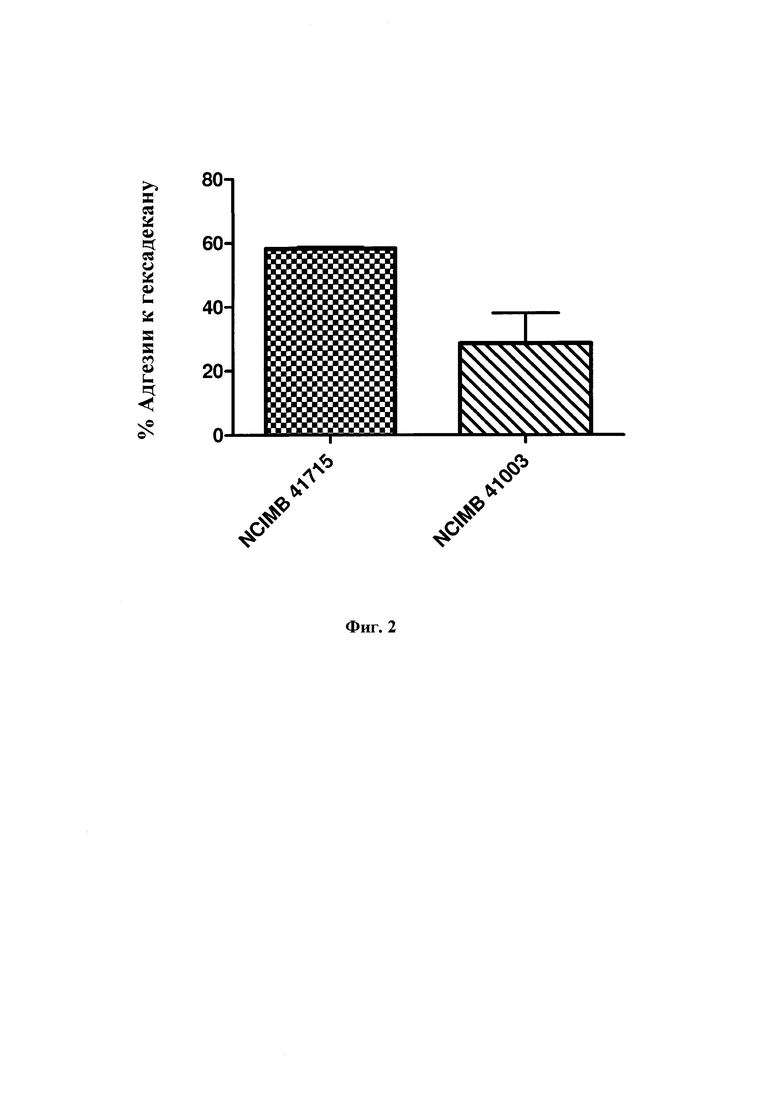
На Фиг. 2 представлена гистограмма% адгезии к гексадекану В. longum NCIMB 41715 и В. longum NCIMB 41003;
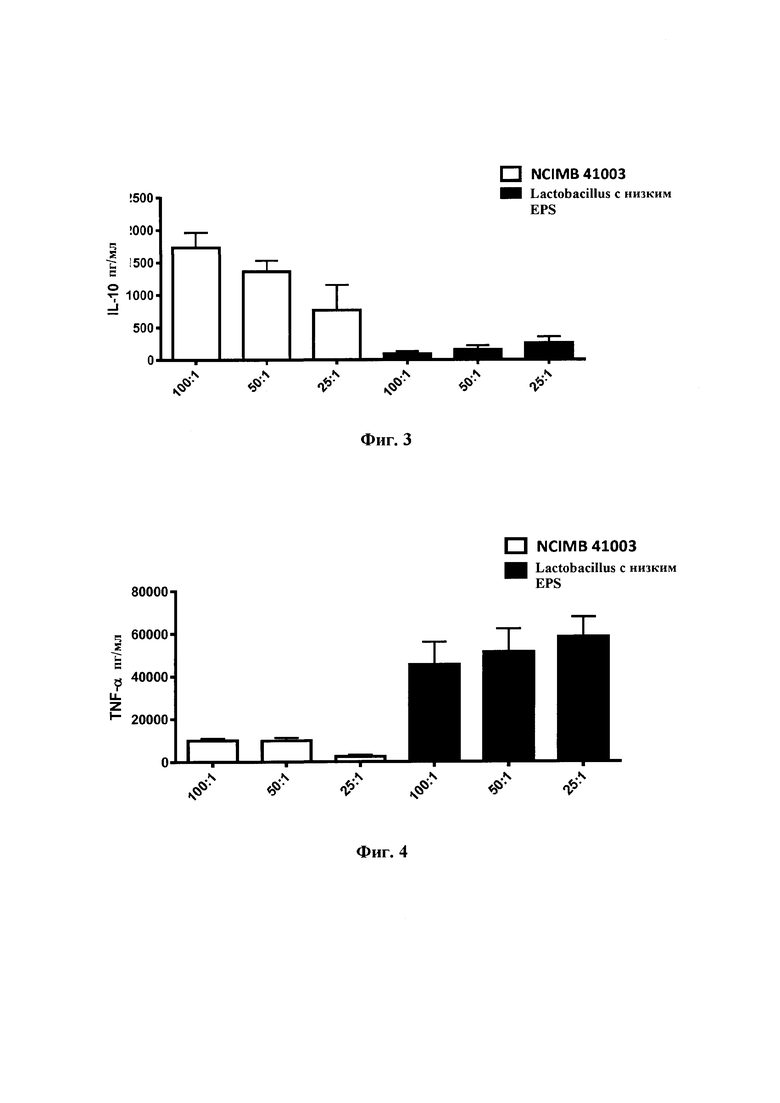
На Фиг. 3 представлена диаграмма индукции IL-10 в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с помощью EPS+ve В. longum NCIMB 41003 и штамма Lactobacillus с низким продуцированием EPS. Наблюдается повышенная индукция противовоспалительного цитокина IL-10 после стимуляции с помощью EPS+ve В. longum NCIMB 41003 по сравнению со штаммом Lactobacillus с низким EPS;
На Фиг. 4 представлена диаграмма индукции TNF-α в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с помощью В. longum NCIMB 41003 и штамма Lactobacillus с низким продуцированием EPS. Наблюдается пониженная индукция провоспалительного цитокина TNF-α после стимуляции с помощью EPS+ve В. longum NCIMB 41003 по сравнению со штаммом Lactobacillus с низким EPS;
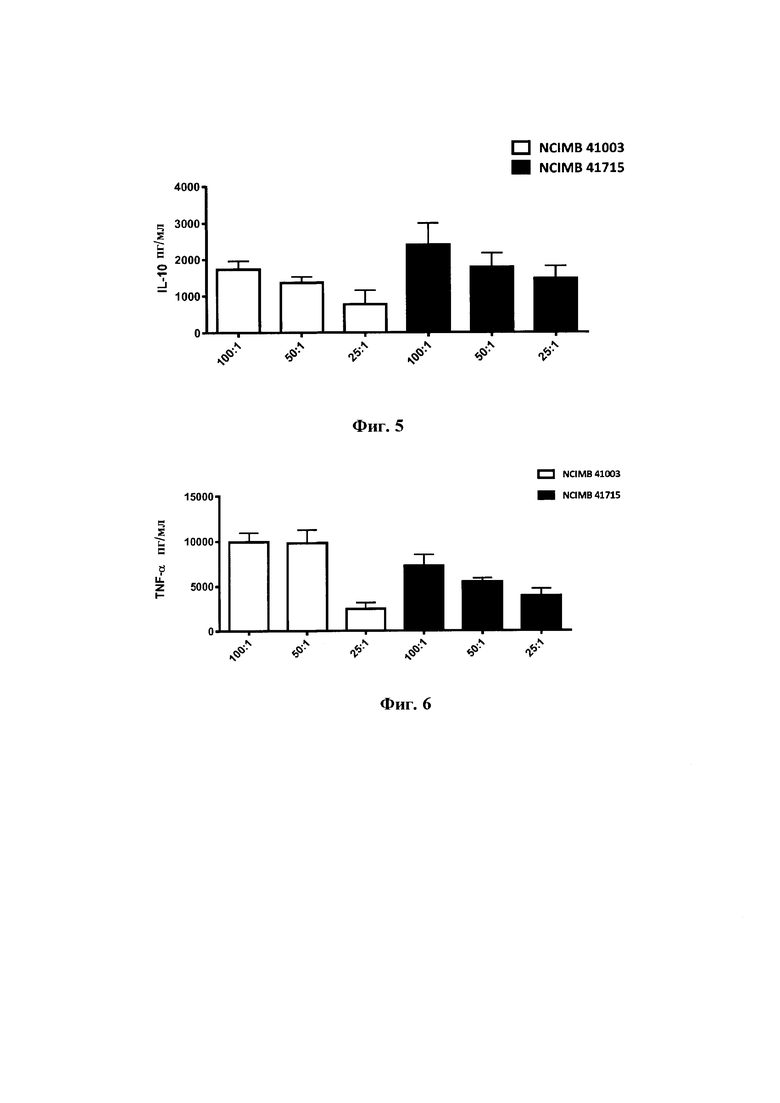
На Фиг. 5 представлена диаграмма индукции IL-10 в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с помощью В. longum NCIMB 41003 и В. longum NCIMB 41715. Оба штамма индуцируют, дозозависимым образом, близкие уровни противовоспалительного цитокина IL-10;
На Фиг. 6 представлена диаграмма индукции TNF-a в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с помощью В. longum NCIMB 41003 и В. longum NCIMB 41715. Я longum NCIMB 41715 индуцирует близкие уровни TNF-α по сравнению с В. longum NCIMB 41003;
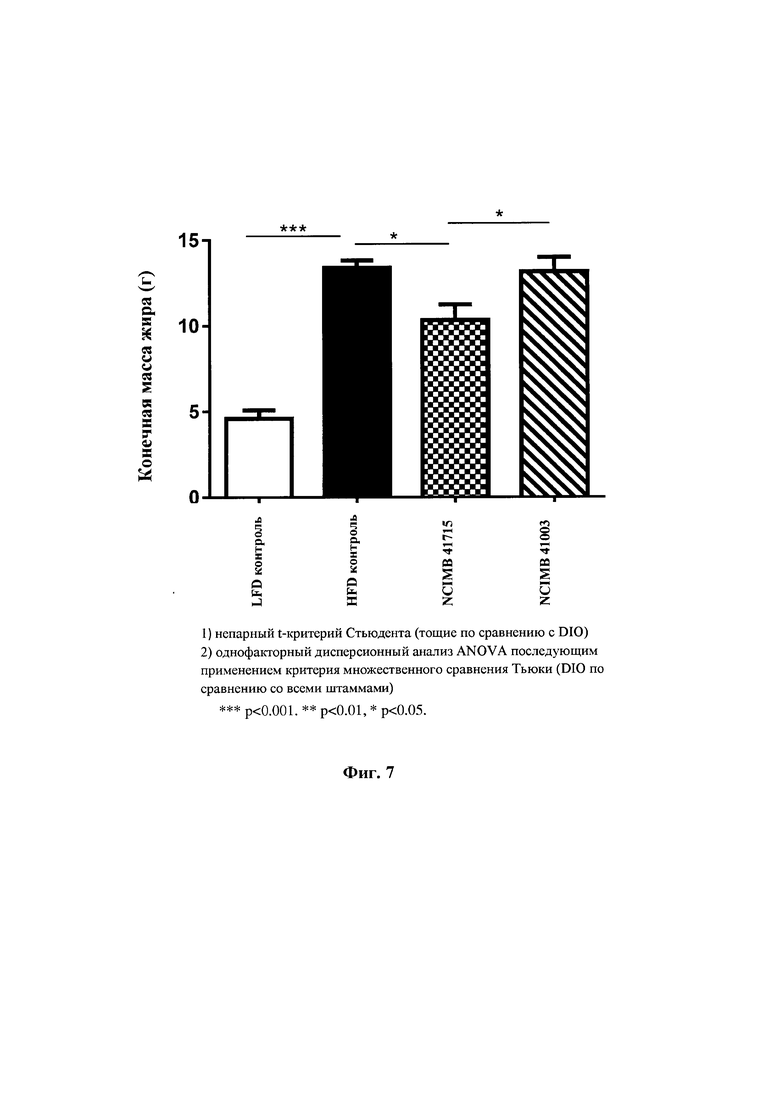
На Фиг. 7 показано, что по сравнению с контрольной группой, находящейся на диете с высоким содержанием жира (HFD), В. longum NCIMB 41715 демонстрировал значительное снижение прироста жировой массы к 16 неделе, в то время как В. longum NCIMB 41003 не оказывал значительного эффекта;
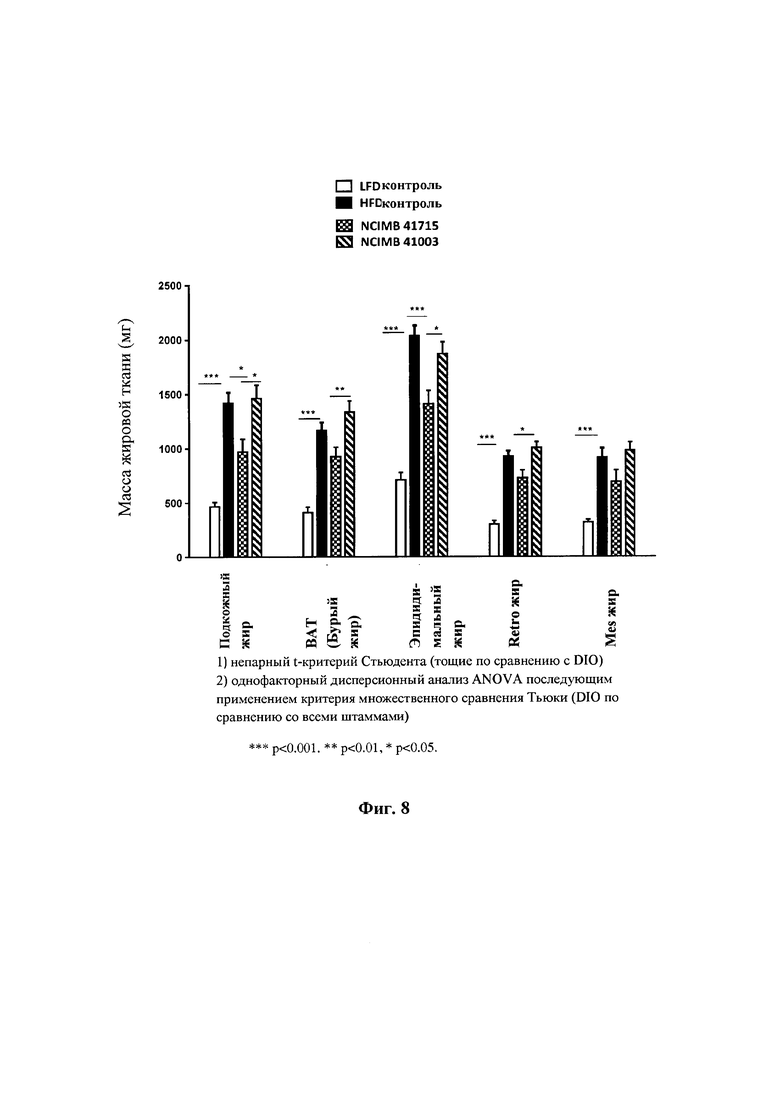
На Фиг. 8 показано влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на массу жировой ткани. В. longum NCIMB 41715 обеспечивал значительное снижение массы жировых тканей (подкожного жира и эпипидимального жира), в то время как В. longum NCIMB 41003 не оказывал значительного эффекта;
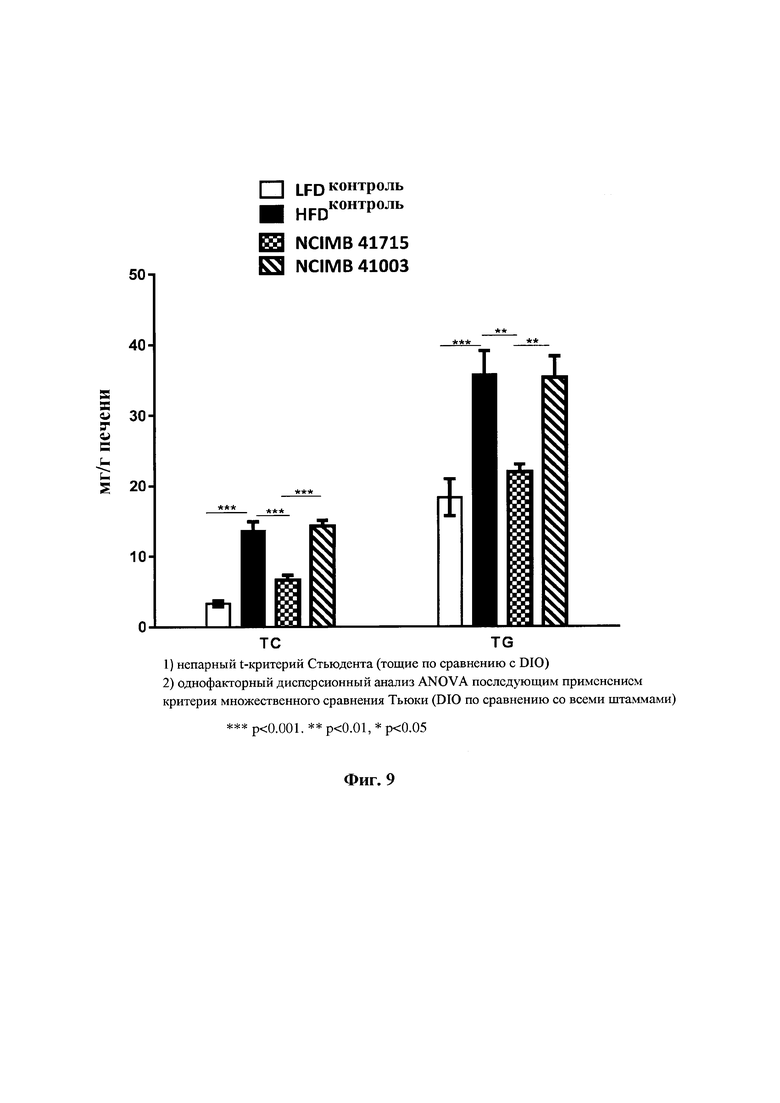
На Фиг. 9 показано влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на общее содержание холестерина в печени и триглицериды. В. longum NCIMB 41715, но не В. longum NCIMB 41003, снижал общее содержание холестерина в печени и триглицериды у мышей DIO;
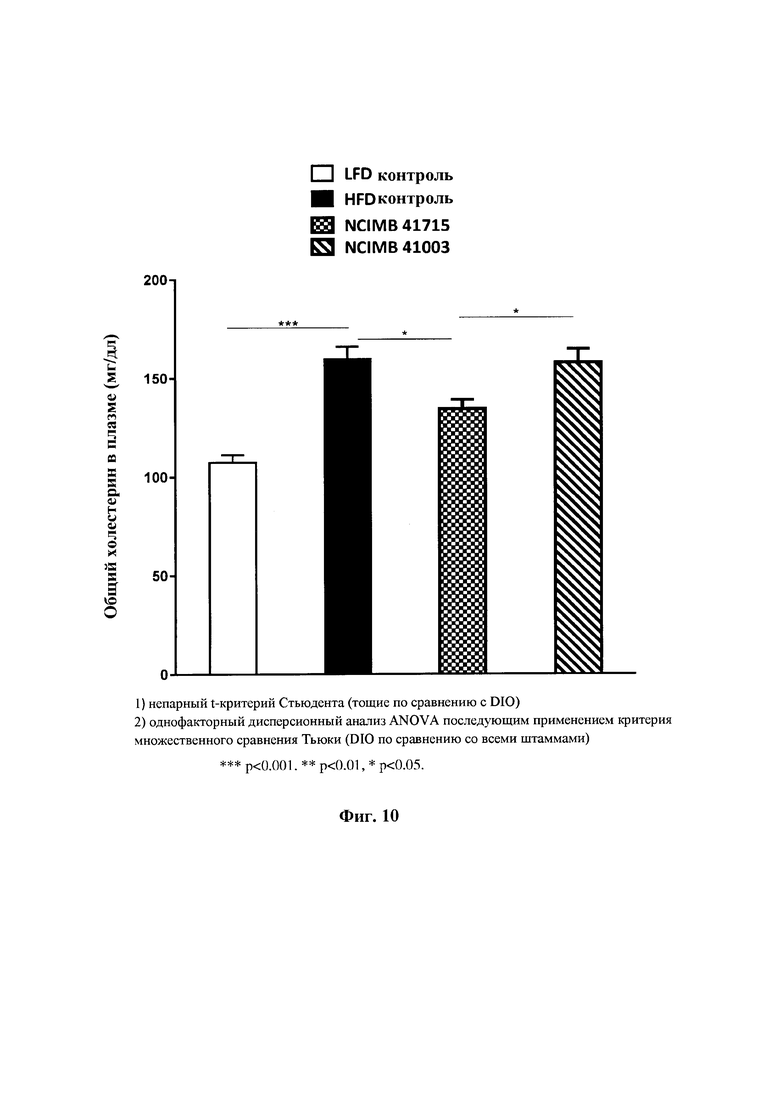
На Фиг. 10 показано влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на общий холестерин в плазме;
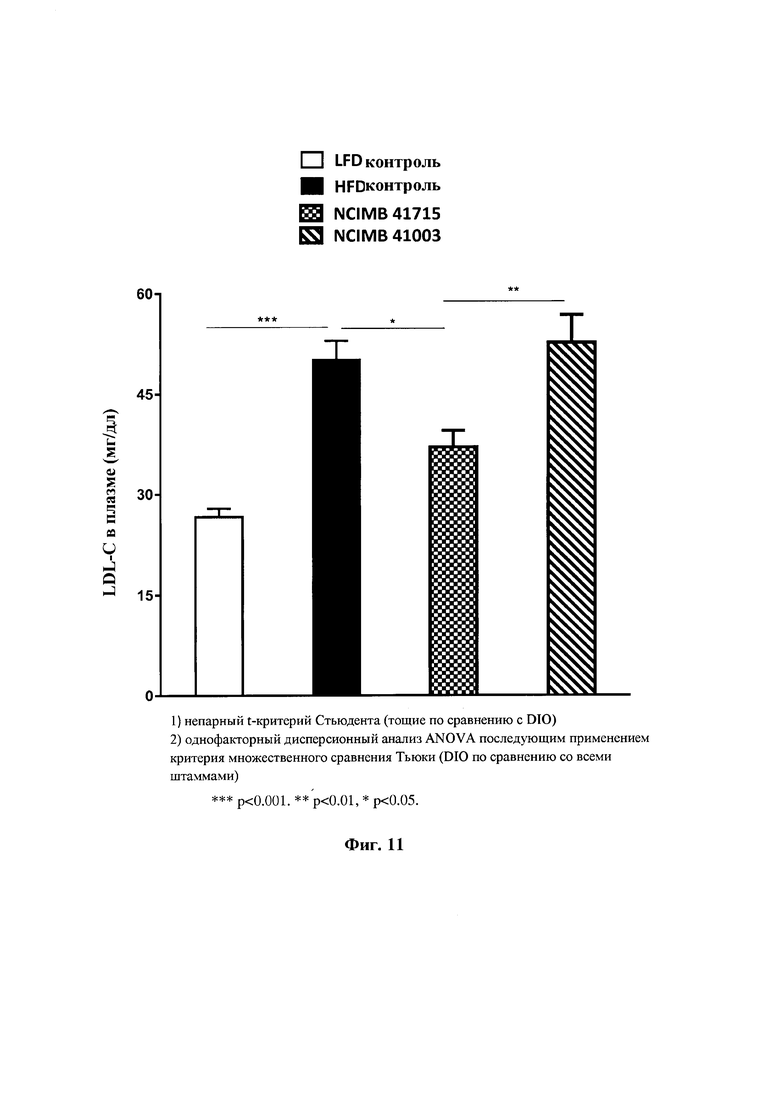
На Фиг. 11 показано влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на LDL- холестерин в плазме;
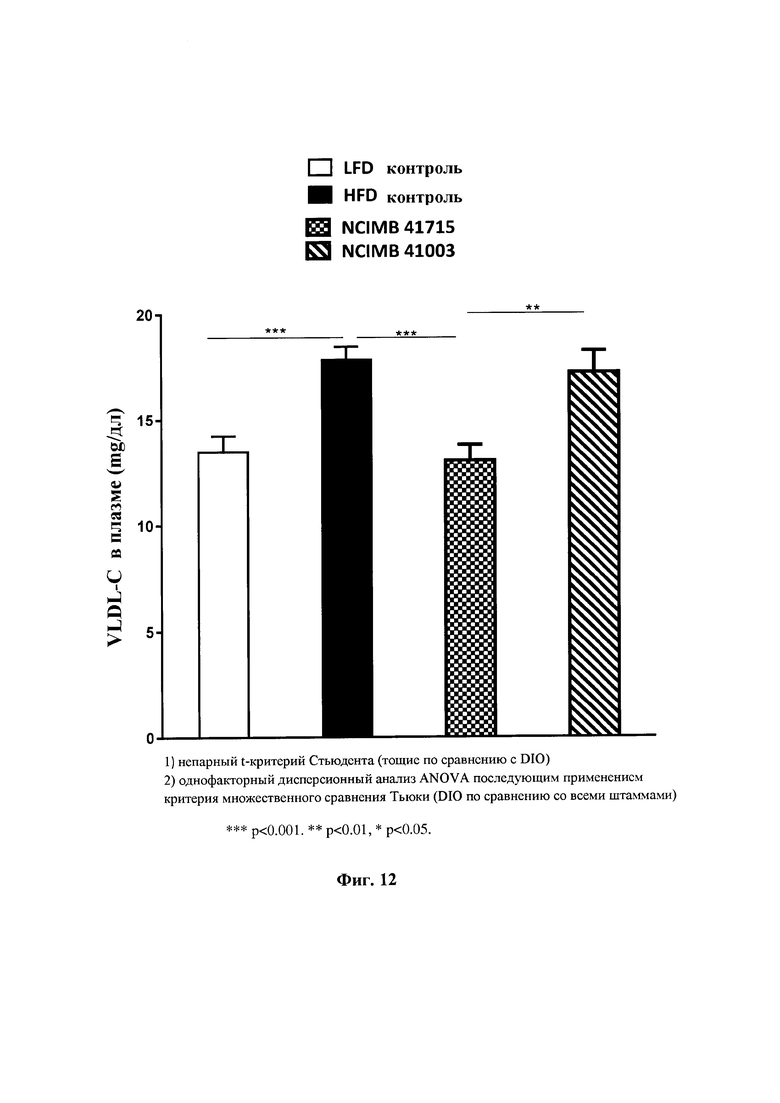
На Фиг. 12 показано влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на VLDL- холестерин в плазме;
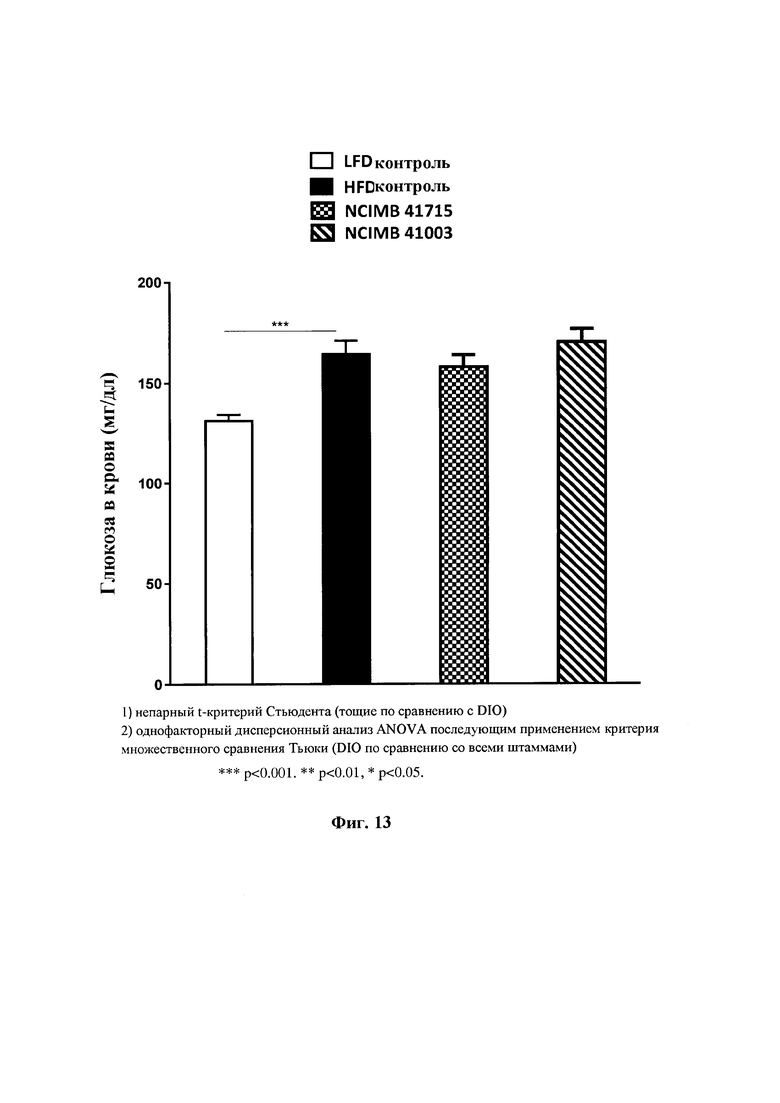
На Фиг. 13 показано влияние В. longum NCIMB 41715 and В. longum NCIMB 41003 на конечный уровень глюкозы в крови;
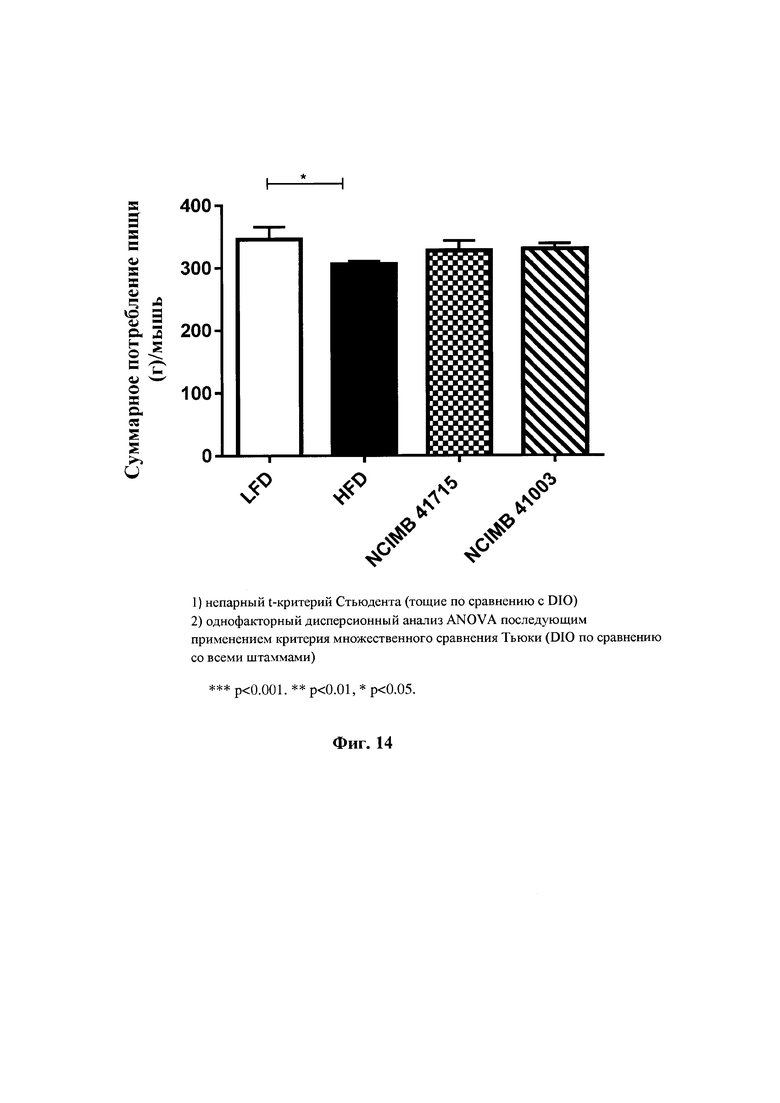
На Фиг. 14 показано суммарное потребление пищи на мышь после введения В. longum NCIMB 41715 и В. longum NCIMB 41003 по сравнению с контрольной группой, находящейся на диете с высоким содержанием жира (HFD) в модели мышей DIO; и
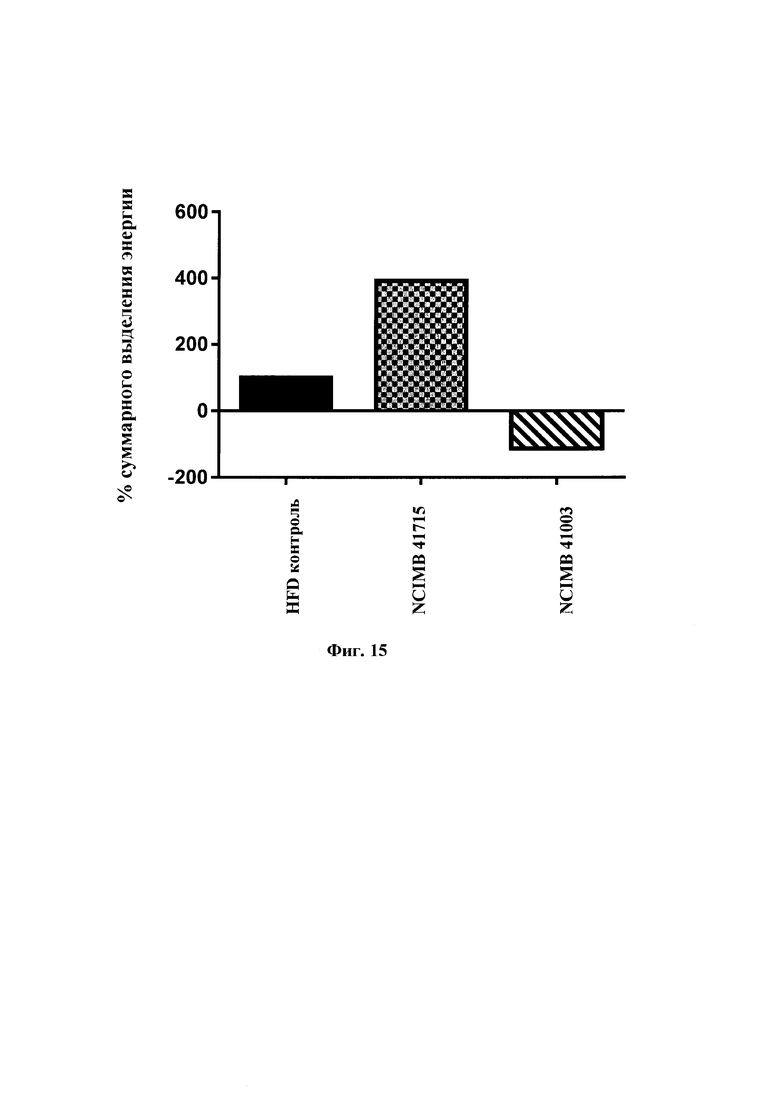
На Фиг. 15 представлена оценка% кумулятивного выделения энергии после введения В. longum NCIMB 41715 и В. longum NCIMB 41003 по сравнению с контрольной группой, находящейся на диете с высоким содержанием жира (HFD) в модели мышей DIO.
Подробное описание изобретения
Депонирование Bifidobacterium longum АН 1362 было произведено в Национальных коллекциях промышленных, пищевых и морских бактерий, Ltd (NCIMB) Ferguson Building, Craibstone Estate, Bucksburn, Aberdeen, AB21 9YA, Scotland, UK, 6 мая, 2010 года с получением учетного номера NCIMB 41715.
Данное описание также ссылается для сравнения на штамм Bifidobacterium longum 35624, который депонирован в Национальных коллекциях промышленных, пищевых и морских бактерий Ltd (NCIMB) Ferguson Building, Craibstone Estate, Bucksburn, Aberdeen, AB21 9YA, Scotland, UK 13 января, 1999 под учетным номером NCIMB 41003.
Примеры
Следующие ниже примеры дополнительно описывают и демонстрируют воплощения в рамках объема изобретения. Примеры приведены исключительно для иллюстрации и не должны рассматриваться как ограничения настоящего изобретения, так как возможны многие его варианты без отклонения от сущности и объема изобретения.
Авторы изобретения обнаружили, что новый EPS-продуцирующий штамм Bifidobacterium (В. longum АН1362) ослаблял маркеры, ассоциированные с ожирением и ассоциированными метаболическими расстройствами. Введение В. longum АН 1362 было ассоциировано с изменением микробиоты кишечника, с уменьшением отложений жира и снижением уровней триглицеридов в печени и общего холестерина в печени, и с увеличением выведения жира. Неожиданно, введение В. longum NCIMB 41003 не оказывало такого же эффекта.
Пример 1 - Идентичность В. longum NCIMB 41715 была подтверждена при помощи BLAST-анализа области межгенного спейсера (IGS).
Метод
Секвенирование межгенного 16s-23s спейсера (IGS) проводили для идентификации В. longum NCIMB 41715. В кратком изложении, тотальную ДНК выделяли из штаммов с использованием 100 мкл экстракционного раствора и 25 мкл раствора для обработки тканей Tissue Preparation solution (набор Sigma-Aldrich, XNAT2). Образцы инкубировали в течение 5 минут при комнатной температуре, затем в течение 2 часов при 95°С, после чего добавляли 100 мкл нейтрализующего раствора (набор Sigma-Aldrich, XNAT2). Раствор ДНК количественно характеризовали, используя спектрофотометр Nanodrop, и хранили при 4°С. ПЦР выполняли с использованием праймеров IGS. Пары праймеров, используемые для идентификации обоих праймеров, представляли собой IGS R 5'-CTGGTGCCAAGGCАТССА-3' и IGS L 5'-GCTGGATCACCTCCTTTCT-3'. Условия цикла представляли собой 94°С в течение 4 минут (1 цикл), 94°С в течение 45 секунд, 53°С в течение 45 секунд, 72°С в течение 45 секунд (28 циклов). Реакционная смесь для ПЦР содержала 2 мкл (100 нг) ДНК, смесь ПЦР (Sigma-Aldrich, Red Taq), 0,025 нМ праймеров IGS L и R (MWG Biotech, Germany). Реакции ПЦР выполняли на амплификаторе Eppendorf. Продукты ПЦР пропускали вместе с маркером молекулярной массы (маркер длины 100 п. о. Ladder, Roche) на 2% агарозном геле, окрашенном EtBr (бромистый этидий), в ТАЕ (трис-ацетатный буфер) для определения профиля IGS. Продукты ПЦР Bifidobacterium (единичный бэнд) очищали с использованием набора для очистки Promega Wizard PCR. Продукты ПЦР Lactobacillus имели 3 бэнда. Бэнд, соответствующий примерно 280 п. о. (нижний бэнд), вырезали, очищали с использованием спин-колонки GenElute Agarose Spin Column (Sigma-Aldrich) и снова устанавливали последовательность, как описано выше, а продукт ПЦР очищали с использованием набора для очистки Promega Wizard PCR. Очищенные продукты ПЦР секвенировали с помощью Beckman Coulter Genomics (UK) с использованием последовательностей праймеров (представленных выше) для области межгенного спейсера. Затем данные по последовательности искали в базе данных нуклеотидов NCBI для определения идентичности штамма по гомологии нуклеотидов. Полученные данные для ДНК-последовательности подвергли обработке при помощи стандартной поисковой системы BLAST на сайте NCBI для определения гомологии нуклеотидов (http://www.ncbi.nlm.nih.gov/BLAST/) для определения наилучшего совпадения с последовательностью.
Результаты
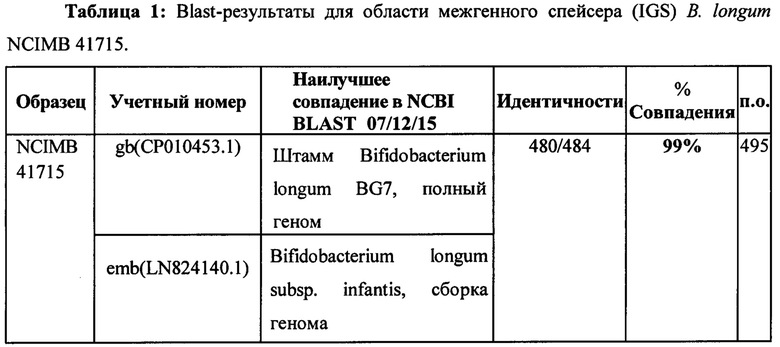
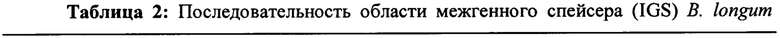
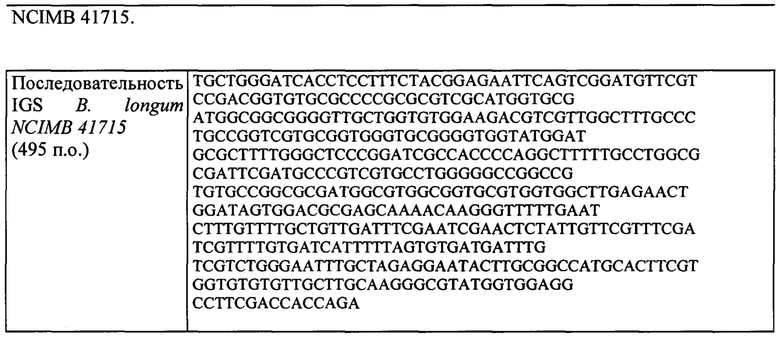
Пример 2 - анализ рыхлого осадка EPS (объемность штамма)
Метод
Каждый штамм ферментировали в бульоне. Частицы, собранные после центрифугирования, промывали и затем лиофилизировали.
Лиофильно-высушенный порошок, скорректированный на общее количество клеток (2×10Е10), ресуспендировали в 10 мл PBS (фосфатно-солевой буфер) и центрифугировали при 4000 об/мин/10 минут/4°С.
Результаты
Фиг. 1: Объемность штаммов В. longum NCIMB 41715 и В. longum NCIMB 41003, измеренная по высоте рыхлого осадка EPS.
В. longum NCIMB 41003 продуцирует 0,9 см рыхлого осадка, в то время как В. longum NCIMB 41715 продуцирует 2,5 см рыхлого осадка.
Вывод
В. longum NCIMB 41003 известен как продуцент высоких уровней EPS. Анализ рыхлого осадка EPS и полученная высота осадка подтверждают, что В. longum NCIMB 41715 продуцирует EPS и продуцирует больше EPS, чем В. longum NCIMB 41003. Пример 3 - Анализ микробной адгезии к гексадекану (MATH) Гидрофобность является физическим свойством молекулы, посредством которого она отталкивает воду. Гидрофобные материалы используют для удаления масла из воды, для контроля над разливами нефти и для процессов химического разделения для удаления неполярных веществ от полярных соединений. Гидрофобность бактериальной клетки зависит от состава ее клеточной поверхности в отношении присутствующих белков, пептидов и полисахаридов. Способность пробиотического штамма прилипать к слизистой оболочке кишечника помогает бактериальной клетке зафиксироваться во время прохождения желудочно-кишечного тракта, обеспечивая ей конкурентные преимущества в кишечнике. Гидрофобность штамма является одним из факторов, вносящих вклад в адгезионную способность. Определение бактериальной адгезии к гексадекану, как показатель способности штаммов прилипать к эпителиальным клеткам кишечника, является правильным качественным подходом (Kiely & Olson, 2000). Метод
Способность В. longum NCIMB 41715 и В. longum NCIMB 41003 прикрепляться к гексадекану, как меру их гидрофобное™, определяли с использованием тестирования микробной адгезии к гексадекану (MATH). Адгезию к гексадекану измеряли в соответствии с методом Rosenberg et al., 1980 с некоторыми модификациями (Crow and Gopal, 1995; Bellon-Fontaine et al., 1996). Бактерии собирали в стационарной фазе посредством центрифугирования при 5000g в течение 15 минут, дважды промывали PBS и ресуспендировали в 0,1 моль/л KNO3 (рН 6.2) до OD600 0,8. Поглощение клеточной суспензии измеряли при 600 нм (А0). 2 мл гексадекана (Sigma Aldrich) добавляли к 2 мл клеточной суспензии. После 10 минут предварительной инкубации при комнатной температуре двухфазную систему перемешивали путем встряхивания в течение 2 минут.Водную фазу удаляли после 20 минут инкубации при комнатной температуре и измеряли ее поглощение при 600 нм (А1). % бактериальной адгезии к гексадекану рассчитывали как (1-А1/А0) × 100, где А0 и А1 соответственно представляют собой поглощение до и после экстракции растворителями. Эксперименты проводили в трех повторах с клетками из независимых культур.
Результаты
Фиг 2: % адгезии В. longum NCIMB 41715 и В. longum NCIMB 41003 к гексадекану, как мера их гидрофобности. Вывод
В. longum NCIMB 41715 (58.3%) показал более высокую аффинность к гексадекану, что указывает на его большую гидрофобность по сравнению с В. longum NCIMB 41003 (28,6%).
Пример 4 - Противовоспалительные профили в РВМС
Противовоспалительный профиль В. longum NCIMB 41715, B. longum NCIMB 41003 и штамма Lactobacillus с низким продуцированием EPS исследовали путем оценки индукции противовоспалительного цитокина IL-10 и провоспалительного цитокина TNF-α в анализе индукции цитокинов в мононуклеарных клетках периферической крови (РВМС).
Метод
Анализ индукции иитокинов в мононуклеарных клетках периферической крови (РВМС).
Кровь получали от трех здоровых добровольцев при одобрении Комитета по этике клинических исследований Cork Teaching Hospitals. Все субъекты воздерживались от приема пробиотиков, антибиотиков или противовоспалительных лекарственных средств в течение одного месяца или более до сдачи крови. РВМС извлекали из цельной крови путем разделения в градиенте плотности с использованием гистопака (Sigma-Aldrich), гидрофильного полисахарида, который разделяет слои крови, с образованием "лейкоцитарной пленки" под слоем плазмы, который содержит РВМС. Для каждого штамма 100 мг лиофилизированного порошка взвешивали и ресуспендировали в стерильном Dulbecco's PBS (Sigma-Aldrich). Бактериальные клетки дважды промывали с помощью центрифугирования (4000 об/мин/10 мин/4°С/Вrаkе 0) и ресуспендировали в стерильном PBS. Выполняли определения количеств микроорганизмов прямым подсчетом под микроскопом и препараты клеток разбавляли до подходящих концентраций с получением соотношения общее количество бактерий: клетки РВМС 100:1; 50:1; 25:1. Технические повторы выполняли трижды. Затем РВМС инкубировали в концентрации 2×105 клеток/мл в течение 48 ч при 37°С (в присутствии пенициллина и стрептомицина (Sigma-Aldrich) с контрольной средой или с возрастающими концентрациями бактериальных штаммов: 1×106 клеток/мл (25:1 бактерии : РВМС), 1×107 клеток/мл (50:1 бактерии:РВМС) и 2×10 клеток/мл (100:1 бактерии: РВМС). В супернатантах определяли противовоспалительный цитокин IL-10 и провоспалительный цитокин TNF-α, которые измеряли с использованием MesoScale Discovery (MSD) наборов мультиплексной платформы культуры тканей (Meso Scale Diagnostics, Maryland, USA). В. longum NCIMB 41003, который, как было показано ранее, обладает противовоспалительной активностью (Groeger et al., 2013), использовали в качестве положительного контроля для установления точности анализа.
Результаты
Фиг. 3: Индукция IL-10 в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с помощью EPS+ve В. longum NCIMB 41003 и штамма Lactobacillus с низким продуцированием EPS. Наблюдается повышенная индукция противовоспалительного цитокина IL-10 после стимуляции с помощью EPS+ve В. longum NCIMB 41003 по сравнению со штаммом Lactobacillus с низким продуцированием EPS.
Фиг.4: Индукция TNF-α в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с В. longum NCIMB 41003 и штаммом Lactobacillus с низким продуцированием EPS. Наблюдается пониженная индукция провоспалительного цитокина TNF-a после стимуляции с помощью EPS+ve В. longum NCIMB 41003 по сравнению со штаммом Lactobacillus с низким продуцированием EPS.
Фиг. 5: Индукция IL-10 в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с В. longum NCIMB 41003 и В. longum NCIMB 41715. Оба штамма индуцируют дозозависимым образом похожие уровни противовоспалительного цитокина IL-10.
Фиг. 6: Индукция TNF-α в анализе индукции цитокинов в РВМС после 48-часовой стимуляции с В. longum NCIMB 41003 и В. longum NCIMB 41715. В. longum NCIMB 41715 индуцирует уровни TNF-α, аналогичные В. longum NCIMB 41003.
Вывод
В. longum NCIMB 41715 и В. longum NCIMB 41003, которые имеют высокое содержание EPS, индуцируют похожие противовоспалительные иммунные профили в анализе индукции цитокинов в РВМС. Штамм, продуцирующий низкие уровни EPS, формирует значительно отличающийся иммунный профиль.
Пример 5 - Влияние введения В. longum NCIMB 41715, В. longum NCIMB 41003 и штамма Lactobacillus, продуцирующего низкие уровни EPS, на метаболические результаты в модели диета-индуцированного ожирения (DIO) у мышей.
Метод
Животные
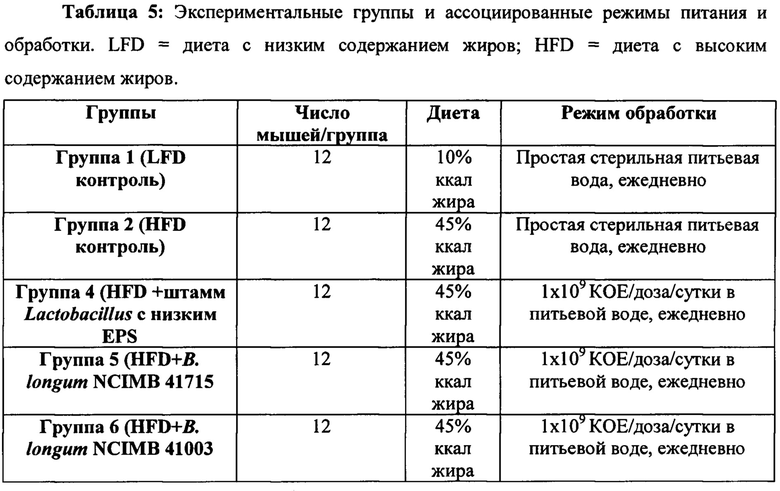
Самцов мышей C57BL/6JRccHsd (Harlan Laboratories, Netherlands) в возрасте 7 недель (72 мыши, n=12 на группу), рандомизированных по массе тела, содержали в контролируемой среде при температуре 22±3°С, влажности 50±20%, 12-часовом свето-темновом цикле и 15-20-разовой замене свежего воздуха в час. Мышей размещали по группам (4 мыши на клетку), и в качестве подстилки использовали автоклавированные кукурузные початки. Мышей получали в возрасте 5 недель и выдерживали в карантине в течение одной недели с последующей акклиматизацией в течение одной недели до начала исследования. Начиная с 0 суток, мышей кормили без ограничения и мышей в каждой клетке обеспечивали 50 мл обычной стерильной питьевой воды (группы 1 и 2; Таблица 1) или питьевой воды, содержащей лиофилизированный пробиотик (1×109 КОЕ/доза/сутки) с помощью поликарбонатных бутылок, снабженных поилками из нержавеющей стали (группы 3, 4, 5 и 6; Таблица 1). Воздействие продолжали в течение 16 недель.
Дизайн исследования
Начиная с 0 суток, группу 1 содержали на диете с низким содержанием жира (LFD) D12450 (10% ккал % жира, облученного гамма-излучением; Research Diets Inc, USA), a остальные пять групп (группы 2-6) содержали на диете с высоким содержанием жира (HFD) D12451 (45% ккал % жира, облученного гамма-излучением; Research Diets Inc) в течение 16 недель. HFD-питание индуцировало резистентность к инсулину и ожирение у животных, которое характеризовалось увеличением массы тела и значений уровня глюкозы в крови натощак. Группы 1 и 2 обеспечивали обычной стерильной питьевой водой, в то время как группы 3, 4, 5 и 6 обеспечивали питьевой водой, содержащей 1×109 КОЕ/доза/сутки соответствующего пробиотика (Таблица 1). Общее наблюдение за здоровьем проводили ежедневно в одно и то же время суток. Оно включало активность, текстуру волоса, движение по клетке и наличие любого выделения из носа, глаз, рта и ушей. Предварительно отмеренный корм содержался в каждой клетке и остатки пищи после кормления измеряли и записывали в каждый третий день для определения количества пищи, потребляемого мышами. Потребление воды животными измеряли ежедневно, начиная с первого дня исследования. Мышам в каждой клетке (n=4) ежедневно давали 50 мл воды. Оставшуюся воду в каждой клетке измеряли каждые 24 часа.
Масса тела и образцы тканей
Массу тела определяли индивидуально для всех животных при поступлении, в день рандомизации, перед началом воздействия и один раз в трое суток после этого. Процентное изменение массы тела рассчитывали по формуле (ТТ-ТС)/ТС * 100, где ТТ представляет собой массу обработанных животных в день тестирования и ТС представляет собой массу контроля в день тестирования. Мышей подвергали эхо-магнитно-резонансной томографии (MRI) с использованием Эхо MRI (EchoMRI-700™) в сутки - 1 и 28, 56, 84 и 112 для оценки туловищного жира и состава нежировых тканей. Животное помещали в пластмассовый держатель без воздействия седативным средством или анестезии. Жир измеряли, как массу всех жировых молекул в организме. Нежировая часть представляет собой массу мышечной ткани, эквивалентную всем частям тела, содержащим воду. Вклад в "свободную воду" вносит, главным образом, мочевой пузырь. Общая вода включает как свободную воду, так и воду, содержащуюся в нежировой части, которая представляет собой полное содержание воды в организме. Пластмассовые держатели дезинфицировали, переходя между животными из разных групп, чтобы избежать перекрестного загрязнения. При обработке животных из разных групп применяли асептические методики. В конце 16 недели животных умерщвляли посредством СО2-асфиксии. Печень, скелетную мышцу, висцеральный жир (эпидидимальный, почечный и брыжеечный), подкожный жир, селезенку, слепую кишку, бурый жир, мозг и кишечник собирали, взвешивали и хранили при -80°С для будущего биохимического и генетического анализа. Метаболические маркеры
Образцы крови собирали в 9 часов утра методом сдавливания хвоста в 0, 30, 60, 90 и 112 сутки для случайных измерений глюкозы крови (всего было сделано 5 отборов образцов), начиная/включая первые сутки дозирования. Анализ глюкозы крови проводили с помощью глюкометра Джонсона и Джонсона (One Touch Ultra 2). При обработке животных из разных групп использовали асептическую методику. В конце 16 недель мышей не кормили в течение 6 часов и собирали кровь методом сдавливания хвоста (способа сбора крови без анестезии) для оценки глюкозы в крови. Кровь собирали посредством ретро-орбитальной пункцией под легкой анестезией изофлураном и отделяли плазму, которую использовали для оценки общего холестерина (ТС), триглицеридов (TG), холестерина липопротеинов высокой плотности (HDL), холестерина липопротеинов низкой плотности (LDL) и неэстерифицированных жирных кислот (NEFA) посредством полностью автоматизированного клинического анализатора с произвольным доступом (ЕМ-360, Erba Mannheim, Germany). Уровни VLDL (холестерина липопротеидов очень низкой плотности) в плазме получали с помощью расчетного метода: (VLDL = Триглицериды (мг/дл)/5). Для оценки ТС и TG в печени, печень гомогенизировали в изопропаноле (1 мл/50 мг ткани) и инкубировали при 4°С в течение 1 часа. Образцы центрифугировали при 4°С в течение 5 минут при 2500 об/мин. Концентрации холестерина и триглицеридов в супернатанте измеряли посредством полностью автоматизированного клинического анализатора с произвольным доступом (ЕМ-360, Erba Mannheim).
Оценка выделения энергии
Два фекальных сгустка собирали от каждой мыши в 6, 10 и 15 неделю и анализировали их общую теплотворную способность с помощью калориметрической бомбы. Для анализа с помощью калориметрической бомбы образцы взвешивали и сушили в печи при 60°С в течение 48 часов. Энергетическое содержание фекалий оценивали с помощью калориметра Parr 6100 с использованием 1109 полумикробомбы (Parr Instruments & Co., Moline, Illinois, USA). Энергетический эквивалент калориметра определяли с использованием стандартов бензойной кислоты, и каждый образец (100 мг) анализировали в трех повторах. Кумулятивное выделение энергии у мышей, которых кормили пробиотиками на протяжении исследования, оценивали как процент относительно энергии, выделяемой мышами из контрольной группы, которых содержали на диете с высоким содержанием жиров. Статистический анализ
Статистический анализ проводили с использованием непарного t-критерия для различий между двумя группами. Однофакторный дисперсионный анализ (ANOVA) с последующим применением критерия множественного сравнения Тьюки использовали при оценке более двух групп. Данные анализировали с использованием GraphPad Prism версия 5.00 для Windows (программное обеспечение GraphPad). Результаты считали статистически значимыми при р<0,05.
Результаты
Фиг. 7: По сравнению с контрольной группой, находящейся на диете с высоким содержанием жиров (HFD), В. longum NCIMB 41715 продемонстрировал значительное снижение прироста жировой массы к 16 неделе, тогда как В. longum NCIMB 41003 не оказывал значительного эффекта.
Фиг. 8: Влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на массу жировой ткани. В. longum NCIMB 41715 значительно уменьшал массу жировой ткани (подкожного жира и эпипидимального жира), в то время как В. longum NCIMB 41003 не оказывал существенного эффекта.
Фиг. 9: Влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на общий холестерин печени и триглицериды. В. longum NCIMB 41715, но не В. longum NCIMB 41003, снижал общий холестерин печени и триглицериды у мышей DIO.
Фиг. 10: Влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на общий холестерин плазмы.
Фиг. 11: Влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на LDL-холестерин плазмы.
Фиг. 12: Влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на VLDL-холестерин плазмы.
Фиг. 13: Влияние В. longum NCIMB 41715 и В. longum NCIMB 41003 на конечный уровень глюкозы в крови.
Фиг. 14: Суммарное потребление пищи на мышь после введения В. longum NCIMB 41715 и В. longum NCIMB 41003 по сравнению с контрольной группой, находящейся на диете с высоким содержанием жиров (HFD) в мышиной модели DIO.
Фиг. 15: Оценка % кумулятивного выведения энергии после введения В. longum NCIMB 41715 и В. longum NCIMB 41003 по сравнению с контрольной группой, находящейся на диете с высоким содержанием жира (HFD) в мышиной модели DIO.
Штамм Lactobacillus с низким продуцированием EPS не оказывал существенного влияния в этой модели.
Вывод
Введение В. longum NCIMB 41715 приводило к существенному снижению массы жира к шестнадцатой недели для обоих штаммов. Это сопровождалось статистически значимым уменьшением подкожного жира и эпидидимального жира для В. longum NCIMB 41715. Введение В. longum NCIMB 41715 приводило к существенному снижению уровней общего холестерина печени и триглицеридов по сравнению с контрольной группой HFD. Кроме того, значительное улучшение уровня общего холестерина, LDL-холестерина и VLDL-холестерина также наблюдалось при введении В. longum NCIMB 41715 по сравнению с контрольной группой HFD. Несмотря на отсутствие существенного различия в суммарном потреблении пищи в ходе исследования, авторы изобретения наблюдали увеличение% выделения энергии для В. longum NCIMB 41715, что дает основание предполагать, что введение гидрофобного штамма В. longum NCIMB 41715 может уменьшить количество энергии, извлеченной из поглощенной пищи, что может быть ответственным за улучшение результатов метаболизма, наблюдаемое на этой модели мышей DIO.
Пребиотики
Введение пробиотических организмов осуществляют путем поглощения микроорганизма в подходящем носителе. Было бы полезно обеспечить среду, которая способствовала бы росту штамма в толстой кишке. Добавление одного или более олигосахаридов, полисахаридов или других пребиотиков усиливает рост молочнокислых бактерий в желудочно-кишечном тракте. Термин пребиотики относится к любому нежизнеспособному пищевому компоненту, который специфически ферментируется в толстой кишке облигатными бактериями, которые, как считается, имеют положительное значение, например бифидобактериями, лактобактериями. Типы пребиотиков могут включать пребиотики, которые содержат фруктозу, ксилозу, сою, галактозу, глюкозу и маннозу. Совместное введение пробиотического штамма с одним или несколькими пребиотическими соединениями может усилить рост вводимого пробиотика in vivo, что приводит к более выраженной пользе для здоровья и называется синбиотическим.
Другие активные ингредиенты
Следует понимать, что штамм можно вводить профилактически или в качестве способа лечения либо самостоятельно, либо с другими пробиотическими и/или пребиотическими веществами, как описано выше. Кроме того, штамм можно использовать как часть профилактического или лечебного режима с использованием других активных материалов, например используемых для лечения воспаления или других заболеваний, особенно заболеваний с иммунологической компонентой. Такие комбинации можно вводить в виде одной композиции или в виде отдельных композиций, вводимых в одно и то же или в разное время и с использованием одинаковых или разных путей введения.
Композиции
Один или более штаммов по изобретению можно вводить животным (включая человека) в перорально поглощаемой форме в обычном препарате, таком как капсулы, микрокапсулы, таблетки, гранулы, порошок, пастилки, пилюли, суппозитории, суспензии и сиропы. Подходящие композиции могут быть получены способами, обычно используемыми с применением обычных органических и неорганических добавок. Количество активного ингредиента в лекарственной композиции может находиться на уровне, который будет оказывать нужный терапевтический эффект.
Композиция также может включать бактериальный компонент, лекарственное средство или биологическое соединение.
Кроме того, вакцина, содержащая один или несколько штаммов по изобретению, может быть получена с использованием любого подходящего известного способа и может включать фармацевтически приемлемый носитель или адъювант.
Штаммы по изобретению могут быть разработаны для облегчения контролируемого высвобождения, такого как замедленное высвобождение штамма. Например, препарат может быть адаптирован для высвобождения штамма в определенном месте желудочно-кишечного тракта, таком как тонкий кишечник или толстая кишка. Для достижения такого контролируемого высвобождения, штамм может быть помещен в капсулу, которая имеет покрытие, адаптированное для высвобождения штамма в определенном месте. Для облегчения такого контролируемого высвобождения имеется ряд покрытий. Одним таким семейством покрытий являются покрытия с товарным знаком Eudragit.
Все документы, указанные в настоящем документе, в релевантной части, включены в данное описание изобретения посредством ссылки.
Изобретение не ограничено описанными выше воплощениями, которые могут различаться деталями.
Ссылки
ADAMS, Е. L., RICE, P. J., GRAVES, В., ENSLEY, Н. Е., YU, Н., BROWN, G. D., GORDON, S., MONTEIRO, M. A., PAPP-SZABO, E., LOWMAN, D. W., POWER, T. D., WEMPE, M. F. & WILLIAMS, D. L. 2008. Differential high-affinity interaction of dectin-1 with natural or synthetic glucans is dependent upon primary structure and is influenced by polymer chain length and side-chain branching. J Pharmacol Exp Ther, 325, 115-23.
ARONSSON, L., HUANG, Y., PARINI, P., KORACH-ANDRE, M., HAKANSSON, J., GUSTAFSSON, J. A., PETTERSSON, S., ARULAMPALAM, V. & RAFTER, J. 2010. Decreased fat storage by Lactobacillus paracasei is associated with increased levels of angiopoietin-like 4 protein (ANGPTL4). PLoS One, 5.
BACKHED, F., DING, H., WANG, Т., HOOPER, L. V., KOH, G. Y., NAGY, A., SEMENKOVICH, C. F. & GORDON, J. I. 2004. The gut microbiota as an environmental factor that regulates fat storage. Proc NatlAcad Sci USA, 101, 15718-23.
BACKHED, F., MANCHESTER, J.K., SEMENKOVICH, С F. & GORDON, J. I. 2007. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice. Proc Natl Acad Sci USA, 104, 979-84.
BLAND, E.J., KESHAVARZ, T. & BUCKE, С 2004. The influence of small oligosaccharides on the immune system. Carbohydr Res, 339, 1673-8.
CANI, P.D., AMAR, J., IGLESIAS, M.A., POGGI, M., KNAUF, C, BASTELICA, D., NEYRINCK, A. M., FAVA, F., TUOHY, К. M., CHABO, C, WAGET, A., DELMEE, E., COUSIN, В., SULPICE, Т., CHAMONTIN, В., FERRIERES, J., TANTI, J. F., GIBSON, G. R, CASTEILLA, L., DELZENNE, N. M., ALESSI, M. С & BURCELIN, R. 2007. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes, 56, 1761-72.
CANI, P. D., BIBILONI, R., KNAUF, C, WAGET, A., NEYRTNCK, A. M., DELZENNE, N.M. & BURCELIN, R. 2008a. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes, 57, 1470-81
CANI, P. D., DELZENNE, N. M., AMAR, J. & BURCELIN, R. 2008b. Role of gut microflora in the development of obesity and insulin resistance following high-fat diet feeding. Pathol Biol (Paris), 56, 305-9.
FANNING, S., HALL, L. J., CRONIN, M., ZOMER, A., MACSHARRY, J., GOULDING, D., MOTHERWAY, M. O., SHANAHAN, F., NALLY, K., DOUGAN, G. & VAN SINDEREN, D. 2012. Bifidobacterial surface-exopolysaccharide facilitates commensal-host interaction through immune modulation and pathogen protection. Proc NatlAcad Sci USA, 109, 2108-13.
GREGOR, M. F. & HOTAMISLIGIL, G. S. 2011. Inflammatory mechanisms in obesity. Annu Rev Immunol, 29, 415-45.
GUH, D. P., ZHANG, W., BANSBACK, N., AMARSI, Z., BIRMINGHAM, C. L. & ANIS, A. H. 2009. The incidence of co-morbidities related to obesity and overweight: a systematic review and meta-analysis. BMC Public Health, 9, 88.
GUPTA, S., RICHARD, L. & FORSYTHE, A. 2015. The humanistic and economic burden associated with increasing body mass index in the EU5. Diabetes Metab Syndr Obes, 8, 327-38.
HIDALGO-CANTABRANA, C, LOPEZ, P., GUEIMONDE, M., DE LOS REYES-GAVILAN, C, SUAREZ, A., MARGOLLES, A. & RUAS-MADIEDO, P. 2012. Immune Modulation Capability of Exopolysaccharides Synthesised by Lactic Acid Bacteria and Bifidobacteria. Probiotics and Antimicrobial Proteins, 4, 227-237.
HIDALGO-CANTABRANA, C, NIKOLIC, M., LOPEZ, P., SUAREZ, A., MILJKOVIC, M., KOJIC, M., MARGOLLES, A., GOLIC, N. & RUAS-MADIEDO, P. 2014. Exopolysaccharide-producing Bifidobacterium animalis subsp.lactis strains and their polymers elicit different responses on immune cells from blood and gut associated lymphoid tissue. Anaerobe, 26, 24-30.
JONES, S.E., PAYNICH, M.L., KEARNS, D.B. & KNIGHT, K.L. 2014. Protection from intestinal inflammation by bacterial exopolysaccharides. J Immunol, 192, 4813-20.
KAHN, S. E., HULL, R. L. & UTZSCHNEIDER, К. M. 2006. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature, AAA, 840-6.
KANKAINEN, M., PAULIN, L., TYNKKYNEN, S., VON OSSOWSKI, I., REUNANEN, J., PARTANEN, P., SATOKARI, R., VESTERLUND, S., HENDRICKX, A. P., LEBEER, S., DE KEERSMAECKER, S. C, VANDERLEYDEN, J., HAMALAINEN, Т., LAUKKANEN, S., SALOVUORI, N.. RITARI, J., ALATALO, E., KORPELA, R., MATTILA-SANDHOLM, Т., LASSIG, A., HATAKKA, K., KINNUNEN, К. Т., KARJALAINEN, H., SAXELIN, M., LAAKSO, K., SURAKKA, A., PALVA, A., SALUSJARVI, Т., AUVINEN, P. & DE VOS, W. M. 2009. Comparative genomic analysis of Lactobacillus rhamnosus GG reveals pili containing a human - mucus binding protein. Proc NatlAcad Sci USA, 106, 17193-8.
KOTZAMPASSI, K., GIAMARELLOS-BOURBOULIS, E.J. & STAVROU, G. 2014. Obesity as a consequence of gut bacteria and diet interactions. ISRN Obes, 2014, 651895.
LEE, H. Y., PARK, J. H., SEOK, S. H., BAEK, M. W., KIM, D. J., LEE, K.E., PAEK, K.S., LEE, Y. & PARK, J. H. 2006. Human originated bacteria, Lactobacillus rhamnosus PL60, produce conjugated linoleic acid and show anti-obesity effects in diet-induced obese mice. Biochim Biophys Ada, 1761, 736-44.
NAITO, E., YOSHIDA, Y., MAKINO, K., KOUNOSHI, Y., KUNIHIRO, S., TAKAHASHI, R., MATSUZAKI, Т., MIYAZAKI, K. & ISHIKAWA, F. 2011. Beneficial effect of oral administration of Lactobacillus casei strain Shirota on insulin resistance in diet-induced obesity mice. JAppl Microbiol, 110,650-7.
RIDAURA, V.K., FAITH, J.J., REY, F. E., CHENG, J., DUNCAN, A. E., KAU, A. L., GRIFFIN, N. W., LOMBARD, V., HENRISSAT, В., BAIN, J. R., MUEHLBAUER, M. J., ILKAYEVA, O., SEMENKOVICH, С F., FUNAI, K., HAYASHI, D. K., LYLE, B. J., MARTINI, M. C, URSELL, L. K., CLEMENTE, J. C, VAN TREUREN, W., WALTERS, W. A., KNIGHT, R., NEWGARD, С. В., HEATH, А. С & GORDON, J. I. 2013. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science, 341, 1241214.
TURNBAUGH, P. J., HAMADY, M., YATSUNENKO, Т., CANTAREL, B. L., DUNCAN, A., LEY, R. E., SOGIN, M. L., JONES, W. J., ROE, B. A., AFFOURTIT, J. P., EGHOLM, M., HENRISSAT, В., HEATH, A. C, KNIGHT, R. & GORDON, J. I. 2009. A core gut microbiome in obese and lean twins. Nature, 457, 480-4.
TURNBAUGH, P. J., LEY, R. E., MAHOWALD, M. A., MAGRINI, V., MARDIS, E. R. & GORDON, J. I. 2006. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, AAA, 1027-31.
VINDEROLA, G., PERDIGON, G., DUARTE, J., FARNWORTH, E. & MATAR, C. 2006. Effects of the oral administration of the exopolysaccharide produced by Lactobacillus kefiranofaciens on the gut mucosal immunity. Cytokine, 36, 254-60.
VOLMAN, J. J., RAMAKERS, J. D. & PLAT, J. 2008. Dietary modulation of immune function by beta-glucans. Physiol Behav, 94, 276-84.
VRIEZE, A., VAN NOOD, E., HOLLEMAN, F., SALOJARVI, J., KOOTTE, R. S., BARTELSMAN, J. F., DALLINGA-THIE, G. M., ACKERMANS, M. Т., SERLIE, M. J., OOZEER, R., DERRIEN, M., DRUESNE, A., VAN HYLCKAMA VLIEG, J. E., BLOKS, V. W., GROEN, A. K., HEILIG, H. G., ZOETENDAL, E. G., STROES, E. S., DE VOS, W. M., HOEKSTRA, J. B. & NIEUWDORP, M. 2012. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology, 143, 913-6.e7.
WHO (2015) Obesity and overweight. Available at: http://www.who.int/mediacentre/factsheets/fs311/en/ (accessed: 10 December 2015).


Группа изобретений относится к биотехнологии и может быть использована при профилактике и лечении ожирения. Предложены штамм бактерий Bifidobacterium longum AH 1362, депонированный в NCIMB под регистрационным номером 41715, композиция, лиофилизированная композиция для профилактики и/или лечения ожирения из ассоциированного с ожирением заболевания, содержащая эффективное количество штамма, пищевой продукт для профилактики ожирения, содержащий штамм, композицию или лиофилизированную композицию, и капсула для профилактики и/или лечения ожирения, содержащая штамм, или композицию, или лиофилизированную композицию. Композиция и лиофилизированная композиция дополнительно могут содержать пробиотик, пребиотик, принимаемый внутрь носитель, белок и/или пептид, в частности белки и/или пептиды, которые богаты глутамином/глутаматом, липид, углевод, витамин, минерал и/или микроэлемент, адъювант в эффективном количестве. Носитель может представлять собой капсулу, таблетку или порошок, пищевой продукт, такой как сквашенное молоко, йогурт, замороженный йогурт, сухое молоко, молочный концентрат, плавленые сыры, соусы или напитки, штамм Bifidobacterium longum NCIMB 41715 присутствует в количестве 106 КОЕ/г композиции, капсула адаптирована к контролируемому высвобождению в желудочно-кишечном тракте. Группа изобретений позволяет лечить ожирение, в том числе и ожирение, ассоциированное с ожирением метаболического синдрома. 6 н. и 11 з.п. ф-лы, 15 ил., 3 табл., 5 пр.
1. Штамм Bifidobacterium longum AH 1362 для профилактики или лечения ожирения и ассоциированного с ожирением заболевания, выбранного из ассоциированного с ожирением метаболического синдрома и неалкогольной жировой болезни печени (NAFLD), депонированный в NCIMB под учетным номером NCIMB 41715.
2. Штамм по п. 1 в форме жизнеспособных клеток.
3. Штамм по п. 1 в форме нежизнеспособных клеток.
4. Композиция для профилактики или лечения ожирения и ассоциированного с ожирением заболевания, выбранного из ассоциированного с ожирением метаболического синдрома и неалкогольной жировой болезни печени (NAFLD), которая содержит эффективное количество штамма по любому из пп. 1-3.
5. Композиция по п. 4, которая дополнительно содержит пробиотик.
6. Композиция по п. 4 или 5, которая дополнительно содержит пребиотик.
7. Композиция по любому из пп. 4-6 дополнительно содержащая принимаемый внутрь носитель.
8. Композиция по п. 7, где принимаемый внутрь носитель представляет собой фармацевтически приемлемый носитель, такой как капсула, таблетка или порошок.
9. Композиция по п. 7, где принимаемый внутрь носитель представляет собой пищевой продукт, такой как сквашенное молоко, йогурт, замороженный йогурт, сухое молоко, молочный концентрат, плавленые сыры, соусы или напитки.
10. Композиция по любому из пп. 4-9, которая дополнительно содержит белок и/или пептид, в частности белки и/или пептиды, которые богаты глутамином/глутаматом, липид, углевод, витамин, минерал и/или микроэлемент.
11. Композиция по любому из пп. 4-10, где штамм присутствует в количестве более 106 КОЕ на грамм композиции.
12. Композиция по любому из пп. 4-11, которая дополнительно содержит адъювант.
13. Лиофилизированная композиция для профилактики или лечения ожирения и ассоциированного с ожирением заболевания, выбранного из ассоциированного с ожирением метаболического синдрома и неалкогольной жировой болезни печени (NAFLD), содержащая эффективное количество штамма по п. 1 или композицию по любому из пп. 4-12.
14. Пищевой продукт для профилактики ожирения, содержащий штамм по п. 1, композицию по любому из пп. 4-12 или лиофилизированную композицию по п. 13.
15. Лекарственное средство для профилактики или лечения ожирения и ассоциированного с ожирением заболевания, выбранного из ассоциированного с ожирением метаболического синдрома и неалкогольной жировой болезни печени (NAFLD), содержащее штамм по п. 1, или композицию по любому из пп. 4-12, или лиофилизированную композицию по п. 13.
16. Капсула для профилактики или лечения ожирения и ассоциированного с ожирением заболевания, выбранного из ассоциированного с ожирением метаболического синдрома и неалкогольной жировой болезни печени (NAFLD), содержащая штамм по п. 1, композицию по любому из пп. 4-12 или лиофилизированную композицию по п. 13.
17. Капсула по п. 16, которая адаптирована для контролируемого высвобождения в желудочно-кишечном тракте.
| WO 2010055499 A2, 20.05.2010 | |||
| WO 2011058535 A1, 19.05.2011 | |||
| ПРОБИОТИЧЕСКАЯ БИФИДОБАКТЕРИЯ Bifidobacterium Longum | 2009 |
|
RU2570557C2 |
| ПРОБИОТИЧЕСКИЙ ШТАММ Bifidobacterium longum, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТАКОЙ ШТАММ, И ЕГО ПРИМЕНЕНИЕ | 2008 |
|
RU2473681C2 |
Авторы
Даты
2021-01-11—Публикация
2016-12-09—Подача