ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к применяемому в качестве лекарственного средства производному 1,4-дизамещенного имидазола, в том числе к его фармацевтически приемлемой соли, и к противоопухолевому средству, включающему производное 1,4-дизамещенного имидазола в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
[0002] Предполагают, что в ряде случаев традиционные методы лечения рака, даже если они могут вызывать обратное развитие опухолей, не дают значимых результатов с точки зрения выживания в силу непрерывной пролиферации злокачественных опухолей, метастазирования или рецидивов рака и резистентности к противоопухолевым средствам. В настоящее время предполагается, что одной из причин отрицательных результатов является раковая стволовая клетка (далее обозначаемая как "CSC"), которая тесно связана с такими факторами, как непрерывная пролиферация злокачественной опухоли. Раковые стволовые клетки были выявлены почти для всех основных типов рака у человека, таких как рак молочной железы, рак толстой кишки, рак легких и гематологическая злокачественная опухоль (непатентный документ 1). Кроме того, раковые стволовые клетки могут сильно отличаться по биологическим свойствам от нормальных раковых клеток, которые дифференцируются из раковых стволовых клеток, и, поэтому, можно ожидать, что создание противоопухолевого средства, воздействие которого будет селективно направлено на раковые стволовые клетки, позволит использовать новый подход при лечении рака (непатентный документ 2).
[0003] Одним из свойств раковых стволовых клеток является их способность к самообновлению (непатентный документ 3). Надежные методы, применяемые для оценки способности к самообновлению клеток, включают, например, метод для измерения способности раковых клеток к сферообразованию в условии несросшихся клеток в отсутствии сыворотки крови (непатентный документ 4).
[0004] В непатентном документе 5 раскрыто, что средство PF-03084014, имеющее структуру N-имидазолиламида, может ингибировать раковые стволовые клетки с проявлением противоракового действия. Однако в непатентном документе 5 не раскрывается соединение формулы (1') по настоящему изобретению.
ПРОТИВОПОСТАВЛЕННЫЕ ДОКУМЕНТЫ
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0005]
Непатентный документ 1: Boman et al., Journal of Clinical Oncology 26(17): 2795-2799. 2008
Непатентный документ 2: Lobo et al., Annu Rev Cell Dev Biol 23: 675-99. 2007
Непатентный документ 3: Al-Hajj et al., Oncogene 23(43): 7274-82. 2004
Непатентный документ 4: Ponti et al., Cancer Res 65(13): 5506-11. 2005
Непатентный документ 5: Zhang et al., Stem Cells Translational Medicine 2: 233-242. 2013
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧА, РЕШАЕМАЯ ИЗОБРЕТЕНИЕМ
[0006] Задачей настоящего изобретения является создание нового противоопухолевого средства, действие которого направлено на раковые стволовые клетки, которые, как считают, тесно связаны с непрерывной пролиферацией злокачественной опухоли, метастазированием или рецидивами рака и резистентностью к противоопухолевым средствам.
СПОСОБЫ РЕШЕНИЯ ЗАДАЧ
[0007] Авторы настоящего изобретения провели обширные исследования для решения упомянутой выше задачи и в результате обнаружили, что соединение следующей формулы (1') или его фармацевтически приемлемая соль (далее называемое, в случае необходимости, "настоящим соединением") обладает мощным ингибирующим действием в отношении способности раковых клеток к сферообразованию и может применяться в качестве нового эффективного противоопухолевого средства. На основе этих новых полученных данных и было создано настоящее изобретение.
[0008] Описание предлагаемого изобретения приводится ниже.
[1] Соединение формулы (1'):
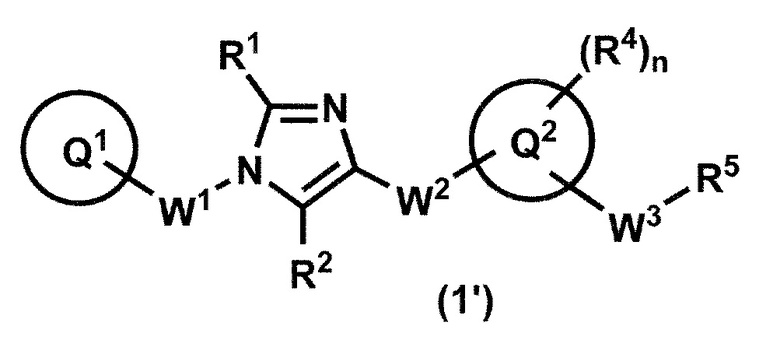
или его фармацевтически приемлемая соль, где кольцо Q1 представляет собой необязательно замещенную C6-10 арильную группу, необязательно замещенную C3-10 циклоалкильную группу или необязательно замещенную 5-10-членную гетероарильную группу;
R1 и R2 представляют собой независимо атом водорода, атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов;
W1 представляет собой необязательно замещенную C1-4 алкиленовую группу;
W2-Q2 представляет собой -NR3aC(O)-Q2, -NR3aC(O)O-Q2, -NR3aC(O)OCH2-Q2, -NR3aC(O)NR3b-Q2, -NR3aC(O)NR3bCH2-Q2, -NR3aC(O)CH2O-Q2, -NR3aC(O)CH2-Q2, -NR3aC(O)CH2CH2-Q2, -C(O)NR3a-Q2, -C(O)NR3aCH2-Q2, -C(O)NR3aCH2CH2-Q2 или -NR3aC(O)-CR3c=CR3d-Q2, где R3a и R3b представляют собой независимо атом водорода или C1-6 алкильную группу; и R3c и R3d представляют собой независимо атом водорода, атом фтора или C1-6 алкильную группу;
кольцо Q2 представляет собой 5-10-членную гетероарильную группу;
W3 представляет собой необязательно замещенную C1-4 алкиленовую группу, необязательно замещенную C3-4 алкениленовая группа или необязательно замещенная C3-4 алкиниленовая группа;
n представляет собой 1, 2, 3, 4 или 5;
R4, в случае присутствия в количестве двух или более, представляет собой независимо атом водорода, атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную C3-10 циклоалкильную группу, необязательно замещенную C2-6 алкенильная группа, необязательно замещенную C2-6 алкинильную группу, цианогруппу, необязательно замещенную C1-6 алкилкарбонильную группу, необязательно замещенную C1-6 алкилсульфонильную группу, необязательно замещенную C1-6 алкоксикарбонильную группу, необязательно замещенную C1-6 алкилкарбониламиногруппу, необязательно замещенную C1-6 алкилсульфониламиногруппу, необязательно замещенную C1-6 алкоксикарбониламиногруппу, необязательно замещенную C1-6 алкилкарбонилоксигруппу, необязательно замещенную аминогруппу, необязательно замещенную аминокарбонильную группу, необязательно замещенную аминосульфонильную группу, необязательно замещенную 5- или 6-членную циклическую аминогруппу, необязательно замещенную 5- или 6-членную циклическую аминокарбонильную группу, нитрогруппу или карбоксильную группу;
когда R4 и W3 присоединены к смежным углеродным атомам на кольце Q2, они могут быть объединены с углеродными атомами с образованием 5-8-членного циклоалканового кольца; и
R5 представляет собой
(1) гидроксильную группу,
(2) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси, C1-6 алкокси и C6-10 арила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(3) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп или
(4) C1-6 алкилкарбониламиногруппу, где ее алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или различных атомов галогенов.
[0009]
[2] Соединение формулы (1):
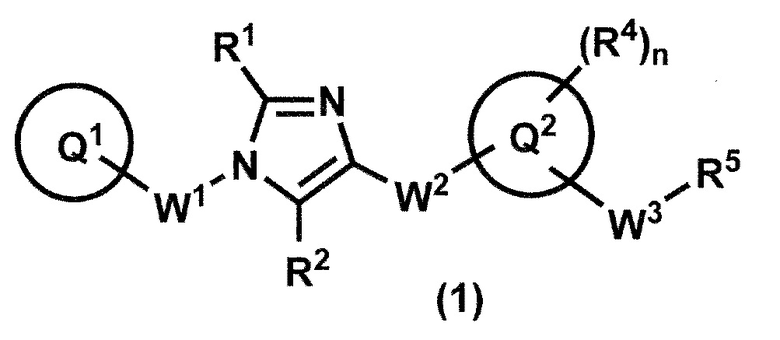
или его фармацевтически приемлемая соль, где кольцо Q1 представляет собой необязательно замещенную C6-10 арильную группу, необязательно замещенную C3-10 циклоалкильную группу или необязательно замещенную 5-10-членную гетероарильную группу;
R1 и R2 представляют собой независимо атом водорода, атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов;
W1 представляет собой необязательно замещенную C1-4 алкиленовую группу;
W2-Q2 представляет собой -NR3aC(O)-Q2, -NR3aC(O)O-Q2, -NR3aC(O)OCH2-Q2, -NR3aC(O)NR3b-Q2, -NR3aC(O)NR3bCH2-Q2, -NR3aC(O)CH2O-Q2, -NR3aC(O)CH2-Q2, -NR3aC(O)CH2CH2-Q2, -C(O)NR3a-Q2, -C(O)NR3aCH2-Q2 или -C(O)NR3aCH2CH2-Q2, где R3a и R3b представляют собой независимо атом водорода или C1-6 алкильную группу;
кольцо Q2 представляет собой 5-10-членную гетероарильную группу;
W3 представляет собой необязательно замещенную C1-4 алкиленовую группу, необязательно замещенную C3-4 алкениленовую группу или необязательно замещенную C3-4 алкиниленовую группу;
n представляет собой 1, 2, 3, 4 или 5;
R4, в случае присутствия в количестве двух или более, представляет собой независимо атом водорода, атом галогена, необязательно замещенную C1-6 алкильную группу, необязательно замещенную C1-6 алкоксильную группу, необязательно замещенную C3-10 циклоалкильную группу, необязательно замещенную C2-6 алкенильную группу, необязательно замещенную C2-6 алкинильную группу, цианогруппу или необязательно замещенную аминогруппу;
когда R4 и W3 присоединены к смежным углеродным атомам на кольце Q2, они могут быть объединены с углеродными атомами с образованием 5-8-членного циклоалканового кольца; и
R5 представляет собой
(1) гидроксильную группу,
(2) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси, C1-6 алкокси и C6-10 арила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(3) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп или
(4) C1-6 алкилкарбониламиногруппу, где ее алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или различных атомов галогенов.
[0010]
[3] Соединение по пункту [1] или [2] или его фармацевтически приемлемая соль, где кольцо Q1 представляет собой
(1) C6-10 арильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из
(a) атома галогена,
(b) C1-6 алкила, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(c) C1-6 алкокси, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(d) циано,
(e) C6-10 арила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(f) 5- или 6-членного гетероарила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(g) C6-10 арилокси, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(h) гидрокси,
(i) амино, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп,
(j) аминокарбонила, где его аминный фрагмент может быть необязательно замещен с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп,
(k) C1-6 алкоксикарбонила, где его алкоксильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(l) C1-6 алкилкарбонила, где его алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(m) C1-6 алкилсульфонила, где его алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(n) C1-6 алкилкарбониламино, где его алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(o) C1-6 алкилсульфониламино, где его алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(p) C1-6 алкоксикарбониламино, где его алкоксильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(q) C1-6 алкилкарбонилокси, где его алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(r) аминосульфонила, где его аминный фрагмент может быть необязательно замещен с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп и
(s) C3-10 циклоалкила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(2) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из (a) - (s), определенных выше в (1) или
(3) 5-10-членную гетероарильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из (a) - (s), определенных выше в (1);
W1 представляет собой C1-4 алкиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси;
W3 представляет собой
(1) C1-4 алкиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(2) C3-4 алкениленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атом галогенов или
(3) C3-4 алкиниленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атом галогенов; и
R4, в случае присутствия в количестве двух или более, представляет собой независимо,
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(6) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атом галогенов,
(7) C2-6 алкинильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атом галогенов,
(8) цианогруппу или
(9) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп;
когда R4 и W3 присоединены к смежным углеродным атомам на кольце Q2, они могут быть объединены с углеродными атомами с образованием 5-8-членного циклоалканового кольца.
[0011]
[4] Соединение по любому одному из пунктов [1] - [3] или его фармацевтически приемлемая соль, где кольцо Q1 представляет собой
(1) фенильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из
(a) атома галогена,
(b) C1-6 алкила, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(c) C1-6 алкокси, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(d) циано,
(e) фенила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкил и C1-6 алкокси,
(f) 5- или 6-членного гетероарила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси и
(g) фенокси, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(2) C3-7 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из (a) - (g), определенных выше в (1) или
(3) пиридильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из (a) - (g), определенных выше в (1).
[0012]
[5] Соединение по любому одному из пунктов [1] - [4] или его фармацевтически приемлемая соль, где кольцо Q1 представляет собой фенильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из
(a) атома галогена,
(b) C1-6 алкила, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или различных атомов галогенов и
(c) C1-6 алкокси, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов.
[0013]
[6] Соединение по любому одному из пунктов [1] - [5] или его фармацевтически приемлемая соль, где W1 представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атом галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных атом галогенов.
[0014]
[7] Соединение по любому одному из пунктов [1] - [6] или его фармацевтически приемлемая соль, где W2-Q2 представляет собой -NR3aC(O)-Q2, -NR3aC(O)CH2O-Q2 или -C(O)NR3a-Q2, где R3a представляет собой атом водорода или C1-6 алкильную группу.
[0015]
[8] Соединение по любому одному из пунктов [1] - [7] или его фармацевтически приемлемая соль, где W2-Q2 представляет собой -NHC(O)-Q2 или -C(O)NH-Q2.
[0016]
[9] Соединение по любому одному из пунктов [1] - [8] или его фармацевтически приемлемая соль, где кольцо Q2 представляет собой пиридильную группу, пиримидильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу, изоксазолильную группу, изотиазолильную группу, хинолинильную группу, изохинолинильную группу, хиназолинильную группу или хиноксалинильную группу.
[0017]
[10] Соединение по любому одному из пунктов [1] - [9] или его фармацевтически приемлемая соль, где кольцо Q2 представляет собой пиридильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу, изоксазолильную группу или хинолинильную группу.
[0018]
[11] Соединение по любому одному из пунктов [1] - [10] или его фармацевтически приемлемая соль, где W3 представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси; и R5 представляет собой гидроксильную группу или C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси.
[0019]
[12] Соединение по пункту 1, которое представлено формулой (1a'):
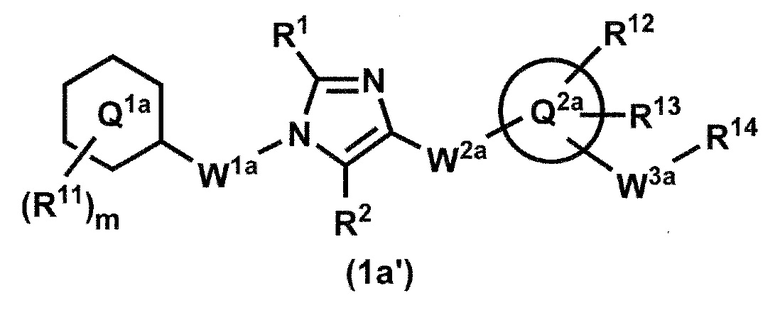
или его фармацевтически приемлемая соль, где кольцо Q1a представляет собой фенильную группу, пиридильную группу или циклогексильную группу;
m представляет собой 1, 2, 3, 4 или 5;
R11, в случае присутствия в количестве двух или более, представляет собой независимо,
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов или
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов;
R1 и R2 представляют собой независимо атом водорода, атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов;
W1a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных атомов галогенов;
W2a-Q2a представляет собой -NR3aC(O)-Q2a, -NR3aC(O)CH2O-Q2a, -C(O)NR3a-Q2a или -NR3aC(O)-CH=CH-Q2a, где R3a представляет собой атом водорода или C1-6 алкильную группу;
кольцо Q2a представляет собой 5- или 6-членную гетероарильную группу;
W3a представляет собой метиленовую группу которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси;
R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(6) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов,
(7) C2-6 алкинильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов,
(8) цианогруппу или
(9) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп;
когда R13 и W3a присоединены к смежным углеродным атомам на кольце Q2, они могут быть объединены с углеродными атомами с образованием 5- или 6-членного циклоалканового кольца; и
R14 представляет собой гидроксильную группу или C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси.
[0020]
[13] Соединение по пункту 1, которое представлено формулой (1a):
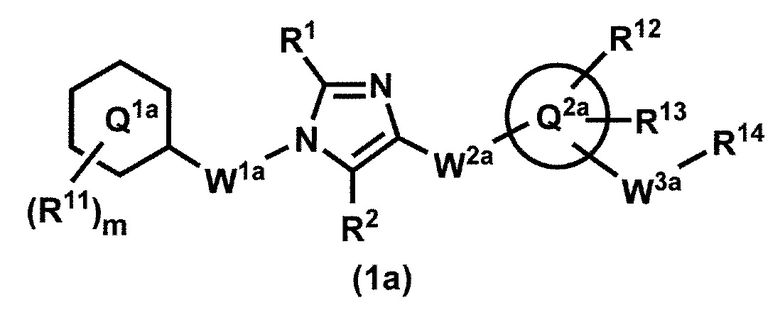
или его фармацевтически приемлемая соль, где кольцо Q1a представляет собой фенильную группу, пиридильную группу или циклогексильную группу;
m представляет собой 1, 2, 3, 4 или 5;
R11, в случае присутствия в количестве двух или более, представляет собой независимо,
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов, или
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов;
R1 и R2 представляют собой независимо атом водорода, атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов;
W1a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных атомов галогенов;
W2a-Q2a представляет собой -NR3aC(O)-Q2a, -NR3aC(O)CH2O-Q2a или -C(O)NR3a-Q2a, где R3a представляет собой атом водорода или C1-6 алкильную группу;
кольцо Q2a представляет собой 5- или 6-членную гетероарильную группу;
W3a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси;
R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(6) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов,
(7) C2-6 алкинильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов,
(8) цианогруппу или
(9) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп;
когда R13 и W3a присоединены к смежным углеродным атомам на кольце Q2a, они могут быть объединены с углеродными атомами с образованием 5- или 6-членного циклоалканового кольца; и
R14 представляет собой гидроксильную группу или C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси.
[0021]
[14] Соединение по пункту [12] или [13] или его фармацевтически приемлемая соль, где кольцо Q1a представляет собой фенильную группу.
[0022]
[15] Соединение по любому одному из пунктов [12] - [14] или его фармацевтически приемлемая соль, где W2a-Q2a представляет собой -NHC(O)-Q2a.
[0023]
[16] Соединение по любому одному из пунктов [12] - [14] или его фармацевтически приемлемая соль, где W2a-Q2a представляет собой -C(O)NH-Q2a.
[0024]
[17] Соединение по любому одному из пунктов [12] - [16] или его фармацевтически приемлемая соль, где кольцо Q2a представляет собой пиридильную группу, пиримидильная группа, пиридазильная группа, пиразильная группа, оксазолильную группу, тиазолильную группу, изоксазолильную группу или изотиазолильную группу.
[0025]
[18] Соединение по любому одному из пунктов [12] - [16] или его фармацевтически приемлемая соль, где кольцо Q2a представляет собой пиридильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу или изоксазолильную группу.
[0026]
[19] Соединение по любому одному из пунктов [12] - [16] или его фармацевтически приемлемая соль, где кольцо Q2a представляет собой пиридильную группу.
[0027]
[20] Соединение по любому одному из пунктов [12] - [19] или его фармацевтически приемлемая соль, где R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или
(6) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп.
[0028]
[21] Соединение по любому одному из пунктов [12] - [20] или его фармацевтически приемлемая соль, где R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси или
(4) аминогруппу.
[0029]
[22] Соединение по любому одному из пунктов [12] - [21] или его фармацевтически приемлемая соль, где R13 представляет собой атом галогена, C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов или аминогрупп; и R12 представляет собой атом водорода.
[0030]
[23] Соединение по любому одному из пунктов [12] - [22] или его фармацевтически приемлемая соль, где W3a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов; и R14 представляет собой гидроксильную группу.
[0031]
[24] Соединение по любому одному из пунктов [1] - [23] или его фармацевтически приемлемая соль, где R1 и R2 представляют собой атом водорода.
[0032]
[25] Соединение по пункту [1], которое представлено формулой (1b):
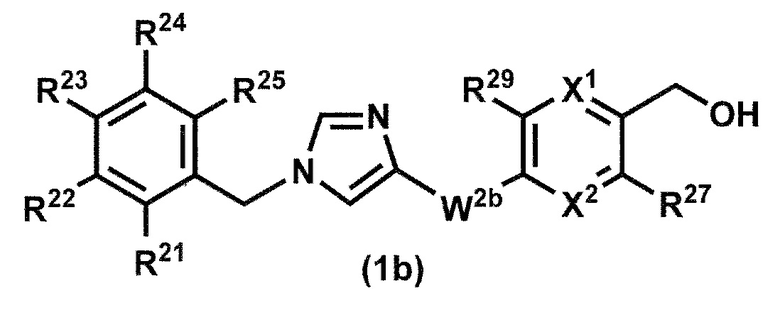
или его фармацевтически приемлемая соль, где X1 представляет собой N или CR26;
X2 представляет собой N или CR28;
при условии, что, по меньшей мере, один из X1 и X2 представляет собой N;
R21, R22, R23, R24 и R25 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов, или
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов;
W2b представляет собой -NHC(O)- или -C(O)NH-;
R26, R27, R28, и R29 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или
(6) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп.
[0033]
[26] Соединение по пункту [25] или его фармацевтически приемлемая соль, где R22 представляет собой атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов.
[0034]
[27] Соединение по пункту [25] или его фармацевтически приемлемая соль, где R22 представляет собой атом галогена или трифторметильную группу.
[0035]
[28] Соединение по любому одному из пунктов [25] - [27] или его фармацевтически приемлемая соль, где R21, R23, R24 и R25 представляют собой независимо
(1) атом водорода,
(2) атом галогена или
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов.
[0036]
[29] Соединение по любому одному из пунктов [25] - [28] или его фармацевтически приемлемая соль, где W2b представляет собой -NHC(O)-.
[0037]
[30] Соединение по любому одному из пунктов [25] - [29] или его фармацевтически приемлемая соль, где X1 представляет собой N.
[0038]
[31] Соединение по любому одному из пунктов [25] - [30] или его фармацевтически приемлемая соль, где X1 представляет собой N; и X2 представляет собой CH.
[0039]
[32] Соединение по любому одному из пунктов [25] - [31] или его фармацевтически приемлемая соль, где R27 представляет собой атом галогена, C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов или аминогрупп; и R29 представляет собой атом водорода.
[0040]
[33] Соединение по любому одному из пунктов [25] - [32] или его фармацевтически приемлемая соль, где R27 представляет собой метильную группу, замещенную с помощью от 1 до 3 атомов фтора; и R29 представляет собой атом водорода.
[0041]
[34] Соединение по любому одному из пунктов [25] - [33] или его фармацевтически приемлемая соль, где R27 представляет собой метильную группу, замещенную с помощью 2 атомов фтора; и R29 представляет собой атом водорода.
[0042]
[35] Соединение по пункту [1], которое представлено формулой (1c):
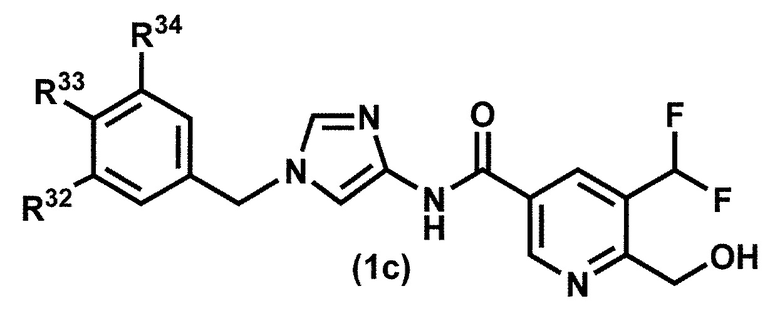
или его фармацевтически приемлемая соль, где R32 представляет собой атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов; и
R33 и R34 представляют собой независимо атом водорода или атом галогена.
[0043]
[36] Соединение по пункту [35] или его фармацевтически приемлемая соль, где R32 представляет собой атом фтора, атом хлора или трифторметильную группу.
[0044]
[37] Соединение по пункту [1], выбранное из следующих соединений, или его фармацевтически приемлемая соль:
6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид (пример 10),
6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 12),
5-(дифторметил)-6-(гидроксиметил)-N-{1-[3-(трифторметил)-бензил]-1H-имидазол-4-ил}никотинамид (пример 17),
5-(дифторметил)-6-(гидроксиметил)-N-[1-(3,4,5-трифтор-бензил)-1H-имидазол-4-ил]никотинамид (пример 18),
6-(гидроксиметил)-5-(трифторметил)-N-{1-[3-(трифторметил)-бензил]-1H-имидазол-4-ил}никотинамид (пример 19),
6-(гидроксиметил)-5-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид (пример 39),
6-(гидроксиметил)-5-метил-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 42),
5-амино-6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 45),
5-амино-6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид (пример 46),
N-[1-(3,4-дифторбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 54),
N-[1-(3-хлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 55),
5-(дифторметил)-N-{1-[4-фтор-3-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид (пример 57),
5-(дифторметил)-N-{1-[3-фтор-5-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид (пример 60),
N-[1-(3-хлор-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 61),
N-[1-(3-бром-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 62),
5-(дифторметил)-6-(гидроксиметил)-N-{1-[3-метокси-5-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 65),
5-(дифторметил)-6-(гидроксиметил)-N-{1-[4-метил-3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 70),
N-[1-(3,4-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 71),
N-[1-(3,5-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 75),
N-[1-(3-бром-5-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 76),
N-[1-(3-хлор-5-фторбензил)-1H-имидазол-4-ил]-5-(дифто-рметил)-6-(гидроксиметил)никотинамид (пример 78),
N-[1-(3,5-дифторбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 79) и
6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]пиридазин-3-карбоксамид (пример 85).
[0045]
[38] Соединение по пункту [1], выбранное из следующих соединений, или его фармацевтически приемлемая соль:
5-(дифторметил)-6-(гидроксиметил)-N-{1-[3-(трифторметил)-бензил]-1H-имидазол-4-ил}никотинамид (пример 17),
5-(дифторметил)-6-(гидроксиметил)-N-[1-(3,4,5-трифтор-бензил)-1H-имидазол-4-ил]никотинамид (пример 18),
N-[1-(3,4-дифторбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 54),
N-[1-(3-хлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 55),
5-(дифторметил)-N-{1-[4-фтор-3-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид (пример 57),
N-[1-(3-бромбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 58),
5-(дифторметил)-N-{1-[3-фтор-5-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид (пример 60),
N-[1-(3-хлор-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 61),
N-[1-(3-бром-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 62),
5-(дифторметил)-6-(гидроксиметил)-N-[1-(3-метилбензил)-1H-имидазол-4-ил]никотинамид (пример 63),
5-(дифторметил)-6-(гидроксиметил)-N-{1-[3-метокси-5-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 65),
N-[1-(4-хлор-3-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 66),
N-[1-(4-бром-3-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 67),
5-(дифторметил)-6-(гидроксиметил)-N-{1-[4-метил-3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 70),
N-[1-(3,4-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 71),
5-(дифторметил)-N-{1-[3-фтор-4-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид (пример 74),
N-[1-(3,5-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 75),
N-[1-(3-бром-5-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 76),
N-[1-(3-хлор-5-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 78),
N-[1-(3,5-дифторбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 79) и
N-[1-(3-бром-4-хлорбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 80).
[0046]
[39] Соединение по пункту [1], выбранное из следующих соединений, или его фармацевтически приемлемая соль:
6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 12),
5-(дифторметил)-6-(гидроксиметил)-N-{1-[3-(трифторметил)-бензил]-1H-имидазол-4-ил}никотинамид (пример 17),
5-(дифторметил)-6-(гидроксиметил)-N-[1-(3,4,5-трифтор-бензил)-1H-имидазол-4-ил]никотинамид (пример 18),
6-(гидроксиметил)-5-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид (пример 39),
5-амино-6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 45),
5-амино-6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид (пример 46),
5-(дифторметил)-N-{1-[4-фтор-3-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид (пример 57),
5-(дифторметил)-N-{1-[3-фтор-5-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид (пример 60),
N-[1-(3-хлор-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 61),
N-[1-(3-бром-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 62),
5-(дифторметил)-6-(гидроксиметил)-N-{1-[4-метил-3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид (пример 70),
N-[1-(3,4-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 71),
N-[1-(3,5-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 75),
N-[1-(3-бром-5-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 76),
N-[1-(3-хлор-5-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид (пример 78) и
N-[1-(3,5-дифторбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид (пример 79).
[0047]
[40] Лекарственный препарат, включающий соединение по любому одному из пунктов [1] to [39] или его фармацевтически приемлемая соль в качестве активного ингредиента.
[0048]
[41] Противоопухолевое средство, включающее соединение по любому одному из пунктов [1] - [39] или его фармацевтически приемлемую соль в качестве активного ингредиента.
[0049]
[42] Противоопухолевое средство по пункту [41], где опухоль представляет собой острый лейкоз, хронический лимфолейкоз, хронический миелолейкоз, истинную полицитемию, злокачественную лимфому, миелому, опухоль головного мозга, рак головы и шеи, рак пищевода, рак щитовидной железы, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак молочной железы, рак желудка, рак желчного пузыря или рак желчного протока, рак печени, рак поджелудочной железы, рак толстой кишки, рак прямой кишки, рак яичников, хориоэпителиому, эндометриальный рак, рак шейки матки, рак уротелия, почечно-клеточный рак, рак предстательной железы, рак яичка, опухоль Вильмса, злокачественную меланому, нейробластому, остеосаркому, саркому Юинга или саркому мягких тканей.
[0050]
[43] Лекарственный препарат, включающий соединение по любому одному из пунктов [1] - [39] или его фармацевтически приемлемую соль в комбинации с другим противораковым средством, выбранным из группы, состоящей из противоракового алкилирующего средства, противоракового антиметаболита, противоракового антибиотика, противоракового средства на основе растительного сырья, противоракового координационного соединения платины, противоракового производного камптотецина, противоракового ингибитора тирозинкиназы, ингибитора серин-треонинкиназы, ингибитора фосфолипидкиназы, моноклонального антитела, интерферона, модификатора биологического отклика, гормонального препарата, ингибитора иммунной контрольной точки, ингибитора молекулы, связанной с динамикой развития, ингибитора посттрансляционной модификации белка и другого противоракового средства или его фармацевтически приемлемой соли.
[0051]
[44] Способ лечения рака, который включает введение терапевтически эффективного количества соединения по любому одному из пунктов [1] - [39] или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом.
[0052]
[45] Применение соединения по любому одному из пунктов [1] - [39] или его фармацевтически приемлемой соли для приготовления средства для лечения рака.
[0053]
[46] Фармацевтическая композиция для применения при лечении рака, включающая соединение по любому одному из пунктов [1] - [39] или его фармацевтически приемлемую соль.
[0054]
[47] Соединение по любому одному из пунктов [1] - [39] или его фармацевтически приемлемая соль для применения при лечении рака.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0055] Настоящее соединение обладает мощным ингибирующим действием в отношении способности раковых клеток к сферообразованию. Кроме того, предпочтительное настоящее соединение обладает высокой биодоступностью при пероральном введении. Поэтому, настоящее соединение может применяться в качестве вводимого перорально противоопухолевого средства.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0056] Далее, настоящее изобретение объясняется подробно. Число углеродных атомов в определении используемого в изобретении "заместителя" может быть выражено, например, как "C1-6". В частности, термин "C1-6 алкил" используется в том же значении, что и алкильная группа, имеющая от 1 до 6 углеродных атомов.
[0057] Конкретные примеры используемого в изобретении "атома галогена" включают атом фтора, атом хлора, атом брома и атом йода.
[0058] Используемый в изобретении термин "C1-6 алкильная группа" обозначает линейную или разветвленную, насыщенную углеводородную группу, имеющую от 1 до 6 углеродных атомов. Ее предпочтительные примеры включают "C1-4 алкильную группу". Конкретные примеры "C1-6 алкильной группы" включают метил, этил, пропил, изопропил, бутил, изобутил, вторбутил, третбутил, пентил, изопентил, неопентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил и 2-этилбутил.
[0059] Используемый в изобретении термин "C2-6 алкенильная группа" обозначает линейную или разветвленную, ненасыщенную углеводородную группу, имеющую от 2 до 6 углеродных атомов и от 1 до 3 двойных связей углерод-углерод. Ее предпочтительные примеры включают "C2-4 алкенильную группу". Конкретные примеры "C2-6 алкенильной группы" включают этенил, пропенил, бутенил, пентенил и гексенил.
[0060] Используемый в изобретении термин "C2-6 алкинильная группа" обозначает линейную или разветвленную, ненасыщенную углеводородную группу, имеющую от 2 до 6 углеродных атомов и от 1 до 3 тройных связей углерод-углерод. Ее предпочтительные примеры включают "C2-4 алкинильную группу". Конкретные примеры "C2-6 алкинильной группы" включают этинил, пропинил, бутинил, пентинил и гексинил.
[0061] Используемый в изобретении термин "C1-4 алкиленовая группа" обозначает линейную или разветвленную, двухвалентную насыщенную углеводородную группу, имеющую от 1 до 4 углеродных атомов, или двухвалентную насыщенную углеводородную группу, содержащую циклическую структуру, имеющую от 3 до 4 углеродных атомов.
Конкретные примеры линейной или разветвленной "C1-4 алкиленовой группы" включают метилен, этилен, триметилен, тетраметилен, 1-метилметилен, 1-этилметилен, 1-пропилметилен, 1-метилэтилен, 2-метилэтилен и 1-этилэтилен. Ее предпочтительные примеры включают метилен и этилен.
Конкретные примеры "C1-4 алкиленовой группы", содержащей циклическую структуру, включают следующие группы:
 .
.
[0062] Используемый в изобретении термин "C3-4 алкениленовая группа" обозначает линейную или разветвленную, двухвалентную углеводородную группу, имеющую от 3 до 4 углеродных атомов и двойную связь углерод-углерод. Конкретные примеры "C3-4 алкениленовой группы" включают пропенилен и бутенилен.
[0063] Используемый в изобретении термин "C3-4 алкиниленовая группа" обозначает линейную или разветвленную, двухвалентную углеводородную группу, имеющую от 3 до 4 углеродных атомов и тройную связь углерод-углерод. Конкретные примеры "C3-4 алкиниленовой группы" включают пропинилен и бутинилен.
[0064] Фрагмент "C1-6 алкил" в используемом в изобретении термине "C1-6 алкоксильная группа" определяется как в случае приведенного выше "C1-6 алкила". Ее предпочтительные примеры включают "C1-4 алкоксильная группа". Конкретные примеры "C1-6 алкоксильной группы" включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, вторбутокси и третбутокси.
[0065] Используемый в изобретении термин "C3-10 циклоалкильная группа" обозначает 3-10-членную моноциклическую или полициклическую, насыщенную или частично-ненасыщенную углеводородную группу. Предпочтительной группой является "C3-7 циклоалкильная группа", и, более предпочтительной, циклогексильная группа. Конкретные примеры "C3-10 циклоалкильной группы" включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, декалинил, адамантил и норборнил.
[0066] Используемый в изобретении термин "C6-10 арильная группа" обозначает ароматическую углеводородную группу, имеющую от 6 до 10 углеродных атомов. Предпочтительной группой является "C6 арильная группа" (фенил). Конкретные примеры "C6-10 арильной группы" включают фенил, 1-нафтил или 2-нафтил.
[0067] Примеры используемого в изобретении термина "5-10-членная гетероарильная группа" включают 5-10-членную моно- или бициклическую ароматическую группу, которая содержит один или более одинаковых или различных (например, от 1 до 4) гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Бициклическая гетероарильная группа также охватывает конденсированную кольцевую группу моноциклической гетероарильной группы, упомянутой выше, с ароматической группой (такой как бензол и пиридин) или с неароматическим кольцом (таким как циклогексил и пиперидин). Конкретные примеры "гетероарильной группы" включают группы следующих формул:
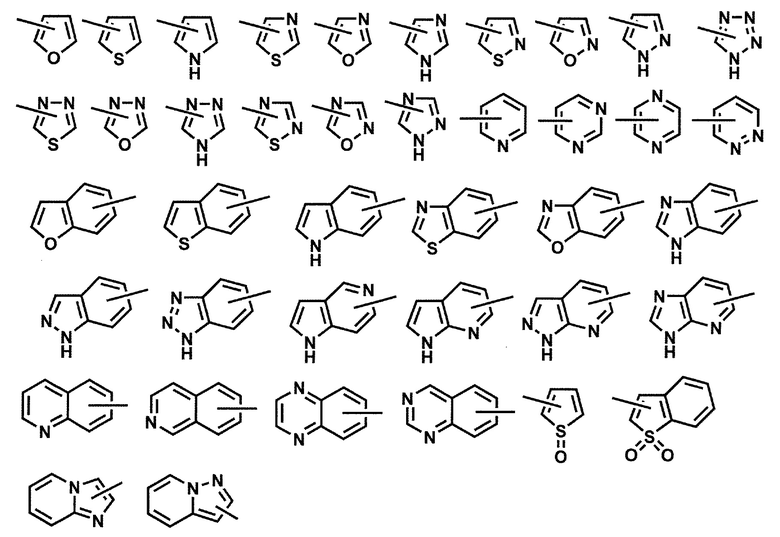
[0068] Химическая связь, изображенная в поперечном направлении в кольце в приведенных выше формулах, означает, что "группа" присоединена в любом доступном для замещения положении в кольце. Например, когда группа представляет собой гетероарильную группу следующей формулы:
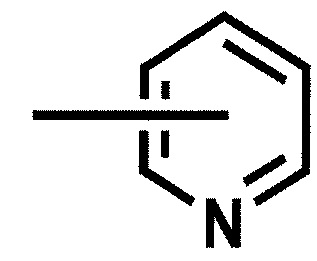 ,
,
группа обозначает 2-пиридильную группу, 3-пиридильную группу или 4-пиридильную группу.
[0069] Кроме того, когда "гетероарильная группа" представляет собой бициклическую группу, например, группу следующей формулы:
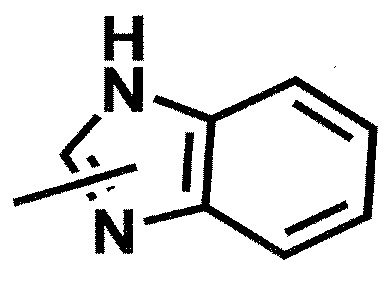 ,
,
группа может представлять собой 1-бензимидазолил, 2-бензимидазолил или 4-, 5-, 6- или 7-бензимидазолил.
[0070] Используемый в изобретении термин "аминокарбонильная группа" обозначает формильную группу, в которой атом водорода заменен на аминогруппу.
[0071] Фрагмент "C1-6 алкил" используемого в изобретении термина "C1-6алкилкарбониламиногруппа" определяется как в случае приведенного выше "C1-6 алкила". Предпочтительной группой является "C1-4 алкилкарбониламиногруппа" и, более предпочтительной, метилкарбониламиногруппа (ацетамидная группа).
[0072] Фрагмент "C6-10 арил" термина "C6-10 арилоксигруппа" определяется как в случае приведенного выше "C6-10 арила". Ее предпочтительные примеры включают "C6 арилоксигруппу" (феноксигруппу).
[0073] Фрагмент "C1-6 алкокси" используемого в изобретении термина "C1-6 алкоксикарбонильная группа" определяется как в случае приведенного выше "C1-6 алкокси". Ее предпочтительные примеры включают "C1-4 алкоксикарбонильную группу". Конкретные примеры "C1-6 алкоксикарбонильной группы" включают метоксикарбонил, этоксикарбонил и пропоксикарбонил.
[0074] Фрагмент "C1-6 алкил" используемого в изобретении термина "C1-6 алкилкарбонильная группа" определяется как в случае приведенного выше "C1-6 алкила". Ее предпочтительные примеры включают "C1-4 алкилкарбонильную группу". Конкретные примеры "C1-6 алкилкарбонильной группы" включают ацетил, этилкарбонил и пропилкарбонил.
[0075] Фрагмент "C1-6 алкил" используемого в изобретении термина "C1-6 алкилсульфонильная группа" определяется как в случае приведенного выше "C1-6 алкила". Ее предпочтительные примеры включают "C1-4 алкилсульфонильную группу". Конкретные примеры "C1-6 алкилсульфонильной группы" включают метилсульфонил, этилсульфонил и пропилсульфонил.
[0076] Фрагмент "C1-6 алкил" используемого в изобретении термина "C1-6 алкилсульфониламиногруппа" определяется как в случае приведенного выше "C1-6 алкила". Ее предпочтительные примеры включают "C1-4 алкилсульфониламиногруппу". Конкретные примеры "C1-6 алкилсульфониламиногруппы" включают метилсульфониламино, этилсульфониламино и пропилсульфониламино.
[0077] Фрагмент "C1-6 алкокси" используемого в изобретении термина "C1-6алкоксикарбониламиногруппа" определяется как в случае приведенного выше "C1-6 алкокси". Ее предпочтительные примеры включают "C1-4 алкоксикарбониламиногруппу". Конкретные примеры "C1-6 алкоксикарбониламиногруппы" включают метоксикарбониламино, этоксикарбониламино и пропоксикарбониламино.
[0078] Используемый в изобретении термин "C1-6 алкилкарбонилоксигруппа" обозначает оксигруппу, замещенную упомянутой выше "C1-6 алкилкарбонильной группой". Ее предпочтительные примеры включают "C1-4 алкилкарбонилоксигруппу". Конкретные примеры "C1-6 алкилкарбонилоксигруппы" включают ацетокси, пропионилокси и бутирилокси.
[0079] Используемый в изобретении термин "аминосульфонильная группа" обозначает сульфогруппу, в которой гидроксильная группа замещена аминогруппой.
[0080] Примеры заместителя в терминах "необязательно замещенная C1-6 алкильная группа", "необязательно замещенная C2-6 алкенильная группа", "необязательно замещенная C2-6 алкинильная группа", "необязательно замещенная C1-4 алкиленовая группа", "необязательно замещенная C3-4 алкениленовая группа", "необязательно замещенная C3-4 алкиниленовая группа", "необязательно замещенная C1-6 алкоксильная группа", "необязательно замещенная C1-6 алкилкарбонильная группа", "необязательно замещенная C1-6 алкилсульфонильная группа", "необязательно замещенная C1-6 алкоксикарбонильная группа", "необязательно замещенная C1-6 алкилкарбониламиногруппа", "необязательно замещенная C1-6 алкилсульфониламиногруппа", "необязательно замещенная C1-6 алкоксикарбониламиногруппа", "необязательно замещенная C1-6 алкилкарбонилоксигруппа" включают гидроксильную группу, атом галогена, C3-7 циклоалкильную группу и C1-6 алкоксильную группу и, предпочтительно, атом фтора.
[0081] Примеры заместителя в терминах "необязательно замещенная C6-10 арильная группа", "необязательно замещенная C3-10 циклоалкильная группа", "необязательно замещенная 5-10-членная гетероарильная группа", "необязательно замещенная 5- или 6-членная циклическая аминогруппа" и "необязательно замещенная 5- или 6-членная циклическая аминокарбонильная группа" включают
(a) атом галогена,
(b) C1-6 алкил, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(c) C1-6 алкокси, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(d) циано,
(e) C6-10 арил, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси и
(f) 5- или 6-членный гетероарил, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(g) C6-10 арилокси, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(h) гидрокси,
(i) амино, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп,
(j) аминокарбонил, в котором его аминный фрагмент может быть необязательно замещен с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп,
(k) C1-6 алкоксикарбонил, в котором фрагмент алкокси может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(l) C1-6 алкилкарбонил, в котором алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(m) C1-6 алкилсульфонил, в котором алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(n) C1-6 алкилкарбониламино, в котором алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(o) C1-6 алкилсульфониламино, в котором алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(p) C1-6 алкоксикарбониламино, в котором фрагмент алкокси может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(q) C1-6 алкилкарбонилокси, в котором алкильный фрагмент может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(r) аминосульфонил, в котором аминный фрагмент может быть необязательно замещен с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп, и
(s) C3-10 циклоалкил, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси.
[0082] Примеры заместителя в терминах "необязательно замещенная аминогруппа", "необязательно замещенная аминокарбонильная группа" и "необязательно замещенная аминосульфонильная группа" включают C1-6 алкил, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси и, предпочтительно, C1-3 алкила.
[0083] В настоящем соединении формулы (1'), предпочтительно, чтобы W1, W2, W3, R1, R2, R4, R5, n, кольцо Q1 и кольцо Q2 были такими, как показано ниже, но объем настоящего изобретения не ограничивается следующими соединениями.
[0084] Предпочтительно, чтобы W1 включал C1-4 алкиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси. Более предпочтительно, чтобы W1 представлял собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных атом галогенов; и еще более предпочтительно, метиленовую группу.
[0085] Предпочтительно, чтобы W2-Q2 включал -NR3aC(O)-Q2, -NR3aC(O)CH2O-Q2 или -C(O)NR3a-Q2, где R3a представляет собой атом водорода или C1-6 алкильную группу. Более предпочтительно, чтобы W2-Q2 представлял собой -NHC(O)-Q2 или -C(O)NH-Q2; и еще более предпочтительно, -NHC(O)-Q2.
[0086] В другом варианте осуществления, предпочтительно, чтобы W2-Q2 включал -NR3aC(O)-Q2, -NR3aC(O)CH2O-Q2, -C(O)NR3a-Q2 или -NR3aC(O)-CH=CH-Q2, где R3a представляет собой атом водорода или C1-6 алкильную группу. Более предпочтительно, чтобы W2-Q2 представлял собой -NHC(O)-Q2, -C(O)NH-Q2 или -NHC(O)-CH=CH-Q2; и еще более предпочтительно, -NHC(O)-Q2.
[0087] Предпочтительно, чтобы R1 и R2 независимо включали атом водорода, атом галогена и C1-4 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов. Более предпочтительно, чтобы R1 и R2 представляли собой атом водорода, атом хлора или метильную группу; и еще более предпочтительно, атом водорода.
[0088]
Предпочтительно, чтобы кольцо Q1 включало
(1) C6-10 арильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из
(a) атома галогена,
(b) C1-6 алкила, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(c) C1-6 алкокси, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(d) циано,
(e) фенила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(f) 5- или 6-членного гетероарила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(g) фенокси, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси,
(h) гидрокси,
(i) амино, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп, и
(j) аминокарбонила, в котором аминный фрагмент может быть необязательно замещен с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп,
(2) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из (a) - (j), определенных выше в (1) или
(3) 5-10-членную гетероарильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из (a) - (j), определенных выше в (1).
[0089] Предпочтительно, чтобы кольцо Q1 включало
(1) фенильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, выбранных из группы, состоящей из
(a) атома галогена,
(b) C1-6 алкила, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(c) C1-6 алкокси, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(d) циано,
(e) фенила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси и
(f) 5- или 6-членного гетероарила, который может быть необязательно замещен с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, C1-6 алкила и C1-6 алкокси или
(2) пиридильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из (a) - (f), определенных выше в (1).
[0090] Еще более предпочтительно, чтобы кольцо Q1 включало фенильную группу, которая может быть необязательно замещена с помощью от 1 до 5 одинаковых или различных групп, независимо выбранных из
(a) атома галогена,
(b) C1-6 алкила, который может быть необязательно замещен с помощью от 1 до 3 одинаковых или различных атомов галогенов, и
(c) C1-6 алкокси, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогенов.
[0091] Еще более предпочтительно, чтобы кольцо Q1 представляло собой фенильную группу, замещенную с помощью от 1 до 3 одинаковых или различных атомов галогенов.
[0092] Предпочтительно, чтобы кольцо Q2 представляло собой пиридильную группу, пиримидильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу, изоксазолильную группу, изотиазолильную группу, хинолинильную группу, изохинолинильную группу, хиназолинильную группу или хиноксалинильную группа. Более предпочтительно, чтобы кольцо представляло собой пиридильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу, изоксазолильную группу или хинолинильную группу; еще более предпочтительно, пиридильную группу или пиразильную группу; и наиболее предпочтительно, пиридильную группу.
[0093] Предпочтительно, чтобы R4 включал
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(6) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов,
(7) C2-6 алкинильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов,
(8) цианогруппу или
(9) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп.
[0094] Предпочтительно, чтобы R4 включал
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или
(6) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп.
[0095] Еще более предпочтительно, чтобы R4 включал
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси, или
(4) аминогруппу.
[0096] Еще более предпочтительно, чтобы R4 представлял собой метильную группу, замещенную с помощью от 1 до 3 атомов фтора; и наиболее предпочтительно, метильную группу, замещенную с помощью 2 атомов фтора.
[0097] Предпочтительно, чтобы W3 представлял собой
(1) C1-4 алкиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(2) C3-4 алкениленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или
(3) C3-4 алкиниленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов.
Более предпочтительно, чтобы W3 представлял собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси; и еще более предпочтительно, метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогенов.
Кроме того, предпочтительный вариант осуществления включает настоящее соединение, в котором один или более 1H в W3 заменены на 2H(D) (дейтерированную форму).
[0098] Предпочтительно, чтобы R5 включал гидроксильную группу или C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси. Более предпочтительно, чтобы R5 представлял собой гидроксильную группу.
[0099] n в приведенном выше пункте [1] и m в приведенном выше пункте [12] независимо выбирают из 1, 2, 3, 4 или 5. Предпочтительно, чтобы n и m представляли собой независимо 1, 2 или 3. Когда число способных к замещению положений в кольце, имеющем заместитель R4 или R11, составляет меньше 5, n и m независимо выбирают из максимально возможного числа замещений R4 или R11. Например, когда кольцо Q1 представляет собой пиридильную группу, m выбирают из 1, 2, 3 или 4.
[0100] Настоящее соединение может находиться в формах гидрата и/или сольвата. Поэтому, настоящее соединение также включает в себя гидрат и/или сольват, такой как сольват с этанолом. Кроме того, настоящее соединение включает в себя все типы кристаллических форм настоящего соединения.
Конкретные примеры фармацевтически приемлемой соли соединения формулы (1') включают соль присоединения неорганической кислоты, такую как гидрохлорид, гидробромид, сульфат, фосфат и нитрат; и соль присоединения органической кислоты, такую как ацетат, пропионат, оксалат, сукцинат, лактат, малат, тартрат, цитрат, малеат, фумарат, метансульфонат, п-толуолсульфонат, бензолсульфонат и аскорбат.
[0101] Соединение формулы (1') может находиться в форме таутомера. Поэтому, настоящее соединение также включает в себя таутомер соединения формулы (1').
[0102] Соединение формулы (1') может содержать один или более асимметрических углеродных атомов. Поэтому, настоящее соединение включает в себя не только рацемические формы соединения формулы (1'), но также и его оптически активные формы. Когда соединение формулы (1') содержит два или более асимметрических углеродных атомов, соединение может давать различные стереоизомеры. Поэтому, настоящее соединение также включает в себя стереоизомер соединения и его смесь или индивидуальный стереоизомер.
Кроме того, соединение формулы (1') включает в себя соединение, в котором один или более 1H заменены на 2H(D) (то есть дейтерированную форму).
[0103] Методы получения
Настоящие соединения могут быть получены с помощью методов, приведенных ниже, и с помощью методов, в которых используют известных соединения и известные методики синтеза.
В соответствующих случаях, каждое соединение, используемое в качестве исходного соединения, может быть использовано в форме соли. Приведенные методы являются просто примерами получения соединений, и они могут быть необязательно модифицированы специалистами в области органического синтеза.
[0104] В каждом приведенном ниже методе, любые функциональные группы, которые требуют защиты, могут быть необязательно защищены, и затем, после того, как реакция или реакции будут закончены, защиту удаляют с получением требуемого соединения, даже если использование защитных групп специально не описывается.
[0105] Используемые в изобретении защитные группы включают любые традиционные группы, описанные в многочисленной литературе, например, в монографии T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", 3rd Ed., John Wiley and Sons, inc., New York (1999). Более детально, конкретные примеры защитных групп для аминогруппы включают бензилоксикарбонил, третбутоксикарбонил, ацетил и бензил, и конкретные примеры защитных групп для гидроксильной группы включают триалкилсилил, ацетил и бензил.
[0106] Защитные группы могут быть введены и удалены широко используемыми методами в органическом синтезе (например, методом, описанном в монографии T. W. Greene and P. G. M. Wuts, ʺProtective Groups in Organic Synthesisʺ, 3rd Ed., John Wiley and Sons, inc., New York (1999)) и подобными им методами.
[0107]
Синтез 1
Одно из соединений формулы (1'), соединение формулы (1-7), получают путем присоединения каждого фрагмента в положении a и b, соответственно:
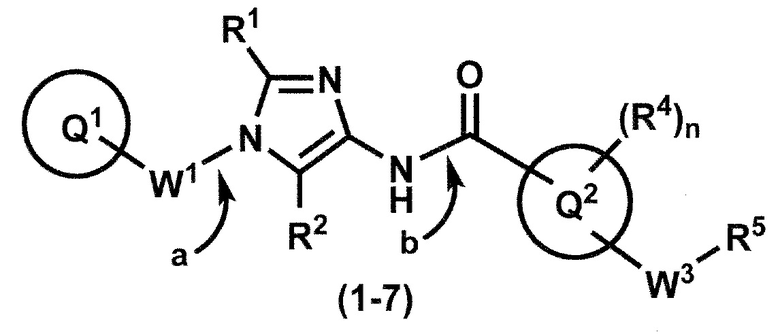
где W1, W3, R1, R2, R4, R5, n, кольцо Q1 и кольцо Q2 определены выше в [1].
[0108] Методы образования каждой связи в положения a и b могут быть проиллюстрированы следующим образом, но порядок проведения метода для образования каждой связи может быть необязательно изменен:
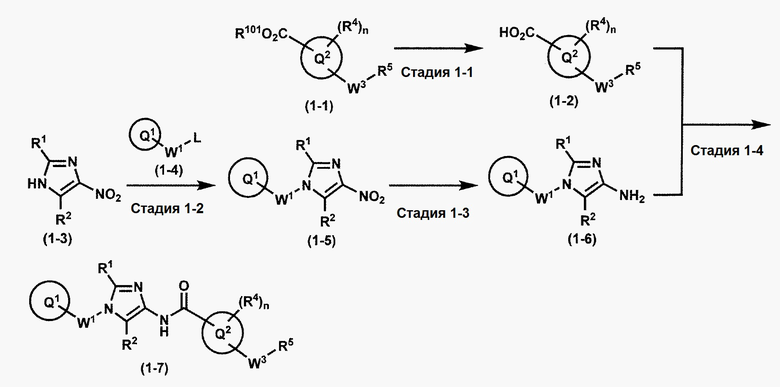
где W1, W3, R1, R2, R4, R5, n, кольцо Q1 и кольцо Q2 определены выше в [1]; R101 представляет собой C1-6 алкильную группу; L представляет собой уходящую группу (такую как атом йода, атом брома, атом хлора и замещенная сульфонильная группа (например, метансульфонильная группа и п-толуолсульфонильная группа)).
[0109] Соединение (1-1) может производиться промышленностью или может быть синтезировано известными методами (например, описанными в руководстве New Version of Heterocyclic Compound (advanced level) edited by Kodansha Scientific Ltd.).
[0110]
Стадия 1-1. Метод получения соединения (1-2)
Соединение (1-2) получают путем гидролиза соединения (1-1) известным методом (например, описанным в монографии Protective Groups in Organic Synthesis 3rd Edition (John Wiley & Sons, Inc.), Comprehensive Organic Transformation, by R. C. Larock, VCH publisher Inc., 1989).
[0111]
Стадия 1-2. Метод получения соединения (1-5)
Соединение (1-5) получают реакцией алкилирования соединений (1-3) и (1-4) в инертном растворителе в присутствии основания.
[0112] Конкретные примеры основания включают органическое основание, такое как триэтиламин, диизопропилэтиламин и пиридин; неорганическое основание, такое как карбонат калия, карбонат натрия, карбонат цезия, гидрокарбонат калия, гидрокарбонат натрия, дигидрофосфат калия, вторичный кислый фосфат калия, фосфат калия, дигидрофосфат натрия, вторичный кислый фосфат натрия, фосфат натрия, гидроксид калия, гидроксид натрия и гидрид натрия; и алкоксид металла, такой как метоксид натрия и третбутоксид калия.
[0113] Конкретные примеры инертного растворителя включают галогенированный углеводород, такой как хлороформ и дихлорметан; ароматический углеводород, такой как толуол; растворитель эфирного типа, такой как диэтиловый эфир, тетрагидрофуран (THF) и 1,4-диоксан; апротонный полярный растворитель, такой как ацетонитрил, ацетон, метилэтилкетон, N,N-диметилформамид, N-метил-2-пирролидинон и диметилсульфоксид; растворитель с основными свойствами, такой как пиридин; и их смесь.
[0114] Температура реакции обычно составляет от 0°C до 150°C, предпочтительно, от 20°C до 100°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 48 часов, предпочтительно, от 30 минут до 10 часов.
[0115]
Стадия 1-3. Метод получения соединения (1-6)
Соединение (1-6) получают восстановлением нитрогруппы в соединении (1-5). Например, могут быть использованы восстановления в кислотной среде металлом, таким как цинк, железо и олово, или солью металла, такой как хлорид олова(II); восстановления сульфидом, таким как гипосульфит натрия (Na2S2O4); и каталитические гидрирования с металлическим катализатором, таким как палладий/уголь, никель Ренея, оксид платины/уголь и родий/уголь в атмосфере водорода.
[0116] При восстановлении металлом или солью металла, количество используемого металла или соль металла обычно составляет приблизительно от 1 моля до 100 молей, предпочтительно, приблизительно от 10 молей до 30 молей на моль соединения (1-5). Кроме того, количество используемой кислоты обычно составляет приблизительно от 1 моля до 100 молей, предпочтительно, приблизительно от 10 молей до 30 молей на моль соединения (1-5). Восстановление обычно проводят в растворителе, который не оказывает отрицательного влияние на протекание реакции (например, в этаноле). Температура реакции обычно составляет от 0°C до 100°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 8 часов.
[0117] В реакции каталитического гидрирования, количество металлического катализатора, используемого для соединения (1-5), обычно составляет от 0,1% по массе до 1000% по массе, предпочтительно, от 1% по массе до 100% по массе. Реакция может быть проведена в растворителе, таком как спирт, например, в метаноле; простой эфир, такой как тетрагидрофуран; и сложный эфир, такой как этилацетат. Давление водорода обычно составляет от 0,1 МПа до 10,0 МПа, предпочтительно, от 0,1 МПа до 0,5 МПа. Температура реакции обычно составляет от 0°C до 120°C, предпочтительно, от 20°C до 80°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 72 часов, предпочтительно, от 1 часа до 48 часов.
[0118] Кроме того, реакция может быть проведена в присутствии кислотного катализатора, в соответствующих случаях. Например, в качестве кислотного катализатора используют органическую кислоту, такую как муравьиная кислота, уксусная кислота и трифторуксусная кислота, и неорганическую кислоту, такую как серная кислота, хлористоводородная кислота и бромистоводородная кислота. Количество используемой кислоты составляет 0,1 моль или более на моль соединения (1-5).
[0119]
Стадия 1-4. Метод получения соединения (1-7)
Соединение (1-7) получают реакцией соединения (1-2) с соединением (1-6) в инертном растворителе в присутствии конденсирующего средства.
[0120] Реакция может быть проведена в присутствии основания, в соответствующих случаях. Температура реакции обычно составляет приблизительно от -20°C до температуры кипения используемого растворителя, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 10 минут до 48 часов, но оно может изменяться в зависимости от использования различных условий, таких как температура реакции, конденсирующее средство, исходный материал и растворитель.
[0121] Конкретные примеры конденсирующего средства включают дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIPC), 1-этил-3-(3-диметиламинопропил)-карбодиимид (WSC), бензотриазол-1-ил-трис(диметиламино)фосфония гексафторфосфат (BOP), дифенилфосфорилазид(DPPA), N,N-карбонилдиимидазол (CDI), O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU) и дифенилхлорфосфат. В соответствующих случаях, реакция может быть проведена с введением добавки, такой как N-гидроксисукцинимид (HOSu), 1-гидроксибензотриазол (HOBt) и 3-гидрокси-4-оксо-3,4-дигидро-1,2,3-бензотриазин (HOOBt).
[0122] Конкретные примеры основания включают органическое основание, такое как триэтиламин, диизопропилэтиламин и пиридин; неорганическое основание, такое как карбонат калия, карбонат натрия, карбонат цезия, гидрокарбонат калия, гидрокарбонат натрия, дигидрофосфат калия, вторичный кислый фосфат калия, фосфат калия, дигидрофосфат натрия, вторичный кислый фосфат натрия, фосфат натрия, гидроксид калия, гидроксид натрия и гидрид натрия; и алкоксид металла, такой как метоксид натрия и третбутоксид калия.
[0123] Конкретный пример инертного растворителя включает галогенированный углеводород, такой как хлороформ и дихлорметан; ароматический углеводород, такой как толуол; растворитель эфирного типа, такой как диэтиловый эфир, тетрагидрофуран (THF) и 1,4-диоксан; апротонный полярный растворитель, такой как ацетонитрил, ацетон, метилэтилкетон, диметилформамид, N-метил-2-пирролидинон и диметилсульфоксид; растворитель с основными свойствами, такой как пиридин; и их смесь.
[0124] Соединение (1-7) также получают реакцией галогенангидрида или ангидрида, полученных из соединения (1-2), с соединением (1-6) в инертном растворителе в присутствии основания.
[0125]
Синтез 2
В соединениях формулы (1-1), соединения формул (2-5), (2-8), (2-11) и (2-13) получают, например, следующим методом.
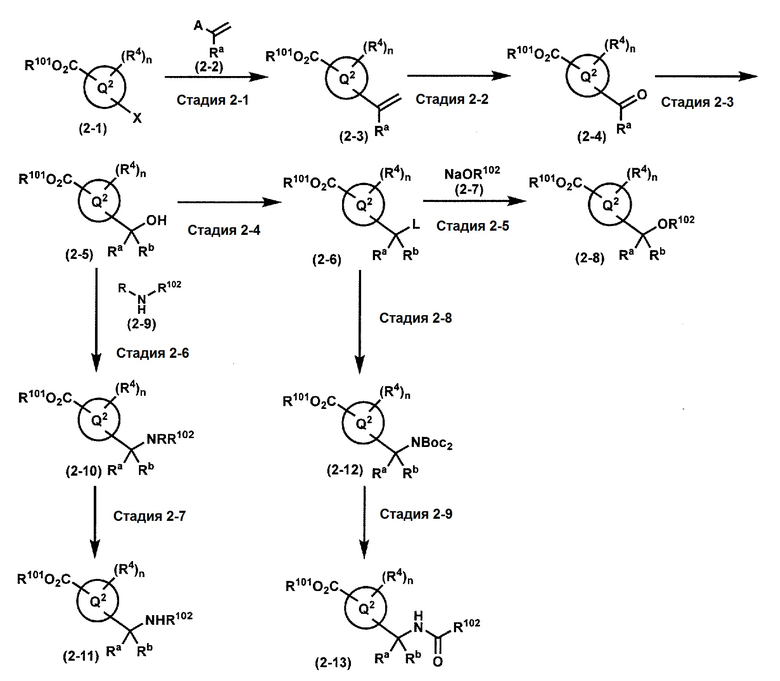
где R4, n и кольцо Q2 определены выше в [1]; A представляет собой бороновую кислоту или боронат; R101 представляет собой C1-6 алкильную группу; R102 представляет собой необязательно замещенную C1-6 алкильную группу; Ra и Rb представляют собой независимо одинаковые или разные атом водорода или метильную группу; R представляет собой бензолсульфонильную группу, замещенную одной или двумя нитрогруппами; X представляет собой атом галогена, и L представляет собой уходящую группу (такую как атом йода, атом брома, атом хлора и замещенная сульфонильная группа (например, метансульфонильная группа и п-толуолсульфонильная группа)).
[0126]
Стадия 2-1: Метод получения соединения (2-3)
Соединение (2-3) получают реакцией соединения (2-1) с соединением (2-2) в инертном растворителе в присутствии палладиевого катализатора и основания.
[0127] Конкретные примеры палладиевого катализатора включают тетракис(трифенилфосфин)палладий(0), бис(дибензилиден-ацетон)палладий(0), трис(дибензилиденацетон)дипалладий(0), бис(тритретбутилфосфин)палладий(0), [1,1'-бис(дифенилфосфино)-ферроцен]палладия(II) дихлорид.
Конкретные примеры основания включают неорганическое основание, такое как карбонат калия, карбонат натрия, карбонат цезия, фосфат калия, гидроксид калия и гидроксид натрия.
Конкретные примеры инертного растворителя включают толуол, 1,2-диметоксиэтан, 1,4-диоксан, DMF, воду и их смесь.
Температура реакции обычно составляет от 50°C до 150°C, предпочтительно, от 80°C до 120°C, но не ограничивается этим диапазоном. Кроме того, реакция может быть проведена при микроволновом облучении. Время проведения реакции обычно составляет от 1 часа до 24 часов, предпочтительно, от 2 часов до 12 часов.
[0128]
Стадия 2-2: Метод получения соединения (2-4)
Соединение (2-4) получают реакцией соединения (2-3) с тетраоксидом осмия или дигидратом осмата калия (IV) в присутствии перйодата натрия.
[0129] Примеры используемого растворителя включают ацетон, 1,4-диоксан, THF, третбутанол, воду и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 25°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 72 часов, предпочтительно, от 1 часа до 24 часов.
[0130] Кроме того, соединение (2-4) получают путем обработки соединения (2-3) источниками кислорода, включая озон, и затем путем реакции обработанного соединения с восстановителем, таким как диметилсульфид, в растворителе, таком как дихлорметан, этилацетат и метанол. Температура реакции обычно составляет от -78°C до комнатной температуры, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 72 часов, предпочтительно, от 6 часов до 24 часов.
[0131]
Стадия 2-3: Метод получения соединения (2-5)
Соединение (2-5) получают реакцией соединения (2-4) с металлорганическим реагентом или гидридным восстановителем.
[0132] Конкретные примеры металлорганического реагента включают метиллитий и метилмагний органическое соединение.
Конкретные примеры гидридного восстановителя включают боргидрид натрия и цианоборгидрид натрия.
[0133] Растворитель, используемый в реакции с металлорганическим реагентом, включает THF, диэтиловый эфир и их смесь, и растворитель, используемый в реакции с гидридным восстановителем, включает метанол, этанол, дихлорметан, толуол и их смесь.
Температура реакции обычно составляет от -78°C до 50°C, предпочтительно, от 0°C до 25°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 5 минут до 12 часов, предпочтительно, от 30 минут до 6 часов.
[0134]
Стадия 2-4: Метод получения соединения (2-6)
Соединение (2-6), в котором L представляет собой замещенную сульфонильную группу, получают реакцией соединения (2-5) с алкил- или арил-сульфонилхлоридом в инертном растворителе в присутствии основания.
[0135] Конкретные примеры алкил- или арил-сульфонилхлорида включают метансульфонилхлорид, бензолсульфонилхлорид, п-толуолсульфонилхлорид и 2,4,6-триметилбензолхлорид.
Примеры основания включают органическое основание, такое как триэтиламин, диизопропилэтиламин и пиридин; карбонат калия, карбонат натрия, карбонат цезия, гидрокарбонат калия и гидрокарбонат натрия.
Примеры инертного растворителя включают THF, дихлорметан, толуол и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 72 часов, предпочтительно, от 1 часа до 24 часов.
[0136] Соединение (2-6), в котором L представляет собой галоген, получают реакцией соединения (2-5) с галогенирующим реагентом или алкил- или арил-сульфонилхлоридом и галогенидом щелочного металла в инертном растворителе.
[0137] Примеры галогенирующего реагента включают тионилхлорид, оксалилдихлорид, трибромид фосфора, пентабромид фосфора и оксихлорид фосфора.
Конкретные примеры алкил- или арил-сульфонилхлорида включают метансульфонилхлорид, бензолсульфонилхлорид, п-толуолсульфонилхлорид и 2,4,6-триметилбензолсульфонилхлорид, и примеры галогенида щелочного металла включают хлорид лития, хлорид натрия, хлорид калия, бромид лития, бромид натрия, бромид калия, йодид лития, йодид натрия и йодид калия.
[0138]
Стадия 2-5: Метод получения соединения (2-8)
Соединение (2-8) получают реакцией соединения (2-6) с алкоксидом натрия формулы (2-7). В соответствующих случаях, алкоксид натрия может быть получен из металлического натрия и различных спиртов.
[0139] Примеры используемого растворителя включают метанол, этанол, THF, DMF, 1,4-диоксан и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 6 часов.
[0140]
Стадия 2-6: Метод получения соединения (2-10)
Соединение (2-10) получают реакцией Мицунобу соединения (2-5) и бензолсульфонамида формулы (2-9) в инертном растворителе в присутствии реагента Мицунобу.
[0141] примеры реагента Мицунобу включают диэтил азодикарбоксилат (DEAD), диизопропил азодикарбоксилат (DIAD), трифенилфосфин и трибутилфосфин. Кроме того, может быть использован цианометилентриметилфосфоран (реагент Тсуноды).
Примеры инертного растворителя включают толуол, бензол, THF, 1,4-диоксан и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 48 часов, предпочтительно, от 12 часов до 24 часов.
[0142]
Стадия 2-7: Метод получения соединения (2-11)
Соединение (2-11) получают реакцией соединения (2-10) с тиолом в присутствии основания и расщепляющейся бензолсульфонильной группы.
Примеры тиола включают тиофенол и додекантиол.
Примеры основания включают неорганическое основание, такое как карбонат цезия и карбонат калия.
Используемый растворитель включает DMF, толуол, THF, 1,4-диоксан и их смесь.
Температура реакции до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 48 часов, предпочтительно, от 3 часов до 12 часов.
[0143]
Стадия 2-8: Метод получения соединения (2-12)
Соединение (2-12) получают реакцией соединения (2-6) с дитретбутил иминодикарбоксилатом в инертном растворителе в присутствии основания.
[0144] Примеры основания включают гидрид натрия, третбутоксид калия, бис(триметилсилил)амид натрия, бис(триметилсилил)амид лития, бис(триметилсилил)амид калия и диизопропиламид лития.
Примеры инертного растворителя включают DMF, THF и их смесь.
Температура реакции обычно составляет от 0°C до 150°C, предпочтительно, от 25°C до 120°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 72 часов, предпочтительно, от 6 часов до 24 часов.
[0145]
Стадия 2-9: Метод получения соединения (2-13)
Соединение (2-13) получают путем удаления Boc группы в соединении (2-12) в кислотных условиях и затем путем обработки полученного амина ацилирующим реагентом в инертном растворителе в присутствии основания.
[0146] Примеры кислоты, используемой на стадии удаления защитной группы, включают трифторуксусную кислоту, хлористоводородную кислоту и серную кислоту.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 72 часов, предпочтительно, от 6 часов до 24 часов.
[0147] Ацилирующий реагент включает галогенангидрид карбоновой кислоты, такой как R102COCl и R102COBr; и ангидрид карбоновой кислоты, такой как (R102CO)2O. В соответствующих случаях, может быть использован промотор, такой как DMAP.
Примеры основания включают органическое основание, такое как триэтиламин, диизопропилэтиламин и пиридин; карбонат калия, карбонат натрия, карбонат цезия, гидрокарбонат калия и гидрокарбонат натрия.
Примеры инертного растворителя включают дихлорметан, 1,2-дихлорэтан, THF, толуол, этилацетат и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 6 часов.
[0148]
Синтез 3
Одно из соединений формулы (2-1), соединение формулы (3-5) получают, например, следующим методом.
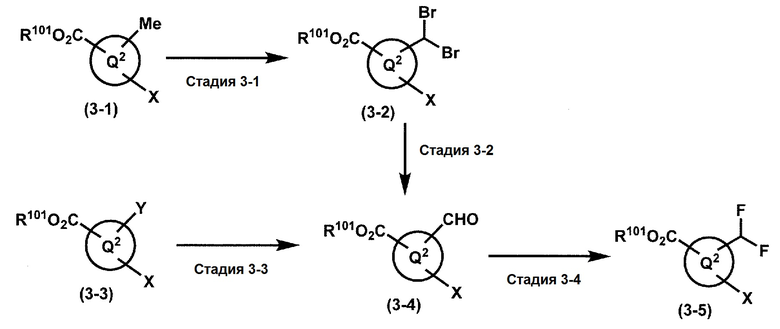
где кольцо Q2 определено выше в [1]; R101 представляет собой C1-6 алкильную группу; X представляет собой атом галогена; и Y представляет собой атом брома или атом йода.
[0149]
Стадия 3-1: Метод получения соединения (3-2)
Соединение (3-2) получают реакцией соединения (3-1) с бромирующим реагентом в инертном растворителе в присутствии радикального инициатора.
[0150] Конкретные примеры радикального инициатора включают азобисизобутиронитрил (AIBN) и пероксид бензоила (BPO).
Конкретные примеры бромирующего реагента включают N-бромсукцинимид и бром.
Примеры инертного растворителя включают тетрахлорид углерода, хлорбензол и их смесь.
Температура реакции обычно составляет от 50°C до 150°C, предпочтительно, от 80°C до 120°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 3 часов до 48 часов, предпочтительно, от 4 часов до 12 часов.
[0151]
Стадия 3-2: Метод получения соединения (3-4)
Соединение (3-4) получают реакцией соединения (3-2) с нитратом серебра в инертном растворителе.
[0152] Конкретные примеры инертного растворителя включают ацетонитрил, THF, 1,4-диоксан и их смесь.
Температура реакции обычно составляет от 50°C до 150°C, предпочтительно, от 80°C до 120°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 3 часов до 48 часов, предпочтительно, от 4 часов до 12 часов.
[0153]
Стадия 3-3: Метод получения соединения (3-4)
Соединение (3-4) также получают реакцией соединения (3-3) с металлорганическим реагентом и затем обработкой полученного соединения формилирующим реагентом.
Примеры металлорганического реагента включают комплекс изопропилмагния хлорид-хлорид лития, изопропилмагния хлорид и н-бутиллитий.
Примеры используемого растворителя включают THF, диэтиловый эфир, толуол и их смесь.
Примеры формилирующего реагента включают DMF и N-формилморфолин.
Температура реакции обычно составляет от -78°C до 50°C, предпочтительно, от -30°C до 25°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 24 часов, предпочтительно, от 1 часа до 6 часов.
[0154]
Стадия 3-4: Метод получения соединения (3-5)
Соединение (3-5) получают реакцией соединения (3-4) с деоксофторирующим реагентом в инертном растворителе.
Конкретные примеры деоксофторирующего реагента включают диэтиламиносеры трифторид (DAST), бис(2-метоксиэтил)аминосеры трифторид (Deoxo-Fluor®), XtalFluor-E®, XtalFluor-M® и 4-третбутил-2,6-диметилфенилсеры трифторид (Fluolead®). В соответствующих случаях, в качестве промотора могут быть использованы соединения, такие как DBU, триэтиламина тригидрофторид и триэтиламина дигидрофторид.
Конкретные примеры инертного растворителя включают дихлорметан, 1,2-дихлорэтан, толуол, THF и их смесь.
Температура реакции обычно составляет от -20°C до 50°C, предпочтительно, от 0°C до 25°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 10 минут до 12 часов, предпочтительно, от 30 минут до 3 часов.
[0155] Соединение (3-5) также получают реакцией соединения (3-4) с тетрафторидом серы.
[0156]
Синтез 4
Одно из соединений формулы (1-1), соединение формулы (4-3) получают, например, следующим методом.
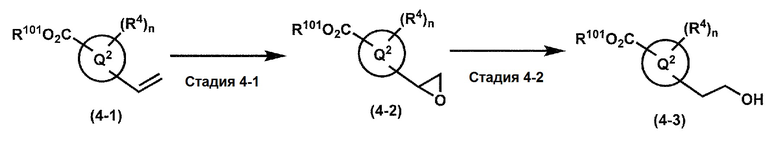
где R4, n и кольцо Q2 определены выше в [1]; и R101 представляет собой C1-6 алкильную группу.
[0157]
Стадия 4-1: Метод получения соединения (4-2)
Соединение (4-2) получают гидробромированием соединения (4-1) бромирующим реагентом в инертном растворителе и затем обработкой полученного соединения основанием.
[0158] Примеры бромирующего реагента, используемого на стадии гидробромирования, включают N-бромсукцинимид.
Примеры инертного растворителя включают третбутанол, воду, THF, 1,4-диоксан и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 6 часов.
[0159] Примеры основания, используемого на стадии обработки, включают гидрид натрия, гидрид калия, NaHMDS, третбутоксид калия, гидроксид натрия, гидроксид калия и триэтиламин.
Примеры инертного растворителя включают THF, 1,4-диоксан, DMF и их смесь.
Температура реакции обычно составляет от 0°C до 80°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 8 часов, предпочтительно, от 1 часа до 4 часов.
[0160]
Стадия 4-2: Метод получения соединения (4-3)
Соединение (4-3) получают гидрированием соединения (4-2) с палладиевым катализатором в инертном растворителе.
[0161] Примеры палладиевого катализатора включают палладий-уголь и гидроксид палладия.
Примеры используемого растворителя включают THF, метанол, этанол, 2-пропанол и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 25°C до 80°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 12 часов, предпочтительно, от 2 часов до 6 часов.
[0162]
Синтез 5
Одно из соединений формулы (1-1), соединение формулы (5-1), получают, например, следующим методом.
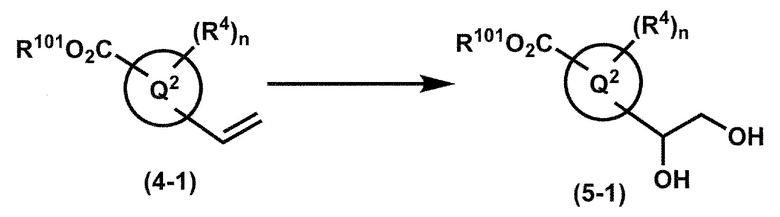
где R4, n и кольцо Q2 определены выше в [1]; и R101 представляет собой C1-6 алкильную группу группа.
[0163] Соединение (5-1) получают реакцией соединения (4-1) с тетраоксидом осмия в соответствующем растворителе в присутствии N-метилморфолин-N-оксида.
[0164] Примеры используемого растворителя включают ацетон, 1,4-диоксан, THF, третбутанол, воду и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 25°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 72 часов, предпочтительно, от 6 часов до 24 часов.
[0165]
Синтез 6
Одно из соединений формулы (1-1), соединение формулы (6-2), получают, например, следующим методом.
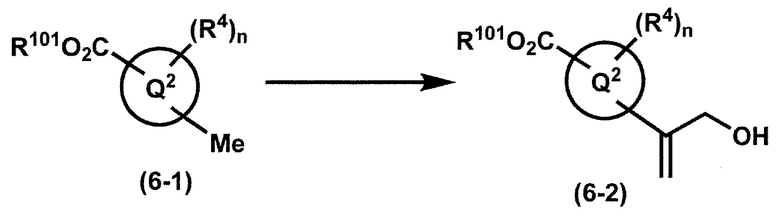
где R4, n и кольцо Q2 определены выше в [1]; и R101 представляет собой C1-6 алкильную группу.
[0166] Соединение (6-2) получают реакцией соединения (6-1) с параформальдегидом при нагревании с помощью микроволнового облучения в присутствии основания.
[0167] Примеры основания включают N,N-диизопропилэтиламин, триэтиламин, пиридин и DBU.
Примеры используемого растворителя включают воду, THF, 1,4-диоксан и их смесь.
Температура реакции обычно составляет от 100°C до 200°C, предпочтительно, от 120°C до 180°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 6 часов.
[0168]
Синтез 7
Одно из соединений формулы (1-1), соединение формулы (7-2), получают, например, следующим методом.
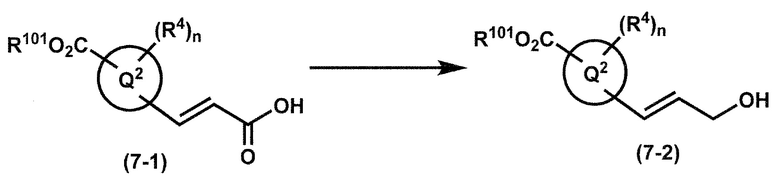
где R4, n и кольцо Q2 определены выше в [1]; и R101 представляет собой C1-6 алкильную группу.
[0169] Соединение (7-2) получают реакцией соединения (7-1) с хлорангидридом карбоновой кислоты в присутствии основания с превращением соединения в ангидрид кислоты и затем восстановлением полученного ангидрида кислоты гидридным восстановителем.
[0170] Примеры основания, используемого на стадии получения ангидрида кислоты, включают N-метилморфолин, N,N-диизопропилэтиламин, триэтиламин, пиридин и DBU.
Конкретные примеры хлорангидрида карбоновой кислоты включают изобутилхлороформиат, этилхлороформиат, метилхлороформиат и ацетилхлорид.
Примеры используемого растворителя включают DME, THF, 1,4-диоксан, дихлорметан, 1,2-дихлорэтан и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 25°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 6 часов.
[0171] Конкретные примеры гидридного восстановителя, используемого на стадии восстановления, включают боргидрид натрия и триацетоксиборгидрид натрия.
Примеры используемого растворителя включают метанол, этанол, 2-пропанол и THF.
Температура реакции обычно составляет от 0°C до 50°C, предпочтительно, от 0°C до 25°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 6 часов.
[0172]
Синтез 8
Одно из соединений формулы (1'), соединение формулы (8-3), получают, например, следующим методом.
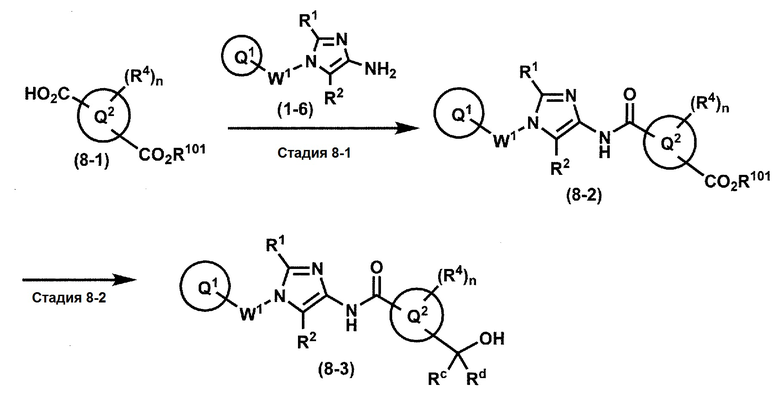
где W1, R1, R2, R4, n, кольцо Q1 и кольцо Q2 определены выше в [1]; R101 представляет собой C1-6 алкильную группу; и Rc и Rd представляют собой независимо одинаково или различно атом водорода, атом дейтерия или метильную группу.
[0173]
Стадия 8-1: Метод получения соединения (8-2)
Соединение (8-2) получают из соединений (8-1) и (1-6) методом со стадии 1-4.
[0174]
Стадия 8-2: Метод получения соединения (8-3)
Соединение (8-3) получают реакцией соединения (8-2) с металлорганическим реагентом или гидридным восстановителем в инертном растворителе.
[0175] Конкретные примеры металлорганического реагента включают метиллитий и метилмагнийорганическое соединение. Примеры используемого растворителя включают THF, диэтиловый эфир и их смесь.
[0176] Конкретные примеры гидридного восстановителя включают боргидрид натрия, боргидрид лития, алюмогидрид лития, цианоборгидрид натрия, триэтилборгидрид лития, диизобутилалюминия гидрид, бис(2-метоксиэтокси)алюмогидрид натрия, бордейтерид лития и алюмодейтерид лития. Примеры используемого растворителя включают метанол, этанол, дихлорметан, толуол и их смесь.
[0177] Температура реакции обычно составляет от -78°C до 25°C, предпочтительно, от 0°C до 25°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 5 минут до 12 часов, предпочтительно, от 30 минут до 6 часов.
[0178]
Синтез 9
В соединениях формулы (1'), соединения формул (9-2), (9-3) и (9-4) получают, например, следующим методом.
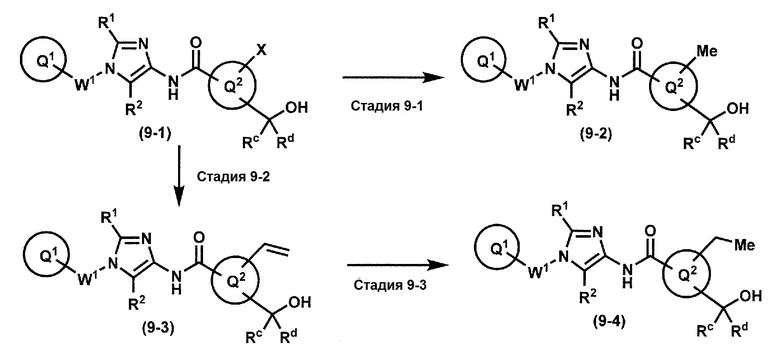
где W1, R1, R2, кольцо Q1 и кольцо Q2 определены выше в [1]; X представляет собой атом галогена; и Rc и Rd представляют собой независимо одинаково или различно атом водорода, атом дейтерия или метильную группу.
[0179]
Стадия 9-1: Метод получения соединения (9-2)
Соединение (9-2) получают катализируемой палладием реакцией кросс-сочетания соединения (9-1) с различными реагентами сочетания в инертном растворителе.
[0180] Конкретные примеры реагента сочетания включают метилхлорцинк, метилбромцинк, метилйодцинк, метилбороновую кислоту, пинаколовый эфир метилбороновой кислоты и калиевую соль метилтрифторборана.
Примеры инертного растворителя включают THF, толуол, 1,2-диметоксиэтан, 1,4-диоксан, DMF и их смесь. Конкретные примеры палладиевого реагента включают тетракис(трифенилфосфин)-палладий(0), бис(дибензилиденацетон)палладий(0), трис(дибензилиденацетон)дипалладий(0), бис(тритретбутилфосфин)-палладий(0), [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) дихлорид.
Конкретные примеры основания включают неорганическое основание, такое как карбонат калия, карбонат натрия, карбонат цезия, фосфат калия, гидроксид калия и гидроксид натрия.
Температура реакции обычно составляет от 0°C до 150°C, предпочтительно, от 25°C до 100°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 72 часов, предпочтительно, от 1 часа до 24 часов.
[0181]
Стадия 9-2: Метод получения соединения (9-3)
Соединение (9-3) получают из соединения (9-1) методом со стадии 2-1.
[0182]
Стадия 9-3: Метод получения соединения (9-4)
Соединение (9-4) получают гидрированием виниловой группы в соединении (9-3) с металлическим катализатором в соответствующем растворителе.
[0183] Примеры металлического катализатора включают палладий/уголь, никель Ренея, оксид платины/уголь и родий/уголь.
Количество металлического катализатора, используемого для соединения (9-2), составляет обычно от 0,1% по массе до 1000% по массе, предпочтительно, от 1% по массе до 100% по массе.
Примеры растворителя включают спирт, такой как метанол; простой эфир, такой как тетрагидрофуран; и сложный эфир, такой как этилацетат.
Давление водорода составляет обычно от 0,1 МПа до 10 МПа, предпочтительно, от 0,1 МПа до 0,5 МПа.
Температура реакции обычно составляет от 0°C до 120°C, предпочтительно, от 20°C до 80°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 72 часов, предпочтительно, от 1 часа до 48 часов.
[0184] Соединение (9-4) также получают реакцией соединения (9-3) с гидратом гидразина.
[0185]
Синтез 10
Одно из соединений формулы (1'), соединение формулы (10-4), получают, например, следующим методом.
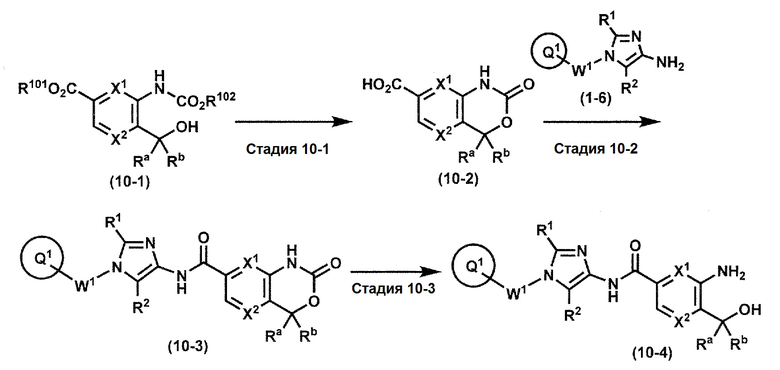
где W1, R1, R2 и кольцо Q1 определены выше в [1]; X1 и X2 определены выше в [25]; R101 представляет собой C1-6 алкильную группу, R102 представляет собой C1-6 алкильную группу, бензильную группу и аллильную группу; и Ra и Rb представляют собой независимо одинаково или различно атом водорода или метильную группу.
[0186] Соединение (10-1) может быть получено, например, методом синтеза 2.
[0187]
Стадия 10-1: Метод получения соединения (10-2)
Соединение (10-2) получают реакцией соединения (10-1) с водным раствором щелочи.
[0188] Примеры водного раствора щелочи включают водный раствор гидроксида натрия, водный раствор гидроксида калия и водный раствор гидроксида лития, и его концентрация обычно составляет 1-10 моль/л, предпочтительно, 1-5 моль/л.
Примеры используемого растворителя включают метанол, этанол, 2-пропанол, THF, 1,4-диоксан и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 10 минут до 24 часов, предпочтительно, от 30 минут до 12 часов.
[0189]
Стадия 10-2: Метод получения соединения (10-3)
Соединение (10-3) получают из соединений (10-2) и (1-6) методом со стадии 1-4.
[0190]
Стадия 10-3: Метод получения соединения (10-4)
Соединение (10-4) получают реакцией соединения (10-3) с водным раствором щелочи.
[0191] Примеры водного раствора щелочи включают водный раствор гидроксида натрия, водный раствор гидроксида калия и водный раствор гидроксида лития, и его концентрация обычно составляет 1-10 моль/л, предпочтительно, 1-5 моль/л.
Примеры используемого растворителя включают метанол, этанол, 2-пропанол, THF, 1,4-диоксан и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 24 часов, предпочтительно, от 1 часа до 6 часов.
[0192]
Синтез 11
Одно из соединений формулы (1'), соединение формулы (11-4), получают, например, следующим методом.
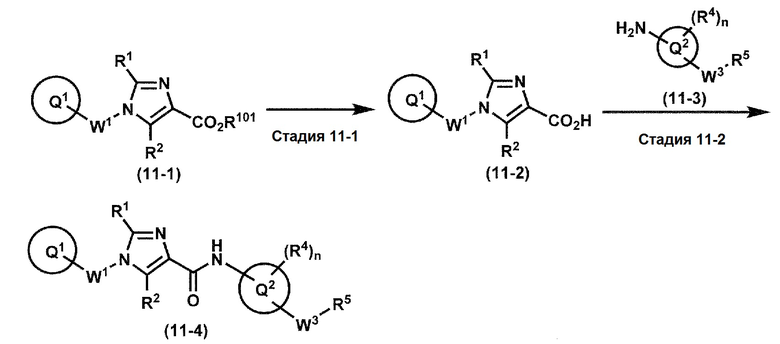
где W1, W3, R1, R2, R4, R5, n, кольцо Q1 и кольцо Q2 определены выше в [1]; и R101 представляет собой C1-6 алкильную группу.
[0193] Соединение (11-1) может производиться промышленностью или может быть синтезировано известными методами (например, как описано в патентном документе WO 2014/125444).
[0194]
Стадия 11-1: Метод получения соединения (11-2)
Соединение (11-2) получают путем гидролиза соединения (11-1) известным методом (например, описанным в монографии Protective Groups in Organic Synthesis 3rd Edition (John Wiley & Sons, Inc.), Comprehensive Organic Transformation, by R. C. Larock, VCH publisher Inc., 1989).
[0195]
Стадия 11-2: Метод получения соединения (11-4)
Соединение (11-4) получают из соединений (11-2) и (11-3) методом со стадии 1-4.
[0196]
Синтез 12
Одно из соединений формулы (1'), соединение формулы (12-5), получают, например, следующим методом.
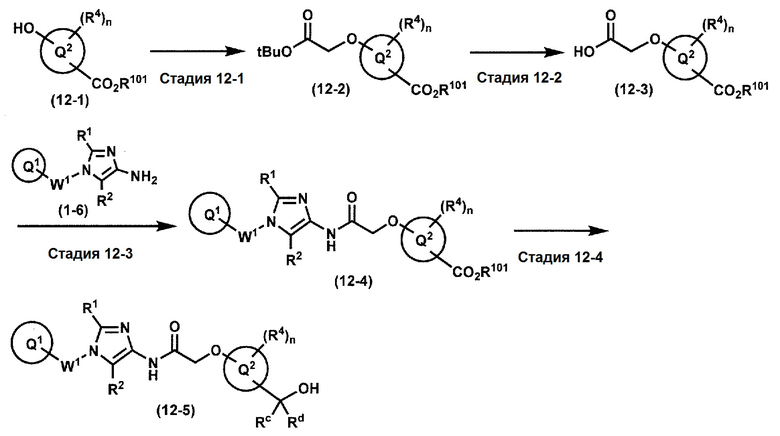
где W1, R1, R2, R4, n, кольцо Q1 и кольцо Q2 определены выше в [1]; R101 представляет собой C1-6 алкильную группу; и Rc и Rd представляют собой независимо одинаково или различно атом водорода, атом дейтерия или метильную группу.
[0197]
Стадия 12-1: Метод получения соединения (12-2)
Соединение (12-2) получают реакцией соединения (12-1) с галогенацетатом в инертном растворителе в присутствии основания.
[0198] Конкретные примеры галогенацетата включают третбутилбутилхлорацетат, третбутилбромацетат и третбутилйодацетат.
Примеры основания включают карбонат калия, карбонат натрия, карбонат цезия, третбутоксид калия, гидрид натрия, бис(триметилсилил)амид натрия, бис(триметилсилил)амид лития, бис(триметилсилил)амид калия и диизопропиламид лития.
Примеры инертного растворителя включают DMF, THF, ацетонитрил и их смесь.
Температура реакции обычно составляет от 25°C до 150°C, предпочтительно, от 70°C до 100°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 10 минут до 12 часов, предпочтительно, от 20 минут до 6 часов.
[0199]
Стадия 12-2: Метод получения соединения (12-3)
Соединение (12-3) получают удалением группы третбутилового эфира в соединении (12-2) в кислотной среде.
Примеры кислоты, используемой на стадии удаления защитной группы, включают хлористоводородную кислоту, серную кислоту, HBr, HI и TFA.
Примеры используемого растворителя включают метанол, этанол, дихлорметан, 1,2-дихлорэтан, THF, 1,4-диоксан, этилацетат, их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 25°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 24 часов, предпочтительно, от 2 часов до 12 часов.
[0200]
Стадия 12-3: Метод получения соединения (12-4)
Соединение (12-4) получают из соединений (12-3) и (1-6) методом со стадии 1-4.
[0201]
Стадия 12-4: Метод получения соединения (12-5)
Соединение (12-5) получают из соединения (12-4) методом со стадии 8-2.
[0202]
Синтез 13
Соединение формулы (2-5) также получают из соединения (2-1), например, следующим методом.
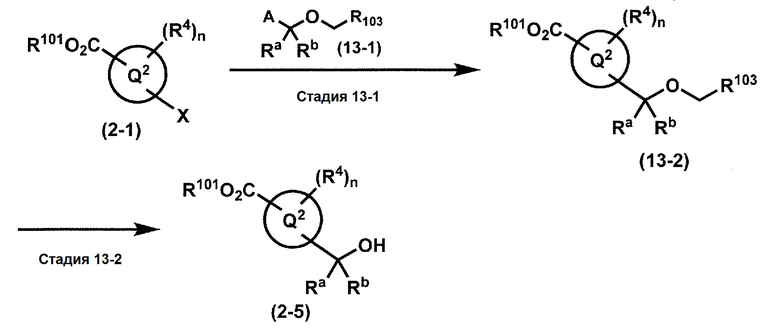
где R4, n и кольцо Q2 определены выше в [1]; R101 представляет собой C1-6 алкильную группу; Ra и Rb представляют собой независимо одинаково или различно атом водорода или метильную группу; A представляет собой бороновую кислоту, боронат, BF3K или BF3Na; R103 представляет собой необязательно замещенную фенильную группу; и X представляет собой атом галогена.
[0203]
Стадия 13-1: Метод получения соединения (13-2)
Соединение (13-2) получают реакцией соединения (2-1) с соединением (13-1) в инертном растворителе в присутствии палладиевого катализатора и основания.
[0204] Примеры палладиевого катализатора включают тетракис(трифенилфосфин)палладий(0), бис(дибензилиденацетон)-палладий(0), трис(дибензилиденацетон)дипалладий(0), бис(тритретбутилфосфин)палладий(0), [1,1'-бис(дифенилфосфино)-ферроцен]палладия(II) дихлорид.
Примеры основания включают карбонат натрия, карбонат калия, карбонат цезия, фосфат калия, гидроксид натрия и гидроксид калия.
Примеры инертного растворителя включают 1,4-диоксан, THF, 1,2-диметоксиэтан, воду и их смесь.
Температура реакции обычно составляет от 50°C до 200°C, предпочтительно, от 80°C до 150°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 48 часов, предпочтительно, от 6 часов до 18 часов.
[0205]
Стадия 13-2: Метод получения соединения (2-5)
Соединение (2-5) получают гидрированием бензильной группы в соединении (13-2) с металлическим катализатором в соответствующем растворителе для удаления группы.
[0206] Примеры металлического катализатора включают палладий/уголь, никель Ренея, оксид платины/уголь и родий/уголь.
Количество металлического катализатора, используемого для соединения (13-2), составляет обычно от 0,1% по массе до 1000% по массе, предпочтительно, от 1% по массе до 100% по массе.
Примеры растворителя включают спирт, такой как метанол; простой эфир, такой как тетрагидрофуран; и сложный эфир, такой как этилацетат.
Давление водорода обычно составляет от 0,1 МПа до 10,0 МПа, предпочтительно, от 0,1 МПа до 0,5 МПа.
Температура реакции обычно составляет от 0°C до 120°C, предпочтительно, от 20°C до 80°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 72 часов, предпочтительно, от 1 часа до 48 часов.
[0207] Кроме того, когда R103 представляет собой фенильную группу, замещенную группой (группами), такой как 4-метоксильная группа и 2,4-диметоксильная группа, соединение (2-5) получают реакцией соединения (13-2) с кислотой.
[0208] Примеры кислоты включают TFA, муравьиную кислоту, хлористоводородную кислоту, серную кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту и (±) 10-камфорсульфоновую кислоту.
Примеры используемого растворителя включают дихлорметан, 1,2-дихлорэтан, 1,4-диоксан, THF, толуол, этилацетат, метанол, этанол, 2-пропанол и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 25°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 9 часов.
[0209]
Синтез 14
Одно из соединений формулы (1'), соединение формулы (14-3), получают, например, следующим методом.
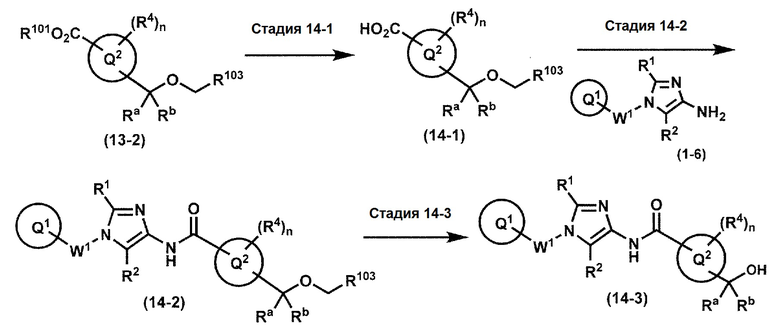
где W1, R1, R2, R4, n, кольцо Q1 и кольцо Q2 определены выше в [1]; R101 представляет собой C1-6 алкильную группу; Ra и Rb представляют собой независимо одинаково или различно атом водорода или метильную группу; и R103 представляет собой необязательно замещенную фенильную группу.
[0210]
Стадия 14-1: Метод получения соединения (14-1)
Соединение (14-1) получают путем гидролиза соединения (13-2) известным методом (например, описанным в монографии Protective Groups in Organic Synthesis 3rd Edition (John Wiley & Sons, Inc.), Comprehensive Organic Transformation, by R. C. Larock, VCH publisher Inc., 1989).
В этом случае, соединение (14-1) может быть также использовано в следующей реакции без выделения.
Например, соединение (13-2) гидролизуют приведенным выше методом с нейтрализацией реакционного раствора и затем удаляют растворитель с получением соединения (14-1), и полученное соединение может быть использовано на стадии 14-2.
[0211]
Стадия 14-2: Метод получения соединения (14-2)
Соединение (14-2) получают из соединений (14-1) и (1-6) методом со стадии 1-4.
[0212]
Стадия 14-3: Метод получения соединения (14-3)
Соединение (14-3) получают гидрированием бензильной группы в соединении (14-2) с металлическим катализатором в соответствующем растворителе с удалением группы.
[0213] Примеры металлического катализатора включают палладий/уголь, никель Ренея, оксид платины/уголь и родий/уголь.
Количество металлического катализатора, используемого для соединения (14-2), обычно составляет от 0,1% по массе до 1000% по массе, предпочтительно, от 1% по массе до 100% по массе.
Примеры растворителя включают спирт, такой как метанол; простой эфир, такой как тетрагидрофуран; и сложный эфир, такой как этилацетат.
Давление водорода обычно составляет от 0,1 МПа до 10 МПа, предпочтительно, от 0,1 МПа до 0,5 МПа.
Температура реакции обычно составляет от 0°C до 120°C, предпочтительно, от 20°C до 80°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 72 часов, предпочтительно, от 1 часа до 48 часов.
[0214] Кроме того, когда R103 представляет собой фенильную группу, замещенную группой (группами), такой как 4-метоксильная группа и 2,4-диметоксильная группа, соединение (14-3) получают реакцией соединения (14-2) с кислотой.
[0215] Примеры кислоты включают TFA, муравьиную кислоту, хлористоводородную кислоту, серную кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту и (±) 10-камфорсульфоновую кислоту.
Примеры используемого растворителя включают дихлорметан, 1,2-дихлорэтан, 1,4-диоксан, THF, толуол, этилацетат, метанол, этанол, 2-пропанол и их смесь.
Температура реакции обычно составляет от 0°C до 100°C, предпочтительно, от 25°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 30 минут до 12 часов, предпочтительно, от 1 часа до 9 часов.
[0216]
Синтез 15
Одно из соединений формулы (1'), соединение формулы (14-2), получают, например, следующим методом.
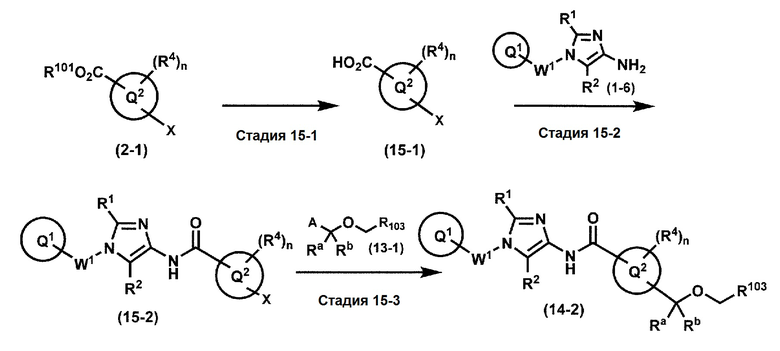
где W1, R1, R2, R4, n, кольцо Q1 и кольцо Q2 определены выше в [1]; R101 представляет собой C1-6 алкильную группу; Ra и Rb представляют собой независимо одинаково или различно атом водорода или метильную группу; X представляет собой атом галогена; A представляет собой бороновую кислоту, боронат, BF3K или BF3Na; и R103 представляет собой необязательно замещенную фенильную группу.
[0217]
Стадия 15-1: Метод получения соединения (15-1)
Соединение (15-1) получают путем гидролиза соединения (2-1) известным методом (например, описанным в монографии Protective Groups in Organic Synthesis 3rd Edition (John Wiley & Sons, Inc.), Comprehensive Organic Transformation, by R. C. Larock, VCH publisher Inc., 1989).
В этом случае, соединение (15-1) может быть также использовано в следующей реакции без выделения.
Например, соединение (2-1) гидролизуют приведенным выше методом с нейтрализацией реакционного раствора, и затем удаляют растворитель с получением соединения (15-1), и полученное соединение может быть использовано на стадии 15-2.
[0218]
Стадия 15-2: Метод получения соединения (15-2)
Соединение (15-2) получают из соединений (15-1) и (1-6) методом со стадии 1-4.
[0219]
Стадия 15-3: Метод получения соединения (14-2)
Соединение (14-2) получают реакцией соединения (15-2) с соединением (13-1) в инертном растворителе в присутствии палладиевого катализатора и основания.
[0220] Примеры палладиевого катализатора включают тетракис(трифенилфосфин)палладий(0), бис(дибензилиденацетон)-палладий(0), трис(дибензилиденацетон)дипалладий(0), бис(тритретбутилфосфин)палладий(0), [1,1'-бис(дифенилфосфино)-ферроцен]палладия(II) дихлорид.
Примеры основания включают карбонат натрия, карбонат калия, карбонат цезия, фосфат калия, гидроксид натрия и гидроксид калия.
Примеры инертного растворителя включают 1,4-диоксан, THF, 1,2-диметоксиэтан, воду и их смесь.
Температура реакции обычно составляет от 50°C до 200°C, предпочтительно, от 80°C до 150°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 1 часа до 48 часов, предпочтительно, от 6 часов до 18 часов.
[0221]
Синтез 16
Одно из соединений формулы (1'), соединение формулы (1-7), получают, например, следующим методом.
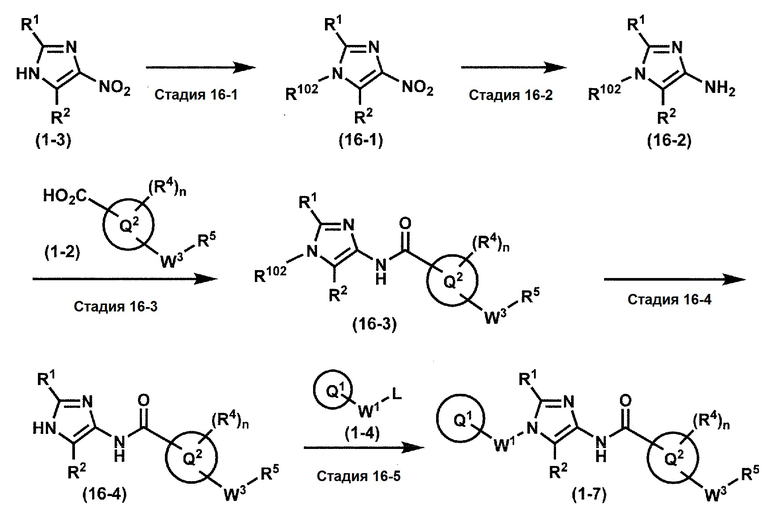
где W1, W3, R1, R2, R4, R5, n, кольцо Q1 и кольцо Q2 определены выше в [1]; R102 представляет собой защитную группу; и L представляет собой уходящую группу (такую как атом йода, атом брома, атом хлора и замещенная сульфонилоксильная группа (такая как метансульфонилоксильная группа и п-толуолсульфонилоксильная группа)).
[0222]
Стадия 16-1: Метод получения соединения (16-1)
Соединение (16-1) получают путем введения защитной группы в атом азота в 1-положение имидазольной группы в соединении (1-3) в инертном растворителе. Примеры защитной группы включают 2-(триметилсилил)этоксиметил, бензилоксикарбонил, третбутокси-карбонил, ацетил и бензил.
[0223] Например, когда вводят 2-(триметилсилил)этокси-метильную группу, соединение (16-1) получают реакцией соединения (1-3) с 2-(триметилсилил)этоксиметилхлоридов в инертном растворителе в присутствии основания.
[0224] Примеры основания включают карбонат калия, карбонат натрия, карбонат цезия, третбутоксид калия, гидрид натрия, бис(триметилсилил)амид натрия, бис(триметилсилил)амид лития, бис(триметилсилил)амид калия и диизопропиламид лития.
Примеры инертного растворителя включают DMF, THF, ацетонитрил и их смесь.
Температура реакции обычно составляет от 0°C до 150°C, предпочтительно, от 0°C до 100°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 10 минут до 24 часов, предпочтительно, от 20 минут до 6 часов.
[0225]
Стадия 16-2: Метод получения соединения (16-2)
Соединение (16-2) получают из соединения (16-1) методом со стадии 1-3.
[0226]
Стадия 16-3: Метод получения соединения (16-3)
Соединение (16-3) получают из соединений (16-2) и (1-2) методом со стадии 1-4.
[0227]
Стадия 16-4: Метод получения соединения (16-4)
Соединение (16-4) получают удалением защитной группы в атоме азота имидазольной группы в соединении (16-3) в инертном растворителе.
[0228] Например, когда удаляют 2-(триметилсилил)этокси-метильную группу, соединение (16-4) получают реакцией соединения (16-3) с кислотой или фторирующим реагентом.
[0229] примеры кислоты включают TFA, муравьиную кислоту, хлористоводородную кислоту, серную кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту и (±) 10-камфорсульфоновую кислоту.
Примеры фторирующего реагента включают тетрабутиламмония фторид.
Примеры используемого растворителя включают дихлорметан, 1,2-дихлорэтан, 1,4-диоксан, THF, толуол, этилацетат, метанол, этанол, 2-пропанол и их смесь.
Температура реакции обычно составляет от 0°C до 150°C, предпочтительно, от 0°C до 50°C, но не ограничивается этим диапазоном. Время проведения реакции обычно составляет от 5 минут до 24 часов, предпочтительно, от 1 часа до 9 часов.
[0230]
Стадия 16-5: Метод получения соединения (1-7)
Соединение (1-7) получают из соединений (16-4) и (1-4) методом со стадии 1-2.
[0231] Промежуточные соединения и требуемые соединения в приведенных выше синтезах могут быть выделены и очищены традиционными для органического синтеза методами очистки, такими как нейтрализация, фильтрация, экстракция, промывка, сушка, концентрирование, перекристаллизация и все типы хроматографии. Промежуточные соединения могут быть также использованы в следующей реакции без какой-либо специальной очистки.
[0232] Оптически активный продукт по настоящему изобретению может быть получен из оптически активного исходного материала или промежуточного соединения или путем оптического разделения рацемата конечного продукта. Метод оптического разделения включает метод физического разделения с использованием оптически активной колонки и метод химического разделения, такой как метод фракционной кристаллизации. Диастереомер настоящего соединения может быть получен, например, методом фракционной кристаллизации.
[0233] Фармацевтически приемлемая соль соединения формулы (1') может быть получена, например, смешением соединения формулы (1') с фармацевтически приемлемой кислотой в растворителе, таком как вода, метанол, этанол и ацетон.
[0234] Настоящее соединение применяют, например, в качестве противоопухолевого средства (противоракового средства). Соответствующий тип рака включает, но этим не ограничивая, опухоль кроветворной ткани и солидный рак. Конкретные примеры опухоли кроветворной ткани включают острый лейкоз, хронический лимфолейкоз, хронический миелолейкоз, истинную полицитемию, злокачественную лимфому и миелому, а конкретные примеры солидного рака включают опухоль головного мозга, рак головы и шеи, рак пищевода, рак щитовидной железы, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак молочной железы, рак желудка, рак желчного пузыря или рак желчного протока, рак печени, рак поджелудочной железы, рак толстой кишки, рак прямой кишки, рак яичников, хориоэпителиому, эндометриальный рак, рак шейки матки, рак уротелия, почечно-клеточный рак, рак предстательной железы, рак яичка, опухоль Вильмса, злокачественную меланому, нейробластому, остеосаркому, саркому Юинга и саркому мягких тканей.
Противоопухолевое средство применяют для профилактики и/или лечения рака, и предполагается, что противоопухолевое средство приводит к редукции или исчезновению раковой опухоли или торможению роста раковой опухоли до определенного уровня. Используемый в изобретении термин "профилактика" означает введение активного ингредиента по настоящему изобретению здоровому субъекту, у которого не развивается заболевание. Например, целью профилактики является предотвращение развития заболевания. Используемый в изобретении термин "лечение" означает введение активного ингредиента по настоящему изобретению человеку, у которого диагностировано врачом развитие заболевания (то есть, пациенту). Например, целью лечения является облегчение заболевания или его симптома, торможение роста раковой опухоли или улучшение состояния пациента состояния, предшествующего развитию заболевания. Кроме того, даже если противоопухолевое средство вводят с целью предотвращения усугубления заболевания или его симптома или роста раковой опухоли, это введение называют "лечением" когда субъектом, которому вводят лекарственное средство, является пациент.
[0235] Настоящее соединение обладает значительным ингибирующим действием в отношении способности раковых стволовых клеток к самообновлению, и поэтому, предполагается, что настоящее соединение может применяться в качестве нового противоопухолевого средства для ингибирования постоянной пролиферации, метастазирования и повторного возникновения злокачественных опухолей из раковых стволовых клеток.
[0236] Настоящее соединение может быть приготовлено в виде подходящей лекарственной формы и введено перорально или парентерально. Примеры лекарственной формы включают, но этим не ограничивая, таблетку, капсулу, порошок, гранулу, раствор, суспензию, инъекцию, пластырь и примочку. Лекарственные препараты изготавливают с использованием фармацевтически приемлемой добавки (добавок) известным методом.
[0237] В соответствующих случаях, может быть использована такая добавка, как наполнитель, разрыхлитель, связующее вещество, суспендирующее вещество, смазывающее вещество, образующее покрытие вещество, растворитель, солюбилизатор, загуститель, диспергирующее вещество, стабилизатор, подсластитель и ароматизатор. Конкретные примеры включают лактозу, маннит, кристаллическую целлюлозу, низкозамещенную гидроксипропилцеллюлозу, кукурузный крахмал, частично прежелатизированный крахмал, кармелозу кальция, кроскармелозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливиниловый спирт, стеарат магния, стеарилфумарат натрия, полиэтиленгликоль, пропиленгликоль, оксид титана и тальк.
[0238] Настоящее соединение может применяться в комбинации с другим лекарственным средством (средствами) для усиления его терапевтического действия и/или снижения его побочных эффектов. Конкретно, настоящее соединение может применяться в комбинации с таким лекарственным средством, как гормональное терапевтическое средство, химиотерапевтическое лекарственное средство, иммунотерапевтическое лекарственное средство или фактор роста клеток и лекарственное средства для ингибирования его воздействия на рецепторы. Далее, лекарственное средство, которое может применяться в комбинации с настоящим соединением, называют "лекарственным средством для комбинированной терапии".
[0239] Примеры лекарственного средства для комбинированной терапии включают противораковое алкилирующее средство, противораковый антиметаболит, противораковый антибиотик, противораковое средство на основе растительного сырья, противораковое координационное соединение платины, противораковое производное камптотецина, противораковый ингибитор тирозинкиназы, серин-треонинкиназу, фосфолипидкиназу, моноклональное антитело, интерферон, модификатор биологического отклика, гормональный препарат, ингибитор иммунной контрольной точки, ингибитор молекулы, связанной с динамикой развития, ингибитор посттрансляционной модификации белка и другие противораковые средства.
[0240] На время осуществления введения настоящего соединения и лекарственного средства для комбинированной терапии не накладывают конкретных ограничений, и они могут быть введены субъекту одновременно или введены последовательно с временным интервалом. Кроме того, настоящее соединение и лекарственное средство для комбинированной терапии могут быть введены в форме комбинированного лекарственного средства. Доза лекарственного средства для комбинированной терапии может быть необязательно определена на основе той дозы, которую обычно применяют в клинике. Кроме того, соотношение при объединении настоящего соединения и лекарственного средства для комбинированной терапии может быть необязательно определено с учетом субъекта, которому осуществляют введение, способа введения, заболевания, подвергаемого лечению, симптома и его комбинации. Например, когда субъектом является человек, лекарственное средство для комбинированной терапии может применяться в количестве от 0,01 до 100 частей по массе относительно 1 части по массе настоящего соединения. Кроме того, для предотвращения побочных эффектов настоящего соединения, в комбинации с настоящим соединением может применяться лекарственное средство (лекарственное средство для комбинированной терапии), такое как противорвотное средство, снотворное средство и противосудорожное средство.
[0241] Доза может изменяться для каждого соединения и в зависимости от различных параметров, таких как заболевание пациента, его возраст, масса тела, пол, симптом и способ введения. Обычно, настоящее соединение вводят взрослому человеку (масса тела: 50 кг) в дозе от 0,1 до 1000 мг/сутки, предпочтительно, в дозе от 0,1 до 300 мг/сутки, которая может быть введена один раз в сутки или 2 или 3 раза в сутки. Кроме того, настоящее соединение может быть введено от одного раза в несколько дней до одного раза в несколько недель.
ПРИМЕРЫ
[0242] Далее, изобретение иллюстрируют более подробно с помощью справочных примеров, примеров и примеров испытаний, но они не являются ограничениями для изобретения. Химические названия соединений, приведенных в следующих далее справочных примерах и примерах, необязательно соответствуют правилам номенклатуры Международного союза теоретической и прикладной химии (IUPAC).
[0243] В изобретении применяются следующие условные сокращения.
THF: тетрагидрофуран
TFA: трифторуксусная кислота
(Boc)2O: дитретбутилдикарбонат
DBU: 1,8-диазабицикло[5,4,0]-7-ундецен
DMF: N,N-диметилформамид
DME: 1,2-диметоксиэтан
DIEA: N,N-диизопропилэтиламин
DMAP: N,N-диметил-4-аминопиридин
EDCI: 1-этил-3-(3-диметиламинопропил)карбодиимид
EDCI·HCl: 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид
HOBt: 1-гидроксибензотриазол
HOBt·H2O: 1-гидроксибензотриазола моногидрат
NBS: N-бромсукцинимид
TBSCl: третбутилдиметилхлорсилан
Me: метил
Et: этил
Ac: ацетил
Boc: третбутоксикарбонил
SEM: 2-(триметилсилил)этоксиметил
Rt: время удерживания
[0244] Идентификация соединения проводится методом жидкостной хроматографией с масс-спектрометрией (LC/MS) при следующих условиях.
LC/MS измерение:
Устройство детектирования: детектор ACQUITY® SQ (Waters)
ВЭЖХ: система ACQUITY UPLC®
Колонка: Waters ACQUITY UPLC® BEH C18 (1,7 мкм, 2,1 мм X 30 мм)
Растворитель: раствор A: 0,06% муравьиная кислота/H2O, раствор B: 0,06% муравьиная кислота/MeCN
Градиент: 0,0-1,3 минут линейный градиент B от 2% до 96%
Расход: 0,8 мл/мин
УФ: 220 нм и 254 нм
[0245]
Справочный пример 1
4-Нитро-1-[3-(трифторметил)бензил]-1H-имидазол
Смесь 4-нитро-1H-имидазола (35,8 г), 3-трифторметилбензил- бромида (75,7 г), йодид калия (0,131 г), карбоната калия (48,1 г) и ацетонитрила (270 мл) перемешивали при 80°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и затем к ней добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем концентрировали под вакуумом. К полученному твердому веществу добавляли диизопропиловый эфир (300 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Полученный осадок собирали на фильтре, промывали диизопропиловым эфиром и сушили при 50°C под вакуумом с получением названного соединения (69,0 г).
LC-MS ([M+H]+/Rt (мин)): 272,1/0,835
[0246]
Справочные примеры 2-3
В соответствии с методом справочного примера 1, получали соединения справочных примеров 2-3 из каждого соответствующего исходного соединения.
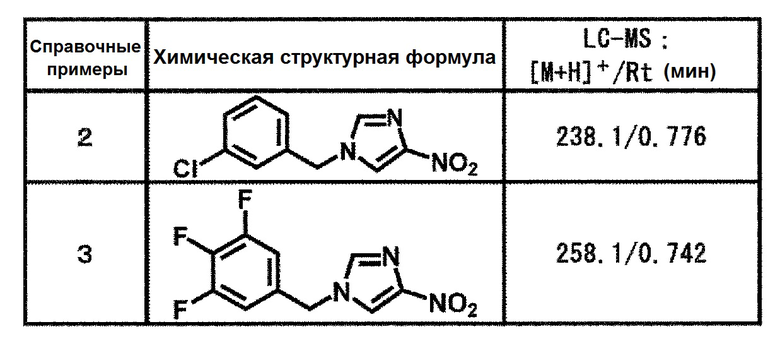
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0247]
Справочный пример 4
1-[3-(Трифторметил)бензил]-1H-имидазол-4-амина гидрохлорид
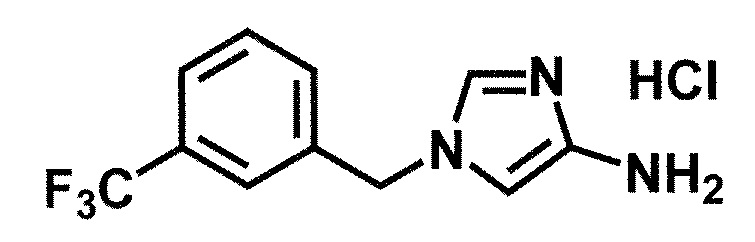
К соединению справочного примера 1 (34,0 г) и родия на активированном угле (5%, 17,0 г) добавляли этилацетат (330 мл), и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 14 часов. Реакционную смесь фильтровали через целит®, промывали этилацетатом (50 мл x 4), и затем к фильтрату добавляли хлористый водород (4 моль/л в этилацетате, 38,0 мл). Фильтрат концентрировали под вакуумом, и затем к полученному неочищенному продукту добавляли этилацетат (200 мл) и гексан (200 мл), и смесь перемешивали при комнатной температуре в течение 10 минут. Полученный осадок собирали на фильтре и промывали смесью гексан/этилацетат (1/1, 20 мл x 3), и затем полученное твердое вещество сушили при 40°C под вакуумом с получением названного соединения (31,4 г).
LC-MS ([M+H]+/Rt (мин)): 242,1/0,548
[0248]
Справочные примеры 5-6
В соответствии с методом справочного примера 4, получали соединения справочных примеров 5-6 из каждого соответствующего исходного соединения.
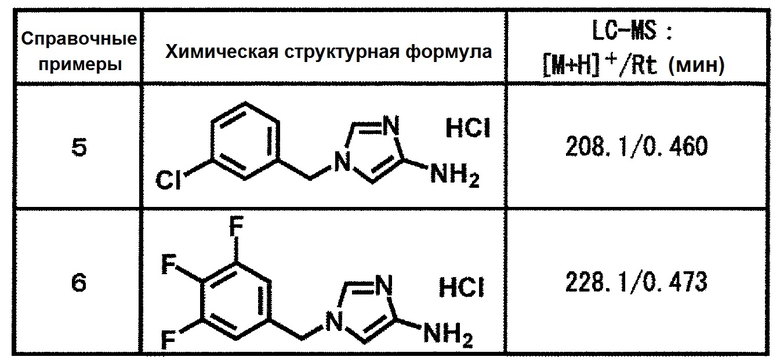
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0249]
Справочный пример 7
Метил 6-({1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}-карбамоил)никотинат
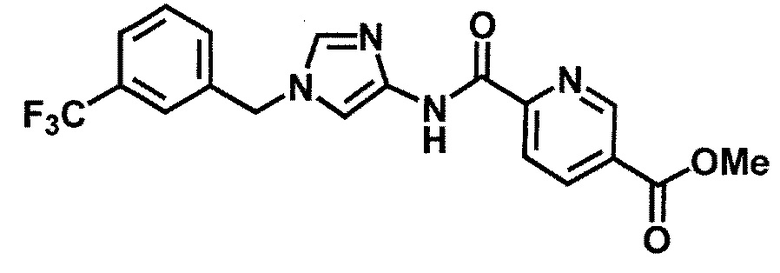
К суспензии соединения справочного примера 4 (300 мг) в DMF (5 мл) добавляли 5-(метоксикарбонил)пиколиновую кислоту (235 мг), EDCI·HCl (248 мг), HOBt (175 мг) и N,N-диизопропилэтиламин (0,279 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду и насыщенный водный раствор карбоната натрия, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором карбоната натрия и затем солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (281 мг).
LC-MS ([M+H]+/Rt (мин)): 404,9/0,901
[0250]
Справочные примеры 8-19
В соответствии с методом справочного примера 7, получали соединения справочных примеров 8-19 из каждого соответствующего исходного соединения.

(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0251]
Справочный пример 20
6-Этенил-5-фтор-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
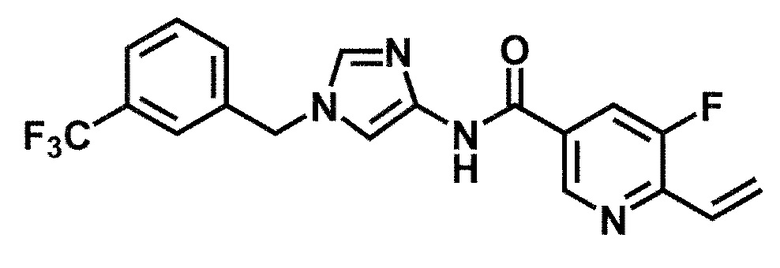
К раствору соединения справочного примера 9 (300 мг) в смеси 1,4-диоксан (5 мл)/вода (0,5 мл) добавляли пинаколовый эфир винилбороновой кислоты (0,232 мл), тетракис(трифенилфосфин)палладий (78 мг) и карбонат калия (281 мг), и смесь перемешивали при микроволновом облучении при 120°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней воду, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат, этилацетат/метанол) с получением названного соединения (122 мг).
LC-MS ([M+H]+/Rt (мин)): 391,2/0,936
[0252]
Справочные примеры 21-30
В соответствии с методом справочного примера 20, получали соединения справочных примеров 21-30 из каждого соответствующего исходного соединения.
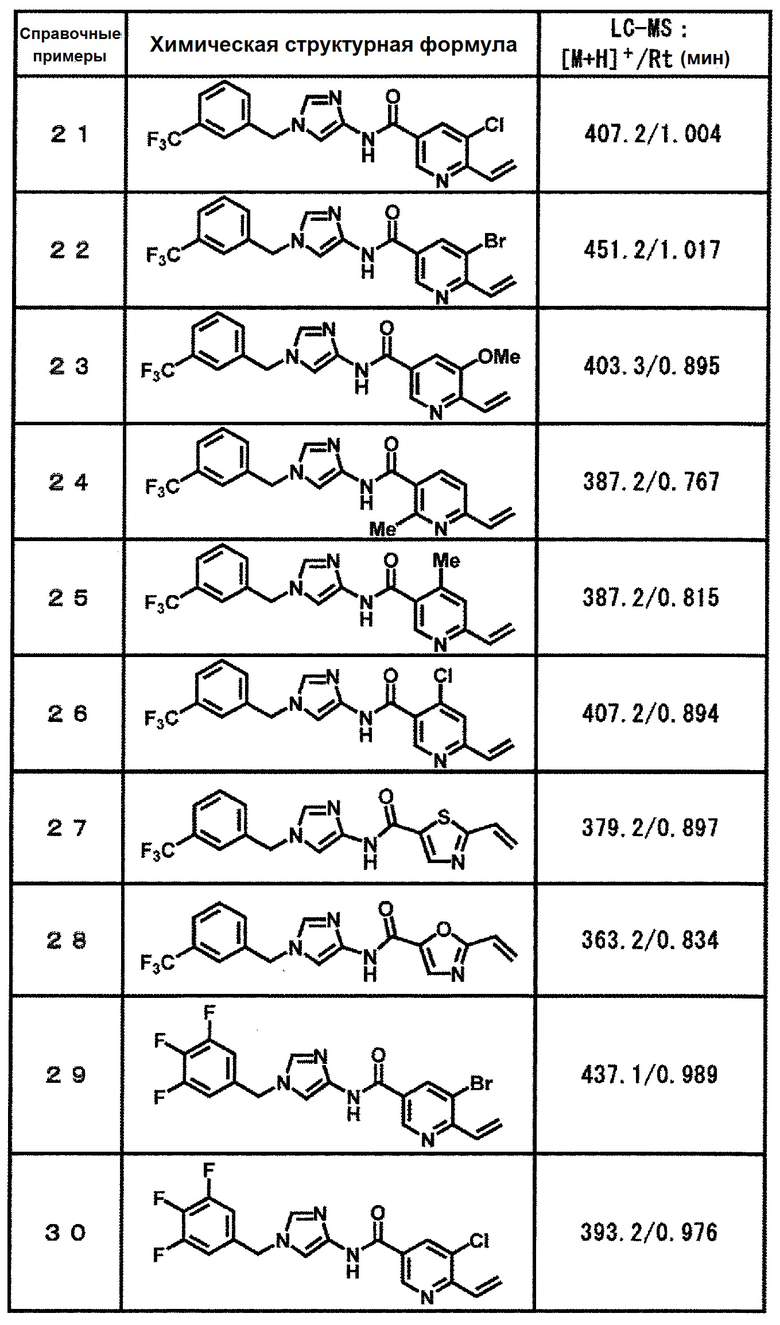
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0253]
Справочный пример 31
6-Этенил-5-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид
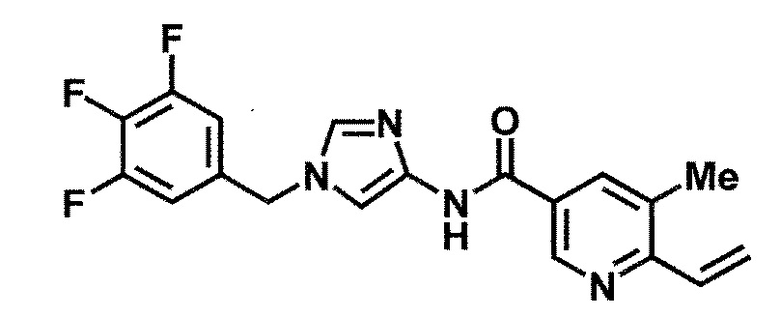
К раствору соединения справочного примера 29 (200 мг) в THF (4 мл) добавляли бис(тритретбутилфосфин)палладий (0) (23 мг) и метилцинка хлорид (2 моль/л в THF, 0,69 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором карбоната натрия и солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на аминосиликагеле (хлороформ/метанол) с получением названного соединения (135 мг).
LC-MS ([M+H]+/Rt (мин)): 373,2/0,824
[0254]
Справочный пример 32
6-(1,2-Дигидроксиэтил)-5-метокси-N-{1-[3-(трифторметил)-бензил]-1H-имидазол-4-ил}никотинамид
К раствору соединения справочного примера 23 (490 мг) в смеси ацетон (5 мл)/вода (2,5 мл) добавляли N-метилморфолин-N-оксид (285 мг) и тетраоксид осмия (2,5 масс.% в третбутаноле, 0,764 мл), и смесь перемешивали при комнатной температуре в течение 24 часов. К реакционной смеси затем добавляли насыщенный водный раствор тиосульфата натрия и воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на аминосиликагеле (хлороформ/метанол) с получением названного соединения (142 мг).
LC-MS ([M+H]+/Rt (мин)): 437,3/0,684
[0255]
Справочные примеры 33-38
В соответствии с методом справочного примера 32, получали соединения справочных примеров 33-38 из каждого соответствующего исходного соединения.
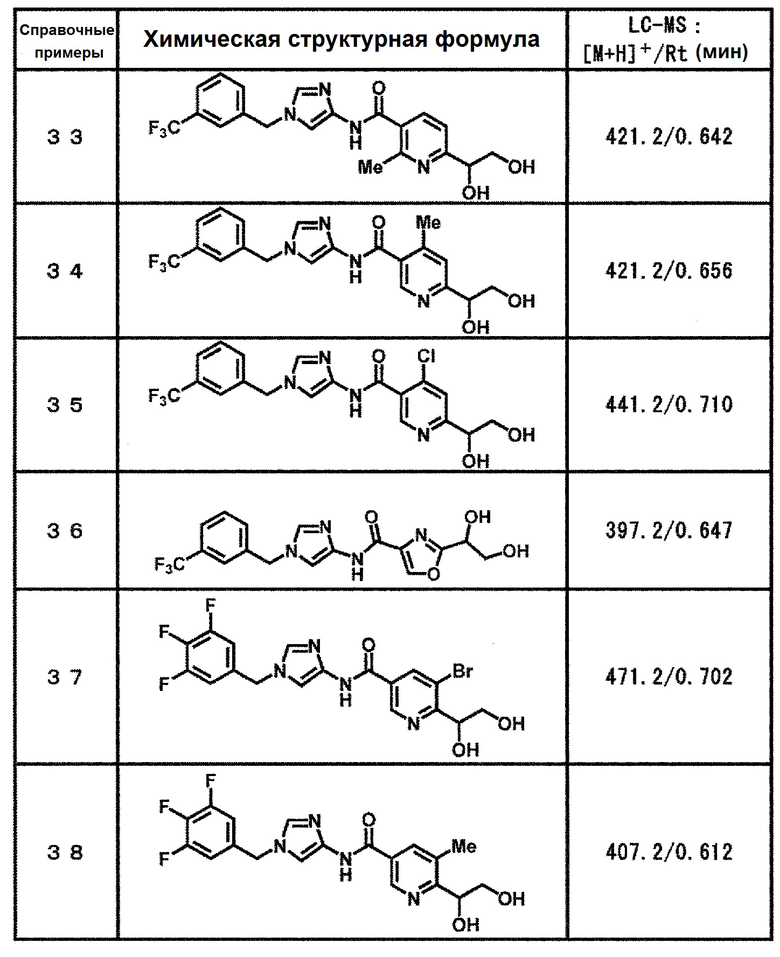
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0256]
Справочный пример 39-1
6-(Хлорметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
К суспензии соединения примера 12 (400 мг) в THF добавляли хлорид лития (90 мг), N,N-диизопропилэтиламин (0,366 мл) и затем метансульфонил хлорид (0,165 мл), и смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли к ней хлорид лития (45 мг), N,N-диизопропилэтиламин (0,183 мл) и метансульфонилхлорид (0,083 мл), и затем смесь дополнительно перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (269 мг).
LC-MS ([M+H]+/Rt (мин)): 395,2/0,835
[0257]
Справочный пример 39-2
6-[(Дитретбутоксикарбонил)аминометил]-N-{1-[3-(трифтор-метил)бензил]-1H-имидазол-4-ил}никотинамид
К раствору дитретбутилиминодикарбоната (586 мг) в DMF (3 мл) добавляли гидрид натрия (118 мг), и смесь перемешивали при комнатной температуре в течение 25 минут. К реакционной смеси добавляли раствор соединения справочного примера 39-1, полученного в приведенном выше примере, (213 мг) в DMF (6 мл), и смесь перемешивали при комнатной температуре в течение 2 часов, и затем при 50°C в течение 4 часов. Смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (119 мг).
LC-MS ([M+H]+/Rt (мин)): 576,5/1,080
[0258]
Справочный пример 40
Этил 6-(этоксиметил)-никотинат
К этанолу (20 мл) добавляли натрий (237 мг) в течение 1 часа и добавляли этил 6-(бромметил)-никотинат (500 мг), и затем смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали под вакуумом с удалением этанола и добавляли насыщенный водный раствор гидрокарбоната натрия, и затем смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (159 мг).
LC-MS ([M+H]+/Rt (мин)): 210,3/0,800
[0259]
Справочный пример 41-1
Метил 5-[(третбутоксикарбонил)амино]-6-хлор-никотинат
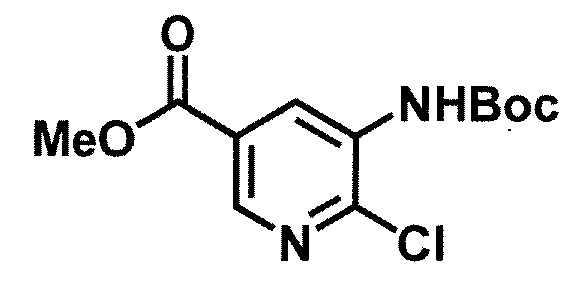
К раствору метил 5-амино-6-хлор-никотината (325 мг) в THF (10 мл) добавляли дитретбутилдикарбонат (760 мг) и DMAP (11 мг), и смесь перемешивали при комнатной температуре в течение 15,5 часов. Д дополнительное количество дитретбутилдикарбоната (38 мг), и смесь перемешивали при 60°C в течение 45 минут. Смесь охлаждали до комнатной температуры, и затем растворитель удаляли. К остатку добавляли метанол (5 мл) и карбонат калия (481 мг), и смесь перемешивали при комнатной температуре в течение 2,5 часов. Добавляли к ней насыщенный водный раствор хлорида аммония, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (321 мг).
LC-MS ([M+H]+/Rt (мин)): 287,1/0,985
[0260]
Справочный пример 41-2
Метил 5-[(третбутоксикарбонил)амино]-6-этенил-никотинат
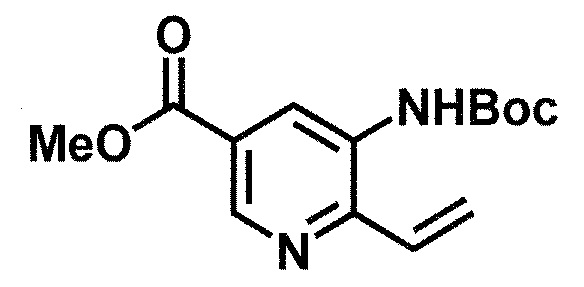
В соответствии с методом справочного примера 20, названное соединение получали из соединения справочного примера 41-1.
LC-MS ([M+H]+/Rt (мин)): 279,5/0,885
[0261]
Справочный пример 41-3
Метил 5-[(третбутоксикарбонил)амино]-6-формил-никотинат
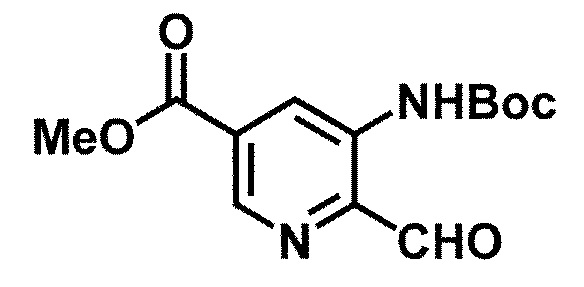
К раствору соединения справочного примера 41-2 (207 мг) в смеси ацетон (8 мл)/вода (4 мл) добавляли перйодат натрия (659 мг) и тетраоксид осмия (2,5 масс.% в третбутаноле, 0,71 мл), и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси затем добавляли насыщенный водный раствор тиосульфата натрия и воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (110 мг).
LC-MS ([M+H]+/Rt (мин)): 281,2/1,037
[0262]
Справочный пример 41-4
Метил 5-[(третбутоксикарбонил)амино]-6-(гидроксиметил)-никотинат

К раствору соединения справочного примера 41-3 (110 мг) в метаноле добавляли боргидрид натрия (15 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси затем добавляли насыщенный водный раствор хлорида аммония и воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом с получением названного соединения (111 мг).
LC-MS ([M+H]+/Rt (мин)): 282,8/0,761
[0263]
Справочный пример 41-5
2-Оксо-1,4-дигидро-2H-пиридо[3,2-d][1,3]оксазин-7-карбоновая кислота
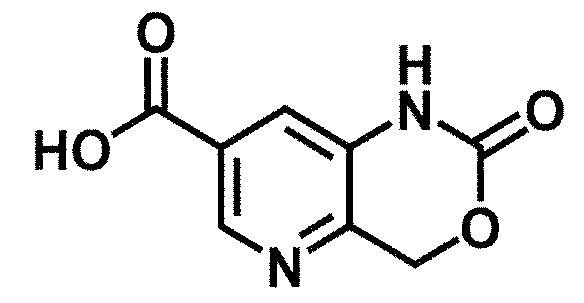
К раствору соединения справочного примера 41-4 (111 мг) в смеси THF (2 мл)/метанол (4 мл) добавляли 2 моль/л водный раствор гидроксида натрия (0,39 мл), и смесь перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли 2 моль/л хлористоводородной кислоты (0,25 мл) для доведения величины pH до 7. Реакционную смесь концентрировали под вакуумом с получением названного соединения (76 мг).
LC-MS ([M+H]+/Rt (мин)): 195,1/0,325
[0264]
Справочный пример 41-6
2-оксо-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}-1,4-дигидро-2H-пиридо[3,2-d][1,3]оксазин-7-карбоксамид
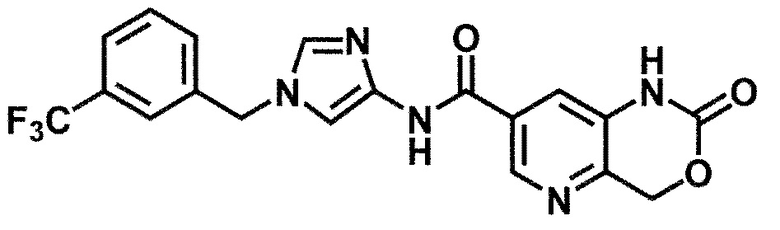
В соответствии с методом справочного примера 7, названное соединение получали из соединений справочных примеров 41-5 и 4.
LC-MS ([M+H]+/Rt (мин)) : 418,2/0,711
[0265]
Справочный пример 42
2-оксо-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]-1,4-дигидро-2H-пиридо[3,2-d][1,3]оксазин-7-карбоксамид
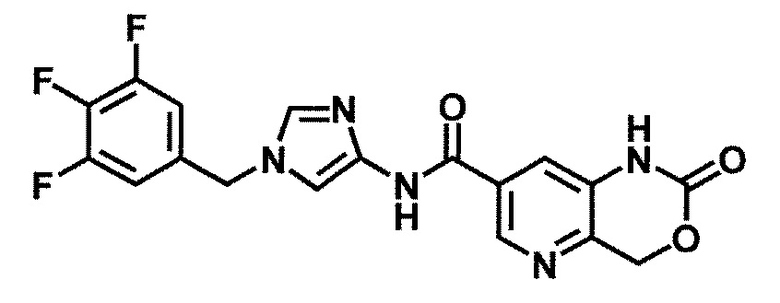
В соответствии с методом справочного примера 7, названное соединение получали из соединений справочных примеров 41-5 и 6.
LC-MS ([M+H]+/Rt (мин)): 404,2/0,670
[0266]
Справочный пример 43-1
Метил 6-хлор-5-(дибромметил)-никотинат
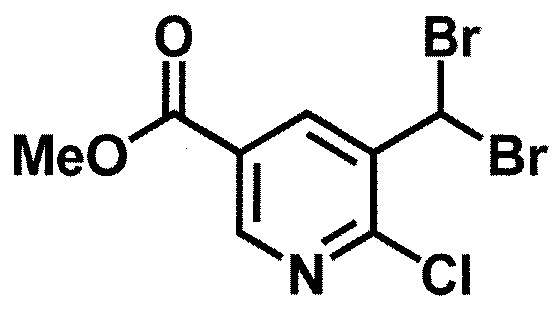
К суспензии метил 6-хлор-5-метил-никотината (467 мг) в тетрахлориде углерода (25 мл) добавляли N-бромсукцинимид (1,34 г) и пероксид бензоила (218 мг), и смесь перемешивали при 100°C в течение 7,5 часов. Смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли насыщенный водный раствор тиосульфата натрия и воду, и затем смесь экстрагировали хлороформом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (833 мг).
LC-MS ([M+H]+/Rt (мин)): 341,9/1,011
[0267]
Справочный пример 43-2
Метил 6-хлор-5-формил-никотинат
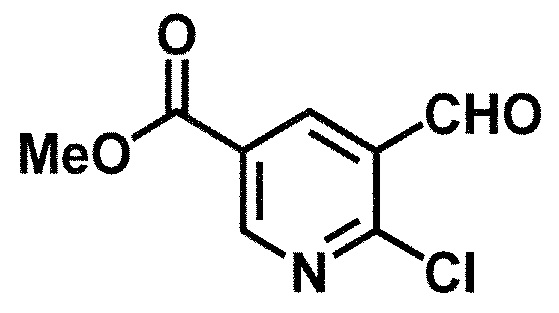
К раствору соединения справочного примера 43-1 (2,71 г) в смеси ацетонитрил (40 мл)/вода (20 мл) добавляли нитрат серебра (6,70 г), и смесь перемешивали при 100°C в течение 3 часов. Нерастворимый продукт удаляли фильтрацией, и растворитель удаляли. К остатку добавляли насыщенный водный раствор гидрокарбоната натрия для доведения величины рН до 8, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом с получением названного соединения (0,84 г).
LC-MS ([M+H]+/Rt (мин)): 200,0/0,671
[0268]
Справочный пример 43-3
Метил 6-хлор-5-(дифторметил)-никотинат
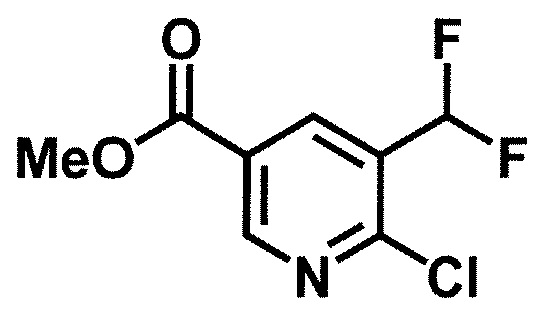
К раствору соединения справочного примера 43-2 (0,84 г) в дихлорметане (20 мл) добавляли DAST (1,11 мл) при охлаждении льдом, и смесь перемешивали при охлаждении льдом в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия для доведения величины рН до 8, и смесь экстрагировали хлороформом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (0,45 г).
LC-MS ([M+H]+/Rt (мин)): 222,0/0,828
[0269]
Справочный пример 43-4
Метил 5-(дифторметил)-6-(гидроксиметил)-никотинат
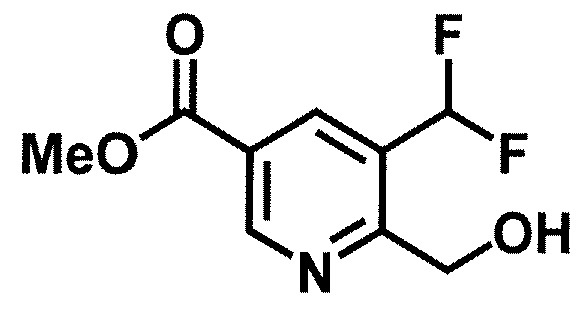
В соответствии с методами справочных примеров 20, 41-3 и 41-4, названное соединение получали из соединения справочного примера 43-3.
LC-MS ([M+H]+/Rt (мин)): 218,1/0,564
[0270]
Справочный пример 44
Метил 6-(гидроксиметил)-5-(трифторметил)-никотинат
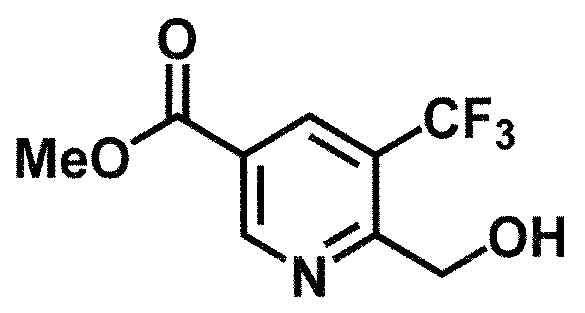
В соответствии с методами справочных примеров 20, 41-3 и 41-4, названное соединение получали из метил 6-хлор-5-(трифторметил)-никотината.
LC-MS ([M+H]+/Rt (мин)): 236,1/0,649
[0271]
Справочный пример 45-1
Метил 5-(2-третбутокси-2-оксоэтокси)-пиколинат
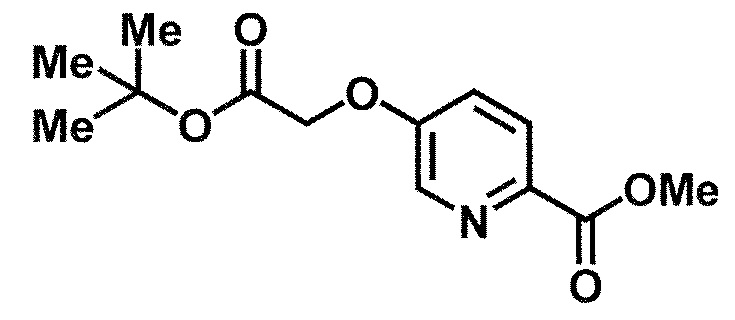
К раствору метил 5-гидроксипиколината (200 мг) в DMF (5 мл) добавляли карбонат калия (361 мг) и третбутилбромацетат, и смесь перемешивали при 70°C в течение 20 минут. Смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли воду, и затем смесь экстрагировали этилацетатом. Органический слой промывали два раза солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом с получением названного соединения (320 мг).
LC-MS ([M+H]+/Rt (мин)): 268,2/0,777
[0272]
Справочный пример 45-2
{[6-(Метоксикарбонил)пиридин-3-ил]окси}уксусная кислота
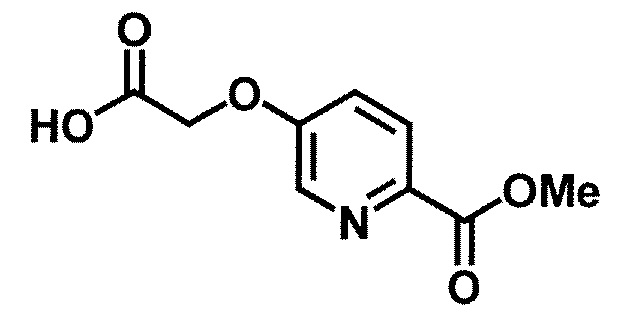
К раствору соединения справочного примера 45-1 (320 мг) в дихлорметане (4 мл) добавляли TFA (2 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли с получением названного соединения (253 мг).
LC-MS ([M+H]+/Rt (мин)): 212,1/0,394
[0273]
Справочный пример 45-3
Метил 5-(2-оксо-2-{[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]амино}этокси)-пиколинат
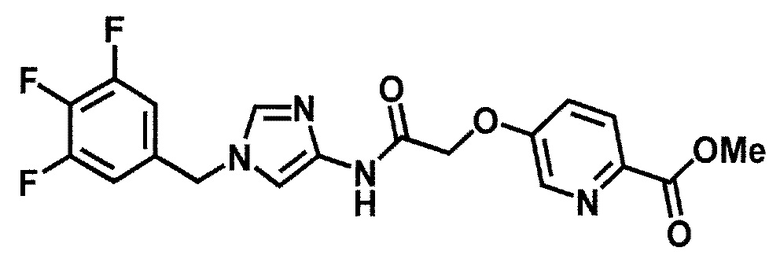
В соответствии с методом справочного примера 7, названное соединение получали из соединений справочных примеров 45-2 и 6.
LC-MS ([M+H]+/Rt (мин)): 421,2/0,731
[0274]
Справочный пример 46-1
4-({[Третбутил(диметил)силил]окси}метил)-5-метил-1,3-тиазол-2-карбоновая кислота
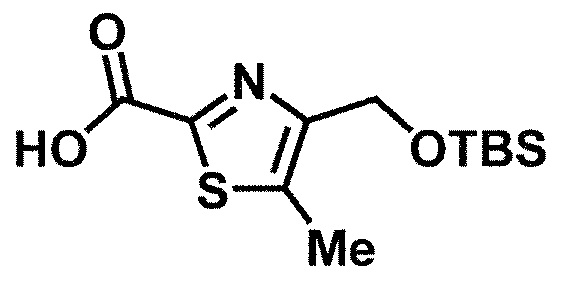
К раствору (2-бром-5-метил-1,3-тиазол-4-ил)метанола (151 мг) в DMF (3 мл) добавляли имидазол (59 мг) и TBSCl (131 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси затем добавляли насыщенный водный раствор хлорида аммония и воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония и солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением 2-бром-4-({[третбутил(диметил)-силил]окси}метил)-5-метил-1,3-тиазола.
К раствору полученного 2-бром-4-({[третбутил(диметил)-силил]окси}метил)-5-метил-1,3-тиазола в THF (4 мл) добавляли н-бутиллитий (0,91 мл) при -78°C, и смесь перемешивали при этой температуре в течение 1 часа. Затем к ней добавляли избыточное количество измельченного сухого льда, и смесь перемешивали при этой температуре в течение 45 минут, и затем при комнатной температуре в течение 40 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом с получением названного соединения (127 мг).
LC-MS ([M+H]+/Rt (мин)): 288,1/1,058
[0275]
Справочный пример 46-2
4-({[Третбутил(диметил)силил]окси}метил)-5-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]-1,3-тиазол-2-карбоксамид
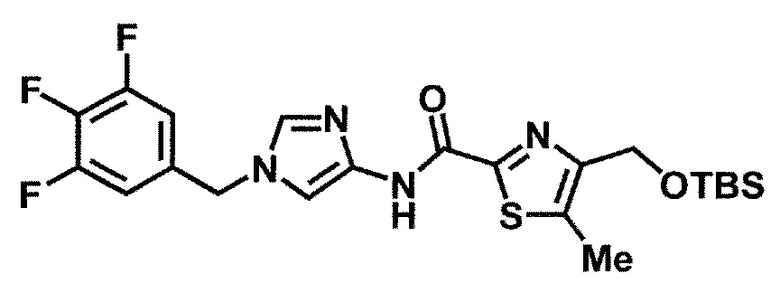
В соответствии с методом справочного примера 7, названное соединение получали из соединений справочных примеров 46-1 и 6.
LC-MS ([M+H]+/Rt (мин)): 497,1/1,314
[0276]
Справочный пример 47
5-({[Третбутил(диметил)силил]окси}метил)-4-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]-1,3-тиазол-2-карбоксамид
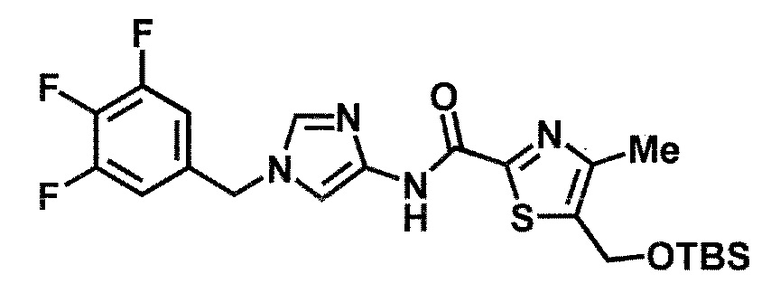
В соответствии с методами справочных примеров 46-1 и 7, названное соединение получали из соответствующего исходного соединения.
LC-MS ([M+H]+/Rt (мин)): 497,1/1,333
[0277]
Справочный пример 48
6-Формил-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}-никотинамид
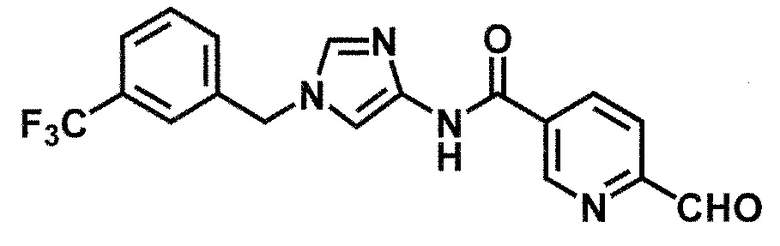
К суспензии соединения примера 12 (200 мг) в дихлорметане (10 мл) добавляли диоксид марганца (2 г), и смесь перемешивали при комнатной температуре в течение 19 часов. Реакционную смесь фильтровали через целит®, и осадок на фильтре промывали этилацетатом и метанолом. Фильтрат концентрировали под вакуумом, и остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (55 мг).
LC-MS ([M+H]+/Rt (мин)): 375,2/0,793
[0278]
Справочный пример 49-1
Метил 1-(3,4,5-трифторбензил-1H-имидазол-4-карбоксилат
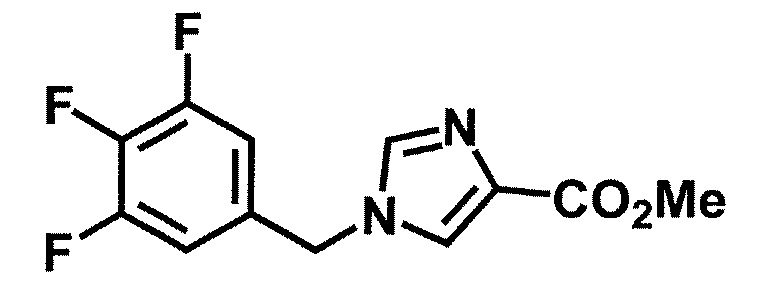
К раствору метил 1H-имидазол-4-карбоксилата (14,0 г) в ацетонитриле (200 мл) добавляли карбонат калия (19,9 г) и йодид калия (0,092 г) и добавляли по каплям 3,4,5-трифторбензилбромид (14,6 мл) при комнатной температуре, и затем смесь перемешивали при 70°C в течение 6 часов. Смесь охлаждали до комнатной температуры и к реакционной смеси добавляли воду и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния, фильтровали и затем концентрировали под вакуумом. Полученный неочищенный продукт промывали смесью гексан/этилацетат (1/2, 60 мл) с получением названного соединения (14,0 г).
LC-MS ([M+H]+/Rt (мин)): 271,4/0,725
[0279]
Справочный пример 49-2
1-(3,4,5-Трифторбензил)-1H-имидазол-4-карбоновая кислота
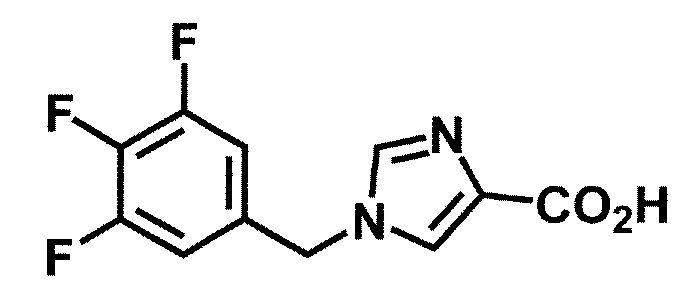
К раствору соединения справочного примера 49-1 (4,75 г) в смеси метанол/THF (50 мл/50 мл) добавляли 2 моль/л водный раствор гидроксида натрия (13,2 мл), и смесь перемешивали при 50°C в течение 5 часов. Реакционную смесь концентрировали под вакуумом, и остаток растворяли в воде и затем добавляли водный раствор хлористоводородной кислоты для доведения величины рН до 5. Полученный осадок собирали на фильтре, промывали водой и гексаном и затем сушили при 50°C под вакуумом с получением названного соединения (4,52 г).
LC-MS ([M+H]+/Rt (мин)): 257,1/0,513
[0280]
Справочный пример 50
6-({[Третбутил(диметил)силил]окси}метил)пиридин-3-амин
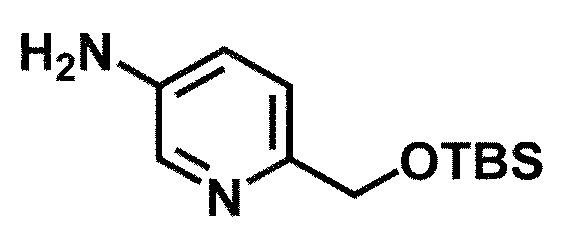
К раствору (5-аминопиридин-2-ил)метанола (135 мг) в THF (15 мл) добавляли триэтиламин (0,30 мл) и TBSCl (328 мг), и смесь перемешивали при комнатной температуре в течение 6 часов. Растворитель удаляли под вакуумом, и полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (99 мг).
LC-MS ([M+H]+/Rt (мин)): 239,2/0,726
[0281]
Справочный пример 51
2-({[Третбутил(диметил)силил]окси}метил)хинолин-6-амин
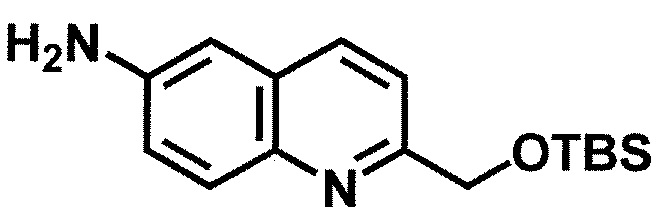
В соответствии с методом справочного примера 50, названное соединение получали из (6-аминохинолин-2-ил)метанола.
LC-MS ([M+H]+/Rt (мин)): 289,9/0,836
[0282]
Справочные примеры 52-53
В соответствии с методом справочного примера 7, получали соединения справочных примеров 52-53 из соединения справочного примера 49 и каждого соответствующего исходного соединения.
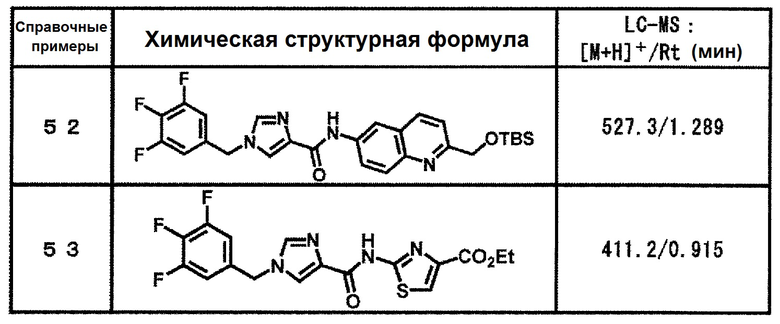
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0283]
Справочный пример 54
Метил 6-(3-гидроксипроп-1-ен-2-ил)никотинат
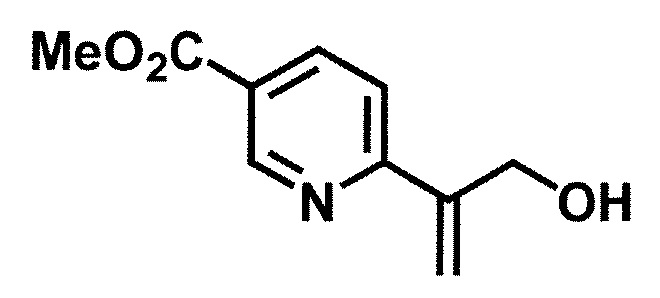
К раствору метил 6-метилникотината (420 мг) в воде (2 мл) добавляли триэтиламин (0,065 мл) и параформальдегид (42 мг), и смесь перемешивали при микроволновом облучении при 150°C в течение 3 часов. К реакционной смеси добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (24 мг).
LC-MS ([M+H]+/Rt (мин)): 194,1/0,532
1Н-ЯМР (400 МГц, CDCl3): δ 9,15-9,13 (1H, м), 8,29 (1H, дд, J=8,4, 2,0 Гц), 7,70 (1H, д, J=8,4 Гц), 5,94 (1H, с), 5,65 (1H, с), 4,61 (2H, с), 3,97 (3H, с).
[0284]
Справочный пример 55
Метил 6-[(1E)-3-гидроксипроп-1-ен-1-ил]никотинат
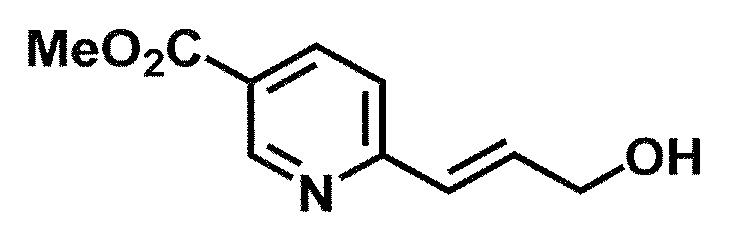
К раствору (2E)-3-[5-(метоксикарбонил)пиридин-2-ил]проп-2-еновой кислоты (50 мг) в DME (1 мл) добавляли N-метилморфолин (0,056 мл) и изобутилхлороформиат (0,035 мл), и смесь перемешивали при 0°C в течение 1 часа. Осадок удаляли фильтрацией, и фильтрат концентрировали с получением неочищенного продукта смешанного ангидрата.
К суспензии боргидрида натрия (23,3 мг) в смеси THF/вода (2 мл/0,5 мл) добавляли раствор полученного смешанного ангидрата в THF при 0°C. Реакционный раствор перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (19 мг).
LC-MS ([M+H]+/Rt (мин)): 194,3/0,741
[0285]
Справочный пример 56-1
Метил 6-(оксиран-2-ил)-никотинат

К раствору этил 6-этенилникотината (210 мг) в смеси третбутиловый спирт/вода (6 мл/3 мл) добавляли NBS (232 мг), и смесь перемешивали при 40°C в течение 2 часов. Реакцию прерывали водным раствором гидроксида натрия на ледяной бане, и реакционный раствор нейтрализовывали хлористоводородной кислотой, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем концентрировали под вакуумом.
Остаток растворяли в THF (10 мл) и добавляли гидрид натрия (78 мг) на ледяной бане, и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли солевой раствор, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (125,3 мг).
LC-MS ([M+H]+/Rt (мин)): 194,1/0,654
[0286]
Справочный пример 56-2
Этил 6-(2-гидроксиэтил)-никотинат
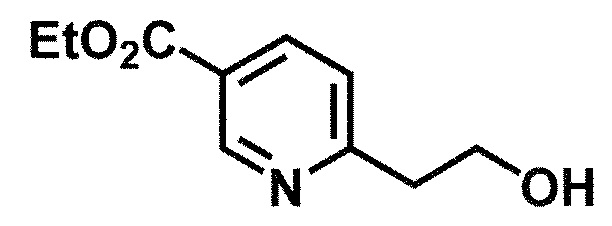
К раствору соединения справочного примера 56-1 (125 мг) в этаноле (10 мл) добавляли 5% палладий на угле (138 мг) и формиат аммония (204 мг), и смесь перемешивали при 50°C в течение 3 часов. Палладий фильтровали через целит®, и фильтрат концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением названного соединения (87,3 мг).
LC-MS ([M+H]+/Rt (мин)): 196,1/0,467
1Н-ЯМР (400 МГц, CDCl3):δ 9,12 (1H, д, J=2,4 Гц), 8,23 (1H, дд, J=8,0, 2,4 Гц), 7,26 (1H, д, J=8,0 Гц), 4,41 (2H, кв, J=7,6 Гц), 4,06-4,03 (2H, м), 3,11-3,07 (2H, м), 1,41 (3H, т, J=7,6 Гц).
[0287]
Справочный пример 57
Метил 5-(гидроксиметил)пиразин-2-карбоксилат
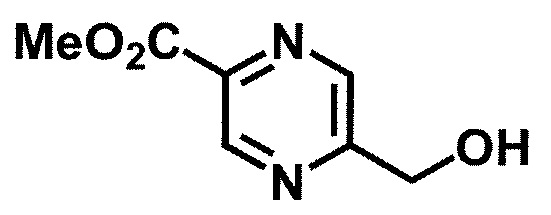
В соответствии с методами справочных примеров 20, 41-3 и 41-4, названное соединение получали из метил 5-хлорпиразин-2-карбоксилата.
LC-MS ([M+H]+/Rt (мин)): 169,0/0,334
[0288]
Справочный пример 58
6-({Метил[(2-нитрофенил)сульфонил]амино}метил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
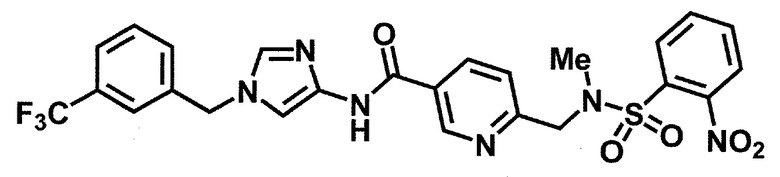
К раствору соединения примера 12 (101 мг) в хлороформе (4 мл) добавляли N-метил-2-нитробензолсульфонамид (79 мг), диэтил- азодикарбоксилат (2,2 моль/л раствор в толуоле, 159 мкл) и трифенилфосфин (92 мг), и смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли дополнительные количества N-метил-2-нитробензолсульфонамида (80 мг), диэтил- азодикарбоксилата (2,2 моль/л раствор в толуоле, 159 мкл) и трифенилфосфин (93 мг), и смесь перемешивали при 60°C в течение 6 часов. Добавляли дополнительные количества N-метил-2-нитробензолсульфонамида (157 мг), диэтилазодикарбоксилата (2,2 моль/л раствор в толуоле, 318 мкл) и трифенилфосфина (194 мг), и смесь перемешивали при 60°C в течение 2 часов. Реакционный раствор концентрировали под вакуумом, и остаток очищали хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (174 мг).
LC-MS ([M+H]+/Rt (мин)): 575,3/0,944
[0289]
Справочный пример 59-1
Метил 5-этенил-6-гидрокси-никотинат
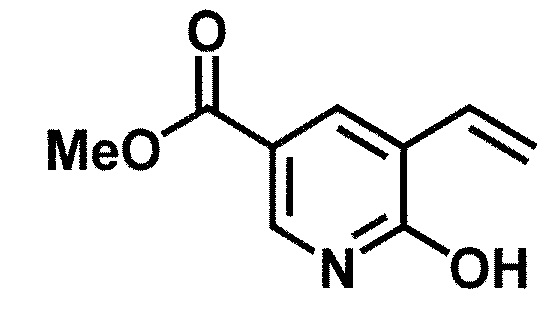
В соответствии с методом справочного примера 20, названное соединение получали из метил 5-бром-6-гидроксиникотината.
LC-MS ([M+H]+/Rt (мин)): 180,0/0,541
[0290]
Справочный пример 59-2
Метил 6-хлор-5-этенил-никотинат
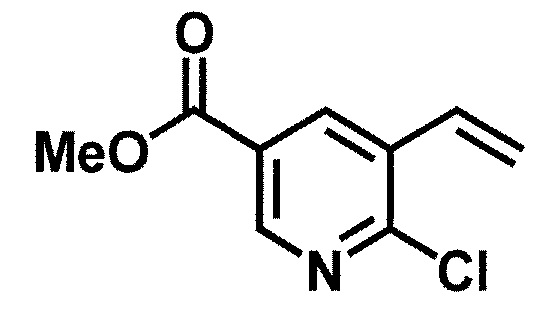
Суспензию соединения справочного примера 59-1 (1,37 г) в оксихлориде фосфора (14,3 мл) перемешивали при 90°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Остаток разбавляли этилацетатом, нейтрализовывали насыщенным водным раствором гидрокарбоната натрия и затем экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом с получением названного соединения (1,45 г).
LC-MS ([M+H]+/Rt (мин)): 198,0/0,870
[0291]
Справочный пример 59-3
Метил 6-хлор-5-формилникотинат
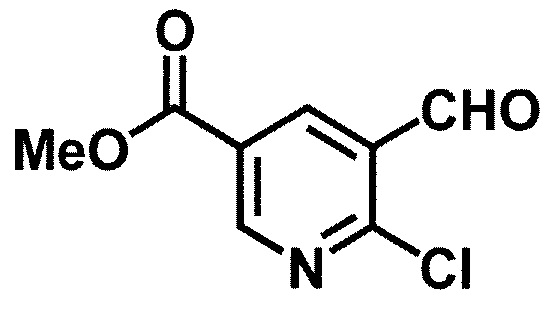
В соответствии с методом справочного примера 41-3, названное соединение получали из соединения справочного примера 59-2.
LC-MS ([M+H]+/Rt (мин)): 200,0/0,671
[0292]
Справочный пример 60-1
Изопропил 5-бром-6-хлорникотинат
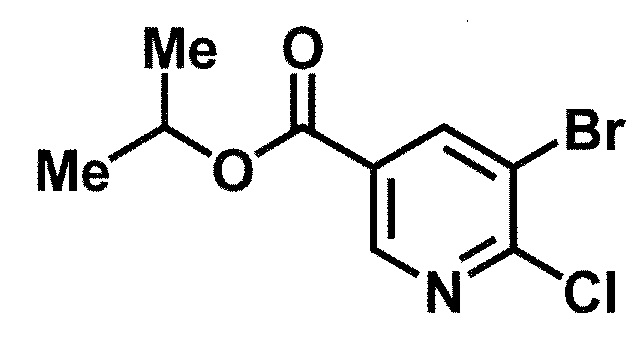
Суспензию 5-бром-6-гидроксиникотиновой кислоты (10 г) в тионилхлориде (17 мл)/DMF (0,36 мл) перемешивали при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. К остатку затем добавляли 2-пропанол (25 мл), и смесь перемешивали при 100°C в течение 40 минут. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. К остатку затем добавляли насыщенный водный раствор карбоната натрия и воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом с получением названного соединения (12,4 г).
LC-MS ([M+H]+/Rt (мин)): 278,0/1,102
[0293]
Справочный пример 60-2
Изопропил 6-хлор-5-формилникотинат
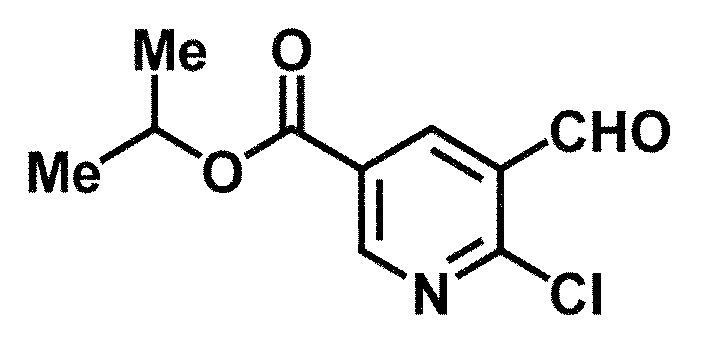
К раствору соединения справочного примера 60-1 (2,0 г) в THF (30 мл), охлажденному до -20°C, добавляли комплекс изопропилмагния хлорида и хлорида лития (1,3 моль/л в THF, 7,2 мл), и затем реакционную смесь перемешивали при -20°C в течение 35 минут. Добавляли комплекс изопропилмагния хлорида и хлорида лития(1,3 моль/л в THF, 0,55 мл), и смесь дополнительно перемешивали при -20°C в течение 25 минут. Добавляли DMF (1,11 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа 10 минут. Добавляли насыщенный водный раствор хлорида аммония и воды, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом с получением названного соединения (1,64 г).
LC-MS ([M+H]+/Rt (мин)): 228,1/0,897
[0294]
Справочный пример 60-3
Изопропил 6-хлор-5-(дифторметил)-никотинат
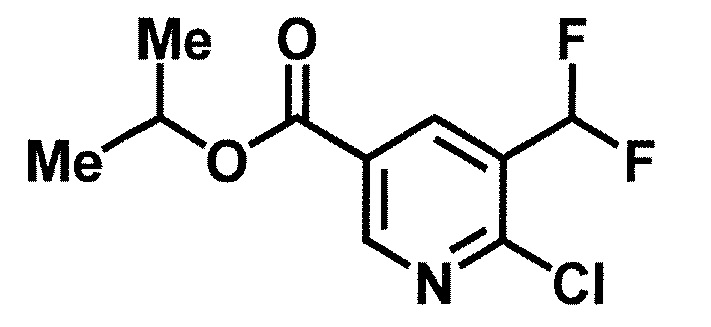
В соответствии с методом справочного примера 43-3, названное соединение получали из соединения справочного примера 60-2.
LC-MS ([M+H]+/Rt (мин)): 250,1/1,014
[0295]
Справочный пример 60-4
Изопропил 6-бром-5-(дифторметил)-никотинат
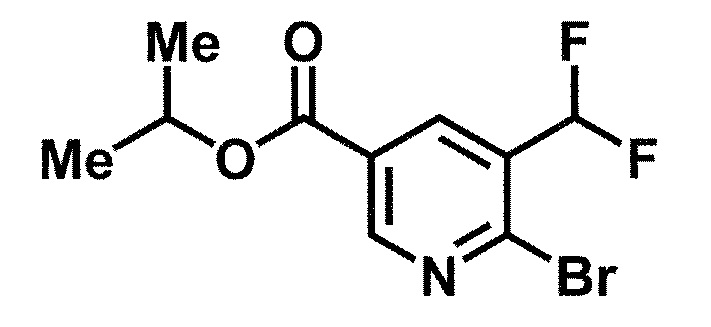
К раствору соединения справочного примера 60-3 (500 мг) в ацетонитриле (10 мл) добавляли бромтриметилсилан (0,52 мл), и смесь перемешивали при 100°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (585 мг).
LC-MS ([M+H]+/Rt (мин)): 294,0/1,035
[0296]
Справочный пример 60-5
Изопропил 5-(дифторметил)-6-{[(4-метоксибензил)окси]метил}-никотинат
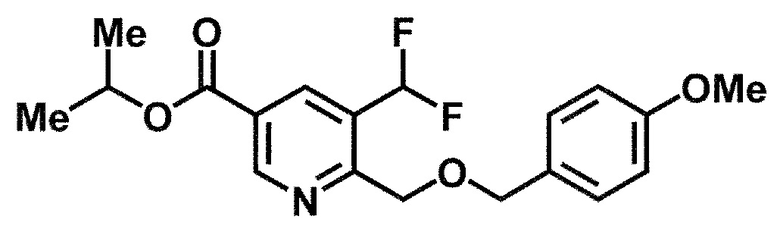
К раствору соединения справочного примера 60-4 (100 мг) в 1,4-диоксане (3 мл)/вода (0,3 мл) добавляли аддукт [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) дихлорида с дихлорметаном (28 мг), (4-метокси)бензилоксиметилтрифторборат калия (114 мг) и карбонат цезия (222 мг), и затем смесь перемешивали при 120°C в течение 9,5 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (70 мг).
LC-MS ([M+H]+/Rt (мин)): 366,5/1,129
1Н-ЯМР (400 МГц, CDCl3): δ 9,20 (1H, с), 8,54 (1H, с), 7,27 (2H, д, J=8,7 Гц), 7,16 (1H, т, J=54,8 Гц), 6,89 (2H, д, J=8,7 Гц), 5,30 (1H, сеп, J=5,9 Гц), 4,83 (2H, с), 4,52 (2H, с), 3,81 (3H, с), 1,40 (6H, д, J=5,9 Гц).
[0297]
Справочный пример 60-6
Изопропил 5-(дифторметил)-6-(гидроксиметил)-никотинат
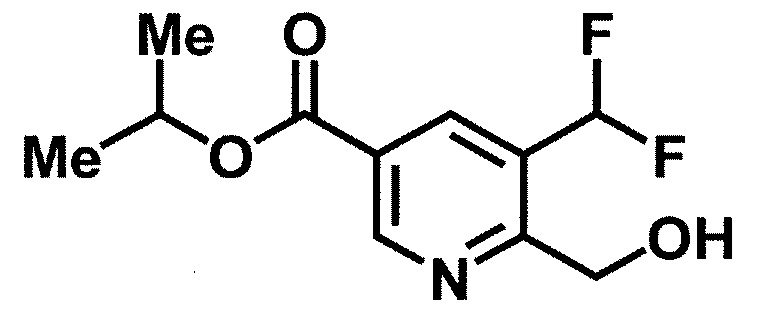
К раствору соединения справочного примера 60-5 (44 мг) в дихлорметане (1,5 мл) добавляли TFA (1,5 мл), и смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь концентрировали под вакуумом, и остаток нейтрализовывали насыщенным водным раствором гидрокарбоната натрия и затем экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (16 мг).
LC-MS ([M+H]+/Rt (мин)): 246,1/0,756
[0298]
Справочный пример 61
Третбутил 5-бром-6-хлорникотинат
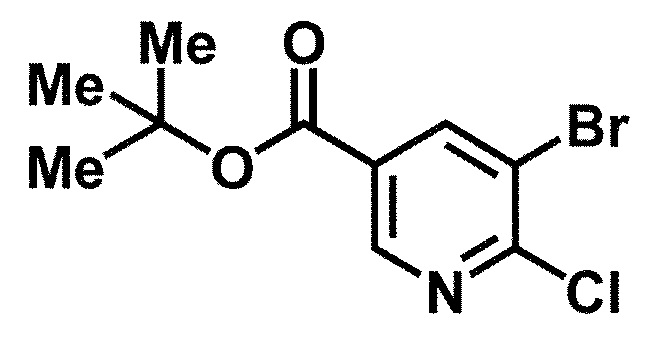
Суспензию 5-бром-6-гидроксиникотиновой кислоты (10 г) в смеси тионилхлорид (17 мл)/DMF (0,36 мл) перемешивали при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. К остатку добавляли толуол (50 мл), N,N-диизопропилэтиламин (16 мл) и третбутанол (22 мл), и затем смесь перемешивали при комнатной температуре в течение 3 часов, и затем при 80°C в течение 1 часа. Добавляли DMAP (0,28 г), и смесь дополнительно перемешивали при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный водный раствор карбоната натрия и воду, и затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором карбоната натрия, насыщенным водным раствором гидросульфата калия, насыщенным водным раствором гидрокарбоната натрия и затем солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (5,85 г).
LC-MS ([M+H]+/Rt (мин)): 292,0/1,188
[0299]
Справочный пример 62
Изопропил 5-(дифторметил)-6-йодникотинат
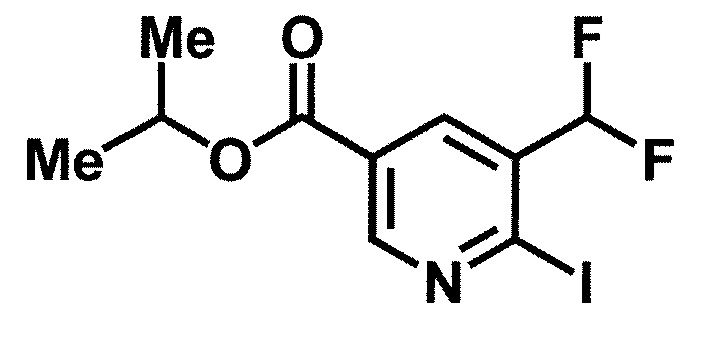
В соответствии с методом справочного примера 60-4, названное соединение получали из соединения справочного примера 60-3 и йодтриметилсилана.
LC-MS ([M+H]+/Rt (мин)): 342,0/1,054
[0300]
Справочный пример 63
Метил 5-(дифторметил)-6-йодникотинат
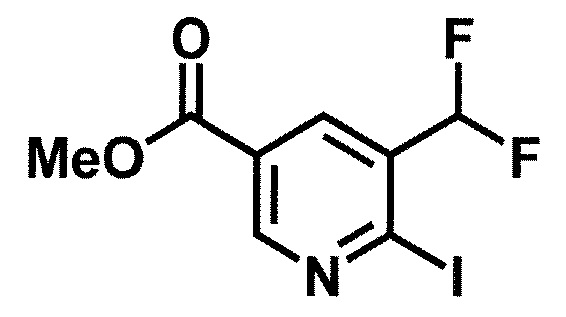
В соответствии с методом справочного примера 60-4, названное соединение получали из соединения справочного примера 43-3 и йодтриметилсилана.
LC-MS ([M+H]+/Rt (мин)): 314,0/0,875
[0301]
Справочный пример 64-1
4-Нитро-1-{[2-(триметилсилил)этокси]метил}-1H-имидазол
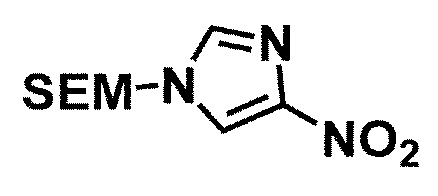
Суспензию гидрида натрия (3,04 г) в DMF (15 мл) охлаждали льдом и добавляли к ней раствор 4-нитроимидазола (5,66 г) в DMF (40 мл), и затем смесь перемешивали при охлаждении льдом в течение 45 минут. Добавляли 2-(триметилсилил)этоксиметилхлорид (9,65 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли метанол, лед и солевой раствор, и смесь экстрагировали смесью гексан/этилацетат (1/1). Органический слой сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (8,62 г).
LC-MS ([M+H]+/Rt (мин)): 244,1/0,927
[0302]
Справочный пример 64-2
1-{[2-(Триметилсилил)этокси]метил}-1H-имидазол-4-амин
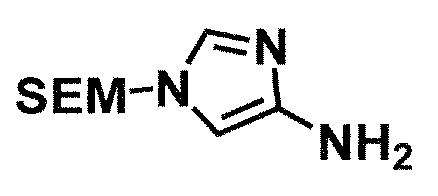
Суспензию соединения справочного примера 64-1 (7,84 г) и родий/уголь (3,92 г) в этилацетате (200 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 10 часов. Реакционную смесь фильтровали через целит®, и к фильтрату добавляли хлористый водород (4 моль/л в 1,4-диоксане, 8 мл), и затем смесь концентрировали под вакуумом с получением названного соединения (6,22 г).
LC-MS ([M+H]+/Rt (мин)): 214,2/0,665
[0303]
Справочный пример 64-3
5-(Дифторметил)-6-{[(4-метоксибензил)окси]метил}-N-(1-{[2-(триметилсилил)этокси]метил}-1H-имидазол-4-ил)никотинамид
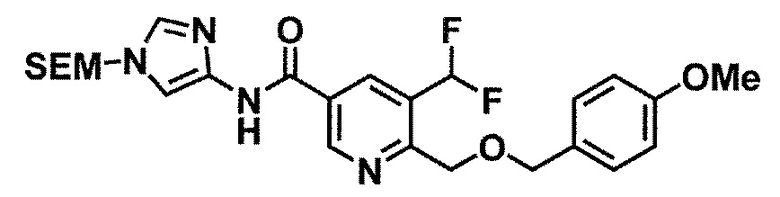
В соответствии с методом примера 49, названное соединение получали из соединений справочных примеров 64-2 и 60-5.
LC-MS ([M+H]+/Rt (мин)): 519,4/1,105
[0304]
Справочный пример 64-4
5-(Дифторметил)-6-(гидроксиметил)-N-(1H-имидазол-4-ил)-никотинамид
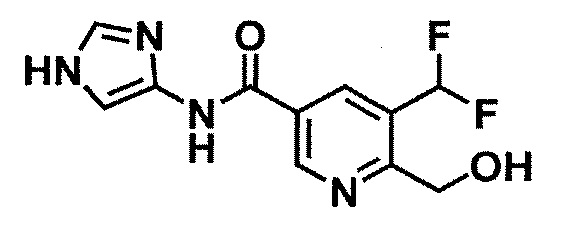
В соответствии с методом примера 50, названное соединение получали из соединения справочного примера 64-3.
LC-MS ([M+H]+/Rt (мин)): 269,1/0,322
[0305]
Справочный пример 65-1
N-{1-[3-(Трифторметил)бензил]-1H-имидазол-4-ил}проп-2-ен-амид
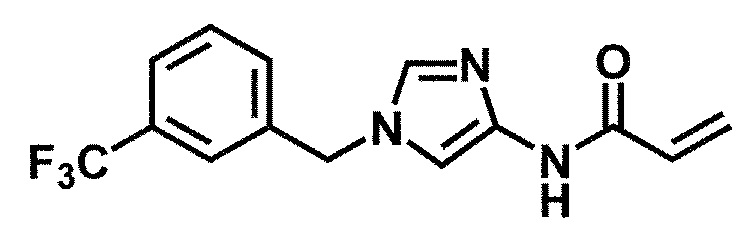
К раствору соединения справочного примера 4 (1 г) и DIEA (1,4 мл) в THF (25 мл) медленно добавляли акрилоилхлорид (0,32 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов и добавляли к ней воду, и затем смесь экстрагировали хлороформом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (0,13 г).
LC-MS ([M+H]+/Rt (мин)): 296,2/0,718
1Н-ЯМР (400 МГц, DMSO-d6):δ 10,56 (1H, с), 7,69-7,66 (3H, м), 7,62-7,57 (2H, м), 7,33 (1H, с), 6,44 (1H, дд, J=17,1, 10,4 Гц), 6,15 (1H, дд, J=17,1, 2,4 Гц), 5,63 (1H, дд, J=10,4, 2,4 Гц), 5,27 (2H, с).
[0306]
Справочный пример 65-2
Метил 5-[(1E)-3-оксо-3-({1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}амино)prop-1-en-1-ил]пиколинат
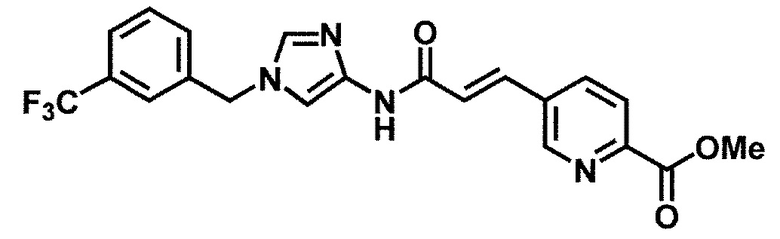
К раствору соединения справочного примера 65-1 (60 мг) в DMF (2 мл) добавляли метил 5-бромпиколинат (53 мг), дихлорбис(три-O-толилфосфин)палладий (II) (16 мг) и триэтиламин (0,042 мл), и смесь перемешивали при 90°C в течение 3,5 часов, и затем при 130°C в течение 2 часов. Смесь охлаждали до комнатной температуры и добавляли к ней воду и небольшое количество метанола, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Полученный остаток очищали колоночной хроматографией на аминосиликагеле (этилацетат/метанол) с получением названного соединения (42 мг).
LC-MS ([M+H]+/Rt (мин)): 431,2/0,790
1Н-ЯМР (400 МГц, DMSO-d6):δ 10,73 (1H, с), 8,87 (1H, с), 8,14-8,08 (2H, м), 7,71-7,56 (6H, м), 7,41 (1H, с), 7,07 (1H, д, J=15,8 Гц), 5,29 (2H, с), 3,88 (3H, с).
[0307]
Справочный пример 66
Этил (2E)-3-[6-(гидроксиметил)пиридин-3-ил]проп-2-еноат
К раствору пинаколового эфира 2-этоксикарбонилвинил- бороновой кислоты (361 мг) в смеси 1,4-диоксан (15 мл)/вода (1,5 мл) добавляли 5-бром-2-гидроксиметилпиридин (300 мг), бис(тритретбутилфосфин)палладий(0) (122 мг) и карбонат калия (662 мг), и смесь перемешивали при микроволновом облучении при 130°C в течение 1,5 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней воду, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (204 мг).
LC-MS ([M+H]+/Rt (мин)): 208,1/0,476
[0308]
Справочный пример 67
Этил (2E)-3-[5-хлор-6-(гидроксиметил)пиридин-3-ил]проп-2-еноат
В соответствии с методом справочного примера 66, названное соединение получали из соответствующего исходного соединения.
LC-MS ([M+H]+/Rt (мин)): 242,1/0,719
[0309]
Справочный пример 68-1
6-Хлор-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]-пиридазин-3-карбоксамид
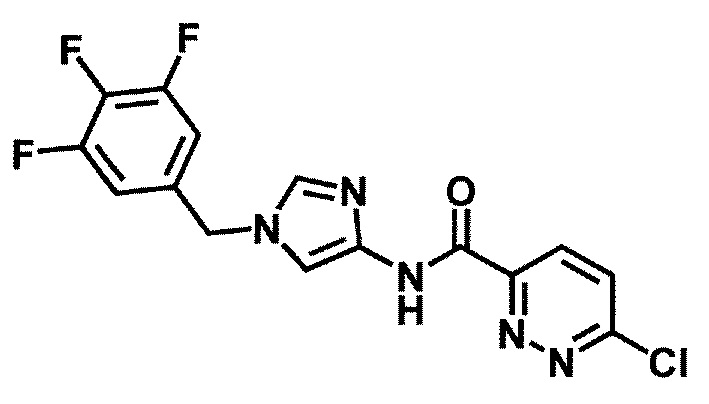
В соответствии с методом справочного примера 7, названное соединение получали из соединения справочного примера 6 и производимого промышленностью исходного соединения.
LC-MS ([M+H]+/Rt (мин)): 368,2/0,820
[0310]
Справочный пример 68-2
6-Этенил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]-пиридазин-3-карбоксамид
В соответствии с методом справочного примера 20, названное соединение получали из соединения справочного примера 68-1.
LC-MS ([M+H]+/Rt (мин)): 360,2/0,809
[0311]
Пример 1
5-(Гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}пиколинамид
К раствору справочного примера 7 (100 мг) в смеси THF (2 мл)/метанол (1 мл) добавляли боргидрид лития (3 моль/л в THF, 0,08 мл), и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. К полученному твердому веществу добавляли этилацетат (2 мл) и гексан (2 мл), и смесь помещали в ультразвуковой ванну, и затем полученное твердое вещество собирали на фильтре, промывали смесью гексан/этилацетат (1/1, 1 мл x 2) и сушили при 40°C под вакуумом с получением названного соединения (70 мг).
LC-MS ([M+H]+/Rt (мин)): 377,2/0733
[0312]
Примеры 2-3
В соответствии с методом примера 1, получали соединения примеров 2-3 из соответствующего соединения из каждого справочного примера.
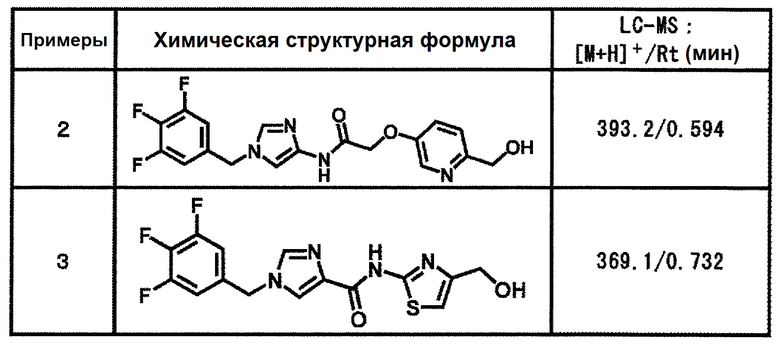
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0313]
Пример 4
6-[Гидрокси(2H2)метил]-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
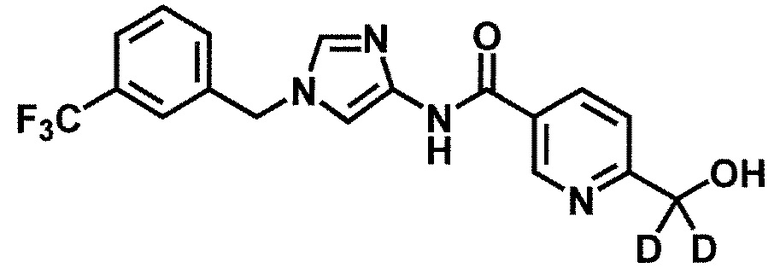
К суспензии алюмодейтерида лития (21 мг) в THF (3 мл) добавляли соединение справочного примера 8 (100 мг) при охлаждении льдом, и смесь перемешивали при этой температуре в течение 30 минут, и затем при комнатной температуре в течение 2 часов. Добавляли алюмодейтерид лития (11 мг), и смесь дополнительно перемешивали при комнатной температуре в течение 1 часа. Добавляли к ней воду (0,040 мл), 10% водный раствор гидроксида натрия (0,060 мл) и затем воду (0,12 мл), и смесь перемешивали при комнатной температуре в течение 20 минут. Нерастворимый продукт удаляли фильтрацией, и остаток промывали водой, смесью этилацетат/метанол (1/1), этилацетатом и затем метанолом. Фильтрат концентрировали под вакуумом, и к остатку добавляли метанол и воду, и затем смесь помещали в ультразвуковую баню. Полученный осадок собирали на фильтре, промывали водой и затем сушили при 50°C под вакуумом с получением названного соединения (53 мг).
LC-MS ([M+H]+/Rt (мин)): 379,2/0,673
1Н-ЯМР (400 МГц, DMSO-d6):δ 11,00 (1H, с), 9,01 (1H, д, J=1,8 Гц), 8,30 (1H, д, J=8,2, 1,8 Гц), 7,73-7,68 (3H, м), 7,64-7,61 (2H, м), 7,54 (1H, д, J=8,2 Гц), 7,47 (1H, д, J=1,2 Гц), 5,48 (1H, с), 5,31 (2H, с).
[0314]
Пример 5
6-(2-Гидроксипропан-2-ил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
К раствору соединения справочного примера 8 (70 мг) в THF (5 мл) добавляли метилмагния бромид (0,97 моль/л в THF, 0,89 мл), и смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли метилмагния бромид (0,97 моль/л в THF, 0,45 мл), и смесь дополнительно перемешивали в течение 5,5 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (10 мг).
LC-MS ([M+H]+/Rt (мин)): 405,2/0,742
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,97 (1H, с), 8,99 (1H, с), 8,27 (1H, д, J=8,2 Гц), 7,77-7,61 (6H, м), 7,47 (1H, с), 5,31-5,30 (3H, м), 1,44 (6H, с).
[0315]
Пример 6
6-(1-Гидроксиэтил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид

В соответствии с методом примера 5, названное соединение получали из соединения справочного примера 48.
LC-MS ([M+H]+/Rt (мин)): 391,2/0,717
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,98 (1H, с), 9,00 (1H, д, J=1,8 Гц), 8,29 (1H, дд, J=8,3, 1,8 Гц), 7,73-7,72 (2H, м), 7,70-7,68 (1H, м), 7,64-7,61 (2H, м), 7,57 (1H, д, J=8,3 Гц), 7,47 (1H, д, J=1,2 Гц), 5,46 (1H, д, J=4,9 Гц), 5,30 (2H, с), 4,75 (1H, квд, J=6,7, 4,9 Гц), 1,36 (3H, д, J=6,7 Гц).
[0316]
Примеры 7-9
В соответствии с методом справочного примера 7, получали соединения примеров 7-9 из соответствующих соединений каждого справочного примера.
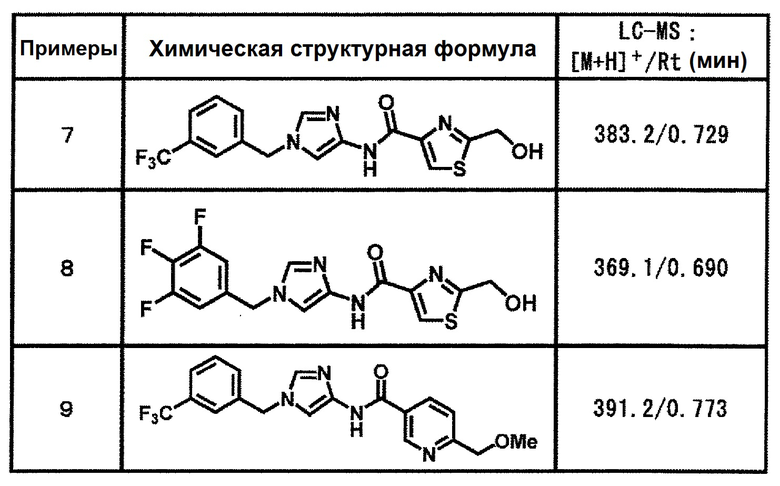
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0317]
Пример 10
6-(Гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид
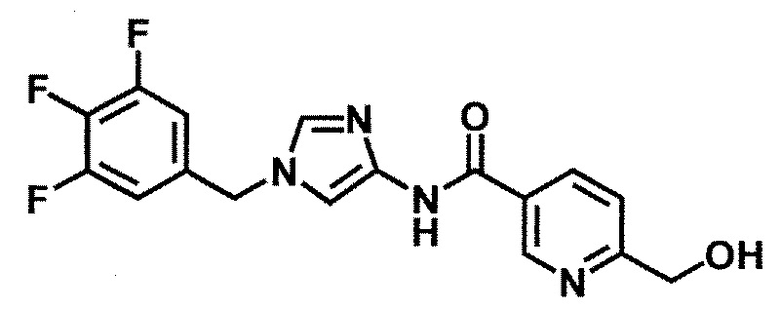
К раствору метил 6-(гидроксиметил)никотината (0,924 г) в THF (22 мл) добавляли 5 моль/л водный раствор гидроксида калия (2,2 мл). Смесь перемешивали при комнатной температуре в течение ночи, концентрировали под вакуумом с удалением растворителя и затем сушили под вакуумом. К раствору полученного твердого вещества в DMF (25 мл) добавляли соединение справочного примера 6 (1,61 г), HATU (2,52 г) и диизопропилэтиламин (2,38 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси затем добавляли насыщенный водный раствор гидрокарбоната натрия и воду, и полученный осадок собирали на фильтре. Полученный осадок на фильтре промывали смесью водой/ацетонитрил и затем этилацетатом и сушили под вакуумом с получением названного соединения (1,375 г).
LC-MS ([M+H]+/Rt (мин)): 363,1/0,66
1Н-ЯМР (400 МГц, DMSO-d6): δ 11,00 (1H, с), 9,01 (1H, д, J=1,8 Гц), 8,30 (1H, дд, J=7,9, 1,8 Гц), 7,69 (1H, д, J=1,2 Гц), 7,54 (1H, д, J=7,9 Гц), 7,48 (1H, д, J=1,2 Гц), 7,38-7,30 (2H, м), 5,52 (1H, т, J=6,1 Гц), 5,18 (2H, с), 4,60 (2H, д, J=6,1 Гц).
[0318]
Примеры 11-21
В соответствии с методом примера 10, получали соединения примеров 11-21 из соответствующих соединений каждого справочного примера.
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой, и используются следующие обозначения: (min)=(мин); 1H-NMR=1H-ЯМР; MHz=МГц; Hz=Гц; s=синглет; d=дуплет; t=триплет; m=мультиплет; dd=дуплет дуплетов)
[0319]
Пример 22
N-[6-(Гидроксиметил)пиридин-3-ил]-1-(3,4,5-трифторбензил)-1H-имидазол-4-карбоксамид
К раствору соединения справочного примера 49-2 (138 мг) и соединения справочного примера 50 (141 мг) в DMF (15 мл) добавляли EDCI·HCl (124 мг), HOBt (87 мг) и N,N-диизопропилэтиламин (0,188 мл), и смесь перемешивали при 80°C в течение 6 часов. К реакционной смеси затем добавляли воду и водный раствор гидроксида натрия, и смесь экстрагировали хлороформом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем концентрировали под вакуумом. Полученный остаток растворяли в метаноле (5 мл) и добавляли смесь 2 моль/л хлористоводородная кислота/метанол (0,81 мл), и затем смесь перемешивали при 40°C в течение 5 часов. К реакционной смеси добавляли воду и затем водный раствор гидроксида натрия, и смесь экстрагировали хлороформом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (86,4 мг).
LC-MS ([M+H]+/Rt (мин)): 363,2/0,640
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,06 (1H, с), 8,84 (1H, с), 8,19-8,14 (1H, м), 7,97-7,95 (2H, м), 7,42-7,34 (3H, м), 5,31-5,26 (1H, м), 5,24 (2H, с), 4,48 (2H, д, J=4,8 Гц).
[0320]
Пример 23
N-[2-(гидроксиметил)хинолин-6-ил]-1-(3,4,5-трифторбензил)-1H-имидазол-4-карбоксамид

В соответствии с методом примера 22, названное соединение получали из соединений справочных примеров 49-2 и 51.
LC-MS ([M+H]+/Rt (мин)):413,3/0,673
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,13 (1H, с), 8,49 (1H, д, J=2,0 Гц), 8,24 (1H, д, J=9,2 Гц), 8,04 (1H, дд, J=9,2, 2,0 Гц), 8,00 (1H, с), 7,98 (1H, с), 7,85 (1H, д, J=8,8 Гц), 7,57 (1H, д, J=8,8 Гц), 7,44-7,38 (2H, м), 5,50-5,46 (1H, м), 5,25 (2H, с), 4,60 (2H, д, J=5,6 Гц).
[0321]
Пример 24
6-(Аминометил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид дитрифторацетат
В соответствии с методом справочного примера 45-2, названное соединение получали из соединения справочного примера 39-2.
LC-MS ([M+H]+/Rt (мин)): 376,2/0,597
[0322]
Пример 25
6-[(Ацетиламино)метил]-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
К раствору соединения примера 24 (30 мг) в THF (1 мл) добавляли триэтиламин (0,111 мл) и безводную уксусную кислоту (0,038 мл), и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (28 мг).
LC-MS ([M+H]+/Rt (мин)): 418,3/0,669
1Н-ЯМР (400 МГц, DMSO-d6): δ 11,02 (1H, с), 9,01 (1H, д, J=1,8 Гц), 8,48 (1H, т, J=6,1 Гц), 8,26 (1H, дд, J=8,3, 1,8 Гц), 7,73-7,68 (3H, м), 7,64-7,59 (2H, м), 7,46 (1H, с), 7,35 (1H, д, J=8,3 Гц), 5,30 (2H, с), 4,37 (2H, д, J=6,1 Гц), 1,90 (3H, с).
[0323]
Пример 26
6-[(Метиламино)метил]-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
К раствору соединения справочного примера 58 (155 мг) в DMF (1 мл) добавляли карбонат калия (59 мг) и тиофенол (30 мкл), и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли диэтиловый эфир, и органический слой экстрагировали 0,1 моль/л хлористоводородной кислотой. К полученному водному слою добавляли насыщенный водный раствор гидрокарбоната натрия для доведения величины рН до 9, и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом и затем полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (93 мг).
LC-MS ([M+2H]2+/Rt (мин)): 195,7/0,628
[0324]
Примеры 27-29
В соответствии с методом справочного примера 32, получали соединения примеров 27-29 из соответствующих соединений каждого справочного примера.
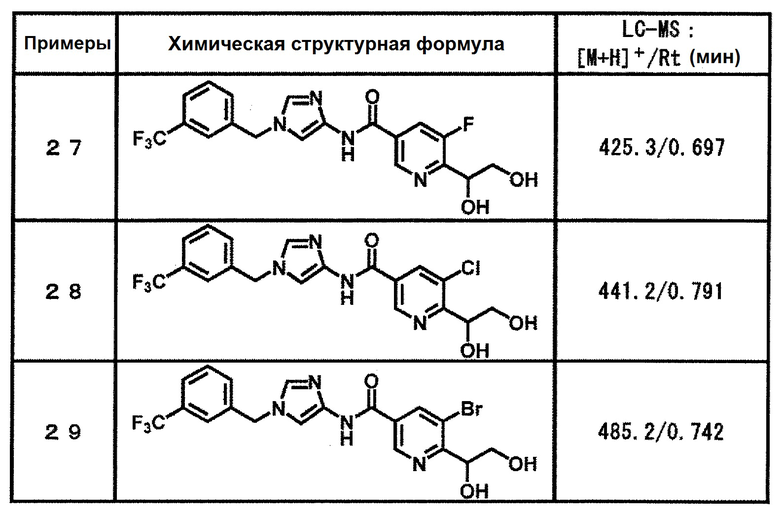
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0325]
Пример 30
5-Фтор-6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
К раствору соединения примера 27 (51 мг) в смеси THF (2 мл)/вода (1 мл) добавляли перйодат натрия (77 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. К раствору полученного остатка в метаноле (1 мл) добавляли боргидрид натрия (4 мг), и смесь перемешивали при комнатной температуре в течение 10 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и смесь перемешивали при комнатной температуре в течение 5 минут и затем концентрировали под вакуумом. К остатку добавляли воду, и смесь помещали в ультразвуковую баню, и затем осадок собирали на фильтре. Полученный осадок на фильтре промывали водой и метанолом и затем сушили при 50°C под вакуумом с получением названного соединения (37 мг).
LC-MS ([M+H]+/Rt (мин)): 395,3/0,739
[0326]
Примеры 31-39
В соответствии с методом примера 30, получали соединения примеров 31-39 из соединений примеров 28-29 и соответствующих соединений каждого справочного примера.
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой, и используются следующие обозначения: (min)=(мин); 1H-NMR=1H-ЯМР; MHz=МГц; Hz=Гц; s=синглет; d=дуплет; t=триплет; m=мультиплет; dd=дуплет дуплетов)
[0327]
Пример 40
2-(Гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}-1,3-тиазол-5-карбоксамид
К раствору соединения справочного примера 27 (211 мг) в смеси ацетон (5 мл)/вода (2,5 мл) добавляли тетраоксид осмия (2,5 масс.% в третбутаноле, 0,525 мл) и перйодат натрия (358 мг), и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли насыщенный водный раствор тиосульфата натрия и воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток грубо очищали колоночной хроматографией на силикагеле (хлороформ/метанол). К полученному соединению добавляли метанол (2 мл) и боргидрид натрия (3 мг), и затем смесь перемешивали при комнатной температуре в течение 18,5 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и воду, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (8 мг).
LC-MS ([M+H]+/Rt (мин)): 383,2/0,705
1Н-ЯМР (400 МГц, DMSO-d6): δ 9,77 (1H, с), 8,31 (1H, с), 7,72-7,71 (2H, м), 7,70-7,67 (1H, м), 7,62-7,60 (2H, м), 7,40 (1H, д, J=1,8 Гц), 6,19 (1H, т, J=5,8 Гц), 5,30 (2H, с), 4,77 (2H, д, J=5,8 Гц).
[0328]
Пример 41
5-Хлор-6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид
В соответствии с методом примера 40, названное соединение получали из соединения справочного примера 30.
LC-MS ([M+H]+/Rt (мин)): 397,2/0,750
[0329]
Пример 42
6-(Гидроксиметил)-5-метил-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
В соответствии с методом справочного примера 31, названное соединение получали из соединения примера 32.
LC-MS ([M+H]+/Rt (мин)): 391,3/0,671
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,96 (1H, с), 8,86 (1H, д, J=1,8 Гц), 8,10 (1H, д, J=1,8 Гц), 7,73-7,68 (3H, м), 7,64-7,59 (2H, м), 7,46 (1H, д, J=1,8 Гц), 5,31 (2H, с), 5,12 (1H, т, J=5,8 Гц), 4,60 (2H, д, J=5,8 Гц), 2,35 (3H, с).
[0330]
Пример 43
5-Этенил-6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
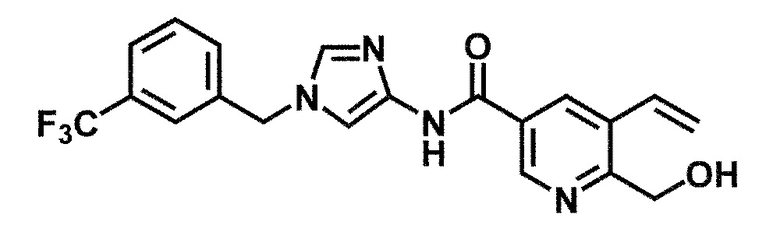
В соответствии с методом справочного примера 20, названное соединение получали из соединения примера 32.
LC-MS ([M+H]+/Rt (мин)): 403,3/0,744
[0331]
Пример 44
5-Этил-6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
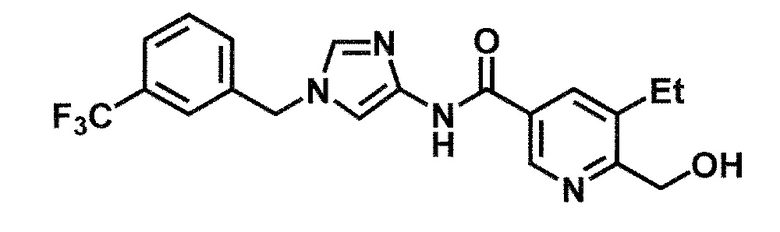
К суспензии оксида платины (30 мг) в смеси этилацетат (2 мл)/метанол (1 мл) добавляли соединение примера 43 (27 мг), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 4 часов. Реакционную смесь фильтровали через целит® и промывали этилацетатом. Фильтрат концентрировали под вакуумом, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат, этилацетат/метанол) с получением названного соединения (16 мг).
LC-MS ([M+H]+/Rt (мин)): 405,3/0,708
[0332]
Пример 45
5-Амино-6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид
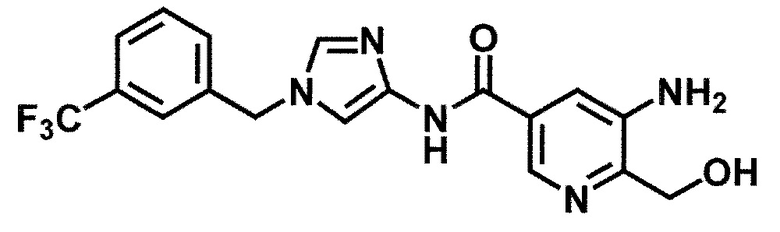
К суспензии соединения справочного примера 41-6 (13 мг) в смеси THF (0,5 мл)/метанол (0,5 мл) добавляли 2 моль/л водный раствор гидроксида натрия (0,031 мл), и смесь перемешивали при 60°C в течение 3 часов, и затем при 90°C в течение 6,5 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней воду, и затем смесь перемешивали при комнатной температуре в течение 5 минут. Полученное твердое вещество собирали на фильтре, промывали водой и сушили при 50°C под вакуумом с получением названного соединения (7 мг).
LC-MS ([M+H]+/Rt (мин)): 392,2/0,647
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,79 (1H, с), 8,29 (1H, д, J=1,8 Гц), 7,72-7,68 (3H, м), 7,64-7,581 (2H, м), 7,43 (1H, д, J=1,2 Гц), 7,42 (1H, д, J=1,8 Гц), 5,36 (2H, с), 5,30 (2H, с), 5,18 (1H, т, J=5,5 Гц), 4,52 (2H, д, J=5,5 Гц)
[0333]
Пример 46
5-Амино-6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид
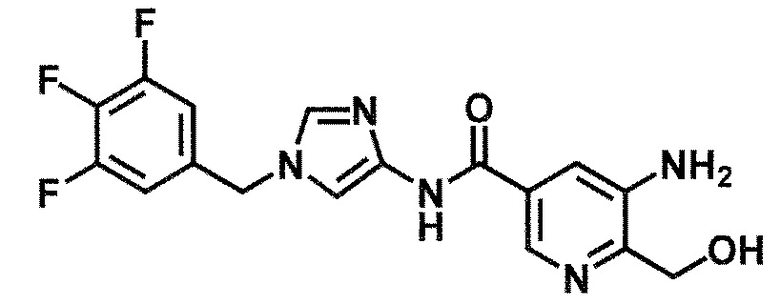
В соответствии с методом примера 45, названное соединение получали из соединения справочного примера 42.
LC-MS ([M+H]+/Rt (мин)): 378,2/0,603
[0334]
Пример 47
4-(Гидроксиметил)-5-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]-1,3-тиазол-2-карбоксамид
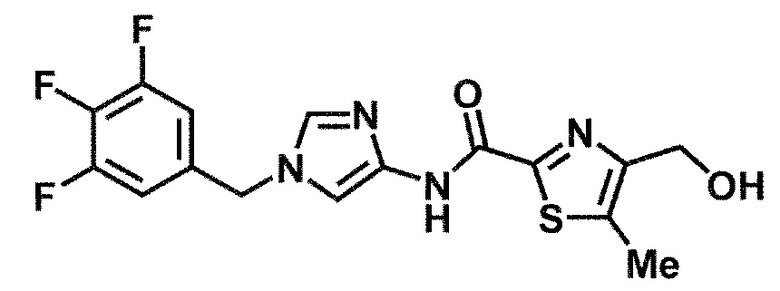
К соединению справочного примера 46-2 (219 мг) добавляли хлористый водород (2 моль/л в метаноле, 2 мл) при комнатной температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, воду и этилацетат, и затем смесь перемешивали при комнатной температуре в течение 10 минут. Полученный осадок собирали на фильтре, промывали водой и гексаном и затем сушили при 50°C под вакуумом с получением названного соединения (84 мг).
LC-MS ([M+H]+/Rt (мин)): 383,2/0,769
[0335]
Пример 48
5-(Гидроксиметил)-4-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]-1,3-тиазол-2-карбоксамид
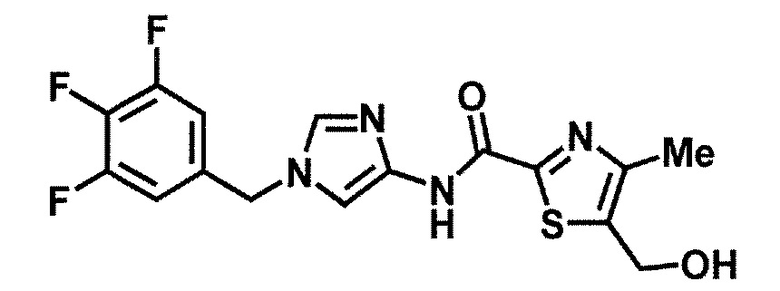
В соответствии с методом примера 47, названное соединение получали из соединения справочного примера 47.
LC-MS ([M+H]+/Rt (мин)): 383,2/0,743
[0336]
Пример 49
5-(Дифторметил)-6-{[(4-метоксибензил)окси]метил}-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид
К раствору соединения справочного примера 60-5 (2,49 г) в метаноле (25 мл) добавляли 2 моль/л водный раствор гидроксида натрия (6,8 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли 4 моль/л хлористоводородной кислоты (2,1 мл) для доведения величины рН до 8. Реакционную смесь концентрировали под вакуумом, и к суспензии полученного остатка в THF (30 мл) добавляли DIEA (1,43 мл) и дифенилхлорфосфат (1,70 мл), и затем смесь перемешивали в течение 2 часов. Добавляли к ней DIEA (1,43 мл) и дифенилхлорфосфат (1,70 мл), и смесь дополнительно перемешивали в течение 1 часа. Добавляли DIEA (2,86 мл) и соединение справочного примера 6 (1,97 г), и смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли 2 моль/л водный раствор гидроксида натрия (10 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли 2 моль/л водный раствор гидроксида натрия (5 мл), и смесь дополнительно перемешивали в течение 1,5 часов. Добавляли метанол (15 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали под вакуумом, и остаток разбавляли водой и затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором карбоната натрия и солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат, этилацетат/метанол) с получением названного соединения (1,88 г).
LC-MS ([M+H]+/Rt (мин)): 534,3/1,021
[0337]
Пример 50
5-(Дифторметил)-6-(гидроксиметил)-N-[1-(3,4,5-трифтор-бензил)-1H-имидазол-4-ил]никотинамид
К раствору соединения примера 49 (1,88 г) в хлороформе (10 мл) добавляли TFA (2 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли TFA (3 мл), и смесь дополнительно перемешивали в течение 3 часов. Реакционную смесь концентрировали под вакуумом, и к остатку добавляли воду и насыщенный водный раствор карбоната натрия, и затем смесь экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором карбоната натрия и солевым раствором, сушили над сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (0,53 г).
1Н-ЯМР (400 МГц, DMSO-d6): δ 11,27 (1H, с), 9,17 (1H, с), 8,54 (1H, с), 7,71 (1H, с), 7,51 (1H, с), 7,42 (1H, т, J=54,8 Гц), 7,37-7,33 (2H, м), 5,61 (1H, т, J=5,8 Гц), 5,19 (2H, с), 4,75 (2H, д, J=5,8 Гц).
LC-MS ([M+H]+/Rt (мин)): 413,2/0,751
[0338]
Примеры 51-52
В соответствии с методом примера 49, получали соединения примеров 51-52 из соединения справочного примера 4 и каждого соответствующего исходного соединения.
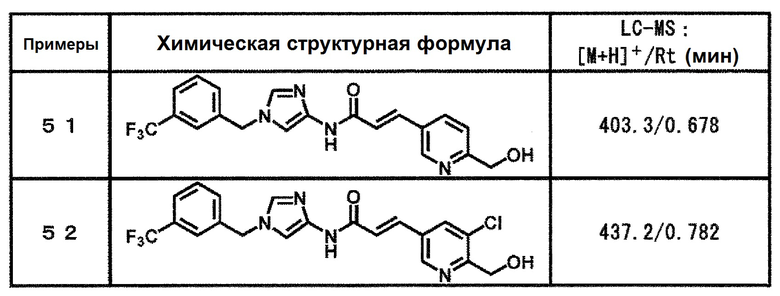
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0339]
Пример 53
(2E)-3-[6-(2-Гидроксипропан-2-ил)пиридин-3-ил]-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}проп-2-енамид
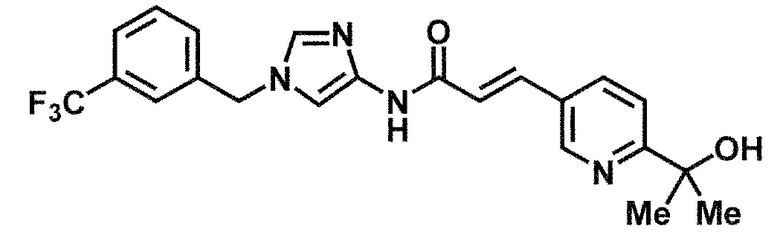
К раствору соединения справочного примера 65-2 (30 мг) в THF (2 мл) добавляли метилмагния бромид (0,97 моль/л в THF, 0,36 мл), и смесь перемешивали при комнатной температуре в течение 1,5 часов. Добавляли метилмагния бромид (0,97 моль/л в THF, 0,36 мл), и смесь дополнительно перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и затем концентрировали под вакуумом. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением названного соединения (13 мг).
LC-MS ([M+H]+/Rt (мин)): 431,3/0,722
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,62 (1H, с), 8,64 (1H, с), 7,92 (1H, дд, J=8,2, 2,1 Гц), 7,70-7,57 (6H, м), 7,50 (1H, д, J=15,9 Гц), 7,38 (1H, с), 6.92 (1H, д, J=15,9 Гц), 5,29 (2H, с), 5,25 (1H, с), 1,43 (6H, с).
[0340]
Примеры 54-55
В соответствии с методом справочного примера 1, получали соединения примеров 54-55 из соединения справочного примера 64-4 и каждого соответствующего исходного соединения.
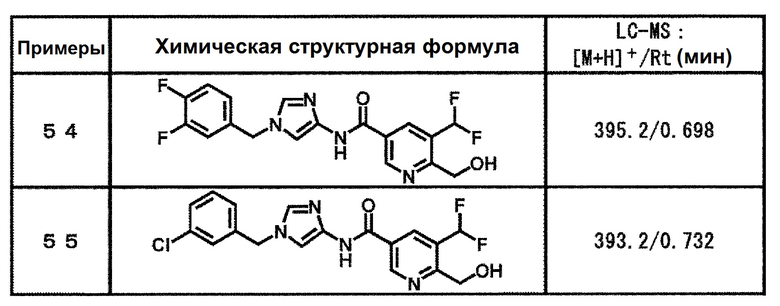
(В данной таблице, в приведенных численных значениях точка отделяет целую часть числа от дробной, то есть выполняет роль запятой)
[0341]
Примеры 56-84
В соответствии с методом справочного примера 1, получали соединения примеров 56-84 из соединения справочного примера 64-4 и каждого соответствующего исходного соединения.

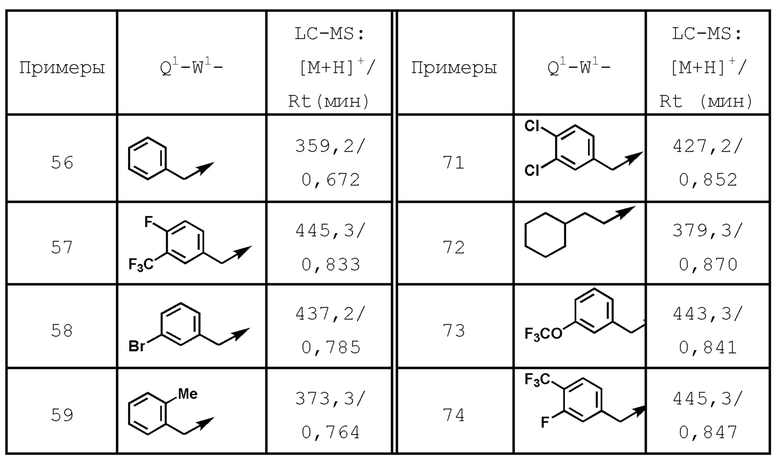
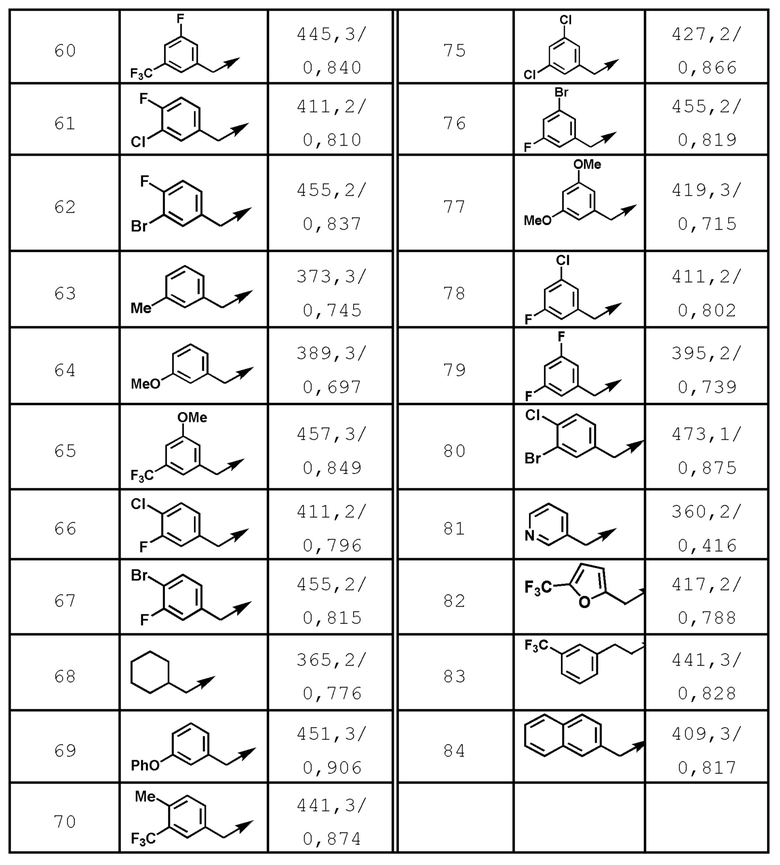
[0342]
Пример 85
6-(Гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]пиридазин-3-карбоксамид
В соответствии с методом примера 40, названное соединение получали из соединения справочного примера 68-2.
LC-MS ([M+H]+/Rt (мин)): 364,2/0,706
[0343]
Пример испытаний 1: Ингибирование способности раковых клеток к сферообразованию
Надежные методы, разработанные для оценки способности клеток к самообновлению, которая является одним из свойств раковых стволовых клеток, включают метод измерения способности раковых клеток к сферообразованию в случае несросшихся клеток в отсутствии сыворотки крови (Cancer Res 65, 5506-5511 (2005)). Клетки линии HCT-116 были доставлены из Американской коллекции типовых культур (ATCC). Клетки линии HCT-116 культивировали при 37°C и 5% CO2, используя среду McCoy 5a, содержащую 10% фетальной бычьей сыворотки (FBS) и 1% пенициллин/стрептомицин. Клетки линии HCT-116 высевали в 384-луночном микропланшете с черным прозрачным дном со сверхнизким прилипанием клеток (Corning Cat. No.3827) в количестве 350-800 клеток/лунка, используя среду DMEM/F12Ю содержащую добавку 2% B27 (GIBCO), 20 нг/мл эпидермального фактора роста (EGF) (peprotech), 10 нг/мл основного фактора роста фибробластов (bFGF) (peprotech), 5 мкг/мл инсулина (Sigma) и 1% пенициллин/стрептомицин. В каждую лунку добавляли испытуемые соединения с доведением конечной концентрации DMSO до 0,1%, и клетки культивировали в течение 4 дней. Затем измеряли число жизнеспособных клеток в каждой лунке с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega) для расчета концентрации каждого испытуемого соединения, при которой достигается 50% ингибирование клеточной пролиферации (величина IC50 для сферообразования; мкмоль/л).
[0344] Эксперимент в примере испытаний 1 проводили для каждого соединения из каждого примера. Концентрации каждого испытуемого соединения при 50% ингибировании клеточной пролиферации (величина IC50 для сферообразования; мкмоль/л) приведены в следующей таблице.
[0345]
Пример испытаний 2: Испытание на ингибирование способности раковых клеток к сферообразованию (в присутствии альбумина бычьей сыворотки (BSA))
Клетки линии HCT-116 были доставлены из Американской коллекции типовых культур (ATCC). Клетки линии HCT-116 культивировали при 37°C и 5% CO2, используя среду McCoy 5a, содержащую 10% фетальной бычьей сыворотки (FBS) и 1% пенициллин/стрептомицин. Клетки линии HCT-116 высевали в 384-луночном микропланшете с черным прозрачным дном со сверхнизким прилипанием клеток (Corning Cat. No.3827) в количестве 350-800 клеток/лунка, используя среду DMEM/F12Ю содержащую добавку 2% B27 (GIBCO), 20 нг/мл эпидермального фактора роста (EGF) (peprotech), 10 нг/мл основного фактора роста фибробластов (bFGF) (peprotech), 5 мкг/мл инсулина (Sigma), 5% альбумина бычьей сыворотки (BSA) и 1% пенициллин/стрептомицин. В каждую лунку добавляли испытуемые соединения с доведением конечной концентрации DMSO до 0,1%, и клетки культивировали в течение 4 дней. Затем измеряли число жизнеспособных клеток в каждой лунке с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega) для расчета концентрации каждого испытуемого соединения, при которой достигается 50% ингибирование клеточной пролиферации (величина IC50 для сферообразования; мкмоль/л).
[0346] Эксперимент в примере испытаний 2 проводили для каждого соединения из каждого примера. Концентрации каждого испытуемого соединения при 50% ингибировании клеточной пролиферации (величина IC50 для сферообразования; мкмоль/л) приведены в следующей таблице.
[0347]
Пример испытаний 3. Исследование фармакокинетики на мыши
Самке мыши в возрасте 7 недель (BALB/cAnNCrlCrlj, CHARLES RIVER LABORATORIES JAPAN, INC.) перорально вводят однократно каждое соединение, суспендированное в 0,5% растворе метилцеллюлозы, в дозе 10 мг/кг или 100 мг/kg. Берут кровь у мыши через 0,5, 1, 2, 4, 8 и 24 часа после введения и отделяют плазму от крови центрифугированием. Рассчитывают площадь под кривой зависимости концентрации в плазме от времени (AUC) на основе изменений концентраций для расчета биодоступности каждого соединения по следующей формуле:
Биодоступность (%)=AUC после перорального введения/AUC после внутривенного введения x 100
Плазму депротеинизируют путем добавления метанола при конечной концентрации 80%, центрифугируя метанольный раствор и фильтруя центрифугированный раствор, и затем количественно определяют настоящее соединение в депротеинизированной плазме методом жидкостная хроматографии с тандемной масс-спектрометрией (LC-MS/MS (API4000, AB SCIEX)). При количественном определении настоящего соединения, получают калибровочную кривую на основе плазмы мыши, в которую добавляют заданное количество соединения. Безафибрат используют в качестве внутреннего стандарта.
[0348]
Пример испытаний 4. Противоопухолевое действие на мышь с опухолью HCT-116
Настоящее соединение может быть использовано для оценки его противоопухолевого действия. Самке "голой" мыши в возрасте от 4 до 7 недель (BALB/cAnNCrj-nu/nu, CHARLES RIVER LABORATORIES JAPAN, INC.) имплантировали под кожу клетки линии HCT-116 (ATCC) в количестве 3×106 клеток/мышь в области брюшка. Приживление трансплантата клеток HCT-116 наблюдали через 5-14 дней после трансплантации, и затем каждое соединение, суспендированное в растворителе, таком как 0,5% раствор метилцеллюлоза, вводили перорально мыши в дозе от 1 до 100 мг/кг от одного до двух раз в сутки. Объем опухоли измеряли через промежутки времени после введения для оценки эффекта по уменьшению объема опухоли в результате введения каждого соединения. Объем опухоли может быть рассчитан, исходя из самой короткой оси и самой длинной оси опухоли, измеренных с помощью штангенциркуля с цифровой индикацией (Mitutoyo), по следующей формуле:
Объем опухоли [мм3]=0,5 x самая короткая ось [мм] x (самая длинная ось [мм])2
Объем опухоли в контрольной группе, в которой вводили только растворитель, такой как 0,5% раствор метилцеллюлозы, сравнивали с объемом опухоли в группе, в которой вводили настоящее соединение, и рассчитывали величину T/C по следующей формуле для оценки противоопухолевого действия настоящего соединения.
T/C(%)=(объем опухоли по окончанию введения в группе, в которой вводили настоящее соединение - объем опухоли в начале введения в группе, в которой вводили настоящее соединение)/(объем опухоли по окончанию введения в контрольной группе - объем опухоли в начале введения в контрольной группе) x 100
Величины T/C (%) для настоящего соединения для каждой дозы и периода введения мыши с опухолью HCT-116 приведены ниже.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0349] Настоящее соединение обладает мощным ингибирующим действием в отношении способности раковых клеток к сферообразованию, и оно может применяться в качестве вводимого перорально противоопухолевого средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ ТИЕНОПИРИМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2158739C2 |
| НОВОЕ ПРОИЗВОДНОЕ НИКОТИНАМИДА ИЛИ ЕГО СОЛЬ | 2011 |
|
RU2560163C2 |
| ПРОИЗВОДНОЕ 6,7-ДИГИДРОПИРАЗОЛО[1,5-a]ПИРАЗИНОНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2018 |
|
RU2792694C2 |
| ИНГИБИТОР СВЯЗЫВАНИЯ СФИНГОЗИН-1-ФОСФАТА | 2007 |
|
RU2395499C2 |
| СУЛЬФОНАМИДНОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2017 |
|
RU2732572C2 |
| ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛПИПЕРИДИНКАРБОКСИЛАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА FAAH | 2005 |
|
RU2376305C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ КОГНИТИВНЫХ ФУНКЦИЙ | 2012 |
|
RU2792010C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ КОГНИТИВНЫХ ФУНКЦИЙ | 2012 |
|
RU2665021C2 |
| ПРОИЗВОДНЫЕ 6-АМИНОХИНАЗОЛИНА ИЛИ 3-ЦИАНОХИНОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА РЕЦЕПТОРНЫХ ТИРОЗИНКИНАЗ EGFR ИЛИ HER-2 | 2010 |
|
RU2536102C2 |
| НОВЫЕ ИМИДАЗОЛИДИНОВЫЕ СОЕДИНЕНИЯ КАК МОДУЛЯТОРЫ АНДРОГЕННЫХ РЕЦЕПТОРОВ | 2009 |
|
RU2488584C2 |
Изобретение относится к применяемым в качестве лекарственного средства производным 1,4-дизамещенного имидазола. Предложено соединение формулы (1а'), где кольцо Q1 представляет собой фенильную, пиридильную или циклогексильную группу; R1 и R2 представляют собой независимо атом водорода, атом галогена или C1-6 алкильную группу; W1а и W3а представляют собой необязательно замещенную C1-4 алкиленовую группу; W2 представляет собой метиленовую группу; W2a-Q2a представляет собой -NR3aC(O)-Q2a, -NR3aC(O)CH2O-Q2a, -C(O)NR3a-Q2a или -NR3aC(O)-CH=CH-Q2a, где R3a представляет собой атом водорода или C1-6 алкильную группу; кольцо Q2 представляет собой пиридильную, пиримидильную, пиридазильную, пиразильную, оксазолильную, тиазолильную, изоксазолильную или изотиазолильную группу; m представляет собой 1, 2, 3, 4 или 5; R11 представляет собой независимо атом водорода, атом галогена, необязательно замещенную C1-6 алкильную группу или C1-6 алкоксильную группу; R12 и R13 представляют собой независимо атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксильную группу, С3-10 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, циано- или аминогруппу; R14 представляет собой гидроксильную группу или C1-6 алкоксильную группу; и его фармакологически приемлемая соль. Предложены также лекарственный препарат для лечения рака, противоопухолевое средство, фармацевтическая композиция, содержащие указанное соединение, способ лечения рака с использованием указанного соединения и варианты применения предложенного соединения для приготовления средства для лечения рака. Технический результат – предложенное соединение обладает мощным ингибирующим действием в отношении способности раковых клеток к сферообразованию и может применяться в качестве вводимого перорально противоопухолевого средства. 7 н. и 22 з.п. ф-лы, 85 пр.
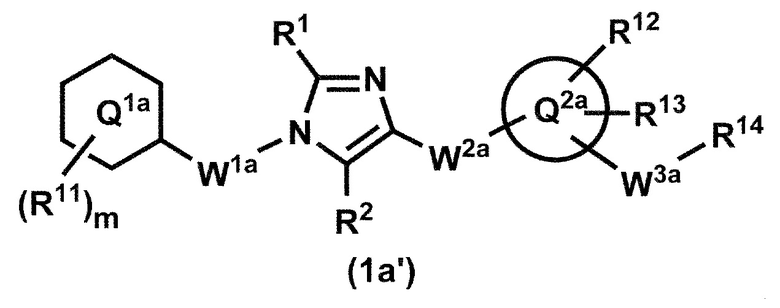
1. Соединение, представленное формулой (1a')
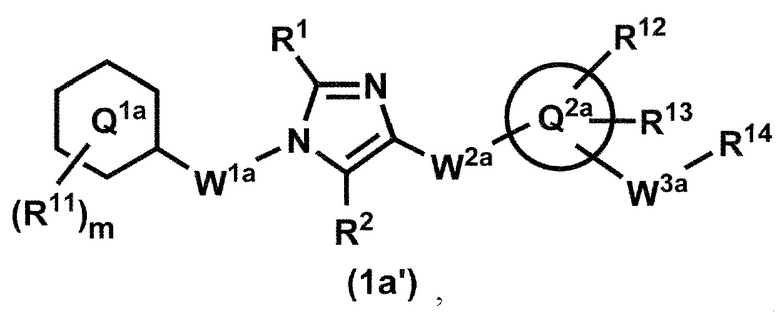
или его фармацевтически приемлемая соль, где кольцо Q1a представляет собой фенильную группу, пиридильную группу или циклогексильную группу;
m представляет собой 1, 2, 3, 4 или 5;
R11, в случае присутствия в количестве двух или более, представляет собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена, или
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена;
R1 и R2 представляют собой независимо атом водорода, атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена;
W1a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных атомов галогена;
W2a-Q2a представляет собой -NR3aC(O)-Q2a, -NR3aC(O)CH2O-Q2a, -C(O)NR3a-Q2a или -NR3aC(O)-CH=CH-Q2a, где R3a представляет собой атом водорода или C1-6 алкильную группу;
кольцо Q2a представляет собой пиридильную группу, пиримидильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу, изоксазолильную группу или изотиазолильную группу;
W3a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси;
R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(6) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена,
(7) C2-6 алкинильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена,
(8) цианогруппу или
(9) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп; и
R14 представляет собой гидроксильную группу или C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси.
2. Соединение по п. 1, представленное формулой (1a)
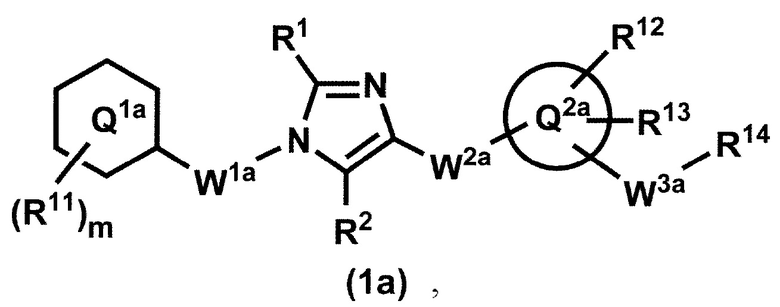
или его фармацевтически приемлемая соль, где кольцо Q1a представляет собой фенильную группу, пиридильную группу или циклогексильную группу;
m представляет собой 1, 2, 3, 4 или 5;
R11, в случае присутствия в количестве двух или более, представляет собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена, или
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена;
R1 и R2 представляют собой независимо атом водорода, атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена;
W1a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных атомов галогена;
W2a-Q2a представляет собой -NR3aC(O)-Q2a, -NR3aC(O)CH2O-Q2a или -C(O)NR3a-Q2a, где R3a представляет собой атом водорода или C1-6 алкильную группу;
кольцо Q2a представляет собой пиридильную группу, пиримидильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу, изоксазолильную группу или изотиазолильную группу;
W3a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена, или этиленовую группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси;
R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C3-10 циклоалкильную группу, которая может быть необязательно замещена с помощью от 1 до 4 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(6) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена,
(7) C2-6 алкинильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена,
(8) цианогруппу или
(9) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп; и
R14 представляет собой гидроксильную группу или C1-6алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси.
3. Соединение по п. 1 или его фармацевтически приемлемая соль, где кольцо Q1a представляет собой фенильную группу.
4. Соединение по п. 1 или его фармацевтически приемлемая соль, где W2a-Q2a представляет собой -NHC(O)-Q2a.
5. Соединение по п. 1 или его фармацевтически приемлемая соль, где кольцо Q2a представляет собой пиридильную группу, пиридазильную группу, пиразильную группу, оксазолильную группу, тиазолильную группу или изоксазолильную группу.
6. Соединение по п. 1 или его фармацевтически приемлемая соль, где кольцо Q2a представляет собой пиридильную группу.
7. Соединение по п. 1 или его фармацевтически приемлемая соль, где R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена, или
(6) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп.
8. Соединение по п. 1 или его фармацевтически приемлемая соль, где R12 и R13 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси, или
(4) амино.
9. Соединение по п. 1 или его фармацевтически приемлемая соль, где R13 представляет собой атом галогена, C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена, или амино и R12 представляет собой атом водорода.
10. Соединение по п. 1 или его фармацевтически приемлемая соль, где W3a представляет собой метиленовую группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена, и R14 представляет собой гидроксильную группу.
11. Соединение по п. 1 или его фармацевтически приемлемая соль, где R1 и R2 представляют собой атом водорода.
12. Соединение по п. 1, представленное формулой (1b)
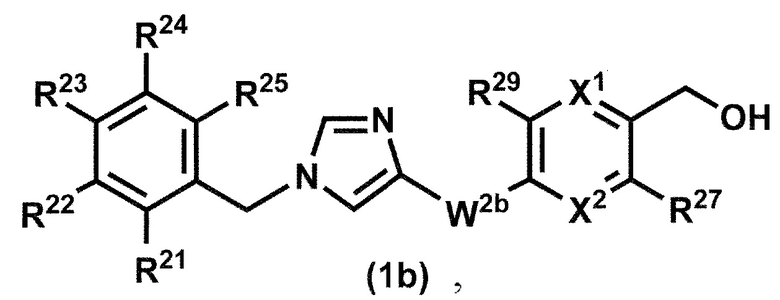
или его фармацевтически приемлемая соль, где X1 представляет собой N или CR26;
X2 представляет собой N или CR28;
при условии, что по меньшей мере один из X1 и X2 представляет собой N;
R21, R22, R23, R24 и R25 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена, или
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена;
W2b представляет собой -NHC(O)- или -C(O)NH-; и
R26, R27, R28 и R29 представляют собой независимо
(1) атом водорода,
(2) атом галогена,
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(4) C1-6 алкоксильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или разных групп, независимо выбранных из группы, состоящей из атома галогена, гидрокси и C1-6 алкокси,
(5) C2-6 алкенильную группу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных атомов галогена, или
(6) аминогруппу, которая может быть необязательно замещена с помощью от 1 до 2 одинаковых или разных C1-6 алкильных групп.
13. Соединение по п. 12 или его фармацевтически приемлемая соль, где R22 представляет собой атом галогена или C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена.
14. Соединение по п. 12 или его фармацевтически приемлемая соль, где R22 представляет собой атом галогена или трифторметильную группу.
15. Соединение по п. 12 или его фармацевтически приемлемая соль, где R21, R23, R24 и R25 представляют собой независимо
(1) атом водорода,
(2) атом галогена или
(3) C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена.
16. Соединение по п. 12 или его фармацевтически приемлемая соль, где W2b представляет собой -NHC(O)-.
17. Соединение по п. 12 или его фармацевтически приемлемая соль, где X1 представляет собой N.
18. Соединение по п. 12 или его фармацевтически приемлемая соль, где X1 представляет собой N и X2 представляет собой CH.
19. Соединение по п. 12 или его фармацевтически приемлемая соль, где R27 представляет собой атом галогена, C1-6 алкильную группу, которая может быть необязательно замещена с помощью от 1 до 3 одинаковых или различных атомов галогена, или аминогруппу и R29 представляет собой атом водорода.
20. Соединение по п. 12 или его фармацевтически приемлемая соль, где R27 представляет собой метильную группу, замещенную с помощью от 1 до 3 атомов фтора, и R29 представляет собой атом водорода.
21. Соединение по п. 1, выбранное из следующих соединений, или его фармацевтически приемлемая соль:
6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид,
6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид,
5-(дифторметил)-6-(гидроксиметил)-N-{1-[3-(трифторметил)-бензил]-1H-имидазол-4-ил}никотинамид,
5-(дифторметил)-6-(гидроксиметил)-N-[1-(3,4,5-трифтор-бензил)-1H-имидазол-4-ил]никотинамид,
6-(гидроксиметил)-5-(трифторметил)-N-{1-[3-(трифтор-метил)бензил]-1H-имидазол-4-ил}никотинамид,
6-(гидроксиметил)-5-метил-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид,
6-(гидроксиметил)-5-метил-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид,
5-амино-6-(гидроксиметил)-N-{1-[3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид,
5-амино-6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]никотинамид,
N-[1-(3,4-дифторбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид,
N-[1-(3-хлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид,
5-(дифторметил)-N-{1-[4-фтор-3-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид,
5-(дифторметил)-N-{1-[3-фтор-5-(трифторметил)бензил]-1H-имидазол-4-ил}-6-(гидроксиметил)никотинамид,
N-[1-(3-хлор-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид,
N-[1-(3-бром-4-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид,
5-(дифторметил)-6-(гидроксиметил)-N-{1-[3-метокси-5-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид,
5-(дифторметил)-6-(гидроксиметил)-N-{1-[4-метил-3-(трифторметил)бензил]-1H-имидазол-4-ил}никотинамид,
N-[1-(3,4-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид,
N-[1-(3,5-дихлорбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид,
N-[1-(3-бром-5-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид,
N-[1-(3-хлор-5-фторбензил)-1H-имидазол-4-ил]-5-(дифтор-метил)-6-(гидроксиметил)никотинамид,
N-[1-(3,5-дифторбензил)-1H-имидазол-4-ил]-5-(дифторметил)-6-(гидроксиметил)никотинамид и
6-(гидроксиметил)-N-[1-(3,4,5-трифторбензил)-1H-имидазол-4-ил]пиридазин-3-карбоксамид.
22. Лекарственный препарат для лечения рака, где рак представляет собой один или более выбранный из группы, состоящей из острого лейкоза, хронического миелолейкоза, миеломы, опухоли головного мозга, рака головы и шеи, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака толстой кишки, рака прямой кишки, рака яичников, рака шейки матки, рака уротелия, почечно-клеточного рака, рака предстательной железы и злокачественной меланомы, включающий соединение по любому одному из пп. 1-21 или его фармацевтически приемлемую соль в качестве активного ингредиента.
23. Противоопухолевое средство, где опухоль представляет собой одну или более выбранную из группы, состоящей из острого лейкоза, хронического миелолейкоза, миеломы, опухоли головного мозга, рака головы и шеи, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака толстой кишки, рака прямой кишки, рака яичников, рака шейки матки, рака уротелия, почечно-клеточного рака, рака предстательной железы и злокачественной меланомы, включающий соединение по любому одному из пп. 1-21 или его фармацевтически приемлемую соль в качестве активного ингредиента.
24. Лекарственный препарат по п. 22, дополнительно включающий другое противораковое средство, выбранное из группы, состоящей из противоракового алкилирующего средства, противоракового антиметаболита, противоракового антибиотика, противоракового средства на основе растительного сырья, противоракового координационного соединения платины, противоракового производного камптотецина, противоракового ингибитора тирозинкиназы, ингибитора серин-треонинкиназы, ингибитора фосфолипидкиназы, моноклонального антитела, интерферона, модификатора биологического отклика, гормонального препарата, ингибитора иммунной контрольной точки, ингибитора молекулы, связанной с динамикой развития, ингибитора посттрансляционной модификации белка и другого противоракового средства или его фармацевтически приемлемой соли.
25. Способ лечения рака, который включает введение терапевтически эффективного количества соединения по любому одному из пп. 1-21 или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом, где рак представляет собой один или более выбранный из группы, состоящей из острого лейкоза, хронического миелолейкоза, миеломы, опухоли головного мозга, рака головы и шеи, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака толстой кишки, рака прямой кишки, рака яичников, рака шейки матки, рака уротелия, почечно-клеточного рака, рака предстательной железы и злокачественной меланомы, где терапевтически эффективное количество соединения представляет собой дозировку от 0,1 до 1000 мг/сутки для пациента массой 50 кг.
26. Применение соединения по любому одному из пп. 1-21 или его фармацевтически приемлемой соли для приготовления средства для лечения рака, где рак представляет собой один или более выбранный из группы, состоящей из острого лейкоза, хронического миелолейкоза, миеломы, опухоли головного мозга, рака головы и шеи, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака толстой кишки, рака прямой кишки, рака яичников, рака шейки матки, рака уротелия, почечно-клеточного рака, рака предстательной железы и злокачественной меланомы.
27. Применение соединения по любому из пп. 1-21 или его фармацевтически приемлемой соли для приготовления средства для для лечения рака для применения в комбинации с другим противораковым средством, выбранным из группы, состоящей из противоракового алкилирующего средства, противоракового антиметаболита, противоракового антибиотика, противоракового средства на основе растительного сырья, противоракового координационного соединения платины, противоракового производного камптотецина, противоракового ингибитора тирозинкиназы, ингибитора серин-треонинкиназы, ингибитора фосфолипидкиназы, моноклонального антитела, интерферона, модификатора биологического отклика, гормонального препарата, ингибитора иммунной контрольной точки, ингибитора молекулы, связанной с динамикой развития, ингибитора посттрансляционной модификации белка и другого противоракового средства или его фармацевтически приемлемой соли, где рак представляет собой один или более выбранный из группы, состоящей из острого лейкоза, хронического миелолейкоза, миеломы, опухоли головного мозга, рака головы и шеи, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака толстой кишки, рака прямой кишки, рака яичников, рака шейки матки, рака уротелия, почечно-клеточного рака, рака предстательной железы и злокачественной меланомы.
28. Фармацевтическая композиция для лечения рака, включающая соединение по любому одному из пп. 1-21 или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку, где рак представляет собой один или более выбранный из группы, состоящей из острого лейкоза, хронического миелолейкоза, миеломы, опухоли головного мозга, рака головы и шеи, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака толстой кишки, рака прямой кишки, рака яичников, рака шейки матки, рака уротелия, почечно-клеточного рака, рака предстательной железы и злокачественной меланомы.
29. Соединение по любому одному из пп. 1-21 или его фармацевтически приемлемая соль для применения при лечении рака, где рак представляет собой один или более выбранный из группы, состоящей из острого лейкоза, хронического миелолейкоза, миеломы, опухоли головного мозга, рака головы и шеи, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака толстой кишки, рака прямой кишки, рака яичников, рака шейки матки, рака уротелия, почечно-клеточного рака, рака предстательной железы и злокачественной меланомы.
| ПРОИЗВОДНЫЕ 1Н-ИМИДАЗОЛА КАК МОДУЛЯТОРЫ РЕЦЕПТОРА КАННАБИНОИДОВ СВ2 | 2006 |
|
RU2410377C2 |
| US 5817677 A1, 06.10.1998 | |||
| US 4140788 A1, 20.02.1979 | |||
| ГЕТЕРОЦИКЛИЛАМИДОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА | 2006 |
|
RU2415851C2 |
Авторы
Даты
2021-01-22—Публикация
2016-06-21—Подача