ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к производному 6,7-дигидропиразоло[1,5-а]пиразинона или его фармацевтически приемлемой соли, обладающим активностью отрицательной аллостерической модуляции в отношении метаботропных рецепторов глутамата (metabotropic glutamate - mGlu) II группы, а также к профилактическому и/или терапевтическому средству для лечения заболевания, связанного с метаботропным рецептором глутамата подтипа 2 (mGluR2) и/или метаботропным рецептором глутамата подтипа 3 (mGluR3), включающему указанное соединение в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
[0002]
Глутамат является основным возбуждающим нейротрансмиттером в центральной нервной системе и воздействует на рецепторы ионных каналов (то есть рецептор глутамата, селективно связывающий N-метил-D-аспартат (NMDA), рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA) и каинатный рецептор) и рецепторы, сопряженные с G-белком (G-protein-coupled receptor - GPCR), такие как метаботропные рецепторы глутамата (mGlu рецепторы). Рецепторы mGlu образуют C класс GPCR и включают внеклеточный сайт связывания ортостерического лиганда помимо семиспирального трансмембранного домена (transmembrane domain - TMD), общего для GPCR. Рецепторы mGlu обладают высокой гомологией в сайте связывания ортостерического лиганда, и считается, что трудно разработать ортостерические лиганды, селективные к данному подтипу. Аллостерические модуляторы проявляют селективность подтипа связыванием с TMD (непатентные документы 1-3).
Рецепторы mGlu включают 8 подтипов: от 1 до 8 (mGluR1 - mGluR18), и подразделяются на группу I (mGluR1, mGluR5), группу II (mGluR2, mGluR3) и группу III (mGluR4, mGluR6, mGluR7, mGluR8), исходя из гомологии, сигнальной системы, подлежащей конъюгации, и фармакологических свойств. Рецепторы mGlu группы II (mGluR2, mGluR3) в основном экспрессируются в пресинапсе и отрицательно модулируют высвобождение глутамата. Поэтому сообщалось, что отрицательные аллостерические модуляторы (negative allosteric modulators - NAM) рецепторов mGlu2/3 обладают потенциалом в качестве антидепрессантов (непатентный документ 4) и усилителей когнитивной функции (непатентный документ 5).
[0003]
Выявленные в последнее время соединения, которые выступают в качестве NAM рецепторов mGlu2/3, описаны в патентной литературе 1-7. Однако в патентной литературе не раскрыто и не описано соединение формулы (1), которое описано ниже.
СПИСОК ЛИТЕРАТУРЫ
ПАТЕНТНАЯ ЛИТЕРАТУРА
[0004]
[Патентный документ 1] WO 2014/195311
[Патентный документ 2] WO 2016/016380
[Патентный документ 3] WO 2016/016381
[Патентный документ 4] WO 2016/016382
[Патентный документ 5] WO 2016/016383
[Патентный документ 6] WO 2016/016395
[Патентный документ 7] WO 2016/087487
НЕПАТЕНТНАЯ ЛИТЕРАТУРА
[0005]
[Непатентный документ 1] Hemstapat et al., Pharmacology and Experimental Therapeutics, 2007, 322, 254-264
[Непатентный документ 2] Lungstrom et al., British Journal of Pharmacology, 2011, 164, 521-537
[Непатентный документ 3] Dore et al., Nature, 2014, 511, 557-562
[Непатентный документ 4] Chaki et al., Neuropharmacology, 2013, 66, 40-52
[Непатентный документ 5] Higgins et al., Neuropharmacology, 2004, 46, 907-917
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
[0006]
Проблема, решаемая настоящим изобретением, заключается в выявлении новых соединений, проявляющих отрицательную аллостерическую модуляцию в отношении рецептором mGlu группы II, и разработке профилактического и/или терапевтического средства, применимого для лечения заболевания, в которое вовлечены рецепторы mGlu II группы (то есть метаботропный глутаматный рецептор подтипа 2 (mGluR2) и/или метаботропный глутаматный рецептор подтипа 3 (mGluR3)).
СРЕДСТВА РЕШЕНИЯ ПРОБЛЕМ
[0007]
Автор настоящего изобретения обнаружил, что проблема решается с помощью соединения формулы (1), которое описано ниже, или его фармацевтически приемлемой соли, которые далее называются также «соединение по настоящему изобретению», и достиг цели настоящего изобретения.
[0008]
Настоящее изобретение включает следующее варианты осуществления.
[0009]
[Пункт 1]
Соединение формулы (1):
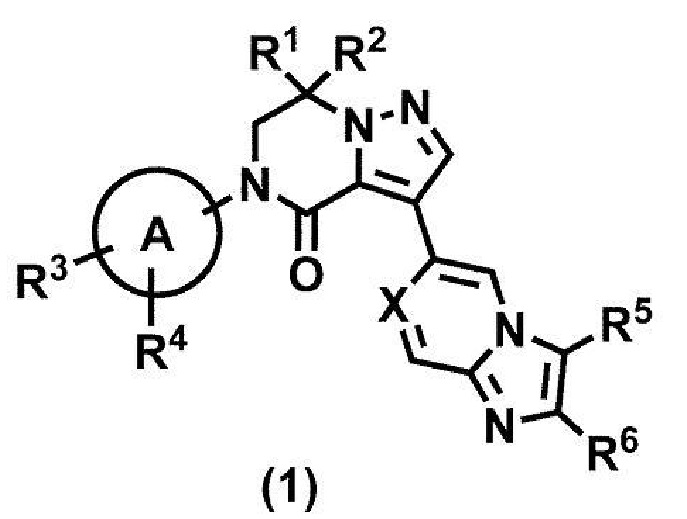
или его фармацевтически приемлемая соль,
где R1 и R2 независимо представляют собой атом водорода, атом галогена, цианогруппу, C1-4 алкил или C3-6 насыщенную карбоциклильную группу, где каждая алкильная и насыщенная карбоциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси, или,
в качестве альтернативы, R1 и R2 вместе с атом углерода, к которому они присоединены, могут образовывать насыщенную С3-4 карбоциклильную группу, где насыщенная карбоциклильная группа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и С1-4 алкокси;
кольцо А представляет собой С6-10 ароматическую карбоциклильную группу, 4-10-членную насыщенную гетероциклильную группу или 5-10-членную ароматическую гетероциклильную группу;
R3 и R4 независимо представляют собой атом водорода, атом галогена, цианогруппу, гидроксильную группу, C1-6 алкил, C1-4 алкокси, C1-4 алкилтио, C2-4 алкенил, 4-6-членную насыщенную гетероциклильную группу или 5- или 6-членную ароматическую гетероциклильную группу (где каждая алкильная, алкокси, алкилтио, насыщенная гетероциклильная группа и ароматическая гетероциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов), C3-6 насыщенную карбоциклильную группу или C3-6 циклоалкоксигруппу, где каждая насыщенная карбоциклильная группа и циклоалкоксигруппа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена и C1-4 алкила;
R5 и R6 независимо представляют собой атом водорода, атом галогена, цианогруппу, гидроксильную группу, C1-6 алкил, C1-6 алкокси, C1-6 алкилтио, 4-6-членную насыщенную гетероциклильную группу (где каждая алкильная, алкокси, алкилтио и насыщенная гетероциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкоксигруппы, необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов), C3-6 циклоалкокси, C3-6 насыщенную карбоциклильную группу (где каждая циклоалкоксигруппа и насыщенная карбоциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы, C1-4 алкильной и C1-4 алкоксигруппы, необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов), -NRaRb, -NRd-C(О)-Rc, -NRd-C(О)-ОRс, -NRd-C(О)-NRaRb, -NRd-SО2-Rc, -CH2-C(О)-NRaRb, -C(О)-Rd, -C(О)-ОRd или -C(О)-NRaRb;
Ra и Rb независимо, и когда присутствует несколько NRaRb, каждая из групп Ra или групп Rb независимо, представляют собой атом водорода, C1-4 алкил (где каждый алкил является независимым и может быть необязательно замещенным от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкоксигруппы), C3-6 насыщенную карбоциклильную группу или 4-6-членную насыщенную гетероциклильную группу, где каждая насыщенная карбоциклильная группа и насыщенная гетероциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы, C1-4 алкила и C1-4 алкокси, или,
в качестве альтернативы, Ra и Rb вместе с атом азота, к которому они присоединены, могут образовывать 4-6-членную азотсодержащую насыщенную гетероциклильную группу, где азотсодержащая насыщенная гетероциклильная группа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы, C1-4 алкила и C1-4 алкокси;
Rc, и когда присутствует несколько групп Rc, каждая независимо, представляет собой С1-4 алкил, С3-6 насыщенную карбоциклильную группу или 4-6-членную насыщенную гетероциклильную группу, где каждая алкильная, насыщенная карбоциклильная группа и насыщенная гетероциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси;
Rd, и когда присутствует несколько групп Rd, каждая независимо, представляет собой атом водорода, C1-4 алкил, C3-6 насыщенную карбоциклильную группу или 4-6-членную насыщенную гетероциклильную группу, где каждая алкильная, насыщенная карбоциклильная группа и насыщенная гетероциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси;
Х представляет собой атом азота или -CRe-; и
Re представляет собой атом водорода, атом галогена, цианогруппу, C1-6 алкил или C1-6 алкокси, где алкильная и алкоксигруппа может быть необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов.
[0010]
[Пункт 2]
Соединение по пункту 1 или его фармацевтически приемлемая соль, где R1 и R2 независимо представляют собой атом водорода или C1-4 алкил, где алкил может быть необязательно замещенным от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси, или, в качестве альтернативы, R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопропановое кольцо или циклобутановое кольцо.
[0011]
[Пункт 3]
Соединение по пункту 1 или 2 или его фармацевтически приемлемая соль, где кольцо A представляет собой бензол, нафталин, пиридин, пиримидин, пиразин, тиофен, тиазол, изотиазол, оксазол, изоксазол, хинолин, изохинолин, бензотиофен, бензофуран, индолизин, имидазопиридин, 1,3-бензодиоксол, хроман, 2,3-дигидробензофуран, 1,3-дигидроизобензофуран, 2,3-дигидро-1Н-инден или 2,3-дигидро-1Н-инден-1-он.
[0012]
[Пункт 4]
Соединение по любому из пунктов с 1 по 3 или его фармацевтически приемлемая соль, где R3 и R4 независимо представляют собой
(1) атом водорода,
(2) атом галогена,
(3) цианогруппу,
(4) гидроксильную группу,
(5) C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов,
(6) С1-4 алкоксигруппу, необязательно замещенную от 1 до 5 одинаковыми или разными атомами галогенов,
(7) С3-6 циклоалкоксигруппу, где циклоалкоксигруппа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из C1-4 алкила и атома галогена, или
(8) С1-4 алкилтиогруппу, необязательно замещенную от 1 до 5 одинаковыми или разными атомами галогенов.
[0013]
[Пункт 5]
Соединение по любому из пунктов с 1 по 4 или его фармацевтически приемлемая соль, где R5 и R6 независимо представляют собой
(1) атом водорода,
(2) атом галогена,
(3) цианогруппу,
(4) гидроксильную группу,
(5) C1-4 алкил, где алкил может быть необязательно замещенным от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкоксигруппы, необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из атомов галогенов,
(6) C1-4 алкокси, где алкоксигруппа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкоксигруппы, необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов,
(7) 4-6-членную насыщенную гетероциклильную группу, где насыщенная гетероциклильная группа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкоксигруппы, необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов, или
(8) -NRaRb, -NRd-C(О)-Rc, -NRd-C(О)-ОRc, -NRd-C(О)-NRaRb, - NRd-SО2-Rc, -CH2-C(О)-NRaRb, -C(О)-Rd, -C(О)-ОRd или -C(О)-NRaRb.
[0014]
[Пункт 6]
Соединение по любому из пунктов с 1 по 5 или его фармацевтически приемлемая соль, где Ra и Rb независимо, и когда присутствует несколько NRaRb, каждая из групп Ra или групп Rb независимо, представляют собой атом водорода или C1-4 алкил, где каждая алкильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси, или, в качестве альтернативы, Ra и Rb вместе с атомом азота, к которому они присоединены, образуют 4-6-членную азотсодержащую насыщенную гетероциклильную группу, где азотсодержащая насыщенная гетероциклильная группа может быть замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы, C1-4 алкила и C1-4 алкокси.
[0015]
[Пункт 7]
Соединение по любому из пунктов с 1 по 6 или его фармацевтически приемлемая соль, где Rc, и когда присутствует несколько групп Rc, каждая независимо, представляет собой C1-4 алкил или C3-6 насыщенную карбоциклильную группу, где каждая алкильная и насыщенная карбоциклильная группа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси.
[0016]
[Пункт 8]
Соединение по любому из пунктов с 1 по 7 или его фармацевтически приемлемая соль, где Rd, и когда присутствует несколько групп Rd, каждая независимо, представляет собой
(1) атом водорода,
(2) C1-4 алкил, где алкильная группа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси, или
(3) С3-6 насыщенную карбоциклильную группу, где насыщенная карбоциклильная группа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси.
[0017]
[Пункт 9]
Соединение по любому из пунктов с 1 по 8 или его фармацевтически приемлемая соль, где Re представляет собой
(1) атом водорода,
(2) атом галогена или
(3) C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов.
[0018]
[Пункт 10]
Соединение по любому из пунктов 1, 3-9 или его фармацевтически приемлемая соль, где R1 и R2 независимо представляют собой атом водорода, метил, этил, изопропил, циклопропил, метоксиметил, гидроксиметил, дифторметил или трифторметил или, в качестве альтернативы, R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопропановое кольцо или циклобутановое кольцо.
[0019]
[Пункт 11]
Соединение по любому из пунктов с 1 по 10 или его фармацевтически приемлемая соль, где кольцо А представляет собой бензол, тиофен, пиридин, хинолин или 1,3-бензодиоксол.
[0020]
[Пункт 12]
Соединение по любому из пунктов с 1 по 11 или его фармацевтически приемлемая соль, где R3 и R4 независимо представляют собой
(1) атом водорода,
(2) атом галогена,
(3) цианогруппу,
(4) С1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов, или
(5) С1-4 алкоксигруппу, необязательно замещенную от 1 до 5 одинаковыми или разными атомами галогенов.
[0021]
[Пункт 13]
Соединение по любому из пунктов с 1 по 12 или его фармацевтически приемлемая соль, где Rc, и когда присутствует несколько групп Rc, каждая независимо, представляет собой C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов.
[0022]
[Пункт 14]
Соединение по любому из пунктов с 1 по 13 или его фармацевтически приемлемая соль, где Rd, и когда присутствует несколько групп Rd, каждая независимо, представляет собой атом водорода или C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов.
[0023]
[Пункт 15]
Соединение по любому из пунктов с 1 по 14 или его фармацевтически приемлемая соль, где R5 и R6 независимо представляют собой
(1) атом водорода,
(2) атом галогена,
(3) цианогруппу,
(4) гидроксильную группу,
(5) C1-4 алкил, где алкил может быть необязательно замещенным от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкоксигруппы, необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из атомов галогенов,
(6) C1-4 алкокси, где алкоксигруппа может быть замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкоксигруппы, необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов,
(7) 4-6-членную насыщенную гетероциклильную группу, где насыщенная гетероциклильная группа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и С1-4 алкокси, необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов, или
(8) -NRaRb.
[0024]
[Пункт 16]
Соединение по любому из пунктов с 1 по 15 или его фармацевтически приемлемая соль, где Ra и Rb независимо, и когда присутствует несколько NRaRb, каждая из групп Ra или групп Rb независимо, представляют собой атом водорода или C1-4 алкил, где алкильная группа может быть необязательно замещенной от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси.
[0025]
[Пункт 17]
Соединение по любому из пунктов с 1 по 16 или его фармацевтически приемлемая соль, где Re представляет собой
(1) атом водорода,
(2) атом фтора или
(3) C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов.
[0026]
[Пункт 18]
Соединение по пункту 1 или его фармацевтически приемлемая соль, где R1 представляет собой метил;
R2 представляет собой атом водорода;
фрагмент 6,7-дигидропиразоло[1,5-а]пиразин-4(5Н)-он имеет S-конфигурацию в 7 положении;
кольцо А представляет собой бензол;
R3 и R4 независимо представляют собой атом водорода, фтор, хлор, дифторметил, трифторметил или дифторметокси;
R5 и R6 независимо представляют собой атом водорода или -NH2; и
Х представляет собой атом азота или -CH-.
[0027]
[Пункт 19]
Соединение по пункту 1 или фармацевтически его приемлемая соль, выбранное из следующих соединений:
пример 1: (7S)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 2: (7S)-3-(имидазо[1,2-а]пиразин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 3: (7S)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-5-[3-хлор-4-фторфенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 4: (7S)-5-[4-(дифторметил)фенил]-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 5: (7S)-5-(4-хлор-3-фторфенил)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 6: (7S)-5-(4-хлорфенил)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 9: (7S)-5-[4-(дифторметокси)фенил]-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он; и
пример 11: (7S)-3-(3-аминоимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он.
[0028]
[Пункт 20]
Соединение по пункту 1 или его фармацевтически приемлемая соль, выбранное из следующий соединений:
пример 13: (7S)-3-(3-фторимидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 14: (7S)-7-метил-3-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 15: (7S)-3-(3-этилимидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он; и
пример 16: (7S)-7-метил-3-(3-пропилимидазо[1,2-a]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он.
[0029]
[Пункт 21]
Соединение по пункту 1 или его гидрохлоридная или фосфатная соль, выбранное из следующих соединений:
пример 1: (7S)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразол[1,5-а]пиразин-4(5H)-он;
пример 3: (7S)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-5-[3-хлор-4-фторфенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
пример 13: (7S)-3-(3-фторимидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он; и
пример 14: (7S)-7-метил-3-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он.
[0030]
[Пункт 22]
Фармацевтическая композиция, включающая соединение по любому из пунктов с 1 по 21 или его фармацевтически приемлемую соль.
[0031]
[Пункт 23]
Терапевтическое средство и/или профилактическое средство для заболевания, в которое вовлечен рецептор mGlu группы II, включающее соединение по любому из пунктов с 1 по 21 или его фармацевтически приемлемую соль в качестве активного ингредиента.
[0032]
[Пункт 24]
Терапевтическое средство и/или профилактическое средство по пункту 23, где рецептор mGlu группы II представляет собой метаботропный рецептор глутамата подтипа 2 (mGluR2).
[0033]
[Пункт 25]
Терапевтическое средство и/или профилактическое средство по пункту 23 или 24, где заболевание, в которое вовлечен рецептор mGlu группы II, представляет собой психическое заболевание или нейродегенеративное заболевание.
[0034]
[Пункт 26]
Терапевтическое средство и/или профилактическое средство по пункту 25, где психическое заболевание или нейродегенеративное заболевание представляет собой депрессивный эпизод тяжелой степени, депрессивное расстройство, биполярное и связанные с ним расстройства, тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, острое стрессовое расстройство, шизофрению, расстройства аутического спектра, болезнь Альцгеймера, когнитивную дисфункцию, деменцию, лекарственную зависимость, ожирение, судороги, тремор, боль или расстройство сна.
[0035]
[Пункт 27]
Применение соединения по любому из пунктов с 1 по 21 или его фармацевтически приемлемой соли в производстве терапевтического средства и/или профилактического средства для заболевания, в которое вовлечен рецептор mGlu группы II.
[0036]
[Пункт 28]
Соединение по любому из пунктов с 1 по 21 или его фармацевтически приемлемая соль для применения в лечении и/или предотвращения заболевания, в которое вовлечен рецептор mGlu группы II.
[0037]
[Пункт 29]
Способ лечения и/или предотвращения заболевания, в которое вовлечен рецептор mGlu группы II, включающий введение терапевтически эффективного количества соединения по любому из пунктов с 1 по 21 или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом.
[0038]
[Пункт 30]
Лекарственное средство, которое включает лекарственное средство, содержащее соединение по любому из пунктов с 1 по 21 или его фармацевтически приемлемую соль, и одно или несколько лекарственных средств для депрессивного эпизода тяжелой степени, депрессивного расстройства, биполярного и связанных с ним расстройств, тревожного расстройства, посттравматического стрессового расстройства, обсессивно-компульсивного расстройства, острого стрессового расстройства, шизофрении, расстройств аутического спектра, болезни Альцгеймера, когнитивной дисфункции, деменции, лекарственной зависимости, ожирения, судорог, тремора, боли или расстройства сна.
[0039]
[Пункт 31]
Лекарственное средство для лечения психического заболевания или нейродегенеративного заболевания, включающее соединение по любому из пунктов с 1 по 21 или его фармацевтически приемлемую соль, для применения в комбинации с одним или несколькими нейролептическими лекарственными средствами.
[0040]
[Пункт 32]
Способ получения соединения формулы (1a)
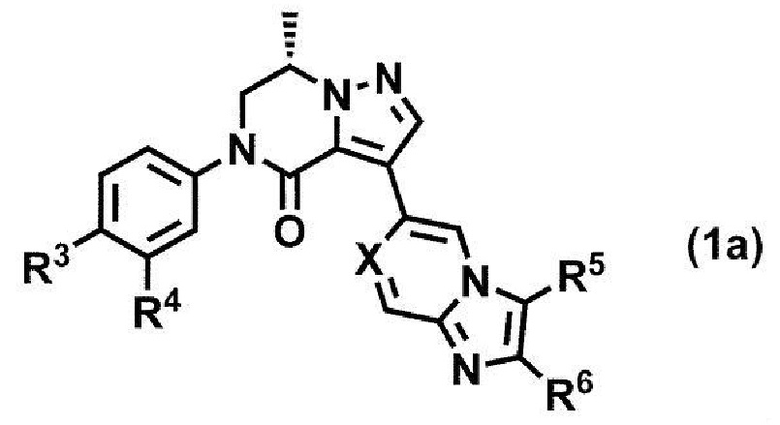
или его фармацевтически приемлемой соли,
где R3 и R4 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или C1-4 алкокси, где каждая алкильная и алкоксигруппа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов;
R5 и R6 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или -NH2; и
X представляет собой атом азота или -CH-,
который включает следующие стадии:
(стадия A1) взаимодействие соединения формулы (4a):
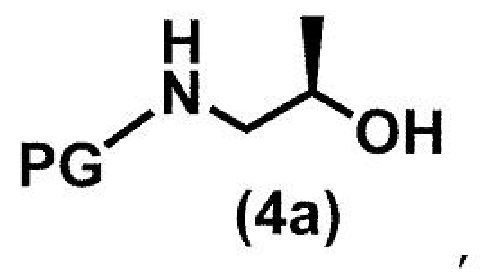
где PG представляет собой защитную группу, такую как трет-бутоксикарбонильная группа и бензилоксикарбонильная группа,
и соединения формулы (3):
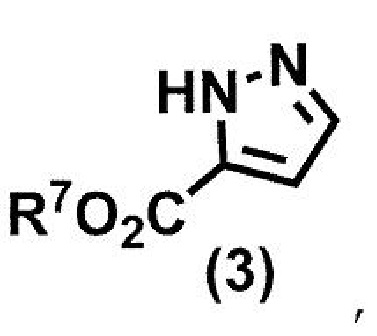
где R7 представляет собой метил или этил,
в условиях реакции Митсунобу (Mitsunobu) с получением соединения формулы (6a):
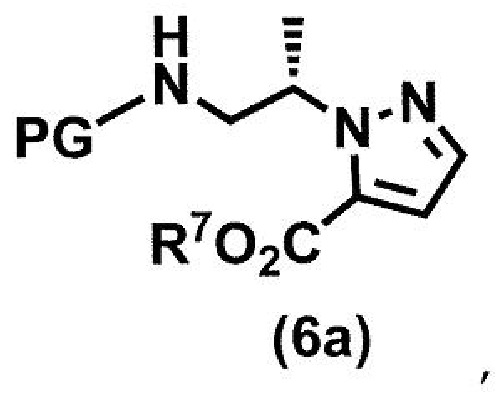
где PG и R7 принимают значения, определенные в данном пункте;
(стадия A2) циклизация соединения формулы (6a) в присутствии кислоты или основания с получением соединения формулы (7a):
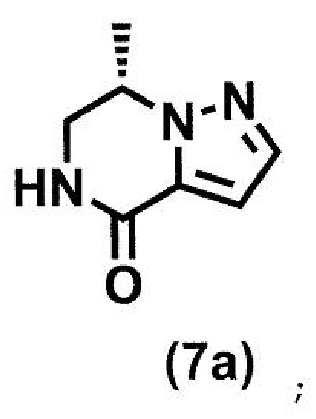
(стадия A3) связывание соединения формулы (7a) и соединения формулы (8a):
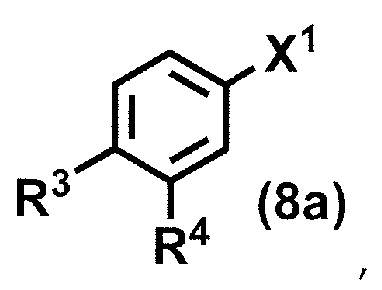
где R3 и R4 принимают значения, определенные в данном пункте, и X1 представляет собой атом йода, атом брома или атом хлора,
в присутствии катализатора переходного металла с получением соединения формулы (9a):
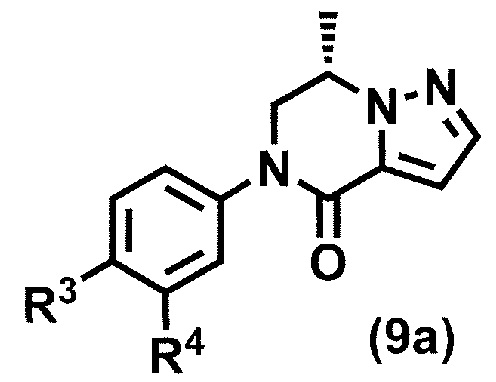
где R3 и R4 принимают значения, определенные в данном пункте;
(стадия A4) взаимодействие соединения формулы (9a) с галогенирующим агентом с получением соединения формулы (15a):
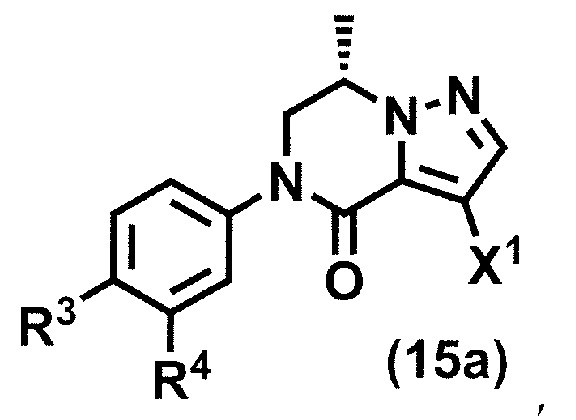
где R3, R4 и X1 принимают значения, определенные в данном пункте; и
(стадия A5) связывание соединения формулы (15a) и соединения формулы (16):
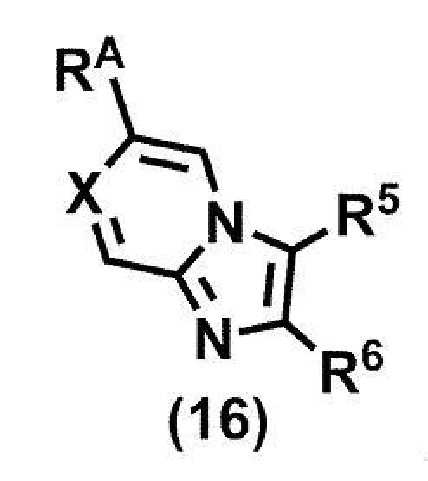
или его соли,
где R5, R6 и X принимают значения, определенные в данном пункте, и RA представляет собой бороновую кислоту или сложный эфир бороновой кислоты,
в присутствии катализатора переходного металла с получением соединения формулы (1a) или его фармацевтически приемлемой соли.
[0041]
[Пункт 33]
Способ получения соединения формулы (1a):

или его фармацевтически приемлемой соли,
где R3 и R4 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или C1-4 алкокси, где каждая алкильная и алкоксигруппа является независимой и может быть необязательно замещенной от 1 до 5 одинаковыми или разными атомами галогенов;
R5 и R6 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или -NH2; и
X представляет собой атом азота или -CH-,
который включает следующие стадии:
(стадия B1) связывание соединения формулы (8a):
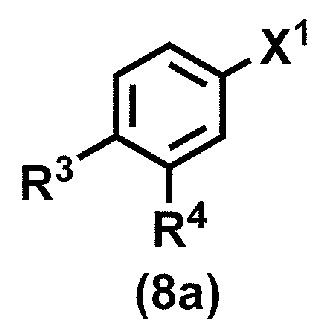
где R3 и R4 принимают значения, определенные в данном пункте, и X1 представляет собой атом йода, атом брома или атом хлора,
с соединением формулы (12a):
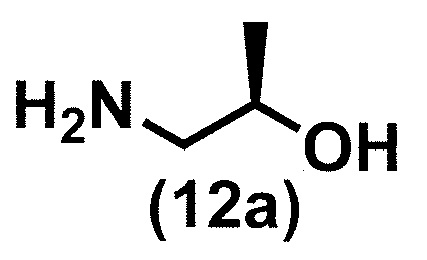
или его солью
в присутствии катализатора переходного металла с получением соединения формулы (13a):
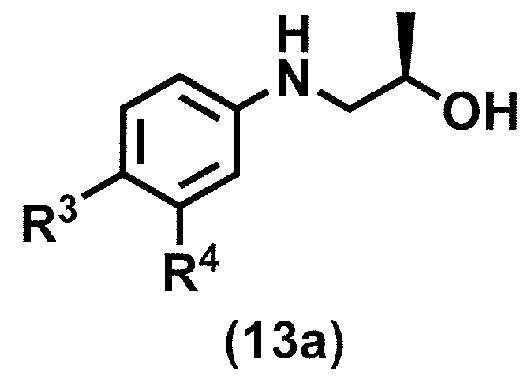
или его соли,
где R3 и R4 принимают значения, определенные в данном пункте;
(стадия B2) взаимодействие соединения формулы (13a) или его соли и соединения формулы (22):
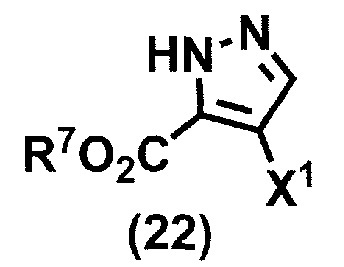
или его соли,
где X1 принимает значения, определенные в данном пункте, и R7 представляет собой метил или этил,
в условиях реакции Митсунобу с получением соединения формулы (23a):
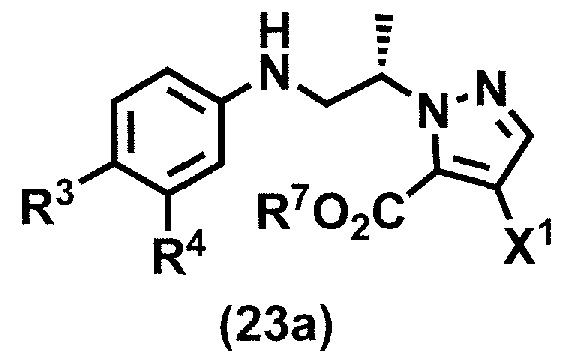
или его соли,
где R3, R4, R7 и X1 принимают значения, определенные в данном пункте;
(стадия B3) гидролиз соединения формулы (23a) или его соли в присутствии кислоты или основания с получением соединения формулы (24):
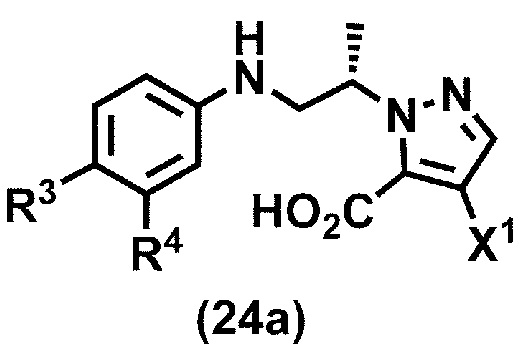
или его соли,
где R3, R4 и X1 принимают значения, определенные в данном пункте;
(стадия B4) циклизация соединения формулы (24a) или его соли в присутствии кислоты или основания с получением соединения формулы (15a):
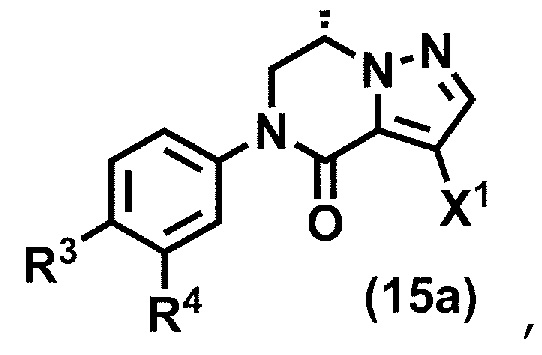
где R3, R4 и X1 принимают значения, определенные в данном пункте; и
(стадия B5) связывание соединения формулы (15a) и соединения формулы (16):
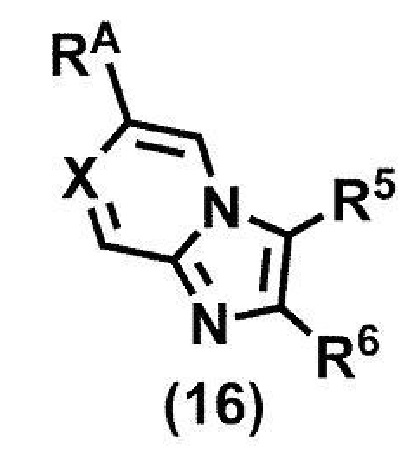
или его соли,
где R5, R6 и X принимают значения, определенные в данном пункте, и RA представляет собой бороновую кислоту или сложный эфир бороновой кислоты,
в присутствии катализатора переходного металла с получением соединения формулы (1a) или его фармацевтически приемлемой соли;
где стадия B3 и стадия B4 могут заменяться одной стадией B6, которая описана ниже:
(стадия B6) циклизация соединения формулы (23a) или его соли в присутствии кислоты или основания с получением соединения формулы (15a).
[0042]
[Пункт 34]
Кристалл (кристаллическая форма I) (7S)-3-(имидазо[1,2- a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7- дигидропиразоло[1,5-a]пиразин-4(5Н)-она, на порошковой дифракционной рентгенограмме которого имеются дифракционные пики при углах дифракции 2θ(°) 4,5 ± 0,2, 8,5 ± 0,2, 8,9 ± 0,2, 10,1 ± 0,2, 13,4 ± 0,2 и 16,9 ± 0,2, определенные порошковой рентгеновской дифракцией.
[0043]
[Пункт 35]
Кристалл (кристаллическая форма II) гидрохлоридной соли (7S)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5H)-она, на порошковой дифракционной рентгенограмме которого имеются дифракционные пики при углах дифракции 2θ(°) 5,7 ± 0,2, 8,7 ± 0,2, 9,5 ± 0,2, 11,0 ± 0,2, 11,3 ± 0,2 и 15,3 ± 0,2, определенные порошковой рентгеновской дифракцией.
[0044]
[Пункт 36]
Кристалл (кристаллическая форма III) 2,5 фосфатной соли (7S)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5H)-она, на порошковой дифракционной рентгенограмме которой имеются дифракционные пики при углах дифракции 2θ(°) 6,1 ± 0,2, 8,9 ± 0,2, 9,8 ± 0,2, 12,1 ± 0,2, 13,4 ± 0,2 и ± 0,2, определенные порошковой рентгеновской дифракцией.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Соединение по настоящему изобретению проявляет отрицательную аллостерическую модуляцию в отношении метаботропных рецепторов глутамата II группы (mGlu). Таким образом, соединение по настоящему изобретению может применяться в качестве терапевтического средства и/или профилактического средства при заболевании, в которое вовлечены рецепторы mGlu II группы (т.е. метаботропный рецептор глутамата подтипа 2 (mGluR2) и/или метаботропный рецептор глутамата подтипа 3 (mGluR3)).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0046]
[Фигура 1]
На фигуре 1 представлена порошковая дифракционная рентгенограмма кристаллической формы I. На горизонтальной оси показаны углы дифракции 2θ (°), на вертикальной оси - количество единиц; то же относится к фигурам 2 и 3.
[Фигура 2]
На фигуре 2 представлена порошковая дифракционная рентгенограмма кристаллической формы II.
[Фигура 3]
На фигуре 3 представлена порошковая дифракционная рентгенограмма кристаллической формы III.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0047]
Далее поясняются термины, используемые в настоящем описании.
[0048]
Термин «группа» означает моновалентную группу. Термин «группа» в описании может быть опущен.
[0049]
Число заместителей в группе, определяемой термином «необязательно замещенная» или «замещенная», не ограничено, если это число применимо к данной группе. Каждое определение каждой группы также применимо в случае, когда группа является частью или заместителем других групп, если не указано иное.
[0050]
Термин «С1-4 алкил» означает алифатическую углеводородную группу, содержащую от 1 до 4 атомов углерода, а термин «С4 алкил» означает алифатическую углеводородную группу, содержащую 4 атома углерода. Это же применимо и к другим численным показателям. Примеры «С1-4 алкила» включают, например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1,1-диметилэтил, 1-метилпропил и 2-метилпропил.
[0051]
Термин «С1-6 алкил» означает алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода. Термин «C1-6 алкил» предпочтительно включает «C1-4 алкил». Примеры «С1-6 алкила» включают 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, а также примеры «С1-4 алкила», которые описаны выше.
[0052]
Термин «галоген» включает, например, атом фтора, атом хлора, атом брома, атом йода. Более предпочтительным является атом фтора или атом хлора.
[0053]
Термин «C1-4 алкокси» означает кислородную группу, замещенную «C1-4 алкилом», который описан выше. Примеры «C1-4 алкокси» включают метокси, этокси, н-пропокси, 1-метилэтокси, н-бутокси, 1,1-диметилэтокси, 1-метилпропокси и 2-метилпропокси. Предпочтительным является метокси или этокси.
[0054]
Термин «C1-6 алкокси» означает кислородную группу, замещенную «C1-6 алкилом», который описан выше. Термин «C1-6 алкокси» предпочтительно включает «С1-4 алкокси». Примеры «C1-6 алкокси» включают н-пентилокси, 3-бутокси, 2-бутокси, 2,2-диметилпропокси, 1-этилпропокси, 1,1-диметилпропокси, н-гексилокси, 4-пентилокси, 3-пентилокси, 2-пентилокси, 1-пентилокси, 3,3-дибутокси, 2,2-дибутокси, 1,1-дибутокси и 1,2-дибутокси, а также примеры «C1-4 алкокси», которые описаны выше.
[0055]
Термин «C3-6 циклоалкокси» означает оксигруппу, замещенную циклическим алкил, содержащим от 3 до 6 атомов углерода. Примеры «C3-6 циклоалкокси» включают, например, циклопропокси, циклобутокси, циклопентилокси и циклогексилокси. Предпочтительным цикоалкокси является циклопропокси или циклобутокси.
[0056]
Термин «C1-4 алкилтио» означает тиольную группу, замещенную «C1-6 алкилом», который описан выше. Примеры «C1-4 алкилтио» включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, s-бутилтио и трет-бутилтио.
[0057]
Термин «C1-6 алкилтио» означает тиольную группу, замещенную «C1-6 алкилом», который описан выше. «C1-6 алкилтио» предпочтительно включает «C1-4 алкилтио». Примеры «C1-6 алкилтио» включают 1-этилпропилтио, н-пентилтио, неопентилтио, н-гексилтио, изогексилтио, а также примеры «C1-4 алкилтио», которые описаны выше.
[0058]
Термин «С2-4 алкенил» означает алифатическую углеводородную группу, содержащую от 2 до 4 атомов углерода в цепи и по меньшей мере одну двойную углерод-углеродную связь. Примеры «С2-4 алкенила» включают винил, аллил, 1-пропенил и 1-бутенил.
[0059]
Термин «С3-6 насыщенный карбоцикл» означает моноциклическое насыщенное или частично ненасыщенное углеводородное кольцо, содержащее от 3 до 6 атомов углерода. Термин «С3-6 насыщенный карбоцикл» предпочтительно включает «С3-4 насыщенный карбоцикл». Примеры «С3-6 насыщенного карбоцикла» включают циклопропан, циклобутан, циклопентан, циклогексан, циклопропен, циклобутен, циклопентен, циклогексен и циклогексадиен. Предпочтительным С3-6 карбоциклом является циклопропан или циклобутан.
[0060]
Термин «С3-4 насыщенная карбоциклильная группа» означает моновалентную группу «С3-4 насыщенного карбоцикла», а также «С3-6 насыщенного карбоцикла», который описан выше.
[0061]
Термин «4-10-членный насыщенный гетероцикл» означает моноциклический или бициклический насыщенный гетероцикл, содержащий от 4 до 10 атомов, в том числе один и два одинаковых или разных гетероатома, выбранных из группы, состоящей из атома кислорода, атома азота и атома серы, и включает гетероцикл, содержащий частично ненасыщенную связь, частично мостиковую структуру или частичную спиро-структуру. Бициклический насыщенный гетероцикл включает конденсированный цикл, в котором моноциклический насыщенный гетероцикл конденсирован с бензолом или моноциклическим 5-6-членным ароматическим гетероциклом. Насыщенный гетероцикл может включать один или два карбонила, тиокарбонила, сульфинила или сульфонила для образования цикла и включает такие циклические группы, как лактам, тиолактам, лактон, тиолактон, циклический имид, циклический карбамат, циклический тиокарбамат. Атом кислорода карбонила, сульфинила и сульфонила или атом серы тиокарбонила не входит в количество 4-10-атомов, образующих цикл (т.е. не включается в атомы, образующие кольцо), или гетероатомов, образующих кольцо. Термин «4-10-членный насыщенный гетероцикл» предпочтительно включает моноциклический или бициклический «4-8-членный насыщенный гетероцикл», более предпочтительно моноциклический «4-6-членный насыщенный гетероцикл», еще более предпочтительно моноциклический «5- или 6-членный насыщенный гетероцикл». Примеры «4-10-членного насыщенного гетероцикла» включают азетидин, пирролидин, пиперидин, пиперазин, морфолин, гомопиперидин, оксетан, тетрагидрофуран, тетрагидропиран, 1,3-бензодиоксол, 1,3-дигидроизобензофуран, предпочтительно пирролидин, пиперидин, пиперазин, морфолин, 1,3-бензодиоксол и 1,3-дигидроизобензофуран.
[0062]
Термин «4-6-членная насыщенная гетероциклическая группа» означает моновалентную группу «4-6-членного насыщенного гетероцикла» из группы «4-10-членного насыщенного гетероцикла», который описан выше. Предпочтительной группой является азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, оксетанил, тетрагидрофуранил или тетрагидропиранил.
[0063]
Термин «4-6-членная азотсодержащая насыщенная гетероциклическая группа» означает моновалентную насыщенную гетероциклическую группу, включающую по меньшей мере один атом азота, в группе «4-6-членного насыщенного гетероцикла», который описан выше. Предпочтительной группой является азетидинил, пирролидинил, пиперидинил, пиперазинил или морфолинил.
[0064]
Термин «С6-10 ароматический карбоцикл» означает моноциклическое или бициклическое ароматическое углеводородный цикл, содержащий от 6 до 10 атомов углерода. Примеры «С6-10 ароматического карбоцикла» включают бензол, 1-нафталин и 2-нафталин, предпочтительно бензол.
[0065]
Термин «5-10-членный ароматический гетероцикл» означает моноциклический или бициклический ароматический гетероцикл, содержащий от 5 до 10 атомов, включая от 1 до 3 одинаковых или разных гетероатома, выбранных из группы, состоящей из атома кислорода, атома азота и атома серы. Термин «5-10-членный ароматический гетероцикл» предпочтительно включает моноциклический или бициклический «5-9-членный ароматический гетероцикл», более предпочтительно моноциклический «5-8-членный ароматический гетероцикл», еще более предпочтительно моноциклический «5-6-членный ароматический гетероцикл». Примеры «5-10-членного ароматического гетероцикла» включают пиридин, пиридазин, пиримидин, пиразин, триазин, тиофен, пиррол, тиазол, изотиазол, пиразол, имидазол, фуран, оксазол, изоксазол, оксадиазол, тиадиазол, триазол, тетразол, хинолин, изохинолин, нафтиридин, хиназолин, бензофуран, бензотиофен, индол, бензоксазол, бензоизоксазол, 1H-индазол, 2H-индазол, бензимидазол, бензоксадиазол, бензотиадиазол, индолизин, бензофуразин, тиенопиримидин, пиразолопиридин, имидазопиридин, имидазопиразин, пиразолопиримидин, триазолопиримидин, тиенотиофен, имидазотиазол, хроман, 2,3-дигидробензофуран, 1,3- дигидробензофуран, 2,3-дигидро-1Н-инден, 2,3-дигидро-1Н-инден-1-он, 2,3-дигидро-1Н-пирролопиридин, 2,3-дигидро-1Н-пирролопиридин-1-он, 1,2-дигидро-3Н-пирролопиридин-3-он и 5,6,7,8-тетрагидроимидазопиразин.
[0066]
Термин «5-членный ароматический гетероцикл» включает, например, тиофен, пиррол, тиазол, изотиазол, пиразол, имидазол, фуран, оксазол, изоксазол, оксадиазол, тиадиазол, триазол и тетразол. Среди них предпочтительным является тиофен, тиазол и изотиазол.
[0067]
Термин «6-членный ароматический гетероцикл» включает, например, пиридин, пиридазин, пиримидин и пиразин. Более предпочтительным является пиридин.
[0068]
Термин «5- или 6-членная ароматическая гетероцикличльная группа» означает моновалентную группу «5-членного ароматического гетероцикла» или «6-членного ароматического гетероцикла».
[0069]
В соединении формулы (1) по настоящему изобретению предпочтительные варианты осуществления R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd, Re, кольца A и X показаны ниже, но область применения настоящего изобретения не ограничивается показанными ниже предпочтительными вариантами осуществления, каждый из которых может быть необязательно объединенным.
[0070]
Предпочтительно, R1 и R2 независимо представляют собой атом водорода или C1-4 алкил, где алкильная группа может быть необязательно замещенной от 1 до 5 заместителями, независимо выбранными из группы, включающей атом фтора и C1-4 алкокси. Более предпочтительно, R1 и R2 независимо представляют собой атом водорода, метил, этил, метоксиметил или трифторметил, еще более предпочтительно атом водорода или метил. Особенно предпочтительно, R1 представляет собой метил, R2 представляет собой атом водорода.
[0071]
Предпочтительно, R3 и R4 независимо представляют собой атом водорода, атом галогена, C1-4 алкил или C1-4 алкокси, где алкильная и алкоксигруппа может быть необязательно замещенной от 1 до 5 атомами фтора. Более предпочтительно, R3 и R4 независимо представляют собой атом водорода, атом фтора, атом хлора, метил, дифторметил, трифторметил, метокси, дифторметокси или трифторметокси, еще более предпочтительно атом водорода, атом фтора, атом хлора, дифторметил, трифторметил или дифторметокси.
[0072]
Предпочтительно, R5 и R6 независимо представляют собой атом водорода, атом галогена, C1-4 алкил, C1-4 алкокси, где алкильная и алкоксигруппа может быть необязательно замещенной от 1 до 5 атомами фтора или -NRaRb. Более предпочтительно, R5 и R6 независимо представляют собой атом водорода, атом фтора, атом хлора, метил, этил, пропил, метокси или -NRaRb, еще более предпочтительно атом водорода, атом фтора, метил, этил, или -NRaRb. Еще более предпочтительно, представляют собой атом водорода, атом фтора, метил или -NH2. Особенно предпочтительно, представляют собой атом водорода или -NH2.
[0073]
Предпочтительно, Rа и Rb независимо представляют собой атом водорода или C1-4 алкил, где алкил может быть необязательно замещенным от 1 до 5 атомами фтора. Более предпочтительно, Rа и Rb независимо представляют собой атом водорода или метил. Более предпочтительно, оба представляют собой атом водорода.
[0074]
Предпочтительно, Rc представляет собой C1-4 алкил, где алкил может быть необязательно замещенным от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, включающей атом галогена, гидроксильную группу и C1-4 алкокси, более предпочтительно метил или этил, еще более предпочтительно метил.
[0075]
Предпочтительно, Rd представляет собой атом водорода и C1-4 алкил, более предпочтительно атом водорода или метил.
[0076]
Предпочтительно, Re представляет собой атом водорода, C1-4 алкил и атом галогена, более предпочтительно атом водорода или атом фтора, еще более предпочтительно атом водорода.
[0077]
Предпочтительно, X представляет собой атом азота и -CH-, более предпочтительно -CH-.
[0078]
Предпочтительно, кольцо А представляет собой бензол, пиридин, тиофен, 1,3-бензодиоксол, бензотиофен, бензофуран и хинолин, более предпочтительно бензол, тиофен, пиридине или 1,3-бензодиоксол, еще более предпочтительно бензол или пиридин, особенно предпочтительно бензол.
[0079]
Один вариант осуществления соединения Формулы (1) включает представленный далее вариант (А).
(А)
Соединение формулы (1) или его фармацевтически приемлемая соль,
где R1 и R2 независимо представляют собой атом водорода или метил;
R3 и R4 независимо представляют собой атом водорода, атом фтора, атом хлора, С1-4 алкил или С1-4 алкокси, где алкильная и алкоксигруппа может быть необязательно замещенной от 1 до 5 атомами фтора;
R5 и R6 независимо представляют собой атом водорода, атом фтора, атом хлора, метил, этил, пропил, метокси или -NRaRb;
Ra и Rb независимо представляют собой атом водорода или C1-4 алкил;
Re представляет собой атом водорода или атом фтора;
X представляет собой атом азота или -CRe-; и
кольцо А представляет собой бензол, тиофен или пиридин.
[0080]
Другой вариант соединения Формулы (1) включает представленный далее вариант (В).
(B)
Соединение формулы (1) или его фармацевтически приемлемая соль,
где R1 представляет собой метил;
R2 представляет собой атом водорода;
R3 и R4 независимо представляют собой атом водорода, атом фтора, атом хлора, метил, дифторметил, трифторметил, метокси, дифторметокси или трифторметокси;
R5 и R6 независимо представляют собой атом водорода, атом фтора, метил или NH2;
Х представляет собой -СН-; и
кольцо А представляет собой бензол или пиридин.
[0081]
Среди соединений по настоящему изобретению более предпочтительными являются соединения, которые не проявляют или проявляют слабое необратимое ингибирование (mechanism-based inhibition - MBI) цитохрома Р450 3А4 (CYP3A4) и более низкие риски проявления значительных побочных эффектов, таких как гепатотоксичность, а также меньшее изменение активности при применении в комбинации с другими препаратами.
[0082]
Термин «фармацевтически приемлемая соль» включает кислотно-аддитивные соли, основно-аддитивные соли, соли аминокислот. Например, кислотно-аддитивные соли включают соли неорганических кислот, такие как гидрохлорид, гидробромид, сульфат, гидройодид, нитрат, фосфат, соли органических кислот, такие как цитрат, оксалат, фталат, фумарат, малеат, сукцинат, малат, ацетат, формиат, пропионат, бензоат, трифторацетат, метансульфонат, бензолсульфонат, пара-толуолсульфонат и камфорсульфонат. Основно-аддитивные соли включают соли неорганических оснований, такие как натриевая соль, калиевая соль, кальциевая соль, магниевая соль, бариевая соль, алюминиевая соль, и соли органических оснований, таких как триметиламин, триэтиламин, пиридин, пиколин, 2,6-лутидин, этаноламин, диэтаноламин, триэтаноламин, трометамин, трис(гидрокси)метиламин, трет-бутиламин, циклогексиламин, дициклогексиламин и N, N-дибензилэтиламин. Соли аминокислот включают соли с основными аминокислотами или кислыми аминокислотами, такими как аргинин, лизин, орнитин, аспарагиновая кислота и глутаминовая кислота. Более предпочтительными из них являются гидрохлорид и фосфат, еще более предпочтительна 2,5 фосфатная соль.
[0083]
Предпочтительными солями исходных материалов и промежуточных соединений и солями, подходящими для фармацевтических препаратов, являются традиционно используемые нетоксичные соли. Такие соли включают кислотно-аддитивные соли, такие как соли органических кислот (например, ацетат, трифторацетат, малеат, фумарат, цитрат, тартрат, метансульфонат, бензолсульфонат, формиат и пара-толуолсульфонат) и соли неорганических кислот (например, гидрохлорид, гидробромид, гидройодид, сульфат, нитрат и фосфат), соли аминокислот (например, аргинина, аспарагиновой кислоты и глутаминовой кислоты), соли металлов, такие как соли щелочных металлов (например, соль натрия и соль калия) и соли щелочно-земельных металлов (например, соли кальция и соли магния), соли аммония, соли органических оснований (например, соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина и соль N, N'-дибензилэтилендиамина), а также соли, которые может необязательно выбрать специалист в данной области.
[0084]
При получении соль настоящего соединения может быть очищена непосредственно в том случае, когда соединение по настоящему изобретению получено в форме такой соли, тогда как в случае, когда соединение по настоящему изобретению получено в свободной форме, такая свободная форма может быть растворена или суспендирована в соответствующем органическом растворителе с последующим добавлением кислоты или основания, что приводит к образованию соответствующей соли в соответствии с общеизвестными методам.
[0085]
Настоящее изобретение включает соединение формулы (1) или его фармацевтически приемлемую соль или сокристалл. Такой кокристалл включает, например, сокристалл (молярное соотношение от 1:1 до 2,5) соединения формулы (1) или его фармацевтически приемлемой соли с молекулой соляной кислоты или молекулой фосфорной кислоты. Соединение по настоящему изобретению может также существовать в виде гидрата и/или сольватов с различными растворителями (например, этанолат) и включает эти гидратные и/или сольваты.
[0086]
Соединения по настоящему изобретению включает соединения, которые могут иметь оптические изомеры относительно хирального центра, атропоизомеры на основе осевой или планарной хиральности, обусловленных затрудненностью внутримолекулярного вращения, или другие изомеры, такие как стереоизомеры, таутомеры и геометрические изомеры, и все возможные изомеры, включая указанные изомеры, и их смеси включены в объем настоящего изобретения. Помимо указанных выше изомеров в настоящее изобретение также включены любые кристаллические формы и их смеси.
[0087]
В частности, оптические изомеры и атропоизомеры могут быть получены в смеси соединений с различной стерической структурой, например в виде рацемической смеси или в виде оптически активного соединения при использования оптически активных исходных материалов или оптически активных промежуточных продуктов. Рацематы соответствующих исходных материалов, промежуточных соединений, конечных продуктов могут быть физически и химически разделены на их оптические энантиомеры известными методами разделения, такими как метод с использованием оптически активной колонки и фракционированная кристаллизация, на соответствующей стадии способа получения, как показано ниже, если это необходимо. Например, в диастереомерном методе два диастереомера получают взаимодействием с оптически разделяющим реагентом. Каждый диастереомер обычно обладает различными физическими свойствами, и может быть выделен с помощью известных методик, таких как фракционированная кристаллизация.
[0088]
Соединение по настоящему изобретению включает пролекарство соединения формулы (1) или его фармацевтически приемлемую соль, а также вышеуказанные изомеры. Соединение по настоящему изобретению также включает соединения, в которых часть или все атомы, образующие соединения формулы (1), заменены изотопами, например соединения, в которых водород представляет собой дейтерий или тритий (2H, 3H), и соединения, в которых 12C заменен на 14C.
[0089]
Термин «пролекарство соединения формулы (1)» в настоящем описании означает соединение, которое превращается в соединение формулы (1) при взаимодействии с ферментами или желудочной кислотой в физиологических условиях в живом организме, т.е. соединение, которое подвергается ферментативному окислению, восстановлению или гидролизу с превращением в соединение формулы (1), или соединение, которое подвергается гидролизу в зависимости от изменения рН желудочного кислоты с превращением в соединение формулы (1).
[0090]
Получение соединения по настоящему изобретению
Получение соединения по настоящему изобретению иллюстрируется приведенными ниже примерами, но настоящее изобретение не ограничивается данными примерами.
Соединение по настоящему изобретению может быть получено, например, способами, показанными в примерах получения с 1 по 12. Эти примеры получения могут быть дополнительно модифицированы специалистами в области органического синтеза. Соединения, используемые в качестве исходных материалов, могут быть заменены их солями или соединениями, в которых при необходимости защищена функциональная группа.
[0091]
В способах получения, представленных ниже, когда любая из функциональных групп, отличных от сайта реакции, может изменяться в зависимости от условий реакции или может не подходить для способов обработки после завершения реакций в дополнение к случаю, когда явно указано на использование защитной группы, любые группы, отличные от сайта реакции, могут быть защищены, если это необходимо, с последующим удалением защиты после завершения реакции или последовательности реакций для получения целевого продукта. Такая защитная группа включает любые общие защитные группы, описанные в литературе (например, в T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", 3rd Ed., John Wiley and Sons, Inc., New York (1999)), и введение и удаление такой защитной группы может осуществляться в соответствии с методами, обычно используемыми в органическом синтезе (например, методами, описанными в указанной выше публикации). В частности, защитные группы для аминогруппы включают, например, бензилоксикарбонил, трет-бутоксикарбонил, ацетил и бензил, и защитные группы для гидроксильной группы включают, например, триалкилсилил, ацетил и бензил.
[0092]
Любые исходные вещества и промежуточные продукты, используемые в каждом из примеров получения, являются коммерчески доступными или могут быть получены или синтезированы из коммерчески доступных соединений или известных соединений в соответствии со способами, известными специалистам в данной области. Такие исходные вещества и промежуточные продукты могут использоваться в их солевых формах или в формах, в которых любые функциональные группы при необходимости являются защищенными.
[0093]
Любое из промежуточных и целевых соединений в примерах получения ниже может быть преобразовано в любое из других соединений, включенных в настоящее изобретение, с помощью необязательного превращения их любых функциональных групп или удлинения различных боковых цепей, в частности с помощью аминогруппы, гидроксильной группы, карбонила или атома галогена с последующим введением и удалением защитной группы, если это необходимо. Превращение функциональных групп и удлинение боковых цепей может осуществляться с помощью или в соответствии с общепринятыми методами (см., например, R.C. Larock, "Comprehensive Organic Transformations", 2nd Ed., John Wiley and Sons Inc., New York (1999)).
[0094]
Термин «инертный растворитель», используемый в примерах получения, которые представлены ниже, означает любой из растворителей, который не взаимодействует с исходными материалами, реагентами, основаниями, кислотами, катализаторами и лигандами, используемыми в реакциях.
[0095]
Получение 1
Соединение (3) получают, например, в соответствии со следующим способом.

(В схеме R7 представляет собой метил или этил).
[0096]
Стадия 1: Соединение (2) может подвергаться этерификации способом, аналогичным известным способам (см., например, R.C. Larock, "Comprehensive Organic Transformations", 2nd Ed., John Wiley and Sons inc., New York (1999)) с получением соединения (3). Соединение (2) может быть коммерчески доступным или может быть синтезировано известными способами.
[0097]
Получение 2
Соединение (6) получают, например, в соответствии со следующими способами.
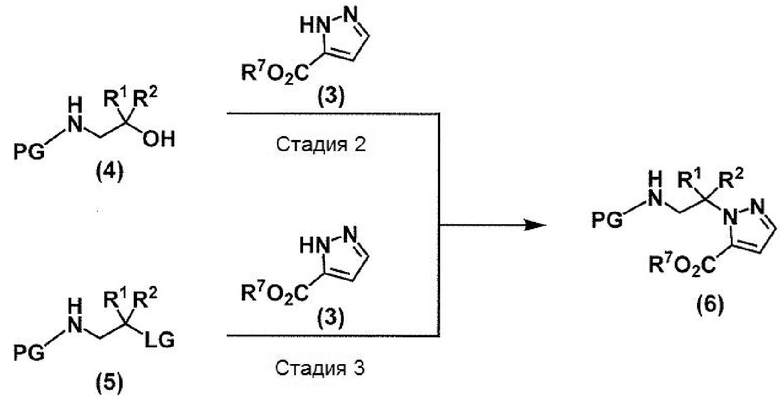
(В схеме R1 и R2 принимают значения, определенные в пункте 1; R7 представляет собой метил или этил; PG представляет собой защитную группу (например, трет-бутоксикарбонильная группу и бензилоксикарбонильную группу); и LG представляет собой удаляемую группу (например, атом йода, атом брома, атом хлора и замещенную сульфонилоксигруппу (например, метансульфонилоксигруппу, трифторметансульфонилоксигруппу и п-толуолсульфонилоксигруппу))).
[0098]
Стадия 2: Соединение (6) может быть получено взаимодействием соединения (3) и соединения (4) в условиях реакции Мицунобу в подходящем инертном растворителе общепринятым методом. В частности, реакция может проводиться в присутствии трифенилфосфина или трибутилфосфина и реагента Мицунобу, такого как диэтилазодикарбоксилат, диизопропилазодикарбоксилат и N, N,N’,N’-тетраметилазодикарбоксамид, или с цианометиленфосфорановым реагентом. Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 5 дней. Соединения (3) и (4) могут быть коммерчески доступными или синтезироваться известными методами.
Примеры инертного растворителя, используемого в данной стадии, включают, например, галогенированные углеводороды, такие как хлороформ и дихлорметан; ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и 1,4-диоксан; и смеси указанных растворителей.
[0099]
Стадия 3: Соединение (6) также может быть получено взаимодействием соединения (3) и соединения (5) в присутствии подходящего основания в подходящем инертном растворителе в общепринятыми методами. При необходимости реакция может проводиться в присутствии подходящего катализатора фазового перехода. Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 5 дней. Соединения (3) и (5) могут быть коммерчески доступными или синтезироваться стандартными методами.
Примеры основания, используемого в данной стадии, включают, например, органические основания, такие как триэтиламин, N, N-диизопропилэтиламин и пиридин; неорганические основания, такие как карбонат калия, карбонат натрия, карбонат цезия, гидрокарбонат калия, гидрокарбонат натрия, дигидрофосфат калия, дикалий гидрофосфат, фосфат калия, дигидрофосфат натрия, динатрий гидрофосфат, фосфат натрия, гидроксид калия, гидроксид натрия и гидрид натрия; и алкоксиды металлов, такие как метоксид натрия и трет-бутоксид калия.
Примеры катализатора фазового перехода, используемого в данной стадии, включают, например, гидросульфат тетрабутиламмония.
Примеры инертного растворителя, используемого в данной стадии, включают, например, галогенированные углеводороды, такие как хлороформ и дихлорметан; кетоны, такие как ацетон и метилкетон; ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; низшие спирты, такие как метанол, этанол и 2-пропанол; полярные апротонные растворители, такие как ацетонитрил, N, N-диметилформамид и N-метил-2-пирролидон; водe и смеси указанных растворителей.
[0100]
Получение 3
Соединение (9) получают, например, следующими способами.
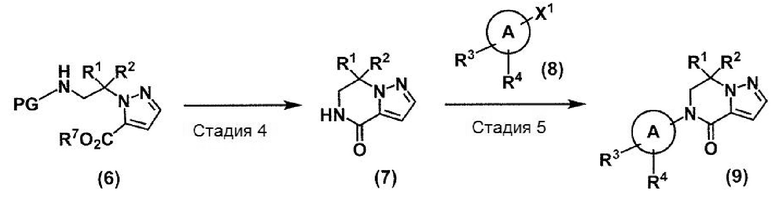
(В схеме кольцо A, R1, R2, R3 и R4 принимают значения, определенные в пункте 1; R7 представляет собой метил или этил; PG представляет собой защитную группу, такую как трет-бутоксикарбонильная группа и бензилоксикарбонильная группа; и X1 представляет собой атом йода, атом брома или атом хлора.)
[0101]
Стадия 4: Соединение (7) может быть получено удалением защитной группы амина PG из соединения (6) в подходящем инертном растворителе любым из способов, известных специалистам данной области (см. T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", 3rd Ed., John Wiley and Sons, inc., New York (1999)), с последующей циклизацией в присутствии подходящего основания или подходящей кислоты. В данной стадии удаление защитной группы и циклизация также могут осуществляться одновременно в единой реакционной системе в присутствии подходящего основания или подходящей кислоты в подходящем инертном растворителе стандартными способами. Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии находится в интервале от 1 минуты до 5 дней.
Примеры основания, используемого в данной стадии, включают, например, органические основания, такие как триэтиламин и пиридин; неорганические основания, такие как карбонат калия и карбонат натрия; и алкоксиды металлов, такие как трет-бутоксид калия.
Примеры кислоты, используемой в данной стадии, включают, например, неорганические кислоты, такие как соляная кислота и серная кислота, а также органические кислоты, такие как уксусная кислота и трифторуксусная кислота.
Примеры инертного растворителя, используемого в данной стадии, включают, например, галогенированные углеводороды, такие как хлороформ и дихлорметан; ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; низшие спирты, такие как метанол, этанол и 2-пропанол; полярные апротонные растворители, такие как ацетонитрил, N, N-диметилформамид и N-метил-2-пирролидон; органические кислоты, такие как уксусная кислоты; и смеси указанных растворителей.
[0102]
Стадия 5: Соединение (9) может быть получено реакцией связывания соединения (7) и соединения(8) в присутствии подходящего катализатора переходного металла и основания в подходящем инертном растворителе в соответствии со стандартными методами. Реакция может проводиться в присутствии подходящего лиганда, если это необходимо. Температура реакции данной стадии обычно находится в интервале от комнатной температуры до температуры кипения используемого растворителя. Продолжительность реакции данной стадии находится в интервале от 1 минуты до 5 дней. Соединение (8) может быть коммерчески доступно или синтезироваться известными методами.
Примеры катализатора переходного металла, используемого в данной стадии, включают, например, ацетат палладия (II), трис(дибензилиденацетон)дипалладий (0), бис(три-трет-бутилфосфин)палладий(0), йодид меди (I) и оксид меди (II).
Примеры лиганда, используемого в данной стадии, включают, например, три-трет-бутилфосфин, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 4,5-бис(дифенилфосфино)-9,9-диметилксантен и N, N'-диметилэтилендиамин.
Примеры основания, используемого в данной стадии, включают, например, алкоксиды металлов, такие как бутоксид натрия, и неорганические основания, такие как трикалийфосфат и карбонат калия.
Примеры инертного растворителя, используемого в данной стадии, включают ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; полярные апротонные растворители, такие как N, N-диметилформамид и N, N-диметилацетамид; и смеси указанных растворителей.
[0103]
Получение 4
Соединение (9) также получают, например, следующими способами.
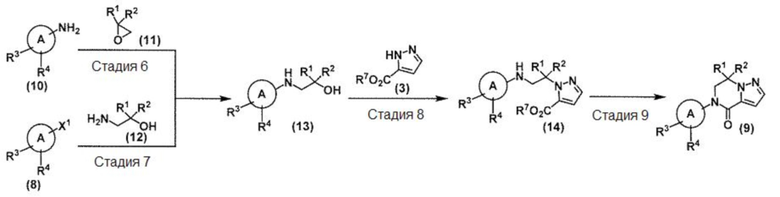
(В схеме кольцо А, R1, R2, R3 и R4 принимают значения, определенные в пункте 1; и R7 и Х1 принимают значения, определенные выше.)
[0104]
Стадия 6: Соединение (13) может быть получено взаимодействием соединения (10) и соединения (11) в подходящем инертном растворителе в соответствии со стандартными методами. Реакция может проводиться в присутствии основания или кислоты с подходящей добавкой, если это необходимо, и в присутствии подходящего катализатора фазового перехода. Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 10 дней.
Соединения (10) и (11) могут быть коммерчески доступными или синтезироваться известными способами.
Примеры добавки, используемой в данной стадии, включают, например, бромид лития.
Примеры основания, используемого в данной стадии, включают, например, органические основания, такие как триэтиламин; и неорганические основания, такие как карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия.
Примеры кислоты, используемой в данной стадии, включают, например, неорганические кислоты, такие как соляная кислота и серная кислота, и органические кислоты, такие как п-толуолсульфоновая кислота и трифторуксусная кислота.
Примеры инертного растворителя, используемого в данной стадии, включают, например, галогенированные углеводороды, такие как хлороформ и дихлорметан; ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; низшие спирты, такие как метанол, этанол и 2-пропанол; полярные апротонные растворители, такие как ацетонитрил, N, N-диметилформамид и N-метил-2-пирролидон; и смеси указанных растворителей
[0105]
Стадия 7: Соединение (13) также может быть получено связыванием соединения (8) и соединения (12) в присутствии подходящего катализатора переходного металла и основания в подходящем инертном растворителе или без применения растворителя.
Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 5 дней. Соединение (8) и соединение (12) могут быть коммерчески доступными или могут синтезироваться известными методами.
Примеры катализатора переходного металла, используемого в данной стадии, включают, например, ацетат палладия (II), трис(дибензилиденацетон)дипалладий (0), бис(три-трет-бутилфосфин)палладий (0), хлорид меди (I), бромид меди (I), йодид меди (I), ацетат меди (I), оксид меди (II).
Примеры основания, используемого в данной стадии, включают, например, органические основания, такие как триэтиламин и пиридин; и неорганические основания, такие как карбонат калия, карбонат натрия, карбонат цезия, гидроксид калия, гидроксид натрия.
Примеры инертного растворителя, используемого в данной стадии, включают, например, галогенированные углеводороды, такие как хлороформ и дихлорметан; ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, и 1,2-диметоксиэтан; низшие спирты, такие как метанол, этанол и 2-пропанол; полярные апротонные растворители, такие как ацетонитрил, N, N-диметилформамид, N-метил-2-пирролидон, диметилсульфоксид и вода; и смеси указанных растворителей.
[0106]
Стадия 8: Соединение (14) может быть получено взаимодействием соединения (3) и соединения (13) в условиях реакции Митсунобу в подходящем инертном растворителе в соответствии со стандартными методами. В частности, реакция может проводиться в присутствии трифенилфосфина или трибутилфосфина и реагента реакции Митсунобу, такого как диэтилазодикарбоксилат, диизопропилазодикарбоксилат и N, N,N’,N’-тетраметилазодикарбоксамид, или цианометилeнфосфоранового реагента. Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 5 дней. Соединение (3) может быть коммерчески доступным или может синтезироваться известными методами.
Примеры инертного растворителя, используемого в данной стадии, включают, например, ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и 1,4-диоксан; и смеси указанных растворителей.
[0107]
Стадия 9: Соединение (9) может быть получено циклизацией соединения (14) в присутствии подходящего основания или подходящей кислоты в подходящем инертном растворителе в соответствии со стандартными методами. Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 5 дней.
Примеры основания, используемого в данной стадии, включают, например, органические основания, такие как триэтиламин; неорганические основания, такие как карбонат калия и карбонат натрия; алкоксиды металлов, такие как трет-бутоксид калия.
Примеры кислоты, используемой в данной стадии, включают, например, неорганические кислоты, такие как соляная кислота, серная кислота, органические кислоты, такие как моногидрат п-толуолсульфоновой кислоты, уксусная кислота, трифторуксусная кислота.
Примеры инертного растворителя, используемого в данной стадии, включают, например, галогенированные углеводороды, такие как хлороформ и дихлорметан; ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; низшие спирты, такие как метанол, этанол и 2-пропанол; полярные апротонные растворители, такие как ацетонитрил, N, N-диметилформамид и N-метил-2-пирролидон; и смеси указанных растворителей.
[0108]
Получение 5
Соединение (15) получают, например, следующим способом.
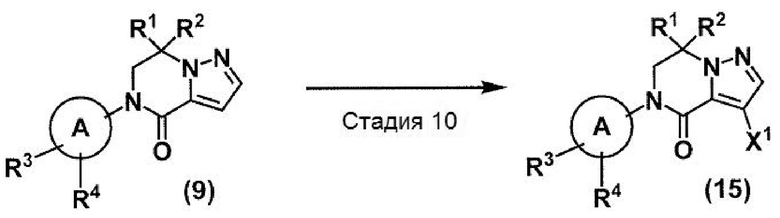
(В схеме кольцо А, R1, R2, R3 и R4 принимают значения, определенные в пункте 1; и X1 принимает значения, определенные выше).
[0109]
Стадия 10: Соединение (15) может быть получено взаимодействием соединения (9) с подходящим галогенирующим агентом в подходящем инертном растворителе в соответствии со стандартными методами. При необходимости реакция может проводиться в присутствии подходящей добавки или кислоты. Температура реакции данной стадии обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 5 дней.
Примеры галогенирующих агентов, используемых в данной стадии, включают, например, N-йодсукцинимид, N-бромсукцинимид, N-хлорсукцинимид, йод, монохлорид йода, бром и 1,3-дийод-5,5-диметилгидантоин.
Примеры добавки, используемой в данной стадии, включают, например, нитрат аммония-церия (IV), ацетат натрия и железо.
Примеры кислоты, используемой в данной стадии, включают, например, соляную кислоту, серную кислоту, уксусную кислоту, пара-толуолсульфоновую кислоту и пара-толуолсульфонат пиридиния.
Примеры инертного растворителя, используемого в данной стадии, включают, например, галогенированные углеводороды, такие как хлороформ, дихлорметан и тетрахлорметан; полярные апротонные растворители, такие как N, N-диметилформамид и этилацетат; полярные протонные растворители, такие как уксусная кислота; и смеси указанных растворителей.
[0110]
Получение 6
Соединение (1) получают, например, следующим способом.
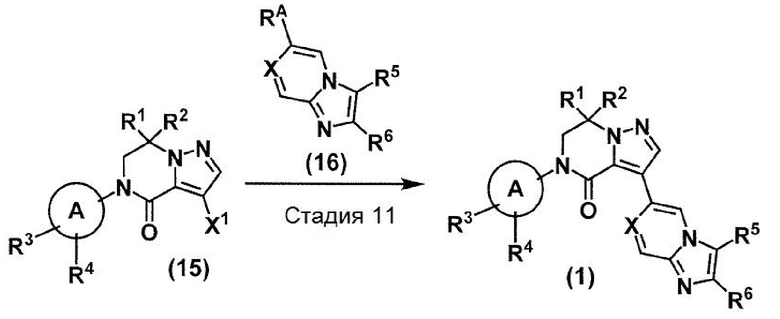
(В схеме кольцо A, X, R1, R2, R3, R4, R5 и R6 принимают значения, определенные в пункте 1; X1 принимает значения, определенные выше; и RA представляет собой бороновую кислоту или сложный эфир бороновой кислоты).
[0111]
Стадия 11: Соединение (1) может быть получено реакцией сочетания соединения (15) и соединения (16) в присутствии подходящего катализатора переходного металла и основания в подходящем инертном растворителе в соответствии со стандартными способами. При необходимости данная стадия может также проводиться в присутствии подходящего лиганда. Температура реакции данной стадии обычно находится в интервале от комнатной температуры до температуры кипения используемого растворителя, предпочтительно в интервале от 50°C to 150°C. Продолжительность реакции данной стадии обычно находится в интервале от 1 минуты до 5 дней, предпочтительно от 1 минуты до 2 дней. Данная стадия может также проводиться с использованием микроволнового излучения. Соединение (16) может быть коммерчески доступным или может синтезироваться известными способами.
Примеры катализатора переходного металла, используемого в данной стадии, включают, например, тетракис(трифенилфосфин)палладий (0), ацетат палладия (II), хлорид палладия (II), трис(дибензилиденацетон)дипалладий (0), дихлорбис(трифенилфосфин)палладий (II), продукт реакции присоединения дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия (II) и дихлорметана и дихлорбис[ди-трет-бутил(4-диметиламинофенил)фосфино]палладий (II).
Примеры основания, используемого в данной стадии, включают, например, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия и фосфат калия.
Примеры лиганда, используемого в данной стадии, включают, например, трифенилфосфин, три-трет-бутилфосфин, 2-дициклогексилфосфино-2',6'-диметоксибифенил и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил.
Примеры инертного растворителя, используемого в данной стадии включают, например, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; полярные апротонные растворители, такие как N, N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон и ацетонитрил; ароматические углеводороды, такие как бензол и толуол; воду; и смеси указанных растворителей.
[0112]
Получение 7
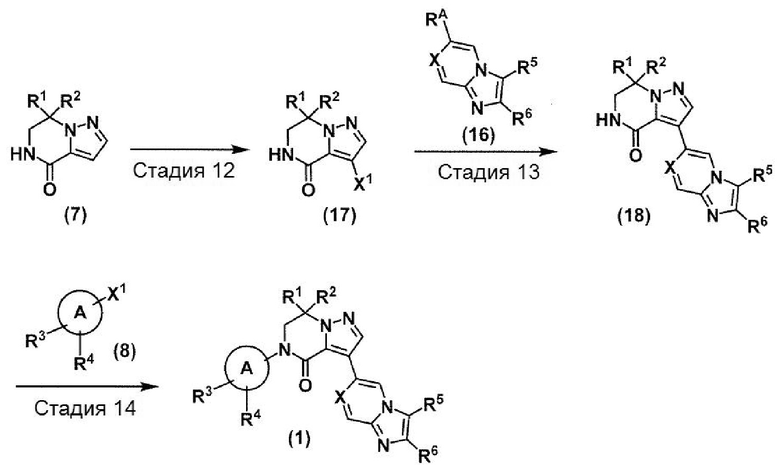
(В схеме кольцо A, X, R1, R2, R3, R4, R5 и R6 принимают значения, определенные в пункте 1; и Х1 и RA принимают значения, определенные выше).
[0113]
Стадия 12: Соединение (17) может быть получено способом, аналогичным описанному в стадии 10, с использованием соединения (7).
[0114]
Стадия 13: Соединение (18) может быть получено способом, аналогичным описанному в стадии 11, с использованием соединения (17) и соединения (16).
[0115]
Стадия 14: Соединение (1) может быть получено способом, аналогичным описанному в стадии 5, с использованием соединения (8) и соединения (18).
[0116]
Получение 8
Соединение (1) также получают, например, следующими способами.
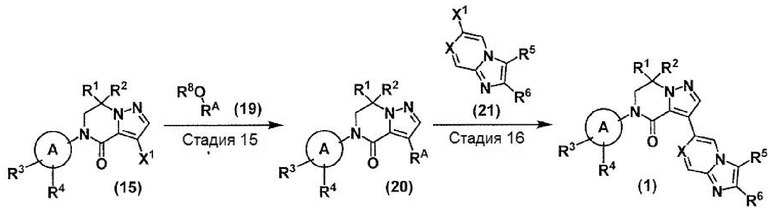
(В схеме кольцо А, Х, R1, R2, R3, R4, R5 и R6 принимают значения, определенные в пункте 1; Х1 и RА принимают значения, определенные выше, и R8 представляет собой С1-4 алкил).
[0117]
Стадия 15: Соединение (20) может быть получено взаимодействием соединения (15) и соединения (19) в присутствии подходящего основания в подходящем инертном растворителе в соответствии со стандартными методами. Температура реакции данной стадии обычно находится в интервале от -78°C до температуры кипения используемого растворителя, предпочтительно от -78°C до комнатной температуры. Продолжительность реакции данной стадии обычно составляет от 1 минуты до 5 дней, предпочтительно от 1 минуты до 2 дней. Соединение (19) может быть коммерчески доступным или может быть синтезировано известными методами.
Примеры основания, используемого в данной стадии, включают, например, комплекс хлорида лития и изопропилмагния, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, диизопропиламид лития, тетраметилпиперидид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия.
Примеры инертного растворителя, используемого в данной стадии, включают, например, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; насыщенные углеводороды, такие как н-гексан, н-гептан и циклогексан; и смеси указанных растворителей.
[0118]
Стадия 16: Соединение (1) может быть получено способом, аналогичным описанному в стадии 11, с использованием соединения (20) и соединения (21). Соединение (21) может быть коммерчески доступным или может быть синтезировано известными методами.
[0119]
Получение 9
Соединение (15) также получают, например, следующими способами.
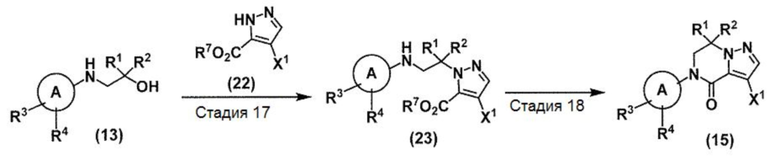
(В схеме кольцо А, R1, R2, R3 и R4 принимают значения, определенные в пункте 1; и R7 и Х1 принимает значения, определенные выше).
[0120]
Стадия 17: Соединение (23) может быть получено способом, аналогичным описанному в стадии 8, с использованием соединения (13) и соединения (22). Соединение (22) может быть коммерчески доступным или может синтезироваться известными методами.
[0121]
Стадия 18: Соединение (15) может быть получено способом, аналогичным описанному в стадии 9, с использованием соединения (23).
[0122]
Получение 10
Соединение (15) также получают, например, следующими способами.
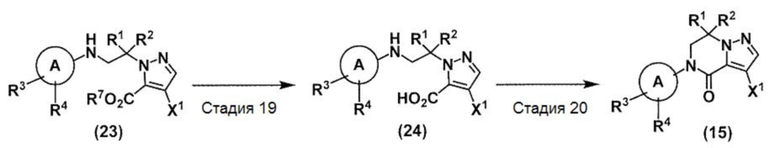
(В схеме кольцо А, R1, R2, R3 и R4 принимают значения, определенные в пункте 1; и R7 и X1 принимают значения, определенные выше).
[0123]
Стадия 19: Соединение (24) может быть получено гидролизом сложноэфирной группы соединения (23) в подходящем инертном растворителе любым из методов, известных специалисту в данной области (например, способом, описанным в R.C. Larock, "Comprehensive Organic Transformations", 2nd Ed., John Wiley and Sons, Inc., New York (1999)).
[0124]
Стадия 20: Соединение (15) может быть получено способом, аналогичным описанному в стадии 9, с использованием соединения (24).
[0125]
Получение 11
Соединение (26) также получают, например, следующим способом.
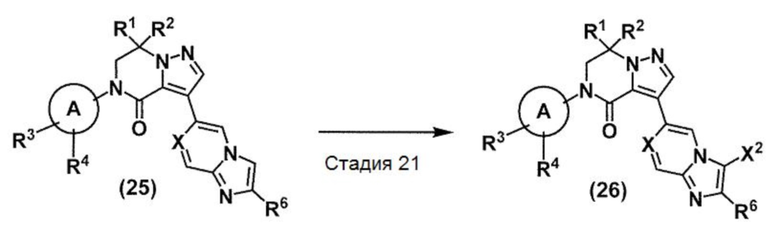
(В схеме кольцо A, X, R1, R2, R3, R4 и R6 принимают значения, определенные в пункте 1; и Х2 представляет собой атом фтора, атом хлора, атом брома и атом йода).
[0126]
Стадия 21: Соединение (26) может быть получено взаимодействием соединения (25) с галогенирующим агентом в подходящем инертном растворителе в соответствии со стандартными методами. При необходимости реакция также может проводиться в присутствии добавки или кислоты. Температура реакции обычно находится в интервале от -20°C до температуры кипения используемого растворителя. Продолжительность реакции находится в интервале от 1 минуты до 5 дней.
Примеры галогенирующего агента, используемого в данном спсобе, включают, например, 1-фтор-4-метил-1,4-диазониабицикло[2,2,2]октанбис(тетрафторборат), трифторметансульфонат 1-фторпридиния, N-фторбензолсульфонимид, N-йодсукцинимид, N-бромсукцинимид, N-хлорсукцинимид, йод, монохлорид йода, бром и 1,3-дийод-5,5-диметилгидантоин.
Примеры используемой добавки включают, например, нитрат аммония-церия (IV), ацетат натрия и железо.
Примеры используемой кислоты, включают, например, соляную кислоту, серную кислоту, уксусную кислоту, пара- толуолсульфокислоту и пара-толуолсульфонат пиридиния.
Примеры используемого инертного растворителя включают, например, галогенированные углеводороды, такие как хлороформ, дихлорметан и тетрахлорметан; апротонные полярные растворители, такие как ацетонитрил, N, N-диметилформамид и этилацетат; протонные полярные растворители, такие как уксусная кислота; и смеси указанных растворителей.
[0127]
Получение 12
Соединение (1) также получают, например, следующими способами.
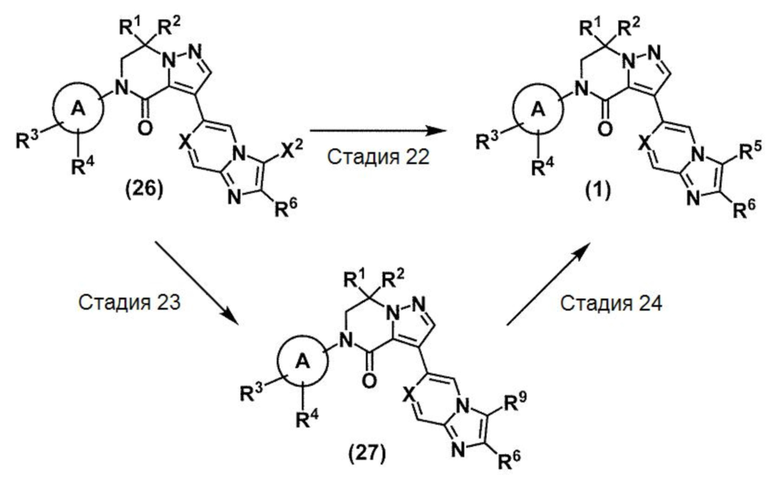
(В схеме кольцо A, X, R1, R2, R3, R4, R5 и R6 принимают значения, определенные в пункте 1; X2 принимает значения, определенные выше; и R9 представляет собой винил или аллил).
[0128]
Стадия 22: Соединение (1) может быть получено взаимодействием соединения (26) и реагента бороновой кислоты или алкилцинкового реагента в присутствии подходящего катализатора переходного металла в подходящем инертном растворителе. Данная стадия при необходимости также может проводиться в присутствии подходящего основания и/или подходящего лиганда. Температура реакции данной стадии обычно находится в интервале от комнатной температуры до температуры кипения используемого растворителя, предпочтительно в интервале от 50°C до 150°C. Продолжительность реакции данной стадии обычно составляет от 1 минуты до 5 дней, предпочтительно от 1 минуты до 2 дней. Данная стадия также может проводиться с использованием микроволнового излучения.
Примеры бороновой кислоты, используемой в данной стадии, включают, например, но без ограничения, метилбороновую кислоту, этилбороновую кислоту и триметилбороксин.
Примеры алкилцинкового реагента, используемого в данной стадии, включают, например, но без ограничения, хлорид метилцинка и хлорид этилцинка; но не ограничиваются этим.
Примеры катализатора переходного металла, используемого в данной стадии, включают, например, но без ограничения, тетракис(трифенилфосфин)палладий (0), ацетат палладия (II), хлорид палладия (II), трис(дибензилиденацетон)дипалладий (0), дихлорбис(трифенилфосфин)палладий (II), продукт реакции присоединения дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия (II) и дихлорметана, дихлорбис[ди-трет-бутил-(4-диметиламинофенил)фосфино]палладий (II) и бис-(три-трет-бутилфосфин)палладий (0).
Примеры основания, используемого в данной стадии, включают, например, но без ограничения, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия и фосфат калия.
Примеры лиганда, используемого в данной стадии, включают, например, но без ограничения, трифенилфосфин, три-трет-бутилфосфин, 2-дициклогексилфосфино-2',6'-дибифенил и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил.
Примеры инертного растворителя, используемого в данной стадии, включают, например, но без ограничения, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; апротонные полярные растворители, такие как N, N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон и ацетонитрил; ароматические углеводороды, такие как бензол и толуол; воду; и смеси указанных растворителей.
[0129]
Стадия 23: Соединение (27) может быть получено реакцией сочетания соединения (26) и реагент бороновой кислоты в присутствии подходящего катализатора переходного металла и соответствующего основания в подходящем инертном растворителе в соответствии со стандартными способами. Данная стадия при необходимости может проводиться в присутствии подходящего лиганда. Температура реакции данной стадии обычно находится в интервале от комнатной температуры до температуры кипения используемого растворителя, предпочтительно от 50°C до 150°C. Продолжительность реакции данной стадии обычно составляет от 1 минуты до 5 дней, предпочтительно от 1 минуты до 2 дней. В реакции данной стадии также может использоваться микроволновое излучение.
Примеры бороновой кислоты, используемой в данной стадии, включают, например, но без ограничения, 4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолан, цис-пропенилбороновую кислоту, транс-пропенилбороновую кислоту, сложный пинаколовый эфир аллилбороновой кислоты.
Примеры катализатора переходного металла, используемого в данной стадии, включают, например, но без ограничения, тетракис(трифенилфосфин)палладий (0), ацетат палладия (II), хлорид палладия (II), трис(дибензилиденацетон)дипалладий (0), дихлорбис(трифенилфосфин)палладий (II), продукт реакции присоединения дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия (II) и дихлорметана и дихлорбис[ди-трет-бутил(4-диметиламинофенил)фосфин]палладий (II).
Примеры основания, используемого в данной стадии, включают, например, но без ограничения, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия и фосфат калия.
Примеры лиганда, используемого в данной стадии, включают, например, но без ограничения, трифенилфосфин, три-трет-бутилфосфин, 2-дициклогексилфосфино-2',6'-бифенил и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил.
Примеры инертного растворителя, используемого в данной стадии, включают, например, но без ограничения, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан и 1,2-диметоксиэтан; полярные апротонные растворители, такие как N, N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон и ацетонитрил; ароматические углеводороды, такие как бензол и толуол; воду; и смеси указанных растворителей.
[0130]
Стадия 24: Соединение (1) может быть получено гидрированием ненасыщенной углеродной связи соединения (27) в подходящем инертном растворителе любым из способов, известных специалисту данной области (например способами, описанными в R.C. Larock, "Comprehensive Organic Transformations", 2nd Ed., John Wiley and Sons, Inc., New York (1999)). Температура реакции данной стадии обычно находится в интервале от комнатной температуры до температуры кипения используемого растворителя. Продолжительность реакции данной стадии составляет от 1 минуты до 5 дней.
[0131]
Основания, используемые в каждой стадии каждого получения, должны выбираться подходящим образом в зависимости от типа взаимодействия и исходных веществ и включают, например, гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидриды металлов, такие как гидрид натрия и гидрид калия; гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксида натрия и трет-бутоксид натрия; металлорганические основания, такие как бутиллитий и диизопропиламид лития; и органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, 4-диметиламинопиридин (DMAP) и 1,8-диазабицикло[5.4.0]-7-ундецен (DBU).
[0132]
Растворители, используемые в каждой стадии каждого получения, должны быть выбраны подходящим образом в зависимости от типа реакции и исходных веществ и включают, например, спирты, такие как метанол, этанол и изопропанол; кетоны, такие как ацетон и метил кетон; галогенированные углеводороды, такие как хлористый метилeн и хлороформ; простые эфиры, такие как тетрагидрофуран (ТГФ) и 1,4-диоксан; ароматические углеводороды, такие как толуол и бензол; алифатические углеводороды, такие как гексан и гептан; сложные эфиры, такие как этилацетат и пропилацетат; амиды, такие как N, N-диметилформамид (ДМФА) и N-метил-2-пирролидон; сульфоксиды, такие как диметилсульфоксид (ДМСО); и нитрилы, такие как ацетонитрил; указанные растворители могут использоваться в качестве единственного компонента или в смеси любых двух или более указанных растворителей. В зависимости от типа реакций вместо растворителя может использоваться органическое основание.
[0133]
Промежуточные и целевые соединения в каждом получении могут выделяться с помощью методик очистки, обычно используемых в органическом синтезе, например нейтрализацией, фильтрацией, экстракцией, промывкой, сушкой, концентрированием, перекристаллизацией и различными методами хроматографии (например, колоночной хроматографией на силикагеле, ионообменной колоночной хроматографией, препаративной и жидкостной хроматографией). Растворители для перекристаллизации включают, например, спиртовые растворители, такие как метанол, этанол и 2-пропанол; простые эфиры, такие как диэтиловый эфир; сложные эфиры, такие как этилацетат; ароматические углеводородные растворители, такие как бензол и толуол; кетоновые растворители, такие как ацетон; галогенсодержащие растворители, такие как дихлорметан и хлороформ; углеводородные растворители, такие как гексан; апротонные растворители, такие как N, N-диметилформамид и ацетонитрил; воду; и смеси указанных растворителей. Другие методики очистки включают методики, описанные в Experimental Chemistry (edited by The Chemical Society of Japan, Maruzen) vol. 1. Молекулярные структуры соединения по настоящему изобретению могут быть легко определены с помощью спектроскопии, такой как спектроскопия ядерного магнитного резонанса, инфракрасная абсорбционная спектрометрия, круговая дихроичная спектроскопия и масс-спектроскопия, со ссылкой на соответствующие структуры, полученные из исходных материалов. Промежуточные продукты также могут использоваться в следующей реакции без какой-либо специфической очистки.
[0134]
Соединение по настоящему изобретению может содержать асимметрический атом или включать заместитель с асимметричным атомом углерода, и такое соединение может иметь оптические изомеры. Соединение по настоящему изобретению включает в себя смесь этих изомеров и разделенный изомер, и может быть получено в соответствии с традиционными методами. К таким методам относятся, например, методы, в которых используется исходное вещество с асимметричным центром, и методы, в которых асимметрия вводится на любой из промежуточных стадий. Например, оптический изомер может быть получен из соответствующего оптически активного исходного вещества или оптическим разделением на любой из подходящих стадий процесса его получения. Такое оптическое разделение включает, например, ВЭЖХ с разделительной колонной для оптических изомеров. Когда соединение формулы (1) или промежуточные продукты его синтеза содержат основную функциональную группу, для получения соответствующей соли с оптически активной кислотой (например, карбоновой кислотой, такой как миндальная кислота, N-бензилоксиаланин, молочная кислота; дикарбоновыми кислотами, такими как винная кислота, О-диизопропилиденвинная кислота и яблочная кислота, и сульфоновыми кислотами, такими как камфорсульфоновая кислота и бромкамфорсульфоновая кислота) в инертном растворителе (например в спиртовых растворителях, таких как метанол, этанол и 2-пропанол; простых эфирах, таких как диэтиловый эфир; сложных эфирах, таких как этилацетат; углеводородных растворителях, таких как толуол; апротонных растворителях, таких как ацетонитрил; смесях любых двух или нескольких из вышеуказанных растворителей) может использоваться диастереомерный метод. Когда соединение по настоящему изобретению или его промежуточные соединения включают кислотную функциональную группу, такую как карбоксильная группа, оптическое разделение может осуществляться с образованием соответствующей соли с оптически активным амином (например, органическими аминами, такими как 1-фенилэтиламин, хинин, хинидин, цинхонидин, цинхонин и стрихнин).
[0135]
Температура получения соли выбирается в интервале от -50°С до температуры кипения растворителя, предпочтительно в интервале от 0°С до температуры кипения, более предпочтительно в интервале от комнатной температуры до температуры кипения растворителя. Для повышения оптической чистоты желательно повысить температуру примерно до температуры кипения растворителя. Осажденная соль может быть дополнительно охлаждаться для выделения фильтрацией для повышения выхода. Количество используемой оптически активной кислоты или оптически активного амина находится в интервале от примерно 0,5 до примерно 2,0 эквивалента соответствующего субстрата, предпочтительно составляет примерно 1 эквивалент. Кристаллическое вещество необязательно может подвергаться перекристаллизации в инертном растворителе (например в спиртовых растворителях, таких как метанол, этанол и 2-пропанол; эфирных растворителях, таких как диэтиловый эфир; сложноэфирных растворителях, таких как этилацетат; углеводородных растворителях, таких как толуол; апротонных растворителях, таких как ацетонитрил; смесях любых двух или нескольких из вышеупомянутых растворителей) для получения соответствующей высокочистой оптически активной соли. Оптически разделенная соль может дополнительно обрабатываться кислотным основанием в соответствии с известными методами для получения соответствующего соединения в свободной форме.
[0136]
Соединение по настоящему изобретению обладает активностью отрицательного аллостерического модулятора (negative allosteric modulator - NAM) в отношении mGlu2 рецепторов и может представлять собой новое терапевтическое средство и/или профилактическое средство для заболеваний, в которые вовлечены mGlu рецепторы II группы (т.е. метаботропные рецепторы глутамата подтипа 2 (mGluR2) и/или метаботропные рецепторы глутамата подтипа 3 (mGluR3), предпочтительно mGluR2), которое проявляет отрицательную аллостерическую модуляцию в отношении mGlu рецепторов группы II. Такие заболевания, в которые вовлечены рецепторы mGlu II группы, включают психические заболевания и нейродегенеративные заболевания, в частности крупное депрессивное расстройство, депрессивные расстройства (такие как депрессивный эпизод тяжелой степени, терапевтически резистентная депрессия, хроническая депрессия), биполярные и связанные с ними расстройства (такие как биполярная депрессия), тревожные расстройства (такие как генерализованное тревожное расстройство, паническое расстройство, социальное тревожное расстройство, специфическая фобия), посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, острое стрессовое расстройство, шизофрению, расстройство аутического спектра, болезнь Альцгеймера, когнитивную дисфункцию, деменцию, лекарственную зависимость, ожирение, судороги, тремор, боль и нарушение сна.
Среди этих психических и нейродегенеративных заболеваний предпочтительными заболеваниями являются депрессивный эпизод тяжелой степени, депрессивные расстройства (такие как большая депрессия, терапевтически резистентная депрессия, хроническая депрессия), биполярное и связанные с ними расстройства (такие как биполярная депрессия), тревожные расстройства (такие как генерализованное тревожное расстройство, паническое расстройство, социальное тревожное расстройство и специфическая фобия), посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, острое стрессовое расстройство, шизофрения, болезнь Альцгеймера, когнитивная дисфункция, деменция, лекарственная зависимость, ожирение, судороги, тремор, боль или расстройство сна.
[0137]
Способ введения соединения по настоящему изобретению может быть любым способом, выбранным из перорального, парентерального и ректального введения, суточная доза варьируется в зависимости от условий, таких как соединение, способ введения, симптомы и возраст пациентов. При пероральном введении взрослому пациенту можно вводить примерно от 0,01 до 1000 мг, предпочтительно от 0,1 до 500 мг, в день в одной дозе или в нескольких разделенных дозах.
[0138]
Соединение по настоящему изобретению может вводиться перорально или парентерально непосредственно или в подходящей лекарственной форме после получения препарата. Такая лекарственная форма включает, например, но без ограничения, таблетки, капсулы, порошки, гранулы, жидкости, суспензии, формы для инъекции, пластыри, катаплазмы. Лекарственные препараты получают с фармацевтически приемлемыми эксципиентами в соответствии с известными способам. Такие эксципиенты могут быть выбраны из носителей, дезинтегрирующих веществ, связующих веществ, флюидизирующих веществ, смазывающих веществ, веществ покрытия, солюбилизаторов, солюбилизирующих добавок, загустителей, диспергаторов, стабилизаторов, подсластителей и ароматизаторов в зависимости от назначения. Такие вспомогательные вещества включают, например, лактозу, маннит, кристаллическую целлюлозу, низкозамещенную гидроксицеллюлозу, кукурузный крахмал, частично прежелатинизированный крахмал, кармеллозу кальция, кроскармеллозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливиниловый спирт, стеарат магния, стеарилфумарат натрия, полиэтиленгликоль, фенгликоль, оксид титана, тальк.
[0139]
Соединение по настоящему изобретению может использоваться в комбинации с одним или несколькими нейролептическими лекарственными средствами для лечения одного или нескольких психически или нейродегенеративных заболеваний, описанных в настоящем документе. Такие нейролептические лекарственные средства включают, например, терапевтические лекарственные средства для лечения депрессивных эпизодов тяжелой степени, депрессивных расстройств (таких как большое депрессивное расстройство, терапевтически резистентная депрессия, хроническая депрессия), биполярных расстройств (таких как биполярная депрессия), тревожных расстройств (таких как генерализованное тревожное расстройство, паническое расстройство, социальное тревожное расстройство, специфическая фобия), посттравматического стрессового расстройства, обсессивно-компульсивного расстройства, острого стрессового расстройства, шизофрении, расстройства аутического спектра, болезни Альцгеймера, когнитивной дисфункции, деменции, лекарственной зависимости, ожирения, судорог, тремора, боли и расстройства сна. Интервал между введением соединения по настоящему изобретению и этих терапевтических лекарственных средств не ограничен; т.е. они могут вводиться субъекту одновременно или с подходящим интервалом. Альтернативно, соединение по настоящему изобретению и любое из этих терапевтических лекарственных средств может вводиться в одном комбинированном препарате. Доза этих терапевтических средств может быть соответствующим образом определена на основе их клинически используемых доз. Соотношение соединения по настоящему изобретению и любого из этих терапевтических лекарственных средств при применении в комбинации может быть соответствующим образом определено исходя из таких данных, как состояние субъекта, которому предполагается введение, способ введения, целевые заболевания, симптомы и их сочетание.
[0140]
Когда соединение по настоящему изобретению используется в качестве активного фармацевтического ингредиента, оно не предназначено для использования только человеком, но его можно использовать и для животных кроме человека, таких как кошки, собаки, крупный рогатый скот, куры и рыбы.
[0141]
Настоящее изобретение более подробно объяснено ниже со ссылкой на справочные примеры, примеры и биологические тесты; однако техническая область настоящего изобретения не огранивается представленными примерами. Названия соединений, использованные в справочных примерах и примерах ниже, не обязательно основаны на системе номенклатуры IUPAC. Для простоты описания могут использоваться аббревиатуры.
ПРИМЕРЫ
[0142]
Соединения идентифицируют с помощью спектроскопии протонного ядерного магнитного резонанса (1H-ЯМР), ЖХ-МС и т.п. Для спектроскопии ядерного магнитного резонанса в качестве внутреннего стандарта используют тетраметилсилан.
[0143]
В справочных примерах и примерах для колоночной хроматографии и амино-хроматографии используют колонки с силикагелем и колонки с аминосиликагелем производства Yamazen Corporation. При очистке методом ТСХ используют Silica GEL 60F254 (Merck) (силикагельная пластина) и TLC plate NH (Fuji Silysia) (NH-модифицированная силикагельная пластина).
[0144]
В справочных примерах и примерах используют следующую аппаратуру. Различные данные в справочных примерах и примерах получают со следующими аппаратами.
Микроволновой реактор: Biotage AB Initiator
ЯМР спектры: [1H-NMR] 400 МГц: JEOL JNM-AL series AL 400
ЖХ-МС спектры: Waters ACQUITY™ UltraPerformance LC
Высокоэффективная жидкостная хроматография (ВЭЖХ): Shimazu LC-20
Порошковая рентгеновская дифракция: Spectris Power X-ray diffraction system Empyrian
CHN Элементный анализатор: Flash 2000 производства Thermo Fisher Scientific Inc.
Ионный анализатор: ICS-5000+ производства Thermo Fisher Scientific Inc.
Названия соединений в справочных примерах и примерах получены с помощью ACD/Name (ACD/Labs 12.0, Advanced Chemistry Development Inc.).
[0145]
ЖХ-МС данные в справочных примерах и примерах получены в следующих условиях. Полученные в масс-спектроскопии значения [МС (m/z)] представлены в [M+H]+.
Условия измерений
Колонка: ACQUITY UPLC BEH C18 1.7 μm 2.1×30 mm column
Растворитель: раствор A: 0,05% HCООH/H20, раствор B: CH3CN
Условия элюирования с градиентом:
0,0-1,3 мин.; A/B=90/10 до 5/95 (линейный градиент)
1,3-1,5 мин.; A/B=90/10
Линейная скорость потока: 0,80 mL/мин.
УФ: 220 нм, 254 нм
Температура колонки: 40°C
[0146]
Данные высокоэффективной жидкостной хроматографии (ВЭЖХ) в справочных примерах и примерах получают в следующих условиях.
Время удерживания показано как Rt (мин.).
Колонка: PhenomenexKinetex2.6 μmC18 (75×3.0 mm)
Растворитель: раствор A: 0,035% ТФУК/Н2O, раствор B: 0,035% ТФУК/CH3CN
Условия градиента:
0,0 мин.; A/B=99/1
0,0-5,70 мин.; A/B=99/1 до 1/99
(Линейный градиент)
5,70-8,00 мин.; A/B=1/99
Линейная скорость потока: 0,90 мл/мин.
УФ: 220 нм, 254 нм
Температура колонки: 40°C
[0147]
Порошковую рентгеновскую дифракцию в справочных примерах и примерах выполняют в следующих условиях.
Рентгеновская трубка: CuKa (длина волны: 1,54 ангстрем)
Рабочее напряжение трубки: 45 кВ
Ток рентгеновской трубки: 40 мA
Область измерений: от 4 до 40 градусов (2θ)
Интервал шага: 0,013 градуса
Время накопления сигнала: 100 секунд/шаг
Полученные дифракционные рентгенограммы (X-ray diffraction - XRD) представлены на фигурах 1-3.
Кристаллические формы определяют на основании характеристических дифракционных пиков каждого кристалла, представленного на дифракционных рентгенограммах фигур с 1 по 3.
Основные и характеристические дифракционные пики, определенные на рентгенограммах фигур 1-3, показаны ниже. Значения углов дифракции 2θ (°) дифракционных пиков в следующих примерах могут содержать определенные отклонения полученных значений в зависимости от измерительных приборов или условий измерения. В частности, такие отклонения полученных значений могут находиться в пределах ±0,2, предпочтительно ±0,1.
[0148]
CHN-элементный анализ в справочных примерах и примерах проводят в следующих условиях.
Температура в печи элементного анализа: 1000°C
Температура восстановительной печи: 700°C
Температура в термостатической ванне: 55°C
Время анализа: 600 секунд
Скорость потока газообразного гелия: 110 мл/мин.
Скорость нагнетания газообразного кислорода: 75 мл/мин.
[0149]
Анализ ионов в справочных примерах и примерах проводят в следующих условиях.
Картридж предварительной обработки образцов: TOYO IC-SP M
Детектор: детектор по проводимости
Предколонка: IonPac AG11-HC (0,4 мм i.d. × 50 мм, Thermo Fisher Scientific)
Колонка: IonPac AS11-HC (0,4 мм i.d. × 250 мм, Thermo Fisher Scientific)
Колонка-подавитель: ACES-300 (4 мм i.d., Thermo Fisher Scientific)
Термостат колонок: 30°C
Скорость потока: 0,015 мл/мин.
Интенсивность впрыска: 0,4 мкл
Продолжительность анализа: 18 мин.
Элюент: раствор гидроксида калия, полученный с генератором элюента EGC KOH (капиллярный)
Условия градиента (концентрации элюента)
0-5 мин; 10 мМ
5-10 мин; 10-30 мM (линейный градиент)
10-18 мин; 30 мМ
[0150]
В справочных примерах и примерах используются следующие аббревиатуры.
CDCl3: дейтерохлороформ
CD3OD: дейтерометанол
DMSO-d6: дейтеродиметилсульфоксид
с: синглет
д: дублет
т: триплет
кв: квартет
м: мультиплет
уш.: уширенный
дд: двойной дублет
тд: тройной дублет
J: постоянная взаимодействия
Гц: герц
мин: минута
атм: атмосфера
HATU: гексафторфосфат О-(7-аза-1H-бензотриазол-1-ил)-N, N,N',N'-тетраметилурония
ВЭЖХ: высокоэффективная жидкостная хроматография
ТГФ: тетрагидрофуран
DME: 1,2-диметоксиэтан
ТФУК: трифторуксусная кислота
ДМФА: N, N-диметилформамид
HBTU: гексафторфосфат О-(бензотриазол-1-ил)-N, N,N',N'-тетраметилурония
X-phos: 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил
S-phos: 2-дициклогексилфосфино-2',6'-диметоксибифенил
N.D.: не определен
RLU: относительная световая единица.
[0151]
Справочный пример 1: этил-1-{(2S)-1-[(трет-бутоксикарбонил)амино]пропан-2-ил}-1Н-пиразол-5-карбоксилат
К раствору трет-бутил-N-[(2R)-2-гидроксипропил]карбамата (18,3 г) в ТГФ (130 мл) при комнатной температуре добавляют этил-1Н-пиразол-3-карбоксилат (16,1 г) и трифенилфосфин (30,2 г) и затем по каплям в течение 30 минут добавляют диизопропилазодикарбоксилат (60,6 мл, раствор в толуоле, 1,9 моль/л). Смесь перемешивают при комнатной температуре в течение 2 часов и затем к смеси добавляют воду (130 мл). Смесь перемешивают в течение 30 минут. Смесь экстрагируют этилацетатом дважды, отделенные органические слои объединяют и сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. К полученному остатку добавляют смесь гексан:диэтиловый эфир (1:1, 200 мл), полученное твердое вещество собирают фильтрацией. Фильтрат концентрируют при пониженном давлении с получением сырого продукта. Полученный сырой продукт очищают с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовки соединения (26,5 г).
1Н-ЯМР (400 МГц, CDCl3) δ: 7,52 (1Н, д, J=1,8 Гц), 6,83 (1Н, д, J=1,8 Гц), 5,58-5,48 (1Н, м), 4,88 (1Н, с), 4,34 (2Н, кв, J=7,1 Гц), 3,66-3,49 (2Н, м), 1,47-1,33 (15Н, м).
[0152]
Справочный пример 2: (7S)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5Н)-он
К раствору соединения справочного примера 1 (26,5 г) в толуоле (90 мл) на ледяной бане добавляют ТФУК (27,8 мл), смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, остаток растворяют в ДМФА (150 мл). К раствору при комнатной температуре по каплям добавляют триэтиламин (37,9 мл). Реакционную смесь кипятят с обратным холодильником в течение 7 часов, затем добавляют воду (300 мл). Смесь перемешивают в течение дополнительных 10 минут. Смесь экстрагируют смесью хлороформ:метанолом (4:1) 14 раз, затем отделенные органические слои объединяют и сушат под безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. К полученному остатку добавляют диэтиловый эфир (100 мл) и смесь тщательно перемешивают. Полученное твердое вещество собирают фильтрацией (6,51 г). Фильтрат концентрируют при пониженном давлении, и к полученному остатку добавляют диэтиловый эфир (100 мл). Смесь перемешивают, полученное твердое вещество собирают фильтрацией (2,51 г). Полученные твердые вещества объединяют с получением указанного в заголовке соединения (8,66 г).
1H-ЯМР (400 МГц, CDCl3) δ: 7,57 (1H, д, J=2,4 Гц), 6,88 (1H, д, J=2,4 Гц), 6,88-6,82 (1H, м), 4,60-4,50 (1H, м), 3,80 (1H, ддд, J=7,6, 4,8, 3,6 Гц), 3,49 (1H, ддд, J=10,4, 7,6, 2,8 Гц), 1,62 (3H, д, J=6,1 Гц).
[0153]
Справочный пример 3: (7S)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
К суспензии 1-бром-4-(трифторметил)бензола (60,6 г), соединения справочного примера 2 (33,92 г) и карбоната калия (62 г) в толуоле (746 мл) добавляют N, N’-диметилэтилендиамин (11,87 г) и йодид меди (8,55 г) и полученную смесь кипятят с обратным холодильником в течение 6 часов. Реакционный раствор оставляют охлаждаться до комнатной температуры и затем к нему добавляют 14% водный раствор аммиака (750 мл) и этилацетат (750 мл). Смесь перемешивают при комнатной температуре в течение 30 минут. Смесь разделяют на слои, органический слой промывают последовательно 14% водным раствором аммиака (750 мл) и насыщенным раствором соли (400 мл), затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. К остатку добавляют изопропанол (760 мл), активированный уголь (7,6 г) и силикагель (24 г) и перемешивают смесь при комнатной температуре в течение 1 часа. Смесь фильтруют через целит, промывают этилацетатом (200 мл) три раза и затем фильтрат концентрируют при пониженном давлении с получением указанного в заголовке соединения (71,8 г).
1H-ЯМР (400 МГц, CDCl3) δ: 7,68 (2H, д, J=8,5 Гц), 7,60 (1H, д, J=1,8 Гц), 7,49 (2H, д, J=8,5 Гц), 6,97 (1H, д, J=1,8 Гц), 4,75-4,67 (1H, м), 4,21 (1H, дд, J=12,5, 4,3 Гц), 3,95 (1H, дд, J=12,5, 7,6 Гц), 1,69 (3H, д, J=6,7 Гц).
[0154]
Справочный пример 4: (7S)-3-йод-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
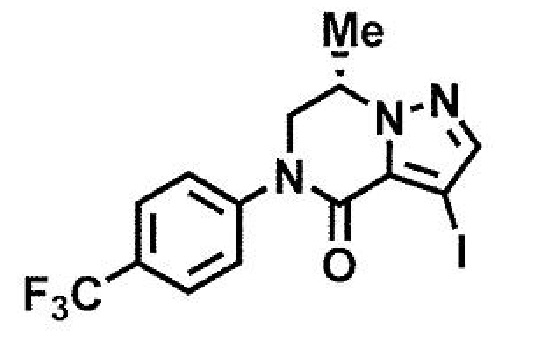
Суспензию соединения справочного примера 3 (104,9 г) и 1,3-дийод-5,5-диметилгидантоина (88 г) в уксусной кислоте (662 мл) перемешивают при 100°C в течение 1 часа. Реакционную суспензию оставляют охлаждаться до комнатной температуры и затем к суспензии по каплям добавляют воду (330 мл). Смесь перемешивают в течение 30 минут. К реакционной смеси по каплям добавляют гексан (200 мл) и воду (990 мл) и перемешивают смесь в течение 30 минут. Полученный твердый осадок собирают фильтрацией и промывают гексан (150 мл) три раза с получением сырого продукта (146 г). К полученному сырому продукту добавляют изопропанол (438 мл). Смесь перемешивают при 75°C и затем смеси дают медленно охладиться до 55°C. К смеси по каплям добавляют воду (657 мл). Смесь перемешивают в течение 1 часа и затем охлаждают до 15°C в течение 3 часов. Полученный твердый осадок собирают фильтрацией, дважды промывают смесью изопропанол:вода (1:2) и сушат при пониженном давлении с получением указанного в заголовке соединения (133 г).
1H-ЯМР (400 МГц, CDCl3) δ: 7,68-7,66 (3H, м), 7,49 (2H, д, J=8,5 Гц), 4,75-4,71 (1H, м), 4,22 (1H, дд, J=12,5, 4,3 Гц), 3,95 (1H, дд, J=12,5, 7,6 Гц), 1,67 (3H, д, J=6,1 Гц).
[0155]
Справочный пример 5: (7S)-3-йод-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
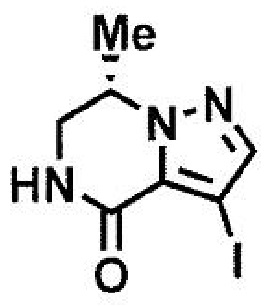
К раствору соединения справочного примера 2 (5,15 г) в уксусной кислоте (85 мл) добавляют 1,3-дийод-5,5-диметилгидантоина (10,35 г). Реакционный раствор перемешивают при 100°C в течение 4 часов и затем дают охладиться до комнатной температуры. К раствору добавляют насыщенный водный раствор тиосульфата натрия. Смесь дважды экстрагируют смесью хлороформ:этанол (4:1), затем органические слои сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (11,06 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 7,93 (1H, с), 4,54-4,47 (1H, м), 3,66-3,61 (1H, м), 3,33-3,29 (1H, м), 1,42 (3H, д, J=6,1 Гц).
ЖХ-МС, m/z 278[M+H]+; время удерживания 0,567 мин.
[0156]
Справочный пример 6: имидазо[1,2-a]пиридин-6-илбороновая кислота
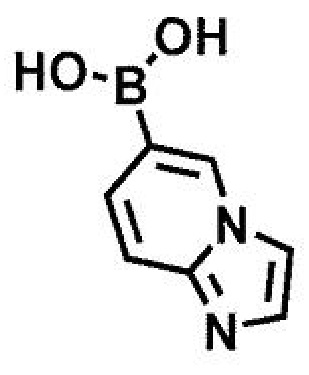
Смесь бис(пинаколато)диборона (3,74 г), 6-бромимидазо[1,2-a]пиридина (2,23 г), хлорида 1,1’-бис(дифенилфосфино)ферроценпалладия (II) (0,924 г) и ацетата калия (2,78 г) в толуоле (16 мл) кипятят с обратным холодильником при перемешивании в течение 2 часов. Смеси дают охладиться до комнатной температуры и затем фильтруют через целит. Фильтрат концентрируют при пониженном давлении с получением сырого продукта указанного в заголовке соединения.
ЖХ-МС, m/z; 163[M+H]+ время удерживания; 0,243 мин.
[0157]
Справочный пример 7: (7S)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
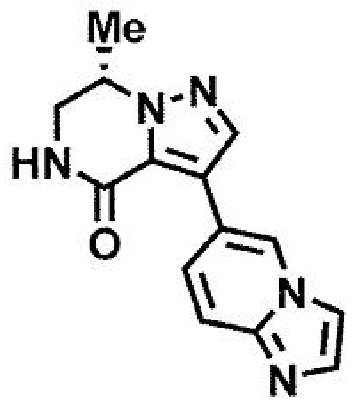
Смесь соединения справочного примера 5 (2,41 г), соединения справочного примера 6 (1,83 г), ацетата палладия (195 мг), X-phos (830 мг), и карбоната калия (2,41 г) в смеси 1,2-диметоксиэтан (16 мл)/вода (8 мл) кипятят с обратным холодильником при перемешивании в течение 4 часов. Реакционной смеси дают охладиться до комнатной температуры, затем разбавляют этилацетатом и фильтруют через целит. К фильтрату добавляют воду и разделяют смесь на слои. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (хлороформ/метанол) с получением указанного в заголовке соединения (693,9 мг).
ЖХ-МС, m/z; 268[M+H]+ время удерживания; 0,376 мин.
[0158]
Справочный пример 8: {(7S)-7-метил-4-оксо-5-[4-(трифторметил)фенил]-4,5,6,7-тетрагидропиразоло[1,5-a]пиразин-3-ил}бороновая кислота
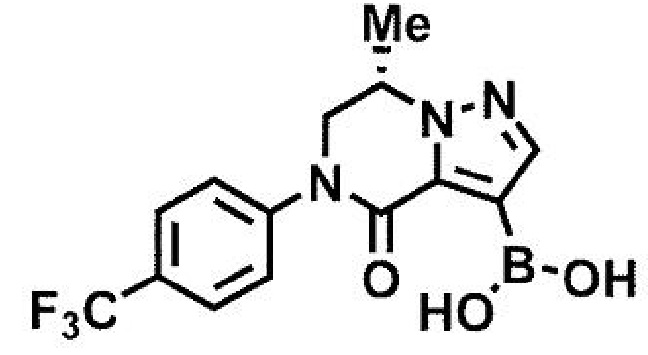
К раствору соединения справочного примера 4 (10,00 г) и 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана (9,60 мл) в ТГФ (100 мл) по каплям добавляют комплекс хлорида изопропилмагния и хлорида лития (42,7 мл) при -25°C. Реакционную смесь перемешивают при -25°C в течение 30 минут и затем к смеси добавляют насыщенный водный раствор хлорида аммония. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (9,12 г).
ЖХ-МС, m/z; 340[M+H]+ время удерживания; 0,865 мин.
[0159]
Справочный пример 9: (2R)-1-{[4-(трифторметил)фенил]амино}пропан-2-ол
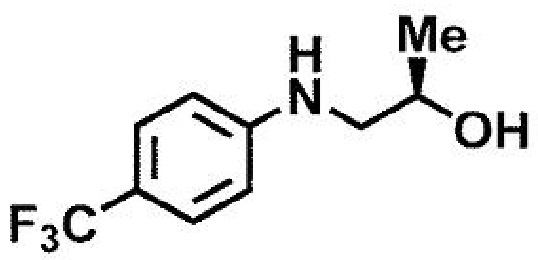
К смеси 1-йод-4-(трифторметил)бензол (168 г), (R)-1-аминопропан-2-ол (116 г) и метанола (168 мл) добавляют гидроксид калия (69,3 г) при 20°C при перемешивании и перемешивают полученную смесь. Реакционную смесь в процессе экзотермической реакции охлаждают до 20°C и добавляют к смеси хлорид меди (I) (6,11 г). Смесь нагревают до 30°C, перемешивают в течение 3 часов и затем перемешивают при 20°C в течение 15 часов. Метанол удаляют при пониженном давлении, к остатку добавляют воду (880 мл), 28% водный раствор аммиака (220 мл) и толуол (880 мл). Смесь перемешивают в течение 30 минут и затем разделяют на слои. Толуоловый слой промывают водой (880 мл) и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения (130 г).
1H-ЯМР (400 МГц, CDCl3) δ: 7,39 (д, 2H, J=8,2 Гц), 6,66 (д, 2H, J=8,2 Гц), 4,09-4,01 (м, 1H), 3,25 (дд, 1H, J=3,0, 12,8 Гц), 3,03 (дд, 1H, J=7,9, 12,8 Гц), 1,27 (д, 3H, J=6,7 Гц).
[0160]
Справочный пример 10: метил-4-бром-1-{(2S)-1-[4-(трифторметил)анилино]пропан-2-ил}-1H-пиразол-5-карбоксилат
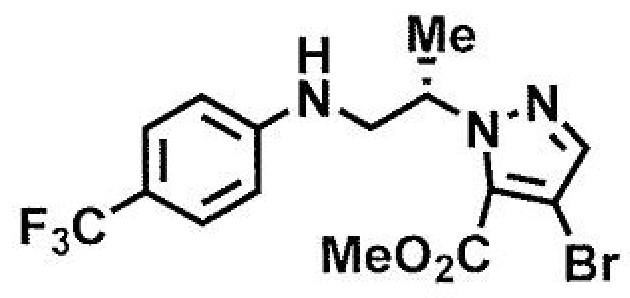
К смеси соединения справочного примера 9 (3,03 г), диизопропилазодикарбоксилата (2,93 г), метил-4-бром-1H-пиразол-5-карбоксилата (2,83 г) и тетрагидрофурана (18 мл) добавляют трифенилфосфин (3,81 г) с перемешиванием при температуре ледяной бани, смесь перемешивают в течение 1,5 часов при температуре ледяной бани и в течение 22 часов при 20°C. Реакционный раствор концентрируют и очищают колоночной хроматографией (силикагель, гексан/этилацетат=от 8/1 до 5/1) с получением указанного в заголовке соединения (2,38 г).
1H-ЯМР (400 МГц, CDCl3) δ: 7,55 (с, 1H), 7,35 (д, 2H, J=8,5 Гц), 6,52 (д, 2H, J=8,5 Гц), 5,57-5,52 (м, 1H), 4,26 (уш., 1H), 3,78 (с, 3H), 3,67-3,59 (м, 1H), 3,50-3,44 (м, 1H), 1,53 (д, 3H, J=6,7 Гц) .
[0161]
Справочный пример 11: 4-бром-1-{(2S)-1-[4-(трифторметил)анилино]пропан-2-ил}-1H-пиразол-5-карбоновая кислота
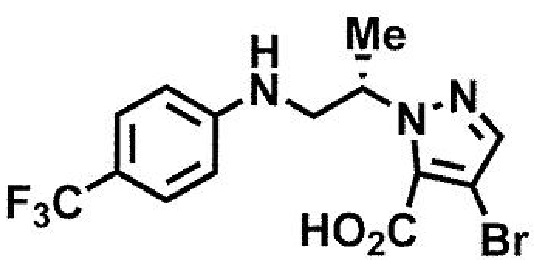
К смеси соединения справочного примера 10 (406 мг) и метанола (2 мл) добавляют водный раствор гидроксида натрия (1 моль/л, 1,5 мл) и перемешивают полученную смесь при комнатной температуре в течение 24 часов. Реакционный раствор охлаждают льдом, подкисляют 5% водным раствором гидросульфата натрия и экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения (392 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 13,84 (уш.с, 1H), 7,75 (с, 1H), 7,32 (д, 2H, J=8,9 Гц), 6,64 (д, 2H, J=8,9 Гц), 6,44 (уш., 1H), 5,52-5,44 (м, 1H), 3,53-3,47 (м, 1H), 3,40-3,35 (м, 1H), 1,43 (д, 3H, J=6,7 Гц).
[0162]
Справочный пример 12: (7S)-3-бром-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
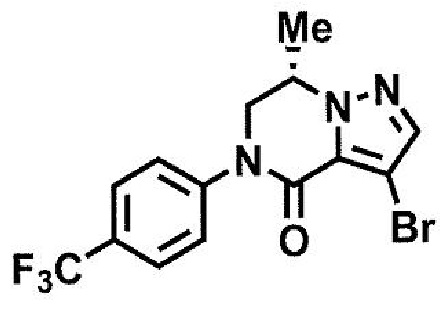
Синтез-1: К смеси соединения справочного примера 11 (392 мг) и толуол (3 мл) добавляют моногидрат п-толуолсульфокислоты (16 мг) и перемешивают смесь при 100°C в течение 12 часов. Реакционный раствор охлаждают до 20°C и к смеси добавляют насыщенный водный раствор гидрокарбоната натрия. Смесь экстрагируют толуолом. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения (356 мг).
Синтез-2: К смеси соединения справочного примера 10 (406 мг) и толуола (3 мл) добавляют моногидрат п-толуолсульфокислоты (16 мг) и перемешивают смесь при 100°C в течение 8 часов. Процентное соотношение площадей жидкостной хроматографии показывает соотношение продукт/исходное вещество=15/82.
1H-ЯМР (400 МГц, CDCl3) δ: 7,67 (д, 2H, J=8,5 Гц), 7,59 (с, 1H), 7,49 (д, 2H, J=8,5 Гц), 4,73-4,65 (м, 1H), 4,20 (дд, 1H, J=4,3, 12,8 Гц), 3,95 (дд, 1H, J=7,3, 12,8 Гц), 1,67 (д, 3H, J=6,7 Гц).
[0163]
Справочный пример 13: (7S)-3-(3-йодимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
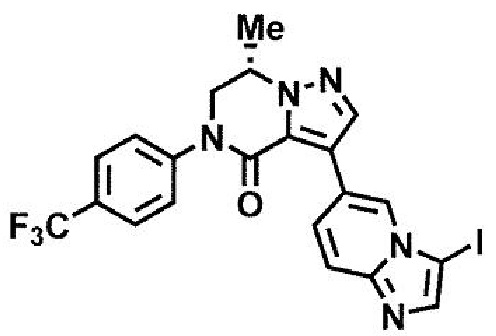
Раствор соединения примера 1 (386 мг) и 1,3-дийод-5,5-диметилгидантоина (178 мг) в уксусной кислоте (4 мл) перемешивают при комнатной температуре в течение 5 часов. К реакционному раствору добавляют насыщенный водный раствор тиосульфата натрия и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (403 мг).
1H-ЯМР (400 МГц, ДМСО-D6) δ: 9,02 (1H, д, J=1,2 Гц), 8,14 (1H, с), 7,82 (2H, д, J=8,5 Гц), 7,70-7,59 (5H, м), 4,85-4,83 (1H, м), 4,38 (1H, дд, J=12,8, 4,3 Гц), 4,12-4,07 (1H, м), 1,60 (3H, д, J=6,7 Гц).
[0164]
Справочный пример 14: (7S)-3-(3-этенилимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
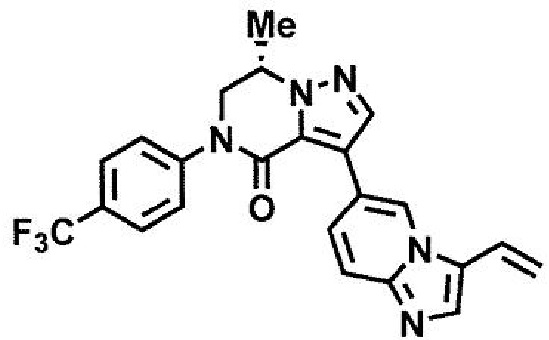
Смесь соединения справочного примера 13 (219 мг), 4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолана (0,14 мл), тетракис(трифенилфосфин)палладия (0) (47,1 мг) и карбоната калия (130 мг) в 1,2-диметоксиэтане (2 мл) и воде (1 мл) кипятят с обратным холодильником при перемешивании в течение 4 часов. Смеси дают охладиться до комнатной температуры, затем разбавляют этилацетатом и фильтруют через целит. К фильтрату добавляют насыщенный водный раствор гидрокарбоната натрия и разделяют смесь на слои. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (87,8 мг).
ЖХ-МС, m/z; 438[M+H]+; время удерживания; 0,805 мин.
[0165]
Справочный пример 15: (7S)-7-метил-3-{3-[(1Z)-проп-1-ен-1-ил]имидазо[1,2-a]пиридин-6-ил}-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
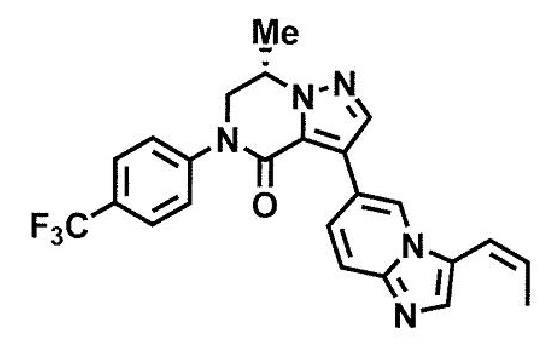
Соединение справочного примера 13 (210 мг) обрабатывают цис―пропенилбороновой кислотой (67,1 мг) в соответствии с методикой справочного примера 14 с получением указанного в заголовке соединения (114,1 мг).
ЖХ-МС, m/z; 452[M+H]+ время удерживания; 0,805 мин.
[0166]
Справочный пример 16: (7S)-5-(4-фтор-3-метилфенил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
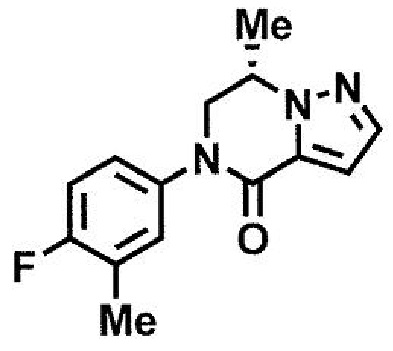
Соединение справочного примера 2 (1,05 г) обрабатывают 4-бром-1-фтор―2-метилбензолом (1,58 г) в соответствии с методикой справочного примера 3 с получением указанного в заголовке соединения (1,80 г).
1H-ЯМР (400 МГц, CDCl3) δ: 7,57 (1H, д, J=1,8 Гц), 7,16 (1H, дд, J=6,7, 3,1 Гц), 7,11-7,07 (1H, м), 7,04-7,02 (1H, м), 6,92 (1H, д, J=1,8 Гц), 4,70-4,62 (1H, м), 4,12 (1H, дд, J=12,8, 4,3 Гц), 3,84 (1H, дд, J=12,8, 7,3 Гц), 2,27 (3H, д, J=1,8 Гц), 1,66 (3H, д, J=6,7 Гц).
[0167]
Справочный пример 17: (7S)-5-(4-фтор-3-метилфенил)-3-йод-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
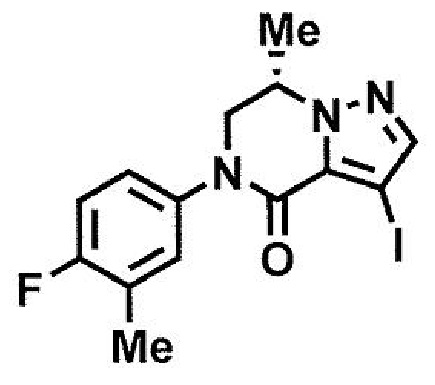
Соединение справочного примера 16 (1,70 г) обрабатывают в соответствии с методикой справочного примера 4 с получением указанного в заголовке соединения (2,00 г).
1H-ЯМР (400 МГц, CDCl3) δ: 7,62 (1H, с), 7,18 (1H, дд, J=6,7, 2,4 Гц), 7,10-7,06 (1H, м), 7,03-7,01 (1H, м), 4,72-4,64 (1H, м), 4,13 (1H, дд, J=12,8, 4,3 Гц), 3,85 (1H, дд, J=12,8, 7,3 Гц), 2,27 (3H, д, J=1,8 Гц), 1,64 (3H, д, J=6,1 Гц).
[0168]
Справочный пример 18: (7S)-5-(4-фтор-3-метилфенил)-3-(3-йодимидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
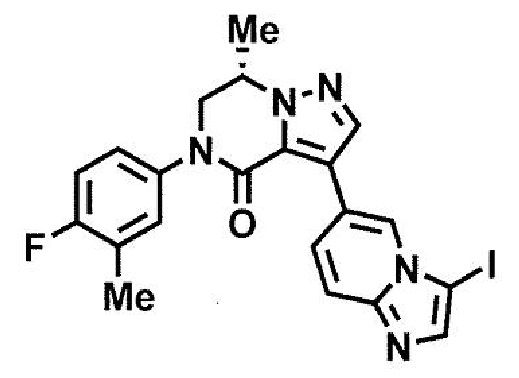
Соединение примера 17 (40,0 мг) обрабатывают в соответствии с методикой справочного примера 13 с получением указанного в заголовке соединения (39,4 мг).
1H-ЯМР (400 МГц, CDCl3) δ: 8,59-8,59 (1H, м), 7,77 (1H, с), 7,65 (1H, с), 7,54-7,53 (2H, м), 7,16 (1H, дд, J=6,9, 2,7 Гц), 7,12-7,08 (1H, м), 7,04-6,99 (1H, м), 4,77-4,74 (1H, м), 4,20 (1H, дд, J=12,8, 4,1 Гц), 3,90 (1H, дд, J=12,8, 7,1 Гц), 2,26 (3H, д, J=1,8 Гц), 1,73 (3H, д, J=6,4 Гц).
[0169]
Справочный пример 19:
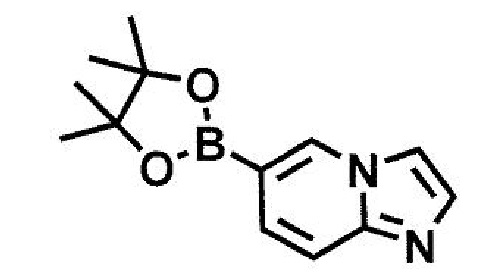
Смесь 6-бромимидазо[1,2-a]пиридина (151,72 г), бис(пинаколато)диборона (235 г), продукта присоединения хлорида 1,1’-бис(дифенилфосфино)ферроценпалладия (II) и дихлорметана (62,9 г) и ацетата калия (189 г) в 1,2-диметоксиэтане (1,59 л) кипятят с обратным холодильником при перемешивании в течение 4,5 часов. Смеси дают охладиться до комнатной температуры, затем полученный твердый осадок собирают фильтрацией и промывают 1,2-диметоксиэтаном (200 мл). К полученному твердому продукту добавляют воду (500 мл) и гексан (500 мл) и суспендируют смесь при перемешивании при комнатной температуре в течение 30 минут. Полученный твердый осадок собирают фильтрацией и промывают 1,2-диметоксиэтаном (400 мл) три раза с получением указанного в заголовке соединения (145,1 г).
1H-ЯМР (400 МГц, CDCl3) δ: 8,55 (1H, т, J=1,2 Гц), 7,62-7,56 (3H, м), 7,44 (1H, дд, J=9,2, 1,2 Гц), 1,35 (13H, с).
[0170]
Пример 1: (7S)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
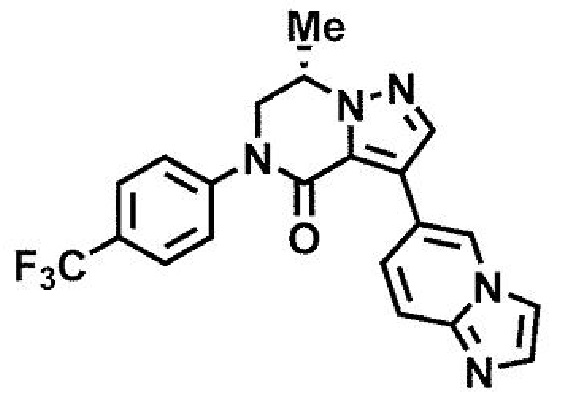
Синтез-1: Смесь соединения справочного примера 4 (1,15 г), соединения справочного примера 6 (661 мг), ацетата палладия (61,1 мг), X-phos (259 мг) и карбоната калия (752 мг) в смеси 1,2-диметоксиэтан (6 мл)/вода (3 мл) кипятят с обратным холодильником при перемешивании в течение 3 часов. Смеси дают охладиться до комнатной температуры, затем разбавляют этилацетатом и фильтруют через целит. К фильтрату добавляют воду и разделяют смесь на слои. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (551,5 мг).
Синтез-2: Смесь соединения справочного примера 12 (177 мг), соединения справочного примера 6 (92 мг), карбоната калия (196 мг), тетракис(трифенилфосфин)палладия (0) (27 мг), 1,4-диоксана (1,9 мл) и воды (0,47 мл) перемешивают при 90°C в течение 3,5 часов. Смесь охлаждают до 20°C и к смеси добавляют насыщенный раствор соли. Смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток смешивают с этилацетатом (примерно 1,5 мл) при комнатной температуре и собирают твердое вещество фильтрацией. Твердый продукт промывают этилацетатом (примерно 0,5 мл) с получением указанного в заголовке соединения (102 мг).
Синтез-3: Смесь соединения справочного примера 4 (116 г), соединения справочного примера 6 (67,0 г), ацетата палладия (6,20 г), X-phos (26,3 г) и карбоната калия (76 г) в смеси 1,2-диметоксиэтан (700 мл)/вода (350 мл) кипятят с обратным холодильником при перемешивании в течение 3 часов. Смеси дают охладиться до комнатной температуры и затем к добавляют этилацетат (500 мл) и 2 моль/л соляной кислоты (1000 мл). Смесь перемешивают при комнатной температуре в течение 30 минут. Смесь фильтруют через целит, осадок на фильтре промывают этилацетатом (500 мл) и затем разделяют фильтрат на слои. Органический слой промывают соляной кислотой (2 моль/л, 500 мл) два раза, водные слои объединяют и доводят значение pH до 9 добавлением водного раствора гидроксида натрия (10 моль/л). Водный слой экстрагируют хлороформом (500 мл) три раза, затем промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. К остатку (125,3 г) добавляют этанол (1253 мл) и кипятят смесь при перемешивании с обратным холодильником в течение 30 минут. К смеси добавляют воду (626 мл) и кипятят полученную смесь при перемешивании с обратным холодильником. Смеси дают охладиться до комнатной температуры, полученный твердый продукт собирают фильтрацией и промывают этилацетатом. К полученному твердому продукту (44,4 г) добавляют этилацетат (666 мл) и кипятят полученную смесь при перемешивании с обратным холодильником в течение 30 минут. Смеси дают охладиться до комнатной температуры, затем полученный твердый продукт собирают фильтрацией, промывают этилацетатом и сушат при пониженном давлении с получением указанного в заголовке соединения (39,77 г).
Синтез-4: Смесь соединения справочного примера 4 (28,5 г), соединения справочного примера 19 (33,5 г), ацетата палладия (1,519 г), S-phos (5,56 г) и карбоната калия (18,0 г) в смеси 1,2-диметоксиэтан (100 мл)/вода (50 мл) кипятят с обратным холодильником при перемешивании в течение 3 часов. Смеси дают охладиться до комнатной температуры, затем разбавляют смесью хлороформ (180 мл)/метанол (20 мл), фильтруют через целит и промывают смесью хлороформ (450 мл)/метанол (50 мл). К полученному фильтрату добавляют водный раствор карбоната натрия и разделяют смесь на слои. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат/метанол) с получением твердого продукта. Полученный твердый продукт (21,23 г) промывают этилацетатом (210 мл) и собирают фильтрацией. К раствору полученного твердого продукта (13,65 г) в смеси хлороформ (117 мл)/метанол (13 мл) добавляют активированный уголь (торговое название "Kyoryoku Shirasagi") (6,5 г) и перемешивают полученную смесь при комнатной температуре в течение 1 часа. Затем к смеси добавляют Argoregin MP-TMT (6,5 г) и перемешивают смесь при комнатной температуре в течение дополнительного 1 часа. Полученный раствор фильтруют через целит и промывают смесью хлороформ (720 мл)/метанол (80 мл) и затем фильтрат концентрируют при пониженном давлении с получением указанного в заголовке соединения (12,03 г).
1H-ЯМР (400 МГц, CDCl3) δ: 8,89 (1H, д, J=1,8 Гц), 7,80 (1H, с), 7,70 (2H, д, J=8,5 Гц), 7,59-7,55 (3H, м), 7,48 (2H, д, J=8,5 Гц), 7,40 (1H, дд, J=9,8, 1,8 Гц), 4,80-4,75 (1H, m), 4,27 (1H, дд, J=12,5, 4,0 Гц), 3,99 (1H, дд, J=12,5, 7,3 Гц), 1,74 (3H, д, J=6,1 Гц).
[Кристаллическая форма I]
Основные дифракционные пики: 2θ (°) = 4,5, 8,5, 8,9, 10,1, 13,4, 16,9, 18,2, 18,6, 22,7, 23,8.
Характеристические дифракционные пики: 2θ (°) = 4,5, 8,5, 8,9, 10,1, 13,4, 16,9.
[0171]
Получение гидрохлоридной соли соединения примера 1
К раствору соединения примера 1 (10,8 г) в хлороформе (100 мл) добавляют смесь 4 моль/л соляная кислота-этилацетат (200 мл) и перемешивают полученную смесь при комнатной температуре в течение 5 минут. Реакционную смесь концентрируют при пониженном давлении и затем к остатку добавляют этанол (100 мл). Смесь кипятят с обратным холодильником при перемешивании в течение 30 минут. К смеси добавляют гексан (50 мл) и кипятят смесь с обратным холодильником при перемешивании в течение дополнительного 1 часа. Смеси дают охладиться до комнатной температуры, полученный твердый продукт собирают фильтрацией, промывают смесью этанол/гексан (1/2) и сушат при пониженном давлении с получением гидрохлоридной соли соединения примера 1 (10,0 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 9,37 (1H, с), 8,39 (1H, д, J=1,8 Гц), 8,28 (1H, дд, J=9,4, 1,5 Гц), 8,20 (1H, д, J=1,8 Гц), 8,12 (1H, с), 7,98 (1H, д, J=9,1 Гц), 7,83 (2H, д, J=8,5 Гц), 7,68 (2H, д, J=8,5 Гц), 4,89-4,87 (1H, м), 4,40 (1H, дд, J=12,8, 6,4 Гц), 4,14 (1H, дд, J=12,8, 7,6 Гц), 1,61 (3H, д, J=6,1 Гц).
[Кристаллическая форма II]
Основные дифракционные пики: 2θ (°) = 5,7, 8,7, 9,5, 11,0, 11,3, 12,7, 13,6, 15,3, 15,5, 16,6, 21,5.
Характеристические дифракционные пики: 2θ (°) = 5,7, 8,7, 9,5, 11,0, 11,3, 15,3.
[0172]
Получение фосфатной соли соединения примера 1
К суспензии соединения примера 1 (8,80 г) в этилацетате (150 мл) добавляют фосфорную кислоту (4,38 мл) и кипятят смесь с обратным холодильником при перемешивании в течение 1 часа. Смеси дают охладиться до комнатной температуры, полученный твердый продукт собирают фильтрацией, промывают этилацетатом и сушат при пониженном давлении с получением 2,5 фосфатной соли соединения примера 1 (14,18 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 9,05 (1H, с), 8,02 (1H, с), 7,97 (1H, с), 7,81 (2H, д, J=8,5 Гц), 7,67 (2H, д, J=8,5 Гц), 7,62-7,58 (3H, м), 4,85-4,82 (1H, м), 4,37 (1H, дд, J=12,8, 4,3 Гц), 4,10 (1H, дд, J=12,8, 7,9 Гц), 1,59 (3H, д, J=6,1 Гц).
[Кристаллическая форма III]
Основные дифракционные пики: 2θ (°) = 6,1, 6,9, 8,9, 9,8, 12,1, 13,4, 13,7, 18,0, 18,2, 20,6.
Характеристические дифракционные пики: 2θ (°) = 6,1, 8,9, 9,8, 12,1, 13,4, 13,7.
CHN-элементный анализ: C21H16F3N5O·2,5 H3PO4; вычислено: C 38,43%; H 3,61%; N 10,67%; найдено: C 38,29%; H 3,59%; N 10,54%.
Ионный анализ: фосфатный ион (PO43-) C21H16F3N5O.2,5H3PO4; вычислено: 36,13%, найдено: 35,94%, 35,90%.
[0173]
Пример 2: (7S)-3-(имидазо[1,2-a]пиразин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
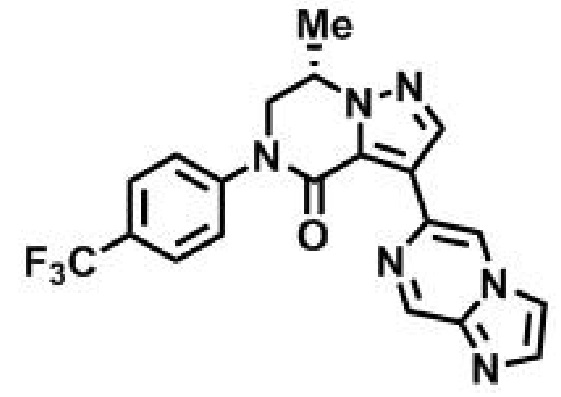
Соединение справочного примера 4 (848 мг) обрабатывают имидазо[1,2-a]пиразин-6-илбороновой кислотой (492 мг) в соответствии с методикой примера 1 с получением указанного в заголовке соединения (4 мг).
1H-ЯМР (400 МГц, CDCl3) δ: 9,71 (1H, с), 9,09 (1H, с), 8,40 (1H, с), 7,76-7,74 (3H, м), 7,66 (1H, с), 7,52 (2H, д, J=7,9 Гц), 4,82-4,80 (1H, м), 4,29 (1H, дд, J=12,2, 3,7 Гц), 3,98 (1H, дд, J=12,2, 6,7 Гц), 1,75 (3H, д, J=6,1 Гц).
[0174]
Пример 3: (7S)-5-(3-хлор-4-фторфенил)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
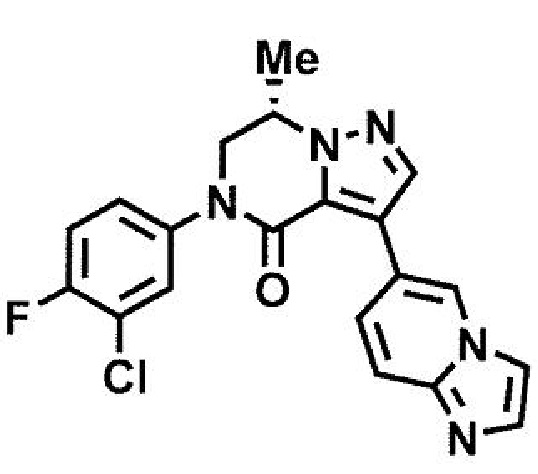
Смесь соединения справочного примера 7 (300 мг), 4-бром-2-хлор-1-фторбензол (0,204 мл), йодида меди (64,1 мг), N, N’-диметилэтилендиамина (0,109 мл) и карбоната калия (310 мг) в толуоле (2,5 мл) кипятят с обратным холодильником при перемешивании в течение 5 часов. Смеси дают охладиться до комнатной температуры и затем к смеси добавляют 28% водный раствор аммиака. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида аммония, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (263,3 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 9,38 (1H, с), 8,40 (1H, д, J=1,8 Гц), 8,28 (1H, дд, J=9,5, 1,5 Гц), 8,19 (1H, д, J=1,8 Гц), 8,12 (1H, с), 7,98 (1H, д, J=9,2 Гц), 7,75 (1H, дд, J=6,7, 2,4 Гц), 7,55-7,46 (2H, м), 4,88-4,83 (1H, м), 4,32 (1H, дд, J=12,8, 4,3 Гц), 4,05 (1H, дд, J=12,8, 7,6 Гц), 1,60 (3H, д, J=6,1 Гц).
[0175]
Примеры 4-9
Соединения соответствующих справочных примеров обрабатывают в соответствии с методикой примера 3 с получением соединений примеров 4-9, которые показаны в представленной ниже таблице.
[0176]
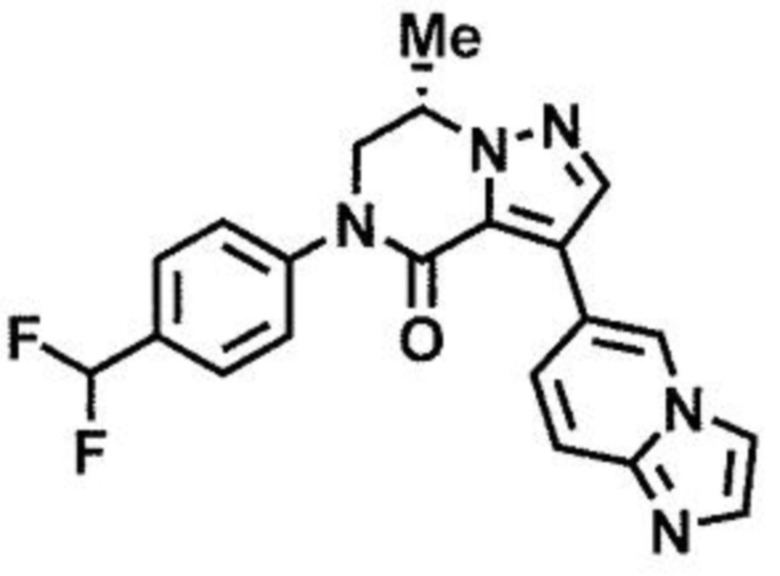
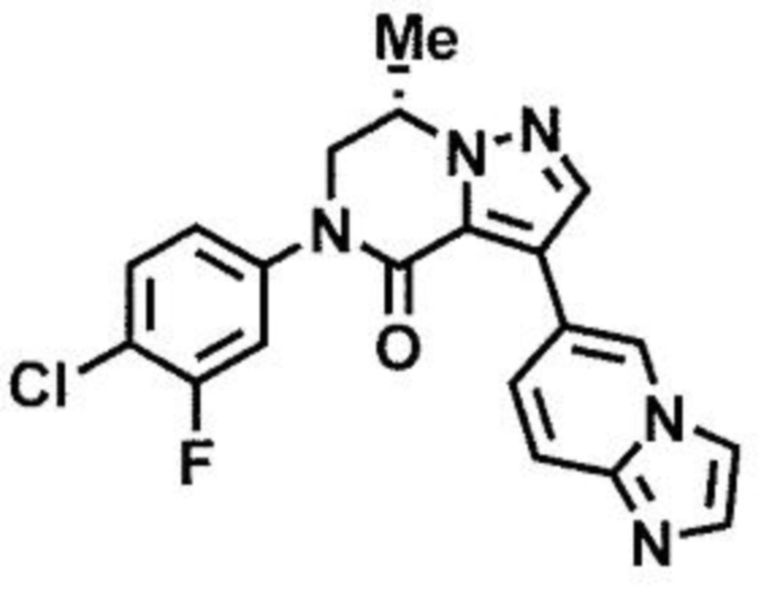
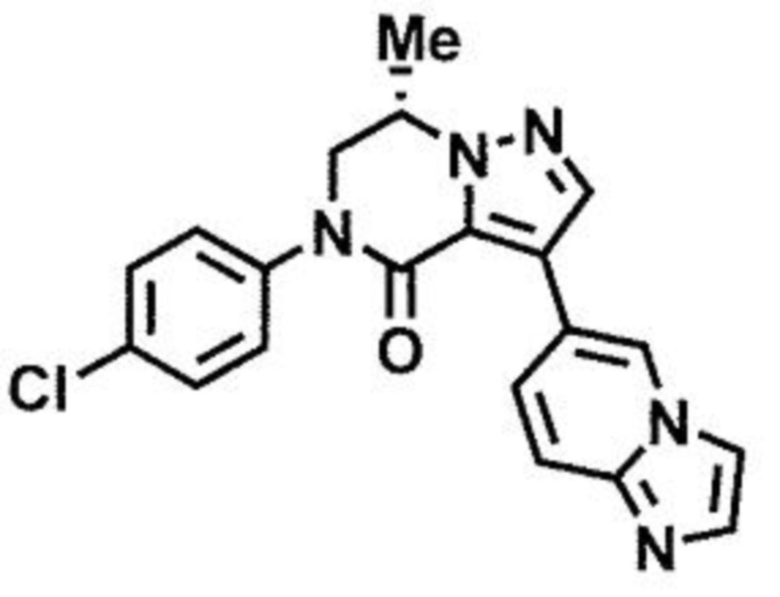
ЖХ-МС, m/z; 384[M+H]+, Rt: 1,558 мин.
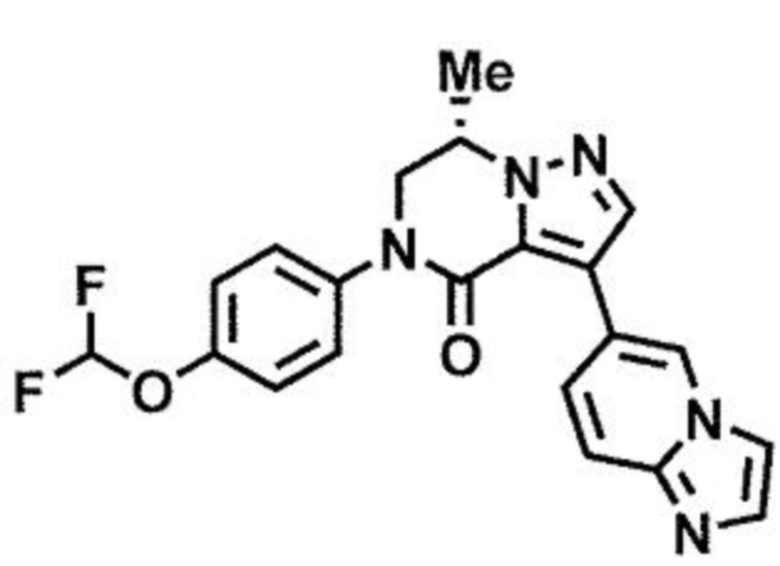
[0177]
Химические названия соединений примеров с 4 по 9 представлены ниже.
Пример 4: (7S)-5-[4-(дифторметил)фенил]-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
Пример 5: (7S)-5-(4-хлор-3-фторфенил)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
Пример 6: (7S)-5-(4-хлорфенил)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
Пример 7: (7S)-5-(5-хлортиофен-2-ил)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
Пример 8: (7S)-5-(2,2-дифтор-1,3-бензодиоксол-5-ил)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
Пример 9: (7S)-5-[4-(дифторметокси)фенил]-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
[0178]
Пример 10: (7S)-3-(2-аминоимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
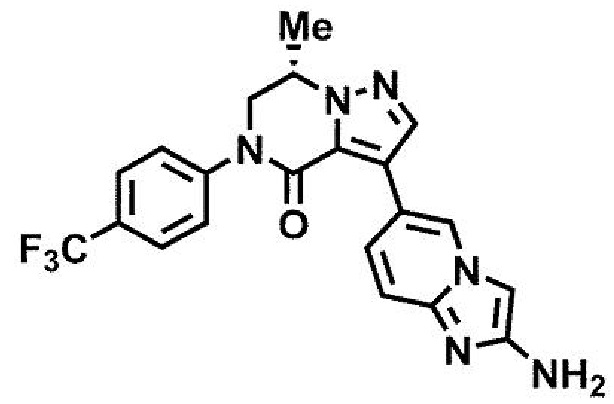
Смесь 6-бромимидазо[1,2-a]пиридин-2-амина (299 мг), соединения справочного примера 8 (318,9 мг), ацетата палладия (21,1 мг), X-phos (90,0 мг) и карбоната калия (260 мг) в ДМФА (2 мл) перемешивают при 105°C в течение 6 часов. Смеси дают охладиться до комнатной температуры и затем смесь разбавляют этилацетатом и фильтруют через целит. К фильтрату добавляют воду и разделяют смесь на слои. Органический слой дважды промывают водой и насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (5,10 мг).
ЖХ-МС, m/z; 427[M+H]+ время удерживания; 0,675 мин.
ВЭЖХ Rt=4,438 мин.
[0179]
Пример 11: (7S)-3-(3-аминоимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
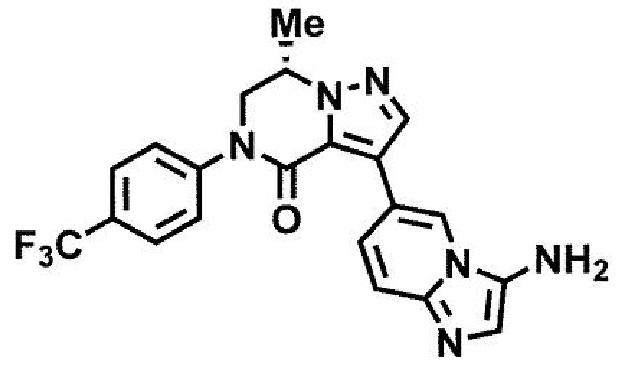
Соединение справочного примера 8 (372 мг) обрабатывают 6-бромимидазо[1,2-a]пиридин-3-амином (302 мг) в соответствии с методикой примера 10 с получением указанного в заголовке соединения (87,5 мг).
1H-ЯМР (400 МГц, CDCl3) δ: 8,64 (1H, д, J=1,8 Гц), 7,79 (1H, с), 7,68 (2H, д, J=8,5 Гц), 7,49-7,46 (3H, м), 7,33 (1H, дд, J=9,2, 1,8 Гц), 7,16 (1H, с), 4,79-4,73 (1H, м), 4,26 (1H, дд, J=12,8, 4,3 Гц), 3,98 (1H, дд, J=12,8, 7,3 Гц), 3,25 (2H, уш.с), 1,73 (3H, д, J=6,7 Гц).
[0180]
Пример 12: (7S)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-5-[5-(трифторметил)пиридин-2-yl]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
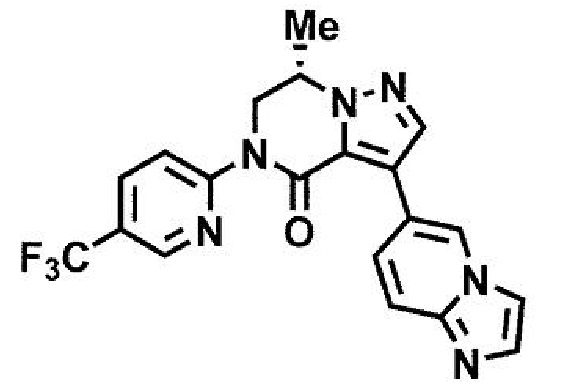
Смесь 2-хлор-5-(трифторметил)пиридин (345 мг), соединения справочного примера 7 (339 мг), тетракис(трифенилфосфин)палладия (0) (147 мг), карбоната цезия (826 мг) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (147 мг) в 1,4-диоксане (3 мл) кипятят с обратным холодильником при перемешивании в течение 5 часов. Смеси дают охладиться до комнатной температуры, затем разбавляют этилацетатом и фильтруют через целит. К фильтрату добавляют насыщенный водный раствор хлорида аммония и разделяют смесь на слои. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (414,9 мг).
ЖХ-МС, m/z; 427[M+H]+ время удерживания; 0,675 мин.
1H-ЯМР (400 МГц, CDCl3) δ: 8,71 (2H, дд, J=11,0, 1,8 Гц), 8,21 (1H, д, J=9,2 Гц), 7,93 (1H, дд, J=8,9, 2,1 Гц), 7,77 (1H, с), 7,63-7,60 (3H, м), 7,40 (1H, дд, J=9,2, 1,8 Гц), 4,76-4,69 (2H, м), 4,39-4,34 (1H, м), 1,72 (3H, д, J=6,7 Гц).
[0181]
Пример 13: (7S)-3-(3-фторимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
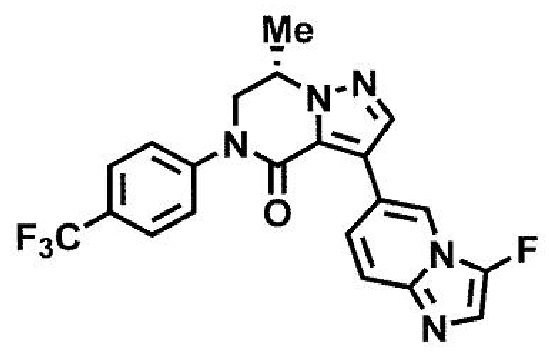
Смесь соединения примера 1 (544 мг) и 1-фтор-4-метил-1,4-диазониабицикло[2,2,2]октанбис(тетрафторборат) (634 мг) в ацетонитриле(6 мл) перемешивают при комнатной температуре в течение 6 часов. К реакционной смеси добавляют насыщенный водный раствор тиосульфата натрия и экстрагируют смесь этилацетатом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (21,8 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 8,85 (1H, с), 8,11 (1H, с), 7,82 (2H, д, J=8,5 Гц), 7,68 (2H, д, J=8,5 Гц), 7,60 (1H, дд, J=9,8, 1,8 Гц), 7,52-7,51 (1H, м), 7,35 (1H, д, J=7,3 Гц), 4,85-4,83 (1H, м), 4,37 (1H, дд, J=12,8, 4,3 Гц), 4,09 (1H, дд, J=12,8, 7,3 Гц), 1,59 (3H, д, J=6,1 Гц).
[0182]
Пример 14: (7S)-7-метил-3-(3-метилимидазо[1,2-a]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
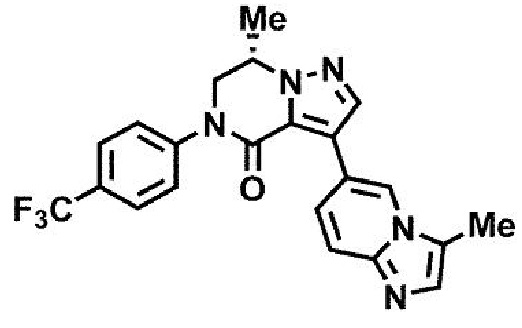
Смесь соединения справочного примера 13 (219 мг), метилбороновой кислоты (73,2 мг), тетракис(трифенилфосфин)палладия (0) (47,1 мг) и гидроксида натрия (48,9 мг) в 1,2-диметоксиэтане (2 мл и воде (1 мл) кипятят с обратным холодильником при перемешивании в течение 4 часов. Смеси дают охладиться до комнатной температуры, затем разбавляют хлороформ и фильтруют через целит. К фильтрату добавляют насыщенный водный раствор гидрокарбоната натрия и разделяют смесь на слои. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (20,3 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 8,75 (1H, с), 8,07 (1H, с), 7,82 (2H, д, J=7,9 Гц), 7,68 (2H, д, J=7,9 Гц), 7,54-7,52 (2H, м), 7,35 (1H, с), 4,84-4,83 (1H, м), 4,39-4,38 (1H, м), 4,09 (1H, дд, J=12,2, 7,9 Гц), 2,43 (3H, с), 1,59 (3H, д, J=6,1 Гц).
[0183]
Пример 15: (7S)-3-(3-этилимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
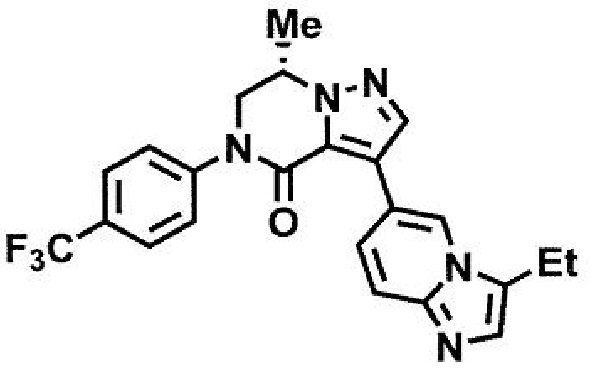
Смесь соединения справочного примера 14 (87 мг) и 10% палладия на угле (166 мг) в метаноле (7 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 3 часов. Реакционную смесь фильтруют через целит и концентрируют фильтрат при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (46,9 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 8,81 (1H, с), 8,07 (1H, с), 7,82 (2H, д, J=8,5 Гц), 7,68 (2H, д, J=8,5 Гц), 7,56-7,50 (2H, м), 7,36 (1H, с), 4,84-4,82 (1H, м), 4,38 (1H, дд, J=12,8, 4,3 Гц), 4,08 (1H, дд, J=12,8, 7,3 Гц), 2,83 (2H, кв, J=7,5 Гц), 1,59 (3H, д, J=6,7 Гц), 1,30 (3H, т, J=7,5 Гц).
[0184]
Пример 16: (7S)-7-метил-3-(3-пропилимидазо[1,2-a]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
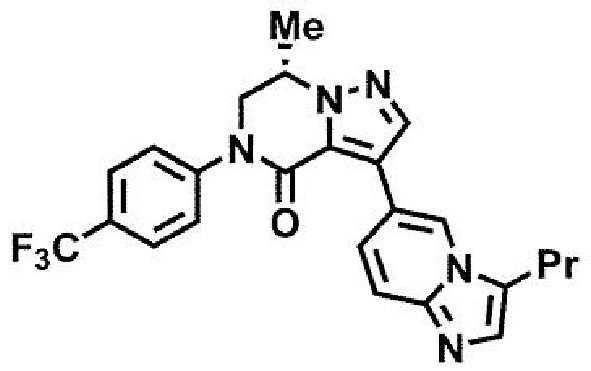
Соединение справочного примера 15 (114,1 мг) обрабатывают в соответствии с методикой примера 15 с получением указанного в заголовке соединения (66,7 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 8,81 (1H, с), 8,06 (1H, с), 7,81 (2H, д, J=8,5 Гц), 7,68 (2H, д, J=8,5 Гц), 7,52 (2H, с), 7,36 (1H, с), 4,85-4,81 (1H, м), 4,37 (1H, дд, J=13,1, 4,0 Гц), 4,08 (1H, дд, J=13,1, 7,6 Гц), 2,82 (2H, t, J=7,3 Гц), 1,74-1,66 (2H, м), 1,59 (3H, д, J=6,7 Гц), 0,95 (3H, т, J=7,3 Гц).
[0185]
Пример 17: (7S)-5-(4-фтор-3-метилфенил)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
Смесь соединения справочного примера 17 (161,8 мг), соединения справочного примера 6 (109 мг), ацетата палладия (9,4 мг), S-phos (34,5 мг) и карбоната калия (116 мг) в смеси 1,2-диметоксиэтан (1,4 мл)/вода (0,7 мл) кипятят с обратным холодильником при перемешивании в течение 2 часов. Смеси дают охладиться до комнатной температуры, затем разбавляют этилацетатом и фильтруют через целит. К фильтрату добавляют насыщенный водный раствор гидрокарбоната натрия и разделяют смесь на слои. Органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (109 мг).
1H-ЯМР (400 МГц, CDCl3) δ: 9,01 (1H, с), 7,80 (1H, с), 7,62-7,57 (3H, м), 7,46 (1H, дд, J=9,6, 1,4 Гц), 7,17-7,16 (1H, м), 7,10-7,07 (2H, м), 4,77-4,73 (1H, м), 4,19 (1H, дд, J=12,8, 4,1 Гц), 3,89 (1H, дд, J=12,8, 7,3 Гц), 2,28 (3H, д, J=1,8 Гц), 1,72 (3H, д, J=6,4 Гц).
[0186]
Пример 18: (7S)-3-(3-фторимидазо[1,2-a]пиридин-6-ил)-5-(4-фтор-3-метилфенил)-7-метил-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
Соединение примера 17 (81,4 мг) обрабатывают в соответствии с методикой примера 13 с получением указанного в заголовке соединения (4,2 мг).
1H-ЯМР (400 МГц, CDCl3) δ: 9,01 (1H, с), 8,12 (1H, д, J=9,8 Гц), 7,86 (1H, д, J=9,2 Гц), 7,80 (1H, с), 7,43 (1H, д, J=6,1 Гц), 7,11-7,00 (3H, м), 4,75-4,74 (1H, м), 4,17 (1H, дд, J=12,8, 4,3 Гц), 3,87 (1H, дд, J=12,8, 7,0 Гц), 2,24 (3H, д, J=1,8 Гц), 1,70 (3H, д, J=6,1 Гц).
[0187]
Пример 19: (7S)-5-(4-фтор-3-метилфенил)-7-метил-3-(3-метилимидазо[1,2-a]пиридин-6-ил)-6,7-дигидропиразоло[1,5-a]пиразин-4(5Н)-он
К смеси соединения справочного примера 18 (30,0 мг) и бис-(три-трет-бутилфосфин)палладия (0) (6,12 мг) в ТГФ (1,2 мл) добавляют хлорид метилцинка (59,8 мкл, 2,0 M раствор в ТГФ) и перемешивают смесь при комнатной температуре в течение 5 часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом два раза. Органические слои объединяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на аминосиликагеле (гексан/этилацетат) с получением указанного в заголовке соединения (16 мг).
1H-ЯМР (400 МГц, CDCl3) δ: 9,14 (1H, с), 8,18 (1H, д, J=9,1 Гц), 7,90 (1H, д, J=9,1 Гц), 7,83 (1H, с), 7,55 (1H, с), 7,11-7,00 (3H, м), 4,76-4,74 (1H, м), 4,17 (1H, дд, J=12,8, 4,1 Гц), 3,86 (1H, дд, J=12,8, 7,1 Гц), 2,52 (3H, с), 2,24 (3H, д, J=1,8 Гц), 1,70 (3H, д, J=6,4 Гц).
[0188]
Биологические испытания
Далее описаны методы фармакологических испытаний соединений по настоящему изобретению и полученные результаты, но настоящее изобретение не предназначено для ограничения этими испытаниями.
[0189]
Тест 1: Оценка с использованием клеток, стабильно экспрессирующих mGlu2 рецептор человека
(1) Клетки, стабильно экспрессирующие рецептор mGlu2 человека, получают и используют для инкубации. В частности, ген mGlu2 рецептора человека вставляют в pcDNA4/TO (K1020-01, Lifetechnologies, Carlsbad, CA, USA) и вводят в TR-экспрессированные клетки HEK, полученные из почки человека (cat#CCL-82.2, ATCC, USA), с последующим скринингом с помощью генетицина (cat#10131-027, Lifetechnologies, Carlsbad, CA, USA) для получения клеток, стабильно экспрессирующих mGlu2 receptor человека.
DMEM с высоким содержанием глюкозы (cat#11995-065, Life technologies, Carlsbad, CA, USA), содержащую 10% Dialysed-FBS (cat#26400-044, Life technologies, Carlsbad, CA, USA), 50 мкг/мл бластицидина S (cat#ANT-BL-1, Life technologies, Carlsbad, CA, USA) и 2 мг/мл G418 (cat#16513-84, nacalai tesque, Kyoto, Japan) используют для инкубации на колбах для клеточной культуры (cat#3133-150, AGC Thechno Glass, Shizuoka, Japan). В процессе инкубации клетки выделяют обработкой с TrypLE Express (cat#12604-013, Life technologies, Carlsbad, CA, USA) с последующей обработкой субкультурой каждые три - четыре дня.
Клетки выделяют с помощью примерно 80% конфлюентности при обработке TrypLE Express через три- четыре дня после субкультуры, временно трансфицированной Gα16, апоэкворин, в смеси среда Хенкса (cat#14065-056, Life technologies, Carlsbad, CA, USA)/20 моль/л HEPES (cat#15630-080, Life technologies, Carlsbad, CA, USA) буфер (pH 7,4), содержащий 0,1% BSA (cat#12604-013, Life technologies, Carlsbad, CA, USA) и 0,1 мкг/мл тетрациклина (cat#33031-64, nacalai tesque, Kyoto, Japan), и затем высевают на 384-луночный планшет (cat#781090, Greiner bio-one, Frickenhausen, Germany) с плотностью 1500 клеток/30 мкл/лунка.
На следующей день после высева в планшет добавляют коэлентразин h (cat#S2011, Promega, Madison, WI, USA) (10 мкл/лунка) так, чтобы конечная концентрация составляла 1 мкмоль/л и оставляют на 4 часа или более при комнатной температуре после центрифугирования.
(2) Получение препарата тестируемого соединения
Тестируемое соединение растворяют в ДМСО так, что концентрация в 1000 раз превышает тестируемую концентрацию. Полученный раствор в ДМСО разбавляют средой (Hanks, 20 ммоль/л HEPES, 0,1% BSA) до концентрации, в 6 раз превышающей тестируемую концентрацию. Глутамат разбавляют смесью среда Хэнкса/20 ммоль/л HEPES/0,1% BSA до концентрации, в 6 раз превышающей EC80 концентрацию.
(3) Оценка отрицательной аллостерической модуляторной активности в отношении рецептора mGlu2 человека
Клетки, стабильно экспрессирующие mGlu2 рецептор человека получают и инкубируют. Люминисцентные сигналы стимулирования рецептора mGlu2 обнаруживают с помощью FDSS7000 (Hamamatsu Photonics). Раствор соединения, приготовленный, как описано выше, добавляют на планшет, куда добавляют клетки и люминисцентные субстраты (10 мкл/лунка). Спустя 120 секунд после добавления, добавляют раствор, содержащий EC80 глутамата (10 мкл/лунка) и измеряют люминесцентные сигналы в течение 300 секунд после добавления (средняя длина волны: 465 нм) для расчета RLU (Integration). Отрицательную аллостерическую модуляторную активность в отношении mGlu2 рецептора соединения вычисляют по формуле (100-100 × (RLU каждого соединения и заданной концентрации)/(RLU ДМСО-группы)).
Соединения по настоящему изобретению оценивают с помощью описанного выше теста, и выявлены соединения с отрицательной аллостерической модуляторной активностью в отношении Glu2 рецептора. Отрицательная аллостерическая модуляторная активность каждого соединения в отношении mGlu2 рецептора (значение IC50 (нмоль/л)) представлена в приведенной далее таблице.
или степень ингибирования (%)
(4) Оценка зависимой от времени отрицательной аллостерической модуляторной активности в отношении mGlu2 рецептора
Получают клетки, стабильно экспрессирующие mGlu2 рецептор человека, и инкубируют их. Люминесцентные сигналы стимуляции mGlu2 рецептора визуализируют с помощью FDSS7000 (Hamamatsu Photonics). Раствор тестируемого соединения, полученный, как описано выше (2), добавляют на планшет, куда затем добавляют клетки и люминесцентные субстраты (10 мкл/лунка). Спустя 2, 15, 30, 60 и 120 минут добавляют раствор, содержащий EC80 глютамата (10 мкл/лунка) и в течение 300 секунд измеряют люминесцентные сигналы (средняя длина волны: 465 нм) для вычисления RLU (Integration). Отрицательную аллостерическую модуляторную активность соединения в отношении mGlu2 рецептора в каждый момент времени после добавления рассчитывают по формуле (100-100 × (RLU каждого соединения и концентрации)/(RLU ДМСО-группы)).
[0190]
Тест 2: Тест принудительного плавания крыс
Существующие антидепрессанты, такие как трициклические антидепрессанты и ингибиторы обратного захвата серотонина, как известно, сокращают время неподвижности в тесте принудителного плавания у крыс. Эта тест-система используется для оценки антидепрессантного действия соединения по настоящему изобретению на основе времени неподвижности.
Для теста принудительного плавания используют самцов крыс возраста 7 недель. В частности, животных помещают в аквариум, наполненный 5,8 л водопроводной воды (температура воды 25 ± 1°C), а затем животных заставляют плавать в течение 15 минут (тренировка плавания). После тренировки плавания животных вытирают насухо и возвращают в домашнюю клетку. На следующий день после тренировки плавания проводят тест принудительного плавания в течение 5 минут так же, как проводилась тренировка по плаванию. Поведение при плавании каждого животного фиксируют на видеокамеру через боковую сторону резервуара. После теста на плавание животных вытирают насухо и возвращают в домашнюю клетку. Тестируемое соединение или положительный контроль, имипрамин, суспендируют в 0,5% растворе метилцеллюлозы для перорального введения. Разбавитель или тестируемое соединение вводят через 15 минут после окончания тренировки по плавании и за 2 часа перед тестом принудительного плавания. Имипрамин вводят через 15 минут после окончания тренировки по плаванию и за 1 час до теста принудительного плавания. Неподвижность определяют как состояние, при котором животное плавает без движения передних лап и туловища в аквариуме, а совокупное время неподвижности во время 5-минутного теста плавания изменяют как время неподвижности особи. Для статистической обработки используют t-критерий Стьюдента и множественное сравнение Даннета.
(4) Оценка зависимой от времени отрицательной аллостерической модуляторной активности в отношении mGlu2 рецептора
Получают клетки, стабильно экспрессирующие mGlu2 рецептор человека, и инкубируют их. Люминесцентные сигналы стимуляции mGlu2 рецептора визуализируют с помощью FDSS7000 (Hamamatsu Photonics). Раствор тстируемого соединения, полученный как описано выше (2), добавляют на планшет, куда добавляют клетки и люминисцентные субстраты (10 мкл/лунка). Через 2, 15, 30, 60 и 120 минут после добавления добавляют раствор, содержащий EC80 глютамата (10 мкл/лунка), и в течение 300 секунд изменяют люминесцентные сигналы (средняя длина волны: 465 нм) для вычисления RLU (Integration). Отрицательную аллостерическую модуляторную активность в отношении mGlu2 рецептора соединения в каждый момент времени после добавления рассчитывают по формуле (100-100 × (RLU каждого соединения и концентрации)/(RLU ДМСО-группы)).
[0190]
Тест 2: Тест принудительного плавания крыс
Существующие антидепрессанты, такие как трициклические антидепрессанты и ингибиторы обратного захвата серотонина, как известно, сокращают время неподвижности в тесте принудительного плавания у крыс. Эта тест-система используется для оценки антидепрессантного действия соединения по настоящему изобретению на основе времени неподвижности.
Для теста принудительного плавания используют самцов крыс возраста 7 недель. В частности, животных помещают в аквариум, наполненный 5,8 л водопроводной воды (температура воды 25 ± 1°C), а затем животных заставляют плавать в течение 15 минут (тренировка плавания). После тренировки плавания животных вытирают насухо и возвращают в домашнюю клетку. На следующий день после тренировки плавания проводят тест принудительного плавания в течение 5 минут так же, как проводилась тренировка по плаванию. Поведение при плавании каждого животного фиксируют на видеокамеру через боковую сторону резервуара. После теста на плавание животных вытирают насухо и возвращают в домашнюю клетку. Тестируемое соединение или положительный контроль, имипрамин, суспендируют в 0,5% растворе метилцеллюлозы для перорального введения. Разбавитель или тестируемое соединение вводят через 15 минут после окончания тренировки по плаванию и за 2 часа перед тестом принудительного плавания. Имипрамин вводят через 15 минут после окончания тренировки по плаванию и за 1 час до теста принудительного плавания. Неподвижность определяют как состояние, при котором животное плавает без движения передних лап и туловища в аквариуме, а совокупное время неподвижности во время 5-минутного теста плавания изменяют как время неподвижности особи. Для статистической обработки используют t-критерий Стьюдента и множественное сравнение Даннета.
[0191]
Тест 3: Эффект усиления диапазона γ-частот в электрокортикограмме у крыс
Изменения выраженности диапазона γ-частот в электрокортикограмме считают показателем кортикальной активности, и антагонисты mGluR2, NAM или антагонисты NMDA рецепторов (такие как кетамин), как известно, повышают выраженность диапазона γ-частот. В данном тесте оценивают способность соединения по настоящему изобретению повышать выраженность диапазона γ-частот.
Тест проводят в темный период использованием самцов крыс Wistar, который имплантируют электроды для записи электроэнцефалограммы. Соединения суспендируют в 0,5% растворе метилцеллюлозы для перорального введения. Частотный анализ энцефалограммы проводят в соответствии с методом, описанным в Progress in Neuro-Psychopharmacology & Biological Psychiatry 63 (2015) 6-13. Частоту электроэнцефалограммы анализируют в интервале от 0,5 до 80 Гц, и частотный диапазон в интервале от 30 до Гц определяют как γ-частоту для расчета уровня мощности. Изменение мощности измеряют каждый 1 час до истечения 2 часов после введения, принимая в качестве индекса значение до введения за 100%. Ввиду повторных измерений, изменение мощности статистически сравнивают, используя повторные измерения с помощью двухфакторного статистического анализа с последующим апостериорным критерием Даннетта.
[0192]
Тест 4: Оценка MBI и клиренса инактивации фермента в отношении CYP3A4
Цитохром P450 (Cytochrome P450 - далее CYP) представляет собой наиболее важную группу ферментов, связанных с метаболизмом лекарственных средств, и большинство фармакокинетических взаимодействий основано на ингибировании активности CYP. CYP включает множество молекулярных видов. В частности, CYP3A4 наиболее активно участвует в метаболизме лекарственных средств в реакции окисления с CYP и составляет основную часть CYP, присутствующих в печени.
Ингибирование CYP обычно делится на два типа, включающих «обратимое ингибирование» и «необратимое ингибирование (суицидное ингибирование - mechanism-based inhibition: MBI)». В частности, ингибирование CYP на основе MBI, как известно, может вызывать серьезные побочные эффекты, такие как гепатотоксичность, а также взаимодействие между различными лекарственными средствами (Curr. Opin. Drug Discov. Devel. 2010 January, 13(1), 66-77, Therapeutics и Clinical Risk Management, 2005, 1(1), 3-13).
MBI и клиренс ферментной инактивации в отношении CYP3A4 оценивают для соединений представленных выше примеров.
Ингибирующее действие и типы ингибирования тестируемых соединений в отношении CYP3A4 оценивают с использованием микросом печени в качестве источника фермента и мидазолама или тестостерона в качестве субстрата CYP3A4. После метаболического взаимодействия в течение 30 минут при 37°C метаболиты CYP3A4 субстрата в присутствии или в отсутствие тестируемого соединения (в 4 концентрациях) количественно определяют с помощью ЖХ-МС/MС, и степень ингибирования вычисляют из соотношения площадей пиков. Значения IC50 вычисляют из графиков концентраций тестируемых соединений. Известно, что когда тестируемое соединение обладает MBI потенциалом, значение IC50 снижается в результате запуска метаболических реакций после преинкубации в присутствии NADPH (кофактор). Таким образом установлено, что существует потенциал MBI, при котором значения IC50 после предварительной инкубации изменяются в 2 раза или более (Xenobiotica, 2009, 39(2), 99-112).
После определения MBI потенциала методом нелинейных наименьших квадратов вычисляют kinact (константу максимальной инактивации) и KI (концентрацию инактиватора, приводящую к инактивации, равной половине максимальной инактивации kinact). Клиренс инактивации фермента вычисляют в соответствии с методом, описанным в Drug Metabolism и Disposition, 2011, 39(7), 1247-1254 CLint=kinact/KI (мл/мин/ммоль) × содержание CYP (пмоль/мг белка)).
Значения MBI и клиренса инактивации фермента в отношении CYP3A4 для каждого соединения примеров, представленных выше, приведены в следующей таблице.
(мкл/мин./мг белка)
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0193]
Как описано выше, соединение по настоящему изобретению проявляет отрицательную аллостерическую модуляцию в отношении метаботропных глутаматных (mGlu) рецепторов II группы. Следовательно, соединение по настоящему изобретению может применяться в качестве терапевтического средства и/или профилактического средства при заболеваниях, в которые вовлечены метаботропные рецепторы глутамата подтипа 2 (mGlu2) и/или метаботропные рецепторы глутамата подтипа 3 (mGlu3).
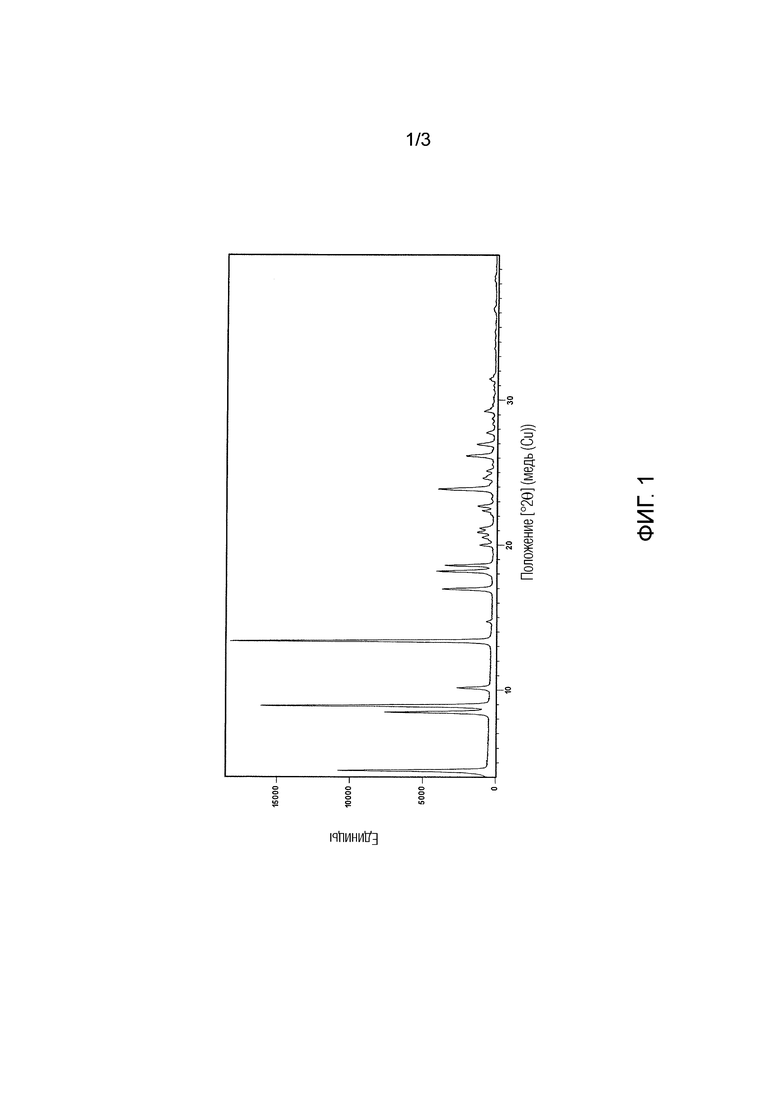
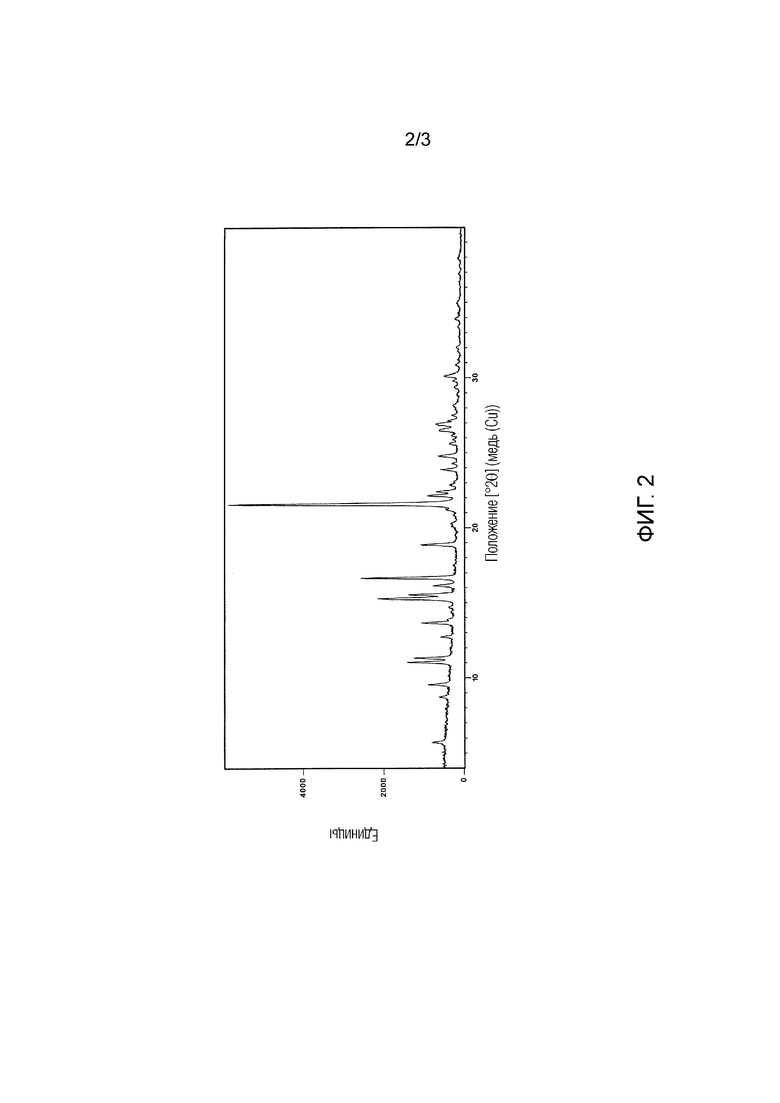
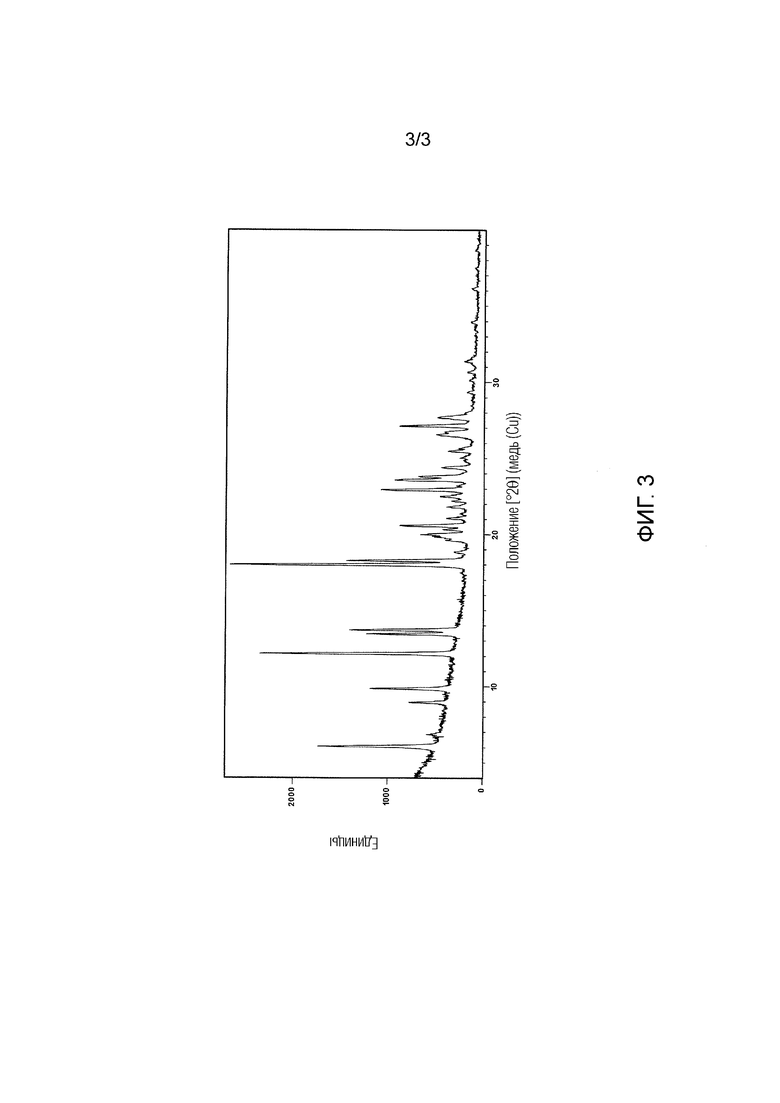
Изобретение относится к соединению формулы (1) или его фармацевтически приемлемой соли. В формуле (1): R1 и R2 независимо представляют атом водорода, атом галогена или C1-4 алкил, где каждый алкил является независимым и может быть необязательно замещен от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси, или, в качестве альтернативы, R1 и R2 вместе с атом углерода, к которому они присоединены, образуют циклопропановое кольцо или циклобутановое кольцо; кольцо А представляет С6-10 ароматическую карбоциклильную группу, 4-10-членную насыщенную гетероциклильную группу или 5-10-членную ароматическую гетероциклильную группу, где гетероциклильная группа включает одинаковые или разные гетероатомы, выбранные из группы, состоящей из атома кислорода, атома азота и атома серы; R3 и R4 независимо представляют атом водорода, атом галогена, C1-6 алкил, C1-4 алкокси или C2-4 алкенил, где алкил и алкокси являются независимыми и они могут быть необязательно замещены от 1 до 5 одинаковыми или разными атомами галогенов; R5 и R6 независимо представляют атом водорода, атом галогена, C1-6 алкил, C1-6 алкокси, где каждый алкил и алкокси являются независимыми и они могут быть необязательно замещены от 1 до 5 одинаковыми или разными атомами галогенов, C3-6 насыщенную карбоциклильную группу или -NRaRb; Ra и Rb независимо, и когда присутствует несколько NRaRb, каждая из групп Ra или групп Rb независимо, представляет атом водорода, C1-4 алкил, где каждый алкил является независимым и он может быть необязательно замещен от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, или, в качестве альтернативы, Ra и Rb вместе с атом азота, к которому они присоединены, могут образовывать 4-6-членную азотсодержащую насыщенную гетероциклильную группу, где азотсодержащая насыщенная гетероциклильная группа может быть необязательно замещена от 1 до 5 одинаковыми или разными атомами галогенов; Х представляет атом азота или -CRe-; и Re представляет атом водорода, атом галогена или C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов. Также предложены фармацевтическая композиция, терапевтическое и/или профилактическое средство, применение соединения формулы (1), способ лечения и/или предотвращения заболевания и способы получения соединения формулы (1а). Предложенное соединение может применяться для предотвращения и/или в качестве лекарственного средства для лечения заболевания, в которое вовлечен mGlu рецептор группы II. 17 н. и 19 з.п. ф-лы, 3 ил., 3 табл., 38 пр.
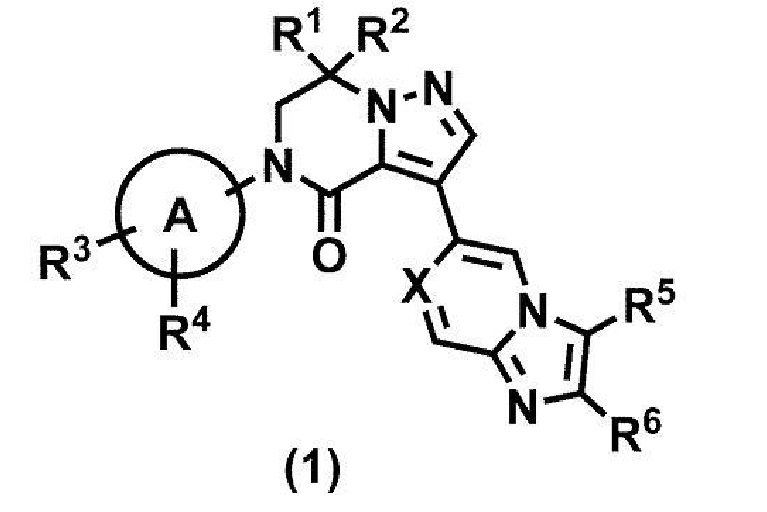
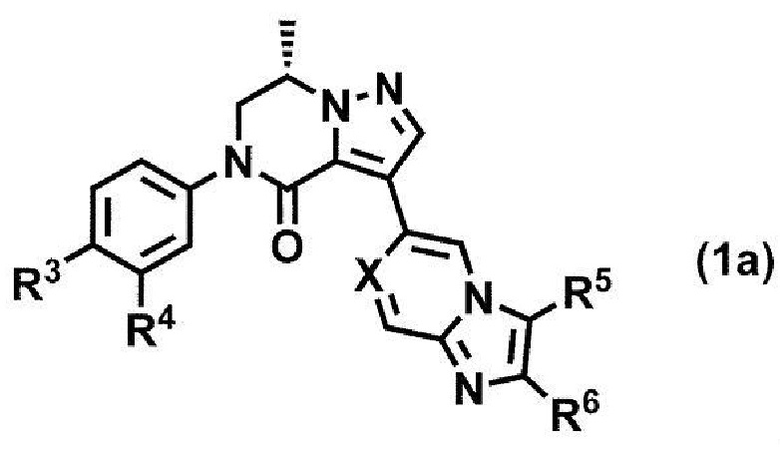
1. Соединение формулы (1):
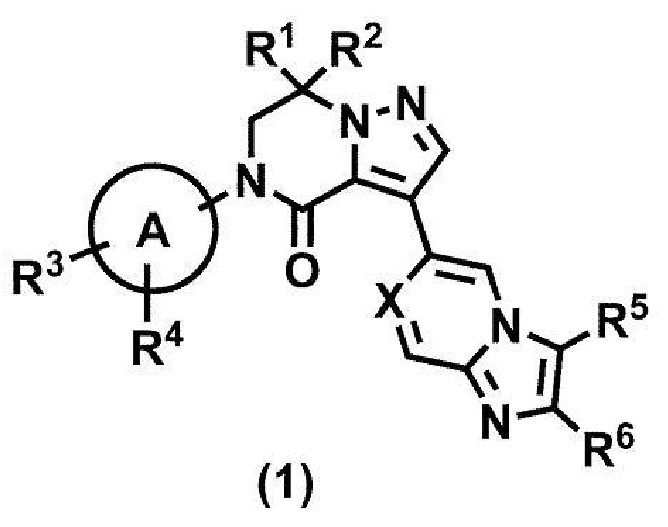
или его фармацевтически приемлемая соль,
где R1 и R2 независимо представляют собой атом водорода, атом галогена или C1-4 алкил, где каждый алкил является независимым и может быть необязательно замещен от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси, или, в качестве альтернативы, R1 и R2 вместе с атом углерода, к которому они присоединены, образуют циклопропановое кольцо или циклобутановое кольцо;
кольцо А представляет собой С6-10 ароматическую карбоциклильную группу, 4-10-членную насыщенную гетероциклильную группу или 5-10-членную ароматическую гетероциклильную группу, где гетероциклильная группа включает одинаковые или разные гетероатомы, выбранные из группы, состоящей из атома кислорода, атома азота и атома серы;
R3 и R4 независимо представляют собой атом водорода, атом галогена, C1-6 алкил, C1-4 алкокси или C2-4 алкенил, где алкил и алкокси являются независимыми и они могут быть необязательно замещены от 1 до 5 одинаковыми или разными атомами галогенов;
R5 и R6 независимо представляют собой атом водорода, атом галогена, C1-6 алкил, C1-6 алкокси, где каждый алкил и алкокси являются независимыми и они могут быть необязательно замещены от 1 до 5 одинаковыми или разными атомами галогенов, C3-6 насыщенную карбоциклильную группу или -NRaRb;
Ra и Rb независимо, и когда присутствует несколько NRaRb, каждая из групп Ra или групп Rb независимо, представляют собой атом водорода, C1-4 алкил, где каждый алкил является независимым и он может быть необязательно замещен от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, или,
в качестве альтернативы, Ra и Rb вместе с атом азота, к которому они присоединены, могут образовывать 4-6-членную азотсодержащую насыщенную гетероциклильную группу, где азотсодержащая насыщенная гетероциклильная группа может быть необязательно замещена от 1 до 5 одинаковыми или разными атомами галогенов;
Х представляет собой атом азота или -CRe-; и
Re представляет собой атом водорода, атом галогена или C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 и R2 независимо представляют собой атом водорода или C1-4 алкил, где алкил может быть необязательно замещен от 1 до 5 одинаковыми или разными заместителями, выбранными из группы, состоящей из атома галогена, гидроксильной группы и C1-4 алкокси.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где кольцо A представляет собой бензол, нафталин, пиридин, пиримидин, пиразин, тиофен, тиазол, изотиазол, оксазол, изоксазол, хинолин, изохинолин, бензотиофен, бензофуран, индолизин, имидазопиридин, 1,3-бензодиоксол, хроман, 2,3-дигидробензофуран, 1,3-дигидроизобензофуран, 2,3-дигидро-1Н-инден или 2,3-дигидро-1Н-инден-1-он.
4. Соединение по любому из пп. с 1 по 3 или его фармацевтически приемлемая соль, где R3 и R4 независимо представляют собой
(1) атом водорода,
(2) атом галогена,
(3) C1-4 алкил, необязательно замещенный от 1 до 5 одинаковыми или разными атомами галогенов, или
(4) С1-4 алкоксигруппу, необязательно замещенную от 1 до 5 одинаковыми или разными атомами галогенов.
5. Соединение по любому из пп. с 1 по 4 или его фармацевтически приемлемая соль, где R5 и R6 независимо представляют собой
(1) атом водорода,
(2) атом галогена,
(3) C1-4 алкил, где алкил может быть необязательно замещен от 1 до 5 одинаковыми или разными атомами галогенов,
(4) C1-4 алкокси, где алкоксигруппа может быть необязательно замещена от 1 до 5 одинаковыми или разными атомами галогенов, или
(5) -NRaRb.
6. Соединение по любому из пп. с 1 по 5 или его фармацевтически приемлемая соль, где Ra и Rb независимо, и когда присутствует несколько NRaRb, каждая из групп Ra или групп Rb независимо, представляют собой атом водорода или C1-4 алкил, где каждая алкильная группа является независимой и она может быть необязательно замещена от 1 до 5 одинаковыми или разными атомами галогенов.
7. Соединение по любому из пп. с 1 по 6 или его фармацевтически приемлемая соль, где Re представляет собой атом водорода или атом галогена.
8. Соединение по любому из пп. 1, 3-7, или его фармацевтически приемлемая соль, где R1 и R2 независимо представляют собой атом водорода, метил, этил, изопропил, метоксиметил, гидроксиметил, дифторметил или трифторметил.
9. Соединение по любому из пп. с 1 по 8 или его фармацевтически приемлемая соль, где кольцо А представляет собой бензол, тиофен, пиридин, хинолин или 1,3-бензодиоксол.
10. Соединение по любому из пп. с 1 по 9 или его фармацевтически приемлемая соль, где Ra и Rb независимо, и когда присутствует несколько NRaRb, каждая из групп Ra или групп Rb независимо, представляют собой атом водорода или C1-4 алкил, где алкильная группа может быть необязательно замещена от 1 до 3 одинаковыми или разными атомами галогенов.
11. Соединение по любому из пп. с 1 по 10 или его фармацевтически приемлемая соль, где Re представляет собой атом водорода или атом фтора.
12. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 представляет собой метил;
R2 представляет собой атом водорода;
фрагмент 6,7-дигидропиразоло[1,5-а]пиразин-4(5Н)-он имеет S-конфигурацию в 7 положении;
кольцо А представляет собой бензол;
R3 и R4 независимо представляют собой атом водорода, фтор, хлор, дифторметил, трифторметил или дифторметокси;
R5 и R6 независимо представляют собой атом водорода или -NH2; и
Х представляет собой атом азота или -CH-.
13. Соединение по п.1 или фармацевтически его приемлемая соль, выбранное из следующих соединений:
(7S)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-3-(имидазо[1,2-а]пиразин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-5-[3-хлор-4-фторфенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-5-[4-(дифторметил)фенил]-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-5-(4-хлор-3-фторфенил)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-5-(4-хлорфенил)-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-5-[4-(дифторметокси)фенил]-3-(имидазо[1,2-а]пиридин-6-ил)-7-метил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он; и
(7S)-3-(3-аминоимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он.
14. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из следующий соединений:
(7S)-3-(3-фторимидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-7-метил-3-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
(7S)-3-(3-этилимидазо[1,2-а]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он; и
(7S)-7-метил-3-(3-пропилимидазо[1,2-a]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он.
15. Соединение, представляющее собой (7S)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5H)-он
или его фармацевтически приемлемую соль.
16. Соединение, представляющее собой
(7S)-3-(имидазо[1,2-a]пиридин-6-ил)-7-метил-5-[3-хлор-4-фторфенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5H)-он;
или его фармацевтически приемлемую соль.
17. Соединение, представляющее собой
(7S)-3-(3-фторимидазо[1,2-a]пиридин-6-ил)-7-метил-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5H)-он;
или его фармацевтически приемлемую соль.
18. Соединение, представляющее собой
(7S)-7-метил-3-(3-метилимидазо[1,2-a]пиридин-6-ил)-5-[4-(трифторметил)фенил]-6,7-дигидропиразоло[1,5-a]пиразин-4(5H)-он,
или его фармацевтически приемлемую соль.
19. Фармацевтическая композиция для лечения и/или профилактики заболевания, в которое вовлечен рецептор mGlu группы II, включающая соединение по любому из пп. с 1 по 18 или его фармацевтически приемлемую соль.
20. Терапевтическое средство и/или профилактическое средство для заболевания, в которое вовлечен рецептор mGlu группы II, включающее соединение по любому из пп. с 1 по 18 или его фармацевтически приемлемую соль в качестве активного ингредиента.
21. Применение соединения по любому из пп. с 1 по 18 или его фармацевтически приемлемой соли в производстве терапевтического средства и/или профилактического средства для лечения и/или профилактики заболевания, в которое вовлечен рецептор mGlu группы II.
22. Применение по п.21, где рецептор mGlu группы II представляет собой метаботропный рецептор глутамата подтипа 2 (mGluR2).
23. Применение по п. 21 или 22, где заболевание, в которое вовлечен рецептор mGlu группы II, представляет собой психическое заболевание или нейродегенеративное заболевание.
24. Применение по п.23, где психическое заболевание или нейродегенеративное заболевание представляет собой депрессивный эпизод тяжелой степени, депрессивное расстройство, биполярное и связанные с ним расстройства, тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, острое стрессовое расстройство, шизофрению, расстройства аутического спектра, болезнь Альцгеймера, когнитивную дисфункцию, деменцию, лекарственную зависимость, ожирение, судороги, тремор, боль или расстройство сна.
25. Применение соединения по любому из пп. с 1 по 18 или его фармацевтически приемлемой соли в производстве терапевтического средства и/или профилактического средства для лечения и/или профилактики заболевания, в которое вовлечен рецептор mGlu группы II, где заболевание представляет собой депрессивный эпизод тяжелой степени, депрессивное расстройство, биполярное и связанные с ним расстройства, тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивного расстройство, острое стрессовое расстройство, шизофрению, расстройство аутического спектра, болезнь Альцгеймера, когнитивную дисфункцию, деменцию, лекарственную зависимость, ожирение, судороги, тремор, боль или расстройство сна.
26. Применение соединения по любому из пп. с 1 по 18 или его фармацевтически приемлемой соли при лечении и/или профилактике заболевания, в которое вовлечен рецептор mGlu группы II.
27. Способ лечения и/или предотвращения заболевания, в которое вовлечен рецептор mGlu группы II, включающий введение терапевтически эффективного количества соединения по любому из пп. с 1 по 18 или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом.
28. Способ по п.27, где рецептор mGlu группы II представляет собой метаботропный рецептор глутамата подтипа 2 (mGluR2).
29. Способ по п. 27 или 28, где заболевание, в которое вовлечен рецептор mGlu группы II, представляет собой психическое заболевание или нейродегенеративное заболевание.
30. Способ по п.29, где психическое заболевание или нейродегенеративное заболевание представляет собой депрессивный эпизод тяжелой степени, депрессивное расстройство, биполярное и связанные с ним расстройства, тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, острое стрессовое расстройство, шизофрению, расстройства аутического спектра, болезнь Альцгеймера, когнитивную дисфункцию, деменцию, лекарственную зависимость, ожирение, судороги, тремор, боль или расстройство сна.
31. Применение соединения по любому из пп. с 1 по 18 или его фармацевтически приемлемой соли в производстве терапевтического средства и/или профилактического средства для лечения и/или профилактики заболевания, в которое вовлечен рецептор mGlu группы II, где терапевтическое средство и/или профилактическое средство включает соединение по любому из пп. 1-18 или его фармацевтически приемлемая соль, и одно или несколько лекарственных средств, выбранных из терапевтических агентов для лечения депрессивных эпизодов тяжелой степени, депрессивных расстройств, биполярных расстройств, тревожного расстройства, посттравматического стрессового расстройства, обсессивно-компульсивного расстройства, острого стрессового расстройства, шизофрении, расстройства аутического спектра, болезни Альцгеймера, когнитивной дисфункции, деменции, лекарственной зависимости, ожирения, судорог, тремора, боли или расстройства сна.
32. Лекарственное средство для лечения и/или предотвращения заболевания, в которое вовлечен рецептор mGlu группы II, содержащее соединение по любому из пп. с 1 по 18 или его фармацевтически приемлемую соль, и одно или несколько лекарственных средств для депрессивного эпизода тяжелой степени, депрессивного расстройства, биполярного и связанных с ним расстройств, тревожного расстройства, посттравматического стрессового расстройства, обсессивно-компульсивного расстройства, острого стрессового расстройства, шизофрении, расстройств аутического спектра, болезни Альцгеймера, когнитивной дисфункции, деменции, лекарственной зависимости, ожирения, судорог, тремора, боли или расстройства сна.
33. Способ лечения заболевания, в которое вовлечен рецептор mGlu группы II, включающий введение пациенту, нуждающемуся в этом терапевтически эффективного количества соединения по любому из пп. с 1 по 18 или его фармацевтически приемлемой соли в комбинации с одним или несколькими лекарственными средствами, выбранными из терапевтических агентов для лечения депрессивных эпизодов тяжелой степени, депрессивных расстройств, биполярных расстройств, тревожного расстройства, посттравматического стрессового расстройства, обсессивно-компульсивного расстройства, острого стрессового расстройства, шизофрении, расстройства аутического спектра, болезни Альцгеймера, когнитивной дисфункции, деменции, лекарственной зависимости, ожирения, судорог, тремора, боли или расстройства сна.
34. Способ лечения заболевания, в которое вовлечен рецептор mGlu группы II, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп. с 1 по 18 или его фармацевтически приемлемой соли в комбинации с одним или несколькими нейролептическими лекарственными средствами.
35. Способ получения соединения формулы (1a):
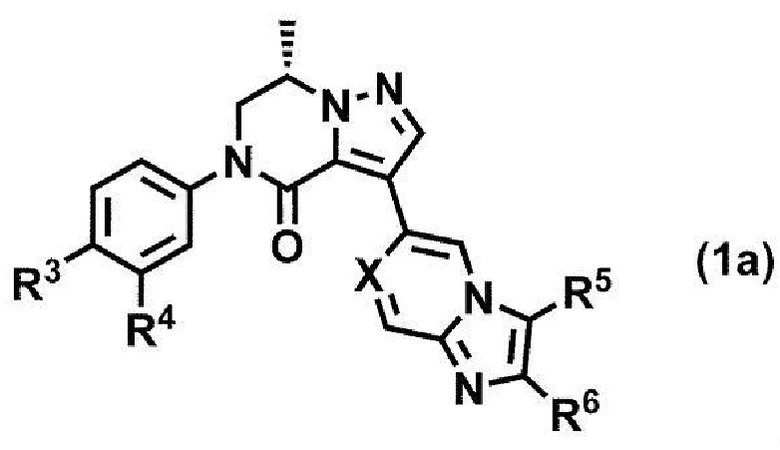
или его фармацевтически приемлемой соли,
где R3 и R4 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или C1-4 алкокси, где каждая алкильная и алкоксигруппа является независимой и она может быть необязательно замещена от 1 до 5 одинаковыми или разными атомами галогенов;
R5 и R6 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или -NH2; и
X представляет собой атом азота или -CH-,
который включает следующие стадии:
(стадия A1) взаимодействие соединения формулы (4a):
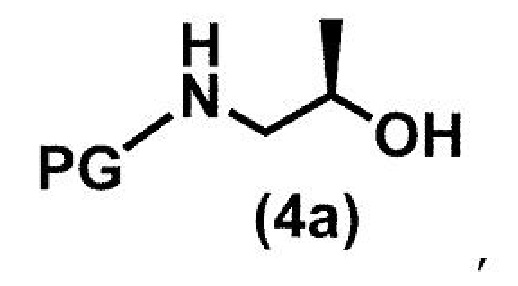
где PG представляет собой защитную группу, такую как трет-бутоксикарбонильная группа и бензилоксикарбонильная группа,
и соединения формулы (3):
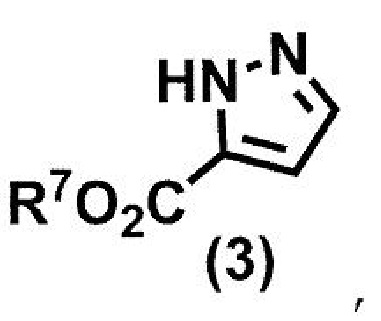
где R7 представляет собой метил или этил,
в условиях реакции Митсунобу (Mitsunobu) с получением соединения формулы (6a):
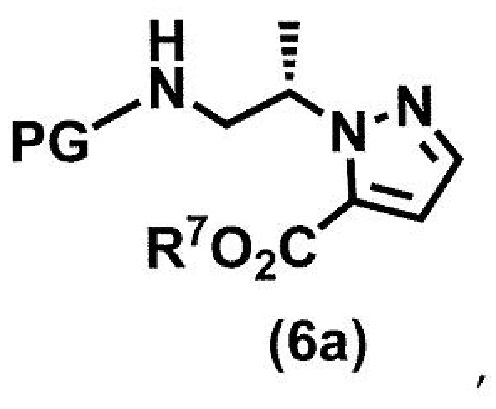
где PG и R7 принимают значения, определенные в данном пункте;
(стадия A2) циклизация соединения формулы (6a) в присутствии кислоты или основания с получением соединения формулы (7a):
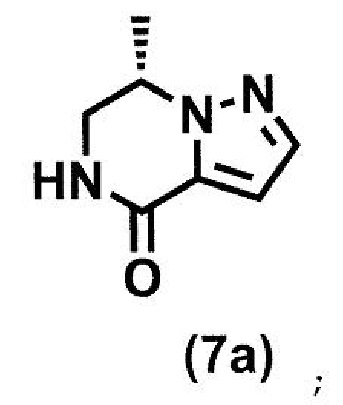
(стадия A3) связывание соединения формулы (7a) и соединения формулы (8a):
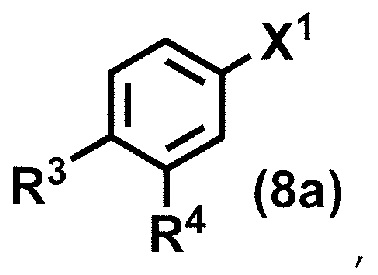
где R3 и R4 принимают значения, определенные в данном пункте, и X1 представляет собой атом йода, атом брома или атом хлора,
в присутствии катализатора переходного металла с получением соединения формулы (9a):
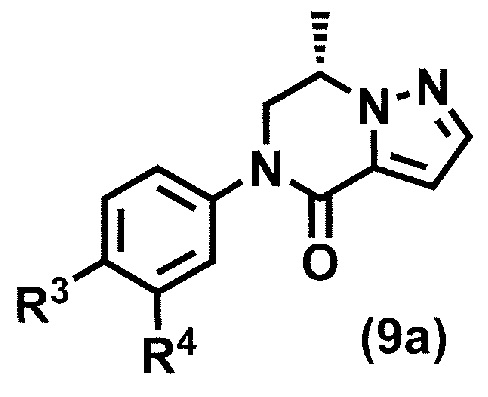
где R3 и R4 принимают значения, определенные в данном пункте;
(стадия A4) взаимодействие соединения формулы (9a) с галогенирующим агентом с получением соединения формулы (15a):
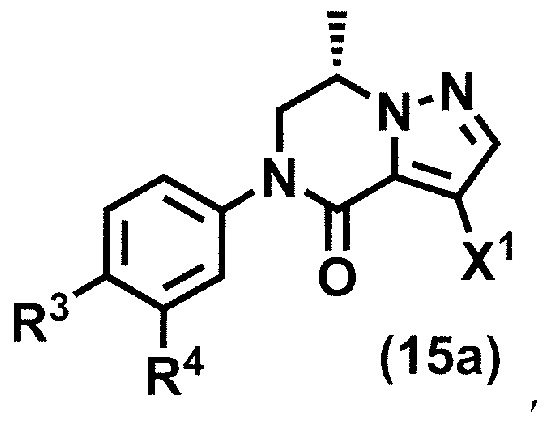
где R3, R4 и X1 принимают значения, определенные в данном пункте; и
(стадия A5) связывание соединения формулы (15a) и соединения формулы (16):
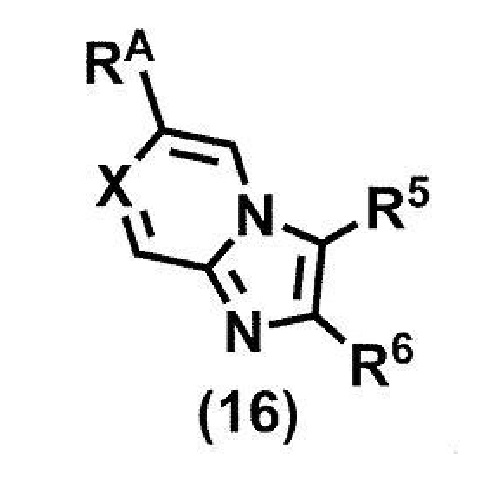
или его соли,
где R5, R6 и X принимают значения, определенные в данном пункте, и RA представляет собой бороновую кислоту или сложный эфир бороновой кислоты,
в присутствии катализатора переходного металла с получением соединения формулы (1a) или его фармацевтически приемлемой соли.
36. Способ получения соединения формулы (1a):
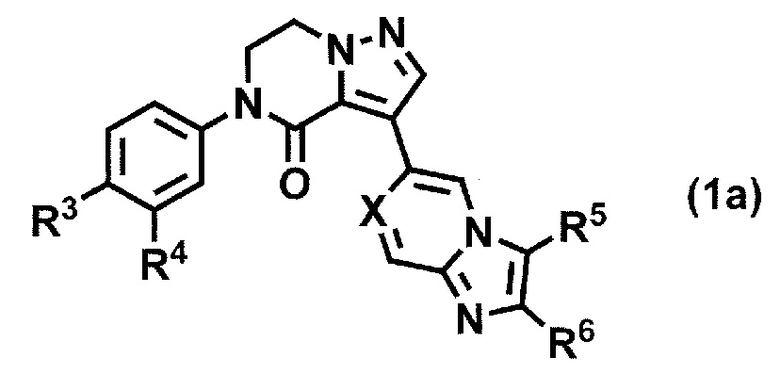
или его фармацевтически приемлемой соли,
где R3 и R4 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или C1-4 алкокси, где каждая алкильная и алкоксигруппа является независимой и может быть необязательно замещена от 1 до 5 одинаковыми или разными атомами галогенов;
R5 и R6 независимо представляют собой атом водорода, атом галогена, C1-6 алкил или -NH2; и
X представляет собой атом азота или -CH-,
который включает следующие стадии:
(стадия B1) связывание соединения формулы (8a):
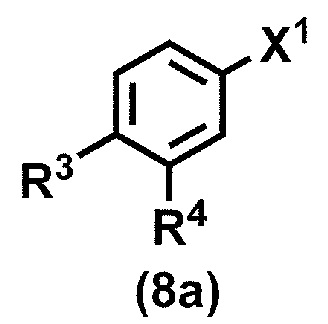
где R3 и R4 принимают значения, определенные в данном пункте, и X1 представляет собой атом йода, атом брома или атом хлора,
с соединением формулы (12a):
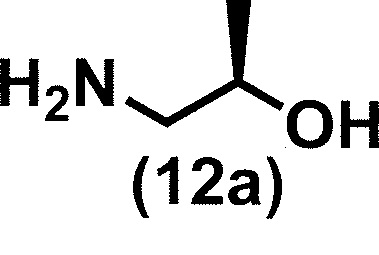
или его солью
в присутствии катализатора переходного металла с получением соединения формулы (13a):
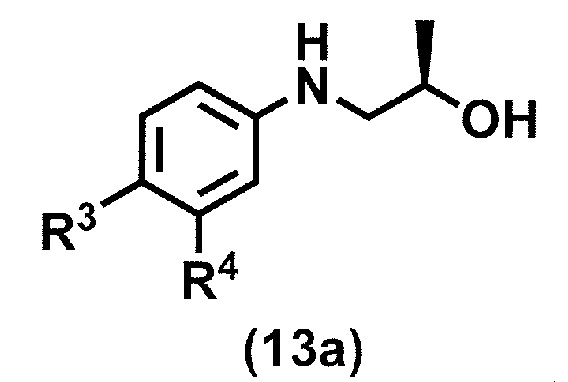
или его соли,
где R3 и R4 принимают значения, определенные в данном пункте;
(стадия B2) взаимодействие соединения формулы (13a) или его соли и соединения формулы (22):
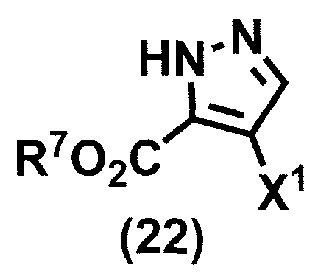
или его соли,
где X1 принимает значения, определенные в данном пункте, и R7 представляет собой метил или этил,
в условиях реакции Митсунобу с получением соединения формулы (23a):
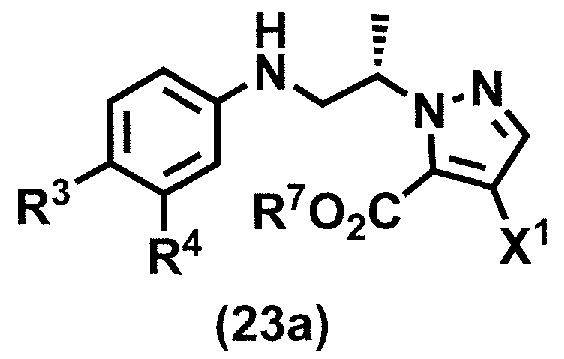
или его соли,
где R3, R4, R7 и X1 принимают значения, определенные в данном пункте;
(стадия B3) гидролиз соединения формулы (23a) или его соли в присутствии кислоты или основания с получением соединения формулы (24):
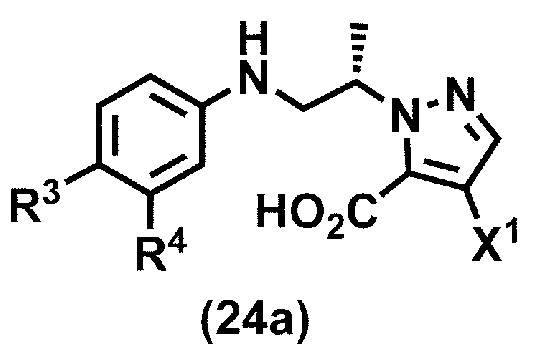
или его соли,
где R3, R4 и X1 принимают значения, определенные в данном пункте;
(стадия B4) циклизация соединения формулы (24a) или его соли в присутствии кислоты или основания с получением соединения формулы (15a):
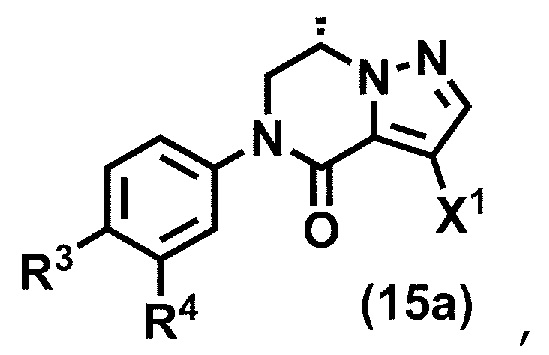
где R3, R4 и X1 принимают значения, определенные в данном пункте; и
(стадия B5) связывание соединения формулы (15a) и соединения формулы (16):
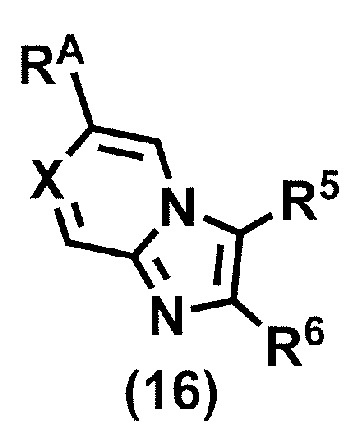

или его соли,
где R5, R6 и X принимают значения, определенные в данном пункте, и
RA представляет собой бороновую кислоту или сложный эфир бороновой кислоты,
в присутствии катализатора переходного металла с получением соединения формулы (1a) или его фармацевтически приемлемой соли;
где стадия B3 и стадия B4 могут заменяться одной стадией B6:
(стадия B6) циклизация соединения формулы (23a) или его соли в присутствии кислоты или основания с получением соединения формулы (15a).
| WO 2014195311 A1, 11.12.2014 | |||
| WO 2016087487 A1, 09.06.2016 | |||
| WO 2016016382 A1, 04.02.2016 | |||
| WO 2017018475 A1, 02.02.2017 | |||
| WO 2009062676 A2, 22.05.2009 | |||
| WO 2010060589 A1, 03.06.2010 | |||
| EA 201692544 A, 31.08.2017. |
Авторы
Даты
2023-03-23—Публикация
2018-11-22—Подача