ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Изобретение касается имидазолидиновых соединений, которые могут оказывать воздействие на активность андрогенных рецепторов (AR). В одном аспекте соединение по изобретению представляет собой антагонист или частичный антагонист и пригодно для профилактики и/или лечения андрогензависимых опухолей и/или любых состояний, при которых может быть вредна AR-стимуляция, таких как акне, алопеция и/или гирсутизм; или в другом аспекте соединение по изобретению является селективным модулятором андрогенных рецепторов (агонистом или смешанным агонистом/антагонистом), который можно использовать для лечения состояний кахексии и болезней с мышечным истощением (включая, но не ограничиваясь этим, индуцированную раком кахексию, ВИЧ-индуцированную, глюкокортикоид-индуцированную, индуцированную иммобилизацией, индуцированную диетой потерю мышечной массы, термические ожоги, хроническую почечную недостаточность, застойную сердечную недостаточность, хроническую обструктивную болезнь легких), возрастное ухудшение функционального состояния (включая, но не ограничиваясь этим, саркопению) и/или мужской или женский остеопороз. Настоящее изобретение также касается способов получения соединений по изобретению, фармацевтических композиций, содержащих соединение по изобретению, и применения соединения по изобретению для профилактики или лечения раскрытых здесь заболеваний.
У мужчин андрогены, основными типичными эндогенными представителями которых являются тестостерон и его метаболит 5α-DHT, связаны с развитием и сохранением первичных мужских половых признаков (эпидидимиса, семенного протока, простаты, наружных половых органов) и вторичных мужских половых признаков (развития волосяного покрова, мускулатуры гортани, распределением жировой ткани, поведением и либидо). Кроме того, они содействуют развитию мышц и костей, а также действуют на гемопоэз, центральную нервную систему и половую функцию.
У женщин андрогены вовлечены, среди прочего, в развитие и сохранение костной ткани и либидо.
Прогрессирующее снижение уровней циркулирующих андрогенов у стареющих мужчин (PADAM - частичное снижение уровней андрогенов у стареющих мужчин) вносит свой вклад в ряд специфических клинических проявлений, включая остеопороз, потерю мышечной массы и силы мышц, сниженное либидо и сексуальную дисфункцию, анемию и изменение когнитивной способности, перепады настроения, депрессию (см. обзор в: Kaufman JM and Vermeulen A., 2005, Снижение уровней андрогенов у пожилых мужчин и их клинические и терапевтические последствия, Endocr Rev. 26:833-76). Однако клиническая безопасность андрогенной терапии сердечно-сосудистых болезней и заболеваний простаты сомнительна. Таким образом, андрогеные добавки не рекомендуются для здоровых пожилых мужчин (Liu FY и др. 2004, Клинический обзор 171: обоснование, эффективность и безопасность андрогенной терапии для пожилых мужчин: будущее исследование и текущие практические рекомендации, J. Clin. Endocrinol. Metab. 89: 4789-96).
Синдром, связанный со снижением уровней циркулирующих андрогенов (ADIF - снижение андрогенов у женщин), описан также у женщин. Он может иметь различные причины, в числе которых старение, химиотерапия и инфицирование вирусом СПИДа. Сопутствующие симптомы включают: остеопороз/остеопению, саркопению и мышечную слабость, сниженное либидо, сексуальную дисфункцию, изменение когнитивной способности, перепады настроения и депрессию. Описан также эндометриоз и повышенный риск рака молочной железы, матки и яичников (Davison SL и Davis SR, 2003, Андрогены у женщин, J. Steroid Biochem. Mol. Biol. 85: 363-366). Введение женщинам высоких доз андрогенов может приводить к появлению признаков мужеподобности, перепадам настроения и акне. Этот риск надо принимать во внимание при введении андрогенов женщинам.
Ограничения применения стероидных агонистов или антагонистов андрогенных рецепторов становятся очевидны, так как их применение отягощено нежелательными эффектами вследствие их метаболизма в другие половые гормоны и стероиды, которые, в свою очередь, индуцируют нежелательные эффекты.
Следовательно, исследуются и чрезвычайно желательны нестероидные альтернативы, так как они допускают благотворное воздействие тестостерона на конкретные органы (костную и мышечную ткань) и на сохранение либидо и с меньшей вероятностью дают вторичные эффекты в определенных тканях, например в простате у мужчин и матке у женщин, поскольку они не причиняют вреда гормональной системе. Они представляют собой безопасную альтернативу общепринятым способам лечения при любых патологиях, связанных с дефицитом андрогена, включая остеопороз или саркопению и сниженное либидо, связанное с синдромами PADAM- и ADIF-типа. Их также можно применять для лечения кахексии, вызванной специфическими заболеваниями, такими как рак или СПИД, или для лечения потери мышечной массы, вызванной длительным лечением глюкокортикоидами. Кроме того, их можно применять для лечения андрогензависимых опухолей, таких как рак простаты или гиперплазия, рост которых на ранней стадии обычно можно регулировать, вводя стероидные антиандрогены.
Селективные модуляторы андрогенных рецепторов (SARM - selective androgen receptor modulators) с нестероидной структурой имеют молекулы, которые действуют в качестве лигандов андрогенного рецептора (AR) с некоторой степенью тканевой специфичности.
Важность AR как мишени является огромной во многих областях обнаружения лекарств и лекарственной терапии. Предполагается, что раскрытые здесь соединения по изобретению действуют двумя основными способами:
- как антагонисты (полные или частичные) ингибиторы AR могут применяться в онкологии и могут быть частично пригодны для лечения андрогензависимого рака простаты. Их также можно применять для мужской контрацепции и для лечения доброкачественной гиперплазии простаты, рака яичников и молочной железы (сравнительный обзор см. Mohler и др., Expert Opin. Ther. Patents (2005) 15 (11), 1565-1585);
- как агонисты (полные или частичные, в том числе смешанные агонисты/антагонисты) они могут быть частично пригодны для лечения метаболических и эндокринных заболеваний, расстройств, в особенности возрастных заболеваний и состояний кахексии. Кроме того, благодаря присутствию в костных клетках, SARM можно с пользой применять для развития и сохранения скелета.
К сожалению, доступные в настоящее время андрогены все еще вызывают побочные эффекты (например, гинекомастию или болезненность молочной железы), из-за низкой тканевой селективности и эффективности высоко желательны SARM с меньшим количеством побочных эффектов.
EP-A-0966447 раскрывает ряд имидазолидиновых соединений, пригодных для лечения состояний, опосредованных воспалительными и иммунными клетками, которые действуют, ингибируя взаимодействие клеточных адгезивных молекул. Хотя раскрытые здесь соединения аналогичны соединениям по настоящему изобретению, в некоторых отношениях отсутствует раскрытие каких-либо соединений, попадающих в область настоящего изобретения.
EP-A-0572191 раскрывает определенные имидазолидины, замещенные йодпропаргильной группой, пригодные в качестве противомикробных агентов.
WO 2007/137874 раскрывает имидазолидиновые соединения, аналогичные соединениям по настоящему изобретению, но в которых в формуле (I), по меньшей мере, один из R3a или R3b представляет собой OH, SH или их производное. Эти соединения требуют, чтобы группа OH или SH была доступна в активных соединениях для возможности связывания His-874 андрогеного рецептора. Эти соединения демонстрируют высокую in vitro активность, но досадно низкую in vivo активность, так что эти соединения не считаются коммерчески жизнеспособными.
Неожиданно было обнаружено, что можно существенно повысить in vivo активность, устраняя из положения R3 слабокислую фенольную OH или SH группу или производные, которые могут давать эту OH или SH группу.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соединения по изобретению могут демонстрировать хорошую абсорбцию, хороший период полураспада, хорошую растворимость, хорошую биологическую доступность и хорошую метаболическую стабильность. В отдельном аспекте соединение по изобретению демонстрирует неожиданные значительные улучшения фармакологических свойств, специфическую улучшенную биологическую доступность.
Таким образом, настоящее изобретение касается имидазолидиновых производных и способов идентификации и конструирования соединения по изобретению, которое влияет на активность андрогенных рецепторов.
В частности, настоящее изобретение касается соединения по изобретению согласно приведенной ниже формуле Ia:
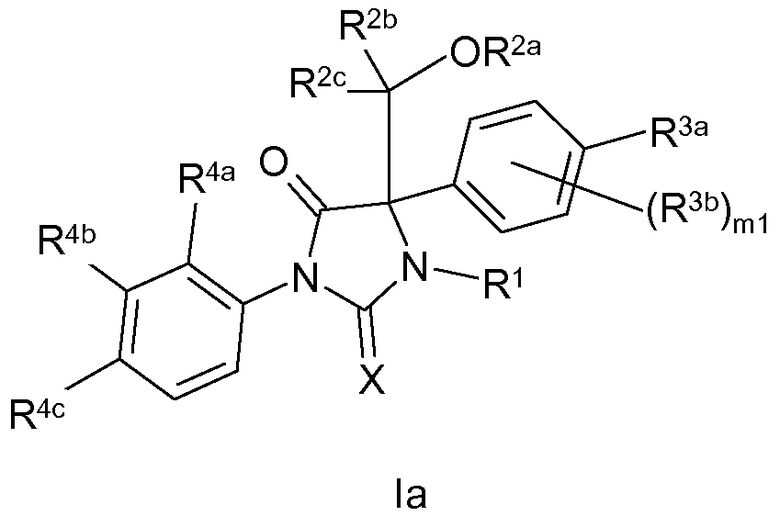
где
X означает O или S;
R1 означает H; или R1 выбран из C1-C6 алкила, C3-C7 циклоалкила, C 3 -C 6 алкенила, C 3 -C 6 алкинила и C1-C6 ацила; каждый из которых необязательно может быть замещен цианогрупой, одним или большим количеством атомов галогена, гидроксилом или представлять собой незамещенный C1-C6 алкокси;
R2a выбран из H, S(O2)OH, P(O)(OH)2 и C(O)(CH2)n1C(O)OH; или R2a выбран из C1-C6 алкила, C1-C6 ацила и C 3 -C 6 алкенила; каждый из которых необязательно может быть замещен арилом, амино или карбокси; n1 равно 0, 1, 2, 3 или 4;
каждый R2b и R2c независимо выбран из H и C1-C6 алкила; или R2b и R2c могут быть объединены вместе с образованием C3-C7 циклоалкила;
R3a означает H, атом галогена, циано или нитро; или R3a представляет собой C1-C6 алкил, необязательно замещенный галогеном, циано, нитро, гидроксилом или C1-C4 алкокси; или R3a представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R3b независимо означает атом галогена, циано или нитро; или каждый R3b независимо представляет собой C1-C6 алкил, необязательно замещенный цианогруппой или галогеном; или каждый R3b представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R4a и R4b независимо представляет собой H, атом галогена, циано, карбокси или нитро; или каждый R4a и R4b выбран из C1-C6 алкила и C1-C6 алкокси; каждый из которых необязательно может быть замещен одним или большим количеством атомов галогена или C1-C6 алкокси; или R4a и R4b объединены вместе с образованием 5- или 6-членного циклоалкила, 5- или 6-членного гетероциклоалкила, 5- или 6-членного арила или 5- или 6-членного гетероарила;
R4c означает атом галогена, циано или нитро; и
m1 равно 0, 1 или 2.
В другом варианте настоящее изобретение касается соединения по изобретению, соответствующего приведенной ниже формуле Ib:
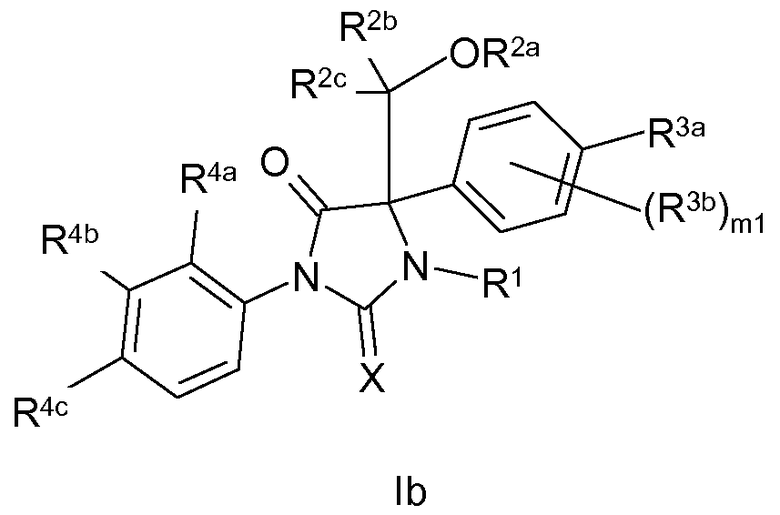
где
X означает O или S;
R1 означает H; или R1 выбран из C1-C6 алкила, C3-C7 циклоалкила, C 3 -C 6 алкенила, C3-C6 алкинила и C1-C6 ацила; каждый из которых необязательно может быть замещен цианогруппой, одним или большим количеством атомов галогена, гидроксилов или незамещенных C1-C6 алкокси;
R2a выбран из H, P(O)(OH)2 и C(O)(CH2)n1C(O)OH; или R2a выбран из C1-C6 ацила и C3-C6 алкенила; каждый из которых необязательно может быть замещен аминогруппой или карбокси; n1 равно 0, 1, 2, 3 или 4;
каждый R2b и R2c независимо выбран из H и C1-C6 алкила; или R2b и R2c могут быть объединены вместе с образованием C3-C7 циклоалкила;
R3a означает H, атом галогена, циано или нитро; или R3a представляет собой C1-C6 алкил, необязательно замещенный галогеном, циано, нитро, гидроксилом или C1-C4 алкокси; или R3a представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R3b независимо представляет собой атом галогена, циано или нитро; или каждый R3b независимо представляет собой C1-C6 алкил, необязательно замещенный цианогруппой или галогеном; или каждый R3b представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R4a и R4b независимо представляет собой H, атом галогена, циано, карбокси или нитро; или каждый R4a и R4b выбран из C1-C6 алкила и C1-C6 алкокси; каждый из которых необязательно может быть замещен одним или большим количеством атомов галогена или C1-C6 алкокси; или R4a и R4b объединены вместе с образованием 5- или 6-членного циклоалкила, 5- или 6-членного гетероциклоалкила, 5- или 6-членного арила или 5- или 6-членного гетероарила;
R4c означает атом галогена, циано или нитро; и
m1 равно 0, 1 или 2.
В другом варианте соединение по изобретению соответствует формуле (VI):
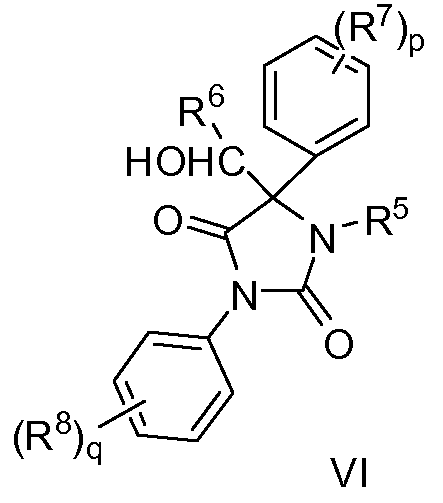
где
R5 означает H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил или C1-C4 алкил, замещенный цианогруппой или одним или большим количеством галогеновых групп;
R6 означает H или C1-C4 алкил;
R7 означает атом галогена, циано, C1-C4 алкил или C1-C4 перфторалкил;
R8 означает атом галогена, циано, нитро, C1-C4 алкил или C1-C4 перфторалкил;
p равно 0, 1 или 2;
q равно 1, 2 или 3;
если p равно 2, то все R7 являются одинаковыми или разными;
если q равно 2 или 3, то все R8 являются одинаковыми или разными, и
его фармацевтически приемлемые эфиры.
В другом варианте соединение по изобретению соответствует формуле VII
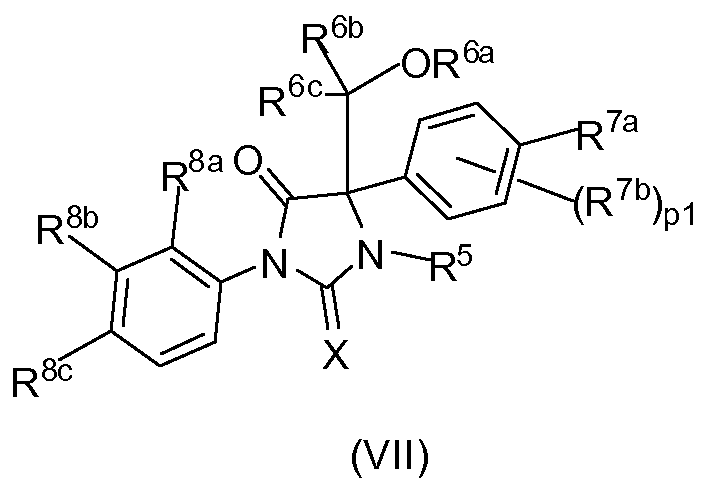
где
X означает O;
R5 означает H, C1-C6 алкил, C3-C6 алкенил или C3-C6 алкинил, каждый из которых может быть незамещенным или замещенным цианогруппой, одним или большим количеством атомов галогена;
R6a означает H, или фосфорный эфир, или его производное, или эфир карбоновой кислоты, предпочтительно P(O)(OH)2, C(=O)-(CH2)2-CO2H или -C(=O)CH(NH3Cl)iPr;
R6b означает H;
R6c независимо выбран из H и C1-C6 алкила;
R7a означает H, атом галогена, циано, C1-C4 алкил, который может быть незамещенным или замещенным одним или большим количеством атомов галогена;
R7b означает атом галогена, циано или C1-C4 алкил, который может быть незамещенным или замещенным галогеном; каждый R8a и R8b независимо представляет собой H, атом галогена, циано, C1-C4 алкил, каждый из которых может быть незамещенным или замещенным одним или большим количеством атомов галогена; R8c означает атом галогена, циано или нитро; и p1 равно 0, 1 или 2.
Еще в одном аспекте настоящее изобретение касается фармацевтических композиций, включающих соединение по изобретению и фармацевтический носитель, наполнитель или разбавитель. В этом аспекте изобретения фармацевтическая композиция может содержать одно или более описанных здесь соединений по изобретению. Кроме того, получаемое и применяемое соединение по изобретению, пригодное для раскрытых здесь фармацевтических композиций и способов лечения, является фармацевтически приемлемым.
Еще в одном аспекте данное изобретение касается способа лечения млекопитающего, подверженного или пораженного состоянием, выбранным из перечисленных здесь состояний, и, в частности, возрастными заболеваниями, включающими, но не ограниченными этим, саркопению, состояния кахексии и потерю мышечной массы, вызванную заболеваниями, включающими, но не ограниченными этим, рак и СПИД, заболевания костей и суставов, такие как остеопороз, сниженное либидо и сексуальная дисфункция или анемия, указанный способ включает введение эффективного количества соединения-агониста или смешанного агониста/антагониста по изобретению или фармацевтической композиции, содержащей соединение-агонист или смешанный агонист/антагонист по изобретению, которое здесь описано.
Еще в одном аспекте настоящее изобретение касается способа лечения млекопитающего, подверженного или пораженного андроген-зависимой опухолью, такой как рак простаты или гиперплазия, указанный способ включает введение эффективного количества соединения-антагониста по изобретению или фармацевтической композиции, содержащей соединение-антагонист по изобретению, которое здесь описано.
Еще в одном аспекте настоящее изобретение касается соединения по изобретению для применения с целью лечения или профилактики состояния, выбранного из перечисленных здесь состояний, и, в частности, возрастных заболеваний, включающих, но не ограниченных этим, саркопению, состояния кахексии и потерю мышечной массы, вызванную заболеваниями, включающими, но не ограниченными этим, рак и СПИД, хроническую обструктивную болезнь легких, хроническую почечную недостаточность, термические ожоги, заболевания костей и суставов, такие как остеопороз, сниженное либидо и сексуальную дисфункцию или анемию, указанный способ включает введение эффективного количества соединения-агониста или смешанного агониста/антагониста по изобретению или фармацевтической композиции, содержащей соединение-агонист или смешанный агонист/антагонист по изобретению, которое здесь описано.
Еще в одном аспекте настоящее изобретение касается соединения по изобретению для применения с целью лечения или профилактики состояния, выбранного из перечисленных здесь состояний, таких как рак простаты или гиперплазия, причем указанный способ включает введение эффективного количества соединения-антагониста по изобретению или фармацевтической композиции, содержащей соединение-антагонист по изобретению, которое здесь описано.
В дополнительных аспектах данное изобретение касается способов синтеза соединения по изобретению с раскрытыми здесь далее типичными протоколами и путями синтеза.
Еще в одном аспекте настоящее изобретение касается способов определения агонистической или антагонистической активности описанного здесь соединения по изобретению.
Таким образом, главной целью этого изобретения является обеспечение нового ряда соединений, которые могут модулировать активность андрогенного рецептора (AR) и таким образом предупреждать или лечить любые болезни, которые могут быть вызваны нарушением их активности.
Еще одной целью настоящего изобретения является обеспечение соединения по изобретению, которое упоминается выше и может действовать как агонист или смешанный агонист/антагонист AR и, благодаря этому, является эффективным при лечении или облегчении таких заболеваний, как возрастные заболевания, включающие, но не ограниченные этим, саркопению, состояния кахексии и потерю мышечной массы, вызванную заболеваниями, включающими, но не ограниченными этим, рак и СПИД, заболевания костей и суставов, такие как остеопороз, сниженное либидо и сексуальная дисфункция или анемия.
Еще одной целью этого изобретения является обеспечение ряда соединений, которые могут действовать как антагонисты AR и, благодаря этому, эффективны при лечении или облегчении заболеваний или их симптомов, таких как андроген-зависимый рак простаты, для мужской контрацепции и при доброкачественной гиперплазии простаты, раке яичников и молочной железы. В одном аспекте соединение по изобретению представляет собой антагонист или частичный антагонист и пригодно для профилактики и/или лечения андрогензависимых опухолей и всех состояний, при которых может быть вредна AR-стимуляция, таких как акне, алопеция и гирсутизм; или в другом аспекте соединение по изобретению является селективным модулятором андрогенных рецепторов (агонистом или смешанным агонистом/антагонистом), который можно использовать для лечения состояний кахексии и заболеваний с мышечным истощением (включая, но не ограничиваясь этим, индуцированную раком кахексию, ВИЧ-индуцированную, глюкокортикоид-индуцированную, индуцированную иммобилизацией, индуцированную диетой потерю мышечной массы, термические ожоги, хроническую почечную недостаточность, хроническую обструктивную болезнь легких), возрастного ухудшения функционального состояния (включая, но не ограничиваясь этим, саркопению) и мужского и женского остеопороза.
Настоящее изобретение также касается способов получения соединения по изобретению, фармацевтических композиций, содержащих соединение по изобретению, и применения соединения по изобретению для профилактики или лечения любого из раскрытых здесь заболеваний.
Еще одной целью этого изобретения является обеспечение фармацевтических композиций, содержащих или включающих соединение по изобретению, для перечисленных здесь терапевтических применений.
Еще одной целью изобретения является обеспечение способов лечения с применением соединения по изобретению и/или фармацевтической композиции по изобретению.
Другие цели и преимущества будут ясны специалистам в данной области из рассмотрения следующего далее подробного описания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Предполагается, что приведенные далее термины имеют значения, представленные с ними ниже и полезные для понимания описания и предлагаемой области настоящего изобретения.
При описании изобретения, которое может включать соединения по изобретению, фармацевтические композиции, содержащие такие соединения по изобретению, и способы применения таких соединений по изобретению и композиций, следующие термины, если присутствуют, имеют следующие значения, если не указано иначе. Также надо понимать, что при описании любых определенных здесь далее фрагментов они могут быть замещенными разнообразными заместителями, и предполагается, что соответствующие определения включают такие замещенные фрагменты в свою область, как показано ниже. Пока не указано по-другому, термин "замещенный" следует определять, как указано ниже. Следует также понимать, что используемые здесь термины "группы" и "радикалы" можно считать взаимозаменяемыми.
Формы единственного числа могут использоваться здесь для означения одного или большего количества (т.е., по меньшей мере, одного) объектов. Например, "аналог" означает один аналог или более одного аналога.
Термин «ацил» относится к радикалу -C(O)R20, где R20 означает атом водорода, C1-C6 алкил, C3-C7 циклоалкил, C3-C10 циклоалкилметил, (4-10)-членный гетероциклоалкил, арил, арилалкил, (5-10)-членный гетероарил или гетероарилалкил, которые определены здесь. Типичные примеры включают, но не ограничены этим, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил и бензилкарбонил. Типичными «ацильными» группами являются -C(O)H, -C(O)-C1-C6 алкил, -C(O)-(CH2)t(C6-C10 арил), -C(O)-(CH2)t((5-10)-членный гетероарил), -C(O)-(CH2)t(C3-C10 циклоалкил) и -C(O)-(CH2)t((4-10)-членный гетероциклоалкил), где t равно целому числу от 0 до 4.
Термин «ациламино» относится к радикалу -NR22C(O)R23, где R22 означает атом водорода, C1-C6 алкил, C3-C7 циклоалкил, (4-10)-членный гетероциклоалкил, C6-C10 арил, арилалкил, (5-10)-членный гетероарил или гетероарилалкил и R23 означает атом водорода, C1-C6 алкил, C3-C10 циклоалкил, (4-10)-членный гетероциклоалкил, C6-C10 арил, арилалкил, (5-10)-членный гетероарил или гетероарилалкил, которые определены здесь. Типичные «ациламино» группы включают, но не ограничены этим, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметилкарбониламино, бензоиламино и бензилкарбониламино. Типичными «ациламино» группами являются -NR21'C(O)-C1-C6 алкил, -NR21'C(O)-(CH2)t(C6-C10 арил), -NR21'C(O)-(CH2)t((5-10)-членный гетероарил), -NR21'C(O)-(CH2)t(C3-C7 циклоалкил) и -NR21'C(O)-(CH2)t((4-10)-членный гетероциклоалкил), где t равно целому числу от 0 до 4, каждый R21' независимо представляет собой H или C1-C6 алкил.
Термин «алкокси» относится к группе -OR26, где R26 означает C1-C6 алкил. Специфическими алкоксигруппами являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Специфическими алкоксигруппами являются низшие алкоксигруппы, т.е. группы, содержащие от 1 до 6 атомов углерода. Дополнительные специфические алкоксигруппы имеют от 1 до 4 атомов углерода.
Термин «алкоксикарбонил» относится к радикалу -C(O)-OR27, где R27 представляет собой C1-C6 алкил, C3-C7 циклоалкил, C3-C10 циклоалкилалкил, (4-10)-членный гетероциклоалкилалкил, аралкил или (5-10)-членный гетероарилалкил, которые определены здесь. Типичными "алкоксикарбонильными" группами являются C(O)O-C1-C6 алкил, -C(O)O-(CH2)t(C6-C10 арил), -C(O)O-(CH2)t((5-10)-членный гетероарил), -C(O)O-(CH2)t(C3-C7 циклоалкил) и -C(O)O-(CH2)t((4-10)-членный гетероциклоалкил), где t равно целому числу от 1 до 4.
Термин «O-арилкарбонил» относится к радикалу -C(O)-OR29, где R29 представляет собой C6-C10 арил, который определен здесь. Типичной "O-арилкарбонильной" группой являются -C(O)O-(C6-C10 арил).
Термин «гетеро-O-арилкарбонил» относится к радикалу -C(O)-OR31, где R31 представляет собой (5-10)-членный гетероарил, который определен здесь.
Термин «алкил» означает линейный или разветвленный алифатический углеводород, сдержащий от 1 до 6 атомов углерода. Дополнительные специфические группы имеют от 1 до 4 атомов углерода. Типичные линейные группы включают метил, этил н-пропил и н-бутил. Термин «разветвленный» означает, что одна или более низших алкильных групп, таких как метил, этил, пропил или бутил, присоединены к линейной алкильной цепи, типичные разветвленные группы включают изопропил, изобутил, трет-бутил и изоамил.
Термин «амино» относится к радикалу -NH2.
Термин «алкиламино» относится к группе -NHR34, где R34 представляет собой C1-C6 алкил.
Термин «алкилариламино» относится к группе -NR36R37, где R36 представляет собой C6-C10 арил и R37 представляет собой C1-C6 алкил.
Термин «ариламино» означает радикал -NHR40, где R40 выбран из C6-C10 арила и (5-10)-членного гетероарила, которые определены здесь.
Термин «диалкиламино» относится к группе -NR42R43, где каждый из R42 и R43 независимо выбран из C1-C6 алкилов.
Термин «диариламино» относится к группе -NR46R47, где каждый из R46 и R47 независимо выбран из C6-C10 арилов.
Термин «аминосульфонил» или «сульфонамид» относится к радикалу -S(O2)NH2.
Термин «аралкил» или «арилалкил» относится к алкильной группе, которая определена выше, замещенной одной или большим количеством арильных групп, которые определены выше. Специфическими аралкильными или арилалкильными группами являются алкильные группы, замещенные одной арильной группой.
Термин «арил» относится к моновалентной ароматической углеводородной группе, получаемой при удалении одного атома водорода с одного атома углерода исходной ароматической циклической системы. В частности, арил относится к ароматической циклической структуре, моноциклической или полициклической, которая включает от 5 до 10 кольцевых членов, чаще от 6 до 10. Если арильная группа представляет собой моноциклическую кольцевую систему, она предпочтительно содержит 6 атомов углерода. Типичные арильные группы включают, но не ограничены этим, группы, производные ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена и тринафталина. В частности, арильные группы включают фенил, нафтил, инденил и тетрагидронафтил.
Термин «амидо» относится к радикалу -C(O)NH2.
Термин «карбокси» относится к радикалу -C(O)OH.
Термин «циклоалкил» относится к циклическим неароматическим углеводородным группам, имеющим от 3 до 7 атомов углерода. Такие циклоалкильные группы включают, например, структуры с одним кольцом, таким как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Термин «циано» относится к радикалу -CN.
Термин «гало» или «галоген» относится к фтору (F), хлору (Cl), брому (Br) и йоду (I). Специфическими галогеновыми группами являются фтор или хлор.
Термин «гетеро», используемый для описания соединения или группы, присутствующей на соединении, означает, что один или более атомов углерода в соединении или группе заменены на гетероатомы азота, кислорода или серы. Префикс «гетеро» может использоваться с любой из описанных выше углеводородных групп, таких как алкил, например гетероалкил, циклоалкил, например гетероциклоалкил, арил, например гетероарил, циклоалкенил, например циклогетероалкенил, и подобные группы, имеющие от 1 до 5, и, в частности, от 1 до 3 гетероатомов.
Термин «гетероарил» означает ароматическую циклическую структуру, моноциклическую или полициклическую, которая включает один или более гетероатомов и от 5 до 12 кольцевых членов, чаще от 5 до 10 кольцевых членов. Гетероарильная группа может представлять собой, например, пятичленную или шестичленную моноциклическую кольцевую или бициклическую структуру, образованную из конденсированных пяти- и шестичленных циклов, или двух конденсированных шестичленных циклов, или (в качестве дополнительного примера) двух конденсированных пятичленных циклов. Каждый цикл может содержать до четырех гетероатомов, обычно выбранных из атомов азота, серы и кислорода. Обычно гетероарильный цикл содержит до 4 гетероатомов, чаще до 3 гетероатомов, еще чаще до 2, например один гетероатом. В одном варианте гетероарильный цикл содержит, по меньшей мере, один кольцевой атом азота. Атомы азота в гетероарильных циклах могут быть основными, как в случае имидазола или пиридина, или по существу неосновными, как в случае азота, индола или пиррола. Вообще, количество основных атомов азота, присутствующих в гетероарильной группе, включая заместители-аминогруппы цикла, составляет менее пяти. Примеры пятичленных моноциклических гетероарильных групп включают, но не ограничены этим, пиррольные, фурановые, тиофеновые, имидазольные, фуразановые, оксазольные, оксадиазольные, оксатриазольные, изоксазольные, тиазольные, изотиазольные, пиразольные, триазольные и тетразольные группы. Примеры шестичленных моноциклических гетероарильных групп включают, но не ограничены этим, пиридин, пиразин, пиридазин, пиримидин и триазин. Специфические примеры бициклических гетероарильных групп, содержащих пятичленный цикл, конденсированный с другим пятичленным циклом, включают, но не ограничены этим, имидазотиазол и имидазоимидазол. Специфические примеры бициклических гетероарильных групп, содержащих шестичленный цикл, конденсированный с пятичленным циклом, включают, но не ограничены этим, следующие группы: бензофуран, бензтиофен, бензимидазол, бензоксазол, изобензоксазол, бензизоксазол, бензтиазол, бензизотиазол, изобензофуран, индол, изоиндол, изоиндолон, индолизин, индолин, изоиндолин, пурин (например, аденин, гуанин), индазол, пиразолопиримидин, триазолопиримидин, бензодиоксол и пиразолопиридин. Специфические примеры бициклических гетероарильных групп, содержащих два конденсированных шестичленных цикла, включают, но не ограничены этим, следующие группы: хинолин, изохинолин, хроман, тиохроман, хромен, изохромен, хроман, изохроман, бензодиоксан, хинолизин, бензоксазин, бензодиазин, пиридопиридин, хиноксалин, хиназолин, циннолин, фталазин, нафтиридин и птеридин. Специфическими гетероарильными группами являются группы, производные тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина.
Примеры типичного арила, имеющего гетероатомы и содержащего заместители, включают следующие соединения:
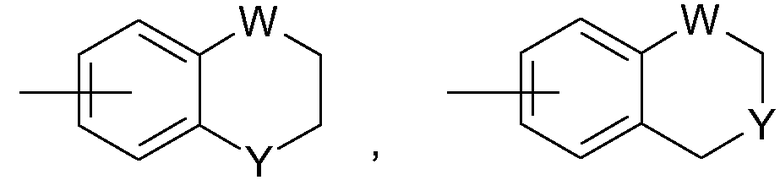 и
и 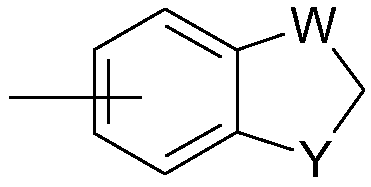 ,
,
где каждый W выбран из C(R54)2, NR54, O и S и каждый Y выбран из карбонила, NR54, O и S; и R54 независимо представляет собой атом водорода, C1-C6 алкил, C3-C7 циклоалкил, (4-10)-членный гетероциклоалкил, C6-C10 арил и (5-10)-членный гетероарил.
Примеры типичных гетероарилов включают следующие соединения:
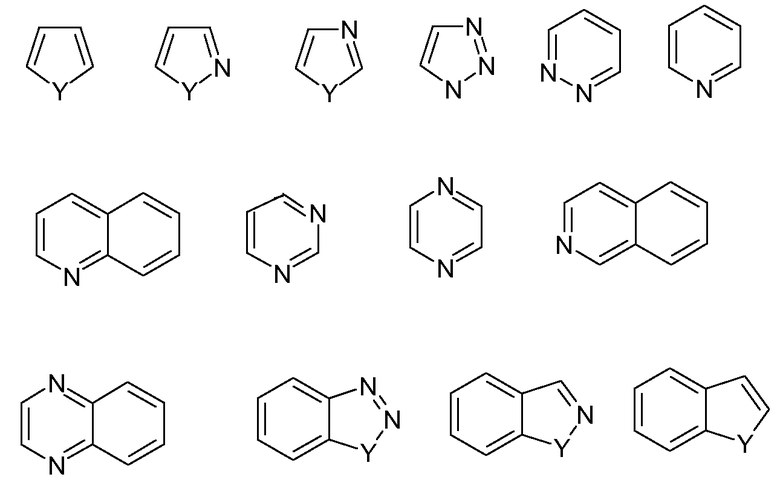
где каждый Y выбран из карбонила, N, NR55, O и S; и R55 независимо представляет собой атом водорода, C1-C6 алкил, C3-C7 циклоалкил, (4-10)-членный гетероциклоалкил, C6-C10 арил и (5-10)-членный гетероарил.
Используемый здесь термин «гетероциклоалкил» относится к 4-10-членным, стабильным гетероциклическим неароматическим циклам и/или группам, включающим конденсированные с ними циклы, содержащие один или более гетероатомов, независимо выбранных из N, O и S. Конденсированная гетероциклическая циклическая система может включать карбоциклические кольца и должна включать только одно гетероциклическое кольцо. Примеры гетероциклических колец включают, но не ограничены этим, морфолин, пиперидин (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), пирролидон, пиран (2H-пиран или 4H-пиран), дигидротиофен, дигидропиран, дигидрофуран, дигидротиазол, тетрагидрофуран, тетрагидротиофен, диоксан, тетрагидропиран (например, 4-тетрагидропиранил), имидазолин, имидазолидинон, оксазолин, тиазолин, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазины, такие как N-метил пиперазин. Дополнительные примеры включают тиоморфолин и его S-оксид и S,S-диоксид (в частности, тиоморфолин). Еще другие примеры включают азетидин, пиперидон, пиперазон и N-алкилпиперидины, такие как N-метилпиперидин. Специфические примеры гетероциклоалкильных групп показаны в следующих иллюстративных примерах:
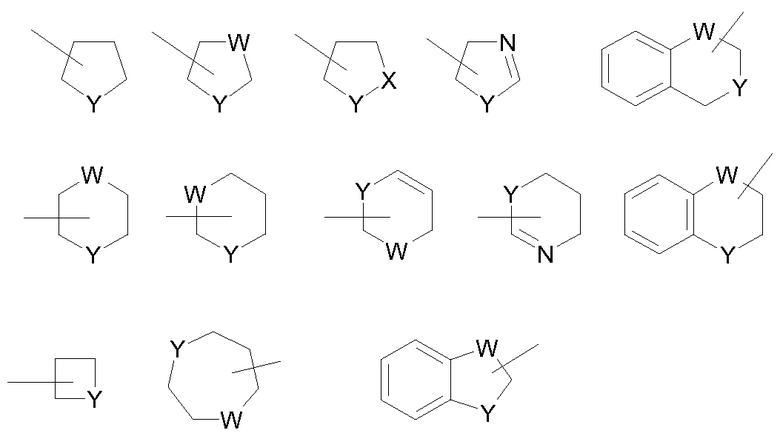
где каждый W выбран из CR56, C(R56)2, NR56, O и S; и каждый Y выбран из NR56, O и S; и R56 независимо представляет собой атом водорода, C1-C6 алкил, C3-C7 циклоалкил, (4-10)-членный гетероциклоалкил, C6-C10 арил, (5-10)-членный гетероарил. Эти гетероциклоалкильные кольца необязательно могут быть замещены одной или большим количеством групп, выбранных из группы, включающей ацил, ациламино, ацилокси (-O-ацил или -OC(O)R20), алкокси, алкоксикарбонил, алкоксикарбониламино (-NR"-алкоксикарбонил или -NH-C(O)-OR27), амино, замещенный амино, аминокарбонил (амидо или -C(O)-NR"2), аминокарбониламино (-NR"-C(O)-NR"2), аминокарбонилокси (-O-C(O)-NR"2), аминосульфонил, сульфониламино, арил, -O-арил, азидо, карбоксил, циано, циклоалкил, галоген, гидрокси, нитро, тиол, -S-алкил, -S-арил, -S(O)-алкил, -S(O)-арил, -S(O)2-алкил и -S(O)2-арил. Замещающие группы включают карбонил или тиокарбонил, которые дают, например, лактам и производные мочевины.
Термин «гидрокси» относится к радикалу -OH.
Термин «нитро» относится к радикалу -NO2.
Термин «замещенный» относится к группе, в которой один или более атомов водорода независимо заменены одинаковыми или разными заместителями. Типичные заместители могут быть выбраны из группы, включающей: галоген, -R57, -O, =О, -OR57, -SR57, -S-, =S, -NR57R58, =NR57, -CCl3, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2O-, -S(O)2OH, -S(O)2R57, -OS(O2)O-, -OS(O)2R57, -P(O)(O-)2, -P(O)(OR57)(O-), -OP(O)(OR57)(OR58), -C(O)R57, -C(S)R57, -C(O)OR57, -C(O)NR57R58, -C(O)O-, -C(S)OR57, -NR59C(O)NR57R58, -NR59C(S)NR57R58, -NR60C(NR59)NR57R58 и -C(NR59)NR57R58;
где каждый R57, R58, R59 и R60 независимо представляет собой:
- атом водорода, C1-C6 алкил, C6-C10 арил, арилалкил, C3-C7 циклоалкил, (4-10)-членный гетероциклоалкил, (5-10)-членный гетероарил, гетероарилалкил; или
- C1-C6 алкил, замещенный атомом галогена или гидрокси; или
- C6-C10 арил, (5-10)-членный гетероарил, C6-C7 циклоалкил или (4-10)-членный гетероциклоалкил, замещенный незамещенным C1-C6 алкилом, атомом галогена, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
В специфическом варианте замещенные группы являются замещенными одним или большим количеством заместителей, в частности от 1 до 3 заместителей, в особенности одной замещающей группой.
Используемый здесь префикс «перфтор» относится к группе, где все атомы водорода указанной группы заменены на атомы фтора. В частности, термин перфторалкил относится к алкилу (который определен здесь), в котором все атомы водорода заменены на атомы фтора. Специфической перфторалкильной группой является CF3.
Еще в одном специфическом варианте замещающая группа или группы выбраны из: атомов галогена, циано, нитро, трифторметила, трифторметокси, азидо, -NR"'SO2R", -SO2NR"R"', -C(O)R", -C(O)OR", -OC(O)R", -NR"'C(O)R", -C(O)NR"R"', NR"R"', (CR”'R "')mOR"', где каждый R" независимо выбран из H, C1-C6 алкила, -(CH2)t(C6-C10 арила), -(CH2)t((5-10)-членного гетероарила), -(CH2)t((C3-C7)циклоалкила) и -(CH2)t((4-10)-членного гетероциклоалкила), где t равно целому числу от 0 до 4; и
- любые присутствующие алкильные группы сами могут быть замещены атомом галогена или гидроксигруппой; и
- любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклоалкильные группы сами могут быть замещены незамещенным C1-C4 алкилом, атомом галогена, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Каждый R"' независимо представляет собой H или C1-C6 алкил.
Термин «сульфо» или «сульфоновая кислота» относится к такому радикалу, как -SO3H.
Специалисту в области органического синтеза понятно, что максимальное количество гетероатомов в стабильном, химически реальном гетероциклическом кольце, будь оно ароматическим или неароматическим, определяется размером цикла, степенью ненасыщенности и валентностью гетероатомов. Вообще, гетероциклическое кольцо может иметь от одного до четырех гетероатомов при условии, что гетероароматический цикл является химически реальным и стабильным.
Выражение «фармацевтически приемлемый» означает вещество, одобренное или одобряемое регулирующими органами федерального или государственного управления или соответствующими органами в странах, отличных от США, или указанное в фармакопее США или другой общепризнанной фармакопее для применения на животных и в особенности на людях.
Выражение «фармацевтически приемлемая соль» относится к соли соединения по изобретению, которая является фармацевтически приемлемой и которая обладает требуемой фармакологической активностью исходного соединения. В частности, такие соли нетоксичны, могут представлять собой аддитивные соли неорганических или органических кислот и аддитивные соли оснований. В частности, такие соли включают: (1) аддитивные соли кислот, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2,2,2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и подобные; или (2) соли, образующиеся, когда кислотный протон присутствует в исходном соединении, либо замещен ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо координирован с органическим основанием, таким как этаноламин, диэтаноламин, триэтиноламин, N-метилглюкамин и подобные. Кроме того, соли включают (только для примера) натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и подобные и, если соединение содержит основную функциональность, соли нетоксических органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и подобные. Выражение "фармацевтически приемлемый катион" относится к приемлемому катионному противоиону кислотной функциональной группы. Примерами таких катионов являются катионы натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобные.
«Фармацевтически приемлемые сложные эфиры» представляют собой сложные эфиры, которые являются в достаточной мере нетоксическими, чтобы быть одобренными регулирующими органами. Предпочтительными сложными эфирами являются фосфорные эфиры и их производные и эфиры карбоновых кислот. Вообще, фармацевтически приемлемые сложные эфиры можно получить с фармацевтически приемлемыми кислотами, такими как фосфорная кислота и ее эфирообразующие производные, такие как алкиловые и диалкиловые сложные эфиры фосфорной кислоты и органических кислот, например уксусной кислоты, пропионовой кислоты, гексановой кислоты, циклопентанпропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, молочной кислоты, малоновой кислоты, янтарной кислоты, яблочной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, 3-(4-гидроксибензоил)бензойной кислоты, коричной кислоты, манделовой кислоты, 4-метилбицикло[2,2,2]-окт-2-ен-1-карбоновой кислоты, глюкогептоновой кислоты, 3-фенилпропионовой кислоты, триметилуксусной кислоты, трет-бутилуксусной кислоты, глюконовой кислоты, глутаминовой кислоты, гидроксинафтойной кислоты, салициловой кислоты, стеариновой кислоты, муконовой кислоты и подобных.
Выражение «фармацевтически приемлемый носитель» относится к разбавителю, адъюванту, наполнителю или носителю, с которым вводят соединение по изобретению.
Термин «пролекарства» относится к соединениям, включающим производные соединений по изобретению, которые имеют отщепляемые группы и при сольволизе или в физиологических условиях становятся соединениями по изобретению, которые являются фармацевтически активными in vivo. Такие примеры включают, но не ограничены этим, производные холинового эфира, сложные эфиры N-алкилморфолина, эфиры глицина, валина или других аминокислот и подобные соединения, эфиры карбоновых кислот, эфиры сульфатов или фосфатов.
Термин «сольват» относится к формам соединения, связанного с растворителем, обычно получаемым по реакции сольволиза. Это физическое взаимодействие включает водородное связывание. Обычные растворители включают воду, этанол, уксусную кислоту и подобное. Соединения по изобретению могут быть получены, например, в кристаллическом виде и могут быть сольватированы или гидратированы. Подходящие сольваты включают фармацевтически приемлемые сольваты, такие как гидраты, и дополнительно включают стехиометрические сольваты и нестехиометрические сольваты. В некоторых случаях сольват можно выделить, например, когда в кристаллическую решетку кристаллического твердого вещества включена одна или более молекул растворителя. Термин «сольват» включает и фазу-раствор, и выделяемые сольваты. Типичные сольваты включают гидраты, этилаты и метилаты.
Термин «субъект» включает людей. Термины «человек», «пациент» и «субъект» используются здесь взаимозаменяемо.
Выражение «терапевтически эффективное количество» означает количество соединения по изобретению, которое при введении субъекту с целью лечения заболевания является достаточным для проведения такого лечения заболевания. "Терапевтически эффективное количество" может варьироваться в зависимости от соединения по изобретению, заболевания и его тяжести, возраста, массы и др. характеристик субъекта, подлежащего лечению.
Термин «предотвращение» или «предупреждение» относится к снижению риска возникновения или развития заболевания или нарушения (т.е. созданию причин неразвития, по меньшей мере, одного из клинических симптомов заболевания) у субъекта, который подвержен воздействию агента, вызывающего заболевание, или предрасположен к заболеванию, заблаговременно до начала заболевания.
Термин «профилактика» связан с термином «предупреждение» и относится к мере или процедуре, целью которой является скорее предупреждение, чем лечение заболевания или исцеление. Неограничительные примеры профилактических мер могут включать введение вакцин; введение гепарина с низкой молекулярной массой пациентам клиники при риске тромбоза вследствие, например, иммобилизации и введение антималярийного агента, такого как хлорохин, заблаговременно до посещения географического региона, где малярия является эпидемическим заболеванием или велик риск заражения малярией.
Термин «терапия» или «лечение» некоторого заболевания или расстройства в одном варианте касается улучшения болезненного состояния или расстройства (т.е. задержки заболевания или снижения проявления, степени или тяжести, по меньшей мере, одного из его клинических симптомов). В другом варианте термин «терапия» или «лечение» касается улучшения, по меньшей мере, одного физического параметра, который может быть не заметен субъекту. Еще в одном варианте термин «терапия» или «лечение» касается модулирования заболевания или расстройства, физического (например, стабилизации заметного симптома), физиологического (например, стабилизации физического параметра) или обоих. В другом варианте "терапия" или "лечение” касается замедления прогрессирования заболевания.
Используемый здесь термин «рак» относится к злокачественному или доброкачественному росту клеток кожи или в органах тела, например, но не ограничиваясь этим, в молочной железе, простате, легких, почке, поджелудочной железе, желудке или кишечнике. Рак имеет тенденцию проникать в смежную ткань и распространяться (давать метастазы) в отдаленных органах, например костях, печени, легких или головном мозге. Используемый здесь термин “рак” включает оба типа клеток метастатических опухолей, таких (но не ограничиваясь этим) как меланома, лимфома, лейкемия, фибросаркома, рабдомиосаркома и мастоцитома, и таких типов карциномы тканей (но не ограничиваясь этим), как колоректальный рак, рак простаты, мелкоклеточный рак легких и немелкоклеточный рак легких, рак молочной железы, рак поджелудочной железы, рак мочевого пузыря, рак почек, рак желудка, глиобластома, первичный рак печени, рак яичников, рак простаты и лейомиосаркома матки.
Используемый здесь термин «агонист» применяют для описания типа соединения, которое связывается с рецептором и запускает реакцию сигнальной трансдукции. Способность изменять активность рецептора, известная также как агонистическая эффективность, относится к способности соединения индуцировать биологическую реакцию в его молекулярной мишени.
Используемый здесь термин «антагонист» применяют для описания соединения, которое само не провоцирует биологическую реакцию при связывании с рецептором, но блокирует или ослабляет агонист-опосредованные реакции.
Считают, что используемое здесь выражение «соединение(я) по изобретению» и эквивалентные выражения охватывают соединения формулы (формул), которые описаны здесь ранее, указанное выражение включает фармацевтически приемлемые соли и сольваты соединений или сольваты фармацевтически приемлемых солей, например гидраты, где контекст это допускает. Аналогично полагают, что ссылка на промежуточные продукты, заявлены они сами или нет, включает их соли и сольваты, где контекст это допускает.
Когда здесь указаны диапазоны, например (но без ограничения) C1-C6 алкил, то при упоминании диапазона должно быть обосновано представление каждого члена указанного диапазона.
Другие производные соединений по изобретению обладают активностью в обеих формах, в виде кислоты и производных кислоты, но кислоточувствительная форма часто предлагает преимущества растворимости, тканевой совместимости или замедленного высвобождения в организме млекопитающего (см. работу Bundgard, H., Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают производные кислот, хорошо известные профессионалам в данной области, такие как, например, сложные эфиры, получаемые взаимодействием исходной кислоты с подходящим спиртом, или амиды, получаемые взаимодействием исходного кислотного соединения с замещенным или незамещенным амином, или ангидриды кислот, или смешанные ангидриды. Особо полезными пролекарствами являются простые алифатические или ароматические сложные эфиры, амиды и ангидриды, производные кислотных групп, подвешенных на соединениях по изобретению. В некоторых случаях желательно получить пролекарства типа двойного сложного эфира, такие как (ацилокси)алкиловые сложные эфиры или ((алкоксикарбонил)окси)алкиловые сложные эфиры. Такие специфические пролекарства представляют собой C1-C8 алкиловые, C2-C8 алкениловые, ариловые, C7-C12 замещенные ариловые и C7-C12 арилалкиловые сложные эфиры соединений по изобретению.
Используемое здесь выражение «изотопный вариант» относится к соединению, которое содержит неприродные пропорции изотопов одного или более атомов, которые составляют такое соединение. Например, «изотопный вариант» соединения может содержать один или более нерадиоактивных изотопов, таких как, например, дейтерий (2H или D), углерод-13 (13C), азот-15 (15N) или подобные. Понятно, что в соединении, где произведено такое изотопное замещение, следующие атомы (где присутствуют) могут варьироваться, так, например, какой-либо атом водорода может представлять собой 2H/D, какой-либо атом углерода может представлять собой 13C или какой-либо атом азота может представлять собой 15N, и специалисты в данной области могут определить наличие и положение таких атомов. Также изобретение может включать получение изотопных вариантов с радиоизотопами, например, в случае когда результирующее соединение можно применять для исследований распределения в ткани лекарства и/или субстрата. Радиоактивные изотопы трития, т.е. 3H, и углерода-14, т.е. 14C, особенно полезны для этой цели с точки зрения простоты их включения и легкости детектирования. Кроме того, можно получить соединения, которые замещены позитрон-испускающими изотопами, такими как 11C, 18F, 15O, и были бы пригодны при исследованиях методом позитронной эмисионной топографии (PET) с целью исследования степени занятости рецепторов субстратом.
Предполагается, что все приведенные здесь изотопные варианты соединения по изобретению, радиоактивные или нерадиоактивные, включены в область соединений по изобретению, которая здесь определена.
Понятно также, что соединения, которые имеют одинаковые молекулярные формулы, но различаются по природе или последовательностью связывания атомов или расположением своих атомов в пространстве, называются «изомерами». Изомеры, которые различаются расположением своих атомов в пространстве, называются «стереоизомерами».
Стереоизомеры, которые не являются зеркальными изображениями друг друга, называются «диастереомерами», и те стереомеры, которые являются зеркальными изображениями, не совмещаемыми при наложении друг на друга, называются «энантиомерами». Если соединение имеет асимметрический центр, например, связанный с четырьмя различными группами, то возможна пара энантиомеров. Энантиомер может характеризоваться абсолютной конфигурацией его асимметрического центра, и его описывают по правилам R- и S-последовательности Кана и Прелога или способом, при котором молекула вращает плоскость поляризованного света, и означают как правовращающий или левовращающий (т.е. как (+) или (-)-изомеры, соответственно). Хиральное соединение может существовать в виде индивидуального энантиомера или смеси энантиомеров, содержащей равные пропорции энантиомеров, называемой «рацемической смесью».
Все стереоизомеры соединений включены в используемое здесь выражение “соединение по изобретению”. Соединение по изобретению обычно имеется в виде стереоизомеров по стереоцентру на имидазольном цикле. Для соединений, где имеется оптический центр, настоящее изобретение предусматривает использование либо энантиомера, либо рацемических смесей в любых пропорциях.
Термин «таутомеры» относится к соединениям, которые являются взаимозаменяемыми формами специфической структуры соединения и которые отличаются смещением атомов водорода и электронов. Таким образом, две структуры могут находиться в равновесии при движении π электронов и атома (обычно H). Например, енолы и кетоны являются таутомерами, так как они быстро взаимопревращаются при обработке кислотой или основанием. Другим примером таутомерии являются аци- и нитро-формы фенилнитрометана, которые также образуются при обработке кислотой или основанием.
Таутомерные формы могут быть существенными для достижения оптимальной химической реактивности и биологической активности представляющего интерес соединения. Используемое здесь выражение “соединение по изобретению” включает таутомерные формы раскрытых соединений.
СОЕДИНЕНИЯ
Настоящее изобретение касается имидазолидиновых производных и способов идентификации и конструирования таких соединений. В частности, настоящее изобретение касается соединения по изобретению, соответствующего приведенной ниже формуле Ia;
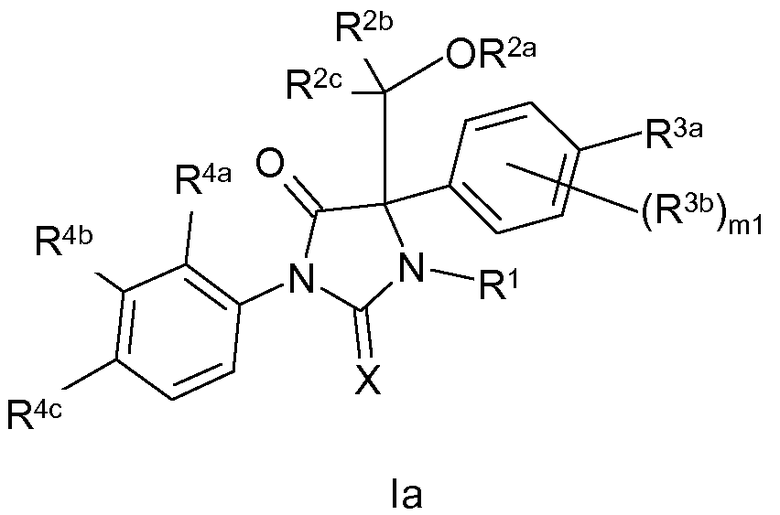
где
X означает O или S,
R1 означает H; или R1 выбран из C1-C6 алкила, C3-C7 циклоалкила, C3-C6 алкенила, C3-C6 алкинила и C1-C6 ацила; каждый из которых необязательно может быть замещен цианогруппой, одним или большим количеством атомов галогена, гидроксилов или незамещенных C1-C6 алкокси;
R2a выбран из H, S(O2)OH, P(O)(OH)2 и C(O)(CH2)n1C(O)OH; или R2a выбран из C1-C6 алкила, C1-C6 ацила и C3-C6 алкенила; каждый из которых необязательно может быть замещен арилом, амино или карбокси, n1 равно 0, 1, 2, 3 или 4;
каждый R2b и R2c независимо выбран из H и C1-C6 алкила; или R2b и R2c могут быть объединены вместе с образованием C3-C7 циклоалкила;
R3a означает H, атом галогена, циано или нитро; или R3a представляет собой C1-C6 алкил, необязательно замещенный атомом галогена, циано, нитро, гидроксилом или C1-C4 алкокси; или R3a представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R3b независимо представляет собой атом галогена, циано или нитро; или каждый R3b независимо представляет собой C1-C6 алкил, необязательно замещенный циано или атомом галогена; или каждый R3b представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R4a и R4b независимо представляет собой H, атом галогена, циано, карбокси или нитро; или каждый R4a и R4b выбран из C1-C6 алкила и C1-C6 алкокси; каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена или C1-C6 алкокси; или R4a и R4b объединены вместе с образованием 5- или 6-членного циклоалкила, 5- или 6-членного гетероциклоалкила, 5- или 6-членного арила или 5- или 6-членного гетероарила;
R4c означает атом галогена, циано или нитро; и
m1 равно 0, 1 или 2.
В частности, настоящее изобретение касается соединения по изобретению, соответствующего приведенной ниже формуле Ib:
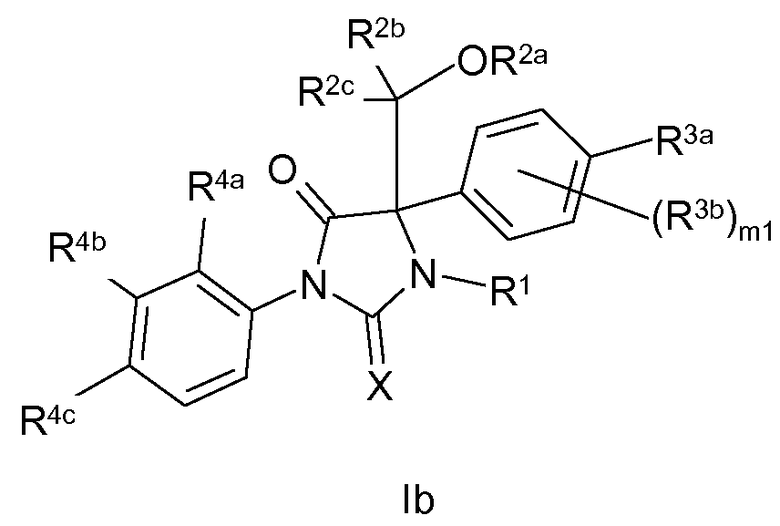
где
X означает O или S;
R1 означает H; или R1 выбран из C1-C6 алкила, C3-C7 циклоалкила, C3-C6 алкенила, C3-C6 алкинила и C1-C6 ацила; каждый из которых необязательно может быть замещен цианогруппой, одним или большим количеством атомов галогена, гидроксилов или C1-C6 алкокси;
R2a выбран из H, P(O)(OH)2 и C(O)(CH2)n1C(O)OH; или R2a выбран из C1-C6 ацила и C3-C6 алкенила; каждый из которых может быть необязательно замещен аминогруппой или карбокси; n1 равно 0, 1, 2, 3 или 4;
каждый R2b и R2c независимо выбран из H и C1-C6 алкила; или R2b и R2c могут быть объединены вместе с образованием C3-C7 циклоалкила;
R3a означает H, атом галогена, циано или нитро; или R3a представляет собой C1-C6 алкил, необязательно замещенный атомом галогена, циано, нитро, гидроксилом или C1-C4 алкокси; или R3a представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R3b независимо означает атом галогена, циано или нитро; или каждый R3b независимо представляет собой C1-C6 алкил, необязательно замещенный цианогруппой или атомом галогена; или каждый R3a представляет собой амидогруппу, необязательно замещенную C1-C6 алкилом;
каждый R4a и R4b независимо представляет собой H, атом галогена, циано, карбокси или нитро; или каждый R4a и R4b выбран из C1-C6 алкила и C1-C6 алкокси; каждый из которых необязательно может быть замещен одним или большим количеством атомов галогена или C1-C6 алкокси; или R4a и R4b объединены вместе с образованием 5- или 6-членного циклоалкила, 5- или 6-членного гетероциклоалкила, 5- или 6-членного арила или 5- или 6-членного гетероарила;
R4c означает атом галогена, циано или нитро; и
m1 равно 0, 1 или 2.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, X означает O.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает H.
Еще в одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает Me или Et.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2c означает C1-C6 алкил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2c означает H, Me или Et.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2b и R2c объединены вместе с образованием циклопропильного или циклобутильного кольца.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, каждый R2b и R2c означает H.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia, R2b означает H, S(O2)OH или P(O)(OH)2, C1-C6 алкил (причем C1-C6 алкил необязательно может быть замещен арилом) или C1-C6 ацил (причем C1-C6 ацил необязательно может быть замещен амино, карбокси).
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ib, R2a означает H, или P(O)(OH)2, или C1-C6 ацил (причем C1-C6 ацил может быть необязательно замещен амино, карбокси).
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia, R2a означает C1-C6 алкил, необязательно замещенный арилом.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает C1-C6 ацил, необязательно замещенный аминогруппой или карбокси.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает H.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает C3-C6 алкенил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает CH2-CH=CH2.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia, R2a означает бензил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia, R2a означает S(O2)OH или P(O)(OH)2.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia, R2a означает фармацевтически приемлемую соль S(O2)OH.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia, R2a означает S(O2)ONa.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ib, R2a означает P(O)(OH)2.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает фармацевтически приемлемую моно- или бис-соль P(O)(OH)2.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает P(O)(ONa)2.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает C(O)(CH2)n1C(O)OH и n1 равно 0, 1, 2 или 3.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает C(O)-CH2CH2-C(O)OH.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает фармацевтически приемлемую соль C(O)-CH2CH2-C(O)OH.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает C(O)-CH2CH2-C(O)ONa.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает C(O)-CH(iPr)NH2.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R2a означает C(O)-CH(iPr)NH3Cl.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает H.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает C1-C6 алкил, замещенный галогеном, цианогруппой или гидроксилом.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает C1-C6 алкил, замещенный цианогруппой.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает C 3 -C 6 алкинил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает -CH2-C≡CH.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает C1-C6 алкил.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает Me, Et, i-Pr или n-Pr.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R1 означает Me.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3a означает H, атом галогена, циано или нитро.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3a означает C1-C6 алкил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3a означает C1-C6 алкил, замещенный галогеном, циано, нитро, гидроксилом или C1-C4 алкокси.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3a означает амидогруппу.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3a означает амидогруппу, замещенную C1-C6 алкилом.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3b означает атом галогена, циано или нитро.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, m1 равно 0.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3b означает C1-C6 алкил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3b означает C1-C6 алкил, замещенный галогеном, цианогруппой.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3b означает амидо.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Ia или Ib, R3b означает амидогруппу, замещенную C1-C6 алкилом.
Что касается соединения по изобретению, соответствующего формуле Ia или Ib, в одном варианте соединение по изобретению соответствует формуле II:
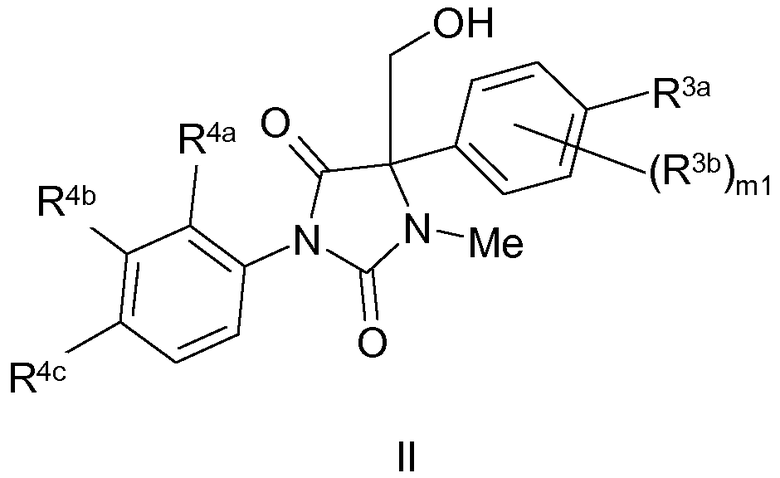
где R3a, R3b, R4a, R4b, R4c и m1 такие, как описано в любом из предыдущих абзацев.
В одном варианте применительно к соединению по изобретению, соответствующему формуле II, R4c означает циано, атом галогена или нитро.
В одном варианте применительно к соединению по изобретению, соответствующему формуле II, R4c означает циано.
В другом варианте применительно к соединению по изобретению, соответствующему формуле II, R4b означает H, атом галогена, циано, C1-C6 алкил или C1-C6 галогеналкил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле II, R4b означает Cl, F, CN или CF3.
Еще в одном варианте применительно к соединению по изобретению, соответствующему формуле II, R4b означает CF3.
В одном варианте применительно к соединению по изобретению, соответствующему формуле II, R4a означает H, атом галогена, циано, C1-C6 алкил или C1-C6 галогеналкил.
В другом варианте применительно к соединению по изобретению, соответствующему формуле II, R4a означает Cl или F.
Еще в одном варианте применительно к соединению по изобретению, соответствующему формуле II, R4a означает H.
Что касается соединения по изобретению, соответствующего формуле II, в одном варианте соединение по изобретению соответствует формуле IIIa или IIIb:
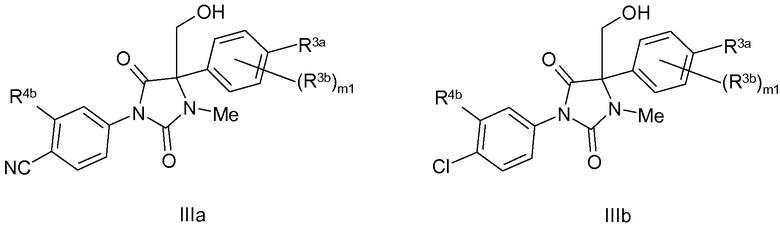
где R3a, R3b, R4b и m1 такие, как описано в любом из предыдущих абзацев.
В одном варианте применительно к соединению по изобретению, соответствующему формуле IIIa или IIIb, R4b означает H, атом галогена, циано, C1-C6 алкил или C1-C6 галогеналкил.
В предпочтительном варианте применительно к соединению по изобретению, соответствующему формуле IIIa или IIIb, R4b означает Cl, F, CN или CF3.
В более предпочтительном варианте применительно к соединению по изобретению, соответствующему формуле IIIa, R4b означает CF3.
В другом более предпочтительном варианте применительно к соединению по изобретению, соответствующему формуле IIIb, R4b означает Cl.
В одном варианте применительно к соединению по изобретению, соответствующему формуле II, соединение по изобретению соответствует формуле IVa или IVb:
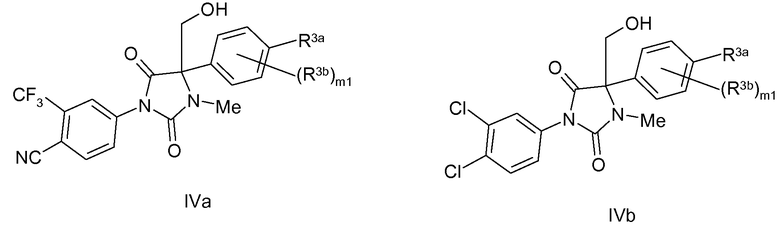
где R3a, R3b и m1 такие, как описано в любом из предыдущих абзацев.
В одном варианте применительно к соединению по изобретению, соответствующему формуле IVa или IVb, R3a означает H, атом галогена, циано, C1-C6 алкил или C1-C6 галогеналкил.
В предпочтительном варианте применительно к соединению по изобретению, соответствующему формуле IVa или IVb, R3a означает H, Me, Cl, F, CN или CF3.
В другом варианте применительно к соединению по изобретению, соответствующему формуле IVa или IVb, m1 равно 1 или 2.
В другом варианте применительно к соединению по изобретению, соответствующему формуле IVa или IVb, R3b означает атом галогена, циано, C1-C6 алкил или C1-C6 галогеналкил.
В предпочтительном варианте применительно к соединению по изобретению, соответствующему формуле IVa или IVb, R3b означает Me, Cl, F, CN или CF3.
В другом варианте применительно к соединению по изобретению, соответствующему формуле IVa или IVb, m1 равно 0.
В одном варианте, что касается соединения по изобретению формулы 1, соединение по изобретению соответствует формуле Va, Vb, Vc или Vd:
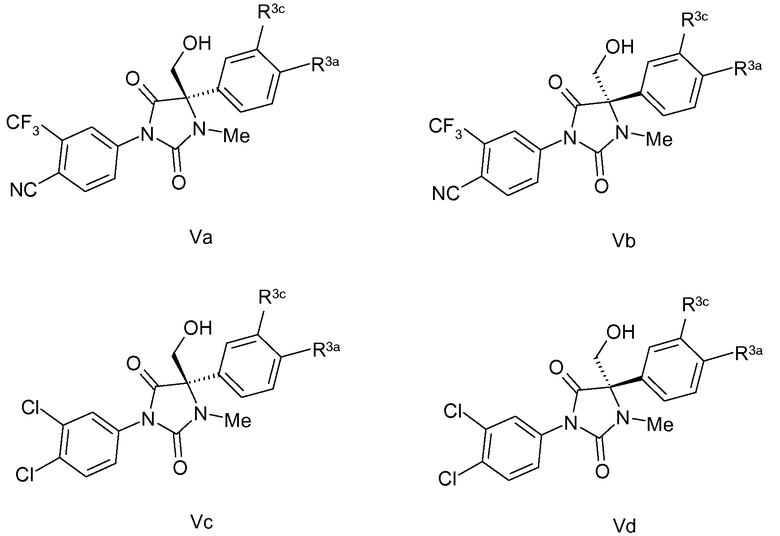
где R3a такой, как описано в любом из предыдущих абзацев;
R3c означает H, атом галогена, циано или нитро; или
R3c означает C1-C6 алкил, необязательно замещенный циано или атомом галогена; или R3c означает амидогруппу, необязательно замещенную C1-C6 алкилом.
Что касается соединения по изобретению формулы I, в одном варианте соединение по изобретению соответствует формуле Va.
Что касается соединения по изобретению формулы I, в одном варианте соединение по изобретению соответствует формуле Vb.
Что касается соединения по изобретению формулы I, в одном варианте соединение по изобретению соответствует формуле Vc.
Что касается соединения по изобретению формулы I, в одном варианте соединение по изобретению соответствует формуле Vd.
В одном варианте применительно к соединению по изобретению формулы Va, Vb, Vc или Vd, R3a означает H, атом галогена или циано; и R3c означает H.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Va, Vb, Vc или Vd, R3a означает H, CN, Cl или F; и R3c означает H.
В одном варианте применительно к соединению по изобретению, соответствующему формуле Va, Vb, Vc или Vd, R3a означает H; и R3c означает H, атом галогена, C1-C6 алкил, C1-C6 галогеналкил или циано.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Va, Vb, Vc или Vd, R3a означает H; и R3c означает CN, Cl, F, Me или CF3.
В другом варианте применительно к соединению по изобретению, соответствующему формуле Va, Vb, Vc или Vd, каждый R3a и R3c означает H.
В предпочтительном варианте, соединение по изобретению соответствует формуле Vb где R3a и R3c представляют собой H.
В другом предпочтительном варианте соединение по изобретению соответствует формуле Vd, где R3a и R3c представляют собой H.
В одном варианте соединение по изобретению выбрано из соединений по изобретению, перечисленных в таблице 1.
Еще в одном варианте соединения по изобретению представляют собой соединения формулы (VI):
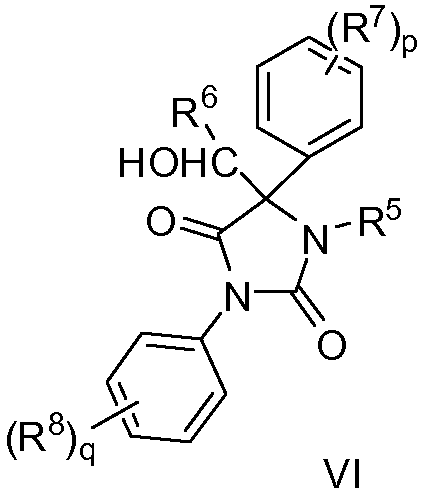
где
R5 означает H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, или R5 означает C1-C4 алкил, замещенный цианогруппой или одной или большим количеством галогеновых групп;
R6 означает C1-C4 алкил;
R7 означает атом галогена, циано, C1-C4 алкил или C1-C4 перфторалкил;
R8 означает атом галогена, циано, нитро, C1-C4 алкил или C1-C4 перфторалкил;
p равно 0, 1 или 2;
q равно 1, 2 или 3;
если p равно 2, то все R7 являются одинаковыми или разными;
если q равно 2 или 3, то все R7 являются одинаковыми или разными; и
их фармацевтически приемлемые эфиры.
В одном варианте предпочтительно, чтобы R6 представлял собой H.
В другом аспекте предпочтительно, чтобы R5 представлял собой метил или этил.
Предпочтительно также, чтобы R5 представлял собой пропинил.
В одном аспекте предпочтительно, чтобы p было равно 1. В этом аспекте предпочтительно, чтобы R7 представлял собой Cl или F.
Если p равно 1, то предпочтительно, чтобы R7 находился в пара-положении.
В другом аспекте предпочтительно, чтобы p было равно 0.
Особо предпочтительно, чтобы какая-либо перфторалкильная группа представляла собой трифторметильную группу.
В другом аспекте предпочтительно, чтобы q было равно 2. В этом варианте предпочтительно, чтобы каждый R8 был выбран из F, Cl, циано, трифторметила и метила.
Если q равно 2, то предпочтительно, чтобы один заместитель R8 находился в пара-положении, а другой - в мета-положении.
Если q равно 2, в одном варианте предпочтительно, чтобы каждый R8 представлял собой Cl. В другом варианте предпочтительно, чтобы каждый R8 был выбран из циано и трифторметила, и особо предпочтительно, чтобы первый R8 представлял собой пара-циано и второй R8 представлял собой мета-трифторметил.
Особо предпочтительным фармацевтически приемлемым эфиром является фосфат.
Особо предпочтительным фармацевтически приемлемым эфиром является гемисукцинат.
Особо предпочтительным фармацевтически приемлемым эфиром является валинат.
Еще в одном аспекте настоящее изобретение касается соединения по изобретению формулы (VII):
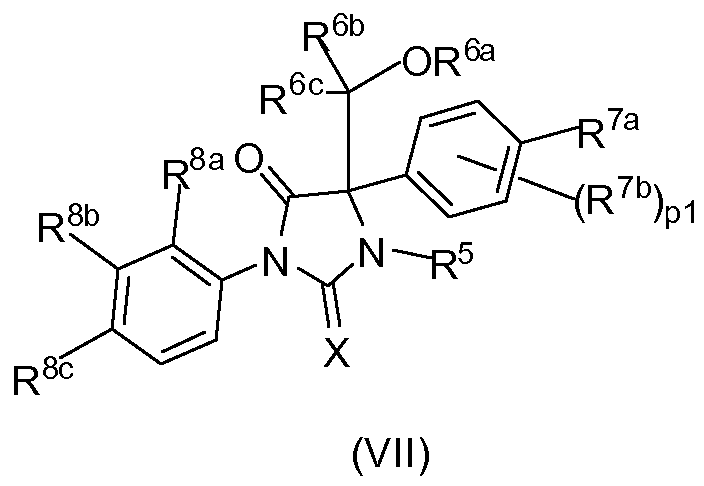
где
X означает O;
R5 означает H, C1-C6 алкил, C3-C6 алкенил или C3-C6 алкинил, каждый из которых может быть незамещенным или замещенным цианогруппой, одним или большим количеством атомов галогена;
R6a означает H, или фосфорный эфир, или его производное, или эфир карбоновой кислоты и предпочтительно P(O)(OH)2, C(=O)-(CH2)2-CO2H или -C(=O)CH(NH3Cl)iPr;
R6b означает H;
R6c независимо выбран из H и C1-C6 алкила;
R7a означает H, атом галогена, циано, C1-C4 алкил, который может быть незамещенным или замещенным одним или большим количеством атомов галогена;
R7b означает атом галогена, циано или C1-C4 алкил, который может быть незамещенным или замещенным атомом галогена; каждый R8a и R8b независимо представляет собой H, атом галогена, циано, C1-C4 алкил, каждый из которых может быть незамещенным или замещенным одним или большим количеством атомов галогена;
R8c означает атом галогена, циано или нитро; и
p1 равно 0, 1 или 2.
В отдельном аспекте R6c выбран из H и C1-C4 алкила.
В отдельном аспекте R7a выбран из H, атома галогена и циано.
В отдельном аспекте R7a означает C1-C4 алкил.
В отдельном аспекте R7a означает C1-C4 алкил, замещенный одним или большим количеством атомов галогена.
В отдельном аспекте R7a означает CF3.
В отдельном аспекте R7b выбран из атома галогена, циано или C1-C4 алкила, который может быть незамещенным или замещенным одним или большим количеством атомов галогена.
В отдельном аспекте каждый R8a и R8b независимо представляет собой H, атом галогена, циано или C1-C4 алкил, который может быть незамещенным или замещенным одним или большим количеством атомов галогена.
В отдельном аспекте R6c означает H.
В отдельном аспекте R6a означает H.
В отдельном аспекте R6a означает P(O)(OH)2.
В отдельном аспекте R5 означает метил или этил.
Еще в одном специфическом аспекте R5 означает пропинил.
В отдельном аспекте p1 равно 0.
В отдельном аспекте R7a означает Cl или F.
В отдельном аспекте R7a означает H.
В других специфических аспектах, где алкильная группа является замещенной атомом галогена, галоген представляет собой F. Еще в одном специфическом аспекте замещенная алкильная группа представляет собой трифторметильную группу.
В отдельном аспекте каждый R8a и R8b выбран из F, Cl, циано, нитро, трифторметила и метила, и R8c выбран из F, Cl, циано и нитро.
В отдельном аспекте R8a означает H.
В отдельном аспекте R8b и R8c означают Cl. В другом варианте R8b и R8c выбраны из циано и трифторметила, и в специфическом варианте R8c означает циано и R8b означает трифторметил.
Предпочтительные соединения по изобретению выбраны из следующих:
4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(1-гидроксипропил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(1-гидроксиэтил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(4-фторфенил)-4-(гидроксиметил)-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(4-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил)-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(4-фторфенил)-4-гидроксиметил-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(3-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил)-2-трифторметилбензонитрил;
(S)-4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
(R)-4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-3-этил-4-(гидроксиметил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(4-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил)-2-трифторметилбензонитрил;
4-[4-(3-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил)-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-трифторметилфенил)имидазолидин-1-ил)-2-трифторметилбензонитрил;
1-(3,4-дихлорфенил)-4-гидроксиметил-3-метил-4-фенилимидазолидин-2,5-дион;
4-[2,5-диоксо-4-(гидроксиметил)-3-(1-метилэтил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[3-цианометил-2,5-диоксо-4-(гидроксиметил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(гидроксиметил)-4-фенил-3-(1-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-метилфенил)имидазолидин-1-ил)-2-трифторметилбензонитрил;
4-[4-(2-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил)-2-трифторметилбензонитрил;
[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил дигидрофосфат;
4-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-4-оксобутановая кислота;
(2S)-1-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-3-метил-1-оксобутан-2-аминий хлорид;
4-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-4-оксобутановая кислота;
(S)-(1-(4-циано-3-(трифторметил)фенил)-3-метил-2,5-диоксо-4-фенилимидазолидин-4-ил)метил дигидрофосфат;
(S)-4-((1-(4-циано-3-(трифторметил)фенил)-3-метил-2,5-диоксо-4-фенилимидазолидин-4-ил)метокси)-4-оксобутановая кислота.
В одном варианте соединение по изобретению, соответствующее любому из описанных здесь вариантов, не является изотопным вариантом.
Что касается соединения формулы I, в одном варианте соединение выбрано из соединений, перечисленных в таблице 1.
В одном аспекте соединение по изобретению, соответствующее любому из описанных здесь вариантов, присутствует как свободное основание.
В одном аспекте соединение по изобретению, соответствующее любому из описанных здесь вариантов, представляет собой фармацевтически приемлемую соль.
В одном аспекте соединение по изобретению, соответствующее любому из описанных здесь вариантов, представляет собой сольват.
В одном аспекте соединение по изобретению, соответствующее любому из описанных здесь вариантов, представляет собой сольват фармацевтически приемлемой соли.
Несмотря на то что указанные для каждого варианта группы в основном отдельно перечислены выше, соединение по изобретению включает соединение, в котором несколько или каждый вариант в приведенной выше формуле, а также других присутствующих здесь формулах выбран из одного или большего количества специфических членов или групп, соответственно указанных, для каждой переменной. Таким образом, предполагается, что это изобретение включает в свою область все комбинации таких вариантов.
Настоящее изобретение касается применения соединения по изобретению, которое определено выше, для профилактики или лечения кахексии.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
При использовании в качестве фармацевтических средств соединение по изобретению обычно вводят в виде фармацевтической композиции. Такие композиции можно получить способом, хорошо известным в фармацевтической области, и они содержат, по меньшей мере, одно активное соединение. В основном, соединение по изобретению вводят в фармацевтически эффективном количестве. Фактически вводимое количество соединения обычно определяется лечащим врачом в свете относящихся к делу обстоятельств, включающих подлежащее лечению состояние, выбранный способ введения, фактически вводимое соединение, возраст, массу и индивидуальную реакцию пациента, тяжесть симптомов пациента.
Фармацевтические композиции по этому изобретению можно вводить различными способами, в том числе пероральным, ректальным, трансдермальным, подкожным, внутрисуставным, внутривенным, внутримышечным и внутриносовым. В зависимости от предполагаемого способа доставки, соединения по изобретению предпочтительно готовят в виде композиций для инъекций или перорального введения или в виде мазей, лосьонов или пластырей (все препараты для трансдермального введения).
Композиции для перорального введения могут иметь вид объемных жидких растворов или суспензий или объемных порошков. Однако чаще для облегчения точного дозирования композиции представляют в виде стандартных дозированных форм. Выражение "стандартные дозированные формы" относится к физически дискретным единицам, подходящим в качестве стандартных доз для субъектов-людей и других млекопитающих, причем каждая единица содержит предварительно определенное количество активного вещества, рассчитанное таким образом, чтобы производить требуемый терапевтический эффект, в сочетании с подходящим фармацевтическим наполнителем, разбавителем или носителем. Типичные стандартные дозированные формы включают предварительно заполненные жидкими композициями мерные ампулы или шприцы или в случае твердых композиций пилюли, таблетки, капсулы или подобное. В таких композициях активное соединение обычно является меньшим компонентом (примерно от 0,1 примерно до 50% мас. или предпочтительно примерно от 1 примерно до 40% мас.), остальное количество составляют различные разбавители или носители и технологические добавки, полезные для получения требуемой дозированной формы.
Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный носитель с буферными, суспендирующими и диспергирующими агентами, красителями, ароматизаторами и подобным. Твердые формы могут включать, например, любые из следующих ингредиентов или соединения аналогичной природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза; разрыхлитель, такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния; вещество, способствующее скольжению, такое как коллоидный диоксид кремния; подслащающий агент, такой как сахароза или сахарин; или ароматизатор, такой как мята перечная, метилсалицилат или ароматизатор апельсиновый.
Композиции для инъекций обычно имеют в качестве основы стерильный физиологический раствор для инъекций, или физиологический раствор с фосфатным буфером, или другие носители для инъекций, известные в данной области. Как и выше, активное соединение в таких композициях обычно является меньшим компонентом, часто составляя примерно от 0,05 до 10% мас., при этом остальное количество составляет носитель для инъекций и подобное.
Трансдермальные композиции обычно получают в виде мази или крема локального действия, содержащего активный ингредиент(ы), как правило, в количестве примерно от 0,01 примерно до 20% мас., предпочтительно примерно от 0,1 примерно до 20% мас., предпочтительно примерно от 0,1 примерно до 10% мас. и более предпочтительно примерно от 0,5 примерно до 15% мас. При получении мази активные ингредиенты обычно объединяют с парафиновой или смешивающейся с водой основой мази. По-другому, можно получать препараты активных ингредиентов в виде крема, например, применяя основу для крема типа «масло в воде». Такие трансдермальные препараты хорошо известны в данной области и, как правило, включают дополнительные ингредиенты для усиления кожной проницаемости, стабильности активных ингредиентов или препарата. Все такие известные трансдермальные препараты и ингредиенты включены в область этого изобретения.
Соединения по изобретению также можно вводить при помощи устройства для трансдермального введения. Следовательно, трансдермальное введение можно выполнять, применяя пластырь, или резервуар, или пористую мембрану, или разнообразные твердые матрицы.
Описанные выше компоненты для композиций, вводимых перорально, посредством инъекций или вводимых локально, являются только типичными. Другие материалы, а также методики обработки и подобное изложены в части 8 работы Remington's Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, которая включена здесь в виде ссылки.
Соединения по изобретению также можно вводить в виде форм с длительным высвобождением или из систем доставки лекарств с длительным высвобождением. Описание типичных материалов с длительным высвобождением можно найти в Remington's Pharmaceutical Sciences.
Следующие примеры препаратов иллюстрируют типичные фармацевтические композиции, которые можно получить согласно данному изобретению. Однако настоящее изобретение не ограничено приведенными далее фармацевтическими композициями.
Препарат 1 - таблетки
Соединение по изобретению в виде сухого порошка можно смешать с сухим связующим желатином при массовом соотношении примерно 1:2. Можно добавить в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в виде 240-270 мг таблеток (80-90 мг активного соединения на таблетку) на прессе для получения таблеток.
Препарат 2 - капсулы
Соединение по изобретению в виде сухого порошка можно смешать с разбавителем крахмалом при массовом соотношении примерно 1:1. Смесью можно заполнить 250 мг капсулы (125 мг активного соединения на капсулу).
Препарат 3 - жидкость
Соединение по изобретению (125 мг) можно смешать с сахарозой (1,75 г) и ксантановой смолой (4 мг), и результирующую смесь можно перемешать, пропустить через сито №10 меш США и затем смешать с приготовленным заранее раствором микрокристаллической целлюлозы и натрийкарбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг), ароматизатор и краситель разбавляют водой и добавляют при перемешивании. Затем добавляют при перемешивании достаточное количество воды. Затем добавляют воду в количестве, достаточном для получения объема 5 мл.
Препарат 4 - таблетки
Соединение по изобретению в виде сухого порошка можно смешать с сухим связующим желатином при массовом соотношении примерно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в виде 450-900 мг таблеток (150-300 мг активного соединения) на прессе для получения таблеток.
Препарат 5 - для инъекций
Соединение по изобретению можно растворить или суспендировать в водной среде для инъекций - стерильном физиологическом растворе с буфером - до концентрации примерно 5 мг/мл.
Препарат 6 - для локального применения
Стеариловый спирт (250 г) и медицинский вазелин (250 г) можно расплавить примерно при 75°C, и затем можно добавить смесь соединения по изобретению (50 г), метилпарабена (0,25 г), пропилпарабена (0,15 г), лаурилсульфата натрия (10 г) и пропиленгликоля (120 г), растворенных в воде (примерно 370 г), и результирующую смесь перемешивают до затвердевания.
СПОСОБЫ ЛЕЧЕНИЯ
Настоящее изобретение касается новых имидазолидиновых соединений, которые модулируют активность андрогенных рецепторов. Эти соединения можно применять для лечения и/или профилактики ряда расстройств, как будет обсуждено ниже с дополнительными подробностями. Специалистам в данной области понятно, что активность соединения по изобретению как антагониста (полного или частичного) или агониста (полного или частичного) представляет непрерывный спектр. Следовательно, притом что некоторые соединения будут очевидными агонистами или очевидными антагонистами, некоторые соединения будут демонстрировать оба типа активности, агонистическую и антагонистическую. Эти соединения со смешанными активностями потенциально применимы для лечения разнообразных расстройств. Здесь в примере приведены подробности, как относительные активности соединения по изобретению можно идентифицировать и классифицировать в качестве агонистов, антагонистов или смешанных агонистов/антагонистов. Таким образом, понятно, что специалисты в данной области вполне способны применять свои обычные общие знания в совокупности с приведенной здесь в примерах информацией для выяснения, является ли конкретное соединение по изобретению агонистом, антагонистом или смешанным агонистом/антагонистом, и, следовательно, выяснения соответствующих применений указанного соединения.
Соединение по изобретению может демонстрировать хорошую абсорбцию, хороший период полураспада, хорошую растворимость, хорошую биологическую доступность, низкую аффинность связывания белка, меньшее межлекарственное взаимодействие и хорошую метаболическую стабильность. В отдельном аспекте соединение по настоящему изобретению демонстрирует неожиданные значительные улучшения фармакологических свойств, в частности улучшенную биологическую доступность. Если соединение по изобретению демонстрирует какое-либо одно или более из этих улучшений, это может повлиять на его применение при описанных здесь состояниях. Например, если соединение по изобретению демонстрирует повышенную биодоступность, то предполагается, что соединение по изобретению можно вводить при меньшей дозе, снижая, таким образом, возможность возникновения любых нежелательных побочных эффектов. Аналогично, улучшения других перечисленных выше свойств также дают преимущества потенциальных применений соединений по изобретению.
Настоящие соединения пригодны в качестве терапевтических агентов для лечения состояний, которые обусловлены или свойственны изменению уровней циркулирующих андрогенов у млекопитающих. Таким образом, в одном аспекте настоящее изобретение касается соединения по изобретению для применения в медицине.
В одном варианте настоящее изобретение касается соединения по изобретению для применения с целью профилактики и/или лечения возрастных заболеваний, включающих, но не ограниченных этим, саркопению, состояния кахексии и потерю мышечной массы, вызванную заболеваниями, включающими, но не ограниченными этим, рак и СПИД, или индуцированных термическими ожогами или длительной иммобилизацией; и заболеваний костей и суставов, таких как остеопороз, снижение либидо и сексуальная дисфункция или анемия. В отдельном аспекте этого варианта соединение по изобретению представляет собой агонист или смешанный агонист/антагонист AR.
Еще в одном варианте настоящее изобретение касается способа лечения и/или предупреждения возрастных заболеваний, включающих, но не ограниченных этим, саркопению, состояния кахексии и потерю мышечной массы, вызванную заболеваниями, включающими, но не ограниченными этим, рак и СПИД, заболеваний костей и суставов, таких как остеопороз, снижение либидо и сексуальная дисфункция или анемия, причем указанный способ включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по изобретению или фармацевтической композиции по изобретению. В отдельном аспекте этого варианта соединение по изобретению представляет собой агонист или смешанный агонист/антагонист AR, или фармацевтическая композиция содержит агонист или смешанный агонист/антагонист AR.
В одном варианте настоящее изобретение касается соединения по изобретению для применения с целью профилактики и/или лечения андроген-зависимой опухоли, такой как рак простаты или гиперплазия. В отдельном аспекте этого варианта соединение по изобретению представляет собой антагонист AR.
В другом варианте настоящее изобретение касается способа лечения и/или профилактики андроген-зависимой опухоли, например рака простаты или гиперплазии, причем указанный способ включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по изобретению или фармацевтической композиции по изобретению. В отдельном аспекте этого варианта соединение по изобретению представляет собой антагонист AR, или фармацевтическая композиция содержит антагонист AR.
В одном аспекте настоящее изобретение касается соединения по изобретению, которое представляет собой антагонист андрогенного рецептора, соответствующий любой из приведенных выше формул I-VII, где значение KSchild ниже 1 мкМ, для применения с целью профилактики или лечения андроген-зависимой опухоли, например рака простаты или гиперплазии.
В одном аспекте настоящее изобретение касается способа лечения и/или профилактики андроген-зависимой опухоли, например рака простаты или гиперплазии, причем указанный способ включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по изобретению, соответствующего любой из приведенных выше формул I-VII, где указанное соединение по изобретению представляет собой антагонист андрогеного рецептора, у которого значение KSchild ниже 1 мкМ.
В одном аспекте настоящее изобретение касается соединения по изобретению которое представляет собой агонист андрогенного рецептора или смешанный агонист/антагонист, соответствующий любой из приведенных выше формул I-VII, где значения EC50 и KSchild оба ниже 1 мкМ, для применения с целью профилактики или лечения возрастных заболеваний, включающих, но не ограниченных этим, саркопению, состояния кахексии и потерю мышечной массы, вызванную заболеваниями, включающими, но не ограниченными этим, рак и СПИД, и заболеваний костей и суставов, таких как остеопороз, снижение либидо и сексуальная дисфункция или анемия.
В одном аспекте настоящее изобретение касается способа лечения и/или профилактики возрастных заболеваний, включающих, но не ограниченных этим, саркопению, состояния кахексии и потерю мышечной массы, вызванную заболеваниями, включающими, но не ограниченными этим, рак и СПИД, и заболеваний костей и суставов, таких как остеопороз, снижение либидо и сексуальная дисфункция или анемия, причем указанный способ включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по изобретению, соответствующего любой из приведенных выше формул I-VII, где указанное соединение по изобретению представляет собой агонист андрогенного рецептора или смешанный агонист/антагонист, у которого значения EC50 и KSchild оба ниже 1 мкМ.
Трансдермальные дозы обычно выбирают так, чтобы обеспечить такие же или меньшие уровни в крови, чем достигаются при применении доз, вводимых посредством инъекции.
Если соединения по этому изобретению применяют для предупреждения состояния саркопении, то обычно их вводят пациенту с риском развития данного состояния по рекомендации и под наблюдением лечащего врача при описанных выше уровнях доз. Пациенты с риском развития специфического состояния, как правило, включают пожилых людей, у которых в результате снижения мышечной массы происходят потеря подвижности или затруднения движения.
Если соединения по этому изобретению применяют для предупреждения состояния остеопороза, то обычно их вводят пациенту с риском развития данного состояния по рекомендации и под наблюдением лечащего врача при описанных выше уровнях доз. Пациенты с риском развития специфического состояния, как правило, включают пожилых людей, у которых снижение плотности костей может вызывать повышенные риски переломов.
Если соединения по этому изобретению применяют для предупреждения состояния кахексии, возникающего в результате первичного недуга, например, но не ограничиваясь этим, рака, ВИЧ, стабильной хронической обструктивной болезни легких (COPD), застойной сердечной недостаточности или последней стадии почечной недостаточности, то обычно их вводят пациенту по рекомендации и под наблюдением лечащего врача при описанных выше уровнях доз. Типичные пациенты, как правило, включают пациентов, проходящих лечение по поводу рака, ВИЧ или СПИД.
Соединение по изобретению можно вводить в виде одного активного агента, или можно вводить его в комбинации с другими терапевтическими агентами, в том числе с другими соединениями, которые демонстрируют такую же или аналогичную терапевтическую активность и для которых определено, что они являются безопасными и эффективными при таком комбинированном введении. В специфическом варианте, совместное введение двух (или более) агентов позволяет лечение первичного состояния и связанных с ним побочных эффектов.
В одном варианте соединение по изобретению вводят совместно с другим терапевтическим агентом с целью лечения и/или профилактики состояния саркопении; конкретные агенты включают, но не ограничены этим, тестостерон, коротиноиды, андрогены, SARM и инсулин-подобный фактор роста 1.
В одном варианте соединение по изобретению вводят по другой терапевтической схеме с целью лечения и/или профилактики состояния саркопении; специфические схемы включают, но не ограничены этим, физические упражнения, сами по себе или в комбинации с креатининмоногидратом или пищевыми белками.
В одном варианте соединение по изобретению вводят совместно с другим терапевтическим агентом с целью лечения и/или профилактики остеопороза; конкретные агенты включают, но не ограничены этим, бисфосфонаты (алендронат, ризедронат, ибендронат натрия или золедроновую кислоту), терипаратид, ранелат стронция, агенты для гормонозаместительной терапии (ралоксифен), добавки с кальцием или витамином D.
В одном варианте соединение по изобретению вводят совместно с другим терапевтическим агентом с целью лечения и/или профилактики кахексии; конкретные агенты включают, но не ограничены этим, стимуляторы аппетита/противорвотные средства (например, но без ограничения, мегестролацетат, тетрагидроканнабинол), ACE-ингибиторы, бета-блокаторы, анаболики (например, но без ограничения, оксандролон, нандролон, грелин).
В одном варианте соединение по изобретению вводят совместно с другим терапевтическим агентом с целью лечения и/или профилактики ВИЧ-индуцированной кахексии; конкретные агенты включают, но не ограничены этим, нуклеотидные агналоги - ингибиторы обратной транскриптазы (NtARTI или NtRTI) (например, но без ограничения, Tenofovir®, Adefovir®), ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) (например, но без ограничения, Efavirenz®, Nevirapine®, Delavirdine®, Etravirine®), ингибиторы протеазы (например, но без ограничения, Saquinavir®, Ritonavir®, Indinavir®, Nelfinavir®, Amprenavir®, Lopinavir®, Atazanavir®, Fosamprenavir®, Tipranavir®, Darunavir®), ингибиторы проникновения (например, но без ограничения, Maraviroc®, Enfuvirtide®) или ингибиторы интегразы (например, но без ограничения, ралтегравир).
В одном варианте соединение по изобретению вводят совместно с другим терапевтическим агентом с целью лечения и/или профилактики кахексии, индуцированной застойной сердечной недостаточностью; конкретные агенты включают, но не ограничены этим, пероральные петлевые диуретики (фуросемид, торсемид или буметамид), бета-блокаторы (бисопрол, карведилол и метопролол с длительным высвобождением), ACE-ингибиторы (каптоприл, зофеноприл, эналаприл, рамиприл, хинаприл, периндоприл, лизиноприл, беназеприл или фозиноприл), антагонисты рецепторов ангиотензина II (кандесартан) или сосудорасширяющие агенты.
В одном варианте соединение по изобретению вводят совместно с другим терапевтическим агентом с целью лечения и/или профилактики кахексии, индуцированной последней стадией почечной недостаточности; конкретные агенты включают, но не ограничены этим, ACE-ингибиторы (каптоприл, зофеноприл, эналаприл, рамиприл, хинаприл, периндоприл, лизиноприл, беназеприл или фозиноприл), антагонисты рецепторов ангиотензина II (кандесартан), витамин D3 или кальций в ассоциации с фосфатными связующими.
Как очевидно специалисту, при совместном введении включают любые средства доставки пациенту двух или более терапевтических агентов как часть упоминаемой выше схемы лечения. Пока два или более агентов можно вводить одновременно в едином препарате, это не существенно. Агенты можно вводить в виде разных препаратов и в разное время.
ОБЩИЕ СИНТЕТИЧЕСКИЕ МЕТОДИКИ
Общее
Соединения по изобретению можно получить из легкодоступных исходных веществ, применяя следующие общие способы и методики. Понятно, что если даны типичные или предпочтительные условия процесса (т.е. реакционные температуры, времена, мольные соотношения реагентов, растворители, давления и др.), то также можно применять другие условия процесса, пока не указано по-другому. Оптимальные реакционные условия можно варьировать в зависимости от специфических реагентов или используемого растворителя, но специалист в данной области может определить такие условия посредством рутинных методик оптимизации.
Кроме того, как ясно специалистам в данной области, для предотвращения нежелательных взаимодействий определенных функциональных групп могут быть необходимы обычные защитные группы. Выбор подходящей защитной группы для специфической функциональной группы, а также подходящие условия введения и удаления защиты хорошо известны в данной области. Например, многочисленные защитные группы и их введение и удаление описаны в работе T. W. Greene and P. G. M. Wuts, Защитные группы в органическом синтезе, издание второе, Wiley, New York, 1991, и цитированных в ней ссылках.
Следующие способы представлены с подробностями в отношении получения типичных соединений, которые перечислены здесь выше. Специалист в данной области органического синтеза может получить соединение по изобретению из известных или коммерчески доступных исходных материалов и реагентов.
Все реагенты имеют коммерческую степень чистоты и, пока не указано по-другому, используются, как принято, без дополнительной очистки. Для взаимодействий, проводимых в инертной атмосфере, используют коммерчески доступные безводные растворители. В других случаях используют растворители реагентной степени чистоты, пока не указано по-другому. Колоночную хроматографию выполняют на силикагеле 60 (35-70 мкм). Тонкослойную хроматографию проводят, используя пластины с предварительно нанесенным покрытием из силикагеля F-254 (толщина 0,25 мм), 1H ЯМР спектры регистрируют на ЯМР-спектрометре Bruker DPX 400 (400 МГц). Химические сдвиги (δ) для 1H ЯМР-спектров выражают в миллионных долях (м.д.) относительно тетраметилсилана (δ 0,00) или соответствующего пика остаточных протонов растворителя, т.е. CHCl3 (δ 7,27), как внутреннего стандарта. Мультиплетность выражают как синглет (с), дублет (д), триплет (т), квартет (кв), мультиплет (м) и широкий (ш.) сигнал. Константы взаимодействия (J) даны в Гц. Масс-спектры с электрораспылением (МС) получены на ЖХМС-спектрометре Micromass. Для всех ЖХМС анализов использовали колонку: Chromolith Performance RP-18 100 мм ×3 мм (Merck AG). Во всех способах применяли следующий градиент:
растворитель A: MeCN; растворитель B: H2O, оба растворителя содержат 0,1% муравьиной кислоты;
градиент: от 100% B до 0% B, от 0 до 3,5 мин; 0% B, от 3,5 до 4,5 мин; от 0% до 100% B, от 4,5 до 4,6 мин; 100% B от 4,6 до 5 мин. Скорость потока: 2,5 мл/мин.
Перечень используемых в экспериментальной секции сокращений:
ОБЩИЕ ПРОЦЕДУРЫ
Общая схема
Соединения по изобретению можно получить согласно следующим методикам.
Способ A. Схема 1
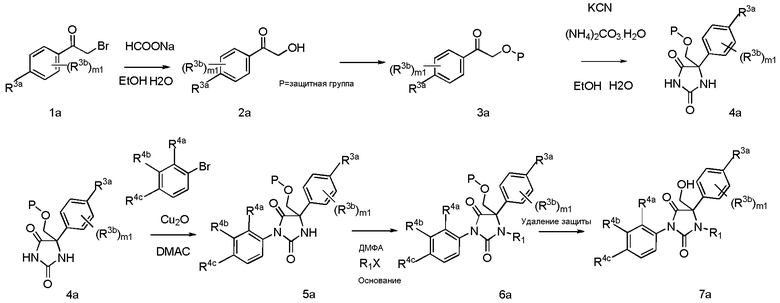
Способ B. Схема 2
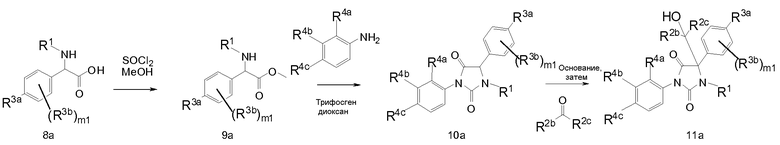
Пример 1: 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил (способ A)
Стадия 1: 1-фенил-2-(2-пропенилокси)этанон
Это соединение получают из 2-гидрокси-1-фенилэтанона согласно методике, используемой в работе G.A, Molander и J.A. McKie для 1-гидрокси-2-бутанона, J. Org. Chem. (1995), 60, 872-882.
Стадия введения защиты (необязательная)
1-Гидрокси-2-бутанон можно защитить при помощи различных хорошо известных групп согласно рутинным методикам, хорошо известным специалистам в данной области. Например, 2-(трет-бутилдиметилсиланилокси)-1-фенилэтанон получают количественно, смешивая 1-гидрокси-2-бутанон, tBDMSCl и имидазол в ДМФА (см. ссылку 10). Затем используют этот промежуточный продукт, как описано на следующих стадиях.
Стадия 2: 4-фенил-2-(пропенилокси)имидазолидин-2,5-дион
0,775 г 1-фенил-2-(2-пропенилокси)этанона, 0,575 г цианида калия и 1,6 г карбоната аммония нагревают до 55°C в течение 3 час в 23 мл смеси этанол/вода 50/50. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический раствор промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия и выпаривают, получая требуемый продукт (бледно-желтое твердое вещество).
ТСХ: Fr=0,42 (гептан/этилацетат 50/50).
1H ЯМР (CD3OD): δ 3,68 (д, 1H); 4,13 (м, 3H); 4,22 (д, 1H); 4,92 (с, 2H); 5,22 (дд, 1H); 5,34 (дд, 1H); 5,95 (ддт, 1H); 7,45 (м, 3H); 7,64 (д, 2H).
ЖХМС: (Rt=5,79 мин): 288+ (MH, MeCN+).
Стадия 3: 4-[2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]-имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 0,47 г 4-фенил-2-(пропенилокси)имидазолидин-2,5-диона в 30 мл диметилацетамида добавляют 0,28 г оксида меди(I) и 0,81 г 4-бром-2-трифторметилбензонитрила. Смесь нагревают при 160°C в течение 3 час. При комн. т. смесь разбавляют 50% водным раствором аммиака и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30 и получая требуемый продукт.
ТСХ: Fr=0,30 (гептан/этилацетат 70/30).
1H ЯМР (CDCl3): δ 3,86 (д, 1H); 4,14 (с, 2H); 4,27 (д, 1H); 5,28 (д, 1H); 5,32 (д, 1H); 5,89 (ддт, 1H); 7,52 (м, 3H); 7,70 (м, 2H); 7,98 (м, 2H); 8,14 (м, 1H).
ЖХМС: (Rt=6,91 мин); 414- (M-H-).
Стадия 4: 4-[2,5-диоксо-3-метил-4-фенил-4-[(2-пропенилокси)метил] имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 0,86 г 4-[2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила и 0,26 мл йодметана в 30 мл ДМФА добавляют 430 мг карбоната калия. Смесь перемешивают при комн. т. в течение 5 час, выпаривают досуха, разбавляют водой и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30 и получая требуемый продукт.
ТСХ: Fr=0,37 (гептан/этилацетат 70/30).
1H ЯМР (CDCl3): δ 3,07 (с, 3H); 3,98 (д, 1H); 4,14 (широкий с, 2H); 4,44 (д, 1H); 5,28 (д, 1H); 5,32 (д, 1H); 5,87 (ддт, 1H); 7,39 (м, 2H); 7,49 (м, 3H); 7,92 (д, 1H); 8,00 (д, 1H); 8,13 (м, 1H).
ЖХМС: (Rt=7,11 мин): 471+ (MH, MeCN+).
Стадия 5: 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметил-бензонитрил
К раствору 0,52 г 4-[2,5-диоксо-3-метил-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в 40 мл дихлорметана добавляют 2 мл комплекса трифторборан-диметилсульфид в 10 мл дихлорметана. Смесь перемешивают при комн. т. в течение 3 час, выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30 и получая требуемый продукт.
Т.пл.=160°C.
ТСХ: Fr=0,33 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 3,09 (с, 3H); 4,18 (д, 2H); 4,73 (д, 1H); 7,38 (м, 2H); 7,50 (м, 3H); 7,93 (д, 1H); 8,02 (д, 1H); 8,17 (м, 1H).
ЖХМС: (Rt=6,53 мин): 358- (M-CH2OH-).
Примеры 2 и 3: 4-[2,5-диоксо-4-(1-гидроксипропил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметил-бензонитрил (способ B)
Стадия 1: метил 2-метиламино-2-фенилацетат
6,63 мл тионилхлорида медленно добавляют к раствору 1,5 г 2-метиламино-2-фенилуксусной кислоты в 100 мл метанола. Смесь является гетерогенной и становится прозрачной после двух часов перемешивания. Смесь перемешивают в течение 48 час при комн. т., затем растворитель выпаривают досуха. Сырой продукт разбавляют водным раствором бикарбоната натрия и экстрагируют этилацетатом. Органические фазы промывают водой, затем насыщенным раствором соли и сушат над сульфатом магния, фильтруют и выпаривают, получая требуемый продукт, который используют как есть для следующей стадии.
ТСХ: Fr=0,56 (дихлорметан/метанол 90/10).
1H ЯМР (CDCl3): δ 1,96-1,99 (широкий с, 1H); 2,43 (с, 3H); 3,73 (с, 3H); 4,30 (с, 1H); 7,31-7,42 (м, 5H).
Стадия 2: 4-[2,5-диоксо-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметил-бензонитрил
К раствору 1,26 г трифосгена в 20 мл безводного толуола медленно добавляют раствор 1,18 г 4-амино-2-трифторметилбензонитрила в 16 мл безводного диоксана. Смесь кипятят с обратным холодильником в течение 1,5 час. После охлаждения при комн. т. смесь выпаривают досуха. К этому сырому продукту, разбавленному 50 мл безводного ТГФ, добавляют 1,13 г метил 2-метиламино-2-фенилацетата в 10 мл ТГФ. Смесь перемешивают при комн. т. в течение 30 мин. Добавляют 1,96 мл TEA, смесь кипятят с обратным холодильником в течение 1,5 час и перемешивают при комн. т. в течение 16 час, затем выпаривают досуха. Сырой продукт разбавляют водным раствором бикарбоната натрия и экстрагируют этилацетатом. Органические фазы промывают водой, затем насыщенным раствором соли и сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт кристаллизуют из этилацетата, фильтруют и ополаскивают этиловым эфиром, получая требуемый продукт.
ТСХ: Fr=0,67 (дихлорметан/этиловый эфир 90/10).
1H ЯМР (CDCl3): δ 3,06 (с, 3H); 5,06 (с, 1H); 7,35-7,39 (м, 2H); 7,48-7,56 (м, 3H); 7,96 (д, 1H); 8,03 (дд, 1H); 8,18 (д, 1H).
ЖХМС: (Rt=2,91 мин, аполярный способ): неионизуемый.
Стадия 3: 4-[2,5-диоксо-4-(1-гидроксипропил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил
К охлажденному до -78°C раствору 200 мг 4-[2,5-диоксо-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила в 4 мл безводного ТГФ медленно добавляют 0,64 мл литий
бис(триметилсилил)амида 20% в гексане. Раствор становится темно-коричневым. Смесь перемешивают при -78°C в течение 10 мин. Затем медленно добавляют 121 мкл пропанового альдегида, раствор становится темно-красным. Добавление еще 121 мкл пропанового альдегида дает общее обесцвечивание смеси. Смесь перемешивают при -78°C в течение 30 мин и гасят реакционную смесь при -78°C водным раствором хлорида аммония. Смесь нагревают при комн. т. и экстрагируют водную фазу этилацетатом. Органические фазы промывают водой, затем насыщенным раствором соли и сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/дихлорметан от 1/1 до 0/1, затем смесью дихлорметан/этиловый эфир от 99/1 до 95/5, получая два диастереомера: изомер A и изомер B.
Аналитические данные для изомера A:
ТСХ: Fr=0,45 (дихлорметан/этиловый эфир 9/1);
1H ЯМР (CDCl3): δ 1,19 (т, 3H); 1,48-1,63 (м, 1H); 1,65-1,78 (м, 1H); 3,26 (с, 3H); 4,70-4,77 (м, 1H); 7,46-7,62 (м, 5H); 7,93 (д, 1H); 7,99 (д, 1H); 8,13 (с, 1H);
ЖХМС: (Rt=3,47 мин): 358- (M-CH3CH2CHOH)-.
Аналитические данные для изомера B:
ТСХ: Fr=0,36 (дихлорметан/этиловый эфир 9/1);
1H ЯМР (CDCl3): δ 1,18 (т, 3H); 1,42-1,55 (м, 1H); 1,72-1,84 (м, 1H); 3,08 (с, 3H); 4,63-4,70 (м, 1H); 7,39-7,55 (м, 5H); 7,95 (д, 1H); 8,02 (д, 1H); 8,15 (с, 1H);
ЖХМС: (Rt=3,46 мин); 358- (M-CH3CH2CHOH)-.
Примеры 4 и 5: 4-[2,5-диоксо-4-(1-гидроксиэтил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметил-бензонитрил
4-[2,5-диоксо-4-(1-гидроксиэтил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил получают, применяя такой же протокол, как применяют для примеров 2 и 4, исходя из 4-[2,5-диоксо-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила при использовании ацетальдегида вместо пропионового альдегида. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/дихлорметан от 1/1 до 0/1, затем смесью дихлорметан/этиловый эфир от 99/1 до 95/5, получая два диастереомера: изомер C и изомер D.
Аналитические данные для изомера C:
ТСХ: Fr=0,32 (дихлорметан/этиловый эфир/NH4OH 90/10/0,1);
1H-ЯМР (CDCl3): δ 1,42 (д, 3H); 3,26 (с, 3H); 5,03-5,61 (м, 1H); 7,47-7,60 (м, 5H); 7,93 (д, 1H); 7,99 (д, 1H); 8,12(с, 1H);
ЖХМС: (Rt=3,35 мин): 358- (M-CH3CHOH)-.
Аналитические данные для изомера D:
ТСХ: Fr=0,26 (дихлорметан/этиловый эфир/NH4OH 90/10/0,1);
1H ЯМР (CDCl3): δ 1,44 (д, 3H); 3,10 (с, 3H); 4,98-5,06 (м, 1H); 7,42-7,56 (м, 5H); 7,95 (д, 1H); 8,02 (д, 1H); 8,16 (с, 1H);
ЖХМС: (Rt=3,34 мин): 358- (M-CH3CHOH)-.
Пример 6: 4-[2,5-диоксо-4-фторфенил-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил (способ A)
Стадия 1: 1-(4-фторфенил)-2-гидроксиэтанон
2 г 2-бром-1-(4-фторфенил)этанона и 6 экв. формиата натрия в 15 мл смеси этанол/вода подвергают микроволновому облучению в течение 5 мин при 150°C, 11 бар. После фильтрования и выпаривания этанола добавляют воду. Ожидаемый продукт выделяют фильтрованием.
1H ЯМР (ДМСО-D6): δ 4,78 (с, 2H); 5,12 (м, 1H); 7,35 (м, 2H); 8,00 (м, 2H).
ЖХМС: (Rt=2,51 мин): без ионизации.
Стадия 2: 1-(4-фторфенил)-2-(2-пропенилокси)этанон
Смешивают вместе 2,4 г 1-(4-фторфенил)-2-гидроксиэтанона, полученного на стадии 1, 10 мл аллилбромида и 9,4 г CaSO4 в атмосфере аргона. Добавляют порциями 6,2 г Ag2O в течение 1,5 час. Эту смесь перемешивают 3 час при комн. т., разбавляют этиловым эфиром, фильтруют и выпаривают растворитель. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 90/10.
1H ЯМР (ДМСО-D6): δ 4,05 (м, 2H); 4,82 (с, 2H); 5,17 (дд, 1H); 5,28 (дд, 1H); 5,92 (ддт, 1H); 7,37 (м, 2H); 8,00 (м, 2H).
ЖХМС: (Rt=2,69 мин): без ионизации.
Стадия 3: 4-(4-фторфенил)-4-[(2-пропенилокси)метил]имидазолидин-2,5-дион
1,8 г 1-(4-фторфенил)-2-(2-пропенилокси)этанона, полученного на стадии 2, 1,21 г цианида калия и 4,69 г карбоната аммония нагревают до 55°C в течение 2 час в 50 мл смеси этанол/вода 50/50. Нагревая смесь при 55°C, добавляют 4,69 г карбоната аммония 3 раза через 1 час, 4 и 15 час, соответственно. Затем реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический раствор сушат над сульфатом натрия и выпаривают, получая требуемый продукт.
1H ЯМР (ДМСО-D6): δ 3,50 (д, 1H); 3,95 (д, 1H); 4,03 (д, 2H); 5,15 (дд, 1H); 5,25 (дд, 1H, (дд, 1H); 5,85 (ддт, 1H); 7,25 (м, 2H); 7,58 (м, 2H); 8,65 (с, 1H); 10,80 (с, 1H).
ЖХМС: (Rt=2,43 мин); без ионизации.
Стадия 4: 4-[2,5-диоксо-4-(4-фторфенил)-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
Добавляют 0,33 г оксида меди(I) и 0,95 г 4-бром-2-трифторметилбензонитрила к раствору 1 г 4-(4-фторфенил)-4-[(2-пропенилокси)метил]имидазолидин-2,5-диона, полученного на стадии 3, в 3 мл DMAC. Смесь нагревают при 160°C в течение 3 час. После охлаждения смесь разбавляют 50% водным раствором аммония и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 2/1.
1H ЯМР (ДМСО-D6): δ 3,62 (д, 1H); 4,07 (м, 2H); 4,15 (д, 1H); 5,15 (д, 1H); 5,22 (д, 1H); 5,85 (ддт, 1H); 7,30 (м, 2H); 7,70 (м, 2H); 8,00 (д, 1H); 8,10 (с, 1H), 8,33(д, 1H).
ЖХМС; (Rt=3,30 мин): 432- (M-H-).
Стадия 5: 4-[2,5-диоксо-4-(4-фторфенил)-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
Добавляют 325 мг карбоната калия и 0,25 мл йодметана к раствору 0,85 г 4-[2,5-диоксо-4-(4-фторфенил)-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила, полученного на стадии 4 и растворенного в 3 мл ДМФА. Смесь перемешивают при комн. т. в течение 4 час в атмосфере аргона, выпаривают досуха, разбавляют водой и насыщенным раствором соли и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают, получая требуемый продукт.
1H ЯМР (ДМСО-D6): δ 2,85 (с, 3H); 4,17 (м, 2H); 4,20 (д, 1H); 4,40 (д, 1H); 5,15 (д, 1H); 5,21 (д, 1H); 5,87 (ддт, 1H); 7,30 (м, 2H); 7,55 (м, 2H); 8,00 (д, 1H); 8,12 (с, 1H), 8,33 (д, 1H).
ЖХМС: (Rt=3,43 мин): без ионизации.
Стадия 6: 4-[2,5-диоксо-4-(4-фторфенил)-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил
Сырую смесь 4-[2,5-диоксо-4-(4-фторфенил)-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила, полученную на стадии 5, растворяют в 5 мл ДХМ в атмосфере аргона. Добавляют 0,9 мл комплекса трифторборан-диметилсульфид. Смесь перемешивают при комн. т. в течение 7 час. Медленно добавляют насыщенный водный раствор бикарбоната натрия, продукт экстрагируют ДХМ и органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью ДХМ/этилацетат 4/1.
1H ЯМР (ДМСО-D6): δ 2,87 (с, 3H); 4,08 (м, 1H); 4,40 (м, 1H); 5,80 (м, 1H); 7,30 (м, 2H); 7,52 (м, 2H); 8,05 (д, 1H); 8,19 (с, 1H), 8,32 (д, 1H).
ЖХМС: (Rt=2,97 мин): 376- (M-CH2OH-).
Пример 7: 4-[4-(4-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил (способ A)
Схема 3
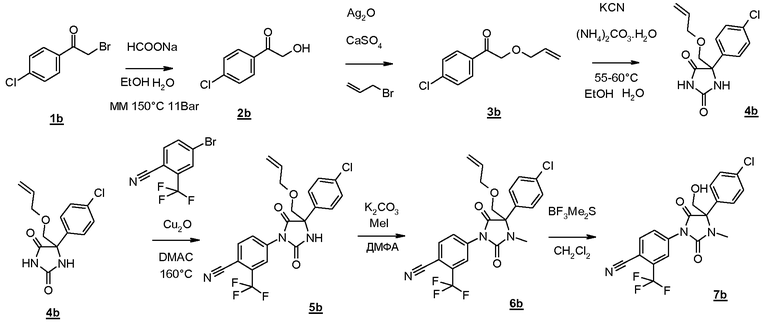
Стадия 1: 1-(4-хлорфенил)-2-гидроксиэтанон
Взаимодействие 2 г 2-бром-1-(4-хлорфенил)этанона с применением протокола примера 6, стадии 1 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 4,78 (с, 2H); 5,15 (м, 1H); 7,60 (д, 2H); 7,94 (д, 2H). ЖХМС: (Rt=2,55 мин): без ионизации.
Стадия 2: 1-(4-хлорфенил)-2-(2-пропенилокси)этанон
Взаимодействие 2,64 г 2-бром-1-(4-хлорфенил)этанона с применением протокола примера 6, стадии 2 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 4,08 (м, 2H); 4,84 (с, 2H); 5,18 (дд, 1H); 5,29 (дд, 1H); 5,92 (ддт, 1H); 7,61 (д, 2H); 7,92 (д, 2H).
Стадия 3: 4-(4-хлорфенил)-4-(2-пропенилокси)имидазолидин-2,5-дион
Взаимодействие 2,5 г 1-(4-хлорфенил)-2-(2-пропенилокси)этанона с применением протокола примера 6, стадии 3 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 3,50 (д, 1H); 3,93 (д, 1H); 4,03 (д, 2H); 5,15 (дд, 1H); 5,25 (дд, 1H, (дд, 1H); 5,84 (ддт, 1H); 7,47 (м, 2H); 7,55 (м, 2H); 8,67 (с, 1H); 10,82 (с, 1H).
ЖХМС: (Rt=3,06 мин): без ионизации.
Стадия 4: 4-[4-(4-хлорфенил)-2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
Взаимодействие 1,4 г 4-(4-хлорфенил)-4-(2-пропенилокси)имидазолидин-2,5-диона с применением протокола примера 6, стадии 4 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 3,71 (д, 1H); 4,05 (м, 2H); 4,15 (д, 1H); 5,13 (д, 1H); 5,21 (д, 1H); 5,85 (ддт, 1H); 7,53 (д, 2H); 7,68 (д, 2H); 7,98 (д, 1H); 8,10 (с, 1H); 8,31 (д, 1H).
ЖХМС: (Rt=3,41 мин): (448/450)- (M-H-).
Стадия 5: 4-[4-(4-хлорфенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
Взаимодействие 0,50 г 4-[4-(4-хлорфенил)-2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила с применением протокола примера 6, стадии 5 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 2,87 (с, 3H); 4,10 (м, 2H); 4,18 (д, 1H); 4,40 (д, 1H); 5,15 (д, 1H); 5,21 (д, 1H); 5,88 (ддт, 1H); 7,54 (м, 4H); 8,00 (д, 1H); 8,12 (с, 1H); 8,33 (д, 1H).
ЖХМС: (Rt=3,57 мин): без ионизации.
Стадия 6: 4[4-(4-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил
Взаимодействие 0,6 г 4-[4-(4-хлорфенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила с применением протокола примера 6, стадии 6 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 2,87 (с, 3H); 4,07 (м, 1H); 4,40 (м, 1H); 5,82 (м, 1H); 7,51 (м, 4H); 8,03 (д, 1H); 8,19 (с, 1H); 8,32 (д, 1H).
ЖХМС: (Rt=3,13 мин): (392/394)- (M-CH2OH-).
Пример 8: 4-[4-(4-фторфенил)-2,5-диоксо-4-гидроксиметил-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил
Стадия 1: 4-[2,5-диоксо-4-(4-фторфенил)-4-[(2-пропенилокси)метил]-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 0,42 г 4-[2,5-диоксо-4-(4-фторфенил)-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в 3 мл ДМФА добавляют 160 мг карбоната калия и 0,2 мл пропаргилбромида (80% раствор в толуоле). Смесь перемешивают при комн. т. в течение 4 час в атмосфере аргона. Затем добавляют 0,04 мл пропаргилбромида (80% раствор в толуоле) и смесь перемешивают 1 час при комн. т., выпаривают досуха, разбавляют водой и насыщенным раствором соли и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают.
Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 4/1.
1H ЯМР (ДМСО-D6): δ 3,17 (с, 1H); 4,05-4,12 (м, 2H); 4,25-4,40 (м, 4H); 5,12 (д, 1H); 5,22 (д, 1H); 5,88 (ддт, 1H); 7,30 (м, 2H); 7,60 (м, 2H); 8,00 (д, 1H); 8,12 (с, 1H); 8,33 (д, 1H).
ЖХМС: (Rt=3,46 мин): без ионизации.
Стадия 2: 4-[4-(4-фторфенил)-2,5-диоксо-4-гидроксиметил-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил
Растворяют 0,45 г 4-[2,5-диоксо-4-(4-фторфенил)-4-[(2-пропенилокси)метил]-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрила, полученного на стадии 1, в 5 мл ДХМ в атмосфере аргона. Добавляют 0,2 мл комплекса трифторборан-диметилсульфид. Смесь перемешивают при комн. т. в течение 18 час. Медленно добавляют насыщенный водный раствор бикарбоната натрия. Продукт экстрагируют ДХМ и органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью ДХМ/этилацетат 6/1.
1H ЯМР (ДМСО-D6): δ 3,10 (м, 3H); 4,10-4,40 (м, 4H); 5,80 (м, 1H); 7,28 (м, 2H); 7,60 (м, 2H); 8,05 (д, 1H); 8,20 (с, 1H); 8,35 (д, 1H).
ЖХМС: (Rt=3,07 мин): 400- (M-CH2OH-).
Пример 9: 4-[4-(3-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметил-бензонитрил (способ A)
Стадия 1: 1-(3-хлорфенил)-2-гидроксиэтанон
Взаимодействие 2 г 2-бром-1-(3-хлорфенил)этанона с применением протокола примера 6, стадии 1 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 4,80 (с, 2H); 5,20 (м, 1H); 7,58 (т, 1H); 7,72 (д, 1H); 7,88 (д, 1H); 7,95 (с, 1H).
ЖХМС: (Rt=2,30 мин): без ионизации.
Стадия 2: 1-(3-хлорфенил)-2-(2-пропенилокси)этанон
Взаимодействие 2,5 г 1-(3-хлорфенил)-2-гидроксиэтанона с применением протокола примера 6, стадии 2 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 4,07 (м, 2H); 4,88 (с, 2H); 5,18 (дд, 1H); 5,30(дд, 1H); 5,92 (ддт, 1H); 7,58(т, 1H); 7,72 (д, 1H); 7,88 (д, 1H); 7,92 (с, 1H).
Стадия 3: 4-(3-хлорфенил)-4-(2-пропенилокси)имидазолидин-2,5-дион
Взаимодействие 1,5 г 1-(3-хлорфенил)-2-(2-пропенилокси)этанона с применением протокола примера 6, стадии 3 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 3,52 (д, 1H); 3,95 (д, 1H); 4,02 (д, 2H); 5,16 (дд, 1H); 5,25 (дд, 1H); 5,85 (ддт, 1H); 7,44 (м, 2H); 7,52 (м, 1H); 7,59 (с, 1H); 8,70 (с, 1H); 10,83 (с, 1H).
ЖХМС: (Rt=2,57 мин): без ионизации.
Стадия 4: 4-[4-(3-хлорфенил)-2,5-диоксо-4-[(2-фенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
Взаимодействие 1,0 г 4-(3-хлорфенил)-4-(2-пропенилокси)имидазолидин-2,5-диона с применением протокола примера 6, стадии 4 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 3,72 (д, 1H); 4,05 (м, 2H); 4,18 (д, 1H); 5,13 (д, 1H); 5,21 (д, 1H); 5,85 (ддт, 1H); 7,50 (м, 2H); 7,62 (м, 1H); 7,70 (с, 1H); 7,98 (д, 1H); 8,10 (с, 1H); 8,32 (д, 1H); 9,12 (с, 1H).
ЖХМС: (Rt=3,41 мин): (448/450)- (M-H-).
Стадия 5: 4-[4-(3-хлорфенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
Взаимодействие 0,66 г 4-[4-(3-хлорфенил)-2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила с применением протокола примера 6, стадии 5 дает требуемый продукт.
1H ЯМР (ДМСО-D6): δ 2,88 (с, 3H); 4,10 (м, 2H); 4,20 (д, 1H); 4,42 (д, 1H); 5,16 (д, 1H); 5,22 (д, 1H); 5,89 (ддт, 1H); 7,50 (м, 1H); 7,52(м, 2H); 7,60(с, 1H); 8,00 (д, 1H); 8,15 (с, 1H), 8,33 (д, 1H).
ЖХМС: (Rt=3,57 мин, аполярный способ): без ионизации.
Стадия 6: 4-[4-(3-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил
Взаимодействие 0,60 г 4-[4-(3-хлорфенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила с применением протокола примера 6, стадии 6 дает требуемый продукт.
1H ЯМР (MeOD): δ 3,08 (с, 3H); 4,20 (м, 1H); 4,61 (м, 1H); 7,45 (м, 1H); 7,52 (м, 2H); 8,14 (м, 2H); 8,25 (с, 1H).
ЖХМС: (Rt=3,10 мин): (392/394)- (M-CH2OH-).
Примеры 10 и 11: (S)-4-[2,5-диоксо-4-гидроксиметил-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил и (R)-4-[2,5-диоксо-4-гидроксиметил-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил
Два энантиомера 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила разделяют хроматографией 1,5 г образца рацемической смеси, полученной в примере 1 на Chiralcel OD (колонка LC50 Prochrom), элюируя смесью 75/25 гептан/изопропанол.
Первым элюируется энантиомер (S). При выпаривании растворителя получают требуемое соединение.
[a]D=-40,8° (c=1%, EtOH).
ВЭЖХ: колонка Chiralcel OD, 250×4,6 мм, гептан/изопропанол 75/25, скорость потока 1 мл/мин, Rt: 9,01 мин.
Энантиомер (R) элюируется вторым. Дальнейшая очистка в аналогичных условиях с последующим выпариванием растворителя дает требуемое соединение.
[a]D=+41,1°(c=1%, EtOH).
ВЭЖХ: колонка Chiralcel OD, 250×4,6 мм, гептан/изопропанол 75/25, скорость потока 1 мл/мин, Rt: 13,24 мин.
Альтернативный способ:
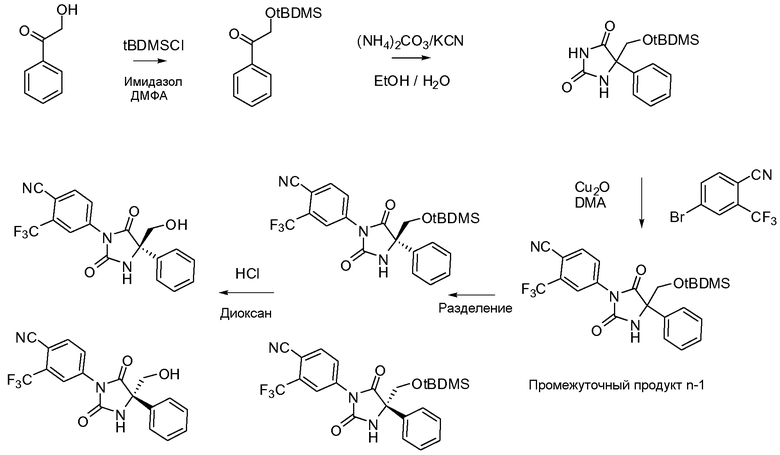
Следуя способу, аналогичному описанному для примера 1 и изображенному на схеме 3, можно провести очистку "промежуточного продукта n-1", получая соединения из примера 10 и 11 после удаления защиты с использованием колонки Chiralpak AD® (250×4,6 мм) и смеси сверхкритический CO2/MeCN/iPrOH (90/5/5) при 40°C и 100 бар с последующим удалением защитной группы по известным методикам (см. ссылку 10).
Пример 12: 4-[2,5-диоксо-3-этил-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил (способ A)
Стадия 1: 4-[2,5-диоксо-3-этил-4-фенил-4-[(2-пропенилокси)метил] имидазолидин-1-ил]-2-трифторметилбензонитрил
Методика примера 1, стадии 1, применяемая к 0,23 г 4-[2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила с 0,18 мл йодэтана, дает требуемое соединение.
ЖХМС: (Rt=3,20 мин); 444+ (MH+).
Стадия 2: 4-[2,5-диоксо-3-этил-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил
0,2 г 4-[2,5-диоксо-3-этил-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила обрабатывают 0,2 мл комплекса трифторборан-диметилсульфид, как описано в примере 3, стадия 2, получая требуемое соединение.
ТСХ: Fr=0,35 (гептан/этилацетат 20/10).
1H ЯМР (ДМСО-D6): δ 1,05 (т, 3H); 3,32 (кв., 2H); 4,22 и 4,40 (2 м, 2H); 5,62 (т, 1H); 7,4-7,5 (м, 5H); 8,08 (д, 1H); 8,20 (с, 1H); 8,33 (д, 1H).
ЖХМС: (Rt=3,81 мин): 372- (M-CH2OH-).
Пример 13: 4-[4-(4-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил (способ A)
Стадия 1: 4-(2-гидроксиацетил)бензонитрил
Раствор 1 г 4-(2-бромацетил)бензонитрила в ацетонитриле (5 мл) и воде (10 мл) обрабатывают посредством микроволнового облучения (125°C, 50 мин). Аналогичный эксперимент проводят пять раз. Вещество из всех пробирок собирают, экстрагируют этиловым эфиром, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
ТСХ: Fr=0,15 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 4,94 (с, 2H); 7,85-7,87 (дд, 2H); 8,05-8,07 (дд, 2H).
ЖХМС: (Rt=2,40 мин): без ионизации.
Стадия 2: 4-[2-(2-пропенилокси)ацетил]бензонитрил
К раствору 2,7 г 4-(2-гидроксиацетил)бензонитрила в аллилбромиде (15 мл) добавляют 10,2 г сульфата кальция и 6,7 г оксида серебра. Смесь перемешивают в атмосфере аргона и в темноте в течение 2 час. Смесь разбавляют AcOEt, фильтруют на целите, концентрируют и очищают на силикагеле (этилацетат/циклогексан: от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,38 (этилацетат/циклогексан 40/60).
1H ЯМР (CDCl3): δ 4,01 (д, 2H); 4,57 (с, 2H); 5,13 (д, 1H); 5,22 (с, 1H); 5,73-5,86 (м, 1H); 7,64 (д, 2H); 7,91 (д, 2H).
ЖХМС: (Rt=3,05 мин): без ионизации.
Стадия 3: 4-[2,5-диоксо-4-[(2-фенилокси)метил]имидазолидин-4-ил]бензонитрил
К раствору 500 мг 4-[2-(2-пропенилокси)ацетил]бензонитрила (в EtOH (5 мл) и воде (5 мл) добавляют 324 мг цианида калия и 1,67 г карбоната аммония. Смесь кипятят с обратным холодильником в течение ночи при 55°C. Смесь экстрагируют этилацетатом, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
ТСХ: Fr=0,16 (этилацетат/циклогексан 30/70).
1H ЯМР (CD3OD): δ 3,45 (д, 1H); 3,86 (м, 3H); 4,95 (д, 1H); 5,06 (дд, 1H); 5,60-5,73 (м, 1H); 7,58 (с, 4H).
ЖХМС: (Rt=2,77 мин): 270- (M-H)-.
Стадия 4: 4-[4-(4-цианофенил)-2,5-диоксо-4-[(2-пропенилокси)метил] имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 675 мг 4-[2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-4-ил]бензонитрила и 622 мг 4-бром-2-трифторметилбензонитрила в DMAC (2,5 мл) добавляют 214 мг оксида меди(I). Смесь кипятят с обратным холодильником в течение ночи при 130°C. Смесь концентрируют, переносят в ДХМ, промывают 10% водным раствором аммония и насыщенным раствором соли. Органическую фазу сушат над сульфатом магния, концентрируют в вакууме и очищают на силикагеле (этилацетат/циклогексан: от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,48 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,85 (д, 1H); 4,09-4,19 (м, 3H); 5,25-5,31 (м, 2H); 5,80-5,87 (м, 1H); 6,07 (с, 1H); 7,79-7,84 (с, 4H); 7,95 (с, 2H); 8,07 (с, 1H).
ЖХМС: (Rt=3,29 мин): 439- (M-H)-.
Стадия 5: 4-[4-(4-цианофенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси) метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 459 мг 4-[4-(4-цианофенил)-2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила, полученного на стадии 4, в ДМФА (1,5 мл) добавляют 173 мг карбоната калия и 130 мкл метилйодида. Смесь перемешивают 3 час при комн. т., выпаривают, промывают насыщенным раствором соли, экстрагируют этилацетатом, сушат над сульфатом магния и концентрируют, получая требуемое соединение.
ТСХ: Fr=0,54 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,09 (с, 3H); 3,95 (д, 1H); 4,14 (м, 2H); 4,39 (д, 1H); 5,28-5,34 (м, 2H); 5,84-5,91 (м, 1H); 7,57 (д, 2H); 7,80 (д, 2H), 7,95 (с, 2H), 8,10 (с, 1H).
ЖХМС: (Rt=3,81 мин): без ионизации.
Стадия 6: 4-[4-(4-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 433 мг 4-[4-(4-цианофенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила, полученного на стадии 5, в ДХМ (5 мл) добавляют 600 мкл комплекса трифторид бора-диметилсульфид. Смесь перемешивают 8 час при комн. т., разбавляют ДХМ, промывают водным раствором бикарбоната натрия, сушат над сульфатом магния, концентрируют и очищают на силикагеле (этилацетат/циклогексан: от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,10 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 3,14 (с, 3H); 4,16 (д, 1H); 4,73 (д, 1H); 7,57 (д, 2H); 7,82 (д, 2H), 7,93-8,00 (м, 2H), 8,13 (с, 1H).
ЖХМС: (Rt=3,05 мин): 383- (M-CH2OH)-.
Пример 14: 4-[4-(3-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил (способ A)
Стадия 1: 3-(2-гидроксиацетил)бензонитрил
Раствор 776 мг 3-(2-бромацетил)бензонитрила в ацетонитриле (5 мл) и воде (10 мл) обрабатывают посредством микроволнового облучения (125°C, 50 мин). Аналогичный эксперимент проводят второй раз, используя 976 мг. Вещество из всех пробирок собирают, экстрагируют этиловым эфиром, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
ТСХ: Fr=0,38 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 4,94 (с, 2H); 7,71 (т, 1H); 7,95 (д, 1H); 8,18 (д, 1H); 8,25 (с, 1H).
Стадия 2: 3-[(2-(2-пропенилокси)ацетил]бензонитрил
К раствору 1,08 г 3-(2-гидроксиацетил)бензонитрила в аллилбромиде (8 мл) добавляют 4 г сульфата кальция и 2,6 г оксида серебра. Смесь перемешивают в атмосфере аргона и темноте в течение ночи. Смесь разбавляют этилацетатом, фильтруют на целите, концентрируют и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 30/70), получая требуемое соединение.
ТСХ: Fr=0,64 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 4,18 (д, 2H); 4,73 (с, 2H); 5,31 (д, 1H); 5,37 (д, 1H); 5,92-6,02 (м, 1H); 7,66 (т, 1H); 7,90 (д, 1H); 8,22 (д, 1H); 8,29 (с, 1H).
ЖХМС: (Rt=3,04 мин): без ионизации.
Стадия 3: 3-[2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-4-ил]бензонитрил
К раствору 450 мг 3-[(2-(2-пропенилокси)ацетил]бензонитрила в EtOH (5 мл) и воде (5 мл) добавляют 291 мг цианида калия и карбонат аммония. Смесь кипятят с обратным холодильником одну ночь при 55°C. Смесь экстрагируют этилацетатом, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
ТСХ: Fr=0,1 (этилацетат/циклогексан 30/70).
1H ЯМР (CD3OD): δ 3,70 (д, 1H); 4,10-4,14 (м, 3H); 5,23 (д, 1H); 5,33 (д, 1H); 5,89-5,98 (м, 1H); 7,67 (т, 1H); 7,80 (д, 2H); 7,98-8,02 (м, 1H).
Стадия 4: 4-[4-(3-цианофенил)-2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 579 мг 3-[2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-4-ил]бензонитрила и 534 мг 4-бром-2-(трифторметил)бензонитрила в DMAC (2,5 мл) добавляют 183 мг оксида меди. Смесь кипятят с обратным холодильником в течение ночи при 130°C. Смесь концентрируют, переносят в ДХМ, промывают 10% водным раствором аммония и насыщенным раствором соли. Органическую фазу сушат над сульфатом магния, концентрируют в вакууме и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,3 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,85 (д, 1H); 4,07-4,21 (м, 3H); 5,26-5,38 (м, 2H); 5,80-5,89 (м, 1H); 6,24 (с, 1H); 7,59-7,70 (м, 1H); 7,80(д, 1H); 7,94-8,19 (м, 5H).
ЖХМС: (Rt=3,26 мин): 439- (M-H)-.
Стадия 5: 4-[4-(3-цианофенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 358 мг 4-[4-(3-цианофенил)-2,5-диоксо-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в ДМФА (1,5 мл) добавляют 135 мг карбоната калия и 101 мкл метилйодида. Смесь перемешивают в течение ночи при комнатной температуре, выпаривают, промывают насыщенным раствором соли, экстрагируют этилацетатом, сушат над сульфатом магния и концентрируют, получая требуемое соединение.
ТСХ: Fr=0,58 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,09 (с, 3H); 3,95 (д, 1H); 4,14 (м, 2H); 4,38 (д, 1H); 5,29-5,34 (м, 2H); 5,84-5,91 (м, 1H); 7,63-7,79 (м, 4H); 7,96 (с, 2H); 8,11 (с, 1H).
ЖХМС: (Rt=3,81 мин): без ионизации.
Стадия 6: 4-[4-(3-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил
Добавляют 328 мкл комплекса трифторборан-диметилсульфид к раствору 354 мг 4-[4-(3-цианофенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в ДХМ (5 мл). Смесь перемешивают 6 час при комнатной температуре, разбавляют ДХМ, промывают водным раствором бикарбоната натрия, сушат над сульфатом магния, концентрируют и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,30 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,14 (с, 3H); 4,17 (м, 1H); 4,71 (д, 1H); 7,65-7,79 (м, 4H); 7,94-8,02 (м, 2H); 8,14 (с, 1H).
ЖХМС: (Rt=3,04 мин): 383- (M-CH2OH)-.
Пример 15: 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-трифторметилфенил)имидазолидин-1-ил]-2-трифторметил-бензонитрил (способ A)
Стадия 1: 1-(3-трифторметилфенил)-2-гидроксиэтанон
Раствор 2-бром-1-[3-(трифторметил)фенил]этанона (1 г) в ацетонитриле (2,5 мл) и воде (10 мл) обрабатывают посредством микроволнового облучения (125°C, 50 мин). Аналогичный эксперимент повторяют пять раз. Вещество из всех пробирок собирают, экстрагируют ДХМ, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
1H ЯМР (CDCl3): δ 4,96 (с, 2H); 7,70 (м, 1H); 7,93 (д, 1H); 8,14(д, 1H), 8,22 (с, 1H).
Стадия 2: 2-[(2-пропенилокси)метил]-1-(3-трифторметилфенил)этанон
К раствору 1-(3-трифторметилфенил)-2-гидроксиэтанона (3,66 г) в аллилбромиде (20 мл) добавляют сульфат кальция (10,9 г) и оксид серебра (7,1 г). Смесь перемешивают в атмосфере аргона и темноте в течение 2 час. Смесь разбавляют этилацетатом, фильтруют на целите, концентрируют и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 15/85), получая требуемое соединение.
ТСХ: Fr=0,79 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 4,20 (м, 2H); 4,78 (с, 2H); 5,30 (д, 1H); 5,38 (д, 1H); 5,94-6,02 (м, 1H); 7,66 (т, 1H); 7,88 (д, 1H); 8,18 (д, 1H), 8,25 (с, 1H).
ЖХМС: (Rt=3,53 мин): без ионизации.
Стадия 3: 4-[(2-пропенилокси)метил]-4-(3-(трифторметилфенил)имидазолидин-2,5-дион
К раствору 2-[(2-пропенилокси)метил]-1-(3-трифторметилфенил)этанона (1,17 г) в EtOH (5 мл) и воде (5 мл) добавляют цианид калия (624 мг) и карбонат аммония (3,2 г). Смесь кипятят с обратным холодильником в течение ночи при 55°C. Смесь экстрагируют этилацетатом, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
ТСХ: Fr=0,45 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,80 (д, 1H); 4,00-4,10 (м, 3H); 5,20-5,27 (м, 2H); 5,77-5,87 (м, 1H); 6,77 (с, 1H); 7,57 (т, 1H); 7,67 (д, 1H); 7,77-7,88 (м, 2H), 8,59 (с, 1H).
ЖХМС: (Rt=3,19 мин): 313- (M-H)-.
Стадия 4: 4-[2,5-диоксо-4-[(2-пропенилокси)метил]-4-(3-трифторметилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 4-[(2-пропенилокси)метил]-4-(3-трифторметилфенил)имидазолидин-2,5-диона (1,45 г) и 4-бром-2-(трифторметил)бензонитрила (1,15 г) в DMAC (7 мл) добавляют оксид меди (528 мг). Смесь кипятят с обратным холодильником в течение ночи при 130°C. Смесь концентрируют, переносят в этилацетат, промывают 10% водным раствором аммония и насыщенным раствором соли. Органическую фазу сушат над сульфатом магния, концентрируют в вакууме и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,69 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,84 (д, 1H); 4,10 (м, 2H); 4,20 (д, 1H); 5,25-5,30 (м, 2H); 5,80-5,89 (м, 1H); 6,57 (с, 1H); 7,62-7,66 (т, 1H); 7,74 (д, 1H); 7,91-7,96 (м, 4H), 8,09 (с, 1H).
ЖХМС: (Rt=3,55 мин): 482- (M-H)-.
Стадия 5: 4-[2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]-4-(3-трифторметилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 814 мг 4-[2,5-диоксо-4-[(2-пропенилокси)метил]-4-(3-трифторметилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрила в ДМФА (1,5 мл) добавляют карбонат калия (279 мг) и метилйодид (420 мкл). Смесь перемешивают 5 час при комнатной температуре, выпаривают, промывают насыщенным раствором соли, экстрагируют этилацетатом, сушат над сульфатом магния и концентрируют, получая требуемое соединение.
ТСХ: Fr=0,39 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 3,09 (с, 3H); 3,98 (д, 1H); 4,14-4,19 (м, 2H); 4,42 (д, 1H); 5,28-5,34 (м, 2H); 5,85-5,92 (м, 1H); 7,64-7,68 (м, 3H); 7,75 (д, 1H); 7,93-8,00 (м, 2H), 8,12 (с, 1H).
ЖХМС: (Rt=4,05 мин): без ионизации.
Стадия 6: 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-трифторметилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 782 мг 4-[4-(3-трифторметилфенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в ДХМ (5 мл) добавляют 662 мкл комплекса трифторборан-диметилсульфид. Смесь перемешивают 6 час при комнатной температуре, разбавляют ДХМ, промывают водным раствором бикарбоната натрия, сушат над сульфатом магния, концентрируют и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,45 (этилацетат/циклогексан 50/50).
1H ЯМР (CDCl3): δ 3,14 (с, 3H); 4,18 (д, 1H); 4,75 (дд, 1H); 7,62-7,69 (м, 3H); 7,76 (д, 1H); 7,95 (д, 1H); 8,02 (д, 1H); 8,16 (с, 1H).
ЖХМС: (Rt=3,10 мин): 426- (M-CH2OH)-.
Пример 16: 1-(3,4-дихлорфенил)-4-гидроксиметил-3-метил-4-фенилимидазолидин-2,5-дион (способ A)
Стадия 1: 1-фенил-2-(2-пропенилокси)этанон
Это соединение получают из 2-гидрокси-1-фенилэтанона согласно методике, применяемой G.A. Molander и J.A. McKie на 1-гидроксибутан-2-оне, J. Org.Chcm. (1995), 60, 872-882.
Стадия 2: 4-фенил-4-[(2-пропенилокси)метил]имидазолидин-2,5-дион
Нагревают 0,775 г 1-фенил-2-(2-пропенилокси)этанона, 0,575 г цианида калия и 1,6 г карбоната аммония до 55°C в течение 3 час в 23 мл смеси этанол/вода 50/50. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический раствор промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия и выпаривают, получая требуемое соединение.
ТСХ: Rt=0,42 (силикагель, элюент: гептан-этилацетат 50-50).
1H ЯМР (CD3OD): δ 3,68 (д, 1H); 4,13 (м, 3H); 4,22 (д, 1H); 4,92 (с, 2H); 5,22 (дд, 1H); 5,34 (дд, 1H); 5,95 (ддт, 1H); 7,45 (м, 3H); 7,64 (д, 2H).
ЖХМС: (Rt=5,79 мин): 288+ (MH, MeCN+).
Стадия 3: 1-(3,4-дихлорфенил)-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-2,5-дион
Растворяют 0,7 г 4-фенил-2-(пропенилокси)имидазолидин-2,5-диона в 2 мл DMAC и добавляют 780 мг 1,2-дихлор-4-йодбензола, а затем 234 мг оксида меди(I). Смесь нагревают при 160°C в течение 3 час. При комн. т. смесь разбавляют 20% водным раствором аммиака и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 2/1.
1H ЯМР (ДМСО-D6): δ 3,70 (д, 1H); 4,08 (м, 2H); 4,15 (д, 1H); 5,17 (д, 1H); 5,25 (д, 1H); 5,88 (ддт, 1H); 7,38-7,50 (м, 4H); 7,62 (д, 2H); 7,67 (м, 1H); 7,78 (д, 1H), 9,40 (с, 1H).
ЖХМС: (Rt=3,44 мин): без ионизации.
Стадия 4: 1-(3,4-дихлорфенил)-4-гидроксиметил-3-метил-4-фенилимидазолидин-2,5-дион
К раствору 0,45 г 5-1-(3,4-дихлорфенил)-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-2,5-диона в 3 мл ДМФА, добавляют 238 мг карбоната калия и 0,143 мл йодметана. Смесь перемешивают при комн. т. в течение 5 час, выпаривают досуха, разбавляют насыщенным раствором соли и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают, получая 0,47 г желтого масла, которое затем растворяют в 5 мл ДХМ в атмосфере аргона. Затем добавляют 0,4 мл комплекса трифторборан-диметилсульфид. Смесь перемешивают при комн. т. в течение 5 час. Медленно добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют ДХМ и органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт очищают кристаллизацией из смеси ДХМ/этиловый эфир.
1H ЯМР (MeOD): δ 3,02 (с, 3H); 4,20 (д, 1H); 4,62 (д, 1H); 7,43-7,57 (м, 5H); 7,68 (д, 1H); 7,92 (д, 1H); 7,75 (м, 1H).
ЖХМС: (Rt=3,13 мин): без ионизации.
Общая методика для примеров с 17 по 19 (способ A)
Стадия 1
Растворяют 0,415 г 4-[2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в 40 мл ДМФА с подходящим алкилгалогенидом и 163 мг карбоната калия. Смесь перемешивают при комн. т. в течение 5 час, выпаривают досуха, разбавляют водой и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и растворитель выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30.
Стадия 2
0,3 мл комплекса трифторборан-диметилсульфид в 10 мл дихлорметана добавляют к раствору соединений, полученных на стадии 1 и растворенных в 15 мл дихлорметана (соответственно, 0,32 г N-изопропила, 0,4 г N-цианометила и 0,4 г N-пропаргила). Смесь перемешивают при комн. т. в течение 6 час, выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30.
Пример 17: 4-[2,5-диоксо-4-гидроксиметил-3-(1-метилэтил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил
Стадия 1: 4-[2,5-диоксо-3-(1-метилэтил)-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
ТСХ: Fr=0,65 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 1,41 (д, 3H); 1,50 (д, 3H); 3,37 (дт, 1H); 4,12 (д, 1H); 4,13 (с, 2H); 4,42 (д, 1H); 5,25 (д, 1H); 5,32 (д, 1H); 5,87 (ддт, 1H); 7,35 (м, 2H); 7,48 (м, 3H); 7,93 (д, 1H); 8,01 (д, 1H); 8,15 (м, 1H).
ЖХМС: (Rt=3,71 мин): 457+ (M+).
Стадия 2: 4-[2,5-диоксо-4-гидроксиметил-3-(1-метилэтил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил
ТСХ: Fr=0,45 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 1,41 (д, 3H); 1,53 (д, 3H); 3,40 (дт, 1H); 4,30 (д, 1H); 4,72 (д, 1H); 7,37 (м, 2H); 7,48 (м, 3H); 7,93 (д, 1H); 8,06 (д, 1H); 8,20 (широкий с, 1H).
ЖХМС: (Rt=3,37 мин); 386- (M-CH2OH-).
Пример 18: 4-[2,5-диоксо-3-цианометил-4-гидроксиметил-4-фенилимидазолидин-1-ил}-2-трифторметилбензонитрил
Стадия 1: 4-[3-цианометил-2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
ТСХ: Fr=0,25 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 4,09 (д, 1H); 4,20 (м, 3H); 4,47 (д, 1H); 4,60 (д, 1H); 5,29 (д, 1H); 5,33 (д, 1H); 5,92 (ддт, 1H); 7,38 (м, 2H); 7,53 (м, 3H); 7,98 (широкий с, 2H); 8,11 (широкий с, 1H).
ЖХМС: (Rt=3,39 мин): без ионизации.
Стадия 2: 4-[2,5-диоксо-3-цианометил-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил
ТСХ: Fr=0,35 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 4,10 (д, 1H); 4,46 (д, 1H); 4,69 (д, 1H); 4,77 (д, 1H); 7,36 (м, 2H); 7,53 (м, 3H); 7,98 (д, 1H); 8,0l(д, 1H); 8,12 (широкий с, 1H).
ЖХМС: (Rt=3,12 мин): 383- (M-CH2OH-).
Пример 19: 4-[2,5-диоксо-4-гидроксиметил-4-фенил-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил
Стадия 1: 4-[2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил
ТСХ: Fr=0,65 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 2,27 (м, 1H); 4,06 (дд, 1H); 4,14 (м, 2H); 4,22 (д, 1H); 4,40 (дд, 1H); 4,46 (д, 1H); 5,26 (д, 1H); 5,31 (д, 1H); 5,91 (ддт, 1H); 7,41 (м, 2Н); 7,49 (м, 3H); 7,94 (д, 1H); 8,01 (дд, 1H); 8,14 (широкий с, 1H).
ЖХМС: (Rt=3,45 мин): без ионизации.
Стадия 2: 4-[2,5-диоксо-4-гидроксиметил-4-фенил-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил
ТСХ: Fr=0,40 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 2,48 (м, 1H); 3,83 (дд, 1H); 4,48 (д, 1H); 4,73 (д, 1H); 4,81 (дд, 1H); 7,46 (м, 2Н); 7,51 (м, 3H); 7,95 (д, 1H); 8,03 (д, 1H); 8,18 (широкий с, 1H).
ЖХМС: (Rt=3,16 мин): 382- (M-CH2OH-).
Пример 20: 4-[2,5-диоксо-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-трифторметил (способ A)
Стадия 1: 4-[2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 0,47 г 4-фенил-4-[(2-пропенилокси)метил]имидазолидин-2,5-диона в 30 мл ДМФА добавляют 0,28 г оксида меди(I) и 0,81 г 4-бром-2-трифторметилбензонитрила. Смесь нагревают при 135°C в течение 20 час, затем выпаривают ее досуха. Сырой продукт разбавляют 20% водным раствором аммиака и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30.
ТСХ: Fr=0,30 (гептан/этилацетат 70/30).
1H ЯМР (CDCl3): δ 3,86 (д, 1H); 4,14 (широкий с, 2H); 4,27 (д, 1H); 5,28 (д, 1H); 5,32 (д, 1H); 5,89 (ддт, 1H); 7,52 (м, 3H); 7,70 (м, 2h); 7,98 (м, 2H); 8,14 (м, 1H).
ЖХМС: (Rt=6,91 мин): 414- (M-H-)
Стадия 2: 4-[2,5-диоксо-4-гидроксиметил-4-фенилимимидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 0,18 г 4-[2,5-диоксо-4-фенил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в 15 мл ДХМ добавляют 0,2 мл комплекса трифторборан-диметилсульфид в 10 мл дихлорметана. Смесь перемешивают при комн. т. в течение 6 час, выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30.
ТСХ: Fr 0,25 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 3,99 (д, 1H); 4,42 (д, 1H); 7,11 (широкий с, 1H); 7,49 (м, 3H); 7,64 (м, 2H); 7,94 (м, 2H); 8,10 (широкий с, 1H).
ЖХМС: (Rt=3,02 мин): 344- (M-CH2OH-).
Пример 21: 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-метилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрил (способ A)
Стадия 1: 2-бром-1-(3-метилфенил)этанон
К раствору 1-(3-метилфенил)этанона (2 г) в этиловом эфире (20 мл) добавляют бром (726 мкл) при 0°C. Смесь обрабатывают водным раствором бикарбоната натрия, экстрагируют этиловым эфиром, сушат над сульфатом магния, концентрируют и очищают на силикагеле (этилацетат/циклогексан 0/100), получая требуемое соединение.
ТСХ: Fr=0,42 (этилацетат/циклогексан 10/90).
1H ЯМР (CDCl3): δ 2,47 (с, 3H); 4,49 (с, 2H); 7,40-7,47 (м, 2H); 7,81-7,91 (м, 2H).
ЖХМС: (Rt=3,42 мин): без ионизации.
Стадия 2: 2-гидрокси-1-(3-метилфенил)этанон
Раствор 2-бром-1-(3-метилфенил)этанона (1 г) в ацетонитриле (2,5 мл) и воде (13 мл) обрабатывают посредством микроволнового облучения (125°C, 50 мин). Аналогичный эксперимент повторяют три раза. Вещество из всех пробирок собирают, экстрагируют ДХМ, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
ТСХ: Fr=0,15 (этилацетат/циклогексан 10/90).
1H ЯМР (CDCl3): δ 2,47 (с, 3H); 4,90 (с, 2H); 7,41-7,49 (м, 2H); 7,74-7,78 (м, 2H).
Стадия 3 2-[(2-пропенилокси)метил]-1-(3-метилфенил)этанон
К раствору 2-гидрокси-1-(3-метилфенил)этанона (1,95 г) в аллилбромиде (10 мл) добавляют сульфат кальция (7,9 г) и оксид серебра (5,1 г). Смесь перемешивают в атмосфере аргона и темноте в течение 2 час. Смесь разбавляют этилацетатом, фильтруют на целите, концентрируют и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 15/85), получая требуемое соединение.
ТСХ: Fr=0,54 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 2,45 (с, 3H); 4,20 (д, 2H); 4,79 (с, 2H); 5,29 (д, 1H); 5,37 (д, 1H); 5,96-6,04 (м, 1H); 7,37-7,45 (м, 2H); 7,75-7,79 (м, 2H).
ЖХМС: (Rt=3,30 мин): без ионизации.
Стадия 4: 4-[(2-пропенилокси)метил]-4-(3-метилфенил)имидазолидин-2,5-дион
К раствору 2-[(пропенилокси)метил]-1-(3-метилфенил)этанона (690 мг) в этаноле (5 мл) и воде (5 мл) добавляют цианид калия (472 мг) и карбонат аммония (2,44 г). Смесь кипятят с обратным холодильником в течение ночи при 55°C. Смесь экстрагируют этилацетатом, сушат над сульфатом магния и концентрируют в вакууме, получая требуемое соединение.
1H ЯМР (CDCl3): δ 2,41 (с, 3H); 3,78 (д, 1H); 4,06-4,09 (м, 3H); 5,22-5,30 (м, 2H); 5,81-5,90 (м, 1H); 5,94 (с, 1H); 7,21-7,39 (м, 4H); 7,61 (с, 1H).
ЖХМС: (Rt=2,97 мин): без ионизации.
Стадия 5: 4-[2,5-диоксо-4-(3-метилфенил)-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 4-[(2-пропенилокси)метил]-4-(3-метилфенил)имидазолидин-2,5-диона (899 мг) и 4-бром-2-(трифторметил)бензонитрила (863 мг) в DMAC (5 мл) добавляют оксид меди(I) (395 мг). Смесь кипятят с обратным холодильником в течение ночи при 130°C. Смесь концентрируют, переносят в этилацетат, промывают 10% водным раствором аммония и насыщенным раствором соли. Органическую фазу сушат над сульфатом магния, концентрируют в вакууме и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,30 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 2,44 (с, 3H); 3,80 (д, 1H); 4,10 (м, 2H); 4,22 (д, 1H); 5,23-5,30 (м, 2H); 5,83-5,90 (м, 1H); 6,37 (с, 1H); 7,26-7,45 (м, 4H); 7,93-7,98 (с, 2H); 8,11 (с, 1H).
ЖХМС: (Rt=3,43 мин): 428- (M-H)-.
Стадия 6: 4-[2,5-диоксо-3-метил-4-(3-метилфенил)-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 4-[2,5-диоксо-4-(3-метилфенил)-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила (829 мг) в ДМФА (1,5 мл) добавляют карбонат калия (320 мг) и метилйодид (480 мкл). Смесь перемешивают 3 час при комн. т., выпаривают, промывают насыщенным раствором соли, экстрагируют этилацетатом, сушат над MgSO4 и концентрируют, получая требуемое соединение.
ТСХ: Fr=0,43 (этилацетат/циклогексан 30/70).
1H ЯМР (CDCl3): δ 2,43 (с, 3H); 3,04 (с, 3H); 3,97 (д, 1H); 4,14 (м, 2H); 4,42 (д, 1H); 5,25-5,34 (м, 2H); 5,85-5,91 (м, 1H); 7,17 (м, 2H); 7,26-7,28 (м, 1H); 7,93 (д, 2H); 8,01 (д, 1H); 8,15 (с, 1H).
ЖХМС: (Rt=4,01 мин): без ионизации.
Стадия 7: 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-метилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрил
К раствору 856 мг 4-[2,5-диоксо-3-метил-4-(3-метилфенил)-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила в ДХМ (5 мл) добавляют комплекс трифторборан-диметилсульфид (812 мкл). Смесь перемешивают 4 час при комн. т., разбавляют ДХМ, промывают водным раствором бикарбоната натрия, сушат над сульфатом магния, концентрируют и очищают на силикагеле (этилацетат/циклогексан от 0/100 до 50/50), получая требуемое соединение.
ТСХ: Fr=0,76 (этилацетат/циклогексан: 50/50).
1H ЯМР (CDCl3): δ 2,44 (с, 3H); 3,09 (с, 3H); 4,17 (д, 1H); 4,72 (д, 1H); 7,17 (м, 2H); 7,28 (м, 1H); 7,39 (м, 1H); 7,93 (д, 1H); 8,03 (д, 1H); 8,18 (с, 1H).
ЖХМС: (Rt=3,19 мин): 372- (M-CH2OH)-.
Пример 22: 4-[4-(2-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил
Взаимодействие 0,80 г 4-[4-(2-хлорфенил)-2,5-диоксо-3-метил-4-[(2-пропенилокси)метил]имидазолидин-1-ил]-2-трифторметилбензонитрила с применением протокола, описанного в примере 6, стадия 6, дает требуемое соединение.
1H ЯМР (ДМСО-D6): δ 2,69 (с, 3H); 4,25 (м, 1H); 4,46 (м, 1H); 5,90 (т, 1H); 7,50 (м, 3H); 7,58 (м, 2H); 8,05 (м, 2H), 8,35 (д, 1H).
ЖХМС: (Rt=3,47 мин): (392/394)- (M-CH2OH-).
Пример 23: [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил гидросульфат
Раствор 0,39 г 4-[3-метил-4-гидроксиметил-2,5-диоксо-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила и 0,48 г комплекса триоксид серы-пиридин в 20 мл пиридина кипятят с обратным холодильником в течение 18 час, затем выпаривают досуха. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью ДХМ/метанол/уксусная кислота/вода 90/10/1/1.
ТСХ: Fr=0,25 (ДХМ/метанол/уксусная кислота/вода 90/10/1/1).
1H ЯМР (CD3OD): δ 3,09 (NCH3); 4,69 (д, 1H); 5,03 (д, 1H); 7,54 (м, 5H); 8,13 (м, 2H); 8,25 (с, 1H).
ЖХМС: (Rt=3,52 мин): 468- (M-H-).
Пример 24: [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил дигидрофосфат
Стадия 1: [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил диэтилфосфат
Раствор 0,4 г 4-[3-метил-4-гидроксиметил-2,5-диоксо-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила в 2 мл пиридина и 0,2 мл диэтилфосфата перемешивают в течение 3 час при комн. т. в атмосфере аргона. Смесь гасят 2M водной соляной кислотой и экстрагируют диэтиловым эфиром и этилацетатом. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью ДХМ/этилацетат 4/1.
ТСХ: Fr=0,7 (4/1 ДХМ/этилацетат).
1H ЯМР (CD3OD): δ 1,31 (кв., 6H); 3,03 (с, 3H); 4,15 (м, 4H); 4,83 и 5,07 (2м, 2H); 7,45-7,55 (м, 5H); 8,06 (м, 1H); 8,15 (м, 2H).
ЖХМС: (Rt=3,76 мин): 526+ (MH+).
Стадия 2: [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил дигидрофосфат
В атмосфере аргона добавляют 1 мл бромтриметилсилана к раствору 0,39 г 1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил диэтилфосфата в 10 мл ДХМ, охлаждаемому при 0°C. Реакционную смесь перемешивают в течение 1 час при 0°C, затем 18 час при комн. т. Растворитель выпаривают, затем растворяют остаток в смеси воды и этанола. Растворители выпаривают и этот процесс повторяют дважды. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью ДХМ/метанол/уксусная кислота/вода 85/15/1/1 и получая 0,25 г белого твердого вещества. После промывания смесью диэтиловый эфир/пентан получают требуемое соединение.
1H ЯМР (ДМСО-D6): δ 2,90 (с, 3H); 4,58 и 4,70 (м, 2H); 7,49 (м, 5H); 8,04 (д, 1H); 8,20 (с, 1H); 8,35 (д, 1H).
ЖХМС: (Rt=2,46 мин): 468- (M-H-).
Пример 25: [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-3-метил-1-оксобутан-2-аминий хлорид
Стадия 1: [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метиловый эфир (2S)-2-[(1,1-диметилэтокси)карбониламино]-3-метилбутановой кислоты
Раствор 0,3 г 4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила, 0,217 г (2S)-2-[(1,1-диметилэтокси)карбониламино]-3-метилбутановой кислоты, 0,122 г 4-диметиламинопиридина и 0,3 г 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида в 50 мл дихлорметана перемешивают в течение 18 час, затем выливают в воду и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30 и получая требуемое соединение.
ТСХ: Fr=0,20 (гептан/этилацетат 70/30).
ЖХМС: (Rt=4,07 мин): 489+ (M-tBuOCO+H+).
Стадия 2: [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-3-метил-1-оксобутан-2-аминий хлорид
Добавляют 2 мл трифторуксусной кислоты к раствору 0,43 г [1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метилового эфира (2S)-2-[(1,1-диметилэтокси)карбониламино]-3-метилбутановой кислоты в 20 мл дихлорметана. Смесь перемешивают при 25°C в течение 2 час, затем растворитель выпаривают досуха. Сырой продукт разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают.
Сырой продукт растворяют в 100 мл смеси дихлорметан/этиловый эфир (5/95) и добавляют 0,4 мл 2M раствора хлористого водорода в этиловом эфире. После фильтрования получают требуемое соединение.
ТСХ: Fr=0,2 (дихлорметан/метанол 95/5).
1H ЯМР (CD3OD): δ 1,06 (м, 6H); 2,25 (м, 1H); 3,07 (д, 3H); 4,12 (м, 1H); 4,75 (дд, 1H); 4,88 (т, 1H); 7,58 (м, 5H); 8,19 (м, 2H); 8,26 (м, 1H).
ЖХМС: (Rt=2,8 мин): 489+ (M+H+).
Пример 26: 4-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-4-оксобутановая кислота
К раствору 0,20 г 4-[3-метил-4-гидроксиметил-2,5-диоксо-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила в 3 мл пиридина добавляют 6 мг диметиламинопиридина и 0,052 г янтарного ангидрида. Смесь перемешивают в течение 12 час, затем выпаривают досуха. Сырой продукт промывают водой и экстрагируют ДХМ. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью циклогексан/этилацетат 50/50 и получая требуемое соединение.
ТСХ: Fr=0,17 (циклогексан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 2,67-2,72 (м, 4H); 3,02 (с, 3H); 4,92 (д, 1H); 5,03 (д, 1H); 7,39 (м, 2H); 7,53 (м, 3H); 7,96 (д, 1H); 8,04 (дд, 1H); 8,18 (д, 1H).
ЖХМС: (Rt=3,49 мин): 358- (M-H-CH2O-C4H4O3).
Пример 27: (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метилдигидрофосфат
Стадия 1: (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метилдиэтилфосфат
Раствор 1,2 г (S)-4-[3-метил-4-гидроксиметил-2,5-диоксо-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила в 6 мл пиридина и 0,6 мл диэтилхлорфосфата перемешивают в течение 48 час при комнатной температуре в атмосфере аргона. Смесь гасят 2M водной соляной кислотой и экстрагируют этилацетатом. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью 1/1 гептан/этилацетат.
ТСХ: Fr=0,12 (1/1 гептан/этилацетат).
1H ЯМР (CDCl3): δ 1,45 (м, 6H); 1,75 (с, 1H); 3,10 (с, 3H); 4,13 (м, 4H); 4,65 (кв., 1H); 5,02 (кв., 1H); 7,37 (м, 2H); 7,51 (м, 3H); 7,95 (д, 1H); 8,0 (дд, 1H); 8,13 (c, 1H).
ЖХМС: (Rt=4,66 мин): 526+ (MH+).
[a]D=-44,8° (c=1%, EtOH).
Стадия 2: (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил дигидрофосфат
В атмосфере аргона добавляют 2,5 мл бромтриметилсилана к раствору 0,80 г (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил диэтилфосфата в 25 мл ДХМ, охлаждаемому при 0°C. Реакционную смесь перемешивают в течение 1 час при 0°C, затем 18 час при комнатной температуре. Растворитель выпаривают, затем остаток растворяют в смеси воды и метанола. Растворители выпаривают и этот процесс повторяют дважды. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью дихлорметан/метанол/уксусная кислота/вода от 90/10/1/1 до 85/15/2/2, получая требуемое соединение.
ТСХ: Fr=0,12 (дихлорметан/метанол/уксусная кислота/вода 85/15/2/2).
1H ЯМР (CD3OD): δ 2,00 (м, 2H); 3,09 (м, 2H); 3,37 (с, 3H); 4,51 (д, 1H); 4,91 (д под пиком воды, 1H); 7,53 (м, 5H); 816 (м, 2H); 8,27 (м, 1H).
ЖХМС: (Rt=2,50 мин): 470+ (M+H+).
[a]D=-47,6° (c=1,05%, EtOH).
Пример 28: (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-4-оксобутановая кислота
К раствору 0,60 г (S)-4-[3-метил-4-гидроксиметил-2,5-диоксо-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила в 24 мл пиридина добавляют 19 мг диметиламинопиридина и 1,54 г янтарного ангидрида. Смесь перемешивают при 110°C в течение 7 час, затем выпаривают досуха. Сырой продукт промывают водой и экстрагируют дихлорметаном. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 50/50 и получая требуемое соединение.
ТСХ: Fr=0,17 (циклогексан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 2,67-2,74 (м, 4H); 3,02 (с, 3H); 4,92 (д, 1H); 5,03 (д, 1H); 7,38 (м, 2H); 7,52 (м, 3H); 7,96 (д, 1H); 8,04 (дд, 1H); 8,18 (д, 1H).
ЖХМС: (Rt=3,22 мин): 358- (M-H-CH2O-C4H4O3).
Пример 29: (S)-((S)-1-(4-циано-3-(трифторметил)фенил)-3-метил-2,5-диоксо-4-фенилимидазолидин-4-ил)метил-3-метилбутаноат-2-аммоний хлорид
Стадия 1: (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метиловый эфир (2S)-2-[(1,1-диметилэтокси)карбониламино]-3-метилбутановой кислоты
Раствор 0,45 г (S)-4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрила, 0,33 г (2S)-2-[(1,1-диметилэтокси)карбониламино]-3-метилбутановой кислоты, 0,185 г 4-диметиламинопиридина и 0,45 г 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида в 70 мл дихлорметана перемешивают в течение 1 час, затем выливают в воду и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают. Сырой продукт очищают методом хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30 и получая требуемое соединение.
ТСХ: Fr=0,20 (гептан/этилацетат 70/30).
1H ЯМР (CDCl3): δ 0,89 и 0,97 (2д, 6H); 1,46 (с, 9H); 2,05 (м, 1H); 3,02 (с, 3H); 4,22 (м, 1H); 4,93 (м, 2H); 5,04 (м, 1H); 7,38 (м, 2H); 7,52 (м, 3H); 7,96 (д, 1H); 8,04 (д, 1H); 8,15 (с, 1H).
ЖХМС: (Rt=3,90 мин): 489+ (M-tBuOCO+H+).
[a]D=-54,7° (c=1,25%, EtOH).
Стадия 2: (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-3-метил-1-оксобутан-2-аминий хлорид
Добавляют 3 мл трифторуксусной кислоты к раствору 0,65 г (S)-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метилового эфира (2S)-2-[(1,1-диметилэтокси)карбониламино]-3-метилбутановой кислоты в 30 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение 5 час, добавляют 20 мл толуола, затем растворитель выпаривают досуха. Сырой продукт разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют и выпаривают.
Сырой продукт растворяют в 120 мл смеси дихлорметан/этиловый эфир (10/90) и добавляют 0,75 мл 2M раствора хлористого водорода в этиловом эфире. После фильтрования получают требуемое соединение.
ТСХ: Fr=0,2 (дихлорметан/метанол 95/5).
1H ЯМР (CD3OD): δ 1,07 и 1,10 (2д, 6H); 2,26 (м, 1H); 3,07(с, 3H); 4,11 (д, 1H); 5,22 и 5,36 (2д, 2H); 7,58 (м, 5H); 8,19 (AB, 2H); 8,25 (с, 1H).
[a]D=-46,7° (c=1,08%, EtOH).
Пример 30: 4-[2,5-диоксо-4-гидроксиметил-3-метил-4-фенилимидазолидин-1-ил]-2-метоксибензонитрил
Стадия 1: 4-[2,5-диоксо-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-метоксибензонитрил
Раствор 384 мг 4-циано-3-метоксифенилизоцианата (полученного согласно WO 2007/137874) в 8 мл диоксана добавляют к раствору 200 мг 2-гидроксиметил-2-фенилглицина (полученного согласно литературной методике) в водном растворе 1,8 мл 1 н. гидроксида натрия в 2 мл воды. Смесь перемешивают при комнатной температуре в течение ночи, подкисляют, добавляя 3 мл 12 н. HCl, и нагревают при 110°C в течение 2 час. Затем раствор обрабатывают насыщенным водным раствором бикарбоната натрия, экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют, выпаривают и очищают на силикагеле, элюируя смесью гептан/этилацетат 60/40 и получая ожидаемый продукт.
ТСХ: Fr=0,30 (гептан/этилацетат 50/50).
1H ЯМР (CDCl3): δ 3,98 (с, 3H); 4,06 и 4,40 (2д, 2H); 6,07 (широкий с, 1H); 7,23 (м, 2H); 7,51 (м, 3H); 7,66 (м, 3H).
ЖХМС: (Rt=5,44 мин): 306- (M-CH2OH)-.
Стадия 2: 4-[2,5-диоксо-4-гидроксиметил-1-метил-4-фенилимидазолидин-1-ил]-2-метоксибензонитрил
Добавляют 173 мг карбоната калия и 86 мкл метилйодида к раствору 141 мг 4-[2,5-диоксо-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-метоксибензонитрила в 2 мл ДМФА. Смесь перемешивают в течение ночи при комнатной температуре, выпаривают досуха. Остаток переносят в воду и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, фильтруют, выпаривают и хроматографируют на силикагеле, элюируя смесью гептан/этилацетат 70/30 и получая ожидаемый продукт.
1H ЯМР (CDCl3): δ 3,09 (с, 3H); 3,97 (с, 3H); 4,17 и 4,72 (2д, 2H); 7,27 (м, 2H); 7,40 (м, 2H); 7,50 (м, 3H); 7,64 (м, 1H).
ЖХМС: (Rt=5,67 мин): без ионизации.
Пример 31: (S)-1-(3,4-дихлорфенил)-4-гидроксиметил-3-метил-4-фенилимидазолидин-2,5-дион
Стадия 1: (S)-1-(3,4-дихлорфенил)-4-гидроксиметил-4-фенилимидазолидин-2,5-дион
Растворяют 217 мг (S)-2-гидроксиметил-2-фенилглицина (полученного согласно A. Olma, Polish J. Chem., 70, (1996), 1442-1447) в 5 мл 0,5 н. водного гидроксида натрия. Медленно добавляют за 10 мин 300 мг 3,4-дихлорфенилизоцианата, растворенного в 5 мл диоксана, затем смесь перемешивают в течение 1 час, pH составляет около 7-7,5. Добавляют 3 мл 0,5 н. водного гидроксида натрия для получения щелочного pH, затем медленно добавляют еще 300 мг 3,4-дихлорфенилизоцианата, растворенного в 5 мл диоксана. Смесь перемешивают еще в течение 1 часа при комнатной температуре, затем добавляют 12 н. соляную кислоту до кислого pH и смесь нагревают в течение 1 час при температуре кипения с обратным холодильником. Диоксан удаляют выпариванием в вакууме, экстрагируют водную фазу этилацетатом. Экстракты промывают насыщенным раствором соли, сушат над сульфатом магния и выпаривают досуха. Остаток очищают на силикагеле, элюируя с градиентом смеси от гептана до чистого этилацетата и получая ожидаемый продукт.
[a]D=-13,3° (c=1,02%, MeOH).
Стадия 2: (S)-1-(3,4-дихлорфенил)-4-гидроксиметил-3-метил-4-фенилимидазолидин-2,5-дион
Растворяют 150 мг (S)-1-(3,4-дихлорфенил)-4-гидроксиметил-4-фенилимидазолидин-2,5-диона в 5 мл диметилформамида, затем добавляют 165 мг карбоната калия и затем 137 мкл диметилсульфата. Смесь перемешивают в течение ночи при комнатной температуре, затем ее переносят в смесь воды и этилацетата. Водную фазу экстрагируют этилацетатом. Экстракты промывают насыщенным раствором соли, сушат над сульфатом магния и выпаривают досуха. Остаток очищают над силикагелем, элюируя с градиентом смеси от гептана до чистого этилацетата и получая ожидаемый продукт.
1H ЯМР (CDCl3): δ 3,04 (с, 3H); 4,11 и 4,65 (2д, 2H); 7,37 (м, 3H); 7,51 (м, 4H); 7,66 (д, 1H).
ЖХМС: (Rt=3,16 мин): 364/366+ (MH+); 333/335- (M-CH2OH)-.
[a]D=-38,5° (c=0,925%, EtOH).
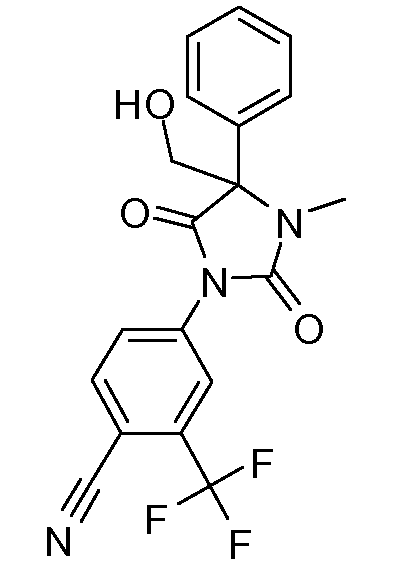

изомер A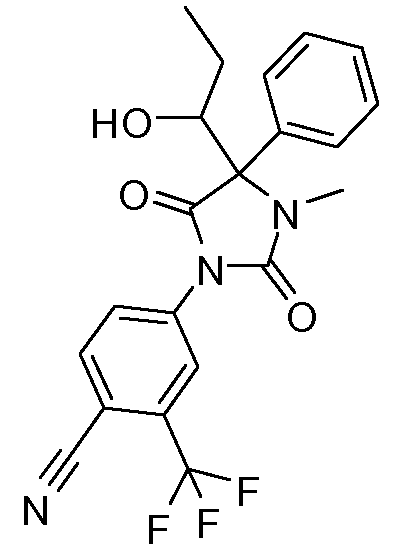
изомер B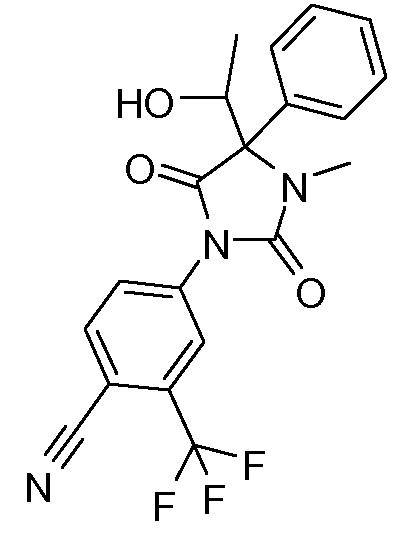
изомер A
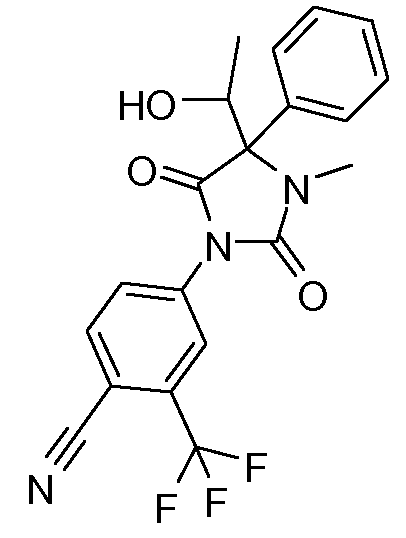
изомер B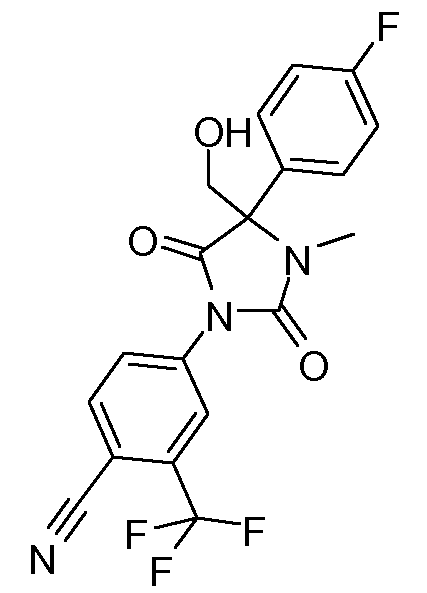
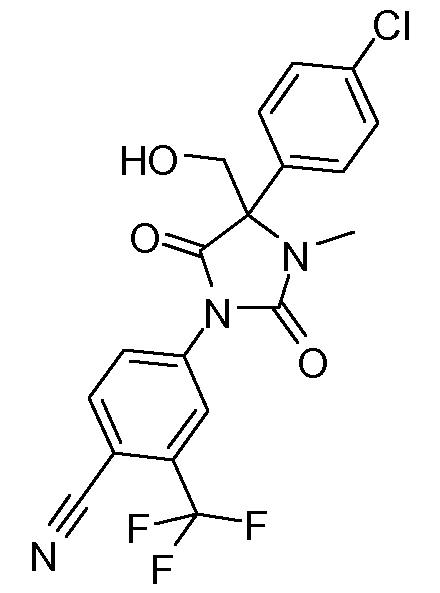
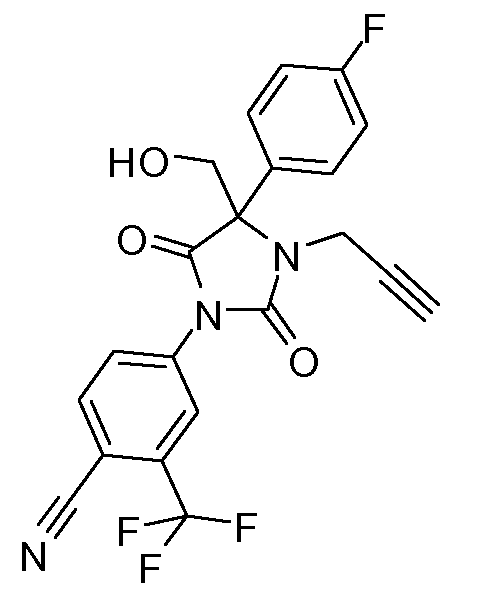
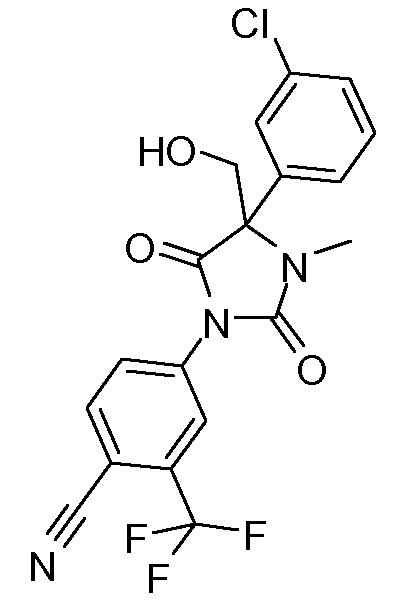
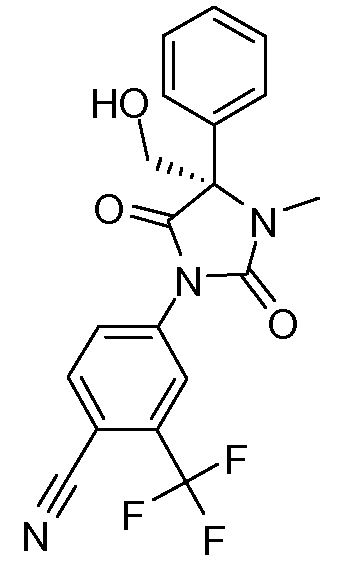
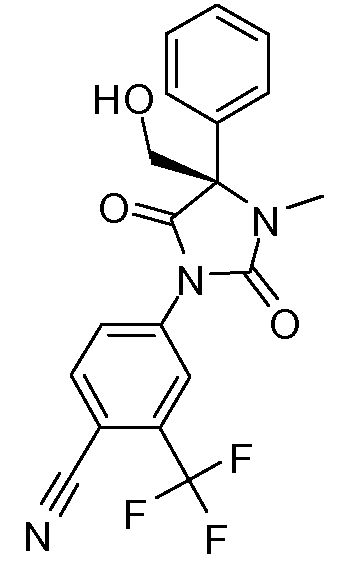
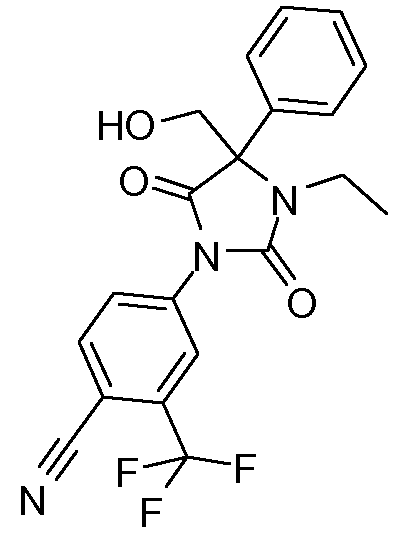
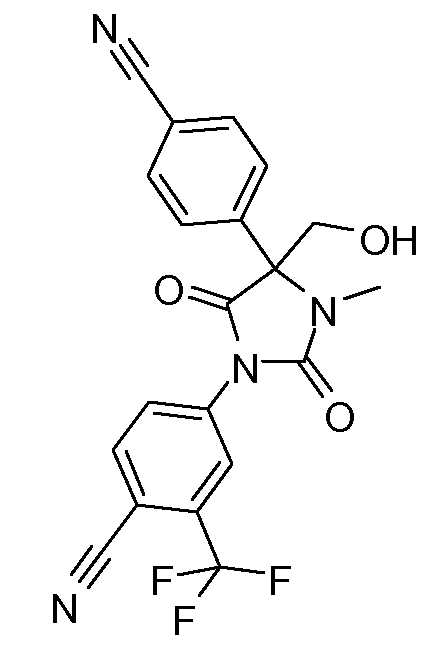
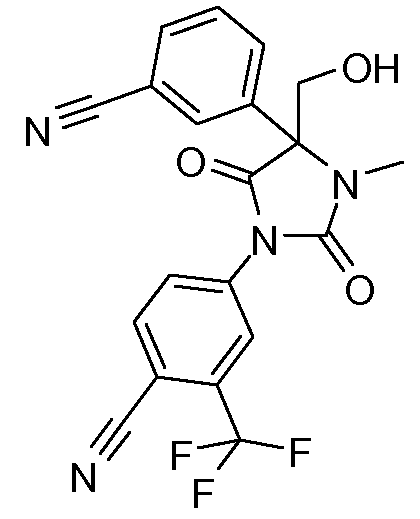
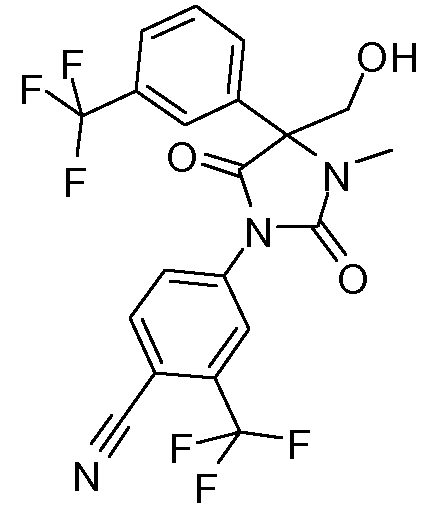

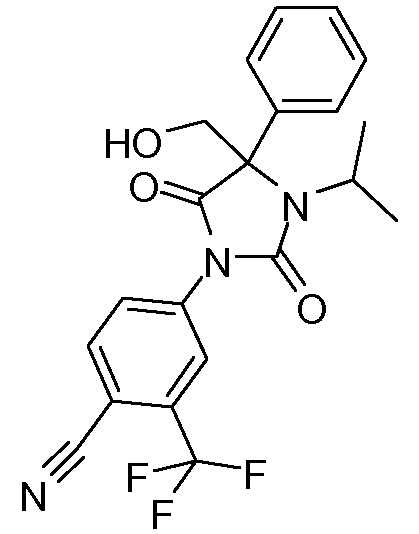

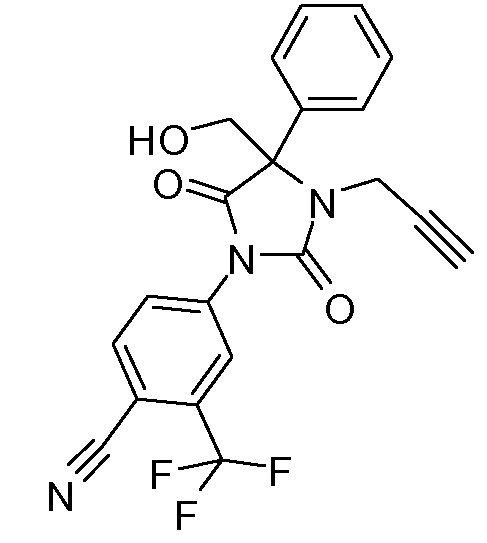
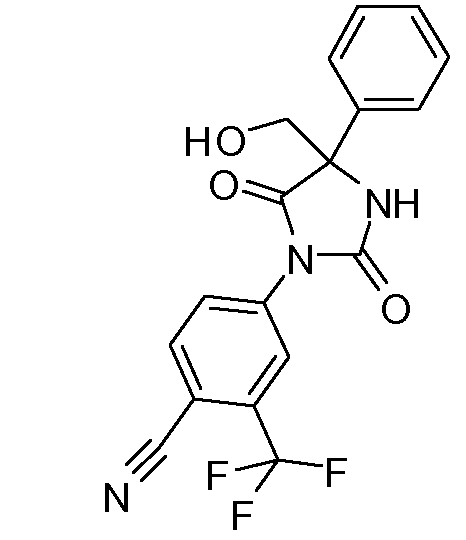
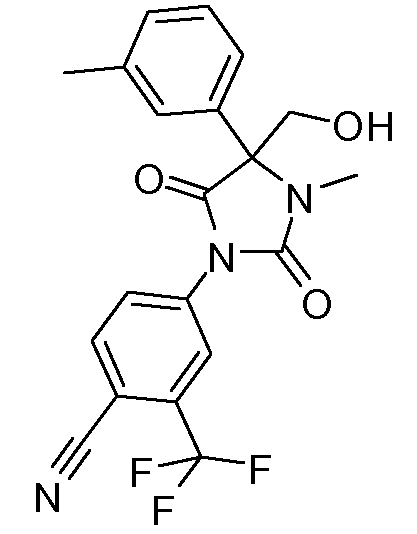

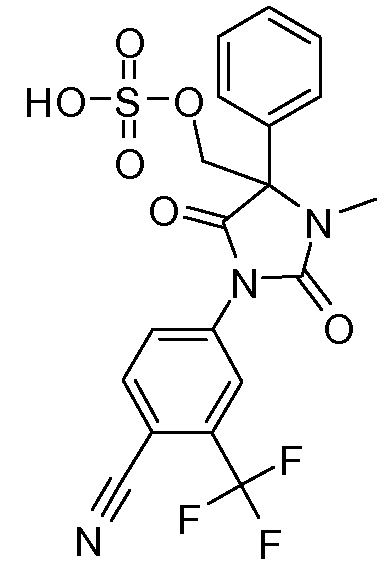
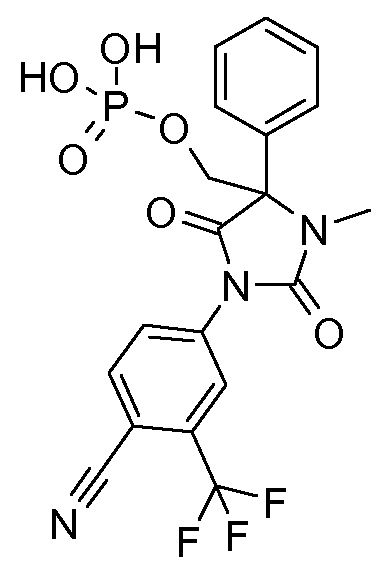

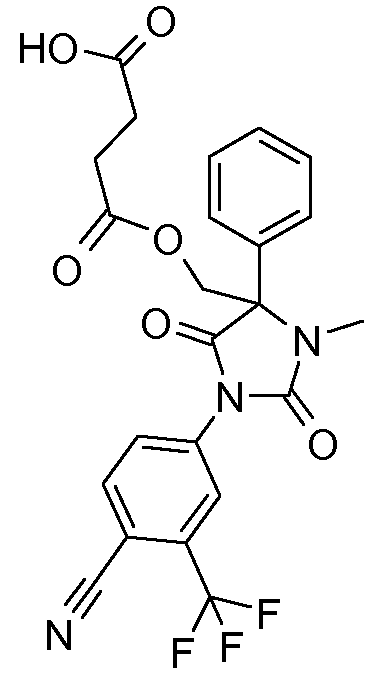
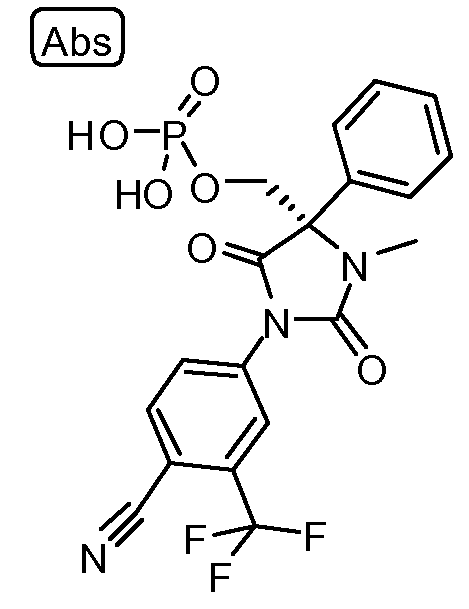
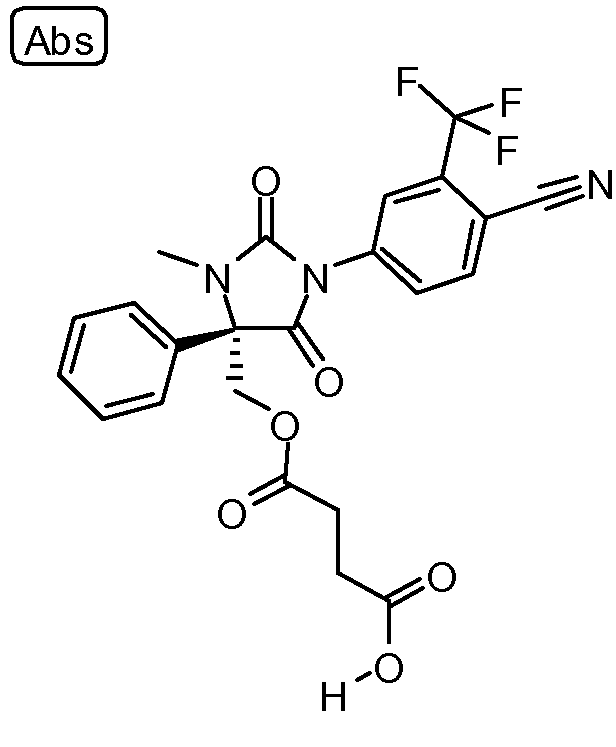
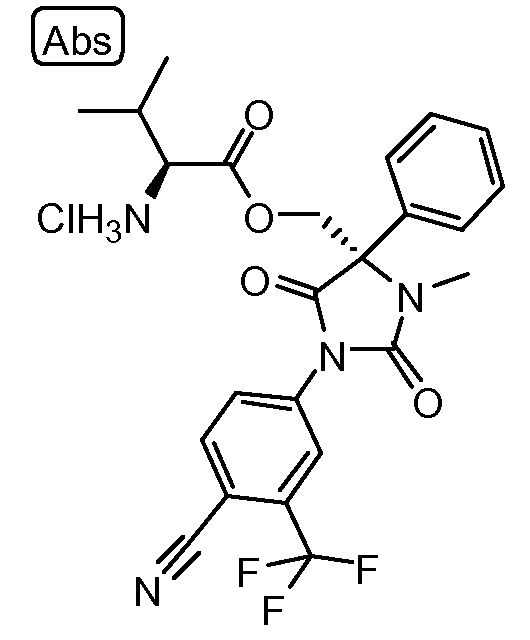
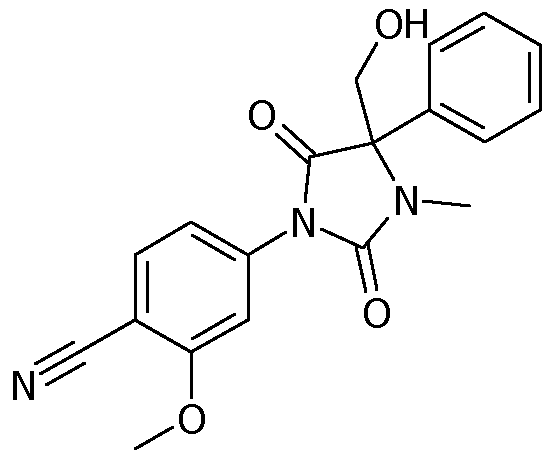
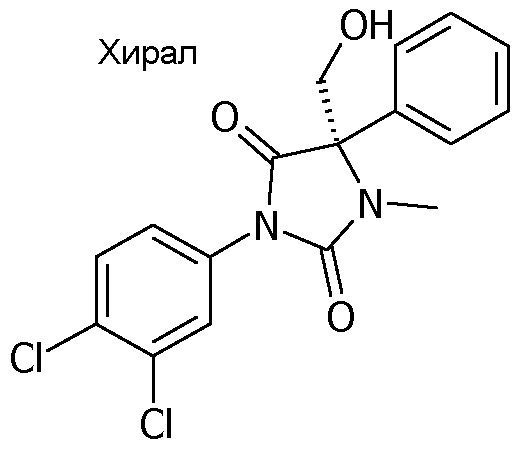
Биологические примеры
Эффективность описанного здесь соединения по изобретению можно продемонстрировать в тестах in vitro трансактивации после одновременной и стабильной экспрессии человеческого андрогеного рецептора (hAR) и репортерного гена под транскрипционным контролем респонсивных элементов (ARE) андрогенных рецепторов (AR) в клетках-хозяевах. Этот тест включает идентификацию чистых или частичных агонистов, которые имитируют эффекты природных гормонов, таких как DHT (дигидротестостерон), в данном случае или, с другой стороны, антагонистов, которые их ингибируют.
Для этого трансактивационного теста плазмиды, кодирующие репортерный ген, и человеческий андрогеный рецептор (hAR) вводят вместе посредством трансфекции в клеточную линию HeLa. Репортерная плазмида содержит люциферазную кДНК под контролем ARE, содержащихся в промоторных последовательностях гена пробазина (3xpbAREminicoll-luciferase/pGL3-puro). Экспрессия репортерного гена служит указанием транскрипционной активности hAR. Она также кодирует белок, позволяющий экспрессирующим его клеткам противостоять обработке пуромицином. Плазмида, кодирующая hAR, содержит кДНК рецептора hAR под контролем промотора цитомегаловируса (CMV). Она также кодирует белок, позволяющий экспрессирующим его клеткам противостоять обработке неомицином. Обработка клеток увеличивающимися количествами потенциально агонистических соединений повышает экспрессию репортерного гена. С другой стороны, для детектирования антагонистов тестируют увеличивающиеся дозы исследуемых соединений в присутствии увеличивающихся концентраций DHT. Экспрессия репортерного гена, которая постоянна для каждой дозы DHT, снижается, когда повышается концентрация тестового соединения.
1 - Исследования функциональной эффективности
1.1 Конструирование плазмид
1.1 a) Конструирование пуромицин-резистентной плазмиды 3xpbAREminicoll-luciferase/pGL3
Первая стадия включает введение в основной вектор pGL3 (Promega) минимального промотора гена коллагеназы выше гена, кодирующего люциферазу. Синтезированы два олигонуклеотида (coll-смысловой и coll-анти). Они позволяют вводить сайты расщепления рестрикционных ферментов SacI (подчеркнуты одной чертой в приведенных ниже последовательностях) и BglII (подчеркнуты двойной чертой в приведенных ниже последовательностях), соответственно, на концах 5' и 3' последовательности между положениями -42 и +46 (жирный шрифт в приведенных ниже последовательностях) описанной промоторной последовательности [P Angel и др. 1987 Mol. Cell. Biol., 7: 2256-2266]. После гибридизации и клонирования между сайтами SacI (положение 8) и BglII (положение 37) "pGL3 основной" плазмиды получают плазмиду "minicoll-luciferase/pGL3". Олигонуклеотидные последовательности "coll-смысловая" и "coll-анти" являются следующими:
coll-смысловая (SEQ ID No: 1):
5' CACTGTGTCGACGCGTGCAAGGACTCTATATATACAGAGGGAGCTTCCTAGCTGGGATATTGGAGCAGCAAGAGGCTGGGAAGCCATCACTTACCTTGCACTGA 3'
coll-анти (SEQ ID No: 2):
3'GATCTCAGTGCAAGGTAAGTGATGGCTTCCCAGCCTCTTGCTGCTCCAATATCCCAGCTAGGAAGCTCCCTCTGTATATATAGAGTCCTTGCACGCGTCGACACAGTGAGCT 5'
Вторая стадия включает мультимеризацию (3 раза) респонсивного элемента андрогенного рецептора, содержащегося на промоторе пробазина (pbARE) (выделено жирным шрифтом в приведенных ниже последовательностях) (F. Claessens и др. 1996 J. Biol. Chem. 271: 19013-19016), и введение его между сайтами KpnI и Ecl136II-плазмиды "minicoll luciferase/pGL3". Синтезируют два олигонуклеотида (coll-смысловой и coll-анти). Они позволяют введение сайтов расщепления рестрикционных ферментов KpnI (подчеркнуты одной чертой в приведенных ниже последовательностях) и тупого конца (подчеркнуты двумя чертами в приведенных ниже последовательностях) на концах 5' и 3', соответственно. После гибридизации получают фрагмент ДНК, который может быть клонирован между сайтами Kpnl (положение 1) и Ecl136II (положение 8) плазмиды "minicoll-luciferase/pGL3", генерируя, таким образом, плазмиду "3xpbAREminicoll-luciferase/pGL3". Олигонуклеотидные последовательности "coll-смысловая" и "3xpbARE-анти" являются следующими:
3xpbARE-смысловая (SEQ ID No: 3):
5' CAAAGAGCTCTAGCTTAATAGGTTCTTGGAGTACTTTACGTGCTTAATAGGTTCTTGGAGTACT TTACGTGCTTAATAGGTTCTTGGAGTACTTT 3'
3xpbARE-анти (SEQ ID No: 4);
3' AAAGTACTCCAAGAACCTATTAAGCACGTAAAGTACTCCAAGAACCTATTAAGCACGTAAAGTA CTCCAAGAACCTATTAAGCTAGAGCTCTTTGGTAC 5'
Третья стадия включает введение пуромицин-резистентного гена в плазмиду "3xpbAREminicoll-luciferase/pGL3". Конструкциию [промотор-пуромицин-резистентный ген последовательности полиаденилирования SV40] (фрагмент 1-1396, библиотека генов U07648) субклонируют, применяя ПЦР амплификацию, исходя из плазмиды "pPUR" (Clontech) и используя два олигонуклеотида (pPUR-смысловой и pPUR-анти), позволяющие ввести сайт расщепления BamHI. Фрагмент из 1550 пар оснований, полученный после ПЦР (30 циклов, 30 сек при 94°C, 30 сек при 55°C, 1,5 мин при 72°C), оценивается посредством BamHI, затем клонируется на отдельном сайте BamHI плазмиды 3xpbAREminicoll-luciferase/pGL3, давая, таким образом, пуромицин резистентную плазмиду 3xpbAREminicoll-luciferase/pGL3. Олигонуклеотидные последовательности "coll-смысловая" и "coll-анти" являются следующими:
pPUR-смысловая (SEQ ID No: 5): 5' TAAGGATCCGCTGTGGAATGTGTGTCAGTT 3'
pPUR-анти (SEQ ID No: 6): 3' GACGGATCCAGACATGATAAGATACATTGA 5'
1.1b Конструирование плазмиды "pcDNA3-hAR"
Последовательность, кодирующую hAR кДНК, клонируют между сайтами EcoRI и XbaI вектора pcDNA3.1(+) (Invitrogen), исходя из вектора psg5-hAR (предоставленного профессором P. Chambon, IGBMC, Illkirch, France). Эта плазмида содержит последовательность, описанную Tilley WD и др. [Tilley WD и др. 1989, Proc Natl Acad Sci USA. 86:327-31; Библиотека генов J04150].
1.2 Создание стабильной клеточной линии HALP
Для этого теста получают клетки HeLa из American Type Culture Collection (Rockville, MD) и культивируют в среде DMEM, содержащей 4,5 г/л глюкозы, дополненной Glutamax, несущественными аминокислотами и 10% фетальной телячьей сывороткой (SVF; Dominique Dutscher).
За день до трансфекции высевают в чашки Петри миллион клеток в среду DMEM, не содержащую фенолового красного, дополненную Glutamax и SVF (5%) без стероидов. Клетки трансфицируют посредством 4 мкг пуромицин-резистентных плазмид pcDNA3-hAR и 3xpbAREminicoll-luciferase/pGL3, используя реагент "липофектамин плюс" (Invitrogen), следуя рекомендациям поставщиков. На следующий день после трансфекции высевают клетки с различными плотностями (от 10000 до 100000 клеток на чашку Петри). Через два дня после трансфекции трансфицированные клетки собирают в среду DMEM, не содержащую фенолового красного, дополненную Glutamax и SVF (5%) без стероидов, содержащую 400 мкг/мл G418 (Invitrogen) и 150 нг/мл пуромицина (Sigma). Культуральную среду обновляют еженедельно, пока не появятся резистентные клоны. Резистентные клоны отделяют и амплифицируют перед исследованием их функциональной реакции.
Исследование функциональной реакции проводят следующим образом: клетки высевают (80000 клеток на лунку, 48 лунок на планшет) за 24 час перед фазой стимуляции в среду DMEM, содержащую 4,5 г/л глюкозы, дополненную Glutamax, несущественными аминокислотами и SVF (5%) без стероидов. В день стимуляции посевную среду заменяют средой DMEM, не содержащей фенолового красного, дополненной Glutamax и SVF (5%) без стероидов, содержащей DHT в диапазоне концентраций от 1 пМ до 1 мкМ. Клетки приводят в контакт с соединениями на 18 час при 37°C. Затем среду удаляют, клетки подвергают лизису и определяют люциферазную активность, применяя реагент "система для определения активности люциферазы" (Promega) в соответствии с инструкциями производителей. Вызванную люминесценцию детектируют на счетчике типа TopCount (Perkin-Elmer). Клон (HALP2), сохраненный для скринингового исследования, демонстрирует кривую транскрипционной реакции, аналогичную кривой, полученной после транзиторной трансфекции тех же векторов в клетках HcLa.
1.3 Исследование функциональной реакции
Исследование функциональной реакции проводят на 96-луночных планшетах. Клетки HALP2 высевают (20000 клеток на лунку) в культуральную среду (DMEM с феноловым красным, 1% Pen-Strep, 1% несущественных аминокислот, 10% эмбриональной бычьей сыворотки, 400 мкг/мл генетицина и 0,150 мкг/мл пуромицина) в день 1. Через 24 час инкубации при 37°C, 5% CO2, высокой влажности (день 2) среду удаляют и обновляют исследовательской средой (DMEM, не содержащей фенолового красного, дополненной 1% Pen-Strep, 1% несущественных аминокислот и 5% эмбриональной бычьей сыворотки без стероидов). Еще через 24 час инкубации при 37°C, 5% CO2, высокой влажности (день 3) среду обновляют еще раз перед фазой стимуляции.
Стимуляция включает пересечение диапазона концентраций DHT (от 0,329 пМ до 640 нМ) с диапазоном концентраций исследуемого соединения (от 6,4 нМ до 4 мкМ). Клетки приводят в контакт с соединениями на 24 час при 37°C, 5% CO2, высокой влажности. Далее в день 4 удаляют среду и приводят в контакт с клетками реагент для определения люциферазной активности в соответствии с инструкциями производителей (SteadyLite, Perkin-Elmer). Вызванную люминесценцию детектируют на считывающем устройстве Envision (Perkin-Elmer).
Агонизм характеризуется значением EC50, другими словами, концентрацией исследуемого соединения, которая индуцирует 50% максимального агонистического эффекта, наблюдаемого в присутствии исследуемого соединения. Антагонизм характеризуется значением KSchild, другими словами, концентрацией исследуемого соединения, которая увеличивает EC50 DHT (дигидротестостерона) в 2 раза. Эту концентрацию определяют посредством общеизвестной Шильд-регрессии.
Определение относительного агонизма/антагонизма соединения производят путем сравнения максимальной активации, получаемой в присутствии указанного соединения, и активации, получаемой с использованием только DHT (100%).
Полуколичественная оценка:
(нМ)
(нМ)
агонист/антагонист
2. Характеристика на животных моделях
2.1 Адаптированная модель теста Хершбергера
In vivo активность соединений по изобретению можно продемонстрировать на адаптированной модели теста Хершбергера следующим образом.
Селективную модулирующую активность андрогеного рецептора исследуют на модели кастрированных неполовозрелых молодых крыс. Эта модель, которая широко признана для оценки анаболических эффектов андрогенных соединений на мышцы и простату, описана в работе Hershberger и др., 1953 Proc. Soc. Expt. Biol. Med., 83: 175.
Способ основан на измерении хорошо известных эффектов андрогенов на рост мышц и вспомогательные мужские половые органы животных, а также мужчин. Последствия кастрации проявляются в виде быстрой инволюции и атрофии простаты, семенных пузырьков и мышц, поднимающих анус (levator ani). Этот эффект можно полностью компенсировать посредством экзогенного введения андрогена, в частности тестостерона. Таким образом, эту модель применяют для определения способности исследуемых молекул сохранять массу вспомогательных половых органов и мышц у неполовозрелых кастрированных крыс и, следовательно, их андрогеную эффективность.
Неполовозрелых молодых крыс Sprague Dawley (4-5 недельного возраста) массой примерно 140-160 г (Charles River, Les Oncins, FRANCE) распределяют случайным образом по разным группам и содержат в обстановке при 22±2°C с циклом чередования день/ночь по 12 час и доступом к пище и питью без ограничения.
В день 0 (за семь дней до начала первой обработки) крыс взвешивают индивидуально, затем анестезируют, вводя внутрибрюшинно дозу кетамина/ксилазина (85/15 мг/кг, примерно 2 мл/кг). Далее каждое животное помещают в стерильную область и дезинфицируют живот и мошонку при помощи бетадина и 70% спирта. В случае контрольных животных, подвергаемых орхиэктомии (ORX), удаляют яички, производя надрез в середине мошонки. Затем накладывают стерильный шов, перевязывая часть ткани над яичком до хирургического иссечения каждого яичка. Животных из групп, подлежащих лечению исследуемыми соединениями, оперируют идентичным образом. В случае незатронутых контрольных животных (SHAM) яички извлекают аналогичным образом и деликатно помещают в их исходное положение. Затем зашивают место хирургического вмешательства, используя стерильную шовную нить, и место снова дезинфицируют, нанося бетадин. Далее каждое животное держат на стерильной подушке до пробуждения перед возвращением в свою клетку. Животных содержат в обстановке при 22±2°C с циклом чередования день/ночь по 12 час и доступом к пище и питью без ограничения. Животных обрабатывают веществами, подлежащими исследованию, начиная со дня 7 после хирургической операции и до дня 10, предшествующего умерщвлению (день 11).
Крыс разделяют на группы и обрабатывают ежедневно с 7 по 10 день в определенных ниже условиях.
Контрольная группа SHAM: носитель (PEG400/ДМСО/вода 79/1/20) вводят перорально.
Контрольная группа ORX: носитель (PEG400/ДМСО/вода 79/1/20) вводят перорально.
Подвергаемая обработке группа ORX: исследуемые соединения вводят индивидуально перорально в виде суспензии в описанном выше носителе при дозе 10 мг/кг.
После обработки в течение 4 последующих дней животных подвергают декапитации, применяя гильотину. Удаляют и взвешивают отдельно мышцы, поднимающие анус, и вентральную простату. Для межэкспериментального сравнения данных массу каждого органа стандартизуют и выражают в миллиграммах на 100 г массы животного (W). Для каждого органа фиксируют среднее значение стандартизованных масс для контрольной группы ORX посредством определения при 0% и фиксируют среднее значение стандартизованных масс контрольной группы SHAM посредством определения при 100%. Эффективность каждого продукта выражают в виде процента и рассчитывают, используя следующую формулу:
(Wобраб-WORX)/(WSHAM-WORX)×100
Последующий тест ANOVA применяют для статистического анализа с целью идентификации различий между группами.
Полуколичественная оценка
%
3. Определение абсолютной биодоступности
Для быстрого скрининга имидазолидиновых производных на основании их абсолютной биодоступности исследуют ограниченный фармакокинетический профиль только с четырьмя временными точками отбора образцов после введения пероральным и внутривенным способом на крысах Sprague Dawley следующим образом: вводят дозу каждого исследуемого соединения перорально (10 мг/кг) и внутривенно (3 мг/кг) животным групп, включающих по 3 самца крыс Sprague Dawley. Пероральные дозы вводят в виде раствора в EtOH/PEG400/H2O (1/79/20 об./об.) через пищеводный зонд (2 мг/мл, 5 мл/кг) и внутривенную дозу вводят в хвостовую вену как раствор в ДМСО/PEG400/H2O (1/65/34 об./об.) в виде болюса (3 мг/мл; 1 мл/кг). Перед пероральным введением дозы животных лишают пищи (вода без ограничения), по меньшей мере, на 16 час до начала исследования и на 6 час после введения.
Кровь отбирают из ретроорбитального синуса в полипропиленовые пробирки (Li-гепаринат) при +4°C в следующие моменты отбора образцов: через 0,083, 0,25, 1 и 3 час после внутривенной инъекции и через 0,25, 1, 3 и 6 час после перорального введения дозы. У трех (3) животных отбирают образец крови в каждый момент времени; у каждого животного отбирают образец крови четыре раза. После центрифугирования при 5000 об/мин и +4°C в течение 10 мин собирают плазму в полипропиленовые пробирки и хранят замороженной при -20°C до исследований. Образцы плазмы исследуют методом ЖХ-МС/МС с нижним пределом количественного определения от 1 до 10 нг/мл в зависимости от соединения (объем плазмы: 100 мкл).
Способ ЖХ-МС/МС для количественного определения в гепаринизированной плазме разработан для каждого исследуемого соединения. Подготовка образца включает осаждение белков плазмы метанолом и фильтрование при центрифугировании супернатанта на фильтровальных планшетах Captiva с 96 глубокими лунками 0,2 мкм. К метанольной фазе супернатанта добавляют воду до исследования способом жидкостной хроматографии (Pursuit 5 C18 20×2,0 мм VARIAN, петля 2 мкл, градиент смеси вода/метанол (от 90/10 до 0/100) в течение 1,7 мин) и тандемной масс-спектрометрии (API4000) с ионизацией распылением при повышенном давлении, регистрацией отрицательных ионов и применением мониторинга выбранных реакций. Способ включает 8 стандартных и 3 качественных уровня контроля с нижним пределом количественного определения, соответствующим первому стандартному уровню.
Воздействия определяют, применяя некомпартментную модель (WinNonLin 2.1), и абсолютную биологическую доступность (F) рассчитывают следующим образом:
[AUC(0-6h) перорально * 3 мг/кг]/AUC(0-3 час) IV 10 мг/кг] и выражают в процентах.
Полуколичественная оценка:
4. Определение абсолютной биологической доступности выбранных соединений по изобретению на крысах и собаках
Абсолютную биодоступность лекарственного средства после перорального введения доз соответствующих сложноэфирных пролекарств исследуют на крысах Sprague Dawley следующим образом: каждое пролекарство вводят перорально (10 мг/кг, т.е. дозу, эквивалентную 8 мг/кг лекарства) и лекарство вводят внутривенно (3 мг/кг) животным групп, состоящих из 3 самцов крыс Sprague Dawley. Пероральные дозы вводят как раствор в EtOH/PEG400/H2O (1/79/20; об./об.) через пищеводный зонд (2 мг/мл; 5 мл/кг) и внутривенную дозу вводят как раствор в ДМСО/PEG400/H2O (1/65/34; об./об.) в виде болюса в хвостовую вену (0,6 мг/мл; 5 мл/кг). Перед пероральным введением дозы животных лишают пищи (вода без ограничения), по меньшей мере, за 16 час до начала исследования и на 6 час после введения.
Кровь отбирают при помощи катетера, вставленного в яремную вену, и собирают в полипропиленовые пробирки (Li-гепаринат) при +4°C в следующие моменты времени: через 0,05, 0,25, 0,5, 1, 3, 5 и 8 час после внутривенной инъекции и через 0,25, 0,5, 1, 3, 5, 8 и 24 час после перорального введения дозы. Для предотвращения ex-vivo расщепления пролекарства с образованием лекарства к пробиркам для сбора крови добавляют некоторый объем PMSF (5 мг/мл фенилметилсульфонилфторида в этанольном растворе), соответствующий 10% объема отобранной крови. У трех (3) животных отбирают образцы крови в определенный момент времени. После центрифугирования при 5000 об/мин в течение 3 мин при +4°C собирают плазму в полипропиленовые пробирки и хранят до исследований в замороженном виде при -20°C.
У собак исследуют абсолютную биологическую доступность лекарственного средства после перорального введения дозы с соответствующими сложноэфирными пролекарствами следующим образом: вводят дозу каждого пролекарства перорально (дозу, эквивалентную 10 мг/кг лекарства) и дозу лекарства вводят внутривенно (3 мг/кг) 3 самцам гончих собак. Пероральные дозы вводят в виде порошка, которым заполнена желатиновая капсула, и внутривенную дозу вводят в головную вену как раствор в ДМСО/PEG400/H2O (1/65/34; об./об.) в виде болюса (3 мг/мл; 1 мл/кг). Перед пероральным введением дозы животных лишают пищи (вода без ограничения), по меньшей мере, за 12 час до начала исследования и на 4 час после введения.
Кровь отбирают посредством прямой венепункции яремной вены каждой из трех собак и собирают в полипропиленовые пробирки (Li-гепаринат) при +4°C в следующие моменты времени: через 0,083, 0,167, 0,25, 0,5, 1, 2, 4, 8, 10 и 24 час после внутривенной инъекции и через 0,25, 0,5, 1, 2, 4, 6, 8, 10 и 24 час после перорального введения дозы. Так как в плазме собак не происходит ex-vivo расщепления пролекарства с образованием лекарства, в пробирки для забора крови не добавляют ингибиторов эстеразы. После центрифугирования при 5000 об/мин в течение 3 мин при +4°C собирают плазму в полипропиленовые пробирки и хранят до исследований в замороженном виде при -20°C.
Уровень лекарства определяют в образцах плазмы крыс и собак методом ЖХ-МС/МС с нижним пределом количественного определения 1 нг/мл (объем плазмы: 25 мкл). Приготовление образца включает осаждение белков плазмы метанолом и фильтрование при центрифугировании супернатанта на фильтровальных планшетах Captiva с глубокими лунками 0,2 мкм. К метанольной фазе супернатанта добавляют воду до анализа методом жидкостной хроматографии (Pursuit 5 C18 20×2,0 мм VARIAN, петля 2 мкл, градиент смеси вода/метанол (от 90/10 до 0/100) за 1,7 мин) с тандемной масс-спектрометрией (API4000) с ионизацией распылением при повышенном давлении, регистрацией отрицательных ионов и применением мониторинга выбранных реакций. Способ включает 8 стандартных и 3 качественных контрольных уровня с нижним пределом количественного определения, соответствующим первому стандартному уровню.
Воздействия определяют, применяя некомпартментную модель (WinNonLin 5.2), и абсолютную биологическую доступность (F) рассчитывают следующим образом:
[AUC(0-z) перорально * 3 мг/кг]/AUC(0-z) IV 8 или 10 мг/кг] и выражают в процентах.
5. In-vivo эксперименты
5.1 Глюкокортикоид-индуцированная потеря мышечной массы (крысы).
В этой модели исследуют эффект соединения по изобретению на потерю мышечной массы, индуцированную дексаметазоном (Kun Ma и др., 2003). Самцов крыс Sprague Dawley 8-недельного возраста обрабатывают ежедневно 0,3 мг/кг дексаметазона посредством подкожного введения в течение 15 дней. Крыс делят на несколько групп: SHAM (без лечения, n=8), контроль (только носитель, n=8), нандролондеканоат (3 мг/кг/день, подкожно, n=8) и исследуемое соединение (выбранный диапазон пероральных доз, n=8). Через 15 дней лечения выделяют икроножную мышцу, взвешивают и определяют мышечную функцию на передней большеберцовой мышце (Hourde и др., 2009).
5.2 TNF-индуцированная кахексия (мыши)
В этой модели (Dario Coletti и др., 2005) индуцируют получение фактора некроза опухоли α (TNF) посредством электропорации ДНК с экспрессией гена TNF в большеберцовой мышце мышей. Хроническое воздействие TNF запускает истощающую мышцы реминисценцию кахексии. Самцов мышей делят на несколько групп: SHAM, контроль, нандролон деканоат и G100192. В конце обработки выделяют икроножную мышцу и камбаловидную мышцу, взвешивают и определяют мышечную функцию на камбаловидной мышце (Hourde и др., 2009).
5.3 Модель иммобилизации (мыши)
Разгрузка скелета вызывает потерю костной и мышечной массы. Эффекты соединения по изобретению на разгрузку скелета исследуют, применяя суспензию, вводимую в хвост, в течение 14 дней (Roland и др., 2005). Самцов мышей делят на несколько групп: без ввода суспензии, введение суспензии в хвост, введение суспензии в хвост с обработкой исследуемым соединением и введение суспензии в хвост с обработкой нандролондеканоатом. В конце эксперимента выделяют камбаловидную мышцу и икроножную мышцу, взвешивают и определяют мышечную функцию на камбаловидной мышце (Hourde и др., 2009).
5.4 Модель с орхидектомией (крысы)
Орхидектомия повышает степень обновления костей и массу мышечного жира. На этой модели исследуют эффект соединения по изобретению на состав мышц (соотношение постной и жировой масс) и обновление костей (Hourde и др., 2009). Самцов крыс Sprague Dalwey 8-недельного возраста делят на несколько групп: интактные крысы (SHAM), крысы с удаленными яичками, обработанные в течение 2 месяцев носителем, нандролондеканоатом или исследуемым соединением. В конце эксперимента исследуют соотношение постной и жировой масс и обновление костей, икроножную мышцу выделяют, взвешивают и определяют мышечную функцию на камбаловидной мышце (Hourde и др., 2009).
Все публикации, включая цитированные в описании патенты и патентные заявки, но не ограничиваясь этим, включены здесь в виде ссылок, как если бы для каждой индивидуальной публикации было бы специально и индивидуально указано, что она включена здесь в виде ссылки во всей своей полноте.
На основании предшествующего описания специалистам в данной области будут приходить на ум различные модификации и изменения в составе и способах по этому изобретению. Предполагается, что все такие модификации, подпадающие под область приложенной формулы изобретения, включены в нее.
Следует понимать, что такие факторы, как способность различных соединений проникать в дифференциальные клетки, могут вносить вклад в различия между активностью соединений в in vitro биохимических и клеточных исследованиях.
По меньшей мере, некоторые из химических названий соединений по изобретению, которые приведены и определены в этой заявке, можно получить автоматически, используя коммерчески доступное программное обеспечение по присваиванию химических названий, и нельзя независимо подтвердить. Типичные программы, выполняющие эту функцию, включают программу значений Lexichem, поставляемую Open Eye Software, Inc., и программу Autonom Software, поставляемую MDL, Inc. В случае когда указанное химическое название и изображенная структура отличаются, изображенную структуру регулируют.
Показанные здесь химические структуры получены с использованием ChemDraw® или ISIS®/DRAW. Любая открытая валентность, появляющаяся на атомах углерода, кислорода или азота в приведенных здесь структурах, указывает на присутствие атома водорода. Если в структуре имеется хиральный центр, но не показана специфическая стереохимия для хирального центра, то структура охватывает оба энантиомера, связанных с хиральной структурой.
ССЫЛКИ:
1. Kaufman JM and Vermeulen A. Endocr Rev. 2005, 26, 833-76.
2. The decline of androgen levels in elderly men and its clinical and therapeutic implications.
Liu PY et al. J. Clin. Endocrinol. Metab. 2004, 89, 4789-96.
Clinical review, 171: The rationale, efficacy and safety of androgen therapy in older men: future research and current practice recommendations.
3. Davison SL and Davis SR. J. Steroid Biochem. Mol. Biol. 2003, 85, 363-366. Androgens in women.
4. Mohler et al. Expert Opin. Ther. Patents 2005, 15 (11), 1565-1585.
5. EP-A-0966447.
6. EP-A-0572191.
7. WO 2007/137874.
8. Bundgard, H. Design of Prodrugs 1985, Elsevier, Amsterdam.
9. Remington's Pharmaceutical Sciences, 17th edition. 1985, Mack Publishing Company, Easton, Pennsylvania.
10. Greene, T.W. and Wuts, P.G.M. Protecting Groops in Organic Synthesis, Second Edition 1991, Wiley, New York.
11. Molander, G.A. and McKie, J.A. J. Org.Chem. 1995, 60, 872-882.
12. Angel, P. et al., Mol. Cell. Biol. 1987, 7: 2256-2266.
13. Claessens, F. et al., J. Biol. Chem. 1996, 271: 19013-19016.
14. Tilley, WD et al., Proc. Natl. Acad. Sci USA 1989, 86: 327-31. Gen library J04150.
15. Hershberger et al., Proc. Soc. Expt. Biol. Med. 1953, 83: 175.
16. Kun Ma, Con Mallidis, Shalender Bhasin, Vahid Mahabadi, Jorge Arfaza, Nestor Gonzalez-Cadavid, Jose Arias and Behrouz Salehian Am J Physiol Endocrinol Metab. 2003, 285: E363-E371.
Glucocorticoid-induced skeletal muscle atrophy is associated with upregulation of myostatin gene expression.
17. C. Hourde, C. Jagerschmidt, P. Clement-Lacroix, A. Vignaud, P. Ammann, G. S. Butler-Browne and A. Ferry. Acta Physiol. 2009, 195: 471-482. Androgen replacement therapy improves function in male rat muscles independently of hypertrophy and activation of the Akt/mTOR pathway.
18. Dario Coletti, Viviana Moresi, Sergio Adamo, Mario Molinaro and David Sassoon. Genesis 2005, 43: 120-128.
Tumor Necrosis Factor-α Gene Transfer Induces Cachexia and Inhibits Muscle Regeneration.
19. Roland M, Hanson AM, Cannon CM, Stodieck LS, Ferguson VL. Biomed Sci Instrum. 2005, 41: 128-34.
Exercise prevention of unloading-induced bone and muscle loss in adult mice.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТИОГИДАНТОИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА АНДРОГЕНА | 2012 |
|
RU2598854C2 |
| ПРОИЗВОДНЫЕ ИЗОХИНОЛИНОНА, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2690853C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ВЗАИМОДЕЙСТВИЯ/АКТИВАЦИИ PD1/PD-L1 | 2019 |
|
RU2777980C2 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2687093C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2695664C1 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2012 |
|
RU2629118C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ЛЕЙКОЗОВ | 2019 |
|
RU2804709C2 |
| КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С KIT | 2014 |
|
RU2706235C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2571662C2 |
Изобретение относится к области органической химии, а именно к новым производным 2,5-диоксо-имидазолидина общей формулы Ib, или к его фармацевтически приемлемым солям и сольватам, или сольватам фармацевтически приемлемых солей, где X означает O; R1 представляет собой H; или R1 выбран из C1-C6 алкила и C3-C6 алкинила, где алкил необязательно может быть замещен цианогруппой; R2a выбран из H, P(O)(OH)2 и C(O)(CH2)n1C(O)OH; или R2a выбран из -С(О)-C1-C6 алкила, который замещен амино; n1 равно 1 или 2; каждый R2b и R2c независимо выбран из H и C1-C6 алкила; R3a представляет собой H, атом галогена или циано; каждый R3b независимо представляет собой атом галогена или циано; или каждый R3b независимо представляет собой C1-C6 алкил, необязательно замещенный тремя атомами галогена; каждый R4a и R4b независимо представляет собой H или атом галогена; или каждый R4a и R4b выбран из C1-C6 алкила и C1-C6 алкокси, где алкил замещен тремя атомами галогена; R4c означает атом галогена или циано; и m1 равно 0 или 1. Также изобретение относится к фармацевтической композиции на основе соединения формулы Ib и его применению. Технический результат: получены новые производные 2,5-диоксо-имидазолидина, модулирующие активность андрогенных рецепторов. 6 н. и 14 з.п. ф-лы, 5 табл., 31 пр.

1. Соединение формулы Ib

где X означает O;
R1 представляет собой H; или
R1 выбран из C1-C6 алкила и C3-C6 алкинила, где алкил необязательно может быть замещен цианогруппой;
R2a выбран из H, P(O)(OH)2 и C(O)(CH2)n1C(O)OH; или
R2a выбран из -С(О)-C1-C6 алкила, который замещен амино;
n1 равно 1 или 2;
каждый R2b и R2c независимо выбран из H и C1-C6 алкила;
R3a представляет собой H, атом галогена или циано;
каждый R3b независимо представляет собой атом галогена или циано; или
каждый R3b независимо представляет собой C1-C6 алкил, необязательно замещенный тремя атомами галогена;
каждый R4a и R4b независимо представляет собой H или атом галогена; или
каждый R4a и R4b выбран из C1-C6 алкила и C1-C6 алкокси, где алкил замещен тремя атомами галогена;
R4c означает атом галогена или циано; и
m1 равно 0 или 1;
или его фармацевтически приемлемые соли и сольваты, или сольваты фармацевтически приемлемых солей.
2. Соединение или его фармацевтически приемлемая соль по п.1, где X означает O.
3. Соединение или его фармацевтически приемлемая соль по п.1 или 2, где R2b означает H, Me или Et.
4. Соединение или его фармацевтически приемлемая соль по п.1 где R2c означает H, Me или Et.
5. Соединение или его фармацевтически приемлемая соль по п.1, где R2a представляет собой H.
6. Соединение или его фармацевтически приемлемая соль по п.1, где R2a представляет собой P(O)(OH)2.
7. Соединение или его фармацевтически приемлемая соль по п.1, где R2a представляет собой C(O)(CH2)n1C(O)OH; и n1 равно 1 или 2.
8. Соединение или его фармацевтически приемлемая соль по п.1, где R1 представляет собой Me, Et, i-Pr или n-Pr.
9. Соединение или его фармацевтически приемлемая соль по п.1, где соединение соответствует формуле II

где R3a, R3b, R4a, R4b, R4c и m1 такие, как в п.1.
10. Соединение или его фармацевтически приемлемая соль по п.1, где R4c представляет собой циано или атом галогена.
11. Соединение или его фармацевтически приемлемая соль по п.1, где R4b представляет собой H, атом галогена или C1-C6 алкил, где алкил замещен тремя атомами галогена.
12. Соединение или его фармацевтически приемлемая соль по п.1, где соединение соответствует формуле Va, Vb, Vc или Vd:

и где R3a такой, как в п.1; и
R3c представляет собой H, атом галогена или циано; или
R3c представляет собой C1-C6 алкил, необязательно замещенный тремя атомами галогена.
13. Соединение или его фармацевтически приемлемая соль по п.12, где R3a представляет собой H, атом галогена или циано; и R3c представляет собой H.
14. Соединение или его фармацевтически приемлемая соль по п.12, где R3a представляет собой H; и R3c представляет собой H, атом галогена, C1-C6 алкил, необязательно замещенный тремя атомами галогена, или циано.
15. Соединение или его фармацевтически приемлемая соль по п.1, где соединение выбрано из следующих:
4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(1-гидроксипропил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(1-гидроксиэтил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(4-фторфенил)-4-(гидроксиметил)-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(4-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метил-имидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(4-фторфенил)-4-гидроксиметил-3-(2-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(3-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метил-имидазолидин-1-ил]-2-трифторметилбензонитрил;
(S)-4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
(R)-4-[2,5-диоксо-4-(гидроксиметил)-3-метил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-3-этил-4-(гидроксиметил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(4-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(3-цианофенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-трифторметилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрил;
1-(3,4-дихлорфенил)-4-гидроксиметил-3-метил-4-фенилимидазолидин-2,5-дион;
4-[2,5-диоксо-4-(гидроксиметил)-3-(1-метилэтил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[3-цианометил-2,5-диоксо-4-(гидроксиметил)-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-(гидроксиметил)-4-фенил-3-(1-пропинил)имидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-гидроксиметил-4-фенилимидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[2,5-диоксо-4-гидроксиметил-3-метил-4-(3-метилфенил)имидазолидин-1-ил]-2-трифторметилбензонитрил;
4-[4-(2-хлорфенил)-2,5-диоксо-4-гидроксиметил-3-метилимидазолидин-1-ил]-2-трифторметилбензонитрил;
[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метил дигидрофосфат;
(2S)-1-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-3-метил-1-оксобутан-2-аммония хлорид;
4-[1-(4-циано-3-трифторметилфенил)-2,5-диоксо-3-метил-4-фенилимидазолидин-4-ил]метокси-4-оксобутановая кислота;
(S)-(1-(4-циано-3-(трифторметил)фенил)-3-метил-2,5-диоксо-4-фенилимидазолидин-4-ил)метил дигидрофосфат;
(S)-4-((1-(4-циано-3-(трифторметил)фенил)-3-метил-2,5-диоксо-4-фенилимидазолидин-4-ил)метокси)-4-оксобутановая кислота;
(S)-((S)-1-(4-циано-3-(трифторметил)фенил)-3-метил-2,5-диоксо-4-фенилимидазолидин-4-ил)метил-3-метилбутаноат-2-аммония хлорид;
4-[2,5-диоксо-4-гидроксиметил-3-метил-4-фенилимидазолидин-1-ил]-2-метоксибензонитрил и
(S)-1-(3,4-дихлорфенил)-4-гидроксиметил-3-метил-4-фенилимидазолидин-2,5-дион.
16. Фармацевтическая композиция, модулирующая активность андрогенных рецепторов, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения по п.1.
17. Применение соединения или фармацевтически приемлемой соли по п.1 для лечения или профилактики состояний, которые обусловлены или свойственны изменению уровней циркулирующих андрогенов у млекопитающих.
18. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения или профилактики состояния, характеризующегося пониженной активностью андрогенных рецепторов.
19. Применение соединения или его фармацевтически приемлемой соли по п.1, где указанное соединение является агонистом или смешанным агонистом/антагонистом андрогенного рецептора, для лечения или профилактики остеопороза, саркопении, сниженного либидо и/или сексуальной дисфункции.
20. Применение соединения или его фармацевтически приемлемой соли по п.1, где указанное соединение является антагонистом или смешанным агонистом/антагонистом андрогенного рецептора, для лечения или профилактики андроген-зависимой опухоли, такой как рак простаты или гиперплазия.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| ЗАМЕЩЕННЫЕ ФЕНИЛИМИДАЗОЛИДИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2152934C1 |
| Способ получения производных гидантоина | 1979 |
|
SU873878A3 |
| Гербицидная композиция | 1971 |
|
SU578823A3 |
Авторы
Даты
2013-07-27—Публикация
2009-09-10—Подача