Область техники
Настоящая заявка заявляет приоритет согласно Корейской заявке на патент №10-2017-0047393, поданной 12 апреля 2017 года, и Корейской заявке на патент №10-2018-0042545, поданной 12 апреля 2018 года, раскрытия которых включены в данный документ посредством ссылки.
Настоящее изобретение относится к соединениям, применимым в качестве агонистов фарнезоид-Х-рецептора (FXR, NR1H4), к фармацевтическому составу, содержащему такие соединения, и к исследованию для оценки возможности их применения в медицине.
Уровень техники
Фарнезоид-Х-рецептор (FXR, NR1H4) является представителем надсемейства ядерных гормональных рецепторов, представляющих собой лиганд-активируемые факторы транскрипции. Высокие уровни FXR экспрессируются в печени, кишечнике, почке, надпочечниках, белой жировой ткани, и их экспрессия индуцируется в ходе дифференцировки адипоцитов in vitro. (Cariu В. et al., J. Biol. Chem., 2006, 16, 11039-11049).
FXR не только осуществляет регуляцию разных физиологических процессов, как например, модулирует регуляцию желчных кислот (ВА), метаболизм липидов/глюкозы, воспаление/фиброз, но в последнее время его также связывают с патологией, ассоциированной с FXR-рецепторами.
Данный ядерный рецептор представляет собой внутриклеточный "датчик" желчных кислот, основная физиологическая роль которого заключается в защите клеток печени от повреждающего воздействия избытка желчных кислот (ВА). Кишечник представляет собой ткань, в которой экспрессируется первый идентифицированный целевой ген FXR. Более того, IBAB-Р экспрессируется в энтероцитах и связывает желчные кислоты, ограничивая таким образом концентрацию свободных ВА внутри клеток и, следовательно, снижая их токсичность. (Makishima М, et al., Science, 1999, 284(5418), 1362-1365). Высокие уровни FXR экспрессируются в печени и регулируют ключевые гены у людей, вовлеченные в синтез, метаболизм и транспорт ВА, включая CYP7A1, UGT2B4, BSEP, MDR3, MRP2, ASBT, NTCP, OST α и OST β. Один эффект от активации FXR заключается в отрицательной регуляции CYP7A1 и в снижении, таким образом, синтеза желчных кислот; причем это осуществляется посредством индукции SHP (короткого гетеродимерного партнера), который в дальнейшем подавляет транскрипцию CYP7A1 (Claude Т. et al., Arterioscler. Thromb. Vase. Biol., 2005, 25, 2020-2031). Нарушенная экспрессия или нарушенная функция данных генов были описаны у пациентов с холестатическим заболеванием печени. Было обнаружено, что агонист FXR, 6-этил-хенодезоксихолевая кислота (6EtCDCA), полностью устраняет нарушенное выделение желчи и защищает гепатоциты печени от повреждения, обусловленного цитотоксичной литохолевой кислотой. (Pelliciari R. et al., J. Med. Chem., 2002, 45(17), 3569-3572).
В кишечнике FXR также индуцирует экспрессию SHP, который подавляет транскрипцию гена апикального натрий-зависимого транспортера желчных кислот (ASBT, SLC10A2), который кодирует высокоаффинный апикальный натрий-зависимый транспортер желчных кислот, обеспечивающий перемещение желчных кислот из просвета кишечника в энтероциты и являющийся частью энтерогепатической рециркуляции желчных кислот (Li Н. et al., Am. J. Physiol. Gastrointest. Liver Physiol., 2005, 288, G60-G66). Ген экспрессируемого в подвздошной кишке белка, связывающего желчные кислоты (IBABP), также индуцируется агонистами FXR в энтероцитах (Grober J. et al., J. Biol. Chem., 1999, 274(42), 29759-29754). По-видимому, FXR также вовлечены в паракринную и эндокринную передачу сигнала посредством положительной регуляции экспрессии цитокина фактора роста фибробластов 15 (грызуны) или 19 (обезьяны, люди) (Holt J. et al., Genes Dev., 2003, 17(13), 1581-1591; Inagaki T. et al., Cell Metab., 2005, 2(4), 217-225).
Также было описано, что активация FXR обеспечивает отрицательную регуляцию провоспалительных ферментов iNOS и СОХ-2, а также миграцию гладкомышечных клеток (Li YTY, et al., Arterioscler Thromb Vase Biol., 2007, 27(12), 2606-2611). FXR также экспрессируется в звездчатых клетках печени (HSC), которые играют роль в отложении внеклеточного матрикса в ходе процесса фиброза. Обработка культивируемых HSC с помощью агониста FXR, 6-этил-хенодезоксихолевой кислоты (6EtCDCA), приводит в результате к снижению экспрессии маркеров фиброза, таких как α-актин гладкомышечных клеток и α1(I)-коллаген. Также сообщали, что 6EtCDCA предупреждает развитие и обеспечивает разрешение фиброза печени во множестве моделей данного заболевания у грызунов. (Fiorucci S. et al., Gastroenterology, 2004, 127(5), 1497-1512; Fiorucci S. et al., J. Pharmacol. Exp. Ther., 2005, 314(2), 584-595).
Процесс энтерогепатической циркуляции желчных кислот также является основным регулятором гомеостаза сывороточного холестерина. После биосинтеза из холестерина в печени желчные кислоты (ВА) секретируются с желчью в просвет тонкого кишечника с целью содействия расщеплению и абсорбции жиров и жирорастворимых витаминов. Соотношение различных ВА определяет гидрофильность пула желчной кислоты и его способность к солюбилизации холестерина. Активация FXR повышает гидрофильность пула, уменьшая солюбилизацию холестерина в кишечнике, эффективно блокируя его абсорбцию. Недавние сообщения показали, что FXR частично противодействует данному эффекту путем непосредственного подавления экспрессии HMGCoA-редуктазы через путь, в который вовлечен SHP (короткий гетеродимерный партнер) и LRH1 (Datta S. et al., J. Biol. Chem., 2006, 281(2), 807-812).
Согласно дальнейшим исследованиям, активация FXR воздействует на метаболизм триглицеридов (TG) посредством ряда сигнальных путей, таких как фактор транскрипции 1, связывающий стеролрегулирующие элементы (SREBF1), ароС-III, ароС-II, синдекан-1 и рецептор VLDL. Недавно новые соединения-модуляторы FXR продемонстрировали способность к снижению уровней как триглицеридов (TG), так и холестерина в плазме крови в моделях здоровых животных и животных с гиперлипидемией (WO 2007070796).
Кроме того, лечение с применением агониста FXR GW4064 или холевой кислоты снижало уровни глюкозы в плазме крови и улучшало чувствительность к инсулину в моделях диабета (мыши db/db, ob/ob и KK-A(y))(Cariu В. et al., J. Biol. Chem., 2006, 281(16), 11039-11049 Zhang Y. et al., Proc. Natl. Acad. Sci., 2006, 103(4), 1006-1011; Ma K. et al., J. Clin. Invest., 2006, 116, 1102-1109). Это демонстрирует, что FXR вовлечен в метаболизм глюкозы.
Следовательно, активность FXR вовлечена во множество заболеваний, включая без ограничения нарушение гомеостаза желчных кислот, воспаление/фиброз и высокие уровни триглицеридов (TG)/холестерина в плазме крови.
Традиционно известные агонисты FXR INT-747(OCA) и EDP-305 представляют собой модифицированные желчные кислоты (ВА), разработанные с целью лечения заболеваний, обусловленных нарушением гомеостаза желчных кислот, таких как неалкогольная жировая болезнь печени (NASH), нарушения, связанные с употреблением алкоголя, первичный билиарный цирроз (РВС), первичный склерозирующий холангит (PSC), и они имеют клинически выраженные побочные эффекты, обусловленные накоплением веществ в организме.
Впоследствии были получены низкомолекулярные соединения-агонисты FXR из соединений GW4064, PX-102(GS-9674)/PX-104, при этом международные фармацевтические компании опубликовали ряд патентов с описанием их различных производных (WO 2000037077, WO 2003015771, WO 2004048349, WO 2009012125, WO 2009149795, WO 2011020615, WO 2013037482 и WO 2016097933).
По мере того, как агонисты FXR совершенствуются относительно ранее опубликованной клинической литературы, ожидается новый механизм действия для использования в лечении.
Разработка агонистов FXR направлена на лечение различных заболеваний, включая без ограничения нарушение гомеостаза желчных кислот, воспаление/фиброз и высокие уровни триглицеридов (TG)/холестерина в плазме крови, поэтому она привлекает широкое международное внимание.
Таким образом, в настоящем изобретение предполагают, что пациенты с метаболическими заболеваниями, в том числе без ограничения с холестатическими заболеваниями печени, фиброзом органов и фиброзом печени, смогут найти для себя терапевтическую область применения нового механизма.
Раскрытие настоящего изобретения
Техническая задача
Настоящее изобретение относится к высокоактивным соединениям, представляющим собой агонист FXR. В частности, настоящее изобретение относится к их производным и способам их получения.
Кроме того, целью настоящего изобретения является обеспечение эффективного лечения заболеваний для применения в медицине, предназначенного для модулирования активности FXR-рецепторов и лечения, предупреждения или уменьшения интенсивности одного или нескольких симптомов заболевания или нарушения, связанных с активностью данных рецепторов, в том числе без ограничения гиперхолестеринемии, гиперлипопротеинемии, гипертриглицеридемии, дислипидемии, липодистрофии, холестаза/фиброза, холестериновой желчнокаменной болезни, заболевания желудочно-кишечного тракта или патологического состояния, гипергликемии, диабета, инсулинорезистентности, нарушенной метаболической пластичности, нефропатии, заболеваний печени, атеросклероза, рака, воспалительных нарушений, остеопороза и старения кожи.
Однако технические задачи, которые должны быть выполнены в настоящем изобретении, не ограничиваются указанными выше, при этом другие объекты могут быть четко понятны специалистам в данной области техники из последующего описания.
Решение технической задачи
Чтобы решить описанную выше проблему, в настоящем изобретении представлено соединение, представленное формулой I, его рацемат, энантиомер, диастереоизомер или его фармацевтически приемлемая соль.
[Формула I]
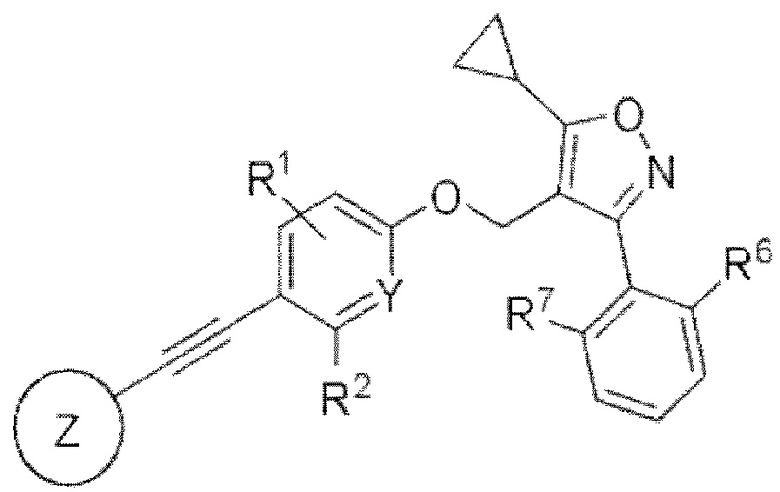
В представленной формуле I
Y представляет собой углерод или азот,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой 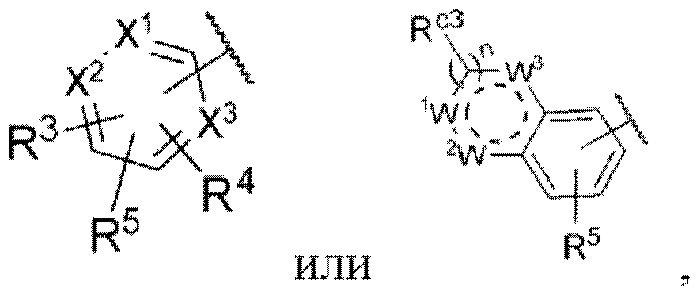
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
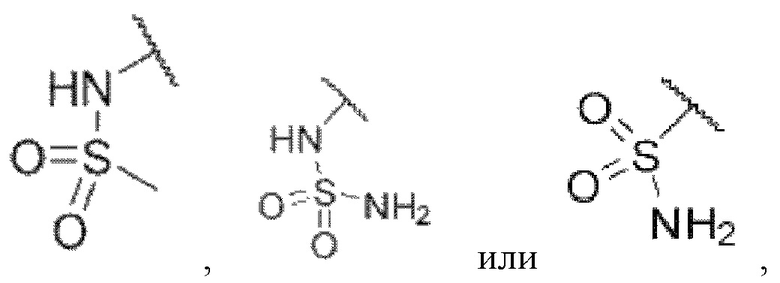
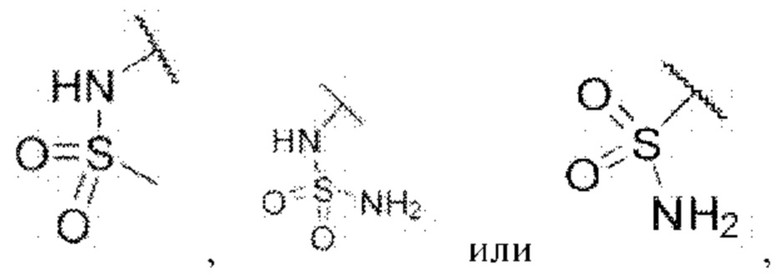
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 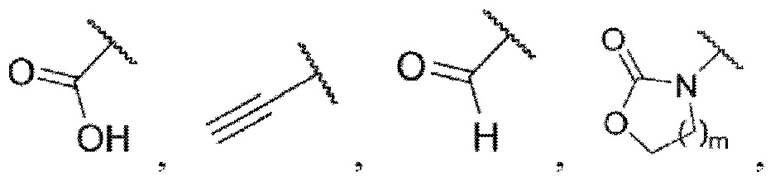 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 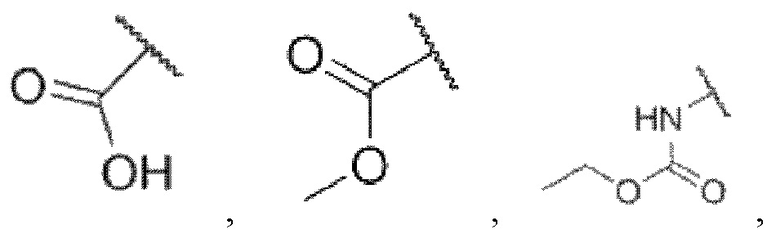
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород, галоген, C1-6алкил, С3-6циклоалкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CHRw1, CRw1, NRw1 или СО,
где Rw1 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, С1-6алкиламин, С1-6алкиловый спирт, 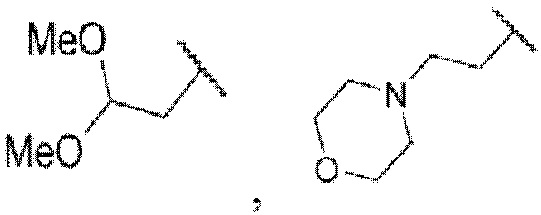 (СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
(СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
В настоящем изобретении представлено соединение, представленное формулой I, его рацемат, энантиомер, диастереоизомер или его фармацевтически приемлемая соль.
В настоящем изобретении представлена фармацевтическая композиция для лечения, предупреждения или уменьшения интенсивности метаболических заболеваний, холестатических заболеваний печени и фиброза органов, содержащая соединение, которое представлено формулой I, его рацемат, энантиомер, диастереоизомер или его фармацевтически приемлемую соль.
В настоящем изобретении представлено применение соединения, которое представлено формулой I, его рацемата, энантиомера, диастереоизомера или его фармацевтически приемлемой соли для лечения, предупреждения или уменьшения интенсивности метаболических заболеваний, холестатических заболеваний печени и фиброза органов.
В настоящем изобретении представлен способ лечения, предупреждения или уменьшения интенсивности метаболических заболеваний, холестатических заболеваний печени и фиброза органов у нуждающегося в этом субъекта, предусматривающий введение субъекту (в том числе человеку) эффективного количества фармацевтической композиции, содержащей соединение, представленное формулой I, его рацемат, энантиомер, диастереоизомер или его фармацевтически приемлемую соль.
Преимущественные эффекты
Соединения по настоящему изобретению являются высокоактивными агонистами FXR, и, соответственно, содержащие их фармацевтические композиции, как предполагается, будут пригодными в вариантах терапии, которые будут улучшены за счет агониста FXR, в таких как терапия метаболических заболеваний, холестатических заболеваний печени и фиброза органов.
Лучший вариант осуществления
Далее в данном документе настоящее изобретение будет описано более подробно.
В настоящем изобретении представлено соединение, представленное формулой I, его рацемат, энантиомер, диастереоизомер или его фармацевтически приемлемая соль.
[Формула I]

В представленной формуле I
Y представляет собой углерод или азот,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой 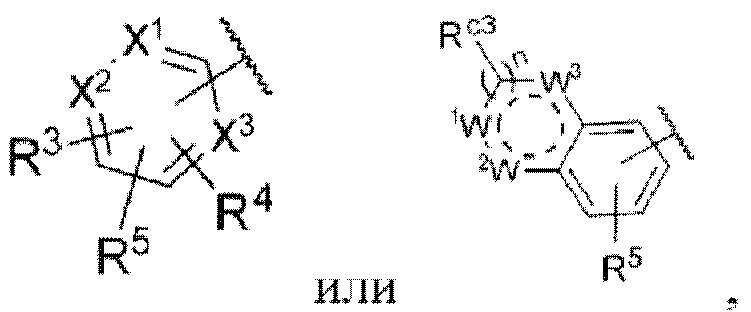
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 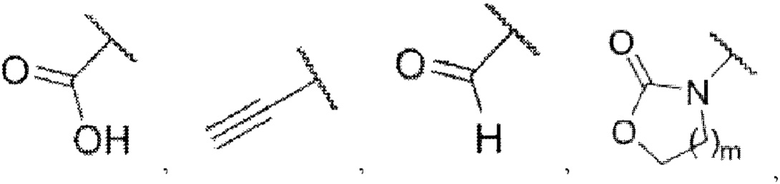 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 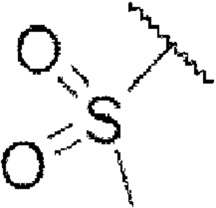 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 

каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CHRw1, CRw1, NRw1 или СО,
где Rw1 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, С1-6алкиламин, С1-6алкиловый спирт,  (СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
(СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
В настоящем изобретении соединение формулы I предпочтительно выбрано из i) или iv), раскрытых ниже:
i) В случае если Z представляет собой 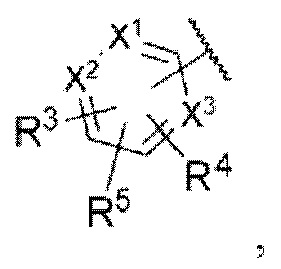 каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, трифторметил,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, трифторметил, 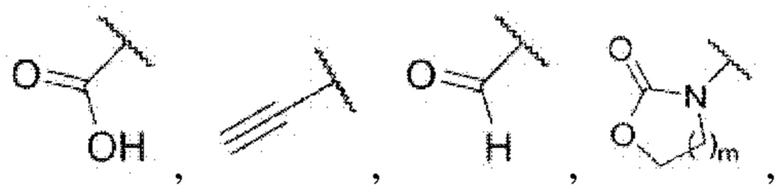 NRa1Ra2, CH2NRa1Ra2, ORa3,
NRa1Ra2, CH2NRa1Ra2, ORa3,  NRa4CO2Ra3,
NRa4CO2Ra3,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота, где m равняется 1 или 2, каждый из Ra1 и Ra2 независимо представляет собой водород, метил, этил, изопропил, трет-бутил, циклопропил, трифторметил,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота, где m равняется 1 или 2, каждый из Ra1 и Ra2 независимо представляет собой водород, метил, этил, изопропил, трет-бутил, циклопропил, трифторметил,  азетидин или пиперидин, Ra3 представляет собой водород, метил, этил, пропил, трет-бутил, циклопропил, трифторметил,
азетидин или пиперидин, Ra3 представляет собой водород, метил, этил, пропил, трет-бутил, циклопропил, трифторметил,  азетидин, пиперидин, пиперазин или морфолин, Ra4 представляет собой водород или метил.
азетидин, пиперидин, пиперазин или морфолин, Ra4 представляет собой водород или метил.
ii) В случае если Z представляет собой 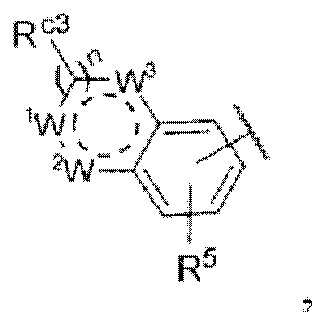 Rc3 представляет собой водород или метил, Rw1 представляет собой водород, метил, этил, пропил, циклопропил,
Rc3 представляет собой водород или метил, Rw1 представляет собой водород, метил, этил, пропил, циклопропил, 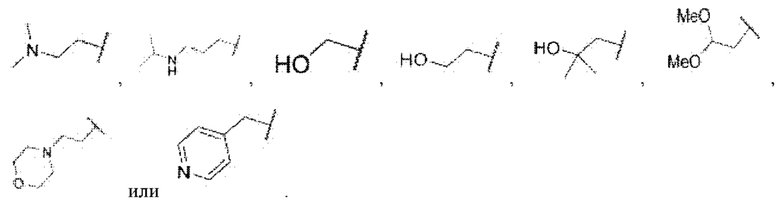
iii) В случае если Z представляет собой 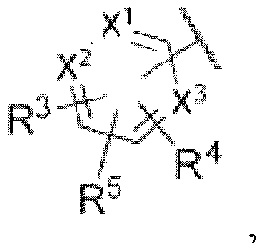 каждый из R1 и R2 независимо представляет собой водород, хлор или трифторметил, каждый из R3 и R4 независимо представляет собой водород, хлор, фтор, йод, циано, метил, этил, изопропил, циклопропил, трифторметил,
каждый из R1 и R2 независимо представляет собой водород, хлор или трифторметил, каждый из R3 и R4 независимо представляет собой водород, хлор, фтор, йод, циано, метил, этил, изопропил, циклопропил, трифторметил, 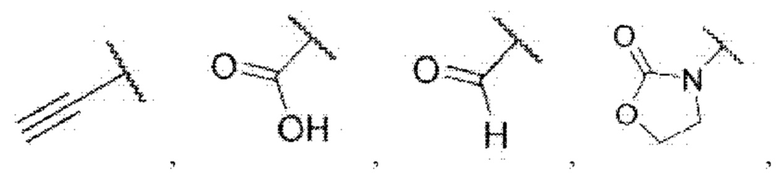 NRa1Ra2, CH2NRa1Ra2, NRa4CO2Ra3, азетидин, пиперазин или пирролидин, где каждый из Ra1 и Ra2 независимо представляет собой водород, метил, этил, изопропил, трет-бутил, циклопропил, трифторэтил,
NRa1Ra2, CH2NRa1Ra2, NRa4CO2Ra3, азетидин, пиперазин или пирролидин, где каждый из Ra1 и Ra2 независимо представляет собой водород, метил, этил, изопропил, трет-бутил, циклопропил, трифторэтил,  азетидин, пиперидин или оксетан, Ra3 представляет собой водород, метил, этил, трет-бутил, циклопропил, трифторметил,
азетидин, пиперидин или оксетан, Ra3 представляет собой водород, метил, этил, трет-бутил, циклопропил, трифторметил,  азетидин, пиперидин, пиперазин или морфолин, Ra4 представляет собой водород, метил или этил.
азетидин, пиперидин, пиперазин или морфолин, Ra4 представляет собой водород, метил или этил.
iv) В случае если Z представляет собой  каждый из R1 и R2 независимо представляет собой водород, хлор или фтор, n равняется 0 или 1, R5 представляет собой
каждый из R1 и R2 независимо представляет собой водород, хлор или фтор, n равняется 0 или 1, R5 представляет собой 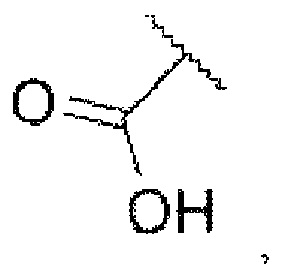 каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CRw1 или NRw1, где Rw1 представляет собой водород, метил, этил, изопропил, циклопропил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CRw1 или NRw1, где Rw1 представляет собой водород, метил, этил, изопропил, циклопропил,
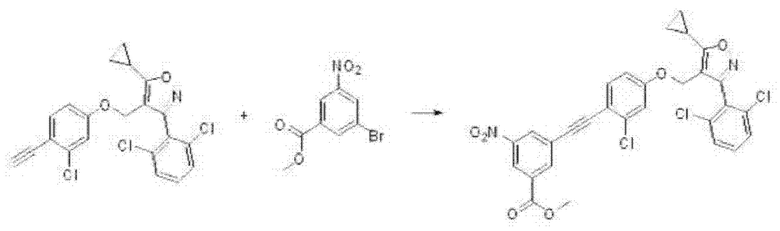
Особенно предпочтительные примеры соединения формулы I в соответствии с настоящим изобретением предусматривают следующие:
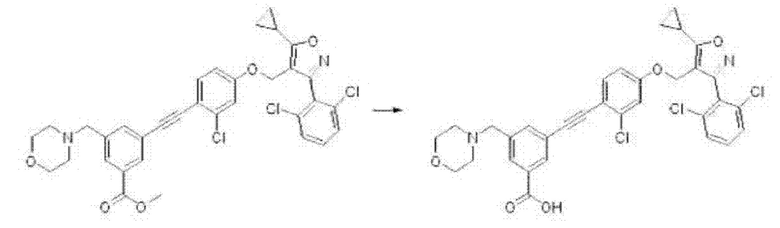
4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-1);
3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-2);
3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойная кислота (I-3);
4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойная кислота (I-4);
4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (I-5);
4-((3-хлор-4-(фенилэтинил)фенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (I-6);
метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (I-7);
метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоат (I-8);
метил-3-((трет-бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (I-9);
метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензоат (I-10);
этил-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)карбамат (I-11);
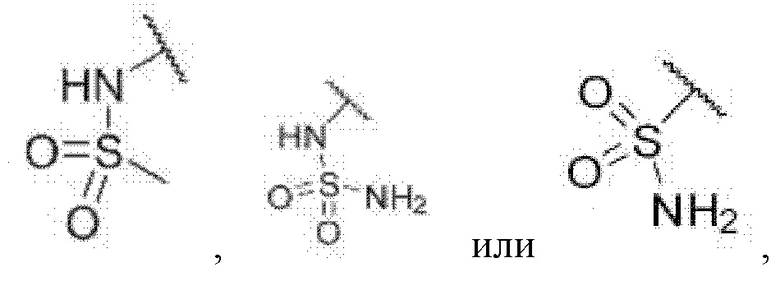
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензолсульфонамид (I-12);
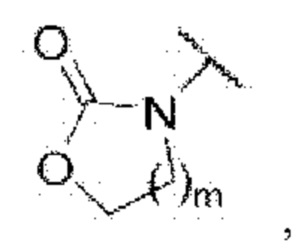
N-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)метансульфонамид (I-13);
N-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)сульфамид (I-14);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-15);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-16);
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновая кислота (I-17);
2-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изоникотиновая кислота (I-18);
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)пиколиновая кислота (I-19);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновая кислота (I-20);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диметиламино)бензойная кислота (I-21);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-3-(диметиламино)бензойная кислота (I-22);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(диметиламино)бензойная кислота (I-23);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диэтиламино)бензойная кислота (I-24);
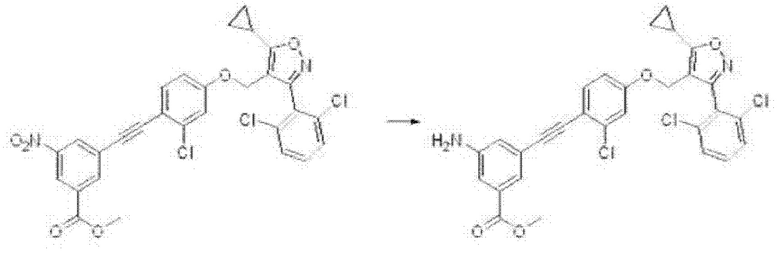
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-25);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-(диметиламино)бензойная кислота (I-26);
3-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-27);
4-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-28);
2-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-29);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-фторбензойная кислота (I-30);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметил)бензойная кислота (I-31);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этинилбензойная кислота (I-32);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-цианобензойная кислота (I-33);
3-((2,6-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-34);
2-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-35);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойная кислота (I-36);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойная кислота (I-37);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-фторбензойная кислота (I-38);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметокси)бензойная кислота (I-39);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метоксибензойная кислота (I-40);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензойная кислота (I-41);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропиламино)метил)бензойная кислота (I-42);
3-(азетидин-1-илметил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-43);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((метиламино)метил)бензойная кислота (I-44);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этиламино)метил)бензойная кислота (I-45);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2,2,2-трифторэтил)амино)метил)бензойная кислота (I-46);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((изопропиламино)метил)бензойная кислота (I-47);
3-((трет-бутиламино)метил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-48);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((диметиламино)метил)бензойная кислота (I-49);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(морфолинометил)бензойная кислота (I-50);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((оксетан-3-иламино)метил)бензойная кислота (I-51);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метиламино)бензойная кислота (I-52);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(этиламино)бензойная кислота (I-53);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(изопропиламино)бензойная кислота (I-54);
3-(азетидин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-55);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пирролидин-1-ил)бензойная кислота (I-56);
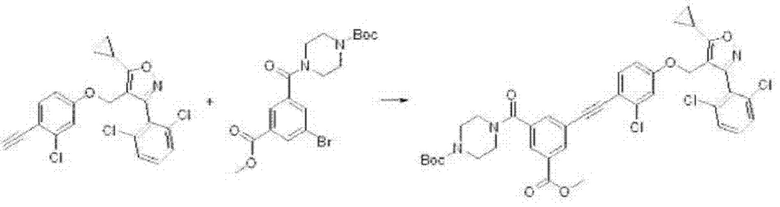
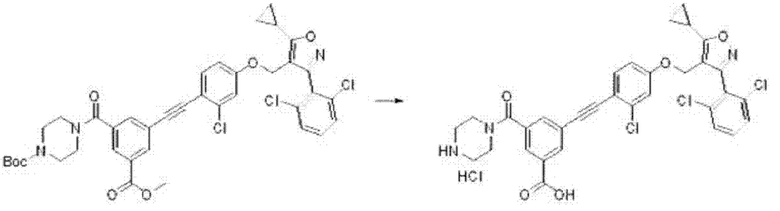
3-(азетидин-3-иламино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты гидрохлорид (I-57);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперидин-4-иламино)бензойной кислоты гидрохлорид (I-58);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-ил)бензойной кислоты гидрохлорид (I-59);
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метилбензойная кислота (I-60);
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метоксибензойная кислота (I-61);
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метоксибензойная кислота (1-62);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метилбензойная кислота (I-63);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-циклопропилбензойная кислота (I-64);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этилбензойная кислота (I-65);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-изопропилбензойная кислота (I-66);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензойная кислота (I-67);
3-((2,5-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-68);
3-((2,3-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-69);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-6-фторфенил)этинил)бензойная кислота (I-70);
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензойная кислота (I-71);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(3-этилуреидо)бензойная кислота (I-72);
3-ацетамидо-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-73);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензойная кислота (I-74);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензойная кислота (I-75);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропоксикарбонил)амино)бензойная кислота (I-76);
3-((трет-бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-77);
3-((трет-бутоксикарбонил)(метил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-78);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((циклопропилметокси)карбонил)амино)бензойная кислота (I-79);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-циклопропилэтокси)карбонил)амино)бензойная кислота (I-80);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-гидроксиэтокси)карбонил)амино)бензойная кислота (I-81);
3-(((азетидин-3-илокси)карбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-82);
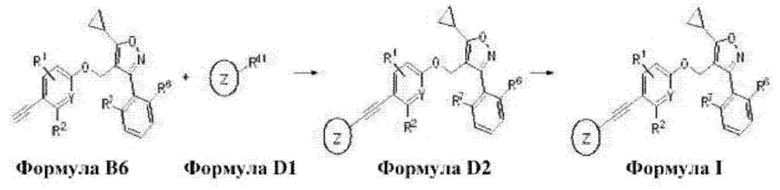
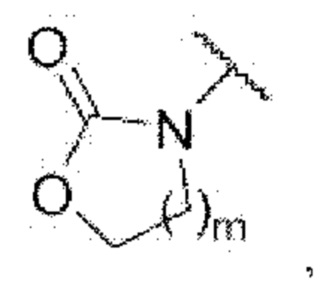
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(2-оксооксазолидин-3-ил)бензойная кислота (I-83);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изофталевая кислота (I-84);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-карбонил)бензойной кислоты гидрохлорид (I-85);
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метилсульфонамидо)бензойная кислота (I-86);
3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-87);
3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-88);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индазол-6-карбоновая кислота (I-89);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-бензо[d]имидазол-6-карбоновая кислота (I-90);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индол-6-карбоновая кислота (I-91);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-(диметиламино)этил)-1Н-индол-6-карбоновая кислота (I-92);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(3-(изопропиламино)пропил)-1Н-индол-6-карбоновая кислота (I-93);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(пиридин-4-илметил)-1Н-индол-6-карбоновая кислота (I-94);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-морфолиноэтил)-1Н-индол-6-карбоновой кислоты гидрохлорид (I-95);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2,2-диметоксиэтил)-1Н-индол-6-карбоновая кислота (I-96);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидроксиэтил)-1Н-индол-6-карбоновая кислота (I-97);
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидрокси-2-метилпропил)-1Н-индол-6-карбоновая кислота (I-98);
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индазол-4-карбоновая кислота (I-99);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-дигидробензофуран-7-карбоновая кислота (I-100);
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индол-4-карбоновая кислота (I-101);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновая кислота (I-102);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-7-карбоновая кислота (I-103);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-7-карбоновая кислота (I-104);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-7-карбоновая кислота (I-105);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-7-карбоновая кислота (I-106);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(гидроксиметил)бензо[d]оксазол-7-карбоновая кислота (I-107);
7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)хиноксалин-5-карбоновая кислота (I-108);
7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-диметилхиноксалин-5-карбоновая кислота (I-109);
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-циклопропилбензо[d]оксазол-7-карбоновая кислота (I-110);
2-бутил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновая кислота (I-111);
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-4-карбоновая кислота (I-112);
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-4-карбоновая кислота (I-113);
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-4-карбоновая кислота (I-114) и
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-4-карбоновая кислота (I-115).
В настоящем изобретении "С1-6алкил" представляет собой насыщенную углеводородную группу с прямой или разветвленной цепью, состоящую из 1-6 атомов углерода. Иллюстративный алкил включает без ограничения метил, этил, пропил, бутил, пентил, гексил, 1-метилэтил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, 1-метилбутил, 1,1-диметилпропил, 1-метилпентил или 1,1-диметилбутил.
В настоящем изобретении "С3-6циклоалкил" предусматривается как насыщенное углеводородное кольцо с 3-6 атомами углерода. Иллюстративный циклоалкил включает без ограничения циклопропил, циклобутил, циклопентил или циклогексил.
В настоящем изобретении "С1-6алкиламин" представляет собой насыщенный углеводородный амин с прямой или разветвленной цепью из 1-6 атомов углерода. Иллюстративные алкиламины включают без ограничения метиламин, этиламин, пропиламин, бутиламин, 1-метилэтиламин, диэтиламин или диметиламин.
В настоящем изобретении "С1-6алкиловый спирт" представляет собой группу R-ОН, где R определен выше. Иллюстративный алкиловый спирт, содержащий 1-6 атомов углерода, включает без ограничения метиловый спирт, этиловый спирт, пропиловый спирт, изопропиловый спирт или н-бутиловый спирт.
В настоящем изобретении под "галогеном" подразумевают атом брома, фтора или хлора.
В настоящем изобретении под "галоген-С1-6алкилом" подразумевают С1-6алкильный радикал с одним или несколькими атомами водорода, замененными атомом галогена, определенным выше. Иллюстративный галогеналкил включает без ограничения дифторметил или трифторметил.
В настоящем изобретении под "арилом" подразумевают ароматическое кольцо с одним кольцом и замещенное галогеном. Иллюстративный арил включает без ограничения фенил или галогенфенил.
В настоящем изобретении под "гетероарилом" подразумевают моноциклическое кольцо с по меньшей мере одним атомом азота, кислорода или серы. Иллюстративные гетероарилы включают без ограничения пиридинил, хинолил, фуранил, тиенил, оксадиазолил, тиадиазолил, тиазолил, оксазолил, изоксазолил, пиразолил, триазолил, имидазолил, пиримидинил, индолил, пиразинил или индазолил.
В настоящем изобретении под "гетероциклом" подразумевают насыщенное или частично ненасыщенное углеводородное кольцо, содержащее от одного до трех циклов, с по меньшей мере одним атомом азота. Иллюстративные моногетероциклы с 5-6 атомами включают без ограничения пирролидинил, пиперидинил, пиперазинил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, триазолил, тиазолил, пиридил, пиридазинил, пиримидинил, пиразинил или триазинил. Также иллюстративное бициклическое ароматическое кольцо включает без ограничения бензотиазолил, бензоксазолил, бензоксазинон, бензоксадиазолил, 1,3-бензодиоксолил, бензофурил, бензопиразинил, индолил, индазолил, бензимидазолил, бензопиранил, пирролопириданил, фуропиридинил или имидазотиазолил.
Используемый в данном документе термин "фармацевтически приемлемый", когда речь идет о компоненте фармацевтической композиции, означает, что данный компонент при введении животному не вызывает чрезмерных побочных эффектов, таких как избыточная токсичность, раздражение или аллергическая реакция, которые соизмеримы с приемлемым соотношением польза/риск.
Термин "лечение", используемый в данном документе, охватывает любое лечение заболевания у млекопитающего, в частности у человека, и включает ингибирование заболевания, т.е. остановку его развития; или облегчение заболевания, т.е. регрессию заболевания и/или его симптомов или состояния, и замедление прогрессирования заболевания.
Выражение "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое уменьшает интенсивность определенного заболевания или состояния, ослабляет или устраняет его, или предупреждает либо замедляет возникновение определенного заболевания или состояния.
Соединения по настоящему изобретению могут содержать асимметричные или хиральные центры и, следовательно, существуют в различных стереоизомерных формах. Подразумевается, что все стереоизомерные формы соединений по настоящему изобретению, в том числе без ограничения диастереомеры, энантиомеры и атропоизомеры, а также их смеси, такие как рацемические смеси, составляют часть настоящего изобретения. Конкретный стереоизомер также может называться энантиомером, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров в соотношении 50:50 называют рацемической смесью или рацематом.
"Диастереомер" означает стереоизомер с двумя или более центрами хиральности, молекулы которого не являются зеркальным отображением друг друга. Диастереомеры характеризуются различными физическими свойствами, например, значениями температуры плавления, температуры кипения, спектральными свойствами и реакционной способностью. Смеси диастереомеров можно разделять с помощью аналитических методик высокого разрешения, таких как электрофорез и хроматография.
"Энантиомеры" означают два стереоизомера соединения, которые являются не совпадающими при наложении зеркальными отображениями друг друга.
Выражение "фармацевтически приемлемая соль", используемой в данном документе, означает фармацевтически приемлемые органические или неорганические соли соединения по настоящему изобретению. Иллюстративные соли включают без ограничения соли, представляющие собой сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат "мезилат", этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метиленбис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может включать другую молекулу, такую как ион ацетата, ион сукцината или другой противоион. Противоион может представлять собой любой органический или неорганический фрагмент, который стабилизирует заряд исходного соединения. Кроме того, фармацевтически приемлемая соль в своей структуре может иметь более одного заряженного атома. В тех случаях, когда несколько заряженных атомов составляют часть фармацевтически приемлемой соли, она может иметь несколько противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько противоионов.
Если соединение по настоящему изобретению является основанием, требуемая фармацевтически приемлемая соль может быть получена с помощью любого подходящего способа, доступного из уровня техники, например, путем обработки свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и им подобные, или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота, или им подобные.
Если соединение по настоящему изобретению является кислотой, требуемая фармацевтически приемлемая соль может быть получена с помощью любого подходящего способа, например, путем обработки свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочноземельного металла, или им подобные. Иллюстративные примеры подходящих солей включают без ограничения органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиак, первичные, вторичные и третичные амины и циклические амины, такие как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
В другом аспекте настоящего изобретения представлен способ получения соединения, представленного формулой I, или его фармацевтически приемлемой соли.
Способ получения соединения формулы А8 в соответствии с настоящим изобретением показан на следующей схеме 1.
[Схема 1]
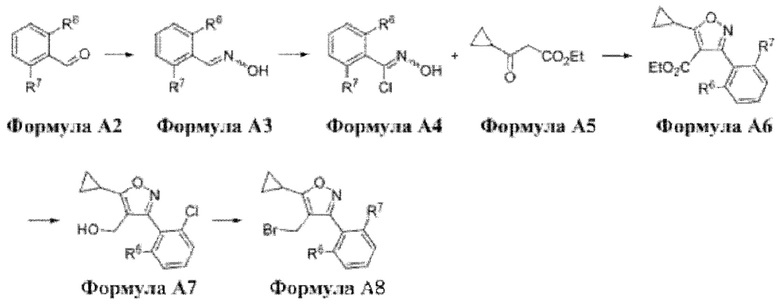
Соединение формулы А8, которое представляет собой соединение по настоящему изобретению, может быть получено с помощью ряда стадий из соединения формулы А2, как показано на схеме 1.
R6 и R7 в формулах А8, А2 и А7, проиллюстрированные на схеме 1, определены ниже.
Выше
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси.
Способ получения соединения формулы А8 в соответствии с настоящим изобретением предусматривает:
получение соединения формулы A3 путем восстановительного аминирования соединения формулы А2 (стадия 1);
получение соединения формулы А4 путем хлорирования соединения формулы A3 (стадия 2);
получение соединения формулы А6 путем реакции образования цикла соединения формулы А4 с соединением формулы А5 (стадия 3);
получение соединения формулы А7 путем восстановления соединения формулы А6 (стадия 4);
получение соединения формулы А8 путем бромирования соединения формулы А7 (стадия 5).
Каждая стадия_вышеописанного способа получения в соответствии со схемой 1 описана далее более подробно.
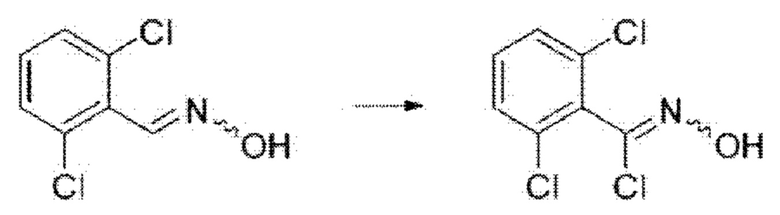
i) На первой стадии соединение формулы А2 может быть превращено в соединение формулы A3 путем восстановительного аминирования в присутствии гидроксиламина и гидроксида натрия в этаноле и дистиллированной воде при 90°С в течение 24 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы A3 из соединения формулы А2 путем восстановительного аминирования на приведенной выше стадии 1 способа получения по настоящему изобретению.
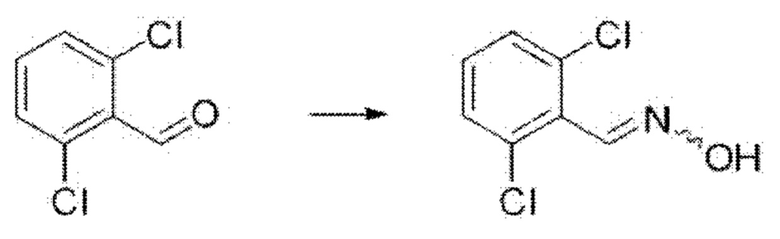
ii) На второй стадии соединение формулы A3, полученное, как описано на стадии
1, может быть превращено в соединение формулы А4 путем хлорирования, осуществляемого в присутствии хлорирующих реагентов в одном или нескольких из N,N-диметилформамида или хлороформа при комнатной температуре в течение 1 часа.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы А4 из соединения формулы A3 путем хлорирования на приведенной выше стадии 2 способа получения по настоящему изобретению.
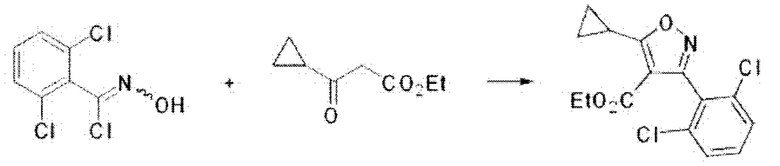
iii) На третьей стадии соединение формулы А4, полученное, как описано на стадии
2, может быть превращено в соединение формулы А6 путем реакции образования цикла с соединением формулы А5 в основной среде при комнатной температуре в течение 24 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы А6 из соединений формул А4 и А5 путем реакции образования цикла на приведенной выше стадии 3 способа получения по настоящему изобретению.
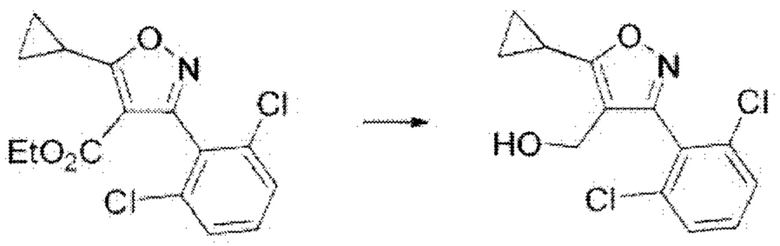
iv) На четвертой стадии соединение формулы А6, полученное, как описано настадии 3, может быть превращено в соединение формулы А7 путем восстановления, осуществляемого в присутствии восстанавливающего реагента в THF при комнатной температуре в течение 7 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы А7 из соединения формулы А6 путем восстановления на приведенной выше стадии 4 способа получения по настоящему изобретению.
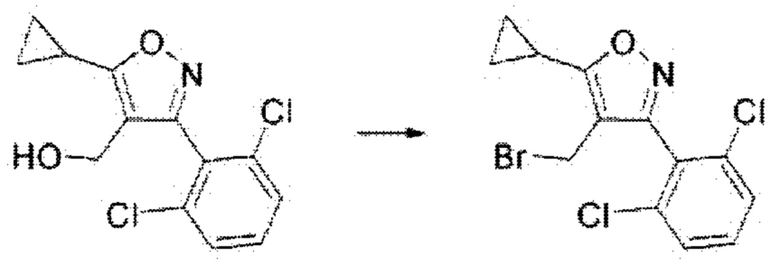
v) На пятой стадии соединение формулы А7, полученное, как описано на стадии 4, может быть превращено в соединение формулы А8 путем бромирования, осуществляемого в присутствии бромирующего реагента в THF при комнатной температуре в течение 4 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы А8 из соединения формулы А7 путем бромирования на приведенной выше стадии 5 способа получения по настоящему изобретению.
Кроме того, на реакционной схеме 2 ниже показан другой способ получения соединения формулы I в соответствии с настоящим изобретением.
[Схема 2]
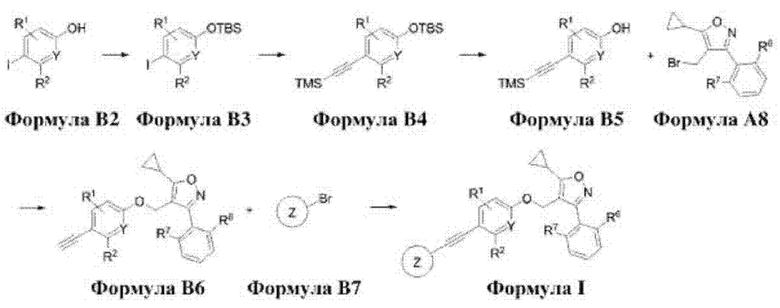
Соединение формулы I, которое представляет собой соединение по настоящему изобретению, может быть получено с помощью ряда стадий из соединения формулы В2, как показано на схеме 2.
Y, R1, R2, R6, R7 и Z в формулах I, В2 и В7, проиллюстрированных на схеме 2, определены ниже.
В представленной формуле I
Y представляет собой углерод или азот,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой 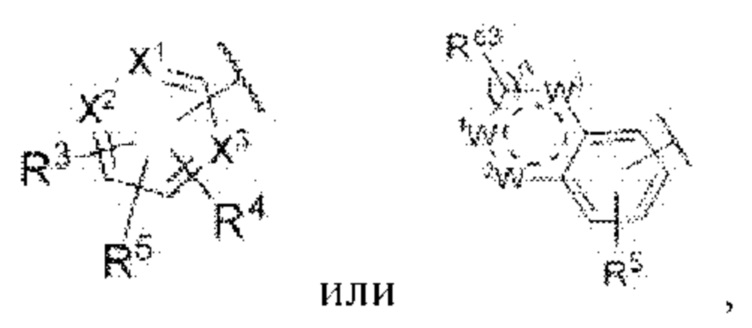
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 
 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, C1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, C1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 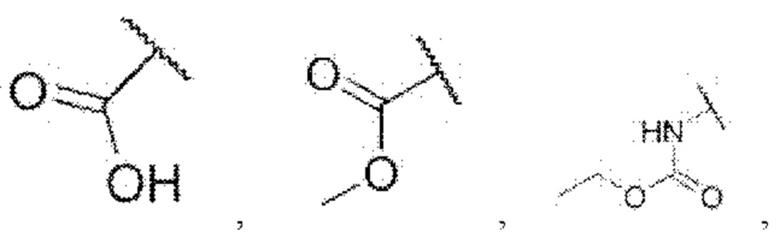
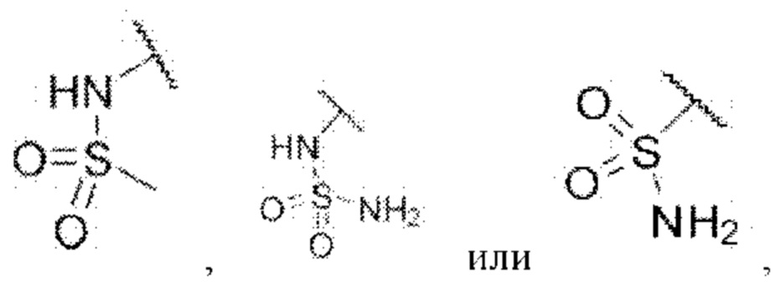
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CHRw1, CRw1, NRw1 или СО,
где Rw1 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, С1-6алкиламин, C1-6алкиловый спирт,  (СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
(СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
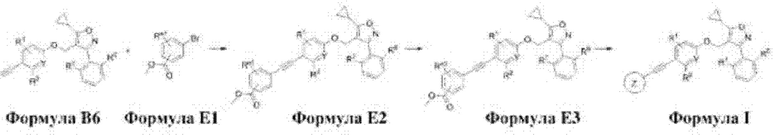
Способ получения соединения формулы I в соответствии с настоящим изобретением предусматривает:
получение соединения формулы В3 путем введения защиты для гидроксильной группы соединения формулы В2 (стадия 1);
получение соединения формулы В4 путем реакции Соногаширы с соединением формулы В3 (стадия 2);
получение соединения формулы В5 путем снятия защитной трет-бутилдиметилокси( )-группы с соединения формулы В4 (стадия 3);
)-группы с соединения формулы В4 (стадия 3);
получение соединения формулы В6 путем замещения соединения формулы В5 соединением А8 (стадия 4);
получение соединения формулы I путем реакции Соногаширы или гидролиза после реакции Соногаширы между соединениями формул В6 и В7 (стадия 5).
Каждая стадия вышеописанного способа получения в соответствии со схемой 2 описана далее более подробно.
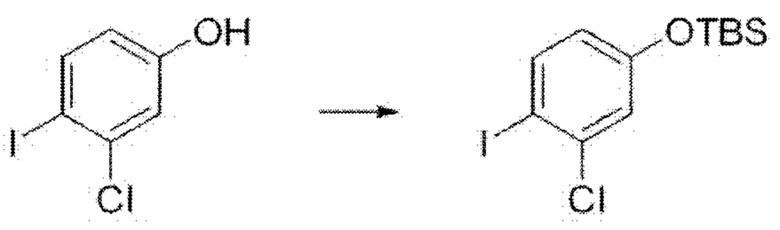
i) На первой стадии соединение формулы В3 может быть получено путем введения защиты гидроксильной группы в формуле В2 с применением трет-бутилдиметилсилилхлорида (TBSCl) и имидазола в N,N-диметилформамиде при комнатной температуре в течение 6-24 часов.
На реакционной схеме ниже приведен пример получения соединения формулы В3 из соединения формулы В2 путем введения защиты для гидроксильной группы на приведенной выше стадии 1 способа получения по настоящему изобретению.
ii) На второй стадии соединение формулы В3, полученное, как описано на стадии 1, может быть превращено в соединение формулы В4 путем реакции Соногаширы с применением каталитического количества тетракис(трифенилфосфин)палладия(0) (Pd(PPh3)4) или дихлорида бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2) в одном или нескольких из N,N-диметилформамида или метанола при 70-100°С в течение 3-24 часов.
На реакционной схеме ниже приведен пример получения соединения формулы В4 из соединения формулы В3 путем реакции Соногаширы на приведенной выше стадии 2 способа получения по настоящему изобретению.

iii) На третьей стадии соединение формулы В4, полученное, как описано на стадии 2, может быть превращено в соединение формулы В5 путем снятия защитной трет-бутилдиметилокси(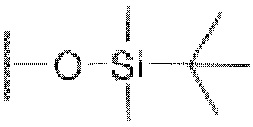 )-группы с применением либо фторида калия в одном или
)-группы с применением либо фторида калия в одном или
нескольких из тетрагидрофурана или метанола, либо раствора тетрабутиламмония фторида при температуре от 0°С до комнатной температуры в течение 1-6 часов.
На реакционной схеме ниже приведен пример получения соединения формулы В5 из соединения формулы В4 путем снятия защиты на приведенной выше стадии 3 способа получения по настоящему изобретению.

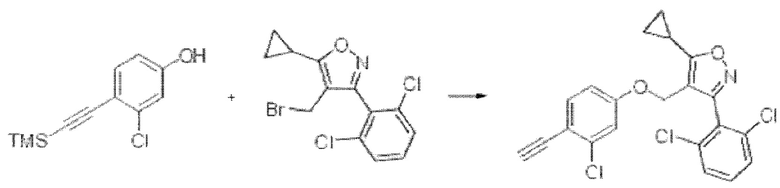
iv) На четвертой стадии соединение формулы В5, полученное, как описано на стадии 3, может быть превращено в соединение формулы В6 путем замещения с применением А8 в основной среде в одном или нескольких из THF или N,N-диметилформамида при комнатной температуре в течение 5-24 часов.
На реакционной схеме ниже приведен пример получения соединения формулы В6 из соединения формулы В5 путем замещения с применением А8 на приведенной выше стадии 4 способа получения по настоящему изобретению.
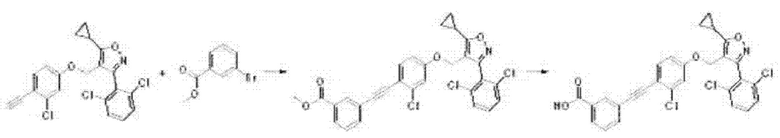
v) На пятой стадии соединение формулы В6, полученное, как описано на стадии 4, может быть превращено в соединение формулы I путем реакции Соногаширы с соединением В7, с применением каталитического количества тетракис(трифенилфосфин)палладия(0) (Pd(PPh3)4) или дихлорида бис(трифенилфосфин)палладия(II) (PdCl2(PPH3)2) и йодида меди(I) в основной среде в одном или нескольких из тетрагидрофурана или N,N-диметилформамида при 70-100°С в течение 3-24 часов. Кроме того, соединение формулы I может быть получено из соединений формул В6 и В7 путем реакции Соногаширы с гидролизом, с применением гидроксида лития в одном или нескольких из тетрагидрофурана, 1,4-диоксана или воды при 80°С в течение 4-48 часов.
Ниже проиллюстрирован пример получения соединения формулы I из соединений формул В6 и В7 путем реакции Соногаширы или гидролиза после реакции Соногаширы на приведенной выше стадии 5 способа получения по настоящему изобретению.
Кроме того, на реакционной схеме 3 ниже показан другой способ получения соединения формулы I в соответствии с настоящим изобретением.
[Схема 3]
Соединение формулы I, которое представляет собой соединение по настоящему изобретению, может быть получено с помощью ряда стадий из соединения формулы В6, как показано на схеме 3.
R1, R2, R6, R7, Rd1, Y и Z в формулах I, D1, В2 и В7, проиллюстрированных на схеме 3, определены ниже.
В представленной формуле I
Rd1 представляет собой бром или йод,
Y представляет собой углерод или азот,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 
 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, C1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 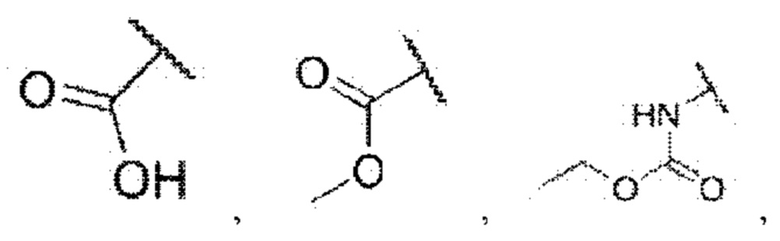
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CHRw1, CRw1, NRw1 или СО,
где Rw1 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, С1-6алкиламин, С1-6алкиловый спирт,  (СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
(СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
Способ получения соединения формулы I в соответствии с настоящим изобретением предусматривает:
получение соединения формулы D2 путем реакции Соногаширы между соединениями формул В6 и D1 (стадия 1);
получение соединения формулы I путем снятия защитной трет-бутилоксикарбонильной ( ) или трет-бутилдиметилокси (
) или трет-бутилдиметилокси ( )-группы с соединения формулы D2 и его гидролиза (стадия 2).
)-группы с соединения формулы D2 и его гидролиза (стадия 2).
Каждая стадия вышеописанного способа получения в соответствии со схемой 3 описана далее более подробно.
i) На первой стадии соединение формулы В6, полученное, как описано на стадии 4 в соответствии со схемой 2, может быть превращено в соединение формулы D2 путем реакции Соногаширы с соединением формулы D1, с применением каталитического количества тетракис(трифенилфосфин)палладия(0) (Pd(PPh3)4) или дихлорида бис(трифенилфосфин)палладия(II) (PdCl2(PPH3)2) и йодида меди(I) в основной среде в одном или нескольких из тетрагидрофурана или N,N-диметилформамида при 70-100°С в течение 3-24 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы D2 из соединений формул В6 и D1 путем реакции Соногаширы на приведенной выше стадии 1 способа получения по настоящему изобретению.
ii) На второй стадии соединение формулы D2, полученное, как описано на стадии 1, может быть превращено в соединение формулы I путем гидролиза с применением гидроксида лития в одном или нескольких из тетрагидрофурана, 1,4-диоксана или воды при температуре от к.т. до 80°С в течение 4-48 часов, с последующим снятием защитной группы в присутствии раствора трибромида бора или раствора хлороводорода в дихлорметане или тетрагидрофуране (THF) при 0-80°С в течение 2-24 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы I из соединения формулы D2 путем гидролиза и снятия защиты на приведенной выше стадии 2 способа получения по настоящему изобретению.
Кроме того, на реакционной схеме 4 ниже показан другой способ получения соединения формулы I в соответствии с настоящим изобретением.
[Схема 4]
Соединение формулы I, которое представляет собой соединение по настоящему изобретению, может быть получено с помощью ряда стадий из соединения формулы В6, как показано на схеме 4.
R1, R2, R6, R7, Re1, Re2, Y и Z в формулах I, В6 и Е3, проиллюстрированных на схеме 4, определены ниже.
В представленной формуле I
Re1 представляет собой альдегид или нитро,
Re2 представляет собой CH2NRa1Ra2 или NH2,
Y представляет собой углерод или азот,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой 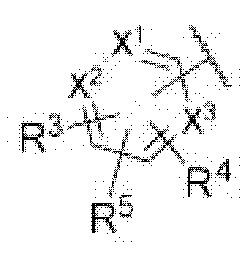 или
или 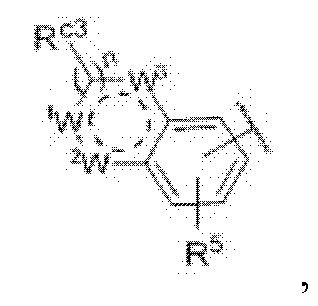
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 
 , CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
, CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8- членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8- членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 
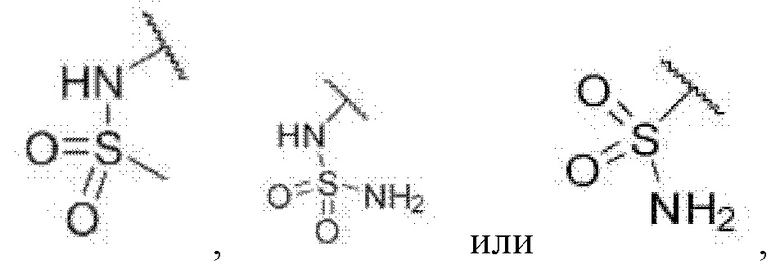
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CHRw1, CRw1, NRw1 или СО,
где Rw1 представляет собой водород, галоген, C1-6алкил, С3-6циклоалкил, галоген-C1-6алкил, C1-6алкиламин, C1-6алкиловый спирт,  (СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
(СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
Способ получения соединения формулы I в соответствии с настоящим изобретением предусматривает:
получение соединения формулы Е2 путем реакции Соногаширы между соединениями формул В6 и Е1 (стадия 1);
получение соединения формулы Е3 путем восстановления или восстановительного аминирования соединения формулы Е2 (стадия 2);
получение соединения формулы I путем гидролиза соединения формулы Е3 (стадия 3).
Каждая стадия вышеописанного способа получения в соответствии со схемой 4 описана далее более подробно.
i) На первой стадии соединение формулы В6, полученное, как описано на стадии 4 в соответствии со схемой 2, может быть превращено в соединение формулы Е2 путем реакции Соногаширы с соединением формулы Е1, с применением каталитического количества тетракис(трифенилфосфин)палладия(0) (Pd(PPh3)4) или дихлорида бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2) и йодида меди(I) в основной среде в одном или нескольких из тетрагидрофурана или N,N-диметилформамида при 70-100°С в течение 3-24 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы Е2 из соединений формул В6 и Е1 путем с на приведенной выше стадии 1 способа получения по настоящему изобретению.
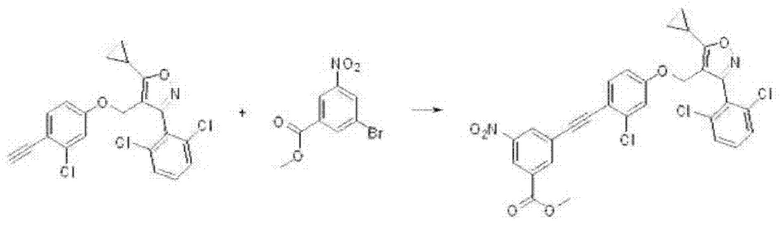
ii) На второй стадии соединение формулы Е2, полученное, как описано на стадии 1, может быть превращено в соединение формулы Е3 путем восстановления или восстановительного аминирования, в зависимости от типа заместителя Re1.
Вторая стадия вышеописанного способа получения в соответствии со схемой 4 описана далее более подробно.
На второй стадии способа получения требуемое соединение формулы Е3 может быть получено путем восстановления или восстановительного аминирования.
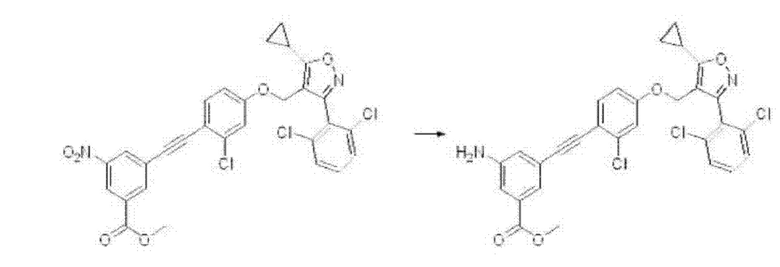
Упомянутая выше реакция восстановления может быть проведена с применением дигидрата хлорида олова(II) в этилацетате или этаноле с соединением формулы Е2 (в случае если Re2 представляет собой нитро в приведенной выше формуле) при комнатной температуре в течение одного дня, и она проиллюстрирована на следующей реакционной схеме.
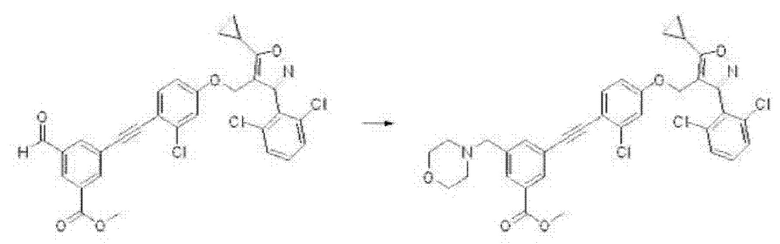
В настоящем изобретении соединение формулы Е2 (в случае если Re1 представляет собой альдегид в приведенной выше формуле) также может быть превращено в соединение формулы Е3 (заместитель может быть введен в присутствии карбоната натрия и Rc4-I в N,N-диметилформамиде) путем восстановительного аминирования в присутствии триацетоксиборгидрида натрия (NaBH(ОАс)3) или уксусной кислоты в одном или нескольких из дихлорметана или 1,2-дихлорэтана при комнатной температуре в течение ночи, и это проиллюстрировано на следующей реакционной схеме.
iii) На третьей стадии соединение формулы Е3, полученное, как описано на стадии 2, может быть превращено в соединение формулы I путем гидролиза с применением гидроксида лития в одном или нескольких из тетрагидрофурана, 1,4-диоксана или воды при температуре от к. т. до 80°С в течение 4-48 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы I из соединения формулы Е3 путем гидролиза на приведенной выше стадии 3 способа получения по настоящему изобретению.
Кроме того, на реакционной схеме 5 ниже показан другой способ получения соединения формулы I в соответствии с настоящим изобретением.
[Схема 5]
Соединение формулы I, которое представляет собой соединение по настоящему изобретению, может быть получено с помощью ряда стадий из соединения формулы В6, как показано на схеме 5.
R1, R2, R3, R6, R7, Y и Z в формулах I, В6 и G4, проиллюстрированных на схеме 5, определены ниже.
В представленной формуле I
Y представляет собой углерод или азот,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой  или
или 
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 
 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 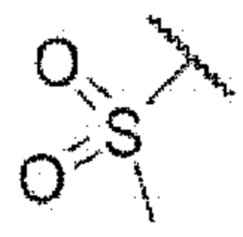 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8- членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8- членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 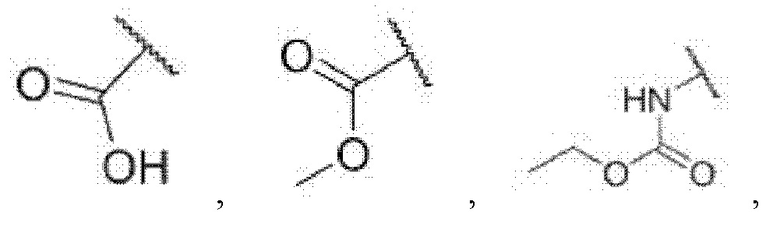
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CHRw1, CRw1, NRw1 или СО,
где Rw1 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, С1-6алкиламин, С1-6алкиловый спирт,  (СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
(СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
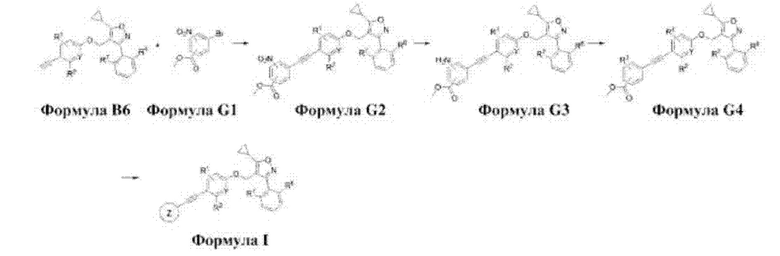
Способ получения соединения формулы I в соответствии с настоящим изобретением предусматривает:
получение соединения формулы G2 путем реакции Соногаширы между соединениями формул В6 и G1 (стадия 1);
получение соединения формулы G3 путем восстановления соединения формулы G2 (стадия 2);
получение соединения формулы G4 путем реакции замещения или присоединения из соединения формулы G3 (стадия 3);
получение соединения формулы I путем гидролиза соединения формулы G4 (стадия 4);
Каждая стадия вышеописанного способа получения в соответствии со схемой 5 описана далее более подробно.
i) На первой стадии соединение формулы В6, полученное, как описано на стадии 4 в соответствии со схемой 2, может быть превращено в соединение формулы G2 путем реакции Соногаширы с соединением формулы G1, с применением каталитического количества тетракис(трифенилфосфин)палладия(0) (Pd(PPh3)4) или дихлорида бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2) и йодида меди(I) в основной среде в одном или нескольких из тетрагидрофурана или N,N-диметилформамида при 70-100°С в течение 3-24 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы G2 из соединений формул В6 и G1 путем реакции Соногаширы на приведенной выше стадии 1 способа получения по настоящему изобретению.
ii) На второй стадии соединение формулы G2, полученное, как описано на стадии 1, может быть превращено в соединение формулы G3 с применением дигидрата хлорида олова(II) в этилацетате или этаноле при комнатной температуре в течение одного дня, и это проиллюстрировано на следующий реакционной схеме.
iii) На третьей стадии соединение формулы G3, полученное, как описано на стадии 2, может быть превращено в соединение формулы G4 путем замещения или присоединения.
Третья стадия вышеописанного способа получения в соответствии со схемой 5 описана далее более подробно.
На третьей стадии способа получения требуемое соединение формулы G4 может быть получено путем замещения или присоединения.
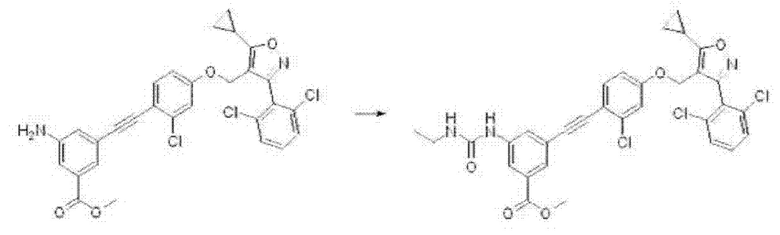
Соединение формулы G3 может быть превращено в соединение формулы G4 путем указанного выше замещения в присутствии трет-бутилнитрила с йодом в толуоле при комнатной температуре в течение 3 часов или путем замещения йодом с последующим замещением аминным соединением с применением L-пролина, карбоната цезия, йодида меди(I) в диметилсульфоксиде.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы G4 из соединения формулы G3 путем замещения или замещения йодом с последующим замещением амином на приведенной выше стадии 3 способа получения по настоящему изобретению. 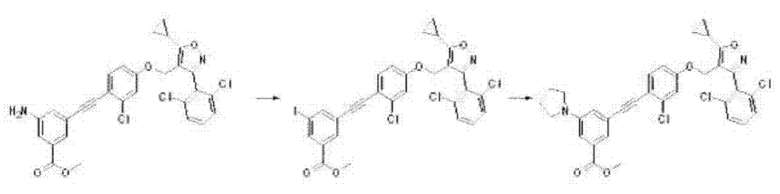
В настоящем изобретении соединение формулы G4 может быть получено путем реакции присоединения, которую проводят с соединением формулы G3 и 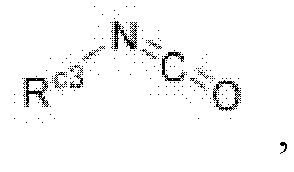
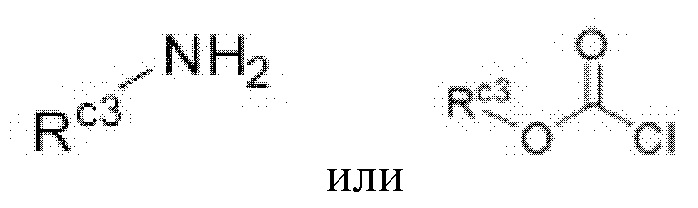 (Rc3 в формуле является таким же, как определенный для приведенной выше формулы I) в дихлорметане или N,N-диметилформамиде при комнатной температуре в течение 3-6 часов, и это проиллюстрировано на следующей реакционной схеме.
(Rc3 в формуле является таким же, как определенный для приведенной выше формулы I) в дихлорметане или N,N-диметилформамиде при комнатной температуре в течение 3-6 часов, и это проиллюстрировано на следующей реакционной схеме.
Соединение формулы G3 может быть превращено в соединение формулы G4 с помощью другого способа, представляющего собой реакцию присоединения, которую проводят с 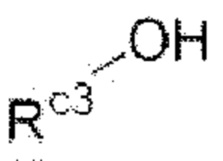 (Rc3 в данной формуле является таким же, как определенный для приведенной выше формулы I) в присутствии трифосгена или 1,1'-карбонилдиимидазола в дихлорметане или тетрагидрофуране (THF) при комнатной температуре в течение 2-6 часов, и это проиллюстрировано на следующей реакционной схеме.
(Rc3 в данной формуле является таким же, как определенный для приведенной выше формулы I) в присутствии трифосгена или 1,1'-карбонилдиимидазола в дихлорметане или тетрагидрофуране (THF) при комнатной температуре в течение 2-6 часов, и это проиллюстрировано на следующей реакционной схеме.
iv) На четвертой стадии соединение формулы G4, полученное, как описано на стадии 3, может быть превращено в соединение формулы I путем гидролиза с применением гидроксида лития в одном или нескольких из тетрагидрофурана, 1,4-диоксана или воды при температуре от к. т. до 80°С в течение 4-48 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы I из формулы G4 путем гидролиза на приведенной выше стадии 4 способа получения по настоящему изобретению.
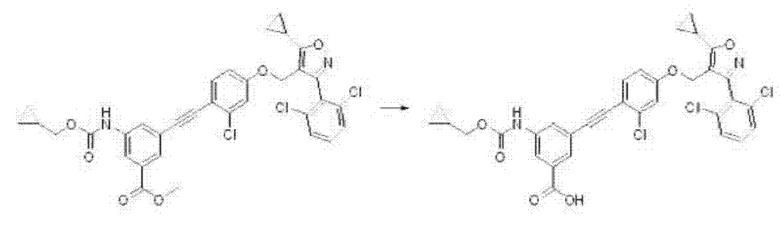
Кроме того, на реакционной схеме 6 ниже показан другой способ получения соединения формулы I в соответствии с настоящим изобретением.
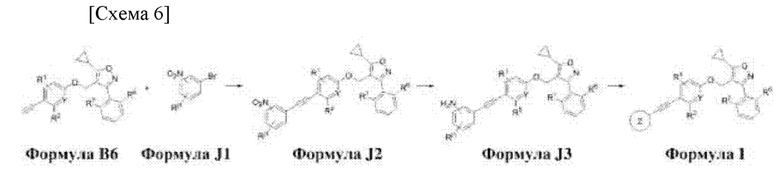
Соединение формулы I, которое представляет собой соединение по настоящему изобретению, может быть получено с помощью ряда стадий из соединения формулы В6, как показано на схеме 6.
R1, R2, R3, R6, R7, Rj1, Y и Z в формулах I, В6 и J3, проиллюстрированных на схеме 6, определены ниже.
В представленной формуле I
Rj1 представляет собой Н или метиловый сложный эфир,
Y представляет собой углерод или азот,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой 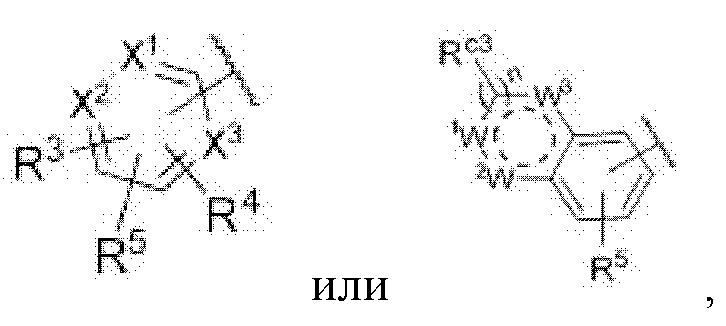
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 
 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3, NHSO2Ra3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 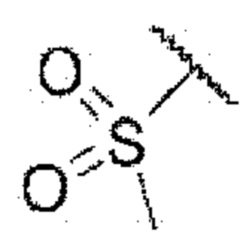 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, или 3- или 8- членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8- членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CHRw1, CRw1, NRw1 или СО,
где Rw1 представляет собой водород, галоген, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, С1-6алкиламин, С1-6алкиловый спирт,  (СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
(СН2)ргетероарил или (СН2)рарил, где р равняется 1, 2 или 3.
Способ получения соединения формулы I в соответствии с настоящим изобретением предусматривает:
получение соединения формулы J2 путем реакции Соногаширы между соединениями формул В6 и J1 (стадия 1);
получение соединения формулы J3 путем восстановления соединения формулы J2 (стадия 2);
получение соединения формулы I с помощью гидролиза или присоединения соединения формулы J3 (стадия 3).
Каждая стадия вышеописанного способа получения в соответствии со схемой 6 описана далее более подробно.
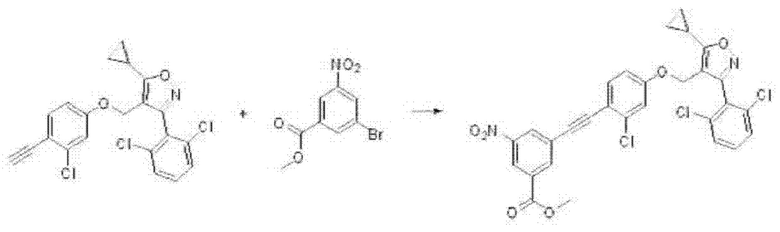
i) На первой стадии соединение формулы В6, полученное, как описано на стадии 4 в соответствии со схемой 2, может быть превращено в соединение формулы J2 путем реакции Соногаширы с соединением формулы J1, с применением каталитического количества тетракис(трифенилфосфин)палладия(0) (Pd(PPh3)4) или дихлорида бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2) и йодида меди(I) в основной среде в одном или нескольких из тетрагидрофурана или N,N-диметилформамида при 70-100°С в течение 3-24 часов.
На реакционной схеме ниже проиллюстрирован пример получения соединения формулы J2 из соединений формул В6 и J1 путем реакции Соногаширы на приведенной выше стадии 1 способа получения по настоящему изобретению.
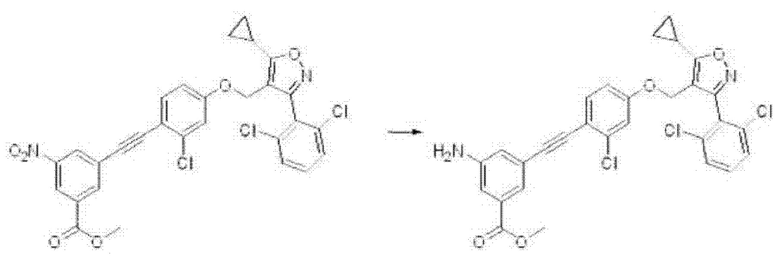
ii) На второй стадии соединение формулы J2, полученное, как описано на стадии 1, может быть превращено в соединение формулы J3 путем реакции восстановления с применением дигидрата хлорида олова(II) в этилацетате или этаноле при комнатной температуре в течение одного дня, и это проиллюстрировано на следующий реакционной схеме.
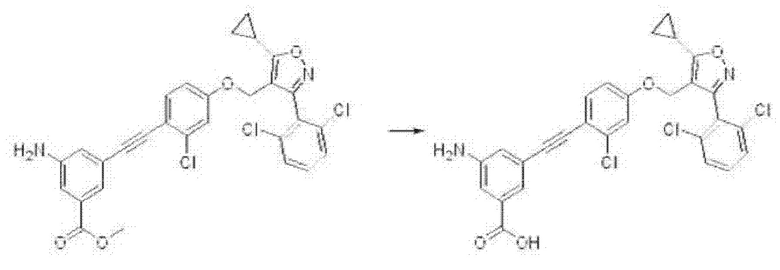
iii) На третьей стадии соединение формулы J3, полученное, как описано на стадии 2, может быть превращено в соединение формулы I путем реакции гидролиза или присоединения.
Третья стадия вышеописанного способа получения в соответствии со схемой 6 описана далее более подробно.
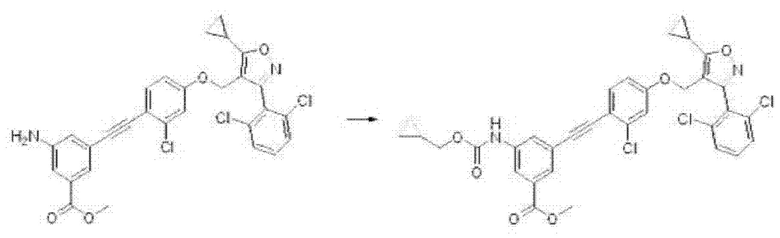
На третьей стадии способа получения требуемое соединение формулы I может быть получено путем реакции гидролиза или присоединения.
Соединение формулы J3 может быть превращено в соединение формулы I путем указанной выше реакции гидролиза присутствии гидроксида лития в одном или нескольких из тетрагидрофурана, 1,4-диоксана или воды, при температуре от к. т. до 80°С в течение 4-48 часов, и это проиллюстрировано на следующей реакционной схеме.
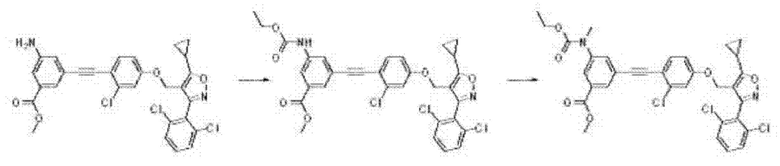
Кроме того, соединение формулы I может быть получено путем реакции присоединения из соединения формулы J3 в основной среде в N,N-диметилформамиде или тетрагидрофуране при условиях комнатной температуры или нагревания в течение 3 или 24 часов в соответствии с настоящим изобретением, и это проиллюстрировано на следующей реакционной схеме.
Кроме того, в настоящем изобретении представлена фармацевтическая композиция для лечения, предупреждения или уменьшения интенсивности метаболических заболеваний, холестатических заболеваний печени и фиброза органов, содержащая соединение формулы I, его рацемат, энантиомер, диастереоизомер или его фармацевтически приемлемую соль.
Метаболические заболевания, холестатические заболевания печении и фиброз органов могут быть обусловлены активностью FXR-рецептора. Иллюстративные заболевания включают гиперхолестеринемию, гиперлипопротеинемию,
гипертриглицеридемию, дислипидемию, липодистрофию, холестаз/фиброз, холестериновую желчнокаменную болезнь, заболевание желудочно-кишечного тракта или патологическое состояние, гипергликемию, диабет, инсулинорезистентность, нарушенную метаболическую пластичность, нефропатию, заболевания печени, атеросклероз, рак, воспалительные нарушения, остеопороз и старение кожи.
В настоящем изобретении представлен способ лечения, предупреждения или уменьшения интенсивности метаболических заболеваний, холестатических заболеваний печени и фиброза органов у нуждающегося в этом субъекта, предусматривающий введение субъекту эффективного количества фармацевтической композиции. Дозировка фармацевтической композиции по настоящему изобретению может варьироваться в зависимости от веса, возраста, пола, физического состояния, питания пациента, времени и пути введения, скорости экскреции и тяжести заболевания. Предпочтительными индивидуумами являются без ограничения млекопитающие (в том числе человек).
Соединения по настоящему изобретению, предусмотренные для фармацевтического применения, можно вводить в виде твердого вещества или жидкости, например, в виде таблетки, капсулы, раствора или суспензии. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения будут очевидны для специалистов в данной области техники. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995).
Пероральное введение
В одном варианте осуществления соединения по настоящему изобретении можно вводить перорально. Пероральное введение может включать проглатывание, в результате чего соединение поступает в желудочно-кишечный тракт, и/или трансбуккальное, лингвальное или сублингвальное введения, при которых соединение поступает в кровоток непосредственно из рта.
Составы, подходящие для перорального введения, включают твердые прессованные массы, твердые микрочастицы, полутвердые составы и жидкие составы (в том числе многофазные или диспергированные системы), такие как таблетки; мягкие или твердые капсулы, содержащие множество отдельных частиц или наночастицы, жидкости, эмульсии или порошки; пастилки (в том числе заполненные жидкостью); жевательные таблетки; гели; быстро диспергируемые лекарственные формы; пленки; суппозитории; спреи и буккальные/мукоадгезивные пластыри. Жидкие составы (в том числе многофазные и диспергированные системы) включают эмульсии, суспензии, растворы, сиропы и настойки. Такие составы могут быть представлены в виде наполнителей в мягких или твердых капсулах (изготовленных, например, из желатина или гидроксипропилметилцеллюлозы) и, как правило, содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло и одно или несколько эмульгирующих средств и/или суспендирующих средств. Жидкие составы также могут быть получены путем ресуспендирования твердого состава, например, из саше.
Соединения по настоящему изобретению также могут применяться в быстрорастворимых, быстро распадающихся лекарственных формах, например, в таких, которые описаны в Expert Opinion in Therapeutic Patents, 11 (6), 981-986 под авторством Liang и Chen (2001).
Доза с немедленным высвобождением может содержать разрыхлитель. Примеры разрыхлителей включают крахмалгликолят натрия, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, порошкообразную целлюлозу, замещенную низшими алкилами гидроксипропилцеллюлозу, полакрилин калия, крахмал, прежелатинизированный крахмал, альгинат натрия и их смеси. Обычно содержание разрыхлителя в слое будет составлять от 1 вес. % до 80 вес. %, предпочтительно от 5 вес. % до 60 вес. %.
Примеры связующих материалов, наполнителей или разбавителей включают лактозу, маннит, ксилит, декстрозу, сахарозу, сорбит, прессуемый сахар, микрокристаллическую целлюлозу, порошкообразную целлюлозу, крахмал, прежелатинизированный крахмал, декстраты, декстран, декстрин, декстрозу, мальтодекстрин, карбонат кальция, двухосновный фосфат кальция, трехосновный фосфат кальция, сульфат кальция, карбонат магния, оксид магния, полоксамеры, полиэтиленоксид, гидроксипропилметилцеллюлозу и их смеси.
При получении лекарственных форм, содержащих композиции по настоящему изобретению, соединения также можно смешивать с традиционными вспомогательными веществами, такими как связующие вещества, в том числе желатин, прежелатинизированный крахмал и им подобные; смазочные средства, такие как гидрогенизированное растительное масло, стеариновая кислота и им подобные; разбавители, такие как лактоза, манноза и сахароза; разрыхлители, такие как карбоксиметилцеллюлоза и крахмалгликолят натрия; суспендирующие средства, такие как повидон, поливиниловый спирт и им подобные; абсорбенты, такие как диоксид кремния; консерванты, такие как метилпарабен, пропилпарабен и бензоат натрия; поверхностно-активные вещества; такие как лаурилсульфат натрия, полисорбат-80 и им подобные; вкусоароматические средства и подсластители. В случае присутствия поверхностно-активных веществ их содержание будет составлять от 0,2 вес. % до 5 вес. %, а содержание абсорбентов будет составлять от 0,2 вес. % до 1 вес. %. Другие вспомогательные вещества включают один или несколько из антиоксидантов, красящих веществ, вкусоароматических средств, консервантов и средств, маскирующих вкус.
В качестве альтернативы, перед таблетированием смеси или порции смесей для таблетирования могут быть подвергнуты влажной, сухой грануляции или грануляции из расплава, отверждению из расплава или экструзии. Конечный состав может предусматривать один или несколько слоев и может быть покрыт оболочкой или быть непокрытым; он даже может быть инкапсулированным.
Таблетированные составы рассматриваются в "Pharmaceutical Dosage Forms: Tablets, Vol. 1" под авторством H. Lieberman и L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-Х).
Твердые составы для перорального введения могут быть составлены для немедленного и/или модифицированного высвобождения. Составы с модифицированным высвобождением включают составы с отсроченным, замедленным, прерывистым, контролируемым, нацеленным и запрограммированным высвобождением.
Парентеральное введение
Соединения по настоящему изобретению также можно вводить непосредственно в кровоток, в мышцу или в внутренний орган. Подходящие способы парентерального введения включают внутривенное, интраартериальное, внутрибрюшинное, интратекальное, интравентрикулярное, внутриуретральное, интрастернальное, интракраниальное, внутримышечное и подкожное.
Подходящие устройства для парентерального введения включают игольчатые (в том числе с микроиглой) инжекторы, безыгольные инжекторы и методики инфузии. Примером безыгольного инжектора является Powderject™.
Составы для парентерального введения, как правило, представляют собой водные растворы, которые могут содержать вспомогательные вещества, такие как соли, углеводы и буферные средства (предпочтительно с рН в диапазоне от 3 до 9), но в случае некоторых вариантов применения они могут быть соответствующим образом составлены в виде стерильного неводного раствора или в виде порошкообразной высушенной формы, подлежащей применению в сочетании с подходящей средой-носителем, такой как стерильная апирогенная вода.
Получение составов для парентерального введения в стерильных условиях, например, путем лиофилизации, можно с легкостью осуществлять с применением стандартных фармацевтических методик, хорошо известных специалистам в данной области техники.
Соответствующая лекарственная форма, такая как комбинация с усилителем растворимости, может повышать растворимость соединения формулы I, применяемого в растворе, не предназначенном для перорального введения.
Составы для парентерального введения могут быть составлены для немедленного и/или модифицированного/контролируемого высвобождения. Составы с контролируемым/модифицированным высвобождением включают составы с отсроченным, замедленным, прерывистым, контролируемым, нацеленным и запрограммированным высвобождением. Таким образом, соединения по настоящему изобретению могут быть составлены в виде твердого вещества, полутвердого вещества или тиксотропной жидкости, предназначенных для введения в качестве имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких составов включают стенты, покрытые лекарственным средством, и микросферические частицы на основе PGLA.
Местное введение
Соединения по настоящему изобретению также можно наносить местно на кожу или слизистые оболочки, то есть вводить дермально или трансдермально. Типичные составы, предназначенные для данной цели, включают гели, гидрогели, лосьоны, растворы, кремы, мази, опудривающие порошки, перевязочные материалы, пены, пленки, кожные пластыри, пластинки, импланты, губки, нити, бандажи и микроэмульсии. Также могут применяться липосомы.
Доза
У пациентов-людей вводимая точная суточная доза зависит от различных факторов, таких как возраст, пол, вес и общее состояние пациента, подлежащего лечению. Размер дозы может быть выбран в пределах, при которых достигается лечебный эффект без вредного или опасного неблагоприятного воздействия.
Например, дозу соединения по настоящему изобретению можно вводить пациентам в эффективном количестве, варьирующем от 0,05 до 1000 мг в сутки. Следующие уровни дозировки и другие уровни дозировки в данном документе приведены для среднестатистического субъекта-человека с весом в диапазоне от приблизительно 65 до 70 кг. Специалист в данной области техники сможет легко определить уровни дозировки, требуемые для субъектов, вес которых выходит за пределы данного диапазона, таких как дети и люди преклонного возраста.
Принцип изобретения
Настоящее изобретение подробно поясняется без ограничения с помощью следующих примеров и экспериментальных примеров.
[Примеры]
<Промежуточное соединение 1> 4-(Бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол
Стадия 1. Получение оксима 2,6-дихлорбензальдегида
К гидрохлориду гидроксиламина (11 г, 160 ммоль) в воде (100 мл) добавляли гидроксид натрия (6,3 г, 160 ммоль) и 2,6-дихлорбензальдегид (25 г, 140 ммоль) в этаноле (200 мл) и перемешивали в течение 24 часов при 90°С Реакционную смесь выпаривали в вакууме, фильтровали с водой (200 мл, 2 раза) и высушивали в вакууме с получением промежуточного соединения оксима 2,6-дихлорбензальдегида (25,9 г, 96%).
1H-ЯМР (DMSO, 400 МГц): δ 11,80 (s, 1H), 8,22 (s, 1H), 7,55 (d, 2Н), 7,45-7,41 (dd, 1H).
Стадия 2. Получение 2,6-дихлор-N-гидроксибензимидоилхлорида
К раствору промежуточного соединения (стадия 1) (25,9 г, 140 ммоль) в хлороформе (1000 мл) добавляли N-хлорсукцинимид (NCS, 18,4 г, 140 ммоль) и перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь выпаривали в вакууме, разбавляли дихлорметаном и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения 2,6-дихлор-N-гидроксибензимидоилхлорида (29 г) без какой-либо дополнительной очистки.
Стадия 3. Получение этил-5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-карбоксилата
К этил-3-циклопропил-3-оксопропанату (25 мл, 194 ммоль) в триэтиламине (150 мл) добавляли промежуточное соединение (стадия 2) (29 г, 129 ммоль) и перемешивали в течение 24 часов при комнатной температуре. Реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения этил-5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-карбоксилата (22,37 г, 56%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,41-7,38 (m, 2Н), 7,35-7,31 (m, 4Н), 3,69 (s, 3Н), 2,91 (m, 1H), 1,43-1,39 (m, 2Н), 1,30-1,26 (m, 2Н).
Стадия 4. (Получение 5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метанола
К промежуточному соединению (стадия 3) (22,37 г, 71,7 ммоль) в тетрагидрофуране (72 мл) добавляли 1 М гидрид диизобутилалюминия (DIBAL-H, 144 мл, 144 ммоль) при 0°С и перемешивали в течение 7 часов при комнатной температуре. Реакционную смесь разбавляли этилацетатом и промывали с помощью 10 вес./вес. % раствора лимонной кислоты и воды. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения (5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метанола (12,2 г, 60%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,44-7,40 (m, 2Н), 7,37-7,33 (m, 1H), 4,41 (d, 2Н), 2,19 (m, 1H), 1,40 (t, 1H), 1,30-1,25 (m, 2Н), 1,17-1,10 (m, 2Н).
Стадия 5. Получение 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола
К промежуточному соединению (стадия 4) (12,2 г, 43,02 ммоль) в дихлорметане (158 мл) медленно добавляли трифенилфосфин (ТРР, 16,9 г, 64,53 ммоль) и тетрабромметан (21,4 г, 64,53 ммоль) при 0°С и перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением указанного в заголовке соединения (13,44 г, 90%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,46-7,45 (dd, 2Н), 7,40-7,36 (dd, 1H), 4,23 (s, 2Н), 2,12 (m, 1H), 1,32-1,23 (m, 2Н), 1,22-1,17 (m, 2Н).
<Пример 1> 4-((4-((5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-1)
Стадия 1. Получение трет-бутил(4-йодфенокси)диметилсилана
К раствору 4-йодфенола (2 г, 9,1 ммоль) в N,N-диметилформамиде (45 мл) добавляли трет-бутилдиметилсилилхлорид (TBSCl, 2,1 г, 13,6 ммоль) и имидазол (1,2 г, 18,2 ммоль) и перемешивали в течение 12 часов при комнатной температуре. Реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения трет-бутил(4-йодфенокси)диметилсилана (2,8 г, 93%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,32 (m, 2Н), 6,43 (m, 2Н), 0,78 (t, 9Н), 0,23 (t, 6Н).
Стадия 2. Получение трет-бутил(4-((триметилсилил)этил)фенокси)силана
К раствору промежуточного соединения (стадия 1) (2,8 г, 8,5 ммоль) в N,N-диметилформамиде (50 мл) добавляли триметилсилилацетилен (2,4 мл, 17 ммоль), дихлорид бис(трифенилфосфин)палладия(ii) (PdCl2(PPh3)2, 0,6 г, 0,85 ммоль), йодид меди(I) (0,16 г, 0,85 ммоль) и триэтиламин (0,6 мл, 4,25 ммоль) и перемешивали в течение 12 часов при 80°С. Реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения трет-бутил(4-((триметилсилил)этил)фенокси)силана (1,99 г, 77%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,32 (m, 2Н), 6,43 (m, 2Н), 0,78 (s, 9Н), 0,25 (s, 9Н), 0,23 (s, 6Н).
Стадия 3. Получение 4-((триметилсилил)этинил)фенола
К раствору промежуточного соединения (стадия 2) (1,99 г, 6,5 ммоль) в метаноле (65 мл) добавляли фторид калия (KF, 3,8 г, 65 ммоль) при 0°С и перемешивали в течение 1 часа. Реакционную смесь разбавляли дихлорметаном и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали и выпаривали в вакууме. Полученный в результате 4-((триметилсилил)этил)фенол применяли на следующей стадии без какой-либо дополнительной очистки.
Стадия 4. Получение 5-циклопропил-3-(2,6-дихлорфенил)-4-((4-этинилфенокси)метил)изоксазола
К раствору промежуточного соединения (стадия 3) (1,25 г, 6,5 ммоль) в N,N-диметилформамиде (65 мл) добавляли 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (промежуточное соединение 1) (2,25 г, 6,5 ммоль) и карбонат калия (1,34 г, 9,75 ммоль), перемешивали в течение 12 часов при комнатной температуре. Реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения 5-циклопропил-3-(2,6-дихлорфенил)-4-((4-этинилфенокси)метил)изоксазола (2,05 г, 82%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,41-7,30 (m, 5Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
Стадия 5. Получение метил-4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
К раствору промежуточного соединения (стадия 4) (200 мг, 0,52 ммоль) в N,N-диметилформамиде (5,2 мл) добавляли 4-йодбензоат (67 мг, 0,52 ммоль), дихлорид бис(трифенилфосфин)палладия(ii) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодид меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU, 0,4 мл, 2,6 ммоль) и перемешивали в течение 4 часов при 80°С. Реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения метил-4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (175 мг, 65%).
1Н-ЯМР (MeOD, 400 МГц): δ 8,03 (d, 2Н), 8,01-7,40 (m, 7Н), 6,83 (d, 2Н), 4,94 (s, 2Н), 3,93 (s, 3Н), 2,37-2,34 (m, 1H), 1,24-1,22 (m, 4Н).
Стадия 6. Получение 4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
К раствору промежуточного соединения (стадия 5) (175 мг, 0,34 ммоль) в 1,4-диоксане (3 мл) и дистиллированной воде (0,4 мл) добавляли гидроксид лития (14,2 мг, 0,34 ммоль) и перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь подкисляли до рН=2~3 с помощью 1 н. HCl и экстрагировали этилацетатом. Объединенные органические слои высушивали над MgSO4, фильтровали и выпаривали в вакууме с получением указанного в заголовке соединения (133 мг, 78%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,01 (dd, 2Н), 7,55 (dd, 2Н), 7,43-7,40 (m, 4Н), 7,34-7,32 (m, 1H), 6,79 (d, 2Н), 4,83 (s, 2Н), 2,20-2,16 (m, 1H), 1,30-1,22 (m, 2Н), 1,19-1,13 (m, 2Н).
<Пример 2> 3-((4-((5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-2)
Стадия 1. Получение метил-3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию данного промежуточного соединения (стадия 4 примера 1) (100 мг, 0,26 ммоль) с метил-3-бромбензоатом (56 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (40 мг, 30%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,17 (s, 1H), 8,17-7,96 (m, 1H), 7,68-7,65 (m, 1H), 7,42-7,40 (m, 5H), 7,34-7,30 (m, 1H), 6,80-6,77 (m, 2H), 4,82 (s, 2H), 3,93 (s, 3Н), 2,19-2,15 (m, 1H), 1,31-1,27 (m, 2H), 1,17-1,13 (m, 2H).
Стадия 2. Получение 3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (40 мг, 0,08 ммоль) с гидроксидом лития (LiOH, 3,3 мг, 0,08 ммоль) с получением указанного в заголовке соединения (30 мг, 78%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,19-8,18 (m, 1H), 8,00-7,98 (m, 1H), 7,68-7,66 (m, 1H), 7,43-7,40 (m, 5Н), 7,36-7,34 (m, 1H), 6,80-6,77 (m, 2Н), 4,83 (s, 2Н), 2,20-2,16 (m, 1H), 1,31-1,26 (m, 2Н), 1,19-1,14 (m, 2Н).
<Пример 3> 3-((4-((5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойная кислота (I-3)
Стадия 1. Получение трет-бутил(4-йод-3-(трифторметил)фенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 1). Таким образом, проводили реакцию 4-йод-3-(трифторметил)фенола (40 мг, 0,14 ммоль) с трет-бутилдиметилсилилхлоридом (TBSCl, 32 мг, 0,21 ммоль) и имидазолом (19 мг, 0,28 ммоль) с получением промежуточного соединения трет-бутил(4-йод-3-(трифтор метил)фенокси)диметилсилана (52 мг, 93%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,64 (d, 1H), 6,97 (d, 1H), 6,48 (dd, 1H), 0,96 (s, 9Н), 0,16 (s, 6Н).
Стадия 2. Получение трет-бутилдиметил(3-(трифторметил)-4- ((триметилсилил)этинил)фенокси)силана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 2). Таким образом, обеспечили реакцию данного промежуточного соединения (стадия 1) (52 мг, 0,13 ммоль) с триметилсилилацетиленом (0,036 мл, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(ii) (PdCl2(PPh3)2, 9,1 мг, 0,013 ммоль), йодидом меди(I) (2,4 мг, 0,013 ммоль) и триэтиламином (0,095 мл, 0,65 ммоль) с получением промежуточного соединения трет-бутилдиметил(3-(трифторметил)-4-((триметилсилил)этинил)фенокси)силана (41,1 мг, 88%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,35 (d, 1H), 6,87 (d, 1H), 6,66 (dd, 1H), 0,96 (s, 9Н), 0,25 (s, 9Н), 0,19 (s, 6Н).
Стадия 3. Получение 3-(трифторметил)-4-((триметилсилил)этинил)фенола Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 3). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (41,1 мг, 0,16 ммоль) с фторидом калия (KF, 93 мг, 1,6 ммоль) с получением промежуточного соединения 3-(трифторметил)-4-((триметилсилил)этинил)фенола. Полученный остаток применяли на следующей стадии без какой-либо дополнительной очистки.
Стадия 4. Получение 5-циклопропил-3-(2,6-дихлорфенил)-4-((4-этинил-3-(трифторметил)фенокси)метил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию данного промежуточного соединения (стадия 3) (0,16 ммоль) с 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазолом (промежуточное соединение 1) (50 мг, 0,144 ммоль) и карбонатом калия (26,6 мг, 0,192 ммоль) с получением промежуточного соединения 5-циклопропил-3-(2,6-дихлорфенил)-4-((4-этинил-3-(трифторметил)фенокси)метил)изоксазола (36 мг, 50%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,50-7,48 (m, 1H), 7,40-7,30 (m, 3Н), 7,08-7,04 (m, 1H), 6,90-6,86 (m, 1H), 4,86 (s, 2Н), 3,25 (s, 1H), 2,17-2,11 (m, 1H), 1,35-1,22 (m, 2Н), 1,18-1,14 (m, 2Н).
Стадия 5. Получение метил-3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию данного промежуточного соединения (стадия 4) (36 мг, 0,080 ммоль) с метил-3-йодбензоатом (21 мг, 0,080 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 5,6 мг, 0,008 ммоль), йодидом меди(I) (1,5 мг, 0,008 ммоль) и триэтиламином (0,013 мл, 0,096 ммоль) с получением промежуточного соединения метил-3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензоата (3 мг, 75%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,17-8,16 (m, 1H), 8,02-7,99 (m, 1H), 7,70-7,67 (m, 1H), 7,54-7,51 (m, 1H), 7,45-7,31 (m, 4Н), 7,09-7,08 (m, 1H), 6,94-6,91 (m, 1H), 4,88 (s, 2Н), 3,94 (s, 3Н), 2,18-2,13 (m, 1H), 1,33-1,29 (m, 2Н), 1,22-1,15 (m, 2Н).
Стадия 6. Получение 3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 5) (35 мг, 0,06 ммоль) с гидроксидом лития (2,5 мг, 0,06 ммоль) с получением указанного в заголовке соединения (23 мг, 68%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,23-8,21 (m, 1H), 8,06-8,05 (m, 1H), 7,71-7,66 (m, 1H), 7,55-7,31 (m, 5Н), 7,09-7,08 (m, 1H), 7,00-6,91 (m, 1H), 4,88 (s, 2Н), 2,17-2,12 (m, 1H), 1,33-1,28 (m, 2Н), 1,20-1,15 (m, 2Н).
<Пример 4> 4-((4-((5-Циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойная кислота (I-4)
Стадия 1. Получение метил-4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию промежуточного соединения (стадия 4 примера 3) 5-циклопропил-3-(2,6-дихлорфенил)-4-((4-этинил-3-(трифторметил)фенокси)метил)изоксазола (45 мг, 0,1 ммоль) с метил-4-йодбензоатом (28 мг, 0,1 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 13 мг, 0,02 ммоль), йодидом меди(I) (1,7 мг, 0,01 ммоль) и триэтиламином (0,06 мл, 0,46 ммоль) с получением промежуточного соединения метил-4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензоата (42 мг, 71%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,02 (dd, 2Н), 7,57-7,52 (m, 3Н), 7,41-7,39 (m, 2Н), 7,35 (dd, 1H), 7,09 (d, 1H), 6,94 (dd, 1H), 4,88 (s, 2Н), 3,93 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,27 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 2. Получение 4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (42 мг, 0,07 ммоль) с гидроксидом лития (29 мг, 0,7 ммоль) с получением указанного в заголовке соединения (40 мг, 100%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,27 (s, 1H), 8,05 (d, 2Н), 7,78 (d, 1H), 7,73-7,58 (m, 5Н), 7,24-7,21 (m, 2Н), 5,15 (s, 2Н), 2,59 (m, 1H), 1,29-1,21 (m, 4Н).
<Пример 5> 4-((3-Хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (I-5)
Стадия 1. Получение трет-бутил(3-хлор-4-йодфенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 1). Таким образом, проводили реакцию 3-хлор-4-йодфенола (10 г, 39,5 ммоль) с трет-бутилдиметилсилилхлоридом (TBSCl, 7,5 г, 47,2 ммоль) и имидазолом (3 г, 59 ммоль) с получением промежуточного соединения трет-бутил(3-хлор-4-йодфенокси)диметилсилана (9 г, 66%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,64 (d, 1H), 6,97 (d, 1H), 6,48 (dd, 1H), 0,96 (s, 9Н), 0,16 (s, 6Н).
Стадия 2. Получение трет-бутил(3-хлор-4-((триметилсилил)этинил)фенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (9 г, 24,4 ммоль) с триметилсилилацетиленом (6,76 мл, 48,8 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 0,85 г, 1,22 ммоль), йодидом меди(I) (0,23 г, 1,22 ммоль), триэтиламином (15,3 мл, 109,8 ммоль) с получением промежуточного соединения трет-бутил(3-хлор-4-((триметилсилил)этинил)фенокси)диметилсилана (7,44 г, 90%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,35 (d, 1H), 6,87 (d, 1H), 6,66 (dd, 1H), 0,96 (s, 9Н), 0,25 (s, 9Н), 0,19 (s, 6Н).
Стадия 3. Получение 3-хлор-4-((триметилсилил)этинил)фенола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 3). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (7,44 г, 21,9 ммоль) с фторидом калия (KF, 12,7 г, 219 ммоль) с получением промежуточного соединения 3-хлор-4-((триметилсилил)этинил)фенола и его применяли без дополнительной очистки.
Стадия 4. Получение 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию промежуточного соединения (стадия 3) (4,92 г, 21,9 ммоль) с 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазолом (пример 1) (7,59 г, 21,9 ммоль) и карбонатом калия (4,54 г, 32,9 ммоль) с получением указанного в заголовке соединения (7,15 г, 78%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,41-7,30 (m, 4Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
<Пример 6> 4-((3-Хлор-4-(фенилэтинил)фенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (I-6)
Стадия 1. Получение 4-((3-хлор-4-(фенилэтинил)фенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (128 мг, 0,306 ммоль) с бромбензолом (48 мг, 0,306 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21,5 мг, 0,031 ммоль), йодидом меди(I) (5,8 мг, 0,031 ммоль) и триэтиламином (0,052 мл, 0,367 ммоль) с получением указанного в заголовке соединения (7,15 г, 78%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,54-7,52 (m, 2Н), 7,42-7,31 (m, 7Н), 6,87-6,86 (d, 1H), 6,69-6,66 (dd, 1H), 4,81 (s, 2Н), 2,17-2,04 (m, 1H), 1,29-1,24 (m, 2Н), 1,19-1,14 (m, 2Н).
<Пример 7> Метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (I-7)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 6) (128 мг, 0,31 ммоль) с метил-3-йодбензоатом (80 мг, 0,31 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 22 мг, 0,03 ммоль), йодидом меди(I) (5,8 мг, 0,03 ммоль) и триэтиламином (0,052 мл, 0,37 ммоль) с получением указанного в заголовке соединения (107 мг, 63%).
1H-ЯМР (CDCl3, 400 МГц): δ 8,20-8,19 (m, 1H), 8,01-7,98 (m, 1H), 7,72-7,69 (m, 1H), 7,43-7,32 (m, 5Н), 6,88-6,87 (m, 1H), 6,71-6,68 (m, 1H), 4,82 (s, 2Н), 3,94 (s, 3Н), 2,18-2,15 (m, 1H), 1,32-1,28 (m, 2Н), 1,20-1,16 (m, 2Н).
(Пример 8) Метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоат (I-8)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-нитробензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (3,6 г, 8,59 ммоль) с метил-3-бром-5-нитробензоатом (2,6 г, 10,3 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 302 мг, 0,429 ммоль), йодидом меди(I) (81,8 мг, 0,429 ммоль) и триэтиламином (1,44 мл, 10,3 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-нитробензоата (3,9 г, 80%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,78 (t, 1H), 8,51 (t, 1H), 8,46 *t, 1H), 7,44-7,40 (m, 3Н), 7,36-7,32 (m, 1H), 6,89 (d, 1H), 6,73 (dd, 1H), 4,84 (s, 2Н), 4,00 (s, 3Н), 2,19-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,20-1,15 (m, 2Н).
Стадия 2. Получение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Промежуточное соединение (стадия 1) растворяли в этилацетате (70 мл) и этаноле (35 мл) и добавляли дигидрат хлорида олова(II) (15,5 г, 68,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 дня. Реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (3,0 г, 77%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,59-7,58 (m, 1H), 7,41-7,27 (m, 5Н), 7,00-6,99 (m, 1H), 6,87-6,86 (m, 1H), 6,69-6,67 (m, 1H), 4,82 (s, 2Н), 3,90 (s,3H), 2,19-2,12 (m, 1H), 1,31-1,28 (m, 2Н), 1,20-1,14 (m, 2Н).
Стадия 3. Получение метил-3-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоата
Промежуточное соединение (стадия 2) растворяли в N,N-диметилформамиде (8,8 мл) и этилхлорформиате (250 мкл, 2,64 ммоль), добавляли триэтиламин (369 мкл, 2,64 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU, 13 мкл, 0,0881 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (254 мг, 65%).
1Н-ЯМР (CDCl3, 400 МГц): δ 13,42 (br, 1H), 8,03 (d, 1H), 7,82 (t, 1H), 7,65-7,61 (m, 2Н), 7,58-7,54 (m, 1H), 7,13 (d, 1H), 6,87 (dd, 1H), 5,01 (s, 2Н), 1,05-1,32 (m, 5Н).
(Пример 9) Метил-3-(трет-бутоксикарбонил)амино)-5-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (I-9)
Стадия 1. Получение метил-3-(трет-бутоксикарбонил)амино)-5-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 8 (стадия 3). Таким образом, проводили реакцию метил-3-амино-5-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (стадия 2 примера 8) (500 мг, 0,880 ммоль) с ди-трет-бутилдикарбонатом (385 мг, 1,76 ммоль), 4-диметиламинопиридином (5,4 мг, 0,044 ммоль) и триэтиламином (0,2 мл, 1,32 ммоль) с получением указанного в заголовке соединения (300 мг, 51%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,12 (t, 1H), 7,89 (t, 1H), 7,79 (t, 1H), 7,51-7,31 (m, 5Н), 6,86 (d, 1H), 6,69 (dd, 1H), 6,61 (s, 1H), 4,81 (s, 2Н), 3,93 (s, 3Н), 2,17 (m, 1H), 1,52 (s, 9Н), 1,31 1,23 (m, 2Н), 1,19-1,16 (m, 2Н).
(Пример 10) Метил-3-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензоат (I-10)
Стадия 1. Получение метил-3-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензоата
Соединение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоат (пример 8) (220 мг, 0,348 ммоль) растворяли в N,N-диметилформамиде (5 мл) и добавляли гидрид натрия (25 мг, 1,04 ммоль) и йодметан (87 мкл, 1,39 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (113 мг, 48%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,02 (t, 1H), 7,88 (s, 1H), 7,62 (s, 1H), 7,42-7,38 (m, 1H), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 4,22 (q, 2Н), 3,93 (s, 3Н), 3,32 (s, 3Н), 2,17-2,13 (m, 1Н), 1,34 (t, 3Н), 1,32-1,24 (m, 2Н), 1,23-1,14 (m, 2Н).
<Пример 11> Этил-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)карбамат (I-11)
Стадия 1. Получение 4-((3-хлор-4-((3-нитрофенил)этинил)фенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (300 мг, 0,72 ммоль) с 1-йод-3-нитробензолом (178,4 мг, 0,72 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 81 мг, 0,07 ммоль), йодидом меди(I) (13,3 мг, 0,07 ммоль) и N,N-диизопропилэтиламином (0,15 мл, 0,86 ммоль) с получением промежуточного соединения 4-((3-хлор-4-((3-нитрофенил)этинил)фенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (368,8 мг, 95%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,36 (s, 1H), 8,17 (d, 1H), 7,82 (d, 1H), 7,55-7,43 (m, 2Н), 7,42-7,40 (m, 3Н), 6,88 (d, 1H), 6,71 (dd, 1H), 4,83 (s, 2Н), 2,18-2,13 (m, 1H), 1,31-1,30 (m, 2Н), 1,19-1,17 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)анилина
Данное соединение получали с применением процедуры, описанной для примера 8 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (100 мг, 0,19 ммоль) с дигидратом хлорида олова(II) (208,9 мг, 0,93 ммоль) с получением промежуточного соединения 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)анилина (60 мг, 62%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,70 (s, 1H), 7,68 (d, 1H), 7,55-7,33 (m, 4Н), 7,15-7,12 (m, 1H), 6,99-6,93 (m, 1H), 6,88 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 2,17-2,14(m, 1H), 1,30-1,24 (m, 2Н), 1,19-1,14 (m, 2Н).
Стадия 3. Получение этил(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)карбамата
К суспензии промежуточного соединения (стадия 2) (30 мг, 0,06 ммоль) в дихлорметане добавляли триэтиламин (12,3 мкл, 0,08 ммоль) и этилхлорформиат (8,3 мкл, 0,08 ммоль) и перемешивали в течение 7 часов при комнатной температуре. К реакционной смеси добавляли воду и продукт экстрагировали в дихлорметане. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением указанного в заголовке соединения (25 мг, 72%).
1Н-ЯМР (MeOD, 400 МГц): δ 7,53 (s, 1H), 7,43-7,41 (m, 2Н), 7,38-7,29 (m, 3Н), 7,17 (t, 1H), 7,05 (dd, 1H), 6,81 (d, 1H), 6,65 (dd, 1H), 5,90 (s, 2Н), 4,08 (q, 2Н), 2,28-2,21 (m, 1H), 1,19 (t, 3Н), 1,14-1,08 (m, 4Н).
<Пример 12> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензолсульфонамид (I-12)
Стадия 1. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензолсульфонамида
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (75 мг, 0,17 ммоль) с 3-бромбензолсульфонамидом (200 мг, 0,85 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 13 мг, 0,02 ммоль), йодидом меди(I) (3,5 мг, 0,02 ммоль) и триэтиламином (0,030 мл, 0,21 ммоль) с получением указанного в заголовке соединения (12 мг, 12%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,08 (m, 1H), 7,86-7,89 (m, 1H), 7,70-7,64 (m, 3Н), 7,57-7,44 (m, 3Н), 6,88 (m, 1H), 6,71-6,68 (m, 1H), 4,83 (s, 2Н), 2,17-2,14 (m, 1H), 1,33-1,28 (m, 2Н), 1,20-1,15 (m, 2Н).
<Пример 13> N-(3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)метансульфонамид (I-13)
Стадия 1. Получение N-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)метансульфонамида
К раствору 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)анилина (стадия 2 примера 11) (35 мг, 0,0686 ммоль) в тетрагидрофуране (1 мл) добавляли метансульфонилхлорид (2 капли) и к реакционной смеси добавляли триэтиламин (0,05 мл, 0,343 ммоль) и перемешивали в течение 8 часов. Реакционную смесь концентрировали в вакууме, добавляли 1 н. HCl (водн.) и экстрагировали в этилацетате. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением указанного в заголовке соединения (27 мг, 67%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,42-7,32 (m, 7Н), 7,22-7,19 (m, 1H), 6,87 (d, 1H), 6,70-6,68 (dd, 1H), 6,38 (s, 1H), 4,82 (s, 2Н), 6,04 (s, 3Н), 2,15-2,14 (m, 1H), 1,31-1,24 (m, 2Н), 1,19-1,15 (m, 2Н).
<Пример 14> N-(3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)сульфамид (I-14)
Стадия 1. Получение N-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)сульфамида
Данное соединение получали с применением процедуры, описанной для примера 13 (стадия 1). Таким образом, проводили реакцию 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)анилина (стадия 2 примера 11) (34,8 мг, 0,0683 ммоль) с хлорсульфонилизоцианатом (2 капли) и пиридином (15 мкл, 0,1366 ммоль) с получением указанного в заголовке соединения (23,9 мг, 89%).
1Н-ЯМР (DMSO, 400 МГц): δ 9,67 (s, 1H), 7,64-7,62 (m, 2Н), 7,57-7,50 (m, 2Н), 7,31-7,29 (d, 2Н), 7,21-7,08 (m, 5Н), 6,83-6,80 (dd, 1H), 4,98 (s, 2Н), 1,21-1,17 (m, 2Н), 1,15-1,13 (m, 2Н).
<Пример 15> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-15)
Стадия 1. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил) изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (пример 7) (105 мг, 0,190 ммоль) с гидроксидом лития (8 мг, 0,19 ммоль) с получением указанного в заголовке соединения (66 мг, 65%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,27-8,26 (m, 1H), 8,08-8,05 (m, 1H), 7,77-7,75 (m, 1H), 7,49-7,32 (m, 5Н), 6,89-6,88 (m, 1H), 6,72-6,69 (m, 1H), 4,83 (s, 2Н), 2,17-2,14 (m, 1H), 1,33-1,28 (m, 2Н), 1,20-1,15 (m, 2Н).
<Пример 16> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-16)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (175 мг, 0,42 ммоль) с метил-4-бромбензоатом (100 мг, 0,38 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 53 мг, 0,08 ммоль), йодидом меди(I) (7 мг, 0,04 ммоль) и триэтиламином (0,26 мл, 1,89 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (150 мг, 71%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,02 (dd, 2Н), 7,59 (dd, 2Н), 7,42-7,40 (m, 3Н), 7,35 (dd, 1H), 6,88 (d, 1H), 6,71 (dd, 1H), 4,82 (s, 2Н), 3,92 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (150 мг, 0,27 ммоль) с гидроксидом лития (114 мг, 2,7 ммоль) с получением указанного в заголовке соединения (106 мг, 73%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,16 (s, 1H), 7,98 (dd, 2Н), 7,65-7,62 (m, 4Н), 7,57-7,53 (m, 2Н), 7,11 (d, 1H), 6,85 (dd, 1H), 4,99 (s, 2Н), 2,46 (m, 1H), 1,22-1,12 (m, 4Н).
<Пример 17> 6-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновая кислота (I-17)
Стадия 1. Получение метил-6-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотината
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-6-бромникотинатом (61,9 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl3(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-6-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотината (77 мг, 68%).
1Н-ЯМР (CDCl3, 400 МГц): δ 9,20 (dd, 1H), 8,28 (dd, 1H), 7,60 (dd, 1H), 7,50 (d, 1H), 7,43-7,39 (m, 2Н), 7,36-7,31 (m, 1H), 6,89 (d, 1H), 6,71 (dd, 1H), 4,83 (s, 3Н), 3,97 (s, 3Н), 2,20-2,10 (m, 1Н), 1,34-1,29 (m, 2Н), 1,21-1,15 (m, 2Н).
Стадия 2. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (77 мг, 0,14 ммоль) с гидроксидом лития (58 мг, 1,40 ммоль) с получением указанного в заголовке соединения (23,5 мг, 27%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,55 (br, 1H), 9,06 (dd, 1H), 8,29 (dd, 1H), 7,74 (dd, 1H), 7,65 7,60 (m, 3Н), 7,53-7,58 (m, 1Н), 7,13 (d, 1H), 6,87 (dd, 1H), 5,01 (s, 2Н), 1,25-1,12 (m, 5Н).
<Пример 18> 2-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изоникотиновая кислота (I-18)
Стадия 1. Получение метил-2-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изоникотината
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-2-бромизоникотинатом (61,9 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-2-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изоникотината (47,6 мг, 36%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,77 (dd, 1H), 8,07 (dd, 1H), 7,78 (dd, 1H), 7,49 (d, 1Н),7,31-7,44 (m, 2Н), 7,26 (s, 1H), 6,89 (d, 1H), 6,71 (dd, 1H), 4,83 (s, 2Н), 3,98 (s, 3Н), 2,18-2,13 (m, 1H), 1,35-1,21 (m, 2Н), 1,21-1,11 (m, 2Н).
Стадия 2. Получение 2-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изоникотиновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (47,6 мг, 0,086 ммоль) с гидроксидом лития (36 мг, 0,86 ммоль) с получением указанного в заголовке соединения (27 мг, 58%).
1H-ЯМР (DMSO, 400МГц): δ 13,73 (br, 1H), 8,03 (d, 1H), 7,82 (t, 1H), 7,60-7,65 (m, 1Н), 7,58-7,53 (m, 3Н), 7,13 (d, 1H), 6,87 (dd, 1H), 5,01 (s, 2Н), 1,32-1,03 (m, 5Н).
<Пример 19> 6-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)пиколиновая кислота (I-19)
Стадия 1. Получение метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)пиколината
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-6-бромпиколинатом (65,9 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)пиколината (60,4 мг, 45%).
1H-ЯМР (CDCl3, 400МГц): δ 8,06 (dd, 1H), 7,83 (t, 1H), 7,70 (dd 1H), 7,50 (d, 1H), 7,43-7,39 (m, 2Н), 7,36-7,31 (m, 1H), 6,88 (d, 1H), 6,70 (dd, 1H), 4,83 (s, 2Н), 4,49 (q, 2Н), 2,18-2,12 (m, 1H), 1,45 (t, 3Н), 1,30 (dd, 2Н), 1,17 (dd, 2Н).
Стадия 2. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)пиколиновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия_6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (60,4 мг, 0,106 ммоль) с гидроксидом лития (44,5 мг, 1,06 ммоль) с получением указанного в заголовке соединения (9,7 мг, 17%).
1H-ЯМР (DMSO, 400МГц): δ 13,42 (br, 1H), 8,03 (d, 1H), 7,82 (t, 1H), 7,65-7,61 (m, 2Н), 7,58-7,54 (m,1H), 7,13 (d, 1H), 6,87 (dd, 1H), 5,01 (s, 2Н), 1,05-1,32 (m, 5Н).
<Пример 20> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновая кислота (I-20)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотината
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-5-бромникотинатом (65,9 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотината (68,8 мг, 52%).
1Н-ЯМР (CDCl3, 400МГц): δ 9,13 (s, 1H), 8,90 (s, 1H), 8,41 (d, 1H), 7,46-7,40 (m, 3Н), 7,36-7,32 (m, 1H), 6,90 (d, 1H), 6,72 (dd, 1H), 4,84 (s, 2Н), 3,97 (s, 3Н), 2,16 (m, 1H), 1,32-1,28 (m, 2Н), 1,21-1,15 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (68,8 мг, 0,124 ммоль) с гидроксидом лития (52 мг, 1,24 ммоль) с получением указанного в заголовке соединения (44,8 мг, 67%).
1Н-ЯМР (CDCl3, 400МГц): δ 9,26 (s, 1H), 8,98 (s, 1H), 8,54 (d, 1H), 7,45-7,40 (m, 3Н), 7,36-7,32 (m, 1H), 6,89 (d, 1H), 6,72 (dd, 1H), 4,84 (s, 2Н), 2,16 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,17 (m, 2Н).
<Пример 21> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диметиламино)бензойная кислота (I-21)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диметиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-4-бром-3-(диметиламино)бензоатом (67 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диметиламино)бензоата (70 мг, 42%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,55-7,54 (m, 1H), 7,42-7,31 (m, 5Н), 7,02-7,01 (m, 1H), 6,87-6,86 (m, 1H), 6,70-6,67 (m, 1H), 4,82 (s, 2Н), 3,91 (s, 3Н), 3,01 (s, 6Н), 2,18-2,14 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диметиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия_6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (70 мг, 0,118 ммоль) с гидроксидом лития (4,9 мг, 0,118 ммоль) с получением указанного в заголовке соединения (54 мг, 78%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,60 (s, 1H), 7,43-7,32 (m, 5Н), 7,05-7,04 (m, 1H), 6,88-6,87 (m, 1H), 6,70-6,68 (m, 1H), 4,82 (s, 2Н), 3,02 (s, 6Н), 2,18-2,14 (m, 1H), 1,32-1,29 (m, 2Н), 1,19-1,16 (m, 2Н).
<Пример 22> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-3-(диметиламино)бензойная кислота (I-22)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-3-(диметиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-4-бром-3-(диметиламино)бензоатом (67 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-3-(диметиламино)бензоата (80 мг, 55%).
1H-ЯМР (CDCl3, 400МГц): δ 7,58 (br, 1H), 7,53 (br, 1H), 7,43-7,41 (m, 3Н), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,716,68 (dd, 1H), 4,82 (s, 2Н), 3,91 (s, 3Н), 3,02 (s, 6Н), 2,15 (m, 1H), 1,32-1,29 (m, 2Н), 1,19-1,14 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-3-(диметиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (80 мг, 0,14 ммоль) с гидроксидом лития (58,7 мг, 1,4 ммоль) с получением указанного в заголовке соединения (42 мг, 55%).
1H-ЯМР (DMSO, 400МГц): δ 7,92 (d, 1H), 7,79-7,76 (dd, 1H), 7,65-7,62 (m, 2Н), 7,57-7,52 (m, 2Н), 7,07 (d, 1H), 6,93 (d, 1H), 6,83-6,80 (dd, 1H), 4,98 (s, 2Н), 3,08 (s, 6Н), 2,49 (m, 1H), 1,21-1,13 (m, 4Н).
<Пример 23> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(диметиламино)бензойная кислота (I-23)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(диметиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-4-бром-2-(диметиламино)бензоатом (134 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(диметиламино)бензоата (132 мг, 43%).
1H-ЯМР (CDCl3, 400МГц): δ 7,66-7,64 (m, 1H), 7,43-7,32 (m, 4Н), 7,09-7,08 (m, 1H), 7,02-6,99 (m, 1H), 6,88-6,87 (m, 1H), 6,70-6,68 (m, 1H), 4,82 (s, 2Н), 3,91 (s, 3Н), 2,87 (s, 6Н), 2,18-2,14 (m, 1H), 1,32-1,28 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(диметиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (132 мг, 0,221 ммоль) с гидроксидом лития (9,3 мг, 0,221 ммоль) с получением указанного в заголовке соединения (36 мг, 28%).
1H-ЯМР (CDCl3, 400МГц): δ 8,26-8,24 (m, 1H), 7,57-7,52 (m, 2Н), 7,43-7,33 (m, 4Н), 6,89-6,88 (m, 1H), 6,72-6,69 (m, 1H), 4,83 (s, 2Н), 2,84 (s, 6Н), 2,16-2,12 (m, 1H), 1,31-1,28 (m, 2H), 1,19-1,15 (m, 2H).
<Пример 24> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диэтиламино)бензойная кислота (I-24)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3 -(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диэтиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (20 мг, 0,052 ммоль) с метил-3-бром-5-(диэтиламино)бензоатом (14,9 мг, 0,052 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 4,2 мг, 0,006 ммоль), йодидом меди(I) (1,14 мг, 0,006 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,04 мл, 0,26 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диэтиламино)бензоата (9 мг, 28%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,55-7,54 (m, 1H), 7,42-7,31 (m, 5Н), 7,02-7,01 (m, 1H), 6,87-6,86 (m, 1H), 6,70-6,67 (m, 1H), 4,82 (s, 2Н), 3,91 (s, 3Н), 3,49 (s, 3Н), 3,42-3,37 (m, 3Н), 2,18-2,14 (m, 1H), 1,32-1,28 (m, 2Н), 1,20-1,16 (m, 6Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диэтиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (9 мг, 0,0144 ммоль) с гидроксидом лития (0,6 мг, 0,0144 ммоль) с получением указанного в заголовке соединения (5 мг, 57%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,52-7,50 (m, 1H), 7,42-7,40 (m, 3Н), 7,35-7,31 (m, 2Н), 6,99-6,98 (m, 1H), 6,87-6,86 (m, 1H), 6,70-6,67 (m, 1H), 4,82 (s, 2Н), 3,49 (s, 3Н), 3,42-3,37 (m, 3Н), 2,17-2,15 (m, 1H), 1,31-1,30 (m, 2Н), 1,20-1,16 (m, 6Н).
<Пример 25> 3-Амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (1-25)
Стадия 1. Получение 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной в примере 1 (стадия 6). Таким образом, проводили реакцию метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (стадия 2 примера 8) (71 мг, 0,13 ммоль) с гидроксидом лития (54,6 мг, 1,30 ммоль) с получением указанного в заголовке соединения (54 мг, 78%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,62 (s, 1H), 7,41-7,31 (m, 5Н), 7,01-6,99 (m, 1H), 6,86-6,85 (m, 1H), 6,69-6,68 (m, 1H), 4,81 (s, 2Н), 2,16-2,14 (m, 1H), 1,31-1,29 (m, 2Н), 1,18-1,15 (m, 2Н).
<Пример 26> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-(диметиламино)бензойная кислота (I-26)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-(диметиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-3-бром-4-(диметиламино)бензоатом (67 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-(диметиламино)бензоата (70 мг, 48%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,14 (d, 1H), 7,87-7,84 (dd, 1H), 7,42-7,38 (m, 3Н), 7,35-7,31 (m, 1H), 6,86 (d, 1H), 6,82 (d, 1H), 6,70-6,68 (dd, 1H), 4,82 (s, 2Н), 3,88 (s, 3Н), 3,14 (s, 6Н), 2,16 (m, 1H), 1,30-1,26 (m, 2Н), 1,24-1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-(диметиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (70 мг, 0,12 ммоль) с гидроксидом лития (50,4 мг, 1,2 ммоль) с получением указанного в заголовке соединения (35 мг, 53%).
1Н-ЯМР (DMSO, 400МГц): δ 7,95 (d, 1H), 7,79-7,76 (dd, 1H), 7,64-7,62 (m, 2Н), 7,57-7,51 (m, 2Н), 7,07 (d, 1H), 6,93 (d, 1H), 6,83-6,80 (dd, 1H), 4,97 (d, 1H), 3,08 (s, 6Н), 2,47 (m, 1H), 1,23-1,13 (m, 4Н).
<Пример 27> 3-Хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-27)
Стадия 1. Получение метил-3-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-3-бром-5-хлорбензоатом (65 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-3-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (87 мг, 61%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,06 (m, 1H), 7,96 (m, 1H), 7,67 (m, 1H), 7,42-7,35 (m, 3Н), 7,34-7,31 (m, 1H), 6,88 (d, 1H), 6,71-6,68 (dd, 1H), 4,83 (s, 2Н), 3,94 (s, 3Н), 2,15 (m, 1H), 1,31-1,24 (m, 2Н), 1,18-1,16 (m, 2Н).
Стадия 2. Получение 3-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (87 мг, 0,16 ммоль) с гидроксидом лития (67,2 мг, 1,6 ммоль) с получением указанного в заголовке соединения (43 мг, 50%).
1Н-ЯМР (DMSO, 400МГц): δ 7,93 (br, 1H), 7,88 (br, 1H), 7,64-7,62 (m, 3Н), 7,56 (m, 2Н), 7,10 (d, 1H), 6,85-6,83 (dd, 1H), 4,99 (s, 2Н), 2,47 (m, 1H), 1,22-1,14 (m, 4Н).
<Пример 28> 4-Хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (1-28)
Стадия 1. Получение метил-4-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-3-бром-4-хлорбензоатом (65 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-4-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (87 мг, 61%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,22 (d, 1H), 7,92-7,89 (dd, 1H), 7,51-7,40 (m, 4Н), 7,35-7,33 (m, 1H), 6,88 (d, 1H), 6,71-6,69 (dd, 1H), 4,83 (s, 2Н), 3,93 (s, 3Н), 2,15 (m, 1H), 1,31-1,24 (m, 2Н), 1,18-1,16 (m, 2Н).
Стадия 2. Получение 4-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (87 мг, 0,16 ммоль) с гидроксидом лития (67,2 мг, 1,6 ммоль) с получением указанного в заголовке соединения (43 мг, 50%).
1Н-ЯМР (DMSO, 400МГц): δ 8,10 (d, 1H), 7,94-7,91 (dd, 1H), 7,72 (d, 1H), 7,65-7,53 (m, 4Н), 7,11 (d, 1H), 6,87-6,84(d, 1H), 5,00 (s, 2Н), 2,47 (m, 1H), 1,21-1,13 (m, 4Н).
<Пример 29> 2-Хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-29)
Стадия 1. Получение метил-2-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (155 мг, 0,37 ммоль) с метил-5-бром-2-хлорбензоатом (100 мг, 0,34 ммоль), дихлоридом бис(трифенилфосфин)палладия(П) (PdCl2(PPh3)2, 48 мг, 0,06 ммоль), йодидом меди(I) (6,5 мг, 0,03 ммоль) и триэтиламином (0,23 мл, 1,7 ммоль) с получением промежуточного соединения метил-2-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (155 мг, 78%).
1H-ЯМР (CDCl3, 400МГц): δ 7,98 (s, 1H), 7,55 (dd, 1H), 7,44-7,31 (m, 5Н), 6,87 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,94 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,27 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 2-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (155 мг, 0,264 ммоль) с гидроксидом лития (58,7 мг, 2,64 ммоль) с получением указанного в заголовке соединения (75 мг, 50%).
1Н-ЯМР (DMSO, 400МГц): δ 13,65 (s, 1H), 7,88 (d, 1H), 7,67-7,53 (m, 6Н), 7,10 (d, 1H), 6,85 (dd, 1H), 4,99 (s, 2Н), 2,46 (m, 1H), 1,22-1,12 (m, 4Н).
<Пример 30> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-фторбензойная кислота (I-30)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-фторбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (50 мг, 0,119 ммоль) с метил-3-фтор-5-йодбензоатом (40 мг, 0,143 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 8,4 мг, 0,012 ммоль), йодидом меди(I) (2,3 мг, 0,012 ммоль) и триэтиламином (0,020 мл, 0,143 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-фторбензоата (23 мг, 34%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,99-7,98 (m, 1H), 7,71-7,67 (m, 1H), 7,43-7,32 (m, 5Н), 6,88-6,87 (m, 1H), 6,71-6,69 (m, 1H), 4,83 (s, 2Н), 3,94 (s, 3Н), 2,17-2,15 (m, 1H), 1,33-1,28 (m, 2Н), 1,19-1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-фторбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (23 мг, 0,040 ммоль) с гидроксидом лития (1,7 мг, 0,040 ммоль) с получением указанного в заголовке соединения (17 мг, 76%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,05-8,04 (m, 1H), 7,76-7,73 (m, 1H), 7,47-7,43 (m, 4Н), 7,36-7,32 (m, 1H), 6,89-6,88 (m, 1H), 6,72-6,69 (m, 1H), 4,83 (s, 2Н), 2,18-2,14 (m, 1H), 1,33-1,30 (m, 2Н), 1,17-1,15 (m, 2Н).
<Пример 31> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметил)бензойная кислота (I-31)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)-5-(трифторметил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (50 мг, 0,119 ммоль) с метил-3-бром-5-(трифторметил)бензоатом (41 мг, 0,143 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 8,4 мг, 0,012 ммоль), йодидом меди(I) (2,3 мг, 0,012 ммоль) и триэтиламином (0,020 мл, 0,143 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметил)бензоата (56 мг, 76%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,35 (s, 1H), 8,23 (s, 1H), 7,94 (s, 1H), 7,43-7,31 (m, 4Н), 6,89-6,88 (m, 1H), 6,73-6,70 (m, 1H), 4,83 (s, 2Н), 3,98 (s, 3Н), 2,18-2,14 (m, 1H), 1,33-1,28 (m, 2Н), 1,20-1,17 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (55 мг, 0,089 ммоль) с гидроксидом лития (3,7 мг, 0,089 ммоль) с получением указанного в заголовке соединения (50 мг, 93%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,40 (s, 1H), 8,29 (s, 1H), 7,99 (s, 1H), 7,52-7,32 (m, 4Н), 6,90-6,89 (m, 1H), 6,73-6,70 (m, 1H), 4,84 (s, 2Н), 2,18-2,14 (m, 1H), 1,32-1,28 (m, 2Н), 1,20-1,15 (m, 2Н).
<Пример 32> 3-((2-Хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этинилбензойная кислота (I-32)
Стадия 1. Получение метил-3-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этинилбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (11,2 мг, 0,027 ммоль) с метил-3-бром-5-((триметилсилил)этинил)бензоатом (7,6 мг, 0,032 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этинилбензоата (14,7 мг, 85%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,10 (t, 1H), 8,08 (t, 1H), 7,78 (t, 1H), 7,51-7,32 (m, 4 Н), 6,87 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,93 (s, 3Н), 2,24-2,10 (m, 1H), 1,30-1,26 (m, 2Н), 1,23-1,12 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этинилбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (14,7 мг, 0,023 ммоль) с гидроксидом лития (9,5 мг, 0,23 ммоль) с получением указанного в заголовке соединения (4,0 мг, 31%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,98 (br, 1H), 8,24-8,20 (m, 1H), 8,17-8,12(m, 1H), 7,87-7,85 (m, 1H), 7,44-7,39 (m, 3Н), 7,37-7,34 (m, 1H), 6,88 (d, 1H), 6,70 (dd, 1H), 4,83 (s, 2Н), 3,16 (s, 1H), 2,12-2,19 (m, 1H), 1,35-1,28 (m, 2Н), 1,22-1,14 (m, 2Н).
<Пример 33> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-цианобензойная кислота (I-33)
Стадия 1 Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-цианобензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-3-бром-5-цианобензоатом (129 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-цианобензоата (165 мг, 55%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,39 (s, 1H), 8,26 (s, 1H), 7,97 (s, 1H), 7,45-7,34 (m, 4Н), 6,91 (d, 1H), 6,75-6,72 (dd, 1H), 4,86 (s, 2Н), 4,00 (s, 3Н), 2,19-2,15 (m, 1H), 1,35-1,31 (m, 2Н), 1,22-1,17 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-цианобензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (165 мг, 0,28 ммоль) с гидроксидом лития (117 мг, 2,8 ммоль) с получением указанного в заголовке соединения (97 мг, 62%).
1Н-ЯМР (DMSO, 400МГц): δ 8,20 (s, 1H), 8,17 (s, 1H), 8,01 (s, 1H), 7,64-7,53 (m, 4Н), 7,11 (dd, 1H), 6,86-6,83 (dd, 1H), 4,99 (s, 2Н), 2,48 (m, 1H), 1,24-1,12 (m, 4Н).
<Пример 34> 3-((2,6-Дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (1-34)
Стадия 1. Получение трет-бутил(3,5-дихлор-4-йодфенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 1). Таким образом, проводили реакцию 3,5-дихлор-4-йодфенола (2 г, 6,92 ммоль) с трет-бутилдиметилсилилхлоридом (TBSCl, 1,56 г, 10,38 ммоль) и имидазолом (0,94 г, 13,84 ммоль) с получением промежуточного соединения трет-бутил(3,5-дихлор-4-йодфенокси)диметилсилана (2,45 г, 88%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,82 (s, 2Н), 0,96 (s, 9Н), 0,16 (s, 6Н).
Стадия 2. Получение трет-бутил (3,5-дихлор-4-((триметилсилил)этинил)фенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (2,45 г, 6,09 ммоль) с триметилсилилацетиленом (1,73 мл, 12,18 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 0,43 г, 0,61 ммоль), йодидом меди(I) (0,12 г, 0,61 ммоль) и триэтиламином (1,7 мл, 12,18 ммоль) с получением промежуточного соединения трет-бутил(3,5-дихлор-4-((триметилсилил)этинил)фенокси)диметилсилана (1,12 г, 52%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,82 (s, 2Н), 0,96 (s, 9Н), 0,25 (s, 9Н), 0,16 (s, 6Н).
Стадия 3. Получение 3,5-дихлор-4-((триметилсилил)этинил)фенола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 3). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (1,12 г, 3,17 ммоль) с фторидом калия (KF, 1,84 г, 31,7 ммоль) с получением промежуточного соединения 3,5-дихлор-4-((триметилсилил)этинил)фенола. Полученный остаток применяли на следующей стадии без какой-либо дополнительной очистки.
Стадия 4. Получение 5-циклопропил-4-((3,5-дихлор-4-этинилфенокси)метил)-3-(2,6-дихлорфенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию данного промежуточного соединения (стадия 3) (3,17 ммоль) с 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазолом (промежуточное соединение 1) (1,1 г, 3,17 ммоль) и карбонатом калия (0,66 г, 4,76 ммоль) с получением промежуточного соединения 5-циклопропил-4-((3,5-дихлор-4-этинилфенокси)метил)-3-(2,6-дихлорфенил)изоксазола (1,16 г, 81%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,41-7,30 (m, 3Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
Стадия 5. Получение метил-3-((2,6-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию данного промежуточного соединения (стадия 4) (200 мг, 0,48 ммоль) с метил-3-бромбензоатом (103 мг, 0,48 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 35 мг, 0,05 ммоль), йодидом меди(I) (10 мг, 0,05 ммоль) и триэтиламином (0,14 мл, 0,96 ммоль) с получением промежуточного соединения метил-3-((2,6-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (158 мг, 56%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,22-8,21 (m, 1H), 8,02-8,00 (m, 1H), 7,75-7,72 (m, 1H), 7,46-7,32 (m, 4Н), 6,81 (d, 2Н), 4,83 (s, 2Н), 3,94 (s, 3Н), 2,17-2,12 (m, 1H), 1,34-1,30 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 6. Получение 3-((2,6-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 5) (158 мг, 0,269 ммоль) с гидроксидом лития (112 мг, 2,70 ммоль) с получением указанного в заголовке соединения (150 мг, 97%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,08-8,07 (m, 1H), 7,89-7,88 (m, 1H), 7,45-7,28 (m, 5Н), 6,68-6,67 (m, 2Н), 4,75 (s, 2Н), 2,11-2,08 (m, 1H), 1,27-1,26 (m, 2Н), 1,15-1,13 (m, 2Н).
<Пример 35> 2-Хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-35)
Стадия 1. Получение метил-2-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (268 мг, 0,64 ммоль) с метил-3-бром-2-хлорбензоатом (173 мг, 0,58 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 81 мг, 0,12 ммоль), йодидом меди(I) (11 мг, 0,06 ммоль) и триэтиламином (0,4 мл, 2,9 ммоль) с получением промежуточного соединения метил-2-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (152 мг, 44%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,72-7,67 (m, 2Н), 7,46-7,40 (m, 3Н), 7,35-7,24 (m, 2Н), 6,88 (d, 1H), 6,71 (dd, 1H), 4,82 (s, 2Н), 3,94 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,14 (m, 2Н).
Стадия 2. Получение 2-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (152 мг, 0,26 ммоль) с гидроксидом лития (109 мг, 2,6 ммоль) с получением указанного в заголовке соединения (86 мг, 58%).
1Н-ЯМР (DMSO, 400МГц): δ 13,61 (s, 1H), 7,78 (t, 2Н), 7,64-7,53 (m, 4Н), 7,48 (t, 1H), 7,11 (d, 1H), 6,86 (dd, 1H), 4,99 (s, 2Н), 2,47 (m, 1H), 1,24-1,12 (m, 4Н).
<Пример 36> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойная кислота (I-36)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (60 мг, 0,143 ммоль) с метил-2-фтор-3-йодбензоатом (48 мг, 0,171 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 10,1 мг, 0,014 ммоль), йодидом меди(I) (2,8 мг, 0,014 ммоль) и триэтиламином (0,024 мл, 0,172 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензоата (76 мг, 93%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,99-7,98 (m, 1H), 7,71-7,30 (m, 4Н), 6,98-6,97 (m, 1H), 6,78-6,77 (m, 1H), 6,61-6,59 (m, 1H), 4,80 (s, 2Н), 3,93 (s, 3Н), 2,17-2,15 (m, 1H), 1,23-1,19 (m, 2H), 1,15-1,10 (m, 2H).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (76 мг, 0,133 ммоль) с гидроксидом лития (11,2 мг, 0,266 ммоль) с получением указанного в заголовке соединения (62 мг, 83%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,82-7,80 (m, 1H), 7,43-7,28 (m, 4Н), 6,94-6,93 (m, 1H), 6,77-6,76 (m, 1H), 6,59-6,57 (m, 1H), 4,76 (s, 2Н), 2,14-2,07 (m, 1H), 1,23-1,19 (m, 2Н), 1,15-1,10 (m, 2Н).
<Пример 37> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойная кислота (I-37)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (60 мг, 0,143 ммоль) с метил-2-фтор-5-йодбензоатом (48 мг, 0,171 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 10,1 мг, 0,014 ммоль), йодидом меди(I) (2,8 мг, 0,014 ммоль) и триэтиламином (0,024 мл, 0,172 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензоата (42 мг, 51%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,21-8,20 (m, 1H), 7,78-7,75 (m, 1H), 7,50-7,40 (m, 4Н), 7,20-7,15 (m, 1H), 7,00-6,98 (m, 1H), 6,84-6,81 (m, 1H), 5,14 (s, 2Н), 4,15 (s, 3Н), 2,23-2,21 (m, 1H), 1,45-1,41 (m, 2Н), 1,21-1,18 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (42 мг, 0,0735 ммоль) с гидроксидом лития (9,3 мг, 0,221 ммоль) с получением указанного в заголовке соединения (32 мг, 79%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,14-8,13 (m, 1H), 7,64-7,61 (m, 1H), 7,41-7,31 (m, 4Н), 7,12-7,07 (m, 1H), 6,85-6,84 (m, 1H), 6,68-6,66 (m, 1H), 4,81 (s, 2H), 2,17-2,10 (m, 1H), 1,31-1.27 (m, 2H), 1,19-1,14 (m, 2H).
<Пример 38> 3-((2-Хлор-4-((5-циклопропил-3-(2.,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-фторбензойная кислота (I-38)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-фторбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (50 мг, 0,119 ммоль) с метил-4-фтор-3-йодбензоатом (40 мг, 0,143 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 8,4 мг, 0,012 ммоль), йодидом меди(I) (2,3 мг, 0,012 ммоль) и триэтиламином (0,020 мл, 0,143 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-фторбензоата (54 мг, 66%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,20-8,19 (m, 1H), 7,79-7,76 (m, 1H), 7,52-7,41 (m, 4Н), 7,22-7,17 (m, 1H), 7,01-6,99 (m, 1H), 6,84-6,81 (m, 1H), 5,14 (s, 2Н), 4,16 (s, 3Н), 2,23-2,21 (m, 1H), 1,46-1,42 (m, 2Н), 1,22-1,19 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-фторбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (54 мг, 0,0946 ммоль) с гидроксидом лития (7,9 мг, 0,189 ммоль) с получением указанного в заголовке соединения (40 мг, 76%).
1H-ЯМР (CDCl3, 400МГц): δ 8,20-8,19 (m, 1H), 7,97-7,96 (m, 1H), 7,46-7,29 (m, 4Н), 7,04-7,02 (m, 1H), 6,84-6,83 (m, 1H), 6,66-6,64 (m, 1H), 4,80 (s, 2Н), 2,17-2,10 (m, 1H), 1,30-1,28 (m, 2Н), 1,18-1,13 (m, 2Н).
<Пример 39> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметокси)бензойная кислота (I-39)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этил)-5-(трифторметокси)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,23 ммоль) с метил-3-бром-5-(трифторметокси)бензоатом (68,8 мг, 0,23 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 16 мг, 0,023 ммоль), йодидом меди(I) (4,4 мг, 0,023 ммоль) и триэтиламином (0,1 мл, 0,71 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этил)-5-(трифторметокси)бензоата (67,0 мг, 50%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,12 (s, 1H), 8,11 (s, 1H), 7,73 (s, 1H), 7,54-7,31 (m, 4Н), 6,88 (d, 1H), 6,71 (dd, 1H), 4,83 (s, 2Н), 3,95 (s, 3Н), 2,19-2,12 (m, 1H), 1,37-1,29 (m, 2Н), 1,26-1,18 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметокси)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (67,0 мг, 0,10 ммоль) с LiOH (44,0 мг, 1,05 ммоль) с получением указанного в заголовке соединения (58 мг, 93%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,17 (s, 1H), 7,89 (s, 1H), 7,59 (s, 1H), 7,43-7,32 (m, 4Н), 6,88 (d, 1H), 6,72 (dd, 1H), 4,83 (s, 2Н), 2,19-2,12 (m, 1H), 1,32-1,27 (m, 2Н), 1,24-1,14 (m, 2Н).
<Пример 40> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метоксибензойная кислота (I-40)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метоксибензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 6) (150 мг, 0,35 ммоль) с метил-3-бром-5-метоксибензоатом (88 мг, 0,35 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 12,5 мг, 0,018 ммоль), йодидом меди(I) (3,4 мг, 0,018 ммоль) и триэтиламином (0,1 мл, 1,07 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этил)-5-метоксибензоата (24,0 мг, 12%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,80 (s, 1H), 7,79 (s, 1H), 7,54-7,52 (m, 2Н), 7,42-7,33 (m, 2Н), 7,23 (t, 1H), 6,87 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 4,0 (s, 3Н), 3,86 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,28 (m, 2H), 1,19-1,14 (m, 2H).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метоксибензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (24,0 мг, 0,04 ммоль) с LiOH (16,7 мг, 0,40 ммоль) с получением указанного в заголовке соединения (9 мг, 40%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,76 (s, 1H), 7,50 (s, 1H), 7,49-7,30 (m, 4Н), 7,27 (s, 1H), 7,17 (s, 1H), 6,81 (dd, 1H), 4,77 (s, 2Н), 3,81 (s, 3Н), 2,13-2,10 (m, 1H), 1,26-1,20 (m, 2Н), 1,14-1,10 (m, 2Н).
<Пример 41> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензойная кислота (I-41)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (3,2 г, 13 ммоль) с метил-3-бром-5-формилбензоатом (3,71 г, 16 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2 (420 мг, 0,65 моль), йодидом меди(I) (114 мг, 0,65 моль) и триэтиламином (2,2 мл, 16 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (4,1 г, 58%).
1Н-ЯМР (CDCl3, 400МГц): δ 10,06 (s, 1H), 8,46-8,40 (m, 2Н), 8,20-8,19 (m, 1H), 7,43-7,31 (m, 4Н), 6,89 (d, 1H), 6,71 (dd, 1H), 4,83 (s, 2Н), 3,98 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,25 (m, 2Н), 1,19-1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (100 мг, 0,172 ммоль) с гидроксидом лития (72,2 мг, 1,72 ммоль) с получением указанного в заголовке соединения (35 мг, 33%).
1Н-ЯМР (DMSO, 400МГц): δ 13,70 (s, 1H), 10,10 (s, 1H), 8,41(s, 1H), 8,26-8,23 (m, 2Н), 7,64-7,53 (m, 4Н), 7,11 (d, 1H), 6,86 (dd, 1H), 4,99 (s, 2Н), 2,66-2,32 (m, 1H), 1,20-1,14 (m, 4Н).
<Пример 42> 3-((2-Хлор-4-((5-циклопропил-3-(2.,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропиламино)метил)бензойная кислота (I-42)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропиламино)метил)бензоата
К раствору промежуточного соединения (стадия 1 примера 41) (150 мг, 0,258 ммоль) в 1,2-дихлорэтане (2 мл) добавляли циклопропиламин (0,042 мл, 0,60 ммоль) и уксусную кислоту (16 мг, 0,258 ммоль) и перемешивали в течение 12 часов при комнатной температуре. К раствору реакционной смеси добавляли цианоборгидрид натрия (49 мг, 0,775 ммоль) и перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь концентрировали в вакууме, добавляли дихлорметан и промывали солевым раствором. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропиламино)метил)бензоата (100 мг, 64%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,10 (s, 1H), 7,93 (s, 1H), 7,68 (s, 1H), 7,42-7,35 (m, 4Н), 6,87 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,92 (s, 3Н), 3,45-3,41 (m, 4Н), 2,25-2,12 (m, 4Н), 1,32-1,14 (m, 4Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропиламино)метил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (58 мг, 0,12 ммоль) с гидроксидом лития (40 мг, 0,96 ммоль) с получением указанного в заголовке соединения (62 мг, 82%).
1Н-ЯМР (DMSO, 400МГц): δ 12,50 (brs, 1H), 7,93 (s, 1H), 7,88 (s, 1H), 7,70 (s, 1H), 7,63-7,53 (m, 4Н), 7,09 (d, 1H), 6,83 (dd, 1H), 4,98 (s, 2Н), 3,82 (s, 2Н), 2,10-2,04 (m, 1H), 1,20-1,13 (m, 5Н), 0,38-0,30 (m, 4Н).
<Пример 43> 3-(Азетидин-1-илметил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-43)
Стадия 1. Получение метил-3-(азетидин-1-илметил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (150 мг, 0,258 ммоль) с азетидинциклопропиламином (40 мкл, 0,60 ммоль) и уксусной кислотой (16 мг, 0,258 ммоль), цианоборгидридом натрия (49 мг, 0,775 ммоль) с получением промежуточного соединения метил-3-(азетидин-1-илметил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (100 мг, 64%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,07 (s, 1H), 7,94 (s, 1H), 7,66 (s, 1H), 7,41-7,30 (m, 4Н), 6,87 (d, 1H), 6,69 (dd, 1H), 4,81 (s, 2Н), 3,92 (s, 3Н), 3,88 (s, 2Н), 2,17-2,11 (m, 2Н), 1,31-1,13 (m, 5Н), 0,47-0,39 (m, 4Н).
Стадия 2. Получение 3-(азетидин-1-илметил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (23 мг, 0,04 ммоль) с гидроксидом лития (15 мг, 0,36 ммоль) с получением указанного в заголовке соединения (11 мг, 49%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,64 (s, 1H), 8,25 (s, 1H), 7,47 (s, 1H), 7,41-7,31 (m, 4Н), 6,86 (d, 1H), 6,68 (dd, 1H), 4,81 (s, 2Н), 4,05 (s, 2Н), 3,95-3,90 (m, 2Н), 2,18-2,11 (m, 1H), 1,31-1,14 (m, 6Н).
<Пример 44> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((метиламино)метил)бензойная кислота (1-44)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((метиламино)метил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (150 мг, 0,258 ммоль) с метиламином (0,1 мл, 0,60 ммоль) и уксусной кислотой (16 мг, 0,258 ммоль), цианоборгидридом натрия (49 мг, 0,775 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((метиламино)метил)бензоата (100 мг, 64%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,19 (s, 1H), 7,99 (s, 1H), 7,69 (s, 1H), 7,41-7,31 (m, 4Н), 6,87 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 3,93 (s, 3Н), 3,66 (s, NH, 1H), 2,50 (s, 2Н), 2,17-2,13 (m, 1H), 2,04 (s, 3Н), 1,31-1,27 (m, 2Н), 1,23-1,13 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((метиламино)метил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (26 мг, 0,04 ммоль) с гидроксидом лития (18 мг, 0,43 ммоль) с получением указанного в заголовке соединения (8,5 мг, 32%).
1Н-ЯМР (DMSO, 400МГц): δ 8,18 (s, 1H), 7,93 (s, 1H), 7,67-7,52 (m, 5Н), 7,09 (d, 1H), 6,83 (dd, 1H), 4,98 (s, 2Н), 4,01 (s, 2Н), 1,25-1,11 (m, 5Н).
<Пример 45> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этиламино)метил)бензойная кислота (I-45)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этиламино)метил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (150 мг, 0,258 ммоль) с уксусной кислотой (16 мг, 0,258 ммоль), 6,0 М этиламином (0,1 мл, 0,60 ммоль) и цианоборгидридом натрия (49 мг, 0,775 ммоль) с получением промежуточного соединения 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этиламино)метил)бензоата (100 мг, 64%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,08 (s, 1H), 7,95 (s, 1H), 7,69 (s, 1H), 7,42-7,38 (m, 3Н), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,81 (s, 2Н), 3,92 (s, 3Н), 3,84 (s, 2Н), 2,70 (q, 2Н), 2,18-2,13 (m, 1H), 1,31-1,27 (m, 2Н), 1,20-1,12 (m, 5Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этиламино)метил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (100 мг, 0,164 ммоль) с гидроксидом лития (69 мг, 1,64 ммоль) с получением указанного в заголовке соединения (88 мг, 91%).
1Н-ЯМР (DMSO, 400МГц): δ 8,14 (s, 1H), 8,01 (s, 1H), 7,88 (s, 1H), 7,64-7,61 (m, 2Н), 7,57-7,53 (m, 2Н), 7,10 (d, 1H), 6,85 (dd, 1H), 4,98 (s, 2Н), 4,18 (s, 2Н), 2,97 (q, 2Н), 2,52-2,47 (m, 1H), 1,23-1,17 (m, 5Н), 1,59-1,32 (m, 2Н).
<Пример 46> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2,2,2-трифторэтил)амино)метил)бензойная кислота (I-46)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2,2,2-трифторэтил)амино)метил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (200 мг, 0,344 ммоль) с уксусной кислотой (21 мг, 0,344 ммоль), трифторэтиламином (51 мг, 0,516 ммоль) и цианоборгидридом натрия (65 мг, 1,03 ммоль) с получением промежуточного соединения 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2,2,2-трифторэтил)амино)метил)бензоата (176 мг, 77%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,08 (s, 1H), 7,94 (s, 1H), 7,68 (s, 1H), 7,43-7,38 (m, 3Н), 7,33-7,29 (m, 1H), 6,86 (d, 1H), 6,69 (dd, 1H), 4,81 (s, 3Н), 3,96-3,93 (m, 5Н), 3,22 (q, 2Н), 2,18-2,12 (m, 1H), 1,29-1,22 (m, 2Н), 1,19-1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2,2,2-трифторэтил)амино)метил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (176 мг, 0,254 ммоль) с гидроксидом лития (54 мг, 1,28 ммоль) с получением указанного в заголовке соединения (130 мг, 78%).
1H-ЯМР (CDCl3, 400МГц): δ 7,83-7,74 (m, 2Н), 7,37-7,33 (m, 3Н), 7,27-7,23 (m, 2Н), 7,15-7,13 (m, 1H), 6,74 (d, 1H), 6,55 (dd, 1H), 4,72 (s, 2Н), 4,14 (q, 2Н), 3,59 (s, 2Н), 2,11-2,02 (m, 1H), 1,20-1,11 (m, 2Н), 0,90-0,85 (m, 2Н).
<Пример 47> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4- ил)метокси)фенил)этинил)-5-((изопропиламино)метил)бензойная кислота (I-47)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((изопропиламино)метил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (200 мг, 0,344 ммоль) с уксусной кислотой (21 мг, 0,344 ммоль), изопропиламином (31 мг, 0,516 ммоль) и цианоборгидридом натрия (65 мг, 1,03 ммоль) с получением промежуточного соединения 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((изопропиламино)метил)бензоата (95 мг, 44%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,07 (s, 1H), 7,95 (s, 1H), 7,69 (s, 1H), 7,42-7,39 (m, 3Н), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,92 (s, 3Н), 3,82 (s, 2Н), 2,88-2,82 (m, 1H), 2,17-2,12 (m, 1H), 1,32-1,27 (m, 2Н), 1,25-1,24 (m, 2Н), 1,16(d, 6Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((изопропиламино)метил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (95 мг, 0,144 ммоль) с гидроксидом лития (61 мг, 1,44 ммоль) с получением указанного в заголовке соединения (71 мг, 81%).
1Н-ЯМР (DMSO, 400МГц): δ 9,04 (s, 1H), 8,17 (s, 1H), 8,03 (s, 1H), 7,99 (s, 1H), 7,64-7,62 (m, 2Н), 7,57-7,53 (m, 2Н), 7,11 (d, 1H), 6,86 (dd, 1H), 4,99 (s, 2Н), 4,24 (s, 2Н), 3,30-3,25 (m, 1H), 2,50-2,47 (m, 1H), 1,31 (d, 6Н), 1,20-1,12 (m, 4Н).
<Пример 48> 3-((трет-Бутиламино)метил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-48)
Стадия 1. Получение метил-3-((трет-бутиламино)метил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (200 мг, 0,344 ммоль) с уксусной кислотой (21 мг, 0,344 ммоль), трет-бутиламином (38 мг, 0,516 ммоль) и цианоборгидридом натрия (65 мг, 1,03 ммоль) с получением промежуточного соединения метил-3-((трет-бутиламино)метил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (45 мг, 21%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,05(s, 1H), 7,96(s, 1H), 7,71 (s, 1H), 7,41-7,38 (m, 3Н), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,81 (s, 2Н), 4,32 (s, 1H), 3,94 (s, 3Н), 3,76 (s, 2Н), 2,18-2,12 (m, 1H), 1,38-1,31 (m, 2Н), 1,27-1,14 (m, 2Н).
Стадия 2. Получение 3-((трет-бутиламино)метил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (45 мг, 0,070 ммоль) с гидроксидом лития (30 мг, 0,70 ммоль) с получением указанного в заголовке соединения (45 мг, 83%).
1Н-ЯМР (DMSO, 400МГц): δ 13,45 (s, 1H), 9,03 (s, 1H), 8,19 (s, 1H), 8,04 (s, 1H), 8,01 (s, 1H), 7,64-7,62 (m, 2Н), 7,58-7,53 (m, 2Н), 7,11 (d, 1H), 6,86 (dd, 1H), 4,99 (s, 2Н), 4,22 (s, 2Н), 3,30-3,25 (m, 1H), 2,50-2,46 (m, 1H), 1,38 (s, 9Н), 1,20-1,12 (m, 4Н).
<Пример 49> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((диметиламино)метил)бензойная кислота (I-49)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((диметиламино)метил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (200 мг, 0,344 ммоль) с уксусной кислотой (21 мг, 0,344 ммоль), диметиламином (34 мкл, 0,516 ммоль) и цианоборгидридом натрия (65 мг, 1,03 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((диметиламино)метил)бензоата (65 мг, 34%).
1H-ЯМР (CDCl3, 400МГц): δ 8,13 (s, 1H), 7,95 (s, 1H), 7,72 (s, 1H), 7,41-7,31 (m, 4Н), 6,86 (d, 1H), 6,68 (dd, 1H), 4,81 (s, 2Н), 3,92 (s, 3Н), 3,63 (s, 2Н), 2,38 (s, 6Н), 2,18-2,12 (m, 1H), 1,31-1,25 (m, 2Н), 1,17-1,12 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((диметиламино)метил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (65 мг, 0,04 ммоль) с гидроксидом лития (40 мг, 0,40 ммоль) с получением указанного в заголовке соединения (9,7 мг, 40%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,71 (s, 1H), 8,23 (s, 1H), 7,48 (s, 1H), 7,41-7,31 (m, 4Н), 6,86 (d, 1H), 6,68 (dd, 1H), 4,81 (s, 2Н), 3,69 (s, 2Н), 2,69 (s, 6Н), 2,18-2,11 (m, 1H), 1,31-1,27 (m, 2Н), 1,19-1,14 (m, 2Н).
<Пример 50> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(морфолинометил)бензойная кислота (I-50)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(морфолинометил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 41 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (200 мг, 0,344 ммоль) с уксусной кислотой (21 мг, 0,344 ммоль), морфолином (45 мг, 0,516 ммоль) и цианоборгидридом натрия (65 мг, 1,03 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(морфолинометил)бензоата (99 мг, 44%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,09 (s, 1H), 7,95 (s, 1H), 7,69 (s, 1H), 7,42-7,39 (m, 3Н), 7,35-7,31 (m, 1H), 6,88 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 3,93 (s, 3Н), 3,72-3,70 (m, 4Н), 3,52 (s, 2Н), 2,45-2,44 (m, 4Н), 2,17-2,13 (m, 1H), 1,32-1,24 (m, 2Н), 1,19-1,14 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(морфолинометил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (99 мг, 0,151 ммоль) с гидроксидом лития (63 мг, 1,51 ммоль) с получением указанного в заголовке соединения (85 мг, 96%).
1Н-ЯМР (DMSO, 400МГц): δ 7,96-7,76 (m, 3Н), 7,64-7,62 (m, 2Н), 7,57-7,53 (m, 2Н), 7,10 (d, 1H), 6,85 (dd, 1H), 4,99 (s, 2Н), 3,78 (s, 2Н), 3,30-3,25 (m, 4Н), 2,50-2,46 (m, 5Н), 1,27-1,11 (m, 4Н).
<Пример 51> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((оксетан-3-иламино)метил)бензойная кислота (I-51)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((оксетан-3-иламино)метил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 42 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензоата (стадия 1 примера 41) (200 мг, 0,344 ммоль) с уксусной кислотой (21 мг, 0,344 ммоль), оксетан-3-иламином (38 мг, 0,516 ммоль) и цианоборгидридом натрия (65 мг, 1,03 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((оксетан-3-иламино)метил)бензоата (98 мг, 45%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,08 (s, 1H), 7,92 (s, 1H), 7,66 (s, 1H), 7,41-7,29 (m, 4Н), 6,88 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 4,78 (t, 2Н), 4,42 (t, 2Н), 4,03-3,99 (m, 1H), 3,92 (s, 3Н), 3,77 (s, 2Н), 2,19-2,11 (m, 1H), 1,29-1,23 (m, 2Н), 1,17-1,13 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((оксетан-3-иламино)метил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (98 мг, 0,154 ммоль) с гидроксидом лития (64 мг, 1,54 ммоль) с получением указанного в заголовке соединения (40 мг, 46%).
1Н-ЯМР (DMSO, 400МГц): δ 7,91-7,89 (m, 2Н), 7,66 (s, 1H), 7,59-7,56 (m, 2Н), 7,53-7,49 (m, 2Н), 6,98 (d, 1H), 6,80 (dd, 1H), 4,94 (s, 2Н), 4,60 (t, 2Н), 4,37 (t, 2Н), 4,01-3,97 (m, 1H), 3,77 (s, 2Н), 2,42-2,38 (m, 1H), 1,21-1,17 (m, 2Н), 1,10-1,07 (m, 2Н).
<Пример 52> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метиламино)бензойная кислота (I-52)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-3-бром-5-(метиламино)бензоатом (63 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метиламино)бензоата (70 мг, 48%).
1Н-ЯМР (DMSO, 400МГц): δ 7,52-7,39 (m, 4Н), 7,34 (t, 1H), 7,21-7,20 (dd, 1H), 6,91-6,88 (m, 2Н), 6,76-6,73 (dd, 1H), 4,39 (s, 2Н), 3,88 (s, 3Н), 2,79 (s, 3Н), 2,34 (m, 1H), 1,28-1,20 (m, 4Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (70 мг, 0,13 ммоль) с гидроксидом лития (54,5 мг, 1,3 ммоль) с получением указанного в заголовке соединения (36,8 мг, 53%).
1Н-ЯМР (DMSO, 400МГц): δ 7,64 (d, 1H), 7,62 (d, 1H), 7,57-7,52 (m, 2Н), 7,21 (m, 1Н), 7,14 (t, 1H), 7,08 (d, 1H), 6,83 (d, 1H), 6,80 (m, 1H), 6,13 (br, 1H), 4,98 (s, 2Н), 2,71 (d, 3Н), 2,47 (m, 1H), 1,23-1,12 (m, 4Н).
<Пример 53> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(этиламино)бензойная кислота (I-53)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(этиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-3-бром-5-(этиламино)бензоатом (67 мг, 0,26 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,2 мл, 1,3 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(этиламино)бензоата (70 мг, 48%).
1Н-ЯМР (DMSO, 400МГц): δ 7,52-7,39 (m, 4Н), 7,34 (t, 1H), 7,21-7,20 (dd, 1H), 6,91-6,88 (m, 2Н), 6,76-6,73 (dd, 1H), 4,39 (s, 2Н), 3,88 (s, 3Н), 3,03 (m, 2Н), 2,79 (s, 3Н), 2,34 (m, 1H), 1,28-1,20 (m, 4Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(этиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (70 мг, 0,13 ммоль) с гидроксидом лития (54,5 мг, 1,3 ммоль) с получением указанного в заголовке соединения (37,7 мг, 53%).
1Н-ЯМР (DMSO, 400МГц): δ 7,64 (d, 1H), 7,62 (d, 1H), 7,57-7,52 (m, 2Н), 7,21 (, 1H), 7,14 (t, 1H), 7,08 (d, 1H), 6,83 (d, 1H), 6,80 (m, 1H), 6,13 (br, 1H), 4,98 (s, 2Н), 2,71 (d, 3Н), 2,52 (m, 2Н), 2,47 (m, 1H), 1,23-1,12 (m, 4Н).
<Пример 54> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(изопропиламино)бензойная кислота (I-54)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(изопропиламино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (50 мг, 0,119 ммоль) с метил-3-йод-5-(изопропиламино)бензоатом (46 мг, 0,143 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 8,4 мг, 0,012 ммоль), йодидом меди(I) (2,3 мг, 0,012 ммоль) и триэтиламином (0,020 мл, 0,143 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(изопропиламино)бензоата (23 мг, 34%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,99-7,98 (m, 1H), 7,71-7,67 (m, 1H), 7,43-7,32 (m, 5Н), 6,88-6,87 (m, 1H), 6,71-6,69 (m, 1H), 4,83 (s, 2Н), 3,94 (s, 3Н), 2,17-2,15 (m, 1H), 1,33-1,28 (m, 2Н), 1,19-1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(изопропиламино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (23 мг, 0,040 ммоль) с гидроксидом лития (17 мг, 0,40 ммоль) с получением указанного в заголовке соединения (13 мг, 56%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,05-8,04 (m, 1H), 7,76-7,73 (m, 1H), 7,47-7,43 (m, 4Н), 7,36-7,32 (m, 1H), 6,89-6,88 (m, 1H), 6,72-6,69 (m, 1H), 4,83 (s, 2H), 2,18-2,14 (m, 1H), 1,33-1,30 (m, 2H), 1,17-1,15 (m, 2H).
<Пример 55> 3-(Азетидин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-55)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензоата
К раствору метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (стадия 2 примера 8) (300 мг, 0,528 ммоль) в толуоле (5 мл) добавляли трет-бутилнитрит (0,126 мл, 1,05 ммоль) и йод (536 мг, 2,11 ммоль) и перемешивали в течение 1 часа при 55°С. Реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензоата (108 мг, 44%).
1Н-ЯМР (CDCl3, 400МГц): δ 8,20 (t, 1H), 7,99 (dt, 1H), 7,70 (dt, 1H), 7,46-7,22 (m, 4Н), 6,88 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,94 (s, 3Н), 2,19-2,12 (m, 1H), 1,33-1,24 (m, 2Н), 1,23-1,14 (m, 2Н).
Стадия 2. Получение метил-3-(азетидин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
К раствору промежуточного соединения (стадия 1) (44 мг, 0,065 ммоль) в диметилсульфоксиде (1 мл) добавляли азетидин (12 мг, 0,13 ммоль), L-пролин (2,2 мг, 0,019 ммоль), карбонат цезия (36 мг, 0,11 ммоль) и йодид меди(I) (1,6 мг, 0,01 ммоль) и перемешивали в течение 1 дня при 80°С Реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения метил-3-(азетидин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (14 мг, 36%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,55 (d, 1H), 7,42-7,31 (m, 4Н), 7,05-7,04 (m, 1H), 6,87-6,86 (m, 1H), 6,72-6,67 (m, 2Н), 4,82 (s, 2Н), 3,97-3,90 (m, 7Н), 2,43-2,38 (m, 2Н), 2,18-2,13 (m, 1H), 1,32-1,29 (m, 2Н), 1,19-1,16 (m, 2Н).
Стадия 3. Получение 3-(азетидин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (14 мг, 0,023 ммоль) с гидроксидом лития (10 мг, 0,23 ммоль) с получением указанного в заголовке соединения (14 мг, 99%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,60 (m, 1H), 7,41-7,31 (m, 4Н), 7,07 (m, 1H), 6,87-6,86 (m, 1H), 6,68-6,66 (m, 2Н), 4,81 (s, 2Н), 3,94-3,90 (m, 4Н), 2,40-2,37 (m, 2Н), 2,16-2,14 (m, 1H), 1,30-1,27 (m, 2Н), 1,18-1,14(m, 2Н).
<Пример 56> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пирролидин-1-ил)бензойная кислота (I-56)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(пирролидин-1-ил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 55 (стадия 2). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензоата (стадия 1 примера 55) (44 мг, 0,065 ммоль) с пирролидином (15 мг, 0,13 ммоль), L-пролином (2,2 мг, 0,019 ммоль), карбонатом цезия (36 мг, 0,11 ммоль) и йодидом меди(I) (1,6 мг, 0,01 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(пирролидин-1-ил)бензоата (14 мг, 36%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,48 (d, 1H), 7,43-7,40 (m, 3Н), 7,36-7,32 (m, 1H), 7,19-7,18 (m, 1H), 6,88-6,84 (m, 2Н), 6,70-6,67 (m, 1H), 4,82 (s, 2Н), 3,91 (s, 3Н), 3,33 (t, 4Н), 2,17-2,15 (m, 1H), 2,03-2,01 (m, 4Н), 1,32-1,28 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пирролидин-1-ил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (14 мг, 0,031 ммоль) с гидроксидом лития (13 мг, 0,31 ммоль) с получением указанного в заголовке соединения (11 мг, 62%).
1H-ЯМР (CDCl3, 400МГц): δ 7,55-7,32 (m, 5Н), 7,24-7,23 (m, 1H), 6,90-6,87 (m, 2Н), 6,70-6,67 (m, 1H), 4,82 (s, 2Н), 3,35 (t, 4Н), 2,18-2,13 (m, 1H), 2,14-2,02 (m, 4Н), 1,31-1,28 (m, 2Н), 1,19-1,15 (m, 2Н).
<Пример 57> 3-(Азетидин-3-иламино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты гидрохлорид (I-57)
Стадия 1. Получение трет-бутил-3-((3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)фенил)амино)азетидин-1-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (300 мг, 0,72 ммоль) с трет-бутил-3-((3-бром-5-(метоксикарбонил)фенил)амино)азетидин-1-карбоксилатом (277,38 мг, 0,72 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 49 мг, 0,07 ммоль), йодидом меди(I) (13 мг, 0,07 ммоль) и триэтиламином (0,12 мл, 0,86 ммоль) с получением промежуточного соединения трет-бутил-3-((3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)фенил)амино)азетидин-1-карбоксилата (370 мг, 71%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,60 (s, 1Н), 7,41-7,32 (m, 4Н), 7,21 (s, 1H), 6,90 (s, 1H), 6,81 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 4,36-4,32 (m, 2Н), 4,19-4,11 (m, 2Н), 3,90 (s, 3Н), 3,73 (dd, 1H), 2,16-2,05 (m, 1H), 1,48 (s, 9Н), 1,42-1,24 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 3-((1-(трет-бутоксикарбонил)азетидин-3-ил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (35 мг, 0,048 ммоль) с гидроксидом лития (17 мг, 0,48 ммоль) с получением промежуточного соединения 3-((1-(трет-бутоксикарбонил)азетидин-3-ил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты (29 мг, 85%).
1Н-ЯМР (CDCl3, 400МГц): 5 7,66 (s, 1H), 7,43-7,39 (m, 3Н), 7,35-7,33 (m, 1H), 7,19 (s, 1H), 6,87 (d, 2Н), 6,70 (dd, 1H), 4,82 (s, 2Н), 4,37-4,33 (m, 2Н), 4,28-4,26 (m, 1H), 3,78-3,74 (m, 2Н), 2,19-2,17 (m, 1H), 1,49 (s, 9Н), 1,30-1,28 (m, 2Н), 1,26-1,20 (m, 2Н).
Стадия 3. Получение 3-(азетидин-3-иламино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное промежуточное соединение (стадия 2) (29 мг, 0,041 ммоль) растворяли в дихлорметане. После перемешивания при комнатной температуре в течение 3 ч. добавляли 5~6 н. раствор HCl (41 мкл, 0,20 ммоль) при 0°С. К реакционной смеси добавляли этилацетат и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали и перекристаллизовывали с получением указанного в заголовке соединения (10 мг, 38%).
1Н-ЯМР (DMSO, 400МГц): δ 8,93 (br s, 2Н), 7,64 (d, 2Н), 7,62-7,52 (m, 2Н), 7,31 (s, 1H), 7,15 (d, 1H), 7,09 (d, 1H), 6,85-6,81 (m, 2Н), 4,98 (s, 2Н), 4,48-4,44 (m, 1H), 4,29-4,27 (m, 2Н), 3,87-3,78 (m, 2Н), 1,23-1,19 (m, 2Н), 1,17-1,14 (m, 2Н).
<Пример 58> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперидин-4-иламино)бензойной кислоты гидрохлорид (I-58)
Стадия 1. Получение трет-бутил-4-((3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)фенил)амино)пиперидин-1-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (300 мг, 0,72 ммоль) с трет-бутил-4-((3-бром-5-(метоксикарбонил)фенил)амино)пиперидин-1-карбоксилатом (298 мг, 0,72 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 49 мг, 0,07 ммоль), йодидом меди(I) (13 мг, 0,07 ммоль) и триэтиламином (0,12 мл, 0,86 ммоль) с получением промежуточного соединения трет-бутил-4-((3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)фенил)амино)пиперидин-1-карбоксилата (340 мг, 63%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,52 (s, 1H), 7,41-7,31 (m, 3Н), 7,26 (s, 1H), 7,21 (s, 1H), 6,89-6,86 (m, 2Н), 6,67 (dd, 1H), 4,81 (s, 2Н), 4,14-4,09 (m, 2Н), 3,90 (s, 3Н), 3,79-3,68 (m, 2Н), 2,98-2,88 (m, 2Н), 2,46-2,44 (m, 1H), 2,21-2,10 (m, 1H), 2,18-2,00 (m, 2Н), 1,48 (s, 9Н), 1,38-1,33 (m, 2Н), 1,29-1,18 (m, 2Н).
Стадия 2. Получение 3-((1-(трет-бутоксикарбонил)пиперидин-4-ил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (49,4 мг, 0,07 ммоль) с гидроксидом лития (27,6 мг, 0,7 ммоль) с получением 3-((1-(трет-бутоксикарбонил)пиперидин-4-ил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты (18 мг, 35%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,72 (s, 2Н), 7,58-7,29 (m, 4Н), 6,93 (s, 1H), 6,87 (s, 1H), 6,68 (dd, 1H), 4,82 (s, 2Н), 4,20-4,00 (m, 2Н), 3,58-3,46 (m, 1H), 3,09-2,98 (m, 2Н), 2,28-2,17 (m, 2Н), 1,47 (s, 9Н), 1,35-1,30 (m, 2Н), 1,29-1,26 (m, 2Н).
Стадия 3. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперидин-4-иламино)бензойной кислоты
Данное промежуточное соединение (стадия 2) (18 мг, 0,024 ммоль) растворяли в дихлорметане. После перемешивания при комнатной температуре в течение 3 ч. добавляли 5~6 н. раствор HCl (12 мкл, 0,048 ммоль) при 0°С. К реакционной смеси добавляли этилацетат_и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали и перекристаллизовывали с получением указанного в заголовке соединения (7 мг, 44%).
1Н-ЯМР (MeOD, 400МГц): δ 7,66-7,50 (m, 3Н), 7,48-7,43 (m, 3Н), 7,14 (s, 1H), 6,94 (s, 1H), 6,78 (dd, 1H), 4,98 (s, 2Н), 3,82-3,70 (m, 2Н), 3,53-3,41 (m, 2Н), 3,33-3,12 (m, 2Н), 2,38-2,22 (m, 2Н), 1,90-1,80 (m, 2Н), 1,25-1,22 (m, 2Н).
<Пример 59> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-ил)бензойной кислоты гидрохлорид (I-59)
Стадия 1. Получение трет-бутил-4-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)фенил)пиперазин-1-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с трет-бутил-4-(3-бром-5-(метоксикарбонил)фенил)пиперазин-1-карбоксилатом (70 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения трет-бутил-4-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)фенил)пиперазин-1-карбоксилата (114 мг, 65%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,71 (s, 1H), 7,57 (s, 1H), 7,44-7,41 (m, 3Н), 7,38-7,34 (m, 1H), 7,24 (d, 1H), 6,90-6,89 (d, 1H), 6,72-6,70 (dd, 1H), 4,84 (s, 2Н), 6,94 (s, 3Н), 3,62-3,60 (t, 4Н), 3,23 (s, 4Н), 2,20-2,15 (m, 1H), 1,51 (s, 9Н), 1,34-1,26 (m, 2Н), 1,21-1,18 (m, 2Н).
Стадия 2. Получение 3-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (114 мг, 0,15 ммоль) с гидроксидом лития (63 мг, 1,5 ммоль) с получением промежуточного соединения 3-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты (108 мг, 98%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,68 (s, 1Н),7,53-7,52 (m, 1H), 7,35-7,32 (m, 3Н), 7,28-7,24 (m, 1H), 6,81-6,80 (d, 1H), 6,64-6,61 (dd, 1H), 4,75 (s, 2Н), 3,54-3,52 (t, 4Н), 3,15 (s, 4Н), 2,10-2,05 (m, 1H), 1,42 (s, 9Н), 1,25-1,21 (m, 2Н), 1,11-1,09 (m, 2Н).
Стадия 3. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-ил)бензойной кислоты гидрохлорида
Данное соединение получали с применением процедуры, описанной для примера 57 (стадия 3). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (108 мг, 0,14 ммоль) с 6 М раствором хлористоводородной кислоты с получением указанного в заголовке соединения (59 мг, 64%).
1H-ЯМР (MeOD, 400МГц): 7,70-7,67 (m, 2Н), 7,55-7,44 (m, 4Н), 7,39-7,38 (m, 1H), 6,95-6,94 (d, 1H), 6,80-6,77 (dd, 1H), 4,91 (s, 3Н), 3,53-3,50 (m, 4Н), 3,42-3,40 (m, 4Н), 2,40-2,35 (m, 1H), 1,25-1,21 (m, 4Н).
<Пример 60> 3-Амино-5-((2-хлор-4-(15-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метилбензойная кислота (I-60)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метил-5-нитробензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-3-бром-4-метил-5-нитробензоатом (78,6 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метил-5-нитробензоата (88 мг, 60%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,65 (d, 1H), 7,42-7,40 (m, 3Н), 7,35-7,31 (m, 2Н), 6,88 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,89 (s, 3Н), 2,42 (s, 3Н), 2,18-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метилбензоата
Данное соединение получали с применением процедуры, описанной для примера 8 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (88 мг, 0,14 ммоль) с дигидратом хлорида олова(II) (315 мг, 1,4 ммоль) с получением промежуточного соединения метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метилбензоата (50 мг, 61%).
1Н-ЯМР (CDCl3, 400МГц): δ 7,65 (d, 1H), 7,42-7,40 (m, 3Н), 7,35-7,31 (m, 2Н), 6,88 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,89 (s, 3Н), 3,78 (s, 2Н), 2,42 (s, 3Н), 2,18-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 3. Получение 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метилбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (50 мг, 0,08 ммоль) с гидроксидом лития (36 мг, 0,8 ммоль) с получением указанного в заголовке соединения (53 мг, 108%).
1Н-ЯМР (DMSO, 400МГц): δ 12,65 (s, 1H), 7,64 (d, 1H), 7,62 (s, 1H), 7,57-7,53 (m, 2Н), 7,27 (s, 2Н), 7,08 (d, 1H), 6,82 (dd, 1H), 5,34 (s, 2Н), 4,98(s, 2Н), 2,47 (m, 1H), 2,29 (s, 3Н), 1,23-1,19 (m, 2Н), 1,17-1,13 (m, 2Н).
<Пример 61> 3-Амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метоксибензойная кислота (I-61)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метокси-5-нитробензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,26 ммоль) с метил-3-бром-4-метокси-5-нитробензоатом (72 мг, 0,26 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и N,N-диизопропилэтиламином (0,52 мл, 2,98 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метокси-5-нитробензоата (102,8 мг, 63%).
1Н-ЯМР (DMSO, 400 МГц): δ 12,60 (s, 1H), 8,26 (d, 1H), 7,97 (d, 1H), 7,89 (t, 1H), 7,83 (t, 1H), 7,50-7,44 (m, 1H), 7,40 (d, 1H), 7,21 (t, 1H), 4,37 (s, 2Н), 3,79-3,67 (m, 1H), 3,59-3,33 (m, 3Н), 3,29-3,06 (m, 3Н).
Стадия 2. Получение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метоксибензоата
Данное соединение получали с применением процедуры, описанной для примера 8 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (102,8 мг, 0,164 ммоль) с дигидратом хлорида олова(II) (369 мг, 1,64 ммоль) с получением промежуточного соединения метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метоксибензоата (80 мг, 51%).
1Н-ЯМР (DMSO, 400 МГц): δ 12,60 (s, 1H), 8,26 (d, 1H), 7,97 (d, 1H), 7,89 (t, 1H), 7,83 (t, 1H), 7,50-7,44 (m, 1H), 7,40 (d, 1H), 7,21 (t, 1H), 4,37 (s, 2Н), 3,79-3,67 (m, 1H), 3,59-3,33 (m, 3Н), 3,29-3,06 (m, 3Н).
Стадия 3. Получение 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метоксибензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (80 мг, 0,14 ммоль) с гидроксидом лития (58,7 мг, 1,4 ммоль) с получением указанного в заголовке соединения (42 мг, 55%).
1H-ЯМР (MeOD, 400 МГц): δ 7,54 (s, 1H), 7,43-7,51 (m, 4Н), 6,94 (d, 1H), 6,79 (dd, 1H), 4,97 (s, 2Н), 4,05 (s, 3Н), 2,32-2,42 (m, 1H), 1,27-1,37 (m, 2Н), 0,88-0,96 (m, 2Н).
<Пример 62> 3-Амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метоксибензойная кислота (I-62)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метокси-3-нитробензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (140 мг, 0,33 ммоль) с метил-5-бром-2-метокси-3-нитробензоатом (96,9 мг, 0,33 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 34,7 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и N,N-диизопропилэтиламином (69 мкл, 0,4 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метокси-3-нитробензоата (126,5 мг, 61,1%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,13 (s, 1H), 8,02 (s, 1H), 7,43-7,33 (m, 4Н), 6,88 (d, 1H), 6,67-6,65 (m, 1H), 4,83 (s, 2Н), 4,01 (s, 3Н), 3,97 (s, 3Н), 2,18-2,13 (m, 1H), 1,33-1,26 (m, 2Н), 1,20-1,15 (m, 2Н).
Стадия 2. Получение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метоксибензоата
Данное соединение получали с применением процедуры, описанной для примера 8 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (126,5 мг, 0,2 ммоль) с дигидратом хлорида олова(II) (225,63 мг, 1,0 ммоль) с получением промежуточного соединения метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метоксибензоата (51 мг, 43%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,39-7,33 (m, 5Н), 7,05 (s, 1H), 6,86 (s, 1H), 6,68 (dd, 1H), 4,80 (s, 2Н), 3,86 (s, 3Н), 3,84 (s, 3Н), 2,15-2,05 (m, 1H), 1,29-1,24 (m, 2Н), 1,16-1,11 (m, 2Н).
Стадия 3. Получение 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метоксибензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (51 мг, 0,09 ммоль) с гидроксидом лития (36 мг, 0,9 ммоль) с получением указанного в заголовке соединения (37,3 мг, 71%).
1Н-ЯМР (MeOD, 400 МГц): δ 7,55-7,50 (m, 2Н), 7,48-7,46 (m, 1H), 7,41 (d, 1H), 7,21 (d, 1H), 7,08 (d, 1H), 6,92 (d, 1H), 6,76 (dd, 1H), 4,95 (s, 2Н), 4,13 (s, 3Н), 2,38-2,34 (m, 1H), 1,30-1,22 (m, 4Н).
<Пример 63> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метилбензойная кислота (I-63)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метилбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-3-бром-5-метилбензоатом (65,5 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метилбензоата (87 мг, 31%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,00 (s, 1H), 7,82 (s, 1H), 7,53 (s, 1H), 7,42-7,35 (m, 3Н), 7,33-7,26 (m, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,92 (s, 3Н), 2,40 (s, 3Н), 2,22-2,11 (m, 1H), 1,32-1,29 (m, 2Н), 1,21-1,15 (m, 2Н).
Стадия 2. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метилбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (87 мг, 0,153 ммоль) с гидроксидом лития (64,3 мг, 1,53 ммоль) с получением указанного в заголовке соединения (28,8 мг, 34%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,43 (br, 1H), 7,81 (d, 1H), 7,65-7,63 (m, 1H), 7,59 (br, 1H), 7,58-7,54 (m, 1H), 7,10 (d, 1H), 6,84 (dd, 1H), 4,99 (s, 2Н), 2,39 (s, 3Н), 1,21-1,11 (m, 5Н).
<Пример 64> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-циклопропилбензойная кислота (I-64)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-циклопропилбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (77,3 мг, 0,18 ммоль) с метил-3-циклопропил-5-йодбензоатом (55,8 мг, 0,18 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 23 мг, 0,02 ммоль), йодидом меди(1) (4 мг, 0,02 ммоль) и N,N-диизопропилэтиламином (38 мкл, 0,22 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-циклопропилбензоата (45,9 мг, 43%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,97 (t, 1H), 7,69 (t, 1H), 7,43-7,38 (m, 4Н), 7,36-7,31 (m, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,80 (s, 2Н), 3,92 (s, 3Н), 2,24-2,12 (m, 1H), 1,98-1,90 (m, 1H), 1,33-1,28 (m, 2Н), 1,20-1,14 (m, 2Н), 1,05-0,99 (m, 2Н), 0,79-0,73 (m, 2Н).
Стадия 2. Получение 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метоксибензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (45,9 мг, 0,077 ммоль) с гидроксидом лития (32,5 мг, 0,77 ммоль) с получением указанного в заголовке соединения (22,8 мг, 51%).
1Н-ЯМР (DMSO, 400 МГц): δ 7,77 (d, 1H), 7,66-7,60 (m, 3Н), 7,59-7,52 (m, 2Н), 7,44 (s, 1H), 7,08 (d, 1H), 6,83 (dd, 1H), 4,98 (s, 2Н), 2,57-2,53 (m, 1H), 2,10-2,01 (m, 1H), 1,24-1,18 (m, 2Н), 1,16-1,09 (m, 2Н).
<Пример 65> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этилбензойная кислота (I-65)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этилбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (84,7 мг, 0,2 ммоль) с метил-3-этил-5-йодбензоатом (58,7 мг, 0,2 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 23,1 мг, 0,02 ммоль), йодидом меди(I) (3,8 мг, 0,02 ммоль) и N,N-диизопропилэтиламином (41,8 мкл, 0,24 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этилбензоата (78,2 мг, 67%).
1H-ЯМР (CDCl3, 400 МГц): δ 8,01 (t, 1H), 7,84 (t, 1H), 7,54 (t, 1H), 7,43-7,41 (m, 1H), 7,39 (d, 2H), 7,36-7,32 (m, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,81 (s, 2H), 3,92 (s, 3Н), 2,69 (q, 2H), 2,19-2,11 (m, 1H), 1,32-1,22 (m, 5H), 1,20-1,14 (m, 2H).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этилбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (78,2 мг, 0,13 ммоль) с гидроксидом лития (56,5 мг, 1,3 ммоль) с получением указанного в заголовке соединения (27 мг, 37%).
1Н-ЯМР (MeOD, 400 МГц): δ 7,93 (d, 2Н), 7,62-7,53 (m, 3Н), 7,52-7,46 (m, 2Н), 6,96 (d, 1H), 6,80 (dd, 1H), 4,99 (s, 2Н), 2,75 (q, 2Н), 2,44-2,34 (m, 1H), 1,30 (t, 3Н), 1,27-1,21 (m, 4Н).
<Пример 66> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-изопропилбензойная кислота (I-66)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-изопропилбензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (64,2 мг, 0,15 ммоль) с метил-3-йод-5-изопропилбензоатом (46,6 мг, 0,15 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 17,3 мг, 0,02 ммоль), йодидом меди(I) (2,9 мг, 0,02 ммоль) и N,N-диизопропилэтиламином (31,3 мкл, 0,18 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-изопропилбензоата (76,3 мг, 86%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,02 (t, 1H), 7,87 (t, 1H), 7,56 (t, 1H), 7,44-7,39 (m, 3Н), 7,36-7,31 (m, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 3,92 (s, 3Н), 3,00-2,91 (m, 1H), 2,20-2,12 (m, 1H), 1,32-1,29 (m, 2Н), 1,28 (d, 6Н), 1,21-1,14 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-изопропилбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (76,3 мг, 0,13 ммоль) с гидроксидом лития (53,8 мг, 1,3 ммоль) с получением указанного в заголовке соединения (37 мг, 50%).
1Н-ЯМР (DMSO, 400 МГц): δ 7,84 (d, 2Н), 7,65-7,61 (m, 2Н), 7,53-7,59 (m, 2Н), 7,09 (d, 1H), 6,84 (dd, 1H), 4,89 (s, 2Н), 3,06-2,96 (m, 1H), 1,23 (d, 6Н), 1,21-1,17 (m, 2Н), 1,17-1,15 (m, 2Н).
<Пример 67> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензойная кислота (I-67)
Стадия 1. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензоата (стадия 2 примера 56) (108 мг, 0,159 ммоль) с гидроксидом лития (66,7 мг, 1,59 ммоль) с получением указанного в заголовке соединения (41 мг, 39%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,50 (br, 1H), 8,22(t, 1H), 8,11 (t, 1H), 7,98 (t, 1H), 7,65-7,61 (m, 3Н), 7,59-7,53 (m, 1H), 7,10 (d, 1H), 6,85 (dd, 1H), 4,99 (s, 2Н), 2,39 (s, 3Н), 1,27-1,12 (m, 5Н).
<Пример 68> 3-((2,5-Дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-68)
Стадия 1. Получение трет-бутил(2,5-дихлор-4-йодфенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 1). Таким образом, проводили реакцию 2,5-дихлор-4-йодфенола (0,5 г, 1,73 ммоль) с трет-бутилдиметилсилилхлоридом (TBSCl, 0,39 г, 2,60 ммоль), имидазолом (0,23 г, 3,46 ммоль) с получением промежуточного соединения трет-бутил(2,5-дихлор-4-йодфенокси)диметилсилана (0,61 г, 88%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,24 (s, 1H), 6,97 (s, 1H), 0,96 (s, 9Н), 0,16 (s, 6Н).
Стадия 2. Получение трет-бутил(2,5-дихлор-4-((триметилсилил)этинил)фенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (0,61 г, 1,52 ммоль) с дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 106,68 мг, 0,15 ммоль), йодидом меди(I) (29 мг, 1,22 ммоль), триэтиламином (0,42 мл, 3,04 ммоль) с получением промежуточного соединения трет-бутил(2,5-дихлор-4-((триметилсилил)этинил)фенокси)диметилсилана (368,97 мг, 65%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,24 (s, 1H), 6,97 (s, 1H), 0,96 (s, 9Н), 0,25 (s, 9Н), 0,16 (s, 6Н).
Стадия 3. Получение 2,5-дихлор-4-((триметилсилил)этинилфенола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 3). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (368,97 мг, 0,99 ммоль) с фторидом калия (KF, 574 мг, 9,9 ммоль) с получением промежуточного соединения 2,5-дихлор-4-((триметилсилил)этинилфенола (185 мг, 45%), и его применяли непосредственно на следующей стадии без дополнительной очистки.
Стадия 4. Получение 5-циклопропил-4-((2,5-дихлор-4-этинилфенокси)метил)-3-(2,6-дихлорфенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию данного промежуточного соединения (стадия 3) (256,6 мг, 0,99 ммоль) с 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазолом (промежуточное соединение 1) (343,6 мг, 0,99 ммоль), карбонатом калия (205,2 мг, 1,49 ммоль) с получением промежуточного соединения 5-циклопропил-4-((2,5-дихлор-4-этинилфенокси)метил)-3-(2,6-дихлорфенил)изоксазола (345,4 мг, 77%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,41-7,30 (m, 3Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
Стадия 5. Получение метил-3-((2,5-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию данного промежуточного соединения (стадия 4) (345,4 мг, 0,762 ммоль) с метил-3-бромбензоатом (163,9 мг, 0,762 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 49 мг, 0,07 ммоль), йодидом меди(I) (7 мг, 0,035 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,16 мл, 1,05 ммоль) с получением промежуточного соединения метил-3-((2,5-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (232,7 мг, 52%).
1Н-ЯМР (DMSO, 400 МГц): δ 11,33 (s, 1H), 8,06 (t, 1H), 8,02-7,98 (m, 1H), 7,83-7,79 (m, 1H), 7,77 (s, 1H), 7,61 (t, 1H), 7,12 (s, 1H), 3,89 (s, 3Н).
Стадия 6. Получение 3-((2,5-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 2 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 5) (232,7 мг, 0,40 ммоль) с гидроксидом лития (167,8 мг, 4 ммоль) с получением указанного в заголовке соединения (133 мг, 58%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,04 (t, 1H), 7,97(d, 1H), 7,79-7,71 (m, 2Н), 7,65-7,52 (m, 4Н), 7,45 (s, 1H), 5,14 (s, 2Н), 1,28-1,12 (m, 5Н).
<Пример 69> 3-((2,3-Дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-69)
Стадия 1. Получение трет-бутил(2,3-дихлор-4-йодфенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 1). Таким образом, проводили реакцию 2,3-дихлор-4-йодфенола (0,5 г, 1,73 ммоль) с трет-бутилдиметилсилилхлоридом (TBSCl, 0,39 г, 2,60 ммоль), имидазолом (0,23 г, 3,46 ммоль) с получением промежуточного соединения трет-бутил(2,3-дихлор-4-йодфенокси)диметилсилана (0,61 г, 88%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,42 (m, 1H), 6,42 (m, 1H), 0,96 (s, 9Н), 0,16 (s, 6Н).
Стадия 2. Получение трет-бутил(2,3-дихлор-4-((триметилсилил)этинил)фенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (0,61 г, 1,52 ммоль) с дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 106,68 мг, 0,15 ммоль), йодидом меди(I) (29 мг, 1,22 ммоль), триэтиламином (0,42 мл, 3,04 ммоль) и триметилсилилацетиланом (0,42 мл, 3,04 ммоль) с получением промежуточного соединения трет-бутил(2,3-дихлор-4-((триметилсилил)этинил)фенокси)диметилсилана (368,97 мг, 65%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,42 (m, 1H), 6,42 (m, 1H), 0,96 (s, 9Н), 0,25 (s, 9Н), 0,16 (s, 6Н).
Стадия 3. Получение 2,3-дихлор-4-((триметилсилил)этинилфенола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 3). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (368,97 мг, 0,99 ммоль) с фторидом калия (KF, 574 мг, 9,9 ммоль) с получением промежуточного соединения 2,3-дихлор-4-((триметилсилил)этинилфенола (185 мг, 45%), и его применяли непосредственно на следующей стадии без дополнительной очистки.
Стадия 4. Получение 5-циклопропил-4-((2,3-дихлор-4-этинилфенокси)метил)-3-(2,6-дихлорфенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию данного промежуточного соединения (стадия 3) (256,6 мг, 0,99 ммоль) с 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазолом (промежуточное соединение 1) (343,6 мг, 0,99 ммоль) и карбонатом калия (205,2 мг, 1,49 ммоль) с получением промежуточного соединения 5-циклопропил-4-((2,3-дихлор-4-этинилфенокси)метил)-3-(2,6-дихлорфенил)изоксазола (345,4 мг, 77%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,41-7,30 (m, 3Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
Стадия 5. Получение метил-3-((2,3-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию данного промежуточного соединения (стадия 4) (345,4 мг, 0,762 ммоль) с метил-3-бромбензоатом (163,9 мг, 0,762 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 49 мг, 0,07 ммоль), йодидом меди(I) (7 мг, 0,035 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,16 мл, 1,05 ммоль) с получением промежуточного соединения метил-3-((2,3-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (232,7 мг, 52%).
1Н-ЯМР (DMSO, 400 МГц): δ 8,06 (t, 1H), 8,03-7,78 (m, 2Н), 7,96-7,53 (m, 5Н), 7,27 (d, 1H), 5,15 (s, 2Н), 3,89 (s, 3Н), 1,28-1,13 (m, 5Н).
Стадия 6. Получение 3-((2,3-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 5) (232,7 мг, 0,40 ммоль) с гидроксидом лития (167,8 мг, 4 ммоль) с получением указанного в заголовке соединения (133 мг, 58%).
1Н-ЯМР (DMSO, 400 МГц): δ 8,05 (t, 1H), 7,99 (d, 1H), 7,79 (d, 1H), 7,67-7,53 (m, 5Н), 7,26 (d, 1H), 5,14 (s, 2Н), 1,12-1,26 (m, 5Н).
<Пример 70> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-6-фторфенил)этинил)бензойная кислота (I-70)
Стадия 1. Получение трет-бутил(3-хлор-5-фтор-4-йодфенокси)диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 1). Таким образом, проводили реакцию 3-хлор-5-фтор-4-йодфенола (0,5 г, 1,84 ммоль) с трет-бутилдиметилсилилхлоридом (TBSCl, 0,39 г, 2,60 ммоль), имидазолом (0,23 г, 3,46 ммоль) с получением промежуточного соединения трет-бутил(3-хлор-5-фтор-4-йодфенокси)диметилсилана (0,54 г, 76%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,69 (d, 1H), 6,97 (d, 1H), 0,96 (s, 9Н), 0,16 (s, 6Н).
Стадия 2. Получение трет-бутил(3-хлор-5-фтор-4-((триметилсилил)этинил)фенокси))диметилсилана
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (0,54 г, 1,40 ммоль) с дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 106,68 мг, 0,14 ммоль), йодидом меди(I) (29 мг, 0,14 ммоль), триэтиламином (0,42 мл, 3,04 ммоль) и триметилсилилацетиленом (0,42 мл, 3,04 ммоль) с получением промежуточного соединения трет-бутил(3-хлор-5-фтор-4-((триметилсилил)этинил)фенокси)диметилсилана (239,91 мг, 48%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,69 (d, 1H), 6,97 (d, 1H), 0,96 (s, 9Н), 0,25 (s, 9Н), 0,16 (s, 6Н).
Стадия 3. Получение 3-хлор-5-фтор-4-((триметилсилил)этинил)фенола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 3). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (239,91 мг, 0,67 ммоль) с фторидом калия (390 мг, 6,7 ммоль) с получением промежуточного соединения 3-хлор-5-фтор-4-((триметилсилил)этинил)фенола без дополнительной очистки.
Стадия 4. Получение 4-((3-хлор-4-этинил-5-фторфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию данного промежуточного соединения (стадия 3) (162,6 мг, 0,67 ммоль) с 4-(бромметил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазолом (промежуточное соединение 1) (232,5 мг, 0,67 ммоль), карбонатом калия (138,90 мг, 1,01 ммоль) с получением промежуточного соединения 4-((3-хлор-4-этинил-5-фторфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (210,7 мг, 72%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,41-7,30 (m, 3Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
Стадия 5. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-6-фторфенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию данного промежуточного соединения (стадия 4) (210,7 мг, 0,48 ммоль) с метил-3-бромбензоатом (103,2 мг, 0,48 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 35 мг, 0,05 ммоль), йодидом меди(I) (9,5 мг, 0,05 ммоль), 1,8-диазабицикло(5.4.0)ундец-7-еном (DBU, 0,36 мл, 2,4 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-6-фторфенил)этинил)бензоата (131,5 мг, 48%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,21 (t, 1H), 8,02-7,99 (m, 1H), 7,73-7,71 (m, 1H), 7,45-7,32 (m, 4Н), 6,71 (d, 1H), 6,50 (dd, 1H), 4,81 (s, 2Н), 3,93 (s, 3Н), 2,16-2,12 (m, 1H), 1,32-1,27 (m, 2Н), 1,21-1,16 (m, 2Н).
Стадия 6. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-6-фторфенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 5) (131,5 мг, 0,23 ммоль) с гидроксидом лития (96,5 мг, 2,3 ммоль) с получением указанного в заголовке соединения (79,4 мг, 62%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,29 (s, 1H), 8,09 (d, 1H), 7,79 (d, 1H), 7,50-7,33 (m, 4Н), 6,71 (d, 1H), 6,51 (dd, 1H), 4,82 (s, 2Н), 2,17-2,11 (m, 1H), 1,33-1,28 (m, 2Н), 1,21-1,16 (m, 2Н).
<Пример 71> 3-Амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензойная кислота (I-71)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метил-3-нитробензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-5-бром-2-метил-3-нитробензоатом (70,1 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метил-3-нитробензоата (105,2 мг, 72%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,11-8,10 (d, 1H), 7,96 (d, 1H), 7,42-7,39 (m, 3Н), 7,35-7,31 (m, 1H), 6,88-6,87 (d, 1H), 6,71-6,69 (dd, 1H), 4,83 (s, 2Н), 3,95 (s, 3Н), 2,63 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,26-1,15 (m, 2Н).
Стадия 2. Получение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензоата
Данное соединение получали с применением процедуры, описанной для примера 8 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (105,2 мг, 0,172 ммоль) с дигидратом хлорида олова(II) (388 мг, 1,72 ммоль) с получением промежуточного соединения метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензоата (62 мг, 62%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,42-7,31 (m, 5Н), 6,97 (d, 1H), 6,86 (d, 1H), 6,68 (dd, 1H), 4,81 (s, 2Н), 3,89 (s, 3Н), 3,76 (s, 2Н), 2,35 (s, 3Н), 2,17-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 3. Получение 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (62 мг, 0,106 ммоль) с гидроксидом лития (44 мг, 1,06 ммоль) с получением указанного в заголовке соединения (53 мг, 88%).
1Н-ЯМР (DMSO, 400 МГц): δ 7,64-7,62 (m, 2Н), 7,57-7,48 (m, 2Н), 7,06 (dd, 2Н), 6,92 (d, 1H), 6,82 (dd, 1H), 5,28 (s, 2Н), 4,97 (s, 2Н), 2,47 (m, 1H), 2,21 (s, 3Н), 1,21-1,19 (m, 2Н), 1,14-1,13 (m, 2Н).
<Пример 72> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(3-этилуреидо)бензойная кислота (I-72)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(3-этилуреидо)бензоата
Промежуточное соединение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (стадия 2 примера 8) (150 мг, 0,264 ммоль) растворяли в дихлорметане (3 мл) и добавляли этилизоцианат (31 мкл, 0,396 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 дня. Реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(3-этилуреидо)бензоата (117 мг, 69%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,95 (t, 1H), 7,86 (t, 1H), 7,79 (t, 1H), 7,44-7,38 (m, 2Н), 7,36-7,30 (m, 2Н), 6,85 (d, 1H), 6,67 (dd, 1H), 5,41 (s, 2Н), 4,82 (s, 2Н), 3,89 (s, 3Н), 3,74 (q, 1H), 2,19-2,10 (m, 1Н), 1,24-1,20 (m, 3Н), 1,15-1,11 (m, 4Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(3-этилуреидо)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (105 мг, 0,165 ммоль) с гидроксидом лития (58 мг, 1,65 ммоль) с получением указанного в заголовке соединения (20,6 мг, 20%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,12 (br, 1H), 8,82 (s, 1H), 7,93 (s, 1H), 7,88 (s, 1H), 7,64-7,62 (m, 2Н), 7,57-7,55 (m, 2Н), 7,09 (d, 1H), 6,84 (dd, 1H), 4,99 (s, 2Н), 3,11 (s, 2Н), 1,24-1,15 (m, 5Н), 1,07-1,04 (q, 3Н).
<Пример 73> 3-Ацетамидо-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-73)
Стадия 1. Получение метил-3-ацетамидо-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Промежуточное соединение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (стадия 2 примера 8) (100 мг, 0,176 ммоль) растворяли в N,N-диметилформамиде (1,7 мл) и добавляли ацетилхлорид (26 мкл, 0,264 ммоль) и триэтиламин (55 мкл, 0,264 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 дня. Реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением промежуточного соединения метил-3-ацетамидо-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (44 мг, 41%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,23 (t, 1H), 7,91 (dd, 1H), 7,50-7,40 (m, 2Н), 7,38-7,32 (m, 2Н), 6,88 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 4,27 (q, 1H), 4,26 (q, 2Н), 3,94 (s, 3Н), 2,31 (s, 3Н), 2,19-2,12 (m, 1Н), 1,33-1,24 (m, 2Н), 1,23-1,14 (m, 2Н).
Стадия 2. Получение 3-ацетамидо-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Промежуточное соединение (стадия 1) растворяли в смеси 1,4-диоксан (1,0 мл)/вода (0,14 мл) и добавляли гидроксид лития (58 мг, 0,716 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. рН реакционной смеси регулировали от 4 до 5 с помощью 1 н. раствора хлористоводородной кислоты и реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали с получением указанного в заголовке соединения (18,0 мг, 42%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,45 (br, 1H), 10,25 (br, 1H), 8,15 (s, 1H), 8,04 (s, 1H), 7,68 (s, 1H), 7,64-7,20 (m, 2Н), 7,58-7,54 (m, 2Н), 7,09 (d, 1H), 6,84 (dd, 1H), 4,99 (s, 2Н), 2,07(s, 3Н), 1,21-1,14 (m, 5Н).
<Пример 74> 3-((2-Хлор-4-((5-циклопропил-3-(2.,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензойная кислота (I-74)
Стадия 1. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоата (пример 8) (55,1 мг, 0,086 ммоль) с гидроксидом лития (36,1 мг, 0,86 ммоль) с получением указанного в заголовке соединения (45,2 мг, 84%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,55 (br, 1H), 9,98 (s, 1H), 8,09 (s, 1H), 7,87 (s, 1H), 7,64-7,62 (m, 3Н), 7,58-7,54 (m, 1H), 7,09 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 4,16 (q, 2Н), 1,25 (t, 3Н), 1,21-1,14 (m, 5H).
<Пример 75> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензойная кислота (I-75)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 10 (стадия 1). Таким образом, проводили реакцию метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоата (пример 8) (50 мг, 0,078 ммоль) с гидридом натрия (5,6 мг, 0,234 ммоль) и йодметаном (6 мкл, 0,093 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензоата (35 мг, 69%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,02 (t, 1H), 7,88 (s, 1H), 7,62 (s, 1H), 7,42-7,38 (m, 1H), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 4,22 (q, 2Н), 3,93 (s, 3Н), 3,32 (s, 3Н), 2,17-2,13 (m, 1Н), l,34 (t, 3Н), 1,32-1,24 (m, 2Н), 1,23-1,14 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (20 мг, 0,031 ммоль) с гидроксидом лития (12,8 мг, 0,31 ммоль) с получением указанного в заголовке соединения (18 мг, 94%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,38 (br, 1H), 7,88 (t, 1H), 7,83 (t, 1H), 7,72 (t, 1H), 7,64-7,62 (m, 2Н), 7,57-7,53 (m, 2Н), 7,10 (d, 1H), 6,85 (dd, 1H), 4,98 (s, 2Н), 4,13 (q, 2Н), 3,27 (s, 3Н), 1,23-1,11 (m, 8Н).
<Пример 76> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропоксикарбонил)амино)бензойная кислота (I-76)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропоксикарбонил)амино)бензоата
Диизопропиламин (0,3 мл, 1,8 ммоль) добавляли к раствору циклопропанола (0,1 мл, 1,8 ммоль) и трифосгена (267 мг, 0,9 ммоль) в дихлорметане, который был охлажден до 0°С, и перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (стадия 2 примера 8) (100 мг, 0,18 ммоль) и диизопропилэтиламин (0,12 мл, 0,54 ммоль) и перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли воду и продукт экстрагировали в дихлорметане. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропоксикарбонил)амино)бензоата (35 мг, 30%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,96 (m, 1H), 7,84 (m, 2Н), 6,86 (d, 1H), 6,69 (dd, 1H), 7,42-7,31 (m, 4Н), 6,86 (d, 1H), 6,72 (dd, 1H), 5,64 (s, 2Н), 4,82 (s, 2Н), 3,92 (s, 3Н), 2,16 (m, 1H), 1,31-1,14 (m, 4Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропоксикарбонил)амино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (30 мг, 0,046 ммоль) с гидроксидом лития (19 мг, 0,46 ммоль) с получением указанного в заголовке соединения (9 мг, 31%).
1Н-ЯМР (DMSO, 400 МГц): δ 9,92 (s, 1H), 8,02 (s, 1H), 7,79 (s, 1H), 7,65-7,63 (m, 3Н), 7,59-7,54 (m, 2Н), 7,10 (m, 1H), 6,85-6,82 (m, 1H), 5,02 (s, 2Н), 4,09 (m, 1H), 1,23-1,14 (m, 6Н), 0,72-0,70 (m, 4Н).
<Пример 77> 3-((трет-Бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-77)
Стадия 1. Получение 3-((трет-бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию метил-3-((трет-бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (пример 9) (300 мг, 0,449 ммоль) с гидроксидом лития (188 мг, 4,49 ммоль) с получением указанного в заголовке соединения (227 мг, 77%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,27 (br, 1H), 8,10(t, 1H), 7,84 (t, 1H), 7,64-7,60 (m, 3Н), 7,57-7,56 (m, 2Н), 7,09 (d, 1H), 6,84 (dd, 1H), 4,99 (s, 2Н), 1,49 (s, 9Н), 1,19-1,14 (m, 5Н).
<Пример 78> 3-((трет-Бутоксикарбонил)(метил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-78)
Стадия 1. Получение метил-3-((трет-бутоксикарбонил)(метил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 10 (стадия 1). Таким образом, проводили реакцию метил-3-((трет-бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (пример 9) (220 мг, 0,329 ммоль) с гидридом натрия (24 мг, 0,988 ммоль) и йодметаном (87 мкл, 1,31 ммоль) с получением промежуточного соединения метил-3-((трет-бутоксикарбонил)(метил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (102 мг, 45%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,98 (t, 1H), 7,88 (t, 1H), 7,60 (s, 1H), 7,42-7,39 (m, 3Н), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 3,93 (s, 3Н), 3,29 (s, 3Н), 2,17 (m, 1H), l,46(s, 9Н), 1,32 1,24 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 3-((трет-бутоксикарбонил)(метил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (100 мг, 0,146 ммоль) с гидроксидом лития (61,5 мг, 1,46 ммоль) с получением указанного в заголовке соединения (28,3 мг, 29%).
1H-ЯМР (DMSO, 400 МГц): δ 13,37 (br, 1H), 7,88 (t, 1H), 7,79 (t, 1H), 7,67 (s, 1H), 7,64-7,62 (m, 2Н), 7,57-7,53 (m, 2Н), 7,10 (d, 1H), 6,85 (dd, 1H), 4,98 (s, 2Н), 3,27 (s, 3Н), 1,40 (s, 9Н), 1,21-1,11 (m, 5Н).
<Пример 79> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((циклопропилметокси)карбонил)амино)бензойная кислота (I-79)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((циклопропилметокси)карбонил)амино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 76 (стадия 1). Таким образом, проводили реакцию 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (стадия 2 примера 8) (100 мг, 0,18 ммоль), диизопропиламина (0,3 мл, 1,6 ммоль), трифосгена (53 мг, 0,18 ммоль), циклопропанметанола (0,03 мл, 0,35 ммоль) и N,N-диизопропилэтиламина (0,12 мл, 0,54 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропилметокси)амино)бензоата (38 мг, 32%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,93 (m, 1H), 7,89 (m, 2Н), 7,43-7,32 (m, 4Н), 6,87 (d, 1H), 6,72 (dd, 1H), 4,82 (s, 2Н), 4,03 (s, 1H), 4,01 (m, 1H), 3,93 (s, 3Н), 2,16 (m, 1H), 1,56-1,16 (m, 4Н), 0,62 (m, 2Н), 0,34 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((циклопропилметокси)карбонил)амино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (30 мг, 0,045 ммоль) с гидроксидом лития (19 мг, 0,46 ммоль) с получением указанного в заголовке соединения (15 мг, 52%).
1Н-ЯМР (DMSO, 400 МГц): δ 9,92 (s, 1H), 7,97 (s, 1H), 7,74 (s, 1H), 7,54 (m, 3Н), 7,46 (m, 2Н), 6,99 (m, 1H), 6,72 (dd, 1H), 4,88 (s, 2Н), 3,84 (d, 2Н), 1,84 (d, 2Н), 1,13-1,04 (m, 4Н), 0,46 (m, 2Н), 0,22 (m, 2Н).
<Пример 80> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-циклопропилэтокси)карбонил)амино)бензойная кислота (I-80)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-циклопропилэтокси)карбонил)амино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 76 (стадия 1). Таким образом, проводили реакцию 3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (стадия 2 примера 8) (150 мг, 0,264 ммоль), 1,1'-карбонилдиимидазола (47 мг, 0,29 ммоль) и циклопропилэтилового спирта (43 мг, 0,5 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-циклопропилэтокси)карбонил)амино)бензоата (30 мг, 17%)).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,92 (s, 1H), 7,89 (s, 2Н), 7,44-7,32 (m, 4Н), 6,87 (m, 1H), 6,70 (m, 1H), 4,82 (s, 2Н), 4,27 (m, 2Н), 3,92 (s, 3Н), 2,17 (m, 1H), 1,60 (m, 2Н), 1,33-1,16 (m, 4Н), 0,76 (m, 1H), 0,49 (m, 2Н), 0,11 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-циклопропилэтокси)карбонил)амино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (30 мг, 0,044 ммоль) с гидроксидом лития (50 мг, 1,2 ммоль) с получением указанного в заголовке соединения (13 г, 44%).
1Н-ЯМР (DMSO, 400 МГц): δ 9,84 (s, 1H), 7,96 (s, 1H), 7,75 (s, 1H), 7,52 (m, 3Н), 7,45 (d, 2Н), 6,98 (d, 1H), 6,72 (dd, 1H), 5,64 (s, 2Н), 4,87 (s, 2Н), 4,06 (m, 2Н), 1,43 (m, 2Н), 0,74-0,65 (m, 4Н), 0,30 (m, 2Н), 0,01 (m, 2Н).
<Пример 81> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-гидроксиэтокси)карбонил)амино)бензойная кислота (I-81)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-гидроксиэтокси)карбонил)амино)бензоата
Данное соединение получали с применением процедуры, описанной для примера 78 (стадия 1). Таким образом, проводили реакцию метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (стадия 2 примера 8) (70 мг, 0,123 ммоль), 1,1'-карбонилдиимидазола (22 мг, 0,136 ммоль) и этиленгликоля (13,6 мкл, 0,24 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-гидроксиэтокси)карбонил)амино)бензоата (20 мг, 25%)).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,94 (m, 1H), 7,90 (m, 1H), 7,42-7,32 (m, 4Н), 7,00 (s, 1H), 6,87 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 4,53 (m, 3Н), 4,35 (m, 1H), 3,92 (s, 3Н), 2,17 (m, 1H), 1,32-1,16 (m, 4Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-гидроксиэтокси)карбонил)амино)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (20 мг, 0,03 ммоль) с гидроксидом лития (50 мг, 1,2 ммоль) с получением указанного в заголовке соединения (11 мг, 57%).
1Н-ЯМР (DMSO, 400 МГц): δ 9,93 (s, 1H), 8,03 (s, 1H), 7,78 (s, 1H), 7,64 (m, 3Н), 7,54 (m, 2Н), 7,09 (d, 1H), 6,83 (dd, 1H), 4,98 (s, 2Н), 4,12 (t, 2Н), 3,63 (m, 2Н), 1,23-1,14 (m, 5Н).
<Пример 82> 3-(((Азетидин-3-илокси)карбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-82)
Стадия 1. Получение трет-бутил-3-(((3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенилэтинил)-5-(метоксикарбонил)фенил)карбамоил)окси)азетидин-1-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 78 (стадия 1). Таким образом, проводили реакцию метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (стадия 2 примера 8) (170 мг, 0,30 ммоль), трет-бутил-3-гидроксиазетидин-1-карбоксилата (120 мг, 0,69 ммоль), N,N-диизопропилэтиламина (0,19 мл, 1,04 ммоль) и трифосгена (72 мг, 0,24 ммоль) с получением промежуточного соединения трет-бутил-3-(((3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенилэтинил)-5-(метоксикарбонил)фенил)карбамоил)окси)азетидин-1-карбоксилата (80 мг, 35%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,94 (m, 2Н), 7,86 (s, 1H), 7,43-7,32 (m, 3Н), 6,94 (s, 1H), 6,87 (m, 1H), 6,69 (dd, 1H), 5,23 (m, 1H), 4,82 (s, 2Н), 4,29 (m, 2Н), 3,98 (m, 2Н), 3,93 (s, 3Н), 2,16 (m, 1H), 1,56 (m, 9Н), 1,45-1,15 (m, 4Н).
Стадия 2. Получение 3-(((азетидин-3-илокси)карбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (30 мг, 0,04 ммоль) с гидроксидом лития (19 мг, 0,46 ммоль) с получением указанного в заголовке соединения (12 мг, 61%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,28 (s, 1H), 10,08 (s, 1H), 8,10 (s, 1H), 7,87 (s, 1H), 7,64 (m, 3Н), 7,55 (m, 2Н), 7,10 (m, 1H), 6,84 (dd, 1H), 4,99 (s, 2Н), 3,95 (d, 2Н), 1,24-1,19 (m, 7Н), 0,57 (m, 2Н), 0,35 (m, 2Н).
<Пример 83> 3-((2-Хлор-4-((5-циклопропил-3-(2.,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(2-оксооксазолидин-3-ил)бензойная кислота (I-83)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(2-оксооксазолидин-3-ил)бензоата
Промежуточное соединение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (стадия 2 примера 8) (100 мг, 0,176 ммоль) растворяли в ацетонитриле (2 мл) и добавляли 2-хлорэтилхлорформиат (27,3 мкл, 0,264 ммоль) и карбонат калия (36,5 мг, 0,264 ммоль). Реакционную смесь нагревали при 80°С в течение 4 часов. Реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(2-оксооксазолидин-3-ил)бензоата (73 мг, 65%).
Н-ЯМР (CDCl3, 400 МГц): δ 8,01 (t, 1H), 7,97 (t, 1H), 7,95 (t, 1H), 7,42-7,40 (m, 3Н), 7,35-7,31 (m, 1H), 6,87 (d, 1H), 6,70 (dd, 1H), 4,82 (s, 2Н), 4,54 (q, 2Н), 4,14 (q, 2Н), 3,91 (s, 3Н), 2,19 (m, 1H) 1,31-1,27 (m, 2Н), 1,20, 1,16 (m, 2Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(2-оксооксазолидин-3-ил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (65 мг, 0,101 ммоль) с гидроксидом лития (43 мг, 1,019 ммоль) с получением указанного в заголовке соединения (21 мг, 33%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,45 (br, 1H), 8,16 (s, 1H), 7,89 (s, 1H), 7,76 (s, 1H), 7,64-7,62 (m, 2Н), 7,59-7,53 (m, 2Н), 7,10 (d, 1H), 6,85 (dd, 1H), 4,99 (s, 2Н), 4,48 (q, 2Н), 4,16 (q, 2H), 1,24-1,13 (m, 5H).
<Пример 84> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изофталевая кислота (I-84)
Стадия 1. Получение диметил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изофталата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (пример 5) (196,2 мг, 0,47 ммоль) с диметил-5-йодизофталатом (150 мг, 0,47 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 54,3 мг, 0,05 ммоль), йодидом меди(I) (10 мг, 0,05 ммоль) и N,N-диизопропилэтиламином (0,1 мл, 0,56 ммоль) с получением промежуточного соединения диметил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изофталата (278 мг, 97%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,64 (t, 1H), 8,37 (d, 1H), 7,41-7,50 (m, 2Н), 7,32-7,40 (m, 3Н), 6,90 (d, 1H), 6,73 (d, 1H), 4,85 (s, 2Н), 3,98 (s, 6Н), 2,13-2,23 (m, 1H), 1,30-1,37 (m, 2Н), 1,16-1,24 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изофталевой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (278 мг, 0,46 ммоль) с гидроксидом лития (193 мг, 4,6 ммоль) с получением указанного в заголовке соединения (66,6 мг, 71,5%).
1Н-ЯМР (MeOD, 400 МГц): δ 8,61 (t, 1H), 8,30 (d, 2Н), 7,55 (d, 1H), 7,53 (d, 1H), 7,50 (d, 1H), 7,48 (d, 1H), 6,96 (d, 1H), 6,80 (d, 1H), 4,97 (s, 2Н), 2,33-2,42 (m, 1H), 1,21-1,27 (m, 4Н).
<Пример 85> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-карбонил)бензойной кислоты гидрохлорид (I-85)
Стадия 1. Получение трет-бутил-4-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)бензоил)пиперазин-1-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (пример 5) (115 мг, 0,27 ммоль) с трет-бутил-4-(3-(метоксикарбонил)бензоил)пиперазин-1-карбоксилатом (130 мг, 0,27 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 34,7 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль), N,N-диизопропилэтиламином (56,4 мкл, 0,32 ммоль) с получением промежуточного соединения трет-бутил-4-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метоксикарбонил)бензоил)пиперазин-1-карбоксилата (88 мг, 43%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,24 (s, 1H), 8,00 (s, 1H), 7,74 (s, 1H), 7,50-7,38(m, 3Н), 7,35-7,31 (m, 1H), 6,88 (d, 1H), 6,70 (dd, 1H), 4,83 (s, 3Н), 3,99 (s, 3Н), 3,85-3,80 (m, 2Н), 3,66-3,40 (m, 6Н), 2,21-2,12 (m, 1H), 1,48 (s, 9Н), 1,38-1,32 (m, 2Н), 1,20-1,12 (m, 2Н).
Стадия 2. Получение 3-(4-(трет-бутоксикарбонил)пиперазин-1-карбонил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (88 мг, 0,12 ммоль) с гидроксидом лития (48,3 мг, 1,2 ммоль) с получением 3-(4-(трет-бутоксикарбонил)пиперазин-1-карбонил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты (61 мг, 67,7%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,28 (s, 1H), 8,05 (s, 1H), 7,79 (s, 1H), 7,45-7,33 (m, 3Н), 7,31-7,28(m, 1H), 6,88 (s, 1H), 6,70 (dd, 1H), 4,83 (s, 2Н), 3,90-3,82(m, 1H), 3,62-3,30 (m, 6Н), 2,30-2,12 (m, 2Н), 1,48 (s, 9Н), 1,38-1,33 (m, 2Н), 1,29-1,16 (m, 2Н).
Стадия 3. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-карбонил)бензойной кислоты гидрохлорида
Данное соединение получали с применением процедуры, описанной для примера 57 (стадия 3). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (61 мг, 0,08 ммоль) с 5~6 н. раствором HCl (48 мкл, 0,24 ммоль) с получением указанного в заголовке соединения (35 мг, 64%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,56 (br, 1H), 8,07 (s, 1H), 7,99 (s, 1H), 7,84 (s, 1H), 7,66-7,60 (m, 2Н), 7,58-7,52 (m, 2Н), 7,19 (s, 1H), 6,85 (dd, 1H), 4,99 (s, 2Н), 3,82-3,74 (m, 3Н), 3,42-3,34 (m, 2Н), 3,21-3,10 (m, 4Н), 1,31-1,19 (m, 4Н).
<Пример 86> 3-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метилсульфонамидо)бензойная кислота (I-86)
Стадия 1. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метилсульфонамидо)бензоата
Промежуточное соединение метил-3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат (стадия 2 примера 8) (150 мг, 0,264 ммоль) растворяли в смеси дихлорметан (2 мл)/N,N-диметилформамид (1 мл) и добавляли метилсульфонилхлорид (22,5 мкл, 0,290 ммоль) и 1,8-диазобицикло[5.4.0]ундец-7-ен (DBU, 40 мкл, 0,264 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 дня. Реакционную смесь экстрагировали этилацетатом и промывали водой. Объединенную органическую фазу высушивали над MgSO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метилсульфонамидо)бензоата (74 мг, 44%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,01 (t, 1H), 7,79 (t, 1H), 7,61 (t, 1H), 7,42-7,40 (m, 2Н), 7,35-7,31 (m, 1H), 6,88 (d, 1H), 6,71 (dd, 1H), 6,56 (s, 1H), 4,82 (s, 2Н), 3,94 (s, 3Н), 2,19 (m, 1H) 1,05-1,32 (m, 4Н).
Стадия 2. Получение 3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метилсульфонамидо)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (20 мг, 0,031 ммоль) с гидроксидом лития (13 мг, 0,31 ммоль) с получением указанного в заголовке соединения (16 мг, 85%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,33 (br, 1H), 10,14 (s, 1H), 7,81 (s, 1H), 7,73 (s, 1H), 7,64-7,61 (m, 2Н), 7,59-7,57 (m, 1H), 7,53 (s, 1H), 7,10 (d, 1H), 6,85 (dd, 1H), 4,98 (s, 2Н), 3,06 (s, 3Н), 1,05-1,32 (m, 5Н).
<Пример 87> 3-((2-Хлор-4-((5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота (I-87)
Стадия 1. Получение оксима 2-(трифторметил)бензальдегида
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 1). Таким образом, проводили реакцию 2-(трифторметил)бензальдегида (11 г, 160 ммоль) с гидроксидом натрия (6,3 г, 160 ммоль), 2,6-дихлорбензальдегидом (25 г, 140 ммоль) с получением промежуточного соединения оксима 2-(трифторметил)бензальдегида (25,9 г, 96%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,53-8,52 (t, 1H), 8,04-8,02 (d, 1H), 7,85 (s, 1H), 7,72-7,70 (d, 1H), 7,60-7,56 (t, 1H), 7,53-7,51 (d, 1H).
Стадия 2. Получение N-гидрокси-2-(трифторметил)бензамидоилхлорида
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (25,9 г, 140 ммоль) с N-хлорсукцинимидом (NCS, 18,4 г, 140 ммоль) с получением N-гидрокси-2-(трифторметил)бензамидоилхлорида (29 г), и его применяли без дополнительной очистки.
1Н-ЯМР (CDCl3, 400 МГц): δ 8,57 (s, 1H), 7,77-7,75 (d, 1H), 7,67-7,58 (m, 3Н).
Стадия 3. Получение этил-5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 3). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (29 г, 129 ммоль) с этил-3-циклопропил-3-оксопропаноатом (25 мл, 194 ммоль) и триэтиламином (150 мл) с получением промежуточного соединения этил-5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-карбоксилата (22,37 г, 56%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,80-7,78 (m, 1H), 7,66-7,62 (m, 2Н), 7,42-7,40 (m, 1H), 3,64 (s, 3Н), 2,07-2,03 (m, 1H), 1,16-1,12 (m, 2Н), 1,01-0,97 (m, 2Н).
Стадия 4. Получение (5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанола
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 4). Таким образом, проводили реакцию промежуточного соединения (стадия 3) (22,37 г, 71,7 ммоль) с 1 М гидридом диизобутилалюминия в THF (DIBAL-H, 144 мл, 144 ммоль) с получением промежуточного соединения (5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанола (12,2 г, 60%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,81-7,79 (m, 1H), 7,65-7,57 (m, 2Н), 7,47-7,45 (m, 1H), 4,40 (s, 2Н), 2,19-2,12 (m, 1H), 1,27-1,23 (m, 2Н), 1,15-1,10 (m, 2Н).
Стадия 5. Получение 4-(бромметил)-5-циклопропил-3-(2-(трифторметил)фенил)изоксазола
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 5). Таким образом, проводили реакцию промежуточного соединения (стадия 4) (12,2 г, 43,02 ммоль) с трифенилфосфитом (ТРР, 16,9 г, 64,53 ммоль), тетрабромметаном (21,4 г, 64,53 ммоль) с получением промежуточного соединения 4-(бромметил)-5-циклопропил-3-(2-(трифторметил)фенил)изоксазола (13,44 г, 90%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,83-7,81 (m, 1H), 7,68-7,62 (m, 2Н), 7,55-7,53 (m, 1H), 4,20 (s, 2Н), 2,12-2,08 (m, 1H), 1,30-1,25 (m, 2Н), 1,24-1,18 (m, 2Н).
Стадия 6. Получение 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2-(трифторметил)фенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию промежуточного соединения (стадия 5) (7,59 г, 21,9 ммоль) с 3-хлор-4-((триметилсилил)этинил)фенолом (стадия 3 примера 5) (4,92 г, 21,9 ммоль), карбонатом калия (4,54 г, 32,9 ммоль) с получением промежуточного соединения 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2-(трифторметил)фенил)изоксазола (7,15 г, 78%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,41-7,30 (m, 4Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
Стадия 7. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию промежуточного соединения (стадия 6) (128 мг, 0,31 ммоль) с метил-3-йодбензоатом (80 мг, 0,31 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 22 мг, 0,03 ммоль), йодидом меди(I) (5,8 мг, 0,03 ммоль), триэтиламином (0,052 мл, 0,37 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (107 мг, 63%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,20 (s, 1H), 8,00-7,98 (m, 1H), 7,81-7,79 (m, 1H), 7,72-7,69 (m, 1H), 7,62-7,59 (m, 2Н), 7,45-7,41 (m, 3Н), 6,88-6,87 (d, 1H), 6,71-6,68 (dd, 1H), 4,75 (s, 2H), 3,93 (s, 3Н), 2,14-2,10 (m, 1H), 1,28-1,26 (m, 2Н), 1,18-1,14 (m, 2Н).
Стадия 8. Получение 3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 7) (107 мг, 0,20 ммоль) с гидроксидом лития (84 мг, 2,0 ммоль) с получением указанного в заголовке соединения (92,5 мг, 86%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,27 (s, 1H), 8,02 (s, 1H), 7,97-7,65 (d, 1H), 7,92-7,90 (d, 1H), 7,80-7,71 (m, 3Н), 7,59-7,55 (m, 3Н), 7,14-7,13 (d, 1H), 6,89-6,86 (dd, 1H), 4,95 (s, 2Н), 2,51-2,42 (m, 1H), 1,21-1,10 (m, 4Н).
<Пример 88> 3-((2-Хлор-4-((5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота I-88
Стадия 1. Получение оксима 2-(трифторметокси)бензальдегида
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 1). Таким образом, проводили реакцию 2-(трифторметил)бензальдегида (11 г, 160 ммоль) с гидроксидом натрия (6,3 г, 160 ммоль), 2,6-дихлорбензальдегидом (25 г, 140 ммоль) с получением промежуточного соединения оксима 2-(трифторметокси)бензальдегида (25,9 г, 96%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,41 (s, 1H), 7,89-7,87 (dd, 1H), 7,47-7,41 (m, 1H), 7,38-7,26 (m, 2Н).
Стадия 2. Получение N-гидрокси-2-(трифторметокси)бензамидоилхлорида Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (25,9 г, 140 ммоль) с N-хлорсукцинимидом (NCS, 18,4 г, 140 ммоль) с получением промежуточного соединения N-гидрокси-2-(трифторметокси)бензамидоилхлорида (29 г), и его применяли без дополнительной очистки.
1Н-ЯМР (CDCl3, 400 МГц): δ 8,79 (s, 1H), 7,62-7,59 (m, 1H), 7,51-7,47 (m, 1H), 7,40-7,33 (m, 2Н).
Стадия 3. Получение этил-5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 3). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (29 г, 129 ммоль) с этил-3-циклопропил-3-оксопропаноатом (25 мл, 194 ммоль) и триэтиламином (150 мл) с получением промежуточного соединения 5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-карбоксилата (22,37 г, 56%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,54-7,48 (m, 2Н), 7,41-7,33 (m, 2Н), 3,77 (s, 3Н), 2,05-2,01 (m, 1H), 1,14-1,10 (m, 2Н), 0,99-0,94 (m, 2Н).
Стадия 4. Получение (5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанола
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 4). Таким образом, проводили реакцию промежуточного соединения (стадия 3) (22,37 г, 71,7 ммоль) с 1 М гидридом диизобутилалюминия в THF (DIBAL-H, 144 мл, 144 ммоль) с получением промежуточного соединения (5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанола (12,2 г, 60%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,58-7,50 (m, 2Н), 7,42-7,38 (m, 2Н), 4,50 (s, 2Н), 2,21-2,16 (m, 1H), 1,27-1,22 (m, 2Н), 1,15-1,11 (m, 2Н).
Стадия 5. Получение 4-(бромметил)-5-циклопропил-3-(2-(трифторметокси)фенил)изоксазола
Данное соединение получали с применением процедуры, описанной для промежуточного соединения 1 (стадия 5). Таким образом, проводили реакцию промежуточного соединения (стадия 4) (12,2 г, 43,02 ммоль) с трифенилфосфитом (ТРР, 16,9 г, 64,53 ммоль), тетрабромметаном (21,4 г, 64,53 ммоль) с получением промежуточного соединения 4-(бромметил)-5-циклопропил-3-(2-(трифторметокси)фенил)изоксазола (13,44 г, 90%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,60-7,53 (m, 2Н), 7,45-7,40 (m, 2Н), 4,33 (s, 2Н), 2,15 (m, 1H), 1,29-1,26 (m, 2Н), 1,25-1,20 (m, 2Н).
Стадия 6. Получение 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2-(трифторметокси)фенил)изоксазола
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 4). Таким образом, проводили реакцию промежуточного соединения (стадия 5) (7,59 г, 21,9 ммоль) с 3-хлор-4-((триметилсилил)этинил)фенолом (стадия 3 примера 5) (4,92 г, 21,9 ммоль) и карбонатом калия (4,54 г, 32,9 ммоль) с получением промежуточного соединения 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2-(трифторметокси)фенил)изоксазола (7,15 г, 78%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,41-7,30 (m, 4Н), 6,83 (d, 1H), 6,66 (dd, 1H), 4,80 (s, 2Н), 3,26 (s, 1H), 2,17-2,10 (m, 1H), 1,31-1,27 (m, 2Н), 1,23-1,17 (m, 2Н).
Стадия 7. Получение метил-3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию промежуточного соединения (стадия 6) (128 мг, 0,31 ммоль) с метил-3-йодбензоатом (80 мг, 0,31 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 22 мг, 0,03 ммоль), йодидом меди(I) (5,8 мг, 0,03 ммоль) и триэтиламином (0,052 мл, 0,37 ммоль) с получением промежуточного соединения метил-3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензоата (107 мг, 63%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,20 (s, 1H), 8,00-7,98 (m, 1H), 7,72-7,69 (m, 1H), 7,45-7,37 (m, 4Н), 4,88 (s, 2Н), 3,93 (s, 3Н), 2,16-2,11 (m, 1H), 1,28-1,24 (m, 2Н), 1,14-1,13 (m, 2Н).
Стадия 8. Получение 3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 7) (107 мг, 0,20 ммоль) с гидроксидом лития (84 мг, 2,0 ммоль) с получением указанного в заголовке соединения (92,5 мг, 86%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,6 (s, 1H), 8,02 (s, 1H), 7,97-7,95 (d, 1H) 7,78-7,76 (d, 1H), 7,69-.51 (m, 6Н), 7,15 (d, 1H), 6,90-6,88 (dd, 1H), 5,02 (s, 2Н), 2,47-2,42 (m, 1H), 1,20-1,15 (m, 2Н), 1,14-1,11 (m, 2Н).
<Пример 89> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-6-карбоновая кислота (I-89)
Стадия 1. Получение 1-(трет-бутил)-6-метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-1,6-дикарбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (176 мг, 0,422 ммоль) с 1-(трет-бутил)-6-метил-4-бром-1H-индазол-1,6-дикарбоксилатом (100 мг, 0,281 ммоль), йодидом меди(I) (5,3 мг, 0,028 ммоль) и дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 39,5 г, 0,056 ммоль) с получением промежуточного соединения 1-(трет-бутил)-6-метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-1,6-дикарбоксилата (107 мг, 55%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,70 (s, 1H), 8,62 (s, 1H), 8,17-8,16 (d, 1H), 7,45-7,39 (m, 4Н), 7,36-7,32 (m, 1H), 6,89 (d, 1H), 6,73-6,70 (dd, 1H), 4,83 (s, 2Н), 4,04 (s, 3Н), 2,19-2,13 (m, 1H), 1,74 (s, 9Н), 1,33-1,29 (m, 2Н), 1,20-1,18 (m, 2Н).
Стадия 2. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-6-карбоксилата
К раствору промежуточного соединения (стадия 1) (98 мг, 0,140 ммоль) в дихлорметане (3 мл) добавляли трифторуксусную кислоту (0,15 мл) и перемешивали в течение 3 дней при комнатной температуре. Реакционную смесь концентрировали в вакууме, добавляли этилацетат и промывали водой. Объединенные органические слои высушивали над MgSO4, фильтровали, выпаривали в вакууме и очищали с применением хроматографии на силикагеле с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-6-карбоксилата (24 мг, 28%).
1Н-ЯМР (CDCl3, 400 МГц): δ 10,47 (s, 1H), 8,59 (s, 1H), 8,08 (d, 1H), 7,87 (s, 1H), 7,45-7,40 (m, 3Н), 7,35-7,31 (m, 1H), 6,89-6,88 (d, 1H), 6,72-6,69 (dd, 1H), 4,83 (s, 1H), 4,09 (s, 3Н), 2,18-2,13 (m, 1H), 1,32-1,26 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 3. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (24 мг, 0,04 ммоль) с гидроксидом лития (17 мг, 0,405 ммоль) с получением указанного в заголовке соединения (20 мг, 86%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,62 (s, 1H), 8,11 (s, 1H), 7,90 (s, 1H), 7,45-7,41 (m, 3Н), 7,36-7,32 (m, 1H), 6,89-6,88 (d, 1H), 6,72-6,69 (dd, 1H), 4,83 (s, 2Н), 2,02-2,12 (m, 1H), 1,32-1,19 (m, 4Н).
<Пример 90> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-бензо[d]имидазол-6-карбоновая кислота (I-90)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-бензо[d]имидазол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (101 мг, 0,24 ммоль) с 1-(трет-бутил)-6-метил-4-бром-1H-бензо[d]имидазол-1,6-дикарбоксилатом (71 мг, 0,20 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 7 мг, 0,01 ммоль), йодидом меди(I) (2 мг, 0,01 ммоль) и триэтиламином (0,03 мл, 0,24 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-бензо[d]имидазол-6-карбоксилата (57 мг, 48%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,19 (s, 1H), 8,02 (s, 1H), 7,69-7,32 (m, 5Н), 7,00 (m, 1H), 6,70 (m, 1H), 4,84 (s, 2Н), 3,96 (s, 3Н), 2,17 (m, 1H), 1,32-1,28 (m, 2Н), 1,20-1,15 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-бензо[d]имидазол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (30 мг, 0,05 ммоль) с гидроксидом лития (50 мг, 1,2 ммоль) с получением указанного в заголовке соединения (15 мг, 52%).
1Н-ЯМР (DMSO, 400 МГц): δ 8,39 (s, 1H), 8,18 (s, 1H), 7,97 (s, 1H), 7,64 (m, 2Н), 7,56 (m, 2Н), 7,10 (d, 1H), 6,87 (dd, 1H), 5,00 (s, 2Н), 3,16 (m, 2Н), 1,23-1,13 (m, 4Н).
<Пример 91> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-6-карбоновая кислота (I-91)
Стадия 1. Получение 1-(трет-бутил)-6-метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-1,6-дикарбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (236 мг, 0,56 ммоль) с 1-(трет-бутил)-6-метил-4-бром-1H-индол-1,6-дикарбоксилатом (200 мг, 0,56 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 79 мг, 0,11 ммоль), йодидом меди(I) (11 мг, 0,06 ммоль) и триэтиламином (0,39 мл, 2,82 ммоль) с получением промежуточного соединения 1-(трет-бутил)-6-метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-1,6-дикарбоксилата (141 мг, 36%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,83 (s, 1H), 8,12 (d, 1H), 7,97 (d, 1H), 7,48-7,32 (m, 5Н), 6,92-6,90 (m, 2Н), 6,73 (dd, 1H), 4,83 (s, 2Н), 3,95 (s, 3Н), 2,18-2,14 (m, 1H), 1,70 (s, 9Н), 1,32-1,28 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 2. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 89 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (141 мг, 0,2 ммоль) с трифторуксусной кислотой (0,28 мл, 3,8 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-6-карбоксилата (49 мг, 41%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,52 (s, 1H), 8,14 (t, 1H), 8,03 (d, 1H), 7,52-7,32 (m, 5Н), 6,91-6,89 (dd, 2Н), 6,73 (dd, 1H), 4,83 (s, 2Н), 3,95 (s, 3Н), 2,19-2,14 (m, 1H), 1,33-1,29 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 3. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (49 мг, 0,08 ммоль) с гидроксидом лития (33 мг, 0,8 ммоль) с получением указанного в заголовке соединения (45 мг, 98%).
1Н-ЯМР (DMSO, 400 МГц): δ 11,77 (s, 1H), 8,09 (s, 1H), 7,77 (d, 1H), 7,72 (t, 1H), 7,65-7,61 (m, 3Н), 7,58 (dd, 1H), 7,11 (d, 1H), 6,86 (dd, 1H), 6,70 (s, 1H), 4,99 (s, 2Н), 2,48 (m, 1H), 1,24-1,21 (m, 2Н), 1,17-1,12 (m, 2Н).
<Пример 92> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-(диметиламино)этил)-1H-индол-6-карбоновая кислота (I-92)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-(диметиламино)этил)-1Н-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (41,87 мг, 0,10 ммоль) с 1-(трет-бутил)-6-метил-4-бром-1H-индол-1,6-дикарбоксилатом (32,52 мг, 0,10 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 7,7 мг, 0,011 ммоль), йодидом меди(I) (2 мг, 0,011 ммоль) и триэтиламином (42 мкл, 0,30 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-1,6-дикарбоксилата (67 мг, 68%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,12 (s, 1H), 8,03 (d, 1H), 7,50-7,34 (m, 5Н), 6,92 (d, 1H), 6,84-6,83 (d, 1H), 6,74-6,71 (dd, 1H), 4,85 (s, 2Н), 4,33-4,29 (t, 2Н), 3,97 (s, 3Н), 2,75-2,71 (t, 2Н), 2,31 (s, 6Н), 2,20-2,17 (m, 1H), 1,34-1,30 (m, 2Н), 1,22-1,19 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-(диметиламино)этил)-1H-индол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (46 мг, 0,069 ммоль) с гидроксидом лития (29 мг, 0,694 ммоль) с получением указанного в заголовке соединения (0,014 г, 31%).
1Н-ЯМР (DMSO, 400 МГц): δ 12,85 (s, 1H), 8,16 (s, 1H), 7,78 (d, 1H), 7,74-7,73 (d, 1H), 7,65-7,61 (m, 3Н), 7,58-7,54 (m, 1H), 7,12-7,11 (d, 1H), 6,86-6,83 (m, 1H), 6,68 (d, 1H), 4,99 (s, 2Н), 4,4-4,36 (t, 2Н), 2,64-2,60 (t, 2Н), 2,18 (s, 6Н), 1,23-1,18 (m, 2Н), 1,16-1,14 (m, 2Н).
<Пример 93> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(3-(изопропиламино)пропил)-1Н-индол-6-карбоновая кислота (1-93)
Стадия 1. Получение метил-1-(3-((трет-бутоксикарбонил)(изопропил)амино)пропил)-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-4-бром-1-(3-((трет-бутоксикарбонил)(изопропил)амино)пропил)-1Н-индол-6-карбоксилатом (235 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(1) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-1-(3-((трет-бутоксикарбонил)(изопропил)амино)пропил)-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индол-6-карбоксилата (165 мг, 38%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,07 (s, 1H), 8,01 (s, 1H), 7,47 (d, 1H), 7,42-7,31 (m, 4Н), 6,90 (d, 1H), 6,83 (d, 1H), 6,72-6,69 (dd, 1H), 4,82 (s, 2Н), 4,21 (q, 2Н), 3,95 (s, 3Н), 3,12 (br, 2Н), 2,16-2,04 (m, 3Н), 1,52 (br, 1H), 1,45 (s, 9Н), 1,31-1,27 (m, 2Н), 1,86-1,15 (m, 2Н), 1,05 (s, 3Н), 1,03 (s, 3Н).
Стадия 2. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(3-(изопропиламино)пропил)-1Н-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 89 (стадия 2). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (165 мг, 0,20 ммоль) с трифторуксусной кислотой (0,2 мл, 2,0 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(3-(изопропиламино)пропил)-1Н-индол-6-карбоксилата (85,7 мг, 62%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,07 (s, 1H), 8,01 (s, 1H), 7,47 (d, 1H), 7,42-7,31 (m, 4Н), 6,90 (d, 1H), 6,83 (d, 1H), 6,72-6,69 (dd, 1H), 4,82 (s, 2Н), 4,21 (q, 2Н), 3,95 (s, 3Н), 3,12 (br, 2Н), 2,16-2,04 (m, 3Н), 1,52 (br, 1H), 1,31-1,27 (m, 2Н), 1,86-1,15 (m, 2Н), 1,05 (s, 3Н), 1,03 (s, 3Н).
Стадия 3. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(3-(изопропиламино)пропил)-1Н-индол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 2) (85,7 мг, 0,12 ммоль) с гидроксидом лития (50 мг, 1,2 ммоль) с получением указанного в заголовке соединения (32 мг, 39%).
1Н-ЯМР (DMSO, 400 МГц): δ 8,14 (s, 1H), 7,08 (s, 1H), 7,71 (d, 1H), 7,65-7,53 (m, 5Н), 7,11 (d, 1H), 6,86-6,83 (dd, 1H), 6,68 (d, 1H), 4,90 (s, 2Н), 4,30 (q, 2Н), 3,06 (br, 2Н), 2,46 (m, 2H), 1,48 (m, 1H), 1,22-1,12 (m, 4H), 1,01 (s, 3Н), 1,00 (s, 3Н).
<Пример 94> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(пиридин-4-илметил)-1H-индол-6-карбоновая кислота
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(пиридин-4-илметил)-1H-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-4-бром-1-(пиридин-4-илметил)-1H-индол-6-карбоксилатом (82,5 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(пиридин-4-илметил)-1H-индол-6-карбоксилата (78 мг, 48%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,54-8,53 (d, 2Н), 8,04 (s, 1H), 7,95 (s, 1H), 7,49-7,47 (d, 1H), 7,43 (d, 2Н), 7,41-7,34 (m, 2Н), 6,95-6,91 (m, 4Н), 6,74-6,71 (m, 1H), 5,42 (s, 2Н), 4,83 (s, 2Н), 3,91 (s, 3Н), 2,19-2,14 (m, 1H), 1,33-1,30 (m, 2Н), 1,20-1,15 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(пиридин-4-илметил)-1H-индол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (78 мг, 0,114 ммоль) с гидроксидом лития (47,8 мг, 1,14 ммоль) с получением указанного в заголовке соединения (72,4 мг, 95%).
1Н-ЯМР (DMSO, 400 МГц): δ 12,88 (s, 1H), 8,50 (s, 2Н), 8,06 (s, 1H), 7,89-7,88 (d, 1H), 7,80 (s, 1H), 7,65-7,54 (m, 4Н), 7,13-7,12 (d, 1Н), 7,04-7,03 (d, 2Н), 6,87-6,81 (m, 2Н), 5,68 (s, 2Н), 5,00 (s, 2Н), 1,23-1,19 (m, 2Н), 1,15 (m, 2Н).
<Пример 95> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-морфолиноэтил)-1H-индол-6-карбоновой кислоты гидрохлорид (I-95)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-морфолинэтил)-1H-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-4-бром-1-(2-морфолиноэтил)-1H-индол-6-карбоксилатом (105 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-морфолин-этил)-1H-индол-6-карбоксилата (87,6 мг, 52%).
1H-ЯМР (CDCl3, 400 МГц): δ 8,12 (s, 1H), 8,01 (s, 1H), 7,48-7,31 (m, 5Н), 6,90 (d, 1H), 6,82-6,81 (d, 1H), 6,72-6,69 (m, 1H), 4,83 (s, 2Н), 4,32-4,28 (t, 2Н), 3,95 (s, 3H), 3,69-3,37 (t, 3H), 2,77-2,74 (m, 2Н), 2,48-2,46 (m, 4Н), 2,18-2,12 (m, 1H), 1,32-1,29 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-морфолиноэтил)-1H-индол-6-карбоновой кислоты гидрохлорида
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (87,6 мг, 0,124 ммоль) с гидроксидом лития (52 мг, 1,24 ммоль) с получением указанного в заголовке соединения (72,8 мг, 85%).
1H-ЯМР (DMSO, 400 МГц): δ 12,89 (s, 1H), 10,96 (s, 1H), 8,30 (s, 1H), 7,83-7,81 (m, 2Н), 7,65-7,62 (m, 3H), 7,58-7,54 (m, 1H), 7,12 (d, 1H), 6,87-6,84 (dd, 1H), 6,78 (s, 1H), 5,00 (s, 2Н), 4,79 (s, 2Н), 4,00-3,90 (m, 2Н), 3,75 (m, 2Н), 3,57-3,56 (m, 2Н), 3,47-3,44 (m, 2Н), 3,15 (m, 2Н), 1,23-1,17 (m, 2Н), 1,15-1,12 (m, 2Н).
<Пример 96> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2,2-диметоксиэтил)-1Н-индол-6-карбоновая кислота (I-96)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2,2-диметоксиэтил)-1Н-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5- циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-4-бром-1-(2,2-диметоксиэтил)-1Н-индол-6-карбоксилатом (178 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2,2-диметоксиэтил)-1Н-индол-6-карбоксилата (205 мг, 58%).
1H-ЯМР (CDCl3, 400 МГц): δ 8,13 (s, 1H), 8,02 (d, 1H), 7,48-7,31 (m, 6Н), 6,90 (d, 1H), 6,84 (d, 1H), 6,72-6,70 (dd, 1H), 4,83 (s, 2Н), 4,55 (m, 1H), 4,28 (d, 2Н), 6,96 (s, 3H), 3,35 (s, 6Н), 2,16 (m, 1H), 1,32-1,27 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2,2-диметоксиэтил)-1H-индол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (205 мг, 0,30 ммоль) с гидроксидом лития (126 мг, 3,0 ммоль) с получением указанного в заголовке соединения (115 мг, 58%).
1H-ЯМР (DMSO 400 МГц): δ 8,19 (s, 1H), 7,80 (s, 1H), 7,69 (d, 1H), 7,65-7,54 (m, 4Н), 7,12 (d, 1H), 6,86-6,84 (dd, 1H), 6,71 (d, 1H), 6,99 (s, 2Н), 4,62 (q, 1H), 4,01 (dd, 2Н), 6,27 (s, 6Н), 2,51 (m, 1H), 1,23-1,14(m, 4Н).
<Пример 97> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидроксиэтил)-1H-индол-6-карбоновая кислота (I-97)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидроксиэтил)-1H-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,239 ммоль) с метил-4-бром-1-(2-((трет-бутилдиметилсилил)окси)этил)-1H-индол-6-карбоксилатом (118 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидроксиэтил)-1H-индол-6-карбоксилата (48,6 мг, 32%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,10 (s, 1H), 8,01 (d, 1H), 7,48-7,40 (m, 4Н), 7,35-7,31 (m, 1H), 6,90 (d, 1H), 6,85-6,84 (d, 1H), 6,72-6,69 (m, 1H), 4,83 (s, 2Н), 4,37-4,35 (t, 2Н), 4,00-3,99 (d, 2Н), 3,94 (s, 2Н), 2,18-2,13 (m, 1H), 1,61 (s, 1H), 1,32-1,28 (m, 2Н), 1,25-1,16 (m, 2Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидроксиэтил)-1H-индол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (48,6 мг, 0,076 ммоль) с гидроксидом лития (32 мг, 0,76 ммоль) с получением указанного в заголовке соединения (41,5 мг, 88%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,18 (s, 1H), 8,08 (d, 1H), 7,49-7,40 (m, 4Н), 7,36-7,32 (m, 1H), 6,91-6,90 (d, 1H), 6,87 (d, 1H), 6,73-6,70 (m, 1H), 4,83 (s, 2Н), 4,40-4,37 (t, 2Н), 4,02-4,00 (t, 2Н), 2,18-2,17 (m, 1H), 1,32-1,27 (m, 2Н), 1,20-1,16 (m, 2Н).
<Пример 98> 4-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидрокси-2-метилпропил)-1H-индол-6-карбоновая кислота (I-98)
Стадия 1. Получение метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидрокси-2-метилпропил)-1Н-индол-6-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (пример 5) (100 мг, 0,239 ммоль) с метил-4-бром-1-(2-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1H-индол-6-карбоксилатом (126 мг, 0,287 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (21 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и триэтиламином (0,2 мл, 1,44 ммоль) с получением промежуточного соединения метил-4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидроксиэтил)-1H-индол-6-карбоксилата (44,4 мг, 28%).
1H-ЯМР (DMSO, 400 МГц): δ 8,27 (s, 1H), 7,77 (d, 1H), 7,66-7,8 (m, 4Н), 7,56-7,54 (t, 1H), 7,12-7,11 (d, 1H), 6,96(s, 3H), 6,68-6,84 (m, 1H), 6,70-6,69 (d, 1H), 4,99 (s, 2Н), 4,74 (s, 1H), 4,19 (s, 2Н), 1,23-1,14 (m, 4Н), 1,09 (s, 6Н).
Стадия 2. Получение 4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидрокси-2-метилпропил)-1H-индол-6-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (44,4 мг, 0,066 ммоль) с гидроксидом лития (27 мг, 0,66 ммоль) с получением указанного в заголовке соединения (39 мг, 91%).
1Н-ЯМР (DMSO, 400МГц): δ 8,27 (s, 1H), 7,77 (d, 1H), 7,66-7,8 (m, 4Н), 7,56-7,54 (t, 1H), 7,12-7,11 (d, 1H), 6,68-6,84 (m, 1H), 6,70-6,69 (d, 1H), 4,99 (s, 2Н), 4,74 (s, 1H), 4,19 (s, 2Н), 1,23-1,14 (m, 4Н), 1,09 (s, 6Н).
<Пример 99> 6-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-4-карбоновая кислота (I-99)
Стадия 1. Получение 1-(трет-бутил)-4-метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-1,4-дикарбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (118 мг, 0,28 ммоль) с 1-(трет-бутил)-4-метил-6-бром-1H-индазол-1,4-дикарбоксилатом (100 мг, 0,28 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) ((PdCl2(PPh3)2, 20 мг, 0,028 ммоль), йодидом меди(I) (2,6 мг, 0,014 ммоль) и триэтиламином (0,08 мл, 0,56 ммоль) с получением промежуточного соединения 1-(трет-бутил)-4-метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-1,4-дикарбоксилата (74 мг, 38%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,63 (s, 1H), 8,55 (s, 1H), 8,09 (d, 1H), 7,37-7,33 (m, 3H), 7,29-7,25 (m, 1H), 6,82 (d, 1H), 6,65 (dd, 1H), 4,76 (s, 2Н), 3,96 (s, 3H), 2,11-2,07 (m, 1H), 1,67 (s, 9Н), 1,26-1,22 (m, 2Н), 1,17-1,10 (m, 2Н).
Стадия 2. Получение метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 89 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (74 мг, 0,11 ммоль) с трифторуксусной кислотой (0,2 мл, 2,7 ммоль) с получением промежуточного соединения метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-4-карбоксилата (36 мг,55%).
1H-ЯМР (CDCl3, 400 МГц): δ 8,62 (s, 1H), 8,11 (s, 1H), 7,90 (s, 1H), 7,50-7,34 (m, 4H), 6,91 (d, 1H), 6,74 (dd, 1H), 4,85 (s, 2H), 4,06 (s, 3H), 2,20-2,14 (m, 1H), 1,35-1,30 (m, 2H), 1,22-1,17 (m, 2H).
Стадия 3. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индазол-4-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (36 мг, 0,06 ммоль) с гидроксидом лития (25 мг, 0,6 ммоль) с получением указанного в заголовке соединения (35 мг, 100%).
1H-ЯМР (DMSO, 400 МГц): δ 13,57 (s, 1H), 8,42 (s, 1H), 7,97 (s, 1H), 7,83 (d, 1H), 7,65-7,54 (m, 4Н), 7,11 (d, 1H), 6,86 (dd, 1H), 4,99 (s, 2Н), 2,46 (m, 1H), 1,30-1,21 (m, 2Н), 1,16-1,12 (m, 2Н).
<Пример 100> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-дигидробензофуран-7-карбоновая кислота (I-100)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-дигидробензофуран-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,23 ммоль) с метил-3-бром-2,3-дигидробензофуран-7-карбоксилатом (61 мг, 0,23 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 8 мг, 0,01 ммоль), йодидом меди(I) (2,2 мг, 0,01 ммоль) и триэтиламином (0,1 мл, 0,71 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этил)-2,3-дигидробензофуран-7-карбоксилата (50 мг, 37%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,93 (s, 1H), 7,76-7,71 (m, 1H), 7,52-7,50 (m, 1H), 7,44-7,33 (m, 5Н), 6,99 (s, 1H), 6,69 (dd, 1H), 4,81 (s, 2Н), 4,78 (t, 2Н), 3,91 (s, 3H), 3,26 (t, 2Н), 2,17-2,13 (m, 1H), 1,32-1,28 (m, 2Н), 1,19-1,14 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3,(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-дигидробензофуран-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1(стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (50 мг, 0,08 ммоль) с гидроксидом лития (35 мг, 0,84 ммоль) с получением указанного в заголовке соединения (27 мг, 56%).
1Н-ЯМР (DMSO, 400 МГц): δ 7,95 (s, 1H), 7,70-7,48 (m, 5Н), 7,09 (s, 1H), 6,82 (dd, 1H), 4,97 (s, 2Н), 4,67 (t, 2Н), 3,26-3,14 (t, 3H), 1,24-1,12 (m, 2Н), 0,87-0,84 (m, 2Н).
<Пример 101> 6-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-4-карбоновая кислота (I-101)
Стадия 1. Получение 1-(трет-бутил)-4-метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-1,4-дикарбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (354 мг, 0,846 ммоль) с 1-(трет-бутил)-4-метил-6-бром-1H-индол-1,4-дикарбоксилатом (100 мг, 0,282 ммоль) с йодидом меди(I) (5,3 мг, 0,028 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 40 мг, 0,056 ммоль) и триэтиламином (0,2 мл, 1,411 ммоль) с получением промежуточного соединения 1-(трет-бутил)-4-метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-1,4-дикарбоксилата (74 мг, 38%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,18 (d, 1H), 8,32 (s, 1H), 7,48-7,45 (m, 4Н), 7,42-7,38 (m, 1H), 7,16 (s, 1H), 6,89 (d, 1H), 6,72-6,69 m, 1H), 4,83 (s, 2Н), 3,94 (s, 3H), 2,20-2,15 (m, 1H), 1,62 (s, 9Н), 1,33-1,31 (m, 2Н), 1,20-1,17 (m, 2Н).
Стадия 2. Получение метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 89 (стадия 2). Таким образом, проводили реакцию промежуточного соединения (стадия 1) (74 мг, 0,108 ммоль) с трифторуксусной кислотой (0,2 мл) с получением промежуточного соединения метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-4-карбоксилата (29 мг, 45%).
1Н-ЯМР (CDCl3, 400 МГц): δ 9,56 (s, 1H), 8,07 (d, 1H), 7,78 (s, 1H), 7,43-7,41 (m, 4Н), 7,37-7,33 (m, 1H), 7,15 (s, 1H), 6,88 (d, 1H), 6,71-6,68 (m, 1H), 4,83 (s, 2Н), 3,99 (s, 3H), 2,19-2,15 (m, 1H), 1,32-1,28 (m, 2Н), 1,20-1,15 (m, 2Н).
Стадия 3. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1H-индол-4-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию промежуточного соединения (стадия 2) (29 мг, 0,049 ммоль) с гидроксидом лития (20 мг, 0,489 ммоль) с получением указанного в заголовке соединения (19 мг, 67%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,45 (s, 1H), 8,19 (d, 1H), 7,82 (s, 1H), 7,46-7,42 (m, 4Н), 7,36-7,32 (m, 1H), 6,88 (d, 1H), 6,71-6,68 (dd, 1H), 4,82 (s, 1H), 2,18-2,14 (m, 1H), 2,32-1,24 (m, 4Н).
<Пример 102> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновая кислота (I-102)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (пример 5) (127,2 мг, 0,30 ммоль) с метил-5-бромбензо[d]оксазол-7-карбоксилатом (77,8 мг, 0,30 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 34,7 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и N,N-диизопропилэтиламином (63 мкл, 0,36 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоксилата (31 мг, 17%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,24-8,22 (m, 2Н), 8,14 (d, 1H), 7,74-7,40 (m, 2Н), 7,36-7,31(m, 2Н), 6,89 (d, 1H), 6,70 (dd, 1H), 4,83 (s, 2Н), 4,04 (s, 3H), 2,18-2,14 (m, 1H), 1,33-1,26 (m, 2Н), 1,24-1,15(m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (31 мг, 0,05 ммоль) с гидроксидом лития (22 мг, 0,52 ммоль) с получением указанного в заголовке соединения (20 мг, 69%).
1Н-ЯМР (MeOD4, 400 МГц): δ 8,42 (s, 1H), 8,36 (s, 1H), 7,77 (s, 1H), 7,53-7,44 (m, 3H), 7,40-7,37(m, 1H), 6,88 (d, 1H), 6,73 (dd, 1H), 4,93 (s, 2Н), 2,36-2,33(m, 1H), 1,34-1,20 (m,4Н).
<Пример 103> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-7-карбоновая кислота (I-103)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (100 мг, 0,24 ммоль) с метил-5-бром-2-метилбензо[d]оксазол-7-карбоксилатом (64 мг, 0,24 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 23 мг, 0,02 ммоль), йодидом меди(I) (3,8 мг, 0,02 ммоль) и N,N-диизопропилэтиламином (50 мкл, 0,28 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-7-карбоксилата (44,2 мг, 30%).
1H-ЯМР (CDCl3, 400 МГц): δ 8,24-8,22 (m, 2Н), 8,14 (d, 1H), 7,74-7,40 (m, 2Н), 7,36-7,3l (m, 2Н), 6,89 (d, 1H), 6,70 (dd, 1H), 4,83 (s, 2Н), 4,04 (s, 3H), 2,18-2,14 (m, 1H), 1,33-1,26 (m, 2Н), 1,24-1,15(m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (44 мг, 0,073 ммоль) с гидроксидом лития (30,4 мг, 0,73 ммоль) с получением указанного в заголовке соединения (30 мг, 69%).
1H-ЯМР (MeOD4, 400 МГц): δ 8,42 (s, 1H), 8,36 (s, 1H), 7,77 (s, 1H), 7,53-7,44 (m, 3H), 7,40-7,37 (m, 1H), 6,88 (d, 1H), 6,73 (dd, 1H), 4,93 (s, 2Н), 2,36-2,33 (m, 1H), 1,34-1,20 (m, 4Н).
<Пример 104> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]1оксазол-7-карбоновая кислота (I-104)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол (пример 5) (143,7 мг, 0,34 ммоль) с метил-5-бром-2-этилбензо[d]оксазол-7-карбоксилатом (97,5 мг, 0,34 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 34,7 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и N,N-диизопропилэтиламином (71 мкл, 0,41 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-7-карбоксилата (45,9 мг, 22%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,12 (s, 1H), 7,99 (s, 1H), 7,44-7,40 (m, 3H), 7,36-7,33(m, 1H), 6,86 (d, 1H), 6,68 (dd, 1H), 4,83 (s, 2Н), 4,02 (s, 3H), 3,04 (q, 2Н), 2,19-2,14 (m, 1H), 1,49 (t, 3H), 1,29-1,25 (m, 2Н), 1,19-1,16 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (45 мг, 0,07 ммоль) с гидроксидом лития (30,4 мг, 0,72 ммоль) с получением указанного в заголовке соединения (24 мг, 56,3%).
1Н-ЯМР (MeOD4, 400 МГц): δ 8,05 (s, 1H), 7,96 (s, 1H), 7,56-7,53 (m, 2Н), 7,50-7,46(m, 2Н), 6,95 (s, 1H), 6,79 (d, 1H), 3,07 (q, 2Н), 2,40-2,36(m, 1H), 1,48 (t, 3H), 1,26-1,23 (m, 4Н).
<Пример 105> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-7-карбоновая кислота (I-105)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (130 мг, 0,31 ммоль) с метил-5-бром-2-пропилбензо[d]оксазол-7-карбоксилатом (92,2 мг, 0,31 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 34,7 мг, 0,03 ммоль), йодидом меди(I) (5,7 мг, 0,03 ммоль) и N,N-диизопропилэтиламином (64,8 мкл, 0,37 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-7-карбоксилата (88,4 мг, 45%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,11 (dd, 1H), 7,99 (dd, 1H), 7,44-7,40 (m, 3H), 7,36-7,32(m, 1H), 6,88 (d, 1H), 6,70 (dd, 1H), 4,83 (s, 2Н), 4,02 (s, 3H), 3,01-2,96 (m, 2Н), 2,20-2,14 (m, 1H), 2,13-1,91(m, 2Н), 1,33-1,29 (m, 2Н), 1,20-1,19 (m, 2Н), 1,17 (t, 3H).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (88 мг, 0,14 ммоль) с гидроксидом лития (58 мг, 1,4 ммоль) с получением указанного в заголовке соединения (61 мг, 70%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,68 (br s, 1H), 8,08 (d, 1H), 7,93 (d, 1H), 7,65-7,63 (m, 2Н), 7,59-7,54 (m, 2Н), 7,11 (d, 1H), 6,85 (dd, 1H), 4,99 (s, 2Н), 2,99 (t, 2Н), 1,91-1,80 (m, 2Н), 1,26-1,12 (m, 4Н), 1,02 (t, 3H).
<Пример 106> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-7-карбоновая кислота (I-106)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (326 мг, 0,78 ммоль) с метил-5-бром-2-изопропилбензо[d]оксазол-7-карбоксилатом (232 мг, 0,78 ммоль), тетракис(трифенилфосфин)палладием(0) (Pd(PPh3)4, 92,4 мг, 0,08 ммоль), йодидом меди(I) (15,2 мг, 0,08 ммоль) и N,N-диизопропилэтиламином (0,16 мл, 0,94 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-7-карбоксилата (210 мг, 64%).
1H-ЯМР (CDCl3, 400 МГц): δ 7,44-7,39 (m, 4Н), 7,36-7,31 (m, 2Н), 6,88 (s, 1H), 6,66-6,64 (m, 1H), 4,82 (s, 2Н), 4,02 (s, 3H), 3,35-3,31 (m, 1H), 2,16-2,13 (m, 1H), 1,50 (d, 6Н), 1,31-1,24 (m, 2Н), 1,99-1,16 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (86 мг, 0,14 ммоль) с гидроксидом лития (56,7 мг, 1,4 ммоль) с получением указанного в заголовке соединения (74 мг, 85%).
1Н-ЯМР (MeOD4, 400 МГц): δ 7,91 (s, 1H), 7,77 (s, 1H), 7,40-7,30 (m, 4Н), 6,79 (s, 1H), 6,64 (d, 1H), 4,84 (s, 2Н), 3,25-3,22 (m, 1H), 2,24-2,23 (m, 1H), 1,36 (d, 6Н), 1,17-1,10 (m, 4Н).
<Пример 107> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(гидроксиметил)бензо[d]оксазол-7-карбоновая кислота (I-107)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(метоксиметил)бензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (224 мг, 0,53 ммоль) с метил-5-бром-2-(метоксиметил)бензо[d]оксазол-7-карбоксилатом (145,9 мг, 0,49 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 17,2 мг, 0,025 ммоль), йодидом меди(I) (4,8 мг, 0,025 ммоль) и триэтиламином (82,2 мкл, 0,59 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(метоксиметил)бензо[d]оксазол-7-карбоксилата (108 мг, 35%).
1Н-ЯМР (CDCl3, 400 МГц): δ 7,75 (s, 1H), 7,48 (s, 1H), 7,47-7,31 (m, 4Н), 6,86 (s, 1H), 6,67 (dd, 1H), 4,81 (s, 2Н), 4,66 (s, 2Н), 3,92 (s, 3H), 3,89 (s, 3H), 2,22-2,10 (m, 1H), 1,54-1,29 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(гидроксиметил)бензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (50 мг, 0,08 ммоль) с гидроксидом лития (32,9 мг, 0,8 ммоль) с получением указанного в заголовке соединения (35 мг, 72%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,17 (br, 1H), 7,65-7,62 (m, 2Н), 7,57-7,53 (m, 2Н), 7,43 (d, 1H), 7,13 (d, 1H), 7,09 (d, 1H), 6,82 (dd, 1H), 4,99 (s, 2Н), 4,71 (s, 2Н), 1,24-1,12 (m, 4Н).
<Пример 108> 7-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)хиноксалин-5-карбоновая кислота (I-108)
Стадия 1. Получение метил-7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)хиноксалин-5-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-7-бромхиноксалин-5-карбоксилатом (138 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)хиноксалин-5-карбоксилата (223 мг, 71%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,95 (s, 1H), 8,91 (s, 1H), 8,38 (s, 1H), 8,24 (s, 1H), 7,48-7,23 (m, 4Н), 6,91 (d, 1H), 6,73 (d, 1H), 4,84 (s, 2Н), 4,06 (s, 3H), 2,18 (m, 1H), 1,27-1,20 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)хиноксалин-5-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (223 мг, 0,37 ммоль) с гидроксидом лития (155 мг, 3,7 ммоль) с получением указанного в заголовке соединения (46 мг, 21%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,99 (s, 1H), 9,12 (s, 1H), 8,24 (s, 1H), 7,66-7,63 (m, 3H), 7,56-7,54 (m, 1H), 7,14 (d, 1H), 6,89 (d, 1H), 5,01 (s, 2Н), 2,51 (m, 1H), 1,21-1,15 (m, 4Н).
<Пример 109> 7-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-диметилхиноксалин-5-карбоновая кислота (I-109)
Стадия 1. Получение метил-7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-диметилхиноксалин-5-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-7-бром-2,3-диметилхиноксалин-5-карбоксилатом (153 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-диметилхиноксалин-5-карбоксилата (190 мг, 65%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,24 (d, 1H), 8,11 (d, 1H), 7,45-7,32 (m, 4Н), 6,89 (d, 1H), 6,72-6,70 (dd, 1H), 4,84 (s, 2Н), 4,04 (s, 3H), 2,76 (s, 3H), 2,73 (s, 3H), 2,16 (m, 1H), 1,30-1,24 (m, 2Н), 1,20-1,16 (m, 2Н).
Стадия 2. Получение 7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-диметилхиноксалин-5-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (190 мг, 0,31 ммоль) с гидроксидом лития (130 мг, 3,1 ммоль) с получением указанного в заголовке соединения (63 мг, 33%).
1Н-ЯМР (DMSO, 400 МГц): δ 14,52 (s, 1H), 8,31 (d, 1H), 8,25 (d, 1H), 7,64-7,62 (m, 3H), 7,58-7,54 (m, 1H), 7,13 (d, 1H), 6,88 (m, 1H), 5,01 (s, 2Н), 2,77 (s, 3H), 2,67 (s, 3H), 2,51 (m, 1H), 1,21-1,14 (m, 2Н).
<Пример 110> 5-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-циклопропилбензо[d]оксазол-7-карбоновая кислота (I-110)
Стадия 1. Получение метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-циклопропилбензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (182 мг, 0,43 ммоль) с метил-5-бром-2-циклопропилбензо[d]оксазол-7-карбоксилатом (117 мг, 0,40 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 14 мг, 0,02 ммоль), йодидом меди(I) (3,8 мг, 0,02 ммоль) и триэтиламином (67 мкл, 0,48 ммоль) с получением промежуточного соединения метил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-циклопропилбензо[d]оксазол-7-карбоксилата (121 мг, 48%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,06 (d, 1H), 7,90 (d, 1H), 7,43-7,40 (m, 3H), 7,36-7,31 (m, 1H), 6,88 (d, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 4,00 (s, 3H), 2,32-2,24 (m, 1H), 2,20-2,12 (m, 1H), 1,38-1,33 (m, 2Н), 1,32-1,27 (m, 2Н), 1,26-1,23 (m, 2Н), 1,19-1,15 (m, 2Н).
Стадия 2. Получение 5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-циклопропилбензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (120 мг, 0,19 ммоль) с гидроксидом лития (79,4 мг, 1,9 ммоль) с получением указанного в заголовке соединения (102 мг, 87,4%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,6 (br s, 1H), 7,99 (d, 1H), 7,97 (d, 1H), 7,87-7,62 (m, 2Н), 7,57-7,55 (m, 2Н), 7,09 (d, 1H), 6,83 (dd, 1H), 4,98 (s, 2Н), 2,39-2,30 (m, 1H), 1,26-1,12 (m, 8Н).
<Пример 111> 2-Бутил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновая кислота (I-111)
Стадия 1. Получение метил-2-бутил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (339,3 мг, 0,81 ммоль) с метил-5-бром-2-бутилбензо[d]оксазол-7-карбоксилатом (230 мг, 0,74 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 26 мг, 0,037 ммоль), йодидом меди(I) (7 мг, 0,037 ммоль) и триэтиламином (0,12 мл, 0,89 ммоль) с получением промежуточного соединения метил-2-бутил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоксилата (260 мг, 54%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,11 (d, 1H), 7,98 (d, 1H), 7,44-7,40 (m, 3H), 7,36-7,32 (m, 1H), 6,88 (s, 1H), 6,69 (dd, 1H), 4,82 (s, 2Н), 4,02 (s, 3H), 3,01 (t, 2Н), 2,16-2,14 (m, 1H), 1,93-1,89 (m, 2Н), 1,55-1,40 (m, 2Н), 1,31-1,22 (m, 2Н), 1,20-1,11 (m, 2Н), 1,61 (t, 3H).
Стадия 2. Получение 2-бутил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (260 мг, 0,40 ммоль) с гидроксидом лития (167,9 мг, 4 ммоль) с получением указанного в заголовке соединения (203 мг, 80%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,67 (br s, 1H), 8,06 (d, 1H), 7,91 (d, 1H), 7,68-7,61 (m, 2Н), 7,59-7,54 (m, 2Н), 7,09 (d, 1H), 6,85 (dd, 1H), 4,80 (s, 2Н), 2,99 (t, 2Н), 2,10-2,04 (m, 1H), 1,91-1,88 (m, 2Н), 1,52-1,38 (m, 2Н), 1,21-1,17 (m, 2Н), 1,17-1,13 (m, 2Н), 1,01 (t, 3H).
<Пример 112> 6-((2-Хлор-4-((5-циклопропил-3-(2.,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метил бензо [d]оксазол-4-карбоновая кислота (I-112)
Стадия 1. Получение метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-6-бром-2-метилбензо[d]оксазол-4-карбоксилатом (140 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-4-карбоксилата (164 мг, 52%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,15 (d, 1H), 7,81 (d, 1H), 7,81-7,26 (m, 4Н), 6,89 (d, 1H), 6,72-6,69 (dd, 1H), 4,83 (s, 2Н), 4,04 (s, 3H), 3,09-3,04 (m, 3H), 2,14-2,04 (m, 1H), 1,32-1,17 (m, 4Н).
Стадия 2. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-4-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (164 мг, 0,27 ммоль) с гидроксидом лития (113 мг, 2,7 ммоль) с получением указанного в заголовке соединения (34 мг, 21%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,33 (s, 1H), 8,11 (d, 1H), 7,93 (d, 1H), 7,64-7,52 (m, 4Н), 7,10 (d, 1H), 6,86-6,83 (dd, 1H), 5,02 (s, 2Н), 3,06-3,00 (m, 3H), 1,23-1,08 (m, 4Н).
<Пример 113> 6-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-4-карбоновая кислота (I-113)
Стадия 1. Получение метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-6-бром-2-этилбензо[d]оксазол-4-карбоксилатом (148 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-4-карбоксилата (200 мг, 62%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,15 (d, 1H), 7,81 (d, 1H), 7,81-7,26 (m, 4Н), 6,89 (d, 1H), 6,72-6,69 (dd, 1H), 4,83 (s, 2Н), 4,04 (s, 3H), 3,09-3,04 (m, 2Н), 2,14-2,04 (m, 1H), 1,47 (q, 3H), 1,32-1,17 (m, 4Н).
Стадия 2. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-4-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (200 мг, 0,32 ммоль) с гидроксидом лития (134 мг, 3,2 ммоль) с получением указанного в заголовке соединения (35 мг, 18%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,33 (s, 1H), 8,11 (d, 1H), 7,93 (d, 1H), 7,64-7,52 (m, 4Н), 7,10 (d, 1H), 6,86-6,83 (dd, 1H), 5,02 (s, 2Н), 3,06-3,00 (m, 2Н), 1,38-1,14 (q, 3H), 1,23-1,08 (m, 4Н).
<Пример 114> 6-((2-Хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-4-карбоновая кислота (I-114)
Стадия 1. Получение метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-6-бром-2-пропилбензо[d]оксазол-4-карбоксилатом (155 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-4-карбоксилата (191 мг, 58%).
1Н-ЯМР (CDCl3, 400 МГц): δ 8,15 (d, 1H), 7,81 (d, 1H), 7,43-7,26 (m, 4Н), 6,89 (d, 1H), 6,71-6,69 (dd, 1H), 4,83 (s, 2Н), 4,03 (s, 3H), 3,01 (q, 2Н), 2,18-2,14 (m, 1H), 1,97-1,91 (m, 2Н), 1,32-1,19 (m, 4Н), 1,20-1,17 (m, 3H).
Стадия 2. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-4-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (191 мг, 0,30 ммоль) с гидроксидом лития (130 мг, 3,0 ммоль) с получением указанного в заголовке соединения (37 мг, 20%).
1Н-ЯМР (DMSO, 400 МГц): δ 13,34 (s, 1H), 8,11 (d, 1H), 7,94 (d, 1H), 7,64-7,53 (m, 4Н), 7,11 (d, 1H), 6,86-6,83 (dd, 1H), 4,99 (s, 2Н), 2,98 (q, 2Н), 1,87-1,81 (m, 2Н), 1,23-1,13 (m, 4Н), 1,01 (q, 3H).
<Пример 115> 6-((2-Хлор-4-((5-циклопропил-3-(2.,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-4-карбоновая кислота (I-115)
Стадия 1. Получение метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-4-карбоксилата
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 5). Таким образом, проводили реакцию 4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазола (пример 5) (200 мг, 0,52 ммоль) с метил-6-бром-2-изопропилбензо[d]оксазол-4-карбоксилатом (148 мг, 0,52 ммоль), дихлоридом бис(трифенилфосфин)палладия(II) (PdCl2(PPh3)2, 42 мг, 0,06 ммоль), йодидом меди(I) (11,4 мг, 0,06 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU, 0,4 мл, 2,6 ммоль) с получением промежуточного соединения метил-6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-4-карбоксилата (158 мг, 48%).
1H-ЯМР (CDCl3, 400 МГц): δ 8,15 (d, 1H), 7,81 (d, 1H), 7,43-7,26 (m, 4Н), 6,89 (d, 1H), 6,71-6,69 (dd, 1H), 4,83 (s, 2Н), 4,03 (s, 3H), 2,18-2,14 (m, 2Н), 1,32-1,19 (m, 8Н).
Стадия 2. Получение 6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-4-карбоновой кислоты
Данное соединение получали с применением процедуры, описанной для примера 1 (стадия 6). Таким образом, проводили реакцию данного промежуточного соединения (стадия 1) (158 мг, 0,25 ммоль) с гидроксидом лития (105 мг, 2,5 ммоль) с получением указанного в заголовке соединения (37 мг, 24%).
1H-ЯМР (DMSO, 400 МГц): δ 13,34 (s, 1H), 8,11 (d, 1H), 7,94 (d, 1H), 7,64-7,53 (m, 4Н), 7,11 (d, 1H), 6,86-6,83 (dd, 1H), 4,99 (s, 2Н), 2,49 (m, 2Н), 1,23-1,13 (m, 8Н).
<Эксперимент 1> Тест in vitro на активность в отношении FXR
Для оценивания согласно тесту in vitro соединения по настоящему изобретению (с I-1 по I-115) определяли следующим образом, и данные показаны в таблице 1.
1. Определение активности в отношении FXR в клетке
Репортерный анализ в отношении FXR проводили для измерения активности в отношении FXR соединений согласно настоящему изобретению в клетке. Клетки, несущие репортерный ген для FXR, с высоким уровнем экспрессии человеческого FXR высевали в 96-луночные планшеты для культур клеток и инкубировали в течение 1~2 часов при 37°C в атмосфере с 5% CO2. Соединения по настоящему изобретению, разбавленные в DMSO, с разными концентрациями добавляли в 96-луночные планшеты для культур клеток и их инкубировали в течение 24 часов при 37°С в атмосфере с 5% CO2. После инкубации авторы настоящего изобретения рассчитывали ЕС50 с использованием субстрата для люциферазы. Рассчитывали Емакс. соединений согласно настоящему изобретению, где Емакс. для GW-4064, полного агониста FXR, составляет 100%.

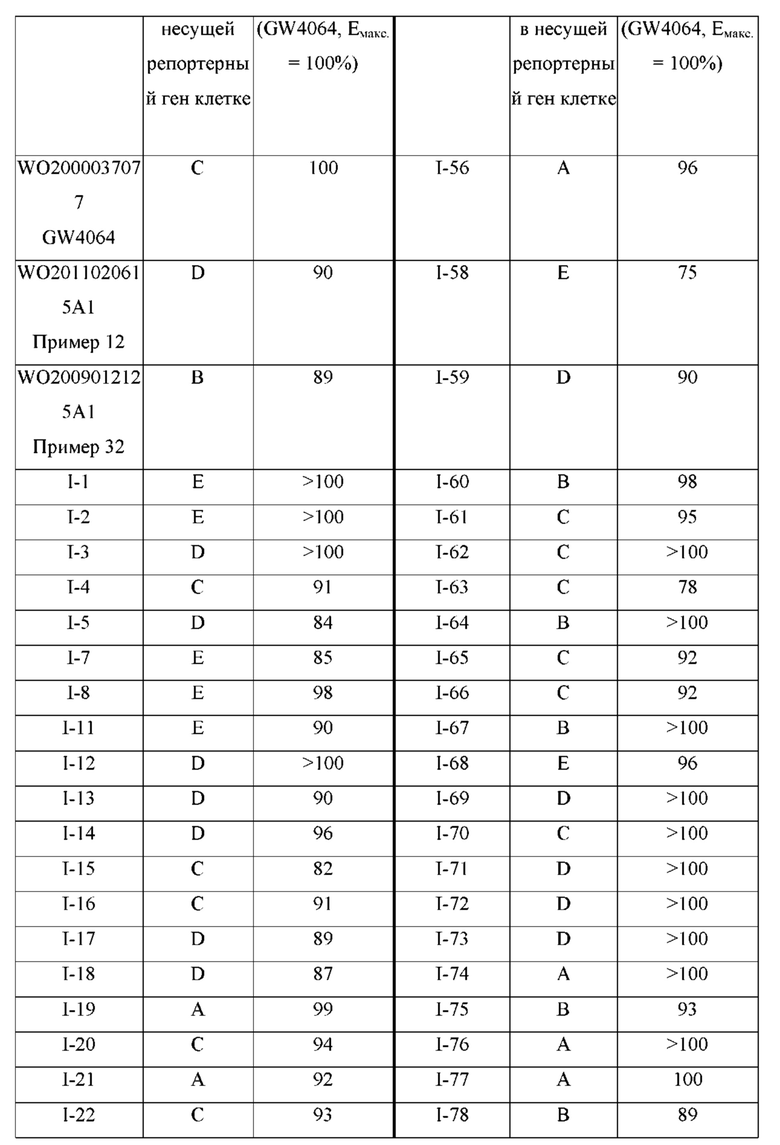
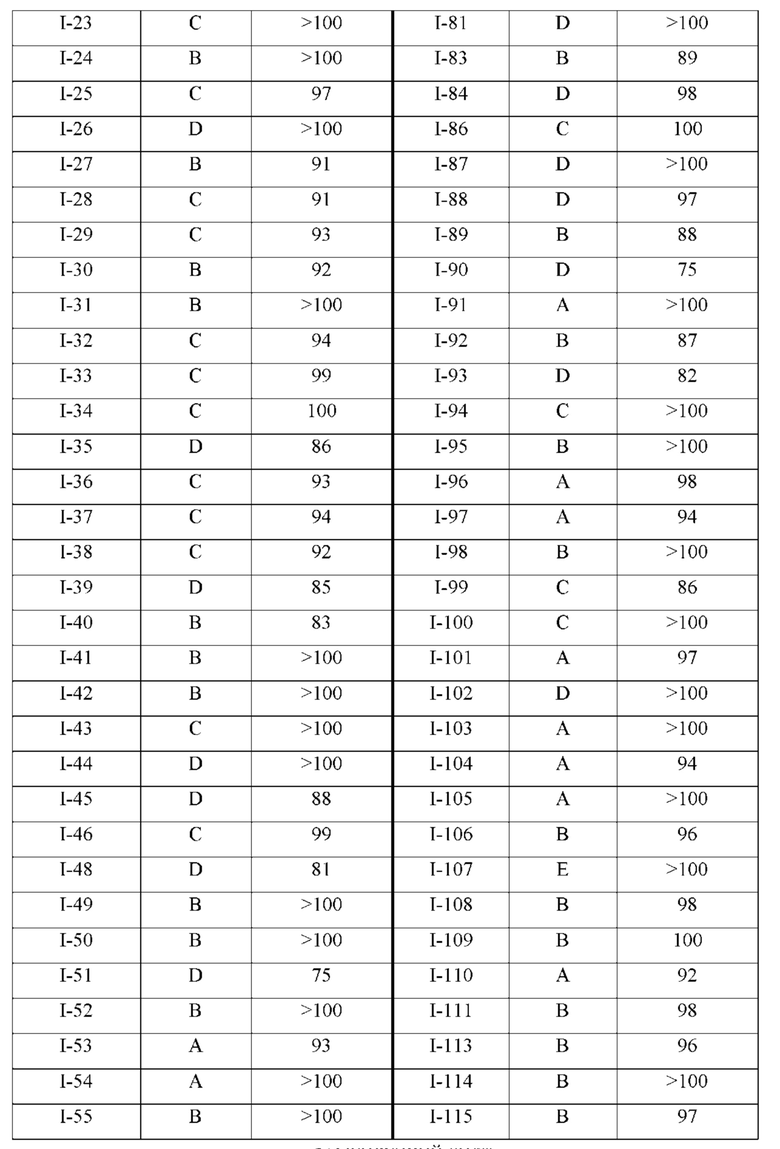
Диапазон А: ЕС50≤20
Диапазон В: 20<ЕС50≤60
Диапазон С: 60<ЕС50≤200
Диапазон D: 200<ЕС50≤1000
Диапазон Е: 1000<ЕС50
В соответствии с приведенной выше таблицей 1 авторы настоящего изобретения подтвердили, что соединения согласно настоящему изобретению являлись агонистами FXR, исходя из клеточного анализа. Соединения с повышенной активностью в отношении FXR в клетке проявляли лучшую активность, чем GW-4064, полный агонист FXR.
<Эксперимент 2> Фармакокинетические параметры в мышиной модели
Для оценки согласно тесту в отношении фармакокинетических параметров 18 соединений по настоящему изобретению из примеров определяли следующим образом. Образцы крови собирали в моменты времени 15, 30, 60, 120, 240, 480, 1140 мин. Количественное определение проводили с помощью способа LC-MS/MS, специфического в отношении выбранного соединения. Фармакокинетические параметры рассчитывали с использованием программного обеспечения WinNonLinnon для блочного анализа.
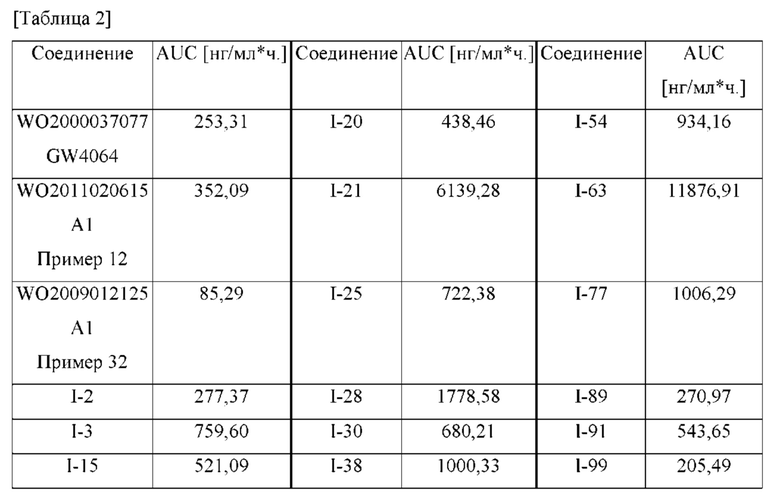

Как можно видеть из таблицы 2, выбранные соединения проявляют значительные фармакокинетические параметры при использовании самцов мышей Balb/c.
| название | год | авторы | номер документа |
|---|---|---|---|
| Соединение на основе оксазолидина и содержащий его селективный агонист андрогенового рецептора | 2015 |
|
RU2702001C2 |
| НОВЫЕ СОЕДИНЕНИЯ КОНДЕНСИРОВАННЫХ ГЕТЕРОЦИКЛИЛ-КАРБОНОГИДРАЗОНОИЛДИЦИАНИДОВ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2826002C1 |
| БЛОКАТОРЫ НАТРИЕВЫХ КАНАЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2645711C2 |
| 2-ЦИАНОПИРИМИДИН-4-ИЛКАРБАМАТ, ИЛИ ПРОИЗВОДНОЕ МОЧЕВИНЫ, ИЛИ ЕГО СОЛЬ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2019 |
|
RU2788740C2 |
| Новые соединения пиридопиримидинона для модулирования каталитической активности гистонлизиндеметилаз (KDMS) | 2015 |
|
RU2684396C2 |
| БИАРИЛЬНОЕ ПРОИЗВОДНОЕ В КАЧЕСТВЕ АГОНИСТА GPR120 | 2015 |
|
RU2683648C2 |
| НОВЫЕ АМИНОАЛКИЛБЕНЗОТИАЗЕПИНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2679891C2 |
| ПРОИЗВОДНОЕ ПИРИМИДИНА, ПОДАВЛЯЮЩЕЕ РОСТ РАКОВОЙ КЛЕТКИ, И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2792849C1 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2724100C2 |
| ИЗОИНДОЛИНОНОВЫЕ ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ MDM2-P53, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2794333C1 |
Изобретение относится к соединению, представленному формулой I, или его фармацевтически приемлемой соли, которые могут найти применение в качестве агонистов фарнезоид-Х-рецептора. В формуле I Y представляет собой углерод; каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил; Z представляет собой 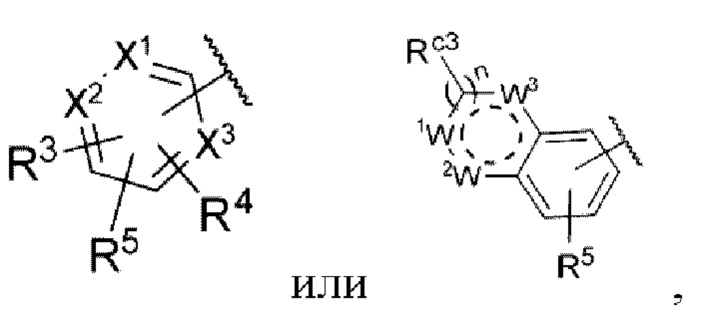 n равняется 0, 1 или 2; каждый из X1, X2 и X3 независимо представляет собой углерод или азот; каждый из R3 и R4 независимо представляет собой водород, галоген, циано, C1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,
n равняется 0, 1 или 2; каждый из X1, X2 и X3 независимо представляет собой углерод или азот; каждый из R3 и R4 независимо представляет собой водород, галоген, циано, C1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 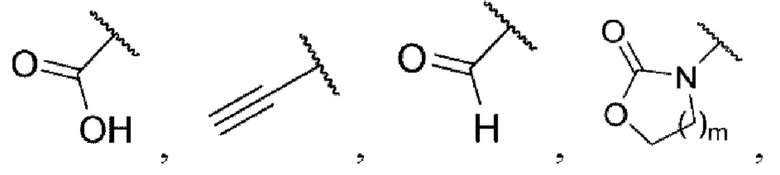 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота, где m равняется 1 или 2; каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота; Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота, где m равняется 1 или 2; каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота; Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота; Ra4 представляет собой водород или С1-6алкил; R5 представляет собой водород,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота; Ra4 представляет собой водород или С1-6алкил; R5 представляет собой водород, 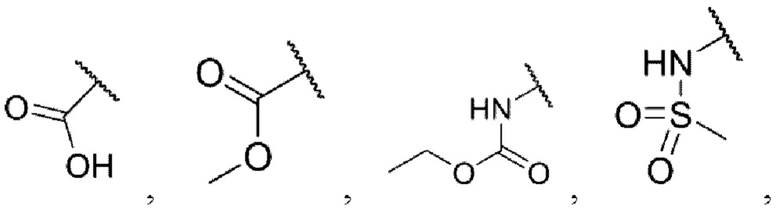
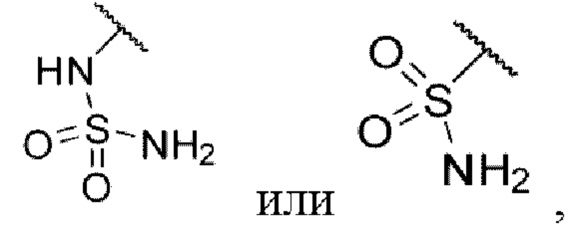 каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси; Rc3 представляет собой водород или С1-6алкил; каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CRw1 или NRw1, где Rw1 представляет собой водород, С1-6алкил, С3-6циклоалкил, С1-6алкиламин, С1-6алкиловый спирт,
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси; Rc3 представляет собой водород или С1-6алкил; каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CRw1 или NRw1, где Rw1 представляет собой водород, С1-6алкил, С3-6циклоалкил, С1-6алкиламин, С1-6алкиловый спирт, 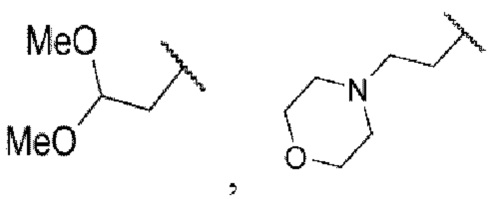 или (СН2)ргетероарил, где гетероарил представляет собой 6-членное моноциклическое кольцо с одним атомом азота, и р равняется 1, 2 или 3. Изобретение относится также к фармацевтической композиции для воздействия на фарнезоид-Х-рецептор, содержащей указанное соединение формулы I или его фармацевтически приемлемую соль. 3 н. и 4 з.п. ф-лы, 2 табл., 115 пр.
или (СН2)ргетероарил, где гетероарил представляет собой 6-членное моноциклическое кольцо с одним атомом азота, и р равняется 1, 2 или 3. Изобретение относится также к фармацевтической композиции для воздействия на фарнезоид-Х-рецептор, содержащей указанное соединение формулы I или его фармацевтически приемлемую соль. 3 н. и 4 з.п. ф-лы, 2 табл., 115 пр.
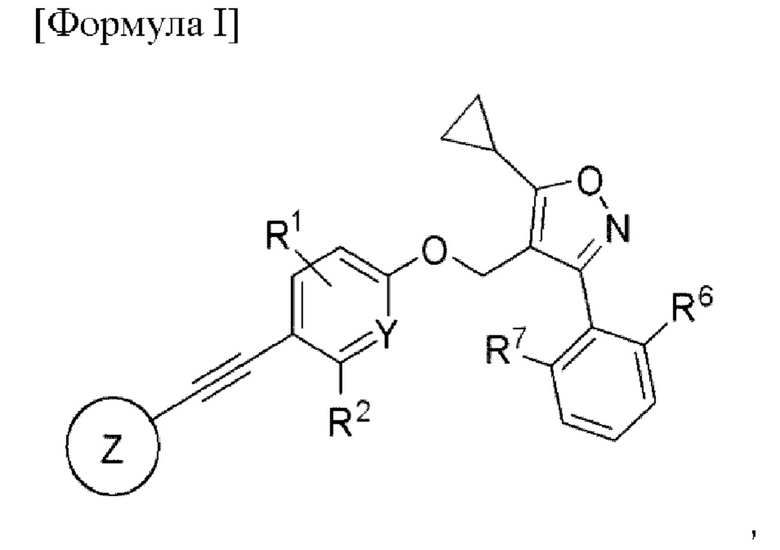
1. Соединение, представленное формулой I, или его фармацевтически приемлемая соль
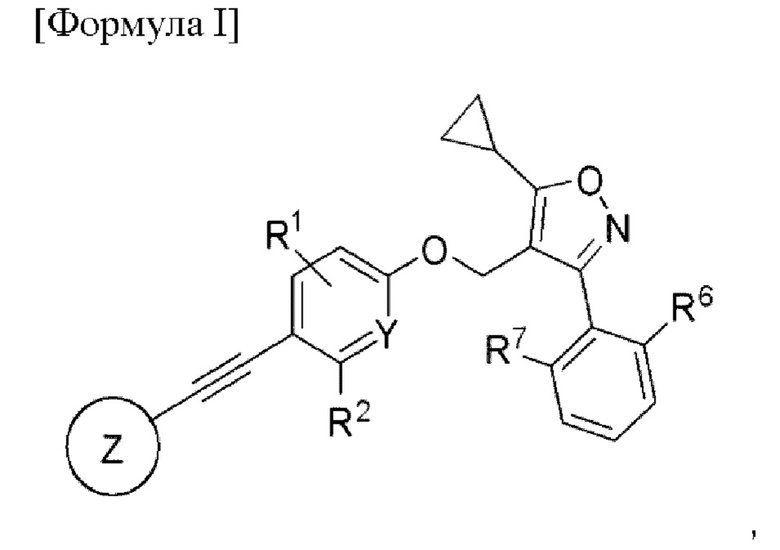
при этом в представленной формуле I
Y представляет собой углерод,
каждый из R1 и R2 независимо представляет собой водород, галоген или трифторметил,
Z представляет собой 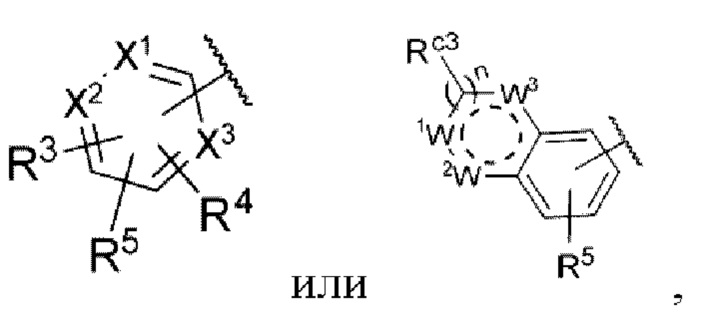
n равняется 0, 1 или 2,
каждый из X1, X2 и X3 независимо представляет собой углерод или азот,
каждый из R3 и R4 независимо представляет собой водород, галоген, циано, C1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 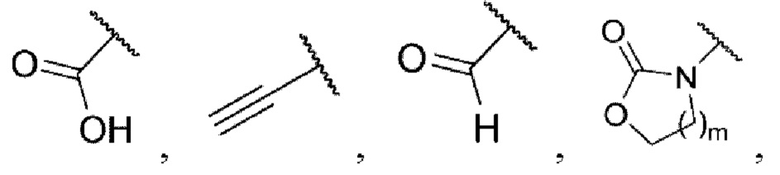 CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
CONRa1Ra2, NRa1Ra2, CH2NRa1Ra2, CH2Rc3, CORa3, ORa3, NRa4CORa3, NRa4CO2Ra3, NHCONHRa3 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra3 представляет собой водород, С1-6алкил, С3-6циклоалкил, галоген-С1-6алкил, 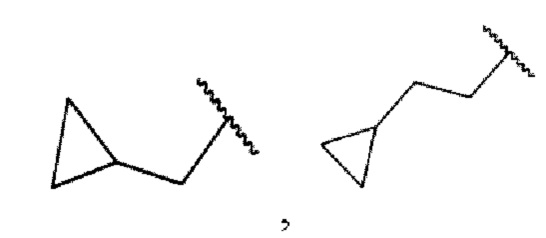 или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
Ra4 представляет собой водород или С1-6алкил,
R5 представляет собой водород, 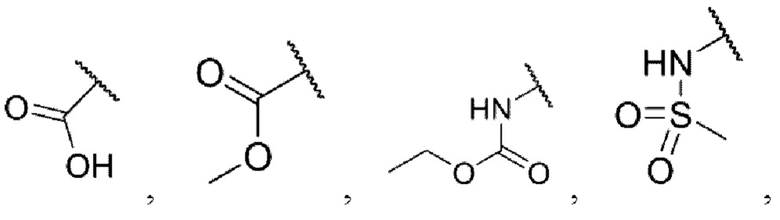
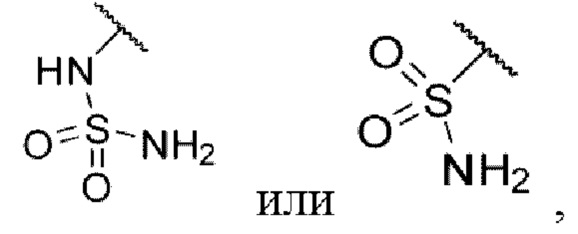
каждый из R6 и R7 независимо представляет собой водород, галоген, трифторметил или трифторметокси,
Rc3 представляет собой водород или С1-6алкил,
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CRw1 или NRw1,
где Rw1 представляет собой водород, С1-6алкил, С3-6циклоалкил, С1-6алкиламин, С1-6алкиловый спирт, 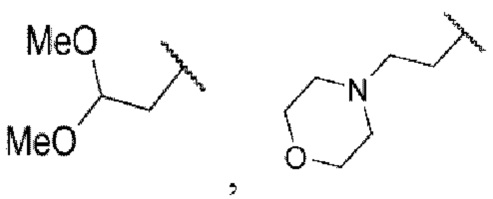 или (СН2)ргетероарил, где гетероарил представляет собой 6-членное моноциклическое кольцо с одним атомом азота, и р равняется 1, 2 или 3.
или (СН2)ргетероарил, где гетероарил представляет собой 6-членное моноциклическое кольцо с одним атомом азота, и р равняется 1, 2 или 3.
2. Соединение по п. 1,
где каждый из R3 и R4 независимо представляет собой водород, галоген, циано, C1-6алкил, С3-6циклоалкил, трифторметил, 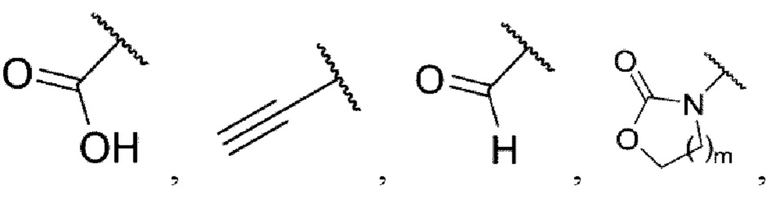 NRa1Ra2, CH2NRa1Ra2, ORa3,
NRa1Ra2, CH2NRa1Ra2, ORa3,  NRa4CO2Ra3,
NRa4CO2Ra3,  или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
или 3- или 8-членные гетероциклы, которые в своей структуре содержат один или два атома кислорода или азота,
где m равняется 1 или 2,
каждый из Ra1 и Ra2 независимо представляет собой водород, метил, этил, изопропил, трет-бутил, циклопропил, трифторэтил, азетидин или пиперидин,
Ra3 представляет собой водород, метил, этил, пропил, трет-бутил, циклопропил, трифторметил,  азетидин, пиперидин, пиперазин или морфолин,
азетидин, пиперидин, пиперазин или морфолин,
Ra4 представляет собой водород или метил,
Rc3 представляет собой водород или метил,
Rw1 представляет собой водород, метил, этил, пропил, циклопропил, 
 представленное формулой I, или его фармацевтически приемлемая соль.
представленное формулой I, или его фармацевтически приемлемая соль.
3. Соединение по п. 1,
где каждый из R1 и R2 независимо представляет собой водород, хлор или трифторметил,
где в случае если Z представляет собой 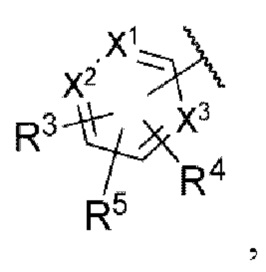
каждый из R3 и R4 независимо представляет собой водород, хлор, фтор, йод, циано, метил, этил, изопропил, циклопропил, трифторметил, 
 NRa1Ra2, CH2NRa1Ra2, NRa4CO2Ra3, азетидин, пиперазин или пирролидин,
NRa1Ra2, CH2NRa1Ra2, NRa4CO2Ra3, азетидин, пиперазин или пирролидин,
где каждый из Ra1 и Ra2 независимо представляет собой водород, метил, этил, изопропил, трет-бутил, циклопропил, трифторэтил, азетидин, пиперидин или оксетан,
Ra3 представляет собой водород, метил, этил, трет-бутил, циклопропил, трифторметил,  азетидин, пиперидин, пиперазин или морфолин,
азетидин, пиперидин, пиперазин или морфолин,
Ra4 представляет собой водород, метил или этил; представленное формулой I, или его фармацевтически приемлемая соль.
4. Соединение по п. 1, где каждый из R1 и R2 независимо представляет собой водород, хлор или фтор,
где в случае если Z представляет собой 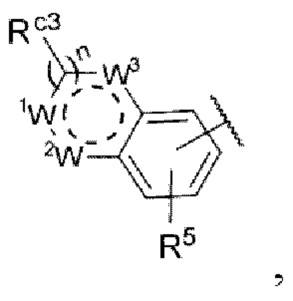
n равняется 0 или 1,
R5 представляет собой 
каждый из W1, W2 и W3 независимо представляет собой кислород, азот, CRw1 или NRw1,
где Rw1 представляет собой водород, метил, этил, изопропил, циклопропил, 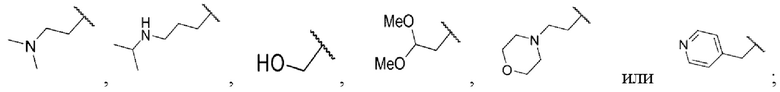 представленное формулой I, или его фармацевтически приемлемая соль.
представленное формулой I, или его фармацевтически приемлемая соль.
5. Соединение по п. 1, представленное формулой I, или его фармацевтически приемлемая соль, где соединение, представленное формулой I, выбрано из группы, состоящей из следующих соединений:
4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойная кислота;
4-((4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-2-(трифторметил)фенил)этинил)бензойная кислота;
4-((3-хлор-4-этинилфенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол;
4-((3-хлор-4-(фенилэтинил)фенокси)метил)-5-циклопропил-3-(2,6-дихлорфенил)изоксазол;
метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат;
метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензоат;
метил-3-((трет-бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензоат;
метил-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензоат;
этил-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)карбамат;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензолсульфонамид;
N-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)метансульфонамид;
N-(3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)фенил)сульфамид;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновая кислота;
2-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изоникотиновая кислота;
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)пиколиновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)никотиновая кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диметиламино)бензойная кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-3-(диметиламино)бензойная кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(диметиламино)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(диэтиламино)бензойная кислота;
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-(диметиламино)бензойная кислота;
3-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
4-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
2-хлор-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-фторбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этинилбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-цианобензойная кислота;
3-((2,6-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
2-хлор-3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойная кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-фторбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-фторбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(трифторметокси)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метоксибензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-формилбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропиламино)метил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((метиламино)метил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этиламино)метил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2,2,2-трифторэтил)амино)метил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((изопропиламино)метил)бензойная кислота;
3-((трет-бутиламино)метил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((диметиламино)метил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((оксетан-3-иламино)метил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метиламино)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(этиламино)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(изопропиламино)бензойная кислота;
3-(азетидин-1-ил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пирролидин-1-ил)бензойная кислота;
3-(азетидин-3-иламино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойной кислоты гидрохлорид;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперидин-4-иламино)бензойной кислоты гидрохлорид;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-ил)бензойной кислоты гидрохлорид;
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метилбензойная кислота;
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-4-метоксибензойная кислота;
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метоксибензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-метилбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-циклопропилбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-этилбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-изопропилбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-йодбензойная кислота;
3-((2,5-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2,3-дихлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)-6-фторфенил)этинил)бензойная кислота;
3-амино-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(3-этилуреидо)бензойная кислота;
3-ацетамидо-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)амино)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((этоксикарбонил)(метил)амино)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-((циклопропоксикарбонил)амино)бензойная кислота;
3-((трет-бутоксикарбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((трет-бутоксикарбонил)(метил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((циклопропилметокси)карбонил)амино)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-циклопропилэтокси)карбонил)амино)бензойная кислота;
3-(((азетидин-3-илокси)карбонил)амино)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(2-оксооксазолидин-3-ил)бензойная кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)изофталевая кислота;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(пиперазин-1-карбонил)бензойной кислоты гидрохлорид;
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(метилсульфонамидо)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
3-((2-хлор-4-((5-циклопропил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индазол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-бензо[с1]имидазол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-(диметиламино)этил)-1Н-индол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(3-(изопропиламино)пропил)-1Н-индол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(пиридин-4-илметил)-1Н-индол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-морфолиноэтил)-1Н-индол-6-карбоновой кислоты гидрохлорид;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2,2-диметоксиэтил)-1Н-индол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидроксиэтил)-1 Н-индол-6-карбоновая кислота;
4-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1-(2-гидрокси-2-метилпропил)-1Н-индол-6-карбоновая
кислота;
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индазол-4-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-Дигидробензофуран-7-карбоновая кислота;
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-1Н-индол-4-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-7-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-7-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-7-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-7-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-(гидроксиметил)бензо[d]оксазол-7-карбоновая кислота;
7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)хиноксалин-5-карбоновая кислота;
7-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2,3-Диметилхиноксалин-5-карбоновая кислота;
5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-циклопропилбензо[d]оксазол-7-карбоновая кислота;
2-бутил-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензо[d]оксазол-7-карбоновая кислота;
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-метилбензо[d]оксазол-4-карбоновая кислота;
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-этилбензо[d]оксазол-4-карбоновая кислота;
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-пропилбензо[d]оксазол-4-карбоновая кислота и
6-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-2-изопропилбензо[d]оксазол-4-карбоновая кислота.
6. Фармацевтическая композиция для воздействия на фарнезоид-Х-рецептор, содержащая соединение по любому из пп. 1-5, которое представлено формулой I, или его фармацевтически приемлемую соль.
7. Соединение, выбранное из группы, состоящей из следующих соединений: 3-(азетидин-1-илметил)-5-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)бензойная кислота,
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(морфолинометил)бензойная кислота и
3-((2-хлор-4-((5-циклопропил-3-(2,6-дихлорфенил)изоксазол-4-ил)метокси)фенил)этинил)-5-(((2-гидроксиэтокси)карбонил)амино)бензойная кислота,
или его фармацевтически приемлемая соль.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| M | |||
| KAINUMA et al | |||
| Design, synthesis, and evaluation of non-steroidal farnesoid X receptor (FXR) antagonist, BIOORGANIC & MEDICINAL CHEMISTRY LETTERS, 2007, V.15, p.2587-2600 | |||
| O | |||
| KINZEL et al | |||
| Novel substituted isoxazole FXR agonists with cyclopropyl, hydroxycyclobutyl and hydroxyazetidinyl linkers: Understanding and | |||
Авторы
Даты
2021-01-25—Публикация
2018-04-12—Подача