Изобретение относится к области медицины, в частности к экспериментальной анестезиологии и реаниматологии и может быть использован для анестезии, например, в эксперименте при исследовании стресса у животных.
При изучении состояния стресса на лабораторных животных необходимо производить измерения уровня нейроэндокринных гормонов гипофизарно-надпочечниковой системы и гормонов надпочечников. Однако забор крови для определения гормонов (при пункции сосудов хвоста, бедренных вен, и т.д.) сам по себе является болезненной манипуляцией, требующей иммобилизации животного, и может спровоцировать рост гормонов надпочечников, затруднив оценку реальной реакции на стрессирующий фактор. Поэтому оптимально забор крови у животных после воздействия стрессирующего фактора проводят или под наркозом (чтобы избежать ложно индуцированных забором крови постстрессорных изменений гормонов в крови), или при эвтаназии на определенном этапе эксперимента (потому что стресс от забора крови «наложится» на иной исследуемый стрессорный фактор).
Известны следующие способы введения в наркоз лабораторных животных: неингаляционная анестезия, ингаляционная анестезия и комбинированная анестезия, которая проводится путем комбинирования нескольких анестетиков (как ингаляционных, так и неингаляционных), что значительно снижает токсичность каждого вещества в отдельности.
При неингаляционной анестезии анестетики вводятся внутривенно или внутримышечно. Проведение инъекций требует обездвиженности животных и болезненных манипуляций, что является дополнительным стрессирующим фактором, искажающим результаты исследований. Так же недостатком вышеназванного способа является влияние средств для неингаляционного наркоза на гистоструктуру надпочечников, которая нормализуется только через 7 суток после наркоза (Разина А.В. Влияние различных вариантов общей анестезии и операционной травмы на организм кроликов. Автореф. канд. вет.н., 2010 г. Казань).
Ингаляционная анестезия основана на введении в организм анестетиков в виде газа через дыхательные пути, не требует обездвиженности животного и проведения ему болезненных манипуляций и является оптимальной при исследовании стрессорных реакций в эксперименте, однако многие из наркозных препаратов (Фторотан, Метоксифлуран, Изофлуран, Закись азота, Углекислый газ, Азот, аргон, Угарный газ) обладают большой токсичностью, что так же может исказить результаты эксперимента. (Методические указания по гуманной эвтаназии животных. Министерство сельского хозяйства и продовольствия Республики Беларусь, Минск, 2008).
Эфир обладает малой токсичностью при большой терапевтической широте, дает выраженный анальгезирующий эффект и хорошую мышечную релаксацию, однако эфирный наркоз длительностью более 3-х минут вызывает подъем адренокортикотропного гормона (гормона гипофиза, регулирующего функцию надпочечников) (Inhibition by Pentobarbital of Ether-Induced ACTH Secretion in the Rat. Monte A. Greer, Carla Rockie Endocrinology, Volume 83, Issue 6, 1 December 1968, Pages 1247-1252, https://doi.org/l0.1210/endo-83-6-1247). Вследствие этого эффекта, применение эфирного наркоза было исключено из арсенала экспериментаторов в течение 50 лет.
Американский ученый Vahl TP конкретизировал, что во избежание инициирования реакции гипофиза на анестезию, отбор проб у животных должен быть завершен менее, чем за 3 мин. после начала анестезии перед эвтаназией и через 4 минуты при физических методах эвтаназии (гильотинировании) (Vahl TP1, Ulrich-Lai YM, Ostrander MM, Dolgas CM, Elfers EE, Seeley RJ, D'Alessio DA, Herman JP. Comparative analysis of ACTH and corticosterone sampling methods in rats. Am J Physiol Endocrinol Metab. 2005 Nov; 289(5):E823-8. Epub 2005 Jun 14.). Премедикация фенобарбиталом отменяет инициацию постэфирного роста АКТГ, однако делает интерпретацию изменений гормонов гипофизарно-надпочечниковой системы при стрессе еще проблематичнее, так как увеличивает время наступления хирургической плоскости анестезии. (Inhibition by Pentobarbital of Ether-Induced ACTH Secretion in the Rat. Monte A. Greer, Carla Rockie Endocrinology, Volume 83, Issue 6, 1 December 1968, Pages 1247-1252, https://doi.org/10.1210/endo-83-6-1247). Проведение же премедикации до воздействия стрессорного фактора, несомненно, снижает способность животных полноценно реагировать на стресс.
Наиболее близким по совокупности существенных признаков к предлагаемому способу является известный способ проведения вводного эфирного наркоза при оперативном вмешательстве, который выбран авторами в качестве прототипа. Данный способ включает помещение лабораторного животного (крысы) в стеклянную емкость с узким горлом со стандартной дозой эфира (1 мл на 1000 л воздуха). (Метод проведения эфирного наркоза по закрытому контуру в эксперименте. Якубовский А.П., Жмайлик P.P. «Смоленский медицинский альманах», 2015 г. №1, стр. 145-146).
Недостатками данного способа проведения вводного наркоза являются длительное время засыпания (до 5 минут).
Таким образом, к общим недостаткам, как показывает анализ результатов экспериментов с определением гормонов гипофизарно-надпочечниковой системы, особенно при исследовании стрессорных воздействий, при применении анестезии перед эвтаназией по способам, описанным в аналогах и прототипе, относится то, что они не обеспечивают получение достоверных результатов измерений уровня нейроэндокринных гормонов гипофизарно-надпочечниковой системы. При этом затруднено дифференцирование этиологии изменений вышеназванных гормонов - индукция стрессорного воздействия, общая анестезия и связанные с ней стрессоры или реакция на сами анестетики и методы их введения. Поскольку образцы в этих исследованиях собираются после того, как животное достигло хирургической плоскости анестезии (введения в наркоз), изменения гормонального статуса могут отражать физиологический ответ на анестезию, независимо от индукции стресса.
Задачей предлагаемого способа является обеспечение достоверных результатов в эксперименте по исследованию стресса при определении уровня нейроэндокринных гормонов гипофизарно-надпочечниковой системы и гормонов надпочечников введенных в стресс лабораторных животных, за счет применения предлагаемого эффективного способа проведения вводного эфирного наркоза перед эвтаназией, который позволяет обеспечить время засыпания оперируемого не более 2 минут.
Поставленная задача решается предлагаемым способом при эвтаназии у крыс при экспериментальном исследовании стресса, включающем ингаляцию эфира путем загрузки лабораторных животных в стеклянную емкость с узким горлом, содержащую эфир, но согласно изобретения, концентрация эфира составляет 0,2 об% на одно животное.
Предлагаемый способ проведения вводного эфирного наркоза в эксперименте, включает вертикальную загрузку крыс в стеклянную емкость с узким горлом, содержащую эфир из расчета 2 мл на 1 л воздуха на 1 животное со средним весом 250 грамм (что составляет 0,2 об% эфира на вес одного животного).
Способ был осуществлен в ходе исследования, результаты которого приведены в таблице 1.
Для осуществления способа выбрана стеклянная емкость, соответствующая ГОСТ 5717.2-2003 «Банки стеклянные для консервов». Основные параметры и размеры: высота - 236 мм, диаметр - 154 мм, венчик - 82 мм, вместимость полная - 3200±50 мл, вместимость номинальная - 3000 мл.
Известно, что концентрация эфира в газовой фазе на некоторой высоте от дна емкости зависит от формы сосуда. При уменьшении поперечного сечения необходимая для наркоза концентрация эфира на заданной высоте достигается быстрее, чем в случае увеличенного поперечного сечения. Форма банки с узким горлом и более широким основанием, по аналогии с колбой Эрленмейера, не имеет «мертвых зон», куда не проникает эфир, что так же способствует более быстрому введению животных в состояние сна.
Экспериментально при осуществлении предлагаемого способа было установлено, что при загрузке животных в сосуд, соответствующий ГОСТу 5717.2-2003, при содержании в нем эфира в количестве 2 мл на 1 л воздуха, время засыпания животных составляет не более 2 минут, причем доза эфира на одно животное, помещенное в сосуд, составляет 0,2 об%. Емкости, отличающиеся по форме от указанной выше, (колба с широким горлом или колпак, табл. 1) не обеспечивают возможность создания концентрации эфира 0,2 об% эфира на одно животное, а необходимое для засыпания животных время возрастает от 4-х до 7-ми минут. Использование вышеуказанного сосуда, соответствующего ГОСТу 5717.2-2003), при снижении дозы эфира до общепринятой (0,1 об% эфира на одно животное) не позволяет снизить время наступления хирургической аналгезии ниже 7 минут.
Способ осуществляют следующим образом.
При проведении эксперимента были проведены исследования в 5-ти группах животных, каждая из которых состояла из 5-ти лабораторных крыс - самок массой 250±30 г. (таблица 1). В четырех группах животные были подвержены эфирному наркозу в различных видах стеклянных емкостей, употребляемых при ингаляционном наркозе в экспериментах и в различных дозировках эфира (банка с узким горлом - 1 мл эфира на 1 л воздуха; банка с узким горлом - 2 мл эфира на 1 л воздуха; колба с широким горлом - 2 мл эфира на 1 л воздуха; колпак - 2 мл эфира на 1 л воздуха), а в одной группе - внутривенному наркозу общим анестетиком диссоциативного действия (золетил).
Критериями нахождения крысы в хирургической плоскости наркоза (состояние сна) считаются отсутствие реакции на прикосновение и болевой раздражитель, отрицательный рефлекс, усугубление и участие вспомогательной мускулатуры в акте дыхания; критериями отсутствия влияния метода вводного наркоза на гормоны гипофизарно-надпочечниковой системы - уровень АКТГ в сыворотке крови (метод высокочувствительного твердофазного иммунофер-ментного анализа (ИФА)).
Пример. Для осуществления способа сосуд с узким горлом по ГОСТ 5717.2-2003 был установлен на столе с вытяжкой, в сосуд помещали ватный тампон средним весом 20±5 гр. На тампон сверху из дозатора выливали 6 мл эфира. Емкость герметично закрывали полиэтиленовой крышкой. Затем Вертикально в сосуд загружались 3 крысы-самки весом 250±20 гр. При каждой загрузке полиэтиленовая крышка снималась, затем снова устанавливалась. Время загрузки на каждую крысу составило 3 секунды. При проведении видеосъемки замеряли время засыпания, составившее 108.8±0.9 сек. Затем животные укладывались на операционный стол и подвергались эвтаназии быстрым разрезом сонных артерий. Кровь собиралась в пробирки, центрифугировалась, в отдельные пробирки отделялась плазменная составляющая. При проведении твердофазного иммуноферментного анализа на иммуноферментном автоматическом анализаторе по общепринятой методике АКТГ в плазме экспериментальных животных составила 5.2±2.0 нг/мл.
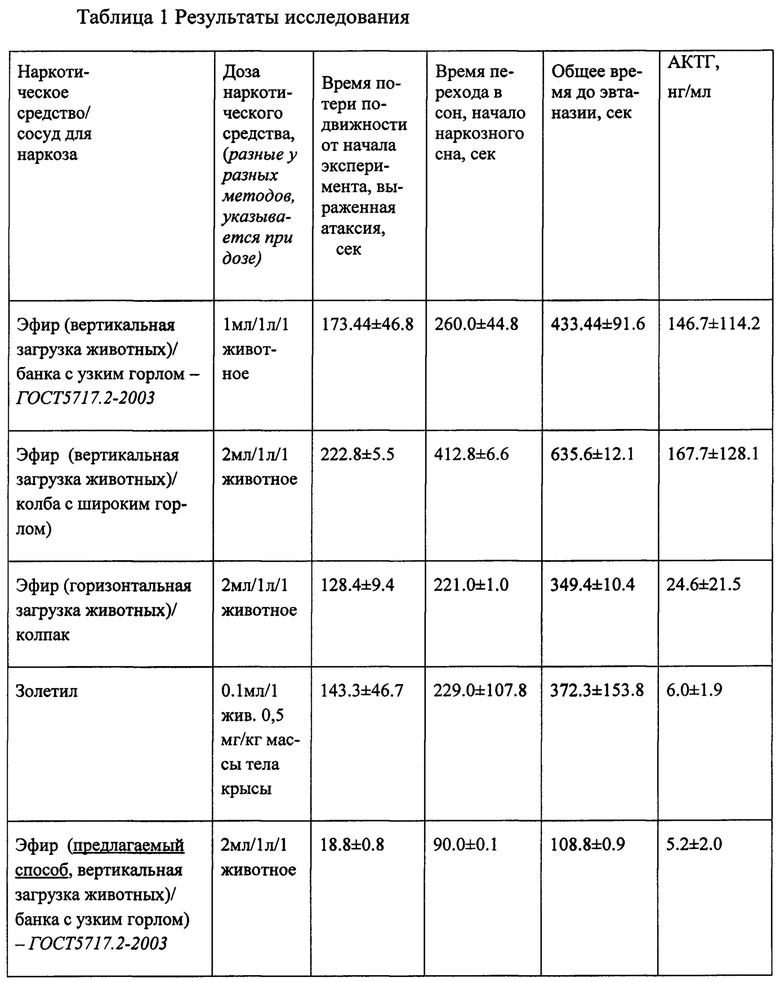
Как видно из полученных результатов (Табл. 1) для 5 групп животных, помещенных в разные сосуды, с разной концентрацией эфира на одно животное следует, что предлагаемый способ позволяет снизить общее время засыпания до эвтаназии до 2 минут, что позволяет избежать постэфирного подъема АКТГ, а так же получить значения, характерные для нормального типа распределения при статистической обработке результатов. При этом отличия между средней арифметической (M) и медианой (Me) значений АКТГ менее 10% (Платонов А.Е., Статистический анализ в медицине и биологии. М.: РАМН, 2000). Малый разброс данных определения АКТГ в плазме крови сравним с результатами, полученными при применении золетила. При иных параметрах емкости для наркоза, как и при более низкой дозе эфира, наблюдается выраженный разброс показателей АКТГ, влияющий на оценку достоверности полученных результатов.
Таким образом, предлагаемый способ позволяет обеспечить получение достоверных результатов в эксперименте по исследованию стресса при определении уровня нейроэндокринных гормонов гипофизарно-надпочечниковой системы и гормонов надпочечников введенных в стресс лабораторных животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АНЕСТЕЗИОЛОГИЧЕСКОГО ПОСОБИЯ ПРИ ОПЕРАТИВНОМ РОДОРАЗРЕШЕНИИ БЕРЕМЕННЫХ С ГЕСТОЗОМ | 2004 |
|
RU2286793C2 |
| Способ оценки центральной десинхронизации организма у крыс | 2020 |
|
RU2753000C1 |
| СПОСОБ ПРОФИЛАКТИКИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ У КАРДИОХИРУРГИЧЕСКИХ БОЛЬНЫХ С НИЗКИМ ФУНКЦИОНАЛЬНЫМ РЕЗЕРВОМ ГИПОФИЗАРНО-НАДПОЧЕЧНИКОВОЙ СИСТЕМЫ | 2000 |
|
RU2190409C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАНИЙ К ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ХРОНИЧЕСКОЙ ЦЕНТРАЛЬНОЙ СЕРОЗНОЙ ХОРИОРЕТИНОПАТИИ | 2012 |
|
RU2495620C1 |
| Способ гуманной эвтаназии лабораторных животных в эксперименте | 2024 |
|
RU2836552C1 |
| КОМБИНАЦИЯ АНАЛОГОВ СОМАТОСТАТИНА С ИНГИБИТОРАМИ 11β- ГИДРОКСИЛАЗЫ | 2013 |
|
RU2663455C2 |
| Способ лечения гормонально-активных опухолей надпочечников | 2015 |
|
RU2628645C2 |
| СПОСОБ ОЦЕНКИ ФУНКЦИИ КОРЫ НАДПОЧЕЧНИКОВ | 2011 |
|
RU2466410C2 |
| СРЕДСТВО ДЛЯ ПОВЫШЕНИЯ УРОВНЯ НЕЙРОТРОФИЧЕСКОГО ФАКТОРА ГОЛОВНОГО МОЗГА (BDNF) В МОДЕЛИ ХРОНИЧЕСКОГО НЕПРЕДСКАЗУЕМОГО УМЕРЕННОГО СТРЕССА | 2023 |
|
RU2836915C1 |
| Биологически активная добавка противострессорного действия на основе экстракта коры ореха черного (Juglans nigra L) | 2019 |
|
RU2728354C1 |
Изобретение относится к медицине, в частности к экспериментальной анестезиологии и реаниматологии, и может быть использовано для проведения вводного эфирного наркоза при эвтаназии у крыс при экспериментальном исследовании стресса. Для этого лабораторное животное загружают в стеклянную емкость с узким горлом, содержащую эфир с концентрацией 0,2 об.% на одно животное. Способ позволяет обеспечить получение достоверных результатов при определении уровня нейроэндокринных гормонов гипофизарно-надпочечниковой системы и гормонов надпочечников введенных в стресс лабораторных животных за счет отсутствия постэфирного подъема АКТГ вследствие снижения общего времени засыпания.1 табл., 1 пр.
Способ проведения вводного эфирного наркоза при эвтаназии у крыс при экспериментальном исследовании стресса, включающий ингаляцию эфира путем загрузки лабораторных животных в стеклянную емкость с узким горлом, содержащую эфир, отличающийся тем, что концентрация эфира составляет 0,2 об.% на одно животное.
| СПОСОБ ПРОВЕДЕНИЯ НАРКОЗА В ЭКСПЕРИМЕНТЕ | 2012 |
|
RU2478386C1 |
| CN 203777100 U, 20.08.2014 | |||
| ЯКУБОВСКИЙ А.П | |||
| и др | |||
| Метод проведения эфирного наркоза по закрытому контуру в эксперименте // Смоленский медицинский альманах, 2015, No 1(1), c.145-146 | |||
| LIU P.T | |||
| et al | |||
| The effects of ether anaesthesia on oxidative stress in rats-dose response// Toxicology | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
Авторы
Даты
2021-01-29—Публикация
2020-06-02—Подача