Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает преимущество и приоритет предварительных заявок на патент США с регистрационными номерами 62/148830; 62/148837; 62/148809; 62/148814; 62/148818 и 62/148824; все из которых были поданы 17 апреля 2015 г. Полное содержание всех вышеуказанных заявок, таким образом, включено посредством ссылки в настоящую заявку.
Область техники настоящего раскрытия
Настоящее раскрытие относится к области молекул, имеющих пестицидную функцию в отношении вредителей типов членистоногие, моллюски и нематоды, способам получения таких молекул, промежуточным соединениям, используемым в таких способах, пестицидным композициям, содержащим такие молекулы, и способам применения таких пестицидных композиций по отношению к таким вредителям. Данные пестицидные композиции можно применять, например, в качестве акарицидов, инсектицидов, майтицидов, моллюскоцидов и нематоцидов.
Уровень техники настоящего раскрытия
«Многие из наиболее опасных заболеваний человека переносятся насекомыми-переносчиками» (Rivero и соавт.). «Исторически, малярия, лихорадка денге, желтая лихорадка, чума, филяриатоз, эпидемический сыпной тиф, трипаносомоз, лейшманиоз и другие трансмиссивные заболевания, были виновны в большем числе заболеваний и смертей людей в 17ом - начале 20ого столетий, чем все другие причины вместе взятые» (Gubler). Трансмиссивные заболевания являются причиной приблизительно 17% паразитарных и инфекционных заболеваний в мире. Малярия сама по себе вызывает более 800000 смертей в год, 85% из которых происходит у детей возрастом до пяти лет. Каждый год происходит от приблизительно 50 до приблизительно 100 миллионов случаев лихорадки денге. Также 250000-500000 случаев геморрагической формы лихорадки денге встречается каждый год (Matthews). Контроль переносчиков инфекции выполняет важнейшую функцию в предотвращении и контроле инфекционных заболеваний. Тем не менее, стойкость к инсектицидам, включая стойкость к нескольким инсектицидам, появилась у всех видов насекомых, которые являются основными переносчиками заболеваний человека (Rivero и соавт.). Недавно более 550 видов членистоногих развили стойкость по меньшей мере к одному пестициду (Whalon и соавт.). Кроме того, случаи стойкости насекомых продолжают значительно превышать число случаев стойкости к гербицидам и фунгицидам (Sparks и соавт.).
Каждый год насекомые, патогены растений и сорняки разрушают более 40% всего производства пищевых продуктов. Данная потеря происходит несмотря на использование пестицидов и применение широкого спектра нехимических средств контроля, таких как чередование культур, и биологических средств контроля. Если хоть некоторую часть данных пищевых продуктов можно спасти, их можно применять для питания более трех миллиардов людей в мире, которые голодают (Pimental).
Паразитические нематоды растений находятся среди наиболее распространенных вредителей и зачастую являются одними из наиболее скрытых и дорогостоящих в отношении борьбы с ними. Было оценено, что потери, связанные с нематодами, составляют от приблизительно 9% в развитых странах до приблизительно 15% в неразвитых странах. Тем не менее, в Соединенных Штатах Америки исследование в 35 штатах относительно различных сельскохозяйственных культур показало потери, происходящие из-за нематод, до 25% (Nicol и соавт.).
Отмечается, что брюхоногие (слизни и улитки) являются менее экономически важными вредителями, чем другие членистоногие или нематоды, но в некоторых зонах они могут значительно снижать урожай, сильно влияя на качество собираемых продуктов, а также перенося заболевания человека, животных и растений. Хотя только несколько дюжин видов брюхоногих являются значительными региональными вредителями, небольшое количество видов являются важными вредителями на мировом уровне. В частности, брюхоногие влияют на большое разнообразие сельскохозяйственных и плодовых культур, таких как пропашные, пастбищные и волокнистые культуры; овощи; кустовые ягоды и плодовые деревья; травы и декоративные растения (Speiser).
Термиты вызывают повреждение всех типов частных и общественных строений, а также сельскохозяйственных и лесных ресурсов. В 2005 г. было оценено, что термиты вызывают ущерб на сумму более 50 миллиардов долларов США каждый год во всем мире (Korb).
Следовательно, по многим причинам, включая причины, указанные выше, существует постоянная необходимость в дорогостоящей (оценивается как приблизительно 256 миллионов долларов США на пестицид в 2010 г.), времязатратной (в среднем приблизительно 10 лет на пестицид) и сложной разработке новых пестицидов (CropLife America).
Некоторые ссылки, цитируемые в настоящем раскрытии
CropLife America, The Cost of New Agrochemical Product Discovery, Development & Registration, and Research & Development predictions for the Future, 2010.
Drewes, M., Tietjen, K., Sparks, T.C., High-Throughput Screening in Agrochemical Research, Modern Methods in Crop Protection Research, Part I, Methods for the Design and Optimization of New Active Ingredients, Edited by Jeschke, P., Kramer, W., Schirmer, U., and Matthias W., p. 1-20, 2012.
Gubler, D., Resurgent Vector-Borne Diseases as a Global Health Problem, Emerging Infectious Diseases, Vol. 4, No. 3, p. 442-450, 1998.
Korb, J., Termites, Current Biology, Vol. 17, No. 23, 2007.
Matthews, G., Integrated Vector Management: Controlling Vectors of Malaria and Other Insect Vector Borne Diseases, Ch. 1, p. 1, 2011.
Nicol, J., Turner S., Coyne, L., den Nijs, L., Hocksland, L., Tahna-Maafi, Z., Current Nematode Threats to World Agriculture, Genomic and Molecular Genetics of Plant - Nematode Interactions, p. 21-43, 2011.
Pimental, D., Pest Control in World Agriculture, Agricultural Sciences - Vol. II, 2009.
Rivero, A., Vezilier, J., Weill, M., Read, A., Gandon, S., Insect Control of Vector-Borne Diseases: When is Insect Resistance a Problem? Public Library of Science Pathogens, Vol. 6, No. 8, p. 1-9, 2010.
Sparks T.C., Nauen R., IRAC: Mode of action classification and insecticide resistance management, Pesticide Biochemistry and Physiology (2014) available online 4 December 2014.
Speiser, B., Molluscicides, Encyclopedia of Pest Management, Ch. 219, p. 506-508, 2002.
Whalon, M., Mota-Sanchez, D., Hollingworth, R., Analysis of Global Pesticide Resistance in Arthropods, Global Pesticide Resistance in Arthropods, Ch. 1, p. 5-33, 2008.
Определения, используемые в настоящем раскрытии
Примеры, приведенные в данных определениях, как правило, являются неисключительными и не должны рассматриваться как ограничивающие настоящее раскрытие. Подразумевается, что заместитель должен соответствовать правилам химического связывания и ограничениям стерической совместимости в отношении конкретной молекулы, к которой он присоединен. Данные определения следует использовать только для целей настоящего раскрытия.
Фраза «активный ингредиент» означает материал, обладающий активностью, пригодный для контроля вредителей, и/или который пригоден для способствования проявлению лучшей активности других материалов для контроля вредителей, примеры таких материалов включают без ограничения акарициды, альгициды, антифиданты, авициды, бактерициды, отпугивающие птиц вещества, хемостерилизаторы, фунгициды, антидоты гербицидов, гербициды, аттрактанты для насекомых, отпугивающие насекомых вещества, инсектициды, отпугивающие млекопитающих вещества, средства для дезориентации самцов, моллюскоциды, нематоциды, активаторы роста растений, регуляторы роста растений, родентициды, синергисты и вируциды (смотрите alanwood.net). Конкретные примеры таких материалов включают без ограничения материалы, перечисленные в группе альфа активных ингредиентов.
Фраза «группа альфа активных ингредиентов» (далее «AIGA») означает в совокупности следующие материалы:
(1) (3-этоксипропил)ртути бромид, 1,2-дибромэтан, 1,2-дихлорэтан, 1,2-дихлорпропан, 1,3-дихлорпропен, 1-MCP, 1-метилциклопропен, 1-нафтол, 2-(октилтио)этанол, 2,3,3-TPA, 2,3,5-трийодбензойная кислота, 2,3,6-TBA, 2,4,5-T, 2,4,5-TB, 2,4,5-TP, 2,4-D, 2,4-DB, 2,4-DEB, 2,4-DEP, 2,4-DES, 2,4-DP, 2,4-MCPA, 2,4-MCPB, 2iP, 2-метоксиэтилртути хлорид, 2-фенилфенол, 3,4-DA, 3,4-DB, 3,4-DP, 3,6-дихлорпиколиновая кислота, 4-аминопиридин, 4-CPA, 4-CPB, 4-CPP, 4-гидроксифенетиловый спирт, 8-гидроксихинолина сульфат, 8-фенилртутьоксихинолин, абамектин, эмамектин, абсцизовая кислота, ACC, ацефат, ацеквиноцил, ацетамиприд, ацетион, ацетохлор, плифенат, ацетофос, ацетопрол, ацибензолар, ацифлуорфен, аклонифен, ACN, акреп, акринатрин, акролеин, акрилонитрил, аципетакс, афидопиропен, афоксоланер, алахлор, напталам, аланикарб, албендазол, альдикарб, альдоксикарб, альдиморф, алдоксикарб, альдрин, аллетрин, аллицин, аллидохлор, аллозамидин, аллоксидим, аллиловый спирт, алликсикарб, алорак, альфа-циперметрин, альфа-эндосульфан, альфа-циперметрин, хемел, фосфид алюминия, фосфид алюминия, аметоктрадин, аметридион, аметрин, амибузин, амикарбазон, амикартиазол, амидитион, амидофлумет, амидосульфурон, аминокарб, аминоциклопирахлор, аминопиралид, амитрол, амипрофос-метил, амипрофос, амипрофос-метил, амисулбром, амитон, амитраз, амитрол, сульфамат аммония, амобам, аморфный диоксид кремния, ампропилфос, AMS, анабазин, анцимидол, анилазин, анилофос, анизурон, антрахинон, анту, афолат, арамит, пропоскур, оксид мышьяка, азомат, аспирин, асулам, атидатион, атратон, атразин, ауреофунгин, абамектин B1, AVG, авиглицин, азаконазол, азадирахтин, азафенидин, азаметифос, меназон, азимсульфурон, азинфосетил, азинфос-этил, азинфосметил, азинфос-метил, азипротрин, азитирам, азобензол, азоциклотин, азотоат, азоксистробин, бахмедеш, барбан, барбан, гексафторсиликат бария, полисульфид бария, силикофторид бария, бартрин, основный карбонат меди, основный хлорид меди, основный сульфат меди, BCPC, бефлубутамид, беналаксил, беналаксил-M, беназолин, беназолин, бенкарбазон, бенклотиаз, фенридазон-пропил, бендиокарб, бентазон, бенефин, бенфлуралин, бенфуракарб, бенфурезат, сафлуфенацил, беноданил, беномил, беноксакор, беноксафос, бенквинокс, бенсульфурон, бенсулид, бенсултап, бенталурон, бентазон, бентазон, бентиаваликарб, бентиазол, тиобенкарб, бентранил, бензадокс, бензалкония хлорид, бензамакрил, изоксабен, бензаморф, гексахлорид бензола, бензфендизон, гексамид, бензипрам, бензобициклон, эндосульфан, бензофенап, бензофлуор, бензогидроксамовая кислота, бензоксимат, фозалон, бензотиадиазол, бензовиндифлупир, бензоксимат, бензоилпроп, бензтиазурон, топрамезон, бензилбензоат, бензиладенин, берберин, бета-цифлутрин, бета-циперметрин, бетоксазин, BHC, биалафос, бициклопирон, бифеназат, бифенокс, бифентрин, бифуцзюньчжи, биланафос, бинапакрил, бинцинсяо, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бифенил, бисазир, бисмертиазол, бисмертиазол-медь, гидрагафен (бисфенилртуть-метиленди(x-нафталин-y-сульфонат)), биспирибак, бистрифлурон, динатрия тиосультап, битертанол, битионол, биксафен, бластицидин-S, бура, бордосская смесь, борная кислота, боскалид, BPPS, брассинолид, брассинолид-этил, бревикомин, бродифакум, галфенпрокс, брофенвалерат, брофланилид, брофлутринат, бромацил, бромадиолон, налед, брометалин, брометрин, бромфенвинфос, бромоацетамид, бромобонил, бромобутид, бромоциклен, бромо-DDT, бромофеноксим, бромофос, метилбромид, бромофос, бромофос-этил, бромопропилат, бромоталонил, бромоксинил, бромпиразон, бромуконазол, бронопол, BRP, BTH, букарполат, буфенкарб, буминафос, бупиримат, бупрофезин, бургундская смесь, бусульфан, бутакарб, бутахлор, бутафенацил, тебутам, бутамифос, флуфипрол, бутатиофос, бутенахлор, бутен-фипронил, бутетрин, бутидазол, бутиобат, бутиурон, бутифос, бутокарбоксим, бутонат, бутопироноксил, бутоксикарбоксим, бутралин, триазбутил, бутроксидим, бутурон, бутиламин, бутилат, бутонат, флуфипрол, какодиловая кислота, кадусафос, кафенстрол, эргокальциферол, арсенат кальция, хлорат кальция, цианамид кальция, цианид кальция, полисульфид кальция, калвинфос, камбендихлор, камфехлор, камфора, каптафол, каптан, метам, карбаморф, карбанолат, карбарил, карбасулам, метам, карбендазим, карбендазол, карбетамид, карбофенотион, карбофуран, дисульфид углерода, тетрахлорид углерода, карбонилсульфид, карбофенотион, малатион, карбосульфан, карбоксазол, карбоксид, карбоксин, карфентразон, карпропамид, картап, карвакрол, карвон, CAVP, CDAA, CDEA, CDEC, целлоцидин, CEPC, цералур, бенквинокс, сабадилла, чешантовая смесь, квиналфос, квиналфос-метил, хинометионат, беналаксил-M, хитозан, хлобентиазон, хлометоксифен, хлоралоза, хлорамбен, хлорамин фосфор, хлорамфеникол, хлораниформетан, хлоранил, хлоранокрил, хлорантранилипрол, хлоразифоп, хлоразин, хлорбензид, хлорбензурон, хлорбициклен, хлорбромурон, хлорбуфам, хлордан, хлордекон, хлордимеформ, хлоремпентрин, каретазан, этефон, хлорэтоксифос, хлоретурон, хлорфенак, хлорфенапир, хлорфеназол, хлорфенетол, монурон, хлорфенпроп, хлорфенсон, хлорфенсульфид, хлорфенвинфос, хлорфенвинфос-метил, хлорфлуазурон, хлорфлуразол, хлорфлурекол, хлорфлурен, хлорфлуренол, хлоридазон, хлоримурон, барбан, хлорпрофам, хлормефос, хлормекват, сулькотрион, хлорметоксинил, хлорнидин, хлорнитрофен, хлоруксусная кислота, хлорбензилат, хлородинитронафталины, хлорфенизон, хлороформ, хлоромебуформ, хлорометиурон, хлоронеб, хлорофацинон, трихлофон, хлоропикрин, хлоропон, хлоропропилат, хлороталонил, хлоротолурон, хлороксифенидим, хлороксурон, хлороксинил, хлорфониум, хлорфоксим, хлорпразофос, хлорпрокарб, хлорпрофам, хлорпирифос, хлорпирифос-метил, хлорквинокс, хлорсульфурон, хлортал, хлортиамид, хлортиофос, хлозолинат, хитозан, колекальциферол, холина хлорид, кромафенозид, циклогексимид, тринексапак, циметакарб, цинерин I, цинерин II, цинерины, цинидон-этил, цинметилин, циносульфурон, синтофен, циобутид, цисанилид, цисметрин, клацифос, профоксидим, кленпирин, клетодим, климбазол, клиодинат, клодинафоп, клоетокарб, клофенцет, ДДТ, клофентезин, клофенвинфос, клофибровая кислота, клофоп, кломазон, кломепроп, никлосамид, клопроп, клопроксидим, клопиралид, клоквинтоцет, клорансулам, клозантел, клотианидин, клотримазол, клоксифонак, вангард, вангард, CMA, CMMP, CMP, CMU, кодлелур, колекальциферол, колофонат, 8-хинолинолат меди, ацетат меди, ацетоарсенит меди, арсенат меди, основный карбонат меди, гидроксид меди, нафтенат меди, олеат меди, оксихлорид меди, силикат меди, сульфат меди, основный сульфат меди, хромат меди-цинка, кумахлор, варфарин, кумафос, кумафурил, кумафос, куматетралил, куметоксистробин, кумитоат, кумоксистробин, CPMC, CPMF, CPPC, кредазин, крезол, крезиловая кислота, кримидин, кротамитон, кротоксифос, круфомат, криолит, куелур, куфранеб, кумилурон, кумилурон, купробам, оксид одновалентной меди, куркуменол, CVMP, цианамид, цианатрин, цианазин, цианофенфос, цианоген, цианофос, циантоат, циантранилипрол, триокситриазин, циазофамид, цибутрин, циклафурамид, цикланилид, цикланилипрол, циклетрин, циклоат, циклогексимид, циклопрат, циклопротрин, циклопириморат, циклосульфамурон, циклоксидим, циклурон, циенопирафен, цифлуфенамид, цифлуметофен, цифлутрин, цигалофоп, цигалотрин, цигексатин, цимиазол, цимоксанил, циометринил, ципендазол, циперметрин, циперкват, цифенотрин, ципразин, ципразол, ципроконазол, ципродинил, ципрофурам, ципромид, ципросульфамид, циромазин, цитиоат, додин, даимурон, далапон, даминозид, даютун, диазон, DBCP, d-камфора, DCB, DCIP, DCPA, DCPTA, DCU, DDD, DDPP, DDT, DDVP, дебакарб, декафентин, декаметрин, декарбофуран, диэтилтолуамид, дегидроуксусная кислота, дикват, делахлор, диоксантион, дельтаметрин, демефион, демефион-O, демефион-S, деметон, деметон-метил, деметон-O, деметон-O-метил, деметон-S, деметон-S-метил, деметон-S-метилсульфон, деметон-S-метилсульфон, DEP, биоаллетрин, ротенон, десмедифам, десметрин, десметрин, d-фаньшилуцюэбинцзюйчжи, диафентиурон, диалифос, диалифос, диаллат, диамидафос, дикамба, диатомовая земля, диазинон, дибром, дибутилфталат, дибутилсукцинат, дикамба, дикаптон, дихлобенил, дихлофентион, дихлофлуанид, дихлон, дихлоральмочевина, дихлорбензурон, дихлорфенидим, дихлорфлурекол, дихлорфлуренол, дихлормат, дихлормид, дихлорметан, дихлормезотиаз, дихлорофен, дихлорпроп, дихлорпроп-P, дихлорвос, дихлозолин, дихлозолин, диклобутразол, диклоцимет, диклофоп, дикломезин, диклоран, диклосулам, дикофол, дикофан, дикумарол, дикрезил, дикротофос, хлоранокрил, дикумарол, дицикланил, дициклонон, диелдрин, диенохлор, диетамкват, диэтатил, этион, этион, диэтофенкарб, диетолат, этион, диэтилпирокарбонат, диэтилтолуамид, дифенакум, дифеноконазол, дифенопентен, дифеноксурон, дифензокват, дифетиалон, дифловидазин, дифлубензурон, дифлуфеникан, дифлуфениканил, дифлуфензопир, дифлуметорим, дикегулак, дилор, диматиф, димефлутрин, димефокс, димефурон, димегипо, димепиперат, диметахлон, диметан, диметакарб, диметаклон, диметахлор, диметаметрин, диметенамид, диметенамид-P, диметипин, диметиримол, диметоат, диметоморф, диметрин, диметилкарбат, диметилдисульфид, диметилфталат, диметилвинфос, диметилан, димексано, димидазон, димоксистробин, диазинон, даимурон, динекс, пиризоксазол, диниконазол, диниконазол-M, динитрамин, динитрофенолы, динобутон, динокап, динокап-4, динокап-6, диноктон, динофенат, динопентон, динопроп, диносам, диносеб, диносульфон, динотефуран, динотерб, динотербон, диофенолан, диоксабензофос, диоксакарб, диоксатион, дифацин, дифацинон, дифенадион, дифенамид, дифенамид, дифенилсульфон, дифениламин, тетрасул, дикегулак, дипропалин, дипропетрин, дипретекс, дипиметитрон, дипиритион, дикват, тетраборат динатрия, динатрия тиосультап, диспарлур, дисугран, дисул, дисульфирам, дисульфотон, диталимфос, дитианон, дитикрофос, дитиоэфир, дитиометон, дитиопир, диурон, диксантоген, d-лимонен, DMDS, DMPA, DNOC, додеморф, додицин, додин, дофенапин, додин, доминикалур, дорамектин, DPC, дразоксолон, DSMA, d-транс-аллетрин, d-транс-ресметрин, дуфулин, димрон, EBEP, EBP, эбуфос, экдистерон, этридиазол, EDB, EDC, EDDP, эдифенфос, эглиназин, эмамектин, EMPC, эмпентрин, энаденин, эндосульфан, эндотал, эндотион, эндрин, энестробурин, имазалил, эноксастробин, хлорфенсон, EPN, эпоколеон, эпофенонан, эпоксиконазол, эприномектин, эпроназ, EPTC, эрбон, эргокальциферол, эрлуцзисяньцаоань, эсдепаллетрин, эсфенвалерат, ESP, эспрокарб, этацелазил, этаконазол, этафос, этем, этабоксам, этахлор, эталфлуралин, этаметсульфурон, этапрохлор, этефон, этидимурон, этиофенкарб, этиолат, этион, этиозин, этипрол, этиримол, этоат-метил, этобензанид, этофумезат, этогексадиол, этопрофос, этоксифен, этоксиквин, этоксисульфурон, этихлозат, этилформиат, этилпирофосфат, этилан, этил-DDD, этилен, этилендибромид, этилендихлорид, этиленоксид, этилицин, 2,3-дигидроксипропил меркаптид этилртути, ацетат этилртути, бромид этилртути, хлорид этилртути, фосфат этилртути, этинофен, ETM, этнипромид, этобензанид, этофенпрокс, этоксазол, этридиазол, этримфос, эвгенол, EXD, фамоксадон, фамфур, хлорфенак, фенамидон, фенаминосульф, фенаминстробин, фенамифос, фенапанил, фенаримол, фенасулам, феназафлор, феназаквин, фенбуконазол, фенбутатин оксид, фенхлоразол, фенхлорфос, фенклофос, фенклорим, фенетакарб, фенфлутрин, фенфурам, фенгексамид, фенидин, фенитропан, фенитротион, фенизон, фэньцзюньтун, фенобукарб, фентин, фенопроп, фенотиокарб, феноксакрим, феноксанил, феноксапроп, феноксапроп-P, феноксасульфон, феноксикарб, фенпиклонил, фенпиритрин, фенпропатрин, фенпропидин, фенпропиморф, фенпиразамин, фенпироксимат, фенквинотрион, фенридазон, фензон, фенсульфотион, фентеракол, фентиапроп, фентион, фентион-этил, фентиапроп, фентин, фентразамид, фентрифанил, фенурон, фенурон-TCA, фенвалерат, фербам, феримзон, фосфат трехвалентного железа, сульфат двухвалентного железа, фипронил, флампроп, флампроп-M, флазасульфурон, флокумафен, флометоквин, флоникамид, флорасулам, флуакрипирим, флуазифоп, флуазифоп-P, флуазинам, флуазолат, флуазурон, флубендиамид, флубензимин, флубоцитринат, флукарбазон, флуцетосульфурон, флухлоралин, флукофурон, флуциклоксурон, флуцитринат, флудиоксонил, флуенетил, флуенсульфон, флуфенацет, флуфенерим, флуфеникан, флуфеноксурон, флуфеноксистробин, флуфенпрокс, флуфенпир, флуфензин, флуфипрол, флугексафон, флуметрин, флуметовер, флуметралин, флуметсулам, флумезин, флумиклорак, флумиоксазин, флумипропин, флуморф, флуометурон, флуопиколид, флуопирам, флуорбензид, флуоридамид, фторацетамид, фторуксусная кислота, флуорохлоридон, флуородифен, флуорогликофен, фторомид, фторомид, флуоромидин, флуоронитрофен, флуороксипир, флуотиурон, флуотримазол, флуоксастробин, флупоксам, флупропацил, флупропадин, флупропанат, флупирадифурон, флупирсульфурон, флуквинконазол, флураланер, флуразол, флурекол, флуренол, флуридон, флурохлоридон, фторомидин, флуроксипир, флурпримидол, флурсуламид, флуртамон, флусилазол, флусульфамид, флутензин, флутиацет, флутиамид, флутианил, флутоланил, флутриафол, флювалинат, флуксапироксад, флуксофеним, фолпел, фолпет, фомесафен, фонофос, форамсульфурон, форхлорфенурон, формальдегид, форметанат, формотион, формпаранат, фосамин, фосетил, фосметилан, фоспират, фостиазат, фостиетан, фронталин, фталид, фуберидазол, фуцаоцзин, фуцаоми, фуцзюньманьчжи, этоксифен-этил, камафурил, фунайхэцаолин, фуфентиомочевина, фуралан, фуралаксил, фураметрин, фураметпир, фурантебуфенозид, фуратиокарб, фуркарбанил, фурконазол, фурконазол-цис, фуретрин, фурфурал, фурилазол, фурмециклокс, фурофанат, фурилоксифен, гамма-BHC, гамма-цигалотрин, гамма-HCH, генит, гиббереллиновая кислота, гиббереллин A3, гиббереллины, глифтор, глитор, хлоралоза, глуфосинат, глуфосинат-P, глиодин, глиоксим, глифосат, глифосин, госсиплур, грандлур, гризеофулвин, гуазатин, гуазатин, галакринат, галауксифен, галфенпрокс, галофенозид, галосафен, галосульфурон, галоксидин, галоксифоп, галоксифоп-P, галоксифоп-R, HCA, HCB, HCH, хемел, хемпа, HEOD, гептахлор, гептафлутрин, гептенофос, гептопаргил, гербимицин, гербимицин A, гетерофос, гексахлор, гексахлоран, гексахлорацетон, гексахлорбензол, гексахлорбутадиен, гексахлорфен, гексаконазол, гексафлумурон, фентиванил, гексафлурат, гексалур, гексамид, гексазинон, гексилтиофос, гекситиазокс, HHDN, голосулф, гомобрассинолид, хуаньцайво, хуаньчунцзин, хуанцаолин, хуаньцзюньцзо, гидраметилнон, гидраргафен, гашеная известь, цианамид водорода, цианистый водород, гидропрен, гидроксиизоксазол, гимексазол, хиквинкарб, IAA, IBA, IBP, икаридин, имазалил, имазаметабенз, имазамокс, имазапик, имазапир, имазаквин, имазетапир, имазосульфурон, имибенконазол, имициафос, имидаклоприд, имидаклотиз, иминоктадин, имипротрин, инабенфид, инданофан, индазифлам, индоксакарб, инезин, инфузорная земля, йодобонил, йодокарб, йодфенфос, йодометан, йодосульфурон, иофенсульфурон, иоксинил, ипазин, IPC, ипконазол, ипфенкарбазон, ипробенфос, ипродион, ипроваликарб, ипримидам, ипсдиенол, ипсенол, IPSP, IPX, изамидофос, исазофос, изобензан, изокарбамид, изокарбофос, изоцил, изодрин, изофенфос, изофенфос-метил, изофетамид, изолан, изометиозин, изонорунон, изопамфос, изополинат, изопрокарб, изопроцил, изопропалин, изопропазол, изопротиолан, изопротурон, изопиразам, изопиримол, изотиоат, изотианил, изоурон, изоваледион, изоксабен, изоксахлортол, изоксадифен, изоксафлутол, изоксапирифоп, изоксатион, изурон, ивермектин, иксоксабен, изопамфос, изопамфос, японилур, жапотрины, жасмолин I, жасмолин II, жасмоновая кислота, цзяхуанчунцзун, цзяцзицзенсяолинь, цзясяньцзюньчжи, цзецаовань, цзецаоси, валидамицин, йодфенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, кадетрин, каппа-бифентрин, каппа-тефлутрин, карбутилат, каретазан, касугамицин, кэцзюньлинь, келеван, кетоспирадокс, кизельгур, кинетин, кинопрен, киралаксил, крезоксим-метил, куйцаоси, лактофен, лямбда-цигалотрин, латилур, арсенат свинца, ленацил, лепимектин, лептофос, ляньбэньцзинчжи, сернистая известь, линдан, линеатин, линурон, лиримфос, литлур, луплур, люфенурон, клацифос, трихлоририкарб, меперфлутрин, клацифос, литидатион, M-74, M-81, MAA, фосфид магния, малатион, малатион, гидразид малеиновой кислоты, малонобен, мальтодекстрин, MAMA, манкоппер, манкозеб, мандестробин, мандипропамид, манеб, матрин, мазидокс, MCC, MCP, MCPA, MCPA-тиоэтил, MCPB, MCPP, мебенил, мекарбам, мекарбинзид, мекарфон, мекопроп, мекопроп-P, медимеформ, мединотерб, медлур, мефенацет, мефеноксам, мефенпир, мефлуидид, мегатомовая кислота, мелиссиловый спирт, мелитоксин, MEMC, меназон, MEP, мепанипирим, меперфлутрин, мефенат, мефосфолан, мепикват, мепронил, мептилдинокап, меркаптодиметур, меркаптофос, меркаптофос тиол, меркаптотион, хлорид двухвалентной ртути, оксид двухвалентной ртути, хлорид одновалентной ртути, мерфос, мерфос оксид, мезопразин, мезосульфурон, мезотрион, месульфен, месульфенфос, месульфен, метакрезол, метафлумизон, металаксил, металаксил-M, метальдегид, метам, метамифоп, метамитрон, метафос, метаксон, метазахлор, метазосульфурон, метазоксолон, метконазол, метепа, метфлуразон, метабензтиазурон, метакрифос, металпропалин, метам, метамидофос, метасульфокарб, метазол, метфуроксам, метибензурон, метидатион, метиобенкарб, метиокарб, метиопирисульфурон, метиотепа, метиозолин, метиурон, метокротофос, метолкарб, метометон, метомил, метопрен, метопротрин, метопротрин, метоквин-бутил, метотрин, метоксихлор, метоксифенозид, метоксифенон, метилафолат, метилбромид, метилэвгенол, метилйодид, метилизотиоцианат, метилпаратион, метилацетофос, метилхлороформ, метилдитиокарбаминовая кислота, метилдимрон, метиленхлорид, метилизофенфос, метилмеркаптофос, метилмеркаптофос оксид, метилмеркаптофос тиол, метилртути бензоат, метилртути дициандиамид, метилртути пентахлорфеноксид, метилнеодеканамид, метилнитрофос, метилтриазотион, метиозолин, метирам, метирам-цинк, метобензурон, метобромурон, метофлутрин, метолахлор, метолкарб, метометурон, метоминостробин, метосулам, метоксадиазон, метоксурон, метрафенон, метриам, метрибузин, метрифонат, метсульфовакс, метсульфурон, мевинфос, мексакарбат, мечувэй, мэшуань, пентметрин, милбемектин, милбемицин оксим, милнеб, пириминостробин, мипафокс, MIPC, мирекс, MNAF, могучунь, молинат, молосултап, момфтортрин, моналид, монисурон, моноамитраз, монохлоруксусная кислота, монокротофос, монолинурон, тиосультап-мононатрий, моносульфирам, моносульфурон, моносультап, монурон, монурон-TCA, морфамкват, мороксидин, морфотион, морзид, моксидектин, MPMC, MSMA, MTMC, мускалур, миклобутанил, миклозолин, мирициловый спирт, N-(этилртуть)-п-толуолсульфонанилид, NAA, NAAm, набам, нафталофос, налед, нафталин, нафталинацетамид, ангидрид нафтойной кислоты, нафталофос, нафтоксиуксусные кислоты, нафтилуксусные кислоты, нафтилиндан-1,3-дионы, нафтилоксиуксусные кислоты, напроанилид, напропамид, напропамид-M, напталам, натамицин, NBPOS, небурон, небурон, нендрин, неоникотин, нихлорфос, никлофен, никлозамид, никобифен, никосульфурон, никотин, никотинсульфат, нифлуридид, никкомицины, NIP, нипираклофен, нипиралофен, нитенпирам, нитиазин, нитралин, нитрапирин, нитрилакарб, нитрофен, нитрофлуорфен, нитростирен, нитротал-изопропил, норбормид, нонанол, норбормид, норурон, норфлуразон, норникотин, норурон, новалурон, новифлумурон, NPA, нуаримол, нуранон, OCH, октахлордипропиловый эфир, октхилинон, o-дихлорбензол, офурас, ометоат, o-фенилфенол, орбенкарб, орфралур, орто-дихлорбензол, ортосульфамурон, орикталур, орисастробин, оризалин, остол, острамон, оватрон, овекс, оксабетринил, оксадиаргил, оксадиазон, оксадиксил, оксамат, оксамил, оксапиразон, оксасульфурон, оксатиапипролин, оксазикломефон, оксиновая медь, оксиновая медь, оксолиновая кислота, окспоконазол, оксикарбоксин, оксидеметон-метил, оксидепрофос, оксидисульфотон, оксиенаденин, оксифлуорфен, оксиматрин, окситетрациклин, окситиоквинокс, PAC, паклобутразол, пайчундин, паллетрин, PAP, пара-дихлорбензол, парафлурон, паракват, паратион, паратион-метил, паринол, парижская зелень, PCNB, PCP, PCP-Na, п-дихлорбензол, PDJ, пебулат, пединекс, пефуразоат, пеларгоновая кислота, пенконазол, пенцикурон, пендиметалин, пенфенат, пенфлуфен, пенфлурон, пеноксалин, пеноксулам, пентахлорфенол, пентахлорфениллаурат, пентанохлор, пентиопирад, пентметрин, пентоксазон, перхлордекон, перфлуидон, перметрин, петоксамид, PHC, фенамакрил, фенамакрил-этил, фенаминосульф, феназиноксид, фенетакарб, фенизофам, фенкаптон, фенмедифам, фенмедифам-этил, фенобензурон, фенотиол, фенотрин, фенпроксид, фентоат, фенилртутьмочевина, ацетат фенилртути, хлорид фенилртути, производное фенилртути и пирокатехина, нитрат фенилртути, салицилат фенилртути, форат, фосацетим, фозалон, фозаметин, фосацетим, фосацетин, фосциклотин, фосдифен, фосетил, фосфолан, фосфолан-метил, фосглицин, фосмет, фоснихлор, фосфамид, фосфамидон, фосфин, фосфинотрицин, фосфокарб, фосфор, фостин, фоксим, фоксим-метил, фталид, фталофос, фталтрин, пикарбутразокс, пикаридин, пиклорам, пиколинафен, пикоксистробин, пимарицин, пиндон, пиноксаден, пипералин, пиперазин, пиперонил бутоксид, пиперонил циклонен, пиперофос, пипроктанил, пипроктанил, пипротал, пириметафос, пиримикарб, пириминил, пиримиоксифос, пиримифос-этил, пиримифос-метил, пивал, пивалдион, плифенат, PMA, PMP, полибутены, поликарбамат, полихлоркамфен, полиэтоксихинолин, полиоксин D, полиоксины, полиоксорим, политиалан, арсенит калия, азид калия, цианат калия, этилксантат калия, нафтенат калия, полисульфид калия, тиоцианат калия, п,п′-ДДТ, праллетрин, прекоцен I, прекоцен II, прекоцен III, претилахлор, примидофос, примисульфурон, пробеназол, прохлораз, проклонол, проциазин, процимидон, продиамин, профенофос, профлуазол, профлуралин, профлутрин, профоксидим, профурит-аминий, проглиназин, прогексадион, прогидрожасмон, промацил, промекарб, прометон, прометрин, прометрин, промурит, пронамид, пропахлор, пропафос, пропамидин, пропамокарб, пропанил, пропафос, пропаквизафоп, пропаргит, пропартрин, пропазин, пропетамфос, профам, пропиконазол, пропидин, пропинеб, пропизохлор, пропоксур, пропоксикарбазон, пропилизом, пропирисульфурон, пропизамид, проквиназид, просулер, просульфалин, просульфокарб, просульфурон, протидатион, протиокарб, протиоконазол, протиофос, протоат, протрифенбут, проксан, примидофос, принахлор, псорален, пиданон, пифлубумид, пиметрозин, пиракарболид, пираклофос, пираклонил, пираклостробин, пирафлуфен, пирафлупрол, пирамат, пираметостробин, пираоксистробин, пирасульфотол, пиразифлумид, пиразолат, пиразолинат, пиразон, пиразофос, пиразосульфурон, пиразотион, пиразоксифен, пиресметрин, пиретрин I, пиретрин II, пиретрины, пирибамбенз-изопропил, пирибамбенз-пропил, пирибенкарб, пирибензоксим, пирибутикарб, пириклор, пиридабен, пиридафол, пиридалил, пиридафентион, пиридафентион, пиридат, пиридинитрил, пирифенокс, пирифлуквиназон, пирифталид, пириметафос, пириметанил, пиримикарб, пиримидифен, пириминобак, пириминостробин, пиримифос-этил, пиримифос-метил, пиримисульфан, пиримитат, пиринурон, пириофенон, пирипрол, пирипропанол, пирипроксифен, пиризоксазол, пиритиобак, пиролан, пироквилон, пироксасульфон, пироксулам, пироксихлор, пироксифур, флутиацет, цинкулин, квассия, квинацетол, квиналфос, квиналфос-метил, квиназамид, квинклорак, квинконазол, квинмерак, квинокламин, хинометионат, квинонамид, квинотион, квиноксифен, квинтиофос, квинтозен, квизалофоп, квизалофоп-P, цювэньчжи, цюйиндин, рабензазол, рафоксанид, R-диниконазол, ребемид, реглон, ренридурон, рескалур, ресметрин, родетанил, родожапонин-III, рибавирин, римсульфурон, ризазол, R-металаксил, родетанил, фенлорсфос, ротенон, риания, сабадилла, сафлуфенацил, сайцзюньмао, сайсэньтун, салициланилид, салифлуофен, сангвинарин, сантонин, S-биоаллетрин, шрадан, скиллирозид, себутилазин, секбуметон, седаксан, селамектин, семиамитраз, сезамекс, сезамолин, дизул, сетоксидим, карбарил, шуаньцзянцаолинь, шуаньцзянаньцаолинь, гидропрен, сидурон, тетраметилфлутри, сиглур, силафлуофен, силатран, силикагель, силтиофам, силтиофам, фенопроп, симазин, симеконазол, симетон, симетрин, симетрин, синтофен, кинопрен, гашеная известь, SMA, метопрен, С-метолахлор, арсенит натрия, азид натрия, хлорат натрия, цианид натрия, фторид натрия, фторацетат натрия, гексафторсиликат натрия, нафтенат натрия, ортофенилфенол натрия, ортофенилфенол натрия, пентахлорфенотлят натрия, пентахлорфенотлят натрия, полисульфид натрия, кремнефтористый натрий, тетратиокарбонат натрия, натрий роданистый, пентанохлор, софамид, спинеторам, спиносад, спиродиклофен, спиромезифен, спиротетрамат, спироксамин, стирофос, стрептомицин, стрихнин, сулкатол, сулкофурон, сулкотрион, сульфаллат, сульфентразон, сульфирам, сульфлурамид, сульфодиазол, сульфометурон, глифосат-тримезий, сульфосульфурон, сульфотеп, сульфоксафлор, сульфоксид, сульфоксим, сера, серная кислота, сульфурилфторид, сулгликапин, сульфосат, сульпрофос, сультропен, свеп, тау-флювалинат, таврон, тазимкарб, TBTO, TBZ, TCA, TCBA, TCMTB, TCNB, TDE, тебуконазол, тебуфенозид, тебуфенпирад, тебуфлоквин, тебупиримфос, тебутам, тебутиурон, теклофталам, текназен, текорам, тедион, тефлубензурон, тефлутрин, тефурилтрион, темботрион, темефос, темефос, тепа, TEPP, тепралоксидим, тепролоксидим, тераллетрин, тербацил, тербукарб, тербухлор, тербуфос, тербуметон, тербутилазин, тербутол, тербутрин, квинтозен, окситетрациклин, тетсикласис, тетрахлорэтан, тетрахлорвинфос, тетраконазол, тетрадифон, тетрафлурон, тетраметрин, тетраметилфлутрин, тетрамин, тетранактин, тетранилипрол, тетрапион, тетрасул, сульфат таллия, сульфат таллия тенилхлор, тета-циперметрин, тиабендазол, тиаклоприд, тиадиазин, тиадифлуор, тиаметоксам, тиаметурон, тиапронил, тиазафлурон, тиазфлурон, тиазон, тиазопир, тикрофос, тициофен, тидиазимин, тиадиазурон, тиенкарбазон, тифенсульфурон, тифлузамид, тиомерсал, тимет, тиобенкарб, тиокарбоксим, тиохлорфенфим, тиохлорфенфим, динитроданбензолы, тиоциклам, тиодан, тиодиазол-медь, тиодикарб, тиофанокарб, тиофанокс, тиофлуоксимат, тиохемпа, тиомерсал, тиометон, тионазин, тиофанат, тиофанат-этил, тиофанат-метил, тиофос, тиоквинокс, тиосемикарбазид, тиосултап, тиотепа, тиоксамил, тирам, тирам, турингиенсин, тиабендазол, тиадинил, тиафенацил, тяоцзеань, TIBA, тифатол, тиокарбазил, тиоклорим, тиоксазафен, тиоксимид, тирпат, TMTD, толклофос-метил, толфенпирад, толпрокарб, толпиралат, толилфлуанид, толилфлуанид, толилмеркурацетат, кумафурил, топрамезон, токсафен, TPN, тралкосидим, тралоцитрин, тралометрин, тралопирил, трансфлутрин, трансперметрин, третамин, триаконтанол, триадимефон, триадименол, триафамон, триаллат, триаллат, триамифос, триапентенол, триаратен, триаримол, триасульфурон, триазамат, триазбутил, триазифлам, триазофос, триазотион, триазоксид, трехосновный хлорид меди, трехосновный сульфат меди, трибенурон, трибуфос, трибутилолова оксид, трикамба, трихламид, трихлопир, трихлорфон, трихлорметафос-3, трихлоронат, трихлортринитробензолы, трихлорфон, триклопир, триклопикарб, трикрезол, трициклазол, цихексатин, тридеморф, тридифан, триэтазин, трифенморф, трифенофос, трифлоксистробин, трифлоксисульфурон, трифлудимоксазин, трифлумезопирим, трифлумизол, трифлумурон, трифлуралин, трифлусульфурон, трифоп, трифопсим, трифорин, тригидрокситриазин, тримедлур, триметакарб, триметурон, тринексапак, фентин, трипрен, трипропиндан, трипролид, тритак, тритиалан, тритиконазол, тритосульфурон, трунк-кол, трибуфос, униконазол, униконазол-P, урбацид, уредепа, валерат, валидамицин, валидамицин, валифеналат, валон, вамидотион, вангард, ванилипрол, вернолат, винклозолин, витамин D3, варфарин, сяочунлюлинь, синьцзюньань, феноминстробин, эноксастробин, XMC, ксилахлор, ксиленолы, ксилилкарб, цимиазол, ишицзин, зариламид, зеатин, цзэнсяоань, диетолат, зета-циперметрин, нафтенат цинка, фосфид цинка, цинк-тиазол, цинк-тиозол, трихлорфенолит цинка, трихлорфенолит цинка, цинеб, цирам, золапрофос, варфарин, зоксамид, пираметостробин, кафенстрол, пираоксистробин, цзомихуанлун, α-хлоргидрин, α-экдизон, α-мултистриатин, α-нафталинуксусные кислоты и экдистерон;
(2) следующие молекулы
(a) N- (3-хлор-1- (пиридин-3-ил)- 1H-пиразол-4-ил)- N-этил-3- ((3,3,3-трифторпропил)тио)пропанамид (далее «AI-1»)
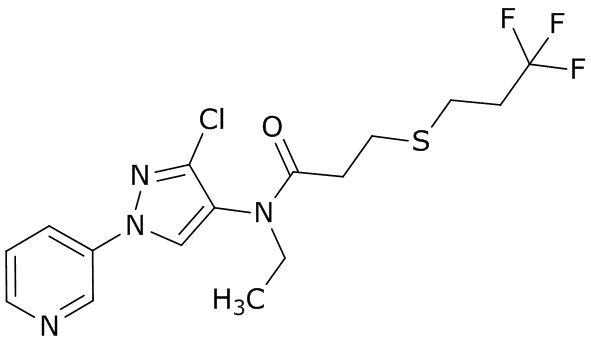
(b) (3S,6S,7R,8R)- 8-бензил-3- (3- ((изобутирилокси)метокси)- 4-метоксипиколинамидо)- 6-метил-4,9-диоксо-1,5-диоксонан-7-илизобутират (далее «AI-2»)
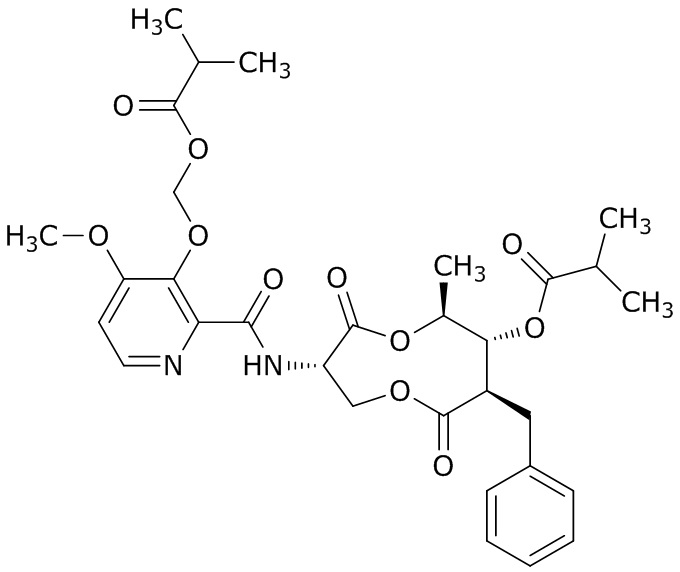 ,
,
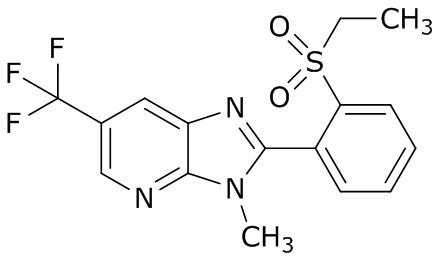
(3) молекула, известная как Lotilaner, которая имеет следующую структуру
 ; и
; и
(4) следующие молекулы в таблице A
Таблица A. Структура №M - активные ингредиенты



При использовании в настоящем раскрытии каждое из вышеуказанного является активным ингредиентом. Для получения большей информации обратитесь за информацией в «Компендиум общих названий пестицидов», находящийся на Alanwood.net, и различные издания, включая он-лайн издание «Справочник пестицидов», находящееся на bcpcdata.com.
Особенно предпочтительный выбор активных ингредиентов представляет собой 1,3-дихлорпропен, хлорпирифос, гексафлумурон, метоксифенозид, новифлумурон, спинеторам, спиносад и сульфоксафлор (далее «AIGA-2»).
Кроме того, другой особенно предпочтительный выбор активных ингредиентов представляет собой ацеквиноцил, ацетамиприд, ацетопрол, авермектин, азинфос-метил, бифеназат, бифентрин, карбарил, карбофуран, хлорфенапир, хлорфлуазурон, хромафенозид, клотианидин, цифлутрин, циперметрин, дельтаметрин, диафентиурон, эмамектина бензоат, эндосульфан, эсфенвалерат, этипрол, этоксазол, фипронил, флоникамид, флуакрипирим, гамма-цигалотрин, галофенозид, индоксакарб, лямбда-цигалотрин, луфенурон, малатион, метомил, новалурон, перметрин, пиридалил, пиримидифен, спиродиклофен, тебуфенозид, тиаклоприд, тиаметоксам, тиодикарб, толфенпирад и зета-циперметрин (далее «AIGA-3»).
Выражение «алкенил» означает ациклический, ненасыщенный (по меньшей мере с одной углерод-углеродной двойной связью), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, винил, аллил, бутенил, пентенил и гексенил.
Выражение «алкенилокси» означает алкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, аллилокси, бутенилокси, пентенилокси, гексенилокси.
Выражение «алкокси» означает алкил, дополнительно содержащий углерод-кислородную одинарную связь, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси.
Выражение «алкил» означает ациклический, насыщенный, разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, метил, этил, пропил, изопропил, бутил и трет-бутил.
Выражение «алкинил» означает ациклический, ненасыщенный (по меньшей мере с одной углерод-углеродной тройной связью), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, этинил, пропаргил, бутинил и пентинил.
Выражение «алкинилокси» означает алкинил, дополнительно содержащий углерод-кислородную одинарную связь, например, пентинилокси, гексинилокси, гептинилокси и октинилокси.
Выражение «арил» означает циклический, ароматический заместитель, состоящий из водорода и углерода, например, фенил, нафтил и бифенил.
Выражение «биопестицид» означает микробное биологическое средство контроля вредителей, которое, как правило, используют аналогичным образом, что и химические пестициды. Обычно они являются бактериальными, но также существуют примеры грибковых средств контроля, включая Trichoderma spp. и Ampelomyces quisqualis. Одним хорошо известным примером биопестицида является Bacillus species, бактериальное заболевание Lepidoptera, Coleoptera и Diptera. Биопестициды включают продукты на основе энтомопатогенных грибов (например, Metarhizium anisopliae), энтомопатогенных нематод (например, Steinernema feltiae) и энтомопатогенных вирусов (например, Cydia pomonella granulovirus). Другие примеры энтомопатогенных организмов включают без ограничения бакуловирусы, простейшие и микроспоридии. Во избежание сомнений биопестициды являются активными ингредиентами.
Выражение «циклоалкенил» означает моноциклический или полициклический, ненасыщенный (по меньшей мере с одной углерод-углеродной двойной связью) заместитель, состоящий из углерода и водорода, например, циклобутенил, циклопентенил, циклогексенил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
Выражение «циклоалкенилокси» означает циклоалкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклобутенилокси, циклопентенилокси, норборненилокси и бицикло[2.2.2]октенилокси.
Выражение «циклоалкил» означает моноциклический или полициклический, насыщенный заместитель, состоящий из углерода и водорода, например, циклопропил, циклобутил, циклопентил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
Выражение «циклоалкокси» означает циклоалкил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклопропилокси, циклобутилокси, циклопентилокси, норборнилокси и бицикло[2.2.2]октилокси.
Выражение «галоген» означает фтор, хлор, бром и йод.
Выражение «галогеналкокси» означает алкокси, дополнительно содержащий от одного до максимально возможного числа идентичных или различных атомов галогенов, например, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2-тетрафторэтокси и пентафторэтокси.
Выражение «галогеналкил» означает алкил, дополнительно содержащий от одного до максимально возможного числа идентичных или различных атомов галогенов, например, фторметил, трифторметил, 2,2-дифторпропил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
Выражение «гетероциклил» означает циклический заместитель, который может быть ароматическим, полностью насыщенным или частично или полностью ненасыщенным, причем циклическая структура содержит по меньшей мере один атом углерода и по меньшей мере один гетероатом, при этом указанный гетероатом представляет собой азот, серу или кислород. Примеры представляют собой:
(1) ароматические гетероциклильные заместители включают без ограничения бензофуранил, бензоизотиазолил, бензоизоксазолил, бензотиенил, бензотиазолил, бензоксазолил, циннолинил, фуранил, имидазолил, индазолил, индолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиазолинил, тиазолил, тиенил, триазинил и триазолил;
(2) полностью насыщенные гетероциклильные заместители включают без ограничения пиперазинил, пиперидинил, морфолинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиофенил, тетрагидротиофенил-оксид, тетрагидротиофенил-диоксид;
(3) частично или полностью ненасыщенные гетероциклильные заместители включают без ограничения 4,5-дигидроизоксазолил, 4,5-дигидрооксазолил, 4,5-дигидро-1H-пиразолил, 2,3-дигидро- [1,3,4]- оксадиазолил, 2,5-диоксоимидазолидинил, 2,4-диоксо-1,3-диазаспиро[4.4]нонанилизоксазолидинонил, оксазолидинонил, имидазолидинонил, изоксазолидинонил, пирролидинонил, 1,2,3,4-тетрагидрохинолинил и тиоксотиазолидинонил; и
(4) дополнительные примеры гетероциклилов включают следующие:
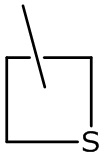

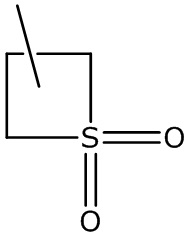
тиетанил тиетанил-оксид и тиетанил-диоксид.
Выражение «место произрастания» означает среду обитания, место размножения, растение, семя, почву, материал или среду, в которой вредитель растет, может расти или может переноситься. Например, место может представлять собой: зону, где растут сельскохозяйственные культуры, деревья, фрукты, злаковые культуры, кормовые виды, виноградники, травяные растения и/или декоративные растения; зону, где постоянно находятся одомашненные животные; внутренние и внешние поверхности зданий (таких как места, где хранят зерно); материалы для строительства, используемые для зданий (такие как пропитанная древесина); и почва вокруг зданий.
Фраза «MoA-материал» означает активный ингредиент с механизмом действия («MoA»), указанным в IRAC Классификации MoA версии 7.3, находящейся на сайте irac-online.org., где описаны следующие группы.
(1) Ингибиторы ацетилхолинэстеразы (AChE) включают следующие активные ингредиенты: аланикарб, альдикарб, бендиокарб, бенфуракарб, бутокарбоксим, бутоксикарбоксим, карбарил, карбофуран, карбосульфан, этиофенкарб, фенобукарб, форметанат, фуратиокарб, изопрокарб, метиокарб, метомил, метолкарб, оксамил, пиримикарб, пропоксур, тиодикарб, тиофанокс, триазамат, триметакарб, XMC, ксилилкарб,
ацефат, азаметифос, азинфос-этил, азинфос-метил, кадусафос,
хлорэтоксифос, хлорфенвинфос, хлормефос, хлорпирифос, хлорпирифос-метил, кумафос, цианофос, деметон-S-метил, диазинон, дихлорфос/DDVP, дикротофос, диметоат, диметилвинфос, дисульфотон, EPN, этион, этопрофос, фамфур, фенамифос, фенитротион, фентион, фостиазат, гептенофос, имициафос, изофенфос, изопропил-O- (метоксиаминотиофосфорил)салицилат, изоксатион, малатион, мекарбам, метамидофос, метидатион, мевинфос, монокротофос, налед, ометоат, оксидеметон-метил, паратион, паратион-метил, фентоат, форат, фозалон, фосмет, фосфамидон, фоксим, пиримифос-метил, профенофос, пропетамфос, протиофос, пираклофос, пиридафентион, квиналфос, сульфотеп, тебупиримфос, темефос, тербуфос, тетрахлорвинфос, тиометон, тиазофос, трихлорфон, вамидотион.
(2) Антагонисты GABA-зависимых хлоридных каналов включают следующие активные ингредиенты: хлордан, эндосульфан, этипрол и фипронил.
(3) Модуляторы натриевых каналов включают следующие активные ингредиенты: акринатрин, аллетрин, d-цис-транс-аллетрин, d-транс-аллетрин, бифентрин, биоаллетрин, биоаллетрин S-циклопентенил, биоресметрин, циклопротрин, цифлутрин, бета-цифлутрин, цигалотрин, лямбда-цигалотрин, гамма-цигалотрин, циперметрин, альфа-циперметрин, бета-циперметрин, тета-циперметрин, зета-циперметрин, цифенотрин
[(1R)- транс-изомеры], дельтаметрин, эмпентрин [(EZ)- (1R)- изомеры], эсфенвалерат, этофенпрокс, фенпропатрин, фенвалерат, флуцитринат, флуметрин, тау-флювалинат, галфенпрокс, имипротрин, кадетрин, перметрин, фенотрин [(1R)- транс-изомер], праллетрин, пиретрины (пиретрум), ресметрин, силафлуофен, тефлутрин,
тетраметрин, тетраметрин [(1R)- изомеры], тралометрин и трансфлутрин, а также метоксихлор.
(4) Агонисты никотинового ацетилхолинового рецептора (nAChR) включают следующие активные ингредиенты:
(4A) ацетампирид, клотианидин, динотефуран, имидаклоприд, нитенпирам, тиаклоприд, тиаметоксам,
(4B) никотин,
(4C) сульфоксафлор,
(4D) флупирадифурон,
(4E) трифлумезопирим и дихлормезотиаз.
(5) Аллостерические активаторы никотинового ацетилхолинового рецептора (nAChR) включают следующие активные ингредиенты: спинеторам и спиносад.
(6) Активаторы хлоридных каналов включают следующие активные ингредиенты: абамектин, эмамектин бензоат, лепимектин и милбемектин.
(7) Имитаторы ювенильного гормона включают следующие активные ингредиенты: гидропрен, кинопрен, метопрен, феноксикарб и пирипроксифен.
(8) Различные неспецифические (относящиеся к нескольким сайтам) ингибиторы включают следующие активные ингредиенты: метилбромид, хлоропикрин, сульфурилфторид, боракс и антимонилтартрат калия.
(9) Модуляторы хордотональных органов включают следующие активные ингредиенты: пиметрозин и флоникамид.
(10) Ингибиторы роста клещей включают следующие активные ингредиенты: клофентезин, гекситиазокс, дифловидазин и этоксазол.
(11) Микробные разрушители мембран средней кишки насекомых включают следующие активные ингредиенты: Bacillus thuringiensis подвид Israelensis, Bacillus thuringiensis подвид. aizawai, Bacillus thuringiensis подвид Kurstaki, Bacillus thuringiensis подвид tenebrionenis,Bt-белки сельскохозяйственных культур (Cry1Ab, Cry1Ac, Cry1Fa, Cry1A.105, Cry2Ab, Vip3A, mCry3A, Cry3Ab, Cry3Bb, Cry34Ab1/Cry35Ab1), а также Bacillus sphaericus.
(12) Ингибиторы митохондриальной АТФ-синтазы включают следующие активные ингредиенты: тетрадифон, пропаргит, азоциклотин, цигексатин, фенбутатин оксид и диафентиурон.
(13) Разобщающие агенты окислительного фосфорилирования, действующие посредством нарушения протонного градиента, включают следующие активные ингредиенты: хлорфенапир, DNOC и сульфлурамид.
(14) Блокаторы каналов никотинового ацетилхолинового рецептора (nAChR) включают следующие активные ингредиенты: бенсултап, картап гидрохлорид, тиоциклам и тиосултап-натрий.
(15) Ингибиторы биосинтеза хитина, тип 0, включают следующие активные ингредиенты: бистрифлурон, хлорфлуазурон, дифлубензурон, флуциклоксурон, флуфеноксурон, гексафлумурон, луфенурон, новалурон, новифлумурон, тефлубензурон и трифлумурон.
(16) Ингибиторы биосинтеза хитина, тип 1, включают следующий активный ингредиент: бупрофезин.
(17) Средство, нарушающее линьку двукрылых, включает следующий активный ингредиент: циромазин.
(18) Агонисты рецептора экдизона включают следующие активные ингредиенты: хромафенозид, галофенозид, метоксифенозид и тебуфенозид.
(19) Агонисты рецептора октопамина включают следующий активный ингредиент: амитраз.
(20) Ингибиторы электронного транспорта митохондриального комплекса III включают следующие активные ингредиенты: гидраметилнон, ацеквиноцил и флуакрипирим.
(21) Ингибиторы электронного транспорта митохондриального комплекса I включают следующие активные ингредиенты: феназаквин, фенпироксимат, пиримидифен, пиридабен, тебуфенпирад, толфенпирад и ротенон.
(22) Блокаторы потенциалозависимых натриевых каналов включают следующие активные ингредиенты: индоксакарб и метафлумизон.
(23) Ингибиторы ацетил-CoA-карбоксилазы включают следующие активные ингредиенты: спиродиклофен, спиромезифен и спиротетрамат.
(24) Ингибиторы электронного транспорта митохондриального комплекса IV включают следующие активные ингредиенты: фосфид алюминия, фосфид кальция, фосфин, фосфид цинка и цианид.
(25) Ингибиторы электронного транспорта митохондриального комплекса II включают следующие активные ингредиенты: циенопирафен и цифлуметофен.
(28) И модуляторы рецептора рианодина включают следующие активные ингредиенты: хлорантранилипрол, циантранилипрол и флубендиамид.
Группы 26 и 27 не определены в данной версии схемы классификации. Кроме того, существует группа UN, которая содержит активные ингредиенты неизвестного или неопределенного механизма действия. Данная группа включает в себя следующие активные ингредиенты: азадирахтин, бензоксимат, бифеназат, бромопропилат, хинометионат, криолит, дикофол, пиридалил и пирифлуквиназон.
Выражение «вредитель» означает организм, который приносит ущерб людям или деятельности человека (например, касающейся сельскохозяйственных культур, пищевых продуктов, домашнего скота и т. д.), при этом указанный организм представлен типами членистоногие, моллюски и нематоды. Конкретными примерами являются муравьи, тля, клопы постельные, жуки, щетинохвостки, гусеницы, тараканы, сверчки, уховертки, блохи, мухи, кузнечики, червовидные личинки, шершни, пчелы-убийцы, цикадки, вши, саранча, личинки насекомых, клещи, ночные бабочки, нематоды, дельфациды, псиллиды, пилильщики, щитовки, чешуйницы, слизни, улитки, пауки, ногохвостки, щитники, симфилы, термиты, трипсы, иксодовые клещи, осы, белокрылки и проволочники.
Дополнительными примерами вредителей являются следующие.
(1) Подтип хелицеровые, мириаподы и шестиногие.
(2) Классы: паукообразные, симфилы и насекомые.
(3) Отряд вши. Неисключительный перечень конкретных родов включает без ограничения Haematopinus spp., Hoplopleura spp., Linognathus spp., Pediculus spp., Polyplax spp., Solenopotes spp. и Neohaematopinis spp. Неисключительный перечень конкретных видов включает без ограничения Haematopinus asini, Haematopinus suis, Linognathus setosus, Linognathus ovillus, Pediculus humanus capitis, Pediculus humanus humanus и Pthirus pubis.
(4) Отряд жесткокрылые. Неисключительный перечень конкретных родов включает без ограничения Acanthoscelides spp., Agriotes spp., Anthonomus spp., Apion spp., Apogonia spp., Araecerus spp., Aulacophora spp., Bruchus spp., Cerosterna spp., Cerotoma spp., Ceutorhynchus spp., Chaetocnema spp., Colaspis spp., Ctenicera spp., Curculio spp., Cyclocephala spp., Diabrotica spp., Dinoderus spp., Gnathocerus spp., Hemicoelus spp., Heterobostruchus spp., Hypera spp., Ips spp., Lyctus spp., Megascelis spp., Meligethes spp., Mezium spp., Niptus spp., Otiorhynchus spp., Pantomorus spp., Phyllophaga spp., Phyllotreta spp., Ptinus spp., Rhizotrogus spp., Rhynchites spp., Rhynchophorus spp., Scolytus spp., Sphenophorus spp., Sitophilus spp., Tenebrio spp. и Tribolium spp. Неисключительный перечень конкретных видов включает без ограничения Acanthoscelides obtectus, Agrilus planipennis, Ahasverus advena, Alphitobius diaperinus, Anoplophora glabripennis, Anthonomus grandis, Anthrenus verbasci, Anthrenus falvipes, Ataenius spretulus, Atomaria linearis, Attagenus unicolor, Bothynoderes punctiventris, Bruchus pisorum, Callosobruchus maculatus, Carpophilus hemipterus, Cassida vittata, Cathartus quadricollis, Cerotoma trifurcata, Ceutorhynchus assimilis, Ceutorhynchus napi, Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar, Cotinis nitida, Crioceris asparagi, Cryptolestes ferrugineus, Cryptolestes pusillus, Cryptolestes turcicus, Cylindrocopturus adspersus, Deporaus marginatus, Dermestes lardarius, Dermestes maculatus, Epilachna varivestis, Euvrilletta peltata, Faustinus cubae, Hylobius pales, Hylotrupes bajulus, Hypera postica, Hypothenemus hampei, Lasioderma serricorne, Leptinotarsa decemlineata, Limonius canus, Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus, Lophocateres pusillus, Lyctus planicollis, Maecolaspis joliveti, Melanotus communis, Meligethes aeneus, Melolontha melolontha, Necrobia rufipes, Oberea brevis, Oberea linearis, Oryctes rhinoceros, Oryzaephilus mercator, Oryzaephilus surinamensis, Oulema melanopus, Oulema oryzae, Phyllophaga cuyabana, Polycaon stoutti, Popillia japonica, Prostephanus truncatus, Rhyzopertha dominica, Sitona lineatus, Sitophilus granarius, Sitophilus oryzae, Sitophilus zeamais, Stegobium paniceum, Tenebroides mauritanicus, Tribolium castaneum, Tribolium confusum, Trogoderma granarium, Trogoderma variabile, Xestobium rufovillosum и Zabrus tenebrioides.
(5) Отряд кожистокрылые. Неисключительный перечень конкретных видов включает без ограничения Forficula auricularia.
(6) Отряд таракановые. Неисключительный перечень конкретных видов включает без ограничения Blattella germanica, Blattella asahinai, Blatta orientalis, Blatta lateralis, Parcoblatta pennsylvanica, Periplaneta americana, Periplaneta australasiae, Periplaneta brunnea, Periplaneta fuliginosa, Pycnoscelus surinamensis и Supella longipalpa.
(7) Отряд двукрылые. Неисключительный перечень конкретных родов включает без ограничения Aedes spp., Agromyza spp., Anastrepha spp., Anopheles spp., Bactrocera spp., Ceratitis spp., Chrysops spp., Cochliomyia spp., Contarinia spp., Culex spp., Culicoides spp., Dasineura spp., Delia spp., Drosophila spp., Fannia spp., Hylemya spp., Liriomyza spp., Musca spp., Phorbia spp., Pollenia spp., Psychoda spp., Simulium spp., Tabanus spp. и Tipula spp. Неисключительный перечень конкретных видов включает без ограничения Agromyza frontella, Anastrepha suspensa, Anastrepha ludens, Anastrepha obliqua, Bactrocera cucurbitae, Bactrocera dorsalis, Bactrocera invadens, Bactrocera zonata, Ceratitis capitata, Dasineura brassicae, Delia platura, Fannia canicularis, Fannia scalaris, Gasterophilus intestinalis, Gracillia perseae, Haematobia irritans, Hypoderma lineatum, Liriomyza brassicae, Melophagus ovinus, Musca autumnalis, Musca domestica, Oestrus ovis, Oscinella frit, Pegomya betae, Piophila casei, Psila rosae, Rhagoletis cerasi, Rhagoletis pomonella, Rhagoletis mendax, Sitodiplosis mosellana и Stomoxys calcitrans.
(8) Отряд полужесткокрылые клопы. Неисключительный перечень конкретных родов включает без ограничения Adelges spp., Aulacaspis spp., Aphrophora spp., Aphis spp., Bemisia spp., Ceroplastes spp., Chionaspis spp., Chrysomphalus spp., Coccus spp., Empoasca spp., Euschistus spp., Lepidosaphes spp., Lagynotomus spp., Lygus spp., Macrosiphum spp., Nephotettix spp., Nezara spp., Nilaparvata spp., Philaenus spp., Phytocoris spp., Piezodorus spp., Planococcus spp., Pseudococcus spp., Rhopalosiphum spp., Saissetia spp., Therioaphis spp., Toumeyella spp., Toxoptera spp., Trialeurodes spp., Triatoma spp. и Unaspis spp. Неисключительный перечень конкретных видов включает без ограничения Acrosternum hilare, Acyrthosiphon pisum, Aleyrodes proletella, Aleurodicus dispersus, Aleurothrixus floccosus, Amrasca biguttula biguttula, Aonidiella aurantii, Aphis gossypii, Aphis glycines, Aphis pomi, Aulacorthum solani, Bactericera cockerelli, Bagrada hilaris, Bemisia argentifolii, Bemisia tabaci, Blissus leucopterus, Boisea trivittata, Brachycorynella asparagi, Brevennia rehi, Brevicoryne brassicae, Cacopsylla pyri, Cacopsylla pyricola, Calocoris norvegicus, Ceroplastes rubens, Cimex hemipterus, Cimex lectularius, Dagbertus fasciatus, Dichelops furcatus, Diuraphis noxia, Diaphorina citri, Dysaphis plantaginea, Dysdercus suturellus, Edessa meditabunda, Eriosoma lanigerum, Eurygaster maura, Euschistus conspersus, Euschistus heros, Euschistus servus, Halyomorpha halys, Helopeltis antonii, Helopeltis theivora, Icerya purchasi, Idioscopus nitidulus, Laodelphax striatellus, Leptocorisa oratorius, Leptocorisa varicornis, Lygus hesperus, Maconellicoccus hirsutus, Macrosiphum euphorbiae, Macrosiphum granarium, Macrosiphum rosae, Macrosteles quadrilineatus, Mahanarva frimbiolata, Megacopta cribraria, Metopolophium dirhodum, Mictis longicornis, Myzus persicae, Nephotettix cincticeps, Neurocolpus longirostris, Nezara viridula, Nilaparvata lugens, Parlatoria pergandii, Parlatoria ziziphi, Peregrinus maidis, Phylloxera vitifoliae, Physokermes piceae, Phytocoris californicus, Phytocoris relativus, Piezodorus guildinii, Poecilocapsus lineatus, Psallus vaccinicola, Pseudacysta perseae, Pseudococcus brevipes, Quadraspidiotus perniciosus, Rhopalosiphum maidis, Rhopalosiphum padi, Saissetia oleae, Scaptocoris castanea, Schizaphis graminum, Sitobion avenae, Sogatella furcifera, Trialeurodes vaporariorum, Trialeurodes abutiloneus, Unaspis yanonensis и Zulia entrerriana.
(9) Отряд перепончатокрылые насекомые. Неисключительный перечень конкретных родов включает без ограничения Acromyrmex spp., Atta spp., Camponotus spp., Diprion spp., Dolichovespula spp., Formica spp., Monomorium spp., Neodiprion spp., Paratrechina spp., Pheidole spp., Pogonomyrmex spp., Polistes spp., Solenopsis spp., Technomyrmex,spp., Tetramorium spp., Vespula spp., Vespa spp. и Xylocopa spp. Неисключительный перечень конкретных видов включает без ограничения Athalia rosae, Atta texana, Caliroa cerasi, Cimbex americana, Iridomyrmex humilis, Linepithema humile, Mellifera Scutellata, Monomorium minimum, Monomorium pharaonis, Neodiprion sertifer, Solenopsis invicta, Solenopsis geminata, Solenopsis molesta, Solenopsis richtery, Solenopsis xyloni, Tapinoma sessile и Wasmannia auropunctata.
(10) Отряд белые муравьи. Неисключительный перечень конкретных родов включает без ограничения Coptotermes spp., Cornitermes spp., Cryptotermes spp., Heterotermes spp., Kalotermes spp., Incisitermes spp., Macrotermes spp., Marginitermes spp., Microcerotermes spp., Procornitermes spp., Reticulitermes spp., Schedorhinotermes spp. и Zootermopsis spp. Неисключительный перечень конкретных видов включает без ограничения Coptotermes acinaciformis, Coptotermes curvignathus, Coptotermes frenchi, Coptotermes formosanus, Coptotermes gestroi, Cryptotermes brevis, Heterotermes aureus, Heterotermes tenuis, Incisitermes minor, Incisitermes snyderi, Microtermes obesi, Nasutitermes corniger, Odontotermes formosanus, Odontotermes obesus, Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes, Reticulitermes hageni, Reticulitermes hesperus, Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis и Reticulitermes virginicus.
(11) Отряд чешуекрылые. Неисключительный перечень конкретных родов включает без ограничения Adoxophyes spp., Agrotis spp., Argyrotaenia spp., Cacoecia spp., Caloptilia spp., Chilo spp., Chrysodeixis spp., Colias spp., Crambus spp., Diaphania spp., Diatraea spp., Earias spp., Ephestia spp., Epimecis spp., Feltia spp., Gortyna spp., Helicoverpa spp., Heliothis spp., Indarbela spp., Lithocolletis spp., Loxagrotis spp., Malacosoma spp., Nemapogon spp., Peridroma spp., Phyllonorycter spp., Pseudaletia spp., Plutella spp., Sesamia spp., Spodoptera spp., Synanthedon spp. и Yponomeuta spp. Неисключительный перечень конкретных видов включает без ограничения Achaea janata, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Amorbia cuneana, Amyelois transitella, Anacamptodes defectaria, Anarsia lineatella, Anomis sabulifera, Anticarsia gemmatalis, Archips argyrospila, Archips rosana, Argyrotaenia citrana, Autographa gamma, Bonagota cranaodes, Borbo cinnara, Bucculatrix thurberiella, Capua reticulana, Carposina niponensis, Chlumetia transversa, Choristoneura rosaceana, Cnaphalocrocis medinalis, Conopomorpha cramerella, Corcyra cephalonica, Cossus cossus, Cydia caryana, Cydia funebrana, Cydia molesta, Cydia nigricana, Cydia pomonella, Darna diducta, Diaphania nitidalis, Diatraea saccharalis, Diatraea grandiosella, Earias insulana, Earias vittella, Ecdytolopha aurantianum, Elasmopalpus lignosellus, Ephestia cautella, Ephestia elutella, Ephestia kuehniella, Epinotia aporema, Epiphyas postvittana, Erionota thrax, Estigmene acrea, Eupoecilia ambiguella, Euxoa auxiliaris, Galleria mellonella, Grapholita molesta, Hedylepta indicata, Helicoverpa armigera, Helicoverpa zea, Heliothis virescens, Hellula undalis, Keiferia lycopersicella, Leucinodes orbonalis, Leucoptera coffeella, Leucoptera malifoliella, Lobesia botrana, Loxagrotis albicosta, Lymantria dispar, Lyonetia clerkella, Mahasena corbetti, Mamestra brassicae, Manduca sexta, Maruca testulalis, Metisa plana, Mythimna unipuncta, Neoleucinodes elegantalis, Nymphula depunctalis, Operophtera brumata, Ostrinia nubilalis, Oxydia vesulia, Pandemis cerasana, Pandemis heparana, Papilio demodocus, Pectinophora gossypiella, Peridroma saucia, Perileucoptera coffeella, Phthorimaea operculella, Phyllocnistis citrella, Phyllonorycter blancardella, Pieris rapae, Plathypena scabra, Platynota idaeusalis, Plodia interpunctella, Plutella xylostella, Polychrosis viteana, Prays endocarpa, Prays oleae, Pseudaletia unipuncta, Pseudoplusia includens, Rachiplusia nu, Scirpophaga incertulas, Sesamia inferens, Sesamia nonagrioides, Setora nitens, Sitotroga cerealella, Sparganothis pilleriana, Spodoptera exigua, Spodoptera frugiperda, Spodoptera eridania, Thecla basilides, Tinea pellionella, Tineola bisselliella, Trichoplusia ni, Tuta absoluta, Zeuzera coffeae и Zeuzea pyrina.
(12) Отряд пухоеды. Неисключительный перечень конкретных родов включает без ограничения Anaticola spp., Bovicola spp., Chelopistes spp., Goniodes spp., Menacanthus spp. и Trichodectes spp. Неисключительный перечень конкретных видов включает без ограничения Bovicola bovis, Bovicola caprae, Bovicola ovis, Chelopistes meleagridis, Goniodes dissimilis, Goniodes gigas, Menacanthus stramineus, Menopon gallinae и Trichodectes canis.
(13) Отряд прыгающие прямокрылые. Неисключительный перечень конкретных родов включает без ограничения Melanoplus spp. и Pterophylla spp. Неисключительный перечень конкретных видов включает без ограничения Acheta domesticus, Anabrus simplex, Gryllotalpa africana, Gryllotalpa australis, Gryllotalpa brachyptera, Gryllotalpa hexadactyla, Locusta migratoria, Microcentrum retinerve, Schistocerca gregaria и Scudderia furcata.
(14) Отряд сеноеды. Неисключительный перечень конкретных видов включает без ограничения Liposcelis decolor, Liposcelis entomophila, Lachesilla quercus и Trogium pulsatorium.
(15) Отряд блохи. Неисключительный перечень конкретных видов включает без ограничения Ceratophyllus gallinae, Ceratophyllus niger, Ctenocephalides canis, Ctenocephalides felis и Pulex irritans.
(16) Отряд пузыреногие. Неисключительный перечень конкретных родов включает без ограничения Caliothrips spp., Frankliniella spp., Scirtothrips spp. и Thrips spp. Неисключительный перечень конкретных видов включает без ограничения Frankliniella bispinosa, Frankliniella fusca, Frankliniella occidentalis, Frankliniella schultzei, Frankliniella tritici, Frankliniella williamsi, Heliothrips haemorrhoidalis, Rhipiphorothrips cruentatus, Scirtothrips citri, Scirtothrips dorsalis, Taeniothrips rhopalantennalis, Thrips hawaiiensis, Thrips nigropilosus, Thrips orientalis, Thrips palmi и Thrips tabaci.
(17) Отряд щетинохвостки. Неисключительный перечень конкретных родов включает без ограничения Lepisma spp. и Thermobia spp.
(18) Отряд клещи. Неисключительный перечень конкретных родов включает без ограничения Acarus spp., Aculops spp., Argus spp., Boophilus spp., Demodex spp., Dermacentor spp., Epitrimerus spp., Eriophyes spp., Ixodes spp., Oligonychus spp., Panonychus spp., Rhizoglyphus spp. и Tetranychus spp. Неисключительный перечень конкретных видов включает без ограничения Acarapis woodi, Acarus siro, Aceria mangiferae, Aculops lycopersici, Aculus pelekassi, Aculus schlechtendali, Amblyomma americanum, Brevipalpus obovatus, Brevipalpus phoenicis, Dermacentor variabilis, Dermatophagoides pteronyssinus, Eotetranychus carpini, Liponyssoides sanguineus, Notoedres cati, Oligonychus coffeae, Oligonychus ilicis, Ornithonyssus bacoti, Panonychus citri, Panonychus ulmi, Phyllocoptruta oleivora, Polyphagotarsonemus latus, Rhipicephalus sanguineus, Sarcoptes scabiei, Tegolophus perseaflorae, Tetranychus urticae, Tyrophagus longior и Varroa destructor.
(19) Отряд пауки. Неисключительный перечень конкретных родов включает без ограничения Loxosceles spp., Latrodectus spp. и Atrax spp. Неисключительный перечень конкретных видов включает без ограничения Loxosceles reclusa, Latrodectus mactans и Atrax robustus.
(20) Класс симфилы. Неисключительный перечень конкретных видов включает без ограничения Scutigerella immaculata.
(21) Подкласс коллемболы. Неисключительный перечень конкретных видов включает без ограничения Bourletiella hortensis, Onychiurus armatus, Onychiurus fimetarius и Sminthurus viridis.
(22) Тип нематоды. Неисключительный перечень конкретных родов включает без ограничения Aphelenchoides spp., Belonolaimus spp., Criconemella spp., Ditylenchus spp., Globodera spp., Heterodera spp., Hirschmanniella spp., Hoplolaimus spp., Meloidogyne spp., Pratylenchus spp. и Radopholus spp. Неисключительный перечень конкретных видов включает без ограничения Dirofilaria immitis, Globodera pallida, Heterodera glycines, Heterodera zeae, Meloidogyne incognita, Meloidogyne javanica, Onchocerca volvulus, Pratylenchus penetrans, Radopholus similis и Rotylenchulus reniformis.
(23) Тип моллюски. Неисключительный перечень конкретных видов включает без ограничения Arion vulgaris, Cornu aspersum, Deroceras reticulatum, Limax flavus, Milax gagates и Pomacea canaliculata.
Особенно предпочтительная группа вредителей, с которыми борются, представляет собой вредителей, питающихся соком растений. Питающиеся соком вредители, как правило, имеют протыкающие и/или всасывающие ротовые части и питаются соком и внутренними растительными тканями растений. Примерами питающихся соком растений вредителей, составляющих конкретную проблему для сельского хозяйства, являются без ограничения тля, цикадки, ночные бабочки, щитовки, трипсы, псиллиды, войлочники, щитники и белокрылки. Конкретными примерами отрядов, которые включают питающихся соком растений вредителей, составляющих конкретную проблему для сельского хозяйства, являются без ограничения вши и полужесткокрылые клопы. Конкретными примерами полужесткокрылых клопов, которые составляют конкретную проблему для сельского хозяйства, являются без ограничения Aulacaspis spp., Aphrophora spp., Aphis spp., Bemisia spp., Coccus spp., Euschistus spp., Lygus spp., Macrosiphum spp., Nezara spp. и Rhopalosiphum spp.
Другая особенно предпочтительная группа вредителей, подлежащая контролю, представляет собой жующих вредителей. Жующие вредители, как правило, имеют ротовые части, которые позволяют им пережевывать ткань растений, включая корни, стебли, листья, почки и репродуктивные ткани (включая без ограничения цветы, плоды и семена). Примерами жующих вредителей, составляющих конкретную проблему для сельского хозяйства, являются без ограничения гусеницы, жуки, кузнечики и саранча. Конкретными примерами отрядов, которые включают жующих вредителей, составляющих конкретную проблему для сельского хозяйства, являются без ограничения жесткокрылые и чешуекрылые. Конкретными примерами жесткокрылых, составляющих конкретную проблему для сельского хозяйства, являются без ограничения Anthonomus spp., Cerotoma spp., Chaetocnema spp., Colaspis spp., Cyclocephala spp., Diabrotica spp., Hypera spp., Phyllophaga spp., Phyllotreta spp., Sphenophorus spp., Sitophilus spp.
Фраза «пестицидно эффективное количество» означает количество пестицида, необходимое для достижения заметного эффекта на вредителя, например, эффектов некроза, смерти, замедления развития, предотвращения появления, уничтожения, истребления или другого уменьшения случаев появления и/или активности вредителя в месте произрастания. Данный эффект может наступать, когда популяции вредителей покинули место произрастания, вредители обезврежены в месте произрастания или вокруг места произрастания и/или вредители уничтожены в месте произрастания или вокруг места произрастания. Разумеется, возможна комбинация данных эффектов. Как правило, популяции, активность вредителей или как популяции, так и активность вредителей необходимо снижать более чем на пятьдесят процентов, предпочтительно более чем на 90 процентов и наиболее предпочтительно более чем на 99 процентов. Как правило, пестицидно эффективное количество для сельскохозяйственных целей составляет от приблизительно 0,0001 грамма на гектар до приблизительно 5000 грамм на гектар, предпочтительно от приблизительно 0,0001 грамма на гектар до приблизительно 500 грамм на гектар и еще более предпочтительно от приблизительно 0,0001 грамма на гектар до приблизительно 50 грамм на гектар.
Подробное описание настоящего раскрытия
В данном документе раскрыты молекулы формулы один,

формула один,
где
(A) R1 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(B) R2 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(C) R3 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(D) R4 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(E) R5 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(F) R6 выбран из группы, состоящей из H и (C1-C4)алкила;
(G) R7 выбран из группы, состоящей из H, F, Cl, Br и I;
(H) R8 выбран из группы, состоящей из F, Cl, Br и I;
(I) R9 выбран из группы, состоящей из H и (C1-C4)алкила;
(J) R10 выбран из группы, состоящей из H, (C1-C4)алкила, (C2-C4)алкенила, (C1-C4)галогеналкила, (C1-C4)алкил(C1-C4)алкокси, C(=O)(C1-C4)алкила и (C1-C4)алкоксиC(=O)(C1-C4)алкила;
(K) R11 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(L) R12 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(M) R13 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(N) R14 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(O) R15 выбран из группы, состоящей из H, (C1-C4)алкила, (C2-C4)алкенила, (C1-C4)галогеналкила, (C1-C4)алкил(C1-C4)алкокси, C(=O)(C1-C4)алкила и (C1-C4)алкоксиC(=O)(C1-C4)алкила;
(P) R16 выбран из группы, состоящей из (C3-C8)циклоалкила, азетидинила, 2,5-диоксоимидазолидинила, 2,4-диоксо-1,3-диазаспиро[4.4]нонанилизоксазолидинонила, имидазолидинонила, изоксазолидинонила, морфолинила, оксазолидинонила, оксетанила, пиперазинила, пиперидинила, пиранила, пирролидинила, пирролидинонила, тетрагидрофуранила, тетрагидропиранила, тетрагидротиофенила, тетрагидротиофенил-оксида, тетрагидротиофенил-диоксида, тиетанила, тиетанил-оксида, тиетанил-диоксида и тиоксотиазолидинонила, при этом каждый из циклоалкила, азетидинила, 2,5-диоксоимидазолидинила, 2,4-диоксо-1,3-диазаспиро[4.4]нонанилизоксазолидинонила, имидазолидинонила, изоксазолидинонила, морфолинила, оксазолидинонила, оксетанила, пиперазинила, пиперидинила, пиранила, пирролидинила, пирролидинонила, тетрагидрофуранила, тетрагидропиранила, тетрагидротиофенила, тетрагидротиофенил-оксида, тетрагидротиофенил-диоксида, тиетанила, тиетанил-оксида, тиетанил-диоксида и тиоксотиазолидинонила может быть необязательно замещен одним или более заместителями, выбранными из H, F, Cl, Br, I, CN, NH2, NO2, оксо, (C1-C4)алкила, (C1-C4)галогеналкила, C(=O)O(C1-C4)алкила, (C=O)NH(C1-C4)алкила, (C=O)NH(C1-C4)галогеналкила, C(=O)(C3-C6)циклопропила, C(=O)(C1-C4)галогеналкила, C(=O)(C1-C4)алкил(C1-C4)алкокси и (C1-C4)алкилморфолинила;
(Q) каждый из Q1 и Q2 независимо выбран из группы, состоящей из O и S; и
N-оксиды, приемлемые с точки зрения сельского хозяйства соли присоединения кислоты, производные солей, сольваты, сложноэфирные производные, кристаллические полиморфы, изотопы, разделенные стереоизомеры и таутомеры молекул формулы один.
Молекулы формулы один могут существовать в различных геометрических или оптических изомерных или различных таутомерных формах. Могут присутствовать один или более центров хиральности, в таком случае молекулы формулы один могут находиться в виде чистых энантиомеров, смесей энантиомеров, чистых диастереомеров или смесей диастереомеров. Специалистам в данной области техники будет понятно, что один стереоизомер может быть более активным, чем другие стереоизомеры. Отдельные стереоизомеры можно получать посредством известных процедур селективного синтеза, посредством традиционных процедур синтеза с применением разделенных исходных материалов или посредством традиционных процедур разделения. В молекуле могут присутствовать двойные связи, в таком случае соединения формулы один могут существовать в виде отдельных геометрических изомеров (цис или транс, E или Z) или смесей геометрических изомеров (цис и транс, E и Z). Могут присутствовать центры таутомеризации. Данное раскрытие охватывает все такие изомеры, таутомеры и их смеси во всех пропорциях.
В другом варианте осуществления молекулы формулы один, карбоксамидо и фенил, которые соединены с циклопропаном, находятся в R,R-конфигурации. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R1 выбран из группы, состоящей из H, F и Cl. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R2 выбран из группы, состоящей из H, F, Cl, Br, (C1-C4)алкила и (C1-C4)галогеналкила. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R2 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R3 выбран из группы, состоящей из H, F, Cl, (C1-C4)алкила, (C1-C4)галогеналкила и (C1-C4)галогеналкокси. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R3 выбран из группы, состоящей из H, F, Cl, CH3, CF3 и OCF3. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R4 выбран из группы, состоящей из H, F, Cl, Br, (C1-C4)алкила и (C1-C4)галогеналкила. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R4 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R5 выбран из группы, состоящей из H, F и Cl. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R6 представляет собой H. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R7 представляет собой Cl. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R8, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R8 представляет собой Cl. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R9, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R9 представляет собой H. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R10, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R10 представляет собой H. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R11, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R11 представляет собой H. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R12 представляет собой H. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R13, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R13 выбран из группы, состоящей из H, Cl и (C1-C4)галогеналкила. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R13 выбран из группы, состоящей из H, F, Cl и CF3. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R14, R15, R16, Q1 и Q2.
В другом варианте осуществления R14 представляет собой H. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R15, R16, Q1 и Q2.
В другом варианте осуществления R15 выбран из группы, состоящей из H и (C1-C4)алкила. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R16, Q1 и Q2.
В другом варианте осуществления R15 выбран из группы, состоящей из H и CH3. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R16, Q1 и Q2.
В другом варианте осуществления R16 выбран из группы, состоящей из циклопропила, циклобутила, циклопентила, циклогексила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида,
при этом каждый из циклопропила, циклобутила, циклопентила, циклогексила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, CN, C(=O)OC(CH3)3 и C(=O)CF3. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, Q1 и Q2.
В другом варианте осуществления Q1 представляет собой O. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и Q2.
В другом варианте осуществления Q2 представляет собой O. Данный вариант осуществления можно применять в комбинации с другими вариантами осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и Q1.
В другом варианте осуществления:
(A) R1 выбран из группы, состоящей из H, F и Cl;
(B) R2 выбран из группы, состоящей из H, F, Cl, Br, (C1-C4)алкила и (C1-C4)галогеналкила;
(C) R3 выбран из группы, состоящей из H, F, Cl, (C1-C4)алкила, (C1-C4)галогеналкила и (C1-C4)галогеналкокси;
(D) R4 выбран из группы, состоящей из H, F, Cl, Br, (C1-C4)алкила и (C1-C4)галогеналкила;
(E) R5 представляет собой H;
(F) R6 представляет собой H;
(G) R7 выбран из группы, состоящей из Cl и Br;
(H) R8 выбран из группы, состоящей из Cl и Br;
(I) R9 представляет собой H;
(J) R10 представляет собой H;
(K) R11 представляет собой H;
(L) R12 представляет собой H;
(M) R13 выбран из группы, состоящей из H, Cl и (C1-C4)галогеналкила;
(N) R14 представляет собой H;
(O) R15 выбран из группы, состоящей из H и (C1-C4)алкила;
(P) R16 выбран из группы, состоящей из (C3-C8)циклоалкила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида, при этом каждый из циклоалкила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, CN, C(=O)O(C1-C4)алкила, C(=O)(C3-C6)циклопропила, C(=O)(C1-C4)галогеналкила и C(=O)(C1-C4)алкил(C1-C4)алкокси; и
(Q) Q1 и Q2 представляют собой O.
В другом варианте осуществления:
(A) R1 выбран из группы, состоящей из H и Cl;
(B) R2 выбран из группы, состоящей из H, Cl, Br, CH3 и CF3;
(C) R3 выбран из группы, состоящей из H, F, Cl, CH3 и CF3, OCF3;
(D) R4 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3;
(E) R5 представляет собой H;
(F) R6 представляет собой H;
(G) R7 выбран из группы, состоящей из Cl и Br;
(H) R8 выбран из группы, состоящей из Cl и Br;
(I) R9 представляет собой H;
(J) R10 представляет собой H;
(K) R11 представляет собой H;
(L) R12 представляет собой H;
(M) R13 выбран из группы, состоящей из H, Cl и CF3;
(N) R14 представляет собой H;
(O) R15 выбран из группы, состоящей из H и CH3;
(P) R16 выбран из группы, состоящей из (C3-C8)циклоалкила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида, при этом каждый из циклоалкила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, CN, C(=O)O(C1-C4)алкила, C(=O)(C3-C6)циклопропила, C(=O)(C1-C4)галогеналкила и C(=O)(C1-C4)алкил(C1-C4)алкокси; и
(Q) Q1 и Q2 представляют собой O.
Получение циклопропилкарбоновых кислот
Стильбены 1-1, где R1, R2, R3, R4, R5, R6 и R9 раскрыты ранее, можно обрабатывать основанием, таким как гидроксид натрия, в присутствии источника карбена, такого как хлороформ или бромоформ, и катализатора межфазного переноса, такого как N-бензил-N,N-диэтилэтанаминия хлорид, в полярном протонном растворителе, таком как вода, при значениях температуры от приблизительно 0°C до приблизительно 40°C с получением диарилциклопропaнов 1-2, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 раскрыты ранее (схема 1, стадия a). Обработка диарилциклопропaнов 1-2 с помощью переходного металла, такого как хлорид рутения(III), в присутствии стехиометрического количества окислителя, такого как периодат натрия, в смеси растворителей, предпочтительно из воды, этилацетата и ацетонитрила, при значениях температуры от приблизительно 0°C до приблизительно 40°C может обеспечивать получение циклопропилкарбоновых кислот 1-3, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 раскрыты ранее (схема 1, стадия b).
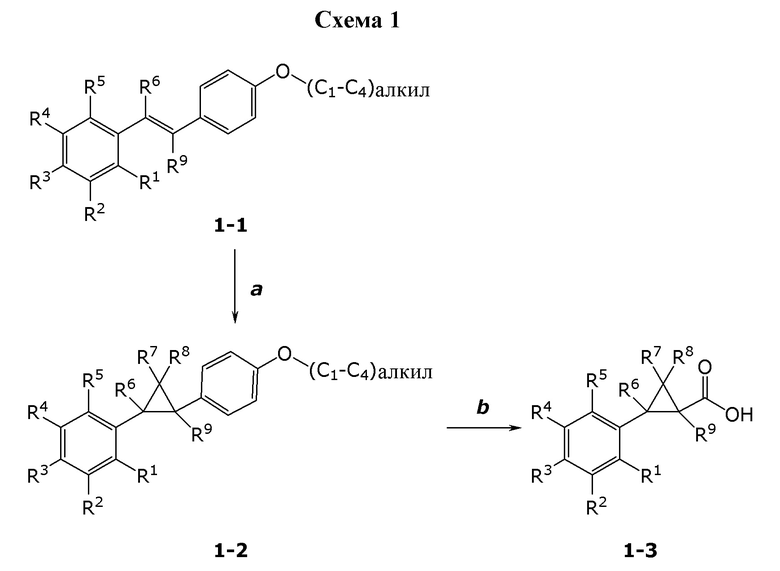
В еще одних вариантах осуществления соединения 1-3 можно получать из арилкетона 1.5-1, где R1, R2, R3, R4 и R5 раскрыты ранее, и R6 представляет собой метил. Ацетофенон 1.5-1 на первой стадии можно вводить в реакцию со стабилизированным карбанионом фосфоната, полученным обработкой фосфоната, такого как этил-2-(диэтоксифосфорил)ацетат, с сильным основанием, таким как гидрид натрия или трет-бутоксид калия, в полярном апротонном растворителе, таком как тетрагидрофуран, при температуре от приблизительно 0°C до приблизительно 5°C (схема 1.5, стадия a). Эта реакция, как и многие другие, включающие обработку альдегидов или кетонов стабилизированными карбанионами фосфоната с получением олефинов, будет легко идентифицирована специалистом в данной области техники как олефинирование Хорнера-Вадсворта-Эммонса. На второй стадии α,β-ненасыщенный сложный эфир 1.5-2, где R1, R2, R3, R4, R5 и R6 определены выше, можно обрабатывать восстанавливающим средством, например, гидридом металла, таким как гидрид диизобутилалюминия, в ароматическом углеводородном растворителе, таком как толуол, при температуре от приблизительно -78°C до приблизительно 22°C с получением промежуточного первичного спирта 1.5-3 (схема 1.5, стадия b), где R1, R2, R3, R4, R5 и R6 определены выше, иR9 раскрыт ранее. Для успешного завершения последовательных химических превращений требуется защита первичного спирта 1.5-3, и можно использовать большое разнообразие стратегий, касающихся применения защитных групп. Например, обработка спирта 1.5-3 посредством 3,4-дигидро-2-H-пирана в присутствии каталитического количества органической кислоты, такой как моногидрат пара-толуолсульфоновой кислоты, в апротонном растворителе, таком как диэтиловый эфир, при температуре от приблизительно 0°C до приблизительно температуры окружающей среды обеспечивает получение защищенного тетрагидро-2-H-пираном (THP) спирта 1.5-4 (схема 1.5, стадия c), где R1, R2, R3, R4, R5, R6 и R9 определены выше. Защищенное с помощью THP стириловое промежуточное соединение можно превращать в защищенное с помощью THP циклопропановое промежуточное соединение 1.5-5, где R1, R2, R3, R4, R5, R6 и R9 определены выше, и R7 и R8 раскрыты ранее, путем обработки источником карбена, таким как хлороформ, в присутствии основания, такого как гидроксид натрия или калия, и катализатора, такого как гексафторфосфат тетрабутиламмония, при температуре от приблизительно 25 до приблизительно 45°C (схема 1.5, стадия d). Снятие защиты с защищенного с помощью THP циклопропанового промежуточного соединения 1.5-5, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 определены выше, можно обеспечивать путем обработки каталитическим количеством органической кислоты, такой как моногидрат пара-толуолсульфоновой кислоты, в полярном протонном растворителе, таком как метанол, при температуре приблизительно 22°C с получением циклопропилметанольного промежуточного соединения 1.5-6 (схема 1.5, стадия e). Окисление промежуточного соединения в виде первичного спирта 1.5-6, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 определены выше, можно обеспечивать при помощи широкого спектра реагентов и условий, известных в данной области техники (Figadere, B. and Franck, X., ʺCarboxylic Acids: Synthesis from Alcoholsʺ Science of Synthesis 2006, (20a) pp 173-204), многие из которых предлагают различные значения совместимости и селективности функциональных групп. Например, обработка спиртового промежуточного соединения 1.5-6 растворами триоксида хрома в растворах разбавленной серной кислоты и ацетона, реагентом Джонса, обеспечивает получение циклопропилкарбоновой кислоты 1-3, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 определены выше (схема 1.5, стадия f).
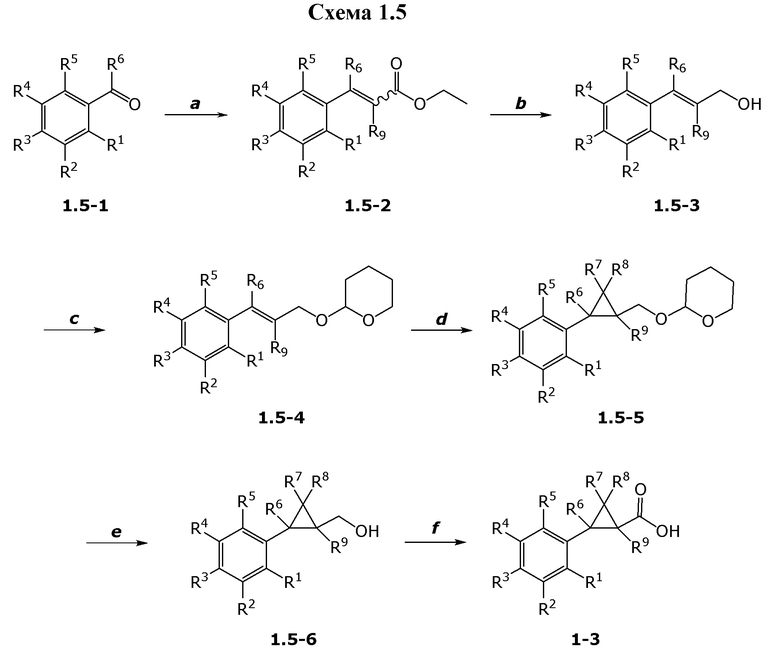
Получение стильбенов
Стильбены 1-1 можно получать несколькими различными способами, указанными на схеме 2. Фенилкарбонилы 2-1, где R1, R2, R3, R4, R5 и R6 раскрыты ранее, можно обрабатывать алкоксибензилфосфонатами 2-2 в присутствии основания, такого как метоксид натрия, в полярном апротонном растворителе, таком как N,N-диметилформамид, при значениях температуры от приблизительно -10°C до приблизительно 30°C с последующим нагреванием до температуры от 40°C до приблизительно 80°C с получением стильбенов 1-1 (схема 2, стадия a).
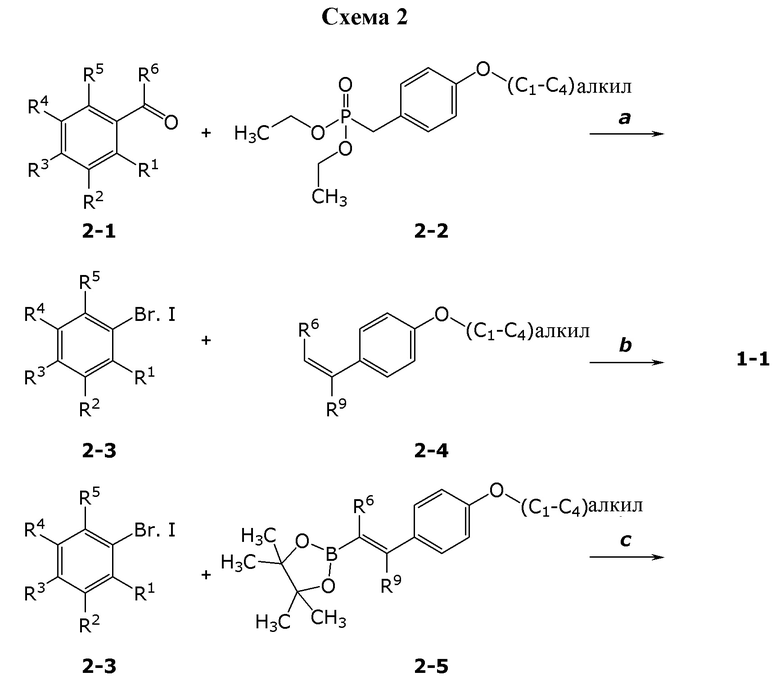
Арилгалогениды 2-3, где R1, R2, R3, R4 и R5 раскрыты ранее, можно обрабатывать винилбензолами 2-4, где R6 и R9 раскрыты ранее, в присутствии катализатора на основе переходного металла, такого как ацетат палладия(II), и бисфосфинового лиганда, такого как 1,1′-бис(дифенилфосфино)ферроцен, в основном растворителе, таком как триэтиламин, при значениях температуры от приблизительно 60°C до приблизительно 100°C с получением стильбенов 1-1 (схема 2, стадия b). В качестве альтернативы, арилгалогениды 2-3 можно обрабатывать винилборонатами 2-5, где R6 и R9 раскрыты ранее, в присутствии катализатора на основе переходного металла, такого как тетракис(трифенилфосфин)палладий(0), и основания, такого как карбонат калия, в смеси растворителей, такой как 1,2-диметоксиэтан и вода, при значениях температуры от приблизительно 60°C до приблизительно 100°C с получением стильбенов 1-1 (схема 2, стадия c).
В еще одном варианте осуществления стильбены 1-1 можно также получать способом олефинирования Виттига (Chalal, M.; Vervandier-Fasseur, D.; Meunier, P.; Cattey, H.; Hierso, J.-C. Tetrahedron 2012, 68, 3899-3907), как указано на схеме 2.5. Фенилкарбонилы 2-1, где R1, R2, R3, R4 и R5, раскрыты ранее, и R6 представляет собой H, можно обрабатывать хлоридами алкоксибензилтрифенилфосфония 2.5-2 в присутствии основания, такого как н-бутиллитий, в полярном апротонном растворителе, таком как тетрагидрофуран, при значениях температуры от приблизительно -78°C до температуры окружающей среды с получением стильбенов 1-1 (схема 2.5, стадия a).
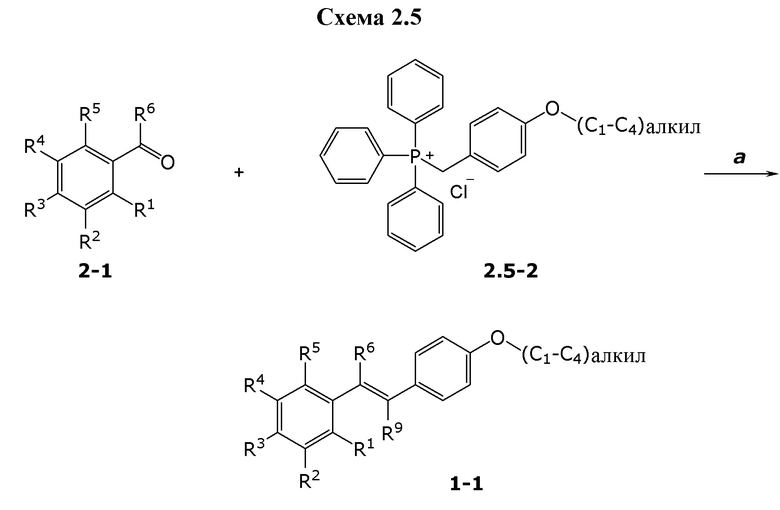
Получение циклопропиламидов
Циклопропиламиды 3-3, где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, Q2, R15 и R16 раскрыты ранее, можно получать обработкой аминами или аминными солями 3-2, где R10, R11, R12, R13, R14, Q2, и R15, и R16 раскрыты ранее, и активированными карбоновыми кислотами 3-1, где A представляет собой активирующую группу, и R1, R2, R3, R4, R5, R6, R7, R8 и R9 раскрыты ранее, с основанием, таким как триэтиламин, диизопропилэтиламин, 4-метилморфолин или 4-диметиламинопиридин, в безводном апротонном растворителе, таком как дихлорметан, тетрагидрофуран, 1,2-дихлорэтан, диметилформамид или любая их комбинация, при значениях температуры от приблизительно 0°C до приблизительно 120°C (схема 3, стадия a).
Активированные карбоновые кислоты 3-1 могут представлять собой галогенангидрид, такой как хлорангидрид, бромангидрид или фторангидрид; сложный эфир карбоновой кислоты, такой как пара-нитрофениловый сложный эфир, пентафторфениловый сложный эфир, этил-(гидроксиимино)цианоацетатный сложный эфир, метиловый сложный эфир, этиловый сложный эфир, бензиловый сложный эфир, N-гидроксисукцинимидиловый сложный эфир, гидроксибензотриазол-1-иловый сложный эфир или гидроксипиридилтриазол-1-иловый сложный эфир; O-ацилизомочевина; ангидрид кислоты или сложный тиоэфир. Хлорангидриды можно получать из соответствующих карбоновых кислот путем обработки дегидратирующим хлорирующим реагентом, таким как оксалилхлорид или тионилхлорид. Активированные сложные эфиры карбоновых кислот 3-1 можно получать из карбоновых кислот in situ с помощью соли урония, такой как гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (HATU), гексафторфосфат O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (HBTU) или гексафторфосфат (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламиноморфолинокарбения (COMU). Активированные сложные эфиры карбоновых кислот 3-1 также можно получать из карбоновых кислот in situ с помощью соли фосфония, такой как гексафторфосфат бензотриазол-1-ил-окситрипирролидинофосфония (PyBop). Активированные сложные эфиры карбоновых кислот 3-1 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид или дициклогексилкарбодиимид, в присутствии триазола, такого как моногидрат гидроксибензотриазола (HOBt) или 1-гидрокси-7-азабензотриазол (HOAt). O-ацилизомочевины можно получать с помощью дегидратирующего карбодиимида, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид или дициклогексилкарбодиимид. Активированные сложные эфиры карбоновых кислот 3-1 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как гексафторфосфат 2-хлор-1,3-диметилимидазолидиния (CIP), в присутствии триазола, такого как 1-гидрокси-7-азабензотриазол (HOAt). Активированные сложные эфиры карбоновых кислот 3-1 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (T3P®), в присутствии основания, такого как пиридин.
Циклопропиламиды 3-3, где R16 представляет собой тиетанил или тетрагидротиофенил, и R15 раскрыт ранее, можно окислять до соответствующего сульфоксида или сульфона путем обработки приблизительно одним эквивалентом мета-хлорпероксибензойной кислоты в полярном апротонном растворителе, таком как дихлорметан (сульфоксид), или приблизительно двумя эквивалентами мета-хлорпероксибензойной кислоты (сульфон) при значениях температуры от приблизительно 0°C до приблизительно 40°C. В качестве альтернативы, циклопропиламиды 3-3, где R16 представляет собой тиетанил или тетрагидротиофенил, и R15 раскрыт ранее, можно окислять до соответствующего сульфоксида или сульфона путем обработки одним эквивалентом пербората натрия в протонном растворителе, таком как уксусная кислота (сульфоксид), или двумя эквивалентами пербората натрия (сульфон). Окисление можно проводить при значениях температуры от приблизительно 40°C до приблизительно 100°C с применением приблизительно 1,5 эквивалента пербората натрия с получением хроматографически разделяемых смесей сульфоксид- и сульфонциклопропиламидов 3-3.
Циклопропиламиды 3-3, где R3 представляет собой NO2, можно восстанавливать до соответствующего NH2 путем обработки источником кислоты, таким как хлорид аммония, и железом в протонном растворителе, таком как метанол, вода или любая их комбинация, при значениях температуры от приблизительно 20°C до приблизительно 60°C.

Циклопропиламиды 4-3, где R1, R2, R3, R4, R5, R6, R7, R8, R9, Q1, R10, R11, R12, R13, R14, R15 и R16 раскрыты ранее, можно получать обработкой аминами или аминными солями 4-2, где R15 и R16 раскрыты ранее, и активированными карбоновыми кислотами 4-1, где A представляет собой активирующую группу, и R1, R2, R3, R4, R5, R6, R7, R8, R9, Q1, R10, R11, R12, R13 и R14 раскрыты ранее, в присутствии основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин или 4-диметиламинопиридин, в безводном апротонном растворителе, таком как дихлорметан, тетрагидрофуран, 1,2-дихлорэтан, диметилформамид или любая их комбинация, при значениях температуры от приблизительно 0°C до приблизительно 120°C (схема 4, стадия a).
Активированные карбоновые кислоты 4-1 могут представлять собой галогенангидрид, такой как хлорангидрид, бромангидрид или фторангидрид; сложный эфир карбоновой кислоты, такой как пара-нитрофениловый сложный эфир, пентафторфениловый сложный эфир, этил-(гидроксиимино)цианоацетатный сложный эфир, метиловый сложный эфир, этиловый сложный эфир, бензиловый сложный эфир, N-гидроксисукцинимидиловый сложный эфир, гидроксибензотриазол-1-иловый сложный эфир или гидроксипиридилтриазол-1-иловый сложный эфир; O-ацилизомочевина; ангидрид кислоты или сложный тиоэфир. Хлорангидриды можно получать из соответствующих карбоновых кислот путем обработки дегидратирующим хлорирующим реагентом, таким как оксалилхлорид или тионилхлорид. Активированные сложные эфиры карбоновых кислот 4-1 можно получать из карбоновых кислот in situ с помощью соли урония, такой как гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (HATU), гексафторфосфат O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (HBTU) или гексафторфосфат(1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламиноморфолинокарбения (COMU). Активированные сложные эфиры карбоновых кислот 4-1 также можно получать из карбоновых кислот in situ с помощью соли фосфония, такой как гексафторфосфат бензотриазол-1-ил-окситрипирролидинофосфония (PyBop). Активированные сложные эфиры карбоновых кислот 4-1 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид или дициклогексилкарбодиимид, в присутствии триазола, такого как моногидрат гидроксибензотриазола (HOBt) или 1-гидрокси-7-азабензотриазол (HOAt). O-ацилизомочевины можно получать с помощью дегидратирующего карбодиимида, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид или дициклогексилкарбодиимид. Активированные сложные эфиры карбоновых кислот 4-1 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как гексафторфосфат 2-хлор-1,3-диметилимидазолидиния (CIP), в присутствии триазола, такого как 1-гидрокси-7-азабензотриазол (HOAt). Активированные сложные эфиры карбоновых кислот 4-1 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (T3P®), в присутствии основания, такого как пиридин.
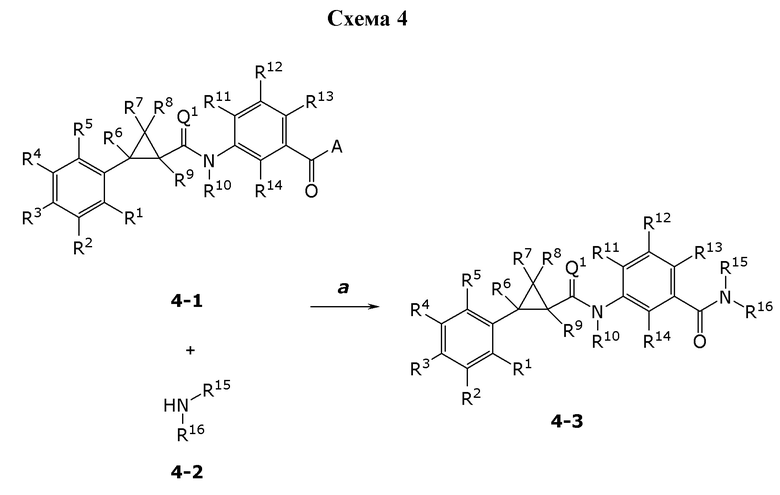
Циклопропиламиды 5-3, где R1, R2, R3, R4, R5, R6, R7, R8, R9, Q1, R10, R11, R12, R13, R14 и Q2 раскрыты ранее, и X представляет собой (C1-C4)галогеналкил или (C1-C4)алкил(C1-C4)алкокси, можно получать путем обработки аминов 5-1, где R1, R2, R3, R4, R5, R6, R7, R8, R9, Q1, R10, R11, R12, R13, R14 и Q2 раскрыты ранее, и активированных карбоновых кислот 5-2, где A представляет собой активирующую группу, и X представляет собой (C1-C4)алкил, (C1-C4)галогеналкил или (C1-C4)алкил(C1-C4)алкокси, основанием, таким как триэтиламин, диизопропилэтиламин, 4-метилморфолин или 4-диметиламинопиридин, в безводном апротонном растворителе, таком как дихлорметан, тетрагидрофуран, 1,2-дихлорэтан, диметилформамид или любая их комбинация, при значениях температуры от приблизительно 0°C до приблизительно 120°C (схема 5, стадия a).
Активированные карбоновые кислоты 5-2 могут представлять собой галогенангидрид, такой как хлорангидрид, бромангидрид или фторангидрид; сложный эфир карбоновой кислоты, такой как пара-нитрофениловый сложный эфир, пентафторфениловый сложный эфир, этил-(гидроксиимино)цианоацетатный сложный эфир, метиловый сложный эфир, этиловый сложный эфир, бензиловый сложный эфир, N-гидроксисукцинимидиловый сложный эфир, гидроксибензотриазол-1-иловый сложный эфир или гидроксипиридилтриазол-1-иловый сложный эфир; O-ацилизомочевина; ангидрид кислоты или сложный тиоэфир. Хлорангидриды можно получать из соответствующих карбоновых кислот путем обработки дегидратирующим хлорирующим реагентом, таким как оксалилхлорид или тионилхлорид. Активированные сложные эфиры карбоновых кислот 5-2 можно получать из карбоновых кислот in situ с помощью соли урония, такой как гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (HATU), гексафторфосфат O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (HBTU) или гексафторфосфат (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламиноморфолинокарбения (COMU). Активированные сложные эфиры карбоновых кислот 5-2 также можно получать из карбоновых кислот in situ с помощью соли фосфония, такой как гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония (PyBop). Активированные сложные эфиры карбоновых кислот 5-2 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид или дициклогексилкарбодиимид, в присутствии триазола, такого как моногидрат гидроксибензотриазола (HOBt) или 1-гидрокси-7-азабензотриазол (HOAt). O-ацилизомочевины можно получать с помощью дегидратирующего карбодиимида, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид или дициклогексилкарбодиимид. Активированные сложные эфиры карбоновых кислот 5-2 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как гексафторфосфат 2-хлор-1,3-диметилимидазолидиния (CIP), в присутствии триазола, такого как 1-гидрокси-7-азабензотриазол (HOAt). Активированные сложные эфиры карбоновых кислот 5-2 также можно получать из карбоновых кислот in situ с помощью реагента для реакций сочетания, такого как 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (T3P®), в присутствии основания, такого как пиридин.
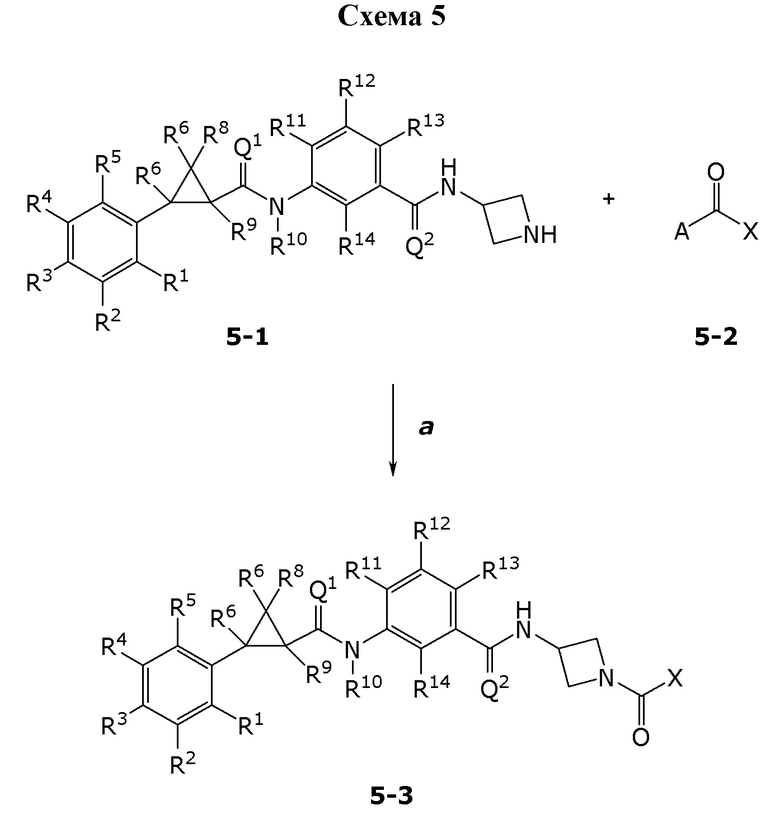
Циклопропиламиды 6-3, где R1, R2, R4, R5, R6, R7, R8, R9, Q1, R10, R11, R12, R13, R14, R15, R16 и Q2 раскрыты ранее, можно получать путем обработки арилбромида 6-1, где R1, R2, R4, R5, R6, R7, R8, R9, Q1, R10, R11, R12, R13, R14, R15, R16 и Q2 раскрыты ранее, и (C1-C6)алкенилстаннана 6-2, где каждый алкенил может быть необязательно замещен одним или более F, источником палладия, таким как дихлорид бис(трифенилфосфин)палладия(II), в апротонном растворителе, таком как 1,4-диоксан, при значениях температуры от приблизительно 20°C до приблизительно 120°C (схема 6, стадия a).

В некоторых вариантах осуществления соединение 1-3 можно получать из α,β-ненасыщенного альдегида 7-1, где R1, R2, R3, R4, R5, R6 и R9 описаны ранее. Специалисту в данной области техники будет понятно, что соединение 7-1 можно синтезировать посредством альдольной конденсации (смотрите Yoshikawa, M.; Kamei, T. международная заявка PCT 2010123006, 2010 г.) соответствующим образом замещенного, коммерчески доступного альдегида и ацетальдегида. Обработка соединения 7-1 с помощью (C1-C6)алкилортоформиата в присутствии кислоты, pH которой составляет 0-5, такой как бромистоводородная кислота, N-бромсукцинимид, хлористоводородная кислота, N-хлорсукцинимид и п-толуолсульфонат пиридиния (PPTS), в (C1-C6)алканольном растворителе при температуре от 0°C до температуры окружающей среды и под давлением окружающей среды обеспечивает получение ацеталя 7-2, где R1, R2, R3, R4, R5, R6 и R9 раскрыты ранее, и Ra представляет собой (C1-C6)алкил, или Ra и Ra, взятые вместе, могут образовывать циклический ацеталь (схема 7, стадия a). Ацеталь 7-2 можно превращать в циклопропилацеталь 7-3, где R1, R2, R3, R4, R5, R6, R7, R8, R9 и Ra раскрыты ранее, путем обработки источником карбена, таким как галоформ, например, бромоформ или хлороформ, в присутствии неорганического основания, такого как гидроксид натрия или калия или карбонат натрия или калия, и катализатора межфазного переноса, такого как хлорид бензилтриэтиламмония, бромид (-)-N-додецил-N-метилэфедриния, бромид тетраметиламмония, бромид тетрапропиламмония, тетрафторборат тетрабутиламмония, хлорид тетраметиламмония или гексафторфосфат тетрабутиламмония, при температуре от приблизительно температуры окружающей среды до температуры ниже точки кипения галоформа (схема 7, стадия b). Предупреждение. Стадия B представляет собой экзотермическую реакцию, и при проведении данной реакции следует выполнять тщательный контроль экзотермического эффекта. Циклопропилацеталь 7-3 можно превращать в альдегид 7-4, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 раскрыты ранее, в полярном растворителе, выбранном из группы, состоящей из ацетона, ацетонитрила, метанола, этанола, нитрометана, N,N-диметилформамида, диметилсульфоксида, этилацетата, тетрагидрофурана и 1,4-диоксана, в присутствии водной минеральной кислоты, выбранной из группы, состоящей из азотной кислоты, хлористоводородной кислоты, бромистоводородной кислоты и серной кислоты (схема 7, стадия c), при температуре окружающей среды. Циклопропильную кислоту 1-3, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 раскрыты ранее, можно получать окислением альдегида 7-4 окислителями, такими как перманганат натрия или перманганат калия, или при условиях окисления Пинника в полярном апротонном растворителе, выбранном из группы, состоящей из ацетона, ацетонитрила, N,N-диметилформамида, диметилсульфоксида, этилацетата, тетрагидрофурана и 1,4-диоксана, при температуре от приблизительно 0°C до приблизительно температуры окружающей среды (схема 7, стадия d). Следует придерживаться стандартных мер безопасности, поскольку при проведении данной реакции может возникать экзотермический эффект.

Специалисту в данной области техники будет понятно, что в некоторых вариантах осуществления циклопропильную кислоту 1-3, где R1, R2, R3, R4, R5, R6, R7, R8 и R9 раскрыты ранее, можно выделять в виде ее (R,R) и (S,S) энантиомеров посредством известного способа, такого как описанного в Kovalenko V. N., Kulinkovich O. G. Tetrahedron: Asymmetry 2011, 22, 26 (схема 8, стадия a).
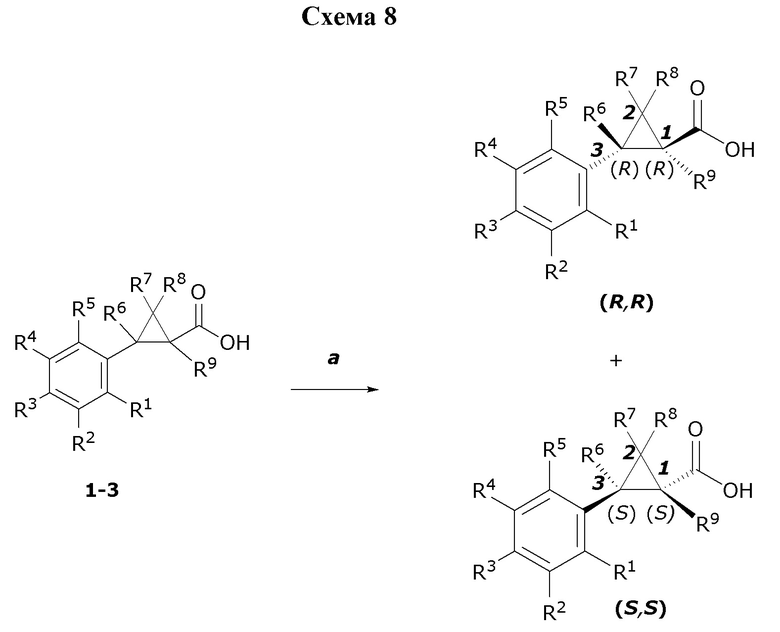
Примеры
Данные примеры представлены в иллюстративных целях и не предназначены для ограничения настоящего раскрытия лишь вариантами осуществления, раскрытыми в данных примерах.
Исходные материалы, реагенты и растворители, которые получали из коммерческих источников, применяли без дополнительной очистки. Безводные растворители получали как Sure/Seal™ от Aldrich и применяли в том виде, в котором получали. Точки плавления определяли на капиллярном приборе для определения точек плавления Thomas Hoover Unimelt или автоматической системе для определения точек плавления OptiMelt от Stanford Research Systems и не корректировали. Примеры, в которых используется «комнатная температура», проводили в лабораториях с регулируемым климатом при значениях температуры в диапазоне от приблизительно 20°C до приблизительно 24°C. Молекулам даны их известные названия, названные согласно программам определения названия в ISIS Draw, ChemDraw или ACD Name Pro. Если в таких программах невозможно назвать молекулу, такую молекулу называют с помощью традиционных правил определения названия. Спектральные данные 1H ЯМР представлены в ppm (δ), и их регистрировали при 300, 400, 500 или 600 МГц; спектральные данные 13C ЯМР представлены в ppm (δ), и их регистрировали при 75, 100 или 150 МГц, и спектральные данные 19F ЯМР представлены в ppm (δ), и их регистрировали при 376 МГц, если иное не указано.
Пример 1. Получение транс-2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоновой кислоты (C1)
Хлорид рутения(III) (0,080 г, 0,39 ммоль) добавляли к перемешанной смеси транс-1,3-дихлор-5-(-2,2-дихлор-3-(4-метоксифенил)циклопропил)бензола (C22) (2,8 г, 7,7 ммоль) и периодата натрия (33 г, 160 ммоль) в смеси вода:этилацетат:ацетонитрил (8:1:1, 155 мл) при 23°C. Полученную двухфазную коричневую смесь энергично перемешивали при 23°C в течение 5 часов. Реакционную смесь разбавляли водой (1000 мл) и экстрагировали дихлорметаном (4×200 мл). Объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали. Остаток разбавляли раствором гидроксида натрия (1 M, 100 мл) и промывали диэтиловым эфиром (4×50 мл). Водный слой доводили до pH 2 с применением концентрированной хлористоводородной кислоты и экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке продукта в виде светло-коричневого порошка (0,78 г, 34%): т. пл. 117-120°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,38 (br s, 1H), 7,52-7,65 (m, 3H), 3,57 (d, J=8,5 Гц, 1H), 3,50 (d, J=8,5 Гц, 1H); IR (тонкая пленка) 3083 (s), 3011 (s), 1731 (s), 1590 (w), 1566 (s), 1448 (w), 1431 (m), 1416 (m) см-1.
Следующие соединения получали аналогично процедуре, указанной в примере 1 .
Транс-2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоновая кислота (C2)
Выделяли в виде желтого порошка (1,5 г, 39%): 1H ЯМР (400 МГц, CDCl3) δ 7,31 (d, J=0,7 Гц, 2H), 3,40 (d, J=8,2 Гц, 1H), 2,86 (d, J=8,3 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 171,05, 134,55, 132,44, 131,75, 128,89, 61,18, 39,26, 37,14; ESIMS масса/заряд 333 ([M-H]-).
Транс-2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоновая кислота (C3)

Выделяли в виде бледно-желтого твердого вещества (3,2 г, 51%): 1H ЯМР (400 МГц, CDCl3) δ 7,47 (d, J=8,3 Гц, 1H), 7,37 (d, J=1,6 Гц, 1H), 7,12 (ddd, J=8,3, 2,1, 0,6 Гц, 1H), 3,43 (d, J=8,3 Гц, 1H), 2,86 (d, J=8,3 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 171,52, 132,91, 132,76, 132,29, 130,66, 130,62, 128,02, 61,48, 39,65, 37,13; ESIMS масса/заряд 298 ([M-H]-).
Пример 2. Получение транс-2,2-дихлор-3-(4-(трифторметил)фенил)циклопропанкарбоновой кислоты (C4)
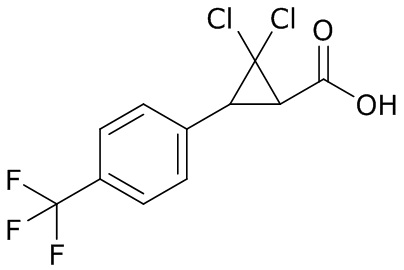
К перемешанной смеси транс-1-(2,2-дихлор-3-(4-(трифторметил)фенил)циклопропил)-4-метоксибензола (C25) (3,50 г, 9,60 ммоль) и периодата натрия (30,8 г, 144 ммоль) в смеси вода:этилацетат:ацетонитрил (8:1:1, 200 мл) добавляли хлорид рутения(III) (0,100 г, 0,400 ммоль) при 23°C. Полученную смесь энергично перемешивали при 23°C в течение 5 часов. Реакционную смесь разбавляли дихлорметаном и промывали водой. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией обеспечивала получение указанного в заголовке соединения в виде грязно-белого твердого вещества (0,630 г, 38%): т. пл. 100-102°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,43 (brs, 1H), 7,77-7,73 (m, 2H), 7,67-7,64 (m, 2H), 3,55 (d, J=8,8 Гц, 1H), 3,44 (d, J=8,8 Гц, 1H); ESIMS масса/заряд 347 ([M-H]-).
Следующие соединения получали аналогично процедуре, указанной в примере 2 .
Транс-2,2-дихлор-3-(3-(трифторметил)фенил)циклопропан
карбоновая кислота (C5)

Выделяли в виде грязно-белого твердого вещества (0,81 г, 33%): т. пл. 86-88°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,37 (brs, 1H), 7,83 (s, 1H), 7,76-7,69 (m, 2H), 7,65-7,59 (m, 1H), 3,59-3,51 (m, 2H); ESIMS масса/заряд 297 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-4-(трифторметокси)фенил)циклопропанкарбоновая кислота (C6)

Выделяли в виде грязно-белого твердого вещества (0,3 г, 19%): т. пл. 134-136°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,45 (brs, 1H), 7,82 (d, J=1,6 Гц, 1H), 7,60-7,53 (m, 2H), 3,53-3,47 (m, 2H); ESIMS масса/заряд 347 ([M-H]-).
Транс-2,2-дихлор-3-(2,4,5-трихлорфенил)циклопропанкарбоновая кислота (C7)
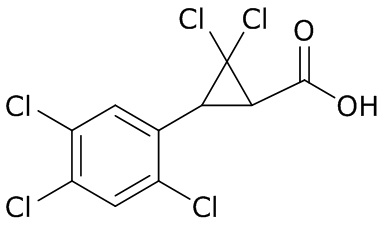
Выделяли в виде грязно-белого твердого вещества (0,267 г, 18%): т. пл. 189-192°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,44 (brs, 1H), 8,01 (s, 1H), 7,82 (s, 1H), 3,52 (d, J=8,2 Гц, 1H), 3,29 (d, J=8,2 Гц, 1H); ESIMS масса/заряд 333 ([M-H]-).
Транс-3-(3,5-бис(трифторметил)фенил)-2,2-дихлорциклопропанкарбоновая кислота (C8)

Выделяли в виде грязно-белого твердого вещества (0,5 г, 31%): т. пл. 112-114°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,43 (brs, 1H), 8,22 (s, 2H), 8,08 (s, 1H), 3,80-3,71 (m, 2H); ESIMS масса/заряд 365 ([M-H]-).
Транс-2,2-дихлор-3-(3,5-дибромфенил)циклопропанкарбоновая кислота (C9)

Выделяли в виде грязно-белого твердого вещества (0,5 г, 24%): т. пл. 157-159°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,36 (brs, 1H), 7,81 (d, J=1,5 Гц, 2H), 7,72 (d, J=1,5 Гц, 2H), 3,57-3,53 (m, 1H), 3,51-3,47 (m, 1H); ESIMS масса/заряд 387 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-5-(трифторметил)фенил)циклопропанкарбоновая кислота (C10)
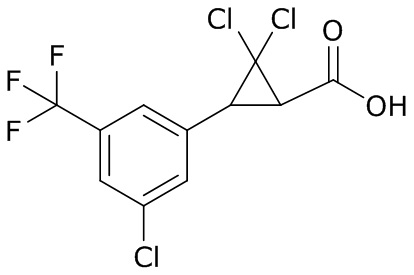
Выделяли в виде грязно-белого твердого вещества (0,73 г, 28%): т. пл. 113-115°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,39 (brs, 1H), 7,91 (s, 1H), 7,86 (s, 1H), 7,84 (s, 1H), 3,69-3,60 (m, 2H); ESIMS масса/заряд 333 ([M-H]-).
Транс-2,2-дихлор-3-(3,5-дихлор-4-фторфенил)циклопропанкарбоновая кислота (C11)
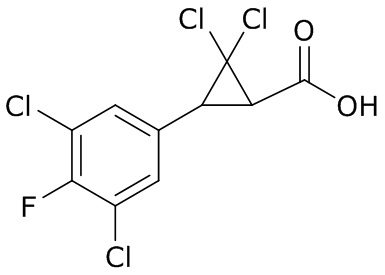
Выделяли в виде грязно-белого твердого вещества (0,539 г, 34%): 1H ЯМР (400 МГц, DMSO-d6): δ 13,37 (brs, 1H), 7,71 (d, J=6,4 Гц, 2H), 3,42 (s, 2H); ESIMS масса/заряд 317 ([M-H]-).
Транс-3-(4-бром-3,5-дихлорфенил)-2,2-дихлорциклопропанкарбоновая кислота (C12)

Выделяли в виде грязно-белого твердого вещества (0,100 г, 10%): 1H ЯМР (400 МГц, DMSO-d6) δ 13,37 (brs, 1H), 7,76 (s, 3H), 3,57 (d, J=8,8 Гц, 1H), 3,48 (d, J=8,8 Гц, 1H); ESIMS масса/заряд 377 ([M-H]-).
Транс-3-(3-бром-5-хлорфенил)-2,2-дихлорциклопропанкарбоновая кислота (C13)
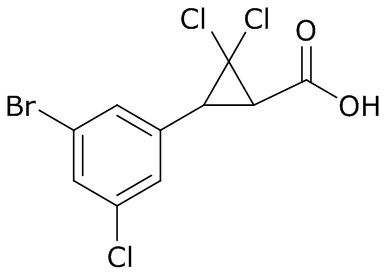
Выделяли в виде грязно-белого твердого вещества (0,4 г, 25%): т. пл. 161-163°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,38 (br s, 1H), 7,70 (d, J=5,3 Гц, 2H), 7,66-7,52 (m, 1H), 3,59-3,43 (m, 2H); ESIMS масса/заряд 341 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-5-фторфенил)циклопропанкарбоновая кислота (C14)
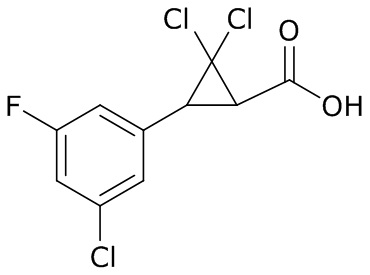
Выделяли в виде грязно-белого твердого вещества (0,700 г, 25%): т. пл. 138-140°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,38 (brs, 1H), 7,46 (s, 1H), 7,42 (td, J=2,0, 8,7 Гц, 1H), 7,37 (d, J=9,8 Гц, 1H), 3,52 (q, J=8,5 Гц, 2H); ESIMS масса/заряд 281 ([M-H]-).
Транс-2,2-дихлор-3-(4-хлор-3-фторфенил)циклопропанкарбоновая кислота (C15)
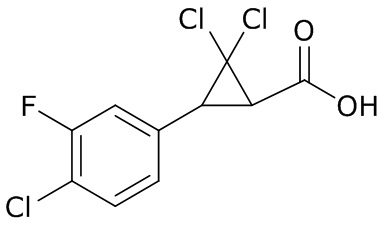
Выделяли в виде грязно-белого твердого вещества (0,500 г, 20%): т. пл. 140-142°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,40 (brs, 1H), 7,59 (m, 1H), 7,55 (d, J=8,4 Гц, 1H), 7,33 (dd, J=2,0, 8,4 Гц, 1H), 3,55-3,38 (m, 2H); ESIMS масса/заряд 281 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-4-фторфенил)циклопропанкарбоновая кислота (C16)

Выделяли в виде грязно-белого твердого вещества (1,0 г, 53%): т. пл. 121-123°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,35 (brs, 1H), 7,71 (dd, J=2,0, 7,2 Гц, 1H), 7,53-7,35 (m, 2H), 3,50-3,41 (m, 2H); ESIMS масса/заряд 281 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-5-метилфенил)циклопропанкарбоновая кислота (C17)
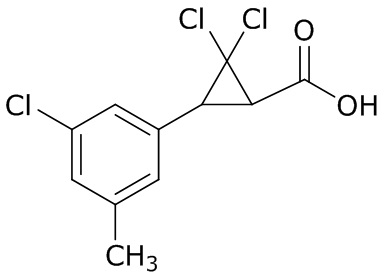
Выделяли в виде грязно-белого твердого вещества (1,0 г, 42%): т. пл. 124-126°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,33 (brs, 1H), 7,30 (s, 1H), 7,23 (s, 1H), 7,21 (s, 1H), 3,38 (s, 2H), 2,31 (s, 3H); ESIMS масса/заряд 277 ([M-H]-).
Транс-2,2-дихлор-3-(3,5-дихлор-4-метилфенил)циклопропанкарбоновая кислота (C18)
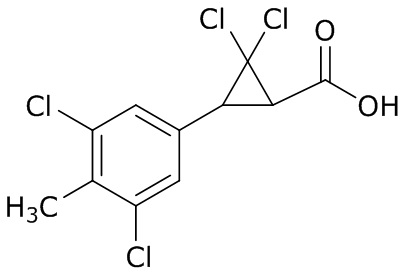
Выделяли в виде грязно-белого твердого вещества (0,8 г, 40%): т. пл. 181-183°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,40 (s, 1H), 7,56 (s, 2H), 3,53-3,50 (m, 1H), 3,46-3,43 (m, 1H), 2,40 (s, 3H); ESIMS масса/заряд 311 ([M-H]-).
Транс-2,2-дихлор-3-(3,4-дихлор-5-метилфенил)циклопропанкарбоновая кислота (C19)
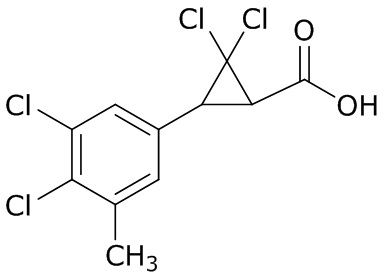
Выделяли в виде грязно-белого твердого вещества (0,73 г, 45%): т. пл. 157-159°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,40 (s, 1H), 7,59 (d, J=2,0 Гц, 1H), 7,44 (d, J=1,6 Гц, 1H), 3,43 (q, J=8,5 Гц, 2H), 2,39 (s, 3H); ESIMS масса/заряд 311 ([M-H]-).
Транс-2,2-дихлор-3-(4-(перфторэтил)фенил)циклопропанкарбоновая кислота (C20)

Выделяли в виде грязно-белого твердого вещества (0,020 г, 10%): т. пл. 116-118°C; 1H ЯМР (300 МГц, CDCl3) δ 7,63 (d, J=8,1 Гц, 2H), 7,42 (d, J=8,1 Гц, 2H), 3,53 (d, J=8,4 Гц, 1H), 2,94 (d, J=8,4 Гц, 1H); ESIMS масса/заряд 347 ([M-H]-).
Транс-2,2-дихлор-3-(4-этоксифенил)циклопропанкарбоновая кислота (C21)
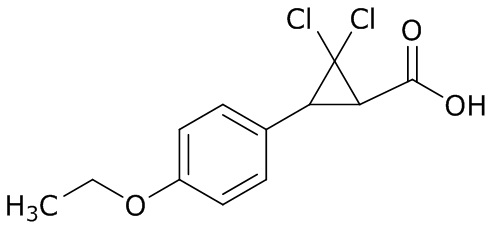
Выделяли в виде грязно-белого твердого вещества (0,025 г, 5%): т. пл. 129-130°C; 1H ЯМР (400 МГц, CDCl3) δ 7,16 (d, J=8,4 Гц, 2H), 6,88 (d, J=8,31 Гц, 2H), 4,03 (q, J=6,8 Гц, 2H), 3,41 (d, J=8,0 Гц, 1H), 2,81 (d, J=8,0 Гц, 1H), 1,41 (t, J=6,8 Гц, 3H); ESIMS масса/заряд 273 ([M-H]-).
Пример 3. Получение транс-1,3-дихлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)бензола (C22)

Водный раствор гидроксида натрия (50%, 6,8 мл, 130 ммоль) добавляли к перемешанному раствору (E)-1,3-дихлор-5-(4-метоксистирил)бензола (C43) (2,4 г, 8,6 ммоль) и хлорида N-бензил-N,N-диэтилэтанаминия (0,20 г, 0,86 ммоль) в хлороформе (14 мл, 170 ммоль) при 23°C. Полученную двухфазную темно-коричневую смесь энергично перемешивали при 23°C в течение 24 часов. Реакционную смесь разбавляли водой (200 мл) и экстрагировали дихлорметаном (2×100 мл). Объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке продукта в виде коричневого масла (2,8 г, 90%): 1H ЯМР (400 МГц, CDCl3) δ 7,34 (t, J=1,8 Гц, 1H), 7,21-7,30 (m, 4H), 6,93 (m, 2H), 3,83 (s, 3H), 3,14 (d, J=8,5 Гц, 1H), 3,08 (d, J=8,5 Гц, 1H); IR (тонкая пленка) 3075 (w), 2934 (w), 2836 (w), 1724 (w), 1640 (w), 1609 (m), 1584 (m), 1568 (s), 1513 (s) см-1.
Следующие соединения получали аналогично процедуре, указанной в примере 3 .
Транс-1,2,3-трихлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)бензол (C23)

Выделяли в виде темной пены (4,7 г, 100%): 1H ЯМР (400 МГц, CDCl3) δ 7,40 (d, J=0,6 Гц, 2H), 7,29-7,22 (m, 2H), 6,96-6,89 (m, 2H), 3,83 (s, 3H), 3,12 (d, J=8,8 Гц, 1H), 3,06 (d, J=8,7 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 159,46, 135,08, 134,23, 130,91, 129,85, 129,16, 125,42, 114,02, 64,67, 55,32, 39,62, 38,48.
Транс-1,2-дихлор-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)бензол (C24)
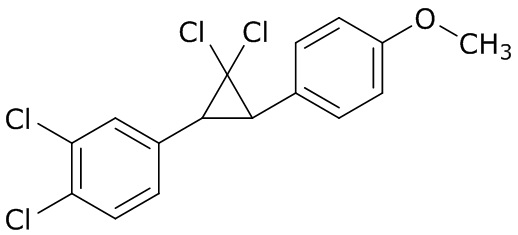
Выделяли в виде оранжево-красного масла (7,6 г, 99%): 1H ЯМР (400 МГц, CDCl3) δ 7,47 (d, J=4,9 Гц, 1H), 7,45 (bs, 1H), 7,30-7,23 (m, 2H), 7,21 (dd, J=8,2, 1,9 Гц, 1H), 6,96-6,90 (m, 2H), 3,83 (s, 3H), 3,11 (app. q, J=8,8 Гц, 2H); 13C ЯМР (101 МГц, CDCl3) δ 159,39, 134,90, 132,62, 131,99, 130,90, 130,40, 129,90, 128,33, 125,81, 113,98, 64,94, 55,33, 39,52, 38,75.
Пример 4. Получение транс-1-(2,2-дихлор-3-(4-(трифторметил)фенил)циклопропил)-4-метоксибензола (C25)

К перемешанному раствору (E)-1-метокси-4-(4-(трифторметил)стирил)бензола (C46) (4,00 г, 14,0 ммоль) и хлорида N-бензил-N,N-диэтилэтанаминия (0,320 г, 14,0 ммоль) в хлороформе (23,1 г, 288 ммоль) добавляли водный раствор гидроксида натрия (50%, 8,64 г, 216 ммоль) в воде (17 мл) при 23°C и полученную смесь энергично перемешивали при 23°C в течение 16 часов. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией обеспечивала получение указанного в заголовке соединения в виде грязно-белого твердого вещества (3,70 г, 68%): 1H ЯМР (300 МГц, CDCl3) δ 7,65 (d, J=8,4 Гц, 2H), 7,49 (d, J=8,4 Гц, 2H), 7,29 (d, J=8,4 Гц, 2H), 6,94 (d, J=8,4 Гц, 2H), 3,83 (s, 3H), 3,19 (s, 2H); ESIMS масса/заряд 361 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 4 .
Транс-1-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-3-(трифторметил)бензол (C26)
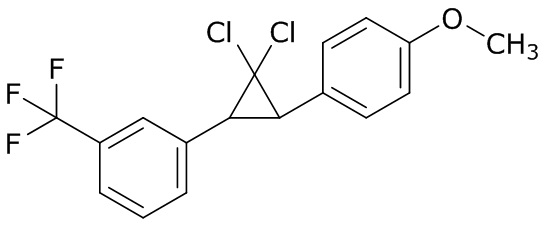
Выделяли в виде коричневой жидкости (3,5 г, 67%): 1H ЯМР (300 МГц, CDCl3) δ 7,62-7,50 (m, 4H), 7,29 (d, J=9,0 Гц, 2H), 6,94 (d, J=9,0 Гц, 2H), 7,35-7,25 (m, 3H), 7,97-6,88 (m, 1H), 3,83 (s, 3H), 3,19 (m, 2H); ESIMS масса/заряд 361 ([M+H]+).
Транс-2-хлор-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-1-(трифторметокси)бензол (C27)

Выделяли в виде грязно-белого твердого вещества (2,5 г, 65%): 1H ЯМР (400 МГц, CDCl3) δ 7,57 (d, J=2,0 Гц, 1H), 7,44 (d, J=8,8 Гц, 1H), 7,35-7,25 (m, 3H), 7,97-6,88 (m, 1H), 3,84 (s, 3H), 3,15-3,05 (m, 2H); ESIMS масса/заряд 411 ([M+H]+).
Транс-1,2,4-трихлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)бензол (C28)

Выделяли в виде коричневой жидкости (2,0 г, 58%): EIMS масса/заряд 394 ([M]+).
Транс-1-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-3,5-бис(трифторметил)бензол (C29)
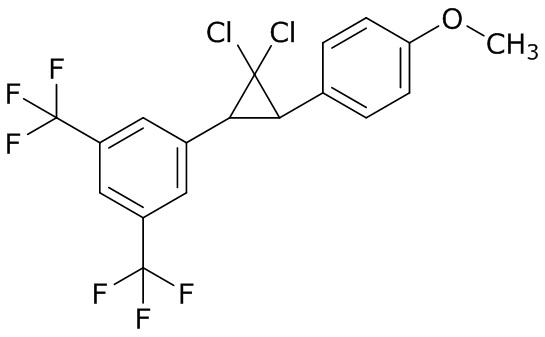
Выделяли в виде коричневой жидкости (3,0 г, 61%): EIMS масса/заряд 428 ([M]+).
Транс-1,3-дибром-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)бензол (C30)

Выделяли в виде коричневой жидкости (3,0 г, 57%): 1H ЯМР (300 МГц, CDCl3) δ 7,64 (s, 1H), 7,45 (s, 2H), 7,25 (d, J=9,0 Гц, 2H), 6,92 (d, J=9,0 Гц, 1H), 3,83 (s, 3H), 3,15-3,05 (m, 2H); ESIMS масса/заряд 453 ([M+H]+).
Транс-1-хлор-3-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-5-(трифторметил)бензол (C31)

Выделяли в виде коричневого твердого вещества (4,0 г, 74%): 1H ЯМР (300 МГц, CDCl3) δ 7,64 (s, 1H), 7,45 (s, 1H), 7,42 (s, 1H), 7,26 (d, J=9,0 Гц, 2H), 6,93 (d, J=9,0 Гц, 1H), 3,83 (s, 3H), 3,15-3,05 (m, 2H); ESIMS масса/заряд 395 ([M+H]+).
Транс-1,3-дихлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-2-фторбензол (C32)

Выделяли в виде коричневого твердого вещества (1,6 г, 54%): 1H ЯМР (300 МГц, CDCl3) δ 7,32 (d, J=6,0 Гц, 2H), 7,30 (d, J=9,0 Гц, 1H), 6,93 (d, J=9,0 Гц, 1H), 3,83 (s, 3H), 3,12-3,05 (m, 2H); ESIMS масса/заряд 297 ([M+H]+).
Транс-2-бром-1,3-дихлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)бензол (C33)
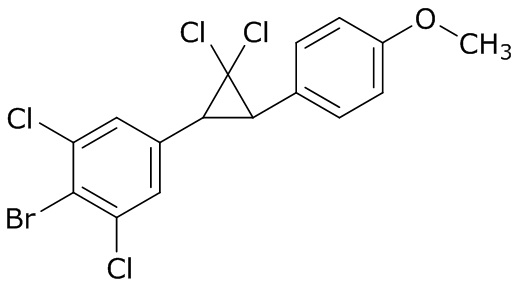
Выделяли в виде грязно-белого твердого вещества (1,5 г, 44%): 1H ЯМР (300 МГц, CDCl3) δ 7,36 (d, J=9,0 Гц, 2H), 7,20 (s, 2H), 6,93 (d, J=9,0 Гц, 2H), 3,83 (s, 3H), 3,15-3,05 (m, 2H); ESIMS масса/заряд 439 ([M+H]+).
Транс-1-бром-3-хлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)бензол (C34)

Выделяли в виде грязно-белого твердого вещества (2,5 г, 50%): 1H ЯМР (400 МГц, CDCl3) δ 7,49 (s, 1H), 7,30 (s, 1H), 7,28-7,24 (m, 3H), 6,92 (d, J=8,0 Гц, 2H), 3,92 (s, 3H), 3,01 (q, J=8,8 Гц, 2H); ESIMS масса/заряд 405 ([M+H]+).
Транс-1-хлор-3-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-5-фторбензол (C35)
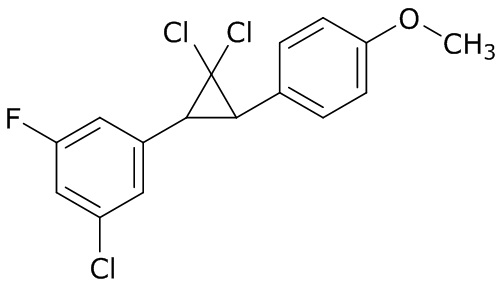
Выделяли в виде коричневой жидкости (3,5 г, 67%): ESIMS масса/заряд 345 ([M+H]+).
Транс-1-хлор-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-2-фторбензол (C36)

Выделяли в виде грязно-белого твердого вещества (2,5 г, 65%): ESIMS масса/заряд 345 ([M+H]+).
Транс-2-хлор-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-1-фторбензол (C37)
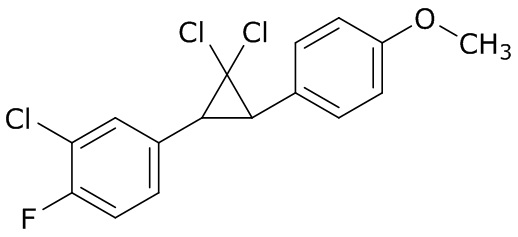
Выделяли в виде коричневой жидкости (2,0 г, 58%): ESIMS масса/заряд 345 ([M+H]+).
Транс-1-хлор-3-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-5-метилбензол (C38)

Выделяли в виде грязно-белого твердого вещества (3,0 г, 47%): 1H ЯМР (400 МГц, CDCl3) δ 7,27 (d, J=8,8 Гц, 2H), 7,14 (s, 2H), 7,06 (s, 1H), 6,92 (d, J=8,8 Гц, 2H), 3,82 (s, 3H), 3,10 (q, J=8,8 Гц, 2H), 2,36 (s, 3H); ESIMS масса/заряд 341 ([M+H]+).
Транс-1,3-дихлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-2-метилбензол (C39)

Выделяли в виде коричневой жидкости (2,5 г, 80%): 1H ЯМР (400 МГц, CDCl3) δ 7,25 (d, J=8,0 Гц, 2H), 7,17 (d, J=8,8 Гц, 1H), 6,92 (d, J=8,0 Гц, 2H), 6,88 (d, J=8,8 Гц, 1H), 3,82 (s, 3H), 3,12-3,03 (m, 2H), 2,47 (s, 3H); ESIMS масса/заряд 375 ([M+H]+).
Транс-1,2-дихлор-5-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-3-метилбензол (C40)
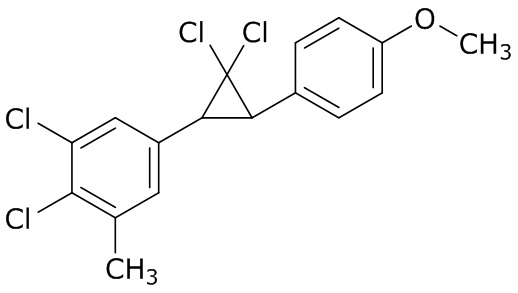
Выделяли в виде коричневой жидкости (4,0 г, 90%): ESIMS масса/заряд 375 ([M+H]+).
Транс-1-(2,2-дихлор-3-(4-(перфторэтил)фенил)циклопропил)-4-метоксибензол (C41)
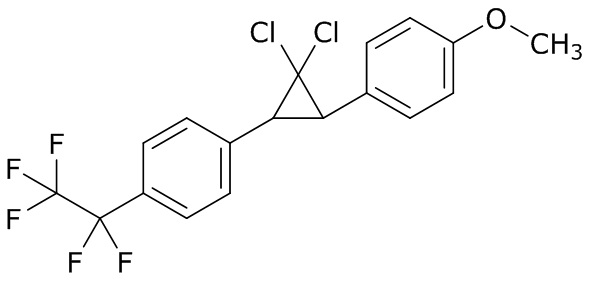
Выделяли в виде грязно-белого твердого вещества (0,5 г, 46%): 1H ЯМР (400 МГц, CDCl3) δ 7,60-7,50 (m, 4H), 7,47 (d, J=8,0 Гц, 2H), 6,92 (d, J=8,0 Гц, 2H), 3,82 (s, 3H), 3,20 (s, 2H); ESIMS масса/заряд 411 ([M+H]+).
Транс-4,4'-(3,3-дихлорциклопропан-1,2-диил)бис(этоксибензол) (C42)

Выделяли в виде грязно-белого твердого вещества (1,5 г, 45%): 1H ЯМР (400 МГц, CDCl3) δ 7,27 (d, J=8,0 Гц, 4H), 6,90 (d, J=8,0 Гц, 4H), 4,04 (q, J=6,8 Гц, 4H), 3,09 (s, 2H), 1,42 (t, J=6,8 Гц, 6H); ESIMS масса/заряд 351 ([M+H]+).
Пример 5. Получение (E)-1,3-дихлор-5-(4-метоксистирил)бензола (C43)

Порошок метоксида натрия (98%, 0,63 г, 11 ммоль) добавляли к перемешанному раствору 3,5-дихлорбензальдегида (2,0 г, 11 ммоль) и диэтил-4-метоксибензилфосфоната (2,0 мл, 11 ммоль) в сухом N,N-диметилформамиде (38 мл) при 23°C. Полученную гетерогенную темно-синюю смесь нагревали до 80°C с получением темно-коричневой смеси и перемешивали в течение 24 часов. Охлажденную реакционную смесь разбавляли водой (500 мл) и экстрагировали диэтиловым эфиром (3×100 мл). Объединенные органические слои разбавляли гексаном (150 мл) и промывали водой (300 мл). Органический слой высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке продукта в виде светло-коричневого масла (2,4 г, 75%): 1H ЯМР (400 МГц, CDCl3) δ 7,44 (m, 2H), 7,34 (d, J=2 Гц, 2H), 7,20 (t, J=2 Гц, 1H), 7,06 (d, J=16,5 Гц, 1H), 6,91 (m, 2H), 6,82 (d, J=16,5 Гц, 1H), 3,84 (s, 3H); IR (тонкая пленка) 2934 (w), 2835 (w), 1724 (w), 1637 (w), 1605 (m), 1581 (m), 1558 (m), 1511 (s) см-1.
Следующие соединения получали аналогично процедуре, указанной в примере 5 .
(E)-1,2,3-Трихлор-5-(4-метоксистирил)бензол (C44)
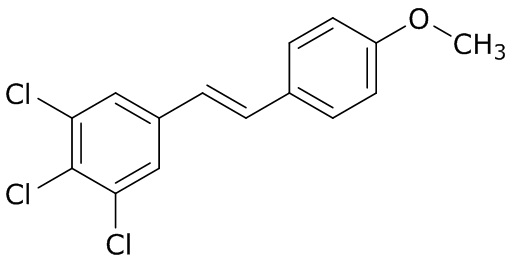
Выделяли в виде грязно-белого твердого вещества (3,7 г, 31%): 1H ЯМР (400 МГц, CDCl3) δ 7,49-7,46 (m, 2H), 7,47-7,39 (m, 2H), 7,04 (d, J=16,3 Гц, 1H), 6,93-6,89 (m, 2H), 6,78 (d, J=16,3 Гц, 1H), 3,84 (s, 3H); 13C ЯМР (101 МГц, CDCl3) δ 159,46, 135,08, 134,23, 130,91, 129,85, 129,16, 125,42, 114,02, 64,67, 55,32, 39,62, 38,48; EIMS масса/заряд 313 ([M]+).
(E)-1,2-Дихлор-4-(4-метоксистирил)бензол (C45)

Выделяли в виде грязно-белого твердого вещества (6,0 г, 53%): т. пл. 91-94°C; 1H ЯМР (400 МГц, CDCl3) δ 7,56 (d, J=2,0 Гц, 1H), 7,46-7,42 (m, 2H), 7,39 (d, J=8,4 Гц, 1H), 7,29 (dd, J=8,4, 2,1 Гц, 1H), 7,04 (d, J=16,2 Гц, 1H), 6,93-6,88 (m, 2H), 6,85 (d, J=16,3 Гц, 1H), 3,84 (s, 3H); 13C ЯМР (101 МГц, CDCl3) δ 159,75, 137,86, 132,72, 130,58, 130,49, 130,12, 129,33, 127,96, 127,77, 125,37, 123,98, 114,24, 55,35; EIMS масса/заряд 279 ([M]+).
Пример 6. Получение (E)-1-метокси-4-(4-(трифторметил)стирил)бензола (C46)

К перемешанному раствору диэтил-4-метоксибензилфосфоната (8,89 г, 34,0 ммоль) в N,N-диметилформамиде (30 мл) добавляли порошок метоксида натрия (1,86 г, 34,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до 0°C и по каплям добавляли 4-(трифторметил)бензальдегид (5,00 г, 28,0 ммоль) в N,N-диметилформамиде (30 мл). Реакционную смесь перемешивали при 60°C в течение 2 часов. Реакционную смесь выливали в ледяную воду, фильтровали и высушивали с получением указанного в заголовке соединения в виде грязно-белого твердого вещества (3,60 г, 80%): 1H ЯМР (300 МГц, CDCl3) δ 7,61-7,52 (m, 4H), 7,47 (d, J=9,0 Гц, 2H), 7,14 (d, J=16,5 Гц, 1H), 6,97 (d, J=16,5 Гц, 1H), 6,91 (d, J=9,0 Гц, 2H), 3,84 (s, 3H); ESIMS масса/заряд 279 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 6 .
(E)-1-(4-Метоксистирил)-3-(трифторметил)бензол (C47)
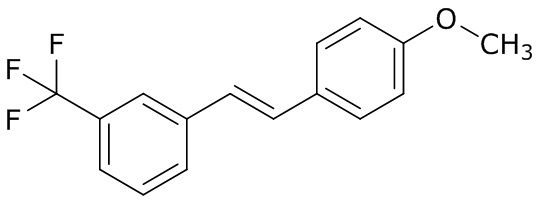
Выделяли в виде грязно-белого твердого вещества (4,0 г, 85%): 1H ЯМР (400 МГц, CDCl3) δ 7,72 (s, 1H), 7,64 (d, J=6,8 Гц, 1H), 7,50-7,44 (m, 4H), 7,12 (d, J=16,0 Гц, 1H), 6,98 (d, J=16,0 Гц, 1H), 6,91 (d, J=8,8 Гц, 2H), 3,84 (s, 3H); ESIMS масса/заряд 279 ([M+H]+).
(E)-2-Хлор-4-(4-метоксистирил)-1-(трифторметокси)бензол (C48)
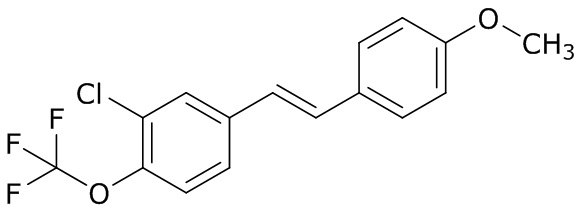
Выделенный. ESIMS масса/заряд 329 ([M+H]+).
(E)-1-(4-Метоксистирил)-3,5-бис(трифторметил)бензол (C49)
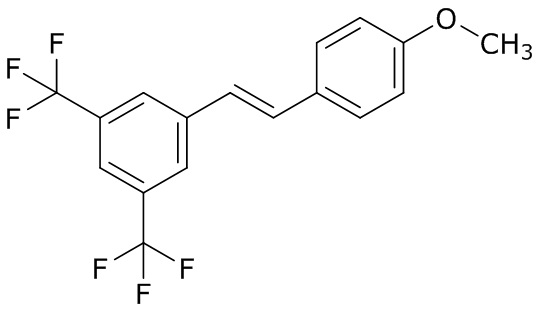
Выделяли в виде грязно-белого твердого вещества (4,0 г, 56%): 1H ЯМР (300 МГц, CDCl3) δ 7,88 (s, 2H), 7,70 (s, 1H), 7,49 (d, J=8,4 Гц, 2H), 7,19 (d, J=16,5 Гц, 1H), 6,99 (d, J=16,5 Гц, 1H), 6,92 (d, J=8,4 Гц, 2H), 3,84 (m, 3H); ESIMS масса/заряд 347 ([M+H]+).
(E)-1,3-Дибром-5-(4-метоксистирил)бензол (C50)
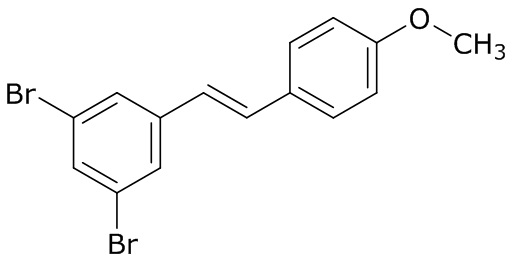
Выделяли в виде грязно-белого твердого вещества (2,2 г, 54%): 1H ЯМР (300 МГц, CDCl3) δ 7,53 (s, 1H), 7,50 (s, 2H), 7,43 (d, J=9,0 Гц, 2H), 7,05 (d, J=16,2 Гц, 1H), 6,90 (d, J=9,0 Гц, 2H), 6,79 (d, J=16,2 Гц, 1H), 3,80 (s, 3H); ESIMS масса/заряд 367 ([M+H]+).
(E)-1-Хлор-3-(4-метоксистирил)-5-(трифторметил)бензол (C51)
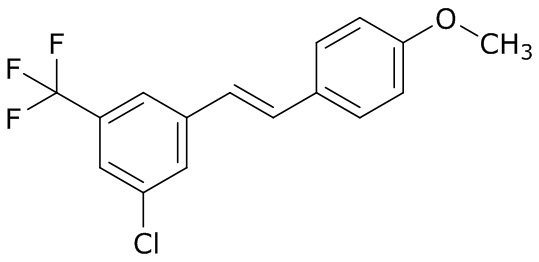
Выделяли в виде грязно-белого твердого вещества (4,3 г, 58%): 1H ЯМР (300 МГц, CDCl3) δ 7,62 (s, 1H), 7,58 (s, 1H), 7,48-7,42 (m, 3H), 7,12 (d, J=16,2 Гц, 1H), 6,95-6,85 (m, 3H), 3,84 (s, 3H); ESIMS масса/заряд 313 ([M+H]+).
(E)-2-Бром-1,3-дихлор-5-(4-метоксистирил)бензол (C52)
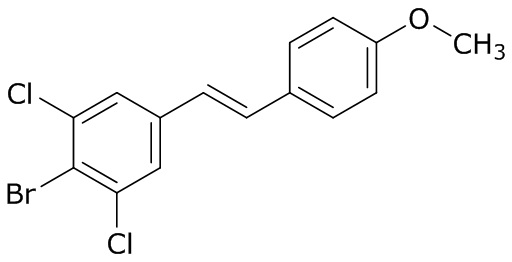
Выделяли в виде грязно-белого твердого вещества (2,8 г, 40%): 1H ЯМР (300 МГц, CDCl3) δ 7,46 (s, 2H), 7,43 (d, J=9,0 Гц, 2H), 7,07 (d, J=13,5 Гц, 1H), 6,90 (d, J=9,0 Гц, 1H), 6,73 (d, J=13,5 Гц, 1H), 3,84 (s, 3H); ESIMS масса/заряд 358 ([M+H]+).
(E)-1-Бром-3-хлор-5-(4-метоксистирил)бензол (C53)
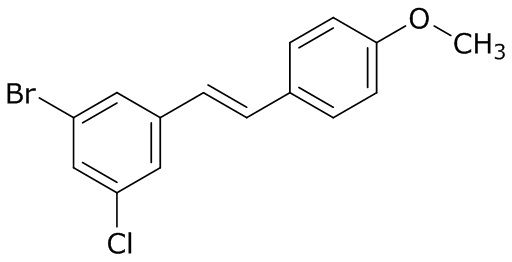
Выделяли в виде грязно-белого твердого вещества (4,0 г, 63%): 1H ЯМР (300 МГц, CDCl3) δ 7,49 (s, 1H), 7,43 (d, J=8,4 Гц, 2H), 7,38 (s, 1H), 7,35 (s, 1H), 7,05 (d, J=16,5 Гц, 1H), 6,91 (d, J=8,4 Гц, 2H), 6,80 (d, J=16,5 Гц, 1H), 3,82 (s, 3H); ESIMS масса/заряд 323 ([M+H]+).
(E)-1-Хлор-3-фтор-5-(4-метоксистирил)бензол (C54)
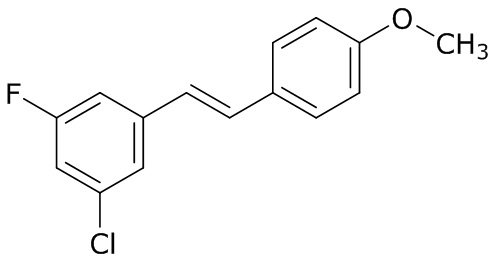
Выделяли в виде грязно-белого твердого вещества (5,0 г, 60%): 1H ЯМР (400 МГц, CDCl3) δ 7,45 (d, J=8,4 Гц, 2H), 7,10-7,0 (m, 3H), 6,96-6,80 (m, 4H), 3,80 (s, 3H); ESIMS масса/заряд 263 ([M+H]+).
(E)-1-Хлор-2-фтор-4-(4-метоксистирил)бензол (C55)
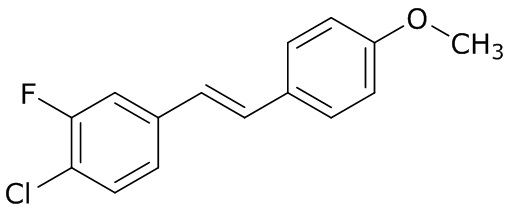
Выделяли в виде грязно-белого твердого вещества (7,0 г, 84%): 1H ЯМР (400 МГц, CDCl3) δ 7,44 (d, J=8,0 Гц, 2H), 7,35-7,31 (m, 1H), 7,28-7,24 (m, 1H), 7,17 (dd, J=1,6, 8,0 Гц, 1H), 7,03 (d, J=16,0 Гц, 1H), 6,90 (d, J=8,0 Гц, 1H), 7,49 (d, J=8,0 Гц, 1H), 6,86 (d, J=16,0 Гц, 1H), 3,82 (s, 3H); ESIMS масса/заряд 263 ([M+H]+).
(E)-2-Хлор-1-фтор-4-(4-метоксистирил)бензол (C56)

Выделяли в виде грязно-белого твердого вещества (6,0 г, 72%): ESIMS масса/заряд 263 ([M+H]+).
(E)-1-Хлор-3-(4-метоксистирил)-5-метилбензол (C57)

Выделяли в виде грязно-белого твердого вещества (5,0 г, 60%): 1H ЯМР (300 МГц, CDCl3) δ 7,44 (d, J=8,4 Гц, 2H), 7,28 (s, 1H), 7,15 (s, 1H), 7,05-7,00 (m, 2H), 6,91-6,83 (m, 3H), 3,83 (s, 3H), 2,24 (s, 3H); ESIMS масса/заряд 259 ([M+H]+).
(E)-1-Метокси-4-(4-(перфторэтил)стирил)бензол (C58)
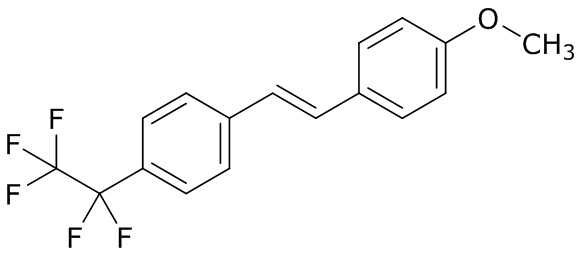
Выделяли в виде грязно-белого твердого вещества (0,5 г, 42%): 1H ЯМР (400 МГц, CDCl3) δ 7,60-7,50 (m, 4H), 7,47 (d, J=8,8 Гц, 2H),7,15 (d, J=16,8 Гц, 1H), 6,98 (d, J=16,8 Гц, 1H), 6,92 (d, J=8,8 Гц, 2H), 3,82 (s, 3H); ESIMS масса/заряд 329 ([M+H]+).
(E)-1,2-Бис(4-этоксифенил)этен (C59)
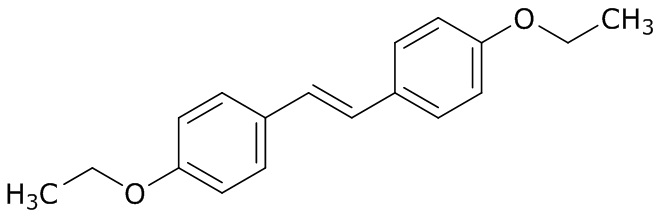
Выделяли в виде грязно-белого твердого вещества (1,7 г, 34%): 1H ЯМР (300 МГц, CDCl3) δ 7,40 (d, J=9,0 Гц, 4H), 6,91 (s, 2H), 6,87 (d, J=9,0 Гц, 4H), 4,05 (q, J=6,9 Гц, 4H), 1,42 (t, J=6,9 Гц, 6H); ESIMS масса/заряд 269 ([M+H]+).
Пример 7. Получение (E)-1,3-дихлор-2-фтор-5-(4-метоксистирил)бензола (C60)
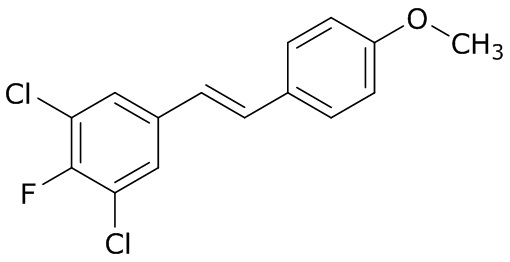
Перемешанную смесь 5-бром-1,3-дихлор-2-фторбензола (2,00 г, 8,20 ммоль), 1-метокси-4-винилбензола (1,32 г, 9,80 ммоль) и триэтиламина (20 мл) в атмосфере аргона дегазировали в течение 5 минут. Добавляли ацетат палладия(II) (0,0368 г, 0,164 ммоль) и 1,1′-бис(дифенилфосфино)ферроцен (0,181 г, 0,328 ммоль) и реакционную смесь нагревали до 90°C в течение 16 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией обеспечивала получение указанного в заголовке соединения в виде грязно-белого твердого вещества (1,60 г, 67%): 1H ЯМР (300 МГц, CDCl3) δ 7,41 (d, J=8,8 Гц, 2H), 7,31 (s, 1H), 7,37 (s, 1H), 6,96 (d, J=16,0 Гц, 1H), 6,89 (d, J=8,8 Гц, 2H), 6,76 (d, J=16,0 Гц, 1H), 3,84 (s, 3H); ESIMS масса/заряд 297 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 7 .
(E)-1,3-Дихлор-5-(4-метоксистирил)-2-метилбензол (C61)

Выделяли в виде грязно-белого твердого вещества (2,5 г, 67%): 1H ЯМР (300 МГц, CDCl3) δ 7,43 (d, J=8,7 Гц, 2H), 7,38 (s, 2H), 7,02 (d, J=16,5 Гц, 1H), 6,90 (d, J=8,7 Гц, 2H), 6,79 (d, J=16,5 Гц, 1H), 3,82 (s, 3H), 2,42 (s, 3H); ESIMS масса/заряд 293 ([M+H]+).
(E)-1,2-Дихлор-5-(4-метоксистирил)-3-метилбензол (C62)
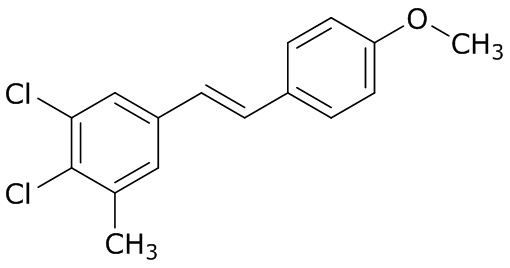
Выделяли в виде грязно-белого твердого вещества (3,0 г, 55%): 1H ЯМР (300 МГц, CDCl3) δ 7,50-7,40 (m, 3H), 7,24 (s, 1H), 7,02 (d, J=15,9 Гц, 1H), 6,90 (d, J=9,0 Гц, 2H), 6,81 (d, J=15,9 Гц, 1H), 3,83 (s, 3H), 2,42 (s, 3H); ESIMS масса/заряд 293 ([M+H]+).
Пример 8. Получение (E)-1,2,4-трихлор-5-(4-метоксистирил)бензола (C63)
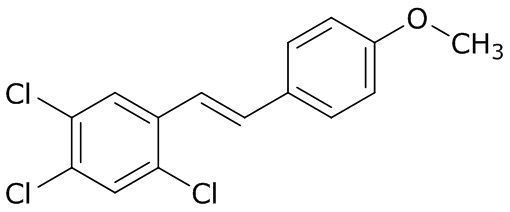
В герметизированную пробирку добавляли 1-бром-2,4,5-трихлорбензол (3,0 г, 12 ммоль), смесь 1,2-диметоксиэтан:вода (10:1, 30 мл), (E)-2-(4-метоксистирил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (C64) (3,7 г, 14 ммоль) и карбонат калия (3,2 г, 24 ммоль). Реакционную смесь дегазировали в течение 10 минут аргоном с последующим добавлением тетракис(трифенилфосфин)палладия(0) (0,55 г, 0,48 ммоль). Реакционную смесь дегазировали в течение 10 минут, затем нагревали при 90°C в течение 16 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией обеспечивала получение указанного в заголовке соединения в виде грязно-белого твердого вещества (3,0 г, 80%): 1H ЯМР (400 МГц, CDCl3) δ 7,73 (s, 1H), 7,50-7,45 (m, 3H), 7,20 (d, J=16,0 Гц, 1H), 7,02 (d, J=16 Гц, 1H), 6,92 (d, J=8,0 Гц, 2H), 3,84 (m, 3H); ESIMS масса/заряд 313 ([M+H]+).
Пример 9. Получение (E)-2-(4-метоксистирил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (C64)

В 50-мл круглодонную колбу добавляли 1-этинил-4-метоксибензол (4,0 г, 30 ммоль), 4,4,5,5-тетраметил-1,3,2-диоксаборолан (3,3 г, 36 ммоль), гидрохлорид цирконоцена (1,2 г, 4,0 ммоль) и триэтиламин (2,8 мл, 15 ммоль) при 0°C. Реакционную смесь затем перемешивали при 65°C в течение 16 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией обеспечивала получение указанного в заголовке соединения в виде грязно-белого полутвердого вещества (3,0 г, 38%): 1H ЯМР (400 МГц, CDCl3) δ 7,43 (d, J=8,8 Гц, 2H), 7,35 (d, J=18,0 Гц, 1H), 6,86 (d, J=8,8 Гц, 2H), 6,01 (d, J=18,0 Гц, 1H), 3,81 (s, 3H), 1,30 (s, 12H).
Пример 10. Получение 3,4,5-трихлорбензальдегида (C65)
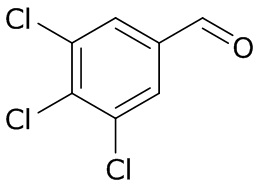
В высушенной в печи, продутой азотом 500-мл круглодонной колбе, оснащенной капельной воронкой для уравнивания давления, 5-бром-1,2,3-трихлорбензол (10,0 г, 38,4 ммоль) растворяли в тетрагидрофуране (100 мл) и полученный раствор охлаждали на ледяной бане в атмосфере азота. Хлорид изопропилмагния (2 M раствор в тетрагидрофуране, 21,1 мл, 42,3 ммоль) добавляли по каплям при тщательном перемешивании в течение 15 минут с помощью капельной воронки. Через 0,5 часа в темный раствор при перемешивании добавляли N,N-диметилформамид (3,72 мл, 48,0 ммоль). Еще через 0,5 часа при перемешивании добавляли хлористоводородную кислоту (1 н., 100 мл). Слои разделяли и органический слой промывали солевым раствором. Объединенные водные слои экстрагировали простым эфиром, и объединенные органические вещества высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (10:1 смесь указанного в заголовке соединения и 1,2,3-трихлорбензола, 7,96 г, 99%): 1H ЯМР (CDCl3) δ 9,91 (s, 1H), 7,88 (s, 2H); EIMS масса/заряд 209 ([M]+).
Пример 11. Получение 1-бром-4-(перфторэтил)бензола (C66)
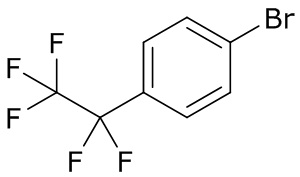
К перемешанному раствору 1-(4-бромфенил)-2,2,2-трифторэтанона (5,00 г, 19,7 ммоль) в дихлорметане в атмосфере аргона добавляли трифторид 4-трет-бутил-2,6-диметилфенилсеры (2,90 г, 11,8 ммоль) и комплекс фтороводорода и пиридина (0,190 г, 9,80 ммоль) при 0°C. Обеспечивали нагревание реакционной смеси до комнатной температуры и перемешивали в течение 16 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные органические экстракты высушивали над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией обеспечивала получение указанного в заголовке соединения в виде бесцветной жидкости (1,00 г, 20%): 1H ЯМР (300 МГц, CDCl3) δ 7,65 (d, J=9,0 Гц, 2H), 7,47 (d, J=9,0 Гц, 2H); EIMS масса/заряд 274 ([M]+).
Пример 12. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензойной кислоты (C67)
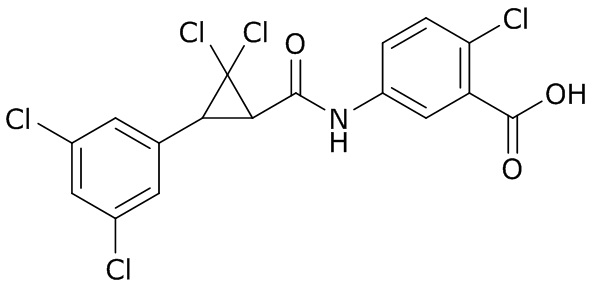
К раствору транс-2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоновой кислоты (C1) (0,300 г, 1,00 ммоль) в дихлорметане (5,00 мл), перемешанном при 0°C, добавляли N,N-диметилформамид (1 каплю) с последующим добавлением оксалилхлорида (0,131 мл, 1,50 ммоль) за 2 минуты. Ледяную баню удаляли и обеспечивали нагревание реакционной смеси до комнатной температуры за 90 минут. Реакционную смесь затем концентрировали с получением желто-оранжевого полутвердого вещества. Полутвердое вещество растворяли в дихлорметане (3,5 мл) и раствор медленно добавляли к охлажденному раствору 5-амино-2-хлорбензойной кислоты (0,206 г, 1,20 ммоль) и триэтиламина (0,209 мл, 1,50 ммоль) в дихлорметане (7 мл). Ледяную баню удаляли и обеспечивали нагревание реакционной смеси до комнатной температуры за 90 минут. Реакционную смесь разбавляли дихлорметаном (10 мл) и промывали хлористоводородной кислотой (0,1 н.). Полученную взвесь фильтровали и твердое вещество промывали водой. Выпавшее в осадок твердое вещество высушивали в вакуумной печи при 40°C с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (0,421 г, 93%): т. пл. 234-236°C; 1H ЯМР (400 МГц, DMSO-d6) δ 13,47 (s, 1H), 10,90 (s, 1H), 8,16 (d, J=2,3 Гц, 1H), 7,78 (dd, J=8,7, 2,4 Гц, 1H), 7,59 (m, 4H), 3,56 (dd, J=49,8, 8,5 Гц, 2H), 1,09 (m, 1H); 13C ЯМР (101 МГц, DMSO-d6) δ 166,26, 165,77, 162,61, 137,57, 137,27, 134,04, 132,18, 131,44, 131,22, 127,88, 127,66, 126,40, 125,92, 122,88, 121,17, 102,37, 62,11, 38,41, 36,83; ESIMS масса/заряд 454 ([M+H]+).
Пример 13. Получение транс-2-хлор-N-циклопропил-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)
бензамида (F1)

К перемешанной смеси транс-2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоновой кислоты (C1) (0,132 г, 0,440 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимида (0,127 г, 0,660 ммоль) в 1,2-дихлорэтане (4,40 мл) при комнатной температуре последовательно добавляли 5-амино-N-циклопропил-2-(трифторметил)бензамид (C69) (0,129 г, 0,528 ммоль) и 4-диметиламинопиридин (0,0700 г, 0,572 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли дихлорметан и смесь промывали насыщенным водным раствором бикарбоната натрия и хлористоводородной кислотой (1 н.). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке соединения в виде желтого твердого вещества (0,0870 г, 36%).
Следующие соединения получали аналогично процедуре, указанной в примере 13 .
Транс-N-циклопропил-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-2-(трифторметил)бензамид (F2)

Выделяли в виде белого твердого вещества (0,087 г, 17%).
Транс-N-циклопропил-3-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамид (F3)

Выделяли в виде белого твердого вещества (0,200 г, 66%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамид (F4)

Выделяли в виде коричневого полутвердого вещества (0,071 г, 55%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F5)
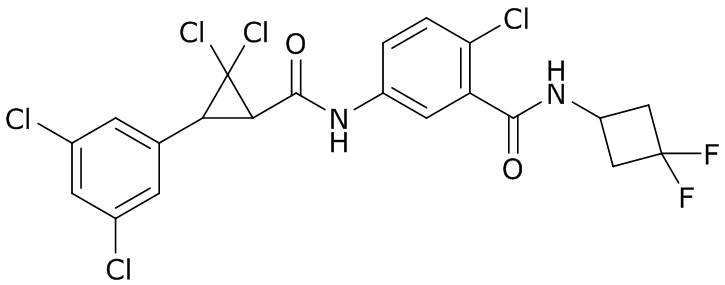
Выделяли в виде желтовато-коричневого порошка (0,200 г, 74%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F6)

Выделяли в виде грязно-белого порошка (0,092 г, 67%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(тетрагидротиофен-3-ил)бензамид (F7)

Выделяли в виде грязно-белого порошка (0,022 г, 16%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(тетрагидротиофен-3-ил)бензамид (F8)

Выделяли в виде грязно-белого порошка (0,040 г, 47%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F9)
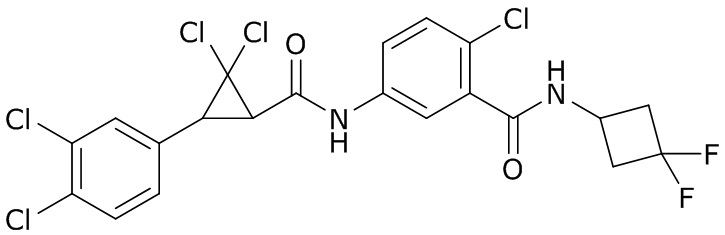
Выделяли в виде белого твердого вещества (0,084 г, 52%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)бензамид (F10)
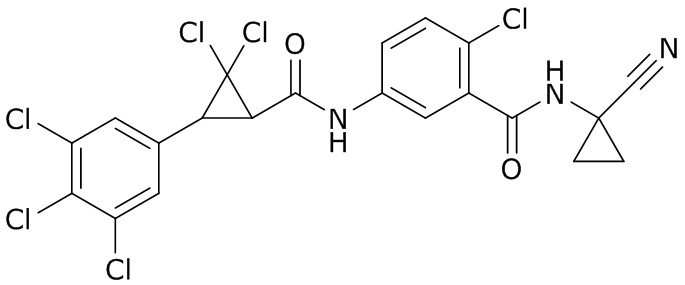
Выделяли в виде коричневого полутвердого вещества (0,140 г, 74%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)бензамид (F11)
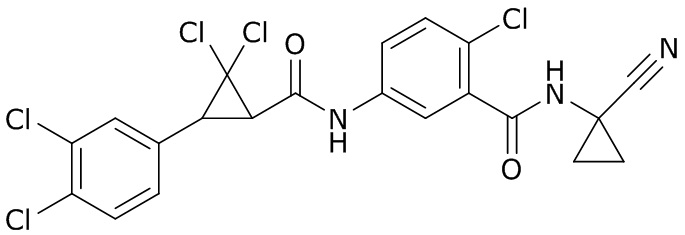
Выделяли в виде коричневого полутвердого вещества (0,110 г, 85%).
Транс-2-хлор-N-(1-цианоциклобутил)-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамид (F12)

Выделяли в виде желтовато-коричневой пены (0,060 г, 45%).
Транс-2-хлор-N-(1-цианоциклобутил)-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)бензамид (F13)

Выделяли в виде желтовато-коричневой пены (0,077 г, 61%).
Транс-2-хлор-N-(1-цианоциклобутил)-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)бензамид (F14)
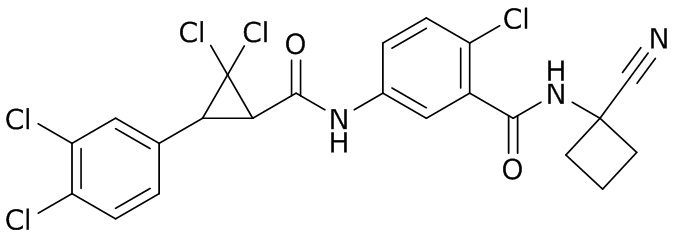
Выделяли в виде желтовато-коричневой пены (0,072 г, 54%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(тиетан-3-ил)бензамид (F15)
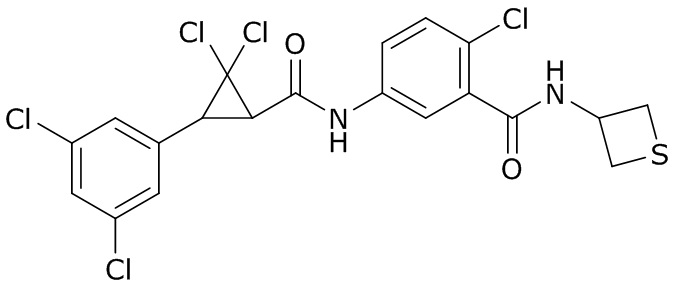
Выделяли в виде белого порошка (0,081 г, 62%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)-N-(тиетан-3-ил)бензамид (F16)
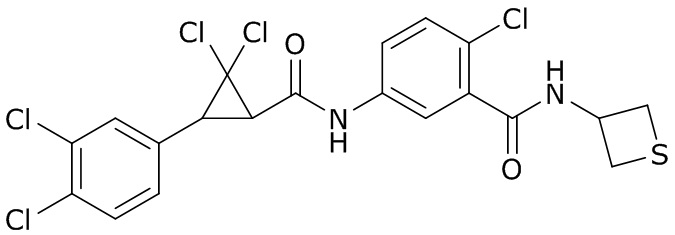
Выделяли в виде бледно-желтого полутвердого вещества (0,089 г, 68%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(тиетан-3-ил)бензамид (F17)
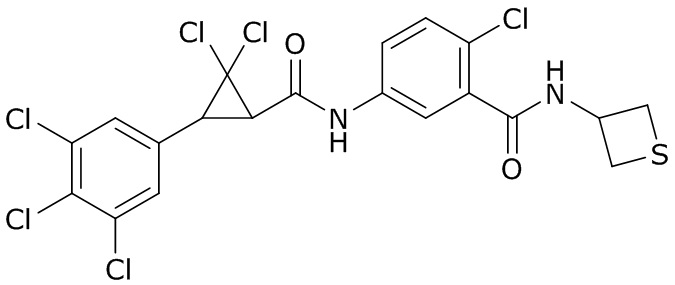
Выделяли в виде белого порошка (0,082 г, 61%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-(трифторметил)фенил)циклопропанкарбоксамидо)бензамид (F18)
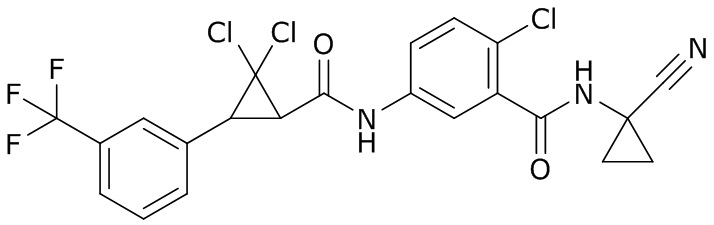
Выделяли в виде белого твердого вещества (0,088 г, 61%).
Транс-2-хлор-5-(2,2-дихлор-3-(3-(трифторметил)фенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F19)

Выделяли в виде белого твердого вещества (0,110 г, 72%).
Транс-2-хлор-5-(2,2-дихлор-3-(2,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F20)
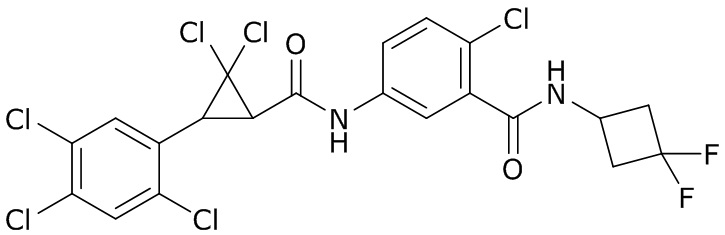
Выделяли в виде белого твердого вещества (0,058 г, 40%).
Транс-2-хлор-5-(2,2-дихлор-3-(3-хлор-4-(трифторметокси)фенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F21)
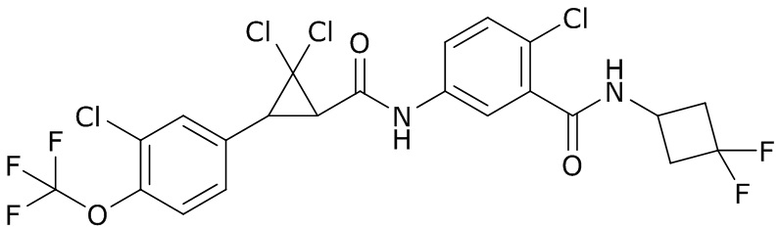
Выделяли в виде белого твердого вещества (0,092 г, 65%).
Транс-2-хлор-5-(2,2-дихлор-3-(4-(трифторметил)фенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F22)
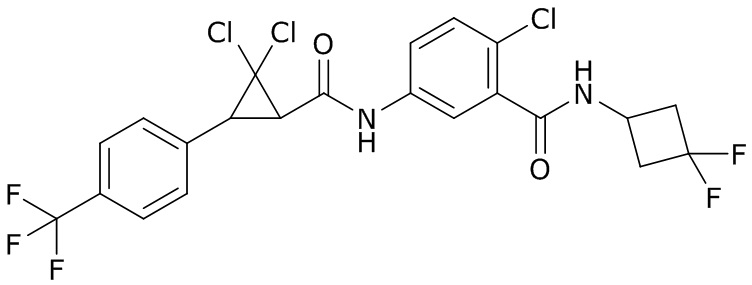
Выделяли в виде белого твердого вещества (0,108 г, 71%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(4-(трифторметил)фенил)циклопропанкарбоксамидо)бензамид (F23)
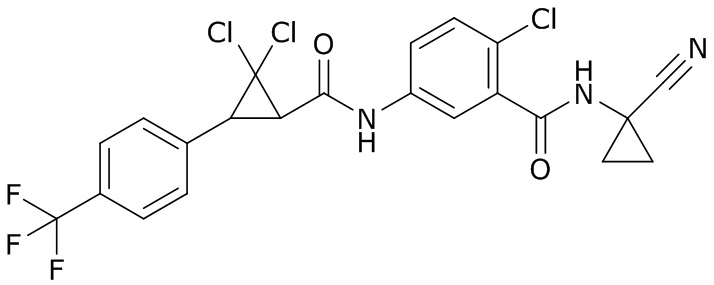
Выделяли в виде белого твердого вещества (0,022 г, 15%).
Транс-5-(3-(3,5-бис(трифторметил)фенил)-2,2-дихлорциклопропанкарбоксамидо)-2-хлор-N-(3,3-дифторциклобутил)бензамид (F24)

Выделяли в виде белого твердого вещества (0,052 г, 37%).
Транс-5-(3-(3,5-бис(трифторметил)фенил)-2,2-дихлорциклопропанкарбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамид (F25)
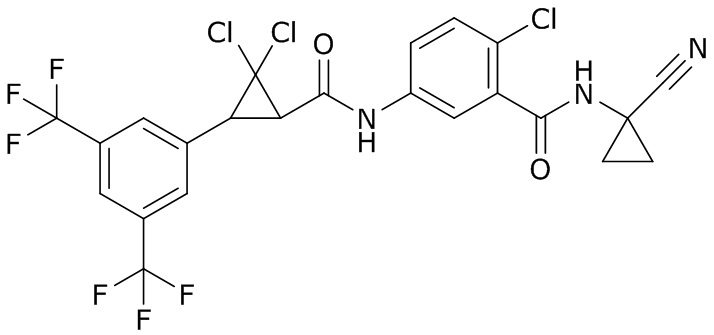
Выделяли в виде белого твердого вещества (0,024 г, 18%).
Транс-2-хлор-5-(2,2-дихлор-3-(3-хлор-5-(трифторметил)фенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F26)
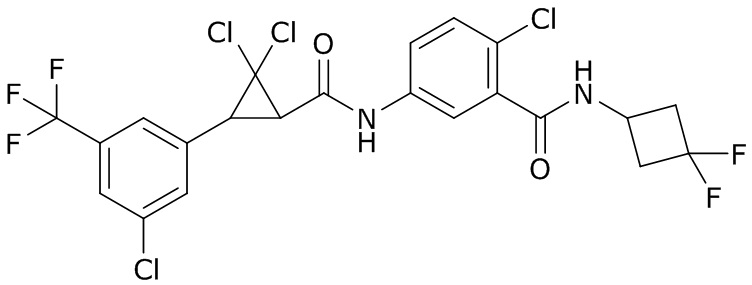
Выделяли в виде белого твердого вещества (0,052 г, 36%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-5-(трифторметил)фенил)циклопропанкарбоксамидо)бензамид (F27)

Выделяли в виде белого твердого вещества (0,022 г, 15%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дибромфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F28)
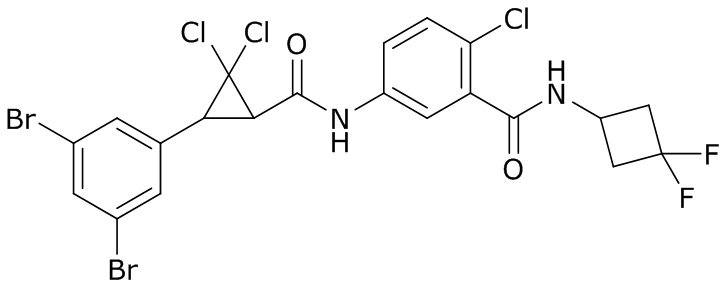
Выделяли в виде белого твердого вещества (0,039 г, 29%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,5-дибромфенил)циклопропанкарбоксамидо)бензамид (F29)
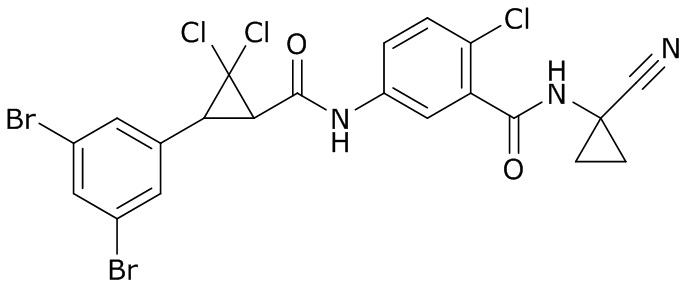
Выделяли в виде прозрачной пленки (0,013 г, 10%)
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлор-4-фторфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F30)
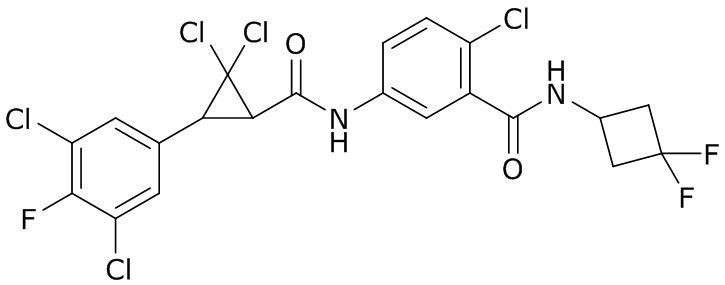
Выделяли в виде белого твердого вещества (0,037 г, 25%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,5-дихлор-4-фторфенил)циклопропанкарбоксамидо)бензамид (F31)

Выделяли в виде прозрачной пленки (0,015 г, 10%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)-N-метилбензамид (F32)
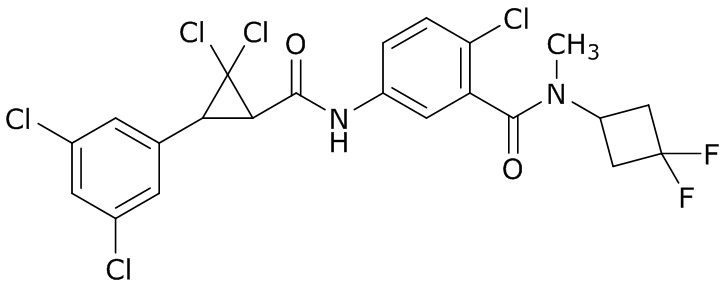
Выделяли в виде белой пены (0,118 г, 85%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)-N-метилбензамид (F33)
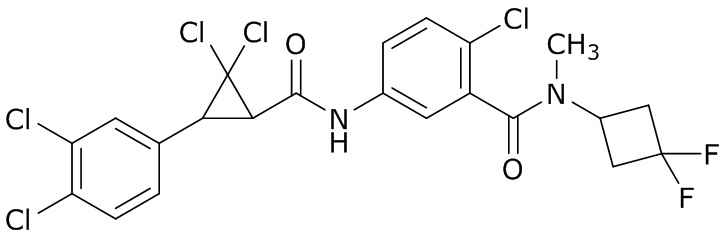
Выделяли в виде белой пены (0,116 г, 83%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)-N-метилбензамид (F34)
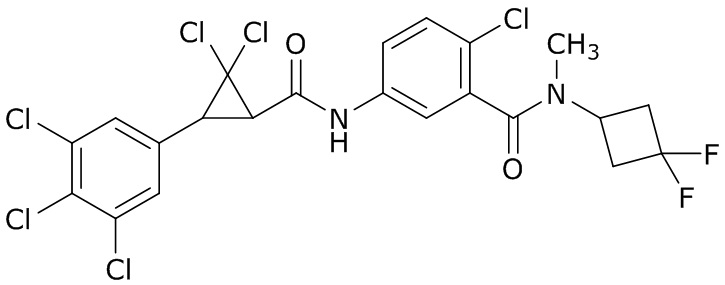
Выделяли в виде белой пены (0,071 г, 54%).
Транс-2-хлор-N-(3-цианоциклопентил)-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамид (F35)

Выделяли в виде белой пены (0,136 г, 88%).
Транс-2-хлор-N-(3-цианоциклопентил)-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)бензамид (F36)
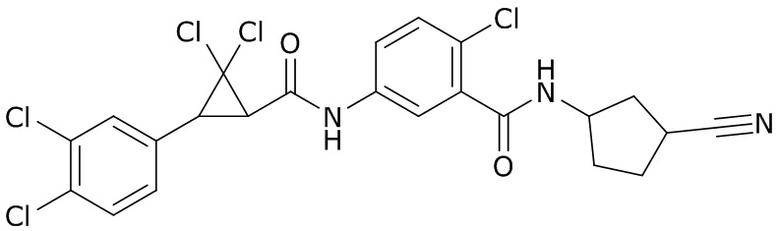
Выделяли в виде грязно-белого порошка (0,114 г, 74%).
Транс-2-хлор-5-(2,2-дихлор-3-фенилциклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F37)
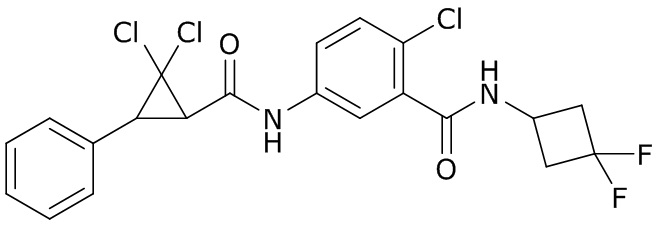
Выделяли в виде белого твердого вещества (0,024 г, 14%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-фенилциклопропанкарбоксамидо)бензамид (F38)
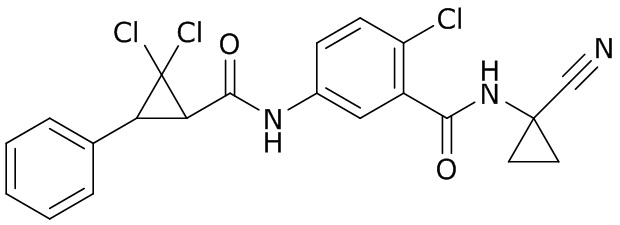
Выделяли в виде желтой пленки (0,008 г, 5%).
Транс-2-хлор-N-(3-цианоциклопентил)-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)бензамид (F39)

Выделяли в виде белого порошка (0,122 г, 78%).
Транс-2-хлор-N-циклобутил-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамид (F40)

Выделяли в виде грязно-белого порошка (0,137 г, 78%).
Транс-2-хлор-N-циклобутил-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)бензамид (F41)

Выделяли в виде грязно-белого порошка (0,113 г, 75%).
Транс-2-хлор-N-циклобутил-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)бензамид (F42)
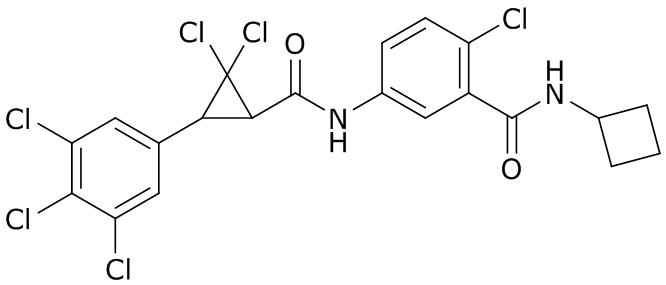
Выделяли в виде грязно-белого порошка (0,121 г, 75%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(4,4-дифторциклогексил)бензамид (F43)
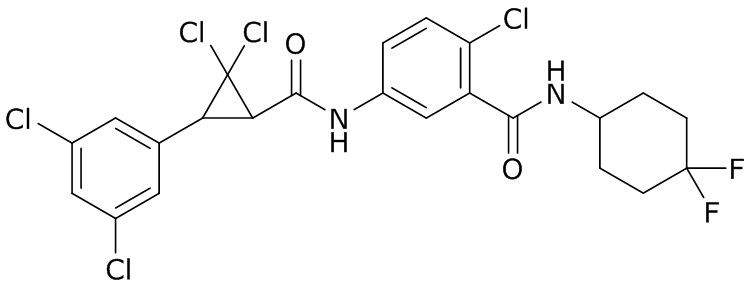
Выделяли в виде грязно-белой пены (0,108 г, 57%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропанкарбоксамидо)-N-(4,4-дифторциклогексил)бензамид (F44)
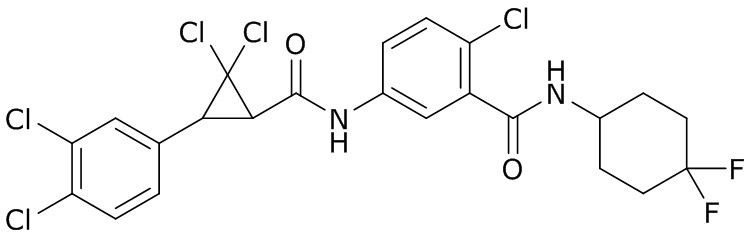
Выделяли в виде коричневого полутвердого вещества (0,108 г, 65%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(4,4-дифторциклогексил)бензамид (F45)

Выделяли в виде белого порошка (0,089 г, 49%).
Транс-2-хлор-5-(2,2-дихлор-3-(3-хлор-5-метилфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F46)
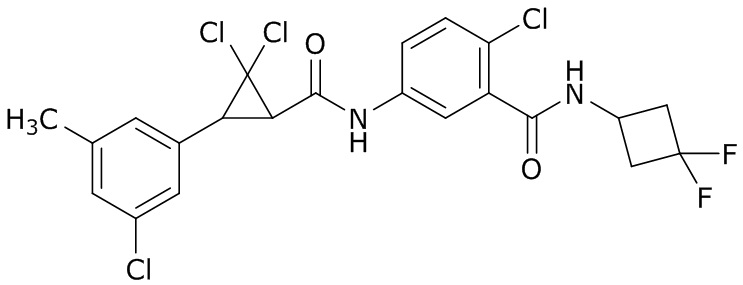
Выделяли в виде белой пены (0,093 г, 66%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-5-метилфенил)циклопропанкарбоксамидо)бензамид (F47)
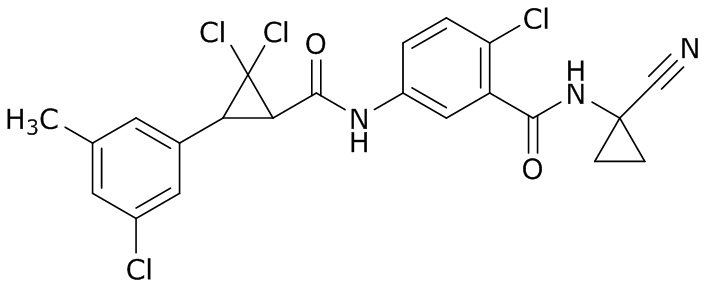
Выделяли в виде бесцветного стеклообразного вещества (0,031 г, 23%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлор-4-метилфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F48)
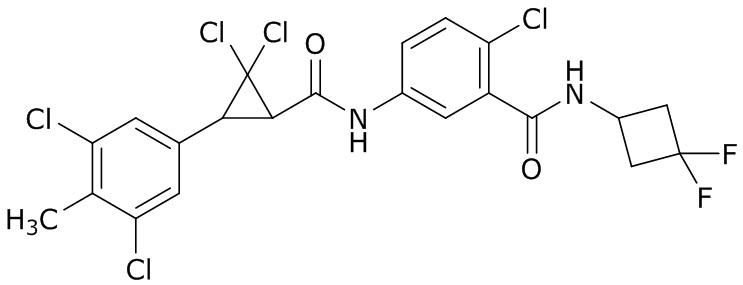
Выделяли в виде белого твердого вещества (0,094 г, 71%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,5-дихлор-4-метилфенил)циклопропанкарбоксамидо)бензамид (F49)
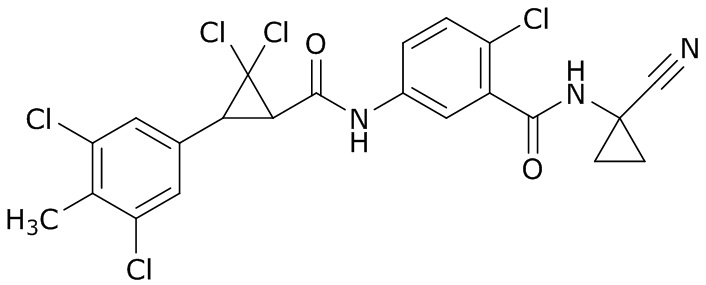
Выделяли в виде бесцветной пленки (0,011 г, 9%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4-дихлор-5-метилфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F50)

Выделяли в виде белого твердого вещества (0,052 г, 39%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,4-дихлор-5-метилфенил)циклопропанкарбоксамидо)бензамид (F51)
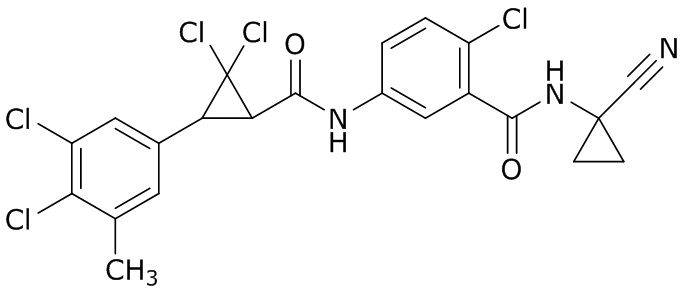
Выделяли в виде белой пены (0,087 г, 69%).
Пример 14. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-морфолинобензамида (F52)
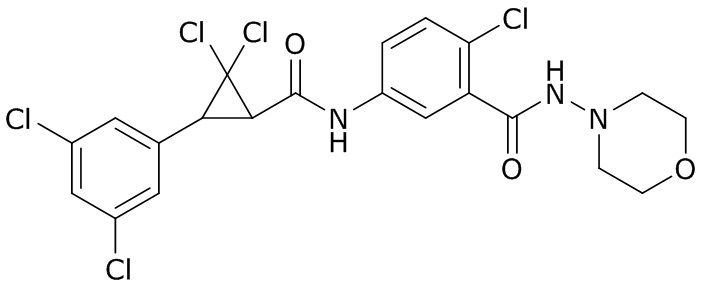
К раствору морфолин-4-амина (0,0200 г, 0,198 ммоль) в дихлорметане (2 мл) последовательно добавляли 1-этил-3-(3-диметиламинопропил)карбодиимид (0,0480 г, 0,248 ммоль), 4-диметиламинопиридин (0,0240 г, 0,198 ммоль) и 2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензойную кислоту (C67) (0,0750 г, 0,165 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Очистка флэш-хроматографией с применением 0-100% этилацетат/гексаны в качестве элюента обеспечивала получение указанного в заголовке соединения в виде белого твердого вещества (0,0378 г, 43%).
Следующие соединения получали аналогично процедуре, указанной в примере 14 .
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(оксетан-3-ил)бензамид (F53)
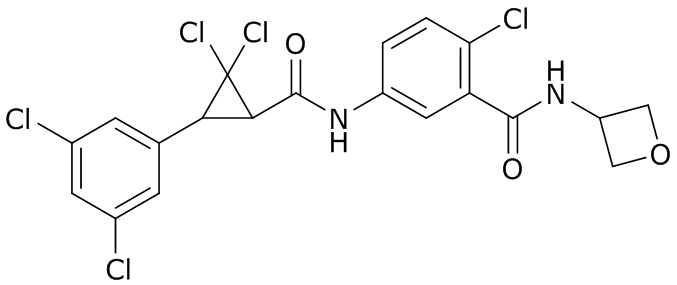
Выделяли в виде белого порошка (0,067 г, 60%).
Транс-трет-бутил-3-(2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамидо)азетидин-1-карбоксилат (F54)

Выделяли в виде светло-зеленого порошка (0,805 г, 60%).
Пример 15. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(тетрагидро-2H-пиран-4-ил)бензамида (F55)
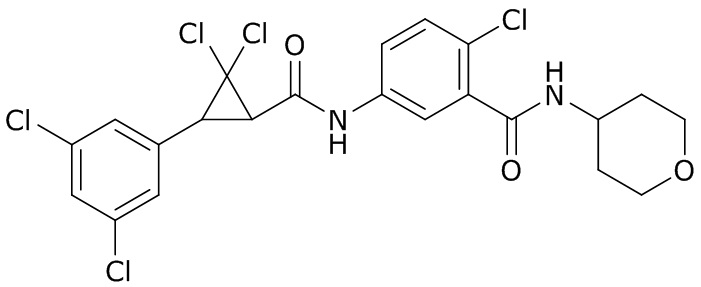
К раствору 2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензойной кислоты (C67) (0,200 г, 0,441 ммоль) в дихлорметане (2,2 мл), перемешанному при 0°C, добавляли N,N-диметилформамид (1 каплю) с последующим добавлением оксалилхлорида (0,0579 мл, 0,661 ммоль). Ледяную баню удаляли и обеспечивали нагревание реакционной смеси до комнатной температуры за 90 минут. Затем реакционную смесь концентрировали с получением окрашенной в кремовый цвет пены (0,210 г). Половину выделенного хлорангидрида (0,100 г, 0,212 ммоль) растворяли в дихлорметане (2 мл) и раствор добавляли к охлажденному раствору тетрагидро-2H-пиран-4-амина (0,0290 г, 0,254 ммоль) и триэтиламина (0,0440 мл, 0,318 ммоль), растворенному в дихлорметане (2 мл). Ледяную баню удаляли и обеспечивали перемешивание реакционной смеси при комнатной температуре в течение 16 часов. Очистка колоночной флэш-хроматографией с применением 0-40% этилацетат/гексаны в качестве элюента обеспечивала получение указанного в заголовке соединения в виде белого твердого вещества (0,0339 г, 29%).
Пример 16. Получение диастереоизомеров транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(1-оксидотиетан-3-ил)бензамида (F56) и (F57)

К раствору транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(тиетан-3-ил)бензамида (F17) (0,150 г, 0,268 ммоль) в дихлорметане (2,68 мл) добавляли мета-хлорпероксибензойную кислоту (0,0630 г, 0,282 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией с применением 0-15% метанол/дихлорметан в качестве элюента обеспечивала получение указанного в заголовке соединения (F56) в виде белого твердого вещества (0,0390 г, 24%) и соединения (F57) в виде белого твердого вещества (0,0200 г, 12%).
Пример 17. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(1,1-диоксидотиетан-3-ил)бензамида (F58)

К раствору транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(тиетан-3-ил)бензамида (F17) (0,140 г, 0,250 ммоль) в дихлорметане (2,5 мл) добавляли мета-хлорпероксибензойную кислоту (0,140 г, 0,626 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли насыщенный водный раствор карбоната натрия и смесь экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией с применением 0-15% метанол/дихлорметан обеспечивала получение указанных в заголовке соединений в виде блекло-желтого твердого вещества (0,0460 г, 30%).
Пример 18. Получение транс-N-(азетидин-3-ил)-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)
бензамида (F59)
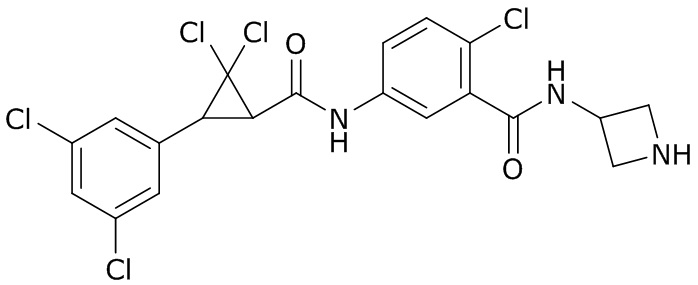
К перемешанной смеси транс-трет-бутил-3-(2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамидо)азетидин-1-карбоксилата (F54) (0,065 г, 0,11 ммоль) в дихлорметане (1,4 мл) при 23°C добавляли трифторуксусную кислоту (0,082 мл, 1,1 ммоль). Полученный гомогенный бесцветный раствор перемешивали при 23°C в течение 3 часов. Реакционную смесь разбавляли насыщенным водным раствором бикарбоната натрия (50 мл) и экстрагировали дихлорметаном (9×15 мл). Объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали с получением необходимого продукта в виде белого порошка (0,047 г, 87%).
Пример 19. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(1-(2,2,2-трифторацетил)азетидин-3-ил)бензамида (F60)
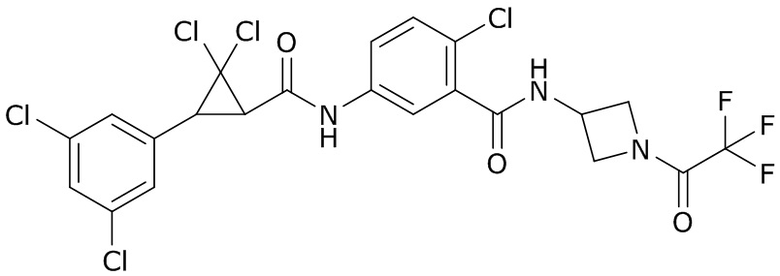
К перемешанной смеси транс-трет-бутил-3-(2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамидо)азетидин-1-карбоксилата (F54) (0,10 г, 0,17 ммоль) в дихлорметане (1,6 мл) при 23°C добавляли трифторуксусную кислоту (0,13 мл, 1,7 ммоль). Полученный гомогенный бесцветный раствор перемешивали при 23°C в течение 4 часов. Реакционную смесь концентрировали и остаток повторно растворяли в дихлорметане (1,6 мл). Добавляли триэтиламин (0,034 мл, 0,25 ммоль) и 2-метоксиуксусную кислоту (0,020 мл, 0,25 ммоль) с последующим добавлением гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (0,063 г, 0,33 ммоль), 4-диметиламинопиридина (0,030 г, 0,25 ммоль). Полученный гомогенный ярко-желтый раствор перемешивали при 23°C в течение 72 часов. Реакционную смесь концентрировали и остаток очищали колоночной флэш-хроматографией с обращенной фазой с помощью 5-100% ацетонитрил/вода в качестве элюента с получением указанного в заголовке продукта в виде белого твердого вещества (0,042 г, 42%).
Пример 20. Получение 5-амино-2-хлор-N-циклопропилбензамида (C68)
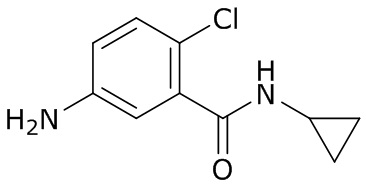
2-Хлор-N-циклопропил-5-нитробензамид (C79) (0,130 г, 0,540 ммоль) растворяли в этилацетате (2,5 мл). Для растворения материала добавляли этанол (2,5 мл). Добавляли железо (0,181 г, 3,24 ммоль) с последующим добавлением воды (0,5 мл), затем уксусной кислоты (0,866 мл, 15,1 ммоль) и смесь перемешивали при комнатной температуре в течение 5 дней. Реакционную смесь фильтровали через Celite®, разбавляли водой и экстрагировали этилацетатом. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке соединения в виде желтого твердого вещества (0,112 г, 88%): 1H ЯМР (400 МГц, CDCl3) δ 7,10 (d, J=8,6 Гц, 1H), 6,96 (d, J=2,9 Гц, 1H), 6,63 (dd, J=8,6, 2,9 Гц, 1H), 6,44 (s, 1H), 3,78 (s, 2H), 2,95-2,82 (m, 1H), 0,89-0,82 (m, 2H), 0,66-0,60 (m, 2H); EIMS масса/заряд 211 ([M]+).
Пример 21. Получение 5-амино-N-циклопропил-2-(трифторметил)бензамида (C69)

К раствору N-циклопропил-5-нитро-2-(трифторметил)бензамида (0,189 г, 0,689 ммоль) в метаноле (2,3 мл) и воде (1,1 мл) добавляли порошкообразное железо (0,192 г, 3,45 ммоль) и хлорид аммония (0,111 г, 2,07 ммоль). Реакционную смесь нагревали при 60°C в течение 2 часов. Реакционную смесь фильтровали через Celite®. Фильтрат разбавляли дихлорметаном и экстрагировали хлористоводородной кислотой (1 н.). Объединенные водные фазы нейтрализовывали насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке соединения в виде блекло-желтого твердого вещества (0,136 г, 73%): 1H ЯМР (400 МГц, CDCl3) δ 7,40 (d, J=8,5 Гц, 1H), 6,74 (d, J=2,4 Гц, 1H), 6,70 6,64 (m, 1H), 5,86 (s, 1H), 4,09 (s, 2H), 2,90 2,80 (m, 1H), 0,91 0,82 (m, 2H), 0,66 0,57 (m, 2H); IR (тонкая пленка) 3333, 3249, 1627 см-1; EIMS масса/заряд 244 ([M]+).
Следующие соединения получали аналогично процедуре, указанной в примере 21 .
5-Амино-2-хлор-N-(1-цианоциклопропил)бензамид (C70)
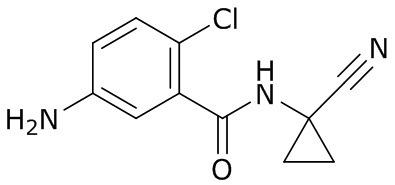
Выделяли в виде желтого твердого вещества (0,326 г, 75%): 1H ЯМР (400 МГц, DMSO-d6) δ 9,23 (s, 1H), 7,08 (d, J=8,6 Гц, 1H), 6,64-6,53 (m, 2H), 5,44 (s, 2H), 1,55 (dd, J=8,2, 5,5 Гц, 2H), 1,19 (dd, J=8,0, 5,4 Гц, 2H); IR (тонкая пленка) 3468, 3261, 2245, 1655 см-1; EIMS масса/заряд 236 ([M]+).
Пример 22. Получение 5-амино-2-хлор-N-(3,3-дифторциклобутил)бензамида (C71)

Гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,840 г, 4,40 ммоль) и 4-диметиламинопиридин (0,460 г, 3,80 ммоль) последовательно добавляли к перемешанной смеси 5-амино-2-хлорбензойной кислоты (0,500 г, 2,90 ммоль), гидрохлорида 3,3-дифторциклобутиламина (0,500 г, 3,50 ммоль) и триэтиламина (0,490 мл, 3,50 ммоль) в дихлорметане (15 мл) при 23°C. Полученную гетерогенную серую смесь перемешивали при 23°C в течение 96 часов. Реакционную смесь концентрировали и остаток очищали колоночной флэш-хроматографией с обращенной фазой с помощью 5-100% ацетонитрил/вода в качестве элюента. Остаток суспендировали в дихлорметане и фильтровали под вакуумом с получением необходимого продукта в виде желтовато-коричневого порошка (0,530 г, 70%): 1H ЯМР (400 МГц, DMSO-d6) δ 8,77 (d, J=7 Гц, 1H), 7,06 (m, 1H), 6,56-6,61 (m, 2H), 5,41 (br s, 2H), 4,17 (m, 1H), 2,89-3,01 (m, 2H), 2,56-2,70 (m, 2H); IR (тонкая пленка) 3482 (w), 3372 (w), 3251 (w), 2917 (m), 2850 (m), 1697 (w), 1631 (s), 1599 (s), 1577 (m), 1540 (s), 1478 (s) см-1; ESIMS масса/заряд 261 ([M+H]+).
Пример 23. Получение 5-амино-2-хлор-N-(тетрагидротиофен-3-ил)бензамида (C72)
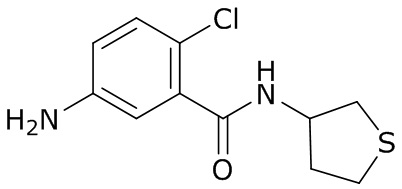
К перемешанной смеси 5-амино-2-хлорбензойной кислоты (0,690 г, 4,00 ммоль) и тетрагидротиофен-3-амина (0,450 г, 4,40 ммоль) в дихлорметане (16 мл) при 23°C последовательно добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,15 г, 6,00 ммоль) и 4-диметиламинопиридин (0,590 г, 4,80 ммоль). Полученный гомогенный серый раствор перемешивали при 23°C в течение 16 часов. Реакционную смесь концентрировали и остаток очищали колоночной флэш-хроматографией с обращенной фазой с помощью 5-100% ацетонитрил/вода в качестве элюента с получением указанного в заголовке соединения в виде светло-коричневого масла (0,780 г, 76%): 1H ЯМР (400 МГц, CDCl3) δ 7,14 (d, J=9 Гц, 1H), 7,00 (d, J=3 Гц, 1H), 6,66 (dd, J=9, 3 Гц, 1H), 6,56 (br s, 1H), 4,91 (m, 1H), 3,78 (br s, 2H), 3,15 (dd, J=11, 5 Гц, 1H), 2,78-3,02 (m, 3H), 2,29 (m, 1H), 2,08 (m, 1H); IR (тонкая пленка) 3340 (w), 3230 (m), 2935 (w), 1634 (s), 1599 (s), 1575 (m), 1520 (s), 1474 (s), 1432 (m) см-1; ESIMS масса/заряд 257 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 23 .
5-Амино-2-хлор-N-(1-цианоциклобутил)бензамид (C73)
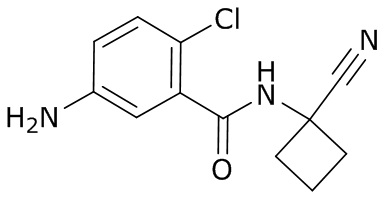
Выделяли в виде коричневого стеклообразного вещества (0,276 г, 27%): 1H ЯМР (400 МГц, CDCl3) δ 9,33 (br s, 1H), 8,09 (m, 1H), 7,09 (d, J=9 Гц, 1H), 6,62 (m, 1H), 5,46 (br s, 2H), 2,57-2,71 (m, 2H), 2,33-2,47 (m, 2H), 1,98-2,11 (m, 2H); IR (тонкая пленка) 3353 (w), 3222 (w), 2951 (w), 2236 (w), 1647 (s), 1600 (s), 1523 (s), 1476 (s), 1435 (m) см-1; ESIMS масса/заряд 250 ([M+H]+).
5-Амино-2-хлор-N-(тиетан-3-ил)бензамид (C74)
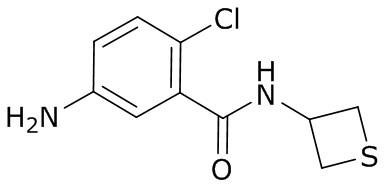
Выделяли в виде белого порошка (0,680 г, 71%): т. пл. 166-168°C; 1H ЯМР (400 МГц, DMSO-d6) δ 8,94 (br d, J=7,5 Гц, 1H), 7,06 (d, J=8,7 Гц, 1H), 6,52-6,61 (m, 2H), 5,41 (br s, 2H), 5,12 (h, J=7,5 Гц, 1H), 3,38-3,47 (m, 2H), 3,20-3,27 (m, 2H); IR (тонкая пленка) 3424 (w), 3303 (m), 2943 (w), 1639 (s), 1598 (m), 1578 (m), 1523 (s), 1474 (m) см-1; ESIMS масса/заряд 243 ([M+H]+).
5-Амино-2-хлор-N-циклобутилбензамид (C75)

Выделяли в виде грязно-белого порошка (): т. пл. 130-132°C; 1H ЯМР (400 МГц, DMSO-d6) δ 8,49 (br d, J=8 Гц, 1H), 7,04 (d, J=8,4 Гц, 1H), 6,52-6,59 (m, 2H), 5,36 (br s, 2H), 4,31 (m, 1H), 2,13-2,23 (m, 2H), 1,91-2,02 (m, 2H), 1,58-1,69 (m, 2H); IR (тонкая пленка) 3447 (w), 3334 (m), 3283 (m), 2991 (w), 2942 (w), 2861 (w), 1618 (s), 1601 (s), 1541 (s), 1476 (m), 1428 (m) см-1; ESIMS масса/заряд 225 ([M+H]+).
Пример 24. Получение 5-амино-2-хлор-N-(3,3-дифторциклобутил)-N-метилбензамида (C76)
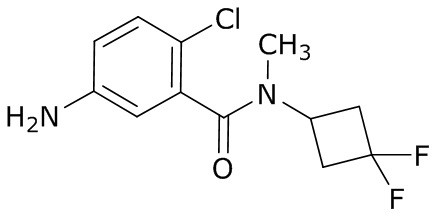
К раствору 2-хлор-N-(3,3-дифторциклобутил)-N-метил-5-нитробензамида (C82) (0,513 г, 1,68 ммоль) в этилацетате (10 мл) в атмосфере азота добавляли палладий на угле (0,179 г, 0,0840 ммоль). Реакционную смесь выдерживали в камере с водородом и энергично перемешивали в течение 5 часов. Реакционную смесь фильтровали через Celite®, промывали этилацетатом. Фильтраты концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (0,394 г, 85%): 1H ЯМР (400 МГц, CDCl3) δ ротамеры 7,14 (dd, J=8,6, 5,6 Гц, 1H), 6,64 (ddd, J=8,5, 7,5, 2,8 Гц, 1H), 6,54 (dd, J=14,9, 2,8 Гц, 1H), 5,03-4,82 (m, 0,5 H), 4,22-4,06 (m, 0,5 H), 3,77 (s, 2H), 3,09 (s, 1,5 H), 3,04-2,91 (m, 1 H), 2,85 (s, 1,5 H), 2,92-2,59 (m, 3H); 19F ЯМР (376 МГц, CDCl3) δ ротамеры -83,92 (d, J=199,2 Гц), -84,69 (d, J=201,6 Гц), -99,42 (d, J=201,6 Гц), -99,78 (d, J=199,1 Гц); ESIMS масса/заряд 275 ([M+H]+).
Пример 25. Получение 5-амино-2-хлор-N-(3-цианоциклопентил)бензамида (C77)

К перемешанной смеси 5-амино-2-хлорбензойной кислоты (0,290 г, 1,70 ммоль), гидрохлорида 3-аминоциклопентанкарбонитрила (0,250 г, 1,70 ммоль) и триэтиламина (0,280 мл, 2,00 ммоль) в дихлорметане (11 мл) при 23°C последовательно добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,490 г, 2,50 ммоль) и 4-диметиламинопиридин (0,270 г, 2,20 ммоль). Полученный гомогенный светлый желтовато-коричневый раствор перемешивали при 23°C в течение 72 часов. Реакционную смесь концентрировали и остаток очищали колоночной флэш-хроматографией с обращенной фазой с помощью 5-100% ацетонитрил/вода в качестве элюента с получением указанного в заголовке соединения в виде грязно-белого порошка (0,350 г, 78%): т. пл. 117-119°C; 1H ЯМР (400 МГц, DMSO-d6) δ 8,46 (br d, J=7 Гц, 1H), 7,05 (d, J=8,2 Гц, 1H), 6,53-6,59 (m, 2H), 5,37 (br s, 2H), 4,19 (m, 1H), 3,01 (p, J=8 Гц, 1H), 2,39 (m, 1H), 2,02 (m, 1H), 1,83-1,95 (m, 2H), 1,61-1,78 (m, 2H); IR (тонкая пленка) 3444 (m), 3360 (m), 3237 (m), 3064 (w), 2951 (w), 2875 (w), 2238 (m), 1626 (s), 1599 (s), 1577 (m), 1544 (s), 1475 (s), 1437 (s) см-1; ESIMS масса/заряд 264 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 25 .
5-Амино-2-хлор-N-(4,4-дифторциклогексил)бензамид (C78)

Выделяли в виде серого порошка (0,560 г, 67%): т. пл. 132°C (с разл.); 1H ЯМР (400 МГц, DMSO-d6) δ 8,28 (br d, J=8 Гц, 1H), 7,04 (d, J=8 Гц, 1H), 6,51-6,60 (m, 2H), 5,37 (br s, 2H), 3,90 (m, 1H), 1,80-2,09 (m, 6H), 1,50-1,63 (m, 2H); IR (тонкая пленка) 3430 (w), 3298 (m), 2948 (w), 1634 (s), 1602 (m), 1579 (m), 1533 (s), 1478 (m) см-1; ESIMS масса/заряд 289 ([M+H]+).
Пример 26. Получение 2-хлор-N-циклопропил-5-нитробензамида (C79)
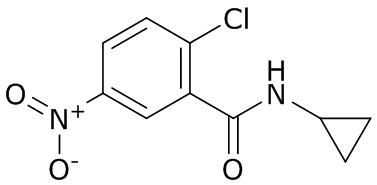
К перемешанной смеси циклопропанамина (0,103 мл, 1,49 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимида (0,357 г, 1,86 ммоль) в 1,2-дихлорэтане (12 мл) при комнатной температуре последовательно добавляли 2-хлор-5-нитробензойную кислоту (0,250 г, 1,24 ммоль) и 4-диметиламинопиридин (0,197 г, 1,61 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь разбавляли дихлорметаном и промывали насыщенным водным раствором бикарбоната натрия и хлористоводородной кислотой (1 н.). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (0,142 г, 45%): т. пл. 173-176°C; 1H ЯМР (400 МГц, CDCl3) δ 8,49 (d, J=2,7 Гц, 1H), 8,21 (dd, J=8,8, 2,7 Гц, 1H), 7,59 (d, J=8,8 Гц, 1H), 6,26 (s, 1H), 3,02-2,89 (m, 1H), 0,98-0,90 (m, 2H), 0,72-0,64 (m, 2H); ESIMS масса/заряд 241 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 26 .
N-Циклопропил-5-нитро-2-(трифторметил)бензамид (C80)

Выделяли в виде белого твердого вещества (0,189 г, 31%): 1H ЯМР (400 МГц, CDCl3) δ 8,40-8,33 (m, 2H), 7,93-7,87 (m, 1H), 5,98 (s, 1H), 2,96-2,88 (m, 1H), 0,96-0,89 (m, 2H), 0,70-0,64 (m, 2H); EIMS масса/заряд 274 ([M]+).
Пример 27. Получение 2-хлор-N-(1-цианоциклопропил)-5-нитробензамида (C81)

К раствору гидрохлорида 1-аминоциклопропанкарбонитрила (0,353 г, 2,98 ммоль), диэтилизопропилэтиламина (0,520 мл, 2,98 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимида (0,713 г, 3,72 ммоль) в 1,2-дихлорэтане (9,92 мл) при комнатной температуре добавляли 2-хлор-5-нитробензойную кислоту (0,500 г, 2,48 ммоль) и 4-диметиламинопиридин (0,394 г, 3,22 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия с последующей обработкой хлористоводородной кислотой (1 н.). Органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (0,444 г, 64%): 1H ЯМР (400 МГц, DMSO-d6) δ 9,62 (s, 1H), 8,37 (d, J=2,7 Гц, 1H), 8,31 (dd, J=8,8, 2,8 Гц, 1H), 7,85 (d, J=8,8 Гц, 1H), 1,59 (dd, J=8,3, 5,4 Гц, 2H), 1,34 (dd, J=8,4, 5,5 Гц, 2H); IR (тонкая пленка) 3271, 3103, 2247, 1664 см-1; ESIMS масса/заряд 266 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 27 .
2-Хлор-N-(3,3-дифторциклобутил)-5-нитробензамид (C82)
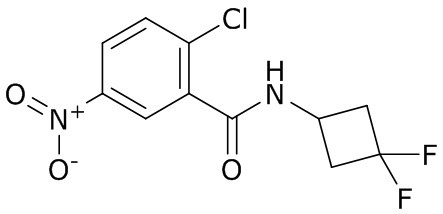
Выделяли в виде белой пены (0,103 г, 71%): 1H ЯМР (400 МГц, ацетон-d6) δ 8,36 (d, J=2,8 Гц, 1H), 8,30 (dd, J=8,8, 2,8 Гц, 1H), 8,26 (s, 1H), 7,79 (d, J=8,7 Гц, 1H), 4,41 (dd, J=15,0, 7,3 Гц, 1H), 3,16-2,97 (m, 2H), 2,88-2,77 (m, 2H); ESIMS масса/заряд 291 ([M+H]+).
Пример 28. Получение 2-хлор-N-(3,3-дифторциклобутил)-N-метил-5-нитробензамида (C83)
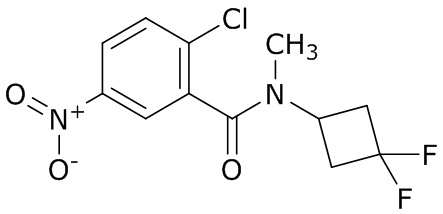
К раствору 2-хлор-N-(3,3-дифторциклобутил)-5-нитробензамида (C82) (0,490 г, 1,69 ммоль) в сухом N,N-диметилформамиде (8 мл), охлажденному на ледяной бане, добавляли гидрид натрия (0,0940 г, 2,36 ммоль). Взвесь перемешивали в течение 30 минут, а затем добавляли йодметан (0,264 мл, 4,21 ммоль). Реакционную смесь перемешивали в течение 3 часов. Реакционную смесь охлаждали в ледяной бане и гасили посредством медленного добавления воды. Реакционную смесь экстрагировали этилацетатом (30 мл). Органический слой промывали водой (2×20 мл) и солевым раствором (20 мл). Органический слой пропускали через фазоразделитель для высушивания и концентрировали с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (0,513 г, колич.): 1H ЯМР (400 МГц, CDCl3) δ ротамеры 8,29-8,13 (m, 2H), 7,66-7,58 (m, 1H), 5,00-4,85 (m, 0,5 H), 4,05-3,92 (m, 0,5 H), 3,16 (s, 1,5 H), 3,10-2,95 (m, 1H), 2,87 (s, 1,5 H) 2,95-2,66 (m, 2H); 19F ЯМР (376 МГц, CDCl3) δ ротамеры -84,01 (d, J=199,7 Гц), -84,85 (d, J=202,6 Гц), -99,36 (d, J=202,5 Гц), -99,67 (d, J=199,7 Гц); ESIMS масса/заряд 305 ([M+H]+).
Следующие молекулы в таблице 1 можно получать согласно процедурам, раскрытым выше.
Таблица P1. Структура и способ получения молекул-прототипов
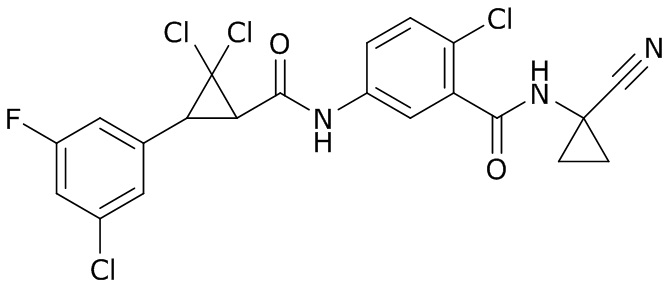
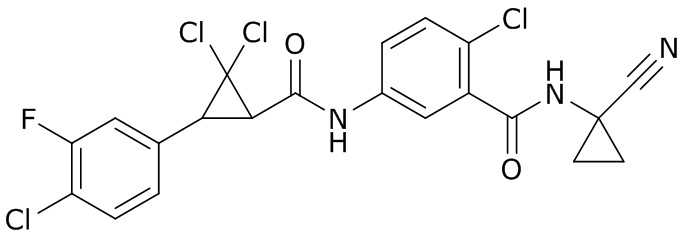

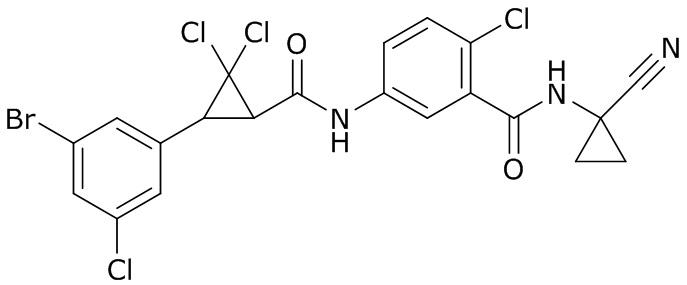
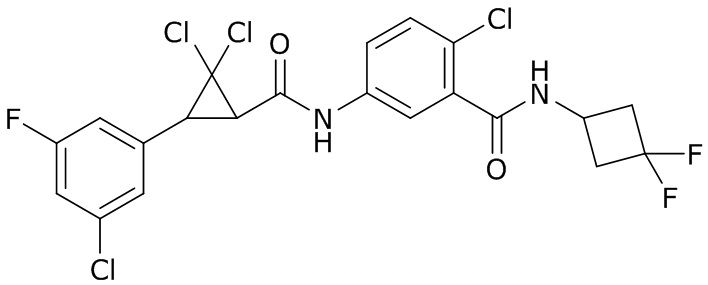


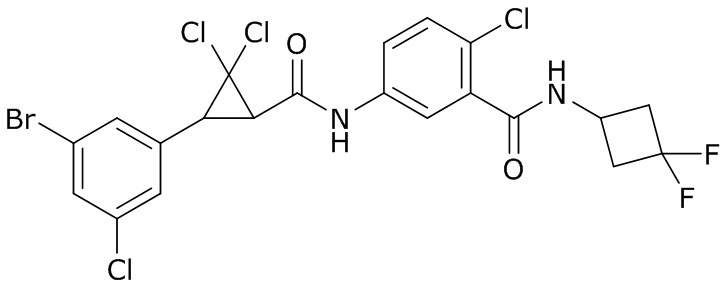
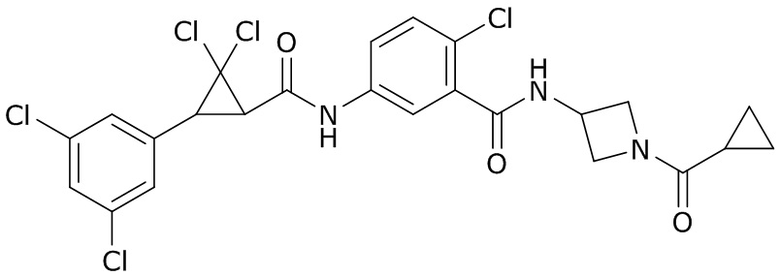

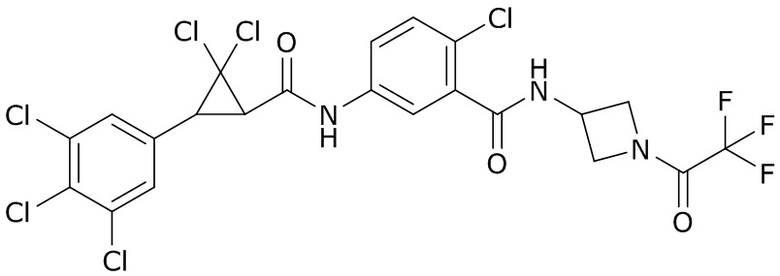




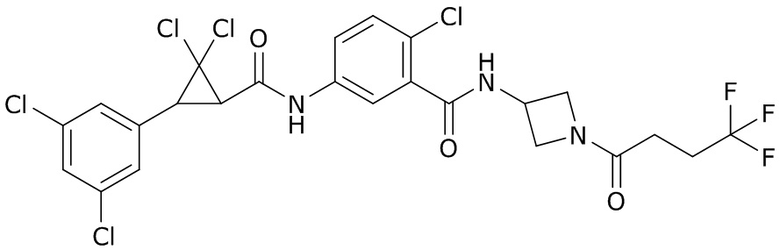
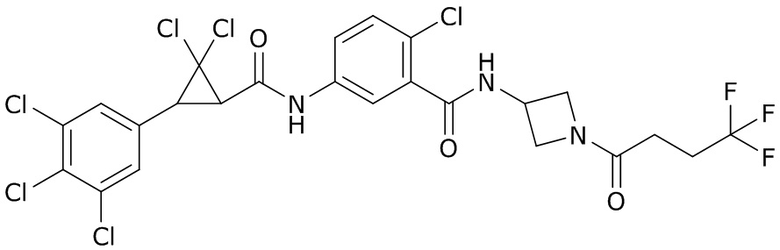

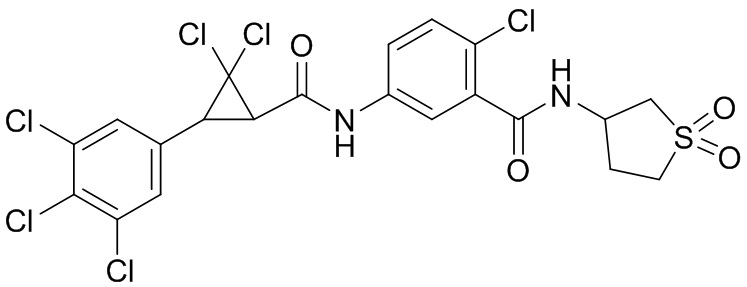
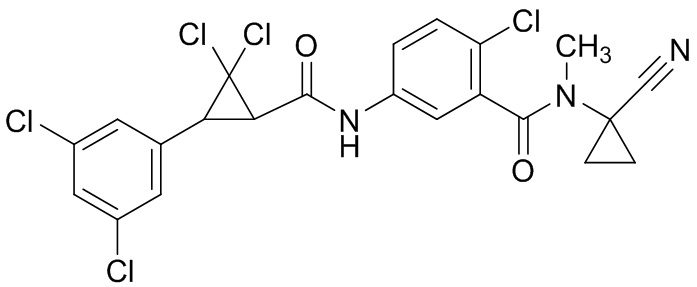
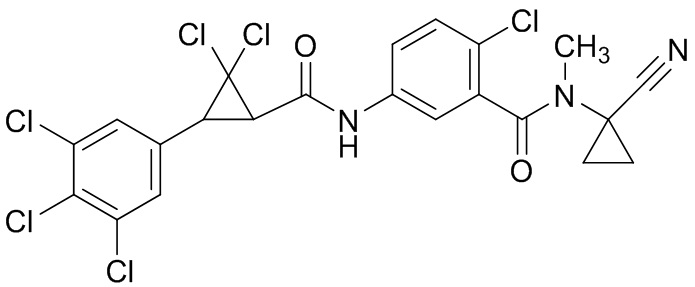

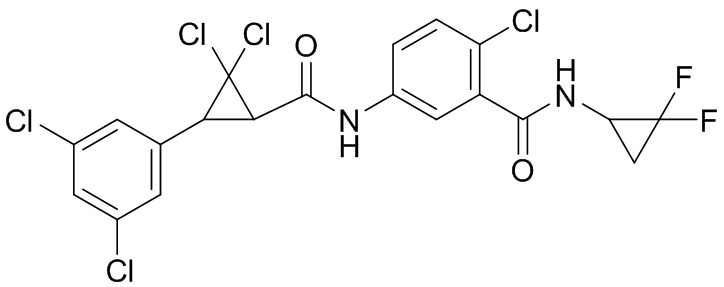
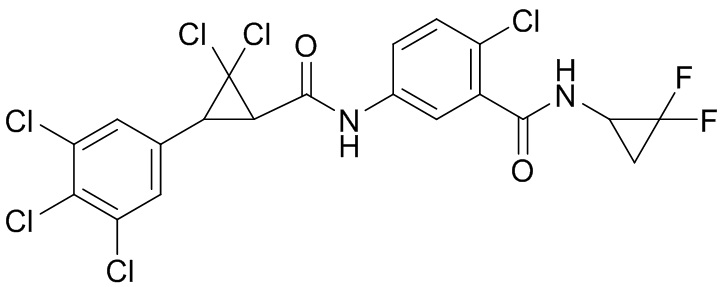

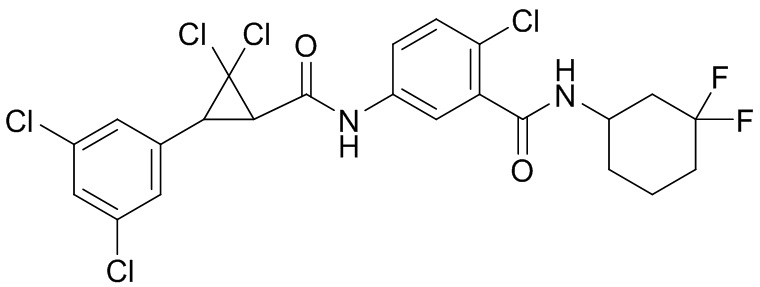
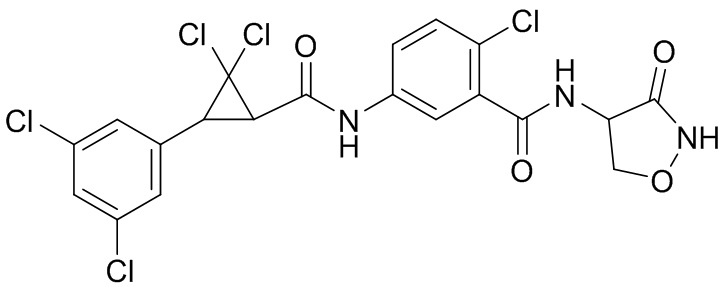
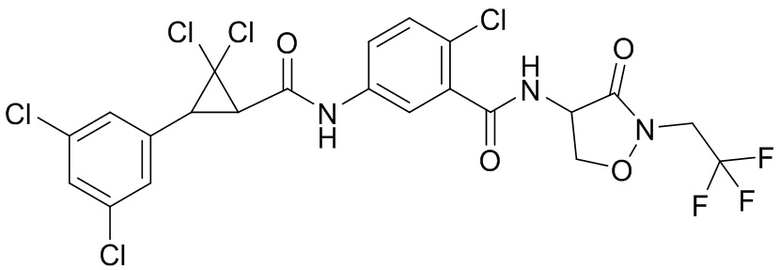

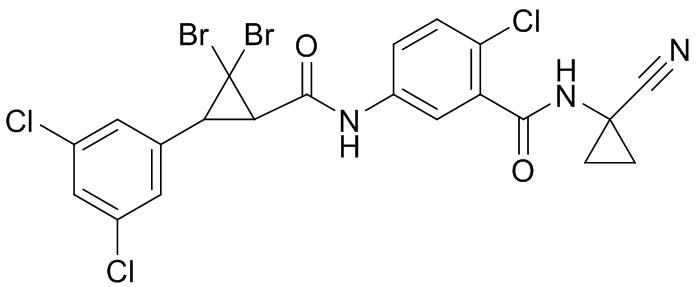
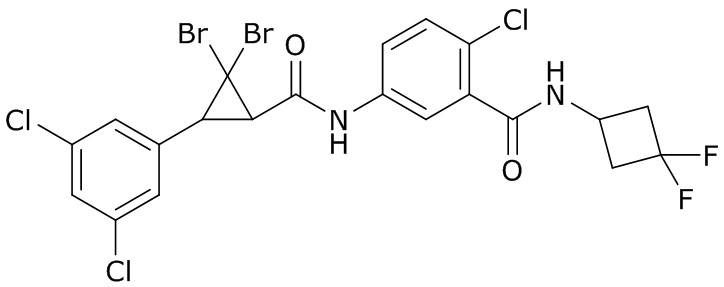
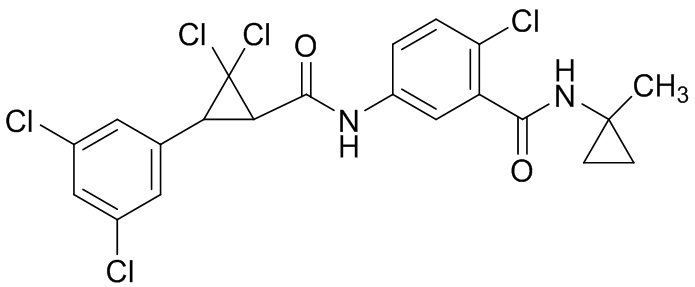
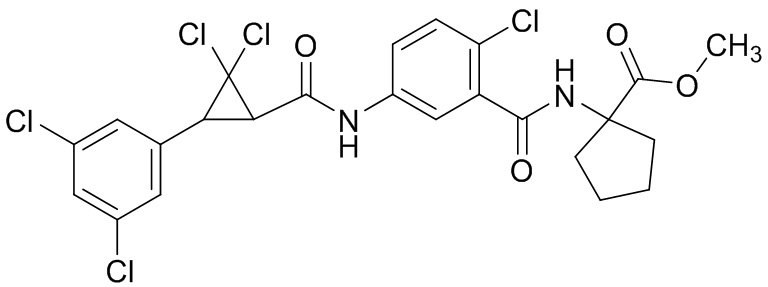
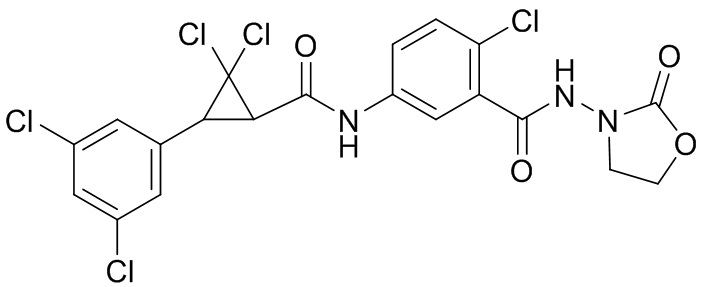

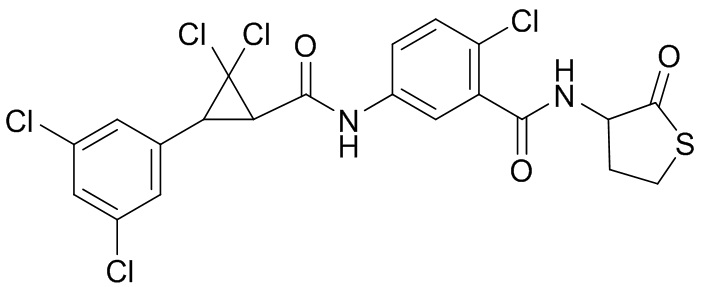

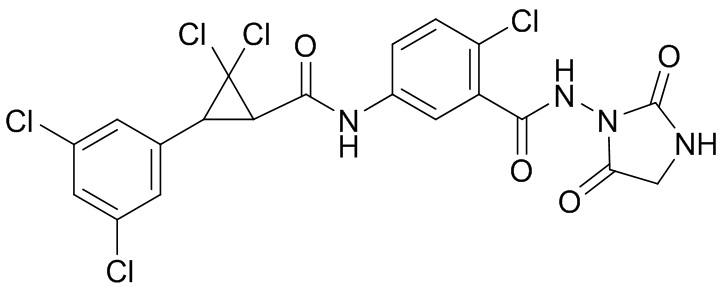

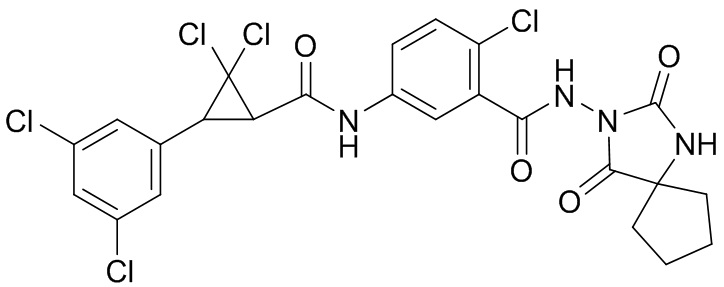


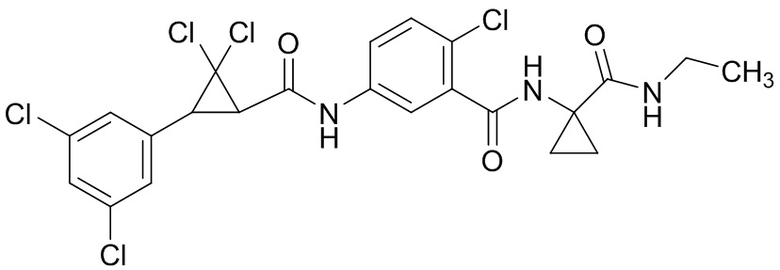
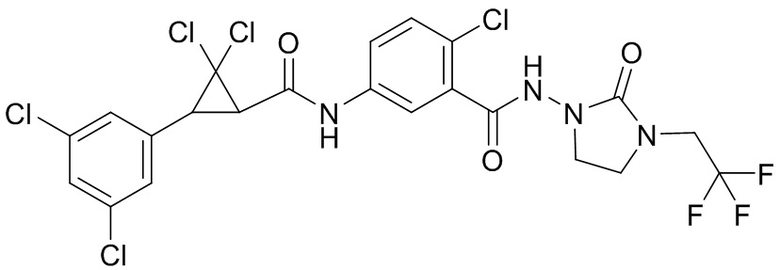
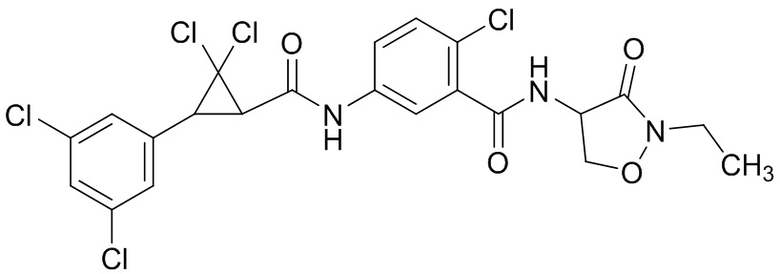
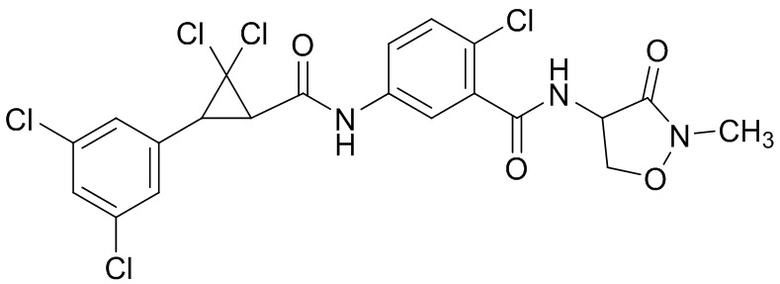

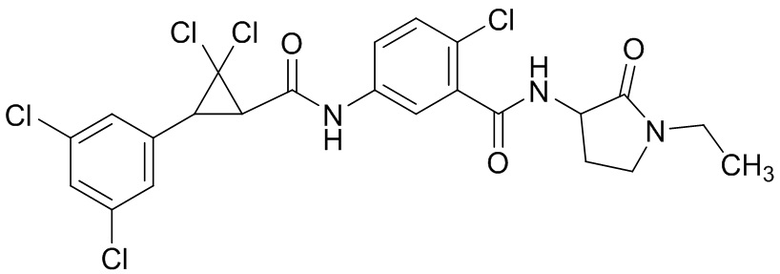
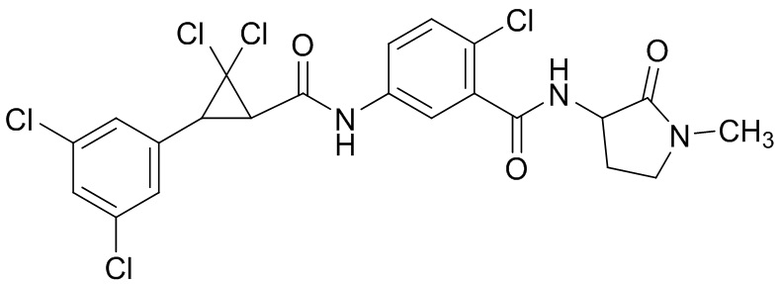
Получ.* означает получение согласно примеру или схеме
Следующие соединения получали аналогично процедуре, указанной в примере 2 .
Транс-3-(4-бром-3-хлорфенил)-2,2-дихлорциклопропан-1-карбоновая кислота
(C84)
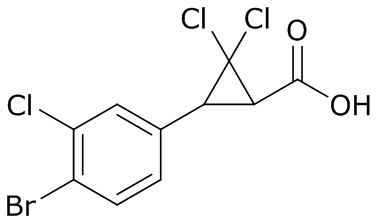
Выделяли в виде коричневого твердого вещества (0,186 г, 60%): 1H ЯМР (400 МГц, CDCl3) δ7,63 (d, J=8,3 Гц, 1H), 7,40-7,32 (m, 1H), 7,04 (ddd, J=8,3, 2,2, 0,7 Гц, 1H), 3,42 (d, J=8,3 Гц, 1H), 2,86 (d, J=8,3 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 171,39, 134,91, 133,89, 133,08, 130,54, 128,16, 122,61, 61,39, 39,70, 37,14; ESIMS масса/заряд 342,8
([M-H]-).
Транс-3-(4-бром-3,5-дифторфенил)-2,2-дихлорциклопропан-1-карбоновая кислота (C85)
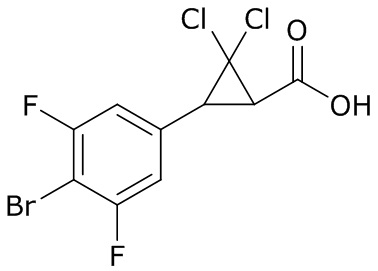
Выделяли в виде белого твердого вещества (2,13 г, 72%): т. пл. 178,3-188,6°C; 1H ЯМР (400 МГц, CDCl3) δ 6,90 (d, J=7,1 Гц, 2H), 3,43 (d, J=8,2 Гц, 1H), 2,86 (d, J=8,2 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -103,87; ESIMS масса/заряд 344,7 ([M-H]-).
Транс-3-(4-бром-3-фтор-5-метоксифенил)-2,2-дихлорциклопропан-1-карбоновая кислота (C86)
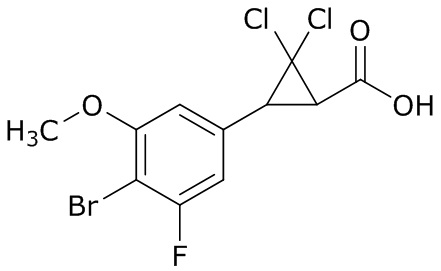
Выделяли в виде маслянистого твердого вещества (0,43 г, 37%): 1H ЯМР (400 МГц, CDCl3) δ 6,70-6,64 (m, 1H), 6,61 (d, J=1,6 Гц, 1H), 3,95 (s, 3H), 3,44 (d, J=8,3 Гц, 1H), 2,86 (d, J=8,3 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -104,22; ESIMS масса/заряд 356,7 ([M-H]-).
Транс-3-(3-бром-5-фтор-4-метоксифенил)-2,2-дихлорциклопропан-1-карбоновая кислота (C87)
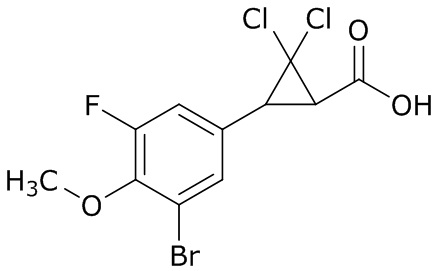
Выделяли в виде коричневого масла (0,24 г, 65%): 1H ЯМР (400 МГц, CDCl3) δ 7,24 (d, J=7,9 Гц, 1H), 6,87 (d, J=11,3 Гц, 1H), 3,91 (d, J=3,8 Гц, 3H), 3,44 (d, J=8,3 Гц, 1H), 2,80 (d, J=8,3 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -135,11; ESIMS масса/заряд 356,7 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-5-(дифторметил)фенил)циклопропан-1-карбоновая кислота (C88)
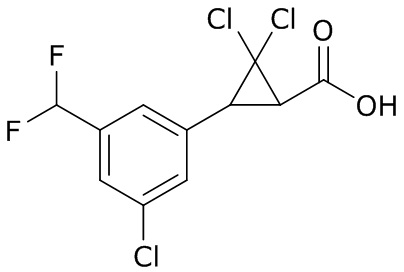
Выделяли в виде грязно-белого твердого вещества (2,6 г, 63%): 1H ЯМР (300 МГц, CDCl3) сигнал COOH отсутствует δ 7,49 (s, 1H), 7,38 (s, 1H), 7,30 (s, 1H), 6,63 (t, J=56,0 Гц, 1H), 3,50 (d, J=8,4 Гц, 1H), 2,91 (d, J=8,0 Гц, 1H); 19F ЯМР (282 МГц, CDCl3) δ 112,04; ESIMS масса/заряд 313 ([M-H]-).
Транс-2,2-дихлор-3-(4-хлор-3-(дифторметил)фенил)циклопропанкарбоновая кислота (C89)
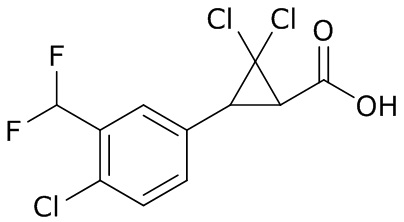
Выделяли в виде грязно-белого твердого вещества (6,2 г, 69%): 1H ЯМР (400 МГц, CDCl3) δ 10,5 (br s, 1H), 7,55 (s, 1H), 7,46 (d, J=8,0 Гц, 1H), 7,34 (d, J=8,4 Гц, 1H), 6,95 (t, J=54,8 Гц, 1H), 3,50 (d, J=8,4 Гц, 1H), 2,91 (d, J=8,4 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ 115,52; ESIMS масса/заряд 313 ([M-H]-).
Транс-2,2-дихлор-3-(3-(дифторметил)-5-фторфенил)циклопропанкарбоновая кислота (C90)
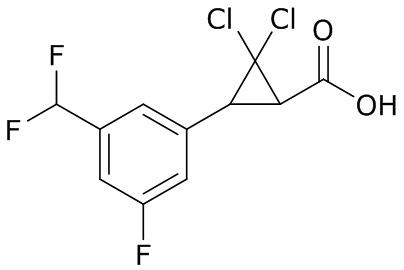
Выделяли в виде грязно-белого твердого вещества (5,00 г, 38%): 1H ЯМР (400 МГц, CDCl3) сигнал COOH отсутствует δ 7,23-7,21 (m, 2H), 7,11 (d, J=8,8 Гц, 1H), 6,64 (t, J=55,6 Гц, 1H), 3,51 (d,J=8,4 Гц, 1H), 2,91 (d, J=8,0 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ 110,37; ESIMS масса/заряд 297,19 ([M-H]-).
Транс-2,2-дихлор-3-(3-(дифторметил)-4-фторфенил)циклопропанкарбоновая кислота (C91)
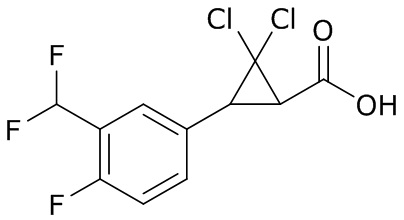
Выделяли в виде грязно-белого твердого вещества (6,0 г, 77%): 1H ЯМР (400 МГц, CDCl3) сигнал COOH отсутствует δ 7,49 (d, J=6,0 Гц, 1H), 7,40 (br s, 1H), 7,17 (t, J=9,2 Гц, 1H), 6,90 (t, J=54,8 Гц, 1H), 3,49 (d, J=8,0 Гц, 1H), 2,89 (d, J=8,4 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ 114,47, 119,69; ESIMS масса/заряд 297 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-4-(дифторметил)фенил)циклопропанкарбоновая кислота (C92)
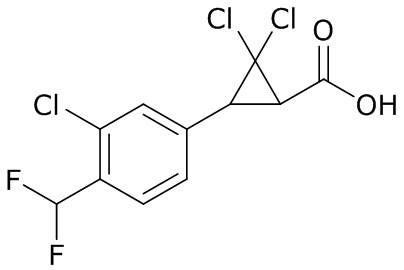
Выделяли в виде грязно-белого твердого вещества (3,5 г, 42%): 1H ЯМР (400 МГц, CDCl3) сигнал COOH отсутствует δ 7,68 (d, J=7,6 Гц, 1H), 7,35 (s, 1H), 7,29 (d, J=8,4 Гц, 1H), 6,94 (t, J=54,8 Гц, 1H), 3,48 (d, J=8,4 Гц, 1H), 2,91 (d, J=8,4 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ 115,46; ESIMS масса/заряд 313 ([M-H]-).
Транс-2,2-дихлор-3-(4-(дифторметил)-3-фторфенил)циклопропанкарбоновая кислота (C93)
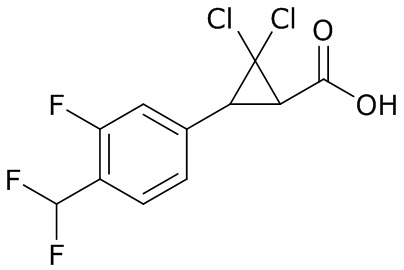
Выделяли в виде грязно-белого твердого вещества (4,4 г, 77%): 1H ЯМР (400 МГц, CDCl3) δ 7,62 (t, J=7,6 Гц, 1H), 7,18 (d, J=7,6 Гц, 1H), 7,06 (d, J=10,0 Гц, 1H), 6,89 (t, J=54,8 Гц, 1H), 3,50 (d, J=8,4 Гц, 1H), 2,90 (d, J=8,4 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ 114,42, 118,63; ESIMS масса/заряд 297,15 ([M-H]-).
Транс-2,2-дихлор-3-(3-(дифторметил)фенил)циклопропанкарбоновая кислота (C94)

Выделяли в виде грязно-белого твердого вещества (6,2 г, 53%): 1H ЯМР (300 МГц, CDCl3) δ 7,49 (br s, 2H), 7,41 (br s, 2H), 6,66 (t, J=56,0 Гц, 1H), 3,53 (d, J=8,4 Гц, 1H), 2,92 (d, J=8,0 Гц, 1H); 19F ЯМР (282 МГц, CDCl3) δ 111,20; ESIMS масса/заряд 279,20 ([M-H]-).
Транс-2,2-дихлор-3-(4-(дифторметил)фенил)циклопропанкарбоновая кислота (C95)

Выделяли в виде грязно-белого твердого вещества (7,00 г, 61%): 1H ЯМР (300 МГц, CDCl3) δ 7,53 (d, J=8,0 Гц, 2H), 7,37 (d, J=8,0 Гц, 2H), 6,66 (t, J=56,4 Гц, 1H), 3,52 (d, J=8,4 Гц, 1H), 2,92 (d, J=8,0 Гц, 1H); 19F ЯМР (282 МГц, CDCl3) δ 112,20; ESIMS масса/заряд 279,30 ([M-H]-).
Следующие соединения получали аналогично процедуре, указанной в примере 4 .
Транс-1-хлор-3-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-5-(дифторметил)бензол (C96)

Выделяли в виде желтой жидкости (11,5 г, 69%): 1H ЯМР (300 МГц, CDCl3): δ 7,47 (s, 2H), 7,39 (s, 1H), 7,28 (d, J=8,7 Гц, 2H), 6,93 (d, J=8,7 Гц, 2H), 6,64 (t, J=56,1 Гц, 1H), 3,83 (s, 3H), 3,16 (q, J=8,7 Гц, 2H).
Транс-1-хлор-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-2-(дифторметил)бензол (C97)
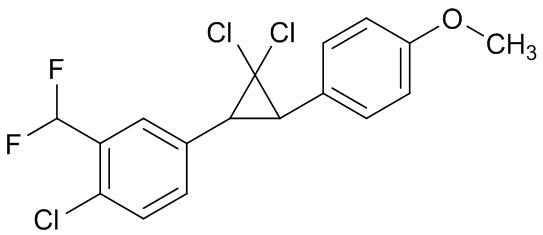
Выделяли в виде бледно-желтого твердого вещества (10,7 г, 83%): 1H ЯМР (400 МГц, CDCl3) δ 7,65 (s, 1H), 7,46-7,41 (m, 2H), 7,28 (d, J=8,4 Гц, 2H), 7,10-6,83 (m, 3H), 3,83 (s, 3H), 3,18-3,13 (m, 2H).
Транс-1-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-3-(дифторметил)-5-фторбензол (C98)

Выделяли в виде грязно-белого твердого вещества (16,5 г, 64%): 1H ЯМР (400 МГц, CDCl3) δ 7,29 (d, J=8,8 Гц, 2H), 7,20 (d, J=8,8 Гц, 2H), 6,93 (d, J=8,8 Гц, 2H), 6,65 (t, J=56,0 Гц, 2H), 3,83 (s, 3H), 3,16 (s, 2H).
Транс-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-2-(дифторметил)-1-фторбензол (C99)
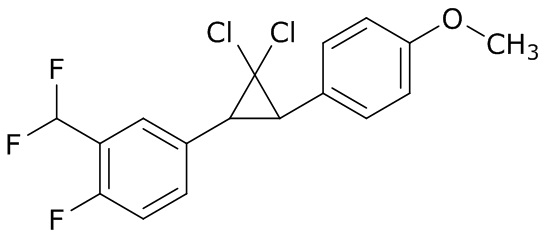
Выделяли в виде грязно-белого твердого вещества (10,0 г, 55%): ESIMS масса/заряд 374 ([M+H]+).
Транс-2-хлор-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-1-(дифторметил)бензол (C100)
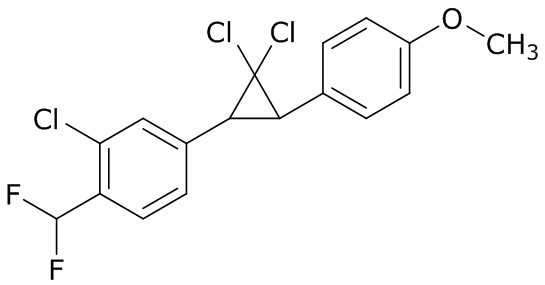
Выделяли в виде грязно-белого твердого вещества (10,0 г, 34%): 1H ЯМР (400 МГц, CDCl3) δ 7,68 (d, J=8,0 Гц, 1H), 7,43 (s, 1H), 7,38 (d, J=8,4 Гц, 1H), 7,28-7,25 (m, 2H), 7,09-6,92 (m, 3H), 3,83 (s, 3H), 3,15 (q, J=12,0 Гц, 2H); ESIMS масса/заряд 376 ([M+H]+).
Транс-2-фтор-4-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-1-(дифторметил)бензол (C101)
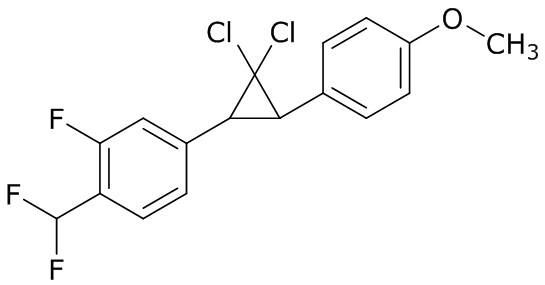
Выделяли в виде бледно-желтой жидкости (6,9 г, 58%): 1H ЯМР (400 МГц, CDCl3) δ 7,31 (t, J=7,6 Гц, 1H), 7,27 (d, J=9,2 Гц, 2H), 7,14 (d, J=10,8 Гц, 1H), 7,04-6,76 (m, 4H), 3,83 (s, 3H), 3,16 (t, J=8,8 Гц, 2H); 19F ЯМР (376 МГц, CDCl3) δ -114,14,
-114,32, -119,30.
Транс-1-(2,2-дихлор-3-(4-метоксифенил)циклопропил)-3-(дифторметил)бензол (C102)

Выделяли в виде бледно-желтого твердого вещества (6,3 г, 95%): 1H ЯМР (400 МГц, CDCl3) δ 7,50 (br s, 4H), 7,29 (d, J=8,8 Гц, 2H), 6,93 (d, J=8,0 Гц, 2H), 6,67 (t, 1H), 3,83 (s, 3H), 3,19 (s, 2H); 19F ЯМР (376 МГц, CDCl3) δ -110,87, -111,02.
Транс-1-(2,2-дихлор-3-(4-(дифторметил)фенил)циклопропил)-4-метоксибензол (C103)
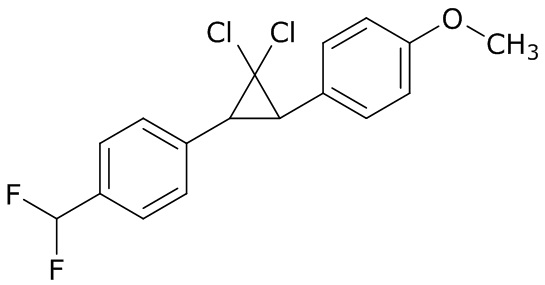
Выделяли в виде белого твердого вещества (14 г, 69%): 1H ЯМР (400 МГц, CDCl3) δ 7,54 (d, J=8,0 Гц, 2H), 7,46 (d, J=8,0 Гц, 2H), 7,28 (t, J=8,4 Гц, 2H), 6,93 (d, J=8,0 Гц, 2H), 6,67 (t, J=56,8 Гц, 1H), 3,83 (s, 3H), 3,18 (s, 2H).
Следующие соединения получали аналогично процедуре, указанной в примере 13 .
Транс-5-(3-(4-бром-3-хлорфенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамид (F66)

Выделяли в виде грязно-белого твердого вещества (0,209 г, 49%).
Транс-2-хлор-5-(2,2-дихлор-3-(4-нитрофенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F69)
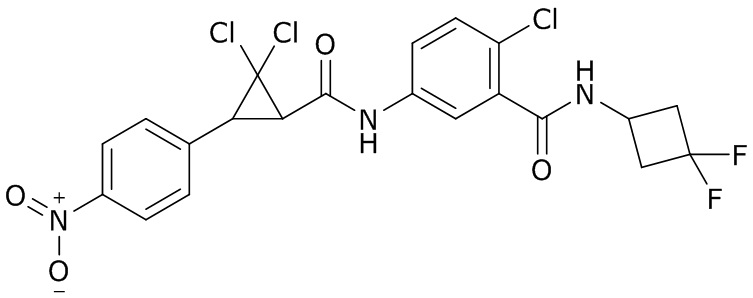
Выделяли в виде желтой пены (0,095 г, 36%).
Транс-5-(2-бром-2-хлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-2-хлор-N-(3,3-дифторциклобутил)бензамид (F71)
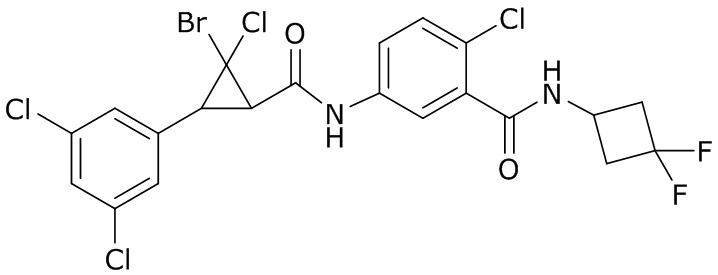
Выделяли в виде белого твердого вещества (0,099 г, 57%).
Транс-5-(2-бром-2-хлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамид (F72)
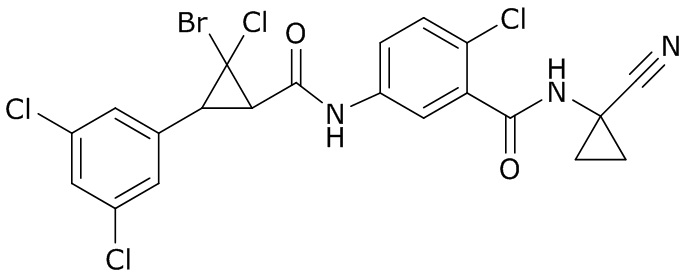
Выделяли в виде белой пены (85 мг, 51%).
Транс-2-хлор-5-(2,2-дихлор-3-(3-хлор-5-цианофенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F77)
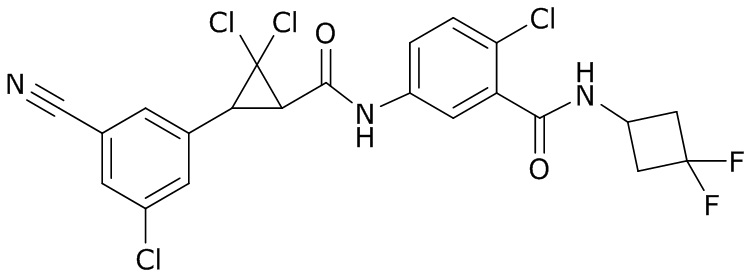
Выделяли в виде белого твердого вещества (0,090 г, 48%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-5-цианофенил)циклопропан-1-карбоксамидо)бензамид (F78)

Выделяли в виде белого твердого вещества (0,097 г, 54%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропан-1-карбоксамидо)-N-((R)-3-оксо-2-(2,2,2-трифторэтил)изоксазолидин-4-ил)бензамид (F79)
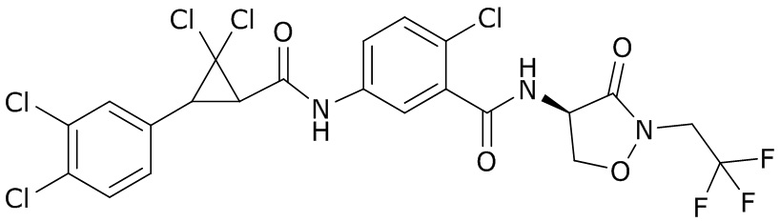
Выделяли в виде светло-желтого твердого вещества (0,039 г, 25%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоксамидо)-N-((R)-3-оксо-2-(2,2,2-трифторэтил)изоксазолидин-4-ил)бензамид (F80)
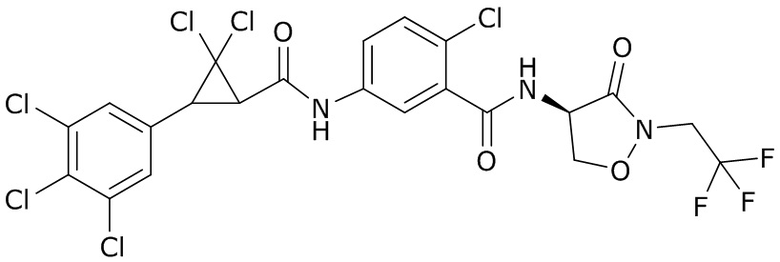
Выделяли в виде светло-желтого твердого вещества (0,049 г, 33%).
Транс-5-(3-(4-бром-3,5-дифторфенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамид (F82)

Выделяли в виде желтой пены (0,078 г, 57%).
Транс-5-(3-(4-бром-3-фтор-5-метоксифенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамид (F83)

Выделяли в виде желтой пены (0,042 г, 31%).
Транс-5-(3-(3-бром-5-фтор-4-метоксифенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамид (F84)
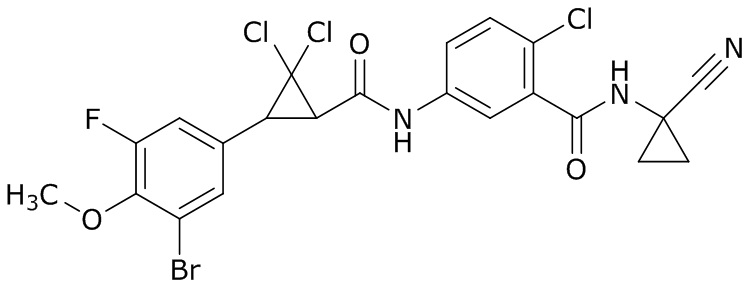
Выделяли в виде желтой пены (0,025 г, 18%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-5-фторфенил)циклопропан-1-карбоксамидо)бензамид (PF1)
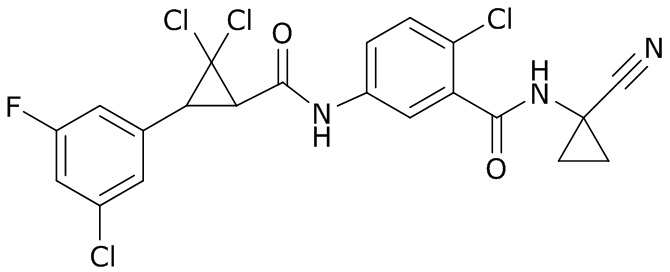
Выделяли в виде белой пены (0,044 г, 31%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(4-хлор-3-фторфенил)циклопропан-1-карбоксамидо)бензамид (PF2)
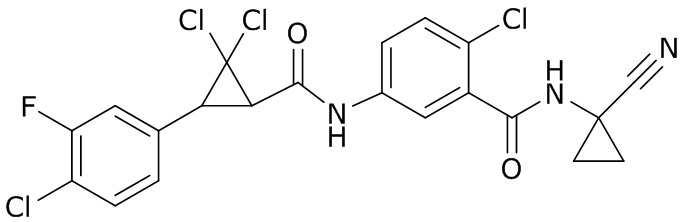
Выделяли в виде бесцветного масла (0,028 г, 21%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-4-фторфенил)циклопропан-1-карбоксамидо)бензамид (PF3)
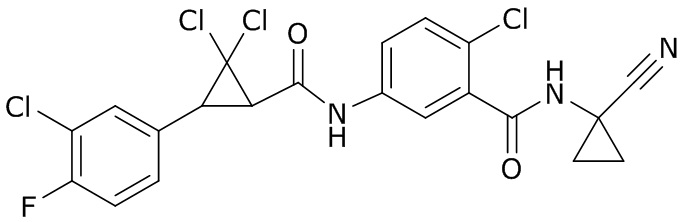
Выделяли в виде белой пены (0,046 г, 33%).
Транс-5-(3-(3-бром-5-хлорфенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамид (PF4)
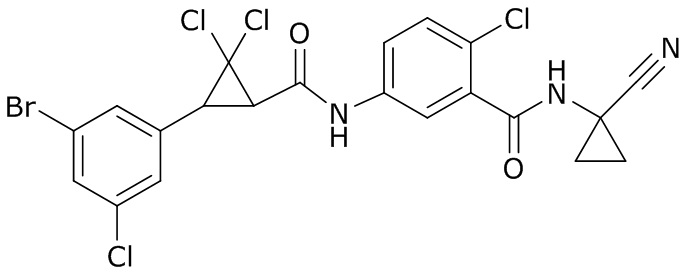
Выделяли в виде белой пены (0,008 г, 8%).
Транс-2-хлор-5-(2,2-дихлор-3-(3-хлор-5-фторфенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (PF5)

Выделяли в виде белой пены (0,066 г, 45%).
Транс-2-хлор-5-(2,2-дихлор-3-(4-хлор-3-фторфенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (PF6)
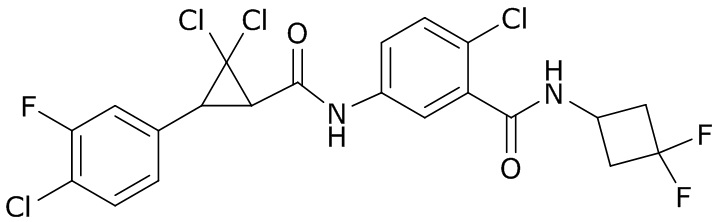
Выделяли в виде светло-желтого масла (0,102 г, 74%).
Транс-2-хлор-5-(2,2-дихлор-3-(3-хлор-4-фторфенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (PF7)
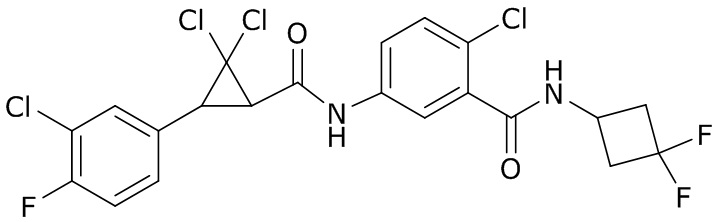
Выделяли в виде белой пены (0,066 г, 45%).
Транс-5-(3-(3-бром-5-хлорфенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(3,3-дифторциклобутил)бензамид (PF8)

Выделяли в виде белой пены (0,044 г, 43%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоксамидо)-N-(1,1-диоксидотетрагидротиофен-3-ил)бензамид (PF19)

Выделяли в виде белого порошка (0,120 г, 63%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-метилбензамид (PF20)

Выделяли в виде желтой пены (0,047 г, 33%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоксамидо)-N-метилбензамид (PF21)

Выделяли в виде желтой пены (0,072 г, 47%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3,4-дихлорфенил)циклопропан-1-карбоксамидо)-N-метилбензамид (PF22)
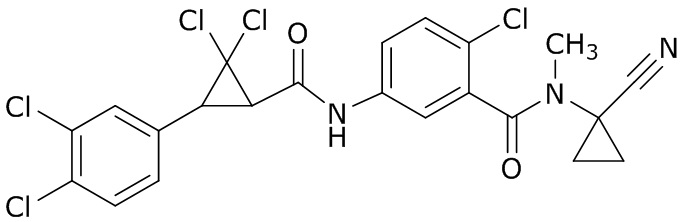
Выделяли в виде желтой пены (0,068 г, 47%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(2,2-дифторциклопропил)бензамид (PF23)

Выделяли в виде белой пены (0,022 г, 38%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-((R)-3-оксо-2-(2,2,2-трифторэтил)изоксазолидин-4-ил)бензамид (PF28)

Выделяли в виде светло-желтого твердого вещества (0,042 г, 27%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дибром-3-(3,5-дихлорфенил)-циклопропан-1-карбоксамидо)бензамид (PF30)
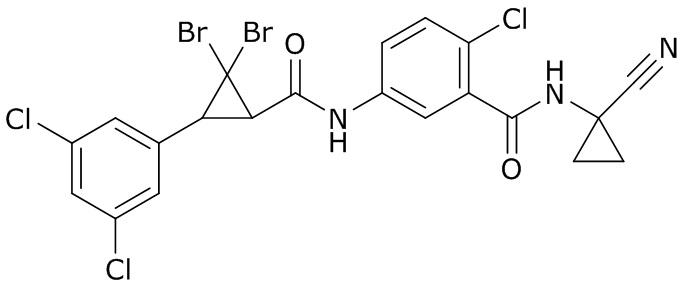
Выделяли в виде бледно-оранжевой пены (0,095 г, 67%).
Транс-2-хлор-5-(2,2-дибром-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (PF31)
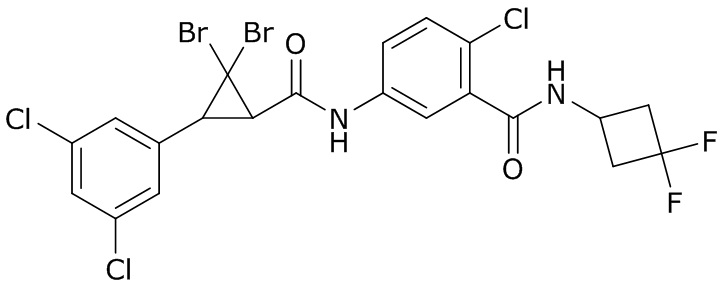
Выделяли в виде бледно-желтого стеклообразного вещества (0,028 г, 27%)
Следующие соединения получали аналогично процедуре, указанной в примере 14 .
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(4-оксоциклогексил)бензамид (F65)
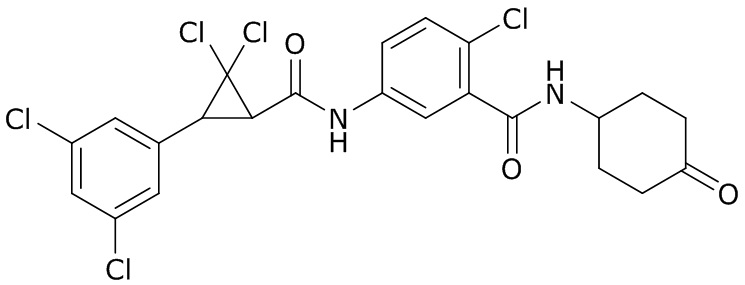
Выделяли в виде белого порошка (0,116 г, 38%).
Следующие соединения получали аналогично процедуре, указанной в примере 15 .
2-Хлор-5-((1R,3R)-2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F73)
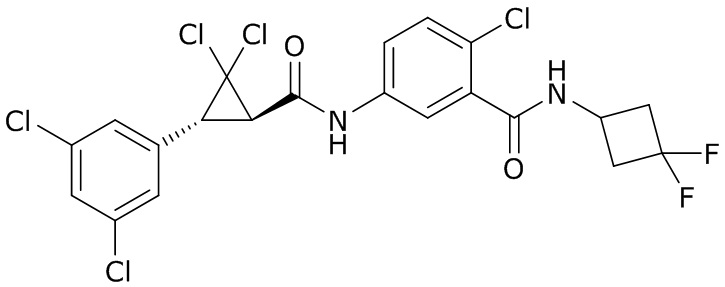
Выделяли в виде белой пены (0,051 г, 29%).
2-Хлор-5-((1S,3S)-2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F74)

Выделяли в виде белой пены (0,065 г, 37%).
2-Хлор-N-(1-цианоциклопропил)-5-((1R,3R)-2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)бензамид (F75)

Выделяли в виде золотистого масла (0,025 г, 15%).
2-Хлор-N-(1-цианоциклопропил)-5-((1S,3S)-2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамид (F76)

Выделяли в виде золотистого масла (0,030 г, 18%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(2-оксопирролидин-3-ил)бензамид (PF29)

Выделяли в виде белого твердого вещества (0,102 г, 90%).
Следующие соединения получали аналогично процедуре, указанной в примере 21 .
5-Амино-2-хлор-N-(1-цианоциклопропил)-N-метилбензамид (C104)
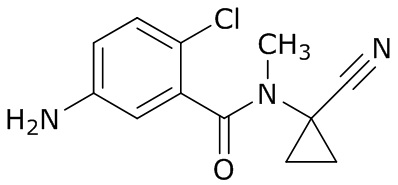
Выделяли в виде желтого масла (0,235 г, 100%): 1H ЯМР (400 МГц, CDCl3) δ 7,24-7,04 (m, 1H), 6,94-6,49 (m, 2H), 3,82 (s, 2H), 2,93 (s, 3H), 2,14 (s, 2H), 1,45 (s, 2H); IR (тонкая пленка) 3360, 2236, 1654, 1477, 1374 см-1; ESIMS масса/заряд 250 ([M+H]+).
5-Амино-2-хлор-N-(2,2-дифторциклопропил)бензамид (C105)

Выделяли в виде желтого твердого вещества (0,027 г, 56%): 1H ЯМР (300 МГц, CD3OD) δ 7,13-7,08 (m, 1H), 6,73-6,68 (m, 2H), 3,43 (tdd, J=10,2, 6,1, 1,8 Гц, 1H), 1,87 (dddd, J=13,3, 10,3, 8,9, 6,4 Гц, 1H), 1,52 (dddd, J=14,5, 8,9, 6,2, 4,7 Гц, 1H); IR (тонкая пленка) 3300, 1646, 1473 см-1; ESIMS масса/заряд 247 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 24 .
(R)-5-Амино-2-хлор-N-(3-оксо-2-(2,2,2-трифторэтил)изоксазолидин-4-ил)бензамид (C106)
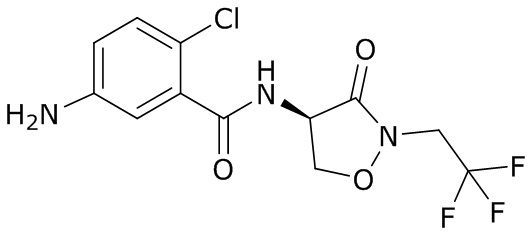
Выделяли в виде желтого масла (0,320 г, 75%): 1H ЯМР (400 МГц, DMSO-d6) δ 8,94 (d, J=8,2 Гц, 1H), 7,08 (d, J=8,4 Гц, 1H), 6,68-6,53 (m, 2H), 5,46 (s, 2H), 5,09-4,95 (m, 1H), 4,65 (t, J=8,6 Гц, 1H), 4,46-4,25 (m, 2H), 4,19-4,06 (m, 1H); 19F ЯМР (376 МГц, DMSO-d6) δ -69,11; ESIMS масса/заряд 338 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 25 .
5-Амино-2-хлор-N-(1,1-диоксидотетрагидротиофен-3-ил)бензамид (C107)
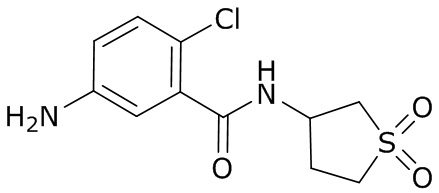
Выделяли в виде розового порошка (0,093 г, 36%): т. пл. 160-163°C; 1H ЯМР (400 МГц, DMSO-d6) δ 8,76 (d, J=7 Гц, 1H), 7,07 (d, J=8 Гц, 1H), 6,63-6,55 (m, 2H), 5,42 (br s, 2H), 4,60 (m, 1H), 3,49 (dd, J=13,5, 7,8 Гц, 1H), 3,31 (m, 1H), 3,18 (m, 1H), 2,97 (dd, J=13, 7,2 Гц, 1H), 2,41 (m, 1H), 2,12 (m, 1H); IR (тонкая пленка) 3458 (w), 3370 (w), 3257 (w), 1646 (m), 1535 (m), 1479 (w) см-1; ESIMS масса/заряд 289 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 26 .
(R)-2-хлор-5-нитро-N-(3-оксо-2-(2,2,2-трифторэтил)изоксазолидин-4-ил)бензамид (C108)
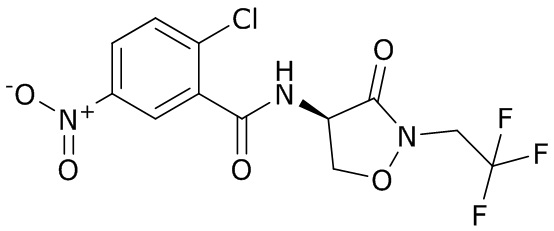
Выделяли в виде оранжевой пены (0,355 г, 70%): 1H ЯМР (300 МГц, DMSO-d6) δ 9,44 (d, J=7,7 Гц, 1H), 8,35-8,29 (m, 2H), 7,92-7,81 (m, 1H), 5,15-5,02 (m, 1H), 4,72 (t, J=8,6 Гц, 1H), 4,48-4,35 (m, 2H), 4,22 (t, J=8,6 Гц, 1H); 19F ЯМР (376 МГц, DMSO-d6) δ -69,11; ESIMS масса/заряд 368 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 28 .
2-Хлор-N-(1-цианоциклопропил)-N-метил-5-нитробензамид (C109)

Выделяли в виде белого твердого вещества (0,280 г, 87%): 1H ЯМР (400 МГц, DMSO-d6) δ 8,40 (d, J=2,8 Гц, 1H), 8,30 (dd, J=8,8, 2,8 Гц, 1H), 7,87 (d, J=8,8 Гц, 1H), 2,84 (s, 3H), 1,73-1,38 (m, 4H); ESIMS масса/заряд 280 ([M+H]+).
Пример 29. Получение транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-4-винилфенил)циклопропан-1-карбоксамидо)бензамида (F67)

Раствор транс-5-(3-(4-бром-3-хлорфенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(1-цианоциклопропил)бензамида (F66) (0,1 г, 0,178 ммоль), дихлорбис(трифенилфосфин)палладия(II) (0,025 г, 0,036 ммоль) и трибутил(винил)станнана (0,156 мл, 0,169 ммоль) в 1,4-диоксане (1 мл) герметизировали в атмосфере азота и нагревали до 90°C в течение 1 часа с помощью микроволнового излучения. Реакционную смесь разбавляли этилацетатом, затем фильтровали через 15 г смеси 10:1 силикагель:карбонат калия, промывали этилацетатом. Раствор концентрировали и полученный неочищенный материал загружали в предварительно загруженный картридж, содержащий 5 г смеси 5:1 силикагель:фторид калия. Очистка колоночной флэш-хроматографией с применением 0-35% этилацетата в гексанах в качестве элюента обеспечивала получение указанного в заголовке соединения в виде бледно-желтой пены (0,091 г, 61%).
Пример 30. Получение транс-5-(3-(4-аминофенил)-2,2-дихлорциклопропан-1-карбоксамидо)-2-хлор-N-(3,3-дифторциклобутил)бензамида (F70)
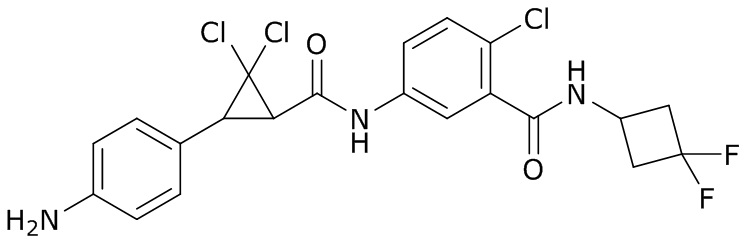
К взвеси транс-2-хлор-5-(2,2-дихлор-3-(4-нитрофенил)циклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамида (F69) (60 мг, 0,116 ммоль) в метаноле (1,0 мл) и воде (0,36 мл) добавляли порошкообразное железо (32,3 мг, 0,578 ммоль) и хлорид аммония (19 мг, 0,347 ммоль). Взвесь перемешивали при 55°C в течение 3 часов. Реакционную смесь фильтровали через подушку из Celite®, промывали этилацетатом и фильтрат концентрировали. Очистка колоночной флэш-хроматографией с применением 0-100% этилацетат/гексаны в качестве элюента обеспечивала получение указанного в заголовке соединения в виде оранжевой пены (0,049 г, 82%).
Пример 31. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлор-фенил)-3-метилциклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамида (F61)

К раствору 5-амино-2-хлор-N-(3,3-дифторциклобутил)бензамида (C71) (0,0623 г, 0,239 ммоль) и транс-2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропанкарбоновой кислоты (C2) (0,075 г, 0,239 ммоль) в этилацетате (3 мл) добавляли пиридин (0,058 мл, 0,717 ммоль) с последующим добавлением 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфоринан-2,4,6-триоксида (T3P®, 50% раствор в этилацетате, 304 мг, 0,478 ммоль) и полученный бледно-желтый раствор перемешивали при комнатной температуре в течение примерно 14 часов. Раствор концентрировали в потоке азота и очищали колоночной флэш-хроматографией на силикагеле с подвижной фазой гексаны/этилацетат. Чистые фракции объединяли и концентрировали под вакуумом в роторном испарителе с получением указанного в заголовке соединения в виде белой пены (0,080 г, 59%).
Следующие соединения получали аналогично процедуре, указанной в примере 31 .
Цис-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропан-1-карбоксамидо)-N-(3,3-дифторциклобутил)бензамид (F62)
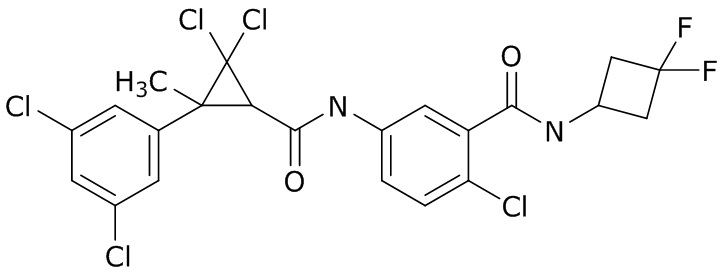
Выделяли в виде белого твердого вещества (0,030 г, 38%).
2-Хлор-N-(1-цианоциклопропил)-5-((1R,3R)-2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоксамидо)бензамид (F63)
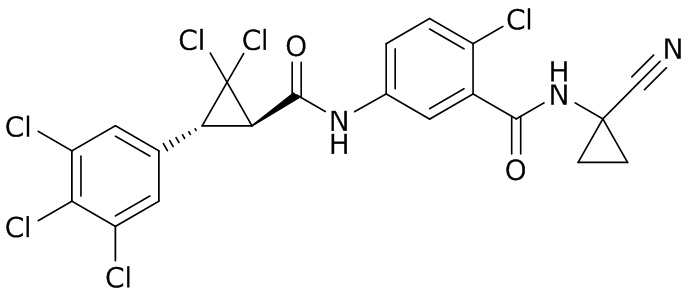
Выделяли в виде белой пены (0,083 г, 64%).
2-Хлор-N-(1-цианоциклопропил)-5-((1S,3S)-2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоксамидо)бензамид (F64)
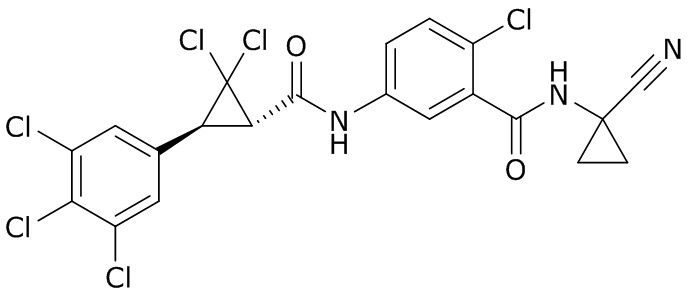
Выделяли в виде белой пены (0,082 г, 63%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-5-(дифторметил)фенил)циклопропан-1-карбоксамидо)бензамид (F85)
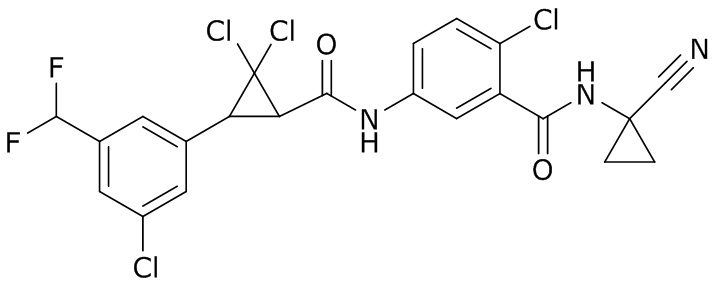
Выделяли в виде бесцветного масла (0,080 г, 72%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(4-хлор-3-(дифторметил)фенил)циклопропан-1-карбоксамидо)бензамид (F86)
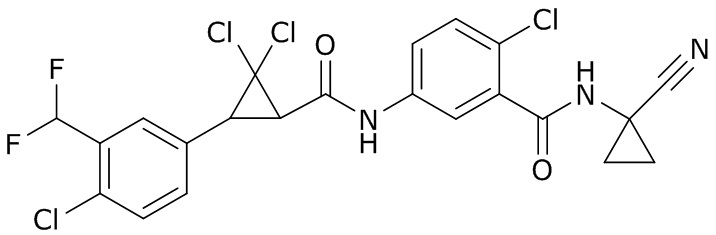
Выделяли в виде бесцветного масла (0,069 г, 62%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-(дифторметил)-5-фторфенил)циклопропан-1-карбоксамидо)бензамид (F87)

Выделяли в виде бесцветного масла (0,084 г, 77%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-(дифторметил)-4-фторфенил)циклопропан-1-карбоксамидо)бензамид (F88)

Выделяли в виде бесцветного масла (0,018 г, 16%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-хлор-4-(дифторметил)фенил)циклопропан-1-карбоксамидо)бензамид (F89)
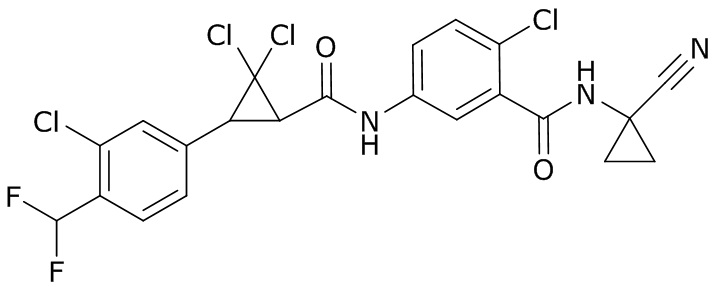
Выделяли в виде бесцветного масла (0,076 г, 68%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(4-(дифторметил)-3-фторфенил)циклопропан-1-карбоксамидо)бензамид (F90)

Выделяли в виде бесцветного масла (0,041 г, 38%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(3-(дифторметил)фенил)циклопропан-1-карбоксамидо)бензамид (F91)
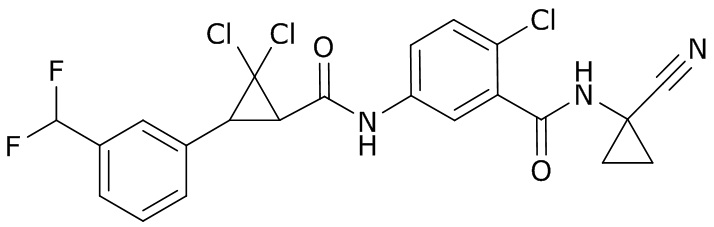
Выделяли в виде бесцветного масла (0,072 г, 69%).
Транс-2-хлор-N-(1-цианоциклопропил)-5-(2,2-дихлор-3-(4-(дифторметил)фенил)циклопропан-1-карбоксамидо)бензамид (F92)
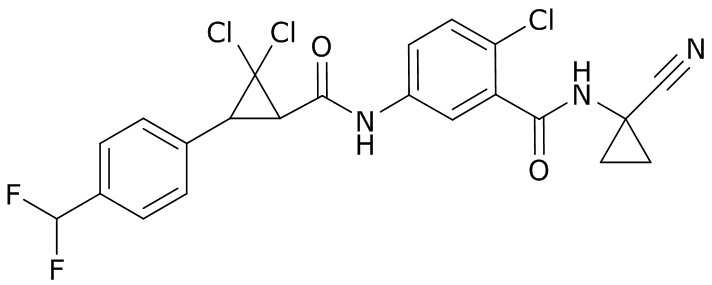
Выделяли в виде бесцветного масла (0,093 г, 89%).
Пример 32. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(3-оксоциклобутил)бензамида (F68)
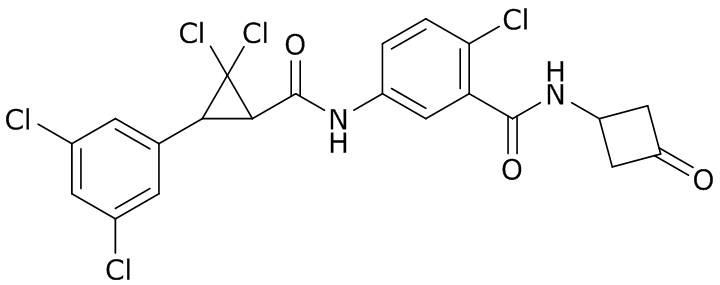
К смеси 2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензойной кислоты (C67) (0,150 г, 0,33 ммоль) и гидрохлорида 3-аминоциклобутан-1-она (0,055 г, 0,36 ммоль) в этилацетате (3,3 мл), перемешанной при 23°C, добавляли пиридин (0,080 мл, 0,99 ммоль) с последующим добавлением 50% раствора 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксида (T3P®) в этилацетате (300 мкл, 0,50 ммоль). Реакционную смесь нагревали до 50°C и перемешивали в течение 18 часов. Реакционную смесь концентрировали и остаток очищали колоночной флэш-хроматографией с обращенной фазой с помощью 5-100% ацетонитрил/вода в качестве элюента с получением указанного в заголовке продукта в виде белого твердого вещества (0,031 г, 18%).
Следующие соединения получали аналогично процедуре, указанной в примере 32 .
Транс-2-хлор-5-(2,2-дихлор-3-(3-хлор-4-фторфенил)циклопропан-1-карбоксамидо)-N-(4-оксоциклогексил)бензамид (F81)
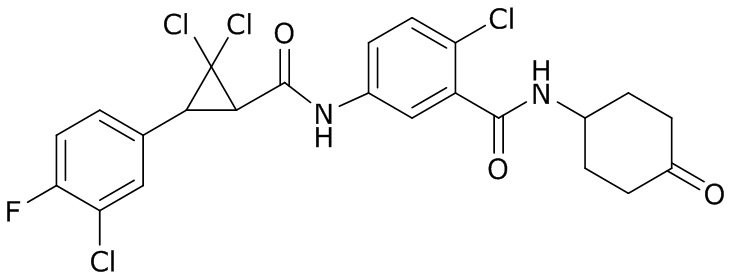
Выделяли в виде белой пленки (0,106 г, 22%).
Пример 33. Получение транс-2-хлор-N-(1-(циклопропанкарбонил)азетидин-3-ил)-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)бензамида (PF9)
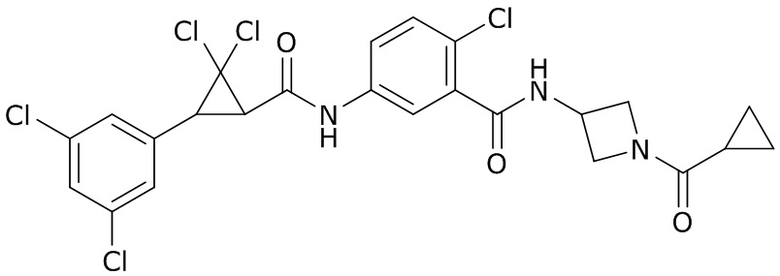
К перемешанной смеси транс-трет-бутил-3-(2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамидо)азетидин-1-карбоксилата (F54) (0,10 г, 0,17 ммоль) в дихлорметане (1,6 мл) при 23°C добавляли трифторуксусную кислоту (0,13 мл, 1,7 ммоль). Полученный гомогенный бесцветный раствор перемешивали при 23°C в течение 4 часов. Реакционную смесь концентрировали и остаток повторно растворяли в дихлорметане (1,6 мл). Последовательно добавляли триэтиламин (0,050 мл, 0,25 ммоль), циклопропанкарбонилхлорид (0,018 мл, 0,20 ммоль) и 4-диметиламинопиридин (0,024 г, 0,20 ммоль). Полученный гомогенный бесцветный раствор перемешивали при 23°C в течение 72 часов. Реакционную смесь концентрировали и остаток очищали колоночной флэш-хроматографией с обращенной фазой с помощью 5-100% ацетонитрил/вода в качестве элюента с получением указанного в заголовке продукта в виде белой пены (0,070 г, 74%).
Следующие соединения получали аналогично процедуре, указанной в примере 33.
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(1-(3,3,3-трифторпропаноил)азетидин-3-ил)бензамид (PF12)
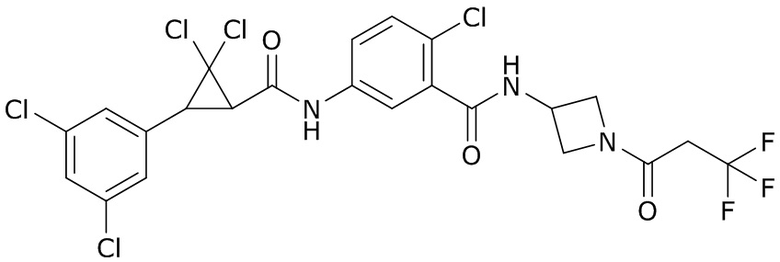
Выделяли в виде коричневой пены (0,026 г, 25%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(1-(2-метоксиацетил)азетидин-3-ил)бензамид (PF14)
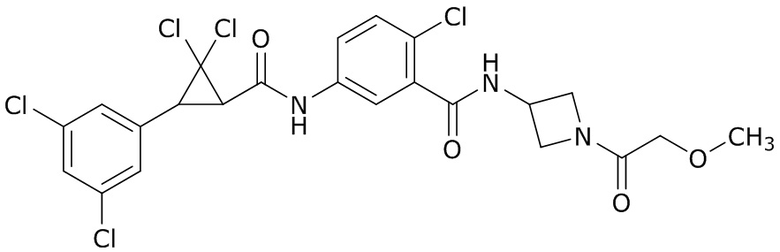
Выделяли в виде бледно-желтой пены (0,062 г, 65%).
Пример 34. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(1-метилциклопропил)бензамида (PF32)

К раствору транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензойной кислоты (C67) (0,100 г, 0,220 ммоль) в дихлорметане (2,205 мл) при 0°C добавляли 1 каплю N,N-диметилформамида и по каплям добавляли оксалилхлорид (0,029 мл, 0,331 ммоль). Охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до 0°C и последовательно добавляли N-метилморфолин (0,073 мл, 0,661 ммоль) и гидрохлорид 1-метилциклопропанамина (0,047 г, 0,441 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь загружали на Celite® и очищали посредством хроматографии (0-100% этилацетат в гексанах) с получением транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(1-метилциклопропил)бензамида (0,088 г, 75%) в виде прозрачного масла.
Следующие соединения получали аналогично процедуре, указанной в примере 34 .
Транс-метил-1-(2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)бензамидо)циклопентанкарбоксилат (PF33)

Выделяли в виде белого твердого вещества (0,074 г, 55%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоксамидо)-N-(2-оксооксазолидин-3-ил)бензамид (PF34)
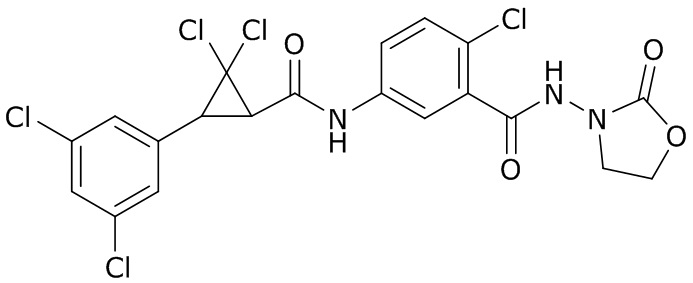
Выделяли в виде белого твердого вещества (0,027 г, 22%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(2-оксотетрагидротиофен-3-ил)бензамид (PF36)

Выделяли в виде белого твердого вещества (0,064 г, 50%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(2-оксотетрагидрофуран-3-ил)бензамид (PF37)

Выделяли в виде белого твердого вещества (0,045 г, 36%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(5-(морфолинометил)-2-оксооксазолидин-3-ил)бензамид (PF41)
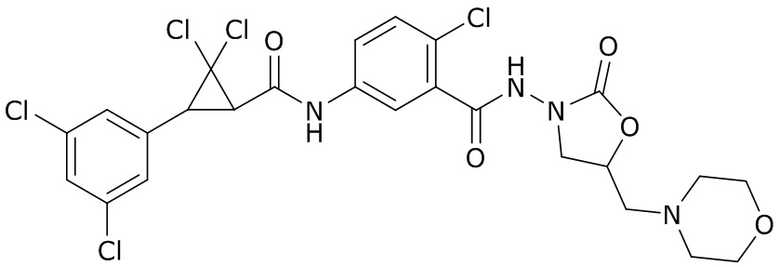
Выделяли в виде белого твердого вещества (0,059 г, 36%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(1-((2,2,2-трифторэтил)карбамоил)циклопропил)бензамид (PF42)

Выделяли в виде белого твердого вещества (0,091 г, 64%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(1-(этилкарбамоил)циклопропил)бензамид (PF43)

Выделяли в виде белого твердого вещества (0,085 г, 62%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-(2-оксо-3-(2,2,2-трифторэтил)имидазолидин-1-ил)бензамид (PF44)
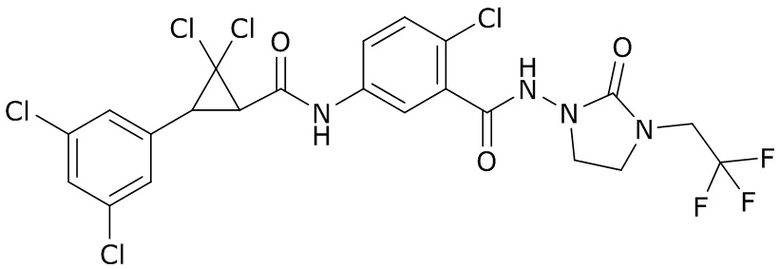
Выделяли в виде белого твердого вещества (0,042 г, 51%).
Транс-2-хлор-5-(2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоксамидо)-N-((R)-2-этил-3-оксоизоксазолидин-4-ил)бензамид (PF45)
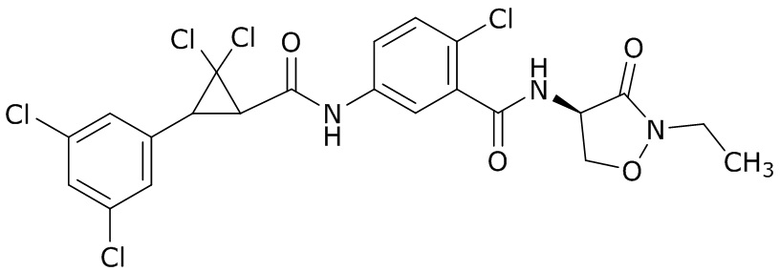
Выделяли в виде белого твердого вещества (0,060 г, 63%).
Пример 35. Получение транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоксамидо)-N-(1-оксидотетрагидротиофен-3-ил)бензамида (PF18)

К раствору транс-2-хлор-5-(2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропанкарбоксамидо)-N-(тетрагидротиофен-3-ил)бензамида (F8) (0,150 г, 0,27 ммоль) в ледяной уксусной кислоте (2,6 мл) добавляли тетрагидрат пербората натрия (0,0630 г, 0,282 ммоль). Реакционную смесь нагревали до 60°C и перемешивали в течение 4 часов. Добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. Остаток суспендировали в гексане и фильтровали под вакуумом с получением указанного в заголовке соединения в виде желтовато-коричневого порошка (0,068 г, 44%).
Пример 36. Получение транс-2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоновой кислоты (C1)
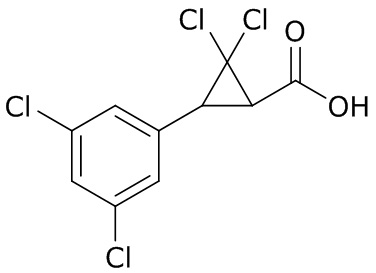
Перманганат натрия (40% водный) (84 г, 236 ммоль) добавляли по каплям к перемешанной смеси транс-2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбальдегида (C115) (58,7 г, 196 ммоль) в ацетоне (982 мл) при 15°C. Полученную смесь перемешивали при 20°C в течение 2 часов. Реакционную смесь разбавляли изопропиловым спиртом (20 мл) и концентрировали для удаления ацетона. К коричневому остатку добавляли Celite® и водный раствор хлористоводородной кислоты (1 н., 295 мл, 295 ммоль). Полученную смесь разбавляли этилацетатом (500 мл) и фильтровали через Celite®. Фильтрат промывали солевым раствором (200 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали. Полученную взвесь разбавляли гептаном (~200 мл) и обеспечивали затвердевание при 20°C. Твердое вещество собирали, промывали гептаном и высушивали с получением указанного в заголовке продукта в виде белого твердого вещества (54,68 г, 91%): 1H ЯМР (300 МГц, CDCl3) δ 7,36 (t, J=1,9 Гц, 1H), 7,17 (dd, J=1,9, 0,7 Гц, 2H), 3,48-3,37 (m, 1H), 2,87 (d, J=8,3 Гц, 1H); 13C ЯМР (400 МГц, CDCl3) δ 135,44, 135,28, 128,66, 127,30, 39,68, 36,88; ESIMS масса/заряд=298,9 ([M-H])-.
Следующие соединения получали аналогично процедуре, указанной в примере 36 .
Транс-2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоновая кислота (C2)
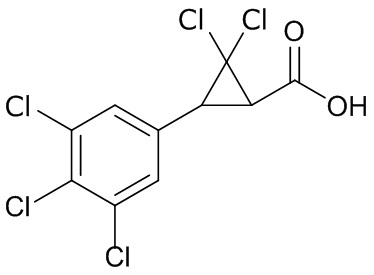
Выделяли в виде белого твердого вещества (2,78 г, 95%): 1H ЯМР (400 МГц, DMSO-d6) δ 13,41 (s, 1H), 7,81 (d, J=0,6 Гц, 2H), 3,62 (d, J=8,6 Гц, 1H), 3,52 (d, J=8,6 Гц, 1H); ESIMS масса/заряд 332 ([M-H]-).
Транс-2,2-дихлор-3-(3,4-дихлорфенил)циклопропан-1-карбоновая кислота(C3)

Выделяли в виде белого твердого вещества (124 г, 82%): т. пл. 133-135°C: 1H ЯМР (500 МГц, DMSO-d6) δ 13,39 (s, 1H), 7,76 (d, J=2,0 Гц, 1H), 7,64 (d, J=8,3 Гц, 1H), 7,44 (dd, J=8,4, 2,1 Гц, 1H), 3,49 (s, 2H). 13C ЯМР (126 МГц, DMSO-d6) δ 166,34, 133,35, 130,47, 130,33, 130,09, 129,77, 128,81, 61,43, 37,00, 36,06.
Транс-2,2-дихлор-3-(3-хлор-4-фторфенил)циклопропан-1-карбоновая кислота (C16)

Выделяли в виде белого твердого вещества (165 г, 71%): 1H ЯМР (400 МГц, CDCl3) δ 11,57 (s, 1H), 7,42 (dd, J=8,2, 7,6 Гц, 1H), 7,11-6,98 (m, 2H), 3,46 (d, J=8,2 Гц, 1H), 2,85 (d, J=8,3 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -114,07; ESIMS масса/заряд 282 ([M-H]-).
Транс-2,2-дихлор-3-(3-хлор-5-цианофенил)циклопропан-1-карбоновая кислота (C110)
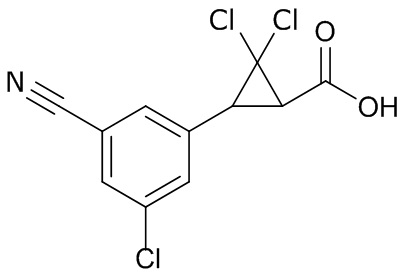
Выделяли в виде белого твердого вещества (2,92 г, 60%): т. пл. 173-175°C: 1H ЯМР (500 МГц, DMSO-d6) δ 13,42 (s, 1H), 8,03 (t, J=1,7 Гц, 1H), 7,98 (t, J=1,9 Гц, 2H), 3,65 (d, J=8,6 Гц, 1H), 3,57 (d, J=8,6 Гц, 1H); ESIMS масса/заряд 290 ([M]).
Пример 37. Получение транс-2,2-дибром-3-(3,5-дихлорфенил)циклопропан-1-карбоновой кислоты (C111)
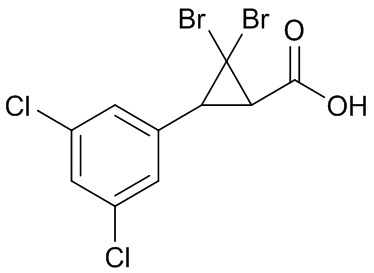
К раствору транс-2,2-дибром-3-(3,5-дихлорфенил)циклопропан-1-карбальдегида (C120) (1,67 г, 4,48 ммоль) в ацетонитриле (15,4 мл) и воде (2,5 мл) добавляли гидросульфит натрия (3,26 г, 31,4 ммоль). Полученный раствор охлаждали до 0°C и медленно добавляли хлорит натрия (3,54 г, 17,9 ммоль). Смесь перемешивали при медленном нагревании до комнатной температуры в течение ночи. Затем смесь разбавляли водным раствором хлористоводородной кислоты (1 н.) до тех пор, пока pH не становился равным или составлял менее 3. Затем смесь несколько раз экстрагировали этилацетатом и объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали in vacuo. Очистка неочищенного твердого вещества колоночной флэш-хроматографией с применением 0-100% этилацетат/гексаны в качестве элюента обеспечивала получение указанного в заголовке соединения в виде светло-коричневого твердого вещества (0,91 г, 52%): 1H ЯМР (400 МГц, CDCl3) δ 7,36 (t, J=1,9 Гц, 1H), 7,17 (dd, J=1,9, 0,8 Гц, 2H), 3,39 (d, J=8,2 Гц, 1H), 2,91 (d, J=8,2 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 172,15, 136,91, 135,25, 128,64, 127,29, 40,29, 37,32, 26,57; ESIMS масса/заряд 386 ([M-H]-).
Пример 38. Получение транс-2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропан-1-карбоновой кислоты (C112)
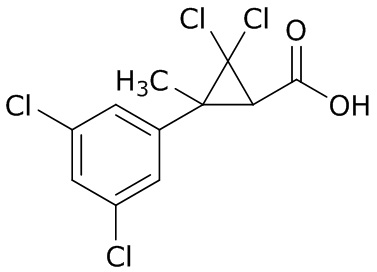
Транс-2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропил)метанол (C136) (1,16 г, 3,87 ммоль) добавляли к перемешиваемому раствору реагента Джонса (4,02 г, 18,6 ммоль) в ацетоне (20 мл) при 5°C. Смесь перемешивали в течение 2 часов при 0-5°C, а затем в течение 12 часов при комнатной температуре. Полученную коричневую суспензию охлаждали до 5°C и гасили изопропиловым спиртом (20 мл), а затем - водой (100 мл). Смесь экстрагировали этилацетатом (3×50 мл). Объединенные органические экстракты промывали водой и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали под пониженным давлением в роторном испарителе. Неочищенный продукт очищали посредством флэш-хроматографии C-18 с помощью смеси ацетонитрил/вода в качестве элюента с получением транс-2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропанкарбоновой кислоты (0,727 г, 59%) в виде белого твердого вещества: 1H ЯМР (400 МГц, ацетон-d6) δ 7,49 (dd, J=18,6, 1,9 Гц, 3H), 3,11 (s, 1H), 1,78 (s, 3H); 13C ЯМР (101 МГц, ацетон-d6) δ 166,55, 146,09, 135,70, 129,69, 128,49, 128,26, 66,75, 41,87, 39,59, 30,41, 30,21, 30,02, 29,83, 29,64, 29,55, 29,45, 29,25, 20,18; ESIMS масса/заряд 313 ([M-H]-).
Следующие соединения получали аналогично процедуре, указанной в примере 38 .
Цис-2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропан-1-карбоновая кислота (C113)

Выделяли в виде прозрачного бесцветного масла (0,088 г, 57%): 1H ЯМР (400 МГц, ацетон-d6) δ 7,60-7,27 (m, 3H), 2,81 (s, 1H), 1,77 (s, 3H); 13C ЯМР (101 МГц, ацетон-d6) δ 166,50, 141,92, 134,78, 129,66, 128,50, 128,26, 127,93, 67,25, 42,16, 41,58, 30,43, 30,24, 30,05, 29,97, 29,85, 29,77, 29,66, 29,57, 29,47, 29,28, 28,71, 20,20; ESIMS масса/заряд 313 ([M-H]-).
Транс-2,2-дихлор-3-(4-нитрофенил)циклопропан-1-карбоновая кислота (C114)
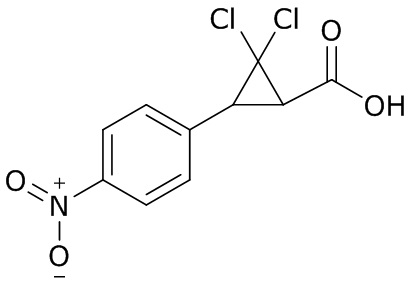
Выделяли в виде розового твердого вещества (0,158 г, 48%): 1H ЯМР (400 МГц, CDCl3) δ 8,26 (d, J=8,3 Гц, 2H), 7,47 (d, J=8,4 Гц, 2H), 3,57 (d, J=8,3 Гц, 1H), 2,98 (d, J=8,3 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 171,34, 147,88, 139,21, 129,75, 123,85, 61,33, 40,14, 37,43; IR (тонкая пленка) 2923, 2603, 1709, 1601, 1520, 1446 см-1; ESIMS масса/заряд 273,9 ([M-H]-).
Пример 39. Получение транс-2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбальдегида (C115)
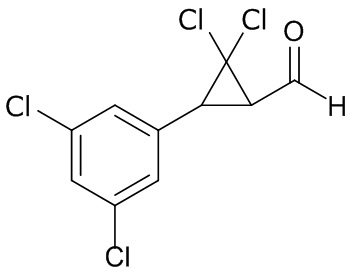
Водную хлористоводородную кислоту (2 н., 237 мл) добавляли к перемешанному раствору 1,3-дихлор-5-((транс-2,2-дихлор-3-(диэтоксиметил)циклопропил)бензола (C121) (85,7 г, 227 ммоль) в ацетонитриле (1184 мл). Смесь перемешивали при 20°C в течение 16 часов. Полученную смесь разбавляли водой (200 мл) и концентрировали с удалением ацетонитрила. Полученную водную смесь экстрагировали гексанами (600 мл). Органический слой промывали водой (300 мл), высушивали над безводным сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией с применением 0-20% этилацетат/гексаны в качестве элюента с получением указанного в заголовке продукта в виде желтого масла (58,7 г, 86%, чистота 95%): 1H ЯМР (400 МГц, CDCl3) δ 9,54 (d, J=4,0 Гц, 1H), 7,46-7,09 (m, 3H), 3,51 (d, J=8,0 Гц, 1H), 2,92 (dd, J=8,0, 4,0 Гц, 1H); 13C ЯМР (126 МГц, CDCl3) δ 193,41, 135,33, 135,09, 128,78, 127,34, 42,89, 39,31; IR (тонкая пленка) 3078, 2847, 1714, 1590, 1566, 1417, 1387.
Следующие соединения получали аналогично процедуре, указанной в примере 39 .
Транс-2,2-дихлор-3-(3,4-дихлорфенил)циклопропан-1-карбальдегид (C116)
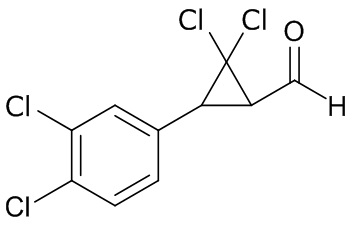
Выделяли в виде оранжевого масла (143 г, 98%): 1H ЯМР (400 МГц, CDCl3) δ 9,53 (d, J=4,1 Гц, 1H), 7,47 (d, J=8,3 Гц, 1H), 7,37 (dd, J=2,2, 0,7 Гц, 1H), 7,12 (ddd, J=8,3, 2,2, 0,7 Гц, 1H), 3,51 (dd, J=7,9, 0,8 Гц, 1H), 2,90 (dd, J=8,0, 4,1 Гц, 1H).
Транс-2,2-дихлор-3-(3-хлор-4-фторфенил)циклопропан-1-карбальдегид (C117)

Выделяли в виде оранжевого масла (230 г, 97%): 1H ЯМР (300 МГц, CDCl3) δ 9,52 (d, J=4,2 Гц, 1H), 7,36-7,30 (m, 1H), 7,19-7,16 (m, 1H), 7,15 (d, J=1,2 Гц, 1H), 3,51 (dt, J=7,9, 0,7 Гц, 1H), 2,88 (dd, J=7,9, 4,2 Гц, 1H).
Транс-2,2-дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбальдегид (C118)
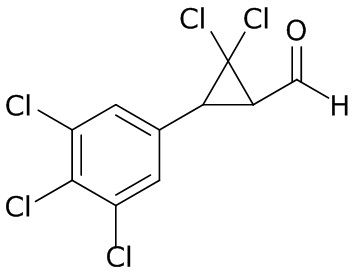
Выделяли в виде желтого твердого вещества (2,8 г, 69%): 1H ЯМР (400 МГц, CDCl3) δ 9,55 (d, J=3,9 Гц, 1H), 7,30 (d, J=0,7 Гц, 2H), 3,48 (dt, J=8,0, 0,8 Гц, 1H), 2,92 (dd, J=7,9, 3,9 Гц, 1H).
Транс-3-хлор-5-(2,2-дихлор-3-формилциклопропил)бензонитрил (C119)

Выделяли в виде желтого твердого вещества (2,9 г, 77%): 1H ЯМР (300 МГц, CDCl3) δ 9,59 (d, J=3,6 Гц, 1H), 7,65 (ddd, J=1,9, 1,4, 0,5 Гц, 1H), 7,52 (td, J=1,8, 0,7 Гц, 1H), 7,48 (td, J=1,5, 0,7 Гц, 1H), 3,56 (dq, J=8,0, 0,6 Гц, 1H), 2,98 (dd, J=8,0, 3,7 Гц, 1H).
Пример 40. Получение транс-2,2-дибром-3-(3,5-дихлорфенил)циклопропан-1-карбальдегида (C120)
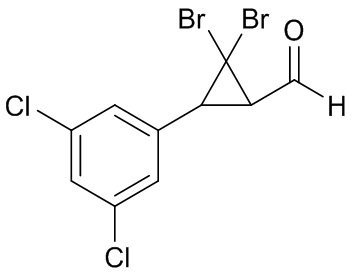
К раствору (E)-1,3-дихлор-5-(3,3-диэтоксипроп-1-ен-1-ил)бензола (C126) (500 мг, 1,817 ммоль) в бромоформе (12,1 мл) добавляли гексафторфосфат(V) тетрабутиламмония (70,4 мг, 0,182 ммоль) с последующим добавлением твердого гидроксида натрия (Аккуратно! Добавлять медленно! 1454 мг, 36,3 ммоль). Смесь нагревали до 90°C при перемешивании в течение ночи. Затем смесь разбавляли дихлорметаном и водой и экстрагировали дополнительным количеством дихлорметана. Затем органический слой высушивали над сульфатом натрия и концентрировали. Очистка колоночной флэш-хроматографией с применением 0-100% этилацетат/гексаны в качестве элюента обеспечивала получение элюата, который затем растворяли в ацетоне (4 мл) и водном растворе хлористоводородной кислоты (2 н., 1 мл, 2 ммоль). Смесь перемешивали в течение ночи. Смесь разбавляли насыщенным раствором бикарбоната натрия, пока pH раствора не становился более 7. Затем смесь экстрагировали диэтиловым эфиром и этилацетатом и объединенные органические слои высушивали над сульфатом натрия и концентрировали с получением темно-коричневого продукта (0,03 г, 4%): 1H ЯМР (400 МГц, CDCl3) δ 9,48 (d, J=4,0 Гц, 1H), 7,37 (t, J=1,9 Гц, 1H), 7,17 (dd, J=1,9, 0,7 Гц, 2H), 3,60-3,36 (m, 1H), 2,90 (dd, J=7,9, 4,0 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 194,74, 136,55, 135,31, 128,76, 127,34, 42,34, 39,84, 26,05; ESIMS масса/заряд 343 ([M-CHO]-).
Пример 41. Получение 1,3-дихлор-5-(транс-2,2-дихлор-3-(диэтоксиметил)циклопропил)бензола (C121)

В 1-л 4-горлую колбу, снабженную механической мешалкой, конденсатором, датчиком температуры и впускным отверстием для азота, загружали (E)-1,3-дихлор-5-(3,3-диэтоксипроп-1-ен-1-ил)бензол (C126) (40 г, 138 ммоль) и CHCl3 (447 мл). Добавляли гексафторфосфат(V) тетрабутиламмония (1,081 г, 2,76 ммоль). Светло-желтый раствор нагревали до 45°C. По каплям посредством капельной воронки (за 1 час) при энергичном перемешивании (~400 об./мин.) добавляли водный раствор гидроксида натрия (50%, 182 мл). Через 20 часов обеспечивали охлаждение смеси. Смесь разбавляли гексаном (200 мл). Органический верхний слой декантировали (отделяли от водной суспензии внизу) с помощью Celite®, промывали осадок на фильтре гексаном (200 мл). Фильтрат промывали солевым раствором (~200 мл), высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения в виде коричневого масла (50,2 г, 97%, чистота 95%): 1H ЯМР (300 МГц, CDCl3) δ 7,31 (t, J=1,9 Гц, 1H), 7,15 (dd, J=1,9, 0,7 Гц, 2H), 4,59 (d, J=6,2 Гц, 1H), 3,80-3,57 (m, 4H), 2,77 (d, J=8,5 Гц, 1H), 2,25 (dd, J=8,5, 6,2 Гц, 1H), 1,30 (t, J=7,0 Гц, 3H), 1,20 (t, J=7,1 Гц, 3H).
Следующие соединения получали аналогично процедуре, указанной в примере 41 .
1,2-Дихлор-4-(транс-2,2-дихлор-3-(диэтоксиметил)циклопропил)бензол (C122)
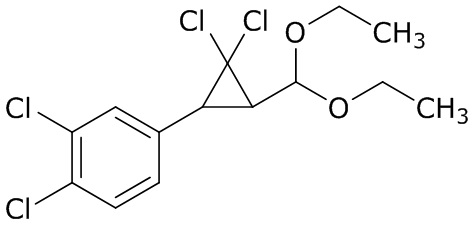
Выделяли в виде коричневого масла (184 г, 99%): 1H ЯМР (400 МГц, CDCl3) δ 7,43 (d, J=8,2 Гц, 1H), 7,36 (dd, J=2,2, 0,7 Гц, 1H), 7,10 (ddd, J=8,3, 2,1, 0,7 Гц, 1H), 4,59 (d, J=6,2 Гц, 1H), 3,82-3,55 (m, 4H), 2,77 (d, J=8,5 Гц, 1H), 2,24 (dd, J=8,5, 6,3 Гц, 1H), 1,30 (t, J=7,0 Гц, 3H), 1,20 (t, J=7,1 Гц, 3H).
2-Хлор-4-(транс-2,2-дихлор-3-(диэтоксиметил)циклопропил)-1-фторбензол (C123)

Выделяли в виде коричневого масла (63 г, 96%): 1H ЯМР (400 МГц, CDCl3) δ 7,44 (dd, J=7,0, 2,2 Гц, 1H), 7,29-7,22 (m, 1H), 7,09 (t, J=8,7 Гц, 1H), 6,62 (dd, J=16,1, 1,2 Гц, 1H), 6,14 (dd, J=16,1, 5,0 Гц, 1H), 5,05 (dd, J=4,9, 1,2 Гц, 1H), 3,70 (dq, J=9,3, 7,0 Гц, 2H), 3,56 (dq, J=9,4, 7,1 Гц, 2H), 1,25 (t, J=7,1 Гц, 6H); 13C ЯМР (101 МГц, CDCl3) δ 158,91, 156,42, 133,65, 133,62, 130,47, 128,65, 128,07, 128,05, 126,39, 126,32, 121,26, 121,08, 116,72, 116,51, 100,93, 61,17, 15,24; 19F ЯМР (376 МГц, CDCl3) δ -116,36.
1,2,3-Трихлор-5-(транс-2,2-дихлор-3-(диэтоксиметил)циклопропил)бензол (C124)
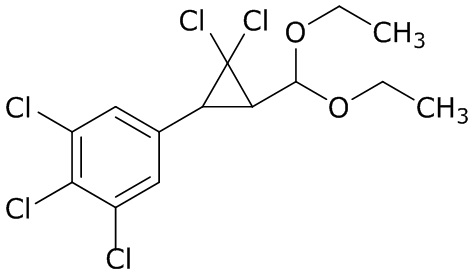
Выделяли в виде коричневого масла (146 г, 93%): 1H ЯМР (400 МГц, CDCl3) δ 7,29 (d, J=0,7 Гц, 2H), 4,59 (d, J=6,1 Гц, 1H), 3,82-3,54 (m, 4H), 2,75 (d, J=8,5 Гц, 1H), 2,23 (dd, J=8,5, 6,1 Гц, 1H), 1,30 (t, J=7,0 Гц, 3H), 1,20 (t, J=7,0 Гц, 3H).
3-Хлор-5-(транс-2,2-дихлор-3-(диэтоксиметил)циклопропил)бензонитрил (C125)

Выделяли в виде желтого масла (4,8 г, 74%): 1H ЯМР (400 МГц, CDCl3) δ 7,59 (t, J=1,7 Гц, 1H), 7,50 (t, J=1,9 Гц, 1H), 7,45 (t, J=1,5 Гц, 1H), 4,61 (d, J=6,0 Гц, 1H), 3,89-3,50 (m, 4H), 2,83 (d, J=8,5 Гц, 1H), 2,28 (dd, J=8,4, 6,0 Гц, 1H), 1,31 (t, J=7,1 Гц, 3H), 1,21 (t, J=7,0 Гц, 3H).
Пример 42. Получение (E)-1,3-дихлор-5-(3,3-диэтоксипроп-1-ен-1-ил)бензола (C126)
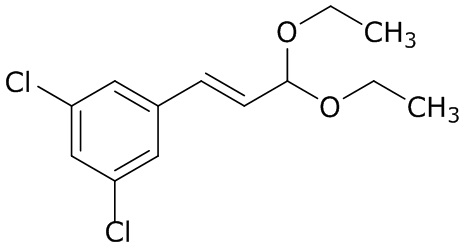
Стадия 1a. Ацетальдегид (120 г, 2688 ммоль) добавляли к перемешанной смеси 3,5-дихлорбензальдегида (96 г, 538 ммоль) в толуоле (400 мл) при 0°C. Раствор гидроксида калия (3,35 г, 53,8 ммоль) в метиловом спирте (10 мл) добавляли по каплям посредством капельной воронки. Полученную смесь перемешивали при 0°C в течение 4 часов, пока весь 3,5-дихлорбензальдегид не израсходовался, как было показано тонкослойной хроматографией. Стадия 1b. Этилацетат (500 мл) и концентрированную хлористоводородную кислоту (37% водная, 44,1 мл, 538 ммоль) добавляли в реакционную смесь. Полученную смесь нагревали при 80°C и обеспечивали дистилляцию бесцветной жидкости (200 мл). Реакционную смесь разбавляли водой (500 мл) и экстрагировали этилацетатом. Органический слой промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали с получением (E)-3-(3,5-дихлорфенил)акрилальдегида в виде светло-желтого твердого вещества (115 г), которое использовали непосредственно без дополнительной очистки: 1H ЯМР (300 МГц, CDCl3) δ 9,72 (dd, J=7,4, 0,5 Гц, 1H), 7,43 (q, J=1,8 Гц, 3H), 7,35 (d, J=16,0 Гц, 1H), 6,69 (dd, J=16,0, 7,4 Гц, 1H).
Стадия 2. Триэтоксиметан (31,4 г, 208 ммоль) и 4-метилбензолсульфонат пиридин-1-ия (0,528 г, 2,079 ммоль) добавляли к перемешанному раствору (E)-3-(3,5-дихлорфенил)акрилальдегида (44 г, 208 ммоль) в этаноле (416 мл). Полученную смесь перемешивали при 20°C в течение 20 часов. Раствор насыщенного водного карбоната натрия (50 мл) добавляли к реакционной смеси. Полученную смесь концентрировали при 45°C с удалением этанола. Концентрат разбавляли водой и экстрагировали гексаном. Органический слой промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке продукта в виде светло-желтого масла (56,13 г, 93%): 1H ЯМР (400 МГц, CDCl3) δ 7,25 (dt, J=10,6, 1,9 Гц, 3H), 6,61 (dd, J=16,1, 1,1 Гц, 1H), 6,22 (dd, J=16,1, 4,7 Гц, 1H), 5,17 (s, 1H), 5,14-5,00 (m, 1H), 3,78-3,49 (m, 4H), 1,24 (q, J=7,2 Гц, 6H); 13C ЯМР (101 МГц, CDCl3) δ 139,34, 135,14, 130,27, 129,88, 127,71, 125,08, 100,60, 61,20, 15,25.
Следующие соединения получали аналогично процедуре, указанной в примере 42.
(E)-1,2-Дихлор-4-(3,3-диэтоксипроп-1-ен-1-ил)бензол (C127)

Выделяли в виде оранжевого масла (142 г, 91%): 1H ЯМР (300 МГц, CDCl3) δ 7,48 (d, J=2,0 Гц, 1H), 7,39 (dd, J=8,3, 0,8 Гц, 1H), 6,62 (d, J=16,1 Гц, 1H), 6,20 (ddd, J=16,1, 4,9, 0,8 Гц, 1H), 5,06 (dt, J=4,9, 1,0 Гц, 1H), 3,78-3,48 (m, 4H), 1,25 (td, J=7,1, 0,8 Гц, 6H).
(E)-2-Хлор-4-(3,3-диэтоксипроп-1-ен-1-ил)-1-фторбензол (C128)
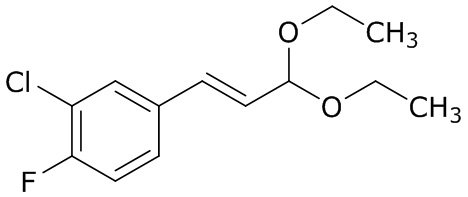
Выделяли в виде оранжевого масла (283 г, 84%): 1H ЯМР (400 МГц, CDCl3) δ 7,44 (dd, J=7,0, 2,2 Гц, 1H), 7,29-7,22 (m, 1H), 7,09 (t, J=8,7 Гц, 1H), 6,62 (dd, J=16,1, 1,2 Гц, 1H), 6,14 (dd, J=16,1, 5,0 Гц, 1H), 5,05 (dd, J=4,9, 1,2 Гц, 1H), 3,70 (dq, J=9,3, 7,0 Гц, 2H), 3,56 (dq, J=9,4, 7,1 Гц, 2H), 1,25 (t, J=7,1 Гц, 6H); 13C ЯМР (101 МГц, CDCl3) δ 158,91, 156,42, 133,65, 133,62, 130,47, 128,65, 128,07, 128,05, 126,39, 126,32, 121,26, 121,08, 116,72, 116,51, 100,93, 61,17, 15,24; 19F ЯМР (376 МГц, CDCl3) δ -116,36.
(E)-1,2,3-Трихлор-5-(3,3-диэтоксипроп-1-ен-1-ил)бензол (C129)
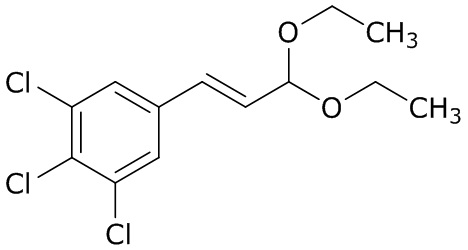
Выделяли в виде оранжевого масла (40 г, 91%): 1H ЯМР (400 МГц, CDCl3) δ 7,41 (s, 2H), 6,58 (dd, J=16,1, 1,2 Гц, 1H), 6,21 (dd, J=16,1, 4,6 Гц, 1H), 5,06 (dd, J=4,7, 1,2 Гц, 1H), 3,69 (dq, J=9,3, 7,1 Гц, 2H), 3,55 (dq, J=9,5, 7,0 Гц, 2H), 1,25 (t, J=7,1 Гц, 6H).
(E)-3-Хлор-5-(3,3-диэтоксипроп-1-ен-1-ил)бензонитрил (C130)

Выделяли в виде бесцветного масла (7,62 г, 62%): 1H ЯМР (400 МГц, CDCl3) δ 7,61 (t, J=1,8 Гц, 1H), 7,58-7,53 (m, 1H), 7,51 (t, J=1,7 Гц, 1H), 6,72-6,61 (m, 1H), 6,28 (dd, J=16,1, 4,5 Гц, 1H), 5,09 (dd, J=4,5, 1,3 Гц, 1H), 3,70 (dq, J=9,4, 7,1 Гц, 2H), 3,56 (dq, J=9,4, 7,0 Гц, 2H), 1,26 (t, J=7,0 Гц, 6H).
Пример 43. Получение этил-3-(3,5-дихлорфенил)бут-2-еноата (C131; соотношение 85:15 E- и Z-изомеров)

К перемешанной смеси гидрида натрия (60% дисперсия в масле) (1,32 г, 33,1 ммоль) в безводном тетрагидрофуране (50 мл) при 5°C по каплям добавляли этил-2-(диэтоксифосфорил)ацетат (7,41 г, 33,1 ммоль). После завершения добавления полученный раствор перемешивали в течение дополнительных 30 минут при 0°C с последующим добавлением 3,5-дихлорацетофенона (5,0 г, 26,5 ммоль), растворенного в тетрагидрофуране (10 мл). Полученную бледно-желтую масляную суспензию перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь гасили насыщенным водным раствором хлорида аммония (100 мл). Водную смесь экстрагировали этиловым эфиром (3×50 мл). Объединенные органические экстракты промывали водой и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали под пониженным давлением в роторном испарителе. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле (подвижная фаза гексаны/этилацетат) с получением этил-3-(3,5-дихлорфенил)бут-2-еноата (5,69 г, 79%) в виде смеси E- (85%) и Z- (15%) изомеров.
Пример 44. Получение (E)-3-(3,5-дихлорфенил)бут-2-ен-1-ола (C132)

К перемешанному раствору этил-3-(3,5-дихлорфенил)бут-2-еноата (C131) (5,69 г, 21,95 ммоль) в безводном толуоле (50 мл) при -78°C по каплям добавляли гидрид диизобутилалюминия (1,5 M раствор в толуоле, 33 мл, 48,3 ммоль). После завершения добавления желтоватый раствор перемешивали при -78°C еще в течение 2 часов, а затем обеспечивали нагревание до комнатной температуры. Через 11 часов реакционную смесь осторожно гасили водным раствором хлористоводородной кислоты (1 н., 50 мл) и экстрагировали толуолом (3×50 мл). Объединенные органические экстракты промывали водой и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали под пониженным давлением в роторном испарителе. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле (подвижная фаза гексаны/этилацетат) с получением (Z)-3-(3,5-дихлорфенил)бут-2-ен-1-ола (0,316 г, 6,3%) в виде прозрачного бесцветного масла и (E)-3-(3,5-дихлорфенил)бут-2-ен-1-ола (1,59 г, 32%) в виде прозрачного бесцветного масла.
Пример 45. Получение (E)-2-((3-(3,5-дихлорфенил)бут-2-ен-1-ил)окси)тетрагидро-2H-пирана (C133)
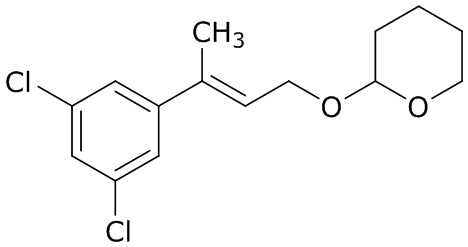
К перемешанному раствору (E)-3-(3,5-дихлорфенил)бут-2-ен-1-ола (C132) (1,59 г, 7,32 ммоль) и моногидрата п-толуолсульфоновой кислоты (0,07 г, 0,366 ммоль) в безводном простом эфире (50 мл) при 0°C по каплям добавляли 3,4-дигидро-2H-пиран (1,05, 12,45 ммоль). Обеспечивали нагревание раствора до комнатной температуры и его перемешивали еще в течение 12 часов. Реакционную смесь гасили водой (100 мл) и экстрагировали простым эфиром (3×50 мл). Объединенные органические экстракты промывали водой и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали под пониженным давлением в роторном испарителе с получением (E)-2-((3-(3,5-дихлорфенил)бут-2-ен-1-ил)окси)тетрагидро-2H-пирана (2,17 г, 93%) в виде прозрачного бесцветного масла.
Следующие соединения получали аналогично процедуре, указанной в примере 45 .
(E)-2-((3-(4-Нитрофенил)аллил)окси)тетрагидро-2H-пиран (C134)
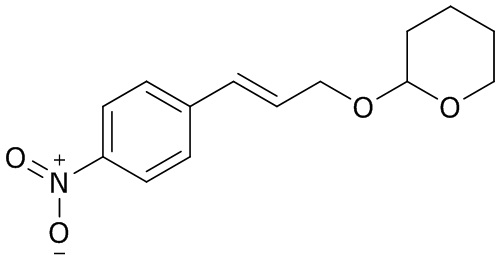
Выделяли в виде желтого масла (2,25 г, 97%): 1H ЯМР (400 МГц, CDCl3) δ 8,26-8,09 (m, 2H), 7,57-7,44 (m, 2H), 6,79-6,63 (m, 1H), 6,51 (ddd, J=16,0, 5,8, 5,2 Гц, 1H), 4,71 (dd, J=4,2, 3,0 Гц, 1H), 4,46 (ddd, J=13,9, 5,2, 1,7 Гц, 1H), 4,20 (ddd, J=13,9, 5,9, 1,6 Гц, 1H), 3,91 (ddd, J=11,2, 8,2, 3,3 Гц, 1H), 3,65-3,47 (m, 1H), 1,96-1,36 (m, 6H); 13C ЯМР (101 МГц, CDCl3) δ 146,95, 143,36, 131,36, 129,36, 126,93, 123,98, 98,33, 67,10, 62,34, 30,58, 25,41, 19,44; IR (тонкая пленка) 2939, 2849, 1595, 1513, 1339 см-1.
Пример 46. Получение транс-2-((2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропил)метокси)тетрагидро-2H-пирана (C135)
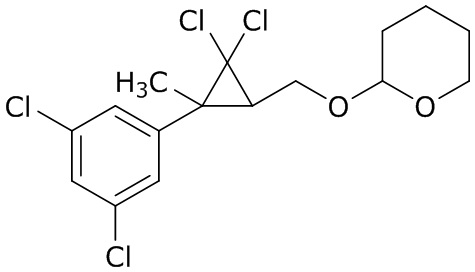
К перемешиваемому раствору (E)-2-((3-(3,5-дихлорфенил)бут-2-ен-1-ил)окси)тетрагидро-2H-пирана (C133) (2,17 г, 7,3 ммоль) и гексафторфосфата(V) тетрабутиламмония (0,283 г, 0,730 ммоль) в хлороформе (20 мл) по частях добавляли порошкообразный гидроксид натрия (2,92 г, 73 ммоль). Полученную желтую суспензию твердых веществ нагревали до 55°C суммарно в течение 7 часов и перемешивали при комнатной температуре в течение дополнительных 12 часов. Реакционную смесь гасили водой (100 мл) и экстрагировали простым эфиром (3×50 мл). Объединенные органические экстракты промывали водой и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали под пониженным давлением в роторном испарителе. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле (подвижная фаза гексаны/этилацетат) с получением транс-2-((2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропил)метокси)тетрагидро-2H-пирана (2,03 г, 69%) в виде прозрачного бесцветного масла.
Пример 47. Получение транс-2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропил)метанола (C136)

К перемешиваемому раствору транс-2-((2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропил)метокси)тетрагидро-2H-пирана (C135) (2,03 г, 5,28 ммоль) в метаноле (20 мл) добавляли моногидрат п-толуолсульфоновой кислоты (0,101 г, 0,528 ммоль). Смесь перемешивали в течение 11 часов при комнатной температуре, а затем концентрировали под вакуумом в роторном испарителе. Очистка посредством флэш-хроматографии на силикагеле (подвижная фаза гексаны/этилацетат) обеспечивала получение транс-2,2-дихлор-3-(3,5-дихлорфенил)-3-метилциклопропил)метанола (1,16 г, 70%) в виде бледно-желтого масла.
Пример 48. Получение транс-(2,2-дихлор-3-(4-нитрофенил)циклопропил)метанола (C137)
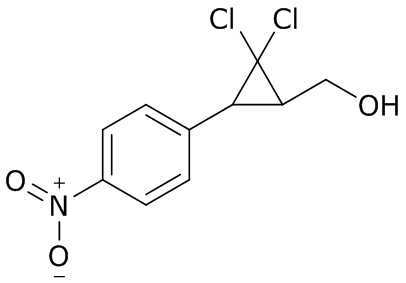
К перемешанному раствору (E)-2-((3-(4-нитрофенил)аллил)окси)тетрагидро-2H-пирана (C134) (0,5 г, 1,899 ммоль) и гексафторфосфата(V) тетрабутиламмония (0,037 г, 0,095 ммоль) в хлороформе (6,33 мл) добавляли порошкообразный гидроксид натрия (1,139 г, 28,5 ммоль) и реакционную смесь энергично перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли водой и дихлорметаном и слои разделяли. Органический слой концентрировали и очищали посредством колоночной флэш-хроматографии с получением 2-((транс-2,2-дихлор-3-(4-нитрофенил)циклопропил)метокси)тетрагидро-2H-пирана в виде смеси диастереомеров. Смесь растворяли в метаноле (10 мл). К метанольному раствору добавляли п-толуолсульфоновую кислоту (0,020 г, 0,107 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь гасили насыщенным раствором бикарбоната натрия и экстрагировали этилацетатом (2x). Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения в виде желтого масла (310 мг, 53% за 2 стадии): 1H ЯМР (400 МГц, CDCl3) δ 8,22 (d, J=8,7 Гц, 2H), 7,52-7,34 (m, 2H), 4,10 (ddd, J=12,4, 7,2, 5,3 Гц, 1H), 3,95 (ddd, J=12,0, 8,0, 5,0 Гц, 1H), 2,78 (d, J=8,3 Гц, 1H), 2,37 (td, J=8,2, 5,4 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 147,43, 141,42, 129,77, 123,59, 63,74, 62,25, 38,50, 37,04; IR (тонкая пленка) 1598, 1514, 1345, 1046 см-1; HRMS-ESI (масса/заряд) [M+Na]+ рассч. для C10H9Cl2NO3Na, 283,9852; обнаружено, 283,9844.
Пример 49. Получение 1-бром-2-хлор-4-(транс-2,2-дихлор-3-(4-метоксифенил)циклопропил)бензола (C138)

К перемешанному раствору (E)-1-бром-2-хлор-4-(4-метоксистирил)бензола (C142) (0,38 г, 1,174 ммоль) и гексафторфосфата(V) тетрабутиламмония (0,045 г, 0,117 ммоль) в хлороформе (5,61 г, 3,77 мл, 47,0 ммоль) добавляли водный раствор гидроксида натрия (50%, 2,348 г, 29,4 ммоль) и полученную смесь энергично перемешивали при комнатной температуре в течение 40 часов. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией с применением 0-10% этилацетат/гексаны в качестве элюента обеспечивала получение указанного в заголовке соединения в виде бесцветного масла (0,362 г, 72%): 1H ЯМР (400 МГц, CDCl3) δ 7,62 (d, J=8,3 Гц, 1H), 7,46 (d, J=2,0 Гц, 1H), 7,29-7,23 (m, 2H), 7,13 (dd, J=8,3, 2,1 Гц, 1H), 6,93 (d, J=8,7 Гц, 2H), 3,83 (s, 3H), 3,12 (d, J=8,7 Гц, 1H), 3,07 (d, J=8,7 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 159,43, 135,68, 134,63, 133,68, 130,80, 129,90, 128,49, 125,81, 121,83, 114,01, 64,86, 55,33, 39,54, 38,85; IR (тонкая пленка) 3356 (br), 3002, 2835, 1514, 1248 см-1.
Следующие соединения получали аналогично процедуре, указанной в примере 49 .
2-Бром-5-(транс-2,2-дихлор-3-(4-метоксифенил)циклопропил)-1,3-дифторбензол (C139)
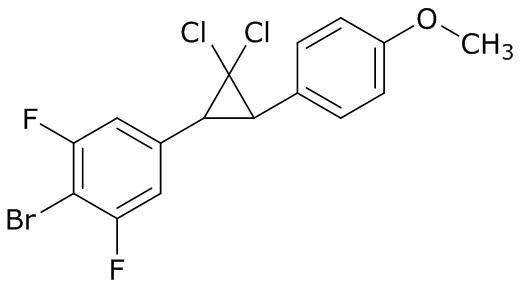
Выделяли в виде желтого твердого вещества (3,44 г, 79%): т. пл. 104,0-109,3°C; 1H ЯМР (400 МГц, CDCl3) δ 7,28-7,22 (m, 2H), 7,02-6,96 (m, 2H), 6,96-6,90 (m, 2H), 3,83 (s, 3H), 3,12 (d, J=8,7 Гц, 1H), 3,08 (d, J=8,7 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 161,10, 159,49, 129,86, 125,47, 114,04, 112,79, 112,56, 112,53, 64,66, 55,33, 39,77, 39,01; 19F ЯМР (376 МГц, CDCl3) δ -104,75.
2-Бром-5-(транс-2,2-дихлор-3-(4-метоксифенил)циклопропил)-1-фтор-3-метоксибензол (C140)
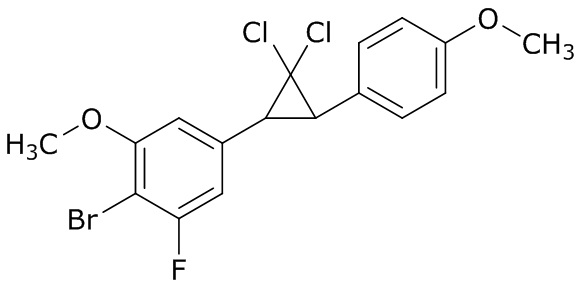
Выделяли в виде желтого масла (1,18 г, 76%): 1H ЯМР (400 МГц, CDCl3) δ 7,30-7,26 (m, 2H), 6,96-6,91 (m, 2H), 6,80-6,74 (m, 1H), 6,70 (d, J=1,6 Гц, 1H), 3,96 (s, 3H), 3,83 (s, 3H), 3,15-3,07 (m, 2H); 13C ЯМР (101 МГц, CDCl3) δ 161,20, 159,43, 136,09, 135,99, 129,91, 125,85, 114,01, 109,29, 109,05, 108,20, 64,91, 56,79, 55,33, 39,59, 39,49; 19F ЯМР (376 МГц, CDCl3) δ -104,96.
1-Бром-5-(транс-2,2-дихлор-3-(4-метоксифенил)циклопропил)-3-фтор-2-метоксибензол (C141)
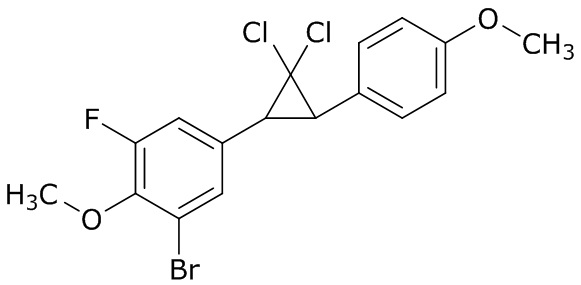
Выделяли в виде желтого масла (0,37 г, 59%): 1H ЯМР (400 МГц, CDCl3) δ 7,31-7,23 (m, 3H), 6,98 (d, J=11,6 Гц, 1H), 6,96-6,90 (m, 2H), 3,92 (s, 3H), 3,83 (s, 3H), 3,13 (d, J=8,8 Гц, 1H), 3,07 (d, J=8,8 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 159,38, 152,57, 147,73, 129,93, 127,93, 125,93, 120,63, 117,66, 117,23, 113,97, 65,40, 56,57, 55,33, 40,10, 39,59; 19F ЯМР (376 МГц, CDCl3) δ -135,58.
Пример 50. Получение (E)-1-бром-2-хлор-4-(4-метоксистирил)бензола (C142)
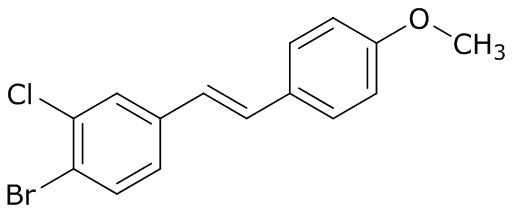
К перемешанному раствору диэтил-(4-метоксибензил)фосфоната (0,619 мл, 2,73 ммоль) в N,N-диметилформамиде (3 мл) при 0°C добавляли раствор метоксида натрия (5,4 M в метаноле, 0,844 мл, 4,56 ммоль). Добавляли 4-бром-3-хлорбензальдегид (0,5 г, 2,278 ммоль) в N,N-диметилформамиде (1 мл) и реакционную смесь нагревали до 65°C в течение 4 часов. Обеспечивали охлаждение реакционной смеси до комнатной температуры и ее разделяли между водой и этилацетатом. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией с применением 0-10% этилацетат/гексаны в качестве элюента обеспечивала получение указанного в заголовке соединения в виде желтого кристаллического твердого вещества (0,484 г, 59%): т. пл. 77-88°C; 1H ЯМР (400 МГц, CDCl3) δ 7,58-7,53 (m, 2H), 7,47-7,39 (m, 2H), 7,22 (dd, J=8,4, 2,1 Гц, 1H), 7,06 (d, J=16,2 Гц, 1H), 6,95-6,87 (m, 2H), 6,84 (d, J=16,3 Гц, 1H), 3,84 (s, 3H); EIMS масса/заряд 324.
Пример 51. Получение (E)-2-бром-1,3-дифтор-5-(4-метоксистирил)бензола (C143) и (E)-2-бром-1-фтор-3-метокси-5-(4-метоксистирил)бензола (C144)

C143 C144
К перемешанному раствору диэтил-(4-метоксибензил)фосфоната (5,54 мл, 24,43 ммоль) в N,N-диметилформамиде (27 мл) при 0°C добавляли раствор метоксида натрия (5,4 M в метаноле, 4,52 мл, 24,43 ммоль). Добавляли 4-бром-3,5-дифторбензальдегид (4,5 г, 20,36 ммоль) в N,N-диметилформамиде (9 мл) и реакционную смесь нагревали до 65°C в течение 1 часа. Обеспечивали охлаждение реакционной смеси до комнатной температуры и ее разделяли между водой и этилацетатом. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией с применением 0-10% этилацетат/гексаны в качестве элюента обеспечивала получение (E)-2-бром-1,3-дифтор-5-(4-метоксистирил)бензола (C143) в виде белого твердого вещества (3,28 г, 47%) и (E)-2-бром-1-фтор-3-метокси-5-(4-метоксистирил)бензола (C144) в виде белого твердого вещества (1,19 г, 16%). C143: т. пл. 104,1-112,7°C; 1H ЯМР (400 МГц, CDCl3) δ 7,48-7,41 (m, 2H), 7,10-7,02 (m, 3H), 6,94-6,88 (m, 2H), 6,82 (d, J=16,2 Гц, 1H), 3,84 (s, 3H); 19F ЯМР (376 МГц, CDCl3) δ -106,11; EIMS масса/заряд 324,0. C144: т. пл. 118,5-123,0°C; 1H ЯМР (400 МГц, CDCl3) δ 7,45 (d, J=8,6 Гц, 2H), 7,06 (d, J=16,2 Гц, 1H), 6,91 (dd, J=9,1, 2,2 Гц, 3H), 6,86 (d, J=16,2 Гц, 1H), 6,78 (t, J=1,5 Гц, 1H), 3,96 (s, 3H), 3,84 (s, 3H); 19F ЯМР (376 МГц, CDCl3) δ -106,15; EIMS масса/заряд 336,0.
Пример 52. Получение (E)-1-бром-3-фтор-2-метокси-5-(4-метоксистирил)бензола (C145)
К перемешанному раствору диэтил-(4-метоксибензил)фосфоната (1,85 мл, 8,14 ммоль) в N,N-диметилформамиде (9 мл) при 0°C добавляли раствор метоксида натрия (5,4 M в метаноле, 1,38 мл, 7,47 ммоль). Добавляли 3-бром-4,5-фторбензальдегид (1,5 г, 6,79 ммоль) в N,N-диметилформамиде (3 мл) и реакционную смесь нагревали до 65°C в течение 2 часов. Обеспечивали охлаждение реакционной смеси до комнатной температуры и ее разделяли между водой и этилацетатом. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией с применением 0-10% этилацетата в качестве элюента обеспечивала получение (E)-1-бром-3-фтор-2-метокси-5-(4-метоксистирил)бензола в виде белого твердого вещества (0,48 г, 20%): т. пл. 78,0-84,8°C; 1H ЯМР (400 МГц, CDCl3) δ 7,47 (d, J=8,7 Гц, 2H), 7,39 (d, J=12,5 Гц, 1H), 7,19 (dd, J=16,1, 1,7 Гц, 1H), 7,14 (d, J=8,1 Гц, 1H), 6,94-6,89 (m, 2H), 6,86 (d, J=16,2 Гц, 1H), 3,90 (s, 3H), 3,84 (s, 3H); 19F ЯМР (376 МГц, CDCl3) δ -135,86; EIMS масса/заряд 336,0.
Пример 53. Получение (E)-3-хлор-5-(4-метоксистирил)бензальдегида (C146)

К перемешанному раствору 3-бром-5-хлорбензальдегида (20,0 г, 91,32 ммоль) в диметилацетамиде добавляли 1-метокси-4-винилбензол (18,3 г, 136,9 ммоль) и триэтиламин (50,5 мл, 273,96 ммоль) и реакционную смесь дегазировали аргоном в течение 5 минут. Добавляли ацетат палладия(II) (410 мг, 1,83 ммоль) и три-о-толилфосфин (1,11 г, 3,65 ммоль) и полученную реакционную смесь нагревали до 100°C в течение 16 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенный органический слой высушивали над сульфатом натрия и концентрировали под пониженным давлением. Полученный неочищенный материал очищали колоночной флэш-хроматографией с помощью 5-10% этилацетата в петролейном эфире в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества (13,5 г, 54%): 1H ЯМР (300 МГц, CDCl3) δ 9,99 (s, 1H), 7,85 (s, 1H), 7,69 (s, 2H), 7,47 (d, J=8,4 Гц, 2H), 7,16 (d, J=16,2 Гц, 1H), 6,94 (t, J=8,4 Гц, 3H), 3,84 (s, 3H); ESIMS масса/заряд 273 ([M+H]+).
Следующие соединения получали аналогично процедуре, указанной в примере 53 .
(E)-2-хлор-5-(4-метоксистирил)бензальдегид (C147)

Выделяли в виде бледно-желтого твердого вещества (11,8 г, 27%): 1H ЯМР (300 МГц, CDCl3) δ 10,45 (s, 1H), 8,02 (s, 1H), 7,62 (d, J=6,4 Гц, 1H), 7,46-7,40 (m, 3H), 7,12 (d, J=16,4 Гц, 1H), 6,95-6,90 (m, 3H), 3,95 (s, 3H); ESIMS масса/заряд 273 ([M+H]+).
(E)-3-Фтор-5-(4-метоксистирил)бензальдегид (C148)
Выделяли в виде бледно-желтого твердого вещества (25 г, 57%): 1H ЯМР (300 МГц, CDCl3) δ 10 (s, 1H), 7,77 (s, 1H), 7,48-7,40 (m, 4H), 7,16 (d, J=16,2 Гц, 1H), 6,94 (t, J=15,6 Гц, 3H), 3,84 (s, 3H); ESIMS масса/заряд 275 ([M+H]+).
(E)-2-Фтор-5-(4-метоксистирил)бензальдегид (C149)
Выделяли в виде грязно-белого твердого вещества (0,25 г, 20%): 1H ЯМР (400 МГц, CDCl3) δ 10,43 (s,1H), 7,90 (d, J=8,4 Гц, 1H), 7,54-7,46 (m, 4H), 7,20 (d, J=16,0 Гц, 1H), 6,94-6,90 (m, 3H), 3,85 (s, 3H); ESIMS масса/заряд 274 ([M+H]+).
(E)-2-Хлор-4-(4-метоксистирил)бензальдегид (C150)
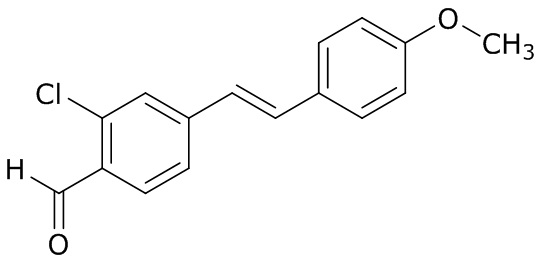
Выделяли в виде грязно-белого твердого вещества (8,0 г, 57%): 1H ЯМР (400 МГц, CDCl3) δ 10,41 (s, 1H), 7,97 (dd, J=2,4, 6,8 Гц, 1H), 7,71-7,67 (m, 1H), 7,44 (d, J=8,0 Гц, 2H), 7,18-7,13 (m, 1H), 7,08-7,04 (m, 1H), 6,95-6,90 (m, 3H), 3,85 (s, 3H); ESIMS масса/заряд 257 ([M+H]+).
(E)-2-Фтор-4-(4-метоксистирил)бензальдегид (C151)
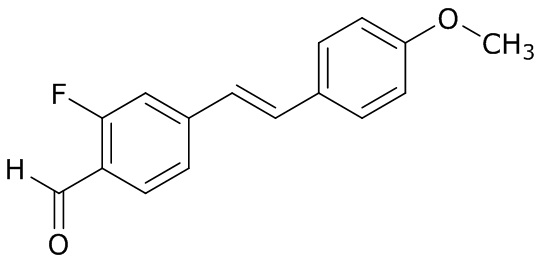
Выделяли в виде коричневого твердого вещества (15 г, 78%): 1H ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1H), 7,83 (t, J=7,6 Гц, 1H), 7,48 (d, J=8,8 Гц, 2H), 7,35 (d, J=8,4 Гц, 1H), 7,23-7,18 (m, 2H), 6,96-6,91 (m, 3H), 3,95 (s, 3H); 19F ЯМР (376 МГц, CDCl3) δ -122,26; ESIMS масса/заряд 257 ([M+H]+).
(E)-3-(4-Метоксистирил)бензальдегид (C152)
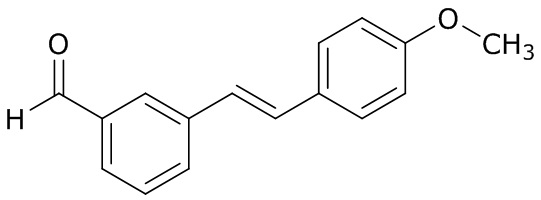
Выделяли в виде коричневого твердого вещества (18 г, 46%): 1H ЯМР (400 МГц, CDCl3) δ 10,15 (s, 1H), 8,00 (s, 1H), 7,73 (d, J=7,2 Гц, 2H), 7,53-7,46 (m, 3H), 7,17 (d, J=16,8 Гц, 1H), 7,01 (d, J=16,0 Гц, 1H), 6,92 (d, J=8,8 Гц, 2H), 3,84(s, 3H); ESIMS масса/заряд 239 ([M+H]+).
(E)-4-(4-метоксистирил)бензальдегид (C153)

Выделяли в виде светло-коричневого твердого вещества (9,0 г, 47%): 1H ЯМР (400 МГц, CDCl3) δ 10 (s, 1H), 7,84 (d, J=8,0 Гц, 2H), 7,61 (d, J=7,6 Гц, 2H), 7,48 (d, J=8,0 Гц, 2H), 7,23 (t, J=7,6 Гц, 1H), 7,00 (d, J=16,0 Гц, 1H), 6,92 (d, J=8,8 Гц, 2H), 3,84 (s, 3H).
Пример 54. Получение (E)-1-хлор-3-(дифторметил)-5-(4-метоксистирил)бензола (C154)
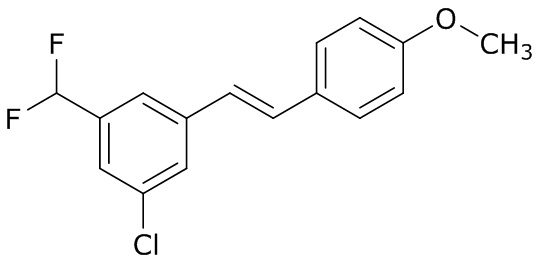
К перемешанному раствору (E)-3-хлор-5-(4-метоксистирил)бензальдегида (C146) (13 г, 47,79 ммоль) в дихлорметане (130 мл) добавляли трифторид диэтиламиносеры (31,5 мл, 238,97 ммоль) при -78°C. Полученный раствор перемешивали в течение 20 часов при комнатной температуре. Реакционную смесь охлаждали до 0°C и по каплям добавляли раствор насыщенного водного раствора бикарбоната натрия. Слои разделяли и водный слой экстрагировали дихлорметаном (3×75 мл). Объединенный органический слой промывали водой и солевым раствором, высушивали над сульфатом натрия и концентрировали. Неочищенный материал очищали колоночной флэш-хроматографией с применением 10-20% этилацетата в гексанах в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла (13,1 г, 94%): 1H ЯМР (400 МГц, CDCl3) δ 7,55 (s, 1H), 7,45 (d, J=8,8 Гц, 3H), 7,34 (s, 1H), 7,10 (d, J=16 Гц, 1H), 6,90 (t, J=8,4 Гц, 3H), 6,61 (t, J=56,4 Гц, 1H), 3,80 (s, 3H); 19F ЯМР (376 МГц, CDCl3) δ -111,72.
Следующие соединения получали аналогично процедуре, указанной в примере 54 .
(E)-1-Хлор-2-(дифторметил)-4-(4-метоксистирил)бензол (C155)
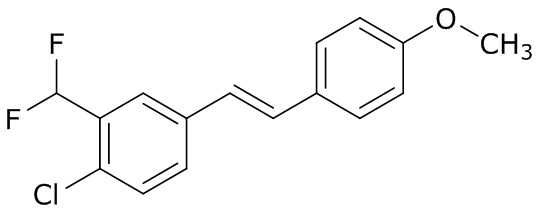
Выделяли в виде грязно-белого твердого вещества (12 г, 94%): 1H ЯМР (300 МГц, CDCl3) δ 7,75 (s, 1H), 7,51-7,44 (m, 3H), 7,37 (d, J=8,4 Гц, 1H), 7,13 (d, J=6,6 Гц, 1H), 7,06 (s, 1H), 6,95-6,89 (m, 3H), 3,95 (s, 3H); 19F ЯМР (282 МГц, CDCl3) δ -115,31; ESIMS масса/заряд 295 ([M+H]+).
(E)-1-(Дифторметил)-3-фтор-5-(4-метоксистирил)бензол (C156)

Выделяли в виде грязно-белого твердого вещества (20 г, 75%); 1H ЯМР (300 МГц, CDCl3) δ 7,46 (d, J=8,0 Гц, 2H), 7,38 (s, 1H), 7,28 (s, 1H), 7,08 (t, J=16,2 Гц, 2H), 6,92 (t, J=15,6 Гц, 3H), 6,63 (t, J=56,0 Гц, 1H), 3,84 (s, 3H); ESIMS масса/заряд 279 ([M+H]+).
(E)-2-(Дифторметил)-1-фтор-4-(4-метоксистирил)бензол (C157)
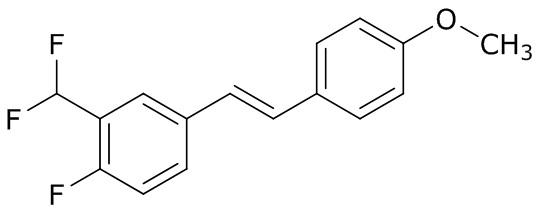
Выделяли в виде грязно-белого твердого вещества (14,0 г, 70%): 1H ЯМР (300 МГц, CDCl3) δ 7,69 (d, J=9,0 Гц, 1H), 7,57-7,53 (m, 1H), 7,45 (d, J=9,9 Гц, 2H), 7,13-7,06 (m, 2H), 7,00-6,89 (m, 4H), 3,85 (s, 3H); ESIMS масса/заряд 279 ([M+H]+).
(E)-2-Хлор-1-(дифторметил)-4-(4-метоксистирил)бензол (C158)
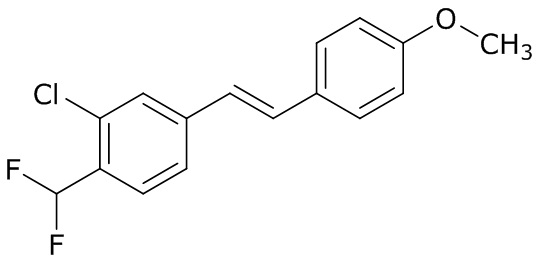
Выделяли в виде грязно-белого твердого вещества (18,0 г, 90%): 1H ЯМР (400 МГц, CDCl3) δ 7,61 (d, J=8,0 Гц, 1H), 7,51 (s, 1H), 7,47-7,43 (m, 3H), 7,14-7,07 (m, 1H), 6,94-6,80 (m, 4H), 3,85(s, 3H); ESIMS масса/заряд 294 ([M+H]+).
(E)-1-(Дифторметил)-2-фтор-4-(4-метоксистирил)бензол (C159)
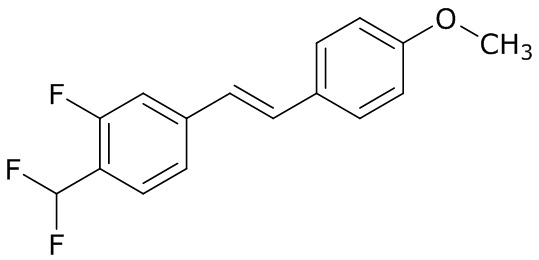
Выделяли в виде бледно-желтого твердого вещества (9 г, 55%): 1H ЯМР (400 МГц, CDCl3) δ 7,54 (t, J=8,0 Гц, 1H), 7,46 (d, J=8,8 Гц, 2H), 7,32 (d, J=8,0 Гц, 1H), 7,22 (d, J=11,6 Гц, 1H), 7,11 (d, J=16,4 Гц, 1H), 7,01-6,83 (m, 4H), 3,95 (s, 3H); 19F ЯМР (376 МГц, CDCl3) δ -113,57, -114,25, -120,33; ESIMS масса/заряд 279 ([M+H]+).
(E)-1-(Дифторметил)-3-(4-метоксистирил)бензол (C160)
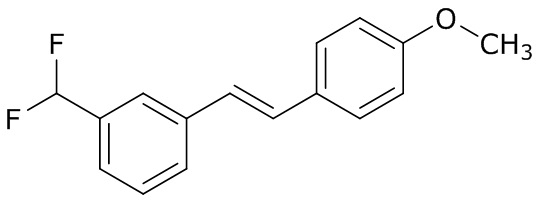
Выделяли в виде бледно-желтого твердого вещества (6 г, 68%): 1H ЯМР (300 МГц, CDCl3) δ 7,62-7,56 (m, 2H), 7,48-7,34 (m, 4H), 7,11 (d, J=16,5 Гц, 1H), 7,00 (s, 1H), 6,95-6,89 (t, 2H), 6,66 (t, 1H), 3,95 (s, 3H); 19F ЯМР (282 МГц, CDCl3) δ -110,84; ESIMS масса/заряд 261 ([M+H]+).
(E)-1-(Дифторметил)-4-(4-метоксистирил)бензол (C161)
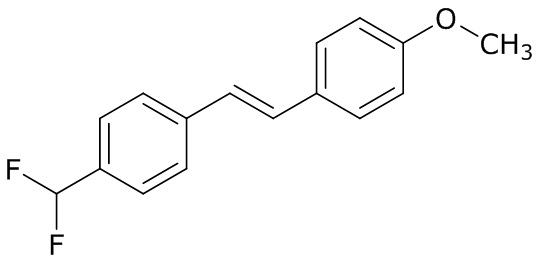
Выделяли в виде грязно-белого твердого вещества (15,4 г, 75%): 1H ЯМР (300 МГц, CDCl3) δ 7,57-7,45 (m, 6H), 7,12 (d, J=15,9 Гц, 1H), 7,00-6,89 (m, 3H), 6,64 (t, J=57 Гц, 1H), 3,92 (s, 3H); ESIMS масса/заряд 260,17 ([M+H]+).
Пример 55. Получение гидрохлорида 3-аминоциклобутан-1-она (C162)
К раствору трет-бутил(3-оксоциклобутил)карбамата (1,0 г, 5,1 ммоль) в дихлорметане (34 мл) при 23°C добавляли 4 M раствор хлористоводородной кислоты в 1,4-диоксане (6,4 мл, 26 ммоль). Реакционную смесь перемешивали при 23°C в течение 24 часов. Реакционную смесь концентрировали с получением указанного в заголовке соединения в виде грязно-белого порошка (0,620 г, 100%): 1H ЯМР (400 МГц, DMSO-d6) δ 8,55 (br s, 3H), 3,92 (m, 1H), 3,44-3,34 (m, 2H), 3,32-3,22 (m, 2H).
Пример 56. Получение 2-хлор-N-(2,2-дифторциклопропил)-5-нитробензамида (C163)
К раствору 2-хлор-5-нитробензойной кислоты (0,2 г, 0,992 ммоль) в сухом дихлорметане (4 мл), охлажденному в ледяной бане, добавляли 1 каплю N,N-диметилформамида с последующим добавлением оксалилхлорида (0,130 мл, 1,488 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Гидрохлорид 2,2-дифторциклопропанамина (0,257 г, 1,984 ммоль) и триэтиламин (0,691 мл, 4,96 ммоль) по отдельности суспендировали в дихлорметане (4 мл). Взвесь охлаждали на ледяной бане и медленно добавляли раствор хлорангидрида. Полученную смесь нагревали до комнатной температуры в течение ночи. Реакционную смесь концентрировали под пониженным давлением и остаток разделяли между этилацетатом и хлористоводородной кислотой (1 н.). Фазы разделяли и органический слой промывали хлористоводородной кислотой (1 н.), затем насыщенным водным раствором бикарбоната натрия, а затем солевым раствором. Органический слой концентрировали и остаток очищали колоночной хроматографией с применением 0-30% этилацетат/гексаны с получением указанного в заголовке соединения в виде белого твердого вещества (0,058 г, 21%): 1H ЯМР (400 МГц, CDCl3) δ 8,57 (d, J=2,7 Гц, 1H), 8,26 (dd, J=8,8, 2,8 Гц, 1H), 7,63 (d, J=8,8 Гц, 1H), 6,53 (s, 1H), 3,70-3,52 (m, 1H), 2,05-1,91 (m, 1H), 1,62-1,48 (m, 1H); IR (тонкая пленка) 3268, 1661, 1538 см-1; ESIMS масса/заряд 277 ([M+H]+).
Пример 57. Получение (1R,3R)-2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоновой кислоты (C164)
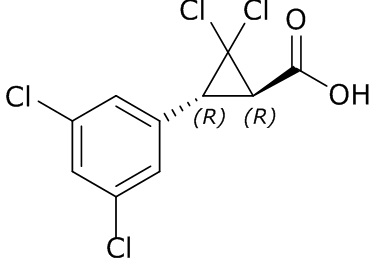
1ое разделение. (R)-1-Фенилэтанамин (6,49 г, 53,0 ммоль) медленно добавляли к перемешанному раствору rac-2,2-дихлор-3-(3,5-дихлорфенил)циклопропанкарбоновой кислоты) (32,45 г, 106 ммоль) в ацетоне (106 мл). Полученный раствор перемешивали при 45°C. После начала осаждения твердого вещества смесь выдерживали при 5°C в течение 4 часов. Твердое вещество собирали, промывали минимальным количеством холодного ацетона и высушивали. Белую твердую соль разбавляли этилацетатом (100 мл) и промывали водным раствором хлористоводородной кислоты (1 н., 10 мл) и солевым раствором (30 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке продукта в виде белого твердого вещества (10,33 г, 88% энантиомерный избыток «ee»).
2ое разделение. (R)-1-Фенилэтанамин (3,4 г, 28 ммоль) медленно добавляли к перемешанному раствору rac-2,2-дихлор-3-(3,5-дихлорфенил)циклопропан-карбоновой кислоты) (10,33 г, 88% ee) в ацетоне (100 мл). Через 2 часа твердое вещество собирали, промывали минимальным количеством холодного ацетона и высушивали. Твердое вещество обрабатывали водным раствором хлористоводородной кислоты с получением указанного в заголовке соединения в виде белого твердого вещества (7,84 г, 97% ee, 24,2%). Удельное вращение: +47,4 (10 мг/мл в ацетонитриле, 589 нм, 25,2°C); 1H ЯМР (300 МГц, CDCl3) δ 7,36 (t, J=1,9 Гц, 1H), 7,17 (dd, J=1,9, 0,7 Гц, 2H), 3,48-3,37 (m, 1H), 2,87 (d, J=8,3 Гц, 1H); 13C ЯМР (400 МГц, DMSO-d6) δ 166,28, 136,40, 133,39, 127,27, 127,04, 61,36, 37,10, 35,98; ESIMS масса/заряд 298,9 ([M-H]-).
ee определяли с помощью способа хиральной HPLC следующим образом: колонка: CHIRALPAK@ ZWIX(+), размер частиц 3 мкм, размер 3 мм x 150 мм, DAIC 511584; подвижная фаза: 49% ацетонитрил/49% метанол/вода с 50 мM муравьиной кислоты и диэтиламином; скорость потока: 0,5 мл/мин.; время: 9 мин.; температура: 25°C.
Следующие соединения получали аналогично процедуре, указанной в примере 57 .
(1R,3R)-2,2-Дихлор-3-(3,4-дихлорфенил)циклопропан-1-карбоновая кислота (C165)

Выделяли в виде белого твердого вещества (6,7 г, 30%, 96% ee). Аналитические данные соответствуют рацемической кислоте C3.
(1R,3R)-2,2-Дихлор-3-(3-хлор-4-фторфенил)циклопропан-1-карбоновая кислота (C166)

Выделяли в виде белого твердого вещества (0,5 г, 13%, 99% ee). Аналитические данные соответствуют рацемической кислоте C16.
(1R,3R)-2,2-Дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоновая кислота (C167)
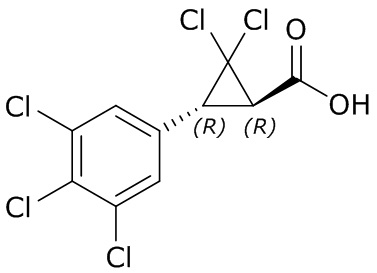
Выделяли в виде белого твердого вещества (2 г, 29%, 99% ee). Аналитические данные соответствуют рацемической кислоте C2.
Пример 58. (1S,3S)-2,2-Дихлор-3-(3,5-дихлорфенил)циклопропан-1-карбоновая кислота (C168)

Исходный раствор из 1ого разделения R,R-кислоты (из примера 33) концентрировали и растворяли в ацетоне (~100 мл) и нагревали до 45°C. При перемешивании путем вращения добавляли (S)-1-фенилэтанамин (5,0 г, 41,2 ммоль, 0,8 экв.) добавляли. Полученный раствор перемешивали при 45°C. После начала осаждения твердого вещества смесь выдерживали при 5°C в течение 2 часов. Твердое вещество собирали, промывали минимальным количеством холодного ацетона и высушивали под вакуумом при 35°C. Твердое вещество обрабатывали с помощью HCl (водн.) с получением свободной S,S-кислоты в виде белого твердого вещества (9,87 г, 85% ee, выход 59%). Посредством второго разделения 85% ee объединенной S,S-кислоты (13,45 г, 41,7 ммоль, 85% ee) с применением такой же процедуры с (S)-1-фенилэтанамином (3,8 г, 31,3 ммоль, 0,75 экв.) получали S,S-кислоту в виде белого твердого вещества (8,53 г, 26% ee, выход 99%). Удельное вращение: -51,9 (10 мг/мл в ACN, 589 нм, 25,2°C). Аналитические данные соответствуют рацемической кислоте C1.
ee определяли с помощью способа хиральной HPLC следующим образом: колонка: CHIRALPAK@ ZWIX(+), размер частиц 3 мкм, размер 3 мм x 150 мм, DAIC 511584; подвижная фаза: 49% ацетонитрил/49% метанол/вода с 50 мM муравьиной кислоты и диэтиламином; скорость потока: 0,5 мл/мин.; время: 9 мин.; температура: 25°C.
Следующие соединения получали аналогично процедуре, указанной в примере 58 .
(1S,3S)-2,2-Дихлор-3-(3,4-дихлорфенил)циклопропан-1-карбоновая кислота (C169)
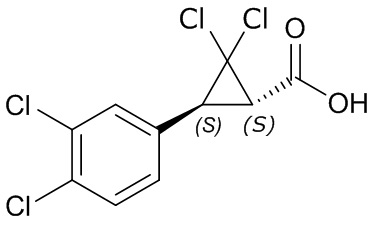
Выделяли в виде белого твердого вещества (7 г, 35%, 98% ee). Аналитические данные соответствуют рацемической кислоте C3.
(1S,3S)-2,2-Дихлор-3-(3-хлор-4-фторфенил)циклопропан-1-карбоновая кислота (C170)
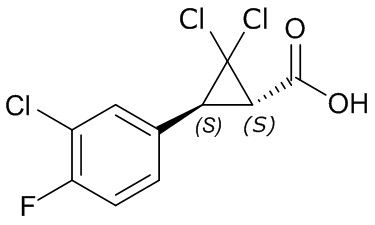
Выделяли в виде белого твердого вещества (0,64 г, 27%, 98% ee). Аналитические данные соответствуют рацемической кислоте C16.
(1S,3S)-2,2-Дихлор-3-(3,4,5-трихлорфенил)циклопропан-1-карбоновая кислота (C171)
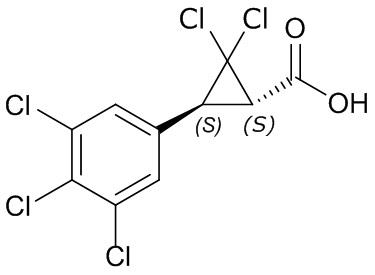
Выделяли в виде белого твердого вещества (0,75 г, 41%, 99% ee). Аналитические данные соответствуют рацемической кислоте C2.
Отмечают, что некоторые реагенты и условия реакций могут не соответствовать определенным функциональным группам, которые могут присутствовать в определенных молекулах формулы один или определенных молекулах, применяемых при получении определенных молекул формулы один. В таких случаях может быть необходимым использование стандартных протоколов введения и удаления защитных групп, описанных в полном объеме в литературе и хорошо известных специалисту в данной области техники. Кроме того, для завершения синтеза необходимых молекул в некоторых случаях может быть необходимым осуществление дополнительных стандартных стадий синтеза, не описанных в данном документе. Специалисту в данной области техники также будет понятно, что возможным является обеспечение синтеза необходимых молекул посредством осуществления некоторых стадий путей синтеза в порядке, отличном от описанного порядка. Специалисту в данной области также будет понятно, что возможным является осуществление взаимопревращений стандартных функциональных групп или реакций замещения в необходимых молекулах с введением или модификацией заместителей.
Биологические анализы
Следующие биоанализы в отношении совки малой (Spodoptera exigua), совки ни (Trichoplusia ni), тли персиковой зеленой (Myzus persicae) и желтолихорадочного комара (Aedes aegypti) включены в настоящий документ из-за ущерба, который причиняют эти животные. Кроме того, совка малая и совка ни являются двумя хорошими видами-индикаторами для широкого ряда жующих вредителей. Более того, тля персиковая зеленая является хорошим видом-индикатором для широкого ряда питающихся соком растений вредителей. Результаты с этими тремя видами-индикаторами вместе с желтолихорадочным комаром показывают широкую применимость молекул формулы один для контроля вредителей в типах членистоногие, моллюски и нематоды (Drewes и соавт.).
Пример A. Биоанализы с использованием совки малой (Spodoptera exigua, LAPHEG) («BAW») и совки ни (Trichoplusia ni, TRIPNI) («CL»)
Совка малая является серьезным представляющим экономический интерес вредителем люцерны, спаржи, видов свеклы, цитрусовых, кукурузы, хлопчатника, видов лука, видов гороха, видов перца, видов картофеля, видов сои, видов сахарной свеклы, видов подсолнечника, табака и видов томатов, помимо прочих сельскохозяйственных культур. Она является местной для Юго-Восточной Азии, но на данный момент встречается в Африке, Австралии, Японии, Северной Америке и Южной Европе. Личинки могут собираться в большие скопления для питания, вызывая значительные потери урожая. Они, как известно, устойчивы к некоторым пестицидам.
Совка ни является серьезным вредителем, встречающимся по всему миру. Она поражает люцерну, виды фасоли, виды свеклы, брокколи, брюссельскую капусту, капусту, канталупу, цветную капусту, сельдерей, виды браунколи, хлопчатник, виды огурца, баклажан, капусту кормовую, салат-латук, виды дыни, горчицу, петрушку, виды гороха, виды перца, виды картофеля, виды сои, шпинат, тыкву, виды томата, виды репы и виды арбуза, помимо прочих сельскохозяйственных культур. Эти виды являются весьма губительными для растений из-за их прожорливости. Личинки каждый день потребляют в три раза больше своего веса. Места поедания отличаются большим накоплением липкого, влажного, фекального материала, который может способствовать более высокому уровню заболеваемости, за счет чего вызывая вторичные проблемы в месте произрастания растений. Они, как известно, устойчивы к некоторым пестицидам.
Следовательно, в связи с вышеуказанными факторами важен контроль этих вредителей. Кроме того, молекулы, с помощью которых осуществляют контроль этих вредителей (BAW и CL), которые известны как жующие вредители, будут пригодны при контроле других вредителей, которые жуют растения.
Некоторые молекулы, раскрытые в данном документе, тестировали в отношении BAW и CL, используя процедуры, описанные в следующих примерах. При описании результатов использовали «Оценочную таблицу для BAW и CL» (см. раздел с таблицами).
Биоанализы с использованием BAW
Биоанализы с использованием BAW проводили с помощью кормления в 128-луночном планшете. Личинки BAW, возрастом одна-пять секунд, помещали в каждую лунку (3 мл) планшета с пищевым рационом, которые предварительно заполняли примерно 1,5 мл искусственного пищевого рациона, в который вносили 50 мкг/см2 тестовой молекулы (растворенной в 50 мкл смеси 90:10 ацетон-вода) (в каждую из восьми лунок), а затем обеспечивали высыхание. Планшеты накрывали прозрачным самоклеющимся покрытием, проделывали отверстия для обеспечения газообмена и выдерживали при 25°C, 14:10 света-темноты в течение пяти-семи дней. Процент смертности регистрировали для личинок в каждой лунке; активность в восьми лунках затем усредняли. Результаты указаны в таблице под названием «Таблица ABC: биологические результаты» (см. раздел с таблицами).
Биоанализ с использованием CL
Биоанализы с использованием CL проводили с помощью кормления в 128-луночном планшете. Личинки CL, возрастом одна-пять секунд, помещали в каждую лунку (3 мл) планшета с пищевым рационом, которые предварительно заполняли 1 мл искусственного пищевого рациона, в который вносили 50 мкг/см2 тестовой молекулы (растворенной в 50 мкл смеси 90:10 ацетон-вода) (в каждую из восьми лунок), а затем обеспечивали высыхание. Планшеты накрывали прозрачным самоклеющимся покрытием, проделывали отверстия для обеспечения газообмена и выдерживали при 25°C, 14:10 света-темноты в течение пяти-семи дней. Процент смертности регистрировали для личинок в каждой лунке; активность в восьми лунках затем усредняли. Результаты указаны в таблице под названием «Таблица ABC: биологические результаты» (см. раздел с таблицами).
Пример B. Биоанализ с использованием тли персиковой зеленой (Myzus persicae, MYZUPE) («GPA»).
GPA является наиболее значительным вредителем-тлей на персиковых деревьях, вызывающим снижение интенсивности роста, сморщивание листьев и отмирание различных тканей. Она также опасна, поскольку она выступает в качестве переносчика вирусов растений, таких как вирус Y картофеля и вирус скручивания листьев картофеля, на представителей семейства пасленовых/картофелевых Solanaceae и различных мозаичных вирусов на многие другие пищевые сельскохозяйственные культуры. GPA поражает такие растения как брокколи, лопух, капуста, морковь, цветная капуста, дайкон, баклажан, виды зеленой фасоли, салат-латук, макадамия, папайя, виды перца, виды батата, виды томата, кресс водяной и цуккини, помимо прочих сельскохозяйственных культур. GPA также поражает многие декоративные культуры, такие как гвоздика, хризантема, цветущая капуста белокочанная, пуансеттия и виды розы. GPA развила стойкость к многим пестицидам. В настоящее время это вредитель, который имеет третье наибольшее количество зарегистрированных случаев стойкости насекомых (Sparks и соавт.). Следовательно, в связи с вышеуказанными факторами важен контроль этого вредителя. Кроме того, молекулы, с помощью которых осуществляют контроль этого вредителя (GPA), который известен как питающийся соком вредитель, пригодны при контроле других вредителей, которые питаются соком растений.
Некоторые молекулы, раскрытые в данном документе, тестировали в отношении GPA, используя процедуры, описанные в следующем примере. При описании результатов использовали «Оценочную таблицу для GPA и YFM» (см. раздел с таблицами).
Проростки капусты, выращенные в 3-дюймовых горшках, с 2-3 небольшими (3-5 см) истинными листьями, использовали в качестве тестового субстрата. Проростки инфицировали с помощью 20-50 GPA (на стадиях бескрылой взрослой особи и нимфы) за один день перед применением химического вещества. Четыре горшка с отдельными проростками использовали для каждой обработки. Тестовые молекулы (2 мг) растворяли в 2 мл растворителя ацетон/метанол (1:1), получая маточные растворы с концентрацией 1000 ppm тестовой молекулы. Маточные растворы разбавляли 5X с помощью 0,025% Tween 20 в воде с получением раствора с концентрацией 200 ppm тестовой молекулы. Ручной аспираторного типа распылитель использовали для распыления раствора на обе стороны листьев капусты до стекания. Контрольные растения (проверка растворителя) обрызгивали только разбавителем, содержащим 20% растворителя ацетон/метанол (1:1) по объему. Обработанные растения выдерживали в камере для выдерживания в течение трех дней при примерно 25°C и относительной влажности (RH) окружающей среды перед оцениванием. Оценку проводили путем подсчета количества живых тлей на растение под микроскопом. Процент контроля измеряли с помощью поправочной формулы Аббота (W. S. Abbott, ʺA Method of Computing the Effectiveness of an Insecticideʺ J. Econ. Entomol. 18 (1925), pp. 265-267) как указано далее. Скорректированный % контроля=100 * (X - Y)/X, где X=количество живых тлей на растениях с проверкой растворителя, а Y=количество живых тлей на обработанных растениях. Результаты указаны в таблице под названием «Таблица ABC: биологические результаты» (см. раздел с таблицами).
Пример C. Биоанализ с использованием желтолихорадочного комара (Aedes aegypti, AEDSAE) («YFM»).
YFM предпочитает питаться находясь на человеческих особях в дневное время и наиболее часто встречается в местах обитания человека или вблизи них. YFM является переносчиком нескольких заболеваний. Он является москитом, который может распространять вирусы лихорадки денге и желтой лихорадки. Желтая лихорадка является вторым наиболее опасным заболеванием, переносимым москитами, после малярии. Желтая лихорадка представляет собой острое вирусное геморрагическое заболевание и до 50% сильно пораженных людей без лечения умрут от желтой лихорадки. Установлено 200000 случаев желтой лихорадки, вызывающих 30000 смертей во всем мире каждый год. Лихорадка денге представляет собой опасное вирусное заболевание; ее иногда называют «костоломной лихорадкой» или «лихорадкой разбитого сердца» из-за сильной боли, которую она может вызвать. Лихорадка денге убивает приблизительно 20000 людей каждый год. Следовательно, в связи с вышеуказанными факторами важен контроль этого вредителя. Кроме того, молекулы, с помощью которых осуществляют контроль этого вредителя (YFM), который известен как сосущий вредитель, пригодны при контроле других вредителей, которые вызывают заболевания людей и животных.
Некоторые молекулы, раскрытые в данном документе, тестировали в отношении YFM, используя процедуры, описанные в следующем параграфе. При описании результатов использовали «Оценочную таблицу для GPA и YFM» (см. раздел с таблицами).
Использовали основные планшеты, содержащие 400 мкг молекулы, растворенной в 100 мкл диметилсульфоксида (DMSO) (эквивалентно раствору с концентрацией 4000 ppm). Основной планшет объединенных молекул содержал 15 мкл на лунку. В этот планшет в каждую лунку добавляли 135 мкл смеси 90:10 воды/ацетона. Робот запрограммирован переносить 15 мкл материала, полученного в результате аспирации, из основного планшета в пустой 96-луночный неглубокий планшет («дочерний» планшет). Существует 6 повторений («дочерних» планшетов), полученных на основной. Созданные «дочерние» планшеты затем сразу же инфицировали личинками YFM.
За день до обработки планшетов яйца москитов помещали в воду Millipore, содержащую порошок печени, чтобы начать вылупление (4 г в 400 мл). После получения «дочерних» планшетов с помощью робота, их инфицировали с помощью 220 мкл смеси порошок печени/личинки москитов (личинки возрастом приблизительно 1 день). После инфицирования планшетов личинками москитов для покрытия планшета для снижения высыхания использовали препятствующую испарению крышку. Планшеты выдерживали при комнатной температуре в течение 3 дней перед оцениванием. Через 3 дня каждую лунку изучали и оценивали, исходя из смертности. Результаты указаны в таблице под названием «Таблица ABC: биологические результаты» (см. раздел с таблицами).
Приемлемые с точки зрения сельского хозяйства соли присоединения кислоты, производные солей, сольваты, сложноэфирные производные, полиморфы, изотопы и радионуклиды
Молекулы формулы один можно составлять в приемлемые с точки зрения сельского хозяйства соли присоединения кислоты. В качестве неограничивающего примера, аминная функциональная группа может образовывать соли с хлористоводородной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксилметансульфоновой и гидроксиэтансульфоновой кислотами. Кроме того, в качестве неограничивающего примера, кислотная функциональная группа может образовывать соли, в том числе полученные из щелочных или щелочноземельных металлов и полученные из аммиака и аминов. Примеры предпочтительных катионов включают натрий, калий и магний.
Молекулы формулы один можно составлять в производные солей. В качестве неограничивающего примера, производные солей можно получать путем приведения свободного основания в контакт с достаточным количеством требуемой кислоты с получением соли. Свободное основание можно регенерировать посредством обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный раствор гидроксида натрия, карбоната калия, аммиака и бикарбоната натрия. В качестве примера во многих случаях пестицид, такой как 2,4-D, делают более растворимым в воде путем превращения его в его диметиламинную соль.
Молекулы формулы один можно составлять в стабильные комплексы с растворителем таким образом, что комплекс остается целым после удаления не задействованного в комплексе растворителя. Эти комплексы часто называют «сольватами». Однако особенно желательно образовывать стабильные гидраты с водой в качестве растворителя.
Молекулы формулы один, содержащие кислотную функциональную группу, можно получать в виде сложноэфирных производных. Эти сложноэфирные производные можно затем использовать таким же образом, как используют молекулы, раскрытые в данном документе.
Молекулы формулы один можно получать в виде различных кристаллических полиморфов. Полиморфизм важен для разработки агрохимикатов, поскольку различные кристаллические полиморфы или структуры одной молекулы могут иметь весьма различные физические свойства и биологические характеристики.
Молекулы формулы один можно получать с различными изотопами. Особенно важными являются молекулы с 2H (также известным как дейтерий) или 3H (также известным как тритий) вместо 1H. Молекулы формулы один можно получать с различными радионуклидами. Особенно важными являются молекулы с 14C (также известным как радиоактивный углерод). Молекулы формулы один с дейтерием, тритием или 14C можно использовать в биологических исследованиях, обеспечивая прослеживание в химических и физиологических процессах, и исследованиях периода полураспада, а также исследованиях MoA.
Комбинации
В другом варианте осуществления настоящего изобретения молекулы формулы один можно использовать в комбинации (например, в сложной смеси или при одновременном или последовательном применении) с одним или более активными ингредиентами.
В другом варианте осуществления настоящего изобретения молекулы формулы один можно использовать в комбинации (например, в сложной смеси или при одновременном или последовательном применении) с одним или более активными ингредиентами, при этом каждый имеет MoA который одинаков, аналогичен, но скорее - отличен от MoA молекул формулы один.
В другом варианте осуществления молекулы формулы один можно использовать в комбинации (например, в сложной смеси или при одновременном или последовательном применении) с одной или более молекулами с акарицидными, альгицидными, авицидными, бактерицидными, фунгицидными, гербицидными, инсектицидными, моллюскоцидными, нематоцидными, родентицидными и/или вирулицидными свойствами.
В другом варианте осуществления молекулы формулы один можно использовать в комбинации (например, в сложной смеси или при одновременном или последовательном применении) с одной или более молекулами, которые представляют собой антифиданты, отпугивающие птиц вещества, хемостерилизаторы, антидоты гербицидов, аттрактанты для насекомых, отпугивающие насекомых вещества, отпугивающие млекопитающих вещества, средства для дезориентации самцов, активаторы роста растений, регуляторы роста растений и/или синергисты.
В другом варианте осуществления молекулы формулы один можно также использовать в комбинации (например, в сложной смеси или при одновременном или последовательном применении) с одним или более биопестицидами.
В другом варианте осуществления в комбинациях пестицидных композиций молекулу формулы один и активный ингредиент можно использовать в широком спектре весовых соотношений. Например, в двухкомпонентной смеси в отношении весового соотношения молекулы формулы один и активного ингредиента можно использовать весовые соотношения из таблицы B. Однако, в общем, предпочтительны весовые соотношения от менее приблизительно 10:1 до приблизительно 1:10. Также иногда предпочтительно использовать трех-, четырех-, пяти-, шести-, семикомпонентную смесь или смесь с большим количеством компонентов, содержащую молекулу формулы один и дополнительные два или более активных ингредиентов.
Весовые соотношения молекулы формулы один и активного ингредиента можно также отображать как X:Y; где X представляет собой весовые части молекулы формулы один, а Y представляет собой весовые части активного ингредиента. Диапазон числовых значений весовых частей для X составляет 0 < X ≤ 100, а весовых частей для Y составляет 0 < Y ≤ 100 и показан наглядно в таблице C. В качестве неограничивающего примера, весовое соотношение молекулы формулы один и активного ингредиента может составлять 20:1.
Диапазоны весовых соотношений молекулы формулы один и активного ингредиента можно отображать как от X1:Y1 до X2:Y2, где X и Y определены выше.
В одном варианте осуществления диапазон весовых соотношений может составлять от X1:Y1 до X2:Y2, где X1 > Y1 и X2 < Y2. В качестве неограничивающего примера, диапазон весовых соотношений молекулы формулы один и активного ингредиента может составлять от 3:1 до 1:3, включая конечные точки.
В другом варианте осуществления диапазон весовых соотношений может составлять от X1:Y1 до X2:Y2, где X1 > Y1 и X2 > Y2. В качестве неограничивающего примера, диапазон весовых соотношений молекулы формулы один и активного ингредиента может составлять от 15:1 до 3:1, включая конечные точки.
В другом варианте осуществления диапазон весовых соотношений может составлять от X1:Y1 до X2:Y2, где X1 < Y1 и X2 < Y2. В качестве неограничивающего примера, диапазон весовых соотношений молекулы формулы один и активного ингредиента может составлять от приблизительно 1:3 до приблизительно 1:20, включая конечные точки.
Составы
Пестицид во множестве случаев не подходит для применения в его чистой форме. Обычно необходимо добавлять другие вещества, чтобы пестицид можно было использовать в необходимой концентрации и в подходящей форме, обеспечивая удобство применения, эксплуатации, транспортировки, хранения и максимальную пестицидную активность. Таким образом, пестициды составляют, например, в приманки, концентрированные эмульсии, пылевидные препараты, эмульгируемые концентраты, препараты для окуривания, гели, гранулы, микрокапсулы, препараты для обработки семян, суспензионные концентраты, суспоэмульсии, таблетки, водорастворимые жидкости, диспергируемые в воде гранулы или сухие текучие вещества, смачиваемые порошки и растворы в сверхнизком объеме.
Пестициды применяют наиболее часто в виде водных суспензий или эмульсий, полученных из концентрированных составов таких пестицидов. Такие водорастворимые, суспендируемые в воде или эмульгируемые составы являются либо твердыми веществами, обычно известными как смачиваемые порошки, диспергируемые в воде гранулы, жидкостями, обычно известными как эмульгируемые концентраты, либо водными суспензиями. Смачиваемые порошки, которые можно прессовать с получением диспергируемых в воде гранул, содержат тщательно перемешанную смесь пестицида, носителя и поверхностно-активных веществ. Концентрация пестицида обычно составляет от приблизительно 10% до приблизительно 90% по весу. Носитель обычно выбирают среди видов аттапульгитовой глины, видов монтмориллонитовой глины, видов диатомитовой земли или очищенных силикатов. Эффективные поверхностно-активные вещества, составляющие от приблизительно 0,5% до приблизительно 10% смачиваемого порошка, выбирают среди сульфированных лигнинов, конденсированных нафталинсульфонатов, нафталинсульфонатов, алкилбензолсульфонатов, алкилсульфатов и неионогенных поверхностно-активных веществ, таких как аддукты этиленоксида и алкилфенолов.
Эмульгируемые концентраты пестицидов содержат целесообразную концентрацию пестицида, такую как от приблизительно 50 до приблизительно 500 грамм на литр жидкости, растворенных в носителе, который является или смешиваемым с водой растворителем, или смесью несмешиваемого с водой органического растворителя и эмульгаторов. Пригодные органические растворители включают ароматические соединения, в частности ксилолы и нефтяные фракции, в частности высококипящие нафталиновые и олефиновые фракции нефти, такие как тяжелый обогащенный ароматическими соединениями лигроин. Можно также использовать другие органические растворители, такие как терпеновые растворители, в том числе производные канифоли, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульгируемых концентратов выбирают из традиционных анионных и неионогенных поверхностно-активных веществ.
Водные суспензии предусматривают суспензии нерастворимых в воде пестицидов, диспергированных в водном носителе при концентрации в диапазоне от приблизительно 5% до приблизительно 50% по весу. Суспензии получают путем тонкого измельчения пестицида и энергичного примешивания его в носитель, состоящий из воды и поверхностно-активных веществ. Ингредиенты, такие как неорганические соли и синтетические или природные камеди, также можно добавлять для повышения плотности и вязкости водного носителя. Часто наиболее эффективно измельчать и смешивать пестицид одновременно путем получения водной смеси и гомогенизации ее в приборе, таком как песчаная мельница, шаровая мельница или гомогенизатор поршневого типа. Пестицид в суспензии может быть микроинкапсулирован в пластиковый полимер.
Масляные дисперсии (OD) предусматривают суспензии нерастворимых в органическом растворителе пестицидов, тонко диспергированных в смеси органического растворителя и эмульгаторов при концентрации в диапазоне от приблизительно 2% до приблизительно 50% по весу. Один или более пестицидов можно растворять в органическом растворителе. Пригодные органические растворители включают ароматические соединения, в частности ксилолы и нефтяные фракции, в частности высококипящие нафталиновые и олефиновые фракции нефти, такие как тяжелый обогащенный ароматическими соединениями лигроин. Другие растворители могут включать растительные масла, масла из семян и сложные эфиры растительных масел и масел из семян. Подходящие эмульгаторы для масляных дисперсий выбирают из традиционных анионных и неионогенных поверхностно-активных веществ. Загустители или гелеобразующие вещества добавляют в состав масляных дисперсий для модификации реологических свойств или свойств текучести жидкости и для предотвращения разделения и осаждения диспергированных частиц или капель.
Пестициды можно также применять в виде гранулированных композиций, которые особенно пригодны для применений в отношении почвы. Гранулированные композиции обычно содержат от приблизительно 0,5% до приблизительно 10% пестицида по весу, диспергированного в носителе, который содержит глину или аналогичное вещество. Такие композиции обычно получают посредством растворения пестицида в подходящем растворителе и нанесения его на гранулированный носитель, который был предварительно сформован в частицы соответствующего размера, в диапазоне от приблизительно 0,5 мм до приблизительно 3 мм. Такие композиции можно также составлять путем получения теста или пасты из носителя и молекулы, а затем дробления и высушивания с получением желаемого размера гранулированных частиц. Другая форма гранул представляет собой эмульгируемые в воде гранулы (EG). Это состав, состоящий из гранул, подлежащих применению в качестве традиционной эмульсии активного(-ых) ингредиента(-ов) типа «масло в воде», либо растворенного(-ых), либо разведенного(-ых) в органическом растворителе, после разрушения и растворения в воде. Эмульгируемые в воде гранулы содержат один или несколько активных ингредиентов, либо растворенных, либо разведенных в подходящем органическом растворителе, которые абсорбируются водорастворимой полимерной оболочкой или некоторым другим типом растворимой или нерастворимой матрицы.
Пылевидные препараты, содержащие пестицид, получают посредством тщательного смешивания пестицида в порошкообразной форме с подходящим пылевидным сельскохозяйственным носителем, таким как каолиновая глина, измельченный вулканит и т. п. Пылевидные препараты могут подходящим образом содержать от приблизительно 1% до приблизительно 10% пестицида. Пылевидные препараты можно применять в качестве средства для протравливания семян или в качестве средства для внекорневого внесения с помощью опыливателя.
Также на практике применяют пестицид в форме раствора в подходящем органическом растворителе, обычно минеральном масле, таком как инсектицидные масла, которые широко используются в агрохимии.
Пестициды также можно применять в форме аэрозольной композиции. В таких композициях пестицид растворяют или диспергируют в носителе, который является смесью газов-вытеснителей. Аэрозольную композицию упаковывают в контейнер, из которого смесь распределяется через распылительный клапан.
Пестицидные приманки образуют при смешивании пестицида с пищей или аттрактантом или как с тем, так и с другим. Когда вредители съедают приманку, они при этом поглощают пестицид. Приманкам можно придавать форму гранул, гелей, текучих порошков, жидкостей или твердых веществ. Приманки можно использовать в местах скопления вредителей.
Препараты для окуривания представляют собой пестициды, которые имеют относительно высокое давление паров и, таким образом, могут существовать в виде газа в достаточных концентрациях для уничтожения вредителей в почве или замкнутых пространствах. Токсичность препарата для окуривания пропорциональна его концентрации и времени воздействия. Они характеризуются хорошей способностью к диффузии и действуют путем проникновения в дыхательную систему вредителя или при абсорбции через кутикулу вредителя. Препараты для окуривания применяют для контроля вредителей в хранящихся продуктах под газонепроницаемыми листами, в герметичных комнатах или зданиях или в специальных камерах.
Пестициды могут быть микроинкапсулированы путем суспендирования частиц или капель пестицида в пластиковых полимерах различных типов. Путем изменения химических свойств полимера или изменения факторов при обработке, можно получать микрокапсулы различных размеров, растворимости, толщины стенки и степеней проницаемости. Эти факторы определяют скорость, с которой активный ингредиент в нем высвобождается, что, в свою очередь, влияет на остаточные характеристики, скорость действия и запах продукта. Микрокапсулы можно составлять в виде суспензионных концентратов или диспергируемых в воде гранул.
Концентраты, представляющие собой масляные растворы, получают посредством растворения пестицида в растворителе, который будет удерживать пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрые снижение численности и уничтожение вредителей, чем другие составы, из-за того, что сами растворители имеют пестицидное действие и растворение воскообразной оболочки покрова повышает скорость поглощения пестицида. Другие преимущества масляных растворов включают лучшую стабильность при хранении, лучшее проникание в бороздки и лучшую адгезию к жирным поверхностям.
Другой вариант осуществления представляет собой эмульсию типа «масло в воде», где эмульсия содержит масляные шарики, каждый из которых имеет ламеллярное жидкокристаллическое покрытие и диспергирован в водной фазе, где каждый масляной шарик содержит по меньшей мере одну молекулу, которая является активной с точки зрения сельского хозяйства, и отдельно покрыт одноламелярным или олиголамеллярным слоем, содержащим (1) по меньшей мере одно неионогенное липофильное поверхностно-активное вещество, (2) по меньшей мере одно неионогенное гидрофильное поверхностно-активное вещество и (3) по меньшей мере одно ионогенное поверхностно-активное вещество, где глобулы имеют средний диаметр частиц, составляющий менее 800 нанометров.
Другие компоненты состава
В общем, когда молекулы, раскрытые в формуле один, используют в составе, такой состав также может содержать другие компоненты. Эти компоненты включают без ограничения (это неполный и невзаимоисключающий список) увлажнители, вещества, способствующие распределению, клейкие вещества, смачивающие вещества, буферы, связывающие вещества, снижающие смещение вещества, вещества, обуславливающие совместимость, пеногасители, очищающие вещества и эмульгаторы. Несколько компонентов описано далее.
Увлажняющее вещество представляет собой вещество, которое при добавлении в жидкость повышает распределение или проникающую способность жидкости путем снижения межфазного натяжения между жидкостью и поверхностью, по которой она распределяется. Увлажняющие вещества используют из-за двух основных функций в агрохимических составах: при обработке и производстве для повышения скорости смачиваемости порошков в воде с получением концентратов для растворимых жидкостей или суспензионных концентратов; и при смешивании продукта с водой в распылителе для снижения времени смачивания смачиваемых порошков и для улучшения проникания воды в диспергируемые в воде гранулы. Примерами увлажняющих веществ, используемых в составах смачиваемого порошка, суспензионного концентрата и диспергируемых в воде гранул, являются лаурилсульфат натрия; диоктилсульфосукцинат натрия; алкилфенолэтоксилаты и этоксилаты алифатических спиртов.
Диспергирующее вещество представляет собой вещество, которое абсорбируется на поверхности частиц, помогает сохранять состояние дисперсии частиц и предотвращает их повторную агрегацию. Диспергирующие вещества добавляют в агрохимические составы для облегчения диспергирования и суспендирования при изготовлении и для обеспечения повторного диспергирования частиц в воде в распылителе. Они широко используются в смачиваемых порошках, суспензионных концентратах и диспергируемых в воде гранулах. Поверхностно-активные вещества, которые используют в качестве диспергирующих веществ, обладают способностью сильно абсорбироваться на поверхности частицы и обеспечивать заряженный или стерический барьер для повторной агрегации частиц. Наиболее часто используемые поверхностно-активные вещества представляют собой анионные, неионогенные или смеси двух типов. Для составов смачиваемого порошка наиболее распространенными диспергирующими веществами являются лигносульфонаты натрия. Для суспензионных концентратов очень хорошую адсорбцию и стабилизацию получают с помощью полиэлектролитов, таких как конденсаты формальдегида сульфоната нафталина натрия. Также используют тристирилфенолэтоксилатфосфатные сложные эфиры. Неионогенные вещества, такие как конденсаты алкиларилэтиленоксида и блок-сополимеры EO-PO, иногда объединяют с анионными веществами в качестве диспергирующих веществ для суспензионных концентратов. В последние годы новые типы полимерных поверхностно-активных веществ с очень высокой молекулярной массой были разработаны в качестве диспергирующих веществ. Они имеют очень длинные гидрофобные «скелеты» и большое число этиленоксидных цепочек, образующих «зубья» «гребня» поверхностно-активного вещества. Эти высокомолекулярные полимеры могут придавать очень хорошую длительную стабильность суспензионным концентратам поскольку гидрофобные скелеты имеют много точек крепления на поверхностях частиц. Примерами диспергирующих веществ, пригодных в агрохимических составах, являются лигносульфонаты натрия; конденсаты формальдегида сульфоната нафталина натрия; тристирилфенолэтоксилатфосфатные сложные эфиры; этоксилаты алифатических спиртов; алкилэтоксилаты; блок-сополимеры EO-PO и привитые сополимеры.
Эмульгирующее вещество представляет собой вещество, которое стабилизирует суспензию капель одной жидкой фазы в другой жидкой фазе. Без эмульгирующего вещества две жидкости будут разделяться на две несмешиваемые жидкие фазы. Наиболее часто используемые смеси эмульгаторов содержат алкилфенол или алифатический спирт с двенадцатью или более этиленоксидными звеньями и растворимую в масле кальциевую соль додецилбензолсульфоновой кислоты. Диапазон значений гидрофильно-липофильного баланса («HLB») от приблизительно 8 до приблизительно 18 будет, как правило, обеспечивать хорошие стабильные эмульсии. Стабильность эмульсии можно иногда улучшать добавлением небольшого количества поверхностно-активного вещества на основе блок-сополимера EO-PO.
Солюбилизирующее вещество представляет собой поверхностно-активное вещество, которое будет образовывать мицеллы в воде при концентрациях выше критической концентрации мицелл. Мицеллы затем способны растворять или солюбилизировать нерастворимые в воде материалы внутри гидрофобной части мицеллы. Типы поверхностно-активных веществ, обычно используемых для солюбилизации, представляют собой неионогенные вещества, сорбитанмоноолеаты, этоксилаты сорбитанмоноолеата и сложные эфиры метилолеата.
Поверхностно-активные вещества иногда используют или отдельно, или с другими добавками, такими как минеральные или растительные масла, в качестве вспомогательных веществ для смесей распылителей для улучшения биологических характеристик пестицида в отношении мишени. Типы поверхностно-активных веществ, используемых для повышения биоактивности, зависят в целом от природы и механизма действия пестицида. Однако они часто являются неионогенными веществами, такими как алкилэтоксилаты; этоксилаты линейных алифатических спиртов и этоксилаты алифатических аминов.
Носитель или разбавитель в сельскохозяйственном составе представляет собой материал, добавляемый в пестицид для придания продукту требуемой эффективности. Носители обычно представляют собой материалы с высокой абсорбирующей способностью, тогда как разбавители обычно представляют собой материалы с низкой абсорбирующей способностью. Носители и разбавители используют в составах пылевидных препаратов, смачиваемых порошков, гранул и диспергируемых в воде гранул.
Органические растворители используют, главным образом, в составах эмульгируемых концентратов, эмульсий типа «масло в воде», суспоэмульсий, масляных дисперсий и составах в сверхнизком объеме и, в меньшей степени, в гранулированных составах. Иногда используют смеси растворителей. Первыми основными группами растворителей являются алифатические парафиновые масла, такие как керосин или очищенные парафины. Вторая основная группа (и наиболее распространенная) содержит ароматические растворители, такие как ксилол и высокомолекулярные фракции C9 и C10 ароматических растворителей. Хлорированные углеводороды пригодны в качестве сорастворителей для предотвращения кристаллизации пестицидов, когда состав эмульгируют в воде. Спирты иногда используют в качестве сорастворителей для повышения силы растворителя. Другие растворители могут включать растительные масла, масла из семян и сложные эфиры растительных масел и масел из семян.
Загустители или гелеобразующие вещества используют, главным образом, в составе суспензионных концентратов, масляных дисперсий, эмульсий и суспоэмульсий для модификации реологических свойств или свойств текучести жидкости и для предотвращения разделения и осаждения диспергированных частиц или капель. Загущающие, гелеобразующие и противоосаждающие вещества обычно распределяют на две категории, а именно нерастворимые в воде частицы и растворимые в воде полимеры. Можно получать составы суспензионного концентрата и масляной дисперсии с помощью глин и видов диоксида кремния. Примеры этих типов материалов включают без ограничения монтмориллонит, бентонит, алюмосиликат магния и аттапульгит. Растворимые в воде полисахариды в водных суспензионных концентратах использовали в качестве загущающе-гелеобразующих веществ в течение многих лет. Типы полисахаридов, наиболее часто используемых, представляют собой натуральные экстракты семян и морских водорослей или синтетические производные целлюлозы. Примеры таких типов материалов включают без ограничения гуаровую камедь; камедь бобов рожкового дерева; каррагенан; альгинаты; метилцеллюлозу; карбоксиметилцеллюлозу натрия (SCMC) и гидроксиэтилцеллюлозу (HEC). Другие типы противоосаждающих веществ основаны на видах модифицированного крахмала, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Другим хорошим противоосаждающим веществом является ксантановая камедь.
Микроорганизмы могут вызывать порчу составленных продуктов. Ввиду этого, для устранения или снижения степени их воздействия используют консерванты. Примеры таких веществ включают без ограничения пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую и калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль п-гидроксибензойной кислоты; метил-п-гидроксибензоат и 1,2-бензизотиазолин-3-он (BIT).
Присутствие поверхностно-активных веществ часто вызывает вспенивание составов на водной основе при операциях смешивания при получении и нанесении посредством распылителя. Для снижения склонности к образованию пены часто добавляют пеногасители или на стадии получения, или перед заливкой в бутыли. В целом, существует два типа пеногасителей, а именно силиконы и несиликоны. Силиконы обычно являются водными эмульсиями диметилполисилоксана, тогда как несиликоновые пеногасители являются нерастворимыми в воде маслами, такими как октанол и нонанол, или диоксидом кремния. В обоих случаях функция пеногасителя состоит в вытеснении поверхностно-активного вещества с поверхности раздела фаз воздух-вода.
«Зеленые» вещества (например, вспомогательные вещества, поверхностно-активные вещества, растворители) могут снижать общую степень воздействия на окружающую среду составов для защиты сельскохозяйственных культур. Зеленые вещества являются биоразлагаемыми и, как правило, получены из природных и/или экологичных источников, например источников, относящихся к растениям и животным. Конкретными примерами являются растительные масла, масла из семян и их сложные эфиры, также алкоксилированные алкилполиглюкозиды.
Области применения
Молекулы формулы один можно использовать в любом месте произрастания. Конкретные места произрастания для использования таких молекул включают места произрастания, где растут люцерна, виды миндаля, виды яблони, ячмень, виды фасоли, канола, кукуруза, хлопчатник, виды крестоцветных, разновидности цветов, виды фуража (райграс многолетний пастбищный, суданская трава, высокая овсяница, мятлик луговой и клевер), виды плодовых, салат-латук, виды овса, масличные культуры, виды апельсина, виды арахиса, виды груши, виды перца, виды картофеля, рис, сорго, виды сои, виды земляники, сахарный тростник, виды сахарной свеклы, виды подсолнечника, табак, виды томата, пшеница (например, стекловидная краснозерная озимая пшеница, мягкая краснозерная озимая пшеница, белозерная озимая пшеница, стекловидная краснозерная яровая пшеница и твердая яровая пшеница) и другие ценные сельскохозяйственные культуры или их семена собираются сажать.
Молекулы формулы один также можно использовать там, где растения, такие как сельскохозяйственные культуры, растут и где имеют место низкие уровни (даже если нет фактического присутствия) вредителей, которые могут приносить ущерб таким растениям в коммерческих масштабах. Использование таких молекул в таком месте произрастания приносит пользу растениям, которые будут произрастать в этом месте произрастания. Такие преимущества могут включать без ограничения способствование росту лучшей корневой системы растения; способствование тому, что растение лучше выдерживает тяжелые условия роста; улучшение здоровья растения; повышение урожая растения (например, увеличенная биомасса и/или повышенное содержание ценных ингредиентов); повышение жизненной силы растения (например, улучшенный рост растений и/или более зеленые листья); повышение качества растений (например, повышенное содержание или улучшенный состав определенных ингредиентов) и повышение стойкости растения к абиотическому и/или биотическому стрессу.
Молекулы формулы один можно использовать с сульфатом аммония при выращивании различных растений, поскольку это может обеспечивать дополнительные преимущества.
Молекулы формулы один можно использовать на растениях, в растениях или вокруг растений, генетически модифицированных для экспрессии специальных признаков, таких как белки Bacillus thuringiensis (например, Cry1Ab, Cry1Ac, Cry1Fa, Cry1A.105, Cry2Ab, Vip3A, mCry3A, Cry3Ab, Cry3Bb, Cry34Ab1/Cry35Ab1), других инсектицидных токсинов, или таких, которые экспрессируют стойкость к гербицидам, или таких с «пакетированными» привнесенными генами, экспрессирующими инсектицидные токсины, стойкость к гербицидам, повышение питательности или любые другие полезные признаки.
Молекулы формулы один можно применять в отношении лиственной и/или плодоносной части растений для контроля вредителей. Или такие молекулы будут вступать в непосредственный контакт с вредителем, или вредитель будет поглощать такие молекулы при поедании растения или при извлечении сока или других питательных веществ из растения.
Молекулы формулы один можно также применять в отношении почвы, и при применении таким образом можно контролировать питающихся корнями и стеблями вредителей. Корни могут поглощать такие молекулы, за счет чего осуществляется их перенос в лиственные части растения для контроля наземных жующих и питающихся соком вредителей.
Системное перемещение пестицидов в растениях можно использовать для контроля вредителей на одной части растения путем применения (например, путем опрыскивания места произрастания) молекулы формулы один в отношении другой части растения. Например, контроль питающихся листьями насекомых можно обеспечивать путем капельного орошения или внесения в борозду, путем обработки почвы, например орошением почвы перед или после высаживания, или путем обработки семян растения перед высаживанием.
Молекулы формулы один можно использовать с приманками. Обычно, в случае приманок, приманки помещают в землю, где, например, термиты могут контактировать с приманкой и/или привлекаться ею. Приманки также можно применять на поверхности здания (горизонтальной, вертикальной или наклонной поверхности), где, например, муравьи, термиты, тараканы и мухи могут контактировать с приманкой и/или привлекаться ею.
Молекулы формулы один могут быть инкапсулированы внутри или помещены на поверхность капсулы. Размер капсул может находится в диапазоне от нанометров (диаметр приблизительно 100-900 нанометров) до микрометров (диаметр приблизительно 10-900 микронов).
Молекулы формулы один можно применять в отношении яиц вредителей. Из-за уникальной способности яиц некоторых вредителей выдерживать определенные пестициды, повторное применение таких молекул может быть необходимым для контроля вновь появляющихся личинок.
Молекулы формулы один можно использовать в качестве препаратов для обработки семян. Обработку семян можно применять в отношении всех типов семян, в том числе тех, из которых будут прорастать генетически модифицированные растения с экспрессией специальных признаков. Иллюстративные примеры включают те, которые экспрессируют белки, токсичные для беспозвоночных вредителей, такие как белки Bacillus thuringiensis или другие инсектицидные токсины, те, которые экспрессируют стойкость к гербицидам, как, например, семена «Roundup Ready», или те с «пакетированными» привнесенными генами, экспрессирующими инсектицидные токсины, стойкость к гербицидам, повышение питательности, засухоустойчивость или любые другие полезные признаки. Кроме того, такие обработки семян молекулами формулы один могут дополнительно повышать способность растения лучше выдерживать тяжелые условия роста. Это обеспечивает получение более здорового, более жизнеспособного растения, что может приводить к большей урожайности во время сбора урожая. В общем, как предполагается, от приблизительно 1 грамма таких молекул до приблизительно 500 грамм на 100000 семян обеспечивает хорошие преимущества, как предполагается, количества от приблизительно 10 грамм до приблизительно 100 грамм на 100000 семян обеспечивают лучшие преимущества, и, как предполагается, количества от приблизительно 25 грамм до приблизительно 75 грамм на 100000 семян обеспечивают еще лучшие преимущества.
Молекулы формулы один можно применять с одним или более активными ингредиентами в почвоулучшителе.
Молекулы формулы один можно использовать для контроля эндопаразитов и эктопаразитов в области ветеринарии или в области сохранения видов не относящихся к человеку животных. Такие молекулы можно применять путем перорального введения в виде, например, таблеток, капсул, напитков, гранул, в виде применения в отношении кожи, например погружения, распыления, выливания, нанесения и присыпания порошком, и путем парентерального введения в виде, например, инъекции.
Молекулы формулы один также можно использовать преимущественно для животноводства, например, крупного рогатого скота, цыплят, гусей, коз, свиней, овец и индюков. Их также можно использовать преимущественно для домашних животных, таких как лошади, собаки и коты. Конкретными вредителями, контроль которых обеспечивают, будут мухи, блохи и клещи, которые докучают таким животным. Подходящие составы вводят перорально животным с питьевой водой или кормом. Дозы и составы, которые подходят, зависят от видов.
Молекулы формулы один также можно использовать для контроля паразитических червей, в частности кишечных, у животных, перечисленных выше.
Молекулы формулы один также можно использовать в терапевтических способах для медицинского ухода за людьми. Такие способы включают без ограничения пероральное введение в виде, например, таблеток, капсул, напитков, гранул и нанесение на кожу.
Молекулы формулы один также можно применять в отношении инвазивных вредителей. Вредители по всему миру мигрируют в новую окружающую среду (для такого вредителя) и затем становятся новыми инвазивными видами в такой новой окружающей среде. Такие молекулы также можно использовать в отношении таких новых инвазивных видов для их контроля в такой новой окружающей среде.
Перед тем как пестицид можно будет использовать или продавать, такие пестициды проходят длительный процесс оценки различными государственными органами (местными, региональными, штата, национальными и международными). Множество требуемых данных определяется контролирующими органами и должно направляться посредством формирования и рассмотрения данных регистратором продукта или третьими лицами в интересах регистратора продукта, часто с помощью компьютерного соединения со всемирной компьютерной сетью. Эти государственные органы затем рассматривают такие данные, и если принимают решение об определении безопасности, выдают возможному пользователю или продавцу подтверждение о регистрации продукта. Затем в этой местности, где была выдана и обеспечена регистрация продукта, такой пользователь или продавец может использовать или продавать такой пестицид.
Молекулы согласно формуле один можно тестировать для определения их эффективности в отношении вредителей. Кроме того, исследование способа действия можно проводить для определения имеет ли указанная молекула отличный механизм действия от других пестицидов. Затем, такие полученные данные можно распространять, например, с помощью интернета, третьим лицам.
Следовательно, с учетом вышеуказанного и таблиц из раздела с таблицами, представлены следующие дополнительные неисключительные пункты (D).
1D. Молекула, имеющая следующую формулу

формула один,
где
(A) R1 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(B) R2 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(C) R3 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(D) R4 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(E) R5 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(F) R6 выбран из группы, состоящей из H и (C1-C4)алкила;
(G) R7 выбран из группы, состоящей из H, F, Cl, Br и I;
(H) R8 выбран из группы, состоящей из F, Cl, Br и I;
(I) R9 выбран из группы, состоящей из H и (C1-C4)алкила;
(J) R10 выбран из группы, состоящей из H, (C1-C4)алкила, (C2-C4)алкенила, (C1-C4)галогеналкила, (C1-C4)алкил(C1-C4)алкокси, C(=O)(C1-C4)алкила и (C1-C4)алкоксиC(=O)(C1-C4)алкила;
(K) R11 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(L) R12 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(M) R13 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(N) R14 выбран из группы, состоящей из H, F, Cl, Br, I, CN, NH2, NO2, (C1-C4)алкила, (C3-C6)циклоалкила, (C2-C4)алкенила, (C3-C6)циклоалкенила, (C2-C4)алкинила, (C1-C4)алкокси, (C1-C4)галогеналкила, (C3-C6)галогенциклоалкила, (C2-C4)галогеналкенила, (C3-C6)галогенциклоалкенила, (C1-C4)галогеналкокси, S(C1-C4)алкила, S(O)(C1-C4)алкила, S(O)2(C1-C4)алкила, S(C1-C4)галогеналкила, S(O)(C1-C4)галогеналкила, S(O)2(C1-C4)галогеналкила, (C1-C4)алкил-S(O)2NH2 и (C1-C4)галогеналкил-S(O)2NH2;
(O) R15 выбран из группы, состоящей из H, (C1-C4)алкила, (C2-C4)алкенила, (C1-C4)галогеналкила, (C1-C4)алкил(C1-C4)алкокси, C(=O)(C1-C4)алкила и (C1-C4)алкоксиC(=O)(C1-C4)алкила;
(P) R16 выбран из группы, состоящей из (C3-C8)циклоалкила, азетидинила, 2,5-диоксоимидазолидинила, 2,4-диоксо-1,3-диазаспиро[4.4]нонанилизоксазолидинонила, имидазолидинонила, изоксазолидинонила, морфолинила, оксазолидинонила, оксетанила, пиперазинила, пиперидинила, пиранила, пирролидинила, пирролидинонила, тетрагидрофуранила, тетрагидропиранила, тетрагидротиофенила, тетрагидротиофенил-оксида, тетрагидротиофенил-диоксида, тиетанила, тиетанил-оксида, тиетанил-диоксида и тиоксотиазолидинонила, при этом каждый из циклоалкила, азетидинила, 2,5-диоксоимидазолидинила, 2,4-диоксо-1,3-диазаспиро[4.4]нонанилизоксазолидинонила, имидазолидинонила, изоксазолидинонила, морфолинила, оксазолидинонила, оксетанила, пиперазинила, пиперидинила, пиранила, пирролидинила, пирролидинонила, тетрагидрофуранила, тетрагидропиранила, тетрагидротиофенила, тетрагидротиофенил-оксида, тетрагидротиофенил-диоксида, тиетанила, тиетанил-оксида, тиетанил-диоксида и тиоксотиазолидинонила может быть необязательно замещен одним или более заместителями, выбранными из H, F, Cl, Br, I, CN, NH2, NO2, оксо, (C1-C4)алкила, (C1-C4)галогеналкила, C(=O)O(C1-C4)алкила, (C=O)NH(C1-C4)алкила, (C=O)NH(C1-C4)галогеналкила, C(=O)(C3-C6)циклопропила, C(=O)(C1-C4)галогеналкила, C(=O)(C1-C4)алкил(C1-C4)алкокси и (C1-C4)алкилморфолинила;
(Q) каждый из Q1 и Q2 независимо выбран из группы, состоящей из O и S;
и N-оксиды, приемлемые с точки зрения сельского хозяйства соли присоединения кислоты, производные солей, сольваты, сложноэфирные производные, кристаллические полиморфы, изотопы, разделенные стереоизомеры и таутомеры молекул формулы один.
2D. Молекула согласно пункту 1D, где карбоксамидо и фенил, которые соединены с циклопропаном, находятся в R,R-конфигурации.
3D. Молекула согласно любому из предыдущих пунктов (для ясности 1D и 2D), где R1 выбран из группы, состоящей из H, F и Cl.
4D. Молекула согласно любому из предыдущих пунктов, где R2 выбран из группы, состоящей из H, F, Cl, Br, (C1-C4)алкила и (C1-C4)галогеналкила.
5D. Молекула согласно любому из предыдущих пунктов, где R2 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3.
6D. Молекула согласно любому из предыдущих пунктов, где R3 выбран из группы, состоящей из H, F, Cl, (C1-C4)алкила, (C1-C4)галогеналкила и (C1-C4)галогеналкокси.
7D. Молекула согласно любому из предыдущих пунктов, где R3 выбран из группы, состоящей из H, F, Cl, CH3, CF3 и OCF3.
8D. Молекула согласно любому из предыдущих пунктов, где R4 выбран из группы, состоящей из H, F, Cl, Br, (C1-C4)алкила и (C1-C4)галогеналкила.
9D. Молекула согласно любому из предыдущих пунктов, где R4 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3.
10D. Молекула согласно любому из предыдущих пунктов, где R5 выбран из группы, состоящей из H, F и Cl.
11D. Молекула согласно любому из предыдущих пунктов, где R6 представляет собой H.
12D. Молекула согласно любому из предыдущих пунктов, где R7 представляет собой Cl.
13D. Молекула согласно любому из предыдущих пунктов, где R8 представляет собой Cl.
14D. Молекула согласно любому из предыдущих пунктов, где R9 представляет собой H.
15D. Молекула согласно любому из предыдущих пунктов, где R10 представляет собой H.
16D. Молекула согласно любому из предыдущих пунктов, где R11 представляет собой H.
17D. Молекула согласно любому из предыдущих пунктов, где R12 представляет собой H.
18D. Молекула согласно любому из предыдущих пунктов, где R13 выбран из группы, состоящей из H, Cl и (C1-C4)галогеналкила.
19D. Молекула согласно любому из предыдущих пунктов, где R13 выбран из группы, состоящей из H, F, Cl и CF3.
20D. Молекула согласно любому из предыдущих пунктов, где R14 представляет собой H.
21D. Молекула согласно любому из предыдущих пунктов, где R15 выбран из группы, состоящей из H и (C1-C4)алкила.
22D. Молекула согласно любому из предыдущих пунктов, где R15 выбран из группы, состоящей из H и CH3.
23D. Молекула согласно любому из предыдущих пунктов, где R16 выбран из группы, состоящей из циклопропила, циклобутила, циклопентила, циклогексила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида, при этом каждый из циклопропила, циклобутила, циклопентила, циклогексила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, CN, C(=O)OC(CH3)3 и C(=O)CF3.
24D. Молекула согласно любому из предыдущих пунктов, где Q1 представляет собой O.
25D. Молекула согласно любому из предыдущих пунктов, где Q2 представляет собой O.
26D. Молекула согласно любому из предыдущих пунктов, где указанная молекула выбрана из молекул в таблице 2 и таблице P1.
27D. Молекула согласно любому из предыдущих пунктов, где указанная молекула выбрана из молекул F1-F92, PF1-PF9, PF12, PF14, PF18-PF23, PF28-PF 34, PF36, PF37 и PF41-PF45 в таблице 2.
28D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекулам (для ясности 1D-27D, далее «пункты, относящиеся к молекуле»), дополнительно содержащая носитель.
29D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент.
30D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из акарицидов, альгицидов, антифидантов, авицидов, бактерицидов, отпугивающих птиц веществ, хемостерилизаторов, фунгицидов, антидотов гербицидов, гербицидов, аттрактантов для насекомых, отпугивающих насекомых веществ, инсектицидов, отпугивающих млекопитающих веществ, средств для дезориентации самцов, моллюскоцидов, нематоцидов, активаторов роста растений, регуляторов роста растений, родентицидов, синергистов и вируцидов.
31D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из AIGA.
32D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит AI-1.
33D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит AI-2.
34D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит Lotilaner.
35D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит молекулу, выбранную из таблицы A.
36D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из AIGA-2.
37D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит биопестицид.
38D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов ацетилхолинэстеразы (AChE).
39D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из антагонистов GABA-управляемых хлоридных каналов.
40D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из модуляторов натриевых каналов.
41D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из агонистов никотинового ацетилхолинового рецептора (nAChR).
42D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из аллостерических активаторов никотинового ацетилхолинового рецептора (nAChR).
43D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из активаторов хлоридных каналов.
44D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из имитаторов ювенильного гормона.
45D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из различных неспецифических (относящихся к нескольким сайтам) ингибиторов.
46D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из модуляторов хордотональных органов.
47D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов роста клещей.
48D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из микробных разрушителей мембран средней кишки насекомых.
49D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов митохондриальной АТФ-синтазы.
50D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из разобщающих агентов окислительного фосфорилирования, действующих посредством нарушения протонного градиента.
51D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из блокаторов каналов никотинового ацетилхолинового рецептора (nAChR).
52D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов биосинтеза хитина, типа 0.
53D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов биосинтеза хитина, типа 1.
54D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из средства, нарушающего линьку двукрылых.
55D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из агонистов рецептора экдизона.
56D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из агонистов рецептора октопамина.
57D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов электронного транспорта митохондриального комплекса III.
58D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов электронного транспорта митохондриального комплекса I.
59D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из блокаторов потенциалозависимых натриевых каналов.
60D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов ацетил-CoA-карбоксилазы.
61D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов электронного транспорта митохондриального комплекса IV.
62D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из ингибиторов электронного транспорта митохондриального комплекса II.
63D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из модуляторов рецептора рианодина.
64D. Композиция, содержащая молекулу согласно любому из предыдущих пунктов, относящихся к молекуле, причем указанная композиция дополнительно содержит активный ингредиент, выбранный из группы UN.
65D. Способ контроля вредителя, причем указанный способ включает применение по отношению к месту произрастания пестицидно эффективного количества молекулы согласно любому из относящихся к молекуле пунктов.
66D. Способ контроля вредителя, причем указанный способ включает применение по отношению к месту произрастания пестицидно эффективного количества композиции согласно любому из пунктов 28D-64D.
67D. Способ по любому из пунктов 65D или 66D, где указанный вредитель выбран из группы, состоящей из муравьев, тли, клопов постельных, жуков, щетинохвосток, гусениц, тараканов, сверчков, уховерток, блох, мух, кузнечиков, червовидных личинок, цикадок, вшей, саранчи, личинок насекомых, клещей, нематод, дельфацид, псиллид, пилильщиков, щитовок, чешуйниц, слизней, улиток, пауков, ногохвосток, щитников, симфил, термитов, трипс, иксодовых клещей, ос, белокрылок и проволочников.
68D. Способ по любому из пунктов 65D или 66D, где указанный вредитель представляет собой вредителя, питающегося соком растения.
69D. Способ по любому из пунктов 65D или 66D, где указанный вредитель выбран из группы, состоящей из тли, цикадок, ночных бабочек, щитовок, трипс, псиллид, войлочников, щитников и белокрылок.
70D. Способ по любому из пунктов 65D или 66D, где указанный вредитель выбран из группы, состоящей из отрядов вшей и полужесткокрылых клопов.
71D. Способ по любому из пунктов 65D или 66D, где указанный вредитель выбран из группы, состоящей из Aulacaspis spp., Aphrophora spp., Aphis spp., Bemisia spp., Coccus spp., Euschistus spp., Lygus spp., Macrosiphum spp., Nezara spp. и Rhopalosiphum spp.
72D. Способ по любому из пунктов 65D или 66D, где указанный вредитель представляет собой жующего вредителя.
73D. Способ по любому из пунктов 65D или 66D, где указанный вредитель выбран из группы, состоящей из гусениц, жуков, кузнечиков и саранчи.
74D. Способ по любому из пунктов 65D или 66D, где указанный вредитель выбран из группы, состоящей из жесткокрылых и чешуекрылых.
75D. Способ по любому из пунктов 65D или 66D, где указанный вредитель выбран из группы, состоящей из Anthonomus spp., Cerotoma spp., Chaetocnema spp., Colaspis spp., Cyclocephala spp., Diabrotica spp., Hypera spp., Phyllophaga spp., Phyllotreta spp., Sphenophorus spp., Sitophilus spp.
Заголовки в данном документе предназначены лишь для удобства и не должны использоваться для толкования какой-либо их части.
ТАБЛИЦЫ
ТАБЛИЦА B
Молекула формулы один: активный ингредиент
ТАБЛИЦА C
(Y) весовые части
(X) весовые части
Таблица 2. Структура и способ получения молекул групп F и PF


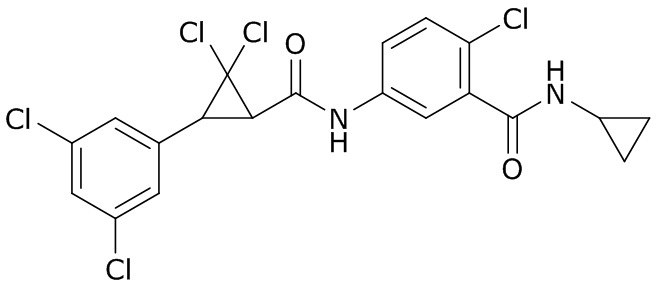




















































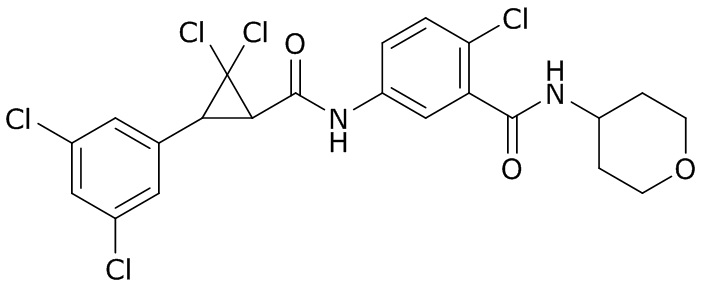
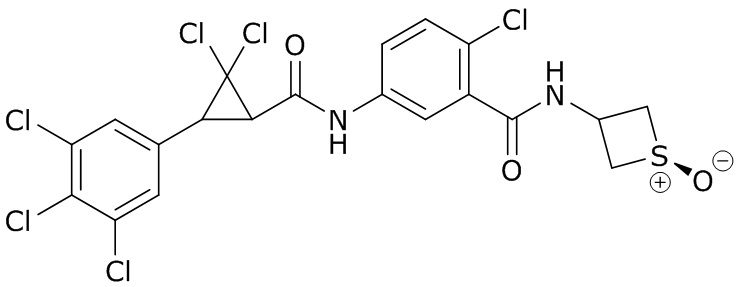
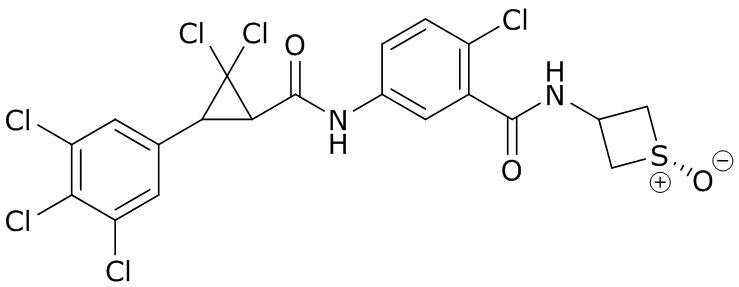



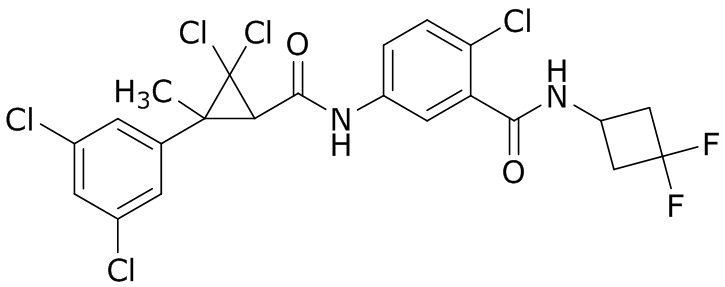

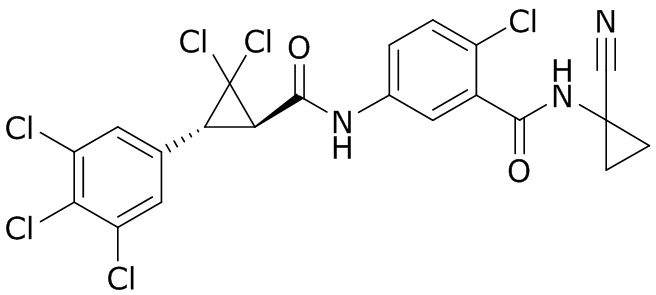
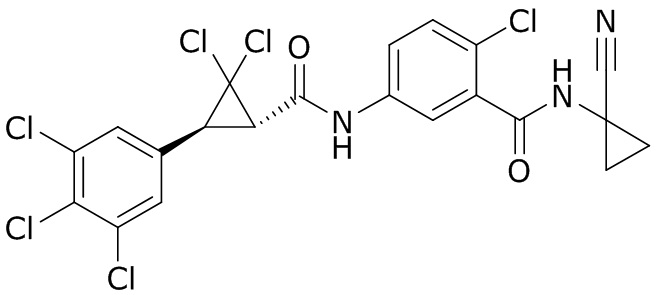

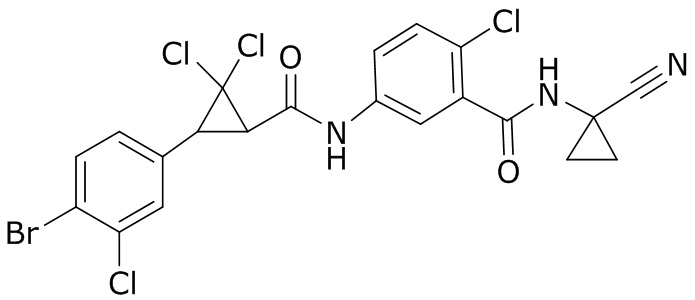
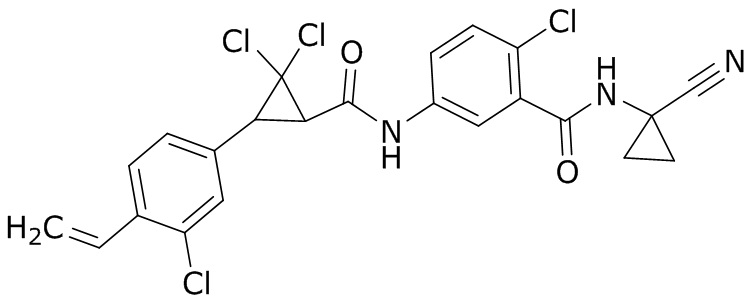
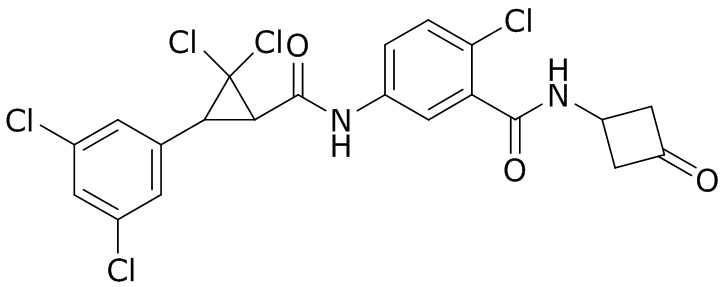
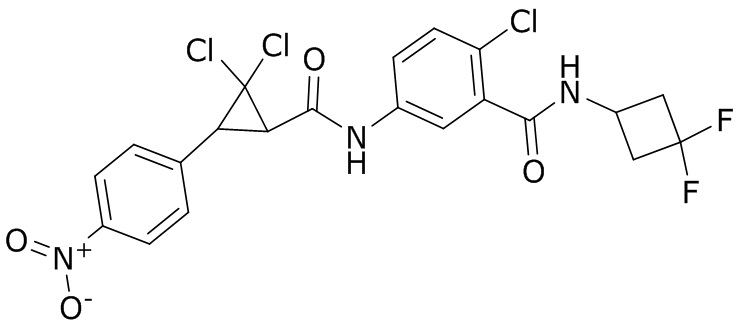
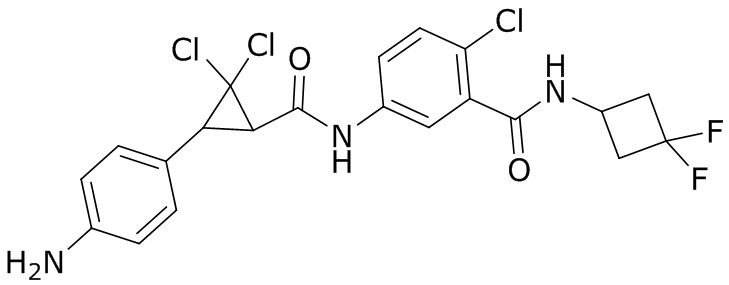
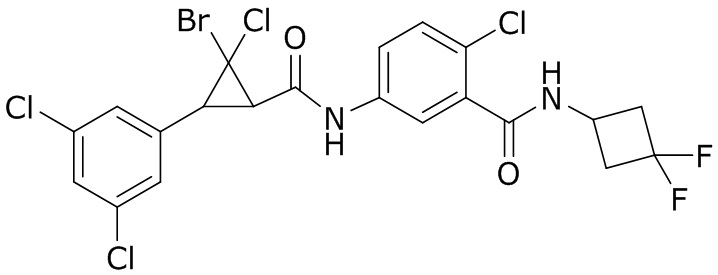
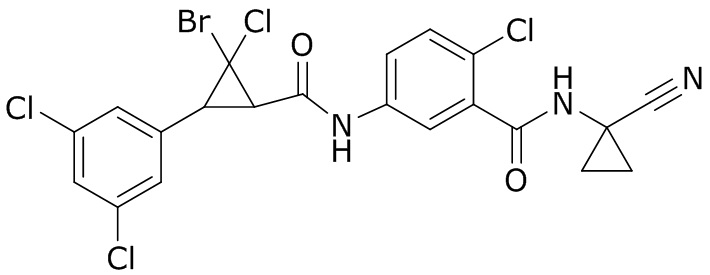
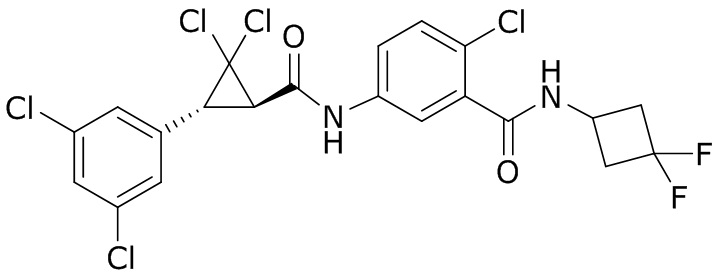
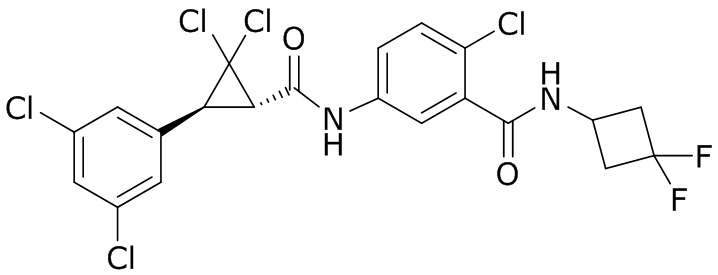
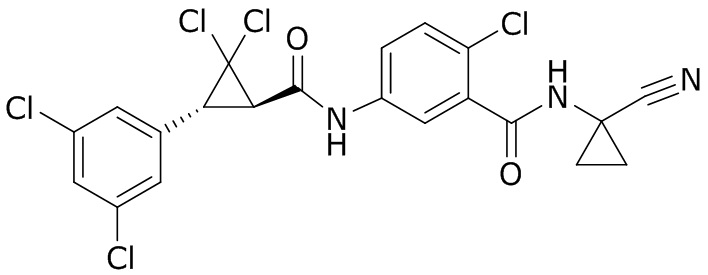
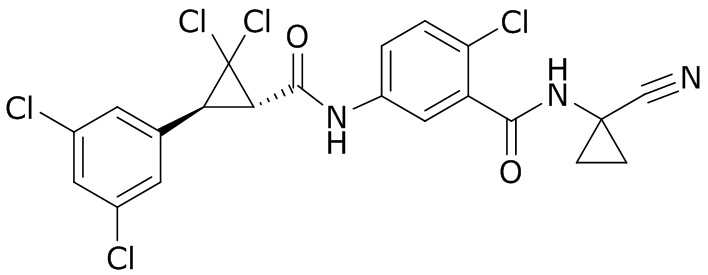


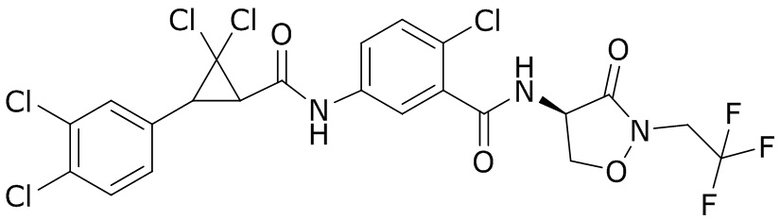


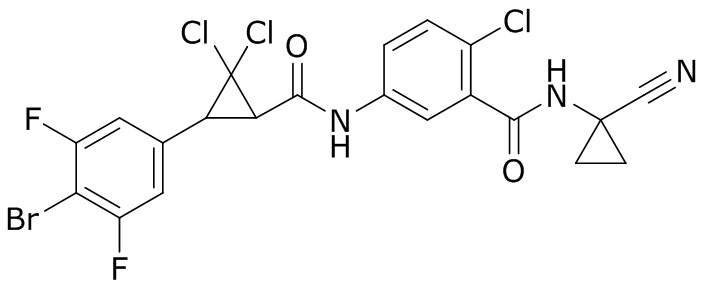

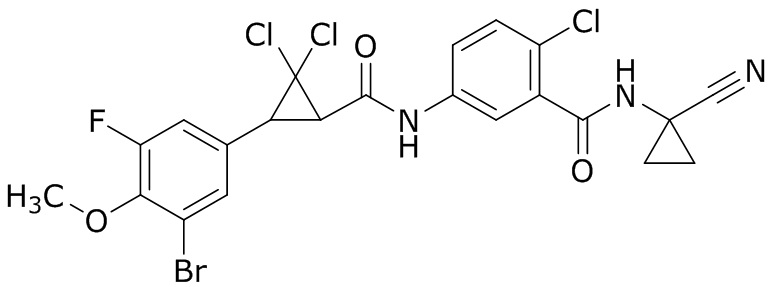
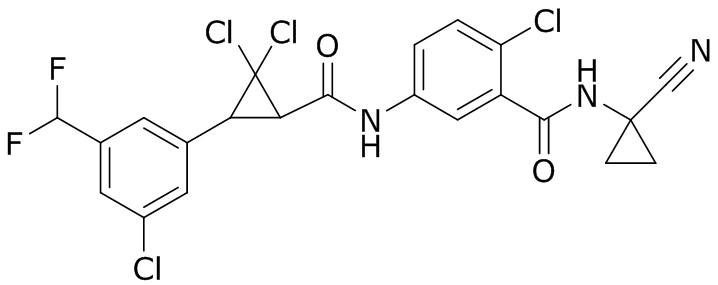
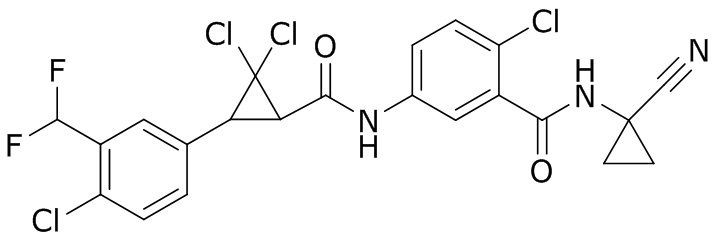
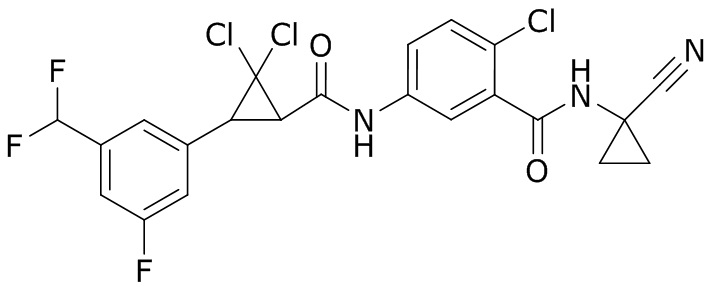
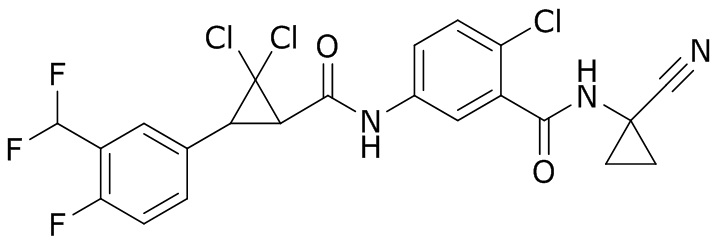

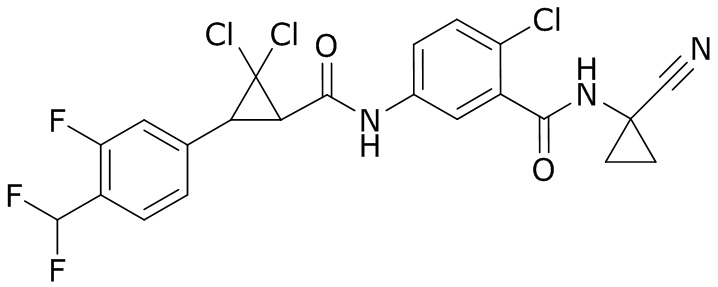
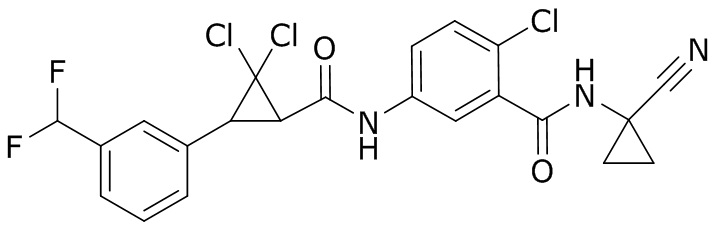


















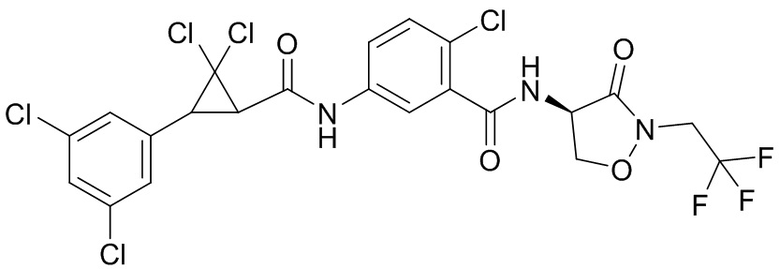










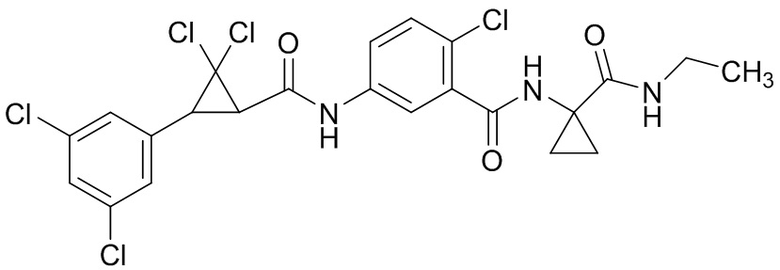

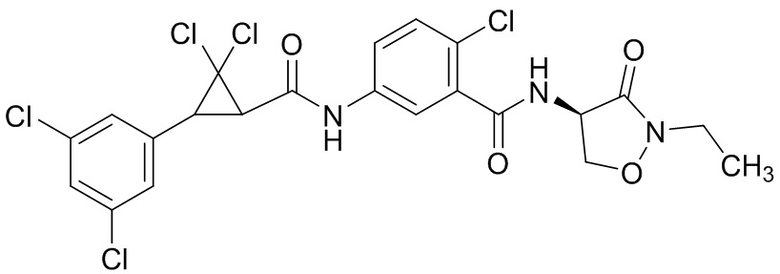
*получено согласно примеру номер
Таблица 3. Структура и способ получения молекул группы C




















































































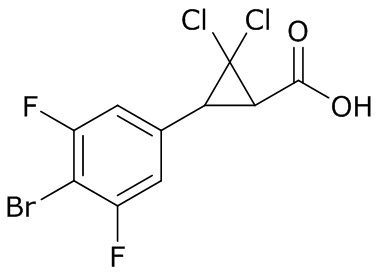
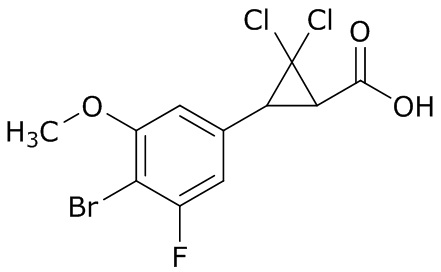
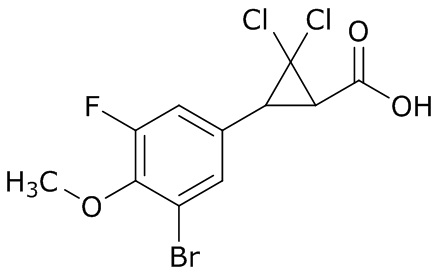
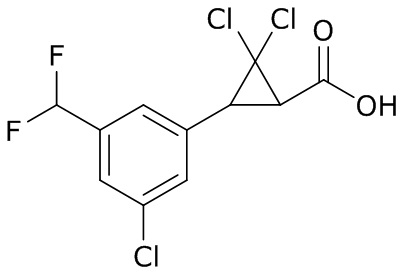
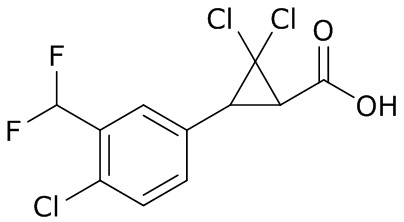
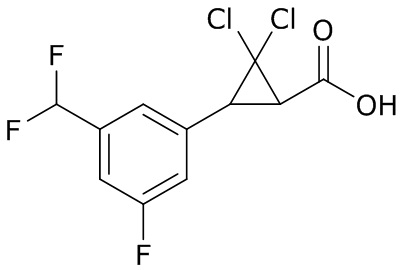
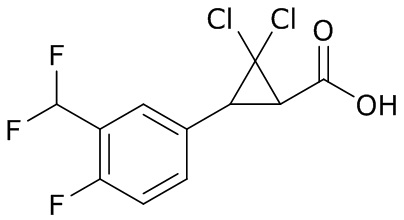
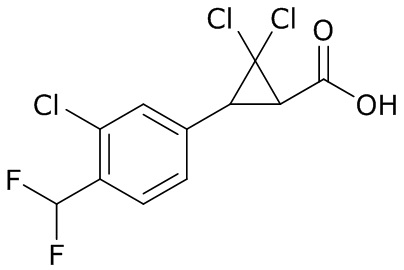

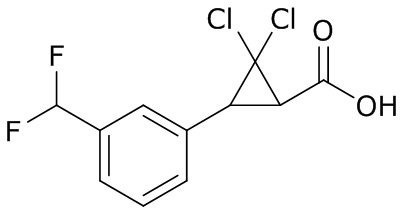

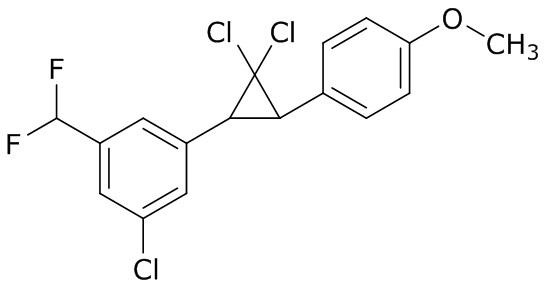

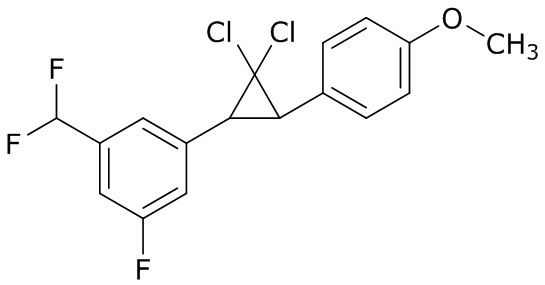
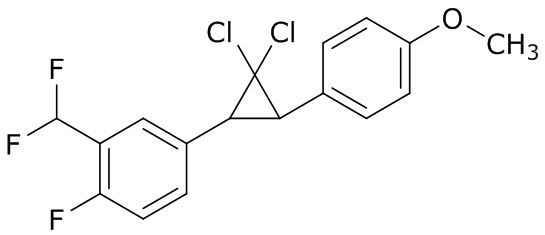
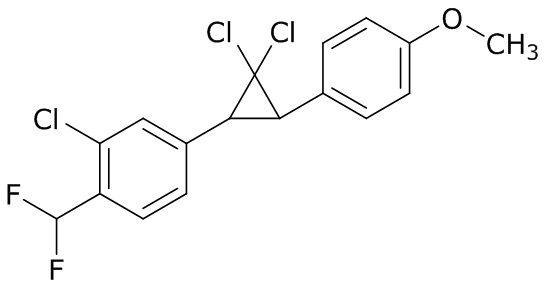

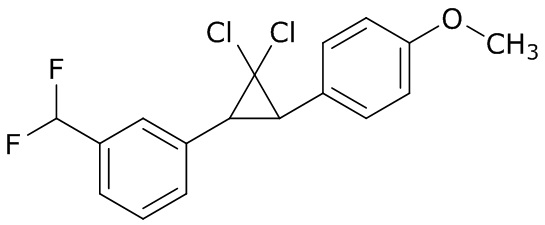


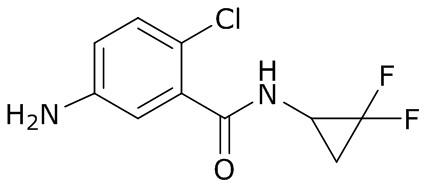

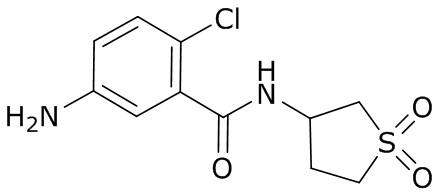


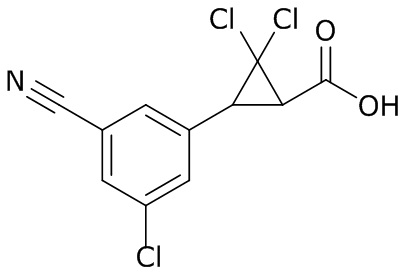
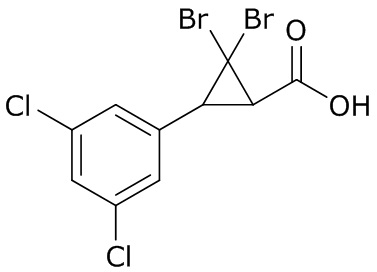
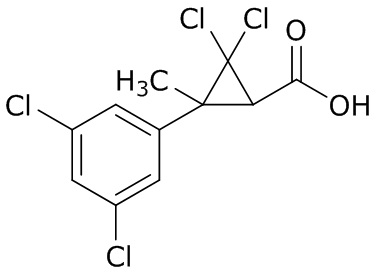
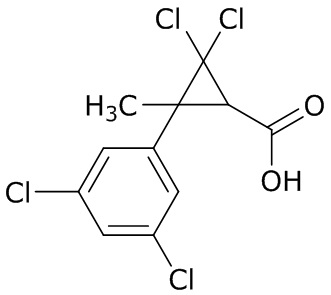
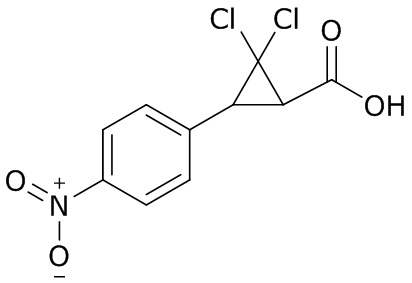
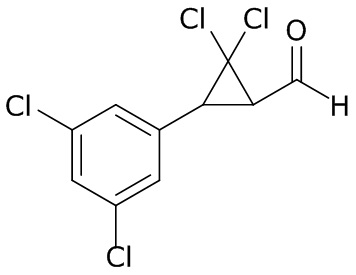
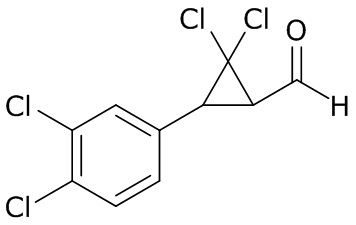


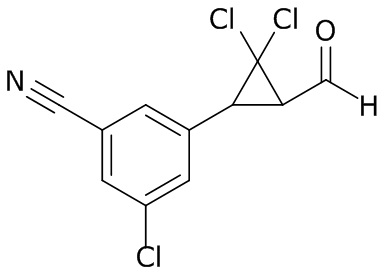

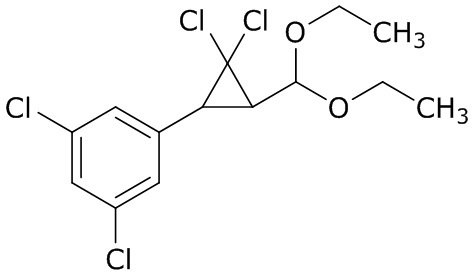
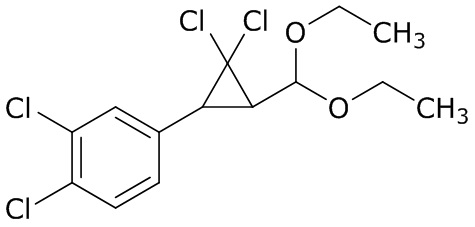
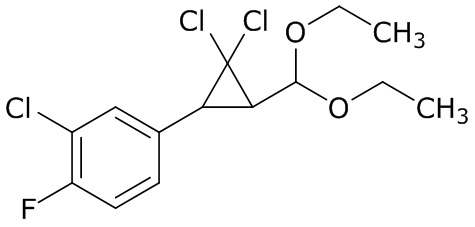


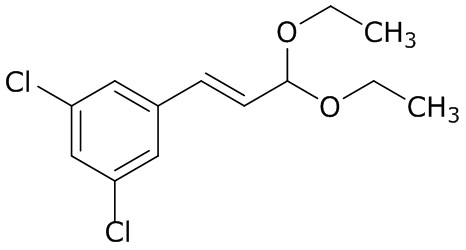

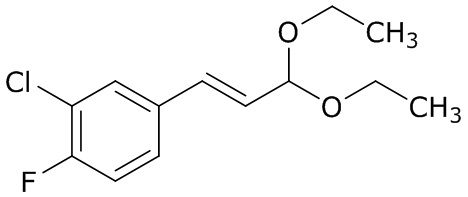



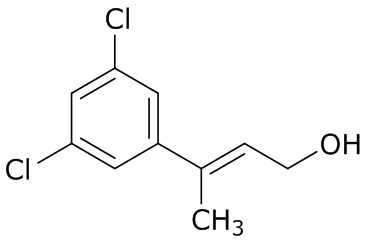


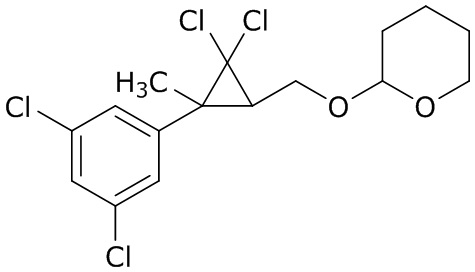
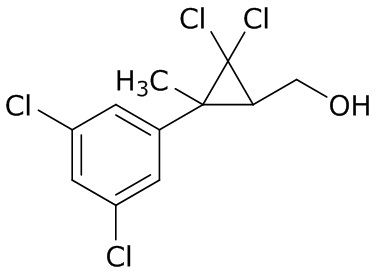
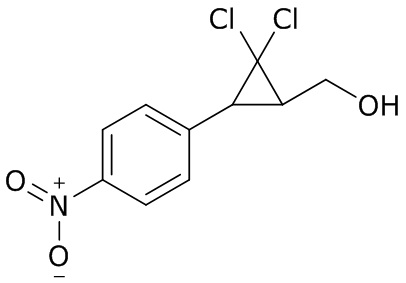
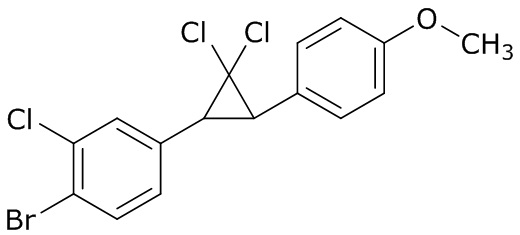
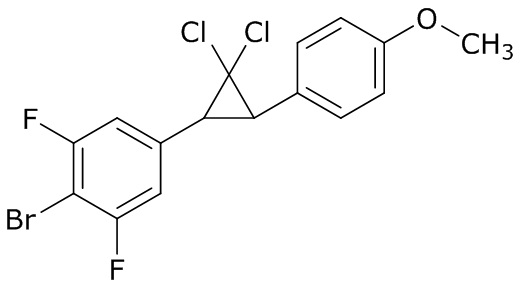

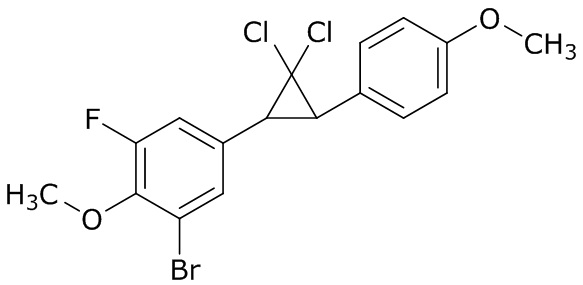
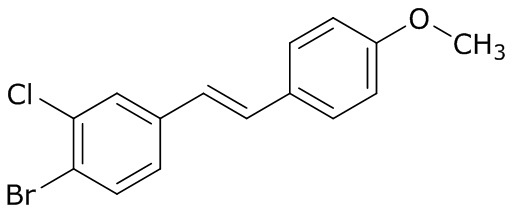
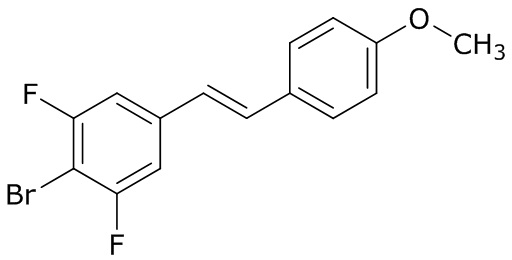
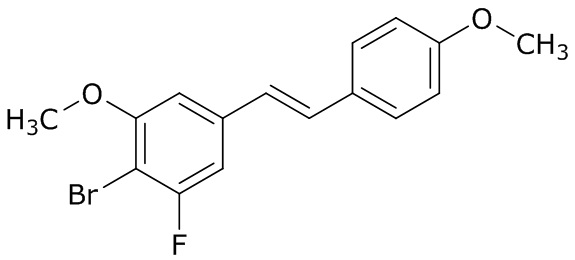

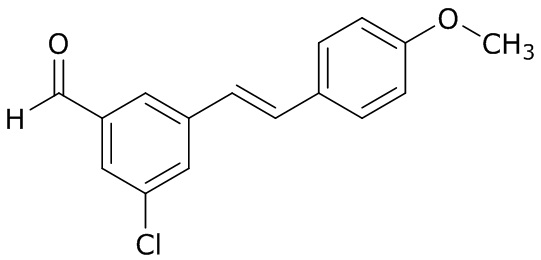

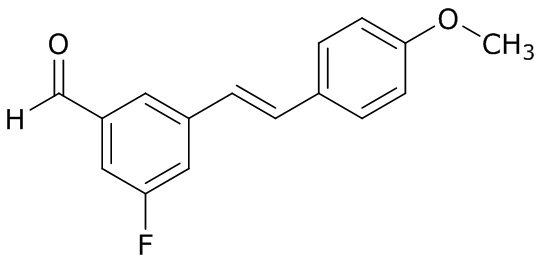
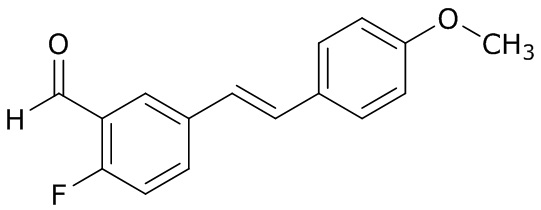
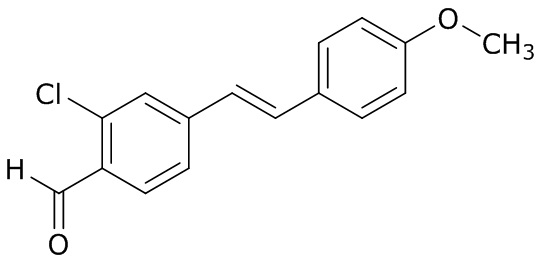
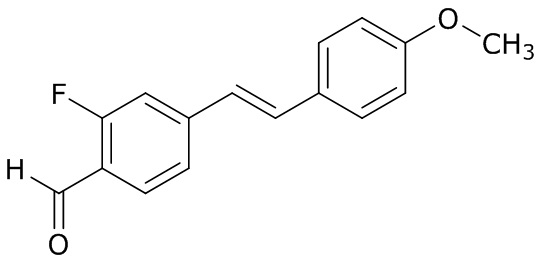


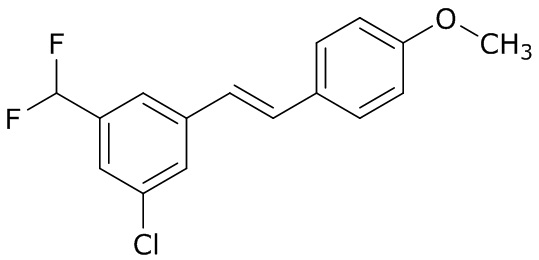
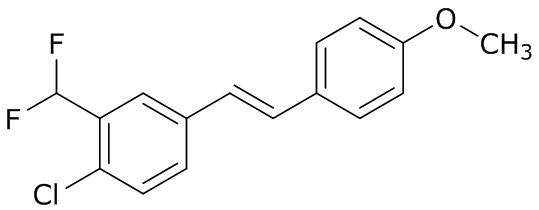


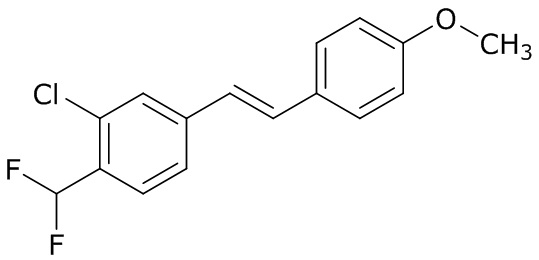
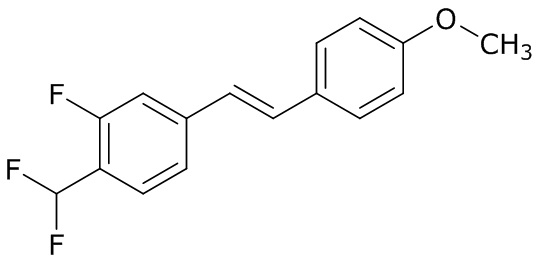
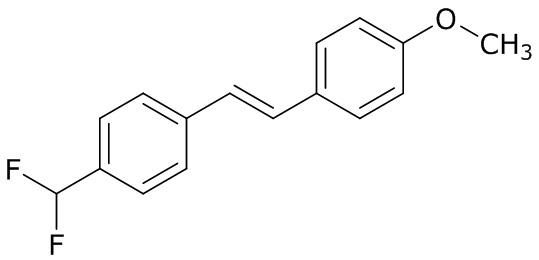


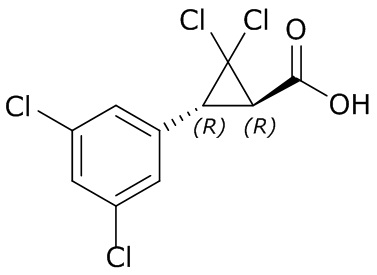
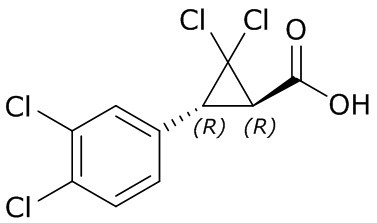
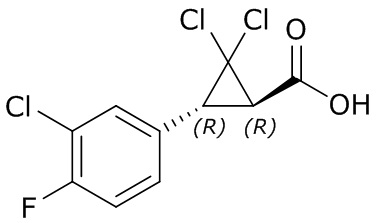
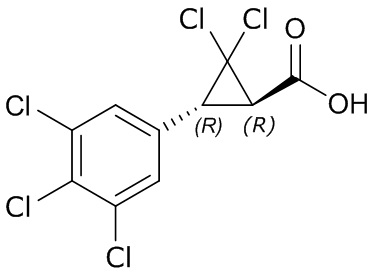
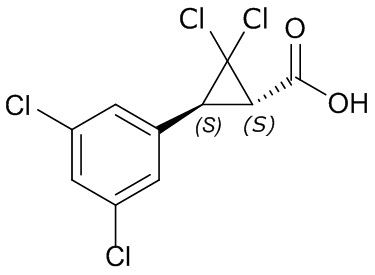



*получено согласно примеру номер
Таблица 4. Аналитические данные для молекул в таблице 2

19F ЯМР (376 МГц, DMSO-d6) δ -82,11 (d, J=195,1 Гц), -95,89 (d, J=194,9 Гц)
19F ЯМР (376 МГц, DMSO-d6) ротамеры δ -82,62 (d, J=195,5 Гц), -83,88 (dd, J=197,5, 7,5 Гц), δ -97,77 (dd, J=197,4, 43,8 Гц), δ -98,04 (d, J=195,5 Гц)
19F ЯМР (376 МГц, DMSO-d6) ротамеры δ -82,62 (d, J=195,5 Гц), -83,88 (dd, J=197,5, 8,6 Гц), -97,77 (dd, J=197,4, 42,4 Гц), -98,04 (d, J=195,4 Гц)
19F ЯМР (376 МГц, DMSO-d6) ротамеры δ -82,63 (d, J=195,4 Гц), -83,89 (dd, J=197,4, 7,5 Гц), -97,78 (dd, J=197,3, 42,9 Гц), -98,03 (d, J=195,5 Гц)
13C ЯМР (126 МГц, DMSO-d6) δ 163,73, 163,06, 138,07, 137,77, 136,63, 134,54, 130,59, 128,39, 128,19, 124,79, 121,62, 119,56, 66,35, 62,62, 55,02, 37,25, 31,17
13C ЯМР (101 МГц, DMSO-d6) δ 165,21, 162,52, 137,53, 137,50, 137,27, 134,04, 130,02, 127,88, 127,67, 123,98, 120,84, 118,94, 65,81, 62,12, 45,41, 38,39, 36,76, 32,16
19F ЯМР (376 МГц, ацетон-d6) δ -84,20, -84,72, -98,24, -98,25, -98,28, -98,76, -98,77, -98,80
19F ЯМР (376 МГц, ацетон) δ -84,24, -84,76, -98,33, -98,37, -98,86, -98,89, -98,90
13C ЯМР (101 МГц, ацетон-d6) δ 167,80, 163,20, 138,62, 136,73, 135,69, 134,55, 131,27, 131,16, 130,62, 125,92, 122,87, 120,93, 120,47, 62,68, 40,19, 37,98, 21,40, 21,28, 16,96
13C ЯМР (101 МГц, ацетон-d6) δ 167,71, 163,19, 138,65, 136,79, 135,73, 134,54, 131,26, 131,14, 130,64, 125,90, 122,75, 120,93, 120,39, 62,68, 40,14, 39,08, 37,96, 21,25, 16,89
13C ЯМР (75 МГц, ацетон-d6) δ 166,95, 162,55, 137,87, 135,91, 135,88, 134,95, 133,89, 130,87, 130,38, 129,33, 124,94, 121,89, 121,36, 120,06, 119,48, 61,90, 39,15, 37,39, 20,45, 20,33, 16,00
19F ЯМР (376 МГц, ацетон-d6) δ -84,56 (d, J=197,7 Гц), -98,51 (d, J=197,8 Гц)
19F ЯМР (376 МГц, метанол-d4) δ -85,61 (d, J=198,8 Гц), -99,65 (d, J=198,7 Гц)
19F ЯМР (376 МГц, ацетон-d6) δ -84,27, -84,28, -84,81, -98,24, -98,28, -98,28, -98,76, -98,80
13C ЯМР (101 МГц, ацетон-d6) смесь диастереомеров δ 166,70, 162,87, 162,33, 138,57, 137,66, 137,56, 135,70, 134,47, 130,14, 127,64, 127,57, 124,75, 121,70, 121,64, 119,81, 119,34, 119,25, 46,76, 44,83, 39,36, 38,90, 37,92, 37,31, 20,25, 20,13, 15,80
19F ЯМР (376 МГц, ацетон-d6) δ -84,26, -84,27, -84,79, -84,79, -98,20, -98,24, -98,73, -98,74, -98,77
19F ЯМР (376 МГц, ацетон-d6) δ -84,26, -84,78, -98,21, -98,25, -98,25, -98,74, -98,78
13C ЯМР (101 МГц, ацетон-d6) δ 206,16, 167,78, 163,37, 163,29, 138,77, 138,28, 136,85, 135,61, 131,26, 128,74, 125,88, 122,82, 122,73, 120,93, 120,45, 62,79, 40,07, 38,41, 30,41, 30,21, 30,08, 30,02, 29,83, 29,64, 29,45, 29,25, 21,36, 21,24, 16,91
13C ЯМР (101 МГц, ацетон-d6) δ 206,18, 205,98, 167,80, 163,37, 163,28, 138,76, 138,27, 136,83, 135,60, 131,26, 128,75, 128,73, 125,88, 122,82, 122,74, 120,93, 120,45, 120,36, 100,89, 62,79, 40,07, 38,41, 30,42, 30,28, 30,22, 30,09, 30,03, 29,98, 29,84, 29,65, 29,45, 29,26, 21,37, 21,24, 16,91
13C ЯМР (75 МГц, ацетон-d6) δ 205,31, 162,28, 162,19, 137,78, 137,68, 137,35, 136,95, 134,77, 133,96, 131,38, 131,25, 130,27, 124,92, 121,46, 121,38, 119,46, 116,86, 114,05, 61,74, 42,50, 42,20, 39,21, 37,22, 29,73, 29,48, 29,22, 28,96, 28,71, 28,45, 28,19
13C ЯМР (75 МГц, ацетон-d6) δ 205,61, 205,35, 166,90, 166,82, 162,33, 162,24, 137,84, 137,74, 137,33, 135,95, 135,91, 134,78, 133,96, 131,39, 131,26, 130,39, 124,98, 121,89, 121,80, 120,05, 119,41, 116,86, 114,05, 61,72, 39,19, 37,23, 29,75, 29,49, 29,23, 29,07, 28,98, 28,81, 28,72, 28,46, 28,21, 20,45, 20,33, 15,99
19F ЯМР (376 МГц, DMSO-d6) δ -69,10
19F ЯМР (376 МГц, DMSO-d6) δ -69,11
19F ЯМР (376 МГц, ацетон-d6) δ -106,91
19F ЯМР (376 МГц, ацетон-d6) δ -107,31
19F ЯМР (376 МГц, ацетон-d6) δ -137,04
19F ЯМР (471 МГц, ацетон-d6) δ -112,11 (dd, J=55,7, 14,8 Гц)
19F ЯМР (471 МГц, ацетон-d6) δ -116,15 (d, J=54,7 Гц)
19F ЯМР (471 МГц, ацетон-d6) δ -111,95 (dd, J=55,6, 14,5 Гц), -112,83 (t, J=9,1 Гц)
19F ЯМР (471 МГц, ацетон-d6) δ -112,05 (dd, J=55,9, 14,3 Гц), -112,97 (t, J=9,1 Гц)
19F ЯМР (471 МГц, ацетон-d6) δ -116,06 (d, J=54,6 Гц)
19F ЯМР (471 МГц, ацетон-d6) δ -114,79 (dd, J=54,7, 3,8 Гц), -119,96 (tt, J=7,4, 3,5 Гц)
19F ЯМР (471 МГц, ацетон-d6) δ -111,13 (dd, J=56,0, 14,4 Гц)
19F ЯМР (471 МГц, ацетон-d6) δ -111,11 (d, J=55,9 Гц)
19F ЯМР (471 МГц, DMSO-d6) δ -110,64
19F ЯМР (471 МГц, DMSO-d6) δ -116,08
19F ЯМР (471 МГц, DMSO-d6) δ -117,28
19F ЯМР (471 МГц, DMSO-d6) δ -82,10 (d, J=193,9 Гц), -95,88 (d, J=195,2 Гц), -110,64
19F ЯМР (471 МГц, DMSO-d6) δ -82,10 (dd, J=194,9, 6,7 Гц), -95,78 (dd, J=194,9, 14,7 Гц), -116,08
19F ЯМР (471 МГц, DMSO-d6) δ -82,10 (d, J=194,3 Гц), -95,87 (d, J=189,4 Гц), -117,29
19F ЯМР (471 МГц, DMSO-d6) δ -82,10 (d, J=195,1 Гц), -95,88 (d, J=191,5 Гц)
19F ЯМР (376 МГц, DMSO-d6) δ -131,47 (dd, J=156,6, 12,9 Гц), -143,68 (dd, J=156,5, 15,9 Гц)
19F ЯМР (376 МГц, DMSO-d6) δ -69,10
19F ЯМР (376 МГц, CDCl3) δ ротамеры -84,54 & -85,07, ротамеры -96,51 & -97,04
Таблица ABC. Биологические результаты
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ С ПЕСТИЦИДНОЙ ФУНКЦИЕЙ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2016 |
|
RU2735602C2 |
| Соединения, полезные в качестве пестицидов, и промежуточные соединения, композиции и способы, связанные с ними | 2016 |
|
RU2821715C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2012 |
|
RU2614976C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2013 |
|
RU2651369C1 |
| МОЛЕКУЛЫ С ОПРЕДЕЛЕННОЙ ПЕСТИЦИДНОЙ АКТИВНОСТЬЮ И ОТНОСЯЩИЕСЯ К НИМ ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ, КОМПОЗИЦИИ И СПОСОБЫ | 2014 |
|
RU2650498C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2013 |
|
RU2627654C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2015 |
|
RU2690375C2 |
| 4-АМИНО-6-(ГЕТЕРОЦИКЛИЧЕСКИЕ)ПИКОЛИНАТЫ И 6-АМИНО-2-(ГЕТЕРОЦИКЛИЧЕСКИЕ)ПИРИМИДИН-4-КАРБОКСИЛАТЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2014 |
|
RU2672587C2 |
| ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ КОНТРОЛЯ ВРЕДИТЕЛЕЙ, СПОСОБ КОНТРОЛЯ ЭНДОПАРАЗИТОВ, ЭКТОПАРАЗИТОВ ИЛИ ОБОИХ И СПОСОБ УСИЛЕНИЯ ЖИЗНЕСТОЙКОСТИ РАСТЕНИЙ | 2011 |
|
RU2576316C2 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2744766C2 |
Изобретение относится к молекулам, имеющих пестицидную функцию в отношении вредителей типов членистоногие, моллюски и нематоды. Предложено соединение формулы (1), где R1 и R5 выбраны из H, F, Cl, Br и I; R2 и R4 выбраны из H, F, Cl, Br, I, CN, (C1-C4)алкила, (C1-C4)алкокси и (C1-C4)галогеналкила; R3 выбран из H, F, Cl, Br, I, NO2 и (C1-C4)галогеналкокси; R6 и R15 выбраны из H и (C1-C4)алкила; R7 и R8 выбраны из группы, состоящей из F, Cl, Br и I; R9, R10, R11, R12 и R14 представляют собой H; R13 выбран из H, F, Cl, Br, I и (C1-C4)галогеналкила; R16 выбран из группы, состоящей из (C3-C8)циклоалкила, азетидинила, изоксазолидинонила, морфолинила, оксазолидинонила, оксетанила, тетрагидрофуранила, тетрагидропиранила, тетрагидротиофенила, тетрагидротиофенил-оксида, тетрагидротиофенил-диоксида, который может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, Cl, Br, I, CN, оксо, (C1-C4)алкила, (C1-C4)галогеналкила, C(=O)O(C1-C4)алкила, (C=O)NH(C1-C4)алкила, (C=O)NH(C1-C4)галогеналкила, C(=O)(C3-C6)циклопропила, C(=O)(C1-C4)галогеналкила и (C1-C4)алкилморфолинила; а каждый из Q1 и Q2 представляет собой O или N-оксиды. Предложен также пестицидный способ контроля вредителя с использованием указанного соединения. Технический результат – расширение ассортимента пестицидов. 2 н. и 12 з.п. ф-лы, 4 табл.
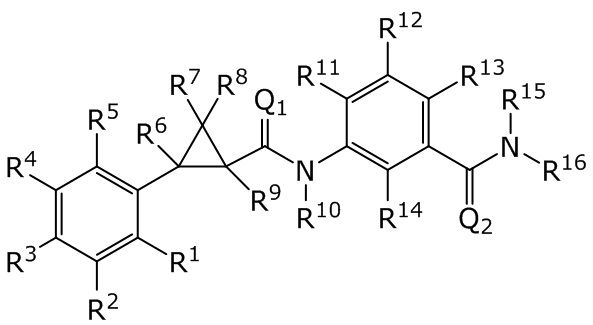 (1)
(1)
1. Молекула, имеющая следующую формулу:

формула один,
где
(A) R1 выбран из группы, состоящей из H, F, Cl, Br и I;
(B) R2 выбран из группы, состоящей из H, F, Cl, Br, I, CN, (C1-C4)алкила, (C1-C4)алкокси и (C1-C4)галогеналкила;
(C) R3 выбран из группы, состоящей из H, F, Cl, Br, I, NO2 и (C1-C4)галогеналкокси;
(D) R4 выбран из группы, состоящей из H, F, Cl, Br, I, CN, (C1-C4)алкила, (C1-C4)алкокси, (C1-C4)галогеналкила;
(E) R5 выбран из группы, состоящей из H, F, Cl, Br и I;
(F) R6 выбран из группы, состоящей из H и (C1-C4)алкила;
(G) R7 выбран из группы, состоящей из F, Cl, Br и I;
(H) R8 выбран из группы, состоящей из F, Cl, Br и I;
(I) R9 представляет собой H;
(J) R10 представляет собой H;
(K) R11 представляет собой H;
(L) R12 представляет собой H;
(M) R13 выбран из группы, состоящей из H, F, Cl, Br, I и (C1-C4)галогеналкила;
(N) R14 представляет собой H;
(O) R15 выбран из группы, состоящей из H и (C1-C4)алкила;
(P) R16 выбран из группы, состоящей из (C3-C8)циклоалкила, азетидинила, изоксазолидинонила, морфолинила, оксазолидинонила, оксетанила, тетрагидрофуранила, тетрагидропиранила, тетрагидротиофенила, тетрагидротиофенил-оксида, тетрагидротиофенил-диоксида, который может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, Cl, Br, I, CN, оксо, (C1-C4)алкила, (C1-C4)галогеналкила, C(=O)O(C1-C4)алкила, (C=O)NH(C1-C4)алкила, (C=O)NH(C1-C4)галогеналкила, C(=O)(C3-C6)циклопропила, C(=O)(C1-C4)галогеналкила и (C1-C4)алкилморфолинила;
(Q) каждый из Q1 и Q2 представляет собой O; и N-оксиды,
и разделенные стереоизомеры.
2. Молекула по п. 1, где R1 выбран из группы, состоящей из H, F и Cl.
3. Молекула по любому из предыдущих пунктов, где R2 выбран из группы, состоящей из H, F, Cl и Br.
4. Молекула по любому из предыдущих пунктов, где R3 выбран из группы, состоящей из H, F и Cl.
5. Молекула по любому из предыдущих пунктов, где R4 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3.
6. Молекула по п. 1, где R5 выбран из группы, состоящей из H.
7. Молекула по любому из предыдущих пунктов, где R7 и R8 представляют собой Cl.
8. Молекула по любому из предыдущих пунктов, где R13 выбран из группы, состоящей из H, Cl и CF3.
9. Молекула по любому из предыдущих пунктов, где R15 выбран из группы, состоящей из H и CH3.
10. Молекула по любому из предыдущих пунктов, где R16 выбран из группы, состоящей из циклопропила, циклобутила, циклопентила, циклогексила, азетидинила, морфолинила, оксетанила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида,
при этом каждый из циклопропила, циклобутила, циклопентила, циклогексила, азетидинила, морфолинила, оксетанила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, CN, C(=O)OC(CH3)3 и C(=O)CF3.
11. Молекула по п. 1, где:
(A) R1 выбран из группы, состоящей из H, F и Cl;
(B) R2 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3;
(C) R3 выбран из группы, состоящей из H, F, Cl и OCF3;
(D) R4 выбран из группы, состоящей из H, F, Cl, Br, CH3 и CF3;
(E) R5 представляет собой H;
(F) R6 представляет собой H;
(G) R7 выбран из группы, состоящей из Cl и Br;
(H) R8 выбран из группы, состоящей из Cl и Br;
(I) R9, R10, R11 и R12 представляют собой H;
(J) R13 выбран из группы, состоящей из H, F, Cl и CF3;
(K) R14 представляет собой H;
(L) R15 выбран из группы, состоящей из H и CH3;
(M) R16 выбран из группы, состоящей из (C3-C8)циклоалкила, азетидинила, морфолинила, оксетанила, пиранила, тетрагидротиофенила, тиетанила, тиетанил-оксида и тиетанил-диоксида, который может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из H, F, CN, C(=O)O(C1-C4)алкила, C(=O)(C3-C6)циклопропила, C(=O)(C1-C4)галогеналкила и C(=O)(C1-C4)алкил(C1-C4)алкокси; и
(N) Q1 и Q2 представляют собой O.
12. Молекула по п. 1, где указанная молекула выбрана из одной из следующих молекул: F1-F92, PF1-PF9, PF12, PF14, PF18-PF23, PF28-PF 34, PF36, PF37 и PF41-PF45
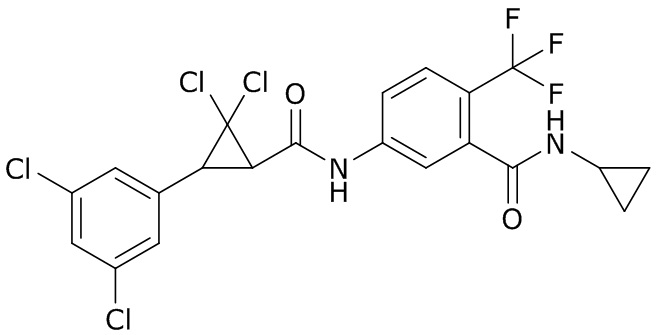
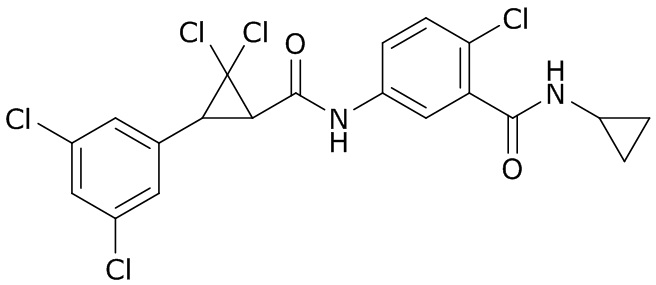
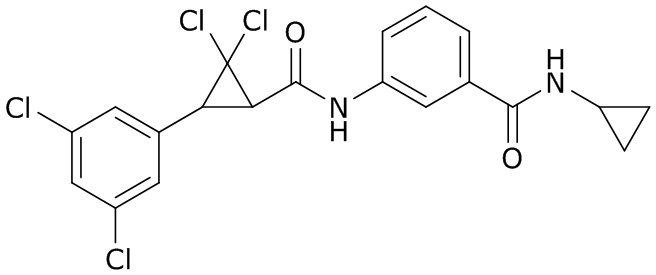
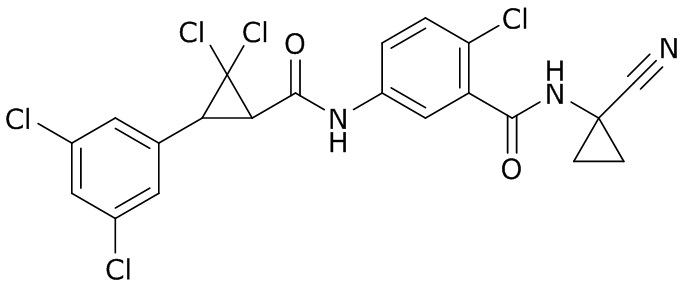







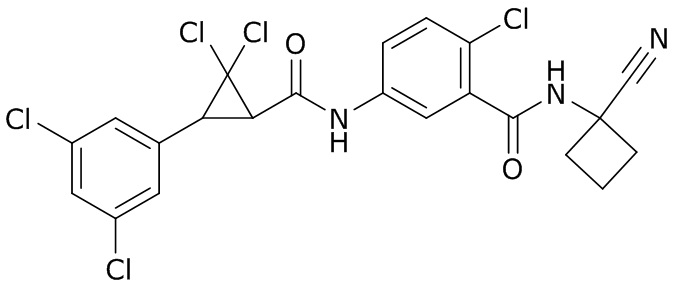
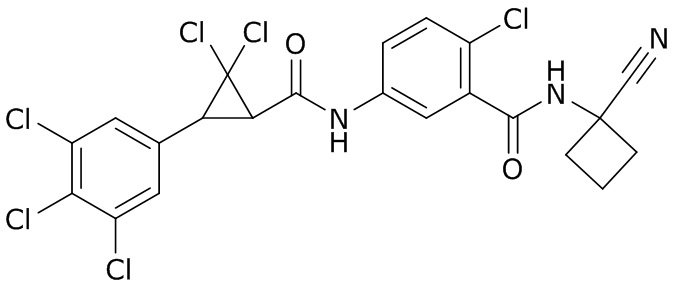
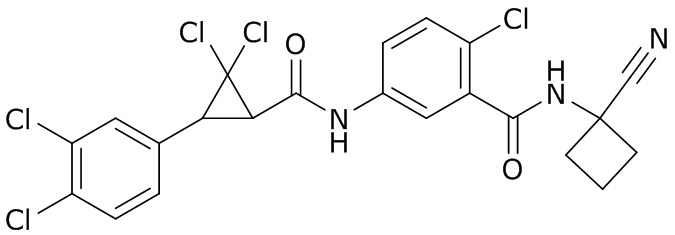
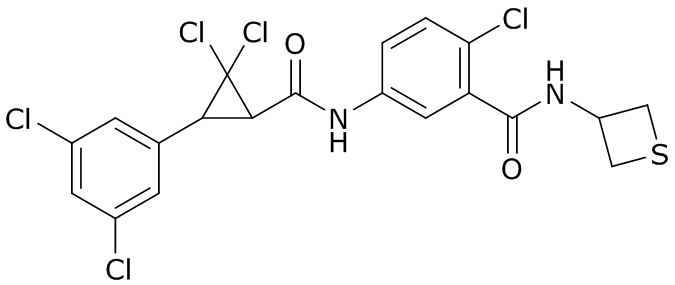
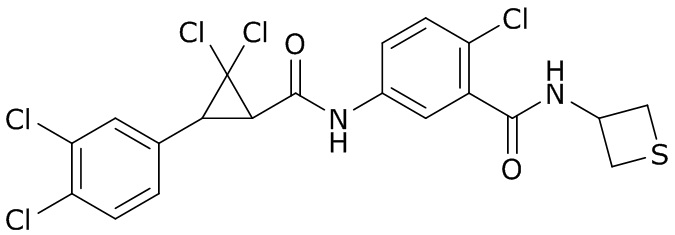


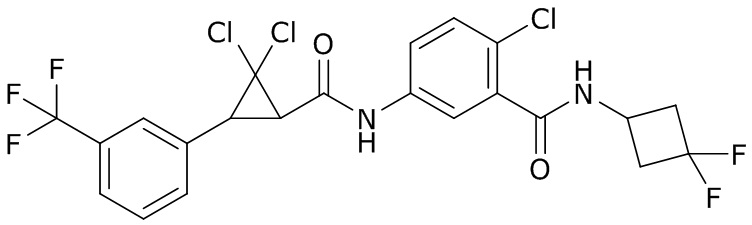


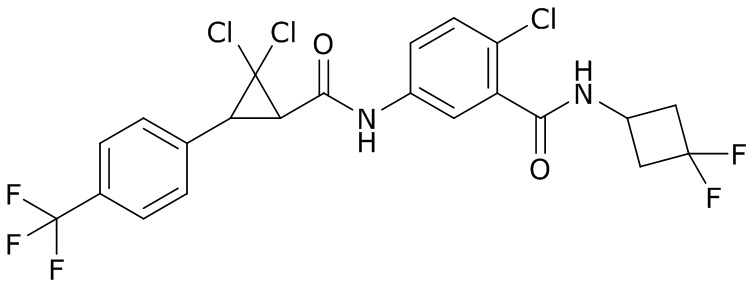
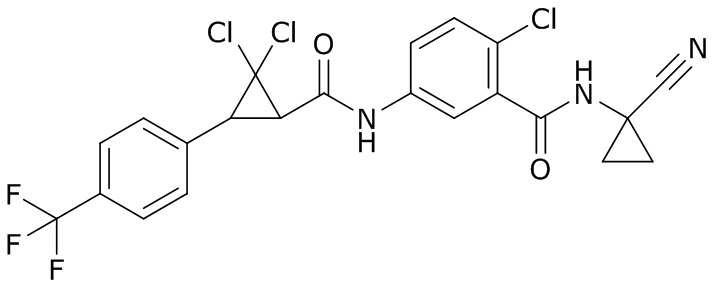
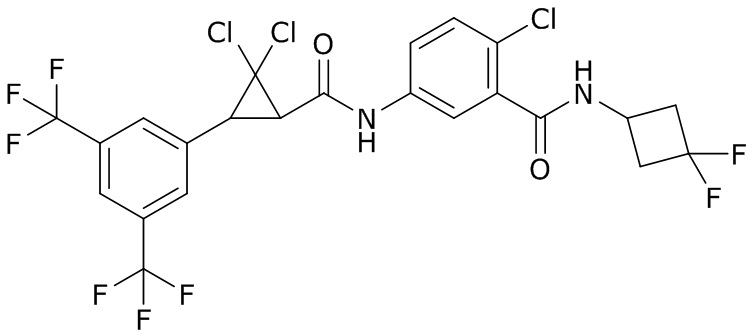
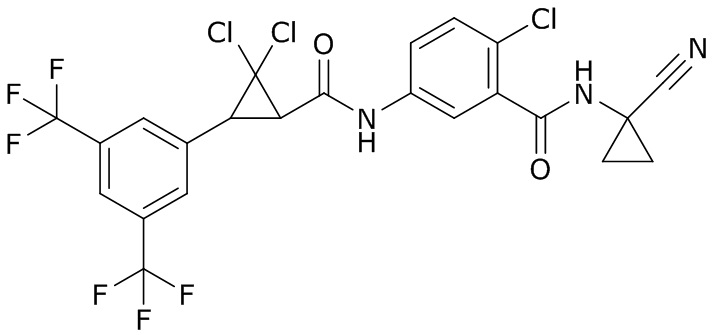
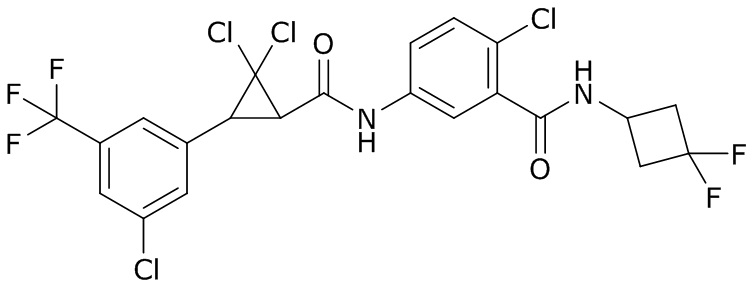


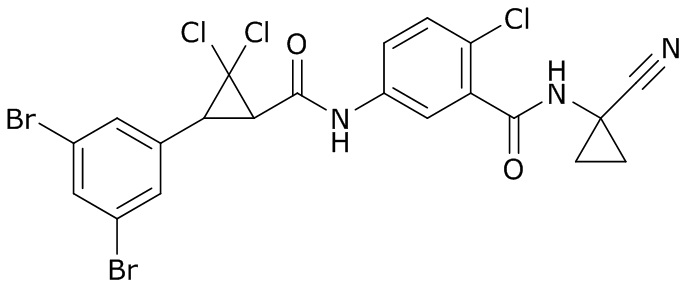
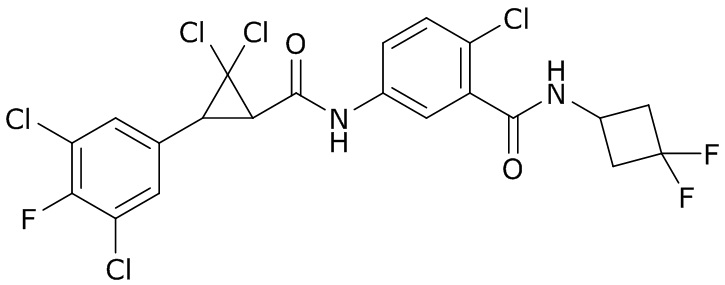
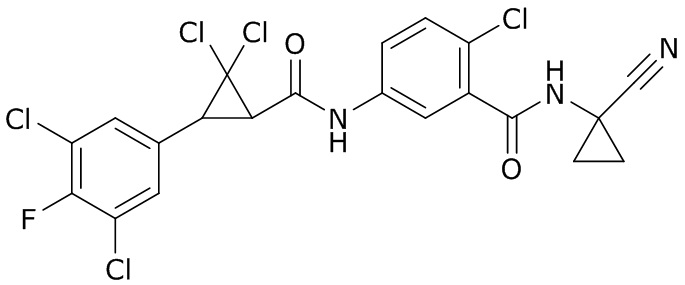
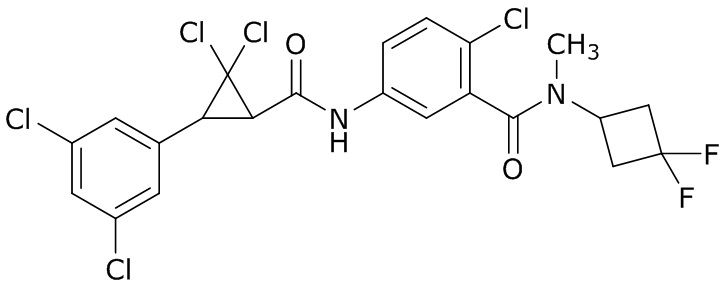
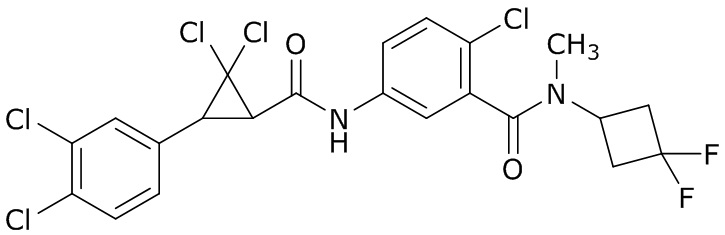


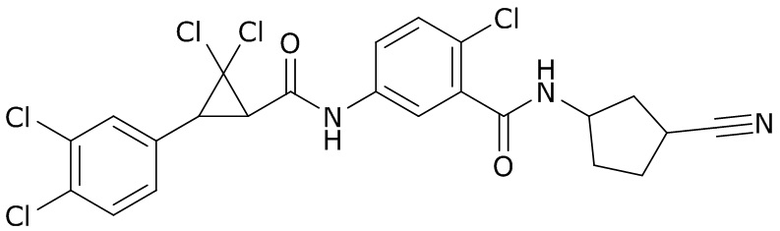
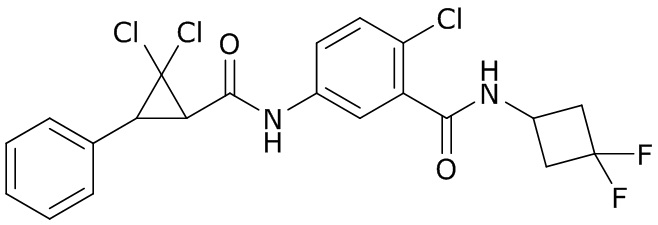
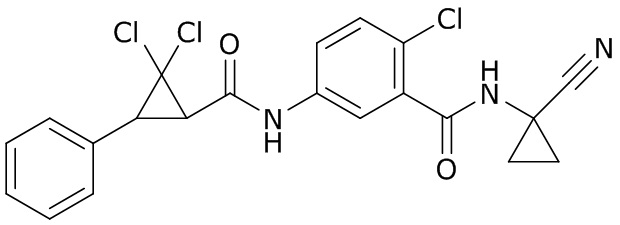
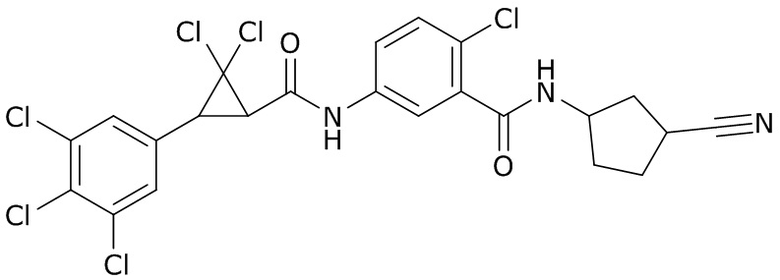
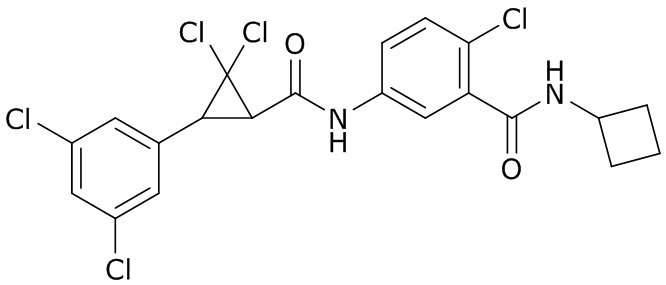
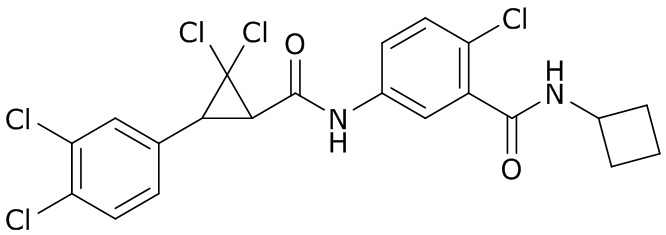
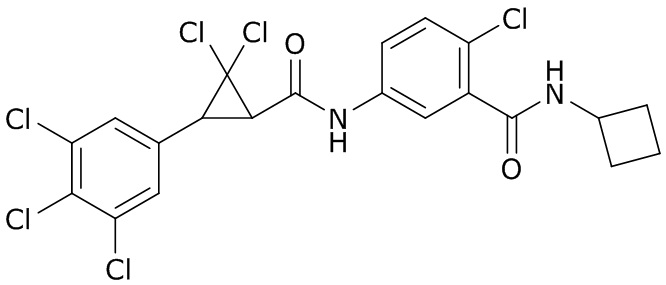

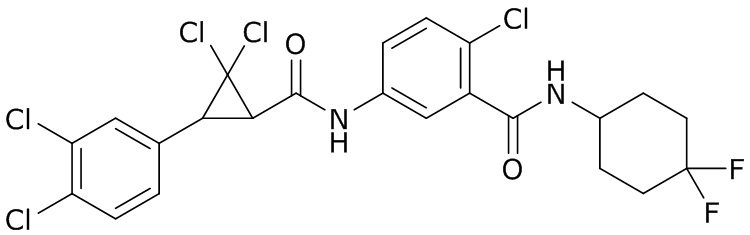
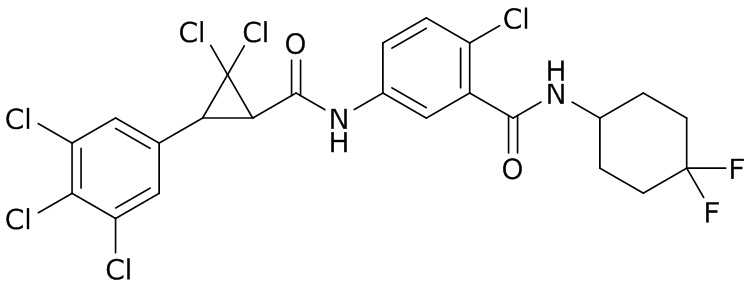



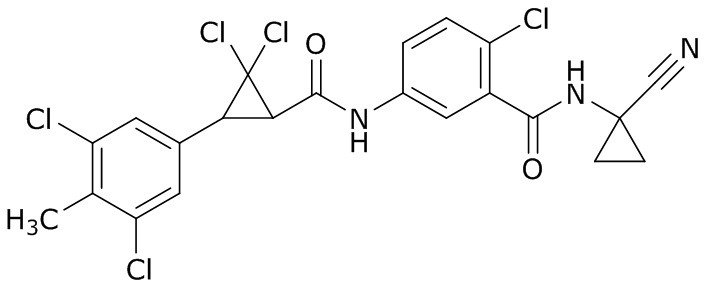
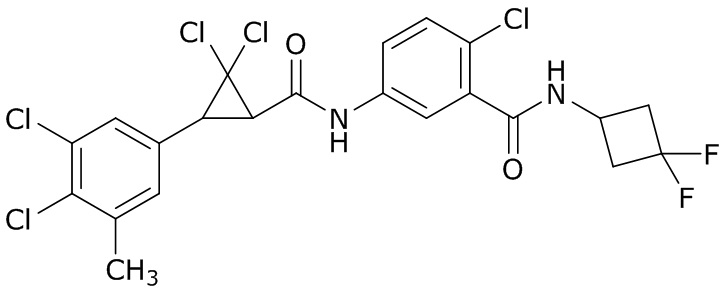
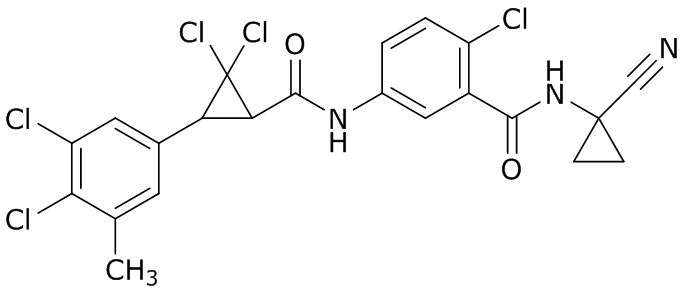
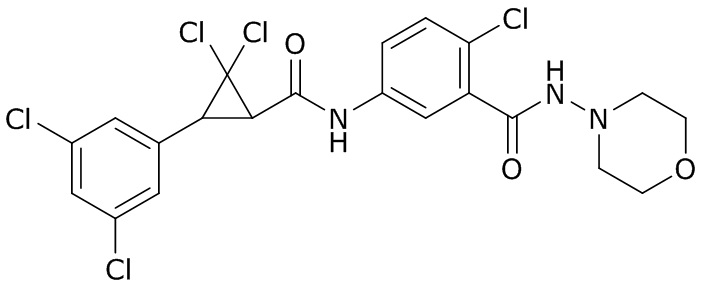

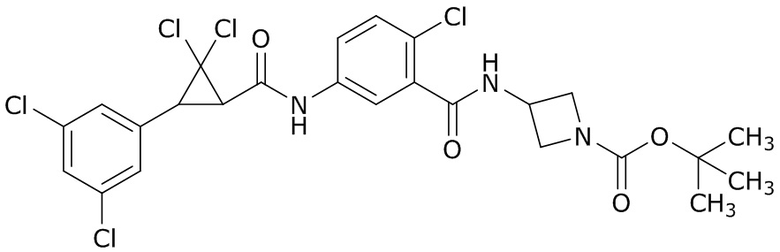
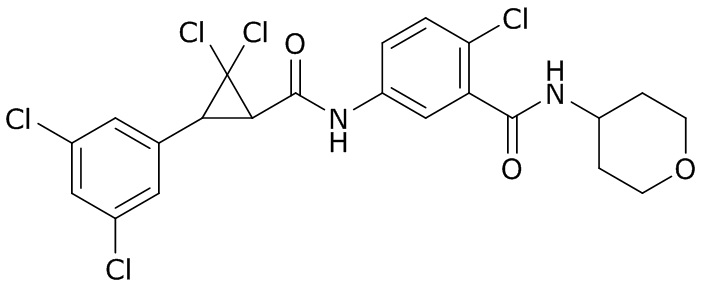
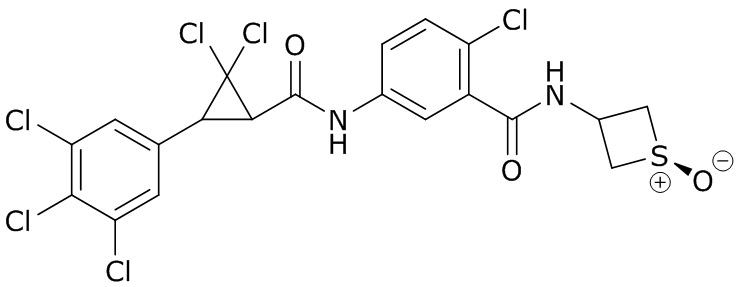

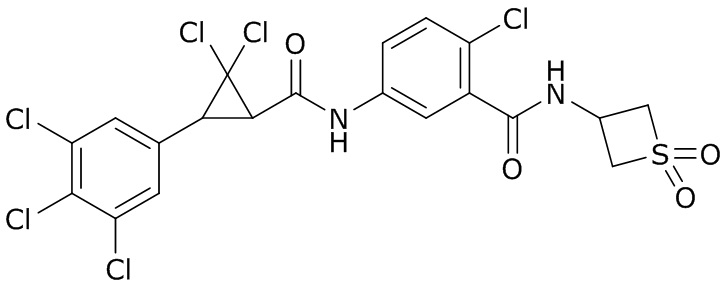


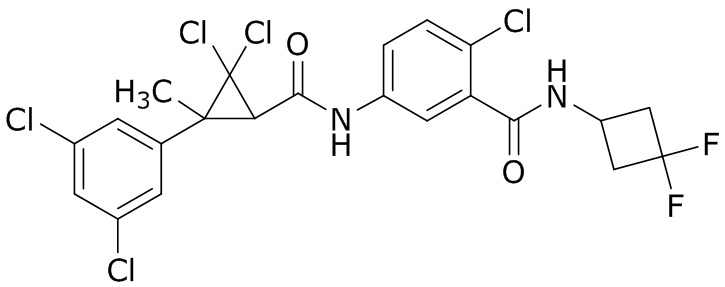
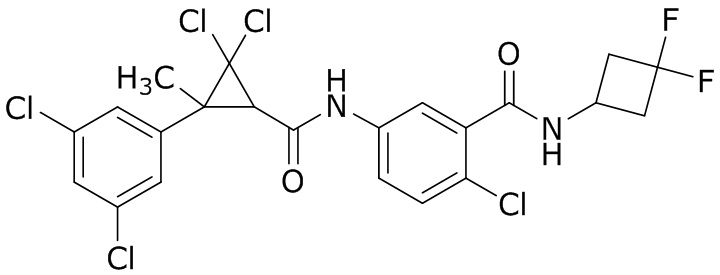
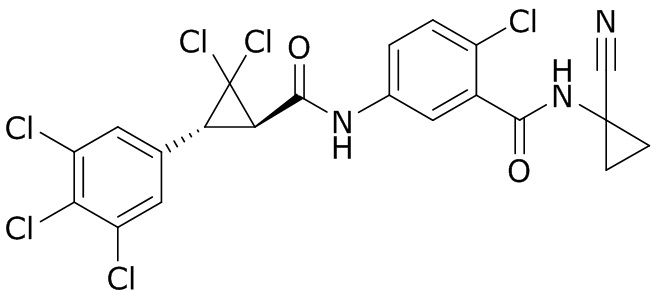
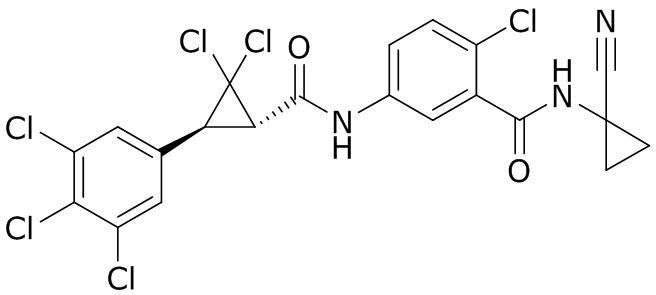

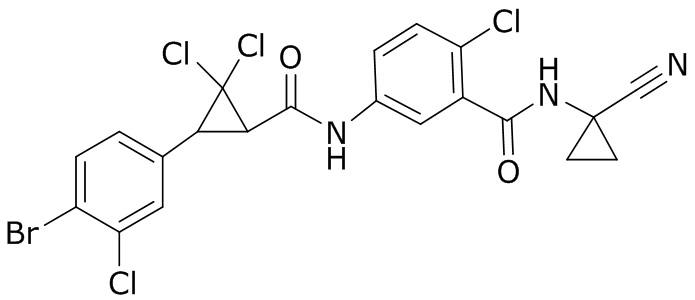
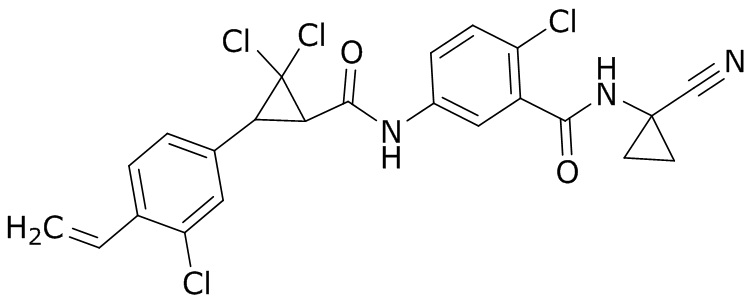
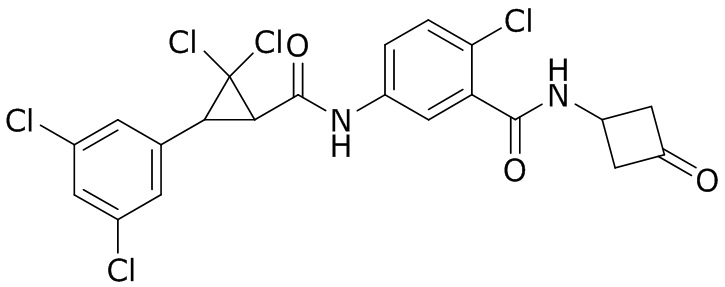

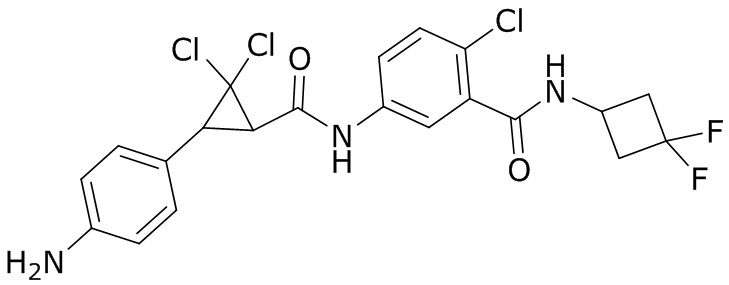
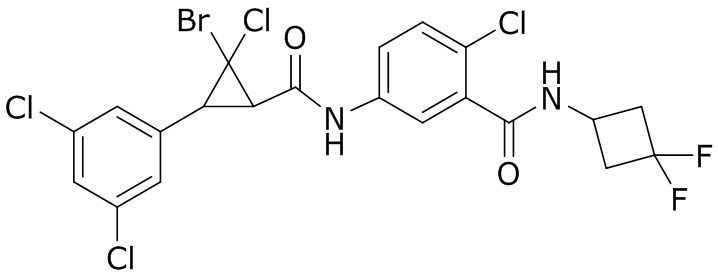
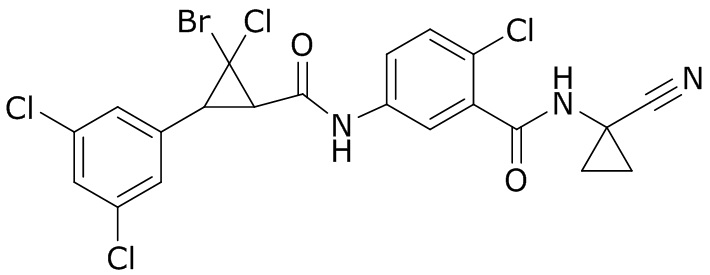

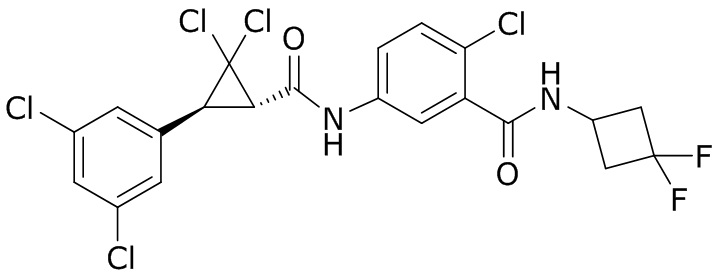
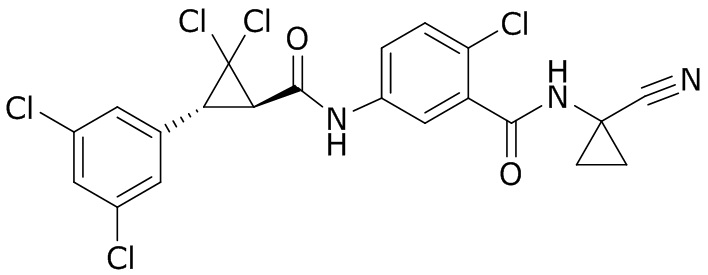

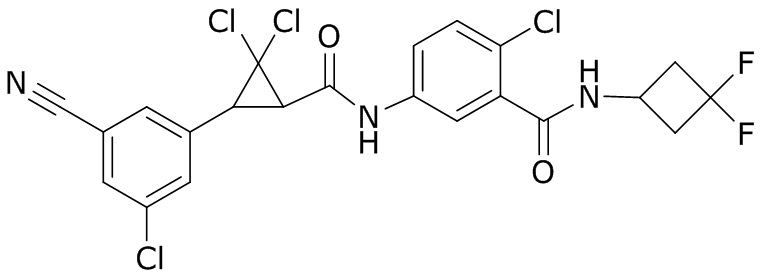
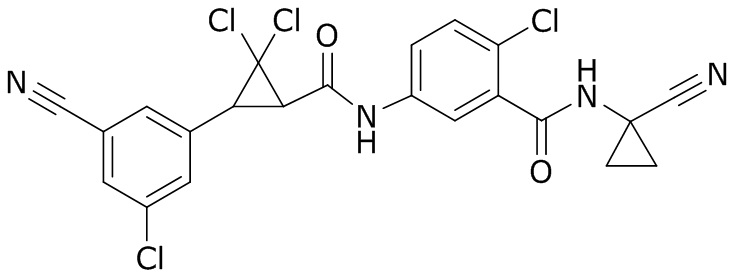

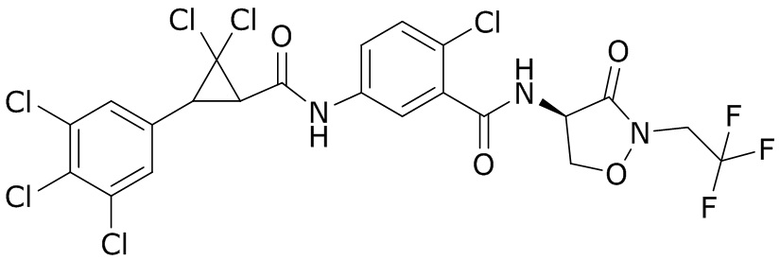


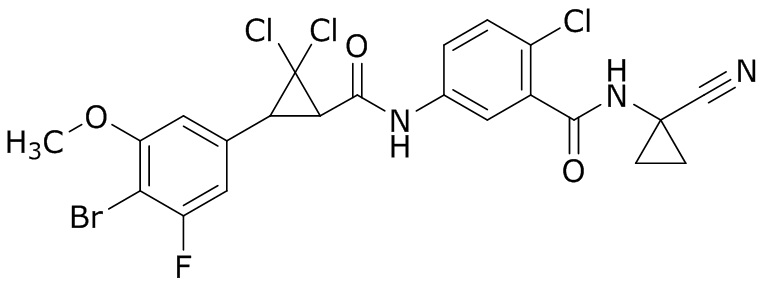
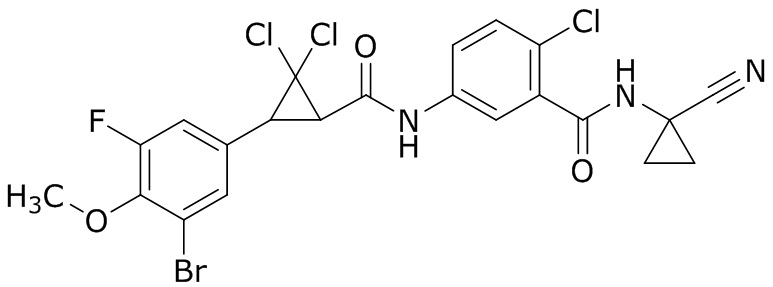



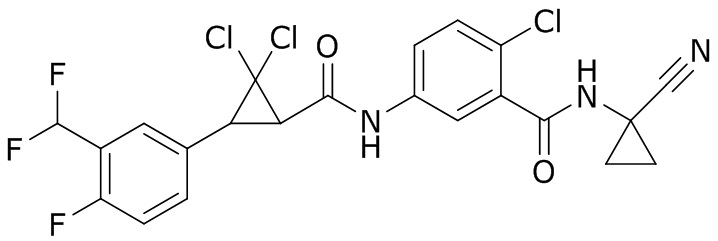

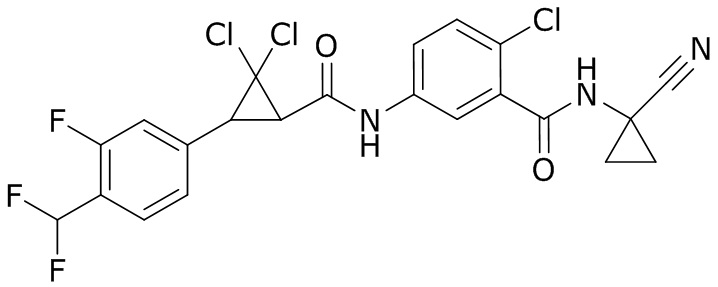
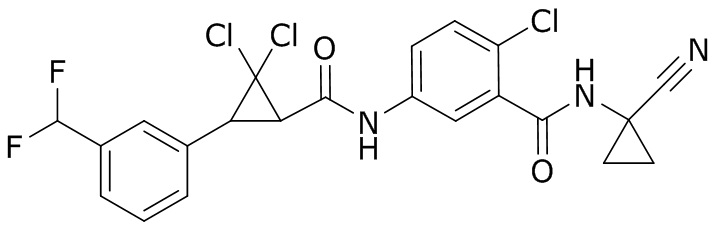
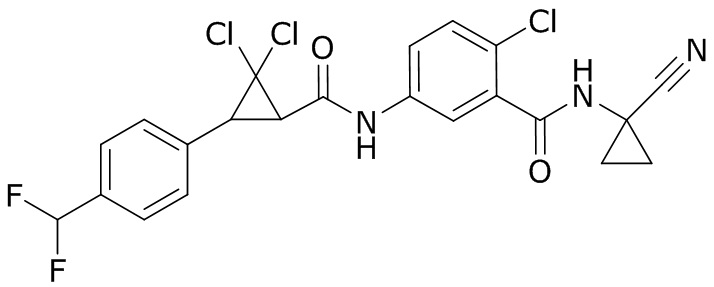




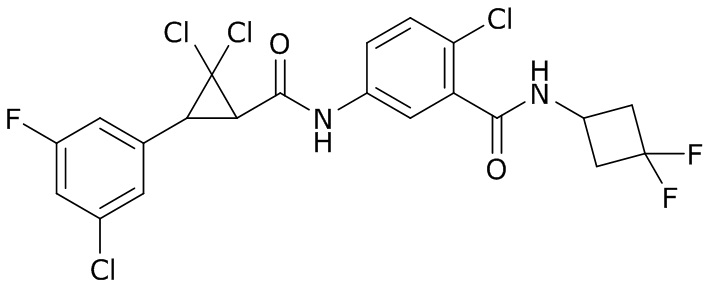
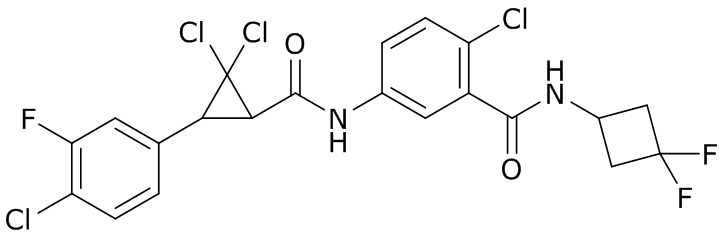
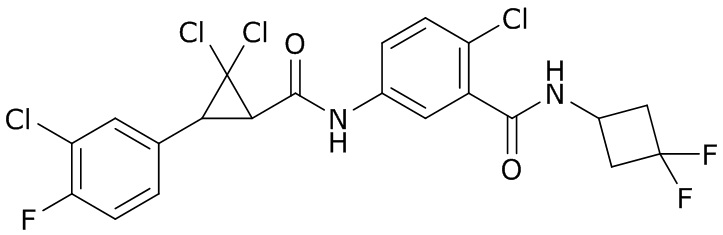
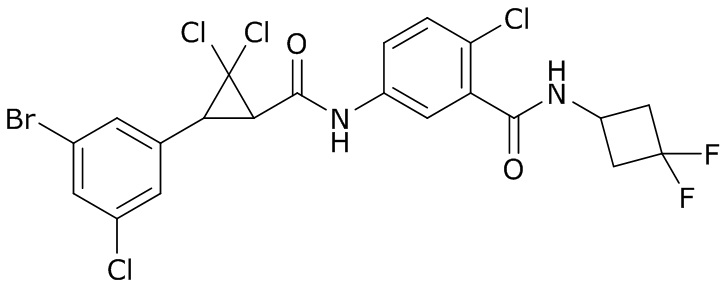

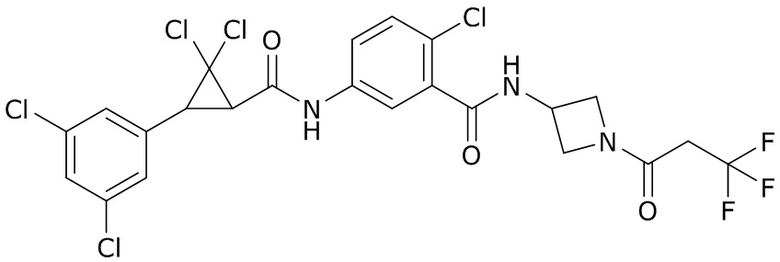


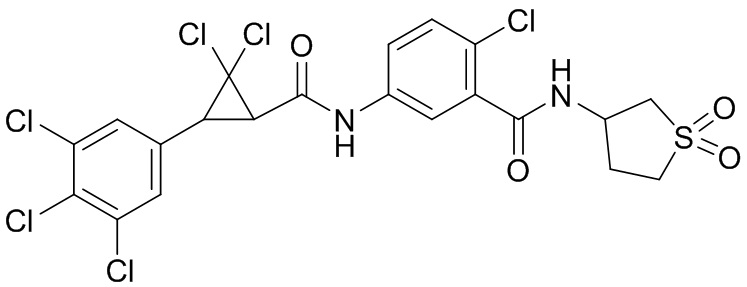

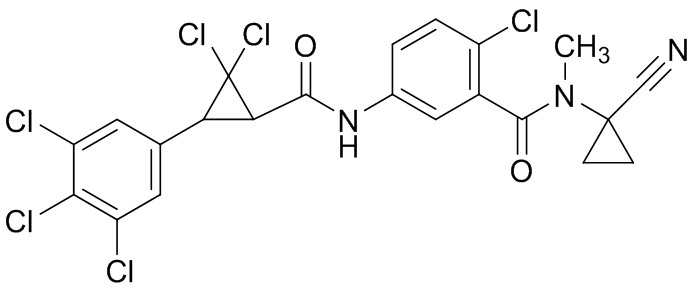
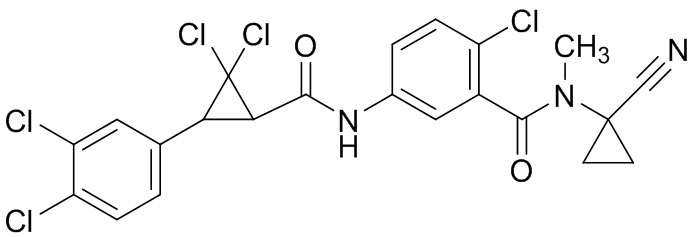
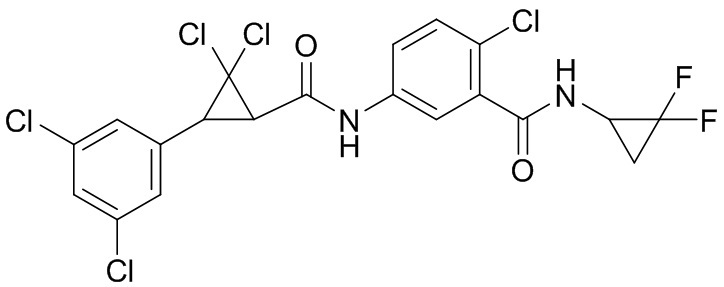
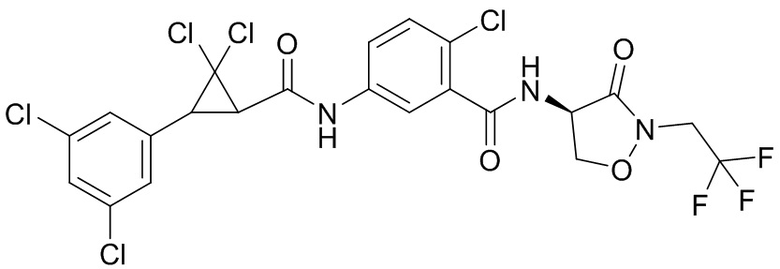
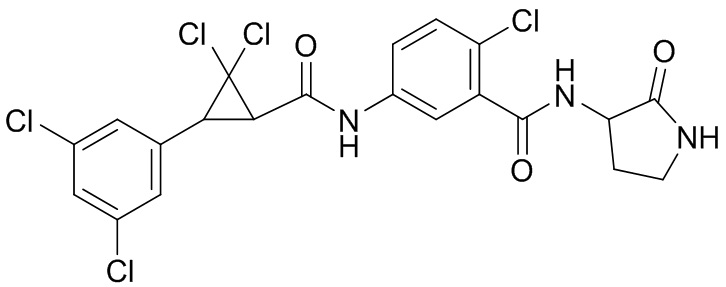
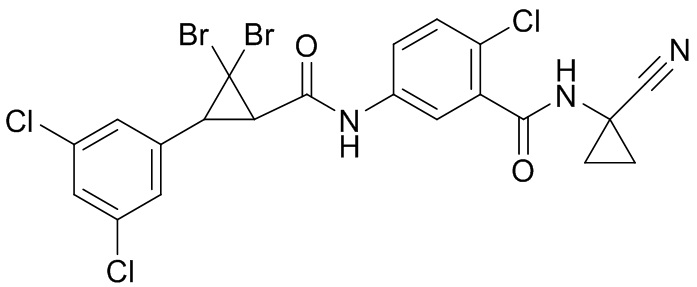
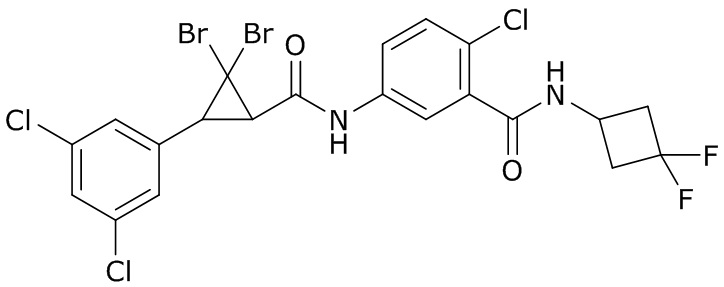
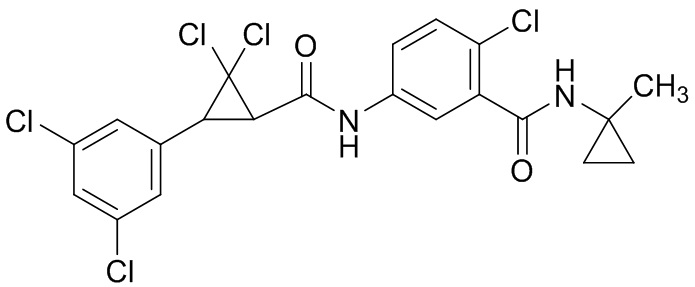

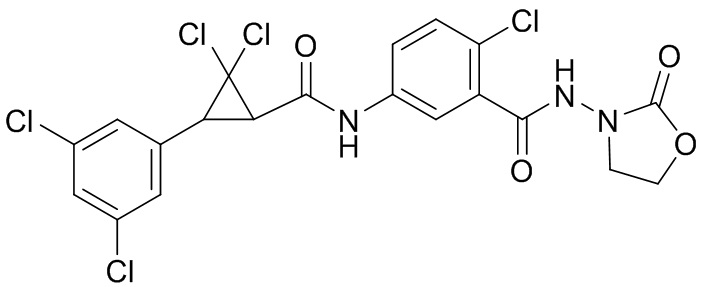
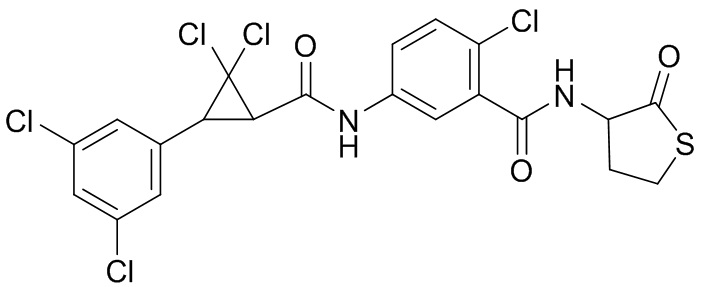
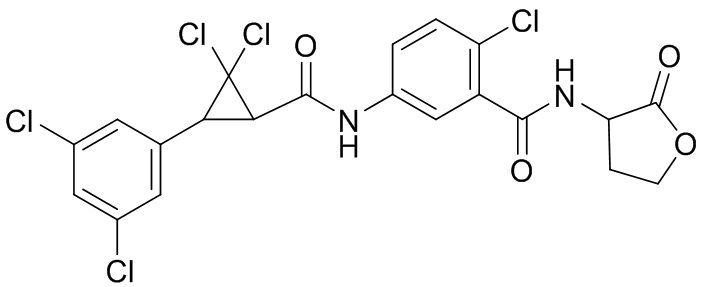

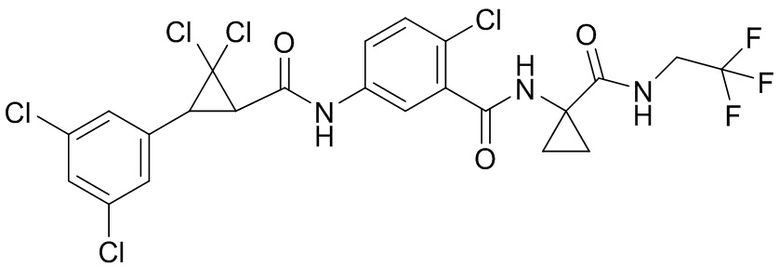

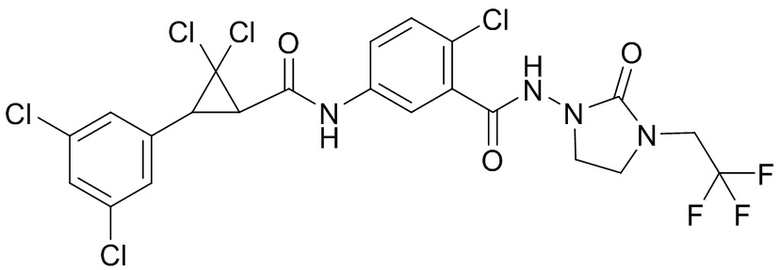
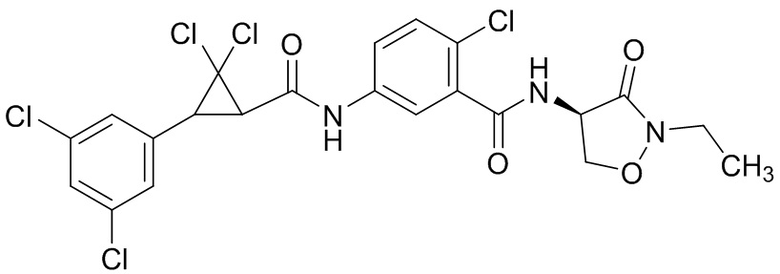
13. Молекула по п. 1, где указанная молекула выбрана из группы, состоящей из молекул F4, F5, F9, F10, F11, F15, F16 и F17








14. Пестицидный способ контроля вредителя, причем указанный способ включает применение по отношению к месту произрастания пестицидно эффективного количества: (a) молекулы по любому из пп. 1-13.
| US 20140171308 A1, 19.07.2014 | |||
| US 20020068838 A1, 06.06.2002 | |||
| ИНСЕКТИЦИДНЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2493148C2 |
Авторы
Даты
2021-02-02—Публикация
2016-04-07—Подача