УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к координационным комплексам на основе металлов, в частности к комплексам металл-гликопротеин, которые можно эффективно применять в качестве терапевтических и диагностических агентов.
2. ОПИСАНИЕ УРОВНЯ ТЕХНИКИ
[0002] В настоящее время проводятся активные исследования в области фотодинамической терапии () для лечения заболеваний, связанных с повышенной пролиферацией клеток, таких как рак и незлокачественные поражения. При разработке новых фотодинамических соединений (ФДС или фотосенсибилизаторов, ФС) для фотодинамической терапии (ФДТ) уделяется все больше внимания супрамолекулярным комплексам металлов. Например, в WO 2013158550 А1 и WO 2014145428 А2 описаны ФДС на основе металлов, которые можно применять в качестве диагностических агентов in vivo, терапевтических агентов для лечения или предотвращения заболеваний, связанных с нежелательной и/или повышенной пролиферацией клеток, включая рак, агентов для лечения инфекционных заболеваний и агентов для дезинфекции и/или стерилизации от патогенных микроорганизмов. В патентах США №6962910, 7612057, 8445475 и 8148360 описаны супрамолекулярные комплексы металлов, способные расщеплять ДНК при облучении низкоэнергетическим световым излучением в видимой области в присутствии молекулярного кислорода или без него.
[0003] Доставка координационных комплексов и ФДС на основе металлов к биологическим мишеням может сопровождаться сложностями, преодолеть которые пытались многие исследователи.
[0004] Например, в заявке на патент США №20120264802 описаны фотосенсибилизирующие соединения на основе функционализированных фуллеренов, подходящие для направленной ФДТ, и способы их применения.
[0005] В публикации WO 2013020204 А1 описаны биоразлагаемые полимерные наночастицы, содержащие внутреннее ядро, образованное из фотодинамического агента, который при активации способен вырабатывать цитотоксичный синглетный кислород. Указанные наночастицы обладают активностью, подавляющей пролиферацию клеток, и подходят для применения для лечения раковых и нераковых состояний, включая актинический кератоз, псориаз и обыкновенные угри. Предпочтительно фотодинамический агент представляет собой производное гипокреллина В, при этом полимерная наночастица содержит полигликолевую кислоту, полимолочную кислоту или поли(лактид-гликолид). Продемонстрировано, что наночастицы, содержащие гипокреллин, активируются под действием света или пероксидом водорода.
[0006] В заявке на патент США №20110288023 описаны модифицированные молекулы трансферрина (Tf) и конъюгаты молекул Tf с терапевтическим агентом. Также описаны способы лечения рака, где терапевтические агенты представляют собой химиотерапевтические агенты. Модифицированные молекулы Tf улучшают доставку конъюгированного терапевтического агента в целевую ткань.
[0007] В публикации WO 2002094271 А1 описан гомогенный конъюгат для направленного воздействия и лечения пораженных клеток, при этом конъюгат содержит противораковое лекарственное средство и транспортный белок, где указанное противораковое лекарственное средство выбрано из группы, состоящей из тепловых сенсибилизаторов, фотосенсибилизаторов и соединений, вызывающих апоптоз, способ получения указанного конъюгата и способы применения конъюгата. Транспортный белок предпочтительно представляет собой трансферрин.
[0008] В патенте США №7001991 описан гомогенный конъюгат для направленного воздействия и лечения пораженных клеток, при этом конъюгат содержит противораковое лекарственное средство и транспортный белок, где указанное противораковое лекарственное средство выбрано из группы, состоящей из тепловых сенсибилизаторов, фотосенсибилизаторов и соединений, вызывающих апоптоз, способ получения указанного конъюгата и способы применения конъюгата. Транспортный белок предпочтительно представляет собой трансферрин.
[0009] В патенте США №7809428 описаны способы ФДТ для лечения нестабильных бляшек путем селективного направленного воздействия и/или уничтожения воспалительных компонентов нестабильных бляшек. В предпочтительном варианте реализации композиции фотосенсибилизаторов прикрепляют к макромолекулярным носителям, которые направленно воздействуют на Т-клетки в нестабильных бляшках. Указанные макромолекулярные носители могут обеспечивать направленную доставку, например, к IL-10, рецептору, моноцитарному воспалительному белку 1 к их рецепторам и трансферрину. Указанные макромолекулярные носители, например, могут представлять собой антитела к указанным биомолекулам, лиганды, связывающие указанные биомолекулы, или их аналоги, включая, но не ограничиваясь ими, моноклональные антитела, которые распознают CD1, CD2, CD3, CD4, CDS, CD6, CD7, CDB, CD25, CD28, CD44, CD71 или трансферрин.
[0010] Местное применение крупных (>500 Да) ФС затруднительно. Неселективность их доставки является еще одной проблемой. Были предложены различные составы для местного применения на основе пластырей и пленок и способы улучшенной доставки ФС непосредственно в раковые клетки для преодоления сложностей, связанных с доставкой крупных (>500 Да) молекул ФС и отсутствием селективности доставки. Указанные составы и способы включают различные составы для местного применения на основе пластырей и пленок (Donnelly et al 2009), окислительно-восстановительную активацию (Graf, Lippard, 2012), опосредованную рецепторами доставку (Nkepang et al., 2014), фотоиндуцированную доставку (Chen et al., 2014; Yin et al., 2014; Sardar et al., 2014), липосомы (Temizel et al., 2014; Muehlmann et al., 2011) и доставку с применением наночастиц, включая фуллерены (Biju, 2014; Yuan, Liu, 2014; Zhen et al., 2014; Wong et al., 2013; Yang et al., 2014; He et al., 2014). Также предложено получение комбинаций трансферрина с фуллеренами (Zhang et al., 2015), а также конъюгация липосом, содержащих ФС, с различными молекулами (фолатами, факторами роста, гликопротеинами, такими как трансферрин, гликолипиды), экспрессия рецепторов которых повышена в раковых клетках (Muehlmann et al., 2011; Nkepang et al., 2014). Липосомы, содержащие ПЭГилированный AIPcS4, конъюгированные с трансферрином, применяли в отношении клеток рака шейки матки (Gijsens et al., 2002). В исследовании влияния конъюгации Tf на эффективность инкапсулированного в липосоме ФС Foscan, фотосенсибилизатора на основе хлора, при ФДТ рака пищевода, тем не менее, получили отрицательный результат, который, вероятно, был связан с дестабилизацией липосом (Paszko et al., 2013).
[0011] Системы доставки на основе белков включают системы на основе альбумина (системы наночастиц), малых белков теплового шока, вирусного капсида и апоферритина (системы белковых клеток «protein cage»), применяемые для доставки доксорубицина, на основе соевого белка (система на основе пленки) для доставки метиленового синего (MaHam et al., 2009). Апоферритин (т.е. ферритин, не связанный с железом, белок массой 450 кДа) применяли для инкапсулирования различных цитостатических противораковых лекарственных средств: доксорубицина, карбоплатина, цисплатина, даунорубицина, при этом иммунный ответ на апоферритин может являться недостатком указанного способа (Heger et al., 2014). Среди PC инкапсулирование метиленового синего в апоферритине обеспечивало увеличение выработки синглетного кислорода и усиление цитотоксического действия на клетки (Heger et al., 2014, обзор).
[0012] Применение трансферрина совместно с липосомами, содержащими фталоцианин тетрасульфоната алюминия (липосомы AlPcS4), описано в работах Derycke et al., 2014; Gaspar et al., 2012.
[0013] Ни в одной из указанных выше работ явным образом не предложено применение трансферрина в комбинации с фотосенсибилизаторами на основе металлов.
[0014] Несмотря на наличие описанных выше разработок, по-прежнему существует потребность в обеспечении улучшенных композиций и способов для доставки ФДС к биологическим мишеням. Кроме того, существует потребность в обеспечении способа увеличения эффективности селективного захвата ФДС биологическими мишенями. Кроме того, существует потребность в увеличении внутриклеточного захвата фотосенсибилизаторов на основе рутения, рутения-родия и осмия, главным образом, раковыми клетками и опухолевыми тканями. Также, существует потребность в увеличении эффективности ФДС при больших длинах волн. Кроме того, существует потребность в увеличении поглощения, выработки АФК и действенности ФДТ при применении фотосенсибилизаторов на основе рутения, рутения-родия и осмия. Кроме того, существует потребность в улучшении действия ФДТ при гипоксии.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0015] Первый аспект изобретения включает композицию, содержащую:
металлсвязывающий гликопротеин; и
химиотерапевтическое соединение, содержащее по меньшей мере один переходный металл, предпочтительно выбранный из группы, состоящей из Ru, Rh и Os,
где композиция имеет по меньшей мере одно из следующих улучшенных свойств по сравнению с химиотерапевтическим соединением без гликопротеина: (а) увеличенный захват раковыми клетками; (b) увеличенный захват опухолями; (с) увеличенную эффективность при длинах волн более 600 нм; (d) увеличенную эффективность при длинах волн 600 нм или менее; (е) увеличенное поглощение при длинах волн более 600 нм; (f) увеличенное поглощение при длинах волн 600 нм или менее; (g) увеличенную выработку активных форм кислорода; (h) улучшенное действие фотодинамической терапии в негипоксических условиях; (i) улучшенной действие фотодинамической терапии в гипоксических условиях; (j) увеличенную LD50; (k) увеличенную МПД; (l) увеличенную фотостабильность; и (m) увеличенный срок хранения.
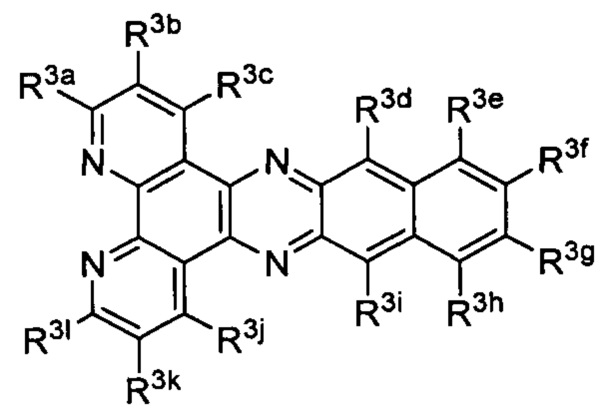
[0016] В определенных вариантах реализации гликопротеин представляет собой трансферрин, и химиотерапевтическое соединение имеет формулу (I):
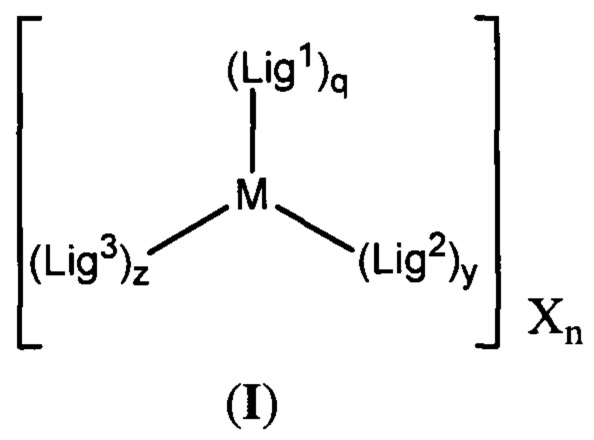
включая гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы указанного соединения, где:
М в каждом случае независимо представляет собой переходный металл, который предпочтительно выбран из группы, состоящей из осмия, рутения и родия;
X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2;
n=0, 1, 2, 3, 4 или 5;
q независимо в каждом случае равен 0, 1 или 2;
y независимо в каждом случае равен 0, 1 или 2;
z независимо в каждом случае равен 1, 2 или 3;
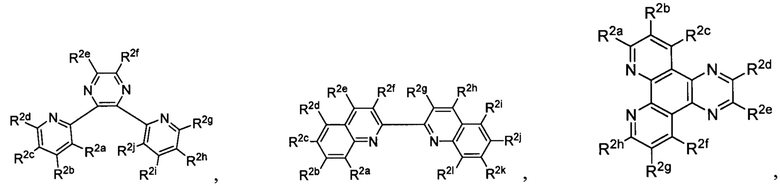
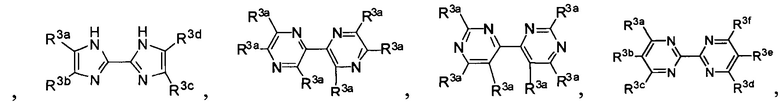
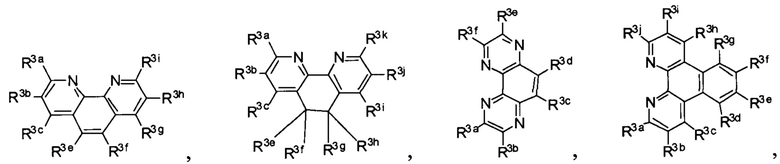
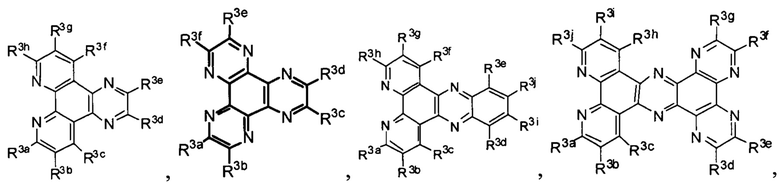
Lig1 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из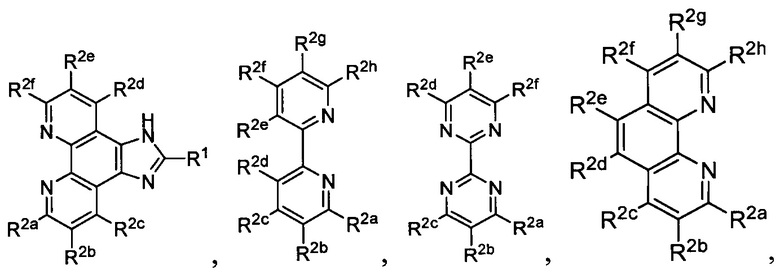
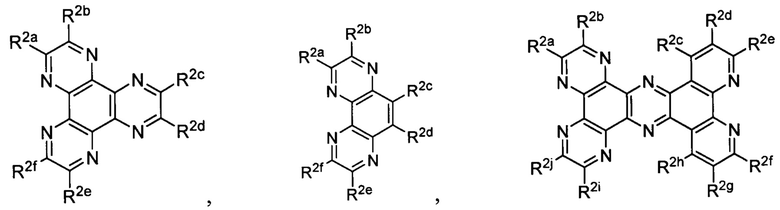 и
и 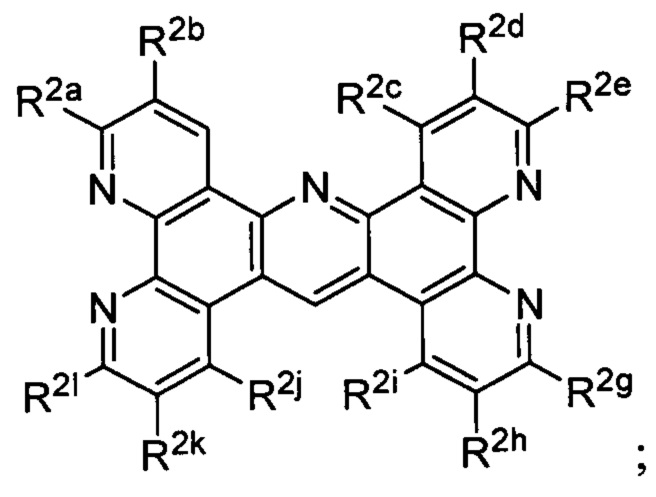
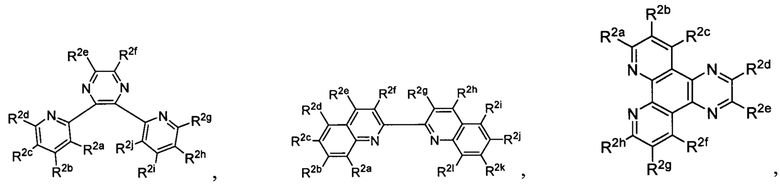
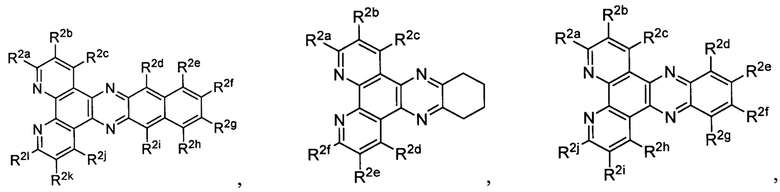
Lig2 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из 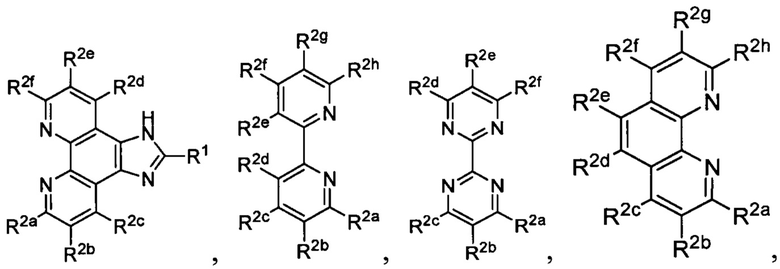
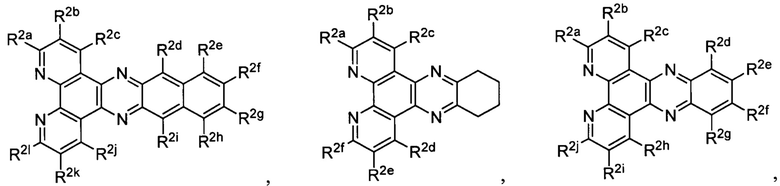
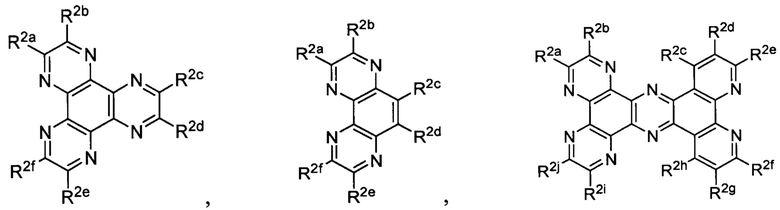 и
и 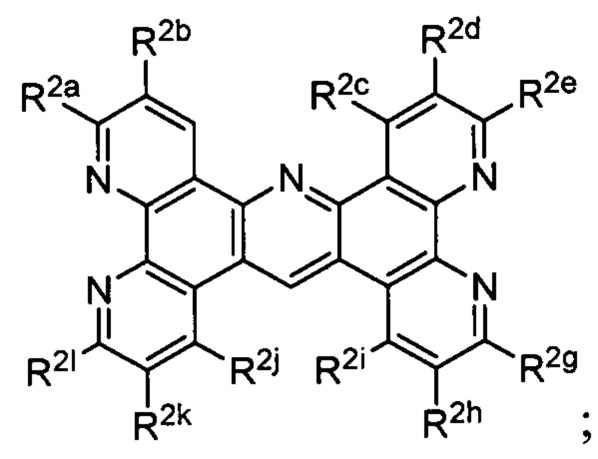
Lig3 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из 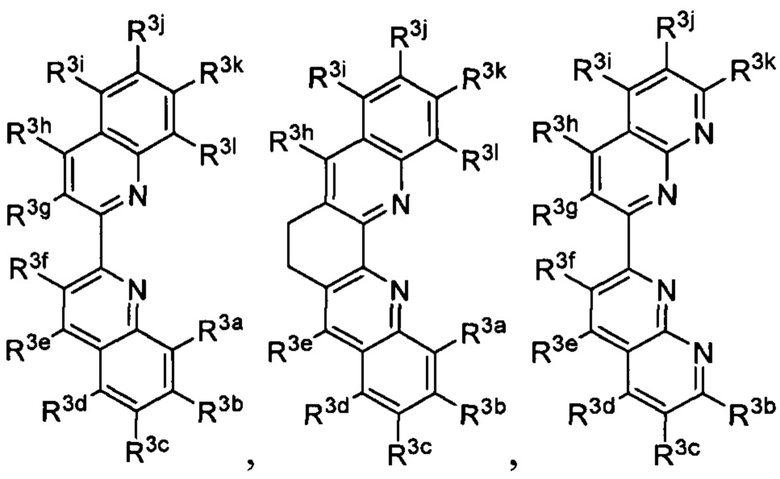 и
и 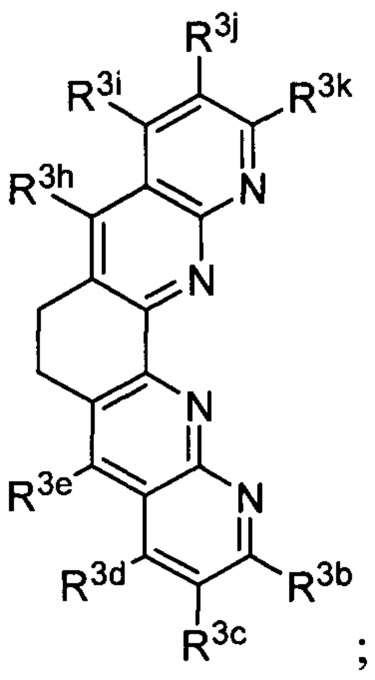
R1 выбран из группы, состоящей из водорода, необязательно замещенного фенила, необязательно замещенного арила, необязательно замещенного гетероарила, 4-пиридила, 3-пиридила, 2-тиазола, 2-пирролила, 2-фуранила, 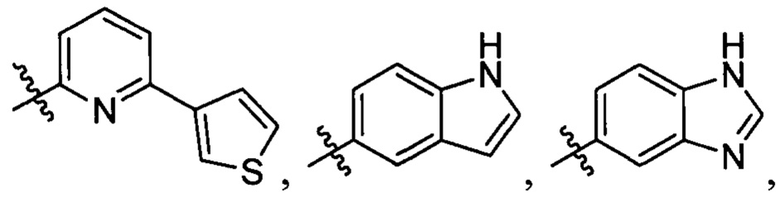
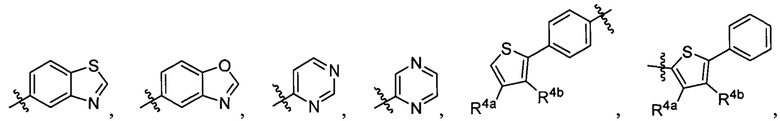
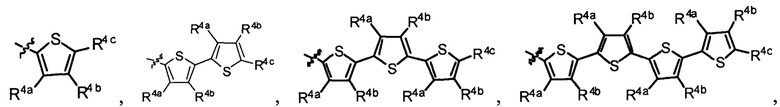
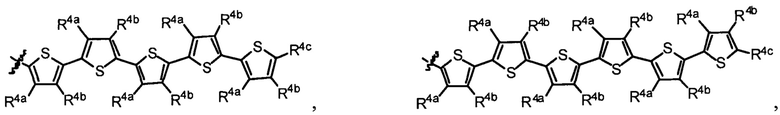
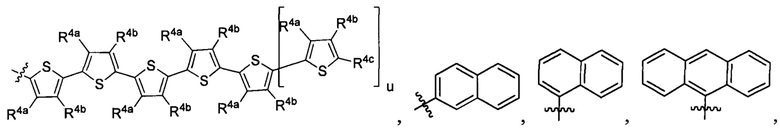
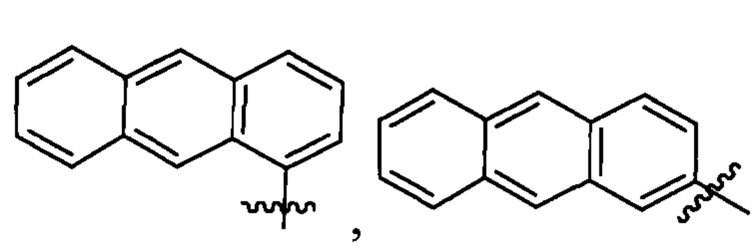 и
и 
u представляет собой целое число;
R2a, R2b, R2c, R2d, R2e, R2f, R2g, R2h, R2i, R2j, R2k и R2l в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, С3-7 необязательно замещенного циклоалкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5, CONR62, NR72, SO3H, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила и необязательно замещенного гетероцикла;
R3a, R3b, R3c, R3d, R3e, R3f, R3g, R3h R3i, R3j, R3k и R3l в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, необязательно замещенного фенила и CO2R8;
R4a, R4b и R4c в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного циклоалкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5, CONR62, NR72, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила и необязательно замещенного гетероцикла;
R4a и R4b в каждом случае их присутствия при тиофеновом кольце, совместно с атомом, к которому они присоединены, образуют необязательно замещенное кольцо, содержащее от 6 атомов в кольце, включая 2 атома кислорода;
R5 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R6 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R7 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила; и
R8 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила.
[0017] В определенных вариантах реализации гликопротеин представляет собой трансферрин, и химиотерапевтическое соединение имеет формулу (VI):
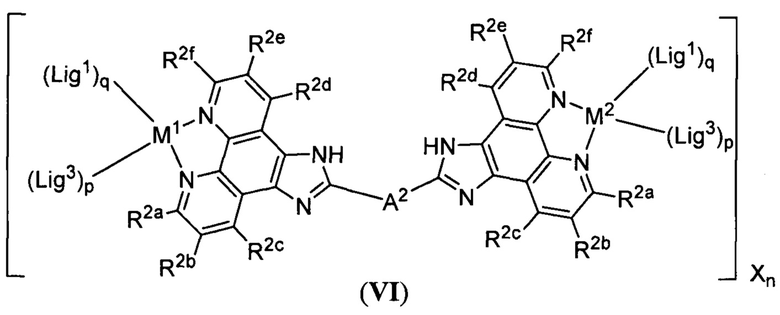
включая гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы, где:
М1 и М2 в каждом случае независимо представляют собой переходный металл и предпочтительно независимо выбраны из группы, состоящей из осмия, марганца, молибдена, рения, рутения, железа, кобальта, родия, иридия, никеля, платины и меди;
А2 выбран из группы, состоящей из 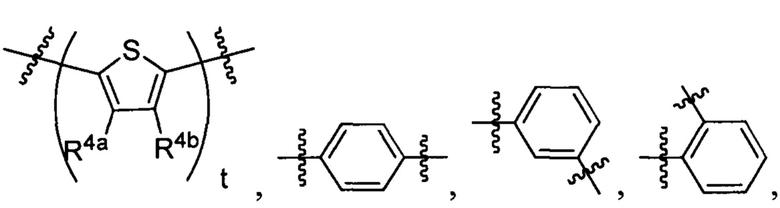
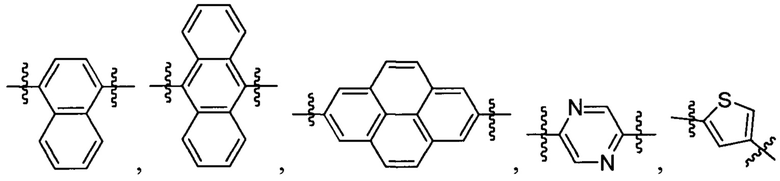 и
и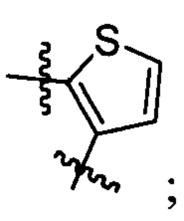
t представляет собой целое число.
[0018] В определенных вариантах реализации гликопротеин представляет собой трансферрин, и химиотерапевтическое соединение имеет формулу (VIIa)
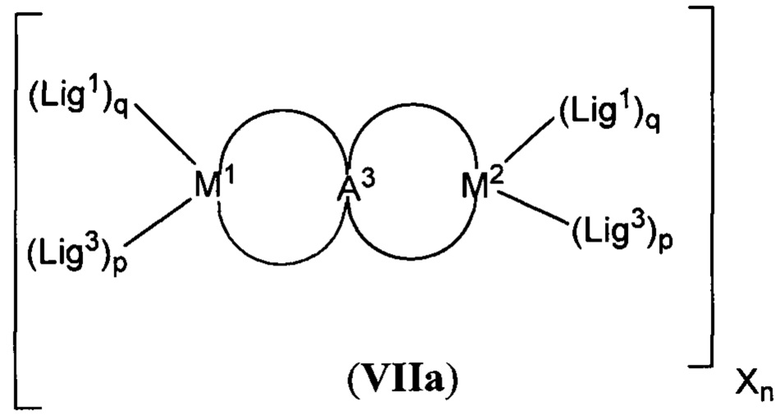
включая гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы указанного соединения, где:
М1 и М2 в каждом случае независимо представляют собой переходный металл и предпочтительно независимо выбраны из группы, состоящей из осмия, марганца, молибдена, рения, рутения, железа, кобальта, родия, иридия, никеля, платины и меди;
Lig1 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, определенной выше;
Lig3 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, определенной выше;
р независимо в каждом случае равен 0, 1 или 2;
q независимо в каждом случае равен 0, 1 или 2;
n равен 0, 1, 2, 3, 4 или 5; и
А3 выбран из группы, состоящей из 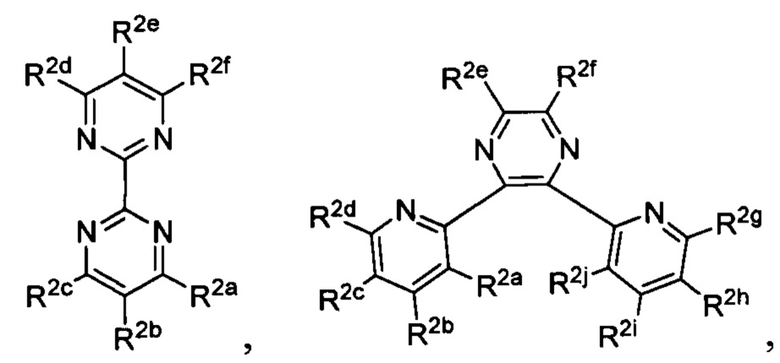
 и
и 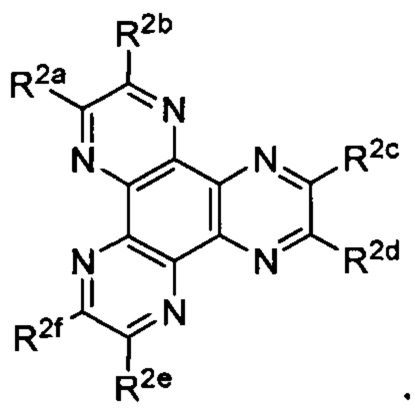
[0019] В определенных вариантах реализации гликопротеин представляет собой трансферрин, и химиотерапевтическое соединение имеет формулу (II)
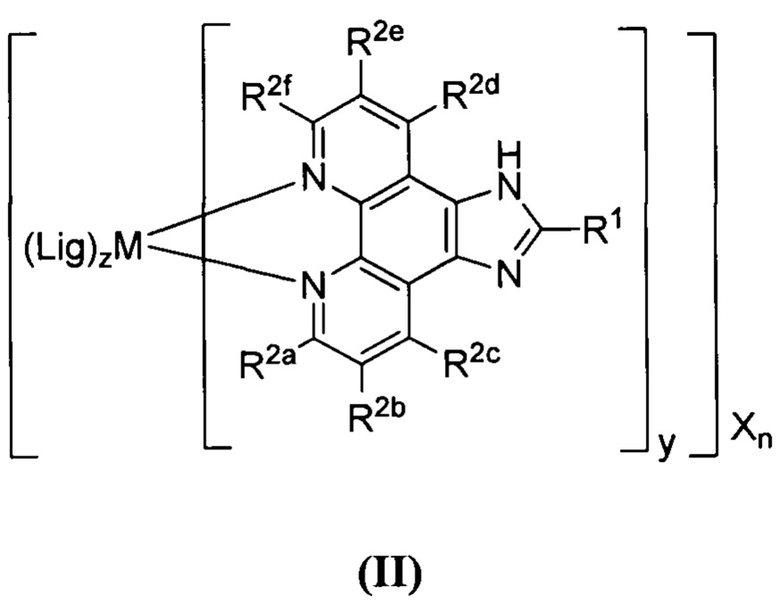
включая гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы указанного соединения, где:
М представляет собой переходный металл, предпочтительно выбранный из группы, состоящей из марганца, молибдена, рения, железа, рутения, осмия, кобальта, родия, иридия, никеля, платины и меди;
X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2;
n=0, 1, 2, 3, 4 или 5;
y=1, 2 или 3;
z=0, 1 или 2;
Lig в каждом случае независимо выбран из группы, состоящей из 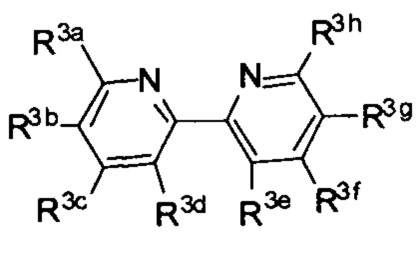
 и
и 
R1 выбран из группы, состоящей из 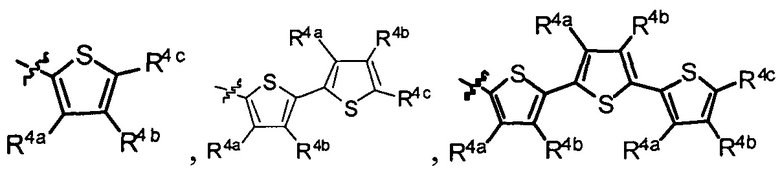

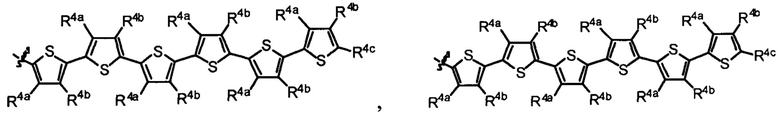 и
и 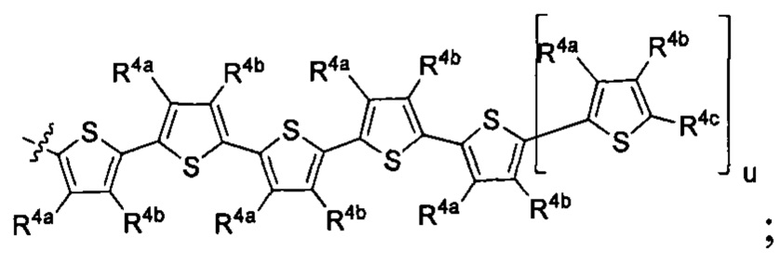
u представляет собой целое число;
R2a, R2b, R2c, R2d, R2e и R2f в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, С3-7 необязательно замещенного циклоалкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5, CONR62, NR72, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила и необязательно замещенного гетероцикла;
R3a, R3b, R3c, R3d, R3e, R3f, R3g, R3h R3i, R3j R3k, R3l и R3m в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси и CO2R8;
R4a, R4b и R4c в каждом случае независимо выбраны из группы, состоящей из водорода, С1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного циклоалкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5, CONR62, NR72, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила и необязательно замещенного гетероцикла;
R4a и R4b в каждом случае присутствия при тиофеновом кольце совместно с атомом, к которому они присоединены, образуют необязательно замещенное кольцо, содержащее от 6 атомов в кольце, включая 2 атома кислорода;
R5 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R6 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R7 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила; и
R8 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила.
[0020] Второй аспект изобретения включает способ лечения состояния, связанного с гиперпролиферацией клеток, включающий:
введение субъекту с указанным состоянием эффективного количества композиции согласно настоящему изобретению; и
облучение субъекта светом, эффективным для активации композиции и излечения таким образом указанного состояния.
[0021] Третий аспект изобретения включает способ разрушения микробной клетки, включающий:
приведение микробной клетки в контакт с эффективным количеством композиции согласно настоящему изобретению; и
облучение микробной клетки светом, эффективным для активации композиции и уничтожения тем самым микробной клетки.
[0022] Указанные и другие задачи, отличительные признаки и преимущества станут понятыми специалистам в данной области техники после изучения последующего подробного описания и прилагаемой формулы изобретения. Все процентные содержания, отношения и доли приведены в пересчете на массу, если не указано иное. Температура во всех случаях выражена в градусах Цельсия (°С), если не указано иное. Содержание всех документов в той части, которая существенна для настоящего изобретения, включено в настоящую заявку посредством ссылок; цитирование какого-либо документа не следует рассматривать как признание того, что он представляет собой уровень техники для настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0023] Изобретение будет описано при помощи следующих чертежей, на которых схожие номера позиций обозначают схожие элементы, где:
[0024] На ФИГ. 1А, 1В и 1С показаны графики зависимости поглощения/увеличения поглощения от длины волны.
[0025] На ФИГ. 2А, 2В и 2С показаны графики зависимости поглощения от длины волны.
[0026] На ФИГ. 3B и 3В показаны графики зависимости флуоресценции от длины волны.
[0027] На ФИГ. 4А и 4В показаны графики зависимости флуоресценции от длины волны.
[0028] На ФИГ. 5А и 5В показаны графики зависимости флуоресценции от длины волны.
[0029] На ФИГ. 6А, 6В и 6С показаны графики зависимости отношения поглощения от падающих фотонов.
[0030] На ФИГ. 7А, 7В и 7С показаны графики зависимости отношения поглощения от падающих фотонов.
[0031] На ФИГ. 8А, 8В и 8С показаны графики зависимости отношения поглощения от падающих фотонов.
[0032] На ФИГ. 9А, 9В и 9С показаны графики зависимости отношения поглощения от падающих фотонов.
[0033] На ФИГ. 10А, 10В и 10С показаны графики клеточного захвата металлов в контрольном и исследуемом образцах.
[0034] На ФИГ. 11А, 11В и 11С показаны графики клеточного захвата металлов в контрольном и исследуемом образцах.
[0035] На ФИГ. 12А и 12В показаны графики % гибели клеток при применении трансферрина или без него.
[0036] На ФИГ. 13А и 13В показаны графики % гибели клеток при применении трансферрина или без него.
[0037] На ФИГ. 14А и 14В показаны графики % гибели клеток при применении трансферрина или без него.
[0038] На ФИГ. 15А и 15В показаны графики % гибели клеток при применении трансферрина или без него.
[0039] На ФИГ. 16А, 16В и 16С показаны графики % гибели клеток при применении трансферрина или без него.
[0040] На ФИГ. 17А, 17В, 17С и 17D показаны графики % гибели клеток при применении трансферрина или без него.
[0041] На ФИГ. 18А, 18В, 18С и 18D показаны графики % гибели клеток при применении трансферрина или без него.
[0042] На ФИГ. 19А, 19В, 19С и 19D показаны графики % гибели клеток при применении трансферрина или без него.
[0043] На ФИГ. 20А и 20В показаны графики % гибели клеток при применении трансферрина или без него и при применении антител или без них.
[0044] На ФИГ. 21А и 21В показаны графики % гибели клеток при применении трансферрина или без него и при применении антител или без них.
[0045] На ФИГ. 22А и 22В показаны графики % гибели клеток при применении трансферрина или без него и при применении антител или без них.
[0046] На ФИГ. 23А и 23В показаны графики зависимости захвата металлов мышцами и опухолевой тканью от времени при применении трансферрина или без него.
[0047] На ФИГ. 24А и 24В показаны графики зависимости захвата металлов мышцами и опухолевой тканью от времени при применении трансферрина или без него.
[0048] На ФИГ. 25А и 25В показаны графики зависимости захвата металлов мышцами и опухолевой тканью от времени при применении трансферрина или без него.
[0049] На ФИГ. 26 показан график зависимости выживаемости в процентах от количества дней, прошедших после ФДТ.
[0050] На ФИГ. 27 показан график зависимости выживаемости в процентах от количества дней, прошедших после ФДТ.
[0051] На ФИГ. 28 показан график зависимости молярного коэффициента экстинкции от длины волны.
[0052] На ФИГ. 29 показан график зависимости молярного коэффициента экстинкции от длины волны.
[0053] На ФИГ. 30 показан график зависимости удельной оптической плотности от количества фотонов.
[0054] На ФИГ. 31 показаны графики зависимости оптической плотности от длины волны.
[0055] На ФИГ. 32 показаны графики зависимости удельных молярных коэффициентов экстинкции от энергии.
[0056] На ФИГ. 33 показаны графики зависимости оптической плотности от длины волны.
[0057] На ФИГ. 34 показаны графики зависимости оптической плотности от длины волны.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0058] Словарь
[0059] Подразумевается, что если в настоящем описании композиции описаны как имеющие, включающие или содержащие конкретные компоненты, или способы описаны как имеющие, включающие или содержащие конкретные стадии способа, то композиции согласно настоящему изобретению также состоят по существу или состоят из указанных компонентов, и способы согласно настоящему изобретению также состоят по существу или состоят из указанных стадий способа.
[0060] Если в настоящей заявке указано, что элемент или компонент включен и/или выбран из перечня указанных элементов или компонентов, то следует понимать, что элемент или компонент может представлять собой любой из указанных элементов или компонентов и может быть выбран из группы, состоящей из двух или более указанных элементов или компонентов.
[0061] Использование форм единственного числа включает множество объектов (и наоборот), если конкретно не указано иное. Кроме того, если перед количественным значением используют термин «примерно», то согласно настоящему изобретению также включено конкретное количественное значение, как таковое, если конкретно не указано иное.
[0062] Следует понимать, что порядок стадий или порядок проведения определенных операций является несущественным, если при этом настоящее изобретение может быть реализовано. Кроме того, две или более стадий или операций можно проводить одновременно.
[0063] Для задач настоящего изобретения термины «соединение», «аналог» и «композиция» можно использовать в равной степени для описания соединений согласно настоящему изобретению, описанных в настоящей заявке, независимо от того, являются они фотодинамическими или нет, включая все энантиомерные формы, диастереомерные формы, соли и т.д., и термины «соединение», «аналог» и «композиция» используют взаимозаменяемо в настоящем описании.
[0064] Соединения, описанные в настоящей заявке, могут содержать асимметрический атом (также называемый хиральным центром), и некоторые соединения могут содержать один или более асимметрических атомов или центров, тем самым становится возможным образование оптических изомеров (энантиомеров) и диастереомеров. Согласно идеям настоящего изобретения соединения, описанные в настоящей заявке, включают указанные энантиомеры и диастереомеры, а также рацемические и разделенные энантиомерно чистые R- и S-стереоизомеры, а также другие смеси R- и S-стереоизомеров и их фармацевтически приемлемых солей. Оптические изомеры можно получать в чистой форме при помощи стандартных способов, известных специалистам в данной области техники, включая, но не ограничиваясь ими, образование диастереомерных солей, кинетическое разделение и асимметрический способ синтеза. Идеи настоящего изобретения также включают цис- и транс-изомеры соединений, содержащих алкенильные фрагменты (например, алкенов и иминов). Также следует понимать, что идеи настоящего изобретения включают все возможные региоизомеры и их смеси, которые можно получать в чистой форме при помощи стандартных способов разделения, известных специалистам в данной области техники, включая, но не ограничиваясь ими, колоночную хроматографию, тонкослойную хроматографию и высокоэффективную жидкостную хроматографию.
[0065] Фармацевтически приемлемые соли соединения согласно идеям настоящего изобретения, содержащие кислотный фрагмент, можно получать с применением органических и неорганических оснований. Включены моно- и полианионные соли в зависимости от числа кислотных атомов водорода, доступных для депротонирования. Подходящие соли, получаемые с применением оснований, включают соли металлов, такие как соли щелочных металлов или щелочно-земельных металлов, например, соли натрия, калия или магния; соли аммония и соли органических аминов, такие как те, что получены с применением морфолина, тиоморфолина, пиперидина, пирролидина, моно-, ди- или три-низший алкил-амина (например, этил-трет-бутил-, диэтил-, диизопропил-, триэтил-, трибутил- или диметилпропиламина) или моно-, ди- или три-гидрокси-низший алкил-амина (например, моно-, ди- или триэтаноламина). Конкретные неограничивающие примеры неорганических оснований включают NaHCO3, Na2CO3, KHCO3, K2CO3, Cs2CO3, LiOH, NaOH, KOH, NaH2PO4, Na2HPO4 и Na3PO4. Также можно получать внутренние соли. Аналогично, если соединение, описанное в настоящей заявке, содержит основный фрагмент, можно получать соли с применением органических и неорганических кислот. Например, можно получать соли с применением следующих кислот: уксусной, пропановой, молочной, бензолсульфокислоты, бензойной, камфорсульфокислоты, лимонной, винной, янтарной, дихлоруксусной, этенсульфокислоты, муравьиной, фумаровой, глюконовой, глутаминовой, гиппуровой, бромоводородной, хлороводородной, изетионовой, молочной, малеиновой, яблочной, малоновой, миндальной, метансульфокислоты, слизевой, нафталинсульфокислоты, азотной, щавелевой, памовой, пантотеновой, фосфорной, фталевой, пропановой, янтарной, серной, винной, толуолсульфокислоты и камфорсульфокислоты, а также других известных фармацевтически приемлемых кислот.
[0066] Если какая-либо переменная встречается более одного раза в любом компоненте или на любой формуле, то ее определение в каждом случае не зависит от определения в любом другом случае (например, в N(R6)2 каждый R6 может быть одинаковыми или отличаться от других). Комбинации заместителей и/или переменных являются допустимыми, только если указанные комбинации обеспечивают стабильные соединения.
[0067] Термины «лечить», «лечение» и «способ лечения» при использовании в настоящем описании относятся к частичному или полному смягчению, подавлению, ослаблению и/или ослаблению состояния, от которого предположительно страдает субъект.
[0068] При использовании в настоящем описании «терапевтически эффективный» и «эффективная доза» относятся к веществу или количеству, которое обеспечивает желаемую(-ый) биологическую(-ий) активность или эффект.
[0069] При использовании в настоящем описании термин «фотодинамическая терапия» относится к способу лечения для уничтожения клеток или модуляции иммунной функции, включая иммунный ответ, клеток и тканей с применением лекарственного средства, которое может активироваться под действием света с определенной длиной волны в определенной дозе.
[0070] При использовании в настоящем описании термин «химиотерапевтическое соединение» относится к химическому соединению, обладающему профилактическими, благоприятными и/или целебными свойствами в отношении одного или более состояний или заболеваний.
[0071] При использовании в настоящем описании термин «фотодинамическое соединение» относится к соединению, которое обеспечивает фотодинамическую терапию. Фотодинамические соединения представляют собой подгруппу химиотерапевтических соединений, таких как определено в настоящем описании.
[0072] За исключением тех случаев, где это специально отмечено, термины «субъект» или «пациент» используют взаимозаменяемо для описания млекопитающих, таких как пациент-человек и приматы, отличные от человека, а также экспериментальных животных, таких как кролики, крысы и мыши, и других животных. Соответственно, термин «субъект» или «пациент» при использовании в настоящем описании обозначает любого пациента или субъекта, представляющего собой млекопитающее, которому можно вводить соединения согласно настоящему изобретению. В типовом варианте реализации настоящего изобретения общепринятые способы скрининга применяют для выявления субъектов и пациентов, подходящих для лечения согласно способам согласно настоящему изобретению, для определения факторов риска, связанных с целевым или предполагаемым заболеванием или состоянием, или для определения статуса существующего заболевания или состояния у субъекта. Указанные способы скрининга включают, например, традиционное обследование для определения факторов риска, которые могут быть связаны с целевым или предполагаемым заболеванием или состоянием. Указанные и другие традиционные способы позволяют клиническому специалисту выбирать пациента, нуждающегося в терапии с применением способов и соединений согласно настоящему изобретению.
[0073] При использовании в настоящем описании термин «биологическая мишень» относится к органу, ткани и/или клетке организма и/или к организму, как таковому.
[0074] Преимущества изобретения
[0075] Изобретение отчасти основано на неожиданном открытии того, что ФДС на основе Ru, Rh и Os, в частности те, что описаны в WO 2013158550 A1, WO 2014145428 А2, патентах США №6962910, 7612057, 8445475 и 8148360, обладают значительно улучшенными химическими, физическими и биомедицинскими свойствами при введении в комбинации с металлсвязывающими гликопротеинами согласно настоящему изобретению.
[0076] Рутений и осмий находятся в той же группе Периодической таблицы элементов, что и железо, в группе 8, и имеют с ним множество общих характеристик. Родий находится в соседней группе 9. Так как рутений и осмий находятся в одной группе с железом, они имеют множество общих характеристик. Например, если рассматривать электронный профиль, молекулы (II) и Os (II) легко связываются с донорными азот- и серосодержащими молекулами (указанные механизмы также важны для индукции NO (Chatterjee D, Shome S, Jaiswal N, Banerjee P. Nitrite reduction mediated by the complex Ru III (EDTA). Dalton Trans. 2014 Sep 28; 43(36): 13596-600) и могут влиять на изменение фотохимических свойств II типа на I тип), которые распространены во многих белках в организме. По указанной причине комплексы переходных металлов могут пользоваться способностью организма обеспечивать эффективный транспорт или захват железа (Antonarakis ES, Emadi А. Ruthenium-based chemotherapeutics: are they ready for prime time? Cancer Chemother Pharmacol. 2010 May; 66(1): 1-9). Транспорт РSФС внутри раковой клетки (митохондрии) происходит за счет связывания с эндогенным трансферрином (гликопротеином, вырабатываемым, главным образом, в печени) посредством рецептора трансферрина (TfR); Bergamo A, Sava G. Ruthenium anticancer compounds: myths and realities of the emerging metal-based drugs. Dalton Trans. 2011 Aug 21; 40(31): 7817-23.
[0077] Быстро делящиеся опухолевые клетки имеют повышенную потребность в железе, и уровень TfR, присутствующих в указанных раковых клетках, значительно увеличен. Было определено, что увеличение количества рецепторов в раковых клетках от двух до двенадцати раз превышает их количество в здоровых клетках (Antonarakis ES, Emadi A. Ruthenium-based chemotherapeutics: are they ready for prime time? Cancer Chemother Pharmacol. 2010 May; 66(1): 1-9). Это приводит к значительному увеличению селективности ФС, так как основная часть дозы выделяется в раковых тканях и не затрагивает большинство здоровых клеток. Указанный эффект вносит вклад в понижение токсичности рутениевых лекарственных средств по сравнению с платиновыми (Bruijnincx, Pieter С.А.; Sadler, Peter J. (2009). "Controlling platinum, ruthenium, and osmium reactivity for anticancer drug design". Advances in Inorganic Chemistry 61. p. 1).
[0078] Так как для роста раковых клеток требуется железо, то можно отметить дополнительное благоприятное действие конкурентного связывания ФДС с рецептором трансферрина в опухолевой клетке. Помимо активного захвата ФДС при указанном механизме происходит подавление пролиферации клеток и HIF-1α. Ангиогенез в средах с нормальным и пониженным содержанием кислорода может обеспечивать дополнительное терапевтическое применение. Кроме того, так как рост и размножение раковых клеток, в общем случае, происходит намного быстрее по сравнению с нормальными здоровыми клетками, указанное явление приводит к созданию среды, которая в меньшей степени обогащена кислородом из-за увеличенной скорости метаболизма. Указанный эффект в комбинации с тенденцией к повышенному содержанию глутатиона в раковых клетках и понижению рН обеспечивает создание химической восстановительной среды. Действительно, данные, полученные авторами настоящего изобретения, показали аддитивное и даже потенциально синергическое действие глутатиона в механизмах гибели раковых клеток от ФДС. Как полагают, опосредованное глутатионом восстановление происходит под действием митохондриальных белков или микросомальных белков, обеспечивающих одноэлектронный перенос, при этом оно также может происходить под действием систем трансмембранного транспорта электронов, которые находятся вне клеток, с учетом того факта, что при местном введении ФС их эффективность сохраняется даже при удалении/выделении ФС во внутриклеточное пространство. В теории, возможно обратное окисление соединений рутения с образованием неактивной формы при их удалении из раковой среды, и, таким образом, помимо крайне высокой фотостабильности ФС, указанное явление также может обеспечивать дополнительную эффективность и безопасность способа лечения.
[0079] Во время активации светом в предпочтительных вариантах реализации помимо индуцированного ФДТ воспаления происходит модификация гибели опухолевых клеток и активация антиген-представляющих клеток («АРС») посредством ассоциированных с опасностью молекулярных фрагментов («DAMP»). Распознавание молекул, высвобождаемых или экспрессируемых мертвыми, погибающими, поврежденными или подавленными «антигенными»-апоптотическими клетками, может обеспечивать высокоактивные и опухоль-специфические иммунные ответы. Индуцируемые ФДТ DAMP, выделяемые погибающими раковыми клетками, могут обеспечивать краткосрочное противоопухолевое действие, направленное на антигены раковых клеток (от 6 до 8 недель) и долгосрочный противоопухолевый эффект (>10 месяцев). DAMP стимулируют иммунные ответы посредством взаимодействия с Т-лимфоцитами («Th»-клетками), клетками-натуральными киллерами («NK») и АФС. Определенные АФС, такие как дендритные клетки и макрофаги, стимулируются и активно перемещаются во время индуцированной ФДТ «иммунологической» гибели клеток («ICD») посредством сигнальных путей опасности, которые провоцируются и регулируются в результате сложных взаимодействий сигнальной системы клеточного стресса, выработки активных форм кислорода («АФК») и определенных метаболических/биосинтетических процессов (т.е. аутофагии, активности каспазы и секреторного пути: калретикулина, аденозина трифосфата («АТФ»), белков теплового шока, белка 1 группы с высокой подвижностью, цитокинов и т.д.).
[0080] Способы согласно настоящему изобретению
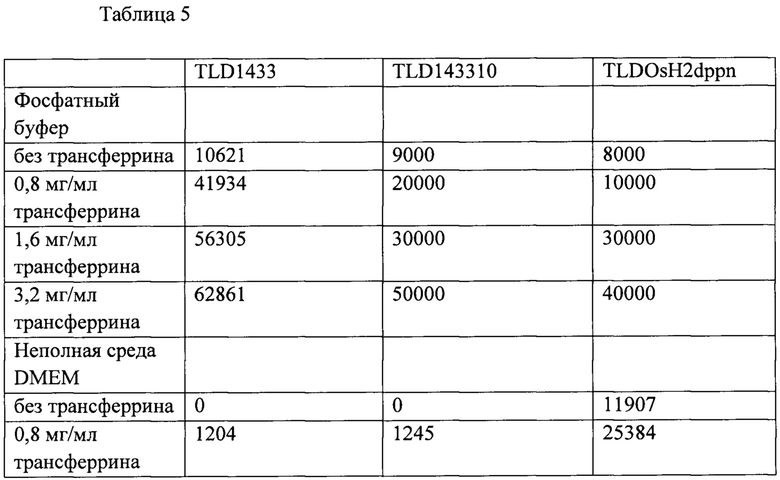
[0081] Способы согласно настоящему изобретению включают применение металлсвязывающих гликопротеинов в качестве носителей для доставки ФДС на основе металлов для улучшения тем самым доставки ФДС к биологической мишени. Способы предназначены для обеспечения улучшенной безопасности и/или эффективности по сравнению с доставкой ФДС на основе металлов без использования экзогенных металлсвязывающих гликопротеинов. ФДС, доставляемые при помощи способов и композиций согласно настоящему изобретению, обладают улучшенными биофизическими, биохимическими и биомедицинскими свойствами, такими как эффективность, переносимость, терапевтическая эффективность, и диагностическими свойствами ФДС при многоволновой фотодинамической терапии в условиях нормального и пониженного содержания кислорода.
[0082] Таким образом, способы согласно настоящему изобретению включают объединение металлсодержащих ФДС с металлсвязывающими гликопротеинами и введение комбинации, например, пациенту, нуждающемуся в ФДТ, или в организм, который необходимо разрушить.
[0083] Настоящее изобретение дополнительно относится к способу получения соединений согласно настоящему изобретению.
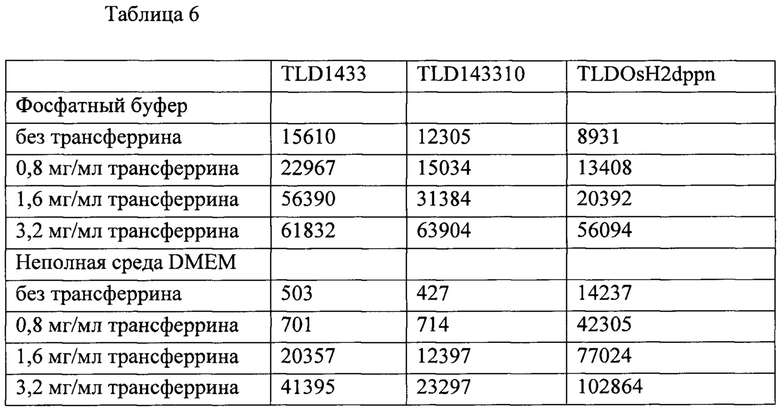
[0084] Соединения, согласно идеям настоящего изобретения, можно получать согласно способам, описанным в настоящей заявке, из коммерчески доступных исходных веществ, соединений, известных из литературы, или легко доступных промежуточных веществ, с применением стандартных способов синтеза и способов, известных специалистам в данной области техники. Стандартные способы синтеза и техники получения органических молекул и координационных комплексов и превращения и изменения функциональных групп можно легко найти в соответствующей научной литературе или справочниках по данной области техники. Следует понимать, что если приведены типовые или предпочтительные условия способа (т.е. температура реакции, продолжительность, мольное отношение реагентов, растворители, давление и т.д.), то также можно применять и другие условия способа, если не указано иное. Оптимальные условия взаимодействия могут быть различными в зависимости от конкретных применяемых реагентов или растворителей, но указанные условия могут быть определены специалистами в данной области техники при помощи стандартных способов оптимизации. Специалистам в области органического и неорганического синтеза будет понятно, что природу и порядок предложенных стадий синтеза можно изменять для оптимизации получения соединений, описанных в настоящей заявке.
[0085] Способы получения, описанные в настоящей заявке, можно контролировать любым подходящим способом, известным в данной области техники. Например, образование продукта можно контролировать при помощи спектроскопии, такой как спектроскопия ядерного магнитного резонанса (например, 1Н или 13С), инфракрасная спектроскопия, спектрофотометрия (например, в УФ-видимой области), масс-спектрометрия, или хроматографии, такой как высокоэффективная жидкостная хроматография (ВЭЖХ), газовая хроматография (ГХ), гельпроникающая хроматография (ГПХ) или тонкослойная хроматография (ТСХ).
[0086] Металлсвязывающие гликопротеины, подходящие для применения согласно настоящему изобретению, могут связывать переходные металлы и доставлять указанные металлы и другие вещества, образующие комплекс с указанными металлами, к биологической мишени. Металлсвязывающие гликопротеины предпочтительно могут связывать металлы группы 8 и/или группы 9 и наиболее предпочтительно Ru, Os и Rh. Наиболее предпочтительными являются связывающие железо гликопротеины трансферрин, лактоферрин, овотрансферрин и меланотрансферрин и их варианты, где трансферрин является наиболее предпочтительным. Гликопротеин можно выделять из природных источников или получать из искусственных источников. Таким образом, например, гликопротеин в определенных вариантах реализации представляет собой рекомбинантный трансферрин, такой как апо-трансферрин или OPTIFERRIN, рекомбинантный человеческий трансферрин, доступный в InVitria, отделении Ventria Bioscience. См. заявку на патент США №20120088729 A1, Zhang et al., "Expression, purification, and characterization of recombinant human transferrin from rice (Oryza sativa L.)." Protein Expr Purif. 2010 Nov; 74(1): 69-79. Epub 2010 May 4, и Steere et al., "Biochemical and structural characterization of recombinant human serum transferrin from rice (Oryza sativa L.)." J Inorg Biochem. 2012 Jul 11; 116C: 37-44. OPTIFERRIN представляет собой особенно предпочтительный гликопротеин, так как он улучшает направленную доставку и снижает фотообесцвечивание комплексов металл-гликопротеин согласно настоящему изобретению.
[0087] Биологические мишени согласно настоящему изобретению представляют собой организмы, органы, ткани и/или клетки, восприимчивые к лечению и/или детектированию с применением комплексов металл-гликопротеин согласно настоящему изобретению. Мишени предпочтительно представляют собой гиперпролиферативные клетки, такие как раковые клетки и незлокачественные поражения.
[0088] Насколько известно, прямое связывание Ru (II) и/или Os (II) с трансферрином (Tf) на момент подачи заявки описано не было, также не было описано связывание фотоактивных соединений (фотосенсибилизаторов или ФС) с Tf. В растворе Tf, предварительно смешанном с раствором ФС (ФС на основе рутения, рутения-родия и осмия), наблюдаются подтверждения металл-специфического связывания ФС с Tf. Полученный комплекс имеет усиленное поглощение/молярный коэффициент экстинкции при больших длинах волн (>600 нм), усиленную выработку АФК (выработка гидроксильных радикалов усиливается в значительно более высокой степени по сравнению выработкой синглетного кислорода, что позволяет предположить переход к фотореакциям I типа в присутствии трансферрина), усиленный и предпочтительный захват раковыми клетками, увеличенную эффективность ФДТ in vitro и сопутствующее снижение темновой токсичности, а следовательно увеличение терапевтического индекса, усиленный и селективный захват раковыми клетками и опухолевыми тканями и увеличенную эффективность ФДТ in vivo в видимой и ближней ИК-области спектра. В определенных вариантах реализации обеспечиваются усиленное поглощение/молярный коэффициент экстинкции при длинах волн, составляющих 600 нм или менее, указанные варианты реализации особенно подходят для возбуждения с применением зеленого, синего, УФ и рентгеновского излучения.
[0089] Фотосенсибилизаторы на основе рутения, рутения-родия и осмия при связывании с трансферрином имеют характеристический профиль связывания.
[0090] Связывание с трансферрином приводит к изменению химических, физических и биомедицинских характеристик молекул и/или составов на основе металлов и индуцирует поглощение фотосенсибилизаторами на основе рутения, рутения-родия и осмия при длинах волн красной и ближней ИК-области спектра, при этом их поглощение в отсутствие трансферрина является пренебрежительно малым.
[0091] Индуцированная облучением флуоресценция фотосенсибилизаторов на основе рутения, рутения-родия и осмия увеличивается в присутствии трансферрина, что может иметь значение при применении комплексов металл-трансферрин для диагностики.
[0092] Связывание фотосенсибилизаторов на основе рутения, рутения-родия и осмия с трансферрином увеличивает их устойчивость к фотообесцвечиванию.
[0093] Связывание фотосенсибилизаторов на основе рутения, рутения-родия и осмия с трансферрином увеличивает выработку активных форм кислорода в бесклеточной среде. Указанный эффект увеличивается при увеличении концентрации трансферрина. Усиленная выработка гидроксильных радикалов позволяет предположить, что фотоэффект фотосенсибилизатора изменяется со II типа на I тип, что важно при лечении объемных гипоксических опухолей путем ФДТ.
[0094] Связывание фотосенсибилизаторов на основе рутения, рутения-родия и осмия с трансферрином увеличивает предпочтительный захват раковыми клетками.
[0095] В присутствии дополнительного количества трансферрина фотосенсибилизаторы на основе рутения, рутения-родия и осмия имеют пониженную темновую токсичность in vitro (при применении раковых клеточных линий); эффективность ФДТ при этом увеличивается. Это приводит к увеличению терапевтического индекса фотосенсибилизаторов.
[0096] Связывание фотосенсибилизаторов на основе рутения, рутения-родия и осмия с дополнительным количеством трансферрина обеспечивает эффективность ФДТ при гипоксических состояниях, которая отсутствует без использования трансферрина.
[0097] Блокировка рецепторов трансферрина с применением специфических антител будет подавлять усиливающее действие трансферрина при ФДТ.
[0098] Инкубация фотосенсибилизаторов на основе рутения, рутения-родия и осмия совместно с трансферрином перед и.п.инъекцией in vivo приводит к увеличению MTD50, что указывает на снижение токсичности ФС.
[0099] Инкубация фотосенсибилизаторов на основе рутения, рутения-родия и осмия совместно с трансферрином перед и.п.инъекцией приводит к увеличению эффективности ФДТ in vivo в ближней ИК (808 нм) и красной (625 нм) области спектра.
[00100] Изобретение обеспечивает:
- селективную доставку фотосенсибилизаторов на основе рутения, рутения-родия и осмия;
- увеличение эффективности ФС, в частности в диапазонах длин волн, при которых фотосенсибилизаторы в иных случаях являются неэффективными (в красной, ближней ИК области спектра);
- эффективность ФДТ при гипоксии в случаях, где ФС являются неэффективными без применения Tf;
- улучшенную безопасность, переносимость и эффективность всех медицинских составов на основе металлов, которые могут быть связаны с Tf и/или веществами на основе Tf, включая зерна и/или липосомы; и
- улучшенные диагностические свойства молекул на основе металлов.
[00101] Изобретение дополнительно включает применение комплексов металл-гликопротеин согласно настоящему изобретению для увеличения захвата клетками фармацевтических агентов на основе металлов, которые не активируются на свету (например, RAPTA, NAMI, KP1019, RM-175).
[00102] Композиции согласно настоящему изобретению
[00103] Композиции согласно настоящему изобретению содержат металлсвязывающий гликопротеин и химиотерапевтическое соединение (например, фотодинамическое соединение), содержащее по меньшей мере один переходный металл, который предпочтительно представляет собой металл 8 или 9 группы и наиболее предпочтительно представляет собой по меньшей мере один металл, выбранный из Ru, Rh и Os.
[00104] Химиотерапевтическое соединение предпочтительно представляет собой по меньшей мере одно соединение, описанное в WO 2013158550 A1, WO 2014145428 А2, патентах США №6962910, 7612057, 8445475 или 8148360. Другие химиотерапевтические соединения, подходящие для применения согласно настоящему изобретению, включают, но не ограничиваются ими, RAPTA, NAMI, KP1019 и их аналоги.
[00105] В определенных вариантах реализации композиции согласно настоящему изобретению содержат комбинации на основе переходных металлов, которые необязательно окружены (напрямую и/или опосредованно связаны) различными лигандами, такие как координационные соединения. В некоторых из указанных вариантов реализации включены мостиковые лиганды, которые являются сильными донорами электронов для металла(-ов).
[00106] Предполагается, что во всех вариантах реализации, предложенных в настоящем описании, примеры подходящих необязательных заместителей не ограничивают объем предложенного изобретения. Соединения согласно настоящему изобретению могут содержать любые заместители или комбинации заместителей, предложенные в настоящем описании.
[00107] Свойства соединений согласно настоящему изобретению:
[00108] Композиции согласно настоящему изобретению подходят для лечения и диагностики болезненных состояний, в частности для разрушения инфекционных организмов, гиперпролиферативных клеток и опухолевых клеток. Композиции предпочтительно содержат ФДС, которые (i) представляют собой координационные комплексы на основе металлов, (ii) поглощают свет в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) (в частности, в ближней инфракрасной (NIR)) области спектра и активируются при длинах волн в диапазоне от УФ до ИК области спектра, в частности, >800 нм, (iii) уничтожают раковые клетки человека в культуре или организме животных, и (iv) уничтожают бактерии и бактерии, устойчивые к антибиотикам.
[00109] Композиции согласно настоящему изобретению также способны разрушать микроорганизмы, такие как Staphylococcus aureus (SA) и S. aureus, устойчивый к метициллину (MRSA), при активации светом в диапазоне от УФ до ИК области спектра, в частности красной и ближней инфракрасной области спектра.
[00110] Изобретение будет проиллюстрировано более подробно при помощи следующих примеров, но следует понимать, что настоящее изобретение не ограничено ими.
[00111] В примерах, приведенных далее, предложены стандартные способы получения иллюстративных соединений согласно настоящему изобретению. Специалистам в данной области техники будут известны способы замены на соответствующие реагенты, исходные вещества и способы очистки, известные специалистам в данной области техники, для получения соединений согласно настоящему изобретению.
ПРИМЕРЫ
[00112] Пример 1
[00113] Трансферрин (0,2 мг/мл) инкубировали совместно с различными фотосенсибилизаторами (10 мкМ) и получали спектры поглощения. На ФИГ. 1А показано увеличение поглощения рутением (TLD1433). На ФИГ. 1В показаны ФС на основе рутения-родия (TLD143310), и на ФИГ. 1С показаны ФС на основе осмия (TLDOsH2dppn) в присутствии трансферрина. Для каждого фотосенсибилизатора на левом графике показаны абсолютные различия поглощения при применении трансферрина и без трансферрина. На правом графике показано относительное увеличение поглощения при применении трансферрина по сравнению с фотосенсибилизатором без трансферрина. Следует отметить, что большое относительное увеличение поглощения может соответствовать небольшому различию абсолютных значений и наоборот.
[00114] Связывание фотосенсибилизаторов с трансферрином сопровождалось увеличением поглощения в видимой и ближней ИК области спектра, в частности, при более высоких длинах волн. Следует отметить, что пренебрежительно малое поглощение фотосенсибилизаторов в красной и ближней ИК области спектра становилось значительным после связывания указанных фотосенсибилизаторов с трансферрином.
[00115] Пример 2: Характеристические профили связывания
[00116] Трансферрин (0,2 мг/мл) инкубировали совместно с фотосенсибилизаторами (10 мкм) и получали спектры поглощения. На ФИГ. 2А, 2В и 2С показано связывание трансферрина с фотосенсибилизаторами на основе рутения (TLD1433, ФИГ. 2А), рутения-родия (TLD143310, ФИГ. 2В) и осмия (TLDOsH2dppn, ФИГ. 2С).
[00117] Связывание фотосенсибилизаторов на основе рутения и рутения-родия с трансферрином характеризуется характеристическими профилями: интенсивным пиком поглощения при 280 нм и новым пиком в диапазоне 400-500 нм. Фотосенсибилизаторы на основе осмия имеют другой профиль связывания: новые пики в диапазонах 300-400 нм и 500-600 нм.
[00118] Пример 3: Флуоресценция
[00119] Флуоресценцию TLD1433 (10 мкМ) измеряли в кварцевых кюветах без использования Tf (в воде) и в присутствии 0,2 мг/мл Tf (в фосфатном буфере + 100 мМ NaCl, рН=7,0). Флуоресценцию измеряли при различных длинах волн возбуждения (380, 400, 450, 470, 500 нм).
[00120] Для TLD1433 была показана поддающаяся измерению флуоресценция, которая усиливалась в присутствии трансферрина. Без использования трансферрина (ФИГ. 3A) максимальная флуоресценция возникала при длинах волн возбуждения 380, 400 и 470 нм (максимальное испускание при 624 нм). В присутствии трансферрина (ФИГ. 3В) флуоресценция значительно увеличивалась, в частности при возбуждении при 470 нм, где происходил незначительный сдвиг максимального испускания к более коротким длинам волн (619 нм).
[00121] Поддающаяся измерению флуоресценция TLD1433 делает его подходящим для диагностических задач (детектирование селективного захвата TLD1433 предпочтительно раковыми тканями).
[00122] Пример 4 (теоретический)
[00123] ФИГ. 4А и 4В
[00124] Флуоресценцию TLD1433 (10 мкМ) измеряли в кварцевых кюветах без использования Tf (в воде) и в присутствии 0,2 мг/мл Tf (в фосфатном буфере + 100 мМ NaCl, рН=7,0). Флуоресценцию измеряли при различных длинах волн возбуждения (380, 400, 450, 470, 500 нм).
[00125] Для TLD143310 показана поддающаяся измерению флуоресценция, которая усиливалась в присутствии трансферрина. Без использования трансферрина (ФИГ. 4А) максимальная флуоресценция возникала при длинах волн возбуждения 380, 400, 470 нм (максимальное испускание при 650 нм). В присутствии трансферрина (ФИГ. 4В) флуоресценция значительно увеличивалась, в частности при возбуждении при 470 нм, где происходил незначительный сдвиг максимального испускания к более коротким длинам волн (637 нм). Поддающаяся измерению флуоресценция TLD143310 делает его подходящим для диагностических задач (детектирование селективного захвата TLD143310 предпочтительно раковыми тканями).
[00126] Пример 5 (теоретический)
[00127] Флуоресценцию TLDOsH2dppn (10 мкМ) измеряли в кварцевых кюветах без использования Tf (в воде) и в присутствии 0,2 мг/мл Tf (в фосфатном буфере + 100 мМ NaCl, рН=7,0). Флуоресценцию измеряли при различных длинах волн возбуждения (380, 400, 450, 470, 500 нм).
[00128] Для TLDOsH2dppn была показана поддающаяся измерению флуоресценция, которая усиливалась в присутствии трансферрина. Без использования трансферрина (ФИГ. 5А) максимальная флуоресценция возникала при длинах волн возбуждения 380, 400, 470 нм (максимальное испускание при 660 нм). В присутствии трансферрина (ФИГ. 5В) флуоресценция значительно усиливалась, в частности при возбуждении при 470 нм, где происходил незначительный сдвиг максимального испускания к более коротким длинам волн (650 нм).
[00129] Поддающаяся измерению флуоресценция TLDOsH2dppn делает его подходящим для диагностических задач (детектирование селективного захвата TLDOsH2dppn предпочтительно раковыми тканями).
[00130] Пример 6: Фотообесцвечивание
[00131] Фотообесцвечивание измеряли: (а) при длине волны в видимой области, соответствующей максимальному поглощению для каждого фотосенсибилизатора. Это позволяет оценивать динамику изменения количества необесцвеченного фотосенсибилизатора при облучении; и (b) при 530, 635 и 808 нм. Это позволяет оценивать динамику изменения количества необесцвеченного фотосенсибилизатора, доступного для обеспечения действия ФДТ при указанных длинах волн, что полезно при лечении ФДТ.
[00132] Фотосенсибилизаторы (10 мкМ) растворяли в фосфатном буфере + 100 мМ NaCl (рН=7,0) или в буфере, содержащем 0,8 мг/мл трансферрина, общий объем составлял 1 мл. Затем на смесь воздействовали лазерным генератором при длине волны 525 нм (130 мВт) и измеряли поглощение при длине волны максимального поглощения в видимой области (432 нм для TLD1433, 425 нм для TLD143310 и 562 нм для TLDOsH2dppn) в конкретные моменты времени. На графике показана зависимость отношения поглощения (поглощение в образцах, подвергнутых воздействию / поглощение в образцах, не подвергавшихся воздействию) от количества падающих фотонов на см2. Уменьшение отношения поглощения свидетельствует об обесцвечивании фотосенсибилизатора.
[00133] Влияние трансферрина на обесцвечивание соединений на основе рутения (TLD1433, ФИГ. 6А), рутения-родия (TLD143310, ФИГ. 6В - теоретический пример) и осмия (TLDOsH2dppn, ФИГ. 6С - теоретический пример) при 525 нм.
[00134] В присутствии трансферрина обесцвечивание фотосенсибилизаторов уменьшалось.
[00135] Пример 7 (теоретический)
[00136] Фотосенсибилизаторы (10 мкМ) растворяли в фосфатном буфере + 100 мМ NaCl (рН=7,0) или в буфере, содержащем 0,8 мг/мл трансферрина, общий объем составлял 1 мл. Затем на смесь воздействовали лазерным генератором при длине волны 525 нм (130 мВт) и измеряли поглощение при 530 нм в конкретные моменты времени. На графике показана зависимость отношения поглощения (поглощение в образцах, подвергнутых воздействию / поглощение в образцах, не подвергавшихся воздействию) от количества падающих фотонов на см2. Уменьшение отношения поглощения свидетельствует об обесцвечивании фотосенсибилизатора.
[00137] Влияние трансферрина на обесцвечивание соединений на основе рутения (TLD1433, ФИГ. 7А), рутения-родия (TLD143310, ФИГ. 7В) и осмия (TLDOsH2dppn, ФИГ. 1С): поглощение при 525 нм. В присутствии трансферрина обесцвечивание фотосенсибилизаторов понижалось. Трансферрин обеспечивает частичную защиту фотосенсибилизаторов от фотообесцвечивания.
[00138] Пример 8 (теоретический)
[00139] Фотосенсибилизаторы (10 мкМ) растворяли в фосфатном буфере + 100 мМ NaCl (рН=7,0) или в буфере, содержащем 0,8 мг/мл трансферрина, общий объем составлял 1 мл. Затем на смесь воздействовали лазерным генератором при длине волны 525 нм (130 мВт) и измеряли поглощение при 635 нм в конкретные моменты времени. На графике показана зависимость отношения поглощения (поглощение в образцах, подвергнутых воздействию / поглощение в образцах, не подвергавшихся воздействию) от количества падающих фотонов на см2. Уменьшение отношения поглощения свидетельствует об обесцвечивании фотосенсибилизатора.
[00140] Влияние трансферрина на обесцвечивание соединений на основе рутения (TLD1433, ФИГ. 8А), рутения-родия (TLD143310, ФИГ. 8В) и осмия (TLDOsH2dppn, ФИГ. 8С): поглощение при 635 нм. В присутствии трансферрина обесцвечивание фотосенсибилизаторов понижалось. Трансферрин обеспечивает частичную защиту фотосенсибилизаторов от фотообесцвечивания.
[00141] Пример 9 (теоретический)
[00142] Фотосенсибилизаторы (10 мкМ) растворяли в фосфатном буфере + 100 мМ NaCl (рН=7,0) или в буфере, содержащем 0,8 мг/мл трансферрина, общий объем составлял 1 мл. Затем на смесь воздействовали лазерным генератором при длине волны 525 нм (130 мВт) и измеряли поглощение при 808 нм в конкретные моменты времени. На графике показана зависимость отношения поглощения (поглощение в образцах, подвергнутых воздействию / поглощение в образцах, не подвергавшихся воздействию) от количества падающих фотонов на см2. Уменьшение отношения поглощения свидетельствует об обесцвечивании фотосенсибилизатора.
[00143] Влияние трансферрина на обесцвечивание соединений на основе рутения (TLD1433, график А), рутения-родия (TLD143310, график В) и осмия (TLDOsH2dppn, график С): поглощение при 808 нм. В присутствии трансферрина обесцвечивание фотосенсибилизаторов понижалось. Трансферрин обеспечивает частичную защиту фотосенсибилизаторов от фотообесцвечивания.
[00144] Пример 10: Выработка АФК (теоретический)
[00145] В таблице 1 показана выработка синглетного кислорода в ФС на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) при 530 нм и удельной энергии падающего пучка 1092 Дж⋅см-2.
[00146]

[00147] Пример 11: (теоретический)
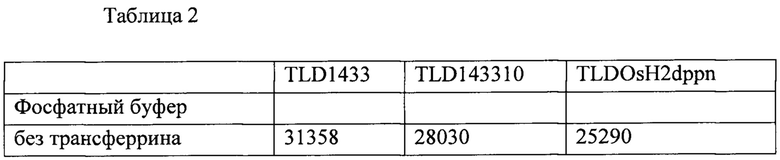
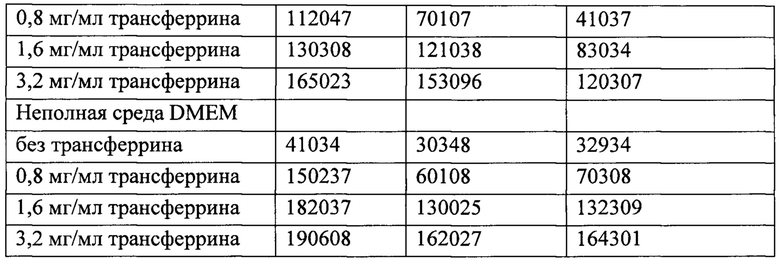
[00148] В таблице 2 показана выработка гидроксильных радикалов ФС на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) при 530 нм и удельной энергии падающего пучка 1092 Дж⋅см-2.
[00149]
[00150] Пример 12: (теоретический)
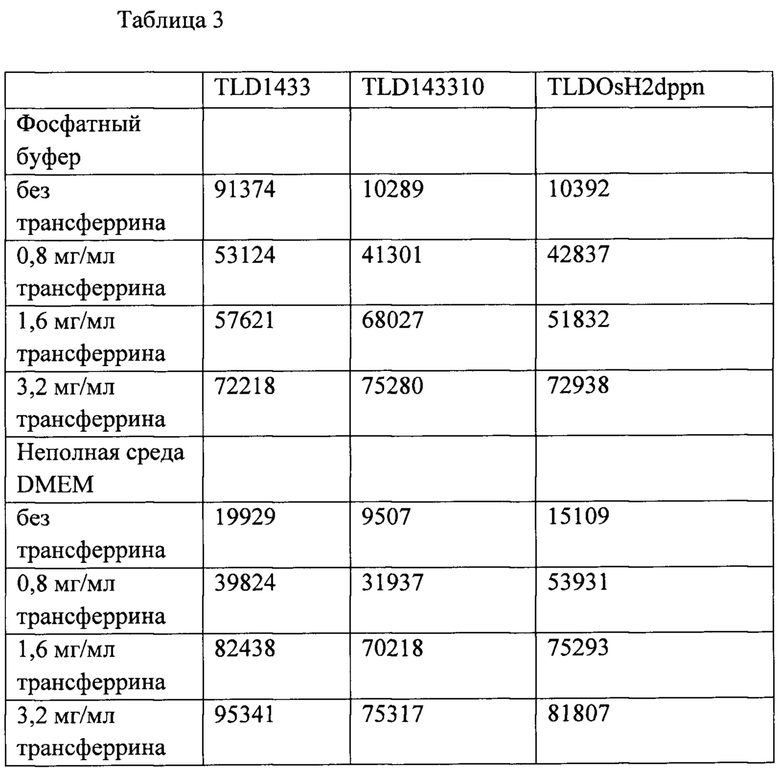
[00151] В таблице 3 показана выработка синглетного кислорода ФС на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) при 635 нм и удельной энергии падающего пучка 649 Дж⋅см-2.
[00152]
[00153] Пример 13 (теоретический)
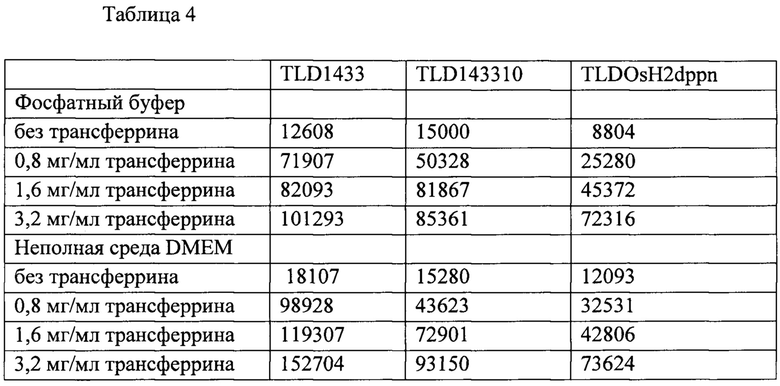
[00154] В таблице 4 показана выработка гидроксильных радикалов ФС на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) при 635 нм и удельной энергии падающего пучка 649 Дж⋅см-2.
[00155]
[00156] Пример 14 (теоретический)
[00157] В таблице 5 показана выработка синглетного кислорода ФС на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) при 808 нм и удельной энергии падающего пучка 4000 Дж⋅см-2.
[00158]

[00159] Пример 15
[00160] В таблице 6 показана выработка гидроксильных радикалов ФС на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) при 808 нм и удельной энергии падающего пучка 4000 Дж⋅см-2.
[00161]
[00162] Пример 16 (теоретический)
[00163] Фотосенсибилизаторы разбавляли в фосфатном буфере (рН=7,0) + 100 мМ NaCl или неполной среде DMEM. Проводили облучение в 96-луночных планшетах (рабочий объем 100 мкл). Выработку синглетного кислорода измеряли по сигналу флуоресценции индикатора SOG, выработку гидроксильных радикалов измеряли по сигналу флуоресценции индикатора HPF. Указанный сигнал представляет собой разность общего сигнала флуоресценции и сигнала в присутствии поглотителей (NaN3 в случае синглетного кислорода и DMTU в случае гидроксильных радикалов).
[00164] Фотосенсибилизаторы на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) вырабатывают активные формы кислорода (АФК) при облучении при 525 нм (0,250 мВт⋅см-2), 650 нм (0,119 мВт⋅см-2) и в ближней ИК области (808 нм, 747 мВт⋅см-2).
[00165] В присутствии трансферрина выработка синглетного кислорода и гидроксильных радикалов усиливалась в зависимости от вводимой дозы: более высокая концентрация трансферрина обеспечивала повышенную выработку АФК. Выработка гидроксильных радикалов увеличивалась в значительно более высокой степени по сравнению с синглетным кислородом, что позволяет предположить изменение типа фотореакций на I тип в присутствии трансферрина.
[00166] Пример 17: Внутриклеточный захват (теоретический)
[00167] В клеточной культуре (клетки U87) проводили воздействие с применением 200 мкМ фотосенсибилизатора в отсутствие дополнительного трансферрина и в присутствии 0,8 мг/мл трансферрина в течение 4 часов. Промывали инкубационную смесь и собирали клетки, подсчитывали количество и проводили лизис. Лизированный раствор растворяли в азотной кислоте и измеряли концентрацию соответствующих металлов путем масс-спектрометрии с индуктивно-связанной плазмой. Концентрация металлов была прямо пропорциональна концентрации фотосенсибилизатора.
[00168] На ФИГ. 10А, 10В и 10С показан увеличенный за счет трансферрина захват фотосенсибилизаторов на основе рутения (TLD1433, ФИГ. 10А), рутения-родия (TLD143310, ФИГ. 10В) и осмия (TLDOsH2dppn, ФИГ. 10С) раковыми клетками.
[00169] Накопление фотосенсибилизаторов в клетках было повышено в присутствии трансферрина. Было показано, что в опухолевых клетках происходит повышенная экспрессия мембранного рецептора трансферрина, полученные результаты указывают на то, что указанные фотосенсибилизаторы могут предпочтительно накапливаться в опухолевых клетках.
[00170] Пример 18: Захват нормальными клетками (теоретический)
[00171] В клеточной культуре (нормальные фибробласты человека) проводили воздействие с применением 200 мкМ фотосенсибилизатора в отсутствие дополнительного трансферрина и в присутствии 0,8 мг/мл трансферрина в течение 4 часов. Промывали инкубационную смесь и собирали клетки, подсчитывали количество и проводили лизис. Лизированный раствор растворяли в азотной кислоте и измеряли концентрацию соответствующих металлов путем масс-спектрометрии с индуктивно-связанной плазмой. Концентрация металлов была прямо пропорциональна концентрации фотосенсибилизатора.
[00172] На ФИГ. 11А, 11В и 11С показан увеличенный за счет трансферрина захват фотосенсибилизаторов на основе рутения (TLD1433, ФИГ. 11А), рутения-родия (TLD143310, ФИГ. 11В) и осмия (TLDOsH2dppn, ФИГ. 11С) нормальными клетками. Накопление фотосенсибилизаторов в клетках было повышено в присутствии трансферрина. Тем не менее, влияние трансферрина на захват было выражено в значительно более низкой степени по сравнению с раковыми клетками, это указывает на предпочтительное увеличение захвата раковыми клетками.
[00173] Пример 19: In vitro - темновая токсичность
[00174] Фотосенсибилизатор предварительно смешивали с 0,4 мг/мл трансферрина человека и инкубировали в течение 1 часа при 37°С. В контрольной группе (без добавления трансферрина) добавляли эквивалентный объем среды, не содержащей трансферрин. Затем клетки инкубировали совместно с предварительно полученной смесью в течение 30 минут (ФИГ. 12А) или 90 минут (ФИГ. 12В). После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин). На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток.
[00175] В присутствии трансферрина происходит снижение темновой токсичности (только фотосенсибилизатора) фотосенсибилизаторов на основе рутения (TLD1433) в отношении раковой клеточной линии AY27. Трансферрин понижает темновую токсичность TLD1433. Этот факт способствует увеличению безопасности лечения с применением ФДТ в присутствии трансферрина. Совместно с подтвержденным связыванием TLD1433 с трансферрином полученные результаты позволяют предположить увеличенный захват TLD1433 в клетках в присутствии трансферрина. Увеличение эффективности ФДТ совместно со снижением темновой токсичности позволяет предположить увеличение терапевтического индекса TLD1433 при применении его в смеси с трансферрином.
[00176] Пример 20 (теоретический)
[00177] Фотосенсибилизатор предварительно смешивали с 0,4 мг/мл человеческого трансферрина и инкубировали в течение 1 часа при 37°С. В контрольной группе (без добавления трансферрина) добавляли эквивалентный объем среды, не содержащей трансферрин. Затем клетки инкубировали совместно с предварительно полученной смесью в течение 30 минут. После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин). На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток.
[00178] В присутствии трансферрина происходит снижение темновой токсичности (только фотосенсибилизатора) фотосенсибилизаторов на основе рутения-родия (TLD143310, ФИГ. 13А) и осмия (TLDOsH2dppn, ФИГ. 13В) в отношении раковой клеточной линии AY27. Трансферрин понижает темновую токсичность фотосенсибилизаторов. Этот факт способствует увеличению безопасности лечения с применением ФДТ в присутствии трансферрина.
[00179] Пример 21: Эффект ФДТ in vitro
[00180] Фотосенсибилизатор предварительно смешивали с 0,4 мг/мл человеческого трансферрина и инкубировали в течение 1 часа при 37°С. В контрольной группе (без добавления трансферрина) добавляли эквивалентный объем среды, не содержащей трансферрин. Затем клетки инкубировали совместно с предварительно полученной смесью в течение 30 минут (ФИГ. 14А) или 90 минут (ФИГ. 14В). После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин) и облучали клетки. На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших от ФДТ клеток и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения».
[00181] В присутствии трансферрина происходит увеличение эффекта ФДТ (635 нм, 90 Дж⋅см-2) фотосенсибилизаторов на основе рутения (TLD1433) в отношении раковой клеточной линии AY27. Трансферрин усиливает эффект ФДТ при применении фотосенсибилизатора даже при небольшом периоде воздействия (30 минут). Это обеспечивает безопасное лечение ФДТ за счет сокращения срока лечения и применения пониженных концентраций фотосенсибилизаторов. Совместно с подтвержденным связыванием TLD1433 с трансферрином полученные результаты позволяют предположить увеличенный захват TLD1433 в клетки в присутствии трансферрина.
[00182] Пример 22 (теоретический)
[00183] Фотосенсибилизатор предварительно смешивали с 0,4 мг/мл трансферрина человека и инкубировали в течение 1 часа при 37°С. В контрольной группе (без добавления трансферрина) добавляли эквивалентный объем среды, не содержащей трансферрин. Затем клетки инкубировали совместно с предварительно полученной смесью в течение 30 минут. После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин) и облучали клетки. На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших клеток в ФДТ и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения».
[00184] В присутствии трансферрина происходит усиление эффекта ФДТ (635 нм, 90 Дж⋅см-2) фотосенсибилизаторов на основе рутения-родия (TLD143310, ФИГ. 15А) и осмия (TLDOsH2dppn, ФИГ. 15В) в отношении раковой клеточной линии AY27.
[00185] Трансферрин усиливает эффект ФДТ при применении фотосенсибилизаторов даже при небольшом периоде воздействия (30 минут). Это обеспечивает безопасное лечение ФДТ за счет сокращения срока лечения и применения пониженных концентраций фотосенсибилизаторов. Совместно с подтвержденным связыванием фотосенсибилизаторов с трансферрином полученные результаты позволяют предположить усиленный захват фотосенсибилизаторов в клетках в присутствии трансферрина.
[00186] Увеличение эффективности ФДТ совместно со снижением темновой токсичности позволяют предположить увеличение терапевтического индекса фотосенсибилизаторов на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) при их предварительном смешении с трансферрином.
[00187] Пример 23 (теоретический)
[00188] Фотосенсибилизатор предварительно смешивали с 0,4 мг/мл человеческого трансферрина и инкубировали в течение 1 часа при 37°С. В контрольной группе (без добавления трансферрина) добавляли эквивалентный объем среды, не содержащей трансферрин. Затем клетки инкубировали совместно с предварительно полученной смесью в течение 30 минут. После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин) и облучали клетки. На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших от ФДТ клеток и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения».
[00189] В присутствии трансферрина происходит усиление эффекта ФДТ (530 нм, 90 Дж⋅см-2) фотосенсибилизаторов на основе рутения-родия (TLD143310, график А) и осмия (TLDOsH2dppn, график В) в отношении раковой клеточной линии AY27. Трансферрин усиливает эффект ФДТ при применении фотосенсибилизаторов даже при небольшом периоде воздействия (30 минут). Это обеспечивает безопасное лечение ФДТ за счет сокращения срока лечения и применения пониженных концентраций фотосенсибилизаторов. Совместно с подтвержденным связыванием фотосенсибилизаторов с трансферрином полученные результаты позволяют предположить увеличенный захват фотосенсибилизаторов в клетках в присутствии трансферрина.
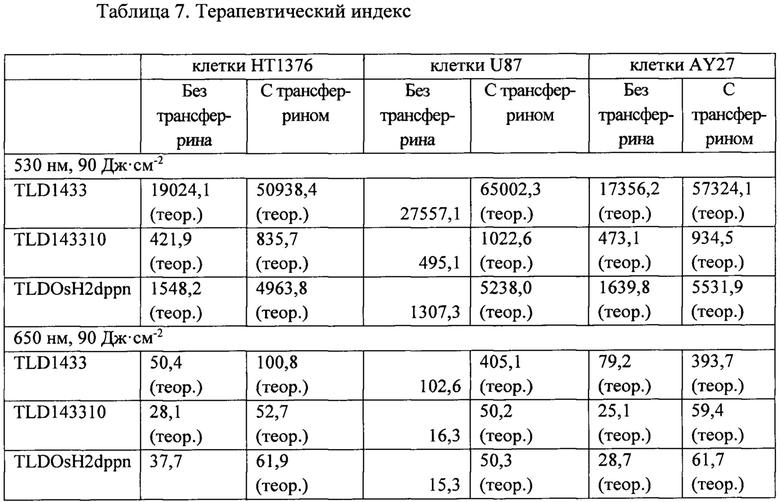
[00190] Пример 24
[00191] Предварительное смешивание с трансферрином приводит к увеличению терапевтического индекса фотосенсибилизаторов на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) за счет увеличения эффективности ФДТ и сопутствующего снижения темновой токсичности. См. таблицу 7.
[00192]
[00193] Пример 25: Гипоксия In Vitro (теоретический)
[00194] Клетки инкубировали в течение 90 минут в предварительной смеси фотосенсибилизатора и 0,4 мг/мл человеческого трансферрина (или без трансферрина в контрольной группе) согласно приведенному выше описанию проведения ФДТ in vitro. Темновая токсичность и эффект ФДТ с применением фотосенсибилизаторов в отношении линии клеток AY27 при облучении при 635 нм (90 Дж⋅см-2) в отсутствие и в присутствии трансферрина в условиях с нормальным (ФИГ. 17А, 17В) и пониженным (0,5-0,1% О2, ФИГ. 17С, 17D) содержанием кислорода. Клетки инкубировали совместно с фотосенсибилизатором и трансферрином в течение 90 минут. После этого облучали клетки и заменяли среду на свежую (не содержащую фотосенсибилизатор и трансферрин). На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент уничтоженных клеток. Эффект ФДТ показан как разность общего количества погибших от ФДТ клеток и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения».
[00195] В присутствии трансферрина происходило усиление эффекта ФДТ (635 нм, 90 Дж⋅см-2) фотосенсибилизаторов на основе рутения (TLD1433) в отношении раковой клеточной линии AY27 в гипоксических условиях. Трансферрин индуцирует активность ФДТ при пониженном содержании кислорода, которую не наблюдают в отсутствие трансферрина. Таким образом, трансферрин обеспечивает увеличенную эффективность фотосенсибилизаторов на основе рутения при лечении путем ФДТ объемных гипоксических опухолей.
[00196] Пример 26 (теоретический)
[00197] Клетки инкубировали в течение 90 минут в предварительной смеси фотосенсибилизатора и 0,4 мг/мл человеческого трансферрина (или без трансферрина в контрольной группе) согласно приведенному выше описанию проведения ФДТ in vitro. Темновая токсичность и эффект ФДТ с применением фотосенсибилизаторов в отношении клеточной линии AY27 при облучении при 635 нм (90 Дж⋅см-2) в отсутствие и в присутствии трансферрина в условиях с нормальным (ФИГ. 18А, 18В) и пониженным (0,5-0,1% О2, ФИГ. 18С, 18D) содержанием кислорода. Клетки инкубировали совместно с фотосенсибилизатором и трансферрином в течение 90 минут. После этого облучали клетки и заменяли среду на свежую (не содержащую фотосенсибилизатор и трансферрин). На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших от ФДТ клеток и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения».
[00198] В присутствии трансферрина происходило усиление эффекта ФДТ (635 нм, 90 Дж⋅см-2) фотосенсибилизаторов на основе рутения-родия (TLD143310) в отношении линии раковых клеток AY27 в гипоксических условиях. Трансферрин индуцирует активность ФДТ при пониженном содержании кислорода, которую не наблюдают в отсутствие трансферрина. Таким образом, трансферрин обеспечивает увеличенную эффективность фотосенсибилизаторов на основе рутения-родия при лечении путем ФДТ объемных гипоксических опухолей.
[00199] Пример 27 (теоретический)
[00200] Клетки инкубировали в течение 90 минут в предварительной смеси фотосенсибилизатора и 0,4 мг/мл человеческого трансферрина (или без трансферрина в контрольной группе) согласно приведенному выше описанию проведения ФДТ in vitro. Темновая токсичность и эффект ФДТ с применением фотосенсибилизаторов в отношении линии клеток AY27 при облучении при 635 нм (90 Дж⋅см-2) в отсутствие и в присутствии трансферрина в условиях с нормальным (ФИГ. 19А, 19В) и пониженным (0,5-0,1% О2, ФИГ. 19С, 19D) содержанием кислорода. Клетки инкубировали совместно с фотосенсибилизатором и трансферрином в течение 90 минут. После этого облучали клетки и заменяли среду на свежую (не содержащую фотосенсибилизатор и трансферрин). На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших клеток от ФДТ и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения».
[00201] В присутствии трансферрина происходило усиление эффекта ФДТ (635 нм, 90 Дж⋅см-2) фотосенсибилизаторов на основе осмия (TLDOsH2dppn) в отношении линии раковых клеток AY27 в гипоксических условиях.
[00202] Трансферрин индуцирует активность ФДТ при пониженном содержании кислорода, которую не наблюдают в отсутствие трансферрина. Таким образом, трансферрин обеспечивает увеличенную эффективность фотосенсибилизаторов на основе осмия при лечении путем ФДТ объемных гипоксических опухолей.
[00203] Пример 28: Антитела к рецептору трансферрина (теоретический)
[00204] Клетки инкубировали совместно с антителом к рецептору трансферрина. Одновременно с этим фотосенсибилизатор предварительно смешивали с 0,4 мг/мл человеческого трансферрина и инкубировали в течение 1 часа при 37°С. В контрольной группе (добавление трансферрина не проводили) добавляли эквивалентный объем среды, не содержащей трансферрин. Клетки отмывали от избытка антитела (клетки, которые инкубировали в среде, не содержащей антитело, использовали в качестве групп сравнения) и инкубировали с предварительно полученными смесями в течение 30 минут. После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин) и облучали клетки. На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших клеток в ФДТ и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения». Темновая токсичность показана на ФИГ. 20А, эффект ФДТ показан на ФИГ. 20В.
[00205] Блокировка рецепторов трансферрина в раковых клетках AY27 предотвращает снижение темновой токсичности и усиление эффекта ФДТ (635 нм, 90 Дж⋅см-2) при применении фотосенсибилизаторов на основе рутения (TLD1433). Полученные результаты подтверждают влияние опосредованного трансферрином захвата фотосенсибилизаторов на основе рутения на снижение темновой токсичности и усиление эффекта ФДТ.
[00206] Пример 29 (теоретический)
[00207] Клетки инкубировали совместно с антителом к рецептору трансферрина. Одновременно с этим фотосенсибилизатор предварительно смешивали с 0,4 мг/мл человеческого трансферрина и инкубировали в течение 1 часа при 37°С. В контрольной группе (добавление трансферрина не проводили) добавляли эквивалентный объем среды, не содержащей трансферрин. Клетки отмывали от избытка антитела (клетки, которые инкубировали в среде, не содержащей антитело, использовали в качестве групп сравнения) и инкубировали с предварительно полученными смесями в течение 30 минут. После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин) и облучали клетки. На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших от ФДТ клеток и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения». Темновая токсичность показана на ФИГ. 21 А, эффект ФДТ показан на ФИГ. 21В.
[00208] Блокировка рецепторов трансферрина в раковых клетках AY27 предотвращает снижение темновой токсичности и усиление эффекта ФДТ (635 нм, 90 Дж⋅см-2) при применении фотосенсибилизаторов на основе рутения-родия (TLD143310). Полученные результаты подтверждают влияние опосредованного трансферрином захвата фотосенсибилизаторов на основе рутения-родия на снижение темновой токсичности и увеличение эффекта ФДТ.
[00209] Пример 30 (теоретический)
[00210] Клетки инкубировали совместно с антителом к рецептору трансферрина. Одновременно с этим фотосенсибилизатор предварительно смешивали с 0,4 мг/мл человеческого трансферрина и инкубировали в течение 1 часа при 37°С. В контрольной группе (добавление трансферрина не проводили) добавляли эквивалентный объем среды, не содержащей трансферрин. Клетки отмывали от избытка антитела (клетки, которые инкубировали в среде, не содержащей антитело, использовали в качестве групп сравнения) и инкубировали с предварительно полученными смесями в течение 30 минут. После этого смесь заменяли на свежую (не содержащую фотосенсибилизатор и трансферрин) и облучали клетки. На следующий день (через 21 час после облучения) измеряли жизнеспособность клеток при помощи исследования жизнеспособности Presto Blue и вычисляли процент погибших клеток. Эффект ФДТ показан как разность общего количества погибших клеток в ФДТ и количества погибших клеток при применении «только фотосенсибилизатора» и «только облучения». Темновая токсичность показана на ФИГ. 22А, эффект ФДТ показан на ФИГ. 22В.
[00211] Блокировка рецепторов трансферрина в раковых клетках AY27 предотвращает снижение темновой токсичности и усиление эффекта ФДТ (635 нм, 90 Дж⋅см-2) при применении фотосенсибилизаторов на основе осмия (TLDOsH2dppn). Полученные результаты подтверждают влияние опосредованного трансферрином захвата фотосенсибилизаторов на основе осмия на снижение темновой токсичности и увеличение эффекта ФДТ.
[00212] Пример 31: Захват в тканях in vivo (теоретический)
[00213] Трансферрин растворяли в 40% PG в фосфатном буфере (рН=7,0)+100 мМ NaCl (0,1 мг/100 мкл) и добавляли в раствор фотосенсибилизатора (для получения дозы 10 мг/кг). Смесь инкубировали в течение 1 часа перед введением инъекции и вводили 100 мкл смеси путем в.в. инъекции каждому животному.
[00214] Смешение фотосенсибилизаторов на основе рутения (TLD1433) с трансферрином (1 мг/кг) увеличивает захват фотосенсибилизатора в тканях. В присутствии трансферрина происходит значительное увеличение селективности захвата в опухолях по сравнению с нормальной мышечной тканью (ФИГ. 23А и 23В).
[00215] Пример 32 (теоретический)
[00216] Трансферрин растворяли в 40% PG в фосфатном буфере (рН=7,0)+100 мМ NaCl (0,1 мг/100 мкл) и добавляли в раствор фотосенсибилизатора (для получения дозы 10 мг/кг). Смесь инкубировали в течение 1 часа перед введением инъекции и вводили 100 мкл смеси путем в.в. инъекции каждому животному.
[00217] Смешение фотосенсибилизаторов на основе рутения-родия (TLD143310) с трансферрином (1 мг/кг) увеличивает захват фотосенсибилизатора в тканях. В присутствии трансферрина происходит значительное увеличение селективности захвата в опухолях по сравнению с нормальной мышечной тканью (ФИГ. 24А и 24В).
[00218] Пример 33 (теоретический)
[00219] Трансферрин растворяли в 40% PG в фосфатном буфере (рН=7,0)+100 мМ NaCl (0,1 мг/100 мкл) и добавляли в раствор фотосенсибилизатора (для получения дозы 10 мг/кг). Смесь инкубировали в течение 1 часа перед введением инъекции и вводили 100 мкл смеси путем в.в. инъекции каждому животному.
[00220] Смешение фотосенсибилизаторов на основе осмия (TLDOsH2dppn) с трансферрином (1 мг/кг) увеличивает захват фотосенсибилизатора в тканях. В присутствии трансферрина происходит значительное увеличение селективности захвата в опухолях по сравнению с нормальной мышечной тканью (ФИГ. 25А и 25В).
[00221] Пример 34: Токсичность in vivo
[00222] Мышам вводили инъекцию (и.п.) увеличивающихся доз фотосенсибилизаторов совместно с трансферрином или без него. Смешение фотосенсибилизаторов с трансферрином увеличивало МПД, это позволяет предположить снижение токсичности фотосенсибилизаторов. В случае TLD1433 на основе рутения полного выживания мышей удавалось добиться при 125 мг/кг; на момент подачи заявки проводились исследования более высоких доз.
[00223] Максимальные переносимые дозы (МПД) фотосенсибилизаторов на основе рутения (TLD1433), рутения-родия (TLD143310) и осмия (TLDOsH2dppn) увеличиваются при применении трансферрина, результаты показаны ниже в таблице 8.
[00224]

[00225] Если рассматривать в комплексе результаты экспериментов in vitro и in vivo, то фотосенсибилизаторы на основе рутения, рутения-родия и осмия необходимо смешивать с трансферрином для лечения пациентов не только для улучшения эффекта ФДТ, но также для снижения токсичности фотосенсибилизаторов.
[00226] Пример 35: Эффект ФДТ in vivo
[00227] В бедрах мышей выращивали подкожные опухоли и проводили ФДТ (808 нм, 600 Дж⋅см-2), когда размер опухоли достигал 5×5 мм. Мышей умерщвляли, если рост опухоли продолжался после лечения путем ФДТ и достигал 10×10 мм. В контрольной группе максимальный срок выживания составлял 10 дней.
[00228] Трансферрин увеличивал выживаемость мышей после лечения путем ФДТ с применением фотосенсибилизатора на основе рутения (TLD1433). Количество животных, у которых полностью исчезли опухоли, значительно увеличивалось при добавлении трансферрина к TLD1433 на основе рутения перед инъекцией (данные получены авторами через 8 дней после лечения путем ФДТ, в полученных ранее данных было показано, что после этого периода повторное появление опухолей не происходит, предположительно безопухолевый период составляет 70 дней).
[00229] Пример 36 (теоретический)
[00230] В бедрах мышей выращивали подкожные опухоли и проводили ФДТ (808 нм, 600 Дж⋅см-2), когда размер опухоли достигал 5×5 мм. Мышей умерщвляли, если рост опухоли продолжался после лечения путем ФДТ и достигал 10×10 мм. В контрольной группе максимальный срок выживания составлял 10 дней.
[00231] Трансферрин увеличивал выживаемость мышей после лечения путем ФДТ с применением фотосенсибилизатора на основе рутения-родия (TLD143310) и осмия (TLDOsH2dppn). Количество животных, у которых полностью исчезли опухоли, значительно увеличивалось при добавлении трансферрина к фотосенсибилизатору на основе рутения-родия (TLD143310) и осмия (TLDOsH2dppn) перед инъекцией. См. таблицу 9 ниже.
[00232]
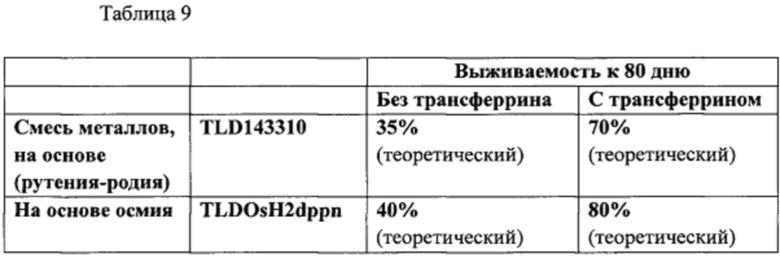
[00233] Пример 36
[00234] В бедрах мышей выращивали подкожные опухоли и проводили ФДТ (635 нм, 192 Дж⋅см-2), когда размер опухоли достигал 5×5 мм. Мышей умерщвляли, если рост опухоли продолжался после лечения путем ФДТ и достигал 10×10 мм. В контрольной группе максимальный срок выживания составлял 10 дней.
[00235] Трансферрин увеличивал выживаемость мышей после лечения путем ФДТ. Количество животных, у которых полностью исчезли опухоли, значительно увеличивалось при добавлении трансферрина к TLD1433 перед инъекцией (ожидаемые результаты). См. ФИГ. 27.
[00236] Пример 37
[00237] В бедрах мышей выращивали подкожные опухоли и проводили ФДТ (635 нм, 192 Дж⋅см-2), когда размер опухоли достигал 5×5 мм. Мышей умерщвляли, если рост опухоли продолжался после лечения путем ФДТ и достигал 10×10 мм. В контрольной группе максимальный срок выживания составлял 10 дней.
[00238] Трансферрин увеличивал выживаемость мышей после лечения путем ФДТ с применением фотосенсибилизатора на основе рутения-родия (TLD143310) и осмия (TLDOsH2dppn). Количество животных, у которых полностью исчезли опухоли, значительно увеличивалось при добавлении трансферрина к фотосенсибилизатору на основе рутения-родия (TLD143310) и осмия (TLDOsH2dppn) перед инъекцией. См. таблицу 10.
[00239]

[00240] Пример 38
[00241] В бедрах мышей выращивали подкожные опухоли и проводили ФДТ (525 нм, 90 Дж⋅см-2), когда размер опухоли достигал 5×5 мм. Мышей умерщвляли, если рост опухоли продолжался после лечения путем ФДТ и достигал 10×10 мм. В контрольной группе максимальный срок выживания составлял 10 дней.
[00242] Трансферрин увеличивал выживаемость мышей после лечения путем ФДТ с применением фотосенсибилизатора на основе рутения-родия (TLD143310) и осмия (TLDOsH2dppn). Количество животных, у которых полностью исчезли опухоли, значительно увеличивалось при добавлении трансферрина к фотосенсибилизатору на основе рутения-родия (TLD143310) и осмия (TLDOsH2dppn) перед инъекцией. См. таблицу 11.
[00243]
[00244] Пример 39
[00245] Измеряли оптическую плотность TLD1433 до и после добавления OPTIFERRIN (доступного в InVitria, отделении Ventria Bioscience) или человеческого апо-трансферрина (Sigma). Как показано на ФИГ. 28, в комплексе TLD1433-OPTIFERRIN происходило значительное увеличение оптической плотности. Кроме того, в комплексе наблюдали новый пик поглощения при волнах в красной (600 нм) и ближней инфракрасной (800 нм) области спектра. Оптическая плотность комплекса с OPTIFERRIN была сравнимой с комплексом апотрансферрина человека. Этот факт подчеркивает возможность применения OPTIFERRIN для увеличения эффективности фотосенсибилизатора TLD1433 производства Theralase. Увеличение оптической плотности напрямую связано с повышенной выработкой активных форм кислорода при лечении путем ФДТ. Поглощение света в красной и ближней инфракрасной областях спектра обеспечивает новые способы лечения различных опухолей.
[00246] Пример 40
[00247] Оптическую плотность Optiferrin и апотрансферрина человека измеряли до и после добавления TLD1433. Связывание трансферрина с железом характеризуется увеличением поглощения при 275 нм и 450 нм. При добавлении TLD1433 происходит характеристическое увеличение оптической плотности Optiferrin, как и у апо-трансферрина человека, что указывает на прямое связывание TLD1433 с Optiferrin. См. ФИГ. 29. Прямое связывание Optiferrin с TLD1433 можно применять при лечении опухолей, обогащенных рецепторами трансферрина, где комплекс Optiferrin+TLD1433 можно вводить для обеспечения предпочтительного захвата TLD1433 раковыми клетками.
[00248] Пример 41
[00249] Измеряли обесцвечивание TLD1433 при отдельном использовании и после инкубации с Optiferrin или человеческим апо-трансферрином при воздействии света с длиной волны 525 нм (зеленый). Обесцвечивание измеряли по снижению оптической плотности при 425 нм в ответ на облучение светом с длиной волны 525 нм, которое нормировали путем деления полученного значения на значение оптической плотности образца, не подвергавшегося воздействию, при 425 нм. Сотношение оптических плотностей, равное 1, указывает на отсутствие обесцвечивания. При обесцвечивании TLD1433 указанное соотношение сдвигается к 0. Optiferrin и апо-трансферрин человека понижали обесцвечивание TLD1433, причем Optiferrin оказывал более выраженное действие. См. ФИГ. 30.
[00250] Пример 42 - связывание Optiferrin с TLD1433 (14С ТН2, GS6-22 и GS6-81G) и ТН1 (лазурь)
[00251] В экспериментах было продемонстрировано, что следующие фотосенсибилизаторы имитируют характеристические профили связывания Fe+Tf, но при применении Optiferrin: TLD1433 GS6-22, GS6-81G, ТН2 QR-100 и ТН1, партия №1411459022. См. фиг. 31.
[00252] Пример 43 - Предотвращение фотообесцвечивания при энергии более 200 Дж с применением TLD 1433
[00253] Проводили фотообесцвечивание 10 мкМ TLD1433 GS6-22 с применением зеленого света (525 нм) с энергией 200 Дж и измеряли OD при 0, 1,2, 5, 10, 20, 50, 100 и 200 джоулях. См. фиг. 32, на которой показано отношение увеличения или снижения молярного коэффициента экстинкции при 350 нм, 400 нм и 600 нм в интервале от начального момента с энергией 0 джоулей и конечного момента с энергией 200 джоулей.
[00254] Пример 44 - Стабильное поглощение TLD1433 в инфракрасной области
[00255] В экспериментах было продемонстрировано, что OD TLD1433 лучше сохраняется в инфракрасной области при добавлении 0,8 г/л (или 10 мкМ) Optiferrin со временем. См. фиг. 33.
[00256] Пример 45 - Инкубация с Optiferrin и сохранение поглощения фотосенсибилизатора TLD1433
[00257] Исследовали продолжительность инкубации для оценки величины поглощения темного образца 10 мкМ TLD1433 при добавлении Optiferrin. См. фиг. 34. Как было показано ранее, указанное добавление однозначно помогает предотвращать фотообесцвечивание TLD1433.
[00258] Несмотря на то, что изобретение было подробно описано при помощи конкретных примеров, специалистам в данной области должно быть понятно, что можно проводить различные изменения и модификации изобретения, не выходя за рамки сущности и объема изобретения.
ССЫЛКИ НА НЕПАТЕНТНУЮ ЛИТЕРАТУРУ
[00259] Antonarakis E.S., Emadi A. Ruthenium-based chemotherapeutics: are they ready for prime time? Cancer Chemother Pharmacol. 2010 May; 66(1): 1-9.
[00260] Bergamo A., Sava G. Ruthenium anticancer compounds: myths and realities of the emerging metal-based drugs. Dalton Trans. 2011 Aug 21; 40(31): 7817-23.
[00261] Biju V. Chemical modifications and bioconjugate reactions of nanomaterials for sensing, imaging, drug delivery and therapy. Chem Soc Rev. 2014 Feb 7; 43(3): 744-64. doi: 10.1039/c3cs60273g.
[00262] Bruijnincx P.C.A., Sadler P.J. (2009). "Controlling platinum, ruthenium, and osmium reactivity for anticancer drug design". Advances in Inorganic Chemistry 61. p. 1
[00263] Chen H., Xiao L., Anraku Y., Mi P., Liu X., Cabral H., Inoue A., Nomoto Т., Kishimura A., Nishiyama N., Kataoka K. Polyion complex vesicles for photoinduced intracellular delivery of amphiphilic photosensitizer. J Am Chem Soc. 2014, 136(1): 157-63. doi: 10.1021/ja406992w. Epub 2013 Dec 26.
[00264] Derycke A.S., Kamuhabwa A., Gijsens A., Roskams Т., De Vos D., Kasran A., Huwyler J., Missiaen L., de Witte P.A., 2004. Transferrin-conjugated liposome targeting of photosensitizer AlPcS4 to rat bladder carcinoma cells. J. Natl Cancer Inst. 96, 1620-1630.
[00265] Garcia P.F., Toneatto J., Silvero M.J., 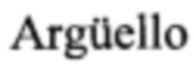 G.A. Binding of [Cr(phen)3]3+ to transferrin at extracellular and endosomal pHs: Potential application in photodynamic therapy. Biochim Biophys Acta. 2014 Jun 25. pii: S0304-4165(14)00230-X. doi: 10.1016/j.bbagen.2014.06.010.
G.A. Binding of [Cr(phen)3]3+ to transferrin at extracellular and endosomal pHs: Potential application in photodynamic therapy. Biochim Biophys Acta. 2014 Jun 25. pii: S0304-4165(14)00230-X. doi: 10.1016/j.bbagen.2014.06.010.
[00266] Gaspar M., Radomska A., Gobbo O.L., Bakowsky U., Radomski M.W., Ehrhardt C., 2012. Targeted delivery of transferrin-conjugated liposomes to an orthotopic model of lung cancer in nude rats. J. Aerosol Med. Pulm. Drug Deliv. http://dx.doi.org/10.1089/jamp. 2011.0928.
[00267] Gijsens A., Derycke A., Missiaen L., De Vos D., Huwyler J., Eberle A., et al. Targeting of the photocytotoxic compound AIPcS4 to Hela cells by transferrin conjugated PEG-liposomes. Int J Cancer, 2002, 101: 78-85
[00268] Graf N., Lippard S. J. Redox activation of metal-based prodrugs as a strategy for drug delivery. Adv. Drug Deliv. Rev. 2012, 64(11): 993-1004. doi:10.1016/j.addr.2012.01.007.
[00269] Guo W., Zheng W., Luo Q., Li X., Zhao Y., Xiong S., Wang F. Transferrin Serves As a Mediator to Deliver Organometallic Ruthenium(II) Anticancer Complexes into Cells. Inorg. Chem. 2013, 52, 328-5338. dx.doi.org/10.1021/ic4002626.
[00270] He H, Cattran AW, Nguyen T, Nieminen AL, Xu P. Triple-responsive expansile nanogel for tumor and mitochondria targeted photosensitizer delivery. Biomaterials. 2014 Aug 21. pii: S0142-9612(14)00891-6. doi: 10.1016/j.biomaterials.2014.08.004.
[00271] Heger Z., Skalickova S., Zitka O., Adam V., Kizek R. Apoferritin applications in medicine. Nanomedicine (Lond.), 2014, 9, 2233-2245.
[00272] MaHam A., Tang Z., Wu H., Wang J., Lin Y. Protein-based nanomedicine platforms for drug delivery. 2009, 5, 1706-1722.
[00273] Nkepang G., Bio M., Rajaputra P., Awuah S.G., You Y. Folate Receptor-mediated Enhanced and Specific Delivery of Far-red Light-activatable Prodrugs of Combretastatin A-4 to FR-positive Tumor. Bioconjug Chem. 2014 Oct 28.
[00274] Paszko E., Vaz G.M., Ehrhardt C., Senge M.O. Transferrin conjugation does not increase the efficiency of liposomal Foscan during in vitro photodynamic therapy of oesophageal cancer. Eur J Pharm Sci. 2013 Jan 23; 48(1-2): 202-10. doi: 10.1016/j.ejФC.2012.10.018.
[00275] Pongratz M., Schluga P., Jakupec, M.A., Arion V.В., Hartinger C.G. Allmaier G., Keppler В.K. Transferrin binding and transferrin-mediated cellular uptake of the ruthenium coordination compound KP1019, studied by means of AAS, ESI-MS and CD spectroscopy. J. Anal. At. Specrom., 2004, 19, 46-51.
[00276] Sardar S., Chaudhuri S., Kar P., Sarkar S., Lemmens P., Pal S.K. Direct observation of key photoinduced dynamics in a potential nano-delivery vehicle of cancer drugs. Phys Chem Phys. 2014 Nov 5.
[00277] Szwed M., Kania K.D., Jozwiak Z. Relationship between therapeutic efficacy of doxorubicin-transferrin conjugate and expression of P-glycoprotein in chronic erythromyeloblastoid leukemia cells sensitive and resistant to doxorubicin. Cell Oncol (Dordr). 2014 Dec; 37(6): 421-8. doi: 10.1007/s13402-014-0205-5. Epub 2014 Nov 20.
[00278] Temizel E., Sagir Т., Ayan E., Isik S., Ozturk R. Delivery of lipophilic porphyrin by liposome vehicles: Preparation and Photodynamic therapy activity against cancer cell lines. Photodiagnosis Photodyn Ther. 2014 Aug 5. pii: S1572-1000(14)00097-0. doi: 10.1016/j.pdpdt.2014.07.006.
[00279] Wong B.S., Yoong S.L., Jagusiak A., Panczyk Т., Но H.K., Ang W.H., Pastorin G. Carbon nanotubes for delivery of small molecule drugs. Adv Drug Deliv Rev. 2013 Dec; 65(15): 1964-2015. doi: 10.1016/j.addr.2013.08.005. Epub 2013 Aug 14.
[00280]
[00281] Yang K., Feng L., Liu Z. The advancing uses of nano-graphene in drug delivery. Expert Opin Drug Deliv. 2014 Dec 3: 1-12.
[00282] Yin M., Ju E., Chen Z., Li Z., Ren J., Qu X. Upconverting Nanoparticles with a Mesoporous TiO2 Shell for Near-Infrared-Triggered Drug Delivery and Synergistic Targeted Cancer Therapy. Chemistry. 2014 Sep 8. doi: 10.1002/chem.201403733.
[00283] Yu J., Hsu C.H., Huang C.C., Chang P.Y. Development of Therapeutic Au-Methylene Blue Nanoparticles for Targeted Photodynamic Therapy of Cervical Cancer Cells. ACS Appl Mater Interfaces. 2014 Dec 10.
[00284] Yuan Y., Liu B. Self-Assembled Nanoparticles Based on PEGylated Conjugated Polyelectrolyte and Drug Molecules for Image-Guided Drug Delivery and Photodynamic Therapy. ACS Appl Mater Interfaces. 2014 Jul 30.
[00285] Zhang H., Hou L., Jiao X., Ji Y., Zhu X., Zhang Z. Transferrin-mediated fullerenes nanoparticles as Fe2+-dependent drug vehicles for synergistic anti-tumor efficacy. Biomaterials. 2015, 37, 353-366. doi: 10.1016/j.biomaterials.2014.10.031.
[00286] Zhen Z., Tang W., Chuang Y.J., Todd Т., Zhang W., Lin X., Niu G., Liu G., Wang L., Pan Z., Chen X., Xie J. Tumor vasculature targeted photodynamic therapy for enhanced delivery of nanoparticles. ACS Nano. 2014 Jun 24; 8(6): 6004-13. doi: 10.1021/nn501134q. Epub 2014 May 12.
| название | год | авторы | номер документа |
|---|---|---|---|
| КООРДИНАЦИОННЫЕ КОМПЛЕКСЫ НА ОСНОВЕ МЕТАЛЛОВ В КАЧЕСТВЕ ФОТОДИНАМИЧЕСКИХ СОЕДИНЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2682674C2 |
| ФОТОДИНАМИЧЕСКИЕ ТИОФЕНЫ НА ОСНОВЕ МЕТАЛЛА И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2677855C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА | 2016 |
|
RU2626600C1 |
| Монокатионный хлориновый фотосенсибилизатор для фотодинамической инактивации опухолевых клеток | 2022 |
|
RU2792003C1 |
| СПОСОБ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ ПРИ ПРОВЕДЕНИИ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ С ФОТОСЕНСИБИЛИЗАТОРОМ ФОТОРАН Е6 ПЕРЕВИВНОЙ СОЕДИНИТЕЛЬНОТКАННОЙ ОПУХОЛИ САРКОМА М-1 КРЫС, ПОЛОЖИТЕЛЬНОЙ ПО МУТАНТНОМУ ГЕНУ р53 | 2020 |
|
RU2736261C2 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2282646C1 |
| Модифицированный фотосенсибилизатор на основе наночастиц селена и гидрофильного полимера | 2024 |
|
RU2835425C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МЕТОДОМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 1994 |
|
RU2113254C1 |
| Способ фотодинамической терапии | 2015 |
|
RU2637279C2 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРЕВИВНОЙ СОЕДИНИТЕЛЬНОТКАННОЙ САРКОМЫ М-1 КРЫС ПРИ КОМБИНИРОВАННОМ ВОЗДЕЙСТВИИ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И ЛУЧЕВОЙ ТЕРАПИИ | 2021 |
|
RU2763663C2 |

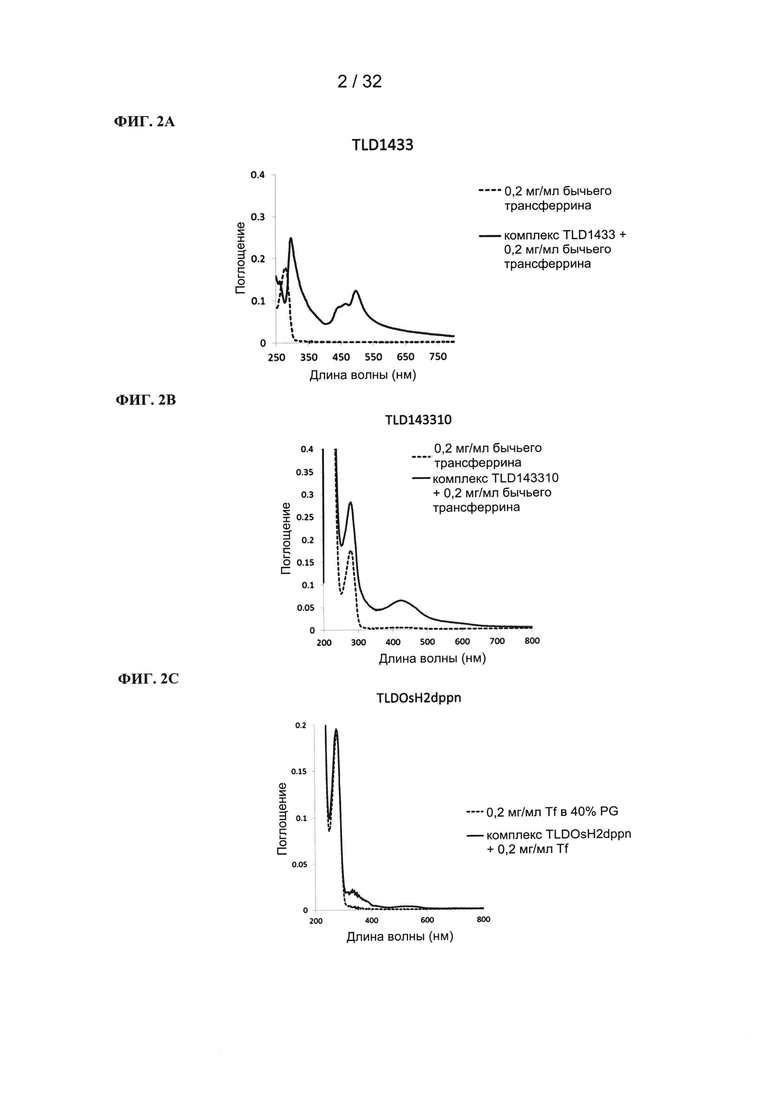
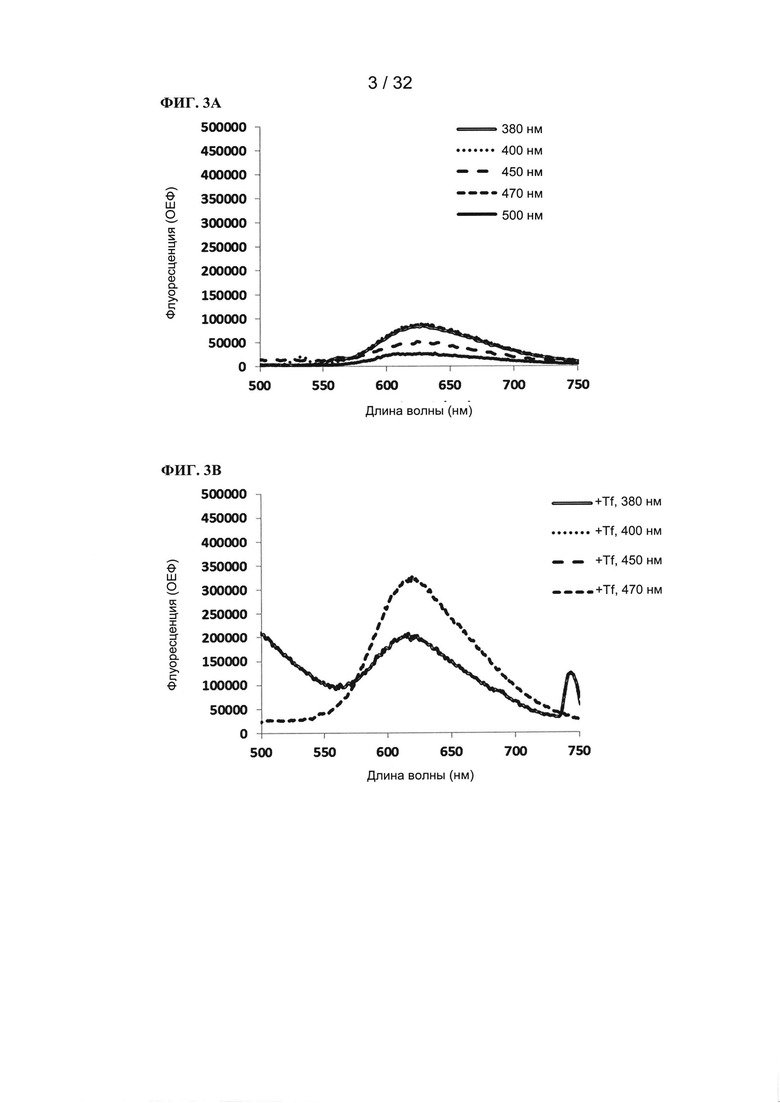
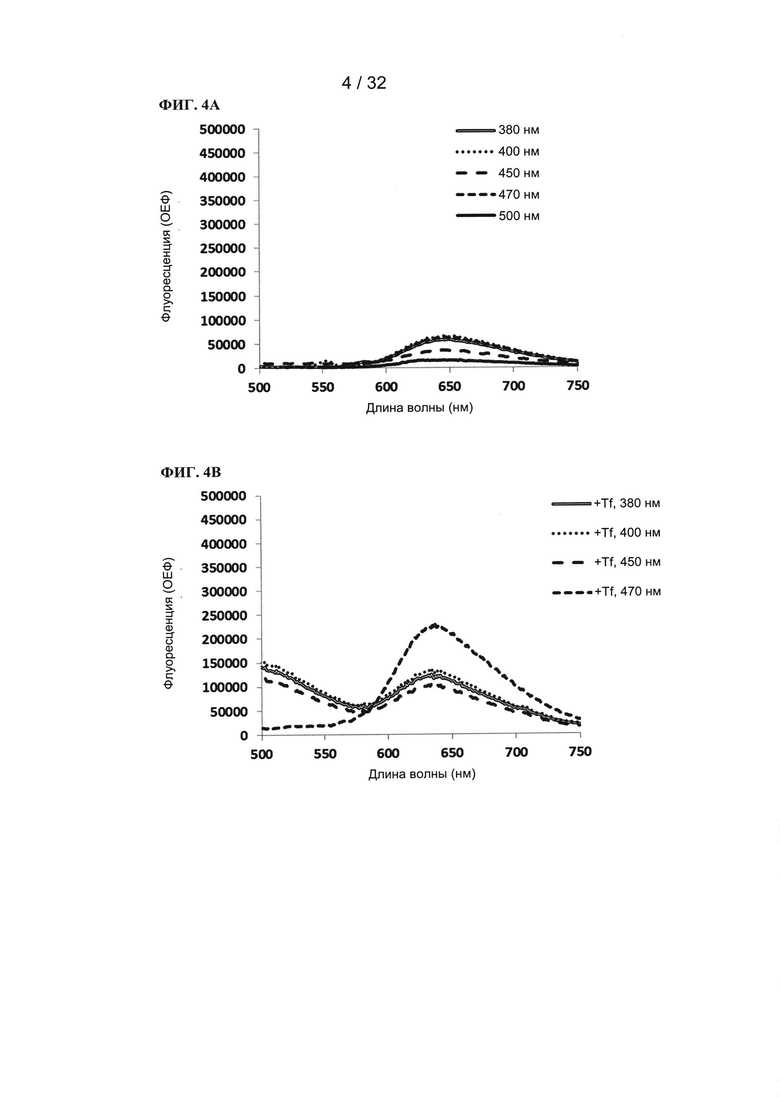

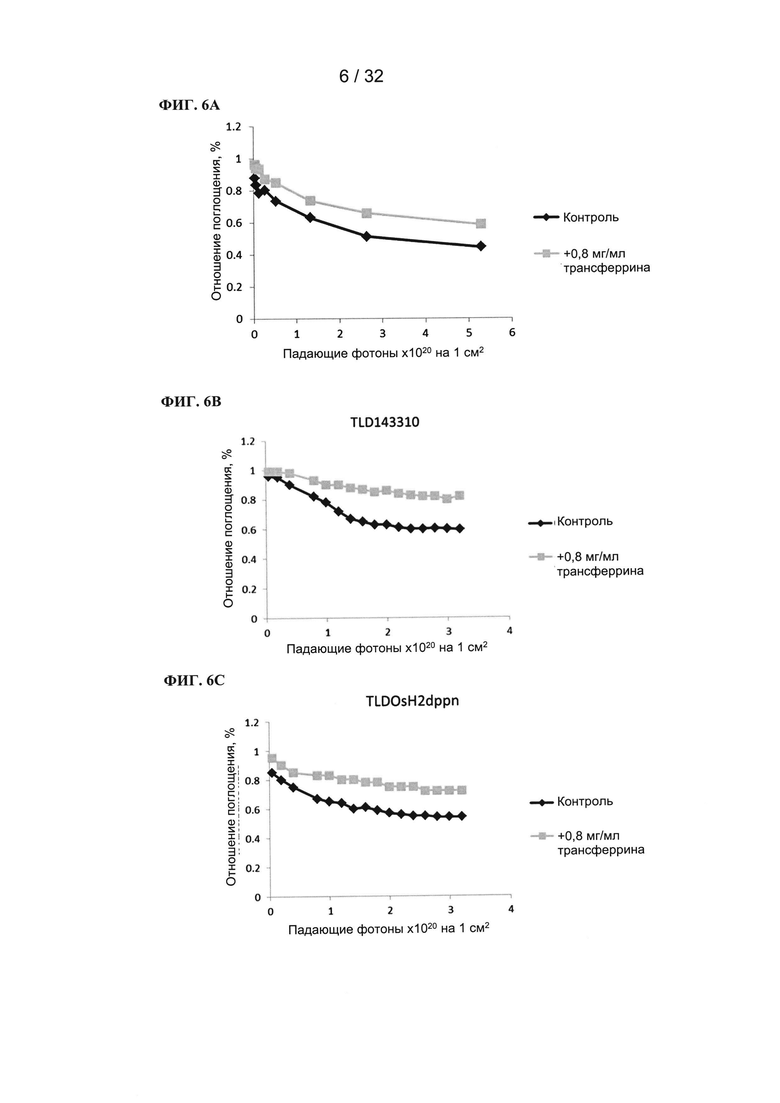
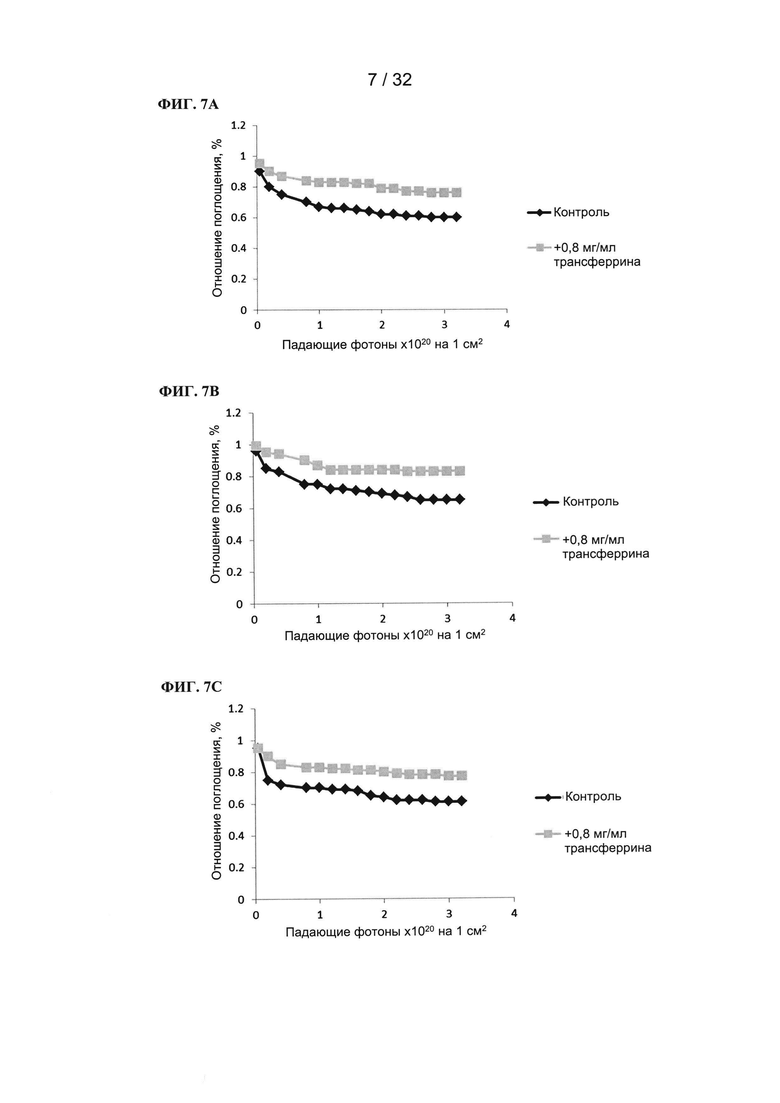
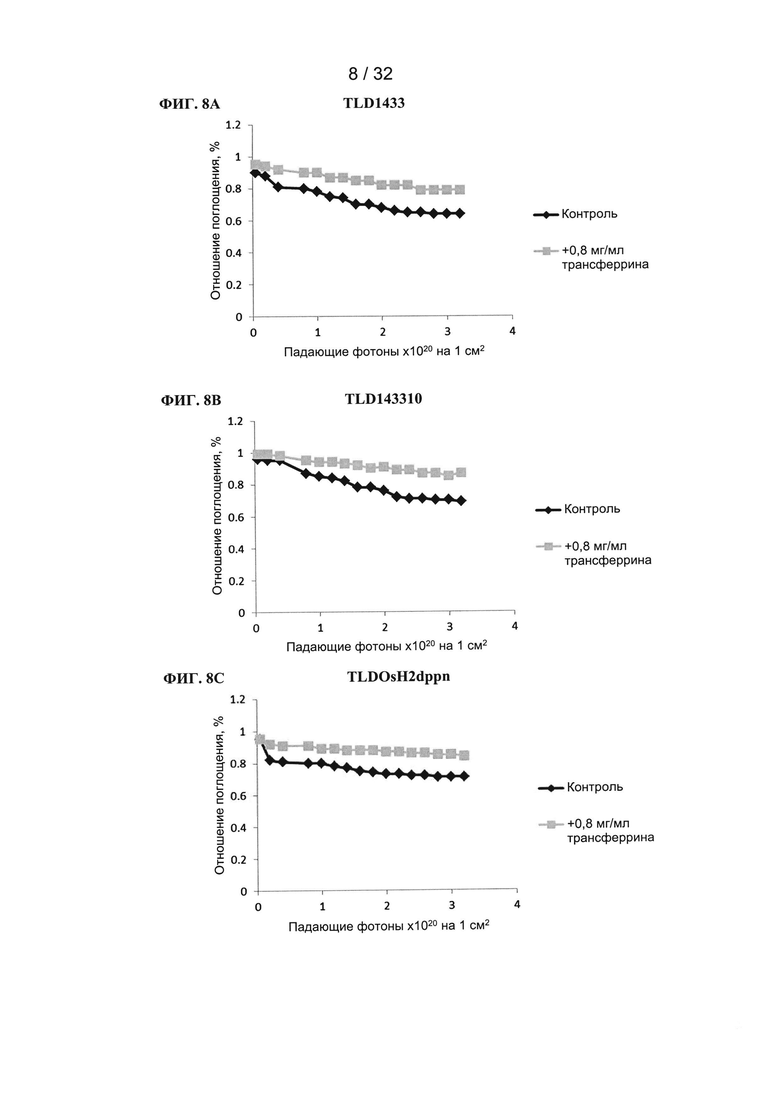

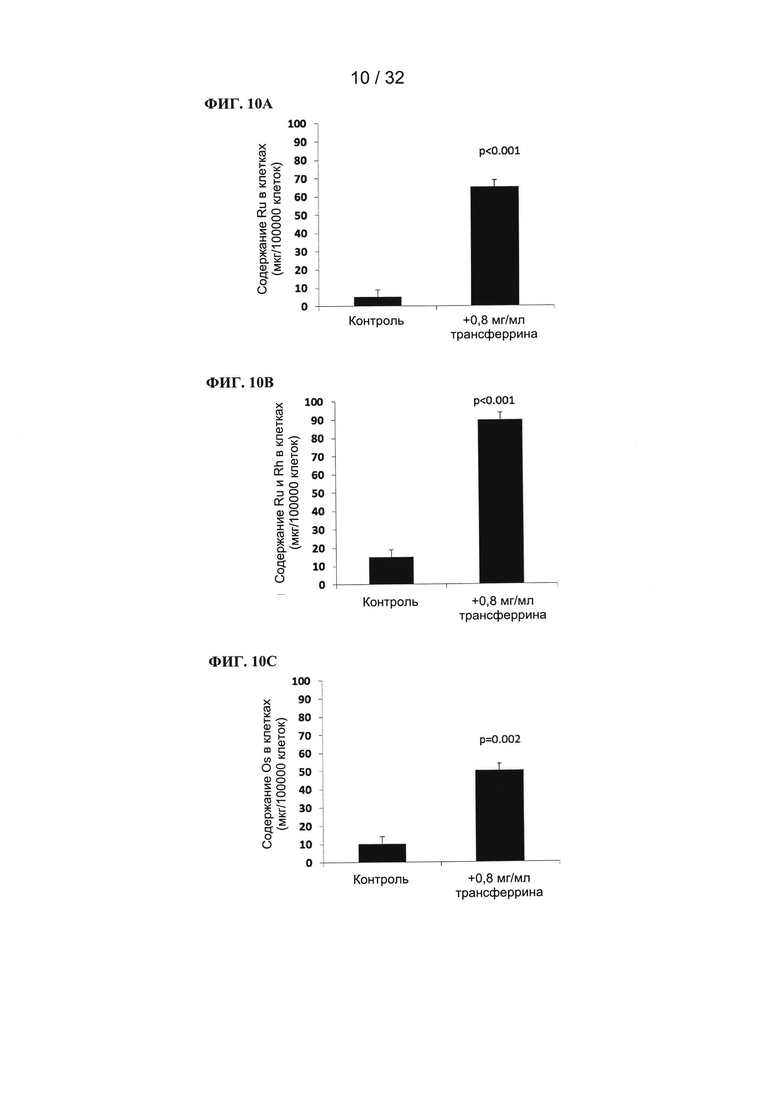
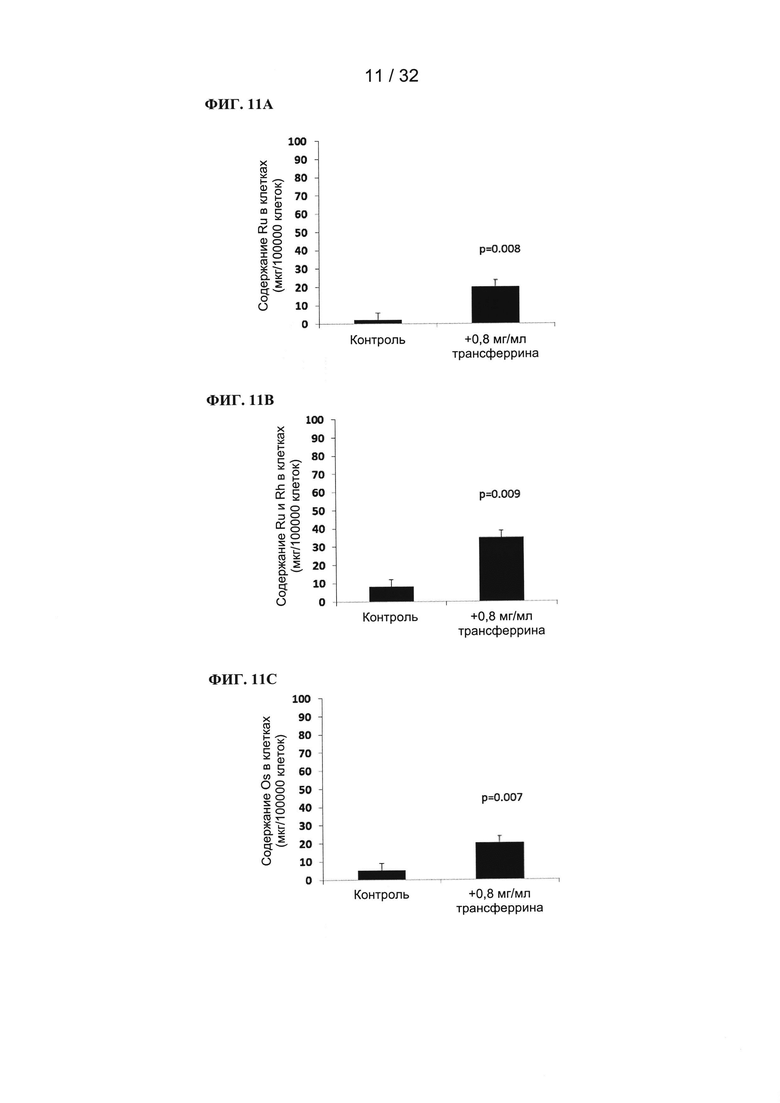
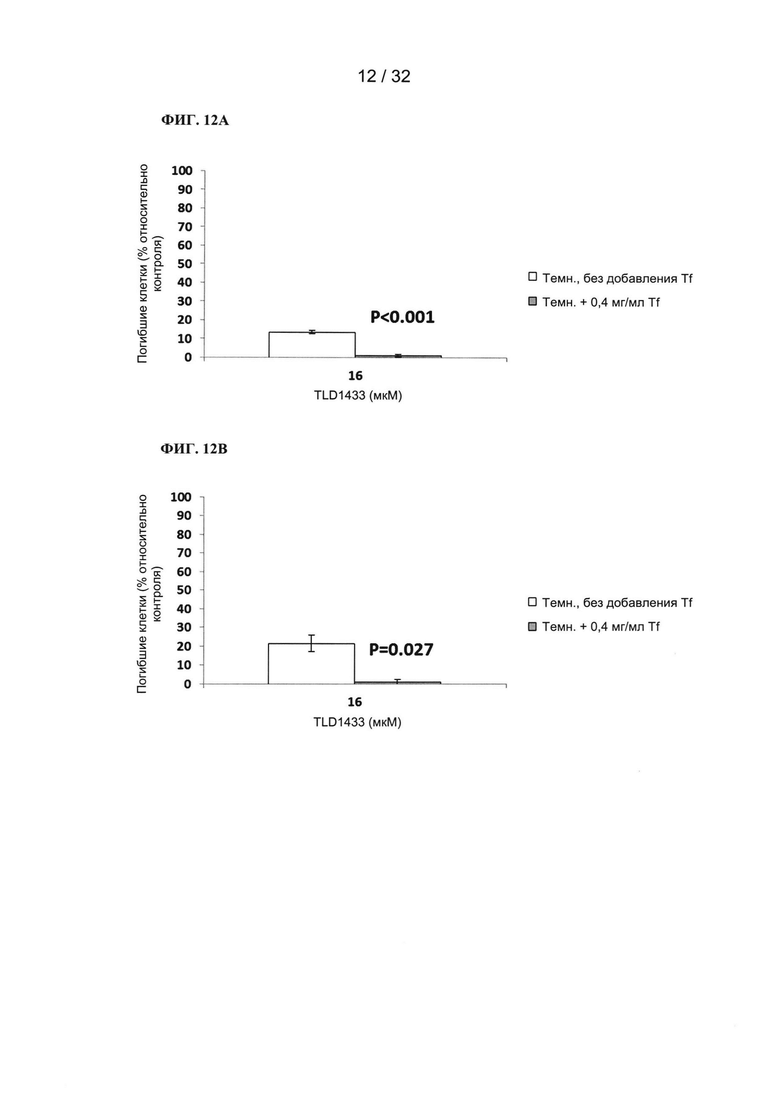
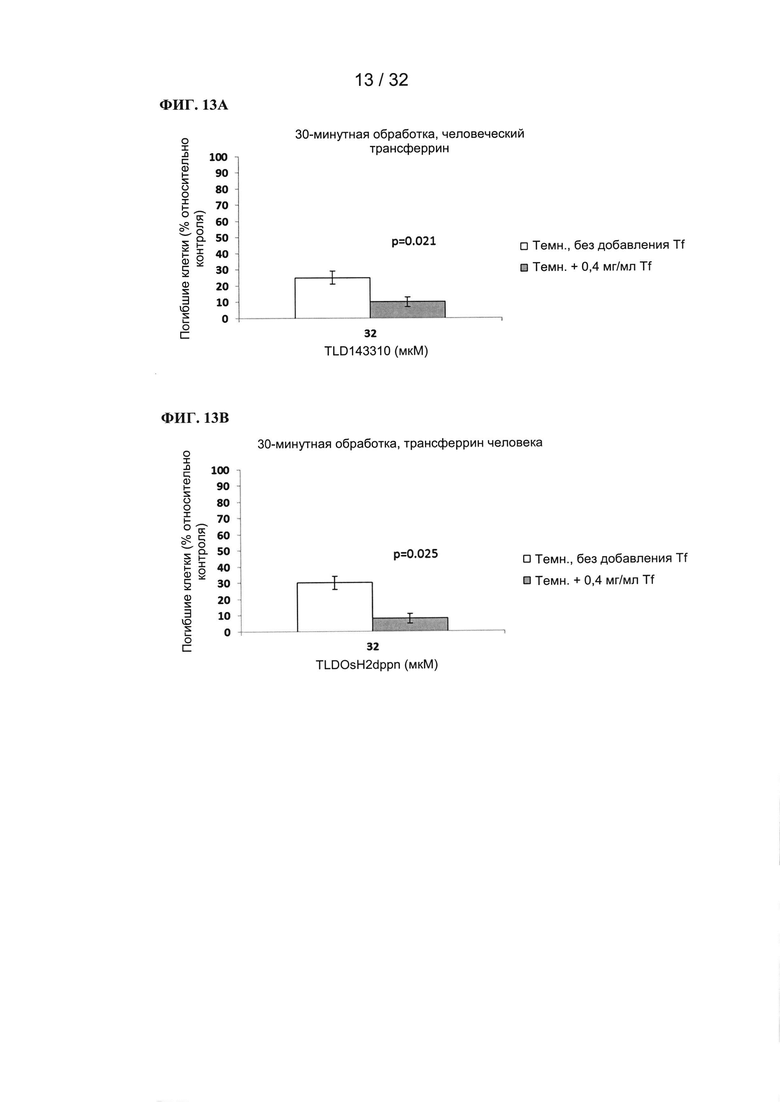
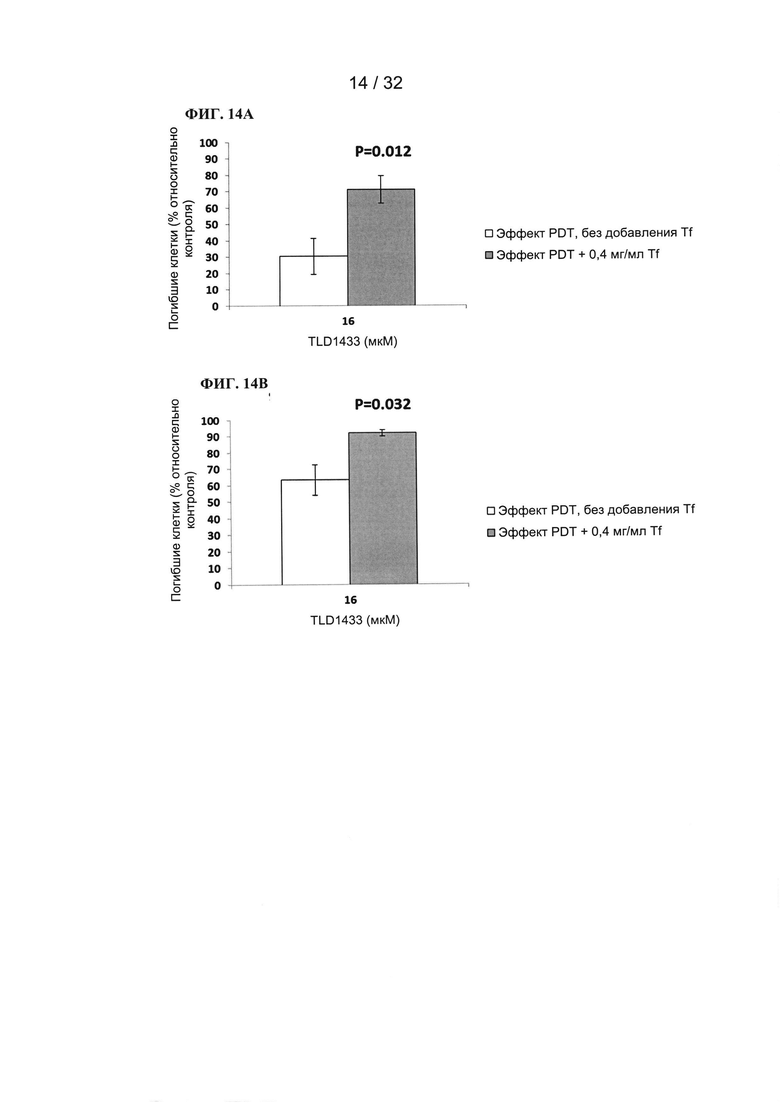
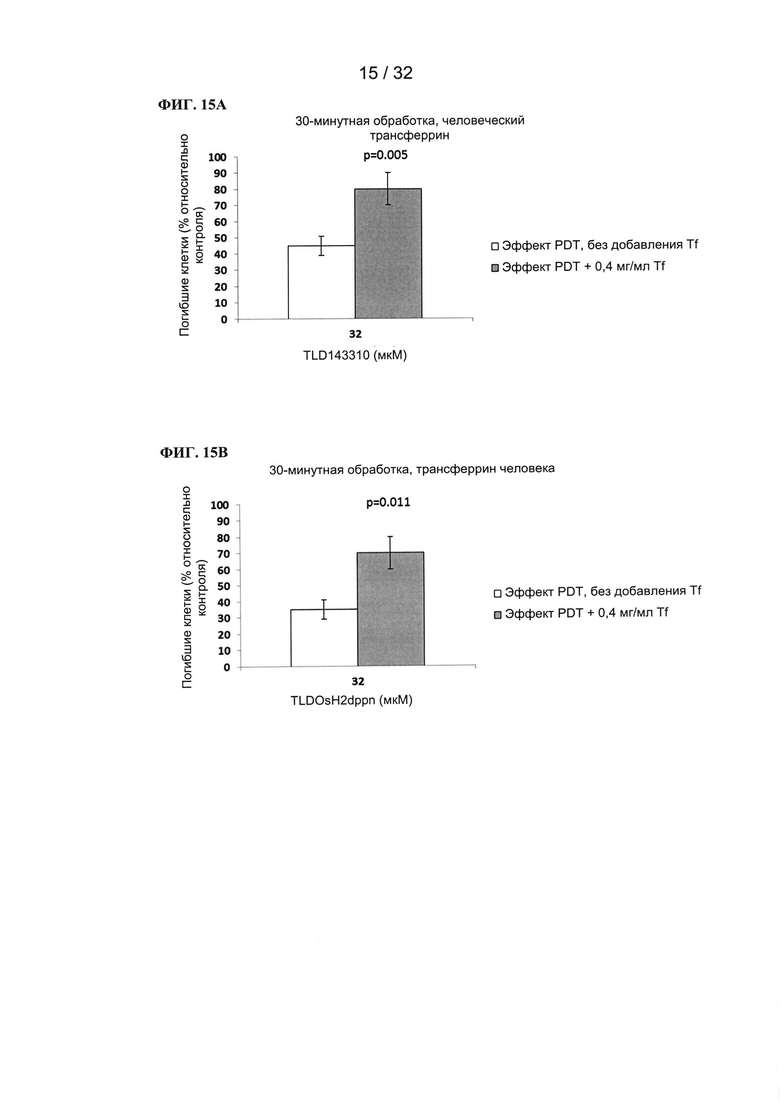
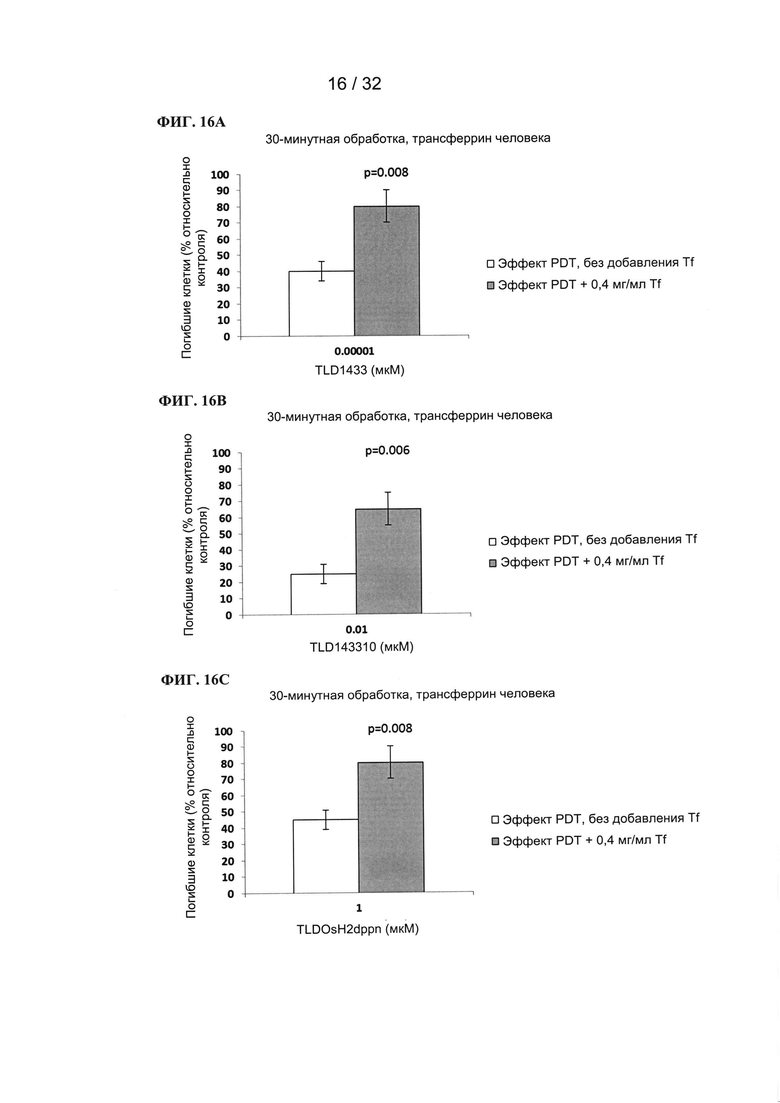
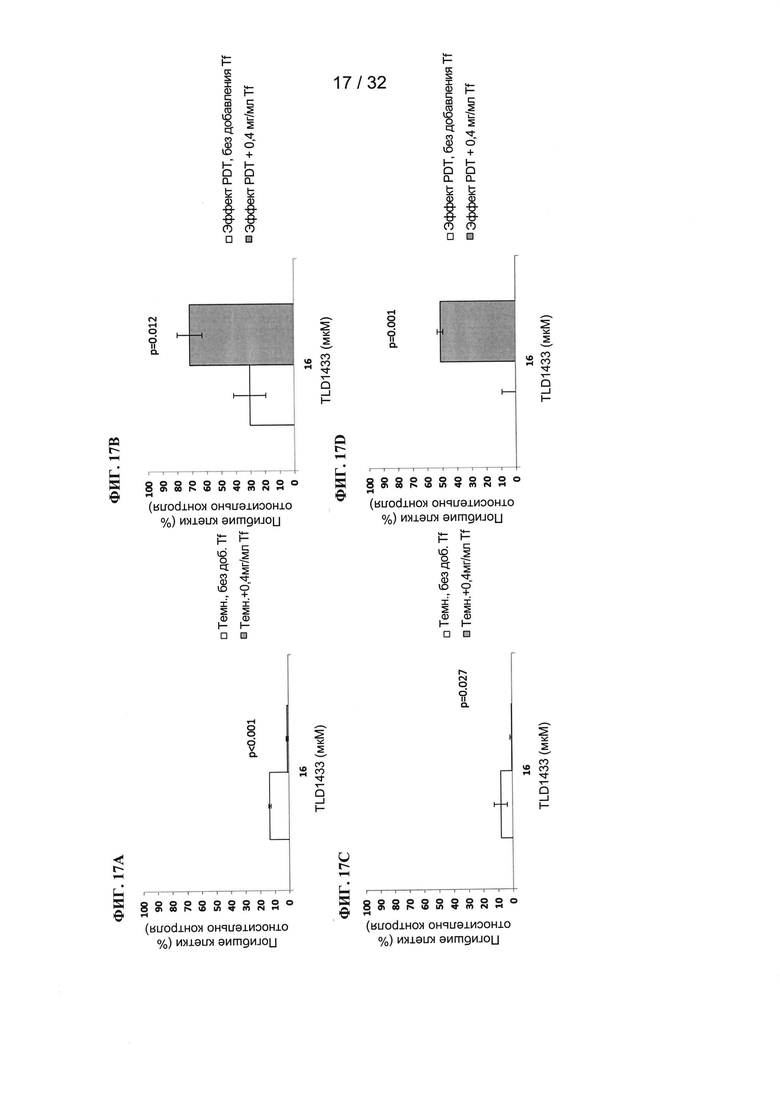
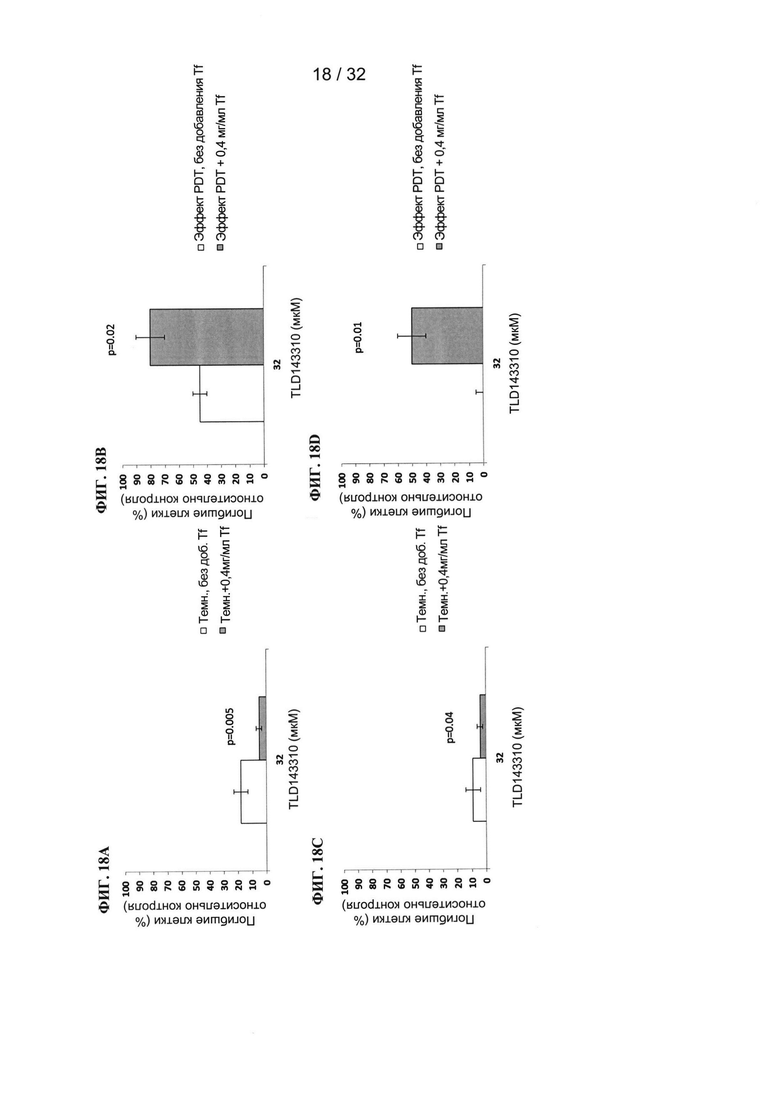
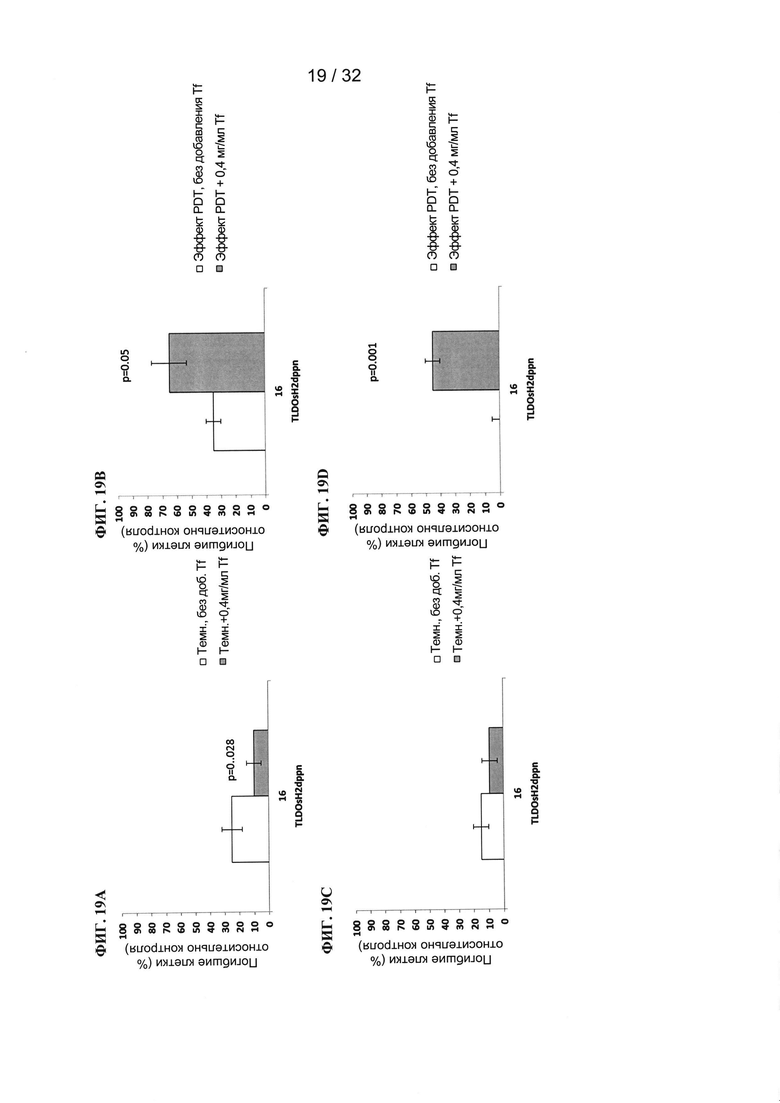
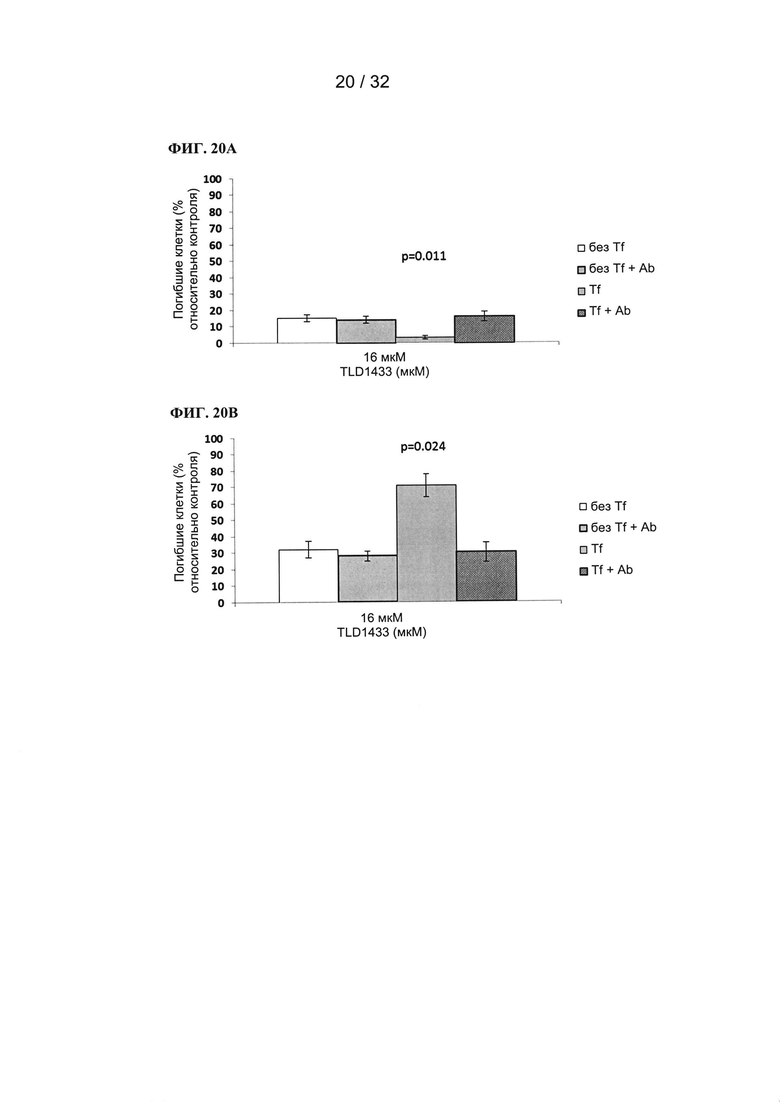
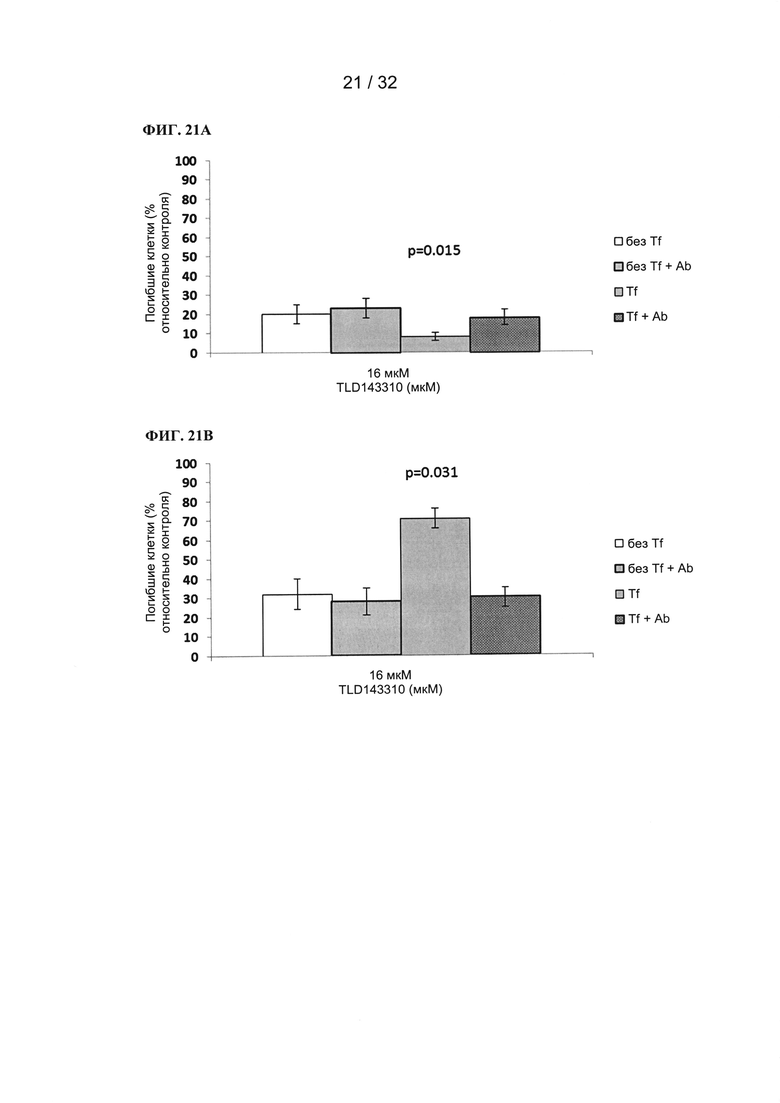
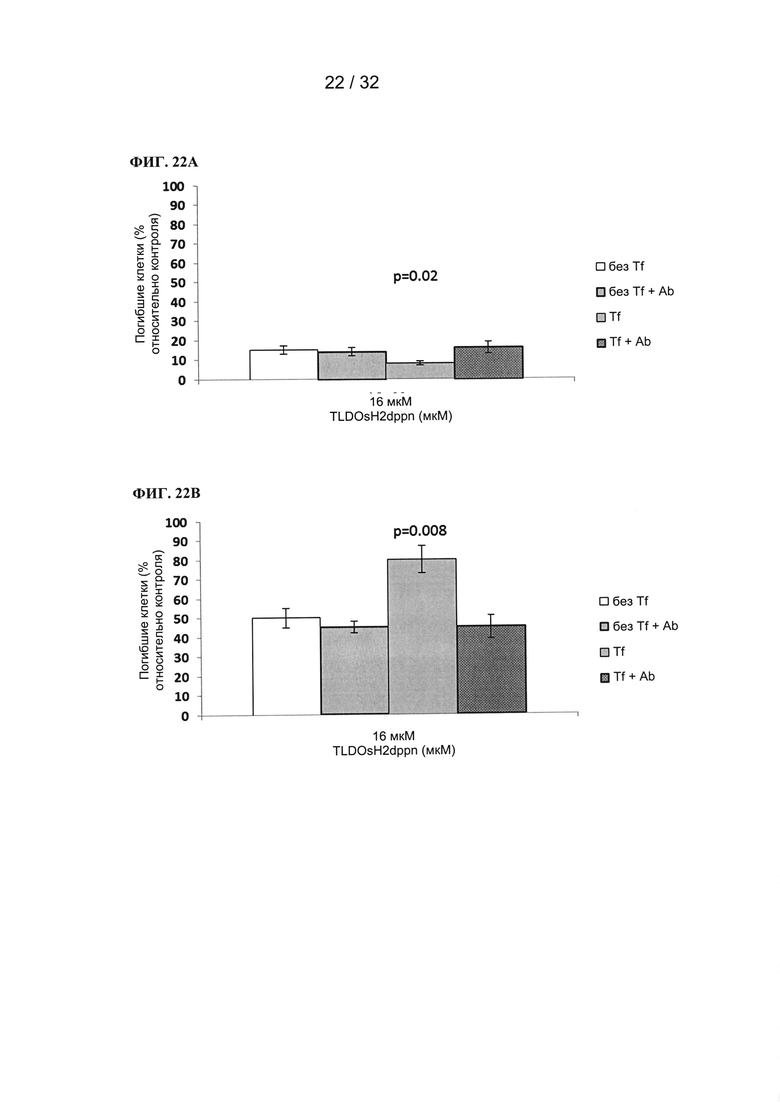
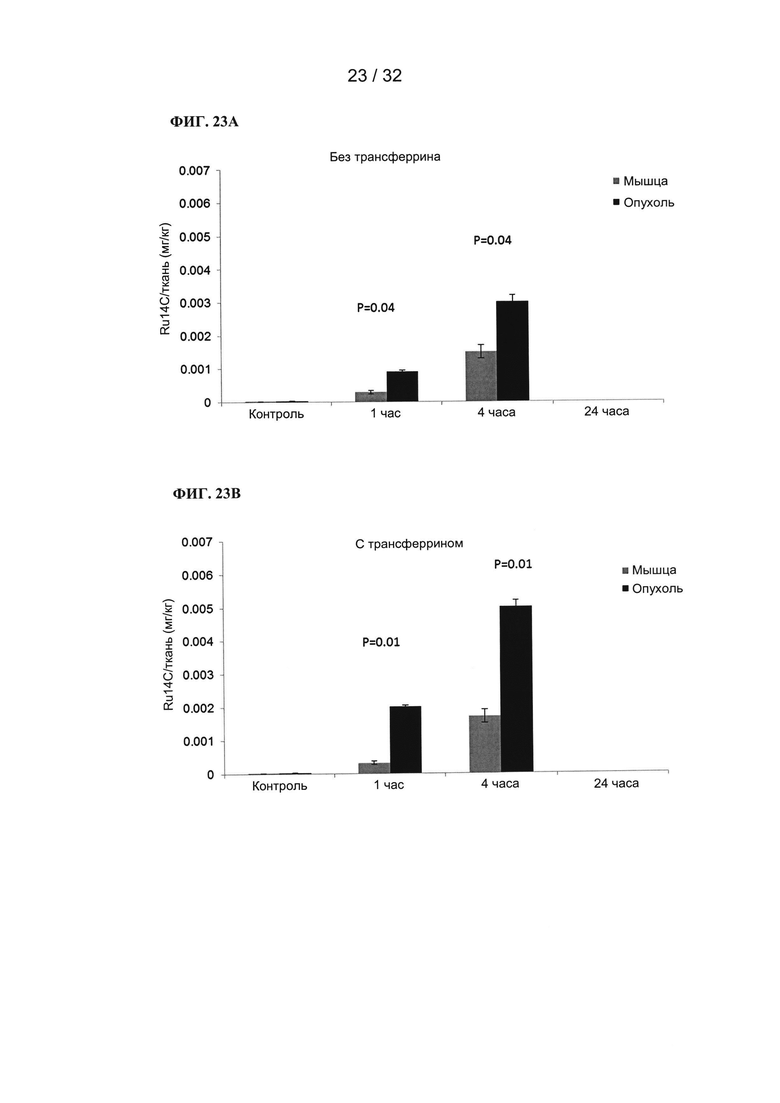
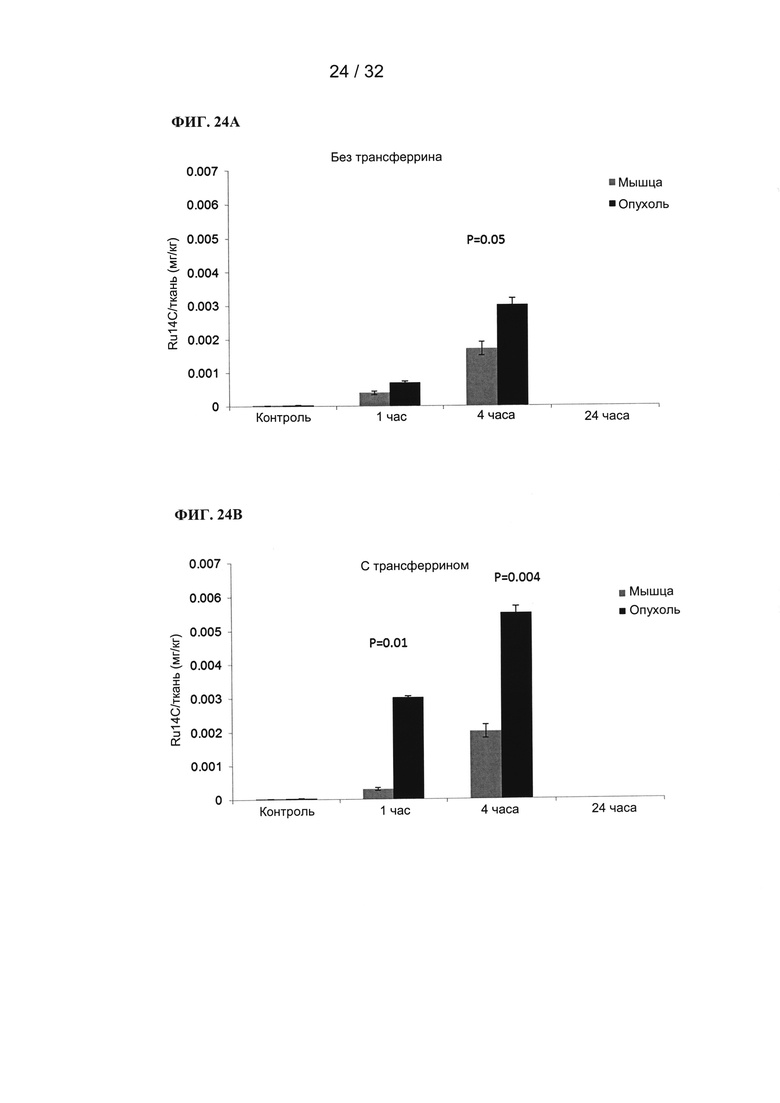

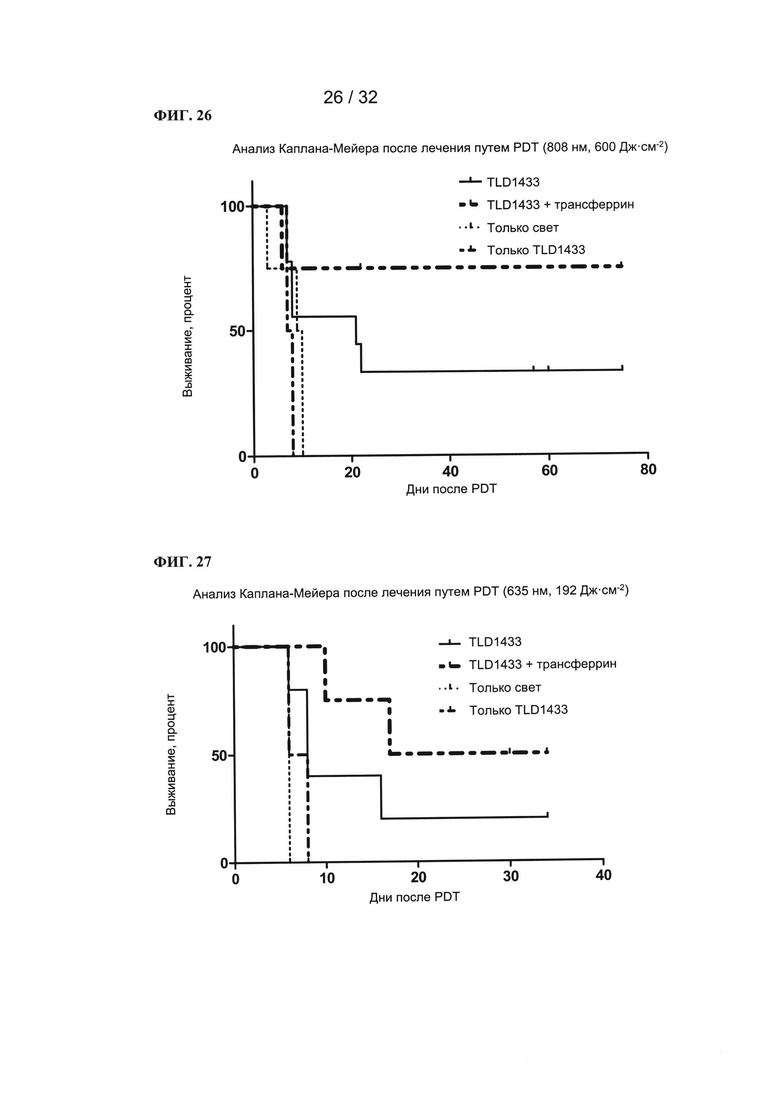
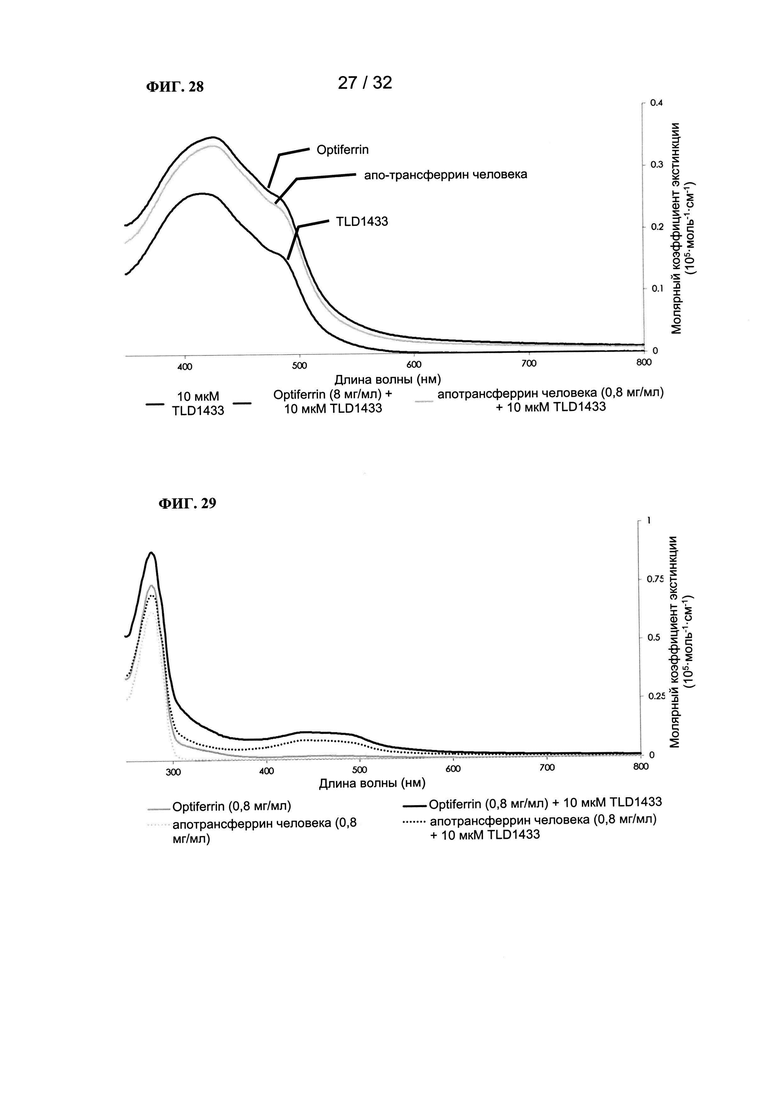
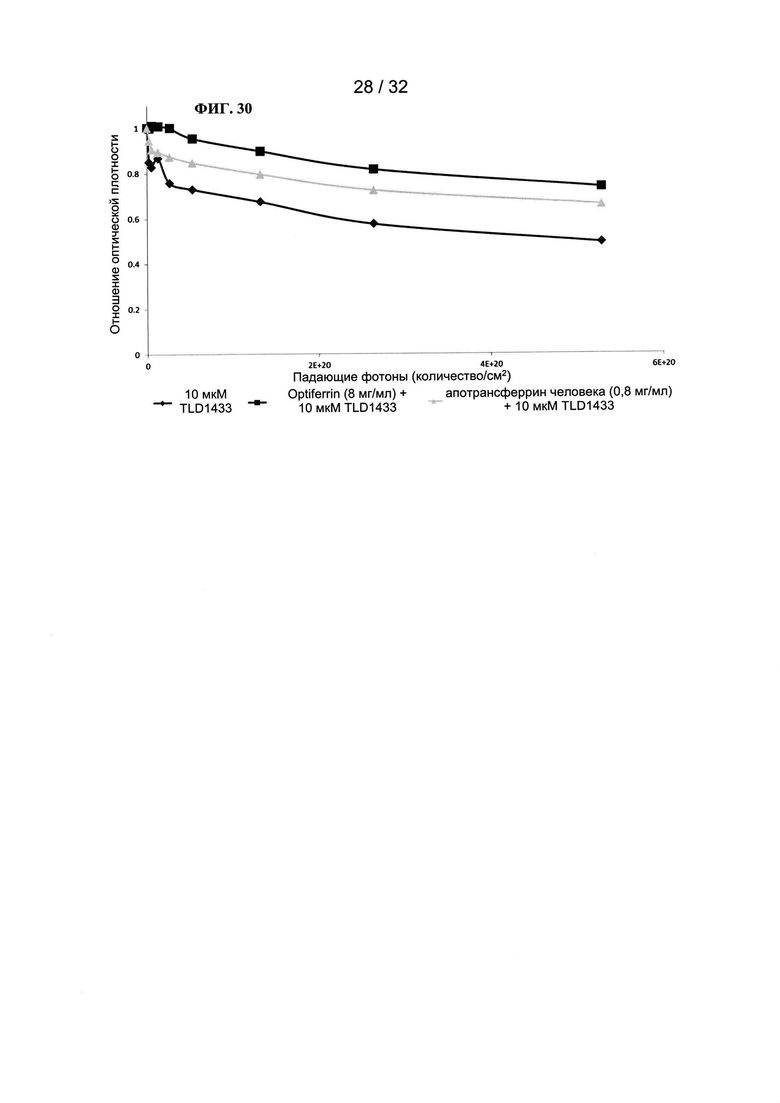
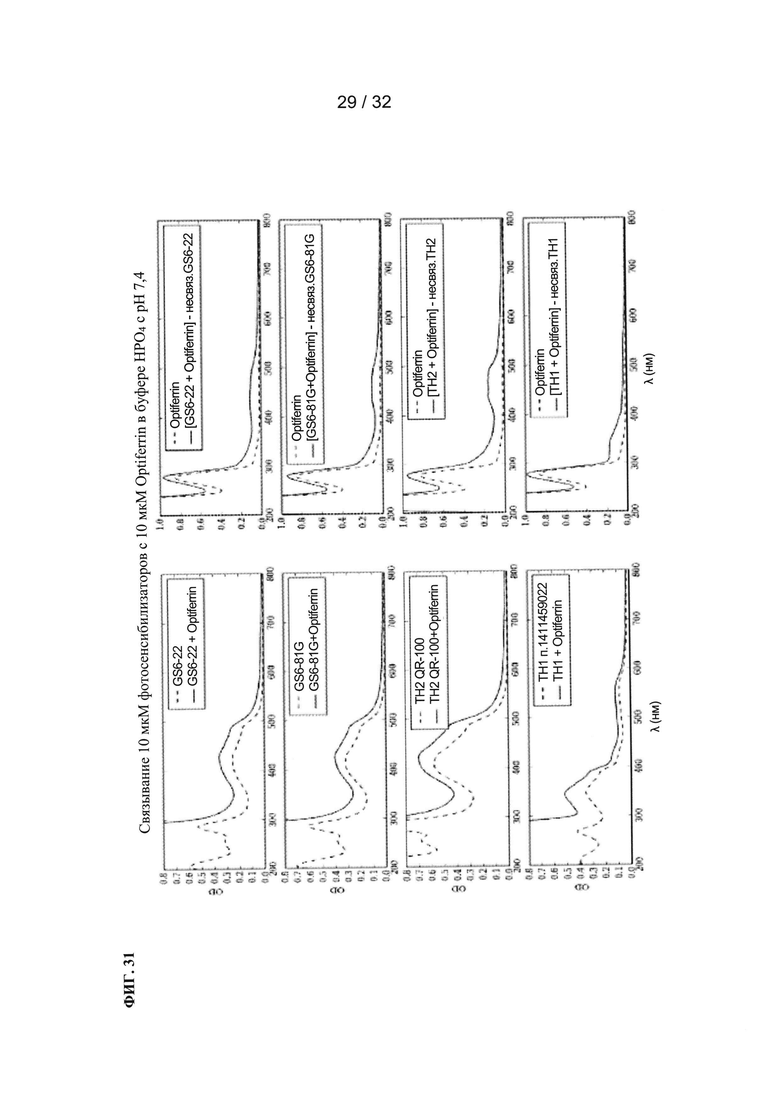

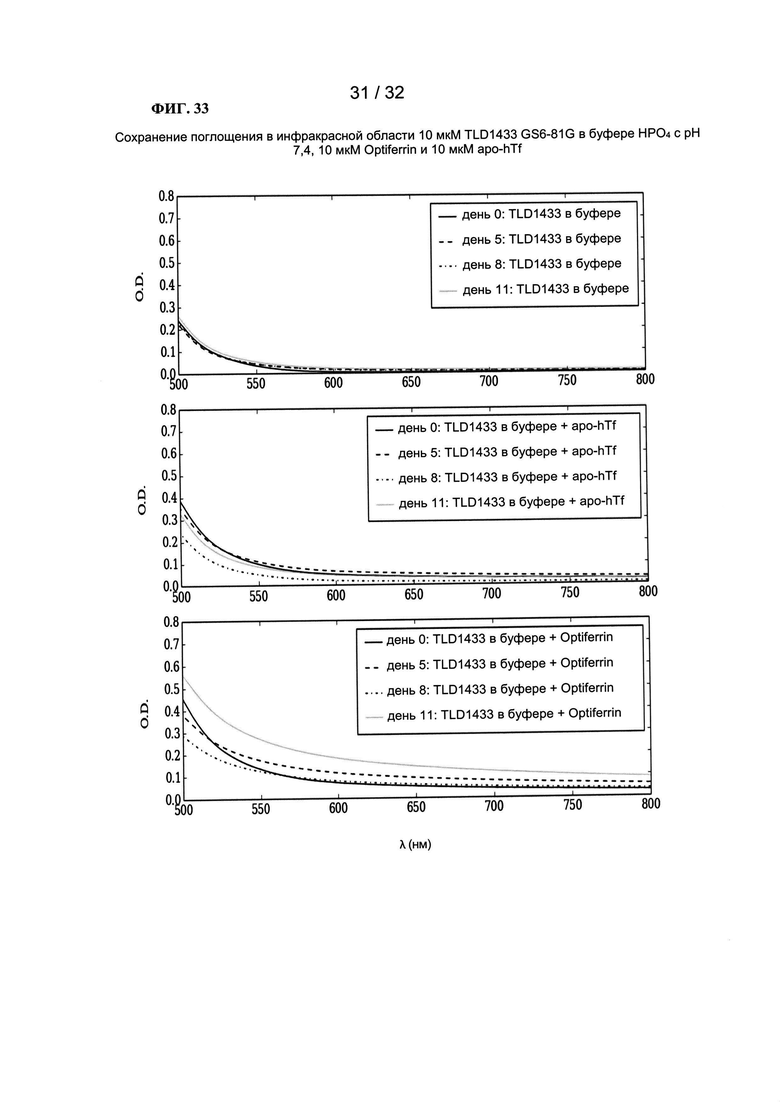
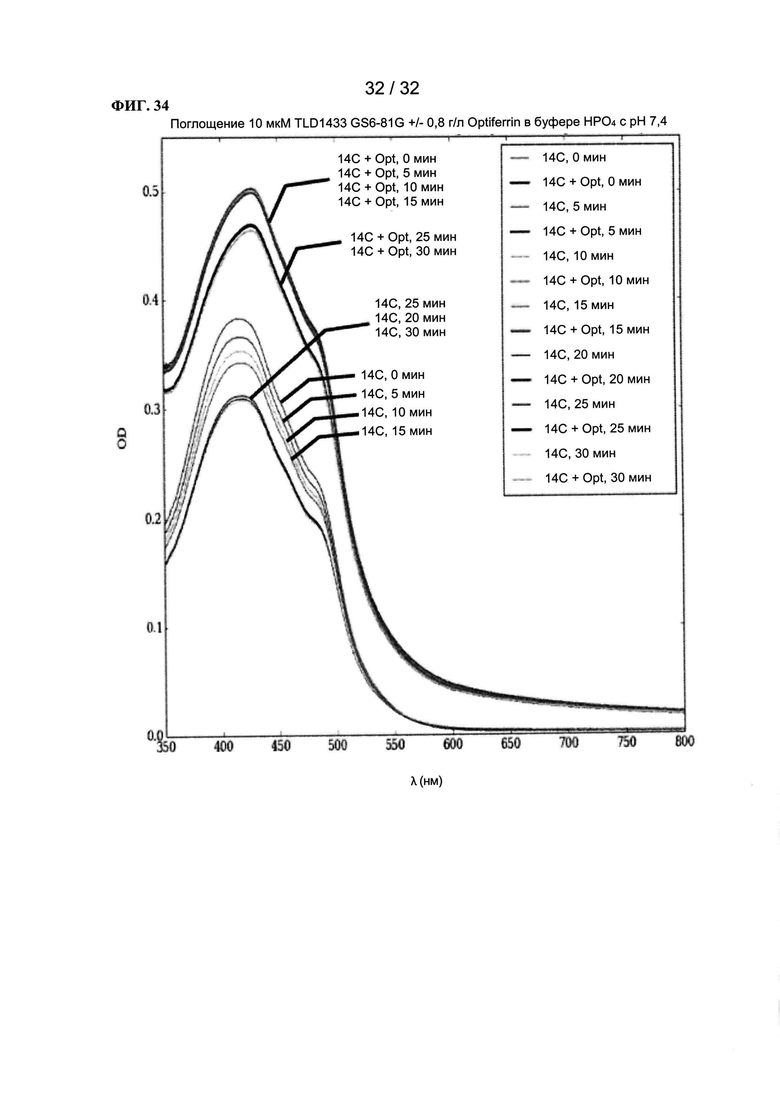
Изобретение относится к композиции для применения для лечения рака. Композиция содержит металлсвязывающий гликопротеин, такой как трансферрин или фетуин, и химиотерапевтическое соединение, имеющее формулу, выбранную из группы, состоящей из
а) формулы (I)
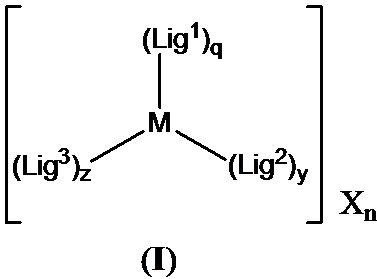 , где M в каждом случае независимо выбран из группы, состоящей из осмия, рутения и родия; X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2; n = 0, 1, 2, 3, 4 или 5; q независимо в каждом случае равен 0, 1 или 2; y независимо в каждом случае равен 0, 1 или 2; z независимо в каждом случае равен 1 или 2; значения Lig1, Lig2 и Lig3 определены в формуле изобретения; и
, где M в каждом случае независимо выбран из группы, состоящей из осмия, рутения и родия; X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2; n = 0, 1, 2, 3, 4 или 5; q независимо в каждом случае равен 0, 1 или 2; y независимо в каждом случае равен 0, 1 или 2; z независимо в каждом случае равен 1 или 2; значения Lig1, Lig2 и Lig3 определены в формуле изобретения; и
b) формулы (II)
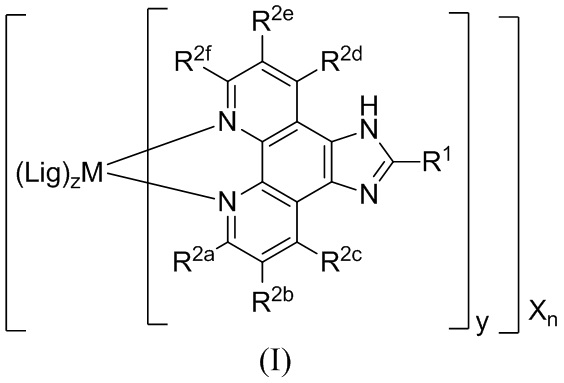
(II), где M выбран из группы, состоящей из рутения, осмия и родия; X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2; n = 0, 1, 2, 3, 4 или 5; y = 1; z = 2; значение Lig определено в формуле изобретения. Также предложен способ лечения заболевания, связанного с гиперпролиферативными клетками, такими как клетки глиобластомы и клетки карциномы. Предложенная композиция включает применение металлсвязывающих гликопротеинов в качестве носителей для доставки фотодинамического соединения (ФДС) на основе металлов для улучшения доставки ФДС к биологической мишени. ФДС, доставляемые при помощи композиции согласно настоящему изобретению, обладают улучшенными свойствами, такими как эффективность, переносимость, терапевтическая эффективность, и диагностическими свойствами ФДС при многоволновой фотодинамической терапии. 3 н. и 6 з.п. ф-лы, 34 ил., 11 табл., 44 пр.
1. Композиция для применения для лечения рака, содержащая:
металлсвязывающий гликопротеин, такой как трансферрин или фетуин; и
химиотерапевтическое соединение, имеющее формулу, выбранную из группы, состоящей из
а) формулы (I)
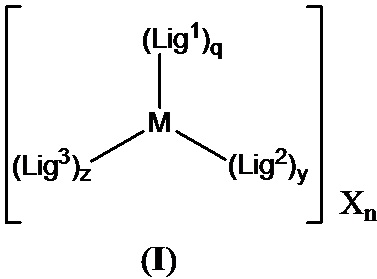
где:
M в каждом случае независимо выбран из группы, состоящей из осмия, рутения и родия;
X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2;
n = 0, 1, 2, 3, 4 или 5;
q независимо в каждом случае равен 0, 1 или 2;
y независимо в каждом случае равен 0, 1 или 2;
z независимо в каждом случае равен 1 или 2;
Lig1 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из 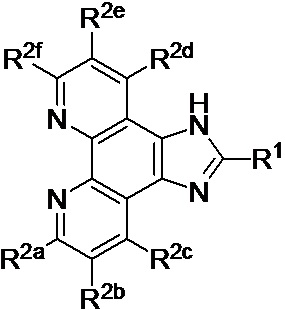 ,
, 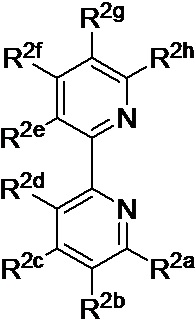 ,
, 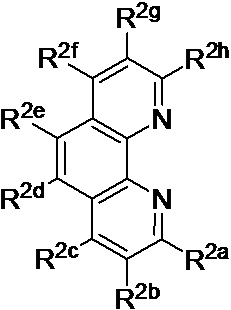 ,
, 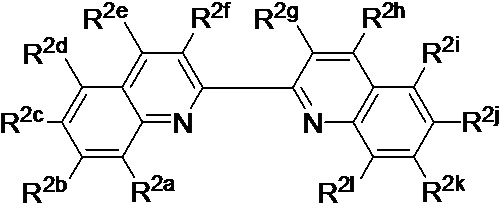 ,
, 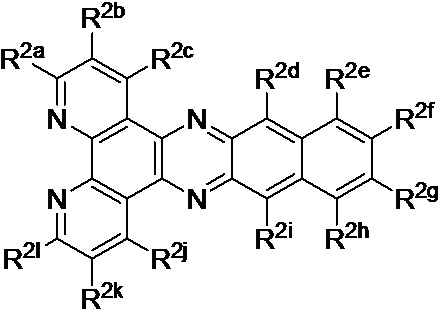 и
и 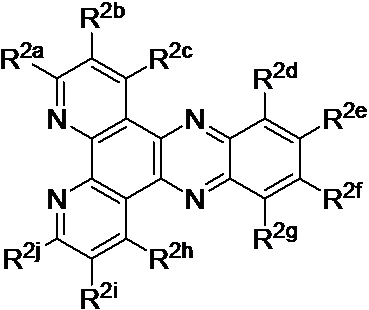 ;
;
Lig2 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
Lig3 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из  и
и 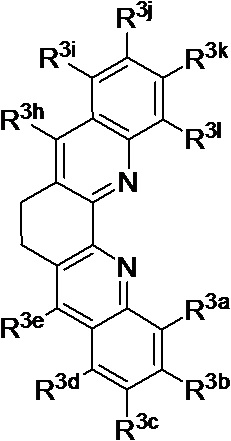 ;
;
R1 выбран из группы, состоящей из водорода, 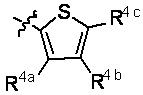 ,
, 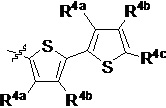 ,
, 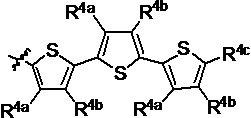 ,
, 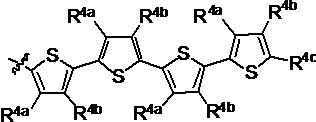 ,
, 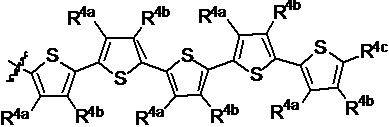 ,
, 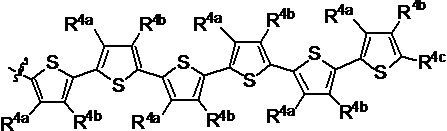 и
и 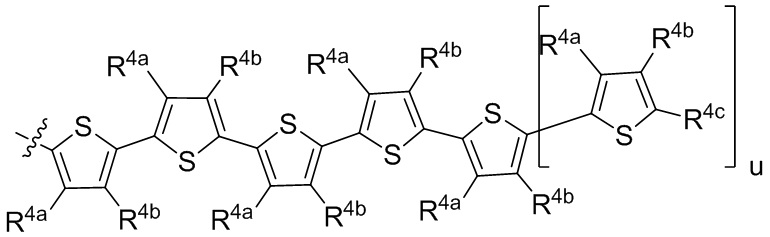 ;
;
u представляет собой целое число;
R2a, R2b, R2c, R2d, R2e, R2f, R2g, R2h, R2i, R2j, R2k и R2l представляют собой водород;
R3a, R3b, R3c, R3d, R3e, R3f, R3g, R3h, R3i, R3j, R3k и R3l представляют собой водород;
R4a, R4b и R4c представляют собой водород; и
b) формулы (II)
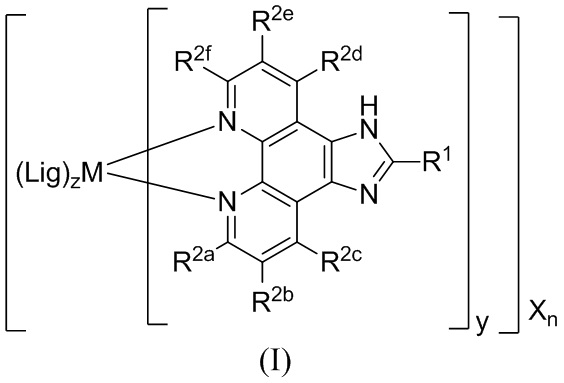
(II)
где:
M выбран из группы, состоящей из рутения, осмия и родия;
X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2;
n = 0, 1, 2, 3, 4 или 5;
y = 1;
z = 2;
Lig представляет собой 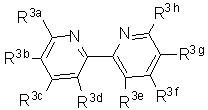 ;
;
R1 выбран из группы, состоящей из  ,
,  ,
, 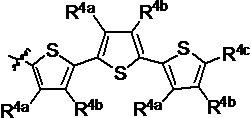 ,
, 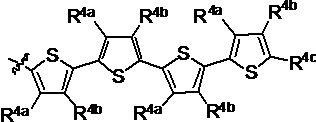 ,
, 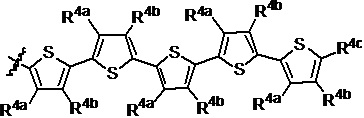 и
и  ;
;
u представляет собой целое число;
R2a, R2b, R2c, R2d, R2e и R2f представляют собой водород;
R3a, R3b, R3c, R3d, R3e, R3f, R3g и R3h в каждом случае независимо выбраны из группы, состоящей из водорода и C1-6 алкила;
R4a, R4b и R4c представляют собой водород.
2. Композиция по п. 1, отличающаяся тем, что указанный металлсвязывающий гликопротеин представляет собой трансферрин, и указанное химиотерапевтическое соединение имеет формулу (I).
3. Композиция по п. 1, отличающаяся тем, что указанный металлсвязывающий гликопротеин представляет собой трансферрин, и указанное химиотерапевтическое соединение имеет формулу (II).
4. Композиция по п. 1, отличающаяся тем, что M выбран из группы, состоящей из Ru и Os.
5. Композиция по п. 1, отличающаяся тем, что указанный металлсвязывающий гликопротеин представляет собой рекомбинантный трансферрин человека.
6. Композиция по п. 1, отличающаяся тем, что указанное химиотерапевтическое соединение представляет собой:
(a) TLD1433, имеющее следующую структуру
 ; или
; или
(b) TLDOsH2dppn, имеющее следующую структуру
 .
.
7. Композиция по п. 6, отличающаяся тем, что указанный металлсвязывающий гликопротеин представляет собой трансферрин.
8. Способ лечения заболевания, связанного с гиперпролиферативными клетками, такими как клетки глиобластомы и клетки карциномы, включающий
введение субъекту с указанным заболеванием эффективного количества композиции по п. 1; и
облучение субъекта светом, эффективным для активации композиции и лечения тем самым указанного заболевания.
9. Способ лечения заболевания, связанного с гиперпролиферативными клетками, такими как клетки глиобластомы и клетки карциномы, включающий введение субъекту с указанным заболеванием эффективного количества композиции по п. 1 для лечения указанного заболевания.
| Беликов В | |||
| Г., Фармацевтическая химия, М., Высшая школа, 1993, стр | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| WO 2013158550 А1, 24.10.2013 | |||
| WO 2014145428 А2, 18.09.2014 | |||
| GUO et | |||
| al., Transferrin serves as a mediator to deliver organometallic ruthenium(II) anticancer complexes into cells, Inorganic Chemestry, 2013, v | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| Мундштучный прибор в гильзовых машинах | 1925 |
|
SU5328A1 |
Авторы
Даты
2021-02-12—Публикация
2016-01-19—Подача