Изобретение относится к области защиты растений в части борьбы с сосущими насекомыми из надсемейства кокцидовых (Coccoidea) отряда полужесткокрылых (Hemiptera), которые являются одними из самых значительных вредителей растений во всем мире.
К основным представителям данного надсемейства относятся червецы, щитовки и ложнощитовки, которые питаются растительными соками растений, вызывая увядание, усыхание растений и их гибель. Питание происходит чаще всего за счет содержимого флоэмы, либо отдельных клеток паренхимы и камбия растений-хозяев. Некоторые виды (ложнощитовки) выделяют на листья и стебли растений, которыми они питаются, липкое, сладкое вещество, называемое медвяной росой. На медвяной росе поселяется сажистый грибок, который еще сильнее ослабляет растение. Примерами растений, которые могут повреждаться представителями надсемействами кокцидовых (Coccoidea), являются азалия, береза, бересклет, можжевельник, магнолия, дуб, сосна, тис, падуб, питтоспорум, лавр, лимон, вишня, абрикос, яблоня, картофель, смородина и многие другие.
Химический контроль играет важную роль в борьбе с насекомыми-вредителями из надсемейства кокцидовых. Это может быть особенно оправдано, когда естественных врагов для защиты растений от вредителей недостаточно. Однако многие современные химические средства оказываются неэффективными для представителей данного надсемейства. Например, ацетамиприд эффективен против ложнощитовок, но не очень эффективен против щитовок и может применяться только путем опрыскивания поврежденной листвы растений, а не традиционно как системный инсектицид. Имидаклоприд эффективен против ложнощитовок, но неэффективен против червецов и большинства щитовок. Динотефуран эффективен против большинства представителей надсемейства кокцидовых, однако для каждого отдельного вредителя, по которому нет информации о его чувствительности к данному препарату, это необходимо проверять.
На сегодняшний день на стадии разработки для борьбы с насекомыми-вредителями находятся препараты на основе коротких немодифицированных антисмысловых ДНК-олигонуклеотидов, которые способны объединить наилучшие характеристики современных препаратов - доступность и избирательность. Это связано с тем, что синтез ДНК становится все более недорогим, а комбинация азотистых оснований в каждом отдельном ДНК-олигонуклеотиде (ДНК-инсектициде) уникальна и обеспечивает безопасность для нецелевых организмов. Кроме этого, ДНК является полимером природного происхождения и не будет накапливаться в окружающей среде.
Известен способ борьбы с мучнистым червецом манго Drosicha mangiferae Stebbins (Hemiptera: Coccoidea) при помощи химического инсектицида - бупрофезина из класса ингибиторов синтеза хитина [Hussain S.I. Toxicity of some insecticides to control mango mealy bug, Drosicha mangiferae, a serious pest of mango in Pakistan / S.I. Hussain, M.A. Saleem, S. Freed // Pakistan Journal of Zoology. - 2012. Vol. 44. №2. - P. 353-359.], в котором используется действующее вещество бупрофезин, нарушающее процессы хитинообразования. Бупрофезин подавляет биосинтез хитина во время линьки и вызывает преждевременную гибель насекомого. Кроме того, он снижает плодовитость взрослых самок после обработки.
Недостатками этого метода является то, что бупрофезин не обладает избирательностью в действии. Он запрещен в некоторых странах из-за его негативного воздействия на окружающую среду, будучи особенно токсичным для водных организмов, а также нецелевых насекомых, хотя и имеет низкую токсичность для человека и других млекопитающих. Хроническое и субхроническое воздействие бупрофезина влияет на печень и щитовидную железу, вызывая изменения в структуре и биохимии тканей [Qureshi I.Z. Exposure to sub-acute doses of fipronil and buprofezin in combination or alone induces biochemical, hematological, histopathological and genotoxic damage in common carp (Cyprinus carpio L.) / I.Z. Qureshi, A. Bibi, S. Shahid, M. Ghazanfar // Aquatic Toxicology. - 2016. Vol.179. - P. 103-114.].
Известен способ борьбы с приморским мучнистым червецом Pseudococcus viburni Signoret (Hemiptera: Coccoidea) при помощи хлорпирифоса из класса фосфорорганических соединений [Curkovic Т. An agricultural detergent as co-adjuvant for entomopathogenic fungi and chlorpyrifos to control Pseudococcus viburni (Hemiptera: Pseudococcidae) / T. Curkovic, L Chiffelle, J. Villar, J.E. Araya, G. Silva // Florida Entomologist. - 2019. Vol. 102. №1. - P. 101-106.]. Попадая в организм насекомых, он блокирует работу ацетилхолинэстеразы, что приводит к параличу и гибели вредителя.
Недостатком этого метода является то, что хлорпирифос долго сохраняется в окружающей среде и его следы часто присутствуют во фруктах, овощах, злаках и молочных продуктах, а также в питьевой воде. Воздействие хлорпирифоса даже в малых дозах опасно и связано с нарушениями развития нервной системы у детей, такими как повышенный риск развития аутизма, потеря рабочей памяти, гиперактивного расстройства с дефицитом внимания и снижение умственного развития. Дети особенно подвержены риску, потому что их мозг все еще развивается. Многие исследования указывают на хлорпирифос как на химическое вещество-разрушитель эндокринной системы. Его присутствие в организме связано с метаболическими нарушениями, раком молочной железы и легких, а также мужским бесплодием [Grandjean P. Neurobehavioural effects of developmental toxicity / P.Grandjean, P.J. Ladrigan // Lancet Neurology. - 2014. Vol. 13. - P. 330-338.], [Rauh V. Seven-year neurodevelopmental scores and prenatal exposure to chlorpyrifos, a common agricultural pesticide / V. Rauh, S. Arunajadai, M. Horton, F. Perera, L. Hoepner, D.B. Barr, R. Whyatt // Children's Health. - 2011. Vol. 119. - P. 1196-1201.], [Cock de M. Does perinatal exposure to endocrine disruptors induce autism spectrum and attention deficit hyperactivity disorders? Review / M. de Cock, G.H. Yolanda, M.M. van de Bor // Exposure to EDCs and neurodevelopmental disorders. - 2012. Vol. 101. - P. 811-818.], [Shelton J.F. Neurodevelopmental Disorders and Prenatal Residential Proximity to Agricultural Pesticides: The CHARGE study / J.F. Shelton, E. M. Geraghty, D.J. Tancredi, L.D. Delwiche, R.J. Schmidt, B. Ritz, R.L. Hansen, I. Hertz-Picciotto // Environmental Health Perspectives. - 2014. Vol. 122. - P. 1103-1110.].
Известен способ борьбы с акациевой ложнощитовкой Parthenolecanium corni Bouche (Hemiptera: Coccoidea) при помощи химического инсектицида - актара из класса неоникотиноидов [Калиновский И.Н. Эффективность инсектицидов в борьбе с акациевой ложнощитовкой на винограде в условиях Оренбургской области / И.Н. Калиновский, В.А. Симоненкова // Известия ОГАУ. - 2013. - №5 (43). - С. 20-23.], в котором используется действующее вещество тиаметоксам, которое быстро всасывается растениями и транспортируется во все его части, включая пыльцу. Инсектицид попадает в насекомое в момент кормления или при непосредственном контакте, в том числе через трахейную систему. Тиаметоксам мешает передаче импульса между нервными клетками, связываясь с никотиновыми рецепторами ацетилхолина в нервной системе и, в конечном итоге, парализует мышцы насекомых.
Недостатком этого метода является то, что тиаметоксам не обладает избирательностью в действии, накапливается в почве и в тканях растений, представляет неприемлемо высокий риск для пчел, в том числе проникает в насекомых через пыльцу и нектар; субнанограмм этого вещества приводит к невозможности вернуться в улей, что является причиной гибели насекомого и, в том числе, основным симптомом коллапса пчелиных колоний. Тиаметоксам обладает длительным периодом полураспада в сельскохозяйственных ирригационных каналах и почве.
Известен способ борьбы с фиолетовой щитовкой Lepidosaphes beckii Newman (Hemiptera: Coccoidea) при помощи химического инсектицида «Адмирал» из класса ювеноидов [Dewer Y. Comparative efficacy of some insecticides against purple scale insect, Lepidosaphes beckii (Hemiptera: Coccoidea) and its parasitoid in citrus orchard in Egypt / Y. Dewer, S. Abdel-Razak, A. Barakat // Egyptian Academic Journal of Biological Sciences. - 2012. №5. - P. 121-127.], в котором используется действующее вещество пирипроксифен. Действует на эндокринную систему насекомых, имитируя ювенильный гормон, тем самым препятствуя линьке и, как следствие, нарушает размножение.
Недостатком этого метода является то, что пирипроксифен обладает низкой растворимостью и высокой стойкостью в окружающей среде. Тем не менее, его восприимчивость к фотодеградации в водной среде и метаболический распад в аэробных условиях могут приводить к его быстрому исчезновению из экосистем. В анаэробных условиях, таких как солоноватые воды или отложения, пирипроксифен гораздо более стабилен, неизменен и токсичен для водных беспозвоночных [Sullivan J.J. Environmental fate and properties of pyriproxyfen / J.J. Sullivan, K.S. Goh // Journal of Pesticide Science. - 2008. №33. - P. 339-350.].
В качестве прототипа выбран способ борьбы с гусеницами непарного шелкопряда (Lymantria dispar) [Патент РФ №2691614, МПК: A01N 63/00, СПК: A01N 63/00, автор - Оберемок В.В., опубл. 14.06.2019 Бюл. №17], в котором используется инсектицид на основе нуклеиновой кислоты, избирательно действующий на личинок насекомых определенного вида с использованием короткого (11 нуклеотидов) одноцепочечного антисмыслового фрагмента ДНК гена 5,8S рибосомальной РНК непарного шелкопряда с последовательностью 5'-TGCGTTGAAA-3' в концентрации 200 пмоль/мкл таким образом, чтобы на гусеницу I-II возраста попало не менее 0,3 мкл раствора. Изобретение позволяет повысить смертность гусениц непарного шелкопряда (Lymantria dispar L.).
Способ-прототип не предназначен для борьбы с насекомыми-вредителями из надсемейства кокцидовых, так как применяемый антисмысловой фрагмент может быть эффективен лишь под определенного целевого насекомого-вредителя - непарного шелкопряда; наблюдается более низкая смертность насекомого в результате применения антисмыслового фрагмента ДНК, чем в заявляемом способе.
Техническим результатом изобретения является увеличение универсальности предлагаемого подхода, а также повышение смертности насекомых в результате применения антисмыслового фрагмента ДНК.
Разработанный способ борьбы с насекомыми-вредителями из надсемейства Coccoidea включает использование инсектицида на основе антисмыслового фрагмента ДНК, избирательно действующего на особей насекомого определенного вида, и отличается тем, что проводят контактную обработку пульверизатором особей насекомого водным раствором короткого антисмыслового фрагмента ДНК гена 28S рибосомальной РНК целевого насекомого-вредителя в концентрации не менее 25 нг/мкл таким образом, чтобы на поверхность растения-хозяина попало не менее 0,5 мг ДНК на 1 квадратный метр листвы.
В классической защите леса применение инсектицидных препаратов не всегда эффективно, т.к. у насекомого вырабатывается генетическая устойчивость к химическим агентам. Поэтому мы предлагаем использовать для борьбы с насекомыми-вредителями из надсемейства Coccoidea препарат на основе соответствующего короткого консервативного антисмыслового ДНК-олигонуклеотида, который способен заменить неизбирательно действующие химические инсектициды, в частности ингибиторы синтеза хитина, фосфорорганические соединения, неоникотиноиды и ювеноиды. Предлагаемые нами ДНК-инсектициды на основе природного полимера являются экологически чистыми, имеют целевой характер и к ним медленней вырабатывается генетическая устойчивость насекомого за счет использования консервативных антисмысловых последовательностей геномов вредителей.
Авторами заявленного технического решения впервые выявлен тот факт, что обработка насекомых-вредителей из надсемейства Coccoidea соответствующим антисмысловым фрагментом гена 28S рибосомальной РНК достоверно увеличивает смертность насекомого по сравнению с контролем. И поскольку влияние ДНК-фрагментов на насекомых-вредителей выявлено впервые, это доказывает существенность отличий.
Причинно-следственная связь между отличительными признаками изобретения и достигаемым техническим результатом заключается в том, что соответствующий антисмысловой фрагмент гена 28S рибосомальной РНК целевого насекомого-вредителя блокирует соответствующий комплементарный участок 28S рибосомальной РНК целевого насекомого-вредителя и инициирует ее расщепление при участии РНКазы Н, тем самым вызывая ингибирование биосинтеза белка, что в конечном итоге приводит к гибели насекомого. Тонкие детали механизма действия ДНК-инсектицидов на сегодняшний день изучаются, но предполагается, что антисмысловые фрагменты гена 28S рибосомальной РНК работает по механизму классического действия немодифицированных антисмысловых олигонуклеотидов, вызывающих разрушение целевой молекулы РНК.
Пример конкретного осуществления способа.
Эксперимент проводился на личинках щитовок и ложнощитовок, находящихся на листве растений-хозяев. Все насекомые находились на листьях растений-хозяев при средней температуре 20-25°С. Последовательности примененных антисмысловых фрагментов из генов 28S рибосомальной РНК Unaspis euonymi Comstock, Dynaspidiotus britannicus Newstead, Ceroplastes japonicus Green, Coccus hesperidum Linnaeus и Icerya purchasi Maskell, были следующими: 5'-AGACCGACGAC-3' - UE-11 для U. euonymi, 5'-ATACCGACGAT-3' - DB-11 для D. britannicus, 5'-CGACCGACGAA-3' - CJ-11 для С japonicus, 5'-CCATCTTTCGG-3' - CH-11 С hesperidum, 5'-ACACCGACGAC-3' - IP-11 для I. purchasi. Личинки контрольной группы, находящиеся на поверхности листьев, были обработаны водой. В качестве контрольного антисмыслового олигонуклеотида использовался ДНК-фрагмент oligoC (случайный фрагмент) с последовательностью 5'-ССССССССССС-3°. В ходе эксперимента на растение-хозяин попадало не менее 0,5 мг ДНК на 1 квадратный метр листвы. Фрагменты были синтезированы на лабораторном ДНК-синтезаторе ASM-800E (БИОССЕТ, Россия). Был использован χ2-критерий Пирсона с поправкой Йетса для оценивания инсектицидного действия фрагментов ДНК. Эксперимент провели в трехкратной повторности.
Антисмысловые фрагменты генов 28S рибосомальной РНК Unaspis euonymi, Dynaspidiotus britannicus, Ceroplastes japonicus, Coccus hesperidum и Icerya purchasi проявили достоверное инсектицидное действие на личинок этих насекомых.
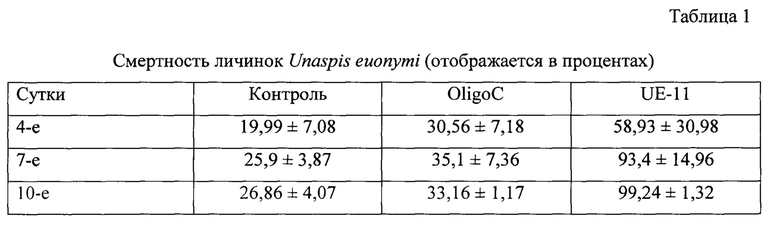
В группе, обработанной водой, oligoC-11 и UE-11, мы наблюдали смертность личинок U. euonymi на растении Euonymus japonicus Thunberg 19,99%, 30,56%, 58,93%; 25,9%, 35,1%, 93,4% и 26,86%, 33,16%, 99,24%, соответственно, на 4-е, 7-е и 10-е сутки после обработки (UE-11 против контроля на 4-е, 7-е и 10-е сутки после обработки соответственно: χ2=2327,865, р<0,001, N=6380, df=1; χ2=1180,5, р<0,001, N=2506, df=1 и χ2=2141,816, р<0,001, N=5113, df=1) (Таблица 1).
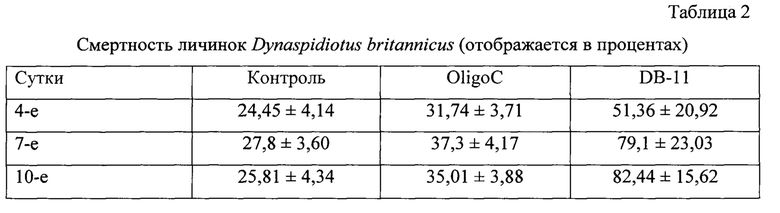
В группе, обработанной водой, oligoC-11 и DB-11, мы наблюдали смертность личинок D. britannicus на растении Laurus nobilis L. 24,45%, 31,74%, 51,36%; 27,8%, 37,3%, 79,1% и 25,81%, 35,01%, 82,44%, соответственно, на 4-е, 7-е и 10-е сутки после обработки (DB-11 против контроля на 4-е, 7-е и 10-е сутки после обработки соответственно: χ2=137,415, р<0,001, N=1774, df=1; χ2=407,1, р<0,001, N=1589, df=1 и χ2=478,511, р<0,001, N=1751, df=1) (Таблица. 2).
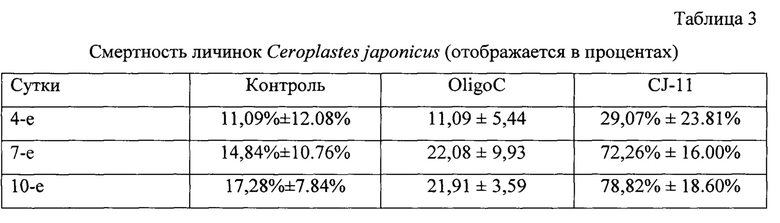
В группе, обработанной водой, oligoC-11 и CJ-11, мы наблюдали смертность личинок С.japonicus на растении Ilex aquifolium L. 11,09%, 11,09%, 29,07%; 14,84%, 22,08%, 72,26% и 17,28%, 21,91%, 78,82%, соответственно, на 4-е, 7-е и 10-е сутки после обработки (CJ-11 против контроля на 4-е, 7-е и 10-е сутки после обработки соответственно: χ2=39.383, р<0.001, N=800, df=1; χ2=266.712, р<0.001, N=800, df=1 и χ2=300.606, р<0.001, N=800, df=1) (Таблица. 3).
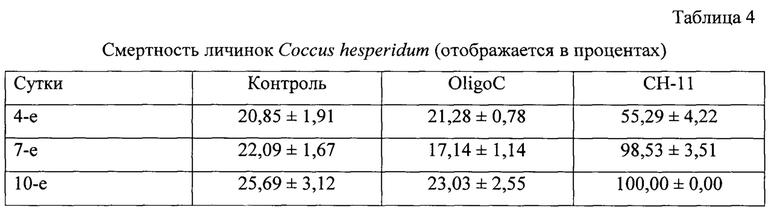
В группе, обработанной водой, oligoC-11 и СН-11, мы наблюдали смертность личинок С.hespiridum на растении Pittosporum tobira (Thunberg) W. Т. Aiton 20,85%, 21,28%, 55,29%; 22,09%, 17,14%, 98,53% и 25,69%, 23,03%, 100%, соответственно, на 4-е, 7-е и 10-е сутки после обработки (СН-11 против контроля на 4-е, 7-е и 10-е сутки после обработки соответственно: χ2=189,007, р<0,001, N=1325, df=1; χ2=493,057, р<0,001, N=882, df=1 и χ2=598,392, р<0,001, N=1007, df=1) (Таблица. 4).
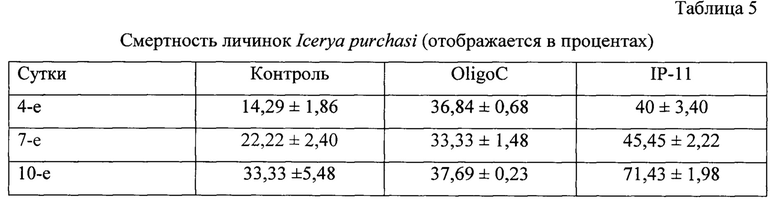
В группе, обработанной водой, oligoC-11 и IP-11, мы наблюдали смертность личинок I. purchasi на растении Pittosporum tobira (Thunberg) W. Т. Aiton 14,29%, 36,84%, 40%; 22,22%, 33,33%, 45,45% и 33,33%, 37,69%, 71,43%, соответственно, на 4-е, 7-е и 10-е сутки после обработки (IP-11 против контроля на 4-е, 7-е и 10-е сутки после обработки соответственно: χ2=131,991, р<0,001, N=1322, df=1; χ2=107,136, р<0,001, N=1367, df=1 и χ2=272,454, р<0,001, N=1352, df=1) (Таблица. 5).
Результаты эксперимента представлены в таблицах 1, 2, 3, 4 и 5. Полученные результаты показывают перспективность применения антисмысловых фрагментов генов 28S рибосомальной РНК в практике лесного хозяйства, сельского хозяйства, садовых ферм с целью борьбы с насекомыми-вредителями из надсемейства кокцидовых (Coccoidea). По сравнению с прототипом заявленный способ является более эффективными и более универсальным.
| название | год | авторы | номер документа |
|---|---|---|---|
| Одноцепочечный ДНК-фрагмент гена 28S рибосомальной РНК и способ его применения для борьбы с Coccus hesperidum | 2020 |
|
RU2763175C1 |
| Способ борьбы с мягкой ложнощитовкой Coccus hesperidum L. | 2020 |
|
RU2751658C1 |
| Способ борьбы с личинками кактусовой щитовки (Diaspis echinocacti Bouche) | 2021 |
|
RU2789227C1 |
| Способ повышения содержания линалилацетата в эфирном масле лаванды узколистной (Lavandula angustifolia Mill.) | 2020 |
|
RU2743395C1 |
| Способ борьбы с личинками колорадского жука (Leptinotarsa decemlineata) | 2016 |
|
RU2675971C2 |
| Способ борьбы с гусеницами непарного шелкопряда (Lymantria dispar) | 2018 |
|
RU2691614C1 |
| Способ борьбы с личинками металловидки серой | 2016 |
|
RU2645258C2 |
| Способ получения препарата для регуляции численности комара обыкновенного (Culex pipiens) | 2016 |
|
RU2664182C2 |
| КОНТРОЛЬ ЖЕСТКОКРЫЛЫХ ВРЕДИТЕЛЕЙ С ПРИМЕНЕНИЕМ МОЛЕКУЛ РНК | 2017 |
|
RU2801251C2 |
| КОМПОЗИЦИИ И СПОСОБЫ БОРЬБЫ С LEPTINOTARSA | 2014 |
|
RU2703498C2 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ борьбы с насекомыми-вредителями из надсемейства Coccoidea включает использование инсектицида на основе дезоксирибонуклеиновой кислоты, в результате которого проводят контактную обработку пульверизатором особей насекомого водным раствором короткого антисмыслового фрагмента ДНК гена 28S рибосомальной РНК целевого насекомого-вредителя таким образом, чтобы на поверхность растения-хозяина попало не менее 0,5 мг ДНК на 1 квадратный метр листвы. Результаты проведенных экспериментов показывают перспективность применения антисмысловых фрагментов гена 28S рибосомальной РНК насекомых-вредителей надсемейства Coccoidea в практике защиты растений. По сравнению с прототипом заявленный способ является более эффективным для целевых насекомых-вредителей и более универсальным. 5 табл., 1 пр.
Способ борьбы с насекомыми-вредителями из надсемейства Coccoidea, включающий использование инсектицида на основе антисмыслового фрагмента ДНК, избирательно действующего на особей насекомого определенного вида, отличающийся тем, что проводят контактную обработку пульверизатором особей насекомого водным раствором коротких антисмысловых фрагментов ДНК генов 28S рибосомальной РНК целевого насекомого-вредителя: 5'-AGACCGACGAC-3' - UE-11 для U. euonymi; 5'-ATACCGACGAT-3' - DB-11 для D. britannicus; 5'-CGACCGACGAA-3' - CJ-11 для С. japonicus, 5'-CCATCTTTCGG-3' - CH-11 для С. hesperidum, 5'-ACACCGACGAC-3' - IP-11 для I. purchasi, таким образом, чтобы на поверхность растения-хозяина попало не менее 0,5 мг ДНК на 1 квадратный метр листвы.
| Способ борьбы с гусеницами непарного шелкопряда (Lymantria dispar) | 2018 |
|
RU2691614C1 |
| DEWER Y | |||
| Comparative efficacy of some insecticides against purple scale insect, Lepidosaphes beckii (Hemiptera: Coccoidea) and its parasitoid in citrus orchard in Egypt, Egyptian Academic Journal of Biological Sciences | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Ребристый каток | 1922 |
|
SU121A1 |
| SULLIVAN J.J | |||
| et al | |||
| Environmental fate and properties of pyriproxyfen, | |||
Авторы
Даты
2021-02-18—Публикация
2020-03-30—Подача