Изобретение относится к области медицины и может быть использовано для профилактики и лечения реакции трансплантат против хозяина, отторжения при трансплантации аллогенных органов, кожных Т-клеточных лимфом, а также ряда аутоиммунных заболеваний.
Одним применяемых в настоящее время способов борьбы с вышеперечисленными диагнозами является экстракорпоральный фотоферез (фотоферез, ЭКФ) - введение в организм реципиента обработанных мононуклеарных клеток.
Экстракорпоральный фотоферез многоступенчатая циклическая процедура, в которой мононуклеары, полученные методом афереза периферической крови пациента, после применения фотосенсибилизатора 8-метоксипсоралена (8-МОП) в концентрации 60-400 нг/мкл подвергаются облучению ультрафиолетом А (1-2 Дж/см2) и затем возвращаются пациенту.
Механизм этого воздействия еще до конца не изучен, однако установлено, что ЭКФ инициирует апоптоз мононуклеаров в кровеносной системе реципиента. Апоптоз мононуклеаров подразделяется на ранний и поздний. Процесс апоптоза характеризуется
активированными каспазами в цитоплазме. При раннем апоптозе целостность поверхностной мембраны не нарушена, а при позднем - имеет место фрагментация поверхностной мембраны. Именно клетки, находящиеся в поздней стадии апоптоза, индуцируют созревание дендритных клеток, превращая их в активные АПК, взаимодействие Т-клеток с которыми приводит к активации Т-регуляторных лимфоцитов.
Таким образом, для успешного проведения профилактики и лечения РТПХ мононуклеарные клетки должны попадать в кровеносную систему реципиента еще живыми, но уже с инициированным апоптозом.
Известен способ профилактики и лечения отторжения почечного трансплантата, включающий проведение экстракорпорального фотофереза путем введения после операции фотосенсибилизатора, выделение концентрата мононуклеарных клеток, разведение его физраствором с последующим ультрафиолетовым облучением полученной суспензии, возвращение ее в кровеносное русло, отличающийся тем, что первый сеанс фотофереза проводят на 3-4 сутки после трансплантации почки, при этом дополнительно сразу после ультрафиолетового облучения проводят замещение физраствора плазмой крови в том же объеме, а затем осуществляют введение в смесь цитокина - гранулоцит-макрофагального колониестимулирующего фактора в дозе 80-120 нг/мл, затем осуществляют инкубацию полученного состава в течение 90-120 минут, замещают плазму с цитокином физраствором в том же объеме с последующим возвращением полученной суспензии в кровеносное русло, на курс 15 сеансов, причем в первые две недели проводят два сеанса в неделю, последующие шесть недель по одному сеансу в неделю, в течение третьего месяца два сеанса, четвертый, пятый и шестой месяц - по одному сеансу в месяц (патент РФ 2 508 924).
Недостатком известного решения является невозможность управления процессом апоптоза полученных мононуклеаров, невозможность длительного хранения полученных мононуклеаров.
Задачей, на решение которой направлено заявляемое изобретение является разработка способа получения мононуклеаров, обработанных ЭКФ, который бы обеспечивал их долгое хранение, а так же возможность управления процессом апоптоза мононуклеаров.
Поставленная задача решается путем применения способа получения криоконсервированных мононуклеарных клеток, включающего выделение концентрата мононуклеарных клеток и проведение экстракорпорального фотофереза. При этом концентрат мононуклеарных клеток после фотофереза подвергают программному замораживанию до -70°С с последующей криоконсервацией в жидком азоте.
Термин программное замораживание подразумевает, что замораживание имеет, как правило, три фазы, характеризующиеся разной скоростью заморозки. Первая фаза - охлаждение мононуклеаров до температуры начала их кристаллизации (1-4°С ниже нуля) характеризуется предпочтительно быстрым кратковременным снижением температуры (10-20°С в мин). Вторая фаза кристаллизации мононуклеаров (4-12°С ниже нуля) характеризуется медленным снижением температуры (0,5-1°С в мин) и предпочтительно наличием, как минимум, одного плато выдержки мононуклеаров при постоянной температуре. Предпочтительно плато выдержки мононуклеаров делают при температуре на 2-3°С ниже температуры эвтектики, при 6-7°С ниже нуля, в течении 5-8 мин. Третья фаза замораживания характеризуется постепенным, монотонным (около 1°С в мин) снижением температуры (до - 70°С).
Применение вышеописанного способа позволяет обеспечить длительное хранение живых мононуклеарных клеток с инициированным апоптозом, а также снизить количество погибших при заморозке мононуклеаров. Так, при заморозке в жидком азоте погибает порядка 13-20% мононуклеарных клеток в результате их повреждения при неконтролируемом выбросе тепла в процессе кристаллизации и при резком снижении температуры клеток. При описанном программном замораживании гибель мононуклеаров составляет примерно 2-4%.
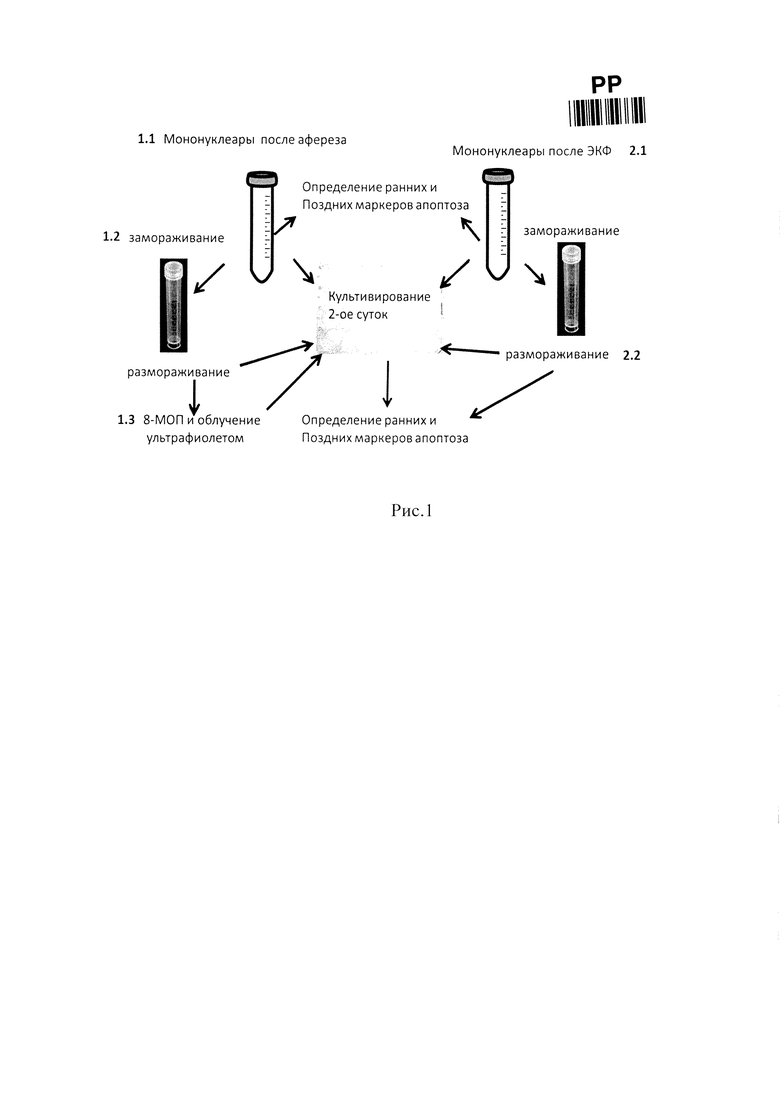
На рис. 1 представлена схема проведения способа.
На рис. 2 представлен пример цитометрического анализа апоптоза в лимфоцитах.
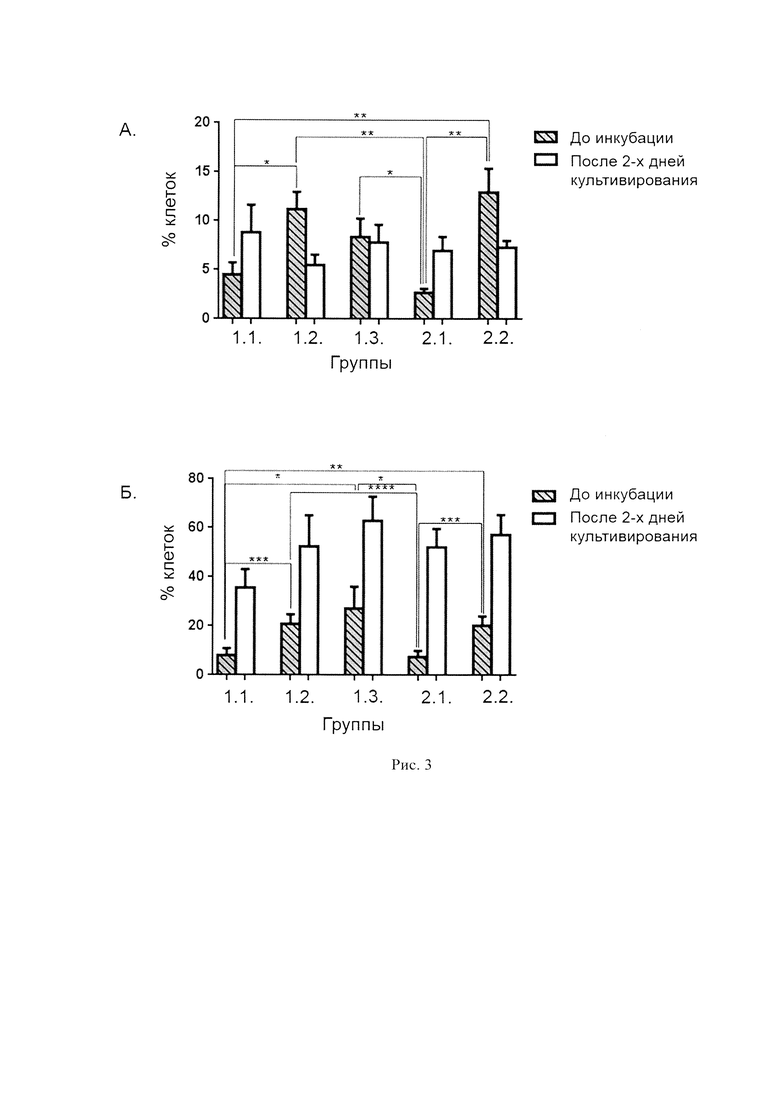
На рис. 3 представлено количество лимфоцитов в ранней (А) и поздней (Б) стадиях апоптоза в исследованных лейкоконцентратах.
В качестве материалов, подтверждающих возможность осуществления настоящего изобретения, представляем одну из серий проводившихся экспериментов, согласно схеме, представленной на рис. 1.
Было отобрано 20 образцов мононуклеаров, полученных от 12 пациентов с хронической РТПХ (пяти больным аферез мононуклеаров проводили от 2 до 4 раз в разные дни с интервалом более 1 недели). В исследование было включено 5 женщин и 7 мужчин. Возраст от 19 до 68 лет (медиана 35 лет). В качестве основного заболевания у 10 пациентов был острый лейкоз, 2 пациента с лимфомой. 11 больным была выполнена трансплантация аллогенных гемопоэтических клеток (алло-ТГСК) от полностью совместимого донора: 5 больным от родственных доноров и 6 больным - от неродственных доноров; 1 пациентке от гаплоидентичного донора.
Аферез мононуклеаров проводили на клеточном сепараторе SpectraOptia (Terumo ВСТ, Япония/США) в режиме сбора мононуклеаров (МНК) со следующими параметрами процедуры: соотношение кровь/антикоагулянт -12:1; настройка сбора (collection preferred) - 40. В результате было обработано от 0,8 до 1,7 от объема циркулирующей крови (ОЦК) (медиана 1,19), медиана времени процедуры - 180 мин (120-250 мин), медиана объема полученного продукта афереза составила 85 мл (60-120 мл).
Образцы для исследования отбирались непосредственно после афереза мононуклеаров (группы 1.1. и 1.2.), до (группа 1.3) и после ЭКФ (группы 2.1. и 2.2). Образцы 1.1 и 1.2. отбирали из контейнера системы для сбора мононуклеаров (Spectra Optia Collection Set 10110, TerumoBCT, Япония/США) во встроенный в систему контейнер для отбора проб. В оставшийся лейкоконцентрат добавляли изотонический раствор хлорида натрия до достижения общего объема продукта 300 мл., после чего в условиях ламинарного шкафа 2 класса биологической безопасности (Nuaire, NU-481-400Е, США) производили отбор образца 1.3 и пробы для контроля параметров продукта на гематологическом анализаторе (Sysmex КХ-21n, Япония) перед облучением: количество лейкоцитов в продукте составило 1,9-10* 109 (медиана 5,85*109), гематокрит - 0,2-2,1% (медиана 0,8%).
Далее, продукт переливали в специальный контейнер для облучения с последующим удалением воздуха из него. После, в условиях сниженного освещения, в продукт добавляли 8-МОП (METOXSALENE S.A.L.F SpA, Италия) в дозе 200 нг/мкл и инкубировали в течение 5 минут.
Затем осуществляли облучение на аппарате Macogenic G2 (Macopharma, Франция) согласно рекомендациям производителя: продолжительность облучения составила от 546 до 682 сек (медиана 606 сек) в дозе 2 Дж/см2. После облучения производили отбор образцов 2.1 и 2.2. Часть образцов анализировались сразу (группы 1.1. и 2.1.), а часть замораживали согласно описанной выше программе. Мононуклеары замораживали в холодном растворе полиглюкина с добавлением 10% диметилсульфоксида. Замороженные клетки хранили при температуре не менее 2-х суток. Размораживание осуществляли при 37°С и отмывали средой RPMI1640 с 10% человеческой инактивированной сывороткой IV группы.
Пробу 1.3 замораживали согласно описанной выше программе. После размораживания добавляли 8-МОП в дозе 20нг/мкл и в последующем облучали на аппарате Macogenic G2 (параметры облучения не менялись).
После разморозки анализировали группы 1.2. и 2.2. Часть образцов из каждой группы проанализировали до и после 48-часового культивирования, чтобы проверить изменение уровня апоптоза в динамике.
Поскольку разные популяции лейкоцитов уходят в апоптоз с различной скоростью на протяжении нескольких суток, 5 образцов были прокультивированы для определения динамики изменения уровня раннего и позднего апоптоза с течением времени. Культивирование проводили в среде RPMI1640 с добавлением 10% человеческой инактивированной сыворотки IV группы, 2 мМ глютамина, 100 ед/мл пенициллина и 50 мкг/мл стрептомицина. Клетки рассаживали по 106 на мл в 24-ячеечные планшеты. Мононуклеары культивировали в течение 2-х суток при температуре 37°С и 5% СО2. Счет клеток производился в камере Горяева после окраски генцианвиолетом на 3% уксусной кислоте или 0,5% трипановым синим.
Для оценки апоптоза клеток использовали набор FITC Annexin V Apoptosis Detection Kit I ("BD Biosciences", США), включающий аннексии V FITC и пропидия йодид (PI). Для отделения лейкоцитов использовали анти-CD45 АРС-Су7 моноклональные антитела (клон 2D1). Для окрашивания брали около 0,2×106 клеток, отмывали 1 мл среды RPMI1640 с 10% человеческой инактивированной сывороткой IV группы. Осадок ресуспензировали в 100 мкл аннексин-связывающего буфера и вносили антитела согласно инструкции к набору. Инкубировали 20 минут при комнатной температуре. После этого добавляли к образцу еще 400 мкл аннексин-связывающего буфера и проводили цитометрический анализ с помощью проточного цитофлюориметра BD FACSCanto II ("BD Biosciences", США).
Цитометрический анализ включал в себя выделение лимфоцитов, основываясь на высоком показателе экспрессии антигена CD45 и низких показателях прямого и бокового светорассеяния этих клеток, с последующим определением количества клеток на ранней и поздней стадиях апоптоза. Клетками на ранних стадиях апоптоза считались те, что связывались только с аннексином V, а на поздних стадиях - и с аннексином V, и с PI.
Пример определения количества клеток на стадиях раннего и позднего апоптоза представлен на рис. 2.
Статистический анализ данных проводили с помощью GraphPad Prism 6. Проверку нормальности распределения выполняли с использованием критерия Шапиро-Уилка. Сравнение полученных данных осуществляли с помощью парного критерия Уилкоксона с поправками на множественное сравнение. Значимыми признавались отличия при р<0,05.
Сравнение доли лимфоцитов в поздней стадии апоптоза между различными группами показало, что до культивирования в лейкоконцентратах подвергшихся замораживанию и размораживанию (группы 1.2., 1.3. и 2.2.) количество клеток было достоверно больше, чем в контрольной группе (образец 1.1.) и в группе образцов сразу после ЭКФ (2.1.). Доля клеток в ранней стадии апоптоза также был выше в образцах после размораживания как до, так и после ЭКФ (группы 1.2. и 2.2) по сравнению с образцами контрольной группы (1.1) и группы, после ЭКФ, но без криоконсервирования (2.1). При этом в образцах группы 1.3, доля клеток в ранней стадии апоптоза была достоверно (р<0,05) выше по сравнению с группой сразу после ЭКФ (2.1). (рис. 3А)
После культивирования количество клеток в ранней стадии апоптоза во всех группах достоверно не изменялось, количество же клеток на поздней стадии апоптоза достоверно повышалось во всех группах, кроме контрольной (1.1) (р<0,001), в ней оно не изменялось. Причем лучшие результаты наблюдали в группе 1.3, т.е в группе где ЭКФ проводили после размораживания мононуклеаров.
Учитывая данные нашей работы, а также ранее выполненные исследования по данным литературы можно сказать, что процент лимфоцитов в поздней стадии апоптоза через 2-е суток культивирования сопоставим при проведении ЭКФ, а также при проведении ЭКФ с последующим криоконсервированием лейкоконцентрата. Таким образом, учитывая отсутствие зависимости эффекта ЭКФ от количества облучаемых и переливаемых пациенту клеток, обоснованным является проведение сбора мононуклеаров, выполнение их экстракорпорального фотооблучения, и в дальнейшем разделение фотооблученных мононуклеаров на несколько доз как для криоконсервирования, так и для возврата незамороженного продукта пациенту.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ индукции антигенассоциированного иммунного ответа | 2021 |
|
RU2752967C1 |
| Малообъемный метод экстракорпоральной фотохимиотерапии | 2021 |
|
RU2791659C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОТТОРЖЕНИЯ ПОЧЕЧНОГО ТРАНСПЛАНТАТА | 2013 |
|
RU2508924C1 |
| Контейнер для деления на дозы, хранения и клинического использования компонентов крови, клеточных суспензий и жидкостей (варианты) | 2023 |
|
RU2801095C1 |
| Способ трансплантации аутологичных гемопоэтических стволовых клеток периферической крови | 2019 |
|
RU2734121C1 |
| СПОСОБ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ АПОПТОЗА, МОДИФИЦИРОВАННОГО ОРГАНИЧЕСКИМИ НИЗКОМОЛЕКУЛЯРНЫМИ СОЕДИНЕНИЯМИ | 2011 |
|
RU2471190C1 |
| Способ оценки влияния нитрозаминов на апоптоз у детей, проживающих в неблагоприятных условиях среды обитания | 2016 |
|
RU2626516C1 |
| Способ оценки у детей влияния стронция на апоптоз, ассоциированный с аллельными вариантами гена FAS | 2016 |
|
RU2621155C1 |
| КОМБИНИРОВАННЫЙ КРИОПРОТЕКТОР "ДИМЕТИЛСУЛЬФОКСИД/РЕОПОЛИГЛЮКИН" ДЛЯ КРИОКОНСЕРВАЦИИ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ИХ КРИОКОНСЕРВАЦИИ ДЛЯ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2563117C1 |
| Способ нерегламентированного замораживания клеток-предшественников периферической крови при температуре минус 80 C с раствором Гекмолит | 2019 |
|
RU2711152C1 |

Изобретение относится к области биотехнологии, а именно к получению криоконсервированных мононуклеарных клеток для проведения полного или части курса профилактики и лечения реакции трансплантат против хозяина или отторжения при трансплантации аллогенных органов или кожных Т-клеточных лимфом, а также ряда аутоиммунных заболеваний. Способ включает выделение концентрата мононуклеарных клеток с индуцированным апоптозом и проведение экстракорпорального фотофереза. Затем концентрат мононуклеарных клеток делят на дозы, подвергают программному замораживанию до -70°С с последующей криоконсервацией в жидком азоте для хранения в течение курса терапии. Изобретение позволяет обеспечить долгое хранение, а также возможность управления процессом апоптоза мононуклеаров. 3 ил.
Способ получения криоконсервированных мононуклеарных клеток для проведения полного или части курса профилактики и лечения реакции трансплантат против хозяина или отторжения при трансплантации аллогенных органов или кожных Т-клеточных лимфом, а также ряда аутоиммунных заболеваний, включающий выделение концентрата мононуклеарных клеток и проведение экстракорпорального фотофереза, отличающийся тем, что концентрат мононуклеарных клеток с индуцированным апоптозом после экстракорпорального фотофереза делят на дозы, затем подвергают программному замораживанию до -70°С с последующей криоконсервацией в жидком азоте для хранения в течение курса терапии.
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОТТОРЖЕНИЯ ПОЧЕЧНОГО ТРАНСПЛАНТАТА | 2013 |
|
RU2508924C1 |
| СПОСОБ КРИОКОНСЕРВИРОВАНИЯ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПУПОВИННОЙ КРОВИ | 2009 |
|
RU2416197C1 |
| ФЕДОРОВ В.А | |||
| "Клеточные технологии в современной медицине", Клеточная трансплантология и тканевая инженерия | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| СПОСОБ ВЗВЕШИВАНИЯ НА РЕГИСТРИРУЮЩИХ КОРОМЫСЛОВЫХ ВЕСАХ | 0 |
|
SU220554A1 |
| Биотехнология | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| В | |||
| Загоскиной, Л | |||
| В | |||
| Назаренко | |||
Авторы
Даты
2021-02-26—Публикация
2020-03-05—Подача