Область техники
[0001]
Настоящее изобретение относится к средствам для замедления старения кожи или средствам для регулирования экспрессии гена, связанного с замедлением старения, в частности, средству для замедления старения кожи и средству для регулирования экспрессии гена, связанного с замедлением старения кожи, содержащему целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, а также к косметическому продукту, содержащему средство для замедления старения или регулирования экспрессии гена, связанного с замедлением старения.
Предшествующий уровень техники
[0002]
Кожу можно условно разделить на эпидермис, контактирующий с внешней средой, дерму, находящуюся под эпидермисом и плотно прилегающую к нему, и подкожную жировую клетчатку, расположенную ниже дермы между дермой и мышцами. Дерма, расположенная между эпидермисом и подкожной жировой клетчаткой, состоит из папиллярного слоя и сетчатого слоя, а также волокнистой соединительной ткани. Дерма состоит примерно на 70% из коллагена, а также содержит компоненты внеклеточного матрикса, в частности, эластичное волокно (эластин) и гиалуроновую кислоту. Коллаген, эластин, гиалуроновая кислота и прочие составляющие дермы вырабатываются дермальными фибробластами, находящимися в сетчатом слое дермы.
[0003]
Эти волокна разрушаются и стареют под воздействием ультрафиолетовых лучей, сухости, старения и других факторов, приводящих к снижению их эластичности и производственной функции компонентов внеклеточного матрикса, что обычно считается причиной старения кожи, в частности, уменьшения упругости и эластичности кожи, появления морщин и обвисания. Таким образом, уменьшение содержания в дерме компонентов внеклеточного матрикса, в частности, коллагена и гиалуроновой кислоты, способствует процессу старения, в частности, уменьшению эластичности кожи и образованию морщин.
[0004]
Следовательно, считается, что старение кожи можно предотвратить или замедлить, если активировать функцию дермальных фибробластов и увеличить производство вышеописанных компонентов внеклеточного матрикса, раскрытых выше. В частности, образующиеся на лице морщины значительное влияют на внешний вид человека и являются признаком старения. Поэтому возрастает спрос на косметическую продукцию с профилактическим или оздоровительным эффектом (эффектом замедления старения и/или замедления образования морщин), способствующую сохранению молодости (непатентный документ 1).
[0005]
В нем сообщается, что дезоксирибонуклеиновая кислота (ДНК), используемая в качестве безопасного и эффективного функционального питания, улучшает состояние кожи (уровень влажности и жирности, плотность мембраны, количество морщин, пятен и веснушек и т.п.) (патентные документы 1, 2).
[0006]
Кроме того, сообщается, что экстракт семян, зародышей (зачатков) или ростков сои, богатых полиаминами, имеет стимулирующее воздействие на образование компонентов внеклеточного матрикса, в частности, эластина, коллагена и гиалуроновой кислоты, способствующих сохранению структуры кожи (патентный документ 3).
[0007]
Тем не менее, насколько известно авторам изобретения, отсутствуют сообщения о взаимодействии этих дезоксирибонуклеиновой кислоты (ДНК) с экстрактом сои.
Документы по известному уровню техники
Патентные документы
[0008]
[Патентный документ 1] Японская не рассмотренная патентная заявка, публикация №2007-291062
[Патентный документ 2] Японская не рассмотренная патентная заявка, публикация №2008-63315
[Патентный документ 3] Японская не рассмотренная патентная заявка, публикация №2012-46544
Непатентный документ
[0009]
[Непатентный документ 1] "Development Technology of Anti-aging, Whitening, Moisturizing Cosmetics" («Разработка технологии производства замедляющих старение, отбеливающих, увлажняющих косметических средств») (издание для потребителей), под редакцией Масато Судзуки, CMC Publishing Co., Ltd., 23 августа 2007 г., первый тираж.
Сущность изобретения
Проблема, которую должно решить изобретение
[0010]
Как раскрыто выше, предотвращения или замедления старения кожи можно ожидать в том случае, когда активируется функция дермальных фибробластов и увеличивается производство компонентов внеклеточного матрикса, в частности, коллагена и гиалуроновой кислоты. Соответственно, задачей настоящего изобретения является разработка средства для замедления старения кожи, средства для регулирования экспрессии гена, связанного с замедлением старения, и косметического продукта, содержащего средство для замедления старения или регулирования экспрессии гена, связанного с замедлением старения, которые будут отличаться улучшенной способностью к активации дермальных фибробластов, высокой безопасностью и возможностью эффективного использования в течение длительного времени.
Средства решения указанной проблемы
[0011]
Авторы изобретения провели масштабные исследования вышеуказанной задачи и обнаружили, что целевая низкомолекулярная ДНК и экстракт сои, которые безопасны даже при длительном приеме, обладают синергическим действием на активацию дермальных фибробластов, то есть синергическим эффектом (синергией) на пролиферацию клеток, стимуляцию производства коллагена, стимуляцию производства гиалуроновой кислоты, синергически стимулируя экспрессию генов, связанных с синтезом гиалуроновой кислоты, и также снижая экспрессию генов, связанных с разложением гиалуроновой кислоты. Настоящее изобретение реализовано на основании этих результатов. Сущность настоящего изобретения следующая.
[0012]
(1) Средство, замедляющее старение кожи и содержащее целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, причем целевая низкомолекулярная ДНК представляет собой продукт гидролиза ДНК, выделенной из животных или растений, а экстракт сои представляет собой экстракт, по меньшей мере, одного вида, выбранного из группы, состоящей из семян, зародышей и ростков сои.
(2) Средство для замедления старения кожи, по п. (1), в котором замедление старения является активацией функции дермальных фибробластов, причем активация функции представляет собой, по меньшей мере, одно действие, выбранное из группы, состоящей из стимулирования пролиферации, стимулирования производства коллагена типа I и стимулирования производства гиалуроновой кислоты в дермальных фибробластах.
(3) Средство для замедления старения кожи, по п.п. (1) или (2), в котором содержание целевой низкомолекулярной ДНК составляет от 0,001 до 1% по массе, и содержание экстракта сои составляет от 0,001 до 1% по массе.
(4) Средство, регулирующее экспрессию гена, связанного с замедлением старения кожи, содержащее целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, причем целевая низкомолекулярная ДНК представляет собой продукт гидролиза ДНК, выделенную из животных или растений, а экстракт сои представляет собой экстракт, по меньшей мере, одного вида, выбранного из группы состоящей из семян, зародышей и ростков сои.
(5) Средство, регулирующее экспрессию гена, связанного с замедлением старения кожи, по п. (4), в котором регуляция экспрессии гена, связанного с замедлением старения кожи, является стимулированием экспрессии по меньшей мере, одного гена, выбранного из группы, состоящей из гена человеческого коллагена типа I альфа 1, гена человеческой гиалуронсинтазы 1 и/или гена человеческой гиалуронсинтазы 2 или снижение экспрессии гена человеческого матрикса металлопептидазы 1 и/или гена человеческой гиалуронидазы 1.
(6) Средство, регулирующее экспрессию гена, связанного с замедлением старения кожи, по п.п. (4) или (5), в котором содержание целевой низкомолекулярной ДНК составляет от 0,001 до 1% по массе, и содержание экстракта сои составляет от 0,001 до 1% по массе. (7) Косметический продукт, содержащий средство, замедляющее старение кожи, по любому из п.п. (1)-(3) или средство, регулирующее экспрессию гена, связанного с замедлением старения кожи, по любому из п.п. (4)-(6).
Технический эффект изобретения
[0013]
Согласно настоящему изобретению, целевая низкомолекулярная ДНК и экстракт сои, являющиеся активными ингредиентами, оказывают синергическое воздействие на активацию дермальных фибробластов и, следовательно, могут предотвращать или замедлять старение кожи, в частности снижение упругости и эластичности кожи, образование морщин и обвисание.
Краткое описание чертежей
[0014]
[Фигура 1] На фигуре показаны результаты гель-проникающей хроматографии (ГПХ) гидролизованной натриевой ДНК, используемой в примерах. На фигуре по горизонтальной оси нанесено время удерживания (мин), а по вертикальной - поглощение в УФ диапазоне (длина волны 260 нм).
Способ осуществления изобретения
[0015]
Способ осуществления настоящего изобретения будет раскрыт ниже, однако следующее описание является только примером способов осуществления настоящего изобретения, и настоящее изобретение ни в коей мере не ограничивается последующим описанием. Следует отметить, что там, где в настоящем описании используется выражение «до», подразумевается, что в диапазон включены численные или физические значения до и после выражения. Кроме того, содержание (%) активных ингредиентов выражается в массовых процентах (масс. %), если не указано иное.
[0016]
Средство, замедляющее старение кожи, согласно данному изобретению, содержит целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, причем целевая низкомолекулярная ДНК представляет собой компонент, который может быть получен гидролизом ДНК, экстрагированной из животных или растений, а экстракт сои представляет собой, по меньшей мере, один экстракт, выбранный из группы состоящей из семян, зародышей и ростков сои.
[0017]
В данном случае под замедлением старения кожи понимают активацию функции дермальных фибробластов, а активация функции означает, по меньшей мере, одно действие, выбранное из группы, состоящей из действия по стимулированию пролиферации, стимулированию производства коллагена типа I и стимулированию производства гиалуроновой кислоты в дермальных фибробластах.
[0018]
Кроме того, средство, регулирующее экспрессию гена, связанного с замедлением старения кожи, согласно данному изобретению содержит целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, причем целевая низкомолекулярная ДНК представляет собой компонент, полученный гидролизом ДНК, выделенной из животных или растений, а экстракт сои представляет собой, по меньшей мере, один экстракт, выбранный из группы, состоящей из семян, зародышей и ростков сои.
[0019]
Согласно настоящему изобретению под генами, связанными с замедлением старения кожи, подразумевают гены, кодирующие любой из энзимов, участвующих в синтезе или распаде коллагена или гиалуроновой кислоты в дермальных фибробластах, описанные ниже.
• ген человеческого коллагена типа I альфа 1 (COL1A1)
• ген человеческого матрикса металлопептидазы 1 (ММР1)
• ген человеческой гиалуронсинтазы 1 (HAS1)
• ген человеческой гиалуронсинтазы 2 (HAS2)
• ген человеческой гиалуронидазы 1 (HYAL1)
[0020]
Кроме того, под регуляцией экспрессии генов понимают стимулирование экспрессии (повышение уровня экспрессии) генов синтазы и/или снижение экспрессии (снижение уровня экспрессии) генов ферментов распада, раскрытых выше. Такая регуляция экспрессии гена, связанного с замедлением старения кожи, подразумевает стимулирование экспрессии, по меньшей мере, одного гена, выбранного из группы, состоящей из гена человеческого коллагена типа I альфа 1 (COL1A1), гена человеческой гиалуронсинтазы 1 (HAS1), гена человеческой гиалуронсинтазы 2 (HAS2), или снижение экспрессии гена человеческого матрикса металлопептидазы 1 (ММР1) и/или гена человеческой гиалуронидазы 1 (HYAL1).
Кроме того, раскрытая выше активация функции дермальных фибробластов может представлять собой раскрытую выше стимуляцию экспрессии генов или раскрытое выше снижение экспрессии генов в дермальных фибробластах.
[0021]
Средство, замедляющее старение кожи, или средство, регулирующее экспрессию гена, связанного с замедлением старения кожи, согласно данному изобретению, содержит целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, а также может содержать другие дополнительные компоненты в случае необходимости.
[0022]
Целевая низкомолекулярная ДНК, согласно данному изобретению, может быть получена гидролизом ДНК, выделенной из животных или растений. Источником ДНК могут быть различные организмы, в частности, животные, растения и микроорганизмы, кроме того, в качестве ДНК может быть использована синтетическая ДНК. При этом наиболее предпочтительно использовать ДНК, полученную из молок (семенников) таких рыб, как лосось, форель и треска, что обусловлено высоким содержанием ДНК и возможностью эффективной утилизации отходов переработки морепродуктов.
[0023]
Извлечение и очистка ДНК из семенников рыб может осуществляться обычным способом (например, в соответствии с раскрытием в публикации японской не рассмотренной патентной заявки №2005-245394). В частности, семенники рыб измельчают, измельченные семенники рыб обрабатывают ферментом расщепления белка (протеазой) при условиях, в которых не повреждается ДНК, в обработанный ферментом раствор добавляют спирт (метиловый, этиловый, изопропиловый или иной спирт) для осаждения ДНК в виде соли ДНК (натриевой соли ДНК), и собирают полученный осадок. В альтернативном варианте в обработанный ферментом раствор добавляют кислоту (соляную, фосфорную, лимонную или иную кислоту) для осаждения ДНК, а осадок собирают, нейтрализуют гидроксидом натрия и высушивают для получения соли ДНК (натриевой соли ДНК).
[0024]
Полученную соль ДНК гидролизуют нуклеолитическим энзимом, в частности, нуклеазой, для получения целевой низкомолекулярной ДНК.
Для гидролиза можно использовать, например, нуклеазу, полученную из пенициллиума.
[0025]
Гидролиз может быть осуществлен, например, путем помещения вышеуказанной соли ДНК (натриевой соли ДНК), в качестве исходного материала, в воду, нагретую примерно до 65°С, после перемешивания ее дальнейшего нагрева до 70°С и добавления нуклеазы для запуска реакции. Температура во время гидролиза, предпочтительно, составляет 60-75°С, более предпочтительно, 70°С.
[0026]
Целевую низкомолекулярную ДНК в порошкообразной форме можно получить, например, путем сублимационной сушки полученного продукта гидролиза. Целевая низкомолекулярная ДНК по вышеуказанному способу может быть получена, по существу, в виде натриевой соли. Отметим, что при этом соль не обязательно должна быть натриевой; в частности, допускается использование калиевой или кальциевой соли. Кроме того, целевая низкомолекулярная ДНК может иметь свободную форму вместо соли.
[0027]
Предпочтительно, целевая низкомолекулярная ДНК содержит от 10 до 80% фракций с молекулярной массой 12000 или менее, более предпочтительно, содержит от 10 до 80% фракций с молекулярной массой 5000 или менее. Отметим, что молекулярно-массовое распределение можно измерить путем классификации образцов по молекулярной массе с использованием гель-проникающей хроматографии с последующим определением количества УФ-детектором.
[0028]
Экстракт сои согласно данному изобретению представляет собой, по меньшей мере, один экстракт выбранный из группы, состоящей из семян, зародышей и ростков сои. Условия экстракции, по существу, не ограничены, однако, предпочтителен способ получения растительного экстракта, содержащего полиамины, в частности, раскрытый в патентном документе 3, согласно которому семена, зародыши или ростки сои измельчают в подходящей среде и экстрагируют в кислой среде. Отметим, что при этом зародыши, используемые в качестве сырья, могут быть отделены от семян и собраны, а ростки сои могут быть собраны с семян сои, пророщенных в подходящих условиях.
[0029]
В данном случае в экстракте сои в изобилии содержатся полиамины. Под общим термином «полиамины» понимают линейные алифатические углеводороды, содержащие две или более первичные аминогруппы, присутствующие в различных живых организмах и известные как фактор роста, связанный с делением клеток и синтезом белков.
[0030]
Содержание полиамина в экстрактах сои, по существу, не ограничено, но составляет, предпочтительно, 0,05% или более, более предпочтительно, 0,1% или более, еще предпочтительнее, 0,15% или более, особенно предпочтительно, 0,2% или более. Отметим, что содержание полиаминов может быть измерено методом высокоэффективной жидкостной хроматографии.
[0031]
Полиамины (путресцин, кадаверин, спермидин, спермин и иные подобные вещества) в изобилии содержатся в экстрактах сои, в частности, в экстракте части ростков сои (далее иногда называемом «экстрактом ростков сои») (патентный документ 3). При использовании экстракта ростков сои, богатого полиаминами, можно ожидать развития эффекта, обеспечиваемого полиаминами.
[0032]
В качестве экстракта сои можно использовать доступный на рынке продукт. В частности, в качестве примеров можно назвать экстракты ростков сои (PHYTOPOLYAMINE (зарегистрированная торговая MapKa)-S (номер продукта: SPA-301) и PHYTOPOLYAMINE-SP (номер продукта: SPA-308)) производства TOYOBO CO., LTD. и материал экстракта сои (SOYPOLYA (зарегистрированная торговая марка)) производства Combi Corporation.
[0033]
Содержание активных ингредиентов в средстве, замедляющем старение, изменяется в зависимости от вида и формы препарата, цели и частоты применения, поэтому трудно установить фиксированное содержание, однако содержание и соотношение содержания каждого компонента, предпочтительно, выбирают таким образом, чтобы обеспечить синергический эффект на активирующее воздействие на дермальные фибробласты.
[0034]
Например, если средство, замедляющее старение (косметический продукт) наносят на кожу, содержание ингредиентов выглядит следующим образом. Содержание целевой низкомолекулярной ДНК составляет, предпочтительно, от 0,01 до 10 мг/мл (примерно от 0,001 до 1%), более предпочтительно, от 0,01 до 5 мг/мл (примерно от 0,001 до 0,5%), еще предпочтительнее, от 0,01 до 2 мг/мл (примерно от 0,001 до 0,2%). Кроме того, содержание экстракта сои составляет, предпочтительно, от 0,01 до 10 мг/мл (от 0,001 до 1%), более предпочтительно, от 0,1 до 5 мг/мл (от 0,01 до 0,5%), еще предпочтительнее, от 0,1 до 2 мг/мл (примерно от 0,01 до 0,2%).
[0035]
Кроме того, соотношение содержания целевой низкомолекулярной ДНК и экстракта сои, по существу, не ограничено, но, с точки зрения массового соотношения, предпочтительным является следующее: целевая низкомолекулярная ДНК : экстракт сои = от 1:50 до 50:1, более предпочтительно, от 1:20 до 10:1, еще предпочтительнее, от 1:10 до 5:1.
[0036]
Кроме того, концентрация полиамина в средстве, замедляющем старение, определяется видом препарата и формой продукта, целью и частотой применения и иными факторами и, по существу, не ограничено, составляя, предпочтительно, от 0,00001 до 100 ммоль, более предпочтительно, от 0,00005 до 75 ммоль, еще предпочтительнее, от 0,0001 до 50 ммоль.
[0037]
Если содержание и соотношение содержания целевой низкомолекулярной ДНК и экстракта сои находятся в пределах предпочтительных диапазонов, это является эффективным в отношении обеспечения синергического эффекта или существенного влияния на активирующее воздействие на дермальные фибробласты (пролиферацию клеток, стимулирование производства коллагена и гиалуроновой кислоты, стимулирование экспрессии гена гиалуронсинтазы, подавление экспрессии гена фермента распада гиалуроновой кислоты), что будет детально раскрыто в нижеследующих примерах.
[0038]
В данном случае под синергическим эффектом на активирующее воздействие на дермальные фибробласты понимают следующее: когда целевая низкомолекулярная ДНК и экстракт сои применяют одновременно к дермальным фибробластам, скорость пролиферации клеток, скорость производства коллагена, или скорость производства гиалуроновой кислоты превышает (существенно превышает) сумму величин, когда целевая низкомолекулярная ДНК и экстракт сои применяются независимо, или когда целевая низкомолекулярная ДНК и экстракт сои применяются одновременно к дермальным фибробластам как уровень экспрессии гена коллагена или гена гиалуронсинтазы, предпочтительно, уровень экспрессии гена гиалуронсинтазы, так и уровень подавления экспрессии гена фермента распада коллагена или гиалуроновой кислоты, предпочтительно, уровень подавления экспрессии гена фермента распада гиалуроновой кислоты, превышает (существенно превышает) сумму величин, когда каждый из компонентов используется независимо. Кроме того, под значительным эффектом понимают эффект со значительной разностью по сравнению с негативным контролем.
[0039]
Средство, замедляющее старение, или средство, регулирующее экспрессию гена, связанного с замедлением старения, согласно данному изобретению, может быть изготовлено в желаемой лекарственной форме путем смешивания известным способом целевой низкомолекулярной ДНК и экстракта сои, а также при необходимости других компонентов. В данном случае, примеры других компонентов включают в себя те же дополнительные компоненты, которые могут входить в состав косметического продукта согласно настоящему изобретению (см. ниже).
[0040]
Косметический продукт, согласно данному изобретению, содержит средство для замедления старения кожи или средство, регулирующее экспрессию гена, связанного с замедлением старения. В данном случае под «содержит» понимают, что косметический продукт может содержать физиологически приемлемый носитель и дополнительные компоненты, в частности, одновременно используемые другие вспомогательные компоненты в соответствии с предполагаемой формой продукта.
[0041]
Косметический продукт, согласно данному изобретению, может быть выполнен в виде, например, косметического продукта по уходу за кожей или косметического продукта для волос, используемого путем нанесения на кожу головы и волосы. Отметим, что косметический продукт, согласно данному изобретению, содержит препараты общего воздействия дополнительно к косметическим продуктам, предусмотренным Законом о фармацевтической продукции.
[0042]
Если средство, замедляющее старение или регулирующее экспрессию гена, связанного с замедлением старения, согласно данному изобретению, предлагается в качестве косметического средства, возможная лекарственная форма, по существу, не ограничена при условии сохранения возможности нанесения на кожу. В частности, средство, замедляющее старение или регулирующее экспрессию гена, связанного с замедлением старения, может быть выполнено в виде лосьона, косметического молочка, крема, геля, желе, эссенции, бальзама для губ, упаковки, маски и т.п., или в лекарственной форме, в виде жидкости, эмульсии, геля, крема, мази, пены, спрея, аэрозоля и т.п.
[0043]
Другие дополнительные компоненты, которые эти косметические продукты могут содержать, по существу, не ограничены; и могут быть использованы добавки, которые могут включаться в состав обычных косметических продуктов. В качестве примеров таких добавок можно назвать: воду, жир и масло, воск, углеводород, жирную кислоту, спирт, эфир, ПАВ, ароматизатор, вяжущее средство, бактерицидное и/или антибактериальное средство, отбеливающее средство, поглотитель УФ-излучения, увлажнитель, активатор клеток, противовоспалительное и/или противоаллергическое средство, антиоксидант, витамин и натуральный экстракт. Содержание этих других дополнительных компонентов также не ограничено и может быть выбрано в соответствии с предполагаемой лекарственной формой или иными подобными факторами.
[0044]
Кроме того, средство, замедляющее старение или регулирующее экспрессию гена, связанного с замедлением старения, согласно данному изобретению, может быть выполнено в качестве продукта питания или напитка, принимаемого внутрь. К пищевым продуктам и напиткам относятся продукты лечебного питания (например, функциональные пищевые продукты, пищевые добавки, биологически активные добавки, продукты, обогащенные питательными веществами, продукты со сбалансированным составом питательных веществ, добавки), полезные для здоровья продукты (например, продукты для определенных категорий пациентов, продукты с определенными питательными элементами и продукты с предписанным действием), диетические продукты (например, продукты для больных людей, сухое молоко с добавками для младенцев и сухое молоко для беременных или кормящих матерей), а также иные продукты, относящиеся к категории продуктов питания и напитков, способствующих снижению риска, профилактике, излечению заболеваний или улучшению состояния (симптомов), вызванных сниженной функцией дермальных фибробластов.
[0045]
Другие дополнительные компоненты, которые могут входить в состав этих продуктов питания и напитков, по существу, не ограничены; допускается включение добавок, входящих в состав обычных продуктов питания и напитков.
Примеры
[0046]
Далее настоящее изобретение будет раскрыто более подробно со ссылкой на примеры, однако объем настоящего изобретения ни в коем случае не ограничивается приведенными примерами.
[0047]
[Пример 1] Действие на пролиферацию клеток, действие на стимулирование производства коллагена и гиалуроновой кислоты 1
Назначение и обзор теста
Считается, что коллаген и гиалуроновая кислота в коже имеют большое значение для повышения упругости кожи, мягкости и жирности кожи. Соответственно, синергический эффект тестовых веществ (целевая низкомолекулярная ДНК и экстракт сои) оценивался по пролиферирующему действию на дермальные фибробласты, а также стимулирующему действию на производство коллагена и гиалуроновой кислоты.
[0048]
2 Материалы и метод тестирования
2-1 Клетка
Использовалась клеточная линия дермальных фибробластов NB1RGB, полученная от новорожденных человеческих младенцев (RIKEN BRC, Япония), культивированная в CO2 инкубаторе (концентрация CO2 5%, 37°С).
[0049]
2-2 Среда
Использована минимальная эссенциальная среда Игла (ЕМЕМ, Wako, Япония), содержащая 0,1% (об/об) эмбриональной бычьей сыворотки (FBS, Hyclone, Великобритания) и 1,0% (об/об) противогрибкового препарата (Invitrogen, США).
[0050]
2-3 Тестовые вещества
(1) Целевая низкомолекулярная ДНК
Использовалась гидролизованная натриевая ДНК (порошок), изготовленная компанией NISSEI BIO CO., LTD. Этот продукт изготовлен раскрытым выше способом путем извлечения натриевой соли ДНК из семенников (молок) лососевых рыб.
Отметим, что результаты гель-проникающей хроматографии (ГПХ) гидролизованной натриевой ДНК (производства NISSEI BIO CO., LTD.) представлены на фигуре 1, а соотношение между временем удерживания и молекулярной массой представлено в таблице 1. Эталон молекулярной массы 12 000 основан на времени удерживания цитохрома-с (MW 12 400).
[0051]
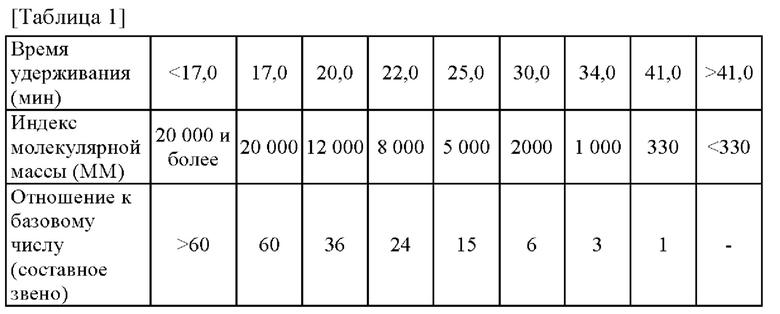
[0052]
По результатам проведенного анализа получены следующие фракции по молекулярной массе гидролизованной натриевой ДНК (производства NISSEI BIO CO., LTD.).
Фракции с молекулярной массой от 12 000 до 5 000 (время элюирования от 20 мин до менее 25 мин): 32,0%
Фракции с молекулярной массой 5 000 или менее (время элюирования 25 мин и более): 32,4%
Таким образом, фракции с молекулярной массой 12 000 или менее гидролизованной натриевой ДНК (производства NISSEI BIO CO., LTD.) составляют 64,4%.
[0053]
Тестовое вещество (гидролизованная натриевая ДНК), скорректированное до 3,0 мг/мл с использованием 30 мкмоль L-аскорбиновой кислоты (CAS №50-81-7, Wako, Япония) и 0,1% минимальной эссенциальной среды Игла с содержанием эмбриональной бычьей сыворотки, были последовательно разбавлены в общем соотношении 10 и приготовлены в двух концентрациях (0,03 мг/мл, 0,3 мг/мл) при использовании (конечные концентрации - 0,01 мг/мл, 0,1 мг/мл).
[0054]
(2) Экстракт сои
Использовался PHYTOPOLYAMINE (зарегистрированная торговая MapKa)-SP (номер продукта: SPA-308, соотношение компонентов: примерно 70% экстракта ростков сои, примерно 30% лимоннокислого натрия) производства TOYOBO CO., LTD.
Тестовое вещество (SPA-308) в концентрациях 0,39 мг/мл, 0,81 мг/мл и 1,53 мг/мл приготовлено с использованием 30 мкмоль L-аскорбиновой кислоты (CAS №50-81-7, Wako, Япония) и 0,1% минимальной эссенциальной среды Игла с содержанием эмбриональной бычьей сыворотки (конечные концентрации - 0,13 мг/мл, 0,27 мг/мл и 0,51 мг/мл).
[0055]
(3) Смешанный раствор (одновременное использование)
Использовались два вида тестовых веществ, раскрытые выше.
Гидролизованную натриевую ДНК, скорректированную до 3,0 мг/мл с использованием минимальной эссенциальной среды Игла с содержанием SPA-308, скорректированной до 0,81 мг/мл с помощью 30 мкмоль L-аскорбиновой кислоты (CAS №50-81-7, Wako, Япония) и 0,1% минимальной эссенциальной среды Игла с содержанием эмбриональной бычьей сыворотки, были последовательно разбавлены в общем соотношении 10 и приготовлены в двух концентрациях (0,03 мг/мл, 0,3 мг/мл) при использовании (конечная концентрация SPA-308 составила 0,27 мг/мл, конечные концентрации гидролизованной натриевой ДНК 0,01 мг/мл, 0,1 мг/мл).
[0056]
2-4 Состав теста
Для расчета пролиферации клеток, производства коллагена и гиалуроновой кислоты использовалось среднее значение из трех лунок на каждую обработанную группу. Кроме того, тест проводился по каждой из групп тестового вещества и оперативного контроля на каждом планшете. Процессы, относящиеся к тесту, включая приготовление тестового вещества, проводились при комнатной температуре, если не было указано иное.
[0057]
2-5 Проведение теста
(1) Клеточная культура
2,0 × 104 клеток/200 мкл клеток NB1 RGB посадили в каждую лунку 96-луночного планшета (партия 3595, Corning, США) и культивировали в CO2 инкубаторе в течение 24 часов. Кроме того, 200 мкл натрий-фосфатного буфера (PBS(-), партия 198601, Nissui, Япония) было добавлено в лунки, не используемые для проведения теста, в целях предотвращения высыхания во время культивирования.
Через 24 часа 100 мкл тестового вещества и негативный контроль были добавлены на 96-луночный планшет и культивированы в течение 48 часов в CO2 инкубаторе. Для негативного контроля использовалось 30 мкмоль L-аскорбиновой кислоты и 0,1% минимальной эссенциальной среды Игла с содержанием эмбриональной бычьей сыворотки.
[0058]
Через 48 часов надосадочную жидкость культуры слили на новый 96-луночный планшет и высушили методом сублимационной сушки (-20°С). Уровень коллагена и гиалуроновой кислоты в надосадочной жидкости культуры измерили методом ИФА (иммуноферментного анализа), раскрытым в 2-5 (3) и (4), с целью оценки стимулирующего действия тестового вещества на производство коллагена и гиалуроновой кислоты. Кроме того, количество клеток на 96-луночном планшете, с которого была слита надосадочная жидкость, подсчитали методом, раскрытым в 2-5 (2), с целью оценки воздействия тестового вещества на пролиферацию клеток.
[0059]
(2) Воздействие на пролиферацию клеток
Влияние тестового вещества на пролиферацию дермальных фибробластов оценивали следующим образом.
Каждую лунку 96-луночного планшета, из которой была удалена среда, дважды осторожно промыли 300 мкл PBS(-), нагретой до 37°С. После этого в лунки добавили 100 мкл раствора 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромида (МТТ, CAS №298-93-1, Sigma-Aldrich, США) по 0,5 мг/мл на лунку и культивировали в течение 2 часов в С02 инкубаторе.
[0060]
По завершении культивирования раствор МТТ удалили, а планшет промыли 200 мкл PBS(-). На планшет добавили 200 мкл 2-пропанола (CAS №67-63-0, Kan to Chemical, Япония), содержащего 0,04 N соляной кислоты (CAS №7647-01-0, Kanto Chemical, Япония), и выдержали в течение 1 часа в темном месте для перевода образующегося нерастворимого формазана в растворимую форму.
[0061]
96-луночный планшет встряхивали в течение 10 секунд с частотой 270 об/мин для однородного рассеивания пигмента в лунке, после чего измерили абсорбцию при 570 нм (OD570) с помощью микропланшетного считывателя (SPARK(TM) 10М, TECAN, Швейцария).
OD570 в группе тестового вещества с OD570 негативного контроля составлял 100%, рассчитали как скорость пролиферации клеток (%). Скорость пролиферации клеток (%) негативного контроля и группы с введением тестового вещества подвергли проверке на достоверность непарным двусторонним тестом (t-критерием Стьюдента). Все тесты имели уровни достоверности менее 5% с двух сторон (р<0,05, р<0,01, р<0,001).
[0062]
(3) Стимулирующее воздействие на производство коллагена
Влияние тестового вещества на производство коллагена типа I, который, как считается, придает коже упругость и эластичность, определили методом конкурентного ИФА следующим образом.
[0063]
Для измерения уровня коллагена в надосадочной жидкости культуры использовали набор для ИФА человеческого коллагена типа I (партия ЕС1-Е105, ACEL, Япония).
[0064]
Стандартный раствор коллагена последовательно разбавляли буфером для разведения в общем соотношении 2 для получения семи концентраций. Кроме того, надосадочную жидкость культуры дважды разбавили буфером для разведения.
[0065]
14 мкл меченого биотином раствора коллагеновых антител добавили к 126 мкл стандартного раствора коллагена и дважды разведенной надосадочной жидкости культуры и смешали при помощи выпуска.
Микротитрационный планшет с иммобилизованным коллагеном трижды промывали 200 мкл промывочного буфера, добавили 50 мкл стандартного раствора с содержанием меченых биотином коллагеновых антител и надосадочную жидкость культуры, после чего смесь встряхивали в течение 1 часа при частоте вращения 270 об/мин.
[0066]
Через 1 час планшет трижды промыли 200 мкл промывочного буфера, добавили 50 мкл раствора авидина, меченого пероксидазой, после чего полученную смесь встряхивали в течение 1 часа при частоте вращения около 270 об/мин. Через 1 час планшет трижды промыли 200 мкл промывочного буфера, добавили 50 мкл субстратного раствора 3,3',5,5'-тетраметилбензидина на каждую лунку и выдержали в течение 15 минут.
[0067]
Затем добавили 50 мкл останавливающего раствора на каждую лунку, встряхивали микропланшет в течение 1 минуты при частоте вращения 270 об/мин для гомогенизации пигмента в лунке, после чего измерили абсорбцию при 450 нм (OD450) с помощью микропланшетного ридера.
[0068]
Калибровочную кривую регрессировали с OD450 стандартного раствора коллагена с использованием логистической модели по 4 параметрам. Значение, полученное из уравнения регрессии, умножили на скорость разбавления для расчета уровня производства коллагена (мкг/мл) негативного контроля и тестового вещества.
Скорость производства коллагена (%) тестового вещества рассчитали для 100% уровня производства коллагена негативного контроля. Скорость производства коллагена (%) негативного контроля и группы добавления тестового вещества подвергли тесту на достоверность непарным двусторонним тестом (t-критерием Стьюдента). Все тесты имели уровни достоверности менее 5% с двух сторон (р<0,05, р<0,01, р<0,001).
[0069]
(4) Стимулирующее воздействие на производство гиалуроновой кислоты
Влияние тестового вещества на уровень производства гиалуроновой кислоты, которая, как считается, удерживает влагу в коллагене и эластине, определили методом сэндвич-ИФА следующим образом.
[0070]
Для измерения уровня гиалуроновой кислоты в надосадочной жидкости культуры использовали набор Hyaluronan Quantikine ELISA (партия DHYALO, R&D Systems, США).
[0071]
Стандартный раствор гиалуроновой кислоты последовательно разбавляли буфером для разведения в общем соотношении 2 для получения семи концентраций. Кроме того, надосадочную жидкость культуры восемь раз разбавили буфером для разведения.
[0072]
На микротитрационный планшет с иммобилизованным агреканом добавили 50 мкл меченого биотином раствора антител гиалуроновой кислоты на каждую лунку. После этого добавили 50 мкл разбавленной надосадочной жидкости культуры и встряхивали в течение 1 часа с частотой вращения примерно 270 об/мин.
[0073]
Через 1 час планшет пять раз промыли 400 мкл промывочного буфера, добавили 100 мкл раствора авидина, меченого пероксидазой, после чего полученную смесь встряхивали в течение 1 часа при частоте вращения около 270 об/мин. Через 1 час планшет пять раз промыли 400 мкл промывочного буфера, добавили 100 мкл субстратного раствора 3,3',5,5'-тетраметилбензидина на каждую лунку и выдержали в течение 30 минут в темном месте.
[0074]
Затем добавили 100 мкл останавливающего раствора на каждую лунку, встряхивали микротитрационный планшет в течение 1 минуты при частоте вращения 270 об/мин для гомогенизации пигмента в лунке, после чего измерили абсорбцию при 450 нм (OD450) с помощью микропланшетного ридера.
[0075]
Калибровочную кривую регрессировали с OD450 стандартного раствора гиалуроновой кислоты с использованием логистической модели по 4 параметрам. Значение, полученное из уравнения регрессии, умножили на скорость разбавления для расчета уровня производства гиалуроновой кислоты (нг/мл) негативного контроля и тестового вещества.
Скорость производства гиалуроновой кислоты (%) тестового вещества рассчитали для 100% уровня производства гиалуроновой кислоты негативного контроля. Скорости производства гиалуроновой кислоты (%) негативного контроля и группы добавления тестового вещества подвергли проверке на достоверность непарным двусторонним тестом (t-критерием Стьюдента). Все тесты имели уровни достоверности менее 5% с двух сторон (р<0,05, р<0,01, р<0,001).
[0076]
3 Результаты тестов
3-1 Целевая низкомолекулярная ДНК
(1) Воздействие на пролиферацию клеток
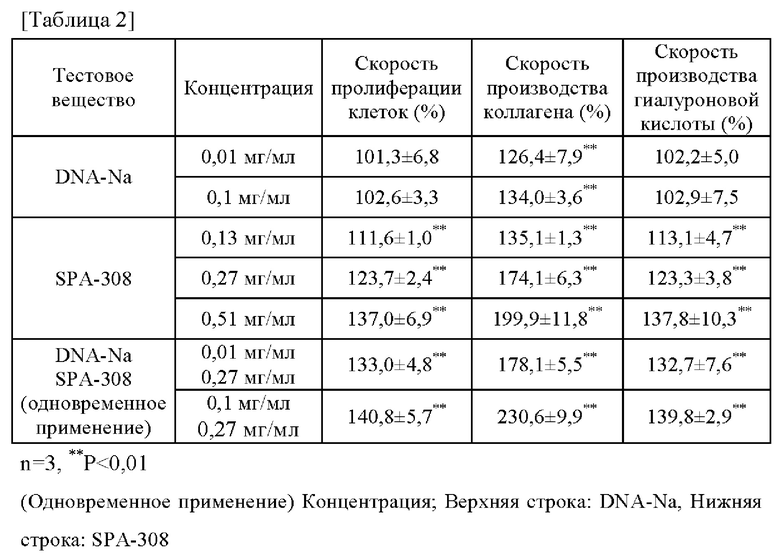
Скорость пролиферации клеток±стандартное отклонение 0,01 мг/мл и 0,1 мг/мл тестового вещества (гидролизованной натриевой ДНК) составляла, при 100% уровне пролиферации клеток (OD570) негативного контроля, 101,3±6,8% и 102,6±3,3%, соответственно.
[0077]
(2) Стимулирующее воздействие на производство коллагена типа I
Скорость производства коллагена±стандартное отклонение 0,01 мг/мл и 0,1 мг/мл тестового вещества (гидролизованной натриевой ДНК) составляли, при 100% уровне производства коллагена негативного контроля, 126,4±7,9% (р<0,01) и 134,0±3,6% (р<0,01), соответственно.
[0078]
(3) Стимулирующее воздействие на производство гиалуроновой кислоты
Скорость производства гиалуроновой кислоты±стандартное отклонение 0,01 мг/мл и 0,1 мг/мл тестового вещества (гидролизованной натриевой ДНК) составляли, при 100% уровне производства гиалуроновой кислоты негативного контроля, 102,2±5,0% и 102,9±7,5%, соответственно.
[0079]
3-2 Экстракт сои
(1) Воздействие на пролиферацию клеток
Скорость пролиферации клеток±стандартное отклонение от 0,13 мг/мл, 0,27 мг/мл и 0,51 мг/мл тестового вещества (SPA-308) составляла, при 100%) уровне пролиферации клеток (OD570) негативного контроля, 111,6±1,0% (р<0,01), 123,7±2,4% (р<0,01), и 137,0±6,9% (р<0,01), соответственно.
[0080]
(2) Стимулирующее воздействие на производство коллагена типа I
Скорость стимулирования производства коллагена±стандартное отклонение от 0,13 мг/мл, 0,27 мг/мл и 0,51 мг/мл тестового вещества (SPA-308) составила при 100% уровне стимулирования производства коллагена негативного контроля, 135,1±1,3% (р<0,01), 174,1±6,3% (р<0,01), и 199,9±11,8% (р<0,01), соответственно.
[0081]
(3) Стимулирующее воздействие на производство гиалуроновой кислоты
Скорость производства гиалуроновой кислоты±стандартное отклонение от 0,13 мг/мл, 0,27 мг/мл и 0,51 мг/мл тестового вещества (SPA-308) составила при 100% уровне производства гиалуроновой кислоты негативного контроля, 113,1±4,7% (р<0,01), 123,3±3,8% (р<0,01) и 137,8±10,3% (р<0,01), соответственно.
[0082]
3-3 Одновременное использование целевой низкомолекулярной ДНК и экстракта сои
(1) Воздействие на пролиферацию клеток
Скорость пролиферации клеток±стандартное отклонение от 0,01 мг/мл + 0,27 мг/мл и 0,1 мг/мл + 0,27 мг/мл тестового вещества (гидролизованная натриевая ДНК+SPA-308) составила, при 100% уровне пролиферации клеток (OD570) негативного контроля, 133,0±4,8% (р<0,01) и 140,8±5,7% (р<0,01), соответственно.
[0083]
(2) Стимулирующее воздействие на производство коллагена типа I
Скорость производства коллагена±стандартное отклонение от 0,01 мг/мл + 0,27 мг/мл и 0,1 мг/мл + 0,27 мг/мл тестового вещества (гидролизованной натриевой ДНК+SPA-308) составили, при 100% уровне производства коллагена негативного контроля, 178,1±5,5% (р<0,01) и 230.6±9,9% (р<0,01), соответственно.
[0084]
(3) Стимулирующее воздействие на производство гиалуроновой кислоты
Скорость производства гиалуроновой кислоты±стандартное отклонение от 0,01 мг/мл + 0,27 мг/мл и 0,1 мг/мл + 0,27 мг/мл тестового вещества (гидролизованной натриевой ДНК+SPA-308) составили, при 100%) уровне производства гиалуроновой кислоты негативного контроля, 132,7±7,6% (р<0,01) и 139,8±2,9% (р<0,01), соответственно.
[0085]
Вышеупомянутые результаты собраны в таблицу 2. В таблице 2 под «ДНК-Na» понимают «гидролизованную натриевую ДНК». Из таблицы 2 следует, что скорость пролиферации клеток, скорость производства коллагена и скорость производства гиалуроновой кислоты при одновременном использовании целевой низкомолекулярной ДНК (гидролизованной натриевой ДНК) и экстракта сои (SPA-308) значительно превышает сумму величин (скоростей) по сравнению с использованием каждого компонента по отдельности. Эти результаты могут подтвердить синергический эффект целевой низкомолекулярной ДНК и экстракта сои на активирующее воздействие на функцию дермальных фибробластов (пролиферация клеток, стимулирование производства коллагена и гиалуроновой кислоты).
[0086]
[0087]
[Пример 2] Регуляция экспрессии синтазы или фермента распада гиалуроновой кислоты
1 Назначение и обзор теста
Коллаген и гиалуроновая кислота в коже имеют большое значение для повышения упругости, мягкости и жирности кожи; известно, что снижение уровня гиалуроновой кислоты в дерме способствует уменьшению эластичности кожи и образованию морщин. Соответственно, в данном примере методом ПЦР в реальном времени определяли влияние тестовых веществ (целевой низкомолекулярной ДНК и экстракта сои) на экспрессию генов, связанных с замедлением старения, в частности, синтеза и распада гиалуроновой кислоты в дермальных фибробластах.
[0088]
2 Материалы и метод тестирования
2-1 Клетка
Использовались те же клетки, как и указанные в 2-1 примера 1, культивированные в тех же условиях.
[0089]
2-2 Среда
Использовалась минимальная эссенциальная среда Игла того же состава, что и в 2-2 примера 1, за исключением того, что содержание FBS (эмбриональной бычьей сыворотки) было изменено на 10,0% (об/об).
[0090]
2-3 Тестовые вещества
(1) Раствор целевой низкомолекулярной ДНК
Использовалась та же целевая низкомолекулярная ДНК (гидролизованная натриевая ДНК), что и в 2-3 (1) примера 1.
Тестовое вещество (гидролизованная натриевая ДНК), скорректированное до 1 мг/мл с использованием 10% минимальной эссенциальной среды Игла с содержанием эмбриональной бычьей сыворотки, при использовании последовательно разбавляли в общем соотношении 10 и в общей сложности приготовили в двух концентрациях (конечные концентрации - 0,01 мг/мл, 0,1 мг/мл).
[0091]
(2) Раствор экстракта сои
Использовался тот же экстракт сои (SPA-308), что и в 2-3 (2) примера 1.
Тестовое вещество (SPA-308), скорректированное до 2,7 мг/мл с использованием 10% минимальной эссенциальной среды Игла с содержанием эмбриональной бычьей сыворотки, при использовании последовательно разбавляли в общем соотношении 10 и в общей сложности приготовили в двух концентрациях (конечные концентрации -0,027 мг/мл, 0,27 мг/мл).
[0092]
(3) Смешанный раствор (одновременное использование)
Использовались два тестовых вещества, раскрытые выше.
Гидролизованную натриевую ДНК, скорректированную до 1 мг/мл с использованием минимальной эссенциальной среды Игла с содержанием SPA-308, скорректированной до 0,27 мг/мл с помощью 10% минимальной эссенциальной среды Игла с содержанием эмбриональной бычьей сыворотки, при использовании последовательно разбавляли в общем соотношении 10 и в общей сложности приготовили в двух концентрациях (конечная концентрация SPA-308 составила 0,27 мг/мл, конечные концентрации гидролизованной натриевой ДНК - 0,01 мг/мл, 0,1 мг/мл).
[0093]
2-4 Анализ экспрессии генов
Анализ экспрессии генов, кодирующих следующие ферменты, выполнен с помощью TaqMan Assay (Applied Biosystems, США).
• человеческая гиалуронсинтаза 1 (HAS1), идентификатор анализа Hs00758053_ml
• человеческая гиалуронсинтаза 2 (HAS2), идентификатор анализа Hs00193435_ml
• человеческая гиалуронидаза 1 (HYAL1), идентификатор анализа Hs00201046_ml
[0094]
В качестве внутреннего стандартного гена использован ген глицеральдегид-3-фосфатдегидрогеназы человека (GAPDH, идентификатор анализа Hs02786624_g1).
[0095]
2-5 Состав теста
Для анализа уровней экспрессии генов использовалось среднее значение 3-х наборов 35-миллиметровой пластины (кат. №150318, Thermo Scientific, США) на обработанную группу. Процессы, относящиеся к тесту, включая приготовление тестового вещества приготавливались при комнатной температуре, если не было указано иное.
[0096]
2-6 Метод тестирования
(1) Клеточная культура и добавление тестового вещества
5,0 × 105 клеток/2 мл клеток NB1RGB поместили в 35-мм пластину и культивировали в течение 24 часов в С02 инкубаторе. Через 24 часа среду удалили с 35-мм пластины, добавили тестовое вещество и среду с содержанием негативного контроля, и культивировали в течение 24 часов в CO2 инкубаторе.
[0097]
(2) Экстрагирование, очистка и количественное определение РНК
Экстрагирование и очистка РНК выполнены с использованием набора PureLink(TM) RNA Mini (кат. №12183018А, Invitrogen, США) следующим образом.
[0098]
После культивирования в течение 24 часов 35-мм пластину, с которой была удалена среда, дважды промыли 2 мкл PBS(-), нагретой до 37°С. Для этого при растворении клеток добавили 600 мкл лизирующего буфера, содержащего дитиотрейтол (CAS №27565-41-9, Invitrogen, США), после собрали лизат. Далее клетки собранного лизата измельчили в гомогенизаторе (кат. №12183-026, Invitrogen, США).
[0099]
600 мкл 70% раствора этанола (CAS №64-17-5, Japan Alcohol, Япония) добавили к жидкости с измельченными клетками, после чего жидкость переместили в колонку на основе кремнеземной мембраны и центрифугировали в течение 15 секунд при комнатной температуре и 12 000 × g, после чего утилизировали фильтрат.
[0100]
700 мкл промывочного буфера, содержащего изотиоцианат гуанидина, и 500 мкл промывочного буфера II, содержащего этанол, добавили к кремнеземной мембране для промывки, после чего центрифугировали в течение 15 секунд при 12 000 × g при комнатной температуре и высушили. К мембране добавили 30 мкл не содержащей рибонуклеазы воды, выдержали в течение 1 минуты при комнатной температуре, после чего мембрану центрифугировали в течение 15 секунд при комнатной температуре и 12 000 × g. Эту процедуру повторили дважды для элюирования РНК из мембраны.
[0101]
Часть элюированной РНК собрали отдельно на 96-луночный УФ-проницаемый планшет (кат. №8404, Thermo Scientific, США) и разбавили в 25 раз буфером Tris-EDTA (ТЕ (рН 8,0), кат. №310-90023, NIPPON GENE, Япония) для измерения поглощения при 260 нм (OD260) с помощью микропланшетного ридера (SPARK(TM) ЮМ TECAN, Швейцария).
[0102]
Концентрации РНК негативного контроля и тестового вещества рассчитали с использованием OD260 по следующей формуле и разбавили буфером ТЕ для корректировки концентраций РНК до 10 мкг/мл.
Концентрация РНК (мкг/мл)=А × K × 0,3 (оптическая длина: см) × 25 (степень разведения)
A: OD260 отрицательного контроля или тестового вещества
K: K=40, коэффициент поглощения РНК
[0103]
(3) Анализ экспрессии генов методом ПЦР в реальном времени
Обратная транскрипция РНК выполнена с использованием SuperScript(TM) IV VILO(TM) Master Mix с ezDNase (кат. №11766050, Invitrogen, США) следующим образом. [0104]
1 мкл буфера 10 × ezDNase, 1 мкл энзима ezDNase, 6 мкл воды без содержания нуклеаз и 2 мкл РНК 10 мкг/мл на каждую лунку добавили в полоску с 8 пробирками (АВ1182, Thermo Scientific, США) и инкубировали в течение 2 минут при 37°С. Через 2 минуты 4 мкл SuperScript(TM) IV VILO(TM) Master Mix и 6 мкл воды без содержания нуклеаз на каждую лунку добавили в полоску с 8 пробирками и нагревали в течение 10 минут при 25°С, 10 минут при 50°С и 5 минут при 85°С для синтеза кДНК с помощью ПЦР в реальном времени (QuantStudio(TM)3, Applied Biosystems, США).
[0105]
10 мкл смеси TaqMan(TM) Fast Advanced Master Mix (кат. №4444557, Applied Biosystems, США), 1 мкл TaqMan Gene Expressior, 7 мкл дистиллированной воды UltraPure(TM) (Invitrogen, кат. №. 10977-015, США) и 2 мкл кДНК на каждую лунку добавили к планшету ПЦР (кат. №N8010560, Thermo Scientific, США), после чего планшет герметично закрыли пластинчатым уплотнением (кат. №4360954, Thermo Scientific, США).
[0106]
Раствор центрифугировали в планшетной центрифуге, удалили пену, после чего осуществили ПЦР в реальном времени с помощью системы ПЦР в реальном времени для вычисления значения порогового цикла (Ct), равного количеству циклов, при котором флуоресцентный сигнал каждого гена негативного контроля и тестового вещества пересекает любой порог. Значение Ct скорректировали до значения ΔCt с использованием внутреннего стандартного гена. Значение ΔCt скорректировали до значения ΔΔCt с использованием среднего значения ΔCt негативных контролей. Если предположить, что разница в обнаружении за цикл методом ΔΔCt в два раза превышает объем разности, то уровень экспрессии гена тестового вещества анализировали присвоением 2-ΔΔCt, когда уровень экспрессии гена негативного контроля был равен 1. Уровни экспрессии генов негативного контроля и группы добавленного тестового вещества проверили на достоверность парным двусторонним тестом (парным т-критерием). Все тесты имели уровни достоверности менее 5% с двух сторон (р<0,05, р<0,01, р<0,001).
[0107]
3 Результаты тестов
3-1 Целевая низкомолекулярная ДНК
(1) Экспрессия гена человеческой гиалуронсинтазы 1 (HAS1)
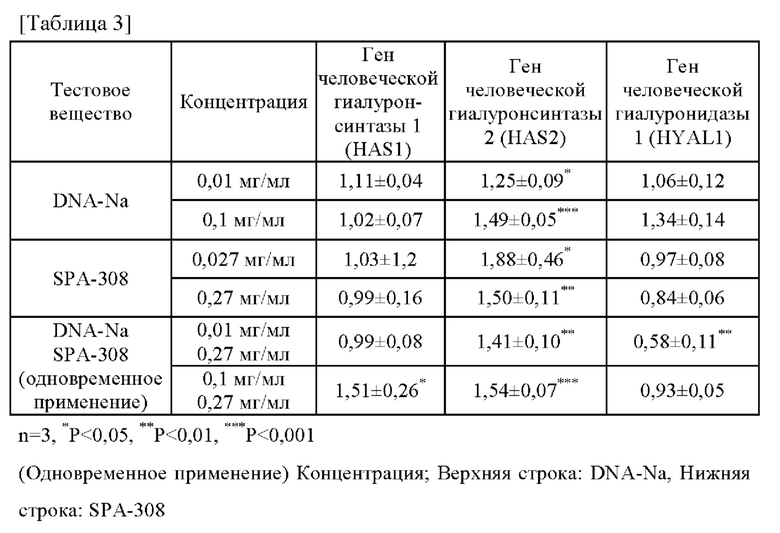
Уровни экспрессии HAS1±стандартное отклонение от 0,01 мг/мл и 0,1 мг/мл тестового вещества (гидролизованной натриевой ДНК) составляли при уровне экспрессии HAS1 негативного контроля, равном 1, 1,11±0,04 и 1,02±0,07, соответственно.
[0108]
(2) Экспрессия гена человеческой гиалуронсинтазы 2 (HAS2)
Уровни экспрессии HAS2±стандартное отклонение от 0,01 мг/мл и 0,1 мг/мл тестового вещества (гидролизованной натриевой ДНК) составляли при уровне экспрессии HAS2 негативного контроля, равном 1, 1,25±0,09 (р<0,05) и 1,49±0,05 (р<0,001), соответственно.
[0109]
(3) Экспрессия гена человеческой гиалуронидазы 1 (HYAL1)
Уровни экспрессии HYAL1±стандартное отклонение от 0,01 мг/мл и 0,1 мг/мл тестового вещества (гидролизованной натриевой ДНК) составляли при уровне экспрессии HYAL1 негативного контроля, равном 1, 1,06±0,12 и 1,34±0,14, соответственно.
[0110]
3-2 Экстракт сои
(1) Экспрессия гена человеческой гиалуронсинтазы 1 (HAS1)
Уровни экспрессии HAS1±стандартное отклонение от 0,027 мг/мл и 0,27 мг/мл тестового вещества (SPA-308) составляли при уровне экспрессии HAS1 негативного контроля, равном 1, 1,03±1,2 и 0,99±0,16, соответственно.
[0111]
(2) Экспрессия гена человеческой гиалуронсинтазы 2 (HAS2)
Уровни экспрессии HAS2±стандартное отклонение от 0,027 мг/мл и 0,27 мг/мл тестового вещества (SPA-308) составляли при уровне экспрессии HAS2 негативного контроля, равном 1, 1,88±0,46 (р<0,05) и 1,50±0,11 (р<0,01), соответственно.
[0112]
(3) Экспрессия гена человеческой гиалуронидазы 1 (HYAL1)
Уровни экспрессии HYAL1±стандартное отклонение от 0,027 мг/мл и 0,27 мг/мл тестового вещества (SPA-308) составляли при уровне экспрессии HYAL1 негативного контроля, равном 1, 0,97±0,08 и 0,84±0,06, соответственно.
[0113]
3-3 Одновременное использование целевой низкомолекулярной ДНК и экстракта сои
(1) Экспрессия гена человеческой гиалуронсинтазы 1 (HAS1)
Уровни экспрессии HAS1±стандартное отклонение от 0,01 мг/мл + 0,27 мг/мл и 0,1 мг/мл + 0,27 мг/мл тестового вещества (гидролизованной натриевой ДНК+SPA-308) составляли при уровне экспрессии HAS1 негативного контроля, равном 1, 0,99±0,08 и 1,51±0,26 (р<0,05), соответственно.
[0114]
(2) Экспрессия гена человеческой гиалуронсинтазы 2 (HAS2)
Уровни экспрессии HAS2±стандартное отклонение от 0,01 мг/мл + 0,27 мг/мл и 0,1 мг/мл + 0,27 мг/мл тестового вещества (гидролизованной натриевой ДНК+SPA-308) составляли при уровне экспрессии HAS2 негативного контроля, равном 1, 1,41±0,10 (р<0,01) и 1,54±0,07 (р<0,001), соответственно.
[0115]
(3) Экспрессия гена человеческой гиалуронидазы 1 (HYAL1)
Уровни экспрессии HYAL1±стандартное отклонение от 0,01 мг/мл + 0,27 мг/мл и 0,1 мг/мл + 0,27 мг/мл тестового вещества (гидролизованной натриевой ДНК+SPA-308) составляли при уровне экспрессии HYAL1 негативного контроля, равном 1, 0,58±0,11 (р<0,01) и 0,93±0,05, соответственно.
[0116]
Раскрытые выше результаты сведены в таблицу 3. В таблице 3 под «ДНК-Na» понимают «гидролизованную натриевую ДНК». Из таблицы 3 следует, что при одновременном использовании целевой низкомолекулярной ДНК (гидролизованной натриевой ДНК) и экстракта сои (SPA-308) уровень экспрессии гена человеческой гиалуронсинтазы 1 (HAS1) синергически возрастает, а уровень экспрессии гена человеческой гиалуронсинтазы 2 (HAS2) значительно повышается по сравнению с негативным контролем. Также было обнаружено синергическое снижение уровня экспрессии гена человеческой гиалуронидазы 1 (HYAL1). Полученные результаты позволяют подтвердить, что при одновременном использовании целевой низкомолекулярной ДНК (гидролизованной натриевой ДНК) и экстракта сои (SPA-308) происходит одновременное стимулирование экспрессии генов, связанных с синтезом гиалуроновой кислоты, и подавление экспрессии генов, связанных с распадом гиалуроновой кислоты.
[0117]
[0118]
Вышеприведенные результаты свидетельствуют о том, что синергическое увеличение производства коллагена и гиалуроновой кислоты при одновременном применении целевой низкомолекулярной ДНК (гидролизованной натриевой ДНК) и экстракта сои (SPA-308), показанном в примере 1, вызвано одновременным проявлением стимулирования экспрессии генов, связанных с синтезом коллагена и гиалуроновой кислоты, и подавления экспрессии гена, связанного с их распадом.
Промышленная применимость
[0119]
Средство для замедления старения кожи согласно данному изобретению имеет действие и функции, отличающиеся от известных средств замедления старения, и способно более эффективно предотвращать и/или замедлять старение кожи, чем известные средства замедления старения; таким образом, оно может быть использовано, в частности, в косметической продукции.
Группа изобретений относится к средству для замедления старения кожи. Средство для активации функции дермальных фибробластов содержит: целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, причем целевая низкомолекулярная ДНК представляет собой продукт гидролиза ДНК, полученной из семенников (молок) рыб, и содержит от 10 до 80% фракций, имеющих молекулярную массу от 330 до 12 000, экстракт сои представляет собой экстракт по меньшей мере одного вида, выбранного из группы, состоящей из семян, зародышей и ростков сои, содержание целевой низкомолекулярной ДНК составляет от 0,001% до 0,5% по массе, а содержание экстракта сои составляет от 0,01 до 0,5% по массе, соотношение содержания целевой низкомолекулярной ДНК и экстракта сои составляет от 1 : 50 до 50 : 1; а упомянутая активация функции представляет собой по меньшей мере одно действие, выбранное из группы, состоящей из стимулирования пролиферации, стимулирования производства коллагена типа I и стимулирования производства гиалуроновой кислоты в дермальных фибробластах. Средство для регуляции экспрессии гена дермальных фибробластов содержит: целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, причем целевая низкомолекулярная ДНК представляет собой продукт гидролиза ДНК, полученной из семенников (молок) рыб, и содержит от 10 до 80% фракций, имеющих молекулярную массу от 330 до 12000; экстракт сои представляет собой экстракт по меньшей мере одного вида, выбранного из группы, состоящей из семян, зародышей и ростков сои; содержание целевой низкомолекулярной ДНК составляет от 0,001% до 0,5% по массе, а содержание экстракта сои составляет от 0,01 до 0,5% по массе, соотношение содержания целевой низкомолекулярной ДНК и экстракта сои составляет от 1 : 50 до 50 : 1; а упомянутая регуляция экспрессии гена представляет собой стимуляцию одного или обоих из гена человеческой гиалуронсинтазы 1 и гена человеческой гиалуронсинтазы 2 дермальных фибробластов, или снижение экспрессии гена человеческой гиалуронидазы 1 дермальных фибробластов. Вышеописанные средства обладают активирующим воздействием на функцию дермальных фибробластов, могут предотвращать или замедлять старение кожи, предотвращать снижение упругости и эластичности кожи, образование морщин и обвисание. 2 н.п. ф-лы, 1 ил., 3 табл., 2 пр.
1. Средство для активации функции дермальных фибробластов, содержащее:
целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов, причем
целевая низкомолекулярная ДНК представляет собой продукт гидролиза ДНК, полученной из семенников (молок) рыб, и содержит от 10 до 80% фракций, имеющих молекулярную массу от 330 до 12 000,
экстракт сои представляет собой экстракт по меньшей мере одного вида, выбранного из группы, состоящей из семян, зародышей и ростков сои,
содержание целевой низкомолекулярной ДНК составляет от 0,001% до 0,5% по массе, а содержание экстракта сои составляет от 0,01 до 0,5% по массе, соотношение содержания целевой низкомолекулярной ДНК и экстракта сои составляет от 1 : 50 до 50 : 1; а
упомянутая активация функции представляет собой по меньшей мере одно действие, выбранное из группы, состоящей из стимулирования пролиферации, стимулирования производства коллагена типа I и стимулирования производства гиалуроновой кислоты в дермальных фибробластах.
2. Средство для регуляции экспрессии гена дермальных фибробластов, содержащее:
целевую низкомолекулярную ДНК и экстракт сои в качестве активных ингредиентов,
причем целевая низкомолекулярная ДНК представляет собой продукт гидролиза ДНК, полученной из семенников (молок) рыб, и содержит от 10 до 80% фракций, имеющих молекулярную массу от 330 до 12000;
экстракт сои представляет собой экстракт по меньшей мере одного вида, выбранного из группы, состоящей из семян, зародышей и ростков сои;
содержание целевой низкомолекулярной ДНК составляет от 0,001% до 0,5% по массе, а содержание экстракта сои составляет от 0,01 до 0,5% по массе, соотношение содержания целевой низкомолекулярной ДНК и экстракта сои составляет от 1 : 50 до 50 : 1; а
упомянутая регуляция экспрессии гена представляет собой стимуляцию одного или обоих из гена человеческой гиалуронсинтазы 1 и гена человеческой гиалуронсинтазы 2 дермальных фибробластов, или снижение экспрессии гена человеческой гиалуронидазы 1 дермальных фибробластов.
| JP 2009234938 A, 15.10.2009 | |||
| JP 200721062 A, 08.11.2007 | |||
| SEIN LEE et al | |||
| A fermented barley and soybean formula enhances skin hydration //J | |||
| Clin | |||
| Biochem | |||
| Nutr | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| JP 200863315 A, 23.03.2008 | |||
| JP 201858793 A, 12.04.2018 | |||
| KR 1020120063646 A, 18.06.2012 | |||
| CN 104203206 B, 13.06.2017 | |||
| Экстракт семян сои, способ его получения, композиция экстракта семян сои, способ стимуляции пролиферации нейронов, лечения заболеваний головного мозга и лечения нейродегенеративных заболеваний (варианты) | 2016 |
|
RU2657439C2 |
Авторы
Даты
2021-03-04—Публикация
2019-07-17—Подача