Данная заявка претендует на приоритет в соответствии с предварительной заявкой U.S № 61/347136, поданной 21 мая 2010 и предварительной заявкой U.S. № 61/228828, поданной 27 июля 2009, которые включены в нее во всей полноте по ссылке.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к материалам и способам для конъюгирования водорастворимых полимеров с белками свертывания крови.
УРОВЕНЬ ТЕХНИКИ
Терапевтические полипептиды, в частности, белки, отвечающие за систему свертывания крови, включая фактор IX (фIX), фактор VIII (фVIII), фактор VIIa (фVIIa), фактор Фон Виллебранда (ФВф), фактор FV (фV), фактор X (фX), фактор XI (фXI), фактор XII (фXII), тромбин (фII), протеин C, протеин S, tPA, PAI-1, тканевой фактор (Тф) и протеазу ADAMTS 13, быстро разрушаются протеолитическими ферментами и нейтрализуются антителами. Это способствует уменьшению их периода полужизни и времени циркуляции, что ограничивает их терапевтическую эффективность. Для достижения и поддержания желаемых терапевтических и профилактических эффектов этих белков системы свертывания требуется частое их введение в относительно высоких дозах. Как следствие, сложно достигнуть адекватного регулирования дозы, а необходимость частых внутривенных инъекций накладывает ограничения на образ жизни пациента.
Пегилирование полипептидных препаратов защищает их при циркуляции и улучшает их фармакодинамические и фармакокинетические профили (Harris and Chess, Nat Rev Drug Discov. 2003;2:214-21). Во время процесса пегилирования происходит присоединение повторяющихся единиц этиленгликоля (полиэтиленгликоля - ПЭГ) к полипептидному препарату. Молекулы ПЭГ обладают большим гидродинамическим объемом (в 5-10 раз превышающим размер глобулярных белков), хорошо растворимы в воде и гидратированы, нетоксичны, неиммуногенны и быстро выводятся из организма. Пегилирование молекул может способствовать устойчивости препаратов к ферментативному расщеплению, увеличивать период полужизни in vivo, уменьшать частоту введения доз, понижать иммуногенность, повышать физическую и термическую стабильность, растворимость, стабильность в жидком виде и уменьшать агрегацию. Первые пегилированные препараты были утверждены Управлением США по надзору за качеством пищевых продуктов и лекарственных средств (FDA) в начале 1990-х гг. С тех пор FDA утвердило ряд пегилированных препаратов для приема внутрь, парентерального введения и местного применения.
Полисиаловая кислота (ПСК), также называемая коломиновой кислотой (КК), является природным полисахаридом. Это гомополимер N-ацетилнейраминовой кислоты с α(2→8)-кетозидными связями, содержащий вицинальные диольные группы на своем невосстанавливающем конце. Она несет отрицательный заряд и встречается в организме человека. Она может быть легко получена с помощью бактерий в больших количествах и с предопределенными физическими характеристиками (Патент US No. 5846951). Поскольку бактериальная ПСК химически и иммунологически идентична человеческой, бактериальная ПСК неиммуногенна, даже при соединении с протеинами. В отличие от некоторых полимеров, ПСК подвергается биоразложению. При ковалентном соединении коломиновой кислоты с каталазой и аспарагиназой было выявлено увеличение стабильности этих ферментов в присутствии протеолитических энзимов плазмы крови. Сравнительные исследования in vivo с полисиалированной и немодифицированной аспарагиназой показали, что полисиалирование увеличивало время полужизни фермента (Fernandes and Gregoriadis, Int Biochimica Biophysica Acta 1341:26-34, 1997).
Приготовление конъюгатов путем ковалентного связывания водорастворимого полимера с терапевтическим протеином может осуществляться различными химическими способами. К примеру, связывание ПЭГ-производных с белками описано в работе Roberts et al. (Adv Drug Deliv Rev 2002;54:459-76). Один подход к связыванию водорастворимых полимеров с терапевтическими протеинами заключается в конъюгации полимеров с углеводными фрагментами молекул протеинов. Вицинальные гидроксильные (OH) углеводные группы протеинов могут быть легко окислены периодатом натрия (NaIO4) с образованием активных альдегидных групп (Rothfus et Smith, J Biol Chem 1963; 238:1402-10; van Lenten et Ashwell, J Biol Chem 1971;246:1889-94). Потом полимер можно соединить с альдегидными группами, используя реагенты, содержащие, например, активные гидразидные группы (Wilchek M and Bayer EA, Methods Enzymol 1987;138:429-42). Более современная технология заключается в использовании реагентов, содержащих аминоокси-группы, которые реагируют с альдегидными, формируя оксимные связи (WO 96/40662, WO2008/025856).
Дополнительные примеры конъюгации водорастворимого полимера с терапевтическим протеином представлены в WO 06/071801, в котором описывается окисление углеводных фрагментов фактора Фон Виллебранда и последующее связывание с ПЭГ гидразидным способом; публикации US No. 2009/0076237, в которой описывается окисление рфVIII и последующее связывание с ПЭГ и иными водорастворимыми полимерами (например, ПСК, ГЭК (HES), декстран) гидразидным способом; WO 2008/025856, в котором описывается окисление различных факторов свертывания, в том числе, рфIX, фVIII и фVIIa и их с, например, ПЭГ, способом аминоокси-групп с формированием оксимных связей; и в патенте US No. 5621039, в котором описывается окисление фIX и последующее связывание с ПЭГ гидразидным способом.
Недавно был предложен улучшенный способ, заключающийся в мягком периодатном окислении сиаловых кислот с формированием альдегидных групп и последующем их взаимодействии с реагентом, содержащим аминоокси-группы, в присутствии каталитических количеств анилина (Dirksen A et Dawson PE, Bioconjugate Chem. 2008;19,2543-8; и Zeng Y et al., Nature Methods 2009;6:207-9). Катализ анилином значительно ускоряет образование оксимных связей, что позволяет использовать очень низкие концентрации реагента.
Несмотря на то, что способы конъюгирования водорастворимых полимеров с терапевтическими протеинами известны, остается необходимость в разработке материалов и способов для конъюгирования водорастворимых полимеров с протеинами, которые улучшали бы фармакокинетические и фармакодинамические свойства белка с минимизацией затрат на различные реагенты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает материалы и способы для конъюгации полимеров и белков, что улучшает фармакодинамические и фармакокинетические свойства белков, минимизирующие затраты, связанные с различными реагентами.
В одном воплощении изобретения, способ конъюгирования водорастворимого полимера с окисленным углеводным фрагментом белка свертывания крови включает контактирование окисленного углеводного фрагмента с активированным водорастворимым полимером в условиях, позволяющих конъюгацию; белок свертывания крови выбирается из группы, состоящей из фактора IX (фIX), фактора VIII (фVIII), фактора VIIa (фVIIa), фактора Фон Виллебранда (ФВф), фактора FV (фV), фактора X (фX), фактора XI (фXI), фактора XII (фXII), тромбина (фII), протеина C, протеина S, tPA, PAI-1, тканевого фактора (Тф) и протеазы ADAMTS 13 или их биологически активных фрагментов, производных или вариантов; водорастворимый полимер, содержащий активную аминоокси-группу, выбирается из группы, состоящей из полиэтиленгликоля (ПЭГ), разветвленного ПЭГ, полисиаловой кислоты (ПСК), углеводов, полисахаридов, пуллулана, хитозана, гиалуроновой кислоты, хондроитинсульфата, дерматансульфата, крахмала, декстрана, карбоксиметил-декстрана, полиалкиленоксида (ПАО), полиалкиленгликоля (ПАГ), полипропиленгликоля (ППГ), полиоксазолина, полиакрилоилморфолина, поливинилового спирта (ПВС), поликарбоксилата, поливинилпирролидона, полифосфазена, полиоксазолина, сополимера полиэтилена с малеиновым ангидридом, сополимера полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформаля) (PHF), 2-метакрилоилокси-2’-этилтриметиламмонийфосфата (MPC); а углеводный фрагмент окисляется путем инкубирования в буфере, содержащем окислитель, выбранный из группы, состоящей из периодата натрия (NaIO4), тетраацетата свинца (Pb(OAc)4) и перрутената калия (KRuO4); причем оксимная связь формируется между окисленным углеводным фрагментом и активной аминоокси-группой водорастворимого полимера.
В еще одном воплощении изобретения, водорастворимый полимер согласно вышеупомянутому способу представляет собой ПСК. В связанном воплощении ПСК содержит 5-500 или 10-300 единиц сиаловой кислоты. В еще одном воплощении, белок свертывания крови согласно вышеупомянутому способу представляет собой фIX. В ином воплощении, белок свертывания крови согласно вышеупомянутому способу представляет собой фVIIa. В другом воплощении, белок свертывания крови согласно вышеупомянутому способу представляет собой фVIII. В еще одном воплощении, вышеупомянутый способ проводится с использованием в качестве окислителя периодата натрия (NaIO4). В ином воплощении, окисленные углеводные фрагменты белка свертывания крови согласно вышеупомянутому способу расположены на участке активационного пептида белка свертывания крови.
В другом воплощении изобретения, вышеупомянутый способ осуществляется с ПСК, приготовленной путем взаимодействия активированного аминоокси-сшивающего агента с окисленной ПСК;
причем аминоокси-сшивающий агент выбран из группы, состоящей из:
сшивающего агента 3-оксопентан-1,5-диоксиамина, имеющего следующую формулу:
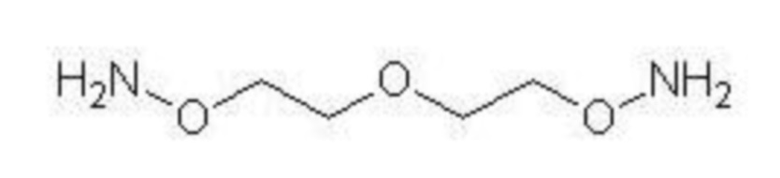 и
и
сшивающего агента 3,6,9-триоксоундекан-1,11-диоксиамина, имеющего следующую формулу:
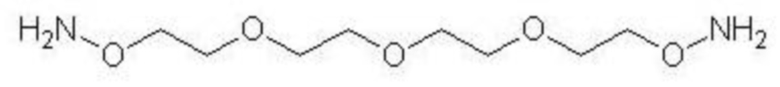 ,
,
а ПСК окислена путем инкубирования с окислителем, чтобы образовать терминальные альдегидные группы на невосстанавливающем конце ПСК. В ином воплощении, вышеупомянутый способ выполняется с активированным аминоокси-сшивающим агентом, содержащим 1-50 этиленгликолевых единиц.
В ином воплощении, вышеуказанный способ выполняется с использованием в качестве аминоокси-сшивающего агента 3-оксопентан-1,5-диоксиамина. В связанном воплощении окислителем выступает NaIO4.
В еще одном воплощении изобретения, вышеупомянутый способ выполняется путем контактирования окисленных углеводных фрагментов и активированных водорастворимых полимеров в буфере, содержащем нуклеофильный катализатор, выбранный из группы, состоящей из анилина и производных анилина.
В ином воплощении изобретения, вышеупомянутый способ содержит этап восстановления оксимной связи конъюгированного белка свертывания крови, выполняемый путем инкубирования конъюгированного белка свертывания крови в буфере, содержащем восстановитель, выбранный из группы, состоящей из цианоборогидрида натрия (NaCNBH3) и аскорбиновой кислоты (витамин C). В связанном воплощении, в качестве восстановителя используется цианоборогидрид натрия (NaCNBH3).
В другом воплощении изобретения, используется модифицированный белок свертывания крови, полученный по указанному выше способу.
В еще одном воплощении изобретения, используется модифицированный фIX, содержащий молекулу фIX или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПСК, соединенную с молекулой фIX, причем указанная аминоокси-ПСК соединена с фIX через один и более углеводных фрагментов.
В другом воплощении изобретения, используется модифицированный фVIIa, содержащий молекулу фVIIa или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПСК, соединенную с молекулой фVIIa, причем указанная аминоокси-ПСК соединена с фVIIa через один и более углеводных фрагментов.
В еще одном воплощении изобретения, используется модифицированный фVIII, содержащий молекулу фVIII или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПСК, соединенную с молекулой фVIII, причем указанная аминоокси-ПСК соединена с фVIII через один и более углеводных фрагментов.
В еще одном воплощении изобретения, используется модифицированный фIX, содержащий молекулу фIX или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПЭГ, соединенную с молекулой фIX, причем указанный аминоокси-ПЭГ соединен с фIX через один и более углеводных фрагментов.
В другом воплощении изобретения, используется модифицированный фVIIa, содержащий молекулу фVIIa или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПЭГ, соединенную с молекулой фVIIa, причем указанный аминоокси-ПЭГ соединен с фVIIa через один и более углеводных фрагментов.
В еще одном воплощении изобретения, используется модифицированный фVIII, содержащий молекулу фVIII или его биологически активный фрагмент, производное или вариант, а также, по меньшей мере, одну молекулу аминоокси-ПЭГ, соединенную с молекулой фVIII, причем указанный аминоокси-ПЭГ соединен с фVIII через один и более углеводных фрагментов.
В ином воплощении, водорастворимый полимер содержит аминоокси-сшивающий агент; указанный водорастворимый полимер выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), разветвленного ПЭГ, полисиаловой кислоты (ПСК), углеводов, полисахаридов, пуллулана, хитозана, гиалуроновой кислоты, хондроитинсульфата, дерматансульфата, крахмала, декстрана, карбоксиметил-декстрана, полиалкиленоксида (ПАО), полиалкиленгликоля (ПАГ), полипропиленгликоля (ППГ), полиоксазолина, полиакрилоилморфолина, поливинилового спирта (ПВС), поликарбоксилата, поливинилпирролидона, полифосфазена, полиоксазолина, сополимера полиэтилена с малеиновым ангидридом, сополимера полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформаля) (PHF), 2-метакрилоилокси-2’-этилтриметиламмонийфосфата (MPC); а указанный аминоокси-сшивающий агент выбран из группы, состоящей из: сшивающего агента 3-оксопентан-1,5-диоксиамина, имеющего формулу:
 и
и
сшивающего агента 3,6,9-триоксоундекан-1,11-диоксиамина, имеющего формулу:

В ином воплощении, указанный способ выполняется таким образом, что аминоокси-сшивающий агент содержит 1-50 этиленгликолевых единиц.
ФИГУРЫ
На фигуре 1 показана первичная структура фактора свертывания крови IX.
На фигуре 2 показано связывание окисленного рфIX с аминоокси-ПСК.
На фигуре 3 показан синтез водорастворимых диаминоокси-сшивающих агентов 3-оксопентан-1,5-диоксиамина и 3,6,9-триоксоундекан-1,11-диоксиамина.
На фигуре 4 показано приготовление аминоокси-ПСК.
На фигуре 5 представлено аналитическое исследование конъюгата ПСК-рфIX способом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) с окрашиванием красителем Кумасси.
На фигуре 6 представлено аналитическое исследование конъюгата ПСК-рфIX с детектированием анти-фIX и анти-ПСК антителами.
На фигуре 7 показана активность нативного рфIX и конъюгата ПСК-рфIX в зависимости от времени после инфузии.
На фигуре 8 показаны уровни ПСК-рфVIII и Advate в зависимости от времени после инфузии.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Фармакологические и иммунологические свойства терапевтических протеинов могут быть улучшены путем химического модифицирования и конъюгации с полимерными соединениями, например, полиэтиленгликолем (ПЭГ), разветвленный ПЭГ, полисиаловая кислота (ПСК), углеводами, полисахаридами, пуллуланом, хитозаном, гиалуроновой кислотой, хондроитинсульфатом, дерматансульфатом, крахмалом, декстраном, карбоксиметил-декстраном, полиалкиленоксидом (ПАО), полиалкиленгликолем (ПАГ), полипропиленгликолем (ППГ), полиоксазолином, полиакрилоилморфолином, поливиниловым спиртом (ПВС), поликарбоксилатом, поливинилпирролидоном, полифосфазеном, полиоксазолином, сополимером полиэтилена с малеиновым ангидридом, сополимером полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформалем) (PHF), 2-метакрилоилокси-2’-этилтриметиламмонийфосфатом (MPC). Свойства получаемых конъюгатов обычно сильно зависят от структуры и размера полимера. Как правило, в данной отрасли предпочтительно использовать полимеры определенного размера или имеющие узкий интервал размеров. Синтетические полимеры типа ПЭГ легко могут быть синтезированы в узком интервале размеров, в то время как ПСК может быть подвергнута очистке с получением полимерных молекул в узком интервале размеров. Также, реактивы для пегилирования с конкретными полимерными цепями и узким интервалом распределения размеров, присутствуют на рынке и имеются в продаже по доступным ценам.
Добавление растворимого полимера, например, полисиалирование - подход к улучшению свойств белков системы свертывания крови, например, фIX, а также иных белков свертывания (например, ФВф, фVIIa (см., к примеру, US 2008/0221032A1, включенный в настоящую заявку посредством ссылки) и фVIII).
БЕЛКИ СИСТЕМЫ СВЕРТЫВАНИЯ КРОВИ
Как указывалось здесь, изобретение охватывает белки свертывания крови, включая фактор IX (фIX), фактор VIII (фVIII), фактор VIIa (фVIIa), фактор Фон Виллебранда (ФВф), фактор FV (фV), фактор X (фX), фактор XI (фXI), фактор XII (фXII), тромбин (фII), протеин C, протеин S, tPA, PAI-1, тканевой фактор (Тф) и протеазу ADAMTS 13, но не ограничиваясь ими. Термин «белок свертывания крови», используемый в этом документе, относится к любому белку из фактора IX (фIX), фактора VIII (фVIII), фактора VIIa (фVIIa), фактора Фон Виллебранда (ФВф), фактора FV (фV), фактора X (фX), фактора XI (фXI), фактора XII (фXII), тромбина (фII), протеина C, протеина S, tPA, PAI-1, тканевого фактора (Тф) и протеазы ADAMTS 13, проявляющему биологическую активность, аналогичную активности нативного белка свертывания крови.
Каскад свертывания крови разделен на три отдельных сегмента: внутренний, внешний, а также общий пути (Schenone et al., Curr Opin Hematol. 2004;11:272-7). Каскад включает ряд ферментов (проферментов) сериновых протеаз и белковые кофакторы. При необходимости неактивный профермент-предшественник превращается в активную форму, которая, в свою очередь, преобразует следующий фермент каскада.
Внутренний путь включает в себя факторы свертывания VIII, IX, X, XI и XII. Инициация внутреннего пути происходит тогда, когда прекалликреин, низкомолекулярный кининоген, фактор XI (фXI) и фактор XII (фXII) вступают в контакт с отрицательно заряженной поверхностью. Также требуются кальций и фосфолипиды, секретируемые из тромбоцитов.
Внешний путь запускается при повреждении внутренних стенок кровеносных сосудов. Обнажается мембранный гликопротеин тканевой фактор, который связывается с циркулирующим фактором VII (фVII) и с малыми присутствующими количествами его активированной формы фVIIa. Это связывание приводит к полной конверсии фVII в фVIIa и, последовательно, в присутствии кальция и фосфолипидов, конверсию фактора IX (фIX) в фактор IXa (фIXa) и фактора X (фX) в фактор Xa (фXa). Ассоциирование фVIIa с тканевым фактором усиливает протеолитическую активность путем перемещения сайтов связывания фVII с субстратами (фIX и фX) в более доступное положение и путем индукции изменения конформации, усиливающей ферментативную активность фVIIa.
Активация фX - общая точка обоих путей. Вместе с фосфолипидами и кальцием факторы Va (фVa) и Xa преобразуют протромбин в тромбин (комплекс протромбиназы), который затем разрезает фибриноген с образованием мономеров фибрина. Мономеры полимеризуются, формируя волокна из фибрина. Фактор XIIIa (фXIIIa) ковалентно связывает эти волокна друг с другом, формируя жесткую сеть.
Превращение фVII в фVIIa также катализируется рядом протеаз, включая тромбин, фIXa, фXa, фактор XIa (фXIa), фактор XIIa (фXIIa). Для ингибирования ранних стадий каскада ингибитор пути тканевого фактора воздействует на комплекс фVIIa/тканевой фактор/фXa.
A. Полипептиды
Одна из особенностей настоящего изобретения - то, что в качестве исходного материала используется белок системы свертывания крови, который может быть получен из человеческой плазмы, либо произведен способами рекомбинантной инженерии, согласно патентам US No. 4757006; US No. 5733873; US No. 5198349; US No. 5250421; US No. 5919766; а также EP 306968. Как здесь описано, термин белок системы свертывания крови относится к любой молекуле свертывания крови, проявляющей активность, связанную с активностью нативного белка свертывания крови. В одном из воплощений изобретения, молекула белка системы свертывания крови представляет собой белок свертывания крови полной длины.
Подразумеваемые молекулы белков свертывания крови включают протеины, имеющие полную длину, предшественников протеинов полной длины, биологически активные субъединицы или фрагменты протеинов полной длины, а также биологически активные производные или варианты какой-либо из этих форм белков свертывания крови. Итак, к белкам свертывания крови относят те, которые (1) имеют аминокислотную последовательность, более чем на примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 91%, примерно 92%, примерно 93%, примерно 94%, примерно 95%, примерно 96%, примерно 97%, примерно 98% или примерно 99% идентичную с участком из, по меньшей мере, около 25, около 50, около 100, около 200, около 300, около 400 и более аминокислот полипептида, закодированного эталонной нуклеиновой кислотой или приведенного здесь; и/или (2) специфически связываются с антителами, например, поликлональными или моноклональными антителами, сформированными против иммуногена, содержащего эталонную аминокислотную кислотную последовательность, описанную здесь, иммуногенный фрагмент или консервативно модифицированный вариант.
Согласно данному изобретению, термин «рекомбинантный белок свертывания крови» относится к любому белку свертывания крови, полученному по технологии рекомбинантной ДНК. В некоторых воплощениях термин включает описанные здесь белки.
Термин «эндогенный белок свертывания крови», используемый в этом документе, включает белки свертывания крови, полученные от млекопитающих, предназначенные для терапии. В это понятие также включаются белки свертывания крови, транскрибируемые на трансгенной или иной чужеродной ДНК, присутствующей в указанном млекопитающем. Термин «экзогенный белок свертывания крови», использованный здесь, включает белки свертывания крови, полученные не от млекопитающих, предназначенные для терапии.
Термины «полученный из плазмы белок свертывания крови» и «плазматический», используемые в этом документе, включают все формы белков, обнаруживаемые в крови млекопитающих, которые способны участвовать в каскаде коагуляции.
Термины «биологически активное производное» или «биологически активный вариант», используемые в этом документе, включают любые производные или варианты молекулы, имеющие аналогичные с ней функциональные или биологические свойства, например, связывающие свойства, либо аналогичную с ней структуру, например, пептидный скелет или основную полимерную единицу.
«Аналог», «вариант» или «производное» - соединение, в значительной степени сходное по структуре и имеющее такую же биологическую активность, что и природное, хотя и имеющее отличия. К примеру, вариант полипептида - полипептид, в значительной степени сходный по структуре и имеющий такую же биологическую активность, что и эталонный полипептид. Варианты и аналоги отличаются по составу аминокислотных последовательностей в сравнении с природными полипептидами, из которых был получен аналог, основываясь на одной и более мутациях, включая (i) делецию одного и большего количеств аминокислотных остатков на одном и более концах полипептида или на одном и более внутренних участках последовательности природного полипептида (например, фрагменты), (ii) вставку или добавку одной и большего количества аминокислот на одном и более концах полипептида (как правило, «добавление» или «слияние») или на одном и более внутренних участках (как правило, «вставка») последовательности природного полипептида (iii) замещение одной и большего количества аминокислот в последовательности природного полипептида на другие аминокислоты. В качестве примера, «производное» относится к полипептиду, имеющему аналогичную или в значительной степени сходную структуру с эталонным полипептидом, который был модифицирован, например, химически.
Варианты и аналоги полипептидов включают инсерционные варианты, при которых один и большее количество аминокислотных остатков добавлены к аминокислотной последовательности белка свертывания крови согласно изобретению. Вставки могут быть расположены на одном или обоих концах протеина, либо могут располагаться во внутренних участках аминокислотной последовательности белка свертывания крови. Инсерционные варианты с дополнительными остатками на одном или обоих концах включают, например, слитые белки и белки, включающие аминокислоты с группами-метками и иные меченые аминокислоты. В одном случае, молекул белка свертывания крови содержит N-терминальный остаток Мет, особенно, если молекула экспрессируется рекомбинантно в бактериальных клетках, например, E. coli.
Делеционные варианты отличаются тем, что из полипептидной последовательности белка свертывания крови, описанного здесь, удалены один или более аминокислотных остатков. Делеции могут быть расположены на одном или обоих концах протеина, либо могут быть обусловлены удалением одного и большего количества остатков из внутренних участков аминокислотной последовательности белка свертывания крови. Делеционные варианты, таким образом, включают фрагменты полипептидной последовательности белка свертывания крови.
Заместительные варианты характеризуются тем, что один или более аминокислотных остатков в последовательности белка свертывания крови удалены и замещены другими остатками. В одном случае, замены могут быть консервативными по природе, консервативные замены этого типа хорошо известны в отрасли. Также, изобретение охватывает замены, которые неконсервативны. Примеры консервативных замещений описаны в Lehninger, [Biochemistry, 2nd Edition; Worth Publishers, Inc., New York (1975), pp.71-77] и представлены ниже.
КОНСЕРВАТИВНЫЕ ЗАМЕЩЕНИЯ
Альтернативный перечень консервативных вариантов замен приведен ниже.
КОНСЕРВАТИВНЫЕ ЗАМЕНЫ II
B. Полинуклеотиды
Нуклеиновые кислоты, кодирующие белки системы свертывания, включают в рамках изобретения, к примеру, гены, пре-мРНК, мРНК, кДНК, полиморфные варианты, аллели, искусственных и природных мутантов, но не ограничиваясь ими.
Полинуклеотиды, кодирующие белки системы свертывания, также включают в рамках изобретения, к примеру, но не ограничиваясь ими, те, которые (1) специфически гибридизированы в жестких гибридизационных условиях с нуклеиновой кислотой, кодирующей аминокислотную последовательность, описанную здесь, а также их консервативно модифицированные варианты; (2) имеют нуклеотидную последовательность с более чем 95%, около 96%, около 97%, около 98%, около 99%, и больше идентичностью нуклеотидной последовательности на участке с, по меньшей мере, около 25, около 50, около 100, около 150, около 200, около 250, около 500, около 1000 и более нуклеотидов (вплоть до полной длины из 1218 нуклеотидов зрелого белка), с эталонной последовательностью нуклеиновой кислоты, описанной здесь. Примером условий “жестких гибридизационных” условий служит гибридизация при 42°C в 50% формамиде, 5× SSC (цитрат и хлорид натрия), 20 мМ Na•PO4, pH 6,8; и отмывка в 1× SSC при 55°C в течение 30 минут. Следует понимать, что в зависимости от длины и содержания ГЦ-нуклеотидов гибридизируемых последовательностей, эти примерные условия могут быть изменены. Для определения приемлемых условий гибридизации приемлемы стандартные в данной области техники формулы. См. Sambrook et al., Molecular Cloning: A Laboratory Manual (Second ed., Cold Spring Harbor Laboratory Press, 1989) §§ 9.47-9.51.
«Природные» полинуклеотидные или полипептидные последовательности, как правило, происходят от млекопитающих, включая, но не ограничиваясь ими, приматов, к примеру, человека; грызунов, к примеру, крыс, мышей, хомяков; от коров, свиней, лошадей, иных млекопитающих. Нуклеиновые кислоты и белки в рамках изобретения могут быть рекомбинантными молекулами (к примеру, гетерологическими, кодирующими последовательность дикого типа или ее варианты, или не встречающимися в природе).
В ряде воплощений изобретения, вышеуказанные полипептиды и полинуклеотиды являются следующими белками системы свертывания крови.
Фактор VIIa
фVII (также известный как стабильный фактор или проконвертин) является гликопротеином, относящимся к группе витамин К-зависимых сериновых протеаз, обладающим ключевой ролью в гемостазе и свертывании крови (Eigenbrot, Curr Protein Pept Sci. 2002;3:287-99).
фVII синтезируется в печени и секретируется в виде одноцепочечного гликопротеина с массой 48 кДа. фVII, как и все гликопротеины, относящиеся к группе витамин К-зависимых сериновых протеаз, имеет доменную структуру, содержащую аминотерминальный домен гамма-карбоксиглутаминовой кислоты (Gla) с 9-12 остатками, ответственными за взаимодействие белка с липидными мембранами, карбокситерминальный домен сериновой протеазы (каталитический домен), а также два домена, аналогичные доменам фактора роста эпидермиса, содержащие ион кальция, отвечающие за взаимодействие с тканевым фактором. Гамма-глутамилкарбоксилаза катализирует карбоксилирование остатков Gla на аминотерминальном участке молекулы. Действие карбоксилазы зависит от восстановленной формы витамина К, который при этом окисляется до эпоксидной формы. Обратное превращение эпоксида витамина К в восстановленную форму происходит под действием витамин-К-эпоксид-редуктазы.
Основная часть фVII циркулирует в крови в виде профермента, активация этой формы происходит при разрезании пептидной связи между 152-м остатком аргинина и 153-м остатком изолейцина. Результирующий активированный фVIIa состоит из NH2-конечной легкой цепи (20 кДа) и COOH-конечной тяжелой цепи (30 кДа), связанных единственной дисульфидной цепью (Цис 135 с Цис 262). Легкая цепь содержит мембран-связывающий Gla-домен, тяжелая цепь содержит каталитический домен.
Концентрация фVII в плазме обусловлена генетическими факторами и факторами окружающей среды, и составляет около 0,5 мг/мл (Pinotti et al., Blood. 2000;95:3423-8). Различные фVII генотипы могут привести к средним уровням фVII, отличающимся в несколько раз. Уровень фVII в плазме повышается у здоровых женщин во время беременности, кроме того, он повышается с возрастом, выше у женщин и у лиц с гипертриглицеридемией. фVII имеет самый короткий период полужизни из всех факторов-прокоагулянтов (3-6 ч). У здоровых людей средняя концентрация фVIIa равна 3,6 нг/мл, период полужизни циркулирующего фVIIa относительно велик (2,5 ч) в сравнении с остальными факторами свертывания крови.
Наследственная недостаточность фVII - редкое аутосомное рецессивное нарушение системы свертывания крови, распространенность которого в популяции оценивается в 1 случай на 500000 людей (Acharya et al., J Thromb Haemost. 2004;2248-56). Приобретенная недостаточность фVII из-за применения ингибиторов также очень редка. Описаны случаи недостаточности после применения таких препаратов, как цефалоспорины, пенициллины, антикоагулянты для приема внутрь. Кроме того, приобретенная недостаточность фVII отмечалась при иных состояниях: миеломе, сепсисе, апластической анемии, при терапии интерлейкином-2 и антитимоцитарным глобулином.
К эталонным полинуклеотидным и полипептидным последовательностям относятся, например, последовательности с номерами доступа GenBank J02933 для геномной последовательности, M13232 для кДНК (Hagen et al. PNAS 1986; 83: 2412-6), и P08709 для полипептидной последовательности (ссылки включены в настоящую заявку во всей полноте). Описано множество полиморфизмов фVII, например, см. Sabater-Lleal et al. (Hum Genet. 2006; 118:741-51) (ссылка включена в настоящую заявку во всей полноте).
Фактор IX
фIX - витамин-К-зависимый протеин плазмы, участвующий во внутреннем пути коагуляции крови путем превращения фX в его активную форму в присутствии ионов кальция, фосфолипидов и фVIIIa. Предоминантная каталитическая способность фIX аналогична сериновым протеазам со специфичностью к связи аргинин-изолейцин в фX. Активация фIX происходит под действием фXIa, который отрезает активационный пептид от фIX, формируя активированную молекулу фIX, содержащую две цепи, связываемы одной или большим количеством дисульфидных связей. Дефекты фIX - причина рецессивной гемофилии B, сцепленной с X-хромосомой.
Гемофилия A и B - наследственные заболевания, которые характеризуются дефицитом полипептидов фVIII и фIX, соответственно. Первопричина дефицита зачастую лежит в мутациях в генах фVIII и фIX, которые расположены в X-хромосоме. Традиционная терапия гемофилии часто заключается во внутривенном введении смешанной плазмы или полуочищенных белков системы свертывания, полученных от людей с нормальной функцией. Эти препараты могут быть загрязнены патогенными агентами или вирусами, например, инфекционными прионами, ВИЧ, парвовирусом, гепатитом A, гепатитом C. Вследствие этого, имеется острая потребность в лекарственных средствах, при производстве которых не используется человеческая сыворотка.
Уровень понижения активности фIX прямо пропорционален тяжести гемофилии B. Текущая терапия гемофилии B заключается в замене недостающего белка полученным из плазмы или рекомбинантным фIX (так называемая заместительная терапия фIX).
Полинуклеотидные и полипептидные последовательности фIX приведены, к примеру, в базе UniProtKB/Swiss-Prot, номер доступа P00740, базе US Pat. номер 6531298, а также на фигуре 1.
Фактор VIII
Фактор свертываемости VIII (фVIII) циркулирует в плазме при очень низкой концентрации, он связан нековалентно с фактором Фон Виллебранда (ФВф). Во время гемостаза, фVIII отделяется от ФВф и действует как кофактор при активации фX, медиируемой фактором IX (фIXa) посредством увеличения скорости активации в присутствии кальция и фосфолипидов или клеточных мембран.
фVIII синтезируется в виде одноцепочечного предшественника с массой примерно 270-330 кДа и с доменной структурой A1-A2-B-A3-C1-C2. При извлечении из плазмы (т.н., «полученный из плазмы» или «плазматический»), фVIII состоит из тяжелой цепи (A1-A2-B) и легкой (A3-C1-C2). Молекулярная масса легкой цепи равна 80 кДа, в то время как, вследствие протеолиза В-домена, вес тяжелой цепи варьируется в интервале 90-220 кДа.
фVIII также синтезируется рекомбинантным способом для терапии нарушений свертываемости крови. Для определения потенциальной эффективности рекомбинантного фVIII (рфVIII) как терапевтического средства были разработаны различные анализы in vitro. Эти анализы имитируют эффекты эндогенного фVIII in vivo. Обработка фVIII in vitro приводит к быстрому подъему и последующему спаду его прокоагулянтной активности, по данным анализов in vitro. Эта активация и деактивация согласуется со специфическим ограниченным протеолизом тяжелой и легкой цепей, что видоизменяет доступность различных связывающих эпитопов фVIII, например, позволяя фVIII отсоединяться от ФВф и связываться с фосфолипидной поверхностью или изменять способность к связыванию с определенными моноклональными антителами.
Нехватка или дисфункция фVIII ассоциированы с наиболее частым нарушением свертываемости крови - гемофилией A. Способ выбора для лечения гемофилии A - заместительная терапия плазмой или концентратами рфVIII. Пациенты с тяжелой гемофилией А с уровнем фVIII ниже 1%, как правило, проходят профилактическую терапию, предназначенную для поддержания уровня фVIII выше 1% между его введениями. Принимая во внимание среднее время полужизни различных препаратов фVIII при циркуляции, как правило, этот уровень достижим при введениях фVIII два-три раза в неделю.
Эталонные полинуклеотидные и полипептидные последовательности: UniProtKB/Swiss-Prot P00451 (FA8_HUMAN); Gitschier J et al., Characterization of the human Factor VIII gene, Nature, 312(5992): 326-30 (1984); Vehar GH et al., Structure of human Factor VIII, Nature, 312(5992):337-42 (1984); Thompson AR. Structure and Function of the Factor VIII gene and protein, Semin Thromb Hemost, 2003:29;11-29 (2002).
Фактор Фон Виллебранда
Фактор Фон Виллебранда (ФВф) - гликопротеин, циркулирующий в плазме в виде нескольких мультимеров, варьирующихся в размере от 500 до 20000 кДа. Мультимерные формы ФВф составлены из полипептидных субъединиц массой 250 кДа, связанных друг с другом дисульфидными связями. ФВф вызывает первичную адгезию тромбоцитов к субэндотелию поврежденной сосудистой стенки. Только большие мультимеры проявляют гемостатическую активность. Предполагается, что эндотелиальные клетки секретируют большие полимерные формы ФВф, а молекулы ФВф, имеющие низкий молекулярный вес (низкомолекулярные формы ФВф), появляются вследствие протеолитического разрезания. Мультимеры, имеющие большие молекулярные массы, накапливаются в тельцах Вейбеля-Паладе клеток эндотелия и высвобождаются после стимуляции.
ФВф синтезируется эндотелиальными клетками и мегакариоцитами в виде препро-ФВф, состоящего из большого количества повторяющихся доменов. После отрезания сигнального пептида, про-ФВф димеризуется посредством образования дисульфидных связей на С-терминальном участке. Димеры служат промоторами мультимеризации, которая управляется путем образования дисульфидных связей на свободных концах. За объединением в мультимеры следует протеолитическое удаление пропептидной последовательности (Leyte et al., Biochem. J. 274 (1991), 257-261).
Первичный продукт трансляции, считываемый с клонированной кДНК ФВф, является полипептидом-предшественником, содержащим 2813 остатков (препро-ФВф). Препро-ФВф состоит из 22 аминокислотных остатков сигнального пептида и 741 аминокислотных остатков пропептида, таким образом, зрелый ФВф содержит 2050 аминокислот (Ruggeri Z.A., and Ware, J., FASEB J., 308-316 (1993).
Дефекты ФВф вызывают болезнь Фон Виллебранда (ФВБ), которая характеризуется более или менее выраженной кровоточивостью. ФВБ 3 типа - наиболее тяжелая форма, при которой ФВф полностью отсутствует, ФВБ 1 типа обусловлена количественной потерей ФВф и ее проявления могут быть весьма мягкими, а ФВБ 2 типа характеризуется качественными дефектами ФВф, ее проявления могут быть такими же тяжелыми, как и при 3 типе. ФВБ 3 типа имеет много подтипов, некоторые из которых ассоциированы с отсутствием или уменьшением количества мультимеров с высоким молекулярным весом. Болезнь Фон Виллебранда типа 2a (ФВБ-2A) характеризуется утратой мультимеров и промежуточных размеров, и больших размеров. ФВБ-2B характеризуется утратой мультимеров с самым большим молекулярным весом. Специалистам в данной отрасли известны и иные болезни и нарушения, связанные с ФВф.
Полинуклеотидная и аминокислотная последовательности препро-ФВф представлены в базе GenBank, номера доступа NM_000552 и NP_000543, соответственно.
Иные белки свертывания крови согласно изобретению описаны в отрасли, например, Mann KG, Thromb Haemost, 1999;82:165-74.
C. Получение белков системы свертывания крови
Получение белков системы свертывания крови включает любые способы, известные в отрасли, предназначенные для (i) получения рекомбинантной ДНК способами генной инженерии, (ii) внедрения рекомбинантной ДНК в прокариотические и эукариотические клетки посредством, к примеру, но не ограничиваясь ими, трансфекцию, электропорацию или микроинъекцию, (iii) культивирования указанных трансформированных клеток, (iv) экспрессирования белков свертывания крови, например, конститутивно или по индукции, а также (v) выделения указанных белков свертывания крови, например, из культуральной среды или путем сбора трансформированных клеток для получения очищенного белка системы свертывания крови.
В иных случаях, белок свертывания крови получают путем экспрессии в подходящей прокариотической или эукариотической клеточной системе, характеризующейся способностью к синтезу фармакологически приемлемой молекулы белка свертывания крови. Примерами эукариотических клеток являются клетки млекопитающих, например, CHO, COS, HEK 293, BHK, SK-Hep, а также HepG2.
Для получения белков системы свертывания крови используется множество векторов, выбранных из эукариотических и прокариотических векторов экспрессии. Примерами векторов прокариотической экспрессии служат плазмиды, например, но не ограничиваясь ими, pRSET, pET и pBAD, а промоторы, используемые для прокариотической экспрессии, включают один или более из lac, trc, trp, recA, araBAD, но не ограничиваясь перечисленными. Примеры векторов для эукариотической экспрессии включают: (i) для экспрессии в дрожжах - такие векторы, как pAO, pPIC, pYES, pMET, но не ограничиваясь ими, с использованием таких промоторов, как AOX1, GAP, GAL1, AUG1, но не ограничиваясь ими; (ii) для экспрессии в клетках насекомых - такие векторы, как pMT, pAc5, pIB, pMIB, pBAC, но не ограничиваясь ими, с использованием таких промоторов, как PH, p10, MT, Ac5, OpIE2, gp64, polh, но не ограничиваясь ими; (iii) для экспрессии в клетках млекопитающих - такие векторы, как pSVL, pCMV, pRc/RSV, pcDNA3, pBPV, а также векторы, полученные из таких вирусных систем, как вирус осповакцины, аденосателлитные вирусы, вирусы герпеса, ретровирусы, но не ограничиваясь ими, с использованием таких промоторов, как CMV, SV40, EF-1, UbC, RSV, ADV, BPV, β-актин, но не ограничиваясь ими.
D. Введение препарата
В одном из воплощений, конъюгированный белок системы свертывания крови согласно изобретению может вводиться путем инъекции, например, внутривенно, внутримышечно, либо интраперитонеально.
Для введения композиций человеку или подопытным животным, содержащих конъюгированный белок крови согласно данному изобретению, в их состав могут быть включены один и большее количество фармацевтически приемлемых носителей. Термины «фармацевтически» или «фармакологически приемлемые» относятся к молекулярным структурам и композициям, которые стабильны, ингибируют деградацию белка, например, агрегацию и разрезание, а также не вызывают аллергических реакций и иных нежелательных реакций при введении путями, известными в отрасли, как описано ниже. К «фармацевтически приемлемым носителям» относятся все клинически пригодные растворители, диспергенты, пленки, антибактериальные и противогрибковые средства, изотонические растворы и средства для замедления абсорбции и т.д., включая средства, перечисленные выше.
Термин «эффективное количество» при использовании в этом документе обозначает дозу, пригодную для лечения млекопитающего, имеющего описанное здесь расстройство свертывания крови.
Композиции могут вводиться перорально, местно, чрескожно, парентерально, ингаляционным спреем, вагинально, ректально, либо интракраниальной инъекцией. Термин парентерально включает здесь подкожные инъекции, внутривенные, внутримышечные, интрацистернальное введение, а также инфузии. Введение может осуществляться способами внутривенных, внутрикожных, внутримышечных, интрамаммарных, интраперитонеальных, интратекальных, ретробульбарных, интрапульмонарных инъекций, а также способом хирургической имплантации в конкретный участок тела. Как правило, композиции не содержат пирогенов, а также иных примесей, которые могут быть опасны для реципиента.
Одно- и многократные введения композиций могут проводиться с уровнями дозировок и по схеме, выбранными лечащим врачом. Для профилактики или лечения болезни, приемлемый уровень дозировки будет зависеть от типа болезни, тяжести и течения, целей применения препарата: профилактических или терапевтических, предшествующей терапии, анамнеза больного и реакции на препарат, а также от индивидуальных суждений лечащего врача.
Изобретение также относится к фармацевтической композиции, содержащей эффективное количество конъюгированного белка крови, как описано здесь. Фармацевтическая композиция может содержать фармацевтически приемлемый носитель, растворитель, соли, буферы, вспомогательные добавки. Фармацевтическая композиция может использоваться для лечения указанных выше расстройств свертывания крови. Фармацевтическая композиция согласно изобретению может являться раствором или лиофилизатом. Растворы фармацевтической композиции могут подвергаться любым подходящим лиофилизационным процессам.
Дополнительно, изобретение включает наборы, содержащие композицию согласно изобретению, упакованную таким способом, чтобы облегчить ее введение субъектам. В одном воплощении, в такой набор включено соединение или композиция, описанная здесь (например, композиция, содержащая конъюгированный белок свертывания крови), упакованные в контейнер, например, запечатанный флакон или бутыль, с этикеткой, прикрепленной к контейнеру или прилагаемой к упаковке, в которой описано практическое использование соединения или композиции. В одном воплощении, набор содержит два контейнера, в первом из которых находится композиция, содержащая конъюгированный белок свертывания крови, а во втором - физиологически приемлемый раствор для восстановления раствора композиции в первом флаконе. Соединение или композиция могут быть упакованы в форму, позволяющую дозирование. Набор может включать приспособление, предназначенное для введения композиции согласно специфическому способу введения. Предпочтительно, чтобы набор содержал этикетку, в которой описано использование терапевтического белка или пептидной композиции.
ВОДОРАСТВОРИМЫЕ ПОЛИМЕРЫ
В одном случае, молекула производного белка свертывания крови (т.е. конъюгированный белок свертывания крови) связана с водорастворимым полимером, включая полиэтиленгликоль (ПЭГ), разветвленный ПЭГ, полисиаловую кислоту (ПСК), углеводы, полисахариды, пуллулан, хитозан, гиалуроновую кислоту, хондроитинсульфат, дерматансульфат, крахмал, декстран, карбоксиметил-декстран, полиалкиленоксид (ПАО), полиалкиленгликоль (ПАГ), полипропиленгликоль (ППГ), полиоксазолин, полиакрилоилморфолин, поливиниловый спирт (ПВС), поликарбоксилат, поливинилпирролидон, полифосфазен, полиоксазолин, сополимер полиэтилена с малеиновым ангидридом, сополимер полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформаль) (PHF), 2-метакрилоилокси-2’-этилтриметиламмонийфосфат (MPC), но не ограничиваясь ими. В одном воплощении изобретения, водорастворимый полимер состоит из молекулы сиаловой кислоты, имеющий молекулярный вес, находящийся в пределах 350-120000, 500-100000, 1000-80000, 1500-60000, 2000-45000 Да, 3000-35000 Да, либо 5000-25000 Да. Связывание водорастворимого полимера может выполняться путем прямого связывания с белком либо через молекулы сшивающих агентов. Один пример химического сшивающего агента - MBPH (4-[4-N-малеимидофенил]масляной кислоты гидразид), содержащий карбогидрат-селективную гидразидную и сульфгидрил-реактивную малеимидную группы (Chamow et al., J Biol Chem 1992;267:15916-22). Иные примерные и предпочтительные сшивающие агенты приведены ниже.
В одном воплощении, производное сохраняет полную функциональную активность нативного терапевтического продукта белка свертывания крови, а также обеспечивает увеличенный период полужизни in vivo в сравнении с нативными терапевтическими продуктами белков свертывания крови. В другом воплощении, производное сохраняет, по меньшей мере, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44. 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56,57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140 или 150 процентов (%) от биологической активности нативного белка свертывания крови. В связанном случае, биологическая активность производного и нативного белков свертывания крови определяется отношениями хромогенной активности антигенов к факторам свертывания крови (фактор свертывания крови:Chr: фактор свертывания крови:Ag). В ином воплощении изобретения, период полужизни конструкции уменьшен или увеличен в 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10 раз в сравнении с периодом полужизни нативного белка свертывания крови in vivo.
A. Сиаловая кислота и ПСК
Термин «фрагменты сиаловых кислот», используемый в этом документе, включает мономеры или полимеры сиаловой кислоты («полисахариды»), которые растворимы в водном растворе или суспензии и не имеют отрицательных эффектов (либо имеют незначительные), например, побочных эффектов, у млекопитающих при введении конъюгатов ПСК с белками системы свертывания крови в фармакологически эффективных количествах. Полимеры могут состоять из 1, 2, 3, 4, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400 или 500 единиц сиаловой кислоты. В ряде случаев различные единицы сиаловой кислоты объединяются в цепочки.
В одном из воплощений изобретения, фрагмент полисахаридного соединения, состоящий из сиаловой кислоты, очень гидрофилен, в ином воплощении все соединение очень гидрофильно. Гидрофильность в первую очередь обусловлена боковыми карбоксильными группами сиаловой кислоты, а также гидроксильными группами. Сахаридная единица может содержать и иные функциональные группы, например, аминогруппу, гидроксильную или сульфатную, а также их комбинации. Эти группы могут присутствовать в природных сахаридных соединениях, либо могут быть введены в получаемые полисахариды.
Природный полимер ПСК доступен в виде полидисперсного препарата с большим разбросом размеров (например, Sigma C-5762) и высокой полидисперсностью (ПД). Поскольку полисахариды, как правило, получают из бактерий, имеется риск попадания эндотоксинов в продукт при его очистке, а при выделении длинноцепочечных фракций вероятность повышения содержания эндотоксинов повышается. Короткие молекулы ПСК, содержащие 1-4 остатка сиаловой кислоты, также могут быть приготовлены синтетически (Kang SH et al., Chem Commun. 2000;227-8; Ress DK and Linhardt RJ, Current Organic Synthesis. 2004;1:31-46), что минимизирует риск высокого содержания эндотоксинов. Тем не менее, препараты ПСК с узким распределением размеров и низкой полидисперсностью, а также свободные от эндотоксинов, могут быть приготовлены в настоящее время. В одном случае в изобретении могут использоваться полисахаридные компоненты, полученные из бактерий. Некоторые из этих природных полисахаридов известны под видом гликолипидов. В одном из воплощений изобретения, полисахаридные соединения практически полностью освобождены от терминальных единиц галактозы.
B. Полиэтиленгликоль (ПЭГ) и пегилирование
В качестве особенности изобретения, фактор свертывания крови, например, фVIII, фVIIa, фIX, или иные молекулы факторов свертывания, конъюгированы с водорастворимым полимером каким-либо из множества химических способов (Roberts JM et al., Advan Drug Delivery Rev 2002;54:459-76). К примеру, в одном воплощении фVIII, фVIIa, либо фIX модифицированы конъюгацией ПЭГ со свободными аминогруппами белка с использованием N-гидроксисукцинимидных (NHS) эфиров. В ином воплощении водорастворимый полимер, к примеру, ПЭГ, соединен со свободными SH-группами малеимидным способом или связыванием гидразидов ПЭГ или аминов ПЭГ с углеводными фрагментами фVIII, фVIIa, либо фIX после предварительного окисления.
В качестве особенности изобретения, конъюгация осуществляется путем прямого связывания (или связывания посредством сшивающих агентов) водорастворимого полимера с фактором свертывания крови, например, фVIII, фVIIa или фIX с образованием стабильных связей. В изобретении могут использоваться разрушаемые, легкоразрываемые или гидролизуемые системы сшивания (Tsubery et al. J Biol Chem 2004;279:38118-24 / Greenwald et al., J Med Chem 1999;42:3657-67 / Zhao et al., Bioconj Chem 2006;17:341-51 / WO2006/138572A2 / US7259224B2 / US7060259B2).
В одном воплощении изобретения, фактор свертывания крови, например, фVIII, фVIIa или фIX, модифицирован в остатках лизина производными полиэтиленгликоля, содержащими активный N-гидроксисукцинимидный эфир (NHS), например, сукцинат сукцинимидила, глутарат сукцинимидила или пропионат сукцинимидила. Эти производные реагируют с остатками лизина фVIII, фVIIa или фIX в мягких условиях, образуя стабильную амидную связь. В одном воплощении изобретения, длина цепи производного ПЭГ равна 5000 Да. В иных воплощениях могут использоваться производные ПЭГ с длиной цепи от 500 до 2000 Да, от 2000 до 5000 Да, более 5000 вплоть до 10000 Да, более 10000 вплоть до 20000 Да, более 20000 вплоть до 150000 Да, а также разветвленные структуры.
Среди альтернативных способов пегилирования аминогрупп, но не ограничиваясь перечисленными, можно назвать химическое конъюгирование с карбонатами ПЭГ с образованием уретановых связей, взаимодействие с альдегидами или кетонами при восстановительном аминировании с образованием вторичных амидных связей.
В одном воплощении данного изобретения, молекула фактора свертывания крови, например, фVIII, фVIIa, фIX, или иного, химически модифицирована производными ПЭГ, доступными в продаже. Эти производные ПЭГ в альтернативных вариантах могут иметь линейные или разветвленные структуры. Примеры производных ПЭГ, содержащих группы NHS, приведены ниже.
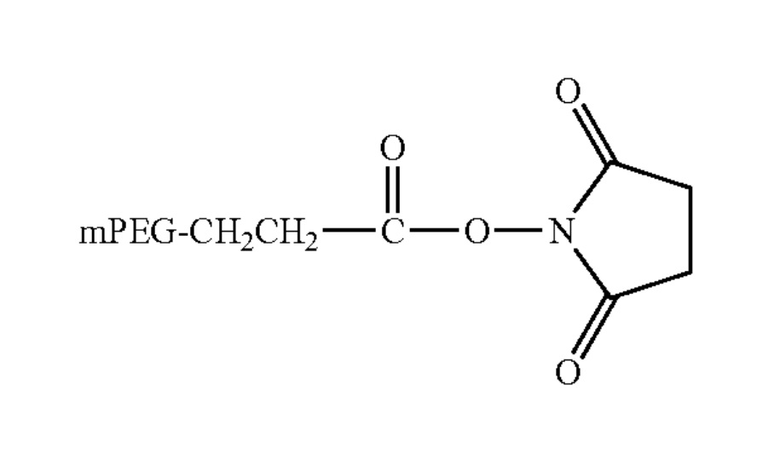
Следующие производные ПЭГ - неисчерпывающий перечень продуктов, доступных у Nektar Therapeutics (Хантсвиль, Алабама; см www.nektar.com/ каталог реагентов ПЭГ; Nektar Advanced PEGylation, прайс-лист 2005-2006):
мПЭГ-сукцинимидилпропионат (mPEG-SPA)
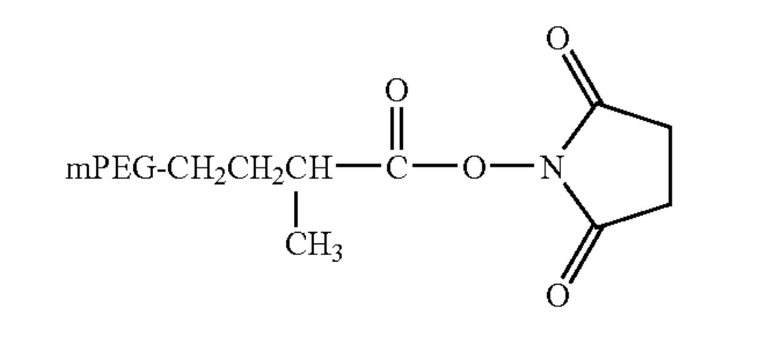
мПЭГ-сукцинимидил-α-метилбутаноат (mPEG-SMB)
mPEG-CM-HBA-NHS (CM=карбоксиметил; HBA=гидроксимасляная кислота)

Структура разветвленных производных ПЭГ (Nektar Therapeutics):
Разветвленный N-гидроксисукцинимид ПЭГ (mPEG2-NHS)

Этот реагент с разветвленной структурой описан более подробно в работе Kozlowski et al. (BioDrugs 2001;5:419-29).
Еще один неисчерпывающий перечень производных ПЭГ, доступных в продаже у NOF Corporation (Токио, Япония; см www.nof.co.jp/english: каталог 2005)
Общая структура линейных производных ПЭГ (NOF Corp.):

X=карбоксиметил
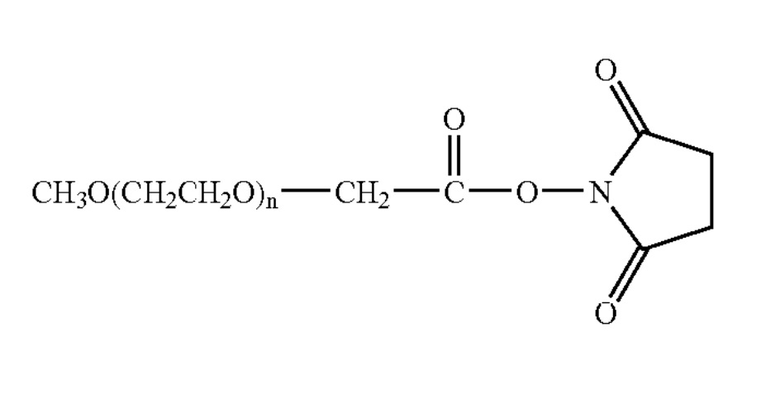
X=карбоксипентил
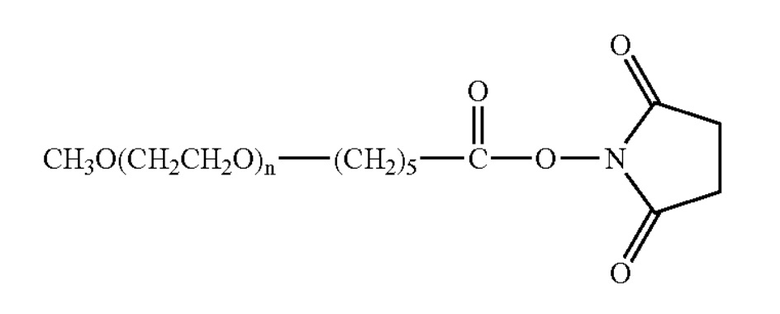
x=сукцинат
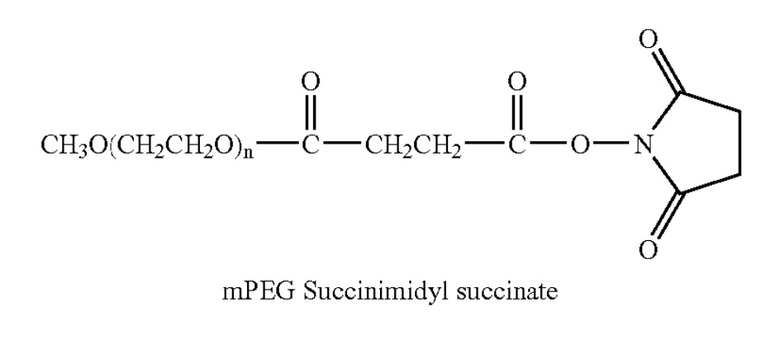
x=глутарат

Структуры разветвленных производных ПЭГ (NOF Corp.): 2,3-бис(метилполиоксиэтилен-окси)-1-(1,5-диоксо-5-сукцинимидилокси, пентилокси)пропан
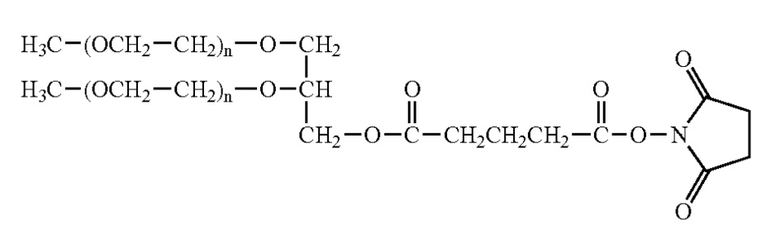
2,3-бис(метилполиоксиэтилен-окси)-1-(сукцинимидил карбоксипентилокси)пропан

Данные производные пропана обладают скелетом глицерина с 1,2-замещением. В данном изобретении также могут применяться производные ПЭГ на основе структуры глицерина с 1,3-замещением или иные разветвленные структуры, описанные в US2003/0143596A1.
Также могут использоваться производные ПЭГ с легко разрываемыми связями (например, с гидролизуемыми сшивками), как описано Tsubery et al. (J Biol Chem 2004;279:38118-24) и Shechter et al. (WO04089280A3).
Как ни удивительно, пегилированные фVIII, фVIIa, фIX, а также иные факторы свертывания крови согласно данному изобретению, обладают функциональной активностью в комбинации с продленным периодом полужизни in vivo. Вдобавок, пегилированные рфVIII, фVIIa, фIX и иные факторы свертывания крови, видимо, более резистентны к инактивации тромбином.
C. Способы присоединения
Белок свертывания крови может быть ковалентно связан с полисахаридными соединениями различными способами, известными специалистам в этой отрасли. В качестве особенности изобретения, фрагменты сиаловой кислоты связаны с белком свертывания крови, например, фIX, фVIII, фVIIa или ФВф, например, по способу, описанному в патенте US No. 4356170, который включен в данную заявку по ссылке.
В рамках изобретения также предполагается возможность использования иных известных способов связывания ПСК с полипептидами. К примеру, в публикации US No. 2007/0282096 описано конъюгирование амино- или гидразидных производных, например, ПСК, с белками. Помимо этого, в публикации US No. 2007/0191597 описаны производные ПСК, содержащие альдегидную группу, взаимодействующую с субстратами (например, белками) на их восстанавливающем конце. Эти публикации включены по ссылке во всей полноте.
Различные способы приведены в колонке 7, строке 15, - колонке 8, строке 5 патента U.S. №. 5846951 (включен по ссылке во всей полноте). Среди примеров техник можно назвать связывание посредством образования пептидной связи между карбоксильной группой белка свертывания крови или полисахарида и аминогруппой белка свертывания крови или полисахарида, либо эфирной связи между карбоксильной группой белка свертывания крови или полисахарида и гидроксильной группой белка свертывания крови или полисахарида. Другой пример связывания белка свертывания крови с полисахаридным соединением - через основание Шиффа, то есть путем взаимодействия свободной аминогруппы белка свертывания крови с альдегидной группой, формируемой на невосстанавливающем конце полисахарида при периодатном окислении (Jennings HJ and Lugowski C, J Immunol. 1981;127:1011-8; Fernandes AI and Gregoriadis G, Biochim Biophys Acta. 1997;1341;26-34). В одном случае образовавшееся основание Шиффа стабилизируется путем специфического восстановления при помощи NaCNBH3 с образованием вторичного амина. Альтернативный подход - формирование терминальных свободных аминогрупп в ПСК путем восстановительного аминирования с NH4Cl после предварительного окисления. Для связывания двух амино- или двух гидроксильных групп могут быть использованы бифункциональные реагенты. Например, ПСК, содержащая аминогруппу, может быть связана с аминогруппой белка при помощи реагентов типа BS3 (бис(сульфосукцинимидил)суберат / Pierce, Рокфорд, Иллинойс). Помимо этого, для связывания амино- и тиоловых групп могут использоваться гетеробифункциональные перекрестно-сшивающие реагенты по типу Sulfo-EMCS (N-ε-малеимидокапроилокси)-сульфосукцинимидный эфир / Pierce).
По иному способу, готовят гидразид ПСК и связывают его с углеводными фрагментами белка после предварительного окисления с формированием альдегидных групп.
Как описано выше, свободная аминогруппа терапевтического протеина реагирует с 1-карбоксильной группой остатка сиаловой кислоты с образованием пептидильной связи или эфирная связь образуется между 1-карбоксильной группой кислоты и гидроксильной или иной подходящей активной группой белка свертывания крови. В качестве варианта, карбоксильная группа может образовывать пептидную связь с деацетилированной 5-аминогруппой или альдегидная группа молекулы белка свертывания крови может образовывать основание Шиффа с N-деацетилированной 5-аминогруппой остатка сиаловой кислоты.
Альтернативно, полисахаридное соединение связано нековалентно с белком свертывания крови. К примеру, полисахаридное соединение и фармакологически активное соединение соединяются в одно целое посредством гидрофобных взаимодействий. Иные нековалентные способы связи - электростатические взаимодействия, при которых противоположно заряженные ионы притягиваются друг к другу.
В различных воплощениях, белок свертывания крови связан или ассоциирован с полисахаридным соединением в стехиометрических отношениях (например, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:7, 1:8, 1:9 или 1:10, и т.д.). В различных воплощениях, 1-6, 7-12 или 13-20 полисахаридов связаны с белком свертывания крови. В иных воплощениях, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и более полисахаридов связаны с белком свертывания крови.
В различных воплощениях, белок свертывания крови модифицирован, то есть в него внедрены сайты гликозилирования (т.е. сайты, отличные от нативных сайтов гликозилирования). Такая модификация может быть выполнена стандартными способами молекулярной биологии, известными в данной отрасли. Далее, белок свертывания крови, перед конъюгированием с водорастворимым полимером, может быть гликозилирован in vivo или in vitro. Эти гликозилированные сайты могут служить мишенями для конъюгации белков с водорастворимыми полимерами (заявка на патент US No. 20090028822, заявка на патент US No. 2009/0093399, заявка на патент US No. 2009/0081188, заявка на патент US No. 2007/0254836, заявка на патент US No. 2006/0111279, а также DeFrees S. et al., Glycobiology, 2006, 16, 9, 833-43).
D. Аминоокси-связывание
В одном воплощении изобретения, для приготовления конъюгатов белков системы свертывания крови используется взаимодействие гидроксиламина или гидроксиламиновых производных с альдегидами (например, с углеводными фрагментами, окисленными периодатом натрия) с образованием оксимной группы. К примеру, гликопротеин (например, белок системы свертывания крови согласно данному изобретению) вначале окисляется окислителем типа периодата натрия (NaIO4) (Rothfus JA et Smith EL., J Biol Chem 1963, 238, 1402-10; и Van Lenten L and Ashwell G., J Biol Chem 1971, 246, 1889-94). Периодатное окисление гликопротеинов основывается на классической реакции Малапрада, описанной в 1928 г., а именно на окислении вицинальных диолов периодатом с образованием активной альдегидной группы (Malaprade L., Analytical application, Bull Soc Chim France, 1928, 43, 683-96). Окислителями также могут выступать тетраацетат свинца (Pb(OAc)4), ацетат марганца (MnO(Ac)3), ацетат кобальта (Co(OAc)2), ацетат таллия (TlOAc), сульфат церия (Ce(SO4)2) (US 4367309), перрутенат калия (KRuO4) (Marko et al., J Am Chem Soc 1997, 119, 12661-2). Под «окислителем» подразумевается соединение, обладающее мягкими окислительными свойствами, позволяющими сформировать активные альдегидные группы при протекании реакции в физиологических условиях.
Второй этап - связывание полимера, содержащего аминоокси-группы, с окисленными углеводными фрагментами с образованием оксимной связи. В одном воплощении изобретения, этот этап может проводиться в присутствии каталитических количеств нуклеофильного катализатора анилина или его производных (Dirksen A et Dawson PE, Bioconjugate Chem. 2008; Zeng Y et al., Nature Methods 2009;6:207-9). Анилиновый катализ существенно ускоряет образование оксимных связей, что позволяет использовать очень малые концентрации реагентов. В другом воплощении оксимная связь стабилизируется восстановлением NaCNBH3 с образованием алкоксиаминовой связи (фигура 2).
В одном воплощении изобретения, этапы реакции конъюгирования водорастворимого полимера с белком свертывания крови проводятся раздельно и последовательно (т.е. исходные материалы (белок свертывания крови, водорастворимый полимер и т.д.), реагенты (окислители, анилин и т.д.) и продукты реакции (окисленные углеводы белков свертывания крови, активированный водорастворимый полимер с аминоокси-группами и т.д.) разделяются между отдельными этапами).
Дополнительные сведения по технологии аминоокси-связывания приведены в следующих источниках, каждый из которых включен в своей полноте: EP 1681303A1 (эритропоэтин, связанный с гидроксиалкилкрахмалом); WO 2005/014024 (конъюгаты полимера и белка, связанные оксимной группой); WO96/40662 (сшивающие агенты, содержащие аминоокси-группы, и их применение для изготовления конъюгатов); WO 2008/025856 (модифицированные протеины); Peri F et al., Tetrahedron 1998, 54, 12269-78; Kubler-Kielb J et. Pozsgay V., J Org Chem 2005, 70, 6887-90; Lees A et al., Vaccine 2006, 24(6), 716-29; и Heredia KL et al., Macromoecules 2007, 40(14), 4772-9.
В различных воплощениях изобретения, водорастворимый полимер, соединенный согласно аминоокси-технологии, описанной здесь, с окисленными углеводными фрагментами белка свертывания крови (например, фVIII, фVIIa или фIX), является, к примеру, но не ограничиваясь перечисленными примерами, полиэтиленгликолем (ПЭГ), разветвленным ПЭГ, полисиаловой кислота (ПСК), углеводами, полисахаридами, пуллуланом, хитозаном, гиалуроновой кислотой, хондроитинсульфатом, дерматансульфатом, крахмалом, декстраном, карбоксиметил-декстраном, полиалкиленоксидом (ПАО), полиалкиленгликолем (ПАГ), полипропиленгликолем (ППГ), полиоксазолином, полиакрилоилморфолином, поливиниловым спиртом (ПВС), поликарбоксилатом, поливинилпирролидоном, полифосфазеном, полиоксазолином, сополимером полиэтилена с малеиновым ангидридом, сополимером полистирола с малеиновым ангидридом, поли(1-гидроксиметилэтилен гидроксиметилформалем) (PHF), 2-метакрилоилокси-2’-этилтриметиламмонийфосфатом (MPC).
Следующие примеры не исчерпывающи, но приведены лишь в качестве приблизительных способов воплощения изобретения.
ПРИМЕРЫ
Пример 1
Приготовление гомобифункционального сшивающего агента NH2[OCH2CH2]2ONH2
Гомобифункциональный сшивающий агент NH2[OCH2CH2]2ONH2

(3-оксопентан-1,5-диоксиамин), содержащий две активные аминооксигруппы, был синтезирован согласно Boturyn et al. (Tetrahedron 1997;53:5485-92) по двухэтапной органической реакции, включающей модифицированную реакцию Габриэля для синтеза первичных аминов (фигура 3). На первом этапе одна молекула 2,2-хлордиэтилового эфира взаимодействовала с двумя молекулами эндо-N-гидрокси-5-норборнен-2,3-дикарбоксимида в диметилформамиде (ДМФ). Целевой гомобифункциональный продукт приготавливали из полученного интермедиата путем гидразинолиза в этаноле.
Пример 2
Приготовление гомобифункционального сшивающего агента NH2[OCH2CH2]4ONH2
Гомобифункциональный сшивающий агент NH2[OCH2CH2]4ONH2

(3,6,9-триоксоундекан-1,11-диоксиамин), содержащий две активные аминооксигруппы, был синтезирован согласно Boturyn et al. (Tetrahedron 1997;53:5485-92) по двухэтапной органической реакции, включающей модифицированную реакцию Габриэля для синтеза первичных аминов (фигура 3). На первом этапе одна молекула бис-(2-(2-хлорэтокси)-этилового) эфира взаимодействовала с двумя молекулами эндо-N-гидрокси-5-норборнен-2,3-дикарбоксимида в диметилформамиде (ДМФ). Целевой гомобифункциональный продукт приготавливали из полученного интермедиата путем гидразинолиза в этаноле.
Пример 3
Приготовление аминоокси-ПСК
500 мг окисленной ПСК (молекулярный вес 18,8 кДа), полученной из Института сывороток Индии (Пуна, Индия), были растворены в 8 мл 50 мМ натрий-ацетатного буфера с pH 5,5. Затем добавили 100 мг 3-оксопентан-1,5-диоксиамина. После встряхивания в течение 2 ч при комнатной температуре, добавили 44 мг цианоборогидрида натрия. После встряхивания в течение еще 4 ч при 4°C, реакционная смесь была загружена в кассету для диализа Slide-A-Lyzer (Pierce, Рокфорд, Иллинойс) (мембрана 3,5 кДа, регенерированная целлюлоза) и диализирована в течение 4 дней в фосфатно-солевом буферном растворе при pH 7,2. Продукт был заморожен при -80°C. Приготовление аминоокси-ПСК согласно этой процедуре представлено на фигуре 4.
Альтернативный способ приготовления аминоокси-ПСК
1000 мг окисленной ПСК (молекулярный вес 20 кДа), полученной из Института сывороток Индии (Пуна, Индия), были растворены в 16 мл 50 мМ фосфатного буфера с pH 6,0. Затем к реакционной смеси добавили 170 мг 3-оксопентан-1,5-диоксиамина. После встряхивания в течение 2 ч при комнатной температуре, добавили 78,5 мг цианоборогидрида натрия, реакцию оставили на ночь на 18 часов. Затем реакционная смесь была подвергнута процедуре ультрафильтрации/диафильтрации (UF/DF) на мембране из регенерированной целлюлозы (Millipore) с порогом фильтрации 5 кДа.
Пример 4
Связывание аминоокси-ПСК с рфIX и очистка конъюгата
К 12,6 мг рфIX, растворенного в 6,3 мл 50 мМ натрий-ацетатного буфера с pH 6,0, добавили 289 мкл водного раствора периодата натрия (10 мкМ). Смесь встряхивали 1 ч в темноте при 4°C, затем реакцию остановили, выдержав раствор 15 минут при комнатной температуре после добавления 6,5 мкл 1M раствора глицерина. Низкомолекулярные примеси были удалены путем ультрафильтрации/диафильтрации (UF/DF) на концентраторах Vivaspin (Sartorius, Геттинген, Германия) (мембрана 30 кДа, регенерированная целлюлоза). Затем к ультрафильтрату добавили 43 мг аминоокси-ПСК, полученную смесь встряхивали 18 часов при 4°C. Избыточная ПСК была удалена способом гидрофобной хроматографии. Проводимость охлажденной реакционной смеси была поднята до 180 мСм/см, затем она была загружена в 5 мл HiTrap Butyl FF (GE Healthcare, Фэрфилд, Коннектикут) колонку для гидрофобной хроматографии (1,6×2,5 см), заранее уравновешенную раствором 50 мМ HEPES, 3 M хлорида натрия, 6,7 мМ хлорида кальция, 0,01% Твин-80 с pH 6,9. Конъюгат был элюирован раствором в количестве, равном 2,4 объемам колонки, содержащим 50 мМ HEPES, 6,7 мМ хлорида кальция, 0,005% Твин-80, с pH 7,4 на потоке 5 мл/мин. Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фIX. Специфическая активность конъюгата ПСК-рфIX составила 80,2 МЕ/мг белка (56,4% от нативного рфIX). Результаты представлены в таблице 1.
Аналитическое исследование конъюгата ПСК-рфIX способом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) с окрашиванием красителем Кумасси представлено на фигуре 5. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) с последующим вестерн-блоттингом с анти-фIX и анти-ПСК антителами представлен на фигуре 6.
Пример 5
Связывание аминоокси-ПСК с рфIX в присутствии анилина в качестве нуклеофильного катализатора
К 3,0 мг рфIX, растворенного в 1,4 мл 50 мМ натрий-ацетатного буфера с pH 6,0, добавили 14,1 мкл водного раствора периодата натрия (10 мкМ). Смесь встряхивали 1 ч в темноте при 4°C, затем реакцию остановили, выдержав раствор 15 минут при комнатной температуре после добавления 1,5 мкл 1M раствора глицерина. Низкомолекулярные примеси были удалены посредством эксклюзионной хроматографии на обессоливающей колонке PD-10 (GE Healthcare, Фэрфилд, Коннектикут). 1,2 мг окисленного рфIX, растворенного в 1,33 мл 50 мМ натрий-ацетатного буфера с pH 6,0, смешали с 70 мкл анилина (200 мМ базовый водного раствора) и встряхивали 45 мин при комнатной температуре. Далее, к смеси добавили 4,0 мг аминоокси-ПСК, встряхивали 2 часа при комнатной температуре и еще 16 часов при 4°C. Брали образцы спустя 1 ч, 2 ч и в конце реакции - спустя 18 ч. Избыток ПСК и несвязанного рфIX удаляли при помощи гидрофобной хроматографии. Проводимость охлажденной реакционной смеси была поднята до 180 мСм/см, затем она была загружена в 5 мл HiTrap Butyl FF (GE Healthcare, Фэрфилд, Коннектикут) колонку для гидрофобной хроматографии (1,6×2,5 см), заранее уравновешенную раствором 50 мМ HEPES, 3 M хлорида натрия, 6,7 мМ хлорида кальция, 0,01% Твин-80 с pH 6,9. Конъюгат был элюирован линейным градиентом 50 мМ HEPES, 6,7 мМ хлорида кальция, 0,005% Твин-80, с pH 7,4 в количестве 20 объемов колонки на потоке 5 мл/мин.
Пример 6
Связывание аминоокси-ПСК с рфIX и восстановление с NaCNBH3
К 10,5 мг рфIX, растворенного в 5,25 мл 50мМ натрий-ацетатного буфера с pH 6,0, добавили 53 мкл водного раствора периодата натрия (10мМ). Смесь встряхивали 1 ч в темноте при 4°C, затем реакцию остановили, выдержав раствор 15 минут при комнатной температуре после добавления 5,3 мкл 1M раствора глицерина. Низкомолекулярные примеси были удалены путем ультрафильтрации/диафильтрации (UF/DF) на концентраторах Vivaspin (Sartorius, Геттинген, Германия) (мембрана 30 кДа, регенерированная целлюлоза). Затем к ультрафильтрату добавили 35,9 мг аминоокси-ПСК, полученную смесь встряхивали 2 часа при комнатной температуре. Затем добавляли 53 мкл водного раствора цианоборогидрида натрия (5M) и выдерживали смесь еще 16 часов. После этого избыток ПСК удаляли при помощи гидрофобной хроматографии. Проводимость охлажденной реакционной смеси была поднята до 180 мСм/см, затем она была загружена в 5 мл HiTrap Butyl FF (GE Healthcare, Фэрфилд, Коннектикут) колонку для гидрофобной хроматографии (1,6×2,5 см), заранее уравновешенную раствором 50 мМ HEPES, 3 M хлорида натрия, 6,7 мМ хлорида кальция, 0,01% Твин-80 с pH 6,9. Конъюгат был элюирован раствором в количестве, равном 2,4 объемам колонки, содержащим 50 мМ HEPES, 6,7 мМ хлорида кальция, 0,005% Твин-80, с pH 7,4 на потоке 5 мл/мин.
Пример 7
Связывание аминоокси-ПСК (сшивающий агент: NH2[OCH2CH2]4ONH2) с рфIX и очистка конъюгата
К 5,6 мг рфIX, растворенного в 2,8 мл 50 мМ натрий-ацетатного буфера с pH 6,0, добавили 102 мкл водного раствора периодата натрия (10мМ). Смесь встряхивали 1 ч в темноте при 4°C, затем реакцию остановили, выдержав раствор 15 минут при комнатной температуре после добавления 2,9 мкл 1M раствора глицерина. Низкомолекулярные примеси были удалены путем ультрафильтрации/диафильтрации (UF/DF) на концентраторах Vivaspin (Sartorius, Геттинген, Германия) (мембрана 30 кДа, регенерированная целлюлоза). Затем к ультрафильтрату добавили 19 мг аминоокси-ПСК, полученную смесь встряхивали 18 часов при 4°C. После этого избыток ПСК удаляли при помощи гидрофобной хроматографии. Проводимость охлажденной реакционной смеси была поднята до 180 мСм/см, затем она была загружена в 5 мл HiTrap Butyl FF (GE Healthcare, Фэрфилд, Коннектикут) колонку для гидрофобной хроматографии (1,6×2,5 см), заранее уравновешенную раствором 50 мМ HEPES, 3 M хлорида натрия, 6,7 мМ хлорида кальция, 0,01% Твин-80 с pH 6,9. Конъюгат был элюирован раствором в количестве, равном 2,4 объемам колонки, содержащим 50 мМ HEPES, 6,7 мМ хлорида кальция, 0,005% Твин-80, с pH 7,4 на потоке 5 мл/мин.
Пример 8
Связывание аминоокси-ПСК с рфVIII
К 11 мг рфVIII, растворенного в 11 мл буфера HEPES с pH 6 (50 мМ HEPES, 5 мМ CaCl2, 150 мМ NaCl, 0,01% Твин), добавили 57 мкл водного раствора периодата натрия (10мМ). Смесь встряхивали 30 мин в темноте при 4°C, затем реакцию остановили, выдержав раствор 30 минут при 4°C после добавления 107 мкл 1M раствора глицерина. Затем к ультрафильтрату добавили 19,8 мг аминоокси-ПСК (18,8 кДа), полученную смесь встряхивали с вечера до утра при 4°C. Потом увеличили ионную силу путем добавления буфера, содержащего 8М ацетата аммония (8M ацетата аммония, 50 мМ HEPES, 5 мМ CaCl2, 350 мМ NaCl, 0,01% Твин-80, pH 6,9), получив итоговую концентрацию ацетата аммония в 2,5M. Далее, реакционная смесь была загружена в колонку HiTrap Butyl FF (GE Healthcare, Fairfield, CT), уравновешенную уравновешивающим буфером (2,5M ацетата аммония, 50мМ HEPES, 5 мМ CaCl2, 350 мМ NaCl, 0,01% Твин-80, pH 6,9). Продукт был элюирован элюирующим буфером (50 мМ HEPES, 5 мМ CaCl2, 0,01% Твин-80, pH 7,4), элюат был сконцентрирован фильтрованием на центрифуге с помощью устройства Vivaspin (Sartorius, Геттинген, Германия) с НОММ 30000.
Пример 9
Фармакокинетические исследования у мышей с гемофилией
фIX-дефицитным мышам вводили либо рфIX, либо ПСК-рфIX (приготовленный согласно примеру 4) в буфере для конечного препарата (10 мМ гистидина, 260 мМ глицина, 29 мМ сукрозы, 0,005% Твин-80, pH 6,8) в объемной дозе 10 мл/кг массы тела. Спустя 5 минут, 3 часа, 9, 16, 24 и 48 часов после инъекции субстанции умерщвлялись группы из 6 мышей, затем брали кровь посредством пункции сердца. Готовили цитратную плазму, затем ее замораживали для хранения до анализа на активность фIX.
Активность фIX определялась способом хромогенного анализа фIX (анализ Biophen FIX, Hyphen Biomed, Невиль-сюр-Уаз, Франция), были построены кривые элиминации (фигура 7). Фактические активные дозы фIX составили 123МЕ фIX/кг для ПСК-рфIX и 143МЕ фIX/кг для рфIX. Фармакокинетические параметры были определены при помощи программы R (The R Foundation for Statistical Computing, 2008). Восстановление in vivo составило 13% для рфIX и 29% для ПСК-рфIX. Скорректированный по дозе показатель AUC для ПСК-рфIX был повышен в 6,4 раз относительно рфIX, терминальный период полужизни был увеличен в 1,2 раз, среднее время удержания ПСК-рфIX было в 1,7 раз больше, чем рфIX (Таблица 2).
Пример 10
Полисиалирование белков свертывания крови
Полисиалирование, описанное в данном документе, может проводиться и с иными белками свертывания крови. К примеру, в различных случаях воплощения изобретения, вышеуказанное полисиалирование, согласно примерам 5, 6 и 9 с аминоокси-ПСК повторяется с такими белками свертывания, как фVIII, фVIIa и ФВф.
Пример 11
Приготовление гомобифункционального сшивающего агента NH2[OCH2CH2]6ONH2
Гомобифункциональный сшивающий агент NH2[OCH2CH2]6ONH2

(3,6,9,12,15-пентаоксогептадекан -1,17-диоксиамин), содержащий две активные аминооксигруппы, был синтезирован согласно Boturyn et al. (Tetrahedron 1997;53:5485-92) по двухэтапной органической реакции, включающей модифицированную реакцию Габриэля для синтеза первичных аминов. На первом этапе одна молекула гексаэтиленгликоля дихлорида взаимодействовала с двумя молекулами эндо-N-гидрокси-5-норборнен-2,3-дикарбоксимида в (ДМФ). Целевой гомобифункциональный продукт приготавливали из полученного интермедиата путем гидразинолиза в этаноле.
Пример 12
Полисилирование рфIX при помощи систем малеимидо-/аминоокси-сшивающих агентов
A. Приготовление модифицирующего реактива
Реактив аминоокси-ПСК приготавливается при помощи системы малеимидо-/аминоокси-сшивающих агентов (Toyokuni et al., Bioconjugate Chem 2003; 14, 1253-9). ПСК-SH (20 кДа), содержащая свободные концевые SH-группы, готовится по двухэтапной процедуре: a) приготовление ПСК-NH2 путем восстановительного аминирования окисленной ПСК при помощи NH4Cl согласно WO05016973A1 и b) внедрение сульфгидрильной группы путем взаимодействия терминальной первичной аминогруппы с 2-иминотиоланом (реактив Траута / Pierce, Рокфорд, Иллинойс), как описано в US7645860. ПСК-SH соединяется с малеимидной группой сшивающего агента при pH 7,5 в фосфатно-солевом буферном растворе с 10-кратным молярным избытком сшивающего агента и концентрацией ПСК-SH 50 мг/мл. Реакционную смесь, осторожно встряхивая, инкубируют 2 часа при комнатной температуре. Затем избыток сшивающего реактива удаляют и обменивают аминоокси-ПСК в окислительном буфере (50 мМ фосфата натрия, pH 6,0) способом диафильтрации. Буфер обменивают 25 раз на мембране Pellicon XL 5 кДа, изготовленной из регенерированной целлюлозы (Millipore, Биллерика, Массачуссетс).
B. Модифицирование рфIX после предварительного окисления при помощи NaIO4
рфIX окисляют в 50 мМ натрий-фосфатном буфере с pH 6,0 при помощи 100 мкМ периодата натрия в буфере. Смесь встряхивали 1 ч в темноте при 4°C, затем реакцию остановили, выдержав раствор 15 минут при комнатной температуре после добавления глицерина до итоговой концентрации в 5 мМ. Низкомолекулярные примеси были удалены посредством эксклюзионной хроматографии на обессоливающей колонке PD-10 (GE Healthcare, Фэрфилд, Коннектикут). Окисленный рфIX был затем смешан с анилином в конечной концентрации 10 мМ, затем был добавлен реагент аминоокси-ПСК в количестве, необходимом для достижения 5-кратного молярного избытка ПСК. Реакционную смесь, осторожно встряхивая, инкубируют 2 часа при комнатной температуре.
C. Очистка конъюгатов
Избыток реактива ПСК и свободного рфIX удаляют посредством гидрофобной хроматографии. Проводимость охлажденной реакционной смеси поднимают до 180 мСм/см и загружают в колонку, заполненную 48 мл Butyl-Sepharose FF (GE Healthcare, Фэрфилд, Коннектикут), заранее уравновешенную раствором 50 мМ HEPES, 3 M хлорида натрия, 6,7 мМ хлорида кальция, 0,01% Твин-80, pH 6,9. Далее конъюгат элюируют линейным градиентом 60% элюирующего буфера (50 мМ HEPES, 6,7 мМ хлорида кальция, pH 7,4) в 40 CV. Наконец, ПСК-рфIX-содержащие фракции собирают и подвергают ультрафильтрации/диафильтрации на мембране 30 кДа, изготовленной из регенерированной целлюлозы (Millipore). Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фIX. Для конъюгата ПСК-рфIX была определена специфическая активность в >50% в сравнении с нативным рфIX.
Пример 13
Приготовление реактива аминоокси-ПСК
Реактив аминоокси-ПСК был приготовлен согласно примеру 3. Конечный продукт был диафильтрован в буфере при pH 7,2 (50 мМ HEPES) с мембраной 5 кДа (регенерированная целлюлоза, Millipore), заморожен при -80°C и лиофилизирован. После лиофилизации реактив был растворен в достаточном объеме воды и использован для приготовления конъюгатов ПСК-белок посредством углеводного модифицирования.
Пример 14
Фармакокинетика полисиалированного рфVIII на фVIII-дефицитной нокаутной мышиной модели
Конъюгат ПСК-фVIII был приготовлен согласно примеру 8. Конъюгат показал специфическую активность в 6237 МЕ/мг (активность фVIII была определена по хромогенному анализу; общее содержание белка - способом Брэдфорда) и имел степень полисиалирования 6,7 (число молей ПСК на моль фVIII) согласно резорциновому способу (Svennerholm L, Biochim Biophys Acta 1957; 24: 604-11).
В качестве модели тяжелой человеческой гемофилии А использовались фVIII-дефицитные мыши, подробно описанные Bi et al. (Nat Genet 1995;10:119-21). Группам из 6 мышей вводился болюсно (200 МЕ фVIII/кг) в вену хвоста либо ПСК-рфVIII, приготовленный согласно примеру 8, либо нативный рфVIII (ADVATE, Baxter Healthcare Corporation) в дозе 200 МЕ фVIII/кг массы тела. Спустя 5 минут, 3, 6, 9, 16, 24, 32 и 42 часов после инъекции осуществляли анестезию и брали кровь посредством пункции сердца, из которой потом готовили цитратную плазму. Уровни активности фVIII плазмы измерялись хромогенным анализом. Результаты эксперимента представлены в таблице 3 и на фигуре 8. Расчеты производились при помощи ПО «R» версии 2.10.1 (Язык и среда для статистического программирования. R Foundation for Statistical Computing, Вена, Австрия. http://www.R-project.org.). В результате, среднее время удержания препарата в организме (СВУ) увеличилось с 5,4 ч (контроль Advate) до 11,1 ч для конъюгата ПСК-рфVIII.
Пример 15
Детальный синтез реактива аминоокси-ПСК
3-оксопентан-1,5-диоксиамин был синтезирован согласно Botyryn et al (Tetrahedron 1997; 53:5485-92) двухэтапным способом органического синтеза, описанным в Примере 1.
Этап 1:
К раствору эндо-N-гидрокси-5-норборнен-2,3-дикарбоксиимида (59,0 г; 1,00 экв) в 700 мл безводного N,N-диметилформамида добавили безводный K2CO3 (45,51 г; 1,00 экв) и 2,2-дихлордиэтиловый эфир (15,84 мл; 0,41 экв). Реакционную смесь перемешивали 22 ч при 50°C. Смесь была выпарена досуха под пониженным давлением. Остаток был суспендирован в 2 л дихлорметана и экстрагирован дважды насыщенным раствором NaCl в воде (каждый раз по 1 л). Дихлорметановый слой был высушен над Na2SO4 и выпарен досуха под пониженным давлением, высушен под высоким вакуумом. Было получено 64,5 г желтоватого порошка 3-оксопентан-1,5-диокси-эндо-2’,3’-дикарбоксиддимиднорборнена (промежуточный продукт 1).
Этап 2:
К раствору промежуточного продукта 1 (64,25 г; 1,00 экв) в 800 мл безводного этанола добавили 31,0 мл гидразингидрата (4,26 экв). Реакционную смесь кипятили с обратным холодильником 2 ч. Концентрация смеси была увеличена путем упаривания раствора до половины исходного объема под пониженным давлением. Выпавший осадок был отфильтрован. Оставшийся этаноловый слой был выпарен досуха под пониженным давлением. Остаток, содержащий сырой продукт 3-оксопентан-1,5-диоксиамина, был высушен в вакууме, было получено 46,3 г продукта. Сырой продукт был далее очищен хроматографией на колонке (Силикагель 60; изократическое элюирование смесью дихлорметан-этанол, 9+1), было получено 11,7 г чистого конечного продукта 3-оксапентан-1,5-диоксиамина.
Пример 16
Полисиалирование рфIX с использованием гидразида ПСК
рфIX полисиалируют при помощи гидразида ПСК, который готовят путем взаимодействия окисленной ПСК с дигидразидом адипиновой кислоты (ДГАК).
Этап 1: Приготовление гидразида ПСК
500 мг окисленной ПСК (молекулярная масса 20 кДа), полученной из Института сыворотки Индии (Пуна, Индия), было растворено в 8 мл 50 мМ натрий-ацетатного буфера с pH 5,5. Затем добавили 100 мг дигидразида адипиновой кислоты (ДГАК). Раствор осторожно встряхивали 2 ч. Затем добавили 44 мг цианоборогидрида натрия. После инкубирования реакционной смеси в течение еще 4 ч при 4°C, она была загружена в кассету для диализа Slide-A-Lyzer (Pierce, Рокфорд, Иллинойс) (мембрана 3,5 кДа, регенерированная целлюлоза) и диализирована в течение 4 дней в фосфатно-солевом буферном растворе при pH 7,2. Продукт был заморожен при -80°C.
Этап 2: Взаимодействие гидразида ПСК с рфIX и очистка конъюгата
рфIX полисиалируют при помощи реактива гидразида ПСК, описанного в п. этап 1. рфIX (концентрация 1 мг/мл) окисляют NaIO4 (концентрация: 80 мкМ) 1 ч в темноте при 4°C, осторожно встряхивая. Реакцию останавливают, добавляя глицерин, а окисленный фIX подвергают ультрафильтрации/диафильтрации на мембране 30 кДа, изготовленной из регенерированной целлюлозы (Vivaspin). Окисленный рфIX далее полисиалируют при pH 6,5 с 200-кратным молярным избытком реагента и концентрацией белка 1 мг/мл. рфIX и реагент полисиалирования инкубируют 2 часа в темноте при комнатной температуре, осторожно встряхивая. Наконец, конъюгат ПСК-рфIX очищают способом гидрофобной хроматографии. Проводимость охлажденной реакционной смеси поднимают до 130 мСм/см путем добавления буфера, содержащего ацетат аммония (50 мМ HEPES, 350 мМ NaCl, 5 мМ хлорида кальция, 8 M ацетата аммония, 0,01% Твин-80, pH 6,9), затем загружают в колонку HiTrap Butyl FF (5 мл, GE Healthcare, Фэрфилд, Коннектикут), заранее уравновешенную раствором 50 мМ HEPES, 2,5 M ацетата аммония, 350 мМ хлорида натрия, 5 мМ хлорида кальция, 0,01% Твин-80, pH 6,9. Конъюгат был элюирован раствором, содержащим 50 мМ HEPES, 5 мМ хлорида кальция, 0,01% Твин-80, pH 7,4. Наконец, ПСК-рфIX-содержащие фракции собирают и подвергают ультрафильтрации/диафильтрации на мембране 30 кДа, изготовленной из регенерированной целлюлозы (Vivaspin). Для конъюгата ПСК-рфIX была определена специфическая активность >50% в сравнении с нативным рфIX (хромогенный анализ).
Пример 17
Полисиалирование рфIX при помощи гидразида ПСК в присутствии анилина, выступающего нуклеофильным катализатором
123 мг рфIX растворяют в 60 мл фосфатного буфера (50 мМ NaPO4, pH 6,5). Затем к смеси добавляют 1,2 мл водного раствора периодата натрия (10 мМ) и инкубируют 1 ч в темноте при 4°C, осторожно встряхивая. Затем реакцию останавливают, выдерживая раствор 15 минут при комнатной температуре после добавления 600 мкл 1M водного раствора глицерина. Смесь подвергают ультрафильтрации/диафильтрации на мембране Pellicon XL Ultracel 30 кДа.
Фильтрат (63,4 мл), содержащий окисленный рфIX, разбавляют 59,6 мл фосфатного буфера (50 мМ NaPO4, pH 6,0), смешивают с 6,5 мл водного раствора анилина (200 мМ) и инкубируют 30 минут при комнатной температуре. Затем добавляют 12,3 мл реагента гидразида ПСК (приготовленного согласно примеру 16) до достижения 5-кратного молярного избытка реагента. Смесь инкубируют 2 часа при комнатной температуре в темноте при осторожном перемешивании.
Избыток реагента гидразида ПСК и свободный рфIX удаляют гидрофобной хроматографией. Проводимость охлажденной реакционной смеси поднимают до 180 мСм/см и загружают в колонку, заполненную 48 мл Butyl-Sepharose FF (GE Healthcare, Фэрфилд, Коннектикут), заранее уравновешенную раствором 50 мМ HEPES, 3 M хлорида натрия, 6,7 мМ хлорида кальция, 0,01% Твин-80, pH 6,9. Далее конъюгат был элюирован раствором, содержащим 50 мМ HEPES, 5 мМ хлорида кальция, 0,01% Твин-80, pH 7,4. Наконец, ПСК-рфIX-содержащие фракции собирают и подвергают ультрафильтрации/диафильтрации на мембране 30 кДа, изготовленной из регенерированной целлюлозы (Millipore). Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фIX. Для конъюгата ПСК-рфIX была определена специфическая активность в 50% в сравнении с нативным рфIX.
Пример 18
Полисиалирование рфIX и его очистка по двухэтапной процедуре
140 мг рфIX были растворены в 62 мл фосфатного буфера (50 мМ NaPO4, pH 6,0). Затем к смеси добавили 1,92 мл водного раствора периодата натрия (10 мМ) и инкубировали 1 ч в темноте при 4°C, осторожно встряхивая, затем реакцию остановили, выдержав 15 минут при комнатной температуре после добавления 64 мкл 1M раствора глицерина в воде. Потом смесь подвергли ультрафильтрации/диафильтрации на мембране Pellicon XL Ultracel 30 кДа.
Фильтрат (69,4 мл), содержащий окисленный рфIX, был разбавлен 73,8 мл фосфатного буфера (50 мМ NaPO4, pH 6,0), смешан с 8,2 мл водного раствора анилина (200 мМ) и инкубирован 30 минут при комнатной температуре. Затем добавили 12,3 мл аминоокси-реагента (приготовленного согласно примеру 3), что создало 2,5-кратный молярный избыток реагента. Эту смесь инкубировали 2,5 ч при комнатной температуре в темноте, осторожно перемешивая.
Свободный рфIX удалили посредством анион-обменной хроматографии. Реакционную смесь разбавили 20 мл буфера A (50 мМ HEPES, 5 мМ CaCl2, pH 7,5) и загрузили в колонку Q-Sepharose FF 26/10 (GE Healthcare, Фэрфилд, Коннектикут), предварительно уравновешенную буфером A. Затем колонку элюировали буфером B (50 мМ HEPES, 1M NaCl, 5мМ CaCl2, pH 7,5). Свободный рфIX элюируется при проводимости 12-25 мСм/см, а конъюгат - при 27-45 мСм/см. Проводимость конъюгат-содержащих фракций далее была поднята до 190 мСм/см путем добавления буфера C (50 мМ HEPES, 5 M NaCl, 5 мМ CaCl2, pH 6,9), далее они были загружены в колонку Butyl Sepharose FF 26/10 (GE Healthcare, Фэрфилд, Коннектикут), заранее уравновешенную буфером D (50 мМ HEPES, 3 M NaCl, 5 мМ CaCl2, pH 6,9). Свободный реагент ПСК был вымыт буфером D в количестве, равном 5 объемам колонки. Потом конъюгат был элюирован 100% буфером E (50 мМ HEPES, 5 мМ CaCl2, pH 7,4). Конъюгат-содержащие фракции были концентрированы ультрафильтрацией/диафильтрацией на мембране 10 кДа, изготовленной из регенерированной целлюлозы (88 см2, порог фильтрации 10 кДа / Millipore). Конечный этап диафильтрации был проведен в гистидиновом буфере с pH 7,2, содержащем 150 мМ NaCl и 5 мМ CaCl2. Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фIX. Специфическая активность конъюгата ПСК-рфIX составила >50% от нативного рфIX.
Пример 19
Связывание аминоокси-ПСК с рфVIIa и очистка конъюгата
Раствор 10 мг рфVIIa в 5 мл реакционного буфера (50 мМ HEPES, 150 мМ хлорида натрия, 5 мМ хлорида кальция, pH 6,0) смешивают с водным раствором NaIO4 (конечная концентрация: 100 мкМ) и инкубируют 1 ч при 4°C в темноте, осторожно перемешивая, затем реакцию останавливают, выдерживая раствор 15 минут после добавления водного раствора цистеина (конечная концентрация: 1 мМ). Реакционную смесь подвергают ультрафильтрации/диафильтрации. К фильтрату (10 мл) добавляют 30-кратный молярный избыток аминоокси-реагента (приготовленного согласно примеру 1). Реакцию связывания проводят 2 часа при комнатной температуре в темноте, осторожно встряхивая. Избыток аминоокси-реагента удаляют посредством гидрофобной хроматографии. Проводимость охлажденной реакционной смеси поднимают до 130 мСм/см путем добавления буфера, содержащего ацетат аммония (50 мМ HEPES, 350 мМ NaCl, 5 мМ хлорида кальция, 8 M ацетата аммония, 0,01% Твин-80, pH 6,9), затем загружают в колонку HiTrap Butyl FF (5 мл, GE Healthcare, Фэрфилд, Коннектикут), заранее уравновешенную раствором 50 мМ, 2,5 M ацетата аммония, 350 мМ хлорида натрия, 5 мМ хлорида кальция, 0,01% Твин-80, pH 6,9. Конъюгат элюируют линейным градиентом 100% элюирующего буфера, содержащего 50 мМ HEPES, 5 мМ хлорида кальция, 0,01% Твин-80, pH 7,4. Наконец, ПСК-рфVIIa-содержащие фракции собирают и подвергают ультрафильтрации/диафильтрации на мембране 30 кДа, изготовленной из регенерированной целлюлозы (Vivaspin). Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фVIIa (Staclot assay, Diagnostica Stago, Асньер, Франция). Была определена специфическая активность в >20% в сравнении с исходным рфVIIa.
Пример 20
Связывание аминоокси-ПСК с рфVIIa в присутствии анилина, выступающего нуклеофильным катализатором
К 3,0 мг рфVIIa, растворенного в 1,4 мл 50 мМ натрий-ацетатного буфера с pH 6,0, добавили 14,1 мкл водного раствора периодата натрия (10 мкМ). Смесь встряхивали 1 ч в темноте при 4°C, затем реакцию остановили, выдержав раствор 15 минут при комнатной температуре после добавления 1,5 мкл 1M раствора глицерина. Низкомолекулярные примеси были удалены посредством эксклюзионной хроматографии на обессоливающей колонке PD-10 (GE Healthcare, Фэрфилд, Коннектикут). 3 мг окисленного рфVIIa, растворенного в 3 мл 50 мМ натрий-ацетатного буфера с pH 6,0, смешали с анилином (нуклеофильный катализатор, конечная концентрация: 10 мМ) и встряхивали 30 мин при комнатной температуре. Далее, к смеси добавили 5-кратный молярный избыток аминоокси-ПСК, смесь встряхивали 2 часа при комнатной температуре. Избыток реагента ПСК и несвязанного рфIX удаляли при помощи гидрофобной хроматографии. Проводимость охлажденной реакционной смеси была поднята до 180 мСм/см, затем она была загружена в 5 мл HiTrap Butyl FF (GE Healthcare, Фэрфилд, Коннектикут) колонку для гидрофобной хроматографии (1,6×2,5 см), заранее уравновешенную раствором 50 мМ HEPES, 3 M хлорида натрия, 6,7 мМ хлорида кальция, 0,01% Твин-80 с pH 6,9. Конъюгат был элюирован линейным градиентом 50 мМ HEPES, 6,7 мМ хлорида кальция, 0,005% Твин-80, с pH 7,4 в количестве 20 объемов колонки на потоке 5 мл/мин.
Пример 21
Приготовление реагента аминоокси-ПЭГ
Разветвленный альдегид ПЭГ (молекулярный 40 кДа) используется для связывания с диаминоокси-сшивающим агентом, приготовленным так, как описано в примере 1. Реагент альдегида ПЭГ доступен в продаже у NOF (NOF Corp., Токио, Япония). 500 мг альдегида ПЭГ растворяют в 8 мл 50 мМ натрий-ацетатного буфера с pH 5,5. Затем добавляют 100 мг 3-оксопентан-1,5-диоксиамина. Встряхивают 2 ч при комнатной температуре, затем добавляют 44 мг цианоборогидрида натрия. После встряхивания в течение еще 4 ч при 4°C, реакционную смесь загружают в кассету для диализа Slide-A-Lyzer (Pierce, Рокфорд, Иллинойс) (мембрана 3,5 кДа, регенерированная целлюлоза) и диализируют в течение 4 дней в фосфатно-солевом буферном растворе при pH 7,2. Продукт замораживают при -80°C.
Пример 22
Пегилирование рфIX реагентом аминоокси-ПЭГ
рфIX пегилируют при помощи линейного 20 кДа реагента пегилирования, содержащего аминоокси-группу. Пример такого реагента - серия Sunbright® CA от NOF (NOF Corp., Токио, Япония). рфIX окисляют при концентрации белка 2 мг/мл при помощи NaIO4 (конечная концентрация: 100 мкМ) 1 час, осторожно встряхивая в темноте при 4°C в реакционном буфере (50 мМ HEPES, 150 мМ хлорида натрия, 5 мМ хлорида кальция, pH 6,0), останавливают реакцию, выдерживая раствор 15 минут после добавления водного раствора глицерина (конечная концентрация: 1 мМ). Реакционную смесь подвергают ультрафильтрации/диафильтрации. К фильтрату добавляют 3-кратный избыток аминоокси-реагента и анилина (нуклеофильный катализатор, конечная концентрация: 10 мМ). Реакцию связывания проводят в течение 2 часов при комнатной температуре в темноте, осторожно встряхивая. Наконец, конъюгат ПЭГ-рфIX очищают способом ионообменной хроматографии на Q-Sepharose FF. Гель, содержащий 1,5 мг протеина/мл, загружают в колонку, предварительно уравновешенную 50 мМ трис с pH 8,0. Конъюгат элюируют 50 мМ трис и 1 M хлоридом натрия с pH 8,0 в количестве 20 объемов колонки, а затем подвергают ультрафильтрации/диафильтрации на мембране 30 кДа. Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фIX. Специфическая активность конъюгата ПЭГ-рфIX составила >75% от нативного рфIX.
Пример 23
Пегилирование рфVIII реагентом аминоокси-ПЭГ
рфVIII пегилируют при помощи линейного 20 кДа реагента пегилирования, содержащего аминоокси-группу. Пример такого реагента - серия Sunbright® CA от NOF (NOF Corp., Токио, Япония). рфVIII окисляют при концентрации белка 1 мг/мл при помощи NaIO4 (конечная концентрация: 100 мкМ) 1 час, осторожно встряхивая в темноте при 4°C в реакционном буфере (50 мМ HEPES, 150 мМ хлорида натрия, 5 мМ хлорида кальция, pH 6,0), останавливают реакцию, выдерживая раствор 15 минут после добавления водного раствора глицерина (конечная концентрация: 1 мМ). Реакционную смесь подвергают ультрафильтрации/диафильтрации. К фильтрату добавляют 20-кратный избыток аминоокси-реагента и анилина (нуклеофильный катализатор, конечная концентрация: 10 мМ). Реакцию связывания проводят в течение 2 часов при комнатной температуре в темноте, осторожно встряхивая. Наконец, конъюгат ПЭГ-рфVIII очищают способом ионообменной хроматографии на Q-Sepharose FF. Гель, содержащий 1,5 мг протеина/мл, загружают в колонку, предварительно уравновешенную буфером 50 мМ HEPES с pH 7,4, содержащим 5 мМ CaCl2. Конъюгат элюируют буфером 50 мМ HEPES, содержащим 5 мМ CaCl2 и 500 мМ хлорида натрия, pH 7,4, а затем подвергают ультрафильтрации/диафильтрации на мембране 30 кДа. Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фVIII. Специфическая активность конъюгата ПЭГ-рфVIII составила >60% от исходного рфVIII.
Пример 24
Пегилирование рфVIIa реагентом аминоокси-ПЭГ
рфVIIa пегилируют при помощи линейного 20 кДа реагента пегилирования, содержащего аминоокси-группу. Пример такого реагента - серия Sunbright® CA от NOF (NOF Corp., Токио, Япония). рфVIIa окисляют при концентрации белка 2 мг/мл при помощи NaIO4 (конечная концентрация: 100 мкМ) 1 час, осторожно встряхивая в темноте при 4°C в реакционном буфере (50 мМ HEPES, 150 мМ хлорида натрия, 5 мМ хлорида кальция, pH 6,0), останавливают реакцию, выдерживая раствор 15 минут после добавления водного раствора глицерина (конечная концентрация: 1 мМ). Реакционную смесь подвергают ультрафильтрации/диафильтрации. К фильтрату добавляют 5-кратный избыток аминоокси-реагента и анилина (нуклеофильный катализатор, конечная концентрация: 10 мМ). Реакцию связывания проводят в течение 2 часов при комнатной температуре в темноте, осторожно встряхивая. Наконец, конъюгат ПЭГ-рфVIIa очищают способом ионообменной хроматографии на Q-Sepharose FF. Гель, содержащий 1,5 мг протеина/мл, загружают в колонку, предварительно уравновешенную буфером 20 мМ HEPES с pH 7,4, содержащим 1 мМ CaCl2. Конъюгат элюируют буфером 20 мМ HEPES, содержащим 1 мМ CaCl2 и 500 мМ хлорида натрия, pH 7,4, а затем подвергают ультрафильтрации/диафильтрации на мембране 30 кДа. Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фVIIa. Специфическая активность конъюгата ПЭГ-рфVIIa составила >25% от исходного рфVIIa.
Пример 25
Пегилирование рфIX ПЭГ-гидразидным реагентом
рфIX пегилируют при помощи линейного 20 кДа реагента пегилирования, содержащего гидразидную группу. Пример такого реагента - серия Sunbright® HZ от NOF (NOF Corp., Токио, Япония). рфIX окисляют при концентрации белка 2 мг/мл при помощи NaIO4 (конечная концентрация: 100 мкМ) 1 час, осторожно встряхивая в темноте при 4°C в реакционном буфере (50 мМ HEPES, 150 мМ хлорида натрия, 5 мМ хлорида кальция, pH 6,0), останавливают реакцию, выдерживая раствор 15 минут после добавления водного раствора глицерина (конечная концентрация: 1 мМ). Реакционную смесь подвергают ультрафильтрации/диафильтрации. К фильтрату добавляют 50-кратный избыток гидразидного реагента и анилина (нуклеофильный катализатор, конечная концентрация: 10 мМ). Реакцию связывания проводят в течение 2 часов при комнатной температуре в темноте, осторожно встряхивая. Наконец, конъюгат ПЭГ-рфIX очищают способом ионообменной хроматографии на Q-Sepharose FF. Реакционную смесь (1,5 мг протеина/мл геля) загружают в колонку, предварительно уравновешенную 50 мМ трис с pH 8,0. Конъюгат элюируют трис-буфером с pH 8,0 (50 мМ трис, 1 M NaCl) в количестве 20 объемов колонки, а затем подвергают ультрафильтрации/диафильтрации на мембране 30 кДа. Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фIX. Специфическая активность конъюгата ПЭГ-рфIX составила >50% от нативного рфIX.
Пример 26
Полисиалирование рфVIII в присутствии 2мМ анилина
рфVIII переносят в реакционный буфер (50 мМ HEPES, 350 мМ хлорида натрия, 5 мМ хлорида кальция, 0,01% Твин-80, pH 6), разбавляют до концентрации белка 1 мг/мл и окисляют при помощи NaIO4 (конечная концентрация: 100 мкМ) в течение 1 часа, осторожно встряхивая в темноте при 4°C в реакционном буфере (50 мМ HEPES, 150 мМ хлорида натрия, 5 мМ хлорида кальция, pH 6,0), затем реакцию останавливают, выдерживая раствор 15 минут после добавления раствора цистеина в воде (конечная концентрация: 1 мМ). Реакционную смесь подвергают ультрафильтрации/диафильтрации. К фильтрату добавляют 20-кратный избыток аминоокси-реагента и анилин (нуклеофильный катализатор, конечная концентрация: 2 мМ). Реакцию связывания проводили 2 часа при комнатной температуре в темноте, осторожно встряхивая. Избыток аминоокси-реагента удаляют посредством гидрофобной хроматографии. Проводимость охлажденной реакционной смеси поднимают до 130 мСм/см путем добавления буфера, содержащего ацетат аммония (50 мМ HEPES, 350 мМ NaCl, 5 мМ хлорида кальция, 8 M ацетата аммония, 0,01% Твин-80, pH 6,9), затем загружают в колонку, заполненную 53 мл Butyl-Sepharose FF (GE Healthcare, Фэрфилд, Коннектикут), заранее уравновешенную раствором 50 мМ HEPES, 2,5 M ацетата аммония, 350 мМ хлорида натрия, 5 мМ хлорида кальция, 0,01% Твин-80, pH 6,9. Конъюгат был элюирован раствором, содержащим 50 мМ HEPES, 5 мМ хлорида кальция, 0,01% Твин-80, pH 7,4. Наконец, ПСК-рфIX-содержащие фракции собирают и подвергают ультрафильтрации/диафильтрации на мембране 30 кДа, изготовленной из регенерированной целлюлозы (Millipore, Биллерика, Массачуссетс). Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фVIII. Для конъюгата ПСК-рфVIII была определена специфическая активность в 80% в сравнении с нативным рфVIII.
Пример 27
Полисиалирование рфVIII в присутствии 10мМ анилина
рфVIII переносят в реакционный буфер (50 мМ HEPES, 350 мМ хлорида натрия, 5 мМ хлорида кальция, 0,01% Твин-80, pH 6), разбавляют до концентрации белка 1 мг/мл и окисляют при помощи NaIO4 (конечная концентрация: 100 мкМ) в течение 1 часа, осторожно встряхивая в темноте при 4°C в реакционном буфере (50 мМ HEPES, 150 мМ хлорида натрия, 5 мМ хлорида кальция, pH 6,0), затем реакцию останавливают, выдерживая раствор 15 минут после добавления раствора цистеина в воде (конечная концентрация: 1 мМ). Реакционную смесь подвергают ультрафильтрации/диафильтрации. К фильтрату добавляют 20-кратный избыток аминоокси-реагента и анилин (нуклеофильный катализатор, конечная концентрация: 10 мМ). Реакцию связывания проводили 2 часа при комнатной температуре в темноте, осторожно встряхивая. Избыток аминоокси-реагента удаляют посредством гидрофобной хроматографии. Проводимость охлажденной реакционной смеси поднимают до 130 мСм/см путем добавления буфера, содержащего ацетат аммония (50 мМ HEPES, 350 мМ NaCl, 5 мМ хлорида кальция, 8 M ацетата аммония, 0,01% Твин-80, pH 6,9), затем загружают в колонку, заполненную 53 мл Butyl-Sepharose FF (GE Healthcare, Фэрфилд, Коннектикут), заранее уравновешенную раствором 50 мМ HEPES, 2,5 M ацетата аммония, 350 мМ хлорида натрия, 5 мМ хлорида кальция, 0,01% Твин-80, pH 6,9. Конъюгат был элюирован раствором, содержащим 50 мМ HEPES, 5 мМ хлорида кальция, 0,01% Твин-80, pH 7,4. Наконец, ПСК-рфIX-содержащие фракции собирают и подвергают ультрафильтрации/диафильтрации на мембране 30 кДа, изготовленной из регенерированной целлюлозы (Millipore, Биллерика, Массачуссетс). Для препарата были определены общее содержание белка (количественный биуретовый анализ содержания белков с использованием бицинхониновой кислоты (БЦК)) и хромогенная активность фVIII. Для конъюгата ПСК-рфVIII была определена специфическая активность в 80% в сравнении с нативным рфVIII.
Пример 28
Пегилирование белка свертывания крови при помощи разветвленного ПЭГ
Пегилирование белков свертывания крови (например, фIX, фVIII и фVIIa, как описано в примерах 22-25) может осуществляться также и с разветвленным или линейным реагентом для пегилирования, как описано в примере 21, который приготовлен из альдегида и подходящего сшивающего агента, содержащего активную аминоокси-группу.
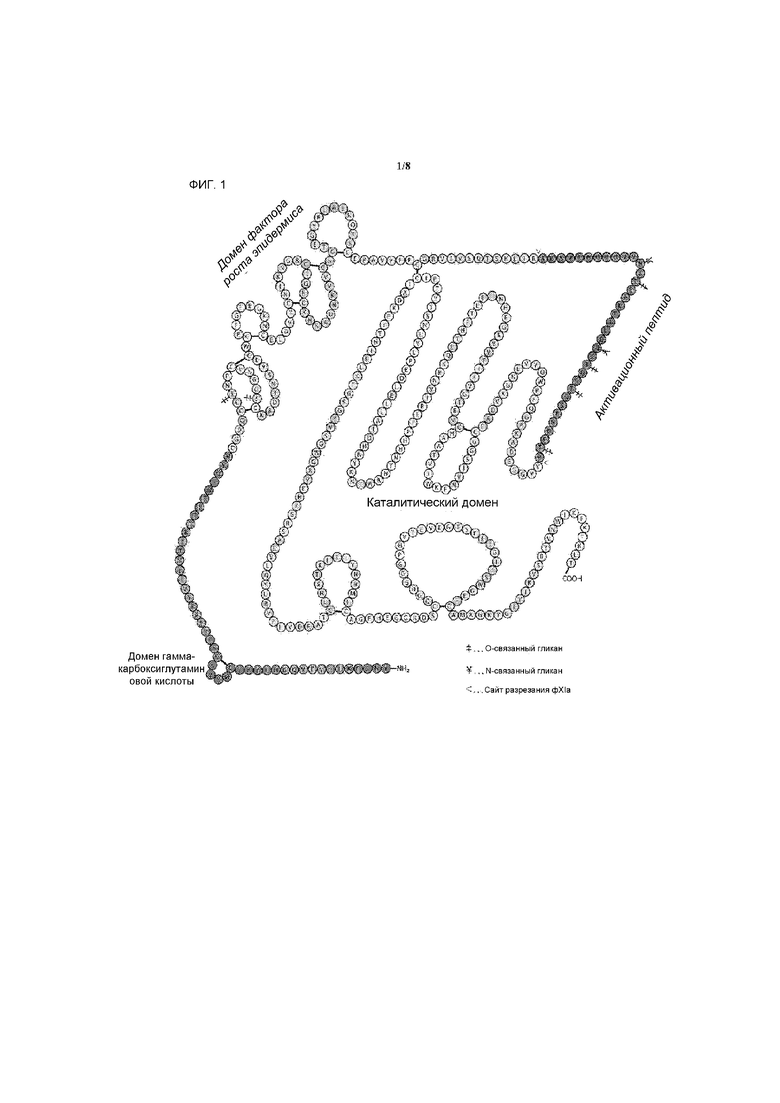
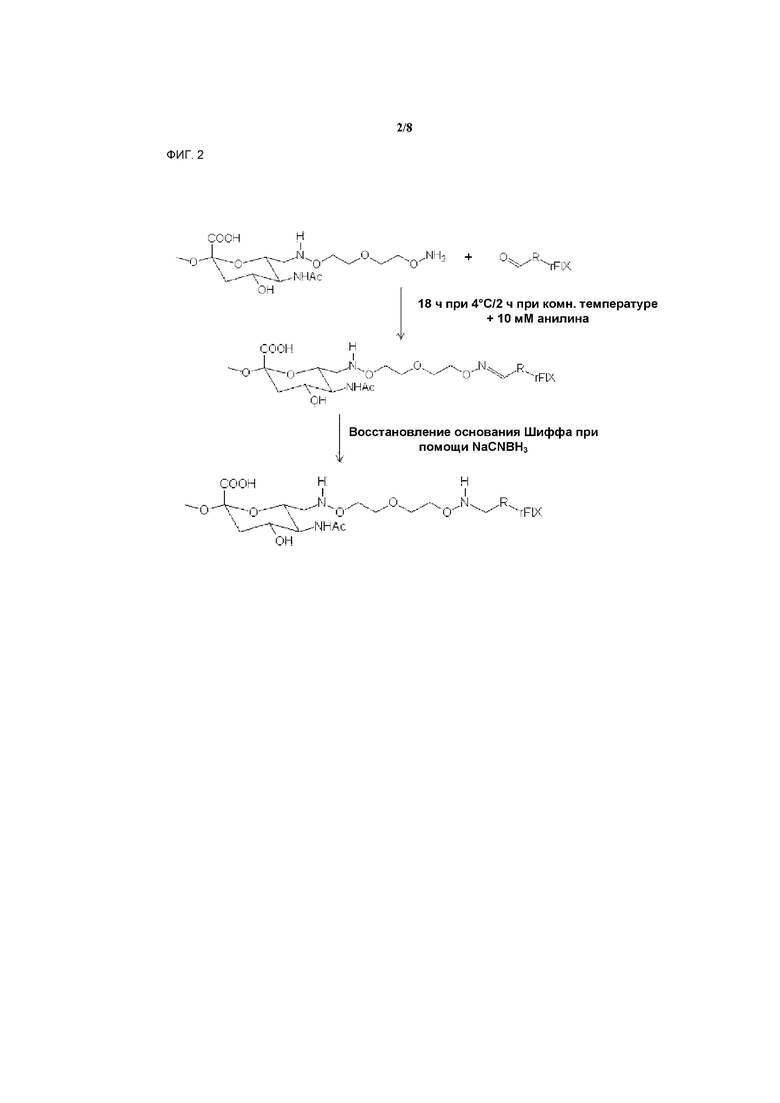


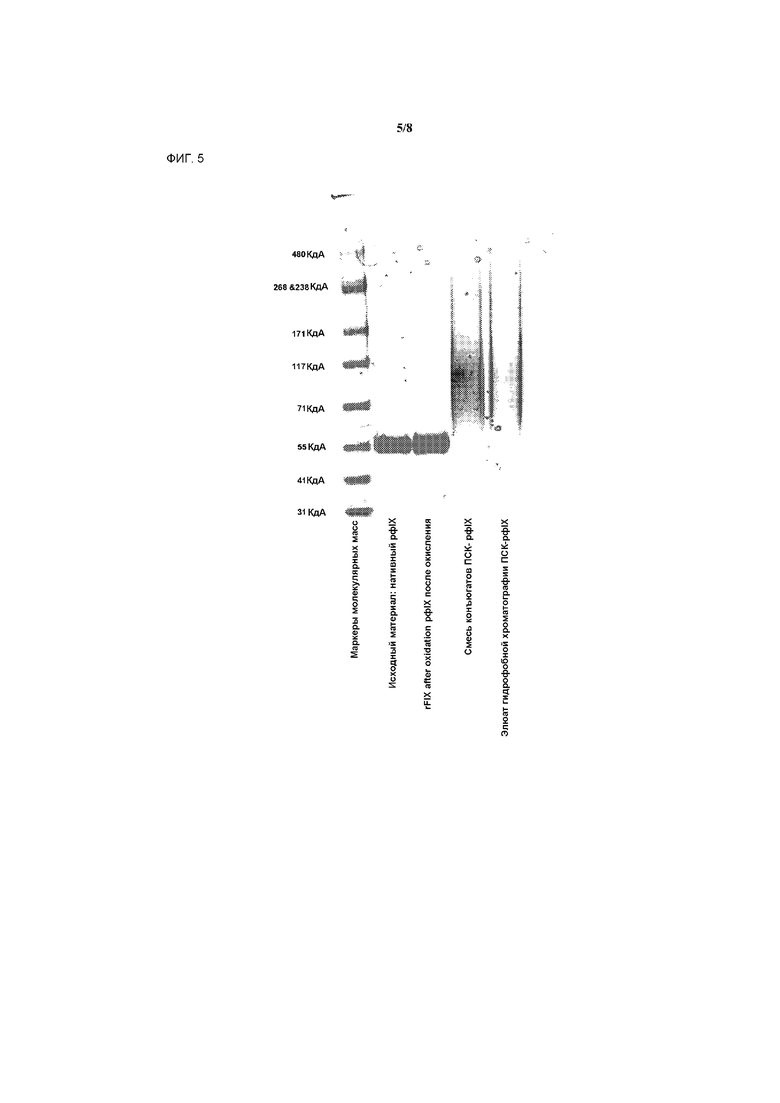
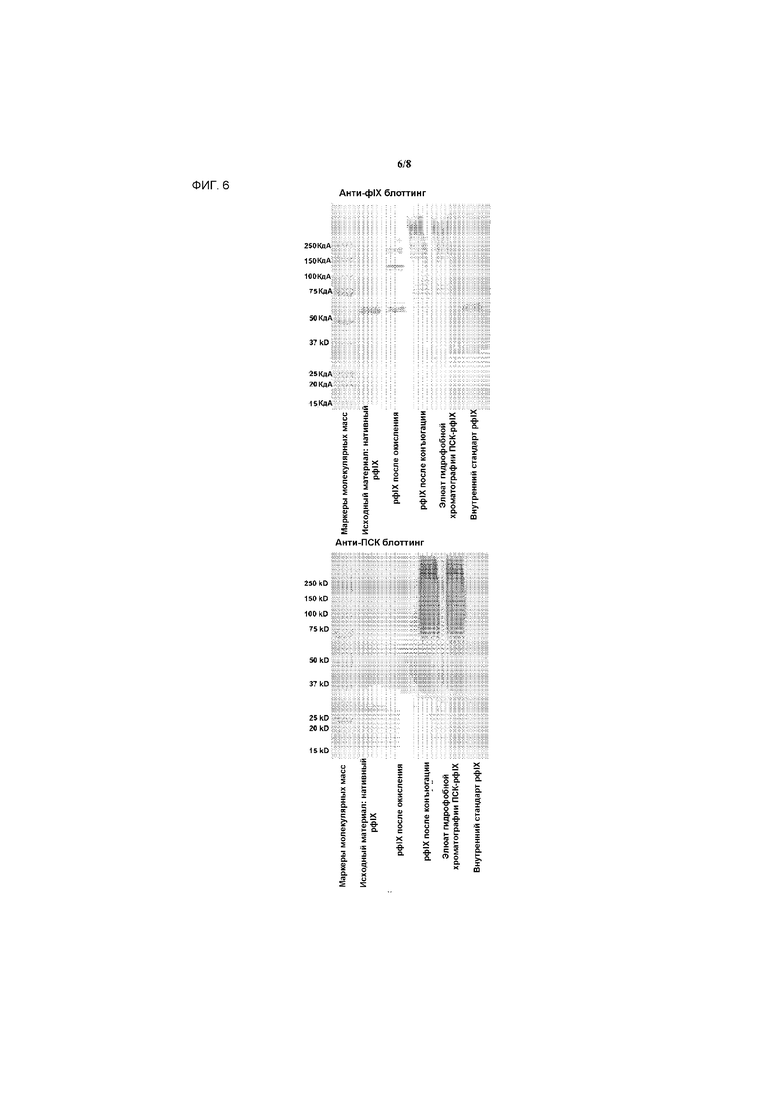

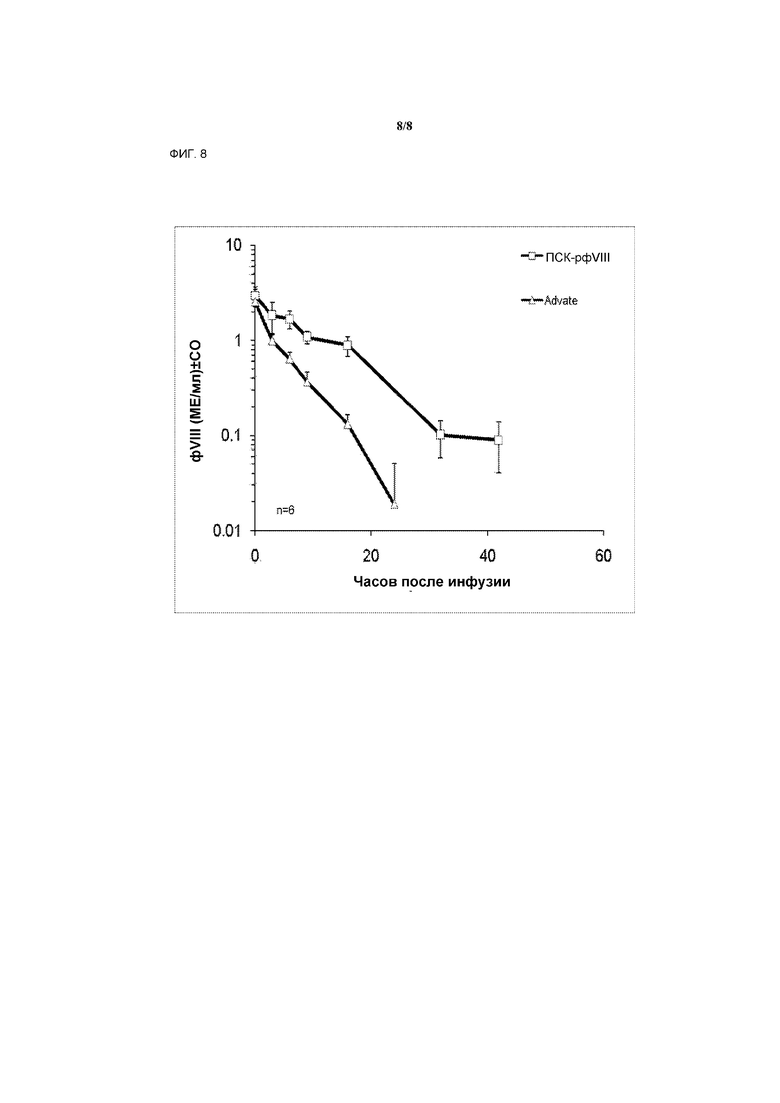
Изобретение относится к модифицированному белку свертывания крови, содержащему: белок свертывания крови, выбранный из группы, состоящей из фактора IX (фIX), фактора VIII (фVIII) или их биологически активных фрагментов и производных; и по меньшей мере один водорастворимый полимер, который представляет собой полисиаловую кислоту (ПСК), которая модифицирована сшивающим агентом, связанным с указанным белком свертывания крови из (a) по одному или более окисленных углеводных фрагментов; где указанный сшивающий агент содержит 1-50 единиц этиленгликоля и где указанный белок свертывания крови имеет оксимную связь между указанными одним или более окисленными углеводными фрагментами и указанным сшивающим агентом на водорастворимом полимере. 18 з.п. ф-лы, 8 ил., 3 табл., 16 пр.
1. Модифицированный белок свертывания крови, содержащий:
(a) белок свертывания крови, выбранный из группы, состоящей фактора IX (фIX), фактора VIII (фVIII) или их биологически активных фрагментов и производных; и
(b) по меньшей мере один водорастворимый полимер, который представляет собой полисиаловую кислоту (ПСК), которая модифицирована сшивающим агентом, связанным с указанным белком свертывания крови из (a) по одному или более окисленных углеводных фрагментов;
где указанный сшивающий агент содержит 1-50 единиц этиленгликоля, и
где указанный белок свертывания крови имеет оксимную связь между указанными одним или более окисленными углеводными фрагментами и указанным сшивающим агентом на водорастворимом полимере.
2. Модифицированный белок свертывания крови по п. 1, где указанный модифицированный белок свертывания крови представляет собой фактор IX (фIX) и имеет специфическую активность по меньшей мере 50% относительно немодифицированного фIX.
3. Модифицированный белок свертывания крови по п. 1, где указанный модифицированный белок свертывания крови представляет собой фактор VIII (фVIII) и имеет специфическую активность по меньшей мере 60% относительно немодифицированного фVIII.
4. Модифицированный белок свертывания крови по п. 1, где указанный сшивающий агент содержит 2 или 4 единицы этиленгликоля.
5. Модифицированный белок свертывания крови по п. 1, где ПСК содержит 5-500 единиц сиаловой кислоты.
6. Модифицированный белок свертывания крови по п. 1, где ПСК содержит 10-300 единиц сиаловой кислоты.
7. Модифицированный белок свертывания крови по п. 1, где ПСК имеет молекулярный вес от 2000 до 45000 Да.
8. Модифицированный белок свертывания крови по п. 1, где ПСК имеет молекулярный вес от 3000 до 35000 Да.
9. Модифицированный белок свертывания крови по п. 1, где ПСК имеет молекулярный вес от 5000 до 25000 Да.
10. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови представляет собой фIX или его биологически активный фрагмент или производное.
11. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови представляет собой фVIII или его биологически активный фрагмент или производное.
12. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фVIII, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да.
13. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фVIII, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да, где указанный сшивающий агент содержит 2 или 4 единицы этиленгликоля.
14. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фVIII, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да, и где указанный модифицированный белок свертывания крови имеет специфическую активность по меньшей мере 50% относительно немодифицированного белка свертывания крови.
15. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фVIII, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да, где указанный сшивающий агент содержит 2 или 4 единицы этиленгликоля, и где указанный модифицированный белок свертывания крови имеет специфическую активность по меньшей мере 50% относительно немодифицированного белка свертывания крови.
16. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фIX, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да.
17. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фIX, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да, где указанный сшивающий агент содержит 2 или 4 единицы этиленгликоля.
18. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фIX, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да, и где указанный модифицированный белок свертывания крови имеет специфическую активность по меньшей мере 50% относительно немодифицированного белка свертывания крови.
19. Модифицированный белок свертывания крови по п. 1, где указанный белок свертывания крови имеет биологическую активность фIX, указанный водорастворимый полимер представляет собой ПСК, имеющую молекулярный вес от 3000 до 35000 Да, где указанный сшивающий агент содержит 2 или 4 единицы этиленгликоля, и где указанный модифицированный белок свертывания крови имеет специфическую активность по меньшей мере 50% относительно немодифицированного белка свертывания крови.
| WO 2008025856 A2, 06.03.2008 | |||
| US 20040224366 A1, 11.11.2004 | |||
| Francesco M | |||
| Veronese | |||
| Peptide and protein PEGylation: a review of problems and solutions / Biomaterials, 2001, V.22, pp.405-417 | |||
| МОЛЕКУЛЫ, ПОДОБНЫЕ ФАКТОРУ VII ИЛИ VIIA | 2001 |
|
RU2278123C2 |
Авторы
Даты
2021-03-05—Публикация
2010-07-26—Подача