Изобретение относится к биотехнологии, а именно к способу стабилизации фицина растворами гиалуроновой кислоты и графт-сополимерами с полисахаридной основной цепью из карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с боковыми цепями из гомополимеров N-винилимидазола (ВИ) или N,N-диметиламиноэтилметакрилата (ДМАЭМА). Изобретение может быть использовано в химико-фармацевтической промышленности, медицинской практике, косметологии.
Фицин (КФ 3.4.22.3) - протеолитический фермент, присутствующий в латексе фиговых деревьев, содержит остаток цистеина в активном центре. Фицин входит в состав группы препаратов, предназначенных для ферментативной обработки тканевых продуктов с получением бесклеточной тканевой матрицы, применяемых в хирургии и трансплантологии [Патент RU 2639477 С2, МПК A61L 27/24, опубл. 21.12.2017, Бюл. №36]. Известна пероральная композиция для предотвращения и уменьшения адгезии бактерий к поверхностям ротовой полости, включающая фицин [Патент RU 2007126845 А, МПК A61K 8/66, дата публ. заявки 27.01.2009, Бюл. №3]. Фицин используется для изготовления средств для лечения и/или профилактики глазных болезней, связанных с неоангиогенезом: макулярной дегенерации, связанной с возрастом (AMD), хориоидальной реваскуляризации, болезни Хиппеля-Линдау, реваскуляризации радужной оболочки, ишемической пролиферативной ретинопатии, реваскуляризации роговой оболочки, и пролиферативной ретинопатии серповидных клеток [Патент RU 2472523 С2, МПК A61K 38/48, А61Р 27/02, опубл. 20.01.2013 Бюл. №2].
Гиалуроновая кислота - природный полисахарид животного происхождения, широко распространен в природе, содержится в основном веществе многих видов соединительной и нервной ткани (в коже, связках, пуповине, сердечных клапанах, стекловидном теле глаза, роговице и др.) и биологических жидкостях (слюне, синовиальной и суставной жидкости). В соединительной ткани дермы гиалуроновая кислота расположена между волокнами коллагена и эластина. Гиалуроновая кислота используется при создании косметических средств ухода за кожей (увлажняющих кремов, масок-салфеток, солнцезащитных гелей, декоративной косметики), терапевтических препаратов для коррекции возрастных изменений кожи и реабилитации после проведения пилингов и пластических операций.
Имеются сведения о комплексном косметическом средстве, содержащем гиалуроновую кислоту. Описанное изобретение обеспечивает омолаживающее, противовоспалительное действие и лифтинг-эффект, кроме того, обладает мощным местным иммуностимулирующим действием, длительным сроком хранения и повышенной биологической активностью [Патент RU 2514003 С1, МПК A61K 8/02, A61K 8/73, A61K 8/19, A61K 8/64, A61K 8/92, В82В 1/00, A61Q 19/00, опубл. 27.04.2014, Бюл. №12]. Гиалуроновая кислота входит в состав пилингового косметического средства, за счет гидратации она усиливает степень отшелушивания, а пилинговый препарат за счет удаления поверхностного эпителия способствует более глубокому проникновению гиалуроновой кислоты в глубокие слои кожи, и соответственно, усилению эффекта гидратации [Патент RU 2524666 С1, МПК A61K 8/18. A61K 8/73, A61K 8/72, A61Q 19/08, A61Q 19/10, опубл. 27.07.2014, Бюл. №21]. Описана композиция внутреннего применения для коррекции гормонального старения кожи, содержащая гиалуроновую кислоту. Эффект композиции заключается в коррекции гормонального старения кожи, увеличения плотности и тургора кожи за счет стимулирования выработки коллагено-эластиновых волокон и обеспечения антиоксидантной защиты [Патент RU 2527344 С2, МПК А61К 36/8945, А61Р 17/00, опубл. 27.08.2014 Бюл. №24]. Деструктурированная гиалуроновая кислота амфифильной формы включена в состав комплексного косметического средства, обеспечивающего повышение проникающей способности активных компонентов и усиление косметических эффектов применения, а именно улучшение показателей влагометрии, эластометрии, профилометрии, а также состояния волос и ногтей [Патент RU 2618428 С1, МПК A61K 8/04, A61K 8/73, A61K 8/63, A61K 8/23, A61K 8/27, A61K 8/25, A61K 8/19, A61Q 19/08, A61Q 5/12, опубл. 03.05.2017 Бюл. №13].
Известно, что графт-сополимеры карбоксиметилцеллюлозы или хитозана с боковыми цепями из N-винилимидазола или N,N-диметиламиноэтилметакрилата являются биодеградируемыми за счет наличия основной цепи из модифицированных полисахаридов [N.М. Mahmoodi, М.Н. Saffar-Dastgerdi, В. Hayati. Environmentally friendly novel covalently immobilized enzyme bionanocomposite: From synthesis to the destruction of pollutant. Composites Part B: Engineering. 2020. Vol. 184. P. 107666; K.J. Edgar, С.M. Buchanan, J.S. Debenham et al. Advances in cellulose ester performance and application. Progress in Polymer Science. 2001. Vol. 26. P. 1605-1688], а также могут выступать в качестве носителя противоопухолевого препарата «Паклитаксел» при пероральном или внутривенном введении [V.А. Kuznetsov, А.V. Sorokin, М.S. Lavlinskaya et al. Graft copolymers of carboxymethyl cellulose with N-vinylimidazole: synthesis and application for drug delivery. 2019. Polymer Bulletin. Vol. 76. P. 4929-4949; V.A. Kuznetsov, A.V. Sorokin, M.S. Lavlinskaya. Synthesis of graft copolymers of carboxymethyl cellulose and N,N-dimethylaminoethyl methacrylate and their study as Paclitaxel carriers. 2020. Polymer Bulletin. DOI: 10.1007/s00289-020-03250-z].
На данный момент нет сведений о комплексах растительного фермента фицина с гиалуроновой кислотой и полисахаридами, модифицированными виниловыми мономерами, такими как графт-сополимеры карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА).
Известен способ получения гетерогенного препарата на основе фицина [Патент RU 2677858 С2, МПК A61K 31/74, A61K 38/46, А61Р 17/02, C12N 11/08, опубл. 22.01.2019, Бюл. №3]. Данный способ включает иммобилизацию фицина в буферном растворе на матрицу ионообменных волокон ВИОН КН-1 в соотношении 20 мл буферного раствора фицина в концентрации 1 мг/мл на 1 г волокон, при этом в качестве буферного раствора используют 0.05 М трис-HCl буфер с рН 7.0; далее проводят инкубирование в течение 24 часов при комнатной температуре с периодическим перемешиванием; а затем промывают образовавшийся осадок 0.05 М трис-HCl буфером с рН 7.0 до отсутствия в промывных водах фицина.
Недостатком способа является получение ферментного препарата в твердой фазе, не позволяющей проникать молекулам фицина в глубокие слои кожи.
Запатентован способ стабилизации ферментов - пепсина, химотрипсина, трипсина, панкреатина, папаина и других протеаз, путем добавления в их растворы полисахаридов - гуаровой камеди, ксантановой камеди, камеди бобов рожкового дерева, крахмала, декстрана, пуллулана, альгиновой кислоты, гиалуроновой кислоты, каррагинана, пектина, хитозана и прочих полисахаридов, а также производных целлюлозы: карбоксиметилцеллюлозы, метилцеллюлозы, этилцеллюлозы, гидроксипропилцеллюлозы [JPH034791A].
В отличие от этого способа предложенное нами использование полисахаридов (карбоксиметилцеллюлозы и хитозана), модифицированных виниловыми мономерами (N-винилимидазолом или N,N-диметиламиноэтилметакрилатом) обеспечивает большее количество связей между полисахаридом и ферментом в ходе иммобилизации, что увеличивает прочность образуемого комплекса и пролонгирует процесс высвобождения фермента в область поврежденных тканей.
Известно, что полимеры на основе поли-β-гликозидов (целлюлозы и ее производных, хитозана, гиалуроновой кислоты и т.д.) склонны к образованию пленок, которые могут защитить кожу от пересыхания или обеспечить дополнительную защиту на поверхности раневого повреждения. Однако способность образовывать конъюгаты у таких полимеров несколько ограничена рядом факторов: поверхностным зарядом, типом функциональной группы и т.д. Поэтому для придания ряда новых свойств целесообразно проводить химическую модификацию природных полисахаридов. Так, например, введение азольных заместителей повышает комплексообразующую способность полисахаридов и снижает поверхностный отрицательный заряд карбоксиметилцеллюлозы [V.A. Kuznetsov, А.V. Sorokin, М.S. Lavlinskaya et al. Graft copolymers of carboxymethyl cellulose with N-vinylimidazole: synthesis and application for drug delivery. 2019. Polymer Bulletin. Vol. 76. P. 4929-4949], а введение звеньев N,N-диметиламиноэтилметакрилата не только снижает поверхностный заряд, но придает водному раствору модифицированного полисахарида стимулочувствительные свойства [V.A. Kuznetsov, А.V. Sorokin, М.S. Lavlinskaya. Synthesis of graft copolymers of carboxymethyl cellulose and N,N-dimethylaminoethyl methacrylate and their study as Paclitaxel carriers. 2020. Polymer Bulletin. DOI: 10.1007/s00289-020-03250-z].
В качестве прототипа служила топическая противомикробная дерматологическая композиция [Патент RU 2668827 С2, МПК A61K 38/08, A61K 31/728, А61Р 31/00, А61Р 17/00, A61K 31/722, опубл. 02.10.2018, Бюл. №28], предложенная в качестве лекарственного средства в медицине и ветеринарии, включающая комбинацию по меньшей мере одного положительно заряженного противомикробного пептида, соединенного с липидом, и гиалуроновой кислоты со средним молекулярным весом от 100 кДа до 800 кДа или одной из ее солей, причем противомикробный пептид представляет собой гексапептид, соединенный с пальмитиновой кислотой, содержащий дисульфидные мостики.
В отличие от прототипа в качестве действующего вещества мы используем не противомикробный пептид, а фермент фицин, который, кроме антимикробных, обладает антиоксидантными, ранозаживляющими, антигельминтными, противовоспалительными свойствами. Ранее нами было показано, что растительная протеаза фицин эффективно разрушает структурные компоненты матрикса биопленки Staphylococcus aureus и Staphylococcus epidermidis уже при концентрации 10 мкг/мл, почти полностью разрушая пленку при концентрации 1 мг/мл, в то время как широко распространенные трипсин и химотрипсин используют в концентрациях 1-2 мг/мл. С помощью атомно-силовой микроскопии мы показали, что после обработки фицином структура биопленки становится пористой и с пониженной вязкостью. Окрашивание красителем конго красным подтвердило гидролиз белкового компонента матрикса биопленок. Кроме того, было установлено, что обработка фицином увеличивает антимикробное действие ципрофлоксацина, гентамицина и бензалкония хлорида против клеток, находящихся внутри биопленок S. aureus и S. epidermidis. Соответственно растворимый фицин является перспективным соединением для разрушения биопленок и уменьшения риска повторного инфицирования организма [D.R. Baidamshina, E.Y. Trizna, M.G. Holyavka et al., Scientific reports, 7, 46-68 (2017); doi: 10.1038/srep46068].
Кроме того, добавление нами в раствор графт-сополимеров карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) позволяет путем включения в полисахаридный гель (один из способов физической иммобилизации ферментов) дополнительно стабилизировать фицин и обеспечить ему пролонгированное действие.
Технический результат заявленного изобретения заключается в разработке способа получения иммобилизованного жидкого или гелеобразного ферментного препарата на основе фицина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты низкомолекулярной (300 кДа), среднемолекулярной (500 кДа) или высокомолекулярной (800 кДа), благодаря чему растворы фицина можно хранить при температурах от 4 до 25°С в течение 21 суток, а фермент при этом становится более стабильным в сравнении с нативным и способен проникать в глубокие слои кожи; при этом внесение в состав препарата модифицированных полисахаридов позволяет не только варьировать вязкость и консистенцию образцов (от жидкого состояния до геля с различной текучестью), но также способствует образованию конъюгатов с ферментом с большим количеством связей и взаимодействий между полисахаридом и ферментом, по сравнению с немодифицированными карбоксиметилцеллюлозой и хитозаном, что дополнительно повышает стабильность препарата и концентрацию активного вещества в пораженном участке кожи, а также обеспечивает контролируемое (порционное) высвобождение фицина, поддерживая его необходимую концентрацию в течение длительного времени. Кроме того, способность модифицированных полисахаридов образовывать устойчивые пленки защищает фермент и обрабатываемый участок кожи от пересыхания, позволяет легко удалить препарат вместе с гноем и экссудатом.
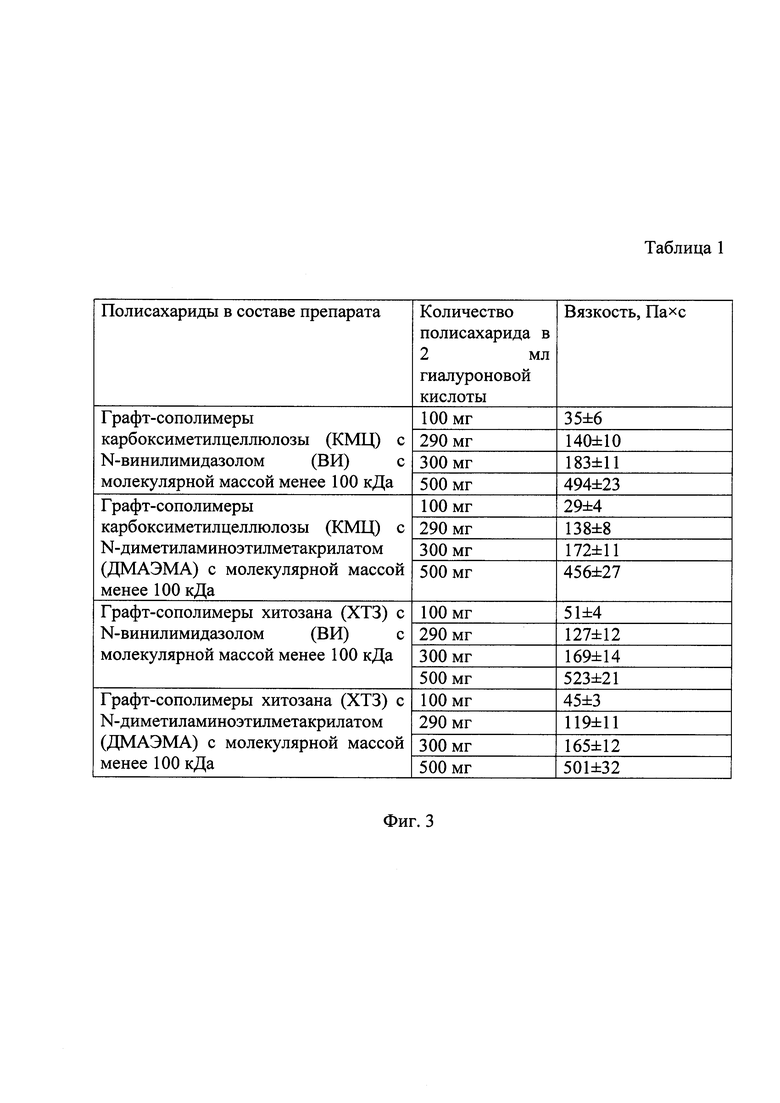
Технический результат достигается тем, что в способе получения иммобилизованного ферментного препарата на основе фицина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты, включающем растворение фицина в водном растворе низкомолекулярной гиалуроновой кислоты 300 к Да или среднемолекулярной гиалуроновой кислоты 500 кДа или высокомолекулярной гиалуроновой кислоты 800 кДа в соотношении 10 мг фицина на 2 мл водного раствора низкомолекулярной гиалуроновой кислоты 300 кДа или среднемолекулярной гиалуроновой кислоты 500 кДа или высокомолекулярной гиалуроновой кислоты 800 кДа в концентрации 1.5%, при этом осуществляют перемешивание до полного растворения при комнатной температуре; затем проводят иммобилизацию фицина, путем добавления к полученной смеси графт-сополимера карбоксиметилцеллюлозы с молекулярной массой 50-100 кДа (КМЦ) или хитозана (ХТЗ) с молекулярной массой 50-100 кДа с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля.
Фиг. 1. Диаграмма значений каталитической активности (А) фицина в присутствии гиалуроновой кислоты различной молекулярной массы после его хранения при 4°С.
Фиг. 2. Диаграмма значений каталитической активности (А) фицина в присутствии гиалуроновой кислоты различной молекулярной массы после его хранения при 25°С.
Фиг. 3. Таблица 1. Вязкость препаратов, содержащих фицин, гиалуроновую кислоту и полисахариды, модифицированные виниловыми мономерами.
Пример реализации способа.
В качестве объекта исследования был выбран фицин фирмы «Sigma-Aldrich», субстратом для гидролиза служил азоказеин фирмы «Sigma-Aldrich». В качестве стабилизирующих агентов применяли три вида гиалуроновой кислоты (ООО «Лаборатория Гиалика») с молекулярной массой 300 (НМГК), 500 (СМГК) и 800 (ВМГК) кДа. В качестве матрицы для иммобилизации фицина применяли графт-сополимеры карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) с молекулярной массой 50-100 кДа.
Стабилизацию фицина осуществляли путем растворения его навески массой 10 мг в 2 мл водного раствора гиалуроновой кислоты с молекулярной массой 300 (НМГК), 500 (СМГК) или 800 (ВМГК) кДа в концентрации 1.5% с последующим перемешиванием при комнатной температуре до полного растворения. Затем к полученной смеси добавляли для иммобилизации фицина графт-сополимер карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) (при молекулярной массе полисахарида 50-100 кДа) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля (табл. 1).
Содержание белка в иммобилизованных препаратах фицина определяли методом Лоури [Lowry О.Н., Rosebrough N.J., Faar A.L., Randall R.J. Protein measurement with folin-phenol reagent // J. Biol. Chem. - 1951. - V. 193. - P. 265-275]. Измерение уровня протеолитической активности фермента проводили на субстрате азоказеине [GarciVCarreno, F.L. The digestive proteases of langostilla (Pleuroncodes planipes, Decapoda): their partial characterization and the effect of feed on their composition //Comparative Biochemistry and Physiology Part B: Comparative Biochemistry - 1992. - V. 103. - P. 575-578]. К 200 мкл образца добавляли 200 мкл трис-HCl буфера (рН 7.5), 800 мкл азоказеина (0.5% в 50 мМ трис-HCl буфере, рН 7.5) и инкубировали 2 часа при 37°С. Далее добавляли 800 мкл трихлоруксусной кислоты (ТХУ) (5%), инкубировали 10 минут при минус 4°С, затем центрифугировали в течение 3 мин при 13000 об/мин для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл 3% NaOH для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 1 см кювете. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 200 мкл трис-HCl буфера и 200 мкл образца, который вносили после инкубации смеси в течение 2 часов при 37°С. За единицу каталитической активности фицина принимали количество фермента, которое в условиях эксперимента гидролизует 1 мкМ субстрата за 1 мин. Удельную протеолитическую активность фицина рассчитывали по формуле:
ПА=D*1000/120/200/C,
где ПА - протеолитическая активность, мкМ/мин на 1 мг белка,
D - оптическая плотность пробы при 410 нм,
С - концентрация белка в пробе, мг/мл, измеренная по методу Лоури,
120 - время инкубации в минутах,
200 - объем пробы, в мкл,
1000 - пересчет в мкМ.
Статистическую обработку полученных результатов проводили при уровне значимости 5% с использованием t-критерия Стьюдента.
Были проведены исследования стабильности фицина в растворах гиалуроновой кислоты (300, 500 и 800 кДа) по сравнению с нативным энзимом. Препараты инкубировали при 4 и 25°С в течение 0, 1, 2, 3, 7, 14 и 21 суток с дальнейшим измерением протеолитической активности. Полученные результаты отражены на фиг. 1, 2.
В ходе наших экспериментов было выявлено, что гиалуроновая кислота не ингибирует фицин. На фиг. 1 представлена диаграмма зависимости каталитической активности энзима от времени его хранения при 4°С. Установлено, что нативный фицин сохраняет 65% каталитической активности интактного образца после 7 суток инкубации при 4°С. На 14 день хранения ферментативная способность энзима составляет 61% от начальной. После 21 дня инкубации фицин инактивирован на 41%. Фицин в растворе низкомолекулярной гиалуроновой кислоты (300 к Да) на 7 день хранения теряет 13% каталитической способности. Активность продолжает снижаться после 2 и 3 недель, но составляет не менее 74% от исходной. Раствор фицина со среднемолекулярной гиалуроновой кислотой (500 кДа) на 7 и 14 сутки хранения снижает свою активность на 12 и 27% соответственно. Энзим сохраняет 60% каталитической способности после 3 недель инкубации. Фицин в растворе высокомолекулярной гиалуроновой кислоты (800 кДа) после 7 дней хранения активен на 68% от исходного уровня. После 14 и 21 дня инкубации при 4°С фермент сохраняет соответственно 65 и 62% активности от интактного образца.
На фиг. 2 изображена диаграмма изменения каталитической активности фицина после его хранения при 25°С. Выявлено, что свободный энзим на 7 сутки инкубации при температуре 25°С сохраняет 60% активности, а на 14 и 21 сутки - 42 и 21%. Фицин в растворе низкомолекулярной гиалуроновой кислоты (300 кДа) наиболее стабилен среди растворов фермента в гиалуроновой кислоте: после 21 дня инкубации энзим проявляет не менее 76% от начальной протеолитической способности. Раствор фицина в среднемолекулярной гиалуроновой кислоте (500 к Да) после 7 и 14 суток инкубации при температуре 25°С стабильнее раствора нативного фермента и сохраняет более 73 и 70% от исходной протеолитической способности. Раствор фицина в высокомолекулярной гиалуроновой кислоте (800 кДа) на 7 сутки проявляет 59% каталитической способности, при повышении срока хранения происходит более значительная инактивация энзима: на 14 сутки остается 48% активности, на 21 сутки - 21%.
Из вышеизложенного материала следует, что фицин в растворе низкомолекулярной гиалуроновой кислоты (300 кДа) наиболее стабилен по сравнению с остальными растворами фермента при хранении при 4°С. Раствор фицина в низкомолекулярной гиалуроновой кислоте (300 к Да) и среднемолекулярной гиалуроновой кислоте (500 кДа) после 21 суток инкубации при температуре 25°С оказался активнее раствора нативного фермента и его раствора в высокомолекулярной гиалуроновой кислоте и сохранял более 70% от исходной протеолитической способности.
Таким образом, был разработан способ получения иммобилизованного ферментного препарата на основе фицина, низкомолекулярной (300 кДа), среднемолекулярной (500 кДа) и высокомолекулярной (800 кДа) гиалуроновой кислоты с последующим добавлением графт-сополимера карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) для иммобилизации фицина.
При этом полученный предложенным способом препарат можно хранить при температурах от 4 до 25°С в течение 21 суток, а фицин при этом становится более стабильным в сравнении с нативным и способен проникать в глубокие слои кожи. Внесение в состав препарата модифицированных полисахаридов позволяет не только варьировать вязкость и консистенцию образцов (от жидкого состояния до геля с различной текучестью), но также способствует образованию конъюгатов с ферментом с большим количеством связей и взаимодействий между полисахаридом и ферментом, по сравнению с немодифицированными карбоксиметилцеллюлозой и хитозаном, что дополнительно повышает стабильность препарата и концентрацию активного вещества в пораженном участке кожи, а также обеспечивает контролируемое (порционное) высвобождение фицина, поддерживая его необходимую концентрацию в течение длительного времени. Кроме того, способность модифицированных полисахаридов образовывать устойчивые пленки защищает фермент и обрабатываемый участок кожи от пересыхания, позволяет легко удалить препарат вместе с гноем и экссудатом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ КОЛЛАГЕНАЗЫ, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750382C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ПАПАИНА, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750378C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ТРИПСИНА, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750376C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ БРОМЕЛАЙНА, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750377C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ФИЦИНА В ГЕЛЕ НА ОСНОВЕ КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ | 2021 |
|
RU2771183C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ФИЦИНА И N-МАЛЕОИЛХИТОЗАНА В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792784C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ФИЦИНА И АЦЕТАТА ХИТОЗАНА В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792783C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА БРОМЕЛАЙНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2788454C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ПАПАИНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2795425C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО ПРЕПАРАТА БРОМЕЛАЙНА И АЛЬГИНАТА НАТРИЯ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792785C1 |

Настоящее изобретение относится к области медицины, а именно к способу получения иммобилизованного ферментного препарата на основе фицина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты, включающему растворение фицина в водном растворе низкомолекулярной гиалуроновой кислоты 300 кДа, или среднемолекулярной гиалуроновой кислоты 500 кДа, или высокомолекулярной гиалуроновой кислоты 800 кДа в соотношении 10 мг фицина на 2 мл водного раствора низкомолекулярной гиалуроновой кислоты 300 кДа, или среднемолекулярной гиалуроновой кислоты 500 кДа, или высокомолекулярной гиалуроновой кислоты 800 кДа в концентрации 1.5%, при этом осуществляют перемешивание до полного растворения при комнатной температуре; затем проводят иммобилизацию фицина путем добавления к полученной смеси графт-сополимера карбоксиметилцеллюлозы с молекулярной массой 50-100 кДа (КМЦ) или хитозана (ХТЗ) с молекулярной массой 50-100 кДа с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля. Настоящее изобретение обеспечивает разработку способа получения иммобилизованного жидкого или гелеобразного ферментного препарата на основе фицина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты низкомолекулярной 300 кДа, среднемолекулярной 500 кДа или высокомолекулярной 800 кДа, благодаря чему растворы фицина можно хранить при температурах от 4 до 25°С в течение 21 суток, а фермент при этом становится более стабильным в сравнении с нативным и способен проникать в глубокие слои кожи; при этом внесение в состав препарата модифицированных полисахаридов позволяет не только варьировать вязкость и консистенцию образцов (от жидкого состояния до геля с различной текучестью), но также способствует образованию конъюгатов с ферментом с большим количеством связей и взаимодействий между полисахаридом и ферментом, по сравнению с немодифицированными карбоксиметилцеллюлозой и хитозаном, что дополнительно повышает стабильность препарата и концентрацию активного вещества в пораженном участке кожи, а также обеспечивает контролируемое (порционное) высвобождение фицина, поддерживая его необходимую концентрацию в течение длительного времени, кроме того, способность модифицированных полисахаридов образовывать устойчивые пленки защищает фермент и обрабатываемый участок кожи от пересыхания, позволяет легко удалить препарат вместе с гноем и экссудатом. 3 ил., 1 пр.
Способ получения иммобилизованного ферментного препарата на основе фицина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты, включающий растворение фицина в водном растворе низкомолекулярной гиалуроновой кислоты 300 кДа, или среднемолекулярной гиалуроновой кислоты 500 кДа, или высокомолекулярной гиалуроновой кислоты 800 кДа в соотношении 10 мг фицина на 2 мл водного раствора низкомолекулярной гиалуроновой кислоты 300 кДа, или среднемолекулярной гиалуроновой кислоты 500 кДа, или высокомолекулярной гиалуроновой кислоты 800 кДа в концентрации 1.5%, при этом осуществляют перемешивание до полного растворения при комнатной температуре; затем проводят иммобилизацию фицина путем добавления к полученной смеси графт-сополимера карбоксиметилцеллюлозы с молекулярной массой 50-100 кДа (КМЦ) или хитозана (ХТЗ) с молекулярной массой 50-100 кДа с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля.
| Прибор для поверки максимальных термометров на сбрасывание ртути в резервуар | 1932 |
|
SU34791A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ФИЦИНА, ОБЛАДАЮЩЕГО РАНОЗАЖИВЛЯЮЩИМИ И РЕГЕНЕРИРУЮЩИМИ СВОЙСТВАМИ | 2017 |
|
RU2677858C2 |
| СПОСОБ СТАБИЛИЗАЦИИ РАСТВОРОВ СТРЕПТОЛИАЗЫ | 1994 |
|
RU2063244C1 |
| EP 1508573 A1, 23.02.2005 | |||
| LILIANA GIANFREDA et al., ENZYME STABILIZATION: STATE OF THE ART / MOLECULAR AND CELLULAR BIOCHEMISTRY, 1991, Vol.100, pp.97-128. | |||
Авторы
Даты
2021-03-09—Публикация
2020-07-28—Подача