Настоящее изобретение относится к гемостатическим композициям, в частности к текучим гемостатическим композициям в стерильной готовой к применению форме, к способам получения гемостатических композиций и к применению композиций для остановки кровотечения в частности при хирургических процедурах.
Образование нерастворимого полимера фибрина из его растворимого предшественника фибриногена является заключительной стадией свертывания крови. Превращение фибриногена в фибрин происходит в три стадии: ограниченный протеолиз фибриногена в мономеры фибрина под действием тромбина; агрегация мономеров фибрина в двунитчатые протофибриллы, в которых молекулы фибрина смещены друг относительно друга на 1/2 длины; и поперечная сшивка агрегированного фибрина для упрочнения тромба.
Молекула фибриногена состоит из трех пар неидентичных полипептидных цепей Аα, Bβ и γ, соединенных друг с другом дисульфидными связями. Цепи фибриногена свернуты с образованием трех различных структурных участков, где два участка D на концах связаны с одним центральным участком Е. Каждый участок D содержит впадины "а" и "b", где происходит полимеризация, расположенные на С-конце цепей γ и Вβ, соответственно. Тромбин катализирует отщепление коротких пептидов, фибринопептидов A (FpA) и В (FpB), от амино-концов цепей Аα и Bβ фибриногена в центральном участке Е, соответственно, открывая два участка полимеризации: "выступ А" с последовательностью на амино-конце Gly-Pro-Arg-; и "выступ В" с последовательностью на амино-конце Gly-His-Arg-. Вновь образованные выступы с участком полимеризации одного мономера фибрина взаимодействуют с соответствующими впадинами другого мономера фибрина посредством взаимодействий выступ-впадина "А-а" и "В-b", что приводит к сборке мономеров фибрина в двунитевые протофибриллы, в которых молекулы фибрина смещены друг относительно друга на 1/2 длины.
Протофибриллы латерально агрегируют с образованием более толстых волокон, которые объединяются с образованием трехмерной сети фибринового тромба. FpA отщепляется от фибриногена быстрее по сравнению с FpB. Удаление FpA запускает образование протофибрилл, тогда как удаление FpB происходит совместно с их поперечной агрегацией. Высвобождение FpB, которое происходит очень медленно в начале реакции, ускоряется при образовании полимера. Такая задержка отщепления FpB необходима для нормальной агрегации фибрина, а также связана с образованием различных типов тромбов. Фибрин I, в котором удалены только FpA, является менее плотным и легче расщепляется плазмином, тогда как фибрин II, в котором удалены FpA и FpB, является более плотным и устойчивым к фибринолизу.
В исследованиях с применением ферментов змеиного яда, которые отщепляют только FpA или преимущественно FpB, было продемонстрировано, что фибриновые тромбы могут образовываться за счет взаимодействий "А-а" или "В-b", указывая на то, что оба взаимодействия могут опосредовать образование протофибрилл. В экспериментах с вариантным рекомбинантным фибриногеном было показано, что "В-b" взаимодействия могут играть важную роль в образовании протофибрилл, если "А-а" взаимодействия ослаблены. В других исследованиях было продемонстрировано, что при связывании фрагментов фибрина с молекулами фибриногена происходят только взаимодействия "А-а", даже если доступны выступы "В" и впадины "b", и что взаимодействия выступ-впадина "В-b" наблюдались, только когда взаимодействия "А-а" были исключены. Тем не менее, в исследованиях ингибирования пептидов было показано, что взаимодействия "В-b" могут происходить одновременно с "А-а".
Фибрин стабилизируется путем образования ковалентных поперечных связей между боковыми цепями различных молекул в волокне фибрина. В реакции переамидирования, которую катализирует фактор XIIIa, пептидные связи образуются между определенными боковыми цепями глутамина и лизина.
Непосредственное надавливание на участок кровотечения может быть недостаточным для остановки кровотечения, если причину кровотечения трудно выявить (например, при диффузном венозном кровотечении) или если присутствует врожденная коагулопатия. Нарушение гемостаза также происходит вследствие наличия антитромбоцитарных агентов и антикоагулянтов, в частности у пациентов, которым проводят сердечную или сосудистую хирургию, а также в результате изменений, связанных с сердечно-легочным шунтированием. В указанных случаях местные гемостатические агенты эффективно дополняют традиционные способы достижения гемостаза.
В хирургических процедурах используют гемостатические агенты на основе желатина. Можно получать различные формы порошка желатина при смешении с текучей средой в зависимости от конечного применения и отношения текучей среды к порошку. Например, при применении повышенных концентраций текучей среды можно получать пасту или суспензию, подходящую в качестве текучего гемостатического агента для применения при диффузном кровотечении в частности на неровных поверхностях или в труднодостижимых участках. Указанные пасты получают на месте применения путем механического перемешивания и смешения порошка и жидкости для обеспечения однородной композиции. Затем пасту помещают в средства или устройство доставки, например, в шприц, и наносят в рану.
Некоторые гемостатические агенты на основе желатина доступны из коммерческих источников в виде наборов, содержащих текучую желатиновую матрицу и лиофилизированный тромбин. Перед применением лиофилизированный тромбин перерастворяют в воде или солевом растворе и смешивают с желатиновой матрицей. Зернистая структура желатиновой матрицы позволяет материалу заполнять раны с любыми неправильными геометрическими формами. Компоненты смеси действуют синергически для промотирования гемостаза в месте кровотечения. Желатиновые гранулы набухают при взаимодействии с кровью, понижают кровоток и обеспечивают аккуратную тампонаду раны. Кровь, проходящая через пространство между гранулами, подвергается воздействию тромбина в высокой концентрации. Тромбин обеспечивает ферментное превращение фибриногена крови в мономеры фибрина, которые полимеризуются. Полимерный фибрин захватывает гранулы желатина и другие клеточные элементы в участке кровотечения. Резорбция желатиновых гранул, заключенных в образующемся тромбе, организмом происходит в течение нескольких недель, что соответствует нормальной продолжительности заживления раны.
Одним из коммерчески доступных гемостатических наборов на основе желатина является набор гемостатической матрицы FLOSEAL Hemostatic Matrix. Желатиновая матрица состоит из гранул поперечно-сшитого желатина, обеспеченных в виде стерильного геля в одноразовом шприце. Тромбин поставляется в виде стерильного лиофилизированного порошкового препарата совместно со стерильным хлоридом натрия в качестве разбавителя. Желатиновую матрицу получают путем экстракции коллагена из соединительного слоя кожи быков, последующей желатинизации коллагена, поперечной сшивки с глутаральдегидом и измельчения поперечно-сшитого желатина на частицы с размером 500-600 мкм. Другим коммерчески доступным гемостатическим набором является набор гемостатической матрицы SURGIFLO Hemostatic Matrix - с тромбином. Матрицу поставляют в предварительно наполненном шприце для смешения с тромбином. Желатин, применяемый для получения матрицы, получают из кожи свиней. Желатин обрабатывают для получения порошкового продукта желатина, который затем обрабатывают для получения пасты. Тромбин обеспечен в виде лиофилизированного порошка для перерастворения в воде.
Несмотря на то, что гемостатические агенты, содержащие желатиновую матрицу и тромбин, являются эффективными для остановки кровотечения во время хирургии, продукты указанного типа имеют несколько недостатков. В частности, тромбин является нестабильным в растворе, и его невозможно стерилизовать в растворе, не снижая по меньшей мере в некоторой степени его активность. Таким образом, тромбин обеспечен отдельно в виде лиофилизированного порошка для перерастворения, и его необходимо смешивать с желатиновой матрицей за несколько часов до применения. Указанные стадии, сопровождающиеся риском нарушения стерильности смеси, не подходят для хирургических процедур и делают нецелесообразным применение продуктов для лечения травматических ран вне больничного учреждения. Тромбин, обеспеченный в коммерчески доступных в настоящее время наборах, получают из объединенных образцов плазмы человека, полученных в лицензированных центрах сбора плазмы после проведения последовательных стадий разделения и фильтрования. Несмотря на то, что указанные процедуры значительно снижают риск вирусной или прионной инфекции, они не устраняют его полностью.
Таким образом, существует необходимость в предложении стабильных готовых к применению гемостатических агентов для остановки кровотечения при хирургических процедурах. Также существует необходимость в предложении готовых к применению гемостатических агентов, которые являются более устойчивыми при стерилизации по сравнению с традиционными текучими гемостатическими агентами, содержащими тромбин. Также требуются гемостатические агенты, которые имеют еще более пониженный риск возникновения вирусных или прионных инфекций по сравнению с коммерчески доступными в настоящее время текучими гемостатическими агентами, содержащими тромбин.
Согласно настоящему изобретению предложена гемостатическая композиция, содержащая: растворимый гемостатический агент, содержащий совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе; биосовместимую жидкость; и частицы биосовместимого поперечно-сшитого полисахарида, подходящего для применения для остановки кровотечения, которые являются нерастворимыми в биосовместимой жидкости.
Согласно определенным вариантам реализации изобретения композиции представляют собой готовые к применению текучие гемостатические композиции.
Было показано, что гемостатические агенты, входящие в состав композиций согласно настоящему изобретению, неожиданно являются устойчивыми при стерилизации, в частности при стерилизации паром или стерилизации сухим жаром. Таким образом, композиции согласно настоящему изобретению можно стерилизовать при помощи традиционных способов стерилизации в отсутствие значительного снижения гемостатической активности. Это является важным преимуществом, так как появляется возможность обеспечения композиций в виде гидратированных стерильных готовых к применению текучих гемостатических композиций. Традиционные гемостатические агенты на основе желатина, содержащие тромбин, являются неустойчивыми при тепловой стерилизации или стерилизации паром гидратированной готовой к применению формы.
Термин "гемостатический" используют в настоящей заявке для обозначения возможности остановки или минимизации кровотечения.
Термин "биосовместимый" используют в настоящей заявке для обозначения материала, который является совместимым с живой тканью благодаря тому, что не является токсичным или вредным и не вызывает иммунологическое отторжение. Материал предпочтительно должен удовлетворять критериям стандарта ISO 10993-1, изданного Международной организации по стандартизации (NAMSA, Northwood, Ohio).
Термин "текучий" используют в настоящей заявке для обозначения композиций, которые являются текучими при приложении давления свыше порогового уровня, например, при выдавливании через отверстие или канюлю или при нанесении в участок доставки при помощи лопатки. Пороговое давление, как правило, находится в диапазоне от 3×104 Па до 5×105 Па. Композиции, тем не менее, в общем случае остаются неподвижными при приложении давления ниже порогового уровня. Текучая композиция в общем случае может заполнять раны с неправильной геометрической формой в целевом участке, в который доставляют композицию.
Гемостатический агент, жидкость и нерастворимые частицы можно объединять и смешивать в условиях, которые являются эффективными для обеспечения по существу гомогенной гемостатической композиции, содержащей непрерывную биосовместимую жидкую фазу, содержащую частицы, по существу однородно распределенные по жидкой фазе.
При использовании в настоящем описании "по существу гомогенный" обозначает такое физическое состояние композиций, при котором твердые частицы однородно распределены в непрерывной жидкой фазе, и отношение твердое вещество : жидкость и плотность в какой-либо области или в поперечном срезе композиции являются по существу одинаковыми.
Согласно определенным аспектам изобретения композиции являются рассасывающимися. Термин "рассасывающийся" используют в настоящей заявке для обозначения композиций, которые разрушаются или растворяются после непосредственного введения в целевой участок организма пациента (и не имеют защиту имплантируемого устройства, такого как грудной имплантат) в течение периода времени, составляющего один год или менее, обычно от 1 дня до 1 года, чаще от 1 до 120 дней или от 1 до 90 дней или от 2 до 30 дней, после первоначального применения. Протокол измерения резорбции и разрушения приведен в публикации WO 98/08550.
Гемостатический агент, применяемый в композициях согласно настоящему изобретению, содержит совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе. Неожиданно было обнаружено, что гемостатический агент может полимеризовать фибриноген, если он содержится в гемостатической композиции согласно настоящему изобретению.
Гемостатический агент для применения в композициях согласно настоящему изобретению может полимеризовать фибриноген в отсутствие тромбина в водном растворе. Каждая молекула фибриногена может связывать по меньшей мере два фибриноген-связывающих пептида. Так как на каждом носителе иммобилизована совокупность фибриноген-связывающих пептидов, то молекулы фибриногена связываются друг с другом посредством носителей. Между молекулами фибриногена и фибриноген-связывающими пептидами образуются нековалентные связи. В водном растворе при контакте гемостатического агента с фибриногеном образуется гидрогель, содержащий полимеризованный фибриноген.
Гемостатический агент должен быть растворимым в биосовместимой жидкости и в плазме крови. Гемостатический агент может иметь растворимость по меньшей мере 10 мг на мл растворителя, например, 10-1000 мг/мл, 33-1000 мг/мл или 33-100 мг/мл. Гемостатический агент должен подходить для введения в кровоточащий участок раны. Носители могут содержать полимер, например, белок, полисахарид или синтетический биосовместимый полимер, такой как полиэтиленгликоль, или комбинацию любого из указанных материалов. Альбумин является одним из примеров белка-носителя. В предпочтительных вариантах реализации фибриноген-связывающие пептиды ковалентно иммобилизованы на носителях.
В некоторых вариантах реализации растворимый гемостатический агент представляет собой растворимый агент для образования биогеля, такой как описано в публикации WO 2008/065388 (содержание которой включено в настоящую заявку во всей полноте). В WO 2008/065388 описано образование биогеля с применением агента, содержащего несколько фибриноген-связывающих пептидов (каждый из которых содержит фибриноген-связывающую пептидную последовательность GPRP- на амино-конце пептида), конъюгированных с человеческим сывороточным альбумином (ЧСА) в качестве носителя.
В некоторых вариантах реализации изобретения каждый носитель в гемостатическом агенте содержит разветвленное ядро и совокупность фибриноген связывающих пептидов, по отдельности ковалентно присоединенных к каждому разветвленному ядру. Например, гемостатический агент может представлять собой пептидный дендример, содержащий разветвленное ядро и совокупность фибриноген-связывающих пептидов, по отдельности ковалентно присоединенных к разветвленному ядру.
Разветвленное ядро может содержать:
от двух до десяти полифункциональных аминокислотных остатков, где каждый фибриноген-связывающий пептид отдельно ковалентно присоединен к полифункциональному аминокислотному остатку разветвленного ядра;
совокупность полифункциональных аминокислотных остатков, где один или более фибриноген-связывающих пептидов по отдельности ковалентно присоединены к каждому из по меньшей мере двух соседних полифункциональных аминокислотных остатков разветвленного ядра;
совокупность полифункциональных аминокислотных остатков, где два или более фибриноген-связывающих пептидов по отдельности ковалентно присоединены по меньшей мере к одному полифункциональному аминокислотному остатку разветвленного ядра;
совокупность полифункциональных аминокислотных остатков, где два или более полифункциональных аминокислотных остатков ковалентно присоединены через боковую цепь соседнего полифункционального аминокислотного остатка; или
один полифункциональный аминокислотный остаток, где фибриноген-связывающий пептид отдельно ковалентно присоединен к каждой функциональной группе полифункционального аминокислотного остатка;
причем полифункциональные аминокислотные остатки включают три- или тетрафункциональные аминокислотные остатки или три- и тетрафункциональные аминокислотные остатки, или один полифункциональный аминокислотный остаток представляет собой три- или тетрафункциональный аминокислотный остаток.
Каждый фибриноген-связывающий пептид имеет различные точки присоединения к разветвленному ядру, поэтому фибриноген-связывающие пептиды описывают в настоящем описании как "по отдельности ковалентно присоединенные" к разветвленному ядру.
Разветвленное ядро содержит любую подходящую аминокислотную последовательность. Разветвленное ядро может содержать до десяти полифункциональных аминокислотных остатков, например, от двух до десяти или от двух до шести полифункциональных аминокислотных остатков.
Разветвленное ядро может содержать совокупность последовательных полифункциональных аминокислотных остатков. Разветвленное ядро может содержать до десяти последовательных полифункциональных аминокислотных остатков.
Термин "трифункциональная аминокислота" используют в настоящей заявке для описания любого органического соединения, содержащего первую функциональную группу, представляющую собой аминогруппу (-NH2), вторую функциональную группу, представляющую собой карбоксильную группу (-СООН), и третью функциональную группу. Термин "тетрафункциональная аминокислота" используют в настоящей заявке для описания любого органического соединения, содержащего первую функциональную группу, представляющую собой аминогруппу (-NH2), вторую функциональную группу, представляющую собой карбоксильную группу (-СООН), третью функциональную группу и четвертую функциональную группу. Третья и четвертая функциональная группа могут представлять собой любую функциональную группу, которая способна взаимодействовать с карбоксильной концевой группой фибриноген-связывающего пептида или с функциональной группой линкера, присоединенного к карбоксильной концевой группе фибриноген-связывающего пептида.
Полифункциональные аминокислоты могут содержать центральный атом углерода (α- или 2-), содержащий аминогруппу, карбоксильную группу, и боковую цепь, содержащую дополнительную функциональную группу (для обеспечения тем самым трифункциональной аминокислоты) или две дополнительные функциональные группы (для обеспечения тем самым тетрафункциональной аминокислоты).
Отдельный или каждый полифункциональный аминокислотный остаток может представлять собой остаток протеиногенной или непротеиногенной полифункциональной аминокислоты или остаток природной или неприродной полифункциональной аминокислоты.
Протеиногенные трифункциональные аминокислоты имеют центральный атом углерода (α- или 2-), содержащий аминогруппу, карбоксильную группу, боковую цепь и атом водорода при α-углероде в левовращающей конфигурации. Примеры подходящих трифункциональных протеиногенных аминокислот включают L-лизин, L-аргинин, L-аспарагиновую кислоту, L-глутаминовую кислоту, L-аспарагин, L-глутамин и L-цистеин.
Примеры подходящих трифункциональных непротеиногенных аминокислотных остатков включают остатки D-лизина, бета-лизина, L-орнитина, D-орнитина и D-аргинина.
Таким образом, примеры подходящих трифункциональных аминокислотных остатков для применения в гемостатическом агенте в составе композиций согласно настоящему изобретению включают остатки лизина, орнитина, аргинина, аспарагиновой кислоты, глутаминовой кислоты, аспарагина, глутамина и цистеина, такие как остатки L-лизина, D-лизина, бета-лизина, L-орнитина, D-орнитина, L-аргинина, D-аргинина, L-аспарагиновой кислоты, D-аспарагиновой кислоты, L-глутаминовой кислоты, D-глутаминовой кислоты, L-аспарагина, D-аспарагина, L-глутамина, D-глутамина, L-цистеина и D-цистеина.
Примеры полифункциональных неприродных аминокислот, подходящих для применения в гемостатическом агенте в составе композиций согласно настоящему изобретению, включают цитруллин, 2,4-диаминоизомасляную кислоту, 2,2'-диаминопимелиновую кислоту, 2,3-диаминопропановую кислоту и цис-4-амино-L-пролин. Полифункциональные неприродные аминокислоты доступны в Sigma-Aldrich.
В некоторых вариантах реализации разветвленное ядро может содержать гомополимерную полифункциональную аминокислотную последовательность, например, последовательность полилизина, полиаргинина или полиорнитина, такое как разветвленное ядро, содержащее от двух до десяти или от двух до шести последовательных остатков лизина, аргинина или орнитина. В других вариантах реализации разветвленное ядро может содержать различные полифункциональные аминокислотные остатки, например, один или более остатков лизина, один или более остатков аргинина и/или один или более остатков орнитина.
В других вариантах реализации разветвленное ядро может содержать совокупность полифункциональных аминокислотных остатков и один или более других аминокислотных остатков.
Если разветвленное ядро содержит совокупность полифункциональных аминокислотных остатков, соседние полифункциональные аминокислотные остатки могут быть связаны друг с другом связями между боковыми цепями аминокислот, пептидными связями, или некоторые соседние полифункциональные аминокислотные остатки могут быть связаны друг с другом связями между боковыми цепями, а другие пептидными связями.
В дополнительных вариантах реализации разветвленное ядро может содержать два или более полифункциональных аминокислотных остатков, и по меньшей мере один фибриноген-связывающий пептид отдельно присоединен к каждому из двух или более полифункциональных аминокислотных остатков, и два или более фибриноген-связывающих пептидов по отдельности присоединены по меньшей мере к одному из полифункциональных аминокислотных остатков разветвленного ядра.
Согласно другим вариантам реализации изобретения два фибриноген-связывающих пептида по отдельности присоединены к концевому полифункциональному аминокислотному остатку разветвленного ядра.
Примеры структур пептидных дендримеров, подходящих для применения в качестве гемостатических агентов в составе композиций согласно настоящему изобретению, включают пептидные дендримеры, в которых:
 разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, и второй трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид;
разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, и второй трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид;
 разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, и второй трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида;
разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, и второй трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида;
 разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, второй трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид, и третий трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид; или
разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, второй трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид, и третий трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид; или
 разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, второй трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид, третий трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид, и четвертый трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид.
разветвленное ядро содержит первый трифункциональный аминокислотный остаток, к которому присоединены два фибриноген-связывающих пептида, второй трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид, третий трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид, и четвертый трифункциональный аминокислотный остаток, к которому присоединен один фибриноген-связывающий пептид.
Пептидный дендример, подходящий для применения в качестве гемостатического агента в составе композиции согласно настоящему изобретению, может иметь следующую общую формулу (I):
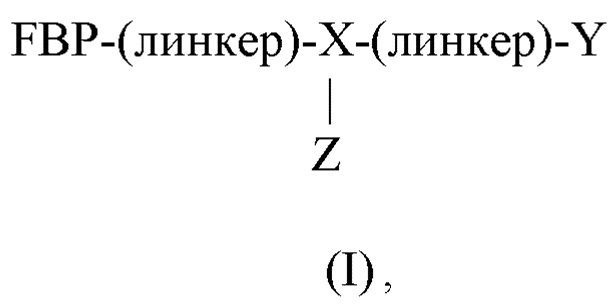
где:
FBP представляет собой фибриноген-связывающий пептид;
-(линкер)- представляет собой необязательный линкер, предпочтительно непептидный линкер;
X представляет собой трифункциональный аминокислотный остаток, предпочтительно лизин, орнитин или аргинин;
Y представляет собой -FBP или -NH2;
Z представляет собой -(линкер)-РВР, если Y представляет собой -FBP, или -[-Xn-(линкер)-FBP]а-(линкер)-РВР, если Y представляет собой -NH2;
где:
Xn представляет собой трифункциональный аминокислотный остаток, предпочтительно лизин, L-орнитин или аргинин; и
а равен 1-10, предпочтительно 1-3.
Например, если Y представляет собой NH2, Z представляет собой -[-Xn-(линкер)-РВР]а-(линкер)-РВР, структура дендримера представляет собой:
если а равен 1:
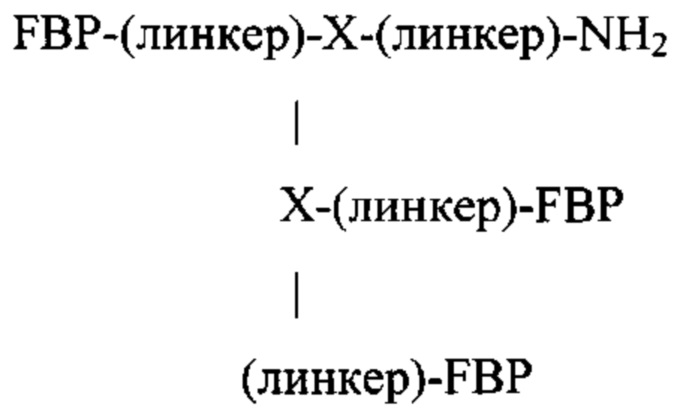
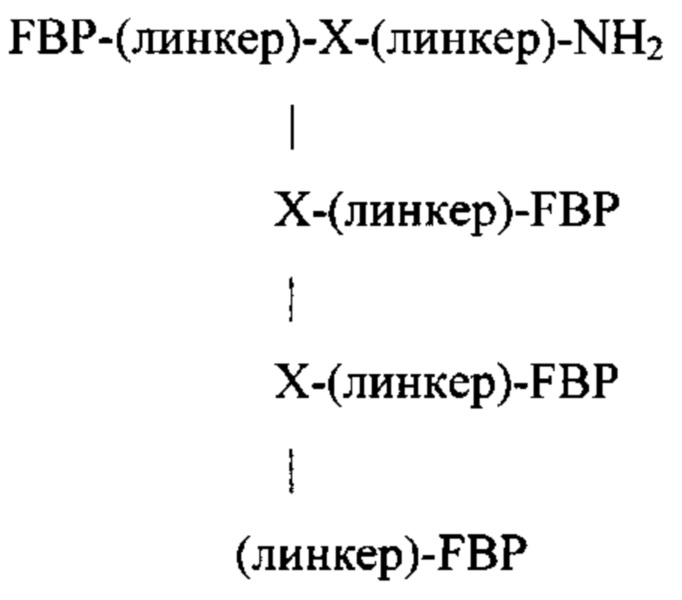
или, если а равен 2:
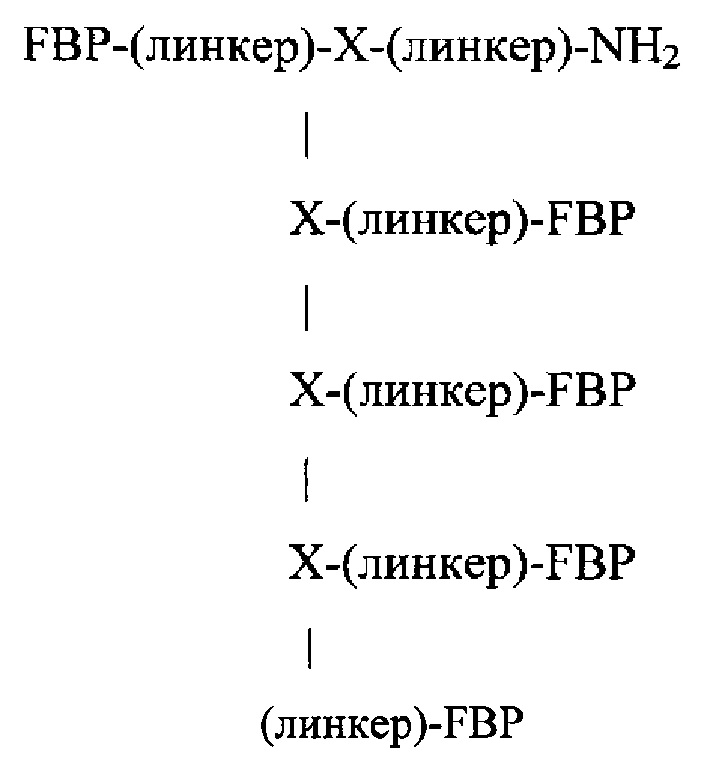
или, если а равен 3:
В качестве альтернативы Z представляет собой -[-Xn-(линкер)-FBP]а-(линкер)-FBP, если Y представляет собой -FBP;
где:
Xn представляет собой трифункциональный аминокислотный остаток, предпочтительно лизин, L-орнитин или аргинин; и
а равен 1-10, предпочтительно 1-3.
Например, если Y представляет собой -FBP, Z представляет собой -[-Xn-(линкер)-FBP]a-(линкер)-FBP, и а равен 1, структура дендримера представляет собой:
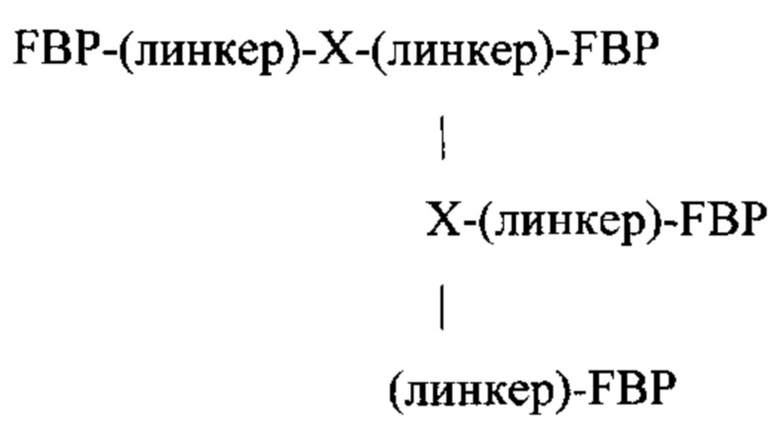
Пептидный дендример, подходящий для применения в качестве гемостатического агента в составе композиции согласно настоящему изобретению, может иметь следующую общую формулу (II):
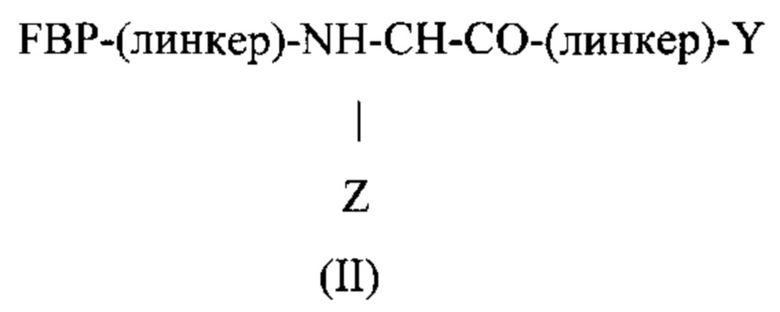
где:
FBP представляет собой фибриноген-связывающий пептид;
-(линкер)- представляет собой необязательный линкер, предпочтительно содержащий -NH(CH2)5CO-;
Y представляет собой -FBP или -NH2;
Z представляет собой:
-R-(линкер)-FBP, если Y представляет собой -FBP, или

если Y представляет собой -NH2; или
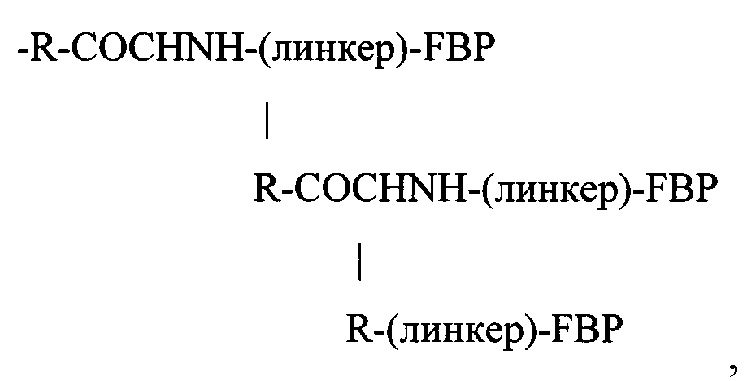
если Y представляет собой -NH2; или
если Y представляет собой -NH2;
где R представляет собой -(CH2)4NH-, -(CH2)3NH- или -(CH2)3NHCNHNH-. Следовательно, в одном варианте реализации Z может представлять собой:
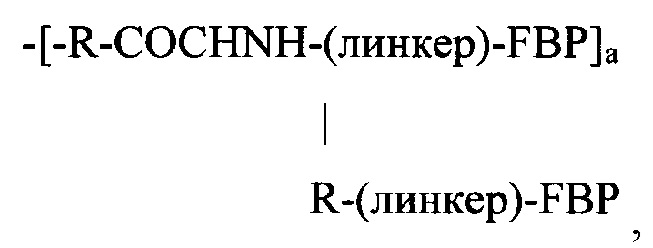
если Y представляет собой -NH2;
где R представляет собой -(CH2)4NH-, -(CH2)3NH- или -(CH2)3NHCNHNH-;
и а равен 1-3.
В качестве альтернативы а может быть равен 4-10, или он может быть равен 1-10.
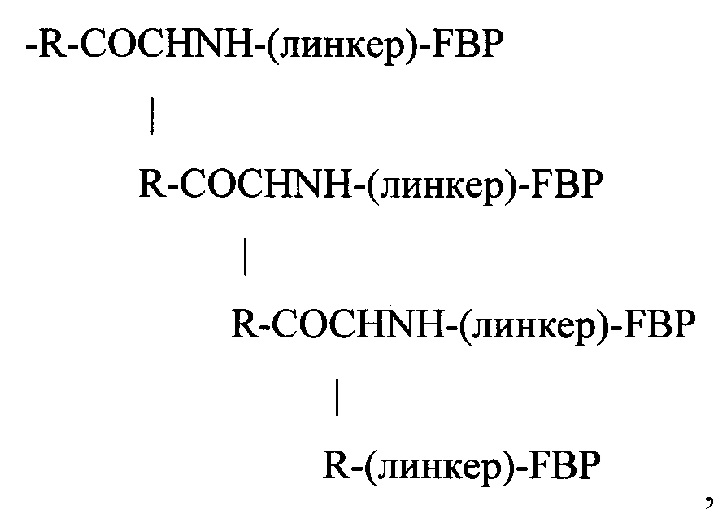
В другом варианте реализации Z представляет собой:
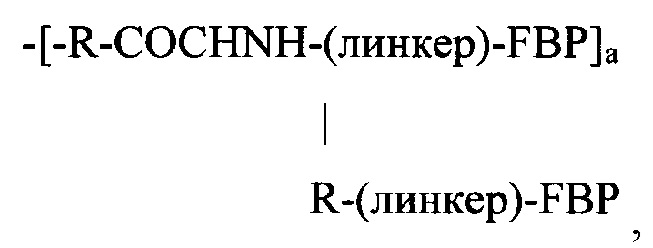
если Y представляет собой -FBP;
где R представляет собой -(CH2)4NH-, -(CH2)3NH- или -(CH2)3NHCNHNH-;
где а равен 1-10, предпочтительно 1-3.
Например, Z представляет собой:
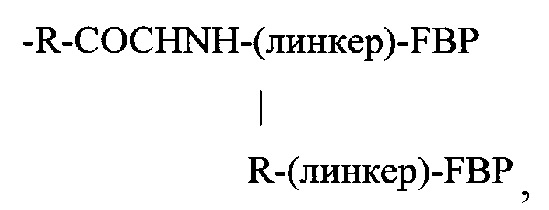
если Y представляет собой -FBP, и а равен 1.
Пептидный дендример, подходящий для применения в качестве гемостатического агента в составе композиции согласно настоящему изобретению, может иметь следующую общую формулу (III):
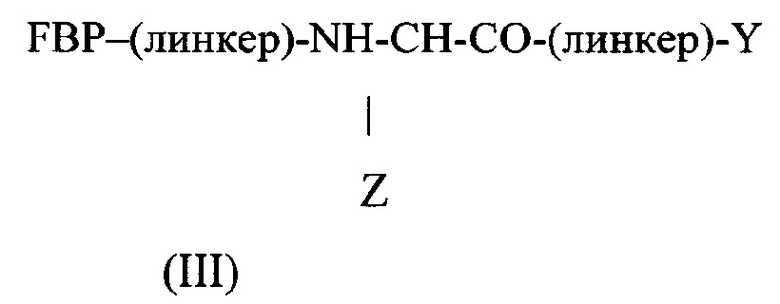
где:
FBP представляет собой фибриноген-связывающий пептид;
-(линкер)- представляет собой необязательный линкер, предпочтительно содержащий -NH(CH2)5CO-;
Y представляет собой -FBP или -NH2;
Z представляет собой:
-(СН2)4NH-(линкер)-FBP, если Y представляет собой -FBP; или

если Y представляет собой -NH2; или
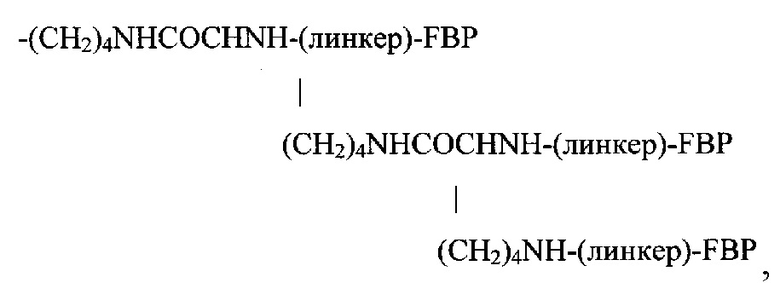
если Y представляет собой -NH2; или
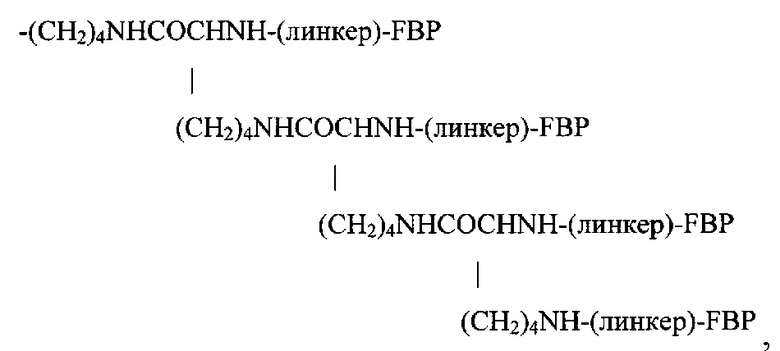
если Y представляет собой -NH2.
Следовательно, в одном варианте реализации Z может представлять собой:
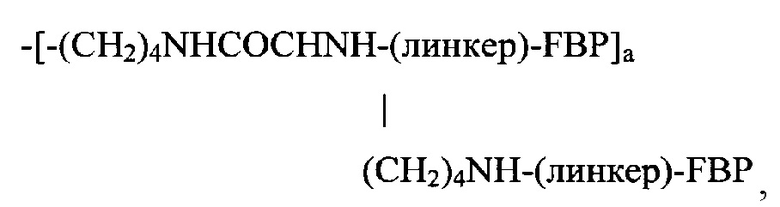
если Y представляет собой -NH2;
где а равен 1-3.
В качестве альтернативы а равен 4-10, или он может быть равен 1-10.
В другом варианте реализации Z представляет собой:
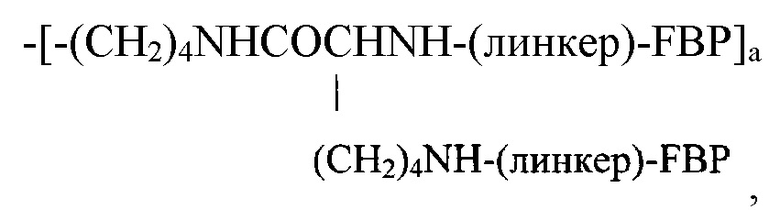
если Y представляет собой -FBP;
где а равен 1-10, предпочтительно 1-3.
Например, Z представляет собой:

если Y представляет собой -FBP, и а равен 1.
Любой подходящий фибриноген-связывающий пептид (FBP) можно применять в гемостатическом агенте в составе композиции согласно настоящему изобретению. Например, FBP может связываться с участком фибриногена, который обычно связан с фибрином или с гликопротеинами GPIIb-IIIa мембран тромбоцитов. Связывание фибрина с фибриногеном обсуждается в Mosesson et al. 2001, Ann. N.Y. Acad. Sci., 936, 11-30. Связывание GPIIb-IIIa с фибриногеном обсуждается в Bennett, 2001, Annals of NY Acad. Sci., 936, 340-354.
Термин "пептид" при использовании в настоящем описании также включает аналоги пептидов. Специалистам в данной области известно несколько аналогов пептидов. Можно применять любой подходящий аналог при условии, что фибриноген способен связывать фибриноген-связывающий пептид.
Примеры подходящих фибриноген-связывающих пептидов и способы их идентификации приведены в WO 2005/035002, WO 2007/015107 и WO 2008/065388.
Примеры последовательностей подходящих FBP включают: 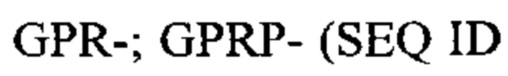

Предпочтительный пример FBP содержит аминокислотную последовательность G(P,H)RX- (SEQ ID NO: 15) на амино-конце, где X представляет собой любую аминокислоту, и (Р,Н) означает, что при указанном положении содержится пролин или гистидин.
FBP, прикрепленный к носителю, может иметь такую же или отличающуюся последовательность. Каждый FBP может иметь длину, составляющую 3-60, 3-30 или 3-10 аминокислотных остатков.
В некоторых вариантах реализации каждый фибриноген-связывающий пептид связывает фибриноген с константой диссоциации (KD), которая составляет от 10-9 до 10-6 М, например, примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 200, 250, 300, 350, 400 нМ или более. Предпочтительной является KD, составляющая примерно 100 нМ. Константа диссоциации может быть измерена в условиях равновесия. Например, меченный радиоизотопом фибриноген с известной концентрацией можно инкубировать совместно с микросферами с поперечно-сшитым фибриноген-связывающим фрагментом. Как правило, проводят поперечную сшивку 5 мкМ пептида с 1 г микросфер или 15-40 мкмоль пептида с 1 г микросфер. Микросферы, связанные с пептидами, разбавляют до 0,5 мг/мл и инкубируют в изотоническом буфере при рН 7,4 (например, в 0,01 М буфере Hepes, содержащем 0,15 М NaCl) совместно с меченным радиоизотопом фибриногеном в концентрации от 0,05 до 0,5 мг/мл в течение до 1 ч при 20°С. Можно отделять фибриноген, связанный с фибриноген-связывающим пептидом на микросферах, от свободного фибриногена путем центрифугирования и измерять количество свободного и связанного фибриногена. Затем можно вычислять константу диссоциации с помощью анализа Скэтчарда путем построения графика зависимости концентрации связанного фибриногена от отношения концентраций связанный свободный фибриноген, где коэффициент наклона кривой представляет собой KD.
Согласно некоторым вариантам реализации фибриноген-связывающие пептиды в составе гемостатического агента, в частности пептидных дендримеров для применения в композициях согласно настоящему изобретению предпочтительно связываются с впадиной "а" фибриногена по сравнению с впадиной "b" фибриногена. Примеры последовательностей подходящих фибриноген-связывающих пептидов, которые предпочтительно связываются с впадиной "а" по сравнению с впадиной "b" фибриногена, включают: 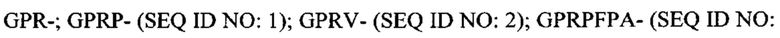
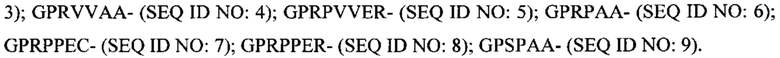
Согласно другим вариантам реализации фибриноген-связывающие пептиды в составе гемостатического агента, в частности пептидных дендримеров для применения в композициях согласно настоящему изобретению предпочтительно связываются с впадиной "b" фибриногена по сравнению с впадиной "а" фибриногена. Примеры последовательностей фибриноген-связывающих пептидов, которые предпочтительно связываются с впадиной "b" по сравнению с впадиной "а" фибриногена, включают: 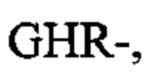
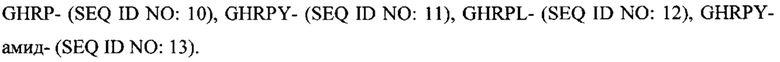
Каждый фибриноген-связывающий может независимо присоединяться по карбоксильному концу (необязательно через линкер) или по амино-концу (необязательно через линкер) к носителю или разветвленному ядру дендримера. Если фибриноген-связывающий пептид присоединен по амино-концу, карбоксильный конец пептида может содержать амидную группу. Присутствие амидной группы, но не карбоксильной группы (или отрицательно заряженного карбоксилатного иона) на свободном карбоксильном конце пептида может способствовать оптимизации связывания фибриноген-связывающего пептида с фибриногеном.
В некоторых вариантах реализации каждый фибриноген-связывающий пептид присоединен (необязательно через линкер) по карбоксильному концу к носителю или разветвленному ядру дендримера. В других вариантах реализации по меньшей мере один фибриноген-связывающий пептид присоединен (необязательно через линкер) по амино-концу к носителю или разветвленному ядру дендримера. Например, по меньшей мере один фибриноген-связывающий пептид, который предпочтительно связывается с впадиной "а" по сравнению с впадиной "b" фибриногена, такой как пептид, содержащий последовательность 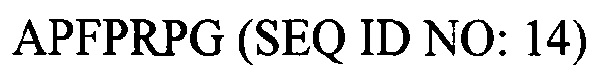 , может быть присоединен (необязательно через линкер) по амино-концу к носителю или разветвленному ядру дендримера.
, может быть присоединен (необязательно через линкер) по амино-концу к носителю или разветвленному ядру дендримера.
Предпочтительно гемостатический агент или пептидный дендример содержит фибриноген-связывающие пептиды с различными последовательностями (и его называют в настоящем описании "химерным" гемостатическим агентом или пептидным дендримером). Например, в некоторых вариантах реализации гемостатический агент или пептидный дендример содержит фибриноген-связывающие пептиды, которые имеют различную селективность связывания с впадиной "а" и впадиной "b" фибриногена.
Гемостатический агент для применения в композициях согласно настоящему изобретению может содержать совокупность носителей, где каждый носитель содержит совокупность фибриноген-связывающих пептидов, присоединенных к носителю, и фибриноген-связывающие пептиды, присоединенные к носителям, содержат фибриноген-связывающие пептиды с различными последовательностями.
В некоторых вариантах реализации совокупность носителей содержит первую совокупность носителей и вторую совокупность носителей, где фибриноген-связывающие пептиды, присоединенные к первой совокупности носителей, имеют последовательность, отличную от последовательности фибриноген-связывающих пептидов, присоединенных ко второй совокупности носителей.
В других вариантах реализации каждый носитель содержит присоединенные к нему фибриноген-связывающие пептиды с различными последовательностями.
Теоретически не существует верхнего предела для количества фибриноген-связывающих пептидов на молекулу носителя. Оптимальное количество, вероятно, зависит от многих факторов, таких как природа носителя и количество реакционно-активных групп на каждом носителе для присоединения фибриноген-связывающих пептидов. Тем не менее, предпочтительно к молекуле носителя в среднем присоединено до 100 фибриноген-связывающих пептидов. Предпочтительным является наличие в среднем по меньшей мере трех, предпочтительно по меньшей мере четырех или пяти фибриноген-связывающих пептидов на молекулу носителя. Предпочтительный диапазон представляет собой 10-20 фибриноген-связывающих пептидов на молекулу носителя.
Носители могут содержать реакционно-активные группы, которые обеспечивают присоединение фибриноген-связывающих пептидов. Например, носители могут содержать на поверхности тиоловые фрагменты или аминовые фрагменты. Если носители являются белковыми, то тиоловые или аминовые фрагменты могут быть обеспечены в боковых цепях аминокислот, например, цистеина или лизина. В качестве альтернативы в носитель можно вводить реакционно-активные группы. Это особенно предпочтительно, если носитель получен из белка, такого как альбумин. Например, можно проводить тиолирование носителя с применением реагента, такого как 2-иминотиолан (2-IT), который способен взаимодействовать с первичными аминогруппами на носителе. В качестве альтернативы можно проводить сочетание цистамина с карбоксильными группами на носителе в присутствии гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) и последующее восстановительное расщепление встроенной дисульфидной связи.
В некоторых вариантах реализации фибриноген-связывающие пептиды ковалентно иммобилизованы на носителе посредством группы-спейсера. Предпочтительным спейсером является непептидный спейсер, например, содержащий гидрофильный полимер, такой как полиэтиленгликоль (ПЭГ). В предпочтительном варианте реализации проводят взаимодействие совокупности пептидных конъюгатов, каждый из которых содержит фибриноген-связывающий пептид, связанный с группой, способной взаимодействовать с тиолом (например, с малеимидной группой), посредством ПЭГ-спейсера, с тиолированным носителем (например, полученным с применением 2-IT или цистамина, как описано выше). Подходящие непептидные спейсеры описаны в WO 2013/114132.
Фибриноген-связывающие пептиды с различными последовательностями могут включать первый фибриноген-связывающий пептид, который предпочтительно связывается с впадиной "а" по сравнению с впадиной "b" фибриногена, и второй фибриноген-связывающий пептид, который связывается с впадиной "а" по сравнению с впадиной "b" фибриногена с большей селективностью чем первый фибриноген-связывающий пептид. Было показано, что пептидные дендримеры с указанными последовательностями фибриноген-связывающих пептидов быстро полимеризуют фибриноген в достаточно широком диапазоне концентраций пептидного дендримера.
Например, первый фибриноген-связывающий пептид может содержать аминокислотную последовательность 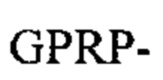 (SEQ ID NO: 1) на амино-конце, и/или второй фибриноген-связывающий пептид может содержать аминокислотную последовательность
(SEQ ID NO: 1) на амино-конце, и/или второй фибриноген-связывающий пептид может содержать аминокислотную последовательность 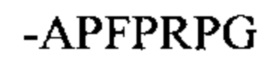 (SEQ ID NO: 14) на карбоксильном конце, где аминокислотные остатки последовательностей указаны в направлении от амино- к карбоксильному концу, и "-" обозначает конец последовательности, который присоединен к разветвленному ядру пептидного дендримера или к носителю. Фибриноген-связывающий пептид с последовательностью
(SEQ ID NO: 14) на карбоксильном конце, где аминокислотные остатки последовательностей указаны в направлении от амино- к карбоксильному концу, и "-" обозначает конец последовательности, который присоединен к разветвленному ядру пептидного дендримера или к носителю. Фибриноген-связывающий пептид с последовательностью  (SEQ ID NO: 14) на карбоксильном конце связывается с впадиной "а" по сравнению с впадиной "b" фибриногена с большей селективностью чем фибриноген-связывающий пептид с последовательностью
(SEQ ID NO: 14) на карбоксильном конце связывается с впадиной "а" по сравнению с впадиной "b" фибриногена с большей селективностью чем фибриноген-связывающий пептид с последовательностью 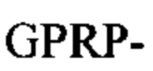 (SEQ ID NO: 1) на амино-конце.
(SEQ ID NO: 1) на амино-конце.
В других вариантах реализации изобретения фибриноген-связывающие пептиды с различными последовательностями могут содержать первый фибриноген-связывающий пептид, который предпочтительно связывается с впадиной "а" по сравнению с впадиной "b" фибриногена, и второй фибриноген-связывающий пептид, который предпочтительно связывается с впадиной "b" по сравнению с впадиной "а" фибриногена. Было показано, что пептидные дендримеры, имеющие указанные последовательности фибриноген-связывающих пептидов, полимеризуются с фибриногеном с образованием относительно плотных гидрогелей по сравнению с эквивалентными пептидными дендримерами, содержащими только фибриноген-связывающие пептиды, которые предпочтительно связываются с впадиной "а" по сравнению с впадиной "b" фибриногена. Полагают, что увеличение плотности полученного гидрогеля происходит в результате связывания фибриноген-связывающих пептидов, входящих в состав дендримера, с впадиной "а" и впадиной "b" фибриногена, что тем самым упрочняет сеть полимеризованного фибриногена.
Например, первый фибриноген-связывающий пептид может содержать аминокислотную последовательность 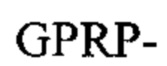 (SEQ ID NO: 1) на амино-конце, и/или второй фибриноген-связывающий пептид может содержать аминокислотную последовательность
(SEQ ID NO: 1) на амино-конце, и/или второй фибриноген-связывающий пептид может содержать аминокислотную последовательность 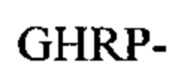 (SEQ ID NO: 10) или аминокислотную последовательность
(SEQ ID NO: 10) или аминокислотную последовательность  (SEQ ID NO: 11) на амино-конце. Фибриноген-связывающие пептиды с последовательностью
(SEQ ID NO: 11) на амино-конце. Фибриноген-связывающие пептиды с последовательностью 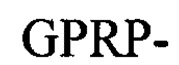 (SEQ ID NO: 1) на амино-конце с некоторой селективностью связываются с впадиной "а" фибриногена. Фибриноген-связывающие пептиды с последовательностью
(SEQ ID NO: 1) на амино-конце с некоторой селективностью связываются с впадиной "а" фибриногена. Фибриноген-связывающие пептиды с последовательностью 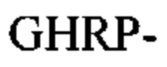 (SEQ ID NO: 10) или
(SEQ ID NO: 10) или 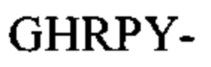 (SEQ ID NO: 11) на амино-конце предпочтительно связываются с впадиной "b" фибриногена.
(SEQ ID NO: 11) на амино-конце предпочтительно связываются с впадиной "b" фибриногена.
Один или более или каждый фибриноген-связывающий пептид может быть ковалентно присоединен к носителю гемостатического агента, например, к разветвленному ядру пептидного дендримера посредством непептидного линкера. Линкер может представлять собой любой подходящий линкер, который не препятствует связыванию фибриногена с фибриноген-связывающими пептидами. Линкер может содержать гибкий линейный линкер, например, линейную алкильную группу. Указанные линкеры обеспечивают удаление фибриноген-связывающих пептидов друг от друга. Например, линкер может содержать группу -NH(CH2)nCO- где n представляет собой любое число, предпочтительно 1-10, например, 5. Линкер, содержащий группу NH(CH2)5CO-, можно получать с применением ε-аминокислоты, 6-аминогексановой кислоты (εAhx).
Теоретически не существует верхнего предела для общего количества фибриноген-связывающих пептидов, которые могут присутствовать в пептидном дендримере. Тем не менее, на практике для любой конкретной структуры можно изменять количество фибриноген-связывающих пептидов и проводить исследование для определения оптимального количества для получения желаемых характеристик полимеризации фибриногена, например, скорости полимеризации фибриногена или плотности гидрогеля, образующегося при полимеризации фибриногена. Пептидные дендримеры могут содержать в целом до двадцати фибриноген-связывающих пептидов на дендример, например, до десяти фибриноген-связывающих пептидов на дендример или до пяти фибриноген-связывающих пептидов на дендример.
Авторы настоящего изобретения неожиданно обнаружили, что смеси пептидного дендримера с пептидным конъюгатом, содержащим два или более фибриноген-связывающих пептидов, способны быстрее полимеризовать фибриноген по сравнению с пептидным дендримером или пептидным конъюгатом, применяемыми по отдельности.
Соответственно, гемостатический агент для применения в композициях согласно настоящему изобретению может содержать пептидный дендример и пептидный конъюгат, содержащий два или более фибриноген-связывающих пептидов.
Пептидный конъюгат может содержать фибриноген-связывающие пептиды с одинаковыми последовательностями или с различными последовательностями. Например, пептидный конъюгат может содержать только фибриноген-связывающие пептиды, которые предпочтительно связываются с впадиной "а" по сравнению с впадиной "b" фибриногена, или только фибриноген-связывающие пептиды, которые предпочтительно связываются с впадиной "b" по сравнению с впадиной "а" фибриногена, или один или более фибриноген-связывающих пептидов, которые предпочтительно связываются с впадиной "а" по сравнению с впадиной "b" фибриногена, и один или более фибриноген-связывающих пептидов, которые предпочтительно связываются с впадиной "b" по сравнению с впадиной "а" фибриногена.
Пептидный конъюгат может содержать носитель к которому присоединены фибриноген-связывающие пептиды. Подходящий носитель может содержать один или более аминокислотных остатков, например, единственный аминокислотный остаток, такой как аминокислотный остаток лизина. Преимуществом конъюгатов, содержащих носители, которые содержат один или более аминокислотных остатков, является то, что их можно легко получать при помощи способов твердофазного пептидного синтеза. Кроме того, их можно легко получать без использования иммуногенных агентов, и они могут быть устойчивы к стерилизации.
Каждый фибриноген-связывающий пептид, входящий в состав пептидного конъюгата, независимо может быть присоединен по карбоксильному концу (необязательно через линкер) или по амино-концу (необязательно через линкер) к носителю. Если фибриноген-связывающий пептид присоединен по амино-концу, карбоксильный конец пептида может содержать амидную группу.
В одном из примеров пептидный конъюгат может иметь следующую общую формулу:
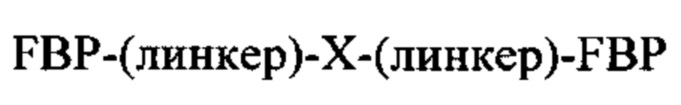
где:
FBP представляет собой фибриноген-связывающий пептид;
-(линкер)- представляет собой необязательный линкер, предпочтительно непептидный линкер;
X представляет собой аминокислоту, предпочтительно полифункциональную аминокислоту, наиболее предпочтительно трифункциональный аминокислотный остаток, такой как лизин, орнитин или аргинин.
Пептидный конъюгат может представлять собой дендример. Дендример может содержать разветвленное ядро и совокупность фибриноген-связывающих пептидов, по отдельности ковалентно присоединенных к разветвленному ядру. Разветвленное ядро может содержать одну или более полифункциональных аминокислот.К каждой полифункциональной аминокислоте или совокупности полифункциональных аминокислот могут быть ковалентно присоединены один или более фибриноген-связывающих пептидов. В некоторых вариантах реализации пептидный конъюгат может представлять собой пептидный дендример, такой как определено выше.
Фибриноген-связывающие пептиды, входящие в состав пептидного дендримера для применения в композиции согласно настоящему изобретению, могут предпочтительно связываться с впадиной "а" фибриногена по сравнению с впадиной "b" фибриногена, и фибриноген-связывающие пептиды, входящие в состав пептидного конъюгата, могут предпочтительно связываться с впадиной "b" фибриногена по сравнению с впадиной "а" фибриногена. Было показано, что указанные композиции обладают синергическим действием и способны быстрее полимеризовать фибриноген по сравнению с пептидным дендримером или пептидным конъюгатом, применяемыми по отдельности. Механизм указанного синергического действия полностью не выяснен, но, не ограничиваясь теорией, полагают, что оно может происходить благодаря тому, что в композиции обеспечено увеличенное количество участков полимеризации "А" и "В" фибриногена.
В качестве альтернативы фибриноген-связывающие пептиды, входящие в состав пептидного дендримера для применения в композиции согласно настоящему изобретению, могут предпочтительно связываться с впадиной "b" фибриногена по сравнению с впадиной "а" фибриногена, и фибриноген-связывающие пептиды, входящие в состав пептидного конъюгата, предпочтительно связываются с впадиной "а" фибриногена по сравнению с впадиной "b" фибриногена.
Следует понимать, что конкретным преимуществом гемостатических агентов для применения в композициях согласно настоящему изобретению, является то, что их можно синтезировать без использования продуктов животного происхождения, что тем самым минимизирует риск передачи вирусной или прионной инфекции из указанных продуктов.
Биосовместимая жидкость, применяемая в композициях согласно настоящему изобретению, может представлять собой водную или неводную жидкость, но в общем случае представляет собой водную жидкость. Водные жидкости могут включать биосовместимые водные растворы, такие как водный раствор хлорида кальция или хлорида натрия. В общем случае биосовместимая жидкость имеет рН, близкий к физиологическому, например, находится в диапазоне рН 6,0-7,5, например, рН 7,3-7,5 или рН 7,35-7,45.
Биосовместимая жидкость может содержать буфер, например, фосфат, HEPES или Tris-буфер, такой как 10-150 мМ фосфатный буфер, 10-150 мМ буфер HEPES или 10-150 мМ Tris-буфер.
Количество и средний диаметр частиц, содержащихся в композиции согласно настоящему изобретению, и относительное количество гемостатического агента, биосовместимой жидкости и нерастворимых частиц являются эффективными для обеспечения композиции, имеющей гемостатические и физические свойства, такие как описано далее.
Согласно определенным вариантам реализации частицы, входящие в состав композиции, имеют размеры и другие физические свойства, которые увеличивают текучесть композиции (например, возможность выдавливания через шприц) и возможность нанесения композиции и заполнения композицией участков или тканей, включая поверхности тканей и определенные полости, такие как межпозвоночное пространство, выемки, впадины или карманы в тканях.
Композиции согласно настоящему изобретению могут быть частично гидратированными или полностью гидратированными и могут иметь степень набухания, например, от 0% до 100%, в зависимости от степени гидратации.
Типовые и предпочтительные диапазоны размеров частично или полностью гидратированных частиц приведены далее:
Размер частиц:
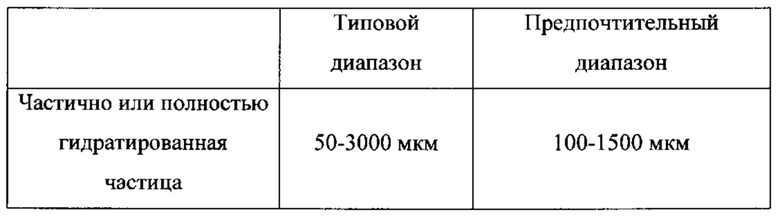
Композиции согласно настоящему изобретению, как правило, находятся в частично или полностью гидратированной форме. Сухой порошок (имеющий содержание влаги менее 20% по массе), содержащий частицы полисахарида, может являться подходящим исходным материалом для получения композиции согласно настоящему изобретению. Частично гидратированные композиции согласно настоящему изобретению, как правило, имеющие степень гидратации от 50% до 80%, подходят для применений, где желательным является дополнительное набухание композиции при нанесении на влажный целевой участок, например, в выемку в ткани. Полностью гидратированные композиции подходят для применений, где набухание in situ является нежелательным, например, в позвоночнике или других областях, в которых присутствуют нервы и другие чувствительные структуры.
"Целевой участок" представляет собой место, в которое необходимо доставлять композицию согласно настоящему изобретению. Целевой участок может представлять собой участок, в котором присутствует или присутствовало кровотечение, вызванное повреждением или хирургической процедурой. Как правило, целевой участок представляет собой область в данной ткани, но в некоторых случаях композицию можно вводить в область, расположенную поблизости от данной области, например, если материал набухает in situ и закрывает данную область.
Геометрические размеры частиц могут быть обеспечены различными способами. Например, исходный материал, содержащий полисахарид, можно разрушать (1) до или после поперечной сшивки полисахаридного исходного материала или (2) до или после гидратации поперечно-сшитого или не сшитого полисахаридного исходного материала, например, в виде полностью или частично гидратированного материала или сухого дисперсного порошка. Термин "сухой" используют в настоящем описании для обозначения того, что содержание влаги является достаточно низким, как правило, менее 20% воды по массе, таким образом, порошок является свободно текучим, и отдельные частицы не образуют агрегатов. Термин "гидратированный" используют в настоящем описании для обозначения того, что содержание влаги является достаточно высоким, как правило, более 50% от равновесного уровня гидратации и обычно находится в диапазоне от 80% до 95% от равновесного уровня гидратации.
Механическое разрушение исходного материала в сухом состоянии может быть предпочтительным в тех случаях, когда желательно контролировать размер частиц и/или распределение частиц по размерам. Контролирование измельчения сухих частиц может быть более простым по сравнению с гидратированной композицией, таким образом проще регулировать размер полученных измельченных частиц. Напротив, механическое разрушение гидратированного материала в общем случае является более простым и включает меньше стадий по сравнению с измельчением сухого полимерного исходного материала. Таким образом, разрушение гидратированного материала может быть предпочтительным, если конечный размер частиц и/или распределение по размерам не важны.
Композицию согласно настоящему изобретению можно механически разрушать во время доставки в целевой участок путем экструзии через отверстие или за счет другого ограничения потока, или ее можно механически разрушать перед доставкой в целевой участок. В качестве альтернативы композицию согласно настоящему изобретению можно механически разрушать перед конечным применением или доставкой. Молекулярную поперечную сшивку цепей полисахаридов можно проводить до или после механического разрушения. Первичной задачей стадии механического разрушения является создание совокупности частиц, имеющих размер, который позволяет наносить композицию и заполнять пространство, в которое ее доставляют. Другой задачей механического разрушения является упрощение прохождения композиции через трубки небольшого диаметра, канюли и/или другие устройства нанесения в целевой участок. Если композицию разрушают перед применением, ее можно наносить или вводить при помощи способов, отличных от экструзии, например, с применением лопатки или ложки.
В некоторых вариантах реализации полисахарид можно изначально получать (например, путем сушки распылением) и/или механически разрушать перед поперечной сшивкой, как правило, перед гидратацией. Полисахарид может быть обеспечен в виде мелкодисперсного или порошкового сухого твердого вещества, которое можно разрушать путем дополнительного измельчения для обеспечения частиц, имеющих целевой размер, как правило, в низком узко ограниченном диапазоне. Также можно проводить дополнительные стадии разделения и модификации размеров, такие как просеивание или циклонное разделение. В случае типовых материалов размер сухих частиц может находиться в диапазоне 10-1500 мкм или 50-1000 мкм. Типовое распределение частиц по размерам является таким, что более 95% частиц по массе имеют размер в диапазоне 50-700 мкм.
Способы измельчения полимерного исходного материала включают гомогенизацию, растирание, расслоение, помол, помол на струйной мельнице. Порошковые полисахаридные исходные материалы также можно получать путем сушки распылением. Распределение частиц по размерам можно дополнительно контролировать и сужать при помощи традиционных способов, таких как просеивание, агрегация или дополнительное измельчение. Затем сухое порошковое твердое вещество можно суспендировать в водном буфере и проводить поперечную сшивку. В других случаях полисахарид можно суспендировать в водном буфере, проводить поперечную сшивку и затем сушить. Затем поперечно-сшитый высушенный полисахарид можно разрушать, после чего повторно суспендируют разрушенный материал в водном буфере.
В типовом способе получения сухой не сшитый полисахаридный исходный материал механически разрушают путем стандартной отдельной операции, такой как гомогенизация, измельчение, расслоение или помол. Порошок разрушают до достаточной степени, чтобы обеспечивать размер сухих частиц, который позволяет получать частицы с размером в целевом диапазоне, если продукт является частично или полностью гидратированным. Взаимосвязь между размером сухих частиц и размером полностью гидратированных субъединиц зависит от набухаемости материала, что дополнительно обсуждается ниже.
В качестве альтернативы дисперсный полисахаридный исходный материал можно получать путем сушки распылением. Способы сушки распылением основаны на пропускании раствора через небольшое отверстие, такое как форсунка, для получения капель, которые высвобождаются в двигающийся в противоположном или сопутствующем направлении газовый поток, как правило, в нагретый газовый поток. Газ выпаривает растворитель из жидкого исходного материала, который может представлять собой раствор или дисперсию. Применение сушки распылением для получения сухого порошкового исходного материала является альтернативой механическому разрушению исходного материала. Сушка распылением, как правило, обеспечивает получение не сшитого сухого порошкового продукта с крайне однородным размером частиц. Затем можно проводить поперечную сшивку частиц согласно приведенному далее описанию.
Во многих случаях механическое разрушение можно контролировать в достаточной степени для получения частиц, имеющих размер и распределение по размерам в рамках целевого диапазона. В других случаях, где требуется более точное распределение частиц по размерам, разрушенный материал можно дополнительно обрабатывать или разделять для обеспечения целевого распределения частиц по размерам, например, путем просеивания или агрегации. Затем можно проводить поперечную сшивку механически разрушенного полимерного исходного материала, что более подробно описано далее.
Если размер частиц в композиции согласно настоящему изобретению не так важен, высушенный полисахаридный исходный материал можно гидратировать, растворять или суспендировать в подходящем буфере и проводить поперечную сшивку перед механическим разрушением. Механическое разрушение, как правило, обеспечивают путем пропускания материала через отверстие, где размер отверстия и сила выдавливания совместно определяют размер частиц и распределение частиц по размерам. Несмотря на то, что указанный способ обычно является более простым по сравнению с механическим разрушением частиц сухого полисахарида перед гидратацией и поперечной сшивкой, контролирование размеров частиц может быть менее точным.
В некоторых вариантах реализации композиция согласно настоящему изобретению может быть упакована в шприц или другое устройство нанесения перед механическим разрушением частиц в композиции. Затем материалы могут механически разрушаться при нанесении через шприц в целевой участок ткани. В качестве альтернативы неразрушенный поперечно-сшитый полисахаридный исходный материал можно хранить в сухой форме перед применением. Затем сухой материал можно помещать в шприц или другое подходящее устройство нанесения, гидратировать внутри устройства нанесения для получения композиции согласно настоящему изобретению и механически разрушать при доставке материала в целевой участок, как правило, через отверстие или через небольшой просвет трубки.
Различные биосовместимые природные, полусинтетические или синтетические полисахариды можно применять для получения частиц, применяемых в композициях согласно настоящему изобретению. Частицы поперечно-сшитого полисахарида должны быть по существу не растворимы в биосовместимой жидкости, выбранной для конкретной композиции. Подходящие частицы имеют растворимость менее 10 мг частиц на мл биосовместимой жидкости, например, менее 1 мг/мл или менее 0,1 мг/мл. Согласно некоторым вариантам реализации применяют не растворимые в воде частицы, которые обеспечивают механическую, химическую и/или биологическую гемостатическую активность.
Типовые полисахариды включают гликозаминогликаны, производные крахмала (например, окисленный крахмал), производные целлюлозы (например, окисленную целлюлозу), производные гемицеллюлозы, ксилан, агарозу, альгина, производные альгината (например, окисленный альгинат), хитозан, хитин и их комбинации.
Поперечную сшивку полисахарида можно проводить любым привычным способом. Например, можно проводить поперечную сшивку полисахаридов с применением подходящих агентов поперечной сшивки.
Можно проводить поперечную сшивку молекул полисахаридов с применением би- или полифункциональных агентов поперечной сшивки, которые ковалентно присоединяются к двум или более полисахаридам. Типовые бифункциональные агенты поперечной сшивки включают альдегиды, эпоксиды, сукцинимиды, карбодиимиды, малеимиды, азиды, карбонаты, изоцианаты, дивинилсульфон (ДВС), простой диглицидиловый эфир 1,4-бутандиола (BDDE), спирты, амины, имидаты, ангидриды, диазоцетат или азиридины. В качестве альтернативы поперечная сшивка может быть обеспечена путем применения окислителей или других агентов, таких как периодаты, которые активируют боковые цепи или фрагменты полисахарида, в результате чего они могут взаимодействовать с другими боковыми цепями или фрагментами с образованием поперечных сшивок.
Как правило, каждая молекула полисахарида в исходном материале имеет молекулярную массу в диапазоне от 10 кДа до 10000 кДа или от 25 кДа до 5000 кДа. Как правило, молекула поперечно-сшитого полисахарида имеет по меньшей мере одну сшивку с другой молекулой полисахарида, часто от 1 до 5 сшивок, где фактический уровень поперечной сшивки может быть выбран таким образом, чтобы обеспечивать желаемый уровень биоразложения.
Степень поперечной сшивки полисахарида влияет на несколько функциональных свойств композиции, включая пригодность для экструзии, всасывание окружающих биологических жидкостей, когезию, возможность заполнения пространств, набухаемость и возможность адгезии к участку ткани. Степень поперечной сшивки должна быть достаточной, чтобы нерастворимые частицы полисахарида могли выдерживать условия стерилизации (например, условия стерилизации паром или сухим жаром), применяемые для стерилизации композиции согласно настоящему изобретению, содержащей частицы. Степень поперечной сшивки можно контролировать путем регулирования концентрации агента поперечной сшивки, изменения относительного количества агента поперечной сшивки и полисахаридного исходного материала или путем изменения реакционных условий. Как правило, степень поперечной сшивки контролируют путем регулирования концентрации агента поперечной сшивки.
В некоторых вариантах реализации (например, в вариантах реализации с применением частиц, содержащих гиалуроновую кислоту) равновесная степень набухания частиц может находиться в диапазоне от 0% до 500%, например, от 0% до 100%.
Равновесную степень набухания можно контролировать путем изменения степени поперечной сшивки, которое в свою очередь обеспечивают путем изменения условий поперечной сшивки, таких как тип способа поперечной сшивки, продолжительность воздействия агента поперечной сшивки, концентрация агента поперечной сшивки и температура поперечной сшивки. Материалы, имеющие различные значения равновесной степени набухания, имеют различные характеристики при различных применениях. Возможность контролирования поперечной сшивки и равновесной степени набухания позволяет оптимизировать композиции согласно настоящему изобретению для различных применений.
Под "набуханием в процентах" понимают разницу массы влажного материала и массы сухого материала, разделенную на массу сухого материала и умноженную на 100, где массу влажного материала измеряют после максимально возможного удаления увлажнителя, не заключенного внутри материала, например, путем фильтрования, и массу сухого материала измеряют после обработки при повышенной температуре в течение периода времени, который является достаточным для выпаривания увлажнителя, например, в течение 2 часов при 120°С. "Равновесная степень набухания" определена как набухание в процентах в равновесии после погружения полисахаридного материала в увлажнитель в течение периода времени, который является достаточным для достижения постоянного содержания воды, как правило, от 18 до 24 часов.
Помимо равновесной степени набухания также важно контролировать гидратацию композиции непосредственно перед доставкой в целевой участок. Материал с 0% гидратацией является не набухшим. Материал со 100% гидратацией имеет равновесное содержание воды. Уровень гидратации от 0% до 100% соответствует набуханию в диапазоне от минимального до максимального значения. На практике многие сухие ненабухшие материалы имеют некоторое остаточное содержание влаги, как правило, менее 20% по массе, чаще от 8% до 15% по массе. Если в настоящем описании используют термин "сухой", он обозначает материалы, имеющие низкое содержание влаги, отдельные частицы которых являются свободно текучими и в общем случае не набухшими.
Степень гидратации можно регулировать очень просто, например, путем контролирования количества биосовместимой жидкости (такой как водный буфер), добавляемой к сухому или частично гидратированному поперечно-сшитому материалу перед применением. Как правило, желательно как минимум вводить достаточное количество водного буфера, которое позволяет проводить экструзию через шприц или другое устройство доставки. В других случаях, тем не менее, может быть желательным применение лопатки или другого устройства нанесения для доставки менее текучих материалов. Предполагаемое применение также должно помогать определению целевой степени гидратации. В тех случаях, где желательно наполнение или закрытие влажной полости, в общем случае желательным является применение частично гидратированной композиции, которая может набухать и заполнять полость за счет поглощения влаги из целевого участка. Напротив, полностью или по существу полностью гидратированные композиции являются предпочтительными для применения в мозге, в области позвоночника и в целевых участках поблизости от нервов и других чувствительных структур организма, которые могут повреждаться в результате набухания после доставки. Также можно получать композиции согласно настоящему изобретению, содержащие избыток буфера, что приводит к образованию двухфазной композиции, содержащей полностью гидратированную фазу и свободную буферную фазу.
Согласно некоторым вариантам реализации изобретения частицы полисахарида содержат гликозаминогликан (ГАГ). ГАГ представляет собой крупный линейный полисахарид, состоящий из повторяющихся дисахаридных звеньев, который в первичной конфигурации содержит аминосахар (GlcNAc или GalNAc) и уроновую кислоту (глюкуроновую кислоту и/или идуроновую кислоту). Подходящий гликозаминогликан для применения согласно настоящему изобретению представляет собой гиалуроновую кислоту (ГК) или ее соль.
ГК состоит из чередующихся остатков β-D-(1→3) глюкуроновой кислоты (GlcA) и β-D-(1→4)-N-ацетилглюкозамина (GlcNAc). Термин "гиалуроновая кислота" используют в литературе для обозначения кислотных полисахаридов с различной молекулярной массой, составленных из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, которые в обычных условиях присутствуют на клеточных поверхностях, в основных внеклеточных веществах соединительных тканей позвоночных, в синовиальной жидкости в суставах, во внутрибульбарной жидкости в глазу, в пуповинной ткани человека и в петушиных гребнях. Термин "гиалуроновая кислота" при использовании в настоящем описании включает смеси полисахаридов с различной молекулярной массой, составленных из D-глюкуроновой кислоты и N-ацетил-D-глюкозамина. Гиалуроновая кислота также известна как гиалуронан, гиалуронат или ГК. Термины "гиалуронан" и "гиалуроновая кислота" используют в настоящем описании взаимозаменяемо.
Состав гиалуроновой кислоты может быть определен согласно модифицированному карбазольному способу (Bitter and Muir, 1962, Anal Biochem.4:330-334). Среднюю молекулярную массу гиалуроновой кислоты можно определять при помощи стандартных для данной области техники способов, таких как те, что описаны в Ueno et al., 1988, Chem. Pharm. Bull. 36, 4971-4975; Wyatt, 1993, Anal. Chim. Acta 272: 1-40; и Wyatt Technologies, 1999, "Light Scattering University DAWN Course Manual" и "DAWN EOS Manual" Wyatt Technology Corporation, Santa Barbara, California.
Гиалуроновая кислота или ее соль может иметь молекулярную массу примерно 10000-10000000 Да, 25000-5000000 Да или 50000-3000000 Да. В конкретных вариантах реализации гиалуроновая кислота или ее соль имеет молекулярную массу в диапазоне от 300000 до 3000000 Да, от 400000 до 2500000 Да, от 500000 до 2000000 Да или от 600000 до 1800000 Да. В других вариантах реализации гиалуроновая кислота или ее соль имеет низкую среднюю молекулярную массу в диапазоне от 10000 до 800000 Да, от 20000 до 600000 Да, от 30000 до 500000 Да, от 40000 до 400000 Да или от 50000 до 300000 Да.
Примеры неорганических солей гиалуроновой кислоты включают гиалуронат натрия, гиалуронат калия, гиалуронат аммония, гиалуронат кальция, гиалуронат магния, гиалуронат цинка и гиалуронат кобальта.
Петушиные гребни являются значимым коммерческим источником гиалуроновой кислоты. Альтернативным источником являются микроорганизмы. В патенте США №4801539 и Европейском патенте №0694616 описаны способы ферментации для получения гиалуроновой кислоты с применением штаммов Streptococcus zooepidemicus. В публикации WO 03/054163, содержание которой включено в настоящую заявку во всей полноте, описан рекомбинантный способ получения гиалуроновой кислоты или ее солей, например, у хозяина грамм-положительной Bacillus.
В патенте США №4582865 (Biomatrix Inc.) описано получение поперечно-сшитых гелей ГК с применением дивинилсульфона (ДВС) в качестве агента поперечной сшивки. Получение поперечно-сшитой ГК или ее соли с применением полифункционального эпоксидного соединения описано в Европейском патенте ЕР 0161887 В1. Другие би- или полифункциональные реагенты, которые применяли для поперечной сшивки ГК посредством ковалентных связей, включают формальдегид (патент США №4713448, Biomatrix Inc.), полиазиридин (WO 03/089476 A1, Genzyme Corp.), L-аминокислоты или сложные эфиры L-аминокислот (WO 2004/067575, Biosphere S.P.A.). Также сообщалось о применении карбодиимидов для поперечной сшивки ГК (патент США №5017229, Genzyme Corp.; патент США №6013679, Anika Research, Inc). Полностью или частично поперечно-сшитые сложные эфиры ГК с алифатическим спиртом и соли указанных неполных эфиров с неорганическими или органическими основаниями описаны в патенте США №4957744.
Предпочтительные агенты химической поперечной сшивки ГК включают дивинилсульфон (ДВС), 1,2,7,8-диэпоксиоктан (ДЭО) и простой диглицидиловый эфир 1,4-бутандиола (BDDE).
Способы получения гелей на основе поперечно-сшитой ГК, подходящих для получения частиц для применения в композициях согласно настоящему изобретению, описаны в WO 2006/056204, заявках на патент США №2010/0035838, 2010/0028437, 2005/0136122, содержание каждой из которых включено в настоящую заявку во всей полноте посредством ссылок. Получение частиц гидрогелей на основе ГК также описано в Sahiner & Jia, Turk J Chem 32 (2008), 397-409: "One-Step Synthesis of Hyaluronic Acid-Based (Sub)micron Hydrogel Particles: Process Optimization and Preliminary Characterization".
Например, в WO 2006/056204 описан способ получения гидрогеля, содержащего гиалуроновую кислоту или ее соль, поперечно-сшитую с дивинилсульфоном (ДВС). Способ включает стадии: (а) обеспечения щелочного раствора гиалуроновой кислоты или ее соли; (b) добавления ДВС в раствор, полученный на стадии (а), в результате чего происходит поперечная сшивка гиалуроновой кислоты или ее соли с ДВС с образованием геля; и (с) обработки геля, полученного на стадии (b), буфером, где гель набухает и образует гидрогель, содержащий гиалуроновую кислоту или ее соль, поперечно-сшитую с ДВС.
Гиалуроновая кислота или ее соль может иметь среднюю молекулярную массу от 100 до 3000 кДа, например, от 500 до 2000 кДа или от 700 до 1800 кДа. ДВС можно добавлять в раствор, полученный на стадии (а), при массовом отношении от 1:1 до 100:1 ГК/ДВС (в пересчете на массу сухих веществ), предпочтительно от 2:1 до 50:1 ГК/ДВС (в пересчете на массу сухих веществ), например, от 2,5:1 до 8:1 или 5:1 ГК/ДВС (в пересчете на массу сухих веществ).
Подходящий гидрогель поперечно-сшитой ГК можно получать с применением технологии Hyasis Link, предложенной Novozyme для получения поперечно-сшитых гелей ГК. В Novozyme также предложен Hyasis, гиалуроновая кислота, выделенная у Bacillus, полученная при помощи рекомбинантного способа получения, основанного на ферментации непатогенного бактериального штамма Bacillus subtilis. В способе не применяют сырье животного происхождения.
Гидрогель поперечно-сшитой ГК можно измельчать, например, с применением любых способов механического разрушения, описанных выше, для обеспечения частиц подходящего размера для применения в композициях согласно настоящему изобретению. В конкретном варианте реализации гидрогель поперечно-сшитой ГК измельчают путем истирания, и частицы гидрогеля поперечно-сшитой ГК подходящего размера отделяют путем просеивания измельченного продукта.
Частицы гидрогеля поперечно-сшитой ГК, подходящие для применения согласно настоящему изобретению, имеют средний диаметр (в частично или полностью гидратированном состоянии), составляющий примерно 100-1500 мкм или 100-1000 мкм. Примером являются частицы гидрогеля поперечно-сшитой ГК, содержащие 2,7% (масс./об.) ГК; имеющие поперечную сшивку 5:1 ГК:ДВС и средний размер частиц гидрогеля примерно 400 мкм.
Конкретным недостатком традиционных гемостатических агентов на основе желатина является то, что желатиновая матрица является непрозрачной. Это может нарушать видимость, что затрудняет точное введение в участок раны и отслеживание степени остановки кровотечения. Авторы настоящего изобретения обнаружили, что удаление пузырьков воздуха из пасты, содержащей частицы поперечно-сшитого полисахарида, в частности из водной пасты, содержащей частицы гидрогеля поперечно-сшитой ГК, например, путем центрифугирования пасты, значительно снижает степень помутнения и обеспечивает по существу прозрачную пасту. Через прозрачную пасту можно наблюдать кровотечение в ране или по линии шва. Это позволяет хирургу более эффективно наблюдать за гемостазом и быстрее реагировать, если это необходимо.
Согласно дополнительному аспекту изобретения предложен способ понижения степени помутнения композиции, содержащей нерастворимые частицы поперечно-сшитого биосовместимого полисахарида, распределенные по фазе биосовместимой жидкости, который включает центрифугирование композиции для удаления пузырьков воздуха из композиции.
Дополнительно предложена по существу прозрачная композиция, содержащая нерастворимые частицы поперечно-сшитого биосовместимого полисахарида, распределенные в фазе биосовместимой жидкости. Жидкая фаза может быть обеспечена биосовместимой жидкостью, такой как описано выше.
Указанные прозрачные композиции можно применять в гемостатических композициях согласно настоящему изобретению для обеспечения тем самым по существу прозрачной гемостатической композиции согласно настоящему изобретению. Например, по существу полностью прозрачную гемостатическую композицию согласно настоящему изобретению можно получать путем смешения растворимого гемостатического агента, содержащего совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе, где по существу прозрачная композиция содержит нерастворимые частицы поперечно-сшитого биосовместимого полисахарида, подходящего для применения для остановки кровотечения, распределенные в фазе биосовместимой жидкости.
В качестве альтернативы по существу прозрачную гемостатическую композицию согласно настоящему изобретению можно получать путем удаления пузырьков воздуха из гемостатической композиции согласно настоящему изобретению. Пузырьки воздуха можно удалять из гемостатической композиции любым подходящим способом, например, путем центрифугирования.
Согласно настоящему изобретению дополнительно предложена по существу прозрачная гемостатическая композиция, содержащая растворимый гемостатический агент, содержащий: совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе; биосовместимую жидкость; и частицы поперечно-сшитого биосовместимого полисахарида, подходящего для применения для остановки кровотечения, которые являются нерастворимыми в биосовместимой жидкости.
Композицию согласно настоящему изобретению считают прозрачной, если хирургический шов диаметром 1 мм или менее, например, диаметром по меньшей мере 0,5 мм, 0,4 мм, 0,3 мм, 0,2 мм или 0,1 мм, виден через слой композиции толщиной 3 мм.
Композиции согласно настоящему изобретению могут дополнительно содержать фармацевтически приемлемое вспомогательное вещество или разбавитель. Подходящие фармацевтически приемлемые вспомогательные вещества и разбавители хорошо известны специалистам в данной области техники. Фармацевтически приемлемые вспомогательные вещества и разбавители включают вещества, подходящие для местного введения композиции согласно настоящему изобретению в участок раны. Подходящие фармацевтически приемлемые разбавители или вспомогательные вещества включают буферы, такие как Tris-HCl, ацетатный или фосфатный буферы, добавки, такие как поверхностно-активные вещества или агенты, увеличивающие растворимость (например, Tween 80, полисорбат 80), антиоксиданты (например, аскорбиновая кислота, метабисульфит натрия), консерванты (например, мета-крезол, парабены (метил-, пропилили бутил-), хлорбутанол, соли фенилртути (например, ацетат, борат, нитрат), сорбиновая кислота, бензиловый спирт) и вещества для увеличения объема (например, лактоза, маннит), агенты, регулирующие тоничность (например, сахара, хлорид натрия), полимерные соединения, такие как полимолочная кислота, полигликолевая кислота.
Композиции согласно настоящему изобретению могут дополнительно включать добавки для более эффективного получения композиции, улучшения физических и механических свойств, улучшения гемостатических свойств композиции или обеспечения антимикробных свойств. Например, композиции согласно настоящему изобретению могут дополнительно содержать эффективное количество одной(-го) или более добавок или соединений, таких как биоактивный(-е) компонент(-ы) для доставки пациенту, модификаторы вязкости, такие как углеводы и спирты, материалы для контролирования скорости резорбции, поверхностно-активные вещества, антиоксиданты, смачивающие агенты, увлажнители, смазывающие агенты, загустители, разбавители, стабилизаторы возбуждения (например, поглотители радикалов), пластификаторы или стабилизаторы. Например, можно добавлять глицерин для улучшения характеристик экструзии или введения композиции через иглу. Глицерин, если его применяют, может содержаться в композициях в количестве от примерно 0% до примерно 20% или от примерно 1% до примерно 10% или примерно 5% глицерина по массе в пересчете на массу жидкой фазы.
Типовые биоактивные компоненты включают, но не ограничиваются ими, белки, углеводы, нуклеиновые кислоты и неорганические и органические биологически активные молекулы, такие как ферменты, антинеоплатические агенты, антимикробные агенты, такие как бактериостатические агенты, бактерицидные агенты, антибиотики, противовирусные агенты, местные анестетики, противовоспалительные агенты, гормоны, антиангиогенные агенты, антитела, нейротрансмиттеры, психоактивные лекарственные средства, лекарственные средства, воздействующие на органы размножения, и олигонуклеотиды, такие как антисмысловые олигонуклеотиды. Указанные биоактивные компоненты, как правило, содержатся в относительно низких концентрациях, как правило, менее 10% по массе от массы композиции, обычно менее 5% по массе и часто менее 1% по массе.
Под "эффективным количеством" понимают количество, которое необходимо для придания композициям тех свойств, для обеспечения которых вводят добавку. Эффективное количество также ограничено максимальным количеством, которое можно добавлять, не вызывая отрицательных биологических эффектов.
Биосовместимая жидкость и частицы композиции согласно настоящему изобретению, как правило, присутствуют в относительных количествах, которые являются эффективными для обеспечения композиции, например, пасты или суспензии, подходящей для применения для остановки кровотечения. В определенных вариантах реализации массовое отношение частиц к жидкости составляет от примерно 1:1 до примерно 1:12 или от примерно 1:3 до примерно 1:8 или примерно 1:5. Композиции согласно настоящему изобретению, как правило, имеют содержание твердых веществ в диапазоне от 1% по массе до 70% по массе, например, от 5% по массе до 20% по массе или от 5% по массе до 16% по массе. В композиции, имеющие более высокое содержание твердых веществ, как правило, более 16% по массе, можно добавлять пластификатор, как правило, в количестве от 0,1% по массе до 30% по массе или от 1% по массе до 5% по массе. Подходящие пластификаторы включают полиэтиленгликоли, сорбит и глицерин.
Согласно изобретению также предложен способ полимеризации фибриногена, который включает приведение в контакт фибриногена с композицией согласно настоящему изобретению.
Относительные концентрации композиции и фибриногена, применяемых для полимеризации, зависят от природы композиции, например, от содержания фибриноген-связывающих пептидов и последовательности фибриноген-связывающих пептидов. Авторы настоящего изобретения наблюдали быструю полимеризацию при применении пептидных дендримеров в концентрациях в диапазоне от 0,005 мг/мл до 2 мг/мл и при физиологическом уровне фибриногена (3 мг/мл).
Для некоторых пептидных дендримеров с увеличением концентрации дендримера скорость полимеризации фибриногена (т.е. "время свертывания") уменьшается. Не связываясь с теорией, полагают, что это происходит вследствие наполнения впадин "а" и/или "b" молекул фибриногена фибриноген-связывающими пептидами дендримера. При указанных более высоких концентрациях дендримера наблюдается избыток фибриноген-связывающих пептидов, конкурирующих за свободные связывающие впадины фибриногена (т.е. незанятые впадины "а" и/или "b"), и полагают, что указанная конкуренция уменьшает скорость, с которой происходит полимеризация.
Согласно изобретению также предложен набор для лечения кровотечения, содержащий композицию согласно настоящему изобретению и отдельно фибриноген.
Композиция может полимеризовать эндогенный фибриноген (т.е. фибриноген хозяина), присутствующий в целевом участке. В некоторых вариантах реализации экзогенный фибриноген совместно с композицией согласно настоящему изобретению можно вводить в целевой участок.
Термин "фибриноген" при использовании в настоящем описании включает природный фибриноген, рекомбинантный фибриноген или производное фибриногена, которое под действием тромбина может превращаться в фибрин (например, природный или рекомбинантный мономер фибрина или производное мономера фибрина, которое способно или неспособно к спонтанной сборке). Фибриноген должен связывать по меньшей мере два фибриноген-связывающих пептида. Фибриноген можно получать из любого источника и от любого вида (включая бычий фибриноген), но предпочтительным является человеческий фибриноген. Человеческий фибриноген можно получать из аутологической или донорской крови. Аутологический фибриноген или рекомбинантный фибриноген является предпочтительным, так как в этом случае уменьшается риск инфицирования при введении субъекту.
Подходящее количество композиции согласно настоящему изобретению для введения субъекту-человеку, зависит, например, от типа гемостатического агента, например, от содержания фибриноген-связывающих пептидов на молекулу носителя, и от типа и размера участка раны или кровотечения. Тем не менее, типовое количество гемостатического агента составляет от 0,1 мл до 50 мл, например, от 0,1 мл до 5 мл или от 1 до 50 мл или от 1 до 5 мл, композиции, содержащей гемостатический агент в концентрации от 0,005 до 25 мг/мл, например, от 0,01 до 10 мг/мл.
Подходящее количество экзогенного фибриногена для введения субъекту-человеку составляет от 0,1 мг до 120 мг, например, от 3 мг до 120 мг.
Композиции согласно настоящему изобретению имеют несколько важных преимуществ. В частности, в определенных вариантах реализации гемостатический агент можно легко получать при помощи традиционных способов твердофазного пептидного синтеза. Это минимизирует риск передачи вирусной или прионной инфекции из указанных продуктов. При оптимальных концентрациях гемостатический агент, входящий в состав композиции согласно настоящему изобретению, может полимеризовать фибриноген в отсутствие тромбина менее чем за секунду. Гемостатический агент, входящий в состав композиций согласно настоящему изобретению, также может полимеризовать фибриноген в плазме человека менее чем за секунду.
Структуру гемостатического агента для применения в композиции согласно настоящему изобретению можно выбирать таким образом, чтобы оптимизировать его свойства для предполагаемого применения композиции. Например, пептидный дендример, содержащий пять фибриноген-связывающих пептидов с одинаковыми последовательностями, которые предпочтительно связываются с впадиной "а" фибриногена, способен полимеризовать фибриноген практически мгновенно. В противоположность этому, "химерный" пептидный дендример, содержащий один или более фибриноген-связывающих пептидов, которые предпочтительно связываются с впадиной "а" фибриногена, и один или более фибриноген-связывающих пептидов, которые предпочтительно связываются с впадиной "b" фибриногена, может полимеризовать фибриноген с меньшей скоростью, но образует гидрогели с увеличенной плотностью и размером.
Было обнаружено, что гемостатические агенты, входящие в состав композиций согласно настоящему изобретению (в частности композиций согласно настоящему изобретению, в которых биосовместимая жидкость представляет собой водную жидкость), неожиданно являются устойчивыми при стерилизации, в частности при стерилизации паром и стерилизации сухим жаром. Таким образом, композиции согласно настоящему изобретению можно стерилизовать при помощи традиционных способов стерилизации в отсутствие значительного снижения гемостатической активности, в частности в отсутствие значительного снижения способности гемостатического агента, входящего в состав композиции, полимеризовать фибриноген. Это является важным преимуществом, так как появляется возможность обеспечения композиций в виде гидратированных стерильных готовых к применению текучих гемостатических композиций. Композиции можно эффективно получать перед применением, при этом гемостатическая активность сохраняется даже после тепловой стерилизации или стерилизации паром.
При использовании в настоящем описании "стерильный" означает по существу не содержащий жизнеспособные микробы и/или микроорганизмы, что также известно и описано в государственных стандартах, относящихся к композициям и медицинским устройствам, описанным и заявленным в настоящем изобретении.
Подходящие традиционные способы стерилизации включают применение насыщенного пара под давлением ("стерилизация паром") или стерилизацию сухим жаром.
Воздействие на микроорганизмы насыщенным паром под давлением в автоклаве приводит к необратимой денатурации ферментов и структурных белков. Автоклав представляет собой камеру высокого давления, применяемую для стерилизации путем воздействия на содержимое автоклава насыщенным паром под высоким давлением, например, при 121°С (249°F) в течение примерно 15-20 минут. Температура, при которой происходит денатурация, изменяется обратно пропорционально содержанию воды. Воздух необходимо откачивать из автоклава перед нагнетанием пара. Указанный способ особенно подходит для водных препаратов и хирургических перевязочных материалов и медицинских устройств.
Согласно изобретению предложен способ стерилизации композиции согласно настоящему изобретению, включающий воздействие на композицию насыщенным паром под давлением в условиях, включая продолжительность, температуру и давление, которые являются эффективными для стерилизации композиции. Подходящими условиями стерилизации с применением насыщенного пара под давлением в автоклаве являются: выдерживание в течение по меньшей мере 15 минут при 121-124°С (200 кПа), по меньшей мере 10 минут при 126-129°С (250 кПа) или по меньшей мере 5 минут при 134-138°С (300 кПа).
В способах стерилизации сухим жаром, как полагают, первичное уничтожение происходит в результате окисления компонентов клеток. Для стерилизации сухим жаром требуется более высокая температура по сравнению с влажным жаром и увеличенная продолжительность воздействия. Способ, таким образом, в большей степени подходит для термоустойчивых неводных материалов, которые невозможно стерилизовать паром из-за его отрицательного воздействия или неспособности проникать внутрь материала.
Согласно изобретению предложен способ стерилизации композиции согласно настоящему изобретению, включающий воздействие на композицию сухим жаром в условиях, включая продолжительность и температуру, которые являются эффективными для стерилизации композиции. Подходящая температура и продолжительность стерилизации сухим жаром включают: выдерживание при 160°С в течение 180 минут, при 170°С в течение 60 минут или при 180°С в течение 30 минут. Для различных препаратов могут требоваться другие условия, чтобы обеспечивать эффективное уничтожение всех нежелательных микроорганизмов. Печь в обычных условиях должна быть оборудована системой нагнетания воздуха для обеспечения равномерного распределения теплоты во всех обрабатываемых материалах.
Согласно изобретению также предложена композиция согласно настоящему изобретению, которая является стерильной. Стерильные композиции согласно настоящему изобретению можно стерилизовать любым подходящим способом, наиболее эффективно путем стерилизации паром или стерилизации сухим жаром.
Авторы настоящего изобретения обнаружили, что гемостатические агенты для применения в композициях согласно настоящему изобретению сохраняют способность полимеризации фибриногена после стерилизации в автоклаве в течение 25 минут при 121°С и остаются стабильными при хранении в течение по меньшей мере тринадцати недель при 40°С. Авторы настоящего изобретения также обнаружили, что композиции согласно настоящему изобретению сохраняют способность полимеризации фибриногена после стерилизации в автоклаве в течение 25 минут при 121°С и остаются стабильными при хранении в течение по меньшей мере двух недель при 40°С. Температура хранения 40°С, которую используют в исследованиях стабильности с ускоренным состариванием, позволяет предсказывать поведение при хранении в течение продолжительных периодов при температурах, которые, как правило, подразумеваются при хранении фармацевтических продуктов, например, при комнатной температуре или при хранении в холодильнике.
Композиции согласно настоящему изобретению могут быть эффективно обеспечены в виде стерильных готовых к применению текучих составов. Указанные композиции могут быть обеспечены в подходящем устройстве нанесения для введения композиции в целевой участок.
Композиции согласно настоящему изобретению можно наносить с применением устройства нанесения, такого как шприц, лопатка, кисть, распыляющее устройство, вручную путем приложения давления, или любым другим традиционным способом. Как правило, композиции наносят с применением шприца или схожего устройства нанесения, в котором возможно выдавливать композицию через отверстие, щель, иглу, трубку или другой канал для получения капель, слоя или схожих форм материала. Механическое разрушение композиции может происходить при выдавливании композиции через отверстие в шприце или другом устройстве нанесения, которое, как правило, имеет размер в диапазоне от 0,01 мм до 5,0 мм, предпочтительно от 0,5 мм до 2,5 мм. Тем не менее, как правило, частицы, входящие в состав композиции, получают из порошка, имеющего целевой размер частиц (из которых при гидратации образуются частицы требуемого размера), или частично или полностью механически разрушают до требуемого размера перед конечной экструзией или другой стадией нанесения.
Медицинские устройства, в которых можно применять гемостатическую композицию согласно настоящему изобретению, включают любые устройства, подходящие для нанесения текучей или инъецируемой гемостатической пасты в целевой участок, в котором требуется остановка кровотечения. Примеры устройств или систем нанесения включают шприцы, такие как шприцы Becton Dickinson или шприцы Monoject типа Люэр. Другие подходящие устройства подробно описаны в патенте США №6045570, содержание которого включено в настоящую заявку во всей полноте посредством ссылки.
Можно наносить композиции, имеющие различную степень гидратации, которые, как правило, но не обязательно, являются по меньшей мере частично гидратированными. В случае нанесения при равновесной степени гидратации композиции имеют по существу равновесную гидратацию и набухают в незначительной степени или вообще не набухают при нанесении в ткань. В некоторых вариантах реализации композицию доставляют пациенту при уровне гидратации ниже равновесной степени набухания. Частицы композиции могут набухать и увеличиваться на 10-20% при контакте с кровью или физиологическими жидкостями. Набухание частично гидратированных композиций происходит в результате поглощения влаги из ткани и окружающего пространства в месте нанесения композиции.
В настоящем изобретении дополнительно предложены наборы, содержащие композицию согласно настоящему изобретению и письменные инструкции по введению композиции в целевой участок. Композиции и письменные инструкции могут быть включены вместе в обычный контейнер, такой как коробка, банка, пакет или лоток. Письменные инструкции могут быть напечатаны на отдельном листе бумаги или другого материала и упакованы на контейнере или внутри контейнера или могут быть напечатаны на контейнере, как таковом. Как правило, композиция(-ии) может(-гут) быть обеспечена(-ы) в отдельном стерильном шприце или другом устройстве нанесения или в отдельной бутыли, банке или пробирке. Если композиция согласно настоящему изобретению обеспечена в гидратированной форме, то набор может необязательно включать отдельный контейнер с подходящим водным буфером для гидратации. Если композиция согласно настоящему изобретению не обеспечена в устройстве нанесения, то также может быть обеспечено подходящее устройство нанесения, например, шприц.
Согласно изобретению также предложен способ получения гемостатической композиции согласно настоящему изобретению, включающий смешение биосовместимой жидкости, растворимого гемостатического агента и частиц поперечно-сшитого биосовместимого полисахарида, подходящего для применения для остановки кровотечения, которые не растворимы в биосовместимой жидкости, где растворимый гемостатический агент содержит совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе.
В конкретных вариантах реализации биосовместимую жидкость, растворимый гемостатический агент и частицы смешивают друг с другом в условиях, которые являются эффективными для образования непрерывной жидкой фазы, содержащей частицы, по существу однородно распределенные по жидкой фазе, за счет чего образуется по существу гомогенная гемостатическая композиция.
Биосовместимую жидкость, растворимый гемостатический агент и частицы можно смешивать друг с другом в любом порядке или по существу одновременно. Например, в одном из вариантов реализации биосовместимую жидкость и частицы можно смешивать друг с другом для получения по существу гомогенной пасты, в которой частицы распределены по жидкости, и затем можно добавлять растворимый гемостатический агент и смешивать с пастой для получения гемостатической композиции. Например, раствор гемостатического агента в биосовместимой жидкости или другой жидкости (но предпочтительно в воде или водной жидкости, такой как водный буфер) можно добавлять в по существу гомогенную пасту и смешивать с пастой для получения гемостатической композиции. Необязательно гомогенную пасту можно центрифугировать для удаления пузырьков воздуха до или после добавления растворимого гемостатического агента. В альтернативном варианте реализации растворимый гемостатический агент можно растворять или смешивать в биосовместимой жидкости и затем можно добавлять частицы смесь и перемешивать для получения гемостатической композиции. Необязательно гемостатическую затем можно центрифугировать для удаления пузырьков воздуха. В дополнительном варианте реализации растворимый гемостатический агент и частицы можно добавлять в биосовместимую жидкость по существу одновременно или непосредственно друг после друга и затем перемешивать для получения гемостатической композиции. Необязательно композицию затем можно центрифугировать для удаления пузырьков воздуха. Удаление пузырьков воздуха приводит к снижению степени помутнения композиции, что делает ее по существу прозрачной.
Гемостатическую композицию можно стерилизовать, например, путем стерилизации паром или стерилизации сухим жаром.
В некоторых вариантах реализации изобретения гемостатическую композицию согласно настоящему изобретению можно вводить в состав гидратированной текучей пасты или суспензии и упаковывать в устройство нанесения (например, в шприц или другое устройство нанесения, такое как описано выше), которое затем стерилизуют для обеспечения стерильной готовой к применению текучей гемостатической композиции.
Таким образом, согласно изобретению предложено устройство нанесения, содержащее стерильную готовую к применению текучую гемостатическую композицию согласно настоящему изобретению.
Устройство нанесения, содержащее упакованную внутри него композицию, можно стерилизовать любым подходящим способом, наиболее эффективно путем стерилизации паром или стерилизации сухим жаром.
Композиции согласно настоящему изобретению могут иметь уплотняющие свойства помимо гемостатического эффекта. Композиции можно наносить для профилактики в рану, в которой отсутствует или присутствует незначительное кровотечение, с образованием связывающего защитного барьера поверх раны, что тем самым способствует исцелению раны.
Согласно изобретению предложена гемостатическая композиция согласно настоящему изобретению для применения в качестве лекарственного средства.
Также согласно изобретению предложена гемостатическая композиция согласно настоящему изобретению для применения для лечения кровотечения или для применения для лечения раны.
Согласно изобретению дополнительно предложено применение гемостатической композиции согласно настоящему изобретению для получения лекарственного средства для лечения кровотечения или для лечения раны.
Согласно изобретению также предложен способ лечения кровотечения, включающий введение эффективного количества гемостатической композиции согласно настоящему изобретению в кровоточащую рану.
Согласно изобретению дополнительно предложен способ лечения раны, включающий введение эффективного количества гемостатической композиции согласно настоящему изобретению в рану.
Эффективное количество композиции согласно настоящему изобретению для введения субъекту, такому как субъект-человек, зависит, например, от типа гемостатического агента, например, от содержания фибриноген-связывающих пептидов на молекулу носителя, и от типа и размера участка раны или кровотечения. Тем не менее, типовое эффективное количество композиции составляет от 0,1 мл до 50 мл, например, от 0,1 мл до 5 мл, от 1 до 50 мл или от 1 до 5 мл, композиции, содержащей гемостатический агент в концентрации от 0,005 до 25 мг/мл, например, от 0,01 до 10 мг/мл.
Варианты реализации изобретения описаны далее исключительно в качестве примеров при помощи прилагаемых чертежей, где:
На фигуре 1 показана способность пептидного дендримера для применения согласно предпочтительному варианту реализации полимеризовать фибриноген в различных концентрациях;
На фигуре 2 показана способность нескольких различных пептидных дендримеров полимеризовать фибриноген в различных концентрациях. Нумерация относится к обозначению пептидного дендримера;
На фигуре 3 показана способность нескольких различных пептидных дендримеров полимеризовать фибриноген в различных концентрациях. Нумерация относится к обозначению пептидного дендримера;
На фигуре 4 показана способность нескольких различных пептидных дендримеров полимеризовать фибриноген при различных концентрациях. Нумерация относится к обозначению пептидного дендримера;
На фигуре 5 показана фотография гидрогелей, полученных путем полимеризации фибриногена с применением различных пептидных дендримеров;
На фигуре 6 показана способность различных комбинаций пептидных дендримеров с пептидными конъюгатами полимеризовать фибриноген в различных концентрациях;
На фигуре 7 показана способность нескольких различных пептидных дендримеров полимеризовать фибриноген в плазме человека;
На фигуре 8А схематически изображены доли печени кроликов, на которых приблизительно показано расположение повреждений, нанесенных при биопсии печени. На фигуре 8В проиллюстрирована оценка степени кровотечения по шкале от 0 до 5;
На фигуре 9 приведена фотография печени кролика после биопсии. Участок, в котором проводили биопсию после обработки контролем, показан выше отметки "Контроль". Участок, в котором биопсию проводили после введения композиции согласно одному из вариантов реализации изобретения, показан выше отметки "Паста ГК + НХР12";
На фигуре 10 показан график зависимости гемостатического эффекта (% эффективной остановки кровотечения) для различных вариантов реализации композиции согласно настоящему изобретению при лечении кровотечения в печени кролика после биопсии от времени и его сравнение с контролем; и
На фигуре 11А показана фотография прозрачной пасты, содержащей частицы геля поперечно-сшитой гиалуроновой кислоты. На фигуре 11В показана фотография одного из вариантов реализации композиции согласно настоящему изобретению, полученной путем смешения прозрачной пасты с гемостатическим агентом. На фигуре 11С показана фотография шприца, содержащего один из вариантов реализации композиции согласно настоящему изобретению, после стерилизации in situ. На фигуре 11D показана фотография одного из вариантов реализации композиции согласно настоящему изобретению после экструзии через шприц. На фигуре 11Е показана фотография одного из вариантов реализации прозрачной композиции согласно настоящему изобретению, нанесенной поверх материала хирургического шва.
Пример 1
Синтез пептидных дендримеров и пептидных конъюгатов
Пептиды синтезировали на амидной МВНА-смоле Ринка с низкой нагрузкой (Novabiochem, 0,36 ммоль/г) при помощи стандартного способа синтеза пептидов по стратегии Fmoc с использованием Fmoc- или Вос-защищенных аминокислот (Novabiochem).
В общем случае, во время синтеза применяли циклы однократного сочетания и использовали химические способы на основе активации HBTU (в качестве сшивающих агентов использовали HBTU и РуВОР (производства AGTC Bioproducts)). Тем не менее, по некоторым положениям сочетание происходило менее эффективно по сравнению с ожиданиями, и требовалось повторное проведение сочетания.
Пептиды собирали с использованием автоматического пептидного синтезатора и HBTU до точек разветвления и путем ручного пептидного синтеза с применением РуВОР для разветвления пептидных цепей.
Для автоматического синтеза использовали трехкратный избыток аминокислоты и HBTU для каждого сочетания и девятикратный избыток диизопропилэтиламина (DIPEA, Sigma) в диметилформамиде (ДМФ, Sigma).
Для ручного синтеза использовали трехкратный избыток аминокислоты и РуВОР для каждого сочетания и девятикратный избыток DIPEA в N-метилпирролидиноне (NMP, Sigma).
Снятие защиты (удаление Fmoc-групп) в растущей цепи пептида с использованием 20% пиперидина (Sigma) в ДМФ не всегда может быть эффективным, и требуется повторное снятие защиты.
Разветвление было обеспечено с использованием Fmoc-Lys(Fmoc)-OH, Fmoc-Lys(Boc)-OH или Fmoc-Lys(Mtt)-OH.
Конечное снятие защиты и отщепление пептида от твердой подложки проводили путем обработки смолы 95% ТФУ (Sigma), содержащей триизопропилсилан (TIS, Sigma), воду и анизол (Sigma) (1:1:1, 5%), в течение 2-3 часов.
Отщепленный пептид осаждали в холодном диэтиловом эфире (Sigma), концентрировали путем центрифугирования и лиофилизировали. Осадок перерастворяли в воде (10-15 мл), фильтровали и очищали путем обращенно-фазовой ВЭЖХ с использованием колонки С-18 (Phenomenex, расход 20 мл/мин) и смесей ацетонитрил/вода, содержащих 0,1% ТФУ, с градиентом концентраций. Очищенный продукт лиофилизировали и анализировали путем ИЭР-ЖХ/МС и аналитической ВЭЖХ; в результате чего подтверждали его чистоту (>95%). Экспериментальные значения массы согласовывались с расчетом.
Пептидные дендримеры и пептидные конъюгаты
Структуры пептидных дендримеров и пептидных конъюгатов, синтезированных при помощи способов, описанных выше, показаны ниже.
Группа "NH2-" в конце последовательности пептида обозначает аминогруппу на амино-конце последовательности. Группа "-am" в конце последовательности пептида обозначает амидную группу на карбоксильном конце последовательности.
Пептидный конъюгат №1:
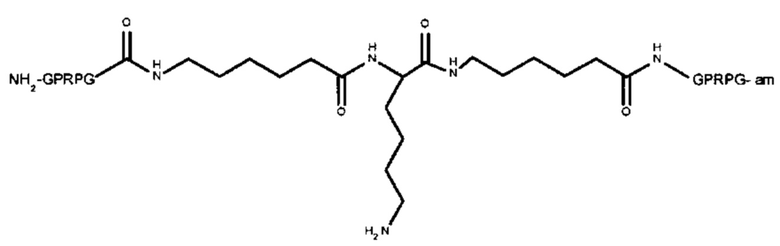
Пептидный конъюгат №2:
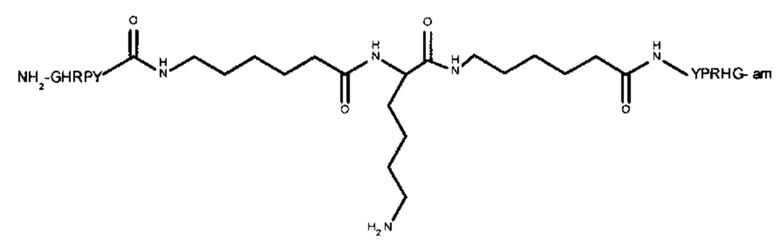
Пептидный дендример №3:
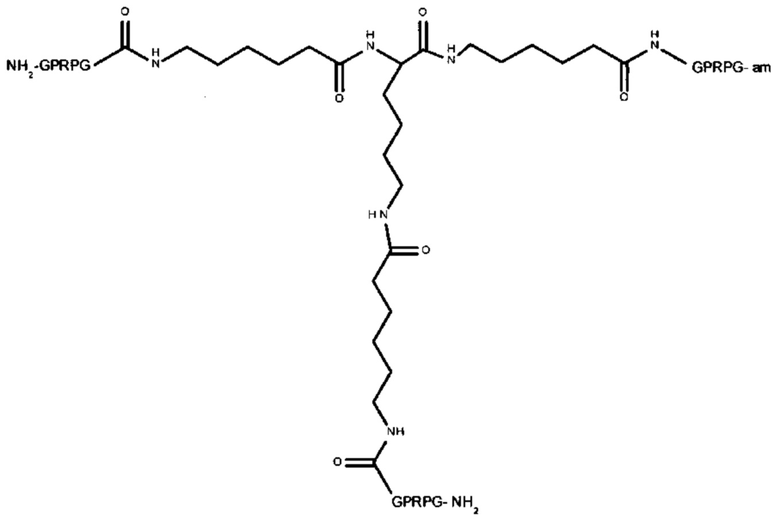
Пептидный дендример №4:
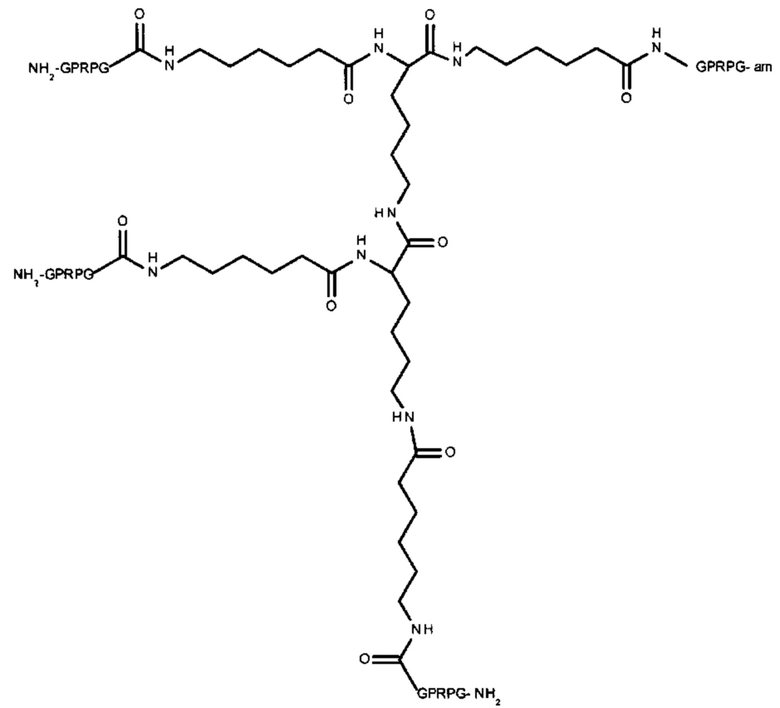
Пептидный дендример №5:
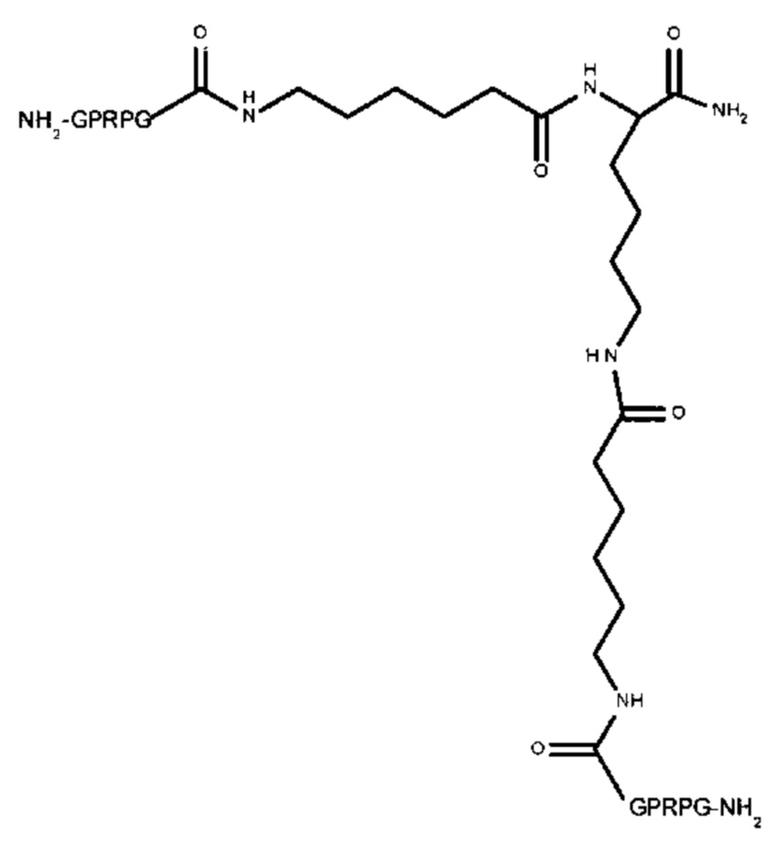
Пептидный дендример №8:
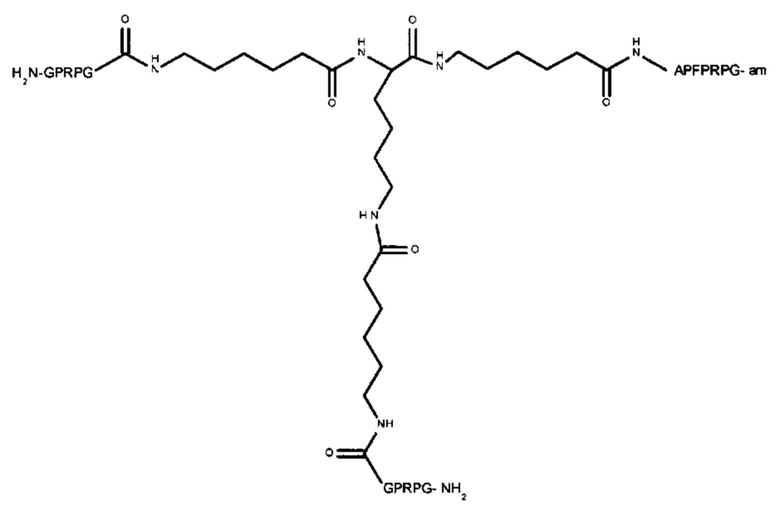
Пептидный дендример №9:
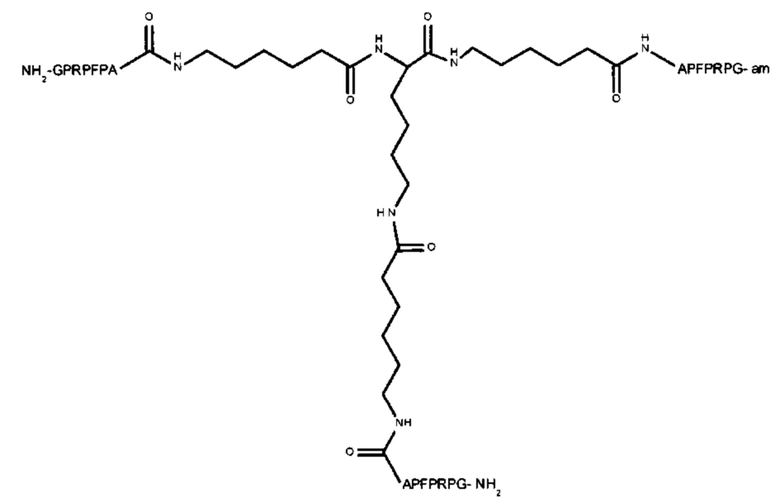
Пептидный дендример №10:
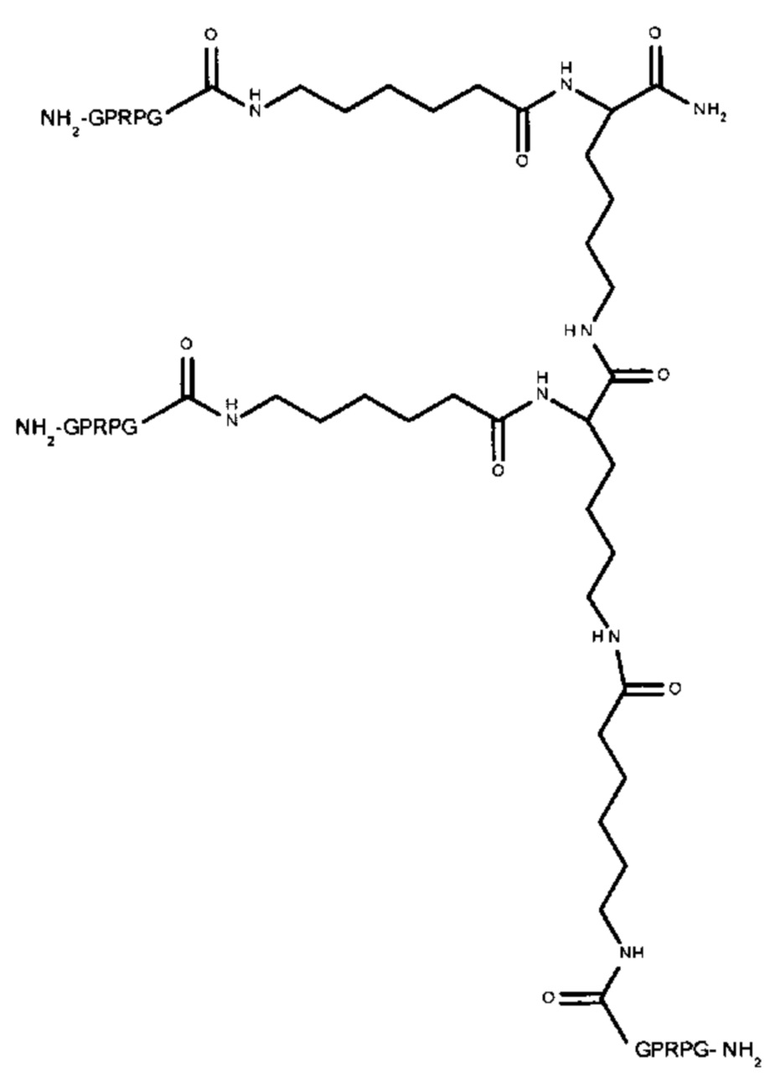
Пептидный дендример №11:
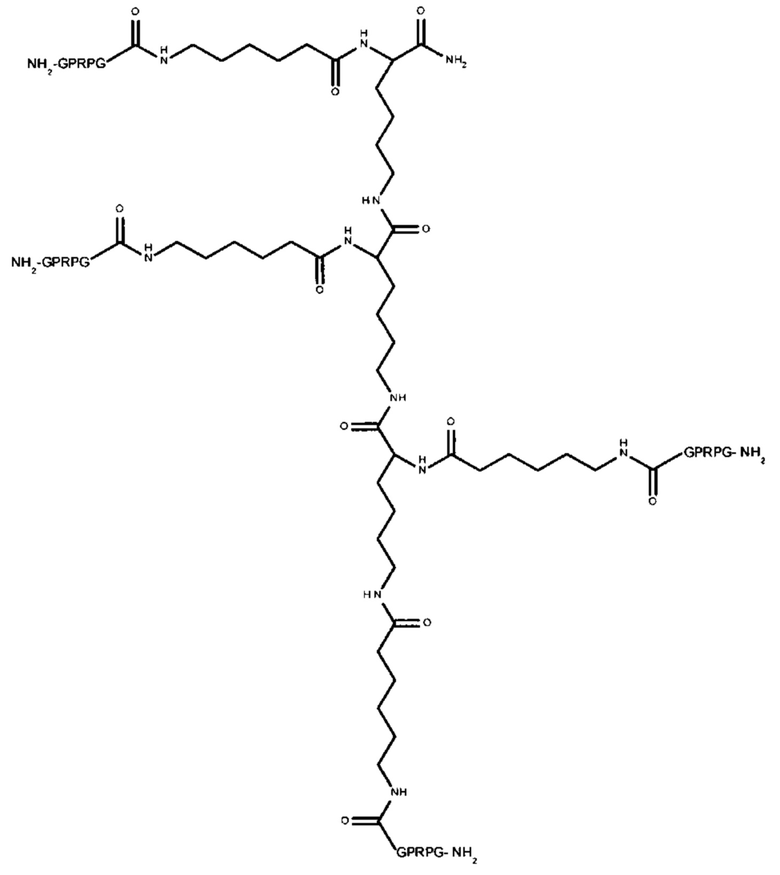
Пептидный дендример №12:
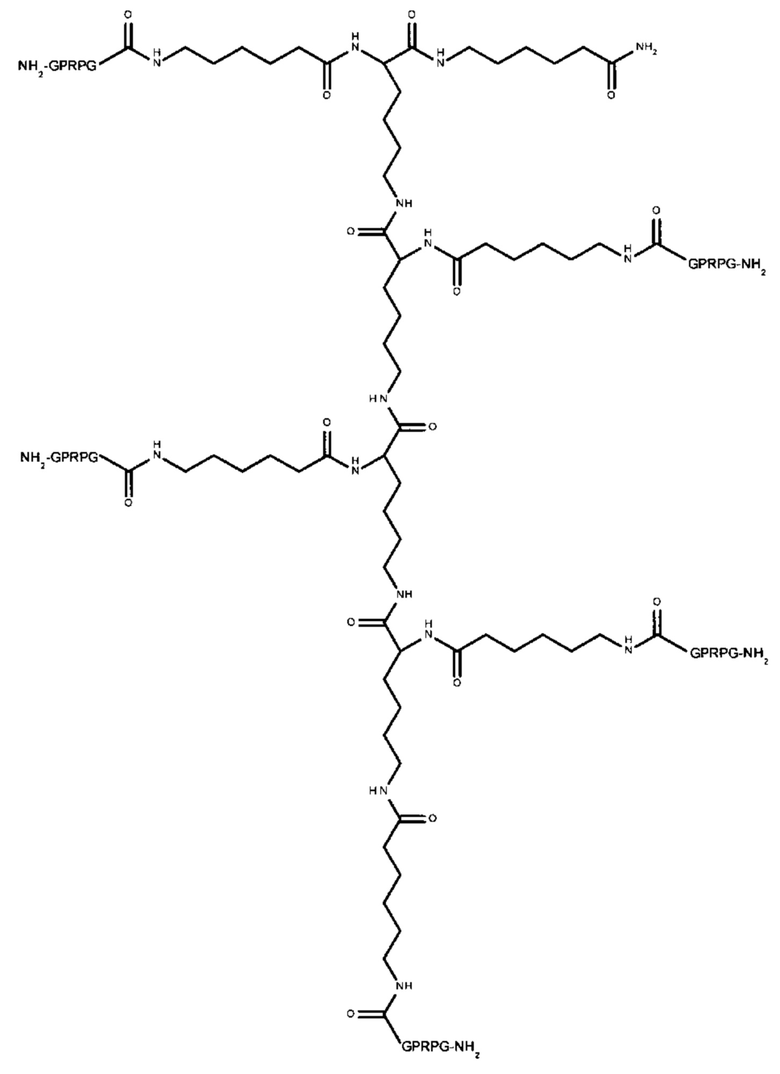
Пептидный дендример №13:
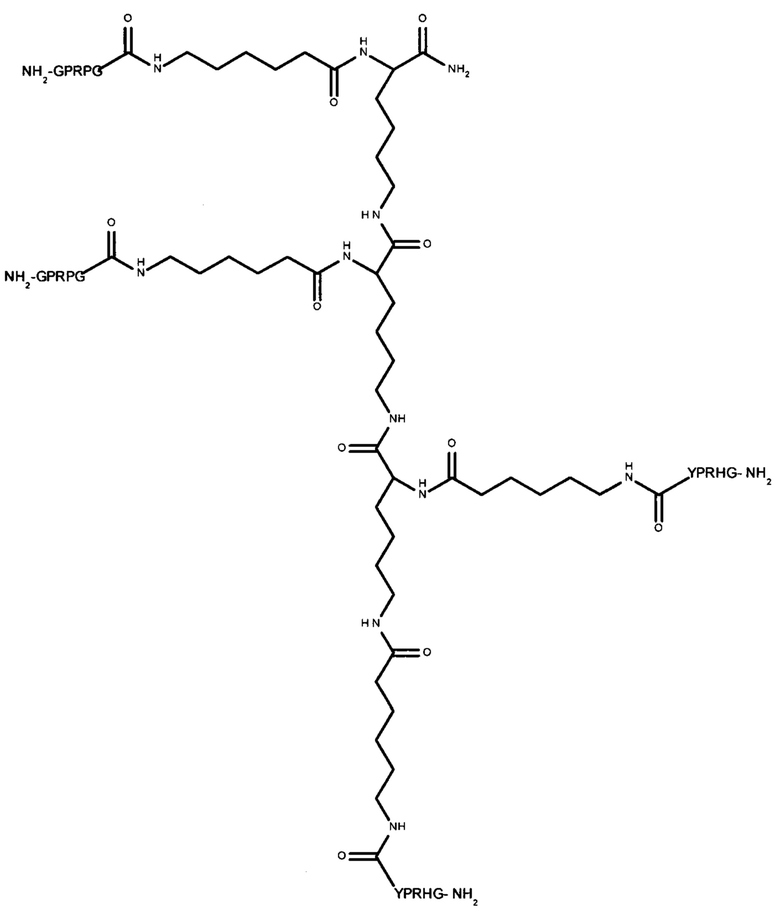
Пример 2
Сополимеризация пептидного дендримера с фибриногеном
Дендример №12 содержит разветвленное ядро с пятью последовательными остатками лизина. Остатки лизина ковалентно связаны через боковую цепь соседнего остатка лизина.
Оценивали способность пептидного дендримера №12 полимеризовать фибриноген. 30 мкл раствора дендримера с концентрацией в диапазоне 0,005-2 мг/мл добавляли в 100 мкл очищенного человеческого фибриногена с концентрацией 3 мг/мл (уровень фибриногена в крови). Полимеризацию фибриногена исследовали с использованием анализатора коагуляции Sigma Amelung КС4 Delta. На фигуре 1 показан график зависимости времени полимеризации (свертывания) (в секундах) от увеличения концентрации дендримера.
Результаты показывают, что дендример сополимеризовался с фибриногеном практически мгновенно даже при очень низких концентрациях дендримера. Полагают, что увеличение времени свертывания при концентрациях дендримера более 0,5 мг/мл можно объяснить избытком фибриноген-связывающих пептидов по сравнению с количеством свободных связывающих карманов в фибриногене. При более высоких концентрациях фибриноген-связывающие пептиды дендримера могут насыщать связывающие карманы фибриногена, что приводит к значительному избытку молекул дендримера, которые не способны сополимеризоваться с фибриногеном.
Пример 3
Влияние изменения количества фибриноген-связывающих пептидов в дендримере на скорость сополимеризации с фибриногеном
В указанном примере изучали влияние изменения количества фибриноген-связывающих пептидов в пептидном дендримере на скорость сополимеризации с фибриногеном.
Оценивали способность пептидных дендримеров №4, 5, 10, 11 и 12 сополимеризоваться с фибриногеном при помощи того же способа, что описан в примере 2. Концентрацию каждого дендримера изменяли в диапазоне 0,005-0,5 мг/мл. На фигуре 2 показан график зависимости времени свертывания (в секундах) от увеличения концентрации каждого из различных дендримеров.
Результаты показывают, что дендример №5 (содержащий только два фибриноген-связывающих пептида/дендример) не вступал в сополимеризацию с фибриногеном. При увеличении количества фибриноген-связывающих пептидов от трех до пяти и при концентрации дендримера от ~0,125 до ~0,275 мг/мл скорость сополимеризации возрастала. При концентрациях дендримера ниже ~0,125 мг/мл дендример №10 (содержащий три фибриноген-связывающих пептида/дендример) обеспечивал ускоренное свертывание по сравнению с дендримером №4 (содержащим четыре фибриноген-связывающих пептида/дендример). В диапазоне ~0,02-0,5 мг/мл дендример №12 (содержащий пять фибриноген-связывающих пептидов/дендример) вызывал практически мгновенное свертывание. В диапазоне ~0,05-0,3 мг/мл дендример №11 (содержащий четыре фибриноген-связывающих пептида/дендример) также вызывал практически мгновенное свертывание.
Был сделан вывод о том, что скорость, с которой фибриноген полимеризуется под действием дендримера, в общем случае увеличивается при увеличении количества фибриноген-связывающих пептидов в дендримере.
Пример 4
Влияние ориентации фибриноген-связывающих пептидов и различных последовательностей фибриноген-связывающих пептидов на скорость сополимеризации с фибриногеном
Для оценки возможного влияния ориентации фибриноген-связывающего пептида на способность пептидного дендримера сополимеризоваться с фибриногеном, синтезировали пептидные дендримеры, содержащие три фибриноген-связывающих пептида, присоединенных к одному трифункциональному аминокислотному остатку (лизин) (именуемые дендримерами "с тремя ответвлениями"), где один из фибриноген-связывающих пептидов был ориентирован таким образом, что его амино-конец был присоединен к разветвленному ядру, и карбоксильный конец был амидированным. Также исследовали способность пептидных дендримеров, содержащих фибриноген-связывающие пептиды с различными последовательностями, сополимеризоваться с фибриногеном.
Каждый из фибриноген-связывающих пептидов в пептидных дендримерах №3 и 10 имеет последовательность 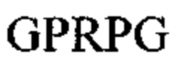 (SEQ ID NO: 17). Каждый фибриноген-связывающий пептид в пептидном дендримере №10 ориентирован так, что его карбоксильный конец присоединен к разветвленному ядру. Один из фибриноген-связывающих пептидов в пептидном дендримере №3 ориентирован так, что его амино-конец присоединен к разветвленному ядру. Карбоксильный конец этого пептида содержит амидную группу.
(SEQ ID NO: 17). Каждый фибриноген-связывающий пептид в пептидном дендримере №10 ориентирован так, что его карбоксильный конец присоединен к разветвленному ядру. Один из фибриноген-связывающих пептидов в пептидном дендримере №3 ориентирован так, что его амино-конец присоединен к разветвленному ядру. Карбоксильный конец этого пептида содержит амидную группу.
Два фибриноген-связывающих пептида в пептидном дендримере №8 имеют последовательность 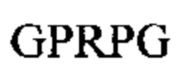 (SEQ ID NO: 17), и третий фибриноген-связывающий пептид имеет последовательность APFPRPG (SEQ ID NO: 14) и ориентирован так, что его амино-конец присоединен к разветвленному ядру. Карбоксильный конец этого пептида содержит амидную группу.
(SEQ ID NO: 17), и третий фибриноген-связывающий пептид имеет последовательность APFPRPG (SEQ ID NO: 14) и ориентирован так, что его амино-конец присоединен к разветвленному ядру. Карбоксильный конец этого пептида содержит амидную группу.
Два фибриноген-связывающих пептида в пептидном дендримере №9 имеют последовательность 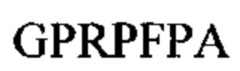 (SEQ ID NO: 3), и третий фибриноген-связывающий пептид имеет последовательность APFPRPG (SEQ ID NO: 14) и ориентирован так, что его амино-конец присоединен к разветвленному ядру. Карбоксильный конец этого пептида содержит амидную группу.
(SEQ ID NO: 3), и третий фибриноген-связывающий пептид имеет последовательность APFPRPG (SEQ ID NO: 14) и ориентирован так, что его амино-конец присоединен к разветвленному ядру. Карбоксильный конец этого пептида содержит амидную группу.
Последовательность 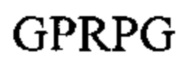 (SEQ ID NO: 17) связывается с впадиной "а" и впадиной "b" фибриногена, но более предпочтительно с впадиной "а". Последовательность
(SEQ ID NO: 17) связывается с впадиной "а" и впадиной "b" фибриногена, но более предпочтительно с впадиной "а". Последовательность 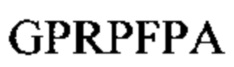 (SEQ ID NO: 3) связывается преимущественно с впадиной "а" фибриногена. Последовательность Pro-Phe-Pro стабилизирует остов пептидной цепи и усиливает аффинность взаимодействия выступ-впадина (Stabenfeld et al., BLOOD, 2010, 116: 1352-1359).
(SEQ ID NO: 3) связывается преимущественно с впадиной "а" фибриногена. Последовательность Pro-Phe-Pro стабилизирует остов пептидной цепи и усиливает аффинность взаимодействия выступ-впадина (Stabenfeld et al., BLOOD, 2010, 116: 1352-1359).
Способность дендримеров сополимеризоваться с фибриногеном оценивали с использованием того же способа, что описан в примере 2, для концентраций каждого дендримера в диапазоне 0,005-0,5 мг/мл. На фигуре 3 показан график зависимости времени свертывания (в секундах), полученный при увеличении концентрации каждого из различных дендримеров.
Результаты показывают, что изменение ориентации одного из фибриноген-связывающих пептидов в дендримере, содержащем три ответвления, таким образом, чтобы пептид имел такую ориентацию, где амино-конец присоединен к разветвленному ядру (т.е. дендример №3), уменьшает способность дендримера сополимеризоваться с фибриногеном (если сравнивать время свертывания для дендримера №3 и дендримера №10). Тем не менее, при более высоких концентрациях фибриногена дендример №3 вступал в сополимеризацию с фибриногеном (данные не показаны).
Дендример, содержащий три ответвления, содержащий фибриноген-связывающий пептид с отличающейся последовательностью, который был ориентирован так, что его амино-конец был присоединен к разветвленному ядру, мог сополимеризоваться с фибриногеном (см. результаты для дендримера №8).
Дендример с тремя ответвлениями, в котором два фибриноген-связывающих пептида содержали последовательность, которая предпочтительно связывалась с впадиной "b" фибриногена (последовательность 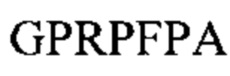 (SEQ ID NO: 3)), где указанные пептиды имели такую ориентацию, в которой их карбоксильные концы были присоединены к разветвленному ядру, и другой пептид, содержащий обратную последовательность (т.е. последовательность
(SEQ ID NO: 3)), где указанные пептиды имели такую ориентацию, в которой их карбоксильные концы были присоединены к разветвленному ядру, и другой пептид, содержащий обратную последовательность (т.е. последовательность  (SEQ ID NO: 14)), имел такую ориентацию, где его амино-конец был присоединен к разветвленному ядру (дендример №9), также продемонстрировал очень высокую активность сополимеризации с фибриногеном.
(SEQ ID NO: 14)), имел такую ориентацию, где его амино-конец был присоединен к разветвленному ядру (дендример №9), также продемонстрировал очень высокую активность сополимеризации с фибриногеном.
Пример 5
Способность пептидных дендримеров, содержащих фибриноген-связывающие пептиды с различными последовательностями, сополимеризоваться с фибриногеном
Мотивы 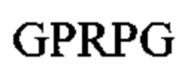 (SEQ ID NO: 15) и
(SEQ ID NO: 15) и 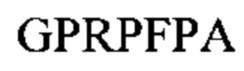 (SEQ ID NO: 3) связываются главным образом с впадиной "а" фибриногена. В настоящем примере описано определение способности химерного пептидного дендримера (т.е. пептидного дендримера, содержащего фибриноген-связывающие пептиды с различными последовательностями, присоединенные к одному разветвленному ядру) сополимеризоваться с фибриногеном.
(SEQ ID NO: 3) связываются главным образом с впадиной "а" фибриногена. В настоящем примере описано определение способности химерного пептидного дендримера (т.е. пептидного дендримера, содержащего фибриноген-связывающие пептиды с различными последовательностями, присоединенные к одному разветвленному ядру) сополимеризоваться с фибриногеном.
Пептидный дендример №13 представляет собой химерный пептидный дендример с четырьмя ответвлениями, содержащий два фибриноген-связывающих пептида с последовательностью 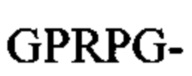 (SEQ ID NO: 17) (которые предпочтительно связываются с впадиной "а") и два фибриноген-связывающих пептида с последовательностью
(SEQ ID NO: 17) (которые предпочтительно связываются с впадиной "а") и два фибриноген-связывающих пептида с последовательностью  (SEQ ID NO: 11) (которые предпочтительно связывается с впадиной "b"). Нехимерные пептидные дендримеры №11 и 12 представляют собой пептидные дендримеры с четырьмя и пятью боковыми группами, соответственно. Каждый фибриноген-связывающий пептид в указанных дендримерах имеет последовательность
(SEQ ID NO: 11) (которые предпочтительно связывается с впадиной "b"). Нехимерные пептидные дендримеры №11 и 12 представляют собой пептидные дендримеры с четырьмя и пятью боковыми группами, соответственно. Каждый фибриноген-связывающий пептид в указанных дендримерах имеет последовательность 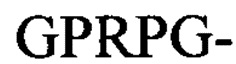 (SEQ ID NO: 17).Каждый фибриноген-связывающий пептид в дендримерах №11, 12 и 13 присоединен по карбоксильному концу к разветвленному ядру.
(SEQ ID NO: 17).Каждый фибриноген-связывающий пептид в дендримерах №11, 12 и 13 присоединен по карбоксильному концу к разветвленному ядру.
Способность дендримеров сополимеризоваться с фибриногеном оценивали с использованием того же способа, что описан в примере 2, для концентраций каждого дендримера в диапазоне 0,005-0,5 мг/мл. На фигуре 4 показан график зависимости времени свертывания (в секундах), полученный при увеличении концентрации каждого из различных дендримеров.
Результаты показывают, что скорость свертывания при применении химерного дендримера была ниже по сравнению с нехимерными дендримерами при концентрациях менее 0,3 мг/мл. Тем не менее, на фигуре 5 показана фотография гидрогелей, полученных с применением различных пептидных дендримеров. Гели обозначены в соответствии с номером используемого пептидного дендримера (11, 12и 13), и "Р" обозначает гидрогель, полученный с использованием продукта, в котором несколько фибриноген-связывающих пептидов присоединены к растворимому человеческому сывороточному альбумину. Гидрогель, полученный с применением химерного дендримера, был более плотным и содержал меньше жидкости по сравнению с гидрогелями, полученными с использованием дендримеров №11 и 12 (при 3 мг/мл фибриногена или при более высоких концентрациях фибриногена). Таким образом, хотя скорость свертывания с использованием химерного дендримера была ниже, гидрогель, полученный с применением этого дендримера, был более плотным.
Пример 6
Способность смесей пептидных дендримеров и пептидных конъюгатов сополимеризоваться с фибриногеном
Фибриноген-связывающий пептид с последовательностью 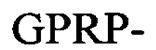 (SEQ ID NO: 1) прочно и предпочтительно связывается с впадиной "а" фибриногена (Laudano et al., 1978 PNAS 7S). Пептидный конъюгат №1 содержит два фибриноген-связывающих пептида с указанной последовательностью, каждый из которых присоединен к остатку лизина. Первый пептид присоединен по карбоксильному концу к остатку лизина посредством линкера, и второй пептид присоединен по амино-концу к остатку лизина посредством линкера. Карбоксильный конец второго пептида содержит амидную группу.
(SEQ ID NO: 1) прочно и предпочтительно связывается с впадиной "а" фибриногена (Laudano et al., 1978 PNAS 7S). Пептидный конъюгат №1 содержит два фибриноген-связывающих пептида с указанной последовательностью, каждый из которых присоединен к остатку лизина. Первый пептид присоединен по карбоксильному концу к остатку лизина посредством линкера, и второй пептид присоединен по амино-концу к остатку лизина посредством линкера. Карбоксильный конец второго пептида содержит амидную группу.
Фибриноген-связывающий пептид с последовательностью 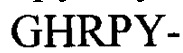 (SEQ ID NO: 11) прочно и предпочтительно связывается с впадиной "b" фибриногена (Doolittle and Pandi, Biochemistry 2006, 45, 2657-2667). Пептидный конъюгат №2 содержит один фибриноген-связывающий пептид с указанной последовательностью, присоединенный по карбоксильному концу к остатку лизина посредством линкера. Второй фибриноген-связывающий пептид, который имеет обратную последовательность (YPRHG (SEQ ID NO: 16)), присоединен по амино-концу к остатку лизина посредством линкера. Карбоксильный конец второго пептида содержит амидную группу.
(SEQ ID NO: 11) прочно и предпочтительно связывается с впадиной "b" фибриногена (Doolittle and Pandi, Biochemistry 2006, 45, 2657-2667). Пептидный конъюгат №2 содержит один фибриноген-связывающий пептид с указанной последовательностью, присоединенный по карбоксильному концу к остатку лизина посредством линкера. Второй фибриноген-связывающий пептид, который имеет обратную последовательность (YPRHG (SEQ ID NO: 16)), присоединен по амино-концу к остатку лизина посредством линкера. Карбоксильный конец второго пептида содержит амидную группу.
Линкер обеспечивает удаление пептидов друг от друга.
Пептидный конъюгат №1 или 2 (2 мг/мл) смешивали с пептидным дендримером №3 или 4 и фибриногеном и оценивали способность смесей сополимеризоваться с фибриногеном при помощи того же способа, что описан в примере 2, для концентраций каждого дендримера в диапазоне 0,025-0,5 мг/мл. На фигуре 6 показан график зависимости времени свертывания (в секундах), полученный при увеличении концентрации каждого из различных дендримеров.
Результаты неожиданно показывают, что только смеси, содержащие пептидный конъюгат №2 (т.е. содержащий пептиды с выступом В) и пептидные дендримеры, имели синергическую и повышенную активность, при этом смеси, содержащие пептидный конъюгат №1 (пептиды с выступом А), были неактивными при добавлении к пептидному конъюгату №2 или к пептидным дендримерам.
Пример 7
Способность пептидных дендримеров полимеризовать фибриноген в плазме человека.
Исследовали способность нескольких различных пептидных дендримеров (№4, 5, 8, 9, 10, 11, 12, 13) полимеризовать фибриноген в плазме человека.
30 мкл каждого дендримера (в концентрации 0,25 мг/мл) добавляли в 100 мкл плазмы человека при 37°С и оценивали полимеризацию фибриногена с использованием анализатора коагуляции Sigma Amelung КС4 Delta.
Время свертывания для каждого дендримера показано на фигуре 7; можно увидеть, что пептидные дендримеры №10, 11, 4, 12 и 13 могли полимеризовать фибриноген в плазме человека, причем дендример №12 был особенно эффективным (время свертывания составляло менее одной секунды). Тем не менее, пептидные дендримеры №5, 8 и 9 не могли полимеризовать фибриноген в плазме человека.
Пример 8
Влияние стерилизации паром на гемостатический агент в растворе
В настоящем примере описано влияние стерилизации паром на гемостатическую активность гемостатического агента (пептидный дендример №12 (см. пример 1): "НХР12") при введении в солевой раствор.
НХР12 в концентрации 50 мг/мл разбавляли 150 мМ хлоридом натрия до концентрации 0,5 мг/мл. Получали состав в виде 6 мл основного раствора (с использованием 60 мкл маточного раствора НХР12). 400 мкл указанного основного раствора использовали в 2 мл стеклянных пробирках с закручивающимися герметичными крышками. Каждую пробирку автоклавировали (200 кПа) в течение 25 минут при 121°С. После стерилизации пробирки размещали при 40°С и хранили до 27 недель.
Для исследования способности образцов полимеризовать фибриноген после хранения каждый образец разбавляли 20 мМ фосфатным буфером, рН 7,6, до концентрации 0,05 мг/мл. 30 мкл каждого разбавленного образца добавляли в 100 мкл человеческого фибриногена в концентрации 3 мг/мл, введенного в 20 мМ фосфатный буфер, рН 7,6. Способность НХР12 в каждом разбавленном образце полимеризовать фибриноген ("свертывающую" активность) при 37°С определяли с использованием анализатора коагуляции Sigma Amelung КС4 Delta. Также определяли активность полимеризации нестерилизованных контрольных образцов. Результаты приведены ниже в таблице 1.

Результаты, приведенные в таблице 1, показывают, что гемостатический агент при введении в солевой раствор сохраняет способность полимеризации фибриногена после стерилизации паром в автоклаве (200 кПа) в течение 25 минут при 121°С и сохраняет указанную активность даже после хранения при 40°С в течение по меньшей мере 27 недель.
Пример 9
Влияние стерилизации паром на готовую к применению текучую гемостатическую композицию
В настоящем примере описано влияние стерилизации паром на гемостатическую активность гемостатического агента (НХР12), включенного в состав готовой к применению текучей пасты, содержащей частицы поперечно-сшитой гиалуроновой кислоты (ГК).
0,6 мл раствора НХР12 в воде смешивали с 1,4 г частиц гидрогеля ГК, гидратированных в 10 мМ фосфатном буфере (концентрация ГК 2,7%; поперечная сшивка 5:1 [ГК/дивинилсульфон, "ДВС"], размер полностью гидратированных частиц 400 мкм) для получения пасты, в которой концентрация НХР12 составляла 1 мг/мл. 200 мг аликвоту пасты вводили в стеклянные пробирки и закрывали каждую пробирку крышкой. Пробирки автоклавировали (200 кПа) в течение 25 минут при 121°С. После стерилизации пробирки размещали при 80°С еще на 16 часов для симуляции ускоренного состаривания. Проводили оценку образцов через 4 и 16 часов.
НХР12 экстрагировали из образцов после хранения и разбавляли 20 мМ фосфатным буфером, рН 7,2, до концентрации 0,1 мг/мл. 30 мкл каждого экстрагированного образца добавляли в 100 мкл плазмы человека (Alpha Labs) и определяли способность НХР12 в каждом разбавленном образце полимеризовать фибриноген ("свертывающую" активность) при 37°С с использованием анализатора коагуляции Sigma Amelung КС4 Delta. Также определяли активность полимеризации нестерилизованных контрольных образцов. Результаты приведены ниже в таблице 2.

Результаты, приведенные в таблице 2, показывают, что пептид НХР12 при введении в готовую к применению текучую пасту совместно с частицами гидрогеля ГК сохраняет способность полимеризации фибриногена плазмы человека после стерилизации паром в автоклаве (200 кПа) в течение 25 минут при 121°С и сохраняет указанную активность даже после хранения при 80°С в течение по меньшей мере 4 часов.
Пример 10
Влияние стерилизации паром на готовую к применению текучую гемостатическую композицию
В настоящем примере описано влияние стерилизации паром на гемостатическую активность гемостатического агента (НХР12), включенного в состав готовой к применению текучей пасты, полученной с применением частиц поперечно-сшитой гиалуроновой кислоты (ГК).
0,6 мл раствора НХР12 в 10 мМ фосфатном буфере, 160 мМ Arg.HCl, рН 6,8, смешивали с 1,4 г частиц гидрогеля ГК (концентрация ГК 2,7%; поперечная сшивка 5:1 [ГК/дивинилсульфон, "ДВС"], размер полностью гидратированных частиц 400 мкм) для получения пасты, в которой концентрация НХР12 составляла 1 мг/мл. 200 мг аликвоту пасты вводили в стеклянные пробирки и закрывали каждую пробирку крышкой. Пробирки автоклавировали (200 кПа) в течение 25 минут при 121°С.После стерилизации пробирки размещали при 40°С. Проводили оценку образцов через 0, 2 и 4 недели.
НХР12 экстрагировали из образцов после хранения и разбавляли 20 мМ фосфатным буфером, рН 7,2, до концентрации 0,06 мг/мл. 30 мкл каждого экстрагированного образца добавляли в 100 мкл человеческого фибриногена в концентрации 3 мг/мл (уровень фибриногена в крови), введенного в 20 мМ фосфатный буфер, рН 7,2. Способность НХР12 в каждом разбавленном образце полимеризовать фибриноген ("свертывающую" активность) при 37°С определяли с использованием анализатора коагуляции Sigma Amelung КС4 Delta. Также определяли активность полимеризации нестерилизованных контрольных образцов. Результаты приведены ниже в таблице 3.
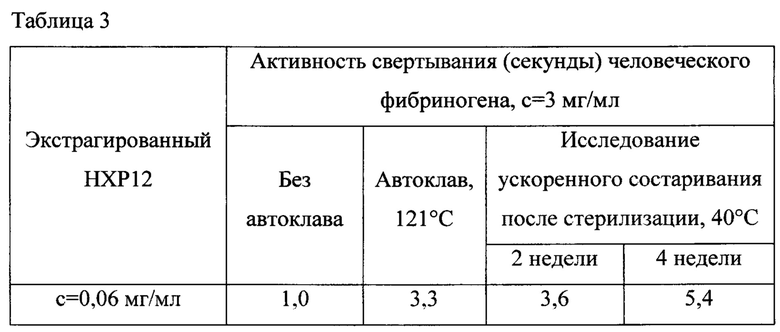
Результаты, приведенные в таблице 3, показывают, что пептид НХР12 при введении в готовую к применению текучую пасту совместно с частицами гидрогеля ГК сохраняет способность полимеризации человеческого фибриногена после стерилизации в автоклаве в течение 25 минут при 121°С (200 кПа) и сохраняет указанную активность даже после хранения при 40°С в течение по меньшей мере 2 недель.
Пример 11
Оценка гемостатической активности гемостатической композиции согласно настоящему изобретению в модели повреждения печени кролика при биопсии
В настоящем примере описано исследование гемостатической активности трех различных композиций согласно настоящему изобретению, каждая из которых имеет различную концентрацию гемостатического агента (пептидный дендример НХР12).
Способы
7 г пасты ГК (концентрация ГК 2,7%; 5:1; ГК/ДВС, размер полностью гидратированных частиц 400 мкм) предварительно вводили в шприц и смешивали с 3 мл пептидного дендримера НХР12 в одной из трех различных концентраций с получением 10 мл конечного продукта. Конечная концентрация НХР12 в каждом 10 мл продукте составляла: образец В, 1 мг/мл; В2, 0,5 мг/мл; ВЗ, 1,4 мг/мл. В качестве контроля (С) 7 г пасты ГК смешивали с 3 мл солевого раствора.
Анестезировали гепаринизированных кроликов (порода: новозеландский белый; пол: самцы). Удаляли все три доли печени из брюшной полости и помещали на марлевые тампоны, смоченные солевым раствором. Проводили исследование образцов путем последовательного нанесения повреждений при биопсии на три доли печени, как показано ниже в таблице 3. На фигуре 8А показана приблизительная ориентация и порядок нанесения повреждений печени в трех долях.

Проводили биопсию долей печени с применением 6 мм иглы для биопсии примерно на глубину 5 мм. Предварительно взвешенный сухой тампон использовали для сбора крови, вытекающей из раны в течение 15 секунд. Затем взвешивали тампон для измерения тяжести кровотечения. После удаления тампона рану осушали другим тампоном и затем наносили исследуемые образцы.
Для нанесения исследуемых образцов смоченные солевым раствором стерильные марлевые тампоны помещали на кровоточащую поверхность и использовали шприц для введения до 2 мл образца В, В2 или В3 или 2 мл контроля (С) между марлей и кровоточащей поверхностью в рану, нанесенную при биопсии. После нанесения осторожно надавливали на марлевый тампон в течение одной минуты. После удаления влажной марли проводили оценку остановки кровотечения в ране через 1, 3, 6, 9 и 12 минут после нанесения исследуемого образца (т.е. после надавливания в течение одной минуты).
Индексы кровотечения 0, 1, 3, 4, 5 и 5 присваивали ситуациям, при которых наблюдали отсутствие кровотечения, смачивание раны, очень слабое, слабое, умеренное и тяжелое кровотечение, соответственно (фигура 8 В). Индексы, определяющие уровень кровотечения, адаптировали на основании Adams et al (J Thromb Thrombolysis DOI 10.1007/s 11239-008-0249-3). В случае успешной остановки кровотечения долю накрывали тампоном, вымоченном в солевом растворе, и повторяли процедуру до тех пор, пока в каждой доле не проводили обработку, такую как описано выше.
Результаты
На фигуре 9 приведена фотография одного из образцов печени после биопсии. В участке, который после проведения биопсии обрабатывали контролем (показан выше отметки "Контроль"), можно было наблюдать кровотечение, при этом гемостатический эффект в участке, который после биопсии обрабатывали композицией согласно настоящему изобретению, содержащей пасту ГК и НХР12 (показан выше отметки "Паста ГК + НХР12"), выражен отчетливо.
На фигуре 10 показан график зависимости гемостатического эффекта (% эффективной остановки кровотечения) от времени анализа (в минутах) для образцов В, В2 и В3 по сравнению с контролем. В противоположность контролю каждая из различных композиций, содержащих пасту ГК и пептидный дендример НХР12, имела высокую активность коагуляции. Указанная активность зависела от дозы, где композиции с повышенной концентрацией НХР12 (образцы В и ВЗ) имели практически 80-100% гемостатическую активность в течение 12-минутной оценки. Композиция с наименьшей концентрацией НХР12 (образец В2) имела 100% гемостатическую активность в первые три минуты оценки, но в последующие 9 минут активность снижалась до ~75%.
В указанном примере показано, что один из вариантов реализации композиции согласно настоящему изобретению, содержащей частицы ГК, которые по существу не обеспечивают остановку кровотечения, и пептидный дендример, который обладает коагулирующими свойствами, неожиданно является эффективным для остановки кровотечения.
Пример 12
Стерильная готовая к применению текучая гемостатическая композиция, содержащая частицы геля поперечно-сшитой ГК и гемостатический агент
Текучую пасту, полученную из частиц геля поперечно-сшитой гиалуроновой кислоты (ГК) (концентрация ГК 2,7%; 5:1; ГК/ДВС, размер полностью гидратированных частиц 400 мкм), переводили в прозрачную форму путем центрифугирования пасты при 600 об./мин в течение 5 минут.Прозрачная паста показана на фигуре 11А.
7 г прозрачной пасты ГК смешивали с 3 мл пептидного дендримера НХР12 (в 10 мМ фосфатном буфере, 160 мМ Arg.HCl, рН 6,8) с получением 10 мл конечного продукта. Конечная концентрация НХР12 составляла 1,05 мг/мл. На фигуре 11В показана фотография фрагмента полученной композиции. На фотографии показано, что композиция является в достаточной мере связанной, чтобы образовывать непрерывный слой поверх раны, и, таким образом, ее можно применять для заполнения раны.
Композицию помещали в стеклянную пробирку и стерилизовали паром в автоклаве (200 кПа) в течение 25 минут при 121°С.
На фигуре 11С показана фотография шприца, содержащего композицию. На фигуре 11D показан шприц, содержащий композицию, через отверстие в кончике которого при помощи плунжера выдавлена часть композиции.
На фигуре 11Е показана фотография одного из вариантов реализации прозрачной композиции согласно настоящему изобретению, нанесенной поверх материала хирургического шва, кодовое обозначение размера "0", диаметр 0,3-0,39 мм. Материал шва четко видно через прозрачную композицию.
Хирург может видеть объекты под прозрачной композицией согласно настоящему изобретению после ее введения. Это значительно упрощает надлежащее введение композиции и определение ее эффективности при прекращении или остановке кровотечения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Haemostatix Limited
<120> Гемостатические композиции
<130> P/73071.WO01
<150> GB1508024.5
<151> 2015-05-11
<160> 17
<170> PatentIn, версия 3.5
<210> 1
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Gly Pro Arg Pro
1
<210> 2
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Gly Pro Arg Val
1
<210> 3
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Gly Pro Arg Pro Phe Pro Ala
1 5
<210> 4
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Gly Pro Arg Val Val Ala Ala
1 5
<210> 5
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Gly Pro Arg Pro Val Val Glu Arg
1 5
<210> 6
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Gly Pro Arg Pro Ala Ala
1 5
<210> 7
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Gly Pro Arg Pro Pro Glu Cys
1 5
<210> 8
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Gly Pro Arg Pro Pro Glu Arg
1 5
<210> 9
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Gly Pro Ser Pro Ala Ala
1 5
<210> 10
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Gly His Arg Pro
1
<210> 11
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Gly His Arg Pro Tyr
1 5
<210> 12
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Gly His Arg Pro Leu
1 5
<210> 13
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Карбоксильный конец содержит амидную группу
<400> 13
Gly His Arg Pro Tyr
1 5
<210> 14
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Карбоксильный конец может содержать амидную группу
<400> 14
Ala Pro Phe Pro Arg Pro Gly
1 5
<210> 15
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Pro или His
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Любая аминокислота
<400> 15
Gly Xaa Arg Xaa
<210> 16
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> misc_feature
<222> (5)..(5)
<223> Карбоксильный конец содержит амидную группу
<400> 16
Tyr Pro Arg His Gly
1 5
<210> 17
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Gly Pro Arg Pro Gly
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДНЫЕ ДЕНДРИМЕРЫ, СОДЕРЖАЩИЕ ФИБРИНОГЕН-СВЯЗЫВАЮЩИЕ ПЕПТИДЫ | 2015 |
|
RU2719562C2 |
| ПРОКОАГУЛЯНТНЫЕ ПЕПТИДЫ, ИХ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2635510C2 |
| СРЕДСТВО ДЛЯ ГЕМОСТАТИЧЕСКОЙ ОБРАБОТКИ РАНЫ | 2013 |
|
RU2661036C2 |
| БИОГЕЛЬ | 2007 |
|
RU2503464C2 |
| КОМПОЗИЦИИ ВАКЦИН И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2600798C2 |
| Пептиды для внутриклеточной доставки нуклеиновых кислот | 2020 |
|
RU2771605C2 |
| Иммуногенная композиция, включающая ее вакцина, набор для приготовления вышеуказанной композиции и способ лечения заболеваний, связанных с патологией секреции гастрина | 2014 |
|
RU2664197C2 |
| Меченые дендримерные пептиды | 2016 |
|
RU2611399C1 |
| ГЛИЦЕРИН-СВЯЗАННЫЕ ПЭГИЛИРОВАННЫЕ САХАРА И ГЛИКОПЕПТИДЫ | 2007 |
|
RU2460543C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2011 |
|
RU2623038C2 |
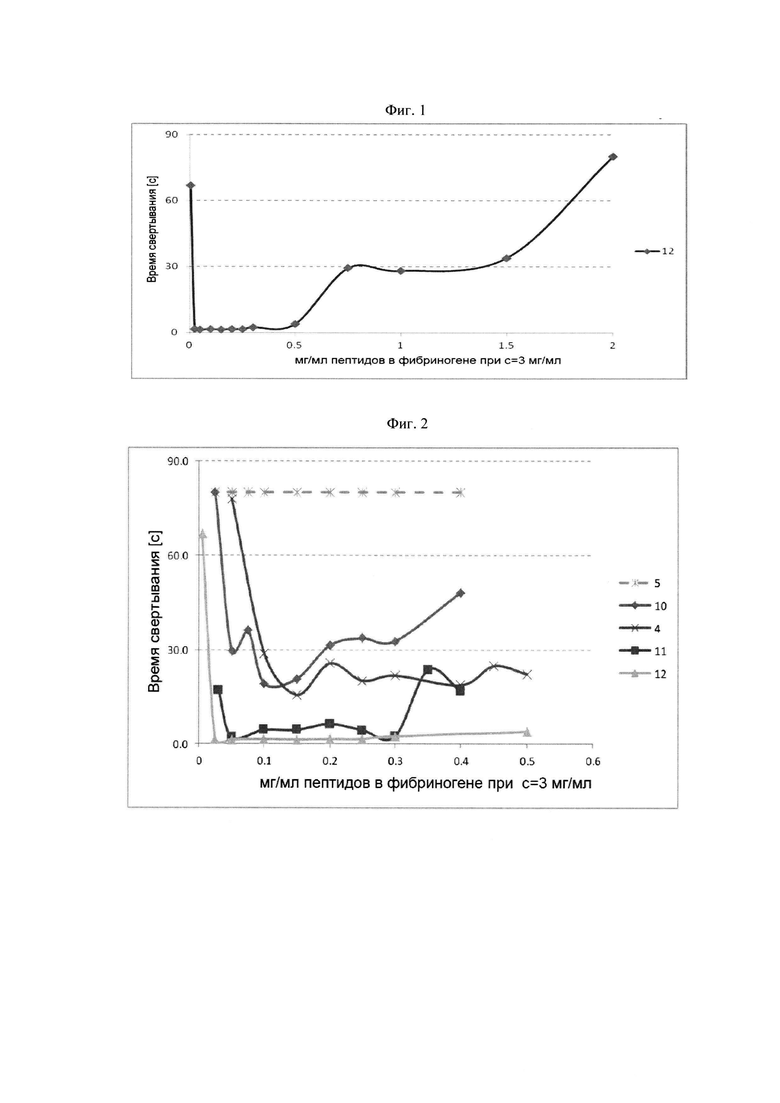
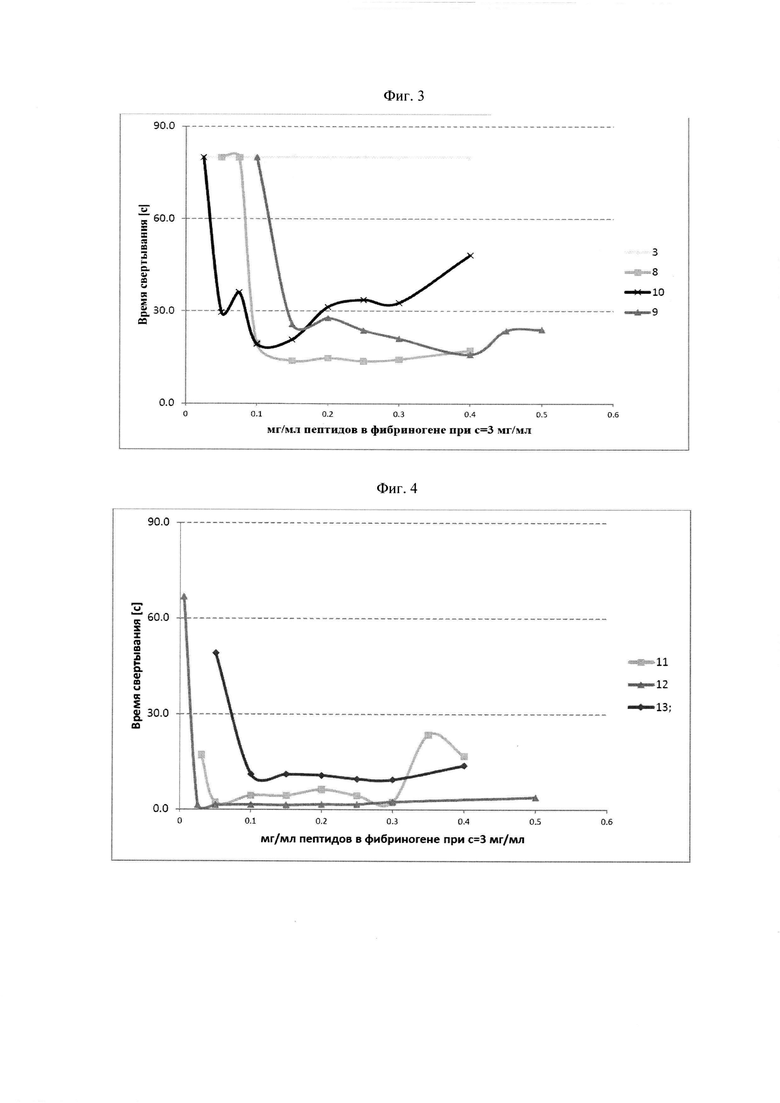
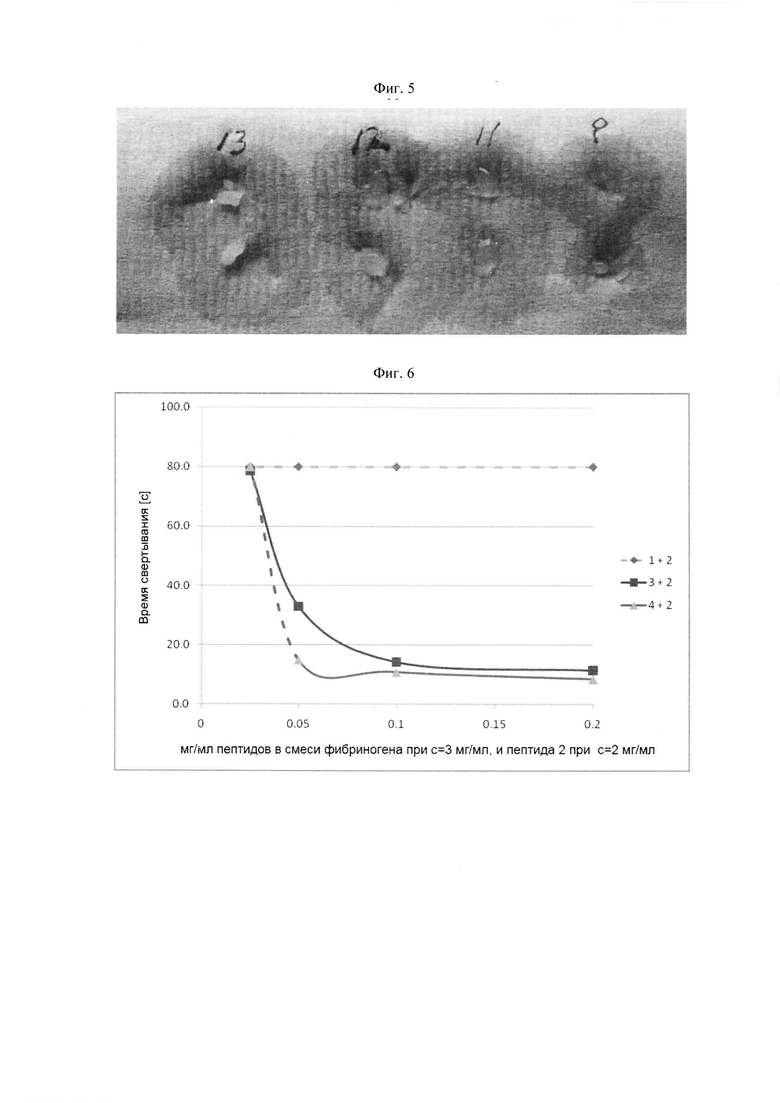
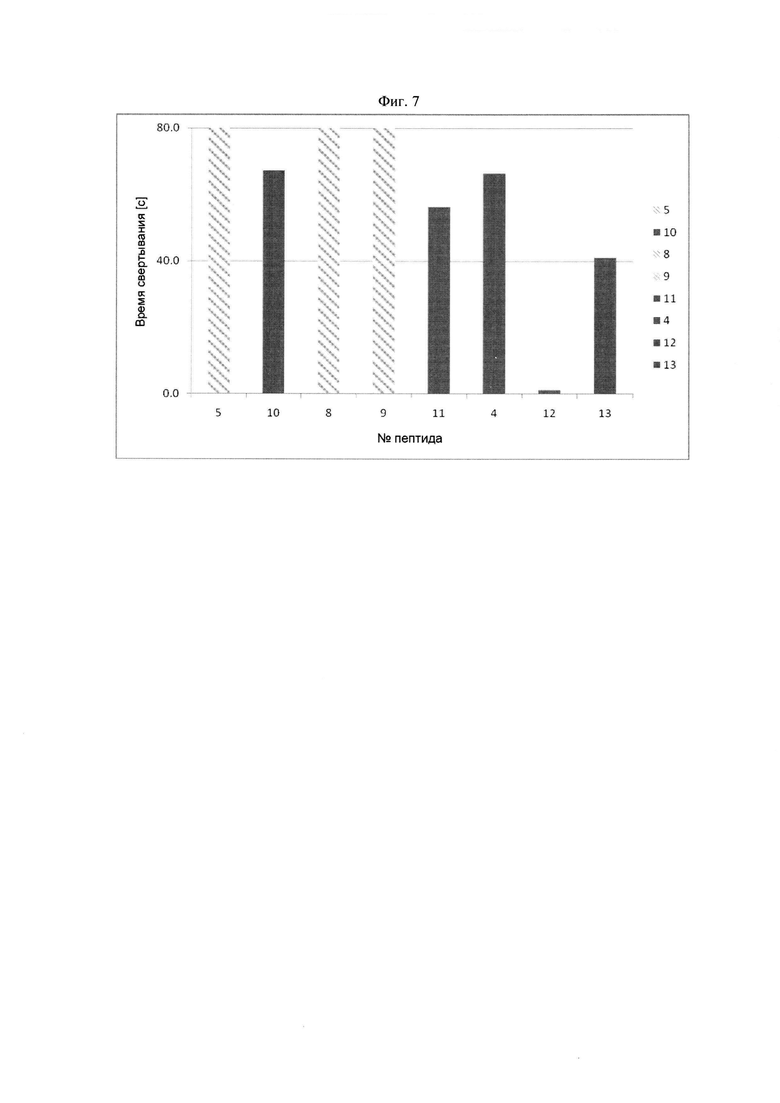
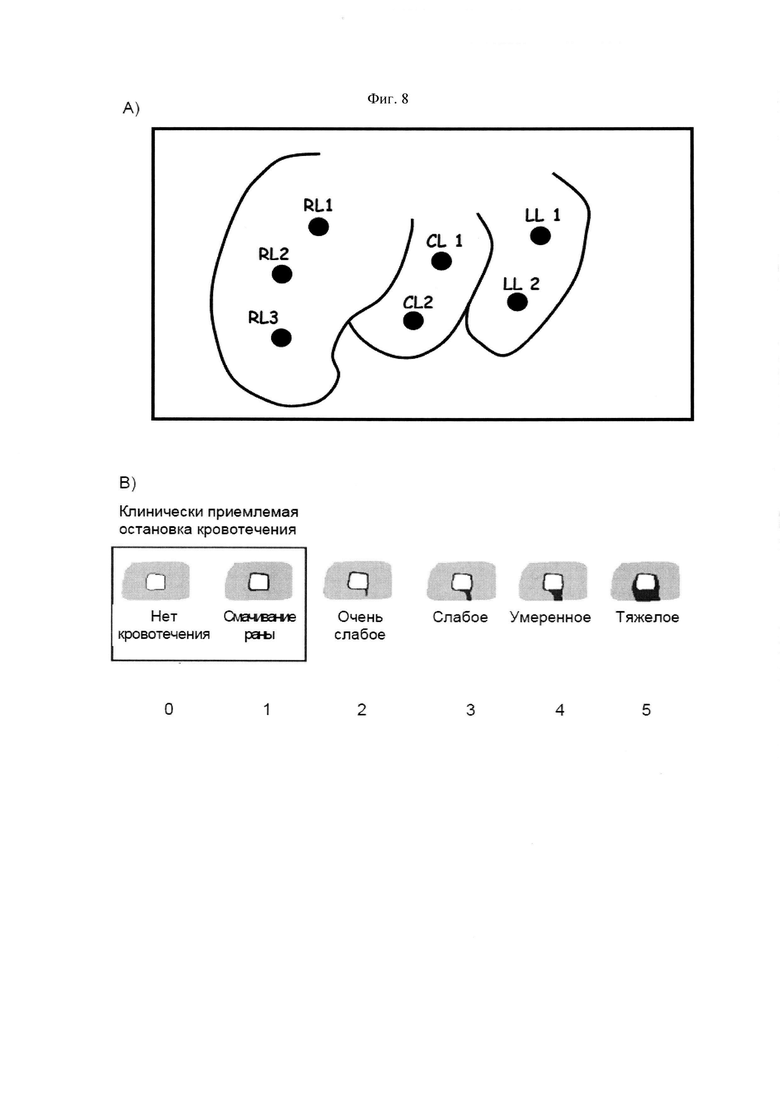

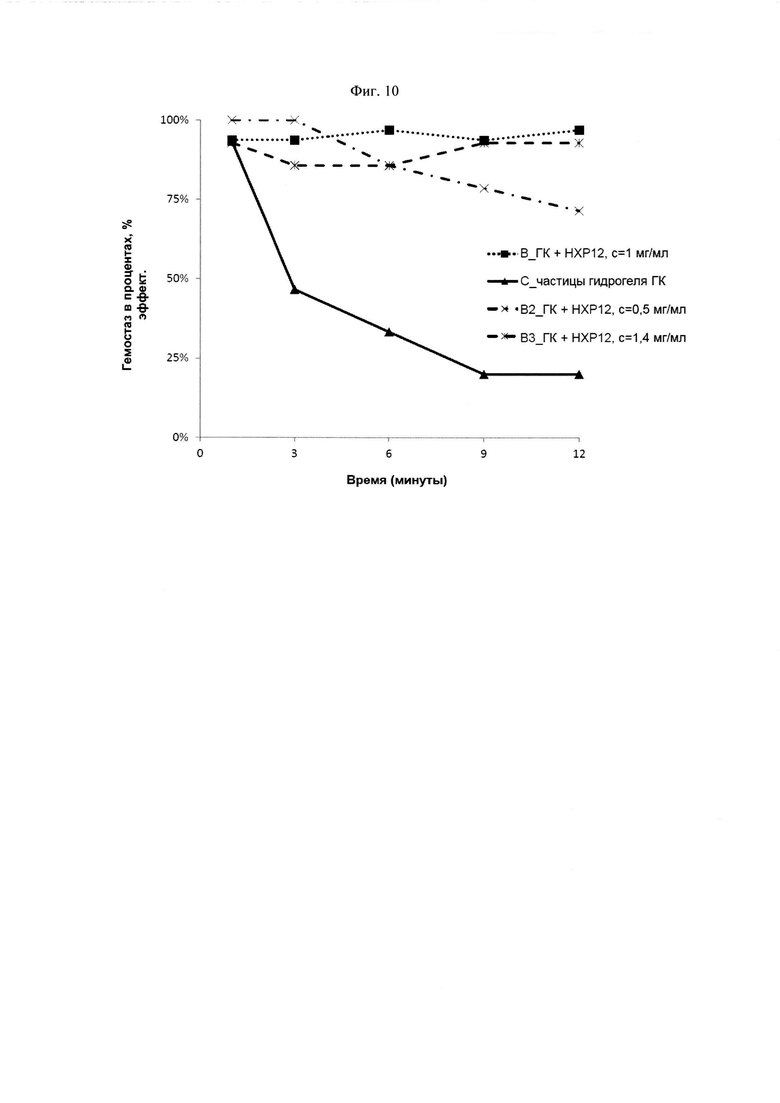
Группа изобретений относится к медицине и касается стерильной готовой к применению текучей гемостатической композиции, содержащей растворимый гемостатический агент, содержащий совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе, где каждый носитель в составе гемостатического агента содержит разветвленное ядро, и фибриноген-связывающие пептиды по отдельности ковалентно присоединены к разветвленному ядру, биосовместимую жидкость и частицы биосовместимого поперечно-сшитого полисахарида, подходящего для применения для остановки кровотечения, которые являются не растворимыми в биосовместимой жидкости. Группа изобретений также касается способа лечения кровотечения, включающего введение эффективного количества указанной композиции в кровоточащую рану, способа получения стерильной готовой к применению текучей гемостатической композиции. Группа изобретений обеспечивает улучшенную стабильность после стерилизации композиции в готовой к использованию форме. 4 н. и 39 з.п. ф-лы, 12 пр., 11 ил., 4 табл.
1. Стерильная готовая к применению текучая гемостатическая композиция, содержащая:
растворимый гемостатический агент, содержащий совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе, где каждый носитель в составе гемостатического агента содержит разветвленное ядро, и фибриноген-связывающие пептиды по отдельности ковалентно присоединены к разветвленному ядру;
биосовместимую жидкость; и
частицы биосовместимого поперечно-сшитого полисахарида, подходящего для применения для остановки кровотечения, которые являются не растворимыми в биосовместимой жидкости,
где разветвленное ядро содержит:
от двух до десяти полифункциональных аминокислотных остатков, где каждый фибриноген-связывающий пептид отдельно ковалентно присоединен к полифункциональному аминокислотному остатку разветвленного ядра;
совокупность полифункциональных аминокислотных остатков, где один или более фибриноген-связывающих пептидов по отдельности ковалентно присоединены к каждому из по меньшей мере двух соседних полифункциональных аминокислотных остатков разветвленного ядра;
совокупность полифункциональных аминокислотных остатков, где два или более фибриноген-связывающих пептидов по отдельности ковалентно присоединены по меньшей мере к одному полифункциональному аминокислотному остатку разветвленного ядра; или
совокупность полифункциональных аминокислотных остатков, где два или более полифункциональных аминокислотных остатков ковалентно присоединены через боковую цепь соседнего полифункционального аминокислотного остатка;
причем полифункциональные аминокислотные остатки включают три- или тетрафункциональные аминокислотные остатки или три- и тетрафункциональные аминокислотные остатки.
2. Композиция по п. 1, отличающаяся тем, что указанную гемостатическую композицию стерилизуют паром или сухим жаром.
3. Композиция по п. 1 или 2, отличающаяся тем, что указанная биосовместимая жидкость обеспечивает непрерывную жидкую фазу, и частицы полимера по существу однородно распределены по жидкой фазе.
4. Композиция по п. 3, отличающаяся тем, что указанное разветвленное ядро содержит совокупность последовательных полифункциональных аминокислотных остатков.
5. Композиция по п. 3 или 4, отличающаяся тем, что указанное разветвленное ядро содержит до десяти полифункциональных аминокислотных остатков.
6. Композиция по любому из пп. 3-5, отличающаяся тем, что указанный полифункциональный аминокислотный остаток или совокупность полифункциональных аминокислотных остатков содержат остаток лизина, орнитина, аргинина, аспарагиновой кислоты, глутаминовой кислоты, аспарагина, глутамина или цистеина.
7. Композиция по любому из пп. 3-6, отличающаяся тем, что указанный гемостатический агент имеет общую формулу (I)
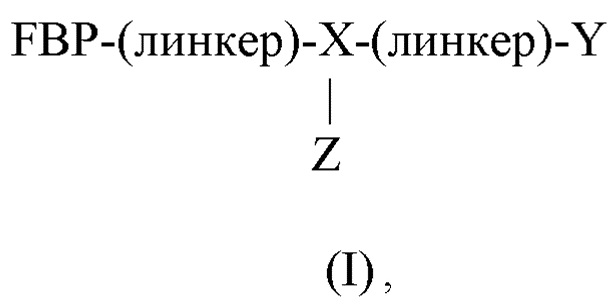
где FBP представляет собой фибриноген-связывающий пептид;
-(линкер)- представляет собой необязательный линкер, предпочтительно непептидный линкер;
X представляет собой трифункциональный аминокислотный остаток, предпочтительно остаток лизина, орнитина, аргинина, аспарагиновой кислоты, глутаминовой кислоты, аспарагина, глутамина или цистеина;
Y представляет собой -FBP или -NH2;
Z представляет собой -[-X-(линкер)-FBP]a-(линкер)-FBP, где a равен 1-10, предпочтительно 1-3.
8. Композиция по любому из пп. 3-7, отличающаяся тем, что указанный гемостатический агент имеет следующую общую формулу (II):
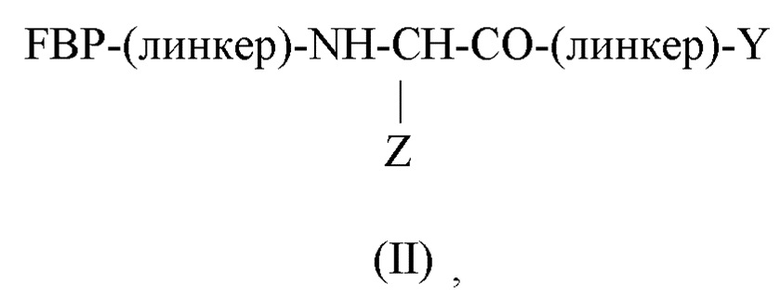
где FBP представляет собой фибриноген-связывающий пептид;
-(линкер)- представляет собой необязательный линкер, предпочтительно содержащий NH(CH2)5CO-;
Y представляет собой -FBP или -NH2;
Z представляет собой:
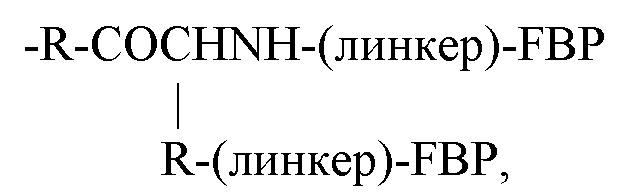
если Y представляет собой -NH2; или
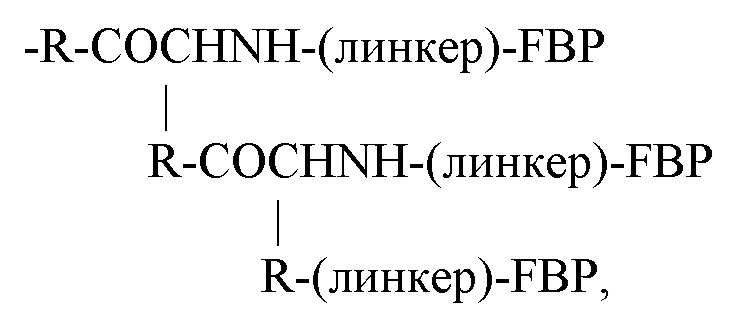
если Y представляет собой -NH2; или
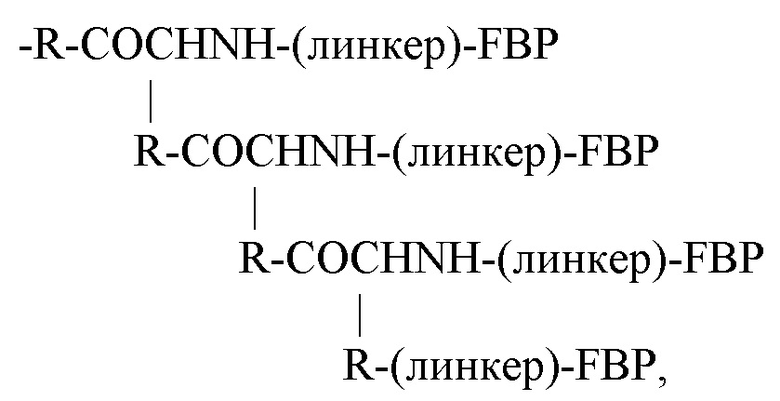
если Y представляет собой -NH2; или
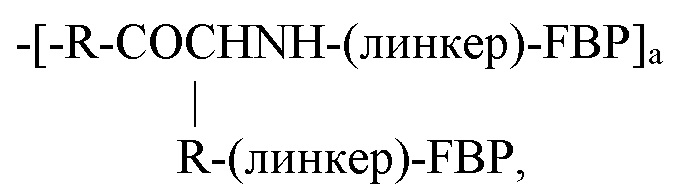
если Y представляет собой -FBP, и a равен 1-10, предпочтительно 1-3,
где R представляет собой -(CH2)4NH-, -(CH2)3NH- или -(CH2)3NHCNHNH.
9. Композиция по любому из пп. 3-8, отличающаяся тем, что указанный гемостатический агент имеет следующую общую формулу (III):
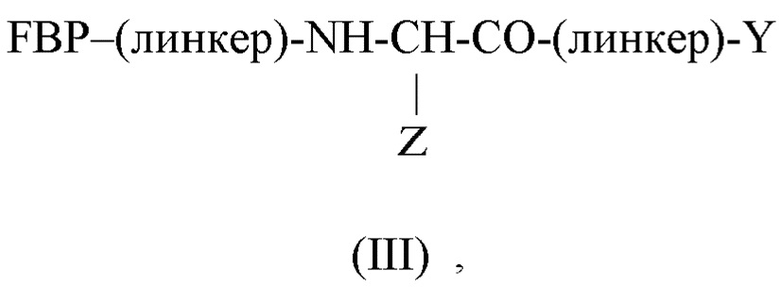
где FBP представляет собой фибриноген-связывающий пептид;
-(линкер)- представляет собой необязательный линкер, предпочтительно содержащий NH(CH2)5CO-;
Y представляет собой -FBP или -NH2;
Z представляет собой:
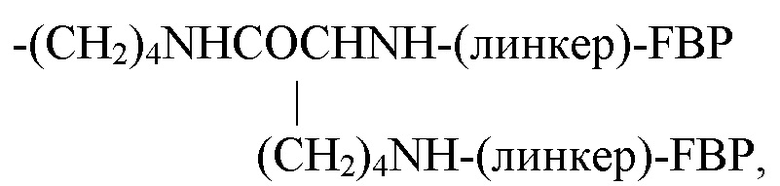
если Y представляет собой -NH2; или
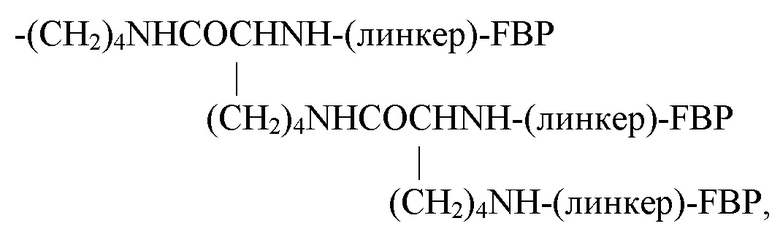
если Y представляет собой -NH2; или
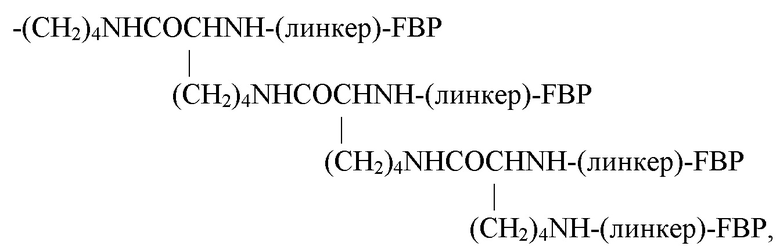
если Y представляет собой -NH2; или
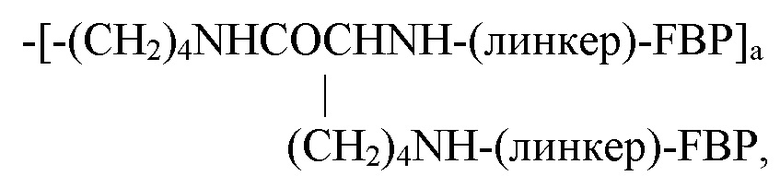
если Y представляет собой -FBP, и a равен 1-10, предпочтительно 1-3.
10. Композиция по любому из пп. 1-9, отличающаяся тем, что каждый фибриноген-связывающий пептид присоединен к разветвленному ядру посредством непептидного линкера.
11. Композиция по п. 10, отличающаяся тем, что указанный линкер содержит линейный линкер, предпочтительно линейную алкильную группу.
12. Композиция по п. 11, отличающаяся тем, что указанный линкер содержит -NH(CH2)nCO-, где n равен 1-10.
13. Композиция по любому из предшествующих пунктов, отличающаяся тем, что фибриноген-связывающие пептиды предпочтительно связываются с впадиной "a" фибриногена по сравнению с впадиной "b" фибриногена.
14. Композиция по любому из пп. 1-12, отличающаяся тем, что фибриноген-связывающие пептиды предпочтительно связываются с впадиной "b" фибриногена по сравнению с впадиной "a" фибриногена.
15. Композиция по любому из предшествующих пунктов, отличающаяся тем, что указанный гемостатический агент содержит фибриноген-связывающие пептиды с различными последовательностями.
16. Композиция по п. 15, отличающаяся тем, что совокупность носителей содержит первую совокупность носителей и вторую совокупность носителей, где фибриноген-связывающие пептиды, присоединенные к первой совокупности носителей, имеют последовательность, отличную от последовательности фибриноген-связывающих пептидов, присоединенных ко второй совокупности носителей.
17. Композиция по п. 15, отличающаяся тем, что каждый носитель содержит присоединенные к нему фибриноген-связывающие пептиды с различными последовательностями.
18. Композиция по любому из пп. 15-17, отличающаяся тем, что фибриноген-связывающие пептиды с различными последовательностями имеют различную селективность связывания с впадиной "a" по сравнению с впадиной "b" фибриногена.
19. Композиция по любому из пп. 15-18, отличающаяся тем, что фибриноген-связывающие пептиды с различными последовательностями содержат первый фибриноген-связывающий пептид, который предпочтительно связывается с впадиной "a" по сравнению с впадиной "b" фибриногена, и второй фибриноген-связывающий пептид, который связывается с впадиной "a" фибриногена по сравнению с впадиной "b" фибриногена с большей селективностью, чем первый фибриноген-связывающий пептид.
20. Композиция по п. 19, отличающаяся тем, что указанный первый фибриноген-связывающий пептид содержит аминокислотную последовательность GPRP- (SEQ ID NO: 1) на амино-конце.
21. Композиция по п. 19 или 20, отличающаяся тем, что указанный второй фибриноген-связывающий пептид содержит аминокислотную последовательность -APFPRPG (SEQ ID NO: 14) на карбоксильном конце.
22. Композиция по любому из пп. 15-18, отличающаяся тем, что фибриноген-связывающие пептиды с различными последовательностями содержат первый фибриноген-связывающий пептид, который предпочтительно связывается с впадиной "a" фибриногена по сравнению с впадиной "b" фибриногена, и второй фибриноген-связывающий пептид, который предпочтительно связывается с впадиной "b" фибриногена по сравнению с впадиной "a" фибриногена.
23. Композиция по п. 22, отличающаяся тем, что указанный первый фибриноген-связывающий пептид содержит аминокислотную последовательность GPRP- (SEQ ID NO: 1) на амино-конце.
24. Композиция по п. 22 или 23, отличающаяся тем, что указанный второй фибриноген-связывающий пептид содержит на амино-конце аминокислотную последовательность GHRP- (SEQ ID NO: 10), предпочтительно аминокислотную последовательность GHRPY- (SEQ ID NO: 11).
25. Композиция по любому из предшествующих пунктов, отличающаяся тем, что указанная биосовместимая жидкость представляет собой водный раствор.
26. Композиция по п. 25, отличающаяся тем, что указанный водный раствор представляет собой солевой раствор.
27. Композиция по любому из предшествующих пунктов, отличающаяся тем, что указанный полисахарид содержит гликозаминогликан, окисленную целлюлозу, хитозан, хитин, альгинат, окисленный альгинат или окисленный крахмал.
28. Композиция по п. 27, отличающаяся тем, что указанный гликозаминогликан содержит гиалуроновую кислоту.
29. Композиция по любому из предшествующих пунктов, отличающаяся тем, что указанные частицы содержат гранулы поперечно-сшитой гиалуроновой кислоты, где основная часть гранул имеет диаметр в диапазоне 100-1500 мкм в частично или полностью гидратированной форме.
30. Композиция по любому из предшествующих пунктов, имеющая содержание твердых веществ 1-70% или 5-20% по массе от массы композиции.
31. Композиция по любому из пп. 1-29, отличающаяся тем, что массовое отношение частиц к жидкости составляет от 1:1 до 1:12 или от 1:3 до 1:8.
32. Композиция по любому из предшествующих пунктов, отличающаяся тем, что указанная композиция является прозрачной.
33. Композиция по любому из пп. 1-32 для применения в качестве лекарственного средства.
34. Композиция по любому из пп. 1-32 для применения для лечения кровотечения или для лечения раны.
35. Применение композиции по любому из пп. 1-32 для получения лекарственного средства для применения для лечения кровотечения или для лечения раны.
36. Способ лечения кровотечения, включающий введение эффективного количества композиции по любому из пп. 1-32 в кровоточащую рану.
37. Способ лечения раны, включающий введение эффективного количества композиции по любому из пп. 1-32 в рану.
38. Способ получения стерильной готовой к применению текучей гемостатической композиции, включающий:
смешение биосовместимой жидкости, растворимого гемостатического агента и частиц биосовместимого поперечно-сшитого полисахарида, подходящего для применения для остановки кровотечения, которые не растворимы в биосовместимой жидкости, где растворимый гемостатический агент содержит совокупность носителей и совокупность фибриноген-связывающих пептидов, иммобилизованных на каждом носителе, где каждый носитель в составе гемостатического агента содержит разветвленное ядро, и фибриноген-связывающие пептиды по отдельности ковалентно присоединены к разветвленному ядру; и
стерилизацию композиции,
где разветвленное ядро содержит:
от двух до десяти полифункциональных аминокислотных остатков, где каждый фибриноген-связывающий пептид отдельно ковалентно присоединен к полифункциональному аминокислотному остатку разветвленного ядра;
совокупность полифункциональных аминокислотных остатков, где один или более фибриноген-связывающих пептидов по отдельности ковалентно присоединены к каждому из по меньшей мере двух соседних полифункциональных аминокислотных остатков разветвленного ядра;
совокупность полифункциональных аминокислотных остатков, где два или более фибриноген-связывающих пептидов по отдельности ковалентно присоединены по меньшей мере к одному полифункциональному аминокислотному остатку разветвленного ядра; или
совокупность полифункциональных аминокислотных остатков, где два или более полифункциональных аминокислотных остатков ковалентно присоединены через боковую цепь соседнего полифункционального аминокислотного остатка;
причем полифункциональные аминокислотные остатки включают три- или тетрафункциональные аминокислотные остатки или три- и тетрафункциональные аминокислотные остатки.
39. Способ по п. 38, отличающийся тем, что указанную композицию стерилизуют паром или сухим жаром.
40. Способ по п. 38 или 39, отличающийся тем, что указанную жидкость, агент и частицы смешивают в условиях, которые являются эффективными для получения непрерывной жидкой фазы, содержащей частицы, по существу однородно распределенные по жидкой фазе, за счет чего образуется по существу гомогенная гемостатическая композиция.
41. Способ по любому из пп. 38-40, дополнительно включающий центрифугирование смеси для удаления пузырьков воздуха из смеси.
42. Способ по любому из пп. 38-40, отличающийся тем, что указанную биосовместимую жидкость и частицы смешивают друг с другом перед добавлением растворимого гемостатического агента.
43. Способ по п. 42, дополнительно включающий центрифугирование смеси биосовместимой жидкости и частиц для удаления пузырьков воздуха из смеси перед добавлением растворимого гемостатического агента.
| ГЕМОСТАТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ГИАЛУРОНОВУЮ КИСЛОТУ | 2009 |
|
RU2486921C2 |
| WO 2012104638 A1, 09.08.2012 | |||
| US 4407829 A1, 04.10.1983 | |||
| DE LACO PA., et al., Efficacy of a hyaluronan derivative gel in postsurgical adhesion prevention in the presence of inadequate hemostasis.Surgery | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2021-03-15—Публикация
2016-05-11—Подача