Изобретение относится к области медицины, а именно, иммунологии и молекулярной биологии, и касается способа определения уровня экспрессии гена, кодирующего IL-18 в тканях глаза кролика (Oryctolagus cuniculus), с помощью ОТ-ПЦР в режиме реального времени и может быть использовано в экспериментальной офтальмологии для определения характера воспалительной реакции, а также на этапе доклинических исследований, в частности, при тестировании противовоспалительных препаратов.
IL-18-цитокин с плейотропной активностью, относящийся к семейству интерлейкина-1, является одним из ключевых медиаторов формирования врожденного и приобретенного иммунного ответа, дифференцировки и функциональной активности макрофагов, дендритных клеток и Т-лимфоцитов.
IL-18 стимулирует продукцию интерферона гамма (IFNγ), колониестимулируюших факторов (CSFs), интерлейкинов (IL-1, IL-2 и др.), фактора некроза опухоли альфа (TNF-α), молекул адгезии и факторов апоптоза, что способствует активации цитотоксических Т-лимфоцитов, НК-клеток и формированию эффективного противоинфекционного и противоопухолевого иммунного ответа.
В силу наличия у этого цитокина разнообразных эффектов, IL-18 принимает участие не только в защитных реакциях организма, но также в формировании целого ряда патологий, сопровождающихся хроническим воспалением и деструкцией тканей: аутоиммунных заболеваний (ревматоидного артрита, болезни Крона и др.), метаболического синдрома, аллергических расстройств и сахарного диабета.
Получены многочисленные доказательства важной роли IL-18 в патогенезе влажной формы возрастной макулярной дегенерации (ВМД).
Согласно современным представлениям, активация воспаления и последующая продукция IL-18 представляют двухэтапный процесс.
Первый этап включает NF-κВ-опосредованное повышение экспрессии целого ряда генов, кодирующих провоспалительные цитокины в ответ на сигналы воспаления.
Наличие, сила воспалительного стимула, а также эффективность воздействия противовоспалительных средств могут быть определены с помощью выявления и оценки уровней транскрипции генов, кодирующих факторы воспаления, в частности, IL-18.
Разработка метода ПЦР с обратной транскрипцией (ОТ-ПЦР) расширила возможности классической ПНР как метода молекулярной диагностики, позволив исследовать геном РНК-содержащих организмов и изучить их роль в развитии инфекционных болезней [Reverse-transcription PCR (RT-PCR) - Bachman J. - Methods Enzymol. 2013; 530:67-74. doi: 10.1016/В978-0-12-420037-1.00002-6].
Метод ОТ-ПЦР нашел широкое применение также в определении уровня экспрессии генов в клетках экспериментальных животных и человека, что обеспечило возможность молекулярной оценки состояния органов и тканей. В настоящее время исследования уровней транскрипции индуцибельных генов, кодирующих цитокины, факторы роста, гормоны, применяется в различных областях медицины, ветеринарии и молекулярной биологии и является перспективным направлением ПНР-диагностики.
Постановка ОТ-ПЦР включает несколько основных этапов: выделение молекул мРНК из биоматериала, обработку ДНКазой проб с мРНК, синтез молекул кДНК при помощи обратной транскриптазы, определение уровня экспрессии исследуемого гена методом ПЦР, проверку специфичности ПЦР-продукта с помощью электрофореза и анализ полученных результатов.
Количество кДНК в анализируемой пробе зависит от наличия веществ, ингибирующих обратную транскрипцию, скорости разрушения мРНК и др. Для учета всех факторов и их влияния на ход реакции требуется параллельное измерение уровня экспрессии коститутивных генов или генов домашнего хозяйства (housekeeping gene), обычно используемых для нормализации, из которых наиболее стабильной экспрессией обладают гены гипоксантин фосфорибозилтрансферазы (HPRT), глицеральдегид 3-фосфат дегидрогеназы (GAPDH), b-актина [Foss D.L., Baarsch М.J., Murtaugh М.Р. Regulation of hypoxanthine phosphoribosyltransferase, glyceraldehyde-3-phosphate dehydrogenase and beta-actin mRNA expression in porcine immune cells and tissues. // Anim Biotechnol. - 1998. - N1. - P. 67-78.], а так же субъединицы А сукцинатдегидрогеназы [Nachar W., Busseuil D., Shi Y., Mihalache-Avram Т., Mecteau M., Rheaume E., Tardif J.C. Optimisation of reference genes for gene-expression analysis in a rabbit model of left ventricular diastolic dysfunction. PLoS One. 2014 Feb 18; 9(2)].
Известен способ оценки уровня экспрессии гена, кодирующего IL-18 в лейкоцитах крови кроликов при их заражении вирусом RHDV (геморрагической болезни кроликов) [Trzeciak-Ryczek A., Tokarz-Deptula В., Deptula W. Expression of IL-IRa, IL-6, IL-8, IL-18, TNF-a and IFN-γ genes in peripheral blood leukocytes of rabbits infected with RHDV (Rabbit Haemorrhagic Disease Virus) // Dev Comp Immunol. - 2017. - Nov; 76: 310-315. doi: 10.1016/j.dci.2017.07.005. Epub 2017 Jul 8]. В этой работе для постановки ОТ-ПЦР авторами использован коммерческий набор SensiFAST SYBR® No-ROX Kit (BIOLINE), подобраны праймеры с помощью программы Vector NTI software, однако не представлен протокол пробоподготовки и отсутствует нуклеотидная последовательность разработанных праймеров исследуемого и референсных генов (HPRT и β - актина), что не позволяет использовать эти данные в качестве руководства на этапе доклинических исследований.
Использование нескольких генов домашнего хозяйства требует расчета нормировочного коэффициента и постановки мультиплексной ПЦР, где одновременно применяется несколько пар праймеров к нескольким генам сравнения, что требует синтеза гибридизационных зондов меченых флуорохромом, индивидуально специфичных для каждого из исследуемых генов. Это значительно усложняет постановку реакции и увеличивает финансовые затраты на ее проведение.
Известен способ определения уровня экспрессии IL-18 в ткани сердца кролика [Fiorelli A.I., Lourenco-Filho D.D., Tavares E.R., Carvalho P.O., Marques A.F., Gutierrez P.S., Maranhao R.C., Stolf N.A.G. Methotrexate associated to lipid core nanoparticles improves cardiac allograft vasculopathy and the inflammatory profile in a rabbit heart graft model // Braz J Med Biol Res. - 2017 Aug 17; 50(10): e6225. doi: 10.1590/1414-431X20176225.], в которой для постановки ОТ-ПЦР используется ряд коммерческих тест систем - TaqMan Universal PCR Master Mix, TaqMan Gene Expression Assays, StepOne Plus Real-Time PCR System (Applied Biosystems), упрощающих проведение реакции, но существенно увеличивающих ее стоимость. В публикации также не представлены нуклеотидные последовательности праймеров исследуемых и референсного генов, что не позволяет воспроизвести постановку в рамках другой лаборатории.
Известен способ оценки уровня экспрессии IL-18 на модели гипертрофии сердечной мышцы кролика [Yoshida Т., Friehs I., Mummidi S., del Nido P.J., Addulnour-Nakhoul S., Delafontaine P., Valente A.J., Chandrasekar B. - Pressure overload induces IL-18 and IL-18R expression, but markedly suppresses IL-18 BP expression in a rabbit model. IL-18 potentiates TNF-α-induced cardiomyocyte death // J Mol Cell Cardiol. - 2014 Oct; 75:141-51. doi: 10.1016/j.yjmcc.2014.07.007. Epub 2014 Aug 7]. Авторы работы используют нозерн-блоттинг - достаточно старый и менее информативный метод, чем ОТ-ПЦР. Нозерн-блоттинг, основанный на гибридизации РНК, предварительно фракционированной с помощью электрофореза, требует синтеза гибридизационных зондов и нескольких этапов постановки с участием исследователя, что увеличивает влияние человеческого фактора на результаты реакции и повышает ошибку опыта. В публикации представлены нуклеотидные последовательности праймеров для клонирования участков гена IL-18, однако не описаны детали постановки реакции - полный перечень компонентов, их количество, температуры отжига праймеров.
Задачей настоящего изобретения является разработка простого, доступного, легко воспроизводимого и экономичного способа оценки экспрессии гена IL-18 в малом объеме биологического материала кроликов.
Техническим результатом является получение протокола пробоподготовки, постановки и расчетов результатов ОТ-ПЦР с оптимально подобранным для этого комплектом реагентов, позволяющих с высокой точностью воспроизвести реакцию в условиях ПЦР-лабораторий, для дальнейшего использования в экспериментальной офтальмологии, в доклинических исследованиях медицинских изделий и, в частности, при испытании противовоспалительных лекарственных средств.
Технический результат достигается за счет:
1) Подбора оригинальных пар праймеров для IL-18 и GAPDH, обеспечивающих специфическую амплификацию без образования побочных структур.
2) Определения компонентов реакционной смеси - концентраций пары прямого и обратного праймеров, установки оптимальных температур элонгации, денатурации и отжига (методом градиента) и количества циклов амплификации.
3) Использования одного нормировочного гена GAPDH, как наиболее универсального, стабильно экспрессируемого практически всеми клетками организма.
4) Подбора наиболее доступных и экономичных реагентов, их минимального количества без потери эффективности реакции.
5) Снижения временных затрат для каждого этапа постановки.
При выборе пар праймеров в электронной базе данных NCBI Gen Bank с использованием программного обеспечения: Primer-BLAST, OligoCalc: Oligonucleotide Properties Calculator и Standard Nucleotide BLAST отбирались наиболее перспективные последовательности олигонуклеотидов для исследуемых генов. Выбранные последовательности праймеров синтезировались на автоматическом синтезаторе ДНК («Евроген»). В результате были получены 2 пары олигонуклеотидов для измерения экспрессии GAPDH и одна пара олигонуклеотидов для измерения экспрессии IL-18.
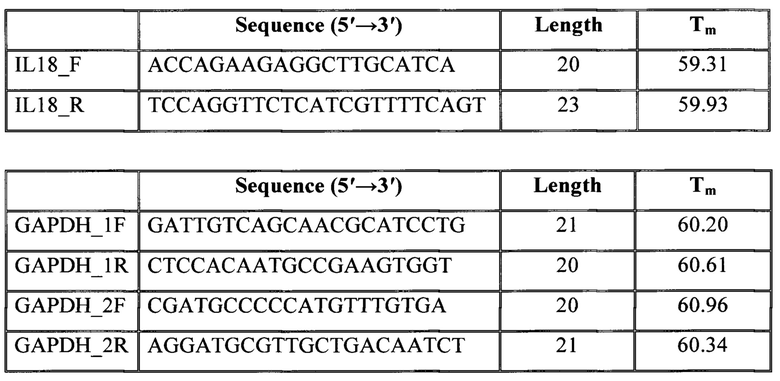
Заданные параметры конструкции (последовательность и молекулярная масса) праймеров требуют индивидуального подбора количества вспомогательных компонентов реакции, а также определения параметров постановки амплификации на всех этапах реакции (элонгация, отжиг и т.д.).
Для определения оптимальных условий проведения реакции осуществлялся ряд постановок с разной компоновкой реагентов по концентрации и объему, позволившим в итоге опытным путем выбрать наиболее удачный и эффективный вариант. Температура отжига олигонуклеотидных праймеров и продолжительность этапов реакции определялись в режиме выполнения температурного градиента, где ряд пробирок с одинаковым содержимым подвергался одновременной амплификации, но с индивидуальной температурой отжига для каждой пробы, отличающихся между собой на 0,5°C.
Для проведения ОТ-ПЦР использовался термоциклер с оптическим блоком для детекции флуоресценции в режиме реального времени (амплификатор) CFX96 Touch (Bio-Rad). Реакция проводилась в течение 2 часов, одновременно фиксировался флуоресцентный сигнал, полученные данные, обработанные в программе Bio-Rad CFX Manager, в дальнейшем представлялись в таблицах и графиках.
Эффективность реакции амплификации определялась построением калибровочной кривой.
Изобретение осуществляется следующим образом.
С помощью программного обеспечения Primer-BLAST, OligoCalc: Oligonucleotide Properties Calculator и Standard Nucleotide BLAST подобраны 2 пары праймеров для измерения экспрессии GAPDH и одна пара олигонуклеотидов для измерения экспрессии IL-18. Ткани кролика О. cuniculus гомогенизируют в течение 90 секунд при скорости 45000 об./мин., с последующим выделением мРНК из образцов. В пробы с полученной мРНК добавляют 1 мкл ингибитора РНКаз, а затем синтезируют кДНК методом обратной транскрипции.
Для амплификации исследуемого и референсного генов при помощи ПЦР в режиме реального времени используют следующие пары праймеров:
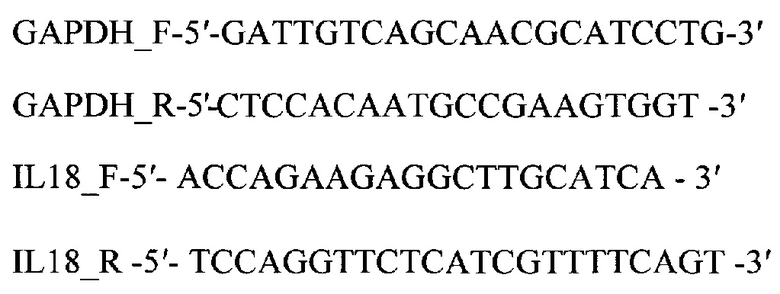
Реакционная смесь для амплификации гена IL-18 содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер IL8_F (концентрация 1 мкМ; Mw 61,16 г/моль) 1 мкл
- обратный праймер IL18_R (концентрация 1 мкМ; Mw 69,50 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Реакционная смесь для амплификации гена GAPDH содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDH_F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Протокол реакции амплификации генов IL18 и GAPDH, включает:
- первичная денатурация - 3 минуты 95°C
- амплификационный цикл (х45)
- денатурация - 15 секунд 95°C
- отжиг праймеров - 30 секунд 55°C
- элонгация и съем флуоресцентного сигнала - 30 секунд 72°C
Эффективность реакции ОТ-ПЦР определяется уравнением калибровочной кривой, построенной при амплификации образца с известной концентрацией ДНК пятикратно разведенного в 4 раза. Значение эффективности используется в формуле расчета нормированной экспрессии исследуемого гена.
Пример.
Материал исследования - 16 образцов тканевого комплекса сетчатка - хориоидея кроликов, 12 из которых были получены при моделировании атрофии ретинального пигментного эпителия. Образцы забираются в чистые эппендорфы и замораживаются в камере глубокой заморозки при температуре - 70°.
Для получения мРНК замороженная ткань глаза предварительно доводится до однородного дисперсного состояния на гомогенизаторе (например, Silent Crusher S (Heidolph) в течение 90 секунд при скорости 45000 об./мин. мРНК из образцов ткани выделяется по протоколу (Part 1) коммерческого набора RNeasy Mini Kit (Qiagen). Затем к образцам добавляется 1 мкл ингибитора РНКаз RNase Inhibitor (Qiagen) и обрабатывается ДНКазой DNase Max Kit (Qiagen) в соответствии с инструкцией производителя.
Контроль количества полученной мРНК осуществлялся при помощи спектрофотометра длине волны 260 нм; в нашем случае - мультирежимный имиджер марки Cytation 5 imaging reader (Biotek). Набор iScript cDNA Synthesis Kit (Bio-Rad) используется для следующего этапа - синтеза кДНК в реакции обратной транскрипции. Для этого в эппендорф вносятся и смешиваются: 9 мкл воды свободной от нуклеаз (Nuclease-free water); 4 мкл 5х iScript Reaction Mix; 1 мкл iScript Reverse Transcriptase; 5 мкл мРНК; 1 мкл RNase Inhibitor (Qiagen).
Общий объем смеси (20 мкл) обрабатывается по протоколу производителя набора iScript cDNA Synthesis Kit на амплификаторе, в нашем случае используется CFX96 Touch (Bio-Rad).
Амплификация кДНК гена IL-18 проводится так же с помощью термоциклера. Флуоресценция регистрируется за счет добавления в реакционную смесь интеркалирующего красителя SYBR Green I (Евроген).
Реакционная смесь для ПЦР в объеме 15 мкл содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер IL18_F (концентрация 1 мкМ; Mw 61,16 г/моль) 1 мкл
- обратный праймер IL18_R (концентрация 1 мкМ; Mw 69,50 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Для амплификации используются праймеры IL 18
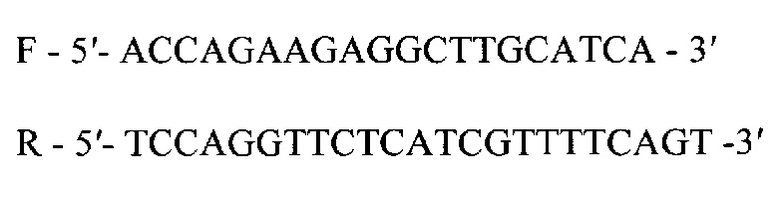
Амплификация кДНК гена GAPDH проводится в объеме 15 мкл, реакционная смесь содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDH_1F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_1R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Для амплификации используются олигонуклеотиды GAPDH
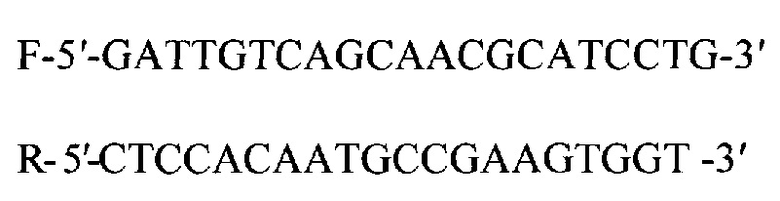
Протокол реакции:
- первичная денатурация - 3 минуты 95°C
- амплификационный цикл (х45)
- денатурация - 15 секунд 95°C
- отжиг праймеров - 30 секунд 55°C
- элонгация и учет флуоресцентного сигнала - 30 секунд 72°C
Дополнительный контроль амплификации осуществляют методом электрофореза в 2% агарозном геле, куда вносят 10 мкл ампликонов смешанных с 6-кратным буфером для загрузки.
Анализ результатов ОТ-ПЦР.
Для каждой из тест-проб при помощи программы Bio-Rad CFX Manager определяется пороговый цикл (Ct), при котором количество кДНК во всех реакционных пробирках достигало одинаковой пороговой величины (задавалась программным обеспечением). Воспроизводимость реакции амплификации исследуемого и референсного гена оценивалась постановкой каждой пробы в тройном повторе, где разница между пороговыми циклами составляет не более 0,5 цикла.
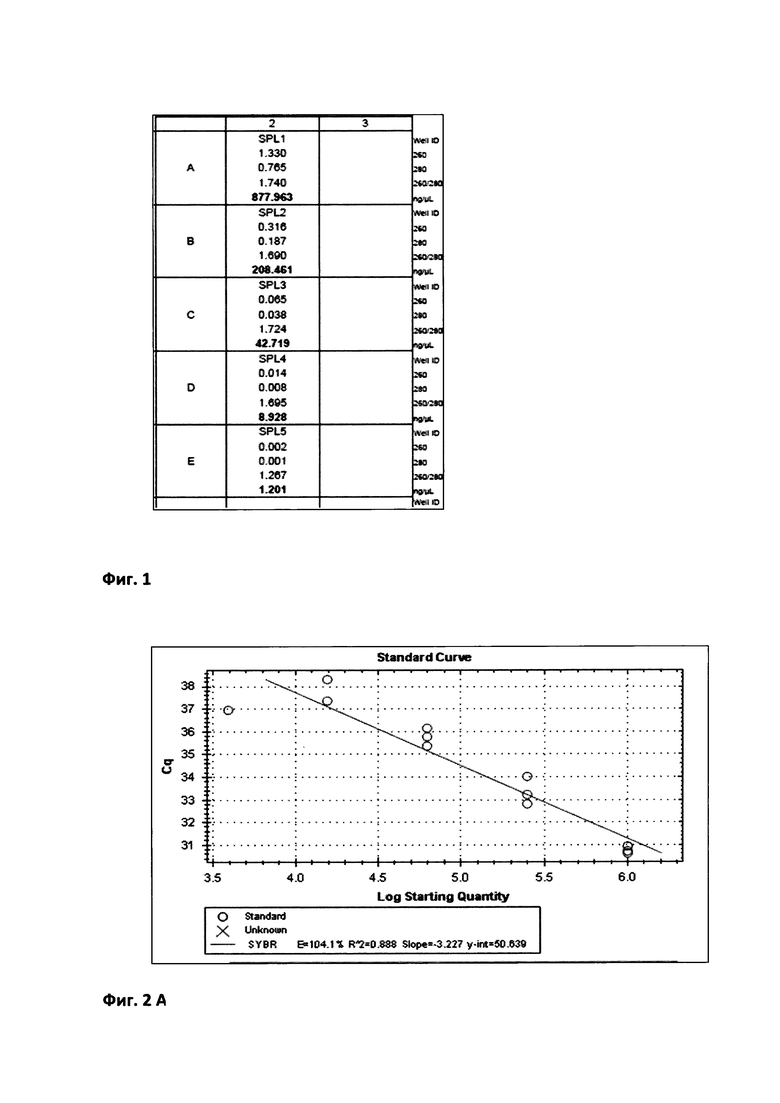
Для определения реакционной эффективности праймеров репрезентативный образец пятикратно последовательно разводился в 4 раза, с последующим измерением количества кДНК при каждом разведении на спектрофотометре (например, Cytation 5 imaging reader (Biotek) (фиг. 1 Концентрация кДНК (нг/мкл) в репрезентативной пробе пятикратно последовательно разведенной в 4 раза) при длине волны 260 нм. Эффективность амплификации образцов, отраженная в калибровочной кривой, рассчитывалась в программе Bio-Rad CFX Manager согласно формулам:
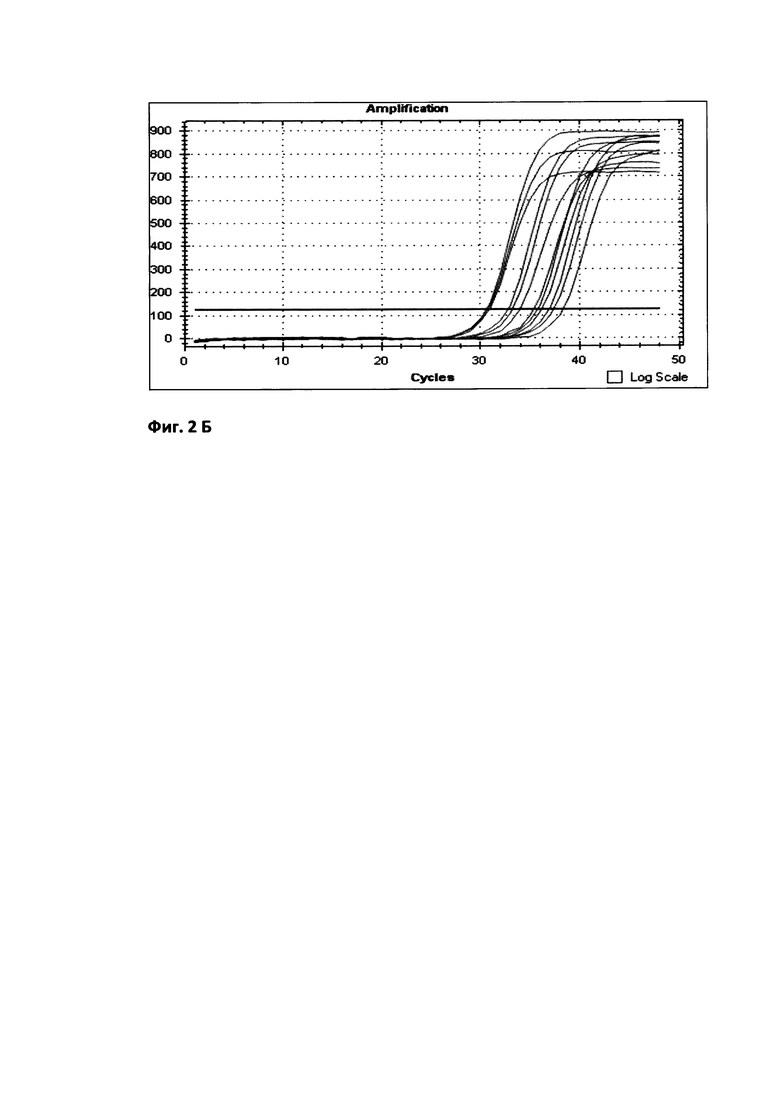
Е=10[-1/m], Е%=(Е-1)×100%, где Е - эффективность, m - наклон стандартной кривой.
Уравнение калибровочной кривой представляет логарифмическую зависимость значения показателя порогового цикла (Ct) пяти образцов разведения репрезентативной пробы от количества кДНК в каждом образце. На фиг. 2 приведены график калибровочной кривой, который показывает зависимость значений Ct; полученных при амплификации пяти стандартных образцов, и значений lg (Xo) этих образцов (А) и график изменения интенсивности свечения репрезентативной пробы при амплификации гена IL18 для 5 образцов с последовательно уменьшающейся в 4 раза концентрацией кДНК (Б).
Анализ результатов исследования выполнен методом расчета относительной величины (ΔС) исследуемого образца (IL18) по формуле:
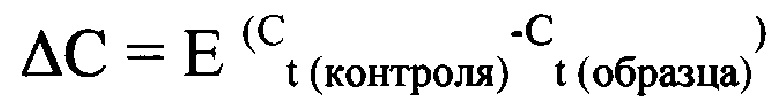
Где:
Е - эффективность набора праймеров и зондов.
Ct (контроля) - среднее значение Ct для нормировочного гена (GAPDH)
Ct (образца) - среднее значение Ct исследуемого образца (IL18)
Нормированная экспрессия (ΔΔС) - относительная величина экспрессии исследуемого гена нормированная к величине экспрессии референсного гена в образце биоматериала, вычислялась по формуле:
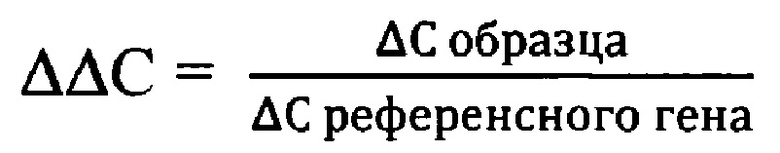
Полученное в ходе расчетов значение ААС использовано для оценки экспрессии гена IL18.
Таким образом, предложенный способ определения уровня экспрессии гена, кодирующего IL18 кролика Oryctolagus cuniculus методом ПЦР в режиме реального времени и набор для определения позволяют при помощи доступных и экономичных реагентов, используя один референсный ген, сделать вывод о характере экспрессируемого профиля IL18 в исследуемой ткани.
IL18_F accagaagaggcttgcatca
IL18_R tccaggttctcatcgttttcagt
GAPDH_F gattgtcagcaacgcatcctg
GAPDH_R ctccacaatgccgaagtggt
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения уровня экспрессии гена, кодирующего CCL-2 в тканях глаза кролика Oryctolagus cuniculus, и набор для его определения | 2020 |
|
RU2750940C1 |
| Способ определения уровня экспрессии гена, кодирующего ZO-1 в тканях глаза кролика Oryctolagus cuniculus и набор для его определения | 2021 |
|
RU2766186C1 |
| Способ определения уровня экспрессии гена, кодирующего PEDF, в тканях глаза кролика Oryctolagus cuniculus и набор для его определения | 2021 |
|
RU2765437C1 |
| Способ определения уровня экспрессии гена, кодирующего 1L-1β в тканях глаза кролика (Oryctolagus cuniculus), и набор для его осуществления | 2019 |
|
RU2731062C1 |
| Способ определения уровня экспрессии гена, кодирующего VEGF-A в тканях глаза кролика Oryctolagus cuniculus, и набор для его определения | 2021 |
|
RU2761339C1 |
| Количественная оценка соотношения hsa-miR-30c-5/VIM, hsa-miR-28-3p/VIM, hsa-miR-1-3p/ANXA2, hsa-miR-30c-5p/FBN1, hsa-miR-15b-5p/MYL6 tr.v.1, hsa-miR-15b-5p/MYL6 tr.v.2, hsa-miR-185-3p/FLNA, hsa-miR-1-3p/YWHAZ, hsa-miR-30c-5p/YWHAZ и hsa-miR-654-3p/FGA в плацентарной площадке женщин в день родоразрешения на сроке более 34 недель гестации как способ дифференциальной диагностики синдрома задержки развития плода, преэклампсии и синдрома маловесного к сроку гестации плода | 2021 |
|
RU2771205C1 |
| Количественный метод определения экспрессии аллелей GNAO1 здоровой формы и с мутацией c.607 G>A | 2021 |
|
RU2777663C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ЭКСПРЕССИИ ХИМЕРНОГО ГЕНА Trim5a | 2015 |
|
RU2592675C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВАГИНИТА У ЖЕНЩИН РЕПРОДУКТИВНОГО ВОЗРАСТА ПО УРОВНЮ ЭКСПРЕССИИ мРНК ГЕНОВ ЦИТОКИНОВ ВО ВЛАГАЛИЩНЫХ МАЗКАХ | 2013 |
|
RU2552310C2 |
| Способ прогнозирования выживаемости больных светлоклеточным почечно-клеточным раком | 2018 |
|
RU2699792C1 |
Изобретение относится к области медицинской биотехнологии и касается способа определения уровня экспрессии гена, кодирующего IL-18 в тканях глаза кролика (Oryctolagus cuniculus), и набор для его определения. Способ включает: а) использование одного референсного гена GAPDH для нормирования полученных результатов, б) подбор оригинальных пар праймеров для исследуемого и референсного генов, в) гомогенизацию тканей глаза в течение 90 секунд при скорости 45000 об/мин, г) выделение мРНК из образцов с последующим добавлением к пробе 1 мкл ингибитора РНКаз, д) синтез кДНК методом обратной транскрипции, е) амплификацию исследуемого и референсного генов при помощи ПЦР в режиме реального времени с фиксацией флуоресценции при помощи интеркалирующего красителя SYBR Green (Евроген), ж) определение относительного количества гена IL18 и референсного гена GAPDH при помощи калибровочной кривой, построенной при амплификации образца с известной концентрацией ДНК, пятикратно разведенного в 4 раза. Эффективность амплификации, определяемая уравнением калибровочной кривой, используется в расчетах относительной величины и нормированной экспрессии исследуемого гена. Набор включает: а) оригинальные олигонуклеотидные праймеры для гена IL1β кролика Oryctolagus cuniculus
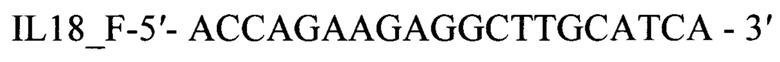
Изобретение позволяет получить протокол пробоподготовки, постановки и расчетов результатов ОТ-ПЦР с оптимально подобранным для этого комплектом реагентов, позволяющих с высокой точностью воспроизвести реакцию в условиях ПЦР-лабораторий, для дальнейшего использования в экспериментальной офтальмологии, в доклинических исследованиях медицинских изделий и, в частности, при испытании противовоспалительных лекарственных средств. 2 н.п. ф-лы, 2 ил., 1 табл., 1 пр.
1. Способ определения уровня экспрессии гена, кодирующего IL18 кролика (Oryctolagus cuniculus) методом ПЦР в режиме реального времени, отличающийся тем, что включает:
а) использование одного референсного гена GAPDH для нормирования полученных результатов,
б) подбор оригинальных пар праймеров для гена IL18 кролика Oryctolagus cuniculus
IL18F-5'-ACCAGAAGAGGCTTGCATCA-3'
IL18R-5'-TCCAGGTTCTCATCGTTTTCAGT-3'
и для гена GAPDH кролика Oryctolagus cuniculus
GAPDHF-5'-GATTGTCAGCAACGCATCCTG-3'
GAPDHR-5'-CTCCACAATGCCGAAGTGGT-3',
в) гомогенизацию тканей глаза в течение 90 секунд при скорости 45000 об/мин;
г) выделение мРНК из образцов с последующим добавлением к пробе 1 мкл ингибитора РНКаз,
д) синтез кДНК методом обратной транскрипции,
е) амплификацию исследуемого и референсного генов при помощи ПЦР в режиме реального времени с фиксацией флуоресценции при помощи интеркалирующего красителя SYBR Green (Евроген),
ж) определение относительного количества гена IL18 и референсного гена GAPDH при помощи калибровочной кривой, построенной при амплификации образца с известной концентрацией ДНК, пятикратно разведенного в 4 раза; эффективность амплификации, определяемая уравнением калибровочной кривой, используется в расчетах относительной величины и нормированной экспрессии исследуемого гена.
2. Набор для определения уровня экспрессии гена, кодирующего IL1β кролика Oryctolagus cuniculus по п. 1, включающий:
а) оригинальные олигонуклеотидные праймеры для гена IL1β кролика Oryctolagus cuniculus
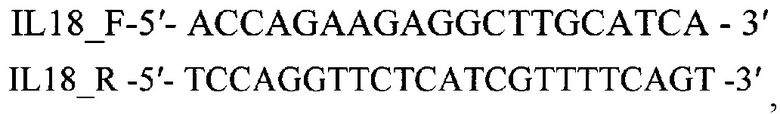
б) оригинальные олигонуклеотидные праймеры для гена GAPDH кролика Oryctolagus cuniculus
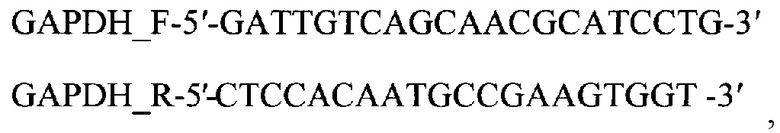
в) реакционную смесь ПЦР в режиме реального времени для амплификации гена IL18, содержащую:
- вода дистиллированная 9,4 мкл,
- буфер 1,5 мкл (Евроген),
- прямой праймер IL8_F (концентрация 1 мкМ; Mw 61,16 г/моль) 1 мкл,
- обратный праймер IL18_R (концентрация 1 мкМ; Mw 69,50 г/моль) 1 мкл,
- dNTP 0,5 мкл,
- кДНК 1 мкл,
- SYBR Green I [1:25000] 0,3 мкл,
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан),
г) реакционную смесь ПЦР в режиме реального времени для амплификации гена GAPDH, содержащую:
- вода дистиллированная 9,4 мкл,
- буфер 1,5 мкл (Евроген),
- прямой праймер GAPDH_F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл,
- обратный праймер GAPDH_R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл,
- dNTP 0,5 мкл,
- кДНК 1 мкл,
- SYBR Green I [1:25000] 0,3 мкл,
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан),
д) протокол реакции амплификации генов IL18 и GAPDH, включающий
- первичная денатурация - 3 минуты 95°C,
- амплификационный цикл (х45),
- денатурация - 15 секунд 95°C,
- отжиг праймеров - 30 секунд 55°C,
- элонгация и съем флуоресцентного сигнала - 30 секунд 72°C.
| YOSHIDA Т et al., Pressure overload induces IL-18 and IL-18R expression, but markedly suppresses IL-18 BP expression in a rabbit model | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| FIORELLI A.I., et al., Methotrexate associated to lipid core | |||
Авторы
Даты
2021-03-23—Публикация
2020-01-31—Подача