Изобретение относится к области медицины, а именно, иммунологии и молекулярной биологии, и касается способа определения уровня экспрессии гена, кодирующего VEGF-A, в тканях глаза кролика (Oryctolagus cuniculus), с помощью ОТ-ПЦР в режиме реального времени и может быть использовано в экспериментальной офтальмологии для определения характера воспалительной реакции, оценки интенсивности ангиогенеза, а также на этапе доклинических исследований, в частности, при тестировании противовоспалительных средств и антиангиогенных препаратов.
VEGF-A - фактор роста эндотелия сосудов (от англ. vascular endothelial growth factor, VEGF-A), впервые описанный как гепарин-связывающий ангиогенный фактор роста, оказывает выраженное митогенное воздействие на эндотелиальные клетки.
VEGF-A, влияя на развитие новых кровеносных сосудов и выживание незрелых кровеносных сосудов, связывается с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF-A и рецептором-2 VEGF-A), экспрессирующимися на поверхности клеток эндотелия, и активирует их. Взаимодействие VEGF-A с указанными рецепторами запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию.
В норме VEGF-A в незначительных концентрациях синтезируется тканями глаза: этот медиатор обнаружен в конъюнктиве, сетчатке и хориоидее [Kim I. et al. Constitutive Expression of VEGF, VEGFR-1, and VEGFR-2 in Normal Eyes // Invest Ophthalmol Vis Sci. 1999. Vol. 40. P. 2115-2121]. У человека и крысы VEGF-A обнаружен в одних и тех же слоях сетчатки: в стенке сосудов, слое ганглионарных клеток и по ходу их отростков, в клетках внутреннего ядерного слоя (особенно в дистальной его части), в синаптических терминалях фоторецепторов в наружном плексиформном слое и в дистальной части по отношению к наружной пограничной мембране фоторецепторов, в базальной части ретинального пигментного эпителия.
Избыточная экспрессия VEGF-А в глазу вызывает аномальный рост новообразованных сосудов с высокой проницаемостью и связана с развитием целого ряда заболеваний, сопровождающихся значительным снижением зрительных функций: влажной формы возрастной макулярной дегенерации, неоваскулярной глаукомы, пролиферативной диабетической ретинопатии и др. Создающиеся в последние годы в большом количестве лекарственные препараты - ингибиторы ангиогенеза (такие, как бевацизумаб и ряд других) способны контролировать или замедлять течение патологического процесса однако, как показал ряд исследований обладают негативным действием в отношении тканей глаза - запускают процесс атрофии.
Клетки организма, располагая полным комплектом генетической информации, транскрибируют лишь ту ее часть, которая необходима на данный момент для их функционирования. Экспрессии тех или иных генов предшествует синтез матричной РНК (м-РНК), которая, в отличие от геномной ДНК, быстро деградирует в клеточном матриксе. Ввиду этого количество и нуклеотидный состав м-РНК в клетке постоянно меняется, отражая в каких белковых продуктах на данный момент нуждается клетка. Количественный метод оценки экспрессии гена сводится к выявлению его транскрипционной активности при помощи определения его продукта - мРНК. Для этого разработано несколько методов, самый распространенный и широко применяемый из которых, ПЦР с обратной транскрипцией. [Reverse-transcription PCR (RT-PCR) - Bachman J. - Methods Enzymol. 2013;530:67-74. doi: 10.1016/B978-0-12-420037-1.00002-6].
В настоящее время исследования уровней транскрипции индуцибельных генов, кодирующих цитокины, факторы роста, хемоаттрактантные белки, гормоны применяется в различных областях медицины, ветеринарии и молекулярной биологии и является перспективным направлением ПЦР-диагностики.
Постановка ОТ-ПЦР включает несколько основных этапов: выделение молекул мРНК из биоматериала, обработку ДНКазой проб с мРНК, синтез молекул кДНК при помощи обратной транскриптазы, определение уровня экспрессии исследуемого гена методом ПЦР, проверку специфичности ПЦР-продукта с помощью электрофореза и анализ полученных результатов.
Количество кДНК в пробе зависит от наличия веществ, ингибирующих обратную транскрипцию, скорости разрушения мРНК и др. Для учета всех факторов и их влияния на ход реакции требуется параллельное измерение уровня экспрессии конститутивных генов или генов домашнего хозяйства (housekeeping gene), обычно используемых для нормализации, из которых наиболее стабильной экспрессией обладают гены гипоксантин фосфорибозилтрансферазы (HPRT), глицеральдегид 3-фосфат дегидрогеназы (GAPDH), b- актина [Foss D.L., Baarsch М. J., Murtaugh M.P. Regulation of hypoxanthine phosphoribosyl transferase, glyceraldehyde-3-phosphate dehydrogenase and beta-actin mRNA expression in porcine immune cells and tissues. // Anim Biotechnol. - 1998. - N1. - P. 67-78.], а также субъединицы A сукцинатдегидрогеназы [Nachar W., Busseuil D., Shi Y., Mihalache-Avram Т., Mecteau M., Rheaume E., Tardif J.C. Optimisation of reference genes for gene-expression analysis in a rabbit model of left ventricular diastolic dysfunction. PLoS One. 2014 Feb 18; 9(2)].
Способ оценки уровня экспрессии гена, кодирующего VEGF-A описан в рамках исследования, посвященного изучению влияния кальций-связывающего белка S100A4 на наоваскуляризацию роговицы кролика после щелочного ожога [Inhibitory Effects of S100 А4 Gene Silencing on Alkali Burn-Induced Corneal Neovascularization: An in Vivo Study Yu-Lin Wang, Gui-Ping Gao, Yu-Qin Wang, Ying Wu, Zhi-You Peng, Quan Zhou- Mol Vis. 2017 Apr 26; 23:286-295. eCollection 2017]. В работе представлены последовательности праймеров исследуемых генов, однако протокол реакции и состав реакционной смеси даны в сокращенной форме, что не позволяет воспроизвести постановку в рамках другой лаборатории.
Известен способ оценки уровня экспрессии VEGF-A в культуре клеток ткани глаза кролика [Hypoxia-Inducible Factor-Dependent Expression of Angiopoietin-Like 4 by Conjunctival Epithelial Cells Promotes the Angiogenic Phenotype of Pterygia Qianli Meng, Yaowu Qin, Monika Deshpande, Fabiana Kashiwabuchi, Murilo Rodrigues, Qiaozhi Lu, Hui Ren, Jennifer H Elisseeff, Gregg L Semenza, Silvia V Montaner, Akrit Sodhi - Invest Ophthalmol Vis Sci. 2017 Sep 1; 58(11):4514-4523]. Авторы исследования изучают влияние ангиопоэтин-подобного белка 4 и других стимуляторов ангиогенеза на возникновение и развитие тяжелых форм птеригиума. В работе приведены нуклеотидные последовательности исследуемых и референсных генов человека и кролика, однако протокол исследования и метод оценки уровня экспрессии не представлены. В качестве конститутивного гена для определения уровня тканевой экспрессии VEGF-A исследователями выбран (32-микроглобулин. Несмотря на то, что в ряде работ показана его эффективность у некоторых видов животных, однако выбор (32-микроглобулина для нормирования экспрессии в тканях глаза вызывает определенные сомнения. Как известно, белок (32-микроглобулин функционирует в качестве важного структурного элемента молекулы главного комплекса гистосовместимости (МНС, major histocompatibility complex) [Иммунология учебник для вузов - В.А. Черешнев, К.В. Шмагель -Магистр-пресс, Москва 2013, с. 306], выполняющей важную роль (презентацию антигена) в адаптивном иммунном ответе. В норме глаз является иммунопривилегированным органом, и в его оболочках значительно снижена экспрессия молекул МНС I и II классов; травмы, инфекции, повышение уровня провоспалительных цитокинов способствуют срыву иммунной привилегии - увеличению экспрессии генов, кодирующих структурные белки МНС. Выбор GAPDH в качестве конститутивного гена для расчета нормированной экспрессии в тканях глаза представляется более надежным, т.к позволит получить более достоверные результаты.
Постановка количественной ПЦР в реальном времени проведена с помощью коммерческого набора Power SYBR Green PCR Master Mix (Applied Biosystems) - сертифицированной готовой реакционной смеси для ПЦР, удобной, но требующей значительных финансовых трат от исследователя.
Способ оценки уровня экспрессии VEGF-A в тканях сетчатки глаза кроликов представлен в работе М. Gozawa и соавт. [М. Gozawa, Y. Takamura, S. Miyake, T. Matsumura, M. Morioka, Y. Yamada, M. Inatani. Photocoagulation of the Retinal Nonperfusion Area Prevents the Expression of the Vascular Endothelial Growth Factor in an Animal Model // Invest Ophthalmol Vis Sci. - 2017 Nov 1; 58(13):5946-5953]. Авторы предлагают на примере модели кроликов с лазер индуцированной окклюзией вен сетчатки оценить уровень экспрессии VEGF-A. Для постановки ПЦР исследователи используют коммерческий набор KOD-plus (Toyobo Co. Ltd.), основным компонентом которого является ДНК-полимераза из термофильных бактерий Thermococcus kodakarensis - более точная и эффективная ДНК-полимераза, чем широко распространенная Taq- полимераза. Однако метод детекции результатов реакции - электрофорез в 1,5% агарозном геле, окрашенном бромистым этидием является более старым, трудоемким и менее точным способом, чем ПЦР в реальном времени. Использование готового коммерческого набора KOD-plus для постановки реакции существенно увеличивает финансовые затраты на ее проведение и не дает возможности подбора более экономически выгодной комбинации компонентов без потери эффективности реакции.
Задачей настоящего изобретения является разработка простого, доступного, легко воспроизводимого и экономичного способа оценки экспрессии гена VEGF-A в малом объеме биологического материала кроликов.
Техническим результатом является получение протокола пробоподготовки, постановки и расчетов результатов ОТ-ПЦР с оптимально подобранным для этого комплектом реагентов, позволяющих с высокой точностью воспроизвести реакцию в условиях других 1ТЦР- лабораторий, для дальнейшего использования в экспериментальной офтальмологии, в доклинических исследованиях средств медицинского назначения и, в частности, при испытании противовоспалительных лекарственных средств.
Технический результат достигается за счет:
1) Подбора оригинальных пар праймеров для VEGF-A и GAPDH, обеспечивающих специфическую амплификацию без образования побочных структур.
2) Определения компонентов реакционной смеси - концентраций пары прямого и обратного праймеров, установки оптимальных температур элонгации, денатурации и отжига (методом градиента) и количества циклов амплификации.
3) Использования одного нормировочного гена GAPDH, как наиболее универсального, стабильно экспрессируемого практически всеми клетками организма.
4) Подбора наиболее доступных и экономичных реагентов, их минимального количества без потери эффективности реакции.
5) Снижения временных затрат для каждого этапа постановки.
При выборе пар праймеров в электронной базе данных NCBI Gen Bank с использованием программного обеспечения: Primer-BLAST, OligoCalc: Oligonucleotide Properties Calculator и Standard Nucleotide BLAST отбирались наиболее перспективные последовательности олигонуклеотидов для исследуемых генов. Выбранные последовательности праймеров синтезировались на автоматическом синтезаторе ДНК («Евроген»). В результате были получены 2 пары олигонуклеотидов для измерения экспрессии GAPDH и 2 пары олигонуклеотидов для измерения экспрессии VEGF-A.
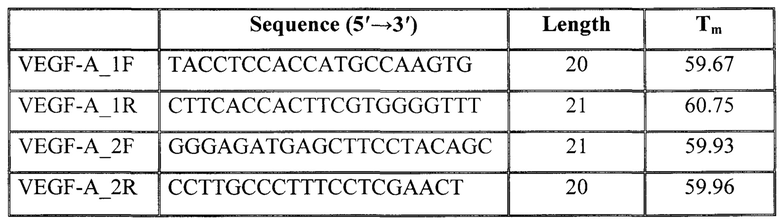
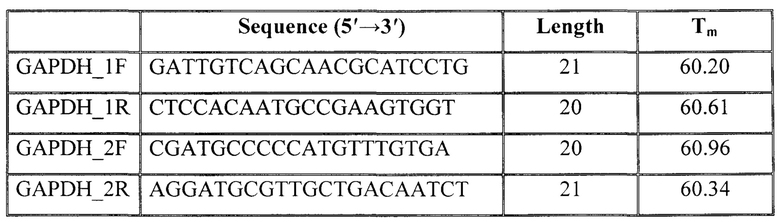
Заданные параметры конструкции (последовательность и молекулярная масса) праймеров требуют индивидуального подбора количества вспомогательных компонентов реакции, а также определения параметров постановки амплификации на всех этапах реакции (элонгация, отжиг и т.д.).
Для определения оптимальных условий проведения реакции осуществлялся ряд постановок с разной компоновкой реагентов по концентрации и объему, позволившим в итоге опытным путем выбрать наиболее удачный и эффективный вариант. Температура отжига олигонуклеотидных праймеров и продолжительность этапов реакции определялись в режиме выполнения температурного градиента, где ряд пробирок с одинаковым содержимым подвергался одновременной амплификации, но с индивидуальной температурой отжига для каждой пробы, отличающихся между собой на 0,5°С.
Для проведения ОТ-ПЦР использовался термоциклер с оптическим блоком для детекции флуоресценции в режиме реального времени (амплификатор) CFX96 Touch (Bio-Rad). Реакция проводилась в течение 2 часов, одновременно фиксировался флуоресцентный сигнал, полученные данные, обработанные в программе Bio-Rad CFX Manager, в дальнейшем представлялись в таблицах и графиках.
Эффективность реакции амплификации определялась построением калибровочной кривой.
Изобретение осуществляется следующим образом.
С помощью программного обеспечения Primer-BLAST, OligoCalc: Oligonucleotide Properties Calculator и Standard Nucleotide BLAST подобраны no 2 пары праймеров для измерения экспрессии GAPDH и VEGF-A. Ткани кролика О. cuniculus гомогенизируют в течение 90 секунд при скорости 45000 об./мин., с последующим выделением мРНК из образцов. В пробы с полученной мРНК добавляют 1 мкл ингибитора РНКаз, а затем синтезируют кДНК методом обратной транскрипции.
Для амплификации исследуемого и референсного генов при помощи ПЦР в режиме реального времени используют следующие пары праймеров:
GAPDH_F-5'-GATTGTCAGCAACGC ATCCTG-3'
GAPDH_R-5'-CTCCACAATGCCGAAGTGGT3'
VEGF-A_2F-GGGAGATGAGCTTCCTACAGC-3'
VEGF-A_2R-CCTTGCCCTTTCCTCGAACT-3'
Реакционная смесь для амплификации гена VEGF-A содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер VEGF-A_F (концентрация 1 мкМ; Mw 64,51 г/моль) 1 мкл
- обратный праймер VEGF-A_R (концентрация 1 мкМ; Mw 59,36 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Реакционная смесь для амплификации гена GAPDH содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDH_F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Протокол реакции амплификации генов VEGF-A и GAPDH, включает:
- первичная денатурация- 3 минуты 95°С
- амплификационный цикл (×45)
- денатурация - 15 секунд 95°С
- отжиг праймеров - 20 секунд 63,2°С
- элонгация и съем флуоресцентного сигнала - 30 секунд 72°С
Эффективность реакции ОТ-ПЦР определяется уравнением калибровочной кривой, построенной при амплификации образца с известной концентрацией ДНК пятикратно разведенного в 4 раза. Значение эффективности используется в формуле расчета нормированной экспрессии исследуемого гена.
Пример.
Материал исследования - 16 образцов тканевого комплекса сетчатка - хориоидея кроликов, 12 из которых были получены при моделировании атрофии ретинального пигментного эпителия. Образцы забираются в чистые эппендорфы и замораживаются в камере глубокой заморозки при температуре -70°С.
Для получения мРНК замороженная ткань глаза предварительно доводится до однородного дисперсного состояния на гомогенизаторе (например, Silent Crusher S (Heidolph) в течение 90 секунд при скорости 45000 об./мин. мРНК из образцов ткани выделяется по протоколу (Part 1) коммерческого набора RNeasy Mini Kit (Qiagen). Затем к образцам добавляется 1 мкл ингибитора РНКаз RNase Inhibitor (Qiagen) и обрабатывается ДНКазой DNase Max Kit (Qiagen) в соответствии с инструкцией производителя.
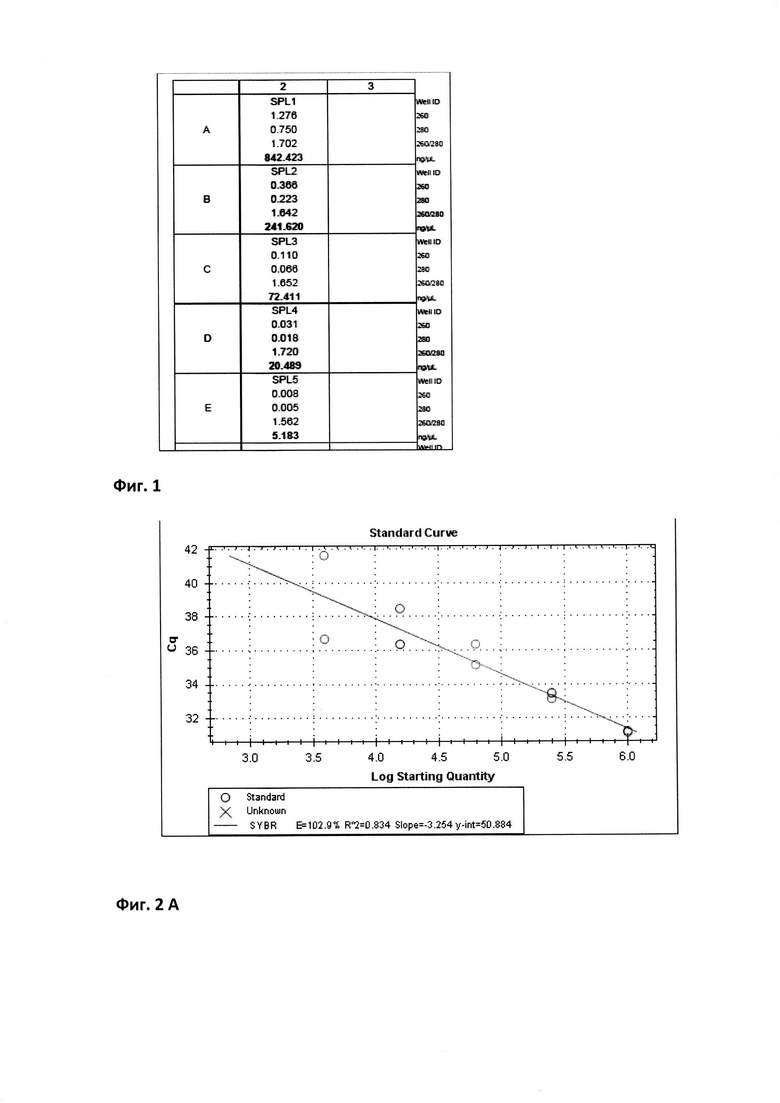
Контроль количества полученной мРНК осуществлялся при помощи спектрофотометра длине волны 260 нм; в нашем случае - мультирежимный имиджер марки Cytation 5 imaging reader (Biotek). Набор iScript cDNA Synthesis Kit (Bio-Rad) используется для следующего этапа - синтеза кДНК в реакции обратной транскрипции. Для этого в эппендорф вносятся и смешиваются: 9 мкл воды свободной от нуклеаз (Nuclease-free water); 4 мкл 5х iScript Reaction Mix; 1 мкл iScript Reverse Transcriptase; 5 мкл мРНК; 1 мкл RNase Inhibitor (Qiagen).
Общий объем смеси (20 мкл) обрабатывается по протоколу производителя набора iScript cDNA Synthesis Kit на амплификаторе, в нашем случае используется CFX96 Touch (Bio-Rad).
Амплификация кДНК гена VEGF-A проводится так же с помощью термоциклера. Флуоресценция регистрируется за счет добавления в реакционную смесь интеркалирующего красителя SYBR Green I (Евроген).
Реакционная смесь для ПЦР в объеме 15 мкл содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер VEGF-A_F (концентрация 1 мкМ; Mw 64,51 г/моль) 1 мкл
- обратный праймер VEGF-A_R (концентрация 1 мкМ; Mw 59,36 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Для амплификации используются праймеры VEGF -А
F-5'-GGGAGATGAGCTTCCTACAGC-3'
R-5'-CCTTGCCCTTTCCTCGAACT-3'
Амплификация кДНК гена GAPDH проводится в объеме 15 мкл, реакционная смесь содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDH_1F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_1R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
Для амплификации используются олигонуклеотиды GAPDH
F-5'-GATTGTCAGCAACGCATCCTG-3'
R-5'-CTCCACAATGCCGAAGTGGT-3'
Протокол реакции:
- первичная денатурация- 3 минуты 95°С
- амплификационный цикл (×45)
- денатурация - 15 секунд 95°С
- отжиг праймеров - 20 секунд 63,2°С
- элонгация и съем флуоресцентного сигнала - 30 секунд 72°С
Дополнительный контроль амплификации осуществляют методом электрофореза в 2% агарозном геле, куда вносят 10 мкл ампликонов смешанных с 6-кратным буфером для загрузки.
Анализ результатов ОТ-ПЦР.
Для каждой из тест-проб при помощи программы Bio-Rad CFX Manager определяется пороговый цикл (Q), при котором количество кДНК во всех реакционных пробирках достигало одинаковой пороговой величины (задавалась программным обеспечением). Воспроизводимость реакции амплификации исследуемого и референсного гена оценивалась постановкой каждой пробы в тройном повторе, где разница между пороговыми циклами составляет не более 0,5 цикла.
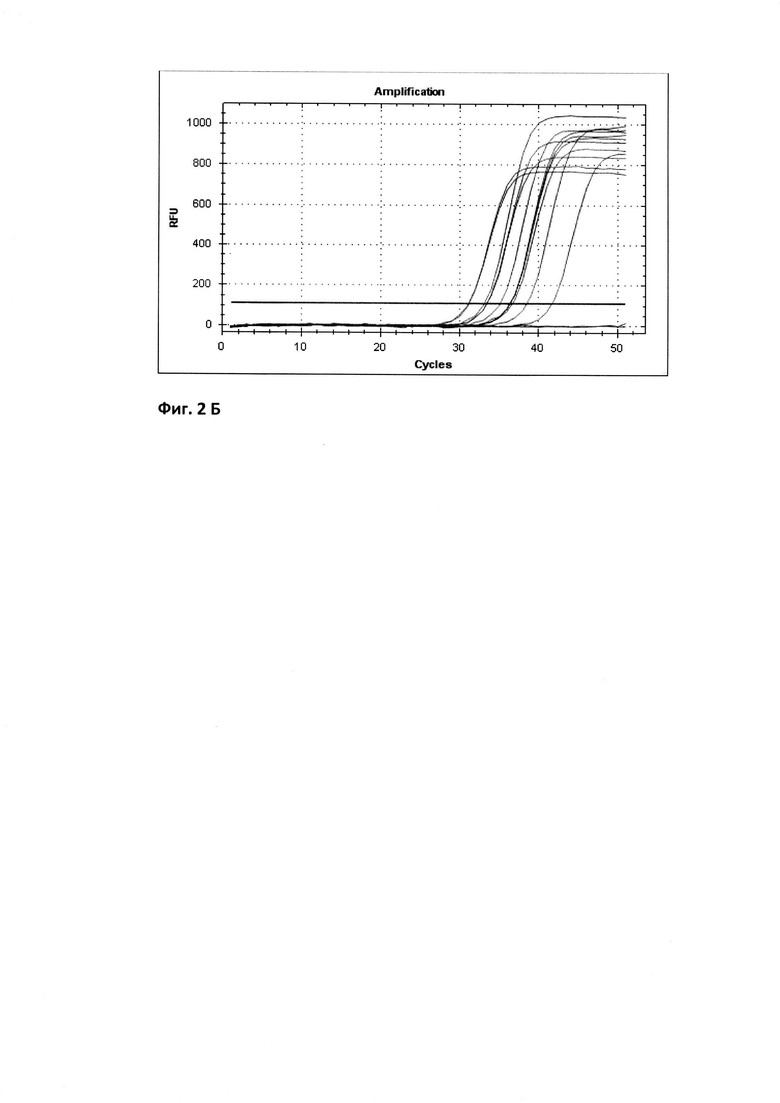
Для определения реакционной эффективности праймеров репрезентативный образец пятикратно последовательно разводился в 4 раза, с последующим измерением количества кДНК при каждом разведении на спектрофотометре (например, Cytation 5 imaging reader (Biotek) (фиг. 1 Концентрация кДНК (нг/мкл) в репрезентативной пробе пятикратно последовательно разведенной в 4 раза) при длине волны 260 нм. Эффективность амплификации образцов, отраженная в калибровочной кривой, рассчитывалась в программе Bio-Rad CFX Manager согласно формулам:
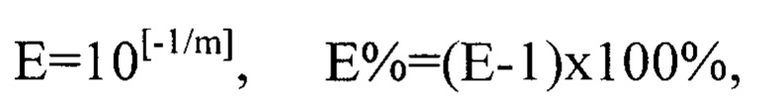 где Е-эффективность, m - наклон стандартной кривой.
где Е-эффективность, m - наклон стандартной кривой.
Уравнение калибровочной кривой представляет логарифмическую зависимость значения показателя порогового цикла (Ct) пяти образцов разведения репрезентативной пробы от количества к ДНК в каждом образце. На фиг. 2 приведены график калибровочной кривой, который показывает зависимость значений Ct, полученных при амплификации пяти стандартных образцов, и значений lg (Х0) этих образцов (А) и график изменения интенсивности свечения репрезентативной пробы при амплификации гена VEGF-A для 5 образцов с последовательно уменьшающейся в 4 раза концентрацией к ДНК (Б).
Анализ результатов исследования выполнен методом расчета относительной величины (АС) исследуемого образца (VEGF-A) по формуле:

Где:
Е - эффективность набора праймеров и зондов.
Ct (контроля) - среднее значение Ct для нормировочного гена (GAPDH)
Ct (образца) - среднее значение Q исследуемого образца (VEGF-A)
Нормированная экспрессия (ААС) - относительная величина экспрессии исследуемого гена нормированная к величине экспрессии референсного гена в образце биоматериала, вычислялась по формуле:
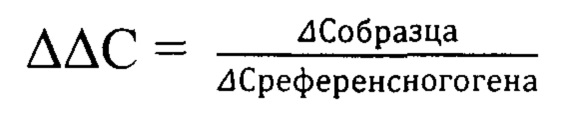
Полученное в ходе расчетов значение ААС использовано для оценки экспрессии гена VEGF-A.
Таким образом, предложенный способ определения уровня экспрессии гена, кодирующего VEGF-A кролика Oryctolagus cuniculus методом Г1ЦР в режиме реального времени и набор для определения позволяют при помощи доступных и экономичных реагентов, используя один референсный ген, сделать вывод о характере экспрессируемого профиля VEGF-A в исследуемой ткани.
VEGF-А_F gggagatgagcttcctacagc
VEGF-А_R ccttgccctttcctcgaact
GAPDH_F gattgtcagcaacgcatcctg
GAPDH_R ctccacaatgccgaagtggt
Изобретение относится к биотехнологии, а именно к иммунологии и молекулярной биологии, и касается способа определения уровня экспрессии гена, кодирующего VEGF-A в тканях глаза кролика (Oryctolagus cuniculus), с помощью ОТ-ПЦР в режиме реального времени и набора для его определения. Изобретение обеспечивает получение протокола пробоподготовки, постановки и расчетов результатов ОТ-ПГДР с оптимально подобранным для этого комплектом реагентов, позволяющих с высокой точностью воспроизвести реакцию в условиях ПЦР-лабораторий, для дальнейшего использования в экспериментальной офтальмологии, в доклинических исследованиях медицинских изделий и, в частности, при испытании противовоспалительных лекарственных средств. 2 н.п. ф-лы, 3 ил., 1 пр.
1. Способ определения уровня экспрессии гена, кодирующего VEGF-A в тканях глаза кролика (Oryctolagus cuniculus), методом ПЦР в режиме реального времени, отличающийся тем, что включает:
а) использование одного референсного гена GAPDH для нормирования полученных результатов,
б) использование оригинальных пар праймеров для гена VEGF-A кролика Oryctolagus cuniculus
VEGF-A_F-5'-GGGAGATGAGCTTCCTACAGC-3'
VEGF-A_R-5'-CCTTGCCCTTTCCTCGAACT-3'
и для гена GAPDH кролика Oryctolagus cuniculus
GAPDH_F-5'-GATTGTCAGCAACGCATCCTG-3'
GAPDH_R-5'-CTCCACAATGCCGAAGTGGT-3',
в) гомогенизацию тканей глаза в течение 90 секунд при скорости 45000 об/мин,
г) выделение мРНК из образцов с последующим добавлением к пробе 1 мкл ингибитора РНКаз,
д) синтез кДНК методом обратной транскрипции,
е) амплификацию исследуемого и референсного генов при помощи ПЦР в режиме реального времени с фиксацией флуоресценции при помощи интеркалирующего красителя SYBR Green (Евроген),
ж) определение относительного количества гена VEGF-A и референсного гена GAPDH при помощи калибровочной кривой, построенной при амплификации образца с известной концентрацией ДНК, пятикратно разведенного в 4 раза, эффективность амплификации, определяемая уравнением калибровочной кривой, используется в расчетах относительной величины и нормированной экспрессии исследуемого гена.
2. Набор для определения уровня экспрессии гена, кодирующего VEGF-A кролика Oryctolagus cuniculus, по п. 1, включающий:
а) оригинальные олигонуклеотидные праймеры для гена VEGF-A кролика Oryctolagus cuniculus
VEGF-A_F-5'-GGGAGATGAGCTTCCTACAGC-3'
VEGF-A_R-5'-CCTTGCCCTTTCCTCGAACT-3',
б) оригинальные олигонуклеотидные праймеры для гена GAPDH кролика Oryctolagus cuniculus
GAPDH_F-5'-GATTGTCAGCAACGCATCCTG-3'
GAPDH_R-5'-CTCCACAATGCCGAAGTGGT-3',
в) реакционную смесь ПЦР в режиме реального времени для амплификации гена VEGF-A, содержащую:
- воду дистиллированную 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер VEGF-A_F (концентрация 1 мкМ; Mw 64,51 г/моль) 1 мкл
- обратный праймер VEGF-AR (концентрация 1 мкМ; Mw 59,36 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан),
г) реакционную смесь ПЦР в режиме реального времени для амплификации гена GAPDH, содержащую:
- воду дистиллированную 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDH_F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq-полимераза (0,5 ед./мкл) 0,3 мкл (Биосан),
д) протокол реакции амплификации генов VEGF-A и GAPDH, включающий:
- первичную денатурацию - 3 минуты 95°С
- амплификационный цикл (×45)
- денатурацию - 15 секунд 95°С
- отжиг праймеров - 20 секунд 63,2°С
- элонгацию и съем флуоресцентного сигнала - 30 секунд 72°С.
| Средство для лечения заболевания, сопровождающегося отеком макулы вследствие повышенной экспрессии VEGF-A | 2016 |
|
RU2669787C2 |
| Scaldaferri F | |||
| et al | |||
| VEGF-A links angiogenesis and inflammation in inflammatory bowel disease pathogenesis, Gastroenterology, 2009 | |||
| Т | |||
| Регулятор для ветряного двигателя в ветроэлектрических установках | 1921 |
|
SU136A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для предохранения паровых котлов, экономайзеров, кипятильников и т.п. приборов от разъедания воздухом, растворенным в питательной воде | 1918 |
|
SU585A1 |
| Dziobek K | |||
| et al | |||
| Changes in the expression profile of VEGF-A, VEGF-B, VEGFR-1, VEGFR-2 in different grades of endometrial cancer, Current pharmaceutical | |||
Авторы
Даты
2021-12-07—Публикация
2021-03-09—Подача