Изобретение относится к области медицины, а именно, иммунологии, патофизиологии и молекулярной биологии, и касается способа определения уровня экспрессии гена, кодирующего белок PEDF, в тканях кролика (Oryctolagus cuniculus), с помощью ОТ-ПЦР в режиме реального времени и может быть использовано в экспериментальной офтальмологии, а также на этапе доклинических исследований.
PEDF (Pigment Epithelium Derived Factor) - фактор, происходящий из пигментного эпителия сетчатки, представляет собой гликопротеин, который принадлежит к суперсемейству серпинов - ингибиторов сериновых протеиназ, является цитокином, обладающим помимо антиангиогенного действия, выраженной нейротрофической активностью. Показано, что PEDF поддерживает нормальное развитие фоторецепторов и экспрессию в них зрительного пигмента после гибели ретинального пигментного эпителия (РПЭ), оказывает протективное действие на фоторецепторы сетчатки при световом и глутаматном повреждении, способствует выживанию нейронов в условиях окислительного стресса, вызванного добавлением перекиси водорода in vitro.
Известно, что цитокины обладают паракринным действием, синтезируются и утилизируются клетками, находящимися в непосредственной близости друг к другу. В связи с тем, что период жизни цитокинов очень короткий (практически сразу после выделения клетками-продуцентами молекулы этих медиаторов связываются с рецепторами), выполнить точные измерения их концентрации даже используя высокочувствительные технологии мультиплексного анализа (Luminex, хМАР, СВА) непосредственно in situ, в месте продукции, часто бывает затруднительно.
Перспективным и уже широко востребованным методом, позволяющим провести молекулярную оценку состояния тканей и органов, является полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) [Reverse-transcription PCR (RT-PCR) - Bachman J. - Methods Enzymol. 2013;530:67-74. doi: 10.1016/В978-0-12-420037-1.00002-6].
Постановка ОТ-ПЦР включает несколько основных этапов: выделение молекул мРНК из биоматериала, обработку ДНКазой проб с мРНК, синтез молекул кДНК при помощи обратной транскриптазы, определение уровня экспрессии исследуемого гена методом ПНР, проверку специфичности ПЦР-продукта с помощью электрофореза и анализ полученных результатов.
Количественный анализ экспрессии генов методом ОТ-ПЦР предполагает предварительный подбор референсных генов или генов домашнего хозяйства (housekeeping gene), которые используются в качестве контроля для нормализации полученных данных. Наиболее стабильной экспрессией обладают гены гипоксантин фосфорибозилтрансферазы (HPRT), глицеральдегид 3-фосфат дегидрогеназы (GAPDH), b-актина [Foss D.L., Baarsch М.J., Murtaugh М.Р. Regulation of hypoxanthine phosphoribosyl transferase, glyceraldehyde-3-phosphate dehydrogenase and beta-actin mRNA expression in porcine immune cells and tissues. // Anim Biotechnol. - 1998. - N1. -P. 67-78], а так же субъединицы А сукцинатдегидрогеназы [Nachar W., Busseuil D., Shi Y., Mihalache-Avram Т., Mecteau M., Rheaume E., Tardif J.C. Optimisation of reference genes for gene-expression analysis in a rabbit model of left ventricular diastolic dysfunction. PLoS One. 2014 Feb 18;9(2)].
Способ оценки уровня экспрессии гена, кодирующего PEDF в эпителии роговицы кроликов, описан в работе Mohan R.R. и соавт. в 2011 г. [Mohan R.R., ToveyJ. С.K., SharmaA., Schultz G.S., Cowden J.W., Tandon A. Targeted decorin gene therapy delivered with adeno-associated virus effectively retards corneal neovascularization in vivo 2011; 6(10): e26432. doi:10.1371/journal. pone. 0026432. Epub 2011 Oct 19]. Авторы изучали влияние декорина, доставляемого в строму роговицы кролика при помощи аденовируса 5 типа, на корнеальный ангиогенез. В работе представлены сведения о наборах, которые использовались для экстракции РНК из тканей глаза кролика и последующего синтеза кДНК, последовательности олигонуклеотидных праймеров к исследуемым и референсному генам, протокол реакции, однако состав реакционной смеси описан не полностью - нет данных о количестве Tag-полимеразы и методе детекции результатов реакции. Метод полуколичественной ПЦР, используемый авторами, подразумевает использование препаратов с высокой степенью очистки, содержащих заведомо высокое количество нуклеиновой кислоты и требующем соблюдения «идеальных» условий для постановки реакции.
Оценка уровня экспрессии гена, кодирующего PEDF в тканях глаза кроликов описана также в публикации, посвященной исследованию сочетанного влияния PEDF и докозагексаеновой кислоты на воспалительный процесс в роговице и дегенеративные изменения нервов, вызванных вирусом герпеса 1 типа (ВПГ 1 типа) [Не J., Neumann D., KakazuA., Pham Т.L., Musarrat F., Cortina M. S., Bazan H.E. P.// PEDF plus DHA modulate inflammation and stimulate nerve regeneration after HSV-1 infection. - 2017 Aug; 161:153-162]. Авторы работы приводят олигонуклеотидные последовательности праймеров к исследуемым и референсному генам, однако не раскрывают детали постановки - протокол реакции, количественный и качественный состав реакционной смеси, а также способ подбора оптимальной температуры отжига праймеров. Известен способ определения уровня экспрессии PEDF у мышей [Falero-Perez J., Park S.Y., Sorenson С.М., Sheibani N. PEDF expression affects retinal endothelial cell proangiogenic properties through alterations in cell adhesive mechanisms. 2017 Oct 1;313(4): C405-C420. Epub 2017 Jul 26.], где представлены последовательности олигонуклеотидных праймеров к исследуемому и референсному генам, но не раскрыты детали постановки, а именно: состав реакционной смеси. Использование мышей для моделирования опыта, в том числе в офтальмологии, широко распространено, однако малый размер глазного яблока не позволяет в полной мере произвести дифференцированную сепарацию тканей и получить качественный биоматериал для анализа.
Задачей настоящего изобретения является разработка простого, доступного, легко воспроизводимого и экономичного способа оценки экспрессии гена PEDF в тканях глаза кроликов.
Техническим результатом является получение протокола пробоподготовки, постановки и расчетов результатов ОТ-ПЦР с оптимально подобранным для этого комплектом реагентов, позволяющих с высокой точностью воспроизвести реакцию в условиях ПЦР-лабораторий, для дальнейшего использования в экспериментальной офтальмологии, в доклинических исследованиях медицинских изделий и, в частности, для оценки состояния барьерных систем глаза и воздействия на них лекарственных препаратов, разрабатываемых для лечения глазных заболеваний.
Технический результат достигается за счет:
1) Подбора оригинальных пар праймеров для PEDF и GAPDH, обеспечивающих специфическую амплификацию без образования побочных структур.
2) Определения компонентов реакционной смеси - концентраций пары прямого и обратного праймеров, установки оптимальных температур элонгации, денатурации и отжига (методом градиента) и количества циклов амплификации.
3) Использования одного нормировочного гена GAPDH, как наиболее универсального, стабильно экспрессируемого практически всеми клетками организма.
4) Подбора наиболее доступных и экономичных реагентов, их минимального количества без потери эффективности реакции.
5) Снижения временных затрат для каждого этапа постановки.
При выборе пар праймеров в электронной базе данных NCBI Gen Bank с использованием программного обеспечения: Primer-BLAST, OligoCalc:
Oligonucleotide Properties Calculator и Standard Nucleotide BLAST отбирались наиболее перспективные последовательности олигонуклеотидов для исследуемых генов. Выбранные последовательности праймеров синтезировались на автоматическом синтезаторе ДНК («Евроген»). В результате были получены 2 пары олигонуклеотидов для измерения экспрессии GAPDH и 4 пары олигонуклеотидов для измерения экспрессии PEDF.


Заданные параметры конструкции (последовательность и молекулярная масса) праймеров требуют индивидуального подбора количества вспомогательных компонентов реакции, а также определения параметров постановки амплификации на всех этапах реакции (элонгация, отжиг и т.д.).
Для определения оптимальных условий проведения реакции осуществлялся ряд постановок с разной компоновкой реагентов по концентрации и объему, позволившим в итоге опытным путем выбрать наиболее удачный и эффективный вариант. Температура отжига олигонуклеотидных праймеров и продолжительность этапов реакции определялись в режиме выполнения температурного градиента, где ряд пробирок с одинаковым содержимым подвергался одновременной амплификации, но с индивидуальной температурой отжига для каждой пробы, отличающихся между собой на 0,5°С.
Для проведения ОТ-ПЦР использовался термоциклер с оптическим блоком для детекции флуоресценции в режиме реального времени (амплификатор) CFX96 Touch (Bio-Rad). Реакция проводилась в течение 2 часов, одновременно фиксировался флуоресцентный сигнал, полученные данные, обработанные в программе Bio-Rad CFX Manager, в дальнейшем представлялись в таблицах и графиках.
Эффективность реакции амплификации определялась построением калибровочной кривой.
Изобретение осуществляется следующим образом.
С помощью программного обеспечения Primer-BLAST, OligoCalc: Oligonucleotide Properties Calculator и Standard Nucleotide BLAST подобраны 2 пары праймеров для измерения экспрессии GAPDH и 4 пары олигонуклеотидов для измерения экспрессии PEDF. Ткани кролика О. cuniculus гомогенизируют в течение 90 секунд при скорости 45000 об./мин., с последующим выделением мРНК из образцов. В пробы с полученной мРНК добавляют 1 мкл ингибитора РНКаз, а затем синтезируют кДНК методом обратной транскрипции.
Для амплификации исследуемого и референсного генов при помощи ПЦР в режиме реального времени используют следующие пары праймеров:
GAPDH_F -5'-GATTGTCAGCAACGCATCCTG-3'
GAPDH_R -5'-CTCCACAATGCCGAAGTGGT-3'
PEDF_F -5'-GAGAGGAAGCTGCGGATAAAA-3'
PEDF_R -5'-GGTCCTCTCCTCATCCAAGT-3'
Реакционная смесь для амплификации гена PEDF содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер PEDF _F (концентрация 1 мкМ; Mw 65,57 г/моль) 1 мкл
- обратный праймер PEDF_R (концентрация 1 мкМ; Mw 59,85 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан).
Реакционная смесь для амплификации гена GAPDH содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDHJ_F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан).
Протокол реакции амплификации генов PEDF и GAPDH, включает:
- первичная денатурация- 3 минуты 95°С
- амплификационный цикл (х50)
- денатурация - 15 секунд 95°С
- отжиг праймеров - 20 секунд 57°С
- элонгация и съем флуоресцентного сигнала - 30 секунд 72°С.
Эффективность реакции ОТ-ПЦР определяется уравнением калибровочной кривой, построенной при амплификации образца с известной концентрацией ДНК пятикратно разведенного в 4 раза. Значение эффективности используется в формуле расчета нормированной экспрессии исследуемого гена.
Пример
Материал исследования - 16 образцов тканевого комплекса сетчатка - хориоидея кроликов, 12 из которых были получены при моделировании атрофии ретинального пигментного эпителия. Образцы забираются в чистые эппендорфы и замораживаются в камере глубокой заморозки при температуре -70°С.
Для получения мРНК замороженная ткань глаза предварительно доводится до однородного дисперсного состояния на гомогенизаторе (например, Silent Crusher S (Heidolph) в течение 90 секунд при скорости 45000 об/мин. мРНК из образцов ткани выделяется по протоколу (Part 1) коммерческого набора RNeasy Mini Kit (Qiagen). Затем к образцам добавляется 1 мкл ингибитора РНКаз RNase Inhibitor (Qiagen) и обрабатывается ДНКазой DNase Max Kit (Qiagen) в соответствии с инструкцией производителя.
Контроль количества полученной мРНК осуществлялся при помощи спектрофотометра длине волны 260 нм; в нашем случае - мультирежимный имиджер марки Cytation 5 imaging reader (Biotek). Набор iScript cDNA Synthesis Kit (Bio-Rad) используется для следующего этапа - синтеза к ДНК в реакции обратной транскрипции. Для этого в эппендорф вносятся и смешиваются: 9 мкл воды свободной от нуклеаз (Nuclease-free water); 4 мкл 5х iScript Reaction Mix; 1 мкл iScript Reverse Transcriptase; 5 мкл мРНК; 1 мкл RNase Inhibitor (Qiagen).
Общий объем смеси (20 мкл) обрабатывается по протоколу производителя набора iScript cDNA Synthesis Kit на амплификаторе, в нашем случае используется CFX96 Touch (Bio-Rad).
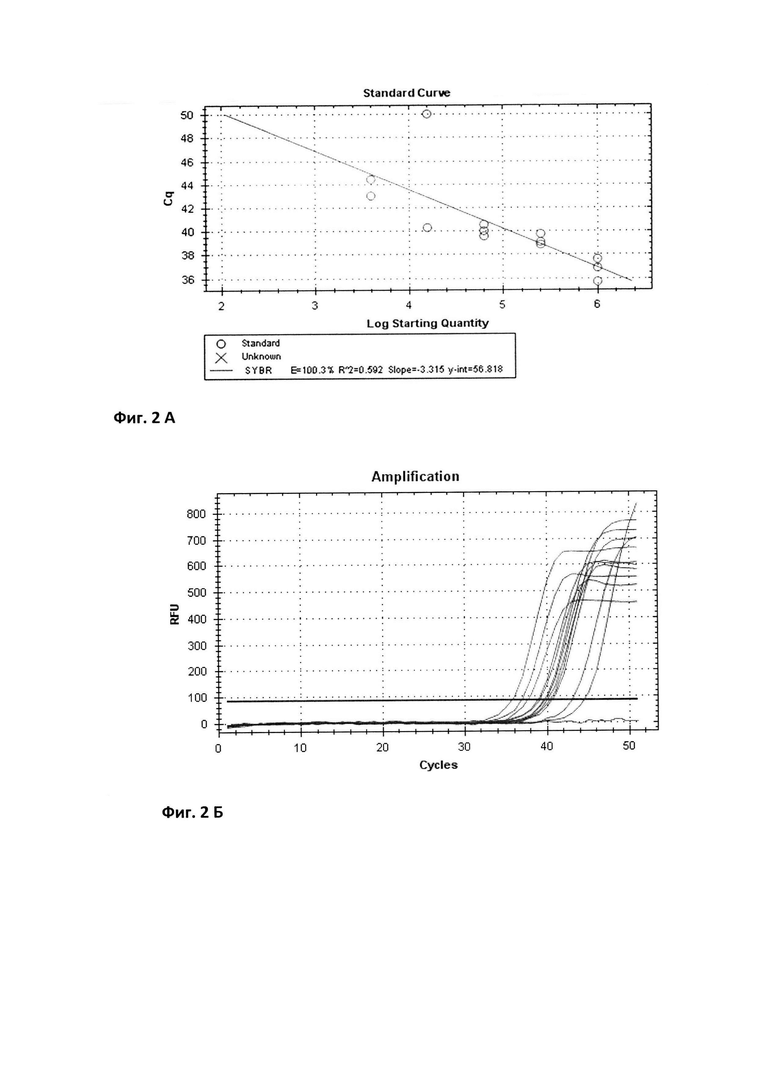
Амплификация кДНК гена PEDF проводится так же с помощью термоциклера. Флуоресценция регистрируется за счет добавления в реакционную смесь интеркалирующего красителя SYBR Green I (Евроген).
Реакционная смесь для ПЦР в объеме 15 мкл содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер PEDF_F (концентрация 1 мкМ; Mw 65,57 г/моль) 1 мкл
- обратный праймер PEDF_R (концентрация 1 мкМ; Mw 59,85 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан).
Для амплификации используются праймеры PEDF
F- 5'- GAGAGGAAGCTGCGGATAAAA -3'
R- 5'- GGTCCTCTCCTCATCCAAGT -3'
Амплификация кДНК гена GAPDH проводится в объеме 15 мкл, реакционная смесь содержит:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDH_F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан).
Для амплификации используются олигонуклеотиды GAPDH
F- 5 '-GATTGTC AGC AACGC ATCCTG-3'
R- 5'-СТССACAATGCCGAAGTGGT -3'
Протокол реакции:
первичная денатурация - 3 минуты 95°С
- амплификационный цикл (х50)
- денатурация - 15 секунд 95°С
- отжиг праймеров - 20 секунд 57°С
- элонгация и съем флуоресцентного сигнала - 30 секунд 72°С.
Дополнительный контроль амплификации осуществляют методом электрофореза в 2% агарозном геле, куда вносят 10 мкл ампликонов смешанных с 6-кратным буфером для загрузки.
Анализ результатов ОТ-ПЦР.
Для каждой из тест-проб при помощи программы Bio-Rad CFX Manager определяется пороговый цикл (Ct), при котором количество кДНК во всех реакционных пробирках достигало одинаковой пороговой величины (задавалась программным обеспечением). Воспроизводимость реакции амплификации исследуемого и референсного гена оценивалась постановкой каждой пробы в тройном повторе, где разница между пороговыми циклами составляет не более 0,5 цикла.
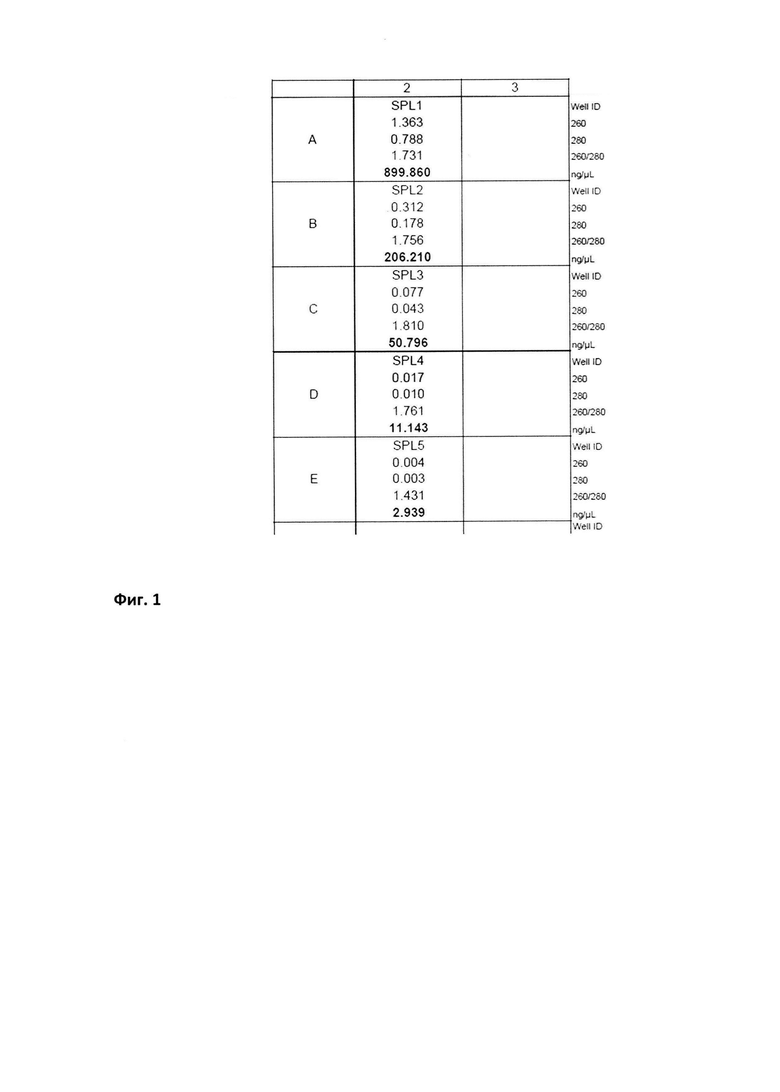
Для определения реакционной эффективности праймеров репрезентативный образец пятикратно последовательно разводился в 4 раза, с последующим измерением количества кДНК при каждом разведении на спектрофотометре (например, Cytation 5 imaging reader (Biotek) (фиг. 1 Концентрация кДНК (нг/мкл) в репрезентативной пробе, пятикратно последовательно разведенной в 4 раза) при длине волны 260 нм. Эффективность амплификации образцов, отраженная в калибровочной кривой, рассчитывалась в программе Bio-Rad CFX Manager согласно формулам:
E=10[-1/m], Е%=(Е-1)×100%,
где Е-эффективность, m- наклон стандартной кривой.
Уравнение калибровочной кривой представляет логарифмическую зависимость значения показателя порогового цикла (Ct) пяти образцов разведения репрезентативной пробы от количества к ДНК в каждом образце. На фиг. 2 приведены график калибровочной кривой, который показывает зависимость значений Ct, полученных при амплификации пяти стандартных образцов, и значений lg (Хo) этих образцов (А) и график изменения интенсивности свечения репрезентативной пробы при амплификации гена PEDF для 5 образцов с последовательно уменьшающейся в 4 раза концентрацией к ДНК (Б).
Анализ результатов исследования выполнен методом расчета относительной величины (АС) исследуемого образца (PEDF) по формуле:
ΔC=E (Сt (контроля)-Ct(образца))
Где:
Е- эффективность набора праймеров и зондов. Ct(контроля) - среднее значение Ct для нормировочного гена (GAPDH) Ct (образца) - среднее значение Ct исследуемого образца (PEDF) Нормированная экспрессия (ΔΔДС) - относительная величина экспрессии исследуемого гена, нормированная к величине экспрессии референсного гена в образце биоматериала, вычислялась по формуле:
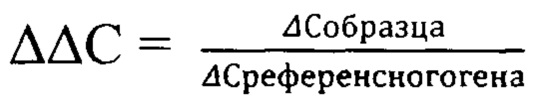
Полученное в ходе расчетов значение ΔΔС использовано для оценки экспрессии гена PEDF.
Таким образом, предложенный способ определения уровня экспрессии гена, кодирующего PEDF кролика Oryctolagus cuniculus методом ПЦР в режиме реального времени и набор для определения позволяют при помощи доступных и экономичных реагентов, используя один референсный ген, сделать вывод о характере экспрессируемого профиля PEDF в исследуемой ткани.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения уровня экспрессии гена, кодирующего ZO-1 в тканях глаза кролика Oryctolagus cuniculus и набор для его определения | 2021 |
|
RU2766186C1 |
| Способ определения уровня экспрессии гена, кодирующего CCL-2 в тканях глаза кролика Oryctolagus cuniculus, и набор для его определения | 2020 |
|
RU2750940C1 |
| Способ определения уровня экспрессии гена, кодирующего IL-18 в тканях глаза кролика Oryctolagus cuniculus, и набор для его определения | 2020 |
|
RU2745323C1 |
| Способ определения уровня экспрессии гена, кодирующего VEGF-A в тканях глаза кролика Oryctolagus cuniculus, и набор для его определения | 2021 |
|
RU2761339C1 |
| Способ определения уровня экспрессии гена, кодирующего 1L-1β в тканях глаза кролика (Oryctolagus cuniculus), и набор для его осуществления | 2019 |
|
RU2731062C1 |
| Количественный метод определения экспрессии аллелей GNAO1 здоровой формы и с мутацией c.607 G>A | 2021 |
|
RU2777663C1 |
| Количественная оценка соотношения hsa-miR-30c-5/VIM, hsa-miR-28-3p/VIM, hsa-miR-1-3p/ANXA2, hsa-miR-30c-5p/FBN1, hsa-miR-15b-5p/MYL6 tr.v.1, hsa-miR-15b-5p/MYL6 tr.v.2, hsa-miR-185-3p/FLNA, hsa-miR-1-3p/YWHAZ, hsa-miR-30c-5p/YWHAZ и hsa-miR-654-3p/FGA в плацентарной площадке женщин в день родоразрешения на сроке более 34 недель гестации как способ дифференциальной диагностики синдрома задержки развития плода, преэклампсии и синдрома маловесного к сроку гестации плода | 2021 |
|
RU2771205C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ЭКСПРЕССИИ ХИМЕРНОГО ГЕНА Trim5a | 2015 |
|
RU2592675C1 |
| Способ диагностики светлоклеточного почечно-клеточного рака | 2016 |
|
RU2643586C1 |
| СПОСОБЫ ОПРЕДЕЛЕНИЯ ВОСПРИИМЧИВОСТИ ПАЦИЕНТА К ВНУТРИБОЛЬНИЧНОЙ ИНФЕКЦИИ И СОСТАВЛЕНИЯ ПРОГНОЗА РАЗВИТИЯ СЕПТИЧЕСКОГО СИНДРОМА | 2014 |
|
RU2663724C2 |
Предложенная группа изобретений относится к области медицины, в частности к иммунологии, патофизиологии и молекулярной биологии. Предложены способ и набор для определения уровня экспрессии гена, кодирующего PEDF кролика Oryctolagus cuniculus методом ПЦР в режиме реального времени. Предложенная группа изобретений обеспечивает получение протокола пробоподготовки, постановки и расчетов результатов ОТ-ПЦР с оптимально подобранным для этого комплектом реагентов, позволяющих с высокой точностью воспроизвести реакцию в условиях ПЦР-лабораторий для дальнейшего использования в экспериментальной офтальмологии, в доклинических исследованиях медицинских изделий и, в частности, для оценки состояния барьерных систем глаза и воздействия на них лекарственных препаратов, разрабатываемых для лечения глазных заболеваний. 2 н.п. ф-лы, 2 табл., 1 пр., 2 ил.
1. Способ определения уровня экспрессии гена, кодирующего PEDF в тканях глаза кролика (Oryctolagus cuniculus) методом ПЦР в режиме реального времени, отличающийся тем, что включает:
а) использование одного референсного гена GAPDH для нормирования полученных результатов,
б) подбор оригинальных пар праймеров для гена PEDF кролика Oryctolagus cuniculus
PEDF_F- 5'- GAGAGGAAGCTGCGGATAAAA -3'
PEDF_R- 5'- GGTCCTCTCCTCATCCAAGT -3'
и для гена GAPDH кролика Oryctolagus cuniculus
GAPDH_F- 5'- GATTGTCAGCAACGCATCCTG -3'
GAPDH_R- 5'- СTCCACAATGCCGAAGTGGT -3',
в) гомогенизацию тканей глаза в течение 90 секунд при скорости 45000 об/мин;
г) выделение мРНК из образцов с последующим добавлением к пробе 1 мкл ингибитора РНКаз,
д) синтез кДНК методом обратной транскрипции,
е) амплификацию исследуемого и референсного генов при помощи ПЦР в режиме реального времени с фиксацией флуоресценции при помощи интеркалирующего красителя SYBR Green (Евроген),
ж) определение относительного количества гена PEDF и референсного гена GAPDH при помощи калибровочной кривой, построенной при амплификации образца с известной концентрацией ДНК пятикратно разведенного в 4 раза, эффективность амплификации, определяемая уравнением калибровочной кривой, используется в расчетах относительной величины и нормированной экспрессии исследуемого гена.
2. Набор для определения уровня экспрессии гена, кодирующего PEDF кролика Oryctolagus cuniculus по п. 1, включающий:
а) оригинальные олигонуклеотидные праймеры для гена PEDF кролика Oryctolagus cuniculus
PEDF_F- 5'- GAGAGGAAGCTGCGGATAAAA -3'
PEDF_R- 5'- GGTCCTCTCCTCATCCAAGT -3'
б) оригинальные олигонуклеотидные праймеры для гена GAPDH кролика Oryctolagus cuniculus
GAPDH_F -5'- GATTGTCAGCAACGСATCCTG -3'
APDH_R -5'- CTCCACAATGCCGAAGTGGT -3'
в) реакционную смесь ПЦР в режиме реального времени для амплификации гена PEDF, содержащую:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер PEDF_F (концентрация 1 мкМ; Mw 65,57 г/моль) 1 мкл
- обратный праймер PEDF_R (концентрация 1 мкМ; Mw 59,85 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
г) реакционную смесь ПЦР в режиме реального времени для амплификации гена GAPDH, содержащую:
- вода дистиллированная 9,4 мкл
- буфер 1,5 мкл (Евроген)
- прямой праймер GAPDH_F (концентрация 1 мкМ; Mw 63,86 г/моль) 1 мкл
- обратный праймер GAPDH_R (концентрация 1 мкМ; Mw 60,83 г/моль) 1 мкл
- dNTP 0,5 мкл
- кДНК 1 мкл
- SYBR Green I [1:25000] 0,3 мкл
- Taq- полимераза (0,5 ед./мкл) 0,3 мкл (Биосан)
д) протокол реакции амплификации генов PEDF и GAPDH, включающий
- первичная денатурация - 3 минуты 95°С
- амплификационный цикл (х50)
- денатурация - 15 секунд 95°С
- отжиг праймеров - 20 секунд 57°С
- элонгация и съем флуоресцентного сигнала - 30 секунд 72°С.
| МАРКЕРНЫЕ ГЕНЫ ДЛЯ ПРИМЕНЕНИЯ В ИДЕНТИФИКАЦИИ ФЕНОТИПИЧЕСКОЙ СТАБИЛЬНОСТИ ХОНДРОЦИТОВ И В СКРИНИНГЕ ФАКТОРОВ, ВЛИЯЮЩИХ НА ПРОДУЦИРОВАНИЕ ХРЯЩА | 2007 |
|
RU2508548C2 |
| KR 20130009204 A, 23.01.2013 | |||
| KR 20130009205 A, 23.01.2013 | |||
| BURGER S | |||
| et al | |||
| Pigment Epithelium-Derived Factor (PEDF) Receptors Are Involved in Survival of Retinal Neurons | |||
| Int | |||
| J | |||
| Mol | |||
| Sci | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| PFANDER D | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2022-01-31—Публикация
2021-08-17—Подача