Область техники
Изобретение относится к области генной инженерии и биотехнологии, а именно к направляющим РНК, которые могут быть использованы в системах CRISPR-Cas12 в составе рибонуклеопротеиновых комплексов для выявления (обнаружения, детекции) гена антибиотикоустойчивости blaVIM-2 (металло-бета-лактамаза класс В VIM-2) Pseudomonas aeruginosa, а также к способам получения препаратов рибонуклеопротеинового комплекса CRJSPR/CAS и к самим препаратам.
Изобретение позволяет in vitro выявлять единичные копии гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
Направляющие РНК, описанные в настоящей заявке, могут быть использованы для детекции гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa после проведения специфической амплификации фрагмента ДНК гена blaVIM-2. Амплификация при этом может быть проведена различными способами, среди которых полимеразная цепная реакция (PCR); петлевая изотермическая амплификация (LAMP); геликаза-зависимая амплификация (HDA); рекомбиназа-опосредованная амплификация (RPA); амплификация со смещением цепи (SDA); амплификация, основанная на последовательности нуклеиновых кислот (NASBA); опосредованная транскрипцией амплификация (ТМА); амплификация, опосредованная никирующим ферментом (NEAR); круговая амплификация (RCA) и многие другие виды амплификации.
Направляющие РНК, описанные в настоящей заявке, могут быть использованы для разработки высокочувствительных и высокотехнологичных диагностических систем нового поколения на основе CRISPR технологий для борьбы с распространением антибиотикоустойчивых бактериальных патогенов.
Уровень техники
Для решения эпидемиологических задач по расшифровке вспышек инфекционных болезней, выявления и идентификации возбудителя, а также детекции специфических бактериальных генов необходимы разработка и внедрение в практику работы надзорных и мониторинговых служб современных технологий молекулярной эпидемиологии. Одной из таких технологий является использование элементов генетического редактирования системы CRISPR/CAS. Данная технология развивается достаточно эффективно в отношении создания средств лечения некоторых болезней, несмотря на ряд трудностей, связанных с возникновением непредвиденных мутаций. При углубленных исследованиях в области применения CRISPR/CAS системы, было выяснено, что она может быть использована для тонких диагностических процедур при выявлении возбудителя/ей инфекции у человека, а также их генотипирования.
В 2018 году было показано, что один из ферментов CRISPR системы - Cas12 после распознавания своей целевой ДНК-мишени начинает неспецифически гидролизовать одноцепочечную, а также двухцепочечную ДНК. Такое свойство Cas12 можно использовать в качестве индикатора присутствия определенной мишени, например, генома вируса или бактерии. Исследователи использовали это открытие для создания технологической платформы обнаружения нуклеиновых кислот, известной как DETECTR (DNA Endonuclease Targeted CRISPR Trans Reporter - ДНК-нацеленная эндонуклеаза CRISPR транс репортер). Впервые DETECTR была использована для выявления и генотипирования вируса папилломы человека (HPV). Предложенная платформа объединяет нуклеазу Cas12a, ее направляющую РНК, специфичную к нуклеиновой кислоте HPV, флуоресцентную репортерную молекулу. Технология DETECTR используется для обнаружения целевой ДНК-мишени после предварительной амплификации (Chen JS, Ma Е, Harrington LB, Da Costa M, Tian X, Palefsky JM, Doudna JA. CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity. Science. 2018 Apr 27; 360(6387):436-439).
He менее важным приложением системы CRISPR/CAS является идентификация бактериальных патогенов и детекция специфических бактериальных генов. Так, например, с помощью платформы SHERLOCK (Specific High Sensitivity Enzymatic Reporter UnLOCKing - Специфичное Высокочувствительное Ферментативное Репортерное Разблокирование) удалось корректно генотипировать ряд штаммов Escherichia coli и Pseudomonas aeruginosa при низкой перекрестной реактивности. Кроме того, платформа SHERLOCK использована для дифференциации клинических изолятов Klebsiella pneumoniae с двумя различными генами антибиотикоустойчивости, что открывает значительные перспективы к созданию мультиплексных систем для одновременной идентификации бактериальных патогенов и выявления у них генов антибиотикоустойчивости.
В связи с этим крайне актуальной является задача разработки новых эффективных методик выявления генов антибиотикоустойчивости у бактериальных патогенов, основанных на генетических технологиях, таких как CRISPR/CAS.
В ходе изучения уровня техники были найдены научные статьи, описывающие разработку и получение направляющих РНК для выявления генов антибиотикоустойчивости у бактериальных патогенов с помощью технологии CRISPR/CAS ( V., Rajer, F., Frykholm, K., Nyberg, L.K., Quaderi, S., Fritzsche, J., Kristiansson, E.,
V., Rajer, F., Frykholm, K., Nyberg, L.K., Quaderi, S., Fritzsche, J., Kristiansson, E.,  Т., Sandegren, L., Westerlund, F., 2016. Direct identification of antibiotic resistance genes on single plasmid molecules using CRISPR/Cas9 in combination with optical DNA mapping. Sci. Rep. 6. https://doi.org/10.1038/srep37938; Quan, J., Langelier, C., Kuchta, A., Batson, J., Teyssier, N., Lyden, A., Caldera, S., McGeever, A., Dimitrov, В., King, R., Wilheim, J., Murphy, M., Ares, L.P., Travisano, K.A., Sit, R., Amato, R., Mumbengegwi, D.R., Smith, J.L., Bennett, A., Gosling, R., Mourani, P.M., Calfee, C.S., Neff, N.F., Chow, E.D., Kim, P.S., Greenhouse, В., DeRisi, J.L., Crawford, E.D., 2019. FLASH: a next-generation CRISPR diagnostic for multiplexed detection of antimicrobial resistance sequences. Nucleic Acids Res. 47, e83. https://doi.org/10.1093/nar/gkz418).
Т., Sandegren, L., Westerlund, F., 2016. Direct identification of antibiotic resistance genes on single plasmid molecules using CRISPR/Cas9 in combination with optical DNA mapping. Sci. Rep. 6. https://doi.org/10.1038/srep37938; Quan, J., Langelier, C., Kuchta, A., Batson, J., Teyssier, N., Lyden, A., Caldera, S., McGeever, A., Dimitrov, В., King, R., Wilheim, J., Murphy, M., Ares, L.P., Travisano, K.A., Sit, R., Amato, R., Mumbengegwi, D.R., Smith, J.L., Bennett, A., Gosling, R., Mourani, P.M., Calfee, C.S., Neff, N.F., Chow, E.D., Kim, P.S., Greenhouse, В., DeRisi, J.L., Crawford, E.D., 2019. FLASH: a next-generation CRISPR diagnostic for multiplexed detection of antimicrobial resistance sequences. Nucleic Acids Res. 47, e83. https://doi.org/10.1093/nar/gkz418).
Ближайшим аналогом изобретения является статья https://doi.org/10.1038/srep37938 ( V., Rajer, F., Frykholm, K., Nyberg, L.K., Quaderi, S., Fritzsche, J., Kristiansson, E.,
V., Rajer, F., Frykholm, K., Nyberg, L.K., Quaderi, S., Fritzsche, J., Kristiansson, E.,  Т., Sandegren, L., Westerlund, F., 2016. Direct identification of antibiotic resistance genes on single plasmid molecules using CRISPR/Cas9 in combination with optical DNA mapping. Sci. Rep. 6. https://doi.org/10.1038/srep37938), в которой описывается анализ, основанный на оптическом картировании ДНК отдельных плазмид, несущих гены антибиотикоустойчивости, бактериальных изолятов в наножидкостных каналах, который предоставляет подробную информацию об этих плазмидах, в том числе о наличии/отсутствии в них генов антибиотикоустойчивости. Описанный анализ позволяет идентифицировать гены антибиотикоустойчивости с использованием CRISPR/CAS9 и направляющих РНК, специфических к генам антибиотикоустойчивости (blaCTX-М группа 1, blaCTX-М группа 9, blaNDM и blaKPC). В ходе анализа рибонуклеопротеиновый комплекс CRISPR/CAS9 линеаризует кольцевые плазмиды в районе гена антибиотикоустойчивости, полученные линейные молекулы ДНК идентифицируется с помощью оптического картирования ДНК.
Т., Sandegren, L., Westerlund, F., 2016. Direct identification of antibiotic resistance genes on single plasmid molecules using CRISPR/Cas9 in combination with optical DNA mapping. Sci. Rep. 6. https://doi.org/10.1038/srep37938), в которой описывается анализ, основанный на оптическом картировании ДНК отдельных плазмид, несущих гены антибиотикоустойчивости, бактериальных изолятов в наножидкостных каналах, который предоставляет подробную информацию об этих плазмидах, в том числе о наличии/отсутствии в них генов антибиотикоустойчивости. Описанный анализ позволяет идентифицировать гены антибиотикоустойчивости с использованием CRISPR/CAS9 и направляющих РНК, специфических к генам антибиотикоустойчивости (blaCTX-М группа 1, blaCTX-М группа 9, blaNDM и blaKPC). В ходе анализа рибонуклеопротеиновый комплекс CRISPR/CAS9 линеаризует кольцевые плазмиды в районе гена антибиотикоустойчивости, полученные линейные молекулы ДНК идентифицируется с помощью оптического картирования ДНК.
Предложенный анализ только в перспективе сможет быть применен к образцам с низкой концентрацией ДНК - предложенный способ, описывает проведение анализа с образцами, содержащими около 108 копий плазмидных ДНК, несущих гены антибиотикоустойчивости (60 нг ДНК, плазмидной ДНК размером 67 т.п.н. - 220 т.п.н.). Кроме того, недостатками описанного анализа является необходимость использования дорогостоящего высокотехнологичного оборудования (специализированные нанофлюидные биочипы, инвертированный флуоресцентный микроскоп с увеличением не менее 100×), а также необходимость проведения сложного анализа полученных данных с применением специализированного программного обеспечения.
Исходя из этого, возникает техническая проблема, заключающаяся в необходимости разработки и получения направляющих РНК для выявления единичных копий гена антибиотикоустойчивости blaVIM-2 (металло-бета-лактамаза класс В VIM-2) Pseudomonas aeruginosa in vitro, а также в разработке способов получения препаратов рибонуклеопротеинового комплекса CRISPR/CAS на их основе.
Раскрытие сущности
Предложенная технология перспективна для разнообразных применений, включая количественное определение ДНК/РНК, быструю мультиплексную детекцию экспрессии, другие виды чувствительной детекции, например, выявление загрязнения образцов нуклеиновыми кислотами. Технология основанная на CRISPR/CAS является многофункциональной, устойчивой к ошибкам технологией детекции ДНК, пригодной для быстрой постановки диагнозов, включая инфекционные заболевания, и генотипирования инфекционных агентов и выявление генов антибиотикоустойчивости бактериальных патогенов.
Применение предложенной технологии делает возможным создание диагностических систем нового поколения, которые будут обладать следующими свойствами:
- высокая чувствительность;
- возможность проведения диагностики у постели больного;
- возможность проведения диагностики в полевых условиях без применения специализированного высокотехнологичного оборудования;
- скорость и простота анализа;
- сниженная стоимость анализа;
- отсутствие необходимости оснащения диагностической лаборатории дорогостоящим оборудованием;
- отсутствие необходимости проведения выделения нуклеиновых кислот возбудителя.
Изобретение относится к новым средствам - направляющим РНК, которые могут быть использованы в системах CRISPR-Cas12 для ультрачувствительного выявления, идентификации, обнаружения или детекции гена антибиотикоустойчивости biaVIM-2 Pseudomonas aeruginosa в биологических образцах.
Технической задачей предложенного изобретения является разработка новых средств - направляющих РНК, которые могут быть использованы в системах CRISPR-Cas12 с белками Cas12, например, LbCpf1 из Lachnospiraceae, для ультрачувствительного выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
При осуществлении настоящего изобретения, согласно приведенной в формуле изобретения совокупности существенных признаков, достигается неожиданный технический результат - возможность ультрачувствительного выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa до единичных копий в одной реакции. Изобретение обеспечивает повышение эффективности выявления гена антибиотикоустойчивости biaVIM-2 Pseudomonas aeruginosa с 1-5×105 до 2-3×102 копий/мл. Также предложенное изобретение позволяет увеличить выход продукта реакции, получив желаемую концентрацию финального препарата направляющей РНК, и обеспечивает формирование корректной конформации шпильки, содержащейся в направляющей РНК.
Технический результат достигается за счет:
- разработки молекул направляющих РНК, которые могут быть использованы в системах CRISPR-Cas12 для ультрачувствительного выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, где указанные направляющие РНК выбраны из последовательностей SEQ ID NO: 1-5, способны связываться с целевыми высоко консервативными участками гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, содержат РНК-шпильку, которая распознается РНК-направляемой ДНК-эндонуклеазой LbCpf1 из Lachnospiraceae, с обеспечением выявления единичных копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
- применения РНК-направляемой ДНК-эндонуклеаз LbCpf1 из Lachnospiraceae, полученной согласно способу, разработанному авторами ранее (Патент RU 2707542, 28.03.2019), для создания рибонуклеопротеиновых комплексов (РПК) системы CRISPR/CAS, пригодных для детекции гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa в ультранизких концентрациях (единичные копии).
- разработки набора специфических олигонуклеотидов, выбранных из SEQ ID NO: 6 и SEQ ID NO: 7, для предварительной амплификации фрагмента гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
- оптимизации условий проведения предварительной амплификации фрагмента гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
- определения условий проведения ультрачувствительной детекции гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa и установления последовательности стадий метода.
Направляющие РНК согласно настоящему изобретению соответствуют высоко консервативным фрагментам гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa. Наиболее предпочтительны направляющие РНК, распознающиеся РНК-направляемой ДНК-эндонуклеазой LbCpH из Lachnospiraceae, характеризующиеся, имеющие или содержащие нуклеотидную последовательность, выбранную из:
- SEQ ID NO: 1;
- SEQ ID NO: 2;
- SEQ ID NO: 3;
- SEQ ID NO: 4;
- SEQ ID NO: 5;
- или идентичной любой из них по меньшей мере на 80% - 99,99%,
- или комплементарной любой из них,
- или гибридизующейся с любой из них в строгих условиях.
Специфические олигонуклеотиды для проведения предварительной амплификации фрагмента гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa согласно настоящему изобретению соответствуют высоко консервативному участку гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa. Наиболее предпочтительны олигонуклеотиды, характеризующиеся, имеющие или содержащие нуклеотидную последовательность, выбранную из:
- SEQ ID NO: 6;
- SEQ ID NO: 7;
- или идентичной любой из них по меньшей мере на 80% - 99,99%,
- или комплементарной любой из них,
- или гибридизующейся с любой из них в строгих условиях.
Согласно предложенному изобретению получают рибонуклеопротеиновые комплексы (РПК), состоящие из по меньшей мере одной направляющей РНК и РНК-направляемой ДНК-нуклеазы системы CRISPR/CAS LbCpf1 из Lachnospiraceae, пригодные для использования для выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa в ультранизких концентрациях (единичные копии).
Препараты РПК представляют собой растворы, содержащие направляющую РНК, выбранную из SEQ ID NO: 1-5, объединенную с белком системы CRISPR/CAS (LbCpf1 из Lachnospiraceae) или лиофильно высушенные РПК.
Полученные направляющие РНК могут быть использованы в составе набора для обнаружения гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с инструкцией по применению.
Набор может дополнительно включать компоненты для проведения предварительной амплификации высоко консервативного фрагмента гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, в том числе один или несколько специфических олигонуклеотидов, выбранных из SEQ ID NO: 6 и SEQ ID NO: 7. При этом по меньшей мере одна направляющая РНК в составе набора может находиться в комплексе с белком системы CRISPR/CAS (LbCpf1 из Lachnospiraceae) в одном контейнере или отдельно в разных контейнерах.
Способ получения препарата рибонуклеопротеинового комплекса CRISPR/CAS предусматривает:
(i) синтез направляющей РНК с SEQ ID NO: 1-5,
(ii) объединение CAS-белка семейства CRISPR/CAS LbCpf1 из Lachnospiraceae, в комплекс с по меньшей мере одной направляющей РНК, полученной на стадии (i), и при необходимости
(iii) лиофильную сушку рибонуклеопротеинового комплекса CRISPR/CAS, полученного на стадии (ii),
с получением, таким образом, препарата рибонуклеопротеинового комплекса CRISPR/CAS.
В предложенном способе синтез направляющих РНК может быть проведен методом in vitro транскрипции с последующим переосаждением продуктов реакции in vitro транскрипции из реакционной смеси добавлением хлорида натрия до конечной концентрации 400 тМ и равного объема изопропилового спирта.
Также предложенный способ предусматривает непосредственно перед объединением с CAS-белком прогрев направляющей РНК при 90°С в течение 5 минут и позволяют медленно остыть до комнатной температуры, что обеспечивает формирование корректной конформации шпильки, содержащейся в направляющей РНК.
Предложен препарат рибонуклеопротеинового комплекса CRISPR/CAS для выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, который может быть получен раскрытым в настоящей заявке способом. Препарат содержит CAS-белок семейства CRISPR/CAS LbCpf1 из Lachnospiraceae в комплексе с по меньшей мере одной направляющей РНК с SEQ ID NO: 1-5.
Препарат может быть представлен как в жидкой форме - раствора указанного рибонуклеопротеинового комплекса CRISPR/CAS, так и в виде лиофилизата - лиофильно высушенного порошка указанного рибонуклеопротеинового комплекса CRISPR/CAS.
Предложенная технология позволяет определить единичные копии гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa в биологических образцах пациента, выбранных из жидкости и/или ткани, предположительно содержащих Pseudomonas aeruginosa. Биологическим образцом может быть образец крови, сыворотки или плазмы крови, клеток крови, слюны, мокроты, лимфоидных тканей, тканей кроветворных органов и других биологических материалов от пациента, которые могут быть использованы для анализа на наличие гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
Краткое описание чертежей
Фиг. 1. Визуализация фрагмента гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с 37 по 447 п.о. (размером 411 п.о.) после предварительной амплификации при помощи электрофореза в агарозном геле, где цифрами 1-8 обозначены:
1 - ПЦР-продукт blaVIM-2, полученный в ходе амплификации 1 нг модельной матрицы pGEM-T-blaVIM-2;
2 - ПЦР-продукт blaVIM-2, полученный в ходе амплификации 0,1 нг модельной матрицы pGEM-T-blaVIM-2;
3 - ПЦР-продукт blaVIM-2, полученный в ходе амплификации 0,01 нг модельной матрицы pGEM-T-blaVIM-2;
4 - ПЦР-продукт blaVIM-2, полученный в ходе амплификации 0,001 нг модельной матрицы pGEM-T-blaVIM-2;
5 - ПЦР-продукт blaVIM-2, полученный в ходе амплификации 0,0001 нг модельной матрицы pGEM-T-blaVIM-2;
6 - ПЦР-продукт blaVIM-2, полученный в ходе амплификации 0,00001 нг модельной матрицы pGEM-T-blaVIM-2;
7 - отрицательный контроль, не содержащий модельной матрицы pGEM-T-blaVIM-2;
М - стандарты молекулярных масс: снизу вверх 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1200, 1500, 2000, 3000 пар нуклеотидов (GeneRuler 100 bp Plus, Thermo Fisher Scientific, США).
Фиг. 2. Визуализация ПЦР-продуктов, кодирующих направляющие РНК, специфичные к гену антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, при помощи электрофореза в агарозном геле, где цифрами 1-5 обозначены:
1 - ПЦР-продукт, кодирующий sgRNA blaVIM-2 №93;
2 - ПЦР-продукт, кодирующий sgRNA blaVIM-2 №95;
3 - ПЦР-продукт, кодирующий sgRNA blaVIM-2 №207;
4 - ПЦР-продукт, кодирующий sgRNA blaVIM-2 №285;
5 - ПЦР-продукт, кодирующий sgRNA blaVIM-2 №366;
М - стандарты молекулярных масс: снизу вверх 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1200, 1500, 2000, 3000 пар нуклеотидов (GeneRuler 100 bp Plus, Thermo Fisher ScientiRc, США).
Фиг. 3. Профиль флуоресценции в реальном времени для предварительно амплифицированной мишени blaVIM-2 Pseudomonas aeruginosa, обработанной рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №93 и белок LbCpf1.
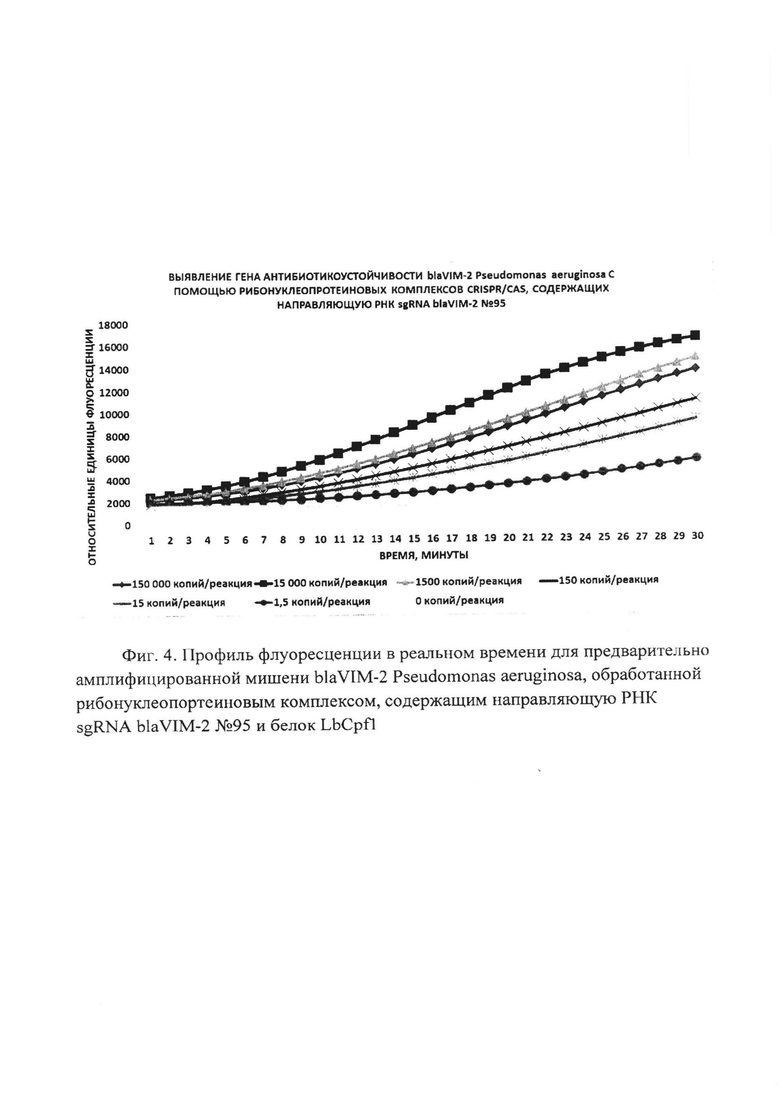
Фиг. 4. Профиль флуоресценции в реальном времени для предварительно амплифицированной мишени blaVIM-2 Pseudomonas aeruginosa, обработанной рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №95 и белок LbCpf1.
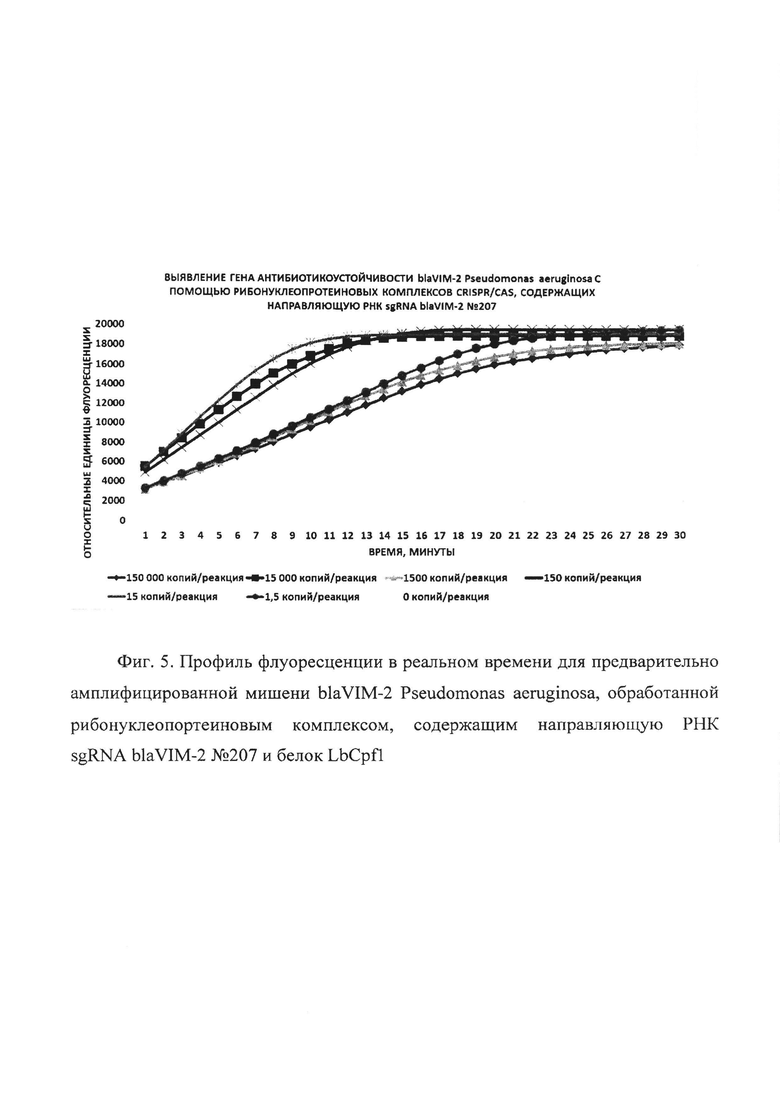
Фиг. 5. Профиль флуоресценции в реальном времени для предварительно амплифицированной мишени blaVIM-2 Pseudomonas aeruginosa, обработанной рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №207 и белок LbCpf1.
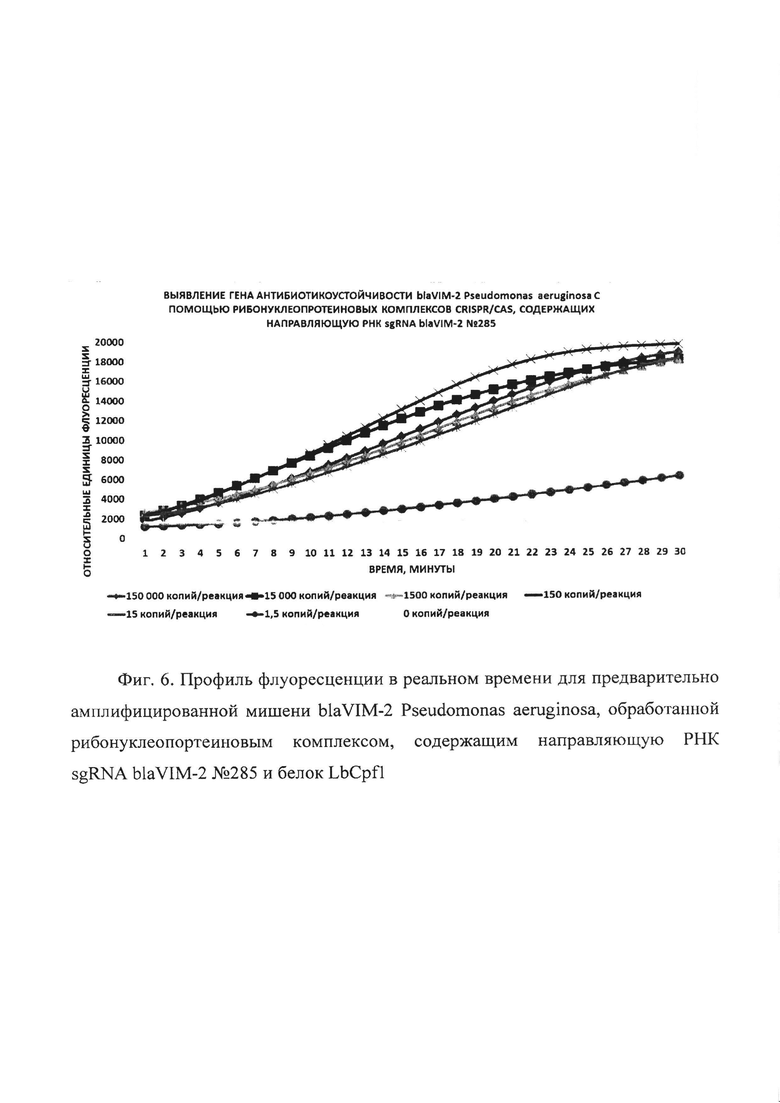
Фиг. 6. Профиль флуоресценции в реальном времени для предварительно амплифицированной мишени blaVIM-2 Pseudomonas aeruginosa, обработанной рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №285 и белок LbCpf1.
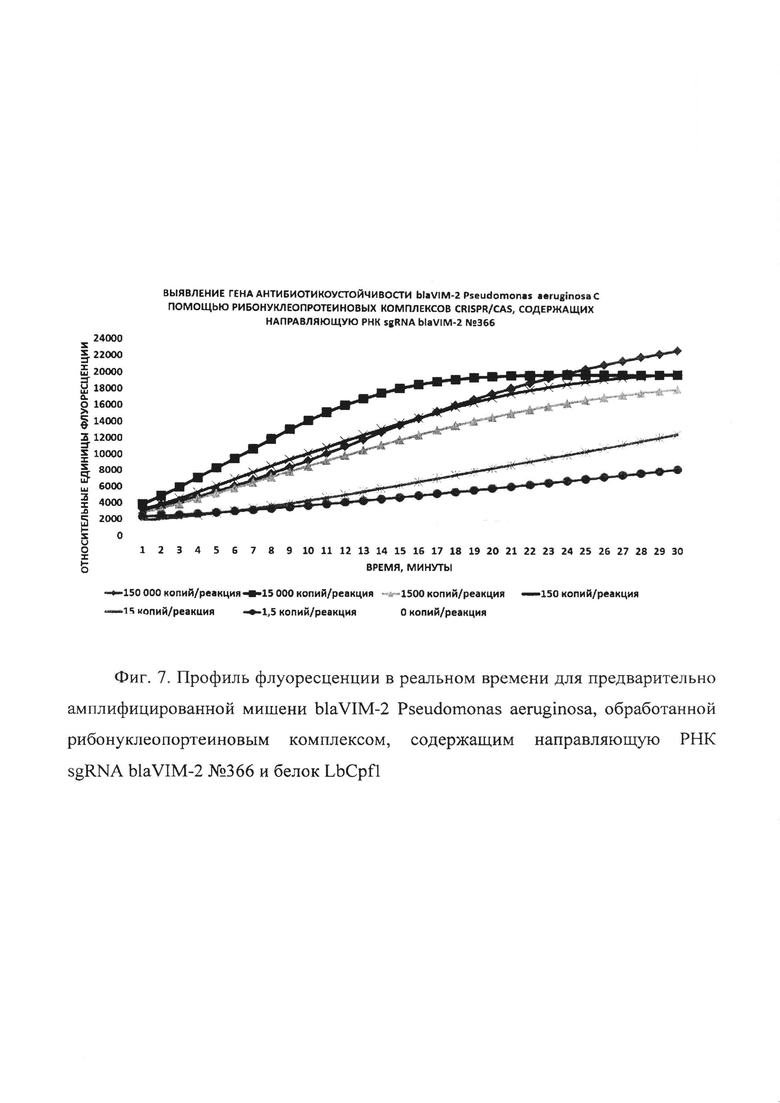
Фиг. 7. Профиль флуоресценции в реальном времени для предварительно амплифицированной мишени blaVIM-2 Pseudomonas aeruginosa, обработанной рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №366 и белок LbCpf1.
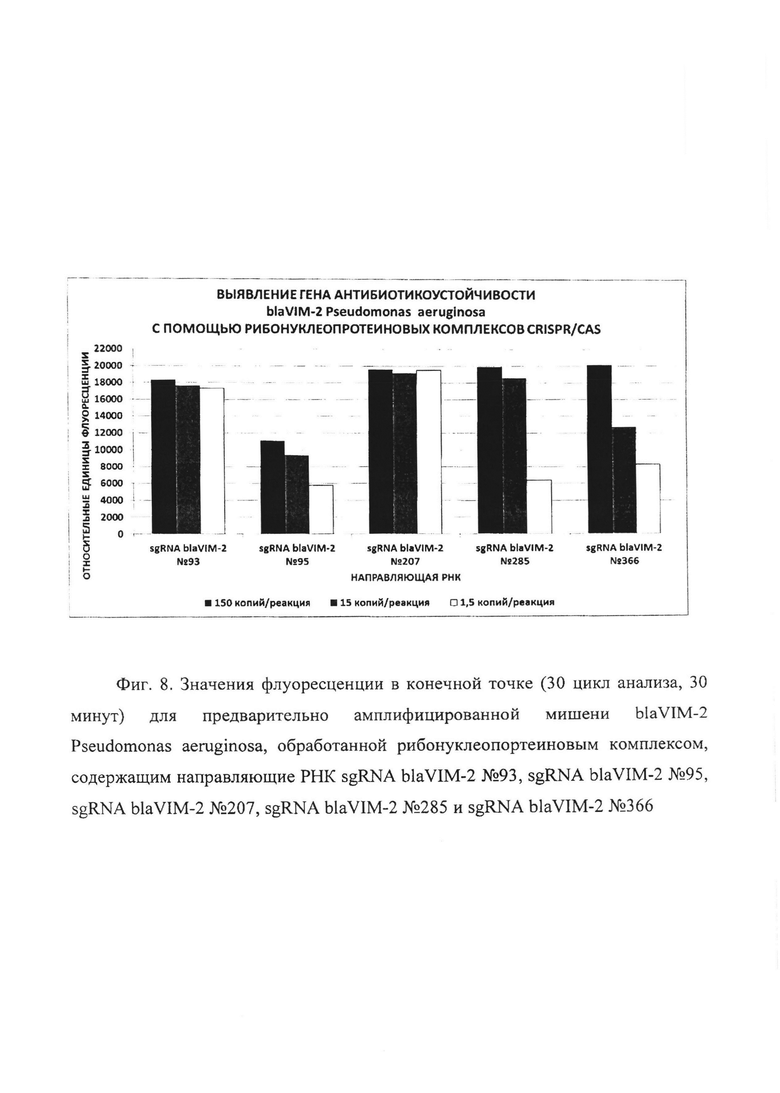
Фиг. 8. Значения флуоресценции в конечной точке (30 цикл анализа, 30 минут) для предварительно амплифицированной мишени blaVIM-2 Pseudomonas aeruginosa, обработанной рибонуклеопортеиновым комплексом, содержащим направляющие РНК sgRNA blaVIM-2 №93, sgRNA blaVIM-2 №95, sgRNA blaVIM-2 №207, sgRNA blaVIM-2 №285 и sgRNA blaVIM-2 №366.
Фиг. 9. Значения флуоресценции в конечной точке (30 цикл анализа, 30 минут) для предварительно амплифицированных с клинических образцов мишеней blaVIM-2 Pseudomonas aeruginosa, обработанных рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №93.
Фиг. 10. Значения флуоресценции в конечной точке (30 цикл анализа, 30 минут) для предварительно амплифицированных с клинических образцов мишеней blaVIM-2 Pseudomonas aeruginosa, обработанных рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №95.
Фиг. 11. Значения флуоресценции в конечной точке (30 цикл анализа, 30 минут) для предварительно амплифицированных с клинических образцов мишеней blaVIM-2 Pseudomonas aeruginosa, обработанных рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA biaVIM-2 №207.
Фиг. 12. Значения флуоресценции в конечной точке (30 цикл анализа, 30 минут) для предварительно амплифицированных с клинических образцов мишеней blaVIM-2 Pseudomonas aeruginosa, обработанных рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №285.
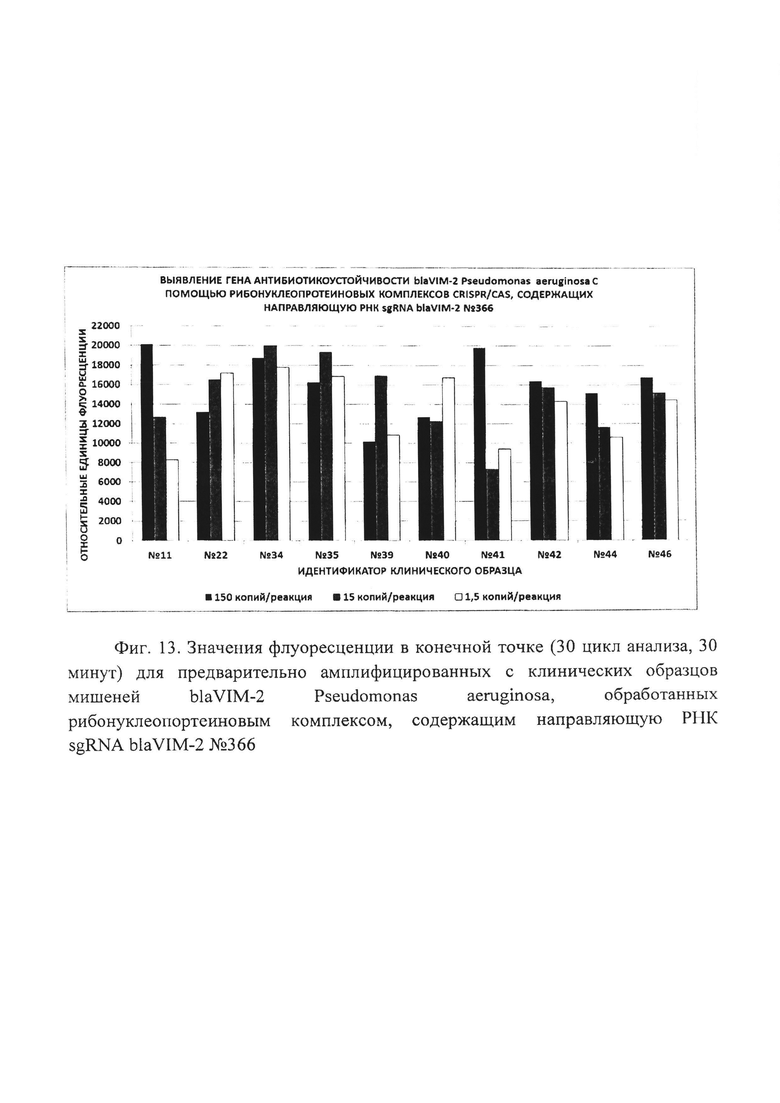
Фиг. 13. Значения флуоресценции в конечной точке (30 цикл анализа, 30 минут) для предварительно амплифицированных с клинических образцов мишеней blaVIM-2 Pseudomonas aeruginosa, обработанных рибонуклеопортеиновым комплексом, содержащим направляющую РНК sgRNA blaVIM-2 №366.
Примеры осуществления изобретения
ПРИМЕР 1: ПОДБОР ПОСЛЕДОВАТЕЛЬНОСТЕЙ-МИШЕНЕЙ В ГЕНЕ АНТИБИОТИКОУСТОЙЧИВОСТИ BLAVIM-2 PSEUDOMONAS AERUGINOSA ДЛЯ СОЗДАНИЯ НАПРАВЛЯЮЩИХ РНК
Для подбора последовательностей-мишеней в гене антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa для создания направляющих РНК были использованы современные алгоритмы in silico анализа нуклеотидных последовательностей и программы, находящиеся в открытом доступе, включая Benchling (https://www.benchling.com/molecular-biology/). Был составлен перечень участков в гене антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с теоретически рассчитанной вероятностью их расщепления в высоко консервативных участках (Таблица 1).

Направляющие РНК, специфически узнающие высоко консервативный участок антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, представлены уникальными последовательностями SEQ ID NO: 1-5.
ПРИМЕР 2: ПОДГОТОВКА МАТЕРИАЛА ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АНТИБИОТИКОУСТОЙЧИВОСТИ BLAVIM-2 PSEUDOMONAS AERUGINOSA МЕТОДОМ ПРЕДВАРИТЕЛЬНОЙ АМПЛИФИКАЦИИ
Подготовку материала для обнаружения гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa проводят методом предварительной амплификации. В качестве модельной матрицы гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa биологического образца используют плазмидную ДНК pGEM-T-blaVIM-2, содержащую в своем составе фрагмент гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с 37 по 447 п.о. (размером 411 п.о.).
Предварительную амплификацию участка, соответствующего фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с 37 по 447 п.о., проводят с использованием специфических олигонуклеотидов с SEQ ID NO: 6-7, приведенных в Таблице 2.

ПЦР-продукт, кодирующий фрагмент антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, получают в реакции амплификации с использованием ПЦР-смеси-2 blue (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) и специфических олигонуклеотидов For blaVIM-2 и Rev blaVIM-2 (ГенТерра, Россия). Размер амплифицированного фрагмента blaVIM-2 составляет 411 пар нуклеотидов.
Температурный профиль амплификации для получения ПЦР-продукта, фрагмент гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с 37 по 447 п.о.:
1. денатурация: 95°С в течение 3 минут;
2. 40 циклов амплификации:
95°С - 15 сек,
55°С - 45 сек,
72°С - 30 сек;
3. финальная элонгация: 72°С в течение 5 минут.
В ходе подготовки материала для обнаружения гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa методом предварительной амплификации проводят титрование модельной матрицы pGEM-T-blaVIM-2 путем приготовления серийных разведений (Таблица 3).
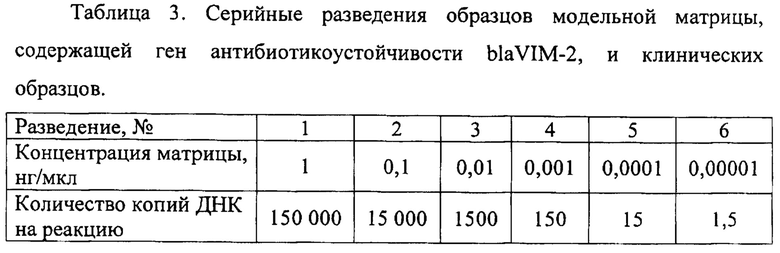
Для оценки эффективности предварительной амплификации полученные фрагменты гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa визуализируют при помощи электрофореза в агарозном геле (Фиг. 1).
Подготовленный описанным способом материал используют для экспериментов по выявлению гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с помощью рибонуклеопротеиновых комплексов LbCpf1 из Lachnospiraceae, содержащих направляющие РНК sgRNA blaVIM-2 №93, sgRNA blaVIM-2 №95, sgRNA blaVIM-2 №207, sgRNA blaVIM-2 №285 и sgRNA blaVIM-2 №366, без предварительной очистки.
ПРИМЕР 3: ПОЛУЧЕНИЕ НАПРАВЛЯЮЩИХ РНК И СОЗДАНИЕ РИБОНУКЛЕОПРОТЕИНОВЫХ КОМПЛЕКСОВ ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АНТИБИОТИКОУСТОЙЧИВОСТИ BLAVIM-2 PSEUDOMONAS AERUGINOSA».
Для получения направляющих РНК для обнаружения гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa разработан набор специфических олигонуклеотидов, приведенных в Таблице 4.


Получение направляющих РНК проводят в несколько этапов:
1. получение ПЦР-продукта с использованием набора специфических олигонуклеотидов (табл. 4), кодирующего направляющую РНК, способную связываться с целевым высоко консервативным участком гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, содержащую РНК-шпильку, которая распознается РНК-направляемой ДНК-эндонуклеазой LbCpf1 из Lachnospiraceae;
2. очистка ПЦР-продукта, кодирующего направляющую РНК, специфичную к фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa;
3. синтез направляющей РНК, специфичной к фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa;
4. очистка направляющей РНК, специфичной к фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
ПЦР-продукт, кодирующий направляющую РНК sgRNA blaVIM-2 №93, получают в реакции амплификации с использованием ПЦР-смеси-2 blue (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) и специфических олигонуклеотидов T7pr и sgRNA-93-Rev (ГенТерра, Россия). Размер амплифицированного фрагмента, кодирующего sgRNA blaVIM-2 №93, составляет 62 пары нуклеотидов.
ПЦР-продукт, кодирующий направляющую РНК sgRNA blaVIM-2 №95, получают в реакции амплификации с использованием ПЦР-смеси-2 blue (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) и специфических олигонуклеотидов T7pr и sgRNA-95-Rev (ГенТерра, Россия). Размер амплифицированного фрагмента, кодирующего sgRNA blaVIM-2 №95, составляет 62 пары нуклеотидов.
ПЦР-продукт, кодирующий направляющую РНК sgRNA blaVIM-2 №207, получают в реакции амплификации с использованием ПЦР-смеси-2 blue (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) и специфических олигонуклеотидов T7pr и sgRNA-207-Rev (ГенТерра, Россия). Размер амплифицированного фрагмента, кодирующего sgRNA blaVIM-2 №207, составляет 62 пары нуклеотидов.
ПЦР-продукт, кодирующий направляющую РНК sgRNA blaVIM-2 №285, получают в реакции амплификации с использованием ПЦР-смеси-2 blue (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) и специфических олигонуклеотидов T7pr и sgRNA-285-Rev (ГенТерра, Россия). Размер амплифицированного фрагмента, кодирующего sgRNA blaVIM-2 №285, составляет 62 пары нуклеотидов.
ПЦР-продукт, кодирующий направляющую РНК sgRNA blaVIM-2 №366, получают в реакции амплификации с использованием ПЦР-смеси-2 blue (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) и специфических олигонуклеотидов T7pr и sgRNA-366-Rev (ГенТерра, Россия). Размер амплифицированного фрагмента, кодирующего sgRNA blaVIM-2 №366, составляет 62 пары нуклеотидов.
Температурный профиль амплификации для получения ПЦР-продуктов, кодирующих направляющие РНК:
1. денатурация: 95°С в течение 3 минут;
2. 35 циклов амплификации:
95°С - 15 сек,
55°С - 45 сек,
72°C - 30 сек;
3. финальная элонгация: 72°С в течение 5 минут.
ПЦР-продукты, кодирующие направляющие РНК, специфичные к фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, визуализируют при помощи электрофореза в агарозном геле (Фиг. 2).
Очистку ПЦР-продуктов, кодирующих направляющие РНК, специфичные к фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, проводят с использованием коммерчески доступного набора ISOLATE II PCR and Gel Kit (BioLine, США) согласно инструкции производителя. Очищенные ПЦР-продукты, кодирующие направляющие РНК, специфичные к фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, используют в качестве матрицы для синтеза направляющих РНК.
Синтез направляющих РНК, специфичных к фрагменту гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, осуществляется методом in vitro транскрипции с использованием коммерчески доступных наборов реагентов (HiScribe™ Т7 High Yield RNA Synthesis Kit, NEB, США) согласно инструкции производителя. Продукты реакции in vitro транскрипции переосаждают из реакционной смеси добавлением хлорида натрия до конечной концентрации 400 mM и равного объема изопропилового спирта. Такие модификации протокола производителя, внесенные авторами, позволяют увеличить выход продукта реакции и получить желаемую концентрацию финального препарата направляющей РНК.
Создание готового рибонуклеопротеинового комплекса, содержащего белок семейства CRISPR/CAS LbCpf1 из Lachnospiraceae, и направляющую РНК авторы проводят по стандартному протоколу с некоторыми модификациями (In vitro enzymology of Cas9 // Anders C, Jinek M. Methods Enzymol. 2014; 546:1-20. doi: 10.1016/B978-0-12-801185-0.00001-5).
Непосредственно перед объединением с CAS-белком препарат направляющей РНК (в количестве 250 нг) прогревают при 90°С в течение 5 минут и позволяют медленно остыть до комнатной температуры (инкубация при комнатной температуре не менее 10 минут). Такое прогревание необходимо для формирования корректной конформации шпильки, содержащейся в направляющей РНК. Многие производители коммерческих препаратов CAS-белков пропускают данный этап при подготовке рибонуклеопротеинового комплекса.
Для формирования готового рибонуклеопротеинового комплекса 250 нг CAS-белка LbCpf1 из Lachnospiraceae и подготовленную направляющую РНК смешивают и инкубируют 15 минут при комнатной температуре. Полученный таким способом рибонуклеопротеиновый комплекс готов для выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa.
ПРИМЕР 4: ОБНАРУЖЕНИЕ ЕДИНИЧНЫХ КОПИЙ ГЕНА АНТИБИОТИКОУСТОЙЧИВОСТИ BLAVIM-2 PSEUDOMONAS AERUGINOSA С ПОМОЩЬЮ РИБОНУКЛЕОПРОТЕИНОВЫХ КОМПЛЕКСОВ CRISPR/CAS НА ПРИМЕРЕ МОДЕЛЬНОЙ МАТРИЦЫ
Предварительно амплифицированный материал, полученный способом, описанным в Примере 2, используют в качестве матрицы для обнаружения гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с помощью рибонуклеопротеиновых комплексов CRISPR/CAS, полученных способом, описанным в Примере 3.
Для обнаружения гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с помощью рибонуклеопротеиновых комплексов CRISPR/CAS готовят реакционную смесь, содержащую следующие компоненты:
- 10× буфер (100 mM TrisHCl рН 8,0, 1 М NaCl);
- 50 mM MgCl2 (конечная концентрация в реакционной смеси 10 mM);
- 250 нг рибонуклеопротеинового комплекса (LbCpf1 из Lachnospiraceae и направляющие РНК sgRNA blaVIM-2 №93, sgRNA MaVIM-2 №95, sgRNA blaVIM-2 №207, sgRNA blaVIM-2 №285 и sgRNA blaVIM-2 №366);
- 20 pmol флуоресцентный зонд (6FAM-TTATT-BHQ1);
- мишень (предварительно амплифицированный фрагмента гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa);
- вода mQ.
Реакционные смеси, содержащие все необходимые компоненты, помещают в амплификатор ДТПрайм 5 (ДНК-Технология, Россия) и задают следующие параметры реакции:
30-60 циклов:
37°С - 35 сек,
37°С - 25 сек, съемка флуоресценции.
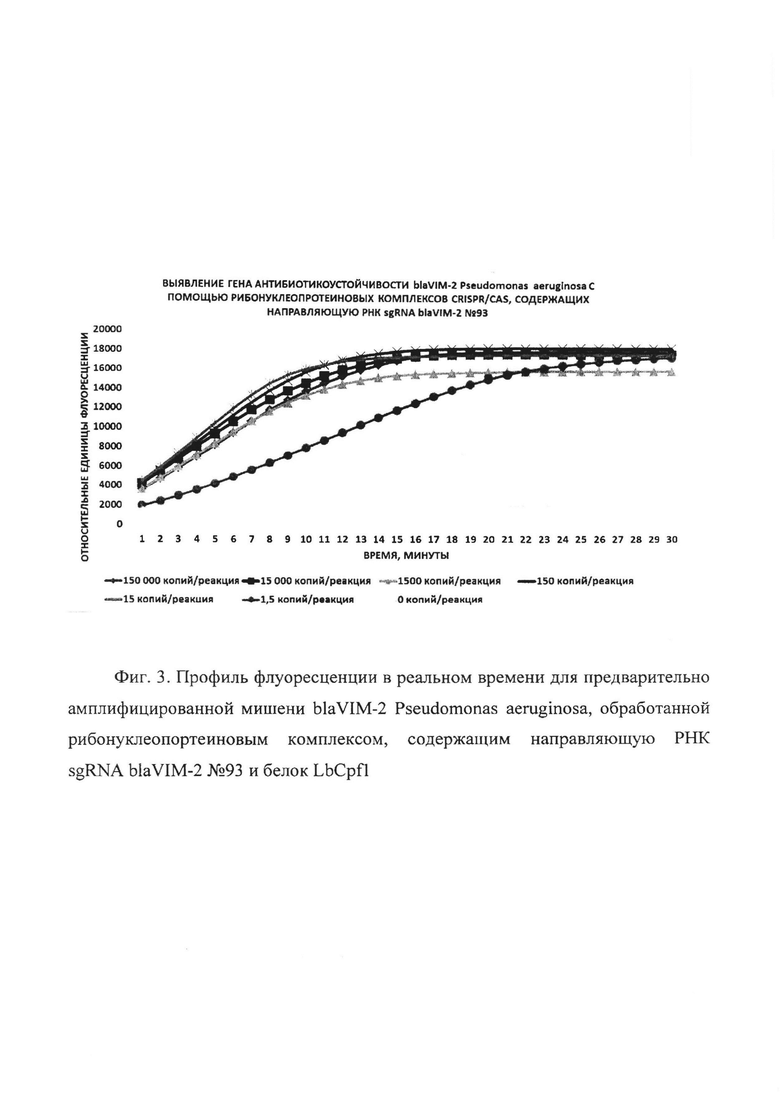
В первую очередь были проведены эксперименты по обнаружению единичных копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с помощью рибонуклеопротеиновых комплексов CRISPR/CAS, сформированных на основе LbCpf1 из Lachnospiraceae, с использованием в качестве мишени модельной матрицы - плазмидной ДНК pGEM-T-blaVIM-2, содержащей в своем составе фрагмент гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с 37 по 447 п.о. размером 411 п.о. Показано, что рибонуклеопротеиновые комплексы CRISPR/CAS обладают способностью выявлять единичные копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa. Типичные результаты анализа приведены на примерах профилей флуоресценции в реальном времени для предварительно амплифицированной мишени blaVIM-2 Pseudomonas aeruginosa, обработанной рибонуклеопортеиновыми комплексами, содержащими направляющие РНК sgRNA blaVIM-2 №93, sgRNA blaVIM-2 №95, sgRNA blaVIM-2 №207, sgRNA blaVIM-2 №285 и sgRNA blaVIM-2 №366 и белок LbCpf1, на Фиг. 3, Фиг. 4, Фиг. 5, Фиг. 6 и Фиг. 7 соответственно. Отметим, что уже на 30-ом цикле анализа (30 минут) значение сигнала, полученного в ходе детекции единичных копий (1,5 копий/реакция) гена blaVIM-2 Pseudomonas aeruginosa, превышало значение «шума» (неспецифической флуоресценции контрольного образца, не содержащего мишени) минимум втрое.
В ходе работ была оценена эффективность выявления единичных копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, содержащегося в составе модельной матрицы, с использованием различных направляющих РНК. Показано, что рибонуклеопротеиновые комплексы CRISPR/CAS, сформированные на основе LbCpf1 из Lachnospiraceae и направляющих РНК, выявляют единичные копии гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с различной эффективностью, и их можно расположить в следующем порядке но уменьшению активности: sgRNA blaVIM-2 №207 > sgRNA blaVIM-2 №93 > sgRNA blaVIM-2 №366 > sgRNA blaVIM-2 №285 > sgRNA blaVIM-2 №95 (Фиг. 8).
ПРИМЕР 5: ОБНАРУЖЕНИЕ ЕДИНИЧНЫХ КОПИЙ ГЕНА АНТИБИОТИКОУСТОЙЧИВОСТИ BLAVIM-2 PSEUDOMONAS AERUGINOSA С ПОМОЩЬЮ РИБОНУКЛЕОПРОТЕИНОВЫХ КОМПЛЕКСОВ CRISPR/CAS НА ОГРАНИЧЕННОЙ ПАНЕЛИ КЛИНИЧЕСКИХ ОБРАЗЦОВ
Разработанные направляющие РНК были апробированы на ограниченной панели клинических образцов (10 шт.), содержащих Pseudomonas aeruginosa, несущую ген антибиотикоустойчивости blaVIM-2 (ранее подтверждено микробиологическими методами и методом секвенирования следующего поколения).
Для обнаружения единичных копий гена антибиотикоустойчивости blaVIM-2 с помощью рибонуклеопротеиновых комплексов CRISPR/CAS была проведена предварительная амплификация фрагментов этого гена. Для проведения предварительной амплификации были подготовлены серийные (согласно Таблице 3) разведения препаратов ДНК, выделенных из клинических образцов 10 пациентов с помощью коммерчески доступного набора DNeasy Blood & Tissue Kit (QIAGEN, США) согласно инструкции производителя.
ПЦР-продукты, кодирующие фрагмент гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, получают в реакции амплификации с использованием ПЦР-смеси-2 blue (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) как описано в Примере 2, применяя описанный температурный профиль и продолжительность реакции амплификации.
Полученный таким способом материал используют в качестве матрицы для обнаружения единичных копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с помощью рибонуклеопротеиновых комплексов CRISPR/CAS, полученных способом, описанным в Примере 3.
Обнаружение единичных копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa с помощью рибонуклеопротеиновых комплексов CRISPR/CAS проводят способом, описанным в Примере 4.
В ходе проведенного анализа было показано, что рибонуклеонротеиновые комплексы CRISPR/CAS обладают способностью выявлять единичные копии (1,5 копий/реакция) гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa в препаратах ДНК, выделенных из клинических образцов. При этом уже на 2-15 цикле (2-15 минут) анализа значение сигнала превышало значение «шума» (неспецифической флуоресценции контрольного образца, не содержащего мишени) втрое, а к 5-26 циклу (5-26 минут) анализа - более чем в 5 раз (широкий диапазон и разница в циклах обусловлены различиями использованных в анализе направляющих РНК, Таблица 5). Типичные результаты анализа приведены на примерах значений флуоресценции в конечной точке (30 цикл анализа, 30 минут) для предварительно амплифицированных мишеней blaVIM-2 Pseudomonas aeruginosa (10 независимых клинических образцов), обработанных рибонуклеопортеиновыми комплексами, содержащими направляющие РНК sgRNA blaVIM-2 №93, sgRNA blaVIM-2 №95, sgRNA blaVIM-2 №207, sgRNA blaVIM-2 №285 и sgRNA blaVIM-2 №366 и белок LbCpf1, на Фиг. 9, Фиг. 10, Фиг. 11, Фиг. 12 и Фиг. 13 соответственно
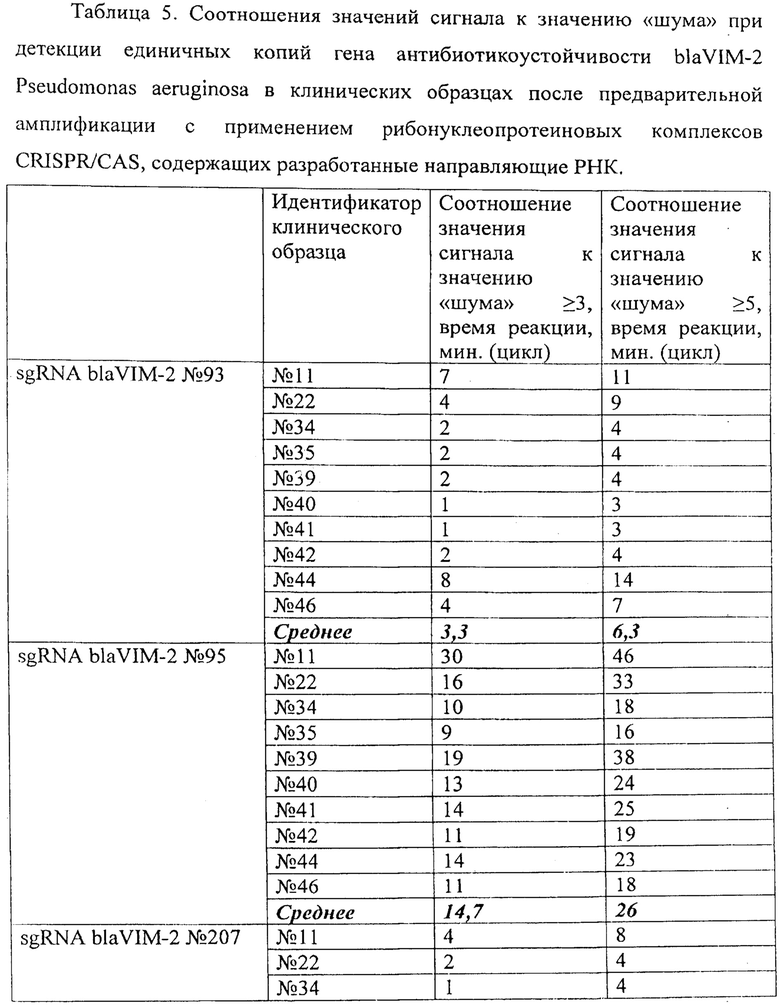
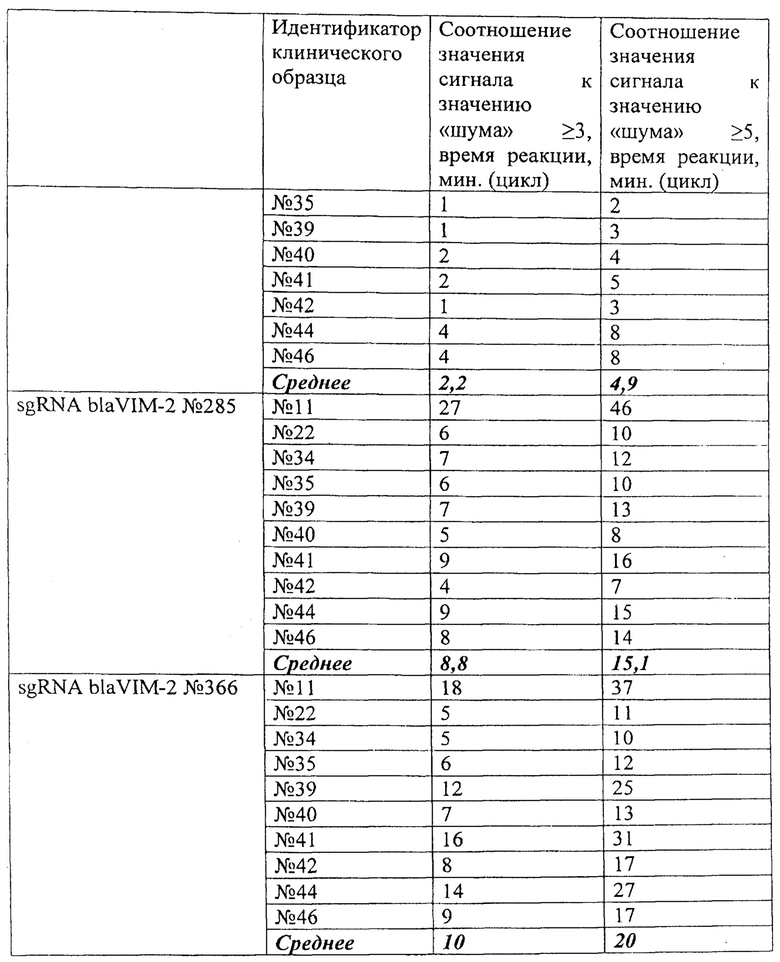
Эффективность выявления единичных копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, содержащегося в составе препаратов ДНК, выделенных из клинических образцов, с использованием различных направляющих РНК в составе рибонуклеопротеиновых комплексов CRISPR/CAS, сформированных на основе LbCpf1 из Lachnospiraceae, можно представить в следующем порядке по убыванию: sgRNA blaVIM-2 №207 > sgRNA blaVIM-2 №93 > sgRNA blaVIM-2 №285 > sgRNA blaVIM-2 №366 > sgRNA blaVIM-2 №95 (Таблица 5).
Таким образом, разработанные направляющие РНК позволяют ультрачувствительно выявлять единичные копии гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa в клинических образцах после предварительной амплификации в составе рибонуклеопротеиновых комплексов CRISPR/CAS.
--->
Перечень последовательностей
<110> ФБУН ЦНИИ Эпидемиологии Роспотребнадзора
<120>
<160> NUMBER OF SEQ ID NO: NOS: 7
<210> SEQ ID NO: NO 1
<211> 40
<212> RNA
<213> artificial
<400> SEQUENCE 1 (sgRNA blaVIM-2 №93):
aau uuc uac uaa gug uag aug cug acu guc gga uac uca c 40
<210> SEQ ID NO: NO 2
<211> 40
<212> RNA
<213> artificial
<400> SEQUENCE 2 (sgRNA blaVIM-2 №95):
aau uuc uac uaa gug uag auu ccg uag auu cua gcg gug a 40
<210> SEQ ID NO: NO 3
<211> 40
<212> RNA
<213> artificial
<400> SEQUENCE 3 (sgRNA blaVIM-2 №207):
aau uuc uac uaa gug uag aua ugg cgc agu cua ccc guc c 40
<210> SEQ ID NO: NO 4
<211> 40
<212> RNA
<213> artificial
<400> SEQUENCE 4 (sgRNA blaVIM-2 №285):
aau uuc uac uaa gug uag auc uuc uca auc ucc gcg aga a 40
<210> SEQ ID NO: NO 5
<211> 40
<212> RNA
<213> artificial
<400> SEQUENCE 5 (sgRNA blaVIM-2 №366):
aau uuc uac uaa gug uag aua uga cga ccg cgu cgg cgg c 40
<210> SEQ ID NO: NO 6
<211> 22
<212> DNA
<213> artificial
<400> SEQUENCE 6 (For blaVIM-2):
acc gcg tct atc atg gct att g 22
<210> SEQ ID NO: NO 7
<211> 20
<212> DNA
<213> artificial
<400> SEQUENCE 7 (Rev blaVIM-2):
ctc gtt ccc ctc tac ctc gg 20
<---






Данное изобретение относится к области генной инженерии и биотехнологии. Предложен способ получения гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, а также препарат рибонуклеопротеинового комплекса CRISPR/CAS для выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa. Настоящее изобретение может найти дальнейшее применение в выявлении единичных копий гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa. 2 н. и 4 з.п. ф-лы, 13 ил., 5 табл., 5 пр.
1. Способ получения препарата рибонуклеопротеинового комплекса CRISPR/CAS для выявления гена антибиотикоустойчивости blaVIM-2 (металло-бета-лактамаза класс В VIM-2) Pseudomonas aeruginosa, состоящий из стадий:
(i) синтеза направляющей РНК с SEQ ID NO: 1-5;
(ii) объединения CAS-белка семейства CRISPR/CAS LbCpf1 из Lachnospiraceae в комплекс с по меньшей мере одной направляющей РНК, полученной на стадии (i); и при необходимости
(iii) лиофильной сушки рибонуклеопротеинового комплекса CRISPR/CAS, полученного на стадии (ii);
с получением, таким образом, препарата рибонуклеопротеинового комплекса CRISPR/CAS.
2. Способ по п. 1, где синтез направляющих РНК осуществляют методом in vitro транскрипции с последующим переосаждением продуктов реакции in vitro транскрипции из реакционной смеси добавлением хлорида натрия до конечной концентрации 400 mM и равного объема изопропилового спирта.
3. Способ по любому из пп. 1, 2, где непосредственно перед объединением с CAS-белком направляющую РНК прогревают при 90°С в течение 5 минут и позволяют медленно остыть до комнатной температуры, что обеспечивает формирование корректной конформации шпильки, содержащейся в направляющей РНК.
4. Препарат рибонуклеопротеинового комплекса CRISPR/CAS для выявления гена антибиотикоустойчивости blaVIM-2 Pseudomonas aeruginosa, полученный способом по любому из пп. 1-3, содержащий CAS-белок семейства CRISPR/CAS LbCpf1 из Lachnospiraceae в комплексе с по меньшей мере одной направляющей РНК с SEQ ID NO: 1-5.
5. Препарат по п. 4, где препарат представляет собой раствор указанного рибонуклеопротеинового комплекса CRISPR/CAS.
6. Препарат по п. 4, где указанный препарат лиофилизирован.
| MULLER V et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Rep., 2016, Vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| CHEN JS et al | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ приготовления искусственной массы из продуктов конденсации фенолов с альдегидами | 1920 |
|
SU360A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОПИГМЕНТОВ | 1925 |
|
SU436A1 |
Авторы
Даты
2021-03-29—Публикация
2020-04-15—Подача