Область техники
Изобретение относится к области медицины и фармакологии и может быть использовано для получения биоматериалов для стимуляции регенерации тканей после повреждения, в том числе для реконструктивной хирургии, восстановления мягких тканей, в травматологии и ортопедии.
Уровень техники
Из уровня техники известен способ получения децеллюляризированного внеклеточного матрикса (дВКМ), производимого мезенхимными стромальными клетками (МСК) костного мозга человека (US 2014023723 А1). При этом ВКМ получают при культивировании МСК костного мозга с добавлением 50 мг/мл аскорбат-2-фосфата, а децеллюляризацию проводят с помощью 0.5% Triton Х-100 в 20 мМ гидроксиде аммония (NH4OH), после чего скребком собирают дВКМ, стерилизуют в 0.02 N уксусной кислоте и разбивают на частицы ультразвуком. Показано, что полученный дВКМ обладает стимулирующим эффектом в остеогенной дифференцировке. Однако следует отметить, что дВКМ, полученный данным способом, содержит остатки уксусной кислоты, являющиеся потенциально опасным агентом при терапевтическом применении.
Также из уровня техники известен способ получения дВКМ, производимого МСК костного мозга человека (CHEN X.D. et al., Extracellular matrix made by bone marrow cells facilitates expansion of marrow-derived mesenchymal progenitor cells and prevents their differentiation into osteoblasts, Journal of bone and mineral research, 2007, T. 22, №. 12 (C. 1944)). При этом дВКМ получают при культивировании МСК костного мозга с добавлением 50 мкМ аскорбиновой кислоты, а децеллюляризацию проводят с помощью 0.5% Triton Х-100 в 20 мМ гидроксиде аммония (NH4OH) в течение 5 минут при 37°С, а также с последующей инкубацией с 100 Е/мл ДНКазы I в течение 1 ч при 37°С. Показано, что полученный дВКМ обладает стимулирующим эффектом образования колоний фибробластов, остеобластов и адипоцитов. Однако для дВКМ, полученного данным способом, не приведены данные об эффективности такого метода децеллюляризации по количеству остаточной ДНК и не проведена оценка иммуногенности полученного материала.
Из уровня техники известен способ получения дВКМ, производимого мезенхимными прогениторными клетками, полученных из эмбриональных телец (US 2013230601 А1). При этом децеллюляризацию проводят с помощью гипертонического раствора 50 мМ Tris-Hcl, 1 мМ NaCl, 10 мМ EDTA путем инкубирования в течение ночи, с последующей отмывкой фосфатным буфером (PBS) и обработкой 1% Triton Х-100 в течение 1-2 часов при комнатной температуре, затем повторением отмывок PBS, и затем инкубированием с 1 мг/мл ДНКазой I в течение 1 часа при 37°С. Показано, что полученный дВКМ обладает стимулирующим эффектом в регенерации. Однако следует отметить, что дВКМ, полученный данным способом, включает стадию получения и использования эмбриональных или индуцированных плюрипотентных клеток, использование которых связано с риском нежелательных онкогенных эффектов, которые для указанного метода не отслеживали.
Из уровня техники известен способ получения дВКМ, производимого МСК пуповины человека (CN 104800891 А). При этом ВКМ получают при культивировании МСК с добавлением 100-200 мкМ аскорбиновой кислоты, а децеллюляризацию проводят с помощью 0.5-5% Triton Х-100 в 10-40 мМ гидроксиде аммония (NH4OH). Показано, что полученный дВКМ обладает антиоксидантным эффектом, который возможно применить в регенеративной медицине. Однако, следует отметить, что в экспериментальных данных данного документа не показано, что дВКМ, полученный данным способом, имеет стимулирующий эффект на какую-либо дифференцировку клеток человека.
В указанных выше изобретениях для получения дВКМ использованы МСК костного мозга, МСК, дифференцированных из эмбриональных телец или плюрипотентных клеток, а также МСК пуповины. Однако более предпочтительным источником с точки зрения доступности получения в достаточном для производства дВКМ количестве является жировая ткань. Кроме того, МСК жировой ткани обладают более выраженными паракринными эффектами, в частности, в отношении стимуляции роста кровеносных сосудов и нервов по сравнению, например, с МСК костного мозга, что определяет преимущества их использования для получения дВКМ для стимуляции регенеративных процессов.
Наиболее близким к заявляемому решению является способ децеллюляризации клеточных пластов МСК жировой ткани человека (НИМИРИЦКИЙ П.П. и др., Клеточные пласты из мезенхимных стромальных клеток жировой ткани человека и получение препаратов внеклеточного матрикса методом децеллюляризации, Технологии живых систем, 2016, Т. 13, №. 6 (С. 4-13)). Указанный способ децеллюляризации клеточных пластов МСК человека предполагает получение препаратов ВКМ и включает следующие стадии: 1) добавление к части пластам аскорбиновой кислоты в концентрации 50 мкг/мл, 2) предварительное снятие клеточного пласта с промывкой фосфатно-солевым буфером (ФСБ) с рН=7,4, и инкубацией в растворе Версена либо в 0,025% растворе Трипсина/ЭДТА, с последующей промывкой ФСБ, 3) обработку пласта различными детергентами, 4) инкубирование образцов с ДНКазой I в концентрации 20 ЕД на лунку непосредственно в лунках культурального планшета в течение 12 часов при 37°С в буфере, содержащем 10 мМ Трис-HCl рН=7,4, 2,5 мМ MgCl2, 0,5 мМ CaCl2. Однако в описании данного изобретения не раскрыта морфология полученного дВКМ на микроуровне и таким образом не подтверждено сохранение и наличие в полученном дВКМ матриксных внеклеточных везикул, не проведена адекватная оценка эффективности децеллюляризации по уровню остаточной ДНК, не представлены способы применения полученного материала, в том числе для стимуляции регенеративных процессов. Таким образом, в описанном изобретении не представлено данных, подтверждающих наличие фармакологических свойств дВКМ.
Раскрытие изобретения
Технической проблемой является создание биоматериала для стимуляции регенерации поврежденных тканей, обладающего комплексным воздействием на различные этапы раневого процесса.
Техническим результатом, на достижение которого направлено заявленное изобретение, является получение биоматериала, эффективно стимулирующего регенерацию тканей за счет формирования сбалансированного микроокружения на основе различных биологически активных молекул и белков ВКМ, секретируемого мезенхимными стволовыми/стромальными клетками (МСК) человека в клеточном пласте, не содержащей ксеногенных компонентов. Эффективность средства обеспечивается за счет подобранного способа/протокола децеллюляризации клеточного пласта, обеспечивающего эффективную децеллюляризацию и низкие иммуногенные свойства биоматериала и одновременно сохранение ВКМ и его ключевых компонентов, необходимых для реализации регенеративного действия МСК, наличие которых изучают с помощью иммуногистохимического анализа, а также сканирующей электронной микроскопией (СЭМ), а именно фибриллярного коллагена I типа, гликопротеинов - ламинина и фибронектина, а также матриксных внеклеточных везикул.
Поставленная задача решается тем, что способ получения биоматериала для регенерации тканей включает культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека в течение двух недель для формирования клеточного пласта, содержащего ВКМ, отбор среды культивирования, эффективное удаление из клеточного пласта клеток с помощью децеллюляризации разными типами детергентов, отмывку от остатков клеток и детергента раствором Хенкса, инкубацию дВКМ с ДНКазой I типа и отмывкой раствором Хенкса для получения биоматериала, содержащего компоненты ВКМ МСК человека, включающие коллаген I типа, фибронектин, ламинин и матриксные везикулы, определяемые методом иммуногистохимии и СЭМ. При этом МСК ЖТ наращивают и культивируют до получения клеточного пласта в специфической среде, поддерживающей рост недифференцированных мезенхимных клеток человека (AdvanceSTEM Cell Culture Media, содержащей 9-11 об. % добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement, HyClone, USA), но для получения ВКМ клеточный пласт кратковременно (3-10 мин) децеллюляризируют, после чего тщательно отмывают от компонентов среды, остатков клеток и детергента раствором Хэнкса (фирмы ПанЭко или аналогичным), и помещают в раствор рекомбинантной ДНКазы I человека, лишенный ксеногенных продуктов, а именно среду роста, в качестве последней используют DMEM с низким содержанием глюкозы (Gibco, USA) или другую базальную среду роста, либо буфер, содержащий ионы кальция, магния или марганца, для поддержания ферментативной активности ДНКазы I, с последующей отмывкой раствором Хенкса.
Культивирование МСК ЖТ может быть осуществлено в культуральных планшетах, флаконах, чашках Петри (фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке с плотностью 50-60*103 см2 в среде роста в объеме 0,1-0,2 мл/см2 в условиях CO2 инкубатора при 37±1°С, 5%-ом содержании СО2 и относительной влажности ≥95% в течение 3-14±1 дней. Удаление среды культивирования и последующая децеллюляризация может быть реализована с помощью растворов ионных и цвиттер-ионных детергентов (Дезоксихолат натрия и 3-[(3-холамидопропил)диметиламмоний-]-1-пропансульфонат (CHAPS), соответственно) в фосфатном буфере рН=7,4, например, при температуре 25±2°С в течение 3-10 минут. Отмывку дВКМ от компонентов среды культивирования, остатков клеток (клеточного дебриса) и детергента осуществляют 2-5 раз посредством раствора Хенкса, при этом для получения стерильного продукта осуществляют микрофильтрацию используемых растворов через фильтры с диаметром пор 0,22 мкм. Далее, проводят инкубирование в растворе ДНКазы I в базальной среде или среде для культивирования без сыворотки, или буфере, содержащем ионы кальция, магния или марганца, при 37°С в течение 30-120 минут. После чего, проводят отмывку раствором Хенкса 2-3 раза.
Таким образом, технический результат достигается за счет того, что биоматериал для регенерации тканей получают с помощью децеллюляризации клеточных пластов МСК человека в растворах, лишенных животных компонентов, с потенциально безопасным для клинического применения составом, обеспечивающих эффективную децеллюляризацию и сохранение ВКМ, содержащего биологически активные факторы, секретируемые клетками вокруг себя и удерживающиеся в структуре ВКМ, отмывке дВКМ с помощью раствора Хенкса, удаление остаточной ДНК из дВКМ, с последующей отмывкой. Полученный биоматериал в стерильном физиологическом растворе можно использовать отдельно или как компонент других материалов тканевой инженерии при комбинировании с биосовместимыми носителями для стимуляции регенерации тканей после повреждения.
Эффективность разрабатываемого биоматериала предполагает наличие целого комплекса воздействий, направленных на стимулирование пролиферации и миграции специализированных клеток, участвующих в процессах репарации и регенерации, таких как эндотелиальные клетки, фибробласты и др., регуляцию процессов воспаления и, наконец, восстановление клеточного состава в месте повреждения с помощью дифференцировки стволовых и прогениторных клеток. При этом необходимость восстановления микроокружения и клеточного состава в зоне регенерации поврежденной ткани является актуальной задачей. Использование биоматериала на основе бесклеточного матрикса, производимого МСК человека, позволит обеспечить комплексное решение проблем, возникающих при регенерации тканей после повреждения. Предполагается, что ускоренное заживление различных повреждений, в том числе за счет стимуляции дифференцировки, может быть осуществлено с помощью ВКМ, содержащего комбинацию биологически активных компонентов, секретированных МСК человека. Данное решение позволяет получить оптимальный бесклеточный биоматериал, содержащий различные биологически активные компоненты, секретированные клетками человека - т.е. прошедшие необходимые модификации и способствующие дифференцировке стволовых и прогениторных клеток, ангиогенезу и нейрогенезу. При этом биоматериал по данному изобретению не содержит ксеногенных и бактериальных фрагментов, а также обеспечивает сбалансированный эффект секретируемых клетками продуктов за счет воссоздания утраченного микроокружения клеток.
Для получения клеточных пластов нами использованы МСК человека, отвечающие за репарацию и регенерацию тканей и органов как в норме, так и при повреждениях. Одним из наиболее богатых источников МСК у человека является жировая ткань. МСК могут быть легко выделены в результате ферментативной обработки образцов жировой ткани, полученной в результате косметической липосакции или в ходе хирургического удаления жирового отложения. Культивирование изолированных МСК жировой ткани приводит к получению относительно гомогенной популяции мультипотентных стромальных фибробластоподобных клеток.
В заявляемом изобретении могут быть использованы МСК, полученные самостоятельно по любому известному из уровня техники способу (см. Пример 1), так и в виде коммерческих препаратов МСК, имеющих сертификат качества и предназначенных, в том числе, для клинического применения, например, такие как продукт АТСС (АТСС® PCS-500-011), представляющий собой МСК человека, выделенные из липоаспирата, культивированные до 2 пассажа и подвергнутые криоконсервации, или аналогичные.
Ранее нами был подробно изучен состав секретома МСК жировой ткани человека и показано, что ключевыми группами секретируемых этими клетками белков являются компоненты ВКМ и факторы, участвующие в стимуляции ангиогенеза и нейрогенеза. Кроме того, мы показали, что в секретоме МСК содержатся внеклеточные везикулы, которые опосредуют многие регенеративные эффекты этих клеток.
Для реализации данного изобретения используется специализированная среда, поддерживающая рост и функциональные свойства недифференцированных МСК человека и их культивирование в виде клеточных пластов для повышенной продукции компонентов ВКМ: AdvanceSTEM Cell Culture Media (HyClone, USA) с добавлением раствора антибиотиков Penicillin-Streptomycin (HyClone, USA) и добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA), которые берут при следующем соотношении компонентов, об. %:
AdvanceSTEM Cell Culture Media - 89-91;
Раствор антибиотиков Penicillin-Streptomycin - 0,95-1,05;
Добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement - 9,5-10,5.
МСК выделяют из подкожной жировой ткани человека и культивируют в приготовленной по указанной выше схеме среде роста до 4-5 пассажа. Также возможно использование линейных иммортализованных МСК.
Отличительной особенностью изобретения является непосредственная и кратковременная децеллюляризация клеточных пластов из МСК после удаления культуральной среды, что дополнительно может способствовать эффективному удалению потенциально токсичных и иммуногенных компонентов биоматериала, а также обеспечивать сохранение биологически активных компонентов ВКМ, включающих, по меньшей мере, белки внеклеточного матрикса и матриксные внеклеточные везикулы. Помимо прочего, использование для отмывки наиболее физиологичного раствора Хенкса способствует дополнительному сохранению нативных конформаций биологически активных компонентов в составе ВКМ. Кроме того, отличительной особенностью данного изобретения является использование рекомбинатной человеческой ДНКазы I, что дополнительно позволяет исключить наличие ксеногенных продуктов в составе полученного по данному изобретению биоматериала.
Отличительной технической особенностью изобретения является возможность его использования для поддержания пролиферации и выживаемости МСК человека, а также стимуляции дифференцировки этих клеток в адипогенном и остеогенном направлениях при культивировании на полученном в результате реализации изобретения биоматериале.
В результате осуществления данного изобретения получают биоматериал на основе бесклеточного матрикса, производимого МСК человека, который может быть использован как лекарственное средство (препарат) или биоматериал для стимуляции регенерации тканей.
Краткое описание чертежей
Изобретение поясняется чертежами, где на фигурах представлены:
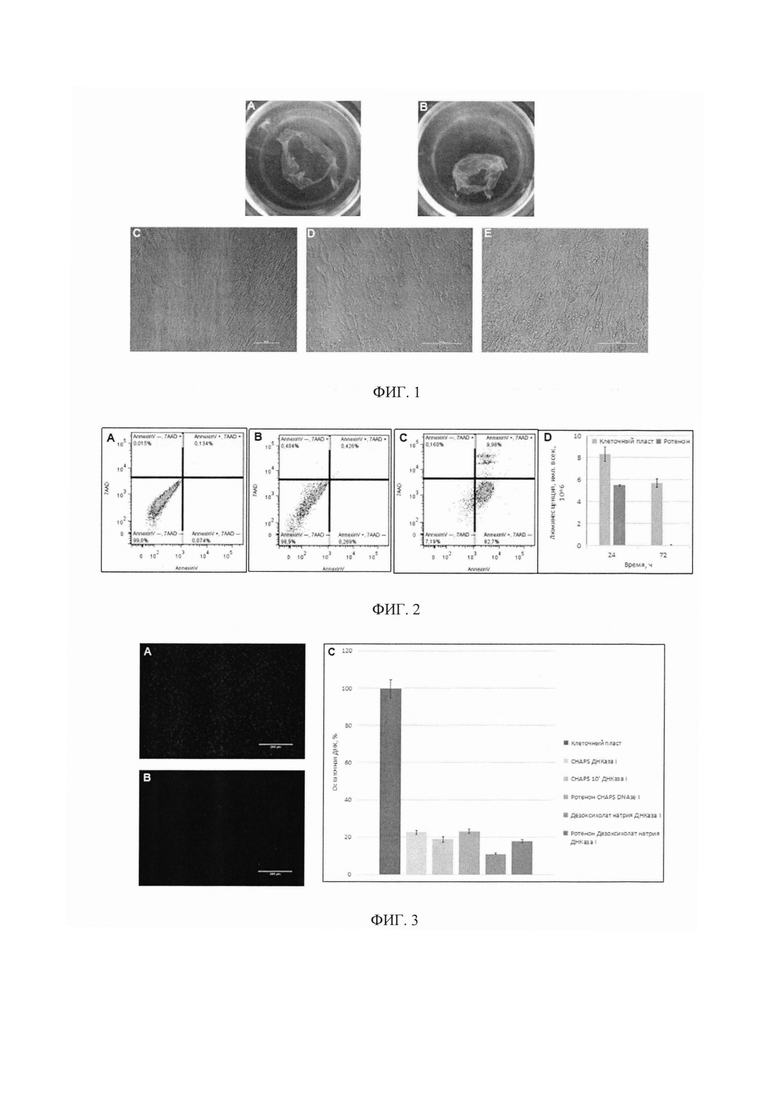
Фигура 1. Примеры полученных биоматериалов: клеточный пласт (Фиг. 1А, 1С) и биоматериалы на основе бесклеточного матрикса МСК жировой ткани человека (Фиг. 1В, 1D, 1Е).
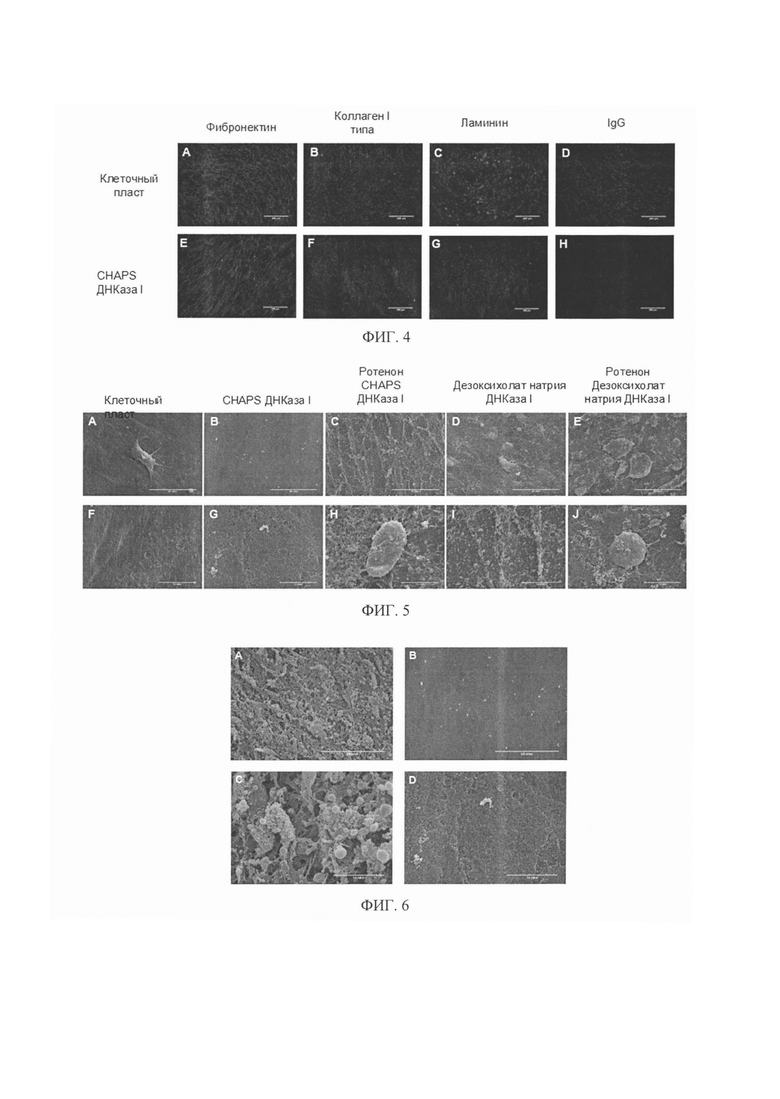
Фигура 2. Диаграмма, отражающая эффективность индукции апоптоза с помощью ротенона в суспезии клеток (Фиг. 2С) и в клеточном пласте (Фиг. 2D). Данные проточной цитометрии суспензии клеток, предварительно обработанной ротеноном, меченной с помощью Аннексина V (Рис. 2А) и 7-AAD (Рис. 2 В). Эффективность апоптоза в клеточных пластах с использованием ротенона показана на диаграмме (Рис. 2D).
Фигура 3. Эффективность децеллюляризации была оценена по мечению DAPI (Фиг. 3А, 3В) и по остаточной ДНК, представленной на диаграмме в процентах от исходного содержания ДНК в клеточном пласте (см. Фиг. 3С). Использование всех протоколов позволило эффективно удалить ДНК (80-90 процентов эффективности). При этом при децеллюляризации дезоксихолатом натрия эффективность удаления ДНК была лучше, но стоит отметить, что количество остаточного матрикса в биоматериале было меньше (Фиг. 1D).
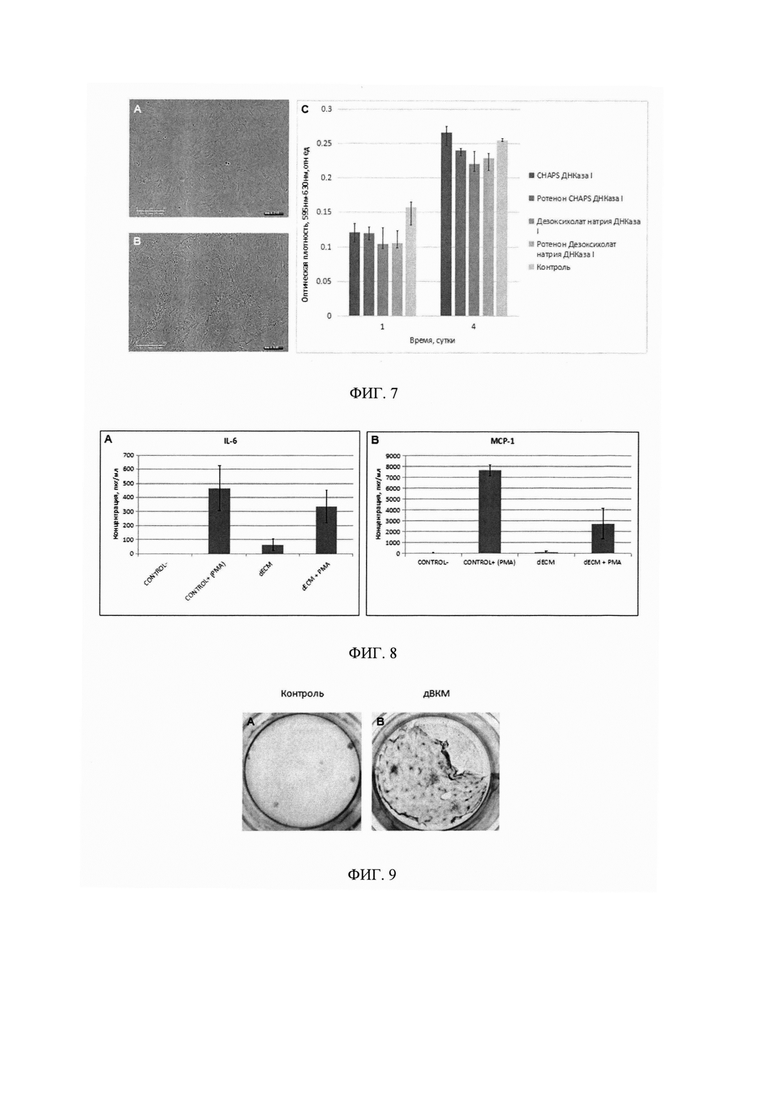
Фигура 4. На фотографиях показано сохранение во всех образцах полученного биоматериала белков ВКМ, а именно коллагена I типа, фибронектина, ламинина, что было оценено с помощью иммуногистохимического анализа.
Фигура 5. Микроструктура полученных биоматериалов. При децеллюляризации клеточного пласта с помощью дезоксихолата натрия ВКМ был существенно разрушен и имел сетчатую структуру (Фиг. 1D, 5С). При децеллюляризации с помощью CHAPS ВКМ сохранялся лучше (Фиг. 5B, 5G). Предварительная инкубация клеточных пластов с ротеноном также влияла на сохранение остатков клеток.
Фигура 6. Микроструктура биоматериалов с разным временем обработки клеточных пластов детергентом CHAPS (от 3 до 10 минут). В результате обработки CHAPS в течение 3 минут наблюдали высокую эффективность децеллюляризации (Фиг. 3) и получили плотный объемный массив сохраненного ВКМ с отдельно выделяющимися везикулярными структурами, или матриксными везикулами (Фиг. 6А, 6С)
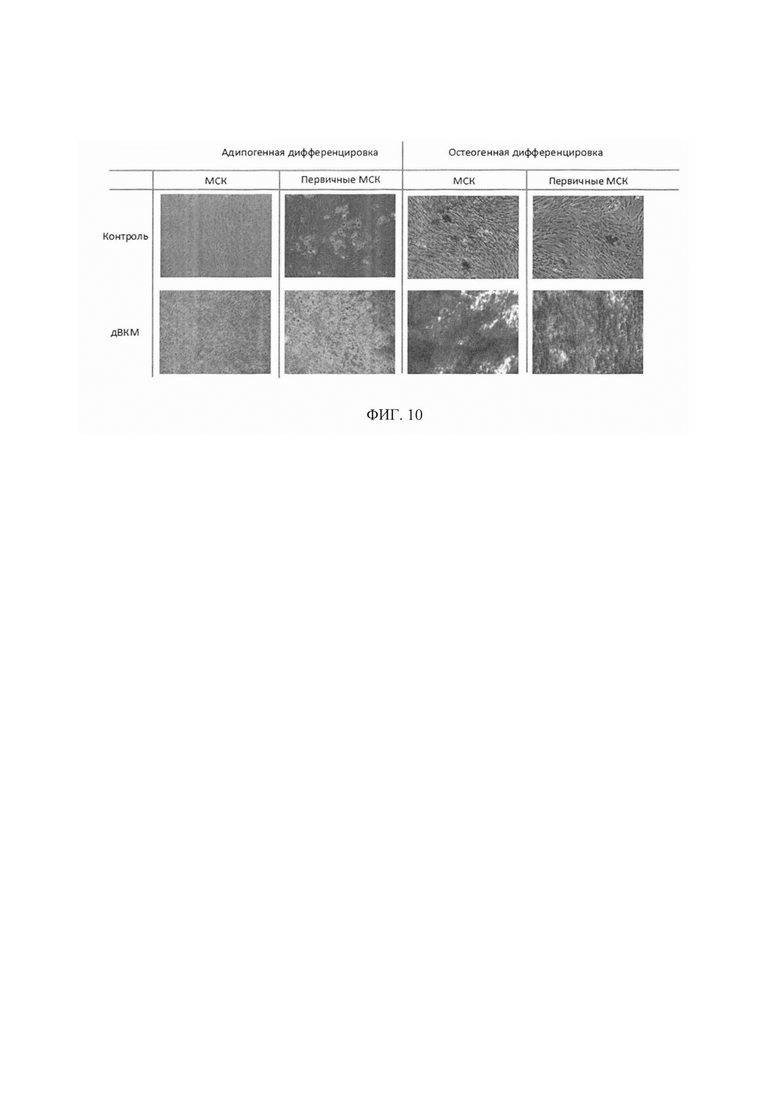
Фигура 7. Репрезентативные микрофотографии, отражающие результаты прижизненного анализа в системе Incucyte. Показано, что МСК адгезируют на поверхности образцов дВКМ и пролиферируют в течение всего срока эксперимента. На диаграмме (Фиг. 7С) представлены результаты количественной оценки пролиферации с использованием МТТ-теста, демонстрирующие различия в поддержании пролиферации клеток между образцами. Так, клетки больше пролиферировали на биоматериале, полученном с помощью обработки клеточных пластов CHAPS с ДНКазой I.
Фигура 8. Профайл цитокинов, продуцируемых клетками промоноцитарной линии человека (ТНР-1) после культивирования на пластике и на дВКМ. На диаграмме представлены уровни секреции IL-6 (Фиг. 8А) и МСР-1 (Фиг. 8В) моноцитами/макрофагами человека, в том числе под воздействием форболового эфира (РМА), измеренные с помощью иммуноферментного анализа.
Фигура 9. Результаты теста на колониеобразование (CFU-теста) после 14 дней культивирования показали, что МСК ЖТ образуют колонии на пластике и на биоматериале. При этом площадь образованных колоний была значительно больше при культивировании МСК на дВКМ.
Фигура 10. Для оценки влияния полученного биоматериала на дифференцировку в остеогенном и адипогенном направлениях иммортализованные МСК и первично выделенные МСК жировой ткани культивировали в течение 10-ти дней на пластике или на дВКМ в индукционных средах роста. дВКМ значительно ускорял остеогенную дифференцировку клеток по сравнению с дифференцировкой клеток на пластике. Наибольшая разница проявлялась на 10-й день, когда для клеток, культивируемых на пластике, наблюдали только первые признаки дифференцировки, в то время как клетки, культивированные на дВКМ, почти полностью дифференцировались в остеогенном направлении. Адипогенная дифференцировка первичных МСК была так же более выраженной при культивировании клеток на дВКМ по сравнению с пластиком.
Осуществление изобретения
Ниже представлено подробное описание изобретения на примерах конкретного выполнения, которые демонстрируют практическую осуществимость изобретения, но не ограничивают возможность осуществления изобретения с помощью иных средств и методов.
Пример 1. Культивирование МСК жировой ткани человека.
МСК выделяют из подкожного жирового отложения здоровых доноров обоих полов. Клетки выделяют из материала, полученного при проведении малого хирургического вмешательства под местной анестезией или в ходе плановых хирургических операций. Хирургический материал (15 г жировой ткани, взятой из околопупочной области или другой области локализации подкожного жира) помещают в одноразовую пробирку с буфером HBSS (HyClone) содержащим 5-ти кратную концентрацию антибиотика 500 ед/мл (HyClone).
В стерильных условиях культурального бокса биоптат фрагментируют до однородной массы, используя стерильные инструменты, после чего подвергают его ферментативной обработке в растворе, содержащем среду AdvanceSTEM™ (HyClone) /500 ед/мл антибиотика (HyClone), 200 ед/мл коллагеназы I типа и диспазы (40 ед/ml) (Worthington Biochemical) (соотношение объема ферментов и жира должно быть 1:1:1), при 37°С в течение 30-45 минут при постоянном помешивании. По окончании инкубации к образцу добавляют равный объем среды с сывороткой и фильтруют через нейлоновые мембраны с размером пор 100 мкм (BD). Профильтрованную суспензию центрифугируют в течение 5 мин при 200 g, после чего супернатант полностью удаляют. Осадок клеток подвергают обработке буфером для лизиса эритроцитов (BD) до покраснения раствора, после чего центрифугируют в течение 5 мин при 200 g. Супернатант полностью удаляют, а осажденные клетки ресуспендируют в среде роста МСК. Для культивирования мезенхимных клеток используют среду AdvanceSTEM™ support expansion and maintenance of undifferentiated human MSCs (HyClone) в сочетании с добавлением 10 об. % раствора добавок AdvanceSTEM™ Stem Cell Growth Supplement (HyClone) и 100 ед/мл антибиотика (HyClone). Эта среда была разработана фирмой-производителем (HyClone) для культивирования недифференцированных МСК, в частности клеток, происходящих из жировой ткани, без добавления сыворотки (http://www.thermo.com).
Линию иммортализованных мезенхимных стромальных клеток (МСК), выделенных из жировой ткани человека (ASC52telo, АТСС®) использовали для сборки клеточных пластов и получения ВКМ. МСК культивировали в среде роста AdvanceSTEM™ (HyClone, USA) с добавлением 10 об. % Mesenchymal Stem Cell Growth Supplement (HyClone, USA), 1 об. % раствора антибиотика/антимикотика (HyClone, USA), 1 об. % GlutaMAX-1 (Gibco, USA) в атмосфере 5% CO2 при 37°C.
Для получения ВКМ из клеточных пластов МСК высаживали на культуральный пластик в количестве 50,000 клеток/мл и культивировали в течение 14-ти дней.
Пример 2. Получение биоматериала на основе бесклеточного матрикса, производимого МСК жировой ткани человека.
Для получения ВКМ или бесклеточного матрикса из клеточных пластов МСК удаляли среду для культивирования. Затем клеточные пласты были обработаны одним из детергентов: 0,5-1 масс. % 3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate (CHAPS) (Sigma, Germany), 0,1-0,5 масс. % дезоксихолат натрия (Sigma, Germany), растворенные в фосфатном буфере (PBS) (Панэко, Россия) в количестве 250-300 мкл на 1 кв.см, клеточного пласта в течение разных временных интервалов (от 3 до 10 минут) при комнатной температуре, после чего промывали 2-5 раз стерильным раствором Хенкса (HBSS) (Панэко, Россия), и инкубировали с ДНКазой I (50 Е/мл, SciStore, Россия) в количестве 125-150 мкл раствора на 1 кв.см, клеточного пласта в течение 30-120 мин при 37°С. Все представленные концентрации использованных реагентов и сроки инкубации были исследованы в пограничных и средних значениях указанных интервалов, для которых была показана их сравнимая эффектность для получения дВКМ. Кроме того, в качестве нового подхода к децеллюляризации в протокол был включен индуктор апоптоза - ротенон. За 24 часа до обработки детергентами к некоторым образцам добавляли 500 нМ ротенона (Sigma, Germany) в среду культивирования из расчета 250-300 мкл раствора в среде на 1 кв. см, клеточного пласта и затем проводили децеллюляризацию, как описано выше. Для подготовки полученного биоматериала к культивированию клеток дВКМ промывали 2-3 раза стерильным раствором Хенкса (HBSS) (Панэко, Россия).
Влияние индуктора апоптоза на клетки в суспензии исследовали на проточном цитометре с помощью мечения клеток в состоянии апоптоза посредством Annexin V (Invitrogen, США) и мертвых клеток посредством 7-Aminoactinomycin D (7-AAD)(BioLegend, США), а также в составе клеточного пласта исследовали с помощью оценки количества аденозин трифосфата с использованием ATPlite 1 step kit (PerkinElmer, США).
Так как не предполагается снятие перед децеллюляризацией клеточного пласта с поверхности культуральной емкости и обработка его дополнительными агентами, после децеллюляризации его можно снять с поверхности подручными инструментами (пинцет, или пластиковый носик, или пластиковый стерильный скребок) и нанести на фармацевтически приемлемый носитель. Полученный биоматериал возможно высушить при 25±2°С или с использованием лиофильной сушки и использовать как покрытие для культивирования клеток, сохранив биологически активные вещества. Хранение необходимо осуществлять при -80±2°С с предварительной регидратацией перед последующим использованием.
Пример 3. Оценка эффективности децеллюляризации полученного биоматериала на основе бесклеточного матрикса, производимого МСК жировой ткани человека.
Эффективность децеллюляризации оценивали по количеству остаточной ДНК, которую измеряли с помощью набора PicoGreen assay kit (Life Technologies, USA) согласно инструкции производителя. Образцы дВКМ лизировали в 500 мкл тризола в течение 10 мин при комнатной температуре. Лизаты разводили в 50 раз раствором буфера ТЕ. 100 мкл лизата помещали в 96-ти луночный планшет со 100 мкл красителя PicoGreen. Планшет инкубировали в темноте в течение 10 минут и затем измеряли оптическую плотность на планшетном спектрофотометре The 2104 EnVision® Multilabel Plate Readers (PerkinElmer, США).
Пример 4. Изучение морфологии и биологически активных компонентов полученного биоматериала.
Для подготовки к исследованию методом сканирующей электронной микроскопии (далее - СЭМ) образцы дВКМ фиксировали в 10 об. % нейтральном формалине, после чего отмывали в дистиллированной воде и обезвоживали в спиртах восходящей концентрации, смеси спирт-ацетон и далее чистом ацетоне. Далее использовали метод сушки в критической точке с помощью аппарата Quorum K350 (Quorum gala instrument gmbh, Германия). Подготовленные таким образом образцы монтировали на специальный алюминиевый столик токопроводящим углеродным клеем, напыляли золотом или платино-паладиевым сплавом в напылительной установке Quorum Q150TS (Quorum gala instrument gmbh, Германия) и просматривали в сканирующем электронном микроскопе S 3400N (Hitachi, Япония).
Сохранение белков ВКМ исследовали с помощью иммуногистохимического анализа с применением антител против коллагена I типа, фибронектина и ламинина. дВКМ фиксировали в 4 масс. % параформальдегиде (Panreac, Испания) в течение 30 мин, затем инкубировали в 0,2 об. % растворе Triton X100 (Sigma, США) в течение 10 мин. Далее для блокировки неспецифического связывания антител образцы дВКМ инкубировали в растворе, содержащем 1 масс. % бычьего сывороточного альбумина (БСА) (Sigma, Germany) и 10 об. % нормальной сыворотки козла (Abcam, Великобритания) в течение 1 ч при комнатной температуре. Затем, образцы инкубировали с первичными поликлональными антителами кролика к коллагену I типа, фибронектину и ламинину (Abcam, Великобритания) в растворе с 1 масс. % БСА при +4°С в течение ночи. В качестве вторых антител использовали флуоресцентно меченые антитела козла против IgG кролика (Invitrogen, США). Ядра клеток метили DAPI (DAKO, США). Препараты анализировали с помощью флуоресцентного микроскопа Leica DM6000B, оборудованного камерой Leica DFC 360FX camera (Leica Microsystems GmbH, Германия).
Пример 5. Изучение иммуногенности и влияния полученного биоматериала на дифференцировку моноцитов в макрофаги.
Линию промоноцитарных клеток человека (ТНР-1) культивировали в среде RPMI1640 (Gibco, USA) с добавлением 10 об. % эмбриональной бычьей сыворотки (FBS) (Gibco, USA), 1 об. % раствора антибиотика/антимикотика (HyClone, USA), 1 об .% GlutaMAX-1 (Gibco, USA), 1 об. % HEPES (Gibco, USA) и 0,0001 об. % β-меркаптоэтанола (Sigma, USA) в атмосфере 5% CO2 при 37°С.
Для оценки иммуногенности оценивали способность дВКМ влиять на спонтанную и индуцированную дифференцировку макрофагов. Для этого промоноциты линии ТНР-1 в количестве 500,000 клеток/мл добавляли в 12-ти луночный планшет на пластик или дВКМ. В качестве индуктора макрофагальной дифференцировки добавляли форболовый эфир (форбол-12-миристат-13-ацетат, ФМА, FMA) (Sigma, США) в концентрации 50 нг/мл. Культивировали клетки в течение 7 суток, после чего собирали кондиционированную среду, центрифугировали ее при 300 g 10 минут. В супернатанте анализировали концентрацию IL-6, IL-8, IL-10, IL-12p70, МСР-1 с помощью наборов для иммуноферментного анализа (R&D, США), согласно инструкции производителя. Оптическую плотность образцов измеряли на длинах волн 450 нм и 525 нм на планшетном спектрофотометре The 2104 EnVision® Multilabel Plate Readers (PerkinElmer, США).
Пример 6. Определение эффективности стимуляции пролиферации и образования колоний МСК человека при культивировании на биоматериале на основе дВКМ.
МСК ЖТ человека были высажены в 12-ти луночный планшет, покрытый дВКМ, в количестве 15000/мл. Затем планшеты помещали в систему IncuCyte® ZOOM Live Cell Analysis System (Essen Bioscience, США) и осуществляли цейтраферную съемку каждые 4 часа в течение 4-х дней.
Для оценки пролиферации МСК ЖТ человека высаживали на культуральный пластик, покрытый дВКМ, в количестве 15000/мл, и культивировали в течение 4-х дней. Пролиферацию оценивали методом МТТ (Paneco, Russia) на 1 и 4 день. Показания считывали на планшетном спектрофотометре The 2104 EnVision® Multilabel Plate Readers (PerkinElmer, США).
Для определения свойства дВКМ поддерживать образование колоний проводили CFU-тест. МСК высаживали на 6-ти луночный планшет, покрытый дВКМ, в количестве 70 клеток/мл. Клетки культивировали в течение 2-х недель, затем фиксировали раствором 4 масс. % параформальдегида и окрашивали кристаллическим фиолетовым (Sigma, USA) в течение 30 мин при комнатной температуре, после чего оценивали число и средний размер колоний в каждой лунке.
С учетом полученных результатов биоматериал может быть использован для поддержания пролиферации и выживаемости стволовых и прогениторных клеток при введении в поврежденные ткани. Полученные при культивировании на дВКМ клетки могут быть использованы по отдельности (после открепления от биоматериала) или вместе с биоматериалом для клеточной терапии с целью стимуляции эндогенной регенерации тканей после повреждения.
Пример 7. Оценка влияния биоматериала на основе дВКМ на дифференцировку МСК человека в остеогенном и адипогенном направлениях
Дифференцировку МСК ЖТ человека в остеогенном и адипогенном направлении i проводили с использованием наборов StemPro™ Osteogenesis Differentiation Kit (Gibco, США) и StemPro™ Adipogenesis Differentiation Kit (Gibco, США), соответственно, согласно инструкциям производителя.
Первичные или линейные МСК были высажены в 12-ти луночные планшеты, покрытые дВКМ, или на пластик в количестве 15,000 клеток/мл, культивированы в течение 48 ч в полной среде роста. Через 48 ч среда была сменена на дифференцировочную, смена среды на свежую производилась каждые 3 дня. Клетки культивировали в течение 10 дней, после чего образцы фиксировали раствором 4 масс. % параформальдегида в течение 30 мин. Для качественной оценки дифференцировки окрашивали клетки раствором ализаринового красного из набора The Mesenchymal Stem Cell Osteogenesis Kit (Chemicon, США) для остеогенной дифференцировки и раствором Oil Red О из набора Mesenchymal Stem Cell Adipogenesis Kit (Chemicon, США) для адипогенной дифференцировки, согласно инструкциям производителя.
С учетом полученных результатов биоматериал может быть использован для стимуляции остеогенеза или адипогенеза в соответствующих тканях. Полученные при культивировании и индукции дифференцировки в нужном направлении на дВКМ клетки могут быть использованы по отдельности (после открепления от биоматериала) или вместе с биоматериалом для замещения утраченных при повреждении участков костной или жировой тканей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2620167C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2652902C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ТКАНЕЙ НА ОСНОВЕ КОМПОНЕНТОВ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ СРЕДСТВА | 2020 |
|
RU2766707C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2653779C1 |
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ СОЗДАНИЯ ВЫСОКОРЕГЕНЕРАТИВНОГО РАНЕВОГО ПОКРЫТИЯ | 2022 |
|
RU2795904C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИАЛЬНОЙ КОНТАМИНАЦИИ БИОМАТЕРИАЛОВ | 2016 |
|
RU2630673C1 |
| Способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека | 2022 |
|
RU2813729C1 |
| Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека | 2019 |
|
RU2716594C1 |
Группа изобретений относится к области биохимии, биомедицины и биотехнологии и включает биоматериал на основе бесклеточного матрикса, производимого мезенхимными стромальными клетками (МСК) человека, способ его получения, а также способы стимуляции регенеративных процессов с помощью полученного биоматериала, а именно стимуляции дифференцировки и поддержания пролиферации и жизнеспособности недифференцированных МСК человека, которые являются ключевыми участниками регенерации различных тканей после повреждения. Группа изобретений может быть использована для получения лекарственных средств и биоматериалов для стимуляции регенерации тканей после повреждения, в том числе для реконструктивной хирургии, восстановления мягких тканей, в травматологии и ортопедии. 4 н. и 5 з.п. ф-лы, 10 ил., 7 пр.
1. Биоматериал на основе бесклеточного матрикса, производимого мезенхимными стромальными клетками (МСК) человека, для стимуляции регенеративных процессов, характеризующийся тем, что он включает структурные белки внеклеточного матрикса (ВКМ), коллаген I и IV типов, фибронектин и ламинин, а также заякоренные в дВКМ внеклеточные везикулы размером от 0,5 до 5 мкм, содержащий не более 10-18% остаточной ДНК по сравнению с клеточным пластом и не обладающий иммуногенными свойствами.
2. Способ получения биоматериала по п. 1, включающий следующие стадии:
а) высевание и культивирование МСК человека с использованием питательной среды до формирования клеточного пласта и накопления внеклеточного матрикса (ВКМ), продуцируемого клетками;
б) удаление питательной среды и децеллюляризация клеточного пласта посредством его обработки в течение 3-10 минут детергентом, выбранным из группы, включающей 0,1-0,5 масс. % дезоксихолат натрия, 0,5-1% масс. % 3-[(3-холамидопропил)диметиламмоний-]-1-пропансульфонат (CHAPS), в количестве 250-300 мкл раствора на 1 кв. см клеточного пласта;
в) промывание децеллюляризированного ВКМ (дВКМ) раствором Хенкса 2-5 раз, и инкубирование с ДНКазой I 50 Ед/мл в количестве 125-150 мкл раствора на 1 кв. см клеточного пласта в течение 30-120 минут, с последующим промыванием дВКМ раствором Хенкса с получением биоматериала на основе бесклеточного матрикса.
3. Способ по п. 2, характеризующийся тем, что перед децеллюляризацией полученный на этапе а) клеточный пласт дополнительно инкубируют с использованием среды роста, содержащей индуктор апоптоза.
4. Способ по п. 3, характеризующийся тем, что индуктор апоптоза выбран из группы блокаторов переноса электронов в дыхательной цепи митохондрий.
5. Способ по п. 3, характеризующийся тем, что в качестве индуктора апоптоза использован ротенон 500 нМ в количестве 250-300 мкл раствора на 1 кв. см клеточного пласта.
6. Способ стимуляции регенеративных процессов с использованием биоматериала по п. 1, полученного способом по п. 2, путем замещения утраченных при повреждении участков костной или жировой ткани человека, характеризующийся тем, что он включает следующие стадии: а) высевание клеток МСК на биоматериал по п. 1 в питательной среде и наращивание до формирования клетками монослоя, б) замену питательной среды на индукционную среду для дифференцировки, где индукционная среда для дифференцировки выбрана из группы, включающей среду для остеогенной или адипогенной дифференцировки, в) культивирование в течение 5-21 суток, г) введение в поврежденный участок полученного биоматериала с клетками или без клеток, открепленных от биоматериала.
7. Способ по п. 6, характеризующийся тем, что в качестве индукционной среды для дифференцировки выбрана остеогенная среда роста, содержащая, по крайней мере, дексаметазон 10-8 М, β-глицерол-2-фосфата 10 мМ, 2-фосфо-L-аскорбиновую кислоту 0,2 мМ.
8. Способ по п. 6, характеризующийся тем, что в качестве индукционной среды для дифференцировки выбрана адипогенная среда роста, содержащая, по крайней мере, дексаметазон 10-6 М, инсулин 10 мкМ, индометацин 200 мкМ, 3-изобутил-1-метилксантин 0,5 мM.
9. Способ стимуляции регенеративных процессов тканей после повреждения путем повышения пролиферации и жизнеспособности стволовых и прогениторных клеток человека с использованием биоматериала по п. 1, полученного способом по п. 2, характеризующийся тем, что он включает высевание МСК человека на биоматериал по п. 1 в питательной среде с последующим культивированием в течение 1-7 суток, с последующим использованием наращенных клеток по отдельности после открепления от биоматериала или вместе с биоматериалом для стимуляции эндогенной регенерации тканей после повреждения.
| НИМИРИЦКИЙ П.П | |||
| и др., Клеточные пласты из мезенхимных стромальных клеток жировой ткани человека и получение препаратов внеклеточного матрикса методом децеллюляризации, Технологии живых систем, 2016, Т | |||
| Насос | 1917 |
|
SU13A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| Композиция для изготовления биодеградируемых скаффолдов и способ ее получения | 2017 |
|
RU2684769C1 |
| Способ выделения мезенхимных стволовых клеток из орбитальной жировой ткани | 2015 |
|
RU2609657C1 |
| US 20120288480 A1, 15.11.2012. | |||
Авторы
Даты
2020-04-15—Публикация
2018-12-07—Подача