Изобретение относится к лабораторной медицине, а именно к способам криоконсервации, и может быть использовано для криоконсервации микровезикул плазмы крови.
Микровезикулы - субклеточные везикулы, размером 150-1000 нм, выделяемые клетками во внеклеточное пространство как в норме, так и при патологии [Mause, S.F. and С.Weber, Microparticles: protagonists of a novel communication network for intercellular information exchange. Circ Res, 2010. 107(9): p.1047-57.]. Интерес к ним обусловлен тем, что предполагается их использование в качестве диагностических маркеров различных заболеваний [D'Souza-Schorey, С.and J.W. Clancy, Tumor-derived microvesicles: shedding light on novel microenvironment modulators and prospective cancer biomarkers. Genes Dev, 2012. 26(12): p. 1287-99.], так как показано, что при наличии патологии, уровень микровезикул в биологических жидкостях возрастает [Chironi, G., et al, Circulating leukocyte-derived microparticles predict subclinical atherosclerosis burden in asymptomatic subjects. Arterioscler Thromb Vase Biol, 2006. 26(12): p. 2775-80.3].
По данным мировой литературы в настоящее время проводится множество исследований микровезикул. Однако работа с микровезикулами достаточно трудоемка и требует большого количества времени, также исследование микровезикул пациентов предполагает сбор значительного количества материала для набора исследуемых групп пациентов. В связи с этим разработка протоколов и методов криоконсервации микровезикул является актуальной задачей.
В настоящее время существуют протоколы по заморозке клеток, они хорошо отработаны. Но микровезикулы более чувствительный объект, нежели клетки, поэтому стандартные протоколы криоконсервации клеток не подходят для криоконсервации микровезикул.
Известен способ криоконсервации микровезикул плазмы крови, заключающийся в том, что производится забор венозной крови в специальные пробирки, содержащие цитрат натрия и декстрозу (пробирки - коммерческий продукт), затем производится серия центрифугирований плазмы, обеднение ее от тромбоцитов и быстрая заморозка нескольких миллилитров полученной обедненной от тромбоцитов плазмы в жидком азоте с возможностью хранения образцов в жидком азоте в течение продолжительного срока [Gelderman, М.Р. and J. Simak, Flow cytometric analysis of cell membrane microparticles. Methods Mol Biol. 2008. 484: p. 79-931.
Недостатком способа является частичная гибель микровезикул по сравнению с исходным материалом, а также выпадение в осадок фибрина после размораживания. Кроме того, в России в стандартных медицинских учреждениях не используют готовые пробирки, предлагаемые исследователями из США, поэтому для проведения исследования их нужно приобретать за рубежом.
Известен способ заморозки микровезикул из культуральной среды, заключающийся в том, что после культивирования ткани в качестве криопротектора используют вещество диметилсульфоксид (ДМСО), при этом исследуют концентрации ДМСО, необходимые для сохранения микровезикул на уровне исходной культуральной среды, а также сравнивают протоколы криоконсервации при различных температурных режимах. Анализ микровезикул производили при помощи проточного цитофлюориметра [Романов Ю.А., Волгина Н.Е., Дугина Т.Н., Кабаева Н.В., Сухих Г.Т., Влияние условий хранения на сохранность микровезикул мультипотентных мезаенхимальных стромальных клеток пупочного канатика человека Клеточные технологии в биологии и медицине, 2019. 1: р. 12-16].
Недостатком способа является то, что в способе не рассматриваются микровезикулы плазмы крови, то есть способ применим к другой культуральной среде.
Технический результат изобретения заключается в увеличении сохранности микровезикул плазмы крови после криозаморозки, снижении расходов, в доступности необходимых средств для исследования.
Указанный технический результат достигается в способе криоконсервации микровезикул плазмы крови, включающем забор венозной крови с добавлением цитрата натрия и декстрозы, центрифугирование с целью обеднения тромбоцитами в режиме 9900g при температуре 10°С в течение 5 минут и быструю заморозку в жидком азоте для длительного хранения, в котором венозную кровь забирают в пробирки с цитратом натрия, добавляют раствор декстрозы и раствор гепарина в соотношении 3,8% цитрата натрия, 3,68 мг декстрозы, 30 ЕД гепарина на 1 мл венозной крови, центрифугируют, затем плазму, обедненную от тромбоцитов, смешивают с ДМСО и фильтрованной эмбриональной телячьей сывороткой (ЭТС) в соотношении: 40% ЭТС, 10% ДМСО, 50% плазмы, замораживают в жидком азоте.
Соотношение 3,8% цитрата натрия, 3,68 мг декстрозы, 30 ЕД гепарина на 1 мл венозной крови определено экспериментально. Могут быть использованы стандартные пробирки с цитратом натрия.
Добавление гепарина в плазму на этапе криконсервации позволяет избежать выпадения в осадок фибрина после разморозки плазмы.
Смешивание плазмы, обедненной от тромбоцитов, с ДМСО и ЭТС в соотношении 40% ЭТС, 10% ДМСО, 50% плазмы позволяет сохранить микровезикулы различных клеточных популяций, в том числе минорных популяций.
Таким образом, основные отличительные признаки заявляемого способа позволяют улучшить качество криоконсервации плазмы крови, повысить сохранность микровезикул после разморозки, а также удешевить способ и сделать его более доступным.
Анализ микровезикул проводили на проточном цитофлюориметре.
Для анализа микровезикул образцы плазмы быстро размораживали на водяной бане при 37°С, центрифугировали ее, проводили серию отмывок специальными буферами (коммерческие реагенты) полученного осадка микровезикул, далее микровезикулы окрашивали антителами и исследовали при помощи проточного цитофлюориметра.
Производилась криоконсервация плазмы доноров, в отсутствии каких-либо криопротекторов, так и присутствии отдельных криопротекторов и их смесей, а также произведено сравнение с нативной свежей плазмой. Исследуемые способы криоконсервации (соотношения реагентов везде одинаковые):
1. Криоконсервация плазмы в отсутствии криопротекторов;
2. Криоконсервация плазмы с добавлением только декстрозы;
3. Криоконсервация плазмы с добавлением только ДМСО;
4. Криоконсервация плазмы с добавлением только ЭТС;
5. Криоконсервация плазмы с добавлением ЭТС и ДМСО;
6. Криоконсервация плазмы с добавлением декстрозы, ДМСО и ЭТС (заявляемый способ);
В табл. 1 представлены результаты сравнения способов криоконсервации. Показано количество событий, собранных в результате анализа содержания микровезикул после разморозки плазмы на проточном цитофлюориметре.
Данные представлены в виде «медиана {нижний квартиль; верхний квартиль}». Достоверность различий между группами: ## - р<0.01 - отличие от способа криоконсервации с добавлением декстрозы, ДМСО и ЭТС (заявляемый способ); && - р<0.01, &&& - р<0.001 - отличие от свежей плазмы.
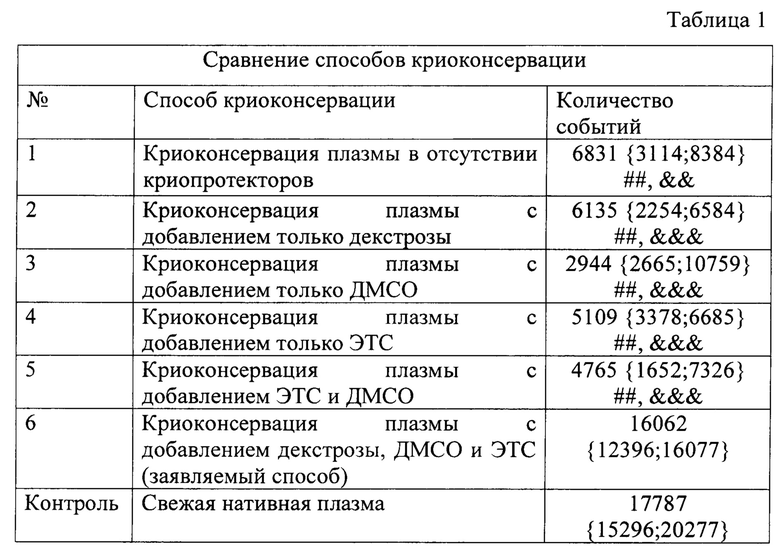
Сравнение способов криоконсервации плазмы иллюстрируется также фиг 1, где:
П-плазма, Плазма_крио - способ криоконсервации плазмы в отсутствии криопротекторов; П+декстроза - способ криоконсервации плазмы с добавлением только декстрозы; П+ДМСО - способ криоконсервации плазмы с добавлением только ДМСО; П+ЭТС - способ криоконсервации плазмы с добавлением только ЭТС; П+ДМСО+ЭТС - способ криоконсервации плазмы с добавлением ЭТС и ДМСО; П+декстроза+ДМСО+ЭТС - способ криоконсервации плазмы с добавлением декстрозы, ДМСО и ЭТС (заявляемый способ); Плазма_свежая - нативная свежая плазма. Данные представлены в виде «медиана {нижний квартиль; верхний квартиль}». Достоверность различий между группами: ## - р<0.01 -отличие способа криоконсервации с добавлением декстрозы, ДМСО и ЭТС отличие способа криоконсервации с добавлением декстрозы, ДМСО и ЭТС (заявляемый способ); && - р<0.01,&&& - р<0.001 - отличие от свежей плазмы.
Полученные данные были статистически обработаны с помощью программы Graph Prism 8.0. Для сравнение полученных данных использовался многофакторный дисперсионный анализ Anova. Статистически значимыми признавались различия при р<0,05, р<0,01, р<0,001. Эксперименты проводили четыре раза, в каждом эксперименте для каждого способа криоконсервации использовали по 3 повтора.
Выявлено, что заявляемый способ криоконсервации позволяет сохранить популяцию лейкоцитарных микровезикул - минорную популяцию микровезикул плазмы крови, на уровне сопоставимом со свежей нативной плазмой.
Способ осуществляют, например, следующим образом.
Материалы и растворы, необходимые для криоконсервации микровезикул из периферической крови:
1. Декстроза (моногидрат D-глюкозы).
2. Раствор Хенкса без Са2+ и Mg2+ или эквивалентный раствор.
3. Эмбриональная телячья сыворотка (ЭТС).
4. Диметилсульфоксид (ДМСО).
5. Гепарин натрия (раствор для инъекций).
6. Пробирки для забора крови, содержащие 3.8% цитрата натрия или эквивалентные пробирки с содержанием цитрата натрия, достаточным для ингибирования свертывания крови.
7. Мембранные фильтры с диаметром пор 0,2 мкм.
8. Пробирки эппендорф.
9. Криопробирки.
10. Одноразовые наконечники для дозаторов переменного объема до 10 мкл, до 300 мкл, до 1000 мкл.
Необходимое оборудование:
1. Вертикальный ламинарно-потоковый шкаф.
2. Набор механических дозаторов переменного объема.
3. Центрифуга.
4. Холодильник 6+2°С.
5. Жидкий азот и сосуд Дьюара для жидкого азота.
6. Аккумуляторы холода (хладагенты) лабораторные.
Перед криоконсервацией микровезикул необходимо:
1. Сделать стерильный раствор декстрозы в растворе Хенкса без Са2+ и Mg2+ или эквивалентном растворе, профильтровать его через фильтры с диаметром пор не более 0,2 мкм.
2. Инактивировать ЭТС, и профильтровать ее через фильтры с диаметром пор не более 0,2 мкм.
Затем осуществляют криоконсервацию микровезикул.
Это можно делать как в стерильных условия, работая в ламинарно-потоковом шкафу, так и в нестерильных условиях. В обоих случаях необходимо работать с использованием лабораторных хладагентов.
1. Произвести забор крови из локтевой вены в пробирку с голубой крышкой, содержащей 3.8% цитрата натрия или эквивалентную пробирку с содержанием цитрата натрия, достаточным для ингибирования свертывания крови.
2. Пробирки со свежей кровью хранить не более 1 часа при +4°С.
3. В пробирку со свежей кровью добавляют раствор декстрозы, приготовленный в растворе Хенкса без Са2+ и Mg2+ или эквивалентном растворе из расчета 3,68 мг декстрозы на 1 мл периферической крови.
4. Аккуратно перемешивают содержимое пробирки, переворачивая ее несколько раз.
5. Центрифугируют пробирку с периферической кровью и раствором декстрозы при +10°С, 2600g 15 минут (стадия обеднения плазмы от клеточной массы);
6. Переносят плазму, обедненную от клеточной массы в пробирки эппендорф.
7. Добавляют гепарин натрия в пробирки эппендорф с отобранной плазмой из расчета 30 ЕД гепарина натрия на 1 мл плазмы.
8. Центрифугируют пробирки эппендорф с плазмой при +10°С, 9900g 5 минут (стадия обеднения плазмы от тромбоцитов).
9. Маркируют криопробирки, переносят в них плазму, обедненную от тромбоцитов, добавляют ЭТС и ДМСО. Конечный раствор плазмы в криопротекторах должен содержать: 40% ЭТС, 10% ДМСО и 50% плазмы.
10. Аккуратно перемешивают содержимое, переворачивая криопробирку несколько раз.
11. Криопробирки с содержимым быстро замораживают в жидком азоте. Для этого помещают криопробирки в резервуар для хранения в жидком азоте (сосуд Дьюара), хранят до проведения дальнейшего анализа.
Способ позволяет повысить качество заморозки микровезикул, увеличить сохранности микровезикул плазмы крови после криозаморозки, снизить расходы на исследование, обеспечить доступность необходимых средств для исследования.
Список литературы
1. Mause, S.F. and С.Weber, Microparticles: protagonists of a novel communication network for intercellular information exchange. Circ Res, 2010. 107(9): p. 1047-57.
2. D'Souza-Schorey, C. and J.W. Clancy, Tumor-derived micro vesicles: shedding light on novel microenvironment modulators and prospective cancer biomarkers. Genes Dev, 2012. 26(12): p. 1287-99.
3. Chironi, G., et al., Circulating leukocyte-derived microparticles predict subclinical atherosclerosis burden in asymptomatic subjects. Arterioscler Thromb Vase Biol, 2006. 26(12): p. 2775-80.
4. Federici, C, et al., Natural-Killer-Derived Extracellular Vesicles: Immune Sensors and Interactors. Front Immunol, 2020. 11: p. 262.
5. Mikhailova, V.A., et al., Detection of microparticles of leukocytic origin in the peripheral blood in normal pregnancy and preeclampsia. Bull Exp Biol Med, 2014.157(6): p. 751-6.
6. Khalaj, K., et al., Extracellular vesicles from endometriosis patients are characterized by a unique miRNA-lncRNA signature. JCI Insight, 2019. 4(18).
7. Gelderman, M.P. and J. Simak, Flow cytometric analysis of cell membrane microparticles. Methods Mol Biol, 2008. 484: p. 79-93.
8. Романов Ю.А., Волгина Н.Е., Дугина Т.Н., Кабаева Н.В., Сухих Г.Т., Влияние условий хранения на сохранность микровезикул мультипотентных мезаенхимальных стромальных клеток пупочного канатика человека Клеточные технологии в биологии и медицине, 2019. 1: р. 12-16.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ отмывания криоконсервированных мезенхимальных стромальных клеток | 2024 |
|
RU2829884C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТАВА ИНДИВИДУАЛЬНЫХ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ В КРОВИ ЧЕЛОВЕКА | 2014 |
|
RU2583940C1 |
| СПОСОБ ВИТРИФИКАЦИИ ОВАРИАЛЬНОЙ ТКАНИ | 2018 |
|
RU2678106C2 |
| Способ криоконсервации аутологичных вагинальных лактобацилл | 2022 |
|
RU2802074C1 |
| Состав криоконсерванта для длительного хранения первичных кератиноцитов | 2019 |
|
RU2731065C1 |
| Способ сохранения бактерий в фекальной микробиоте и бактериальных культур, выращенных на плотных агаризованных питательных или дифференциальных средах в условиях низких температур с использованием составной среды для заморозки | 2019 |
|
RU2737321C1 |
| Применение пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({ [(1S, 2R, 5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил} тио)ацетата, обладающий ингибирующим действием на активацию тромбоцитов | 2015 |
|
RU2671567C2 |
| СПОСОБ ДИАГНОСТИКИ НАРУЖНОГО ГЕНИТАЛЬНОГО ЭНДОМЕТРИОЗА | 2021 |
|
RU2761539C1 |
| Способ заморозки ооцитов крупного рогатого скота | 2018 |
|
RU2707252C1 |
| Способ оптимизации криоконсервации овариальной ткани для долгосрочного хранения | 2022 |
|
RU2794963C1 |
Изобретение относится к медицинской биотехнологии, а именно к способам криоконсервации, и может быть использовано для криоконсервации микровезикул плазмы крови. С этой целью венозную кровь забирают в пробирки с цитратом натрия, добавляют раствор декстрозы и раствор гепарина натрия в соотношении 3,8% цитрата натрия, 3,68 мг декстрозы, 30 ЕД гепарина на 1 мл венозной крови, центрифугируют, затем плазму, обедненную от тромбоцитов, смешивают с ДМСО и фильтрованной эмбриональной телячьей сывороткой (ЭТС) в соотношении 40% ЭТС, 10% ДМСО, 50% плазмы и замораживают в жидком азоте. Способ позволяет повысить качество заморозки микровезикул, увеличить сохранность микровезикул после криозаморозки, снизить расходы и обеспечить доступность необходимых средств для исследования. 1 ил., 1 табл.
Способ криоконсервации микровезикул плазмы крови, включающий забор венозной крови с добавлением цитрата натрия и декстрозы, центрифугирование с целью обеднения тромбоцитами в режиме 9900 g при температуре 10°С в течение 5 минут и быструю заморозку в жидком азоте для длительного хранения, отличающийся тем, что венозную кровь забирают в пробирки с цитратом натрия, добавляют раствор декстрозы и раствор гепарина натрия в соотношении 3,8% цитрата натрия, 3,68 мг декстрозы, 30 ЕД гепарина на 1 мл венозной крови центрифугируют, затем плазму, обедненную от тромбоцитов, смешивают с ДМСО и фильтрованной эмбриональной телячьей сывороткой (ЭТС) в соотношении 40% ЭТС, 10% ДМСО, 50% плазмы и замораживают в жидком азоте.
| GELDERMAN, M.P, et al, Flow cytometric analysis of cell membrane microparticles | |||
| Methods Mol Biol, 2008 | |||
| Способ генерирования переменного тока | 1923 |
|
SU484A1 |
| Цилиндрический сушильный шкаф с двойными стенками | 0 |
|
SU79A1 |
| РОМАНОВ Ю.А., Волгина Н.Е., Дугина Т.Н., Кабаева Н.В., Сухих Г.Т | |||
| Влияние условий хранения на сохранность микровезикул мультипотентных мезенхимальных стромальных клеток пупочного канатика человека Клеточные технологии в биологии | |||
Авторы
Даты
2021-04-22—Публикация
2020-09-21—Подача