Изобретение относится к химии серосодержащих и терпеновых соединений, а именно к терпенсульфиду - метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио) ацетату, обладающего антиагрегационным и антикоагуляционным свойствами, который может быть использован в медицинской практике при заготовке и хранении препаратов крови в качестве средства для консервации тромбоконцентратов и создания нового лекарственного средства для профилактики тромбозов.
Известны средства, обладающие антиагрегационным действием (2-ЦИКЛОАЛКИЛ-АМИНО-5-ТИЕНИЛ-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ / Чупахин О.Н. [и др.]; заявитель и патентообладатель Государственное образовательное учреждение высшего профессионального образования "Уральский государственный технический университет-УПИ"; заявл. 2008130297/04, 22.07.2008; опубл. 20.01.2010), (Пат. 2039558 РФ, А61K 31/44, А61K 31/505).
СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ / Киричук В.Ф. [и др.]; заявитель и патентообладатель Саратовский государственный медицинский институт - №93035343/14, заявл. 07.07.1993, опубл. 20.07.1995), (Пат. 2186782 РФ, C07J 53/00, C07J 63/00, C07D 271/08, C07D 271/12, А61K 31/50, А61K 31/4245, А61K 31/56).
СРЕДСТВО "ПАТРИМИН", ОБЛАДАЮЩЕЕ СЕДАТИВНЫМ, ГИПОТЕНЗИВНЫМ, АНТИКОАГУЛЯНТНЫМ, АНТИАГРЕГАЦИОННЫМ И ГИПОЛИПИДЕМИЧЕСКИМ ДЕЙСТВИЕМ / Колхир В.К [и др.]; заявитель и патентообладатель Закрытое акционерное общество "Простанорм" - №2001117333/14, заявл. 2001.06.26, опубл. 2002.09.20).
КОМПЛЕКСЫ ВКЛЮЧЕНИЯ ПРОИЗВОДНЫХ 1,2,5-ОКСАДИАЗОЛ-2-ОКСИДА С ПОЛИЦИКЛИЧЕСКИМИ ПРОИЗВОДНЫМИ ГЛЮКОПИРАНОЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ / Хропов Ю.В. [и др.]; заявитель и патентообладатель Биологический факультет Московского государственного университета им. М.В. Ломоносова - №2001101367/04, заявл. 16.01.2001, опубл. 10.08.2002), (Пат.2189241 РФ, А61K 35/78.
НОВЫЕ АРИЛИРОВАННЫЕ КАМФЕНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ / Мечулам Рафаель (IL) [и др.], заявитель ИЙССУМ РИСЕРЧ ДИВЕЛОПМЕНТ КОМПАНИ ОФ ЗЕ ХЕБРЮ ЮНИВЕРСИТИ ОФИЕРУСАЛИМ, ЛТД. (IL)-2012106897/04, заявл. 18.11.2010, опубл. 27.12.2013) С07С 43/215(2006.01).
2-({[(1S,2R,5S)-6,6-ДИМЕТИЛБИЦИКЛО[3.1.1.]ГЕПТ-2-ИЛ]МЕТИЛ} СУЛЬФИНИЛ) ЭТАНОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ АНТИАГРЕГАЦИОННОМ ДЕЙСТВИЕМ / Никитина Л.Е. [и др.]; заявитель и патентообладатель Государственное образовательное учреждение высшего профессионального образования "Казанский государственный медицинский университет"; заявл. 2013113468, 26.03.2013; опубл. 10.08.2013), (Пат. 019948 РФ, С07С 315/02, С07С 317/44, А61Р 7/02.
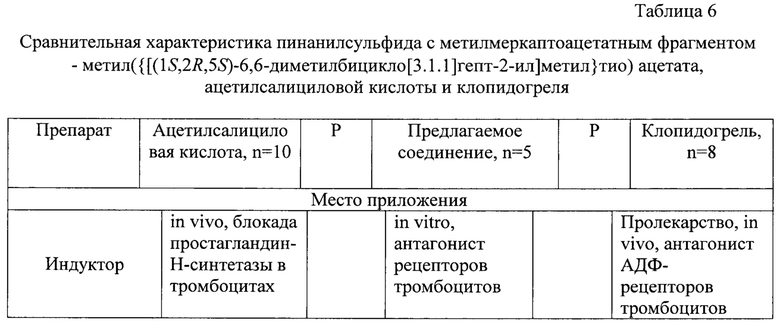
Одним из приоритетных направлений в трансфузиологии является введение препаратов крови, без которых в ряде случаев невозможно восстановление процессов жизнедеятельности у больных с самыми различными заболеваниями. Для этого в основном используют плазму крови, эритроцитарные и тромбоцитарные клеточные массы. При заборе донорской крови повреждается сосудистая стенка и повышается уровень стрессового гормона - адреналина. Эти изменения вызывают активацию тромбоцитов, и они приобретают способность к адгезии, агрегации, а также к связыванию и активации плазменных факторов свертывания. Данные процессы обусловлены возбуждением специфических клеточных рецепторов, трансформацией клеточной мембраны и как следствие, поступлению в кровоток тромбогенных частиц - микровезикул [Зубаиров Д.М. Микровезикулы в крови, функции и их роль в тромбооразовании / Д.М Зубаиров, Л.Д. Зубаирова // М.: ГЭОТАР-Медиа. - 2009. - 167 с.]. Поэтому при получении препаратов крови необходимо заблокировать возможность развития этих событий. С этой целью в основном используются цитрат натрия или гепарин. Однако, как показывают результаты проточной цитометрии, стабилизирующий эффект этих веществ недостаточен - тромбоцитарные микровезикулы (поле R2) освобождаются из тромбоцитов (поле R1) как при стабилизации крови цитратом натрия (А), так и гепарином (В) (фиг. 1).
Воздействие различных индукторов на рецепторы тромбоцитов приводит к увеличению концентрации ионов Са2+ в клеточной цитоплазме за счет функционирования фосфоинозитольной Са2+-мобилизующей системы [Шитикова А.С. Тромбоцитарный гемостаз / А.С. Шитикова - Санкт-Петербург: Изд-во. СПб ГМУ, 2000. - 227 с.]. Не останавливаясь на полной последовательности взаимодействия ее компонентов отметить лишь то, что она приводит к адгезии тромбоцитов, реакции высвобождения, агрегации, формированию прокоагулянтной фосфолипидной поверхности и отшнуровыванию в кровоток фосфолипопротеиновых микровезикул [Зубаиров Д.М. Микровезикулы в крови, функции и их роль в тромбооразовании / Д.М Зубаиров, Л.Д. Зубаирова // М.: ГЭОТАР-Медиа. - 2009. - 167 с.]. Эти процессы развиваются последовательно в зависимости от концентрации ионов Са2+, создаваемой в цитоплазме в ответ на действие того или иного агониста. Слабые агонисты (АДФ, катехоламины и др.) обеспечивают поступление ионов Са2+ в цитоплазму в основном из внутриклеточного депо. Концентрация ионов Са2+ возрастает от 1⋅10-7 до 5⋅10-7 М, что достаточно лишь для развития реакции высвобождения. Последующие процессы активации тромбоцитов развиваются лишь при действии сильных агонистов (тромбин, коллаген, фактор активации тромбоцитов, тромбоксаны). Они обеспечивают поступление ионов Са2+ в цитоплазму, как из внутриклеточного депо, так и из внеклеточной среды. При этом концентрация ионов Са2+ в цитоплазме возрастает до 5⋅10-6 М. В конце активации, при слияние мембран около них, как и при механическом разрушении тромбоцитов, создается такая же концентрация ионов Са2+, как и в крови - 1,2⋅10-3 М. При введении в кровь цитрата натрия, связывается только внеклеточный кальций и не затрагивается внутриклеточный. Следовательно, увеличение концентрации внутриклеточного свободного кальция может быть самодостаточной для активации тромбоцитов и поэтому цитрат натрия только снижает эффективность этого процесса. Вместе с этим, понятно становится и неэффективность подавления гепарином активности сильного индуктора тромбообразования - тромбина, так как он не является единственным для этого процесса.
Кроме того, оценка качества тромбоцитов в начале и конце срока хранения показала, что через пять суток в исследуемых тромбоконцентратах наблюдалось резкое падение всех морфофункциональных параметров тромбоцитов таблица 1.
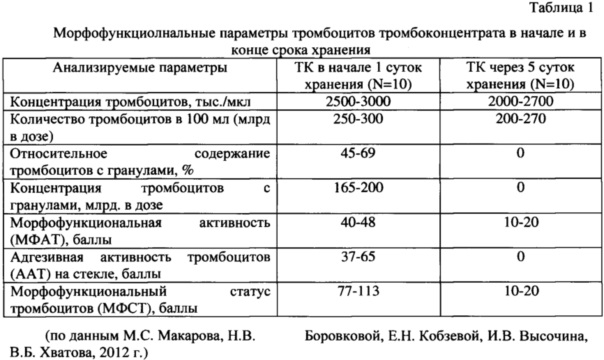
В соответствии с этим, целью нашего исследования было создание нового средства, направленного на улучшение качества и функционального состояния препаратов крови и, в частности, тромбоконцентрата. Модификация природных терпенов путем введения серосодержащих биологически активных фрагментов позволяет получить стабилизатор крови нового типа, который в сочетание с цитратом натрия повышает сохранность препарата тромбоцитов.
Известны структурные аналоги заявляемого соединения: 2-({[(1S,2R,5S)-6,6-диметил-бицикло[3.1.1]гепт-2-ил]метил} сульфинил) этанол (Синтез и противогрибковая активность сульфидов, сульфоксидов, сульфонов на основе β-пинена / Никитина Л.Е. [и др.] // ХФЖ. - Т. 44. - №3. - 2010. - С. 17-20).
Цель изобретения - новое эффективное соединение, обладающее стабилизирующим действием на тромбоциты человека, и способ его получения.
Поставленная цель достигается предлагаемым изобретением, а именно, пинанилсульфидом с метилмеркаптоацетатным фрагментом - метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио)ацетатом, обладающим ингибирующем действием на активацию тромбоцитов. Способ получения метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио)ацетата заключается в окислении терпенсульфида 2-({[1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио)ацетата с использованием системы Ti(O-i-Pr)4/(R)-C6H5CH(OH)COOH/t-BuOOH (Catalytic asymmetric oxidation of sulfide with titanium-mandelic acid complex: practical synthesis of (S)-3-[1-(2-methylphenyl)imidazol-2-ylsulfinyl]propan-1-ol, the key intermediate of OPC-29030 / M. Matsugi [at al.] // Tetrahedron. - V. 57. - 2001. - P. 2739-2744). Метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио)ацетат предварительно получен по известной методике в реакции (-) -β-пинена с метилмеркаптоацетатом (Синтез и противогрибковая активность сульфидов, сульфоксидов, сульфонов на основе β-пинена / Никитина Л.Е. [и др.] // ХФЖ. - Т.44. - №3. - 2010. - С. 17-20).
Заявляемое соединение - пинанилсульфид с метилмеркаптоацетатным фрагментом метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио)ацетат является новым соединением и его свойства в литературе не описаны.
Пример конкретного выполнения.
Способ получения соединения пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио)ацетата,заключается в окислении терпенсульфида - 2-({[1S,2R,5S)-6,6-диметилбицикло [3.1.1]гепт-2-ил]метил} тио) ацетата смесью Ti(O-i-Pr)4, (R)-C6H5CH(OH)COOH и t-BuOOH при комнатной температуре в течение 20 часов до полной конверсии исходного сульфида.
К 0.0125 ммоль Ti(O-i-Pr)4 при комнатной температуре и перемешивании добавляли 0.025 ммоль R-миндальной кислоты в 5 мл абсолютного CCl4. Через 1 час добавляли 2 ммоль 2-({[1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио) ацетата, еще через 0.5 часа - 4 ммоль t-BuOOH. Реакционную смесь перемешивали в течение 20 часов до полной конверсии исходного сульфида (ТСХ контроль), затем выливали в воду и экстрагировали эфиром. Эфирный экстракт промывали насыщенным раствором K2СО3, водой до нейтральной реакции, из воды экстрагировали эфиром. Органический слой сушили MgSO4. После отгонки растворителя продукт выделяли методом колоночной хроматографии на силикагеле (элюент - хлористый метилен, ацетон 5:1). Получили 74% продукта - пинанилсульфида с метилмеркаптоацетатным фрагментом в виде желтого масла. ЯМР 1Н спектр (400 МГц, CDCl3) δ, м.д.: 1.05, 1.06 (с, 3Н, Н-9); 1.24, 1.26 (с, 3Н, Н-8); 1.31 (м, 1Н, Н-7), 1.64 (м, 1H, Н-3), 1.69-2.09 (м, 4Н, Н-1, Н-2, 2Н-4), 2.71 (м, 1Н, Н-5); 2.15-3.25 (м, 2Н, Н-10); 3.44, 3.51 (м, 2Н, SOCH2); 3.82 (с, 3Н, ОСН3).
ЯМР 13С спектр (100 МГц, CDCl3), м.д.: 21.88, 22.72 (С-3); 23.86 (С-9); 26.51, 26.63 (С-4); 28.40, 28.44 (С-8); 33.47, 33.75 (С-7); 35.44, 35.73 (С-5); 39.24, 39.34 (С-6); 41.51, 41.54 (С-1); 45.39, 47.30 (С-2); 56.64, 56.93 (С-10); 53.53 (ОСН3); 61.63, 62.53 (SOCH2); 166.36 (СО). Масс-спектр, m/z (Iотн, %): 258 (М+, 6), 241 (35), 227 (4), 185 (43), 159 (4), 135 (26), 122 (23), 107 (20), 93 (83), 81 (100), 69 (85), 67 (54), 55 (39), 41 (79), 39 (15), 29 (10).
Нами установлена антиагрегационная и антикоагуляционная активность пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио) ацетата, позволяющая использовать его для консервации препарата крови - тромбоконцентрата и создания на его основе нового лекарственного средства для профилактики тромбозов.
Возможность использования, полученного пинанилсульфида для коррекции гемостаза, определяли in vitro на плазме крови человека. Венозную кровь забирали в пластиковую центрифужную пробирку объемом более 10 мл с раствором антикоагулянта (130 мМ цитрата натрия). Кровь стабилизировали раствором цитрата натрия в отношении 1:9 и медленно перемешивали. Затем центрифугировали при 1400 об/мин в течение 10 минут для получения богатой тромбоцитами плазмы. После отбора 2,5 мл супернатанта, оставшуюся кровь центрифугировали в течение 20 мин при 3000 об/мин для получения бедной тромбоцитами плазмы, которая использовалась для разведения богатой тромбоцитами плазмы до фиксированной объемной концентрации тромбоцитов и определения коагуляционного гемостаза. Плазму, обедненную микровезикулами, готовили путем фильтрации бесклеточной плазмы через мембрану с размерами пор 0,1 мкм (Millipore).
Для оценки системы гемостаза использовали определение скоростей агрегации тромбоцитов, тромбодинамики и поверхностно зависимые стандартные коагуляционные тесты: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое и тромбиновое время с расчетом Международного Нормализованного Отношения (MHO). Агрегационную активность тромбоцитов устанавливали с помощью анализатора «Chronolog-Log Corporation» (США) по методу G. Born. Для этого в кювету прибора помещали 250 мКл богатой тромбоцитами плазмы. Оптическим контролем служил такой же объем плазмы, не содержащей тромбоцитов. О степени агрегации судили по максимальной величине падения оптической плотности после окончания реакции по сравнению с исходной величиной. Тромбодинамика плазмы оценивалась по скорости фибринообразования на приборе «Регистратор тромбодинамики Т-2» (Россия), путем видео регистрации роста фибринового сгустка в пространстве при активации свертывания от поверхности с иммобилизованным тканевым фактором. Коагуляционную активность определяли на коагулометре «Минилаб-7001» (Россия). Тромбоцитарные микровезикулы находили с помощью проточного цитометра FACSCAN Calibur (Becton Dickinson, USA). Абсолютное количество микровезикул в 1 мкл определяли по светорассеиванию за фиксированное время (60 секунд) с использованием программы Cell Quest [Line V. Iversen, Ole Ostergaard, Christoffer T. Nielsen et al. J. Immunol Methods. - 2013. - Feb 28; 388 (1-2). - Р. 49-59]. Тромбоконцентрат заготавливался методом автоматического цитофереза на аппарате «Haemonetics corporation MSC+», производство США, при выполнении протокола LDP - сбор тромбоцитов, обедненных лейкоцитами (не более 1⋅106 в дозе), в установленном оператором количестве (2⋅1011 в дозе). Данные параметры сбора установлены по умолчанию и основаны на характеристиках среднестатистического донора и стандартных требованиях к процедуре сбора тромбоцитов. Для цитофереза использовались одноразовые системы (магистрали, колокол и гемаконы) для сбора тромбоцитов, производства «Haemonetics corporation MSC+», США.
Процедура заготовки включала в себя: допуск и подготовку донора, проведение венепункции при помощи подготовленной системы, отбор проб для анализов из закрытой системы в пластиковые мешки-сателлиты (Haemonetics corporation MSC+», США) или пробирки типа «BD Вакутейнер» (Becton Dickinson, США). При проведении тромбоцитафереза используется принцип прерывистого потока через камеру сепарации (колоколом). Стабилизированная цитратом кровь через замкнутую систему стерильных магистралей поступает во вращающийся стерильный одноразовый колокол, где наиболее тяжелая фракция - эритроциты отбрасываются к стенке, а самая легкая фракция - плазма начинает выходить через специальный порт, после чего ее можно собирать в специализированные мешки. В конце цикла на выходе из колокола вместе с плазмой появляются клетки крови - тромбоциты, что определяется оптическим датчиком и тогда выходной поток направляется в мешок для сбора тромбоцитов - воздухопроницаемый контейнер для его сбора, транспортировки и хранения. После окончания процедуры, мешки с тромбоконцентратом маркировались путем фиксации термонаклейки в соответствии с ГОСТом 52938-2008 и передавались для хранения. Хранение тромбоконцентрата осуществлялось в мешках из специального пластика для сбора тромбоцитов (производитель «Haemonetics corporation MSC+», США) в течение 5 суток при t +22-24°С при постоянном помешивании в тромбомиксере («Presvak», Аргентина). Антикоагулянт: ACD(A), соотношение коагулянта к тромбоконцентрату 1:9. Состав антикоагулянта: кислоты лимонной моногидрат - 8 гр.; натрия цитрат - 22 гр.; глюкозы моногидрат - 24,5 гр.; воды - до 1000 мл.
Для определения спонтанной агрегации тромбоцитов, тромбодинамики и коагуляционной активности плазмы использовалась венозная кровь больных с ишемической болезнью сердца (ИБС) и выраженными изменениями в системе гемостаза, а индуцированная агрегация тромбоцитов и количество микровезикул определялась на плазме, полученной от здоровых доноров. С этой целью к 0,45 мл плазмы добавляли 0,05 мл раствора, содержащего 36,55 мМ пинанилсульфида в 30% растворе этилового спирта, и инкубировали полученную смесь в течение 5 мин при температуре 37°С. В контрольных опытах к плазме добавляли растворитель, используемый для приготовления препарата (30% раствор этилового спирта). Для индукции агрегации тромбоцитов применяли растворы: АДФ (5 мкм), адреналина (10 мкм), коллагена (2 мкг/мл), арахидоновой кислоты (0,5 мМ) и ристомицина (1 мг/мл).
Относительную эффективность полученного соединения определяли путем сравнения с ацетилсалициловой кислотой и клопидогрелем (плавиксом), как наиболее клинически значимыми антиагрегационными препаратами. Для этого использовалась плазма больных ИБС, которые получали соответствующие лекарственные препараты.
Результаты исследования обработаны с помощью пакета статистических программ Microsoft Excel. Достоверность различий параметров определяли регрессионным и вариационным анализами по критерию Стьюдента при уровне значимости менее 0,05.
Из результатов следует, что пинанилсульфид обладает высокой антиагрегационной активностью: полностью подавляет спонтанную и индуцированную агрегацию тромбоцитов (табл. 2).

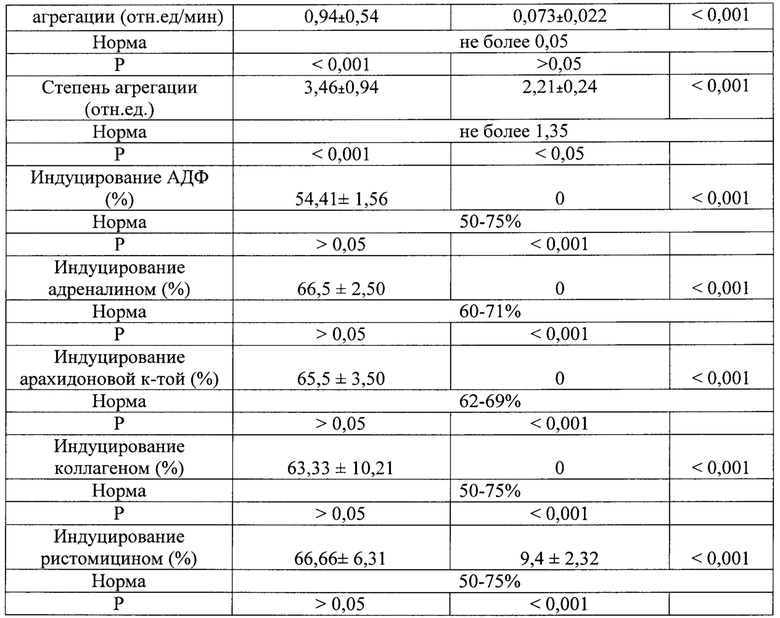
n - Количество измерений; *р - достоверность <0, 05 по сравнению с показателями без препарата
Способность пинанилсульфида ингибировать активацию тромбоцитов подтверждают и результаты определения тромбоцитарных микровезикул в тромбоконцентратах (табл. 3).
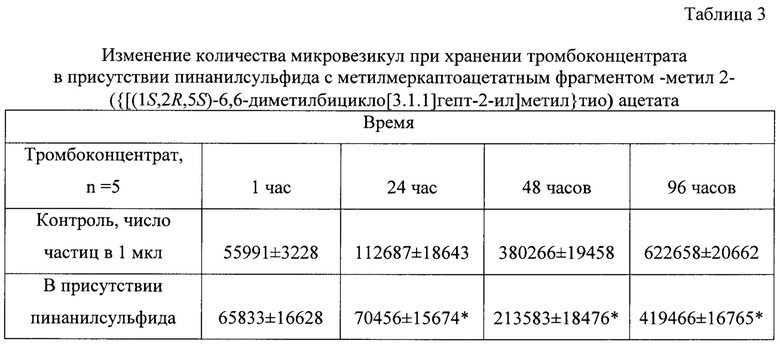
n - количество образцов, *р - достоверность <0, 05 по сравнению с показателями без препарата - контролем.
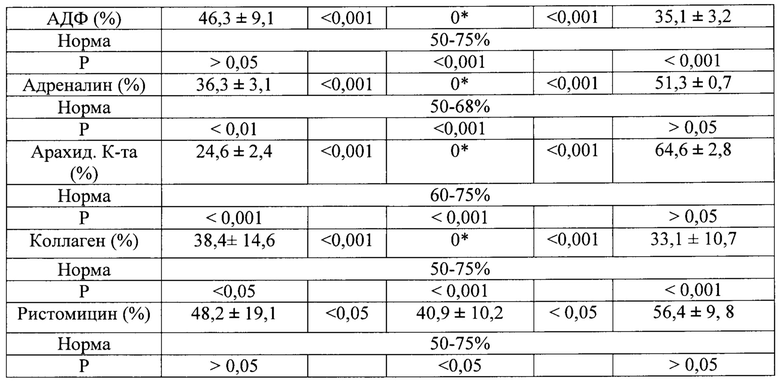
Из представленных данных следует, что по мере хранения тромбоконцентратов количество микровезикул повышалось (фиг. 2А) и к концу срока увеличилось в 11 раз (табл. 3), а при добавлении в препараты тромбоцитов пинанилсульфида их число увеличивалось в меньшей степени (фиг. 2В) и в сравнение с тромбоконцентратами без препарата сокращалось в 1,5 раза (табл. 3).
Кроме того, снижается и коагуляционная активность плазмы: увеличивается АЧТВ, протромбиновое время, MHO, достигая нормальных значений и уменьшается количество Д-димера (табл. 4). Однако при этом наше соединение не сказывалось на активности тромбина (тромбиновое время не изменяется). Это означает, что пинанилсульфид ингибирует активацию коагуляционных факторов.

n - количество измерений; *р - достоверность<0, 05 по сравнению с показателями без препарата
Результаты определения влияния пинанилсульфида на процесс тромбодинамики также как поверхностно зависимые стандартные коагуляционные тесты свидетельствуют об ингибировании активации коагуляционных факторов: уменьшались скорости роста фибринового сгустка (V - скорость задержки роста, Vi - начальная скорость, Vst - стационарная скорость), его размер (CS), плотность (D) и исчезали спонтанные сгустки фибрина (Tsp) в присутствии препарата (табл. 5. фиг. 3Б). Подобные результаты получили и в плазме без пинанилсульфида, но обедненной микровезикулами (табл. 5, фиг. 3В).
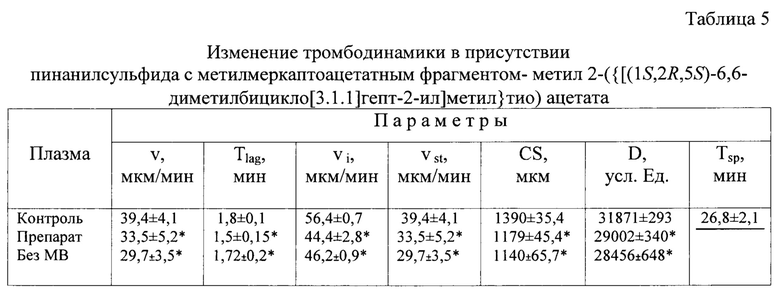
Контроль - плазма, полученная от больных ИБС с выраженными гиперкоагуляционными проявлениями; Препарат - плазма с выраженными гиперкоагуляционными проявлениями в присутствии пинанилсульфида; MB - плазма с выраженными гиперкоагуляционными проявлениями обедненная микровезикулами; количество измерений n=5, *р - достоверность<0,05 по сравнению с контролем.
Следовательно, наблюдаемый гипокоагуляционный эффект при введении в плазму пинанилсульфида обусловлен снижением коагуляционной способности как тканевого фактора, так и присутствующих в растворе микровезикул.
Предлагаемое вещество по химической природе не имеет аналогов среди антиагрегационных лекарственных препаратов. Поэтому в качестве препарата сравнения выбрали ацетилсалициловую кислоту и клопидогрель (плавике), как наиболее эффективные антиагрегационные препараты, используемые в настоящее время в клинической практике. В таблице 6 приведены результаты индуцированной агрегации тромбоцитов в присутствии препаратов.
Активация тромбоцитов индуцируется различными физиологическими молекулами (коллагеном, адреналином, АДФ и др.) путем воздействуя на их рецепторы. Наши результаты показали, что пинанилсульфид, в отличие от ацетилсалициловой кислоты и клопидогреля, значительно ингибировал рецепторную активность тромбоцитов: полностью подавлял индуцированную адреналином, АДФ, коллагеном, арахидоновой кислотой агрегацию тромбоцитов и снижал воздействие ристоцетина (табл. 6).
Таким образом, из полученных данных следует, что особенностью предлагаемого нами соединения является его способность подавлять активацию тромбоцитов путем ингибирования рецепторов, отвечающих за передачу импульса, запускающего внутриклеточные процессы. При этом активируются мембраносвязанные ферменты фосфолипазы А2 и С, что приводит к высвобождению из фосфолипидов арахидоновой кислоты. Арахидоновая кислота под действием фермента циклооксигеназы превращается в простагландины G2 и Н2, которые ингибируют активность этого фермента и приводят к образованию тромбоксана А2. Тромбоксан А2 является ионофором для ионов кальция и вызывает увеличение их внутриклеточной концентрации. Эти процессы приводят к изменению структуры клеточной мембраны тромбоцитов, и они приобретают как способность к адгезии и агрегации, так и тромбогенные свойства, что в свою очередь приводит к активации плазменного гемостаза. Поэтому обнаруженное свойство полученного соединения блокировать как тромбоцитарный, так и коагуляционный гемостаз может оказаться весьма перспективным для разработки принципиально новых препаратов, используемых для профилактики тромбофилии. Кроме того, учитывая способность пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио)ацетата, полностью подавлять активацию тромбоцитов и снижать коагуляционные свойства плазмы, а также низкую токсичность серосодержащих терпенов (Синтез и противогрибковая активность соединений пинанового ряда / Никитина Л.Е. [и др.] // ХФЖ. - 2009. - Т. 43. - Вып. 5. - С. 20-23), полученное вещество и в настоящее время может быть использовано в качестве стабилизатора препаратов крови.
Краткое описание чертежей
фиг. 1. Микровезикулы в пробах плазмы по данным проточной цитометрии: А - кровь стабилизирована цитратом натрия, В - кровь стабилизирована гепарином. Dot-plot цитограмма дифференциация микровезикул и тромбоцитов по FSC SSC в логарифмической шкале: R1 - регион тромбоцитов, R2 - регион микровезикул,
фиг. 2. Динамика роста количества микровезикул при хранении в тромбоконцентратах: А - без препарата, В - в присутствии пинанилсульфида,
фиг 3. А - сгустки фибрина в плазме без препарата, Б - плазма, содержащая пинанилсульфид, В - плазма без микровезикул.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-(1S,2R,5S)-6,6-ДИМЕТИЛБИЦИКЛО[3.1.1]ГЕПТ-2ИЛ]МЕТИЛ}СУЛЬФИНИЛ)ЭТАНОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ АНТИАГРЕГАЦИОННЫМ ДЕЙСТВИЕМ | 2013 |
|
RU2522198C2 |
| Антиагрегационное и антиоксидантное средство | 2023 |
|
RU2808474C1 |
| Способ получения антиагрегационного и антиоксидантного средства | 2023 |
|
RU2819387C1 |
| КОМБИНАЦИИ АЛЬФА-2-ДЕЛЬТА-ЛИГАНДА С СЕЛЕКТИВНЫМ ИНГИБИТОРОМ ЦИКЛООКСИГЕНАЗЫ-2 | 2003 |
|
RU2286151C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2709017C1 |
| СРЕДСТВА, ВЫЗЫВАЮЩИЕ АПОПТОЗ, ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ И ИММУННЫХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2594282C2 |
| ПРОИЗВОДНОЕ 8-АЗАПРОСТАГЛАНДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, АГЕНТ ДЛЯ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2306309C2 |
| ПРОИЗВОДНЫЕ 3-(5-ГИДРОКСИ-1-ОКСОИЗОИНДОЛИН-2-ИЛ) ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 (IKZF2) СЕМЕЙСТВА IKAROS | 2019 |
|
RU2797559C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ И ОНКОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2009 |
|
RU2545023C9 |
| ПРОИЗВОДНЫЕ 3-(5-АМИНО-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 СЕМЕЙСТВА IKAROS (IKZF2) | 2019 |
|
RU2815714C2 |

Изобретение относится к химии серосодержащих и терпеновых соединений, а именно к применению пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио) ацетата, в качестве средства, обладающего ингибирующим действием на активацию тромбоцитов, который может быть использован в медицинской практике в качестве средства, обладающего антиагрегационным и антикоагуляционным действием, для консервации препаратов крови и профилактики тромбозов, а также может быть использован для создания нового лекарственного препарата для профилактики тромбофилии. 3 ил., 6 табл.
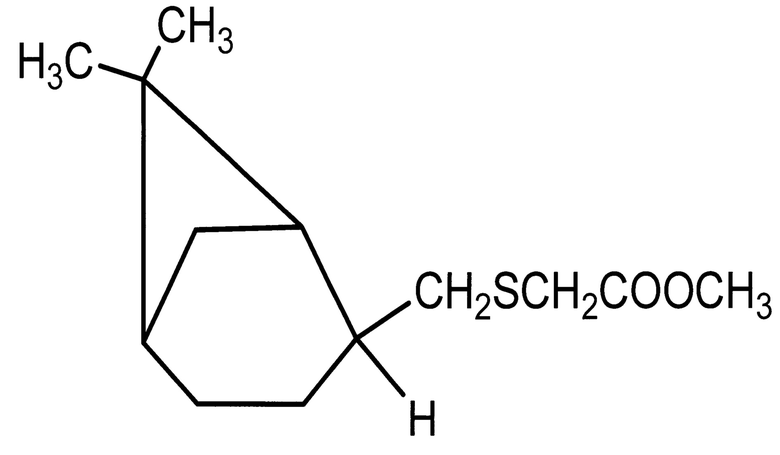
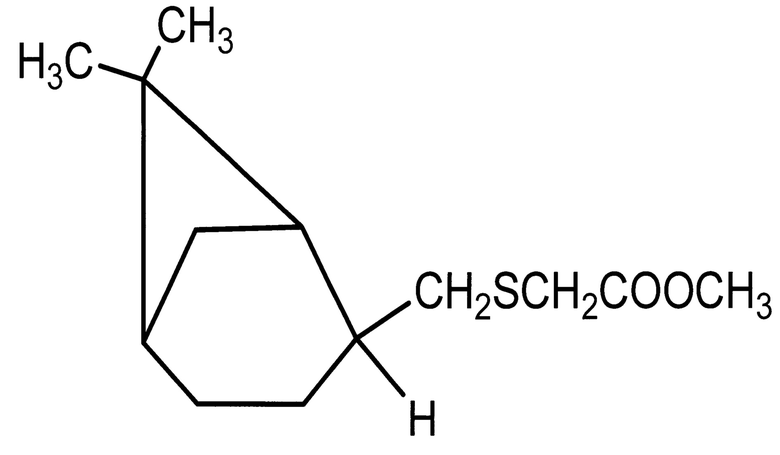
Применение пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({[(1S,2R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}тио) ацетата, в качестве средства, обладающего ингибирующем действием на активацию тромбоцитов
| RU 2013113468 A, 10.08.2013 | |||
| Sebastien Navarre et al | |||
| "Competing β-scission and hydrogen transfer to the pinanyl radical in the addition of methyl thioglycolate to β-pinene derivatives ", Journal of the Chemical Society, Perkin Transactions 2, Journal of the Chemical Society, Perkin Transactions 2, 2000, Issue 12, р | |||
| Приспособление для обточки карандашей | 1925 |
|
SU2359A1 |
| L.E | |||
| Nikitina et al | |||
| "Synthesis and antifungal activity of compounds of the pinane series" Pharmaceutical Chemistry Journal, v | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Способ модулирования для радиотелефона | 1921 |
|
SU251A1 |
Авторы
Даты
2018-11-02—Публикация
2015-10-16—Подача