По настоящей заявке испрашивается приоритет заявки PCT № PCT/CN2014/082589, поданной 21 июля 21 2014 года, и заявки PCT № PCT/CN2014/090504, поданной 6 ноября 2014 года. Полное содержание этих заявок включено в настоящее описание посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Рассматриваемая заявка содержит перечень последовательностей, который был представлен в электронном виде в формате ASCII и настоящим включен посредством ссылки во всей полноте. Упомянутая копия в формате ASCII, созданная 15 июля 2015 года, называется N2067-7047WO3_SL.txt и имеет размер 323686 байт.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится в целом к использованию иммунных эффекторных клеток (например, T-клеток, NK-клеток), сконструированных для экспрессии химерного антигенного рецептора (CAR), для лечения заболевания, ассоциированного с экспрессией белка кластер дифференцировки 33 (CD33).
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Большинство пациентов с острым миелоидным лейкозом (ОМЛ) неизлечимы с помощью стандартной терапии (Mrozek et al, 2012, J Clin Oncol, 30:4515-23), и пациенты с рецидивирующим или рефрактерным (RR-) имеют особенно плохой прогноз (Kern et al, 2003, Blood 2003, 101:64-70; Wheatley et al, 1999, Br J Haematol, 107:69-79).
Генная инженерия может придавать T-клеткам специфичность к выбранной мишени. T-клетки могут быть трансдуцированы генетическим материалом, кодирующим одноцепочечный вариабельный фрагмент (scFv) антитела, в сочетании с сигнальной молекулой, благодаря чему определяющая комплементарность область (CDR) используется для распознавания антигена клеточной поверхности не ограниченным ГКГС образом. Эти клетки называются T-клетками с химерным антигенным рецептором (CAR). Предклинические и клинические попытки нацеливания на по меньшей мере 20 различных поверхностных молекул во множестве злокачественных опухолей продемонстрировали некоторую активность, но эти попытки часто были ограничены плохой жизнестойкостью вводимого продукта в виде T-клеток с CAR (Sadelain et al, 2009, Curr Opin Immunol 2009, 21:215-23). Недавний успех в отношении перенаправленных анти-CD19 T-клеток у пациентов с хроническим лимфоидным лейкозом (ХЛЛ) в поздней стадии и острым лимфоидным лейкозом (ОЛЛ) (Porter et al, 2011, N Engl J Med, 365:725-33; Kalos et al, 2011, Science Transl Med, 3:95ra73; Grupp and Kalos, 2013, N Engl J Med, 368:1509-18) продемонстрировал, что эти клетки могут уничтожать массивную опухолевую нагрузку после одного введения с ремиссией продолжительностью вплоть до 3 лет на данный момент, что подчеркивает исключительный потенциал терапии T-клетками с CAR. Было несколько предклинических попыток нацеливания на ОМЛ в моделях на животных (Marin et al, 2010, Haematologica, 95:2144-52; Tettamanti et al, 2013, Br J Haematol, 161:389-401). Недавно опубликованное небольшое клиническое исследование продемонстрировало, что можно получать T-клетки и вводить их пациентам с агрессивной злокачественной опухолью (Ritchie et al, 2013, Mol Ther, 2013 Nov;21(11):2122-9). Помимо способности химерного антигенного рецептора на генетически модифицированных T-клетках распознавать и разрушать клетки-мишени, успешная терапия терапевтическими T-клетками должна обладать способностью пролиферировать и сохраняться в течение времени и в дальнейшем отслеживать уклонившиеся лейкозные клетки. Переменное качество T-клеток, является ли оно результатом анергии, супрессии или истощения, может оказывать воздействие на активность трансформированных CAR T-клеток. Специалисты в настоящее время имеют ограниченные возможности по контролю за изменчивостью качества T-клеток. Для того чтобы быть эффективными, трансформированные CAR T-клетки пациента должны поддерживать и сохранять способность к пролиферации в ответ на антиген для CAR. Было продемонстрировано, что T-клетки пациента с ОЛЛ могут осуществлять это с помощью CART19, содержащей мышиный scFv (смотри, например, Grupp et al., NEJM 368:1509-1518 (2013)).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение предлагает выделенную молекулу нуклеиновой кислоты, кодирующую химерный антигенный рецептор (CAR), причем CAR содержит антитело или фрагмент антитела, который включает в себя CD33-связывающий домен (например, человеческий или гуманизированный связывающий CD33 домен), трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном варианте осуществления CAR содержит антитело или фрагмент антитела, который включает в себя CD33-связывающий домен, описанный в настоящем документе (например, человеческий или гуманизированный связывающий CD33 домен, описанный в настоящем документе), трансмембранный домен, описанный в настоящем документе, и внутриклеточный сигнальный домен, описанный в настоящем документе (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен).
В одном варианте осуществления кодируемый CD33-связывающий домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (LC CDR1), определяющей комплементарность области 2 легкой цепи (LC CDR2) и определяющей комплементарность области 3 легкой цепи (LC CDR3) CD33-связывающего домена, описанного в настоящем документе, и/или одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (HC CDR1), определяющей комплементарность области 2 тяжелой цепи (HC CDR2) и определяющей комплементарность области 3 тяжелой цепи (HC CDR3) CD33-связывающего домена, описанного в настоящем документе, например, CD33-связывающего домена, содержащего одну или несколько, например, все три, LC CDR и одну или несколько, например, все три, HC CDR. В одном варианте осуществления кодируемый CD33-связывающий домен (например, человеческий или гуманизированный связывающий CD33 домен) содержит вариабельную область легкой цепи, описанную в настоящем документе (например, в таблице 8 или 9), и/или вариабельную область тяжелой цепи, описанную в настоящем документе (например, в таблице 8 или 9). В одном варианте осуществления кодируемый CD33-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности из таблицы 8 или 9. В варианте осуществления кодируемый CD33-связывающий домен (например, scFv) содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в таблице 8 или 9, или последовательность, идентичную на 95-99% аминокислотной последовательности из таблицы 8 или 9; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в таблице 8 или 9, или последовательность, идентичную на 95-99% аминокислотной последовательности из таблицы 8 или 9.
В других вариантах осуществления кодируемый CD33-связывающий домен содержит HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9. В вариантах осуществления CD33-связывающий домен дополнительно содержит LC CDR1, LC CDR2 и LC CDR3. В вариантах осуществления CD33-связывающий домен содержит LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9.
В некоторых вариантах осуществления кодируемый CD33-связывающий домен содержит одну, две или все из LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9, и одну, две или все из HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9.
В одном варианте осуществления кодируемый CD33-связывающий домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 39-47, 57-65, 66-74 или 262-268. В варианте осуществления кодируемый CD33-связывающий домен (например, scFv) содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности в соответствии с SEQ ID NO: 39-47, 57-65, 66-74 или 262-268, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 39-47, 57-65, 66-74 или 262-268. В другом варианте осуществления кодируемый CD33-связывающий домен содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 57-65, или последовательность, идентичную ей на 95-99%. В другом варианте осуществления кодируемый CD33-связывающий домен содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 66-74, или последовательность, идентичную ей на 95-99%. В одном варианте осуществления молекула нуклеиновой кислоты содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 255-261, или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления кодируемый CD33-связывающий домен включает в себя линкер (Gly4-Ser)n, причем n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном варианте осуществления кодируемый CAR включает в себя трансмембранный домен, который содержит трансмембранный домен белка, например, белка, описанного в настоящем документе, например, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления кодируемый трансмембранный домен содержит последовательность в соответствии с SEQ ID NO: 6. В одном варианте осуществления кодируемый трансмембранный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 6, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 6. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая трансмембранный домен, содержит последовательность в соответствии с SEQ ID NO: 17 или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления кодируемый CD33-связывающий домен соединен с трансмембранным доменом шарнирной областью, например, шарнирной областью, описанной в настоящем документе. В одном варианте осуществления кодируемая шарнирная область содержит SEQ ID NO: 2 или последовательность, идентичную ей на 95-99%. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая шарнирную область, содержит последовательность в соответствии с SEQ ID NO: 13 или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен, например, костимулирующий домен, описанный в настоящем документе. В вариантах осуществления внутриклеточный сигнальный домен содержит костимулирующий домен. В вариантах осуществления внутриклеточный сигнальный домен содержит первичный сигнальный домен. В вариантах осуществления внутриклеточный сигнальный домен содержит костимулирующий домен и первичный сигнальный домен.
В одном варианте осуществления кодируемый костимулирующий домен представляет собой функциональный сигнальный домен, полученный из белка, например, описанного в настоящем документе, например, выбранного из группы, состоящей из молекулы ГКГС класса I, белков-рецепторов ФНО, иммуноглобулин-подобных белков, цитокиновых рецепторов, интегринов, сигнальных лимфоцит-активирующих молекул (SLAM-белков), активирующих рецепторов NK-клеток, BTLA, рецептора толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83. В вариантах осуществления кодируемый костимулирующий домен содержит 4-1BB, CD27, CD28 или ICOS.
В одном варианте осуществления кодируемый костимулирующий домен из 4-1BB содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7. В одном варианте осуществления кодируемый костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 7, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 18 или последовательность, идентичную ей на 95-99%. В другом варианте осуществления кодируемый костимулирующий домен из CD28 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 379. В одном варианте осуществления кодируемый костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 379, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 379. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен из CD28 содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 380 или последовательность, идентичную ей на 95-99%. В другом варианте осуществления кодируемый костимулирующий домен из CD27 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 8. В одном варианте осуществления кодируемый костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 8, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 8. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен из CD27, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 19 или последовательность, идентичную ей на 95-99%. В другом варианте осуществления кодируемый костимулирующий домен из ICOS содержит аминокислотную последовательность в соответствии с SEQ ID NO: 381. В одном варианте осуществления кодируемый костимулирующий домен из ICOS содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 381, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 381. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен из ICOS, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 382 или последовательность, идентичную ей на 95-99%.
В вариантах осуществления кодируемый первичный сигнальный домен содержит функциональный сигнальный домен из CD3-дзета. В вариантах осуществления функциональный сигнальный домен из CD3-дзета содержит аминокислотную последовательность в соответствии с SEQ ID NO: 9 (мутантная CD3-дзета) или SEQ ID NO: 10 (человеческая CD3-дзета дикого типа) или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен из 4-1BB и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен из 4-1BB содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7 и/или аминокислотную последовательность CD3-дзета в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 7 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен из 4-1BB, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 18 или последовательность, идентичную ей на 95-99%, и/или нуклеотидную последовательность CD3-дзета в соответствии с SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен из CD27 и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен из CD27 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 8 и/или аминокислотную последовательность CD3-дзета в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 8 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 8 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 8 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен из CD27, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 19 или последовательность, идентичную ей на 95-99%, и/или нуклеотидную последовательность CD3-дзета в соответствии с SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен из CD28 и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен из CD28 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 379 и/или аминокислотную последовательность CD3-дзета в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 379 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 379 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 379 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен из CD28, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 380 или последовательность, идентичную ей на 95-99%, и/или нуклеотидную последовательность CD3-дзета в соответствии с SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен из ICOS и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен из ICOS содержит аминокислотную последовательность в соответствии с SEQ ID NO: 381 и/или аминокислотную последовательность CD3-дзета в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 381 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 381 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 381 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен из ICOS, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 382 или последовательность, идентичную ей на 95-99%, и/или нуклеотидную последовательность CD3-дзета в соответствии с SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность, идентичную ей на 95-99%.
В другом аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкт CAR, содержащий лидерную последовательность, например, лидерную последовательность, описанную в настоящем документе, например, аминокислотную последовательность в соответствии с SEQ ID NO: 1; CD33-связывающий домен, описанный в настоящем документе, например, CD33-связывающий домен, содержащий LC CDR1, LC CDR2, LC CDR3, HC CDR1, HC CDR2 и HC CDR3, описанный в настоящем документе (например, человеческий или гуманизированный связывающий CD33 домен, описанный в таблице 8 или 9), или последовательность, идентичную ему на 95-99%; шарнирную область, описанную в настоящем документе, например, аминокислотную последовательность в соответствии с SEQ ID NO: 2; трансмембранный домен, описанный в настоящем документе, например, имеющий последовательность в соответствии с SEQ ID NO: 6; и внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описанный в настоящем документе. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит костимулирующий домен, например, костимулирующий домен, описанный в настоящем документе (например, костимулирующий домен из 4-1BB, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 7, или костимулирующий домен из CD27, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 8), и/или первичный сигнальный домен, например, первичный сигнальный домен, описанный в настоящем документе (например, стимулирующий домен из CD3-дзета, имеющий последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10). В одном варианте осуществления выделенная молекула нуклеиновой кислоты, кодирующая конструкт CAR, включает в себя лидерную последовательность, кодируемую последовательностью нуклеиновой кислоты в соответствии с SEQ ID NO: 1 или последовательностью, идентичной ей на 95-99%.
В одном варианте осуществления выделенная молекула нуклеиновой кислоты содержит (например, состоит из нее) нуклеиновую кислоту, кодирующую аминокислотную последовательность CAR в соответствии с SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55 или SEQ ID NO: 56; или аминокислоту, имеющую одну, две или три модификации (например, замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности в соответствии с SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55 или SEQ ID NO: 56; или аминокислотную последовательность, идентичную на 85%, 90%, 95%, 96%, 97%, 98% или 99% аминокислотной последовательности в соответствии с SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55 или SEQ ID NO: 56.
В одном варианте осуществления выделенная молекула нуклеиновой кислоты содержит (например, состоит из нее) последовательность нуклеиновой кислоты в соответствии с SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82 или SEQ ID NO: 83 или последовательность нуклеиновой кислоты, идентичную на 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности нуклеиновой кислоты в соответствии с SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82 или SEQ ID NO: 83.
В одном аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CD33-связывающий домен, причем CD33-связывающий домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (LC CDR1), определяющей комплементарность области 2 легкой цепи (LC CDR2) и/или определяющей комплементарность области 3 легкой цепи (LC CDR3) CD33-связывающего домена, описанного в настоящем документе, и одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (HC CDR1), определяющей комплементарность области 2 тяжелой цепи (HC CDR2) и определяющей комплементарность области 3 тяжелой цепи (HC CDR3) CD33-связывающего домена, описанного в настоящем документе, например, человеческого или гуманизированного связывающего CD33 домена, содержащего одну или несколько, например, все три, LC CDR и одну или несколько, например, все три, HC CDR.
В других вариантах осуществления кодируемый CD33-связывающий домен содержит HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9. В вариантах осуществления CD33-связывающий домен дополнительно содержит LC CDR1, LC CDR2 и LC CDR3. В вариантах осуществления CD33-связывающий домен содержит LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9.
В некоторых вариантах осуществления кодируемый CD33-связывающий домен содержит одну, две или все из LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9, и одну, две или все из HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9.
В одном варианте осуществления кодируемый CD33-связывающий домен содержит вариабельную область легкой цепи, описанную в настоящем документе (например, в SEQ ID NO: 66, 67, 68, 69, 70, 71, 72, 73 или 74), и/или вариабельную область тяжелой цепи, описанную в настоящем документе (например, в SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64 или 65). В одном варианте осуществления кодируемый CD33-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности в соответствии с SEQ ID NO: 39, 40, 41, 42, 43, 44, 45, 46 или 47. В варианте осуществления CD33-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в SEQ ID NO: 66, 67, 68, 69, 70, 71, 72, 73 или 74, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 66, 67, 68, 69, 70, 71, 72, 73 или 74; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64 или 65, или последовательность, идентичную на 95-99% аминокислотной последовательности в SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64 или 65. В одном варианте осуществления CD33-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46 и SEQ ID NO: 47, или последовательность, идентичную ей на 95-99%. В одном варианте осуществления кодируемый CD33-связывающий домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем документе, например, в таблице 8, прикреплена к вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем документе, например, в таблице 8, с помощью линкера, например, линкера, описанного в настоящем документе. В одном варианте осуществления кодируемый CD33-связывающий домен включает в себя линкер (Gly4-Ser)n, причем n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В другом аспекте настоящее изобретение относится к выделенной молекуле CD33-связывающего домена (например, полипептиду, антителу или его фрагменту), кодируемой молекулой нуклеиновой кислоты. В одном варианте осуществления выделенный CD33-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55 и SEQ ID NO: 56, или последовательность, идентичную ей на 95-99%.
В другом аспекте настоящее изобретение относится к выделенной молекуле химерного антигенного рецептора (CAR) (например, полипептиду), содержащей CD33-связывающий домен (например, человеческое или гуманизированное антитело или фрагмент антитела, которые специфически связываются с CD33), трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном варианте осуществления CAR содержит антитело или фрагмент антитела, которые включают в себя CD33-связывающий домен, описанный в настоящем документе (например, человеческое или гуманизированное антитело или фрагмент антитела, которые специфически связываются с CD33, как описано в настоящем документе), трансмембранный домен, описанный в настоящем документе, и внутриклеточный сигнальный домен, описанный в настоящем документе (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен, описанный в настоящем документе).
В одном варианте осуществления CD33-связывающий домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (LC CDR1), определяющей комплементарность области 2 легкой цепи (LC CDR2) и определяющей комплементарность области 3 легкой цепи (LC CDR3) CD33-связывающего домена, описанного в настоящем документе, и одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (HC CDR1), определяющей комплементарность области 2 тяжелой цепи (HC CDR2) и/или определяющей комплементарность области 3 тяжелой цепи (HC CDR3) CD33-связывающего домена, описанного в настоящем документе, например, CD33-связывающего домена, содержащего одну или несколько, например, все три, LC CDR и одну или несколько, например, все три, HC CDR. В одном варианте осуществления CD33-связывающий домен содержит вариабельную область легкой цепи, описанную в настоящем документе (например, в таблице 8), и/или вариабельную область тяжелой цепи, описанную в настоящем документе (например, в таблице 8 или 9). В одном варианте осуществления CD33-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности, приведенной в таблице 8 или 9. В варианте осуществления CD33-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в таблице 8 или 9, или последовательность, идентичную на 95-99% аминокислотной последовательности, приведенной в таблице 8 или 9; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в таблице 8 или 9, или последовательность, идентичную на 95-99% аминокислотной последовательности, приведенной в таблице 8 или 9.
В других вариантах осуществления CD33-связывающий домен содержит HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9. В вариантах осуществления CD33-связывающий домен дополнительно содержит LC CDR1, LC CDR2 и LC CDR3. В вариантах осуществления CD33-связывающий домен содержит LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9.
В некоторых вариантах осуществления CD33-связывающий домен содержит одну, две или все из LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9, и одну, две или все из HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9.
В одном варианте осуществления CD33-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 57-74 или SEQ ID NO: 262-268; или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) в любой из вышеупомянутых последовательностей; или последовательность, идентичную на 95-99% любой из вышеупомянутых последовательностей. В одном варианте осуществления CD33-связывающий домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем документе, например, в таблице 8 или 9, прикреплена к вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем документе, например, в таблице 8 или 9, с помощью линкера, например, линкера, описанного в настоящем документе. В одном варианте осуществления CD33-связывающий домен включает в себя линкер (Gly4-Ser)n, причем n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном варианте осуществления выделенная молекула CAR содержит трансмембранный домен белка, например, белка, описанного в настоящем документе, например, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность в соответствии с SEQ ID NO: 6. В одном варианте осуществления трансмембранный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности в соответствии с SEQ ID NO: 6, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 6.
В одном варианте осуществления CD33-связывающий домен соединен с трансмембранным доменом шарнирной областью, например, шарнирной областью, описанной в настоящем документе. В одном варианте осуществления кодируемая шарнирная область содержит SEQ ID NO: 2 или последовательность, идентичную ей на 95-99%.
В одном варианте осуществления выделенная молекула CAR дополнительно содержит последовательность, кодирующую костимулирующий домен, например, костимулирующий домен, описанный в настоящем документе.
В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит костимулирующий домен. В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит первичный сигнальный домен. В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит костимулирующий домен и первичный сигнальный домен.
В одном варианте осуществления костимулирующий домен содержит функциональный сигнальный домен белка, выбранного из группы, состоящей из молекулы ГКГС класса I, белков-рецепторов ФНО, иммуноглобулин-подобных белков, цитокиновых рецепторов, интегринов, сигнальных лимфоцит-активирующих молекул (SLAM-белков), активирующих рецепторов NK-клеток, BTLA, рецептора толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
В одном варианте осуществления костимулирующий домен из 4-1BB содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7. В одном варианте осуществления костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности в соответствии с SEQ ID NO: 7, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7. В другом варианте осуществления костимулирующий домен из CD28 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 379. В одном варианте осуществления костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 379, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 379. В другом варианте осуществления костимулирующий домен из CD27 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 8. В одном варианте осуществления костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 8, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 8. В другом варианте осуществления костимулирующий домен из ICOS содержит аминокислотную последовательность в соответствии с SEQ ID NO: 381. В одном варианте осуществления костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 381, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 381.
В вариантах осуществления первичный сигнальный домен содержит функциональный сигнальный домен из CD3-дзета. В вариантах осуществления функциональный сигнальный домен из CD3-дзета содержит SEQ ID NO: 9 (мутантная CD3-дзета), или SEQ ID NO: 10 (человеческая CD3-дзета дикого типа), или последовательность, идентичную им на 95-99%.
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен из 4-1BB и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7 и/или аминокислотную последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7 и/или последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи.
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен из CD27 и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления внутриклеточный сигнальный домен из CD27 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 8 и/или аминокислотную последовательность CD3-дзета в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 8 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 8 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 8 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи.
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен из CD28 и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен из CD28 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 379 и/или аминокислотную последовательность CD3-дзета в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 379 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 379 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 379 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи.
В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен из ICOS и/или функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления внутриклеточный сигнальный домен из ICOS содержит аминокислотную последовательность в соответствии с SEQ ID NO: 381 и/или аминокислотную последовательность CD3-дзета в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 381 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 381 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 381 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи.
В одном варианте осуществления выделенная молекула CAR дополнительно содержит лидерную последовательность, например, лидерную последовательность, описанную в настоящем документе. В одном варианте осуществления лидерная последовательность содержит аминокислотную последовательность в соответствии с SEQ ID NO: 1 или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 1.
В другом аспекте настоящее изобретение относится к выделенной молекуле CAR, содержащей лидерную последовательность, например, лидерную последовательность, описанную в настоящем документе, например, лидерную последовательность в соответствии с SEQ ID NO: 1 или идентичную ей на 95-99%, CD33-связывающий домен, описанный в настоящем документе, например, CD33-связывающий домен, содержащий LC CDR1, LC CDR2, LC CDR3, HC CDR1, HC CDR2 и HC CDR3, описанный в настоящем документе, например, CD33-связывающий домен, описанный в таблице 8, или последовательность, идентичную ему на 95-99%, шарнирную область, например, шарнирную область, описанную в настоящем документе, например, шарнирную область в соответствии с SEQ ID NO: 2 или идентичную ей на 95-99%, трансмембранный домен, например, трансмембранный домен, описанный в настоящем документе, например, трансмембранный домен, имеющий последовательность в соответствии с SEQ ID NO: 6 или последовательность, идентичную ей на 95-99%, внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описанный в настоящем документе (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном варианте осуществления внутриклеточный сигнальный домен содержит костимулирующий домен, например, костимулирующий домен, описанный в настоящем документе, например, костимулирующий домен из 4-1BB, имеющий последовательность в соответствии с SEQ ID NO: 7 или идентичную ей на 95-99%, и/или первичный сигнальный домен, например, первичный сигнальный домен, описанный в настоящем документе, например, стимулирующий домен из CD3-дзета, имеющий последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10 или идентичную ей на 95-99%. В одном варианте осуществления внутриклеточный сигнальный домен содержит костимулирующий домен, например, костимулирующий домен, описанный в настоящем документе, например, костимулирующий домен из 4-1BB, имеющий последовательность в соответствии с SEQ ID NO: 7, и/или первичный сигнальный домен, например, первичный сигнальный домен, описанный в настоящем документе, например, стимулирующий домен из CD3-дзета, имеющий последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10.
В одном варианте осуществления выделенная молекула CAR содержит (например, состоит из нее) аминокислотную последовательность в соответствии с SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55 или SEQ ID NO: 56, или аминокислотную последовательность, имеющую по меньшей мере одну, две, три, четыре, пять, 10, 15, 20 или 30 модификаций (например, замен, например, консервативных замен), но не более чем 60, 50 или 40 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности в соответствии с SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55 или SEQ ID NO: 56, или аминокислотную последовательность, идентичную на 85%, 90%, 95%, 96%, 97%, 98% или 99% аминокислотной последовательности в соответствии с SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55 или SEQ ID NO: 56.
В одном аспекте настоящее изобретение относится к CD33-связывающему домену, содержащему одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (LC CDR1), определяющей комплементарность области 2 легкой цепи (LC CDR2) и определяющей комплементарность области 3 легкой цепи (LC CDR3) CD33-связывающего домена, описанного в настоящем документе, и/или одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (HC CDR1), определяющей комплементарность области 2 тяжелой цепи (HC CDR2) и определяющей комплементарность области 3 тяжелой цепи (HC CDR3) CD33-связывающего домена, описанного в настоящем документе, например, CD33-связывающего домена, содержащего одну или несколько, например, все три, LC CDR и одну или несколько, например, все три, HC CDR.
В других вариантах осуществления CD33-связывающий домен содержит HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9. В вариантах осуществления CD33-связывающий домен дополнительно содержит LC CDR1, LC CDR2 и LC CDR3. В вариантах осуществления CD33-связывающий домен содержит LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9.
В некоторых вариантах осуществления CD33-связывающий домен содержит одну, две или все из LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9, и одну, две или все из HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9.
В одном варианте осуществления CD33-связывающий домен содержит вариабельную область легкой цепи, описанную в настоящем документе (например, в SEQ ID NO: 66, 67, 68, 69, 70, 71, 72, 73 или 74) и/или вариабельную область тяжелой цепи, описанную в настоящем документе (например, в SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64 или 65). В одном варианте осуществления CD33-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности в соответствии с SEQ ID NO: 39, 40, 41, 42, 43, 44, 45, 46 или 47. В варианте осуществления CD33-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в SEQ ID NO: 66, 67, 68, 69, 70, 71, 72, 73 или 74, или последовательность, идентичную на 95-99% аминокислотной последовательности в SEQ ID NO: 66, 67, 68, 69, 70, 71, 72, 73 или 74; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64 или 65, или последовательность, идентичную на 95-99% аминокислотной последовательности в SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64 или 65. В одном варианте осуществления CD33-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46 и SEQ ID NO: 47, или последовательность, идентичную ей на 95-99%. В одном варианте осуществления CD33-связывающий домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем документе, например, в таблице 8 или 9, прикреплена к вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем документе, например, в таблице 8 или 9, с помощью линкера, например, линкера, описанного в настоящем документе. В одном варианте осуществления CD33-связывающий домен включает в себя линкер (Gly4-Ser)n, причем n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В другом аспекте настоящее изобретение относится к вектору, содержащему молекулу нуклеиновой кислоты, описанную в настоящем документе, например, молекулу нуклеиновой кислоты, кодирующую CAR, описанный в настоящем документе. В одном варианте осуществления вектор выбирают из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора.
В одном варианте осуществления вектор представляет собой лентивирусный вектор. В одном варианте осуществления вектор дополнительно содержит промотор. В одном варианте осуществления промотор представляет собой промотор EF-1. В одном варианте осуществления промотор EF-1 содержит последовательность в соответствии с SEQ ID NO: 11. В другом варианте осуществления промотор представляет собой промотор PGK, например, усеченный промотор PGK, как описано в настоящем документе.
В одном варианте осуществления вектор представляет собой in vitro транскрибируемый вектор, например, вектор, который транскрибирует РНК молекулы нуклеиновой кислоты, описанной в настоящем документе. В одном варианте осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит поли(A)-хвост, например, поли-A-хвост, описанный в настоящем документе, например, содержащий приблизительно 150 аденозиновых оснований (SEQ ID NO: 377). В одном варианте осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит 3'-НТО, например, 3'-НТО, описанную в настоящем документе, например, содержащую по меньшей мере один повтор 3'-НТО, происходящей от человеческого бета-глобулина. В одном варианте осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит промотор, например, промотор T2A.
В другом аспекте настоящее изобретение относится к клетке, содержащей вектор, описанный в настоящем документе. В одном варианте осуществления клетка представляет собой клетку, описанную в настоящем документе, например, иммунную эффекторную клетку, например, человеческую T-клетку, например, человеческую T-клетку, описанную в настоящем документе, или человеческую NK-клетку, например, человеческую NK-клетку, описанную в настоящем документе. В одном варианте осуществления человеческая T-клетка представляет собой CD8+ T-клетку.
В одном варианте осуществления экспрессирующая CAR клетка, описанная в настоящем документе, может дополнительно экспрессировать другое средство, например, средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует ингибирующую молекулу. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета, например, как описано в настоящем документе. В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например, ингибирующую молекулу, ассоциированный со вторым полипептидом, который передает положительный сигнал в клетку, например, внутриклеточным сигнальным доменом, описанным в настоящем документе. В одном варианте осуществления средство содержит первый полипептид, например, ингибирующую молекулу, такую как PD1, PD-L1, PD-L2, LAG3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), CTLA4, VISTA, CD160, BTLA, LAIR1, TIM3, 2B4, TGFR-бета, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TIGIT или фрагмент любой из них (например, по меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем документе (например, содержит костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем документе) и/или первичный сигнальный домен (например, сигнальный домен из CD3-дзета, описанный в настоящем документе)). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1) и второй полипептид внутриклеточного сигнального домена, описанного в настоящем документе (например, сигнального домена из CD28, описанного в настоящем документе, и/или сигнального домена из CD3-дзета, описанного в настоящем документе).
В другом аспекте настоящее изобретение относится к способу производства клеток, содержащему трансдукцию клетки, описанной в настоящем документе, например, иммунной эффекторной клетки, описанной в настоящем документе, например, T-клетки, описанной в настоящем документе, или NK-клетки, вектором, содержащим нуклеиновую кислоту, кодирующую CAR, например, CAR, описанный в настоящем документе.
Настоящее изобретение предлагает также способ генерирования популяции сконструированных клеток с измененной РНК, например, клеток, описанных в настоящем документе, например, иммунных эффекторных клеток, например, T-клеток или NK-клеток, временно экспрессирующих экзогенную РНК. Способ содержит введение транскрибированной in vitro РНК или синтетической РНК в клетку, причем РНК содержит нуклеиновую кислоту, кодирующую молекулу CAR, описанную в настоящем документе.
В другом аспекте настоящее изобретение относится к способу обеспечения противоопухолевого иммунитета у млекопитающего, содержащему введение млекопитающему эффективного количества клеток, экспрессирующих молекулу CAR, например, клеток, экспрессирующих молекулу CAR, описанную в настоящем документе. В одном варианте осуществления клетка представляет собой аутологичную иммунную эффекторную клетку, например, T-клетку или NK-клетку. В одном варианте осуществления клетка представляет собой аллогенную иммунную эффекторную клетку, например, T-клетку или NK-клетку. В одном варианте осуществления млекопитающее представляет собой человека, например, пациента с гематологическим раком.
В другом аспекте настоящее изобретение относится к способу лечения млекопитающего, имеющего заболевание, ассоциированное с экспрессией CD33 (например, пролиферативное заболевание, предраковое состояние и не связанный с раком симптом, ассоциированный с экспрессией CD33), содержащему введение млекопитающему эффективного количества клеток, экспрессирующих молекулу CAR, например, молекулу CAR, описанную в настоящем документе. В одном варианте осуществления млекопитающее представляет собой человека, например, пациента с гематологическим раком.
В одном варианте осуществления заболевание представляет собой заболевание, описанное в настоящем документе. В одном варианте осуществления заболевание, ассоциированное с экспрессией CD33, выбирают из пролиферативного заболевания, такого как рак или злокачественная опухоль, или предракового состояния, такого как миелодисплазия, миелодиспластический синдром или предлейкоз, или оно представляет собой не связанный с раком симптом, ассоциированный с экспрессией CD33. В одном варианте осуществления заболевание представляет собой гематологический рак, выбранный из группы, состоящей из одного или нескольких острых лейкозов, включая, но без ограничения, острый миелоидный лейкоз (ОМЛ); миелодиспластический синдром; миелопролиферативные новообразования; хронический миелоидный лейкоз (ХМЛ); новообразование из бластных плазмацитоидных дендритных клеток; и заболевание, ассоциированное с экспрессией CD33, включая, но без ограничения, атипичные и/или неклассические раки, злокачественные опухоли, предраковые состояния или пролиферативные заболевания, экспрессирующие CD33; и их комбинации.
В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем документе, вводят в комбинации со средством, которое повышает эффективность клетки, экспрессирующей молекулу CAR, например, средством, описанным в настоящем документе.
В другом аспекте настоящее изобретение относится к способу кондиционирования субъекта перед клеточной трансплантацией, содержащему введение субъекту эффективного количества клеток, содержащих молекулу CAR, раскрытую в настоящем документе. В одном варианте осуществления клеточная трансплантация представляет собой трансплантацию стволовых клеток. Трансплантация стволовых клеток представляет собой трансплантацию гематопоэтических стволовых клеток или трансплантацию костного мозга. В одном варианте осуществления клеточная трансплантация является аллогенной или аутологичной.
В одном варианте осуществления кондиционирование субъекта перед клеточной трансплантацией содержит уменьшение количества CD33-экспрессирующих клеток у субъекта. CD33-экспрессирующие клетки у субъекта представляют собой CD33-экспрессирующие нормальные клетки или CD33-экспрессирующие раковые клетки, и, в некоторых случаях, кондиционирование субъекта будет уменьшать количество как CD33-экспрессирующих нормальных, так и раковых клеток перед клеточной трансплантацией.
В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем документе, вводят в комбинации с низкой иммуностимулирующей дозой ингибитора mTOR. Не желая быть связанными теорией, авторы полагают, что лечение с помощью низкой иммуностимулирующей дозы (например, дозы, недостаточной для полного подавления иммунной системы, но достаточной для улучшения иммунной функции) сопровождается уменьшением количества PD-1-положительных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или увеличением количества PD-1-отрицательных клеток. PD-1-положительные иммунные эффекторные клетки (например, T-клетки или NK-клетки), но не PD-1-отрицательные иммунные эффекторные клетки (например, T-клетки или NK-клетки) могут быть истощены посредством контакта с клетками, которые экспрессируют лиганд PD-1, например, PD-L1 или PD-L2.
В варианте осуществления этот подход можно использовать для оптимизации активности клеток с CAR, описанных в настоящем документе, у субъекта. Не желая быть связанными теорией, авторы полагают, что в варианте осуществления активность эндогенных немодифицированных иммунных эффекторных клеток, например, T-клеток или NK-клеток, улучшается. Не желая быть связанными теорией, авторы полагают, что в варианте осуществления активность экспрессирующей CAR к CD33 клетки улучшается. В других вариантах осуществления клетки, например, иммунные эффекторные клетки (например, T-клетки или NK-клетки), которые должны экспрессировать или будут сконструированы для экспрессии CAR, могут быть обработаны ex vivo посредством контакта с некоторым количеством ингибитора mTOR, которое увеличивает количество PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, NK-клеток, или повышает отношение PD1-отрицательные иммунные эффекторные клетки, например, T-клетки или NK-клетки/PD1-положительные иммунные эффекторные клетки, например, T-клетки или NK-клетки.
В варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR, например, аллостерического ингибитора, например, RAD001, или каталитического ингибитора, начинают перед введением экспрессирующей CAR клетки, описанной в настоящем документе, например, иммунных эффекторных клеток (например, T-клеток или NK-клеток). В варианте осуществления клетки с CAR вводят по прошествии достаточного времени или достаточного дозирования ингибитора mTOR, так что уровень PD1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или отношение PD1-отрицательные иммунные эффекторные клетки, например, T-клетки или NK-клетки/PD1-положительные иммунные эффекторные клетки, например, T-клетки или NK-клетки, по меньшей мере временно повышается. В варианте осуществления клетку, например, иммунную эффекторную клетку (например, T-клетку или NK-клетку), которая должна быть сконструирована для экспрессии CAR, отбирают по прошествии достаточного времени или после достаточного дозирования низкой иммуностимулирующей дозы ингибитора mTOR, так что уровень PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, или отношение PD1-отрицательные иммунные эффекторные клетки, например, T-клетки или NK-клетки/PD1-положительные иммунные эффекторные клетки, например, T-клетки или NK-клетки, у субъекта или после отбора у субъекта по меньшей мере временно повышается.
В варианте осуществления настоящее изобретение предлагает ингибитор mTOR для использования в лечении субъекта, причем упомянутый ингибитор mTOR усиливает иммунный ответ упомянутого субъекта, и причем упомянутый субъект получил, получает или скоро будет получать иммунную эффекторную клетку, которая экспрессирует CAR к CD33, как описано в настоящем документе.
В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем документе, вводят в комбинации со средством, которое ослабляет один или несколько побочных эффектов, ассоциированных с введением клетки, экспрессирующей молекулу CAR, например, средством, описанным в настоящем документе.
В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем документе, вводят в комбинации со средством, которое лечит заболевание, ассоциированное с CD33, например, средством, описанным в настоящем документе. В определенных вариантах осуществления заболевание, ассоциированное с CD33, представляет собой пролиферативное заболевание, такое как рак или злокачественная опухоль, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз, или представляет собой не связанный с раком симптом, ассоциированный с экспрессией CD33.
В определенных вариантах осуществления заболевание, ассоциированное с CD33, представляет собой гематологический рак, выбранный из группы, состоящей из одного или нескольких острых лейкозов, включая, но без ограничения, острый миелоидный лейкоз (ОМЛ); миелодиспластический синдром; миелопролиферативные новообразования; хронический миелоидный лейкоз (ХМЛ); новообразование из бластных плазмацитоидных дендритных клеток; и заболевание, ассоциированное с экспрессией CD33, включая, но без ограничения, атипичные и/или неклассические раки, злокачественные опухоли, предраковые состояния или пролиферативные заболевания, экспрессирующие CD33; и их комбинации.
В некоторых вариантах осуществления CAR к CD33, описанный в настоящем документе, воздействует на CD33-экспрессирующую клетку. В вариантах осуществления CAR к CD33, описанный в настоящем документе, воздействует на МДС-бласт. В некоторых вариантах осуществления МДС-бласт содержит делецию 5q (del(5q)). В вариантах осуществления экспрессирующую CAR к CD33 клетку, описанную в настоящем документе, используют для лечения субъекта, имеющего МДС. В вариантах осуществления экспрессирующую CAR к CD33 клетку, описанную в настоящем документе, используют для лечения субъекта, имеющего МДС, ассоциированный с выделенной del(5q).
В вариантах осуществления CAR к CD33, описанный в настоящем документе, воздействует на MDSC, например, MDSC у субъекта, имеющего рак (например, множественную миелому, хронический лимфоцитарный лейкоз или солидные злокачественные опухоли, такие как рак яичников, рак толстой кишки или рак молочной железы). В вариантах осуществления MDSC является отрицательной по линии дифференцировки (LIN-), HLA-DR-отрицательной и CD33-положительной. В некоторых вариантах осуществления экспрессирующая CAR к CD33 клетка, описанная в настоящем документе, воздействует на МДС-бласт и MDSC. В вариантах осуществления экспрессирующую CAR к CD33 клетку, описанную в настоящем документе, используют для лечения множественной миеломы, хронического лимфоцитарного лейкоза (ХЛЛ) или солидных злокачественных опухолей, таких как рак яичников, рак толстой кишки или рак молочной железы.
В другом аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CAR настоящего изобретения, выделенной полипептидной молекуле CAR настоящего изобретения, вектору, содержащему CAR настоящего изобретения, и клетке, содержащей CAR настоящего изобретения, для использования в качестве лекарственного средства, например, как описано в настоящем документе.
В другом аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CAR настоящего изобретения, выделенной полипептидной молекуле CAR настоящего изобретения, вектору, содержащему CAR настоящего изобретения, и клетке, содержащей CAR настоящего изобретения, для использования в лечении заболевания, экспрессирующего CD33, например, заболевания, экспрессирующего CD33, как описано в настоящем документе.
Дополнительные признаки и варианты осуществления вышеупомянутых композиций и способов включают в себя один или несколько из следующих:
В определенных вариантах осуществления молекула CAR к CD33 (например, нуклеиновая кислота CAR к CD33 или полипептид CAR к CD33, как описано в настоящем документе) или CD33-связывающий домен, как описано в настоящем документе, включает в себя одну, две или три CDR из вариабельной области тяжелой цепи (например, HC CDR1, HC CDR2 и/или HC CDR3), приведенные в таблице 1; и/или одну, две или три CDR из вариабельной области легкой цепи (например, LC CDR1, LC CDR2 и/или LC CDR3) из CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенные в таблице 2; или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR к CD33 (например, нуклеиновая кислота CAR к CD33 или полипептид CAR к CD33, как описано в настоящем документе) или анти-CD33 антигенсвязывающий домен, как описано в настоящем документе, включают в себя одну, две или три CDR из вариабельной области тяжелой цепи (например, HC CDR1, HC CDR2 и/или HC CDR3), приведенные в таблице 3; и/или одну, две или три CDR из вариабельной области легкой цепи (например, LC CDR1, LC CDR2 и/или LC CDR3) из CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенные в таблице 4; или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR к CD33 или анти-CD33 антигенсвязывающий домен включают в себя одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), приведенные в таблице 5; и/или одну, две или три CDR из вариабельной области легкой цепи (например, LC CDR1, LC CDR2 и/или LC CDR3) из CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенные в таблице 6; или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR к CD33 или анти-CD33 антигенсвязывающий домен включают в себя
(i) LC CDR1, LC CDR2 и LC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена легкой цепи для CD33, приведенной в таблице 8 или 9, или LC CDR в таблице 2, 9, 4 или 6; и/или.
(ii) HC CDR1, HC CDR2 и HC CDR3 в соответствии с любой аминокислотной последовательностью связывающего домена тяжелой цепи для CD33, приведенной в таблице 8 или 9, или HC CDR в таблице 1, 9, 3 или 5.
В определенных вариантах осуществления молекула CAR к CD33 (например, нуклеиновая кислота CAR к CD33 или полипептид CAR к CD33, как описано в настоящем документе) или анти-CD33 антигенсвязывающий домен, как описано в настоящем документе, включают в себя:
(1) три CDR легкой цепи (LC), выбранные из одной из следующих:
(i) LC CDR1 в соответствии с SEQ ID NO: 111, LC CDR2 в соответствии с SEQ ID NO: 120 и LC CDR3 в соответствии с SEQ ID NO: 129 из CAR33-1;
(ii) LC CDR1 в соответствии с SEQ ID NO: 112, LC CDR2 в соответствии с SEQ ID NO: 121 и LC CDR3 в соответствии с SEQ ID NO: 130 из CAR33-2;
(iii) LC CDR1 в соответствии с SEQ ID NO: 113, LC CDR2 в соответствии с SEQ ID NO: 122 и LC CDR3 в соответствии с SEQ ID NO: 131 из CAR33-3;
(iv) LC CDR1 в соответствии с SEQ ID NO: 114, LC CDR2 в соответствии с SEQ ID NO: 123 и LC CDR3 в соответствии с SEQ ID NO: 132 из CAR33-4;
(iv) LC CDR1 в соответствии с SEQ ID NO: 115, LC CDR2 в соответствии с SEQ ID NO: 124 и LC CDR3 в соответствии с SEQ ID NO: 133 из CAR33-5;
(vi) LC CDR1 в соответствии с SEQ ID NO: 116, LC CDR2 в соответствии с SEQ ID NO: 125 и LC CDR3 в соответствии с SEQ ID NO: 134 из CAR33-6;
(vii) LC CDR1 в соответствии с SEQ ID NO: 117, LC CDR2 в соответствии с SEQ ID NO: 126 и LC CDR3 в соответствии с SEQ ID NO: 135 из CAR33-7;
(viii) LC CDR1 в соответствии с SEQ ID NO: 118, LC CDR2 в соответствии с SEQ ID NO: 127 и LC CDR3 в соответствии с SEQ ID NO: 136 из CAR33-8; или
(ix) LC CDR1 в соответствии с SEQ ID NO: 119, LC CDR2 в соответствии с SEQ ID NO: 128 и LC CDR3 в соответствии с SEQ ID NO: 137 из CAR33-9; и/или
(2) три CDR тяжелой цепи (HC), выбранные из одной из следующих:
(i) HC CDR1 в соответствии с SEQ ID NO: 84, HC CDR2 в соответствии с SEQ ID NO: 93 и HC CDR3 в соответствии с SEQ ID NO: 102 из CAR33-1;
(ii) HC CDR1 в соответствии с SEQ ID NO: 85, HC CDR2 в соответствии с SEQ ID NO: 94 и HC CDR3 в соответствии с SEQ ID NO: 103 из CAR33-2;
(iii) HC CDR1 в соответствии с SEQ ID NO: 86, HC CDR2 в соответствии с SEQ ID NO: 95 и HC CDR3 в соответствии с SEQ ID NO: 104 из CAR33-3;
(iv) HC CDR1 в соответствии с SEQ ID NO: 87, HC CDR2 в соответствии с SEQ ID NO: 96 и HC CDR3 в соответствии с SEQ ID NO: 105 из CAR33-4;
(iv) HC CDR1 в соответствии с SEQ ID NO: 88, HC CDR2 в соответствии с SEQ ID NO: 97 и HC CDR3 в соответствии с SEQ ID NO: 106 из CAR33-5;
(vi) HC CDR1 в соответствии с SEQ ID NO: 89, HC CDR2 в соответствии с SEQ ID NO: 98 и HC CDR3 в соответствии с SEQ ID NO: 107 из CAR33-6;
(vii) HC CDR1 в соответствии с SEQ ID NO: 90, HC CDR2 в соответствии с SEQ ID NO: 99 и HC CDR3 в соответствии с SEQ ID NO: 108 из CAR33-7;
(viii) HC CDR1 в соответствии с SEQ ID NO: 91, HC CDR2 в соответствии с SEQ ID NO: 100 и HC CDR3 в соответствии с SEQ ID NO: 109 из CAR33-8; или
(ix) HC CDR1 в соответствии с SEQ ID NO: 92, HC CDR2 в соответствии с SEQ ID NO: 101 и HC CDR3 в соответствии с SEQ ID NO: 110 из CAR33-9.
В определенных вариантах осуществления молекула CAR к CD33 (например, нуклеиновая кислота CAR к CD33 или полипептид CAR к CD33, как описано в настоящем документе) или анти-CD33 антигенсвязывающий домен, как описано в настоящем документе, включают в себя:
(1) три CDR легкой цепи (LC), выбранные из одной из следующих:
(i) LC CDR1 в соответствии с SEQ ID NO: 296, LC CDR2 в соответствии с SEQ ID NO: 305 и LC CDR3 в соответствии с SEQ ID NO: 314 из CAR33-1;
(ii) LC CDR1 в соответствии с SEQ ID NO: 297, LC CDR2 в соответствии с SEQ ID NO: 306 и LC CDR3 в соответствии с SEQ ID NO: 315 из CAR33-2;
(iii) LC CDR1 в соответствии с SEQ ID NO: 298, LC CDR2 в соответствии с SEQ ID NO: 307 и LC CDR3 в соответствии с SEQ ID NO: 316 из CAR33-3;
(iv) LC CDR1 в соответствии с SEQ ID NO: 299, LC CDR2 в соответствии с SEQ ID NO: 308 и LC CDR3 в соответствии с SEQ ID NO: 317 из CAR33-4;
(iv) LC CDR1 в соответствии с SEQ ID NO: 300, LC CDR2 в соответствии с SEQ ID NO: 309 и LC CDR3 в соответствии с SEQ ID NO: 318 из CAR33-5;
(vi) LC CDR1 в соответствии с SEQ ID NO: 301, LC CDR2 в соответствии с SEQ ID NO: 310 и LC CDR3 в соответствии с SEQ ID NO: 319 из CAR33-6;
(vii) LC CDR1 в соответствии с SEQ ID NO: 302, LC CDR2 в соответствии с SEQ ID NO: 311 и LC CDR3 в соответствии с SEQ ID NO: 320 из CAR33-7;
(viii) LC CDR1 в соответствии с SEQ ID NO: 303, LC CDR2 в соответствии с SEQ ID NO: 312 и LC CDR3 в соответствии с SEQ ID NO: 321 из CAR33-8; или
(ix) LC CDR1 в соответствии с SEQ ID NO: 304, LC CDR2 в соответствии с SEQ ID NO: 313 и LC CDR3 в соответствии с SEQ ID NO: 322 из CAR33-9; и/или
(2) три CDR тяжелой цепи (HC), выбранные из одной из следующих:
(i) HC CDR1 в соответствии с SEQ ID NO: 269, HC CDR2 в соответствии с SEQ ID NO: 278 и HC CDR3 в соответствии с SEQ ID NO: 287 из CAR33-1;
(ii) HC CDR1 в соответствии с SEQ ID NO: 270, HC CDR2 в соответствии с SEQ ID NO: 279 и HC CDR3 в соответствии с SEQ ID NO: 288 из CAR33-2;
(iii) HC CDR1 в соответствии с SEQ ID NO: 271, HC CDR2 в соответствии с SEQ ID NO: 280 и HC CDR3 в соответствии с SEQ ID NO: 289 из CAR33-3;
(iv) HC CDR1 в соответствии с SEQ ID NO: 272, HC CDR2 в соответствии с SEQ ID NO: 281 и HC CDR3 в соответствии с SEQ ID NO: 290 из CAR33-4;
(iv) HC CDR1 в соответствии с SEQ ID NO: 273, HC CDR2 в соответствии с SEQ ID NO: 282 и HC CDR3 в соответствии с SEQ ID NO: 291 из CAR33-5;
(vi) HC CDR1 в соответствии с SEQ ID NO: 274, HC CDR2 в соответствии с SEQ ID NO: 283 и HC CDR3 в соответствии с SEQ ID NO: 292 из CAR33-6;
(vii) HC CDR1 в соответствии с SEQ ID NO: 275, HC CDR2 в соответствии с SEQ ID NO: 284 и HC CDR3 в соответствии с SEQ ID NO: 293 из CAR33-7;
(viii) HC CDR1 в соответствии с SEQ ID NO: 276, HC CDR2 в соответствии с SEQ ID NO: 285 и HC CDR3 в соответствии с SEQ ID NO: 294 из CAR33-8; или
(ix) HC CDR1 в соответствии с SEQ ID NO: 277, HC CDR2 в соответствии с SEQ ID NO: 286 и HC CDR3 в соответствии с SEQ ID NO: 295 из CAR33-9.
В определенных вариантах осуществления молекула CAR к CD33 (например, нуклеиновая кислота CAR к CD33 или полипептид CAR к CD33, как описано в настоящем документе) или анти-CD33 антигенсвязывающий домен, как описано в настоящем документе, включают в себя:
(1) три CDR легкой цепи (LC), выбранные из одной из следующих:
(i) LC CDR1 в соответствии с SEQ ID NO: 350, LC CDR2 в соответствии с SEQ ID NO: 359 и LC CDR3 в соответствии с SEQ ID NO: 368 из CAR33-1;
(ii) LC CDR1 в соответствии с SEQ ID NO: 351, LC CDR2 в соответствии с SEQ ID NO: 360 и LC CDR3 в соответствии с SEQ ID NO: 369 из CAR33-2;
(iii) LC CDR1 в соответствии с SEQ ID NO: 352, LC CDR2 в соответствии с SEQ ID NO: 361 и LC CDR3 в соответствии с SEQ ID NO: 370 из CAR33-3;
(iv) LC CDR1 в соответствии с SEQ ID NO: 353, LC CDR2 в соответствии с SEQ ID NO: 362 и LC CDR3 в соответствии с SEQ ID NO: 371 из CAR33-4;
(iv) LC CDR1 в соответствии с SEQ ID NO: 354, LC CDR2 в соответствии с SEQ ID NO: 363 и LC CDR3 в соответствии с SEQ ID NO: 372 из CAR33-5;
(vi) LC CDR1 в соответствии с SEQ ID NO: 355, LC CDR2 в соответствии с SEQ ID NO: 364 и LC CDR3 в соответствии с SEQ ID NO: 373 из CAR33-6;
(vii) LC CDR1 в соответствии с SEQ ID NO: 356, LC CDR2 в соответствии с SEQ ID NO: 365 и LC CDR3 в соответствии с SEQ ID NO: 374 из CAR33-7;
(viii) LC CDR1 в соответствии с SEQ ID NO: 357, LC CDR2 в соответствии с SEQ ID NO: 366 и LC CDR3 в соответствии с SEQ ID NO: 375 из CAR33-8; или
(ix) LC CDR1 в соответствии с SEQ ID NO: 358, LC CDR2 в соответствии с SEQ ID NO: 367 и LC CDR3 в соответствии с SEQ ID NO: 376 из CAR33-9; и/или
(2) три CDR тяжелой цепи (HC), выбранные из одной из следующих:
(i) HC CDR1 в соответствии с SEQ ID NO: 323, HC CDR2 в соответствии с SEQ ID NO: 332 и HC CDR3 в соответствии с SEQ ID NO: 341 из CAR33-1;
(ii) HC CDR1 в соответствии с SEQ ID NO: 324, HC CDR2 в соответствии с SEQ ID NO: 333 и HC CDR3 в соответствии с SEQ ID NO: 342 из CAR33-2;
(iii) HC CDR1 в соответствии с SEQ ID NO: 325, HC CDR2 в соответствии с SEQ ID NO: 334 и HC CDR3 в соответствии с SEQ ID NO: 343 из CAR33-3;
(iv) HC CDR1 в соответствии с SEQ ID NO: 326, HC CDR2 в соответствии с SEQ ID NO: 335 и HC CDR3 в соответствии с SEQ ID NO: 344 из CAR33-4;
(iv) HC CDR1 в соответствии с SEQ ID NO: 327, HC CDR2 в соответствии с SEQ ID NO: 336 и HC CDR3 в соответствии с SEQ ID NO: 345 из CAR33-5;
(vi) HC CDR1 в соответствии с SEQ ID NO: 328, HC CDR2 в соответствии с SEQ ID NO: 337 и HC CDR3 в соответствии с SEQ ID NO: 346 из CAR33-6;
(vii) HC CDR1 в соответствии с SEQ ID NO: 329, HC CDR2 в соответствии с SEQ ID NO: 338 и HC CDR3 в соответствии с SEQ ID NO: 347 из CAR33-7;
(viii) HC CDR1 в соответствии с SEQ ID NO: 330, HC CDR2 в соответствии с SEQ ID NO: 339 и HC CDR3 в соответствии с SEQ ID NO: 348 из CAR33-8; или
(ix) HC CDR1 в соответствии с SEQ ID NO: 331, HC CDR2 в соответствии с SEQ ID NO: 340 и HC CDR3 в соответствии с SEQ ID NO: 349 из CAR33-9.
В определенных вариантах осуществления молекула CAR к CD33 (например, нуклеиновая кислота CAR к CD33 или полипептид CAR к CD33, как описано в настоящем документе) или анти-CD33 антигенсвязывающий домен, как описано в настоящем документе, включают в себя аминокислотную последовательность scFv 2213 (SEQ ID NO: 142) или нуклеотидную последовательность, кодирующую scFv 2213 (SEQ ID NO: 141), или его антигенсвязывающий домен (например, его VH, VL или одну или несколько CDR).
В определенных вариантах осуществления молекула CAR к CD33 (например, нуклеиновая кислота CAR к CD33 или полипептид CAR к CD33, как описано в настоящем документе) или анти-CD33 антигенсвязывающий домен, как описано в настоящем документе, включают в себя аминокислотную последовательность scFv my96 (SEQ ID NO: 147) или его антигенсвязывающий домен (например, его VH, VL или одну или несколько CDR).
Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют значение, обычно понимаемое средним специалистом в области техники, к которой принадлежит настоящее изобретение. Хотя при реализации на практике или тестировании настоящего изобретения можно использовать способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем документе, включены посредством ссылки во всей полноте. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения. Заголовки, подзаголовки или элементы, обозначенные цифрами или буквами, например, (a), (b), (i) и так далее, представлены только для удобства чтения. Использование в данном документе заголовков или элементов, обозначенных цифрами или буквами, не требует, чтобы этапы или элементы были выполнены в алфавитном порядке, или чтобы этапы или элементы были обязательно отделены друг от друга. Другие признаки, цели и преимущества настоящего изобретения будут очевидны из описания и чертежей и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Нижеследующее подробное описание предпочтительных вариантов осуществления настоящего изобретения будет более понятным при чтении совместно с прилагаемыми чертежами. С целью иллюстрации настоящего изобретения на чертежах показаны варианты осуществления, которые в настоящее время являются предпочтительными. Следует, тем не менее, понимать, что настоящее изобретение не ограничено точными конфигурациями и инструментальными средствами вариантов осуществления, показанных на чертежах.
Фигура 1 представляет собой изображение, демонстрирующее, что CD33 экспрессируется на большинстве бластов во многих первичных образцах пациентов с ОМЛ (ОМЛ-бласты гейтировали с использованием стандартных характеристик боковое светорассеяниеlow CD45dim); n=35-46 на группу.
Фигуры 2A, 2B, и 2C представляют собой графики и профиль проточной цитометрии, демонстрирующие экспрессию CD33 в костном мозге пациентов с миелодиспластическим синдромом. Фигура 2A показывает процентную долю CD33-экспрессирующих клеток в камере CD34+ CD38- гематопоэтических стволовых клеток у пациентов с МДС. Фигура 2B показывает процентную долю CD33-экспрессирующих клеток в камере CD34+ CD38+, содержащей миелоидные предшественники, у пациентов с МДС. Фигура 2C представляет собой гистограмму, показывающую среднюю интенсивность флуоресценции у пациентов с МДС в камере CD34+ CD38-.
Фигура 3 показывает схематическое представление конструктов CAR, используемых в примере 1. Все они представляют собой CAR второго поколения, использующие сигнализацию 41BB и CD3-дзета. scFv CART33 получали из клона MY9-6.
Фигура 4 представляет собой изображение, демонстрирующее in vitro активность CART33. CART33-опосредованная дегрануляция T-клеток: трансдуцированные CAR33 и нетрансдуцированные T-клетки инкубировали с линией CD33+ клеток MOLM14 и контрольной линией клеток ОЛЛ NALM6 в течение 4 часов в присутствии CD28, CD49d и монензина. Дегрануляцию по CD107a измеряли с помощью проточной цитометрии. Экспрессия как мышиных, так и гуманизированных конструктов CART33 выявляет специфическую дегрануляцию в присутствии MOLM14 (P<0,001).
Фигура 5 представляет собой изображение, демонстрирующее in vitro активность CART33. Производство цитокинов: экспрессирующие как гуманизированные, так и мышиные CAR33 T-клетки производят цитокин после инкубации с MOLM14. T-клетки инкубировали с линией CD33+ клеток MOLM14 и контрольной линией клеток NALM6 в течение 4 часов. Затем клетки фиксировали, пермеабилизировали и окрашивали на внутриклеточные некроз опухоли-альфа и интерферон-гамма. Затем образцы анализировали посредством использования проточной цитометрии.
Фигура 6 представляет собой изображение, демонстрирующее in vitro активность CART33. Пролиферация экспрессирующих CAR123 и CAR33 T-клеток: пролиферация гуманизированных CART33 и мышиных CART33 в ответ на MOLM14. T-клетки помечали CFSE и инкубировали в контрольных условиях или с MOLM14 в течение 120 часов, и измеряли с помощью проточной цитометрии разбавление CFSE в качестве маркера пролиферации.
Фигуры 7A и 7B представляют собой два графика, демонстрирующих in vitro активность CART33. Специфический киллинг экспрессирующих CAR123, гуманизированный CAR33 и мышиный CAR33 T-клеток: T-клетки инкубировали с MOLM14 или T-клеточной линией клеток ОЛЛ Jurkat (контроль) в течение 24 часов. huCART33 приводили к значительно большему специфическому киллингу по сравнению с мышиными CART33 при низких отношениях E:T. На фигуре 7B CART33-Jurkat представлены с помощью треугольников, CART33-MOLM14 представлены с помощью перевернутых треугольников и CART123-MOLM14 представлены с помощью квадратов.
Фигура 8 представляет собой изображение, демонстрирующее, что CART33 (шарнир IgG4) и CART33 (шарнир CD8) обладают эквивалентной in vitro активностью. Анализ дегрануляции: CART33 (шарнир IgG4), CART33 (шарнир CD8), CART123 и нетрансдуцированные T-клетки инкубировали с линией CD33+ клеток MOLM14, и измеряли дегрануляцию по CD107a с помощью проточной цитометрии. Оба конструкта CART33 подвергались специфической дегрануляции в присутствии MOLM14.
Фигура 9 представляет собой изображение, демонстрирующее, что CART33 (шарнир IgG4) и CART33 (шарнир CD8) обладают эквивалентной in vitro активностью. Производство цитокинов: оба конструкта CAR33 и CAR123 специфически индуцируют производство цитокинов после инкубации с линией клеток MOLM14. T-клетки инкубировали с MOLM14 в течение 4 часов в присутствии CD28, CD49d и монензина. Затем клетки отбирали, фиксировали, пермеабилизировали и окрашивали на некроз опухоли-альфа, MIP1a и интерферон-гамма. Затем процентную долю клеток, производящих цитокины, измеряли с помощью проточной цитометрии.
Фигура 10 представляет собой изображение, демонстрирующее, что CART33 (шарнир IgG4) и CART33 (шарнир CD8) обладают эквивалентной in vitro активностью. Пролиферация контрольных нетрансдуцированных, экспрессирующих CAR33 (шарнир IgG4) (то есть, CAR33-IgG4H), CAR33 (шарнир CD8) (то есть, CAR33-CD8H) или CAR123 T-клеток в ответ на MOLM14. T-клетки помечали с помощью CFSE и инкубировали с MOLM14 в течение 120 часов.
Фигура 11 представляет собой схематическую диаграмму, демонстрирующую сравнение in vivo противоопухолевого эффекта CART33-CD8H, CART33-IgG4H и CART123. NOD-SCID- мышей с нокаутом общей гамма-цепи (NSG) инъецировали линией клеток ОМЛ MOLM14 1×106 в/в и визуализировали в отношении приживления через 6 дней. На день 7 мышей обрабатывали T-клетками, экспрессирующими CAR33 (шарнир IgG4), CAR33 (шарнир CD8), CAR123, или контрольным носителем (нетрансдуцированными клетками). Общее количество инъецированных T-клеток составляло 2×106 в/в. Затем мышей подвергали серии еженедельных визуализаций для оценки опухолевой нагрузки.
Фигура 12 представляет собой изображение, демонстрирующее эквивалентный in vivo противоопухолевый эффект T-клеток CART33-CD8H, CART33-IgG4H и CART123. Опухолевая нагрузка с течением времени по биолюминесцентной визуализации (BLI); данные из одного эксперимента (n=5 на группу), отражающего 4 независимых эксперимента для мышей, показанных на фигуре 11.
Фигура 13 представляет собой схематическую диаграмму, демонстрирующую сравнение CART33 и CART123 при эрадикации первичного ОМЛ in vivo. Мышей NSG, трансгенных по человеческим цитокинам IL3/GM-CSF/SCF (мышей NSGS), инъецировали образцом первичного ОМЛ 5×106 в/в. Приживление подтверждали с помощью ретроорбитального кровопускания через 2-4 недели, и затем мышей обрабатывали с помощью CART33, CART123 или контрольным носителем (нетрансдуцированными клетками). Общее количество инъецированных T-клеток составляло 1×105 в/в. Затем мышей подвергали серии ретроорбитальных кровопусканий для оценки нагрузки ОМЛ.
Фигура 14 представляет собой изображение, демонстрирующее, что CART33 и CART123 производят эквивалентную эрадикацию первичного ОМЛ in vivo. Анализ периферической крови мышей, обработанных нетрансдуцированными (UTD), CART33 или CART123, на исходном уровне, на день 14 и день +70. В соответствии со схемой эксперимента, описанной на фигуре 13, у мышей, обработанных CART33 или CART123, не детектировали ОМЛ.
Фигура 15 представляет собой изображение, демонстрирующее, что CART33 и CART123 производят эквивалентную эрадикацию первичного ОМЛ in vivo. Сводная информация по нагрузке заболевания, измеренной в бластах на мкл в ретроорбитальных кровопусканиях в различных временных точках, как указано, у мышей в схеме эксперимента, описанной на фигуре 13.
Фигура 16 представляет собой изображение, демонстрирующее, что CART33 и CART123 производят эквивалентную эрадикацию первичного ОМЛ in vivo. Выживаемость мышей, обработанных CART33, CART123 или UTD (p<0,001, когда обработку с помощью или CART33, или CART123 сравнивают с UTD), в соответствии со схемой эксперимента, описанной на фигуре 13.
Фигура 17 представляет собой схематическую диаграмму, демонстрирующую схему тестирования токсичности клеток CART33 для гематопоэтических стволовых клеток. Схема эксперимента: мышам с гуманизированной иммунной системой (HIS) делали ретроорбитальное кровопускание через 6-8 недель после инъекции человеческих CD34+ клеток, полученных из фетальной печени, для подтверждения приживления человеческих клеток. Затем мышей обрабатывали с помощью или CART33, или UTD (по 1×106 клеток) и затем подвергали серии еженедельных ретроорбитальных кровопусканий. Затем мышей умерщвляли на день 28, и органы отбирали и анализировали.
Фигура 18 представляет собой изображение, демонстрирующее токсичность клеток CART33 для гематопоэтических стволовых клеток клеток. Анализ с помощью проточной цитометрии периферической крови (из ретроорбитального кровопускания) с 28 дня при завершении эксперимента, показанного на фигуре 17. Обработка с помощью CART33 приводит к значительному уменьшению количества миелоидных клеток и моноцитов периферической крови по сравнению с обработкой с помощью нетрансдуцированных T-клеток.
Фигура 19 представляет собой изображение, демонстрирующее токсичность клеток CART33 для гематопоэтических стволовых клеток. Сводная статистика на день 28 анализа периферической крови мышей, обработанных CART33, UTD или не обработанных (n=5), из эксперимента, показанного на фигуре 17. CART33 приводили к значительной токсичности на моноцитах и клетках CD33+ миелоидной линии дифференцировки при относительном щажении B-клеток и тромбоцитов.
Фигура 20 представляет собой изображение, демонстрирующее токсичность клеток CART33 для гематопоэтических стволовых клеток. Графики из анализа костного мозга с помощью проточной цитометрии на день 28 мышей из эксперимента, показанного на фигуре 17. Обработка с помощью CART33 приводила к значительному уменьшению количества миелоидных предшественников (CD34+CD38+) и гематопоэтических стволовых клеток (CD34+CD38-), гейтированных по синглетам, huCD45dim, отрицательных по линии дифференцировки.
Фигура 21 представляет собой изображение, демонстрирующее токсичность клеток CART33 для гематопоэтических стволовых клеток. Срезы бедра мышей из эксперимента, показанного на фигуре 17, получали от мышей на день 28 после обработки UTD T-клетками или клетками CART33. Проводили окрашивание huCD45 и CD34 с помощью IHC. Нет различий в huCD45 между контрольными T-клетками и CART33, хотя обе эти группы продемонстрировали меньшее окрашивание huCD45, вероятно в связи с эффектом взаимодействия аллогенных человеческих и античеловеческих белков. Имело место специфическое уменьшение количества CD34+ клеток у мышей, обработанных CART33. Результаты отражают два эксперимента.
Фигура 22 представляет собой схематическую диаграмму, демонстрирующую схему тестирования гематопоэтической токсичности CART33 и CART123 in vivo. Схема эксперимента: мыши NSGS получали бусульфан и/п и затем на следующий день 2×106 клеток без-T-клеточного костного мозга от нормального донора. Приживление подтверждали по анализу периферической крови с помощью проточной цитометрии через 4 недели, и затем мышей обрабатывали с помощью 1×106 аутологичных T-клеток, трансдуцированных CART33, CART123 или UTD. Затем мышей подвергали ретроорбитальному кровопусканию на день 7 и день 14 и умерщвляли для некропсии на день 14.
Фигура 23 представляет собой изображение, демонстрирующее, что CART33 и CART123 производят эквивалентную гематопоэтическую токсичность in vivo. Показан типичный график анализа костного мозга мышей из эксперимента, показанного на фигуре 22, с помощью проточной цитометрии на день 28. Обработка с помощью CART33 и CART123 приводила к значительному уменьшению количества миелоидных предшественников (CD34+CD38+) и гематопоэтических стволовых клеток (CD34+CD38-), гейтированных по huCD45dim, Lin-. Результаты отражают два эксперимента.
Фигура 24 представляет собой изображение, демонстрирующее, что CART33 и CART123 являются цитотоксическими для клеток костного мозга при миелодиспластическом синдроме (МДС). Обогащенный CD34 КМ пациентов с МДС инкубировали с UTD, CART33 (шарнир IgG4), CART33 (шарнир CD8) или CART123. Имело место уменьшение количества клеток CD45dimCD34+ в образцах, обработанных с помощью CART33 или CART123.
Фигура 25 представляет собой схематическую диаграмму вектора для экспрессии мышиных CART33.
Фигура 26 представляет собой схематическую диаграмму вектора для экспрессии гуманизированных CART33.
Фигура 27 представляет собой изображение, показывающее экспрессию scFv на клеточной поверхности на линии T-клеток Jurkat, которые содержат репортер люциферазы, управляемый NFAT-регулируемым промотором (называемых клетками JNL). Клетки JNL трансдуцировали лентивирусным вектором, экспрессирующим кДНК, кодирующую GFP, scFv, который связывается с CD19, или кДНК, которые кодируют scFv, который был сгенерирован к hsCD33. Экспрессию на клеточной поверхности отдельных scFv на JNL детектировали посредством инкубирования клеток с рекомбинантным Fc-меченым hsCD33 с последующей инкубацией с Fc-специфическим вторичным антителом, конъюгированным с фикоэритрином.
Фигуры 28A, 28B, 28C и 28D представляют собой изображения, показывающие способность отдельных scFv, воздействующих на hsCD33, выявлять активность NFAT в клетках JNL. Клетки JNL, экспрессирующие scFv против hsCD33, совместно культивировали с линиями клеток MOLM13 или MOLP8, которые, соответственно, экспрессируют hsCD33 или не имеют экспрессии hsCD33 на клеточной поверхности (фигура 28A; hsCD33, сплошная зеленая линия; изотипический контроль, серая пунктирная линия и заштрихованный участок). Фигура 28B изображает активацию клеток JNL, экспрессирующих scFv, воздействующий на hsCD33, в присутствии клеток MOLM13 (сплошные линии) или MOLP8 (пунктирные линии). Клетки JNL, экспрессирующие отдельные scFv, высеивали при различных отношениях эффектора (то есть клеток JNL) к мишени (то есть MOLM13 или MOLP8) и анализировали в отношении экспрессии в относительных единицах люциферазы (RLU) с использованием Bright-Glo™ Luciferase Assay на приборе EnVision через 24 часа после инкубации. Фигура 28C представляет собой вариант фигуры 28B, изображающий активацию клеток JNL в присутствии MOLM13. Фигура 28D представляет собой вариант фигуры 28B, изображающий активацию клеток JNL в присутствии MOLP8.
Фигуры 29A и 29B представляют собой панели изображений, показывающих активность scFv, воздействующих на hsCD33, в полученных от донора первичных T-клетках. Изображена экспрессия scFv на клеточной поверхности первичных человеческих T-клеток, трансдуцированных лентивирусным вектором, который экспрессирует scFv, который воздействует на hsCD33. Экспрессию scFv детектировали посредством инкубирования клеток с рекомбинантным Fc-меченым hsCD33 и Fc-специфическим вторичным антителом, конъюгированным с фикоэритрином, как описано на фигуре 27.
Фигуры 30A и 30B представляют собой изображения, показывающие пролиферативную активность T-клеток, экспрессирующих scFv, воздействующие на CD33. T-клетки помечали CFSE и совместно культивировали в присутствии MOLM13 (фигура 30A, сплошной черный столбец), MOLP8 (фигура 30A, незаштрихованный белый столбец) или культивировали отдельно (фигура 30A, заштрихованный столбец) для оценки пролиферативной способности первичных UTD T-клеток или клеток, экспрессирующих scFv, воздействующие на hsCD33. Кроме того, оценивали антигензависимое деление клеток в первичных T-клетках посредством измерения медианной интенсивности флуоресценции (MFI) CFSE-меченых T-клеток, экспрессирующих клоны scFv CD33-2, -3, -4, -5, -6 и -9, культивированные совместно с клетками MOLM13, MOLP8 или отдельно (фигура 30B).
Фигура 31 представляет собой изображение, показывающее цитолитическю активность T-клеток, экспрессирующих scFv, воздействующие на CD33. Для оценки цитолитической активности 25000 клеток MOLM13 высеивали с первичными T-клетками, экспрессирующими отдельные scFv, при различных отношениях эффектора (то есть T-клеток) к мишени (то есть MOLM13) и анализировали в отношении величины киллинга MOLM13 посредством подсчета абсолютного количества CFSE-меченых клеток MOLM13 после 4 дней культивирования.
Фигура 32 представляет собой изображение, показывающее перекрестную реактивность T-клеток, экспрессирующих scFv, воздействующие на CD33, к CD33 яванского макака (cyCD33) с помощью проточной цитометрии. Клетки JNL, трансдуцированные лентивирусным вектором, экспрессирующим scFv, сгенерированные против hsCD33, инкубировали или с рекомбинантным Fc-меченым hsCD33 (пунктирная линия), или с cyCD33 (сплошная линия), за чем следовала инкубация с Fc-специфическим вторичным антителом, конъюгированным с фикоэритрином.
Фигуры 33A и 33B изображают экспрессию мРНК CAR33 в T-клетках от нормальных доноров после электропорации. Фигура 33A представляет собой ряд профилей проточной цитометрии, показывающих экспрессию CAR33 в T-клеточной популяции в указанных временных точках. Процентная доля экспрессирующих CAR33 клеток (обведено рамкой) количественно определена и показана на профиле. Фигура 33B представляет собой графическое представление процентной доли экспрессии CAR33.
Фигуры 34A и 34B сравнивают экспрессию трансдуцированного с помощью лентивируса CAR33 с электропорированного мРНК CAR33. Фигура 34A показывает стабильную экспрессию трансдуцированного с помощью лентивируса CAR33 (CART33LV) в указанные моменты времени в течение 4 дней. Фигура 34B показывает временную экспрессию электропорированного мРНК CAR33 (РНК-CART33) в указанные моменты времени в течение 4 дней. Экспрессия CAR33 представлена средней интенсивностью флуоресценции (MFI) по оси x, и общее количество клеток представлено по оси y.
Фигуры 35A, 35B, 35C и 35D представляют собой графические представления, сравнивающие цитолитическую активность T-клеток, экспрессирующих CD33 после лентивирусной трансдукции или электропорации мРНК. Эксперимент повторяли через 1 день (фигура 35A), 2 дня (фигура 35B), 3 дня (фигура 35C) и 4 дня (фигура 35D) после электропорации T-клеток. Клетки CART33 инкубировали с линией CD33-положительных клеток MOLM14 и контрольной линией клеток мантийноклеточной лимфомы JEKO при отношениях E:T (эффектор к мишени), указанных по оси x. Киллинг в процентах при каждом отношении указан по оси y.
Фигуры 36A и 36B представляют собой графические представления, сравнивающие цитолитическую активность T-клеток, экспрессирующих CD33 после лентивирусной трансдукции или электропорации мРНК с течением времени. Фигура 36A показывает специфический киллинг трансдуцированных с помощью лентивируса клеток с CAR33 по сравнению с клетками РНК-CAR33 при инкубации с клетками MOLM14 при отношении E:T (эффектор:мишень), составляющем 2:1, в течение 4 дней. Фигура 36B показывает специфический киллинг трансдуцированных с помощью лентивируса клеток с CAR33 по сравнению с клетками РНК-CAR33 при инкубации с клетками MOLM14 при отношении E:T (эффектор:мишень), составляющем 1:1, в течение 4 дней.
Фигуры 37A, 37B, 37C и 37D показывают, что клетки CART33 проявляют устойчивые in vitro эффекторные функции в ответ на линию CD33+ клеток MOLM14 или на образцы первичного ОМЛ. Графики отражают четыре независимых эксперимента. Фигура 37A показывает дегрануляцию по CD107a. CART33, CART123 и нетрансдуцированные T-клетки (UTD) инкубировали с линией CD33+/CD123+ клеток MOLM14, PMA/иономицином в качестве положительного неспецифического T-клеточного стимулятора и контрольной T-клеточной линией клеток ОЛЛ Jurkat в присутствии костимулирующих молекул CD49d, CD28 и монензина. Дегрануляцию по CD107a измеряли с помощью проточной цитометрии после 4 часов инкубации. Фигура 37B показывает специфический киллинг CD33-экспрессирующих клеток. CART33, CART123 и UTD инкубировали с MOLM14-luc или Jurkat-luc в течение 24 часов при различных отношениях E:T, как указано, и затем осуществляли биолюминесцентную визуализацию в качестве измерения оставшихся живых клеток. Черная/сплошная линия (квадраты) представляет CART123, инкубированные с MOLM14; синяя/пунктирная линия (треугольники, направленные вниз/закрашенные треугольники) представляет CART33, инкубированные с MOLM14; и красная/пунктирная линия (треугольники, направленные вверх/незакрашенные треугольники) представляет CART33, инкубированные с Jurkat. Фигуры 37C и 37D показывают пролиферацию клеток CART33 в ответ на CD33-экспрессирующие клетки. T-клетки помечали CFSE и инкубировали с MOLM14, PMA/IONO в качестве положительного специфического T-клеточного стимулятора, Jurkat в качестве отрицательного контроля или образцами ОМЛ в течение 120 часов. Количество пролиферирующих T-клеток оказалось значительно выше в ответ на MOLM14 по сравнению с Jurkat и оказалось сравнимым с CART123.
Фигуры 38A, 38B и 38C показывают производство цитокинов клетками CART33 в ответ на CD33-экспрессирующие клетки MOLM14. Клетки CART33, CART123 и UTD инкубировали с MOLM14, PMA/иономицином и Jukat в течение 4 часов. Затем клетки фиксировали и пермеабилизировали, окрашивали на 5 различных цитокинов (фактор некроза опухоли-альфа, интерферон-гамма, гранулоцитарно-макрофагальный колониестимулирующий фактор, макрофагальный белок воспаления 1b и интерлейкин-2), и выполняли анализы с помощью проточной цитометрии. Большинство клеток CART33 производят более чем один цитокин в ответ на MOLM14 (фигура 38A), аналогично их ответу на PMA/иономицин (положительный контроль, фигура 38B). Фигура 38C показывает, что производство IL-2, IFN-γ, GM-CSF и ФНО-α в ответ на MOLM14 оказалось значительно выше в клетках CART33, чем в CART123. Клетки CART33, CART123 и UTD инкубировали с MOLM14, Jurkat и PMA/иономицином в течение 24 часов. Затем отбирали супернатант и выполняли 30-плексный анализ Luminex. Уровни остатка цитокинов представлены на фигуре 39.
Фигура 39 представляет собой ряд графиков, показывающих сравнение производства цитокинов клетками CART33 и CART123 в ответ на MOLM14. Клетки CART33, CART123 и UTD инкубировали с MOLM14, Jurkat и PMA/иономицином в течение 24 часов. Затем отбирали супернатант и выполняли 30-плексный анализ Luminex для указанных цитокинов.
Фигура 40 показывает специфический киллинг CD33-экспрессирующих клеток MOLM14 in vitro. CART123, CART33 (шарнир CD8) и CART33 (шарнир IgG4) инкубировали с MOLM14 при указанных отношениях E:T, и оценивали киллинг с помощью биолюминесцентной визуализации. CART33 (шарнир IgG4) приводили к более специфическому киллингу, чем CART33 (шарнир CD8) при более низком отношении E:T.
Фигуры 41A, 41B и 41C показывают противоопухолевую активность в отношении миелодиспластических синдромов (МДС). Фигура 41A представляет собой график, показывающий специфическую дегрануляцию по CD107a в ответ на клетки костного мозга пациентов с МДС. Фигура 41B представляет собой набор изображений, показывающих специфический киллинг клона МДС, имеющего делецию 5q. Фигура 41C представляет собой график, показывающий количественное описание клонов с делецией 5q, оставшихся после обработки, определенное с помощью FISH. Имело место значительное уменьшение процентной доли 5q-клона в группе, обработанной CART33, по сравнению с группами с обработкой UTD и без обработки.
Фигуры 42A, 42B, 42C показывают, что обработка CART33 приводит к выживаемости для привитых ксенотрансплантатов MOLM14. Схема эксперимента представлена на фигуре 11. На фигуре 42A количественно определяли опухолевую нагрузку с течением времени с помощью биолюминесцентной визуализации (BLI); данные из одного эксперимента (n=5 на группу), каждая мышь представлена линией. Фигура 42B показывает сводную выживаемость по трем независимым экспериментам. Обработка с помощью CART33 приводила к значительному преимуществу по выживаемости по сравнению с обработкой UTD. Фигура 42C представляет собой типичные биолюминесцентные изображения из одного эксперимента.
Фигуры 43A и 43B показывают, что обработка с помощью CART33 приводит к дозозависимому уменьшению лейкозной нагрузки для привитых ксенотрансплантатов MOLM14. Фигура 43A схематически показывает схему эксперимента, описанного в примере 6. Фигура 43B показывает количественное описание опухолевой нагрузки с течением времени, измеренной с помощью биолюминесцентной визуализации (BLI) в различных группах.
Фигура 44 представляет собой график, показывающий опухолевую нагрузку с течением времени, измеренную с помощью биолюминесцентной визуализации (BLI) в различных группах при схеме эксперимента, показанной на фигуре 11.
Фигура 45 показывает, что комбинация РНК-CART33 и химиотерапии приводит к дальнейшему уменьшению лейкозной нагрузки для привитых ксенотрансплантатов MOLM14.
Фигуры 46A и 46B показывают антителосвязывающую способность для CD33 и CD123 на MOLM14 и образцах первичного ОМЛ, использованных для in vivo экспериментов. Анализ осуществляли с использованием набора QUANTUM SIMPLY CELLULAR (Bangs Laboratories, Inc). Образцы промывали в проточном буфере и затем окрашивали указанным антителом (CD33 или CD123), конъюгированным с PE. Пять различных микросфер, предложенных в наборе, также окрашивали тем же антителом. Среднюю интенсивность флуоресценции мишени сравнивали с интенсивностью флуоресценции пяти микросфер, и затем вычисляли значение антителосвязывающей способности в соответствии с протоколом производителя. Фигура 46A показывает антителосвязывающую способность MOLM14 для CD33 и CD123, тогда как фигура 46B показывает антителосвязывающую способность для CD33 и CD123 первичных образцов, использованных в этих экспериментах.
Фигура 47 представляет собой график, показывающий пролиферацию по числу клеток различных T-клеток - T-клеток CART-33 (от CD33-1 до CD33-9, или Upenn), T-клеток CART-CD19 (CD19) или нетрансдуцированных T-клеток (Клетки) под воздействием PL21, HL-60 или клеток-мишеней MOLP8.
Фигура 48A представляет собой график, показывающий долю в процентах лизиса клеток-мишеней HL-60-Luc под воздействием различных T-клеток CART-33 (от CD33-1 до CD33-9, или Upenn), T-клеток CART-CD19 (CD19) или нетрансдуцированных T-клеток (Клетки) при различных отношениях эффектора к T-клетке. Фигура 48B представляет собой график, показывающий долю в процентах лизиса клеток-мишеней PL21/Luc под воздействием различных T-клеток CART-33 (от CD33-1 до CD33-9, или Upenn), T-клеток CART-CD19 (CD19) или нетрансдуцированных T-клеток (Клетки) при различных отношениях эффектора к T-клетке. Фигура 48C представляет собой график, показывающий долю в процентах лизиса клеток-мишеней U87/Luc под воздействием различных T-клеток CART-33 (от CD33-1 до CD33-9, или Upenn), T-клеток CART-CD19 (CD19) или нетрансдуцированных T-клеток (Клетки) при различных отношениях эффектора к T-клетке.
Фигура 49 представляет собой график, показывающий концентрацию цитокинов (человеческого интерферона-гамма (IFN-γ), человеческого интерлейкина-2 (IL-2) и человеческого фактора некроза опухоли (ФНО)), производимых различными T-клетками CART-33 (от CD33-1 до CD33-9, или Upenn), T-клетками CART-CD19 (CD19) или нетрансдуцированными T-клетками (клетки) под воздействием PL21, HL60 или клеток-мишеней MOLP8.
Фигура 50A представляет собой график проточной цитометрии, показывающий стратегию гейтирования для MDSC. Фигура 50B представляет собой график, показывающий долю в процентах отрицательных по линии дифференцировки, HLA-DR-отрицательных, CD33+ (LIN-HLDR-CD33+) клеток в костном мозге нормальных доноров (КМ НД) или пациентов с миелодиспластическим синдромом (МДС) (КМ МДС). Фигура 5°C представляет собой график, показывающий уровень CD33, измеренный по средней интенсивности флуоресценции (MFI) в популяции MDSC (MDSC) по сравнению с популяцией злокачественного МДС (МДС) и популяцией от нормальных доноров (НД-КМ).
Фигура 51A представляет собой панель графиков проточной цитометрии, показывающих степень дегрануляции (уровень CD107a) и производство цитокинов (GM-CSF, IL-2, ФНО-a) из CART33. Дегрануляция по CD107a и производство цитокинов показаны по оси y, а CAR против CD33 по оси x. Отрицательный контроль показан слева (Jurkat), а MDSC справа. Фигура 51B представляет собой график, показывающий количественное описание дегрануляции и производства цитокинов CART33 против различных мишеней - Jurkat, PMA/иономицина (PMA/IONO), МДС (не MDSC) и MDSC.
Фигуры 52A-52D показывают различные конфигурации на одном векторе, например, в которых U6-регулируемая кшРНК расположена в обратном направлении или в прямом направлении от EF1-альфа-регулируемых кодирующих CAR элементов. В примерах конструктов, изображенных на фиг. 52A и 52B, транскрипция происходит через промоторы U6 и EF1-альфа в одном и том же направлении. В примерах конструктов, изображенных на фиг. 52C и 52D, транскрипция происходит через промоторы U6 и EF1-альфа в различных направлениях. На фигуре 52E кшРНК (и соответствующий промотор U6) расположен на первом векторе, а CAR (и соответствующий промотор EF1-альфа) расположен на втором векторе.
Фигура 53 изображает структуры двух примеров конфигураций RCAR. Антигенсвязывающие элементы содержат антигенсвязывающий домен, трансмембранный домен и домен-переключатель. Внутриклеточные связывающие элементы содержат домен-переключатель, костимулирующий сигнальный домен и первичный сигнальный домен. Эти две конфигурации демонстрируют, что первый и второй домены-переключатели, описанные в настоящем документе, могут находиться в различной ориентации по отношению к антигенсвязывающему элементу и внутриклеточному связывающему элементу. Другие конфигурации RCAR описаны далее в настоящем документе.
Фигура 54 показывает, что пролиферация экспрессирующих CAR, трансдуцированных T-клеток увеличивается низкими дозами RAD001 в системе клеточной культуры. CART совместно культивировали с клетками Nalm-6 в присутствии различных концентраций RAD001. Количество CAR-положительных CD3-положительных T-клеток (черный цвет) и всех T-клеток (серый цвет) оценивали после 4 дней совместного культивирования.
Фигура 55 изображает измерения роста опухоли клеток NALM6-luc при ежедневном дозировании RAD001 по 0,3, 1, 3 и 10 мг/кг (mpk) или дозировании носителя. Кружки обозначают носитель; квадраты обозначают дозу RAD001 10 мг/кг; треугольники обозначают дозу RAD001 3 мг/кг, перевернутые треугольники обозначают дозу RAD001 1 мг/кг; и ромбы обозначают дозу RAD001 0,3 мг/кг.
Фигуры 56A и 56B показывают фармакокинетические кривые, показывающие количество RAD001 в крови мышей NSG с опухолями NALM6. Фиг. 56A показывает ФК на день 0 после первой дозы RAD001. Фиг. 56B показывает ФК на день 14 после последней дозы RAD001. Ромбы обозначают дозу RAD001 10 мг/кг; квадраты обозначают дозу RAD001 1 мг/кг; треугольники обозначают дозу RAD001 3 мг/кг; и x обозначают дозу RAD001 10 мг/кг.
Фигуры 57A и 57B показывают in vivo пролиферацию гуманизированных CD19-CART-клеток с дозированием RAD001 и без него. Низкие дозы RAD001 (0,003 мг/кг) ежедневно приводят к увеличению пролиферации T-клеток с CAR выше нормального уровня пролиферации huCAR19. Фигура 57A показывает CD4+ T-клетки с CAR; фиг. 57B показывает CD8+ T-клетки с CAR. Кружки обозначают ФСБ; квадраты обозначают huCTL019; треугольники обозначают huCTL019 с 3 мг/кг RAD001; перевернутые треугольники обозначают huCTL019 с 0,3 мг/кг RAD001; ромбы обозначают huCTL019 с 0,03 мг/кг RAD001; и кружки обозначают huCTL019 с 0,003 мг/кг RAD001.
Фигура 58 представляет собой график, показывающий прогрессирование заболевания ОМЛ, вызванного ксенотрансплантатом HL-60-luc. Синие кружки: мыши, обработанные 100 мкл ФСБ через хвостовую вену; красные квадраты: мыши, обработанные T-клетками с CD19-CAR; зеленые треугольники: мыши, обработанные трансдуцированными CAR CD33-1 T-клетками; перевернутые пурпурные треугольники: мыши, обработанные трансдуцированными CAR CD33-2 T-клетками; оранжевые ромбы: мыши, обработанные трансдуцированными CAR CD33-4 T-клетками; черные квадраты: мыши, обработанные трансдуцированными CAR CD33-5 T-клетками; коричневые треугольники: мыши, обработанные трансдуцированными CAR CD33-6 T-клетками; темно-синие кружки: мыши, обработанные трансдуцированными CAR CD33-7 T-клетками; и перевернутые темно-пурпурные треугольники: мыши, обработанные трансдуцированными CAR CD33-9 T-клетками.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют значение, обычно понимаемое средним специалистом в области техники, к которой относится настоящее изобретение.
Единственное число относится к одному или более чем одному (то есть по меньшей мере к одному)объекту. В качестве примера, "элемент" означает один элемент или более чем один элемент.
Термин "приблизительно" при ссылке на измеряемое значение, такое как количество, продолжительность времени и тому подобное, предназначен для того, чтобы охватить изменения, составляющие ±20%, или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1%, от указанного значения, если такие изменения являются подходящими для выполнения раскрытых способов.
Термин "химерный антигенный рецептор" или, альтернативно, "CAR" относится к рекомбинантной полипептидной конструкции, содержащей по меньшей мере внеклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый в настоящем документе как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, происходящий от стимулирующей молекулы, как определено ниже. В некоторых вариантах осуществления домены в полипептидной конструкции CAR расположены в одной и той же полипептидной цепи, например, содержат химерный белок слияния. В некоторых вариантах осуществления домены в полипептидной конструкции CAR не соприкасаются друг с другом, например, расположены в различных полипептидных цепях, например, как предложено в RCAR, описанном в настоящем документе.
В одном аспекте стимулирующая молекула CAR представляет собой дзета-цепь, ассоциированную с T-клеточным рецепторным комплексом. В одном аспекте цитоплазматический сигнальный домен содержит первичный сигнальный домен (например, первичный сигнальный домен из CD3-дзета). В одном аспекте цитоплазматический сигнальный домен дополнительно содержит один или несколько функциональных сигнальных доменов, происходящих от по меньшей мере одной костимулирующей молекулы, как определено ниже. В одном аспекте костимулирующую молекулу выбирают из 4 1BB (то есть CD137), CD27, ICOS и/или CD28. В одном аспекте CAR содержит химерный белок слияния, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, происходящий от стимулирующей молекулы. В одном аспекте CAR содержит химерный белок слияния, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, происходящий от костимулирующей молекулы, и функциональный сигнальный домен, происходящий от стимулирующей молекулы. В одном аспекте CAR содержит химерный белок слияния, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий два функциональных сигнальных домена, происходящих от одной или нескольких костимулирующих молекул, и функциональный сигнальный домен, происходящий от стимулирующей молекулы. В одном аспекте CAR содержит химерный белок слияния, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий по меньшей мере два функциональных сигнальных домена, происходящих от одной или нескольких костимулирующих молекул, и функциональный сигнальный домен, происходящий от стимулирующей молекулы. В одном аспекте CAR содержит необязательную лидерную последовательность на N-конце (N-ter) белка слияния CAR. В одном аспекте CAR дополнительно содержит лидерную последовательность на N-конце внеклеточного антигенраспознающего домена, причем лидерная последовательность, необязательно, отщепляется от антигенраспознающего домена (например, aa scFv) во время клеточного процессинга и локализации CAR в клеточной мембране.
CAR, который содержит антигенсвязывающий домен (например, scFv, однодоменное антитело или TCR (например, связывающий домен TCR-альфа или связывающий домен TCR-бета)), который воздействует на специфический опухолевый маркер X, причем X может представлять собой опухолевый маркер, как описано в настоящем документе, также называется XCAR. Например, CAR, который содержит антигенсвязывающий домен, который воздействует на CD33, называется CD33CAR. CAR может экспрессироваться в любой клетке, например, иммунной эффекторной клетке, как описано в настоящем документе (например, T-клетке или NK-клетке).
Термин "сигнальный домен" относится к функциональной части белка, которая действует посредством передачи информация внутри клетки для регуляции клеточной активности через определенные сигнальные пути, генерируя вторичные мессенджеры или функционируя в качестве эффекторов, отвечая на такие мессенджеры.
Как используется в настоящем документе, термин "CD33" относится к белку кластер дифференцировки 33, который представляет собой антигенную детерминанту, детектируемую на лейкозных клетках, а также на нормальных клетках-предшественниках миелоидной линии дифференцировки. Человеческие и мышиные аминокислотные и нуклеиновокислотные последовательности могут быть найдены в публичной базе данных, такой как GenBank, UniProt и Swiss-Prot. Например, аминокислотная последовательность человеческого CD33 может быть найдена под № доступа P20138 UniProt/Swiss-Prot, а нуклеотидная последовательность, кодирующая человеческий CD33, может быть найдена под № доступа NM_001772.3. В одном аспекте антигенсвязывающая часть CAR распознает и связывает эпитоп внутри внеклеточного домена белка CD33 или его фрагментов. В одном аспекте белок CD33 экспрессируется на раковой клетке. Как используется в настоящем документе, "CD33" включает белки, содержащие мутации, например, точечные мутации, фрагменты, вставки, делеции и варианты сплайсинга полноразмерного CD33 дикого типа.
Термин "антитело", как используется в настоящем документе, относится к белковой или полипептидной последовательности, происходящей от иммуноглобулиновой молекулы, которая специфически связывается с антигеном. Антитела могут быть поликлональными или моноклональными, много- или одноцепочечными или представлять собой интактные иммуноглобулины и могут происходить из природных источников или из рекомбинантных источников. Антитела могут представлять собой тетрамеры иммуноглобулиновых молекул.
Термин "фрагмент антитела" относится к по меньшей мере одной части интактного антитела или ее рекомбинантным вариантам и относится к антигенсвязывающему домену, например, определяющей антиген вариабельной области интактного антитела, которого достаточно для придания фрагменту антитела распознавания и специфического связывания с мишенью, такой как антиген. Примеры фрагментов антител включают, но без ограничения, фрагменты Fab, Fab', F(ab')2 и Fv, фрагменты антител scFv, линейные антитела, однодоменные антитела, такие как sdAb (или VL, или VH), верблюжьи домены VHH и мультиспецифические молекулы, образованные из фрагментов антител, такие как двухвалентный фрагмент, содержащий два или более, например, два, фрагмента Fab, связанные дисульфидным мостиком в шарнирной области, или две или более, например, две, выделенные CDR, или другие связанные связывающие эпитоп фрагменты антитела. Фрагмент антитела может также быть введен в однодоменные антитела, макситела, минитела, нанотела, интратела, диатела, триатела, тетратела, v-NAR и бис-scFv (смотри, например, Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005). Фрагменты антител можно также прививать на каркасы, основанные на полипептидах, такие как фибронектин типа III (Fn3) (смотри патент США № 6703199, который описывает минитела с фибронектиновым полипептидом).
Термин "scFv" относится к белку слияния, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, причем вариабельные области легкой и тяжелой цепи связаны рядом посредством короткого гибкого полипептидного линкера и способны экспрессироваться как одноцепочечный полипептид, и причем scFv сохраняет специфичность интактного антитела, от которого он происходит. Если не указано, как используется в настоящем документе, scFv может содержать вариабельные области VL и VH в любом порядке, например, по отношению к N-концевой и C-концевой областям полипептида scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
Термины "определяющая комплементарность область" или "CDR", как используется в настоящем документе, относятся к последовательностям аминокислот в вариабельных областях антитела, которые придают антигенную специфичность и аффинность связывания. Например, в общем случае, есть три CDR в каждой вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и три CDR в каждой вариабельной области легкой цепи (LCDR1, LCDR2 и LCDR3). Точные границы аминокислотной последовательности заданной CDR могут быть определены с использованием любой из ряда хорошо известных схем, включая описанные Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации Кэбота), Al-Lazikani et al., (1997) JMB 273927-948 (схема нумерации Чотиа), или их комбинации. В соответствии со схемой нумерации Кэбота в некоторых вариантах осуществления аминокислотные остатки CDR в вариабельном домене (VH) тяжелой цепи нумеруют как 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки CDR в вариабельном домене (VL) легкой цепи нумеруют 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). В соответствии со схемой нумерации Чотиа в некоторых вариантах осуществления аминокислоты CDR в VH нумеруют 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки CDR в VL нумеруют 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). В объединенной схеме нумерации Кэбота и Чотиа в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам, которые являются частью CDR Кэбота, CDR Чотиа или обеих. Например, в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в VH, например, VH млекопитающего, например, человеческом VH; и аминокислотным остаткам 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в VL, например, VL млекопитающего, например, человеческом VL.
Часть композиции CAR настоящего изобретения, содержащая антитело или его фрагмент антитела, может существовать во множестве форм, например, в которых антигенсвязывающий домен экспрессируется как часть полипептидной цепи, включая, например, фрагмент однодоменного антитела (sdAb), одноцепочечное антитело (scFv) или, например, гуманизированное или человеческое антитело (Harlow et al., 1999, в Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, в Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426). В одном аспекте антигенсвязывающий домен композиции CAR настоящего изобретения содержит фрагмент антитела. В другом аспекте CAR содержит фрагмент антитела, который содержит scFv.
Как используется в настоящем документе, термин "связывающий домен" или "молекула антитела" относится к белку, например, иммуноглобулиновой цепи или ее фрагменту, содержащему по меньшей мере одну последовательность иммуноглобулинового вариабельного домена. Термин "связывающий домен" или "молекула антитела" охватывает антитела и фрагменты антител. В варианте осуществления молекула антитела представляет собой мультиспецифическую молекулу антитела, например, она содержит множество последовательностей иммуноглобулиновых вариабельных доменов, причем первая последовательность иммуноглобулинового вариабельного домена из множества имеет специфичность связывания к первому эпитопу, и вторая последовательность иммуноглобулинового вариабельного домена из множества имеет специфичность связывания ко второму эпитопу. В варианте осуществления мультиспецифическая молекула антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело имеет специфичность не более чем к двум антигенам. Биспецифическая молекула антитела характеризуется первой последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания к первому эпитопу, и второй последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания ко второму эпитопу.
Термин "тяжелая цепь антитела" относится к большей из полипептидных цепей двух типов, присутствующих в молекулах антител в их природных конформациях, которая обычно определяет класс, к которому принадлежит антитело.
Термин "легкая цепь антитела" относится к меньшей из полипептидных цепей двух типов, присутствующих в молекулах антител в их природных конформациях. Легкие цепи каппа (κ) и лямбда (λ) соотносятся с двумя главными изотипами легкой цепи антитела.
Термин "рекомбинантное антитело" относится к антителу, которое создано с использованием технологии рекомбинантной ДНК, такому как, например, антитело, экспрессируемое системой экспрессии бактериофагов или дрожжей. Данный термин также следует интерпретировать как означающий антитело, которое было создано посредством синтеза молекулы ДНК, кодирующей антитело, причем молекула ДНК экспрессирует белок антитела или аминокислотную последовательность, определяющую антитело, причем ДНК или аминокислотная последовательность были получены с использованием технология рекомбинантной ДНК или аминокислотной последовательности, которая доступна и хорошо известна в данной области техники.
Термин "антиген" или "Ag" относится к молекуле, которая вызывает иммунный ответ. Данный иммунный ответ может включать в себя или производство антител, или активацию специфических иммунологически компетентных клеток, или и то, и другое. Специалисту будет понятно, что любая макромолекула, включая практически все белки или пептиды, может служить антигеном. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалисту будет понятно, что любая ДНК, которая содержит нуклеотидные последовательности или частичную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, тем самым кодирует "антиген", как этот термин используют в настоящем документе. Кроме того, специалисту в данной области техники будет понятно, что антиген не обязательно кодируется исключительно полноразмерной нуклеотидной последовательностью гена. Совершенно очевидно, что настоящее изобретение включает в себя, но без ограничения, использование частичных нуклеотидных последовательностей из более чем одного гена, и что эти нуклеотидные последовательности расположены в различных комбинациях для кодирования полипептидов, которые вызывают желаемый иммунный ответ. Кроме того, специалисту будет понятно, что антиген вообще не обязательно закодирован "геном". Совершенно очевидно, что антиген может быть создан синтезом или может быть получен из биологического образца, или может представлять собой макромолекулу, отличную от полипептида. Такой биологический образец может включать, но без ограничения, образец ткани, образец опухоли, клетку или жидкость с другими биологическими компонентами.
Термин "противоопухолевый эффект" относится к биологическому эффекту, который может проявляться различными способами, включая, но без ограничения, например, уменьшение объема опухоли, уменьшение количества опухолевых клеток, уменьшение количества метастазов, увеличение продолжительности жизни, снижение пролиферации опухолевых клеток, уменьшение выживаемости опухолевых клеток или ослабление различных физиологических симптомов, ассоциированных с раковым состоянием. "Противоопухолевый эффект" также может проявляться в первую очередь в способности пептидов, полинуклеотидов, клеток и антител настоящего изобретения предупреждать возникновение опухоли.
Термин "противораковый эффект" относится к биологическому эффекту, который может проявляться различными способами, включая, но без ограничения, например, уменьшение объема опухоли, уменьшение количества раковых клеток, уменьшение количества метастазов, увеличение продолжительности жизни, снижение пролиферации раковых клеток, уменьшение выживаемости раковых клеток или ослабление различных физиологических симптомов, ассоциированных с раковым состоянием. "Противораковый эффект" также может проявляться в первую очередь в способности пептидов, полинуклеотидов, клеток и антител предупреждать возникновение рака. Термин "противоопухолевый эффект" относится к биологическому эффекту, который может проявляться различными способами, включая, но без ограничения, например, уменьшение объема опухоли, уменьшение количества опухолевых клеток, снижение пролиферации опухолевых клеток или уменьшение выживаемости опухолевых клеток.
Термин "аутологичный" относится к любому материалу, происходящему от того же индивидуума, которому он должен быть позже повторно введен.
Термин "аллогенный" относится к любому материалу, происходящему от другого животного того же вида, что и индивидуум, которому вводят данный материал. Двух или более индивидуумов называют аллогенными друг другу, когда гены в одном или нескольких локусах не идентичны. В некоторых аспектах аллогенный материал от индивидуумов того же вида может достаточно отличаться генетически для антигенного взаимодействия.
Термин "ксеногенный" относится к трансплантату, полученному от животного другого вида.
Термин "аферез", как используется в настоящем документе, относится к принятому в данной области техники экстракорпоральному процессу, посредством которого кровь донора или пациента удаляют из донора или пациента и пропускают через приспособление, которое отделяет выбранный конкретный компонент(ы) и возвращает остальное в циркуляцию донора или пациента, например, посредством повторной трансфузии. Таким образом, в данном контексте "образец афереза" относится к образцу, полученному с использованием афереза.
Термин "комбинация" относится или к фиксированной комбинации в одной стандартной лекарственной форме, или к комбинированному введению, когда соединение настоящего изобретения и компонент комбинации (например, другой препарат, как рассмотрено ниже, также называемый "терапевтическим средством" или "дополнительным средством") могут быть введены независимо в одно и то же время или по-отдельности в пределах временных интервалов, особенно, когда эти временные интервалы позволяют компонентам комбинации демонстрировать совместный, например, синергистический, эффект. Одиночные компоненты могут быть упакованы в набор или по-отдельности. Один или оба из компонентов (например, порошки или жидкости) могут быть перед введением разведены или разбавлены до желаемой дозы. Предполагается, что термины "совместное введение" или "комбинированное введение" или тому подобное, как используются в настоящем документе, охватывают введение выбранного компонента комбинации одному субъекту, нуждающемуся в этом (например, пациенту), и предполагается, что они включают в себя схемы лечения, в которых средства необязательно вводят посредством одного и того же пути введения или в одно и то же время. Термин "фармацевтическая комбинация", как используется в настоящем документе, обозначает продукт, который получается из смешивания или объединения более чем одного активного ингредиента и включает в себя как фиксированные, так и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что оба активных ингредиента, например, соединение настоящего изобретения и компонент комбинации, вводят пациенту одновременно в форме одной единицы или дозировки. Термин "нефиксированная комбинация" означает, что оба активных ингредиента, например, соединение настоящего изобретения и компонент комбинации, вводят пациенту в виде отдельных единиц или одновременно, в одно время, или последовательно без конкретных временных ограничений, причем такое введение обеспечивает терапевтически эффективные уровни этих двух соединений в теле пациента. Последнее также применимо к коктейльной терапии, например, введению трех или более активных ингредиентов.
Термин "рак" относится к заболеванию, отличающемуся быстрым и неконтролируемым ростом аберрантных клеток. Раковые клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части тела. Примеры различных раков описаны в настоящем документе и включают, но без ограничения, рак молочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, рак почек, рак печени, рак головного мозга, лимфому, лейкоз, рак легкого и тому подобное. Термины "опухоль" и "рак" используются в настоящем документе взаимозаменяемо, например, оба термна охватывают твердые и жидкие, например, диффузные или циркулирующие, опухоли. Как используется в настоящем документе, термин "рак" или "опухоль" включает предзлокачественные, а также злокачественные раки и опухоли.
"Происходящий от", как этот термин используют в настоящем документе, указывает на взаимосвязь между первой и второй молекулой. Он в общем относится к структурному сходству между первой молекулой и второй молекулой и не определяет или включает в себя ограничение в отношении процесса или источника для первой молекулы, которая происходит от второй молекулы. Например, в случае внутриклеточного сигнального домена, который происходит от молекулы CD3-дзета, внутриклеточный сигнальный домен сохраняет достаточную структуру CD3-дзета, так что обладает требуемой функцией, а именно способностью генерировать сигнал в соответствующих условиях. Он не определяет или включает в себя ограничение в отношении конкретного процесса производства внутриклеточного сигнального домена, например, он не означает, что для получения внутриклеточного сигнального домена следует начинать с последовательности CD3-дзета и удалять нежелательную последовательность или вводить мутации, чтобы прийти к внутриклеточному сигнальному домену.
Фраза "заболевание, ассоциированное с экспрессией CD33", как используется в настоящем документе, включает в себя, но без ограничения, заболевание, ассоциированное с клеткой, которая экспрессирует CD33 (например, дикого типа или мутантный CD33), или состояние, ассоциированное с клеткой, которая экспрессирует CD33 (например, дикого типа или мутантный CD33), включая, например, пролиферативное заболевание, такое как рак или злокачественная опухоль, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанный с раком симптом, ассоциированный с клеткой, которая экспрессирует CD33 (например, дикого типа или мутантный CD33). Во избежание сомнений, заболевание, ассоциированное с экспрессией CD33, может включать состояние, ассоциированное с клеткой, которая в настоящий момент не экспрессирует CD33, например, потому, что экспрессия CD33 подверглась понижающей регуляции, например, благодаря лечению с помощью молекулы, воздействующей на CD33, например, ингибитора CD33, описанного в настоящем документе, но которая в свое время экспрессировала CD33. В одном аспекте рак, ассоциированный с экспрессией CD33 (например, дикого типа или мутантного CD33), представляет собой гематологический рак. В одном аспекте гематологический рак включает, но без ограничения, острый миелоидный лейкоз (ОМЛ), миелодисплазию и миелодиспластический синдром, миелофиброз и миелопролиферативные новообразования, острый лимфоидный лейкоз (ОЛЛ), волосистоклеточный лейкоз, пролимфоцитарный лейкоз, хронический миелоидный лейкоз (ХМЛ), новообразование из бластных плазмацитоидных дендритных клеток и тому подобное. Другие заболевания, ассоциированные с экспрессией CD33 (например, дикого типа или мутантного CD33), включают, но без ограничения, например, атипичные и/или неклассические раки, злокачественные опухоли, предраковые состояния или пролиферативные заболевания, ассоциированные с экспрессией CD33 (например, дикого типа или мутантного CD33). Также могут быть включены не связанные с раком симптомы, ассоциированные с экспрессией CD33 (например, дикого типа или мутантного CD33). В вариантах осуществления не связанный с раком симптом, ассоциированный с экспрессией CD33, включает, но без ограничения, например, аутоиммунное заболевание, (например, волчанку), воспалительные нарушения (аллергию и астму) и трансплантацию. В некоторых вариантах осуществления экспрессирующая опухолевый антиген клетка экспрессирует, или в любой момент времени экспрессировала, мРНК, кодирующую опухолевый антиген. В варианте осуществления экспрессирующая опухолевый антиген клетка производит белок опухолевого антигена (например, дикого типа или мутантный), и белок опухолевого антигена может присутствовать на нормальном уровне или на пониженном уровне. В варианте осуществления экспрессирующая опухолевый антиген клетка производила детектируемые уровни белка опухолевого антигена в один момент, и впоследствии по существу не производила детектируемого белка опухолевого антигена.
Термин "консервативные модификации последовательности" относится к модификациям аминокислот, которые не воздействуют или не изменяют значительно характеристики связывания антитела или фрагмента антитела, содержащего данную аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, присоединения и делеции. Модификации могут быть введены в антитело или фрагмент антитела настоящего изобретения посредством стандартных методов, известных в данной области техники, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативными являются замены, в которых аминокислотный остаток заменяется на аминокислотный остаток, имеющий схожую боковую цепь. В данной области техники определены семейства аминокислотных остатков, имеющих схожие боковые цепи. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в CAR настоящего изобретения могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененный CAR может быть подвергнут тестированию с использованием функциональных анализов, описанных в настоящем документе.
Термин "стимуляция" относится к первичному ответу, индуцируемому связыванием стимулирующей молекулы (например, комплекса TCR/CD3) с ее когнатным лигандом, что опосредует событие трансдукции сигнала, такое как, но без ограничения, трансдукция сигнала посредством комплекса TCR/CD3. Стимуляция может опосредовать изменение экспрессии некоторых молекул, такое как понижающая регуляция TGF-β и/или реорганизация структур цитоскелета, и тому подобное.
Термин "стимулирующая молекула" относится к молекуле, экспрессируемой T-клеткой, которая обеспечивает первичную цитоплазматическую сигнальную последовательность(и), которая регулирует первичную активацию комплекса TCR стимулирующим образом для по меньшей мере некоторых аспектов T-клеточного сигнального пути. В одном аспекте первичный сигнал инициируется, например, связыванием комплекса TCR/CD3 с молекулой ГКГС, нагруженной пептидом, что ведет к опосредованию T-клеточного ответа, включая, но без ограничения, пролиферацию, активацию, дифференцировку и тому подобное. Первичная цитоплазматическая сигнальная последовательность (также называемая "первичным сигнальным доменом"), которая действует стимулирующим образом, может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащих ITAM первичных цитоплазматических сигнальных последовательностей, которые особенно полезны в настоящем изобретении, включают, но без ограничения, происходящие от TCR-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известного как "ICOS"), FcεRI и CD66d, DAP10 и DAP12. В конкретных CAR настоящего изобретения внутриклеточный сигнальный домен в любом одном или нескольких CAR настоящего изобретения содержит внутриклеточную сигнальную последовательность, например, первичную сигнальную последовательность CD3-дзета. В конкретном CAR настоящего изобретения первичная сигнальная последовательность CD3-дзета представляет собой последовательность, определенную как SEQ ID NO: 9, или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных. В конкретном CAR настоящего изобретения первичная сигнальная последовательность CD3-дзета представляет собой последовательность, приведенную в SEQ ID NO: 10, или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных.
Термин "антигенпрезентирующая клетка" или "APC" относится к клетке иммунной системы, такой как вспомогательная клетка (например, B-клетка, дендритная клетка и тому подобные), которая демонстриует чужеродный антиген в комплексе с главными комплексами гистосовместимости (ГКГС) на своей поверхности. T-клетки могут распознавать эти комплексы с использованием своих T-клеточных рецепторов (TCR). APC процессируют антигены и презентируют их T-клеткам.
"Внутриклеточный сигнальный домен", как этот термин используют в настоящем документе, относится к внутриклеточной части молекулы. В вариантах осуществления внутриклеточный сигнальный домен трансдуцирует сигнал эффекторной функции и направляет клетку к выполнению специализированной функции. Хотя может использоваться весь внутриклеточный сигнальный домен, во многих случаях нет необходимости в использовании всей цепи. Если используют усеченную часть внутриклеточного сигнального домена, такая усеченная часть может быть использована вместо интактной цепи в том случае, если она трансдуцирует сигнал эффекторной функции. Таким образом, предполагается, что термин внутриклеточный сигнальный домен включают в себя любую усеченную часть внутриклеточного сигнального домена, достаточную для трансдукции сигнала эффекторной функции. Внутриклеточный сигнальный домен может генерировать сигнал, который стимулирует иммунную эффекторную функцию содержащей CAR клетки, например, CART-клетки или экспрессирующей CAR NK-клетки. Примеры иммунной эффекторной функции, например, в CART-клетке или экспрессирующей CAR NK-клетке, включают цитолитическую активность и хелперную активность, включая секрецию цитокинов.
В варианте осуществления внутриклеточный сигнальный домен может содержать первичный внутриклеточный сигнальный домен. Примеры первичных внутриклеточных сигнальных доменов включают происходящие от молекул, отвечающих за первичную стимуляцию или антиген-зависимую стимуляцию. В варианте осуществления внутриклеточный сигнальный домен может содержать костимулирующий внутриклеточный домен. Примеры костимулирующих внутриклеточных сигнальных доменов включают происходящие от молекул, отвечающих за костимулирующие сигналы или антиген-независимую стимуляцию. Например, в случае экспрессирующей CAR иммунной эффекторной клетки, например, CART-клетки или экспрессирующей CAR NK-клетки, первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность T-клеточного рецептора, и костимулирующий внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность от корецептора или костимулирующей молекулы.
Первичный внутриклеточный сигнальный домен может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащих ITAM первичных цитоплазматических сигнальных последовательностей включают, но без ограничения, происходящие от CD3-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известного как "ICOS"), FcεRI и CD66d, DAP10 и DAP12.
Термин "дзета" или, альтернативно, "дзета-цепь", "CD3-дзета" или "TCR-дзета" определяют как белок, предлагаемый под № доступа в GenBank BAG36664.1, или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных, и "стимулирующий домен дзета" или, альтернативно, "стимулирующий домен из CD3-дзета" или "стимулирующий домен TCR-дзета" определяют как аминокислотные остатки из цитоплазматического домена дзета-цепи, которых достаточно для функциональной передачи начального сигнала, необходимого для активации T-клеток. В одном аспекте цитоплазматический домен дзета содержит остатки 52-164 в соответствии с № доступа в GenBank BAG36664.1 или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных, которые являются их функциональными ортологами. В одном аспекте "стимулирующий домен дзета" или "стимулирующий домен из CD3-дзета" представляет собой последовательность, определенную как SEQ ID NO: 9. В одном аспекте "стимулирующий домен дзета" или "стимулирующий домен из CD3-дзета" представляет собой последовательность, определенную как SEQ ID NO: 10.
Термин "костимулирующая молекула" относится к партнеру по когнатному связыванию на T-клетке, который специфически связывается с костимулирующим лигандом, тем самым опосредуя костимулирующий ответ T-клетки, такой как, но без ограничения, пролиферация. Костимулирующие молекулы являются молекулами клеточной поверхности, отличными от рецепторов антигенов или их лигандов, которые нужны для эффективного иммунного ответа. Костимулирующие молекулы включают, но без ограничения, молекулу ГКГС класса I, белки-рецепторы ФНО, иммуноглобулин-подобные белки, цитокиновые рецепторы, интегрины, сигнальные лимфоцит-активирующие молекулы (SLAM-белки), активирующие рецепторы NK-клеток, BTLA, рецептор толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфически связывается с CD83.
Костимулирующий внутриклеточный сигнальный домен относится к внутриклеточной части костимулирующей молекулы.
Внутриклеточный сигнальный домен может содержать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, от которой он происходит, или его функциональный фрагмент.
Термин "4-1BB" относится к члену суперсемейства TNFR с аминокислотной последовательностью, предлагаемой под № доступа в GenBank AAA62478.2, или эквивалентным остаткам из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных; и "костимулирующий домен из 4-1BB" определяют как аминокислотные остатки 214-255 в № доступа в GenBank AAA62478.2 или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных. В одном аспекте "костимулирующий домен из 4-1BB" представляет собой последовательность, определенную как SEQ ID NO: 7, или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных.
"Иммунная эффекторная клетка", как этот термин используют в настоящем документе, относится к клетке, которая участвует в иммунном ответе, например, в активации иммунного эффекторного ответа. Примеры иммунных эффекторных клеток включают в себя T-клетки, например, альфа/бета-T-клетки и гамма/дельта-T-клетки, B-клетки, клетки-естественные киллеры (NK), T-клетки-естественные киллеры (NKT), тучные клетки и фагоциты миелоидного происхождения.
"Иммунная эффекторная функция или иммунный эффекторный ответ", как этот термин используют в настоящем документе, относится к функции или ответу, например, иммунной эффекторной клетки, которые усиливают или стимулируют иммунную атаку клетки-мишени. Например, иммунные эффекторные функция или ответ относятся к свойству T или NK-клеток, которое стимулирует киллинг или ингибирование роста или пролиферации клетки-мишени. В случае T-клетки первичная стимуляция и костимуляция представляют собой примеры иммунной эффекторной функции или ответа.
Термин "эффекторная функция" относится к специальной функции клетки. Эффекторная функция T-клетки, например, может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов.
Термин "кодирующий" относится к свойству, присущему специфическим последовательностям нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза в биологических процессах других полимеров и макромолекул, имеющих или определенную последовательность нуклеотидов (например, рРНК, тРНК и мРНК), или определенную последовательность аминокислот и биологические свойства, проистекающие из них. Таким образом, ген, кДНК или РНК кодируют белок, если транскрипция и трансляция мРНК, соответствующей этому гену, производит белок в клетке или другой биологической системе. Как кодирующая нить, нуклеотидная последовательность которой идентична последовательности мРНК и обычно приводится в перечнях последовательностей, так и некодирующая нить, используемая в качестве матрицы для транскрипции гена или кДНК, могут называться кодирующей белок или другой продукт этих гена или кДНК.
Если не указано иное, "нуклеотидная последовательность, кодирующая аминокислотную последовательность" включает в себя все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга, и которые кодируют одну и ту же аминокислотную последовательность. Фраза "нуклеотидная последовательность, которая кодирует белок или РНК" может также включать в себя интроны, если нуклеотидная последовательность, кодирующая белок, может в некоторых вариантах содержать интрон(ы).
Термины "эффективное количество" или "терапевтически эффективное количество" используются взаимозаменяемо в настоящем документе и относятся к количеству соединения, состава, материала или композиции, как описано в настоящем документе, эффективному для достижения определенного биологического результата.
Термин "эндогенный" относится к любому материалу из организма, клетки, ткани или системы, или производимому внутри них.
Термин "экзогенный" относится к любому материалу, введенному в организм, клетку, ткань или систему, или производимому снаружи от них.
Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности, управляемой промотором.
Термин "вектор переноса" относится к композиции веществ, которая содержит выделенную нуклеиновую кислоту, и которую можно использовать для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области техники известны многочисленные векторы, включая, но без ограничения, линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор переноса" включает в себя автономно реплицирующиеся плазмиду или вирус. Термин также следует интерпретировать как дополнительно включающий в себя неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосома и тому подобное. Примеры вирусных векторов переноса включают, но без ограничения, аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы и тому подобное.
Термин "вектор экспрессии" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий контрольные последовательности экспрессии, функционально связанные с нуклеотидной последовательностью, подлежащей экспрессии. Вектор экспрессии содержит достаточно действующих в цис-положении элементов для экспрессии; другие элементы для экспрессии могут поставляться клеткой-хозяином или в системе in vitro экспрессии. Векторы экспрессии включают в себя все известные в данной области техники, включая космиды, плазмиды (например, оголенные или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые включают в себя рекомбинантный полинуклеотид.
Термин "лентивирус" относится к роду семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов в том, что они способны инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки-хозяина, так что они являются одним наиболее эффективных способов вектора доставки генов. ВИЧ, SIV и FIV являются примерами лентивирусов.
Термин "лентивирусный вектор" относится к вектору, происходящему по меньшей мере частично от лентивирусного генома, в частности включая самоинактивирующийся лентивирусный вектор, как предложено в документе Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). Другие примеры лентивирусных векторов, которые могут быть использованы в клинике, включают, но без ограничения, например, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAX™ от Lentigen и тому подобные. Неклинические типы лентивирусных векторов также доступны и должны быть известны специалисту в данной области техники.
Термин "гомологичный" или "идентичность" относятся к идентичности последовательностей субъединиц между двумя полимерными молекулами, например, между двумя молекулами нуклеиновой кислоты, такими как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Когда положение субъединицы в обеих из двух молекул занято одной и той же мономерной субъединицей; например, если положение в каждой из двух молекул ДНК занято аденином, то они гомологичны или идентичны в этом положении. Гомология между двумя последовательностями является непосредственной функцией количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях гомологичны, две последовательности гомологичны на 50%; если 90% положений (например, 9 из 10) совпадают или гомологичны, две последовательности гомологичны на 90%.
"Гуманизированные" формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую от нечеловеческого иммуноглобулина. По большей части гуманизированные антитела и их фрагменты антител представляют собой человеческие иммуноглобулины (реципиентное антитело или фрагмент антитела), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены на остатки из CDR отличного от человека вида (донорное антитело), такого как мышь, крыса или кролик, имеющие желаемую специфичность, аффинность и способность. В некоторых случаях остатки каркасной области (FR) Fv человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированное антитело/фрагмент антитела может содержать остатки которые, не обнаруживаются ни в реципиентном антителе, ни в импортированной CDR или каркасных последовательностях. Эти модификации могут дополнительно уточнять и оптимизировать активность антитела или фрагмента антитела. В общем случае, гуманизированное антитело или его фрагмент антитела будет содержать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют нечеловеческому иммуноглобулину и все или значительная часть областей FR имеют последовательность от человеческого иммуноглобулина. Гуманизированное антитело или фрагмент антитела могут также содержать по меньшей мере часть иммуноглобулиновой константной области (Fc), обычно от человеческого иммуноглобулина. Для дальнейших подробностей смотри Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
"Полностью человеческий" относится к иммуноглобулину, такому как антитело или фрагмент антитела, если вся молекула имеет человеческое происхождение или состоит из аминокислотной последовательности, идентичной человеческой форме антитела или иммуноглобулин.
Термин "выделенный" означает измененный или удаленный из естественного состояния. например, нуклеиновая кислота или пептид естественно присутствующие в живом животном, не являются "выделенными", но те же самые нуклеиновая кислота или пептид частично или полностью отделенные от сопутствующих материалов их естественного состояния, являются "выделенными". Выделенные нуклеиновая кислота или белок могут существовать в по существу очищенной форме или могут существовать в ненативном окружении, таком как, например, клетка-хозяин.
В контексте настоящего изобретения используются следующие сокращения для часто встречающихся оснований нуклеиновой кислоты. "A" относится к аденозину, "C" относится к цитозину, "G" относится к гуанозину, "T" относится к тимидину, и "U" относится к уридину.
Термины "функционально связанный" или "транскрипционный контроль" относятся к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, если первая последовательность нуклеиновой кислоты помещена в функциональную взаимосвязь со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор воздействует на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут соприкасаться друг с другом и, например, если необходимо соединить две кодирующие белок области, находятся в одной и той же рамке считывания.
Термин "парентеральное" введение иммуногенной композиции включает, например, методы подкожной (п/к), внутривенной (в/в), внутримышечной (в/м) или интрастернальной инъекции, внутриопухолевый или инфузии.
Термины "нуклеиновая кислота" или "полинуклеотид" относятся к дезоксирибонуклеиновым кислотам (ДНК) или рибонуклеиновым кислотам (РНК) и их полимерам или в одно- или в двухцепочечной форме. Если специально не оговорено, термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые имеют связывающие свойства, аналогичные эталонной нуклеиновой кислоте, и метаболизируются аналогичным природным нуклеотидам образом. Если не указано иное, конкретная последовательность нуклеиновой кислоты также неявно охватывает ее консервативно модифицированные варианты (например, замены вырожденных кодонов), аллели, ортологи, SNP и комплементарные последовательности, а также явно указанную последовательность. Если говорить конкретнее, замены вырожденных кодонов могут быть получены посредством создания последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов заменено на остатки смешанного основания и/или дезоксиинозина (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
Термины "пептид", "полипептид" и "белок" используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не налагается никаких ограничений на максимальное количество аминокислот, которое может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. Как используется в настоящем документе, термин относится как к более коротким цепям, которые также обычно называют в данной области техники, например, пептидами, олигопептидми и олигомерами, так и к более длинным цепям, которые обычно называют в данной области техники белками, которых существует много типов. "Полипептиды" включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, белки слияния и другие. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию.
Термин "промотор" относится к последовательности ДНК, распознаваемой клетками аппарата синтеза или введенным аппаратом синтеза, необходимой для начала специфической транскрипции полинуклеотидной последовательности.
Термин "промотор/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, которая требуется для экспрессии продукта гена, функционально связанного с данными промотором/регуляторной последовательностью. В некоторых случаях данная последовательность может представлять собой последовательность корового промотора, а в других случаях данная последовательность может также включать в себя последовательность энхансера и другие регуляторные элементы, который требуются для экспрессии продукта гена. Промотор/регуляторная последовательность может, например, представлять собой последовательность, экспрессирующую продукт гена ткань-специфическим образом.
Термин "конститутивный" промотор относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает производство продукта гена в клетке в большинстве или всех физиологических условиях клетки.
Термин "индуцируемый" промотор относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает производство продукта гена в клетке по существу только тогда, когда в клетке присутствует индуктор, который соответствует промотору.
Термин "ткань-специфический" промотор относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или определяется геном, вызывает производство продукта гена в клетке по существу только тогда, когда клетка представляет собой клетку типа ткани, соответствующего промотору.
Термины "ассоциированный с раком антиген" или "опухолевый антиген" взаимозаменяемо относятся к молекуле (обычно белку, углеводу или липиду), которая экспрессируется на поверхности раковой клетки, или полностью, или в виде фрагмента (например, ГКГС/пептида), и которая полезна для преимущественного направления фармакологического средства на раковую клетку. В некоторых вариантах осуществления опухолевый антиген представляет собой маркер, экспрессируемый как нормальными клетками, так и раковыми клетками, например, маркер линии дифференцировки, например, CD19 на B-клетках. В некоторых вариантах осуществления опухолевый антиген представляет собой молекулу клеточной поверхности, которая сверхэкспрессируется в раковых клетках по сравнению с нормальной клеткой, например, 1-кратно сверхэкспрессируется, 2-кратно сверхэкспрессируется, 3-кратно или более сверхэкспрессируется по сравнению с нормальной клеткой. В некоторых вариантах осуществления опухолевый антиген представляет собой молекулу клеточной поверхности, которая неадекватно синтезируется в раковой клетке, например, молекулу, которая содержит делеции, присоединения или мутации по сравнению с молекулой, экспрессируемой на нормальной клетке. В некоторых вариантах осуществления опухолевый антиген будет экспрессироваться исключительно на клеточной поверхности раковой клетки, полностью или в виде фрагмента (например, ГКГС/пептида), и не синтезироваться или экспрессироваться на поверхности нормальной клетки. В некоторых вариантах осуществления CAR настоящего изобретения включают в себя CAR, содержащие антигенсвязывающий домен (например, антитело или фрагмент антитела), который связывается с презентируемым ГКГС пептидом. Обычно пептиды, происходящие от эндогенных белков, заполняют все карманы молекул главного комплекса гистосовместимости (ГКГС) класса I и распознаются T-клеточными рецепторами (TCR) на CD8+T-лимфоцитах. Комплексы ГКГС класса I конститутивно экспрессируются всеми ядросодержащими клетками. При раке вирус-специфические и/или опухоль-специфические комплексы пептид/ГКГС представляют уникальный класс мишеней клеточной поверхности для иммунотерапии. Были описаны TCR-подобные антитела, воздействующие на пептиды, происходящие от вирусных или опухолевых антигенов, в контексте человеческого лейкоцитарного антигена (HLA)-A1 или HLA-A2 (смотри, например, Sastry et al., J Virol. 2011 85(5):1935-1942; Sergeeva et al., Blood, 2011 117(16):4262-4272; Verma et al., J Immunol 2010 184(4):2156-2165; Willemsen et al., Gene Ther 2001 8(21):1601-1608 ; Dao et al., Sci Transl Med 2013 5(176):176ra33 ; Tassev et al., Cancer Gene Ther 2012 19(2):84-100). Например, TCR-подобное антитело может быть идентифицировано скринингом библиотеки, такой как библиотека фагового отображения человеческого scFv.
Термины "поддерживающий опухоль антиген" или "поддерживающий рак антиген" взаимозаменяемо относятся к молекуле (обычно белку, углеводу или липиду), который экспрессируется на поверхности клетки, который сам по себе не является раковым, но поддерживает раковые клетки, например, посредством стимуляции их роста или выживаемости, например, резистентности к иммунным клеткам. Примеры клеток данного типа включают стромальные клетки и супрессорные клетки миелоидного происхождения (MDSC). Сам поддерживающий опухоль антиген не должен играть роль в поддержании опухолевых клеток до тех пор, пока антиген присутствует на клетке, которая поддерживает раковые клетки.
Термин "гибкий полипептидный линкер" или "линкер", как используется в контексте scFv, относится к пептидному линкеру, который состоит из аминокислот, таких как остатки глицина и/или серина, используемые по-отдельности или в комбинации, для связывания вместе вариабельной области тяжелой цепи и вариабельной области легкой цепи. В одном варианте осуществления гибкий полипептидный линкер представляет собой линкер Gly/Ser и содержит аминокислотную последовательность (Gly-Gly-Gly-Ser)n (SEQ ID NO: 38), где n представляет собой положительное целое число, равное или большее чем 1. Например, n=1, n=2, n=3, n=4, n=5 и n=6, n=7, n=8, n=9 и n=10. В одном варианте осуществления гибкие полипептидные линкеры включают, но без ограничения, (Gly4 Ser)4 (SEQ ID NO: 27) или (Gly4 Ser)3 (SEQ ID NO: 28). В другом варианте осуществления линкеры включают множественные повторы (Gly2Ser), (GlySer) или (Gly3Ser) (SEQ ID NO: 29). Также в пределы объема настоящего изобретения включены линкеры, описанные в WO2012/138475, включенной в настоящий документ посредством ссылки.
Как используется в настоящем документе, 5'-кэп (также называемый кэп РНК, 7-метилгуанозиновый кэп РНК или кэп m7G РНК) представляет собой модифицированный нуклеотид гуанин, который присоединен к "переднему" или 5'-концу эукариотической информационной РНК вскоре после начала транскрипции. 5'-кэп состоит из концевой группы, которая связана с первым транскрибируемым нуклеотидом. Ее присутствие является критическим для распознавания рибосомой и защиты от РНКаз. Присоединение кэпа связано с транскрипцией и происходит котранскрипционно, так что они воздействуют друг на друга. Вскоре после начала транскрипции 5'-конец синтезируемой мРНК связывается синтезирующим кэп комплексом, ассоциированным с РНК-полимеразой. Этот ферментный комплекс катализирует химические реакции, которые необходимы для кэпирования мРНК. Синтез продолжается в виде многостадийной биохимической реакции. Кэпирующая группа может быть модифицирована для модулирования функциональных свойств мРНК, таких как ее стабильность или эффективность трансляции.
Как используется в настоящем документе, "транскрибируемая in vitro РНК" относится к РНК, предпочтительно мРНК, которая была синтезирована in vitro. Обычно транскрибируемая in vitro РНК генерируется из вектора in vitro транскрипции. Вектор in vitro транскрипции содержит матрицу, которая используется для генерирования транскрибируемой in vitro РНК.
Как используется в настоящем документе, "поли(A)" представляет собой ряд аденозинов, прикрепленных посредством полиаденилирования к мРНК. В предпочтительном варианте осуществления конструкта для временной экспрессии поли-A составляет между 50 и 5000 (SEQ ID NO: 30), предпочтительно, больше чем 64, более предпочтительно, больше чем 100, наиболее предпочтительно, больше чем 300 или 400. Поли(A)-последовательности могут быть модифицированы химически или ферментативно для модулирования функциональных свойств мРНК, таких как локализация, стабильность или эффективность трансляции.
Как используется в настоящем документе, "полиаденилирование" относится к ковалентной связи полиаденильного участка или его модифицированного варианта с молекулой информационной РНК. В эукариотических организмах большая часть молекул информационной РНК (мРНК) полиаденилированы с 3'-конца. 3'-поли(A)-хвост представляет собой длинную последовательность адениновых нуклеотидов (часто несколько сотен), присоединенных к пре-мРНК посредством действия фермента полиаденилатполимеразы. В высших эукариотах поли(A)-хвост присоединяется к транскриптам, которые содержат специфическую последовательность, сигнал полиаденилирования. Поли(A)-хвост и белковая связь с ним помогает защитить мРНК от деградации экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорта мРНК из ядра и трансляции. Полиаденилирование происходит в ядре непосредственно после транскрипции ДНК в РНК, но дополнительно может также происходить позже в цитоплазме. После терминации транскрипции цепь мРНК расщепляется действием эндонуклеазного комплекса, ассоциированного с РНК-полимеразой. Сайт расщепления обычно характеризуется присутствием последовательности оснований AAUAAA около сайта расщепления. После расщепления мРНК аденозиновые остатки присоединяются к свободному 3'-концу в сайте расщепления.
Как используется в настоящем документе, "временный" относится к экспрессии неинтегрированного трансгена в течение периода, составляющего часы, дни или недели, причем период времени экспрессии меньше, чем период времени экспрессии данного гена в случае интеграции в геном или содержания в стабильном плазмидном репликоне в клетке-хозяине.
Как используется в настоящем документе, термины "лечить" и "лечение" относятся к уменьшению или ослаблению прогрессирования, тяжести и/или продолжительности пролиферативного нарушения или ослаблению одного или нескольких симптомов (предпочтительно, одного или нескольких выраженных симптомов) пролиферативного нарушения, происходящих от введения одной или нескольких терапий (например, одного или нескольких терапевтических средств, таких как CAR настоящего изобретения). В конкретных вариантах осуществления термины "лечить" и "лечение" относятся к ослаблению по меньшей мере одного измеряемого физического параметра пролиферативного нарушения, такого как рост опухоли, не обязательно воспринимаемого пациентом. В других вариантах осуществления термины "лечить" и "лечение" относятся к ингибированию прогрессирования пролиферативного нарушения физически посредством, например, стабилизации выраженного симптома, физиологически посредством, например, стабилизации физического параметра, или и тем, и другим образом. В других вариантах осуществления термины "лечить" и "лечение" относятся к уменьшению или стабилизации размера опухоли или числа раковых клеток.
Термин "путь трансдукции сигнала" относится к биохимической взаимосвязи между множеством молекул трансдукции сигнала, которые играют роль в передаче сигнала из одной части клетки в другую часть клетки. Фраза "рецептор клеточной поверхности" включает в себя молекулы и комплексы молекул, способные к приему сигнала и передаче сигнала через мембрану клетки.
Предполагается, что термин "субъект" включает в себя живые организмы, у которых может быть вызван иммунный ответ (например, млекопитающие, люди).
Термин "по существу очищенная" клетка относится к клетке, которая по существу свободна от других типов клеток. По существу, очищенная клетка также относится к клетке, которая была отделена от клеток других типов, с которыми она обычно связана в своем естественном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к однородной популяции клеток. В других случаях данный термин относится просто к клеткам, которые были отделены от клеток, с которыми они естественным образом связаны в своем естественном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
Термин "терапевтический", как используется в настоящем документе, означает лечение. Терапевтический эффект получают посредством уменьшения, супрессии, ремиссии или эрадикации болезненного заболевания.
Термин "профилактика", как используется в настоящем документе, означает предупреждение или защитное лечение заболевания или болезненного состояния.
В контексте настоящего изобретения "опухолевый антиген", или "антиген гиперпролиферативных нарушений", или "антиген, ассоциированный с гиперпролиферативным нарушением" относятся к антигенам, которые являются общими для конкретных гиперпролиферативных нарушений. В определенных аспектах антигены гиперпролиферативных нарушений настоящего изобретения происходят от раков, включая, но без ограничения, первичную или метастатическую меланому, тимому, лимфому, саркому, рак легкого, рак печени, неходжкинскую лимфому, ходжкинскую лимфому, лейкозы, рак матки, рак шейки матки, рак мочевого пузыря, рак почек и аденокарциномы, такие как рак молочной железы, рак предстательной железы, рак яичников, рак поджелудочной железы и тому подобное.
Термин "трансфицированный", или "трансформированный", или "трансдуцированный" относится к процессу, посредством которого экзогенную нуклеиновую кислоту переносят или вводят в клетку-хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка представляет собой клетку, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную клетку субъекта и ее потомство.
Термин "специфически связывает" относится к антителу или лиганду, который распознает белок-когнатный партнер по связыванию (например, стимулирующую и/или костимулирующую молекулу, презентированную на T-клетке), присутствующий в образце, и связывается с ним, причем эти антитело или лиганд по существу не распознают другие молекулы в образце или не связываются с ними.
"Регулируемый химерный антигенный рецептор (RCAR)", как используется в настоящем документе, относится к набору полипептидов, обычно двум в простейших вариантах осуществления, которые, находясь в иммунной эффекторной клетке, придают клетке специфичность к клетке-мишени, обычно раковой клетке, и генерацию внутриклеточных сигналов. В некоторых вариантах осуществления RCAR содержит по меньшей мере внеклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый в настоящем документе как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, происходящий от стимулирующей молекулы и/или костимулирующей молекулы, как определено в настоящем документе в контексте молекулы CAR. В некоторых вариантах осуществления набор полипептидов в RCAR не соприкасаются друг с другом, например, находятся в различных полипептидных цепях. В некоторых вариантах осуществления RCAR включает в себя переключатель димеризации, который в присутствии молекулы димеризации, может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. В некоторых вариантах осуществления RCAR экспрессируется в клетке (например, иммунной эффекторной клетке), как описано в настоящем документе, например, RCAR-экспрессирующей клетке (также обозначаемой в настоящем документе как "RCARX-клетка"). В варианте осуществления RCARX-клетка представляет собой T-клетку и называется RCART-клеткой. В варианте осуществления RCARX-клетка представляет собой NK-клетку и называется RCARN-клеткой. RCAR может придавать RCAR-экспрессирующей клетке специфичность к клетке-мишени, обычно раковой клетке, и регулируемую генерацию внутриклеточных сигналов или пролиферацию, что может оптимизировать иммунное эффекторное свойство RCAR-экспрессирующей клетки. В вариантах осуществления RCAR-клетка по меньшей мере частично опирается на антигенсвязывающий домен при придании специфичности к клетке-мишени, которая содержит антиген, связываемый антигенсвязывающим доменом.
"Мембранный якорь" или "связывающий с мембраной домен", как этот термин используют в настоящем документе, относится к полипептиду или фрагменту, например, миристоильной группе, достаточным для заякоревания внеклеточного или внутриклеточного домена к плазматической мембране.
"Домен-переключатель", как этот термин используют в настоящем документе, например, при ссылке на RCAR, относится к объекту, обычно полипептидному объекту, который в присутствии молекулы димеризации связывается с другим доменом-переключателем. Эта связь приводит к функциональному связыванию первого объекта, связанного, например, слитого, с первым доменом-переключателем, и второго объекта, связанного, например, слитого, со вторым доменом-переключателем. Первый и второй домены-переключатели вместе называются переключателем димеризации. В вариантах осуществления первый и второй домены-переключатели являются одинаковыми друг с другом, например, они представляют собой полипептиды, имеющие одинаковую первичную аминокислотную последовательность, и вместе называются переключателем гомодимеризации. В вариантах осуществления первый и второй домены-переключатели отличаются друг от друга, например, они представляют собой полипептиды, имеющие различные первичные аминокислотные последовательности, и вместе называются переключателем гетеродимеризации. В вариантах осуществления переключатель является внутриклеточным. В вариантах осуществления переключатель является внеклеточным. В вариантах осуществления домен-переключатель представляет собой полипептидный объект, например, на основе FKBP или FRB, и молекула димеризации представляет собой небольшую молекулу, например, рапалог. В вариантах осуществления домен-переключатель представляет собой полипептидный объект, например, scFv, который связывает пептид myc, и молекула димеризации представляет собой полипептид, его фрагмент или мультимер полипептида, например, лиганд myc или мультимеры лиганда myc, который связывается с одним или несколькими scFv к myc. В вариантах осуществления домен-переключатель представляет собой полипептидный объект, например, рецептор myc, и молекула димеризации представляет собой антитело или его фрагменты, например, антитело к myc.
"Молекула димеризации", как этот термин используют в настоящем документе, например, при ссылке на RCAR, относится к молекуле, которая стимулирует связь первого домена-переключателя со вторым доменом-переключателем. В вариантах осуществления молекула димеризации не встречается естественным образом у субъекта, или не встречается в концентрации, которая приводила бы к значительной димеризации. В вариантах осуществления молекула димеризации представляет собой небольшую молекулу, например, рапамицин или рапалог, например, RAD001.
Термин "биоэквивалентный" относится к количеству средства, отличного от эталонного соединения (например, RAD001), требуемому для произведения эффекта, эквивалентного эффекту, производимому эталонной дозой или эталонным количеством эталонного соединения (например, RAD001). В варианте осуществления эффект представляет собой уровень ингибирования mTOR, например, измеренный по ингибированию киназы P70 S6, например, оцененный в in vivo или in vitro анализе, например, измеренный с помощью анализа, описанного в настоящем документе, например, анализа Boulay или измерения уровней фосфорилированного S6 с помощью вестерн-блоттинга. В варианте осуществления эффект представляет собой изменение отношения PD-1-положительные/PD-1-отрицательные между иммунными эффекторными клетками, например, между T-клетками или NK-клетками, измеренное с помощью клеточной сортировки. В варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляют собой количество или дозу, которые дают такой же уровень ингибирования киназы P70 S6, как и эталонная доза или эталонное количество эталонного соединения. В варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляют собой количество или дозу, которые дают такой же уровень изменения отношения PD-1-положительные/PD-1-отрицательные между иммунными эффекторными клетками, например, между T-клетками или NK-клетками, как и эталонная доза или эталонное количество эталонного соединения.
Термин "низкая иммуностимулирующая доза" при использовании в сочетании с ингибитором mTOR, например, аллостерическим ингибитором mTOR, например, RAD001 или рапамицином, или каталитическим ингибитором mTOR, относится к дозе ингибитора mTOR, которая частично, но не полностью ингибирует активность mTOR, например, измеренную по ингибированию активности киназы P70 S6. Способы оценки активности mTOR, например, по ингибированию киназы P70 S6, рассмотрены в настоящем документе. Данная доза недостаточна для того, чтобы приводить к полной иммуносупрессии, но достаточна для усиления иммунного ответа. В варианте осуществления низкая иммуностимулирующая доза ингибитора mTOR приводит к уменьшению количества PD-1-положительных иммунных эффекторных клеток, например, T-клеток или NK-клеток, и/или увеличению количества PD-1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или увеличению отношения PD-1-отрицательные иммунные эффекторные клетки (например, T-клетки или NK-клетки)/PD-1-положительные иммунные эффекторные клетки (например, T-клетки или NK-клетки).
В варианте осуществления низкая иммуностимулирующая доза ингибитора mTOR приводит к увеличению количества наивных T-клеток. В варианте осуществления низкая иммуностимулирующая доза ингибитора mTOR приводит к одному или нескольким из следующего:
увеличение экспрессии одного или нескольких из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, на предшественниках T-клеток памяти;
уменьшение экспрессии KLRG1, например, на T-клетках памяти, например, на предшественниках T-клеток памяти; и
увеличение количества предшественников T-клеток памяти, например, клеток с любой одной из следующих характеристик или их комбинацией: повышенный уровень CD62Lhigh, повышенный уровень CD127high, повышенный уровень CD27+, пониженный уровень KLRG1 и повышенный уровень BCL2;
причем любое из изменений, описанных выше, происходит, например, по меньшей мере временно, например, по сравнению с не подвергавшимся лечению субъектом.
"Рефрактерный", как используется в настоящем документе, относится к заболеванию, например, раку, которое не отвечает на лечение. В вариантах осуществления рефрактерный рак может быть резистентным к лечению до или в начале лечения. В других вариантах осуществления рефрактерный рак может становиться резистентным во время лечения. Рефрактерный рак также называют резистентным раком.
"Рецидивирующий" или "рецидив", как используется в настоящем документе, относится к повторному появлению заболевания (например, рака) или признаков и симптомов заболевания, такого как рак, после периода улучшения или реагирования, например, после предшествующего лечения с помощью терапии, например, терапии рака. Например, в период реагирования уровень раковых клеток может падать ниже определенного порога, например, ниже 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%. При повторном появлении уровень раковых клеток может подниматься выше определенного порога, например, выше 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%.
Диапазоны: на протяжении настоящего раскрытия различные аспекты настоящего изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов дано только для удобства и краткости и не должно рассматриваться в качестве негибкого ограничения объема настоящего изобретения. Соответственно, описание диапазона следует рассматривать как конкретно раскрывающее все возможные поддиапазоны, а также отдельные числовые значения в пределах этого диапазона. Например, описание диапазона, такого как от 1 до 6, следует рассматривать как конкретно раскрывающее такие поддиапазоны, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и так далее, а также отдельные числовые значения в пределах этого диапазона, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. В качестве другого примера, диапазон, такой как идентичность на 95-99%, включает в себя что-либо с идентичностью на 95%, 96%, 97%, 98% или 99%, и включает в себя такие поддиапазоны как идентичность на 96-99%, 96-98%, 96-97%, 97-99%, 97-98% и 98-99%. Это применяется независимо от ширины диапазона.
Описание
В настоящем описании предлагаются композиции веществ и способы применения для лечения или предупреждения заболеваний, таких как рак, с использованием химерных антигенных рецепторов (CAR) к CD33.
В одном аспекте настоящее изобретение предлагает ряд химерных антигенных рецепторов (CAR), содержащих антитело или фрагмент антитела, сконструированные для специфического связывания с белком CD33 или его фрагментами. В одном аспекте настоящее изобретение предлагает клетку (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку), сконструированную для экспрессии CAR, причем данная клетка (например, "CART") проявляет противоопухолевое свойство. В одном аспекте клетку трансформируют с помощью CAR, и по меньшей мере часть CAR экспрессируется на клеточной поверхности. В некоторых вариантах осуществления клетку (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку) трансдуцируют с помощью вирусного вектора, кодирующего CAR. В некоторых вариантах осуществления вирусный вектор представляет собой ретровирусный вектор. В некоторых вариантах осуществления вирусный вектор представляет собой лентивирусный вектор. В некоторых таких вариантах осуществления клетка может стабильно экспрессировать CAR. В другом варианте осуществления клетку (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку) трансфицируют нуклеиновой кислотой, например, мРНК, кДНК, ДНК, кодирующей CAR. В некоторых таких вариантах осуществления клетка может временно экспрессировать CAR.
В одном аспекте CD33-связывающий домен, например, человеческий или гуманизированный связывающий CD33 домен, в CAR представляет собой фрагмент антитела scFv. В одном аспекте такие фрагменты антител функциональны в том, что они сохраняют эквивалентную аффинность связывания, например, они связывают один и тот же антиген с эффективностью, сравнимой с антителом IgG, имеющим такие же вариабельные области тяжелой и легкой цепи. В одном аспекте такие фрагменты антител функциональны в том, что они обеспечивают биологический ответ, который может включать в себя, но без ограничения, активацию иммунного ответа, ингибирование возникновения трансдукции сигнала от их антигенов-мишеней, ингибирование киназной активности и тому подобное, как будет понятно специалисту.
В некоторых аспектах антитела настоящего изобретения включены в химерный антигенный рецептор (CAR). В одном аспекте CAR содержит полипептидную последовательность, приведенную в настоящем документе как SEQ ID NO: 48-56.
В одном аспекте часть CD33-связывающего домена, например, гуманизированного или человеческого связывающего CD33 домена, в CAR настоящего изобретения кодируется трансгеном, последовательность которого была кодон-оптимизирована для экспрессии в клетке млекопитающего. В одном аспекте весь конструкт CAR настоящего изобретения кодируется трансгеном, вся последовательность которого была кодон-оптимизирована для экспрессии в клетке млекопитающего. Оптимизация кодонов относится к тому открытию, что частота встречаемости синонимичных кодонов (то есть, кодонов, которые кодируют одну и ту же аминокислоту) в кодирующей ДНК в различных видах смещена. Такое вырождение кодонов делает возможным кодирование идентичного полипептида с помощью множества нуклеотидных последовательностей. Множество способов оптимизации кодонов известны в данной области техники и включают, например, способы, раскрытые по меньшей мере в патентах США №№ 5786464 и 6114148.
В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 39-47. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 39. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 40. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 41. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 42. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 43. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 44. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 45. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 46. В одном аспекте человеческий связывающий CD33 домен содержит часть scFv, приведенную в SEQ ID NO: 47. В одном аспекте CAR настоящего изобретения объединяют антигенсвязывающий домен специфического антитела с внутриклеточной сигнальной молекулой. Например, в некоторых аспектах внутриклеточная сигнальная молекула включает, но без ограничения, сигнальные модули CD3-дзета-цепь, 4-1BB и CD28 и их комбинации. В одном аспекте антигенсвязывающий домен связывается с CD33. В одном аспекте CAR к CD33 содержит CAR, выбранный из последовательности, приведенной в одной или нескольких из SEQ ID NO: 48-56. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 48. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 49. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 50. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 51. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 52. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 53. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 54. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 55. В одном аспекте CAR к CD33 содержит последовательность, приведенную в SEQ ID NO: 56.
Кроме того, настоящее изобретение предлагает композиции CAR к CD33 и их применение в лекарственных средствах или способах лечения, помимо других заболеваний, рака или любой злокачественной опухоли или аутоиммунных заболеваний с участием клеток или тканей, которые экспрессируют CD33.
В одном аспекте CAR настоящего изобретения можно использовать для эрадикации CD33-экспрессирующих нормальных клеток, и тем самым он применим для использования в качестве клеточной кондиционирующей терапии перед клеточной трансплантацией или другой подходящей терапией. Клеточная трансплантация включает в себя трансплантацию стволовых клеток, например, трансплантацию гематопоэтических стволовых клеток, и трансплантацию костного мозга. Клеточная трансплантация является аллогенной или аутологичной. В вариантах осуществления CAR настоящего изобретения уничтожает CD33-экспрессирующие нормальные клетки, или CD33-экспрессирующие раковые клетки, или и те, и другие, перед клеточной трансплантацией или другой подходящей терапией. В одном аспекте CD33-экспрессирующая нормальная клетка представляет собой CD33-экспрессирующую миелоидную клетку-предшественник, и клеточная трансплантация представляет собой трансплантацию стволовых клеток.
В одном аспекте настоящее изобретение предлагает клетку (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку), сконструированную для экспрессии химерного антигенного рецептора (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку, например, CART) настоящего изобретения, причем клетка (например, иммунная эффекторная клетка, например, T-клетка или NK-клетка, например, "CART") проявляет противоопухолевое свойство. Соответственно, настоящее изобретение предлагает CD33-CAR, который содержит CD33-связывающий домен и введен методами генной инженерии в клетку (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку), и способы их использования для адоптивной терапии.
В одном аспекте антигенсвязывающий домен CAR содержит человеческое антитело или фрагмент антитела к CD33. В одном аспекте антигенсвязывающий домен CAR содержит гуманизированное антитело или фрагмент антитела к CD33. В одном аспекте антигенсвязывающий домен CAR содержит фрагмент человеческого антитела к CD33, содержащий scFv. В одном аспекте антигенсвязывающий домен CAR представляет собой человеческий scFv к CD33. В одном аспекте антигенсвязывающий домен CAR содержит фрагмент гуманизированного антитела к CD33, содержащий scFv. В одном аспекте антигенсвязывающий домен CAR представляет собой гуманизированный scFv к CD33.
В одном аспекте CD33-CAR содержит по меньшей мере один внутриклеточный домен, например, описанный в настоящем документе, например, выбранный из группы из сигнального домена из CD137 (4-1BB), сигнального домена из CD28, сигнального домена из CD3-дзета и любой их комбинации. В одном аспекте CD33-CAR содержит по меньшей мере один внутриклеточный сигнальный домен от одной или нескольких костимулирующих молекул, отличных от CD137 (4-1BB) или CD28.
Химерный антигенный рецептор (CAR)
Настоящее изобретение предлагает также CAR (например, полипептид CAR), который содержит анти-CD33-связывающий домен (например, CD33-связывающий домен, как описано в настоящем документе), трансмембранный домен и внутриклеточный сигнальный домен, причем упомянутый CD33-связывающий домен содержит определяющую комплементарность область 1 тяжелой цепи (HC CDR1), определяющую комплементарность область 2 тяжелой цепи (HC CDR2) и определяющую комплементарность область 3 тяжелой цепи (HC CDR3) в соответствии с любыми аминокислотными последовательностями связывающего домена тяжелой цепи, приведенными в таблице 8 или 9. CD33-связывающий домен CAR может дополнительно содержать определяющую комплементарность область 1 легкой цепи (LC CDR1), определяющую комплементарность область 2 легкой цепи (LC CDR2) и определяющую комплементарность область 3 легкой цепи (LC CDR3) в соответствии с любыми аминокислотными последовательностями связывающего домена тяжелой цепи, приведенными в таблице 8 или 9.
Настоящее изобретение предлагает также молекулы нуклеиновой кислоты, кодирующие CAR, описанный в настоящем документе, например, кодирующий CAR, который содержит CD33-связывающий домен (например, как описано в настоящем документе), трансмембранный домен и внутриклеточный сигнальный домен, причем упомянутый CD33-связывающий домен содержит определяющую комплементарность область 1 тяжелой цепи (HC CDR1), определяющую комплементарность область 2 тяжелой цепи (HC CDR2) и определяющую комплементарность область 3 тяжелой цепи (HC CDR3) в соответствии с любыми аминокислотными последовательностями связывающего домена тяжелой цепи, приведенными в таблице 8 или 9. В одном варианте осуществления кодируемый CD33-связывающий домен CAR может дополнительно содержать определяющую комплементарность область 1 легкой цепи (LC CDR1), определяющую комплементарность область 2 легкой цепи (LC CDR2) и определяющую комплементарность область 3 легкой цепи (LC CDR3) в соответствии с любыми аминокислотными последовательностями анти-BMCA связывающего домена тяжелой цепи, приведенными в таблице 8 или 9.
В конкретных аспектах конструкт CAR настоящего изобретения содержит домен человеческого scFv, выбранный из группы, состоящей из SEQ ID NO:39-47, причем перед scFv может находиться необязательная лидерная последовательность, такая как приведенная в SEQ ID NO: 1, а после него может следовать необязательная шарнирная последовательность, такая как приведенная в SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, трансмембранная область, такая как приведенная в SEQ ID NO: 6, внутриклеточный сигнальный домен, который включает в себя SEQ ID NO: 7 или SEQ ID NO: 8, и последовательность CD3-дзета, которая включает в себя SEQ ID NO: 9 или SEQ ID NO: 10, например, причем домены соприкасаются и находятся в одной и той же рамке считывания, образуя один белок слияния. Также в настоящее изобретение включена нуклеотидная последовательность, которая кодирует полипептид каждого из человеческих фрагментов scFv, выбранных из группы, состоящей из SEQ ID NO: 39-47. Также в настоящее изобретение включена нуклеотидная последовательность, которая кодирует полипептид каждого из человеческих фрагментов scFv, выбранных из группы, состоящей из SEQ ID NO: 39-47, и каждый из доменов в соответствии с SEQ ID NO: 12 и 6-9 и кодируемый CAR к CD33 настоящего изобретения.
В одном аспекте пример конструкта CD33CAR содержит необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнир, трансмембранный домен и внутриклеточный стимулирующий домен. В одном аспекте пример конструкта CD33CAR содержит необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнир, трансмембранный домен, внутриклеточный костимулирующий домен и внутриклеточный стимулирующий домен. Конкретные конструкты CAR к CD33, содержащие гуманизированные домены scFv настоящего изобретения, определены как SEQ ID NO: 138.
В некоторых вариантах осуществления полноразмерные последовательности CAR к CD33 также приведены в настоящем документе как SEQ ID NO: 48-56, как показано в таблице 8.
Типичная лидерная последовательность определена как SEQ ID NO: 1. Типичная последовательности шарнира/спейсера определена как SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5. Типичная последовательность трансмембранного домена определена как SEQ ID NO: 6. Типичная последовательность внутриклеточного сигнального домена белка 4-1BB определена как SEQ ID NO: 7. Типичная последовательность внутриклеточного сигнального домена из CD27 определена как SEQ ID NO: 8. Типичная последовательность домена из CD3-дзета определена как SEQ ID NO: 9 или SEQ ID NO: 10.
В одном аспекте настоящее изобретение охватывает рекомбинантный нуклеиновокислотный конструкт, содержащий молекулу нуклеиновой кислоты, кодирующую CAR, причем данная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую CD33-связывающий домен, например, описанный в настоящем документе, например, который соприкасается и находится в одной рамке считывания с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен. В одном аспекте человеческий связывающий CD33 домен выбирают из одной или нескольких из SEQ ID NO:39-47. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 39. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 40. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 41. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 42. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 43. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 44. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 45. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 46. В одном аспекте человеческий связывающий CD33 домен представляет собой SEQ ID NO: 47.
В одном аспекте настоящее изобретение охватывает рекомбинантный нуклеиновокислотный конструкт, содержащий молекулу нуклеиновой кислоты, кодирующую CAR, причем данная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую CD33-связывающий домен, например, причем данная последовательность соприкасается и находится в одной рамке считывания с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен. Типичный внутриклеточный сигнальный домен, который можно использовать в CAR, включает в себя, но без ограничения, один или несколько внутриклеточных сигнальных доменов из, например, CD3-дзета, CD28, 4-1BB и тому подобных. В некоторых случаях CAR может содержать любую комбинацию из CD3-дзета, CD28, 4-1BB и тому подобных.
В одном аспекте последовательность нуклеиновой кислоты конструкта CAR настоящего изобретения выбирают из одной или нескольких из SEQ ID NO: 75-83. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 75. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 76. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 77. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 78. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 79. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 80. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 81. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 82. В одном аспекте последовательность нуклеиновой кислоты конструкта CAR содержит (например, состоит из нее) SEQ ID NO: 83.
Последовательности нуклеиновой кислоты, кодирующие желаемые молекулы, могут быть получены с использованием рекомбинантных способов, известных в данной области техники, таких как, например, с помощью скрининга библиотек клеток, экспрессирующих данный ген, с помощью получения гена из вектора, о котором известно, что он включает его в себя, или с помощью выделения непосредственно из содержащих его клеток и тканей с использованием стандартных методов. В качестве альтернативы, представляющая интерес нуклеиновая кислота может быть произведена синтетически, а не клонирована.
Настоящее изобретение включает в себя ретровирусные и лентивирусные векторные конструкты, экспрессирующие CAR, которые могут быть непосредственно трансдуцированы в клетку.
Настоящее изобретение также включает в себя РНК-конструкт, который может быть непосредственно трансфицирован в клетку. Способ генерирования мРНК для использования в трансфекции включает в себя in vitro транскрипцию (IVT) матрицы со специально сконструированными праймерами, после чего следует присоединение поли-A для получения конструкта, содержащего 3'- и 5'-нетранслируемую последовательность ("НТО"), 5'-кэп и/или участок внутренней посадки рибосомы (IRES), подлежащую экспрессии нуклеиновую кислоту и поли-A хвост, обычно длиной 50-2000 оснований (SEQ ID NO: 35). Получаемая таким образом РНК может эффективно трансфицировать различные типы клеток. В одном варианте осуществления матрица включает в себя последовательности для CAR. В варианте осуществления вектор с РНК CAR трансдуцируют в клетку посредством электропорации.
Антигенсвязывающий домен
CAR настоящего изобретения содержат мишень-специфический связывающий элемент. Выбор фрагмента зависит от типа и количества лигандов, которые определяют поверхность клетки-мишени. Например, антигенсвязывающий домен может быть выбран для распознавания антигена, который действует как маркер клеточной поверхности на клетках-мишенях, ассоциированный с конкретным болезненным состоянием.
В одном аспекте CAR-опосредованный T-клеточный ответ может быть направлен на представляющий интерес антиген посредством конструирования антигенсвязывающего домена, который специфически связывает желаемый антиген в CAR.
В одном аспекте CAR настоящего изобретения содержит связывающий домен, который специфически связывается с CD33. В одном аспекте CAR настоящего изобретения содержит антигенсвязывающий домен, который специфически связывается с человеческим CD33.
Антигенсвязывающий домен может представлять собой любой белок, который связывается с антигеном, включая, но без ограничения, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело и их функциональный фрагмент, включая, но без ограничения, однодоменное антитело, такое как вариабельный домен (VH) тяжелой цепи, вариабельный домен (VL) легкой цепи и вариабельный домен (VHH) нанотела верблюжьего происхождения, и альтернативный каркас, о котором известно в данной области техники, что он функционирует в качестве антигенсвязывающего домена, такой как рекомбинантный фибронектиновый домен и тому подобные. В некоторых случаях полезно, чтобы антигенсвязывающий домен происходил от того вида, в котором CAR будет в конце концов использован. Например, для использования на людях может быть полезным, чтобы антигенсвязывающий домен CAR содержал человеческие или гуманизированные остатки для антигенсвязывающего домена антитела или фрагмента антитела.
В некоторых случаях полезно, чтобы антигенсвязывающий домен происходил от того вида, в котором CAR будет в конце концов использован. Например, для использования на людях может быть полезным, чтобы антигенсвязывающий домен CAR содержал человеческие или гуманизированные остатки для антигенсвязывающего домена антитела или фрагмента антитела. Таким образом, в одном аспекте антигенсвязывающий домен содержит человеческое антитело или фрагмент антитела. В одном варианте осуществления человеческий связывающий CD33 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (LC CDR1), определяющей комплементарность области 2 легкой цепи (LC CDR2) и определяющей комплементарность области 3 легкой цепи (LC CDR3) человеческого связывающего CD33 домена, описанного в настоящем документе, и/или одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (HC CDR1), определяющей комплементарность области 2 тяжелой цепи (HC CDR2) и определяющей комплементарность области 3 тяжелой цепи (HC CDR3) человеческого связывающего CD33 домена, описанного в настоящем документе, например, человеческого связывающего CD33 домена, содержащего одну или несколько, например, все три, LC CDR и одну или несколько, например, все три, HC CDR. В одном варианте осуществления человеческий связывающий CD33 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (HC CDR1), определяющей комплементарность области 2 тяжелой цепи (HC CDR2) и определяющей комплементарность области 3 тяжелой цепи (HC CDR3) человеческого связывающего CD33 домена, описанного в настоящем документе, например, человеческий связывающий CD33 домен содержит две вариабельные области тяжелой цепи, причем каждая содержит HC CDR1, HC CDR2 и HC CDR3, описанные в настоящем документе. В одном варианте осуществления человеческий связывающий CD33 домен содержит человеческую вариабельную область легкой цепи, описанную в настоящем документе (например, в таблице 2), и/или человеческую вариабельную область тяжелой цепи, описанную в настоящем документе (например, в таблице 1). В одном варианте осуществления человеческий связывающий CD33 домен содержит человеческую вариабельную область тяжелой цепи, описанную в настоящем документе (например, в таблице 1), например, по меньшей мере две человеческие вариабельные области тяжелой цепи, описанные в настоящем документе (например, в таблице 1). В одном варианте осуществления CD33-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь с аминокислотной последовательностью в соответствии с таблицами 1-2. В варианте осуществления CD33-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в таблице 2, или последовательность, идентичную на 95-99% аминокислотной последовательности из таблицы 13; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более чем 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в таблице 2, или последовательность, идентичную на 95-99% аминокислотной последовательности из таблицы 1. В одном варианте осуществления человеческий связывающий CD33 домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39-47, или последовательность, идентичную ей на 95-99%. В одном варианте осуществления человеческий связывающий CD33 домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем документе, например, в таблице 2, прикреплена к вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем документе, например, в таблице 1, с помощью линкера, например, линкера, описанного в настоящем документе. В одном варианте осуществления человеческий связывающий CD33 домен включает в себя линкер (Gly4-Ser)n, причем n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном аспекте антигенсвязывающий домен содержит гуманизированное антитело или фрагмент антитела. В одном варианте осуществления гуманизированный связывающий CD33 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (LC CDR1), определяющей комплементарность области 2 легкой цепи (LC CDR2) и определяющей комплементарность области 3 легкой цепи (LC CDR3) CD33-связывающего домена, описанного в настоящем документе, и/или одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (HC CDR1), определяющей комплементарность области 2 тяжелой цепи (HC CDR2) и определяющей комплементарность области 3 тяжелой цепи (HC CDR3) CD33-связывающего домена, описанного в настоящем документе, например, гуманизированного связывающего CD33 домена, содержащего одну или несколько, например, все три, LC CDR и одну или несколько, например, все три, HC CDR. В одном варианте осуществления гуманизированный связывающий CD33 домен включает в себя линкер (Gly4-Ser)n, причем n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном аспекте CAR к CD33, который включает в себя гуманизированный связывающий CD33 домен, содержит SEQ ID NO: 143. В некоторых аспектах нечеловеческое антитело является гуманизированным, причем конкретные последовательности или области антитела модифицированы для повышения сходства с антителом, естественно производимым в человеке, или его фрагментом. В одном аспекте антигенсвязывающий домен является гуманизированным. Примеры гуманизированных антител к CD33 для использования с CART, описанной в настоящем документе, включают hp67.6 или гемтузумаб, как описано в WO2012123755.
Гуманизированное антитело может быть получено с использованием множества способов, известных в данной области техники, включая, но без ограничения, трансплантацию CDR (смотри, например, европейский патент № EP 239400; международную публикацию № WO 91/09967; и патенты США №№ 5225539, 5530101 и 5585089, каждый из которых включен в настоящий документ во всей полноте посредством ссылки), венирование или перекладку (смотри, например, европейские патенты №№ EP 592106 и EP 519596; документы Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., 1994, Protein Engineering, 7(6):805-814; и Roguska et al., 1994, PNAS, 91:969-973, каждый из которых включен в настоящий документ во всей полноте посредством ссылки), перетасовку цепей (смотри, например, патент США № 5565332, который включен в настоящий документ во всей полноте посредством ссылки) и способы, раскрытые, например, в публикации патентной заявки США № US2005/0042664, публикации патентной заявки США № US2005/0048617, патенте США № 6407213, патенте США № 5766886, международной публикации № WO 9317105, документах Tan et al., J. Immunol., 169:1119-25 (2002), Caldas et al., Protein Eng., 13(5):353-60 (2000), Morea et al., Methods, 20(3):267-79 (2000), Baca et al., J. Biol. Chem., 272(16):10678-84 (1997), Roguska et al., Protein Eng., 9(10):895-904 (1996), Couto et al., Cancer Res., 55 (23 Supp):5973s-5977s (1995), Couto et al., Cancer Res., 55(8):1717-22 (1995), Sandhu J S, Gene, 150(2):409-10 (1994) и Pedersen et al., J. Mol. Biol., 235(3):959-73 (1994), каждый из которых включен в настоящий документ во всей полноте посредством ссылки. Часто каркасные остатки в каркасных областях заменяют соответствующим остатком из антитела-донора CDR для изменения, например, улучшения, связывания антигена. Эти каркасные замены идентифицируют посредством способов, хорошо известных в данной области техники, например, посредством моделирования взаимодействий CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена, и сравнения последовательностей для идентификации необычных каркасных остатков в конкретных положениях. (Смотри, например, документы Queen et al., патент США № 5585089; и Riechmann et al., 1988, Nature, 332:323, которые включены в настоящий документ посредством ссылки во всей полноте.)
Гуманизированное антитело или фрагмент антитела содержит один или несколько аминокислотных остатков, оставшихся в нем от источника, который является нечеловеческим. Эти нечеловеческие аминокислотные остатки часто называют "импортными" остатками, который обычно берут из "импортного" вариабельного домена. Как предусмотрено в настоящем документе, гуманизированные антитела или фрагменты антител содержат одну или несколько CDR из нечеловеческих иммуноглобулиновых молекул и каркасных областей, причем аминокислотные остатки, содержащие каркас, происходят полностью или по большей части из человеческой зародышевой линии. Множество способов гуманизации антител или фрагментов антител хорошо известны в данной области техники и могут в основном быть выполнены в соответствии со способом Winter и сотр. (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)) посредством замены CDR грызуна или последовательностей CDR на соответствующие последовательности человеческого антитела, то есть трансплантации CDR (EP 239400; публикация PCT № WO 91/09967; и патенты США №№ 4816567; 6331415; 5225539; 5530101; 5585089; 6548640, содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте). В таких гуманизированных антителах и фрагментах антител по существу меньшая, чем интактный человеческий вариабельный домен, часть заменена соответствующей последовательностью из отличного от человека вида. Гуманизированные антитела часто представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые каркасные (FR) остатки заменены остатками из аналогичных участков антител грызунов. Гуманизация антител и фрагментов антител также может быть получена посредством венирования или перекладки (EP 592106; EP 519596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., Protein Engineering, 7(6):805-814 (1994); и Roguska et al., PNAS, 91:969-973 (1994)) или перетасовки цепей (патент США № 5565332), содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте.
Выбор человеческих вариабельных доменов, как легких, так и тяжелых, для использования в получении гуманизированных антител заключается в уменьшении антигенности. В соответствии с так называемым способом "наилучшего соответствия" последовательность вариабельного домена антитела грызуна подвергают скринингу по всей библиотеке известных человеческих последовательностей вариабельных доменов. Затем человеческую последовательность, которая является наиболее близкой к последовательности грызуна, принимают в качестве человеческого каркаса (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987), содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте). Другой способ использует конкретный каркас, происходящий от консенсусной последовательности всех человеческих антител определенной подгруппы легких или тяжелых цепей. Тот же самый каркас может быть использован для нескольких различных гуманизированных антител (смотри, например, Nicholson et al. Mol. Immun. 34 (16-17): 1157-1165 (1997); Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993), содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте). В некоторых вариантах осуществления каркасная область, например, все четыре каркасные области, вариабельной области тяжелой цепи происходит от последовательности зародышевой линии VH4_4-59. В одном варианте осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, от аминокислоты в соответствующей мышиной последовательности (например, SEQ ID NO: 138). В одном варианте осуществления каркасная область, например, все четыре каркасные области, вариабельной области легкой цепи происходит от последовательности зародышевой линии VK3_1.25. В одном варианте осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, от аминокислоты в соответствующей мышиной последовательности (например, SEQ ID NO: 138).
В некоторых аспектах часть композиции CAR настоящего изобретения, которая содержит фрагмент антитела, гуманизирована с сохранением высокой аффинности к антигену-мишени и других полезных биологических свойств. В соответствии с одним аспектом настоящего изобретения гуманизированные антитела и фрагменты антител получают посредством способа анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов широко доступны и хорошо известны специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных кандидатных иммуноглобулиновых последовательностей. Исследование этих отображений позволяет проанализировать вероятную роль остатков в функционировании кандидатной иммуноглобулиновой последовательности, например, проанализировать остатки, которые влияют на способность кандидатного иммуноглобулина связываться с антигеном-мишенью. Таким образом, FR остатки могут быть выбраны и объединены из реципиентной и импортной последовательностей таким образом, что достигается желаемая характеристика антитела или фрагмента антитела, такая как повышение аффинности к антигену-мишени. В общем случае, остатки CDR непосредственно и наиболее существенно участвуют в воздействии на связывание антигена.
Гуманизированное антитело или фрагмент антитела могут сохранять такую же антигенную специфичность, что и исходное антитело, например, в настоящем изобретении способность связывать человеческий CD33 или его фрагмент. В некоторых вариантах осуществления гуманизированное антитело или фрагмент антитела могут иметь улучшенные аффинность и/или специфичность связывания с человеческим CD33 или его фрагментом.
В одном аспекте часть антигенсвязывающего домена содержит одну или несколько последовательностей, выбранных из SEQ ID NO: 39-47. В одном аспекте CAR к CD33, который включает в себя человеческий связывающий CD33 домен, выбирают из одной или нескольких последовательностей, выбранных из SEQ ID NO: 48-56.
В одном аспекте CD33-связывающий домен характеризуется определенными функциональными признаками или свойствами антитела или фрагмента антитела. Например, в одном аспекте часть композиции CAR настоящего изобретения, которая содержит антигенсвязывающий домен, специфически связывает человеческий CD33 или его фрагмент. В одном аспекте настоящее изобретение относится к антигенсвязывающему домену, содержащему антитело или фрагмент антитела, причем связывающий домен антитела специфически связывается с белком CD33 или его фрагментом, причем антитело или фрагмент антитела содержат вариабельную легкую цепь и/или вариабельную тяжелую цепь, которые включают в себя аминокислотную последовательность в соответствии с SEQ ID NO: 48-56. В одном аспекте антигенсвязывающий домен содержит аминокислотную последовательность scFv, выбранную из SEQ ID NO: 39-47. В определенных аспектах scFv соприкасается и находится в одной рамке считывания с лидерной последовательностью. В одном аспекте лидерная последовательность представляет собой полипептидную последовательность, определенную как SEQ ID NO: 1.
В одном аспекте CD33-связывающий домен представляет собой фрагмент, например, одноцепочечный вариабельный фрагмент (scFv). В одном аспекте CD33-связывающий домен представляет собой Fv, Fab, (Fab')2 или бифункциональное (например, биспецифическое) гибридное антитело (например, Lanzavecchia et al., Eur. J. Immunol. 17, 105 (1987)). В одном аспекте антитела и его фрагменты настоящего изобретения связывают белок CD33 или его фрагмент с аффинностью как у дикого типа или более высокой.
В некоторых случаях человеческий scFv может быть получен из библиотеки отображения. Библиотека отображения представляет собой собрание объектов; каждый объект включает в себя доступный полипептидный компонент и многоразовый компонент, который кодирует или идентифицирует полипептидный компонент. Полипептидный компонент варьируют таким образом, чтобы были представлены различные аминокислотные последовательности. Полипептидный компонент может иметь любую длину, например, от трех аминокислот до более чем 300 аминокислот. Объект библиотеки отображения может включать в себя более чем один полипептидный компонент, например, две полипептидные цепи в Fab. В одном типичном варианте осуществления библиотеку отображения можно использовать для идентификации человеческого связывающего CD33 домена. При выборе полипептидный компонент каждого элемента библиотеки исследуют с помощью CD33 или его фрагмента, и если полипептидный компонент связывается с CD33, элемент библиотеки отображения идентифицируют, обычно по связыванию на подложке.
Связавшиеся элементы библиотеки отображения восстанавливают с подложки и анализируют. Анализ может включать в себя амплификацию и последующую селекцию в схожих или отличающихся условиях. Например, можно чередовать положительную и отрицательную селекцию. Анализ может также включать в себя определение аминокислотной последовательности полипептидного компонента, то есть анти-CD33-связывающего домена, и очистку полипептидного компонента для подробной характеризации.
Для библиотек отображения можно использовать множество форматов. Примеры включают фаговое отображение. При фаговом отображении белковый компонент обычно ковалентно связан с белком оболочки бактериофага. Связь возникает благодаря трансляции нуклеиновой кислоты, кодирующей белковый компонент, слитый с белком оболочки. Связь может включать в себя гибкий пептидный линкер, сайт протеазы или аминокислоту, введенную в результате супрессии стоп-кодона. Фаговое отображение описано, например, в документах US 5223409; Smith (1985) Science 228:1315-1317; WO 92/18619; WO 91/17271; WO 92/20791; WO 92/15679; WO 93/01288; WO 92/01047; WO 92/09690; WO 90/02809; de Haard et al. (1999) J. Biol. Chem 274:18218-30; Hoogenboom et al. (1998) Immunotechnology 4:1-20; Hoogenboom et al. (2000) Immunol Today 2:371-8 и Hoet et al. (2005) Nat Biotechnol. 23(3)344-8. Бактериофаг, отображающий белковый компонент, может быть выращен и собран с использованием стандартных способов получения фагов, например, ПЭГ-преципитации из среды для роста. После выбора отдельных отображающих фагов нуклеиновая кислота, кодирующая выбранные белковые компоненты, может быть выделена из клеток, инфицированных выбранными фагами, или из самих фагов после амплификации. Отдельные колонии или бляшки могут быть выбраны, нуклеиновая кислота выделена и секвенирована.
Другие форматы отображения включают отображение на основе клеток (смотри, например, WO 03/029456), слияния белок-нуклеиновая кислота (смотри, например, US 6207446), рибосомное отображение (Смотри, например, Mattheakis et al. (1994) Proc. Natl. Acad. Sci. USA 91:9022 и Hanes et al. (2000) Nat Biotechnol. 18:1287-92; Hanes et al. (2000) Methods Enzymol. 328:404-30; и Schaffitzel et al. (1999) J Immunol Methods. 231(1-2):119-35) и периплазматическое отображение в E. coli (2005 Nov 22;PMID: 16337958).
В некоторых случаях могут быть получены scFv в соответствии со способом, известным в данной области техники (смотри, например, Bird et al., (1988) Science 242:423-426 и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Молекулы ScFv могут быть получены посредством связывания областей VH и VL вместе с использованием гибких полипептидных линкеров. Молекулы scFv содержат линкер (например, линкер Ser-Gly) с оптимизированными длиной и/или аминокислотным составом. Длина линкера может сильно влиять на то, как вариабельные области scFv складываются и взаимодействуют. Фактически, если используется короткий полипептидный линкер (например, 5-10 аминокислот), предотвращается внутрицепочечный фолдинг. Межцепочечный фолдинг также требует соединения двух вариабельных областей вместе для образования функционального участка связывания эпитопа. Для примеров ориентаций и размеров линкеров смотри, например, Hollinger et al. 1993 Proc Natl Acad. Sci. U.S.A. 90:6444-6448, публикации патентной заявки США №№ 2005/0100543, 2005/0175606, 2007/0014794 и публикации PCT №№ WO2006/020258 и WO2007/024715, включенные в настоящий документ посредством ссылки.
scFv может содержать линкер из по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50 или более аминокислотных остатков между своими областями VL и VH. Последовательность линкера может содержать любую природную аминокислоту. В некоторых вариантах осуществления последовательность линкера содержит аминокислоты глицин и серин. В другом варианте осуществления последовательность линкера содержит набор повторов глицина и серина, такой как (Gly4Ser)n, где n представляет собой положительный целое число, равное или большее 1 (SEQ ID NO: 25). В одном варианте осуществления линкер может представлять собой (Gly4Ser)4 (SEQ ID NO: 27) или (Gly4Ser)3 (SEQ ID NO: 28). Изменения длины линкера могут сохранять или увеличивать активность, что приводит к более высокой эффективности при исследованиях активности.
Типичные конструкты человеческого CAR к CD33 и антигенсвязывающие домены
Типичные конструкты CAR к CD33, раскрытые в настоящем документе, содержат scFv (например, человеческий scFv, как раскрыто в таблицах 8 и 9 в настоящем документе), которому необязательно предшествует необязательная лидерная последовательность (например, SEQ ID NO: 1 и SEQ ID NO: 12 в качестве типичных лидерных аминокислотной и нуклеотидной последовательностей, соответственно). Последовательности человеческих фрагментов scFv (SEQ ID NO: 39-83, включают в себя необязательную лидерную последовательность) приведены в настоящем документе в таблице 8. Последовательности человеческих фрагментов scFv без лидерной последовательности приведены в настоящем документе в таблице 9 (SEQ ID NO: 255-261 для нуклеотидных последовательностей и SEQ ID NO: 262-268 для аминокислотных последовательностей). Конструкт CAR к CD33 может дополнительно включать в себя необязательный шарнирный домен, например, шарнирный домен CD8 (например, включающий в себя аминокислотную последовательность в соответствии с SEQ ID NO: 2 или кодируемый последовательностью нуклеиновой кислоты в соответствии с SEQ ID NO: 13); трансмембранный домен, например, трансмембранный домен CD8 (например, включающий в себя аминокислотную последовательность в соответствии с SEQ ID NO: 6 или кодируемый нуклеотидной последовательностью в соответствии с SEQ ID NO: 17); внутриклеточный домен, например, внутриклеточный домен 4-1BB (например, включающий в себя аминокислотную последовательность в соответствии с SEQ ID NO: 7 или кодируемый нуклеотидной последовательностью в соответствии с SEQ ID NO: 18); и функциональный сигнальный домен, например, домен CD3-дзета (например, включающий в себя аминокислотную последовательность в соответствии с SEQ ID NO: 9 или 10 или кодируемый нуклеотидной последовательностью в соответствии с SEQ ID NO: 20 или 21). В определенных вариантах осуществления домены соприкасаются и находятся в одной и той же рамке считывания, образуя один белок слияния. В других вариантах осуществления домены находятся в отдельных полипептидах, например, как в молекуле RCAR, как описано в настоящем документе.
В определенных вариантах осуществления полноразмерная молекула CAR к CD33 включает в себя аминокислотную последовательность, или кодируется соответствующей нуклеотидной последовательностью, в соответствии с CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенную в таблице 8, или последовательность, по существу (например, на 95-99%) идентичную ей.
В определенных вариантах осуществления молекула CAR к CD33, или анти-CD33 антигенсвязывающий домен, включает в себя аминокислотную последовательность scFv в соответствии с CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенную в таблице 8 (с лидерной последовательностью или без нее); или включает в себя аминокислотную последовательность scFv, или кодируется соответствующей нуклеотидной последовательностью, в соответствии с CAR33-1, CAR33-2, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-9, приведенную в таблице 9, или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR к CD33, или анти-CD33 антигенсвязывающий домен, включает в себя вариабельную область тяжелой цепи и/или вариабельную область легкой цепи из CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенные в таблице 8, или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR к CD33, или анти-CD33 антигенсвязывающий домен, включает в себя одну, две или три CDR из вариабельной области тяжелой цепи (например, HC CDR1, HC CDR2 и/или HC CDR3), приведенные в таблице 1; и/или одну, две или три CDR из вариабельной области легкой цепи (например, LC CDR1, LC CDR2 и/или LC CDR3) из CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенные в таблице 2; или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR к CD33, или анти-CD33 антигенсвязывающий домен, включает в себя одну, две или три CDR из вариабельной области тяжелой цепи (например, HC CDR1, HC CDR2 и/или HC CDR3), приведенные в таблице 3; и/или одну, две или три CDR из вариабельной области легкой цепи (например, LC CDR1, LC CDR2 и/или LC CDR3) из CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенные в таблице 4; или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
В определенных вариантах осуществления молекула CAR к CD33, или анти-CD33 антигенсвязывающий домен, включает в себя одну, две или три CDR из вариабельной области тяжелой цепи (например, HC CDR1, HC CDR2 и/или HC CDR3), приведенные в таблице 5; и/или одну, две или три CDR из вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) из CAR33-1, CAR33-2, CAR33-3, CAR33-4, CAR33-5, CAR33-6, CAR33-7, CAR33-8, CAR33-9, приведенные в таблице 6; или последовательность, по существу идентичную (например, идентичную на 95-99% или вплоть до 5, 4, 3, 2 или 1 изменения в аминокислотах, например, замены (например, консервативной замены)) любой из вышеупомянутых последовательностей.
Последовательности человеческих последовательностей CDR доменов scFv показаны в таблице 1 для вариабельных доменов тяжелой цепи и в таблице 2 для вариабельных доменов легкой цепи. "ID" обозначает для соответствующий SEQ ID NO для каждой CDR. CDR, приведенные в таблицах 1 и 2, соответствуют комбинации схем нумерации Кэбота и Чотиа.
Таблица 1. CDR вариабельных доменов тяжелой цепи
Таблица 2. CDR вариабельных доменов легкой цепи
Таблица 3: CDR вариабельных доменов тяжелой цепи в соответствии со схемой нумерации Кэбота (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD)
Таблица 4: CDR вариабельных доменов легкой цепи в соответствии со схемой нумерации Кэбота (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD)
Таблица 5: CDR вариабельных доменов тяжелой цепи в соответствии со схемой нумерации Чотиа (Al-Lazikani et al., (1997) JMB 273927-948)
Таблица 6: CDR вариабельных доменов легкой цепи в соответствии со схемой нумерации Чотиа (Al-Lazikani et al., (1997) JMB 273927-948)
В определенных вариантах осуществления молекула CAR, описанная в настоящем документе (например, нуклеиновая кислота CAR или полипептид CAR), или CD33-связывающий домен включают в себя:
(1) одну, две или три CDR легкой цепи (LC), выбранные из одной из следующих:
(i) LC CDR1 в соответствии с SEQ ID NO: 111, LC CDR2 в соответствии с SEQ ID NO: 120 и LC CDR3 в соответствии с SEQ ID NO: 129 из CAR33-1;
(ii) LC CDR1 в соответствии с SEQ ID NO: 112, LC CDR2 в соответствии с SEQ ID NO: 121 и LC CDR3 в соответствии с SEQ ID NO: 130 из CAR33-2;
(iii) LC CDR1 в соответствии с SEQ ID NO: 113, LC CDR2 в соответствии с SEQ ID NO: 122 и LC CDR3 в соответствии с SEQ ID NO: 131 из CAR33-3;
(iv) LC CDR1 в соответствии с SEQ ID NO: 114, LC CDR2 в соответствии с SEQ ID NO: 123 и LC CDR3 в соответствии с SEQ ID NO: 132 из CAR33-4;
(iv) LC CDR1 в соответствии с SEQ ID NO: 115, LC CDR2 в соответствии с SEQ ID NO: 124 и LC CDR3 в соответствии с SEQ ID NO: 133 из CAR33-5;
(vi) LC CDR1 в соответствии с SEQ ID NO: 116, LC CDR2 в соответствии с SEQ ID NO: 125 и LC CDR3 в соответствии с SEQ ID NO: 134 из CAR33-6;
(vii) LC CDR1 в соответствии с SEQ ID NO: 117, LC CDR2 в соответствии с SEQ ID NO: 126 и LC CDR3 в соответствии с SEQ ID NO: 135 из CAR33-7;
(viii) LC CDR1 в соответствии с SEQ ID NO: 118, LC CDR2 в соответствии с SEQ ID NO: 127 и LC CDR3 в соответствии с SEQ ID NO: 136 из CAR33-8; или
(ix) LC CDR1 в соответствии с SEQ ID NO: 119, LC CDR2 в соответствии с SEQ ID NO: 128 и LC CDR3 в соответствии с SEQ ID NO: 137 из CAR33-9; и/или
(2) одну, две или три CDR тяжелой цепи (HC) из одной из следующих:
(i) HC CDR1 в соответствии с SEQ ID NO: 84, HC CDR2 в соответствии с SEQ ID NO: 93 и HC CDR3 в соответствии с SEQ ID NO: 102 из CAR33-1;
(ii) HC CDR1 в соответствии с SEQ ID NO: 85, HC CDR2 в соответствии с SEQ ID NO: 94 и HC CDR3 в соответствии с SEQ ID NO: 103 из CAR33-2;
(iii) HC CDR1 в соответствии с SEQ ID NO: 86, HC CDR2 в соответствии с SEQ ID NO: 95 и HC CDR3 в соответствии с SEQ ID NO: 104 из CAR33-3;
(iv) HC CDR1 в соответствии с SEQ ID NO: 87, HC CDR2 в соответствии с SEQ ID NO: 96 и HC CDR3 в соответствии с SEQ ID NO: 105 из CAR33-4;
(iv) HC CDR1 в соответствии с SEQ ID NO: 88, HC CDR2 в соответствии с SEQ ID NO: 97 и HC CDR3 в соответствии с SEQ ID NO: 106 из CAR33-5;
(vi) HC CDR1 в соответствии с SEQ ID NO: 89, HC CDR2 в соответствии с SEQ ID NO: 98 и HC CDR3 в соответствии с SEQ ID NO: 107 из CAR33-6;
(vii) HC CDR1 в соответствии с SEQ ID NO: 90, HC CDR2 в соответствии с SEQ ID NO: 99 и HC CDR3 в соответствии с SEQ ID NO: 108 из CAR33-7;
(viii) HC CDR1 в соответствии с SEQ ID NO: 91, HC CDR2 в соответствии с SEQ ID NO: 100 и HC CDR3 в соответствии с SEQ ID NO: 109 из CAR33-8; или
(ix) HC CDR1 в соответствии с SEQ ID NO: 92, HC CDR2 в соответствии с SEQ ID NO: 101 и HC CDR3 в соответствии с SEQ ID NO: 110 из CAR33-9.
В определенных вариантах осуществления молекула CAR, описанная в настоящем документе (например, нуклеиновая кислота CAR или полипептид CAR), включает в себя:
(1) одну, две или три CDR легкой цепи (LC), выбранные из одной из следующих:
(i) LC CDR1 в соответствии с SEQ ID NO: 296, LC CDR2 в соответствии с SEQ ID NO: 305 и LC CDR3 в соответствии с SEQ ID NO: 314 из CAR33-1;
(ii) LC CDR1 в соответствии с SEQ ID NO: 297, LC CDR2 в соответствии с SEQ ID NO: 306 и LC CDR3 в соответствии с SEQ ID NO: 315 из CAR33-2;
(iii) LC CDR1 в соответствии с SEQ ID NO: 298, LC CDR2 в соответствии с SEQ ID NO: 307 и LC CDR3 в соответствии с SEQ ID NO: 316 из CAR33-3;
(iv) LC CDR1 в соответствии с SEQ ID NO: 299, LC CDR2 в соответствии с SEQ ID NO: 308 и LC CDR3 в соответствии с SEQ ID NO: 317 из CAR33-4;
(iv) LC CDR1 в соответствии с SEQ ID NO: 300, LC CDR2 в соответствии с SEQ ID NO: 309 и LC CDR3 в соответствии с SEQ ID NO: 318 из CAR33-5;
(vi) LC CDR1 в соответствии с SEQ ID NO: 301, LC CDR2 в соответствии с SEQ ID NO: 310 и LC CDR3 в соответствии с SEQ ID NO: 319 из CAR33-6;
(vii) LC CDR1 в соответствии с SEQ ID NO: 302, LC CDR2 в соответствии с SEQ ID NO: 311 и LC CDR3 в соответствии с SEQ ID NO: 320 из CAR33-7;
(viii) LC CDR1 в соответствии с SEQ ID NO: 303, LC CDR2 в соответствии с SEQ ID NO: 312 и LC CDR3 в соответствии с SEQ ID NO: 321 из CAR33-8; или
(ix) LC CDR1 в соответствии с SEQ ID NO: 304, LC CDR2 в соответствии с SEQ ID NO: 313 и LC CDR3 в соответствии с SEQ ID NO: 322 из CAR33-9; и/или
(2) одну, две или три CDR тяжелой цепи (HC), выбранные из одной из следующих:
(i) HC CDR1 в соответствии с SEQ ID NO: 269, HC CDR2 в соответствии с SEQ ID NO: 278 и HC CDR3 в соответствии с SEQ ID NO: 287 из CAR33-1;
(ii) HC CDR1 в соответствии с SEQ ID NO: 270, HC CDR2 в соответствии с SEQ ID NO: 279 и HC CDR3 в соответствии с SEQ ID NO: 288 из CAR33-2;
(iii) HC CDR1 в соответствии с SEQ ID NO: 271, HC CDR2 в соответствии с SEQ ID NO: 280 и HC CDR3 в соответствии с SEQ ID NO: 289 из CAR33-3;
(iv) HC CDR1 в соответствии с SEQ ID NO: 272, HC CDR2 в соответствии с SEQ ID NO: 281 и HC CDR3 в соответствии с SEQ ID NO: 290 из CAR33-4;
(iv) HC CDR1 в соответствии с SEQ ID NO: 273, HC CDR2 в соответствии с SEQ ID NO: 282 и HC CDR3 в соответствии с SEQ ID NO: 291 из CAR33-5;
(vi) HC CDR1 в соответствии с SEQ ID NO: 274, HC CDR2 в соответствии с SEQ ID NO: 283 и HC CDR3 в соответствии с SEQ ID NO: 292 из CAR33-6;
(vii) HC CDR1 в соответствии с SEQ ID NO: 275, HC CDR2 в соответствии с SEQ ID NO: 284 и HC CDR3 в соответствии с SEQ ID NO: 293 из CAR33-7;
(viii) HC CDR1 в соответствии с SEQ ID NO: 276, HC CDR2 в соответствии с SEQ ID NO: 285 и HC CDR3 в соответствии с SEQ ID NO: 294 из CAR33-8; или
(ix) HC CDR1 в соответствии с SEQ ID NO: 277, HC CDR2 в соответствии с SEQ ID NO: 286 и HC CDR3 в соответствии с SEQ ID NO: 295 из CAR33-9.
В определенных вариантах осуществления молекула CAR, описанная в настоящем документе (например, нуклеиновая кислота CAR или полипептид CAR), включает в себя:
(1) одну, две или три CDR легкой цепи (LC), выбранные из одной из следующих:
(i) LC CDR1 в соответствии с SEQ ID NO: 350, LC CDR2 в соответствии с SEQ ID NO: 359 и LC CDR3 в соответствии с SEQ ID NO: 368 из CAR33-1;
(ii) LC CDR1 в соответствии с SEQ ID NO: 351, LC CDR2 в соответствии с SEQ ID NO: 360 и LC CDR3 в соответствии с SEQ ID NO: 369 из CAR33-2;
(iii) LC CDR1 в соответствии с SEQ ID NO: 352, LC CDR2 в соответствии с SEQ ID NO: 361 и LC CDR3 в соответствии с SEQ ID NO: 370 из CAR33-3;
(iv) LC CDR1 в соответствии с SEQ ID NO: 353, LC CDR2 в соответствии с SEQ ID NO: 362 и LC CDR3 в соответствии с SEQ ID NO: 371 из CAR33-4;
(iv) LC CDR1 в соответствии с SEQ ID NO: 354, LC CDR2 в соответствии с SEQ ID NO: 363 и LC CDR3 в соответствии с SEQ ID NO: 372 из CAR33-5;
(vi) LC CDR1 в соответствии с SEQ ID NO: 355, LC CDR2 в соответствии с SEQ ID NO: 364 и LC CDR3 в соответствии с SEQ ID NO: 373 из CAR33-6;
(vii) LC CDR1 в соответствии с SEQ ID NO: 356, LC CDR2 в соответствии с SEQ ID NO: 365 и LC CDR3 в соответствии с SEQ ID NO: 374 из CAR33-7;
(viii) LC CDR1 в соответствии с SEQ ID NO: 357, LC CDR2 в соответствии с SEQ ID NO: 366 и LC CDR3 в соответствии с SEQ ID NO: 375 из CAR33-8; или
(ix) LC CDR1 в соответствии с SEQ ID NO: 358, LC CDR2 в соответствии с SEQ ID NO: 367 и LC CDR3 в соответствии с SEQ ID NO: 376 из CAR33-9; и/или
(2) одну, две или три CDR тяжелой цепи (HC), выбранные из одной из следующих:
(i) HC CDR1 в соответствии с SEQ ID NO: 323, HC CDR2 в соответствии с SEQ ID NO: 332 и HC CDR3 в соответствии с SEQ ID NO: 341 из CAR33-1;
(ii) HC CDR1 в соответствии с SEQ ID NO: 324, HC CDR2 в соответствии с SEQ ID NO: 333 и HC CDR3 в соответствии с SEQ ID NO: 342 из CAR33-2;
(iii) HC CDR1 в соответствии с SEQ ID NO: 325, HC CDR2 в соответствии с SEQ ID NO: 334 и HC CDR3 в соответствии с SEQ ID NO: 343 из CAR33-3;
(iv) HC CDR1 в соответствии с SEQ ID NO: 326, HC CDR2 в соответствии с SEQ ID NO: 335 и HC CDR3 в соответствии с SEQ ID NO: 344 из CAR33-4;
(iv) HC CDR1 в соответствии с SEQ ID NO: 327, HC CDR2 в соответствии с SEQ ID NO: 336 и HC CDR3 в соответствии с SEQ ID NO: 345 из CAR33-5;
(vi) HC CDR1 в соответствии с SEQ ID NO: 328, HC CDR2 в соответствии с SEQ ID NO: 337 и HC CDR3 в соответствии с SEQ ID NO: 346 из CAR33-6;
(vii) HC CDR1 в соответствии с SEQ ID NO: 329, HC CDR2 в соответствии с SEQ ID NO: 338 и HC CDR3 в соответствии с SEQ ID NO: 347 из CAR33-7;
(viii) HC CDR1 в соответствии с SEQ ID NO: 330, HC CDR2 в соответствии с SEQ ID NO: 339 и HC CDR3 в соответствии с SEQ ID NO: 348 из CAR33-8; или
(ix) HC CDR1 в соответствии с SEQ ID NO: 331, HC CDR2 в соответствии с SEQ ID NO: 340 и HC CDR3 в соответствии с SEQ ID NO: 349 из CAR33-9.
В вариантах осуществления полностью человеческие анти-CD33 одноцепочечные вариабельные фрагменты (scFv) создают и клонируют в лентивирусный вектор экспрессии с внутриклеточной цепью CD3-дзета и внутриклеточным костимулирующим доменом из 4-1BB. Названия типичных полностью человеческих анти-CD33 scFv приведены в таблице 7.
Таблица 7
В вариантах осуществления порядок, в котором домены VL и VH появляются в scFv, является переменным (то есть, ориентация VL-VH или VH-VL), причем или три, или четыре копии субъединицы "G4S" (SEQ ID NO: 25), где каждая субъединица содержит последовательность GGGGS (SEQ ID NO: 25) (например, (G4S)3 (SEQ ID NO: 28) или (G4S)4 (SEQ ID NO: 27)), соединяют вариабельные домены для создания целого домена scFv, как показано в таблице 1.
Типичные последовательности человеческих фрагментов scFv (SEQ ID NO: 39-83, включают в себя необязательную лидерную последовательность) приведены в настоящем документе в таблице 8. Следует отметить, что фрагменты scFv в соответствии с SEQ ID NO: 39-83 без лидерной последовательности (например, без аминокислотной последовательности в соответствии с SEQ ID NO: 1 или нуклеотидной последовательности в соответствии с SEQ ID NO: 12) также охватываются настоящим изобретением. Типичные последовательности человеческих фрагментов scFv без лидерной последовательности приведены в настоящем документе в таблице 9 (SEQ ID NO: 255-261 для нуклеотидных последовательностей и SEQ ID NO: 262-268 для аминокислотных последовательностей).
лидер (аминокислотная последовательность) (SEQ ID NO: 1)
MALPVTALLLPLALLLHAARP
лидер (последовательность нуклеиновой кислоты) (SEQ ID NO: 12)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCC
шарнир CD8 (аминокислотная последовательность) (SEQ ID NO: 2)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD
шарнир CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 13)
ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT
трансмембранный CD8 (аминокислотная последовательность) (SEQ ID NO: 6)
IYIWAPLAGTCGVLLLSLVITLYC
трансмембранный CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 17)
ATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGC
Внутриклеточный домен из 4-1BB (аминокислотная последовательность) (SEQ ID NO: 7)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
Внутриклеточный домен из 4-1BB (последовательность нуклеиновой кислоты) (SEQ ID NO: 18)
AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG
Внутриклеточный домен из CD28 (аминокислотная последовательность) (SEQ ID NO: 379)
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS (SEQ ID NO: 379)
Внутриклеточный домен из CD28 (нуклеотидная последовательность) (SEQ ID NO: 380)
AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 380)
Внутриклеточный домен из ICOS (аминокислотная последовательность) (SEQ ID NO: 381)
T K K K Y S S S V H D P N G E Y M F M R A V N T A K K S R L T D V T L (SEQ ID NO: 381)
Внутриклеточный домен из ICOS (нуклеотидная последовательность) (SEQ ID NO: 382)
ACAAAAAAGAAGTATTCATCCAGTGTGCACGACCCTAACGGTGAATACATGTTCATGAGAGCAGTGAACACAGCCAAAAAATCCAGACTCACAGATGTGACCCTA (SEQ ID NO: 382)
Домен CD3-дзета (аминокислотная последовательность) (SEQ ID NO: 9)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
CD3-дзета (последовательность нуклеиновой кислоты) (SEQ ID NO: 20)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
Домен CD3-дзета (аминокислотная последовательность; эталонная последовательность NCBI NM_000734.3) (SEQ ID NO: 10)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
CD3-дзета (последовательность нуклеиновой кислоты; эталонная последовательность NCBI NM_000734.3); (SEQ ID NO: 21)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAG
AACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTT
TGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGA
AGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGG
AGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGC
ACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGC
CCTTCACATGCAGGCCCTGCCCCCTCGC
Шарнир IgG4 (аминокислотная последовательность) (SEQ ID NO: 36)
ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM
Шарнир IgG4 (нуклеотидная последовательность) (SEQ ID NO: 37)
GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG
В вариантах осуществления эти клоны содержат изменение остатка Q/K в сигнальном домене костимулирующего домена, происходящего от цепи CD3-дзета.
Таблица 8: Человеческие конструкты CAR к CD33
CAR33-1
Full - nt
CAR33-1
Full - aa
CAR33-1
scFv - aa
CAR33-1
VH- aa
CAR33-1
VL - aa
CAR33-2
Full - nt
CAR33-2
Full - aa
CAR33-2
scFv - aa
CAR33-2
VH - aa
CAR33-2
VL - aa
CAR33-3
Full - nt
CAR33-3
Full - aa
CAR33-3
scFv- aa
CAR33-3
VH - aa
CAR33-3
VL - aa
CAR33-4
Full - nt
CAR33-4
Full - aa
CAR33-4
scFv - aa
CAR33-4
VH - aa
CAR33-4
VL - aa
CAR33-5
Full - nt
CAR33-5
Full - aa
CAR33-5
scFv- aa
CAR33-5
VH - aa
CAR33-5
VL - aa
CAR33-6
Full - nt
CAR33-6
Full - aa
CAR33-6
scFv - aa
CAR33-6
VH - aa
CAR33-6
VL - aa
CAR33-7
Full - nt
CAR33-7
Full - aa
CAR33-7
scFv - aa
CAR33-7
VH - aa
CAR33-7
VL - aa
CAR33-8
Full - nt
CAR33-8
Full - aa
CAR33-8
scFv - aa
CAR33-8
VH - aa
CAR33-8
VL - aa
CAR33-9
Full - nt
CAR33-9
Full - aa
CAR33-9
scFv - aa
CAR33-9
VH - aa
CAR33-9
VL - aa
Таблица 9. Последовательности человеческих scFv в CAR к CD33
(CD33-1) scFv - nt
(CD33-1) scFv - aa
В вариантах осуществления фрагменты scFv CAR клонируют в лентивирусные векторы для создания конструкта полноразмерного CAR в одной кодирующей рамке и с использованием промотора, например, промотора EF1-альфа, для экспрессии (SEQ ID NO: 11).
SEQ ID NO: 11. Промотор EF1-альфа
CGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACGGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGAGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGA
Gly/Ser (SEQ ID NO: 25)
GGGGS
Gly/Ser (SEQ ID NO: 26):
Данная последовательность может охватывать 1-6 повторяющихся единиц "Gly Gly Gly Gly Ser"
GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 27)
GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 28)
GGGGSGGGGS GGGGS
Gly/Ser (SEQ ID NO: 29)
GGGS
Поли-A: (A)5000 (SEQ ID NO: 30)
Данная последовательность может охватывать 50-5000 аденинов.
Поли-A: (T)100 (SEQ ID NO: 31)
Поли-A: (T)5000 (SEQ ID NO: 32)
Данная последовательность может охватывать 50-5000 тиминов.
Поли-A: (A)5000 (SEQ ID NO: 33)
Данная последовательность может охватывать 100-5000 аденинов.
Поли-A: (A)400 (SEQ ID NO: 34)
Поли-A: (A)2000 (SEQ ID NO: 35)
Gly/Ser (SEQ ID NO: 38): Данная последовательность может охватывать 1-10 повторяющихся единиц "Gly Gly Gly Ser"
GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS
Дополнительные примеры молекул CAR или их фрагментов антител приведены в примере 3. Раскрыты мышиные и гуманизированные варианты анти-CD33 антитела, 2213. Например, в примере 3 приведено следующее: нуклеотидная последовательность нуклеотидной последовательности мышиного анти-CD33 IgG4 2213 (SEQ ID NO: 138); нуклеотидная последовательность CAR 2213 (SEQ ID NO: 139); аминокислотная последовательность CAR 2213 (SEQ ID NO: 140); нуклеотидная последовательность scFv 2213 (SEQ ID NO: 141); и аминокислотная последовательность scFv 2213 (SEQ ID NO: 142); нуклеотидная последовательность гуманизированного анти-CD33 IgG4H 2218 (SEQ ID NO: 143).
Другие варианты осуществления, раскрытые в примере 3, включают молекулы CAR и фрагменты анти-CD33 антитела гемтузумаба озогамицина, ранее продававшегося как милотарг (например, гуманизированный вариант, описанный в настоящем документе как "гуманизированный my96"). Аминокислотная последовательность анти-CD33 scFv гемтузумаба озогамицина (иммуноконъюгата, воздействующего на CD33) с сигнальными доменами из 41BB и CD3-дзета описана в примере 3; и SEQ ID NO: 145. Соответствующая нуклеотидная последовательность гуманизированного my96 приведена как SEQ ID NO: 144. Нуклеотидная последовательность гуманизированного my96 приведена в настоящем документе как SEQ ID NO: 146, а аминокислотная последовательность представляет собой SEQ ID NO: 147.
В одном варианте осуществления CAR к CD33 и CD33-CART, описанные в настоящем документе, содержат антигенсвязывающий домен, содержащий одну или несколько, например, одну, две или три, CDR вариабельного домена тяжелой цепи и/или одну или несколько, например, одну, две или три, CDR вариабельного домена легкой цепи, или VH или VL последовательности scFv, кодируемой под номером доступа GenBank AM402974.1. Смотри документ Wang et al., Mol. Ther., vol. 23:1, pp. 184-191 (2015), настоящим включенный посредством ссылки.
Фрагменты scFv CAR могут быть клонированы в лентивирусные векторы для создания конструкта полноразмерного CAR в одной кодирующей рамке и с использованием промотора EF1-альфа для экспрессии (SEQ ID NO: 11).
Конструкт CAR может включать в себя линкер Gly/Ser, имеющий одну или несколько из следующих последовательностей: GGGGS (SEQ ID NO: 25); охватывающая 1-6 повторяющихся единиц "Gly Gly Gly Gly Ser", например, GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS (SEQ ID NO: 26); GGGGSGGGGS GGGGSGGGGS (SEQ ID NO: 27); GGGGSGGGGS GGGGS (SEQ ID NO: 28); GGGS (SEQ ID NO: 29); или охватывающая 1-10 повторяющихся единиц "Gly Gly Gly Ser", например, GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS (SEQ ID NO: 38). В вариантах осуществления конструкт CAR включает в себя последовательность поли-A, например, последовательность, охватывающую 50-5000 или 100-5000 аденинов (например, SEQ ID NO: 30, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 35), или последовательность, охватывающую 50-5000 тиминов (например, SEQ ID NO: 31, SEQ ID NO: 32). В качестве альтернативы, конструкт CAR может включать в себя, например, линкер, включающий в себя последовательность GSTSGSGKPGSGEGSTKG (SEQ ID NO: 383)
Биспецифические CAR
В варианте осуществления мультиспецифическая молекула антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело имеет специфичность к не более чем двум антигенам. Биспецифическая молекула антитела характеризуется первой последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания к первому эпитопу, и второй последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания ко второму эпитопу. В варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, на одном и том же белке (или субъединице мультимерного белка). В варианте осуществления первый и второй эпитопы перекрываются. В варианте осуществления первый и второй эпитопы не перекрываются. В варианте осуществления первый и второй эпитопы находятся на различных антигенах, например, на различных белках (или различных субъединицах мультимерного белка). В варианте осуществления биспецифическая молекула антитела содержит последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые имеют специфичность связывания к первому эпитопу, и последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые имеют специфичность связывания ко второму эпитопу. В варианте осуществления биспецифическая молекула антитела содержит полуантитело, имеющее специфичность связывания к первому эпитопу, и полуантитело, имеющее специфичность связывания ко второму эпитопу. В варианте осуществления биспецифическая молекула антитела содержит полуантитело или его фрагмент, имеющие специфичность связывания к первому эпитопу, и полуантитело или его фрагмент, имеющие специфичность связывания ко второму эпитопу. В варианте осуществления биспецифическая молекула антитела содержит scFv или его фрагмент, имеющий специфичность связывания к первому эпитопу, и scFv или его фрагмент, имеющий специфичность связывания ко второму эпитопу.
В определенных вариантах осуществления молекула антитела представляет собой мультиспецифическую (например, биспецифическую или триспецифическую) молекулу антитела. Протоколы генерирования биспецифических или гетеродимерных молекул антител известны в данной области техники; включая, но без ограничения, например, подход "выступ-во-впадину", описанный, например, в US 5731168; электростатически управляемую конъюгацию Fc, как описано, например, в WO 09/089004, WO 06/106905 и WO 2010/129304; образование гетеродимеров искусственных доменов с обменом цепей (SEED), как описано, например, в WO 07/110205; обмен Fab-фрагментами, как описано, например, в WO 08/119353, WO 2011/131746 и WO 2013/060867; конъюгирование двойного антитела, например, посредством перекрестного сшивания антител для создания биспецифической структуры с использованием гетеробифункционального реагента, содержащего аминореактивную группу и сульфгидрильную реактивную группу, как описано, например, в US 4433059; биспецифические детерминанты антител, создаваемые посредством рекомбинации полуантител (пар тяжелая-легкая цепь или Fab) из различных антител в цикле восстановления и окисления дисульфидных связей между двумя тяжелыми цепями, как описано, например, в US 4444878; трифункциональные антитела, например, три фрагмента Fab', перекрестно сшитые посредством сульфгидрильных реактивных групп, как описано, например, в US5273743; биосинтетические связывающие белки, например, пару scFv, перекрестно сшитых посредством C-концевых хвостов, предпочтительно посредством дисульфидного или аминореактивного химического перекрестного сшивания, как описано, например, в US5534254; бифункциональные антитела, например, фрагменты Fab с различной специфичностью связывания, димеризованные посредством лейциновых застежек (например, c-fos и c-jun), которые заменяют константный домен, как описано, например, в US5582996; биспецифические и олигоспецифические одно- и олиговалентные рецепторы, например, области VH-CH1 двух антител (двух фрагментов Fab), связанные посредством полипептидного спейсера между областью CH1 одного антитела и областью VH другого антитела, обычно с ассоциированными легкими цепями, как описано, например, в US5591828; биспецифические конъюгаты ДНК-антитело, например, перекрестное сшивание антител или фрагментов Fab посредством двухцепочечного участка ДНК, как описано, например, в US5635602; биспецифические белки слияния, например, экспрессионный конструкт, содержащий два scFv с гидрофильным спиральным пептидным линкером между ними и полной константной областью, как описано, например, в US5637481; многовалентные и мультиспецифические связывающие белки, например, димеры полипептидов, содержащие первый домен со связывающей областью вариабельной области тяжелой цепи Ig и второй домен со связывающей областью вариабельной области легкой цепи Ig, обычно называемые диателами (также включены структуры более высокого порядка, создающие биспецифические, триспецифические или тетраспецифические молекулы), как описано, например, в US5837242; конструкты-минитела со связанными цепями VL и VH, дополнительно соединенные с помощью пептидных спейсеров с шарнирной областью антитела и областью CH3, которые могут быть димеризованы для образования биспецифических/многовалентных молекул, как описано, например, в US5837821; домены VH и VL, связанные с помощью копоткого пептидного линкера (например, 5 или 10 аминокислот) или вообще без линкера, в любой ориентации, которые могут образовывать димеры для образования биспецифических диател; тримеры и тетрамеры, как описано, например, в US5844094; цепочку доменов VH (или доменов VL в членах семейства), соединенных пептидными связями, с перекрестно сшиваемыми группами с C-конца, дополнительно ассоциированными с доменами VL для образования ряда FV (или scFv), как описано, например, в US5864019; и одноцепочечные связывающие полипептиды с доменами VH и VL, связанными посредством пептидного линкера, объединенные в многовалентные структуры посредством нековалентного или химического перекрестного сшивания для образования, например, гомобивалентных, гетеробивалентных, трехвалентных и четырехвалентных структур с использованием формата типа scFV или диатела, как описано, например, в US5869620. Дополнительные типичные мультиспецифические и биспецифические молекулы и способы их производства можно найти, например, в US5910573, US5932448, US5959083, US5989830, US6005079, US6239259, US6294353, US6333396, US6476198, US6511663, US6670453, US6743896, US6809185, US6833441, US7129330, US7183076, US7521056, US7527787, US7534866, US7612181, US2002004587A1, US2002076406A1, US2002103345A1, US2003207346A1, US2003211078A1, US2004219643A1, US2004220388A1, US2004242847A1, US2005003403A1, US2005004352A1, US2005069552A1, US2005079170A1, US2005100543A1, US2005136049A1, US2005136051A1, US2005163782A1, US2005266425A1, US2006083747A1, US2006120960A1, US2006204493A1, US2006263367A1, US2007004909A1, US2007087381A1, US2007128150A1, US2007141049A1, US2007154901A1, US2007274985A1, US2008050370A1, US2008069820A1, US2008152645A1, US2008171855A1, US2008241884A1, US2008254512A1, US2008260738A1, US2009130106A1, US2009148905A1, US2009155275A1, US2009162359A1, US2009162360A1, US2009175851A1, US2009175867A1, US2009232811A1, US2009234105A1, US2009263392A1, US2009274649A1, EP346087A2, WO0006605A2, WO02072635A2, WO04081051A1, WO06020258A2, WO2007044887A2, WO2007095338A2, WO2007137760A2, WO2008119353A1, WO2009021754A2, WO2009068630A1, WO9103493A1, WO9323537A1, WO9409131A1, WO9412625A2, WO9509917A1, WO9637621A2, WO9964460A1. Содержание вышеупомянутых заявок включено в настоящий документ посредством ссылки во всей полноте.
В каждом антителе или фрагменте антитела (например, scFv) биспецифической молекулы антитела VH может быть расположен в обратном направлении или в прямом направлении от VL. В некоторых вариантах осуществления у расположенных в обратном направлении антитела или фрагмента антитела (например, scFv) их VH (VH1) расположен в обратном направлении от их VL (VL1), а у расположенных в прямом направлении антитела или фрагмента антитела (например, scFv) их VL (VL2) расположен в обратном направлении от их VH (VH2), так что вся биспецифическая молекула антитела имеет конфигурацию VH1-VL1-VL2-VH2. В других вариантах осуществления у расположенных в обратном направлении антитела или фрагмента антитела (например, scFv) их VL (VL1) расположен в обратном направлении от их VH (VH1), а у расположенных в прямом направлении антитела или фрагмента антитела (например, scFv) их VH (VH2) расположен в обратном направлении от их VL (VL2), так что вся биспецифическая молекула антитела имеет конфигурацию VL1-VH1-VH2-VL2. Необязательно, между двумя антителами или фрагментами антител (например, scFv), например, между VL1 и VL2, если конструкт сконфигурирован в виде VH1-VL1-VL2-VH2, или между VH1 и VH2, если конструкт сконфигурирован в виде VL1-VH1-VH2-VL2, расположен линкер. Линкер может представлять собой линкер, описанный в настоящем документе, например, линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). В общем случае, линкер между двумя scFv должен быть достаточно длинным, для того чтобы избежать ошибочного спаривания между доменами этих двух scFv. Необязательно, линкер расположен между VL и VH первого scFv. Необязательно, линкер расположен между VL и VH второго scFv. В конструктах, которые содержат несколько линкеров, любые два или более из линкеров могут быть одинаковыми или различными. Соответственно, в некоторых вариантах осуществления биспецифический CAR содержит VL, VH и, необязательно, один или несколько линкеров в расположении, описанном в настоящем документе.
В одном аспекте биспецифическая молекула антитела характеризуется первой последовательностью иммуноглобулинового вариабельного домена, например, scFv, которая имеет специфичность связывания к CD33, например, содержит scFv, описанный в настоящем документе, например, как описано в таблице 8 или в таблице 9, или содержит CDR легкой цепи и/или CDR тяжелой цепи из scFv к CD33, описанного в настоящем документе, и второй последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания ко второму эпитопу на другом антигене. В некоторых аспектах вторая последовательность иммуноглобулинового вариабельного домена имеет специфичность связывания к антигену, экспрессируемому на клетках ОМЛ, например, антигену, отличному от CD33. Например, вторая последовательность иммуноглобулинового вариабельного домена имеет специфичность связывания к CD123. В качестве другого примера, вторая последовательность иммуноглобулинового вариабельного домена имеет специфичность связывания к CLL-1. В качестве другого примера, вторая последовательность иммуноглобулинового вариабельного домена имеет специфичность связывания к CD34. В качестве другого примера, вторая последовательность иммуноглобулинового вариабельного домена имеет специфичность связывания к FLT3. Например, вторая последовательность иммуноглобулинового вариабельного домена имеет специфичность связывания к фолатному рецептору-бета. В некоторых аспектах вторая последовательность иммуноглобулинового вариабельного домена имеет специфичность связывания к антигену, экспрессируемому на B-клетках, например, к CD19, CD20, CD22 или ROR1.
Химерный TCR
В одном аспекте CD33 антитела и фрагменты антител настоящего изобретения (например, раскрытые в таблицах 8 и 9) могут быть привиты на один или несколько константных доменов цепи T-клеточного рецептора ("TCR"), например, цепи TCR-альфа или TCR-бета, для создания химерного TCR, который специфически связывается с CD33. Не связывая себя теорией, авторы полагают, что химерные TCR будут передавать сигнал через комплекс TCR при связывании антигена. Например, scFv к CD33, раскрытый в настоящем документе, может быть привит на константный домен, например, по меньшей мере на часть внеклеточного константного домена, трансмембранного домена и цитоплазматического домена, цепи TCR, например, цепи TCR-альфа и/или цепи TCR-бета. В качестве другого примера, фрагмент антитела к CD33, например, домен VL, как описано в настоящем документе, может быть привит на константный домен цепи TCR-альфа, и фрагмент антитела к CD33, например, домен VH, как описано в настоящем документе, может быть привит на константный домен цепи TCR-бета (или альтернативно, домен VL может быть привит на константный домен цепи TCR-бета, и домен VH может быть привит на цепь TCR-альфа). В качестве другого примера, CDR антитела или фрагмента антитела к CD33, например, CDR антитела или фрагмента антитела к CD33, как описано в таблицах 1, 2, 3, 4, 5 или 6, могут быть привиты на цепь TCR-альфа и/или бета для создания химерного TCR, который специфически связывается с CD33. Например, LCDR, раскрытые в настоящем документе, могут быть привиты на вариабельный домен цепи TCR-альфа, а HCDR, раскрытые в настоящем документе, могут быть привиты на вариабельный домен цепи TCR-бета, или наоборот. Такие химерные TCR могут быть получены посредством способов, известных в данной области техники (например, Willemsen RA et al, Gene Therapy 2000; 7: 1369-1377; Zhang T et al, Cancer Gene Ther 2004; 11: 487-496; Aggen et al, Gene Ther. 2012 Apr;19(4):365-74).
Трансмембранный домен
По отношению к трансмембранному домену в различных вариантах осуществления может быть сконструирован CAR, содержащий трансмембранный домен, который прикреплен к внеклеточному домену CAR. Трансмембранный домен может включать в себя одну или несколько дополнительных аминокислот рядом с трансмембранной областью, например, одну или несколько аминокислот, ассоциированных с внеклеточной областью белка, от которого произошел трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, вплоть до 15 аминокислот внеклеточной области), и/или одну или несколько дополнительных аминокислот, ассоциированных с внутриклеточной областью белка, от которого произошел трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, вплоть до 15 аминокислот внутриклеточной области). В одном аспекте трансмембранный домен ассоциирован с одним из других доменов, которые использует CAR. В некоторых случаях, трансмембранный домен может быть выбран или модифицирован посредством аминокислотной замены для предотвращения связывания таких доменов с трансмембранными доменами того же или других белков поверхности мембраны, например, для минимизации взаимодействия с другими элементами рецепторного комплекса. В одном аспекте трансмембранный домен способен к гомодимеризации с другим CAR на поверхности экспрессирующей CAR клетки, например, CART-клетки. В другом аспекте аминокислотная последовательность трансмембранного домена может быть модифицирована или заменена таким образом, чтобы минимизировать взаимодействия со связывающими доменами нативного партнера по связыванию, присутствующего в той же экспрессирующей CAR клетке, например, CART.
Трансмембранный домен может происходить или из природного, или из рекомбинантного источника. Если источник является природным, домен может происходить от любого связанного с мембраной или трансмембранного белка. В одном аспекте трансмембранный домен способен сигнализировать внутриклеточному домену(ам) о том, связан ли CAR с мишенью. Трансмембранный домен, особенно полезный в настоящем изобретении, может включать в себя по меньшей мере трансмембранную область(и) из, например, альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8 (например, CD8-альфа, CD8-бета), CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. В некоторых вариантах осуществления, трансмембранный домен может включать в себя по меньшей мере трансмембранную область(и) из, например, KIRDS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, IL2R-бета, IL2R-гамма, IL7R-α, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKG2D, NKG2C.
В некоторых случаях трансмембранный домен может быть прикреплен к внеклеточной области CAR, например, антигенсвязывающему домену CAR, посредством шарнира, например, шарнира из человеческого белка. Например, в одном варианте осуществления шарнир может представлять собой шарнир человеческого Ig (иммуноглобулина), например, шарнир IgG4, или шарнир CD8a. В одном варианте осуществления шарнир или спейсер содержит (например, состоит из нее) аминокислотную последовательность в соответствии с SEQ ID NO: 2. В одном аспекте трансмембранный домен содержит (например, состоит из него) трансмембранный домен в соответствии с SEQ ID NO: 6.
В одном аспекте шарнир или спейсер содержит шарнир IgG4. Например, в одном варианте осуществления шарнир или спейсер содержит шарнир с аминокислотной последовательностью ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM (SEQ ID NO: 3). В некоторых вариантах осуществления шарнир или спейсер содержит шарнир, кодируемый нуклеотидной последовательностью GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG (SEQ ID NO: 14).
В одном аспекте шарнир или спейсер содержит шарнир IgD. Например, в одном варианте осуществления шарнир или спейсер содержит шарнир с аминокислотной последовательностью RWPESPKAQASSVPTAQPQAEGSLAKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECPSHTQPLGVYLLTPAVQDLWLRDKATFTCFVVGSDLKDAHLTWEVAGKVPTGGVEEGLLERHSNGSQSQHSRLTLPRSLWNAGTSVTCTLNHPSLPPQRLMALREPAAQAPVKLSLNLLASSDPPEAASWLLCEVSGFSPPNILLMWLEDQREVNTSGFAPARPPPQPGSTTFWAWSVLRVPAPPSPQPATYTCVVSHEDSRTLLNASRSLEVSYVTDH (SEQ ID NO: 4). В некоторых вариантах осуществления шарнир или спейсер содержит шарнир, кодируемый нуклеотидной последовательностью AGGTGGCCCGAAAGTCCCAAGGCCCAGGCATCTAGTGTTCCTACTGCACAGCCCCAGGCAGAAGGCAGCCTAGCCAAAGCTACTACTGCACCTGCCACTACGCGCAATACTGGCCGTGGCGGGGAGGAGAAGAAAAAGGAGAAAGAGAAAGAAGAACAGGAAGAGAGGGAGACCAAGACCCCTGAATGTCCATCCCATACCCAGCCGCTGGGCGTCTATCTCTTGACTCCCGCAGTACAGGACTTGTGGCTTAGAGATAAGGCCACCTTTACATGTTTCGTCGTGGGCTCTGACCTGAAGGATGCCCATTTGACTTGGGAGGTTGCCGGAAAGGTACCCACAGGGGGGGTTGAGGAAGGGTTGCTGGAGCGCCATTCCAATGGCTCTCAGAGCCAGCACTCAAGACTCACCCTTCCGAGATCCCTGTGGAACGCCGGGACCTCTGTCACATGTACTCTAAATCATCCTAGCCTGCCCCCACAGCGTCTGATGGCCCTTAGAGAGCCAGCCGCCCAGGCACCAGTTAAGCTTAGCCTGAATCTGCTCGCCAGTAGTGATCCCCCAGAGGCCGCCAGCTGGCTCTTATGCGAAGTGTCCGGCTTTAGCCCGCCCAACATCTTGCTCATGTGGCTGGAGGACCAGCGAGAAGTGAACACCAGCGGCTTCGCTCCAGCCCGGCCCCCACCCCAGCCGGGTTCTACCACATTCTGGGCCTGGAGTGTCTTAAGGGTCCCAGCACCACCTAGCCCCCAGCCAGCCACATACACCTGTGTTGTGTCCCATGAAGATAGCAGGACCCTGCTAAATGCTTCTAGGAGTCTGGAGGTTTCCTACGTGACTGACCATT (SEQ ID NO: 15).
В одном аспекте трансмембранный домен может быть рекомбинантным, в случае чего он будет содержать преимущественно гидрофобные остатки, такие как лейцин и валин. В одном аспекте на каждом конце рекомбинантного трансмембранного домена может быть обнаружен триплет из фенилаланина, триптофана и валина.
Необязательно, короткий олиго- или полипептидный линкер от 2 до 10 аминокислот длиной может образовывать связь между трансмембранным доменом и цитоплазматической областью CAR. Дублет глицин-серин обеспечивает особенно подходящий линкер. Например, в одном аспекте линкер содержит аминокислотную последовательность GGGGSGGGGS (SEQ ID NO: 5). В некоторых вариантах осуществления линкер кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 16).
В одном аспекте шарнир или спейсер содержит шарнир KIR2DS2.
Цитоплазматический домен
Цитоплазматический домен или область CAR настоящего изобретения включает в себя внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен способен к активации по меньшей мере одной из нормальных эффекторных функций иммунной клетки, в которую CAR был введен.
Примеры внутриклеточных сигнальных доменов для использования в CAR настоящего изобретения включают цитоплазматические последовательности T-клеточного рецептора (TCR) и корецепторов, которые совместно действуют для инициирования трансдукции сигнала после взаимодействия антигена с рецептором, а также любое производное или вариант этих последовательностей и любую рекомбинантную последовательность, которая имеет такие же функциональные возможности.
Известно, что сигналов, генерируемых с помощью одного только TCR, недостаточно для полной активации T-клетки, и что также требуется вторичный и/или костимулирующий сигнал. Таким образом, можно сказать, что активация T-клетки является опосредованной двумя отдельными классами цитоплазматических сигнальных последовательностей: теми, которые инициируют антиген-зависимую первичную активацию посредством TCR (первичные внутриклеточные сигнальные домены), и теми, которые действуют антиген-независимым образом для обеспечения вторичного или костимулирующего сигнала (вторичный цитоплазматический домен, например, костимулирующий домен).
Первичный сигнальный домен регулирует первичную активацию комплекса TCR или стимулирующим образом, или ингибирующим образом. Первичные внутриклеточные сигнальные домены, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы или ITAM.
Примеры содержащих ITAM первичных внутриклеточных сигнальных доменов, особенно полезных в настоящем изобретении, включают домены из TCR-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известного как "ICOS"), FcεRI, DAP10, DAP12 и CD66d. В одном варианте осуществления CAR настоящего изобретения содержит внутриклеточный сигнальный домен, например, первичный сигнальный домен из CD3-дзета.
В одном варианте осуществления первичный сигнальный домен содержит модифицированный домен c ITAM, например, мутировавший домен c ITAM, который имеет измененную (например, повышенную или пониженную) активность по сравнению с нативным доменом c ITAM. В одном варианте осуществления первичный сигнальный домен содержит модифицированный ITAM-содержащий первичный внутриклеточный сигнальный домен, например, оптимизированный и/или усеченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В варианте осуществления первичный сигнальный домен содержит один, два, три, четыре или более мотивов ITAM.
Дополнительные примеры молекул, содержащих первичный внутриклеточный сигнальный домен, которые особенно полезны в настоящем изобретении, включают DAP10, DAP12 и CD32.
Внутриклеточный сигнальный домен CAR может сам содержать первичный сигнальный домен, например, сигнальный домен из CD3-дзета, или он может быть объединен с любым другим желательным внутриклеточным сигнальным доменом(ами), подходящим в контексте CAR настоящего изобретения. Например, внутриклеточный сигнальный домен CAR может содержать первичный сигнальный домен, например, часть CD3-дзета-цепи, и костимулирующий сигнальный домен. Костимулирующий сигнальный домен относится к части CAR, содержащей внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, которая необходима для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают молекулу ГКГС класса I, белки-рецепторы ФНО, иммуноглобулин-подобные белки, цитокиновые рецепторы, интегрины, сигнальные лимфоцит-активирующие молекулы (SLAM-белки), активирующие рецепторы NK-клеток, BTLA, рецептор толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфически связывается с CD83, и тому подобные. Например, было продемонстрировано, что костимуляция с помощью CD27 усиливает размножение, эффекторную функцию и выживаемость человеческих CART-клеток in vitro и увеличивает жизнестойкость и противоопухолевый активность человеческих T-клеток in vivo (Song et al. Blood. 2012; 119(3):696-706).
Внутриклеточные сигнальные последовательности в цитоплазматической части CAR настоящего изобретения могут быть связаны друг с другом в случайном или определенном порядке. Необязательно, короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9, или 10 аминокислот), может образовывать связь между внутриклеточной сигнальной последовательностью. В одном варианте осуществления дублет глицин-серин можно использовать в качестве подходящего линкера. В одном варианте осуществления одну аминокислоту, например, аланин, глицин, можно использовать в качестве подходящего линкера.
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов. В варианте осуществления два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов разделены молекулой линкера, например, молекулой линкера, описанной в настоящем документе. В одном варианте осуществления внутриклеточный сигнальный домен содержит два костимулирующих сигнальных домена. В некоторых вариантах осуществления молекула линкера представляет собой остаток глицина. В некоторых вариантах осуществления линкер представляет собой остаток аланина.
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из CD28. В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из 4-1BB. В одном аспекте сигнальный домен из 4-1BB представляет собой сигнальный домен в соответствии с SEQ ID NO: 7. В одном аспекте сигнальный домен из CD3-дзета представляет собой сигнальный домен в соответствии с SEQ ID NO: 9 (мутантная CD3-дзета) или SEQ ID NO: 10 (человеческая CD3-дзета дикого типа).
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из CD27. В одном аспекте сигнальный домен из CD27 содержит аминокислотную последовательность QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP (SEQ ID NO: 8).
В одном аспекте сигнальный домен из CD27 кодируется последовательностью нуклеиновой кислоты AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 19).
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из CD28. В одном аспекте сигнальный домен из CD28 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 379. В одном аспекте сигнальный домен из CD28 кодируется последовательностью нуклеиновой кислоты в соответствии с SEQ ID NO: 380.
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из ICOS. В одном аспекте сигнальный домен из CD28 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 381. В одном аспекте сигнальный домен из ICOS кодируется последовательностью нуклеиновой кислоты в соответствии с SEQ ID NO: 382.
В одном аспекте экспрессирующая CAR клетка, описанная в настоящем документе, может дополнительно содержать второй CAR, например, второй CAR, который включает в себя другой антигенсвязывающий домен, например, к той же самой мишени (CD33) или к другой мишени (например, CD123, CLL-1, CD34, FLT3 или фолатному рецептору-бета). В одном варианте осуществления второй CAR включает в себя антигенсвязывающий домен к мишени, экспрессируемой на клетках острого миелоидного лейкоза, такой как, например, CD123, CLL-1, CD34, FLT3 или фолатный рецептор-бета. В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который воздействует на первый антиген и включает в себя внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и второй CAR, который воздействует на второй, отличный от него, антиген и включает в себя внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. Без ограничения теорией, помещение костимулирующего сигнального домена, например, 4-1BB, CD28, CD27, ICOS или OX-40, на первый CAR и первичного сигнального домена, например, CD3-дзета, на второй CAR может ограничивать активность CAR в отношении клеток, в которых экспрессируются обе мишени. В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR к CD33, который включает в себя CD33-связывающий домен, трансмембранный домен и костимулирующий домен, и второй CAR, который воздействует на антиген, отличный от CD33 (например, антиген, экспрессируемый на клетках ОМЛ, например, CD123, CLL-1, CD34, FLT3 или фолатный рецептор-бета), и включает в себя антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления экспрессирующая CAR клетка содержит первый CAR к CD33, который включает в себя CD33-связывающий домен, трансмембранный домен и первичный сигнальный домен, и второй CAR, который воздействует на антиген, отличный от CD33 (например, антиген, экспрессируемый на клетках ОМЛ, например, CD123, CLL-1, CD34, FLT3 или фолатный рецептор-бета), и включает в себя антигенсвязывающий домен к этому антигену, трансмембранный домен и костимулирующий сигнальный домен.
В одном варианте осуществления экспрессирующая CAR клетка содержит CAR к CD33, описанный в настоящем документе, и ингибирующий CAR. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, который связывает антиген, обнаруживаемый на нормальных клетках, но не на раковых клетках, например, на нормальных клетках, которые также экспрессируют CD33. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибирующей молекулы. Например, внутриклеточный домен ингибирующего CAR может представлять собой внутриклеточный домен PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета.
В одном варианте осуществления, когда экспрессирующая CAR клетка содержит два или более различных CAR, антигенсвязывающие домены различных CAR могут быть такими, что антигенсвязывающие домены не взаимодействуют друг с другом. Например, клетка, экспрессирующая первый и второй CAR, может иметь антигенсвязывающий домен первого CAR, например, в виде фрагмента, например, scFv, который не образует связь с антигенсвязывающим доменом второго CAR, например, антигенсвязывающий домен второго CAR представляет собой VHH.
В некоторых вариантах осуществления антигенсвязывающий домен содержит однодоменные антигенсвязывающие (SDAB) молекулы, включая молекулы, определяющие комплементарность области которых представляют собой часть однодоменного полипептида. Примеры включают, но без ограничения, вариабельные домены тяжелой цепи, связывающие молекулы, естественно лишенные легких цепей, отдельные домены, происходящие от обычных 4-цепочечных антител, сконструированные домены и однодоменные каркасы, отличные от происходящих от антител. Молекулы SDAB могут представлять собой любые из уровня техники или любые будущие однодоменные молекулы. Молекулы SDAB могут происходить из любого вида, включая, но без ограничения, мышь, человека, верблюда, ламу, миногу, рыбу, акулу, козу, кролика и быка. Данный термин также включает природные однодоменные молекулы антител из вида, отличного от верблюдовых и акул.
В одном аспекте молекула SDAB может происходить от вариабельной области иммуноглобулина, обнаруживаемого в рыбе, как например, происходящая от иммуноглобулинового изотипа, известного как новый антигенный рецептор (NAR), обнаруженного в сыворотке акулы. Способы получения однодоменных молекул, происходящих от вариабельной области NAR ("IgNAR"), описаны в WO 03/014161 и Streltsov (2005) Protein Sci. 14:2901-2909.
В соответствии с другим аспектом молекула SDAB представляет собой природную однодоменную антигенсвязывающую молекулу, известную как тяжелая цепь, лишенная легких цепей. Такие однодоменные молекулы раскрыты, например, в WO 9404678 и Hamers-Casterman, C. et al. (1993) Nature 363:446-448. Для ясности, этот вариабельный домен, происходящий от молекулы тяжелой цепи, естественно лишенной легкой цепи, именуется в настоящем документе VHH или нанотелом для его отличия от обычного VH четырехцепочечных иммуноглобулинов. Такая молекула VHH может происходить от вида верблюдовых, например, верблюда, ламы, дромадера, альпаки и гуанако. Молекулы тяжелой цепи, естественно лишенной легкой цепи, могут производить другие виды помимо верблюдовых; такие VHH находятся в пределах объема настоящего изобретения.
Молекулы SDAB могут быть рекомбинантными, CDR-привитыми, гуманизированным, камелизированными, деиммунизированными и/или созданными in vitro (например, выбранными посредством фагового отображения).
Было также обнаружено, что для клеток, содержащих множество химерных встроенных в мембрану рецепторов, содержащих антигенсвязывающий домен, взаимодействия между антигенсвязывающими доменами рецепторов могут быть нежелательными, например, потому, что они ингибируют способность одного или нескольких из антигенсвязывающих доменов связываться со своим когнатным антигеном. Соответственно, в настоящем документе раскрыты клетки, содержащие первый и второй неприродные химерные встроенные в мембрану рецепторы, содержащие антигенсвязывающие домены, которые минимизируют такие взаимодействия. Также в настоящем документе раскрыты нуклеиновые кислоты, кодирующие первый и второй неприродные химерные встроенные в мембрану рецепторы, содержащие антигенсвязывающие домены, которые минимизируют такие взаимодействия, а также способы производства и использования таких клеток и нуклеиновых кислот. В варианте осуществления антигенсвязывающий домен одного из упомянутого первого и упомянутого второго неприродных химерных встроенных в мембрану рецепторов содержит scFv, а другой содержит, например, одиночный домен VH верблюда, акулы или миноги или одиночный домен VH, происходящий от человеческой или мышиной последовательности.
В некоторых вариантах осуществления заявленное изобретение содержит первый и второй CAR, причем антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR не содержит вариабельный легкий домен и вариабельный тяжелый домен. В некоторых вариантах осуществления антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR представляет собой scFv, а другой не представляет собой scFv. В некоторых вариантах осуществления антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR содержит одиночный домен VH, например, одиночный домен VH верблюда, акулы или миноги или одиночный домен VH, происходящий от человеческой или мышиной последовательности. В некоторых вариантах осуществления антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR содержит верблюжий домен VHH.
В некоторых вариантах осуществления антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR содержит scFv, а другой содержит одиночный домен VH, например, одиночный домен VH верблюда, акулы или миноги или одиночный домен VH, происходящий от человеческой или мышиной последовательности. В некоторых вариантах осуществления антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR содержит scFv, а другой содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из упомянутого первого CAR и упомянутого второго CAR содержит scFv, а другой содержит верблюжий домен VHH.
В некоторых вариантах осуществления связывание антигенсвязывающего домена упомянутого первого CAR с его когнатным антигеном по существу не уменьшается из-за присутствия упомянутого второго CAR, когда они присутствуют на поверхности клетки. В некоторых вариантах осуществления связывание антигенсвязывающего домена упомянутого первого CAR с его когнатным антигеном в присутствии упомянутого второго CAR составляет 85%, 90%, 95%, 96%, 97%, 98% или 99% от связывания антигенсвязывающего домена упомянутого первого CAR с его когнатным антигеном в отсутствие упомянутого второго CAR.
В некоторых вариантах осуществления антигенсвязывающие домены упомянутого первого CAR и упомянутого второго CAR, когда они присутствуют на поверхности клетки, связываются друг с другом меньше, чем если бы оба представляли собой антигенсвязывающие домены scFv. В некоторых вариантах осуществления антигенсвязывающие домены упомянутого первого CAR и упомянутого второго CAR связываются друг с другом на 85%, 90%, 95%, 96%, 97%, 98% или 99% меньше, если бы оба представляли собой антигенсвязывающие домены scFv.
В другом аспекте экспрессирующая CAR клетка, описанная в настоящем документе, может дополнительно экспрессировать другое средство, например, средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует ингибирующую молекулу. Ингибирующие молекулы, например, PD1, могут в некоторых вариантах осуществления уменьшать способность экспрессирующей CAR клетки вызывать иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета. В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, представляет собой, например, молекулу, описанную в настоящем документе, например, средство, которое содержит первый полипептид, например, ингибирующую молекулу, ассоциированный со вторым полипептидом, который передает положительный сигнал в клетку, например, внутриклеточным сигнальным доменом, описанным в настоящем документе. В одном варианте осуществления средство содержит первый полипептид, например, ингибирующую молекулу, такую как PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета или фрагмент любой из них (например, по меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем документе (например, содержит костимулирующий домен (например, 41BB, CD27, ICOS или CD28, например, как описано в настоящем документе) и/или первичный сигнальный домен (например, сигнальный домен из CD3-дзета, описанный в настоящем документе)). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1) и второй полипептид внутриклеточного сигнального домена, описанного в настоящем документе (например, сигнального домена из CD28, описанного в настоящем документе, и/или сигнального домена из CD3-дзета, описанного в настоящем документе). В вариантах осуществления экспрессирующая CAR клетка, описанная в настоящем документе, содержит костимулирующий рецептор-переключатель, например, как описано в документе WO 2013/019615, который включен в настоящий документ посредством ссылки во всей полноте. PD1 представляет собой ингибирующий элемент из CD28-семейства рецепторов, которое также включает в себя CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Было показано, что два лиганда для PD1, PD-L1 и PD-L2, понижающе регулируют активацию T-клетки после связывания с PD1 (Freeman et a. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 распространен в человеческих раках (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммуносупрессия может быть обращена посредством ингибирования локального взаимодействия PD1 с PD-L1.
В одном варианте осуществления средство, содержащее внеклеточный домен (ECD) ингибирующей молекулы, например, молекулы программируемой смерти 1 (PD1), может быть слито с трансмембранным доменом и внутриклеточными сигнальными доменами, например, из 41BB и CD3-дзета (также обозначается в настоящем документе как PD1-CAR). В одном варианте осуществления PD1-CAR при использовании в комбинации с CAR к CD33, описанным в настоящем документе, улучшает жизнестойкость экспрессирующей CAR клетки, например, T- или NK-клетки. В одном варианте осуществления CAR представляет собой PD1-CAR, содержащий внеклеточный домен из PD1, указанный подчеркиванием в SEQ ID NO: 24. В одном варианте осуществления PD1-CAR содержит аминокислотную последовательность в соответствии с SEQ ID NO: 24.
Malpvtalllplalllhaarppgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 24).
В одном варианте осуществления PD1-CAR содержит аминокислотную последовательность, приведенную ниже (SEQ ID NO: 22).
pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 22).
В одном варианте осуществления средство содержит последовательность нуклеиновой кислоты, кодирующую PD1-CAR, например, PD1-CAR, описанный в настоящем документе. В одном варианте осуществления последовательность нуклеиновой кислоты для PD1-CAR показана ниже, причем ECD PD1 ниже в SEQ ID NO: 23 подчеркнут
atggccctccctgtcactgccctgcttctccccctcgcactcctgctccacgccgctagaccacccggatggtttctggactctccggatcgcccgtggaatcccccaaccttctcaccggcactcttggttgtgactgagggcgataatgcgaccttcacgtgctcgttctccaacacctccgaatcattcgtgctgaactggtaccgcatgagcccgtcaaaccagaccgacaagctcgccgcgtttccggaagatcggtcgcaaccgggacaggattgtcggttccgcgtgactcaactgccgaatggcagagacttccacatgagcgtggtccgcgctaggcgaaacgactccgggacctacctgtgcggagccatctcgctggcgcctaaggcccaaatcaaagagagcttgagggccgaactgagagtgaccgagcgcagagctgaggtgccaactgcacatccatccccatcgcctcggcctgcggggcagtttcagaccctggtcacgaccactccggcgccgcgcccaccgactccggccccaactatcgcgagccagcccctgtcgctgaggccggaagcatgccgccctgccgccggaggtgctgtgcatacccggggattggacttcgcatgcgacatctacatttgggctcctctcgccggaacttgtggcgtgctccttctgtccctggtcatcaccctgtactgcaagcggggtcggaaaaagcttctgtacattttcaagcagcccttcatgaggcccgtgcaaaccacccaggaggaggacggttgctcctgccggttccccgaagaggaagaaggaggttgcgagctgcgcgtgaagttctcccggagcgccgacgcccccgcctataagcagggccagaaccagctgtacaacgaactgaacctgggacggcgggaagagtacgatgtgctggacaagcggcgcggccgggaccccgaaatgggcgggaagcctagaagaaagaaccctcaggaaggcctgtataacgagctgcagaaggacaagatggccgaggcctactccgaaattgggatgaagggagagcggcggaggggaaaggggcacgacggcctgtaccaaggactgtccaccgccaccaaggacacatacgatgccctgcacatgcaggcccttccccctcgc (SEQ ID NO: 23).
В другом аспекте настоящее изобретение предлагает популяцию CAR-экспрессирующих клеток, например, CART-клеток или экспрессирующих CAR NK-клеток. В некоторых вариантах осуществления популяция CAR-экспрессирующих клеток содержит смесь клеток, экспрессирующих различные CAR. Например, в одном варианте осуществления популяция CAR-экспрессирующих клеток (например, CART-клеток или экспрессирующих CAR NK-клеток) может включать в себя первую клетку, экспрессирующую CAR, имеющий CD33-связывающий домен, описанный в настоящем документе, и вторую клетку, экспрессирующую CAR, имеющий другой CD33-связывающий домен, например, CD33-связывающий домен, описанный в настоящем документе, который отличается от CD33-связывающего домена в CAR, экспрессируемом первой клеткой. В качестве другого примера, популяция CAR-экспрессирующих клеток может включать в себя первую клетку, экспрессирующую CAR, который включает в себя CD33-связывающий домен, например, описанный в настоящем документе, и вторую клетку, экспрессирующую CAR, который включает в себя антигенсвязывающий домен к мишени, отличной от CD33 (например, CD123, CD34, CLL-1, FLT3 или фолатному рецептору-бета). В одном варианте осуществления популяция CAR-экспрессирующих клеток включает в себя, например, первую клетку, экспрессирующую CAR, который включает в себя первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, который включает в себя вторичный сигнальный домен, например, костимулирующий сигнальный домен.
В другом аспекте настоящее изобретение предлагает популяцию клеток, причем по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий CD33 домен, описанный в настоящем документе, а вторая клетка экспрессирует другое средство, например, средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует ингибирующую молекулу. Ингибирующие молекулы, например, могут в некоторых вариантах осуществления уменьшать способность экспрессирующей CAR клетки вызывать иммунный эффектор ответ. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета. В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, например, описано в настоящем документе, например, средство содержит первый полипептид, например, ингибирующую молекулу, ассоциированный со вторым полипептидом, который передает положительный сигнал в клетку, например, внутриклеточным сигнальным доменом, описанным в настоящем документе. В одном варианте осуществления средство содержит первый полипептид, например, ингибирующую молекулу, такую как PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета или фрагмент любой из них (например, по меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем документе (например, содержит костимулирующий домен (например, 41BB, CD27, ICOS или CD28, например, как описано в настоящем документе) и/или первичный сигнальный домен (например, сигнальный домен из CD3-дзета, описанный в настоящем документе)). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1) и второй полипептид внутриклеточного сигнального домена, описанного в настоящем документе (например, сигнального домена из CD28, описанного в настоящем документе, и/или сигнального домена из CD3-дзета, описанного в настоящем документе).
В одном аспекте настоящее изобретение предлагает способы, содержащие введение популяции CAR-экспрессирующих клеток (например, CART-клеток или экспрессирующих CAR NK-клеток), например, смеси клеток, экспрессирующих различные CAR, в комбинации с другим средством, например, ингибитором киназы, таким как ингибитор киназы, описанный в настоящем документе. В другом аспекте настоящее изобретение предлагает способы, содержащие введение популяции клеток, причем по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий противораковый ассоциированный антигенсвязывающий домен, как описано в настоящем документе, и вторая клетка экспрессирует другое средство, например, средство, которое усиливает активность экспрессирующей CAR клетки, в комбинации с другим средством, например, ингибитором киназы, таким как ингибитор киназы, описанный в настоящем документе.
CAR с рецептором клеток-естественных киллеров (NKR)
В варианте осуществления молекула CAR, описанная в настоящем документе, содержит один или несколько компонентов рецептора клеток-естественных киллеров (NKR), таким образом образуя NKR-CAR. Компонент NKR может представлять собой трансмембранный домен, шарнирный домен или цитоплазматический домен из любого из следующих рецепторов клеток-естественных киллеров: иммуноглобулин-подобного рецептора клеток-киллеров (KIR), например, KIR2DL1, KIR2DL2/L3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR2DS1, KIR2DS2, KIR2DS3, KIR2DS4, DIR2DS5, KIR3DL1/S1, KIR3DL2, KIR3DL3, KIR2DP1 и KIR3DP1; рецептора естественной цитотоксичности (NCR), например, NKp30, NKp44, NKp46; семейства сигнальных лимфоцит-активирующих молекул (SLAM) рецепторов иммунных клеток, например, CD48, CD229, 2B4, CD84, NTB-A, CRACC, BLAME и CD2F-10; Fc-рецептора (FcR), например, CD16, и CD64; и рецепторов Ly49, например, LY49A, LY49C. Молекулы NKR-CAR, описанные в настоящем документе, могут взаимодействовать с молекулой-адаптором или внутриклеточным сигнальным доменом, например, DAP12. Типичные конфигурации и последовательности молекул CAR, содержащих компоненты NKR, описаны в международной публикации № WO2014/145252, содержание которой настоящим включено посредством ссылки.
Стратегии регуляции химерных антигенных рецепторов
Существует много способов регуляции активности CAR. В некоторых вариантах осуществления желателен регулируемый CAR (RCAR), в котором можно управлять активностью CAR, для оптимизации безопасности и эффективности терапии с помощью CAR. Например, в качестве выключателя безопасности при терапии с помощью CAR настоящего изобретения можно использовать вызывание апоптоза с помощью, например, каспазы, слитой в домен димеризации (смотри, например, Di et al., N Engl. J. Med. 2011 Nov. 3; 365(18):1673-1683). В другом примере, CAR-экспрессирующие клетки могут также экспрессировать молекулу индуцируемой каспазы-9 (iCaspase-9), что после введения препарата-димеризатора (например, римидуцида (также называемого AP1903 (Bellicum Pharmaceuticals) или AP20187 (Ariad)) приводит к активации каспазы-9 и апоптозу клеток. Молекула iCaspase-9 содержит химический индуктор димеризации (CID), связывающий домен, который опосредует димеризацию в присутствии CID. Это приводит к индуцируемому и селективному истощению CAR-экспрессирующих клеток. В некоторых случаях молекула iCaspase-9 кодируется молекулой нуклеиновой кислоты, отдельной от CAR-кодирующего вектора(ов). В некоторых случаях молекула iCaspase-9 кодируется той же молекулой нуклеиновой кислоты, что и CAR-кодирующий вектор. ICaspase-9 может предоставлять выключатель безопасности для предотвращения любой токсичности CAR-экспрессирующих клеток. Смотри, например, Song et al. Cancer Gene Ther. 2008; 15(10):667-75; № идентификатора клинического исследования NCT02107963; и Di Stasi et al. N. Engl. J. Med. 2011; 365:1673-83.
Альтернативные стратегии регуляции терапии с помощью CAR настоящего изобретения включают использование небольших молекул или антител, которые деактивируют или выключают активность CAR, например, посредством удаления CAR-экспрессирующих клеток, например, посредством индуцирования антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC). Например, CAR-экспрессирующие клетки, описанные в настоящем документе, могут также экспрессировать антиген, который распознается молекулами, способными индуцировать клеточную смерть, например, ADCC или индуцируемую комплементом клеточную смерть. Например, CAR-экспрессирующие клетки, описанные в настоящем документе, могут также экспрессировать рецептор, допускающий воздействие на него антитела или фрагмента антитела. Примеры таких рецепторов включают EpCAM, VEGFR, интегрины (например, интегрины αVβ3, α4, αIIbβ3, α4β7, α5β1, αVβ3, αV), элементы суперсемейства рецепторов ФНО (например, TRAIL-R1, TRAIL-R2), рецептор PDGF, интерфероновый рецептор, фолатный рецептор, GPNMB, ICAM-1, HLA-DR, CEA, CA-125, MUC1, TAG-72, рецептор IL-6, 5T4, GD2, GD3, CD2, CD3, CD4, CD5, CD11, CD11a/LFA-1, CD15, CD18/ITGB2, CD19, CD20, CD22, рецептор CD23/lgE, CD25, CD28, CD30, CD33, CD38, CD40, CD41, CD44, CD51, CD52, CD62L, CD74, CD80, CD125, CD147/базиджин, CD152/CTLA-4, CD154/CD40L, CD195/CCR5, CD319/SLAMF7 и EGFR и их усеченные варианты (например, варианты, сохраняющие один или несколько внеклеточных эпитопов, но без одной или нескольких областей в цитоплазматическом домене). Например, CAR-экспрессирующие клетки, описанные в настоящем документе, могут также экспрессировать усеченный рецептор эпидермального фактора роста (EGFR), у которого отсутствует сигнальная способность, но сохранен эпитоп, который распознается молекулами, способными индуцировать ADCC, например, цетуксимабом (ERBITUX®), так что введение цетуксимаба индуцирует ADCC и последующее истощение CAR-экспрессирующих клеток (смотри, например, WO2011/056894 и Jonnalagadda et al., Gene Ther. 2013; 20(8)853-860). Другая стратегия включает в себя экспрессирование высококомпактного маркера/суицидального гена, который объединяет эпитопы-мишени как из антигена CD32, так и из CD20, в CAR-экспрессирующих клетках, описанных в настоящем документе, который связывает ритуксимаб, что приводит к селективному истощению CAR-экспрессирующих клеток, например, посредством ADCC (смотри, например, Philip et al., Blood. 2014; 124(8)1277-1287). Другие способы истощения CAR-экспрессирующих клеток, описанных в настоящем документе, включают введение CAMPATH®, моноклонального анти-CD52 антитела, которое селективно связывает и воздействует на зрелые лимфоциты, например, CAR-экспрессирующие клетки, для разрушения, например, посредством индуцирования ADCC. В других вариантах осуществления на CAR-экспрессирующие клетки можно селективно воздействовать с использованием лиганда CAR, например, антиидиотипического антитела. В некоторых вариантах осуществления антиидиотипическое антитело может вызывать эффекторную клеточную активность, например, активность ADCC или ADC, тем самым уменьшая количество CAR-экспрессирующих клеток. В других вариантах осуществления лиганд CAR, например, антиидиотипическое антитело, может быть связан со средством, которое индуцирует клеточный киллинг, например, токсином, что уменьшает количество CAR-экспрессирующих клеток. В качестве альтернативы, сами молекулы CAR могут быть выполнены таким образом, что можно регулировать активность, например, включать и выключать, как описано ниже.
В некоторых вариантах осуществления RCAR содержит набор полипептидов, обычно два в простейших вариантах осуществления, в которых компоненты стандартного CAR, описанного в настоящем документе, например, антигенсвязывающий домен и внутриклеточный сигнальный домен, разделены на отдельные полипептиды или элементы. В некоторых вариантах осуществления набор полипептидов включает в себя переключатель димеризации, который в присутствии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. Дополнительное описание и типичные конфигурации таких регулируемых CAR предлагаются в настоящем документе и в международной публикации № WO 2015/090229, настоящим включенной посредством ссылки во всей полноте.
В варианте осуществления RCAR содержит два полипептида или элемента: 1) внутриклеточный сигнальный элемент, содержащий внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, описанный в настоящем документе, и первый домен-переключатель; 2) антигенсвязывающий элемент, содержащий антигенсвязывающий домен, например, который воздействует на опухолевый антиген, описанный в настоящем документе, как описано в настоящем документе, и второй домен-переключатель. Необязательно, RCAR содержит трансмембранный домен, описанный в настоящем документе. В варианте осуществления трансмембранный домен может быть расположен на внутриклеточном сигнальном элементе, на антигенсвязывающем элементе или на обоих. (Если не указано иное, когда в настоящем документе описаны члены или элементы RCAR, порядок может быть таким, как приведено, но также включены и другие порядки. Другими словами, в варианте осуществления порядок таков, как он указан в тексте, но в других вариантах осуществления порядок может быть другим. Например, порядок элементов на одной стороне трансмембранной области может отличаться от примера, например, положение домена-переключателя относительно внутриклеточного сигнального домена может быть другим, например, обратным).
В варианте осуществления первый и второй домены-переключатели могут образовывать внутриклеточный или внеклеточный переключатель димеризации. В варианте осуществления переключатель димеризации может представлять собой переключатель гомодимеризации, например, когда первый и второй домены-переключатели являются одинаковыми, или переключатель гетеродимеризации, например, когда первый и второй домены-переключатели отличаются друг от друга.
В вариантах осуществления RCAR может содержать "мульти-переключатель". Мульти-переключатель может содержать домены-переключатели гетеродимеризации или домены-переключатели гомодимеризации. Мульти-переключатель содержит множество из, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 доменов-переключателей, независимо, на первом элементе, например, антигенсвязывающем элементе, и втором элементе, например, внутриклеточном сигнальном элементе. В варианте осуществления первый элемент может содержать множество первых доменов-переключателей, например, доменов-переключателей на основе FKBP, и второй элемент может содержать множество вторых доменов-переключателей, например, доменов-переключателей на основе FRB. В варианте осуществления первый элемент может содержать первый и второй домен-переключатель, например, домен-переключатель на основе FKBP и домен-переключатель на основе FRB, и второй элемент может содержать первый и второй домены-переключатели, например, домен-переключатель на основе FKBP и домен-переключатель на основе FRB.
В варианте осуществления внутриклеточный сигнальный элемент содержит один или несколько внутриклеточных сигнальных доменов, например, первичный внутриклеточный сигнальный домен и один или несколько костимулирующих сигнальных доменов.
В варианте осуществления антигенсвязывающий элемент может содержать один или несколько внутриклеточных сигнальных доменов, например, один или несколько костимулирующих сигнальных доменов. В варианте осуществления антигенсвязывающий элемент содержит множество, например, 2 или 3, костимулирующих сигнальных доменов, описанных в настоящем документе, например, выбранных из 4-1BB, CD28, CD27, ICOS и OX40, и в вариантах осуществления не содержит ни одного первичного внутриклеточного сигнального домена. В варианте осуществления антигенсвязывающий элемент содержит следующие костимулирующие сигнальные домены в направлении снаружи клетки внутрь: 4-1BB-CD27; 41BB-CD27; CD27-4-1BB; 4-1BB-CD28; CD28-4-1BB; OX40-CD28; CD28-OX40; CD28-4-1BB; или 4-1BB-CD28. В таких вариантах осуществления внутриклеточный связывающий элемент содержит домен из CD3-дзета. В одном таком варианте осуществления RCAR содержит (1) антигенсвязывающий элемент, содержащий антигенсвязывающий домен, трансмембранный домен и два костимулирующих домена, и первый домен-переключатель; и (2) внутриклеточный сигнальный домен, содержащий трансмембранный домен или связывающий с мембраной домен и по меньшей мере один первичный внутриклеточный сигнальный домен, и второй домен-переключатель.
Вариант осуществления предлагает RCAR, в котором антигенсвязывающий элемент не связан с поверхностью клетки с CAR. Это позволяет клетке, имеющей внутриклеточный сигнальный элемент, удобно спариваться с одним или несколькими антигенсвязывающими доменами без трансформации клетки последовательностью, которая кодирует антигенсвязывающий элемент. В таких вариантах осуществления RCAR содержит: 1) внутриклеточный сигнальный элемент, содержащий: первый домен-переключатель, трансмембранный домен, внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, и первый домен-переключатель; и 2) антигенсвязывающий элемент, содержащий: антигенсвязывающий домен и второй домен-переключатель, причем антигенсвязывающий элемент не содержит трансмембранный домен или связывающий с мембраной домен, и, необязательно, не содержит внутриклеточный сигнальный домен. В некоторых вариантах осуществления RCAR может дополнительно содержать 3) второй антигенсвязывающий элемент, содержащий: второй антигенсвязывающий домен, например, второй антигенсвязывающий домен, который связывает антиген, отличный от того, который связывается антигенсвязывающим доменом; и второй домен-переключатель.
Также в настоящем документе предлагаются RCAR, в которых антигенсвязывающий элемент имеет способность к биспецифическим активации и таргетированию. В данном варианте осуществления антигенсвязывающий элемент может содержать множество, например, 2, 3, 4 или 5, антигенсвязывающих доменов, например, scFv, причем каждый антигенсвязывающий домен связывается с антигеном-мишенью, например, различными антигенами или одним и тем же антигеном, например, одними и теми же или различными эпитопами на одном и том же антигене. В варианте осуществления множество антигенсвязывающих доменов образуют тандем, и, необязательно, линкер или шарнирная область расположены между антигенсвязывающими доменами. Подходящие линкеры и шарнирные области описаны в настоящем документе.
Вариант осуществления предлагает RCAR, имеющие конфигурацию, которая позволяет переключать пролиферацию. В данном варианте осуществления RCAR содержит: 1) внутриклеточный сигнальный элемент, содержащий: необязательно, трансмембранный домен или связывающий с мембраной домен; один или несколько костимулирующих сигнальных доменов, например, выбранных из 4-1BB, CD28, CD27, ICOS и OX40, и домен-переключатель; и 2) антигенсвязывающий элемент, содержащий: антигенсвязывающий домен, трансмембранный домен и первичный внутриклеточный сигнальный домен, например, домен из CD3-дзета, причем антигенсвязывающий элемент не содержит домен-переключатель или не содержит домен-переключатель, который димеризуется с доменом-переключателем на внутриклеточном сигнальном элементе. В варианте осуществления антигенсвязывающий элемент не содержит костимулирующий сигнальный домен. В варианте осуществления внутриклеточный сигнальный элемент содержит домен-переключатель из переключателя гомодимеризации. В варианте осуществления внутриклеточный сигнальный элемент содержит первый домен-переключатель переключателя гетеродимеризации, и RCAR содержит второй внутриклеточный сигнальный элемент, который содержит второй домен-переключатель переключателя гетеродимеризации. В таких вариантах осуществления второй внутриклеточный сигнальный элемент содержит те же внутриклеточные сигнальные домены, что и внутриклеточный сигнальный элемент. В варианте осуществления переключатель димеризации является внутриклеточным. В варианте осуществления переключатель димеризации является внеклеточным.
В любой из конфигураций RCAR, описанных в настоящем документе, первый и второй домены-переключатели содержат переключатель на основе FKBP-FRB, как описано в настоящем документе.
Также в настоящем документе предлагаются клетки, содержащие RCAR, описанный в настоящем документе. Любую клетку, которая сконструирована для экспрессии RCAR, можно использовать в качестве RCARX-клетки. В варианте осуществления RCARX-клетка представляет собой T-клетку и называется RCART-клеткой. В варианте осуществления RCARX-клетка представляет собой NK-клетку и называется RCARN-клеткой.
Также в настоящем документе предлагаются нуклеиновые кислоты и векторы, содержащие кодирующие RCAR последовательности. Последовательность, кодирующая различные элементы RCAR, может быть расположена на той же молекуле нуклеиновой кислоты, например, тех же плазмиде или векторе, например, вирусном векторе, например, лентивирусном векторе. В варианте осуществления (i) последовательность, кодирующая антигенсвязывающий элемент, и (ii) последовательность, кодирующая внутриклеточный сигнальный элемент, могут присутствовать на одной и той же нуклеиновой кислоте, например, векторе. Производство соответствующих белков может быть получено, например, посредством использования отдельных промоторов или посредством использования бицистронного продукта транскрипции (что может приводить к производству двух белков посредством расщепления одного продукта трансляции или посредством трансляции двух отдельных белковых продуктов). В варианте осуществления последовательность, кодирующая расщепляемый пептид, например, последовательность P2A или F2A, расположена между (i) и (ii). В варианте осуществления последовательность, кодирующая IRES, например, IRES EMCV или EV71, расположена между (i) и (ii). В этих вариантах осуществления (i) и (ii) транскрибируются как одна РНК. В варианте осуществления первый промотор функционально связан с (i), и второй промотор функционально связан с (ii), так что (i) и (ii) транскрибируются как отдельные мРНК.
В качестве альтернативы, последовательности, кодирующие различные элементы RCAR, могут быть расположены на различных молекулах нуклеиновой кислоты, например, различных плазмидах или векторах, например, вирусных векторах, например, лентивирусных векторах. Например, (i) последовательность, кодирующая антигенсвязывающий элемент, может присутствовать на первой нуклеиновой кислоте, например, первом векторе, и (ii) последовательность, кодирующая внутриклеточный сигнальный элемент, может присутствовать на второй нуклеиновой кислоте, например, втором векторе.
Переключатели димеризации
Переключатели димеризации могут быть нековалентными или ковалентными. В нековалентном переключателе димеризации молекула димеризации стимулирует нековалентное взаимодействие между доменами-переключателями. В ковалентном переключателе димеризации молекула димеризации стимулирует ковалентное взаимодействие между доменами-переключателями.
В варианте осуществления RCAR содержит переключатель димеризации на основе FKBP/FRAP или FKBP/FRB. FKBP12 (FKBP или связывающий FK506 белок) представляет собой распространенный цитоплазматический белок, который служит в качестве первоначальной внутриклеточной мишени для природного иммуносупрессивного препарата рапамицина. Рапамицин связывается с FKBP и с большим гомологом PI3K FRAP (RAFT, mTOR). FRB представляет собой часть FRAP длиной 93 аминокислоты, которой достаточно для связывающий комплекса FKBP-рапамицин (Chen, J., Zheng, X. F., Brown, E. J. & Schreiber, S. L. (1995) Identification of an 11-kDa FKBP12-rapamycin-binding domain within the 289-kDa FKBP12-rapamycin-associated protein and characterization of a critical serine residue. Proc Natl Acad Sci USA 92: 4947-51).
В вариантах осуществления переключатель на основе FKBP/FRAP, например, FKBP/FRB, может использовать молекулу димеризации, например, рапамицин или аналог рапамицина.
Аминокислотная последовательность FKBP имеет следующий вид:
D V P D Y A S L G G P S S P K K K R K V S R G V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S Y (SEQ ID NO: 148)
В вариантах осуществления домен-переключатель FKBP может содержать фрагмент FKBP, обладающий способностью связываться с FRB или его фрагментом или аналогом в присутствии рапамицина или рапалога, например, выделенную часть SEQ ID NO: 148, которая представляет собой:
V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S (SEQ ID NO: 149)
Аминокислотная последовательность FRB имеет следующий вид:
ILWHEMWHEG LEEASRLYFG ERNVKGMFEV LEPLHAMMER GPQTLKETSF NQAYGRDLME AQEWCRKYMK SGNVKDLTQA WDLYYHVFRR ISK (SEQ ID NO: 150)
"Переключатель на основе FKBP/FRAP, например, FKBP/FRB", как этот термин используют в настоящем документе, относится к переключателю димеризации, содержащему: первый домен-переключатель, который содержит фрагмент FKBP или его аналог, обладающий способностью связываться с FRB или его фрагментом или аналогом в присутствии рапамицина или рапалога, например, RAD001, и который идентичен по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% последовательности FKBP в соответствии с SEQ ID NO: 148 или 149 или отличается от нее не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток; и второй домен-переключатель, который содержит фрагмент FRB или его аналог, обладающий способностью связываться с FRB или его фрагментом или аналогом в присутствии рапамицина или рапалога, и который идентичен по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% последовательности FRB в соответствии с SEQ ID NO: 150 или отличается от нее не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток. В варианте осуществления RCAR, описанный в настоящем документе, содержит один домен-переключатель, который содержит аминокислотные остатки, раскрытые в SEQ ID NO: 148 (или SEQ ID NO: 149), и один домен-переключатель, который содержит аминокислотные остатки, раскрытые в SEQ ID NO: 150.
В вариантах осуществления переключатель димеризации FKBP/FRB содержит модифицированный домен-переключатель FRB, который демонстрирует изменение, например, увеличение, образования комплекса между доменом-переключателем на основе FRB, например, модифицированным доменом-переключателем FRB, доменом-переключателем на основе FKBP и молекулой димеризации, например, рапамицином или рапалогом, например, RAD001. В варианте осуществления модифицированный домен-переключатель FRB содержит одну или несколько мутаций, например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, выбранных из мутаций в аминокислотном положении(ях) L2031, E2032, S2035, R2036, F2039, G2040, T2098, W2101, D2102, Y2105 и F2108, в которых аминокислота дикого типа мутировала в любую другую природную аминокислоту. В варианте осуществления мутантный FRB содержит мутацию в E2032, где E2032 мутировала в фенилаланин (E2032F), метионин (E2032M), аргинин (E2032R), валин (E2032V), тирозин (E2032Y), изолейцин (E2032I), например, SEQ ID NO: 151, или лейцин (E2032L), например, SEQ ID NO: 152. В варианте осуществления мутантный FRB содержит мутацию в T2098, где T2098 мутировала в фенилаланин (T2098F) или лейцин (T2098L), например, SEQ ID NO: 153. В варианте осуществления мутантный FRB содержит мутацию в E2032 и в T2098, где E2032 мутировала в любую аминокислоту, и где T2098 мутировала в любую аминокислоту, например, SEQ ID NO: 154. В варианте осуществления мутантный FRB содержит мутации E2032I и T2098L, например, SEQ ID NO: 155. В варианте осуществления мутантный FRB содержит мутации E2032L и T2098L, например, SEQ ID NO: 156.
Таблица 10. Типичный мутантный FRB, обладающий повышенной аффинностью к молекуле димеризации.
Другие подходящие переключатели димеризации включают переключатель димеризации на основе GyrB-GyrB, переключатель димеризации на основе гиббереллина, переключатель димеризации на основе tag/binder и переключатель димеризации на основе halo-tag/snap-tag. При следовании рекомендациям, предлагаемым в настоящем документе, такие переключатели и соответствующие молекулы димеризации будут очевидны для среднего специалиста.
Молекула димеризации
Связи между доменами-переключателями способствует молекула димеризации. В присутствии молекулы димеризации взаимодействие или связь между доменами-переключателями делает возможной трансдукцию сигнала между полипептидом, ассоциированным, например, слитым, с первым доменом-переключателем, и полипептидом, ассоциированным, например, слитым, со вторым доменом-переключателем. В присутствии неограничивающих уровней молекулы димеризации трансдукция сигнала повышается в 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 5, 10, 50, 100 раз, например, при измерении в системе, описанной в настоящем документе.
Рапамицин и аналоги рапамицина (иногда называемые рапалогами), например, RAD001, можно использовать в качестве молекул димеризации в переключателе димеризации на основе FKBP/FRB, описанном в настоящем документе. В варианте осуществления молекула димеризации может быть выбрана из рапамицина (сиролимуса), RAD001 (эверолимуса), зотаролимуса, темсиролимуса, AP-23573 (ридафоролимуса), биолимуса и AP21967. Дополнительные аналоги рапамицина, подходящие для использования с переключателем димеризации на основе FKBP/FRB описаны далее в разделе, озаглавленном "Комбинированные терапии", или в подразделе, озаглавленном "Комбинация с низкой иммуностимулирующей дозой ингибитора mTOR".
Расщепленный CAR
В некоторых вариантах осуществления экспрессирующая CAR клетка использует расщепленный CAR. Подход расщепленного CAR описан более подробно в публикациях WO2014/055442 и WO2014/055657, включенных в настоящий документ посредством ссылки. Кратко говоря, система расщепленного CAR содержит клетку, экспрессирующую первый CAR, имеющий первый антигенсвязывающий домен и костимулирующий домен (например, 41BB), и данная клетка также экспрессирует второй CAR, имеющий второй антигенсвязывающий домен и внутриклеточный сигнальный домен (например, CD3-дзета). Когда клетка встречает первый антиген, костимулирующий домен активируется, и клетка пролиферирует. Когда клетка встречает второй антиген, внутриклеточный сигнальный домен активируется, и запускается активность клеточного киллинга. Таким образом, экспрессирующая CAR клетка полностью активируется только в присутствии обоих антигенов. В вариантах осуществления первый антигенсвязывающий домен распознает CD33, например, содержит антигенсвязывающий домен, описанный в настоящем документе, и второй антигенсвязывающий домен распознает антиген, экспрессируемый на клетках острого миелоидного лейкоза, например, CD123, CLL-1, CD34, FLT3 или фолатный рецептор-бета. В вариантах осуществления первый антигенсвязывающий домен распознает CD33, например, содержит антигенсвязывающий домен, описанный в настоящем документе, и второй антигенсвязывающий домен распознает антиген, экспрессируемый на B-клетках, например, CD19, CD20, CD22 или ROR1.
Стабильность и мутации
Стабильность CD33-связывающего домена, например, молекул scFv (например, растворимого scFv), может быть оценена по отношению к биофизическим свойствам (например, термостабильности) обычной контрольной молекулы scFv или полноразмерного антитела. В одном варианте осуществления человеческий scFv имеет термостабильность, которая больше чем на приблизительно 0,1, приблизительно 0,25, приблизительно 0,5, приблизительно 0,75, приблизительно 1, приблизительно 1,25, приблизительно 1,5, приблизительно 1,75, приблизительно 2, приблизительно 2,5, приблизительно 3, приблизительно 3,5, приблизительно 4, приблизительно 4,5, приблизительно 5, приблизительно 5,5, приблизительно 6, приблизительно 6,5, приблизительно 7, приблизительно 7,5, приблизительно 8, приблизительно 8,5, приблизительно 9, приблизительно 9,5, приблизительно 10 градусов, приблизительно 11 градусов, приблизительно 12 градусов, приблизительно 13 градусов, приблизительно 14 градусов или приблизительно 15 градусов Цельсия, чем у контрольной связывающей молекулы (например, обычной молекулы scFv) в описанных анализах.
Улучшенная термостабильность CD33-связывающего домена, например, scFv, затем передается всему конструкту CAR33, что ведет к улучшению терапевтических свойств конструкта CAR33. Термостабильность CD33-связывающего домена, например, scFv, может быть улучшена по меньшей мере приблизительно на 2°C или 3°C по сравнению с обычным антителом. В одном варианте осуществления CD33-связывающий домен, например, scFv, имеет улучшенную на 1°C термостабильность по сравнению с обычным антителом. В другом варианте осуществления CD33-связывающий домен, например, scFv, имеет улучшенную на 2°C термостабильность по сравнению с обычным антителом. В другом варианте осуществления scFv имеет улучшенную на 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15°C термостабильность по сравнению с обычным антителом. Можно сравнивать, например, молекулы scFv, раскрытые в настоящем документе, и полноразмерные антитела. Термостабильность может быть измерена с использованием способов, известных в данной области техники. Например, в одном варианте осуществления может быть измерена Tm. Способы измерения Tm и другие способы определения стабильности белков описаны более подробно ниже.
Мутации в scFv изменяют стабильность scFv и улучшают общую стабильность scFv и конструкта CAR33. Стабильность гуманизированного или человеческого scFv определяют с использованием измерений, таких как Tm, температурная денатурация и температурная агрегация.
Связывающая способность мутантных scFv может быть определена с использованием спосбов анализа, описанных в примерах.
В одном варианте осуществления CD33-связывающий домен, например, scFv, содержит по меньшей мере одну такую мутацию, что мутировавший scFv придает улучшенную стабильность конструкту CAR33. В другом варианте осуществления CD33-связывающий домен, например, scFv, содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мутаций, возникающих из-за процесса гуманизации, таких, что мутировавший scFv придает улучшенную стабильность конструкту CAR33.
Способы оценки стабильности белка
Стабильность антигенсвязывающего домена может быть оценена с использованием, например, способов, описанных ниже. Такие способы обеспечивают определение множества тепловых переходов разворачивания, при которых наименее стабильный домен или разворачивается первым, или ограничивает общий порог стабильности многодоменной единицы, которая разворачивается совместно (например, многодоменного белка, который демонстрирует единственный переход разворачивания). Наименее стабильный домен может быть идентифицирован рядом дополнительных способов. Для исследования того, какой из доменов ограничивает общую стабильность, может быть осуществлен мутагенез. Кроме того, может быть использована резистентность многодоменного белка к протеазам в условиях, когда благодаря ДСК или другим спектроскопическим способам известно, что наименее стабильный домен внутренне развернут (Fontana, et al., (1997) Fold. Des., 2: R17-26; Dimasi et al. (2009) J. Mol. Biol. 393: 672-692). Когда идентифицирован наименее стабильный домен, последовательность, кодирующая данный домен (или его часть), может быть использована в данных способах в качестве тестовой последовательности.
a) Термостабильность
Термостабильность композиций может быть проанализирована с использованием ряда неограничивающих биофизических или биохимических методов, известных в данной области техники. В определенных вариантах осуществления термостабильность оценивают с помощью аналитической спектроскопии.
Типичным способом аналитической спектроскопии является дифференциальная сканирующая калориметрия (ДСК). ДСК использует калориметр, который чувствителен к поглощению тепла, которое сопровождает разворачивание большинства белков или белковых доменов (смотри, например, Sanchez-Ruiz, et al., Biochemistry, 27: 1648-52, 1988). Для определения термостабильности белка образец белка вводят в калориметр, и повышают температуру до тех пор, пока Fab или scFv не развернется. Температура, при которой белок разворачивается, указывает на общую стабильность белка.
Другим типичным способом аналитической спектроскопии является спектроскопия кругового дихроизма (КД). КД-спектрометрия измеряет оптическую активность композиции как функцию повышения температуры. Спектроскопия кругового дихроизма (КД) измеряет различия поглощения левополяризованного света по сравнению с правополяризованным светом, которое возникает вследствие структурной асимметрии. Беспорядочная или развернутая структура приводит к спектру КД, очень отличающемуся от спектра упорядоченной или свернутой структуры. Спектр КД отражает чувствительность белков к денатурирующему воздействию повышения температуры и поэтому указывает на термостабильность белка (смотри van Mierlo and Steemsma, J. Biotechnol., 79(3):281-98, 2000).
Другим типичным способом аналитической спектроскопии для измерения термостабильности является флуоресцентная эмиссионная спектроскопия (смотри van Mierlo and Steemsma выше). Еще одним типичным способом аналитической спектроскопии для измерения термостабильности является спектроскопия ядерного магнитного резонанса (ЯМР) (смотри, например, van Mierlo and Steemsma выше).
Термостабильность композиции может быть измерена биохимически. Типичным биохимическим способом оценки термостабильности является анализ с тепловой нагрузкой. В "анализе с тепловой нагрузкой" композицию подвергают диапазону повышенных температур в течение заданного периода времени. Например, в одном варианте осуществления тестируемые молекулы scFv или молекулы, содержащие молекулы scFv, подвергают диапазону повышающихся температур, например, в течение 1-1,5 часов. Затем анализируют активность белка с помощью подходящего биохимического анализа. Например, если белок представляет собой связывающий белок (например, scFv или scFv-содержащий полипептид), может быть определена активность связывания связывающего белка посредством функционального или количественного ELISA.
Такой анализ может быть проведен в высокопроизводительном формате и в форматах, раскрытых в примерах с использованием E. coli и высокопроизводительного скрининга. Библиотека CD33-связывающих доменов, например, вариантов scFv, может быть создана с использованием способов, известных в данной области техники. Можно индуцировать экспрессию CD33-связывающих доменов, например, scFv, и можно подвергать CD33-связывающие домены, например, scFv, тепловой нагрузке. Протестированные образцы, подвергавшиеся нагрузке, могут быть проанализированы на связывание, и те CD33-связывающие домены, например, scFv, которые окажутся стабильными, могут быть воспроизведены в большем количестве и дополнительно охарактеризованы.
Термостабильность оценивают посредством измерения температуры плавления (Tm) композиции с использованием любого из вышеуказанных способов (например, способов аналитической спектроскопии). Температура плавления представляет собой температуру в средней точке кривой теплового перехода, где 50% молекул композиции находятся в свернутом состоянии (смотри, например, Dimasi et al. (2009) J. Mol Biol. 393: 672-692). В одном варианте осуществления значения Tm для CD33-связывающего домена, например, scFv, составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C. В одном варианте осуществления значения Tm для IgG составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C. В одном варианте осуществления значения Tm для многовалентного антитела составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C.
Термостабильность также оценивают посредством измерения удельной теплоемкости или теплоемкости (Cp) композиции с использованием аналитического калориметрического способа (например, ДСК). Удельная теплоемкость композиции представляет собой энергию (например, в ккал/моль), требуемую для увеличения на 1°C температуры 1 моля воды. Большая Cp является признаком денатурированной или неактивной белковой композиции. Изменение теплоемкости (ΔCp) композиции измеряют посредством определения удельной теплоемкости композиции до и после ее теплового перехода. Термостабильность можно также оценивать посредством измерения или определения других параметров термодинамической стабильности, включая свободную энергию Гиббса для разворачивания (ΔG), энтальпию разворачивания (ΔH) или энтропию разворачивания (ΔS). Один или несколько из вышеуказанных биохимических анализов (например, анализ с тепловой нагрузкой) используют для определения температуры (то есть значения TC), при которой 50% композиции сохраняет свою активность (например, активность связывания).
Кроме того, мутации в CD33-связывающем домене, например, scFv, изменяют термостабильность CD33-связывающего домена, например, scFv, по сравнению с немутантным CD33-связывающим доменом, например, scFv. Когда гуманизированный или человеческий CD33-связывающий домен, например, scFv, включен в конструкт CAR33, CD33-связывающий домен, например, гуманизированный или человеческий scFv, придает термостабильность всему конструкту CAR к CD33. В одном варианте осуществления CD33-связывающий домен, например, scFv, содержит одну мутацию, которая придает термостабильность CD33-связывающему домену, например, scFv. В другом варианте осуществления CD33-связывающий домен, например, scFv, содержит множество мутаций, которые придают термостабильность CD33-связывающему домену, например, scFv. В одном варианте осуществления множество мутаций в CD33-связывающем домене, например, scFv, оказывают аддитивное воздействие на термостабильность CD33-связывающего домена, например, scFv.
b) % Агрегации
Стабильность композиции может быть определена посредством измерения ее склонности к агрегации. Агрегация может быть измерена с помощью ряда неограничивающих биохимических или биофизических способов. Например, агрегация композиции может быть оценена с использованием хроматографии, например, эксклюзионной хроматографии (SEC). SEC разделяет молекулы на основании размера. Колонку заполняют полутвердыми гранулами полимерного геля, которые будут принимать внутрь себя ионы и небольшие молекулы, но не большие молекулы. Когда белковую композицию наносят сверху колонки, компактно свернутые белки (то есть неагрегированные белки) распределяются по большему объему растворителя, чем доступно для больших белковых агрегатов. Следовательно, большие агрегаты движутся через колонку быстрее, и, таким образом, смесь может быть разделена или фракционирована на свои компоненты. Каждая фракция может быть по-отдельности количественно определена (например, посредством светорассеяния), когда она элюирует из геля. Соответственно, % агрегации композиции может быть определен посредством сравнения концентрации в фракции с общей концентрацией белка, нанесенного на гель. Стабильные композиции элюируют из колонки как по существу одна фракция и выглядят как по существу один пик на профиле элюирования или хроматограмме.
c) Аффинность связывания
Стабильность композиции можно оценивать посредством определения аффинности ее связывания с мишенью. В данной области техники известно большое множество способов определения аффинности связывания. Типичный способ определения аффинности связывания использует поверхностный плазмонный резонанс. Поверхностный плазмонный резонанс представляет собой оптическое явление, которое делает возможным анализ биоспецифических взаимодействий в реальном времени посредством детектирования изменений концентраций белка в биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.). Для дальнейшего описания смотри Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26; Jonsson, U., i (1991) Biotechniques 11:620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8:125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277.
В одном аспекте антигенсвязывающий домен CAR содержит аминокислотную последовательность, которая гомологична аминокислотной последовательности антигенсвязывающего домена, описанной в настоящем документе, и антигенсвязывающий домен сохраняет желаемые функциональные свойства фрагментов антител к CD33, описанных в настоящем документе. В одном конкретном аспекте композиция CAR настоящего изобретения содержит фрагмент антитела. В другом аспекте этот фрагмент антитела содержит scFv.
В различных аспектах антигенсвязывающий домен CAR конструируют посредством модификации одной или нескольких аминокислот в одной или обеих вариабельных областях (например, VH и/или VL), например, в одной или нескольких областях CDR и/или в одной или нескольких каркасных областях. В одном конкретном аспекте композиция CAR настоящего изобретения содержит фрагмент антитела. В другом аспекте этот фрагмент антитела содержит scFv.
Среднему специалисту в данной области техники будет понятно, что антитело или фрагмент антитела настоящего изобретения могут быть дополнительно модифицированы так, что у них изменяется аминокислотная последовательность (например, от дикого типа), но не желаемая активность. Например, в белке могут быть сделаны дополнительные замены нуклеотидов, ведущие к аминокислотным заменам в "несущественных" аминокислотных остатках, например, несущественный аминокислотный остаток в молекуле может быть заменен другим аминокислотным остатком из того же семейства боковых цепей. В другом варианте осуществления цепочка аминокислот может быть заменена структурно схожей цепочкой, которая отличается порядком и/или композицией членов семейства боковых цепей, например, может быть сделана консервативная замена, при которой аминокислотный остаток заменен на аминокислотный остаток, имеющий схожую боковую цепь.
В данной области техники определены семейства аминокислотных остатков, имеющих схожие боковые цепи, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
Процентная идентичность в контексте двух или более нуклеиновокислотных или полипептидных последовательностей относится к двум или более последовательностям, которые являются одинаковыми. Две последовательности являются "по существу идентичными", если две последовательности имеют указанную процентную долю аминокислотных остатков или нуклеотидов, которые являются одинаковыми (например, идентичность 60%, необязательно идентичность 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% по указанной области или, если не она указана, по всей последовательности) при сравнении и выравнивании для максимального соответствия по окну сравнения или обозначенной области при измерении с использованием одного из следующих алгоритмов сравнения последовательностей или посредством ручного выравнивания и визуального исследования. Необязательно, идентичность существует по области, которая имеет длину по меньшей мере приблизительно 50 нуклеотидов (или 10 аминокислот), или, более предпочтительно, по области, которая имеет длину от 100 до 500 или 1000 или более нуклеотидов (или 20, 50, 200 или более аминокислот).
Для сравнения последовательностей обычно одна последовательность выполняет роль эталонной последовательности, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей тестируемые и эталонную последовательности вводят в компьютер, обозначают координаты подпоследовательностей, если необходимо, и назначают программные параметры алгоритма последовательностей. Можно использовать программные параметры по умолчанию, или могут быть назначены альтернативные параметры. Затем алгоритм сравнения последовательностей вычисляет процентную идентичность последовательности для тестируемых последовательностей относительно эталонной последовательности на основании программных параметров. Способы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для сравнения может быть проведено, например, посредством алгоритма локальной гомологии Smith и Waterman, (1970) Adv. Appl. Math. 2:482c, посредством алгоритма выравнивания гомологий Needleman и Wunsch, (1970) J. Mol. Biol. 48:443, посредством поиска метода подобия Pearson и Lipman, (1988) Proc. Nat'l. Acad. Sci. USA 85:2444, посредством компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) или посредством ручного выравнивания и визуального исследования (смотри, например, Brent et al., (2003) Current Protocols in Molecular Biology).
Двумя примерами алгоритмов, которые подходят для определения процентной доли идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, который описаны в Altschul et al., (1977) Nuc. Acids Res. 25:3389-3402; и Altschul et al., (1990) J. Mol. Biol. 215:403-410, соответственно. Программное обеспечение для выполнения анализов BLAST публично доступно через Национальный центр информации по биотехнологии.
Процентная идентичность между двумя аминокислотными последовательностями может также быть определена с использованием алгоритма E. Meyers и W. Miller, (1988) Comput. Appl. Biosci. 4:11-17, который включен в программу ALIGN (версии 2.0), с использованием таблицы остатков веса PAM120, штрафа за удлинение пропуска, равного 12, и штрафа за пропуск, равного 4. Кроме того, процентная идентичность между двумя аминокислотными последовательностями может быть определена с использованием алгоритма Needleman и Wunsch (1970) J. Mol. Biol. 48:444-453, который был включен в программу GAP в пакете программного обеспечения GCG (доступен на www.gcg.com), с использованием или матрицы Blossom 62, или матрицы PAM250 и веса пропуска, равного 16, 14, 12, 10, 8, 6 или 4, и веса удлинения, равного 1, 2, 3, 4, 5 или 6.
В одном аспекте настоящее изобретение предусматривает модификации исходной аминокислотной последовательности антитела или фрагмента (например, scFv), которые создают функционально эквивалентные молекулы. Например, VH или VL CD33-связывающего домена, например, scFv, входящего в CAR, могут быть модифицированы с сохранением идентичности по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% от исходной каркасной области VH или VL CD33-связывающего домена, например, scFv. Настоящее изобретение предусматривает модификации всего конструкта CAR, например, модификации в одной или нескольких аминокислотных последовательностях различных доменов конструкта CAR, для того чтобы создавать функционально эквивалентные молекулы. Конструкт CAR может быть модифицирован с сохранением идентичности по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% от исходного конструкта CAR.
РНК-трансфекция
В настоящем документе раскрыты способы получения транскрибируемой in vitro РНК CAR. Настоящее изобретение также включает в себя кодирующий CAR РНК-конструкт, который может быть непосредственно трансфицирован в клетку. Способ генерирования мРНК для использования в трансфекции может включать в себя in vitro транскрипцию (IVT) матрицы со специально сконструированными праймерами, за чем следует присоединение поли-A для получения конструкта, содержащего 3'- и 5'-нетранслируемую последовательность ("НТО"), 5'-кэп и/или участок внутренней посадки рибосомы (IRES), подлежащую экспрессии нуклеиновую кислота и поли-A хвост, обычно длиной 50-2000 оснований (SEQ ID NO: 35). Получаемая таким образом РНК может эффективно трансфицировать различные типы клеток. В одном аспекте матрица включает в себя последовательности для CAR.
В одном аспекте CAR к CD33 кодируется информационной РНК (мРНК). В одном аспекте мРНК, кодирующую CAR к CD33, вводят в иммунную эффекторную клетку (например, T-клетку или NK-клетку) для получения экспрессирующей CAR клетки (например, CART-клетки или экспрессирующей CAR NK-клетки).
В одном варианте осуществления транскрибируемая in vitro РНК CAR может быть введена в клетку как форма временной трансфекции. РНК получают посредством in vitro транскрипции с использованием генерируемой полимеразной цепной реакцией (ПЦР) матрицы. Представляющая интерес ДНК из любого источника может быть непосредственно превращена посредством ПЦР в матрицу для in vitro синтеза мРНК с использованием подходящих праймеров и РНК-полимеразы. Источник ДНК может представлять собой, например, геномную ДНК, плазмидную ДНК, фаговую ДНК, кДНК, синтетическую последовательность ДНК или любой другой подходящий источник ДНК. Желаемой матрицей для in vitro транскрипции является CAR настоящего изобретения. Например, матрица для РНК CAR содержит внеклеточную область, содержащую одноцепочечный вариабельный домен противоопухолевого антитела; шарнирную область, трансмембранный домен (например, трансмембранный домен из CD8a); и цитоплазматическую область, которая включает в себя внутриклеточный сигнальный домен, например, содержащий сигнальный домен из CD3-дзета и сигнальный домен из 4-1BB.
В одном варианте осуществления ДНК для использования для ПЦР содержит открытую рамку считывания. ДНК может происходить от природной последовательности ДНК из генома организма. В одном варианте осуществления нуклеиновая кислота может включать в себя некоторые или все из 5'- и/или 3'-нетранслируемых областей (НТО). Нуклеиновая кислота может включать в себя экзоны и интроны. В одном варианте осуществления ДНК для использования для ПЦР представляет собой человеческую последовательность нуклеиновой кислоты. В другом варианте осуществления ДНК для использования для ПЦР представляет собой человеческую последовательность нуклеиновой кислоты, включающую в себя 5'- и 3'-НТО. ДНК может альтернативно представлять собой искусственную последовательность ДНК, которая обычно не экспрессируется в природном организме. Типичной искусственной последовательностью ДНК является содержащая части генов, которые лигированы вместе с образованием открытой рамки считывания, которая кодирует белок слияния. Части ДНК, которые лигированы вместе, могут происходить из одного организма или из более чем одного организма.
ПЦР используют для создания матрицы для in vitro транскрипции мРНК, которую используют для трансфекции. Способы осуществления ПЦР хорошо известны в данной области техники. Праймеры для использования в ПЦР конструируют так, чтобы они имели области, которые по существу комплементарны областям ДНК, подлежащей использованию в качестве матрицы для ПЦР. "По существу комплементарный", как используется в настоящем документе, относится к последовательностям нуклеотидов, в которых большинство или все из оснований в последовательности праймеров комплементарны, или одно или несколько оснований некомплементарны или не совпадают. По существу комплементарные последовательности способны к отжигу или гибридизации с предполагаемой ДНК-мишенью при условиях отжига, используемых для ПЦР. Праймеры могут быть сконструированы так, чтобы они были по существу комплементарны любой части матрицы ДНК. Например, праймеры могут быть сконструированы для амплификации части нуклеиновой кислоты, которая обычно транскрибируется в клетках (открытая рамка считывания), включая 5'- и 3'-НТО. Праймеры также могут быть сконструированы для амплификации части нуклеиновой кислоты, которая кодирует конкретный домен, представляющий интерес. В одном варианте осуществления праймеры конструируют для амплификации кодирующей области человеческой кДНК, включая все или части 5'- и 3'-НТО. Праймеры, подходящие для ПЦР, могут быть сгенерированы с помощью синтетических способов, которые хорошо известны в данной области техники. "Прямые праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны нуклеотидам на матрице ДНК, которые расположены в обратном направлении от последовательности ДНК, которая должна быть амплифицирована. "В обратном направлении" используют в настоящем документе для обозначения локализации 5' по отношению к последовательности ДНК, подлежащей амплификации, относительно кодирующей нити. "Обратные праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны двухнитевой матрице ДНК, которая расположена в прямом направлении от последовательности ДНК, которая должна быть амплифицирована. "В прямом направлении" используют в настоящем документе для обозначения локализации 3' по отношению к последовательности ДНК, подлежащей амплификации, относительно кодирующей нити.
В способах, раскрытых в настоящем документе, можно использовать любую ДНК-полимеразу, подходящую для ПЦР. Реагенты и полимераза коммерчески доступны из ряда источников.
Также можно использовать химические структуры со способностью обеспечения стабильности и/или эффективности трансляции. РНК, предпочтительно, содержит 5'- и 3'-НТО. В одном варианте осуществления 5'-НТО имеет длину между одним и 3000 нуклеотидов. Длину последовательностей 5'- и 3'-НТО, подлежащих присоединению к кодирующей области, можно изменять различными способами, включая, но без ограничения, конструирование праймеров для ПЦР, которые отжигаются на различных областях НТО. Используя этот подход, средний специалист в данной области техники может модифицировать длины 5'- и 3'-НТО, требуемые для достижения оптимальной эффективности трансляции после трансфекции транскрибируемой РНК.
5'- и 3'-НТО могут представлять собой природные эндогенные 5'- и 3'-НТО для представляющей интерес нуклеиновой кислоты. В качестве альтернативы, последовательности НТО, которые являются не эндогенными для представляющей интерес нуклеиновой кислоты, могут быть присоединены посредством включения последовательностей НТО в прямые и обратные праймеры или посредством любых других модификаций матрицы. Использование последовательностей НТО, которые являются не эндогенными для представляющей интерес нуклеиновой кислоты, может подходить для модификации стабильности и/или эффективности трансляции РНК. Например, известно, что богатые AU элементы в последовательностях 3'-НТО могут уменьшать стабильность мРНК. Поэтому, 3'-НТО могут быть выбраны или сконструированы для увеличения стабильности транскрибируемой РНК на основании свойств НТО, которые хорошо известны в данной области техники.
В одном варианте осуществления 5'-НТО может содержать последовательность Козак эндогенной нуклеиновой кислоты. В качестве альтернативы, когда 5'-НТО, которая является не эндогенной для представляющей интерес нуклеиновой кислоты, добавляют посредством ПЦР, как описано выше, консенсусная последовательность Козак может быть повторно сконструирована посредством присоединения последовательности 5'-НТО. Последовательности Козак могут увеличивать эффективность трансляции некоторых РНК-транскриптов, но, по-видимому, не являются необходимыми для всех РНК для обеспечения эффективной трансляции. В данной области техники известна необходимость в последовательностях Козак для многих мРНК. В других вариантах осуществления 5'-НТО может представлять собой 5'-НТО РНК-вируса, РНК-геном которого стабилен в клетках. В других вариантах осуществления можно использовать различные аналоги нуклеотидов в 3'- или 5'-НТО для препятствования экзонуклеазной деградации мРНК.
Для обеспечения синтеза РНК из матрицы ДНК без необходимости в клонировании генов, к матрице ДНК в обратном направлении по отношению к подлежащей транскрипции последовательности должен быть прикреплен промотор транскрипции. Когда последовательность, которая функционирует в качестве промотора для РНК-полимеразы, присоединяют к 5'-концу прямого праймера, промотор РНК-полимеразы становится включенным в продукт ПЦР в обратном направлении от открытой рамки считывания, которая подлежит транскрипции. В одном предпочтительном варианте осуществления промотор представляет собой промотор полимеразы T7, как описано в другом месте в настоящем документе. Другие подходящие промоторы включают, но без ограничения, промоторы РНК-полимераз T3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6 известны в данной области техники.
В предпочтительном варианте осуществления мРНК имеет как кэп на 5'-конце, так и 3'-поли(A)-хвост, что определяет связывание рибосомы, инициацию трансляции и стабильность мРНК в клетке. На кольцевой матрице ДНК, например, плазмидной ДНК, РНК-полимераза производит длинный конкатемерный продукт, который не подходит для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной с конца 3'-НТО, приводит к мРНК нормального размера, которая не эффективна в эукариотической трансфекции, даже если ее полиаденилировать после транскрипции.
На линейной матрице ДНК РНК-полимераза фага T7 может удлинять 3'-конец трнаскрипта за пределами последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270:1485-65 (2003).
Обычным способом интеграции поли-A/T-удлинений в матрицу ДНК является молекулярное клонирование. Однако поли-A/T-последовательность, интегрированная в плазмидную ДНК, может вызывать нестабильность плазмиды, и поэтому плазмидные матрицы ДНК, полученные из бактериальных клеток, часто сильно загрязнены делециями и другими аберрациями. Это делает процедуры клонирования не только трудоемкими и требующими времени, но часто и не надежными. Поэтому очень желателен способ, который позволит конструировать матрицы ДНК с поли-A/T-3'-удлинением без клонирования.
Поли-A/T-сегмент транскрипционной матрицы ДНК может быть получен во время ПЦР посредством использования обратного праймера, содержащего поли-T-хвост, такой как 100T-хвост (SEQ ID NO: 31) (размер может составлять 50-5000 T (SEQ ID NO: 32)), или после ПЦР посредством любого другого способа, включая, но без ограничения, лигирование ДНК или in vitro рекомбинацию. Поли(A)-хвосты также обеспечивают стабильность РНК и уменьшают ее деградацию. Обычно длина поли(A)-хвоста положительно коррелирует со стабильностью транскрибируемой РНК. В одном варианте осуществления поли(A)-хвост составляет между 100 и 5000 аденозинов (SEQ ID NO: 33).
Поли(A)-хвосты РНК могут быть дополнительно удлинены после in vitro транскрипции с использованием поли(A)-полимеразы, такой как поли-A-полимераза E. coli (E-PAP). В одном варианте осуществления увеличение длины поли(A)-хвоста от 100 нуклеотидов до 300-400 нуклеотидов (SEQ ID NO: 34) приводит к приблизительно двукратному повышению эффективности трансляции РНК. Кроме того, стабильность мРНК может увеличивать присоединение различных химических групп к 3'-концу. Такое присоединение может содержать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, с использованием поли(A)-полимеразы можно вводить в поли(A)-хвост аналоги АТФ. Аналоги АТФ могут дополнительно увеличивать стабильность РНК.
5'-кэпы также придают стабильность молекулам РНК. В предпочтительном варианте осуществления РНК, получаемые посредством способов, раскрытых в настоящем документе, включают в себя 5'-кэп. 5'-кэп обеспечивают с использованием способов, известных в данной области техники и описанных в настоящем документе (Cougot, et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski, et al., РНК, 7:1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
РНК, получаемые посредством способов, раскрытых в настоящем документе, могут также содержать последовательность участка внутренней посадки рибосомы (IRES). Последовательность IRES может представлять собой любую вирусную, хромосомную или искусственно сконструированную последовательность, которая инициирует кэп-независимое связывание рибосомы с мРНК и облегчает инициацию трансляции. Могут быть включены любые растворенные вещества, подходящие для электропорации клеток, которые могут содержать факторы, облегчающие клеточную проницаемость и жизнеспособность, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
РНК может быть введена в клетки-мишени с использованием любого из ряда различных способов, например, коммерчески доступных способов, которые включают, но без ограничения, электропорацию (Amaxa Nucleofector-II (Amaxa Biosystems, Cologne, Германия)), ECM 830 (BTX) (Harvard Instruments, Boston, Mass.) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendort, Hamburg, Германия), опосредованную катионными липосомами трансфекцию с использованием липофекции, полимерную инкапсуляцию, опосредованную пептидами трансфекцию или системы биолистической доставки частиц, такие как "генные пушки" (смотри, например, Nishikawa, et al. Hum Gene Ther., 12(8):861-70 (2001).
Невирусные способы доставки
В некоторых аспектах можно использовать невирусные способы для доставки нуклеиновой кислоты, кодирующей CAR, описанный в настоящем документе, в клетку, или ткань, или субъекта.
В некоторых вариантах осуществления невирусный способ включает в себя использование транспозона (также называемого подвижным элементом). В некоторых вариантах осуществления транспозон представляет собой фрагмент ДНК, который может встраиваться в некотором местоположении в геноме, например, фрагмент ДНК, который способен к саморепликации и встраиванию своей копии в геном, или фрагмент ДНК, который может быть вырезан из более длинной нуклеиновой кислоты и вставлен в геном в другом месте. Например, транспозон содержит последовательность ДНК, состоящую из инвертированных повторов, фланкирующих гены для транспозиции.
Типичные способы доставки нуклеиновой кислоты с использованием транспозона включают систему транспозона Sleeping Beauty (SBTS) и систему транспозона piggyBac (PB). Смотри, например, документы Aronovich et al. Hum. Mol. Genet. 20.R1(2011):R14-20; Singh et al. Cancer Res. 15(2008):2961-2971; Huang et al. Mol. Ther. 16(2008):580-589; Grabundzija et al. Mol. Ther. 18(2010):1200-1209; Kebriaei et al. Blood. 122.21(2013):166; Williams. Molecular Therapy 16.9(2008):1515-16; Bell et al. Nat. Protoc. 2.12(2007):3153-65; и Ding et al. Cell. 122.3(2005):473-83, которые включены в настоящий документ посредством ссылки.
SBTS включает в себя два компонента: 1) транспозон, содержащий трансген, и 2) источник фермента транспозазы. Транспозаза может перемещать транспозон из плазмиды-носителя (или другого донора ДНК) в ДНК-мишень, такую как хромосома/геном клетки-хозяина. Например, транспозаза связывается с плазмидой-носителем/донором ДНК, вырезает транспозон (включая трансген(ы)) из плазмиды и вставляет его в геном клетки-хозяина. Смотри, например, Aronovich et al. выше.
Типичные транспозоны включают транспозон на основе pT2. Смотри, например, документы Grabundzija et al. Nucleic Acids Res. 41,3(2013):1829-47; и Singh et al. Cancer Res. 68,8(2008): 2961-2971, которые включены в настоящий документ посредством ссылки. Типичные транспозазы включают транспозазу типа Tc1/mariner, например, транспозазу SB10 или транспозазу SB11 (гиперактивную транспозазу, которая может экспрессироваться, например, от промотора цитомегаловируса). Смотри, например, документы Aronovich et al.; Kebriaei et al.; и Grabundzija et al., которые включены в настоящий документ посредством ссылки.
Использование SBTS обеспечивает эффективную интеграцию и экспрессию трансгена, например, нуклеиновой кислоты, кодирующей CAR, описанный в настоящем документе. В настоящем документе предлагаются способы генерирования клетки, например, T-клетки или NK-клетки, которая стабильно экспрессирует CAR, описанный в настоящем документе, например, с использованием системы транспозона, такой как SBTS.
В соответствии со способами, описанными в настоящем документе, в некоторых вариантах осуществления одну или несколько нуклеиновых кислот, например, плазмид, содержащих компоненты SBTS, доставляют в клетку (например, T- или NK-клетку). Например, нуклеиновую кислоту(ы) доставляют с помощью стандартных способов доставки нуклеиновых кислот (например, плазмидной ДНК), например, способов, описанных в настоящем документе, например, электропорации, трансфекции или липофекции. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген, например, нуклеиновую кислоту, кодирующую CAR, описанный в настоящем документе. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген (например, нуклеиновую кислоту, кодирующую CAR, описанный в настоящем документе), а также последовательность нуклеиновой кислоты, кодирующей фермент транспозазу. В других вариантах осуществления предлагается система с двумя нуклеиновыми кислотами, например, двухплазмидная система, например, в которой первая плазмида содержит транспозон, содержащий трансген, а вторая плазмида содержит последовательность нуклеиновой кислоты, кодирующую фермент транспозазу. Например, первую и вторую нуклеиновые кислоты совместно доставляют в клетку-хозяина.
В некоторых вариантах осуществления создают клетки, например, T- или NK-клетки, которые экспрессируют CAR, описанный в настоящем документе, посредством использования комбинации вставки гена с помощью SBTS и генетического редактирования с помощью нуклеазы (например, нуклеаз с цинковым пальцем (ZFN), эффекторных нуклеаз, подобных активаторам транскрипции (TALEN), системы CRISPR/Cas или реконструированных в сконструированные мегануклеазы хоуминг-эндонуклеаз).
В некоторых вариантах осуществления использование невирусного способа доставки позволяет перепрограммировать клетки, например, T- или NK-клетки, и направить введение клеток в субъекта. Преимущества невирусных векторов включают, но без ограничения, легкость и относительно низкую стоимость получения достаточных количеств, необходимых для удовлетворения популяции пациентов, стабильность во время хранения и отсутствие иммуногенности.
Конструкты нуклеиновой кислоты, кодирующие CAR
Настоящее изобретение предлагает также молекулы нуклеиновой кислоты, кодирующие один или несколько конструктов CAR, описанных в настоящем документе. В одном аспекте предлагается молекула нуклеиновой кислоты в виде транскрипта информационной РНК. В одном аспекте молекула предлагается нуклеиновой кислоты в виде ДНК-конструкта.
Соответственно, в одном аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR), причем CAR содержит CD33-связывающий домен (например, гуманизированный или человеческий связывающий CD33 домен), трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, например, костимулирующий сигнальный домен и/или первичный сигнальный домен, например, дзета-цепь. В одном варианте осуществления CD33-связывающий домен представляет собой CD33-связывающий домен, описанный в настоящем документе, например, CD33-связывающий домен, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39-47, или последовательность, идентичную ей на 95-99%. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, например, описанного в настоящем документе, например, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность в соответствии с SEQ ID NO: 6 или последовательность, идентичную ей на 95-99%. В одном варианте осуществления CD33-связывающий домен соединен с трансмембранным доменом шарнирной областью, например, шарниром, описанным в настоящем документе. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, или последовательность, идентичную ей на 95-99%. В одном варианте осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, например, описанного в настоящем документе, например, выбранного из группы, состоящей из молекулы ГКГС класса I, белков-рецепторов ФНО, иммуноглобулин-подобных белков, цитокиновых рецепторов, интегринов, сигнальных лимфоцит-активирующих молекул (SLAM-белков), активирующих рецепторов NK-клеток, BTLA, рецептора толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83. В одном варианте осуществления костимулирующий домен содержит последовательность в соответствии с SEQ ID NO: 7 или последовательность, идентичную ей на 95-99%. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен из 4-1BB и функциональный сигнальный домен из CD3-дзета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 7 или SEQ ID NO: 8 или последовательность, идентичную ей на 95-99%, и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10 или последовательность, идентичную ей на 95-99%, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи.
В другом аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкт CAR, содержащий лидерную последовательность в соответствии с SEQ ID NO: 1, домен scFv, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO:39-47 (или последовательность, идентичную ей на 95-99%), шарнирную область в соответствии с SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5 (или последовательность, идентичную ей на 95-99%), трансмембранный домен, имеющий последовательность в соответствии с SEQ ID NO: 6 (или последовательность, идентичную ей на 95-99%), костимулирующий домен из 4-1BB, имеющий последовательность в соответствии с SEQ ID NO: 7, или костимулирующий домен из CD27, имеющий последовательность в соответствии с SEQ ID NO: 8 (или последовательность, идентичную ей на 95-99%), или костимулирующий домен из CD28, имеющий последовательность в соответствии с SEQ ID NO: 379 (или последовательность, идентичную ей на 95-99%), или костимулирующий домен из ICOS, имеющий последовательность в соответствии с SEQ ID NO: 381 (или последовательность, идентичную ей на 95-99%), и стимулирующий домен из CD3-дзета, имеющий последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10 (или последовательность, идентичную ей на 95-99%).
В другом аспекте настоящее изобретение относится к выделенной полипептидной молекуле, кодируемой молекулой нуклеиновой кислоты. В одном варианте осуществления выделенная полипептидная молекула содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 48-56, или последовательность, идентичную ей на 95-99%.
В другом аспекте настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей молекулу химерного антигенного рецептора (CAR), которая содержит CD33-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, причем упомянутый CD33-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 75-83, или последовательность, идентичную ей на 95-99%. В одном варианте осуществления кодируемая молекула CAR дополнительно содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранного из группы, состоящей из молекулы ГКГС класса I, белков-рецепторов ФНО, иммуноглобулин-подобных белков, цитокиновых рецепторов, интегринов, сигнальных лимфоцит-активирующих молекул (SLAM-белков), активирующих рецепторов NK-клеток, BTLA, рецептора толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83. В одном варианте осуществления костимулирующий домен содержит последовательность в соответствии с SEQ ID NO: 7. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154, KIR2DS2, OX40, CD2, CD27, LFA-1 (CD11a и CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, IL2R-β, IL2R-g (обычно гамма), IL7R-α, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, NKG2D, NKG2C, DNAM1 (CD226), SLAMF4, (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR и PAG/Cbp.
В одном варианте осуществления трансмембранный домен содержит последовательность в соответствии с SEQ ID NO: 6. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен из 4-1BB и функциональный сигнальный домен дзета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 7 и последовательность в соответствии с SEQ ID NO: 9, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи. В одном варианте осуществления CD33-связывающий домен соединен с трансмембранным доменом шарнирной областью. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 2. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5.
В другом аспекте настоящее изобретение относится к кодируемой молекуле CAR, содержащей лидерную последовательность в соответствии с SEQ ID NO: 1, домен scFv, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 39-47, или последовательность, идентичную ей на 95-99%, шарнирную область в соответствии с SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, трансмембранный домен, имеющий последовательность в соответствии с SEQ ID NO: 6, костимулирующий домен из 4-1BB, имеющий последовательность в соответствии с SEQ ID NO: 7, или костимулирующий домен из CD27, имеющий последовательность в соответствии с SEQ ID NO: 8, и стимулирующий домен из CD3-дзета, имеющий последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10. В одном варианте осуществления кодируемая молекула CAR содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 48-56, или последовательность, идентичную ей на 95-99%.
Последовательности нуклеиновой кислоты, кодирующие желаемые молекулы, могут быть получены с использованием рекомбинантных способов, известных в данной области техники, таких как, например, с помощью скрининга библиотек клеток, экспрессирующих данный ген, с помощью получения гена из вектора, о котором известно, что он включает его в себя, или с помощью выделения непосредственно из содержащих его клеток и тканей с использованием стандартных методов. В качестве альтернативы, представляющий интерес ген может быть произведен синтетически, а не клонирован.
Настоящее изобретение предлагает также векторы, в которые введена ДНК настоящего изобретения. Векторы, происходящие от ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения долгосрочного переноса генов, поскольку они обеспечивают продолжительную стабильную интеграцию трансгена и его распространение в дочерних клетках. Лентивирусные векторы имеют дополнительное преимущество над векторами, происходящими от онкоретровирусов, таких как вирусы мышиного лейкоза, заключающееся в том, они могут трансдуцировать непролиферирующие клетки, такие как гепатоциты. Они также имеют дополнительное преимущество низкой иммуногенности. Ретровирусный вектор может также представлять собой, например, гаммаретровирусный вектор. Гаммаретровирусный вектор может включать в себя, например, промотор, сигнал упаковки (Ψ), участок связывания праймера (PBS), один или несколько (например, два) длинных концевых повторов (LTR) и представляющий интерес трансген, например, ген, кодирующий CAR. У гаммаретровирусного вектора могут отсутствовать вирусные структурные гены, такие как gag, pol и env. Типичные гаммаретровирусные векторы включают вирус мышиного лейкоза (MLV), вирус некроза селезенки (SFFV) и вирус миелопролиферативной саркомы (MPSV) и векторы, происходящие от них. Другие гаммаретровирусные векторы описаны, например, в документе Tobias Maetzig et al., "Gammaretroviral Vectors: Biology, Technology and Application", Viruses. 2011 Jun; 3(6): 677-713.
В другом варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR настоящего изобретения, представляет собой аденовирусный вектор (A5/35). В другом варианте осуществления экспрессия нуклеиновых кислот, кодирующих CAR, может быть осуществлена с использованием транспозонов, таких как Sleeping Beauty, crisp, CAS9 и нуклеаз с цинковым пальцем. Смотри ниже документ June et al. 2009, Nature Reviews Immunology 9.10: 704-716, включенный в настоящий документ посредством ссылки.
В кратком изложении, экспрессия природных или синтетических нуклеиновых кислот, кодирующих CAR, обычно достигается посредством функционального связывания нуклеиновой кислоты, кодирующей полипептид CAR или его части, с промотором и включения конструкта в вектор экспрессии. Векторы могут подходить для репликации и интеграции в эукариотах. Типичные векторы клонирования содержат терминаторы транскрипции и трансляции, последовательности инициации и промоторы, подходящие для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
Экспрессионные конструкты настоящего изобретения можно также использовать для иммунизации нуклеиновой кислотой и генной терапии с использованием стандартных протоколов доставки генов. Способы доставки генов известны в данной области техники. Смотри, например, патенты США №№ 5399346, 5580859, 5589466, включенные посредством ссылки в настоящий документ во всей полноте. В другом варианте осуществления настоящее изобретение предлагает вектор для генной терапии.
Нуклеиновая кислота может быть клонирована в множество типов векторов. Например, нуклеиновая кислота может быть клонирована в вектор, включая, но без ограничения, плазмиду, фагмиду, производное фага, вирус животных и космиду. Векторы, представляющие особый интерес, включают векторы экспрессии, векторы репликации, векторы для создания зондов и векторы для секвенирования.
Затем вектор экспрессии может быть предоставлен клетке в форме вирусного вектора. Технология вирусных векторов хорошо известна в данной области техники и описана, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY, и в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые подходят в качестве векторов, включают, но без ограничения, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. В общем случае, подходящий вектор содержит точку начала репликации, функционирующую по меньшей мере в одном организме, последовательность промотора, удобные сайты эндонуклеазной рестрикции и один или несколько селектируемых маркеров (например, WO 01/96584; WO 01/29058; и патент США № 6326193).
Был разработан ряд систем на основе вирусов для переноса генов в клетки млекопитающих. Например, ретровирусы обеспечивают удобную платформу для систем доставки генов. Выбранный ген может быть введен в вектор и упакован в ретровирусные частицы с использованием способов, известных в данной области техники. Рекомбинантный вирус может быть затем выделен и доставлен в клетки субъекта или in vivo, или ex vivo. В данной области техники известен ряд ретровирусных систем. В некоторых вариантах осуществления используют аденовирусные векторы. В данной области техники известен ряд аденовирусных векторов. В одном варианте осуществления используют лентивирусные векторы.
Дополнительные элементы промоторов, например, энхансеры, регулируют частоту инициации транскрипции. Обычно они расположены в области 30-110 п.о. в обратном направлении от сайта начала, хотя было показано, что ряд промоторов также содержат функциональные элементы в прямом направлении от сайта начала. Расстояние между элементами промоторов часто является гибким, так что функция промотора сохраняется, когда элементы инвертированы или перемещены друг относительно друга. В промоторе тимидинкиназы (tk) расстояние между элементами промоторов можно увеличивать до 50 п.о. друг от друга, пока активность не начнет снижаться. Оказывается, что в зависимости от промотора отдельные элементы могут функционировать для активации транскрипции или вместе, или независимо. Типичные промоторы включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK).
Примером промотора, который способен к экспрессии трансгена CAR в T-клетке млекопитающего, является промотор EF1a. Нативный промотор EF1a управляет экспрессией альфа-субъединицы комплекса фактора элонгации-1, который отвечает за ферментативную доставку аминоацилированных тРНК рибосоме. Промотор EF1a широко используется в плазмидах для экспрессии в млекопитающих, и было показано, что он эффективен при управлении экспрессией CAR из трансгенов, клонированных лентивирусный вектор. Смотри, например, Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). В одном аспекте промотор EF1a содержит последовательность, определенную как SEQ ID NO: 11.
Другим примером промотора является последовательность немедленно-раннего промотора цитомегаловируса (CMV). Эта последовательность промотора представляет собой последовательность сильного конститутивного промотора, способного к управлению высокими уровнями экспрессии любой полинуклеотидной последовательности, функционально связанной с ним. Однако можно также использовать последовательности других конститутивных промоторов, включая, но без ограничения, ранний промотор вируса обезьян 40 (SV40), мышиный вирус опухоли молочной железы (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса птичьего лейкоза, немедленно-ранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, а также промоторы человеческих генов, такое как, но без ограничения, промотор актина, промотор миозина, промотор фактора элонгации-1α, промотор гемоглобина и промотор креатинкиназы. Кроме того, настоящее изобретение не должно быть ограничено использованием конститутивных промоторов. Индуцируемые промоторы также рассматриваются как часть настоящего изобретения. Использование индуцируемого промотора обеспечивает молекулярный переключатель, способный к включению экспрессии полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия желательна, или к выключению экспрессии, когда экспрессия нежелательна. Примеры индуцируемых промоторов включают, но без ограничения, промотор металлотионеина, промотор глюкокортикоидов, промотор прогестерона и промотор тетрациклина.
Другим примером промотора является промотор фосфоглицераткиназы (PGK). В вариантах осуществления может быть желательным усеченный промотор PGK (например, промотор PGK с одной или несколькими, например, 1, 2, 5, 10, 100, 200, 300 или 400, делециями нуклеотидов по сравнению с последовательностью промотора PGK дикого типа). Нуклеотидные последовательности типичных промоторов PGK приведены ниже.
Промотор WT PGK
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCGCGGCGACGCAAAGGGCCTTGGTGCGGGTCTCGTCGGCGCAGGGACGCGTTTGGGTCCCGACGGAACCTTTTCCGCGTTGGGGTTGGGGCACCATAAGCT
(SEQ ID NO: 384)
Типичные усеченные промоторы PGK:
PGK100:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTG
(SEQ ID NO: 385)
PGK200:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACG
(SEQ ID NO: 386)
PGK300:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCG
(SEQ ID NO: 387)
PGK400:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCG
(SEQ ID NO: 388)
Вектор может также включать в себя, например, сигнальную последовательность для облегчения секреции, сигнал полиаденилирования и терминатор транскрипции (например, из гена бычьего гормона роста (BGH)), элемент, обеспечивающий эписомальную репликацию и репликацию в прокариотах (например, происходящий из SV40 и ColE1 или другие, известные в данной области техники), и/или элементы для обеспечения селекции (например, ген резистентности к ампициллину и/или маркер зеоцин).
Для того чтобы оценить экспрессию полипептида CAR или его частей, вектор экспрессии, подлежащий введению в клетку, может также содержать или ген селектируемого маркера, или репортерный ген, или и тот, и другой для облегчения идентификации и селекции экспрессирующих клеток из популяции клеток, которые пытались трансфицировать или инфицировать посредством вирусных векторов. В других аспектах селектируемый маркер может располагаться на отдельном фрагменте ДНК и использоваться в процедуре котрансфекции. Как селектируемые маркеры, так и репортерные гены могут быть фланкированы подходящими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Подходящие селектируемые маркеры включают, например, гены резистентности к антибиотикам, такие как neo и тому подобные.
Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценки функциональных свойств регуляторных последовательностей. В общем случае, репортерный ген представляет собой ген, который не присутствует или не экспрессируется реципиентными организмом или тканью, и который кодирует полипептид, экспрессия которого проявляется в некотором легко детектируемом свойстве, например, ферментативной активности. Экспрессию репортерного гена оценивают в подходящий момент времени после того, как ДНК была введена в реципиентные клетки. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфеникол-ацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters 479: 79-82). Подходящие системы экспрессии хорошо известны и могут быть приготовлены с использованием известных способов или получены коммерчески. В общем случае, в качестве промотора идентифицируют конструкт с минимальной 5'-фланкирующей областью, показывающий наивысший уровень экспрессии репортерного гена. Такие области промотора могут быть связаны с репортерным геном и могут использоваться для оценки средств на способность к модулированию промотор-управляемой транскрипции.
В одном варианте осуществления вектор может дополнительно содержать нуклеиновую кислоту, кодирующую второй CAR. В одном варианте осуществления второй CAR включает в себя антигенсвязывающий домен к мишени, экспрессируемой на клетках острого миелоидного лейкоза, такой как, например, CD123, CD34, CLL-1, FLT3 или фолатный рецептор-бета. В одном варианте осуществления вектор содержит последовательность нуклеиновой кислоты, кодирующую первый CAR, который специфически связывает первый антиген и включает в себя внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и нуклеиновой кислоты, кодирующей второй CAR, который специфически связывает второй, отличающийся, антиген и включает в себя внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. В одном варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR к CD33, который включает в себя CD33-связывающий домен, трансмембранный домен и костимулирующий домен, и нуклеиновую кислоту, кодирующую второй CAR, который специфически связывает антиген, отличный от CD33 (например, антиген, экспрессируемый на клетках ОМЛ, например, CD123, CD34, CLL-1, FLT3 или фолатный рецептор-бета), и включает в себя антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR к CD33, который включает в себя CD33-связывающий домен, трансмембранный домен и первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, который специфически связывает антиген, отличный от CD33 (например, антиген, экспрессируемый на клетках ОМЛ, например, CD123, CLL-1, CD34, FLT3 или фолатный рецептор-бета), и включает в себя антигенсвязывающий домен к данному антигену, трансмембранный домен и костимулирующий сигнальный домен.
В одном варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую CAR к CD33, описанный в настоящем документе, и нуклеиновую кислоту, кодирующую ингибирующий CAR. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, который связывает антиген, обнаруживаемый на нормальных клетках, но не на раковых клетках, например, на нормальных клетках, которые также экспрессируют CD33. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибирующей молекулы. Например, внутриклеточный домен ингибирующего CAR может представлять собой внутриклеточный домен PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета.
В вариантах осуществления вектор может содержать две или более последовательности нуклеиновой кислоты, кодирующие CAR, например, CAR к CD33, описанный в настоящем документе, и второй CAR, например, ингибирующий CAR или CAR, который специфически связывается с антигеном, отличным от CD33 (например, с антигеном, экспрессируемым на клетках ОМЛ, например, CD123, CLL-1, CD34, FLT3 или фолатным рецептором-бета). В таких вариантах осуществления две или более последовательности нуклеиновой кислоты, кодирующие CAR, кодируются одной нуклеиновой молекулой в одной рамке и в виде одной полипептидной цепи. В данном аспекте два или более CAR могут, например, быть разделены одним или нескольким сайтами расщепления пептида. (Например, сайтом автоматического расщепления или субстратом для внутриклеточной протеазы). Примеры сайтов расщепления пептида включают следующие, причем остатки GSG являются необязательными:
T2A: (GSG) E G R G S L L T C G D V E E N P G P (SEQ ID NO: 389)
P2A: (GSG) A T N F S L L K Q A G D V E E N P G P (SEQ ID NO: 390)
E2A: (GSG) Q C T N Y A L L K L A G D V E S N P G P (SEQ ID NO: 391)
F2A: (GSG) V K Q T L N F D L L K L A G D V E S N P G P (SEQ ID NO: 392)
В данной области техники известны способы введения и экспрессии генов в клетку. В контексте вектора экспрессии вектор может быть легко введен в клетку-хозяина, например, клетку млекопитающего, бактериальную, дрожжевую клетку или клетку насекомого, с помощью любого способа в данной области техники. Например, вектор экспрессии может быть перенесен в клетку-хозяина с помощью физических, химических или биологических средств.
Физические способы введения полинуклеотида в клетку-хозяина включают преципитацию фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и тому подобное. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области техники. Смотри, например, Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY). Предпочтительным способом введения полинуклеотида в клетку-хозяина является трансфекция фосфатом кальция.
Биологические способы введения полинуклеотида, представляющего интерес, в клетку-хозяина включают использование ДНК- и РНК-векторов. Вирусные векторы, и особенно ретровирусные векторы, стали наиболее широко используемым способом введения генов в клетки млекопитающего, например, человеческие. Другие вирусные векторы могут происходить от лентивируса, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и тому подобных. Смотри, например, патенты США №№ 5350674 и 5585362.
Химические средства введения полинуклеотида в клетку-хозяина включают коллоидные дисперсионные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии масло в воде, мицеллы, смешанные мицеллы и липосомы. Типичной коллоидной системой для использования в качестве носителя для доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула). Доступны другие способы направленной доставки нуклеиновых кислот современного уровня техники, такие как доставка полинуклеотидов с таргетными наночастицами или другая подходящая система доставки в субмикронном масштабе.
В случае, если используют невирусную систему доставки, типичным носителем для доставки является липосома. Предусмотрено использование липидных композиций для введения нуклеиновых кислот в клетку-хозяина (in vitro, ex vivo или in vivo). В другом аспекте нуклеиновая кислота может быть связана с липидом. Нуклеиновая кислота, связанная с липидом, может быть инкапсулирована в водном внутреннем пространстве липосомы, рассеяна в липидном бислое липосомы, прикреплена к липосоме с помощью связывающей молекулы, которая связана как с липосомой, так и с олигонуклеотидом, захвачена в липосому, связана в комплекс с липосомой, диспергирована в растворе, содержащем липид, смешана с липидом, объединена с липидом, может содержаться в виде суспензии в липиде, содержаться в мицелле или образовывать с ней комплекс или быть иначе связана с липидом. Соответствующие композиции липида, липида/ДНК или липида/вектора экспрессии не ограничены какой-либо конкретной структурой в растворе. Например, они могут присутствовать в структуре бислоя, в виде мицелл или со "схлопнувшейся" структурой. Они также могут просто быть рассеяны в растворе, возможно образуя агрегаты, которые не являются однородными по размеру и форме. Липиды представляют собой жирные вещества, которые могут представлять собой природные или синтетические липиды. Например, липиды включают жирные капли, которые естественным образом возникают в цитоплазме, а также класс соединений, которые содержат длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
Липиды, подходящие для использования, могут быть получены из коммерческих источников. Например, димиристилфосфатидилхолин ("DMPC") может быть получен от Sigma, St. Louis, MO; дицетилфосфат ("DCP") может быть получен от K & K Laboratories (Plainview, NY); холестерин ("Choi") может быть получен от Calbiochem-Behring; димиристилфосфатидилглицерин ("DMPG") и другие липиды могут быть получены от Avanti Polar Lipids, Inc. (Birmingham, AL). Маточные растворы липидов в хлороформе или смеси хлороформ/метанол можно хранить при приблизительно -20°C. Хлороформ используют в качестве единственного растворителя, так как он легче испаряется, чем метанол. "Липосома" является общим термином, охватывающим множество одно- и многослойных липидных носителей, образуемых посредством создания замкнутых липидных бислоев или агрегатов. Липосомы могут быть охарактеризованы как имеющие везикулярные структуры с фосфолипидной бислойной мембраной и внутренней водной средой. Многослойные липосомы содержат множество липидных слоев, разделенных водной средой. Они образуются спонтанно при суспендировании фосфолипидов в избытке водного раствора. Липидные компоненты претерпевают само-перегруппировку до образования замкнутых структур и захватывают воду и растворенные вещества между липидными бислоями (Ghosh et al., 1991 Glycobiology 5: 505-10). При этом, также охватываются композиции, которые имеют в растворе другие структуры, чем нормальная везикулярная структура. Например, липиды могут принимать мицеллярную структуру или просто существовать в виде неоднородных агрегатов липидных молекул. Также рассматриваются комплексы липофектамин-нуклеиновая кислота.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяина или иного воздействия ингибитора настоящего изобретения на клетку, для того чтобы подтвердить присутствие рекомбинантной последовательности ДНК в клетке-хозяине, может быть осуществлено множество анализов. Такие анализы включают, например, "молекулярные биологические" анализы, хорошо известные специалистам в данной области техники, такие как Саузерн- и нозерн-блоттинг, ПЦР-РВ и ПЦР; "биохимические" анализы, такие как детектирование присутствия или отсутствия конкретного пептида, например, с помощью иммунологических средств (ELISA и вестерн-блоттинги) или посредством анализов, описанных в настоящем документе, для идентификации средств, попадающих в пределы объема настоящего изобретения.
Настоящее изобретение дополнительно предлагает вектор, содержащий кодирующую CAR молекулу нуклеиновой кислоты. В одном аспекте вектор CAR может быть непосредственно трансдуцирован в клетку, например, иммунную эффекторную клетку, например, T-клетку или NK-клетку. В одном аспекте вектор представляет собой вектор клонирования или экспрессии, например, вектор, включающий, но без ограничения, один или несколько плазмидных (например, плазмиды экспрессии, векторы клонирования, миникольца, минивекторы, двойные микрохромосомы), ретровирусных и лентивирусных векторных конструктов. В одном аспекте вектор способен к экспрессии конструкта CAR в T-клетках млекопитающего. В одном аспекте T-клетка млекопитающего представляет собой человеческую T-клетку.
Источники клеток
Перед размножением и генетической модификацией из субъекта получают источник клеток (например, иммунные эффекторные клетки, например, T-клетки или NK-клетки). Термин "субъект" предназначается для включения в себя живых организмов, в которых может быть вызван иммунный ответ (например, млекопитающих). Примеры субъектов включают людей, собак, кошек, мышей, крыс и их трансгенные виды. T-клетки могут быть получены из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из участка инфицирования, асцит, плевральный выпот, ткань селезенки и опухоли.
В определенных аспектах настоящего изобретения может быть использовано любое количество линий иммунных эффекторных клеток (например, T-клеток или NK-клеток), доступных в данной области техники. В определенных аспектах настоящего изобретения T-клетки могут быть получены из единицы крови, отобранной у субъекта с использованием любого количества способов, известных специалисту, таких как разделение с помощью Ficoll™. В одном предпочтительном аспекте клетки из циркулирующей крови индивидуума получают посредством афереза. Продукт афереза обычно содержит лимфоциты, включая T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие белые кровяные клетки, красные кровяные клетки и тромбоциты. В одном аспекте клетки, отобранные с помощью афереза, могут быть промыты для удаления фракции плазмы и для помещения клеток в подходящий буфер или среду для последующих этапов обработки. В одном аспекте настоящего изобретения клетки промывают с помощью фосфатно-солевого буфера (ФСБ). В альтернативном аспекте в растворе для промывания отсутствует кальций, и может отсутствовать магний, или могут отсутствовать многие, если не не все двухвалентные катионы.
Первоначальные этапы активации в отсутствие кальция могут приводить к увеличению активации. Как легко поймут средние специалисты в данной области техники, этап промывания может быть выполнен посредством способов, известных специалистам в данной области техники, например, посредством использования полуавтоматической "проточной" центрифуги (например, обработчика клеток Cobe 2991, Baxter CytoMate или Haemonetics Cell Saver 5) в соответствии с инструкциями изготовителя. После промывания клетки могут быть ресуспендированы во множестве биосовместимых буферов, таких как, например, свободный от Ca, свободный от Mg ФСБ, PlasmaLyte A или другой солевой раствор с буфером или без. В качестве альтернативы, нежелательные компоненты образца афереза могут быть удалены, а клетки непосредственно ресуспендированы в культуральной среде.
Считается, что способы настоящей заявки могут использовать условия культуральной среды, содержащей 5% или менее, например, 2%, человеческой сыворотки AB, и использовать известные условия и композиции культуральной среды, например, описанные в документе Smith et al., "Ex vivo expansion of human T cells for adoptive immunotherapy using the novel Xeno-free CTS Immune Cell Serum Replacement" Clinical & Translational Immunology (2015) 4, e31; doi:10,1038/cti.2014,31.
В одном аспекте T-клетки выделяют из лимфоцитов периферической крови посредством лизирования красных кровяных клеток и истощения моноцитов, например, посредством центрифугирования в градиенте PERCOLLTM или посредством проточного элютриационного центрифугирования.
Конкретная субпопуляция T-клеток, такая как CD3+, CD28+, CD4+, CD8+, CD45RA+ и CD45RO+T-клетки, может быть также выделена посредством способов положительной или отрицательной селекции. Например, в одном аспекте T-клетки выделяют посредством инкубации с анти-CD3/анти-CD28 (например, 3×28)-конъюгированными гранулами, такими как DYNABEADS® M-450 CD3/CD28 T, в течение периода времени, достаточного для положительной селекции желаемых T-клеток. В одном аспекте период времени составляет приблизительно 30 минут. В другом аспекте период времени находится в диапазоне, включающем в себя от 30 минут до 36 часов или более и все промежуточные целочисленные значения. В другом аспекте период времени составляет по меньшей мере 1, 2, 3, 4, 5 или 6 часов. В еще одном предпочтительном аспекте период времени составляет от 10 до 24 часов. В одном аспекте период времени инкубации составляет 24 часа. Более продолжительное время инкубации можно использовать для выделения T-клеток в любой ситуации, в которой T-клеток мало по сравнению с другими типами клеток, например, при выделении проникающих в опухоль лимфоцитов (TIL) из опухолевой ткани или из иммунологически скомпрометированных индивидуумов. Кроме того, использование более продолжительного времени инкубации может увеличивать эффективность захвата CD8+ T-клеток. Таким образом, посредством простого сокращения или удлинения времени, в течение которого T-клеткам позволяют связываться с CD3/CD28 гранулами, и/или посредством увеличения или уменьшения отношения гранул к T-клеткам (как описано в настоящем документе далее), субпопуляции T-клеток могут быть преимущественно подвергнуты положительной или отрицательной селекции в начале культивирования или в других временных точках во время процесса. Кроме того, посредством увеличения или уменьшения отношения анти-CD3 и/или анти-CD28 антител на гранулах или другой поверхности субпопуляции T-клеток могут быть преимущественно подвергнуты положительной или отрицательной селекции в начале культивирования или в других желаемых временных точках. Специалисту будет ясно, что в контексте настоящего изобретения можно также использовать несколько раундов селекции. В определенных аспектах желательным может быть выполнение процедуры селекции и использование "неотселектированных" клеток в процессе активации и размножения. "Неотселектированные" клетки также можно подвергать последующим раундам селекции.
Обогащение популяции Т-клеток посредством отрицательной селекции может быть выполнено с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно селектируемых клеток. Одним способом является клеточная сортировка и/или селекция посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, которая использует коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на отрицательно селектируемых клетках. Например, для обогащения CD4+ клетками посредством отрицательной селекции коктейль моноклональных антител обычно включает в себя антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. В определенных аспектах могут быть желательными обогащение или положительная селекция регуляторных T-клеток, которые обычно экспрессируют CD4+, CD25+, CD62Lhi, GITR+ и FoxP3+. В качестве альтернативы, в определенных аспектах регуляторные T-клетки истощают с помощью анти-C25-конъюгированных гранул или другого аналогичного способа селекции.
Способы, описанные в настоящем документе, могут включать в себя, например, селекцию конкретной субпопуляции иммунных эффекторных клеток, например, T-клеток, которые представляют собой истощенную по регуляторным T-клеткам популяцию, истощенные по CD25+ клетки, с использованием, например, способа отрицательной селекции, например, описанного в настоящем документе. Предпочтительно, популяция, истощенная по регуляторным T-клеткам, содержит меньше чем 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток.
В одном варианте осуществления, регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с использованием анти-CD25 антитела, или его фрагмента, или CD25-связывающего лиганда, IL-2. В одном варианте осуществления анти-CD25 антитело, или его фрагмент, или CD25-связывающий лиганд конъюгируют с субстратом, например, гранулой, или иным образом наносят на субстрат, например, гранулу. В одном варианте осуществления анти-CD25 антитело или его фрагмент конъюгируют с субстратом, как описано в настоящем документе.
В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с использованием реагента для истощения по CD25 от MiltenyiTM. В одном варианте осуществления отношение клеток к реагенту для истощения по CD25 составляет 1e7 клеток на 20 мкл, или 1e7 клеток на 15 мкл, или 1e7 клеток на 10 мкл, или 1e7 клеток на 5 мкл, или 1e7 клеток на 2,5 мкл, или 1e7 клеток на 1,25 мкл. В одном варианте осуществления, например, для регуляторных T-клеток, например, истощения по CD25+, используют больше чем 500 миллионов клеток на мл. В другом аспекте используют концентрацию клеток 600, 700, 800, или 900 миллионов клеток на мл.
В одном варианте осуществления популяция иммунных эффекторных клеток, подлежащих истощению, включает в себя приблизительно 6×109 CD25+ T-клеток. В других аспектах популяция иммунных эффекторных клеток, подлежащих истощению, включают в себя приблизительно от 1×109 до 1×1010 CD25+ T-клеток и любое промежуточное целочисленное значение. В одном варианте осуществления получаемая популяция регуляторных истощенных T-клеток содержит 2×109 регуляторных T-клеток, например, CD25+ клеток, или меньше (например, 1×109, 5×108, 1×108, 5×107, 1×107 или меньше CD25+ клеток).
В одном варианте осуществления регуляторные T-клетки, например, CD25+ клетки, удаляют из популяции с использованием системы CliniMAC с набором магистралей для истощения, таким как, например, магистрали 162-01. В одном варианте осуществления система CliniMAC выполняется с настройками для истощения, такими как, например, DEPLETION2.1.
Без ограничения конкретной теорией, уменьшение уровня отрицательных регуляторов иммунных клеток (например, уменьшение количества нежелательных иммунных клеток, например, TREG-клеток) у субъекта перед аферезом или во время производства экспрессирующего CAR клеточного продукта может снижать риск рецидива у субъекта. Например, в данной области техники известны способы истощения TREG-клеток. Способы уменьшения количества TREG-клеток включают, но без ограничения, циклофосфамид, анти-GITR антитело (анти-GITR антитело, описанное в настоящем документе), CD25-истощение и их комбинации.
В некоторых вариантах осуществления способы производства содержат уменьшение количества (например, истощение) TREG-клеток перед производством экспрессирующей CAR клетки. Например, способы производства содержат приведение образца, например, образца афереза, в контакт с анти-GITR антителом и/или анти-CD25 антителом (или его фрагментом или CD25-связывающим лигандом), например, для истощения TREG-клеток перед производством экспрессирующего CAR клеточного (например, T-клеточного, NK-клеточного) продукта.
В варианте осуществления субъект предварительно получает одну или несколько терапий, которые уменьшают количество TREG-клеток перед отбором клеток для производства экспрессирующего CAR клеточного продукта, что снижает риск рецидива у субъекта на лечение экспрессирующими CAR клетками. В варианте осуществления способы уменьшения количества TREG-клеток включают, но без ограничения, введение субъекту одного или нескольких из циклофосфамида, анти-GITR антитела, CD25-истощение или их комбинацию. Введение одного или нескольких из циклофосфамида, анти-GITR антитела, CD25-истощение или их комбинация могут осуществляться до, во время или после введения экспрессирующего CAR клеточного продукта.
В варианте осуществления субъект предварительно получает циклофосфамид перед отбором клеток для производства экспрессирующего CAR клеточного продукта, что снижает риск рецидива у субъекта на лечение экспрессирующими CAR клетками. В варианте осуществления субъект предварительно получает анти-GITR антитело перед отбором клеток для производства экспрессирующего CAR клеточного продукта, что снижает риск рецидива у субъекта на лечение экспрессирующими CAR клетками.
В одном варианте осуществления популяция клеток, подлежащая удалению, представляет собой не регуляторные T-клетки или опухолевые клетки, но клетки, которые иным образом отрицательно влияют на размножение и/или функцию CART-клеток, например, клетки, экспрессирующие CD14, CD11b, CD33, CD15 или другие маркеры, экспрессируемые потенциально иммуносупрессивными клетками. В одном варианте осуществления предусмотрено удаление таких клеток одновременно с регуляторными T-клетками и/или опухолевыми клетками, или после упомянутого истощения, или в другом порядке.
Способы, описанные в настоящем документе, могут включать в себя более чем один этап селекции, например, более чем один этап истощения. Обогащение T-клеточной популяции посредством отрицательной селекции может быть выполнено, например, с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно селектируемых клеток. Одним способом является клеточная сортировка и/или селекция посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, которая использует коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на отрицательно селектируемых клетках. Например, для обогащения CD4+ клетками посредством отрицательной селекции коктейль моноклональных антител может включать в себя антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8.
Способы, описанные в настоящем документе, могут дополнительно включать в себя удаление из популяции клеток, которые экспрессируют опухолевый антиген, например, опухолевый антиген, который не содержит CD25, например, CD19, CD30, CD38, CD123, CD20, CD14 или CD11b, для обеспечения таким образом популяции истощенных по T-регуляторам, например, истощенных по CD25+, и истощенных по опухолевому антигену клеток, которые подходят для экспрессии CAR, например, CAR, описанного в настоящем документе. В одном варианте осуществления экспрессирующие опухолевый антиген клетки удаляют одновременно с регуляторными T-клетками, например, CD25+ клетками. Например, анти-CD25 антитело или его фрагмент и антитело к противоопухолевому антигену или его фрагмент могут быть прикреплены к одному и тому же субстрату, например, грануле, который можно использовать для удаления клеток, или анти-CD25 антитело, или его фрагмент, или антитело к противоопухолевому антигену, или его фрагмент, могут быть прикреплены к отдельным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток, и удаление экспрессирующих опухолевый антиген клеток происходят последовательно и могут происходить, например, в любом порядке.
Также предлагаются способы, которые включают в себя удаление из популяции клеток, которые экспрессируют ингибитор контрольных точек, например, ингибитор контрольных точек, описанный в настоящем документе, например, одних или нескольких из PD1+ клеток, LAG3+ клеток и TIM3+ клеток, для обеспечения таким образом популяции истощенных по T-регуляторам, например, истощенных по CD25+, клеток, и истощенных по ингибитору контрольных точек клеток, например, истощенных по PD1+, LAG3+ и/или TIM3+ клеток. Типичные ингибиторы контрольных точек включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета. В одном варианте осуществления экспрессирующие ингибитор контрольных точек клетки удаляют одновременно с T-регуляторными, например, CD25+, клетками. Например, анти-CD25 антитело или его фрагмент и антитело к ингибитору контрольных точек или его фрагмент могут быть прикреплены к одной и той же грануле, которую можно использовать для удаления клеток, или анти-CD25 антитело или его фрагмент и антитело к ингибитору контрольных точек или его фрагмент могут быть прикреплены к отдельным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток, и удаление экспрессирующих ингибитор контрольных точек клеток происходят последовательно и могут происходить, например, в любом порядке.
В одном варианте осуществления может быть выбрана T-клеточная популяция, которая экспрессирует один или несколько из IFN-γ, TNF-α, IL-17A, IL-2, IL-3, IL-4, GM-CSF, IL-10, IL-13, гранзима B и перфорина или других подходящих молекул, например, других цитокинов. Способы скрининга клеточной экспрессии могут быть определены, например, с помощью способов, описанных в публикации PCT № WO 2013/126712.
Для выделения желаемой популяции клеток посредством положительной или отрицательной селекции можно варьировать концентрацию клеток и поверхности (например, частиц, таких как гранулы). В определенных аспектах может быть желательным значительное уменьшение объема, в котором смешаны вместе гранулы и клетки (например, увеличение концентрации клеток), для обеспечения максимального контакта клеток и гранул. Например, в одном аспекте используют концентрацию, составляющую 2 миллиарда клеток на мл. В одном аспекте используют концентрацию, составляющую 1 миллиард клеток на мл. В другом аспекте используют больше чем 100 миллионов клеток на мл. В другом аспекте используют концентрацию клеток, составляющую 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток на мл. В еще одном аспекте используют концентрацию клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток на мл. В других аспектах можно использовать концентрации, составляющие 125 или 150 миллионов клеток на мл.
Использование высоких концентрации может приводить к увеличению выхода клеток, активации клеток и размножения клеток. Кроме того, использование высоких концентраций клеток делает возможным более эффективный захват клеток, которые могут слабо экспрессировать антигены-мишени, представляющие интерес, таких как CD28-отрицательные T-клетки, или из образцов, в которых присутствует много опухолевых клеток (например, лейкозная кровь, опухолевая ткань и так далее). Такие популяции клеток могут иметь терапевтическое значение, и их было бы желательно получать. Например, использование высокой концентрации клеток делает возможной более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
В родственном аспекте может быть желательным использование более низких концентраций клеток. Посредством значительного разбавления смеси T-клеток и поверхности (например, частиц, таких как гранулы) минимизируют взаимодействия между частицами и клетками. Так отбирают клетки, которые экспрессируют большие количества желаемых антигенов, подлежащих связыванию с частицами. Например, CD4+ T-клетки экспрессируют более высокие уровни CD28 и эффективнее захватываются, чем CD8+ T-клетки в разбавленных концентрациях. В одном аспекте используемая концентрация клеток составляет 5×10e6/мл. В других аспектах используемая концентрация может составлять от приблизительно 1×105/мл до 1×106/мл и любое промежуточное целочисленное значение.
В других аспектах клетки можно инкубировать на ротаторе в течение изменяющихся промежутков времени с изменяющимися скоростями или при 2-10°C, или при комнатной температуре.
T-клетки для стимуляции могут также быть заморожены после этапа промывания. Без ограничения теорией, этап замораживания и последующего оттаивания обеспечивает более однородный продукт посредством удаления гранулоцитов и до некоторой степени моноцитов в клеточной популяции. После этапа промывания, который удаляет плазму и тромбоциты, клетки могут быть суспендированы в растворе для замораживания. При том, что множество растворов для замораживания и параметров известны в данной области техники и будут подходящими в данном контексте, один способ включает в себя использование ФСБ, содержащего 20% DMSO и 8% человеческого сывороточного альбумина, или культуральной среды, содержащей 10% дестрана-40 и 5% декстрозы, 20% человеческого сывороточного альбумина и 7,5% DMSO, или 31,25% Plasmalyte-A, 31,25% декстрозы 5%, 0,45% NaCl, 10% дестрана-40 и 5% декстрозы, 20% человеческого сывороточного альбумина и 7,5% DMSO, или других подходящих сред для замораживания клеток, содержащих, например, геспан и PlasmaLyte A, затем клетки замораживают до -80°C со скоростью 1° в минуту и хранят в паровой фаза емкости для хранения с жидким азотом. Можно использовать другие способы контролируемого замораживания, а также неконтролируемое замораживающий непосредственно при -20°C или в жидком азоте.
В определенных аспектах криосохраненные клетки оттаивают и промывают, как описано в настоящем документе, и оставляют на один час при комнатной температуре перед активацией с использованием способов настоящего изобретения.
Также в контексте настоящего изобретения рассматривается отбор образцов крови или продукта афереза у субъекта в период времени перед тем, когда размножаемые клетки, как описано в настоящем документе, могут понадобиться. При этом, источник клеток, подлежащих размножению, может быть собран в любой необходимый момент времени, и желаемые клетки, такие как иммунные эффекторные клетки, например, T-клетки или NK-клетки, могут быть выделены и заморожены для дальнейшего использования в клеточной терапии, например, T-клеточной терапии, для любого числа заболевании или состояний, для которых может быть полезна клеточная терапия, например, T-клеточная терапия, таких как описанные в настоящем документе. В одном аспекте образец крови или аферез забирают у в целом здорового субъекта. В определенных аспектах образец крови или аферез забирают у в целом здорового субъекта, который подвержен риску развития заболевания, но у которого заболевание еще не развилось, и клетки, представляющие интерес, выделяют и замораживают для последующего использования. В определенных аспектах иммунные эффекторные клетки, например, T-клетки или NK-клетки, могут быть размножены, заморожены и использованы в дальнейшем. В определенных аспектах образцы отбирают у пациента вскоре после диагностирования конкретного заболевания, как описано в настоящем документе, но перед каким бы то ни было лечением. В другом аспекте клетки выделяют из образца крови или афереза у субъекта перед любым количеством соответствующих модальностей лечения, включая, но без ограничения, лечение с помощью таких средств, как натализумаб, эфализумаб, противовирусные средства, химиотерапия, излучение, иммуносупрессивные средства, такие как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антитела или другие иммуноаблативные средства, такие как CAMPATH, анти-CD3 антитела, цитоксан, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228 и облучение.
В другом аспекте настоящего изобретения T-клетки получают у пациента непосредственно после лечения, которое оставляет у субъекта функционирующие T-клетки. В этом отношении было отмечено, что после некоторых процедур лечения рака, в частности лечения с помощью препаратов, которые повреждают иммунную систему, вскоре после лечения во время периода, когда пациенты обычно должны восстанавливаться после лечения, качество получаемых T-клеток может быть оптимальным или улучшенным в отношении их способности размножаться ex vivo. Аналогично, после манипуляций ex vivo с использованием способов, описанных в настоящем документе, эти клетки могут находиться в предпочтительном состоянии для усиления приживления и размножения in vivo. Таким образом, в контексте настоящего изобретения предполагается отбирать кровяные клетки, включая T-клетки, дендритные клетки или другие клетки гематопоэтической линии дифференцировки, во время данной фазы восстановления. Кроме того, в определенных аспектах можно использовать мобилизацию (например, мобилизацию с помощью GM-CSF) и кондиционирующие схемы для создания у субъекта состояния, в котором облегчены репопуляция, рециркуляция, регенерация и/или размножение конкретных типов клеток, особенно во время определенного окна времени после терапии. Иллюстративные клеточные типы включают T-клетки, B-клетки, дендритные клетки и другие клетки иммунной системы.
В одном варианте осуществления иммунные эффекторные клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем документе, получают у субъекта, который получил низкую иммуностимулирующую дозу ингибитора mTOR. В варианте осуществления популяцию иммунных эффекторных клеток, например, T-клеток, которые должны быть сконструированы для экспрессии CAR, отбирают по прошествии достаточного времени или после достаточного дозирования низкой иммуностимулирующей дозы ингибитора mTOR, так что уровень PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, или отношение PD1-отрицательные иммунные эффекторные клетки, например, T-клетки/PD1-положительные иммунные эффекторные клетки, например, T-клетки, у субъекта или после отбора у субъекта по меньшей мере временно повышается.
В других вариантах осуществления популяция иммунных эффекторных клеток, например, T-клеток, которые сконструированы или будут сконструированы для экспрессии CAR, может быть обработана ex vivo посредством приведения в контакт с некоторым количеством ингибитора mTOR, что увеличивает количество PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, или повышает отношение PD1-отрицательные иммунные эффекторные клетки, например, T-клетки/PD1-положительные иммунные эффекторные клетки, например, T-клетки.
В одном варианте осуществления популяция T-клеток дефицитна по диацилглицеринкиназе (DGK). DGK-дефицитные клетки включают клетки, которые не экспрессируют РНК или белок DGK или обладают пониженной или ингибированной активностью DGK. DGK-дефицитные клетки могут быть сгенерированы с помощью генетических подходов, например, введения РНК-интерферирующих средств, например, миРНК, кшРНК, микроРНК, для снижения или предотвращения экспрессии DGK. В качестве альтернативы, DGK-дефицитные клетки могут быть сгенерированы посредством лечения с помощью ингибиторов DGK, описанных в настоящем документе.
В одном варианте осуществления популяция T-клеток дефицитна по Ikaros. Ikaros-дефицитные клетки включают клетки, которые не экспрессируют РНК или белок Ikaros или обладают пониженной или ингибированной активностью Ikaros, Ikaros-дефицитные клетки могут быть сгенерированы с помощью генетических подходов, например, введения РНК-интерферирующих средств, например, миРНК, кшРНК, микроРНК, для снижения или предотвращения экспрессии Ikaros. В качестве альтернативы, Ikaros-дефицитные клетки могут быть сгенерированы посредством лечения с помощью ингибиторов Ikaros, например, леналидомида.
В вариантах осуществления популяция T-клеток является DGK-дефицитной и Ikaros-дефицитной, например, не экспрессирует DGK и Ikaros или обладает пониженной или ингибированной активностью DGK и Ikaros. Такие DGK- и Ikaros-дефицитные клетки могут быть сгенерированы с помощью любого из способов, описанных в настоящем документе.
В варианте осуществления NK-клетки получают у субъекта. В другом варианте осуществления NK-клетки представляют собой линию NK-клеток, например, линию клеток NK-92 (Conkwest).
Аллогенный CAR
В вариантах осуществления, описанных в настоящем документе, иммунная эффекторная клетка может представлять собой аллогенную иммунную эффекторную клетку, например, T-клетку или NK-клетку. Например, клетка может представлять собой аллогенную T-клетку, например, аллогенную T-клетку, не экспрессирующую функциональный T-клеточный рецептор (TCR) и/или человеческий лейкоцитарный антиген (HLA), например, HLA класса I и/или HLA класса II.
T-клетка без функционального TCR может быть, например, сконструирована таким образом, что она не экспрессирует никакой функциональный TCR на своей поверхности, сконструирована таким образом, что она не экспрессирует одну или несколько субъединиц, которые содержат функциональный TCR (например, сконструирована таким образом, что она не экспрессирует (или проявляет пониженную экспрессию) TCR-альфа, TCR-бета, TCR-гамма, TCR-дельта, TCR-эпсилон и/или TCR-дзета), или сконструирована таким образом, что она производит очень мало функционального TCR на своей поверхности. В качестве альтернативы, T-клетка может экспрессировать по существу поврежденный TCR, например, посредством экспрессии мутировавшей или усеченной формы одной или нескольких из субъединиц TCR. Термин "по существу поврежденный TCR" означает, что данный TCR не вызывает неблагоприятной иммунной реакции у хозяина.
T-клетка, описанная в настоящем документе может быть, например, сконструирована таким образом, что она не экспрессирует функциональный HLA на своей поверхности. Например, T-клетка, описанная в настоящем документе, может быть сконструирована таким образом, что экспрессия на клеточной поверхности HLA, например, HLA класса 1 и/или HLA класса II, понижающе отрегулирована. В некоторых аспектах понижающая регуляция HLA может быть выполнена посредством уменьшения или устранения экспрессии бета-2-микроглобулина (B2M).
В некоторых вариантах осуществления в T-клетке могут отсутствовать функциональный TCR и функциональный HLA, например, HLA класса I и/или HLA класса II.
Модифицированные T-клетки, у которых отсутствует экспрессия функциональных TCR и/или HLA, могут быть получены с помощью любых подходящих средств, включая нокаут или нокдаун одной или нескольких субъединиц TCR или HLA. Например, T-клетка может иметь нокдаун TCR и/или HLA благодаря использованию миРНК, кшРНК, коротких палиндромных повторов, регулярно расположенных группами (CRISPR), эффекторной нуклеазы, подобной активаторам транскрипции (TALEN), или эндонуклеазы с цинковым пальцем (ZFN).
В некоторых вариантах осуществления аллогенная клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низком уровне ингибирующую молекулу, например, клетку, сконструированную с помощью любого способа, описанного в настоящем документе. Например, клетка может представлять собой клетку, которая не экспрессируют или экспрессирует на низком уровне ингибирующую молекулу, например, которая может уменьшать способность экспрессирующей CAR клетки вызывать иммунный эффекторный ответ. Примеры ингибирующих молекул включают в себя PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета. Ингибирование ингибирующей молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка, может оптимизировать активность экспрессирующей CAR клетки. В вариантах осуществления можно использовать ингибирующую нуклеиновую кислоту, например, ингибирующую нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу с цинковым пальцем (ZFN), например, как описано в настоящем документе.
миРНК и кшРНК для ингибирования TCR или HLA
В некоторых вариантах осуществления экспрессия TCR и/или экспрессия HLA могут быть ингибированы с использованием миРНК или кшРНК, которые воздействуют на нуклеиновую кислоту, кодирующую TCR, и/или HLA, и/или ингибирующую молекулу, описанную в настоящем документе (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета), в T-клетке.
Экспрессия миРНК и кшРНК в T-клетках может быть получена с использованием любых обычных экспрессионных систем, например, таких, как лентивирусная экспрессионная система.
Типичные кшРНК, которые понижающе регулируют экспрессию компонентов TCR, описаны, например, в публикации № US 2012/0321667. Типичные миРНК и кшРНК, которые понижающе регулируют экспрессию генов HLA класса I и/или HLA класса II, описаны, например, в публикации № US 2007/0036773.
CRISPR для ингибирования TCR или HLA
"CRISPR" или "CRISPR для TCR и/или HLA" или "CRISPR для ингибирования TCR и/или HLA", как используется в настоящем документе, относится к набору коротких палиндромных повторов, регулярно расположенных группами, или к системе, содержащей такой набор повторов. "Cas", как используется в настоящем документе, относится к CRISPR-ассоциированному белку. Система "CRISPR/Cas" относится к системе, происходящей от CRISPR и Cas, которую можно использовать для сайленсинга или мутации гена TCR и/или HLA и/или ингибирующей молекулы, описанной в настоящем документе (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета).
Природные системы CRISPR/Cas обнаружены в приблизительно 40% секвенированных геномов эубактерий и 90% секвенированных архей. Grissa et al. (2007) BMC Bioinformatics 8: 172. Эта система представляет собой тип прокариотической иммунной системы, которая придает резистентность к чужеродным генетическим элементам, таким как плазмиды и фаги, и обеспечивает форму приобретенного иммунитета. Barrangou et al. (2007) Science 315: 1709-1712; Marragini et al. (2008) Science 322: 1843-1845.
Система CRISPR/Cas была модифицирована для использования в редактировании генов (сайленсинг, усиление или изменение указанных генов) в эукариотах, таких как мыши или приматы. Wiedenheft et al. (2012) Nature 482: 331-8. Это достигается посредством введения в эукариотическую клетку плазмиды, содержащей специально сконструированный CRISPR и один или несколько соответствующих Cas.
Последовательность CRISPR, иногда называемая локусом CRISPR, содержит чередующиеся повторы и спейсеры. В природных CRISPR спейсеры обычно содержат последовательности, чужеродные для бактерии, такие как последовательность плазмиды или фага; в системе CRISPR/Cas для TCR и/или HLA спейсеры происходят от последовательности гена TCR или HLA.
РНК из локуса CRISPR конститутивно экспрессируется и процессируется белками Cas на небольшие РНК. Они содержат спейсер, фланкированный последовательностью повтора. РНК направляют другие белки Cas к выключению экзогенных генетических элементов на уровне РНК или ДНК. Horvath et al. (2010) Science 327: 167-170; Makarova et al. (2006) Biology Direct 1: 7. Таким образом, спейсеры служат в качестве матриц для молекул РНК, аналогично миРНК. Pennisi (2013) Science 341: 833-836.
При том, что это естественно происходит во многих различных типах бактерий, точные конфигурации CRISPR и структура, функция и количество генов Cas и их продукт несколько отличаются от вида к виду. Haft et al. (2005) PLoS Comput. Biol. 1: e60; Kunin et al. (2007) Genome Biol. 8: R61; Mojica et al. (2005) J. Mol. Evol. 60: 174-182; Bolotin et al. (2005) Microbiol. 151: 2551-2561; Pourcel et al. (2005) Microbiol. 151: 653-663; и Stern et al. (2010) Trends. Genet. 28: 335-340. Например, белки Cse (подтип Cas, E. coli) (например, CasA) образуют функциональный комплекс, Cascade, который процессирует РНК-транскрипты CRISPR в единицы спейсер-повтор, которые Cascade сохраняет. Brouns et al. (2008) Science 321: 960-964. В других прокариотах Cas6 процессирует транскрипт CRISPR. Инактивация фага на основе CRISPR в E. Coli требует Cascade и Cas3, но не Cas1 или Cas2. Белки Cmr (модуль Cas RAMP) в Pyrococcus furiosus и других прокариотах образуют функциональный комплекс с небольшими РНК CRISPR, который распознает и расщепляет комплементарные РНК-мишени. Более простая система CRISPR основана на белке Cas9, который представляет собой нуклеазу с двумя активными сайтами рестрикции, одним для каждой нити двойной спирали. Объединение Cas9 и РНК модифицированного локуса CRISPR можно использовать в системе для редактирования генов. Pennisi (2013) Science 341: 833-836.
Таким образом, систему CRISPR/Cas можно использовать для редактирования гена TCR и/или HLA (добавления или удаления пары оснований) или введения преждевременной остановки, что, таким образом, снижает экспрессию TCR и/или HLA. Систему CRISPR/Cas можно альтернативно использовать как РНК-интерференцию, выключая ген TCR и/или HLA обратимым образом. В клетке млекопитающего, например, РНК может направлять белок Cas на промотор TCR и/или HLA, стерически блокируя РНК-полимеразы.
Могут быть созданы искусственные системы CRISPR/Cas, которые ингибируют TCR и/или HLA, с использованием технологии, известной в данной области техники, например, описанные в публикации № US 20140068797 и документе Cong (2013) Science 339: 819-823. Могут также быть созданы другие искусственные системы CRISPR/Cas, которые известны в данной области техники, которые ингибируют TCR и/или HLA, например, описанные в документе Tsai (2014) Nature Biotechnol., 32:6 569-576, патентах США №№ 8871445; 8865406; 8795965; 8771945; и 8697359.
TALEN для ингибирования TCR и/или HLA
"TALEN" или "TALEN для HLA и/или TCR" или "TALEN для ингибирования HLA и/или TCR" относится к эффекторной нуклеазе, подобной активаторам транскрипции, искусственной нуклеазе, которую можно использовать для редактирования гена HLA и/или TCR и/или ингибирующей молекулы, описанной в настоящем документе (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета).
TALEN получают искусственно посредством слияния связывающего ДНК домена эффектора TAL с расщепляющим ДНК доменом. Эффекторы, подобные активаторам транскрипции (TALE) могут быть сконструированы для связывания любой желаемой последовательности ДНК, включая часть гена HLA или TCR. Посредством объединения сконструированного TALE с расщепляющим ДНК доменом может быть получен фермент рестрикции, который является специфическим к любой желаемой последовательности ДНК, включая последовательность HLA или TCR. Затем он может быть введен в клетку, причем его можно использовать для редактирования генома. Boch (2011) Nature Biotech. 29: 135-6; и Boch et al. (2009) Science 326: 1509-12; Moscou et al. (2009) Science 326: 3501.
TALE представляют собой белки, секретируемые бактериями Xanthomonas. Связывающий ДНК домен содержит повторяющуюся высоко консервативную аминокислотную последовательность 33-34, исключая 12-ю и 13-ю аминокислоты. Эти два положения высоко вариабельны и демонстрируют высокую корреляцию с распознаванием конкретного нуклеотида. Они, таким образом, могут быть сконструированы для связывания с желаемой последовательностью ДНК.
Для получения TALEN белок TALE сливают с нуклеазой (N), которая представляет собой дикого типа или мутантную эндонуклеазу FokI. Было сделано несколько мутаций в FokI для ее использования в TALEN; они, например, улучшают специфичность или активность расщепления. Cermak et al. (2011) Nucl. Acids Res. 39: e82; Miller et al. (2011) Nature Biotech. 29: 143-8; Hockemeyer et al. (2011) Nature Biotech. 29: 731-734; Wood et al. (2011) Science 333: 307; Doyon et al. (2010) Nature Methods 8: 74-79; Szczepek et al. (2007) Nature Biotech. 25: 786-793; и Guo et al. (2010) J. Mol. Biol. 200: 96.
Домен FokI функционирует в виде димера, требуя два конструкта с уникальными связывающими ДНК доменами в качестве сайтов в целевом геноме с надлежащей ориентацией и расстоянием между ними. Как количество аминокислотных остатков между связывающим ДНК доменом TALE и расщепляющим доменом FokI, так и количество оснований между двумя отдельными связывающими сайтами TALEN являются, по-видимому, важными параметрами для достижения высоких уровней активности. Miller et al. (2011) Nature Biotech. 29: 143-8.
TALEN для HLA или TCR можно использовать внутри клетки для получения двухнитевого разрыва (DSB). В сайт разрыва может быть введена мутация, если механизмы восстановления неправильно восстановят разрыв посредством негомологичного соединения концов. Например, неправильное восстановление может вводить мутацию со сдвигом рамки. В качестве альтернативы, чужеродная ДНК может быть введена в клетку вместе с TALEN; в зависимости от последовательностей чужеродной ДНК и хромосомной последовательности этот процесс можно использовать для коррекции дефекта в гене HLA или TCR или введения такого дефекта в ген HLA или TCR дикого типа, что уменьшает экспрессию HLA или TCR.
TALEN, специфические к последовательностям HLA или TCR, могут быть сконструированы с использованием любого способа, известного в данной области техники, включая различные схемы с использованием модульных компонентов. Zhang et al. (2011) Nature Biotech. 29: 149-53; Geibler et al. (2011) PLoS ONE 6: e19509.
Нуклеаза с цинковым пальцем для ингибирования HLA и/или TCR
"ZFN", или "нуклеаза с цинковым пальцем", или "ZFN для HLA и/или TCR", или "ZFN для ингибирования HLA и/или TCR" относятся к нуклеазе с цинковым пальцем, искусственной нуклеазе, которую можно использовать для редактирования гена HLA и/или TCR и/или ингибирующей молекулы, описанной в настоящем документе (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета).
Как и TALEN, ZFN содержит домен нуклеазы FokI (или его производное), слитый с ДНК-связывающим доменом. В случае ZFN ДНК-связывающий домен содержит один или несколько цинковых пальцев. Carroll et al. (2011) Genetics Society of America 188: 773-782; и Kim et al. (1996) Proc. Natl. Acad. Sci. USA 93: 1156-1160.
Цинковый палец представляет собой небольшой белковый структурный мотив, стабилизированный одним или несколькими ионами цинка. Цинковый палец может содержать, например, Cys2His2 и может распознавать последовательность длиной приблизительно 3 п.о. Различные цинковые пальцы известной специфичности могут быть объединены для получения многопальцевых полипептидов, которые распознают последовательности длиной приблизительно 6, 9, 12, 15 или 18 п.о. Доступны различные способы селекции и модульной сборки для создания цинковых пальцев (и их комбинаций), распознающих конкретные последовательности, включая фаговое отображение, дрожжевые одногибридные системы, бактериальные одногибридные и двугибридные системы и клетки млекопитающих.
Как и TALEN, ZFN должна димеризоваться для расщепления ДНК. Таким образом, требуется пара ZFN для воздействия на непалиндромные участки ДНК. Две отдельные ZFN должны связаться с противоположными нитями ДНК, причем их нуклеазы должны находиться на надлежащем расстоянии друг от друга. Bitinaite et al. (1998) Proc. Natl. Acad. Sci. USA 95: 10570-5.
Кроме того, как и TALEN, ZFN может создавать двухнитевой разрыв в ДНК, который может создавать мутацию со сдвигом рамки при неправильном восстановлении, что ведет к уменьшению экспрессии и количества HLA и/или TCR в клетке. ZFN можно также использовать с гомологичной рекомбинацией для создания мутаций в гене HLA или TCR.
ZFN, специфические к последовательностям HLA и/или TCR, могут быть сконструированы с использованием любого способа, известного в данной области техники. Смотри, например, Provasi (2011) Nature Med. 18: 807-815; Torikai (2013) Blood 122: 1341-1349; Cathomen et al. (2008) Mol. Ther. 16: 1200-7; Guo et al. (2010) J. Mol. Biol. 400: 96; патентную публикацию США 2011/0158957; и патентную публикацию США 2012/0060230.
Экспрессия теломеразы
Без ограничения какой-либо конкретной теорией, в некоторых вариантах осуществления терапевтическая T-клетка имеет короткую жизнестойкость в пациенте из-за укороченных теломер в данной T-клетке; соответственно, трансфекция гена теломеразы может удлинять теломеры T-клетки и улучшать жизнестойкость T-клетки в пациенте. Смотри Carl June, "Adoptive T cell therapy for cancer in the clinic", Journal of Clinical Investigation, 117:1466-1476 (2007). Таким образом, в варианте осуществления иммунная эффекторная клетка, например, T-клетка, эктопически экспрессирует субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. В некоторых аспектах настоящее раскрытие предлагает способ получения экспрессирующей CAR клетки, содержащий приведение клетки в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетка может быть приведена в контакт с нуклеиновой кислотой до, одновременно или после контакта с конструктом, кодирующим CAR.
В одном аспекте настоящее раскрытие предлагает способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток). В варианте осуществления способ содержит: предоставление популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток), приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR; и приведение популяция иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT, в условиях, которые обеспечивают экспрессию CAR и теломеразы.
В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, представляет собой ДНК. В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, содержит промотор, способный к управлению экспрессией субъединицы теломеразы.
В варианте осуществления hTERT имеет аминокислотную последовательность в соответствии с GenBank Protein ID AAC51724.1 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795), выглядящую следующим образом:
MPRAPRCRAVRSLLRSHYREVLPLATFVRRLGPQGWRLVQRGDPAAFRALVAQCLVCVPWDARPPPAAPSFRQVSCLKELVARVLQRLCERGAKNVLAFGFALLDGARGGPPEAFTTSVRSYLPNTVTDALRGSGAWGLLLRRVGDDVLVHLLARCALFVLVAPSCAYQVCGPPLYQLGAATQARPPPHASGPRRRLGCERAWNHSVREAGVPLGLPAPGARRRGGSASRSLPLPKRPRRGAAPEPERTPVGQGSWAHPGRTRGPSDRGFCVVSPARPAEEATSLEGALSGTRHSHPSVGRQHHAGPPSTSRPPRPWDTPCPPVYAETKHFLYSSGDKEQLRPSFLLSSLRPSLTGARRLVETIFLGSRPWMPGTPRRLPRLPQRYWQMRPLFLELLGNHAQCPYGVLLKTHCPLRAAVTPAAGVCAREKPQGSVAAPEEEDTDPRRLVQLLRQHSSPWQVYGFVRACLRRLVPPGLWGSRHNERRFLRNTKKFISLGKHAKLSLQELTWKMSVRGCAWLRRSPGVGCVPAAEHRLREEILAKFLHWLMSVYVVELLRSFFYVTETTFQKNRLFFYRKSVWSKLQSIGIRQHLKRVQLRELSEAEVRQHREARPALLTSRLRFIPKPDGLRPIVNMDYVVGARTFRREKRAERLTSRVKALFSVLNYERARRPGLLGASVLGLDDIHRAWRTFVLRVRAQDPPPELYFVKVDVTGAYDTIPQDRLTEVIASIIKPQNTYCVRRYAVVQKAAHGHVRKAFKSHVSTLTDLQPYMRQFVAHLQETSPLRDAVVIEQSSSLNEASSGLFDVFLRFMCHHAVRIRGKSYVQCQGIPQGSILSTLLCSLCYGDMENKLFAGIRRDGLLLRLVDDFLLVTPHLTHAKTFLRTLVRGVPEYGCVVNLRKTVVNFPVEDEALGGTAFVQMPAHGLFPWCGLLLDTRTLEVQSDYSSYARTSIRASLTFNRGFKAGRNMRRKLFGVLRLKCHSLFLDLQVNSLQTVCTNIYKILLLQAYRFHACVLQLPFHQQVWKNPTFFLRVISDTASLCYSILKAKNAGMSLGAKGAAGPLPSEAVQWLCHQAFLLKLTRHRVTYVPLLGSLRTAQTQLSRKLPGTTLTALEAAANPALPSDFKTILD (SEQ ID NO: 157).
В варианте осуществления hTERT имеет последовательность по меньшей мере на 80%, 85%, 90%, 95%, 96^, 97%, 98% или 99% идентичную последовательности в соответствии с SEQ ID NO: 157. В варианте осуществления hTERT имеет последовательность в соответствии с SEQ ID NO: 157. В варианте осуществления hTERT содержит делецию (например, не более чем 5, 10, 15, 20 или 30 аминокислот) с N-конца, C-конца или с обоих концов. В варианте осуществления hTERT содержит трансгенную аминокислотную последовательность (например, из не более чем 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце или на обоих концах.
В варианте осуществления hTERT кодируется последовательностью нуклеиновой кислоты в соответствии с № доступа в GenBank AF018167 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795):
1 caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc
61 cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc
121 tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg
181 gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg
241 cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg
301 cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg
361 cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct
421 acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc
481 gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg
541 tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca
601 ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg
661 cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga
721 ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg
781 ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga
841 cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag
901 ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc
961 agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc
1021 ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc
1081 ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg
1141 agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc
1201 tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc
1261 agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag
1321 cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg
1381 acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt
1441 acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc
1501 acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca
1561 agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca
1621 ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg
1681 ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt
1741 atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga
1801 gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt
1861 cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc
1921 gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag
1981 ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt
2041 tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg
2101 gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc
2161 cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc
2221 aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc
2281 gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc
2341 acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg
2401 agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca
2461 gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg
2521 gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct
2581 gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc
2641 tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa
2701 ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga
2761 agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga
2821 tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg
2881 tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc
2941 gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt
3001 gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct
3061 acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc
3121 atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc
3181 tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg
3241 ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc
3301 tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc
3361 agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg
3421 cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg
3481 agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc
3541 ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct
3601 gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc
3661 tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc
3721 agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc
3781 cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc
3841 caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt
3901 gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg
3961 ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa
4021 aaaaaaa (SEQ ID NO: 158)
В варианте осуществления hTERT кодируется нуклеиновой кислотой, имеющей последовательность, по меньшей мере на 80%, 85%, 90%, 95%, 96, 97%, 98% или 99% идентичную последовательности в соответствии с SEQ ID NO: 158. В варианте осуществления hTERT кодируется нуклеиновой кислотой в соответствии с SEQ ID NO: 158.
Активация и размножение T-клеток
T-клетки могут быть активированы и размножены в общем с использованием способов, описанных, например, в патентах США 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041; и публикации патентной заявки США № 20060121005.
Обычно T-клетки настоящего изобретения могут быть размножены посредством контакта с поверхностью, несущей прикрепленное к ней средство, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и лигандом, который стимулирует костимулирующую молекулу на поверхности T-клеток. В частности, популяции T-клеток можно стимулировать, как описано в настоящем документе, например, посредством контакта с анти-CD3 антителом или его антигенсвязывающим фрагментом или с анти-CD2 антителом, иммобилизованным на поверхности, или посредством контакта с активатором протеинкиназы C (например, бриостатином) в сочетании с кальциевым ионофором. Для костимуляции вспомогательной молекулы на поверхности T-клеток используют лиганд, который связывает вспомогательную молекулу. Например, популяция T-клеток может быть приведена в контакт с анти-CD3 антителом и анти-CD28 антителом в условиях, подходящих для стимуляции пролиферации T-клеток. Для стимуляции пролиферации или CD4+ T-клеток, или CD8+ T-клеток можно использовать анти-CD3 антитело и анти-CD28 антитело. Можно использовать примеры анти-CD28 антитела, включая 9.3, B-T3, XR-CD28 (Diaclone, Besançon, Франция), как и другие способы, широко известные в данной области техники (Berg et al., Transplant Proc. 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med. 190(9):13191328, 1999; Garland et al., J. Immunol Meth. 227(1-2):53-63, 1999).
В определенных аспектах первичный стимулирующий сигнал и костимулирующий сигнал для T-клетки могут быть предоставлены с помощью различных протоколов. Например, средства, обеспечивающие каждый сигнал, могут находиться в растворе или быть связаны с поверхностью. При связывании с поверхностью средства могут быть связаны с одной и той же поверхностью (то есть, в "цис" расположении) или с различными поверхностями (то есть, в "транс" расположении). В качестве альтернативы, одно средство может быть связано с поверхностью, а другое средство может находиться в растворе. В одном аспекте средство, обеспечивающее костимулирующий сигнал, связано с клеточной поверхностью, а средство, обеспечивающее сигнал первичной активации, находится в растворе или связано с поверхностью. В определенных аспектах оба средства могут находиться в растворе. В одном аспекте средства могут находиться в растворимой форме, а затем быть перекрестно сшиты с поверхностью, такой как клетка, экспрессирующая Fc-рецепторы, или антитело, или другое связывающий средство, которое будет связываться с данными средствами. В связи с этим смотри, например, публикации патентных заявок США №№ 20040101519 и 20060034810 в отношении искусственных антигенпрезентирующих клеток (aAPC), которые рассматриваются для использования при активации и размножении T-клеток в настоящем изобретении.
В одном аспекте два средства иммобилизованы на гранулах, или на одной и той же грануле, то есть "цис", или на различных гранулах, то есть "транс." В качестве примера, средство, обеспечивающее сигнал первичной активации представляет собой анти-CD3 антитело или его антигенсвязывающий фрагмент, а средство, обеспечивающее костимулирующий сигнал, представляет собой анти-CD28 антитело или его антигенсвязывающий фрагмент; и оба средства совместно иммобилизованы на одной и той же грануле в эквивалентных молекулярных количествах. В одном аспекте используют отношение 1:1 для антител, связанных с гранулами, для размножения CD4+ T-клеток и роста T-клеток. В определенных аспектах настоящего изобретения используют такое отношение анти-CD3:CD28 антител, связанных с гранулами, что наблюдается увеличение размножения T-клеток по сравнению с размножением, наблюдаемым при использовании отношения 1:1. В одном конкретном аспекте наблюдается увеличение, составляющее от приблизительно 1 до приблизительно 3-кратного по сравнению с размножением, наблюдаемым при использовании отношения 1:1. В одном аспекте отношение антител к CD3:CD28, связанных с гранулами, находится в диапазоне, включающем в себя от 100:1 до 1:100 и все промежуточные целочисленные значения. В одном аспекте настоящего изобретения с частицами связано больше анти-CD28 антитела, чем анти-CD3 антитела, то есть отношение CD3:CD28 меньше чем один. В определенных аспектах настоящего изобретения отношение анти-CD28 антитела к анти-CD3 антителу, связанным с гранулами, больше чем 2:1. В одном конкретном аспекте используют отношение CD3:CD28 антител, связанных гранулами, равное 1:100. В одном аспекте, используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:75. В другом аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:50. В одном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:30. В одном предпочтительном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:10. В одном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:3. В еще одном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 3:1.
Для стимуляции T-клеток или других клеток-мишеней можно использовать отношения частиц к клеткам, составляющее от 1:500 до 500:1 и любое промежуточное целочисленное значение. Как легко смогут понять средние специалисты в данной области техники, отношение частиц к клеткам может зависеть от размера частиц относительно клетки-мишени. Например, гранулы небольшого размера могут связываться только с несколькими клетками, тогда как гранулы большего размера могут связываться со многими клетками. В определенных аспектах отношение клеток к частицам находится в диапазоне, включающем в себя от 1:100 до 100:1 и любое промежуточное целочисленное значение, а в других аспектах для стимуляции T-клеток также может быть использовано отношение, которое содержит от 1:9 до 9:1 и все промежуточные целочисленные значения. Отношение анти-CD3- и анти-CD28-связанных частиц к T-клеткам, которое приводит к стимуляции T-клеток, может, как отмечено выше, изменяться, однако некоторые предпочтительные значения включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 и 15:1, причем одно предпочтительное отношение частиц на T-клетку составляет по меньшей мере 1:1. В одном аспекте используют отношение частиц к клеткам, составляющее 1:1 или меньше. В одном конкретном аспекте предпочтительное отношение частица:клетка составляет 1:5. В других аспектах отношение частиц к клеткам может изменяться в зависимости от дня стимуляции. Например, в одном аспекте отношение частиц к клеткам составляет от 1:1 до 10:1 на первый день, и каждый день или через день после этого в течение вплоть до 10 дней к клеткам добавляют дополнительные частицы при итоговых отношениях, составляющих от 1:1 до 1:10 (исходя из количества клеток на день добавления). В одном конкретном аспекте отношение частиц к клеткам составляет 1:1 на первый день стимуляции, и его доводят до 1:5 на третий и пятый дни стимуляции. В одном аспекте частицы добавляют ежедневно или через день до итогового отношения, составляющего 1:1 на первый день и 1:5 на третий и пятый дни стимуляции. В одном аспекте отношение частиц к клеткам составляет 2:1 на первый день стимуляции, и его доводят до 1:10 на третий и пятый дни стимуляции. В одном аспекте частицы добавляют ежедневно или через день до итогового отношения, составляющего 1:1 на первый день и 1:10 на третий и пятый дни стимуляции. Специалисту в данной области техники будет понятно, что для использования в настоящем изобретении подходящими могут быть различные другие отношения. В частности, отношения будут изменяться в зависимости от размера частиц и от размера и типа клеток. В одном аспекте наиболее типичные отношения для использования на первый день лежат вблизи от 1:1, 2:1 и 3:1.
В других аспектах настоящего изобретения клетки, такие как T-клетки, объединяют с покрытыми средством гранулами, затем гранулы и клетки разделяют, и затем клетки культивируют. В альтернативном аспекте перед культивированием покрытые средством гранулы и клетки не разделяют, но культивируют вместе. В другом аспекте гранулы и клетки вначале концентрируют с помощью силы, такой как магнитная сила, что приводит к увеличению лигирования маркеров клеточной поверхности, что индуцирует стимуляцию клеток.
В качестве примера, белки клеточной поверхности могут быть лигированы посредством обеспечения контакта парамагнитных гранул, к которым прикреплены анти-CD3 и анти-CD28 (гранул 3×28), с T-клетками. В одном аспекте клетки (например, от 104 до 109 T-клеток) и гранулы (например, парамагнитные гранулы DYNABEADS® M-450 CD3/CD28 T в отношении 1:1) объединяют в буфере, например, ФСБ (без двухвалентных катионов, таких как кальций и магний). При этом средним специалистам в данной области техники будет ясно, что можно использовать любую концентрацию клеток. Например, клетка-мишень может очень редко встречаться в образце и содержатся только в 0,01% образца, или весь образец (то есть, 100%) может содержать представляющую интерес клетку-мишень. Соответственно, любое количество клеток находится в контексте настоящего изобретения. В определенных аспектах может быть желательным значительно уменьшить объем, в котором частицы и клетки смешивают вместе (то есть увеличить концентрацию клеток) для обеспечения максимального контакта клеток и частиц. Например, в одном аспекте используют концентрацию, составляющую приблизительно 10 миллиардов клеток на мл, 9 миллиардов на мл, 8 миллиардов на мл, 7 миллиардов на мл, 6 миллиардов на мл, 5 миллиардов на мл или 2 миллиарда клеток на мл. В одном аспекте используют больше чем 100 миллионов клеток на мл. В другом аспекте используют концентрацию клеток, составляющую 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток на мл. В еще одном аспекте используют концентрацию клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток на мл. В других аспектах можно использовать концентрации, составляющие 125 или 150 миллионов клеток на мл. Использование высоких концентраций может приводить к увеличению выхода клеток, активации клеток и размножения клеток. Кроме того, использование высоких концентраций клеток делает возможным более эффективный захват клеток, которые могут слабо экспрессировать антигены-мишени, представляющие интерес, таких как CD28-отрицательные T-клетки. Такие популяции клеток могут иметь терапевтическое значение, и в определенных аспектах их было бы желательно получать. Например, использование высоких концентраций клеток делает возможной более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
В одном варианте осуществления клетки, трансдуцированные с нуклеиновой кислотой, кодирующей CAR, например, CAR, описанный в настоящем документе, размножают, например, с помощью способа, описанного в настоящем документе. В одном варианте осуществления клетки размножают в культуре в течение периода, составляющего от нескольких часов (например, от приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 часа) до приблизительно 14 дней (например, до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней). В одном варианте осуществления клетки размножают в течение периода, составляющего от 4 до 9 дней. В одном варианте осуществления клетки размножают в течение периода, составляющего 8 дней или менее, например, 7, 6 или 5 дней. В одном варианте осуществления клетки, например, клетку с CAR к CD33, описанную в настоящем документе, размножают в культуре в течение 5 дней, и получаемые клетки являются более активными, чем те же клетки, размноженные в культуре в течение 9 дней в тех же условиях культивирования. Активность может быть определена, например, по различным T-клеточным функциям, например, по пролиферации, киллингу клеток-мишеней, производству цитокинов, активации, миграции или их комбинациям. В одном варианте осуществления клетки, например, клетка с CAR к CD33, описанная в настоящем документе, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех- или четырех-кратное увеличение клеточных удвоений при антигенной стимуляции по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR к CD33, описанный в настоящем документе, размножают в культуре в течение 5 дней, и получаемые клетки проявляют более высокое производство провоспалительных цитокинов, например, уровни IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка с CAR к CD33, описанная в настоящем документе, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех-, четырех-, пяти-, десяти-кратное или более увеличение пг/мл производства провоспалительных цитокинов, например, уровней IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования.
В одном аспекте настоящего изобретения смесь может быть культивирована в течение от нескольких часов (приблизительно 3 часов) до приблизительно 14 дней или любого промежуточного целочисленного количества часов. В одном аспекте смесь может быть культивирована в течение 21 дня. В одном аспекте настоящего изобретения гранулы и T-клетки культивируют вместе в течение приблизительно восьми дней. В одном аспекте гранулы и T-клетки культивируют вместе в течение 2-3 дней. Также желательным может быть проведение нескольких циклов стимуляции, так что время культивирования T-клеток может составлять 60 дней или более. Условия, подходящие для культивирования T-клеток, включают в себя соответствующие среды (например, минимальные эссенциальные среды, или RPMI Media 1640, или X-vivo 15, (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGF-β и ФНО-α или любые другие добавки для роста клеток, известные специалисту. Другие добавки для роста клеток включают, но без ограничения, поверхностно-активное вещество, плазманат и восстанавливающие средства, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут включать RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer с добавлением аминокислот, пирувата натрия и витаминов, или без сыворотки, или дополненные подходящим количеством сыворотки (или плазмы), или определенным набором гормонов, и/или количеством цитокина(ов), достаточным для роста и размножения T-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые предназначены для введения субъекту. Клетки-мишени сохраняют в условиях, необходимых для поддержания роста, например, при подходящих температуре (например, 37° C) и атмосфере (например, воздух плюс 5% CO2).
В одном варианте осуществления клетки размножают в подходящих средах (например, средах, описанных в настоящем документе), которые включают в себя один или несколько интерлейкинов, что приводит к по меньшей мере 200-кратному (например, 200-кратному, 250-кратному, 300-кратному, 350-кратному) увеличению количества клеток в течение 14-дневного периода размножения, например, измеренного с помощью способа, описанного в настоящем документе, такого как проточная цитометрия. В одном варианте осуществления клетки размножают в присутствии IL-15 и/или IL-7 (например, IL-15 и IL-7).
В вариантах осуществления способы, описанные в настоящем документе, например, способы получения экспрессирующей CAR клетки, содержат удаление регуляторных T-клеток, например, CD25+ T-клеток, из клеточной популяции, например, с использованием анти-CD25 антитела, или его фрагмента, или CD25-связывающего лиганда, IL-2. Способы удаления регуляторных T-клеток, например, CD25+ T-клеток, из клеточной популяции описаны в настоящем документе. В вариантах осуществления способы, например, способы получения, дополнительно содержат приведение клеточной популяции (например, клеточной популяции, в которой были истощены регуляторные T-клетки, такие как CD25+ T-клетки; или клеточной популяции, которая ранее контактировала с анти-CD25 антителом, его фрагментом или CD25-связывающим лигандом) в контакт с IL-15 и/или IL-7. Например, клеточную популяцию (например, которая ранее контактировала с анти-CD25 антителом, его фрагментом или CD25-связывающим лигандом) размножают в присутствии IL-15 и/или IL-7.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, приводят в контакт с композицией, содержащей полипептид интерлейкина-15 (IL-15), полипептид рецептора-альфа интерлейкина-15 (IL-15Ra) или комбинацию как полипептида IL-15, так и полипептида IL-15Ra, например, hetIL-15, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, приводят в контакт с композицией, содержащей полипептид IL-15, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, приводят в контакт с композицией, содержащей комбинацию как полипептида IL-15, так и полипептида IL-15 Ra, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, приводят в контакт с композицией, содержащей hetIL-15, во время получения экспрессирующей CAR клетки, например, ex vivo.
В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, приводят в контакт с композицией, содержащей hetIL-15, во время ex vivo размножения. В варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, приводят в контакт с композицией, содержащей полипептид IL-15, во время ex vivo размножения. В варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, приводят в контакт с композицией, содержащей как полипептид IL-15, так и полипептид IL-15Ra, во время ex vivo размножения. В одном варианте осуществления приведение в контакт приводит к выживаемости и пролиферации субпопуляции лимфоцитов, например, CD8+ T-клеток.
T-клетки, которые подвергались воздействию различных времен стимуляции, могут иметь различные характеристики. Например, типичные продукты крови или аферезных мононуклеарных клеток периферической крови имеют популяцию хелперных T-клеток (TH, CD4+), которая больше, чем популяция цитотоксических или супрессорных T-клеток (TC, CD8+). Ex vivo размножение T-клеток посредством стимуляции рецепторов CD3 и CD28 производит популяцию T-клеток, которая приблизительно за 8-9 дней состоит преимущественно из TH клеток, тогда как приблизительно через 8-9 дней популяция T-клеток содержит гораздо большую популяцию TC клеток. Соответственно, в зависимости от цели лечения может быть полезным введение субъекту популяции T-клеток, содержащей преимущественно TH клетки. Аналогично, если была выделена антиген-специфическая подгруппа TC клеток, полезным может быть размножение данной подгруппы до более высокого уровня.
Кроме того, помимо маркеров CD4 и CD8, другие фенотипические маркеры значительно изменяются, но по большей части воспроизводимо, в течение процесса размножения клеток. Таким образом, такая воспроизводимость обеспечивает способность к адаптации активированного T-клеточного продукта к конкретным целям.
После того, как CAR к CD33 сконструирован, можно использовать различные анализы для оценки активности молекулы, такой как, но без ограничения, способность к размножению T-клеток после антигенной стимуляции, поддержание T-клеточного размножения в отсутствие повторной стимуляции и противораковая активность в подходящих моделях in vitro и на животных. Анализы для оценки эффектов CAR к CD33 описаны более подробно ниже.
Анализ экспрессии CAR с помощью вестерн-блоттинга в первичных T-клетках можно использовать для детектирования присутствия мономеров и димеров. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Кратко говоря, T-клетки (смесь 1:1 CD4+ и CD8+ T-клеток), экспрессирующие CAR, размножают in vitro в течение более чем 10 дней с последующим лизисом и ДСН-ПААГ в восстанавливающих условиях. CAR, содержащие полноразмерный цитоплазматический домен TCR-ζ и эндогенную цепь TCR-ζ, детектируют посредством вестерн-блоттинга с использованием антитела к цепи TCR-ζ. Те же самые подгруппы T-клеток используют для анализа с помощью ДСН-ПААГ в невосстанавливающих условиях для осуществления оценки образования ковалентных димеров.
Размножение CAR+ T-клеток in vitro после антигенной стимуляции может быть измерено с помощью проточной цитометрии. Например, смесь CD4+ и CD8+ T-клеток стимулируют aAPC αCD3/αCD28 с последующей трансдукцией лентивирусными векторами, экспрессирующими GFP, под управлением промоторов, подлежащих анализу. Типичные промоторы включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK). Флуоресценцию GFP оценивают на 6 день культивирования в подгруппах CD4+ и/или CD8+ T-клеток с помощью проточной цитометрии. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В качестве альтернативы, смесь CD4+ и CD8+ T-клеток стимулируют покрытыми αCD3/αCD28 магнитными гранулами на день 0 и трансдуцируют CAR на день 1 с использованием бицистронного лентивирусного вектора, экспрессирующего CAR вместе с eGFP с использованием последовательности рибосомального скачка 2A. Культуры повторно стимулируют CD19+ K562-клетками (K562-CD19), K562-клетками дикого типа (K562 дикого типа) или K562-клетками, экспрессирующими hCD32 и 4-1BBL в присутствии анти-CD3 и анти-CD28 антитела (K562-BBL-3/28), после промывания. Через день в культуры добавляют 100 МЕ/мл экзогенного IL-2. GFP+ T-клетки подсчитывают с помощью проточной цитометрии с использованием подсчета на основе гранул. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Аналогичные анализы могут быть выполнены с использованием анти-CD123 T-клеток (смотри, например, Gill et al Blood 2014;123:2343) или с помощью T-клеток с CAR против CD33.
Также может быть измерено установившееся размножение CAR+ T-клеток в отсутствие повторной стимуляции. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Кратко говоря, измеряют средний объем T-клетки (fl) на 8 день культивирования с использованием счетчика частиц Coulter Multisizer III, Nexcelom Cellometer Vision или Millipore Scepter после стимуляции с помощью покрытых αCD3/αCD28 магнитных гранул на день 0 и трансдукции указанным CAR на день 1.
Также для измерения активности CART можно использовать модели на животных. Например, модель ксенотрансплантата с использованием человеческих CD19-специфических CAR+ T-клеток можно использовать для лечения первичного человеческого пре-B-ОЛЛ у иммунодефицитных мышей. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Кратко говоря, после установления ОЛЛ мышей рандомизируют по группам лечения. Различные количества сконструированных αCD19-ζ и αCD19-BB-ζ T-клеток совместно инъецируют в отношении 1:1 мышам NOD-SCID-γ-/-, имеющим B-ОЛЛ. Количество копий векторов αCD19-ζ и αCD19-BB-ζ в ДНК селезенки мышей оценивают в различные моменты времени после инъекции T-клеток. Животных оценивают в отношении лейкоза еженедельно. Измеряют количество CD19+ бластных клеток B-ОЛЛ периферической крови у мышей, которым инъецировали αCD19-ζ CAR+ T-клетки или ложно-трансдуцированные T-клетки. Кривые выживаемости для групп сравнивают с использованием логрангового критерия. Кроме того, также могут быть проанализированы абсолютные количества CD4+ и CD8+ T-клеток периферической крови через 4 недели после инъекции NOD-SCID-γ-/- мышам T-клеток. Мышам инъецируют лейкозные клетки и через 3 недели инъецируют T-клетки, сконструированные для экспрессии CAR с помощью бицистронного лентивирусного вектора, который кодирует CAR, связанный с eGFP. T-клетки нормализуют до 45-50% входящих GFP+ T-клеток посредством смешивания с ложно-трансдуцированными клетками перед инъекцией и подтверждают с помощью проточной цитометрии. Животных оценивают в отношении лейкоза еженедельно. Кривые выживаемости для групп CAR+ T-клеток сравнивают с использованием логрангового критерия. Аналогичные эксперименты могут быть выполнены с CD33-CART.
Может быть оценен дозозависимый ответ на лечение CAR. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Например, получают периферическую кровь через 35-70 дней после установления лейкоза у мышей, инъецированных на день 21 T-клетками с CAR, эквивалентным количеством ложно-трансдуцированных T-клеток или без T-клеток. Мышам из каждой группы случайным образом пускали кровь для определения числа CD19+ бластов ОЛЛ периферической крови, и затем их умерщвляли на дни 35 и 49. Оставшихся животных оценивали на дни 57 и 70. Аналогичные эксперименты могут быть выполнены с CD33-CART.
Оценка клеточной пролиферации и производства цитокинов была описана ранее, например, в документе Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Кратко говоря, оценку CAR-опосредованной пролиферации осуществляют в микротитровальных планшетах посредством смешивания промытых T-клеток с K562-клетками, экспрессирующими CD19 (K19) или CD32 и CD137 (KT32-BBL), до конечного отношения T-клетки:K562, составляющего 2:1. K562-клетки облучают перед использованием гамма-излучением. Анти-CD3 (клон OKT3) и анти-CD28 (клон 9,3) моноклональные антитела добавляют к культурам с клетками KT32-BBL, чтобы они служили в качестве положительного контроля стимуляции пролиферации T-клеток, поскольку эти сигналы поддерживают размножение продолжительных CD8+ T-клеток ex vivo. T-клетки подсчитывают в культурах с использованием флуоресцентных гранул CountBright™ (Invitrogen, Carlsbad, CA) и проточной цитометрии, как описано производителем. CAR+ T-клетки идентифицируют по экспрессии GFP с использованием T-клеток, которые сконструированы с помощью связанных с eGFP-2A экспрессирующих CAR лентивирусных векторов. В случае CAR+ T-клеток, не экспрессирующих GFP, CAR+ T-клетки детектируют с помощью биотинилированного рекомбинантного белка CD33 и вторичного конъюгата авидин-PE. Также одновременно детектируют экспрессию CD4+ и CD8+ на T-клетках с помощью специфических моноклональных антител (BD Biosciences). Измерения цитокинов выполняют на супернатантах, собранных через 24 часа после повторной стимуляции с использованием цитометрического матричного набора гранул для определения цитокинов человеческих TH1/TH2 (BD Biosciences, San Diego, CA) в соответствии с инструкциями изготовителя или с использованием 30-плексного набора Luminex (Invitrogen). Флуоресценцию оценивают с использованием проточного цитометра BD Fortessa, и данные анализируют в соответствии с инструкциями изготовителя. Аналогичные эксперименты могут быть проведены с CD33-CART.
Цитотоксичность может быть оценена с помощью стандартного анализа высвобождения 51Cr. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Кратко говоря, клетки-мишени (линии K562 и первичные клетки пре-B-ОЛЛ) нагружают 51Cr (в виде NaCrO4, New England Nuclear, Boston, MA) при 37°C в течение 2 часов с частым встряхиванием, промывают дважды в полной RPMI и высеивают в микротитровальные планшеты. Эффекторные T-клетки смешивают с клетками-мишенями в лунках в полной RPMI при различных отношениях эффекторная клетка:клетка-мишень (E:T). Также готовят дополнительные лунки, содержащие только среду (спонтанное высвобождение, SR) или 1% раствор детергента тритон-X 100 (общее высвобождение, TR). После 4 часов инкубации при 37°C отбирают супернатант из каждой лунки. Затем измеряют высвобожденный 51Cr с использованием счетчика гамма-частиц (Packard Instrument Co., Waltham, MA). Каждый выриант эксперимента выполняют по меньшей мере в трех повторностях, и вычисляют процентную долю лизиса с использованием формулы: % лизиса=(ER-SR)/(TR-SR), где ER представляет средний 51Cr, высвобожденный для каждого из условий эксперимента.
Можно использовать технологии визуализации для оценки специфической миграции и пролиферации CAR в моделях на несущих опухоль животных. Такие анализы были описаны, например, в документе Barrett et al., Human Gene Therapy 22:1575-1586 (2011). Кратко говоря, мышей NOD/SCID/γc-/- (NSG) инъецируют в/в клетками Nalm-6, а затем через 7 дней T-клетками через 4 часа после электропорации конструктов CAR. T-клетки стабильно трансфицируют лентивирусным конструктом для экспрессии люциферазы светлячка, и мышей визуализируют в отношении биолюминесценции. В качестве альтернативы, терапевтическая эффективность и специфичность одной инъекции CAR+ T-клеток в ксенотрансплантатной модели Nalm-6 может быть измерена следующим образом: мышей NSG инъецируют Nalm-6, трансдуцированными для стабильной экспрессии люциферазы светлячка, с одной последующей инъекцией в хвостовую вену T-клеток, электропорированных CAR к CD33, 7 дней спустя. Животных визуализируют после инъекции в различных временных точках. Например, могут быть созданы тепловые карты фотонной плотности положительного по люциферазе светлячка лейкоза у типичных мышей на день 5 (за 2 дня до лечения) и день 8 (через 24 ч после CAR+ PBL). Можно также использовать другие анализы, включая описанные в разделе примеров в настоящем документе, а также известные в данной области техники, для оценки конструктов CAR к CD33 настоящего изобретения.
В качестве альтернативы, или в комбинации со способами, раскрытыми в настоящем документе, раскрыты способы и композиции для одного или нескольких из: детектирования и/или количественного описания CAR-экспрессирующих клеток (например, in vitro или in vivo (например, клинического мониторинга)); размножения и/или активации иммунных клеток; и/или CAR-специфической селекции, которая включает в себя использование лиганда CAR. В одном типичном варианте осуществления лиганд CAR представляет собой антитело, которое связывается с молекулой CAR, например, связывается с внеклеточным антигенсвязывающим доменом CAR (например, антитело, которое связывается с антигенсвязывающим доменом, например, антиидиотипическое антитело; или антитело, которое связывается с константной областью внеклеточного связывающего домена). В других вариантах осуществления лиганд CAR представляет собой молекулу антигена CAR (например, молекулу антигена CAR, как описано в настоящем документе).
В одном аспекте раскрыт способ детектирования и/или количественного описания CAR-экспрессирующих клеток. Например, можно использовать лиганд CAR для детектирования и/или количественного описания CAR-экспрессирующих клеток in vitro или in vivo (например, клинического мониторинга CAR-экспрессирующих клеток у пациента или дозирования пациенту). Способ включает в себя:
предоставление лиганда CAR (необязательно, меченого лиганда CAR, например, лиганда CAR, который включает в себя маркер, гранулу, радиоактивную или флуоресцентную метку);
получение экспрессирующей CAR клетки (например, получение образца, содержащего CAR-экспрессирующие клетки, такого как производственный образец или клинический образец);
приведение экспрессирующей CAR клетки в контакт с лигандом CAR в условиях, в которых происходит связывание, что позволяет детектировать уровень (например, количество) присутствующих CAR-экспрессирующих клеток. Связывание экспрессирующей CAR клетки с лигандом CAR может быть детектировано с использованием стандартных методов, таких как FACS, ELISA и тому подобные.
В другом аспекте раскрыт способ размножения и/или активации клеток (например, иммунных эффекторных клеток). Способ включает в себя:
предоставление экспрессирующей CAR клетки (например, первой экспрессирующей CAR клетки или временно экспрессирующей CAR клетки);
приведение упомянутой экспрессирующей CAR клетки в контакт с лигандом CAR, например, лигандом CAR, описанном в настоящем документе), в условиях, в которых происходят размножение и/или пролиферация иммунных клеток, благодаря чему получают популяцию активированных и/или размноженных клеток.
В определенных вариантах осуществления лиганд CAR присутствует (например, иммобилизован или прикреплен к субстрату, например, неприродному субстрату). В некоторых вариантах осуществления субстрат представляет собой неклеточный субстрат. Неклеточный субстрат может представлять собой твердую подложку, выбранную из, например, планшета (например, микротитровального планшета), мембраны (например, нитроцеллюлозной мембраны), матрицы, чипа или гранулы. В вариантах осуществления лиганд CAR присутствует в субстрате (например, на поверхности субстрата). Лиганд CAR может быть иммобилизован, прикреплен или ковалентно или нековалентно связан (например, перекрестно сшит) с субстратом. В одном варианте осуществления лиганд CAR прикреплен (например, ковалентно прикреплен) к грануле. В вышеупомянутых вариантах осуществления популяция иммунных клеток может быть размножена in vitro или ex vivo. Способ может дополнительно включать в себя культивирование популяции иммунных клеток в присутствии лиганда молекулы CAR, например, с использованием любого из способов, описанных в настоящем документе.
В других вариантах осуществления способ размножения и/или активации клеток дополнительно содержит добавление второй стимулирующей молекулы, например, CD28. Например, лиганд CAR и вторая стимулирующая молекула могут быть иммобилизованы на субстрате, например, одной или нескольких гранулах, что обеспечивает увеличение размножения и/или активации клеток.
В еще одном аспекте предлагается способ селекции или обогащения экспрессирующих CAR клеток. Способ включает в себя приведение экспрессирующей CAR клетки в контакт с лигандом CAR, как описано в настоящем документе; и селекцию клеток на сновании связывания лиганда CAR.
В других вариантах осуществления предлагается способ истощения, уменьшения количества и/или киллинга экспрессирующей CAR клетки. Способ включает в себя приведение экспрессирующей CAR клетки в контакт с лигандом CAR, как описано в настоящем документе; и воздействие на клетку на основании связывания лиганда CAR, что уменьшает количество экспрессирующих CAR клеток и/или убивает их. В одном варианте осуществления лиганд CAR связан с токсическим средством (например, токсином или клеточно-аблятивным препаратом). В другом варианте осуществления антиидиотипическое антитело может вызывать активность эффекторных клеток, например, активность ADCC или ADC.
Типичные анти-CAR антитела, которые можно использовать в способах, раскрытых в настоящем документе, описаны, например, в документах WO 2014/190273 и Jena et al., "Chimeric Antigen Receptor (CAR)-Specific Monoclonal Antibody to Detect CD19-Specific T cells in Clinical Trials", PLOS March 2013 8:3 e57838, содержание которых включено посредством ссылки. В одном варианте осуществления молекула антиидиотипического антитела распознает молекулу анти-CD19 антитела, например, анти-CD19 scFv. Например, молекула антиидиотипического антитела может конкурировать за связывание с CD19-специфическим CAR mAb клоном № 136.20.1, описанным в документе Jena et al., PLOS March 2013 8:3 e57838; может иметь те же CDR (например, одну или несколько, например, все, из VH CDR1, VH CDR2, CH CDR3, VL CDR1, VL CDR2 и VL CDR3 при использовании определения Кэбота, определения Чотиа или комбинации определений Кэбота и Чотиа), что и CD19-специфический CAR mAb клон № 136.20.1; может иметь одну или несколько (например, 2) вариабельных областей как у CD19-специфического CAR mAb клона № 136.20.1 или может содержать CD19-специфический CAR mAb клон № 136.20.1. В некоторых вариантах осуществления антиидиотипическое антитело изготовлено в соответствии со способом, описанным в документе Jena et al. В другом варианте осуществления молекула антиидиотипического антитела представляет собой молекулу антиидиотипического антитела, описанную в документе WO 2014/190273. В некоторых вариантах осуществления молекула антиидиотипического антитела имеет те же CDR (например, одну или несколько, например, все, из VH CDR1, VH CDR2, CH CDR3, VL CDR1, VL CDR2 и VL CDR3), что и молекула антитела из WO 2014/190273, такая как 136.20.1; может иметь одну или несколько (например, 2) вариабельных областей молекулы антитела из WO 2014/190273 или может содержать молекулу антитела из WO 2014/190273, такую как 136.20.1. В других вариантах осуществления анти-CAR антитело связывается с константной областью внеклеточного связывающего домена молекулы CAR, например, как описано в WO 2014/190273. В некоторых вариантах осуществления анти-CAR антитело связывается с константной областью внеклеточного связывающего домена молекулы CAR, например, константной областью тяжелой цепи (например, шарнирной областью CH2-CH3) или константной областью легкой цепи. Например, в некоторых вариантах осуществления анти-CAR антитело конкурирует за связывание с моноклональным антителом 2D3, описанным в WO 2014/190273, имеет те же CDR (например, одну или несколько, например, все, из VH CDR1, VH CDR2, CH CDR3, VL CDR1, VL CDR2 и VL CDR3), что и 2D3, или имеет одну или несколько (например, 2) вариабельных областей 2D3, или содержит 2D3, как описано в WO 2014/190273.
В некоторых аспектах и вариантах осуществления композиции и способы настоящего документа оптимизированы для конкретной подгруппы T-клеток, например, как описано в документе сериальный № US 62/031699, поданном 31 июля 2014 года, содержание которого включено в настоящий документ посредством ссылки во всей полноте. В некоторых вариантах осуществления оптимизированные подгруппы T-клеток демонстрируют увеличенную жизнестойкость по сравнению с контрольной T-клеткой, например, T-клеткой другого типа (например, CD8+ или CD4+), экспрессирующей тот же конструкт.
В некоторых вариантах осуществления CD4+ T-клетка содержит CAR, описанный в настоящем документе, причем данный CAR содержит внутриклеточный сигнальный домен, подходящий (например, оптимизированный, например, приводящий к увеличенной жизнестойкости) для CD4+ T-клетки, например, домен из ICOS. В некоторых вариантах осуществления CD8+ T-клетка содержит CAR, описанный в настоящем документе, причем данный CAR содержит внутриклеточный сигнальный домен, подходящий (например, оптимизированный, например, приводящий к увеличенной жизнестойкости) для CD8+ T-клетки, например, домен из 4-1BB, домен из CD28 или другой костимулирующий домен, отличный от домена из ICOS. В некоторых вариантах осуществления CAR, описанный в настоящем документе, содержит антигенсвязывающий домен, описанный в настоящем документе, например, CAR содержит антигенсвязывающий домен, который воздействует на CD33, например, CAR из таблицы 8 или CAR, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 140, или антигенсвязывающий домен, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 147.
В аспекте в настоящем документе описан способ лечения субъекта, например, субъекта, имеющего рак. Способ включает в себя введение упомянутому субъекту эффективного количества:
1) CD4+ T-клетки, содержащей CAR (CARCD4+),
содержащей:
антигенсвязывающий домен, например, антигенсвязывающий домен, описанный в настоящем документе, например, антигенсвязывающий домен, который воздействует на CD33, например, антигенсвязывающий домен из таблицы 8 или 9 или антигенсвязывающий домен, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 140 или 147;
трансмембранный домен; и
внутриклеточный сигнальный домен, например, первый костимулирующий домен, например, домен из ICOS; и
2) CD8+ T-клетки, содержащей CAR (CARCD8+), содержащей:
антигенсвязывающий домен, например, антигенсвязывающий домен, описанный в настоящем документе, например, антигенсвязывающий домен, который воздействует на CD33, например, антигенсвязывающий домен из таблицы 8 или 9 или антигенсвязывающий домен, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 140 или 147;
трансмембранный домен; и
внутриклеточный сигнальный домен, например, второй костимулирующий домен, например, домен из 4-1BB, домен из CD28 или другой костимулирующий домен, отличный от домена из ICOS;
причем CARCD4+ и CARCD8+ отличаются друг от друга.
Необязательно, способ дополнительно включает в себя введение:
3) второй CD8+ T-клетки, содержащей CAR (второй CARCD8+), содержащей:
антигенсвязывающий домен, например, антигенсвязывающий домен, описанный в настоящем документе, например, антигенсвязывающий домен, который специфически связывается с CD33, например, антигенсвязывающий домен из таблицы 8 или 9 или антигенсвязывающий домен, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 140 или 147;
трансмембранный домен; и
внутриклеточный сигнальный домен, причем второй CARCD8+ содержит внутриклеточный сигнальный домен, например, костимулирующий сигнальный домен, не присутствующий на CARCD8+, и, необязательно, не содержит сигнальный домен из ICOS.
Терапевтическое применение
Ассоциированные с CD33 заболевания и/или нарушения
Настоящее изобретение предлагает, помимо прочего, композиции и способы для лечения заболевания, ассоциированного с экспрессией CD33, или состояния, ассоциированного с клетками, которые экспрессируют CD33, включая, например, пролиферативное заболевание, такое как рак или злокачественная опухоль, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанного с раком симптома, ассоциированного с клетками, которые экспрессируют CD33. В одном аспекте рак, ассоциированный с экспрессией CD33, представляет собой гематологический рак. В одном аспекте гематологический рак включает в себя, но без ограничения, ОМЛ, миелодиспластический синдром, ОЛЛ, хронический миелоидный лейкоз, новообразование из бластных плазмацитоидных дендритных клеток, миелопролиферативные новообразования и тому подобное. Кроме того, заболевания, ассоциированные с экспрессией CD33, включают, но без ограничения, например, атипичные и/или неклассические раки, злокачественные опухоли, предраковые состояния или пролиферативные заболевания, ассоциированные с экспрессией CD33. Также могут быть включены не связанные с раком симптомы, ассоциированные с экспрессией CD33.
В одном аспекте настоящее изобретение предлагает способы лечения заболевания, ассоциированного с экспрессией CD33. В одном аспекте настоящее изобретение предлагает способы лечения заболевания, причем часть опухоли является отрицательной по CD33, и часть опухоли является положительной по CD33. Например, CAR настоящего изобретения подходят для лечения субъектов, которые подвергались лечению заболевания, ассоциированного с повышенной экспрессией CD33, причем субъект, который подвергался лечению в связи с повышенными уровнями CD33, демонстрирует заболевание, ассоциированное с повышенными уровнями CD33. В вариантах осуществления CAR настоящего изобретения подходят для лечения субъектов, которые подвергались лечению заболевания, ассоциированного с экспрессией CD33, причем субъект, который подвергался лечению, связанному с экспрессией CD33, демонстрирует заболевание, ассоциированное с экспрессией CD33.
В одном аспекте настоящее изобретение относится к вектору, содержащему CAR к CD33, функционально связанный с промотором для экспрессии в иммунных эффекторных клетках млекопитающего, например, T-клетках или NK-клетках. В одном аспекте настоящее изобретение предлагает рекомбинантную иммунную эффекторную клетку (например, T-клетку или NK-клетку), экспрессирующую CAR к CD33, для использования при лечении CD33-экспрессирующих опухолей, причем рекомбинантную иммунную эффекторную клетку (например, T-клетку или NK-клетку), экспрессирующую CAR к CD33, называют экспрессирующей CAR к CD33 клеткой (например, CD33-CART или экспрессирующей CAR к CD33 NK-клеткой). В одном аспекте экспрессирующая CAR клетка (например, CD33-CART или экспрессирующая CAR к CD33 NK-клетка) настоящего изобретения способна к приведению опухолевой клетки в контакт с по меньшей мере одним CAR к CD33 настоящего изобретения, экспрессируемым на ее поверхности, так что экспрессирующая CAR клетка (например, CD33-CART или экспрессирующая CAR к CD33 NK-клетка) воздействует на опухолевую клетку, и рост опухоли ингибируется.
В одном аспекте настоящее изобретение относится к способу ингибирования роста CD33-экспрессирующей опухолевой клетки, содержащему приведение опухолевой клетки в контакт с экспрессирующей CAR к CD33 клеткой (например, CD33-CART или экспрессирующей CAR к CD33 NK-клеткой) настоящего изобретения, так что экспрессирующая CAR клетка (например, CD33-CART или экспрессирующая CAR к CD33 NK-клетка) активируется в ответ на антиген и воздействует на раковую клетку, причем рост опухоли ингибируется.
В одном аспекте настоящее изобретение относится к способу лечения рака у субъекта. Способ содержит введение субъекту экспрессирующей CAR к CD33 клетки (например, CD33-CART или экспрессирующей CAR к CD33 NK-клетки) настоящего изобретения, так что происходит лечение рака у субъекта. Примером рака, который можно лечить с помощью экспрессирующей CAR к CD33 клетки (например, CD33-CART или экспрессирующей CAR к CD33 NK-клетки) настоящего изобретения, является рак, ассоциированный с экспрессией CD33. Пример рака, который можно лечить с помощью экспрессирующей CAR к CD33 клетки (например, CD33-CART или экспрессирующей CAR к CD33 NK-клетки) настоящего изобретения включает, но без ограничения, ОМЛ, миелодиспластический синдром, хронический миелоидный лейкоз и другие миелопролиферативные новообразования или новообразование из бластных плазмацитоидных дендритных клеток и тому подобное.
Настоящее изобретение включает в себя тип клеточной терапии, при которой иммунные эффекторные клетки, например, T-клетки или NK-клетки, генетически модифицированы для экспрессии химерного антигенного рецептора (CAR), и экспрессирующую CAR клетку (например, CD33-CART или экспрессирующую CAR к CD33 NK-клетку) вводят нуждающемуся в этом реципиенту. Вводимая клетка способна убивать опухолевые клетки у реципиента. В отличие от терапий антителами, CAR-модифицированные клетки (например, T-клетки или NK-клетки) способны реплицироваться in vivo, что приводит к продолжительной жизнестойкости, что может приводить к устойчивому контролю опухоли. В различных аспектах клетки (например, T-клетки или NK-клетки), введенные пациенту, или их потомство сохраняются у пациента в течение по меньшей мере четырех месяцев, пяти месяцев, шести месяцев, семи месяцев, восьми месяцев, девяти месяцев, десяти месяцев, одиннадцати месяцев, двенадцати месяцев, тринадцати месяцев, четырнадцати месяцев, пятнадцати месяцев, шестнадцати месяцев, семнадцати месяцев, восемнадцати месяцев, девятнадцати месяцев, двадцати месяцев, двадцати одного месяца, двадцати двух месяцев, двадцати трех месяцев, двух лет, трех лет, четырех лет или пяти лет после введения клети (например, T-клетки или NK-клетки) пациенту.
Настоящее изобретение также включает в себя тип клеточной терапии, при которой иммунные эффекторные клетки (например, T-клетки или NK-клетки) модифицируют, например, с помощью транскрибируемой in vitro РНК, для временной экспрессии химерного антигенного рецептора (CAR), и иммунную эффекторную клетку (например, T-клетку или NK-клетку) вводят нуждающемуся в этом реципиенту. Вводимая клетка способна убивать опухолевые клетки у реципиента. Таким образом, в различных аспектах иммунные эффекторные клетки (например, T-клетки или NK-клетки), введенные пациенту, присутствуют в течение меньше чем один месяц, например, три недели, две недели, одну неделю, после введения иммунной эффекторной клетки (например, T-клетки или NK-клетки) пациенту.
Без ограничения какой-либо конкретной теорией, противоопухолевый иммунный ответ, вызываемый CAR-модифицированными иммунными эффекторными клетками (например, T-клетками или NK-клетками) может представлять собой активный или пассивный иммунный ответ или, альтернативно, может быть обусловлен непосредственным или опосредованным иммунным ответом. В одном аспекте трансдуцированные CAR иммунные эффекторные клетки (например, T-клетки или NK-клетки) демонстрируют секрецию специфических провоспалительных цитокинов и сильную цитолитическую активность в ответ на человеческие раковые клетки, экспрессирующие CD33, противодействуют ингибированию растворимого CD33, опосредуют неспецифический киллинг и опосредуют регрессию развившейся человеческой опухоли. Например, лишенные антигенов опухолевые клетки в гетерогенном поле CD33-экспрессирующей опухоли могут быть подвержены опосредованному разрушению перенаправленными на CD33 иммунными эффекторными клетками (например, T-клетками или NK-клетками), которые ранее реагировали с соседними антиген-положительными раковыми клетками.
В одном аспекте полностью человеческие CAR-модифицированные иммунные эффекторные клетки (например, T-клетки или NK-клетки) настоящего изобретения могут представлять собой тип вакцины для ex vivo иммунизации и/или in vivo терапии у млекопитающего. В одном аспекте млекопитающее представляет собой человека.
По отношению к ex vivo иммунизации по меньшей мере одно из следующих происходит in vitro перед введением клетки млекопитающему: i) размножение клеток, ii) введение нуклеиновой кислоты, кодирующей CAR, в клетки или iii) криосохранение клеток.
Ex vivo процедуры хорошо известны в данной области техники и рассмотрены более полно ниже. Кратко говоря, клетки выделяют из млекопитающего (например, человека) и генетически модифицируют (то есть трансдуцируют или трансфицируют in vitro) с помощью вектора, экспрессирующего CAR, раскрытый в настоящем документе. CAR-модифицированная клетка может быть введена реципиенту-млекопитающему для обеспечения терапевтической пользы. Реципиент-млекопитающее может представлять собой человека, и CAR-модифицированная клетка может быть аутологичной по отношению к реципиенту. В качестве альтернативы, клетки могут быть аллогенными, сингенными или ксеногенными по отношению к реципиенту.
Процедура ex vivo размножения гематопоэтических стволовых клеток и клеток-предшественников описана в патенте США № 5199942, включенном в настоящий документ посредством ссылки, и может быть применена к клеткам настоящего изобретения. Другие подходящие способы известны в данной области техники, поэтому настоящее изобретение не ограничено любым конкретным способом ex vivo размножения клеток. Кратко говоря, ex vivo культивирование и размножение T-клеток содержит: (1) отбор CD34+ гематопоэтических стволовых клеток и клеток-предшественников у млекопитающего из собранной периферической крови или эксплантатов костного мозга; и (2) размножение таких клеток ex vivo. В дополнение к факторам клеточного роста, описанным в патенте США № 5199942, для культивирования и размножения клеток можно использовать другие факторы, такие как flt3-L, IL-1, IL-3 и лиганд c-kit.
В дополнение к использованию вакцины на клеточной основе для ex vivo иммунизации настоящее изобретение предлагает также композиции и способы для in vivo иммунизации для вызывания иммунного ответа, направленного против антигена, у пациента.
Обычно клетки, активированные и размноженные, как описано в настоящем документе, можно использовать в лечении и предупреждении заболеваний, которые возникают у индивидуумов, которые иммунологически скомпрометированы. В частности, CAR-модифицированные иммунные эффекторные клетки (например, T-клетки или NK-клетки) настоящего изобретения используют в лечении заболеваний, нарушений и состояний, ассоциированных с экспрессией CD33. В определенных аспектах клетки настоящего изобретения используют в лечении пациентов, подверженных риску развития заболеваний, нарушений и состояний, ассоциированных с экспрессией CD33. Таким образом, настоящее изобретение предлагает способы лечения или предупреждения заболеваний, нарушений и состояний, ассоциированных с экспрессией CD33, содержащих введение субъекту, нуждающемуся в этом, терапевтически эффективного количества CAR-модифицированных иммунных эффекторных клеток (например, T-клеток или NK-клеток) настоящего изобретения.
В одном аспекте CAR-экспрессирующие клетки (например, CART-клетки или экспрессирующие CAR NK-клетки) настоящего изобретения можно использовать для лечения пролиферативного заболевания, такого как рак или злокачественная опухоль, или предракового состояния, такого как миелодисплазия, миелодиспластический синдром или предлейкоз. В одном аспекте рак, ассоциированный с экспрессией CD33, представляет собой гематологический рак, прелейкемию, гиперпрофилеративное нарушение, гиперплазию или дисплазию, которые характеризуется аномальным ростом клеток.
В одном аспекте CAR-экспрессирующие клетки (например, CART-клетки или экспрессирующие CAR NK-клетки) настоящего изобретения используют для лечения рака, причем рак представляет собой гематологический рак. Состояниями гематологического рака являются такие типы рака, как лейкоз и злокачественные лимфопролиферативные состояния, которые воздействуют на кровь, костный мозг и лимфатическую систему.
В одном аспекте композиции и CAR-экспрессирующие клетки (например, CART-клетки или экспрессирующие CAR NK-клетки) настоящего изобретения особенно подходят для лечения миелоидных лейкозов, ОМЛ и его подтипов, хронического миелоидного лейкоза (ХМЛ) и миелодиспластического синдрома (МДС).
Лейкоз может быть классифицирован на острый лейкоз и хронический лейкоз. Острый лейкоз может быть дополнительно классифицирован на острый миелогенный лейкоз (ОМЛ) и острый лимфоидный лейкоз (ОЛЛ). Хронический лейкоз включает в себя хронический миелогенный лейкоз (ХМЛ) и хронический лимфоидный лейкоз (ХЛЛ). Другие родственные состояния включают миелодиспластические синдромы (МДС, ранее известные как "предлейкоз"), которые представляют собой разнородную совокупность гематологических состояний, объединенных неэффективным производством (или дисплазией) миелоидных кровяных клеток и риском трансформации в ОМЛ.
Лимфома представляет собой группу опухолей кровяных клеток, которые развиваются из лимфоцитов. Типичные лимфомы включают неходжкинскую лимфому и ходжкинскую лимфому.
При ОМЛ злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных долгоживущих миелоидных клеток-предшественников приводит к большому количеству незрелых форм крови в циркуляции и замещению нормального костного мозга злокачественными клетками. Симптомы включают в себя усталость, бледность, легкое возникновение кровоподтеков и кровотечений, лихорадку и инфекцию; симптомы лейкозной инфильтрации присутствуют только приблизительно у 5% пациентов (часто в виде кожных проявлений). Исследование мазка периферической крови и костного мозга является диагностическим. Существующее лечение включает в себя индукционную химиотерапию для достижения ремиссии и постремиссионную химиотерапию (с трансплантацией стволовых клеток или без) для предотвращения рецидива.
ОМЛ имеет ряд подтипов, которые отличаются друг от друга по морфологии, иммунофенотипу и цитохимически. На основании преобладающего типа клеток описано пять классов, включая миелоидный, миелоидно-моноцитарный, моноцитарный, эритроидный и мегакариоцитарный.
Степень индукции ремиссии находится в диапазоне от 50 до 85%. Как сообщают, продолжительная безрецидивная выживаемость происходит у 20-40% пациентов и возрастает до 40-50% у более молодых пациентов, получивших трансплантацию стволовых клеток.
Прогностические факторы помогают определять протокол и интенсивность лечения; пациенты с сильно отрицательными прогностическими признаками обычно получают более интенсивные формы терапии, поскольку полагают, что потенциальная польза оправдывает повышенную токсичность лечения. Наиболее важным прогностическим фактором является кариотип лейкозных клеток; благоприятные кариотипы включают t(15;17), t(8;21) и inv16 (p13;q22). Отрицательные факторы включают большой возраст, предшествующую миелодиспластическую фазу, вторичный лейкоз, высокое число БКК и отсутствие палочек Ауэра.
Первоначальная терапия стремится индуцировать ремиссию и больше всего отличается от ОЛЛ тем, что ОМЛ реагирует на меньшее количество препаратов. Основная схема индукции включает в себя цитарабин посредством непрерывного в/в введения или высоких доз в течение 5-7 дней; в это время дают даунорубицин или идаруцибин в/в в течение 3 дней. Некоторые схемы включают в себя 6-тиогуанин, этопозид, винкристин и преднизон, но их вклад остается неясным. Лечение обычно приводит к значительной миелосупрессии с инфекцией или кровотечением; имеет место значительная задержка перед восстановлением костного мозга. В это время тщательная профилактическая и поддерживающая терапия имеет жизненно важное значение.
Хронический миелогенный (или миелоидный) лейкоз (ХМЛ) также известен как хронический гранулоцитарный лейкоз и характеризуется как рак белых кровяных клеток. Обычные схемы лечения ХМЛ включают в себя ингибиторы тирозинкиназы Bcr-Abl, иматиниб (Gleevec®), дазатиниб и нилотиниб. Ингибиторы тирозинкиназы Bcr-Abl особенно подходят для пациентов с ХМЛ с транслокацией хромосомы Philadelphia.
Миелодиспластические синдромы (МДС) представляют собой гематологические медицинские состояния, характеризующиеся беспорядочным и неэффективным гемопоэзом или производством крови. Таким образом, количество и качество кроветворных клеток необратимо снижается. У некоторых пациентов с МДС может развиваться тяжелая анемия, тогда как другие являются бессимптомными. В данной области техники известна схема классификации МДС с критериями, обозначающими отношение или частоту определенных типов клеток крови, например, миелобластов, моноцитов и предшественников красных клеток. МДС включает в себя рефрактерную анемию, рефрактерную анемию с кольцевидными сидеробластами, рефрактерную анемию с избытком бластов, рефрактерную анемию с избытком бластов на стадии трансформации, хронический миеломоноцитарный лейкоз (ХМЛ).
Лечение МДС изменяется с тяжестью симптомов. Агрессивные формы лечения для пациентов, испытывающих тяжелые симптомы, включают трансплантаты костного мозга и поддерживающую терапию с помощью поддержки продуктами крови (например, переливаний крови) и гематопоэтических факторов роста (например, эритропоэтина). Для лечения МДС часто используют другие средства: 5-азацитидин, децитабин и леналидомид. В некоторых случаях можно также вводить хелаторы железа дефероксамин (Desferal®) и деферазирокс (Exjade®).
В другом варианте осуществления CAR-экспрессирующие клетки (например, CART-клетки или экспрессирующие CAR NK-клетки) настоящего изобретения используют для лечения раков или лейкозов с помощью лейкозных стволовых клеток. Например, лейкозные стволовые клетки представляют собой CD34+/CD38- лейкозные клетки.
Настоящее изобретение предлагает, помимо прочего, композиции и способы для лечения рака. В одном аспекте рак представляет собой гематологический рак, включая, но без ограничения, лейкоз (такой как острый миелогенный лейкоз, хронический миелогенный лейкоз, острый лимфоидный лейкоз, хронический лимфоидный лейкоз и миелодиспластический синдром) и злокачественные лимфопролиферативные состояния, включая лимфому (такую как множественная миелома, неходжкинская лимфома, лимфома Беркитта и мелкоклеточная и крупноклеточная фолликулярная лимфома).
В одном аспекте CAR-экспрессирующие клетки (например, CART-клетки или экспрессирующие CAR NK-клетки) настоящего изобретения можно использовать для лечения других раков и злокачественных опухолей, таких как, но без ограничения, например, острые лейкозы, включая, но без ограничения, например, B-клеточный острый лимфоидный лейкоз ("BALL"), T-клеточный острый лимфоидный лейкоз ("TALL"), острый лимфоидный лейкоз (ОЛЛ); один или несколько хронических лейкозов, включая, но без ограничения, например, хронический миелогенный лейкоз (ХМЛ), хронический лимфоцитарный лейкоз (ХЛЛ); дополнительные гематологические раки или гематологические состояния, включая, но без ограничения, например, B-клеточный пролимфоцитарный лейкоз, новообразование из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную В-крупноклеточную лимфому, фолликулярную лимфому, волосистоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, мантийноклеточную лимфому, лимфому из клеток краевой зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, плазмобластную лимфому, новообразование из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", который представляет собой разнородную совокупность гематологических состояний, объединенных неэффективным производством (или дисплазией) миелоидных кровяных клеток, и тому подобное. CAR-модифицированные иммунные эффекторные клетки (например, T-клетки или NK-клетки) настоящего изобретения можно вводить или отдельно, или в виде фармацевтической композиции в комбинации с разбавителями и/или другими компонентами, такими как IL-2, или другие цитокины, или клеточные популяции.
Настоящее изобретение предлагает также способы ингибирования пролиферации или уменьшения популяции CD33-экспрессирующих клеток, причем данные способы содержат приведение популяции клеток, содержащей CD33-экспрессирующую клетку, в контакт с экспрессирующей CAR к CD33 клеткой (например, CD33CART-клеткой или экспрессирующей CAR к CD33 NK-клеткой) настоящего изобретения, которая связывается с CD33-экспрессирующей клеткой. В конкретном аспекте настоящее изобретение предлагает способы ингибирования пролиферации или уменьшения популяции раковых клеток, экспрессирующих CD33, причем данные способы содержат приведение популяции CD33-экспрессирующих раковых клеток в контакт с экспрессирующей CAR к CD33 клеткой (например, CD33CART-клеткой или экспрессирующей CAR к CD33 NK-клеткой) настоящего изобретения, которая связывается с CD33-экспрессирующей клеткой. В одном аспекте настоящее изобретение предлагает способы ингибирования пролиферации или уменьшения популяции раковых клеток, экспрессирующих CD33, причем данные способы содержат приведение популяции CD33-экспрессирующих раковых клеток в контакт с экспрессирующей CAR к CD33 клеткой (например, CD33CART-клеткой или экспрессирующей CAR к CD33 NK-клеткой) настоящего изобретения, которая связывается с CD33-экспрессирующей клеткой. В определенных аспектах экспрессирующая CAR к CD33 клетка (например, CD33CART-клетка или экспрессирующая CAR к CD33 NK-клетка) настоящего изобретения уменьшает численность, число, количество или процентную долю клеток и/или раковых клеток по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95% или по меньшей мере на 99% у субъекта или в модели на животных с миелоидным лейкозом или другим раком, ассоциированным с CD33-экспрессирующими клетками, относительно отрицательного контроля. В одном аспекте субъект представляет собой человека.
Настоящее изобретение предлагает также способы предупреждения, лечения и/или ведения заболевания, ассоциированного с CD33-экспрессирующими клетками (например, гематологического рака или атипичного рака, экспрессирующего CD33), причем данные способы содержат введение нуждающемуся субъекту экспрессирующей CAR к CD33 клетки (например, CD33CART-клетки или экспрессирующей CAR к CD33 NK-клетки) настоящего изобретения, которая связывается с CD33-экспрессирующей клеткой. В одном аспекте субъект представляет собой человека. Неограничивающие примеры нарушений, ассоциированных с CD33-экспрессирующими клетками, включают аутоиммунные нарушения (такие как волчанка), воспалительные нарушения (такие как аллергии и астма) и раки (такие как гематологические раки или атипичные раки, экспрессирующие CD33).
Настоящее изобретение предлагает также способы предупреждения, лечения и/или ведения заболевания, ассоциированного с CD33-экспрессирующими клетками, причем данные способы содержат введение нуждающемуся субъекту экспрессирующей CAR к CD33 клетки (например, CD33CART-клетки или экспрессирующей CAR к CD33 NK-клетки) настоящего изобретения, которая связывается с CD33-экспрессирующей клеткой. В одном аспекте субъект представляет собой человека.
Настоящее изобретение предлагает способы предупреждения рецидива рака, ассоциированного с CD33-экспрессирующими клетками, причем данные способы содержат введение субъекту, нуждающемуся в этом, экспрессирующей CAR к CD33 клетки (например, CD33CART-клетки или экспрессирующей CAR к CD33 NK-клетки) настоящего изобретения, которая связывается с CD33-экспрессирующей клеткой. В одном аспекте способы содержат введение субъекту, нуждающемуся в этом, эффективного количества экспрессирующей CAR к CD33 клетки (например, CD33CART-клетки или экспрессирующей CAR к CD33 NK-клетки), описанной в настоящем документе, которая связывается с CD33-экспрессирующей клеткой, в комбинации с эффективным количеством другой терапии.
Комбинированные терапии
Экспрессирующая CAR клетка, описанная в настоящем документе, может быть использована в комбинации с другими известными средствами и терапиями. Введение "в комбинации", как используется в настоящем документе, означает, что два (или более) различных видов лечения доставляются субъекту, когда субъект страдает от нарушения, например, два или более вида лечения доставляют после того, как субъекту был поставлен диагноз нарушения, и до того, как нарушение было вылечено или устранено, или лечение было прекращено по другим причинам. В некоторых вариантах осуществления доставка одного вида лечения продолжает происходить, когда начинается доставка второго, так что имеет место перекрывание в отношении введения. В настоящем документе это иногда обозначается как "одновременная" или "совместная доставка". В других вариантах осуществления доставка одного вида лечения заканчивается до того, как начинается доставка другого вида лечения. В некоторых вариантах осуществления в любом из случаев лечение является более эффективным вследствие комбинированного введения. Например, второй вид лечения является более эффективным, например, эквивалентный эффект наблюдается при меньшем количестве второго вида лечения, или второй вид лечения уменьшает симптомы в большей степени, чем можно было бы наблюдать при введении второго вида лечения в отсутствие первого вида лечения, или аналогичную ситуацию наблюдают для первого лечения. В некоторых вариантах осуществления доставку осуществляют таким образом, что уменьшение симптома или другого параметра, связанного с нарушением, оказывается большим, чем можно было бы наблюдать при доставке одного вида лечения в отсутствие другого. Эффект двух видов лечения может быть частично аддитивным, полностью аддитивным или больше чем аддитивным. Доставка может осуществляться таким образом, что эффект от доставки первого вида лечения продолжают детектировать во время доставки второго.
Экспрессирующая CAR клетка, описанная в настоящем документе, и по меньшей мере одно дополнительное терапевтическое средство могут быть введены одновременно, в одной или в разных композициях, или последовательно. Для последовательного введения экспрессирующая CAR клетка, описанная в настоящем документе, может быть введена первой, а дополнительное средство может быть введено вторым, или порядок введения может быть обратным.
Терапия с помощью CAR и/или другие терапевтические средства, процедуры или модальности могут быть введены в течение периодов активного нарушения или в течение периода ремиссии или менее активного заболевания. Терапия с помощью CAR может быть введена до другого лечения, одновременно с лечением, после лечения или во время ремиссии нарушения.
При введении в комбинации терапия с помощью CAR и дополнительное средство (например, второе или третье средство) или все они могут быть введены в количестве или дозе, которые выше, ниже или совпадают с количеством или дозировкой каждого средства при использовании по-отдельности, например, в качестве монотерапии. В определенных вариантах осуществления введенное количество или дозировка терапии с помощью CAR, дополнительного средства (например, второго или третьего средства) или их всех ниже (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%), чем количество или дозировка каждого средства при использовании по-отдельности, например, в качестве монотерапии. В других вариантах осуществления количество или дозировка терапии с помощью CAR, дополнительного средства (например, второго или третьего средства) или их всех, которые приводят к желаемому эффекту (например, лечению рака), ниже (например, ниже по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%), чем количество или дозировка каждого средства при использовании по-отдельности, например, в качестве монотерапии, требуемые для достижения того же терапевтического эффекта.
В других аспектах экспрессирующую CAR клетку, описанную в настоящем документе, можно использовать в схеме лечения в комбинации с хирургией, химиотерапией, излучением, иммуносупрессивными средствами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммуноаблативными средствами, такими как CAMPATH, анти-CD3 антитела или другие терапии антителами, цитоксин, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228, цитокины и облучение, пептидная вакцина, такая как описанная в Izumoto et al. 2008 J Neurosurg 108:963-971.
В некоторых случаях соединения настоящего изобретения объединяют с другими терапевтическими средствами, такими как другие противораковые средства, противоаллергические средства, средства против тошноты (или противорвотные), обезболивающие средства, цитопротекторные средства и их комбинации.
В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, можно использовать в комбинации с химиотерапевтическим средством. Типичные химиотерапевтические средства включают антрациклин (например, доксорубицин (например, липосомальный доксорубицин)), алкалоид барвинка (например, винбластин, винкристин, виндезин, винорелбин), алкилирующее средство (например, циклофосфамид, декарбазин, мелфалан, ифосфамид, темозоломид), антитело иммунных клеток (например, алемтузумаб, гемтузумаб, ритуксимаб, офатумумаб, тозитумомаб, брентуксимаб), антиметаболит (включая, например, антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндезаминазы (например, флударабин)), ингибитор mTOR, агонист индуцированного глюкокортикоидами родственного TNFR белка (GITR), ингибитор протеасом (например, аклациномицин A, глиотоксин или бортезомиб), иммуномодулятор, такой как талидомид или производное талидомида (например, леналидомид).
Химиотерапевтические средства общего назначения, рассматриваемые для использования в комбинированных терапиях, включают бусульфан (Myleran®), бусульфан для инъекций (Busulfex®), кладрибин (Leustatin®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозина арабинозид (Cytosar-U®), липосомный цитарабин для инъекций (DepoCyt®), даунорубицина гидрохлорид (Cerubidine®), липосомный даунорубицина цитрат для инъекций (DaunoXome®), дексаметазон, доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), гидроксимочевину (Hydrea®), идаруцибин (Idamycin®), митоксантрон (Novantrone®), гемтузумаба озогамицин (Mylotarg®).
В вариантах осуществления химиотерапевтические средства общего назначения, рассматриваемые для использования в комбинированных терапиях, включают анастрозол (Arimidex®), бикалутамид (Casodex®), блеомицина сульфат (Blenoxane®), бусульфан (Myleran®), бусульфан для инъекций (Busulfex®), капецитабин (Xeloda®), N4-пентоксикарбонил-5-дезокси-5-фтороцитидин, карбоплатин (Paraplatin®), кармустин (BiCNU®), хлорамбуцил (Leukeran®), цисплатин (Platinol®), кладрибин (Leustatin®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозина арабинозид (Cytosar-U®), липосомный цитарабин для инъекций (DepoCyt®), дакарбазин (DTIC-Dome®), дактиномицин (актиномицин D, космеган), даунорубицина гидрохлорид (Cerubidine®), липосомный даунорубицина цитрат для инъекций (DaunoXome®), дексаметазон, доцетаксел (Taxotere®), доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), 5-фторурацил (Adrucil®, Efudex®), флутамид (Eulexin®), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевину (Hydrea®), идаруцибин (Idamycin®), ифосфамид (IFEX®), иринотекан (Camptosar®), L-аспарагиназу (ELSPAR®), лейковорин кальция, мелфалан (Alkeran®), 6-меркаптопурин (Purinethol®), метотрексат (Folex®), митоксантрон (Novantrone®), милотарг, паклитаксел (Taxol®), феникс (иттрий-90/MX-DTPA), пентостатин, полифепросан 20 с имплантатом кармустина (Gliadel®), тамоксифена цитрат (Nolvadex®), тенипозид (Vumon®), 6-тиогуанин, тиотепу, тирапазамин (Tirazone®), топотекана гидрохлорид для инъекций (Hycamptin®), винбластин (Velban®), винкристин (Oncovin®) и винорелбин (Navelbine®).
Противораковые средства, представляющие особый интерес для комбинации с соединениями настоящего изобретения, включают: антрациклины; алкилирующие средства; антиметаболиты; препараты, которые или ингибируют кальций-зависимую фосфатазу кальциневрин или киназу p70S6 FK506, или ингибируют киназу p70S6; ингибиторы mTOR; иммуномодуляторы; антрациклины; алкалоиды барвинка; ингибиторы протеосом; агонисты GITR; ингибиторы протеинтирозинфосфатазы; ингибитор киназы CDK4; ингибитор BTK; ингибитор киназы MKN; ингибитор киназы DGK; или онколитический вирус.
Типичные антиметаболиты включают, без ограничения, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндезаминазы: метотрексат (Rheumatrex®, Trexall®), 5-фторурацил (Adrucil®, Efudex®, Fluoroplex®), флоксуридин (FUDF®), цитарабин (Cytosar-U®, Tarabine PFS), 6-меркаптопурин (Puri-Nethol®)), 6-тиогуанин (тиогуанин Tabloid®), флударабина фосфат (Fludara®), пентостатин (Nipent®), пеметрексед (Alimta®), ралтитрексед (Tomudex®), кладрибин (Leustatin®), клофарабин (Clofarex®, Clolar®), азацитидин (Vidaza®), децитабин и гемцитабин (Gemzar®). Предпочтительные антиметаболиты включают цитарабин, клофарабин и флударабин.
Типичные алкилирующие средства включают, без ограничения, азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены: урациловый иприт (Aminouracil Mustard®, Chlorethaminacil®, Demethyldopan®, Desmethyldopan®, Haemanthamine®, Nordopan®, Uracil nitrogen mustard®, Uracillost®, Uracilmostaza®, Uramustin®, Uramustine®), хлорметин (Mustargen®), циклофосфамид (Cytoxan®, Neosar®, Clafen®, Endoxan®, Procytox®, RevimmuneTM), ифосфамид (Mitoxana®), мелфалан (Alkeran®), хлорамбуцил (Leukeran®), пипоброман (Amedel®, Vercyte®), триэтиленмеламин (Hemel®, Hexalen®, Hexastat®), триэтилентиофосфорамин, темозоламид (Temodar®), тиотепу (Thioplex®), бусульфан (Busilvex®, Myleran®), кармустин (BiCNU®), ломустин (CeeNU®), стрептозоцин (Zanosar®) и дакарбазин (DTIC-Dome®). Дополнительные типичные алкилирующие средства включают, без ограничения, оксалиплатин (Eloxatin®); темозоламид (Temodar® и Temodal®); дактиномицин (также известный как актиномицин-D, Cosmegen®); мелфалан (также известный как L-PAM, L-сарколизин и фенилаланиновый иприт, Alkeran®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); кармустин (BiCNU®); бендамустин (Treanda®); бусульфан (Busulfex® и Myleran®); карбоплатин (Paraplatin®); ломустин (также известный как CCNU, CeeNU®); цисплатин (также известный как CDDP, Platinol® и Platinol®-AQ); хлорамбуцил (Leukeran®); циклофосфамид (Cytoxan® и Neosar®); дакарбазин (также известный как DTIC, DIC и имидазола карбоксамид, DTIC-Dome®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); ифосфамид (Ifex®); преднумустин; прокарбазин (Matulane®); мехлорэтамин (также известный как азотистый иприт, мустин и мехлорэтамина гидрохлорид, Mustargen®); стрептозоцин (Zanosar®); тиотепу (также известную как тиофосфоамид, TESPA и TSPA, Thioplex®); циклофосфамид (Endoxan®, Cytoxan®, Neosar®, Procytox®, Revimmune®); и бендамустин-HCl (Treanda®).
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с флударабином, циклофосфамидом и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с флударабином, циклофосфамидом и ритуксимабом (FCR). В вариантах осуществления субъект имеет ХЛЛ. Например, субъект имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах субъект не имеет del(17p). В вариантах осуществления субъект содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления субъект не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления флударабин вводят в дозировке, составляющей приблизительно 10-50 мг/м2 (например, приблизительно 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 мг/м2), например, внутривенно. В вариантах осуществления циклофосфамид вводят в дозировке, составляющей приблизительно 200-300 мг/м2 (например, приблизительно 200-225, 225-250, 250-275 или 275-300 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозировке, составляющей приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с бендамустином и ритуксимабом. В вариантах осуществления субъект имеет ХЛЛ. Например, субъект имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах субъект не имеет del(17p). В вариантах осуществления субъект содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления субъект не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления бендамустин вводят в дозировке, составляющей приблизительно 70-110 мг/м2 (например, 70-80, 80-90, 90-100 или 100-110 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозировке, составляющей приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и/или кортикостероидом (например, преднизоном). В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP). В вариантах осуществления субъект имеет диффузную В-крупноклеточную лимфому (DLBCL). В вариантах осуществления субъект имеет немассивную локализованную DLBCL (например, содержит опухоль, имеющую размер/диаметр меньше чем 7 см). В вариантах осуществления субъекта лечат с помощью излучения в комбинации с R-CHOP. Например, субъекту вводят R-CHOP (например, 1-6 циклов, например, 1, 2, 3, 4, 5 или 6 циклов R-CHOP), за чем следует излучение. В некоторых случаях субъекту вводят R-CHOP (например, 1-6 циклов, например, 1, 2, 3, 4, 5 или 6 циклов R-CHOP) после излучения.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и ритуксимабом (EPOCH-R). В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с подобранной дозой EPOCH-R (DA-EPOCH-R). В вариантах осуществления субъект имеет B-клеточную лимфому, например, агрессивную B-клеточную лимфому с перестройкой Myc.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ритуксимабом и/или леналидомидом. Леналидомид ((RS)-3-(4-амино-1-оксо-1,3-дигидро-2H-изоиндол-2-ил)пиперидин-2,6-дион) является иммуномодулятором. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ритуксимабом и леналидомидом. В вариантах осуществления субъект имеет фолликулярную лимфому (FL) или мантийноклеточную лимфому (МКЛ). В вариантах осуществления субъект имеет FL и ранее не получал терапию рака. В вариантах осуществления леналидомид вводят в дозировке, составляющей приблизительно 10-20 мг (например, 10-15 или 15-20 мг), например, ежедневно. В вариантах осуществления, ритуксимаб вводят в дозировке, составляющей приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
Типичные ингибиторы mTOR включают, например, темсиролимус; ридафоролимус (ранее известный как деферолимус, (1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфинат, также известный как AP23573 и MK8669, и описанный в публикации PCT № WO 03/064383); эверолимус (Afinitor® или RAD001); рапамицин (AY22989, Sirolimus®); симапимод (CAS 164301-51-3); эмсиролимус, (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанол (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-он (PF04691502, CAS 1013101-36-4); и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолин-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серин-(SEQ ID NO: 378), внутренняя соль (SF1126, CAS 936487-67-1), и XL765.
Типичные иммуномодуляторы включают, например, афутузумаб (доступен от Roche®); пэгфилграстим (Neulasta®); леналидомид (CC-5013, Revlimid®); талидомид (Thalomid®), актимид (CC4047); и IRX-2 (смесь человеческих цитокинов, включающая в себя интерлейкин-1, интерлейкин-2 и интерферон-γ, CAS 951209-71-5, доступен от IRX Therapeutics).
Типичные антрациклины включают, например, доксорубицин (Adriamycin® и Rubex®); блеомицин (lenoxane®); даунорубицин (даунорубицина гидрохлорид, дауномицин и рубидомицина гидрохлорид, Cerubidine®); липосомальный даунорубицин (липосома даунорубицина цитрата, DaunoXome®); митоксантрон (DHAD, Novantrone®); эпирубицин (Ellence™); идаруцибин (Idamycin®, Idamycin PFS®); митомицин C (Mutamycin®); гелданамицин; гербимицин; равидомицин; и дезацетилравидомицин.
Типичные алкалоиды барвинка включают, например, винорелбина тартрат (Navelbine®), винкристин (Oncovin®) и виндезин (Eldisine®)); винбластин (также известный как винбластина сульфат, винкалейкобластин и VLB, Alkaban-AQ® и Velban®); и винорелбин (Navelbine®).
Типичные ингибиторы протеосом включают бортезомиб (Velcade®); карфилзомиб (PX-171-007, (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилоксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3-фенилпропан-2-ил)-2-((S)-2-(2-морфолинацетамидо)-4-фенилбутанамидо)-пентанамид); маризомиб (NPI-0052); иксазомиба цитрат (MLN-9708); деланзомиб (CEP-18770); и O-метил-N-[(2-метил-5-тиазолил)карбонил]-L-серил-O-метил-N-[(1S)-2-[(2R)-2-метил-2-оксиранил]-2-оксо-1-(фенилметил)этил]-L-серинамид (ONX-0912).
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с брентуксимабом. Брентуксимаб представляет собой конъюгат антитело-препарат анти-CD30 антитела и монометилового ауристатина E. В вариантах осуществления субъект имеет ходжкинскую лимфому (HL), например, рецидивирующую или рефрактерную HL. В вариантах осуществления субъект имеет CD30+ HL. В вариантах осуществления субъект подвергался аутологичной трансплантации стволовых клеток (ASCT). В вариантах осуществления субъект не подвергался ASCT. В вариантах осуществления брентуксимаб вводят в дозировке, составляющей приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с брентуксимабом и дакарбазином или в комбинации с брентуксимабом и бендамустином. Дакарбазин представляет собой алкилирующее средство с химическим названием 5-(3,3-диметил-1-триазенил)имидазол-4-карбоксамид. Бендамустин представляет собой алкилирующее средство с химическим названием 4-[5-[бис(2-хлорэтил)амино]-1-метилбензимидазол-2-ил]бутановая кислота. В вариантах осуществления субъект имеет ходжкинскую лимфому (HL). В вариантах осуществления субъект ранее не получал терапию рака. В вариантах осуществления субъекту по меньшей мере 60 лет, например, 60, 65, 70, 75, 80, 85 или больше. В вариантах осуществления дакарбазин вводят в дозировке, составляющей приблизительно 300-450 мг/м2 (например, приблизительно 300-325, 325-350, 350-375, 375-400, 400-425 или 425-450 мг/м2), например, внутривенно. В вариантах осуществления бендамустин вводят в дозировке, составляющей приблизительно 75-125 мг/м2 (например, 75-100 или 100-125 мг/м2, например, приблизительно 90 мг/м2), например, внутривенно. В вариантах осуществления брентуксимаб вводят в дозировке, составляющей приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором CD20, например, анти-CD20 антителом (например, анти-CD20 моно- или биспецифическим антителом) или его фрагментом. Типичные анти-CD20 антитела включают, но без ограничения, ритуксимаб, офатумумаб, окрелизумаб, велтузумаб, обинутузумаб, TRU-015 (Trubion Pharmaceuticals), окаратузумаб и Pro131921 (Genentech). Смотри, например, Lim et al. Haematologica. 95,1(2010):135-43.
В некоторых вариантах осуществления анти-CD20 антитело содержит ритуксимаб. Ритуксимаб представляет собой химерное мышиное/человеческое моноклональное антитело IgG1-каппа, которое связывается с CD20 и вызывает цитолиз экспрессирующей CD20 клетки, например, как описано в www.accessdata.fda.gov/drugsatfda_docs/label/2010/103705s5311lbl.pdf. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ритуксимабом. В вариантах осуществления субъект имеет ХЛЛ или МКЛЛ.
В некоторых вариантах осуществления ритуксимаб вводят внутривенно, например, в виде внутривенного вливания. Например, каждое введение обеспечивает приблизительно 500-2000 мг (например, приблизительно 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1100, 1100-1200, 1200-1300, 1300-1400, 1400-1500, 1500-1600, 1600-1700, 1700-1800, 1800-1900 или 1900-2000 мг) ритуксимаба. В некоторых вариантах осуществления ритуксимаб вводят в дозе, составляющей от 150 мг/м2 до 750 мг/м2, например, приблизительно 150-175 мг/м2, 175-200 мг/м2, 200-225 мг/м2, 225-250 мг/м2, 250-300 мг/м2, 300-325 мг/м2, 325-350 мг/м2, 350-375 мг/м2, 375-400 мг/м2, 400-425 мг/м2, 425-450 мг/м2, 450-475 мг/м2, 475-500 мг/м2, 500-525 мг/м2, 525-550 мг/м2, 550-575 мг/м2, 575-600 мг/м2, 600-625 мг/м2, 625-650 мг/м2, 650-675 мг/м2 или 675-700 мг/м2, где м2 указывает на площадь поверхности тела субъекта. В некоторых вариантах осуществления ритуксимаб вводят с интервалом дозирования, составляющим по меньшей мере 4 дня, например, 4, 7, 14, 21, 28, 35 дней или более. Например, ритуксимаб вводят с интервалом дозирования, составляющим по меньшей мере 0,5 недели, например, 0,5, 1, 2, 3, 4, 5, 6, 7, 8 недель или более. В некоторых вариантах осуществления ритуксимаб вводят в дозе и с интервалом дозирования, описанными в настоящем документе, в течение периода времени, например, в течение по меньшей мере 2 недель, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 недель или больше. Например, ритуксимаб вводят в дозе и с интервалом дозирования, описанными в настоящем документе, в общей сложности в количестве по меньшей мере 4 доз на цикл лечения (например, по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или больше доз на цикл лечения).
В некоторых вариантах осуществления анти-CD20 антитело содержит офатумумаб. Офатумумаб представляет собой анти-CD20 человеческое моноклональное антитело IgG1κ с молекулярным весом, составляющим приблизительно 149 кДа. Например, офатумумаб создают с использованием трансгенной мыши и гибридомной технологии и экспрессируют и очищают из линии рекомбинантных мышиных клеток (NS0). Смотри, например, www.accessdata.fda.gov/drugsatfda_docs/label/2009/125326lbl.pdf; и клинические исследования с номерами идентификатора NCT01363128, NCT01515176, NCT01626352 и NCT01397591. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с офатумумабом. В вариантах осуществления субъект имеет ХЛЛ или МКЛЛ.
В некоторых вариантах осуществления офатумумаб вводят в виде внутривенного вливания. Например, каждое введение обеспечивает приблизительно 150-3000 мг (например, приблизительно 150-200, 200-250, 250-300, 300-350, 350-400, 400-450, 450-500, 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1200, 1200-1400, 1400-1600, 1600-1800, 1800-2000, 2000-2200, 2200-2400, 2400-2600, 2600-2800 или 2800-3000 мг) офатумумаба. В вариантах осуществления офатумумаб вводят в начальной дозировке, составляющей приблизительно 300 мг, за чем следует 2000 мг, например, в количестве приблизительно 11 доз, например, в течение 24 недель. В некоторых вариантах осуществления офатумумаб вводят с интервалом дозирования, составляющим по меньшей мере 4 дня, например, 4, 7, 14, 21, 28, 35 дней или более. Например, офатумумаб вводят с интервалом дозирования, составляющим по меньшей мере 1 неделю, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 26, 28, 20, 22, 24, 26, 28, 30 недель или более. В некоторых вариантах осуществления офатумумаб вводят в дозе и с интервалом дозирования, описанными в настоящем документе, в течение периода времени, например, в течение по меньшей мере 1 недели, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 40, 50, 60 недель или больше, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или больше, или 1, 2, 3, 4, 5 лет или больше. Например, офатумумаб вводят в дозе и с интервалом дозирования, описанными в настоящем документе, в количестве в общей сложности по меньшей мере 2 доз на цикл лечения (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 20 или больше доз на цикл лечения).
В некоторых случаях анти-CD20 антитело содержит окрелизумаб. Окрелизумаб представляет собой гуманизированное анти-CD20 моноклональное антитело, например, как описано в клинических исследованиях с идентификаторами №№ NCT00077870, NCT01412333, NCT00779220, NCT00673920, NCT01194570 и документе Kappos et al. Lancet. 19,378(2011):1779-87.
В некоторых случаях анти-CD20 антитело содержит велтузумаб. Велтузумаб представляет собой гуманизированное моноклональное антитело против CD20. Смотри, например, клинические исследования с идентификаторами №№ NCT00547066, NCT00546793, NCT01101581 и документ Goldenberg et al. Leuk Lymphoma. 51(5)(2010):747-55.
В некоторых случаях анти-CD20 антитело содержит GA101. GA101 (также называемый обинутузумабом или RO5072759) представляет собой гуманизированное и гликоинженерное анти-CD20 моноклональное антитело. Смотри, например, Robak. Curr. Opin. Investig. Drugs. 10,6(2009):588-96; клинические исследования с номерами идентификатора NCT01995669, NCT01889797, NCT02229422 и NCT01414205; и www.accessdata.fda.gov/drugsatfda_docs/label/2013/125486s000lbl.pdf.
В некоторых случаях анти-CD20 антитело содержит AME-133v. AME-133v (также называемый LY2469298 или окаратузумабом) представляет собой гуманизированное моноклональное антитело IgG1 против CD20 с повышенной аффинностью к рецептору FcγRIIIa и усиленной антитело-зависимой клеточной цитотоксической (ADCC) активностью по сравнению с ритуксимабом. Смотри, например, Robak et al. BioDrugs 25,1(2011):13-25; и Forero-Torres et al. Clin Cancer Res. 18,5(2012):1395-403.
В некоторых случаях анти-CD20 антитело содержит PRO131921. PRO131921 представляет собой гуманизированное анти-CD20 моноклональное антитело, сконструированное для лучшего связывания с FcγRIIIa и усиленной ADCC по сравнению с ритуксимабом. Смотри, например, Robak et al. BioDrugs 25,1(2011):13-25; и Casulo et al. Clin Immunol. 154,1(2014):37-46; и клиническое исследование с идентификатором № NCT00452127.
В некоторых случаях анти-CD20 антитело содержит TRU-015. TRU-015 представляет собой анти-CD20 белок слияния, происходящий от доменов антитела против CD20. TRU-015 меньше, чем моноклональные антитела, но сохраняет Fc-опосредованные эффекторные функции. Смотри, например, Robak et al. BioDrugs 25,1(2011):13-25. TRU-015 содержит анти-CD20 одноцепочечный вариабельный фрагмент (scFv), связанный с человеческими шарнирным, CH2 и CH3 доменами IgG1, но без доменов CH1 и CL.
В некоторых вариантах осуществления анти-CD20 антитело, описанное в настоящем документе, конъюгировано или иным образом связано с терапевтическим средством, например, химиотерапевтическим средством (например, цитоксаном, флударабином, ингибитором гистондеацетилазы, деметилирующим средством, пептидной вакциной, противоопухолевым антибиотиком, ингибитором тирозинкиназы, алкилирующим средством, антимикротрубочным или антимитотическим средством), противоаллергическим средством, средством против тошноты (или противорвотным), обезболивающим средством или цитопротекторным средством, описанным в настоящем документе.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором B-клеточной лимфомы 2 (BCL-2) (например, венетоклаксом, также называемым ABT-199 или GDC-0199;) и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с венетоклаксом и ритуксимабом. Венетоклакс представляет собой небольшую молекулу, которая ингибирует антиапоптотический белок, BCL-2. Структура венетоклакса (4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамида) показана ниже.
В вариантах осуществления субъект имеет ХЛЛ. В вариантах осуществления субъект имеет рецидивирующую ХЛЛ, например, субъект ранее получал терапию рака. В вариантах осуществления венетоклакс вводят в дозировке, составляющей приблизительно 15-600 мг (например, 15-20, 20-50, 50-75, 75-100, 100-200, 200-300, 300-400, 400-500 или 500-600 мг), например, ежедневно. В вариантах осуществления ритуксимаб вводят в дозировке, составляющей приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно, например, ежемесячно.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят в комбинации с онколитическим вирусом. В вариантах осуществления онколитические вирусы способны селективно реплицироваться в раковой клетке и вызывать ее гибель или замедлять ее рост. В некоторых случаях онколитические вирусы не оказывают воздействия или оказывают минимальное воздействие на нераковые клетки. Онколитический вирус включает, но без ограничения, онколитический аденовирус, онколитические вирусы простого герпеса, онколитический ретровирус, онколитический парвовирус, онколитический вирус осповакцины, онколитический вирус Sinbis, онколитический вирус гриппа или онколитический РНК-вирус (например, онколитический реовирус, онколитический вирус ньюкаслской болезни (NDV), онколитический вирус кори или онколитический вирус везикулярного стоматита (VSV)).
В некоторых вариантах осуществления онколитический вирус представляет собой вирус, например, рекомбинантный онколитический вирус, описанный в US2010/0178684 A1, который включен в настоящий документ посредством ссылки во всей полноте. В некоторых вариантах осуществления рекомбинантный онколитический вирус содержит последовательность нуклеиновой кислоты (например, гетерологичную последовательность нуклеиновой кислоты), кодирующую ингибитор иммунного или воспалительного ответа, например, как описано в US2010/0178684 A1, включенном в настоящий документ посредством ссылки во всей полноте. В вариантах осуществления рекомбинантный онколитический вирус, например, онколитический NDV, содержит проапоптотический белок (например, апоптин), цитокин (например, GM-CSF, интерферон-гамма, интерлейкин-2 (IL-2), фактор некроза опухоли-альфа), иммуноглобулин (например, антитело против фибронектина ED-B), ассоциированный с опухолью антиген, биспецифический белок-адаптер (например, биспецифическое антитело или фрагмент антитела, направленные против белка NDV HN и T-клеточного костимулирующего рецептора, такого как CD3 или CD28; или белок слияния между человеческим IL-2 и одноцепочечным антителом, направленным против белка NDV HN). Смотри, например, документ Zamarin et al. Future Microbiol. 7,3(2012):347-67, включенный в настоящий документ посредством ссылки во всей полноте. В некоторых вариантах осуществления онколитический вирус представляет собой химерный онколитический NDV, описанный в US 8591881 B2, US 2012/0122185 A1 или US 2014/0271677 A1, каждый из которых включен в настоящий документ посредством ссылки во всей полноте.
В некоторых вариантах осуществления онколитический вирус содержит условно-репликативный аденовирус (CRAd), который сконструирован для репликации исключительно в раковых клетках. Смотри, например, Alemany et al. Nature Biotechnol. 18(2000):723-27. В некоторых вариантах осуществления онколитический аденовирус включает описанные в таблице 7 на странице 725 в документе Alemany et al., включенном в настоящий документ посредством ссылки во всей полноте.
Типичные онколитические вирусы включают, но без ограничения, следующие:
онколитический аденовирус группы B (ColoAd1) (PsiOxus Therapeutics Ltd.) (смотри, например, клиническое исследование с идентификатором NCT02053220);
ONCOS-102 (ранее называемый CGTG-102), который представляет собой аденовирус, содержащий гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (Oncos Therapeutics) (смотри, например, клиническое исследование с идентификатором NCT01598129);
VCN-01, который представляет собой генетически модифицированный онколитический человеческий аденовирус, кодирующий человеческую гиалуронидазу PH20 (VCN Biosciences, S.L.) (смотри, например, клинические исследования с идентификаторами NCT02045602 и NCT02045589);
условно-репликативный аденовирус ICOVIR-5, который представляет собой вирус, происходящий от человеческого аденовируса дикого типа серотипа 5 (Had5), который был модифицирован для селективной репликации в раковых клетках с дерегулированным путем ретинобластомы/E2F (Institut Català d'Oncologia) (смотри, например, клиническое исследование с идентификатором NCT01864759);
Celyvir, который содержит происходящие из костного мозга аутологичные мезенхимальные стволовые клетки (MSC), инфицированные ICOVIR5, онколитическим аденовирусом (Hospital Infantil Universitario Niño Jesús, Madrid, Spain/Ramon Alemany) (смотри, например, клиническое исследование с идентификатором NCT01844661);
CG0070, который представляет собой условно реплицирующийся онколитический аденовирус серотипа 5 (Ad5), в котором человеческий промотор E2F-1 управляет экспрессией важных вирусных генов E1a, тем самым ограничивая вирусную репликацию и цитотоксичность дефективными по пути Rb опухолевыми клетками (Cold Genesys, Inc.) (смотри, например, клиническое исследование с идентификатором NCT02143804); или
DNX-2401 (ранее называвшийся дельта-24-RGD), который представляет собой аденовирус, который был сконструирован для селективной репликации в дефицитных по ретинобластомному (Rb) пути клетках и для инфицирования клеток, которые более эффективно экспрессируют некоторые RGD-связывающие интегрины (Clinica Universidad de Navarra, Universidad de Navarra/DNAtrix, Inc.) (смотри, например, клиническое исследование с идентификатором NCT01956734).
В некоторых вариантах осуществления онколитический вирус, описанный в настоящем документе, вводят посредством инъекции, например, подкожной, внутриартериальной, внутривенной, внутримышечной, интратекальной или интраперитонеальной инъекции. В вариантах осуществления онколитический вирус, описанный в настоящем документе, вводят внутрь опухоли, чрескожно, трансмукозально, перорально, интраназально или посредством введения в легкие.
В варианте осуществления клетки, экспрессирующие CAR, описанный в настоящем документе, вводят субъекту в комбинации с молекулой, которая уменьшает популяцию Treg-клеток. Способы, которые уменьшают количество (например, истощают) Treg-клетки, известны в данной области техники, и включают, например, истощение по CD25, введение циклофосфамида, модулирование функции GITR. Не желая быть связанными теорией, авторы полагают, что уменьшение количества Treg-клеток у субъекта перед аферезом или перед введением экспрессирующей CAR клетки, описанной в настоящем документе, уменьшает количество нежелательных иммунных клеток (например, Treg) в микроокружении опухоли и уменьшает риск рецидива у субъекта. В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с молекулой, воздействующей на GITR и/или модулирующей функции GITR, такой как агонист GITR и/или антитело к GITR, которое истощает регуляторные T-клетки (Treg). В вариантах осуществления клетки, экспрессирующие CAR, описанный в настоящем документе, вводят субъекту в комбинации с циклофосфамидом. В одном варианте осуществления молекулы, связывающие GITR, и/или молекулы, модулирующие функции GITR, (например, агонист GITR и/или истощающие Treg антитела к GITR) вводят перед введением экспрессирующей CAR клетки. Например, в одном варианте осуществления агонист GITR может быть введен перед аферезом клеток. В вариантах осуществления перед введением (например, введением или повторным введением) экспрессирующей CAR клетки или перед аферезом клеток субъекту вводят циклофосфамид. В вариантах осуществления перед введением (например, введением или повторным введением) экспрессирующей CAR клетки или перед аферезом клеток субъекту вводят циклофосфамид и анти-GITR антитело. В одном варианте осуществления субъект имеет рак (например, солидный рак или гематологический рак, такой как ОЛЛ или ХЛЛ). В варианте осуществления субъект имеет ХЛЛ. В вариантах осуществления субъект имеет ОЛЛ. В вариантах осуществления субъект имеет солидный рак, например, солидный рак, описанный в настоящем документе. Типичные агонисты GITR включают, например, белки слияния GITR и анти-GITR антитела (например, двухвалентные анти-GITR антитела), такие как, например, белок слияния GITR, описанный в патенте США № 6111090, европейском патенте № 090505B1, патенте США № 8586023, публикациях PCT №№ WO 2010/003118 и 2011/090754, или анти-GITR антитело, описанное, например, в патенте США № 7025962, европейском патенте № 1947183B1, патенте США № 7812135, патенте США № 8388967, патенте США № 8591886, европейском патенте № EP 1866339, публикации PCT № WO 2011/028683, публикации PCT № WO 2013/039954, публикации PCT № WO2005/007190, публикации PCT № WO 2007/133822, публикации PCT № WO2005/055808, публикации PCT № WO 99/40196, публикации PCT № WO 2001/03720, публикации PCT № WO99/20758, публикации PCT № WO2006/083289, публикации PCT № WO 2005/115451, патенте США № 7618632 и публикации PCT № WO 2011/051726.
В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором mTOR, например, ингибитором mTOR, описанным в настоящем документе, например, рапалогом, таким как эверолимус. В одном варианте осуществления ингибитор mTOR вводят перед экспрессирующей CAR клеткой. Например, в одном варианте осуществления ингибитор mTOR может быть введен перед аферезом клеток.
В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с агонистом GITR, например, агонистом GITR, описанным в настоящем документе. В одном варианте осуществления агонист GITR вводят перед экспрессирующей CAR клеткой. Например, в одном варианте осуществления агонист GITR может быть введен перед аферезом клеток.
В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором протеинтирозинфосфатазы, например, ингибитором протеинтирозинфосфатазы, описанным в настоящем документе. В одном варианте осуществления ингибитор протеинтирозинфосфатазы представляет собой ингибитор SHP-1, например, ингибитор SHP-1, описанный в настоящем документе, такой как, например, натрия стибоглюконат. В одном варианте осуществления ингибитор протеинтирозинфосфатазы представляет собой ингибитор SHP-2.
В одном варианте осуществления экспрессирующую CAR клетку, описанную в настоящем документе, можно использовать в комбинации с ингибитором киназы. В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, ингибитор CDK4, описанный в настоящем документе, например, ингибитор CD4/6, такой как, например, 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-ил-пиридин-2-иламино)-8H-пиридо[2,3-d]пиримидин-7-он, гидрохлорид (также называемый палбоциклиб или PD0332991). В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ингибитор BTK, описанный в настоящем документе, такой как, например, ибрутиниб. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, ингибитор mTOR, описанный в настоящем документе, такой как, например, рапамицин, аналог рапамицина, OSI-027. Ингибитор mTOR может представлять собой, например, ингибитор mTORC1 и/или ингибитор mTORC2, например, ингибитор mTORC1 и/или ингибитор mTORC2, описанный в настоящем документе. В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, например, ингибитор MNK, описанный в настоящем документе, такой как, например, 4-амино-5-(4-фторанилино)-пиразоло[3,4-d]пиримидин. Ингибитор MNK может представлять собой, например, ингибитор MNK1a, MNK1b, MNK2a и/или MNK2b. В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор PI3K/mTOR, описанный в настоящем документе, такой как, например, PF-04695102. В одном варианте осуществления ингибитор киназы представляет собой ингибитор DGK, например, ингибитор DGK, описанный в настоящем документе, такой как, например, DGKinh1 (D5919) или DGKinh2 (D5794).
В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, выбранный из алоизина A; флавопиридола или HMR-1275, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4-хроменона; кризотиниба (PF-02341066; 2-(2-хлорфенил)-5,7-дигидрокси-8-[(2R,3S)-2-(гидроксиметил)-1-метил-3-пирролидинил]-4H-1-бензопиран-4-она, гидрохлорида (P276-00); 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина (RAF265); индисулама (E7070); росковитина (CYC202); палбоциклиба (PD0332991); динациклиба (SCH727965); N-[5-[[(5-трет-бутилоксазол-2-ил)метил]тио]тиазол-2-ил]пиперидин-4-карбоксамида (BMS 387032); 4-[[9-хлор-7-(2,6-дифторфенил)-5H-пиримидо[5,4-d][2]бензазепин-2-ил]амино]-бензойной кислоты (MLN8054); 5-[3-(4,6-дифтор-1H-бензимидазол-2-ил)-1H-индазол-5-ил]-N-этил-4-метил-3-пиридинметанамина (AG-024322); 4-(2,6-дихлорбензоиламино)-1H-пиразол-3-карбоновой кислоты N-(пиперидин-4-ил)амида (AT7519); 4-[2-метил-1-(1-метилэтил)-1H-имидазол-5-ил]-N-[4-(метилсульфонил)фенил]-2-пиримидинамина (AZD5438); и XL281 (BMS908662).
В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, палбоциклиб (PD0332991), и палбоциклиб вводят в дозе, составляющей приблизительно 50 мг, 60 мг, 70 мг, 75 мг, 80 мг, 90 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг (например, 75 мг, 100 мг или 125 мг), ежедневно в течение периода времени, например, ежедневно в течение 14-21 дней 28-дневного цикла или ежедневно в течение 7-12 дней 21-дневного цикла. В одном варианте осуществления вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов палбоциклиба.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором циклин-зависимой киназы (CDK) 4 или 6, например, ингибитором CDK4 или ингибитором CDK6, описанным в настоящем документе. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором CDK4/6 (например, ингибитором, который воздействует как на CDK4, так и на CDK6), например, ингибитором CDK4/6, описанным в настоящем документе. В варианте осуществления субъект имеет МКЛ. МКЛ представляет собой агрессивный рак, который плохо реагирует на доступные в настоящее время терапии, то есть является по существу неизлечимым. Во многих случаях МКЛ в клетках МКЛ экспрессируется циклин D1 (регулятор CDK4/6) (например, вследствие хромосомной транслокации с участием генов иммуноглобулинов и циклина D1). Таким образом, не связывая себя теорией, можно предположить, что клетки МКЛ высоко чувствительны к ингибированию CDK4/6 с высокой специфичностью (то есть с минимальным воздействием на нормальные иммунные клетки). Сами по себе ингибиторы CDK4/6 имели некоторую эффективность в лечении МКЛ, но достигалась только частичная ремиссия с высокой частотой рецидивов. Типичным ингибитором CDK4/6 является LEE011 (также называемый рибоциклибом), структура которого показана ниже.
Не связывая себя теорией, авторы полагают, что введение экспрессирующей CAR клетки, описанной в настоящем документе, с ингибитором CDK4/6 (например, LEE011 или другим ингибитором CDK4/6, описанным в настоящем документе) может приводить к более сильному реагированию, например, с более высокой частотой ремиссии и/или более низкой частотой рецидивов, например, по сравнению с одним только ингибитором CDK4/6.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, выбранный из ибрутиниба (PCI-32765); GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774; и LFM-A13. В предпочтительном варианте осуществления ингибитор BTK не уменьшает или не ингибирует киназную активность интерлейкин-2-индуцируемой киназы (ITK), и его выбирают из GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774; и LFM-A13.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ибрутиниб (PCI-32765). В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором BTK (например, ибрутинибом). В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ибрутинибом (также называемым PCI-32765). Структура ибрутиниба (1-[(3R)-3-[4-амино-3-(4-феноксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-она) показана ниже.
В вариантах осуществления субъект имеет ХЛЛ, мантийноклеточную лимфому (МКЛ) или мелкоклеточную лимфоцитарную лимфому (МКЛЛ). Например, субъект имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах субъект не имеет del(17p). В вариантах осуществления субъект имеет рецидивирующие ХЛЛ или МКЛЛ, например, субъект ранее получал терапию рака (например, ранее получал одну, две, три или четыре предшествующие терапии рака). В вариантах осуществления субъект имеет рефрактерные ХЛЛ или МКЛЛ. В других вариантах осуществления субъект имеет фолликулярную лимфому, например, рецидивирующую или рефрактерную фолликулярную лимфому. В некоторых вариантах осуществления ибрутиниб вводят в дозировке, составляющей приблизительно 300-600 мг/день (например, приблизительно 300-350, 350-400, 400-450, 450-500, 500-550 или 550-600 мг/день, например, приблизительно 420 мг/день или приблизительно 560 мг/день), например, перорально. В вариантах осуществления ибрутиниб вводят в дозе, составляющей приблизительно 250 мг, 300 мг, 350 мг, 400 мг, 420 мг, 440 мг, 460 мг, 480 мг, 500 мг, 520 мг, 540 мг, 560 мг, 580 мг, 600 мг (например, 250 мг, 420 мг или 560 мг), ежедневно в течение периода времени, например, ежедневно в течение 21-дневного цикла или ежедневно в течение 28-дневного цикла. В одном варианте осуществления вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов ибрутиниба. В некоторых вариантах осуществления ибрутиниб вводят в комбинации с ритуксимабом. Смотри, например, документ Burger et al. (2013) Ibrutinib In Combination With Rituximab (iR) Is Well Tolerated and Induces a High Rate Of Durable Remissions In Patients With High-Risk Chronic Lymphocytic Leukemia (CLL): New, Updated Results Of a Phase II Trial In 40 Patients, Abstract 675 presented at 55th ASH Annual Meeting and Exposition, New Orleans, LA 7-10 Dec. Не связывая себя теорией, авторы полагают, что добавление ибрутиниба усиливает T-клеточный пролиферативный ответ и может сдвигать T-клетки от фенотипа T-хелпер-2 (Th2) к T-хелпер-1 (Th1). Th1 и Th2 являются фенотипами хелперных T-клеток, причем Th1 и Th2 направляют различные пути иммунного ответа. Фенотип Th1 связан с провоспалительными реакциями, например, для киллинга клеток, таких как внутриклеточные патогены/вирусы или раковые клетки, или сохраняющимися аутоиммунными реакциями. Фенотип Th2 связан с накоплением эозинофилов и противовоспалительными реакциями.
В некоторых вариантах осуществления способов, применений и композиций настоящего документа ингибитор BTK представляет собой ингибитор BTK, описанный в международной заявке WO/2015/079417, которая включена в настоящий документ посредством ссылки во всей полноте. Например, в некоторых вариантах осуществления ингибитор BTK представляет собой соединение формулы (I) или его фармацевтически приемлемую соль;
 (I)
(I)
причем
R1 представляет собой водород, C1-C6 алкил, необязательно замещенный гидроксигруппой;
R2 представляет собой водород или галоген;
R3 представляет собой водород или галоген;
R4 представляет собой водород;
R5 представляет собой водород или галоген;
или R4 и R5 прикреплены друг к другу и обозначают связь, -CH2-, -CH2-CH2-, -CH=CH-, -CH=CH-CH2-; -CH2-CH=CH-; или -CH2-CH2-CH2-;
R6 и R7 обозначают независимо друг от друга H, C1-C6 алкил, необязательно замещенный гидроксилом, C3-C6 циклоалкил, необязательно замещенный галогеном или гидроксигруппой, или галоген;
R8, R9, R, R', R10 и R11 независимо друг от друга обозначают H или C1-C6 алкил, необязательно замещенный C1-C6 алкоксигруппой; или любые два из R8, R9, R, R', R10 и R11 вместе с атомом углерода, с которым они связаны, могут образовывать 3-6-членное насыщенное карбоциклическое кольцо;
R12 представляет собой водород или C1-C6 алкил, необязательно замещенный галогеном или C1-C6 алкоксигруппой;
или R12 и любой один из R8, R9, R, R', R10 или R11 вместе с атомами, с которыми они связаны, могут образовывать 4, 5, 6 или 7-членное азациклические кольцо, причем данное кольцо может, необязательно, быть замещено галогеном, цианогруппой, гидроксилом, C1-C6 алкилом или C1-C6 алкоксигруппой;
n представляет собой 0 или 1; и
R13 представляет собой C2-C6 алкенил, необязательно замещенный C1-C6 алкилом, C1-C6 алкоксигруппой или N,N-ди-C1-C6 алкиламиногруппой; C2-C6 алкинил, необязательно замещенный C1-C6 алкилом или C1-C6 алкоксигруппой; или C2-C6 алкиленилоксид, необязательно замещенный C1-C6 алкилом.
В некоторых вариантах осуществления ингибитор BTK формулы I выбирают из: N-(3-(5-((1-акрилоилазетидин-3-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (E)-N-(3-(6-амино-5-((1-(бут-2-еноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-((1-пропиолоилазетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-((1-(бут-2-иноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-((1-акрилоилпиперидин-4-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (E)-N-(3-(6-амино-5-(2-(N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилпропиоламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (E)-N-(3-(6-амино-5-(2-(4-метокси-N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(2-((4-амино-6-(3-(4-циклопропил-2-фторбензамидо)-5-фтор-2-метилфенил)пиримидин-5-ил)окси)этил)-N-метилоксиран-2-карбоксамида; N-(2-((4-амино-6-(3-(6-циклопропил-8-фтор-1-оксоизохинолин-2(1H)-ил)фенил)пиримидин-5-ил)окси)этил)-N-метилакриламида; N-(3-(5-(2-акриламидоэтокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-этилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-(2-фторэтил)акриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-((1-акриламидоциклопропил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(5-(2-акриламидопропокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(бут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(N-метилакриламидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(3-(N-метилакриламидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-((1-(бут-2-иноил)пирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-2-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она; N-(2-((4-амино-6-(3-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-5-фтор-2-(гидроксиметил)фенил)пиримидин-5-ил)окси)этил)-N-метилакриламида; N-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(((2S,4R)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; 2-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она; N-(3-(5-(((2S,4S)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(((2S,4S)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-(((2S,4R)-1-акрилоил-4-фторпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(((2S,4R)-1-(бут-2-иноил)-4-фторпирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-((1-пропиолоилазетидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-2-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она; (R)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (R)-N-(3-(5-((1-акрилоилпиперидин-3-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-(((2R,3S)-1-акрилоил-3-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-(((2S,4R)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; или N-(3-(5-(((2S,4S)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида.
Если не предусмотрено иное, химические термины, используемые выше при описании ингибитора BTK формулы I используются в соответствии с их значениями, приведенными в международной заявке WO/2015/079417, которая включена в настоящий документ посредством ссылки во всей полноте.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, выбранный из темсиролимуса; ридафоролимуса (1R,2R,4S)-4-[(2R)-2 [(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.049]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфината, также известного как AP23573 и MK8669; эверолимуса (RAD001); рапамицина (AY22989); симапимода; (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанола (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF04691502); и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолин-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серин-(SEQ ID NO: 378), внутренней соли (SF1126); и XL765.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, рапамицин, и рапамицин вводят в дозе, составляющей приблизительно 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг (например, 6 мг), ежедневно в течение периода времени, например, ежедневно в течение 21-дневного цикла или ежедневно в течение 28-дневного цикла. В одном варианте осуществления вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов рапамицина. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например эверолимус, и эверолимус вводят в дозе, составляющей приблизительно 2 мг, 2,5 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг (например, 10 мг), ежедневно в течение периода времени, например, ежедневно в течение 28-дневного цикла. В одном варианте осуществления вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или больше циклов эверолимуса.
В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, выбранный из CGP052088; 4-амино-3-(п-фторфениламино)-пиразоло[3,4-d]пиримидина (CGP57380); церкоспорамида; ETC-1780445-2; и 4-амино-5-(4-фторанилино)-пиразоло[3,4-d]пиримидина.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором фосфоинозитид-3-киназы (PI3K) (например, ингибитором PI3K, описанным в настоящем документе, например, иделалисибом или дувелисибом) и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с иделалисибом и ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с дувелисибом и ритуксимабом. Иделалисиб (также называемый GS-1101 или CAL-101; Gilead) представляет собой небольшую молекулу, которая блокирует дельта-изоформу PI3K. Структура иделалисиба (5-фтор-3-фенил-2-[(1S)-1-(7H-пурин-6-иламино)пропил]-4(3H)-хиназолинона) показана ниже.

Дувелисиб (также называемый IPI-145; Infinity Pharmaceuticals и Abbvie) представляет собой небольшую молекулу, которая блокирует PI3K-δ,γ. Структура дувелисиба (8-хлор-2-фенил-3-[(1S)-1-(9H-пурин-6-иламино)этил]-1(2H)-изохинолинона) показана ниже.
В вариантах осуществления субъект имеет ХЛЛ. В вариантах осуществления субъект имеет рецидивирующий ХЛЛ, например, субъект ранее получал терапию рака (например, ранее получал анти-CD20 антитело или ранее получал ибрутиниб). Например, субъект имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах, субъект не имеет del(17p). В вариантах осуществления субъект содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления субъект не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления субъект имеет делецию в длинном плече хромосомы 11 (del(11q)). В других вариантах осуществления субъект не имеет del(11q). В вариантах осуществления иделалисиб вводят в дозировке, составляющей приблизительно 100-400 мг (например, 100-125, 125-150, 150-175, 175-200, 200-225, 225-250, 250-275, 275-300, 325-350, 350-375 или 375-400 мг), например, два раза в день. В вариантах осуществления дувелисиб вводят в дозировке, составляющей приблизительно 15-100 мг (например, приблизительно 15-25, 25-50, 50-75, или 75-100 мг), например, дважды день. В вариантах осуществления ритуксимаб вводят в дозировке, составляющей приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор фосфатидилинозитол-3-киназы (PI3K) и mTOR, выбранный из 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF-04691502); N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевины (PF-05212384, PKI-587); 2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрила (BEZ-235); апитолисиба (GDC-0980, RG7422); 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамида (GSK2126458); 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-она малеиновой кислоты (NVP-BGT226); 3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола (PI-103); 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амина (VS-5584, SB2343); и N-[2-[(3,5-диметоксифенил)амино]хиноксалин-3-ил]-4-[(4-метил-3-метоксифенил)карбонил]аминофенилсульфонамида (XL765).
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором киназы анапластической лимфомы (ALK). Типичные киназы ALK включают, но без ограничения, кризотиниб (Pfizer), церитиниб (Novartis), алектиниб (Chugai), бригатиниб (также называемый AP26113; Ariad), энтректиниб (Ignyta), PF-06463922 (Pfizer), TSR-011 (Tesaro) (смотри, например, клиническое исследование с идентификатором № NCT02048488), CEP-37440 (Teva) и X-396 (Xcovery). В некоторых вариантах осуществления субъект имеет солидный рак, например, солидный рак, описанный в настоящем документе, например, рак легкого.
Химическое название кризотиниба 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-илпиразол-4-ил)пиридин-2-амин. Химическое название церитиниба 5-хлор-N2-[2-изопропокси-5-метил-4-(4-пиперидинил)фенил]-N4-[2-(изопропилсульфонил)фенил]-2,4-пиримидиндиамин. Химическое название алектиниба 9-этил-6,6-диметил-8-(4-морфолинопиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил. Химическое название бригатиниба 5-хлор-N2-{4-[4-(диметиламино)-1-пиперидинил]-2-метоксифенил}-N4-[2-(диметилфосфорил)фенил]-2,4-пиримидиндиамин. Химическое название энтректиниба N-(5-(3,5-дифторбензил)-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)-2-((тетрагидро-2H-пиран-4-ил)амино)бензамид. Химическое название PF-06463922 (10R)-7-амино-12-фтор-2,10,16-триметил-15-оксо-10,15,16,17-тетрагидро-2H-8,4-(метено)пиразоло[4,3-h][2,5,11]-бензоксадиазациклотетрадецин-3-карбонитрил. Химическая структура CEP-37440 (S)-2-((5-хлор-2-((6-(4-(2-гидроксиэтил)пиперазин-1-ил)-1-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-2-ил)амино)пиримидин-4-ил)амино)-N-метилбензамид. Химическое название X-396 (R)-6-амино-5-(1-(2,6-дихлор-3-фторфенил)этокси)-N-(4-(4-метилпиперазин-1-карбонил)фенил)пиридазин-3-карбоксамид.
Можно также использовать препараты, которые или ингибируют кальций-зависимую фосфатазу кальциневрин (циклоспорин и FK506), или ингибируют киназу p70S6, которая важна для индуцируемой факторами роста сигнализации (рапамицин) (Liu et al., Cell 66:807-815, 1991; Henderson et al., Immun. 73:316-321, 1991; Bierer et al., Curr. Opin. Immun. 5:763-773, 1993). В другом аспекте клеточные композиции настоящего изобретения можно вводить пациенту в сочетании (например, до, одновременно или после) с трансплантацией костного мозга, T-клеточно-аблятивной терапией с использованием химиотерапевтических средств, таких как флударабин, наружной дистанционной лучевой терапией (XRT), циклофосфамидом и/или антителами, такими как OKT3 или CAMPATH. В одном аспекте клеточные композиции настоящего изобретения вводят после B-клеточно-аблятивной терапии, такой как с помощью средств, которые реагируют с CD20, например, ритуксана. Например, в одном варианте осуществления субъекты могут подвергаться стандартному лечению с помощью высоких доз химиотерапии, за чем следует трансплантация стволовых клеток периферической крови. В определенных вариантах осуществления после трансплантации субъекты получают введение размноженных иммунных клеток настоящего изобретения. В дополнительном варианте осуществления размноженные клетки вводят до или после хирургии.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с ингибитором индоламин-2,3-диоксигеназы (IDO). IDO представляет собой фермент, который катализирует деградацию аминокислоты L-триптофана до кинуренина. Многие раки сверхэкспрессируют IDO, например, рак предстательной железы, прямой кишки, поджелудочной железы, шейки матки, желудка, яичников, головы и легкого. pDC, макрофаги и дендритные клетки (DC) могут экспрессировать IDO. Не связывая себя теорией, авторы полагают, что уменьшение количества L-триптофана (например, катализируемое IDO) приводит к иммуносупрессивному окружению посредством индуцирования анергии и апоптоза T-клеток. Таким образом, не связывая себя теорией, авторы полагают, что ингибитор IDO может усиливать эффективность экспрессирующей CAR клетки, описанной в настоящем документе, например, посредством уменьшения супрессии или гибели экспрессирующих CAR иммунных клеток. В вариантах осуществления субъект имеет солидную опухоль, например, солидную опухоль, описанную в настоящем документе, например, рак предстательной железы, прямой кишки, поджелудочной железы, шейки матки, желудка, яичников, головы или легкого. Типичные ингибиторы IDO включают, но без ограничения, 1-метил-триптофан, индоксимод (NewLink Genetics) (смотри, например, клинические исследования с идентификаторами №№ NCT01191216; NCT01792050) и INCB024360 (Incyte Corp.) (смотри, например, клинические исследования с идентификаторами №№ NCT01604889; NCT01685255).
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с модулятором супрессорных клеток миелоидного происхождения (MDSC). MDSC накапливаются на периферии и на месте опухоли при многих солидных опухолях. Эти клетки подавляют T-клеточные реакции, тем самым снижая эффективность терапии с помощью экспрессирующих CAR клеток. Не связывая себя теорией, авторы полагают, что введение модулятора MDSC усиливает эффективность экспрессирующей CAR клетки, описанной в настоящем документе. В варианте осуществления субъект имеет солидную опухоль, например, солидную опухоль, описанную в настоящем документе, например, глиобластому. Типичные модуляторы MDSC включают, но без ограничения, MCS110 и BLZ945. MCS110 представляет собой моноклональное антитело (mAb) против макрофагального колониестимулирующего фактора (M-CSF). Смотри, например, клиническое исследование с идентификатором № NCT00757757. BLZ945 представляет собой низкомолекулярный ингибитор рецептора колониестимулирующего фактора 1 (CSF1R). Смотри, например, Pyonteck et al. Nat. Med. 19(2013):1264-72. Структура BLZ945 показана ниже.
В вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с CD19-CART-клеткой (например, CTL019, например, как описано в документе WO2012/079000, включенном в настоящий документ посредством ссылки). В вариантах осуществления субъект имеет острый миелоидный лейкоз (ОМЛ), например, CD19-положительный ОМЛ или CD19-отрицательный ОМЛ. В вариантах осуществления субъект имеет CD19+ лимфому, например, CD19+ неходжкинскую лимфому (NHL), CD19+ FL или CD19+ DLBCL. В вариантах осуществления субъект имеет рецидивирующую или рефрактерную CD19+ лимфому. В вариантах осуществления лимфоистощающую химиотерапию вводят субъекту перед, одновременно или после введения (например, вливания) CD19-CART-клеток. В примере, лимфоистощающую химиотерапию вводят субъекту перед введением CD19-CART-клеток. Например, лимфоистощающую химиотерапию заканчивают за 1-4 дня (например, за 1, 2, 3 или 4 дня) до введения CD19-CART-клеток. В вариантах осуществления вводят несколько доз CD19-CART-клеток, например, как описано в настоящем документе. Например, одна доза содержит приблизительно 5×108 CD19-CART-клеток. В вариантах осуществления лимфоистощающую химиотерапию вводят субъекту перед, одновременно или после введения (например, вливания) экспрессирующей CAR клетки, описанной в настоящем документе, например, не экспрессирующей CAR к CD19 клетки. В вариантах осуществления CD19-CART вводят субъекту перед, одновременно или после введения (например, вливания) не экспрессирующей CAR к CD19 клетки, например, не экспрессирующей CAR к CD19 клетки, описанной в настоящем документе.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с экспрессирующей CAR к CD19 клеткой, например, CTL019, например, как описано в документе WO2012/079000, включенном в настоящий документ посредством ссылки, для лечения заболевания, ассоциированного с экспрессией CD33, например, рака, описанного в настоящем документе. Не связывая себя теорией, авторы полагают, что введение экспрессирующей CAR к CD19 клетки в комбинации с экспрессирующей CAR клеткой улучшает эффективность экспрессирующей CAR клетки, описанной в настоящем документе, посредством таргетинга ранних раковых клеток линии дифференцировки, например, раковых стволовых клеток, модулирования иммунного ответа, истощения регуляторных B-клеток и/или улучшения микроокружения опухоли. Например, экспрессирующая CAR к CD19 клетка воздействует на раковые клетки, которые экспрессируют ранние маркеры линии дифференцировки, например, раковые стволовые клетки и CD19-экспрессирующие клетки, тогда как экспрессирующая CAR клетка, описанная в настоящем документе, воздействует на раковые клетки, которые экспрессируют поздние маркеры линии дифференцировки, например, CD33. Такой подход прекондиционирования может улучшать эффективность экспрессирующей CAR клетки, описанной в настоящем документе. В таких вариантах осуществления экспрессирующую CAR к CD19 клетку вводят перед, одновременно или после введения (например, вливания) экспрессирующей CAR клетки, описанной в настоящем документе.
В вариантах осуществления экспрессирующая CAR клетка, описанная в настоящем документе, также экспрессирует CAR, воздействующий на CD19, например, CAR к CD19. В варианте осуществления клетку, экспрессирующую CAR, описанный в настоящем документе, и CAR к CD19, вводят субъекту для лечения рака, описанного в настоящем документе, например, ОМЛ. В варианте осуществления конфигурации одной или обеих из молекул CAR содержат первичный внутриклеточный сигнальный домен и костимулирующий сигнальный домен. В другом варианте осуществления конфигурации одной или обеих из молекул CAR содержат первичный внутриклеточный сигнальный домен и два или более, например, 2, 3, 4, или 5 или более, костимулирующих сигнальных доменов. В таких вариантах осуществления молекула CAR, описанная в настоящем документе, и CAR к CD19 могут иметь одинаковые или различные первичные внутриклеточные сигнальные домены, одинаковые или различные костимулирующие сигнальные домены, или одинаковое количество или различное количество костимулирующих сигнальных доменов. В качестве альтернативы, CAR, описанный в настоящем документе, и CAR к CD19 выполнены в виде расщепленного CAR, в котором одна из молекул CAR содержит антигенсвязывающий домен и костимулирующий домен (например, из 4-1BB), тогда как другая молекула CAR содержит антигенсвязывающий домен и первичный внутриклеточный сигнальный домен (например, из CD3-дзета).
В некоторых вариантах осуществления экспрессирующую CAR клетку, описанную в настоящем документе, вводят субъекту в комбинации с полипептидом интерлейкина-15 (IL-15), полипептидом рецептора-альфа интерлейкина-15 (IL-15Ra) или комбинацией как полипептида IL-15, так и полипептида IL-15Ra, например, hetIL-15 (Admune Therapeutics, LLC). hetIL-15 представляет собой гетеродимерный нековалентный комплекс IL-15 и IL-15Ra. hetIL-15 описан, например, в документах US 8124084, US 2012/0177598, US 2009/0082299, US 2012/0141413 и US 2011/0081311, включенных в настоящий документ посредством ссылки. В вариантах осуществления het-IL-15 вводят подкожно. В вариантах осуществления субъект имеет рак, например, солидный рак, например, меланому или рак толстой кишки. В вариантах осуществления субъект имеет метастатический рак.
В вариантах осуществления субъекту, имеющему заболевание, описанное в настоящем документе, например, гематологическое нарушение, например, ОМЛ или МДС, вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации со средством, например, цитотоксическим или химиотерапевтическим средством, биологической терапией (например, антителом, например, моноклональным антителом, или клеточной терапией) или ингибитором (например, ингибитором киназы). В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с цитотоксическим средством, например, CPX-351 (Celator Pharmaceuticals), цитарабином, даунорубицином, возароксином (Sunesis Pharmaceuticals), сапацитабином (Cyclacel Pharmaceuticals), идаруцибином или митоксантроном. CPX-351 представляет собой липосомальную композицию, содержащую цитарабин и даунорубицин в молярном отношении 5:1. В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с гипометилирующим средством, например, ингибитором ДНК-метилтрансферазы, например, азацитидином или децитабином. В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с биологической терапией, например, антителом или клеточной терапией, например, 225Ac-линтузумабом (Actimab-A; Actinium Pharmaceuticals), IPH2102 (Innate Pharma/Bristol Myers Squibb), SGN-CD33A (Seattle Genetics) или гемтузумаба озогамицином (милотарг; Pfizer). SGN-CD33A представляет собой конъюгат антитело-препарат (ADC), содержащий димер пирролобензодиазепина, который прикреплен к анти-CD33 антителу. Actimab-A представляет собой анти-CD33 антитело (линтузумаб), меченое актинием. IPH2102 представляет собой моноклональное антитело, которое воздействует на иммуноглобулин-подобные рецепторы клеток-киллеров (KIR). В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с ингибитором FLT3, например, сорафенибом (Bayer), мидостаурином (Novartis), квизартинибом (Daiichi Sankyo), креноланибом (Arog Pharmaceuticals), PLX3397 (Daiichi Sankyo), AKN-028 (Akinion Pharmaceuticals) или ASP2215 (Astellas). В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с ингибитором изоцитратдегидрогеназы (IDH), например, AG-221 (Celgene/Agios) или AG-120 (Agios/Celgene). В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с регулятором клеточного цикла, например, ингибитором polo-подобной киназы 1 (Plk1), например, воласертибом (Boehringer Ingelheim); или ингибитором циклин-зависимой киназы 9 (Cdk9), например, алвоцидибом (Tolero Pharmaceuticals/Sanofi Aventis). В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с ингибитором сигнальной сети B-клеточного рецептора, например, ингибитором B-клеточной лимфомыа 2 (Bcl-2), например, венетоклаксом (Abbvie/Roche); или ингибитором тирозинкиназы Брутона (Btk), например, ибрутинибом (Pharmacyclics/Johnson & Johnson Janssen Pharmaceutical). В вариантах осуществления субъекту вводят экспрессирующую CAR клетку, описанную в настоящем документе, в комбинации с ингибитором аминопептидазы M1, например, тоседостатом (CTI BioPharma/Vernalis); ингибитором гистондеацетилазы (HDAC), например, прациностатом (MEI Pharma); ингибитором мультикиназы, например, ригосертибом (Onconova Therapeutics/Baxter/SymBio); или пептидным обратным агонистом CXCR4, например, BL-8040 (BioLineRx). В вариантах осуществления субъекту вводят воздействующую на CD33 экспрессирующую CAR клетку в комбинации с экспрессирующей CAR клеткой, которая воздействует на антиген, отличный от CD33, например, CLL, BCMA, CD123, CD19, FLT-3 или фолатный рецептор-бета.
В другом варианте осуществления субъекты получают вливание композиций клеток CART33 настоящего изобретения перед трансплантацией клеток, например, трансплантацией аллогенных стволовых клеток. В предпочтительном варианте осуществления клетки CART33 временно экспрессируют CAR33, например, благодаря электропорации мРНК CAR против CD33, в результате чего экспрессия CAR33 прекращается перед введением донорских стволовых клеток во избежание неудачного приживления.
Некоторые пациенты могут испытывать аллергические реакции на соединения настоящего изобретения и/или другое противораковое средство(а) во время или после введения; поэтому для минимизации риска аллергической реакции часто вводят противоаллергические средства. Подходящие противоаллергические средства включают кортикостероиды, такие как дексаметазон (например, Decadron®), беклометазон (например, Beclovent®), гидрокортизон (также известный как кортизон, гидрокортизона натрия сукцинат, гидрокортизона натрия фосфат, продается под торговым названием Ala-Cort®, гидрокортизона фосфат, Solu-Cortef®, Hydrocort Acetate® и Lanacort®), преднизолон (продается под торговым наименованием Delta-Cortel®, Orapred®, Pediapred® и Prelone®), преднизон (продается под торговым наименованием Deltasone®, Liquid Red®, Meticorten® и Orasone®), метилпреднизолон (также известный как 6-метилпреднизолон, метилпреднизолона ацетат, метилпреднизолона сукцинат натрия, продается под торговым наименованием Duralone®, Medralone®, Medrol®, M-Prednisol® и Solu-Medrol®); антигистаминные средства, такие как дифенгидрамин (например, Benadryl®), гидроксизин и ципрогептадин; и бронходилататоры, такие как агонисты бета-адренергического рецептора, альбутерол (например, Proventil®) и тербуталин (Brethine®).
Некоторые пациенты могут испытывать тошноту во время и после введения соединения настоящего изобретения и/или другого противоракового средства (средств); поэтому для предотвращения тошноты (в верхней части желудка) и рвоты используют противорвотные средства. Подходящие противорвотные средства включают апрепитант (Emend®), ондансетрон (Zofran®), гранисетрон HCl (Kytril®), лоразепам (Ativan®), дексаметазон (Decadron®), прохлорперазин (Compazine®), касопитант (Rezonic® и Zunrisa®) и их комбинации.
Часто прописывают лекарства для облегчения боли, испытываемой в течение периода лечения, для повышения комфорта пациента. Часто используют Обычные безрецептурные анальгетики, такие Tylenol®. Однако опиоидные анальгетические препараты, такие как гидрокодон/парацетамол или гидрокодон/ацетаминофен (например, Vicodin®), морфин (например, Astramorph® или Avinza®), оксикодон (например, OxyContin® или Percocet®), оксиморфона гидрохлорид (Opana®) и фентанил (например, Duragesic®) также полезны при умеренной или сильной боли.
С целью защиты нормальных клеток от токсичности лечения и ограничения токсичности для органов можно в качестве дополнительной терапии использовать цитопротекторные средства (такие как нейропротекторы, поглотители свободных радикалов, кардиопротекторы, нейтрализаторы экстравазации антрациклинов, нутриенты и тому подобное). Подходящие цитопротекторные средства включают амифостин (Ethyol®), глутамин, димесну (Tavocept®), месну (Mesnex®), дексразоксан (Zinecard® или Totect®), ксалипроден (Xaprila®) и лейковорин (также известный как лейковорин кальция, цитроворум-фактор и фолиновая кислота).
Структура активных соединений, указанных числовыми кодами, дженерическими или торговыми наименованиями, может быть найдена в современном издании стандартного справочника "The Merck Index" или в базах данных, например, в Patents International (например, IMS World Publications).
Вышеупомянутые соединения, которые можно использовать в комбинации с соединением настоящего изобретения, могут быть получены и введены, как описано в данной области техники, например, в документах, приведенных выше.
В одном варианте осуществления настоящее изобретение предлагает фармацевтические композиции, содержащие по меньшей мере одно соединение настоящего изобретения (например, соединение настоящего изобретения) или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым носителем, подходящим для введения субъекту-человеку или животному, или отдельно, или вместе с другими противораковыми средствами.
В одном варианте осуществления настоящее изобретение предлагает способы лечения субъектов-людей или животных, страдающих от клеточного пролиферативного заболевания, такого как рак. Настоящее изобретение предлагает способы лечения субъекта-человека или животного, нуждающегося в таком лечении, содержащие введение субъекту терапевтически эффективного количества соединения настоящего изобретения (например, соединения настоящего изобретения) или его фармацевтически приемлемой соли или отдельно, или вместе с другими противораковыми средствами.
В частности, композиции или будут составлены вместе в виде комбинированного терапевтического средства, или введены по-отдельности.
При комбинированной терапии соединение настоящего изобретения и другое противораковое средство(а) могут быть введены или одновременно, в одно время, или последовательно без конкретных временных ограничений, причем такое введение обеспечивает терапевтически эффективные уровни этих двух соединений в теле пациента.
В предпочтительном варианте осуществления соединение настоящего изобретения и другое противораковое средство(а) обычно вводят последовательно в любом порядке посредством вливания или перорально. Схема дозирования может изменяться в зависимости от стадии заболевания, физической формы пациента, профилей безопасности отдельных препаратов и переносимости отдельных препаратов, а также других критериев, хорошо известных лечащему врачу и медицинскому специалисту(ам), вводящему комбинацию. Соединение настоящего изобретения и другое противораковое средство(а) могут быть введены в пределах минут друг от друга, часов, дней или даже недель друг от друга в зависимости от конкретного используемого для лечения цикла. Кроме того, цикл может включать в себя введение одного препарата чаще, чем другого во время цикла лечения и в различных дозах на одно введение препарата.
В другом аспекте настоящего изобретения предлагаются наборы, которые включают в себя одно или несколько соединений настоящего изобретения и комбинации компонентов, как раскрыто в настоящем документе. Типичные наборы включают в себя (a) соединение настоящего изобретения или его фармацевтически приемлемую соль, (b) по меньшей мере один компонент комбинации, например, как указано выше, в результате чего такой набор может содержать вкладыш в упаковку или другую маркировку, включающую в себя инструкции по введению.
Соединение настоящего изобретения можно также использовать для получения преимущества в комбинации с известными терапевтическими способами, например, введением гормонов или, особенно, излучением. Соединение настоящего изобретения можно, в частности, использовать в качестве радиосенсибилизатора, особенно для лечения опухолей, которые демонстрируют плохую чувствительность к лучевой терапии.
В одном варианте осуществления субъекту может быть введено средство, которое уменьшает или ослабляет побочный эффект, связанный с введением экспрессирующей CAR клетки. Побочные эффекты, связанные с введением экспрессирующей CAR клетки, включают, но без ограничения, CRS и гемофагоцитарный лимфогистиоцитоз (HLH), также называемый синдромом активации макрофагов (MAS). Симптомы CRS включают высокую температуру, тошноту, преходящую гипотензию, гипоксию и тому подобное. CRS может включать в себя клинические конституциональные признаки и симптомы, такие как лихорадка, усталость, анорексия, миалгии, арталгии, тошнота, рвота и головная боль. CRS может включать в себя клинические кожные признаки и симптомы, такие как сыпь. CRS может включать в себя клинические гастроинтестинальные признаки и симптомы, такие как тошнота, рвота и диарея. CRS может включать в себя клинические респираторные признаки и симптомы, такие как тахипноэ и гипоксемия. CRS может включать в себя клинические сердечно-сосудистые признаки и симптомы, такие как тахикардия, расширенное пульсовое давление, гипотензия, повышение сердечного выброса (раннего) и потенциальное уменьшение сердечного выброса (позднего). CRS может включать в себя клинические признаки и симптомы коагуляции, такие как повышенный d-димер, гипофибриногенемия с кровотечением или без. CRS может включать в себя клинические почечные признаки и симптомы, такие как азотемия. CRS может включать в себя клинические гепатические признаки и симптомы, такие как трансаминит и гипербилирубинемия. CRS может включать в себя клинические неврологические признаки и симптомы, такие как головная боль, изменения психического состояния, спутанность сознания, делирий, трудности при поиске слов или явная афазия, галлюцинации, тремор, дисметрия, измененная походка и судороги.
Соответственно, способы, описанные в настоящем документе, могут содержать введение экспрессирующей CAR клетки, описанной в настоящем документе, субъекту и последующее введение одного или нескольких средств, для того чтобы справиться с повышенными уровнями растворимого фактора, возникающими из-за лечения с помощью экспрессирующей CAR клетки. В одном варианте осуществления растворимый фактор, повышенный у субъекта, представляет собой один или несколько из IFN-γ, TNF-α, IL-2 и IL-6. В варианте осуществления фактор, повышенный у субъекта, представляет собой один или несколько из IL-1, GM-CSF, IL-10, IL-8, IL-5 и фракталкина. Поэтому средство, введенное для лечения данного побочного эффекта, может представлять собой средство, которое нейтрализует один или несколько из этих растворимых факторов. В одном варианте осуществления средство, которое нейтрализует один или несколько из этих растворимых форм, представляет собой антитело или фрагмент антитела. Примеры таких средств включают, но без ограничения, стероид (например, кортикостероид), ингибитор TNF-α и ингибитор IL-6. Примером ингибитора TNF-α является молекула анти-TNF-α антитела, такая как инфликсимаб, адалимумаб, цертолизумаб пегол и голимумаб. Другим примером ингибитора TNF-α является белок слияния, такой как этанерцепт. Низкомолекулярные ингибиторы TNF-α включают, но без ограничения, производные ксантина (например, пентоксифиллин) и бупропион. Примером ингибитора IL-6 является молекула анти-IL-6 антитела, такая как тоцилизумаб (toc), сарилумаб, элсилимомаб, CNTO 328, ALD518/BMS-945429, CNTO 136, CPSI-2364, CDP6038, VX30, ARGX-109, FE301 и FM101. В одном варианте осуществления молекула анти-IL-6 антитела представляет собой тоцилизумаб. Примером основанного на IL-1R ингибитора является анакинра.
В некоторых вариантах осуществления субъекту вводят, помимо прочего, кортикостероид, такой как, например, метилпреднизолон, гидрокортизон.
В некоторых вариантах осуществления субъекту вводят вазопрессорное средство, такое как, например, норэпинефрин, дофамин, фенилэфрин, эпинефрин, вазопрессин или их комбинацию.
В варианте осуществления субъекту может быть введено жаропонижающее средство. В варианте осуществления субъекту может быть введено анальгетическое средство.
В одном варианте осуществления субъекту может быть введено средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном варианте осуществления это средство может представлять собой средство, которое ингибирует ингибирующую молекулу, например, это средство представляет собой ингибитор контрольных точек. Ингибирующие молекулы, например, молекула программируемой смерти 1 (PD1), могут в некоторых вариантах осуществления уменьшать способность экспрессирующей CAR клетки вызывать иммунный эффекторный ответ. Примеры ингибирующих молекул включают в себя PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета. Ингибирование ингибирующей молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка, может оптимизировать активность экспрессирующей CAR клетки. В вариантах осуществления можно использовать ингибирующую нуклеиновую кислоту, например, ингибирующую нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу с цинковым пальцем (ZFN), например, как описано в настоящем документе, для ингибирования экспрессии ингибирующей молекулы в экспрессирующей CAR клетке. В варианте осуществления ингибитор представляет собой кшРНК. В варианте осуществления ингибирующая молекула ингибируется внутри экспрессирующей CAR клетки. В этих вариантах осуществления молекула дцРНК, которая ингибирует экспрессию ингибирующей молекулы, связана с нуклеиновой кислотой, которая кодирует компонент, например, все компоненты, CAR.
В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, функционально связана с промотором, например, происходящим от H1 или U6 промотором, таким образом, что молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, экспрессируется, например, экспрессируется внутри экспрессирующей CAR клетки. Смотри, например, Tiscornia G., "Development of Lentiviral Vectors Expressing siRNA", Chapter 3, в Gene Transfer: Delivery and Expression of DNA and RNA (eds. Friedmann and Rossi). Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, USA, 2007; Brummelkamp TR, et al. (2002) Science 296: 550-553; Miyagishi M, et al. (2002) Nat. Biotechnol. 19: 497-500. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, присутствует на том же векторе, например, лентивирусном векторе, который содержит молекулу нуклеиновой кислоты, которая кодирует компонент, например, все компоненты, CAR. В таком варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, расположена на векторе, например, лентивирусном векторе, в направлении 5'- или 3'- по отношению к нуклеиновой кислоте, которая кодирует компонент, например, все компоненты, CAR. Молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, может транскрибироваться в том же или другом направлении, что и нуклеиновая кислота, которая кодирует компонент, например, все компоненты, CAR. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, присутствует на векторе, отличном от вектора, который содержит молекулу нуклеиновой кислоты, которая кодирует компонент, например, все компоненты, CAR. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, временно экспрессируется внутри экспрессирующей CAR клетки. В варианте осуществления молекула нуклеиновой кислоты, которая кодирует молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, стабильно интегрирована в геном экспрессирующей CAR клетки. Фигуры 52A-52E изображает примеры векторов для экспрессии компонента, например, всех компонентов, CAR с молекулой дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию.
Примеры молекул дцРНК, подходящих для ингибирования экспрессии молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, причем молекула, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, представляет собой PD-1, приведены ниже.
В таблице 11 ниже приведены названия средств РНКи PDCD1 (PD1) (происходящих от их положения в мышиной последовательности гена PDCD1 NM_008798.2) вместе с SEQ ID NO: 159-206, представляющими последовательность ДНК. Как смысловые (S), так и антисмысловые (AS) последовательности представлены в данной таблице как последовательности 19mer и 21mer. Также следует отметить, что положение (PoS, например, 176) происходит от номера положения в мышиной последовательности гена PDCD1 NM_008798.2. SEQ ID NO указаны группами по 12, которые соответствуют "sense 19" SEQ ID NO: 159-170; "sense 21" SEQ ID NO: 171-182; "asense 21" SEQ ID NO: 183-194; "asense 19" SEQ ID NO: 195-206.
Таблица 11. Мышиные последовательности кшРНК PDCD1 (PD1)
(SEQ ID NO: 171)
(SEQ ID NO: 183)
(SEQ ID NO: 172)
(SEQ ID NO: 184)
(SEQ ID NO: 196)
(SEQ ID NO: 161)
(SEQ ID NO: 173)
(SEQ ID NO: 185)
(SEQ ID NO: 197)
(SEQ ID NO: 174)
(SEQ ID NO: 186)
(SEQ ID NO: 198)
(SEQ ID NO: 163)
(SEQ ID NO: 175)
(SEQ ID NO: 187)
(SEQ ID NO: 199)
(SEQ ID NO: 176)
(SEQ ID NO: 188)
(SEQ ID NO: 200)
(SEQ ID NO: 177)
(SEQ ID NO: 189)
(SEQ ID NO: 178)
(SEQ ID NO: 190)
(SEQ ID NO: 202)
(SEQ ID NO: 167)
(SEQ ID NO: 179)
(SEQ ID NO: 191)
(SEQ ID NO: 203)
(SEQ ID NO: 180)
(SEQ ID NO: 192)
(SEQ ID NO: 204)
(SEQ ID NO: 181)
(SEQ ID NO: 193)
(SEQ ID NO: 205)
(SEQ ID NO: 182)
(SEQ ID NO: 194)
(SEQ ID NO: 206)
В таблице 12 ниже приведены наименования средств РНКи PDCD1 (PD1) (происходящих от их положения в человеческой последовательности гена PDCD1) вместе с SEQ ID NO. 207-254, представляющими последовательность ДНК. Как смысловые (S), так и антисмысловые (AS) последовательности представлены как последовательности 19mer и 21mer. SEQ ID NO указаны группами по 12, которые соответствуют "sense 19" SEQ ID NO: 207-218; "sense 21" SEQ ID NO: 219-230; "asense 21" SEQ ID NO: 231-242; "asense 19" SEQ ID NO: 243-254.
Таблица 12. Человеческие последовательности кшРНК PDCD1 (PD1)
(SEQ ID NO: 219)
(SEQ ID NO: 231)
(SEQ ID NO: 243)
(SEQ ID NO: 208)
(SEQ ID NO: 220)
(SEQ ID NO: 232)
(SEQ ID NO: 244)
(SEQ ID NO: 209)
(SEQ ID NO: 221)
(SEQ ID NO: 233)
(SEQ ID NO: 245)
(SEQ ID NO: 210)
(SEQ ID NO: 222)
(SEQ ID NO: 234)
(SEQ ID NO: 246)
(SEQ ID NO: 211)
(SEQ ID NO: 223)
(SEQ ID NO: 235)
(SEQ ID NO: 247)
(SEQ ID NO: 212)
(SEQ ID NO: 224)
(SEQ ID NO: 236)
(SEQ ID NO: 248)
(SEQ ID NO: 213)
(SEQ ID NO: 225)
(SEQ ID NO: 237)
(SEQ ID NO: 249)
(SEQ ID NO: 214)
(SEQ ID NO: 226)
(SEQ ID NO: 238)
(SEQ ID NO: 250)
(SEQ ID NO: 215)
(SEQ ID NO: 227)
(SEQ ID NO: 239)
(SEQ ID NO: 251)
(SEQ ID NO: 216)
(SEQ ID NO: 228)
(SEQ ID NO: 240)
(SEQ ID NO: 252)
(SEQ ID NO: 217)
(SEQ ID NO: 229)
(SEQ ID NO: 241)
(SEQ ID NO: 253)
(SEQ ID NO: 218)
(SEQ ID NO: 230)
(SEQ ID NO: 242)
(SEQ ID NO: 254)
В одном варианте осуществления ингибитор ингибирующего сигнала может представлять собой, например, антитело или фрагмент антитела, которые связываются с ингибирующей молекулой. Например, средство может представлять собой антитело или фрагмент антитела, которые связываются с PD1, PD-L1, PD-L2 или CTLA4 (например, ипилимумаб (также называемый MDX-010 и MDX-101 и продаваемый как Yervoy®; Bristol-Myers Squibb; тремелимумаб (моноклональное антитело IgG2, доступное от Pfizer, ранее известное как тицилимумаб, CP-675206)). В варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с TIM3. В варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с LAG3. В вариантах осуществления средство, которое усиливает активность экспрессирующей CAR клетки, например, ингибитор ингибирующей молекулы, вводят в комбинации с аллогенным CAR, например, аллогенным CAR, описанным в настоящем документе (например, описанным в разделе "Аллогенный CAR" в настоящем документе).
PD1 представляет собой ингибирующий элемент семейства рецепторов CD28, которое также включает в себя CD28, CTLA-4, ICOS и BTLA. PD1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Было показано, что два лиганда для PD1, PD-L1 и PD-L2 понижающе регулируют T-клеточную активацию при связывании с PD1 (Freeman et a. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 широко распространен при человеческих раках (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммуносупрессия может быть обращена посредством ингибирования локального взаимодействия PD1 с PD-L1. Антитела, фрагменты антител и другие ингибиторы PD1, PD-L1 и PD-L2 доступны в данной области техники и могут быть использованы в комбинации с CAR к CD33, описанным в настоящем документе. Например, ниволумаб (также называемый BMS-936558 или MDX1106; Bristol-Myers Squibb) представляет собой полностью человеческое моноклональное антитело IgG4, которое специфически блокирует PD1. Ниволумаб (клон 5C4) и другие человеческие моноклональные антитела, которые специфически связываются с PD1, раскрыты в US 8008449 и WO2006/121168. Пидилизумаб (CT-011; Cure Tech) представляет собой гуманизированное моноклональное антитело IgG1k, которое связывается с PD1. Пидилизумаб и другие гуманизированные анти-PD1 моноклональные антитела раскрыты в WO2009/101611. Ламбролизумаб (также называемый MK03475; Merck) представляет собой гуманизированное моноклональное антитело IgG4, которое связывается с PD1. Ламбролизумаб и другие гуманизированные анти-PD1 антитела раскрыты в US 8354509 и WO2009/114335. MDPL3280A (Genentech/Roche) представляет собой человеческое Fc-оптимизированное моноклональное антитело IgG1, которое связывается с PD-L1. MDPL3280A и другие человеческие моноклональные антитела к PD-L1 раскрыты в патенте США № 7943743 и публикации № US 20120039906. Другие анти-PD-L1 связывающие средства включают YW243.55.S70 (вариабельные области тяжелой и легкой цепи показаны в SEQ ID NO 20 и 21 в WO2010/077634) и MDX-1 105 (также называемый BMS-936559, и, например, анти-PD-L1 связывающие средства, раскрытые в WO2007/005874). AMP-224 (B7-DCIg; Amplimmune; например, раскрытый в WO2010/027827 и WO2011/066342) представляет собой растворимый рецептор в виде слияния PD-L2 и Fc, который блокирует взаимодействие между PD1 и B7-H1. Другие анти-PD1 антитела включают AMP 514 (Amplimmune), помимо прочих, например, анти-PD1 антител, раскрытых в US 8609089, US 2010028330 и/или US 20120114649.
TIM3 (T-клеточный иммуноглобулин-3) также отрицательно регулирует T-клеточную функцию, особенно в IFN-g-секретирующий CD4+ T-хелперах-1 и CD8+ T-цитотоксических-1 клетках, и играет критическую роль в T-клеточном истощении. Ингибирование взаимодействия между TIM3 и его лигандами, например, галектином-9 (Gal9), фосфотидилсерином (PS) и HMGB1, может увеличивать иммунный ответ. Антитела, фрагменты антител и другие ингибиторы TIM3 и его лигандов доступны в данной области техники и могут быть использованы комбинации с CAR к CD19, описанным в настоящем документе. Например, антитела, фрагменты антител, малые молекулы или пептидные ингибиторы, которые воздействуют на TIM3, связываются с доменом IgV TIM3 для ингибирования взаимодействия с его лигандами. Антитела и пептиды, которые ингибируют TIM3, раскрыты в WO2013/006490 и US20100247521. Другие анти-TIM3 антитела включают гуманизированные варианты RMT3-23 (раскрыты в документе Ngiow et al., 2011, Cancer Res, 71:3540-3551) и клон 8B.2C12 (раскрыт в документе Monney et al., 2002, Nature, 415:536-541). Биспецифические антитела, которые ингибируют TIM3 и PD-1, раскрыты в US20130156774.
В других вариантах осуществления средство, которое усиливает активность экспрессирующей CAR клетки, представляет собой ингибитор CEACAM (например, ингибитор CEACAM-1, CEACAM-3 и/или CEACAM-5). В одном варианте осуществления ингибитором CEACAM является молекула анти-CEACAM антитела. Типичные анти-CEACAM-1 антитела описаны в WO 2010/125571, WO 2013/082366 WO 2014/059251 и WO 2014/022332, например, моноклональные антитела 34B1, 26H7 и 5F4; или их рекомбинантные формы, как описано, например, в US 2004/0047858, US 7132255 и WO 99/052552. В других вариантах осуществления анти-CEACAM антитело связывается с CEACAM-5, как описано, например, в документе Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529 (DOI:10:1371/journal.pone.0021146), или перекрестно реагирует с CEACAM-1 и CEACAM-5, как описано, например, в WO 2013/054331 и US 2014/0271618.
Не желая быть связанными теорией, авторы полагают, что молекулы клеточной адгезии раково-эмбрионального антигена (CEACAM), такие как CEACAM-1 и CEACAM-5, опосредуют, по меньшей мере частично, ингибирование противоопухолевого иммунного ответа (смотри, например, Markel et al. J Immunol. 2002 Mar 15;168(6):2803-10; Markel et al. J Immunol. 2006 Nov 1;177(9):6062-71; Markel et al. Immunology. 2009 Feb;126(2):186-200; Markel et al. Cancer Immunol Immunother. 2010 Feb;59(2):215-30; Ortenberg et al. Mol Cancer Ther. 2012 Jun;11(6):1300-10; Stern et al. J Immunol. 2005 Jun 1;174(11):6692-701; Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529). Например, CEACAM-1 был описан как гетерофильный лиганд TIM-3 и как играющий роль в TIM-3-опосредованных T-клеточных толерантности и истощении (смотри, например, WO 2014/022332; Huang, et al. (2014) Nature doi:10,1038/nature13848). В вариантах осуществления было показано, что совместная блокада CEACAM-1 и TIM-3 усиливает противоопухолевый иммунный ответ в ксенотрансплантатной модели колоректального рака (смотри, например, WO 2014/022332; Huang, et al. (2014), выше). В других вариантах осуществления совместная блокада CEACAM-1 и PD-1 уменьшает T-клеточную толерантность, как описано, например, в WO 2014/059251. Таким образом, ингибиторы CEACAM можно использовать с другими иммуномодуляторами, описанными в настоящем документе (например, анти-PD-1 и/или анти-TIM-3 ингибиторами), для усиления иммунного ответа против рака, например, меланомы, рака легкого (например, NSCLC), рака мочевого пузыря, рака толстой кишки, рака яичников и других раков, как описано в настоящем документе.
LAG3 (ген активации лимфоцитов-3 или CD223) представляет собой молекулу клеточной поверхности, экспрессируемую на активированных T-клетках и B-клетках, которые, как показано, играют роль в CD8+ T-клеточном истощении. Антитела, фрагменты антител и другие ингибиторы LAG3 и его лигандов доступны в данной области техники и могут быть использованы в комбинации с CAR к CD19, описанным в настоящем документе. Например, BMS-986016 (Bristol-Myers Squib) представляет собой моноклональное антитело, которое воздействует на LAG3. IMP701 (Immutep) представляет собой антитело-антагонист LAG3, и IMP731 (Immutep и GlaxoSmithKline) представляет собой истощающее LAG3 антитело. Другие ингибиторы LAG3 включают IMP321 (Immutep), который представляет собой рекомбинантный белок слияния растворимой части LAG3 и Ig, который связывается с молекулами ГКГС класса II и активизирует антигенпрезентирующие клетки (APC). Другие антитела раскрыты, например, в WO2010/019570.
В некоторых вариантах осуществления средство, которое усиливает активность экспрессирующей CAR клетки, может представлять собой, например, белок слияния, содержащий первый домен и второй домен, причем первый домен представляет собой ингибирующую молекулу или ее фрагмент, а второй домен представляет собой полипептид, который ассоциирован с положительным сигналом, например, полипептид, содержащий внутриклеточный сигнальный домен, как описано в настоящем документе. В некоторых вариантах осуществления полипептид, который ассоциирован с положительным сигналом, может включать в себя костимулирующий домен из CD28, CD27, ICOS, например, внутриклеточный сигнальный домен из CD28, CD27 и/или ICOS, и/или первичный сигнальный домен, например, из CD3-дзета, например, описанный в настоящем документе. В одном варианте осуществления белок слияния экспрессируется той же клеткой, которая экспрессирует CAR. В другом варианте осуществления белок слияния экспрессируется клеткой, например, T-клеткой, которая не экспрессирует CAR к CD33.
В одном варианте осуществления средство, которое усиливает активность экспрессирующей CAR клетки, описанной в настоящем документе представляет собой miR-17-92.
В одном варианте осуществления средство, которое усиливает активность CAR, описанного в настоящем документе, представляет собой цитокин. Цитокины имеют важные функции, связанные с размножением, дифференцировкой, выживаемостью и гомеостазом T-клеток. Цитокины, которые могут быть введены субъекту, получающему экспрессирующую CAR клетку, описанную в настоящем документе, включают в себя: IL-2, IL-4, IL-7, IL-9, IL-15, IL-18 и IL-21 или их комбинацию. В предпочтительных вариантах осуществления введенный цитокин представляет собой IL-7, IL-15, или IL-21 или их комбинацию. Цитокин можно вводить один раз в день или более чем один раз в день, например, два раза в день, три раза в день или четыре раза в день. Цитокин можно вводить в течение более чем одного дня, например, цитокин вводят в течение 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 3 недель или 4 недель. Например, цитокин вводят один раз в день в течение 7 дней.
В вариантах осуществления цитокин вводят в комбинации с экспрессирующими CAR T-клетками. Цитокин может быть введен одновременно или совместно с экспрессирующими CAR T-клетками, например, введен в тот же день. Цитокин может быть получен в той же фармацевтической композиции, что и экспрессирующие CAR T-клетки, или может быть получен в отдельной фармацевтической композиции. В качестве альтернативы, цитокин может быть введен вскоре после введения экспрессирующих CAR T-клеток, например, через 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней или 7 дней после введения экспрессирующих CAR T-клеток. В вариантах осуществления, в которых цитокин вводят по схеме дозирования, которая занимает более одного дня, первый день схемы дозирования цитокина может представлять собой тот же день, что и введение экспрессирующих CAR T-клеток, или первый день схемы дозирования цитокина может быть через 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней или 7 дней после введения экспрессирующих CAR T-клеток. В одном варианте осуществления на первый день субъекту вводят экспрессирующие CAR T-клетки, а на второй день вводят цитокин один раз в день в течение следующих 7 дней. В предпочтительном варианте осуществления цитокин, подлежащий введению в комбинации с экспрессирующими CAR T-клетками, представляет собой IL-7, IL-15 или IL-21.
В других вариантах осуществления цитокин вводят в период времени после введения CAR-экспрессирующих клеток, например, по меньшей мере через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или более после введения CAR-экспрессирующих клеток. В одном варианте осуществления цитокин вводят после оценки ответа субъекта на CAR-экспрессирующие клетки. Например, субъекту вводят CAR-экспрессирующие клетки в соответствии с дозировкой и схемами, описанными в настоящем документе. Ответ субъекта на экспрессирующую CAR клеточную терапию оценивают через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или более после введения CAR-экспрессирующих клеток с использованием любого из способов, описанных в настоящем документе, включая ингибирование роста опухоли, уменьшение количества циркулирующих опухолевых клеток или регрессию опухоли. Субъектам, которые не проявляют достаточного ответа на терапию экспрессирующими CAR клетками, может быть введен цитокин. Введение цитокина субъекту, который имеет субоптимальный ответ на терапию экспрессирующими CAR клетками, улучшает эффективность или противораковую активность экспрессирующих CAR клеток. В предпочтительном варианте осуществления цитокин, который вводят после введения CAR-экспрессирующих клеток, представляет собой IL-7.
Комбинация с низкой иммуностимулирующей дозой ингибитора mTOR
Способы, описанные в настоящем документе, используют низкие иммуностимулирующие дозы ингибиторов mTOR, например, аллостерических ингибиторов mTOR, включая рапалоги, такие как RAD001. Введение низкой иммуностимулирующей дозы ингибитора mTOR (например, дозы, недостаточной для полного подавления иммунной системы, но достаточной для улучшения иммунной функции) может оптимизировать активность иммунных эффекторных клеток, например, T-клеток или CAR-экспрессирующих клеток, у субъекта. Способы измерения ингибирования mTOR, дозировки, схемы лечения и подходящие фармацевтические композиции описаны в патентной заявке США № 2015/01240036, которая настоящим включена посредством ссылки.
В варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR может приводить к одному или нескольким из следующего:
i) уменьшение количества PD-1-положительных иммунных эффекторных клеток;
ii) увеличение количества PD-1-отрицательных иммунных эффекторных клеток;
iii) увеличение отношения PD-1-отрицательные иммунные эффекторные клетки/PD-1-положительные иммунные эффекторные клетки;
iv) увеличение количества наивных T-клеток;
v) увеличение экспрессии одного или нескольких из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, на предшественниках T-клеток памяти;
vi) уменьшение экспрессии KLRG1, например, на T-клетках памяти, например, на предшественниках T-клеток памяти; или
vii) увеличение количества предшественников T-клеток памяти, например, клеток с любой одной из следующих характеристик или их комбинацией: повышенный уровень CD62Lhigh, повышенный уровень CD127high, повышенный уровень CD27+, пониженный уровень KLRG1 и повышенный уровень BCL2;
причем любое из вышеуказанного, например, i), ii), iii), iv), v), vi) или vii), происходит, например, по меньшей мере временно, например, по сравнению с не подвергавшимся лечению субъектом.
В другом варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR приводит к увеличению или продлению пролиферации или жизнестойкости CAR-экспрессирующих клеток, например, в культуре или у субъекта, например, по сравнению с не обработанными CAR-экспрессирующими клетками или не подвергавшимся лечению субъектом. В вариантах осуществления увеличение пролиферации или жизнестойкости связано с увеличением количества CAR-экспрессирующих клеток. Способы измерения увеличения или продления пролиферации описаны в примерах 8 и 9. В другом варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR приводит к увеличению киллинга раковых клеток CAR-экспрессирующими клетками, например, в культуре или у субъекта, например, по сравнению с необработанными CAR-экспрессирующими клетками или не подвергавшимся лечению субъектом. В вариантах осуществления увеличение киллинга раковых клеток связано с уменьшением объема опухоли. Способы измерения киллинга раковых клеток описаны в примере 6.
В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем документе, вводят в комбинации с низкой иммуностимулирующей дозой ингибитора mTOR, например, аллостерического ингибитора mTOR, например, RAD001, или каталитического ингибитора mTOR. Например, введение низкой иммуностимулирующей дозы ингибитора mTOR может быть начато перед введением экспрессирующей CAR клетки, описанной в настоящем документе; завершено перед введением экспрессирующей CAR клетки, описанной в настоящем документе; начато в то же время, что и введение экспрессирующей CAR клетки, описанной в настоящем документе; может перекрываться с введением экспрессирующей CAR клетки, описанной в настоящем документе; или может продолжаться после введения экспрессирующей CAR клетки, описанной в настоящем документе.
В качестве альтернативы или дополнения, введение низкой иммуностимулирующей дозы ингибитора mTOR может оптимизировать иммунные эффекторные клетки, которые должны быть сконструированы для экспрессии молекулы CAR, описанной в настоящем документе. В таких вариантах осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR, например, аллостерического ингибитора, например, RAD001, или каталитического ингибитора, начинают или завершают перед отбором иммунных эффекторных клеток, например, T-клеток или NK-клеток, которые должны быть сконструированы для экспрессии молекулы CAR, описанной в настоящем документе, у субъекта.
В другом варианте осуществления иммунные эффекторные клетки, например, T-клетки или NK-клетки, которые должны быть сконструированы для экспрессии молекулы CAR, описанной в настоящем документе, например, после отбора у субъекта, или экспрессирующие CAR иммунные эффекторные клетки, например, T-клетки или NK-клетки, например, перед введением субъекту, могут быть культивированы в присутствии низкой иммуностимулирующей дозы ингибитора mTOR.
В варианте осуществления введение субъекту низкой иммуностимулирующей дозы ингибитора mTOR содержит введение, например, один раз в неделю, например, в лекарственной форме с немедленным высвобождением, от 0,1 до 20, от 0,5 до 10, от 2,5 до 7,5, от 3 до 6 или приблизительно 5 мг RAD001 или его биоэквивалентной дозы. В варианте осуществления введение субъекту низкой иммуностимулирующей дозы ингибитора mTOR содержит введение, например, один раз в неделю, например, в лекарственной форме с замедленным высвобождением, от 0,3 до 60, ль 1,5 до 30, от 7,5 до 22,5, от 9 до 18 или приблизительно 15 мг RAD001 или его биоэквивалентной дозы.
В варианте осуществления доза ингибитора mTOR связана или обеспечивает ингибирование mTOR по меньшей мере на 5, но не более чем на 90%, по меньшей мере на 10, но не более чем на 90%, по меньшей мере на 15, но не более чем на 90%, по меньшей мере на 20, но не более чем на 90%, по меньшей мере на 30, но не более чем на 90%, по меньшей мере на 40, но не более чем на 90%, по меньшей мере на 50, но не более чем на 90%, по меньшей мере на 60, но не более чем на 90%, по меньшей мере на 70, но не более чем на 90%, по меньшей мере на 5, но не более чем на 80%, по меньшей мере на 10, но не более чем на 80%, по меньшей мере на 15, но не более чем на 80%, по меньшей мере на 20, но не более чем на 80%, по меньшей мере на 30, но не более чем на 80%, по меньшей мере на 40, но не более чем на 80%, по меньшей мере на 50, но не более чем на 80%, по меньшей мере на 60, но не более чем на 80%, по меньшей мере на 5, но не более чем на 70%, по меньшей мере на 10, но не более чем на 70%, по меньшей мере на 15, но не более чем на 70%, по меньшей мере на 20, но не более чем на 70%, по меньшей мере на 30, но не более чем на 70%, по меньшей мере на 40, но не более чем на 70%, по меньшей мере на 50, но не более чем на 70%, по меньшей мере на 5, но не более чем на 60%, по меньшей мере на 10, но не более чем на 60%, по меньшей мере на 15, но не более чем на 60%, по меньшей мере на 20, но не более чем на 60%, по меньшей мере на 30, но не более чем на 60%, по меньшей мере на 40, но не более чем на 60%, по меньшей мере на 5, но не более чем на 50%, по меньшей мере на 10, но не более чем на 50%, по меньшей мере на 15, но не более чем на 50%, по меньшей мере на 20, но не более чем на 50%, по меньшей мере на 30, но не более чем на 50%, по меньшей мере на 40, но не более чем на 50%, по меньшей мере на 5, но не более чем на 40%, по меньшей мере на 10, но не более чем на 40%, по меньшей мере на 15, но не более чем на 40%, по меньшей мере на 20, но не более чем на 40%, по меньшей мере на 30, но не более чем на 40%, по меньшей мере на 35, но не более чем на 40%, по меньшей мере на 5, но не более чем на 30%, по меньшей мере на 10, но не более чем на 30%, по меньшей мере на 15, но не более чем на 30%, по меньшей мере на 20, но не более чем на 30%, или по меньшей мере на 25, но не более чем на 30%.
Степень ингибирования mTOR может быть выражена через степень ингибирования киназы P70 S6 или может ей соответствовать, например, степень ингибирования mTOR может быть определена по уровню уменьшения активности киназы P70 S6, например, по уменьшению фосфорилирования субстрата киназы P70 S6. Уровень ингибирования mTOR можно оценивать различными способами, такими как измерение активности киназы P70 S6 с помощью анализа Boulay, как описано в патентной заявке США № 2015/01240036, настоящим включенной посредством ссылки, или как описано в патенте США № 7727950, настоящим включенном посредством ссылки; измерение уровня фосфорилированного S6 с помощью вестерн-блоттинга; или оценка изменения отношения PD1-отрицательных иммунных эффекторных клеток к PD1-положительным иммунным эффекторным клеткам.
Как используется в настоящем документе, термин "ингибитор mTOR" относится к соединению или лиганду или его фармацевтически приемлемой соли, которые ингибируют киназу mTOR в клетке. В варианте осуществления ингибитор mTOR представляет собой аллостерический ингибитор. Аллостерические ингибиторы mTOR включают в себя нейтральное трициклическое соединение рапамицин (сиролимус), родственные рапамицину соединения, то есть соединения, имеющие структурное и функциональное сходство с рапамицином, включая, например, производные рапамицина, аналоги рапамицина (также называемые рапалогами) и другие макролидные соединения, которые ингибируют активность mTOR. В варианте осуществления ингибитор mTOR представляет собой каталитический ингибитор.
Рапамицин является известным макролидным антибиотиком, производимым Streptomyces hygroscopicus, имеющим структуру, показанную в формуле A.
 (A)
(A)
Смотри, например, McAlpine, J.B., et al., J. Antibiotics (1991) 44: 688; Schreiber, S.L., et al., J. Am. Chem. Soc. (1991) 113: 7433; патент США № 3929992. Существуют различные схемы нумерации, предложенные для рапамицина. Во избежание путаницы при наименовании в настоящем документе конкретных аналогов рапамицина названия приводятся со ссылкой на рапамицин при использовании схемы нумерации с формулы A.
Аналогами рапамицина, подходящими для настоящего изобретения, являются, например, O-замещенные аналоги, в которых гидроксильная группа на циклогексильном кольце рапамицина, замещена OR1, где R1 представляет собой гидроксиалкил, гидроксиалкоксиалкил, ациламиноалкил или аминоалкил; например, RAD001, также известный как эверолимус, как описано в US 5665772 и WO94/09010, содержание которых включено посредством ссылки.
Другие подходящий аналоги рапамицина включают замещенные в положении 26 или 28. Аналог рапамицина может представлять собой эпимер аналога, упомянутого выше, в частности эпимер аналога, замещенного в положении 40, 28 или 26, и может, необязательно, быть дополнительно гидрирован, например, как описано в US 6015815, WO95/14023 и WO99/15530, содержание которых включено посредством ссылки, например, ABT578, также известный как зотаролимус, или аналог рапамицина, описанный в US 7091213, WO98/02441 и WO01/14387, содержание которых включено посредством ссылки, например, AP23573, также известный как ридафоролимус.
Примеры аналогов рапамицина из US 5665772, подходящие для использования в настоящем изобретении, включают, но без ограничения, 40-O-бензилрапамицин, 40-O-(4'-гидроксиметил)бензилрапамицин, 40-O-[4'-(1,2-дигидроксиэтил)]бензилрапамицин, 40-O-аллилрапамицин, 40-O-[3'-(2,2-диметил-1,3-диоксолан-4(S)-ил)-проп-2'-ен-1'-ил]рапамицин, (2'E,4'S)-40-O-(4',5'-дигидроксипент-2'-ен-1'-ил)рапамицин, 40-O-(2-гидрокси)этоксикарбонилметилрапамицин, 40-O-(2-гидрокси)этилрапамицин, 40-O-(3-гидрокси)пропилрапамицин, 40-O-(6-гидрокси)гексилрапамицин, 40-O-[2-(2-гидрокси)этокси]этилрапамицин, 40-O-[(3S)-2,2-диметилдиоксолан-3-ил]метилрапамицин, 40-O-[(2S)-23-дигидроксипроп-1-ил]рапамицин, 40-O-(2-ацетокси)этилрапамицин, 40-O-(2-никотиноилокси)этилрапамицин, 40-O-[2-(N-морфолино)ацетокси]этилрапамицин, 40-O-(2-N-имидазолилацетокси)этилрапамицин, 40-O-[2-(N-метил-N'-пиперазинил)ацетокси]этилрапамицин, 39-O-дезметил-39,40-O,O-этиленрапамицин, (26R)-26-дигидро-40-O-(2-гидрокси)этилрапамицин, 40-O-(2-аминоэтил)рапамицин, 40-O-(2-ацетаминоэтил)рапамицин, 40-O-(2-никотинамидоэтил)рапамицин, 40-O-(2-(N-метилимидазо-2'-илкарбэтоксамидо)этил)рапамицин, 40-O-(2-этоксикарбониламиноэтил)рапамицин, 40-O-(2-толилсульфонамидоэтил)рапамицин и 40-O-[2-(4',5'-дикарбоэтокси-1',2',3'-триазол-1'-ил)этил]рапамицин.
Другими известными аналогами рапамицина, подходящими для настоящего изобретения, являются аналоги, в которых гидроксильная группа на циклогексильном кольце рапамицина и/или гидроксигруппа в положении 28 замещены гидроксиэфирной группой, например, аналоги рапамицина, которые можно найти в US RE44768, например, темсиролимус.
Другие аналоги рапамицина, подходящие для настоящего изобретения, включают те, в которых метоксигруппа в положении 16 замещена другим заместителем, предпочтительно (необязательно, гидроксизамещенным) алкинилокси, бензилом, ортометоксибензилом или хлорбензилом, и/или в которых метоксигруппа в положении 39 удалена вместе с углеродом 39, так что циклогексильное кольцо рапамицина становится циклопентильным кольцом без метоксигруппы в положении 39; например, как описано в WO95/16691 и WO96/41807, содержание которых включено посредством ссылки. Аналоги могут быть дополнительно модифицированы таким образом, что гидроксигруппа в положении 40 рапамицина алкилирована, и/или карбонил 32 восстановлен.
Аналоги рапамицина из WO95/16691 включают, но без ограничения, 16-деметокси-16-(пент-2-инил)оксирапамицин, 16-деметокси-16-(бут-2-инил)оксирапамицин, 16-деметокси-16-(пропаргил)оксирапамицин, 16-деметокси-16-(4-гидроксибут-2-инил)оксирапамицин, 16-деметокси-16-бензилокси-40-O-(2-гидроксиэтил)рапамицин, 16-деметокси-16-бензилоксирапамицин, 16-деметокси-16-орто-метоксибензилрапамицин, 16-деметокси-40-O-(2-метоксиэтил)-16-пент-2-инил)оксирапамицин, 39-деметокси-40-дезокси-39-формил-42-норрапамицин, 39-деметокси-40-дезокси-39-гидроксиметил-42-норрапамицин, 39-деметокси-40-дезокси-39-карбокси-42-норрапамицин, 39-деметокси-40-дезокси-39-(4-метил-пиперазин-1-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-(морфолин-4-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-[N-метил,N-(2-пиридин-2-ил-этил)]карбамоил-42-норрапамицин и 39-деметокси-40-дезокси-39-(п-толуолсульфонилгидразонометил)-42-норрапамицин.
Аналоги рапамицина из WO96/41807 включают, но без ограничения, 32-деоксорапамицин, 16-O-пент-2-инил-32-деоксорапамицин, 16-O-пент-2-инил-32-деоксо-40-O-(2-гидроксиэтил)рапамицин, 16-O-пент-2-инил-32-(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин, 32(S)-дигидро-40-O-(2-метокси)этилрапамицин и 32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин.
Другим подходящим аналогом рапамицина является умиролимус, как описано в US2005/0101624, содержание которого включено посредством ссылки.
RAD001, иначе известный как эверолимус (Afinitor®), имеет химическое название (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-дигидрокси-12-{(1R)-2-[(1S,3R,4R)-4-(2-гидроксиэтокси)-3-метоксициклогексил]-1-метилэтил}-19,30-диметокси-15,17,21,23,29,35-гексаметил-11,36-диокса-4-азатрицикло[30.3.1.049]гексатриаконта-16,24,26,28-тетраен-2,3,10,14,20-пентаон, как описано в US 5665772 и WO94/09010, содержание которых включено посредством ссылки.
Дополнительные примеры аллостерических ингибиторов mTOR включают в себя сиролимус (рапамицин, AY-22989), 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (также называемый темсиролимусом или CCI-779) и ридафоролимус (AP-23573/MK-8669). Другие примеры аллостерических ингибиторов mTor включают зотаролимус (ABT578) и умиролимус.
В качестве альтернативы или дополнительно, было обнаружено, что каталитические АТФ-конкурентные ингибиторы mTOR непосредственно воздействуют на домен киназы mTOR и воздействуют как на mTORC1, так и на mTORC2. Они также являются более эффективными ингибиторами mTORC1, чем такие аллостерические ингибиторы mTOR, как рапамицин, поскольку они модулируют результаты работы рапамицин-резистентной mTORC1, такие как фосфорилирование 4EBP1-T37/46 и кэп-зависимая трансляция.
Каталитические ингибиторы включают: BEZ235 или 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)-фенил]-пропионитрил или монотозилатную солевую форму (синтез BEZ235 описан в WO2006/122806); CCG168 (иначе известный как AZD-8055, Chresta, C.M., et al., Cancer Res, 2010, 70(1), 288-298), который имеет химическое название {5-[2,4-бис-((S)-3-метилморфолин-4-ил)-пиридо[2,3-d]пиримидин-7-ил]-2-метоксифенил}метанол; 3-[2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил]-N-метилбензамид (WO09104019); 3-(2-амидобензо[d]оксазол-5-ил)-1-изопропил-1H-пиразоло[3,4-d]пиримидин-4-амин (WO10051043 и WO2013023184); N-(3-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид (WO07044729 и WO12006552); PKI-587 (Venkatesan, A.M., J. Med.Chem., 2010, 53, 2636-2645), который имеет химическое название 1-[4-[4-(диметиламино)пиперидин-1-карбонил]фенил]-3-[4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил]мочевина; GSK-2126458 (ACS Med. Chem. Lett., 2010, 1, 39-43), который имеет химическое название 2,4-дифтор-N-{2-метокси-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид; 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амин (WO10114484); и (E)-N-(8-(6-амино-5-(трифторметил)пиридин-3-ил)-1-(6-(2-цианопропан-2-ил)пиридин-3-ил)-3-метил-1H-имидазо[4,5-c]хинолин-2(3H)-илиден)цианамид (WO12007926).
Дополнительные примеры каталитических ингибиторов mTOR включают 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметилфенил)-1,3-дигидроимидазо[4,5-c]хинолин-2-он (WO2006/122806) и Ku-0063794 (Garcia-Martinez JM, et al.,Biochem J., 2009, 421(1), 29-42. Ku-0063794 is a specific inhibitor of the mammalian target of rapamycin (mTOR).) WYE-354 является другим примером каталитического ингибитора mTOR (Yu K, et al. (2009). Biochemical, Cellular, and In vivo Activity of Novel ATP-Competitive and Selective Inhibitors of the Mammalian Target of Rapamycin. Cancer Res. 69(15): 6232-6240).
Ингибиторы mTOR, используемые в соответствии с настоящим изобретением, также включают пролекарства, производные, фармацевтически приемлемые соли или аналоги любого из вышеперечисленного.
Ингибиторы mTOR, такие как RAD001, могут быть составлены для доставки на основе хорошо известных в данной области техники способов, основанных на конкретных дозировках, описанных в настоящем документе. В частности, патент США № 6004973 (включенный в настоящий документ посредством ссылки) приводит примеры композиций, пригодных для употребления с ингибиторами mTOR, описанными в настоящем документе.
Способы и биомаркеры для оценки эффективности CAR или пригодности образцов
В другом аспекте настоящее изобретение предлагает способ оценки или мониторинга эффективности терапии с помощью экспрессирующих CAR клеток (например, терапии CD33CAR) у субъекта (например, субъекта, имеющего рак, например, гематологический рак) или пригодности образца (например, образца афереза) для терапии с помощью CAR (например, терапии CD33CAR). Способ включает в себя получение значения эффективности терапии с помощью CAR или пригодности образцов, причем упомянутое значение указывает на эффективность или пригодность терапии экспрессирующими CAR клетками.
В вариантах осуществления значение эффективности терапии с помощью CAR или пригодности образцов содержит меру одного, двух, трех, четырех, пяти, шести или более (всех) из следующего:
(i) уровня или активности одной, двух, трех или более (например, всех) из покоящихся TEFF-клеткок, покоящихся TREG-клеток, молодых T-клеток (например, молодых CD4 или CD8 клеток или гамма/дельта-T-клеток) или ранних T-клеток памяти или их комбинации в образце (например, образце афереза или образце готового экспрессирующего CAR клеточного продукта);
(ii) уровня или активности одной, двух, трех или более (например, всех) из активированных TEFF-клеток, активированных TREG-клеток, старых T-клеток (например, старых CD4 или CD8 клеток) или поздних T-клеток памяти или их комбинации в образце (например, образце афереза или образце готового экспрессирующего CAR клеточного продукта);
(iii) уровня или активности маркера истощения иммунных клеток, например, одного, двух или более ингибиторов иммунных контрольных точек (например, PD-1, PD-L1, TIM-3 и/или LAG-3) в образце (например, образце афереза или образце готового экспрессирующего CAR клеточного продукта). В одном варианте осуществления иммунная клетка имеет истощенный фенотип, например, коэкспрессирует по меньшей мере два маркера истощения, например, коэкспрессирует PD-1 и TIM-3. В других вариантах осуществления иммунная клетка имеет истощенный фенотип, например, коэкспрессирует по меньшей мере два маркера истощения, например, коэкспрессирует PD-1 и LAG-3;
(iv) уровня или активности CD27 и/или CD45RO- (например, CD27+ CD45RO-) иммунных эффекторных клеток, например, в популяции CD4+ или CD8+ T-клеток в образце (например, образце афереза или образце готового экспрессирующего CAR клеточного продукта);
(v) уровня или активности одного, двух, трех, четырех, пяти, десяти, двадцати или более из биомаркеров, выбранных из CCL20, IL-17a и/или IL-6, PD-1, PD-L1, LAG-3, TIM-3, CD57, CD27, CD122, CD62L, KLRG1;
(vi) уровня или активности цитокинов (например, качества репертуара цитокинов) в образце экспрессирующего CAR клеточного продукта, например, образце CAR33-экспрессирующего клеточного продукта; или
(vii) эффективности трансдукции экспрессирующей CAR клетки в образце готового экспрессирующего CAR клеточного продукта.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, терапия экспрессирующими CAR клетками содержит множество (например, популяцию) экспрессирующих CAR иммунных эффекторных клеток, например, множество (например, популяцию) T-клеток или NK-клеток или их комбинацию. В одном варианте осуществления терапия экспрессирующими CAR клетками представляет собой терапию CD33CAR.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, меру одного или нескольких из (i)-(vii) получают из образца афереза получаемого у субъекта. Образец афереза можно оценивать перед введением или повторным введением.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, меру одного или нескольких из (i)-(vii) получают из образца готового экспрессирующего CAR клеточного продукта, например, образца CD33CAR-экспрессирующего клеточного продукта. Готовый экспрессирующий CAR клеточный продукт можно оценивать перед введением или повторным введением.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, субъекта оценивают перед получением, во время или после получения терапии экспрессирующими CAR клетками.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, мера одного или нескольких из (i)-(vii) оценивает профиль для одного или нескольких из экспрессии генов, проточной цитометрии или экспрессии белка.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, способ дополнительно содержит идентификацию субъекта как отвечающего на лечение, не отвечающего на лечение, имеющего рецидив или не имеющего рецидива на основании меры одного или нескольких из (i)-(vii).
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, отвечающий на лечение (например, полностью отвечающий на лечение) имеет, или его идентифицируют как имеющего, более высокий уровень или активность одного, двух или более (всех) из GZMK, PPF1BP2 или наивных T-клеток по сравнению с не отвечающим на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокий уровень или активность одного, двух, трех, четырех, пяти, шести, семи или более (например, всех) из IL22, IL-2RA, IL-21, IRF8, IL8, CCL17, CCL22, эффекторных T-клеток или регуляторных T-клеток по сравнению с отвечающим на лечение.
В варианте осуществления имеющий рецидив представляет собой пациента, имеющего, или которого идентифицируют как имеющего, повышенный уровень экспрессии одного или нескольких (например, 2, 3, 4 или всех) из следующих генов по сравнению с не имеющими рецидива: MIR199A1, MIR1203, uc021ovp, ITM2C и HLA-DQB1 и/или пониженные уровни экспрессии одного или нескольких (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или всех) из следующих генов по сравнению с не имеющими рецидива: PPIAL4D, TTTY10, TXLNG2P, MIR4650-1, KDM5D, USP9Y, PRKY, RPS4Y2, RPS4Y1, NCRNA00185, SULT1E1 и EIF1AY.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, полностью отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую, например, статистически значимо более высокую, процентную долю CD8+ T-клеток по сравнению с эталонным значением, например, процентной долей CD8+ T-клеток у не отвечающего на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, полностью отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю CD27+ CD45RO- иммунных эффекторных клеток, например, в CD8+ популяции, по сравнению с эталонным значением, например, количеством CD27+ CD45RO- иммунных эффекторных клеток у не отвечающего на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, полностью отвечающий на лечение или частично отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую, например, статистически значимо более высокую, процентную долю CD4+ T-клеток по сравнению с эталонным значением, например, процентной долей CD4+ T-клеток у не отвечающего на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, полностью отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю одного, двух, трех или более (например, всех) из покоящихся TEFF-клеток, покоящихся TREG-клеток, молодых T-клеток (например, молодых CD4 или CD8 клеток, или гамма/дельта-T-клеток) или ранних T-клеток памяти или их комбинации по сравнению с эталонным значением, например, количеством покоящихся TEFF-клеток, покоящихся TREG-клеток, молодых T-клеток (например, молодых CD4 или CD8 клеток) или ранних T-клеток памяти у не отвечающего на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю одного, двух, трех или более (например, всех) из активированных TEFF-клеток, активированных TREG-клеток, старых T-клеток (например, старых CD4 или CD8 клеток) или поздних T-клеток памяти или их комбинации по сравнению с эталонным значением, например, количеством активированных TEFF-клеток, активированных TREG-клеток, старых T-клеток (например, старых CD4 или CD8 клеток) или поздних T-клеток памяти у отвечающего на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю маркера истощения иммунных клеток, например, одного, двух или более ингибиторов иммунных контрольных точек (например, PD-1, PD-L1, TIM-3 и/или LAG-3). В одном варианте осуществления не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю экспрессирующий PD-1, PD-L1 или LAG-3 иммунных эффекторных клеток (например, CD4+ T-клеток и/или CD8+ T-клеток) (например, экспрессирующих CAR CD4+ клеток и/или CD8+ T-клеток) по сравнению с процентной долей экспрессирующих PD-1 или LAG-3 иммунных эффекторных клеток у отвечающего на лечение.
В одном варианте осуществления не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю иммунных клеток, имеющих истощенный фенотип, например, иммунных клеток, которые коэкспрессируют по меньшей мере два маркера истощения, например, коэкспрессируют PD-1, PD-L1 и/или TIM-3. В других вариантах осуществления не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю иммунных клеток, имеющих истощенный фенотип, например, иммунных клеток, которые коэкспрессируют по меньшей мере два маркера истощения, например, коэкспрессируют PD-1 и LAG-3.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю PD-1/PD-L1+/LAG-3+ клеток в популяции экспрессирующих CAR клеток (например, популяции CD33CAR+ клеток) по сравнению с отвечающим (например, полностью отвечающим) на терапию экспрессирующими CAR клетками.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, частично отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокие процентные доли PD-1/PD-L1+/LAG-3+ клеток, чем отвечающий на лечение, в популяции экспрессирующих CAR клеток (например, популяции CD33CAR+ клеток).
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, не отвечающий на лечение имеет, или его идентифицируют как имеющего, истощенный фенотип PD1/PD-L1+ CAR+ и коэкспрессию LAG3 в популяции экспрессирующих CAR клеток (например, популяции CD33CAR+ клеток).
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, не отвечающий на лечение имеет, или его идентифицируют как имеющего, более высокую процентную долю PD-1/PD-L1+/TIM-3+ клеток в популяции экспрессирующих CAR клеток (например, популяции CD33CAR+ клеток) по сравнению с отвечающим на лечение (например, полностью отвечающим на лечение).
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, частично отвечающие на лечение имеют, или их идентифицируют как имеющих, более высокую процентную долю PD-1/PD-L1+/TIM-3+ клеток в популяции экспрессирующих CAR клеток (например, популяции CD33CAR+ клеток), чем отвечающие на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, присутствие CD8+ CD27+ CD45RO- T-клеток в образце афереза является положительным предиктором ответа субъекта на терапию экспрессирующими CAR клетками (например, терапию CD33CAR).
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, высокая процентная доля PD1+ CAR+ и LAG3+ или TIM3+ T-клеток в образце афереза является плохим прогностическим предиктором ответа субъекта на терапию экспрессирующими CAR клетками (например, терапию CD33CAR).
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, отвечающий на лечение (например, полностью или частично отвечающий на лечение) имеет один, два, три или более (или все) из следующих профилей:
(i) имеет более высокое количество CD27+ иммунных эффекторных клеток по сравнению с эталонным значением, например, количеством CD27+ иммунных эффекторных клеток у не отвечающего на лечение;
(ii) (i) имеет более высокое количество CD8+ T-клеток по сравнению с эталонным значением, например, количеством CD8+ T-клеток у не отвечающего на лечение;
(iii) имеет более низкое количество иммунных клеток, экспрессирующих один или несколько ингибиторов контрольных точек, например, ингибитор контрольных точек, выбранный из PD-1, PD-L1, LAG-3, TIM-3 или KLRG-1 или комбинации, по сравнению с эталонным значением, например, количеством клеток, экспрессирующих один или несколько ингибиторов контрольных точек у не отвечающего на лечение; или
(iv) имеет более высокое количество одного, двух, трех, четырех или более (всех) из покоящихся TEFF-клеток, покоящихся TREG-клеток, наивных CD4 клеток, нестимулированных клеток памяти или ранних T-клеток памяти или их комбинации, по сравнению с эталонным значением, например, количеством покоящихся TEFF-клеток, покоящихся TREG-клеток, наивных CD4 клеток, нестимулированных клеток памяти или ранних T-клеток памяти у не отвечающего на лечение.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, уровень или активность цитокинов из (vi) выбирают из одного, двух, трех, четырех, пяти, шести, семи, восьми или более (или всех) из цитокинов CCL20/MIP3a, IL-17A, IL-6, GM-CSF, IFN-γ, IL-10, IL-13, IL-2, IL-21, IL-4, IL-5, IL-9 или TNF-α или их комбинации. Цитокин может быть выбран из одного, двух, трех, четырех или более (всех) из IL-17a, CCL20, IL-2, IL-6 или TNF-a. В одном варианте осуществления повышенный уровень или активность цитокина, выбранного из одного или обоих из IL-17a и CCL20, указывает на повышение реагирования или уменьшение рецидивов.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, эффективность трансдукции, составляющая 15% или выше, в (vii) указывает на повышение реагирования или уменьшение рецидивов.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящем документе, эффективность трансдукции, составляющая меньше чем 15%, в (vii) указывает на понижение реагирования или увеличение рецидивов.
В вариантах осуществления отвечающий на лечение, не отвечающий на лечение, имеющий рецидив или не имеющий рецидива, идентифицированные с помощью способов настоящего документа, могут быть дополнительно оценены в соответствии с клиническими критериями. Например, полностью отвечающий на лечение представляет собой, или идентифицирован в качестве, субъекта, имеющего заболевание, например, рак, который демонстрирует полный ответ, например, полную ремиссию, на лечение. Полный ответ может быть идентифицирован, например, с использованием NCCN Guidelines® или документов Cheson et al, J Clin Oncol 17:1244 (1999) и Cheson et al., "Revised Response Criteria for Malignant Lymphoma", J Clin Oncol 25:579-586 (2007) (которые включены посредством ссылки в настоящий документ во всей полноте), как описано в настоящем документе. Частично отвечающий на лечение представляет собой, или идентифицирован в качестве, субъекта, имеющего заболевание, например, рак, который демонстрирует частичный ответ, например, частичную ремиссию, на лечение. Частичный ответ может быть идентифицирован, например, с использованием NCCN Guidelines® или критериев Cheson, как описано в настоящем документе. Не отвечающий на лечение представляет собой, или идентифицирован в качестве, субъекта, имеющего заболевание, например, рак, который не демонстрирует ответа на лечение, например, этот пациент имеет стабильное заболевание или прогрессирующее заболевание. Не отвечающий на лечение может быть идентифицирован, например, с использованием NCCN Guidelines® или критериев Cheson, как описано в настоящем документе.
В качестве альтернативы или в комбинации со способами, раскрытыми в настоящем документе, чувствительный к упомянутой величине, выполняя один, два, три, четыре или более из:
введения, например, отвечающему на лечение или не имеющему рецидива, терапии экспрессирующими CAR клетками;
введения измененного дозирования терапии экспрессирующими CAR клетками;
изменения расписания или временного хода терапии экспрессирующими CAR клетками;
введения, например, не отвечающему на лечение или частично отвечающему на лечение, дополнительного средства в комбинации с терапией экспрессирующими CAR клетками, например, ингибитора контрольных точек, например, ингибитора контрольных точек, описанного в настоящем документе;
введения не отвечающему на лечение или частично отвечающему на лечение терапии, которая увеличивает количество молодых T-клеток у субъекта перед лечением с помощью терапии экспрессирующими CAR клетками;
модификации способа получения терапии экспрессирующими CAR клетками, например, обогащения молодыми T-клетками перед введением нуклеиновой кислоты, кодирующей CAR, или повышения эффективности трансдукции, например, для субъекта, идентифицированного в качестве не отвечающего на лечение или частично отвечающего на лечение;
введения альтернативной терапии, например, для не отвечающего на лечение, или частично отвечающего на лечение, или имеющего рецидив; или
если субъект представляет собой, или идентифицирован в качестве, не отвечающего на лечение или имеющего рецидив, уменьшения популяции TREG-клеток и/или генной сигнатуры TREG, например, посредством одного или нескольких из истощения по CD25, введения циклофосфамида, анти-GITR антитела или их комбинации.
В определенных вариантах осуществления субъекта подвергают предварительному лечению с помощью анти-GITR антитела. В некоторых вариантах осуществления субъекта подвергают лечению с помощью анти-GITR антитела перед введением или повторным введением.
Биополимерные способы доставки
В некоторых вариантах осуществления одна или несколько CAR-экспрессирующих клеток, как раскрыто в настоящем документе, могут быть введены или доставлены субъекту с помощью биополимерного каркаса, например, биополимерного имплантата. Биополимерные каркасы могут поддерживать или улучшать доставку, размножение и/или рассеяние CAR-экспрессирующих клеток, описанных в настоящем документе. Биополимерный каркас содержит биосовместимый (например, по существу не вызывающий воспалительного или иммунного ответа) и/или биоразлагаемый полимер, который может быть природным или синтетическим.
Примеры подходящих биополимеров включают, но без ограничения, агар, агарозу, альгинат, альгинат/кальций-фосфатный цемент (CPC), бета-галактозидазу (β-GAL), (1,2,3,4,6-пентаацетил-a-D-галактозу), целлюлозу, хитин, хитозан, коллаген, эластин, желатин, коллаген гиалуроновой кислоты, гидроксиапатит, поли(3-гидроксибутират-ко-3-гидроксигексаноат) (PHBHHx), поли(лактид), поли(капролактон) (PCL), поли(лактид-ко-гликолид) (PLG), полиэтиленоксид (PEO), поли(молочную-ко-гликолевую кислоту) (PLGA), полипропиленоксид (PPO), поливиниловый спирт (PVA), шелк, соевый белок и изолят соевого белка по-отдельности или в комбинации с любой другой полимерной композицией в любой концентрации и в любом отношении. Биополимер может быть дополнен или модифицирован с помощью способствующих адгезии или миграции молекул, например, коллаген-миметических пептидов, которые связываются с коллагеновым рецептором лимфоцитов, и/или стимулирующих молекул для улучшения доставки, размножения или функции, например, противораковой активности, клеток, подлежащих доставке. Биополимерный каркас может представлять собой инъецируемую, например, в виде геля или полутвердую, или твердую композицию.
В некоторых вариантах осуществления CAR-экспрессирующие клетки, описанные в настоящем документе, высевают на биополимерный каркас перед доставкой субъекту. В вариантах осуществления биополимерный каркас дополнительно содержит одно или несколько дополнительных терапевтических средств, описанных в настоящем документе (например, другую экспрессирующую CAR клетку, антитело или малую молекулу), или средств, которые увеличивают активность экспрессирующей CAR клетки, например, внедренной или конъюгированной с биополимерами каркаса. В вариантах осуществления биополимерный каркас инъецируют, например, внутрь опухоли, или хирургически имплантируют в опухоль или достаточно близко от опухоли для опосредования противоопухолевого эффекта. Дополнительные примеры биополимерных композиций и способов их доставки описаны в документах Stephan et al., Nature Biotechnology, 2015, 33:97-101; и WO2014/110591.
Фармацевтические композиции и виды лечения
Фармацевтические композиции настоящего изобретения могут содержать экспрессирующую CAR клетку, например, множество CAR-экспрессирующих клеток, как описано в настоящем документе, в комбинации с одним или несколькими фармацевтически или физиологически приемлемыми носителями, разбавителями или вспомогательными средствами. Такие композиции могут содержать буферы, такие как нейтральный буферный раствор, фосфатный буферный раствор и тому подобные; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие средства, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия); и консерванты. Композиции настоящего изобретения в одном аспекте составляют для внутривенного введения.
Фармацевтические композиции настоящего изобретения можно вводить соответствующим подлежащему лечению (или предупреждению) заболеванию образом. Количество и частота введения будут определяться такими факторами, как состояние пациента и тип и тяжесть заболевания пациента, хотя соответствующие дозировки могут быть определены с помощью клинических исследований.
В одном варианте осуществления фармацевтическая композиция по существу свободна от примеси, например, отсутствуют детектируемые уровни примеси, например, выбранной из группы, состоящей из эндотоксина, микоплазмы, компетентного по репликации лентивируса (RCL), p24, нуклеиновой кислоты VSV-G, HIV gag, остатка гранул с анти-CD3/анти-CD28 покрытием, мышиных антител, смешанной человеческой сыворотки, бычьего сывороточного альбумина, бычьей сыворотки, компонентов культуральной среды, компонентов упаковывающих вектор клеток или плазмид, бактерий и грибов. В одном варианте осуществления бактерия по меньшей мере выбрана из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumonia и Streptococcus pyogenes группы A.
Когда указано "иммунологически эффективное количество", "эффективное противоопухолевое количество", "эффективное ингибирующее опухоль количество" или "терапевтическое количество", точное количество композиций настоящего изобретения, подлежащее введению, может быть определено врачом с учетом индивидуальных различий в возрасте, весе, размере опухоли, степени инфекции или метастазирования и состояния пациента (субъекта). Как правило, можно утверждать, что фармацевтическая композиция, содержащая T-клетки, описанные в настоящем документе, может быть введена в дозировке, составляющей от 104 до 109 клеток на кг веса тела, в некоторых случаях от 105 до 106 клеток на кг веса тела, включая все целочисленные значения в пределах данных диапазонов. T-клеточные композиции также можно вводить в этих дозировках множество раз. Клетки могут быть введены посредством использования способов введения, которые хорошо известны в иммунотерапии (смотри, например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988).
В определенных аспектах может быть желательно вводить активированные T-клетки субъекту, а затем повторно отбирать кровь (или осуществлять аферез), активировать в ней T-клетки в соответствии с настоящим изобретением и повторно вливать пациенту эти активированные и размноженные T-клетки. Этот процесс можно осуществлять множество раз каждые несколько недель. В определенных аспектах можно активировать T-клетки из отборов крови объемом от 10 см3 до 400 см3. В определенных аспектах активируют T-клетки из отборов крови объемом 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3.
Введение рассматриваемых композиций может быть осуществлено любым удобным способом, в том числе посредством аэрозольной ингаляции, инъекции, приема внутрь, переливания, имплантации или трансплантации. Композиции, описанные в настоящем документе, могут быть введены пациенту трансартериально, подкожно, внутрикожно, внутрь опухоли, внутрь узлов, внутрь костного мозга, внутримышечно, посредством внутривенной (в/в) инъекции, или внутрибрюшинно. В одном аспекте T-клеточные композиции настоящего изобретения вводят пациенту посредством внутрикожной или подкожной инъекции. В одном аспекте композиции экспрессирующих CAR клеток (например, T-клеток или NK-клеток) настоящего изобретения вводят посредством в/в инъекции. Композиции CAR-экспрессирующих клеток (например, T-клеток или NK-клеток) могут быть инъецированы непосредственно в опухоль, лимфатический узел или участок инфекции.
В конкретном типичном аспекте субъекты могут подвергаться лейкаферезу, при котором лейкоциты собирают, обогащают или истощают ex vivo для отбора и/или выделения представляющих интерес клеток, например, иммунных эффекторных клеток (например, T-клеток или NK-клеток). Эти изоляты иммунных эффекторных клеток (например, T-клеток или NK-клеток) могут быть размножены с помощью способов, известных в данной области техники, и обработаны таким образом, что могут быть введены один или несколько конструктов CAR настоящего изобретения, посредством чего создают экспрессирующую CAR клетку (например, T-клетку с CAR или экспрессирующую CAR NK-клетку) настоящего изобретения. Субъекты, нуждающиеся в этом, могут впоследствии подвергаться стандартному лечению с помощью высоких доз химиотерапии с последующей трансплантацией стволовых клеток периферической крови. В определенных аспектах после или одновременно с трансплантацией субъекты получают введение размноженных CAR-экспрессирующих клеток (например, T-клеток или NK-клеток) настоящего изобретения. В дополнительном аспекте размноженные клетки вводят до или после хирургии.
В вариантах осуществления осуществляют лимфоистощение у субъекта, например, перед введением одной или нескольких клеток, которые экспрессируют CAR, описанный в настоящем документе, например, CD33-связывающий CAR, описанный в настоящем документе. В вариантах осуществления лимфоистощение содержит введение одного или нескольких из мелфалана, цитоксана, циклофосфамида и флударабина.
Дозировка вышеуказанных препаратов, подлежащих введению пациенту, будет изменяться в зависимости от точной природы подвергаемого лечению состояния и реципиента лечения. Пересчет дозировок для введения человеку может быть осуществлен в соответствии с принятой в данной области техники практикой. Доза для CAMPATH, например, обычно будет находиться в диапазоне от 1 до приблизительно 100 мг для взрослого пациента при обычном введении ежедневно в течение периода от 1 до 30 дней. Предпочтительная ежедневная доза составляет от 1 до 10 мг в день, хотя в некоторых случаях можно использовать большие дозы, составляющие вплоть до 40 мг в день (описано в патенте США № 6120766).
В одном варианте осуществления CAR вводят в иммунные эффекторные клетки (например, T-клетки или NK-клетки), например, с использованием in vitro транскрипции, и субъект (например, человек) получает первоначальное введение иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток) настоящего изобретения и одно или несколько последующих введений иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток) настоящего изобретения, причем одно или несколько последующих введений вводят меньше чем через 15 дней, например, через 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 дня после предыдущего введения. В одном варианте осуществления более чем одно введение иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток) настоящего изобретения вводят субъекту (например, человеку) в неделю, например, в неделю вводят 2, 3 или 4 введения иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток) настоящего изобретения. В одном варианте осуществления субъект (например, субъект-человек) получает более чем одно введение иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток) в неделю (например, 2, 3 или 4 введений в неделю) (что также обозначается в настоящем документе как цикл), за чем следует неделя без введений иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток), и затем субъекту вводят одно или несколько дополнительных введений иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток) (например, более чем одно введение иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток) в неделю). В другом варианте осуществления субъект (например, субъект-человек) получает более чем один цикл иммунных эффекторных клеток с CAR (например, T-клеток, NK-клеток), и время между циклами составляет меньше чем 10, 9, 8, 7, 6, 5, 4 или 3 дня. В одном варианте осуществления иммунные эффекторные клетки с CAR (например, T-клетки, NK-клетки) вводят через день в количестве 3 введений в неделю. В одном варианте осуществления иммунные эффекторные клетки с CAR (например, T-клетки, NK-клетки) настоящего изобретения вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или более недель.
В одном аспекте экспрессирующие CAR к CD33 клетки (например, CD33-CART или экспрессирующие CAR к CD33 NK-клетки) создают с использованием лентивирусных вирусных векторов, таких как лентивирус. CAR-экспрессирующие клетки (например, CART или экспрессирующие CAR NK-клетки), создаваемые таким образом, будут иметь стабильную экспрессию CAR.
В одном аспекте CAR-экспрессирующие клетки, например, CART, создают с использованием вирусного вектора, такого как гаммаретровирусный вектор, например, гаммаретровирусный вектор, описанный в настоящем документе. CART, создаваемые с использованием этих векторов, могут иметь стабильную экспрессию CAR.
В одном аспекте CAR-экспрессирующие клетки (например, CART или экспрессирующие CAR NK-клетки) временно экспрессируют векторы с CAR в течение 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 дней после трансдукции. Временная экспрессия CAR может быть осуществлена посредством доставки вектора с РНК CAR. В одном аспекте РНК CAR трансдуцируют в клетку, например, T-клетку или NK-клетку, посредством электропорации.
Потенциальной проблемой, которая может возникать у пациентов, подвергавшихся лечению с использованием временно экспрессирующих CAR-экспрессирующих клеток (например, CART или экспрессирующих CAR NK-клеток) (в частности несущих мышиный scFv CAR-экспрессирующих клеток (например, CART или экспрессирующих CAR NK-клеток)) является анафилаксия после нескольких процедур лечения.
Не связывая себя этой теорией, авторы полагают, что такой анафилактический ответ может быть вызван развитием у пациента гуморального анти-CAR ответа, то есть анти-CAR антител, имеющих изотип анти-IgE. Полагают, что производящие антитела клетки пациента претерпевают переключение класса с изотипа IgG (который не вызывает анафилаксии) на изотип IgE при перерыве десять-четырнадцать дней в воздействии антигена.
Если пациент имеет высокий риск генерирования ответа через анти-CAR антитела во время терапии с помощью временных CAR (таких как генерируемые с помощью трансдукции РНК), перерыв в введении экспрессирующей CAR клетки (например, CART или экспрессирующей CAR NK-клетки) не должен продолжаться больше чем десять-четырнадцать дней.
ПРИМЕРЫ
Настоящее изобретение далее описано подробно посредством ссылки на нижеследующие экспериментальные примеры. Эти примеры приведены только с целью иллюстрации и не предназначены для ограничения, если не указано иное. Таким образом, настоящее изобретение никоим образом не должно быть истолковано как ограниченное нижеследующими примерами, а, скорее, должно быть истолковано как охватывающее любые и все вариации, которые станут очевидными благодаря идеям, предлагаемым в настоящем документе.
Помимо последующего описания, полагают, что средний специалист в данной области техники может, с использованием предшествующего описания и нижеследующих иллюстративных примеров, создавать и использовать соединения настоящего изобретения и осуществлять на практике заявленные способы. Нижеследующие рабочие примеры конкретно указывают на различные аспекты настоящего изобретения, и их не следует интерпретировать как ограничивающие каким-либо образом остальную часть раскрытия.
Пример 1: Конструкты с гуманизированным CAR
Уровни CD33 измеряли в первичный образцах патентов от пациентов, имеющих ОМЛ, с помощью проточной цитометрии с использованием коммерчески доступного антитела (клон HIM3-4, eBioscience; или клон WM53, Biolegend). Результаты, представленные в настоящем документе, демонстрируют, что CD33 экспрессировался во многих первичных образцах пациентов с ОМЛ (ОМЛ-бласты гейтировали с использованием стандартных характеристик боковое светорассеяниеlow CD45dim); n=35-46 на группу).
Схематическое представление конструктов CAR, использованных в данном примере, показано на фигуре 3. Все они представляют собой CAR второго поколения, использующие сигнализацию 41BB и CD3-дзета. scFv CART33 получали из клона MY9-6.
In vitro активность CART33
Эксперимент, описанный в настоящем документе, измерял CART33-опосредованную дегрануляцию T-клеток. Трансдуцированные CART33 и UTD T-клетки инкубировали с линией CD33+ клеток MOLM14 и контрольной линией клеток ОЛЛ NALM6, и измеряли дегрануляцию по CD107a с помощью проточной цитометрии. Экспрессия как мышиных, так и гуманизированных конструктов CART33 выявила специфическую дегрануляцию в присутствии MOLM14 (P<0,001) (фиг. 4).
Эксперимент, описанный в настоящем документе, измерял производство цитокинов в ответ на CART33. Как экспрессирующие гуманизированные, так и мышиные CART33 T-клетки, производили цитокин после инкубации с MOLM14 (фиг. 5). Внутриклеточные некроз опухоли-альфа и интерферон-гамма измеряли с помощью проточной цитометрии.
Эксперимент, описанный в настоящем документе, измерял пролиферацию экспрессирующих CART123 и CART33 T-клеток. Пролиферацию гуманизированных CART33 и мышиных CART33 измеряли в ответ на MOLM14. Результаты показаны на фигуре 6. T-клетки помечали CFSE и инкубировали в контрольных условиях или с MOLM14 в течение 120 часов. Непролиферирующие T-клетки сохраняли один яркий пик экспрессии CFSE (зеленая флуоресценция в канале FITC), тогда как пролиферирующие CART-клетки имели более одного пика CFSE и экспрессию, которая была ниже исходного уровня.
Эксперимент, описанный в настоящем документе, измерял специфический киллинг CART123, гуманизированных CART33 и мышиных CART33-экспрессирующих T-клеток. T-клетки инкубировали с MOLM14 или NALM6 (контроль) в течение 24 часов. Экспрессия huCART33 приводила к значительно большему специфическому киллингу по сравнению с мышиными CART33 при низких отношениях E:T (фиг. 7). Киллинг измеряли с использованием основанного на проточной цитометрии анализа после CFSE-мечения опухолевых клеток (например, Cao et al, Cytometry Part A 2010;7&A:534-545) или посредством инкубирования CART-клеток с экспрессирующими люциферазу клетками-мишенями при различных отношениях эффектор-мишень в течение вплоть до 20 часов, за чем следовала оптическая визуализация фотонов, испускаемых клетками-мишенями. В данном последнем анализе количество живых клеток-мишеней положительно коррелирует с количеством испускаемых фотонов.
Профиль цитокинов гуманизированных CART33, мышиных CART33, CART123-экспрессирующих T-клеток определяли после инкубации в течение 24 часов с одними только T-клеточными средами, PMA/иономицином, MOLM14 или NALM6 (контрольная линия клеток) (фиг. 8) с использованием 30-плексного набора Luminex (Invitrogen).
CART33 (шарнир IgG4) и CART33 (шарнир CD8) имеют эквивалентную in vitro активность
Эксперимент, описанный в настоящем документе, измерял дегрануляцию. CART33 (шарнир IgG4), CART33 (шарнир CD8), CART123 и нетрансдуцированные T-клетки инкубировали с линией CD33+ клеток MOLM14, и измеряли дегрануляцию по CD107a с помощью проточной цитометрии. Результаты, представленные в настоящем документе, демонстрируют, что оба конструкта CART33 подвергались специфической дегрануляции в присутствии MOLM14 (фиг. 8).
Эксперимент, описанный в настоящем документе, измерял производство цитокинов. Оба конструкта CART33 и CART123 специфически индуцировали производство цитокинов после инкубации с линией клеток MOLM14 (фиг. 9). Внутриклеточный некроз опухоли-альфа, MIP1a и интерферон-гамма измеряли с помощью проточной цитометрии.
Эксперимент, описанный в настоящем документе, измерял пролиферацию контрольных нетрансдуцированных, экспрессирующих CART33 (шарнир IgG4), CART33 (шарнир CD8) или CART123 T-клеток в ответ на MOLM14 (фиг. 10). T-клетки помечали CFSE и инкубировали с MOLM14 в течение 120 часов. Пролиферацию измеряли с помощью разбавления CFSE. Непролиферирующие T-клетки ярко окрашиваются CFSE и демонстрируют один пик. Одно деление клеток видно как два пика, два деления клеток как три пика и так далее.
Эквивалентный in vivo противоопухолевый эффект CART33-CD8H, CART33-IgG4H и CART123
Для сравнения in vivo противоопухолевого эффекта CART33-CD8H, CART33-IgG4H и CART123 NOD-SCID- мышей с нокаутом общей гамма-цепи (NSG) инъецировали линией клеток ОМЛ MOLM14 1×106 в/в и визуализировали в отношении приживления через 6 дней. На день 7 мышей обрабатывали T-клетками, экспрессирующими CART33 (шарнир IgG4), CART33 (шарнир CD8), CART123, или контрольным носителем (нетрансдуцированными клетками). Общее количество инъецированных T-клеток составляло 2×106 в/в. Затем мышей подвергали серии еженедельных визуализаций для оценки опухолевой нагрузки (фиг. 11).
Данные по опухолевой нагрузке с течением времени получали с помощью биолюминесцентной визуализации (BLI). Данные из одного эксперимента (n=5 на группу), отражающего 4 независимых эксперимента на мышах, показаны на фигуре 12. Результаты, представленные в настоящем документе, демонстрируют эквивалентный in vivo противоопухолевый эффект T-клеток CART33-CD8H, CART33-IgG4H и CART123.
CART33 и CART123 производят эквивалентную эрадикацию первичного ОМЛ in vivo
Для сравнения CART33 и CART123 при эрадикации первичного ОМЛ in vivo мышей NSG, трансгенных по человеческим цитокинам IL3/GM-CSF/SCF (мышей NSGS) инъецировали образцом первичного ОМЛ 5×106 в/в. Приживление подтверждали с помощью ретроорбитального кровопускания через 2-4 недели, и затем мышей обрабатывали с помощью CART33, CART123 или контрольного носителя (нетрансдуцированных клеток). Общее количество инъецированных T-клеток составляло 1×105 в/в. Затем мышей подвергали серии ретроорбитальных кровопусканий для оценки нагрузки ОМЛ (фиг. 13).
Анализ периферической крови мышей, обработанных UTD, CART33 или CART123, выполняли на исходном уровне, на день 14 и день +70 (фиг. 14). Кровь получали из ретроорбитального синуса анестезированных мышей с использованием стандартных методов. Затем стандартный объем крови 50-60 мкл лизировали в 1 мл лизирующего буфера ACK. Затем кровь окрашивали с использованием флуоресцентно меченых антител, и присутствие ОМЛ или CART-клеток детектировали с использованием проточной цитометрии. ОМЛ не детектировали у мышей, обработанных CART33 или CART123.
Нагрузку заболевания измеряли в бластах на мкл в ретроорбитальных кровопусканиях в различных временных точках (фиг. 15).
Измеряли выживаемость мышей, обработанных CART33, CART123 или UTD (p<0,001, когда или CART33, или CART123 сравнивают с UTD) (фиг. 16). Результаты, представленные в настоящем документе, демонстрируют, что CART33 и CART123 производят эквивалентную эрадикацию первичного ОМЛ in vivo.
Токсичность клеток CART33 для гематопоэтических стволовых клеток
Для определения токсичности клеток CART33 для гематопоэтических стволовых клеток мышам с гуманизированной иммунной системой (HIS) делали ретроорбитальное кровопускание через 6-8 недель после инъекции человеческих CD34+ клеток, полученных из фетальной печени, для подтверждения приживления человеческих клеток. Затем мышей обрабатывали с помощью или CART33, или UTD (по 1×106 клеток) и затем подвергали серии еженедельных ретроорбитальных кровопусканий. Затем мышей умерщвляли на день 28, и органы отбирали и анализировали (фиг. 17).
Выполняли анализ с помощью проточной цитометрии периферической крови (из ретроорбитального кровопускания) с дня 28 при завершении эксперимента (фиг. 18). Статистический анализ анализа на день 28 периферической крови мышей, обработанных CART33, UTD или не обработанных (n=5), показал, что CART33 приводил к значительной токсичности на моноцитах и CD33+ клетках миелоидной линии дифференцировки при относительном щажении B-клеток и тромбоцитов (фиг. 19). Анализ костного мозга с помощью проточной цитометрии на день 28 показал, что обработка с помощью CART33 приводила к значительному уменьшению количества миелоидных предшественников (CD34+CD38+) и гематопоэтических стволовых клеток (CD34+CD38-), гейтированных по синглетам, huCD45dim, отрицательных по линии дифференцировки (фиг. 20).
Срезы бедра получали от мышей на день 28 после обработки UTD T-клетками или клетками CART33. Проводили окрашивание huCD45 и CD34 с помощью IHC (фиг. 21). Нет различий в huCD45 между контрольными T-клетками и CART33, хотя обе эти группы показывают меньшее окрашивание huCD45, вероятно в связи с эффектом взаимодействия аллогенных человеческих и античеловеческих белков. Имело место специфическое уменьшение количества CD34+ клеток у мышей, обработанных CART33. Результаты отражают два эксперимента.
CART33 и CART123 производят эквивалентную гематопоэтическую токсичность in vivo
Для определения гематопоэтической токсичности CART33 и CART123 in vivo мыши NSGS получали бусульфан и/п и затем на следующий день 2×106 клеток без-T-клеточного костного мозга от нормального донора. Приживление подтверждали по анализу периферической крови с помощью проточной цитометрии через 4 недели, и затем мышей обрабатывали с помощью 1×106 аутологичных T-клеток, трансдуцированных CART33, CART123 или UTD. Затем мышей подвергали ретроорбитальному кровопусканию на день 7 и день 14 и умерщвляли для некропсии на день 14 (фиг. 22).
Выполняли анализ костного мозга с помощью проточной цитометрии на день 28. Обработка с помощью CART33 и CART123 приводила к значительному уменьшению количества миелоидных предшественников (CD34+CD38+) и гематопоэтических стволовых клеток (CD34+CD38-), гейтированных на huCD45dim, Lin-. Результаты отражают два эксперимента (фиг. 23). Результаты, представленные в настоящем документе, подтверждают, что CART33 и CART123 производят эквивалентную гематопоэтическую токсичность in vivo.
Обогащенный CD34 КМ пациентов с МДС инкубировали с UTD, CART33 (шарнир IgG4), CART33 (шарнир CD8) или CART123. Имело место уменьшение количества клеток CD45dimCD34+ в образцах, обработанных с помощью CART33 или CART123 (фиг. 24). Результаты, представленные в настоящем документе, демонстрируют, что CART33 и CART123 являются цитотоксическими для клеток костного мозга при миелодиспластическом синдроме (МДС).
Дополнительный эксперименты для проверки активности гуманизированных CART33, описаны в примерах 5-6.
Пример 2: Конструкты CAR
Полностью человеческие анти-CD33 одноцепочечные вариабельные фрагменты (scFv) создавали и клонировали в лентивирусный вектор экспрессии с внутриклеточной CD3-дзета-цепью и внутриклеточным костимулирующим доменом из 4-1BB, и давали им названия, приведенные в таблице 7 (которая приведена в подробном описании).
Порядок, в котором домены VL и VH появляются в scFv, был различным (то есть, ориентация VL-VH или VH-VL), и или три, или четыре копии субъединицы "G4S" (SEQ ID NO: 25), где каждая субъединица содержит последовательность GGGGS (SEQ ID NO: 25) (например, (G4S)3 (SEQ ID NO: 28) или (G4S)4(SEQ ID NO: 27)), соединяют вариабельные домены для создания всего домена scFv, как показано в таблице 1.
Последовательности человеческих фрагменов scFv (SEQ ID NO: 39-83, включающие в себя необязательную лидерную последовательность) приведены в настоящем документе в таблице 8 (в подробном описании). Последовательности человеческих фрагментов scFv без лидерной последовательности приведены в настоящем документе в таблице 9 (SEQ ID NO: 255-261 для нуклеотидных последовательностей и SEQ ID NO: 262-268 для аминокислотных последовательностей) в подробном описании.
Все эти клоны содержали замену остатков Q/K в сигнальном домене костимулирующего домена, происходящего от CD3-дзета-цепи. Фрагменты scFv CAR затем клонировали в лентивирусные векторы для создания полноразмерного конструкта CAR в одной кодирующей рамке и с использованием промотора EF1-альфа для экспрессии (SEQ ID NO: 11).
Последовательности конструктов CAR и последовательности их доменов приведены в подробном описании. Анализ конструктов с человеческим CAR проводили, как описано в примере 4.
Пример 3: Последовательности гуманизированных CART
Нуклеотидная последовательность мышиного анти-CD33 IgG4 2213 (SEQ ID NO: 138)
GTGCACGAGTGGGTTACATCGAACTGGATCTCAACAGCGGTAAGATCCTTGAGAGTTTTCGCCCCGAAGAACGTTTTCCAATGATGAGCACTTTTAAAGTTCTGCTATGTGGCGCGGTATTATCCCGTATTGACGCCGGGCAAGAGCAACTCGGTCGCCGCATACACTATTCTCAGAATGACTTGGTTGAGTACTCACCAGTCACAGAAAAGCATCTTACGGATGGCATGACAGTAAGAGAATTATGCAGTGCTGCCATAACCATGAGTGATAACACTGCGGCCAACTTACTTCTGACAACGATCGGAGGACCGAAGGAGCTAACCGCTTTTTTGCACAACATGGGGGATCATGTAACTCGCCTTGATCGTTGGGAACCGGAGCTGAATGAAGCCATACCAAACGACGAGCGTGACACCACGATGCCTGTAGCAATGGCAACAACGTTGCGCAAACTATTAACTGGCGAACTACTTACTCTAGCTTCCCGGCAACAATTAATAGACTGGATGGAGGCGGATAAAGTTGCAGGACCACTTCTGCGCTCGGCCCTTCCGGCTGGCTGGTTTATTGCTGATAAATCTGGAGCCGGTGAGCGTGGGTCTCGCGGTATCATTGCAGCACTGGGGCCAGATGGTAAGCCCTCCCGTATCGTAGTTATCTACACGACGGGGAGTCAGGCAACTATGGATGAACGAAATAGACAGATCGCTGAGATAGGTGCCTCACTGATTAAGCATTGGTAACTGTCAGACCAAGTTTACTCATATATACTTTAGATTGATTTAAAACTTCATTTTTAATTTAAAAGGATCTAGGTGAAGATCCTTTTTGATAATCTCATGACCAAAATCCCTTAACGTGAGTTTTCGTTCCACTGAGCGTCAGACCCCGTAGAAAAGATCAAAGGATCTTCTTGAGATCCTTTTTTTCTGCGCGTAATCTGCTGCTTGCAAACAAAAAAACCACCGCTACCAGCGGTGGTTTGTTTGCCGGATCAAGAGCTACCAACTCTTTTTCCGAAGGTAACTGGCTTCAGCAGAGCGCAGATACCAAATACTGTTCTTCTAGTGTAGCCGTAGTTAGGCCACCACTTCAAGAACTCTGTAGCACCGCCTACATACCTCGCTCTGCTAATCCTGTTACCAGTGGCTGCTGCCAGTGGCGATAAGTCGTGTCTTACCGGGTTGGACTCAAGACGATAGTTACCGGATAAGGCGCAGCGGTCGGGCTGAACGGGGGGTTCGTGCACACAGCCCAGCTTGGAGCGAACGACCTACACCGAACTGAGATACCTACAGCGTGAGCTATGAGAAAGCGCCACGCTTCCCGAAGGGAGAAAGGCGGACAGGTATCCGGTAAGCGGCAGGGTCGGAACAGGAGAGCGCACGAGGGAGCTTCCAGGGGGAAACGCCTGGTATCTTTATAGTCCTGTCGGGTTTCGCCACCTCTGACTTGAGCGTCGATTTTTGTGATGCTCGTCAGGGGGGCGGAGCCTATGGAAAAACGCCAGCAACGCGGCCTTTTTACGGTTCCTGGCCTTTTGCTGGCCTTTTGCTCACATGTTCTTTCCTGCGTTATCCCCTGATTCTGTGGATAACCGTATTACCGCCTTTGAGTGAGCTGATACCGCTCGCCGCAGCCGAACGACCGAGCGCAGCGAGTCAGTGAGCGAGGAAGCGGAAGAGCGCCCAATACGCAAACCGCCTCTCCCCGCGCGTTGGCCGATTCATTAATGCAGCTGGCACGACAGGTTTCCCGACTGGAAAGCGGGCAGTGAGCGCAACGCAATTAATGTGAGTTAGCTCACTCATTAGGCACCCCAGGCTTTACACTTTATGCTTCCGGCTCGTATGTTGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGCTATGACCATGATTACGCCAAGCGCGCAATTAACCCTCACTAAAGGGAACAAAAGCTGGAGCTGCAAGCTTAATGTAGTCTTATGCAATACTCTTGTAGTCTTGCAACATGGTAACGATGAGTTAGCAACATGCCTTACAAGGAGAGAAAAAGCACCGTGCATGCCGATTGGTGGAAGTAAGGTGGTACGATCGTGCCTTATTAGGAAGGCAACAGACGGGTCTGACATGGATTGGACGAACCACTGAATTGCCGCATTGCAGAGATATTGTATTTAAGTGCCTAGCTCGATACATAAACGGGTCTCTCTGGTTAGACCAGATCTGAGCCTGGGAGCTCTCTGGCTAACTAGGGAACCCACTGCTTAAGCCTCAATAAAGCTTGCCTTGAGTGCTTCAAGTAGTGTGTGCCCGTCTGTTGTGTGACTCTGGTAACTAGAGATCCCTCAGACCCTTTTAGTCAGTGTGGAAAATCTCTAGCAGTGGCGCCCGAACAGGGACTTGAAAGCGAAAGGGAAACCAGAGGAGCTCTCTCGACGCAGGACTCGGCTTGCTGAAGCGCGCACGGCAAGAGGCGAGGGGCGGCGACTGGTGAGTACGCCAAAAATTTTGACTAGCGGAGGCTAGAAGGAGAGAGATGGGTGCGAGAGCGTCAGTATTAAGCGGGGGAGAATTAGATCGCGATGGGAAAAAATTCGGTTAAGGCCAGGGGGAAAGAAAAAATATAAATTAAAACATATAGTATGGGCAAGCAGGGAGCTAGAACGATTCGCAGTTAATCCTGGCCTGTTAGAAACATCAGAAGGCTGTAGACAAATACTGGGACAGCTACAACCATCCCTTCAGACAGGATCAGAAGAACTTAGATCATTATATAATACAGTAGCAACCCTCTATTGTGTGCATCAAAGGATAGAGATAAAAGACACCAAGGAAGCTTTAGACAAGATAGAGGAAGAGCAAAACAAAAGTAAGACCACCGCACAGCAAGCGGCCGCTGATCTTCAGACCTGGAGGAGGAGATATGAGGGACAATTGGAGAAGTGAATTATATAAATATAAAGTAGTAAAAATTGAACCATTAGGAGTAGCACCCACCAAGGCAAAGAGAAGAGTGGTGCAGAGAGAAAAAAGAGCAGTGGGAATAGGAGCTTTGTTCCTTGGGTTCTTGGGAGCAGCAGGAAGCACTATGGGCGCAGCGTCAATGACGCTGACGGTACAGGCCAGACAATTATTGTCTGGTATAGTGCAGCAGCAGAACAATTTGCTGAGGGCTATTGAGGCGCAACAGCATCTGTTGCAACTCACAGTCTGGGGCATCAAGCAGCTCCAGGCAAGAATCCTGGCTGTGGAAAGATACCTAAAGGATCAACAGCTCCTGGGGATTTGGGGTTGCTCTGGAAAACTCATTTGCACCACTGCTGTGCCTTGGAATGCTAGTTGGAGTAATAAATCTCTGGAACAGATTTGGAATCACACGACCTGGATGGAGTGGGACAGAGAAATTAACAATTACACAAGCTTAATACACTCCTTAATTGAAGAATCGCAAAACCAGCAAGAAAAGAATGAACAAGAATTATTGGAATTAGATAAATGGGCAAGTTTGTGGAATTGGTTTAACATAACAAATTGGCTGTGGTATATAAAATTATTCATAATGATAGTAGGAGGCTTGGTAGGTTTAAGAATAGTTTTTGCTGTACTTTCTATAGTGAATAGAGTTAGGCAGGGATATTCACCATTATCGTTTCAGACCCACCTCCCAACCCCGAGGGGACCCGACAGGCCCGAAGGAATAGAAGAAGAAGGTGGAGAGAGAGACAGAGACAGATCCATTCGATTAGTGAACGGATCTCGACGGTATCGATTAGACTGTAGCCCAGGAATATGGCAGCTAGATTGTACACATTTAGAAGGAAAAGTTATCTTGGTAGCAGTTCATGTAGCCAGTGGATATATAGAAGCAGAAGTAATTCCAGCAGAGACAGGGCAAGAAACAGCATACTTCCTCTTAAAATTAGCAGGAAGATGGCCAGTAAAAACAGTACATACAGACAATGGCAGCAATTTCACCAGTACTACAGTTAAGGCCGCCTGTTGGTGGGCGGGGATCAAGCAGGAATTTGGCATTCCCTACAATCCCCAAAGTCAAGGAGTAATAGAATCTATGAATAAAGAATTAAAGAAAATTATAGGACAGGTAAGAGATCAGGCTGAACATCTTAAGACAGCAGTACAAATGGCAGTATTCATCCACAATTTTAAAAGAAAAGGGGGGATTGGGGGGTACAGTGCAGGGGAAAGAATAGTAGACATAATAGCAACAGACATACAAACTAAAGAATTACAAAAACAAATTACAAAAATTCAAAATTTTCGGGTTTATTACAGGGACAGCAGAGATCCAGTTTGGCTGCATACGCGTCGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACTGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGTGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGAGCTAGCTCTAGAGCCACCATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCCGGATCCAACATCATGCTGACCCAGAGCCCTAGCAGCCTGGCCGTGTCTGCCGGCGAGAAAGTGACCATGAGCTGCAAGAGCAGCCAGAGCGTGTTCTTCAGCAGCTCCCAGAAGAACTACCTGGCCTGGTATCAGCAGATCCCCGGCCAGAGCCCCAAGCTGCTGATCTACTGGGCCAGCACCAGAGAAAGCGGCGTGCCCGATAGATTCACCGGCAGCGGCTCTGGCACCGACTTCACCCTGACAATCAGCAGCGTGCAGAGCGAGGACCTGGCCATCTACTACTGCCACCAGTACCTGAGCAGCCGGACCTTTGGCGGAGGCACCAAGCTGGAAATCAAGAGAGGCGGCGGAGGCTCAGGCGGAGGCGGATCTAGTGGCGGAGGATCTCAGGTGCAGCTGCAGCAGCCAGGCGCCGAGGTCGTGAAACCTGGCGCCTCTGTGAAGATGTCCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTACATCCACTGGATCAAGCAGACCCCTGGACAGGGCCTGGAATGGGTGGGAGTGATCTACCCCGGCAACGACGACATCAGCTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGCCGACAAGTCTAGCACCACCGCCTACATGCAGCTGTCCAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCAGAGAAGTGCGGCTGCGGTACTTCGATGTGTGGGGAGCCGGCACCACCGTGACCGTGTCATCTTCCGGAGAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATGATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGCAAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAAGTCGACAATCAACCTCTGGATTACAAAATTTGTGAAAGATTGACTGGTATTCTTAACTATGTTGCTCCTTTTACGCTATGTGGATACGCTGCTTTAATGCCTTTGTATCATGCTATTGCTTCCCGTATGGCTTTCATTTTCTCCTCCTTGTATAAATCCTGGTTGCTGTCTCTTTATGAGGAGTTGTGGCCCGTTGTCAGGCAACGTGGCGTGGTGTGCACTGTGTTTGCTGACGCAACCCCCACTGGTTGGGGCATTGCCACCACCTGTCAGCTCCTTTCCGGGACTTTCGCTTTCCCCCTCCCTATTGCCACGGCGGAACTCATCGCCGCCTGCCTTGCCCGCTGCTGGACAGGGGCTCGGCTGTTGGGCACTGACAATTCCGTGGTGTTGTCGGGGAAGCTGACGTCCTTTCCTTGGCTGCTCGCCTGTGTTGCCACCTGGATTCTGCGCGGGACGTCCTTCTGCTACGTCCCTTCGGCCCTCAATCCAGCGGACCTTCCTTCCCGCGGCCTGCTGCCGGCTCTGCGGCCTCTTCCGCGTCTTCGCCTTCGCCCTCAGACGAGTCGGATCTCCCTTTGGGCCGCCTCCCCGCCTGGAATTCGAGCTCGGTACCTTTAAGACCAATGACTTACAAGGCAGCTGTAGATCTTAGCCACTTTTTAAAAGAAAAGGGGGGACTGGAAGGGCTAATTCACTCCCAACGAAGACAAGATCTGCTTTTTGCTTGTACTGGGTCTCTCTGGTTAGACCAGATCTGAGCCTGGGAGCTCTCTGGCTAACTAGGGAACCCACTGCTTAAGCCTCAATAAAGCTTGCCTTGAGTGCTTCAAGTAGTGTGTGCCCGTCTGTTGTGTGACTCTGGTAACTAGAGATCCCTCAGACCCTTTTAGTCAGTGTGGAAAATCTCTAGCAGTAGTAGTTCATGTCATCTTATTATTCAGTATTTATAACTTGCAAAGAAATGAATATCAGAGAGTGAGAGGAACTTGTTTATTGCAGCTTATAATGGTTACAAATAAAGCAATAGCATCACAAATTTCACAAATAAAGCATTTTTTTCACTGCATTCTAGTTGTGGTTTGTCCAAACTCATCAATGTATCTTATCATGTCTGGCTCTAGCTATCCCGCCCCTAACTCCGCCCAGTTCCGCCCATTCTCCGCCCCATGGCTGACTAATTTTTTTTATTTATGCAGAGGCCGAGGCCGCCTCGGCCTCTGAGCTATTCCAGAAGTAGTGAGGAGGCTTTTTTGGAGGCCTAGCTAGGGACGTACCCAATTCGCCCTATAGTGAGTCGTATTACGCGCGCTCACTGGCCGTCGTTTTACAACGTCGTGACTGGGAAAACCCTGGCGTTACCCAACTTAATCGCCTTGCAGCACATCCCCCTTTCGCCAGCTGGCGTAATAGCGAAGAGGCCCGCACCGATCGCCCTTCCCAACAGTTGCGCAGCCTGAATGGCGAATGGGACGCGCCCTGTAGCGGCGCATTAAGCGCGGCGGGTGTGGTGGTTACGCGCAGCGTGACCGCTACACTTGCCAGCGCCCTAGCGCCCGCTCCTTTCGCTTTCTTCCCTTCCTTTCTCGCCACGTTCGCCGGCTTTCCCCGTCAAGCTCTAAATCGGGGGCTCCCTTTAGGGTTCCGATTTAGTGCTTTACGGCACCTCGACCCCAAAAAACTTGATTAGGGTGATGGTTCACGTAGTGGGCCATCGCCCTGATAGACGGTTTTTCGCCCTTTGACGTTGGAGTCCACGTTCTTTAATAGTGGACTCTTGTTCCAAACTGGAACAACACTCAACCCTATCTCGGTCTATTCTTTTGATTTATAAGGGATTTTGCCGATTTCGGCCTATTGGTTAAAAAATGAGCTGATTTAACAAAAATTTAACGCGAATTTTAACAAAATATTAACGCTTACAATTTAGGTGGCACTTTTCGGGGAAATGTGCGCGGAACCCCTATTTGTTTATTTTTCTAAATACATTCAAATATGTATCCGCTCATGAGACAATAACCCTGATAAATGCTTCAATAATATTGAAAAAGGAAGAGTATGAGTATTCAACATTTCCGTGTCGCCCTTATTCCCTTTTTTGCGGCATTTTGCCTTCCTGTTTTTGCTCACCCAGAAACGCTGGTGAAAGTAAAAGATGCTGAAGATCAGTTGG
Нуклеотидная последовательность CAR 2213 (SEQ ID NO: 139)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCCGGATCCAACATCATGCTGACCCAGAGCCCTAGCAGCCTGGCCGTGTCTGCCGGCGAGAAAGTGACCATGAGCTGCAAGAGCAGCCAGAGCGTGTTCTTCAGCAGCTCCCAGAAGAACTACCTGGCCTGGTATCAGCAGATCCCCGGCCAGAGCCCCAAGCTGCTGATCTACTGGGCCAGCACCAGAGAAAGCGGCGTGCCCGATAGATTCACCGGCAGCGGCTCTGGCACCGACTTCACCCTGACAATCAGCAGCGTGCAGAGCGAGGACCTGGCCATCTACTACTGCCACCAGTACCTGAGCAGCCGGACCTTTGGCGGAGGCACCAAGCTGGAAATCAAGAGAGGCGGCGGAGGCTCAGGCGGAGGCGGATCTAGTGGCGGAGGATCTCAGGTGCAGCTGCAGCAGCCAGGCGCCGAGGTCGTGAAACCTGGCGCCTCTGTGAAGATGTCCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTACATCCACTGGATCAAGCAGACCCCTGGACAGGGCCTGGAATGGGTGGGAGTGATCTACCCCGGCAACGACGACATCAGCTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGCCGACAAGTCTAGCACCACCGCCTACATGCAGCTGTCCAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCAGAGAAGTGCGGCTGCGGTACTTCGATGTGTGGGGAGCCGGCACCACCGTGACCGTGTCATCTTCCGGAGAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATGATCTACATC
TGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGCAAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
Аминокислотная последовательность CAR 2213 (SEQ ID NO: 140)
MALPVTALLLPLALLLHAARPGSNIMLTQSPSSLAVSAGEKVTMSCKSSQSVFFSSSQKNYLAWYQQIPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQSEDLAIYYCHQYLSSRTFGGGTKLEIKRGGGGSGGGGSSGGGSQVQLQQPGAEVVKPGASVKMSCKASGYTFTSYYIHWIKQTPGQGLEWVGVIYPGNDDISYNQKFKGKATLTADKSSTTAYMQLSSLTSEDSAVYYCAREVRLRYFDVWGAGTTVTVSSSGESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKMIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
Нуклеотидная последовательность scFv 2213 (SEQ ID NO: 141)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCCGGATCCAACATCATGCTGACCCAGAGCCCTAGCAGCCTGGCCGTGTCTGCCGGCGAGAAAGTGACCATGAGCTGCAAGAGCAGCCAGAGCGTGTTCTTCAGCAGCTCCCAGAAGAACTACCTGGCCTGGTATCAGCAGATCCCCGGCCAGAGCCCCAAGCTGCTGATCTACTGGGCCAGCACCAGAGAAAGCGGCGTGCCCGATAGATTCACCGGCAGCGGCTCTGGCACCGACTTCACCCTGACAATCAGCAGCGTGCAGAGCGAGGACCTGGCCATCTACTACTGCCACCAGTACCTGAGCAGCCGGACCTTTGGCGGAGGCACCAAGCTGGAAATCAAGAGAGGCGGCGGAGGCTCAGGCGGAGGCGGATCTAGTGGCGGAGGATCTCAGGTGCAGCTGCAGCAGCCAGGCGCCGAGGTCGTGAAACCTGGCGCCTCTGTGAAGATGTCCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTACATCCACTGGATCAAGCAGACCCCTGGACAGGGCCTGGAATGGGTGGGAGTGATCTACCCCGGCAACGACGACATCAGCTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGCCGACAAGTCTAGCACCACCGCCTACATGCAGCTGTCCAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCAGAGAAGTGCGGCTGCGGTACTTCGATGTGTGGGGAGCCGGCACCACCGTGACCGTGTCATCT
Аминокислотная последовательность scFv 2213 (SEQ ID NO: 142)
MALPVTALLLPLALLLHAARPGSNIMLTQSPSSLAVSAGEKVTMSCKSSQSVFFSSSQKNYLAWYQQIPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQSEDLAIYYCHQYLSSRTFGGGTKLEIKRGGGGSGGGGSSGGGSQVQLQQPGAEVVKPGASVKMSCKASGYTFTSYYIHWIKQTPGQGLEWVGVIYPGNDDISYNQKFKGKATLTADKSSTTAYMQLSSLTSEDSAVYYCAREVRLRYFDVWGAGTTVTVSS
Нуклеотидная последовательность гуманизированного анти-CD33 IgG4H 2218 (SEQ ID NO: 143)
GTGCACGAGTGGGTTACATCGAACTGGATCTCAACAGCGGTAAGATCCTTGAGAGTTTTCGCCCCGAAGAACGTTTTCCAATGATGAGCACTTTTAAAGTTCTGCTATGTGGCGCGGTATTATCCCGTATTGACGCCGGGCAAGAGCAACTCGGTCGCCGCATACACTATTCTCAGAATGACTTGGTTGAGTACTCACCAGTCACAGAAAAGCATCTTACGGATGGCATGACAGTAAGAGAATTATGCAGTGCTGCCATAACCATGAGTGATAACACTGCGGCCAACTTACTTCTGACAACGATCGGAGGACCGAAGGAGCTAACCGCTTTTTTGCACAACATGGGGGATCATGTAACTCGCCTTGATCGTTGGGAACCGGAGCTGAATGAAGCCATACCAAACGACGAGCGTGACACCACGATGCCTGTAGCAATGGCAACAACGTTGCGCAAACTATTAACTGGCGAACTACTTACTCTAGCTTCCCGGCAACAATTAATAGACTGGATGGAGGCGGATAAAGTTGCAGGACCACTTCTGCGCTCGGCCCTTCCGGCTGGCTGGTTTATTGCTGATAAATCTGGAGCCGGTGAGCGTGGGTCTCGCGGTATCATTGCAGCACTGGGGCCAGATGGTAAGCCCTCCCGTATCGTAGTTATCTACACGACGGGGAGTCAGGCAACTATGGATGAACGAAATAGACAGATCGCTGAGATAGGTGCCTCACTGATTAAGCATTGGTAACTGTCAGACCAAGTTTACTCATATATACTTTAGATTGATTTAAAACTTCATTTTTAATTTAAAAGGATCTAGGTGAAGATCCTTTTTGATAATCTCATGACCAAAATCCCTTAACGTGAGTTTTCGTTCCACTGAGCGTCAGACCCCGTAGAAAAGATCAAAGGATCTTCTTGAGATCCTTTTTTTCTGCGCGTAATCTGCTGCTTGCAAACAAAAAAACCACCGCTACCAGCGGTGGTTTGTTTGCCGGATCAAGAGCTACCAACTCTTTTTCCGAAGGTAACTGGCTTCAGCAGAGCGCAGATACCAAATACTGTTCTTCTAGTGTAGCCGTAGTTAGGCCACCACTTCAAGAACTCTGTAGCACCGCCTACATACCTCGCTCTGCTAATCCTGTTACCAGTGGCTGCTGCCAGTGGCGATAAGTCGTGTCTTACCGGGTTGGACTCAAGACGATAGTTACCGGATAAGGCGCAGCGGTCGGGCTGAACGGGGGGTTCGTGCACACAGCCCAGCTTGGAGCGAACGACCTACACCGAACTGAGATACCTACAGCGTGAGCTATGAGAAAGCGCCACGCTTCCCGAAGGGAGAAAGGCGGACAGGTATCCGGTAAGCGGCAGGGTCGGAACAGGAGAGCGCACGAGGGAGCTTCCAGGGGGAAACGCCTGGTATCTTTATAGTCCTGTCGGGTTTCGCCACCTCTGACTTGAGCGTCGATTTTTGTGATGCTCGTCAGGGGGGCGGAGCCTATGGAAAAACGCCAGCAACGCGGCCTTTTTACGGTTCCTGGCCTTTTGCTGGCCTTTTGCTCACATGTTCTTTCCTGCGTTATCCCCTGATTCTGTGGATAACCGTATTACCGCCTTTGAGTGAGCTGATACCGCTCGCCGCAGCCGAACGACCGAGCGCAGCGAGTCAGTGAGCGAGGAAGCGGAAGAGCGCCCAATACGCAAACCGCCTCTCCCCGCGCGTTGGCCGATTCATTAATGCAGCTGGCACGACAGGTTTCCCGACTGGAAAGCGGGCAGTGAGCGCAACGCAATTAATGTGAGTTAGCTCACTCATTAGGCACCCCAGGCTTTACACTTTATGCTTCCGGCTCGTATGTTGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGCTATGACCATGATTACGCCAAGCGCGCAATTAACCCTCACTAAAGGGAACAAAAGCTGGAGCTGCAAGCTTAATGTAGTCTTATGCAATACTCTTGTAGTCTTGCAACATGGTAACGATGAGTTAGCAACATGCCTTACAAGGAGAGAAAAAGCACCGTGCATGCCGATTGGTGGAAGTAAGGTGGTACGATCGTGCCTTATTAGGAAGGCAACAGACGGGTCTGACATGGATTGGACGAACCACTGAATTGCCGCATTGCAGAGATATTGTATTTAAGTGCCTAGCTCGATACATAAACGGGTCTCTCTGGTTAGACCAGATCTGAGCCTGGGAGCTCTCTGGCTAACTAGGGAACCCACTGCTTAAGCCTCAATAAAGCTTGCCTTGAGTGCTTCAAGTAGTGTGTGCCCGTCTGTTGTGTGACTCTGGTAACTAGAGATCCCTCAGACCCTTTTAGTCAGTGTGGAAAATCTCTAGCAGTGGCGCCCGAACAGGGACTTGAAAGCGAAAGGGAAACCAGAGGAGCTCTCTCGACGCAGGACTCGGCTTGCTGAAGCGCGCACGGCAAGAGGCGAGGGGCGGCGACTGGTGAGTACGCCAAAAATTTTGACTAGCGGAGGCTAGAAGGAGAGAGATGGGTGCGAGAGCGTCAGTATTAAGCGGGGGAGAATTAGATCGCGATGGGAAAAAATTCGGTTAAGGCCAGGGGGAAAGAAAAAATATAAATTAAAACATATAGTATGGGCAAGCAGGGAGCTAGAACGATTCGCAGTTAATCCTGGCCTGTTAGAAACATCAGAAGGCTGTAGACAAATACTGGGACAGCTACAACCATCCCTTCAGACAGGATCAGAAGAACTTAGATCATTATATAATACAGTAGCAACCCTCTATTGTGTGCATCAAAGGATAGAGATAAAAGACACCAAGGAAGCTTTAGACAAGATAGAGGAAGAGCAAAACAAAAGTAAGACCACCGCACAGCAAGCGGCCGCTGATCTTCAGACCTGGAGGAGGAGATATGAGGGACAATTGGAGAAGTGAATTATATAAATATAAAGTAGTAAAAATTGAACCATTAGGAGTAGCACCCACCAAGGCAAAGAGAAGAGTGGTGCAGAGAGAAAAAAGAGCAGTGGGAATAGGAGCTTTGTTCCTTGGGTTCTTGGGAGCAGCAGGAAGCACTATGGGCGCAGCGTCAATGACGCTGACGGTACAGGCCAGACAATTATTGTCTGGTATAGTGCAGCAGCAGAACAATTTGCTGAGGGCTATTGAGGCGCAACAGCATCTGTTGCAACTCACAGTCTGGGGCATCAAGCAGCTCCAGGCAAGAATCCTGGCTGTGGAAAGATACCTAAAGGATCAACAGCTCCTGGGGATTTGGGGTTGCTCTGGAAAACTCATTTGCACCACTGCTGTGCCTTGGAATGCTAGTTGGAGTAATAAATCTCTGGAACAGATTTGGAATCACACGACCTGGATGGAGTGGGACAGAGAAATTAACAATTACACAAGCTTAATACACTCCTTAATTGAAGAATCGCAAAACCAGCAAGAAAAGAATGAACAAGAATTATTGGAATTAGATAAATGGGCAAGTTTGTGGAATTGGTTTAACATAACAAATTGGCTGTGGTATATAAAATTATTCATAATGATAGTAGGAGGCTTGGTAGGTTTAAGAATAGTTTTTGCTGTACTTTCTATAGTGAATAGAGTTAGGCAGGGATATTCACCATTATCGTTTCAGACCCACCTCCCAACCCCGAGGGGACCCGACAGGCCCGAAGGAATAGAAGAAGAAGGTGGAGAGAGAGACAGAGACAGATCCATTCGATTAGTGAACGGATCTCGACGGTATCGATTAGACTGTAGCCCAGGAATATGGCAGCTAGATTGTACACATTTAGAAGGAAAAGTTATCTTGGTAGCAGTTCATGTAGCCAGTGGATATATAGAAGCAGAAGTAATTCCAGCAGAGACAGGGCAAGAAACAGCATACTTCCTCTTAAAATTAGCAGGAAGATGGCCAGTAAAAACAGTACATACAGACAATGGCAGCAATTTCACCAGTACTACAGTTAAGGCCGCCTGTTGGTGGGCGGGGATCAAGCAGGAATTTGGCATTCCCTACAATCCCCAAAGTCAAGGAGTAATAGAATCTATGAATAAAGAATTAAAGAAAATTATAGGACAGGTAAGAGATCAGGCTGAACATCTTAAGACAGCAGTACAAATGGCAGTATTCATCCACAATTTTAAAAGAAAAGGGGGGATTGGGGGGTACAGTGCAGGGGAAAGAATAGTAGACATAATAGCAACAGACATACAAACTAAAGAATTACAAAAACAAATTACAAAAATTCAAAATTTTCGGGTTTATTACAGGGACAGCAGAGATCCAGTTTGGCTGCATACGCGTCGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACTGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGTGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGAGCTAGCTCTAGAGCCACCATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCCGGATCCGAGATCGTGCTGACACAGAGCCCTGGAAGCCTGGCCGTGTCTCCTGGCGAGCGCGTGACAATGAGCTGCAAGAGCAGCCAGAGCGTGTTCTTCAGCAGCTCCCAGAAGAACTACCTGGCCTGGTATCAGCAGATCCCCGGCCAGAGCCCCAGACTGCTGATCTACTGGGCCAGCACCAGAGAAAGCGGCGTGCCCGATAGATTCACCGGCAGCGGCTCTGGCACCGACTTCACCCTGACAATCAGCAGCGTGCAGCCCGAGGACCTGGCCATCTACTACTGCCACCAGTACCTGAGCAGCCGGACCTTTGGCCAGGGCACCAAGCTGGAAATCAAGAGAGGCGGCGGAGGCTCTGGCGGAGGCGGATCTAGTGGCGGAGGATCTCAGGTGCAGCTGCAGCAGCCTGGCGCCGAGGTCGTGAAACCTGGCGCCTCTGTGAAGATGTCCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTACATCCACTGGATCAAGCAGACCCCTGGACAGGGCCTGGAATGGGTGGGAGTGATCTACCCCGGCAACGACGACATCAGCTACAACCAGAAGTTCCAGGGCAAGGCCACCCTGACCGCCGACAAGTCTAGCACCACCGCCTACATGCAGCTGTCCAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCAGAGAAGTGCGGCTGCGGTACTTCGATGTGTGGGGCCAGGGAACCACCGTGACCGTGTCATCTTCCGGAGAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATGATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGCAAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAAGTCGACAATCAACCTCTGGATTACAAAATTTGTGAAAGATTGACTGGTATTCTTAACTATGTTGCTCCTTTTACGCTATGTGGATACGCTGCTTTAATGCCTTTGTATCATGCTATTGCTTCCCGTATGGCTTTCATTTTCTCCTCCTTGTATAAATCCTGGTTGCTGTCTCTTTATGAGGAGTTGTGGCCCGTTGTCAGGCAACGTGGCGTGGTGTGCACTGTGTTTGCTGACGCAACCCCCACTGGTTGGGGCATTGCCACCACCTGTCAGCTCCTTTCCGGGACTTTCGCTTTCCCCCTCCCTATTGCCACGGCGGAACTCATCGCCGCCTGCCTTGCCCGCTGCTGGACAGGGGCTCGGCTGTTGGGCACTGACAATTCCGTGGTGTTGTCGGGGAAGCTGACGTCCTTTCCTTGGCTGCTCGCCTGTGTTGCCACCTGGATTCTGCGCGGGACGTCCTTCTGCTACGTCCCTTCGGCCCTCAATCCAGCGGACCTTCCTTCCCGCGGCCTGCTGCCGGCTCTGCGGCCTCTTCCGCGTCTTCGCCTTCGCCCTCAGACGAGTCGGATCTCCCTTTGGGCCGCCTCCCCGCCTGGAATTCGAGCTCGGTACCTTTAAGACCAATGACTTACAAGGCAGCTGTAGATCTTAGCCACTTTTTAAAAGAAAAGGGGGGACTGGAAGGGCTAATTCACTCCCAACGAAGACAAGATCTGCTTTTTGCTTGTACTGGGTCTCTCTGGTTAGACCAGATCTGAGCCTGGGAGCTCTCTGGCTAACTAGGGAACCCACTGCTTAAGCCTCAATAAAGCTTGCCTTGAGTGCTTCAAGTAGTGTGTGCCCGTCTGTTGTGTGACTCTGGTAACTAGAGATCCCTCAGACCCTTTTAGTCAGTGTGGAAAATCTCTAGCAGTAGTAGTTCATGTCATCTTATTATTCAGTATTTATAACTTGCAAAGAAATGAATATCAGAGAGTGAGAGGAACTTGTTTATTGCAGCTTATAATGGTTACAAATAAAGCAATAGCATCACAAATTTCACAAATAAAGCATTTTTTTCACTGCATTCTAGTTGTGGTTTGTCCAAACTCATCAATGTATCTTATCATGTCTGGCTCTAGCTATCCCGCCCCTAACTCCGCCCAGTTCCGCCCATTCTCCGCCCCATGGCTGACTAATTTTTTTTATTTATGCAGAGGCCGAGGCCGCCTCGGCCTCTGAGCTATTCCAGAAGTAGTGAGGAGGCTTTTTTGGAGGCCTAGCTAGGGACGTACCCAATTCGCCCTATAGTGAGTCGTATTACGCGCGCTCACTGGCCGTCGTTTTACAACGTCGTGACTGGGAAAACCCTGGCGTTACCCAACTTAATCGCCTTGCAGCACATCCCCCTTTCGCCAGCTGGCGTAATAGCGAAGAGGCCCGCACCGATCGCCCTTCCCAACAGTTGCGCAGCCTGAATGGCGAATGGGACGCGCCCTGTAGCGGCGCATTAAGCGCGGCGGGTGTGGTGGTTACGCGCAGCGTGACCGCTACACTTGCCAGCGCCCTAGCGCCCGCTCCTTTCGCTTTCTTCCCTTCCTTTCTCGCCACGTTCGCCGGCTTTCCCCGTCAAGCTCTAAATCGGGGGCTCCCTTTAGGGTTCCGATTTAGTGCTTTACGGCACCTCGACCCCAAAAAACTTGATTAGGGTGATGGTTCACGTAGTGGGCCATCGCCCTGATAGACGGTTTTTCGCCCTTTGACGTTGGAGTCCACGTTCTTTAATAGTGGACTCTTGTTCCAAACTGGAACAACACTCAACCCTATCTCGGTCTATTCTTTTGATTTATAAGGGATTTTGCCGATTTCGGCCTATTGGTTAAAAAATGAGCTGATTTAACAAAAATTTAACGCGAATTTTAACAAAATATTAACGCTTACAATTTAGGTGGCACTTTTCGGGGAAATGTGCGCGGAACCCCTATTTGTTTATTTTTCTAAATACATTCAAATATGTATCCGCTCATGAGACAATAACCCTGATAAATGCTTCAATAATATTGAAAAAGGAAGAGTATGAGTATTCAACATTTCCGTGTCGCCCTTATTCCCTTTTTTGCGGCATTTTGCCTTCCTGTTTTTGCTCACCCAGAAACGCTGGTGAAAGTAAAAGATGCTGAAGATCAGTTGG
Гуманизированный my96 (L2H) IgG4H BBz NT (SEQ ID NO: 144)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCCGGATCCGAGATCGTGCTGACACAGAGCCCTGGAAGCCTGGCCGTGTCTCCTGGCGAGCGCGTGACAATGAGCTGCAAGAGCAGCCAGAGCGTGTTCTTCAGCAGCTCCCAGAAGAACTACCTGGCCTGGTATCAGCAGATCCCCGGCCAGAGCCCCAGACTGCTGATCTACTGGGCCAGCACCAGAGAAAGCGGCGTGCCCGATAGATTCACCGGCAGCGGCTCTGGCACCGACTTCACCCTGACAATCAGCAGCGTGCAGCCCGAGGACCTGGCCATCTACTACTGCCACCAGTACCTGAGCAGCCGGACCTTTGGCCAGGGCACCAAGCTGGAAATCAAGAGAGGCGGCGGAGGCTCTGGCGGAGGCGGATCTAGTGGCGGAGGATCTCAGGTGCAGCTGCAGCAGCCTGGCGCCGAGGTCGTGAAACCTGGCGCCTCTGTGAAGATGTCCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTACATCCACTGGATCAAGCAGACCCCTGGACAGGGCCTGGAATGGGTGGGAGTGATCTACCCCGGCAACGACGACATCAGCTACAACCAGAAGTTCCAGGGCAAGGCCACCCTGACCGCCGACAAGTCTAGCACCACCGCCTACATGCAGCTGTCCAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCAGAGAAGTGCGGCTGCGGTACTTCGATGTGTGGGGCCAGGGAACCACCGTGACCGTGTCATCTTCCGGAGAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATGATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGCAAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
Гуманизированный my96 (L2H) IgG4H BBz AA (SEQ ID NO: 145)
MALPVTALLLPLALLLHAARPGSEIVLTQSPGSLAVSPGERVTMSCKSSQSVFFSSSQKNYLAWYQQIPGQSPRLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQPEDLAIYYCHQYLSSRTFGQGTKLEIKRGGGGSGGGGSSGGGSQVQLQQPGAEVVKPGASVKMSCKASGYTFTSYYIHWIKQTPGQGLEWVGVIYPGNDDISYNQKFQGKATLTADKSSTTAYMQLSSLTSEDSAVYYCAREVRLRYFDVWGQGTTVTVSSSGESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKMIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
Гуманизированный my96 (L2H) scFv nt (SEQ ID NO: 146)
GAGATCGTGCTGACACAGAGCCCTGGAAGCCTGGCCGTGTCTCCTGGCGAGCGCGTGACAATGAGCTGCAAGAGCAGCCAGAGCGTGTTCTTCAGCAGCTCCCAGAAGAACTACCTGGCCTGGTATCAGCAGATCCCCGGCCAGAGCCCCAGACTGCTGATCTACTGGGCCAGCACCAGAGAAAGCGGCGTGCCCGATAGATTCACCGGCAGCGGCTCTGGCACCGACTTCACCCTGACAATCAGCAGCGTGCAGCCCGAGGACCTGGCCATCTACTACTGCCACCAGTACCTGAGCAGCCGGACCTTTGGCCAGGGCACCAAGCTGGAAATCAAGAGAGGCGGCGGAGGCTCTGGCGGAGGCGGATCTAGTGGCGGAGGATCTCAGGTGCAGCTGCAGCAGCCTGGCGCCGAGGTCGTGAAACCTGGCGCCTCTGTGAAGATGTCCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTACATCCACTGGATCAAGCAGACCCCTGGACAGGGCCTGGAATGGGTGGGAGTGATCTACCCCGGCAACGACGACATCAGCTACAACCAGAAGTTCCAGGGCAAGGCCACCCTGACCGCCGACAAGTCTAGCACCACCGCCTACATGCAGCTGTCCAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCAGAGAAGTGCGGCTGCGGTACTTCGATGTGTGGGGCCAGGGAACCACCGTGACCGTGTCATCT
Гуманизированный my96 (L2H) scFv AA (SEQ ID NO: 147)
EIVLTQSPGSLAVSPGERVTMSCKSSQSVFFSSSQKNYLAWYQQIPGQSPRLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQPEDLAIYYCHQYLSSRTFGQGTKLEIKRGGGGSGGGGSSGGGSQVQLQQPGAEVVKPGASVKMSCKASGYTFTSYYIHWIKQTPGQGLEWVGVIYPGNDDISYNQKFQGKATLTADKSSTTAYMQLSSLTSEDSAVYYCAREVRLRYFDVWGQGTTVTVSS
Пример 4: Конструкты с человеческим CAR
Для изображения экспрессии scFv на клеточной поверхности на линии T-клеток Jurkat, которые содержат репортер люциферазы, управляемый NFAT-регулируемым промотором (называемых клетками JNL), клетки JNL трансдуцировали лентивирусным вектором, экспрессирующим кДНК, кодирующую GFP, scFv, который связывается с CD19, или кДНК, которые кодируют scFv, который был сгенерирован к hsCD33 (фиг. 27). Экспрессию на клеточной поверхности отдельных scFv на JNL детектировали посредством инкубирования клеток с рекомбинантным Fc-меченым hsCD33 с последующей инкубацией с Fc-специфическим вторичным антителом, конъюгированным с фикоэритрином. Было обнаружено, что клоны CD33-1, -2, -3, -4, -5, -6, -7 и -9 связываются с hsCD33 на заметном уровне по сравнению с клетками JNL, экспрессирующими GFP или scFv, который воздействует на CD19, который служил в данном анализе в качестве отрицательного контроля. Было также обнаружено, что у CD33-8 отсутствовало заметное связывание как с hsCD33, так и с белком L (данные не показаны), белком клеточной поверхности бактерий, который связывает легкие цепи иммуноглобулинов. Данные, представленные в настоящем документе, демонстрируют, что клоны CD33-1, -2, -3, -4, -5, -6, -7 и -9 кодируют scFv, которые связываются с hsCD33.
Оценивали способность отдельных scFv, воздействующих на hsCD33, выявлять активность NFAT в клетках JNL (фигура 28). Клетки JNL, экспрессирующие scFv против hsCD33, совместно культивировали с линиями клеток MOLM13 или MOLP8, которые, соответственно, экспрессируют hsCD33 или не имеют экспрессии hsCD33 на клеточной поверхности (фигура 28A; hsCD33, сплошная зеленая линия; изотипический контроль, серая пунктирная линия и заштрихованный участок). Фигура 28B изображает активацию клеток JNL, экспрессирующих scFv, воздействующий на hsCD33, в присутствии клеток MOLM13 (сплошные линии) или MOLP8 (пунктирные линии). Клетки JNL, экспрессирующие отдельные scFv, высеивали при различных отношениях эффектора (то есть клеток JNL) к мишени (то есть MOLM13 или MOLP8) и анализировали в отношении экспрессии в относительных единицах люциферазы (RLU) с использованием Bright-Glo™ Luciferase Assay на приборе EnVision через 24 часа после инкубации. Было обнаружено, что клоны scFv CD33-1, -2, -3, -4, -5, -6, -7, -9 и scFv, основанный на последовательности милотарг, моноклонального антитела, которое связывается с человеческим антигеном CD33 (CD33-UPenn), были способны к переключению NFAT-зависимой активности люциферазы, хотя и в разной степени, в присутствии MOLM13 по сравнению с клетками MOLP8 или JNL, экспрессирующими GFP.
Также оценивали активность scFv, воздействующих на hsCD33, в полученных от донора первичных T-клетках (фигуры 29A и 29B). Наивные T-клетки были выделены из PBMC здорового донора посредством отрицательной селекции с использованием стандартных протоколов и активированы с использованием набора Dynabeads® Human T-Expander CD3/CD28 Invitrogen. Через 24 часа после стимуляции T-клетки трансдуцировали с помощью лентивируса, экспрессирующего отдельные scFv, воздействующие на hsCD33, и выращивали в культуре в течение дополнительных 9 дней. T-клеточные культуры анализировали в отношении их способности претерпевать размножение клеток и выявлять цитолитическую активность антиген-зависимым и антиген-независимым образом. Экспрессия scFv на клеточной поверхности первичных человеческих T-клеток, трансдуцированных с помощью лентивирусного вектора, который экспрессирует scFv, который воздействует на hsCD33, изображена на фигурах 29A и 29B. Экспрессию scFv детектировали посредством инкубирования клеток с рекомбинантным Fc-меченым hsCD33 и Fc-специфическим вторичным антителом, конъюгированным с фикоэритрином, как описано на фигуре 27. В соответствии с вышеупомянутыми результатами с фигуры 27, клоны scFv CD33-1, -2, -3, -4, -5, -6, -7 и -9, экспрессируемые в первичных T-клетках, связываются с hsCD33 на заметном уровне по сравнению с T-клетками, экспрессирующими GFP, у которых отсутствует способность к связыванию hsCD33. Таким образом, клоны scFv CD33-1, -2, -3, -4, -5, -6, -7 и -9 можно использовать для конструирования первичных T-клеток для воздействия на человеческий антиген CD33.
T-клетки помечали CFSE и совместно культивировали в присутствии MOLM13 (фигура 30A, сплошной черный столбец), MOLP8 (фигура 30A, незаштрихованный белый столбец) или культивировали отдельно (фигура 30A, заштрихованный столбец) для оценки пролиферативной способности первичных UTD T-клеток или клеток, экспрессирующих scFv, воздействующие на hsCD33. Было обнаружено, что T-клетки, экспрессирующие клоны scFv CD33-2, -3, -4, -5, -6 и -9, были способны к размножению антиген-зависимым образом, о чем свидетельствует увеличение абсолютного количества T-клеток в присутствии CD33-экспрессирующих клеток MOLM13 по сравнению с UTD или CD33-отрицательными MOLP8 клетками (фигура 30A). Кроме того, оценивали антигензависимое деление клеток в первичных T-клетках посредством измерения медианной интенсивности флуоресценции (MFI) CFSE-меченых T-клеток, экспрессирующих клоны scFv CD33-2, -3, -4, -5, -6 и -9, культивированные совместно с клетками MOLM13, MOLP8 или отдельно (фигура 30B). В соответствии с вышеупомянутым увеличением размножения T-клеток (фигура 30A) наблюдали пониженные уровни CFSE в T-клетках, совместно культивированных с MOLM13, по сравнению с клетками UTD или MOLP8 (фигура 30B). После гейтирования на T-клетках, которые были или scFv+, или scFv-, было обнаружено, что scFv-экспрессирующие T-клетки имеют пониженные уровни CFSE относительно их scFv- аналогов при совместном культивировании с MOLM13. При этом уровни CFSE оказались близкими для scFv+ или scFv- T-клеток, совместно культивированных на клетках MOLP8 (фигура 30B), что указывает на увеличение пролиферации в ответ на распознавание антигена. Результаты, представленные в настоящем документе, также соответствуют способности клонов scFv CD33-2, -3, -4, -5, -6 и -9 выявлять scFv-зависимую активацию клеток JNL в присутствии CD33 (фигура 28B). Таким образом, клоны scFv CD33-2, -3, -4, -5, -6 и -9 можно использовать для активации пролиферации первичных T-клеток CD33-зависимым образом.
Кроме того, T-клетки CART-CD33 тестировали на их способность к пролиферации в ответ на воздействие антигена на клетках-мишенях. Клетки-мишени включали клетки PL-21, HL60 и Molp8. На день анализа (день 0) клетки-мишени подсчитывали и переносили в пробирку 50 мл в 6 мл T-клеточной среды при 3e6 клеток на мл. Клетки-мишени облучали на льду при 10000 рад. После облучения клетки-мишени промывали дважды в T-клеточной среде, подсчитывали и ресуспендировали до 5e5 клеток на мл в T-клеточной среде на льду. Замороженные трансдуцированные T-клетки оттаивали, промывали в 10 мл полной T-клеточной среды, центрифугировали при 300 g в течение 10 мин и аккуратно ресуспендировали в 3 мл полной T-клеточной среды при RT. Затем T-клетки подсчитывали с помощью Cellometer и ресуспендировали до 2,5e6/мл в 10 мл среды. В 96-луночном планшете с U-образным дном 25000 облученных клеток-мишеней и 25000 трансдуцированных T-клеток с CAR (отношение 1:1) объединяли в дублирующихся лунках. В отдельную лунку добавляли 75000 анти-CD3/CD28 гранул в 100 мкл среды к 25000 трансдуцированных T-клеток для создания отношения клеток к гранулам 1:3 в качестве положительного контроля; в другую лунку добавляли только 100 мкл среды к 25000 трансдуцированных T-клеток в качестве контроля в виде только среды. Клетки инкубировали в течение 4 дней при 37°C, 5% CO2. На день 4, клетки отбирали, и дубликаты объединяли посредством пипетирования и переносили в ту же лунку на планшете с U-образным дном для окрашивания CD4, CD8 и CAR для FACS с использованием белка L или рекомбинантного человеческого белка CD33. После окрашивания клетки ресуспендировали в 120 мкл MACS+0,5% БСА буфер, и добавляли в каждую лунку 20 мкл гранул Countbright на лунку. Пролиферацию измеряли как количество детектированных FACS-положительных клеток в период времени, используемый для подсчета 2500 гранул (фигура 47). Протестированные T-клетки CART-CD33 (например, происходящие от клонов scFv CD33-1, -2, -4, -5, -6, -7, -9 и гуманизированного My96 (называемые "Upenn")) пролиферировали в большей степени, чем нетрансдуцированные клетки или T-клетки CART-CD19, под воздействием клеток-мишеней HL-60. T-клетки CART-CD33 (например, происходящие от клонов scFv CD33-1, -2, -4, -5, -6, -7, -9 и гуманизированного My96 (называемые Upenn) пролиферировали в большей степени, чем нетрансдуцированные клетки, и в приблизительно равной или большей степени, чем T-клетки CART-CD19, под воздействием клеток-мишеней PL21. T-клетки CART-CD33 пролиферировали приблизительно в той же степени или слегка большей степени, чем нетрансдуцированные клетки или T-клетки CART-CD19, под воздействием клеток MOLP8, которые не экспрессируют мишень CD33.
Для оценки цитолитической активности 25000 клеток MOLM13 высеивали с первичными T-клетками, экспрессирующими отдельные scFv, при различных отношениях эффектора (то есть T-клеток) к мишени и анализировали в отношении величины киллинга MOLM13 посредством подсчета абсолютного количества CFSE-меченых клеток MOLM13 после 4 дней культивирования (фигура 31). Было обнаружено, что клоны scFv CD33-2, -3, -4, -5, -6 и -9 были способны индуцировать лизис клеток-мишеней, хотя и в различной степени. Таким образом, клоны scFv CD33-2, -3, -4, -5, -6 и -9 можно использовать для конструирования первичных T-клеток для непосредственного воздействия на CD33-экспрессирующие клетки-мишени и их киллинга.
T-клеточный киллинг был направлен на линии CD33-экспрессирующих клеток PL21 и HL-60 острого миелогенного лейкоза, стабильно экспрессирующие люциферазу. Неэкспрессирующие CD33 клетки U87 использовали в качестве контроля, а нетрансдуцированные T-клетки (UTD) использовали для определения уровней неспецифического фонового киллинга. Цитолитическую активность CART-CD33 измеряли посредством титрирования отношений клеток эффектор:мишень 10:1 и 2-кратных нисходящих разбавлений T-клеток, где эффекторы были определены как T-клетки, экспрессирующие анти-CD33 химерный рецептор. Анализы начинали посредством смешивания соответствующего количества T-клеток с постоянным количеством клеток-мишеней. Через 20 часов измеряли люциферазный сигнал с использованием Bright-Glo™ Luciferase Assay на приборе EnVision. При сравнении этих кривых киллинга титрирование количества эффекторных клеток показывает, что клетки, экспрессирующие CD33, были разрушены (фигуры 48A, 48B и 48C). T-клетки от того же донора, которые трансдуцировали любыми из несущих человеческий scFv клеток CAR-CD33, были способны к селективному киллингу мишеней CD33+, хотя были отмечены различия в активности, которые могут быть переведены в различия в клинической активности.
CART-CD33 клетки тестировали на их способность производить цитокин в ответ на антиген. Клетки оттаивали и давали им восстановиться в течение ночи. Нетрансдуцированные T-клетки (UTD) использовали в качестве неспецифического контроля для фоновых T-клеточных эффектов. T-клетки направляли на клетки HL-60, PL21 или MOLP8. Анализ тестировал отношение эффектор:мишень, составляющее 2,5:1, где эффекторы были определены как T-клетки, экспрессирующие CAR против CD33. Анализ проводили через 16 часов после смешивания клеток, когда среду удаляют для анализа цитокинов IFN-гамма, ФНО-альфа и IL-2 с использованием набора CBA-Flex для детектирования человеческих цитокинов. Когда T-клетки CART-CD33 культивировали с раковыми клетками, эндогенно экспрессирующими CD33, все CD33-CART производили цитокины в ответ на экспрессирующие мишень клетки (фигура 49). Различие в реактивности различных клонов CD33-CART в отношении слабо экспрессирующих CD33 клеток-мишеней можно перевести в лучшую клиническую эффективность CART-клеток, трансдуцированных этими конструктами.
В конце оценивали перекрестную реактивность scFv к CD33 яванского макака (cyCD33) с помощью проточной цитометрии, как изображено на фигуре 32. Клетки JNL, трансдуцированные лентивирусным вектором, экспрессирующим scFv, сгенерированные против hsCD33, инкубировали или с рекомбинантным Fc-меченым hsCD33 (красная линия), или с cyCD33 (синяя линия), за чем следовала инкубация с Fc-специфическим вторичным антителом, конъюгированном с фикоэритрином. В то время как клоны scFv CD33-1, -2, -3, -4, -5, -6, -7, -9 и CD33-UPenn были способны к связыванию hsCD33, авторы отметили, что только клон scFv CD33-5 оказался перекрестно реагирующим как с hsCD33, так и с cyCD33 (фигура 32).
Пример 5: Характеризация электропорированных РНК клеток CART33
Сравнение экспрессии CAR33 в T-клетках, трансдуцированных с помощью лентивируса или электропорированных РНК
Генерировали мРНК CAR против CD33, содержащую гуманизированный анти-CD33 scFv и шарнир IgG4, например, SEQ ID NO: 145, с помощью in vitro транскрипции. T-клетки от нормального донора выделяли и электропорировали мРНК CAR33. После электропорации клетки стимулировали гранулами CD3/CD28 и выращивали в культуре. Экспрессию CAR33 измеряли и количественно определяли с помощью проточной цитометрии через 8 часов, 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней или 7 дней после электропорации (фиг. 33A). Результаты данного эксперимента демонстрируют, что электропорация РНК CAR33 приводит к экспрессии CAR33 в T-клетках донора в течение по меньшей мере 7 дней. Экспрессия была наивысшей (например, больше чем 60%) до дня 4 после электропорации (фиг. 33B). Экспрессия CAR33 уменьшалась на 5-7 день после электропорации.
Экспрессию CAR33 благодаря электропорации РНК сравнивали со стабильной экспрессией CAR33 благодаря лентивирусной трансдукции. Донорные T-клетки трансдуцировали с помощью лентивирусного конструкта, содержащего CAR33, такого как вектор с фигуры 26, с использованием стандартных способов. Экспрессию CAR33 измеряли посредством анализа с помощью проточной цитометрии и количественно определяли по средней интенсивности флуоресценции (MFI). Экспрессию CAR33 оценивали через 8 часов, 1 день, 2 дня, 3 дня и 4 дня после электропорации или трансдукции для трансдуцированных с помощью лентивируса клеток CART33 (фиг. 34A) и для РНК-трансфицированных клеток CART33 (фиг. 34B). Серые пики с левой стороны гистограмм на фигуре 34 представляют отсутствие экспрессии CAR33, тогда как возрастающая экспрессия CAR33 увеличивается в направлении правой части графиков. Лентивирусная трансдукция приводит к стабильной экспрессии CAR33 в T-клетках, причем уровень экспрессии CAR33 остается неизменным от 8 часов до 4 дней после трансдукции. Напротив, электропорация РНК приводит к временной экспрессии CAR33 в T-клетках. Если говорить конкретнее, экспрессия CAR33 является наивысшей от 8 часов до 1 дня после электропорации, и экспрессия CAR33 уменьшается от 2 до 4 дня после электропорации.
Цитотоксическая активность in vitro
Для оценки активности специфического киллинга электропорированных РНК и трансдуцированных с помощью лентивируса клеток CART33, клетки CART33 инкубировали с CD33-экспрессирующими клетками-мишенями, такими как линия клеток острого миелоидного лейкоза MOLM14, или CD33-отрицательными контрольными клетками, такими как линия клеток мантийноклеточной лимфомы JEKO, при различных отношениях эффектора (клеток CART33) к мишени (CD33-положительных или отрицательных клеток) в течение 24 часов. Отношения эффектора к мишени составляли 0:1, 0,125:1, 0,25:1, 0,5:1, 1:1 и 2:1. Эксперимент повторяли в различных временных точках через 1 день, 2 дня, 3 дня и 4 дня после электропорации/трансдукции T-клеток. Через один день после электропорации электропорированные РНК клетки CART33 демонстрировали специфический киллинг начиная с отношения E:T, составляющего 0,125:1 (фиг. 35A). Специфический киллинг в CAR33-положительных клетках MOLM14 наблюдали на 2 (фиг. 35B), 3 (фиг. 35C) и 4 (фиг. 35D) день после электропорации клеток CART33, однако отношения E:T для специфического киллинга возрастали с течением времени, что указывает на временную природу специфического киллинга. Трансдуцированные с помощью лентивируса клетки CART33 демонстрировали сильную активность специфического киллинга с 1 по 4 день даже при более низких отношениях E:T.
При отображении данных результатов другим способом, когда специфическую активность при одном конкретном отношении E:T сравнивали между 1-4 днями после электропорации, данные показывают, что специфический киллинг электропорированных РНК клеток CART33 уменьшался с течением времени после электропорации, когда отношения E:T составляли 2:1 (фиг. 36A) или 1:1 (фиг. 36B). Эти результаты демонстрируют временную природу специфического киллинга электропорированных РНК клеток CART33. Напротив, трансдуцированные с помощью лентивируса клетки CART33 демонстрировали стабильные уровни специфического киллинга в течение дней 1-4 после трансдукции.
Пример 6: Гуманизированные CART33 проявляют сильную предклиническую активность против человеческих ОМЛ и МДС
CAR второго поколения конструировали из анти-CD33 scFv гемтузумаба озогамицина (иммуноконъюгат, воздействующий на CD33) с сигнальными доменами из 4-1BB и CD3-дзета (описаны в примере 3; и SEQ ID NO: 145). Здесь описана предклиническая активность CAR33 второго поколения, и проведено сравнение с разработанным ранее CAR, воздействующим на CD123 (CAR123). Результаты показывают, что CART33 оказался способен к уничтожению CD34+ клеток человеческих острой миелоидной лимфомы и миелодиспластического синдрома, хотя это приводит к значительной миелотоксичности в мышиных ксенотрансплантатах. Таким образом, также был создан временно экспрессируемый модифицированный с помощью мРНК CART33 для использования в будущих исследованиях и клинических исследованиях.
В данном примере использовали следующие материалы и методы:
Создание CART-клеток
ДНК плазмиды pTRPE анти-CD33-41BB-CD3-дзета (CAR33) создавали клонированием в ориентации от легкой к тяжелой цепи гуманизированного античеловеческого scFv к CD33, происходящего от гемтузумаба озогамицина (клон my96), в описанный ранее мышиный плазмидный вектор CART19. 25 T-клеток нормальных доноров отбирали с помощью положительной селекции из лейкаферезных пакетов с использованием микрогранул анти-CD4 и анти-CD8 (Miltenyi), смешивали вместе в отношении 1:1 и размножали in vitro с использованием анти-CD3/CD28 Dynabeads (Invitrogen, добавляли на первый день культивирования) с низкой дозой IL-2. T-клетки трансдуцировали с помощью лентивирусного супернатанта от клеток 293T, трансфицированных плазмидой pTRPE my96-CD33-41BB-CD3-дзета на следующий день после стимуляции при множественности заражения (MOI), составляющей 3. Анти-CD3/CD28 Dynabeads удаляли на день 6, и T-клетки размножали в культуре в T-клеточной среде (среда X-vivo 15, дополненная человеческой сывороткой 5%, пенициллином, стрептомицином и глютамаксом) в течение вплоть до 15 дней и затем криосохраняли для будущих экспериментов. Перед всеми экспериментами T-клетки оттаивали и оставляли в течение ночи при 37 градусов. Получение клеток CART123 описано ранее (Gill et al., 2014, Blood, 123:2343-54).
Клетки
Линию клеток MOLM14 получали из ATCC и сохраняли в среде R10 (среда RPMI, дополненная 10% фетальной телячьей сыворотки, пенициллином и стрептомицином). В некоторых экспериментах использовали клетки MOLM14-люцифераза-GFP. Деидентифицированные образцы костного мозга первичных человеческих ОМЛ и МДС получали в лаборатории Pennsylvania Stem Cell and Xenograft Core. Для всех функциональных исследований клетки ОМЛ оттаивали по меньшей мере за 12 часов до анализа и оставляли в течение ночи при 37 градусов. Образцы костного мозга МДС обогащали CD34+ клетками посредством положительной селекции с использованием колонок MACSQuant (Miltenyi).
Анализ с помощью проточной цитометрии
Античеловеческие антитела закупали у Biolegend, eBioscience или Becton Dickinson. Клетки выделяли из in vitro культуры или из животных, промывали один раз в ФСБ, дополненном 2% фетальной телячьей сывороткой, и окрашивали на льду после блокады рецепторов Fc. Для определения количества клеток использовали гранулы Countbright в соответствии с инструкциями изготовителя (Invitrogen). Во всех анализах популяцию, представляющую интерес, гейтировали на основании характеристик прямого или бокового светорассеяния с последующим гейтированием по синглетам, и живые клетки гейтировали с использованием Live Dead Aqua (Invitrogen). Поверхностную экспрессию CAR против CD33 детектировали посредством окрашивания с помощью конъюгированного с Alexa Fluor 647 козьего антимышиного F(ab')2 антитела от Jackson Immunoresearch. Проточную цитометрию осуществляли на четырехлазерном анализаторе Fortessa (Becton-Dickinson).
Анализы функций T-клеток
1. Анализы дегрануляции T-клеток
Анализы дегрануляции осуществляли как описано ранее. 26 T-клеток инкубировали с клетками-мишенями при отношении 1:5. Во время инкубации добавляли CD107a, CD28, CD49d и монензин. Через 4 часа клетки отбирали и окрашивали на экспрессию CAR, CD3 и окрашивание Live Dead. Клетки фиксировали и пермеабилизировали, и затем осуществляли окрашивание на внутриклеточные цитокины.
2. Анализы пролиферации:
T-клетки промывали и ресуспендировали при 1×107 на мл в 100 мкл ФСБ и окрашивали с помощью 100 мкл 2,5 мкМ CFSE (Life Technologies) в течение 5 минут при 37 Цельсия. Затем реакцию останавливали с помощью холодной R10, и клетки промывали три раза. Мишени облучали с дозой, составляющей 100 Гр. T-клетки инкубировали при отношении 1:1 с облученными клетками-мишенями в течение 120 часов. Затем клетки отбирали, окрашивали на CD3, CAR и Live Dead aqua, и затем добавляли гранулы Countbright (Invitrogen) перед анализом с помощью проточной цитометрии.
3. Анализы цитотоксичности:
Люцифераза+ клетки MOLM14 или меченые CFSE образцы первичного ОМЛ использовали для анализа цитотоксичности, как описано ранее (Cao et al., 2010, Cytometry A, 77:534-545). Кратко говоря, мишени инкубировали при указанных отношениях с эффекторными T-клетками в течение 4 или 16 часов. Киллинг вычисляли или с помощью биолюминесцентной визуализации в камере Xenogen IVIS-200 Spectrum, или с помощью проточной цитометрии. Для последней отбирали клетки, и добавляли гранулы Countbright и 7-AAD перед анализом. Оставшиеся живые клетки-мишени были CFSE+ 7-AAD-. Для МДС T-клетки инкубировали с CD34-обогащенным костным мозгом при отношении 1:1 в течение 4 или 24 часов, как указано, и затем измеряли цитотоксичность с помощью проточной цитометрии или посредством флуоресцентной гибридизации in situ (с использованием зонда для специфической хромосомной аномалии в образце МДС).
4. Измерения цитокинов:
Эффекторные клетки и клетки-мишени инкубировали при отношении 1:1 в T-клеточной среде в течение 24 или 72 часов, как указано. Супернатант отбирали и анализировали с помощью 30-плексной матрицы Luminex в соответствии с протоколом производителя (Invitrogen).
Эксперименты in vivo
Мыши NOD-SCID-γ-цепь-/- (NSG) и NSG, трансгенные по человеческому IL-3, фактору стволовых клеток и GM-CSF (NSG-S), исходно получали от Jackson Labs. Все эксперименты осуществляли в соответствии с протоколами, одобренными Комитетом по содержанию и использованию животных Университета Пенсильвании. Схемы используемых ксенотрансплантатных моделей рассмотрены подробно на соответствующих фигурах и в разделе результатов. Клетки (MOLM 14, первичные клетки или T-клетки) инъецировали в 200 мкл ФСБ в указанной концентрации в хвостовые вены мышей. Биолюминесцентную визуализацию осуществляли с использованием камеры Xenogen IVIS-200 Spectrum. Мышей с гуманизированной иммунной системой (HIS) создавали с помощью инъекции фетальных CD34+ клеток печени новорожденным мышам NSG и использовали в возрасте приблизительно 8 недель.
Создание мРНК-модифицированнлого CART33
Конструкт CAR из плазмиды pTRPE анти-CD33-41BB-CD3z субклонировали в вектор pDA 28, как опубликовано ранее. In vitro транскрипцию осуществляли с использованием транскрипционного набора mMESSAGE mMachine ®T7 ULTRA (Ambion). РНК очищали с использованием RNeasy Mini Kit (Qiagen). РНК-CAR33 электропорировали в T-клетки, как описано ранее. Электропорацию осуществляли с использованием ECM830 Electro Square Wave Porator (Harvard Apparatus BTX).
Гистология и иммуногистохимия
Фиксированные формалином залитые в парафин срезы бедер мышей окрашивали с помощью гематоксилина и эозина, докрашивали с помощью mAb к человеческому CD45 и человеческому CD34 и исследовали с помощью микроскопа Nikon.
РЕЗУЛЬТАТЫ:
CD33 в качестве мишени при ОМЛ и конструкты CART33
Для проверки клинической значимости CD33 в качестве мишени для иммунотерапии при ОМЛ вначале оценивали уровень экспрессии CD33 при ОМЛ и обнаружили экспрессию на большинстве ОМЛ-бластов почти во всех образцах первичного ОМЛ (фигура 1), а также в костном мозге пациентов с МДС (фигуры 2A, 2B и 2C). Для оценки потенциальной нецелевой токсичности CART33 выполняли иммуногистохимический анализ ткани на 30 нормальных тканях, окрашенных с помощью анти-CD33 антитела (LSBio). CD33 экспрессировался на миелоидной линии дифференцировки в костном мозге и на резидентных макрофагах в печени, легком и почках (фигура 21). Для тестирования эффективности CAR33 были сконструированы четыре конструкта, происходящие от мышиного и гуманизированного scFv из клона my96 гемтузумаба озогамицина. Два конструкта использовали шарнир IgG4, и два конструкта использовали шарнир CD8 (фигура 3).
CART33 показывают сильную in vitro активность против линий клеток ОМЛ, образцов первичного ОМЛ и МДС
Активность четырех различных конструктов CART33 тестировали in vitro и сравнивали с CART123 (Gill et al, 2014, Blood, 123:2343-2354). Гуманизированные CART33 оказались стабильно лучше мышиных CART33 (смотри пример 1), и поэтому все последующие исследования выполняли на двух гуманизированных конструктах CAR33. Линию клеток MOLM14 использовали в качестве модельной опухоли (MOLM14 экспрессирует CD33 и CD123). Инкубация CART33 с MOLM14 приводила к значительной дегрануляции (фигура 37A), сильной цитотоксичности при низких отношениях эффектор:мишень (фигура 37B), экстенсивной пролиферации (фигуры 37C и 37D) и устойчивому производству цитокинов (фигуры 38A, 38B, 38C и 39), которое было значительно выше, чем при инкубации с контрольной линией клеток T-клеточного лейкоза Jurkat. Большинство CART33 производили два или более цитокина на клетку после инкубации с MOLM14, аналогично сильной неспецифической стимуляции PMA/иономицином (фигуры 38A и 38B). Эта функция была связана с большей in vivo активностью (Carpenito et al., 2009, Proc Natl Acad Sci USA, 106:3360-3365). Кроме того, клетки CART33 производили больше цитокинов, чем клетки CART123 (фигура 38C), а также приводили к значительной in vitro активности против образцов первичного ОМЛ. CART33 с шарниром IgG4 приводили к большей цитотоксичности по сравнению с CART33 с шарниром CD8 (фигуры 8, 9, 10 и 40).
Также исследовали активность CART33 in vitro в отношении МДС. Образцы костного мозга пациентов с МДС обогащали CD34 (чистота ~85%) и затем инкубировали с клетками CART33, CART123 или нетрансдуцированными контрольными T-клетками (UTD) при отношении E:T, составляющем 1:5, в течение 4 часов в присутствии CD49d, костимуляции CD28 и монензина. Затем измеряли дегрануляцию по CD107a с помощью проточной цитометрии, и количественно определяли процентную долю дегрануляции. Фигуры 41B и 41C показывают специфический киллинг клона МДС, имеющего делецию 5q. Обогащенный CD34 образец костного мозга пациента с МДС и делецией 5q инкубировали с клетками CART33, UTD или без обработки при отношении E:T, составляющем 1:1, в течение 4 часов. Затем образец отбирали и выполняли FISH для 5q- (фигура 41B). CART33 демонстрировали значительную in vitro активность в отношении МДС. Это было видно по специфической дегрануляции CART33 в ответ на обогащенные CD34 образцы МДС (фигура 41A), специфическому киллингу после 24-часовой инкубации CART33 с CD34-обогащенными образцами МДС (отношение эффектор:мишень 1:1, фигура 24) и специфическому уменьшению злокачественного клона (измеренному с помощью FISH) после 4 часов инкубации (фигуры 41B и 41C).
Результаты из анализов in vitro, описанных выше, сведены в таблице ниже.
Таблица 13. In vitro активность CART33 по сравнению с CART123 и контрольными нетрансдуцированными T-клетками
(медиана, пг/мл)
* все p-значения составляют <0,05 при сравнении с UTD.
CART33 приводят к уменьшению лейкозной нагрузки и преимуществу по выживаемости для привитых ксенотрансплантатов MOLM14.
Для тестирования in vivo активности CART33 мышей NSG инъецировали люцифераза+ MOLM14 (фигура 11). После подтверждения приживления с помощью биолюминесцентной визуализации мыши получали одну инъекцию CART33 или контрольных нетрансдуцированных T-клеток (UTD) при различных уровнях дозирования. Затем мышей подвергали последовательной визуализации, и количественно определяли нагрузку заболевания с использованием биолюминесценции. Мыши, обработанные контрольными T-клетками, быстро уступали заболеванию, тогда как мыши, обработанные CART33, демонстрировали значительное уменьшение заболевания и преимущество по выживаемости (фигура 42A, 42B и 42C). Кроме того, исследовали зависимость ответа от дозы у обработанных CART33 мышей. Как схематически показано на фигуре 43A, мышей с нокаутом NOD-SCID-гамма-цепи (NSG) инъецировали линией клеток ОМЛ MOLM14 1×106 в/в и визуализировали в отношении приживления через 6 дней. Мышей обрабатывали CART33 5×106, CART33 2×106, CART33 1×106 или контрольными нетрансдуцированными T-клетками 5×106. Затем мышей подвергали серии еженедельных визуализаций для оценки нагрузки ОМЛ. Наблюдали дозозависимый ответ (фигуры 43A и 43B) у обработанных CART33 мышей и большую антилейкозную активность у CART33 с шарниром IgG4 по сравнению с CAR33 с шарниром CD8 (фигура 44). Для всех последующих экспериментов использовали только CART33 с шарниром IgG4.
CART33 приводят к эрадикации лейкоза в ксенотрансплантатах первичного ОМЛ и к продолжительной безрецидивной выживаемости.
Клетки первичного лейкоза, вероятно, являются более гетерогенными клонально, чем долговременно размножаемые линии клеток, и лучше отражают заболевание человека. Поэтому оценивали эффективность CART33 в первичных ксенотрансплантатах ОМЛ. Мышей NSG-S инъецировали образцами первичного ОМЛ, экспрессирующими CD33 и CD123. Нагрузку заболевания количественно определяли в периферической крови и посредством анализа выживаемости (фигура 13). Приживление определяли как >1% циркулирующих клеток huCD45+, и оно обычно достигалось через 2-4 недели после инъекции лейкозных клеток. Затем этих мышей обрабатывали с помощью одной инъекции клеток CART33, CART123 или UTD (1×105 посредством инъекции в хвостовую вену). Лейкоз подвергался эрадикации в течение 4 недель от инъекции CART33 или CART123 (фигуры 14 и 15), и была продемонстрирована продолжительная безрецидивная выживаемость (фигура 16).
CART33 приводит к ожидаемой токсичности для гематопоэтических стволовых клеток и миелоидных предшественников.
Поскольку известна экспрессия CD33 на миелоидных предшественниках, хотя и в меньшей степени по сравнению с лейкозными клетками, исследовали воздействие CART33 на нормальный гемопоэз. Для оценки гематопоэтической токсичности CART33 использовали две различные модели. Мышам с гуманизированной иммунной системой (HIS) с постнатально привитыми человеческими фетальными CD34+ клетками делали кровопускание для подтверждения приживления, и затем обрабатывали CART33, CART123 или нетрансдуцированными T-клетками (фигура 17). Мышам делали кровопускание еженедельно в течение 4 недель. Затем мышей умерщвляли и отбирали у этих мышей для анализа костный мозг и селезенку. Как ожидалось на основании экспрессии CD33 на миелоидной линии дифференцировки, у этих мышей развивалось уменьшение количества миелоидных клеток периферической крови, включая моноциты, по сравнению с мышами, обработанными нетрансдуцированными T-клетками (фигура 22). Анализ костного мозга через 4 недели после обработки продемонстрировал уменьшение количества CD34+CD38-гематопоэтических стволовых клеток и CD34+CD38+ миелоидных предшественников по проточной цитометрии (фигура 20) или иммуногистохимии (фигура 21). Модель HIS смещена в направлении B-клеточной линии дифференцировки, и поэтому использовали вторую модель, которая больше смещена в миелоидную сторону. В этом случае костный мозг нормальных взрослых доноров истощали по T-клеткам и инъецировали кондиционированным бусульфаном мышам NSG-S. Аутологичные CART33, CART123 или UTD создавали посредством трансдуцирования T-клеток периферической крови донора костного мозга соответствующим лентивирусом. После подтверждения приживления у этих мышей, их обрабатывали аутологичными CART33, CART123 или UTD с последующими еженедельными ретроорбитальными кровопусканиями в течение в общей сложности 4 недель (фигура 22). Затем мышей умерщвляли, и ткани отбирали и анализировали. Аналогично ксенотрансплантатам HIS, авторы наблюдали уменьшение количества миелоидных клеток и моноцитов периферической крови и в камерах CD34+ костного мозга.
Временно РНК-модифицированные "биоразлагаемые" CART33 приводили к сильной, но временной противолейкозной активности
Поскольку CD33 экспрессируется на нормальных гематопоэтических клетках и резидентных макрофагах ткани (фигуры 1 и 2), перед клиническим применением важно проверить механизм обеспечения безопасности. Поэтому разработали РНК-модифицированные CART33. Электропорация T-клеток РНК-модифицированным CAR-33 приводила к высокому уровню экспрессии CAR, который постепенно уменьшался в течении семи дней (фигуры 33A, 33B, и 34, и как описано в примере 9). По сравнению с трансдуцированным с помощью лентивируса CART33 (LV-CART33) РНК-модифицированный CART33 имеет аналогичную, но временную in vitro активность. Инкубация MOLM14 с РНК-CART33 приводила к специфической цитотоксичности, сравнимой с LV-CART33 при отношениях E:T, составляющих 1:1 и 2:1, и она уменьшалась со временем после электропорации (фигура 35, и как описано в примере 9).
Тестировали комбинацию РНК-CART33 с химиотерапией in vivo. Мышей NSG, привитых MOLM14, обрабатывали комбинацией или трех доз циклофосфамида (60 мг/кг и/п) и РНК-CART33, или циклофосфамида и UTD. 10×106 T-клеток давали в/в в трех дозах (фигура 45). Если говорить конкретнее, мышей NSG инъецировали MOLM14-luc (1×106 в/в) и визуализировали для подтверждения приживления через четыре дня. Мышей рандомизировали для получения или РНК-CART33 с циклофосфамидом, или нетрансдуцированных T-клеток с циклофосфамидом (60 мг/кг и/п). T-клетки давали в дозе, составляющей 10×106, в/в в трех различных дозах на дни 5, 9, 16. Циклофосфамид давали на дни 8 и 14. Комбинация циклофосфамида и РНК-модифицированных CART33 приводила к улучшению контроля лейкоза по сравнению с контрольными мышами.
ОБСУЖДЕНИЕ
В данном примере детектировали предклиническую активность и безопасность CART33 при ОМЛ, и разрабатывали и проверяли временную экспрессию CART33 в качестве способа предотвращения токсичности при использовании у пациентов с рефрактерным ОМЛ. Это первый подробный предклинический отчет о активности CART33, который содержит исчерпывающие данные о выживаемости и токсичности на множестве мышиных моделей, а также противолейкозной активности РНК-модифицированных CART33. CART33 продемонстрировали сильные эффекторные функции против линии клеток ОМЛ и образцов первичного ОМЛ, включая специфический киллинг при низких отношениях E:T, дегрануляцию, значительную пролиферацию и устойчивое производство цитокинов, а также были активны при уменьшении клона МДС после только 4 часов инкубации при отношении 1:1.
Обработка с помощью CART33 также приводила к эрадикации ОМЛ и преимуществам по выживаемости для ксенотрансплантатов как MOLM14, так и первичного ОМЛ после одного введения. Ожидаемую миелоидную гематопоэтическую токсичность с CART33 наблюдали в двух различных гуманизированных мышиных моделях. Из-за потенциальной миелотоксичности и возможных проблем с экспрессией CD33 на резидентных макрофагах ткани были разработаны РНК-модифицированные CART33, и была продемонстрирована сильная, но временная in vitro активность. Также был продемонстрирован противолейкозный эффект посредством комбинации РНК-CART33 и химиотерапии.
Эксперименты, описанные в настоящем документе и в примере 1, также продемонстрировали, что использование шарнира IgG4 оказалось лучше, чем использование шарнира CD8 с CART33. Молекула IgG4 значительно отличается от молекулы CD8. Она содержит в три раза больше аминокислот, что может приводить к более гибкому шарниру.
Ожидали гематопоэтическую токсичность и уменьшение количества миелоидных предшественников, а также цитопению периферической крови, наблюдаемые с CART33 в этих предклинических исследованиях, на основании экспрессии CD33 на лейкозных, а также миелоидных предшественниках.
Возможность нецелевой токсичности при использовании CART33 требует включения временно экспрессируемой, а не постоянной анти-CD33 терапии в клинических исследованиях. РНК-модифицированные CAR использовали в предклинических моделях (Barrett et al., 2013, Hum Gene Ther, 24:717-727; и Barrett et al., 2011, Hum Gene Ther, 22:1575-1586), и исследование фазы I РНК-модифицированных антимезотилиновых T-клеток с CAR у пациентов с солидной опухолью продемонстрировало, что этот подход является безопасным и целесообразным (Beatty et al., 2014, рак Immunol Res, 2:112-120). Поэтому были разработаны РНК-модифицированные CART33 в качестве способа временной экспрессии "биоразлагаемых" CAR для ослабления возможной нецелевой токсичности CART33.
Поскольку недавние более масштабные клинические исследования продемонстрировали преимущества по выживаемости при комбинации GO с химиотерапией при низком и промежуточном риске заболевания (Hills et al., 2014, Lancet Oncol., 15:986-996), протестировали эффективность комбинации нескольких вливаний РНК-модифицированных CART33 с химиотерапией в мышиных ксенотрансплантатах ОМЛ (фигура 45). Эта комбинация приводила к более глубоким и продолжительным реакциям и к преимуществам по выживаемости для этих мышей.
Эти наблюдения выделяют несколько потенциальных трансляционных применений РНК-модифицированных CART33. Их можно использовать отдельно или в комбинации с химиотерапией у пациентов с рецидивирующим рефрактерным ОМЛ, которые не могут подвергаться трансплантации аллогенных стволовых клеток, для придания им возможности трансплантации. Кроме того, РНК-модифицированные CART33 можно включать в кондиционирующие схемы перед трансплантацией аллогенных стволовых клеток. Поскольку безопасность и реализуемость этого подхода у пациентов были продемонстрированы, последующие стратегии могут включать в себя лентивирусные CART33 с "выключателем". Кроме того, открытие того, что как CART33, так и CART123 эффективны против ОМЛ, открывает новые терапевтические горизонты в комбинированной таргетной клеточной терапии.
Пример 7: Применение терапии T-клетками с химерным антигенным рецептором против супрессорных клеток миелоидного происхождения (MDSC) при раке
Недавние данные показывают, что окружение костного мозга при миелодиспластическом синдроме (МДС) содержит популяцию CD33-экспрессирующих супрессорных клеток миелоидного происхождения (MDSC), которые играют важную роль в патогенезе МДС посредством секреции цитокинов, которые способствуют неэффективному гемопоэзу, а также иммуносупрессии (Chen et al. J. Clin. Investig. 23(2013): 21-223). Chen et al. описывают, что MDSC играют роль в индуцировании миелодисплазии посредством взаимодействия CD33-S100A9. Данный пример описывает эксперименты для определения, можно ли воздействовать на MDSC с помощью терапии T-клетками с CAR против CD33. Результаты, описанные в настоящем документе, показывают, что как на клоны аномального МДС, так и на поддерживающую их популяцию MDSC можно воздействовать одновременно с помощью одного T-клеточного продукта с CAR против CD33.
MDSC были фенотипированы на 4 МДС и 3 нормальных образца костного мозга (фигуры 50A, 50B, и 50C). Для фенотипирования осуществляли проточную цитометрию с использованием следующей стратегии гейтирования: MDSC определяли как отрицательные по линии дифференцировки (LIN-), HLA-DR-отрицательные, CD33-положительные клетки в образцах костного мозга МДС (фигура 50A). MDSC были шире распространены в диспластическом костном мозге (МДС-КМ), чем в нормальном костном мозге (НД-КМ) (фигура 50B). Кроме того, средняя интенсивность флуоресценции (MFI) CD33 в популяции MDSC оказалась сравнимой с MFI CD33 в популяции злокачественного МДС и оказалась значительно выше, чем MFI CD33 в популяции huCD45+LIN- из НД-КМ (фигура 50C). Таким образом, экспрессия CD33 в MDSC оказалась сравнимой с его экспрессией в популяции злокачественного МДС и оказалась значительно выше, чем его экспрессия в нормальном костном мозге. Способность CART33 вызывать ответ на МДС-бласты и на MDSC из костного мозга с МДС оценивали посредством количественной оценки степени дегрануляции по CD107a и производства цитокинов клетками CART33. CART33 инкубировали в течение четырех часов с отрицательным контролем (клетки Jurkat), положительным контролем (PMA и иономицин), отсортированными CD34+ МДС или отсортированными MDSC из костного мозга МДС. С использованием конструкта CAR33-UPenn (происходящего от анти-CD33 scFv гемтузумаба озогамицина) было обнаружено, что CD34 МДС клетки и MDSC индуцировали в целом эквивалентные ответы в CART33 (фигуры 51A и 51B). Эти результаты указывают на то, что CART-33, имеющие меньшую аффинность, могут иметь дифференциальную активность против MDSC.
MDSC также играют роль в резистентности к иммунной атаке множества других злокачественных опухолей, включая хронический лимфоцитарный лейкоз (ХЛЛ) (где они известны как клетки-няни), а также солидные злокачественные опухоли, такие как рак яичников, рак молочной железы и толстой кишки (Di Mitri et al. Nature 515,7525(2014):134-137; Gabrilovich et al. Nat. Reviews Immunol. 12,4(2012):253-68; и Kim et al. Proc. Acad. Sci. U.S.A. 111,32(2014):1-6). Эти результаты демонстрируют, что на MDSC можно воздействовать с помощью CART33 или отдельно, или в комбинации с другими иммунотерапиями.
Пример 8: Низкая доза RAD001 стимулирует пролиферацию CART в модели клеточной культуры
Оценивали воздействие низких доз RAD001 на пролиферацию T-клеток с CAR in vitro посредством совместного культивирования CART-экспрессирующих клеток с клетками-мишенями в присутствии различных концентраций RAD001.
Материалы и методы
Генерация CAR-трансдуцированных T-клеток
Лентивирусный вектор переноса с гуманизированным античеловеческим CAR к CD19 (huCART19) использовали для получения геномного материала, упакованного в псевдотипированные VSVg лентивирусные частицы. Аминокислотной и нуклеотидной последовательностью гуманизированного античеловеческий CAR к CD19 (huCART19) является CAR 1, ID 104875, описанный в публикации PCT, WO2014/153270, поданной 15 марта 2014 года, и обозначенный в ней SEQ ID NO. 85 и 31.
Лентивирусный вектор переноса ДНК смешивают с тремя компонентами упаковки VSVg env, gag/pol и rev в комбинации с реагентом липофектамином для переноса клеток Lenti-X 293T. Среду заменяют через 24 ч и 30 ч после этого, вирус-содержащую среду отбирают, фильтруют и сохраняют при -80°C. CART генерируют посредством трансдукции свежих или замороженных наивных T-клеток, полученный посредством отрицательной магнитной селекции крови или лейкопака здорового донора. T-клетки активируют посредством инкубации с анти-CD3/анти-CD28 гранулами в течение 24 ч, после чего к культурам добавляют вирусный супернатант или концентрированный вирус (MOI=2 или 10, соответственно). Модифицированным T-клеткам дают размножаться в течение приблизительно 10 дней. Процентную долю трансдуцированных (экспрессирующих CAR на клеточной поверхности) клеток и уровень экспрессии CAR (относительную интенсивность флуоресценции, Geo Mean) определяют посредством анализа с помощью проточной цитометрии между днями 7 и 9. Комбинация замедления скорости роста и приближения размера T-клеток к ~350 фл определяет состояние для криосохранения T-клеток для последующего анализа.
Оценка пролиферации CART
Для оценки функциональных свойств CART T-клетки оттаивают и подсчитывают, и оценивают жизнеспособность с помощью Cellometer. Количество CAR-положительных клеток в каждой культуре нормализуют с использованием нетрансдуцированных T-клеток (UTD). Воздействие RAD001 на CART тестировали титрованием RAD001, начиная с 50 нМ. Линией клеток-мишеней, используемой во всех экспериментах по совместному культивированию, является Nalm-6, линия клеток человеческого пре-B-клеточного острого лимфобластного лейкоза (ОЛЛ), экспрессирующая CD19 и трансдуцированная для экспрессии люциферазы.
Для измерения пролиферации CART T-клетки культивируют с клетками-мишенями при отношении, составляющем 1:1. Анализ выполняют в течение 4 дней, когда клетки окрашивают на экспрессию CD3, CD4, CD8 и CAR. Количество T-клеток оценивают с помощью проточной цитометрии с использованием гранул для подсчета в качестве эталона.
Результаты
Пролиферативную способность CART-клеток тестировали в 4-дневном анализе совместного культивирования. Количество CAR-положительных CD3-положительных T-клеток (темные столбцы) и всех CD3-положительных T-клеток (светлые столбцы) оценивали после культивирования CAR-трансдуцированных и нетрансдуцированных T-клеток с Nalm-6 (фиг. 54). Клетки huCART19 размножали при культивировании в присутствии меньше чем 0,016 нМ RAD001 и в меньшей степени при более высоких концентрациях этого соединения. Важно, что как при 0,0032, так и при 0,016 нМ RAD001 пролиферация была выше, чем наблюдали без добавления RAD001. Нетрансдуцированные T-клетки (UTD) не демонстрировали детектируемого размножения.
Пример 9: Низкая доза RAD001 стимулирует размножение CART in vivo
Данный пример оценивает способность клеток huCAR19 к пролиферации in vivo при различных концентрациях RAD001.
Материалы и методы:
Клетки NALM6-luc: Была разработана линия клеток NALM6 человеческого острого лимфобластного лейкоза (ОЛЛ) из периферической крови пациента с рецидивирующим ОЛЛ. Затем клетки были помечены люциферазой светлячка. Эти суспендированные клетки выращивают в RPMI, дополненной 10% термически инактивированной фетальной бычьей сыворотки.
Мыши: Мышей NSG (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) возрастом 6 недель получали из Jackson Laboratory (артикул 005557).
Имплантация опухоли: Клетки NALM6-luc выращивали и размножали in vitro в RPMI, дополненной 10% термически инактивированной фетальной бычьей сывороткой. Затем клетки переносили в коническую пробирку объемом 15 мл и дважды промывали холодным стерильным ФСБ. Затем клетки NALM6-luc подсчитывали и ресуспендировали при концентрации, составляющей 10×106 клеток на миллилитр ФСБ. Клетки помещали на лед и немедленно (в течение одного часа) имплантировали мышам. Клетки NALM6-luc инъецировали внутривенно через хвостовую вену в объеме 100 мкл в количестве в общей сложности 1×106 клеток на мышь.
Дозирование T-клеток с CAR: Мышам вводили 5×106 T-клеток с CAR через 7 дней после имплантации опухоли. Клетки частично оттаивали на водяной бане при 37 градусов Цельсия и затем полностью оттаивали посредством добавления в пробирку, содержащую клетки, 1 мл холодного стерильного ФСБ. Оттаявшие клетки переносили в пробирку falcon объемом 15 мл и доводили до конечного объема, составляющего 10 мл, с помощью ФСБ. Клетки дважды промывали при 1000 об/мин в течение 10 минут каждый раз и затем подсчитывали на гемоцитометре. Затем T-клетки ресуспендировали при концентрации, составляющей 50×106 T-клеток с CAR на мл холодного ФСБ, и сохраняли на льду до дозирования мышам. Мышам инъецировали внутривенно через хвостовую вену 100 мкл T-клеток с CAR для получения дозы, составляющей 5×106 T-клеток с CAR на мышь. Восемь мышей на группу обрабатывали или только с помощью 100 мкл ФСБ (ФСБ), или гуманизированными T-клетками с CD19-CAR.
Дозирование RAD001: Составляли концентрированную микроэмульсию объемом 50 мг, что эквивалентно 1 мг RAD001, и затем ресуспендировали в D5W (декстроза 5% в воде) во время дозирования. Мышам ежедневно перорально (через желудочный зонд) дозировали 200 мкл желаемых доз RAD001.
ФК-анализ: Мышам ежедневно дозировали RAD001, начиная с 7 дней после имплантации опухоли. Группы дозирования были следующими: 0,3 мг/кг, 1 мг/кг, 3 мг/кг и 10 мг/кг. Мышам делали кровопускание на дни 0 и 14 после первой и последней дозы RAD001 в следующие временные точки для ФК-анализа: 15 минут, 30 минут, 1 час, 2 часа, 4 часа, 8 часов, 12 часов и 24 часа.
Результаты:
Распространение и фармакокинетику RAD001 тестировали в мышах NSG с опухолями NALM6-luc. Ежедневное пероральное дозирование только RAD001 не оказывало воздействия на рост опухолей NALM6-luc (фигура 55). Фармакокинетический анализ RAD001 показывает, что он достаточно стабилен в крови несущих опухоль мышей (фигура 56A и 56B). Как на день 0, так и на день 14 ФК-анализы показывают, что концентрации RAD001 в крови выше 10 нм даже через 24 часа после дозирования при наиболее низкой протестированной дозе (0,3 мг/кг).
На основании этих доз T-клетки с CAR huCAR19 дозировали с RAD001 и без него для определения пролиферативной способности этих клеток. Наивысшая используемая доза составляла 3 мг/кг на основании уровней RAD001 в крови через 24 часа после дозирования. Поскольку концентрация RAD001 была выше 10 нМ через 24 часа после итоговой дозы RAD001, несколько более низкие дозы RAD001 использовали в in vivo исследовании с T-клетками с CAR. T-клетки с CAR дозировали в/в за один день до начала ежедневного перорального RAD001 дозирования. За размножением T-клеток у мышей следили посредством FACS.
Наиболее низкие дозы RAD001 показывают усиление пролиферации T-клеток с CAR (фигура 57). Это усиление пролиферации является более очевидным и продолжительным для CD4+ T-клеток с CAR, чем для CD8+ T-клеток с CAR. При этом для CD8+ T-клеток с CAR усиление пролиферации можно наблюдать в ранние временные точки после дозы T-клеток с CAR.
Пример 10: Противоопухолевая активность трансдуцированных CAR к CD33 T-клеток in vivo
HL-60 представляет собой линию клеток человеческого острого промиелоцитарного лейкоза, выделенную из периферической крови 36 кавказской женщины-пациента с ОМЛ, и ее можно выращивать в виде ксенотрансплантата в иммунологически скомпрометированных мышах. Этот ксенотрансплантат имитирует заболевание в костном мозге, наблюдаемое у людей, образуя модель, с помощью которой тестируют эффективность терапий ОМЛ в костях. Этих мышей можно использовать для тестирования эффективности T-клеток с химерным антигенным рецептором (CAR), специфических к клеточным маркерам, обнаруживаемым на клетках острого миелоидного (или промиелоцитарного) лейкоза, таких как CD33 (Siglec-3).
HL-60 клетки помечали репортерным геном люциферазы светлячка и использовали в ортотопической модели острого миелоидного лейкоза (ОМЛ) в мышах NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG) для тестирования эффективности T-клеток с CAR, специфических к CD33.
Экспрессию CD33 тестировали на HL-60 клетках, и эти клетки использовали в in vitro анализах, для того чтобы посмотреть на способность CD33-специфических T-клеток с CAR распознавать и реагировать на мишень. In vivo HL-60 клетки росли при имплантации внутривенно через хвостовую вену, и рост был ограничен главным образом костным мозгом. Через одну неделю после имплантации опухолевых клеток заболевание сдвигалось полностью в кости и начинало расти с экспоненциальной скоростью. При отсутствии лечения мыши начинают демонстрировать клинические симптомы и паралич задних конечностей через 4-6 недель после имплантации опухоли. Несколько клонов scFv CD33 из in vitro анализа тестировали в этой in vivo модели.
Материалы и методы:
Линия клеток HL-60: Линию HL-60 человеческих клеток ОМЛ разработали из периферической крови пациента с острым промиелоцитарным лейкозом. Затем клетки были помечены с помощью люциферазы светлячка. Эти суспендированные клетки выращивали в RPMI, дополненной 10% термически инактивированной фетальной бычьей сывороткой.
Мыши: Мышей NSG (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) возрастом 6 недель получали из Jackson Laboratory (артикул 005557).
Имплантация опухоли: Клетки HL-60-luc выращивали и размножали in vitro в RPMI, дополненной 10% термически инактивированной фетальной бычьей сывороткой. Затем клетки переносили в коническую пробирку объемом 15 мл и дважды промывали холодным стерильным ФСБ. Затем клетки HL-60-luc подсчитывали и ресуспендировали при концентрации, составляющей 10×106 клеток на миллилитр ФСБ. Клетки помещали на лед и немедленно (в течение одного часа) имплантировали мышам. Клетки HL-60-luc инъецировали внутривенно через хвостовую вену в объеме 100 мкл в количестве в общей сложности 1×106 клеток на мышь.
Дозирование T-клеток с CAR: Мышам вводили 5×106 CAR+ T-клеток через 14 дней после имплантации опухоли. Имплантированные клетки росли в мышах медленно; за 14 дней они начали увеличивать скорость роста опухоли. Клетки частично оттаивали на водяной бане при 37 градусов Цельсия и затем полностью оттаивали посредством добавления в пробирку, содержащую клетки, 1 мл холодного стерильного ФСБ. Оттаявшие клетки переносили в пробирку falcon объемом 15 мл и доводили до конечного объема, составляющего 10 мл, с помощью ФСБ. Клетки дважды промывали при 1000 об/мин в течение 10 минут каждый раз и затем подсчитывали на гемоцитометре. T-клетки с CAR нормализовали по трансдукции CAR, так что каждая группа имела одинаковую процентную долю CAR+ T-клеток. Затем 5×106 CAR+ T-клеток ресуспендировали при концентрации, составляющей 50×106 CAR+ T-клеток на мл холодного ФСБ, и сохраняли на льду до дозирования мышам. Мышам инъецировали внутривенно через хвостовую вену 100 мкл T-клеток с CAR для получения дозы, составляющей 5×106 T-клеток с CAR на мышь.
Восемь мышей на группу обрабатывали только с помощью 100 мкл ФСБ (ФСБ), контрольных T-клеток с CD19-CAR (CD19), T-клеток с CAR CD33-1 (клон 1), T-клеток с CAR CD33-2 (клон 2), T-клеток с CAR CD33-4 (клон 4), T-клеток с CAR CD33-5 (клон 5), T-клеток с CAR CD33-6 (клон 6), T-клеток с CAR CD33-7 (клон 7) и T-клеток с CAR CD33-9 (клон 9). Все T-клетки были получены от одного и того же донора-человека параллельно.
Наблюдение за животными: Состояние здоровья мышей проверяли ежедневно, включая измерения веса тела два раза в неделю. Процентное изменение веса тела вычисляли как (BWcurrent-BWinitial)/(BWinitial)×100%. Опухолевую нагрузку проверяли два раза в неделю с помощью биолюминесцентной визуализации. Мышам внутрибрюшинно инъецировали D-люциферин за 10 минут до анестезии и визуализации мышей с помощью Xenogen. Нагрузку заболевания вычисляли посредством вычисления биолюминесценции опухолевых клеток (в фотонах в секунду).
Результаты:
Противоопухолевую активность семи CD33-CAR оценивали и непосредственно сравнивали с T-клетками с CAR, направленным против CD19, в модели HL-60 человеческого острого миелогенного лейкоза (ОМЛ). После имплантации опухоли на день 0 мышей рандомизировали по группам лечения и обрабатывали с помощью 5×106 CAR+ T-клеток внутривенно на день 7. Нагрузку заболевания ОМЛ и здоровье животных проверяли до тех пор, пока животные не достигали конечной точки. Мышей в контрольных группах ФСБ и T-клеток с CAR к CD19 умерщвляли на день 22 после дозирования T-клеток с CAR (29 дней после имплантации опухоли), когда нагрузка заболевания в контрольных группах приближалась к максимальной люминесценции по визуализации. Мышей в группах, обработанных T-клетками с CAR CD33-1, CD33-2, CD33-7 и CD33-9, умерщвляли на день 29 после дозирования T-клеток с CAR (36 дней после имплантации опухоли), когда нагрузка заболевания в этих группах достигала люминесценции, при которой умерщвляли контрольные группы. Мыши в группах, обработанных T-клетками с CAR CD33-4, CD33-5 и CD33-6 демонстрировали позднее снижение нагрузки заболевания.
Результат биолюминесцентной визуализации данного исследования показан на фигуре 58. Средняя биолюминесценция (+/- СОС) опухолевых клеток показывала нагрузку заболевания во всем животном. Она показана в фотонах в секунду (ф/с) в ROI (область интереса), которая представляла собой всю мышь. Группа обработки ФСБ, которая не получала никаких T-клеток, продемонстрировала исходный уровень кинетики роста опухоли HL-60 у внутривенно имплантированных мышей NSG. Группа обработки CD19 получала контрольные T-клетки с CAR, не специфические к клеткам HL-60, которые подвергались тому же процессу in vitro размножения, что и T-клетки с CAR к CD33. Эти клетки служили в качестве T-клеточного контроля для демонстрации неспецифического ответа T-клеток в данной модели опухоли. Группы обработки как ФСБ, так и T-клетками с CAR к CD19 продемонстрировали непрерывное прогрессирование опухоли на протяжении эксперимента. Все T-клетки с CAR к CD33 замедляли прогрессирование заболевания после инъекций 5×106 T-клеток с CAR, хотя клоны оказались разделены на две группы с различным ответом.
В этом исследовании эффективности на мышах NSG с ксенотрансплантатной моделью человеческого ОМЛ оценивали противоопухолевую активность T-клеток, трансдуцированных CAR к CD33. Эти исследования показывают, что модель HL-60-luc повторяла ОМЛ человека в мыши NSG и допускала воздействие на него T-клетками с CAR к CD33 (фигура 58). Рост ксенотрансплантата HL-60-luc человеческого ОМЛ в мышах NSG после обработки T-клетками с CAR, специфическими к CD33, демонстрирует задержку прогрессирования заболевания (фигура 58). Это исследование продемонстрировало, что семь CD33-CAR были способны вызывать противоопухолевый ответ в ксенотрансплантатной модели ОМЛ (фигура 58).
ЭКВИВАЛЕНТЫ
Раскрытия всех без исключения патентов, патентных заявок и публикаций, цитируемых в настоящем документе, настоящим включены в настоящий документ посредством ссылки во всей полноте. При том, что настоящее изобретение было раскрыто со ссылкой на конкретные аспекты, очевидно, что другие аспекты и вариации настоящего изобретения могут быть разработаны другими специалистами в данной области техники без отхода от сущности и объема настоящего изобретения. Прилагаемую формулу изобретения следует интерпретировать как включающую в себя все такие аспекты и эквивалентные изменения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К НЕКТИНУ-4 ЧЕЛОВЕКА | 2019 |
|
RU2825839C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ НЕКТИНА-2 ЧЕЛОВЕКА | 2020 |
|
RU2820275C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2708032C2 |
| КОНСТРУКЦИИ, НАПРАВЛЕННЫЕ НА КОМПЛЕКСЫ ПЕПТИДА AFP/МНС, И ВИДЫ ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2754041C2 |
| АНТИТЕЛА, СПЕЦИФИЧЕСКИЕ К РЕЦЕПТОРУ ПОЛИОВИРУСА (PVR) ЧЕЛОВЕКА | 2017 |
|
RU2756275C2 |
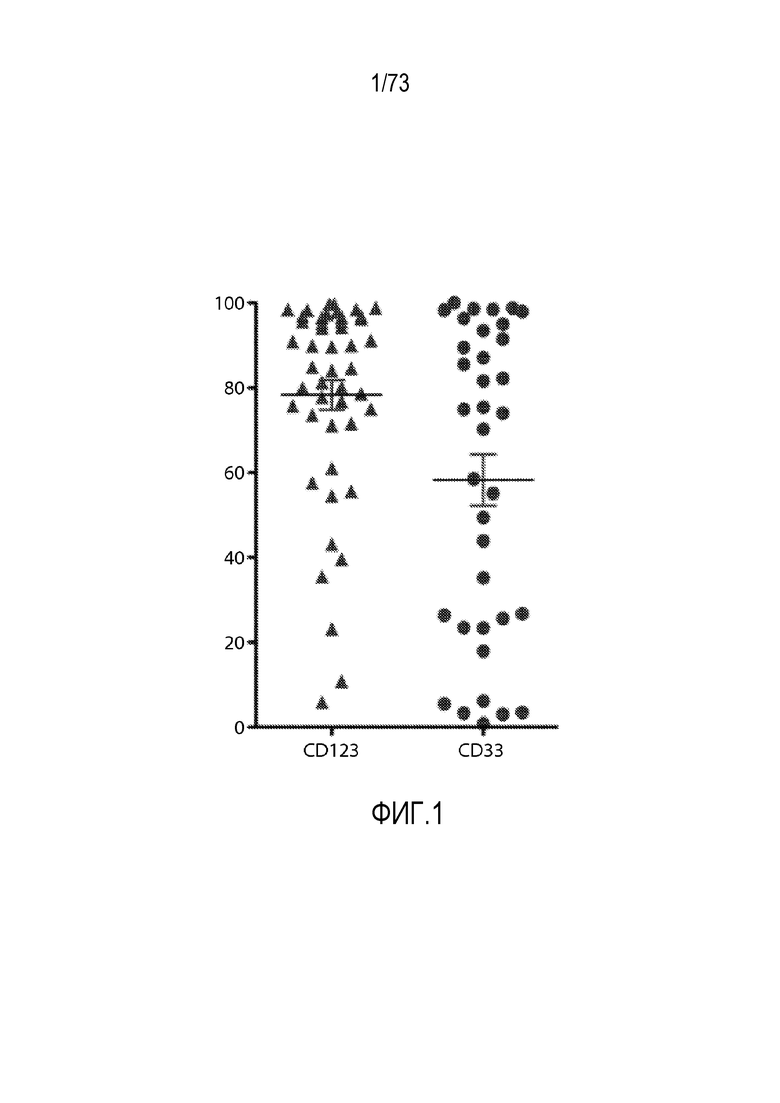
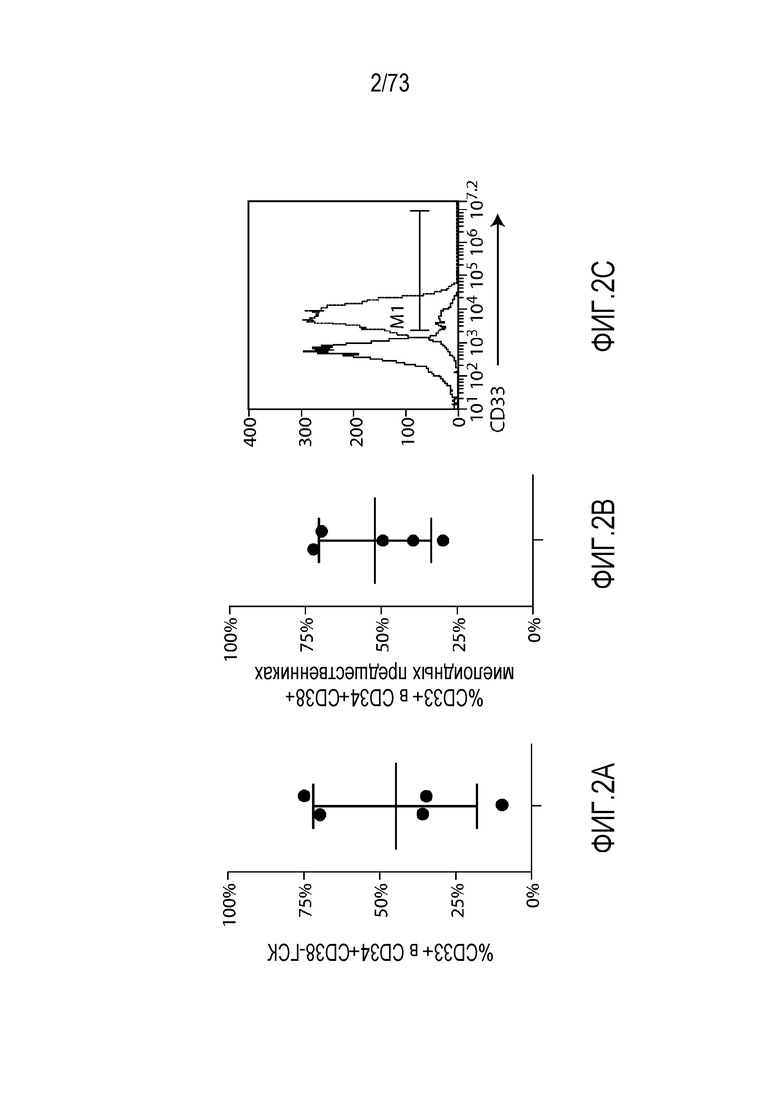

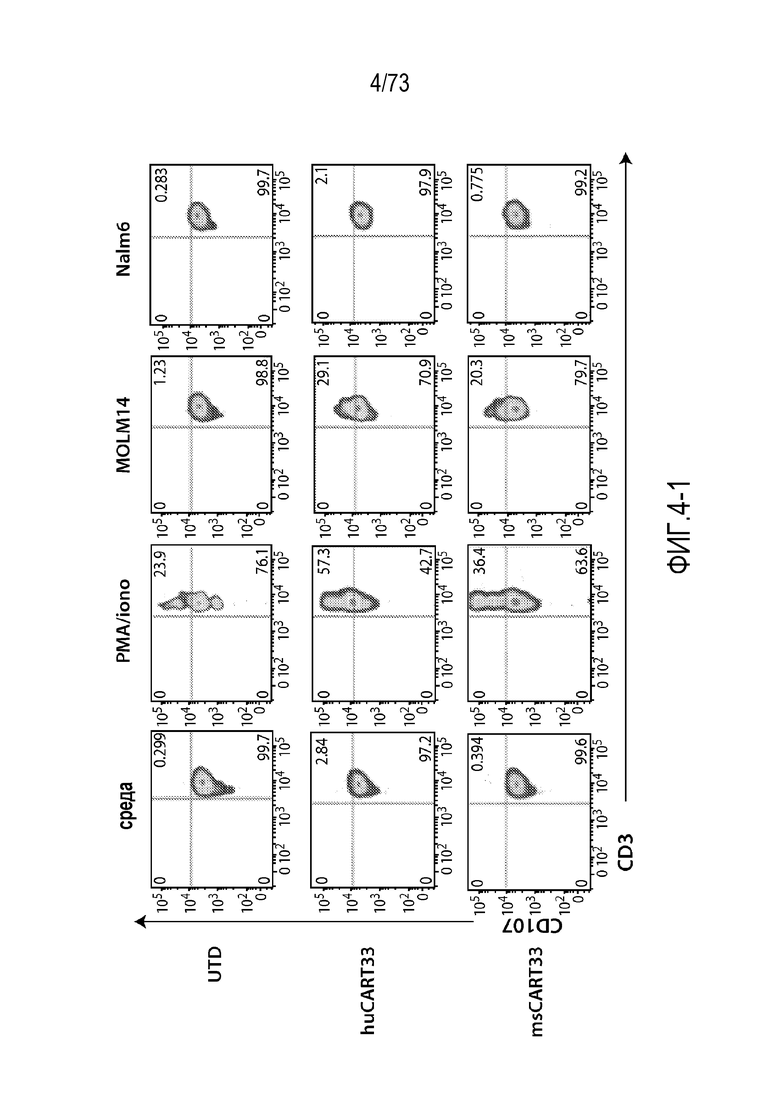
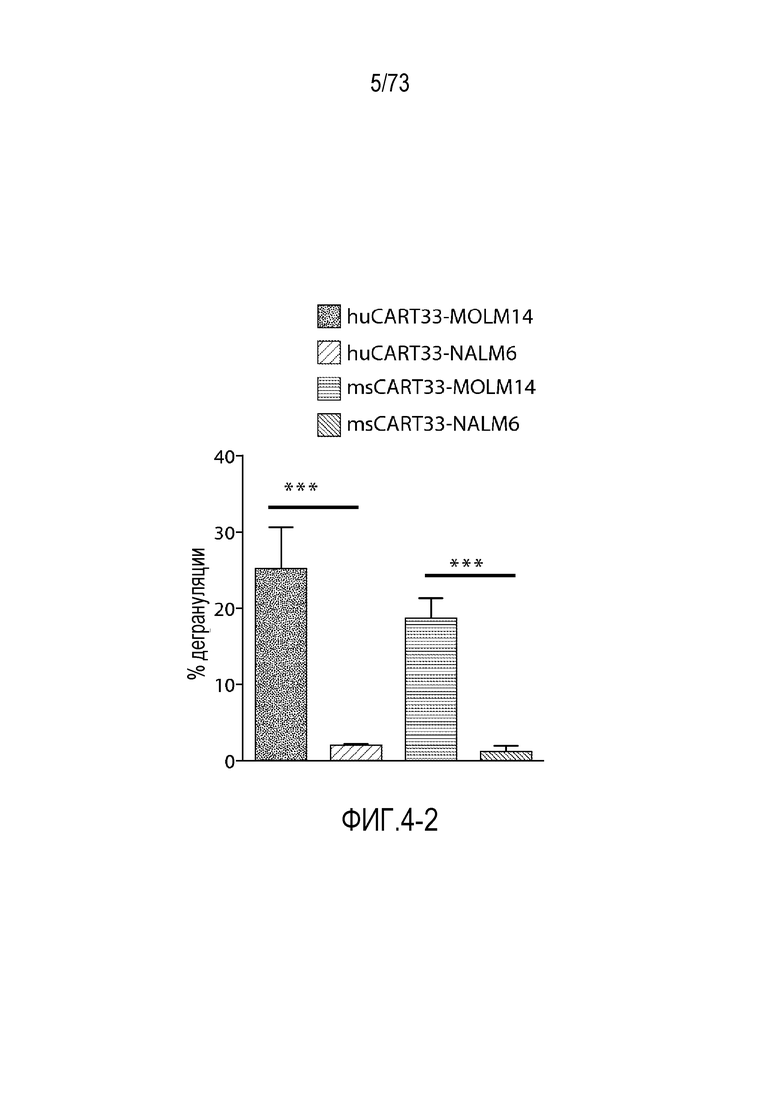


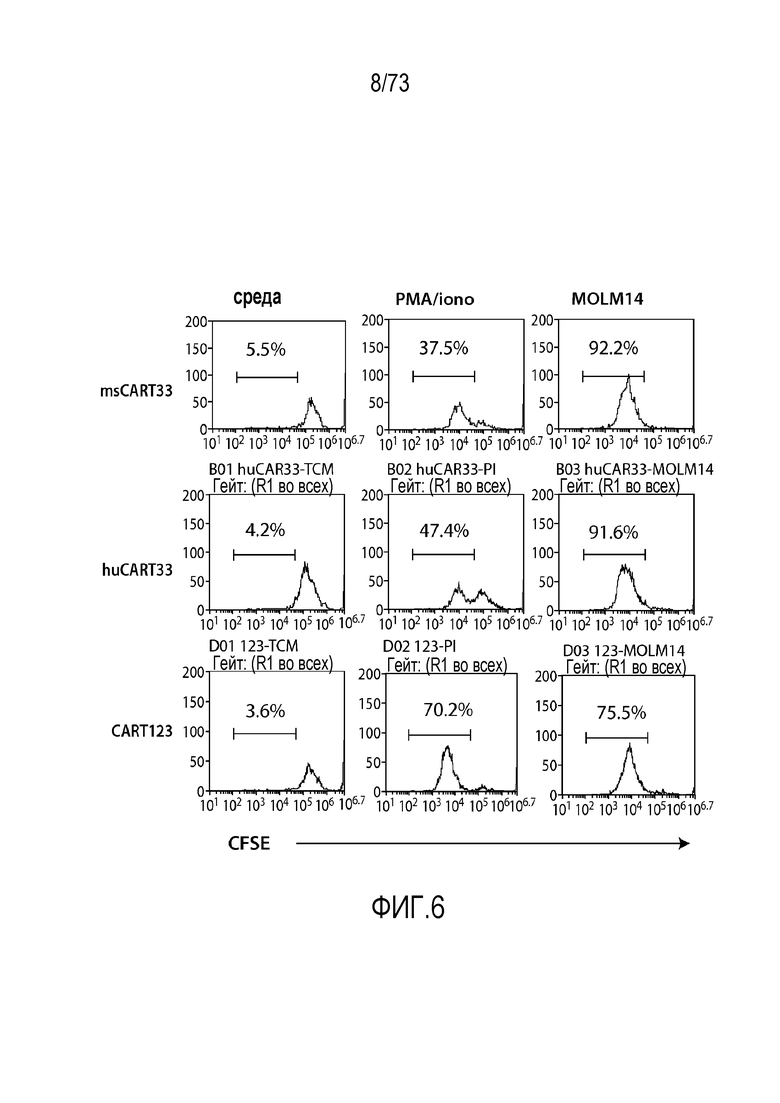
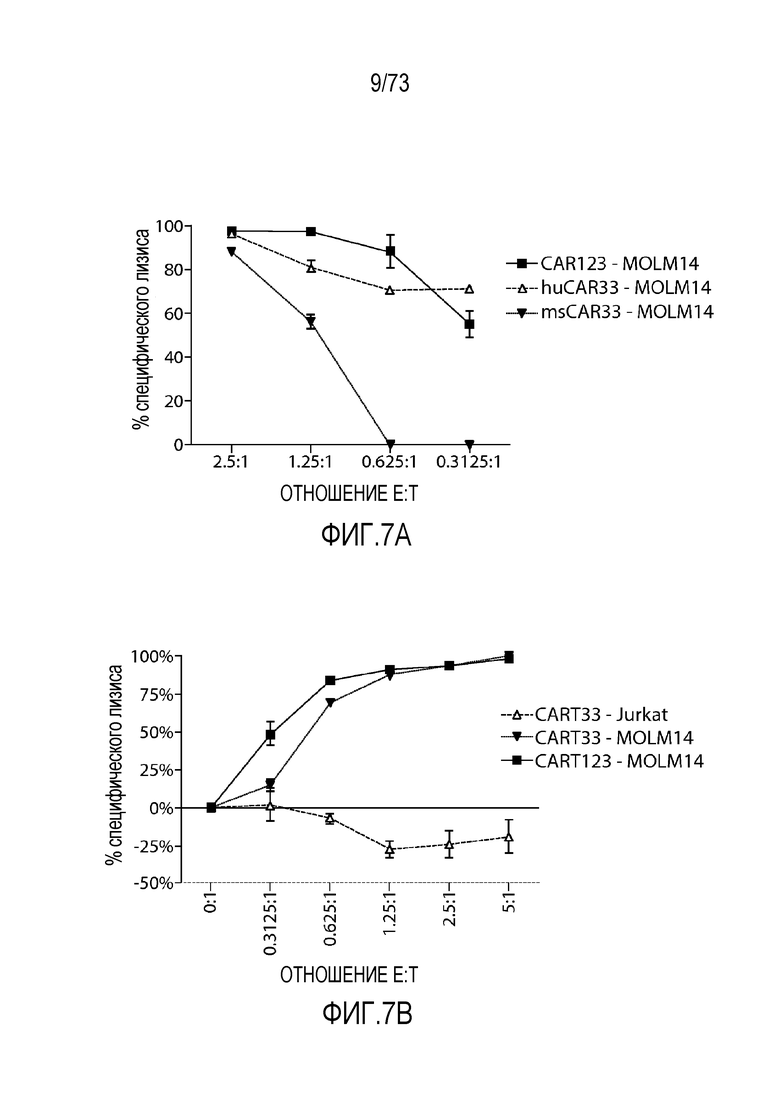
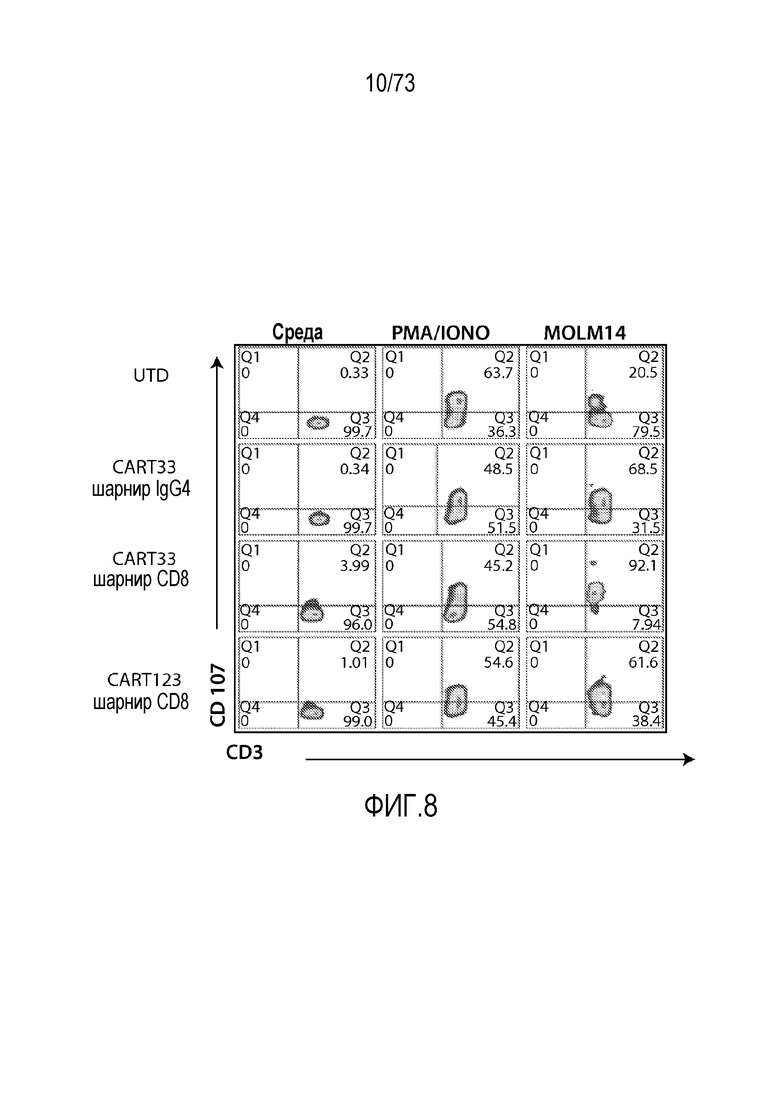
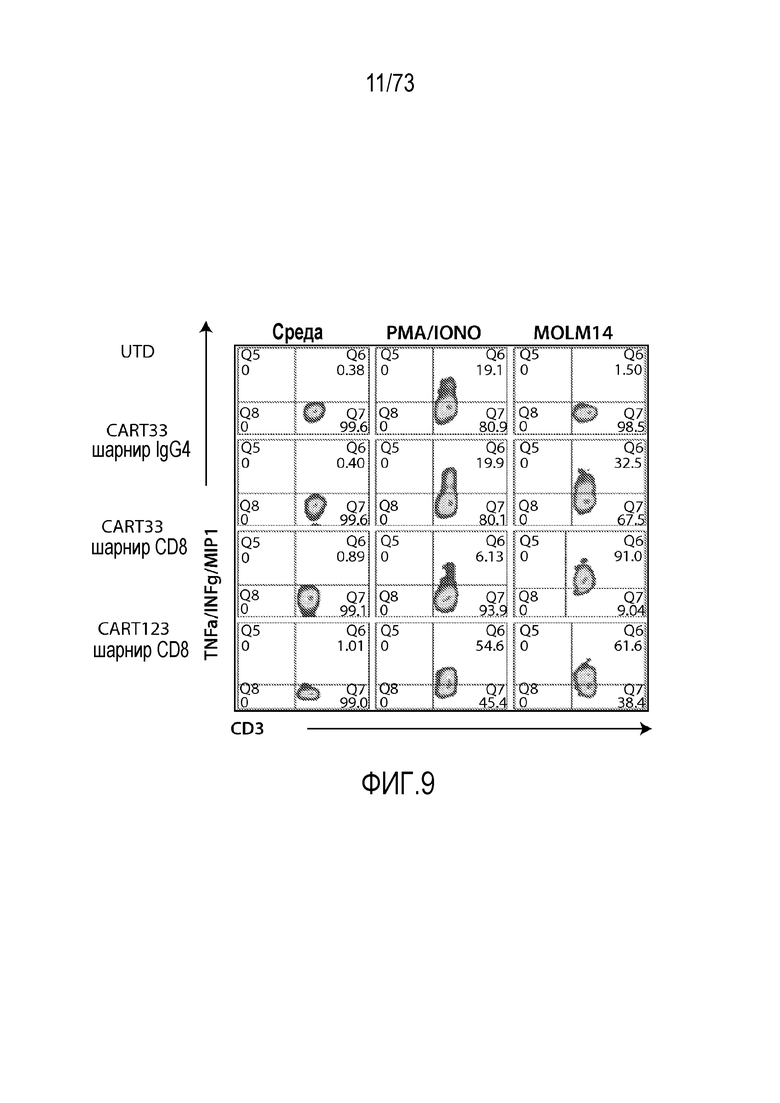
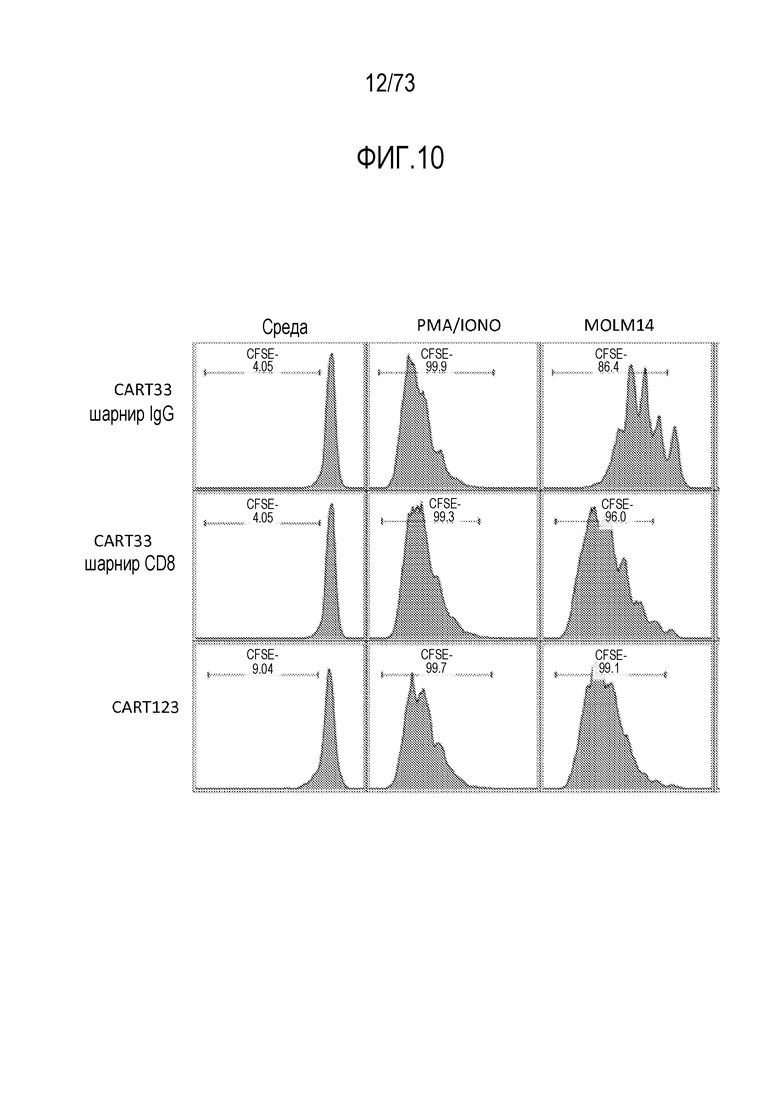

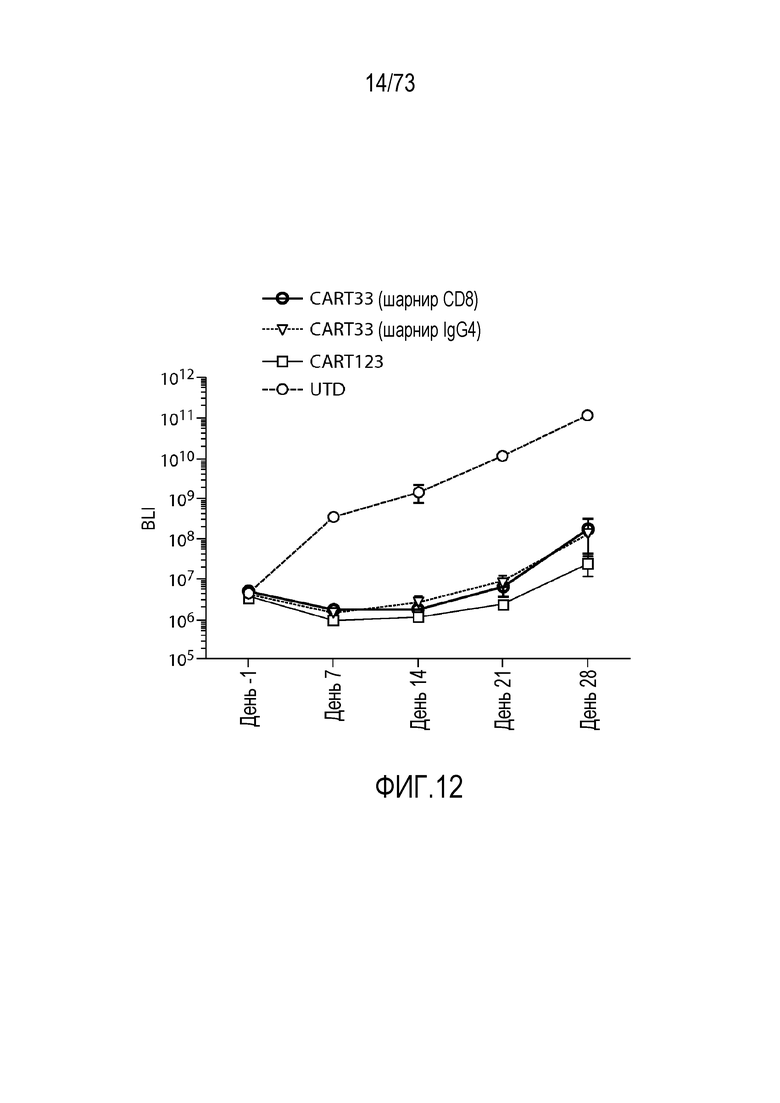
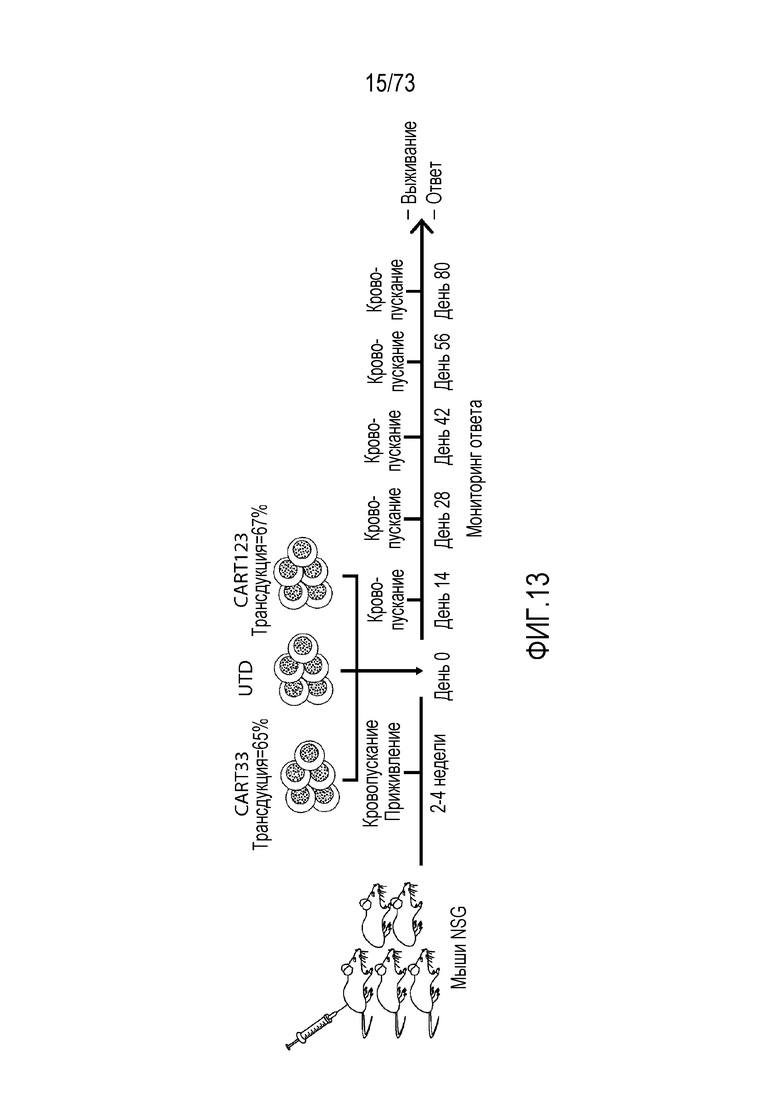

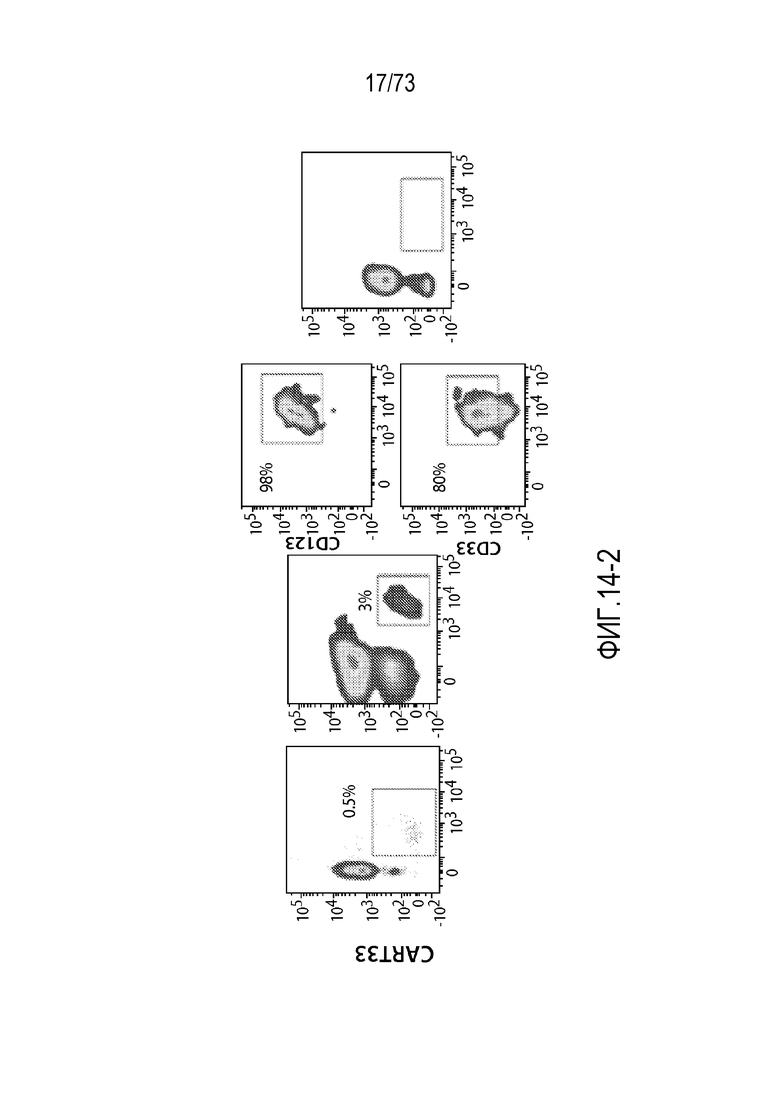
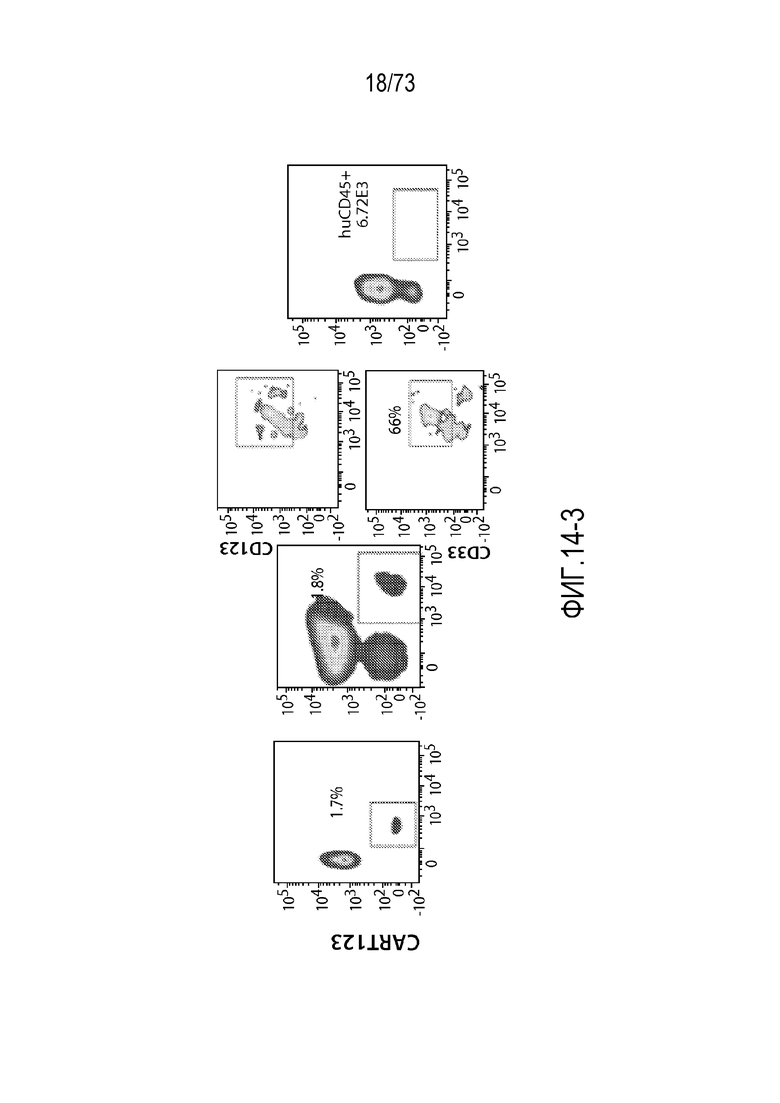

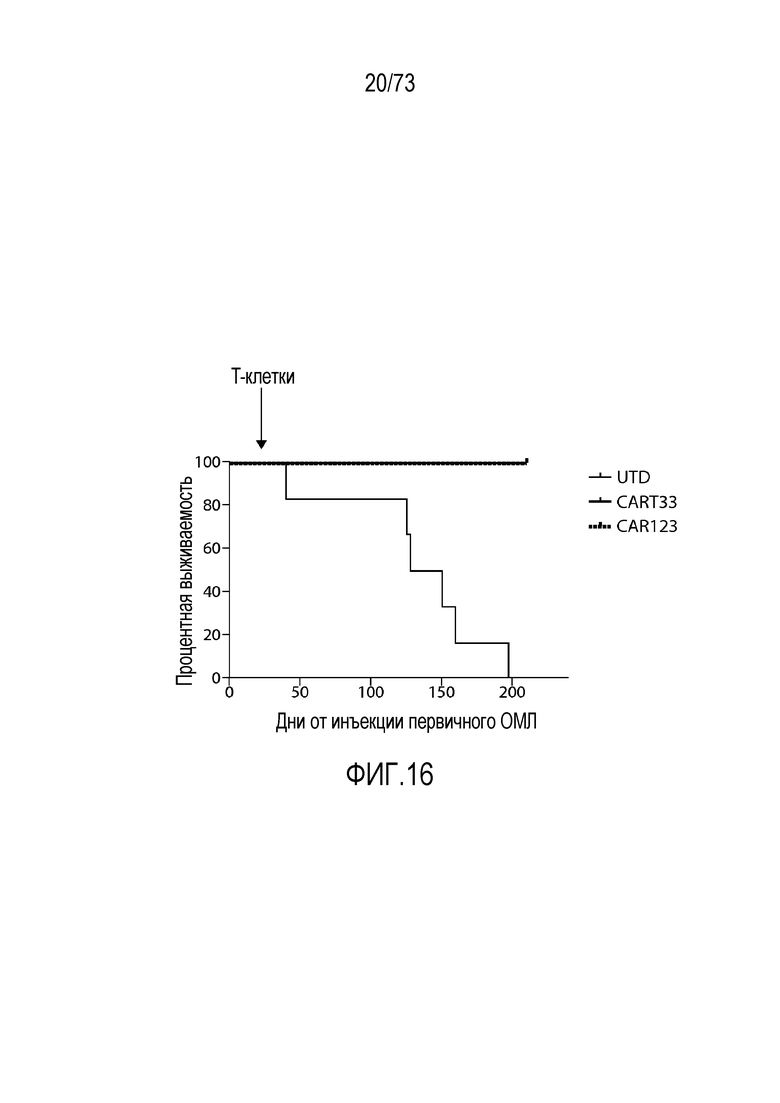
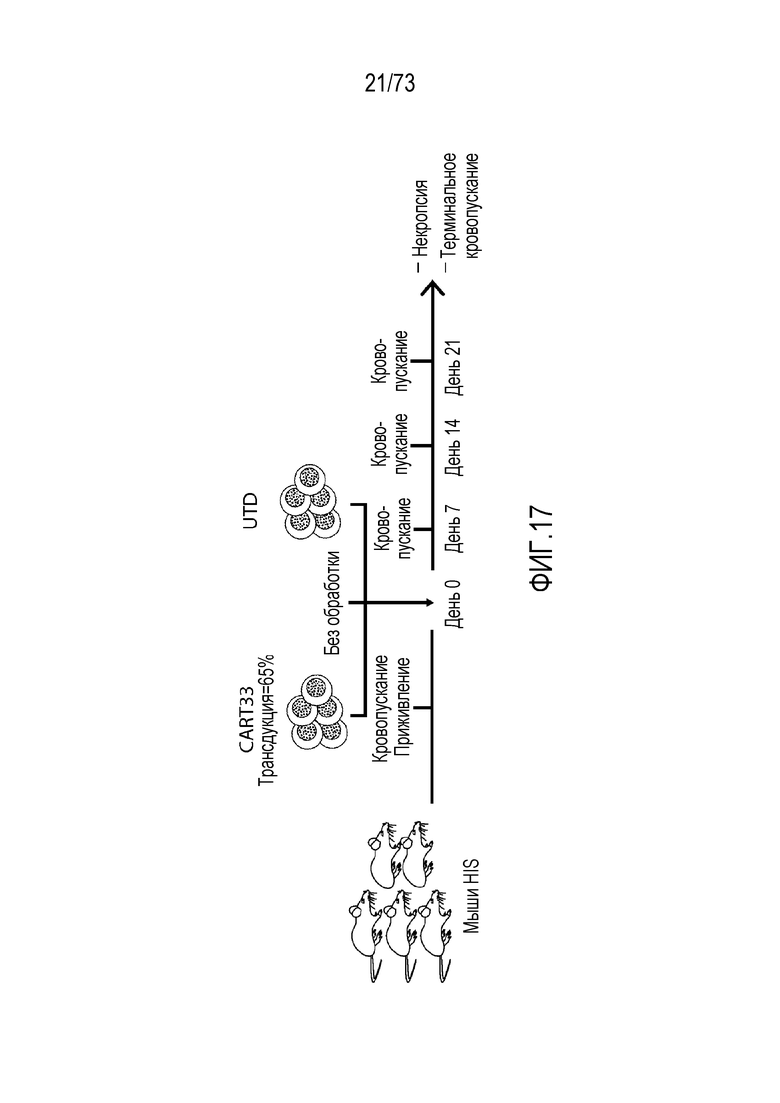
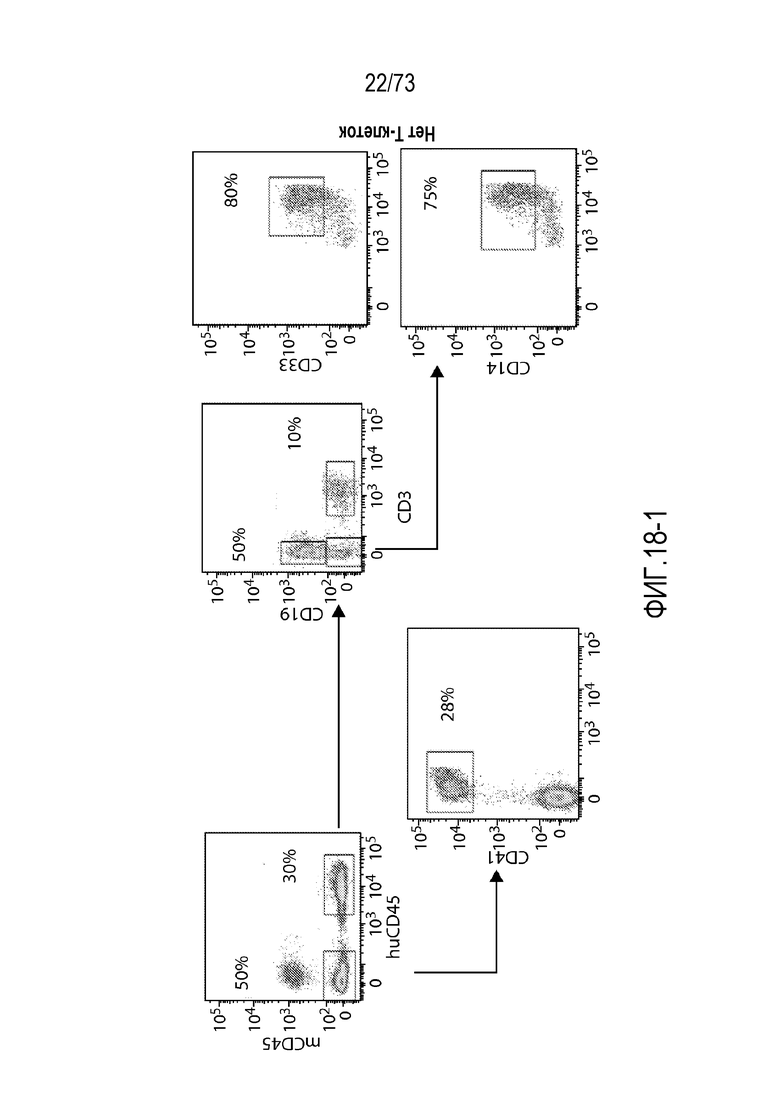
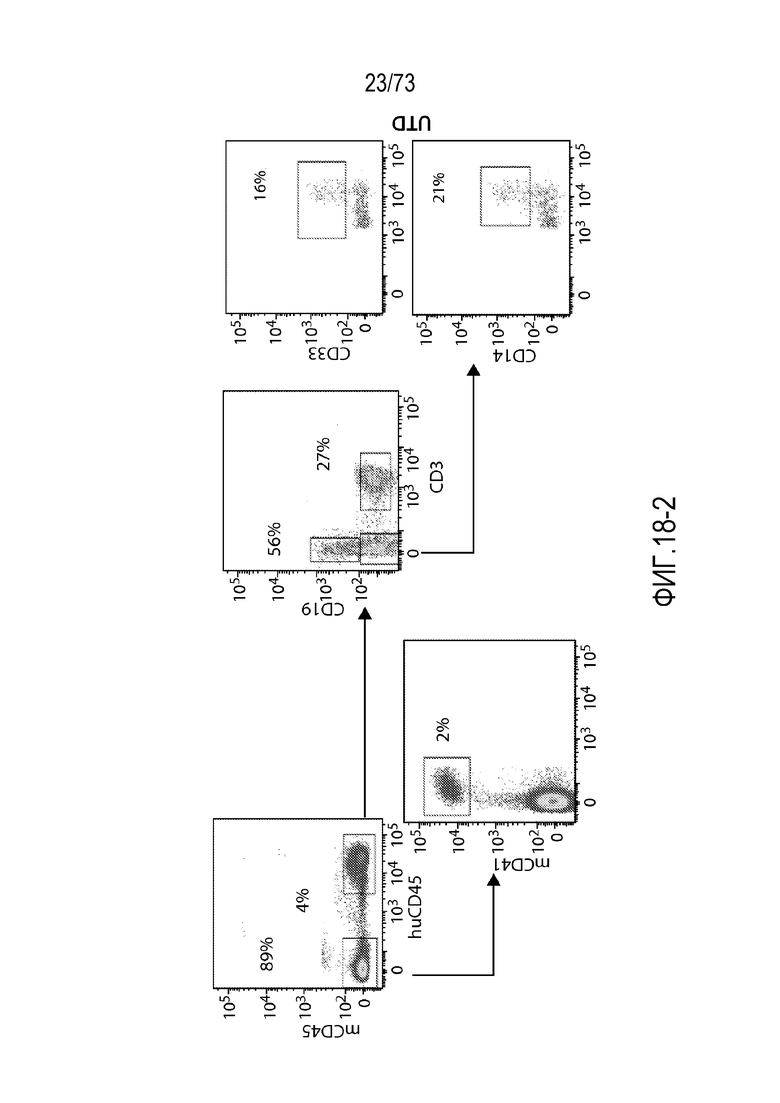
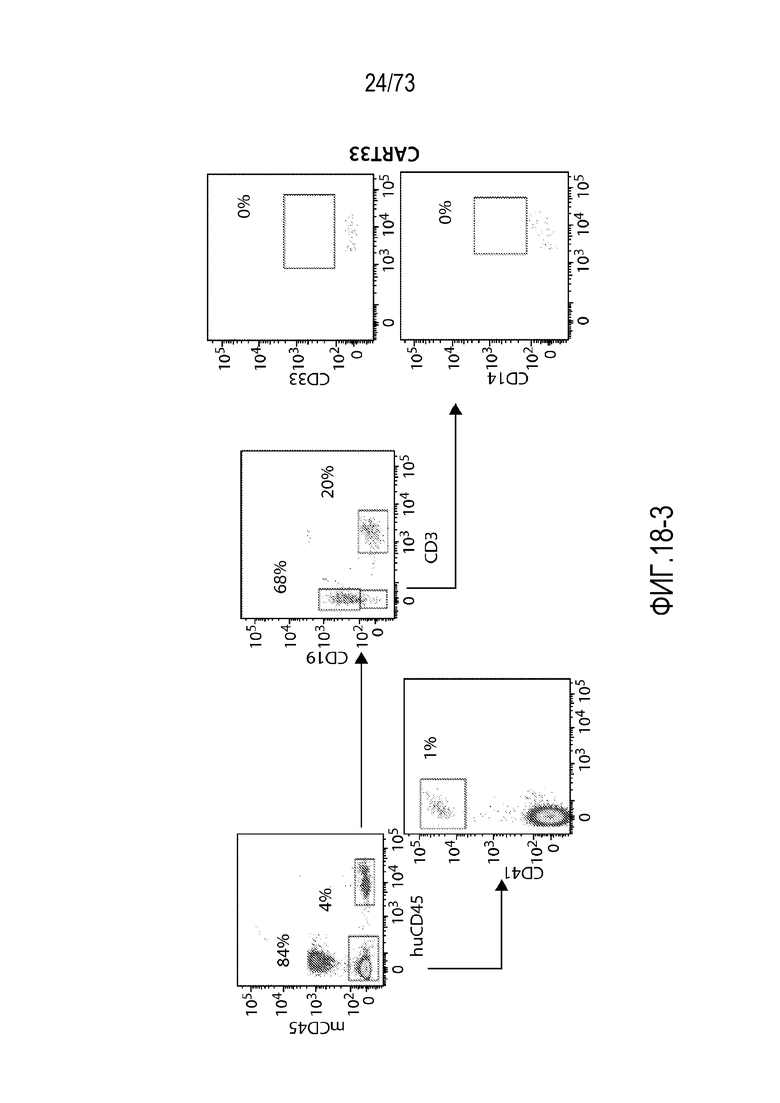
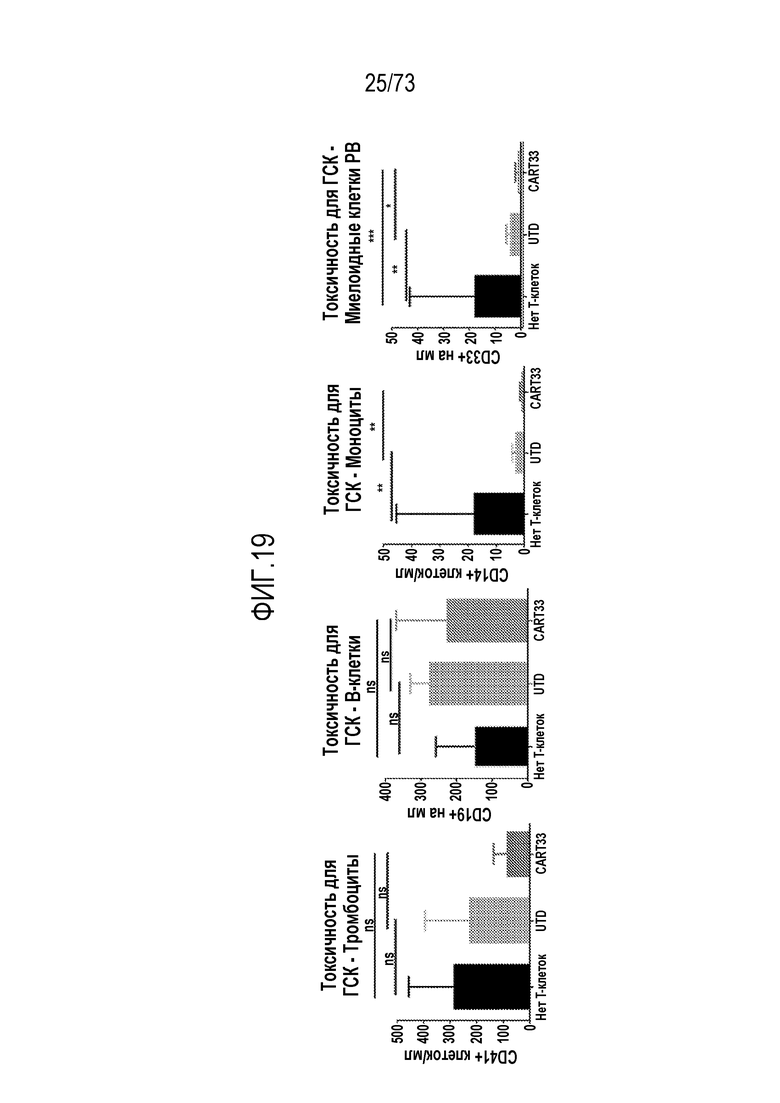

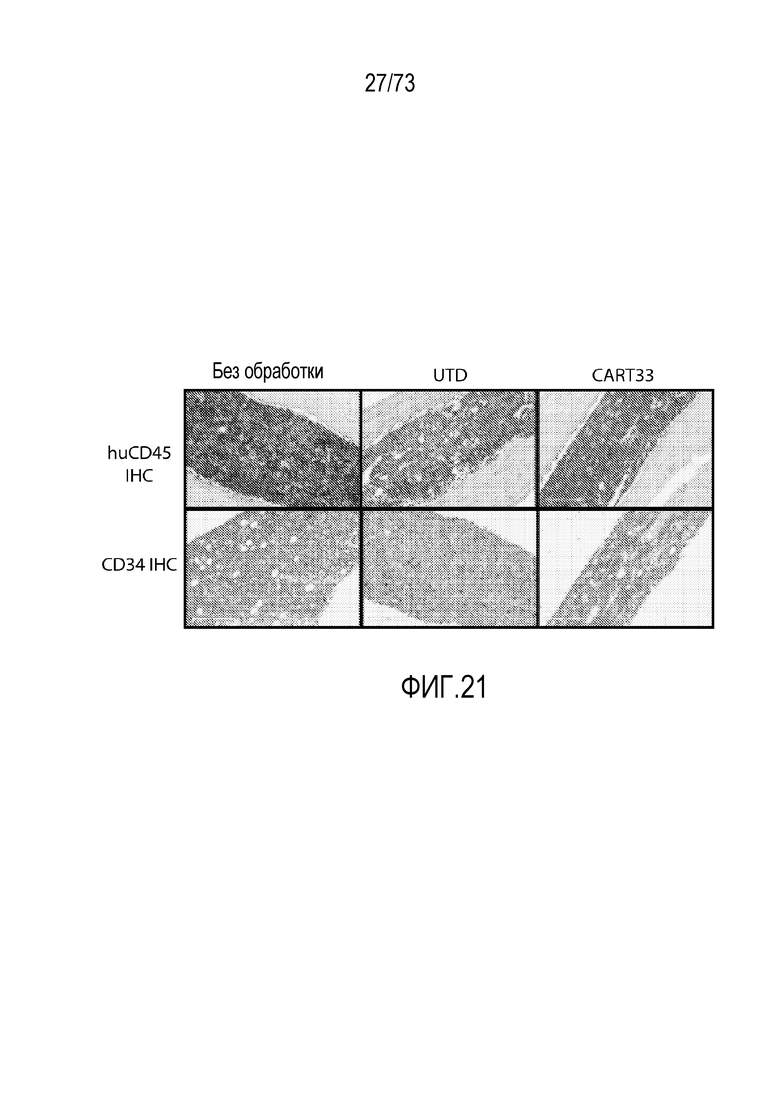
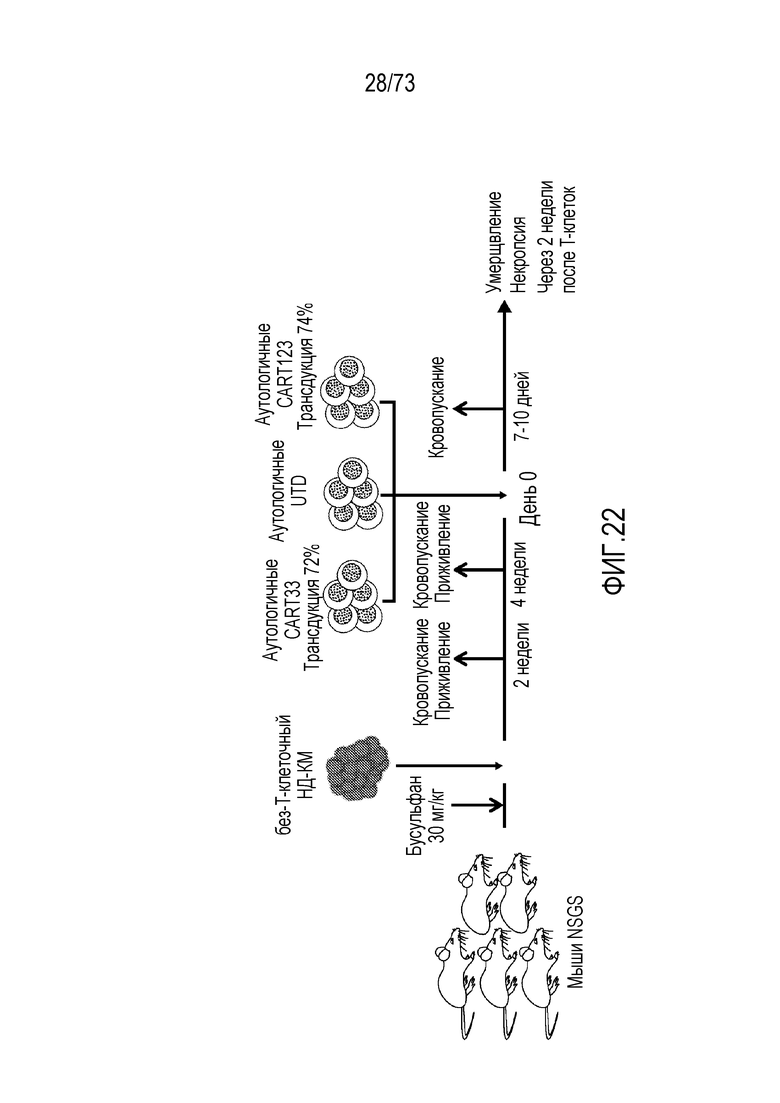

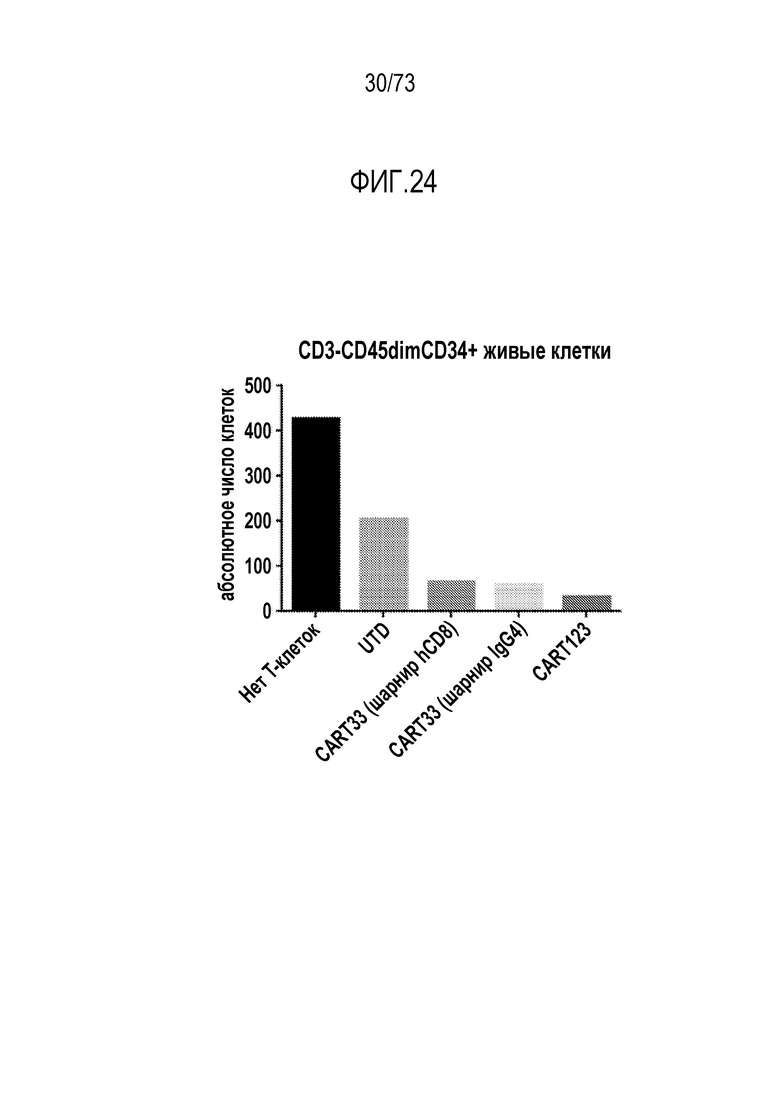

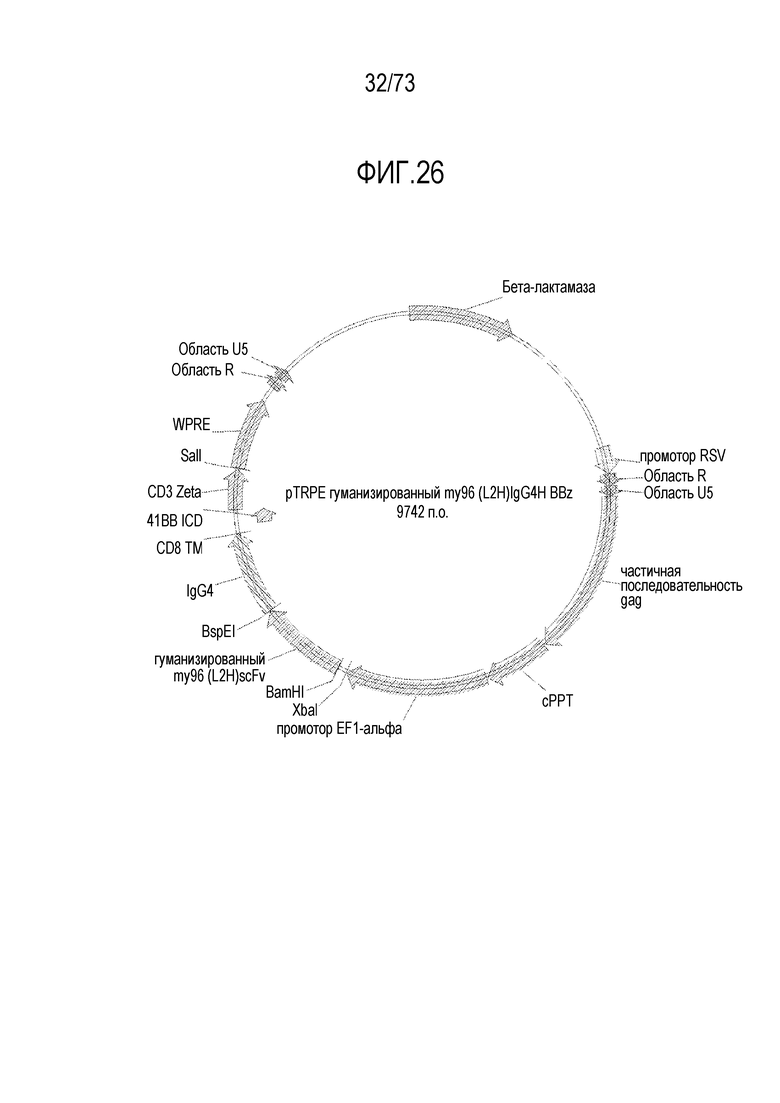
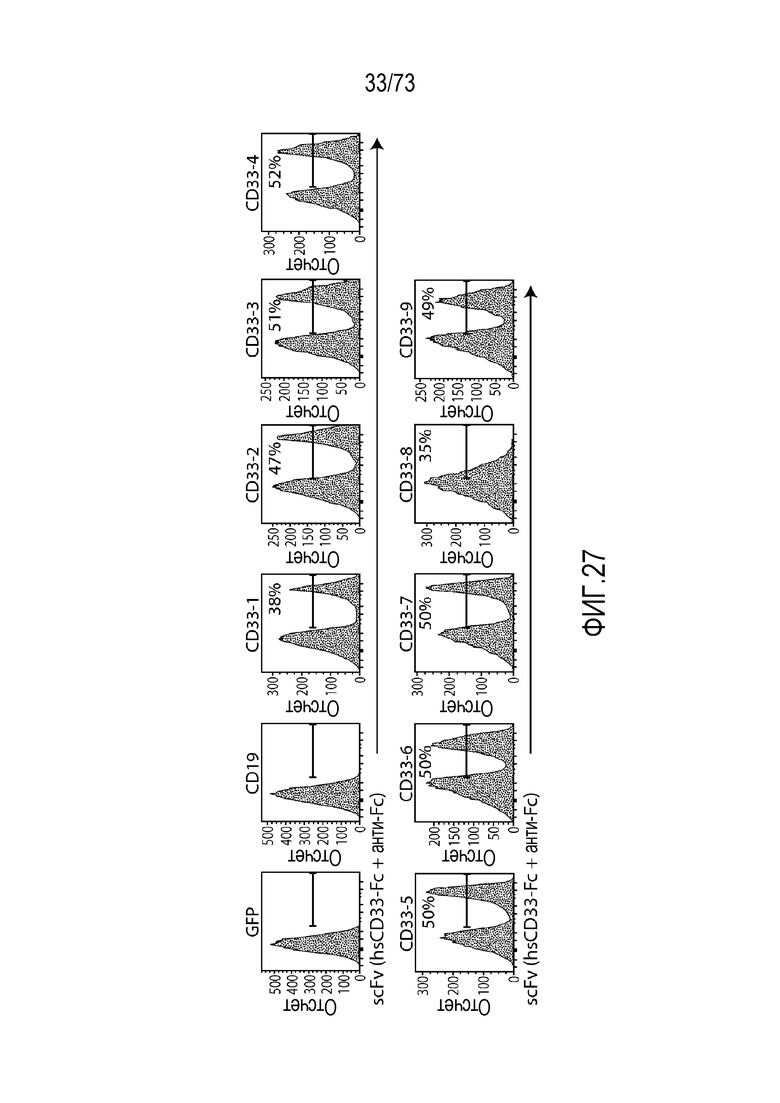
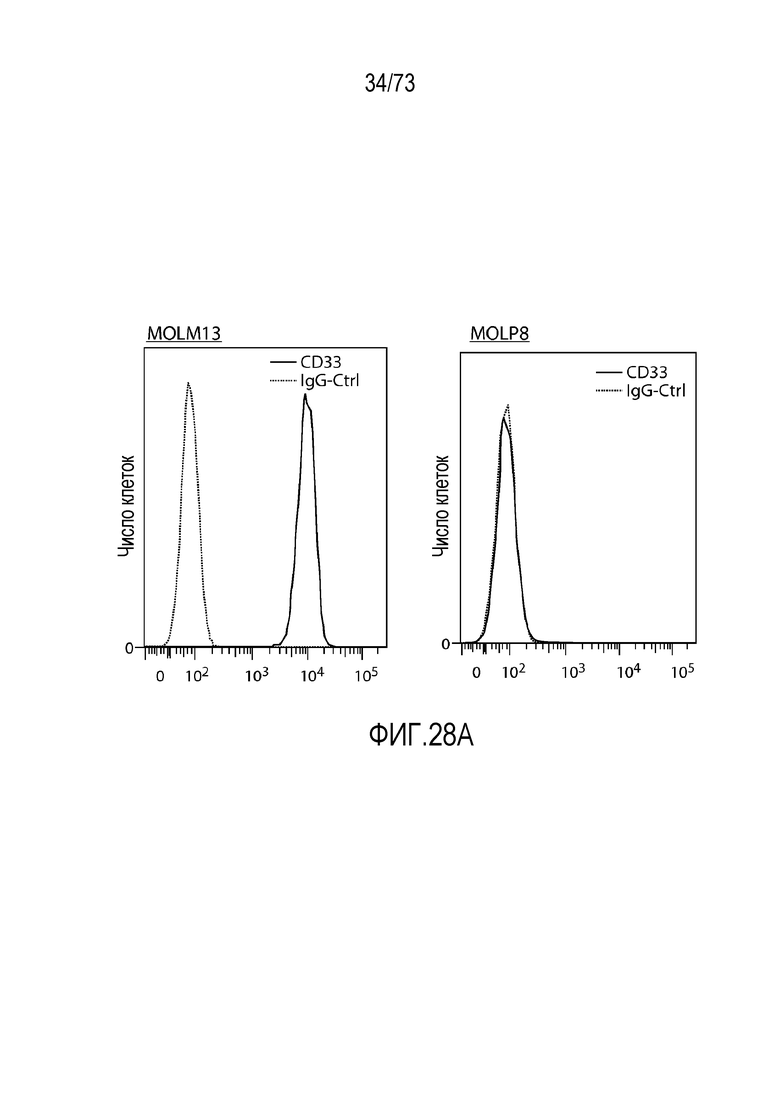
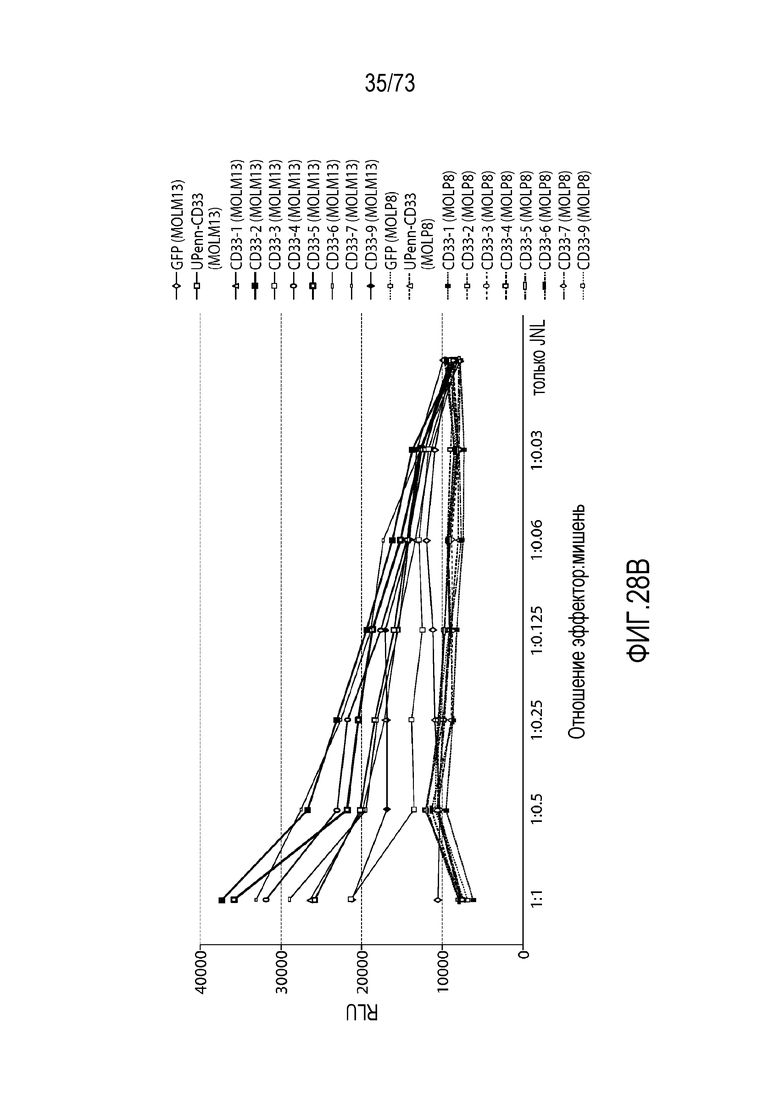
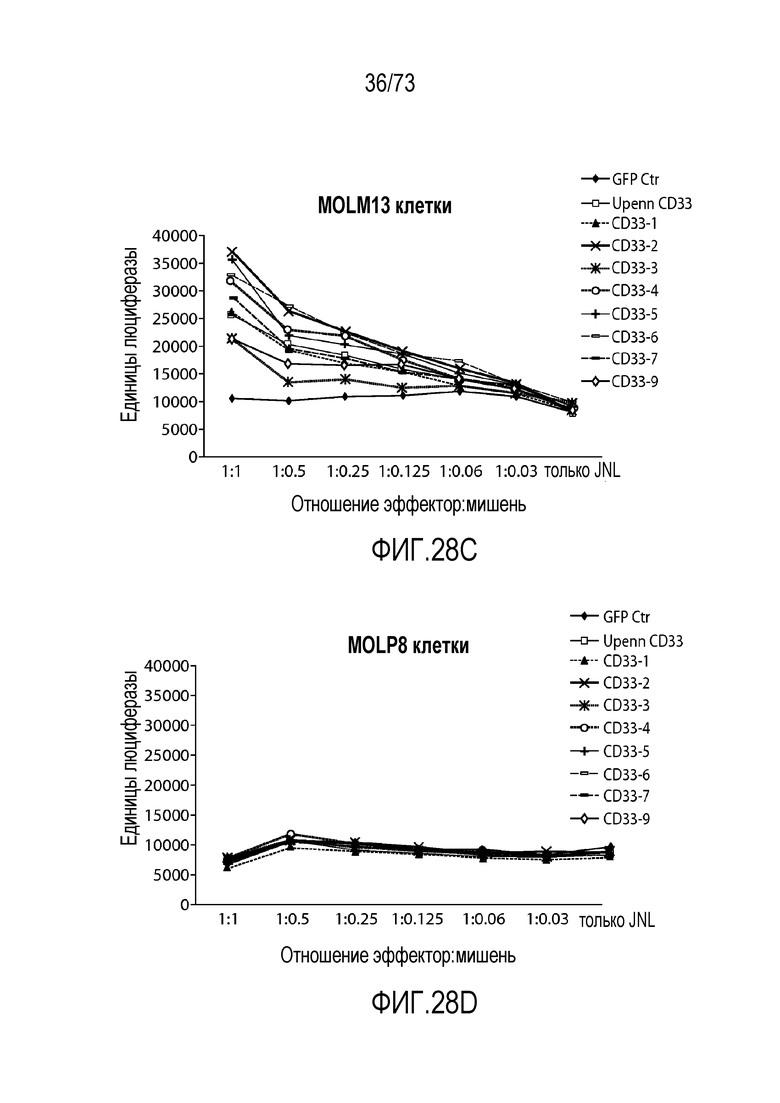
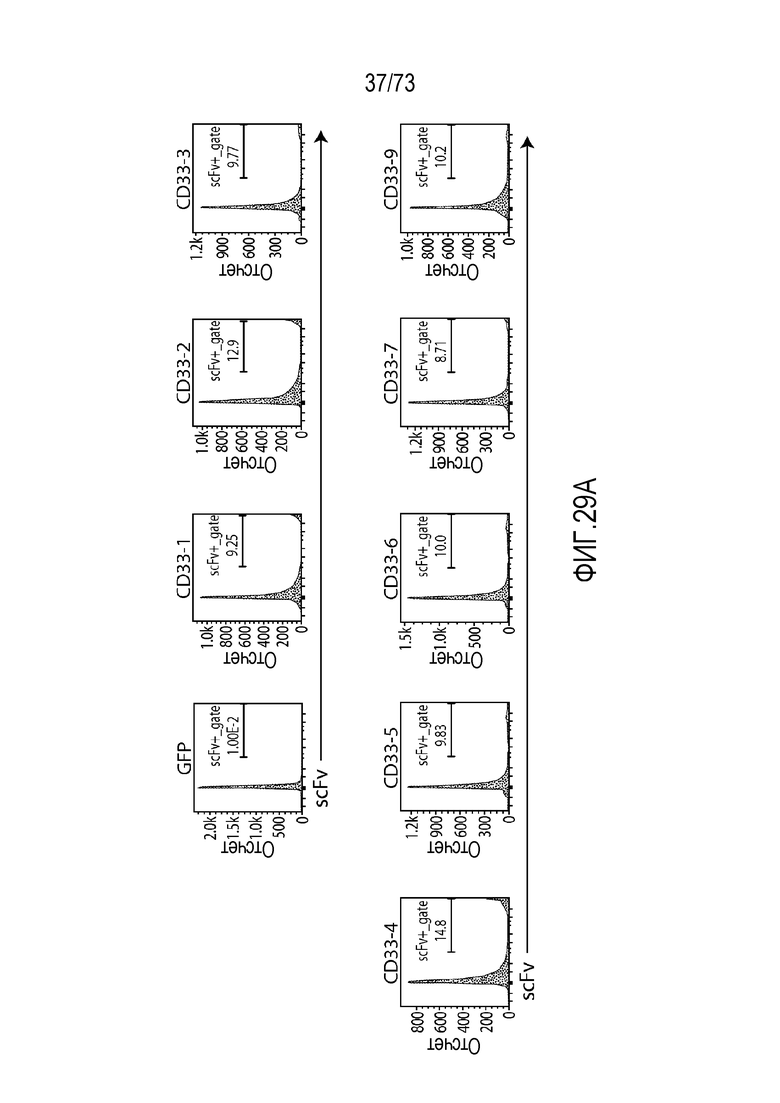
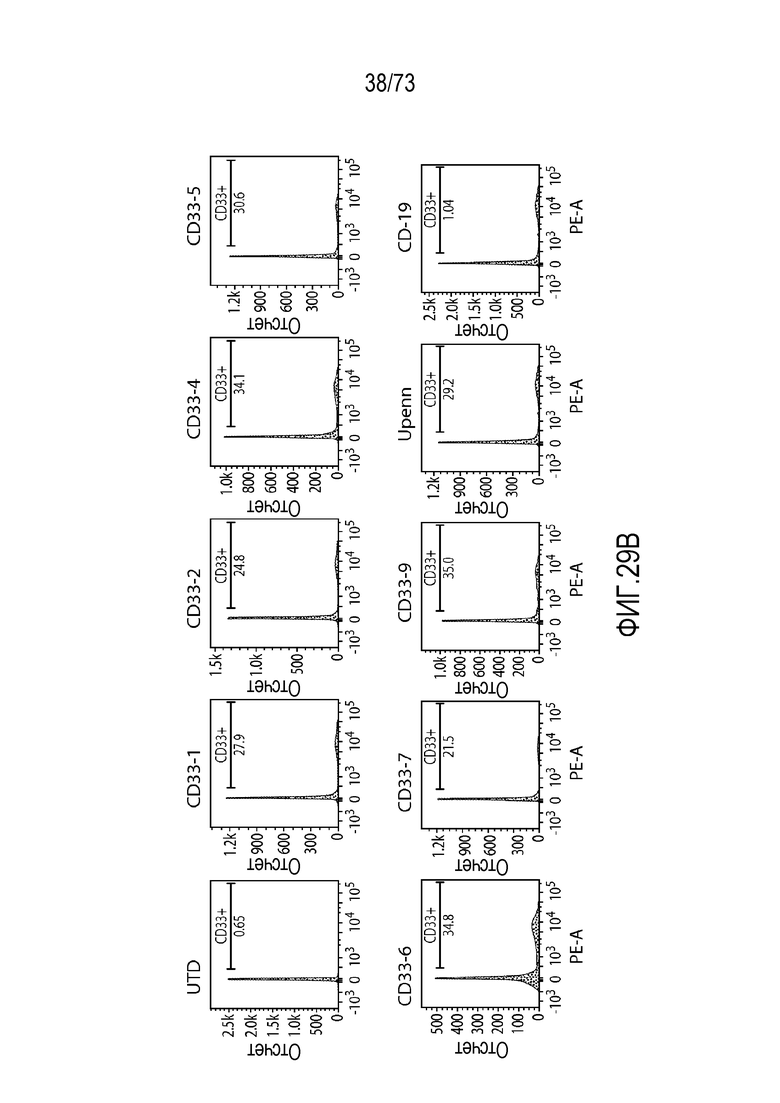
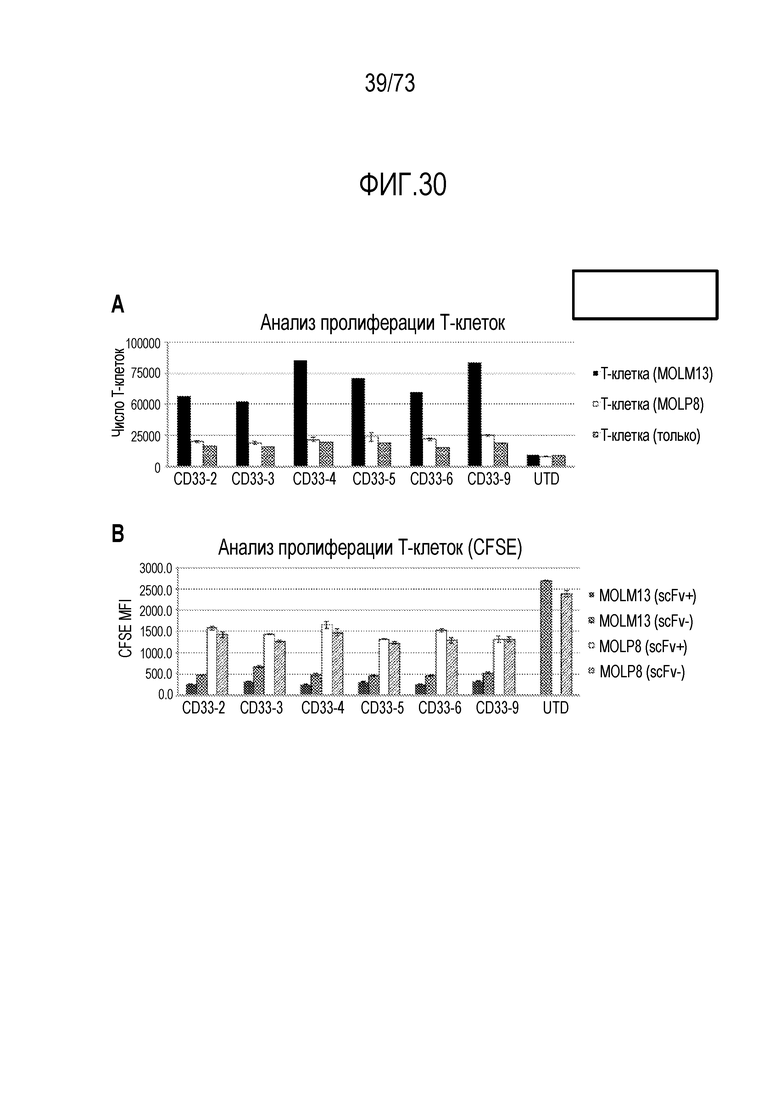
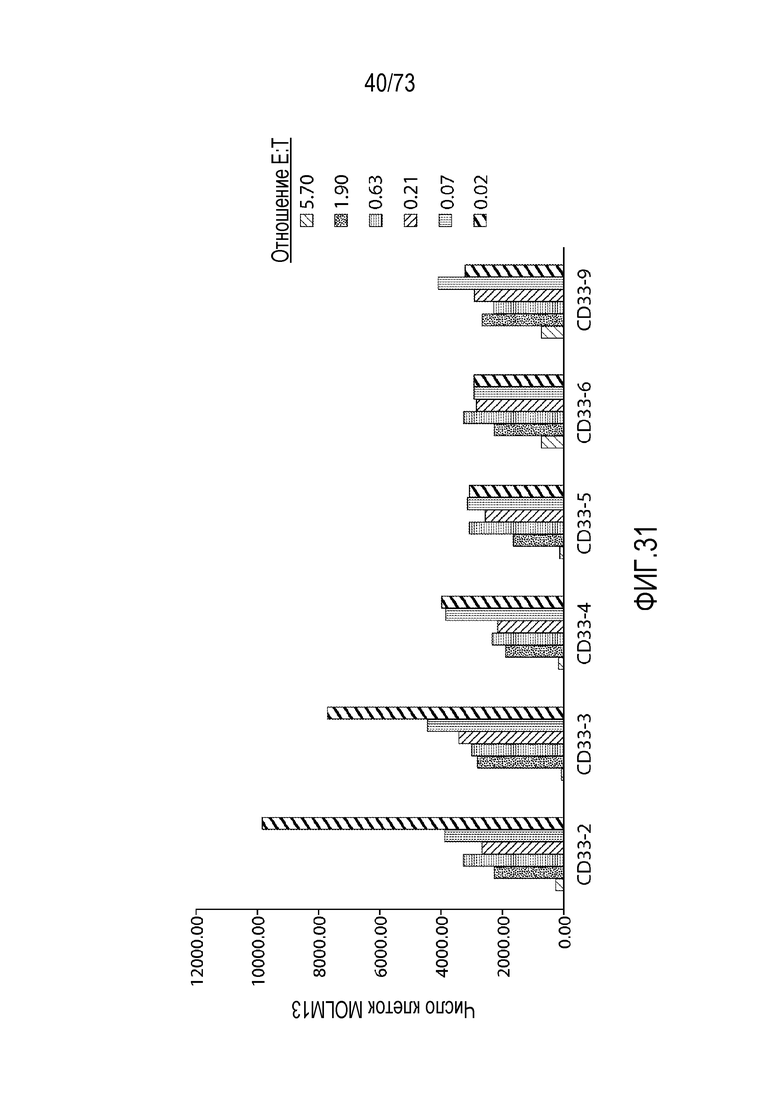
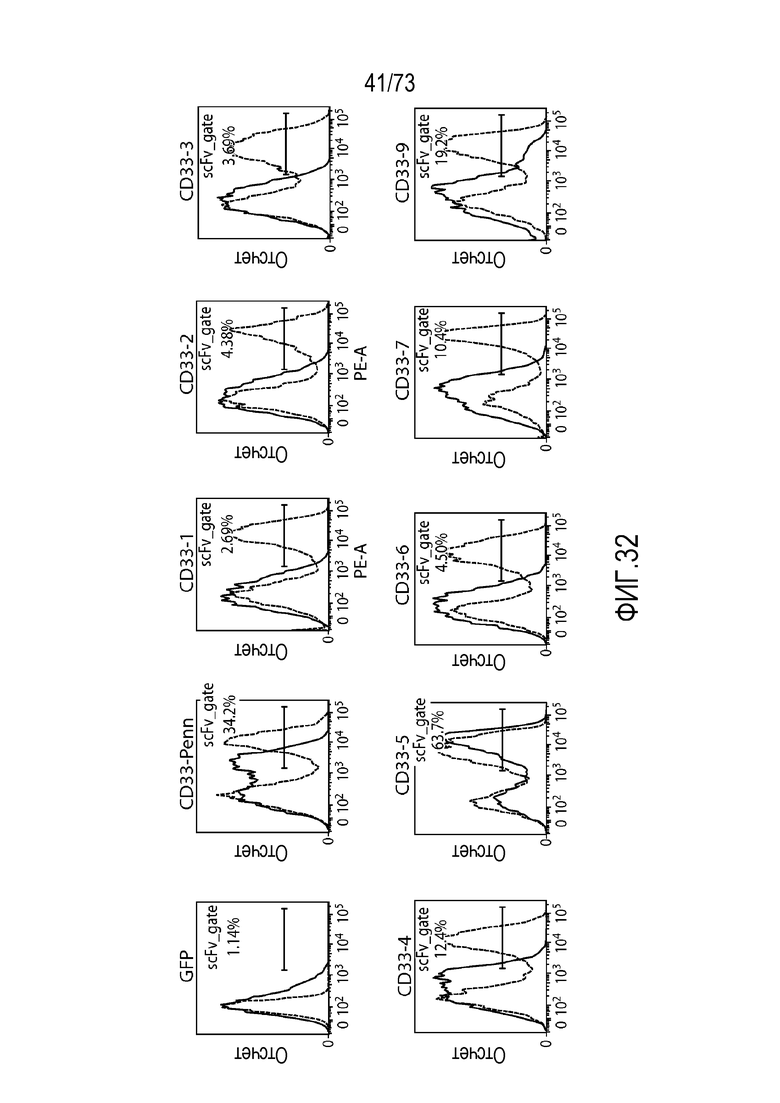
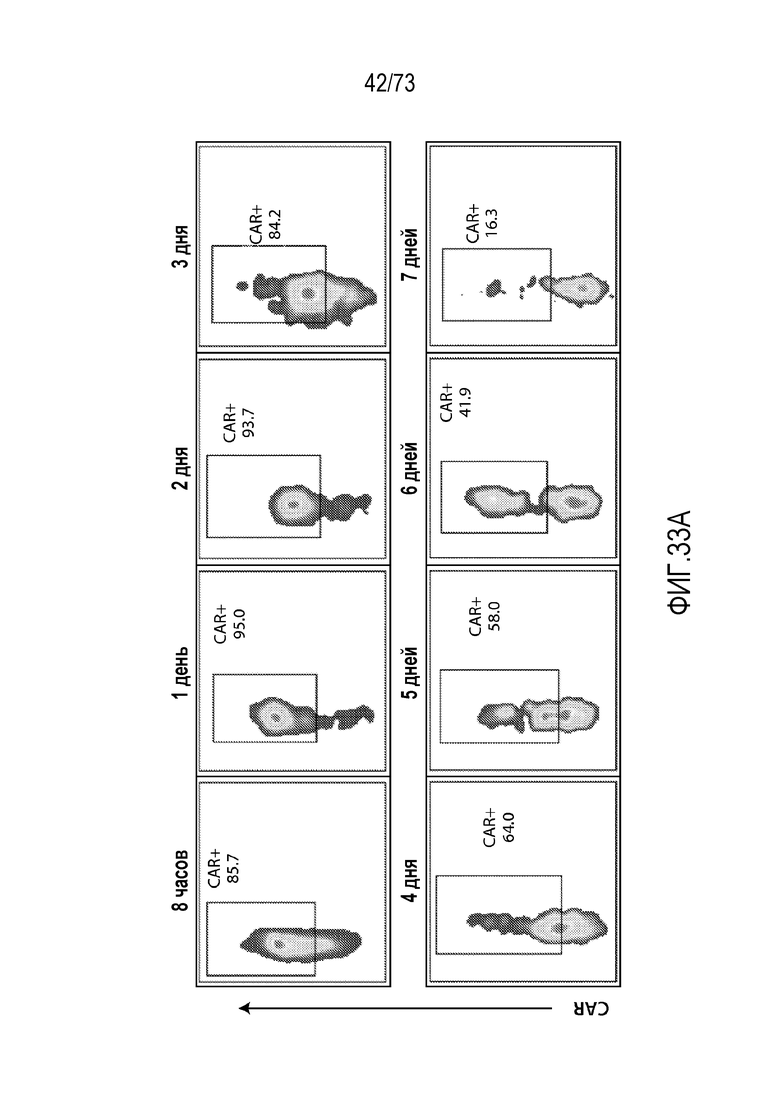
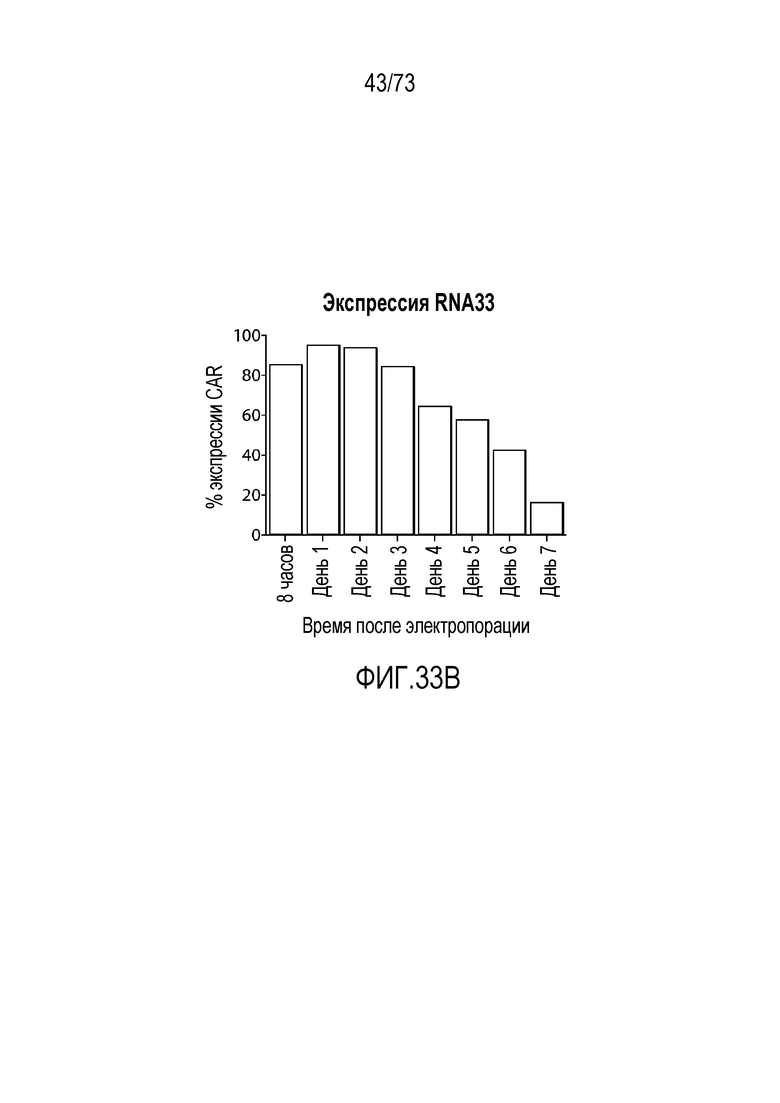
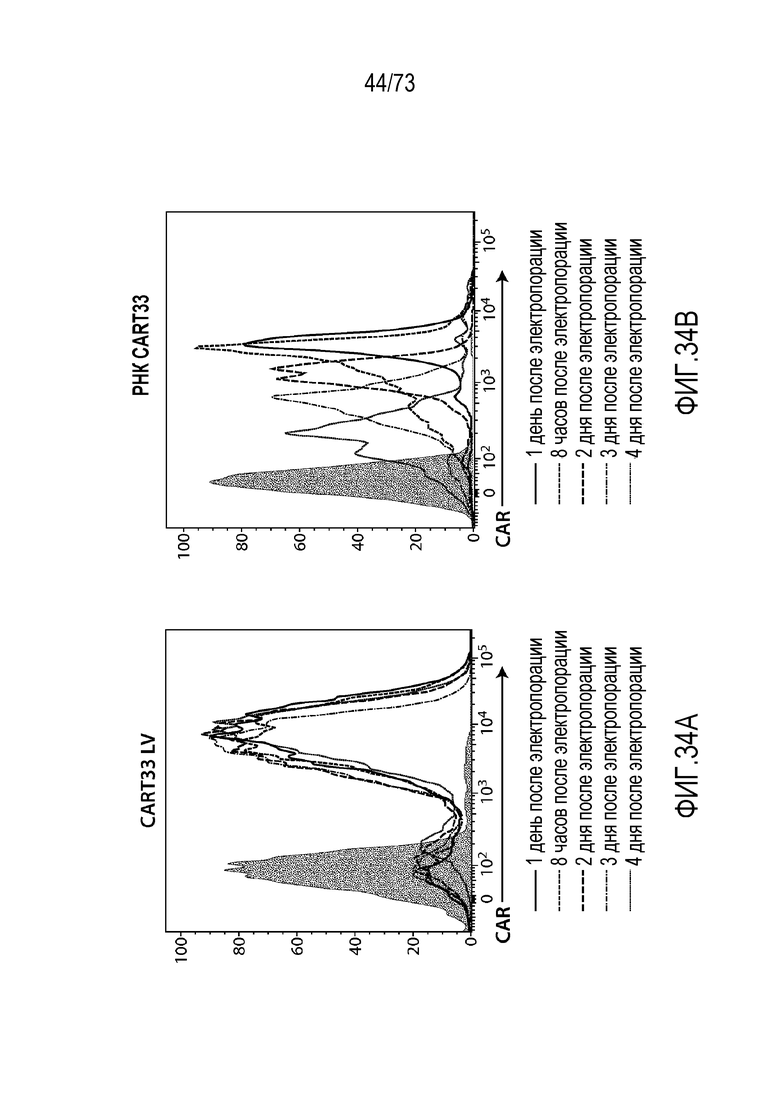
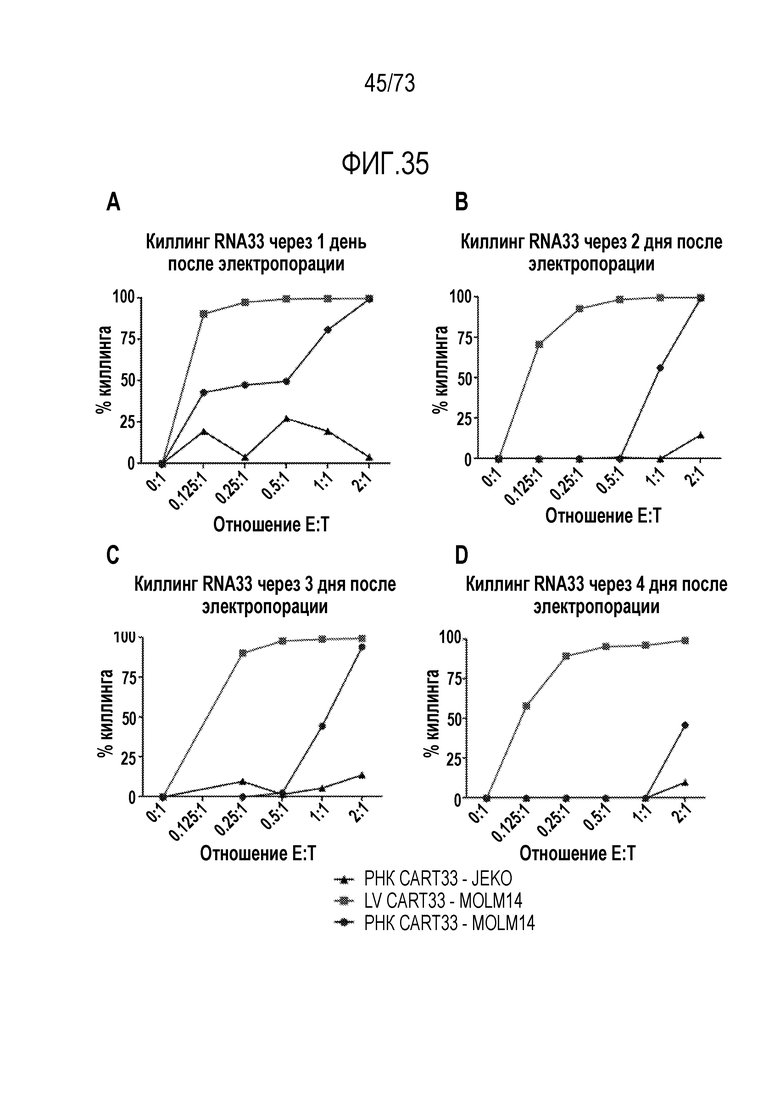

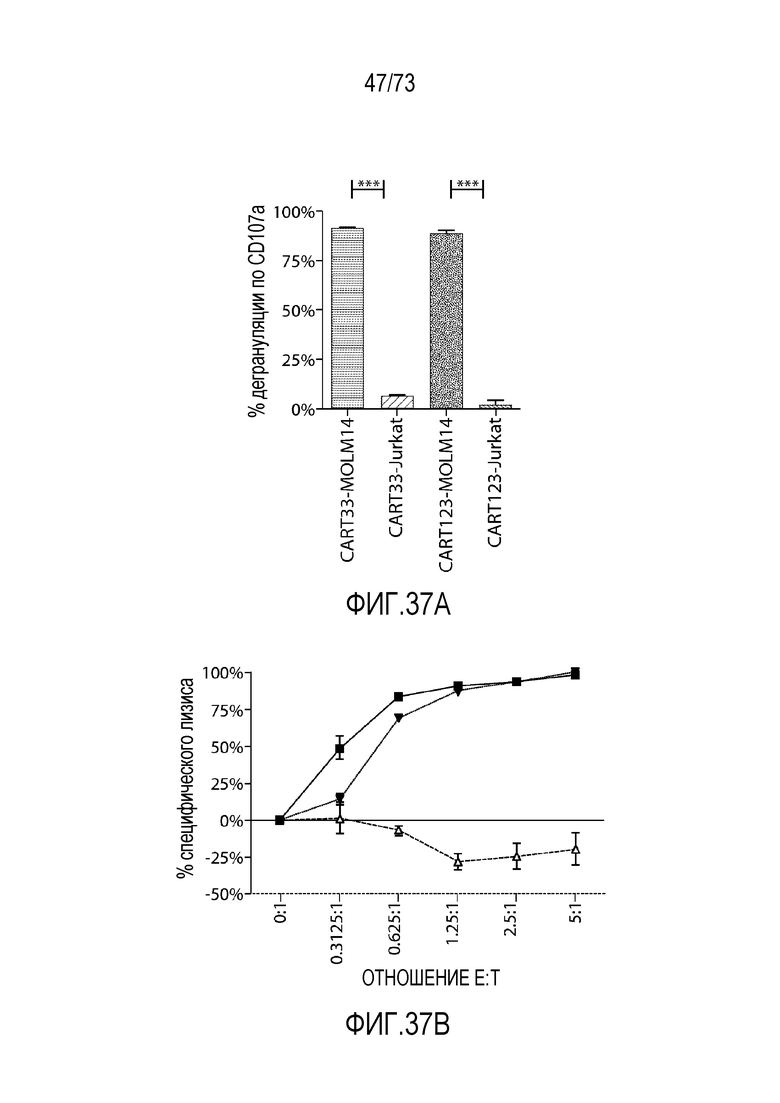
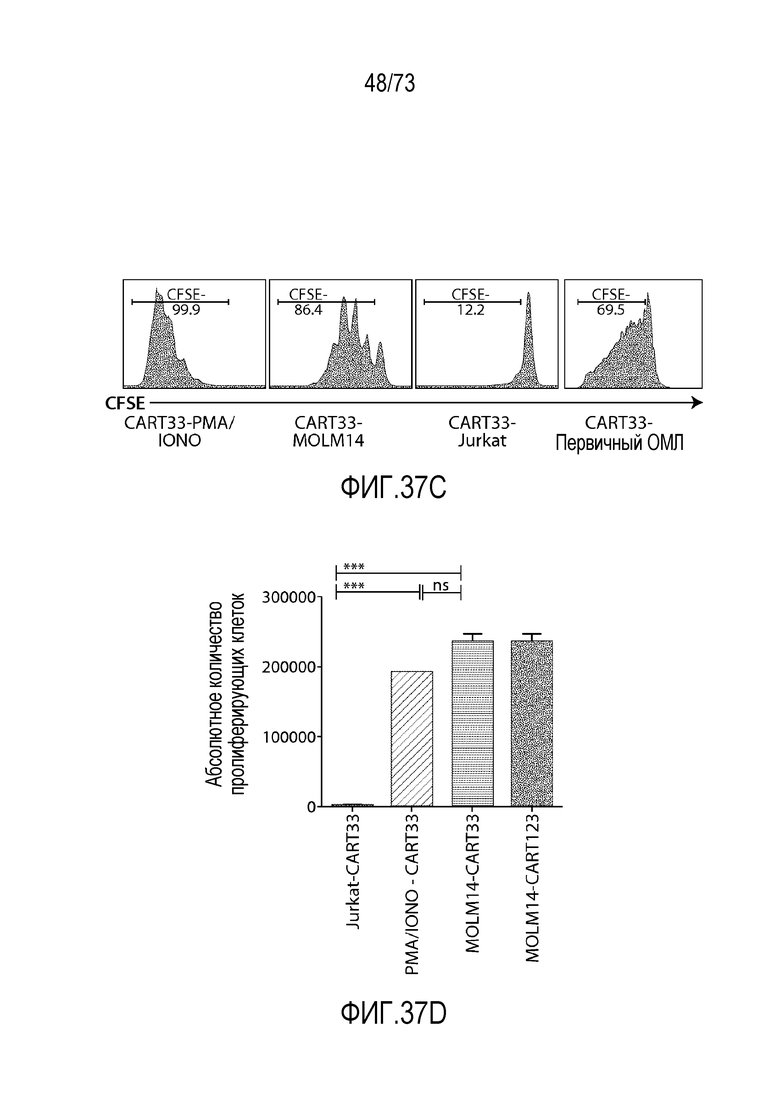
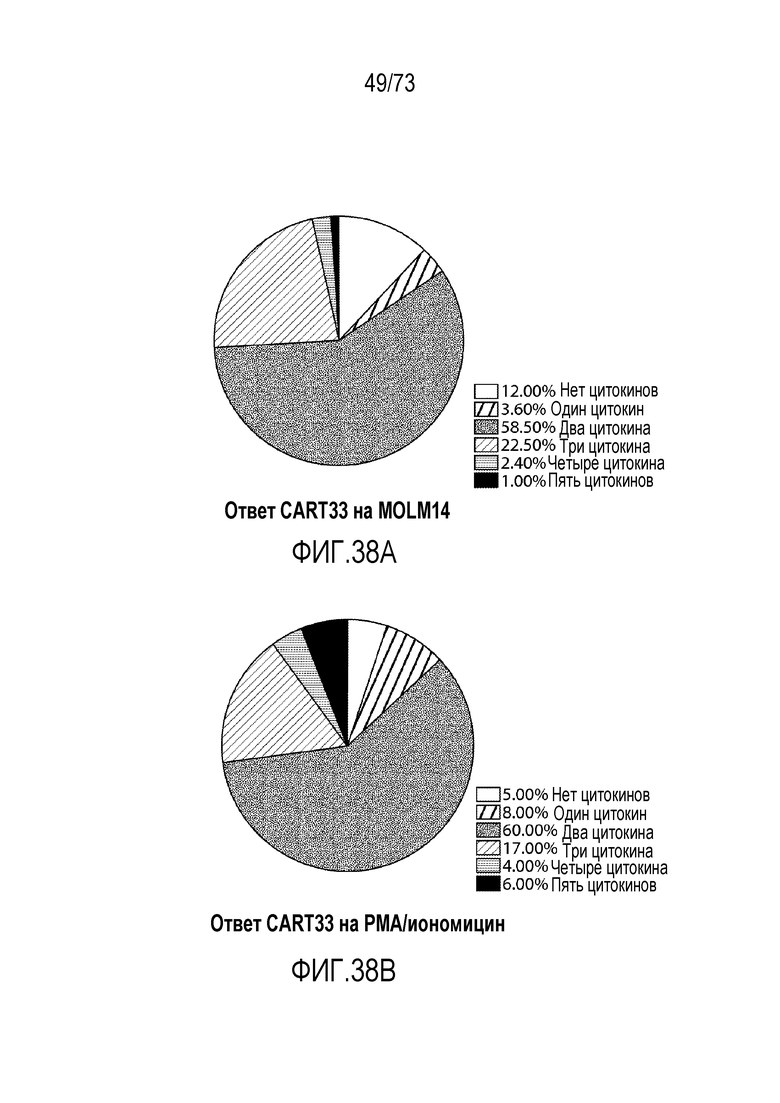
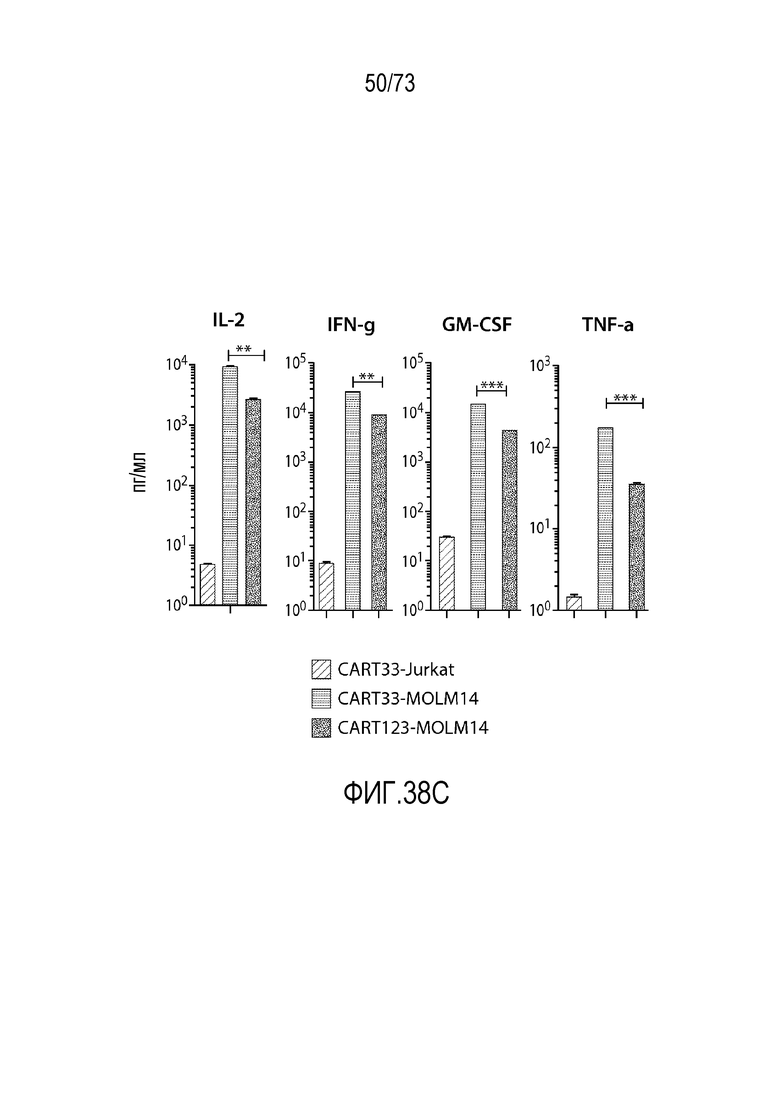
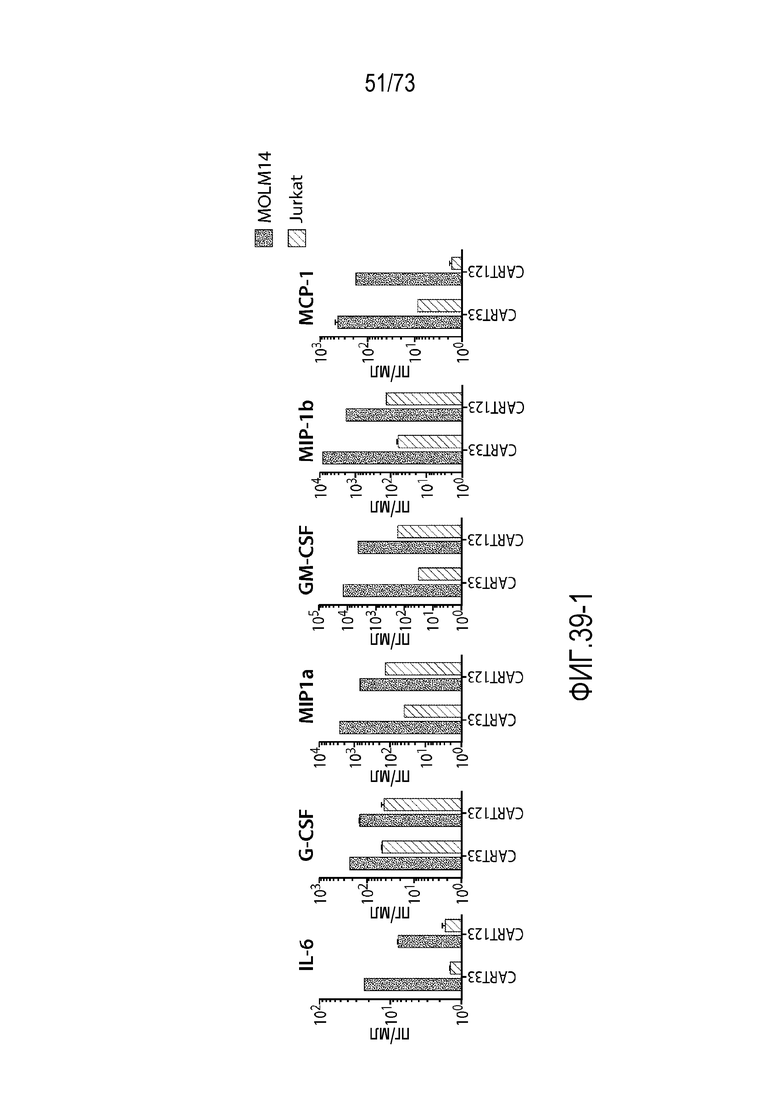
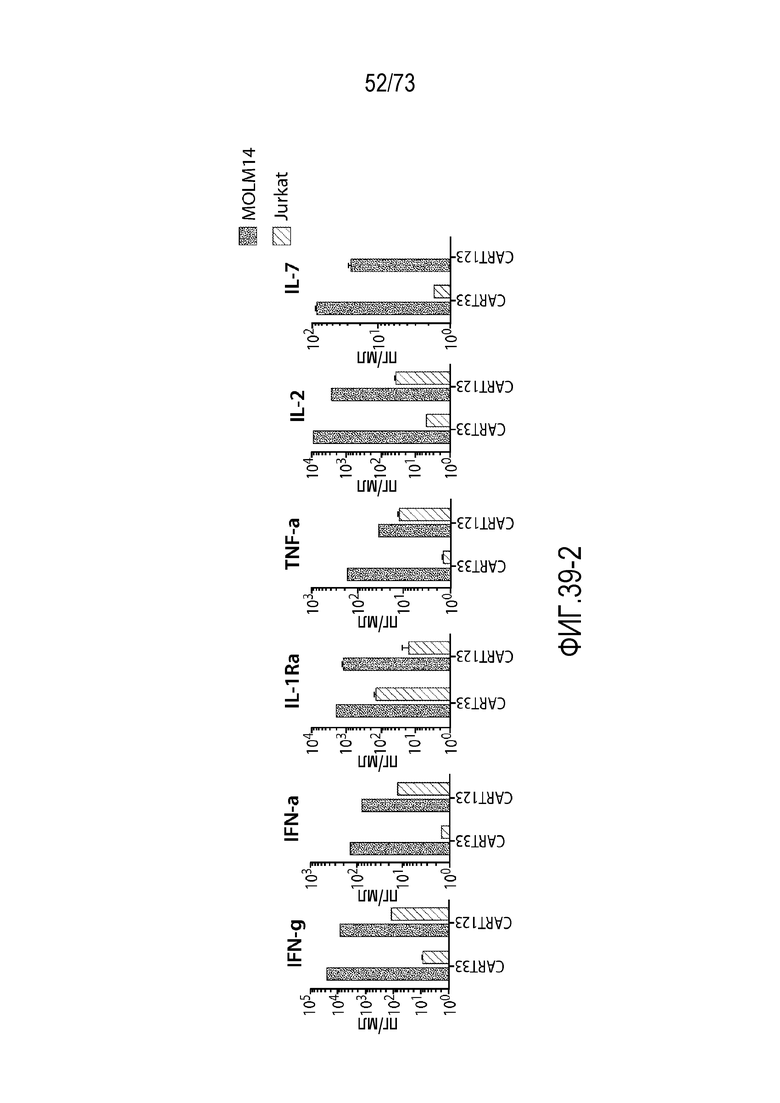
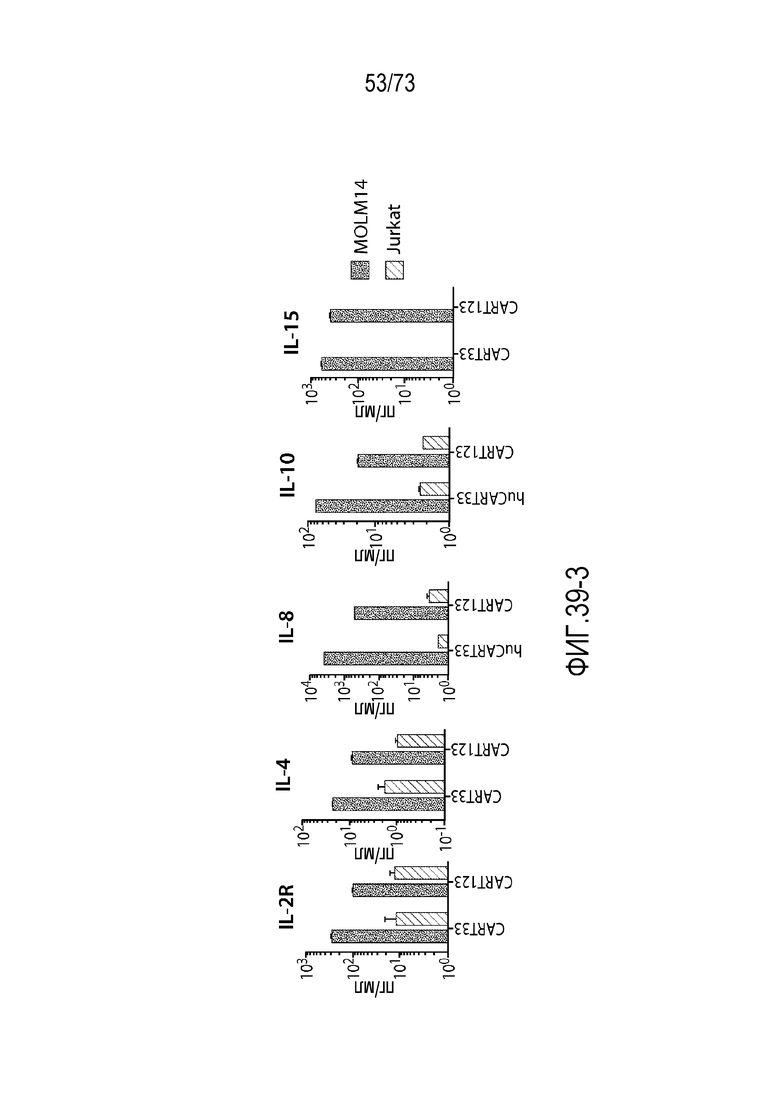
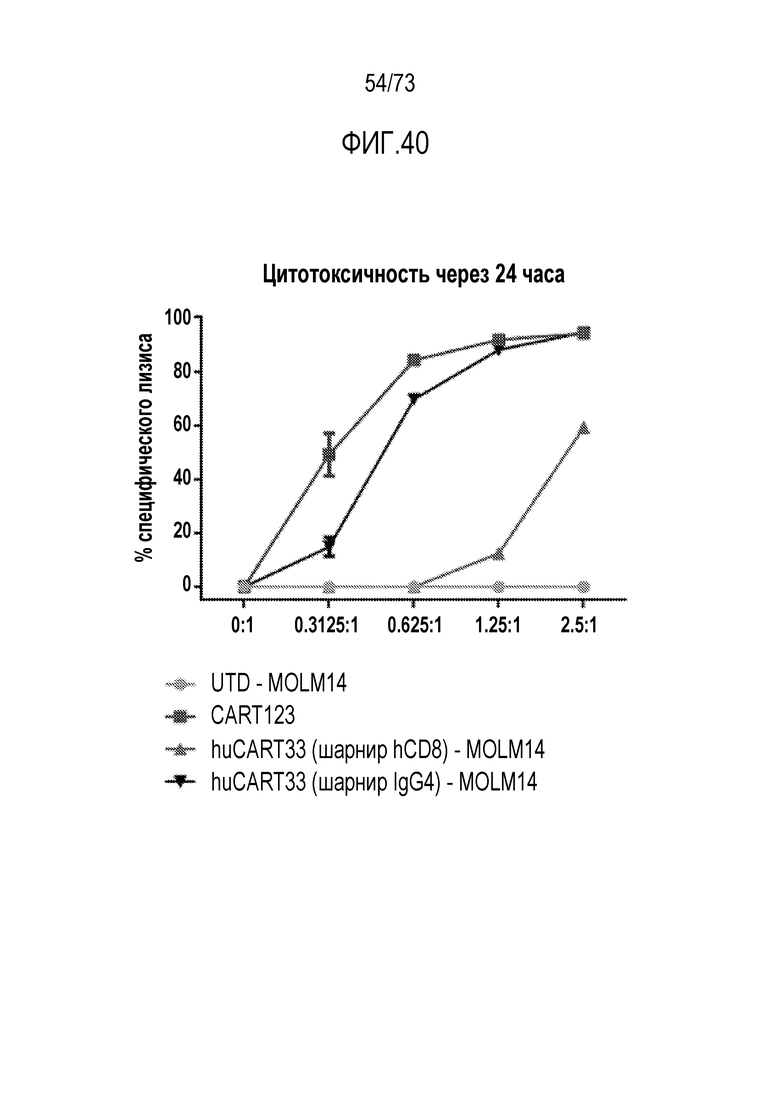
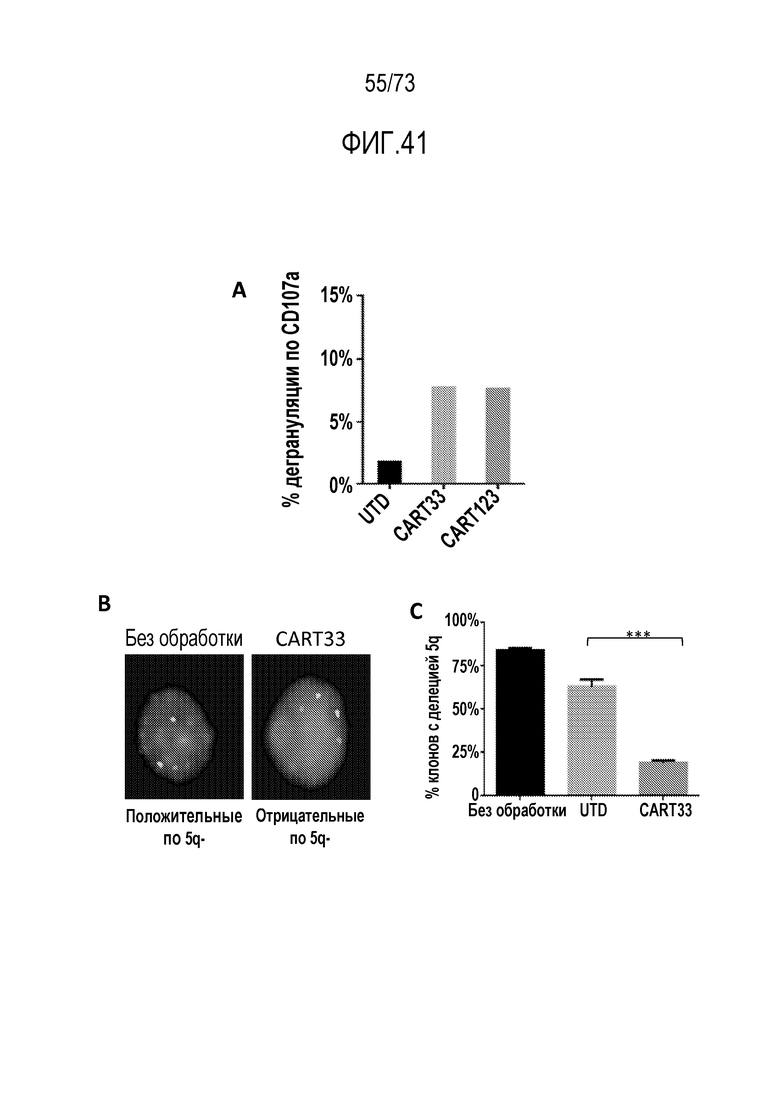

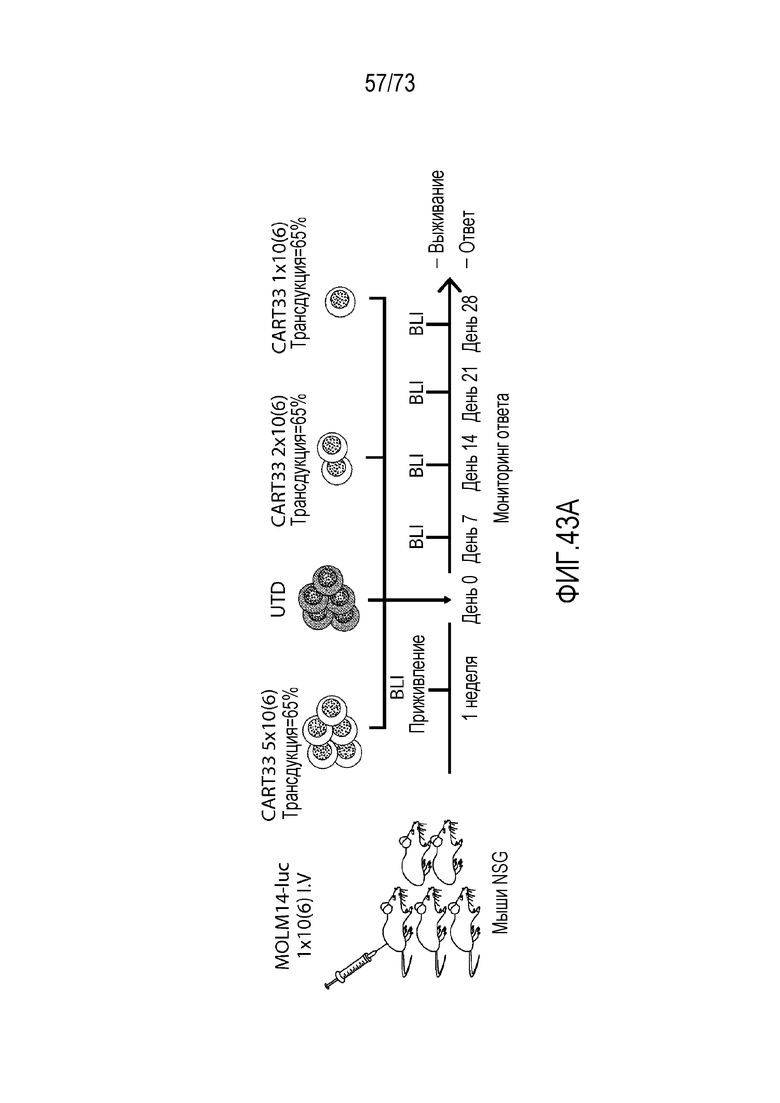
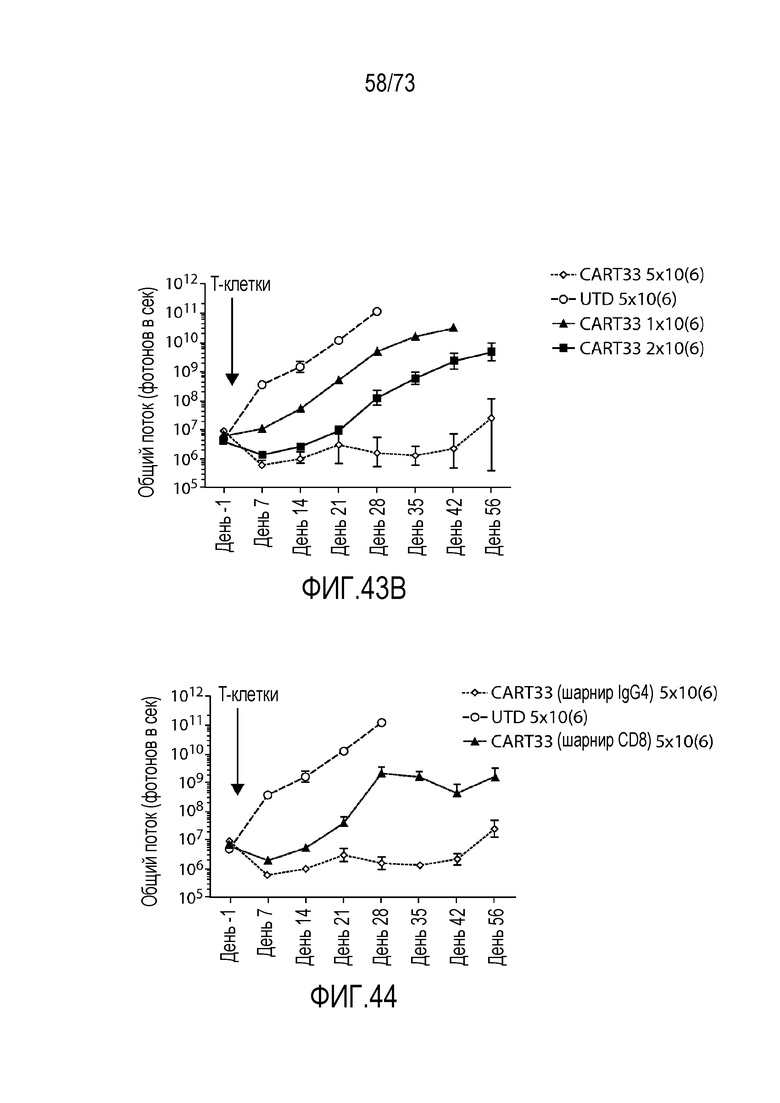

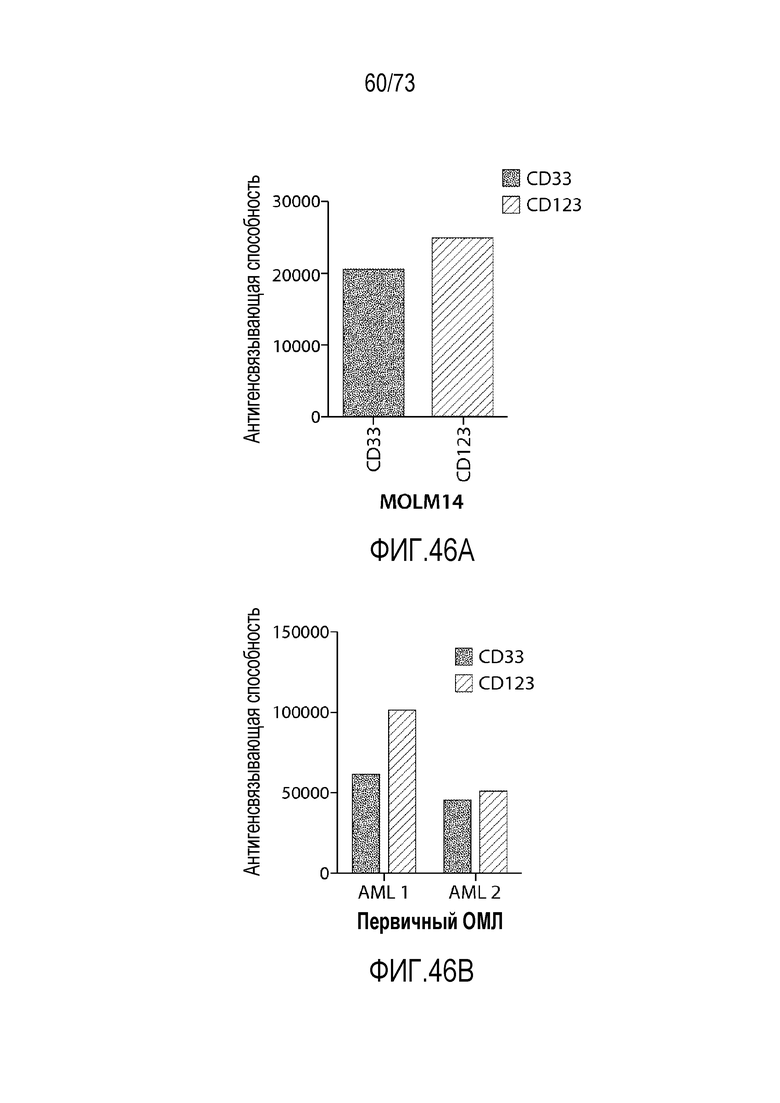
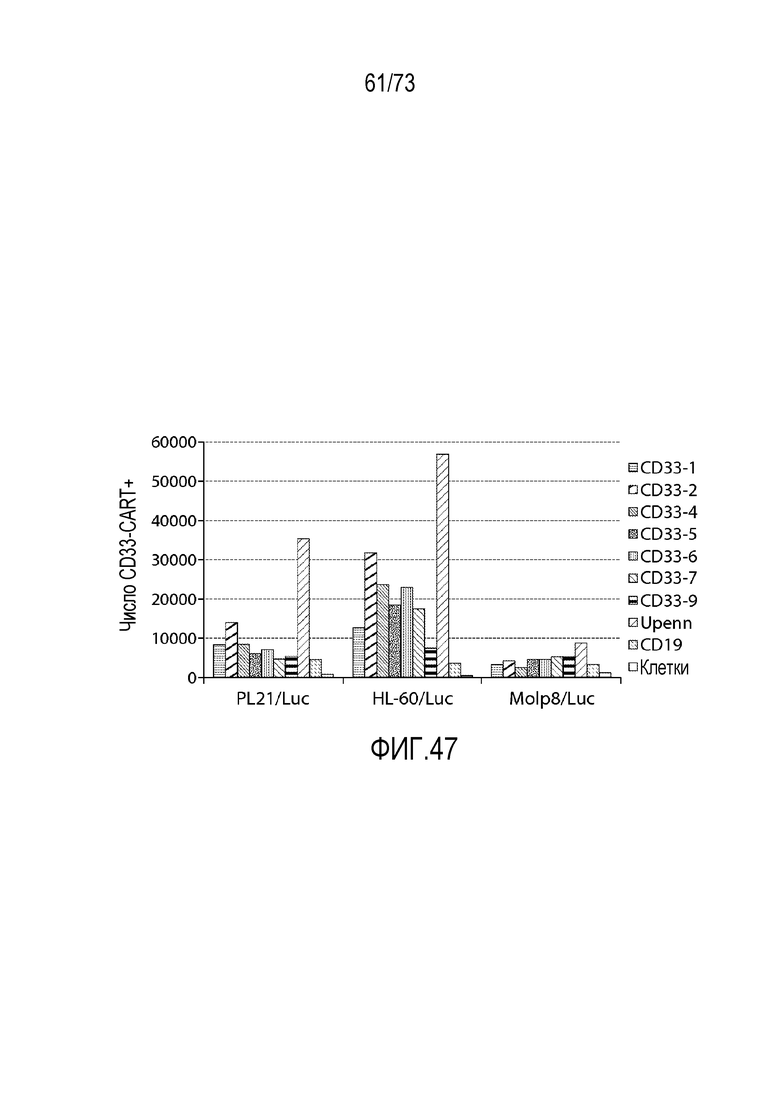
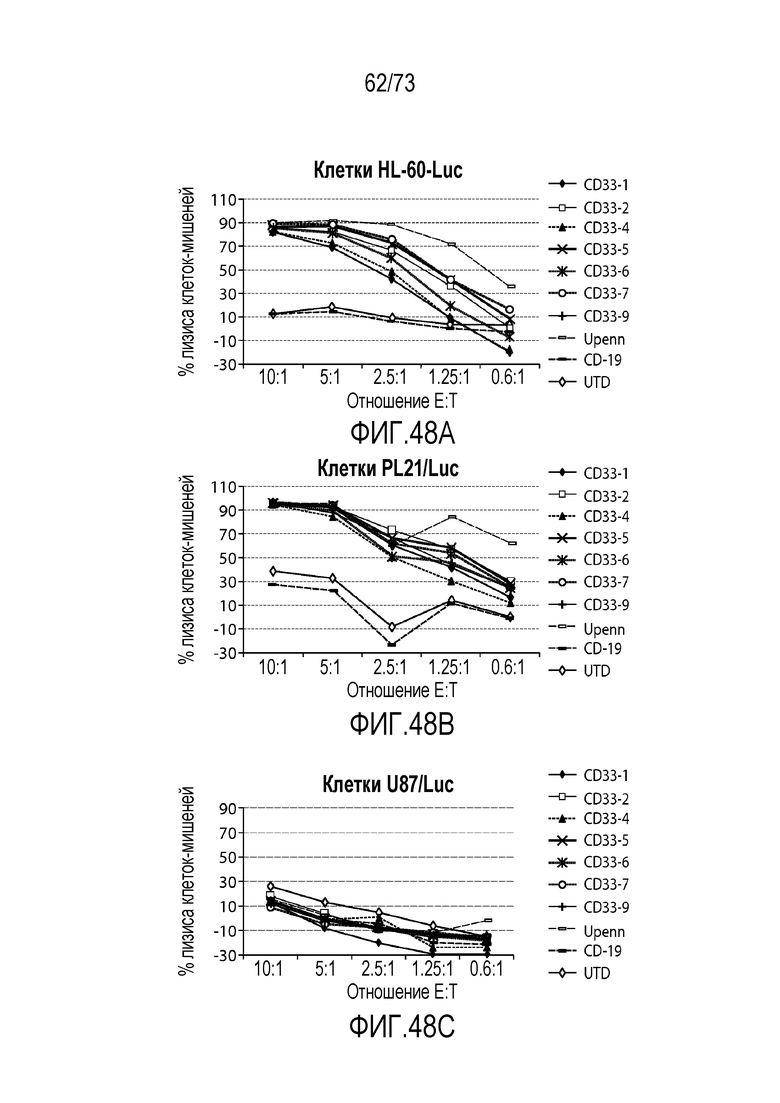
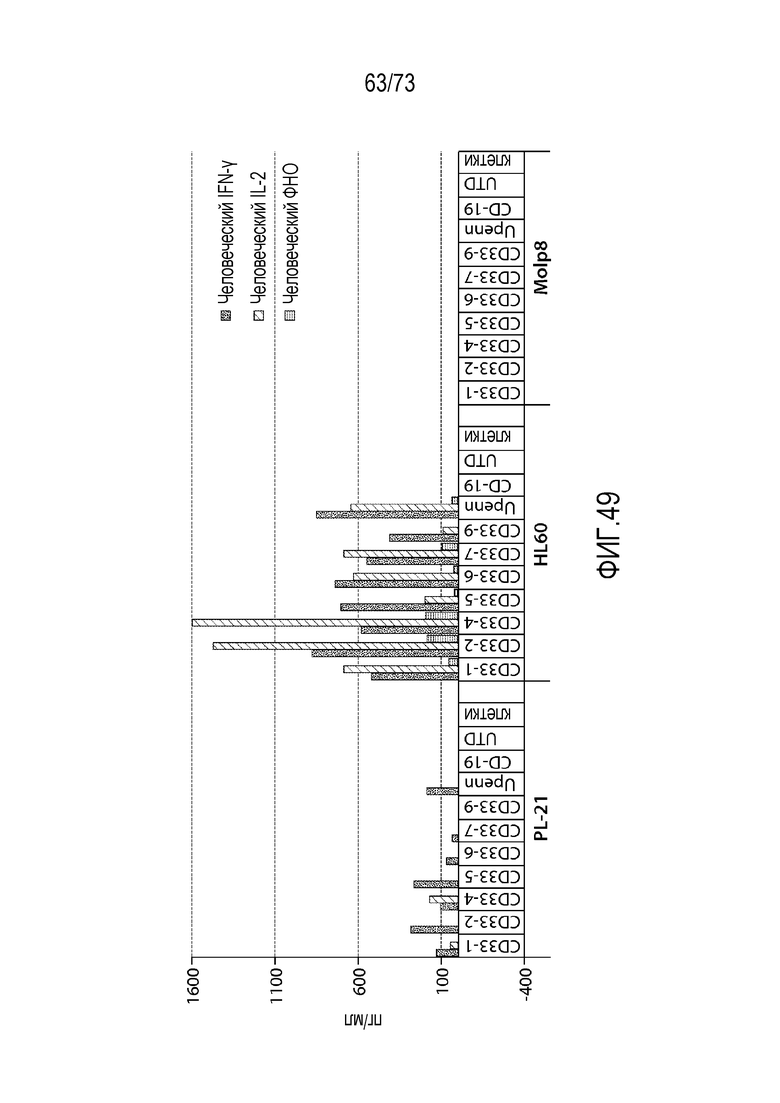
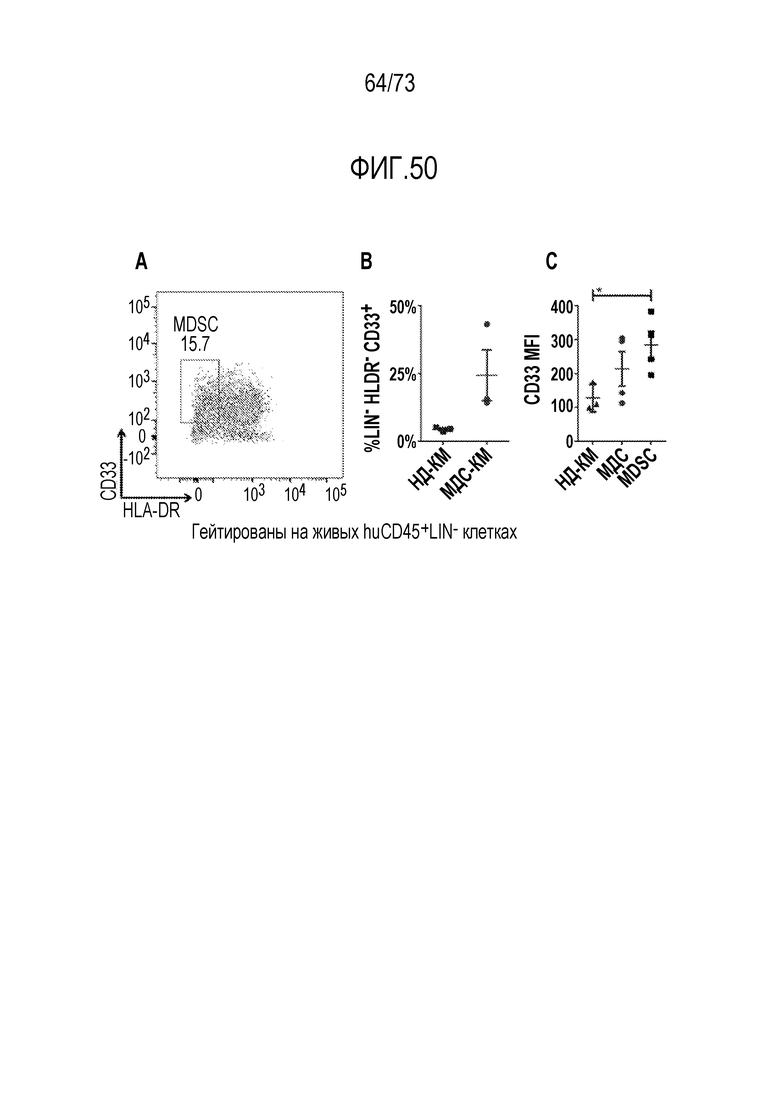

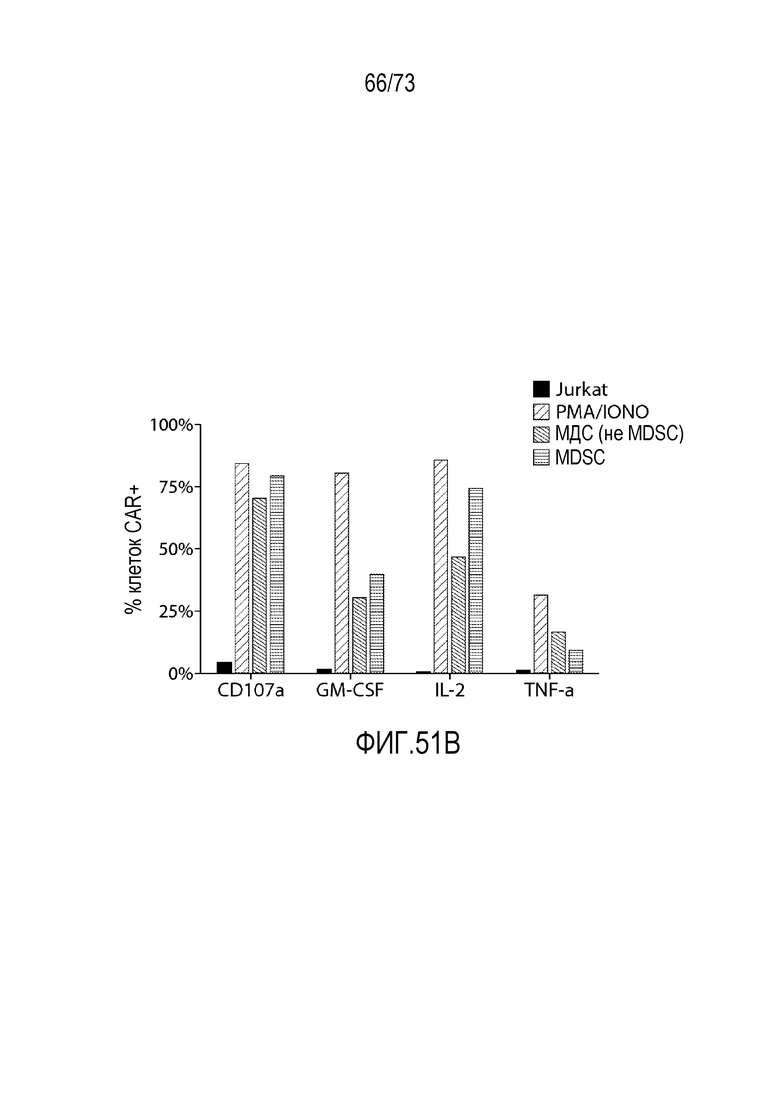
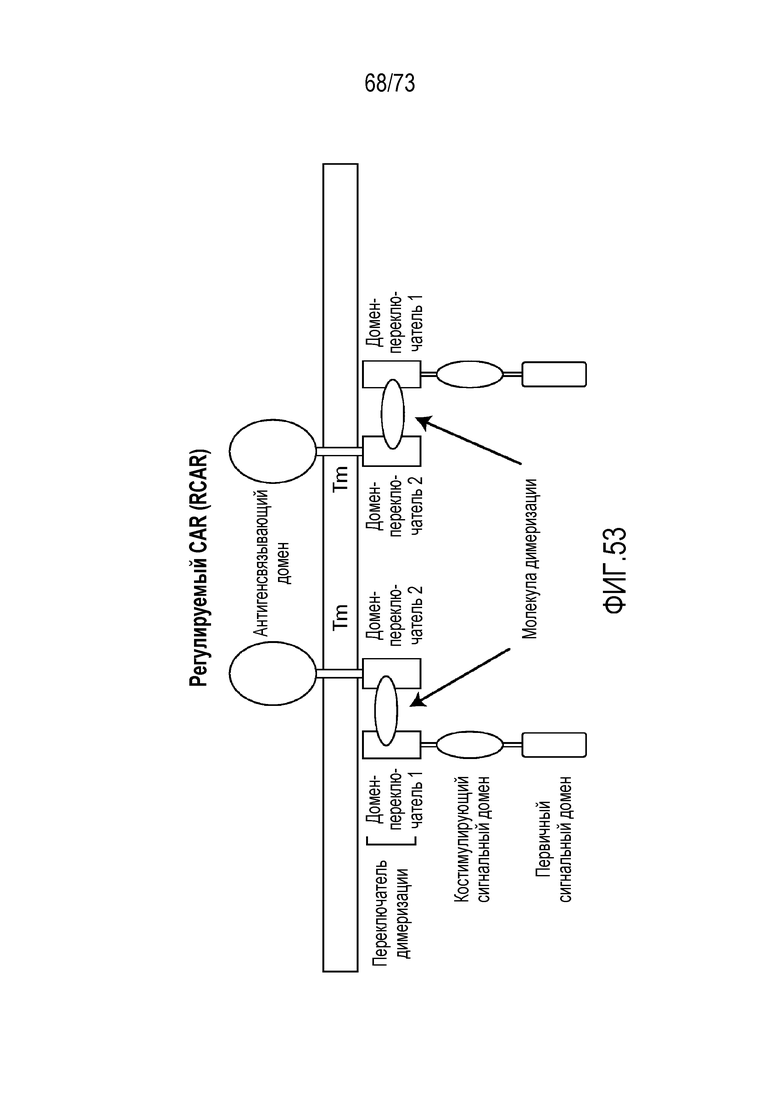
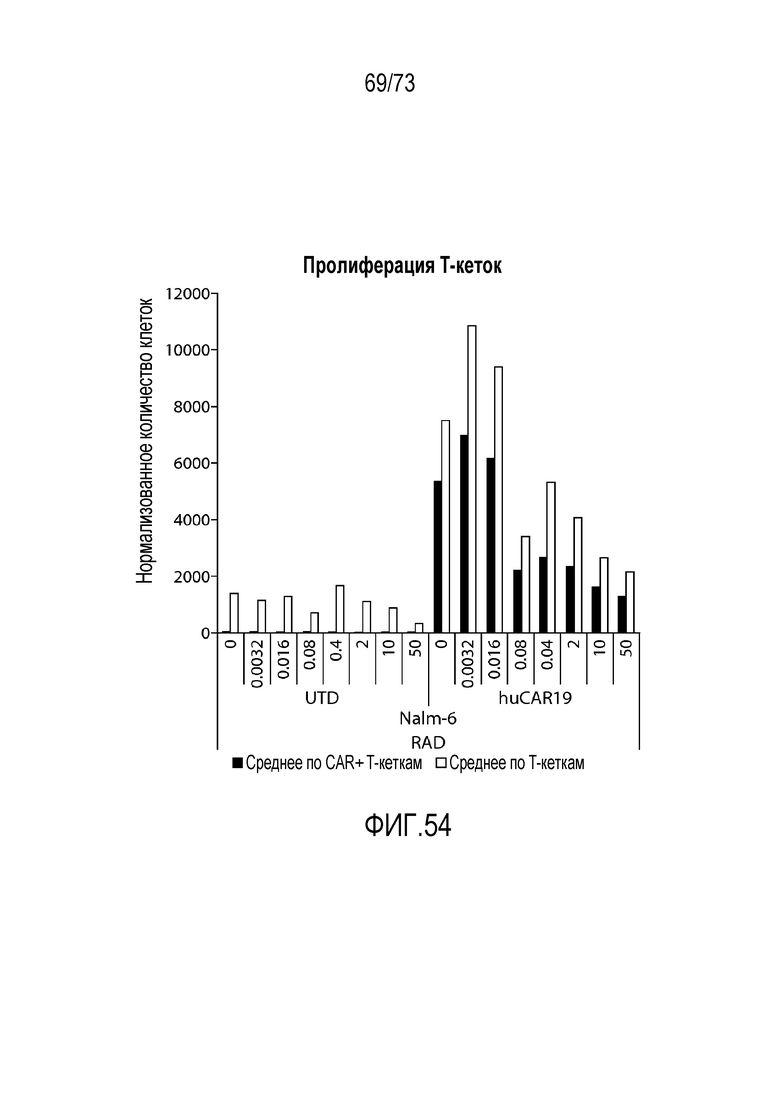
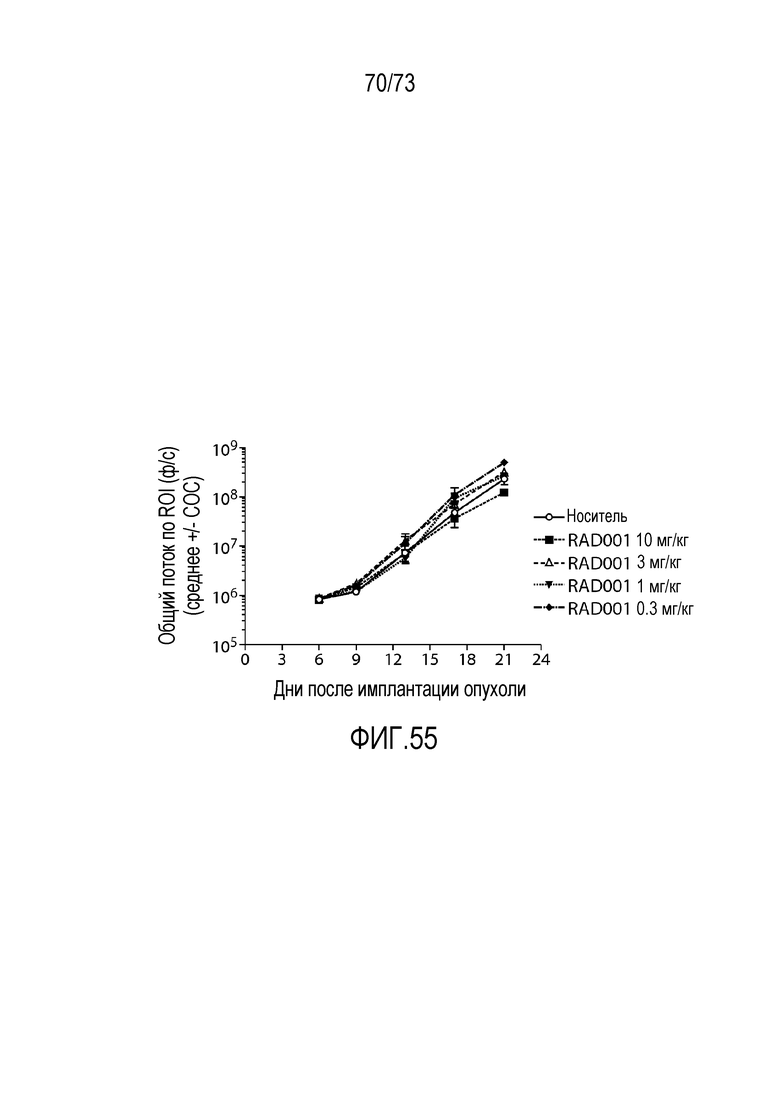
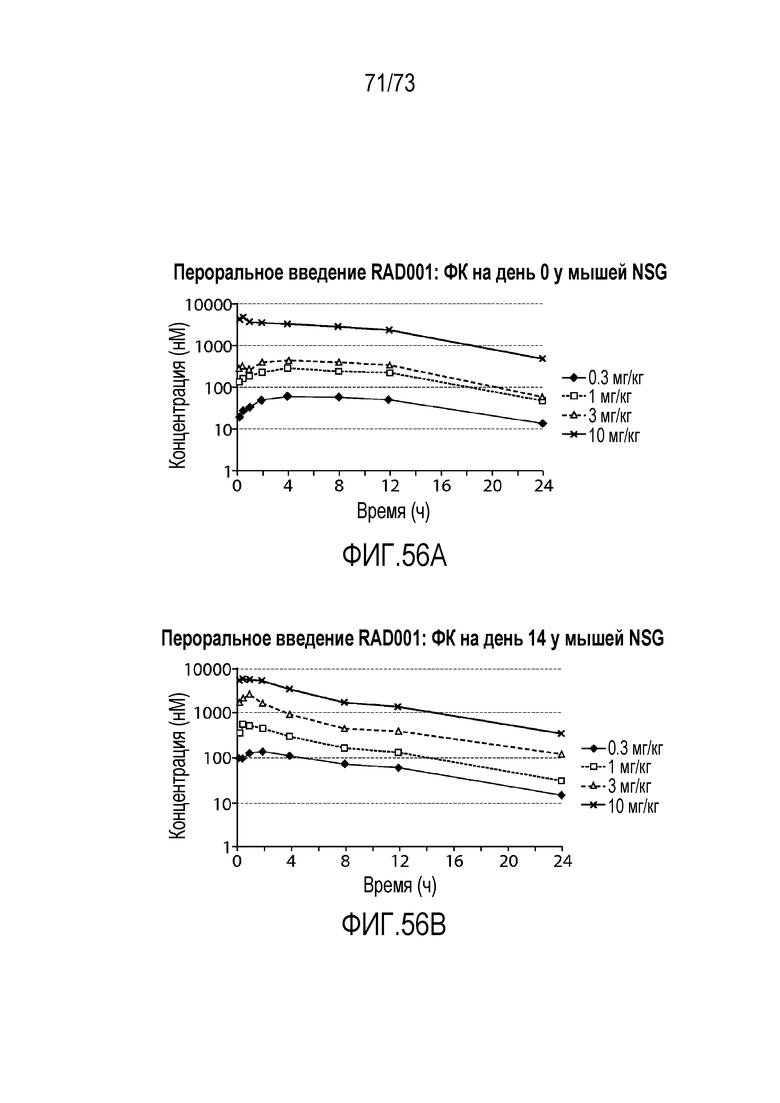
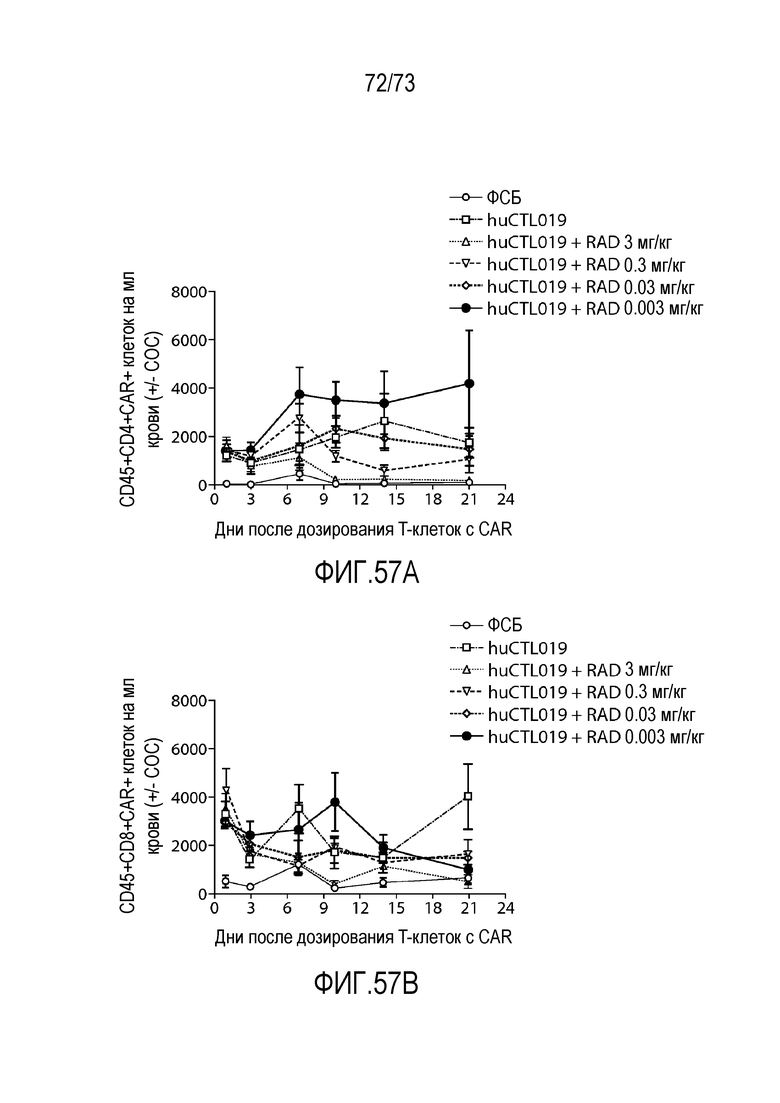
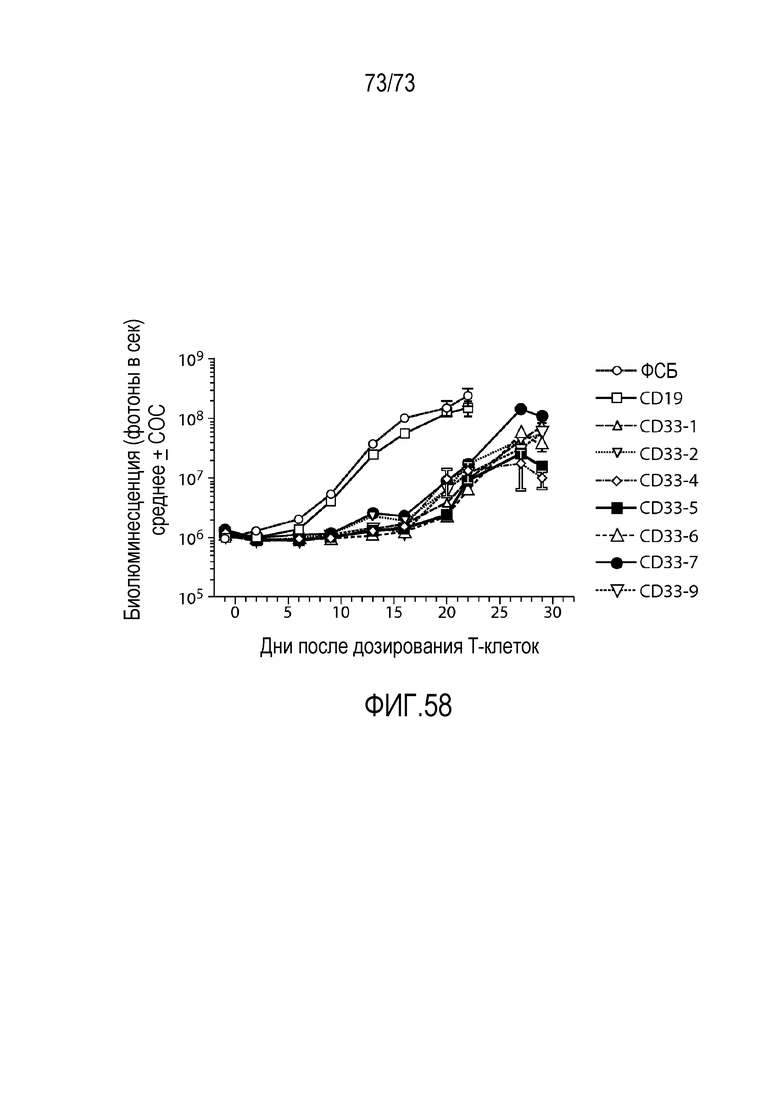
Изобретение относится к области биотехнологии, в частности к молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR) для связывания с CD33, связывающему CD33 домену, а также к полипептиду химерного антигенного рецептора (CAR) для связывания с CD33. Также раскрыт вектор, иммунная эффекторная клетка и популяция иммунных эффекторных клеток, содержащие вышеуказанную молекулу, а также способ получения вышеуказанной клетки и популяции. Изобретение также относится к способу обеспечения иммунитета против CD33-экспрессирующей опухоли у млекопитающего, к способу кондиционирования субъекта, имеющего CD33-экспрессирующую клетку перед клеточной трансплантацией, предусматривающим использование вышеуказанных веществ. Изобретение позволяет эффективно осуществлять лечение млекопитающего, имеющего заболевание, ассоциированное с экспрессией CD33. 12 н. и 47 з.п. ф-лы, 58 ил., 13 табл., 10 пр.
1. Молекула нуклеиновой кислоты, кодирующая химерный антигенный рецептор (CAR) для связывания с CD33, причем CAR содержит человеческий связывающий CD33 домен, который специфически связывается с CD33, трансмембранный домен и внутриклеточный сигнальный домен, содержащий первичный сигнальный домен, и необязательно костимулирующий домен, где CD33-связывающий домен соединен с трансмембранным доменом шарнирной областью, и причем упомянутый CD33-связывающий домен содержит определяющую комплементарность область 1 тяжелой цепи (HC CDR1), определяющую комплементарность область 2 тяжелой цепи (HC CDR2), определяющую комплементарность область 3 тяжелой цепи (HC CDR3), определяющую комплементарность область 1 легкой цепи (LC CDR1), определяющую комплементарность область 2 легкой цепи (LC CDR2) и определяющую комплементарность область 3 легкой цепи (LC CDR3), где
(a) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 89, 98, 107, 116, 125 и 134 соответственно;
(b) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 274, 283, 292, 301, 310 и 319 соответственно;
(c) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 328, 337, 346, 355, 364 и 373 соответственно;
(d) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 84, 93, 102, 111, 120 и 129 соответственно;
(e) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 269, 278, 287, 296, 305 и 314 соответственно;
(f) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 323, 332, 341, 350, 359 и 368 соответственно;
(g) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 85, 94, 103, 112, 121 и 130 соответственно;
(h) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 270, 279, 288, 297, 306 и 315 соответственно;
(i) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 324, 333, 342, 351, 360 и 369 соответственно;
(j) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 87, 96, 105, 114, 123 и 132 соответственно;
(k) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 272, 281, 290, 299, 308 и 317 соответственно;
(l) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 326, 335, 344, 353, 362 и 371 соответственно;
(m) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 88, 97, 106, 115, 124 и 133 соответственно;
(n) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 273, 282, 291, 300, 309 и 318 соответственно;
(o) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 327, 336, 345, 354, 363 и 372 соответственно;
(p) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 90, 99, 108, 117, 126 и 135 соответственно;
(q) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 275, 284, 293, 302, 311 и 320 соответственно;
(r) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 329, 338, 347, 356, 365 и 374 соответственно;
(s) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 92, 101, 110, 119, 128 и 137 соответственно;
(t) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 277, 286, 295, 304, 313 и 322 соответственно; или
(u) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 331, 340, 349, 358, 367 и 376 соответственно.
2. Молекула нуклеиновой кислоты по п. 1, которая кодирует CAR, содержащий:
(i) аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74; или
(iii) аминокислотную последовательность, идентичную на 95-99% аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74.
3. Молекула нуклеиновой кислоты по п. 1, которая кодирует CAR, содержащий:
(i) аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65; или
(iii) аминокислотную последовательность, идентичную на 95-99% аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65.
4. Молекула нуклеиновой кислоты по п. 1, причем кодируемый CD33-связывающий домен содержит:
(i) аминокислотную последовательность SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций в SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268; или
(iii) аминокислотную последовательность на 95-99% идентичную SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268.
5. Молекула нуклеиновой кислоты по п. 1, причем кодируемый CD33-связывающий домен кодируется молекулой нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 259, 255-258, 260 и 261 или последовательность, идентичную ей на 95-99%.
6. Молекула нуклеиновой кислоты по п. 1, причем кодируемый CAR включает в себя трансмембранный домен, который содержит трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154.
7. Молекула нуклеиновой кислоты по п. 1, причем:
(i) кодируемый трансмембранный домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 6, аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 6, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 6; или
(ii) последовательность нуклеиновой кислоты, кодирующая трансмембранный домен, содержит последовательность в соответствии с SEQ ID NO: 17, или последовательность, идентичную ей на 95-99%.
8. Молекула нуклеиновой кислоты по п. 1, причем:
(i) кодируемая шарнирная область содержит аминокислотную последовательность в соответствии с SEQ ID NO: 2 или последовательность, идентичную ей на 95-99%; или
(ii) последовательность нуклеиновой кислоты, кодирующая шарнирную область, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 13 или последовательность, идентичную ей на 95-99%.
9. Молекула нуклеиновой кислоты по п. 1, причем кодируемый костимулирующий домен представляет собой функциональный сигнальный домен, полученный из белка, выбранного из группы, состоящей из молекулы ГКГС класса I, белков-рецепторов ФНО, иммуноглобулин-подобных белков, цитокиновых рецепторов, интегринов, сигнальных лимфоцит-активирующих молекул, SLAM-белков, активирующих рецепторов NK-клеток, BTLA, рецептора толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1, CD11a/CD18, 4-1BB, CD137, B7-H3, CDS, ICAM-1, ICOS, CD278, GITR, BAFFR, LIGHT, HVEM, LIGHTR, KIRDS2, SLAMF7, NKp80, KLRF1, NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1, CD226, SLAMF4, CD244, 2B4, CD84, CD96, Tactile, CEACAM1, CRTAM, Ly9, CD229, CD160, BY55, PSGL1, CD100, SEMA4D, CD69, SLAMF6, NTB-A, Ly108, SLAM, SLAMF1, CD150, IPO-3, BLAME, SLAMF8, SELPLG, CD162, LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
10. Молекула нуклеиновой кислоты по п. 9, причем кодируемый костимулирующий домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7, или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 7, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7.
11. Молекула нуклеиновой кислоты по п. 9, причем последовательность нуклеиновой кислоты, кодирующая костимулирующий домен, содержит нуклеотидную последовательность в соответствии с SEQ ID NO: 18 или последовательность, идентичную ей на 95-99%.
12. Молекула нуклеиновой кислоты по п. 1, причем кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен из 4-1BB и/или функциональный сигнальный домен из CD3-дзета.
13. Молекула нуклеиновой кислоты по п. 1, причем кодируемый внутриклеточный сигнальный домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7 и/или последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10; или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10; или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10.
14. Молекула нуклеиновой кислоты по п. 1, причем кодируемый внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 7 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи.
15. Молекула нуклеиновой кислоты по п. 1, причем последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен, содержит последовательность в соответствии с SEQ ID NO: 18, или последовательность, идентичную ей на 95-99%, и/или последовательность в соответствии с SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность, идентичную ей на 95-99%.
16. Молекула нуклеиновой кислоты по п. 1, которая содержит лидерную последовательность, которая кодирует аминокислотную последовательность в соответствии с SEQ ID NO: 1.
17. Молекула нуклеиновой кислоты по п. 1, которая кодирует CAR, содержащий:
(i) аминокислотную последовательность в соответствии с SEQ ID NO: 48, 49, 51-54 или 56;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций в SEQ ID NO: 48, 49, 51-54 или 56; или
(iii) аминокислотную последовательность на 95-99% идентичную SEQ ID NO: 48, 49, 51-54 или 56.
18. Молекула нуклеиновой кислоты по п. 1, содержащая нуклеотидную последовательность в соответствии с SEQ ID NO: 75, 76, 78, 79, 80, 81 или 83 или нуклеотидную последовательность на 95-99% идентичную SEQ ID NO: 75, 76, 78, 79, 80, 81 или 83.
19. Полипептидная молекула, содержащая аминокислотную последовательность, кодируемую молекулой нуклеиновой кислоты по любому из пп. 1-18, для специфического связывания с CD33.
20. Полипептид химерного антигенного рецептора (CAR) для связывания с CD33, причем CAR содержит антитело или фрагмент антитела, который включает в себя человеческий связывающий CD33 домен, который специфически связывается с CD33, трансмембранный домен и внутриклеточный сигнальный домен, содержащий первичный сигнальный домен и необязательно костимулирующий домен, где CD33-связывающий домен соединен с трансмембранным доменом шарнирной областью, и причем упомянутый CD33-связывающий домен содержит определяющую комплементарность область 1 тяжелой цепи (HC CDR1), определяющую комплементарность область 2 тяжелой цепи (HC CDR2), определяющую комплементарность область 3 тяжелой цепи (HC CDR3), определяющую комплементарность область 1 легкой цепи (LC CDR1), определяющую комплементарность область 2 легкой цепи (LC CDR2) и определяющую комплементарность область 3 легкой цепи (LC CDR3), где
(a) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 89, 98, 107, 116, 125 и 134 соответственно;
(b) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 274, 283, 292, 301, 310 и 319 соответственно;
(c) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 328, 337, 346, 355, 364 и 373 соответственно;
(d) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 84, 93, 102, 111, 120 и 129 соответственно;
(e) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 269, 278, 287, 296, 305 и 314 соответственно;
(f) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 323, 332, 341, 350, 359 и 368 соответственно;
(g) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 85, 94, 103, 112, 121 и 130 соответственно;
(h) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 270, 279, 288, 297, 306 и 315 соответственно;
(i) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 324, 333, 342, 351, 360 и 369 соответственно;
(j) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 87, 96, 105, 114, 123 и 132 соответственно;
(k) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 272, 281, 290, 299, 308 и 317 соответственно;
(l) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 326, 335, 344, 353, 362 и 371 соответственно;
(m) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 88, 97, 106, 115, 124 и 133 соответственно;
(n) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 273, 282, 291, 300, 309 и 318 соответственно;
(o) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 327, 336, 345, 354, 363 и 372 соответственно;
(p) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 90, 99, 108, 117, 126 и 135 соответственно;
(q) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 275, 284, 293, 302, 311 и 320 соответственно;
(r) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 329, 338, 347, 356, 365 и 374 соответственно;
(s) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 92, 101, 110, 119, 128 и 137 соответственно;
(t) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 277, 286, 295, 304, 313 и 322 соответственно; или
(u) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 331, 340, 349, 358, 367 и 376 соответственно.
21. Полипептид CAR по п. 20, содержащий:
(i) аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74; или
(iii) аминокислотную последовательность, идентичную на 95-99% аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74.
22. Полипептид CAR по п. 20, содержащий:
(i) аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65; или
(iii) аминокислотную последовательность, идентичную на 95-99% аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65.
23. Полипептид CAR по п. 20, содержащий:
(i) аминокислотную последовательность SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций в SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268; или
(iii) аминокислотную последовательность на 95-99% идентичную SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268.
24. Полипептид CAR по п. 20, в котором трансмембранный домен содержит трансмембранный домен из белка, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154.
25. Полипептид CAR по п. 20, в котором:
(i) трансмембранный домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 6,
(ii) аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 6, или
(iii) последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 6.
26. Полипептид CAR по п. 20, в котором шарнирная область содержит SEQ ID NO: 2 или последовательность, идентичную ей на 95-99%.
27. Полипептид CAR по п. 20, в котором костимулирующий домен представляет собой функциональный сигнальный домен, полученный из белка, выбранного из группы, состоящей из молекулы ГКГС класса I, белков-рецепторов ФНО, иммуноглобулин-подобных белков, цитокиновых рецепторов, интегринов, сигнальных лимфоцит-активирующих молекул, SLAM-белков, активирующих рецепторов NK-клеток, BTLA, рецептора толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1, CD11a/CD18, 4-1BB, CD137, B7-H3, CDS, ICAM-1, ICOS, CD278, GITR, BAFFR, LIGHT, HVEM, LIGHTR, KIRDS2, SLAMF7, NKp80, KLRF1, NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1, CD226, SLAMF4, CD244, 2B4, CD84, CD96, Tactile, CEACAM1, CRTAM, Ly9, CD229, CD160, BY55, PSGL1, CD100, SEMA4D, CD69, SLAMF6, NTB-A, Ly108, SLAM, SLAMF1, CD150, IPO-3, BLAME, SLAMF8, SELPLG, CD162, LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
28. Полипептид CAR по п. 20, в котором костимулирующий домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7, или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 7, или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7.
29. Полипептид CAR по п. 20, в котором внутриклеточный сигнальный домен содержит функциональный сигнальный домен из 4-1BB и/или функциональный сигнальный домен из CD3-дзета.
30. Полипептид CAR по п. 20, в котором внутриклеточный сигнальный домен содержит аминокислотную последовательность в соответствии с SEQ ID NO: 7 и/или последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10; или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 20, 10 или 5 модификаций аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10; или последовательность, идентичную на 95-99% аминокислотной последовательности в соответствии с SEQ ID NO: 7 и/или аминокислотной последовательности в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10.
31. Полипептид CAR по п. 20, в котором внутриклеточный сигнальный домен содержит последовательность в соответствии с SEQ ID NO: 7 и последовательность в соответствии с SEQ ID NO: 9 или SEQ ID NO: 10, причем последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке и в виде одной полипептидной цепи.
32. Полипептид CAR по п. 20, который содержит лидерную последовательность, которая содержит аминокислотную последовательность в соответствии с SEQ ID NO: 1.
33. Полипептид CAR по п. 20, содержащий:
(i) аминокислотную последовательность в соответствии с SEQ ID NO: 48, 49, 51-54 или 56;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций в SEQ ID NO: 48, 49, 51-54 или 56; или
(iii) аминокислотную последовательность на 95-99% идентичную SEQ ID NO: 48, 49, 51-54 или 56.
34. Вектор, содержащий молекулу нуклеиновой кислоты по любому из пп. 1-18, для получения CAR, причем вектор выбирают из группы, состоящей из ДНК-вектора, РНК-вектора, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора.
35. Вектор по п. 34, дополнительно содержащий промотор EF-1, содержащий последовательность в соответствии с SEQ ID NO: 11.
36. Иммунная эффекторная клетка для получения CAR, содержащего человеческий связывающий CD33 домен, содержащая молекулу нуклеиновой кислоты по любому из пп. 1-18 или вектор по п. 34 или 35.
37. Популяция иммунных эффекторных клеток для получения CAR, содержащего человеческий связывающий CD33 домен, где клетки популяции содержат молекулу нуклеиновой кислоты по любому из пп. 1-18 или вектор по п. 34 или 35.
38. Способ производства иммунной эффекторной клетки для получения CAR, содержащего человеческий связывающий CD33 домен, содержащий трансдукцию иммунной эффекторной клетки вектором по п. 34 или 35.
39. Способ генерирования популяции иммунных эффекторных клеток для получения CAR, содержащего человеческий связывающий CD33 домен, содержащий введение множества транскрибированных in vitro РНК или синтетических РНК в иммунные эффекторные клетки популяции, причем РНК содержит последовательность нуклеиновой кислоты, кодирующую полипептидную молекулу по п. 19 или полипептид CAR по пп. 20-33.
40. Способ обеспечения иммунитета против CD33-экспрессирующей опухоли у млекопитающего, содержащий введение млекопитающему эффективного количества популяции иммунных эффекторных клеток, содержащих молекулу нуклеиновой кислоты по любому из пп. 1-18, полипептидную молекулу по п. 19 или полипептид CAR по любому из пп. 20-33.
41. Способ по п. 40, в котором клетка представляет собой аутологичную T-клетку или аллогенную T-клетку.
42. Способ лечения млекопитающего, имеющего заболевание, ассоциированное с экспрессией CD33, содержащий введение млекопитающему эффективного количества популяции иммунных эффекторных клеток, содержащих молекулу нуклеиновой кислоты по любому из пп. 1-18, полипептидную молекулу по п. 19 или полипептид CAR по любому из пп. 20-33.
43. Способ по п. 42, в котором заболевание, ассоциированное с экспрессией CD33, представляет собой:
(i) рак, или злокачественную опухоль, или предраковое состояние, выбранное из одного или нескольких из миелодисплазии, миелодиспластического синдрома или предлейкоза, или
(ii) не связанный с раком симптом, ассоциированный с экспрессией CD33.
44. Способ по п. 42 или 43, в котором заболевание представляет собой гематологический рак.
45. Способ по п. 42 или 43, в котором заболевание представляет собой острый лейкоз, выбранный из одного или нескольких из острого миелоидного лейкоза (ОМЛ); миелодиспластического синдрома; миелопролиферативных новообразований; хронического миелоидного лейкоза (ХМЛ); или новообразования из бластных плазмацитоидных дендритных клеток, или их комбинации.
46. Способ по п. 44, в котором популяцию иммунных эффекторных клеток вводят в комбинации с одним или несколькими из:
(i) средства, которое повышает эффективность клетки, содержащей нуклеиновую кислоту CAR или полипептид CAR;
(ii) средства, которое ослабляет один или несколько побочных эффектов, ассоциированных с введением клетки, содержащей нуклеиновую кислоту CAR или полипептид CAR; или
(iii) средства, которое лечит заболевание, ассоциированное с CD33.
47. Молекула нуклеиновой кислоты по любому из пп. 1-18, полипептидная молекула по п. 19, полипептид CAR по любому из пп. 20-33, вектор по п. или 34, или 35, или клетка по п. 36 для использования в качестве лекарственного средства для лечения заболевания, ассоциированного с экспрессией CD33.
48. Молекула нуклеиновой кислоты по любому из пп. 1-9, полипептидная молекула по п. 19, полипептид CAR по любому из пп. 20-33, вектор по п. или 34 или 35 или клетка по п. 36 для использования в лечении заболевания, ассоциированного с экспрессией CD33.
49. Популяция иммунных эффекторных клеток по п. 37, дополнительно экспрессирующая ингибирующую молекулу, которая содержит первый полипептид, который содержит по меньшей мере часть ингибирующей молекулы, ассоциированной со вторым полипептидом, который содержит внутриклеточный сигнальный домен.
50. Популяция иммунных эффекторных клеток по п. 49, в которой ингибирующая молекула содержит первый полипептид, который содержит по меньшей мере часть PD1, и второй полипептид, содержащий костимулирующий домен и первичный сигнальный домен.
51. Способ по п. 46, в котором средство представляет собой ингибитор mTOR и субъекту вводят низкую иммуностимулирующую дозу ингибитора mTOR, например RAD001 или рапамицина.
52. Способ по п. 51, в котором ингибитор mTOR вводят в течение продолжительности времени, достаточной для уменьшения доли PD-1-положительных T-клеток, увеличения доли PD-1-отрицательных T-клеток или увеличения отношения PD-1-отрицательные T-клетки/PD-1-положительные T-клетки в периферической крови субъекта или в препарате T-клеток, выделенных из субъекта.
53. Способ кондиционирования субъекта, имеющего CD33-экспрессирующую клетку перед клеточной трансплантацией, содержащий введение субъекту эффективного количества клеток, содержащих молекулу нуклеиновой кислоты по любому из пп. 1-18, полипептидную молекулу по п. 19 или полипептид CAR по любому из пп. 20-33.
54. Способ по п. 53, в котором клеточная трансплантация представляет собой трансплантацию стволовых клеток, например трансплантацию гематопоэтических стволовых клеток, или трансплантацию костного мозга.
55. Способ по п. 53, в котором кондиционирование субъекта перед клеточной трансплантацией содержит уменьшение количества CD33-экспрессирующих клеток у субъекта, например CD33-экспрессирующих нормальных клеток или CD33-экспрессирующих раковых клеток.
56. Связывающий CD33 домен для специфического связывания с CD33, содержащий определяющую комплементарность область 1 тяжелой цепи (HC CDR1), определяющую комплементарность область 2 тяжелой цепи (HC CDR2), определяющую комплементарность область 3 тяжелой цепи (HC CDR3), определяющую комплементарность область 1 легкой цепи (LC CDR1), определяющую комплементарность область 2 легкой цепи (LC CDR2) и определяющую комплементарность область 3 легкой цепи (LC CDR3), где:
(a) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 89, 98, 107, 116, 125 и 134 соответственно;
(b) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 274, 283, 292, 301, 310 и 319 соответственно;
(c) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 328, 337, 346, 355, 364 и 373 соответственно;
(d) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 84, 93, 102, 111, 120 и 129 соответственно;
(e) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 269, 278, 287, 296, 305 и 314 соответственно;
(f) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 323, 332, 341, 350, 359 и 368 соответственно;
(g) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 85, 94, 103, 112, 121 и 130 соответственно;
(h) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 270, 279, 288, 297, 306 и 315 соответственно;
(i) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 324, 333, 342, 351, 360 и 369 соответственно;
(j) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 87, 96, 105, 114, 123 и 132 соответственно;
(k) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 272, 281, 290, 299, 308 и 317 соответственно;
(l) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 326, 335, 344, 353, 362 и 371 соответственно;
(m) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 88, 97, 106, 115, 124 и 133 соответственно;
(n) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 273, 282, 291, 300, 309 и 318 соответственно;
(o) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 327, 336, 345, 354, 363 и 372 соответственно;
(p) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 90, 99, 108, 117, 126 и 135 соответственно;
(q) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 275, 284, 293, 302, 311 и 320 соответственно;
(r) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 329, 338, 347, 356, 365 и 374 соответственно;
(s) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 92, 101, 110, 119, 128 и 137 соответственно;
(t) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 277, 286, 295, 304, 313 и 322 соответственно; или
(u) указанные последовательности HC CDR1, HC CDR2, HC CDR3, LC CDR1, LC CDR2 и LC CDR3 содержат аминокислотные последовательности SEQ ID NO: 331, 340, 349, 358, 367 и 376 соответственно.
57. Связывающий CD33 домен по п. 56, содержащий:
(i) аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74; или
(iii) аминокислотную последовательность на 95-99% идентичной аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 71, 66, 67, 69, 70, 72 или 74.
58. Связывающий CD33 домен по п. 56 или 57, содержащий:
(i) аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65; или
(iii) аминокислотную последовательность на 95-99% идентичной аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 62, 57, 58, 60, 61, 63 или 65.
59. Связывающий CD33 домен по п. 56, содержащий:
(i) аминокислотную последовательность SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268;
(ii) аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более чем 30, 20 или 10 модификаций SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268; или
(iii) аминокислотную последовательность на 95-99% идентичную SEQ ID NO: 39, 40, 42-45, 47, 57, 58, 60-63, 65, 66, 67, 69-72, 74 или 262-268.
| CAROL E.O'HEAR et al., Anti-CD33 Chimeric Antigen Receptor Therapy For Acute Myeloid Leukemia, Blood, 2013, 122:1441 | |||
| PIZZITOLA I et al., Chimeric antigen receptors against CD33/CD123 antigens efficiently target primary acute myeloid leukemia cells in vivo, Leukemia, 2014, Vol.28, N.8, pp.1596-1605, doi: 10.1038/leu.2014.62 | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2021-05-04—Публикация
2015-07-21—Подача