ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение принадлежит к области иммунотерапии и относится к антителам и их фрагментам, которые связываются с белком нектин-2 человека (CD112), к полинуклеотидным последовательностям, кодирующим эти антитела и фрагменты, и к клеткам, продуцирующим их. Настоящее изобретение также относится к терапевтическим и диагностическим композициям, содержащим указанные антитела и фрагменты, и к способам лечения и диагностики заболеваний, в частности, рака, с применением указанных антител и фрагментов.
УРОВЕНЬ ТЕХНИКИ
Иммунотерапия рака используется для создания и усиления противоопухолевого иммунного ответа, например, с помощью лечения антителами, специфичными в отношении антигенов на опухолевых клетках, с помощью слияний антигенпрезентирующих клеток с опухолевыми клетками или с помощью специфичной активации противоопухолевых Т-клеток. Способность привлекать иммунные клетки (например, Т-клетки) против опухолевых клеток у пациента обеспечивает терапевтический метод борьбы с различными типами рака и метастазами, которые до сих пор считались неизлечимыми.
Опосредуемые Т-клетками иммунные ответы включают несколько последовательных этапов, регулируемых балансом между костимулирующими и коингибирующими сигналами, которые контролируют величину иммунного ответа. Ингибирующие сигналы, называемые иммунными контрольными точками, имеют решающее значение для поддержания аутотолерантности и для ограничения опосредуемого иммунной системой сопутствующего повреждения тканей. Эти ингибирующие сигналы меняются по мере устранения, ухудшения или сохранения инфекции или провокации иммунной системы, и эти изменения влияют на ответ T-клеток и изменяют форму иммунного ответа.
Экспрессия белков иммунных контрольных точек изменяется опухолями. Например, положительная регуляция лиганда запрограммированной смерти 1 (PD-L1) на поверхности раковых клеток позволяет им связываться с молекулой контрольной точки PD-1, экспрессируемой на Т-клетках. Это приводит к ингибированию Т-клеток, которые в ином случае могли бы атаковать опухолевые клетки, и позволяет опухолевым клеткам уклоняться от иммунной системы хозяина. Таким образом, иммунные контрольные точки представляют собой значительные препятствия для активации функционального клеточного иммунитета против рака. Соответственно, антагонистические антитела, специфичные в отношении ингибирующих лигандов на Т-клетках (например, PD-1), представляют собой примеры нацеленных агентов против иммунных контрольных точек, которые используются в терапии рака (например, ниволумаб и пембролизумаб). Другим примером молекулы иммунной контрольной точки является Т-клеточный иммунорецептор с доменами Ig и ITIM (TIGIT). TIGIT представляет собой коингибирующую молекулу, экспрессируемую на различных иммунных клетках, включая Т-клетки и клетки естественных киллеров (NK-клетки). TIGIT связывается с высокой аффинностью с рецептором полиовируса (PVR) и с нектином-2.
Нектин-2, который также был назван связанным с полиовирусным рецептором белком-2, подобным полиовирусному рецептору белком 2, CD112 или PRR-2, представляет собой однопроходный трансмембранный гликопротеин с двумя Ig-подобными доменами C2-типа и Ig-подобным доменом V-типа. Нектин-2 выступает в качестве посредника прикрепления клеток к молекулам внеклеточного матрикса как один из компонентов плазматической мембраны в адгезивных контактах. Он также играет роль рецептора проникновения для определенных мутантных штаммов вируса простого герпеса и вируса псевдобешенства и участвует в распространении этих вирусов от клетки к клетке. Вариации в этом гене были ассоциированы с различиями в степени тяжести рассеянного склероза. Важно отметить, что нектин-2 также может служить модулятором передачи сигналов Т-клетками. Он может быть как костимулятором функций Т-клеток, так и коингибитором, в зависимости от рецептора, с которым он связывается. После связывания с CD226 (DNAM-1) он стимулирует пролиферацию Т-клеток и продукцию цитокинов, включая IL-2 и IFNγ, в то время как после взаимодействия с PVRIG (CD112R) и/или TIGIT он ингибирует пролиферацию Т-клеток. Эти два разнонаправленных взаимодействия являются конкурирующими.
Было показано, что нектин-2 сверхэкспрессируется в различных опухолях, включая рак молочной железы и рак яичников (Oshima et al. Molecular Cancer 2013). Наличие нектина-2 на опухолевых клетках приводит к неблагоприятному прогнозу и уменьшению активности Т-клеток (Stamm et al., Oncogen 2018).
В заявке на патент США № 2017/0037133 раскрыт ингибитор против CD112 (нектина-2, PVRL2), CD155 (PVR), галектина-9, TIM-3 и/или TIGIT для применения в способе лечения гемобластоза, в частности, острого миелолейкоза (ОМЛ). Ингибитор может представлять собой конструкцию антитела.
Существует неудовлетворенная потребность в обеспечении дополнительных и более эффективных, специфичных, безопасных и/или стабильных агентов, которые по отдельности или в комбинации с другими агентами могут стимулировать атаку опухолей или инфицированных вирусом клеток клетками иммунной системы. Такие агенты могут представлять собой моноклональные антитела, ингибирующие связывание нектина-2 с CD112R и TIGIT.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложены антитела и их фрагменты, которые распознают белок нектин-2 (CD112), предотвращают его связывание с T-клеточным иммунорецептором с доменами Ig и ITIM (TIGIT) и CD112R (PVRIG) и ингибируют супрессорную активность лимфоцитов, таких как клетки естественных киллеров (NK) и Т-клетки. Антитела к нектину-2, раскрытые в данном документе, способны связываться с нектином-2, присутствующим на раковых клетках. Указанные антитела и их фрагмент характеризуются наличием уникальных наборов последовательностей определяющих комплементарность участков (CDR), высокой аффинностью и высокой специфичностью в отношении нектина-2 человека, и пригодны для иммунотерапии рака для борьбы с уклонением опухоли от иммунной системы в качестве самостоятельной терапии и в комбинации с другими противораковыми агентами. Антитела также могут быть пригодны в лечении вирусных инфекций и могут применяться для диагностики рака. Согласно настоящему изобретению также предложены CAR-T-клетки и способы их применения для адоптивной терапии.
В данном документе раскрыто, что высокоаффинные антитела к нектину-2, описанные в данном документе, блокируют взаимодействия TIGIT- и/или CD112R-нектин-2, а затем восстанавливают активность Т-клеток и NK-клеток. Антитела согласно настоящему изобретению являются высокоспецифичными в отношении нектина-2 человека. Эти свойства делают моноклональные антитела (МАТ) согласно настоящему изобретению значимыми кандидатами для применения в иммунотерапии рака, что позволяет вводить более низкие дозы с меньшим количеством побочных эффектов.
Было обнаружено, что МАТ к нектину-2 в соответствии с настоящим изобретением предпочтительно индуцируют пролиферацию Т-клеток путем, который аналогичен индуцируемому МАТ к PD-1 и МАТ к CTLA-4. Комбинация некоторых МАТ к нектину-2 с клинически одобренными терапевтическими МАТ к PD-1 и МАТ к CTLA4 приводила к значительному увеличению активности по сравнению с уровнем активности, индуцированным любым из отдельных МАТ. Неожиданно некоторые из комбинаций МАТ к нектину-2, описанных в данном документе, с антителом к PD-1 продемонстрировали синергический эффект в отношении уничтожения опухолевых клеток. Эффект индукции был показан для мононуклеарных клеток периферической крови (МКПК) человека и, главным образом, для Т-клеток. Кроме того, МАТ к нектину-2 были способны индуцировать активацию NK-клеток в присутствии раковых клеток-мишеней. Также раскрыто, что некоторые антитела к нектину-2 не оказывали блокирующего эффекта на костимулирующую передачу сигналов DNAM-1, поэтому они не оказывали вредного эффекта на сигналы иммунной индукции. Кроме того, было обнаружено, что антитела, описанные в данном документе, обладают высокой специфичностью в отношении белка нектина-2 человека или яванской макаки.
МАТ к нектину-2, раскрытые в данном документе, могут иметь функциональную тяжелую цепь (Fc), которая может дополнительно запускать противораковые иммунные ответы.
Некоторые из МАТ к нектину-2, описанных в данном документе, могут быть способны уменьшать жизнеспособность опухолевых клеток иммуно-независимым образом.
В соответствии с одним аспектом настоящего изобретения предложено антитело, или фрагмент указанного антитела, содержащий по меньшей мере антигенсвязывающую часть, которое специфично связывается с нектином-2 человека и ингибирует его связывание по меньшей мере с одним из рецепторов TIGIT и CD112R, причем указанные антитела обладают аффинностью в отношении нектина-2 человека, составляющей по меньшей мере 10-9 М.
Согласно настоящему изобретению также предложено антитело, или фрагмент указанного антитела, способное ингибировать связывание нектина-2 человека с TIGIT человека или CD112R человека, для применения в лечении рака вместе с Т-лимфоцитами и/или клетками естественных киллеров (NK), причем указанные антитела обладают аффинностью в отношении нектина-2 человека, составляющей по меньшей мере 10-9 М.
В соответствии с некоторыми вариантами реализации антитело специфично связывается с нектином-2 человека и ингибирует его связывание с TIGIT и CD112R.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит набор из шести последовательностей CDR, выбранных из группы, состоящей из:
i. трех определяющих комплементарность участков (CDR) вариабельной области тяжелой цепи (HC), содержащей SEQ ID NO: 7, и трех CDR вариабельной области легкой цепи (LC), содержащей SEQ ID NO: 8, или их аналога или производного, имеющего по меньшей мере 90% идентичности последовательности с указанной последовательностью антитела или фрагмента; и
ii. трех CDR вариабельной области тяжелой цепи, содержащей SEQ ID NO: 17, и трех CDR вариабельной области легкой цепи, содержащей SEQ ID NO: 18, или их аналога или производного, имеющего по меньшей мере 90% идентичности последовательности с указанной последовательностью антитела или фрагмента.
Существует несколько методов определения последовательностей CDR конкретной молекулы антитела, известных в данной области техники, однако не существует стандартного однозначного метода. Определение последовательностей CDR из вариабельных областей тяжелой и легкой цепи антитела может быть выполнено в соответствии с любым методом, известным в данной области техники, включая, не ограничиваясь перечисленным, методы, известные как KABAT, Chothia и IMGT. Выбранный набор CDR может включать последовательности, идентифицированные более чем одним методом, а именно некоторые последовательности CDR могут быть определены с использованием KABAT, а некоторые - с использованием IMGT, например. В соответствии с некоторыми вариантами реализации последовательности CDR вариабельных областей МАТ определены с использованием метода IMGT.
В соответствии с некоторыми вариантами реализации антитело или фрагмент содержит последовательности CDR моноклонального антитела, обозначенного как клон 7, а именно три последовательности CDR, содержащиеся в вариабельной области тяжелой цепи, представленной в SEQ ID NO: 7, и три последовательности CDR, содержащиеся в вариабельной области легкой цепи, представленной в SEQ ID NO: 8, или моноклонального антитела, обозначенного как клон 11, а именно три последовательности CDR, содержащиеся в вариабельной области тяжелой цепи, представленной в SEQ ID NO: 17, и три последовательности CDR, содержащиеся в вариабельной области легкой цепи, представленной в SEQ ID NO: 18.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR1 тяжелой цепи, содержащую последовательность RFTMS (SEQ ID NO: 1). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR2 тяжелой цепи, содержащую последовательность TISSGGSYTYYPDSVKG (SEQ ID NO: 2). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR3 тяжелой цепи, содержащую последовательность DRDFYGPYYAMDY (SEQ ID NO: 3).
В соответствии с определенными вариантами реализации антитело или фрагмент антитела содержит: (i) CDR1 HC, содержащую последовательность RFTMS (SEQ ID NO: 1); (ii) CDR2 HC, содержащую последовательность TISSGGSYTYYPDSVKG (SEQ ID NO: 2); и (iii) CDR3 HC, содержащую последовательность DRDFYGPYYAMDY (SEQ ID NO: 3).
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR1 легкой цепи, содержащую последовательность KSSQSLLNSGNQKNYLA (SEQ ID NO: 4). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR2 легкой цепи, содержащую последовательность FASTRES (SEQ ID NO: 5). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR3 легкой цепи, содержащую последовательность QQHYTTPLT (SEQ ID NO: 6).
В соответствии с определенными вариантами реализации антитело или фрагмент антитела содержит: (i) CDR1 LC, содержащую последовательность KSSQSLLNSGNQKNYLA (SEQ ID NO: 4); (ii) CDR2 LC, содержащую последовательность FASTRES (SEQ ID NO: 5); и (iii) CDR3 HC, содержащую последовательность QQHYTTPLT (SEQ ID NO: 6).
В соответствии с некоторыми конкретными вариантами реализации антитело или фрагмент содержит последовательность CDR1 тяжелой цепи, содержащую последовательность RFTMS (SEQ ID NO: 1), CDR2 тяжелой цепи, содержащую последовательность TISSGGSYTYYPDSVKG (SEQ ID NO: 2), CDR3 тяжелой цепи, содержащую последовательность DRDFYGPYYAMDY (SEQ ID NO: 3), CDR1 легкой цепи, содержащую последовательность KSSQSLLNSGNQKNYLA (SEQ ID NO: 4), CDR2 легкой цепи, содержащую последовательность FASTRES (SEQ ID NO: 5), и CDR3 легкой цепи, содержащую последовательность QQHYTTPLT (SEQ ID NO: 6), или их аналоги, содержащие не более 5% аминокислотных замен, делеций и/или инсерций в последовательности гипервариабельной области (HVR).
В соответствии с некоторыми конкретными вариантами реализации антитело или фрагмент содержит набор из шести последовательностей CDR, состоящий из:
i. CDR1 тяжелой цепи, имеющего последовательность, представленную в SEQ ID NO: 1;
ii. CDR2 тяжелой цепи, имеющего последовательность, представленную в SEQ ID NO: 2;
iii. CDR3 тяжелой цепи, имеющего последовательность, представленную в SEQ ID NO: 3;
iv. CDR1 легкой цепи, имеющего последовательность, представленную в SEQ ID NO: 4;
v. CDR2 легкой цепи, имеющего последовательность, представленную в SEQ ID NO: 5; и
vi. CDR3 легкой цепи, имеющего последовательность, представленную в SEQ ID NO: 6
В соответствии с некоторыми вариантами реализации антитело или его фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 7, или ее аналог или производное, имеющие по меньшей мере 90% идентичности последовательности с указанной последовательностью вариабельной области тяжелой цепи.
В соответствии с некоторыми вариантами реализации антитело или его фрагмент содержит вариабельную область легкой цепи, представленную в SEQ ID NO: 8, или ее аналог, имеющий по меньшей мере 90% идентичности последовательности с указанной последовательностью вариабельной области легкой цепи.
В соответствии с конкретным вариантом реализации антитело или его фрагмент содержит вариабельную область тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 7, и вариабельную область легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 8, или их аналог, имеющий по меньшей мере 90% идентичности последовательности с указанной последовательностью легкой и/или тяжелой цепи.
В соответствии с некоторыми вариантами реализации антитело или фрагмент содержит последовательности CDR моноклонального антитела, обозначенного клон 11, а именно три последовательности CDR, содержащиеся в вариабельной области тяжелой цепи, представленной в SEQ ID NO: 17, и три последовательности CDR, содержащиеся в вариабельной области легкой цепи, представленной в SEQ ID NO: 18.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR1 тяжелой цепи, содержащую последовательность SYWIH (SEQ ID NO: 11). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR2 тяжелой цепи, содержащую последовательность AVYPGNSDSNYNQKFKA (SEQ ID NO: 12). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR3 тяжелой цепи, содержащую последовательность LVGTFDY (SEQ ID NO: 13).
В соответствии с определенными вариантами реализации антитело или фрагмент антитела содержит: (i) CDR1 HC, содержащую последовательность SYWIH (SEQ ID NO: 11); (ii) CDR2 HC, содержащую последовательность AVYPGNSDSNYNQKFKA (SEQ ID NO: 12); и (iii) CDR3 HC, содержащую последовательность LVGTFDY (SEQ ID NO: 13).
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR1 легкой цепи, содержащую последовательность KASQNVGINVV (SEQ ID NO: 14). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR2 легкой цепи, содержащую последовательность SASYRYS (SEQ ID NO: 15). В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит CDR3 легкой цепи, содержащую последовательность QQYNTNPFT (SEQ ID NO: 16).
В соответствии с определенными вариантами реализации антитело или фрагмент антитела содержит: (i) CDR1 LC, содержащую последовательность KASQNVGINVV (SEQ ID NO: 14); (ii) CDR2 LC, содержащую последовательность SASYRYS (SEQ ID NO: 15); и (iii) CDR3 HC, содержащую последовательность QQYNTNPFT (SEQ ID NO: 16).
В соответствии с некоторыми конкретными вариантами реализации антитело или фрагмент содержит последовательность CDR1 тяжелой цепи, содержащую последовательность SYWIH (SEQ ID NO: 11), CDR2 тяжелой цепи, содержащую последовательность AVYPGNSDSNYNQKFKA (SEQ ID NO: 12), CDR3 тяжелой цепи, содержащую последовательность LVGTFDY (SEQ ID NO: 13), CDR1 легкой цепи, содержащую последовательность KASQNVGINVV (SEQ ID NO: 14), CDR2 легкой цепи, содержащую последовательность SASYRYS (SEQ ID NO: 15), и CDR3 легкой цепи, содержащую последовательность QQYNTNPFT (SEQ ID NO: 16), или их аналоги, содержащие не более 5% аминокислотных замен, делеций и/или инсерций в последовательности гипервариабельной области (HVR).
В соответствии с некоторыми конкретными вариантами реализации антитело или фрагмент содержит набор из шести последовательностей CDR, состоящий из:
i. CDR1 тяжелой цепи, имеющей последовательность, представленную в SEQ ID NO: 11;
ii. CDR2 тяжелой цепи, имеющей последовательность, представленную в SEQ ID NO: 12;
iii. CDR3 тяжелой цепи, имеющей последовательность, представленную в SEQ ID NO: 13;
iv. CDR1 легкой цепи, имеющей последовательность, представленную в SEQ ID NO: 14;
v. CDR2 легкой цепи, имеющей последовательность, представленную в SEQ ID NO: 15; и
vi. CDR3 легкой цепи, имеющей последовательность, представленную в SEQ ID NO: 16.
В соответствии с некоторыми вариантами реализации антитело или его фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 17, или ее аналог или производное, имеющие по меньшей мере 90% идентичности последовательности с указанной последовательностью вариабельной области тяжелой цепи.
В соответствии с некоторыми вариантами реализации антитело или его фрагмент содержит вариабельную область легкой цепи, представленную в SEQ ID NO: 18, или ее аналог, имеющий по меньшей мере 90% идентичности последовательности с указанной последовательностью вариабельной области легкой цепи.
В соответствии с конкретным вариантом реализации антитело или его фрагмент содержит вариабельную область тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 17, и вариабельную область легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 18, или их аналог, имеющий по меньшей мере 90% идентичности последовательности с указанной последовательностью легкой и/или тяжелой цепи.
В соответствии с некоторыми вариантами реализации антитело представляет собой выделенное моноклональное антитело.
В соответствии с некоторыми вариантами реализации антитело или его фрагмент распознает нектин-2 человека с аффинностью по меньшей мере 5×10-9 M. В соответствии с другими вариантами реализации антитело или фрагмент антитела связывается с нектином-2 человека с аффинностью 5×10-9 М, 10-9 М, 5×10-10 М, 10-10 М, 5×10-11 М или даже выше. В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела связывается с нектином-2 человека с аффинностью в диапазоне от 10-9 M до 10-11 M. В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела связывается с нектином-2 человека с аффинностью в диапазоне от 10-9 M до 10-10 M. В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела связывается с нектином-2 человека с аффинностью в диапазоне от 10-10 M до 10-11 M. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
Аналоги и производные выделенного антитела и фрагментов, описанных выше, также включены в объем настоящего изобретения.
В соответствии с некоторыми вариантами реализации аналог антитела или фрагмента антитела имеет по меньшей мере 90% идентичности последовательности с гипервариабельной областью последовательности референсного антитела.
В соответствии с определенными вариантами реализации аналог или производное выделенного антитела или его фрагмента имеет по меньшей мере 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичности последовательности с вариабельной областью последовательности референсного антитела. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела в соответствии с настоящим изобретением содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 7 или SEQ ID NO: 17, или аналог, имеющий по меньшей мере 95% сходства последовательности с указанной последовательностью.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит вариабельную область легкой цепи, представленную в SEQ ID NO: 8 или SEQ ID NO: 18, или аналог, имеющий по меньшей мере 95% сходства последовательности с указанной последовательностью.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит тяжелую цепь и легкую цепь, причем: (i) тяжелая цепь содержит SEQ ID NO: 7, и легкая цепь содержит SEQ ID NO: 8; или (ii) тяжелая цепь содержит SEQ ID NO: 17, и легкая цепь содержит SEQ ID NO: 18. Также включены аналоги антител или фрагментов, имеющие по меньшей мере 95% сходства последовательности с указанными тяжелыми или легкими цепями.
В соответствии с некоторыми вариантами реализации аналог имеет по меньшей мере 96, 97, 98 или 99% сходства или идентичности последовательности с вариабельными областями легкой или тяжелой цепи антитела, описанными выше. В соответствии с некоторыми вариантами реализации аналог содержит не более одной аминокислотной замены, делеции или добавления к одной или более последовательностям CDR гипервариабельной области, а именно любой из последовательностей CDR, представленных в SEQ ID NO: 1, 2, 3, 4, 5, 6, 11, 12, 13, 14, 15 и 16. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения. В соответствии с некоторыми вариантами реализации аминокислотная замена представляет собой консервативную замену.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит гипервариабельную область (HVR), имеющую области легкой и тяжелой цепи, определенные выше, в которой 1, 2, 3, 4 или 5 аминокислот были заменены, удалены и/или добавлены. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит HVR, имеющую области легкой и тяжелой цепи, определенные выше, в которой была заменена одна аминокислота. В соответствии с конкретными вариантами реализации антитело или фрагмент антитела содержит CDR, определенную выше, в которой была заменена одна аминокислота.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит набор CDR, выбранный из группы, состоящей из:
i. набора из шести CDR, причем: CDR1 HC представляет собой RFTMS (SEQ ID NO: 1); CDR2 HC представляет собой TISSGGSYTYYPDSVKG (SEQ ID NO: 2); CDR3 HC представляет собой DRDFYGPYYAMDY (SEQ ID NO: 3); CDR1 LC представляет собой KSSQSLLNSGNQKNYLA (SEQ ID NO: 4); CDR2 LC представляет собой FASTRES (SEQ ID NO: 5); и CDR3 LC представляет собой QQHYTTPLT (SEQ ID NO: 6); и
ii. набора из шести CDR, причем: последовательность CDR1 HC представляет собой SYWIH (SEQ ID NO: 11); CDR2 HC представляет собой AVYPGNSDSNYNQKFKA (SEQ ID NO: 12); CDR3 HC представляет собой LVGTFDY (SEQ ID NO: 13); CDR1 LC представляет собой KASQNVGINVV (SEQ ID NO: 14); CDR2 LC представляет собой SASYRYS (SEQ ID NO: 15); и CDR3 LC представляет собой QQYNTNPFT (SEQ ID NO: 16).
Согласно настоящему изобретению также предложены антитела и их связывающие фрагменты, содержащие тяжелую цепь и легкую цепь, причем указанные цепи содержат набор последовательности вариабельной области тяжелой цепи и последовательности вариабельной области легкой цепи, выбранных из группы, состоящей из:
i. SEQ ID NO: 7 и 8; и
ii. SEQ ID NO: 17 и 18.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела способны ингибировать связывание нектина-2 человека с TIGIT или CD112R, экспрессируемым на Т-клетках или NK-клетках.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела способны ингибировать связывание нектина-2 человека с TIGIT и CD112R, экспрессируемыми на Т-клетках или NK-клетках.
В соответствии с конкретным вариантом реализации антитело выбрано из группы, состоящей из: химерного антитела и фрагмента антитела, содержащего по меньшей мере антигенсвязывающую часть антитела. В соответствии с конкретными вариантами реализации антитело представляет собой химерное антитело. В соответствии с другими вариантами реализации химерное антитело содержит константную область человека. В соответствии с конкретным вариантом реализации фрагмент антитела выбран из группы, состоящей из: Fab, Fab', F(ab')2, Fd, Fd', Fv, dAb, выделенной области CDR, одноцепочечной вариабельной области (scFv), одноцепочечного антитела (scab), «диател» и «линейных антител». Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации антитело или фрагмент антитела содержит константную область, выбранную из группы, состоящей из: IgG1 мыши, IgG2a мыши, IgG2b мыши, IgG3 мыши, IgG1 человека, IgG2 человека, IgG3 человека и IgG4 человека. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми конкретными вариантами реализации моноклональное антитело представляет собой химерное моноклональное антитело.
В соответствии с некоторыми вариантами реализации химерное антитело содержит константные области человека.
В соответствии с некоторыми вариантами реализации константные области человека химерного антитела выбраны из группы, состоящей из: IgG1 человека, IgG2 человека, IgG3 человека и IgG4 человека.
В соответствии с некоторыми вариантами реализации константная область человека химерного антитела выбрана из группы, состоящей из: IgG1 человека и IgG2 человека.
В соответствии с некоторыми вариантами реализации предложен конъюгат, содержащий антитело или его фрагмент, описанные выше.
Антитела или их фрагменты в соответствии с настоящим изобретением могут быть присоединены к цитотоксическому фрагменту, радиоактивному фрагменту или идентифицируемому фрагменту.
Согласно другому аспекту настоящего изобретения предложены полинуклеотидные последовательности, кодирующие антитела, обладающие высокой аффинностью и специфичностью в отношении нектина-2 человека, а также векторы и клетки-хозяева, несущие эти полинуклеотидные последовательности.
В соответствии с некоторыми вариантами реализации предложены полинуклеотидные последовательности, кодирующие аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи, описанные выше.
В соответствии с некоторыми вариантами реализации полинуклеотидная последовательность кодирует антитело или фрагмент или цепь антитела, способные связываться с эпитопом в белке нектин-2 человека, с которым связывается: (i) антитело (в данном документе обозначенное как клон 7), имеющее вариабельную область тяжелой цепи из SEQ ID NO: 7 и вариабельную область легкой цепи из SEQ ID NO: 8; или (ii) антитело (в данном документе обозначенное как клон 11), имеющее вариабельную область тяжелой цепи из SEQ ID NO: 17 и вариабельную область легкой цепи из SEQ ID NO: 18.
В соответствии с некоторыми вариантами реализации полинуклеотидная последовательность кодирует антитело или фрагмент или цепь антитела, содержащие последовательность, представленную в последовательности, выбранной из группы, состоящей из: (i) SEQ ID NO: 7 и SEQ ID NO: 8; и (ii) SEQ ID NO: 17 и SEQ ID NO: 18. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми другими вариантами реализации полинуклеотидная последовательность в соответствии с настоящим изобретением кодирует антитело или фрагмент или цепь антитела, содержащие:
i. набор из шести CDR, причем: CDR1 HC представляет собой RFTMS (SEQ ID NO: 1); CDR2 HC представляет собой TISSGGSYTYYPDSVKG (SEQ ID NO: 2); CDR3 HC представляет собой DRDFYGPYYAMDY (SEQ ID NO: 3); CDR1 LC представляет собой KSSQSLLNSGNQKNYLA (SEQ ID NO: 4); CDR2 LC представляет собой FASTRES (SEQ ID NO: 5); и CDR3 LC представляет собой QQHYTTPLT (SEQ ID NO: 6); или
ii. набор из шести CDR, причем: последовательность CDR1 HC представляет собой SYWIH (SEQ ID NO: 11); CDR2 HC представляет собой AVYPGNSDSNYNQKFKA (SEQ ID NO: 12); CDR3 HC представляет собой LVGTFDY (SEQ ID NO: 13); CDR1 LC представляет собой KASQNVGINVV (SEQ ID NO: 14); CDR2 LC представляет собой SASYRYS (SEQ ID NO: 15); и CDR3 LC представляет собой QQYNTNPFT (SEQ ID NO: 16). Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации определенные выше полинуклеотидные последовательности кодируют молекулу, выбранную из группы, состоящей из: антитела, фрагмента антитела, содержащего по меньшей мере антигенсвязывающую часть, и конъюгата антитела, содержащего указанное антитело или фрагмент антитела. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации полинуклеотидная последовательность кодирует вариабельную область тяжелой цепи моноклонального антитела, содержащую последовательность, представленную в SEQ ID NO: 7, или ее вариант, имеющий по меньшей мере 90% идентичности последовательности.
В соответствии с некоторыми вариантами реализации полинуклеотидная последовательность кодирует вариабельную область тяжелой цепи моноклонального антитела, содержащую последовательность, представленную в SEQ ID NO: 17, или ее вариант, имеющий по меньшей мере 90% идентичности последовательности.
В соответствии с некоторыми вариантами реализации полинуклеотидная последовательность кодирует вариабельную область легкой цепи моноклонального антитела, содержащую последовательность, представленную в SEQ ID NO: 8, или ее вариант, имеющий по меньшей мере 90% идентичности последовательности.
В соответствии с некоторыми вариантами реализации полинуклеотидная последовательность кодирует вариабельную область легкой цепи моноклонального антитела, содержащую последовательность, представленную в SEQ ID NO: 18, или ее вариант, имеющий по меньшей мере 90% идентичности последовательности.
В соответствии с некоторыми вариантами реализации настоящего изобретения предложен полипептид, содержащий по меньшей мере одну последовательность, кодируемую по меньшей мере одной полинуклеотидной последовательностью, раскрытой выше.
В дополнительном аспекте настоящего изобретения предложена конструкция нуклеиновой кислоты, содержащая молекулу нуклеиновой кислоты, кодирующую по меньшей мере одну цепь антитела или ее фрагмент в соответствии с настоящим изобретением. В соответствии с некоторыми вариантами реализации конструкция нуклеиновой кислоты представляет собой плазмиду.
В соответствии с некоторыми вариантами реализации плазмида содержит по меньшей мере одну полинуклеотидную последовательность, представленную в последовательности, выбранной из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 19 и SEQ ID NO: 20. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В еще одном аспекте настоящего изобретения предложена клетка, способная продуцировать антитело или фрагмент антитела, содержащие определенные последовательности CDR и/или определенные вариабельные области тяжелой и легкой цепей, определенные выше.
В соответствии с некоторыми вариантами реализации предложена клетка, содержащая по меньшей мере одну полинуклеотидную последовательность, раскрытую выше.
В соответствии с некоторыми вариантами реализации клетка, продуцирующая моноклональное антитело, представляет собой клетку гибридомы.
Согласно настоящему изобретению предложена, в соответствии с другим аспектом, фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно антитело, фрагмент антитела или их конъюгаты, распознающие нектин-2 человека с высокой аффинностью и специфичностью, и необязательно по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, разбавитель, соль или носитель, причем указанное по меньшей мере одно антитело или фрагмент антитела способны ингибировать связывание нектина-2 человека с TIGIT человека и/или CD112R человека.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция содержит моноклональное антитело или его фрагмент, способные связываться с эпитопом в белке нектин-2 человека, с которым связывается моноклональное антитело, выбранное из группы, состоящей из: клона 7 и клона 11, имеющих последовательности вариабельной области и CDR, раскрытые выше.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция содержит по меньшей мере одно моноклональное антитело, содержащее:
i. набор из шести CDR, причем: CDR1 HC представляет собой (SEQ ID NO: 1); CDR2 HC представляет собой (SEQ ID NO: 2); CDR3 HC представляет собой (SEQ ID NO: 3); CDR1 LC представляет собой (SEQ ID NO: 4); CDR2 LC представляет собой (SEQ ID NO: 5); и CDR3 LC представляет собой (SEQ ID NO: 6); или
ii. набор из шести CDR, причем: последовательность CDR1 HC представляет собой (SEQ ID NO: 11); CDR2 HC представляет собой (SEQ ID NO: 12); CDR3 HC представляет собой (SEQ ID NO: 13); CDR1 LC представляет собой (SEQ ID NO: 14); CDR2 LC представляет собой (SEQ ID NO: 15); и CDR3 LC представляет собой (SEQ ID NO: 16).
Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция содержит антитело или его фрагмент, содержащие вариабельную область тяжелой цепи, имеющую последовательность, выбранную из группы, состоящей из SEQ ID NO: 7 и SEQ ID NO: 17. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция содержит антитело или его фрагмент, содержащие вариабельную область легкой цепи, имеющую последовательность, выбранную из группы, состоящей из SEQ ID NO: 8 и SEQ ID NO: 18. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с конкретным вариантом реализации фармацевтическая композиция содержит антитело или его фрагмент, содержащие вариабельную область тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 7, и вариабельную область легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 8.
В соответствии с конкретным вариантом реализации фармацевтическая композиция содержит антитело или его фрагмент, содержащие вариабельную область тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 17, и вариабельную область легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 18.
Также предложены молекулы одноцепочечной вариабельной области (scFv) антител согласно настоящему изобретению. Молекулы scFv содержат антигенсвязывающий сайт антитела, экспрессируемый в одной полипептидной цепи. В соответствии с некоторыми вариантами реализации настоящего изобретения предложены молекулы scFv, содержащие вариабельные области тяжелой цепи и легкой цепи антител к нектину-2. В соответствии с определенными вариантами реализации scFv содержит шарнирную область между двумя вариабельными областями.
В соответствии с некоторыми вариантами реализации последовательность scFv представлена в SEQ ID NO: 22, SEQ ID NO: 24 или их аналоге, имеющем по меньшей мере 85% сходства последовательности с указанными последовательностями. В соответствии с некоторыми вариантами реализации аналог scFv имеет по меньшей мере 90% идентичности последовательности с последовательностью, выбранной из SEQ ID NO: 22 и SEQ ID NO: 24.
В соответствии с другим аспектом настоящего изобретения предложен химерный антигенный рецептор (CAR), содержащий внеклеточную часть (связывающий домен), способную связываться с нектином-2.
В соответствии с некоторыми вариантами реализации CAR содержит внеклеточную часть, содержащую любое из предложенных антител или их фрагментов, описанных в данном документе.
В соответствии с некоторыми вариантами реализации CAR содержит сайт связывания нектина-2, содержащий шесть последовательностей CDR, выбранных из группы, состоящей из:
i. трех определяющих комплементарность участков (CDR) вариабельной области тяжелой цепи (HC), содержащей SEQ ID NO: 7, и трех CDR вариабельной области легкой цепи (LC), содержащей SEQ ID NO: 8, или их аналога или производного, имеющих по меньшей мере 90% идентичности последовательности с указанной последовательностью антитела или фрагмента; и
ii. трех CDR вариабельной области тяжелой цепи, содержащей SEQ ID NO: 17, и трех CDR вариабельной области легкой цепи, содержащей SEQ ID NO: 18, или их аналога или производного, имеющих по меньшей мере 90% идентичности последовательности с указанной последовательностью антитела или фрагмента.
В соответствии с некоторыми вариантами реализации CAR содержит сайт связывания нектина-2, содержащий набор CDR, выбранный из группы, состоящей из:
i. набора из шести CDR, причем: CDR1 HC представляет собой RFTMS (SEQ ID NO: 1); CDR2 HC представляет собой TISSGGSYTYYPDSVKG (SEQ ID NO: 2); CDR3 HC представляет собой DRDFYGPYYAMDY (SEQ ID NO: 3); CDR1 LC представляет собой KSSQSLLNSGNQKNYLA (SEQ ID NO: 4); CDR2 LC представляет собой FASTRES (SEQ ID NO: 5); и CDR3 LC представляет собой QQHYTTPLT (SEQ ID NO: 6); и
ii. набора из шести CDR, причем: последовательность CDR1 HC представляет собой SYWIH (SEQ ID NO: 11); CDR2 HC представляет собой AVYPGNSDSNYNQKFKA (SEQ ID NO: 12); CDR3 HC представляет собой LVGTFDY (SEQ ID NO: 13); CDR1 LC представляет собой KASQNVGINVV (SEQ ID NO: 14); CDR2 LC представляет собой SASYRYS (SEQ ID NO: 15); и CDR3 LC представляет собой QQYNTNPFT (SEQ ID NO: 16).
В соответствии с некоторыми вариантами реализации CAR содержит антигенсвязывающий домен, содержащий SEQ ID NO: 22 или 24, трансмембранный домен и внутриклеточный Т-клеточный сигнальный домен.
В соответствии с некоторыми вариантами реализации предложен лимфоцит, модифицированный для экспрессии CAR, описанного в данном документе.
В соответствии с некоторыми вариантами реализации предложена Т-клетка, модифицированная для экспрессии CAR, описанного в данном документе, и обозначена CAR-T. В соответствии с определенными вариантами реализации предложена NK-клетка, модифицированная для экспрессии CAR, описанного в данном документе, и обозначена CAR-NK.
В соответствии с некоторыми вариантами реализации предложена популяция лимфоцитов, модифицированных для экспрессии CAR, описанного в данном документе. В соответствии с конкретными вариантами реализации предложена популяция Т-клеток или NK-клеток, модифицированных для экспрессии CAR, описанного в данном документе.
В соответствии с некоторыми вариантами реализации CAR содержит одноцепочечную вариабельную область (scFv), содержащую вариабельные области тяжелой цепи и легкой цепи антител, описанных в данном документе.
В соответствии с настоящим изобретением также предложена одноцепочечная вариабельная область (scFv), содержащая вариабельные области тяжелой цепи и легкой цепи антител, описанных в данном документе. В соответствии с определенными вариантами реализации между вариабельными областями имеется шарнирная область.
В соответствии с некоторыми вариантами реализации последовательность scFv представлена в SEQ ID NO: 22, SEQ ID NO: 24 или их аналоге, имеющем по меньшей мере 85% сходства последовательности с любой из указанных последовательностей.
Согласно настоящему изобретению также предложены, в некоторых вариантах реализации, полинуклеотиды, кодирующие CAR, содержащие последовательность, представленную в SEQ ID NO: 21 или SEQ ID NO: 23.
В соответствии с некоторыми вариантами реализации CAR содержит по меньшей мере один белковый домен, выбранный из группы, состоящей из последовательности scFv, домена стебля CD8, TM-домена CD28, домена 41BB и домена CD3ζ (CD3Z, дзета). В соответствии с некоторыми вариантами реализации CAR содержит домен scFv. В соответствии с некоторыми вариантами реализации CAR содержит домен стебля CD8. В соответствии с некоторыми вариантами реализации CAR содержит TM-домен CD28. В соответствии с некоторыми вариантами реализации CAR содержит домен CD3Z. В соответствии с некоторыми вариантами реализации CAR содержит домен 41BB. В соответствии с конкретными вариантами реализации CAR содержит домен стебля CD8, TM-домен CD28, домен 41BB и домен CD3Z.
В соответствии с некоторыми вариантами реализации CAR содержит последовательность scFv, содержащую сайт связывания нектина-2 антител, раскрытых в данном документе, и по меньшей мере один домен, выбранный из группы, состоящей из: домена стебля CD8, TM-домена CD28, домена 41BB и домена CD3Z. В соответствии с конкретными вариантами реализации CAR содержит последовательность scFv, содержащую сайт связывания нектина-2 антител, раскрытых в данном документе, и домен стебля CD8, TM-домен CD28, домен 41BB и домен CD3Z.
В соответствии с конкретными вариантами реализации предложена модифицированная Т-клетка, экспрессирующая последовательность scFv, выбранную из группы, состоящей из: SEQ ID NO: 22, SEQ ID NO: 24 или их аналога, имеющего по меньшей мере 85% сходства последовательности с любой из указанных последовательностей; домен стебля CD8, TM-домен CD28, домен 41BB и домен CD3Z.
В соответствии с некоторыми вариантами реализации предложена популяция Т-клеток, содержащая Т-клетки, экспрессирующие последовательность scFv, выбранную из группы, состоящей из: SEQ ID NO: 22, SEQ ID NO: 24 или их аналога, имеющего по меньшей мере 85% сходства последовательности с любой из указанных последовательностей; домен стебля CD8, TM-домен CD28, домен 41BB и домен CD3Z.
Согласно аспекту настоящего изобретения предложен способ лечения рака у субъекта, включающий введение терапевтически эффективного количества по меньшей мере одного лимфоцита, содержащего CAR, описанный в данном документе, указанному субъекту.
Также предложены фармацевтические композиции, содержащие по меньшей мере одно антитело, фрагмент антитела или конъюгат антитела в соответствии с настоящим изобретением, для применения в восстановлении цитотоксичности NK путем ингибирования связывания нектина-2 с TIGIT и/или CD112R, экспрессируемыми на NK-клетках.
В соответствии с другими вариантами реализации антитело, фрагмент антитела или конъюгат антитела способны ингибировать связывание нектина-2 человека с TIGIT и/или CD112R, экспрессируемыми на Т-клетках.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция в соответствии с настоящим изобретением предназначена для применения в иммунотерапии рака или в усилении иммунного ответа.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция дополнительно содержит лимфоциты человека, экспрессирующие TIGIT и/или CD112R.
В соответствии с некоторыми вариантами реализации лимфоциты человека представляют собой клетки-киллеры, выбранные из группы, состоящей из: Т-клеток, NK-клеток и клеток естественных Т-киллеров (NKT).
В соответствии с некоторыми вариантами реализации клетки-киллеры являются аутологичными или аллогенными.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция содержит аутологичные или аллогенные NK-клетки, экспрессирующие TIGIT и/или CD112R.
Рак, поддающийся лечению композицией в соответствии с настоящим изобретением, может представлять собой любой вид рака, экспрессирующий нектин-2. В соответствии с некоторыми вариантами реализации рак сверхэкспрессирует нектин-2. В соответствии с некоторыми вариантами реализации настоящего изобретения рак представляет собой метастатический рак. В соответствии с некоторыми вариантами реализации фармацевтическая композиция в соответствии с настоящим изобретением предназначена для применения в ингибировании образования или распространения метастазов или в уменьшении общего количества метастазов у субъекта.
В соответствии с некоторыми вариантами реализации настоящего изобретения рак выбран из группы, состоящей из меланомы, рака молочной железы, рака яичников, рака поджелудочной железы, колоректального рака, рака ободочной кишки, рака шейки матки, рака почек, рака легких, рака щитовидной железы, рака предстательной железы, рака головного мозга, рака почек, рака горла, карциномы гортани, рака мочевого пузыря, рака печени, фибросаркомы, рака из клеток эндометрия, глиобластомы, саркомы, миелоидного рака, лейкоза и лимфомы. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации рак представляет собой солидный рак. В соответствии с некоторыми конкретными вариантами реализации солидный рак выбран из группы, состоящей из рака молочной железы, рака легких, рака мочевого пузыря, рака поджелудочной железы и рака яичников.
В соответствии с некоторыми вариантами реализации солидные опухоли лечат с помощью CAR-T или CAR-NK. В соответствии с конкретными вариантами реализации солидные опухоли лечат с помощью CAR-T. В соответствии с дополнительными вариантами реализации гемобластозы лечат с помощью CAR-NK или CAR-T-клеток. В соответствии с конкретными вариантами реализации гемобластозы лечат с помощью CAR-NK-клеток.
В соответствии с некоторыми вариантами реализации рак представляет собой низкозлокачественную глиому. В соответствии с некоторыми вариантами реализации рак представляет собой светлоклеточную карциному почек (KIRC). В соответствии с некоторыми вариантами реализации рак представляет собой аденокарциному легких.
В соответствии с определенными вариантами реализации рак выбран из группы, состоящей из: меланомы, рака молочной железы, колоректального рака, рака почек, рака легких, рака предстательной железы и рака головного мозга. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с другими вариантами реализации рак представляет собой гемобластоз. В соответствии с некоторыми вариантами реализации фармацевтическая композиция предназначена для совместного применения с лимфоцитами человека в лечении рака.
В соответствии с некоторыми вариантами реализации лимфоциты человека представляют собой клетки-киллеры, выбранные из группы, состоящей из: Т-клеток, NK-клеток и NKT-клеток. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации клетки-киллеры являются аутологичными или аллогенными.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция в соответствии с настоящим изобретением предназначена для применения в предотвращении или лечении вирусной инфекции.
В соответствии с еще одним аспектом настоящего изобретения предложен способ ингибирования связывания нектина-2 человека с TIGIT или CD112R с помощью моноклонального антитела или фрагмента антитела, определенных в данном документе.
В соответствии с дополнительным аспектом настоящего изобретения предложен способ усиления иммунного ответа у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества антитела, фрагмента антитела или конъюгата антитела, описанных в данном документе.
В соответствии с еще одним аспектом настоящего изобретения предложен способ лечения рака, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества фармацевтической композиции, содержащей по меньшей мере одно антитело, фрагмент антитела или его конъюгат, распознающие нектин-2 человека с высокой аффинностью и специфичностью и способные ингибировать связывание нектина-2 с его лигандом.
В соответствии с некоторыми вариантами реализации настоящего изобретения терапевтически эффективное количество приводит к уменьшению размера опухоли или количества метастазов у субъекта.
В соответствии с некоторыми вариантами реализации способ лечения рака включает введение или выполнение по меньшей мере одной дополнительной противораковой терапии. В соответствии с определенными вариантами реализации дополнительная противораковая терапия представляет собой хирургическое вмешательство, химиотерапию, лучевую терапию или иммунотерапию.
В соответствии с некоторыми вариантами реализации способ лечения рака включает введение антитела, которое распознает нектин-2 человека с высокой аффинностью и специфичностью, и дополнительного противоракового агента. В соответствии с некоторыми вариантами реализации дополнительный противораковый агент выбран из группы, состоящей из: иммуномодулятора, активированной лимфоцитарной клетки, ингибитора киназы и химиотерапевтического агента.
В соответствии с другими вариантами реализации дополнительный иммуномодулятор представляет собой антитело, фрагмент антитела или конъюгат антитела, связывающиеся с антигеном, отличным от нектина-2 человека.
В соответствии с некоторыми вариантами реализации дополнительный иммуномодулятор представляет собой антитело к молекуле иммунной контрольной точки. В соответствии с некоторыми вариантами реализации дополнительный иммуномодулятор представляет собой антитело к молекуле иммунной контрольной точки, выбранной из группы, состоящей из человеческого белка запрограммированной клеточной смерти 1 (PD-1), PD-L1 и PD-L2, молекулы адгезии клеток, связанной с карциноэмбриональным антигеном 1 (CEACAM1), гена активации лимфоцитов 3 (LAG3), CD137, OX40 (также называемого CD134), иммуноглобулиноподобных рецепторов клеток-киллеров (KIR), TIGIT, PVR, CTLA-4, NKG2A, GITR и любой другой молекулы контрольных точек или их комбинации. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения. В соответствии с определенными вариантами реализации дополнительный иммуномодулятор представляет собой антитело к PD-1. В соответствии с некоторыми вариантами реализации дополнительный иммуномодулятор представляет собой антитело к CTLA-4.
В соответствии с некоторыми вариантами реализации противораковый агент выбран из группы, состоящей из: эрбитукса, цитарабина, флударабина, фторурацила, меркаптопурина, метотрексата, тиогуанина, гемцитабина, винкристина, винбластина, винорелбина, кармустина, ломустатина, хлорамбуцила, циклофосфамида, цисплатина, карбоплатина, ифосфамида, мехлорэтамина, мелфалана, тиотепы, дакарбазина, блеомицина, дактиномицина, даунорубицина, доксорубицина, идарубицина, митомицина, митоксантрона, пликамицина, этопозида, тенипозида и любой их комбинации. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации противораковый агент представляет собой ингибитор рецептора эпидермального фактора роста (EGFR). В соответствии с некоторыми вариантами реализации ингибитор EGFR выбран из группы, состоящей из: цетуксимаба (Erbitux®), панитумумаба (Vectibix®) и нецитумумаба (Portrazza®). В соответствии с некоторыми вариантами реализации ингибитор EGFR представляет собой цетуксимаб (Erbitux®).
В соответствии с некоторыми вариантами реализации настоящего изобретения субъект представляет собой субъекта-человека.
В соответствии с некоторыми вариантами реализации настоящего изобретения применение дополнительно включает применение агента, подавляющего активность или экспрессию иммунного коингибирующего рецептора.
В соответствии с некоторыми вариантами реализации настоящего изобретения иммунная клетка представляет собой Т-клетку.
В соответствии с некоторыми вариантами реализации настоящего изобретения иммунный коингибирующий рецептор выбран из группы, состоящей из PD-1, TIGIT, PVR, CTLA-4, LAG3, TIM3, BTLA, VISTA, B7H4, CD96, BY55 (CD 160), LAIR1, SIGLEC10 и 2B4. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
Согласно аспекту настоящего изобретения предложен способ модуляции функции и/или активности иммунной системы, включающий модуляцию связывания нектина-2 с TIGIT и/или CD112R с помощью антитела в соответствии с настоящим изобретением.
В соответствии с некоторыми вариантами реализации способ лечения рака включает предотвращение или уменьшение образования, роста или распространения метастазов у субъекта.
В соответствии с некоторыми вариантами реализации способ лечения рака включает введение нуждающемуся в этом субъекту фармацевтической композиции, содержащей антитело или фрагмент указанного антитела, способные ингибировать связывание нектина-2 человека с TIGIT человека или CD112R человека, и дополнительно введение указанному субъекту лимфоцитов человека.
В соответствии с некоторыми вариантами реализации лимфоциты человека представляют собой клетки-киллеры, выбранные из группы, состоящей из: Т-клеток, NK-клеток и NKT-клеток.
В соответствии с некоторыми вариантами реализации клетки-киллеры являются аутологичными или аллогенными.
Согласно настоящему изобретению также предложен способ предотвращения или лечения вирусной инфекции, включающий введение субъекту по меньшей мере одного антитела, специфичного в отношении нектина-2 человека, или его фрагмента, содержащего по меньшей мере антигенсвязывающий домен, причем указанное МАТ или его фрагмент способны ингибировать связывание нектина-2 с TIGIT или CD112R.
Согласно аспекту настоящего изобретения предложен способ диагностики или прогнозирования рака у субъекта, причем указанный способ включает определение уровня экспрессии нектина-2 в биологическом образце от указанного субъекта с помощью по меньшей мере одного антитела, описанного в данном документе.
Настоящее изобретение дополнительно включает, в соответствии с другим аспектом, способ определения или количественной оценки нектина-2 в образце, причем указанный способ включает приведение биологического образца в контакт с антителом или фрагментом антитела и измерение уровня образования комплекса, при этом указанное антитело или фрагмент антитела содержит:
i. набор из шести CDR, причем: CDR1 HC представляет собой (SEQ ID NO: 1); CDR2 HC представляет собой (SEQ ID NO: 2); CDR3 HC представляет собой (SEQ ID NO: 3); CDR1 LC представляет собой (SEQ ID NO: 4); CDR2 LC представляет собой (SEQ ID NO: 5); и CDR3 LC представляет собой (SEQ ID NO: 6); или
ii. набор из шести CDR, причем: последовательность CDR1 HC представляет собой (SEQ ID NO: 11); CDR2 HC представляет собой (SEQ ID NO: 12); CDR3 HC представляет собой (SEQ ID NO: 13); CDR1 LC представляет собой (SEQ ID NO: 14); CDR2 LC представляет собой (SEQ ID NO: 15); и CDR3 LC представляет собой (SEQ ID NO: 16).
Способы определения и количественной оценки могут быть выполнены in vitro или ex vivo в соответствии с некоторыми вариантами реализации, или могут применяться в диагностике состояний, ассоциированных с экспрессией нектина-2. Антитела в соответствии с настоящим изобретением также могут применяться для создания методов скрининга. Например, иммуноферментный анализ (ELISA) или радиоиммуноанализ (RIA), а также такой метод как ИГХ (иммуногистохимия) или FACS (флуоресцентно-активированная сортировка клеток), могут быть созданы для измерения уровней секретируемого или ассоциированного с клеткой полипептида с помощью антител и методов, известных в данной области техники.
В соответствии с некоторыми вариантами реализации способ детектирования или количественной оценки наличия нектина-2, экспрессируемого на клетках или секретируемого в биологическую среду, включает следующие этапы:
i. инкубирование образца с антителом, специфичным в отношении нектина-2 человека, или фрагментом указанного антитела, содержащим по меньшей мере антигенсвязывающую часть;
ii. детектирование связанного нектина-2 с помощью детектируемого зонда.
В соответствии с некоторыми вариантами реализации способ дополнительно включает следующие этапы:
i. сравнение количества (ii) со стандартной кривой, полученной для референсного образца, содержащего известное количество нектина-2; и
ii. вычисление количества нектина-2 в образце на основании стандартной кривой.
В соответствии с некоторыми конкретными вариантами реализации образец представляет собой биологическую жидкость.
В соответствии с некоторыми вариантами реализации способ выполняют in vitro или ex vivo.
Также предложен набор для измерения экспрессии или наличия нектина-2 в биологическом образце, содержащий по меньшей мере одно антитело или фрагмент антитела в соответствии с настоящим изобретением. В соответствии с некоторыми вариантами реализации набор содержит антитело или фрагмент антитела, содержащие:
i. набор из шести CDR, причем: CDR1 HC представляет собой (SEQ ID NO: 1); CDR2 HC представляет собой (SEQ ID NO: 2); CDR3 HC представляет собой (SEQ ID NO: 3); CDR1 LC представляет собой (SEQ ID NO: 4); CDR2 LC представляет собой (SEQ ID NO: 5); и CDR3 LC представляет собой (SEQ ID NO: 6); или
ii. набор из шести CDR, причем: последовательность CDR1 HC представляет собой (SEQ ID NO: 11); CDR2 HC представляет собой (SEQ ID NO: 12); CDR3 HC представляет собой (SEQ ID NO: 13); CDR1 LC представляет собой (SEQ ID NO: 14); CDR2 LC представляет собой (SEQ ID NO: 15); и CDR3 LC представляет собой (SEQ ID NO: 16).
Согласно аспекту настоящего изобретения предложен набор для детектирования рака, причем указанный диагностический набор содержит антитело или фрагмент указанного антитела, раскрытые в данном документе.
В соответствии с некоторыми вариантами реализации настоящего изобретения предложен способ диагностики, раннего детектирования, оценки тяжести или определения стадии заболевания, связанного с иммунной системой, или пролиферативного заболевания, включающий определение экспрессии, концентрации или активности нектина-2 в образце от субъекта с помощью антитела в соответствии с настоящим изобретением или его фрагмента или конъюгата, и сравнение экспрессии или активности нектина-2 с референсной величиной экспрессии, концентрации или активности нектина-2. Указанная референсная величина может быть получена из образца, взятого у нормального субъекта, у того же субъекта, когда он находился на другой стадии заболевания, или определяется на основании клинических данных большой популяции субъектов.
Дополнительные варианты реализации и полный объем области применения настоящего изобретения станут понятны из подробного описания изобретения, приведенного далее в данном документе. Тем не менее, следует понимать, что подробное описание изобретения и конкретные примеры, хотя в них и описаны предпочтительные варианты реализации настоящего изобретения, приведены исключительно в целях иллюстрации, так как разные изменения и модификации, не выходящие за рамки сущности и объема изобретения, будут понятны специалистам в данной области техники после изучения этого подробного описания изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигуры 1A-1C показывают корреляцию уровней экспрессии нектина-2 (высокий или низкий, как указано) с вероятностью выживания пациентов с низкозлокачественной глиомой (A), светлоклеточной карциномой почек (B) и аденокарциномой легких (C). Наборы данных были получены с сайта TCGA и проанализированы с использованием сайта oncolnc.org. (https://doi.org/10.7717/peerj-cs.67).
Фигура 2 представляет собой схематическую иллюстрацию рецепторов, экспрессируемых на иммунных клетках, и их соответствующие величины аффинности в отношении нектина-2, экспрессируемого опухолями или на антигенпрезентирующих клетках (АПК). TIGIT представляет собой коингибирующий рецептор на многих иммунных клетках (например, Т- и NK-клетках); DNAM-1 (также называемый CD226) представляет собой активирующий рецептор на многих иммунных клетках (например, Т-клетках), а CD112R (также называемый PVRIG) представляет собой коингибирующий рецептор на лимфоидных иммунных клетках (например, Т- и NK-клетках); нектин-2 (CD112) представляет собой ингибирующий лиганд для иммунных клеток, главным образом, за счет его связывания с CD112R, на основании представленных величин аффинности.
Фигуры 3A-3D. Анализ характеристик связывания и блокирования полученных МАТ к нектину-2. Фигура 3А иллюстрирует связывание клонов антитела к нектину-2 с клетками MDA-231, которые эндогенно экспрессируют нектин-2, или с клетками 8866-hNectin-2, которые сверхэкспрессируют нектин-2. Фигура 3В показывает результаты анализа методом FACS связывания CD112R-Fc с клетками 8866-hNectin2. Три клона (№ 9, 11 и 13) из полученных антител частично блокировали эти взаимодействия, в то время как один клон (№ 7) полностью блокировал их. Фигура 3С показывает результаты анализа методом FACS связывания DNAM-1-Fc с клетками 8866-hNectin2. За исключением клона 15, ни один из других клонов (№ 7-13) не блокировал связывание активирующего рецептора DNAM-1 с нектином-2. Фигура 3D показывает результаты анализа методом FACS связывания TIGIT-Fc с клетками CHOK1-hNectin2 в присутствии клонов 7 и 11, направленных против нектина-2. Оба клона блокируют >66% связывания TIGIT-Fc.
Фигуры 4A-4C показывают, что блокирование нектина-2 с помощью МАТ к нектину-2 (указано на оси X) усиливает активацию NK-клеток. Активацию NK измеряли по индукции поверхностной экспрессии CD107a и выражали как кратное изменение по сравнению с контрольным IgG (ось Y). Результаты показаны для линий раковых клеток человека A549 (аденокарцинома легких) (Фигура 4A) и MDA-MB-231 (аденокарцинома молочной железы) (Фигура 4B). Наиболее значительный эффект был отмечен для клонов № 3, 7 и 11. *=p<0,04, **p<0,02, ***p<0,002 согласно двустороннему t-критерию Стьюдента. Показаны типичные данные для одного из пяти доноров. Химерные варианты IgG1 человека клонов 7 и 11 дополнительно усиливали дегрануляцию (Фигура 4C), что привело к >200% дегрануляции по сравнению с изотипическим контролем. ***р<0,002. Показаны типичные данные для одного из двух доноров.
Фигуры 5A-5B демонстрируют, что связывание МАТ, клонов 7 и 11, с нектином-2 человека и обезьяны является сходным. Фигура 5А показывает наложенные кривые связывания обоих МАТ, которые были добавлены в диапазоне 13,3 нМ-0,02 нМ в ряде трехкратных разведений к клеткам СНО, экспрессирующим нектин-2 человека или яванской макаки (Cyno) (Macaca fascicularis) (идентификатор белка: XP_005589607.1). Результаты анализа методом FACS для этого анализа выражены как относительная интенсивность связывания по сравнению с максимальным связыванием, которое было установлено как 100%. Для детектирования использовали козье антитело к белку мыши-647 в разведении 1:250. Также представлены обобщенные результаты анализа данных для этого анализа, которые также демонстрируют, что оба МАТ связываются с нектином-2 человека и яванской макаки (Cyno) (Macaca fascicularis) (идентификатор белка: XP_005589607.1) с высокой и сходной аффинностью. Связывание МАТ к нектину-2 также исследовали с использованием нектина-2 Chlorocebus (африканской зеленой мартышки) (XP_007995342.1, экспрессируемого клетками Vero). Фигура 5В показывает связывание МАТ к нектину-2 с эндогенным нектином-2 человека (экспрессируемым клетками 293T) и эндогенным нектином-2 африканской зеленой мартышки (экспрессируемым клетками Vero), протестированное с помощью анализа FACS, как описано для Фигуры 5А (диапазон концентрации антитела: 20-0,0003 нМ). Этот анализ выявил сходное связывание антитела с обеими мишенями, нектином-2 человека и нектином-2 обезьяны, с высокой аффинностью для обоих клонов к нектину-2, как следует из сводной таблицы.
Фигуры 6A-6B показывают эффект антител к нектину-2 человека на пролиферацию Т-клеток. МКПК человека метили CFSE и инкубировали с клетками-мишенями MDA-MB-231 (6A) или A549 (6B) в присутствии PHA-L и указанных антител. Результаты представлены как кратное увеличение пролиферации относительно контроля. Показаны результаты для 1 донора МКПК, который является типичным для 7 протестированных доноров.
Фигуры 7A-7B показывают эффект антител к нектину-2 человека, по отдельности или в комбинации с известными блокаторами контрольных точек, на пролиферацию CD8+ Т-клеток. МКПК человека метили CFSE и инкубировали с клетками-мишенями RKO (Фигура 7A) или A549 (Фигура 7B) в присутствии PHA-L и указанных антител. Результаты представлены как кратное увеличение пролиферации относительно контроля. Все протестированные комбинации приводили к значительному увеличению пролиферации CD8+ Т-клеток по сравнению с обработками отдельным препаратом. Показаны результаты для одного донора МКПК из двух протестированных доноров.
Фигуры 8A-8B показывают эффект антител к нектину-2 человека на секрецию IFNγ. МКПК человека инкубировали с клетками-мишенями, как описано для Фиг. 7. Через 96 часов планшеты центрифугировали и собирали супернатанты. Количественную оценку IFNγ проводили с использованием MAX™ Deluxe для ИФА IFN-γ человека от Biolegend в соответствии с протоколом производителя. Показаны результаты для одного донора МКПК из пяти протестированных доноров.
Фигуры 9A-9B показывают эффект антител к нектину-2 человека, по отдельности или в комбинации с известными блокаторами контрольных точек, в отношении уничтожения опухолевых клеток с помощью МКПК человека. Анализ проводили, как описано для Фигуры 7. Через 96-120 часов иммунные клетки были удалены, опухолевые клетки тщательно промыты и жизнеспособность прикрепившихся опухолевых клеток была определена с использованием CellTiter-Glo® в соответствии с протоколом производителя. Все результаты были в пределах линейного диапазона набора. Результаты представлены как кратное усиление уничтожения опухолевых клеток относительно контроля. Все протестированные комбинации приводили к значительному усилению уничтожения опухолевых клеток по сравнению с обработками отдельным препаратом. Показаны результаты для одного донора МКПК из двух протестированных доноров.
Фигура 10 показывает эффект МАТ к нектину-2 на развитие опухоли in vivo. Самкам мышей Scid (n=33) вводили путем подкожной инъекции 5×106 клеток MDA-MB-231 в матригеле. После того, как опухоли достигли 80-120 мм3, мыши были рандомизированы на три группы и получали дважды в неделю слепым методом внутривенные инъекции фосфатно-солевого буфера (ФСБ) (светло-серые ромбы), контрольного антитела hIgG1 (серые квадраты) или клон-7-IgG1 человека (2.7.1) (черный круг), оба при 3 мг/кг. *p<0,04, **p<0,02, ***p<0,008.
Фигуры 11A-11B показывают эффект МАТ к нектину-2 с hIgG2 Fc, либо по отдельности, либо с PD-1, на уничтожение опухолевых клеток и пролиферацию МКПК. Клетки A549 инкубировали совместно с МКПК при соотношении E:T 7:1 в течение 96 часов в присутствии 4 мкг/мл PHA-L, либо без антитела, либо с клон-11-IgG2 человека (2.11.2), с китрудой (Keytruda™) (оба при 3,5 мкг/мл), либо с их комбинацией (каждый при 3,5 мкг/мл). Показано уничтожение опухолевых клеток (Фигура 11A) и пролиферация МКПК (Т-клеток) (Фигура 11B). *p<0,01, **p<0,002, ***p<0,0008.
Фигуры 12A-12E показывают эффект CAR-T, экспрессирующих scFv, происходящий из клона антитела 7 и клона антитела 11 (CAR-T 2.07 и CAR-T 2.11, соответственно), на активацию специфичных Т-клеток в присутствии опухолевых клеток, которые экспрессируют нектин-2. МКПК от здоровых доноров трансдуцировали конструкциями CAR-T. Общий схематический рисунок этих конструкций показан на Фигуре 12A, где scFv представляет собой одну цепь МАТ к нектину-2, описанных в данном документе. CAR-T МКПК против нектина-2 инкубировали с клетками-мишенями U937 или BT-474 при различных соотношениях E:T. Показано уничтожение клеток-мишеней (Фигуры 12B и 12D), а также секреция IFNγ активированными МКПК (Фигуры 12C и 12E, p<0,03). Фигуры 12B-E показывают типичные эксперименты из трех, выполненных для каждой линии клеток (серые столбики CAR-T 2.07, черные столбики CAR-T 2.11).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложены эффективные антитела, специфичные в отношении нектина-2 человека. Согласно настоящему изобретению также предложено получение и применение указанных антител в качестве терапевтических агентов. В частности, МАТ согласно настоящему изобретению можно применять для усиления активности в отношении уничтожения опухолевых клеток, а также в качестве диагностических реагентов. Согласно некоторым вариантам реализации настоящего изобретения предложены антитела, специфичные в отношении нектина-2, для эффективного восстановления иммунной активности против раковых клеток, сверхэкспрессирующих нектин-2. Согласно другим вариантам реализации антитела, описанные в данном документе, предназначены для применения в лечении вирусной инфекции. Антитела предотвращают проникновение вируса герпеса в клетки путем блокирования нектина-2.
Термин «антиген» в контексте настоящего документа относится к молекуле или части молекулы, способной вызывать образование антитела и специфично связываемой антителом. Антиген может иметь один или более эпитопов. Упомянутое выше специфичное связывание означает, что антиген будет взаимодействовать высокоселективным образом со своим соответствующим антителом, а не с множеством других антител, которые могут быть индуцированы другими антигенами. Антиген в соответствии с некоторыми вариантами реализации настоящего изобретения представляет собой белок нектин-2.
Термин «нектин-2» или «молекула клеточной адгезии нектин 2» в контексте настоящего документа относится к гликопротеину плазматической мембраны человека, также известному как CD112 и PVRL2. Белок нектин-2 представляет собой однопроходный мембранный гликопротеин I типа с двумя Ig-подобными доменами C2-типа и Ig-подобным доменом V-типа. Этот белок является одним из компонентов плазматической мембраны в адгезивных контактах. Он также обуславливает проникновение определенных мутантных штаммов вируса простого герпеса и вируса псевдобешенства и участвует в распространении этих вирусов от клетки к клетке. Примерный нектин-2 в соответствии с настоящим изобретением представлен под обозначениями или номерами доступа SwissPort, UniPort и GenBank: Gene ID: 5819, Q92692, I68093, NP_001036189.1, NP_002847.1 и № Q92692.
Антитела или их фрагмент в соответствии с настоящим изобретением связываются с эпитопом в нектине-2. В частности, антитела связываются с эпитопом в эктодомене (внеклеточной части) белка нектин-2.
Термин «антигенная детерминанта» или «эпитоп» в контексте настоящего документа относится к области молекулы антигена, которая специфично взаимодействует с определенным антителом. Пептидные последовательности, происходящие из эпитопа, можно применять, по отдельности или в сочетании с фрагментом-носителем, с помощью способов, известных в данной области техники, для иммунизации животных и получения дополнительных поликлональных или моноклональных антител. Выделенные пептиды, происходящие из эпитопа, можно применять в способах диагностики для детектирования антител.
Следует отметить, что аффинность может быть количественно оценена с использованием известных методов, таких как поверхностный плазмонный резонанс (SPR) (описанный в Scarano S, Mascini M, Turner AP, Minunni M. Surface plasmon resonance imaging for affinity-based biosensors. Biosens Bioelectron. 2010, 25: 957-66), и может быть рассчитана с использованием, например, константы диссоциации, Kd, при этом более низкая Kd отражает более высокую аффинность.
Антитела или иммуноглобулины содержат две тяжелые цепи, связанные вместе дисульфидными связями, и две легкие цепи, причем каждая легкая цепь связана с соответствующей тяжелой цепью дисульфидными связями с образованием Y-образной структуры. Протеолитическое расщепление антитела дает домены Fv (вариабельный фрагмент) и Fc (кристаллизуемый фрагмент). Антигенсвязывающие домены, Fab, включают области, в которых полипептидная последовательность варьируется. Термин F(ab')2 означает два плеча Fab', соединенных дисульфидными связями. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов (CH). Каждая легкая цепь имеет вариабельный домен (VL) на одном конце и константный домен (CL) на другом своем конце, причем вариабельный домен легкой цепи находится рядом с вариабельным доменом тяжелой цепи, а константный домен легкой цепи находится рядом с первым константным доменом тяжелой цепи (CH1). Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий сайт. Домены на легкой и тяжелой цепях имеют одинаковую общую структуру, и каждый домен содержит четыре каркасные области, последовательности которых относительно консервативны, к которым присоединяются три гипервариабельных домена, известных как определяющие комплементарность участки (CDR 1-3). Эти домены вносят вклад в специфичность и аффинность антигенсвязывающего сайта.
Идентификацию или определение CDR из конкретной вариабельной последовательности тяжелой или легкой цепи обычно осуществляют с помощью одного из нескольких методов, известных в данной области техники. Например, такое определение выполняют в соответствии с Kabat (Wu T.T and Kabat E.A., J Exp Med, 1970; 132:211-50) и IMGT (Lefranc M-P, et al., Dev Comp Immunol, 2003, 27:55-77).
В случаях использования термина «CDR, имеющая последовательность» или аналогичного термина он включает варианты, в которых CDR содержит указанные последовательности, а также варианты, в которых CDR состоит из указанной последовательности.
Специфичность антитела в отношении антигена обусловлена гипервариабельной областью (HVR), а именно уникальными последовательностями CDR как легкой, так и тяжелой цепей, которые вместе образуют антигенсвязывающий сайт.
Изотип тяжелой цепи (гамма, альфа, дельта, эпсилон или мю) определяет класс иммуноглобулина (IgG, IgA, IgD, IgE или IgM, соответственно). Легкая цепь может иметь один из двух изотипов (каппа, κ или лямбда, λ). Оба изотопа встречаются во всех классах антител.
Термин «антитело» используется в самом широком смысле и включает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела и фрагменты антител, достаточно длинные, чтобы проявлять желаемую биологическую активность, а именно связывание с нектином-2 человека.
Антитело или антитела в соответствии с настоящим изобретением включают интактные антитела, такие как поликлональные антитела или моноклональные антитела (МАТ), а также их протеолитические фрагменты, такие как фрагменты Fab или F(ab')2. Одноцепочечные антитела входят в объем настоящего изобретения.
Фрагменты антител
«Фрагменты антител» содержат только часть интактного антитела, обычно включающую антигенсвязывающий сайт интактного антитела и, таким образом, сохраняющую способность связывать антиген. Примеры фрагментов антител, охватываемых настоящим определением, включают: (i) фрагмент Fab, имеющий домены VL, CL, VH и CH1; (ii) фрагмент Fab', представляющий собой фрагмент Fab, имеющий один или более остатков цистеина на С-конце домена CH1; (iii) фрагмент Fd, имеющий домены VH и CH1; (iv) фрагмент Fd', имеющий домены VH и CH1 и один или более остатков цистеина на С-конце домена CH1; (v) фрагмент Fv, имеющий домены VL и VH одного плеча антитела; (vi) фрагмент dAb (Ward et al., Nature 1989, 341, 544-546), состоящий из домена VH; (vii) выделенные области CDR; (viii) фрагменты F(ab')2, двухвалентный фрагмент, включающий два фрагмента Fab', связанных дисульфидным мостиком в шарнирной области; (ix) молекулы одноцепочечных антител (например, одноцепочечный Fv; scFv) (Bird et al., Science 1988, 242, 423-426; и Huston et al., Proc. Natl. Acad. Sci. (USA) 1988, 85,5879-5883); (x) «диатела» с двумя антигенсвязывающими сайтами, содержащими вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL), в одной и той же полипептидной цепи (см., например, EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 1993, 90, 6444-6448); (xi) «линейные антитела», содержащие пару последовательно расположенных сегментов Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng., 1995, 8, 1057-1062; и патент США № 5641870).
Были разработаны различные методики получения фрагментов антител. Традиционно эти фрагменты получали путем протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods24:107-117 (1992) и Brennan et al., Science,229:81 (1985)). Однако в настоящее время эти фрагменты можно непосредственно продуцировать с помощью рекомбинантных клеток-хозяев. Например, фрагменты антител могут быть выделены из фаговых библиотек антител. В качестве альтернативы, фрагменты Fab'-SH могут быть непосредственно выделены из E. coli и химически связаны с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology10:163-167 (1992)). Согласно другому подходу фрагменты F(ab')2 могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Другие методики получения фрагментов антител будут понятны квалифицированному специалисту. Согласно другим вариантам реализации предпочтительное антитело представляет собой одноцепочечный фрагмент Fv (scFv).
Одноцепочечные антитела могут представлять собой одноцепочечные составные полипептиды, обладающие способностью связывать антиген и содержащие аминокислотные последовательности, гомологичные или аналогичные вариабельным областям легкой и тяжелой цепи иммуноглобулина, т. е. связанные VH-VL или одноцепочечный Fv (scFv). Методики получения одноцепочечных антител (патент США № 4946778) могут быть адаптированы для получения одноцепочечных антител к нектину-2.
Термин «моноклональное антитело» (МАТ) в контексте настоящего документа относится к антителу, полученному из популяции по существу однородных антител, т. е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела обладают высокой специфичностью и направлены против одного антигена. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение «моноклональный» не должно толковаться как требующее получения антитела каким-либо конкретным способом. МАТ могут быть получены способами, известными специалистам в данной области техники. Например, моноклональные антитела для применения согласно настоящему изобретению могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature 1975, 256, 495, или могут быть получены методами рекомбинантной ДНК (см., например, патент США № 4816567). Моноклональные антитела также могут быть выделены из фаговых библиотек антител с использованием методик, описанных, например, в Clackson et al., Nature 1991, 352, 624-628 или Marks et al., J. Mol. Biol., 1991, 222:581-597.
Конструирование и разработка рекомбинантных одновалентных антигенсвязывающих молекул, происходящих из моноклональных антител, посредством быстрой идентификации и клонирования генов функциональных вариабельных областей тяжелой (VH) и легкой (VL) цепи, а также конструирование и клонирование синтетической последовательности ДНК, оптимизированной для экспрессии в рекомбинантных бактериях, описаны в Fields et at., 2013, 8(6):1125-48.
МАТ согласно настоящему изобретению могут принадлежать к любому классу иммуноглобулинов, включая IgG, IgM, IgE, IgA и IgD. Гибридома, продуцирующая МАТ, может быть культивирована in vitro или in vivo. Высокие титры МАТ могут быть получены путем продуцирования in vivo, когда клетки из отдельных гибридом вводят путем внутрибрюшинной инъекции праймированным пристином мышам Balb/c для получения асцитной жидкости, содержащей высокие концентрации целевых МАТ. МАТ могут быть очищены из таких асцитных жидкостей или из культуральных супернатантов с использованием способов, хорошо известных специалистам в данной области техники.
Также рассматриваются антиидиотипические антитела, обладающие специфической иммунореактивностью по отношению к гипервариабельным областям антитела согласно настоящему изобретению.
Согласно настоящему изобретению предложено моноклональное антитело или фрагмент антитела, содержащий антигенсвязывающий домен (ABD), который содержит три CDR легкой цепи и три CDR тяжелой цепи, причем указанный ABD имеет по меньшей мере 90% идентичности или сходства последовательности с ABD моноклонального мышиного антитела, содержащего: (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 7, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 8 (в данном документе обозначено как клон 7); или (ii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 18 (в данном документе обозначено как клон 11). Такое антитело может иметь домен ABD, имеющий по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96, по меньшей мере 97, по меньшей мере 98, по меньшей мере 99% идентичности или сходства последовательности, или 100% идентичности последовательности с соответствующим ABD клона антитела 7 или клона антитела 11.
Идентичность последовательностей относится к количеству аминокислот или нуклеотидов, которые точно совпадают у двух разных последовательностей. Сходство последовательностей допускает рассмотрение консервативной замены аминокислот как идентичных аминокислот. Полинуклеотидные последовательности, описанные в данном документе, могут быть оптимизированы по кодонам для экспрессии в конкретных клетках, таких как клетки человека. Оптимизация кодонов не изменяет кодируемые аминокислотные последовательности цепи антитела, но может, например, увеличивать экспрессию в клетках.
Согласно настоящему изобретению также предложены консервативные аминокислотные варианты молекул антител в соответствии с настоящим изобретением. Также могут быть получены варианты в соответствии с настоящим изобретением, сохраняющие общую молекулярную структуру кодируемых белков. Учитывая свойства отдельных аминокислот, составляющих раскрытые белковые продукты, специалист может определить необходимость некоторых целесообразных замен. Аминокислотные замены, т.е. «консервативные замены», могут быть сделаны, например, на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы задействованных остатков. В контексте настоящего документа термин «аналог антитела» относится к антителу, полученному из другого антитела посредством одной или более консервативных аминокислотных замен.
В контексте настоящего документа термин «вариант антитела» относится к любой молекуле, содержащей антитело согласно настоящему изобретению. Например, вариантом антитела считаются слитые белки, в которых антитело или его антигенсвязывающий фрагмент связаны с другим химическим структурным элементом.
Аналоги и варианты последовательностей антител также входят в объем настоящей заявки. Они включают, не ограничиваясь перечисленным, консервативные и неконсервативные замены, инсерции и делеции аминокислот в последовательности. Такая модификация и получаемый в результате аналог или вариант антитела входят в объем настоящего изобретения при условии, что они придают или даже улучшают связывание антитела с нектином-2 человека.
Консервативные замены аминокислот, известные специалистам в данной области техники, входят в объем настоящего изобретения. Консервативные аминокислотные замены включают замену одной аминокислоты другой, имеющей тот же тип функциональной группы или боковой цепи, например, алифатический, ароматический, положительно заряженный, отрицательно заряженный. Эти замены могут повысить пероральную биодоступность, проникновение и нацеливание на конкретные популяции клеток, иммуногенность и т. п. Специалист поймет, что отдельные замены, делеции или добавления к пептидной, полипептидной или белковой последовательности, которые приводят к изменению, добавлению или удалению одной аминокислоты или небольшого процента аминокислот в кодируемой последовательности, представляют собой «консервативно модифицированный вариант», если изменение приводит к замене аминокислоты на химически схожую аминокислоту. Таблицы консервативных замен, в которых приведены функционально схожие аминокислоты, хорошо известны в данной области техники. Например, согласно одной из таблиц, известных в данной области техники, каждая из следующих шести групп содержит аминокислоты, которые являются консервативными заменами друг друга:
1) аланин (A), серин (S), треонин (T);
2) аспарагиновая кислота (D), глутаминовая кислота (E);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (M), валин (V); и
6) фенилаланин (F), тирозин (Y), триптофан (W).
Следует подчеркнуть, что последовательности вариантных цепей определяют методами секвенирования с использованием специфических праймеров. Различные методы секвенирования, применяемые на одной и той же последовательности, могут приводить к несколько различающимся последовательностям из-за технических проблем и использования разных праймеров, особенно на концах последовательности.
Термины «молекула, имеющая антигенсвязывающую часть антитела» и «антигенсвязывающие фрагменты» в контексте настоящего документа подразумевают не только интактные молекулы иммуноглобулинов любого изотипа и продуцируемые любой линией клеток животных или микроорганизмом, но также их антигенсвязывающую реакционноспособную часть, включая, не ограничиваясь перечисленным, фрагмент Fab, фрагмент Fab', фрагмент F(ab')2, вариабельную часть их тяжелой и/или легкой цепей, Fab мини-антител (см., например, WO 93/15210, заявку на патент США № 08/256790, WO 96/13583, заявку на патент США № 08/817788, WO 96/37621, заявку на патент США № 08/999554), и одноцепочечные антитела, содержащие такую реакционноспособную часть, а также любой другой тип молекулы, в которую физически внедрена такая реакционноспособная часть антитела. Такие молекулы могут быть получены с помощью любой известной методики, включая, не ограничиваясь перечисленным, ферментативное расщепление, пептидный синтез или рекомбинантные методики.
Антитела в данном документе конкретно включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, происходящих из определенного вида или принадлежащих к определенному классу или подклассу антител, в то время как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, происходящих из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител при условии, что они проявляют желаемую биологическую активность (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA81:6851-6855 (1984)). Кроме того, может быть осуществлена прививка определяющего комплементарность участка (CDR) для изменения определенных свойств молекулы антитела, включая аффинность или специфичность. Неограничивающий пример прививки CDR раскрыт в патенте США № 5225539.
Химерные антитела представляют собой молекулы, разные части которых происходят из разных видов животных, например, имеющие вариабельную область, происходящую из мышиного МАТ, и константную область иммуноглобулина человека. Антитела, в которых каркасные остатки вариабельной области по существу происходят из антитела человека (называемого акцепторным антителом), а CDR по существу происходят из мышиного антитела (называемого донорным антителом), также называются гуманизированными антителами. Химерные антитела в основном используются для уменьшения иммуногенности при применении и для увеличения выхода при получении, например, когда мышиные МАТ имеют более высокий выход из гибридом, но более высокую иммуногенность у людей, так что используются химерные МАТ человек/мышь. Химерные антитела и способы их получения известны в данной области техники (например, РСТ заявки на патент WO 86/01533, WO 97/02671, WO 90/07861, WO 92/22653 и патенты США № 5693762, 5693761, 5585089, 5530101 и 5225539).
В соответствии с некоторыми вариантами реализации антитело представляет собой моноклональное антитело.
В соответствии с некоторыми конкретными вариантами реализации моноклональное антитело представляет собой химерное моноклональное антитело.
В соответствии с некоторыми вариантами реализации химерное антитело содержит константные области человека.
В соответствии с некоторыми вариантами реализации константные области человека химерного антитела выбраны из группы, состоящей из: IgG1 человека, IgG2 человека, IgG3 человека и IgG4 человека.
В соответствии с некоторыми вариантами реализации константные области человека химерного антитела выбраны из группы, состоящей из: IgG1 человека и IgG2 человека.
В соответствии с конкретным вариантом реализации предложено химерное моноклональное антитело, которое распознает нектин-2 человека, содержащее:
i. набор из шести CDR, причем: CDR1 HC представляет собой (SEQ ID NO: 1); CDR2 HC представляет собой (SEQ ID NO: 2); CDR3 HC представляет собой (SEQ ID NO: 3); CDR1 LC представляет собой (SEQ ID NO: 4); CDR2 LC представляет собой (SEQ ID NO: 5); и CDR3 LC представляет собой (SEQ ID NO: 6); или
ii. набор из шести CDR, причем: последовательность CDR1 HC представляет собой (SEQ ID NO: 11); CDR2 HC представляет собой (SEQ ID NO: 12); CDR3 HC представляет собой (SEQ ID NO: 13); CDR1 LC представляет собой (SEQ ID NO: 14); CDR2 LC представляет собой (SEQ ID NO: 15); и CDR3 LC представляет собой (SEQ ID NO: 16).
Фармакология
В фармацевтических и лекарственных препаратах активный агент предпочтительно используется вместе с одним или более фармацевтически приемлемыми носителями и необязательно любыми другими терапевтическими ингредиентами. Носитель(и) должен быть фармацевтически приемлемым в том смысле, что он должен быть совместимым с другими ингредиентами препарата и не оказывать чрезмерно пагубного действия на его реципиента. Активный агент обеспечивается в количестве, эффективном для достижения желаемого фармакологического эффекта, как описано выше, и в количестве, подходящем для достижения желаемого воздействия.
Обычно антитела, их фрагменты и конъюгаты согласно настоящему изобретению, содержащие антигенсвязывающую часть антитела или содержащие другой полипептид, включая пептидомиметик, будут суспендированы в стерильном физиологическом растворе для применения в терапевтических целях. В качестве альтернативы фармацевтические композиции могут быть изготовлены с обеспечением контроля высвобождения активного ингредиента (молекулы, содержащей антигенсвязывающую часть антитела) или продления его присутствия в организме пациента. Известны многочисленные подходящие системы доставки лекарственных средств, которые включают, например, имплантируемые системы для высвобождения лекарственных средств, гидрогели, гидроксиметилцеллюлозу, микрокапсулы, липосомы, микроэмульсии, микросферы и тому подобное. Препараты с контролируемым высвобождением могут быть приготовлены с использованием полимеров для образования комплекса с молекулой в соответствии с настоящим изобретением или ее адсорбции. Например, биосовместимые полимеры включают матриксы из сополимера этилена и винилацетата и матриксы из сополимера димера стеариновой кислоты и себациновой кислоты полиангидридного типа. Скорость высвобождения молекулы в соответствии с настоящим изобретением, т.е. антитела или фрагмента антитела, из такого матрикса зависит от молекулярной массы молекулы, количества молекулы в матриксе и размера диспергированных частиц.
Фармацевтическая композиция согласно настоящему изобретению может быть введена любыми подходящими способами, например, перорально, местно, интраназально, подкожно, внутримышечно, внутривенно, внутриартериально, внутрисуставно, внутриочагово, внутриопухолево или парентерально. Обычно для доставки антител используют внутривенное (в/в) введение.
Обычные специалисты в данной области техники поймут, что терапевтически эффективное количество молекулы в соответствии с настоящим изобретением будет зависеть, среди прочего, от схемы введения, единичной дозы вводимой молекулы, от того, вводится ли молекула в комбинации с другими терапевтическими агентами, иммунного статуса и состояния здоровья пациента, терапевтической активности вводимой молекулы, ее устойчивости в кровообращении и мнения лечащего врача.
В контексте настоящего документа термин «терапевтически эффективное количество» относится к количеству лекарственного средства, эффективному для лечения заболевания или нарушения у млекопитающего. В случае рака терапевтически эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) метастазирование опухоли; ингибировать, до некоторой степени, рост опухоли; и/или облегчать, до некоторой степени, один или более симптомов, ассоциированных с нарушением. В тех случаях, когда лекарственное средство может предотвращать рост и/или уничтожать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Для терапии рака эффективность in vivo может быть измерена, например, путем оценки продолжительности выживаемости, времени до прогрессирования заболевания (ВДП), частоты ответов (ЧО), длительности ответа и/или качества жизни.
Рак, поддающийся лечению с помощью настоящего изобретения, включает, но не ограничивается перечисленным: карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких видов рака включают плоскоклеточный рак, рак легких (включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких), рак брюшины, гепатоклеточный рак, желудочный рак или рак желудка (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почек или почечный рак, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени и различные типы рака головы и шеи, а также В-клеточную лимфому (включая низкозлокачественную/фолликулярную неходжкинскую лимфому (НХЛ); мелкоклеточную лимфоцитарную (МЛ) НХЛ; среднезлокачественную/фолликулярную НХЛ; среднезлокачественную диффузную НХЛ; высокозлокачественную иммунобластную НХЛ; высокозлокачественную лимфобластную НХЛ; высокозлокачественную мелкоклеточную НХЛ с нерасщеплённым ядром; НХЛ с массивным поражением; мантийноклеточную лимфому; СПИД-ассоциированную лимфому; и макроглобулинемию Вальденстрема); хронический лимфоцитарный лейкоз (ХЛЛ); острый лимфобластный лейкоз (ОЛЛ); волосатоклеточный лейкоз; хронический миелобластный лейкоз; и посттрансплантационное лимфопролиферативное нарушение (ПТЛР), а также патологическую сосудистую пролиферацию, ассоциированную с факоматозами, отек (например, ассоциированный с опухолями головного мозга) и синдром Мейгса. Предпочтительно рак выбран из группы, состоящей из рака молочной железы, колоректального рака, ректального рака, немелкоклеточного рака легких, неходжкинской лимфомы (НХЛ), почечно-клеточного рака, рака предстательной железы, рака печени, рака поджелудочной железы, саркомы мягких тканей, саркомы Капоши, нейроэндокринной карциномы, рака головы и шеи, меланомы, рака яичников, мезотелиомы и множественной миеломы. Раковые состояния, поддающиеся лечению согласно настоящему изобретению, включают разные виды метастатического рака.
В соответствии с другими вариантами реализации фармацевтическая композиция в соответствии с настоящим изобретением предназначена для применения в лечении рака, характеризующегося сверхэкспрессией нектина-2. Типы рака, связанные со сверхэкспрессией нектина-2, можно идентифицировать с использованием известных баз данных, таких как Атлас ракового генома (TCGA). В соответствии с определенными вариантами реализации рак, поддающийся лечению с помощью композиции в соответствии с настоящим изобретением, выбран из группы, состоящей из адренокортикальной карциномы (АСС), хромофобной почечно-клеточной карциномы (KICH), гепатоклеточной карциномы печени (LIHC), аденокарциномы ободочной и прямой кишки (COAD, READ), аденокарциномы протоков поджелудочной железы (PAAD), феохромоцитомы и параганглиомы (PCPG), папиллярной карциномы почек (KIRP), аденокарциномы легких (LUAD), плоскоклеточной карциномы головы и шеи (HNSC), аденокарциномы предстательной железы (PRAD), карциномы тела матки (эндометрия) (UCEC), рака шейки матки (CESC), меланомы кожи (SKCM), мезотелиомы (MESO), уротелиального рака мочевого пузыря (BLCA), светлоклеточной карциномы почек (KIRC), плоскоклеточной карциномы легких (LUSC), карциносаркомы матки (UCS), саркомы (SARC), серозной цистаденокарциномы яичников (OV), папиллярной карциномы щитовидной железы (THCA), мультиформной глиобластомы (GBM), рака молочной железы (BRCA), низкозлокачественной глиомы (LGG) и диффузной В-крупноклеточной лимфомы (DLBC). Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
Молекулы согласно настоящему изобретению в качестве активных ингредиентов растворяют, диспергируют или смешивают со вспомогательным веществом, которое, как хорошо известно, является фармацевтически приемлемым и совместимым с активным ингредиентом. Подходящими вспомогательными веществами являются, например, вода, физиологический раствор, фосфатно-солевой буфер (ФСБ), декстроза, глицерин, этанол или тому подобное, и их комбинации. Другие подходящие носители хорошо известны специалистам в данной области техники. Кроме того, при желании композиция может содержать незначительные количества дополнительных веществ, таких как смачивающие или эмульгирующие агенты, буферные агенты для регулировки pH.
Фармацевтическая композиция в соответствии с настоящим изобретением может быть введена вместе с противоопухолевой композицией.
Термин «лечение» в контексте настоящего документа относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Нуждающиеся в лечении включают тех, кто уже страдает нарушением, а также тех, у кого нарушение необходимо предотвратить.
Термин «рак» относится или описывает физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, не ограничиваясь перечисленным, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких видов рака включают меланому, рак легких, рак щитовидной железы, рак молочной железы, рак ободочной кишки, рак предстательной железы, рак печени, рак мочевого пузыря, рак почек, рак шейки матки, рак поджелудочной железы, лейкоз, лимфому, миелоидный рак, рак яичников, рак матки, саркому, рак желчных протоков или рак эндометрия.
В соответствии с некоторыми вариантами реализации способ лечения рака включает введение фармацевтической композиции как части схемы лечения, включающей введение по меньшей мере одного дополнительного противоракового агента.
В соответствии с некоторыми вариантами реализации противораковый агент выбран из группы, состоящей из антиметаболита, ингибитора митоза, таксана, ингибитора топоизомеразы, ингибитора топоизомеразы II, аспарагиназы, алкилирующего агента, противоопухолевого антибиотика и их комбинаций. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации антиметаболит выбран из группы, состоящей из цитарабина, флударабина, фторурацила, меркаптопурина, метотрексата, тиогуанина, гемцитабина и гидроксимочевины. В соответствии с некоторыми вариантами реализации ингибитор митоза выбран из группы, состоящей из винкристина, винбластина и винорелбина. В соответствии с некоторыми вариантами реализации ингибитор топоизомеразы выбран из группы, состоящей из топотекана и иринотекана. В соответствии с некоторыми вариантами реализации алкилирующий агент выбран из группы, состоящей из бусульфана, кармустина, ломустина, хлорамбуцила, циклофосфамида, цисплатина, карбоплатина, ифосфамида, мехлорэтамина, мелфалана, тиотепы, дакарбазина и прокарбазина. В соответствии с некоторыми вариантами реализации противоопухолевый антибиотик выбран из группы, состоящей из блеомицина, дактиномицина, даунорубицина, доксорубицина, идарубицина, митомицина, митоксантрона и пликамицина. В соответствии с некоторыми вариантами реализации топоизомераза II выбрана из группы, состоящей из этопозида и тенипозида. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми конкретными вариантами реализации дополнительный противораковый агент выбран из группы, состоящей из бевацизумаба, карбоплатина, циклофосфамида, доксорубицина гидрохлорида, гемцитабина гидрохлорида, топотекана гидрохлорида, тиотепы и их комбинаций. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
Моноклональные антитела в соответствии с настоящим изобретением можно применять как часть комбинированной терапии по меньшей мере с одним противораковым агентом. В соответствии с некоторыми вариантами реализации дополнительный противораковый агент представляет собой иммуномодулятор, активированную лимфоцитарную клетку, ингибитор киназы или химиотерапевтический агент.
В соответствии с некоторыми вариантами реализации противораковый агент представляет собой иммуномодулятор, будь то агонист или антагонист, такой как антитело к молекуле иммунной контрольной точки.
Блокада иммунных контрольных точек посредством иммунотерапии оказалась новым перспективным средством лечения рака. Пути иммунных контрольных точек состоят из ряда костимулирующих и ингибирующих молекул, которые работают согласованно, поддерживая аутотолерантность и защищая ткани от повреждения иммунной системой в физиологических условиях. Опухоли используют определенные пути контрольных точек, чтобы уклоняться от иммунной системы. Таким образом, ингибирование таких путей стало многообещающей стратегией противоракового лечения.
Ипилимумаб, антитело к белку 4, ассоциированному с цитотоксическими Т-лимфоцитами (CTLA-4) (одобрено в 2011 г.), был первым иммунотерапевтическим агентом, который продемонстрировал положительные результаты в лечении пациентов, страдающих раком. Это антитело препятствует ингибирующим сигналам во время презентации антигена Т-клеткам. Пембролизумаб, антитело к белку запрограммированной клеточной смерти 1 (PD-1) (одобрено в 2014 г.), блокирует отрицательную иммунорегуляторную передачу сигналов рецептором PD-1, экспрессируемым Т-клетками. Дополнительный агент к PD-1 был подан на одобрение надзорных органов в 2014 году для лечения немелкоклеточного рака легких (НМРЛ). В настоящее время проводятся активные исследования множества других иммунных контрольных точек, среди них: CEACAM1, NKG2A, B7-H3, B7-H4, VISTA, CD112R, ген активации лимфоцитов-3 (LAG3), CD137, OX40 (также называемый CD134) и иммуноглобулиноподобные рецепторы клеток-киллеров (KIR).
В соответствии с некоторыми конкретными вариантами реализации иммуномодулятор выбран из группы, состоящей из: антитела, ингибирующего CTLA-4, антитела к человеческому белку запрограммированной клеточной смерти 1 (PD-1), к PD-L1 и к PD-L2, активированной цитотоксической лимфоцитарной клетки, агента, активирующего лимфоциты, антитела к CEACAM, антитела к TIGIT и ингибитора сигнального пути RAF/MEK. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения. В соответствии с некоторыми конкретными вариантами реализации дополнительный иммуномодулятор выбран из МАТ к PD-1, МАТ к PD-L1, МАТ к PD-L2, МАТ к CEACAM1, МАТ к CTLA-4, МАТ к TIGIT, PVR, интерлейкина 2 (ИЛ-2) или лимфокин-активированных клеток-киллеров (ЛАК).
В соответствии с другими вариантами реализации дополнительный противораковый агент представляет собой химиотерапевтический агент. Химиотерапевтический агент, который может быть введен вместе с антителом в соответствии с настоящим изобретением или отдельно, может содержать любой такой агент, известный в данной области техники, проявляющий противоопухолевую активность, включая, не ограничиваясь перечисленным: митоксантрон, ингибиторы топоизомеразы, веретённый яд из барвинка: винбластин, винкристин, винорелбин (таксол), паклитаксел, доцетаксел; алкилирующие агенты: мехлорэтамин, хлорамбуцил, циклофосфамид, мелфалан, ифосфамид; метотрексат; 6-меркаптопурин; 5-фторурацил, цитарабин, гемцитабин; подофиллотоксины: этопозид, иринотекан, топотекан, дакарбазин; антибиотики: доксорубицин (адриамицин), блеомицин, митомицин; нитрозомочевины: кармустин (BCNU), ломустин, эпирубицин, идарубицин, даунорубицин; неорганические ионы: цисплатин, карбоплатин; интерферон, аспарагиназу; гормоны: тамоксифен, лейпролид, флутамид и мегестрола ацетат.
В соответствии с некоторыми вариантами реализации химиотерапевтический агент выбран из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и родственных ингибиторов, алкалоидов барвинка, эпиподофиллотоксинов, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов платины, антрацендиона, замещенной мочевины, производных метилгидразина, адренокортикального супрессора, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогенов, андрогенов, антиандрогенов и аналога гонадотропин-рилизинг-гормона. В соответствии с другим вариантом реализации химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила (5-FU), лейковорина (LV), иринотекана, оксалиплатина, капецитабина, паклитаксела и доцетаксела. Можно применять один или более химиотерапевтических агентов.
В соответствии с некоторыми вариантами реализации фармацевтическая композиция в соответствии с настоящим изобретением предназначена для применения в лечении рака или для применения в усилении иммунного ответа.
Термин «усиление иммунного ответа» относится к увеличению реакции иммунной системы и индукции или продлению ее памяти. Фармацевтическую композицию в соответствии с настоящим изобретением можно применять для стимуляции иммунной системы после вакцинации. Таким образом, в одном из вариантов реализации фармацевтическую композицию можно применять для улучшения вакцинации.
Согласно определенным вариантам реализации рак выбран из рака легких, рака щитовидной железы, рака молочной железы, рака ободочной кишки, меланомы, рака предстательной железы, рака печени, рака мочевого пузыря, рака почек, рака шейки матки, рака поджелудочной железы, лейкоза, лимфомы, миелоидного рака, рака яичников, рака матки, саркомы, рака желчных протоков и рака из клеток эндометрия. Каждый возможный вариант представляет собой отдельный вариант реализации настоящего изобретения.
В соответствии с некоторыми вариантами реализации фармацевтическую композицию, содержащую по меньшей мере одно антитело или его фрагмент в соответствии с настоящим изобретением, и фармацевтическую композицию, содержащую дополнительный иммуномодулятор или ингибитор киназы, применяют в лечении рака путем раздельного введения.
В соответствии с еще одним аспектом настоящего изобретения предложен способ лечения рака у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества моноклонального антитела или фрагмента антитела в соответствии с настоящим изобретением.
Термин «эффективное количество» в контексте настоящего документа относится к достаточному количеству моноклонального антитела или фрагмента антитела, которое при введении субъекту будет оказывать предусмотренный терапевтический эффект. Эффективное количество, необходимое для достижения терапевтического конечного результата, может зависеть от ряда факторов, включая, например, конкретный тип опухоли и тяжесть состояния пациента, а также от того, вводится ли комбинация совместно с облучением. Эффективное количество (доза) активных агентов в контексте настоящего изобретения должно быть достаточным, чтобы обеспечить полезный терапевтический ответ у субъекта с течением времени, включая, не ограничиваясь перечисленным, ингибирование роста опухоли, уменьшение скорости роста опухоли, предотвращение роста опухоли и метастазов и повышение выживаемости.
Токсичность и терапевтическая эффективность композиций, описанных в данном документе, могут быть определены с помощью стандартных фармацевтических процедур на клеточных культурах или экспериментальных животных, например, путем определения ИК50 (концентрации, которая обеспечивает 50% ингибирование) и максимальной переносимой дозы для соединения согласно настоящему изобретению. Данные, полученные в результате этих анализов клеточных культур и исследований на животных, могут быть использованы при разработке диапазона дозировок для применения у людей. Дозировка может варьироваться в зависимости, среди прочего, от используемой лекарственной формы, выбранного режима дозирования, композиции агентов, используемых для лечения, и используемого пути введения, а также других значимых факторов. Точный состав, путь введения и дозировка могут быть выбраны индивидуальным врачом с учетом состояния пациента. В зависимости от тяжести и восприимчивости состояния, подлежащего лечению, введение доз также может представлять собой однократное введение композиции с медленным высвобождением, при этом курс лечения может продолжаться от нескольких дней до нескольких недель или до тех пор, пока не произойдет излечение или не будет достигнуто уменьшение патологического состояния. Количество композиции, подлежащей введению, безусловно, будет зависеть от субъекта, которого лечат, тяжести заболевания, способа введения, заключения лечащего врача и всех прочих значимых факторов.
«Выполнение введения» или «введение» вещества, соединения или агента субъекту можно осуществлять с использованием одного из множества методов, известных специалистам в данной области техники. Например, соединение или агент могут быть введены энтерально или парентерально. Энтеральное введение относится к введению через желудочно-кишечный тракт, включая пероральное, сублингвальное или ректальное. Парентеральное введение включает внутривенное, внутрикожное, внутримышечное, внутрибрюшинное, подкожное, окулярное, сублингвальное, интраназальное, ингаляционное, интраспинальное, внутрицеребральное и чрескожное введение (путем всасывания, например, через кожный проток). Соединение или агент также могут быть надлежащим образом введены с помощью перезаряжаемых или биоразлагаемых полимерных устройств или других устройств, например, пластырей и насосов, или препаратов, обеспечивающих пролонгированное, медленное или контролируемое высвобождение соединения или агента. Введение также может быть выполнено, например, один раз, множество раз и/или в течение одного или более длительных периодов. Согласно некоторым вариантам реализации введение включает как прямое введение, включая самостоятельное введение, так и непрямое введение, включая действия по назначению лекарственного средства. Например, в контексте настоящего документа лечащий врач, который инструктирует пациента самостоятельно вводить лекарственное средство или получить лекарственное средство путем введения другим лицом, и/или который дает пациенту рецепт на лекарственное средство, вводит лекарственное средство указанному пациенту.
Антитела обычно вводят в диапазоне от приблизительно 0,1 до приблизительно 20 мг/кг массы тела пациента, обычно от приблизительно 0,5 до приблизительно 10 мг/кг и часто от приблизительно 1 до приблизительно 5 мг/кг. В этой связи предпочтительно использовать антитела с периодом полувыведения из крови, равным по меньшей мере 12 часов, предпочтительно по меньшей мере 4 дня, более предпочтительно до 21 дня. Ожидается, что химерные антитела будут иметь период полувыведения из крови до 14-21 дня. В некоторых случаях может быть предпочтительным введение большой нагрузочной дозы с последующими периодическими (например, еженедельными) поддерживающими дозами в течение периода лечения. Антитела также могут быть доставлены с помощью систем доставки с медленным высвобождением, насосов и других известных систем доставки для непрерывной инфузии.
Антитела согласно настоящему изобретению можно применять в разных видах адоптивной иммунотерапии на основе CAR, в которых применяются модифицированные лимфоциты, содержащие CAR, для лечения рака. Система CAR-T описана в данном документе как неограничивающий пример.
В T-клеточной терапии химерный антигенный рецептор (CAR) применяется в лечении рака или опухолей (например, CAR-T-клеточная терапия). CAR-T-клеточная терапия представляет собой клеточную иммунотерапию, которая включает введение пациенту, страдающему раком, генетически модифицированных Т-клеток, которые действуют на опухолевые клетки и вызывают апоптоз опухолевых клеток. Генетически модифицированные Т-клетки получают путем экспрессии на Т-клетке CAR, имеющего вариабельные области антитела (VL и VH), объединенные с внутриклеточным доменом, таким как фрагмент последовательности цепи CD3ζ, с использованием методики переноса генов. CAR это общий термин для химерного белка, в котором легкая цепь и тяжелая цепь вариабельной области моноклонального антитела, специфичного в отношении опухолевого антигена, связаны друг с другом, а затем связаны с цепью Т-клеточного рецептора (TCR) на C-конце.
В соответствии с некоторыми вариантами реализации CAR содержит по меньшей мере один белковый домен, выбранный из группы, состоящей из домена стебля CD8, TM-домена CD28, домена 41BB и домена CD3ζ. В соответствии с некоторыми вариантами реализации CAR содержит домен стебля CD8. В соответствии с некоторыми вариантами реализации CAR содержит TM-домен CD28. В соответствии с некоторыми вариантами реализации CAR содержит сигнальный домен CD3ζ. В соответствии с некоторыми вариантами реализации CAR содержит домен 41BB. В соответствии с конкретными вариантами реализации CAR содержит домен стебля CD8, TM-домен CD28, домен 41BB и домен CD3ζ.
В соответствии с некоторыми вариантами реализации CAR содержит костимулирующий домен, происходящий из 4-1BB (или 41BB, или CD137), ICOS, OX40, CD27, KIR2DS2, MYD88-CD40 или CD28. Согласно некоторым вариантам реализации CAR содержит сигнальные домены CD3ζ, 41BB и CD28.
В соответствии с некоторыми вариантами реализации CAR содержит трансмембранный домен (TM), выбранный из TM CD28, TM DAP12, TM CD8, TM CD3ζ, TM DAP10 и TM ICOS.
В соответствии с некоторыми вариантами реализации CAR содержит последовательность шарнирной области. В соответствии с некоторыми вариантами реализации последовательность шарнирной области происходит из шарнира CD8, CD28 или IgG4.
В соответствии с некоторыми вариантами реализации предложен химерный антигенный рецептор (CAR), содержащий вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL) в соответствии с настоящим изобретением. В соответствии с определенными вариантами реализации предложен генетически модифицированный лимфоцит, на поверхности которого экспрессируется CAR. В соответствии с некоторыми конкретными вариантами реализации предложена генетически модифицированная Т-клетка, на поверхности которой экспрессируется CAR (CAR-T-клетка).
В соответствии с некоторыми вариантами реализации CAR содержит сайт связывания нектина-2, содержащий шесть последовательностей CDR, выбранных из группы, состоящей из:
i. трех определяющих комплементарность участков (CDR) вариабельной области тяжелой цепи (HC), содержащей SEQ ID NO: 7, и трех CDR вариабельной области легкой цепи (LC), содержащей SEQ ID NO: 8, или их аналога или производного, имеющего по меньшей мере 90% идентичности последовательности с указанной последовательностью антитела или фрагмента; и
ii. трех CDR вариабельной области тяжелой цепи, содержащей SEQ ID NO: 17, и трех CDR вариабельной области легкой цепи, содержащей SEQ ID NO: 18, или их аналога или производного, имеющего по меньшей мере 90% идентичности последовательности с указанной последовательностью антитела или фрагмента.
В соответствии с некоторыми вариантами реализации аналог или производное имеет по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности с указанной последовательностью антитела или фрагмента.
В соответствии с некоторыми вариантами реализации CAR содержит сайт связывания нектина-2, содержащий шесть последовательностей CDR, выбранных из группы, состоящей из:
i. трех определяющих комплементарность участков (CDR) вариабельной области тяжелой цепи (HC), содержащей SEQ ID NO: 7, и трех CDR вариабельной области легкой цепи (LC), содержащей SEQ ID NO: 8; и
ii. трех CDR вариабельной области тяжелой цепи, содержащей SEQ ID NO: 17, и трех CDR вариабельной области легкой цепи, содержащей SEQ ID NO: 18.
В соответствии с некоторыми вариантами реализации CAR содержит сайт связывания нектина-2, содержащий набор CDR, выбранный из группы, состоящей из:
i. набора из шести CDR, причем: CDR1 HC представляет собой RFTMS (SEQ ID NO: 1); CDR2 HC представляет собой TISSGGSYTYYPDSVKG (SEQ ID NO: 2); CDR3 HC представляет собой DRDFYGPYYAMDY (SEQ ID NO: 3); CDR1 LC представляет собой KSSQSLLNSGNQKNYLA (SEQ ID NO: 4); CDR2 LC представляет собой FASTRES (SEQ ID NO: 5); и CDR3 LC представляет собой QQHYTTPLT (SEQ ID NO: 6); и
ii. набора из шести CDR, причем: последовательность CDR1 HC представляет собой SYWIH (SEQ ID NO: 11); CDR2 HC представляет собой AVYPGNSDSNYNQKFKA (SEQ ID NO: 12); CDR3 HC представляет собой LVGTFDY (SEQ ID NO: 13); CDR1 LC представляет собой KASQNVGINVV (SEQ ID NO: 14); CDR2 LC представляет собой SASYRYS (SEQ ID NO: 15); и CDR3 LC представляет собой QQYNTNPFT (SEQ ID NO: 16).
В соответствии с некоторыми вариантами реализации CAR содержит антигенсвязывающий домен, содержащий SEQ ID NO: 20 или 22, или аналог, имеющий по меньшей мере 85% идентичности с SEQ ID NO: 20 или 22; и трансмембранный домен и внутриклеточный Т-клеточный сигнальный домен.
В соответствии с определенным аспектом настоящего изобретения предложена клетка, содержащая CAR, описанный в данном документе. В соответствии с некоторыми вариантами реализации клетка экспрессирует или способна экспрессировать CAR согласно настоящему изобретению. В соответствии с некоторыми вариантами реализации клетка представляет собой лимфоцит. В соответствии с некоторыми вариантами реализации клетка выбрана из Т-клетки и клетки естественного киллера (NK).
В соответствии с некоторыми вариантами реализации клетка, такая как Т-клетка, содержит молекулу нуклеиновой кислоты, кодирующую CAR согласно настоящему изобретению. В соответствии с другими вариантами реализации клетка, такая как Т-клетка, содержит конструкцию нуклеиновой кислоты, содержащую молекулу нуклеиновой кислоты, кодирующую CAR согласно настоящему изобретению. В соответствии с дополнительным вариантом реализации настоящего изобретения предложен вектор, содержащий конструкцию или молекулу нуклеиновой кислоты, кодирующую CAR согласно настоящему изобретению. В соответствии с такими вариантами реализации Т-клетка способна экспрессировать или экспрессирует CAR согласно настоящему изобретению.
В соответствии с некоторыми вариантами реализации предложен лимфоцит, модифицированный для экспрессии CAR, описанного в данном документе. В соответствии с некоторыми вариантами реализации предложена Т-клетка, модифицированная для экспрессии CAR, описанного в данном документе.
В соответствии с дополнительными вариантами реализации предложена NK-клетка, модифицированная для экспрессии CAR, описанного в данном документе.
CAR согласно настоящему изобретению содержит трансмембранный домен (TM-домен), костимулирующий домен и активационный домен. В соответствии с некоторыми вариантами реализации TM-домен представляет собой TM-домен рецептора, выбранного из CD4, CD3ζ, CD28 и CD8, или его аналог, имеющий по меньшей мере 85% идентичности аминокислот с исходной последовательностью, и/или костимулирующий домен выбран из костимулирующего домена белка, выбранного из CD28, 4-1BB, OX40, iCOS, CD27, CD80 и CD70, его аналога, имеющего по меньшей мере 85% идентичности аминокислот с исходной последовательностью, и любой их комбинации, и/или активационный домен выбран из активационных доменов FcRγ и CD3-ζ. В соответствии с некоторыми вариантами реализации CAR содержит лидерный пептид.
В соответствии с некоторыми вариантами реализации настоящего изобретения предложена клеточная композиция, содержащая множество клеток согласно настоящему изобретению, например, клетки, экспонирующие CAR.
Термин «приблизительно» означает, что подразумевается допустимый интервал погрешности, например, до 5% или 10% для конкретного значения.
Диагностика
Согласно настоящему изобретению также раскрыты способы диагностики и прогнозирования рака.
Согласно аспекту настоящего изобретения предложен способ диагностики и/или прогнозирования рака или инфекционного заболевания у субъекта, причем указанный способ включает этап определения уровня экспрессии нектина-2 в биологическом образце от указанного субъекта с использованием по меньшей мере одного антитела, описанного в данном документе.
Термин «биологический образец» включает множество типов образцов, полученных от организма, которые могут быть использованы в диагностическом или контрольном анализе. Термин включает кровь и другие жидкие образцы биологического происхождения, образцы солидных тканей, такие как биоптат, или полученные из них тканевые культуры или клетки и их потомство. Кроме того, данный термин может включать циркулирующие опухолевые или другие клетки. Термин конкретно включает клинический образец и, кроме того, включает клетки в клеточной культуре, клеточные супернатанты, клеточные лизаты, сыворотку, плазму, мочу, околоплодные воды, биологические жидкости, включая внутриглазную жидкость и стекловидное тело в качестве образцов из глаз, а также образцы тканей. Данный термин также включает образцы, с которыми после получения были произведены какие-либо манипуляции, такие как обработка реагентами, солюбилизация или обогащение определенными компонентами.
Определение уровня экспрессии нектина-2 может быть выполнено с помощью меченого антитела к нектину-2, как описано в данном документе. Определение экспрессии может быть выполнено, например, с помощью ELISA.
Способ согласно настоящему изобретению может дополнительно включать этап сравнения указанного уровня экспрессии с контрольным уровнем.
Следующие примеры представлены для более полной иллюстрации некоторых вариантов реализации настоящего изобретения. Тем не менее их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
ПРИМЕРЫ
Ниже приведены ссылки на следующие примеры, которые вместе с приведенными выше описаниями иллюстрируют настоящее изобретение, но не ограничивают его.
Как правило, используемая в данном документе номенклатура и лабораторные процедуры, применяемые в настоящем изобретении, включают молекулярные, биохимические, микробиологические, иммунологические методики и методики рекомбинантной ДНК. Такие методики хорошо известны в данной области техники. Для удобства читателя в данном документе приведены другие общие ссылки на общеизвестные процедуры.
Пример 1. Высокая экспрессия мРНК нектина-2 коррелирует с низкой вероятностью выживания различных пациентов, страдающих раком.
Корреляцию между экспрессией мРНК нектина-2 и вероятностью выживания исследовали на основании данных с сайта TCGA и анализировали с использованием сайта oncolnc.org, (https://doi.org/10.7717/peerj-cs.67). Эта корреляция указана стрелками на Фигуре 1 для пациентов с низкозлокачественной глиомой (Фигура 1A; p = 5,22×10-5), светлоклеточной карциномой почек (Фигура 1B; p = 0,00037) и аденокарциномой легких (Фигура 1C; p = 0,0319).
Пример 2. Нектин-2 связывается и влияет на иммунные клетки посредством специфичных рецепторов.
Схематическая иллюстрация (Фигура 2) рецепторов, экспрессируемых на иммунных клетках, и их соответствующие величины аффинности в отношении нектина-2, экспрессируемого опухолями или на антигенпрезентирующих клетках (АПК). TIGIT относится к коингибирующему рецептору на иммунных клетках, таких как Т- и NK-клетки; DNAM-1 (также называемый CD226) относится к активирующему рецептору на иммунных клетках (например, Т-клетках), а CD112R (также называемый PVRIG) относится к коингибирующему рецептору на лимфоидных иммунных клетках (например, Т- и NK-клетках); нектин-2 (CD112) представляет собой ингибирующий лиганд для иммунных клеток, главным образом, за счет его связывания с CD112R. В соответствии с настоящим изобретением МАТ к нектину-2 могут блокировать взаимодействия нектина-2 с его лигандами CD112R и/или TIGIT и повышать активацию иммунных клеток.
Пример 3. Анализ характеристик связывания и блокирования МАТ к нектину-2.
Клоны к нектину-2 не связывались с исходными клетками 8866 (ВЭБ-положительная лимфома Беркитта), которые не экспрессируют нектин-2. На Фигуре 3A проиллюстрировано связывание клонов к нектину-2 с клетками MDA-MB-231 (аденокарцинома молочной железы) (черные столбики), которые эндогенно экспрессируют нектин-2, или клетками 8866-hNectin-2 (серые столбики), которые сверхэкспрессируют нектин-2. Все МАТ использовали из супернатантов гибридом при 30 мкл/лунку. Для детектирования использовали козье антитело к белку мыши-647 в разведении 1:250. На Фигуре 3В показаны результаты анализа методом FACS связывания CD112R-Fc (внеклеточный домен CD112R, слитый с областью Fc IgG1 человека) с клетками 8866-hNectin2. Три клона (№ 9, 11 и 13) из полученных антител частично блокировали эти взаимодействия, в то время как один клон (№ 7) полностью блокировал их. Фигура 3С показывает результаты анализа методом FACS связывания DNAM-1-Fc с клетками 8866-hNectin2. За исключением клона 15, ни один из других клонов (№ 7-13) не блокировал связывание активирующего рецептора DNAM-1 с нектином-2. На Фигуре 3D показаны результаты анализа методом FACS связывания TIGIT-Fc с клетками CHOK1-hNectin2 в присутствии клонов 7 и 11, направленных против нектина-2. Оба клона блокируют >66% связывания TIGIT-Fc. Все белки Fc использовали при 20 мкг/мл и инкубировали совместно с 30 мкл/лунку указанного супернатанта МАТ. Для детектирования использовали APC-конъюгированное антитело к белку человека в разведении 1:200 (Jackson immunoresearch AB_2340526). Эти результаты свидетельствуют о том, что некоторые из клонов могут предотвращать связывание ингибирующих рецепторов без какого-либо вмешательства в связывание активирующих рецепторов.
Пример 4. Блокирование нектина-2 с помощью МАТ к нектину-2 усиливает активацию NK-клеток.
NK-клетки от здоровых доноров инкубировали в присутствии различных МАТ и линий клеток-мишеней при соотношении E:T 2:1 в течение 2 часов при 37°C. Активацию NK-клеток измеряли по индукции поверхностной экспрессии CD107a и отображали как кратное изменение по сравнению с контрольным IgG (ось Y). Все МАТ использовали при 5 мкг/мл. Результаты показаны на Фигуре 4 для линий раковых клеток человека A549 (Фигура 4A и 4C, аденокарцинома легких) и MDA-MB-231 (Фигура 4B, аденокарцинома молочной железы). Наиболее значительный эффект был отмечен для клонов № 3, 7 и 11. *=p<0,04, **p<0,02, ***p<0,002 согласно двустороннему t-критерию Стьюдента. Показаны типичные данные для одного из пяти доноров. Химерные варианты IgG1 человека клонов 7 и 11 дополнительно усиливали дегрануляцию (Фигура 4C), что привело к >200% дегрануляции по сравнению с изотипическим контролем. ***р<0,002. Показаны типичные данные для одного из двух доноров. Эти данные свидетельствуют о том, что блокирование нектина-2 специфичными клонами увеличивает активность NK-клеток против ряда мишеней. Более того, наличие эффекторного Fc дополнительно увеличивает активность NK, что указывает на другой возможный способ действия МАТ.
Пример 5. Нектин-2 экспрессируется в различных раковых клетках.
Экспрессию нектина-2 и PVR на различных линиях опухолевых клеток человека анализировали с помощью FACS. Анализ выполняли для клеток меланомы, клеток рака молочной железы, клеток колоректального рака (CRC), клеток почек (HEK), клеток рака легких, клеток рака предстательной железы и клеток опухоли головного мозга (GBM), которые все экспрессируют PVR и нектин-2. Использовали коммерческое МАТ к нектину-2 (клон Tx31) и разработанное собственными силами МАТ к PVR. Все МАТ использовали при 2 мкг/мл. Для детектирования использовали козье антитело к белку мыши-647 в разведении 1:250. Было обнаружено, что нектин-2 высоко экспрессируется в различных раковых клетках.
Пример 6. Сходное связывание МАТ к нектину-2 с нектином-2 человека и яванской макаки.
Исследовали связывание МАТ к нектину-2 (клоны 7 и 11) с нектином-2 человека (идентификатор белка Q92692) и яванской макаки (Cyno) (Macaca fascicularis, идентификатор белка: XP_005589607.1). Анализ белка нектина-2 человека и яванской макаки с использованием BLAST выявил, что внеклеточные домены зрелых белков имеют 14 аминокислотных различий между видами. На Фигуре 5А показаны наложенные кривые связывания обоих МАТ, которые были добавлены в диапазоне 13,3 нМ-0,02 нМ в ряде трехкратных разведений к клеткам СНО, экспрессирующим нектин-2 человека или яванской макаки. Результаты анализа методом FACS для этого анализа выражены как относительная интенсивность связывания по сравнению с максимальным связыванием, которое было установлено как 100%. Для детектирования использовали козье антитело к белку мыши-647 (Jackson immunoresearch AB_2338910) в разведении 1:250. Также представлены обобщенные результаты анализа данных в этом анализе, которые также демонстрируют, что оба МАТ связываются с нектином-2 человека и яванской макаки с высокой и сходной аффинностью.
Связывание МАТ к нектину-2 также исследовали с использованием клеток Vero, происходящих из Chlorocebus (африканская зеленая мартышка). Этот вид экспрессирует белок нектин-2 (XP_007995342.1), имеющий 97% сходства с нектином-2 человека. На Фигуре 5B показано связывание МАТ к нектину-2 с эндогенным нектином-2 человека (экспрессируемым клетками 293T) и с эндогенным нектином-2 африканской зеленой мартышки (экспрессируемым клетками Vero), протестированное с помощью анализа методом FACS, как описано для Фигуры 5A (диапазон концентрации антитела: 20-0,0003 нМ). Этот анализ показывает сходное связывание антител с обеими мишенями, нектином-2 человека и нектином-2 обезьяны, с высокой аффинностью для обоих клонов к нектину-2, как следует из сводных таблиц.
Пример 7. МАТ к нектину-2 человека влияют на пролиферацию Т-клеток.
МКПК человека метили CFSE (C34554 ThermoFischer) и инкубировали с клетками-мишенями MDA-MB-231 (Фигура 6A) или A549 (Фигура 6B) в присутствии 0,2 мкг/мл PHA-L (Roche) и указанных антител при 2 мкг/мл. После инкубации иммунные клетки собирали и окрашивали антителами к CD8 человека. Клеточную пролиферацию CD8+ Т-клеток оценивали по интенсивности сигнала CFSE. Уровни CFSE клеток, обработанных mIgG, устанавливали как 1. Результаты представлены как кратное увеличение пролиферации относительно данного контроля. Эксперименты проводили с четырьмя повторами; все p-значения были ниже 0,02 согласно двустороннему t-критерию Стьюдента. Показаны результаты для 1 донора МКПК, который является типичным для 7 протестированных доноров. Данные свидетельствуют о том, что блокирование нектина-2 указанными клонами увеличивает пролиферацию CD8+ Т-клеток в присутствии опухолевых клеток различного происхождения.
Пример 8. МАТ к нектину-2 человека влияют на пролиферацию CD8+ Т-клеток, по отдельности или в комбинации с известными блокаторами контрольных точек.
Чтобы исследовать эффект МАТ на пролиферацию Т-клеток, МКПК человека метили CFSE и инкубировали с клетками-мишенями RKO (клетки карциномы ободочной кишки человека; Фигура 7A) или A549 (Фигура 7B) в присутствии 0,2 мкг/мл PHA-L и указанных МАТ при 2 мкг/мл. Для комбинированного лечения каждое из МАТ добавляли при 2 мкг/мл. После инкубации иммунные клетки собирали и окрашивали антителами к CD8 человека. Анализировали всю популяцию и пролиферирующие CD8 клетки, и уровни CFSE клеток, обработанных mIgG, устанавливали как 1. Эксперименты проводили с четырьмя повторами; все p-значения были ниже 0,02 согласно двустороннему t-критерию Стьюдента. Результаты представлены как кратное увеличение пролиферации относительно контроля. Показаны результаты для одного донора МКПК из двух протестированных доноров. Все протестированные комбинации приводили к значительному увеличению пролиферации CD8+ Т-клеток по сравнению с обработками отдельным препаратом.
Пример 9. Антитела к нектину-2 человека влияют на секрецию IFNγ.
МКПК человека метили CFSE и инкубировали с клетками-мишенями RKO (Фигура 8A) или A549 (Фигура 8B) в присутствии 0,2 мкг/мл PHA-L и указанных антител при 2 мкг/мл. Для комбинированного лечения каждое из МАТ добавляли при 2 мкг/мл. Через 96 часов планшеты центрифугировали и собирали супернатанты. Количественную оценку IFNγ проводили с использованием MAX™ Deluxe для ИФА IFN-γ человека от Biolegend в соответствии с протоколом производителя. Показаны результаты для одного донора МКПК из пяти протестированных доноров. Все обработки привели к значительному увеличению секреции IFNγ (p<0,001 двусторонний t-критерий Стьюдента).
Пример 10. Антитела к нектину-2 человека по отдельности или в комбинации с известными блокаторами контрольных точек влияют на уничтожение опухолевых клеток с помощью МКПК.
Анализ проводили, как описано в примере 8. Через 96-120 часов иммунные клетки удаляли, опухолевые клетки тщательно промывали и жизнеспособность прикрепившихся опухолевых клеток определяли с использованием CellTiter-Glo® в соответствии с протоколом производителя. Все результаты были в пределах линейного диапазона набора. Уничтожение опухолевых клеток в лунках, обработанных mIgG, устанавливали как 1. Все обработки отдельными препаратами значительно (p<0,01 двусторонний t-критерий) усиливали уничтожение опухолевых клеток (Фигура 9A, RKO; Фигура 9B, A549). Показаны результаты для одного донора МКПК из двух протестированных доноров. Большинство протестированных комбинаций привело к значительному усилению уничтожения опухолевых клеток по сравнению с обработками отдельным препаратом.
Пример 11. МАТ к нектину-2 значительно ингибируют развитие опухоли in vivo.
Самкам мышей Scid (n=33) вводили путем подкожной инъекции 5×106 клеток MDA-MB-231 в матригеле. После того, как опухоли достигли 80-120 мм3, мыши были рандомизированы на три группы и получали дважды в неделю слепым методом в/в инъекции фосфатно-солевого буфера (ФСБ) (светло-серые ромбы, Фигура 10), контрольного антитела hIgG1 (серые квадраты) или клон-7-IgG1 человека (2.7.1) (черный круг), оба при 3 мг/кг. Как показано на Фигуре 10, для клона 2.7.1 наблюдали значительное ингибирование роста опухоли (TGI), начиная с 7 дня после лечения, которое достигло 54% в конце исследования. *p<0,04, **p<0,02, ***p<0,008.
Пример 12. Химерные МАТ к нектину-2 с Fc IgG2 человека приводят к усилению уничтожения опухолевых клеток и пролиферации МКПК в синергии с МАТ к PD-1.
Клетки A549 инкубировали совместно с МКПК при соотношении E:T 7:1 в течение 96 часов в присутствии 4 мкг/мл PHA-L, либо без антитела, либо с клон-11-hIgG2 (2.11.2), китрудой (оба при 3,5 мкг/мл), либо с их комбинацией (каждый при 3,5 мкг/мл). В группе обработки 2.11.2 наблюдали значительное усиление уничтожения опухолевых клеток (Фигура 11A) и пролиферации МКПК (T-клеток) (Фигура 11B), которое дополнительно увеличивалось при комбинировании с антителом к PD-1, китрудой. *p<0,01, **p<0,002, ***p<0,0008.
Пример 13. CAR-T-клетки, экспрессирующие scFv, происходящие из клонов 7 и 11, специфично активируются в присутствии опухолевых клеток, экспрессирующих нектин-2.
МКПК от здоровых доноров трансдуцировали различными конструкциями CAR-T, содержащими молекулу scFv в соответствии с настоящим изобретением и по меньшей мере одну регуляторную, трансмембранную и/или стимулирующую область. На схематическом рисунке, показанном на Фигуре 12A, CAR-T содержит scFv и четыре области: стебель CD8, TM CD28, 4-1BB и CD3ζ. МКПК против нектина-2 CAR-T 2.07 (сайты связывания, происходящие из клона 7) или CAR-T 2.11 (сайты связывания, происходящие из клона 11) инкубировали с клетками-мишенями U937 или BT-474 при различных соотношениях E:T. Подавляющее большинство протестированных соотношений E:T (p<0,005, за исключением случаев, когда указано NS) приводило к значимому уничтожению клеток-мишеней (Фигура 12B и 12D), а также секреции IFNγ активированными МКПК (Фигуры 12C и 12E, p<0,03). Фигуры 12B-E показывают типичные эксперименты из трех, выполненных для каждой линии клеток (серые столбики CAR-T 2.07, черные столбики CAR-T 2.11).
Пример 14. Последовательности антител
В таблице 1 подробно описаны некоторые последовательности антител согласно настоящему изобретению.
Приведенное выше описание конкретных вариантов реализации будет настолько полно раскрывать общий характер изобретения, что другие могут, применяя общие знания, легко изменять и/или адаптировать такие конкретные варианты реализации для различных применений без проведения излишних экспериментов и без отклонения от общей концепции, и, следовательно, такие адаптации и модификации должны быть включены и предназначены для включения в пределах значения и диапазона эквивалентов раскрытых вариантов реализации. Следует понимать, что формулировки или терминология, используемые в данном документе, предназначены для описания, а не ограничения.
--->
Перечень последовательностей
<110> Yissum Research Development Company Ltd. Еврейского университета
в Иерусалиме
Медицинский факультет Университета Риеки
<120> АНТИТЕЛА, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ НЕКТИНА-2 ЧЕЛОВЕКА
<130> Yissum/0156 PCT
<150> US 62/791808
<151> 2019-01-13
<160> 32
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> Белок
<213> Mus musculus
<400> 1
Arg Phe Thr Met Ser
1 5
<210> 2
<211> 17
<212> Белок
<213> Mus musculus
<400> 2
Thr Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 13
<212> Белок
<213> Mus musculus
<400> 3
Asp Arg Asp Phe Tyr Gly Pro Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 4
<211> 17
<212> Белок
<213> Mus musculus
<400> 4
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 5
<211> 7
<212> Белок
<213> Mus musculus
<400> 5
Phe Ala Ser Thr Arg Glu Ser
1 5
<210> 6
<211> 9
<212> Белок
<213> Mus musculus
<400> 6
Gln Gln His Tyr Thr Thr Pro Leu Thr
1 5
<210> 7
<211> 122
<212> Белок
<213> Mus musculus
<400> 7
Asp Val Asn Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Phe
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Thr Leu Asp Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Asp Arg Asp Phe Tyr Gly Pro Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 8
<211> 113
<212> Белок
<213> Mus musculus
<400> 8
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Ile Ser Val Gly
1 5 10 15
Gln Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Val His Phe Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln
85 90 95
His Tyr Thr Thr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 9
<211> 366
<212> ДНК
<213> Mus musculus
<400> 9
gacgtgaatc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt aggtttacca tgtcttgggt tcgccagact 120
ccggagaaga cattggactg ggtcgcaacc attagtagtg gtggttctta cacctactat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtac aagagatcga 300
gatttctacg gcccttacta tgctatggac tactggggtc aaggaacctc agtcaccgtc 360
tcctca 366
<210> 10
<211> 339
<212> ДНК
<213> Mus musculus
<400> 10
gacattgtga tgacacagtc tccatcctcc ctggctatct cagtaggaca gaaggtcact 60
atgagctgca agtccagtca gagcctttta aatagtggca atcaaaagaa ctatttggcc 120
tggtaccagc aaaaaccagg acagtctcct aaacttctgg tacactttgc atccactagg 180
gaatctgggg tccctgatcg cttcataggc agtggatctg ggacagattt cactcttacc 240
atcagcagtg tgcaggctga agacctggca gattacttct gtcagcaaca ttataccact 300
ccgctcacgt tcggtgctgg gaccaagctg gagctgaaa 339
<210> 11
<211> 5
<212> Белок
<213> Mus musculus
<400> 11
Ser Tyr Trp Ile His
1 5
<210> 12
<211> 17
<212> Белок
<213> Mus musculus
<400> 12
Ala Val Tyr Pro Gly Asn Ser Asp Ser Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Ala
<210> 13
<211> 7
<212> Белок
<213> Mus musculus
<400> 13
Leu Val Gly Thr Phe Asp Tyr
1 5
<210> 14
<211> 11
<212> Белок
<213> Mus musculus
<400> 14
Lys Ala Ser Gln Asn Val Gly Ile Asn Val Val
1 5 10
<210> 15
<211> 7
<212> Белок
<213> Mus musculus
<400> 15
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 16
<211> 9
<212> Белок
<213> Mus musculus
<400> 16
Gln Gln Tyr Asn Thr Asn Pro Phe Thr
1 5
<210> 17
<211> 116
<212> Белок
<213> Mus musculus
<400> 17
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Thr Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Val Tyr Pro Gly Asn Ser Asp Ser Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Ala Lys Ala Lys Leu Thr Ala Val Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Lys Leu Val Gly Thr Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 18
<211> 107
<212> Белок
<213> Mus musculus
<400> 18
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Ser Ser Ile Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Ile Asn
20 25 30
Val Val Trp Tyr Gln Gln Arg Ala Gly Gln Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Thr Asn Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 19
<211> 348
<212> ДНК
<213> Mus musculus
<400> 19
gaggttcagc tccagcagtc tgggactgtg ctgacaaggc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggcta catttttacc agctactgga ttcactgggt aaaacagcgg 120
cctggacagg gtctggaatg gattggcgct gtttatcctg gaaatagtga ttctaactac 180
aaccagaagt tcaaggccaa ggccaaactg actgcagtca catccaccag cactgcctac 240
atggagctca gcagcctgac aagtgaggac tctgcggtct attactgtac aaagctagtt 300
gggacgtttg actactgggg ccaaggcacc actctcacag tctcctcg 348
<210> 20
<211> 321
<212> ДНК
<213> Mus musculus
<400> 20
gacattgtga tgacccagtc tcaaaaattc atgtcctcat caataggaga cagggtcagc 60
gtcacctgca aggccagtca gaatgtgggc attaatgtag tttggtatca acagagagca 120
gggcagtctc ctaaaacact gatttactcg gcatcctacc ggtacagtgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat ttcactctca ccatcagcaa tgtgcagtct 240
gaagacttgg cagagtattt ctgtcagcaa tataacacca atccattcac gttcggctcg 300
gggacaaagt tggaaataaa a 321
<210> 21
<211> 750
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК
<400> 21
gacgtgaatc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt aggtttacca tgtcttgggt tcgccagact 120
ccggagaaga cattggactg ggtcgcaacc attagtagtg gtggttctta cacctactat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtac aagagatcga 300
gatttctacg gcccttacta tgctatggac tactggggtc aaggaacctc agtcaccgtc 360
tcctcaggtg gaggtggctc cggaggaggt ggttctggag gaggtggttc tgatatcgtg 420
atgacacagt ctccatcctc cctggctatc tcagtaggac agaaggtcac tatgagctgc 480
aagtccagtc agagcctttt aaatagtggc aatcaaaaga actatttggc ctggtaccag 540
caaaaaccag gacagtctcc taaacttctg gtacactttg catccactag ggaatctggg 600
gtccctgatc gcttcatagg cagtggatct gggacagatt tcactcttac catcagcagt 660
gtgcaggctg aagacctggc agattacttc tgtcagcaac attataccac tccgctcacg 720
ttcggtgctg ggaccaagct ggagctgaaa 750
<210> 22
<211> 250
<212> Белок
<213> Искусственная последовательность
<220>
<223> Белок
<400> 22
Asp Val Asn Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Phe
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Thr Leu Asp Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Asp Arg Asp Phe Tyr Gly Pro Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser
130 135 140
Pro Ser Ser Leu Ala Ile Ser Val Gly Gln Lys Val Thr Met Ser Cys
145 150 155 160
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
165 170 175
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Val His
180 185 190
Phe Ala Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ile Gly Ser
195 200 205
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu
210 215 220
Asp Leu Ala Asp Tyr Phe Cys Gln Gln His Tyr Thr Thr Pro Leu Thr
225 230 235 240
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
245 250
<210> 23
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК
<400> 23
gaggttcagc tccagcagtc tgggactgtg ctgacaaggc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggcta catttttacc agctactgga ttcactgggt aaaacagcgg 120
cctggacagg gtctggaatg gattggcgct gtttatcctg gaaatagtga ttctaactac 180
aaccagaagt tcaaggccaa ggccaaactg actgcagtca catccaccag cactgcctac 240
atggagctca gcagcctgac aagtgaggac tctgcggtct attactgtac aaagctagtt 300
gggacgtttg actactgggg ccaaggcacc actctcacag tctcctcggg tggaggtggc 360
tccggaggag gtggttctgg aggaggtggt tctgatatcg tgatgaccca gtctcaaaaa 420
ttcatgtcct catcaatagg agacagggtc agcgtcacct gcaaggccag tcagaatgtg 480
ggcattaatg tagtttggta tcaacagaga gcagggcagt ctcctaaaac actgatttac 540
tcggcatcct accggtacag tggagtccct gatcgcttca caggcagtgg atctgggaca 600
gatttcactc tcaccatcag caatgtgcag tctgaagact tggcagagta tttctgtcag 660
caatataaca ccaatccatt cacgttcggc tcggggacaa agttggaaat aaaa 714
<210> 24
<211> 238
<212> Белок
<213> Искусственная последовательность
<220>
<223> Белок
<400> 24
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Thr Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Val Tyr Pro Gly Asn Ser Asp Ser Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Ala Lys Ala Lys Leu Thr Ala Val Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Lys Leu Val Gly Thr Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Ser
130 135 140
Ser Ile Gly Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val
145 150 155 160
Gly Ile Asn Val Val Trp Tyr Gln Gln Arg Ala Gly Gln Ser Pro Lys
165 170 175
Thr Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg
180 185 190
Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn
195 200 205
Val Gln Ser Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Thr
210 215 220
Asn Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
225 230 235
<210> 25
<211> 141
<212> Белок
<213> Mus musculus
<400> 25
Met Asn Phe Gly Leu Arg Leu Ile Phe Leu Val Leu Thr Leu Lys Gly
1 5 10 15
Val Gln Cys Asp Val Asn Leu Val Glu Ser Gly Gly Gly Leu Val Lys
20 25 30
Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Arg Phe Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Thr Leu
50 55 60
Asp Trp Val Ala Thr Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met
100 105 110
Tyr Tyr Cys Thr Arg Asp Arg Asp Phe Tyr Gly Pro Tyr Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
130 135 140
<210> 26
<211> 133
<212> Белок
<213> Mus musculus
<400> 26
Met Glu Ser Gln Thr Gln Val Leu Met Phe Leu Leu Leu Trp Val Ser
1 5 10 15
Gly Ala Cys Ser Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala
20 25 30
Ile Ser Val Gly Gln Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Ser Pro Lys Leu Leu Val His Phe Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Asp Tyr
100 105 110
Phe Cys Gln Gln His Tyr Thr Thr Pro Leu Thr Phe Gly Ala Gly Thr
115 120 125
Lys Leu Glu Leu Lys
130
<210> 27
<211> 423
<212> ДНК
<213> Mus musculus
<400> 27
atgaacttcg ggctcagatt gattttcctt gtccttactt taaaaggtgt ccagtgtgac 60
gtgaatctgg tggagtctgg gggaggctta gtgaagcctg gagggtccct gaaactctcc 120
tgtgcagcct ctggattcac tttcagtagg tttaccatgt cttgggttcg ccagactccg 180
gagaagacat tggactgggt cgcaaccatt agtagtggtg gttcttacac ctactatcca 240
gacagtgtga agggccgatt caccatctcc agagacaatg ccaagaacac cctgtacctg 300
caaatgagca gtctgaagtc tgaggacaca gccatgtatt actgtacaag agatcgagat 360
ttctacggcc cttactatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 420
tca 423
<210> 28
<211> 399
<212> ДНК
<213> Mus musculus
<400> 28
atggaatcac agacccaggt cctcatgttt cttctgctct gggtatctgg tgcctgttca 60
gacattgtga tgacacagtc tccatcctcc ctggctatct cagtaggaca gaaggtcact 120
atgagctgca agtccagtca gagcctttta aatagtggca atcaaaagaa ctatttggcc 180
tggtaccagc aaaaaccagg acagtctcct aaacttctgg tacactttgc atccactagg 240
gaatctgggg tccctgatcg cttcataggc agtggatctg ggacagattt cactcttacc 300
atcagcagtg tgcaggctga agacctggca gattacttct gtcagcaaca ttataccact 360
ccgctcacgt tcggtgctgg gaccaagctg gagctgaaa 399
<210> 29
<211> 135
<212> Белок
<213> Mus musculus
<400> 29
Met Glu Cys Asn Trp Ile Leu Pro Phe Ile Leu Ser Val Thr Ser Gly
1 5 10 15
Val Tyr Ser Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Thr Arg
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ile Phe
35 40 45
Thr Ser Tyr Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Ala Val Tyr Pro Gly Asn Ser Asp Ser Asn Tyr Asn
65 70 75 80
Gln Lys Phe Lys Ala Lys Ala Lys Leu Thr Ala Val Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Lys Leu Val Gly Thr Phe Asp Tyr Trp Gly Gln Gly
115 120 125
Thr Thr Leu Thr Val Ser Ser
130 135
<210> 30
<211> 127
<212> Белок
<213> Mus musculus
<400> 30
Met Glu Ser Gln Thr Gln Val Phe Val Tyr Met Leu Leu Trp Leu Ser
1 5 10 15
Gly Val Asp Gly Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser
20 25 30
Ser Ser Ile Gly Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn
35 40 45
Val Gly Ile Asn Val Val Trp Tyr Gln Gln Arg Ala Gly Gln Ser Pro
50 55 60
Lys Thr Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp
65 70 75 80
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Asn Val Gln Ser Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn
100 105 110
Thr Asn Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 31
<211> 405
<212> ДНК
<213> Mus musculus
<400> 31
atggaatgta actggatact tccttttatt ctgtcggtaa cctcaggggt ctactcagag 60
gttcagctcc agcagtctgg gactgtgctg acaaggcctg gggcttcagt gaagatgtcc 120
tgcaaggctt ctggctacat ttttaccagc tactggattc actgggtaaa acagcggcct 180
ggacagggtc tggaatggat tggcgctgtt tatcctggaa atagtgattc taactacaac 240
cagaagttca aggccaaggc caaactgact gcagtcacat ccaccagcac tgcctacatg 300
gagctcagca gcctgacaag tgaggactct gcggtctatt actgtacaaa gctagttggg 360
acgtttgact actggggcca aggcaccact ctcacagtct cctcg 405
<210> 32
<211> 381
<212> ДНК
<213> Mus musculus
<400> 32
atggagtcac agactcaggt ctttgtatac atgttgctgt ggttgtctgg tgttgatgga 60
gacattgtga tgacccagtc tcaaaaattc atgtcctcat caataggaga cagggtcagc 120
gtcacctgca aggccagtca gaatgtgggc attaatgtag tttggtatca acagagagca 180
gggcagtctc ctaaaacact gatttactcg gcatcctacc ggtacagtgg agtccctgat 240
cgcttcacag gcagtggatc tgggacagat ttcactctca ccatcagcaa tgtgcagtct 300
gaagacttgg cagagtattt ctgtcagcaa tataacacca atccattcac gttcggctcg 360
gggacaaagt tggaaataaa a 381
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К НЕКТИНУ-4 ЧЕЛОВЕКА | 2019 |
|
RU2825839C2 |
| АНТИТЕЛА, СПЕЦИФИЧЕСКИЕ К РЕЦЕПТОРУ ПОЛИОВИРУСА (PVR) ЧЕЛОВЕКА | 2017 |
|
RU2756275C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА ПРОТИВ МЕЗОТЕЛИНА ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2714902C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2826270C2 |
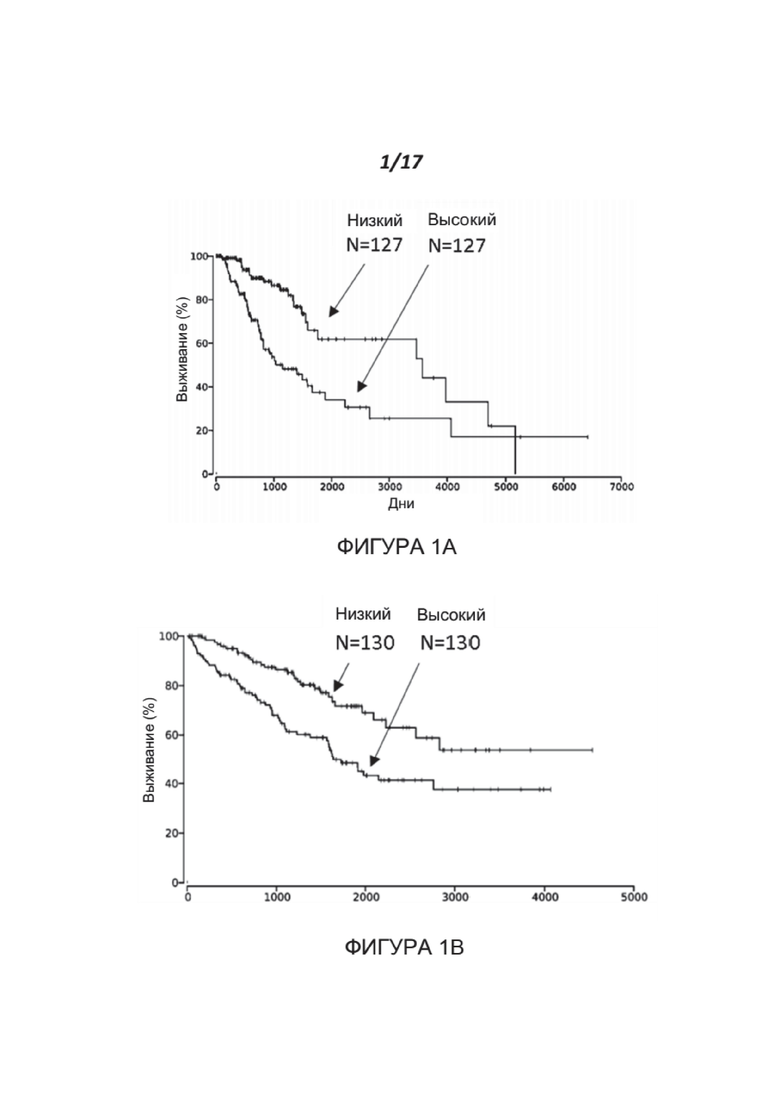
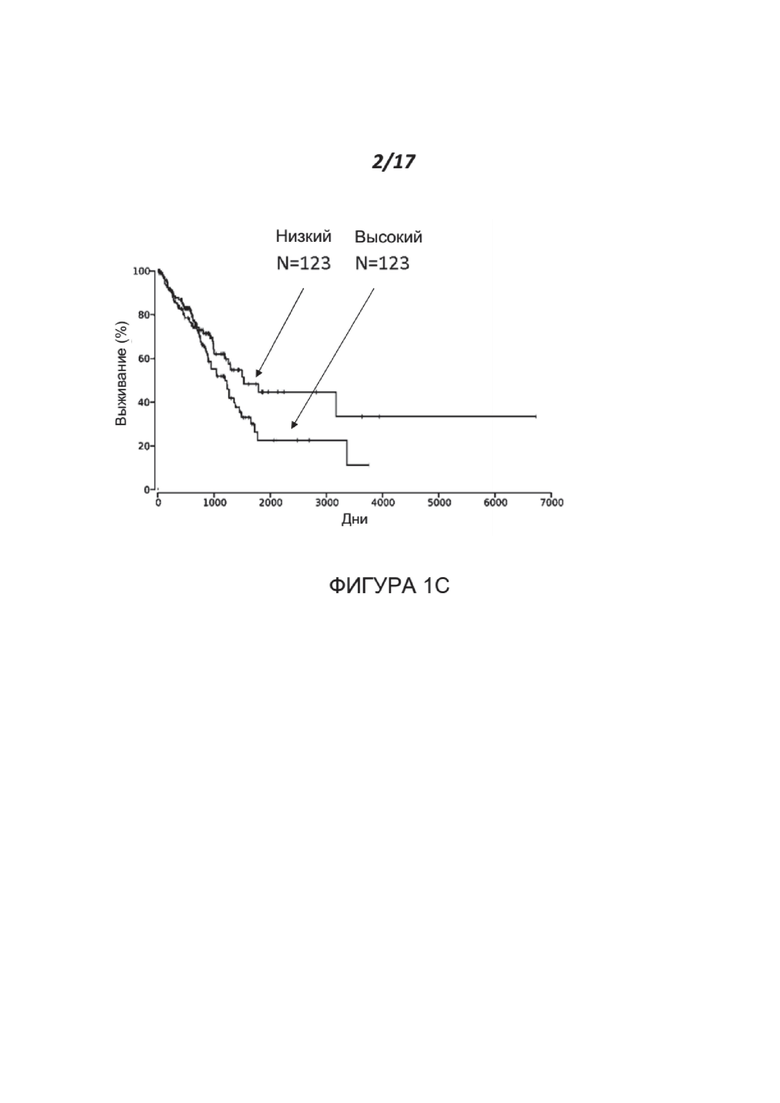
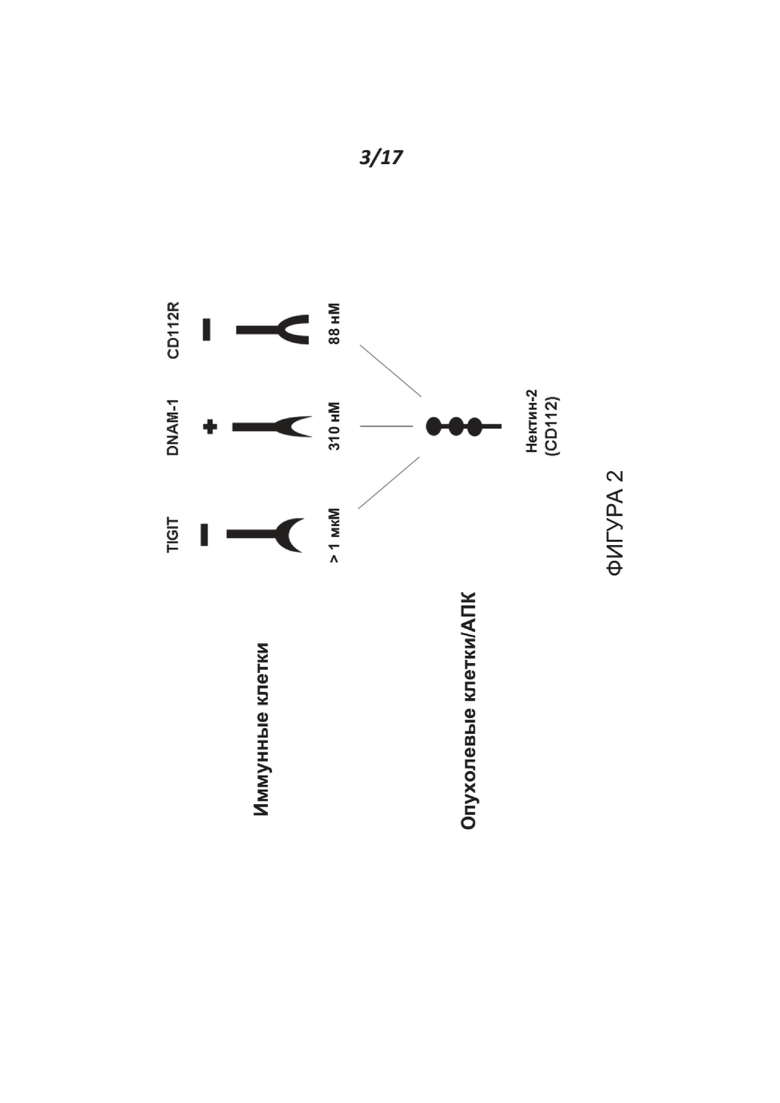
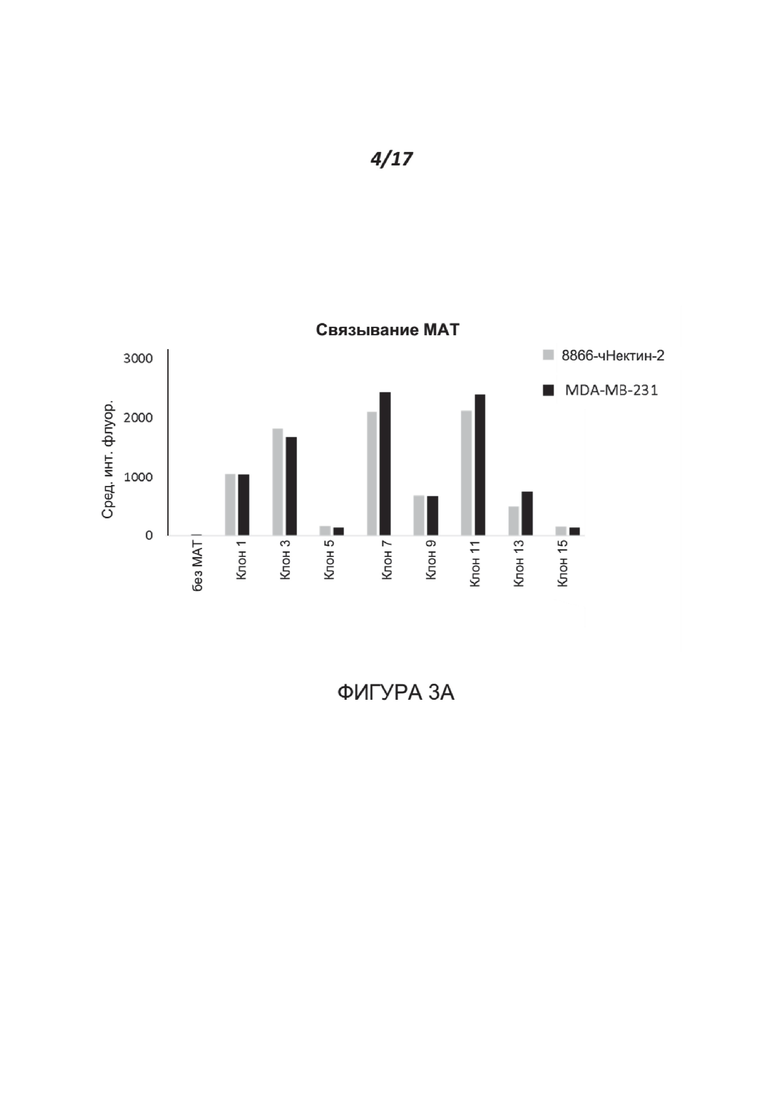
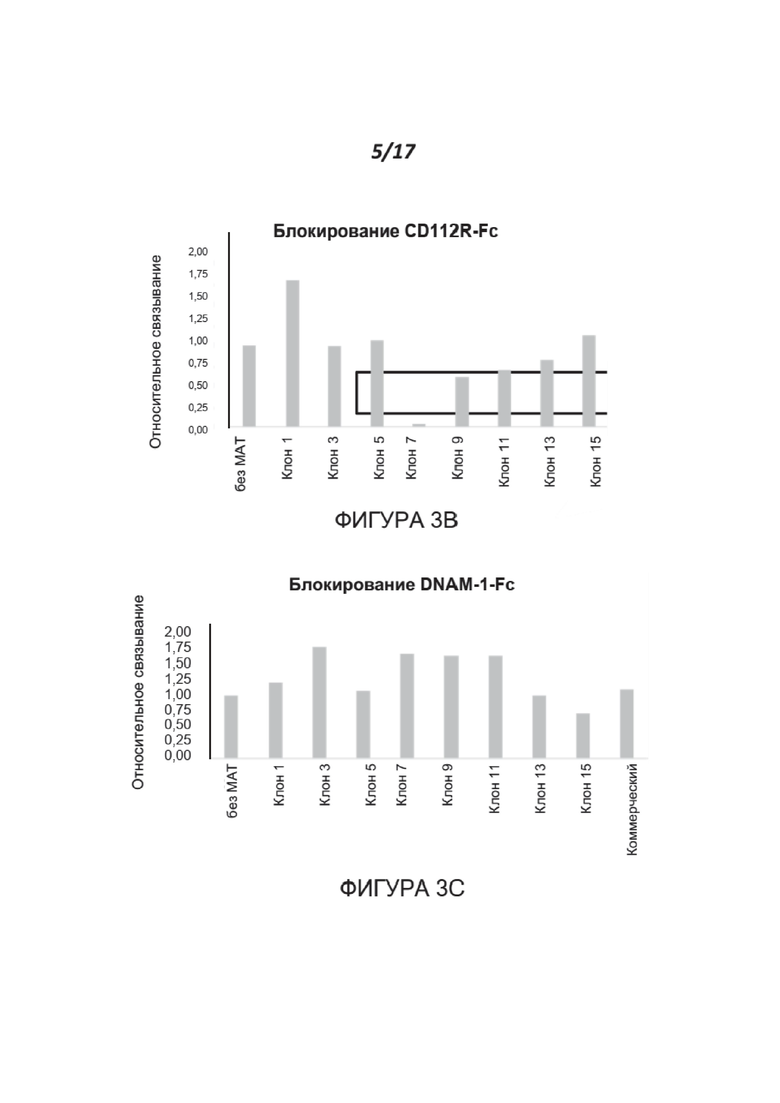
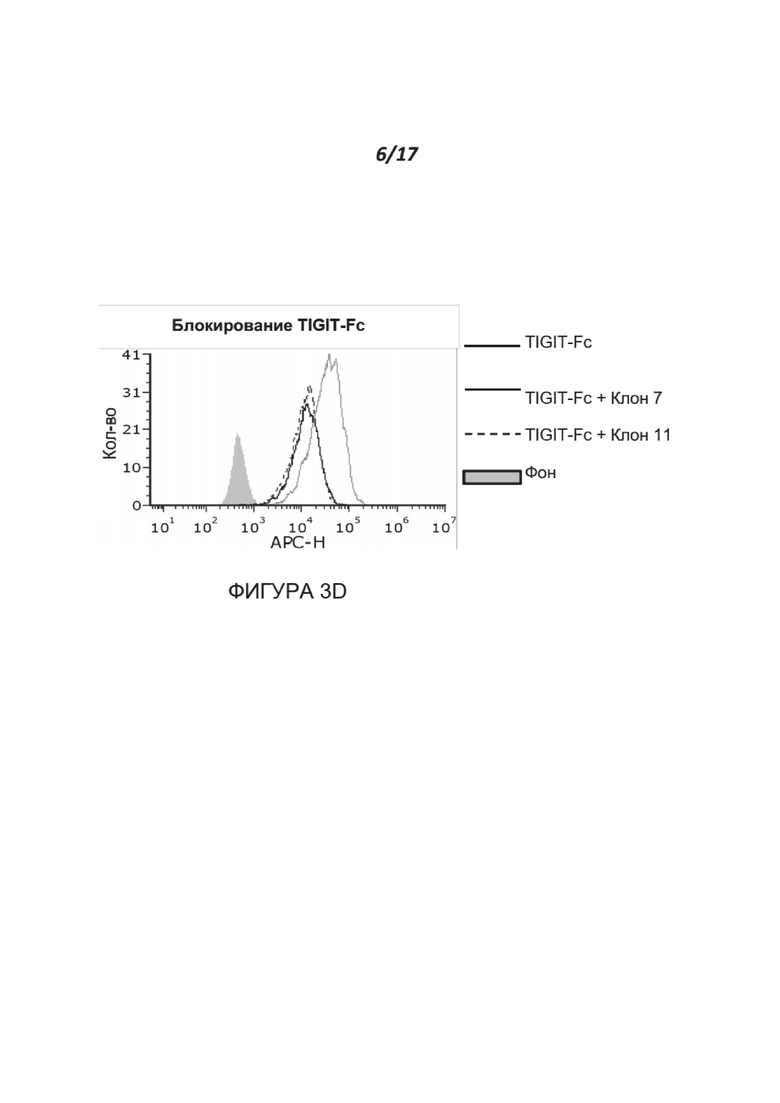
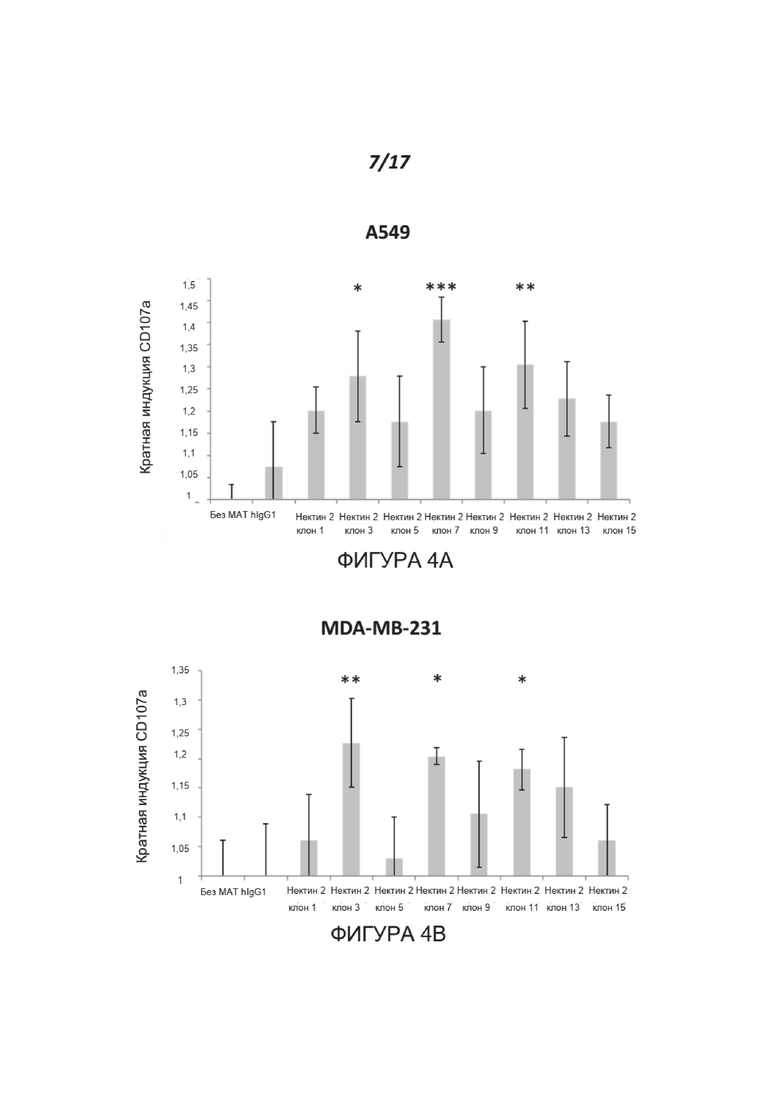
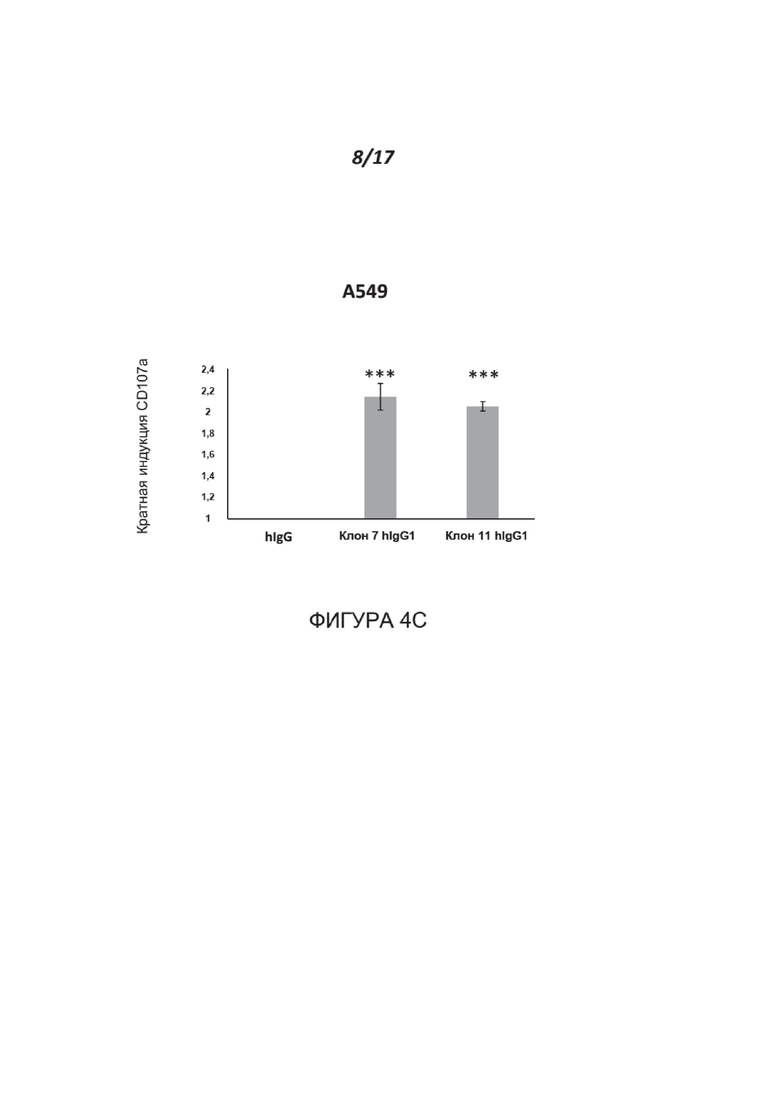
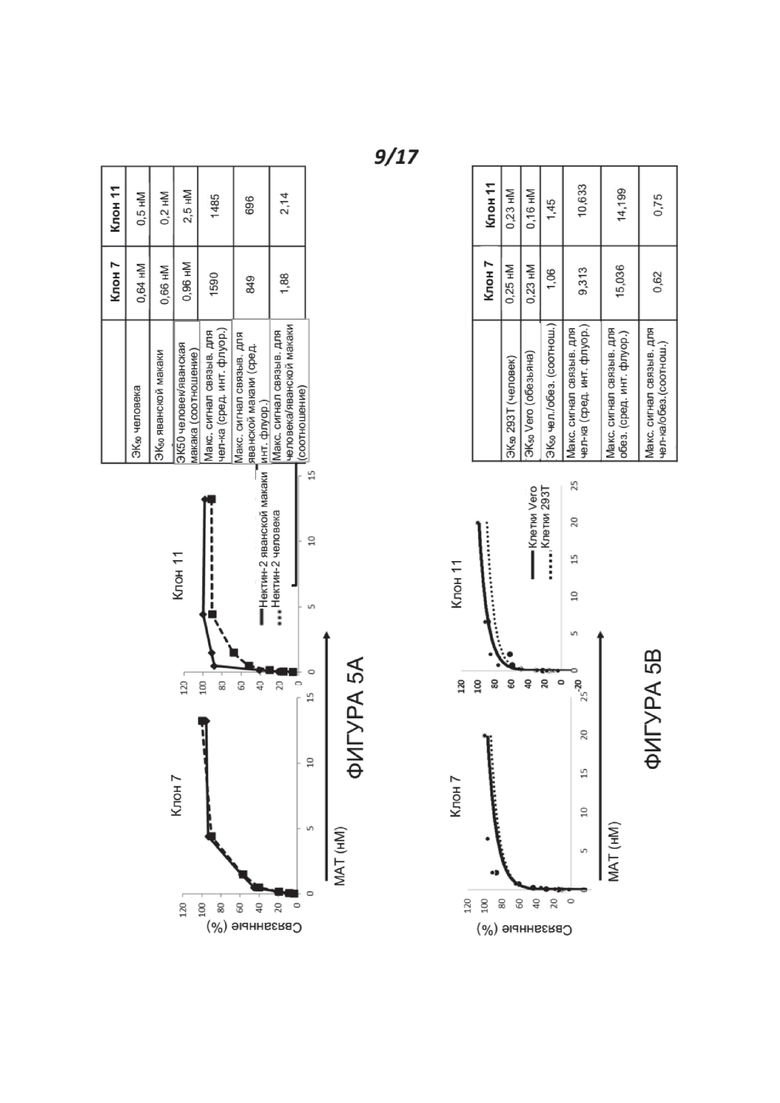
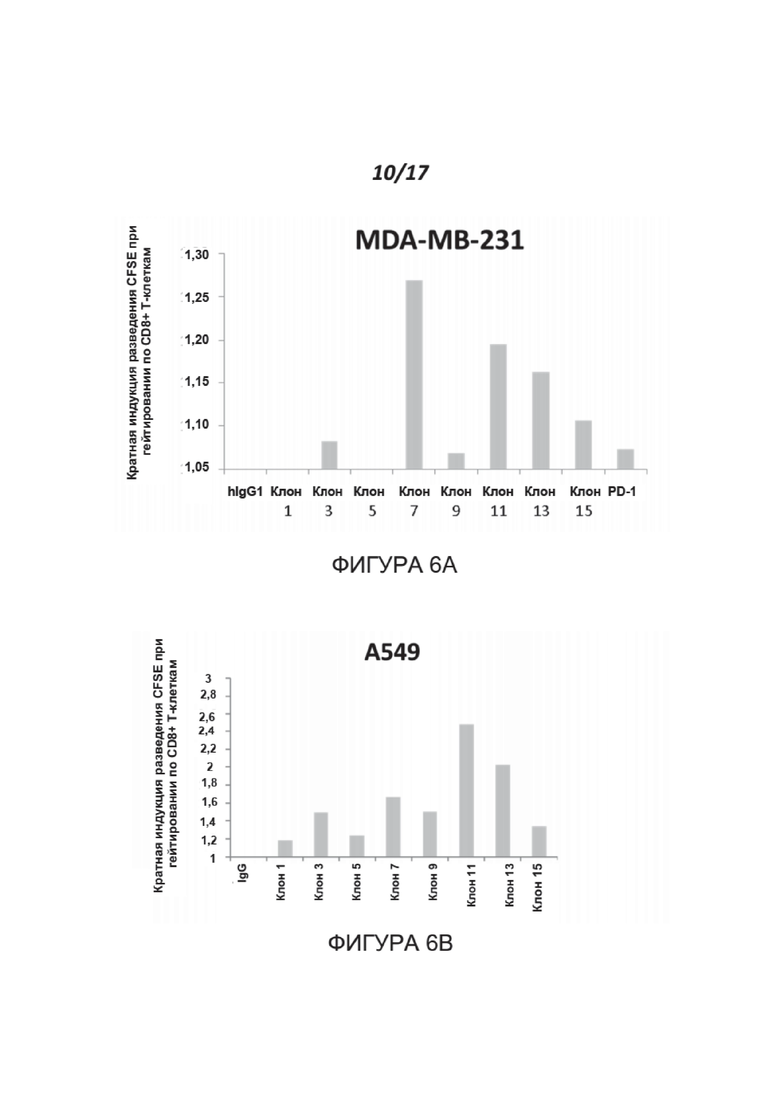
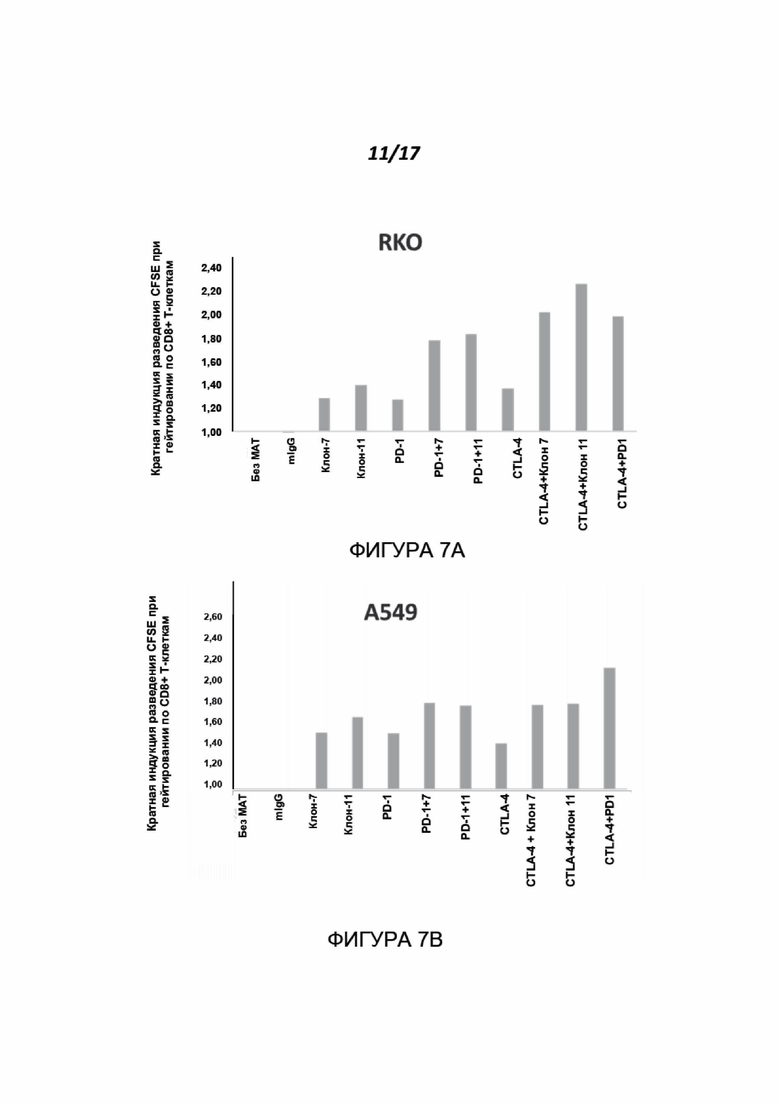
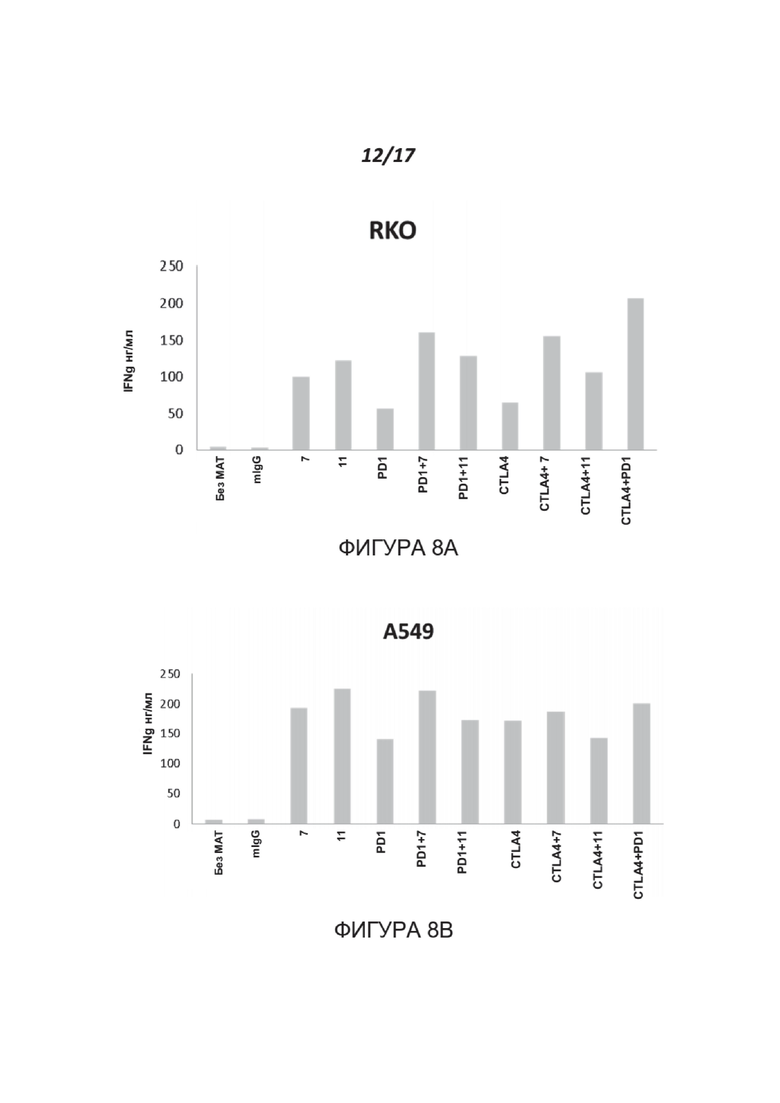
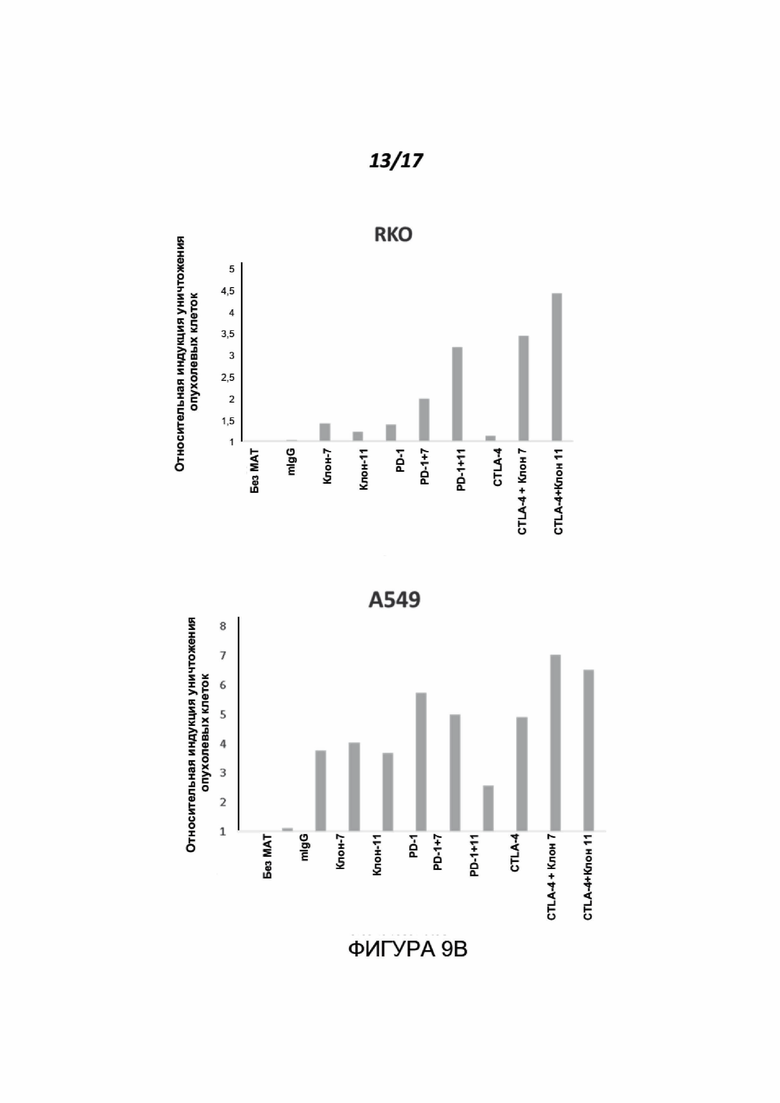
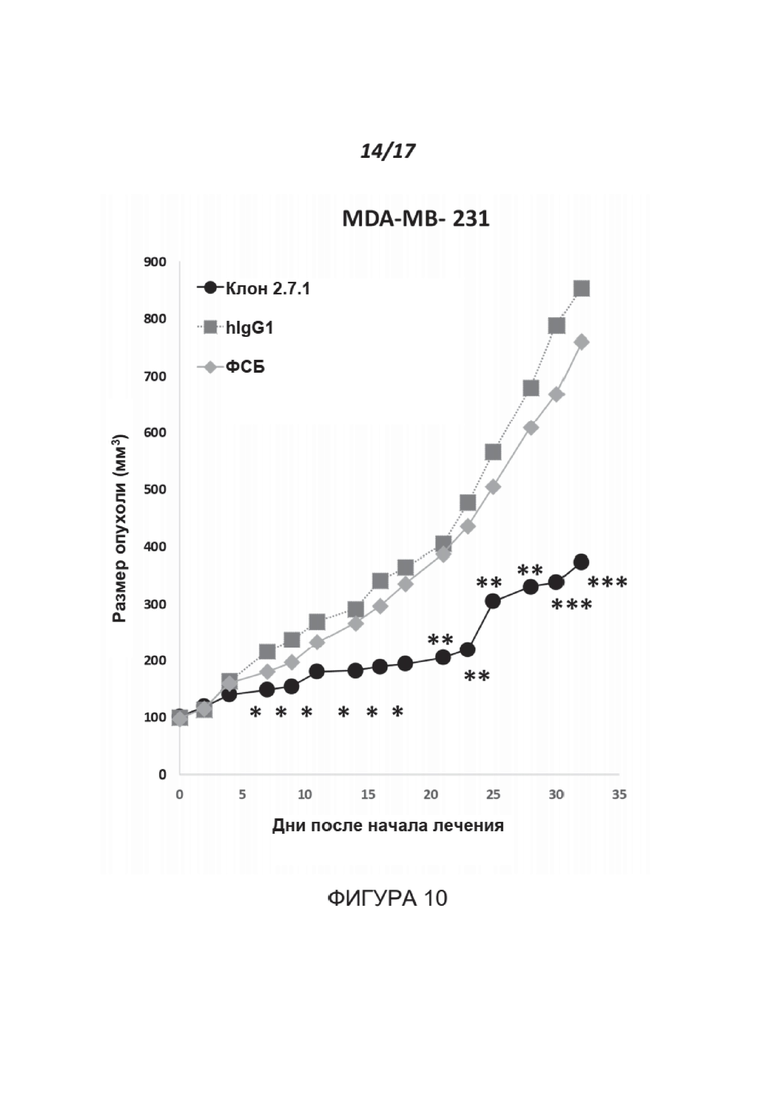
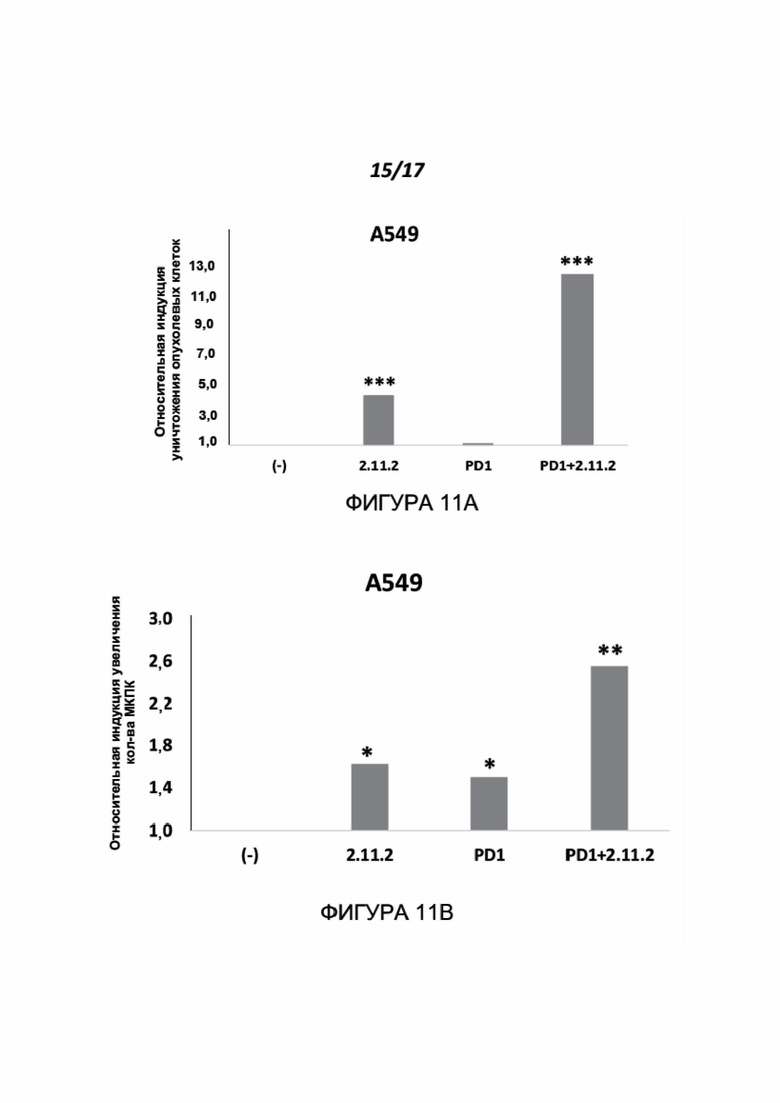
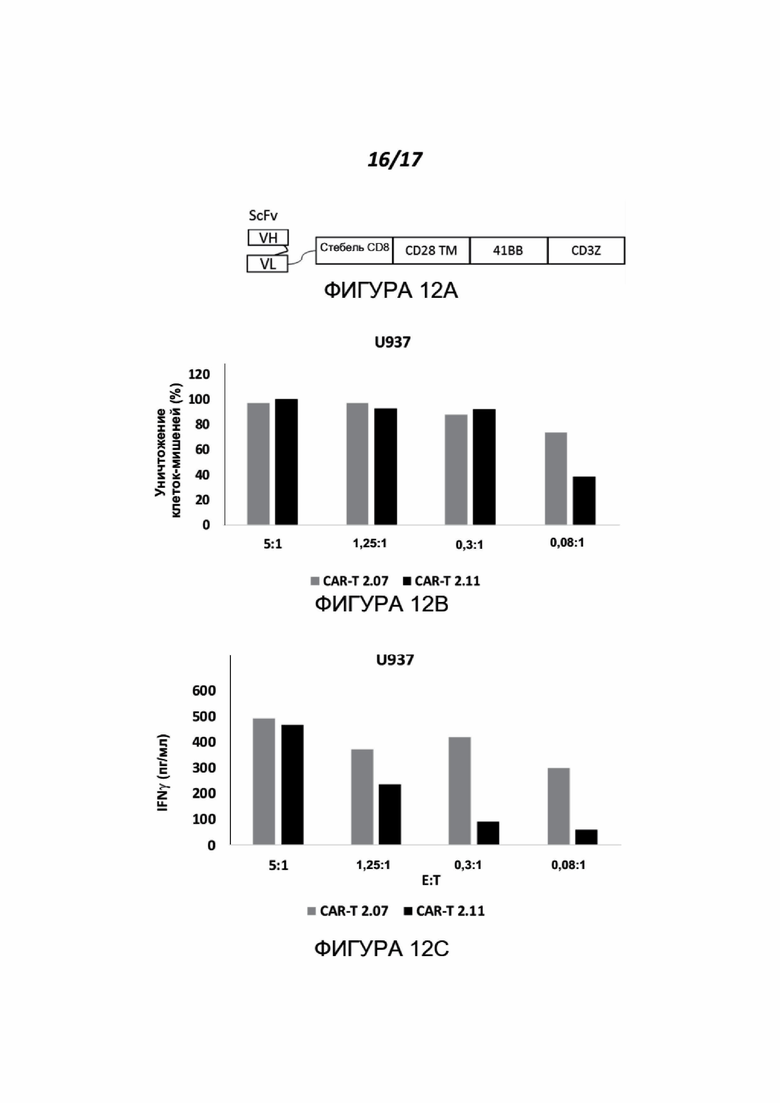
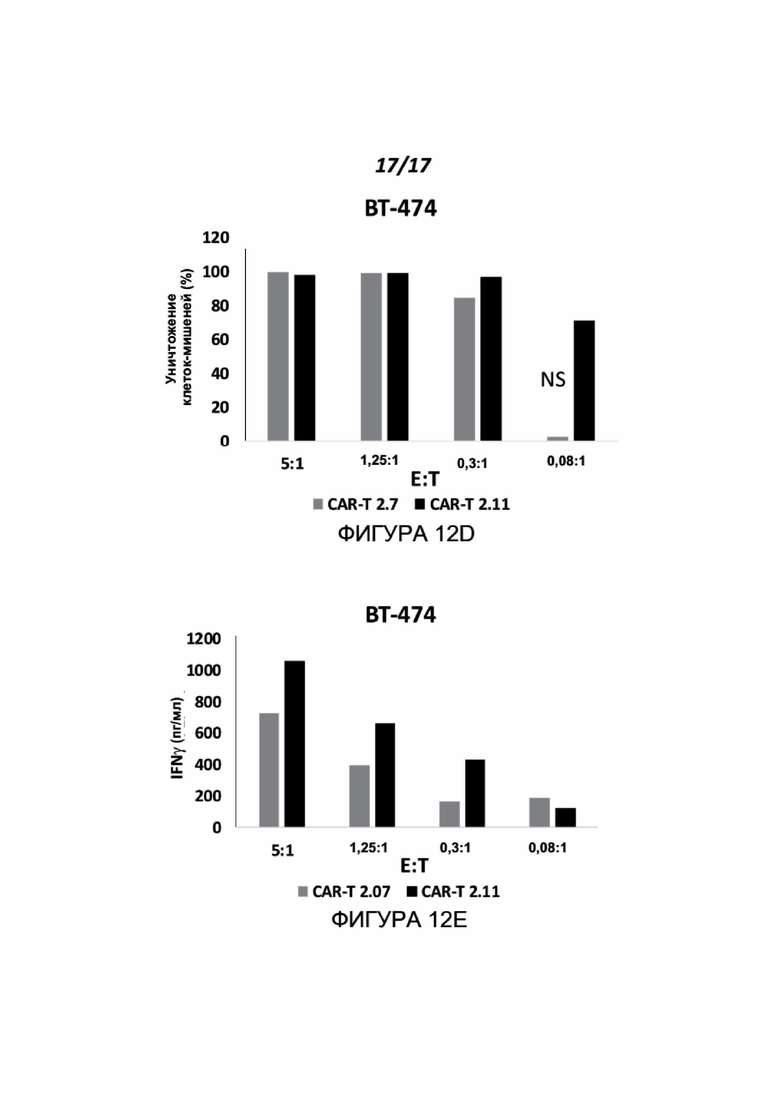
Изобретение относится к области биотехнологии, в частности антителу, которое специфически связывается с нектином-2, или к фрагменту указанного антитела, а также к композиции, конъюгату и химерному антигенному рецептору (CAR), его содержащим. Также раскрыты нуклеиновая кислота, кодирующая последовательность области тяжелой цепи и легкой цепи указанного антитела или фрагмента антитела, а также клетка и популяция клеток, ее содержащие. Изобретение эффективно для лечения опухолей, в которых сверхэкспрессируется нектин-2, а также для диагностики рака у субъекта, на уровни экспрессии нектина-2. 10 н. и 12 з.п. ф-лы, 12 ил., 1 табл., 14 пр.
1. Антитело, которое специфически связывается с нектином-2, или фрагмент указанного антитела, содержащий по меньшей мере антигенсвязывающую часть, причем указанное антитело или фрагмент антитела содержит:
(i) три определяющие комплементарность участка (CDR) вариабельной области тяжелой цепи (HC), содержащей SEQ ID NO: 7, и три CDR вариабельной области легкой цепи (LC), содержащей SEQ ID NO: 8; или
(ii) три CDR вариабельной области тяжелой цепи, содержащей SEQ ID NO: 17, и три CDR вариабельной области легкой цепи, содержащей SEQ ID NO: 18.
2. Антитело или фрагмент антитела по п. 1, содержащие набор CDR, выбранный из группы, состоящей из:
i. набора из шести CDR, причем: CDR1 HC представляет собой RFTMS (SEQ ID NO: 1); CDR2 HC представляет собой TISSGGSYTYYPDSVKG (SEQ ID NO: 2); CDR3 HC представляет собой DRDFYGPYYAMDY (SEQ ID NO: 3); CDR1 LC представляет собой KSSQSLLNSGNQKNYLA (SEQ ID NO: 4); CDR2 LC представляет собой FASTRES (SEQ ID NO: 5); и CDR3 LC представляет собой QQHYTTPLT (SEQ ID NO: 6); и
ii. набора из шести CDR, причем: последовательность CDR1 HC представляет собой SYWIH (SEQ ID NO: 11); CDR2 HC представляет собой AVYPGNSDSNYNQKFKA (SEQ ID NO: 12); CDR3 HC представляет собой LVGTFDY (SEQ ID NO: 13); CDR1 LC представляет собой KASQNVGINVV (SEQ ID NO: 14); CDR2 LC представляет собой SASYRYS (SEQ ID NO: 15); и CDR3 LC представляет собой QQYNTNPFT (SEQ ID NO: 16).
3. Антитело или фрагмент антитела по любому из пп. 1 или 2, содержащие последовательность вариабельной области тяжелой цепи, выбранную из SEQ ID NO: 7 и SEQ ID NO: 17, или аналог, имеющий по меньшей мере 95% сходства последовательности с указанной последовательностью вариабельной области тяжелой цепи; и
последовательность вариабельной области легкой цепи, выбранную из SEQ ID NO: 8 и SEQ ID NO: 18, или аналог, имеющий по меньшей мере 95% сходства последовательности с указанной последовательностью вариабельной области легкой цепи.
4. Антитело или фрагмент антитела по любому из пп. 1-3, содержащие тяжелую цепь и легкую цепь, причем указанная тяжелая цепь содержит SEQ ID NO: 7, и указанная легкая цепь содержит SEQ ID NO: 8; или
указанная тяжелая цепь содержит SEQ ID NO: 17, и указанная легкая цепь содержит SEQ ID NO: 18.
5. Антитело или фрагмент антитела по любому из пп. 1-4, отличающийся тем, что указанный фрагмент антитела представляет собой одноцепочечный Fv (scFv).
6. Антитело или фрагмент антитела по п. 5, где фрагмент антитела содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 24 и SEQ ID NO: 22 или варианта указанной последовательности, имеющего по меньшей мере 95% сходства последовательности с указанной последовательностью.
7. Нуклеиновая кислота, кодирующая последовательность области тяжелой цепи и легкой цепи антитела или фрагмента антитела по любому из пп. 1-6.
8. Нуклеиновая кислота по п. 7, содержащая полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи антитела, отличающаяся тем, что указанная полинуклеотидная последовательность выбрана из группы, состоящей из SEQ ID NO: 9 и SEQ ID NO: 19 или их варианта, имеющего по меньшей мере 85% идентичности с указанными последовательностями.
9. Нуклеиновая кислота по п. 7, содержащая полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи антитела, отличающаяся тем, что указанная полинуклеотидная последовательность выбрана из группы, состоящей из: SEQ ID NO: 10 и SEQ ID NO: 20 или их варианта, имеющего по меньшей мере 85% идентичности с указанными последовательностями.
10. Клетка, способная продуцировать антитело или фрагмент антитела по любому из пп. 1-6, содержащая нуклеиновую кислоту по любому из пп. 7-9.
11. Конъюгат, который специфически связывается с нектином-2, содержащий антитело или фрагмент антитела по любому из пп. 1-6, причем конъюгат содержит цитотоксический фрагмент, радиоактивный фрагмент или идентифицируемый фрагмент.
12. Фармацевтическая композиция для лечения опухолей, в которых сверхэкспрессируется нектин-2, содержащая в качестве активного ингредиента по меньшей мере одно антитело или его фрагмент по любому из пп. 1-6 и 11 и фармацевтически приемлемое вспомогательное вещество, разбавитель, соль или носитель.
13. Фармацевтическая композиция по п. 12 для применения в лечении рака у субъекта или модуляции иммунной системы путем ингибирования связывания нектина-2 с TIGIT или CD112R, или в предотвращении или лечении вирусной инфекции у субъекта.
14. Применение фармацевтической композиция по п. 13 в лечении рака, в котором сверхэкспрессируется нектин-2, у субъекта.
15. Применение по п. 14, дополнительно включающее дополнительную противораковую терапию, выбранную из хирургического вмешательства, химиотерапии, лучевой терапии и иммунотерапии.
16. Применение по п. 14, причем указанное применение включает введение дополнительного иммуномодулятора, активированной лимфоцитарной клетки, ингибитора киназы, химиотерапевтического агента или любого другого противоракового агента.
17. Способ диагностики рака у субъекта, на уровни экспрессии нектина-2 в нем, где указанный способ включает приведение биологического образца, взятого от указанного субъекта, в контакт с антителом или фрагментом антитела по любому из пп. 1-6 и 11, детектирование связанного антитела или фрагмента антитела, и определение уровня экспрессии нектина-2 в указанном образце.
18. Химерный антигенный рецептор (CAR) для применения в лечении рака, в котором сверхэкспрессируется нектин-2, причем указанный CAR содержит внеклеточную часть, способную связываться с нектином-2, трансмембранный домен и внутриклеточный домен клеточной передачи сигналов лимфоцита, причем указанная внеклеточная часть содержит по меньшей мере одно антитело или фрагмент антитела по любому из пп. 1-6.
19. CAR по п. 18, отличающийся тем, что фрагмент антитела содержит антигенсвязывающий домен, содержащий SEQ ID NO: 22 или 24 или его аналог, имеющий по меньшей мере 85% сходства с любой из указанных последовательностей.
20. CAR по п. 18 или 19, содержащий домен стебля CD8, TM-домен CD28, домен 41BB и домен CD3 ζ.
21. Популяция Т-клеток или NK-клеток для применения в лечении рака, в котором сверхэкспрессируется нектин-2, причем клетки содержат нуклеиновую кислоту, кодирующую CAR, где CAR содержит внеклеточную часть, содержащую по меньшей мере одно антитело или фрагмент антитела по любому из пп. 1-6, трансмембранный домен и внутриклеточный домен клеточной передачи сигналов лимфоцита.
22. Клетка, способная продуцировать антитело или фрагмент антитела по любому из пп. 1-6, содержащая (i) последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи антитела или фрагмента антитела по любому из пп. 1-6, и (ii) последовательность нуклеиновой кислоты, кодирующую вариабельную область легкой цепи антитела или фрагмента антитела по любому из пп. 1-6.
| WO2017021526 A1, 09.02.2017 | |||
| WO2017041004 A1, 09.03.2017 | |||
| TSUTOMU OSHIMA et al., Nectin-2 is a potential target for antibody therapy of breast and ovarian cancers, Molecular Cancer, 2013, 12:60 | |||
| TSUTOMU OSHIMA et al., Fc engineering of anti-Nectin-2 antibody improved thrombocytopenic adverse event in monkey, PLoS One, 2018; 13(5): e0196422 | |||
| Р.А |
Авторы
Даты
2024-06-03—Публикация
2020-01-13—Подача