По настоящей заявке испрашивается приоритет по заявке PCT № PCT/CN2014/090501, зарегистрированной 6 ноября 2014 года, и заявке PCT № PCT/CN2014/082586, зарегистрированной 21 июля 2014 года. Полное содержание этих заявок включено в настоящее описание в качестве ссылок.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит список последовательностей, поданный в электронном виде в формате ASCII и включенный, таким образом, в качестве ссылки в полном объеме. Указанная копия ASCII, созданная 15 июля 2015 года, названа N2067-7045WO3_SL.txt и имеет размер 771026 байтов.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в основном, относится к применению иммунных эффекторных клеток (например, T-клеток, NK-клеток), сконструированных для экспрессии химерного антигенного рецептора (CAR), для лечения заболевания, ассоциированного с экспрессией B-клеточного антигена созревания (BCMA).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
B-клеточный антиген созревания (BCMA) является членом семейства рецепторов фактора некроза опухолей (TNFR), экспрессируемым клетками B-клеточной линии. Экспрессия BCMA является наиболее высокой на окончательно дифференцированных B-клетках. BCMA участвует в опосредовании выживания плазматических клеток для поддержания длительного гуморального иммунитета. В последнее время экспрессию BCMA связывают с рядом злокачественных новообразований, аутоиммунных нарушений и инфекционных заболеваний. Злокачественные новообразования с повышенной экспрессией BCMA включают некоторые гемобластозы, такие как множественная миелома, лимфома Ходжкина и неходжкинская лимфома, различные лейкозы и глиобластома.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR), где CAR содержит антитело или фрагмент антитела, включающий связывающий домен человека против BCMA или гуманизированный связывающий домен против BCMA, трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимуляторный домен и/или первичный сигнальный домен). В одном из вариантов осуществления CAR содержит антитело или фрагмент антитела, включающий связывающий домен человека против BCMA, представленный в настоящем описании, или гуманизированный связывающий домен против BCMA, представленный в настоящем описании, трансмембранный домен, представленный в настоящем описании, и внутриклеточный сигнальный домен, представленный в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимуляторный домен и/или первичный сигнальный домен).
В одном из вариантов осуществления кодируемый BCMA-связывающий домен (например, человеческий или гуманизированный связывающий домен против BCMA) содержит одну или более (например, все три) из определяющей комплементарность области легкой цепи 1 (CDR1 LC), определяющей комплементарность области легкой цепи 2 (CDR2 LC) и определяющей комплементарность области легкой цепи 3 (CDR3 LC) человеческого или гуманизированного связывающего домена против BCMA, представленного в настоящем описании, и/или одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) связывающего домена против BCMA, представленного в настоящем описании, например, человеческого или гуманизированного связывающего домена против BCMA, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC. В одном из вариантов осуществления кодируемый связывающий домен человека против BCMA содержит вариабельную область легкой цепи, представленную в настоящем описании (например, в таблице 1), и/или вариабельную область тяжелой цепи, представленную в настоящем описании (например, в таблице 1). В одном из вариантов осуществления кодируемый гуманизированный связывающий домен против BCMA содержит вариабельную область легкой цепи, приведенную в SEQ ID NO: 271 или 273, и/или вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 271 или 273. В одном из вариантов осуществления кодируемый связывающий домен человека против BCMA является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью из таблицы 1. В одном из вариантов осуществления кодируемый гуманизированный связывающий домен против BCMA является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью SEQ ID NO: 271 или 273. В варианте осуществления человеческий или гуманизированный связывающий домен против BCMA (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 1 или SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности из таблицы 1 или SEQ ID NO: 271 или 273, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 1 или SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности из таблицы 1. В одном из вариантов осуществления кодируемый связывающий домен человека против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, и SEQ ID NO: 149, или последовательность с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления кодируемый гуманизированный связывающий домен против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 271 или SEQ ID NO: 273, или последовательность с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления кодируемый человеческий или гуманизированный связывающий домен против BCMA включает линкер (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В других вариантах осуществления кодируемый BCMA-связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC из любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16. В вариантах осуществления BCMA-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления BCMA-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC из любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленных в таблице 1 или 16.
В некоторых вариантах осуществления кодируемый BCMA-связывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC из любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленных в таблице 1 или 16, и одну, две или все из CDR1 HC, CDR2 HC и CDR3 HC из любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16.
В одном из вариантов осуществления кодируемый связывающий домен против BCMA содержит вариабельную область легкой цепи, представленную в настоящем описании (например, в таблице 16), и/или вариабельную область тяжелой цепи, представленную в настоящем описании (например, в таблице 16). В одном из вариантов осуществления кодируемый гуманизированный связывающий домен против BCMA содержит вариабельную область легкой цепи, приведенную в SEQ ID NO: 259, SEQ ID NO: 260, SEQ ID NO: 261, SEQ ID NO: 262, и/или вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 255, SEQ ID NO: 256, SEQ ID NO: 257, SEQ ID NO: 258. В одном из вариантов осуществления кодируемый связывающий домен против BCMA является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью из таблицы 16. В варианте осуществления человеческий или гуманизированный связывающий домен против BCMA (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в SEQ ID NO: 259, SEQ ID NO: 260, SEQ ID NO: 261, SEQ ID NO: 262, или последовательности с 95-99% идентичности по отношению к ним, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в SEQ ID NO: 255, SEQ ID NO: 256, SEQ ID NO: 257, SEQ ID NO: 258, или последовательности с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления кодируемый связывающий домен против BCMA включает (Gly4-Ser)n линкер, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном из вариантов осуществления кодируемый связывающий домен человека против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 и SEQ ID NO: 266, или последовательность с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления кодируемый CAR включает трансмембранный домен, содержащий трансмембранный домен белка, например, представленный в настоящем описании, например, выбранный из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном из вариантов осуществления кодируемый трансмембранный домен содержит последовательность SEQ ID NO: 6. В одном из вариантов осуществления кодируемый трансмембранный домен содержит аминокислотную последовательность, содержащую, по меньшей мере, одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 6, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 6. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая трансмембранный домен, содержит последовательность SEQ ID NO: 17 или последовательность с 95-99% идентичности по отношению к ней.
В одном из вариантов осуществления кодируемый связывающий домен против BCMA соединяют с трансмембранным доменом посредством шарнирной области, например, шарнирной области, представленной в настоящем описании. В одном из вариантов осуществления кодируемая шарнирная область содержит SEQ ID NO: 2 или последовательность с 95-99% идентичности по отношению к ней. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая шарнирную область, содержит последовательность SEQ ID NO: 13 или последовательность с 95-99% идентичности по отношению к ней.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимуляторный домен, например, костимуляторный домен, представленный в настоящем описании. В вариантах осуществления внутриклеточный сигнальный домен содержит костимуляторный домен. В вариантах осуществления внутриклеточный сигнальный домен содержит первичный сигнальный домен. В вариантах осуществления внутриклеточный сигнальный домен содержит один или более (например, один или более, два или более, или три или более) из костимуляторного домена и первичного сигнального домена.
В одном из вариантов осуществления кодируемый костимуляторный домен является функциональным сигнальным доменом, полученным из белка, например, представленного в настоящем описании, например, выбранного из группы, состоящей из молекулы MHC класса I, белков рецепторов ФНО, иммуноглобулин-подобных белков, рецепторов цитокинов, интегринов, сигнальных молекул активации лимфоцитов (белков SLAM), активирующих рецепторов NK-клеток, BTLA, рецептора Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающегося с CD83. В вариантах осуществления кодируемый костимуляторный домен содержит 4-1BB, CD27, CD28 или ICOS.
В одном из вариантов осуществления кодируемый костимуляторный домен 4-1BB содержит аминокислотную последовательность SEQ ID NO: 7. В одном из вариантов осуществления кодируемый костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 7, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 7. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимуляторный домен, содержит нуклеотидную последовательность SEQ ID NO: 18 или последовательность с 95-99% идентичности по отношению к ней. В другом варианте осуществления кодируемый костимуляторный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 1104. В одном из вариантов осуществления кодируемый костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1104, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1104. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимуляторный домен CD28, содержит нуклеотидную последовательность SEQ ID NO: 1105 или последовательность с 95-99% идентичности по отношению к ней. В другом варианте осуществления кодируемый костимуляторный домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8. В одном из вариантов осуществления кодируемый костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 8. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимуляторный домен CD27, содержит нуклеотидную последовательность SEQ ID NO: 19 или последовательность с 95-99% идентичности по отношению к ней. В другом варианте осуществления кодируемый костимуляторный домен ICOS содержит аминокислотную последовательность SEQ ID NO: 1106. В одном из вариантов осуществления кодируемый костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1106, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1106. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимуляторный домен ICOS, содержит нуклеотидную последовательность SEQ ID NO: 1107 или последовательность с 95-99% идентичности по отношению к ней.
В вариантах осуществления кодируемый первичный сигнальный домен содержит функциональный сигнальный домен CD3 дзета. В вариантах осуществления функциональный сигнальный домен CD3 дзета содержит аминокислотную последовательность SEQ ID NO: 9 (мутантный CD3 дзета) или SEQ ID NO: 10 (CD3 дзета человека дикого типа) или последовательность с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен 4-1BB содержит аминокислотную последовательность SEQ ID NO: 7 и/или аминокислотную последовательность CD3 дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 7 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 7 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен 4-1BB, содержит нуклеотидную последовательность SEQ ID NO: 18, или последовательность с 95-99% идентичности по отношению к ней, и/или нуклеотидную последовательность CD3 дзета SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD27 и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8 и/или аминокислотную последовательность CD3 дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 8 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 8 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен CD27, содержит нуклеотидную последовательность SEQ ID NO: 19, или последовательность с 95-99% идентичности по отношению к ней, и/или нуклеотидную последовательность CD3 дзета SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD28 и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 1104 и/или аминокислотную последовательность CD3 дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1104 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1104 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 1104 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен CD28, содержит нуклеотидную последовательность SEQ ID NO: 1105, или последовательность с 95-99% идентичности по отношению к ним, и/или нуклеотидную последовательность CD3 дзета SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен ICOS и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен ICOS содержит аминокислотную последовательность SEQ ID NO: 1106 и/или аминокислотную последовательность CD3 дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1106 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1106 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 1106 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен ICOS, содержит нуклеотидную последовательность SEQ ID NO: 1107, или последовательность с 95-99% идентичности по отношению к ним, и/или нуклеотидную последовательность CD3 дзета SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность с 95-99% идентичности по отношению к ним.
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность, например, лидерную последовательность, представленную в настоящем описании, например, аминокислотную последовательность SEQ ID NO: 1, связывающий домен против BCMA, представленный в настоящем описании, например, связывающий домен человека против BCMA, содержащий CDR1 LC, CDR2 LC, CDR3 LC, CDR1 HC, CDR2 HC и CDR3 HC, представленный в настоящем описании (например, связывающий домен человека против BCMA, описываемый в таблице 1 или 16), или последовательность с 95-99% идентичности по отношению к нему, шарнирную область, представленную в настоящем описании, например, аминокислотную последовательность SEQ ID NO: 2, трансмембранный домен, представленный в настоящем описании, например, имеющий последовательность SEQ ID NO: 6, и внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, представленный в настоящем описании. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит костимуляторный домен, например, костимуляторный домен, представленный в настоящем описании (например, костимуляторный домен 4-1BB, имеющий аминокислотную последовательность SEQ ID NO: 7, или костимуляторный домен CD27, имеющий аминокислотную последовательность SEQ ID NO: 8), и/или первичный сигнальный домен, например, первичный сигнальный домен, представленный в настоящем описании, (например, стимуляторный домен CD3 дзета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10). В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты, кодирующая конструкцию CAR, включает лидерную последовательность, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 1, или последовательностью с 95-99% идентичности по отношению к ней.
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность, например, лидерную последовательность, представленную в настоящем описании, например, аминокислотную последовательность SEQ ID NO: 1, связывающий домен против BCMA, представленный в настоящем описании (например, гуманизированный связывающий домен против BCMA, содержащий CDR1 LC, CDR2 LC, CDR3 LC, CDR1 HC, CDR2 HC и/или CDR3 HC, представленный в настоящем описании, например, гуманизированный связывающий домен против BCMA, представленный в настоящем описании (например, гуманизированный связывающий домен против BCMA, содержащий последовательность, выбранную из группы, состоящей из SEQ ID NO: 271 или SEQ ID NO: 273), или последовательность с 95-99% идентичности по отношению к нему), шарнирную область, представленную в настоящем описании, например, аминокислотную последовательность SEQ ID NO: 2, трансмембранный домен, представленный в настоящем описании, например, имеющий последовательность SEQ ID NO: 6, и внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, представленный в настоящем описании. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит костимуляторный домен, например, костимуляторный домен, представленный в настоящем описании (например, костимуляторный домен 4-1BB, имеющий последовательность SEQ ID NO: 7), и/или первичный сигнальный домен, например, первичный сигнальный домен, представленный в настоящем описании (например, стимуляторный домен CD3 дзета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10). В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты, кодирующая конструкцию CAR, включает лидерную последовательность, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 1 или последовательностью с 95-99% идентичности по отношению к ней.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты, кодирующая конструкцию CAR, включает последовательность связывающего домена человека против BCMA, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155, SEQ ID NO: 156, SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169 или SEQ ID NO: 170, или последовательностью с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты, кодирующая конструкцию CAR, включает последовательность гуманизированного связывающего домена против BCMA, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 272, SEQ ID NO: 274 или последовательностью с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты содержит (например, состоит из) нуклеиновую кислота, кодирующую аминокислотную последовательность CAR SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 или SEQ ID NO: 233, или аминокислотную последовательность, имеющую 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичности или имеющую одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 или SEQ ID NO: 233.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты содержит (например, состоит из) последовательность нуклеиновой кислоты SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 234, SEQ ID NO: 235, SEQ ID NO: 236, SEQ ID NO: 237, SEQ ID NO: 238, SEQ ID NO: 239, SEQ ID NO: 240, SEQ ID NO: 241, SEQ ID NO: 242, SEQ ID NO: 243, SEQ ID NO: 244, SEQ ID NO: 245, SEQ ID NO: 246, SEQ ID NO: 247, SEQ ID NO: 248, SEQ ID NO: 249, SEQ ID NO: 250, SEQ ID NO: 251, SEQ ID NO: 252, SEQ ID NO: 253 или SEQ ID NO: 254, или последовательность нуклеиновой кислоты, имеющую 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичности или имеющую одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности в последовательности нуклеиновой кислоты SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 234, SEQ ID NO: 235, SEQ ID NO: 236, SEQ ID NO: 237, SEQ ID NO: 238, SEQ ID NO: 239, SEQ ID NO: 240, SEQ ID NO: 241, SEQ ID NO: 242, SEQ ID NO: 243, SEQ ID NO: 244, SEQ ID NO: 245, SEQ ID NO: 246, SEQ ID NO: 247, SEQ ID NO: 248, SEQ ID NO: 249, SEQ ID NO: 250, SEQ ID NO: 251, SEQ ID NO: 252, SEQ ID NO: 253 или SEQ ID NO: 254.
В одном из аспектов изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей связывающий домен против BCMA, где связывающий домен против BCMA содержит одну или более (например, все три) из определяющей комплементарность области легкой цепи 1 (CDR1 LC), определяющей комплементарность области легкой цепи 2 (CDR2 LC) и/или определяющей комплементарность области легкой цепи 3 (CDR3 LC) связывающего домена против BCMA, представленного в настоящем описании, и одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и/или определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) связывающего домена против BCMA, представленного в настоящем описании, например, связывающего домена человека против BCMA, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC. В одном из вариантов осуществления кодируемый связывающий домен против BCMA содержит вариабельную область легкой цепи, представленную в настоящем описании (например, в SEQ ID NO: 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 259, 260, 261 или 262), и/или вариабельную область тяжелой цепи, представленную в настоящем описании (например, в SEQ ID NO: 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 81, 82, 83, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 255, 256, 257 или 258). В одном из вариантов осуществления кодируемый связывающий домен против BCMA является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 или SEQ ID NO: 266, или последовательности с 95-99% идентичности по отношению к ним. В варианте осуществления связывающий домен против BCMA (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в SEQ ID NO: 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 259, 260, 261 или 262, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 259, 260, 261 или 262, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в SEQ ID NO: 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 81, 82, 83, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 255, 256, 257 или 258, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 81, 82, 83, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 255, 256, 257 или 258. В одном из вариантов осуществления связывающий домен против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, и SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 или SEQ ID NO: 266, или последовательность с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления кодируемый связывающий домен против BCMA является scFv, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1 или 16, соединяют с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1 или 16, с помощью линкера, например, линкера, представленного в настоящем описании. В одном из вариантов осуществления кодируемый связывающий домен против BCMA включает линкер (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи. В одном из вариантов осуществления выделенная последовательность нуклеиновой кислоты, кодирующая связывающий домен человека против BCMA, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155, SEQ ID NO: 156, SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169 и SEQ ID NO: 170, или последовательность с 95-99% идентичности по отношению к ним.
В других вариантах осуществления кодируемый BCMA-связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16. В вариантах осуществления BCMA-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления BCMA-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленных в таблице 1 или 16.
В некоторых вариантах осуществления кодируемый BCMA-связывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленных в таблице 1 или 16, и одну, две или все из CDR1 HC, CDR2 HC, и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16.
В варианте осуществления связывающий домен против BCMA (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, содержащую (или состоящую из) вариабельную область легкой цепи SEQ ID NO: 271 или 273, и аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к ним, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, содержащую (или состоящую из) вариабельную область тяжелой цепи SEQ ID NO: 271 или 273, и аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к ней. В одном из вариантов осуществления кодируемый гуманизированный связывающий домен против BCMA является scFv, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, представленную в настоящем описании, например, приведенную в SEQ ID NO: 271 или 273, соединяют с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, представленную в настоящем описании, например, приведенную в SEQ ID NO: 271 или 273, с помощью линкера, например, линкера, представленного в настоящем описании. В одном из вариантов осуществления кодируемый связывающий домен против BCMA включает линкер (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 4 (SEQ ID NO: 26).
В другом аспекте изобретение относится к выделенной полипептидной молекуле, например, выделенной молекуле химерного антигенного рецептора (CAR), кодируемой молекулой нуклеиновой кислоты. В одном из вариантов осуществления выделенная полипептидная молекула содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 и SEQ ID NO: 233, или последовательность с 95-99% идентичности по отношению к ним.
В другом аспекте изобретение относится к выделенной молекуле химерного антигенного рецептора (CAR) (например, полипептиду), содержащей связывающий домен против BCMA (например, человеческое или гуманизированное антитело или фрагмент антитела, специфически связывающееся с BCMA), трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимуляторный домен и/или первичный сигнальный домен). В одном из вариантов осуществления CAR содержит антитело или фрагмент антитела, включающее связывающий домен против BCMA, представленный в настоящем описании (например, антитело человека или фрагмент антитела, специфически связывающееся с BCMA, как представлено в настоящем описании), трансмембранный домен, представленный в настоящем описании, и внутриклеточный сигнальный домен, представленный в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимуляторный домен и/или первичный сигнальный домен, представленный в настоящем описании).
В одном из вариантов осуществления связывающий домен против BCMA содержит одну или более (например, все три) из определяющей комплементарность области легкой цепи 1 (CDR1 LC), определяющей комплементарность области легкой цепи 2 (CDR2 LC) и определяющей комплементарность области легкой цепи 3 (CDR3 LC) связывающего домена против BCMA, представленного в настоящем описании, и одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) связывающего домена против BCMA, представленного в настоящем описании, например, человеческого или гуманизированного связывающего домена против BCMA, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC. В одном из вариантов осуществления связывающий домен против BCMA содержит вариабельную область легкой цепи, представленную в настоящем описании (например, в таблице 1 или SEQ ID NO: 271 или 273), и/или вариабельную область тяжелой цепи, представленную в настоящем описании (например, в таблице 1 или SEQ ID NO: 271 или 273). В одном из вариантов осуществления связывающий домен против BCMA является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью, представленной в таблице 1, SEQ ID NO: 271 или 273. В варианте осуществления связывающий домен против BCMA (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 1 или SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности, представленной в таблице 1 или SEQ ID NO: 271 или 273, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 1 или SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности, представленной в таблице 1 или SEQ ID NO: 271 или 273. В одном из вариантов осуществления связывающий домен против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 или SEQ ID NO: 266, или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) в любой из указанных выше последовательностей, или последовательность с 95-99% идентичности по отношению к любой из указанных выше последовательностей. В одном из вариантов осуществления связывающий домен против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 271 или SEQ ID NO: 273, или последовательность с 95-99% идентичности по отношению к ней. В одном из вариантов осуществления связывающий домен против BCMA является scFv, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1 или 16, SEQ ID NO: 271 или SEQ ID NO: 273, соединяют с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1 или 16, SEQ ID NO: 271 или SEQ ID NO: 273, с помощью линкера, например, линкера, представленного в настоящем описании. В одном из вариантов осуществления связывающий домен против BCMA включает линкер (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В других вариантах осуществления BCMA-связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16. В вариантах осуществления BCMA-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления BCMA-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленных в таблице 1 или 16.
В некоторых вариантах осуществления BCMA-связывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленных в таблице 1 или 16, и одну, две или все из CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16.
В одном из вариантов осуществления выделенная молекула CAR содержит трансмембранный домен белка, например, представленный в настоящем описании, например, выбранный из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном из вариантов осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6. В одном из вариантов осуществления трансмембранный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 6, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 6.
В одном из вариантов осуществления связывающий домен против BCMA соединяют с трансмембранным доменом посредством шарнирной области, например, шарнирной области, представленной в настоящем описании. В одном из вариантов осуществления кодируемая шарнирная область содержит SEQ ID NO: 2 или последовательность с 95-99% идентичности по отношению к ней.
В одном из вариантов осуществления выделенная молекула CAR дополнительно содержит последовательность, кодирующую костимуляторный домен, например, костимуляторный домен, представленный в настоящем описании. В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит костимуляторный домен. В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит первичный сигнальный домен. В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит костимуляторный домен и первичный сигнальный домен.
В одном из вариантов осуществления костимуляторный домен содержит функциональный сигнальный домен белка, выбранного из группы, состоящей из молекулы MHC класса I, белков рецепторов ФНО, иммуноглобулин-подобных белков, рецепторов цитокинов, интегринов, сигнальных молекул активации лимфоцитов (белков SLAM), активирующих рецепторов NK-клеток, BTLA, рецептора Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающегося с CD83.
В одном из вариантов осуществления костимуляторный домен содержит последовательность SEQ ID NO: 7. В одном из вариантов осуществления костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 7, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 7. В другом варианте осуществления костимуляторный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 1104. В одном из вариантов осуществления костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1104, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1104. В другом варианте осуществления костимуляторный домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8. В одном из вариантов осуществления костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 8. В другом варианте осуществления костимуляторный домен ICOS содержит аминокислотную последовательность SEQ ID NO: 1106. В одном из вариантов осуществления костимуляторный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1106, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1106.
В вариантах осуществления первичный сигнальный домен содержит сигнальный домен или CD3 дзета. В вариантах осуществления функциональный сигнальный домен CD3 дзета содержит SEQ ID NO: 9 (мутантный CD3 дзета) или SEQ ID NO: 10 (CD3 дзета человека дикого типа), или последовательность с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и/или последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 7 и/или последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 7 и/или последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и/или последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD27 и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8 и/или аминокислотную последовательность CD3 дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 8 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 8 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD28 и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 1104 и/или аминокислотную последовательность CD3 дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1104 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 379 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 1104 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен ICOS и/или функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен ICOS содержит аминокислотную последовательность SEQ ID NO: 1106 и/или аминокислотную последовательность CD3 дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 1106 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1106 и/или аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 1106 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи.
В одном из вариантов осуществления выделенная молекула CAR дополнительно содержит лидерную последовательность, например, лидерную последовательность, представленную в настоящем описании. В одном из вариантов осуществления лидерная последовательность содержит аминокислотную последовательность SEQ ID NO: 1 или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 1.
В другом аспекте изобретение относится к выделенной молекуле CAR, содержащей лидерную последовательность, например, лидерную последовательность, представленную в настоящем описании, например, лидерную последовательность SEQ ID NO: 1, или имеющую 95-99% идентичности по отношению к ней, связывающий домен против BCMA, представленный в настоящем описании, например, связывающий домен против BCMA, содержащий CDR1 LC, CDR2 LC, CDR3 LC, CDR1 HC, CDR2 HC и CDR3 HC, представленный в настоящем описании, например, связывающий домен против BCMA, описываемый в таблице 1 или 16, SEQ ID NO: 271 или SEQ ID NO: 273 или последовательность с 95-99% идентичности по отношению к ним, шарнирную область, например, шарнирную область, представленную в настоящем описании, например, шарнирную область SEQ ID NO: 2, или имеющую 95-99% идентичности по отношению к ней, трансмембранный домен, например, трансмембранный домен, представленный в настоящем описании, например, трансмембранный домен, имеющий последовательность SEQ ID NO: 6 или последовательность, имеющую 95-99% идентичности по отношению к ней, внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, представленный в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимуляторный домен и/или первичный сигнальный домен). В одном из вариантов осуществления внутриклеточный сигнальный домен содержит костимуляторный домен, например, костимуляторный домен, представленный в настоящем описании, например, костимуляторный домен 4-1BB, имеющий последовательность SEQ ID NO: 7 или имеющий 95-99% идентичности по отношению к ней, и/или первичный сигнальный домен, например, первичный сигнальный домен, представленный в настоящем описании, например, стимуляторный домен CD3 дзета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10 или имеющий 95-99% идентичности по отношению к ней. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит костимуляторный домен, например, костимуляторный домен, представленный в настоящем описании, например, костимуляторный домен 4-1BB, имеющий последовательность SEQ ID NO: 7, и/или первичный сигнальный домен, например, первичный сигнальный домен, представленный в настоящем описании, например, стимуляторный домен CD3 дзета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10.
В одном из вариантов осуществления выделенная молекула CAR содержит (например, состоит из) аминокислотную последовательность SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 или SEQ ID NO: 233, или аминокислотную последовательность, имеющую по меньшей мере одну, две, три, четыре, пять, 10, 15, 20 или 30 модификаций (например, замен, например, консервативных замен), но не более 60, 50 или 40 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 или SEQ ID NO: 233, или аминокислотную последовательность, имеющую 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 или SEQ ID NO: 233.
В других вариантах осуществления связывающий домен против BCMA содержит CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленного в таблице 1 или 16. В вариантах осуществления BCMA-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления BCMA-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленного в таблице 1 или 16.
В некоторых вариантах осуществления связывающий домен против BCMA содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленного в таблице 1 или 16, и одну, две или все из CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленного в таблице 1 или 16.
В одном из аспектов изобретение относится к BCMA-связывающему домену, содержащему одну или более (например, все три) из определяющей комплементарность области легкой цепи 1 (CDR1 LC), определяющей комплементарность области легкой цепи 2 (CDR2 LC) и определяющей комплементарность области легкой цепи 3 (CDR3 LC) BCMA-связывающего домена, представленного в настоящем описании, и/или одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) BCMA-связывающего домена, представленного в настоящем описании, например, BCMA-связывающего домена, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC.
В других вариантах осуществления BCMA-связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленного в таблице 1 или 16. В вариантах осуществления BCMA-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления BCMA-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленного в таблице 1 или 16.
В некоторых вариантах осуществления BCMA-связывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленного в таблице 1 или 16, и одну, две или все из CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16.
В одном из вариантов осуществления BCMA-связывающий домен содержит одну или более (например, все три) из определяющей комплементарность области легкой цепи 1 (CDR1 LC), определяющей комплементарность области легкой цепи 2 (CDR2 LC) и определяющей комплементарность области легкой цепи 3 (CDR3 LC) BCMA-связывающего домена, представленного в настоящем описании, и одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) BCMA-связывающего домена, представленного в настоящем описании, например, человеческого или гуманизированного связывающего домена против BCMA, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC. В одном из вариантов осуществления BCMA-связывающий домен содержит вариабельную область легкой цепи, представленную в настоящем описании (например, в таблице 1 или SEQ ID NO: 271 или 273), и/или вариабельную область тяжелой цепи, представленную в настоящем описании (например, в таблице 1 или SEQ ID NO: 271 или 273). В одном из вариантов осуществления BCMA-связывающий домен является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью, представленной в таблице 1, SEQ ID NO: 271 или 273. В варианте осуществления BCMA-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 1 или SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности, представленной в таблице 1 или SEQ ID NO: 271 или 273, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 1 или SEQ ID NO: 271 или 273, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности, представленной в таблице 1 или SEQ ID NO: 271 или 273. В одном из вариантов осуществления BCMA-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 или SEQ ID NO: 266, или аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) в любой из указанных выше последовательностей, или последовательность с 95-99% идентичности по отношению к любой из указанных выше последовательностей. В одном из вариантов осуществления BCMA-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 271 или SEQ ID NO: 273, или последовательность с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления связывающий домен против BCMA является scFv, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1 или 16, SEQ ID NO: 271 или SEQ ID NO: 273, соединяют с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1 или 16, SEQ ID NO: 271 или SEQ ID NO: 273, с помощью линкера, например, линкера, представленного в настоящем описании. В одном из вариантов осуществления BCMA-связывающий домен включает линкер (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В другом аспекте изобретение относится к вектору, содержащему молекулу нуклеиновой кислоты, представленную в настоящем описании, например, молекулу нуклеиновой кислоты, кодирующую CAR, представленный в настоящем описании. В одном из вариантов осуществления вектор выбран из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора.
В одном из вариантов осуществления вектор является лентивирусным вектором. В одном из вариантов осуществления вектор дополнительно содержит промотор. В одном из вариантов осуществления промотор является промотором EF-1. В одном из вариантов осуществления промотор EF-1 содержит последовательность SEQ ID NO: 11. В другом варианте осуществления промотор является промотором PGK, например, укороченным промотором PGK, как представлено в настоящем описании.
В одном из вариантов осуществления вектор является транскрибируемым in vitro вектором, например, вектором, транскрибирующим РНК молекулы нуклеиновой кислоты, представленной в настоящем описании. В одном из вариантов осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит поли(A)-хвост, например, поли(A)-хвост, представленный в настоящем описании, например, содержащий приблизительно 150 аденозиновых оснований (SEQ ID NO: 382). В одном из вариантов осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит 3'-UTR, например, 3'-UTR, представленную в настоящем описании, например, содержащую по меньшей мере один повтор 3'-UTR, полученный из бета-глобулина человека. В одном из вариантов осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит промотор, например, промотор T2A.
В другом аспекте изобретение относится к клетке, содержащей вектор, представленный в настоящем описании. В одном из вариантов осуществления клетка является клеткой, представленной в настоящем описании, например, иммунной эффекторной клеткой, например, T-клеткой человека или NK-клеткой человека, например, T-клеткой человека, представленной в настоящем описании, или NK-клеткой человека, представленной в настоящем описании. В одном из вариантов осуществления человек T-клетка является CD8+ T-клеткой.
В другом варианте осуществления CAR-экспрессирующая клетка, представленная в настоящем описании, может дополнительно экспрессировать другое средство, например, средство, повышающее активность CAR-экспрессирующей клетки. Например, в одном из вариантов осуществления средство может являться средством, ингибирующим ингибиторную молекулу. Примеры ингибиторных молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета. В вариантах осуществления средство является средством, ингибирующим PD1. В вариантах осуществления средство является средством, ингибирующим PD-L1. В одном из вариантов осуществления средство, ингибирующее ингибиторную молекулу, может являться средством, представленным в настоящем описании, таким как, например, средство, содержащее первый полипептид, например, ингибиторную молекулу, связанную со вторым полипептидом, обеспечивающим положительный сигнал для клетки, например, внутриклеточный сигнальный домен, представленный в настоящем описании. В одном из вариантов осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, PD-L2, LAG3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), CTLA4, VISTA, CD160, BTLA, LAIR1, TIM3, 2B4, TGFR бета, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TIGIT, или фрагмент любого из них (например, по меньшей мере, часть внеклеточного домена любого из них), и второй полипептид, являющийся внутриклеточным сигнальным доменом, представленным в настоящем описании (например, содержащим костимуляторный домен (например, 41BB, CD27 или CD28, например, как представлено в настоящем описании), и/или первичным сигнальным доменом (например, сигнальным доменом CD3 дзета, представленным в настоящем описании). В одном из вариантов осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере, часть внеклеточного домена PD1) и второй полипептид из внутриклеточного сигнального домена, представленного в настоящем описании (например, сигнального домена CD28, представленного в настоящем описании, и/или сигнального домена CD3 дзета, представленного в настоящем описании).
В другом аспекте изобретение относится к способу получения клетки, включающему трансдукцию клетки, представленной в настоящем описании, например, иммунной эффекторной клетки, представленной в настоящем описании, например, T-клетки или NK-клетки, представленной в настоящем описании, с использованием вектора, содержащего нуклеиновую кислоту, кодирующую CAR, например, CAR, представленный в настоящем описании.
Настоящее изобретение также относится к способу получения популяции РНК-сконструированных клеток, например, клеток, представленных в настоящем описании, например, иммунных эффекторных клеток, например, T-клеток или NK-клеток, транзиторно экспрессирующих экзогенную РНК. Способ включает встраивание транскрибируемой in vitro РНК или синтетической РНК в клетку, где РНК содержит нуклеиновую кислоту, кодирующую молекулу CAR, представленную в настоящем описании.
В другом аспекте изобретение относится к способу обеспечения противоопухолевого иммунитета у млекопитающего, включающему введение млекопитающему эффективного количества клеток, экспрессирующих молекулу CAR, например, клеток, экспрессирующих молекулу CAR, представленную в настоящем описании. В одном из вариантов осуществления клетка является аутологичной иммунной эффекторной клеткой, например, T-клеткой или аутологичной NK-клеткой. В одном из вариантов осуществления клетка является иммунной эффекторной клеткой, например, аллогенной T-клеткой или аллогенной NK-клеткой. В одном из вариантов осуществления млекопитающее является человеком, например, пациентом с гемобластозом.
В другом аспекте изобретение относится к способу лечения млекопитающего, имеющего заболевание, ассоциированное с экспрессией BCMA (например, пролиферативное заболевание, предраковое состояние и несвязанное со злокачественным новообразованием показание, ассоциированное с экспрессией BCMA) включающему введение млекопитающему эффективного количества клеток, экспрессирующих молекулу CAR, например, молекулу CAR, представленную в настоящем описании. В одном из вариантов осуществления млекопитающее является человеком, например, пациентом с гемобластозом.
В одном из вариантов осуществления заболевание является заболеванием, представленным в настоящем описании. В одном из вариантов осуществления заболевание, ассоциированное с экспрессией BCMA, выбрано из гемобластоза, такого как острые лейкозы, включая, в качестве неограничивающих примеров, острый миелолейкоз (AML), миелодиспластический синдром, миелопролиферативные неоплазии, хронический миелолейкоз (CML), неоплазию из бластных плазмацитоидных дендритных клеток, и заболевания, ассоциированного с экспрессией BCMA, включая, в качестве неограничивающих примеров, атипичные и/или неклассические злокачественные новообразования, злокачественные новообразования, предраковые состояния или пролиферативные заболевания с экспрессией BCMA, и их комбинации. В одном из вариантов осуществления заболевание, ассоциированное с экспрессией BCMA, является гемобластозом, выбранным из группы, состоящей из одного или более острых лейкозов, включая, в качестве неограничивающих примеров, острый B-клеточный лимфоидный лейкоз ("BALL"), острый T-клеточный лимфоидный лейкоз ("TALL"), острый лимфоидный лейкоз (ALL), один или более хронических лейкозов, включая, в качестве неограничивающих примеров, хронический миелогенный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL), дополнительные гемобластозы или гематологические состояния, включая, в качестве неограничивающих примеров, B-клеточный пролимфоцитарный лейкоз, неоплазию из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, MALT-лимфому, лимфому из клеток мантийной зоны, лимфому из клеток маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, плазмобластную лимфому, неоплазию из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", представляющий собой широкий спектр гематологических состояний, объединенных неэффективной продукцией (или дисплазией) миелоидных клеток крови, и заболевание, ассоциированное с экспрессией BCMA, включает, в качестве неограничивающих примеров, атипичные и/или неклассические злокачественные новообразования, злокачественные новообразования, предраковые состояния или пролиферативные заболевания с экспрессией BCMA и их комбинации.
В вариантах осуществления заболевание, ассоциированное с экспрессией BCMA, включает пролиферативное нарушение плазматических клеток, например, бессимптомную миелому (вялотекущую множественную миелому или индолентную миелому), моноклональную гаммапатию неустановленной этиологии (MGUS), макроглобулинемию Вальденстрема, плазмоцитомы (например, плазмоклеточную дискразию, солитарную миелому, солитарную плазмоцитому, экстрамедуллярную плазмоцитому и множественную плазмоцитому), системный амилоидоз легких цепей и POEMS-синдром (также известный как синдром Кроу-Фуказа, болезнь Такацуки и PEP-синдром).
В вариантах осуществления заболевание, ассоциированное с экспрессией BCMA, включает злокачественное новообразование, например, злокачественное новообразование, представленное в настоящем описании, например, рак предстательной железы (например, кастрационно-резистентный или резистентный к терапии рак предстательной железы или метастазирующий рак предстательной железы), рак поджелудочной железы или рак легких.
В одном из вариантов осуществления терапевтических способов клетку, экспрессирующую молекулу CAR, представленную в настоящем описании (например, молекула CAR BCMA), вводят в комбинации с клеткой, содержащей молекулу CAR CD19. В одном из вариантов осуществления клетку, экспрессирующую молекулу CAR BCMA вводят до, после или одновременно с введением клетки, экспрессирующей CAR CD19. В одном из вариантов осуществления клетка, экспрессирующая молекулу CAR BCMA, и клетка, экспрессирующая молекулу CAR CD19, являются частью единой композиции, и в других вариантах осуществления клетка, экспрессирующая молекулу CAR BCMA, и клетка, экспрессирующая молекулу CAR CD19, являются частью отдельных композиций. В одном из вариантов осуществления клетка, экспрессирующая молекулу CAR, представленную в настоящем описании (например, молекулу CAR BCMA), также экспрессирует молекулу CAR CD19. В одном из вариантов осуществления заболевание, ассоциированное с BCMA, является множественной миеломой, например, CD19-отрицательной множественной миеломой. В одном из вариантов осуществления заболевание, ассоциированное с экспрессией BCMA, является множественной миеломой например, множественной миеломой, являющейся CD19-отрицательной, например, имеющей подавляющее большинство (например, 99,95%) неопластических плазматических клеток с CD19-отрицательным фенотипом, например, как определяют посредством проточной цитометрии и RT-ПЦР.
В одном из вариантов осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, представленную в настоящем описании, вводят в комбинации со средством, повышающим эффективность клетки, экспрессирующей молекулу CAR, например, средством, представленным в настоящем описании.
В одном из вариантов осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, представленную в настоящем описании, вводят в комбинации с низкой усиливающей иммунитет дозой ингибитора mTOR. Не желая быть связанными какой-либо теорией, полагают, что лечение низкой, усиливающей иммунитет дозой (например, дозой, недостаточной для полной супрессии иммунной системы, но достаточной для улучшения иммунной функции) сопровождается снижением PD-1-положительных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или повышением PD-1-отрицательных клеток. PD-1-положительные иммунные эффекторные клетки, например, T-клетки или NK-клетки, но не PD-1-отрицательыне иммунные эффекторные клетки (например, T-клетки или NK-клетки), можно подвергать истощению посредством вовлечения клеток, экспрессирующих лиганд PD-1, например, PD-L1 или PD-L2.
В варианте осуществления этот подход можно использовать для оптимизации свойств клеток CAR, представленных в настоящем описании, у индивидуума. Не желая быть связанными какой-либо теорией, полагают, что в варианте осуществления улучшают свойства эндогенных, немодифицированных иммунных эффекторных клеток, например, T-клеток или NK-клеток. Не желая быть связанными какой-либо теорией, полагают, что в варианте осуществления улучшают свойства клетки, экспрессирующей CAR BCMA. В других вариантах осуществления клетки, например, иммунные эффекторные клетки (например, T-клетки или NK-клетки), имеющие или конструируемые для экспрессии CAR, можно обрабатывать ex vivo посредством приведения в контакт с количеством ингибитора mTOR, повышающим количество PD1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или повышающим соотношение PD1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток/PD1-положительных иммунных эффекторных клеток, например, T-клеток или NK-клеток.
В варианте осуществления введение низкой, усиливающей иммунитет дозы ингибитора mTOR, например, аллостерического ингибитора, например, RAD001, или каталитического ингибитора, начинают перед введением CAR-экспрессирующей клетки, представленной в настоящем описании, например, иммунных эффекторных клеток (например, T-клеток или NK-клеток). В варианте осуществления клетки CAR вводят после достаточного периода времени, или достаточного введения доз ингибитора mTOR, таким образом, что уровень PD1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или соотношение PD1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток/PD1-положительных иммунных эффекторных клеток, например, T-клеток или NK-клеток, по меньшей мере транзиторно, повышается.
В варианте осуществления клетку, например, иммунную эффекторную клетку (например, T-клетку или NK-клетку), подлежащую конструированию для экспрессии CAR, собирают после достаточного периода времени или после достаточного введения низкой, усиливающей иммунитет дозы ингибитора mTOR, таким образом, что уровень PD1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или соотношение PD1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток/PD1-положительных иммунных эффекторных клеток, например, T-клеток или NK-клеток, у индивидуума, или собранных из индивидуума, по меньшей мере, транзиторно, повышается.
В варианте осуществления изобретение относится к ингибитору mTOR для применения в лечении индивидуума, где указанный ингибитор mTOR повышает иммунный ответ указанного индивидуума, и где указанному индивидууму вводят или собираются вводить иммунную эффекторную клетку, экспрессирующую CAR BCMA, как представлено в настоящем описании. В одном из вариантов осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, представленную в настоящем описании, вводят в комбинации со средством, улучшающим один или более побочных эффектов, ассоциированных с введением клетки, экспрессирующей молекулу CAR, например, средством, представленным в настоящем описании.
В одном из вариантов осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, представленную в настоящем описании, вводят в комбинации со средством, с помощью которого лечат заболевание, ассоциированное с BCMA, например, средством, представленным в настоящем описании.
В определенных вариантах осуществления заболевание, ассоциированное с BCMA, является пролиферативным заболеванием, таким как злокачественное новообразование или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз, или является несвязанным со злокачественным новообразованием показанием, ассоциированным с экспрессией BCMA.
В определенных вариантах осуществления заболевание, ассоциированное с BCMA, является гемобластозом, выбранным из группы, состоящей из одного или более острых лейкозов, включая, в качестве неограничивающих примеров, острый миелолейкоз (AML), миелодиспластический синдром, миелопролиферативные неоплазии, хронический миелолейкоз (CML), неоплазию из бластных плазмацитоидных дендритных клеток, множественную миелому, и заболеванием, ассоциированным с экспрессией BMCA, включая, в качестве неограничивающих примеров, атипичные и/или неклассические злокачественные новообразования, злокачественные новообразования, предраковые состояния или пролиферативные заболевания с экспрессией BCMA, и их комбинациями. В одном из вариантов осуществления заболевание, ассоциированное с BCMA, является множественной миеломой. В вариантах осуществления заболевание, ассоциированное с экспрессией BCMA, включает пролиферативное нарушение из плазматических клеток, например, бессимптомную миелому (вялотекущую множественную миелому или индолентную миелому), моноклональную гаммапатию неустановленной этиологии (MGUS), макроглобулинемию Вальденстрема, плазмоцитомы (например, плазмоклеточную дискразию, солитарную миелому, солитарную плазмоцитому, экстрамедуллярную плазмоцитому, и множественную плазмоцитому), системный амилоидоз легких цепей и POEMS-синдром (также известный как синдром Кроу-Фуказа, болезнь Такацуки и PEP-синдром). В вариантах осуществления заболевание, ассоциированное с экспрессией BCMA, включает злокачественное новообразование, например, злокачественное новообразование, представленное в настоящем описании, например, рак предстательной железы (например, кастрационно-резистентный или резистентный к терапии рак предстательной железы или метастазирующий рак предстательной железы), рак поджелудочной железы или рак легких.
В вариантах осуществления CAR BCMA-экспрессирующую клетку, например, CAR BCMA-экспрессирующую клетку, представленную в настоящем описании, используют для лечения индивидуума, имеющего множественную миелому. В вариантах осуществления CAR BCMA-экспрессирующую клетку, например, CAR BCMA-экспрессирующую клетку, представленную в настоящем описании, используют для лечения индивидуума, имеющего пролиферативное нарушение из плазматических клеток, например, бессимптомную миелому (вялотекущую множественную миелому или индолентную миелому), моноклональную гаммапатию неустановленной этиологии (MGUS), макроглобулинемию Вальденстрема, плазмоцитомы (например, плазмоклеточную дискразию, солитарную миелому, солитарную плазмоцитому, экстрамедуллярную плазмоцитому, и множественную плазмоцитому), системный амилоидоз легких цепей и POEMS-синдром (также известный как синдром Кроу-Фуказа, болезнь Такацуки и PEP-синдром). В вариантах осуществления CAR BCMA-экспрессирующую клетку, например, CAR BCMA-экспрессирующую клетку, представленную в настоящем описании, используют для лечения индивидуума, имеющего злокачественное новообразование, например, злокачественное новообразование, представленное в настоящем описании, например, рак предстательной железы (например, кастрационно-резистентный или резистентный к терапии рак предстательной железы или метастазирующий рак предстательной железы), рак поджелудочной железы или рак легких.
В вариантах осуществления CAR BCMA-экспрессирующую клетку, например, CAR BCMA-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в соответствии со схемой введения, включающей общую дозу клеток, вводимых индивидууму, посредством фракционирования дозы, например, одного, двух, трех или больше отдельных введений частичной дозы. В вариантах осуществления первую процентную долю общей дозы вводят в первый день лечения, вторую процентную долю общей дозы вводят в последующий (например, второй, третий, четвертый, пятый, шестой, седьмой или более поздний) день лечения и, необязательно, третью процентную долю (например, оставшуюся процентную долю) общей дозы вводят в более поздний (например, третий, четвертый, пятый, шестой, седьмой, восьмой, девятый, десятый или более поздний) день лечения. Например, 10% общей дозы клеток вводят в первый день, 30% общей дозы клеток вводят во второй день и оставшиеся 60% общей дозы клеток вводят в третий день лечения. Например, общая доза клеток включает от 1 до 5×107 или 1 до 5×108 клеток BCMA-CART.
В вариантах осуществления перед введением CAR-экспрессирующих клеток индивидууму проводят терапию с истощением лимфоцитов (например, с использованием цитоксана, например, в дозе 1,5 г/м2). В вариантах осуществления перед введением CAR-экспрессирующих клеток индивидууму не проводят терапию с истощением лимфоцитов (например, с использованием цитоксана).
В вариантах осуществления не проводят химиотерапию с истощением лимфоцитов и вводят общую дозу клеток BCMA-CART от 1 до 5×107 (например, посредством инфузии), при этом вводят 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения. В другом варианте осуществления не проводят химиотерапию с истощением лимфоцитов и вводят общую дозу клеток BCMA-CART от 1 до 5×108 (например, посредством инфузии), при этом вводят 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения. В вариантах осуществления химиотерапию с истощением лимфоцитов (цитоксан в дозе 1,5 г/м2) проводят за три дня до введения клеток BCMA-CART, а затем вводят общую дозу клеток BCMA-CART от 1 до 5×107 (например, посредством инфузии), при этом вводят 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения. В вариантах осуществления химиотерапию с истощением лимфоцитов (цитоксан в дозе 1,5 г/м2) проводят за три дня до введения клеток BCMA-CART, а затем вводят общую дозу клеток BCMA-CART от 1 до 5×108 (например, посредством инфузии), при этом вводят 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения.
В другом аспекте изобретение относится к способу кондиционирования индивидуума перед трансплантацией клеток, включающему введение индивидууму эффективного количества клеток, содержащих молекулу CAR, представленную в настоящем описании. В одном из вариантов осуществления трансплантация клеток является трансплантацией стволовых клеток. Трансплантация стволовых клеток является трансплантацией гематопоэтических стволовых клеток или трансплантацией костного мозга. В одном из вариантов осуществления трансплантация клеток является аллогенной или аутологичной.
В одном из вариантов осуществления кондиционирование индивидуума перед трансплантацией клеток включает снижение количества BCMA-экспрессирующих клеток у индивидуума. BCMA-экспрессирующие клетки у индивидуума являются BCMA-экспрессирующими нормальными клетками или BCMA-экспрессирующими злокачественными клетками, и в некоторых случаях при кондиционировании индивидуума перед трансплантацией клеток будут снижать BCMA-экспрессирующие нормальные и злокачественные клетки.
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CAR по изобретению, выделенной полипептидной молекуле CAR по изобретению, вектору, содержащему CAR по изобретению, и клетке, содержащей CAR по изобретению, для применения в качестве лекарственного средства, например, как представлено в настоящем описании.
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CAR по изобретению, выделенной полипептидной молекуле CAR по изобретению, вектору, содержащему CAR по изобретению, и клетке, содержащей CAR по изобретению, для применения в лечении заболевания с экспрессией BCMA, например, заболевания с экспрессией BCMA, как представлено в настоящем описании.
Дополнительные признаки и варианты осуществления указанных выше композиций и способов включают одно или более из следующего:
В определенных вариантах осуществления молекула CAR BCMA (например, нуклеиновая кислота CAR BCMA или полипептид CAR BCMA, как представлено в настоящем описании) или BCMA-связывающий домен, как представлено в настоящем описании, включает одну, две или три CDR из вариабельной области тяжелой цепи (например, CDR1 HC, CDR2 HC и/или CDR3 HC), представленной в таблице 20, и/или одну, две или три CDR из вариабельной области легкой цепи (например, CDR1 LC, CDR2 LC и/или CDR3 LC) BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2, C13F12.1, представленной в таблице 21, или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 5, 4, 3, 2 или 1 замены аминокислот, например, замены (например, консервативной замены)) любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CAR BCMA (например, нуклеиновая кислота CAR BCMA или полипептид CAR BCMA, как представлено в настоящем описании) или антигенсвязывающий домен против BCMA, как представлено в настоящем описании, включает одну, две или три CDR из вариабельной области тяжелой цепи (например, CDR1 HC, CDR2 HC и/или CDR3 HC), представленной в таблице 22, и/или одну, две или три CDR из вариабельной области легкой цепи (например, CDR1 LC, CDR2 LC и/или CDR3 LC) BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2, C13F12.1, представленной в таблице 23, или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 5, 4, 3, 2 или 1 замены аминокислоты, например, замены (например, консервативной замены)) любой из указанных выше последовательностей. В определенных вариантах осуществления молекула CAR BCMA или антигенсвязывающий домен против BCMA включает одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), представленной в таблице 24, и/или одну, две или три CDR из вариабельной области легкой цепи (например, CDR1 LC, CDR2 LC и/или CDR3 LC) BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2, C13F12.1, представленной в таблице 25, или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 5, 4, 3, 2 или 1 замены аминокислоты, например, замены (например, консервативной замены)) любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CAR BCMA или антигенсвязывающий домен против BCMA включает
(i) CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей легкой цепи BCMA-связывающего домена, представленных в таблице 1 или 16, в SEQ ID NO: 271 или 273 или в CDR LC в таблице 21, 23 или 25; и/или,
(ii) CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей тяжелой цепи BCMA-связывающего домена, представленных в таблице 1 или 16, в SEQ ID NO: 271 или 273 или в CDR HC в таблице 20, 22 или 24.
В определенных вариантах осуществления молекула BCMA (например, нуклеиновая кислота CAR BCMA или полипептид CAR BCMA, как представлено в настоящем описании) или антигенсвязывающий домен против BCMA, как представлено в настоящем описании, включает:
(1) три CDR легкой цепи (LC), выбранные из одного из следующего:
(i) CDR1 LC SEQ ID NO: 504, CDR2 LC SEQ ID NO: 544 и CDR3 LC SEQ ID NO: 584 BCMA-4 CAR (139103);
(ii) CDR1 LC SEQ ID NO: 514, CDR2 LC SEQ ID NO: 554 и CDR3 LC SEQ ID NO: 594 BCMA-10 CAR (139109);
(iii) CDR1 LC SEQ ID NO: 516, CDR2 LC SEQ ID NO: 556 и CDR3 LC SEQ ID NO: 596 BCMA-13 CAR (139112); или
(iv) CDR1 LC SEQ ID NO: 518, CDR2 LC SEQ ID NO: 558 и CDR3 LC SEQ ID NO: 598 BCMA-15 CAR (139114); и/или
(2) три CDR тяжелой цепи (HC), выбранные из одного из следующего:
(i) CDR1 HC SEQ ID NO: 384, CDR2 HC SEQ ID NO: 424 и CDR3 HC SEQ ID NO: 464 BCMA-4 CAR (139103);
(ii) CDR1 HC SEQ ID NO: 394, CDR2 HC SEQ ID NO: 434 и CDR3 HC SEQ ID NO: 474 BCMA-10 CAR (139109);
(iii) CDR1 HC SEQ ID NO: 396, CDR2 HC SEQ ID NO: 436 и CDR3 HC SEQ ID NO: 476 BCMA-13 CAR (139112); или
(iv) CDR1 HC SEQ ID NO: 398, CDR2 HC SEQ ID NO: 438 и CDR3 HC SEQ ID NO: 478 BCMA-15 (139114).
В определенных вариантах осуществления молекула CAR BCMA (например, нуклеиновая кислота CAR BCMA или полипептид CAR BCMA как представлено в настоящем описании) или антигенсвязывающий домен против BCMA, как представлено в настоящем описании, включает:
(1) три CDR легкой цепи (LC), выбранные из одного из следующего:
(i) CDR1 LC SEQ ID NO: 744, CDR2 LC SEQ ID NO: 784 и CDR3 LC SEQ ID NO: 824 BCMA-4 CAR (139103);
(ii) CDR1 LC SEQ ID NO: 754, CDR2 LC SEQ ID NO: 794 и CDR3 LC SEQ ID NO: 834 BCMA-10 CAR (139109);
(iii) CDR1 LC SEQ ID NO: 756, CDR2 LC SEQ ID NO: 796 и CDR3 LC SEQ ID NO: 836 BCMA-13 CAR (139112); или
(iv) CDR1 LC SEQ ID NO: 758, CDR2 LC SEQ ID NO: 798 и CDR3 LC SEQ ID NO: 838 BCMA-15 CAR (139114); и/или
(2) три CDR тяжелой цепи (HC), выбранные из одного из следующего:
(i) CDR1 HC SEQ ID NO: 624, CDR2 HC SEQ ID NO: 664 и CDR3 HC SEQ ID NO: 704 BCMA-4 CAR (139103);
(ii) CDR1 HC SEQ ID NO: 634, CDR2 HC SEQ ID NO: 674 и CDR3 HC SEQ ID NO: 714 BCMA-10 CAR (139109);
(iii) CDR1 HC SEQ ID NO: 636, CDR2 HC SEQ ID NO: 676 и CDR3 HC SEQ ID NO: 716 BCMA-13 CAR (139112); или
(iv) CDR1 HC SEQ ID NO: 638, CDR2 HC SEQ ID NO: 678 и CDR3 HC SEQ ID NO: 718 BCMA-15 CAR (139114).
В определенных вариантах осуществления молекула CAR BCMA (например, нуклеиновая кислота CAR BCMA или полипептид CAR BCMA, как представлено в настоящем описании) или антигенсвязывающий домен против BCMA, как представлено в настоящем описании, включает:
(1) три CDR легкой цепи (LC), выбранные из одного из следующего:
(i) CDR1 LC SEQ ID NO: 984 CDR2 LC SEQ ID NO: 1024 и CDR3 LC SEQ ID NO: 1064 BCMA-4 CAR (139103);
(ii) CDR1 LC SEQ ID NO: 994, CDR2 LC SEQ ID NO: 1034 и CDR3 LC SEQ ID NO: 1074 BCMA-10 CAR (139109);
(iii) CDR1 LC SEQ ID NO: 996, CDR2 LC SEQ ID NO: 1036 и CDR3 LC SEQ ID NO: 1076 BCMA-13 CAR (139112); или
(iv) CDR1 LC SEQ ID NO: 998, CDR2 LC SEQ ID NO: 1038 и CDR3 LC SEQ ID NO: 1078 BCMA-15 CAR (139114); и/или
(2) три CDR тяжелой цепи (HC), выбранные из одного из следующего:
(i) CDR1 HC SEQ ID NO: 864, CDR2 HC SEQ ID NO: 904 и CDR3 HC SEQ ID NO: 944 BCMA-4 CAR (139103);
(ii) CDR1 HC SEQ ID NO: 874, CDR2 HC SEQ ID NO: 914 и CDR3 HC SEQ ID NO: 954 BCMA-10 CAR (139109);
(iii) CDR1 HC SEQ ID NO: 876, CDR2 HC SEQ ID NO: 916 и CDR3 HC SEQ ID NO: 956 BCMA-13 CAR (139112);
(iv) CDR1 HC SEQ ID NO: 878, CDR2 HC SEQ ID NO: 918 и CDR3 HC SEQ ID NO: 958 BCMA-15 CAR (139114).
В определенных вариантах осуществления молекула CAR BCMA (например, нуклеиновая кислота CAR BCMA или полипептид CAR BCMA, как представлено в настоящем описании) или антигенсвязывающий домен против BCMA, как представлено в настоящем описании, включает аминокислотную последовательность гуманизированного scFv SEQ ID NO: 271 или 273 или нуклеотидную последовательность, кодирующую scFv (SEQ ID NO: 272 или 274), или его антигенсвязывающий домен (например, VH, VL или одну или более их CDR).
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое общепринято понятно специалисту в области, к которой принадлежит изобретение. Хотя в практическом осуществлении или тестировании настоящего изобретения можно использовать способы и материалы, схожие или эквивалентные представленным в настоящем описании, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. Кроме того, материалы, способы и примеры являются исключительно иллюстративными и не предназначены для ограничения. Заголовки, подзаголовки или пронумерованные или обозначенные буквами элементы, например, (a), (b), (i) и т.д., представлены исключительно для простоты чтения. Использование заголовков или пронумерованных или обозначенных буквами элементов в настоящем описании не требует того, чтобы этапы или элементы осуществляли в алфавитном порядке, или того, чтобы этапы или элементы обязательно отделяли друг от друга. Другие признаки, объекты и преимущества изобретения будут очевидны из описания, чертежей и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1, содержащая фигуры 1A и 1B, является двумя графическими представлениями экспрессии BCMA в образцах миеломы, которую определяют посредством количественной ПЦР. Экспрессию BCMA определяли в различных линиях клеток миеломы (фиг. 1A). Сравнивали экспрессию BCMA в нормальных плазматических клетках и образцах от пациентов с миеломой (фиг. 1B).
Фигура 2, содержащая фигуры 2A, 2B, 2C, 2D и 2E, является серией графических представлений экспрессии BCMA в линиях клеток множественной миеломы и первичных образцах посредством проточной цитометрии. BCMA определяли на поверхности клеток линий U266 (фиг. 2A), H929 (фиг. 2B) и 8226 (фиг. 2C). BCMA также однородно экспрессировался на большинстве клональных плазматических клеток у 9 из 10 анализируемых пациентов с множественной миеломой (фиг. 2D и 2E).
Фигура 3, содержащая фигуры 3A и 3B, является серией графических представлений, где показано отсутствие экспрессии BCMA в нормальных клетках периферической крови и после экспансии CD3/CD28 (фиг. 3A) и на нормальных клетках костного мозга (фиг. 3B).
Фигура 4, содержащая фигуры 4A, 4B, 4C, 4D, 4E,и 4F, является серией изображений и графиком, где показана экспрессия BCMA в нормальных тканях. Ткани, положительно окрашенные на экспрессию BCMA при иммуногистохимическом анализе, являлись лимфоузлом (фиг. 4A) и миндалиной (фиг. 4B). Типичные ткани, не окрашивающиеся на экспрессию BCMA (BCMA-отрицательные), включали легкое (фиг. 4C), поджелудочную железу (фиг. 4D) и щитовидную железу (фиг. 4E). Также осуществляли анализ гибридизации РНК in situ в различных тканях (фиг. 4F).
Фигура 5 является схематическим представлением четырех конструкций CAR, содержащих гуманизированные scFv мыши против BCMA, обозначенные как pBCMA1, pBCMA2, pBCMA3 и pBCMA4.
Фигура 6 является серией графиков проточной цитометрии, на которых показана эффективность трансдукции и экспрессия конструкций BMCA-CAR на T-клетках. SS1-BBz представляет собой CAR против мезотелина, служащий в качестве отрицательного контроля.
Фигура 7, содержащая фигуру 7A и фигуру 7B, является двумя графиками, на которых показана антиген-специфическая продукция цитокинов BCMA-CART, измеряемая посредством анализов ELISA. Оценивали продукцию ИЛ-2 (фиг. 7A) и интерферона-гамма (ИФНγ) (фиг. 7B).
Фигура 8, содержащая фигуру 8A, фигуру 8B, фигуру 8C и фигуру 8D, является серией графиков, на которых показана цитотоксическая активность BCMA-CART в отношении указанных линий клеток миеломы: K562, экспрессирующей BCMA (фиг. 8A), 8226 (фиг. 8B), NCI H929 (фиг. 8C) и OPM2 (фиг. 8D).
Фигура 9, содержащая фигуру 9A и фигуру 9B, является графиком и серией изображений, на которых показана противоопухолевая активность BCMA-CART в доклинической модели множественной миеломы на животных. На фигуре 9A показано количественное определение средней биолюминесценции, представляющей опухолевую массу у целого животного животное (представленное в фотонах/секунду). На фигуре 9B представлены изображения биолюминесценции, определяемой у исследуемых мышей на 5, 15 и 20 день после обработки.
Фигура 10, содержащая фигуры 10A и 10B, является серией схематических представлений рабочих конструкций CAR BCMA, содержащих гуманизированные scFv мыши против BCMA.
Фигура 11 является серией графиков, на которых показана мишене-специфическая активация рабочих конструкций BCMA CAR, трансдуцируемых в репортерную линию клеток, посредством анализа репортерного гена люциферазы.
Фигура 12 является графиком проточной цитометрии, на котором показано распределение популяций CD4+ и CD8+ T-клеток после экспансии CD3/CD28 перед трансдукцией с использованием рабочих конструкций BCMA CAR.
Фигура 13 является серией графиков, на которых показаны эффективность трансдукции CART посредством детекции антигена BCMA-Fc через 10 дней после трансдукции посредством проточной цитометрии и соответствующие гистограммы.
Фигура 14 является серией гистограмм, на которых показана пролиферация рабочих клеток BCMA CART посредством окрашивания CFSE после стимуляции с использованием указанных клеток-мишеней (например, K562, K562, экспрессирующей BCMA, KMS11-luc, MM1-S-luc, NCI-H929, KMs26, RPMI 8226 и бус с CD3/CD28).
Фигура 15, содержащая фигуры 15A и 15B, представляет собой два графика, на которых показана пролиферация рабочих клеток BCMA CART посредством количества клеток (измеряемого посредством проточной цитометрии) в случае CART-экспрессирующих клеток (фиг. 15A) и общего количества клеток (фиг. 15B) после стимуляции с использованием указанных клеток-мишеней.
Фигура 16 является графиком, на котором показано цитолиз рабочих BCMA CART в ответ на BCMA-экспрессирующие клетки-мишени, клетки KMS11-люцифераза (слева) и клетки MM1-S-люцифераза (справа), в анализе люциферазы.
Фигура 17 является серией графиков, на которых показано цитолиз рабочих BCMA CART в ответ на BCMA-экспрессирующие клетки-мишени в анализе цитолиза клеток CFSE.
Фигура 18 является серией графиков, на которых показана мишене-специфическая активация CAR BCMA, содержащих scFv человека против BCMA, трансдуцированных в репортерную линию клеток в анализе репортерного гена люциферазы.
Фигура 19 является графиком проточной цитометрии, на котором показано распределение популяций CD4+ и CD8+ T-клеток после экспансии CD3/CD28 и перед трансдукцией CAR.
Фигура 20 является серией графиков проточной цитометрии и соответствующих гистограмм, на которых показана эффективность трансдукции посредством оценки экспрессии CAR на трансдуцированных T-клетках.
Фигура 21 является серией гистограмм, на которых показана пролиферация клеток BCMA CART в ответ на стимуляцию с использованием указанных клеток-мишеней (K562, K562, экспрессирующих BCMA, RPMI 8226, KM11-luc и NCI-H929), измеряемая посредством окрашивания CFSE.
Фигура 22, содержащая фигуру 22A, фигуру 22B и фигуру 22C, является серией графиков, на которых показана пролиферация клеток BCMA CART в ответ на стимуляцию с использованием указанных клеток-мишеней (K562, K562, экспрессирующих BCMA, RPMI 8226, KMS11-luc и NCI-H929), измеряемая посредством проточной цитометрии. Пролиферацию CART-клеток анализировали независимо для каждой популяции T-клеток, экспрессирующих CD3 (фиг. 22A), CD4 (фиг. 22B) и CD8 (фиг. 22C).
Фигура 23, содержащая фигуры 23A, 23B и 23C, является серией графиков, на которых показан цитолиз BCMA CART в ответ на BCMA-экспрессирующие клетки-мишени KMS11-люцифераза в анализе люциферазы. Мощность цитолиза (процент убитых клеток-мишеней) каждой конструкции CAR BCMA сравнивают с BCMA-3NP и BCMA-4NP на каждом графике на фигуре 23A. На фигуре 23B выбранные конструкции BCMA CAR сравнивали друг с другом. На фигуре 23C соотношение эффектор:мишень нормализовали по CAR-экспрессирующим клеткам. Ось X представляет собой процент убитых клеток-мишеней, ось Y представляет собой соотношение эффектор:мишень (E:T).
Фигура 24 является графиком, на котором показано, что лечение с использованием BCMA CART приводит к контролю прогрессирования заболевания в ксенотрансплантате множественной миеломы человека KMS-11-luc у мышей NSG. Средняя биолюминесценция (+/- SEM) опухолевых клеток представляет опухолевую массу у целого животного, как представлено на графике в фотонах/секунду (ф/с) ROI (интересующей области, например, целой мыши). Значимость вычисляли с помощью ANOVA относительно наполнителя, * означает P<0,01.
Фигура 25, содержащая фигуры 25A и 25B, является двумя графиками, на которых показана противоопухолевая активность T-клеток с CAR BCMA в модели множественной миеломы человека KMS-11 в двух независимых экспериментах. Средняя биолюминесценция (+/- SEM) опухолевых клеток представляет опухолевую массу у целого животного, представленное на графиках в фотонах/секунду (ф/с) (или суммарный поток или BLI) целой мыши. Значимость вычисляли с помощью ANOVA относительно наполнителя в день 28, на фигуре 25A * означает P<0,01. На фигуре 25B BCMA-4NP* означает результаты первого эксперимента для BCMA-4NP (результаты представлены на фигуре 25A).
Фигура 26, содержащая фигуры 26A, 26B, 26C и 26D, является графиками, на которых показана пролиферация клеток BCMA-CART при количественном анализе клеток BCMA-CART в периферической крови мышей, несущих опухоль KMS-11-luc. T-клетки периферической крови анализировали в дни 1, 3, 7, 10, 14 и еженедельно впоследствии после лечения CAR T-клетками. Что касается первого эксперимента с опухолями (результаты представлены на фигуре 25A), оценка популяции CD4+ CART представлена на фигуре 26A и оценка популяции CD8+ CART представлена на фигуре 26B. Что касается второго эксперимента с опухолями (результаты представлены на фигуре 25B), оценка популяции CD4+ CART представлена на фигуре 26C и оценка популяции CD8+ CART представлена на фигуре 26D.
Фигура 27, содержащая фигуры 27A, 27B, 27C и 27D, является графиками, на которых показана экспансия CAR BCMA-экспрессирующих T-клеток в костном мозге и селезенке в конце первого эксперимента с опухолями (результаты представлены на фигуре 25A). Вычисляли среднее количество CD4+ CAR BCMA-экспрессирующих T-клеток в костном мозге (фиг. 27A) и селезенке (фиг. 27B). Вычисляли среднее количество CD4=8+ CAR BCMA-экспрессирующих T-клеток в костном мозге (фиг. 27C) и селезенке (фиг. 27D). Образец J6MO представляет собой CAR T-клетки, экспрессирующие конструкцию CAR BCMA-4NP.
Фигура 28, содержащая фигуры 28A и 28B, является графиками, на которых представлен титр лентивируса для выбранных конструкций BCMA CAR в двух независимых экспериментах с лентивирусом. При первом тестировании тестировали два разных препарата ДНК конструкций BCMA CAR (A и B) (фиг. 28A). При втором тестировании тестировали три различных препарата ДНК конструкций BCMA CAR (A, B и C) (фиг. 28B).
Фигура 29 является графиком, на котором показан конкурентный анализ BCMA-4NP и выбранных конструкций BCMA CAR, BCMA-4 (B4), BCMA-10 (B10), BCMA-13 (B13) и BCMA-15 (B15).
Фигура 30, содержащая фигуры 30A, 30B, 30C, 30D и 30E, является графиками, на которых показаны результаты анализов аффинности выбранных конструкций BCMA: BMCA-10 (фиг. 30A), BCMA-13 (фиг. 30B), BCMA-15 (фиг. 30C), BCMA-4 (фиг. 30D) и BCMA-4NP (фиг. 30E).
Фигура 31 является графиком, на котором показано селективное связывание выбранных CAR BCMA-экспрессирующих T-клеток в случае рекомбинантного BCMA. Рекомбинантные формы BCMA и близкородственных членов семейств BAFFR и TACI, содержащих белки, слитые с Fc-доменами, инкубировали с T-клетками, экспрессирующими BCMA-4, BCMA-10, BCMA-13 и BCMA-15. Определяли процентную долю клеток, связавшихся с рекомбинантными белками (% положительных клеток).
Фигура 32, содержащая фигуры 32A, 32B, 32C, 32D, 32E и 32F, является серией изображений, на которых показано иммуногистохимическое окрашивание BCMA в ткани головного мозга. Окрашивание на BCMA в лазящих волокнах мозжечка яванского макака (фиг. 32A). Окрашивание на BCMA в тельцах нервных клеток в нижнем оливном ядре яванского макака (фиг. 32B). Окрашивание на BCMA (фиг. 32C) и Ig-окрашивание (контроль) (фиг. 32E) в продолговатом мозге яванского макака. Окрашивание BCMA (фиг. 32D) и Ig-окрашивание (контроль) (фиг. 32F) в продолговатом мозге человека.
Фигура 33, содержащая фигуры 33A, 33B, 33C, 33D и 33E, является серией изображений и графиком, на котором изображен РНК-анализ экспрессии BCMA в ткани головного мозга. Гибридизация РНК BCMA, DAPB и PPIB in situ в мозжечке не являющегося человеком примата (фиг. 33A). Гибридизация РНК BCMA, DAPB и PPIB in situ в продолговатом мозге не являющегося человеком примата (фиг. 33B). Анализ количественной ПЦР BCMA в мозжечке, продолговатом мозге, желудке и почке человека (фиг. 33C). Анализ количественной ПЦР BCMA в белом веществе, сером веществе, продолговатом мозге, желудке и почке яванского макака (фиг. 33D). Анализ RNAseq нормальной ткани человека (фиг. 33E), рамкой показана экспрессия BCMA в мозжечке.
Фигура 34 является схематической диаграммой, на которой показана хронология исследования для оценки безопасности и осуществимости терапии клетками BCMA CART при рецидивирующей и/или рефрактерной миеломе.
Фигуры 35A и 35B являются графиками, на которых показана концентрация цитокинов, секретируемых BCMA-10 CART при сокультивировании с клетками-мишенями. Фигура 35A является графиком, на котором показана концентрация интерлейкина-2 (ИЛ-2) и интерферона-гамма (ИФНγ), секретируемых BCMA-10 CART. Фигура 35B является графиком, на котором показана концентрация фактора некроза опухоли (ФНО), секретируемого BCMA-10 CART.
Фигуры 36A и 36B являются графиками, на которых показана кривая роста и эффективность лентивирусной трансдукции huBCMA-BBz T-клеток. Фигура 36A является графиком, на котором показано количество T-клеток, трансдуцированных с использованием вектора huBCMA-BBz, через несколько дней после экспансии. Фигура 36B является панелью графиков проточной цитометрии, на которых показана экспрессия в день 6 при экспансии ex vivo BCMA на клетках CART-BCMA (T-клетках, трансдуцированных с использованием вектора huBCMA-BBz) по сравнению с нетрансдуцированными клетками NTD.
Фигура 37 является панелью гистограмм проточной цитометрии, на которых показана поверхностная экспрессия BCMA на различных линиях клеток, включая клетки K562-BCMA и линии клеток множественной миеломы NCI H929, U266, RPMI 8226, OPM2 и MM1S. На всех графиках оранжевый сплошной пик представляет изотипический контроль, и синий сплошной пик представляет окрашивание с использованием антитела против BCMA.
Фигуры 38A и 38B являются графиками, на которых показана концентрация цитокинов, продуцируемых клетками CART-BCMA в ответ на линии клеток миеломы. На фигуре 38A показана концентрация продуцируемого ИЛ-2, и на фигуре 38B показана концентрация продуцируемого ИФНγ. Значения представляют собой концентрацию цитокина в пг/мл.
Фигуры 39A, 39B и 39C являются графиками, на которых показано антиген-специфический цитолиз BCMA+ линий клеток множественной миеломы клетками CART-BCMA. На фигуре 39A показано антиген-специфический цитолиз клеток K562-BCMA, на фигуре 39B показано антиген-специфический цитолиз клеток RPMI 8226 и на фигуре 39C показано антиген-специфический цитолиз клеток MM1S.
Фигуры 40A, 40B и 4°C являются графиками, на которых показано, что клетки CART-BCMA демонстрируют эффективную противомиеломную активность in vivo. Фигура 40A является графиком, на котором показана общая интенсивность излучения у мышей, которым вводили нетрансдуцированные клетки, и фигура 40B является графиком, на котором показана общая интенсивность излучения у мышей с CART-BCMA. Фигура 4°C является графиком, на котором показан процент выживаемости мышей NTD или CART-BCMA после инъекции T-клеток. Представлено дорзальное испускание фотонов из опухолей RPMI 8226 CBG+, при этом отдельные животные изображены серым, и средняя общая интенсивность излучения представлена красным. n=10 для каждой группы. Время представлено в неделях после инъекции T-клеток.
На фигуре 41A-41D показаны различные конфигурации в отдельном векторе, например, где U6-регулируемая shRNA находится выше или ниже EF1 альфа-регулируемых CAR-кодирующих элементов. В примерах конструкций, изображенных на фиг. 41A и 41B, транскрипция происходит с помощью промоторов U6 и EF1 альфа в одном направлении. В примерах конструкций, изображенных на фиг. 41C и 41D, транскрипция происходит с помощью промоторов U6 и EF1 альфа в разных направлениях. На фигуре 41E, shRNA (и соответствующий промотор U6) находится на первом векторе, и CAR (и соответствующий промотор EF1 альфа) находится на втором векторе.
На фигуре 42 изображены структуры двух примеров конфигураций RCAR. Антигенсвязывающие члены содержат антигенсвязывающий домен, трансмембранный домен и домен-переключатель. Внутриклеточные связывающие члены содержат домен-переключатель, костимуляторный сигнальный домен и первичный сигнальный домен. Две конфигурации свидетельствуют о том, что первый и второй домены-переключатели, представленные в настоящем описании, могут находиться в разных ориентациях в отношении антигенсвязывающего члена и внутриклеточного связывающего члена. Другие конфигурации RCAR дополнительно представлены в настоящем описании.
На фигуре 43 показано, что пролиферацию CAR-экспрессирующих, трансдуцированных T-клеток повышают низкими дозами RAD001 в системе культивирования клеток. CART сокультивировали с клетками Nalm-6 в присутствие различных концентраций RAD001. Количество CAR-положительных CD3-положительных T-клеток (черный) и общее количество T-клеток (серый) оценивали через 4 дня сокультивирования.
На фигуре 44 изображены измерения роста опухоли клеток NALM6-luc с ежедневным введением дозы RAD001 0,3, 1, 3 и 10 мг/кг (мг/кг) или дозы наполнителя. Кругами обозначен наполнитель, квадратами обозначена доза 10 мг/кг RAD001, треугольниками обозначена доза 3 мг/кг RAD001, перевернутыми треугольниками обозначена доза 1 мг/кг RAD001 и ромбами обозначена доза 0,3 мг/кг RAD001.
На фигурах 45A и 45B показаны фармакокинетические кривые, на которых показано количество RAD001 в крови мышей NSG с опухолями NALM6. На фиг. 45A показана PK в день 0 после первой дозы RAD001. На фиг. 45B показана PK в день 14 после последней дозы RAD001. Ромбами обозначена доза 10 мг/кг RAD001, квадратами обозначена доза 1 мг/кг RAD001, треугольниками обозначена доза 3 мг/кг RAD001 и X обозначена доза 10 мг/кг RAD001.
На фигурах 46A и 46B показана пролиферация in vivo клеток с гуманизированным CD19 CART с введением дозы RAD001 и без него. Низкие ежедневные дозы RAD001 (0,003 мг/кг) приводят к повышению пролиферации CAR T-клеток выше нормального уровня пролиферации huCAR19. На фигурах 46A показаны CD4+ CAR T-клетки, на фиг. 46B показаны CD8+ CAR T-клетки. Кругами обозначен PBS, квадратами обозначен huCTL019, треугольниками обозначен huCTL019 с 3 мг/кг RAD001, перевернутыми треугольниками обозначен huCTL019 с 0,3 мг/кг RAD001, ромбами обозначен huCTL019 с 0,03 мг/кг RAD001 и кругами обозначен huCTL019 с 0,003 мг/кг RAD001.
На фиг. 47 изображена экспрессия CD19 в опухолевых клетках пациента. Опухолевые клетки CD138+ CD45dim окрашивали на CD19 (ось x) и CD38 (ось y). Приблизительно 1-2% опухолевых клеток экспрессировали антиген CD19.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, имеют то же значение, которое общепринято понятно специалисту в области, к которой принадлежит изобретение.
Термин в единственном числе относится к одному или более (т.е. по меньшей мере одному) грамматическому объекту в описании. В качестве примера, термин "элемент" относится к одному элементу или более элементам.
Термин "приблизительно" в отношении измеримого значения, такого как количество, длительность времени и т.п., предназначен для включения вариантов ±20%, или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1% указанного значения, т.к. такие варианты подходят для осуществления описываемых способов.
Термин "химерный антигенный рецептор" или, альтернативно, "CAR" относится к рекомбинантной полипептидной конструкции, содержащей, по меньшей мере, внеклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый в настоящем описании как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, полученный из стимуляторной молекулы, описываемой ниже. В некоторых вариантах осуществления домены в полипептидной конструкции CAR находятся в одной полипептидной цепи, например, содержат химерный слитый белок. В некоторых вариантах осуществления домены в полипептидной конструкции CAR не являются смежными друг с другом, например, находятся в разных полипептидных цепях, например, как в RCAR, как представлено в настоящем описании.
В одном из аспектов стимуляторная молекула CAR является дзета-цепью, ассоциированной с T-клеточным рецепторным комплексом. В одном из аспектов цитоплазматический сигнальный домен содержит первичный сигнальный домен (например, первичный сигнальный домен CD3 дзета). В одном из аспектов цитоплазматический сигнальный домен дополнительно содержит один или более функциональных сигнальных доменов, полученных по меньшей мере из одной костимуляторной молекулы, описываемой ниже. В одном из аспектов костимуляторная молекула выбрана из 4-1BB (т.е. CD137), CD27, ICOS и/или CD28. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антиген-распознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, полученный из стимуляторной молекулы. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антиген-распознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, полученный из костимуляторной молекулы, и функциональный сигнальный домен, полученный из стимуляторной молекулы. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антиген-распознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий два функциональных сигнальных домена, полученных из одной или более костимуляторных молекул, и функциональный сигнальный домен, полученный из стимуляторной молекулы. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антиген-распознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий по меньшей мере два функциональных сигнальных домена, полученных из одной или более костимуляторных молекул, и функциональный сигнальный домен, полученный из стимуляторной молекулы. В одном из аспектов CAR содержит необязательную лидерную последовательность на амино-конце (N-конце) слитого белка CAR. В одном из аспектов CAR дополнительно содержит лидерную последовательность на N-конце внеклеточного антиген-распознающего домена, где лидерная последовательность, необязательно, отщепляется от антиген-распознающего домена (например, scFv) при клеточном процессинге и транспорте CAR к клеточной мембране.
CAR, содержащий антигенсвязывающий домен (например, scFv, однодоменное антитело или TCR (например, связывающий домен TCR альфа или связывающий домен TCR бета)), воздействующий на конкретный опухолевый маркер X, где X может являться опухолевым маркером, представленным в настоящем описании, также обозначают как XCAR. Например, CAR, содержащий антигенсвязывающий домен, воздействующий на BCMA, обозначают как CAR BCMA. CAR можно экспрессировать в любой клетке, например, иммунной эффекторной клетке, как представлено в настоящем описании (например, T-клетке или NK-клетке).
Термин "сигнальный домен" относится к функциональной части белка, действующей, передавая информацию внутри клетки для регуляции клеточной активности посредством определенных путей передачи сигнала посредством образования вторичных мессенджеров или функционирования в качестве эффекторов, отвечающих на такие мессенджеры.
Как применяют в настоящем описании, термин "BCMA" относится к B-клеточному антигену созревания. BCMA (также известный как TNFRSF17, BCM или CD269) является членом семейства рецепторов фактора некроза опухоли (TNFR) и, главным образом, экспрессируется на окончательно дифференцированных B-клетках, например, B-клетках памяти и плазматических клетках. Его лиганд назван B-клеточным активатором семейства ФНО (BAFF) и индуцирующим пролиферацию лигандом (APRIL). BCMA участвует в опосредовании выживаемости плазматических клеток для поддержания длительного гуморального иммунитета. Ген BCMA расположен на хромосоме 16, приводя к образованию первичного транскрипта мРНК длиной 994 нуклеотидов (регистрационный номер NCBI NM_001192.2), кодирующего белок из 184 аминокислот (NP_001183.2). Описан второй антисмысловой транскрипт, полученный из локуса BCMA, который может играть роль в регуляции экспрессии BCMA. (Laabi Y. et al., Nucleic Acids Res., 1994, 22:1147-1154). Описаны дополнительные варианты транскрипции с неизвестным значением (Smirnova AS et al. Mol Immunol., 2008, 45(4):1179-1183. Идентифицирована вторая изоформа, также известная как TV4 (идентификатор Uniprot Q02223-2). Как применяют в настоящем описании, термин "BCMA" включает белки, содержащие мутации, например, точечные мутации, фрагменты, инсерции, делеции и варианты сплайсинга полноразмерного BCMA дикого типа.
Как применяют в настоящем описании, термин "антитело" относится к последовательности белка или полипептида, полученной из молекулы иммуноглобулина, специфически связывающейся с антигеном. Антитела могут являться поликлональными или моноклональными, много- или одноцепочечными или интактными иммуноглобулинами, и их можно получать из природных источников или рекомбинантных источников. Антитела могут являться тетрамерами молекул иммуноглобулинов.
Термин "фрагмент антитела" относится по меньшей мере к одной части интактного антитела или его рекомбинантным вариантам и относится к антигенсвязывающему домену, например, антигенраспознающей вариабельной области интактного антитела, достаточной для придания способности к распознаванию и специфическому связыванию фрагмента антитела с мишенью, такой как антиген. Неограничивающие примеры фрагментов антител включают Fab, Fab'-, F(ab')2- и Fv-фрагменты, scFv-фрагменты антител, линейные антитела, однодоменные антитела, такие как sdAb (VL или VH), домены VHH верблюжьих и полиспецифические молекулы, образованные из фрагментов антител, таких как бивалентный фрагмент, содержащий два или более, например, два, Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области, или две или более, например, две, связанные выделенных CDR или другие эпитоп-связывающие фрагменты антител. Фрагмент антитела также можно встраивать в однодоменные антитела, макситела, минитела, нанотела, интратела, диатела, триатела, тетратела, v-NAR и бис-scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005). Фрагменты антител также можно пересаживать на каркасы на основе полипептидов, таких как фибронектин типа III (Fn3) (см. патент США №: 6703199, в котором описывают минитела на основе полипептида фибронектина).
Термин "scFv" относится к слитому белку, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, где вариабельные области легкой и тяжелой цепи смежно связывают с помощью короткого гибкого полипептидного линкера, и они способны экспрессироваться в виде одноцепочечного полипептида, и где scFv сохраняет специфичность интактного антитела, из которого его получают. Как применяют в настоящем описании, если не указано иначе, scFv может содержать вариабельные области VL и VH в любом порядке, например, относительно N-конца и C-конца полипептида scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
Как применяют в настоящем описании, термины "определяющая комплементарность область" или "CDR" относятся к аминокислотным последовательностям в вариабельных областях антитела, придающим специфичность в отношении антигена и аффинность связывания. Например, в основном, существует три CDR в каждой вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и три CDR в каждой вариабельной области легкой цепи (LCDR1, LCDR2, и LCDR3). Точные границы аминокислотной последовательности указанной CDR можно определять с использованием любой из ряда хорошо известных схем, включая описываемые Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации по "Kabat"), Al-Lazikani et al., (1997) JMB 273.927-948 (схема нумерации по "Chothia") или их комбинации. В случае схемы нумерации по Kabat в некоторых вариантах осуществления аминокислотные остатки CDR в вариабельном домене тяжелой цепи (VH) нумеруют как 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3), а аминокислотные остатки CDR в вариабельном домене легкой цепи (VL) нумеруют 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). В случае схемы нумерации по Chothia в некоторых вариантах осуществления аминокислоты CDR в VH нумеруют как 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3), а аминокислотные остатки CDR в VL нумеруют как 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). В комбинированной схеме нумерации по Kabat и Chothia в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам, являющимся частью CDR по Kabat, CDR по Chothia, или и той, и другой. Например, в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в VH, например, VH млекопитающего, например, VH человека, и аминокислотным остаткам 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в VL, например, VL млекопитающего, например, VL человека.
Часть композиции CAR по изобретению, содержащей антитело или фрагмент антитела, может существовать во множестве форм, например, где антигенсвязывающий домен экспрессируется в виде части полипептидной цепи, включая, например, фрагмент однодоменного антитела (sdAb), одноцепочечное антитело (scFv) или, например, гуманизированное антитело (Harlow et al., 1999, в: Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, в: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426). В одном из аспектов антигенсвязывающий домен композиции CAR по изобретению содержит фрагмент антитела. В дополнительном аспекте CAR содержит фрагмент антитела, содержащий scFv.
Как применяют в настоящем описании, термин "связывающий домен" или "молекула антитела" (также обозначаемый в настоящем описании как "связывающий домен против мишени (например, BCMA)") относится к белку, например, цепи иммуноглобулина или его фрагмента, содержащему по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Термин "связывающий домен" или "молекула антитела" включает антитела и фрагменты антител. В варианте осуществления молекула антитела является полиспецифической молекулой антитела, например, она содержит множество последовательностей вариабельных доменов иммуноглобулина, где первая последовательность вариабельного домена иммуноглобулина из множества имеет специфичность связывания для первого эпитопа, и вторая последовательность вариабельного домена иммуноглобулина из множества имеет специфичность связывания для второго эпитопа. В варианте осуществления молекула полиспецифического антитела является молекулой биспецифического антитела. Биспецифическое антитело имеет специфичность не более чем для двух антигенов. Молекула биспецифического антитела отличается первой последовательностью вариабельного домена иммуноглобулина, имеющей специфичность связывания для первого эпитопа, и второй последовательностью вариабельного домена иммуноглобулина, имеющей специфичность связывания для второго эпитопа. Термин "тяжелая цепь антитела" относится к более крупной из двух типов полипептидных цепей, присутствующих в молекулах антител в их природных конформациях, и, как правило, определяющей класс, к которому принадлежит антитело.
Термин "легкая цепь антитела" относится к меньшей из двух типов полипептидных цепей, присутствующих в молекулах антител в их природных конформациях. Каппа- (κ) и лямбда- (λ) легкие цепи относятся к двум основным изотипам легких цепей антител.
Термин "рекомбинантное антитело" относится к антителу, получаемому с использованием технологии рекомбинантных ДНК, такому как, например, антитело, экспрессируемое бактериофагом или дрожжевой системой экспрессии. Термин также следует истолковывать в значении антитела, получаемого посредством синтеза молекулы ДНК, кодирующей антитело, и где с молекулы ДНК экспрессируется белок антитела, или аминокислотной последовательности, определяющей антитело, где ДНК или аминокислотную последовательность получают с использованием технологии рекомбинантной ДНК, или аминокислотной последовательности, доступной и хорошо известной в этой области.
Термин "антиген" или "Ag" относится к молекуле, вызывающей иммунный ответ. Этот иммунный ответ может включать продукцию антител, или активацию специфичных иммунокомпетентных клеток, или и то, и другое. Специалистам в этой области будет понятно, что любая макромолекула, включая практически все белки или пептиды, может служить в качестве антигена. Кроме того, антигены можно получать из рекомбинантной или геномной ДНК. Специалистам в этой области будет понятно, что любая ДНК, содержащая нуклеотидные последовательности, или частичная нуклеотидная последовательность, кодирующая белок, вызывающий иммунный ответ, таким образом, кодирует "антиген" в том смысле, в котором этот термин используют в настоящем описании. Кроме того, специалисту в этой области будет понятно, что антиген может кодироваться не только полноразмерной нуклеотидной последовательностью гена. Очевидно, что настоящее изобретение, в качестве неограничивающих примеров, относится к применению частичных нуклеотидных последовательностей нескольких генов, и что эти нуклеотидные последовательности расположены в различных комбинациях так, что они кодируют полипептиды, вызывающие желаемый иммунный ответ. Кроме того, специалистам в этой области будет понятно, что антиген вообще может не кодироваться "геном". Очевидно, что антиген можно получать синтезированным, или его можно получать из биологического образца, или он может являться макромолекулой помимо полипептида. Такой биологический образец может включать, в качестве неограничивающих примеров, образец ткани, образец опухоли, клетку или жидкость с другими биологическими компонентами.
Термин "противоопухолевый эффект" относится к биологическому эффекту, который может проявляться различными способами, включая, в качестве неограничивающих примеров, например, снижение объема опухоли, снижение количества опухолевых клеток, снижение количества метастазов, повышение предполагаемой продолжительности жизни, снижение пролиферации опухолевых клеток, снижение выживаемости опухолевых клеток или улучшение различных физиологических симптомов, ассоциированных со злокачественным состоянием. "Противоопухолевый эффект" также может проявляться как способность пептидов, полинуклеотидов, клеток и антител по изобретению предотвращать появление опухолей в первом участке.
Термин "противораковый эффект" относится к биологическому эффекту, который может проявляться различными способами, включая, в качестве неограничивающих примеров, например, снижение объема опухоли, снижение количества злокачественных клеток, снижение количества метастазов, повышение предполагаемой продолжительности жизни, снижение пролиферации злокачественных клеток, снижение выживаемости злокачественных клеток или улучшение различных физиологических симптомов, ассоциированных со злокачественным состоянием. "Противораковый эффект" также может проявляться как способность пептидов, полинуклеотидов, клеток и антител по изобретению предотвращать появление опухоли в первом участке. Термин "противоопухолевый эффект" относится к биологическому эффекту, который может проявляться различными способами, включая, в качестве неограничивающих примеров, например, снижение объема опухоли, снижение количества опухолевых клеток, снижение пролиферации опухолевых клеток или снижение выживаемости опухолевых клеток. Термин "аутологичный" относится к любому материалу, полученному из одного индивидуума, которому его позднее вводят.
Термин "аллогенный" относится к любому материалу, полученному из другого животного того же вида, что и индивидуум, которому материал вводят. Указывают, что два или более индивидуума являются аллогенными по отношению друг к другу, если гены в одном или более локусах не являются идентичными. В некоторых аспектах аллогенный материал из индивидуумов одного вида может в достаточной степени являться генетически непохожим, чтобы взаимодействовать антигенно.
Термин "ксеногенный" относится к трансплантату, полученному из животного другого вида.
Как применяют в настоящем описании, термин "аферез" относится к известному в этой области экстракорпоральному способу, посредством которого кровь донора или пациента удаляют из донора или пациента и пропускают через аппарат, с помощью которого отделяют выбранные конкретные составляющие и возвращают оставшуюся часть в кровоток донора или пациента, например, посредством обратного переливания крови. Таким образом, термин "аферезный образец" относится к образцу, полученному с использованием афереза.
Термин "комбинация" относится к фиксированной комбинации в одной стандартной лекарственной форме или комбинированному введению, где соединение по настоящему изобретению и партнера по комбинации (например, другое лекарственное средство, как описано ниже, также обозначаемое как "терапевтическое средство" или "ко-средство") можно вводить независимо одновременно или раздельно через временные интервалы, особенно когда эти временные интервалы делают возможной демонстрацию партнерами по комбинации кооперативного, например, синергического, действия. Отдельные компоненты можно упаковывать в набор или раздельно. Один или оба компонента (например, порошки или жидкости) можно восстанавливать или разводить до желаемой дозы перед введением. Как применяют в настоящем описании, термины "совместное введение" или "комбинированное введение" или т.п. предназначены для включения введения выбранного партнера по комбинации отдельному нуждающемуся в этом индивидууму (например, пациенту) и предназначены для включения схем лечения, в которых средства не обязательно вводить одним путем введения или одновременно. Как применяют в настоящем описании, термин "фармацевтическая комбинация" означает продукт, являющийся результатом смешивания или комбинирования нескольких активных ингредиентов, и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например, соединение по настоящему изобретению и партнера по комбинации, вводят пациенту одновременно в форме единого объекта или дозы. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например, соединение по настоящему изобретению и партнера по комбинации, вводят пациенту в виде отдельных объектов одновременно, параллельно или последовательно без конкретных временных пределов, где такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также применимо к терапии смесью соединений, например, введению трех или более активных ингредиентов.
Термин "злокачественное новообразование" относится к заболеванию, отличающемуся быстрым и неконтролируемым ростом аномальных клеток. Злокачественные клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части тела. Неограничивающие примеры различных злокачественных новообразований представлены в настоящем описании и включают рак молочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, злокачественную опухоль почки, рак печени, рак головного мозга, лимфому, лейкоз, рак легких и т.п. Предпочтительные злокачественные новообразования, подвергаемые лечению способами, представленными в настоящем описании, включают множественную миелому, лимфому Ходжкина или неходжкинскую лимфому.
Термины "опухоль" и "злокачественное новообразование" в настоящем описании используют взаимозаменяемо, например, оба термина включают солидные и несолидные, например, диффузные или циркулирующие, опухоли. Как применяют в настоящем описании, термин "злокачественное новообразование" или "опухоль" включает предраковые, а также злокачественные новообразования и опухоли.
Как применяют в настоящем описании, термин "полученный из" означает взаимосвязь между первой и второй молекулой. Как правило, он относится к структурному сходству между первой молекулой и второй молекулой и не означает или не включает ограничение способа или источника в отношении первой молекулы, полученной из второй молекулы. Например, в случае внутриклеточного сигнального домена, полученного из молекулы CD3 дзета, внутриклеточный сигнальный домен сохраняет достаточную структуру CD3 дзета таким образом, что он обладает необходимой функцией, а именно, способностью генерировать сигнал в соответствующих условиях. Он не означает или не включает ограничение в отношении конкретного способа получения внутриклеточного сигнального домена, например, он не означает, что для получения внутриклеточного сигнального домена необходимо начинать с последовательности CD3 дзета и подвергать делеции нежелательную последовательность или включать мутации для получения внутриклеточного сигнального домена.
Фраза "заболевание, ассоциированное с экспрессией BCMA" включает, в качестве неограничивающих примеров, заболевание, ассоциированное с клетками, экспрессирующими BCMA (например, BCMA дикого типа или мутантный BCMA), или состояние, ассоциированное с клетками, экспрессирующими BCMA (например, BCMA дикого типа или мутантный BCMA), включая, например, пролиферативные заболевания, такие как злокачественное новообразование или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз, или несвязанное со злокачественным новообразованием показание, ассоциированное с клетками, экспрессирующими BCMA (например, BCMA дикого типа или мутантный BCMA). Чтобы избежать сомнений, заболевание, ассоциированное с экспрессией BCMA, может включать состояние, ассоциированное с клеткой, в настоящее время не экспрессирующей BCMA, например, т.к. экспрессия BCMA подвергнута отрицательной регуляции, например, в результате лечения молекулой против BCMA, например, ингибитором BCMA, представленным в настоящем описании, но в какое-то время экспрессирующей BCMA. В одном из аспектов злокачественное новообразование, ассоциированное с экспрессией BCMA (например, BCMA дикого типа или мутантного BCMA), является гемобластозом. В одном из аспектов гемобластоз является лейкозом или лимфомой. В одном из аспектов злокачественное новообразование, ассоциированное с экспрессией BCMA (например, BCMA дикого типа или мутантного BCMA), является злокачественным новообразованием из дифференцированных плазматических B-клеток. В одном из аспектов злокачественное новообразование, ассоциированное с экспрессией BCMA (например, BCMA дикого типа или мутантного BCMA), включает злокачественные новообразования, включая, в качестве неограничивающих примеров, например, один или более острых лейкозов, включая, в качестве неограничивающих примеров, например, острый B-клеточный лимфоидный лейкоз ("BALL"), острый T-клеточный лимфоидный лейкоз ("TALL"), острый лимфоидный лейкоз (ALL), один или более хронических лейкозов, включая, в качестве неограничивающих примеров, например, хронический миелогенный лейкоз (CML), хронический лимфоидный лейкоз (CLL). Дополнительные злокачественные образования или гематологические состояния, ассоциированные с экспрессией BMCA (например, BCMA дикого типа или мутантного BCMA), включают, в качестве неограничивающих примеров, например, B-клеточный пролимфоцитарный лейкоз, неоплазию из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, MALT-лимфому, лимфому из клеток мантийной зоны, лимфому из клеток маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, плазмобластную лимфому, неоплазию из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", представляющий собой широкий спектр гематологических состояний, объединенных неэффективной продукцией (или дисплазией) миелоидных клеток крови, и т.п. В некоторых вариантах осуществления злокачественное новообразование является множественной миеломой, лимфомой Ходжкина, неходжкинской лимфомой или глиобластомой. В вариантах осуществления заболевание, ассоциированное с экспрессией BCMA, включает пролиферативное нарушение из плазматических клеток, например, бессимптомную миелому (вялотекущую множественную миелому или индолентную миелому), моноклональную гаммапатию неустановленной этиологии (MGUS), макроглобулинемию Вальденстрема, плазмоцитомы (например, плазмоклеточную дискразию, солитарную миелому, солитарную плазмоцитому, экстрамедуллярную плазмоцитому и множественную плазмоцитому), системный амилоидоз легких цепей и POEMS-синдром (также известный как синдром Кроу-Фуказа, болезнь Такацуки и PEP-синдром). Дополнительные заболевания, ассоциированные с экспрессией BCMA (например, BCMA дикого типа или мутантного BCMA) включают, в качестве неограничивающих примеров, например, атипичные и/или неклассические злокачественные новообразования, злокачественные новообразования, предраковые состояния или пролиферативные заболевания, ассоциированные с экспрессией BCMA (например, BCMA дикого типа или мутантного BCMA), например, злокачественное новообразование, представленное в настоящем описании, например, рак предстательной железы (например, кастрационно-резистентный или резистентный к терапии рак предстательной железы или метастазирующий рак предстательной железы), рак поджелудочной железы или рак легких.
Несвязанные со злокачественным новообразованием показания, ассоциированные с BCMA (например, BCMA дикого типа или мутантным BCMA), включают вирусные инфекции, например, ВИЧ, грибковые инфекции, например, C. neoformans, аутоиммунное заболевание, например ревматоидный артрит, системную красную волчанку (SLE), обыкновенную пузырчатку и синдром Шегрена, воспалительное заболевание кишечника, язвенный колит, связанные с трансплантацией аллоспецифические нарушения иммунитета, связанные со слизистым иммунитетом, и нежелательные иммунные ответы на биологические средства (например, фактор VIII), когда важен гуморальный иммунитет. В вариантах осуществления несвязанное со злокачественным новообразованием показание, ассоциированное с экспрессией BCMA, включает, в качестве неограничивающих примеров, например, аутоиммунное заболевание, (например, системную красную волчанку), воспалительные нарушения (аллергию и астму) и трансплантацию. В некоторых вариантах осуществления опухолевая антиген-экспрессирующая клетка экспрессирует, или в какое-либо время экспрессировала, мРНК, кодирующую опухолевый антиген. В варианте осуществления опухолевая антиген-экспрессирующая клетка продуцирует опухолевый антигенный белок (например, дикого типа или мутантный), и опухолевый антигенный белок может присутствовать на нормальных уровнях или сниженных уровнях. В варианте осуществления опухолевая антиген-экспрессирующая клетка продуцировала детектируемые уровни опухолевого антигенного белка в одно время, а затем продуцировала, по существу, недетектируемый опухолевый антигенный белок.
Термин "консервативные модификации последовательности" относится к модификациям аминокислот, которые значимо не влияют или не изменяют характеристики связывания антитела или фрагмента антитела, содержащего аминокислотную последовательность. Такие консервативные модификации включают замены аминокислот, инсерции и делеции. Модификации можно включать в антитело или фрагмент антитела по изобретению стандартными способами, известными в этой области, такими как сайт-специфический мутагенез и ПЦР-опосредованный мутагенез. Консервативные замены являются заменами, при которых аминокислотный остаток заменяют аминокислотным остатком, имеющим схожую боковую цепь. В этой области определены семейства аминокислотных остатков, имеющих схожие боковые цепи. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или более аминокислотных остатков в CAR по изобретению можно заменять другими аминокислотными остатками из одного семейства боковых цепей и измененный CAR можно тестировать с использованием функциональных анализов, представленных в настоящем описании.
Термин "стимуляция" относится к первичному ответу, индуцируемому связыванием стимуляторной молекулы (например, комплекса TCR/CD3) с ее когнатным лигандом, таким образом, опосредующим передачу сигнала, в качестве неограничивающих примеров, такую как передача сигнала через комплекс TCR/CD3. Стимуляция может опосредовать измененную экспрессию конкретных молекул, такую как отрицательная регуляция TGF-β, и/или реорганизацию структур цитоскелета и т.п.
Термин "стимуляторная молекула" относится к молекуле, экспрессируемой T-клеткой, из которой получают первичные цитоплазматические сигнальные последовательности, регулирующие первичную активацию комплекса TCR стимулирующим образом в случае, по меньшей мере, некоторых аспектов T-клеточного пути передачи сигнала. В некоторых вариантах осуществления ITAM-содержащий домен в CAR повторяет передачу сигнала первичного TCR независимо от эндогенных комплексов TCR. В одном из аспектов первичный сигнал инициируется, например, связыванием комплекса TCR/CD3 с молекулой MHC, нагруженной пептидом, что приводит к опосредованию T-клеточного ответа, включая, в качестве неограничивающих примеров, пролиферацию, активацию, дифференцировку и т.п. Первичная цитоплазматическая сигнальная последовательность (также обозначаемая как "первичный сигнальный домен"), действующая стимуляторным образом, может содержать сигнальный мотив, известный в качестве иммунорецепторного тирозинового активирующего мотива или ITAM. Неограничивающие примеры ITAM, содержащего первичную цитоплазматическую сигнальную последовательность, особенно применимую в настоящем изобретении, включают полученные из TCR дзета, FcR гамма, FcR бета, CD3 гамма, CD3 дельта, CD3 эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известный как "ICOS"), FcεRI и CD66d, DAP10 и DAP12. В конкретном CAR по изобретению внутриклеточный сигнальный домен в любом одном или более CAR по изобретению содержит внутриклеточную сигнальную последовательность, например, первичную сигнальную последовательность CD3 дзета. В конкретном CAR по изобретению первичная сигнальная последовательность CD3 дзета является последовательностью, приведенной как SEQ ID NO: 9, или эквивалентными остатками не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п. В конкретном CAR по изобретению первичная сигнальная последовательность CD3 дзета является последовательностью, приведенной в SEQ ID NO: 10, или эквивалентными остатками не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п. Термин "антигенпредставляющая клетка" или "APC" относится к клетке иммунной системы, такой как вспомогательная клетка (например, B-клетка, дендритная клетка и т.п.), презентирующей чужеродный антиген в комплексе с главным комплексом гистосовместимости (MHC) на своей поверхности. T-клетки могут распознавать эти комплексы с помощью своих T-клеточных рецепторов (TCR). APC процессируют антигены и презентируют их T-клеткам.
Как применяют в настоящем описании, термин "внутриклеточный сигнальный домен" относится к внутриклеточной части молекулы. В вариантах осуществления внутриклеточный сигнальный домен передает сигнал эффекторной функции и заставляет клетку осуществлять специализированную функцию. Хотя можно использовать целый внутриклеточный сигнальный домен, во многих случаях не является необходимым использовать целую цепь. В той степени, в которой используют укороченную часть внутриклеточного сигнального домена, такую укороченную часть можно использовать вместо интактной цепи при условии, что она передает сигнал эффекторной функции. Таким образом, термин "внутриклеточный сигнальный домен" предназначен для включения любой укороченной части внутриклеточного сигнального домена, достаточной для передачи сигнала эффекторной функции.
Внутриклеточный сигнальный домен генерирует сигнал, стимулирующий иммунную эффекторную функцию клетки, содержащей CAR, например, CART-клетки. Примеры иммунной эффекторной функции, например, в CART-клетке, включают цитолитическую активность и хелперную активность, включая секрецию цитокинов.
В варианте осуществления внутриклеточный сигнальный домен может содержать первичный внутриклеточный сигнальный домен. Примеры первичных внутриклеточных сигнальных доменов включают полученные из молекул, отвечающих за первичную стимуляцию или антигензависимую стимуляцию. В варианте осуществления внутриклеточный сигнальный домен может содержать костимуляторный внутриклеточный домен. Примеры костимуляторных внутриклеточных сигнальных доменов включают полученные из молекул, отвечающих за костимуляторные сигналы или антиген-независимую стимуляцию. Например, в случае CART первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность T-клеточного рецептора, и костимуляторный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность из корецептора или костимуляторной молекулы.
Первичный внутриклеточный сигнальный домен может содержать сигнальный мотив, известный в качестве иммунорецепторного тирозинового активирующего мотива или ITAM. Неограничивающие примеры содержащих ITAM первичных цитоплазматических сигнальных последовательностей включают полученные из CD3 дзета, FcR гамма, FcR бета, CD3 гамма, CD3 дельта, CD3 эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известный как "ICOS"), FcεRI, CD66d, DAP10 и DAP12.
Термин "дзета" или, альтернативно, "дзета-цепь", "CD3 дзета" или "TCR-дзета" определяют как белок, представленный в GenBank под регистрационным номером BAG36664.1, или эквивалентные остатки не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п., и термин "стимуляторный домен дзета" или, альтернативно, "стимуляторный домен CD3 дзета" или "стимуляторный домен TCR-дзета" определяют как аминокислотные остатки из цитоплазматического домена дзета-цепи, достаточные для функциональной передачи исходного сигнала, необходимого для активации T-клеток. В одном из аспектов цитоплазматический домен дзета содержит остатки 52-164 из записи GenBank под регистрационным номером BAG36664.1 или эквивалентные остатки не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п., являющиеся их функциональными ортологами. В одном из аспектов "стимуляторный домен" или "стимуляторный домен CD3 дзета" является последовательностью, приведенной как SEQ ID NO: 9. В одном из аспектов "стимуляторный домен дзета" или "стимуляторный домен CD3 дзета" является последовательностью, приведенной как SEQ ID NO: 10.
Термин "костимуляторная молекула" относится к когнатному партнеру по связыванию на T-клетке, специфически связывающемуся с костимуляторным лигандом, таким образом, опосредуя костимуляторный ответ T-клетки, в качестве неограничивающих примеров, такой как пролиферация. Костимуляторные молекулы являются молекулами поверхности клетки, иными, чем антигенные рецепторы или их лиганды, необходимыми для эффективного иммунного ответа. Костимуляторные молекулы включают, в качестве неограничивающих примеров, молекулу MHC класса I, белки рецепторов ФНО, иммуноглобулин-подобные белки, рецепторы цитокинов, интегрины, сигнальные молекулы активации лимфоцитов (белки SLAM), активирующие рецепторы NK-клеток, BTLA, рецептор Толл-лигандов, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, специфически связывающийся с CD83.
Костимуляторный внутриклеточный сигнальный домен относится к внутриклеточной части костимуляторной молекулы.
Внутриклеточный сигнальный домен может содержать целую внутриклеточную часть или целый нативный внутриклеточный сигнальный домен молекулы, из которой его получают, или его функциональный фрагмент.
Термин "4-1BB" относится к члену суперсемейства TNFR с аминокислотной последовательностью, представленной в GenBank под регистрационным номером AAA62478.2, или эквивалентными остатками не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п., и "костимуляторный домен 4-1BB" определяют как аминокислотные остатки 214-255 из записи GenBank под регистрационным номером AAA62478.2 или эквивалентные остатки не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п. В одном из аспектов "костимуляторный домен 4-1BB" является последовательностью, приведенной как SEQ ID NO: 7, или эквивалентными остатками не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п.
Как применяют в настоящем описании, термин "иммунная эффекторная клетка" относится к клетке, участвующей в иммунном ответе, например, в стимуляции эффекторного иммунного ответа. Примеры иммунных эффекторных клеток включают T-клетки, например, альфа/бета T-клетки и гамма/дельта T-клетки, B-клетки, естественные киллеры (NK-клетки), естественные киллерные T-клетки (NKT), тучные клетки и фагоциты миелоидного происхождения.
Как применяют в настоящем описании, термин "иммунная эффекторная функция или эффекторный иммунный ответ" относится к функции или ответу, например, иммунной эффекторной клетки, усиливающему или стимулирующему иммунную атаку клетки-мишени. Например, иммунная эффекторная функция или ответ относится к свойству T- или NK-клетки, стимулирующей цитолиз или ингибирование роста или пролиферации клетки-мишени. В случае T-клетки первичная стимуляция и костимуляция являются примерами иммунной эффекторной функции или ответа.
Термин "эффекторная функция" относится к специализированной функции клетки. Эффекторная функция T-клетки, например, может являться цитолитической активностью или хелперной активностью, включая секрецию цитокинов.
Термин "кодирующий" относится к внутреннему свойству конкретных последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих определенную последовательность нуклеотидов (например, рРНК, тРНК и мРНК) или определенную последовательность аминокислот и биологические свойства, являющиеся их результатом. Таким образом, ген, кДНК или РНК кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, приводит к образованию белка в клетке или другой биологической системе. И кодирующую цепь, нуклеотидная последовательность которой идентична последовательности мРНК, и которую, как правило, предоставляют в списках последовательностей, и некодирующую цепь, используемую в качестве матрицы для транскрипции гена или кДНК, можно обозначать как кодирующую белок или другой продукт этого гена или кДНК.
Если не указано иначе, "нуклеотидная последовательность, кодирующая аминокислотную последовательность" включает все нуклеотидные последовательности, являющиеся вырожденными версиями друг друга и кодирующими одну и ту же аминокислотную последовательность. Фраза "нуклеотидная последовательность, кодирующая белок или РНК" также может включать интроны до той степени, что нуклеотидная последовательность, кодирующая белок, в некоторой версии может содержать интроны.
Термины "эффективное количество" или "терапевтически эффективное количество" в настоящем описании используют взаимозаменяемо, и они относятся к количеству соединения, состава, материала или композиции, как представлено в настоящем описании, эффективному для достижения конкретного биологического результата.
Термин "эндогенный" относится к любому материалу из организма, клетки, ткани или системы или продуцирующемуся внутри организма, клетки, ткани или системы.
Термин "экзогенный" относится к любому материалу, вводимому или продуцирующемуся вне организма, клетки, ткани или системы.
Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности, запускаемой промотором.
Термин "вектор для переноса" относится к композиции по настоящему изобретению, содержащей выделенную нуклеиновую кислоту, которую можно использовать для доставки выделенной нуклеиновой кислоты внутрь клетки. В этой области известны многочисленные векторы, включая, в качестве неограничивающих примеров, линейные полинуклеотиды, полинуклеотиды, связанные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор для переноса" включает автономно реплицирующуюся плазмиду или вирус. Термин также следует истолковывать как дополнительно включающий неплазмидные и невирусные соединения, облегчающие перенос нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосома и т.п. Неограничивающие примеры вирусных векторов для переноса включают аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы и т.п.
Термин "экспрессирующий вектор" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий последовательности контроля экспрессии, функционально связанные с нуклеотидной последовательностью, подлежащей экспрессии. Экспрессирующий вектор содержит достаточные цис-элементы для экспрессии, другие элементы для экспрессии могут находиться в клетке-хозяине или системе экспрессии in vitro. Экспрессирующие векторы включают все известные в этой области векторы, включая космиды, плазмиды (например, безоболочечные или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), включающие рекомбинантный полинуклеотид.
Термин "лентивирус" относится к роду из семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов своей способностью инфицировать неделящиеся клетки, с помощью них можно доставлять значительное количество генетической информации в ДНК клетки-хозяина, таким образом, что они представляют собой один из наиболее эффективных способов доставки генов посредством вектора. ВИЧ, SIV и FIV являются примерами лентивирусов.
Термин "лентивирусный вектор" относится к вектору, полученному, по меньшей мере, из части генома лентивируса, включая, в частности, само-инактивирующийся лентивирусный вектор, как представлено в Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). Другие неограничивающие примеры лентивирусных векторов, которые можно использовать в клинических условиях, включают, например, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAX™ от Lentigen и т.п. Неклинические типы лентивирусных векторов также доступны и известны специалисту в этой области.
Термин "гомологичный" или "идентичность" относится к идентичности последовательности субъединиц между двумя полимерными молекулами, например, между двумя молекулами нуклеиновой кислоты, такими как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Если положение субъединицы в обеих молекулах занято одной и той же мономерной субъединицей, например, если положение в каждой из двух молекул ДНК занято аденином, то они являются гомологичными или идентичными в этом положении. Гомология между двумя последовательностями является прямой функцией количества совпадений или гомологичных положений, например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях является гомологичной, две последовательности являются на 50% гомологичными, если 90% положений (например, 9 из 10) совпадают или являются гомологичными, две последовательности являются на 90% гомологичными.
"Гуманизированные" формы не принадлежащих человеку антител (например, мыши) являются химерными иммуноглобулинами, цепями иммуноглобулинов или их фрагментами (такими как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), содержащие минимальную последовательность, полученную из не принадлежащего человеку иммуноглобулина. Преимущественно, гуманизированные антитела и фрагменты антител являются иммуноглобулинами человека (реципиентным антителом или фрагментом антитела), в которых остатки из определяющей комплементарность области (CDR) реципиента заменяют остатками из CDR не являющихся человеком видов (донорного антитела), таких как мышь, крыса или кролик, имеющими желаемую специфичность, аффинность и активность. В некоторых случаях остатки каркасной области (FR) Fv иммуноглобулина человека заменяют соответствующими не принадлежащими человеку остатками. Кроме того, гуманизированное антитело/фрагмент антитела может содержать остатки, не обнаруживаемые ни в реципиентном антителе, ни в заимствованных последовательностях CDR или каркаса. Можно дополнительно уточнять эти модификации и оптимизировать свойства антитела или фрагмента антитела. В основном, гуманизированное антитело или фрагмент антитела будет содержать, по существу, все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или, по существу, все области CDR соответствуют областям CDR из не принадлежащего человеку иммуноглобулина, и все или значительная часть областей FR являются областями FR из последовательности иммуноглобулина человека. Гуманизированное антитело или фрагмент антитела также может содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Более подробно, см. Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
Термин "полностью человеческий" относится к иммуноглобулину, такому как антитело или фрагмент антитела, где целая молекула имеет человеческое происхождение или состоит из аминокислотной последовательности, идентичной человеческой форме антитела или иммуноглобулина.
Термин "выделенный" означает измененный или удаленный из природного состояния. Например, нуклеиновая кислота или пептид, в природе находящиеся в живом животное, не являются "выделенными", но та же нуклеиновая кислота или пептид, частично или полностью отделенная от сосуществующих материалов в его природном состоянии, является "выделенной". Выделенная нуклеиновая кислота или белок могут существовать в значительной степени в очищенной форме или в неприродном окружении, таком как, например, клетка-хозяин.
В контексте настоящего описания, используют следующие сокращения для общераспространенных оснований нуклеиновой кислоты. "A" относится к аденозину, "C" относится к цитозину, "G" относится к гуанозину, "T" относится к тимидину и "U" относится к уридину.
Термин "функционально связанный" или "транскрипционный контроль" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, если первая последовательность нуклеиновой кислоты находится в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут являться смежными друг с другом, и, например, если необходимо соединять две кодирующие белок области, они находятся в одной рамке считывания.
Термин "парентеральное" введение иммуногенной композиции включает, например, подкожную (s.c.), внутривенную (i.v.), внутримышечную (i.m.) или интрастернальную инъекцию, внутриопухолевые или инфузионные способы.
Термин "нуклеиновая кислота" или "полинуклеотид" относится к дезоксирибонуклеиновым кислотам (ДНК) или рибонуклеиновым кислотам (РНК) и их полимерам в одно- или двухцепочечной форме. Если нет конкретных ограничений, термин включает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, имеющие схожие связывающие свойства с референсной нуклеиновой кислотой и метаболизируемые схожим образом с природными нуклеотидами. Если не указано иначе, конкретная последовательность нуклеиновой кислоты также косвенно включает ее консервативно модифицированные варианты (например, замены вырожденных кодонов, например, консервативные замены), аллели, ортологи, SNP и комплементарные последовательности, а также конкретно указанную последовательность. В частности, замены вырожденных кодонов, например, консервативные замены можно осуществлять, получая последовательности, в которых третье положение одного или более выбранных (или всех) кодонов замещают смешанными основаниями и/или дезоксиинозиновыми остатками (Batzer et al., Nucleic Acid Res 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985) и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
Термины "пептид", "полипептид" и "белок" используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и нет ограничений в отношении максимального количества аминокислот, которое может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. Как применяют в настоящем описании, термин относится к коротким цепям, общепринято обозначаемым в этой области как пептиды, олигопептиды и олигомеры, например, и к более длинным цепям, как правило, обозначаемым в этой области как белки, существует множество типов которых. "Полипептиды" включают, помимо прочего, например, биологически активные фрагменты, по существу, гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию.
Термин "промотор" относится к последовательности ДНК, распознаваемой синтетическим аппаратом клетки или встраиваемым синтетическим аппаратом, необходимой для инициации специфической транскрипции полинуклеотидной последовательности.
Термин "промотор/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, необходимой для экспрессии продукта гена, функционально связанного с промотором/регуляторной последовательностью. В некоторых случаях, эта последовательность может являться коровой последовательностью промотора, а в других случаях эта последовательность также может включать энхансерную последовательность и другие регуляторные элементы, необходимые для экспрессии продукта гена. Промотор/регуляторная последовательность, например, может являться последовательностью, экспрессирующей продукт гена тканеспецифическим образом.
Термин "конститутивный" промотор относится к нуклеотидной последовательности, которая в случае функциональной связи с полинуклеотидом, кодирующим или определяющим продукт гена, вызывает продукцию продукта гена в клетке в большинстве или всех физиологических условиях клетки.
Термин "индуцибельный" промотор относится к нуклеотидной последовательности, которая в случае функциональной связи с полинуклеотидом, кодирующим или определяющим продукт гена, вызывает продукцию продукта гена в клетке, по существу, только при наличии в клетке индуктора, соответствующего промотору.
Термин "тканеспецифический" промотор относится к нуклеотидной последовательности, которая в случае функциональной связи с полинуклеотидом, кодирующим или определяющим продукт гена, вызывает продукцию продукта гена в клетке, по существу, только если клетка является клеткой типа ткани, соответствующего промотору.
Термины "ассоциированный со злокачественным новообразованием антиген" или "опухолевый антиген", используемые взаимозаменяемо, относятся к молекуле (как правило, белку, углеводу или липиду), экспрессирующемуся на поверхности злокачественной клетки, целиком или в виде фрагмента (например, MHC/пептид), и применимому для избирательного таргетинга фармакологического средства к злокачественной клетке. В некоторых вариантах осуществления опухолевый антиген является маркером, экспрессирующимся нормальными клетками и злокачественными клетками, например, линейным маркером, например, CD19 на B-клетках. В некоторых вариантах осуществления опухолевый антиген является молекулой поверхности клетки, гиперэкспрессированной в злокачественной клетке по сравнению с нормальной клеткой, например, с 1-кратной гиперэкспрессией, 2-кратной гиперэкспрессией, 3-кратной гиперэкспрессией или более по сравнению с нормальной клеткой. В некоторых вариантах осуществления опухолевый антиген является молекулой поверхности клетки, неправильно синтезирующейся в злокачественной клетке, например, молекулой, содержащей делеции, инсерции или мутации по сравнению с молекулой, экспрессируемой на нормальной клетке. В некоторых вариантах осуществления опухолевый антиген будет экспрессироваться исключительно на поверхности злокачественной клетки, целиком или в виде фрагмента (например, MHC/пептид), и не будет синтезироваться или экспрессироваться на поверхности нормальной клетки. В некоторых вариантах осуществления CAR по настоящему изобретению относятся к CAR, содержащим антигенсвязывающий домен (например, антитело или фрагмент антитела), связывающийся с MHC-презентированным пептидом. Как правило, пептиды, полученные из эндогенных белков, наполняют карманы молекул главного комплекса гистосовместимости (MHC) класса I и распознаются T-клеточными рецепторами (TCR) на CD8+T-лимфоцитах. Комплексы MHC класса I конститутивно экспрессируются всеми ядросодержащими клетками. При злокачественном новообразовании вирус-специфичные и/или опухолеспецифичные комплексы пептид/MHC представляют уникальный класс мишеней для иммунотерапии, расположенных на поверхности клетки. Описаны TCR-подобные антитела, направленные против пептидов, полученных из вирусных или опухолевых антигенов в контексте лейкоцитарного антигена человека (HLA)-A1 или HLA-A2 (см., например, Sastry et al., J Virol. 2011 85(5):1935-1942; Sergeeva et al., Blood, 2011 117(16):4262-4272; Verma et al., J Immunol 2010 184(4):2156-2165; Willemsen et al., Gene Ther 2001 8(21):1601-1608; Dao et al., Sci Transl Med 2013 5(176):176ra33; Tassev et al., Cancer Gene Ther 2012 19(2):84-100). Например, TCR-подобное антитело можно идентифицировать при скрининге библиотеки, такой как библиотека фагового дисплея scFv человека.
Термины "опухоль-поддерживающий антиген" или "поддерживающий злокачественное новообразование антиген" используют взаимозаменяемо, и они относятся к молекуле (как правило, белку, углеводу или липиду), экспрессирующемуся на поверхности клетки, самому по себе не являющемуся злокачественным, но поддерживающим злокачественные клетки, например, стимулируя их рост или выживаемость, например, резистентность к иммунным клеткам. Примеры клеток этого типа включают стромальные клетки и супрессорные клетки миелоидного происхождения (MDSC). Самому опухоле-поддерживающему антигену нет необходимости играть роль в поддержании опухолевых клеток при условии, что антиген присутствует на клетке, поддерживающей злокачественные клетки.
Термин "гибкий полипептидный линкер" или "линкер", как применяют в отношении scFv, относится к пептидному линкеру, состоящему из аминокислот, таких как остатки глицина и/или серина, используемые в отдельности или в комбинации для связывания вариабельных областей тяжелой и легкой цепи. В одном из вариантов осуществления гибкий полипептидный линкер является линкером Gly/Ser и содержит аминокислотную последовательность (Gly-Gly-Gly-Ser)n (SEQ ID NO: 38), где n является положительным целым числом, равным 1 или более. Например, n=1, n=2, n=3. n=4, n=5 и n=6, n=7, n=8, n=9 и n=10. В одном из вариантов осуществления гибкие полипептидные линкеры включают, в качестве неограничивающих примеров, (Gly4 Ser)4 (SEQ ID NO: 27) или (Gly4 Ser)3 (SEQ ID NO: 28). В другом варианте осуществления линкеры включают множественные повторы (Gly2Ser), (GlySer) или (Gly3Ser) (SEQ ID NO: 29). Кроме того, в объем изобретения включены линкеры, описываемые в WO2012/138475, включенном в настоящее описание в качестве ссылки).
Как применяют в настоящем описании, 5'-кэп (также обозначаемый как РНК-кэп, 7-метилгуанозиновый РНК-кэп или РНК m7G-кэп) является модифицированным гуаниновым нуклеотидом, добавляемым "вперед" или на 5'-конец эукариотической матричной РНК вскоре после начала транскрипции. 5'-кэп состоит из концевой группы, связанной с первым транскрибируемым нуклеотидом. Его наличие является критическим для распознавания рибосомой и защиты от РНКаз. Добавление кэпа сопряжено с транскрипцией и происходит котранскрипционно, таким образом, что одно влияет на другое. Вскоре после начала транскрипции 5'-конец синтезируемой мРНК связывается кэп-синтезирующим комплексом, ассоциированным с РНК-полимеразой. Этот ферментативный комплекс катализирует химические реакции, необходимые для кэпирования мРНК. Синтез происходит как многоэтапная биохимическая реакция. Кэпирующий остаток можно модифицировать для модуляции функциональности мРНК, такой как ее стабильность или эффективность трансляции.
Как применяют в настоящем описании, "транскрибируемая in vitro РНК" относится к РНК, предпочтительно мРНК, синтезируемой in vitro. Как правило, транскрибируемая in vitro РНК образуется из транскрибирующегося in vitro вектора. Транскрибирующийся in vitro вектор содержит матрицу, используемую для получения транскрибируемой in vitro РНК.
Как применяют в настоящем описании, "поли(A)" является серией аденозинов, прикрепляемых к мРНК посредством полиаденилирования. В предпочтительном варианте осуществления конструкции для транзиторной экспрессии поли(A) составляет от 50 до 5000 (SEQ ID NO: 30), предпочтительно - более 64, более предпочтительно - более 100, наиболее предпочтительно - более 300 или 400. Поли(A)-последовательности можно модифицировать химически или ферментативно для модуляции функциональности мРНК, такой как локализация, стабильность или эффективность трансляции.
Как применяют в настоящем описании, "полиаденилирование" относится к ковалентному соединению полиаденилилового остатка или его модифицированного варианта с молекулой матричной РНК. В эукариотических организмах большинство молекул матричной РНК (мРНК) являются полиаденилированными на 3'-конце. 3'-поли(A)-хвост является длинной последовательностью адениновых нуклеотидов (зачастую несколько сотен), добавляемых к пре-мРНК под действием фермента полиаденилатполимеразы. У высших эукариот поли(A)-хвост добавляется к транскриптам, содержащим конкретную последовательность, сигнал полиаденилирования. Поли(A)-хвост и белок, связанный с ним, способствуют защите мРНК от деградации экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорту мРНК из ядра и трансляции. Полиаденилирование происходит в ядре непосредственно после транскрипции ДНК в РНК, но дополнительно может происходить позднее в цитоплазме. После терминации транскрипции цепь мРНК расщепляется под действием эндонуклеазного комплекса, ассоциированного с РНК-полимеразой. Участок расщепления, как правило, отличается наличием последовательности оснований AAUAAA вблизи участка расщепления. После расщепления мРНК остатки аденозина добавляются к свободному 3'-концу в участке расщепления.
Как применяют в настоящем описании, термин "транзиторный" относится к экспрессии невстроенного трансгена в течение часов, дней или недель, где период времени экспрессии является меньшим, чем период времени экспрессии гена, встроенного в геном или содержащегося в стабильном репликоне плазмиды в клетке-хозяине.
Как применяют в настоящем описании, термины "лечить" и "лечение" относятся к снижению или улучшению прогрессирования, тяжести и/или длительности пролиферативного нарушения или улучшению одного или более симптомов (предпочтительно, одного или более заметных симптомов) пролиферативного нарушения, являющемуся результатом введения одного или более терапевтических средств (например, одного или более терапевтических средств, таких как CAR по изобретению). В конкретных вариантах осуществления термины "лечить" и "лечение" относятся к улучшению по меньшей мере одного измеримого физического параметра пролиферативного нарушения, такого как рост опухоли, не обязательно заметного для пациента. В других вариантах осуществления термины "лечить" и "лечение" относятся к ингибированию прогрессирования пролиферативного нарушения физически, например, посредством стабилизации заметного симптома, физиологически, например, посредством стабилизации физического параметра, или и тому, и другому. В других вариантах осуществления термины "лечить" и "лечение" относятся к снижению или стабилизации размера опухоли или количества злокачественных клеток.
Термин "путь передачи сигнала" относится к биохимической взаимосвязи между множеством молекул передачи сигнала, играющих роль в передаче сигнала от одной части клетки другой части клетки. Фраза "рецептор поверхности клетки" включает молекулы и комплексы молекул, способные получать сигнал и передавать сигнал через мембрану клетки.
Термин "индивидуум" предназначен для включения живых организмов, в которых можно вызывать иммунный ответ (например, млекопитающих, человека).
Термин "в значительной степени очищенная" клетка относится к клетке, по существу, не содержащей другие типы клеток. Термин "в значительной степени очищенная клетка" также относится к клетке, отделенной от других типов клеток, в которыми она, как правило, ассоциирована в его природном состоянии. В некоторых случаях популяция, в значительной степени, очищенных клеток относится к гомогенной популяции клеток. В других случаях этот термин просто относится к клетке, отделенной от клеток, с которыми она, как правило, ассоциирована в их природном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
Как применяют в настоящем описании, термин "терапевтический" означает лечение. Терапевтического эффекта достигают посредством снижения, супрессии, ремиссии или эрадикации заболевания.
Как применяют в настоящем описании, термин "профилактика" означает предотвращение или протективное лечение в случае заболевания.
В контексте настоящего описания, "опухолевый антиген" или "антиген гиперпролиферативного нарушения" или "антиген, ассоциированный с гиперпролиферативным нарушением" относится к антигенам, общим для конкретных гиперпролиферативных нарушений. В определенных аспектах антигены гиперпролиферативного нарушения по настоящему изобретению получают из злокачественных новообразований, включая, в качестве неограничивающих примеров, первичную или метастазирующую меланому, тимому, лимфому, саркому, рак легких, рак печени, неходжкинскую лимфому, лимфому Ходжкина, лейкозы, рак матки, рак шейки матки, рак мочевого пузыря, рак почки и аденокарциномы, такие как рак молочной железы, рак предстательной железы (например, кастрационно-резистентный или резистентный к терапии рак предстательной железы или метастазирующий рак предстательной железы), рак яичников, рак поджелудочной железы и т.п., или пролиферативное нарушение из плазматических клеток, например, бессимптомную миелому (вялотекущую множественную миелому или индолентную миелому), моноклональную гаммапатию неустановленной этиологии (MGUS), макроглобулинемию Вальденстрема, плазмоцитомы (например, плазмоклеточную дискразию, солитарную миелому, солитарную плазмоцитому, экстрамедуллярную плазмоцитому и множественную плазмоцитому), системный амилоидоз легких цепей и POEMS-синдром (также известный как синдром Кроу-Фуказа, болезнь Такацуки и PEP-синдром).
Термин "трансфицированный", или "трансформированный", или "трансдуцированный" относится к способу, посредством которого экзогенную нуклеиновую кислоту переносят или встраивают в клетку-хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка является клеткой, трансфицированной, трансформированной или трансдуцированной с использованием экзогенной нуклеиновой кислоты. Клетка включает первичную клетку и ее потомство.
Термин "специфически связывается" относится к антителу или лиганду, распознающему и связывающемуся с когнатным белком-партнером по связыванию (например, стимуляторной и/или костимуляторной молекулой, присутствующей на T-клетке), присутствующим в образце, но где антитело или лиганд, по существу, не распознают или не связываются с другими молекулами в образце.
Как применяют в настоящем описании, термин "регулируемый химерный антигенный рецептор (RCAR)" относится к набору полипептидов, как правило, двум в самых простых вариантах осуществления, которые при их наличии в иммунной эффекторной клетке обеспечивают специфичность клетки для клетки-мишени, как правило, злокачественной клетки, и генерирование внутриклеточного сигнала. В некоторых вариантах осуществления RCAR содержит, по меньшей мере, внеклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый в настоящем описании как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, полученный из стимуляторной молекулы и/или костимуляторной молекулы, как определено в настоящем описании в отношении молекулы CAR. В некоторых вариантах осуществления полипептиды в наборе в RCAR не являются смежными друг с другом, например, они находятся в разных полипептидных цепях. В некоторых вариантах осуществления RCAR включает переключатель димеризации, который при наличии молекулы димеризации, может соединять полипептиды друг с другом, например, может соединять антигенсвязывающий домен с внутриклеточным сигнальным доменом. В некоторых вариантах осуществления RCAR экспрессируется в клетке (например, иммунной эффекторной клетке), как представлено в настоящем описании, например, RCAR-экспрессирующей клетке (также обозначаемой в настоящем описании как "клетка RCARX"). В варианте осуществления клетка RCARX является T-клеткой, и ее обозначают как клетку RCART. В варианте осуществления клетка RCARX является NK-клеткой, и ее обозначают как клетку RCARN. RCAR может обеспечивать RCAR-экспрессирующую клетку специфичностью для клетки-мишени, как правило, злокачественной клетки, и генерированием регулируемого внутриклеточного сигнала или пролиферацией, которые могут оптимизировать иммунные эффекторные свойства RCAR-экспрессирующей клетки. В вариантах осуществления клетка RCAR, по меньшей мере, частично, обусловлена антигенсвязывающим доменом в том, что касается специфичности для клетки-мишени, содержащей антиген, связанный антигенсвязывающим доменом.
Как применяют в настоящем описании, термины "мембранный якорь" или "мембраносвязывающий домен" относятся к полипептиду или остатку, например, миристоильной группе, достаточной для заякоривания внеклеточного или внутриклеточного домена в плазматической мембране.
Как применяют в настоящем описании, термин "домен-переключатель", например, в отношении RCAR, относится к веществу, как правило, основанному на полипептиде веществу, которое в присутствие молекулы димеризации связывается с другим доменом-переключателем. Связывание приводит к функциональному соединению первого вещества, связанного, например, слитого, с первым доменом-переключателем, и второго вещества, связанного, например, слитого, со вторым доменом-переключателем. Первый и второй домен-переключатель в совокупности обозначают как переключатель димеризации. В вариантах осуществления первый и второй домены-переключатели являются одинаковыми, например, они являются полипептидами, имеющими одинаковую первичную аминокислотную последовательность, и их в совокупности обозначают как переключатель гомодимеризации. В вариантах осуществления первый и второй домены-переключатели отличаются друг от друга, например, они являются полипептидами, имеющими разные первичные аминокислотные последовательности, и их в совокупности обозначают как переключатель гетеродимеризации. В вариантах осуществления переключатель является внутриклеточным. В вариантах осуществления переключатель является внеклеточным. В вариантах осуществления домен-переключатель является веществом на основе полипептида, например, на основе FKBP или FRB, и молекула димеризации является низкомолекулярным соединением, например, рапалогом. В вариантах осуществления домен-переключатель является веществом на основе полипептида, например, scFv, связывающимся с пептидом myc, и молекула димеризации является полипептидом, его фрагментом или мультимером полипептида, например, лигандом myc или мультимерами лиганда myc, связывающимися с одним или более scFv против myc. В вариантах осуществления домен-переключатель является веществом на основе полипептида, например, рецептором myc, и молекула димеризации является антителом или его фрагментами, например, антителом против myc.
Как применяют в настоящем описании, термин "Молекула димеризации", например, в отношении RCAR, относится к молекуле, стимулирующей связывание первого домена-переключателя со вторым доменом-переключателем. В вариантах осуществления молекула димеризации в природе не встречается у индивидуума или не встречается в концентрациях, которые будут приводить к значительной димеризации. В вариантах осуществления молекула димеризации является низкомолекулярным соединением, например, рапамицином или рапалогом, например, RAD001.
Термин "биоэквивалент" относится к количеству средства, иного, чем референсное соединение (например, RAD001), необходимое для достижения эффекта, эквивалентного эффекту, достигаемому посредством референсной дозы или референсного количества референсного соединения (например, RAD001). В варианте осуществления эффект является уровнем ингибирования mTOR, например, измеряемым по ингибированию киназы P70 S6, например, оцениваемому в анализе in vivo или in vitro, например, измеряемому посредством анализа, представленного в настоящем описании, например, анализа Boulay, или измерения уровней фосфорилированного S6 посредством вестерн-блоттинга. В варианте осуществления эффект является изменением соотношения PD-1-положительных/PD-1-отрицательных T-клеток, измеряемого посредством сортинга клеток. В варианте осуществления биоэквивалентное количество или доза ингибитора mTOR является количеством или дозой, при которой достигают того же уровня ингибирования киназы P70 S6, что и при референсной дозе или референсном количестве референсного соединения. В варианте осуществления биоэквивалентное количество или доза ингибитора mTOR является количеством или дозой, при которой достигают того же уровня изменения соотношения PD-1-положительных/PD-1-отрицательных T-клеток, что и при референсной дозе или референсном количестве референсного соединения.
Термин "низкая, усиливающая иммунитет доза" при использовании в комбинации с ингибитором mTOR, например, аллостерическим ингибитором mTOR, например, RAD001 или рапамицином, или каталитическим ингибитором mTOR, относится к дозе ингибитора mTOR, которая частично, а не полностью, ингибирует активность mTOR, например, измеряемую по ингибированию киназной активности P70 S6. Способы оценки активности mTOR, например, посредством ингибирования киназы P70 S6, представлены в настоящем описании. Доза является недостаточной, чтобы приводить к полной иммуносупрессии, но достаточной для усиления иммунного ответа. В варианте осуществления низкая, усиливающая иммунитет доза ингибитора mTOR приводит к снижению количеств PD-1-положительных иммунных эффекторных клеток, например, T-клеток или NK-клеток, и/или повышению количества PD-1-отрицательных иммунных эффекторных клеток, например, T-клеток или NK-клеток, или повышению соотношения PD-1-отрицательных иммунных эффекторных клеток (например, T-клеток или NK-клеток)/PD-1-положительных иммунных эффекторных клеток (например, T-клеток или NK-клеток).
В варианте осуществления низкая, усиливающая иммунитет доза ингибитора mTOR приводит к повышению количества наивных T-клеток. В варианте осуществления низкая, усиливающая иммунитет доза ингибитора mTOR приводит к одному или более из следующего:
повышению экспрессии одного или более из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, предшественниках T-клеток памяти;
снижению экспрессии KLRG1, например, на T-клетках памяти, например, предшественниках T-клеток памяти; и
повышению количества предшественников T-клеток памяти, например, клеток с любой из следующих характеристик или их комбинацией: повышенным CD62Lhigh, повышенным CD127high, повышенным CD27+, сниженным KLRG1 и повышенным BCL2;
где любое из описываемых выше изменений происходит, например, по меньшей мере, транзиторно, например, по сравнению с неподвергнутым лечению индивидуумом.
Как применяют в настоящем описании, термин "рефрактерный" относится к заболеванию, например, злокачественному новообразованию, не отвечающему на лечение. В вариантах осуществления рефрактерное злокачественное новообразование может являться резистентным к лечению до лечения или в его начале. В других вариантах осуществления рефрактерное злокачественное новообразование может становиться резистентным в течение лечения. Рефрактерное злокачественное новообразование также называют резистентным злокачественным новообразованием.
Как применяют в настоящем описании, термины "рецидивирующий" или "рецидив" относится к повторному появлению заболевания (например, злокачественного новообразования) или признаков и симптомов заболевания, такого как злокачественное новообразование, после периода улучшения или отвечаемости, например, после предшествующего лечения, например, терапии злокачественного новообразования. Например, период отвечаемости может включать уровень злокачественных клеток ниже конкретного порогового значения, например, ниже 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%. Повторное появление может включать уровень злокачественных клеток, повышающийся выше конкретного порогового значения, например, выше 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%.
Диапазоны: на всем протяжении настоящего описания различные аспекты изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона представлено исключительно для удобства и краткости, и его не следует истолковывать в качестве жесткого ограничения объема изобретения. Таким образом, описание диапазона следует считать конкретно описывающим все возможные поддиапазоны, а также отдельные числовые значения в этом диапазоне. Например, описание диапазона, такого как от 1 до 6, следует считать конкретно описывающим поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельные числа в этом диапазоне, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. В качестве другого примера, диапазон, такой как 95-99% идентичности, включает что-либо с 95%, 96%, 97%, 98% или 99% идентичности, и включает поддиапазоны, такие как 96-99%, 96-98%, 96-97%, 97-99%, 97-98% и 98-99% идентичности. Это применимо независимо от широты диапазона.
Описание
Настоящее изобретение относится к композициям по настоящему изобретению и способам применения для лечения заболевания, такого как злокачественное новообразование, с использованием клеток, экспрессирующих химерные антигенные рецепторы (CAR) BCMA, например, CART-BCMA.
В одном из аспектов изобретение относится к ряду химерных антигенных рецепторов (CAR), содержащих антитело или фрагмент антитела, сконструированное для повышенного связывания с белком BCMA. В одном из аспектов изобретение относится к клетке (например, иммунной эффекторной клетке, например, T-клетке или NK-клетке), сконструированной для экспрессии CAR, где CAR T-клетка ("CART") или CAR NK-клетка проявляет противоопухолевые свойства. В одном из аспектов клетку трансформируют с использованием CAR, и CAR экспрессируется на поверхности клетки. В некоторых вариантах осуществления клетку (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку) трансдуцируют с использованием вирусного вектора, кодирующего CAR. В некоторых вариантах осуществления вирусный вектор является ретровирусным вектором. В некоторых вариантах осуществления вирусный вектор является лентивирусными векторами. В некоторых таких вариантах осуществления клетка может стабильно экспрессировать CAR. В другом варианте осуществления клетку (например, иммунную эффекторную клетку, например, T-клетку или NK-клетку) трансфицируют с использованием нуклеиновой кислотой, например, мРНК, кДНК, ДНК, кодирующей CAR. В некоторых таких вариантах осуществления клетка может транзиторно экспрессировать CAR.
В одном из аспектов антигенсвязывающая часть CAR против BCMA является scFv-фрагментом антитела. В одном из аспектов такие фрагменты антител являются функциональными таким образом, что они сохраняют эквивалентную аффинность связывания, например, они связывают со сравнимой эффективностью тот же антиген, что и антитело IgG, из которого его получают. В других вариантах осуществления фрагмент антитела имеет более низкую аффинность связывания, например, он связывает тот же антиген с более низкой аффинностью связывания, чем антитело, из которого его получают, но он является функциональным таким образом, что он обеспечивает биологический ответ, представленный в настоящем описании. В одном из вариантов осуществления молекула CAR содержит фрагмент антитела, имеющий аффинность связывания KD от 10-4 M до 10-8 M, например, от 10-5 M до 10-7 M, например, 10-6 M или 10-7 M, для антигена-мишени. В одном из вариантов осуществления фрагмент антитела имеет аффинность связывания, являющуюся по меньшей мере в пять раз, в 10 раз, в 20 раз, в 30 раз, в 50 раз, в 100 раз или в 1000 раз меньшую, чем у референсного антитела, например, антитела, представленного в настоящем описании.
В одном из аспектов такие фрагменты антител являются функциональными таким образом, что они обеспечивают биологический ответ, который может включать, в качестве неограничивающих примеров, активацию иммунного ответа, ингибирование источника передачи сигнала от антигена-мишени, ингибирование киназной активности и т.п., как будет понятно специалистам в этой области. В одном из аспектов антигенсвязывающий домен CAR против BCMA является scFv-фрагментом антитела, являющимся гуманизированным по сравнению с последовательностью scFv мыши, из которого его получают. В одном из вариантов осуществления антигенсвязывающий домен против BCMA является антигенсвязывающим доменом человека против BCMA. В одном из вариантов осуществления антигенсвязывающий домен против BCMA является гуманизированным антигенсвязывающим доменом против BCMA.
В некоторых аспектах антитела по изобретению встраивают с химерный антигенный рецептор (CAR). В одном из аспектов CAR содержит BCMA-связывающий домен, содержащий последовательность SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 или SEQ ID NO: 266. В одном из аспектов scFV-домены являются человеческими. В другом аспекте scFV-домены являются гуманизированными вариантами scFV-домена антител или фрагментов антител, описываемых в публикации PCT № WO2012/163805, патенте США № 7083785, патенте EP № 1975231 B1 или публикации PCT № WO13/154760 (содержание каждого из которых, таким образом, включено в настоящее описание в качестве ссылки в полном объеме), в которых описывают антитела или scFv-фрагменты мышиного происхождения, специфически связывающиеся с BCMA человека. Гуманизация этих антител и/или scFv мыши может являться желательной для клинических условий, где специфичные для мыши остатки могут индуцировать ответ человека против антигена мыши (HAMA) у пациентов, которым проводили лечение CART-BCMA, например, лечение с использованием иммунных эффекторных клеток, например, T-клеток или NK-клеток, трансдуцированных с использованием конструкции CAR против BCMA.
В одном из аспектов связывающий домен против BCMA, например, человеческий или гуманизированный scFv, часть CAR по изобретению кодируется трансгеном, последовательность которого кодон-оптимизирована для экспрессии в клетке млекопитающего. В одном из аспектов целая конструкция CAR по изобретению кодируется трансгеном, целая последовательность которого кодон-оптимизирована для экспрессии в клетке млекопитающего. Оптимизация кодонов относится к открытию того, что частота возникновения синонимичных кодонов (т.е. кодонов, кодирующих одну аминокислоту) в кодирующей ДНК различается у различных видов. Такая вырожденность кодонов позволяет идентичному полипептиду кодироваться множеством нуклеотидных последовательностей. В этой области известен ряд способов оптимизации кодонов, и они включают, например, способы, описываемые, по меньшей мере, в патентах США №№ 5786464 и 6114148.
В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 39. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 40. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 41. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 42. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 43. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 44. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 45. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 46. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 47. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 48. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 49. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 50. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 51. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 52. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 53. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 129. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 130. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 131. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 132. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 133. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 134. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 135. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 136. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 137. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 138. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 139. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 140. В одном из аспектов связывающий домен человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 141. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 142. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 143. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 144. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 145. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 146. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 147. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 148. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 149. В одном из аспектов гуманизированный связывающий домен против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 255. В одном из аспектов гуманизированный CAR против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 257.
В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 263. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 264. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 265. В одном из аспектов CAR человека против BCMA содержит scFv-часть, приведенную в SEQ ID NO: 266.
В одном из аспектов в CAR по изобретению комбинируют антигенсвязывающий домен конкретного антитела с внутриклеточной сигнальной молекулой. Например, в некоторых аспектах внутриклеточная сигнальная молекула включает, в качестве неограничивающих примеров, сигнальные модули дзета-цепи CD3, 4-1BB и CD28 и их комбинации. В одном из аспектов антигенсвязывающий домен связывается с BCMA. В одном из аспектов CAR BCMA содержит CAR, выбранный из последовательности, представленной в одной или более из SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 и SEQ ID NO: 233. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 99. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 100. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 101. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 102. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 103. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 104. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 105. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 106. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 107. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 108. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 109. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 110. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 111. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 112. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 213. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 214. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 215. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 216. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 217. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 218. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 219. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 220. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 221. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 222. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 223. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 224. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 225. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 226. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 227. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 228. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 229. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 230. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 231. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 232. В одном из аспектов CAR BCMA содержит последовательность, приведенную в SEQ ID NO: 233.
Кроме того, настоящее изобретение относится к композициям CAR BCMA и их применению в лекарственных веществах или способах лечения, среди прочих заболеваний, злокачественного новообразования или аутоиммунных заболеваний, включающих клетки или ткани, экспрессирующие BCMA.
В одном из аспектов CAR по изобретению можно использовать для эрадикации BCMA-экспрессирующих нормальных клеток, таким образом, он подходит для применения в качестве клеточного кондиционирования перед трансплантацией клеток. В одном из аспектов BCMA-экспрессирующая нормальная клетка является BCMA-экспрессирующей нормальной стволовой клеткой, и трансплантация клеток является трансплантацией стволовых клеток.
В одном из аспектов изобретение относится к клетке (например, T-клетке или NK-клетке), сконструированной для экспрессии химерного антигенного рецептора (CAR), где CAR T-клетка ("CART") или CAR NK-клетка проявляет противоопухолевые свойства. Предпочтительным антигеном является BCMA. В одном из аспектов антигенсвязывающий домен CAR содержит фрагмент антитела человека против BCMA или частично гуманизированный фрагмент антитела против BCMA. В одном из аспектов антигенсвязывающий домен CAR содержит фрагмент антитела человека против BCMA или частично гуманизированный фрагмент антитела против BCMA, содержащий scFv. Таким образом, изобретение относится к BCMA-CAR, содержащему гуманизированный связывающий домен против BCMA и сконструированному в клетке, например, T-клетке или NK-клетке, и способам их применения для адоптивной терапии.
В одном из аспектов BCMA-CAR содержит по меньшей мере один внутриклеточный домен, выбранный из группы сигнального домена CD137 (4-1BB), сигнального домена CD28, сигнального домена CD3 дзета и любой их комбинации. В одном из аспектов BCMA-CAR содержит по меньшей мере один внутриклеточный сигнальный домен из одной или более костимуляторных молекул, иных, чем CD137 (4-1BB) или CD28.
Химерный антигенный рецептор (CAR)
Настоящее изобретение относится к CAR (например, полипептиду CAR), содержащему связывающий домен против BCMA (например, человеческий или гуманизированный BCMA-связывающий домен, как представлено в настоящем описании), трансмембранный домен и внутриклеточный сигнальный домен, и где указанный связывающий домен против BCMA содержит определяющую комплементарность область тяжелой цепи 1 (CDR1 HC), определяющую комплементарность область тяжелой цепи 2 (CDR2 HC) и определяющую комплементарность область тяжелой цепи 3 (CDR3 HC) из любых аминокислотных последовательностей связывающего домена тяжелой цепи против BMCA, представленных в таблице 1 или 16. Связывающий домен против BCMA CAR может дополнительно содержать определяющую комплементарность область легкой цепи 1 (CDR1 LC), определяющую комплементарность область легкой цепи 2 (CDR2 LC) и определяющую комплементарность область легкой цепи 3 (CDR3 LC) из любых аминокислотных последовательностей связывающего домена тяжелой цепи против BMCA, представленных в таблице 1 или 16.
Настоящее изобретение также относится к молекулам нуклеиновой кислоты, кодирующим CAR, как представлено в настоящем описании, например, кодирующим CAR, содержащий связывающий домен против BCMA (например, человеческий или гуманизированный BCMA-связывающий домен, как представлено в настоящем описании), трансмембранный домен и внутриклеточный сигнальный домен, и где указанный связывающий домен против BCMA содержит определяющую комплементарность область тяжелой цепи 1 (CDR1 HC), определяющую комплементарность область тяжелой цепи 2 (CDR2 HC) и определяющую комплементарность область тяжелой цепи 3 (CDR3 HC) из любых аминокислотных последовательностей связывающего домена тяжелой цепи против BMCA, представленных в таблице 1 или 16. В одном из вариантов осуществления кодируемый связывающий домен против BCMA CAR может дополнительно содержать определяющую комплементарность область легкой цепи 1 (CDR1 LC), определяющую комплементарность область легкой цепи 2 (CDR2 LC) и определяющую комплементарность область легкой цепи 3 (CDR3 LC) из любых аминокислотных последовательностей связывающего домена тяжелой цепи против BMCA, представленных в таблице 1 или 16.
В конкретных аспектах конструкция CAR по изобретению содержит scFV-домен, выбранный из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265, и SEQ ID NO: 266, где scFv может предшествовать необязательная лидерная последовательность, такая, как приведено в SEQ ID NO: 1, и после нее может следовать необязательная шарнирная последовательность, такая, как приведено в SEQ ID NO: 2 или SEQ ID NO: 3 или SEQ ID NO: 4 или SEQ ID NO: 5, трансмембранная область, такая, как приведено в SEQ ID NO: 6, внутриклеточный сигнальный домен, включающий SEQ ID NO: 7 или SEQ ID NO: 8, и последовательность CD3 дзета, включающую SEQ ID NO: 9 или SEQ ID NO: 10, где домены являются смежными и находятся в одной рамке считывания для образования единого слитого белка. В настоящее изобретение также включена нуклеотидная последовательность, кодирующая полипептид каждого из scFv-фрагментов, выбранных из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 и SEQ ID NO: 266.
В настоящее изобретение также включена нуклеотидная последовательность, кодирующая полипептид каждого из scFv-фрагментов, выбранных из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265 и SEQ ID NO: 266, и каждый из доменов SEQ ID NO: 1, 2 и 6-9, и кодируемый слитый белок CAR BCMA по изобретению.
В одном из аспектов примеры конструкций BCMA CAR содержат необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнирный, трансмембранный домен и внутриклеточный стимуляторный домен. В одном из аспектов пример конструкции CAR BCMA содержит необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнирный, трансмембранный домен, внутриклеточный костимуляторный домен и внутриклеточный стимуляторный домен. Конкретные конструкции BCMA CAR, содержащие scFV-домены человека по изобретению, приведены как SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 и SEQ ID NO: 149. Полноразмерные последовательности CAR также представлены в настоящем описании как SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 и SEQ ID NO: 149, как представлено в таблице 1.
Пример лидерной последовательности приведен как SEQ ID NO: 1. Пример шарнирной/спейсерной последовательности приведен как SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5. Пример последовательности трансмембранного домена приведен как SEQ ID NO: 6. Пример последовательности внутриклеточного сигнального домена белка 4-1BB приведен как SEQ ID NO: 7. Пример последовательности внутриклеточного сигнального домена CD27 приведен как SEQ ID NO: 8. Пример последовательности домена CD3 дзета приведен как SEQ ID NO: 9 или SEQ ID NO: 10.
В одном из аспектов настоящее изобретение относится к рекомбинантной конструкции нуклеиновой кислоты, содержащей молекулу нуклеиновой кислоты, кодирующую CAR, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую связывающий домен против BCMA, например, представленный в настоящем описании, являющийся смежным и находящийся в той же рамке считывания, что и последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен. В одном из аспектов связывающий домен против BCMA выбран из одной или более из SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155, SEQ ID NO: 156, SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169 и SEQ ID NO: 170. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 54.В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 55. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 56. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 57. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 58. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 59. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 60. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 61. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 62. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 63. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 64. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 65. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 66. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 67. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 68. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 150. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 151. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 152. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 153. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 154. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 155. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 156. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 157. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 158. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 159. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 160. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 161. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 162. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 163. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 164. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 165. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 166. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 167. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 168. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 169. В одном из аспектов связывающий домен против BCMA содержит SEQ ID NO: 170.
В одном из аспектов настоящее изобретение относится к рекомбинантной конструкции нуклеиновой кислоты, содержащей молекулу нуклеиновой кислоты, кодирующую CAR, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую связывающий домен против BCMA, выбранный из одного или более из SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155, SEQ ID NO: 156, SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169 и SEQ ID NO: 170, например, где последовательность является смежной и находится в той же рамке считывания, что и последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен. Неограничивающий пример внутриклеточного сигнального домена, который можно использовать в CAR, включает один или более внутриклеточных сигнальных доменов, например, из CD3 дзета, CD28, 4-1BB и т.п. В некоторых случаях CAR может содержать любую комбинацию CD3 дзета, CD28, 4-1BB и т.п. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR по изобретению выбрана из одной или более из SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 234, SEQ ID NO: 235, SEQ ID NO: 236, SEQ ID NO: 237, SEQ ID NO: 238, SEQ ID NO: 239, SEQ ID NO: 240, SEQ ID NO: 241, SEQ ID NO: 242, SEQ ID NO: 243, SEQ ID NO: 244, SEQ ID NO: 245, SEQ ID NO: 246, SEQ ID NO: 247, SEQ ID NO: 248, SEQ ID NO: 249, SEQ ID NO: 250, SEQ ID NO: 251, SEQ ID NO: 252, SEQ ID NO: 253 или SEQ ID NO: 254. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 114. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 115. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 116. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 117. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 118. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 119. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 120. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 121. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 122. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 123. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 124. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 125. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 126. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 127. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 128. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 234. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 235. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 236. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 237. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 238. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 239. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 240. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 241. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 242. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 243. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 244. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 245. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 246. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 247. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 248. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 249. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 250. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 251. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 252. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 253. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR является SEQ ID NO: 254.
Последовательности нуклеиновой кислоты, кодирующие желаемые молекулы, можно получать известными в этой области рекомбинантными способами, такими как, например, скрининг библиотек из клеток, экспрессирующих ген, получая ген из вектора, о котором известно, что он его включает, или выделяя его непосредственно из клеток и тканей, содержащих его, стандартными способами. Альтернативно, интересующую нуклеиновую кислоту можно получать синтетически, а не клонировать.
Настоящее изобретение относится к конструкциям ретровирусных и лентивирусных векторов, экспрессирующих CAR, которые можно напрямую трансдуцировать в клетку.
Настоящее изобретение также относится к конструкции РНК, которую можно напрямую трансфицировать в клетку. Способ получения мРНК для использования в трансфекции включает транскрипцию in vitro (IVT) матрицы с использованием специально сконструированных праймеров с последующим добавлением поли-A для получения конструкции, содержащей 3'- и 5'-нетранслируемую последовательность ("UTR"), 5'-кэп и/или внутренний участок связывания рибосомы (IRES), нуклеиновую кислоту, подлежащую экспрессии, и поли(A)-хвост, как правило, длиной 50-2000 оснований (SEQ ID NO: 35). Получаемую таким образом РНК можно эффективно трансфицировать в различные типы клеток. В одном из вариантов осуществления матрица включает последовательности CAR. В варианте осуществления вектор РНК CAR трансдуцируют в клетку, например, T-клетку или NK-клетку, посредством электропорации.
Антигенсвязывающий домен
CAR по настоящему изобретению содержат мишене-специфический связывающий домен. Выбор остатка зависит от типа и количества лигандов, определяющих поверхность клетки-мишени. Например, можно выбирать антигенсвязывающий домен, распознающий антиген, действующий в качестве поверхностного клеточного маркера на клетках-мишенях, ассоциированных с конкретным заболеванием.
В одном из аспектов CAR-опосредованный T-клеточный ответ можно направлять против интересующего антигена посредством конструирования антигенсвязывающего домена, специфически связывающегося с желаемым антигеном, в CAR.
В одном из аспектов CAR по настоящему изобретению содержит связывающий домен, специфически связывающийся с BCMA. В одном из аспектов CAR по настоящему изобретению содержит антигенсвязывающий домен, специфически связывающийся с BCMA человека.
Антигенсвязывающий домен может являться любым белком, связывающимся с антигеном, включая, в качестве неограничивающих примеров, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, антитело человека, гуманизированное антитело и его функциональный фрагмент, включая, в качестве неограничивающих примеров, однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен (VHH) нанотела верблюжьего происхождения, и альтернативный каркас, о котором в этой области известно, что он функционирует как антигенсвязывающий домен, такой как рекомбинантный фибронектиновый домен, и т.п. В некоторых случаях полезно получать антигенсвязывающий домен из того же вида, в котором CAR будут, в конечном итоге, использовать. Например, для применения у людей может быть полезным, чтобы антигенсвязывающий домен CAR содержал человеческие или гуманизированные остатки для антигенсвязывающего домена антитела или фрагмента антитела.
Таким образом, в одном из аспектов антигенсвязывающий домен содержит человеческое или гуманизированное антитело или фрагмент антитела. В одном из вариантов осуществления связывающий домен человека против BCMA содержит одну или более (например, все три) из определяющей комплементарность области легкой цепи 1 (CDR1 LC), определяющей комплементарность области легкой цепи 2 (CDR2 LC) и определяющей комплементарность области легкой цепи 3 (CDR3 LC) связывающего домена человека против BCMA, представленного в настоящем описании, и/или одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) связывающего домена человека против BCMA, представленного в настоящем описании, например, связывающего домена человека против BCMA, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC. В одном из вариантов осуществления связывающий домен человека против BCMA содержит одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) связывающего домена человека против BCMA, представленного в настоящем описании, например, связывающий домен человека против BCMA содержит две вариабельные области тяжелой цепи, каждая из которых содержит CDR1 HC, CDR2 HC и CDR3 HC, представленные в настоящем описании. В одном из вариантов осуществления связывающий домен человека против BCMA содержит вариабельную область легкой цепи человека, представленную в настоящем описании (например, в таблице 1), и/или вариабельную область тяжелой цепи человека, представленную в настоящем описании (например, в таблице 1). В одном из вариантов осуществления связывающий домен человека против BCMA содержит вариабельную область тяжелой цепи человека, представленную в настоящем описании (например, в таблице 1), например, по меньшей мере две вариабельные области тяжелой цепи человека, представленные в настоящем описании (например, в таблице 1). В одном из вариантов осуществления связывающий домен против BCMA является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью из таблицы 1. В варианте осуществления связывающий домен против BCMA (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 1, или последовательности с 95-99% идентичности по отношению к аминокислотной последовательности из таблицы 11, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 1, или последовательность с 95-99% идентичности по отношению к аминокислотной последовательности из таблицы 1.
В одном из вариантов осуществления связывающий домен человека против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 и SEQ ID NO: 149, или последовательность с 95-99% идентичности по отношению к ней. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая связывающий домен человека против BCMA, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155, SEQ ID NO: 156, SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169 и SEQ ID NO: 170, или последовательность с 95-99% идентичности по отношению к ней. В одном из вариантов осуществления связывающий домен человека против BCMA является scFv, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1, соединяют с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, представленную в настоящем описании, например, в таблице 1, с помощью линкера, например, линкера, представленного в настоящем описании. В одном из вариантов осуществления связывающий домен человека против BCMA включает линкер (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи. В одном из аспектов часть антигенсвязывающего домена содержит одну или более последовательностей, выбранных из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, и SEQ ID NO: 149. В одном из аспектов CAR выбран из одной или более последовательностей, выбранных из SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 и SEQ ID NO: 233.
В одном из вариантов осуществления связывающий домен против BCMA содержит вариабельную область легкой цепи, представленную в настоящем описании (например, в таблице 16), и/или вариабельную область тяжелой цепи, представленную в настоящем описании (например, в таблице 16). В одном из вариантов осуществления кодируемый гуманизированный связывающий домен против BCMA содержит вариабельную область легкой цепи, приведенную в SEQ ID NO: 259, SEQ ID NO: 260, SEQ ID NO: 261, SEQ ID NO: 262, и/или вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 255, SEQ ID NO: 256, SEQ ID NO: 257, SEQ ID NO: 258. В одном из вариантов осуществления кодируемый связывающий домен против BCMA является scFv, содержащим легкую цепь и тяжелую цепь с аминокислотной последовательностью из таблицы 16. В варианте осуществления человеческий или гуманизированный связывающий домен против BCMA (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в SEQ ID NO: 259, SEQ ID NO: 260, SEQ ID NO: 261, SEQ ID NO: 262, или последовательность с 95-99% идентичности по отношению к ним, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в SEQ ID NO: 255, SEQ ID NO: 256, SEQ ID NO: 257, SEQ ID NO: 258, или последовательность с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления кодируемый связывающий домен против BCMA включает линкер (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном из вариантов осуществления связывающий домен человека против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 263, SEQ ID NO: 264, SEQ ID NO: 265, и SEQ ID NO: 266, или последовательность с 95-99% идентичности по отношению к ним.
В некоторых аспектах не принадлежащее человеку антитело является гуманизированным, где конкретные последовательности или области антитела модифицируют для повышения сходства с антителом, в природе продуцирующимся у человека, или его фрагментом. В одном из аспектов антигенсвязывающий домен является гуманизированным.
Гуманизированное антитело можно получать с использованием ряда способов, известных в этой области, включая, в качестве неограничивающих примеров, пересадку CDR (см., например, европейский патент № EP 239400, международную публикацию № WO91/09967 и патенты США №№ 5225539, 5530101 и 5585089, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме), рекомбинацию поверхностных остатков или изменение поверхностных остатков (см., например, европейские патенты №№ EP 592106 и EP 519596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., 1994, Protein Engineering, 7(6):805-814 и Roguska et al., 1994, PNAS, 91:969-973, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме), перестановку цепей (см., например, патент США № 5565332, включенный в настоящее описание в качестве ссылки в полном объеме) и способы, описываемые, например, в публикации патентной заявки США № US2005/0042664, публикации патентной заявки США № US2005/0048617, патенте США № 6407213, патенте США № 5766886, международной публикации № WO9317105, Tan et al., J. Immunol., 169:1119-25 (2002), Caldas et al., Protein Eng., 13(5):353-60 (2000), Morea et al., Methods, 20(3):267-79 (2000), Baca et al., J. Biol. Chem., 272(16):10678-84 (1997), Roguska et al., Protein Eng., 9(10):895-904 (1996), Couto et al., Cancer Res., 55 (23 Supp):5973s-5977s (1995), Couto et al., Cancer Res., 55(8):1717-22 (1995), Sandhu J S, Gene, 150(2):409-10 (1994), и Pedersen et al., J. Mol. Biol., 235(3):959-73 (1994), каждый из которых включен в настоящее описание в качестве ссылки в полном объеме. Зачастую каркасные остатки в каркасных областях будут заменять соответствующим остатком из CDR-донорного антитела для изменения, например, улучшения, связывания антигена. Эти замены каркаса, например консервативные замены, идентифицируют способами, хорошо известными в этой области, например, посредством моделирования взаимодействий CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена, и сравнения последовательности для идентификации необычных каркасных остатков в конкретных положениях (см., например, Queen et al., патент США № 5585089 и Riechmann et al., 1988, Nature, 332:323, включенные в настоящее описание в качестве ссылки в полном объеме).
Гуманизированное антитело или фрагмент антитела содержит один или более аминокислотных остатков, оставшихся в нем, из источника, не принадлежащего человеку. Эти не принадлежащие человеку аминокислотные остатки часто обозначают как "импортированные" остатки, как правило, взятые из "импортированного" вариабельного домена. Как представлено в настоящем описании, гуманизированные антитела или фрагменты антител содержат одну или более CDR из не принадлежащих человеку молекул иммуноглобулина и каркасные области, где аминокислотные остатки, содержащие каркас, получают полностью или в основном из зародышевой линии человека. В этой области хорошо известно множество способов гуманизации антител или фрагментов антител, и ее можно осуществлять, по существу, способом Winter и соавторов (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), посредством замены CDR грызуна или последовательностей CDR соответствующими последовательностями антитела человека, т.е. пересадки CDR (EP 239400, публикация PCT № WO91/09967 и патенты США №№ 4816567, 6331415, 5225539, 5530101, 5585089, 6548640, содержание которых включено в настоящее описание в качестве ссылки в полном объеме). В таких гуманизированных антителах и фрагментах антител, по существу, менее чем интактный вариабельный домен человека заменяют соответствующей последовательностью не являющихся человеком видов. Гуманизированные антитела часто являются антителами человека, в которых некоторые остатки CDR и, возможно, некоторые каркасные (FR) остатки заменяют остатками из аналогичных участков в антителах грызуна. Гуманизацию антител и фрагментов антител также можно осуществлять посредством ремоделирования поверхностных остатков, или изменения поверхностных остатков (EP 592106, EP 519596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., Protein Engineering, 7(6):805-814 (1994) и Roguska et al., PNAS, 91:969-973 (1994)), или перестановки цепей (патент США № 5565332, содержание которого включено в настоящее описание в качестве ссылки в полном объеме).
Выбор вариабельных доменов человека и легких, и тяжелых цепей для использования в получении гуманизированных антител основан на снижении антигенности. В соответствии с так называемым способом "лучшего совпадения" последовательность вариабельного домена антитела грызуна подвергают скринингу относительно целой библиотеки известных последовательностей вариабельного домена человека. Затем последовательность человека, наиболее близкую к последовательности грызуна, принимают в качестве каркаса человека (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987), содержание которых включено в настоящее описание в качестве ссылок в полном объеме). В другом способе используют конкретный каркас, полученный из консенсусной последовательности всех антител человека из конкретной подгруппы легких или тяжелых цепей. Тот же каркас можно использовать для нескольких других гуманизированных антител (см., например, Nicholson et al. Mol. Immun. 34 (16-17): 1157-1165 (1997); Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993), содержание которых включено в настоящее описание в качестве ссылок в полном объеме). В некоторых вариантах осуществления каркасную область, например, все четыре каркасные области, вариабельной области тяжелой цепи получают из последовательности зародышевой линии VH4_4-59. В одном из вариантов осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, консервативных замен, например, аминокислоты в соответствующей последовательности мыши. В одном из вариантов осуществления каркасную область, например, все четыре каркасные области вариабельной области легкой цепи получают из последовательности зародышевой линии VK3_1.25. В одном из вариантов осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, консервативных замен, например, аминокислот в соответствующей последовательности мыши.
В некоторых аспектах часть композиции CAR по изобретению, содержащей фрагмент антитела, является гуманизированной с сохранением высокой аффинности к антигену-мишени и других предпочтительных биологических свойств. По одному из аспектов изобретения гуманизированные антитела и фрагменты антител получают способом анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов широкодоступны и хорошо известны специалистам в этой области. Доступны компьютерные программы, иллюстрирующие и демонстрирующие возможные трехмерные конформационные структуры выбранных иммуноглобулиновых последовательностей-кандидатов. Изучение этих отображенных данных делает возможным анализ вероятной роли остатков в функционировании иммуноглобулиновой последовательности-кандидата, например, анализ остатков, влияющих на способность иммуноглобулина-кандидата связываться с антигеном-мишенью. Таким образом, остатки FR можно выбирать и комбинировать с последовательностями реципиента и импортированными последовательностями таким образом, что достигают желаемой характеристики антитела или фрагмента антитела, такой как повышенная аффинность к антигену-мишени. В основном, остатки CDR напрямую и наиболее существенно влияют на связывание антигена.
Гуманизированное антитело или фрагмент антитела может сохранять антигенную специфичность, схожую с исходным антителом, например, в настоящем изобретении способность связываться с BCMA человека. В некоторых вариантах осуществления гуманизированное антитело или фрагмент антитела может иметь улучшенную аффинность и/или специфичность связывания с BCMA человека.
В одном из вариантов осуществления гуманизированный связывающий домен CAR против BCMA содержит одну или более (например, все три) из определяющей комплементарность области легкой цепи 1 (CDR1 LC), определяющей комплементарность области легкой цепи 2 (CDR2 LC) и определяющей комплементарность области легкой цепи 3 (CDR3 LC) гуманизированного связывающего домена против BCMA, представленного в настоящем описании, и/или одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) гуманизированного связывающего домена против BCMA, представленного в настоящем описании, например, гуманизированного связывающего домена против BCMA, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC. В одном из вариантов осуществления гуманизированный связывающий домен против BCMA содержит одну или более (например, все три) из определяющей комплементарность области тяжелой цепи 1 (CDR1 HC), определяющей комплементарность области тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области тяжелой цепи 3 (CDR3 HC) гуманизированного связывающего домена против BCMA, представленного в настоящем описании, например, гуманизированный связывающий домен против BCMA содержит две вариабельные области тяжелой цепи, каждая из которых содержит CDR1 HC, CDR2 HC и CDR3 HC, представленные в настоящем описании. В одном из вариантов осуществления гуманизированный связывающий домен против BCMA содержит гуманизированную вариабельную область легкой цепи, представленную в настоящем описании (например, SEQ ID NO: 255 или 257), и/или вариабельную область тяжелой цепи человека, представленную в настоящем описании (например, SEQ ID NO: 255 или 257).
В одном из аспектов связывающий домен против BCMA отличается конкретными функциональными признаками или свойствами антитела или фрагмента антитела. Например, в одном из аспектов часть композиции CAR по изобретению, содержащей антигенсвязывающий домен, специфически связывается с BCMA человека.
В одном из аспектов антигенсвязывающий домен имеет ту же или схожую специфичность связывания с BCMA человека, что и с BCMA мыши. В одном из аспектов изобретение относится к антигенсвязывающему домену, содержащему антитело или фрагмент антитела, где связывающий домен антитела специфически связывается с белком BCMA или его фрагментом, где антитело или фрагмент антитела содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 или SEQ ID NO: 149. В одном из аспектов антигенсвязывающий домен содержит аминокислотную последовательность scFv, выбранную из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 или SEQ ID NO: 149. В определенных аспектах scFv является смежным и находится в той же рамке считывания, что и лидерная последовательность. В одном из аспектов лидерная последовательность является полипептидной последовательностью, приведенной как SEQ ID NO: 1.
В одном из аспектов связывающий домен против BCMA является фрагментом, например, одноцепочечным вариабельным фрагментом (scFv). В одном из аспектов связывающий домен против BCMA является Fv, Fab, (Fab')2 или бифункциональным (например, биспецифическим) гибридным антителом (например, Lanzavecchia et al., Eur. J. Immunol. 17, 105 (1987)). В одном из аспектов антитела и их фрагменты по изобретению связываются с белком BCMA с аффинностью антитела дикого типа или повышенной аффинностью.
В некоторых случаях scFv можно получать известным в этой области способом (см., например, Bird et al., (1988) Science 242:423-426 и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Молекулы scFv можно получать, связывая области VH и VL с использованием гибких полипептидных линкеров. Молекулы scFv содержат линкер (например, линкер Ser-Gly) с оптимизированной длиной и/или аминокислотной композицией. Длина линкера может значительно влиять на то, как сворачиваются и взаимодействуют вариабельные области scFv. Фактически, при использовании короткого полипептидного линкера (например, 5-10 аминокислот) предотвращают внутрицепочечный фолдинг. Межцепочечный фолдинг также необходим для удержания двух вариабельных областей вместе для образования функционального эпитоп-связывающего участка. Примеры ориентации и размера линкера см., например, в Hollinger et al. 1993 Proc Natl Acad. Sci. U.S.A. 90:6444-6448, публикациях патентных заявок США №№ 2005/0100543, 2005/0175606, 2007/0014794 и публикациях PCT №№ WO2006/020258 и WO2007/024715, включенных в настоящее описание в качестве ссылок.
ScFv может содержать линкер из по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50 или более аминокислотных остатков между его областями VL и VH. Последовательность линкера может содержать любую природную аминокислоту. В некоторых вариантах осуществления последовательность линкера содержит аминокислоты глицин и серин. В другом варианте осуществления последовательность линкера содержит наборы глициновых и сериновых повторов, такие как (Gly4Ser)n, где n является положительным целым числом, равным 1 или более 1 (SEQ ID NO: 25). В одном из вариантов осуществления линкер может являться (Gly4Ser)4 (SEQ ID NO: 27) или (Gly4Ser)3(SEQ ID NO: 28). Изменение длины линкера может приводить к сохранению или повышению активности, приводя к превосходящей эффективности в исследованиях активности.
Примеры конструкций BCMA CAR человека и антигенсвязывающих доменов
Примеры конструкций BCMA CAR, представленные в настоящем описании, содержат scFv (например, scFv описываемый в таблицах 1 или 16, которому, необязательно, предшествует необязательная лидерная последовательность (например, SEQ ID NO: 1 и SEQ ID NO: 12 в качестве примера лидерных аминокислотных и нуклеотидных последовательностей, соответственно). Последовательности scFv-фрагментов (SEQ ID NO: 39-53, 129-149 или 263-266, не включая необязательную лидерную последовательность) представлены в настоящем описании в таблицах 1 или 16. Конструкция CAR BCMA может дополнительно включать необязательный шарнирный домен, например, шарнирный домен CD8 (например, включающий аминокислотную последовательность SEQ ID NO: 2 или кодируемый последовательностью нуклеиновой кислоты SEQ ID NO: 13), трансмембранный домен, например, трансмембранный домен CD8 (например, включающий аминокислотную последовательность SEQ ID NO: 6 или кодируемый нуклеотидной последовательностью SEQ ID NO: 17), внутриклеточный домен, например, внутриклеточный домен 4-1BB (например, включающий аминокислотную последовательность SEQ ID NO: 7 или кодируемый нуклеотидной последовательностью SEQ ID NO: 18), и функциональный сигнальный домен, например, домен CD3 дзета (например, включающий аминокислотную последовательность SEQ ID NO: 9 или 10 или кодируемый нуклеотидной последовательностью SEQ ID NO: 20 или 21). В определенных вариантах осуществления домены являются смежными и находятся в одной рамке считывания для образования единого слитого белка. В других вариантах осуществления домены находятся в отдельных полипептидах, например, как в молекуле RCAR, как представлено в настоящем описании.
В определенных вариантах осуществления полноразмерная молекула CAR BCMA включает аминокислотную последовательность или кодируется нуклеотидной последовательностью BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2 или C13F12.1, представленными в таблице 1 или 16, или последовательностью, по существу, (например, на 95-99%) идентичной ей.
В определенных вариантах осуществления молекула CAR BCMA или антигенсвязывающий домен против BCMA включает аминокислотную последовательность scFv BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2 или C13F12.1, представленную в таблице 1 или 16 (с лидерной последовательностью или без нее), или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 заменой аминокислоты, например, заменами (например, консервативными заменами)) любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CAR BCMA или антигенсвязывающий домен против BCMA включает вариабельную область тяжелой цепи и/или вариабельную область легкой цепи BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2 или C13F12.1, представленную в таблице 1 или 16, или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 заменой аминокислоты, например, заменами (например, консервативными заменами)) любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CAR BCMA или антигенсвязывающий домен против BCMA включает одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), представленной в таблице 20, и/или одну, две или три CDR из вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2 или C13F12.1, представленной в таблице 21, или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 заменой аминокислоты, например, заменами (например, консервативными заменами)) любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CAR BCMA или антигенсвязывающий домен против BCMA включает одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), представленной в таблице 22, и/или одну, две или три CDR из вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2 или C13F12.1, представленной в таблице 23, или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 заменой аминокислоты, например, заменами (например, консервативными заменами)) любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CAR BCMA или антигенсвязывающий домен против BCMA включает одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), представленной в таблице 24, и/или одну, две или три CDR из вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14, BCMA-15, 149362, 149363, 149364, 149365, 149366, 149367, 149368, 149369, BCMA_EBB-C1978-A4, BCMA_EBB-C1978-G1, BCMA_EBB-C1979-C1, BCMA_EBB-C1978-C7, BCMA_EBB-C1978-D10, BCMA_EBB-C1979-C12, BCMA_EBB-C1980-G4, BCMA_EBB-C1980-D2, BCMA_EBB-C1978-A10, BCMA_EBB-C1978-D4, BCMA_EBB-C1980-A2, BCMA_EBB-C1981-C3, BCMA_EBB-C1978-G4, A7D12.2, C11D5.3, C12A3.2 или C13F12.1, представленной в таблице 25, или последовательность, по существу, идентичную (например, на 95-99% идентичную или с до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 заменой аминокислоты, например, заменами (например, консервативными заменами)) любой из указанных выше последовательностей.
Последовательности CDR человека scFV-доменов представлены в таблицах 20, 22 и 24 в случае вариабельных доменов тяжелой цепи и в таблицах 21, 23 и 25 в случае вариабельных доменов легких цепей. "ID" означает соответствующую SEQ ID NO для каждой CDR.
Таблица 20: CDR вариабельного домена тяжелой цепи в соответствии со схемой нумерации по Kabat (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD)
Таблица 21: CDR вариабельного домена легкой цепи в соответствии со схемой нумерации по Kabat (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD)
Таблица 22: CDR вариабельного домена тяжелой цепи в соответствии со схемой нумерации по Chothia (Al-Lazikani et al., (1997) JMB 273, 927-948)
Таблица 23: CDR вариабельного домена легкой цепи в соответствии со схемой нумерации по Chothia (Al-Lazikani et al., (1997) JMB 273, 927-948)
Таблица 24. CDR вариабельного домена тяжелой цепи в соответствии с комбинацией схемы нумерации по Kabat (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) и схемы нумерации по Chothia (Al-Lazikani et al., (1997) JMB 273, 927-948).
Таблица 25. CDR вариабельного домена легкой цепи в соответствии с комбинацией схемы нумерации по Kabat (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) и схемы нумерации по Chothia (Al-Lazikani et al., (1997) JMB 273, 927-948).
В определенных вариантах осуществления молекула CAR, представленная в настоящем описании (например, нуклеиновая кислота CAR или полипептид CAR), или BCMA-связывающий домен включает:
(1) одну, две или три CDR легкой цепи (LC), выбранные из одного из следующего:
(i) CDR1 LC SEQ ID NO: 504, CDR2 LC SEQ ID NO: 544 и CDR3 LC SEQ ID NO: 584 BCMA-4 CAR (139103);
(ii) CDR1 LC SEQ ID NO: 514, CDR2 LC SEQ ID NO: 554 и CDR3 LC SEQ ID NO: 594 BCMA-10 CAR (139109);
(iii) CDR1 LC SEQ ID NO: 516, CDR2 LC SEQ ID NO: 556 и CDR3 LC SEQ ID NO: 596 BCMA-13 CAR (139112); или
(iv) CDR1 LC SEQ ID NO: 518, CDR2 LC SEQ ID NO: 558 и CDR3 LC SEQ ID NO: 598 BCMA-15 CAR (139114), и/или
(2) одну, две или три CDR тяжелой цепи (HC) из одного из следующего:
(i) CDR1 HC SEQ ID NO: 384, CDR2 HC SEQ ID NO: 424 и CDR3 HC SEQ ID NO: 464 BCMA-4 CAR (139103);
(ii) CDR1 HC SEQ ID NO: 394, CDR2 HC SEQ ID NO: 434 и CDR3 HC SEQ ID NO: 474 BCMA-10 CAR (139109);
(iii) CDR1 HC SEQ ID NO: 396, CDR2 HC SEQ ID NO: 436 и CDR3 HC SEQ ID NO: 476 BCMA-13 CAR (139112); или
(iv) CDR1 HC SEQ ID NO: 398, CDR2 HC SEQ ID NO: 438 и CDR3 HC SEQ ID NO: 478 BCMA-15 (139114).
В определенных вариантах осуществления молекула CAR, представленная в настоящем описании (например, нуклеиновая кислота CAR или полипептид CAR) включает:
(1) одну, две или три CDR легкой цепи (LC), выбранные из одного из следующего:
(i) CDR1 LC SEQ ID NO: 744, CDR2 LC SEQ ID NO: 784 и CDR3 LC SEQ ID NO: 824 BCMA-4 CAR (139103);
(ii) CDR1 LC SEQ ID NO: 754, CDR2 LC SEQ ID NO: 794 и CDR3 LC SEQ ID NO: 834 BCMA-10 CAR (139109);
(iii) CDR1 LC SEQ ID NO: 756, CDR2 LC SEQ ID NO: 796 и CDR3 LC SEQ ID NO: 836 BCMA-13 CAR (139112); или
(iv) CDR1 LC SEQ ID NO: 758, CDR2 LC SEQ ID NO: 798 и CDR3 LC SEQ ID NO: 838 BCMA-15 CAR (139114); и/или
(2) одну, две или три CDR тяжелой цепи (HC), выбранные из одного из следующего:
(i) CDR1 HC SEQ ID NO: 624, CDR2 HC SEQ ID NO: 664 и CDR3 HC SEQ ID NO: 704 BCMA-4 CAR (139103);
(ii) CDR1 HC SEQ ID NO: 634, CDR2 HC SEQ ID NO: 674 и CDR3 HC SEQ ID NO: 714 BCMA-10 CAR (139109);
(iii) CDR1 HC SEQ ID NO: 636, CDR2 HC SEQ ID NO: 676 и CDR3 HC SEQ ID NO: 716 BCMA-13 CAR (139112); или
(iv) CDR1 HC SEQ ID NO: 638, CDR2 HC SEQ ID NO: 678 и CDR3 HC SEQ ID NO: 718 BCMA-15 CAR (139114).
В определенных вариантах осуществления молекула CAR, представленная в настоящем описании (например, нуклеиновая кислота CAR или полипептид CAR), включает:
(1) одну, две или три CDR легкой цепи (LC), выбранные из одного из следующего:
(i) CDR1 LC SEQ ID NO: 984 CDR2 LC SEQ ID NO: 1024 и CDR3 LC SEQ ID NO: 1064 BCMA-4 CAR (139103);
(ii) CDR1 LC SEQ ID NO: 994, CDR2 LC SEQ ID NO: 1034 и CDR3 LC SEQ ID NO: 1074 BCMA-10 CAR (139109);
(iii) CDR1 LC SEQ ID NO: 996, CDR2 LC SEQ ID NO: 1036 и CDR3 LC SEQ ID NO: 1076 BCMA-13 CAR (139112); или
(iv) CDR1 LC SEQ ID NO: 998, CDR2 LC SEQ ID NO: 1038 и CDR3 LC SEQ ID NO: 1078 BCMA-15 CAR (139114); и/или
(2) одну, две или три CDR тяжелой цепи (HC), выбранные из одного из следующего:
(i) CDR1 HC SEQ ID NO: 864, CDR2 HC SEQ ID NO: 904 и CDR3 HC SEQ ID NO: 944 BCMA-4 CAR (139103);
(ii) CDR1 HC SEQ ID NO: 874, CDR2 HC SEQ ID NO: 914 и CDR3 HC SEQ ID NO: 954 BCMA-10 CAR (139109);
(iii) CDR1 HC SEQ ID NO: 876, CDR2 HC SEQ ID NO: 916 и CDR3 HC SEQ ID NO: 956 BCMA-13 CAR (139112);
(iv) CDR1 HC SEQ ID NO: 878, CDR2 HC SEQ ID NO: 918 и CDR3 HC SEQ ID NO: 958 BCMA-15 CAR (139114).
В вариантах осуществления конструкции CAR против BCMA, например, человеческие или гуманизированные конструкции CAR против BCMA, получают способом, представленным в настоящем описании, например, как описано в примере 4. Неограничивающие примеры scFv против BCMA включают BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14 и BCMA-15. Последовательности scFv-фрагментов человека против BCMA (SEQ ID NO: 39-52) представлены в таблице 1 (и их обозначения представлены в таблице 2).
В вариантах осуществления полные конструкции BCMA CAR (например, SEQ ID NO: 99-113) получают с использованием scFv-фрагментов, например, scFv-фрагментов человека (например, SEQ ID NO: 39-52), в комбинации с дополнительными последовательностями, такими как представленные ниже.
Необходимо отметить, что scFv-фрагменты, представленные в настоящем описании, например, в таблицах 1 и 16 или в SEQ ID NO: 39-53, 129-149, 263-266, 271 или 273, без лидерной последовательности (например, без аминокислотной последовательности SEQ ID NO: 1 или нуклеотидной последовательности SEQ ID NO: 12), находятся в объеме настоящего изобретения. В других вариантах осуществления scFv-фрагменты, представленные в настоящем описании, например, в таблицах 1 и 16 или в SEQ ID NO: 39-53, 129-149, 263-266, 271 или 273 с лидерной последовательностью (например, без аминокислотной последовательности SEQ ID NO: 1 или нуклеотидной последовательности SEQ ID NO: 12), также находятся в объеме настоящего изобретения.
Лидерная последовательность (аминокислотная последовательность) (SEQ ID NO: 1)
MALPVTALLLPLALLLHAARP
Лидерная последовательность (последовательность нуклеиновой кислоты) (SEQ ID NO: 12)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCC
Шарнирная область CD8 (аминокислотная последовательность) (SEQ ID NO: 2)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD
Шарнирная область CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 13)
ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT
Трансмембранный домен CD8 (аминокислотная последовательность) (SEQ ID NO: 6)
IYIWAPLAGTCGVLLLSLVITLYC
Трансмембранный домен CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 17)
ATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGC
Внутриклеточный домен 4-1BB (аминокислотная последовательность) (SEQ ID NO: 7)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
Внутриклеточный домен 4-1BB (последовательность нуклеиновой кислоты) (SEQ ID NO: 18)
AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG
Внутриклеточный домен CD28 (аминокислотная последовательность) (SEQ ID NO: 1104)
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS (SEQ ID NO: 1104)
Внутриклеточный домен CD28 (нуклеотидная последовательность) (SEQ ID NO: 1105)
AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 1105)
Внутриклеточный домен ICOS (аминокислотная последовательность) (SEQ ID NO: 1106)
T K K K Y S S S V H D P N G E Y M F M R A V N T A K K S R L T D V T L (SEQ ID NO: 1106)
Внутриклеточный домен ICOS (нуклеотидная последовательность) (SEQ ID NO: 1107)
ACAAAAAAGAAGTATTCATCCAGTGTGCACGACCCTAACGGTGAATACATGTTCATGAGAGCAGTGAACACAGCCAAAAAATCCAGACTCACAGATGTGACCCTA (SEQ ID NO: 1107)
Домен CD3 дзета (аминокислотная последовательность) (SEQ ID NO: 9)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
CD3 дзета (последовательность нуклеиновой кислоты) (SEQ ID NO: 20)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
Домен CD3 дзета (аминокислотная последовательность, референсная последовательность NCBI NM_000734.3) (SEQ ID NO: 10)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
CD3 дзета (последовательность нуклеиновой кислоты, референсная последовательность NCBI NM_000734.3), (SEQ ID NO: 21)
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccag
aaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttt
tggacaagagacgtggccgggaccctgagatggggggaaagccgagaagga
agaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcgg
aggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggc
acgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgc
ccttcacatgcaggccctgccccctcgc
Шарнирная область IgG4 (аминокислотная последовательность) (SEQ ID NO: 36)
ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM
Шарнирная область IgG4 (нуклеотидная последовательность) (SEQ ID NO: 37)
GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG
В вариантах осуществления scFv-фрагменты CAR клонируют в лентивирусный вектор для получения полноразмерной конструкции CAR в одной кодирующей рамке считывания и с использованием промотора, например, промотора EF1 альфа, для экспрессии (SEQ ID NO: 11).
Промотор EF1 альфа
CGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACGGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGAGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGA (SEQ ID NO: 11).
Gly/Ser (SEQ ID NO: 25)
GGGGS
Gly/Ser (SEQ ID NO: 26): Эта последовательность может включать 1-6 повторов "Gly Gly Gly Gly Ser"
GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 27)
GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 28)
GGGGSGGGGS GGGGS
Gly/Ser (SEQ ID NO: 29)
GGGS
ПолиA: (A)5000 (SEQ ID NO: 30)
ПолиA: (T)100 (SEQ ID NO: 31)
ПолиA: (T)5000 (SEQ ID NO: 32)
ПолиA: (A)5000 (SEQ ID NO: 33)
ПолиA: (A)400 (SEQ ID NO: 34)
ПолиA: (A)2000 (SEQ ID NO: 35)
Gly/Ser (SEQ ID NO: 38): Эта последовательность может включать 1-10 повторов "Gly Gly Gly Ser"
GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS
Аминокислотные последовательности и последовательности нуклеиновой кислоты примеров scFV-доменов против BCMA и примеров молекул CAR BCMA представлены в таблице 1.
В таблице 2 ниже представлены обозначения конструкций BCMA CAR в отношении ID ДНК, также представленных в таблице 1.
Таблица 2: ID конструкций CAR
Таблица 1. Аминокислотные последовательности и последовательности нуклеиновой кислоты примеров scFV-доменов против BCMA и молекул CAR BCMA
Также представлены аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи для каждого scFv. В таблице 2 приведены названия и ID конструкций CAR для нескольких CAR BCMA.
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CAR
Полный CAR
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный BCMA_EBB-C1979-C1 CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
ScFV-домен
ScFV-домен
VH
VL
Полный CART
Полный CART
В вариантах осуществления дополнительные примеры конструкций BCMA CAR получают с использованием последовательностей VH и VL из публикации PCT № WO2012/0163805 (содержание которой включено, таким образом, в настоящее описание в качестве ссылки в полном объеме), например, в зависимости от результатов в отношении CAR pBCMA3 и pBCMA4, описываемых в примерах 2 и 3. Схематическое изображение примеров конструкций BCMA (BCMA-3NP и BCMA-4NP) представлено на фигуре 10A. Две конструкции отличаются ориентацией цепей VH и VL (фиг. 10B). Примеры конструкций BCMA CAR и соответствующих ID ДНК представлены ниже в таблице 3.
Таблица 3. ID рабочих конструкций CAR
В вариантах осуществления дополнительные примеры конструкций BCMA CAR также можно получать с использованием последовательностей VH и VL, приведенных в таблице 16. Аминокислотные последовательности примеров scFV-доменов, содержащих домены VH и VL и линкерную последовательность, и полноразмерные CAR также приведены в таблице 16.
Таблица 16. Дополнительные примеры последовательностей CAR BCMA
VH
VL
scFV-домен
Полный CART
VH
VL
scFV-домен
Полный CART
VH
VL
scFV-домен
Полный CART
VH
VL
scFV-домен
Полный CART
В вариантах осуществления последовательность нуклеиновой кислоты примера гуманизированного scFv против BCMA, в котором VH предшествует VL (H2L, например, pBCMA 2 и pBCMA 4), является следующей:
CAGGTGCAGCTGGTCCAGAGCGGCGCCGAAGTGAAGAAGCCCGGCAGCTCCGTGAAAGTGAGCTGCAAGGCCAGCGGCGGCACCTTCAGCAACTACTGGATGCACTGGGTGAGGCAGGCCCCCGGACAGGGCCTGGAGTGGATGGGCGCCACCTACAGGGGCCACAGCGACACCTACTACAACCAGAAGTTCAAGGGCCGGGTGACCATCACCGCCGACAAGAGCACCAGCACCGCCTACATGGAACTGAGCAGCCTCAGGAGCGAGGACACCGCTGTGTATTACTGCGCCAGGGGCGCCATCTACAACGGCTACGACGTGCTGGACAACTGGGGCCAGGGCACACTAGTGACCGTGTCCAGCGGTGGAGGAGGTAGCGGAGGAGGCGGGAGCGGTGGAGGTGGCTCTGGAGGTGGCGGAAGCGACATCCAGATGACCCAGAGCCCTAGCTCACTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCTCCGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGGCAAGGCCCCCAAGCTGCTGATCTACTACACCTCCAACCTGCACTCCGGCGTGCCCAGCAGGTTCAGCGGAAGCGGCAGCGGCACCGATTTCACCCTGACCATCTCCAGCCTGCAGCCCGAGGACTTCGCCACCTACTACTGCCAGCAGTACAGGAAGCTCCCCTGGACTTTCGGCCAGGGCACCAAACTGGAGATCAAGCGT
(SEQ ID NO: 272)
Соответствующая аминокислотная последовательность примера гуманизированного scFv против BCMA, в котором VH предшествует VL (H2L, например, pBCMA 2 и pBCMA 4), является следующей:
Q V Q L V Q S G A E V K K P G S S V K V S C K A S G G T F S N Y W M H W V R Q A P G Q G L E W M G A T Y R G H S D T Y Y N Q K F K G R V T I T A D K S T S T A Y M E L S S L R S E D T A V Y Y C A R G A I Y N G Y D V L D N W G Q G T L V T V S S G G G G S G G G G S G G G G S G G G G S D I Q M T Q S P S S L S A S V G D R V T I T C S A S Q D I S N Y L N W Y Q Q K P G K A P K L L I Y Y T S N L H S G V P S R F S G S G S G T D F T L T I S S L Q P E D F A T Y Y C Q Q Y R K L P W T F G Q G T K L E I K R (SEQ ID NO: 271)
В вариантах осуществления последовательность нуклеиновой кислоты примера гуманизированного scFv против BCMA, в котором VL предшествует VH (L2H, например, pBCMA1 и pBCMA3), является следующей:
GACATCCAGATGACCCAGAGCCCTAGCTCACTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCTCCGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGGCAAGGCCCCCAAGCTGCTGATCTACTACACCTCCAACCTGCACTCCGGCGTGCCCAGCAGGTTCAGCGGAAGCGGCAGCGGCACCGATTTCACCCTGACCATCTCCAGCCTGCAGCCCGAGGACTTCGCCACCTACTACTGCCAGCAGTACAGGAAGCTCCCCTGGACTTTCGGCCAGGGCACCAAACTGGAGATCAAGCGTGGTGGAGGAGGTAGCGGAGGAGGCGGGAGCGGTGGAGGTGGCTCTGGAGGTGGCGGAAGCCAGGTGCAGCTGGTCCAGAGCGGCGCCGAAGTGAAGAAGCCCGGCAGCTCCGTGAAAGTGAGCTGCAAGGCCAGCGGCGGCACCTTCAGCAACTACTGGATGCACTGGGTGAGGCAGGCCCCCGGACAGGGCCTGGAGTGGATGGGCGCCACCTACAGGGGCCACAGCGACACCTACTACAACCAGAAGTTCAAGGGCCGGGTGACCATCACCGCCGACAAGAGCACCAGCACCGCCTACATGGAACTGAGCAGCCTCAGGAGCGAGGACACCGCTGTGTATTACTGCGCCAGGGGCGCCATCTACAACGGCTACGACGTGCTGGACAACTGGGGCCAGGGCACACTAGTGACCGTGTCCAGC
(SEQ ID NO: 274)
Соответствующая аминокислотная последовательность примера гуманизированного scFv против BCMA, в котором VL предшествует VH (L2H, например, pBCMA1 и pBCMA3), является следующей:
DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKLLIYY TSNLHSGVPSRFSGSGSGTD FTLTISSLQP EDFATYYCQQ YRKLPWTFGQ GTKLEIKRGG GGSGGGGSGGGGSGGGGSQV QLVQSGAEVK KPGSSVKVSC KASGGTFSNY WMHWVRQAPG QGLEWMGATYRGHSDTYYNQ KFKGRVTITA DKSTSTAYME LSSLRSEDTA VYYCARGAIYNGYDVLDNWGQGTLVTVSS (SEQ ID NO: 273)
CAR scFv-фрагменты можно клонировать в лентивирусные векторы для получения полноразмерной конструкции CAR в единой колирующей рамке считывания и с использованием промотора EF1 альфа для экспрессии (SEQ ID NO: 11).
Конструкция CAR может включать линкер Gly/Ser, имеющий одну или более следующих последовательностей: GGGGS (SEQ ID NO: 25), включающую 1-6 повторов "Gly Gly Gly Gly Ser", например, GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS (SEQ ID NO: 26), GGGGSGGGGS GGGGSGGGGS (SEQ ID NO: 27), GGGGSGGGGS GGGGS (SEQ ID NO: 28), GGGS (SEQ ID NO: 29), или включающую 1-10 повторов "Gly Gly Gly Ser", например, GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS (SEQ ID NO: 38).
В вариантах осуществления конструкция CAR включает поли(A)-последовательность, например, последовательность, включающую 50-5000 или 100-5000 аденинов (например, SEQ ID NO: 30, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 35), или последовательность, включающую 50-5000 тиминов (например, SEQ ID NO: 31, SEQ ID NO: 32). Альтернативно, конструкция CAR может включать, например, линкер, включающий последовательность GSTSGSGKPGSGEGSTKG (SEQ ID NO: 1108)
Биспецифические CAR
В варианте осуществления полиспецифическая молекула антитела является биспецифической молекулой антитела. Биспецифическое антитело имеет специфичность не более чем для двух антигенов. Биспецифическая молекула антитела отличается последовательностью первого вариабельного домена иммуноглобулина, имеющего специфичность связывания для первого эпитопа, и последовательностью второго вариабельного домена иммуноглобулина, имеющего специфичность связывания для второго эпитопа. В варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, одном и том же белке (или субъединице мультимерного белка). В варианте осуществления первый и второй эпитопы перекрываются. В варианте осуществления первый и второй эпитопы не перекрываются. В варианте осуществления первый и второй эпитопы находятся на разных антигенах, например, разных белках (или разных субъединицах мультимерного белка). В варианте осуществления биспецифическая молекула антитела содержит последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, имеющие специфичность связывания для первого эпитопа, и последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, имеющие специфичность связывания для второго эпитопа. В варианте осуществления биспецифическая молекула антитела содержит половину антитела, имеющую специфичность связывания для первого эпитопа, и половину антитела, имеющую специфичность связывания для второго эпитопа. В варианте осуществления биспецифическая молекула антитела содержит половину антитела или ее фрагмент, имеющую специфичность связывания для первого эпитопа, и половину антитела или ее фрагмент, имеющую специфичность связывания для второго эпитопа. В варианте осуществления биспецифическая молекула антитела содержит scFv или его фрагмент, имеющий специфичность связывания для первого эпитопа, и scFv или его фрагмент, имеющий специфичность связывания для второго эпитопа.
В определенных вариантах осуществления молекула антитела является полиспецифической (например, биспецифической или триспецифической) молекулой антитела. В этой области известны способы получения биспецифических или гетеродимерных молекул антител, включая, в качестве неограничивающих примеров, например, подход "выступ-во-впадину", описываемый, например, в US5731168, конструирование Fc-пар с использованием эффекта электростатического взаимодействия, как описано, например, в WO09/089004, WO06/106905 и WO2010/129304, образование гетеродимеров доменов, сконструированных с помощью замены цепей (SEED), как описано, например, в WO07/110205, замену Fab-плеч, как описано, например, в WO08/119353, WO2011/131746 и WO2013/060867, получение двойного конъюгата антител, например, посредством перекрестного сшивания антитела для получения биспецифической структуры с использованием гетеробифункционального реагента, содержащего реактивную аминогруппу и сульфгидрильную реактивную группу, как описано, например, в US4433059, детерминанты биспецифического антитела, получаемые посредством рекомбинации половин антител (пар тяжелых и легких цепей или Fab) из разных антител посредством цикла восстановления и окисления дисульфидных связей между двумя тяжелыми цепями, как описано, например, в US4444878, трифункциональные антитела, например, три Fab'-фрагмента, перекрестно сшитые посредством сульфгидрильных реактивных групп, как описано, например, в US5273743, биосинтетические связывающие белки, например, пара scFv, перекрестно сшитые C-концами, предпочтительно, посредством перекрестной сшивки дисульфидных связей или аминогрупп, как описано, например, в US5534254, бифункциональные антитела, например, Fab-фрагменты с разной специфичностью связывания, димеризованные посредством лейциновых молний (например, c-fos и c-jun), имеющие замененный константный домен, как описано, например, в US5582996, биспецифические и олигоспецифические моно- и олиговалентные рецепторы, например, области VH-CH1 двух антител (двух Fab-фрагментов), соединенные полипептидным спейсером между областью CH1 одного антитела и областью VH другого антитела, как правило, со связанными легкими цепями, как описано, например, в US5591828, биспецифические конъюгаты ДНК-антитело, например, перекрестная сшивка антител или Fab-фрагментов с помощью двухцепочечного фрагмента ДНК, как описано, например, в US5635602, биспецифические слитые белки, например, экспрессирующая конструкция, содержащая два scFv с гидрофильным спиральным пептидным линкером между ними и полной константной областью, как описано, например, в US5637481, мультивалентные и полиспецифические связывающие белки, например, димер полипептидов, содержащих первый домен со связывающей областью вариабельной области тяжелой цепи Ig и второй домен со связывающей областью вариабельной области легкой цепи Ig, как правило, обозначаемые как диатела (структуры более высокого порядка также включают биспецифические, триспецифические или тетраспецифические молекулы, как описано, например, в US5837242, конструкции минител со связанными цепями VL и VH, дополнительно соединенными с помощью пептидных спейсеров с шарнирной областью антитела и областью CH3, которые могут димеризоваться с образованием биспецифических/мультивалентных молекул, как описано, например, в US5837821, домены VH и VL, соединенные с помощью короткого пептидного линкера (например, из 5 или 10 аминокислот) или без линкера в любой ориентации, которые могут образовывать димеры с образованием биспецифических диател, тримеры и тетрамеры, как описано, например, в US5844094, нить доменов VH (или доменов VL в челнах семейства), соединенных пептидными связями с перекрестно сшивающими группами на C-концах, дополнительно связанные с доменами VL с образованием серии FV (или scFv), как описано, например, в US5864019, и одноцепочечные связывающие полипептиды с доменом VH и VL, соединенным с помощью пептидного линкера, комбинируют в мультивалентных структурах с помощью нековалентной или химической перекрестной сшивки с образованием, например, гомобивалентных, гетеробивалентных, тривалентных и тетравалентных структур с использованием формата типа scFv или диатела, как описано, например, в US5869620. Дополнительные примеры полиспецифических и биспецифических молекул и способов их получения приведены, например, в US5910573, US5932448, US5959083, US5989830, US6005079, US6239259, US6294353, US6333396, US6476198, US6511663, US6670453, US6743896, US6809185, US6833441, US7129330, US7183076, US7521056, US7527787, US7534866, US7612181, US2002004587A1, US2002076406A1, US2002103345A1, US2003207346A1, US2003211078A1, US2004219643A1, US2004220388A1, US2004242847A1, US2005003403A1, US2005004352A1, US2005069552A1, US2005079170A1, US2005100543A1, US2005136049A1, US2005136051A1, US2005163782A1, US2005266425A1, US2006083747A1, US2006120960A1, US2006204493A1, US2006263367A1, US2007004909A1, US2007087381A1, US2007128150A1, US2007141049A1, US2007154901A1, US2007274985A1, US2008050370A1, US2008069820A1, US2008152645A1, US2008171855A1, US2008241884A1, US2008254512A1, US2008260738A1, US2009130106A1, US2009148905A1, US2009155275A1, US2009162359A1, US2009162360A1, US2009175851A1, US2009175867A1, US2009232811A1, US2009234105A1, US2009263392A1, US2009274649A1, EP346087A2, WO0006605A2, WO02072635A2, WO04081051A1, WO06020258A2, WO2007044887A2, WO2007095338A2, WO2007137760A2, WO2008119353A1, WO2009021754A2, WO2009068630A1, WO9103493A1, WO9323537A1, WO9409131A1, WO9412625A2, WO9509917A1, WO9637621A2, WO9964460A1. Содержание приведенных выше заявок включено в настоящее описание в качестве ссылки в полном объеме.
В каждом антителе или фрагменте антитела (например, scFv) биспецифической молекулы антитела VH может находиться выше или ниже VL. В некоторых вариантах осуществления вышележащее антитело или фрагмент антитела (например, scFv) сконструировано так, что VH (VH1) находится выше его VL (VL1), а нижележащее антитело или фрагмент антитела (например, scFv) сконструировано так, что VL (VL2) находится выше его VH (VH2), таким образом, что общая биспецифическая молекула антитела имеет структуру VH1-VL1-VL2-VH2. В других вариантах осуществления вышележащее антитело или фрагмент антитела (например, scFv) сконструировано так, что VL (VL1) находится выше его VH (VH1) и нижележащее антитело или фрагмент антитела (например, scFv) сконструировано так, что VH (VH2) находится выше его VL (VL2), таким образом, что общая биспецифическая молекула антитела имеет структуру VL1-VH1-VH2-VL2. Необязательно, линкер располагают между двумя антителами или фрагментами антител (например, scFv), например, между VL1 и VL2, если конструкция имеет структуру VH1-VL1-VL2-VH2, или между VH1 и VH2, если конструкция имеет структуру VL1-VH1-VH2-VL2. Линкер может являться линкером, как представлено в настоящем описании, например, линкером (Gly4-Ser)n, где n является 1, 2, 3, 4, 5 или 6, предпочтительно - 4 (SEQ ID NO: 26). В основном, линкер между двумя scFv должен быть достаточно длинным, чтобы избегать ошибочного спаривания между доменами двух scFv. Необязательно, линкер располагают между VL и VH первого scFv. Необязательно, линкер располагают между VL и VH второго scFv. В конструкциях, содержащих множество линкеров, любые два или более линкера могут являться одинаковыми или разными. Таким образом, в некоторых вариантах осуществления биспецифический CAR содержит VL, VH и, необязательно, один или более линкеров в структуре, представленной в настоящем описании.
В одном из аспектов биспецифическая молекула антитела отличается последовательностью первого вариабельного домена иммуноглобулина, например, scFv, имеющего специфичность связывания для BCMA, например, содержит scFv, как представлено в настоящем описании, например, как описано в таблице 1 или таблице 16, или содержит CDR легкой цепи и/или CDR тяжелой цепи из scFv BCMA, представленного в настоящем описании, и последовательностью второго вариабельного домена иммуноглобулина, имеющего специфичность связывания для второго эпитопа на другом антигене. В некоторых аспектах последовательность второго вариабельного домена иммуноглобулина имеет специфичность связывания для антигена, экспрессирующегося на клетках AML, например, антигена, иного, чем BCMA. Например, последовательность второго вариабельного домена иммуноглобулина имеет специфичность связывания для CD123. В качестве другого примера, последовательность второго вариабельного домена иммуноглобулина имеет специфичность связывания для CLL-1. В качестве другого примера, последовательность второго вариабельного домена иммуноглобулина имеет специфичность связывания для CD34. В качестве другого примера, последовательность второго вариабельного домена иммуноглобулина имеет специфичность связывания для FLT3. Например, последовательность второго вариабельного домена иммуноглобулина имеет специфичность связывания для рецептора фолата бета. В некоторых аспектах последовательность второго вариабельного домена иммуноглобулина имеет специфичность связывания для антигена, экспрессирующегося на B-клетках, например, CD10, CD19, CD20, CD22, CD34, CD123, FLT-3, ROR1, CD79b, CD179b или CD79a.
Химерный TCR
В одном из аспектов антитела против BCMA и фрагменты антител по настоящему изобретению (например, описываемые в таблицах 1 и 16) можно пересаживать на один или более константных доменов цепи T-клеточного рецептора ("TCR"), например, альфа-цепи TCR или бета-цепи TCR, для получения химерного TCR, специфически связывающегося с BCMA. Не будучи связанными какой-либо теорией, полагают, что химерные TCR будут передавать сигнал через комплекс TCR после связывания антигена. Например, scFv BCMA, как представлено в настоящем описании, можно пересаживать на константный домен, например, по меньшей мере, часть внеклеточного константного домена, трансмембранного домена и цитоплазматического домена, цепи TCR, например, альфа-цепи TCR и/или бета-цепи TCR. В качестве другого примера, фрагмент антитела против BCMA, например, домен VL, как представлено в настоящем описании, можно пересаживать на константный домен альфа-цепи TCR, и фрагмент антитела против BCMA, например, домен VH, как представлено в настоящем описании, можно пересаживать на константный домен бета-цепи TCR (или альтернативно, домен VL можно пересаживать на константный домен бета-цепи TCR и домен VH можно пересаживать на альфа-цепь TCR). В качестве другого примера, CDR антитела против BCMA или фрагмента антитела, например, CDR антитела против BCMA или фрагмента антитела, описываемого в таблицах 20, 21, 22, 23, 24 или 25, можно пересаживать на альфа-цепь и/или бета-цепь TCR для получения химерного TCR, специфически связывающегося с BCMA. Например, LCDR, представленные в настоящем описании, можно пересаживать на вариабельный домен альфа-цепи TCR и HCDR, представленные в настоящем описании, можно пересаживать на вариабельный домен бета-цепи TCR, или наоборот. Такие химерные TCR можно получать известными в этой области способами (например, Willemsen RA et al, Gene Therapy 2000; 7: 1369-1377; Zhang T et al, Cancer Gene Ther 2004; 11: 487-496; Aggen et al, Gene Ther. 2012 Apr;19(4):365-74).
Трансмембранный домен
Что касается трансмембранного домена, в различных вариантах осуществления CAR можно конструировать так, чтобы он содержал трансмембранный домен, соединенный с внеклеточным доменом CAR. Трансмембранный домен может включать одну или более дополнительных аминокислот, смежных с трансмембранной областью, например, одной или более аминокислотами, связанными с внеклеточной областью белка, из которого получали трансмембранную область (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и до 15 аминокислот из внеклеточной области), и/или одной или более дополнительными аминокислотами, связанными с внутриклеточной областью белка, из которого получают трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и до 15 аминокислот внутриклеточной области). В одном из аспектов трансмембранный домен является доменом, связанным с одним из других доменов используемого CAR. В некоторых случаях трансмембранный домен можно выбирать или модифицировать посредством замены аминокислоты для избежания связывания таких доменов с трансмембранными доменами тех же или других белков поверхности мембраны, например, для минимизации взаимодействий с другими членами рецепторного комплекса. В одном из аспектов трансмембранный домен способен к гомодимеризации с другим CAR на поверхности CAR-экспрессирующей клетки, например, CART-клетке. В другом аспекте аминокислотную последовательность трансмембранного домена можно модифицировать или заменять для минимизации взаимодействий со связывающими доменами нативного партнера по связыванию, присутствующего в той же CAR-экспрессирующей клетке, например, CART.
Трансмембранный домен можно получать из природного или рекомбинантного источника. Если источник является природным, домен можно получать из любого мембраносвязанного или трансмембранного белка. В одном из аспектов трансмембранный домен способен к передаче сигнала к внутриклеточным доменам каждый раз, когда CAR связывается с мишенью. Особенно применимый в настоящем изобретении трансмембранный домен может включать, по меньшей мере, трансмембранные области, например, альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8 (например, CD8 альфа, CD8 бета), CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. В некоторых вариантах осуществления трансмембранный домен может включать, по меньшей мере, трансмембранные области костимуляторной молекулы, например, молекулы MHC класса I, белков рецепторов ФНО, иммуноглобулин-подобных белков, рецепторов цитокинов, интегринов, сигнальных молекул активации лимфоцитов (белков SLAM), активирующих рецепторов NK-клеток, BTLA, рецептора Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающегося с CD83.
В некоторых случаях, трансмембранный домен можно соединять с внеклеточной областью CAR, например, антигенсвязывающим доменом CAR, посредством шарнирной области, например, шарнирной области белка человека. Например, в одном из вариантов осуществления шарнирная область может являться шарнирной областью Ig (иммуноглобулина) человека, например, шарнирной областью IgG4, или шарнирной областью CD8a. В одном из вариантов осуществления шарнирная область или спейсер содержит (например, состоит из) аминокислотную последовательность SEQ ID NO: 2. В одном из аспектов трансмембранный домен содержит (например, состоит из) трансмембранный домен SEQ ID NO: 6.
В одном из аспектов шарнирная область или спейсер содержит шарнирную область IgG4. Например, в одном из вариантов осуществления шарнирная область или спейсер содержит шарнирную область из аминокислотной последовательности ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM (SEQ ID NO: 3). В некоторых вариантах осуществления шарнирная область или спейсер содержит шарнирную область, кодируемую нуклеотидной последовательностью GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG (SEQ ID NO: 14).
В одном из аспектов шарнирная область или спейсер содержит шарнирную область IgD. Например, в одном из вариантов осуществления шарнирная область или спейсер содержит шарнирную область с аминокислотной последовательностью RWPESPKAQASSVPTAQPQAEGSLAKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECPSHTQPLGVYLLTPAVQDLWLRDKATFTCFVVGSDLКДАHLTWEVAGKVPTGGVEEGLLERHSNGSQSQHSRLTLPRSLWNAGTSVTCTLNHPSLPPQRLMALREPAAQAPVKLSLNLLASSDPPEAASWLLCEVSGFSPPNILLMWLEDQREVNTSGFAPARPPPQPGSTTFWAWSVLRVPAPPSPQPATYTCVVSHEDSRTLLNASRSLEVSYVTDH (SEQ ID NO: 4). В некоторых вариантах осуществления шарнирная область или спейсер содержит шарнирную область, кодируемую нуклеотидной последовательностью AGGTGGCCCGAAAGTCCCAAGGCCCAGGCATCTAGTGTTCCTACTGCACAGCCCCAGGCAGAAGGCAGCCTAGCCAAAGCTACTACTGCACCTGCCACTACGCGCAATACTGGCCGTGGCGGGGAGGAGAAGAAAAAGGAGAAAGAGAAAGAAGAACAGGAAGAGAGGGAGACCAAGACCCCTGAATGTCCATCCCATACCCAGCCGCTGGGCGTCTATCTCTTGACTCCCGCAGTACAGGACTTGTGGCTTAGAGATAAGGCCACCTTTACATGTTTCGTCGTGGGCTCTGACCTGAAGGATGCCCATTTGACTTGGGAGGTTGCCGGAAAGGTACCCACAGGGGGGGTTGAGGAAGGGTTGCTGGAGCGCCATTCCAATGGCTCTCAGAGCCAGCACTCAAGACTCACCCTTCCGAGATCCCTGTGGAACGCCGGGACCTCTGTCACATGTACTCTAAATCATCCTAGCCTGCCCCCACAGCGTCTGATGGCCCTTAGAGAGCCAGCCGCCCAGGCACCAGTTAAGCTTAGCCTGAATCTGCTCGCCAGTAGTGATCCCCCAGAGGCCGCCAGCTGGCTCTTATGCGAAGTGTCCGGCTTTAGCCCGCCCAACATCTTGCTCATGTGGCTGGAGGACCAGCGAGAAGTGAACACCAGCGGCTTCGCTCCAGCCCGGCCCCCACCCCAGCCGGGTTCTACCACATTCTGGGCCTGGAGTGTCTTAAGGGTCCCAGCACCACCTAGCCCCCAGCCAGCCACATACACCTGTGTTGTGTCCCATGAAGATAGCAGGACCCTGCTAAATGCTTCTAGGAGTCTGGAGGTTTCCTACGTGACTGACCATT (SEQ ID NO: 15).
В одном из аспектов трансмембранный домен может являться рекомбинантным, в случае чего он будет содержать преимущественно гидрофобные остатки, такие как лейцин и валин. В одном из аспектов триплет фенилаланина, триптофана и валина можно найти на каждом конце рекомбинантного трансмембранного домена.
Необязательно, короткий олиго- или полипептидный линкер длиной от 2 и 10 аминокислот может образовывать соединение между трансмембранным доменом и цитоплазматической областью CAR. Дублет глицин-серин представляет собой особенно подходящий линкер. Например, В одном из аспектов линкер содержит аминокислотную последовательность GGGGSGGGGS (SEQ ID NO: 5). В некоторых вариантах осуществления линкер кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 16).
В одном из аспектов шарнирная область или спейсер содержит шарнирную область KIR2DS2.
Цитоплазматический домен
Цитоплазматический домен или область CAR по настоящему изобретению относится к внутриклеточному сигнальному домену. Внутриклеточный сигнальный домен, как правило, отвечает за активацию по меньшей мере одной из нормальных эффекторных функций иммунной клетки, в которую встраивают CAR.
Примеры внутриклеточных сигнальных доменов для применения в CAR по изобретению включают цитоплазматические последовательности T-клеточного рецептора (TCR) и корецепторов, действующих согласовано для инициации передачи сигнала после вовлечения антигенного рецептора, а также любое производное или вариант этих последовательностей и любую рекомбинантную последовательность, имеющую ту же функциональную способность.
Известно, что сигналы, генерируемые только через TCR, являются недостаточными для полной активации T-клетки, и что также необходим вторичный и/или костимуляторный сигнал. Таким образом, можно сказать, что активация T-клетки опосредована двумя разными классами цитоплазматических сигнальных последовательностей: те, которые инициируют антигензависимую первичную активацию посредством TCR (первичные внутриклеточные сигнальные домены), и те, которые действуют антиген-независимым образом для обеспечения вторичного или костимуляторного сигнала (вторичный цитоплазматический домен, например, костимуляторный домен).
Первичный сигнальный домен регулирует первичную активацию комплекса TCR стимуляторным образом или ингибиторным образом. Первичные внутриклеточные сигнальные домены, действующие стимуляторным образом, могут содержать сигнальные мотивы, известные как иммунорецепторные тирозиновые активирующие мотивы или ITAM.
Примеры ITAM, содержащего первичные внутриклеточные сигнальные домены, особенно применимые в изобретении, включают домен TCR дзета, FcR гамма, FcR бета, CD3 гамма, CD3 дельта, CD3 эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известный как "ICOS"), FcεRI, DAP10, DAP12 и CD66d. В одном из вариантов осуществления CAR по изобретению содержит внутриклеточный сигнальный домен, например, первичный сигнальный домен CD3 дзета.
В одном из вариантов осуществления первичный сигнальный домен содержит модифицированный домен ITAM, например, мутантный домен ITAM, имеющий измененную (например, повышенную или пониженную) активность по сравнению с нативным доменом ITAM. В одном из вариантов осуществления первичный сигнальный домен содержит модифицированный ITAM-содержащий первичный внутриклеточный сигнальный домен, например, оптимизированный и/или укороченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В варианте осуществления первичный сигнальный домен содержит один, два, три, четыре или более мотивов ITAM.
Дополнительные примеры молекул, содержащих первичный внутриклеточный сигнальный домен, особенно применимый в изобретении, включают DAP10, DAP12 и CD32.
Внутриклеточный сигнальный домен CAR может содержать сам первичный сигнальный домен, например, сигнальный домен CD3 дзета, или его можно комбинировать с любыми другими желаемыми внутриклеточными сигнальными доменами, применимыми в отношении CAR по изобретению. Например, внутриклеточный сигнальный домен CAR может содержать первичный сигнальный домен, например, часть дзета-цепи CD3, и костимуляторный сигнальный домен. Костимуляторный сигнальный домен относится к части CAR, содержащей внутриклеточный домен костимуляторной молекулы. Костимуляторная молекула является молекулой поверхности клетки, иной, чем антигенный рецептор или его лиганды, необходимые для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают молекулу MHC класса I, белки рецепторов ФНО, иммуноглобулин-подобные белки, рецепторы цитокинов, интегрины, сигнальные молекулы активации лимфоцитов (белки SLAM), активирующие рецепторы NK-клеток, BTLA, рецептор Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающийся с CD83, и т.п. Например, показано, что костимуляция CD27 повышает экспансию, эффекторную функцию и выживаемость CART-клеток человека in vitro и повышает выживаемость и противоопухолевую активность T-клеток человека in vivo (Song et al. Blood. 2012; 119(3):696-706). Внутриклеточные сигнальные последовательности в цитоплазматической части CAR по изобретению можно соединять друг с другом в случайном или определенном порядке. Необязательно, короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) может образовывать соединение между внутриклеточной сигнальной последовательностью. В одном из вариантов осуществления в качестве подходящего линкера можно использовать дублет глицин-серин. В одном из вариантов осуществления в качестве подходящего линкера можно использовать одну аминокислоту, например, аланин, глицин.
В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал два или более, например, 2, 3, 4, 5 или более, костимуляторных сигнальных домена. В варианте осуществления два или более, например, 2, 3, 4, 5 или более, костимуляторных сигнальных домена разделяют линкерной молекулой, например, линкерной молекулой, представленной в настоящем описании. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит два костимуляторных сигнальных домена. В некоторых вариантах осуществления линкерная молекула является остатком глицина. В некоторых вариантах осуществления линкер является остатком аланина.
В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал сигнальный домен CD3 дзета и сигнальный домен CD28. В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал сигнальный домен CD3 дзета и сигнальный домен 4-1BB. В одном из аспектов сигнальный домен 4-1BB является сигнальным доменом SEQ ID NO: 7. В одном из аспектов сигнальный домен CD3 дзета является сигнальным доменом SEQ ID NO: 9 (мутантным CD3 дзета) или SEQ ID NO: 10 (CD3 дзета человека дикого типа).
В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал сигнальный домен CD3 дзета и сигнальный домен CD27. В одном из аспектов сигнальный домен CD27 содержит аминокислотную последовательность QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP (SEQ ID NO: 8). В одном из аспектов сигнальный домен CD27 кодируется последовательностью нуклеиновой кислоты AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 19).
В одном из аспектов внутриклеточный домен конструируют так, чтобы он содержал сигнальный домен CD3 дзета и сигнальный домен CD28. В одном из аспектов сигнальный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 1104. В одном из аспектов сигнальный домен CD28 кодируется последовательностью нуклеиновой кислоты SEQ ID NO: 1105.
В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал сигнальный домен CD3 дзета и сигнальный домен ICOS. В одном из аспектов сигнальный домен ICOS содержит аминокислотную последовательность SEQ ID NO: 1106. В одном из аспектов сигнальный домен ICOS кодируется последовательностью нуклеиновой кислоты SEQ ID NO: 1107.
В одном из аспектов CAR-экспрессирующая клетка, представленная в настоящем описании, может дополнительно содержать второй CAR, например, второй CAR, включающий другой антигенсвязывающий домен, например, для той же мишени (BCMA) или другой мишени (например, CD19, CD20, или CS-1 или других мишеней множественной миеломы, например, легкой каппа-цепи, CD138, антиген Ley или CD38 (Garfall et al., Discovery Medicine, 2014, 17(91):37-46)). В одном из вариантов осуществления CAR-экспрессирующая клетка содержит первый CAR, направленный против первого антигена и включающий внутриклеточный сигнальный домен, имеющий костимуляторный сигнальный домен, но не первичный сигнальный домен, и второй CAR, направленный против второго, другого, антигена и включающий внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимуляторный сигнальный домен. Не желая быть связанными какой-либо теорией, полагают, что помещение костимуляторного сигнального домена, например, 4-1BB, CD28, CD27 ICOS или OX-40, в первый CAR, и первичного сигнального домена, например, CD3 дзета, во второй CAR может ограничивать активность CAR в отношении клеток, в которых экспрессируются обе мишени. В одном из вариантов осуществления CAR-экспрессирующая клетка содержит первый CAR BCMA, включающий BCMA-связывающий домен, трансмембранный домен и костимуляторный домен, и второй CAR, направленный против антигена, иного, чем BCMA (например, антигена, экспрессирующегося на клетках лейкоза или лимфомы, например, CD19, CD20, CS-1, легкой каппа-цепи, CD139, антигена Ley или CD38) и включает антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления CAR-экспрессирующая клетка содержит первый CAR BCMA, включающий BCMA-связывающий домен, трансмембранный домен и первичный сигнальный домен, и второй CAR, направленный против антигена, иного, чем BCMA (например, антигена, экспрессирующегося на клетках лейкоза или лимфомы, например, CD19, CD20, CS-1, легкой каппа-цепи, CD139, антигена Ley или CD38) и включает антигенсвязывающий домен против антигена, трансмембранный домен и костимуляторный сигнальный домен. В одном из вариантов осуществления CAR-экспрессирующая клетка содержит CAR BCMA, представленный в настоящем описании, и CAR против CD19 (CAR CD19).
В одном из вариантов осуществления CAR-экспрессирующая клетка содержит CAR BCMA, представленный в настоящем описании, и ингибиторный CAR. В одном из вариантов осуществления ингибиторный CAR содержит антигенсвязывающий домен, связывающийся с антигеном, обнаруживаемым на нормальных клетках, но не злокачественных клетках, например нормальных клетках, также экспрессирующих мезотелин. В одном из вариантов осуществления ингибиторный CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибиторной молекулы. Например, внутриклеточный домен ингибиторного CAR может являться внутриклеточным доменом PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозина и TGFR бета.
В одном из вариантов осуществления, если CAR-экспрессирующая клетка содержит два или более разных CAR, антигенсвязывающие домены разных CAR могут являться такими, что антигенсвязывающие домены не взаимодействуют друг с другом. Например, клетка, экспрессирующая первый и второй CAR, может иметь антигенсвязывающий домен первого CAR, например, в качестве фрагмента, например, scFv, не образующий соединение с антигенсвязывающим доменом второго CAR, например, антигенсвязывающий домен второго CAR является VHH.
В некоторых вариантах осуществления антигенсвязывающий домен содержит однодоменные антигенсвязывающие (SDAB) молекулы, включающие молекулы, определяющие комплементарность области которых являются частью однодоменного полипептида. Неограничивающие примеры включают вариабельные домены тяжелой цепи, связывающие молекулы, в которых от природы отсутствуют легкие цепи, отдельные домены, полученные из общепринятых 4-цепочечных антител, сконструированные домены и однодоменные каркасы, иные, чем полученные из антител. Молекулы SDAB могут являться любыми молекулами SDAB, известными в этой области, или любыми однодоменными молекулами в будущем. Молекулы SDAB можно получать из любого вида, включая, в качестве неограничивающих примеров, мышь, человека, верблюда, ламу, миногу, рыбу, акулу, козу, кролика и крупный рогатый скот. Этот термин также включает природные однодоменные молекулы антитела из вида, иного, чем Верблюжьи и акулы.
В одном из аспектов молекулу SDAB можно получать из вариабельной области иммуноглобулина, обнаруживаемого у рыб, такой как, например, полученная из изотипа иммуноглобулина, известного как новый антигенный рецептор (NAR), обнаруживаемый в сыворотке акулы. Способы получения однодоменных молекул, полученных из вариабельной области NAR ("IgNAR"), описаны в WO03/014161 и Streltsov (2005) Protein Sci. 14:2901-2909.
По другому аспекту молекула SDAB является природной однодоменной антигенсвязывающей молекулой, известной как тяжелая цепь, лишенная легких цепей. Такие однодоменные молекулы описаны, например, в WO9404678 и Hamers-Casterman, C. et al. (1993) Nature 363:446-448. Для ясности, этот вариабельный домен, полученный из молекулы тяжелой цепи, от природы лишенной легкой цепи, известен в настоящем описании как VHH или нанотела для его различения от общепринятого VH из четырехцепочечных иммуноглобулинов. Такую молекулу VHH можно получать из видов Camelidae, например, верблюда, ламы, дромадера, альпаки и гуанако. Другие виды, помимо Camelidae, могут продуцировать молекулы тяжелой цепи, от природы лишенные легкой цепи, такие VHH входят в объем изобретения.
Молекулы SDAB могут являться рекомбинантными, CDR-пересаженными, гуманизированными, камелизированными, деиммунизированными и/или полученными in vitro (например, выбранными посредством фагового дисплея).
Также обнаружено, что клетки имеют множество химерных встроенных в мембрану рецепторов, содержащих антигенсвязывающий домен, что взаимодействия между антигенсвязывающим доменом рецепторов может являться нежелательным, например, т.к. они ингибируют способность одного или более антигенсвязывающих доменов связываться с их когнатным антигеном. Таким образом, настоящее изобретение относится к клеткам, имеющим первый и второй неприродный химерный встроенный в мембрану рецептор, содержащий антигенсвязывающие домены, минимизирующие такие взаимодействия. Настоящее изобретение также относится к нуклеиновым кислотам, кодирующим первый и второй неприродный, химерный, встроенный в мембрану рецептор, содержащий антигенсвязывающие домены, минимизирующие такие взаимодействия, а также способам получения и применения таких клеток и нуклеиновых кислот. В варианте осуществления антигенсвязывающий домен одного из указанного первого и указанного второго неприродного, химерного, встроенного в мембрану рецептора содержит scFv, а другой содержит один домен VH, например, один домен VH вида Верблюжьих, акулы или миноги или один домен VH, полученный из последовательности человека или мыши.
В некоторых вариантах осуществления описываемое в заявке изобретение содержит первый и второй CAR, где антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR не содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR является scFv, а другой не является scFv. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR содержит один домен VH, например, один домен VH вида Верблюжьих, акулы или миноги или один домен VH, полученный из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR содержит домен VHH вида Верблюжьих.
В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR содержит scFv, а другой содержит один домен VH, например, один домен VH вида Верблюжьих, акулы или миноги или один домен VH, полученный из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR содержит scFv, а другой содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR и указанного второго CAR содержит scFv, а другой содержит домен VHH вида Верблюжьих.
В некоторых вариантах осуществления при наличии на поверхности клетки связывание антигенсвязывающего домена указанного первого CAR с его когнатным антигеном, по существу, не снижено при наличии указанного второго CAR. В некоторых вариантах осуществления связывание антигенсвязывающего домена указанного первого CAR с его когнатным антигеном в присутствие указанного второго CAR составляет 85%, 90%, 95%, 96%, 97%, 98% или 99% от связывания антигенсвязывающего домена указанного первого CAR с его когнатным антигеном в отсутствие указанного второго CAR.
В некоторых вариантах осуществления при наличии на поверхности клетки антигенсвязывающие домены указанного первого CAR и указанного второго CAR связываются друг с другом меньше, чем если бы оба из них являлись антигенсвязывающими доменами scFv. В некоторых вариантах осуществления антигенсвязывающие домены указанного первого CAR и указанного второго CAR связывается друг с другом на 85%, 90%, 95%, 96%, 97%, 98% или 99% меньше, чем если бы оба из них являлись антигенсвязывающими доменами scFv.
В другом аспекте CAR-экспрессирующая клетка, представленная в настоящем описании, может дополнительно экспрессировать другое средство, например, средство, повышающее активность CAR-экспрессирующей клетки. Например, в одном из вариантов осуществления средство может являться средством, ингибирующим ингибиторную молекулу, например, средством, представленным в настоящем описании. Ингибиторные молекулы, например, PD1, в некоторых вариантах осуществления могут снижать способность CAR-экспрессирующей клетки вызывать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета. В одном из вариантов осуществления средство, ингибирующее ингибиторную молекулу, содержит первый полипептид, например, ингибиторную молекулу, связанный со вторым полипептидом, передающим положительный сигнал в клетку, например, внутриклеточный сигнальный домен, представленный в настоящем описании. В одном из вариантов осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета или фрагмент любого из них (например, по меньшей мере, часть внеклеточного домена любого из них), и второй полипептид, являющийся внутриклеточным сигнальным доменом, представленным в настоящем описании (например, содержащим костимуляторный домен (например, 41BB, CD27 ICOS или CD28, например, как представлено в настоящем описании)), и/или первичным сигнальным доменом (например, сигнальным доменом CD3 дзета, представленным в настоящем описании). В одном из вариантов осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере, часть внеклеточного домена PD1) и второй полипептид внутриклеточного сигнального домена, представленного в настоящем описании (например, сигнального домена CD28, представленного в настоящем описании, и/или сигнального домена CD3 дзета, представленного в настоящем описании). В вариантах осуществления CAR-экспрессирующая клетка, представленная в настоящем описании, содержит костимуляторный рецептор-переключатель, например, как описано в WO2013/019615, включенном в настоящее описание в качестве ссылки в полном объеме. PD1 является ингибиторным членом семейства рецепторов CD28, также включающего CD28, CTLA-4, ICOS, и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Показано, что два лиганда для PD1, PD-L1 и PD-L2 отрицательно регулируют активацию T-клеток после связывания с PD1 (Freeman et al. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 в избытке обнаруживается при злокачественных новообразованиях человека (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммуносупрессию можно реверсировать посредством ингибирования локального взаимодействия PD1 с PD-L1.
В одном из вариантов осуществления средство содержит внеклеточный домен (ECD) ингибиторной молекулы, например, белка программируемой смерти 1 (PD1), который можно подвергать слиянию с трансмембранным доменом и внутриклеточными сигнальными доменами, такими как 41BB и CD3 дзета (также обозначаемый в настоящем описании как CAR PD1). В одном из вариантов осуществления CAR PD1, при использовании в комбинациях с CAR BCMA, представленным в настоящем описании, улучшает выживаемость CAR-экспрессирующей клетки, например, T-клетки или NK-клетки. В одном из вариантов осуществления CAR является CAR PD1, содержащим внеклеточный домен PD1, указанный подчеркиванием в SEQ ID NO: 24. В одном из вариантов осуществления CAR PD1 содержит аминокислотную последовательность SEQ ID NO: 24.
Malpvtalllplalllhaarppgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 24).
В одном из вариантов осуществления CAR PD1 содержит аминокислотную последовательность, представленную ниже (SEQ ID NO: 22).
pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 22).
В одном из вариантов осуществления средство содержит последовательность нуклеиновой кислоты, кодирующую CAR PD1, например, CAR PD1, представленный в настоящем описании. В одном из вариантов осуществления последовательность нуклеиновой кислоты CAR PD1 представлена ниже, при этом ECD PD1 в SEQ ID NO: 23 выделен подчеркиванием.
atggccctccctgtcactgccctgcttctccccctcgcactcctgctccacgccgctagaccacccggatggtttctggactctccggatcgcccgtggaatcccccaaccttctcaccggcactcttggttgtgactgagggcgataatgcgaccttcacgtgctcgttctccaacacctccgaatcattcgtgctgaactggtaccgcatgagcccgtcaaaccagaccgacaagctcgccgcgtttccggaagatcggtcgcaaccgggacaggattgtcggttccgcgtgactcaactgccgaatggcagagacttccacatgagcgtggtccgcgctaggcgaaacgactccgggacctacctgtgcggagccatctcgctggcgcctaaggcccaaatcaaagagagcttgagggccgaactgagagtgaccgagcgcagagctgaggtgccaactgcacatccatccccatcgcctcggcctgcggggcagtttcagaccctggtcacgaccactccggcgccgcgcccaccgactccggccccaactatcgcgagccagcccctgtcgctgaggccggaagcatgccgccctgccgccggaggtgctgtgcatacccggggattggacttcgcatgcgacatctacatttgggctcctctcgccggaacttgtggcgtgctccttctgtccctggtcatcaccctgtactgcaagcggggtcggaaaaagcttctgtacattttcaagcagcccttcatgaggcccgtgcaaaccacccaggaggaggacggttgctcctgccggttccccgaagaggaagaaggaggttgcgagctgcgcgtgaagttctcccggagcgccgacgcccccgcctataagcagggccagaaccagctgtacaacgaactgaacctgggacggcgggaagagtacgatgtgctggacaagcggcgcggccgggaccccgaaatgggcgggaagcctagaagaaagaaccctcaggaaggcctgtataacgagctgcagaaggacaagatggccgaggcctactccgaaattgggatgaagggagagcggcggaggggaaaggggcacgacggcctgtaccaaggactgtccaccgccaccaaggacacatacgatgccctgcacatgcaggcccttccccctcgc (SEQ ID NO: 23).
В другом аспекте настоящее изобретение относится к популяции CAR-экспрессирующих клеток, например, CART-клеток или CAR-экспрессирующих NK-клеток. В некоторых вариантах осуществления популяция CAR-экспрессирующих клеток содержит смесь клеток, экспрессирующих различные CAR. Например, в одном из вариантов осуществления популяция CAR-экспрессирующих клеток (например, CART-клеток или CAR-экспрессирующих NK-клеток) может включать первую клетку, экспрессирующую CAR, содержащий связывающий домен против BCMA, представленный в настоящем описании, и вторую клетку, экспрессирующую CAR, содержащий другой связывающий домен против BCMA, например, связывающий домен против BCMA, представленный в настоящем описании, отличающийся от связывающего домена против BCMA в CAR, экспрессируемом первой клеткой. В качестве другого примера, популяция CAR-экспрессирующих клеток может включать первую клетку, экспрессирующую CAR, включающий связывающий домен против BCMA, например, как представлено в настоящем описании, и вторую клетку, экспрессирующую CAR, включающий антигенсвязывающий домен против мишени, иной, чем BCMA (например, CD19, CD20, CS-1, легкой каппа-цепи, CD139, антигена Ley или CD38). В одном из вариантов осуществления популяция CAR-экспрессирующих клеток включает первую клетку, экспрессирующую CAR, содержащий связывающий домен против BCMA, например, как представлено в настоящем описании, и вторую клетку, экспрессирующую CAR, содержащий антигенсвязывающий домен против CD19 (CAR CD19). В одном из вариантов осуществления популяция CAR-экспрессирующих клеток включает, например, первую клетку, экспрессирующую CAR, включающий первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, включающий вторичный сигнальный домен.
В другом аспекте настоящее изобретение относится к популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, содержащий домен против BCMA, представленный в настоящем описании, и вторая клетка экспрессирует другое средство, например, средство, повышающее активность CAR-экспрессирующей клетки. Например, в одном из вариантов осуществления средство может являться средством, ингибирующим ингибиторную молекулу. Ингибиторные молекулы, например, в некоторых вариантах осуществления могут снижать способность CAR-экспрессирующей клетки вызывать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета. В одном из вариантов осуществления средство, ингибирующее ингибиторную молекулу, содержит первый полипептид, например, ингибиторную молекулу, связанную со вторым полипептидом, передающим положительный сигнал в клетку, например, внутриклеточный сигнальный домен, представленный в настоящем описании. В одном из вариантов осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета, или фрагмент любой из них (например, по меньшей мере, часть внеклеточного домена любой из них), и второй полипептид, являющийся внутриклеточным сигнальным доменом, представленным в настоящем описании (например, содержащим костимуляторный домен (например, 41BB, CD27, ICOS или CD28, например, как представлено в настоящем описании), и/или первичный сигнальный домен (например, сигнальный домен CD3 дзета, представленный в настоящем описании). В одном из вариантов осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере, часть внеклеточного домена PD1) и второй полипептид внутриклеточного сигнального домена, представленного в настоящем описании (например, сигнального домена CD28, представленного в настоящем описании, и/или сигнального домена CD3 дзета, представленного в настоящем описании).
В одном из аспектов настоящее изобретение относится к способам, включающим введение популяции CAR-экспрессирующих клеток (например, CART-клеток или CAR-экспрессирующих NK-клеток), например, смеси клеток, экспрессирующих разные CAR, в комбинации с другим средством, например, ингибитором киназы, таким как ингибитор киназы, представленный в настоящем описании. В другом аспекте настоящее изобретение относится к способам, включающим введение популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, содержащий связывающий домен против антигена, ассоциированного со злокачественным новообразованием, как представлено в настоящем описании, и вторая клетка экспрессирует другое средство, например, средство, повышающее активность CAR-экспрессирующей клетки, в комбинации с другим средством, например, ингибитором киназы, таким как ингибитор киназы, представленный в настоящем описании.
CAR с рецептором естественных киллеров (NKR)
В варианте осуществления молекула CAR, представленная в настоящем описании содержит один или более компонентов рецептора естественных киллеров (NKR), таким образом, образуя NKR-CAR. NKR-компонент может являться трансмембранным доменом, шарнирным доменом или цитоплазматическим доменом из любого из следующих рецепторов естественных киллеров: иммуноглобулин-подобного рецептора киллерных клеток (KIR), например, KIR2DL1, KIR2DL2/L3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR2DS1, KIR2DS2, KIR2DS3, KIR2DS4, DIR2DS5, KIR3DL1/S1, KIR3DL2, KIR3DL3, KIR2DP1, и KIR3DP1, рецептора естественных цитотоксических клеток (NCR), например, NKp30, NKp44, NKp46, семейства сигнальных молекул активации лимфоцитов (SLAM) рецепторов иммунных клеток, например, CD48, CD229, 2B4, CD84, NTB-A, CRACC, BLAME и CD2F-10, Fc-рецептора (FcR), например, CD16 и CD64, и рецепторов Ly49, например, LY49A, LY49C. Молекулы NKR-CAR, представленные в настоящем описании, могут взаимодействовать с адаптерной молекулой или внутриклеточным сигнальным доменом, например, DAP12. Примеры конфигураций и последовательностей молекул CAR, содержащих NKR-компоненты, описывают в международной публикации № WO2014/145252, содержание которой, таким образом, включено в настоящее описание в качестве ссылки.
Стратегии регуляции химерных антигенных рецепторов
Существует множество путей регуляции активности CAR. В некоторых вариантах осуществления регулируемый CAR (RCAR), в котором можно контролировать активность CAR, является желательным для оптимизации безопасности и эффективности терапии CAR. Например, в качестве "переключателя" в терапии CAR по настоящему изобретению можно использовать индуцирование апоптоза с использованием, например, каспазы, слитой с доменом димеризации (см., например, Di et al., N Engl. J. Med. 2011 Nov. 3; 365(18):1673-1683). В другом примере CAR-экспрессирующие клетки также экспрессирует молекулу индуцибельной каспазы-9 (iCaspase-9), которая после введения лекарственного средства-димеризатора (например, римидуцида (также называемого AP1903 (Bellicum Pharmaceuticals) или AP20187 (Ariad)) приводит к активации каспазы-9 и апоптоза клеток. Молекула iCaspase-9 содержит домен, связывающий химический индуктор димеризации (CID), опосредующий димеризацию в присутствие CID. Это приводит к индуцибельному и селективному истощению CAR-экспрессирующих клеток. В некоторых случаях молекула iCaspase-9 кодируется молекулой нуклеиновой кислоты отдельно от CAR-кодирующих векторов. В некоторых случаях, молекула iCaspase-9 кодируется той же молекулой нуклеиновой кислоты, что и CAR-кодирующий вектор. iCaspase-9 может представлять собой "предохранитель", чтобы избежать какой-либо токсичности CAR-экспрессирующих клеток. См., например, Song et al. Cancer Gene Ther. 2008; 15(10):667-75; описание клинического исследования под инвентарным номером NCT02107963 и Di Stasi et al. N. Engl. J. Med. 2011; 365:1673-83.
Альтернативные стратегии для регуляции терапии CAR по настоящему изобретению включают использование низкомолекулярных соединений или антител, деактивирующих или выключающих активность CAR, например, посредством истощения CAR-экспрессирующих клеток, например, посредством индукции антителозависимой клеточно-опосредованной цитотоксичности (ADCC). Например, CAR-экспрессирующие клетки, представленные в настоящем описании, также могут экспрессировать антиген, распознаваемый молекулами, способными индуцировать гибель клеток, например, ADCC или комплимент-индуцированную гибель клеток. Например, CAR-экспрессирующие клетки, представленные в настоящем описании, также могут экспрессировать рецептор, способный подвергаться таргетингу со стороны антитела или фрагмента антитела. Примеры таких рецепторов включают EpCAM, VEGFR, интегрины (например, интегрины ανβ3, α4, αΙ¾β3, α4β7, α5β1, ανβ3, αν), членов суперсемейства рецепторов ФНО (например, TRAIL-R1, TRAIL-R2), рецептор PDGF, рецептор интерферона, рецептор фолата, GPNMB, ICAM-1, HLA-DR, CEA, CA-125, MUC1, TAG-72, рецептор ИЛ-6, 5T4, GD2, GD3, CD2, CD3, CD4, CD5, CD11, CD11a/LFA-1, CD15, CD18/ITGB2, CD19, CD20, CD22, рецептор CD23/lgE, CD25, CD28, CD30, CD33, CD38, CD40, CD41, CD44, CD51, CD52, CD62L, CD74, CD80, CD125, CD147/басигин, CD152/CTLA-4, CD154/CD40L, CD195/CCR5, CD319/SLAMF7, EGFR и их укороченные версии (например, версии, сохраняющие один или более внеклеточных эпитопов, но лишенные одной или более областей в цитоплазматическом домене). Например, CAR-экспрессирующие клетки, представленные в настоящем описании, также могут экспрессировать укороченный рецептор эпидермального фактора роста (EGFR), у которого отсутствует способность к передаче сигнала, но сохраняющий эпитоп, распознаваемый молекулами, способными индуцировать ADCC, например, цетуксимабом (ERBITUX®), таким образом, что введение цетуксимаба индуцирует ADCC и последующее истощение CAR-экспрессирующих клеток (см., например, WO2011/056894, и Jonnalagadda et al., Gene Ther. 2013; 20(8)853-860). Другая стратегия включает экспрессию очень компактного маркера/"гена самоубийства", в котором комбинируют эпитопы-мишени из антигенов CD32 и CD20 в CAR-экспрессирующих клетках, представленных в настоящем описании, связывающихся с ритуксимабом, что приводит к селективному истощению CAR-экспрессирующих клеток, например, посредством ADCC (см., например, Philip et al., Blood. 2014; 124(8)1277-1287). Другие способы истощения CAR-экспрессирующих клеток, представленных в настоящем описании, включают введение CAMPATH®, моноклонального антитела против CD52, селективно связывающегося и воздействующего на зрелые лимфоциты, например, CAR-экспрессирующие клетки, для разрушения, например, посредством индукции ADCC. В других вариантах осуществления на CAR-экспрессирующие клетки можно селективно воздействовать с использованием лиганда CAR, например, антиидиотипического антитела. В некоторых вариантах осуществления антиидиотипическое антитело может вызывать активность эффекторной клетки, например, активности ADCC или ADC, таким образом, снижая количество CAR-экспрессирующих клеток. В других вариантах осуществления лиганд CAR, например, антиидиотипическое антитело, можно соединять со средством, индуцирующим цитолиз клеток, например, токсином, таким образом, снижая количество CAR-экспрессирующих клеток. Альтернативно, сами молекулы CAR можно конфигурировать таким образом, что можно регулировать активность, например, включать и выключать, как описано ниже.
В некоторых вариантах осуществления RCAR содержит набор полипептидов, как правило, два в простейших вариантах осуществления, в котором компоненты стандартного CAR, представленного в настоящем описании, например, антигенсвязывающий домен и внутриклеточный сигнальный домен, разделены по отдельным полипептидам или членам. В некоторых вариантах осуществления набор полипептидов включает переключатель димеризации, который при наличии молекулы димеризации может соединять полипептиды друг с другом, например, может соединять антигенсвязывающий домен с внутриклеточным сигнальным доменом. Дополнительное описание и примеры конфигураций таких регулируемых CAR представлены в настоящем описании и в международной публикации № WO2015/090229, включенной, таким образом, в настоящее описание в качестве ссылки в полном объеме.
В варианте осуществления RCAR содержит два полипептида или члена: 1) внутриклеточный сигнальный член, содержащий внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, представленный в настоящем описании, и первый домен-переключатель, 2) антигенсвязывающий член, содержащий антигенсвязывающий домен, например, направленный против опухолевого антигена, представленного в настоящем описании, как представлено в настоящем описании, и второй домен-переключатель. Необязательно, RCAR содержит трансмембранный домен, представленный в настоящем описании. В варианте осуществления трансмембранный домен может быть расположен на внутриклеточном сигнальном члене, на антигенсвязывающем члене или и том, и другом. (Если не указано иначе, если члены или элементы RCAR представлены в настоящем описании, порядок может быть таким, как представлено, но также включены другие порядки. Другими словами, в варианте осуществления порядок является таким, как определено в тексте, но в других вариантах осуществления порядок может отличаться. Например, порядок элементов на одной стороне трансмембранной области может отличаться от примера, например, расположение домена-переключателя относительно внутриклеточного сигнального домена может отличаться, например, являться обратным).
В варианте осуществления первый и второй домены-переключатели могут образовывать внутриклеточный или внеклеточный переключатель димеризации. В варианте осуществления переключатель димеризация может являться переключателем гомодимеризации, например, если первый и второй домен-переключатель являются одинаковыми, или переключателем гетеродимеризации, например, если первый и второй домен-переключатель отличаются друг от друга.
В вариантах осуществления RCAR может содержать "мульти-переключатель". Мульти-переключатель может содержать домены-переключатели гетеродимеризации или домены-переключатели гомодимеризации. Мульти-переключатель содержит множество, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10, доменов-переключателей, независимо от первого члена, например, антигенсвязывающего члена, и второго члена, например, внутриклеточного сигнального члена. В варианте осуществления первый член может содержать множество первых доменов-переключателей, например, домены-переключатели на основе FKBP, и второй член может содержать множество вторых доменов-переключателей, например, доменов-переключателей на основе FRB. В варианте осуществления первый член может содержать первый и второй домен-переключатель, например, домен-переключатель на основе FKBP и домен-переключатель на основе FRB, и второй член может содержать первый и второй домен-переключатель, например, домен-переключатель на основе FKBP и домен-переключатель на основе FRB.
В варианте осуществления внутриклеточный сигнальный член содержит один или более внутриклеточных сигнальных доменов, например, первичный внутриклеточный сигнальный домен и один или более костимуляторных сигнальных доменов.
В варианте осуществления антигенсвязывающий член может содержать один или более внутриклеточных сигнальных доменов, например, один или более костимуляторных сигнальных доменов. В варианте осуществления антигенсвязывающий член содержит множество, например, 2 или 3, костимуляторных сигнальных доменов, представленных в настоящем описании, например, выбранных из 4-1BB, CD28, CD27, ICOS и OX40, и в некоторых вариантах осуществления не содержит первичный внутриклеточный сигнальный домен. В варианте осуществления антигенсвязывающий член содержит следующие костимуляторные сигнальные домены в направлении от внеклеточного к внутриклеточному: 4-1BB-CD27, 4-1BB-CD27, CD27-4-1BB, 4-1BB-CD28, CD28-4-1BB, OX40-CD28, CD28-OX40, CD28-4-1BB или 4-1BB-CD28. В таких вариантах осуществления внутриклеточный связывающий член содержит домен CD3 дзета. В одном таком варианте осуществления RCAR содержит (1) антигенсвязывающий член, содержащий антигенсвязывающий домен, трансмембранный домен, два костимуляторных домена и первый домен-переключатель, и (2) внутриклеточный сигнальный домен, содержащий трансмембранный домен или мембраносвязывающий домен, по меньшей мере один первичный внутриклеточный сигнальный домен и второй домен-переключатель.
Вариант осуществления относится к RCAR, где антигенсвязывающий член не связан с поверхностью клетки CAR. Это позволяет клетке иметь внутриклеточный сигнальный член, удобно спаренный с одним или более антигенсвязывающими доменами, без трансформации клетки с использованием последовательности, кодирующей антигенсвязывающий член. В таких вариантах осуществления RCAR содержит: 1) внутриклеточный сигнальный член, содержащий: первый домен-переключатель, трансмембранный домен, внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен и первый домен-переключатель, и 2) антигенсвязывающий член, содержащий: антигенсвязывающий домен и второй домен-переключатель, где антигенсвязывающий член не содержит трансмембранный домен или мембраносвязанный домен и, необязательно, не содержит внутриклеточный сигнальный домен. В некоторых вариантах осуществления RCAR может дополнительно содержать 3) второй антигенсвязывающий член, содержащий: второй антигенсвязывающий домен, например, второй антигенсвязывающий домен, связывающийся иным антигеном, чем связываемый антигенсвязывающим доменом, и второй домен-переключатель.
Настоящее изобретение также относится к RCAR, где антигенсвязывающий член имеет способность к биспецифической активации и таргетингу. В этом варианте осуществления антигенсвязывающий член может содержать множество, например, 2, 3, 4 или 5, антигенсвязывающих доменов, например, scFv, где каждый антигенсвязывающий домен связывается с антигеном-мишенью, например, разными антигенами или одним и тем же антигеном, например, одинаковыми или разными эпитопами на одном антигене. В варианте осуществления множество антигенсвязывающих доменов находится в тандеме, и, необязательно, между каждым из антигенсвязывающих доменов располагают линкер или шарнирную область. Подходящие линкеры и шарнирные области представлены в настоящем описании.
Вариант осуществления относится к RCAR, имеющим конфигурацию, делающую возможным переключение пролиферации. В этом варианте осуществления RCAR содержит: 1) внутриклеточный сигнальный член, содержащий: необязательно, трансмембранный домен или мембраносвязанный домен, один или более костимуляторных сигнальных доменов, например, выбранных из 4-1BB, CD28, CD27, ICOS и OX40, и домен-переключатель, и 2) антигенсвязывающий член, содержащий: антигенсвязывающий домен, трансмембранный домен и первичный внутриклеточный сигнальный домен, например, домен CD3 дзета, где антигенсвязывающий член не содержит домен-переключатель или не содержит домен-переключатель, димеризующийся с доменом-переключателем на внутриклеточном сигнальном члене. В варианте осуществления антигенсвязывающий член не содержит костимуляторный сигнальный домен. В варианте осуществления внутриклеточный сигнальный член содержит домен-переключатель из переключателя гомодимеризации. В варианте осуществления внутриклеточный сигнальный член содержит первый домен-переключатель переключателя гетеродимеризации, и RCAR содержит второй внутриклеточный сигнальный член, содержащий второй домен-переключатель из переключателя гетеродимеризации. В таких вариантах осуществления второй внутриклеточный сигнальный член содержит те же внутриклеточные сигнальные домены, что и внутриклеточный сигнальный член. В варианте осуществления переключатель димеризации является внутриклеточным. В варианте осуществления переключатель димеризации является внеклеточным.
В любой из конфигураций RCAR, представленных в настоящем описании, первый и второй домены-переключатели содержат переключатель на основе FKBP-FRB, как представлено в настоящем описании.
Настоящее изобретение также относится к клеткам, содержащим RCAR, представленный в настоящем описании. Любую клетку, сконструированную для экспрессии RCAR, можно использовать в качестве RCARX-клетки. В варианте осуществления RCARX-клетка является T-клеткой, и ее обозначают как RCART-клетку. В варианте осуществления RCARX-клетка является NK-клеткой, и ее обозначают как RCARN-клетку.
Настоящее изобретение также относится к нуклеиновым кислотам и векторам, содержащим последовательности, кодирующие RCAR. Последовательность, кодирующую различные элементы RCAR, можно располагать на одной и той же молекуле нуклеиновой кислоты, например, одной и той же плазмиде или векторе, например, вирусном векторе, например, лентивирусном векторе. В варианте осуществления (i) последовательность, кодирующая антигенсвязывающий член, и (ii) последовательность, кодирующая внутриклеточный сигнальный член, может присутствовать на одной и той же нуклеиновой кислоте, например, векторе. Продукции соответствующих белков можно достигать, например, с использованием отдельных промоторов или с использованием бицистронного продукта транскрипции (что может приводить к продукции двух белков посредством расщепления единого продукта трансляции или посредством трансляции двух отдельных белковых продуктов). В варианте осуществления последовательность, кодирующая расщепляемый пептид, например, последовательность P2A или F2A, располагают между (i) и (ii). В варианте осуществления последовательность, кодирующую IRES, например, EMCV или EV71 IRES, располагают между (i) и (ii). В этих вариантах осуществления (i) и (ii) транскрибируются в виде единой РНК. В варианте осуществления первый промотор функционально связан с (i), и второй промотор функционально связан с (ii), таким образом, что (i) и (ii) транскрибируются в виде отдельных мРНК.
Альтернативно, последовательность, кодирующую различные элементы RCAR, можно располагать на разных молекулах нуклеиновой кислоты, например, разных плазмидах или векторах, например, вирусном векторе, например, лентивирусном векторе. Например, (i) последовательность, кодирующая антигенсвязывающий член, может присутствовать на первой нуклеиновой кислоте, например, первом векторе, и (ii) последовательность, кодирующая внутриклеточный сигнальный член, может присутствовать на второй нуклеиновой кислоте, например, втором векторе.
Переключатели димеризации
Переключатели димеризации могут являться нековалентными или ковалентными. В нековалентном переключателе димеризации молекула димеризации способствует нековалентному взаимодействию между доменами-переключателями. В ковалентном переключателе димеризации молекула димеризации способствует ковалентному взаимодействию между доменами-переключателями.
В варианте осуществления RCAR содержит переключатель димеризации на основе FKBP/FRAP или FKBP/FRB. FKBP12 (FKBP или FK506-связывающий белок) является избыточным цитоплазматическим белком, служащим в качестве исходной внутриклеточной мишени для природного продукта, иммуносупрессирующего лекарственного средства, рапамицина. Рапамицин связывается с FKBP и с крупным гомологом PI3K FRAP (RAFT, mTOR). FRB является частью FRAP размером 93 аминокислоты, достаточной для связывания комплекса FKBP-рапамицин (Chen, J., Zheng, X. F., Brown, E. J. & Schreiber, S. L. (1995) Identification of an 11-kDa FKBP12-rapamycin-binding domain within the 289-kDa FKBP12-rapamycin-associated protein and characterization of a critical serine residue. Proc Natl Acad Sci U S A 92: 4947-51.).
В вариантах осуществления в переключателе на основе FKBP/FRAP, например, FKBP/FRB, можно использовать молекулу димеризации, например, рапамицин или аналог рапамицина.
Аминокислотная последовательность FKBP является следующей:
D V P D Y A S L G G P S S P K K K R K V S R G V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S Y (SEQ ID NO: 275)
В вариантах осуществления домен-переключатель FKBP может содержать фрагмент FKBP, обладающей способностью связываться с FRB или его фрагментом или аналогом в присутствие рапамицина или рапалога, например, подчеркнутой части SEQ ID NO: 275, представляющей собой:
V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S (SEQ ID NO: 276)
Аминокислотная последовательность FRB является следующей:
ILWHEMWHEG LEEASRLYFG ERNVKGMFEV LEPLHAMMER GPQTLKETSF NQAYGRDLME AQEWCRKYMK SGNVKDLTQA WDLYYHVFRR ISK (SEQ ID NO: 277)
Как применяют в настоящем описании, термин "переключатель на основе FKBP/FRAP, например, FKBP/FRB" относится к переключателю димеризации, содержащему: первый домен-переключатель, содержащий фрагмент FKBP или его аналог, обладающий способностью связываться с FRB или его фрагментом или аналогом в присутствие рапамицина или рапалога, например, RAD001, и имеющий по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичности или отличающийся не более чем 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотным остатком от последовательности FKBP SEQ ID NO: 275 или 276, и второй домен-переключатель, содержащий фрагмент или аналог FRB, обладающий способностью связываться с FRB или его фрагментом или аналогом в присутствие рапамицина или рапалога, и имеющий по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичности или отличающийся не более, чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотным остатком от последовательности FRB SEQ ID NO: 277. В варианте осуществления RCAR, представленный в настоящем описании, содержит один домен-переключатель, содержащий аминокислотные остатки, описываемые в SEQ ID NO: 275 (или SEQ ID NO: 276), и один домен-переключатель, содержащий аминокислотные остатки, описываемые в SEQ ID NO: 277.
В вариантах осуществления переключатель димеризации FKBP/FRB содержит модифицированный домен-переключатель FRB, демонстрирующий измененное, например, повышенное, образование комплексов между доменом-переключателем на основе FRB, например, модифицированным доменом-переключателем FRB, доменом-переключателем на основе FKBP и молекулой димеризации, например, рапамицином или рапалогом, например, RAD001. В варианте осуществления модифицированный домен-переключатель FRB содержит одну или более мутаций, например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, выбранных из мутаций в положениях аминокислот L2031, E2032, S2035, R2036, F2039, G2040, T2098, W2101, D2102, Y2105 и F2108, где аминокислоту дикого типа подвергают мутации в любую другую природную аминокислоту. В варианте осуществления мутантный FRB содержит мутацию в E2032, где E2032 подвергают мутации в фенилаланин (E2032F), метионин (E2032M), аргинин (E2032R), валин (E2032V), тирозин (E2032Y), изолейцин (E2032I), например, SEQ ID NO: 278, или лейцин (E2032L), например, SEQ ID NO: 279. В варианте осуществления мутантный FRB содержит мутацию в T2098, где T2098 подвергают мутации в фенилаланин (T2098F) или лейцин (T2098L), например, SEQ ID NO: 280. В варианте осуществления мутантный FRB содержит мутацию в E2032 и T2098, где E2032 подвергают мутации в любую аминокислоту, и где T2098 подвергают мутации в любую аминокислоту, например, SEQ ID NO: 281. В варианте осуществления мутантный FRB содержит мутацию E2032I и T2098L, например, SEQ ID NO: 282. В варианте осуществления мутантный FRB содержит мутацию E2032L и T2098L, например, SEQ ID NO: 283.
Таблица 17. Пример мутантного FRB, имеющего повышенную аффинность для молекулы димеризации.
Другие подходящие переключатели димеризации включают переключатель димеризации на основе GyrB-GyrB, переключатель димеризации на основе гиббереллина, переключатель димеризации-метку/связывающее средство и переключатель димеризации halo-tag/snap-tag. Специалисту в этой области будут очевидны такие переключатели и важные молекулы димеризации при следовании руководству, представленному в настоящем описании.
Молекула димеризации
Связывание между доменами-переключателями стимулируется молекулой димеризации. В присутствие молекулы димеризации взаимодействие или связывание между доменами-переключателями делает возможной передачу сигнала между полипептидом, связанным, например, слитым, с первым доменом-переключателем, и полипептидом, связанным, например, слитым, со вторым доменом-переключателем. В присутствие неограничивающих уровней молекулы димеризации передача сигнала повышается в 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 5, 10, 50, 100 раз, например, как измеряют в системе, представленной в настоящем описании.
Рапамицин и аналоги рапамицина (иногда обозначаемые как рапалоги), например, RAD001, можно использовать в качестве молекул димеризации в переключателе димеризации на основе FKBP/FRB, представленном в настоящем описании. В варианте осуществления молекулу димеризации можно выбирать из рапамицина (сиролимуса), RAD001 (эверолимуса), зотаролимуса, темсиролимуса, AP-23573 (ридафоролимуса), биолимуса и AP21967. Дополнительные аналоги рапамицина, пригодные для использования с переключателями димеризации на основе FKBP/FRB, дополнительно описаны в разделе под названием "Способы комбинированного лечения" или в подразделе под названием "Комбинация с низкой, усиливающей иммунитет дозой ингибитора mTOR".
Разделенный CAR
В некоторых вариантах осуществления в CAR-экспрессирующей клетке используют разделенный CAR. Подход разделенного CAR более подробно описан в публикациях №№ WO2014/055442 и WO2014/055657, включенных в настоящее описание в качестве ссылки. В кратком изложении, система разделенного CAR содержит клетку, экспрессирующую первый CAR, содержащий первый антигенсвязывающий домен и костимуляторный домен (например, 41BB), и клетка также экспрессирует второй CAR, содержащий второй антигенсвязывающий домен и внутриклеточный сигнальный домен (например, CD3 дзета). Если клетка встречается с первым антигеном, костимуляторный домен активируется, и клетка пролиферирует. Если клетка встречается со вторым антигеном, внутриклеточный сигнальный домен активируется и начинается цитолитическая активность. Таким образом, CAR-экспрессирующая клетка полностью активируется лишь в присутствие обоих антигенов. В вариантах осуществления первый антигенсвязывающий домен распознает BCMA, например, содержит антигенсвязывающий домен, представленный в настоящем описании, и второй антигенсвязывающий домен распознает антиген, экспрессирующийся на клетках острого миелолейкоза, например, CD123, CLL-1, CD34, FLT3 или рецептор фолата бета. В вариантах осуществления первый антигенсвязывающий домен распознает BCMA, например, содержит антигенсвязывающий домен, представленный в настоящем описании, и второй антигенсвязывающий домен распознает антиген, экспрессирующийся на B-клетках, например, CD10, CD19, CD20, CD22, CD34, CD123, FLT-3, ROR1, CD79b, CD179b или CD79a.
Стабильность и мутации
Стабильность связывающего домена против BCMA, например, молекул scFv (например, растворимого scFv) можно оценивать по отношению к биофизическим свойствам (например, термической стабильностью) общепринятой контрольной молекулы scFv или полноразмерного антитела. В одном из вариантов осуществления гуманизированный scFv обладает термической стабильностью, большей на приблизительно 0,1, приблизительно 0,25, приблизительно 0,5, приблизительно 0,75, приблизительно 1, приблизительно 1,25, приблизительно 1,5, приблизительно 1,75, приблизительно 2, приблизительно 2,5, приблизительно 3, приблизительно 3,5, приблизительно 4, приблизительно 4,5, приблизительно 5, приблизительно 5,5, приблизительно 6, приблизительно 6,5, приблизительно 7, приблизительно 7,5, приблизительно 8, приблизительно 8,5, приблизительно 9, приблизительно 9,5, приблизительно 10 градусов, приблизительно 11 градусов, приблизительно 12 градусов, приблизительно 13 градусов, приблизительно 14 градусов или приблизительно 15 градусов Цельсия, чем у контрольной связывающей молекулы (например, общепринятой молекулы scFv) в описываемых анализах.
Улучшенная термическая стабильность связывающего домена против BCMA, например, scFv, впоследствии придается всей конструкции CART-BCMA, что приводит к улучшенным терапевтическим свойствам конструкции CART-BCMA. Термическую стабильность связывающего домена против BCMA, например, scFv можно улучшать по меньшей мере на приблизительно 2°C или 3°C по сравнению с общепринятым антителом. В одном из вариантов осуществления связывающий домен против BCMA, например, scFv, имеет улучшенную на 1°C термическую стабильность по сравнению с общепринятым антителом. В другом варианте осуществления связывающий домен против BCMA, например, scFv, имеет улучшенную на 2°C термическую стабильность по сравнению с общепринятым антителом. В другом варианте осуществления scFv имеет улучшенную на 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15°C термическую стабильность по сравнению с общепринятым антителом. Можно сравнивать, например, молекулы scFv, представленные в настоящем описании, и молекулы scFv или Fab-фрагменты антитела, из которых получают VH и VL scFv. Термическую стабильность можно измерять известными в этой области способами. Например, в одном из вариантов осуществления можно измерять Tm. Способы измерения Tm и другие способы определения стабильности белка более подробно описаны ниже.
Мутации в scFv (возникающие в результате гуманизации или прямого мутагенеза растворимого scFv) изменяют стабильность scFv и улучшают общую стабильность scFv и конструкции CART33. Стабильность scFv человека можно сравнивать с scFv мыши посредством измерений, таких как Tm, температуры денатурации и температуры агрегации.
Связывающую способность мутантных scFv можно определять с использованием анализов, описываемых в примерах.
В одном из вариантов осуществления связывающий домен против BCMA, например, scFv, содержит по меньшей мере одну мутацию, возникающую в результате гуманизации таким образом, что мутантный scFv придает улучшенную стабильность конструкции CART-BCMA. В другом варианте осуществления связывающий домен против BCMA, например, scFv, содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мутаций, возникающих в результате гуманизации таким образом, что мутантный scFv придает улучшенную стабильность конструкции CART-BCMA.
Способы оценки стабильности белка
Стабильность антигенсвязывающего домена можно оценивать, например, описываемыми ниже способами. Такие способы позволяют определять множество термических конформационных переходов с разворачиванием, где наименьший стабильный домен разворачивается первым или ограничивает общий порог стабильности мультидоменной единицы, разворачивающейся совместно (например, мультидоменного белка, демонстрирующего один конформационный переход с разворачиванием). Наименьший стабильный домен можно идентифицировать рядом дополнительных способов. Можно осуществлять мутагенез для определения того, какой домен ограничивает общую стабильность. Кроме того, анализ резистентности мультидоменного белка к протеазе можно осуществлять в условиях, в которых известно, что наименьший стабильный домен, по существу, разворачивается, посредством DSC или другими спектроскопическими способами (Fontana, et al., (1997) Fold. Des., 2: R17-26; Dimasi et al. (2009) J. Mol. Biol. 393: 672-692). После идентификации наименьшего стабильного домена последовательность, кодирующую этот домен (или его часть), можно использовать в способах как тестовую последовательность.
a) Термическая стабильность
Термическую стабильность композиций можно анализировать с использованием ряда неограничивающих биофизических или биохимических способов, известных в этой области. В определенных вариантах осуществления термическую стабильность оценивают посредством аналитической спектроскопии.
Примером способа аналитической спектроскопии является дифференциальная сканирующая калориметрия (DSC). В DSC используют калориметр, чувствительный к поглощению тепла, сопровождающего разворачивание большинства белков или белковых доменов (см., например, Sanchez-Ruiz, et al., Biochemistry, 27: 1648-52, 1988). Для определения термической стабильности белка образец белка вносят в калориметр и повышают температуру до разворачивания Fab или scFv. Температура, при которой белок разворачивается, свидетельствует об общей стабильности белка.
Другим примером способа аналитической спектроскопии является спектроскопия кругового дихроизма (CD). При спектроскопии CD измеряют оптическую активность композиции как функцию повышающейся температуры. При спектроскопии кругового дихроизма (CD) измеряют различия в поглощении левополяризованного света по сравнению с правополяризованным светом, которые возникают в результате структурной асимметрии. Нарушенная или развернутая структура приводит к спектру CD, очень отличающемуся от такового у упорядоченной или свернутой структуры. Спектр CD отражает чувствительность белков к денатурирующим эффектам повышенной температуры и, таким образом, свидетельствует о термической стабильности белка (см. van Mierlo and Steemsma, J. Biotechnol., 79(3):281-98, 2000).
Другим примером способа аналитической спектроскопии для измерения термической стабильности является флуоресцентная спектроскопия (см. van Mierlo and Steemsma, выше). Другим примером способа аналитической спектроскопии для измерения термической стабильности является ядерная магнитно-резонансная спектроскопия (ЯМР) (см., например, van Mierlo and Steemsma, выше).
Термическую стабильность композиции можно измерять биохимически. Примером биохимического способа оценки термической стабильности является анализ посредством термической проверки. В "анализе посредством термической проверки" композицию подвергают воздействию диапазона повышенных температур в течение установленного периода времени. Например, в одном из вариантов осуществления тестовые молекулы scFv или молекулы, содержащие молекулы scFv, подвергают воздействию диапазона повышенных температур, например, в течение 1-1,5 часов. Затем оценивают активность белка с помощью соответствующего биохимического анализа. Например, если белок является связывающим белком (например, scFv или scFv-содержащим полипептидом), связывающую активность связывающего белка можно определять посредством функционального или количественного ELISA.
Такой анализ можно осуществлять в высокопроизводительном формате и форматов, описываемых в примерах с использованием E. coli и высокопроизводительного скрининга. Библиотеку связывающего домена против BCMA, например, вариантов scFv, можно получать известными в этой области способами. Экспрессию связывающего домена против BCMA, например, scFv, можно индуцировать и связывающий домен против BCMA, например, scFv, можно подвергать термической проверке. Исследуемые тестовые образцы можно оценивать на связывание, и связывающий домен против BCMA, например, scFv, являющийся стабильным, можно расширять и дополнительно охарактеризовывать.
Термическую стабильность оценивают посредством измерения температуры плавления (Tm) композиции с использованием любого их указанных выше способов (например, способов аналитической спектроскопии). Температура плавления является температурой в середине кривой термического перехода, где 50% молекул композиции находятся в свернутом состоянии (см. например, Dimasi et al. (2009) J. Mol Biol. 393: 672-692). В одном из вариантов осуществления значения Tm для связывающего домена против BCMA, например, scFv, составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C. В одном из вариантов осуществления значения Tm для IgG составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C. В одном из вариантов осуществления значения Tm для поливалентного антитела составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C.
Термическую стабильность также оценивают посредством измерения удельной теплоемкости или теплоемкости (Cp) композиции с использованием аналитического калориметрического способа (например, DSC). Удельная теплоемкость композиции является энергией (например, в ккал/моль), необходимой для повышения температуры 1 моль воды на 1°C. Высокая Cp является признаком денатурированной или неактивной композиции или белка. Изменение теплоемкости (ΔCp) композиции измеряют посредством определения удельной теплоемкости композиции до и после его термического перехода. Термическую стабильность также можно оценивать посредством измерения или определения других параметров термодинамической стабильности, включая свободную энергию Гиббса разворачивания (ΔG), энтальпию разворачивания (ΔH) или энтропию разворачивания (ΔS). Один или более из указанных выше биохимических анализов (например, анализ посредством термической проверки) используют для определения температуры (т.е. значения TC), при которой 50% композиции сохраняет свою активность (например, связывающую активность).
Кроме того, мутации в связывающем домене против BCMA, например, scFv, изменяют термическую стабильность связывающего домена против BCMA, например, scFv, по сравнению с немутантным связывающим доменом против BCMA, например, scFv. Если человеческий или гуманизированный связывающий домен против BCMA, например, scFv, встраивают в конструкцию BCMA, связывающий домен против BCMA, например, гуманизированный scFv, придает термическую стабильность общей конструкции CART против BCMA. В одном из вариантов осуществления связывающий домен против BCMA, например, scFv, содержит одну мутацию, придающую термическую стабильность связывающему домену против BCMA, например, scFv. В другом варианте осуществления связывающий домен против BCMA, например, scFv, содержит множество мутаций, придающих термическую стабильность связывающему домену против BCMA, например, scFv. В одном из вариантов осуществления множественные мутации в связывающем домене против BCMA, например, scFv, имеют аддитивный эффект в отношении термической стабильности связывающего домена против BCMA, например, scFv.
b) % агрегации
Стабильность композиции можно определять посредством измерения ее склонности к агрегации. Агрегацию можно измерять рядом неограничивающих биохимических или биофизических способов. Например, агрегацию композиции можно оценивать с использованием хроматографии, например, эксклюзионной хроматографии (SEC). При SEC разделяют молекулы с учетом их размера. Колонку наполняют полутвердыми бусами полимерного геля, который будет пропускать ионы и низкомолекулярные соединения внутрь себя, но не крупные молекулы. Если белковую композицию наносят сверху колонки, компактные свернутые белки (т.е. неагрегировавшие белки) распределяются в большем объеме растворителя, чем доступно для крупных белковых агрегатов. Таким образом, крупные агрегаты быстрее двигаются через колонку, и, таким образом, смесь можно разделять или фракционировать на компоненты. Каждую фракцию можно раздельно подвергать количественному анализу (например, по рассеянию света) с его элюцией из геля. Таким образом, % агрегации композиции можно определять, сравнивая концентрацию фракции с общей концентрацией белка, нанесенного на гель. Стабильные композиции элюируют из колонки в виде, по существу, единой фракции, и они выглядят как, по существу, единый пик на профиле элюции или хроматограмме.
c) Аффинность связывания
Стабильность композиции можно оценивать посредством определения ее аффинности связывания мишени. В этой области известен широкий спектр способов определения аффинности связывания. В примере способа определения аффинности связывания используют поверхностный плазмонный резонанс. Поверхностный плазмонный резонанс является оптическим явлением, делающим возможным анализ биоспецифических взаимодействий в реальном времени посредством детекции изменений концентрации белка в матрице биосенсора, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden и Piscataway, N.J.). Дополнительное описание см. в Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26; Jonsson, U., i (1991) Biotechniques 11:620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8:125-131 и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277.
В одном из аспектов антигенсвязывающий домен CAR содержит аминокислотную последовательность, гомологичную аминокислотной последовательности антигенсвязывающего домена, представленной в настоящем описании, и антигенсвязывающий домен сохраняет желаемые функциональные свойства фрагментов антител против BCMA, представленных в настоящем описании. В одном конкретном аспекте композиция CAR по изобретению содержит фрагмент антитела. В дополнительном аспекте этот фрагмент антитела содержит scFv.
В различных аспектах антигенсвязывающий домен CAR конструируют посредством модификации одной или более аминокислот в одной или обеих вариабельных областях (например, VH и/или VL), например, в одной или более областях CDR и/или одной или более каркасных областях. В одном конкретном аспекте композиция CAR по изобретению содержит фрагмент антитела. В дополнительном аспекте этот фрагмент антитела содержит scFv.
Специалисту в этой области будет понятно, что антитело или фрагмент антитела по изобретению можно дополнительно модифицировать таким образом, что они отличаются по аминокислотной последовательности (например, из дикого типа), но не по желаемой активности. Например, в белке можно делать дополнительные замены нуклеотидов, например, консервативные замены, приводящие к заменам аминокислот, например, консервативным заменам в "не являющихся необходимыми" аминокислотных остатках. Например, не являющийся необходимым аминокислотный остаток в молекуле можно заменять другим аминокислотным остатком из того же семейства боковых цепей. В другом варианте осуществления цепь аминокислот можно заменять структурно схожей цепью, отличающейся порядком и/или композицией членов семейства боковой цепи, например, консервативной заменой, в которой аминокислотный остаток заменяют аминокислотным остатком, имеющим схожую боковую цепь.
В этой области определены семейства аминокислотных остатков, имеющих схожие боковые цепи, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
Процент идентичности в отношении двух или более последовательностей нуклеиновых кислот или полипептидных последовательностей относится к двум или более последовательностям, являющимся одинаковыми. Две последовательности являются "по существу, идентичными", если две последовательности обладают определенной процентной долей аминокислотных остатков или нуклеотидов, являющихся одинаковыми (например, 60% идентичности, необязательно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности в определенной области, или, если не указано, по всей последовательности), при сравнении и выравнивании для максимального соответствия в окне сравнения или обозначенной области, как измеряют с использованием одного из следующих алгоритмов сравнения последовательности или посредством выравнивания вручную и визуального осмотра. Необязательно, идентичность существует в области, составляющей по меньшей мере приблизительно 50 нуклеотидов (или 10 аминокислот) в длину или более предпочтительно - в области, составляющей от 100 до 500 или 1000 или более нуклеотидов (или 20, 50, 200 или более аминокислот) в длину.
В случае сравнения последовательности, как правило, одна последовательность выступает в качестве референсной последовательности, с которой сравнивают тестовые последовательности. При использовании алгоритма сравнения последовательности тестовые и референсные последовательности вносят в компьютер, обозначают координаты подпоследовательности, при необходимости, и задают параметры программы алгоритма последовательности. Можно использовать параметры программы по умолчанию или можно задавать альтернативные параметры. Затем посредством алгоритма сравнения последовательностей вычисляют процент идентичности последовательности для тестовых последовательностей относительно референсной последовательности с учетом параметров программы. В этой области хорошо известны способы выравнивания последовательностей для их сравнения. Оптимальное выравнивание последовательностей для их сравнения можно осуществлять, например, посредством алгоритма локальной гомологии Smith and Waterman, (1970) Adv. Appl. Math. 2:482c, алгоритма гомологичного выравнивания Needleman and Wunsch, (1970) J. Mol. Biol. 48:443, способом поиска сходства Pearson and Lipman, (1988) Proc. Nat'l. Acad. Sci. USA 85:2444, с помощью компьютерных воплощений этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) или посредством выравнивания вручную и визуального осмотра (см., например, Brent et al., (2003) Current Protocols in Molecular biology).
Двумя примерами алгоритмов, подходящих для определения процента идентичности последовательности и сходства последовательности, являются алгоритмы BLAST и BLAST 2.0, описываемые в Altschul et al., (1977) Nuc. Acids Res. 25:3389-3402 и Altschul et al., (1990) J. Mol. Biol. 215:403-410, соответственно. Программное обеспечение для осуществления анализов BLAST является общедоступным в National Center for Biotechnology Information.
Процент идентичности двух аминокислотных последовательностей также можно определять с использованием алгоритма E. Meyers и W. Miller, (1988) Comput. Appl. Biosci. 4:11-17), встроенного в программу ALIGN (версии 2.0), с использованием таблицы весов PAM120, штрафа за длину пропуска 12 и штрафа за открытие пропуска 4. Кроме того, процент идентичности двух аминокислотных последовательностей можно определять с использованием алгоритма Needleman and Wunsch (1970) J. Mol. Biol. 48:444-453), встроенного в программу GAP в пакете программ GCG (доступном на www.gcg.com), с использованием матрицы Blossom 62 или матрицы PAM250, и штрафа за пропуск 16, 14, 12, 10, 8, 6 или 4 и штрафа за удлинение пропуска 1, 2, 3, 4, 5 или 6.
В одном из аспектов настоящее изобретение включает модификации аминокислотной последовательности исходного антитела или фрагмента (например, scFv), которые приводят к получению функционально эквивалентных молекул. Например, VH или VL связывающего домена против BCMA, например, scFv, содержащиеся в CAR, можно модифицировать так, чтобы они сохраняли по меньшей мере приблизительно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности по отношению к исходной каркасной области VH или VL связывающего домена против BCMA, например, scFv. Настоящее изобретение включает модификации целой конструкции CAR, например, модификации одной или более аминокислотных последовательностей различных доменов конструкции CAR для получения функционально эквивалентных молекул. Конструкцию CAR можно модифицировать так, чтобы она имела по меньшей мере приблизительно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности по отношению к исходной конструкции CAR.
Трансфекция РНК
Настоящее изобретение относится к способам получения транскрибируемой in vitro РНК CAR. Настоящее изобретение также относится к конструкции РНК, кодирующей CAR, которую можно напрямую трансфицировать в клетку. Способ получения мРНК для применения в трансфекции может включать транскрипцию in vitro (IVT) матрицы с использованием специально сконструированных праймеров в последующим добавлением поли(A) для получения конструкции, содержащей последовательность 3'- и 5'-нетранслируемой области ("UTR"), 5'-кэп и/или внутренний участок связывания рибосомы (IRES), нуклеиновую кислоту, подлежащую экспрессии, и поли(A)-хвост, как правило, 50-2000 оснований в длину (SEQ ID NO: 35). Используя полученную таким образом РНК, можно эффективно трансфицировать различные типы клеток. В одном из аспектов матрица включает последовательности CAR.
В одном из аспектов CAR против BCMA кодируется матричной РНК (мРНК). В одном из аспектов мРНК, кодирующую CAR против BCMA, встраивают в иммунную эффекторную клетку, например, T-клетку или NK-клетку, для получения CAR-экспрессирующей клетки (например, CART-клетки или CAR-экспрессирующей NK-клетки).
В одном из вариантов осуществления транскрибируемую in vitro РНК CAR можно встраивать в клетку в форме транзиторной трансфекции. РНК получают посредством транскрипции in vitro с использованием матрицы, полученной посредством полимеразной цепной реакции (ПЦР). Интересующую ДНК из любого источника можно напрямую преобразовывать посредством ПЦР в матрицу для синтеза мРНК in vitro с использованием соответствующих праймеров и РНК-полимеразы. Источником ДНК может являться, например, геномная ДНК, плазмидная ДНК, фаговая ДНК, кДНК, синтетическая последовательность ДНК или любой другой соответствующий источник ДНК. Желаемой моделью для транскрипции in vitro является CAR по настоящему изобретению. Например, матрица для РНК CAR содержит внеклеточную область, содержащую одноцепочечный вариабельный домен противоопухолевого антитела, шарнирную область, трансмембранный домен (например, трансмембранный домен CD8a) и цитоплазматическую область, включающую внутриклеточный сигнальный домен, например, содержащий сигнальный домен CD3 дзета и сигнальный домен 4-1BB.
В одном из вариантов осуществления ДНК для использования в ПЦР содержит открытую рамку считывания. ДНК может быть из природной последовательности ДНК из генома организма. В одном из вариантов осуществления нуклеиновая кислота может включать некоторые или все из 5' и/или 3'-нетранслируемых областей (UTR). Нуклеиновая кислота может включать экзоны и интроны. В одном из вариантов осуществления ДНК для использования в ПЦР является последовательностью нуклеиновой кислоты человека. В другом варианте осуществления ДНК для использования в ПЦР является последовательностью нуклеиновой кислоты человека, включающей 5'- и 3'-UTR. Альтернативно, ДНК может являться искусственной последовательностью ДНК, в норме не экспрессирующейся в природном организме. Примером искусственной последовательности ДНК является последовательность, содержащая части генов, лигированных вместе для получения открытой рамки считывания, кодирующей слитый белок. Лигированные вместе части ДНК могут быть из одного организма или более организмов.
ПЦР используют для получения матрицы для транскрипции in vitro мРНК, используемой для трансфекции. Способы осуществления ПЦР хорошо известны в этой области. Праймеры для использования в ПЦР конструируют так, чтобы они имели области, по существу, комплементарные областям ДНК для использования в качестве матрицы для ПЦР. Как применяют в настоящем описании, термин "по существу, комплементарный" относится к последовательностям нуклеотидов, где большинство или все основания в последовательности праймера являются комплементарными, или одно или более оснований являются некомплементарными или несовпадающими. По существу комплементарные последовательности способны отжигаться или гибридизоваться с предполагаемой ДНК-мишенью в условиях отжига, используемых для ПЦР. Праймеры можно конструировать, по существу, комплементарными любой части ДНК-матрицы. Например, праймеры можно конструировать для амплификации части нуклеиновой кислоты, как правило, транскрибируемой в клетках (открытая рамка считывания), включая 5'- и 3'-UTR. Праймеры также можно конструировать для амплификации части нуклеиновой кислоты, кодирующей конкретный интересующий домен. В одном из вариантов осуществления праймеры конструируют для амплификации кодирующей области кДНК человека, включая все или части 5'-и 3'-UTR. Праймеры, применимые для ПЦР можно получать, способами синтеза, хорошо известными в этой области. "Прямые праймеры" являются праймерами, содержащими область нуклеотидов, по существу, комплементарную нуклеотидам на ДНК-матрице, расположенным выше последовательности ДНК, подлежащей амплификации. Термин "выше" в настоящем описании используют для обозначения 5'-направления к последовательности ДНК, подлежащей амплификации, относительно кодирующей цепи. "Обратные праймеры" являются праймерами, содержащими область нуклеотидов, по существу, комплементарным двухцепочечной ДНК-матрице, расположенной ниже последовательности ДНК, подлежащей амплификации. Термин "ниже" в настоящем описании используют для обозначения 3'-направления к последовательности ДНК, подлежащей амплификации, относительно кодирующей цепи.
В способах, представленных в настоящем описании, можно использовать любую ДНК-полимеразу, применимую для ПЦР. Реагенты и полимераза коммерчески доступны в ряде источников.
Также можно использовать химические структуры, которые могут способствовать стабильности и/или эффективности трансляции. РНК, предпочтительно, содержит 5'- и 3'-UTR. В одном из вариантов осуществления 5'-UTR составляет от одного до 3000 нуклеотидов в длину. Длину последовательностей 5'- и 3'-UTR для добавления в кодирующую область можно изменять различными способами, включая, в качестве неограничивающих примеров, конструирование праймеров для ПЦР, отжигающихся на разных областях UTR. Используя этот подход, специалист в этой области может модифицировать длины 5'- и 3'-UTR, необходимые для достижения оптимальной эффективности трансляции после трансфекции транскрибируемой РНК.
5'- и 3'-UTR могут являться природными, эндогенными 5'- и 3'-UTR для интересующей нуклеиновой кислоты. Альтернативно, можно добавлять последовательности UTR, не являющиеся эндогенными для интересующей нуклеиновой кислоты, посредством встраивания последовательностей UTR в прямые и обратные праймеры или посредством любой другой модификации матрицы. Использование последовательностей UTR, не являющихся эндогенными для интересующей нуклеиновой кислоты, может быть применимым для модификации стабильности и/или эффективности трансляции РНК. Например, известно, что AU-богатые элементы в последовательностях 3'-UTR могут снижать стабильность мРНК. Таким образом, 3'-UTR можно выбирать или конструировать для повышения стабильности транскрибируемой РНК с учетом свойств UTR, хорошо известных в этой области.
В одном из вариантов осуществления 5'-UTR может содержать последовательность Козак эндогенной нуклеиновой кислоты. Альтернативно, если 5'-UTR не является эндогенной по отношению к интересующей нуклеиновой кислоте, добавляемой посредством ПЦР, как описано выше, консенсусную последовательность Козак можно реконструировать посредством добавления последовательности 5'-UTR. Последовательности Козак могут повышать эффективность трансляции некоторых транскриптов РНК, но, по-видимому, не является необходимой для всех РНК, чтобы сделать возможной эффективную трансляцию. Требование в отношении последовательностей Козак для многих мРНК известно в этой области. В других вариантах осуществления 5'-UTR может являться 5'-UTR РНК-вируса, РНК-геном которого является стабильным в клетках. В других вариантах осуществления можно использовать различные аналоги нуклеотидов в 3'- или 5'-UTR для препятствования деградации мРНК экзонуклеазой.
Чтобы сделать возможным синтез РНК из ДНК-матрицы без потребности в клонировании гена, промотор для транскрипции необходимо присоединять к ДНК-матрице выше последовательности, подлежащей транскрипции. Если последовательность, функционирующую в качестве промотора для РНК-полимеразы, добавляют на 5'-конец прямого праймера, промотор для РНК-полимеразы становится встроенным в продукт ПЦР выше открытой рамки считывания, подлежащей транскрипции. В одном из предпочтительных вариантов осуществления промотор является промотором полимеразы T7, как представлено где-либо в настоящем описании. Другие применимые промоторы включают, в качестве неограничивающих примеров, промоторы РНК-полимераз T3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6 известны в этой области.
В предпочтительном варианте осуществления мРНК имеет и кэп на 5'-конце, и 3'-поли(A)-хвост, определяющий связывание с рибосомой, инициацию трансляции и стабильность мРНК в клетке. На кольцевой ДНК-матрице, например, плазмидной ДНК, РНК-полимераза продуцирует длинный конкатемерный продукт, не подходящий для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной на конце 3'-UTR приводит к образованию мРНК нормального размера, не являющейся эффективной при трансфекции эукариот, даже если она полиаденилируется после транскрипции.
На линейной ДНК-матрице РНК-полимераза фага T7 может удлинять 3'-конец транскрипта за пределы последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270:1485-65 (2003).
Общепринятым способом встраивания поли(A/T)-тяжей в ДНК-матрицу является молекулярное клонирование. Однако поли(A/T)-последовательность, встроенная в плазмидную ДНК, может вызывать нестабильность плазмиды, по этой причине плазмидные ДНК-матрицы, полученные из бактериальных клеток зачастую крайне контаминированы делециями и другими аномалиями. Это делает клонирование не только трудоемким и занимающим много времени, но часто и ненадежным. По этой причине способ, делающий возможным конструирование ДНК-матриц с 3'-поли(A/T)-тяжем без клонирования, является крайне желательным.
Поли(A/T)-сегмент транскрипционной ДНК-матрицы можно получать при ПЦР с использованием обратного праймера, содержащего поли(T)-хвост, такой как 100(T)-хвост (SEQ ID NO: 31) (размер может составлять 50-5000 T (SEQ ID NO: 32)), или после ПЦР любым другим способом, включая, в качестве неограничивающих примеров, лигирование ДНК или рекомбинацию in vitro. Поли(A)-хвосты также обеспечивают стабильность РНК и снижают их деградацию. Как правило, длина поли(A)-хвоста положительно коррелирует со стабильностью транскрибируемой РНК. В одном из вариантов осуществления поли(A)-хвост составляет от 100 до 5000 аденозинов (SEQ ID NO: 33).
Поли(A)-хвосты РНК можно дополнительно удлинять после транскрипции in vitro с использованием поли(A)-полимеразы, такой как поли(A)-полимераза E. coli (E-PAP). В одном из вариантов осуществления повышение длины поли(A)-хвоста с 100 нуклеотидов до от 300 до 400 нуклеотидов (SEQ ID NO: 34) приводит приблизительно к двукратному повышению эффективности трансляции РНК. Кроме того, присоединение различных химических групп к 3'-концу может повышать стабильность мРНК. Такое присоединение может включать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, можно встраивать аналоги АТФ в поли(A)-хвост с использованием поли(A)-полимеразы. Аналоги АТФ могут дополнительно повышать стабильность РНК.
5'-кэп также обеспечивает стабильность молекул РНК. В предпочтительном варианте осуществления РНК, получаемая способами, представленными в настоящем описании, включает 5'-кэп. 5'-кэп получают способами, известными в этой области и представленными в настоящем описании (Cougot, et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski, et al., RNA, 7:1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
РНК, получаемая способами, представленными в настоящем описании, также может содержать последовательность внутреннего участка связывания рибосомы (IRES). Последовательность IRES может являться любой вирусной, хромосомной или искусственно сконструированной последовательностью, инициирующей кэп-независимое связывание рибосом с мРНК и облегчающей инициацию трансляции. Можно включать любые растворы, подходящие для электропорации клеток, которые могут содержать факторы, способствующие клеточной проницаемости и жизнеспособности, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
РНК можно встраивать в клетки-мишени любым из ряда различных способов, например, коммерчески доступных способов, включающих, в качестве неограничивающих примеров, электропорацию с использованием Amaxa Nucleofector-II (Amaxa Biosystems, Cologne, Germany), ECM 830 (BTX) (Harvard Instruments, Boston, Mass.) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendorf, Hamburg, Germany), трансфекцию, опосредуемую катионными липосомами, с использованием липофекции, инкапсуляцию полимерами, пептид-опосредованную трансфекцию или системы биолистической доставки частиц, такие как "генные пушки" (см., например, Nishikawa, et al. Hum Gene Ther., 12(8):861-70 (2001).
Невирусные способы доставки
В некоторых аспектах, для доставки нуклеиновой кислоты, кодирующей CAR, представленный в настоящем описании, в клетку, или ткань, или индивидуума можно использовать невирусные способы.
В некоторых вариантах осуществления невирусный способ включает использование транспозона (также называемого мобильным генетическим элементом). В некоторых вариантах осуществления транспозон является фрагментом ДНК, который сам может себя встраивать в участок генома, например, фрагментом ДНК, способным самореплицироваться и встраивать свою копию в геном, или фрагментом ДНК, который может сплайсироваться из более длинной нуклеиновой кислоты и встраиваться в другое место в геноме. Например, транспозон содержит последовательность ДНК, состоящую из инвертированных повторов, фланкирующих гены для транспозиции.
Примеры способов доставки нуклеиновых кислот с использованием транспозона включают систему транспозона "Спящая красавица" (SBTS) и систему транспозона piggyBac (PB). См., например, Aronovich et al. Hum. Mol. Genet. 20.R1(2011):R14-20; Singh et al. Cancer Res. 15(2008):2961-2971; Huang et al. Mol. Ther. 16(2008):580-589; Grabundzija et al. Mol. Ther. 18(2010):1200-1209; Kebriaei et al. Blood. 122,21(2013):166; Williams. Molecular Therapy 16,9(2008):1515-16; Bell et al. Nat. Protoc. 2,12(2007):3153-65 и Ding et al. Cell. 122,3(2005):473-83, все из которых включены в настоящее описание в качестве ссылок.
SBTS включает два компонента: 1) транспозон, содержащий трансген, и 2) источник фермента транспозазы. Транспозаза может переносить транспозон из плазмиды-носителя (или другой донорной ДНК) в ДНК-мишень, такую как хромосома/геном клетки-хозяина. Например, транспозаза связывается с плазмидой-носителем/донорной ДНК, вырезает транспозон (включающий трансгены) из плазмиды и встраивает его в геном клетки-хозяина. См., например, Aronovich et al., выше.
Примеры транспозонов включают транспозон на основе pT2. См., например, Grabundzija et al. Nucleic Acids Res. 41,3(2013):1829-47 и Singh et al. Cancer Res. 68,8(2008): 2961-2971, все из которых включены в настоящее описание в качестве ссылок. Примеры транспозаз включают транспозазу Tc1/типа mariner, например, транспозазу SB10 или транспозазу SB11 (гиперактивную транспозазу, которая может экспрессироваться, например, с промотора цитомегаловируса). См., например, Aronovich et al.; Kebriaei et al. и Grabundzija et al., все из которых включены в настоящее описание в качестве ссылок.
Использование SBTS делает возможной эффективную интеграцию и экспрессию трансгена, например, нуклеиновой кислоты, кодирующей CAR, представленный в настоящем описании. Настоящее изобретение относится к способам получения клетки, например, T-клетки или NK-клетки, стабильно экспрессирующей CAR, представленный в настоящем описании, например, с использованием системы транспозона, такой как SBTS.
В соответствии со способами, представленными в настоящем описании, в некоторых вариантах осуществления одну или более нуклеиновых кислот, например, плазмид, содержащих компоненты SBTS, доставляют в клетку (например, T- или NK-клетку). Например, нуклеиновые кислоты доставляют стандартными способами доставки нуклеиновых кислот (например, плазмидной ДНК), например, способами, представленными в настоящем описании, например, электропорацией, трансфекцией или липофекцией. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген, например, нуклеиновую кислоту, кодирующую CAR, представленный в настоящем описании. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген (например, нуклеиновую кислоту, кодирующую CAR, представленный в настоящем описании), а также последовательность нуклеиновой кислоты, кодирующую фермент транспозазу. Другие варианты осуществления относятся к системе с двумя нуклеиновыми кислотами, например, двойной плазмидной системе, например, где первая плазмида содержит транспозон, содержащий трансген, и вторая плазмида содержит последовательность нуклеиновой кислоты, кодирующую фермент транспозазу. Например, первую и вторую нуклеиновые кислоты совместно доставляют в клетку-хозяина.
В некоторых вариантах осуществления получают клетки, например, T- или NK-клетки, экспрессирующие CAR, представленный в настоящем описании, с использованием комбинации встраивания гена с использованием SBTS и генетического редактирования с использованием нуклеазы (например, нуклеаз с цинковыми пальцами (ZFN), подобных активатору транскрипции эффекторных нуклеаз (TALEN), системы CRISPR/Cas или сконструированных мегануклеаз-реконструированных хоминг-эндонуклеаз).
В некоторых вариантах осуществления использование невирусного способа доставки делает возможным перепрограммирование клеток, например, T- или NK-клеток, и прямую инфузию клеток индивидууму. Преимущества невирусных векторов включают, в качестве неограничивающих примеров, простоту и относительно низкую стоимость получения достаточных количеств, необходимых для соответствия требованиям популяции пациентов, стабильности при хранении и отсутствия иммуногенности.
Конструкции нуклеиновых кислот, кодирующие CAR
Настоящее изобретение также относится к молекулам нуклеиновой кислоты, кодирующим одну или более конструкции CAR, представленных в настоящем описании. В одном из аспектов молекула нуклеиновой кислоты представлена в виде транскрипта матричной РНК. В одном из аспектов молекула нуклеиновой кислоты представлена в виде конструкции ДНК.
Таким образом, в одном из аспектов изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR), где CAR содержит связывающий домен против BCMA (например, связывающий домен человека против BCMA), трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимуляторный домен, например, костимуляторный сигнальный домен и/или первичный сигнальный домен, например, дзета-цепь. В одном из вариантов осуществления связывающий домен против BCMA является связывающим доменом против BCMA, представленным в настоящем описании, например, связывающим доменом против BCMA, содержащим последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 или SEQ ID NO: 149, или последовательность с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления трансмембранный домен является трансмембранным доменом белка, выбранным из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном из вариантов осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6 или последовательность с 95-99% идентичности по отношению к ней. В одном из вариантов осуществления связывающий домен против BCMA соединяют с трансмембранным доменом посредством шарнирной области, например, шарнирной области, представленной в настоящем описании. В одном из вариантов осуществления шарнирная область содержит SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4 или SEQ ID NO: 5, или последовательность с 95-99% идентичности по отношению к ним. В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимуляторный домен. В одном из вариантов осуществления костимуляторный домен является функциональным сигнальным доменом белка, выбранным из группы, состоящей из молекулы MHC класса I, белков рецепторов ФНО, иммуноглобулин-подобных белков, рецепторов цитокинов, интегринов, сигнальных молекул активации лимфоцитов (белков SLAM), активирующих рецепторов NK-клеток, BTLA, рецептора Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающегося с CD83. В одном из вариантов осуществления костимуляторный домен содержит последовательность SEQ ID NO: 7, или последовательность с 95-99% идентичности по отношению к ней, или костимуляторный домен CD27, имеющий последовательность SEQ ID NO: 8 (или последовательность с 95-99% идентичности по отношению к ней), или костимуляторный домен CD28, имеющий последовательность SEQ ID NO: 379 (или последовательность с 95-99% идентичности по отношению к ней), или костимуляторный домен ICOS, имеющий последовательность SEQ ID NO: 381 (или последовательность с 95-99% идентичности по отношению к ней). В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен CD3 дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 или SEQ ID NO: 8, или последовательность с 95-99% идентичности по отношению к ним, и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичности по отношению к ним, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи.
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность SEQ ID NO: 1, scFV-домен, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 или SEQ ID NO: 149 (или последовательности с 95-99% идентичности по отношению к ним), шарнирную область SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5 (или последовательность с 95-99% идентичности по отношению к ним), трансмембранный домен, имеющий последовательность SEQ ID NO: 6 (или последовательность с 95-99% идентичности по отношению к ней), костимуляторный домен 4-1BB, имеющий последовательность SEQ ID NO: 7, или костимуляторный домен CD27, имеющий последовательность SEQ ID NO: 8 (или последовательность с 95-99% идентичности по отношению к ней), или костимуляторный домен CD28, имеющий последовательность SEQ ID NO: 1104 (или последовательность с 95-99% идентичности по отношению к ней), или костимуляторный домен ICOS, имеющий последовательность SEQ ID NO: 1106 (или последовательность с 95-99% идентичности по отношению к ней), и стимуляторный домен CD3 дзета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10 (или последовательность с 95-99% идентичности по отношению к ним).
В другом аспекте изобретение относится к выделенной полипептидной молекуле, кодируемой молекулой нуклеиновой кислоты. В одном из вариантов осуществления выделенная полипептидная молекула содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 и SEQ ID NO: 149 или последовательность с 95-99% идентичности по отношению к ним.
В другом аспекте изобретение относится к молекуле нуклеиновой кислоты, кодирующей молекулу химерного антигенного рецептора (CAR), содержащую связывающий домен против BCMA, трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимуляторный домен, и где указанный связывающий домен против BCMA содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 и SEQ ID NO: 149 или последовательность с 95-99% идентичности по отношению к ним.
В одном из вариантов осуществления кодируемая молекула CAR дополнительно содержит последовательность, кодирующую костимуляторный домен. В одном из вариантов осуществления костимуляторный домен является функциональным сигнальным доменом белка, например, представленным в настоящем описании, например, выбранным из группы, состоящей из молекулы MHC класса I, белков рецепторов ФНО, иммуноглобулин-подобных белков, рецепторов цитокинов, интегринов, сигнальных молекул активации лимфоцитов (белков SLAM), активирующих рецепторов NK-клеток, BTLA, рецептора Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающегося с CD83. В одном из вариантов осуществления костимуляторный домен содержит последовательность SEQ ID NO: 7. В одном из вариантов осуществления трансмембранный домен является трансмембранным доменом белка, например, представленным в настоящем описании, например, выбранным из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном из вариантов осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и последовательность SEQ ID NO: 9, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи. В одном из вариантов осуществления связывающий домен против BCMA соединяют с трансмембранным доменом посредством шарнирной области. В одном из вариантов осуществления шарнирная область содержит SEQ ID NO: 2. В одном из вариантов осуществления шарнирная область содержит SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5.
В другом аспекте изобретение относится к кодируемой молекуле CAR, содержащей лидерную последовательность SEQ ID NO: 1, scFV-домен, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 и SEQ ID NO: 149 или последовательность с 95-99% идентичности по отношению к ним, шарнирную область SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, трансмембранный домен, имеющий последовательность SEQ ID NO: 6, костимуляторный домен 4-1BB, имеющий последовательность SEQ ID NO: 7, или костимуляторный домен CD27, имеющий последовательность SEQ ID NO: 8, или костимуляторный домен CD28, имеющий последовательность SEQ ID NO: 1104 (или последовательность с 95-99% идентичности по отношению к ней), или костимуляторный домен ICOS, имеющий последовательность SEQ ID NO: 1106 (или последовательность с 95-99% идентичности по отношению к ней), и стимуляторный домен CD3 дзета, имеющий последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемая молекула CAR содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 216, SEQ ID NO: 217, SEQ ID NO: 218, SEQ ID NO: 219, SEQ ID NO: 220, SEQ ID NO: 221, SEQ ID NO: 222, SEQ ID NO: 223, SEQ ID NO: 224, SEQ ID NO: 225, SEQ ID NO: 226, SEQ ID NO: 227, SEQ ID NO: 228, SEQ ID NO: 229, SEQ ID NO: 230, SEQ ID NO: 231, SEQ ID NO: 232 и SEQ ID NO: 233, или последовательность с 95-99% идентичности по отношению к ним.
Последовательности нуклеиновой кислоты, кодирующие желаемые молекулы, можно получать известными в этой области рекомбинантными способами, такими как, например, скрининг библиотек из клеток, экспрессирующих ген, получая ген из вектора, о котором известно, что он его включает, или выделяя непосредственно из клеток и тканей, содержащих его, стандартными способами. Альтернативно, интересующий ген можно получать синтетически, а не клонировать.
Настоящее изобретение также относится к векторам, в которые встраивают ДНК по настоящему изобретению. Векторы, полученные из ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения длительного переноса генов, т.к. они делают возможной длительную, стабильную интеграцию трансгена и его размножение в дочерних клетках. Лентивирусный вектор обладает дополнительным преимуществом по сравнению с векторами, полученными из онкоретровирусов, таких как вирусы лейкоза мыши, таким образом, что с их помощью можно трансдуцировать непролиферирующие клетки, такие как гепатоциты. Они также обладают дополнительным преимуществом, состоящим в низкой иммуногенности. Ретровирусный вектор также может являться, например, гаммаретровирусным вектором. Гаммаретровирусный вектор может включать, например, промотор, сигнал упаковки (ψ), участок связывания праймера (PBS), один или более (например, два) длинных концевых повтора (LTR) и интересующий трансген, например, ген, кодирующий CAR. В гаммаретровирусном векторе могут отсутствовать вирусные структурные гены, такие как gag, pol и env. Примеры гаммаретровирусных векторов включают вирус лейкоза мыши (MLV), вирус некроза селезенки (SFFV), вирус миелопролиферативной саркомы (MPSV) и получаемые из них векторы. Другие гаммаретровирусные векторы описывают, например, в Tobias Maetzig et al., ʺGammaretroviral Vectors: Biology, Technology and Applicationʺ Viruses. 2011 Jun; 3(6): 677-713.
В другом варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR по изобретению, является аденовирусным вектором (A5/35). В другом варианте осуществления экспрессию нуклеиновых кислот, кодирующих CAR, можно осуществлять с использованием транспозонов, таких как "Спящая красавица", CRISPR, CAS9 и нуклеазы с цинковыми пальцами. См. ниже June et al. 2009 Nature Reviews Immunology 9.10: 704-716, включенную в настоящее описание в качестве ссылки.
В кратком изложении, экспрессии природных или синтетических нуклеиновых кислот, кодирующих CAR, как правило, достигают, функционально связывая нуклеиновую кислоту, кодирующую полипептид CAR или его части, с промотором и встраивая конструкцию в экспрессирующий вектор. Векторы могут подходить для репликации и интеграции в эукариоты. Типичные клонирующие векторы содержат терминаторы транскрипции и трансляции, последовательности инициации и промоторы, применимые для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
Экспрессирующие конструкции по настоящему изобретению также можно использовать для иммунизации нуклеиновой кислотой и генотерапии с использованием стандартных способов доставки генов. Способы доставки генов известны в этой области. См., например, патенты США №№ 5399346, 5580859, 5589466, включенные в настоящее описание в качестве ссылок в полном объеме. В другом варианте осуществления изобретение относится к вектору для генотерапии.
Нуклеиновую кислоту можно клонировать в ряд типов векторов. Например, нуклеиновая кислота можно клонировать в вектор, включая, в качестве неограничивающих примеров, плазмиду, фагмиду, производное фага, вирус животного и космиду. Особенно интересующие векторы включают экспрессирующие векторы, реплицирующиеся векторы, векторы для получения зондов и векторы для секвенирования.
Кроме того, экспрессирующий вектор можно встраивать в клетку в форме вирусного вектора. Технология вирусного вектора хорошо известна в этой области и ее описывают, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1 -4, Cold Spring Harbor Press, NY) и других руководствах по вирусологии и молекулярной биологии. Вирусы, применимые в качестве векторов, включают, в качестве неограничивающих примеров, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. В основном, подходящий вектор содержит участок начала репликации, функциональный по меньшей мере в одном организме, последовательность промотора, удобные участки узнавания рестрикционных эндонуклеаз и один или более селективных маркеров (например, WO01/96584; WO01/29058 и патент США № 6326193).
Разработан ряд систем на основе вирусов для переноса генов в клетки млекопитающих. Например, ретровирусы представляют собой удобную платформу для систем доставки генов. Выбранный ген можно встраивать в вектор и упаковывать в ретровирусные частицы известными в этой области способами. Затем рекомбинантный вирус можно выделять и доставлять в клетки индивидуума in vivo или ex vivo. В этой области известен ряд ретровирусных систем. В некоторых вариантах осуществления используют аденовирусные векторы. В этой области известен ряд аденовирусных векторов. В одном из вариантов осуществления используют лентивирусный вектор.
Дополнительные промоторные элементы, например, энхансеры, регулируют частоту инициации транскрипции. Как правило, они находятся в области на 30-110 п.н. выше участка старта, хотя показано, что ряд промоторов содержит также функциональные элементы ниже участка старта. Расстояние между промоторными элементами зачастую является гибким, таким образом, что сохраняют функцию промотора, если элементы инвертированы или сдвинуты относительно друг друга. В промоторе тимидинкиназы (tk) расстояние между промоторными элементами можно повышать до 50 п.н. до того, как активность начинает снижаться. По-видимому, в зависимости от промотора отдельные элементы могут функционировать совместно или независимо для активации транскрипции.
Примером промотора, способного экспрессировать трансген CAR в T-клетке млекопитающего, является промотор EF1a. Нативный промотор EF1a регулирует экспрессию альфа-субъединиц комплекса фактора элонгации-1, отвечающего за ферментативную доставку аминоацил-тРНК в рибосому. Промотор EF1a широко используют в плазмидах для экспрессии в клетках млекопитающих, и показано, что он эффективен в регуляции экспрессии CAR с трансгенов, клонированных в лентивирусный вектор. См., например, Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). В одном из аспектов промотор EF1a содержит последовательность, приведенную как SEQ ID NO: 11.
Другим примером промотора является последовательность предраннего промотора цитомегаловируса (CMV). Эта последовательность промотора является последовательностью сильного конститутивного промотора, способного регулировать высокие уровни экспрессии любой полинуклеотидной последовательности, функционально связанной с ним. Однако также можно использовать другие последовательности конститутивных промоторов, включая, в качестве неограничивающих примеров, ранний промотор вируса обезьян 40 (SV40), промотор вируса опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса лейкоза птиц, предранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, а также промоторы генов человека, в качестве неограничивающих примеров, таких как промотор актина, промотор миозина, промотор фактора элонгации-1α, промотор гемоглобина и промотор креатинкиназы. Кроме того, изобретение не следует ограничивать использованием конститутивных промоторов. Индуцибельные промоторы также рассматривают в качестве части изобретения. Использование индуцибельного промотора предоставляет молекулярный переключатель, способный включать экспрессию полинуклеотидной последовательности, с которой он функционально связан, если такая экспрессия является желательной, или выключать экспрессию, если экспрессия нежелательна. Примеры индуцибельных промоторов включают, в качестве неограничивающих примеров, промотор металлотионеина, промотор глюкокортикоида, промотор прогестерона и промотор тетрациклина.
Другим примером промотора является промотор фосфоглицераткиназы (PGK). В вариантах осуществления желательным может являться укороченный промотор PGK (например, промотор PGK с одной или более, например, 1, 2, 5, 10, 100, 200, 300 или 400, делециями нуклеотидов по сравнению с последовательностью промотора PGK дикого типа). Нуклеотидные последовательности примеров промоторов PGK представлены ниже.
Промотор PGK WT
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCGCGGCGACGCAAAGGGCCTTGGTGCGGGTCTCGTCGGCGCAGGGACGCGTTTGGGTCCCGACGGAACCTTTTCCGCGTTGGGGTTGGGGCACCATAAGCT
(SEQ ID NO: 1109)
Примеры укороченных промоторов PGK:
PGK100:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTG
(SEQ ID NO: 1110)
PGK200:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACG
(SEQ ID NO: 1111)
PGK300:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCG
(SEQ ID NO: 1112)
PGK400:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCG
(SEQ ID NO: 1113)
Вектор также может включать, например, сигнальную последовательность для облегчения секреции, сигнал полиаденилирования и терминатор транскрипции (например, из гена бычьего гормона роста (BGH)), элемент, делающий возможной эписомную репликацию и репликацию в прокариотах (например, из SV40 и ColE1 или других известных в этой области), и/или элементы для селекции (например, ген устойчивости к ампициллину и/или маркер зеоцин).
Для оценки экспрессии полипептида CAR или его частей экспрессирующий вектор для встраивания в клетку также может содержать ген селективного маркера или репортерный ген или и тот, и другой для облегчения идентификации и селекции экспрессирующих клетках из популяции клеток, подлежащих трансфекции или инфицированию с помощью вирусных векторов. В других аспектах селективный маркер может находиться на отдельном фрагменте ДНК, и его можно использовать в котрансфекции. И селективные маркеры, и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями, чтобы сделать возможной экспрессию в клетках-хозяевах. Применимые селективные маркеры включают, например, гены устойчивости к антибиотикам, такие как neo и т.п.
Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. В основном, репортерный ген является геном, не присутствующим или не экспрессирующимся в организме или ткани реципиента и кодирующим полипептид, экспрессия которого проявляется некоторыми легко детектируемыми свойствами, например, ферментативной активностью. Экспрессию репортерного гена оценивают в подходящее время после встраивания ДНК в клетки-реципиенты. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters 479: 79-82). Подходящие системы экспрессии хорошо известны и их можно получать известными способами или в коммерческих источниках. В основном, конструкцию с минимальной 5'-фланкирующей области, демонстрирующую наиболее высокий уровень экспрессии репортерного гена, идентифицируют как промотор. Такие промоторные области можно соединять с репортерным геном и использовать для оценки средств на их способность модулировать регулируемую промотором транскрипцию.
В одном из вариантов осуществления вектор может дополнительно содержать нуклеиновую кислоту, кодирующую второй CAR. В одном из вариантов осуществления второй CAR включает антигенсвязывающий домен для мишени, экспрессирующейся на клетках острого миелолейкоза, такой как, например, CD123, CD34, CLL-1, рецептор фолата бета или FLT3, или мишени, экспрессирующейся на B-клетке, например, CD10, CD19, CD20, CD22, CD34, CD123, FLT-3, ROR1, CD79b, CD179b или CD79a. В одном из вариантов осуществления вектор содержит последовательность нуклеиновой кислоты, кодирующую первый CAR, специфически связывающийся с первым антигеном, и включает внутриклеточный сигнальный домен, содержащий костимуляторный сигнальный домен, но не первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, специфически связывающийся со вторым, другим, антигеном, и включает внутриклеточный сигнальный домен, содержащий первичный сигнальный домен, но не костимуляторный сигнальный домен. В одном из вариантов осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR BCMA, включающий BCMA-связывающий домен, трансмембранный домен и костимуляторный домен, и нуклеиновую кислоту, кодирующую второй CAR против антигена, иного, чем BCMA (например, антигена, экспрессирующегося на клетках AML, например, CD123, CD34, CLL-1, рецептор фолата бета или FLT3, или антигена, экспрессирующегося на B-клетке, например, CD10, CD19, CD20, CD22, CD34, CD123, FLT-3, ROR1, CD79b, CD179b или CD79a), и включает антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CAR BCMA, включающий BCMA-связывающий домен, трансмембранный домен и первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, специфически связывающийся с антигеном, иным, чем BCMA (например, антигеном, экспрессирующимся на клетках AML, например, CD123, CD34, CLL-1, рецептор фолата бета или FLT3, или антигеном, экспрессирующимся на B-клетке, например, CD10, CD19, CD20, CD22, CD34, CD123, FLT-3, ROR1, CD79b, CD179b или CD79a), и включает антигенсвязывающий домен против антигена, трансмембранный домен и костимуляторный сигнальный домен.
В одном из вариантов осуществления вектор содержит нуклеиновую кислоту, кодирующую CAR BCMA, представленный в настоящем описании, и нуклеиновую кислоту, кодирующую ингибиторный CAR. В одном из вариантов осуществления ингибиторный CAR содержит антигенсвязывающий домен, связывающийся с антигеном, обнаруживаемым на нормальных клетках, но не злокачественных клетках, например нормальных клетках, также экспрессирующих BCMA. В одном из вариантов осуществления ингибиторный CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибиторной молекулы. Например, внутриклеточный домен ингибиторного CAR может являться внутриклеточным доменом PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозина и TGFR бета.
В вариантах осуществления вектор может содержать две или более последовательности нуклеиновой кислоты, кодирующие CAR, например, CAR BCMA, представленный в настоящем описании, и второй CAR, например, ингибиторный CAR или CAR, специфически связывающийся с антигеном, иным, чем BCMA (например, антигеном, экспрессирующимся на клетках AML, например, CD123, CLL-1, CD34, FLT3 или рецептор фолата бета, или антигеном, экспрессирующимся на B-клетках, например, CD10, CD19, CD20, CD22, CD34, CD123, FLT-3, ROR1, CD79b, CD179b или CD79a). В таких вариантах осуществления две или более последовательности нуклеиновой кислоты, кодирующие CAR, кодируются единой молекулой нуклеиновой кислоты в одной рамке считывания и в виде единой полипептидной цепи. В этом аспекте два или более CAR можно, например, разделять одним или более участками расщепления пептида (например, участком саморасщепления или субстрата для внутриклеточной протеазы). Примеры участков расщепления пептида включают следующие, где остатки GSG необязательны:
T2A: (GSG) E G R G S L L T C G D V E E N P G P (SEQ ID NO: 1114)
P2A: (GSG) A T N F S L L K Q A G D V E E N P G P (SEQ ID NO: 1115)
E2A: (GSG) Q C T N Y A L L K L A G D V E S N P G P (SEQ ID NO: 1116)
F2A: (GSG) V K Q T L N F D L L K L A G D V E S N P G P (SEQ ID NO: 1117)
Способы встраивания и экспрессии генов в клетке известны в этой области. Что касается экспрессирующего вектора, вектор можно легко встраивать в клетку-хозяина, например, клетку млекопитающего, бактерии, дрожжей или насекомого любым способом, известным в этой области. Например, экспрессирующий вектор можно переносить в клетку-хозяина физическими, химическими или биологическими способами.
Физические способы встраивания полинуклеотида в клетку-хозяина включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и т.п. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в этой области. См., например, Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY. Предпочтительным способом встраивания полинуклеотида в клетку-хозяина является трансфекция с фосфатом кальция.
Биологические способы встраивания интересующего полинуклеотида в клетку-хозяина включают использование ДНК- и РНК-векторов. Вирусные векторы, и особенно ретровирусные векторы, стали наиболее широко используемым способом встраивания генов в клетки млекопитающего, например, клетки человека. Другие вирусные векторы можно получать из лентивируса, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. См., например, патенты США №№ 5350674 и 5585362.
Химические способы встраивания полинуклеотида в клетку-хозяина включают системы коллоидных дисперсий, такие как комплексы макромолекул, нанокапсулы, микросферы, бусы и системы на основе липидов, включая эмульсии "масло-в-воде", мицеллы, смешанные мицеллы и липосомы. Примером коллоидной системы для использования в качестве средства доставки in vitro и in vivo является липосома (например, искусственный мембранный носитель). Доступны другие способы, относящиеся к современному уровню техники, направленные на доставку нуклеиновых кислоты, такие как доставка полинуклеотидов с использованием направленных наночастиц или другие подходящие системы доставки субмикронного размера.
В случае использования невирусной системы доставки примером носителя для доставки является липосома. Предусмотрено использование липидных составов для встраивания нуклеиновых кислот в клетку-хозяина (in vitro, ex vivo или in vivo). В другом аспекте нуклеиновую кислоту можно связывать с липидом. Нуклеиновую кислоту, связанную с липидом, можно инкапсулировать во внутренней водной среде липосомы, распределять в липидном бислое липосомы, прикреплять к липосоме с помощью связующей молекулы, связанной с липосомой и олигонуклеотидом, заключать в липосоме, комплексировать с липосомой, диспергировать в растворе, содержащем липид, смешивать с липидом, комбинировать с липидом, включать в качестве суспензии в липиде, включать или комплексировать с мицеллой или иным образом связывать с липидом. Композиции, связанные с липидом, липидом/ДНК или липидом/экспрессирующим вектором, не ограничены конкретной структурой в растворе. Например, они могут находиться в бислойной структуре, в виде мицелл или со "сжатой" структурой. Они также могут просто распределяться в растворе, возможно, образуя агрегаты, неоднородные по размеру или форме. Липиды являются жирными веществами, которые могут являться природными или синтетическими липидами. Например, липиды включают жировые капли, в природе встречающиеся в цитоплазме, а также класс соединений, содержащих длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
Липиды, пригодные для использования, можно получать из коммерческих источников. Например, димиристоилфосфатидилхолин ("DMPC") можно получать в Sigma, St. Louis, MO, дицетилфосфат ("DCP") можно получать в K & K Laboratories (Plainview, NY), холестерин ("Choi") можно получать в Calbiochem-Behring, димиристилфосфатидилглицерин ("DMPG") и другие липиды можно получать в Avanti Polar Lipids, Inc. (Birmingham, AL.). Стоковые растворы липидов в хлороформе или хлороформе/метаноле можно хранить приблизительно при -20°C. Хлороформ используют в качестве единственного растворителя, т.к. он легче испаряется, чем метанол. "Липосома" является общим термином, включающим множество мультиламеллярных липидных носителей, формирующихся посредством образования замкнутых липидных бислоев или агрегатов. Липосомы можно охарактеризовать как имеющие везикулярные структуры с фосфолипидной бислойной мембраной и внутренней водной средой. Мультиламеллярные липосомы имеют множество липидных слоев, разделенных водной средой. Они образуются спонтанно, когда фосфолипиды суспендируют в избытке водного раствора. Липидные компоненты подвергаются самоперестройке перед образованием замкнутых структур и захватывают воду и растворы между липидными бислоями (Ghosh et al., 1991 Glycobiology 5: 505-10). Однако также предусмотрены композиции, имеющие иные структуры в растворе, чем нормальная везикулярная структура. Например, липиды могут представлять мицеллярную структуру или существовать исключительно в виде неоднородных агрегатов молекул липидов. Также предусмотрены комплексы липофектамин-нуклеиновая кислота.
Независимо от способа, используемого для встраивания экзогенных нуклеиновых кислот в клетку-хозяина или иного воздействия ингибитора по настоящему изобретению на клетку, для подтверждения наличия последовательности рекомбинантной ДНК в клетке-хозяине можно осуществлять множество анализов. Такие анализы включают, например, "молекулярно-биологические" анализы, хорошо известные специалистам в этой области, такие как Саузерн- и "нозерн"-блоттинг, RT-ПЦР и ПЦР, "биохимические" анализы, такие как определение наличия или отсутствия конкретного пептида, например, иммунологическими способами (ELISA и вестерн-блоттинг) или посредством анализов, представленных в настоящем описании, для идентификации средств, находящихся в объеме изобретения.
Настоящее изобретение дополнительно относится к вектору, содержащему молекулу нуклеиновой кислоты, кодирующую CAR. В одном из аспектов вектор CAR можно напрямую трансдуцировать в клетку, например, T-клетку или NK-клетку. В одном из аспектов вектор является клонирующим или экспрессирующим вектором, например, вектором, включающим, в качестве неограничивающих примеров, одну или более плазмид (например, экспрессирующих плазмид, клонирующих векторов, миниколец, минивекторов, двойных микрохромосом), конструкции ретровирусных и лентивирусных векторов. В одном из аспектов вектор способен экспрессировать конструкцию CAR в T-клетках или NK-клетках млекопитающих. В одном из аспектов T-клетка млекопитающего является T-клеткой человека. В одном из аспектов NK-клетка млекопитающего является NK-клеткой человека.
Источники клеток
Перед экспансией и генетической модификацией источник клеток, например, иммунных эффекторных клеток (например, T-клеток или NK-клеток), получают из индивидуума. Термин "индивидуум" предназначен для включения живых организмов, в которых можно вызывать иммунный ответ (например, млекопитающих). Примеры индивидуумов включают людей, собак, кошек, мышей, крыс и их трансгенные особи. T-клетки можно получать из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфоузла, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асцитическую жидкость, плевральный выпот, ткань селезенки и опухоли.
В определенных аспектах по настоящему изобретению можно использовать любое количество линий иммунных эффекторных клеток (например, T-клеток или NK-клеток), доступных в этой области. В определенных аспектах по настоящему изобретению T-клетки можно получать из единицы крови, собранной из индивидуума с использованием любого количества способов, известных специалистам в этой области, таких как разделение с помощью Ficoll™. В одном из предпочтительных аспектов клетки из циркулирующей крови индивидуума получают с помощью афереза. Продукт афереза, как правило, содержит лимфоциты, включая T-клетки, моноциты, гранулоциты, B-клетки, другие ядерные лейкоциты, эритроциты и тромбоциты. В одном из аспектов клетки, собранные с помощью афереза, можно промывать для удаления фракции плазмы и для помещения клеток в соответствующий буфер или среду для последующих этапов обработки. В одном аспектов изобретения клетки промывают фосфатно-солевым буфером (PBS). В альтернативном аспекте в промывочном растворе отсутствует кальций и может отсутствовать магний или могут отсутствовать многие, если не все, бивалентные катионы.
Исходные этапы активации в отсутствие кальция могут приводить к усиленной активации. Как будет понятно специалистам в этой области, этап промывки можно осуществлять способами, известными специалистам в этой области, такими как использование полуавтоматизированной "проточной" центрифуги (например, клеточного процессора Cobe 2991, Baxter CytoMate или Haemonetics Cell Saver 5) по инструкциям производителя. После промывки клетки можно ресуспендировать во множестве биосовместимых буферов, таких как, например, Ca-несодержащий, Mg-несодержащий PBS, плазмалит A или другой физиологический раствор с буфером или без него. Альтернативно, нежелательные компоненты аферезного образца можно удалять и клетки можно напрямую ресуспендировать в средах для культивирования.
Установлено, что в способах по настоящему изобретению можно использовать условия сред для культивирования, содержащих 5% или менее, например, 2%, сыворотки AB человека, и использовать условия известных сред для культивирования и композиции, например, описываемые в Smith et al., ʺEx vivo expansion of human T cells for adoptive immunotherapy using the novel Xeno-free CTS Immune Cell Serum Replacementʺ Clinical & Translational Immunology (2015) 4, e31; doi:10.1038/cti.2014.31.
В одном из аспектов T-клетки выделяют из лимфоцитов периферической крови, лизируя эритроциты и истощая моноциты, например, посредством центрифугирования в градиенте PERCOLLTM или проточного элютриационного центрифугирования. Конкретную субпопуляцию T-клеток, такую как CD3+, CD28+, CD4+, CD8+, CD45RA+ и CD45RO+ T-клетки, можно дополнительно выделять способами положительной или отрицательной селекции. Например, в одном из аспектов T-клетки выделяют посредством инкубации с бусами, конъюгированными с антителами против CD3/против CD28 (например, 3×28), такими как DYNABEADS® M-450 CD3/CD28 T, в течение периода времени, достаточного для положительной селекции желаемых T-клеток. В одном из аспектов период времени составляет приблизительно 30 минут. В дополнительном аспекте период времени находится в диапазоне от 30 минут до 36 часов или более, включая все целые значения между ними. В дополнительном аспекте период времени составляет по меньшей мере, 1, 2, 3, 4, 5 или 6 часов. В другом предпочтительном аспекте период времени составляет от 10 до 24 часов. В одном из аспектов период инкубации составляет 24 часа. Более длительную инкубацию можно использовать для выделения T-клеток в любой ситуации, когда есть мало T-клеток по сравнению с другими типами клеток, как при выделении инфильтрирующих опухоль лимфоцитов (TIL) из ткани опухоли или из иммунокомпрометированных индивидуумов. Кроме того, использование более длительной инкубации может повышать эффективность захвата CD8+ T-клеток. Таким образом, уменьшая или увеличивая время, в течение которого T-клеткам позволяют связываться с бусами CD3/CD28, и/или повышая или снижая соотношение бус и T-клеток (как описано далее в настоящем описании), субпопуляции T-клеток можно предпочтительно подвергать положительной или отрицательной селекции в начале культивирования или в другие моменты времени. Кроме того, повышая или снижая соотношение антител против CD3 и/или против CD28 на бусах или другой поверхности, субпопуляции T-клеток можно предпочтительно подвергать положительной или отрицательной селекции в начале культивирования или в другие моменты времени. Специалистам в этой области будет понятно, что в контексте настоящего изобретения также можно использовать множество раундов селекции. В определенных аспектах желательным может являться осуществление селекции и использование "неподвергнутых селекции" клеток в активации и экспансии. "Неподвергнутые селекции" клетки также можно подвергать дополнительным раундам селекции.
Обогащение популяции T-клеток посредством отрицательной селекции можно осуществлять с использованием комбинации антител против поверхностных маркеров, уникальных для подвергнутых отрицательной селекции клеток. Одним из способов является сортинг клеток и/или селекция посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, в которой используют смесь моноклональных антител против поверхностных клеточных маркеров, присутствующих на подвергнутых отрицательной селекции клетках. Например, в случае обогащения CD4+-клеток посредством отрицательной селекции смесь моноклональных антител, как правило, включает антитела против CD14, CD20, CD11b, CD16, HLA-DR и CD8. В определенных аспектах желательным может являться обогащение или положительная селекция регуляторных T-клеток, как правило, экспрессирующих CD4+, CD25+, CD62Lhi, GITR+ и FoxP3+. Альтернативно, в определенных аспектах T-регуляторные клетки подвергают истощению с помощью бус, конъюгированных с антителами против C25, или другого схожего способа селекции.
Способы, представленные в настоящем описании, могут включать, например, селекцию конкретных субпопуляций иммунных эффекторных клеток, например, T-клеток, представляющих собой истощенную в отношении T-регуляторных клеток популяцию, CD25+-истощенные клетки, например, способом отрицательной селекции, например, представленным в настоящем описании. Предпочтительно, популяция, истощенная в отношении T-регуляторных клеток, содержит менее 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток.
В одном из вариантов осуществления T-регуляторные клетки, например, CD25+ T-клетки, удаляют из популяции с использованием антитела против CD25, или его фрагмента, или CD25-связывающего лиганда, ИЛ-2. В одном из вариантов осуществления антитело против CD25, или его фрагмент, или CD25-связывающий лиганд конъюгируют с субстратом, например, бусиной, или иным образом покрывают им субстрат, например, бусину. В одном из вариантов осуществления антитело против CD25 или его фрагмент конъюгируют с субстратом, как представлено в настоящем описании.
В одном из вариантов осуществления T-регуляторные клетки, например, CD25+ T-клетки, удаляют из популяции с использованием реагента для истощения CD25 от MiltenyiTM. В одном из вариантов осуществления соотношение клеток к реагенту для истощения CD25 составляет 1e7 клеток на 20 мкл, или 1e7 клеток на мкл, или 1e7 клеток на 10 мкл, или 1e7 клеток на 5 мкл, или 1e7 клеток на 2,5 мкл, или 1e7 клеток на 1,25 мкл. В одном из вариантов осуществления, например, в случае T-регуляторных клеток, например, при истощении CD25+, используют более 500 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 600, 700, 800 или 900 миллионов клеток/мл.
В одном из вариантов осуществления популяция иммунных эффекторных клеток, подлежащая истощению, включает приблизительно 6×109 CD25+ T-клеток. В других аспектах популяция иммунных эффекторных клеток, подлежащих истощению, включает приблизительно от 1×109 до 1× 1010 CD25+ T-клеток и любое целое число между ними. В одном из вариантов осуществления полученная популяция, истощенная в отношении T-регуляторных клеток, содержит 2×109 T-регуляторных клеток, например, CD25+ клеток, или менее (например, 1×109, 5×108, 1×108, 5×107, 1×107 или менее CD25+ клеток).
В одном из вариантов осуществления T-регуляторные клетки, например, CD25+ клетки, удаляют из популяции с использованием системы CliniMAC с комплектом трубок для истощения, таких как, например, трубки 162-01. В одном из вариантов осуществления систему CliniMAC запускают в условиях истощения, таких как, например, DEPLETION2.1.
Не желая быть связанными какой-либо конкретной теорией, полагают, что снижение уровня отрицательных регуляторов иммунных клеток (например, снижение количества нежелательных иммунных клеток, например, TREG-клеток) у индивидуума перед аферезом или при производстве продукта CAR-экспрессирующих клеток может снижать риск рецидива у индивидуума. Например, в этой области известны способы истощения TREG-клеток. Способы снижения TREG-клеток включают, в качестве неограничивающих примеров, использование циклофосфамида, антитела против GITR (антитело против GITR, представленное в настоящем описании), истощение CD25 и их комбинации.
В некоторых вариантах осуществления способы производства включают снижение количества (например, истощение) TREG-клеток перед производством CAR-экспрессирующей клетки. Например, способы производства включают приведение образца, например, аферезного образца, в контакт с антителом против GITR и/или антителом против CD25 (или его фрагментом или CD25-связывающим лигандом), например, для истощения TREG-клеток перед производством продукта CAR-экспрессирующих клеток (например, T-клеток, NK-клеток).
В варианте осуществления индивидуума предварительно подвергают одному или более способам терапии, снижающим TREG-клетки перед сбором клеток для производства продукта CAR-экспрессирующих клеток, таким образом, снижая риск рецидива у индивидуума в ответ на лечение CAR-экспрессирующими клетками. В варианте осуществления способы снижения TREG-клеток включают, в качестве неограничивающих примеров, проведение индивидууму одного или более из введения циклофосфамида, антитела против GITR, истощения CD25 или их комбинации. Проведение одного или более из введения циклофосфамида, антитела против GITR, истощения CD25 или их комбинации можно осуществлять до, в течение или после инфузии продукта CAR-экспрессирующих клеток.
В варианте осуществления индивидуума предварительно лечат циклофосфамидом перед сбором клеток для производства продукта CAR-экспрессирующих клеток, таким образом, снижая риск рецидива у индивидуума в ответ на лечение CAR-экспрессирующими клетками. В варианте осуществления индивидуума предварительно лечат антителом против GITR перед сбором клеток для производства продукта CAR-экспрессирующих клеток, таким образом, снижая риск рецидива у индивидуума в ответ на лечение CAR-экспрессирующими клетками.
В одном из вариантов осуществления популяция клеток, подлежащая удалению, не является ни регуляторными T-клетками, ни опухолевыми клетками, а клетками, иным образом отрицательно влияющими на экспансию и/или функцию CART-клеток, например клетками, экспрессирующими CD14, CD11b, CD33, CD15 или другие маркеры, экспрессируемые потенциально иммуносупрессирующими клетками. В одном из вариантов осуществления такие клетки предполагают удалять одновременно с регуляторными T-клетками и/или опухолевыми клетками, или после указанного истощения, или в другом порядке.
Способы, представленные в настоящем описании, могут включать несколько этапов селекции, например, несколько этапов истощения. Обогащение популяции T-клеток посредством отрицательной селекции можно осуществлять, например, с использованием комбинации антител против поверхностных маркеров, уникальных для подвергнутых отрицательной селекции клеток. Одним из способов является сортинг клеток и/или селекция посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, в которой используют смесь моноклональных антител против поверхностных клеточных маркеров, присутствующих на подвергнутых отрицательной селекции клеток. Например, для обогащения в отношении CD4+-клеок посредством отрицательной селекции, смесь моноклональных антител может включать антитела против CD14, CD20, CD11b, CD16, HLA-DR и CD8.
Способы, представленные в настоящем описании, могут дополнительно включать удаление клеток из популяции, экспрессирующей опухолевый антиген, например, опухолевый антиген, не содержащий CD25, например, CD19, CD30, CD38, CD123, CD20, CD14 или CD11b, чтобы, таким образом, получать популяцию, истощенную в отношении T-регуляторных клеток, например, CD25+-истощенную, и популяцию истощенных по опухолевому антигену клеток, подходящих для экспрессии CAR, например, CAR, представленного в настоящем описании. В одном из вариантов осуществления клетки, экспрессирующие опухолевый антиген, удаляют одновременно с T-регуляторными, например, CD25+, клетками. Например, антитело против CD25 или его фрагмент и антитело против противоопухолевого антигена или его фрагмент можно присоединять к одному субстрату, например, бусине, который можно использовать для удаления клеток, или антитело против CD25 или его фрагмент или антитело против противоопухолевого антигена или его фрагмент можно присоединять к отдельным бусинам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление T-регуляторных клеток, например, CD25+-клеток, и удаление клеток, экспрессирующих опухолевый антиген, являются последовательными, и их можно осуществлять, например, в любом порядке.
Настоящее изобретение также относится к способам, включающим удаление клеток из популяции, экспрессирующей ингибитор контрольных точек, например, ингибитор контрольных точек, представленный в настоящем описании, например, одной или более из PD1+-клеток, LAG3+-клеток и TIM3+-клеток, чтобы, таким образом, получать популяцию, истощенную в отношении T-регуляторных клеток, например, CD25+-истощенные клетки, и клетки, истощенные по ингибитору контрольных точек, например, PD1+-, LAG3+- и/или TIM3+-истощенные клетки. Примеры ингибиторов контрольных точек включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета. В вариантах осуществления ингибитором контрольных точек является PD1 или PD-L1. В одном из вариантов осуществления клетки, экспрессирующие ингибитор контрольных точек, удаляют одновременно с T-регуляторными, например, CD25+, клетками. Например, антитело против CD25 или его фрагмент и антитело против ингибитора контрольных точек или его фрагмент можно присоединять к одной бусине, которую можно использовать для удаления клеток, или антитело против CD25 или его фрагмент и антитело против ингибитора контрольных точек или его фрагмент можно присоединять к отдельным бусинам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление T-регуляторных клеток, например, CD25+-клеток, и удаление клеток, экспрессирующих ингибитор контрольных точек, являются последовательными, и их можно осуществлять, например, в любом порядке.
В одном из вариантов осуществления селекции можно подвергать популяцию T-клеток, экспрессирующих один или более из ИФНγ, ФНО, ИЛ-17A, ИЛ-2, ИЛ-3, ИЛ-4, ГМ-КСФ, ИЛ-10, ИЛ-13, гранзима B и перфорина или других соответствующих молекул, например, других цитокинов. Способы скрининга экспрессии клеток можно определять, например, способами, описываемыми в публикации PCT №: WO2013/126712.
В случае выделения желаемой популяции клеток посредством положительной или отрицательной селекции можно варьировать концентрацию клеток и поверхности (например, частиц, таких как бусы). В определенных аспектах желательным может являться значительное снижение объема, в котором смешивают бусы и клетки (например, повышая концентрацию клеток), для обеспечения максимального контакта клеток и бус. Например, в одном из аспектов используют концентрацию 2 миллиарда клеток/мл. В одном из аспектов используют концентрацию 1 миллиард клеток/мл. В дополнительном аспекте используют более 100 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В еще одном аспекте используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В дополнительных аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к повышенному выходу клеток, активации клеток и экспансии клеток. Кроме того, использование высоких концентраций клеток делает возможным более эффективный захват клеток, которые могут слабо экспрессировать интересующие антигены-мишени, таких как CD28-отрицательные T-клетки, или из образцов, где присутствует много опухолевых клеток (например, лейкозной крови, опухолевой ткани и т.д.). Такие популяции клеток могут иметь терапевтическое значение, и их получение будет желательным. Например, использование высокой концентрации клеток делает возможной более эффективную селекцию CD8+-T-клеток, в норме имеющих более слабую экспрессию CD28.
В родственном аспекте желательным может являться использование более низких концентраций клеток. Значительно разводя смесь T-клеток и поверхности (например, частиц, таких как бусы), минимизируют взаимодействия между частицами и клетками. Это позволяет осуществлять селекцию клеток, экспрессирующих большие количества желаемых антигенов для связывания с частицами. Например, CD4+ T-клетки экспрессируют более высокие уровни CD28 и более эффективно захватываются, чем CD8+ T-клетки в концентрациях после разведения. В одном из аспектов используемая концентрация клеток составляет 5×10e6/мл. В других аспектах используемая концентрация может составлять приблизительно от 1×105/мл до 1×106/мл, включая любое целое число между ними.
В других аспектах клетки можно инкубировать на ротаторе в течение различных периодов времени при различных скоростях при 2-10°C или при комнатной температуре.
T-клетки для стимуляции также можно замораживать после этапа промывки. Не желая быть связанными какой-либо теорией, полагают, что с помощью этапа замораживания и последующего размораживания получают более однородный продукт, удаляя гранулоциты и, до некоторой степени, моноциты в популяции клеток. После этапа промывки, на котором удаляют плазму и тромбоциты, клетки можно суспендировать в растворе для замораживания. Хотя многие растворы для замораживания и параметры известны в этой области и будут применимы в этом контексте, один из способов включает использование PBS, содержащего 20% DMSO и 8% сывороточного альбумина человека, или сред для культивирования, содержащих 10% декстрана 40 и 5% декстрозы, 20% сывороточного альбумина человека и 7,5% DMSO, или 31,25% плазмалита A, 31,25% декстрозы 5%, 0,45% NaCl, 10% декстрана 40 и 5% декстрозы, 20% сывороточного альбумина человека и 7,5% DMSO, или других подходящих сред для замораживания клеток, содержащих, например, Hespan и плазмалит A, затем клетки замораживают до -80°C при скорости 1° в минуту и хранят в газовой фазе в резервуаре с жидким азотом. Можно использовать другие способы контролируемого замораживания, а также неконтролируемого замораживания непосредственно при -20°C или в жидком азоте.
В определенных аспектах криосохраненные клетки размораживают и промывают, как представлено в настоящем описании, и им позволяют отстаиваться в течение одного часа при комнатной температуре перед активацией способами по настоящему изобретению.
В контексте изобретения также предусмотрен сбор образцов крови или аферезного продукта от индивидуума в период времени перед тем, как выросшие клетки, представленные в настоящем описании, могут понадобиться. В связи с этим, источник клеток для экспансии можно собирать в любой необходимый момент времени, и желаемые клетки, такие как иммунные эффекторные клетки, например, T-клетки или NK-клетки, можно выделять и замораживать для последующего использования в клеточной терапии, например, T-клеточной терапии, для любого количества заболеваний или состояний, при которых может быть полезна клеточная терапия, например, T-клеточная терапия, такая как представленная в настоящем описании. В одном из аспектов образец крови или аферезный образец получают из, как правило, здорового индивидуума. В определенных аспектах образец крови или аферезный образец получают из, как правило, здорового индивидуума, имеющего риск развития заболевания, но у которого заболевание еще не развилось, и интересующие клетки выделяют и замораживают для последующего использования. В определенных аспектах иммунные эффекторные клетки (например, T-клетки или NK-клетки) можно выращивать, замораживать и использовать впоследствии. В определенных аспектах образцы собирают из пациентов вскоре после диагностирования конкретного заболевания, как представлено в настоящем описании, но до какого-либо лечения. В дополнительном аспекте клетки выделяют из образца крови или аферезного образца от индивидуума перед любым количеством соответствующих способов лечения, включая, в качестве неограничивающих примеров, лечение такими средствами, как натализумаб, эфализумаб, противовирусные средства, химиотерапия, лучевая терапия, иммуносупрессирующие средства, такие как циклоспорин, азатиоприн, метотрексат, микофенолат, FK506, антитела или другие иммуноабляционные средства, такие как CAMPATH, антитела против CD3, цитоксан, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228 и лучевая терапия.
В дополнительном аспекте настоящего изобретения T-клетки получают из пациента непосредственно после лечения, оставляющего индивидуума с функциональными T-клетками. В связи с этим, наблюдали, что после конкретного лечения злокачественных опухолей, в частности, лечения лекарственными средствами, повреждающими иммунную систему, вскоре после лечения в течение периода, когда пациенты, как правило, будут восстанавливаться после лечения, качество получаемых T-клеток может являться оптимальным или улучшенным по их способности к экспансии ex vivo. Аналогично, после манипуляции ex vivo способами, представленными в настоящем описании, эти клетки могут находиться в предпочтительном состоянии для повышенной приживления и экспансии in vivo. Таким образом, в контексте настоящего описания предусмотрен сбор клеток крови, включая T-клетки, дендритные клетки или другие клетки гематопоэтического ростка, в течение этой фазы восстановления. Кроме того, в определенных аспектах можно использовать схемы мобилизации (например, мобилизации с помощью ГМ-КСФ) и кондиционирующего лечения для достижения состояния индивидуума, где предпочтительной является репопуляция, рециркуляция, регенерация и/или экспансия конкретных типов клеток, особенно, в течение определенного временного окна после терапии. Иллюстративные типы клеток включают T-клетки, B-клетки, дендритные клетки и другие клетки иммунной системы.
В одном из вариантов осуществления иммунные эффекторные клетки, экспрессирующие молекулу CAR, например, молекулу CAR, представленную в настоящем описании, получают из индивидуума, которому вводят низкую, усиливающую иммунитет дозу ингибитора mTOR. В варианте осуществления популяцию иммунных эффекторных клеток, например, T-клеток, для конструирования для экспрессии CAR, собирают после достаточного периода времени, или после достаточного введения низкой, усиливающей иммунитет дозы ингибитора mTOR, таким образом, что уровень PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, или соотношение PD1-отрицательных иммунных эффекторных клеток, например, T-клеток/PD1-положительных иммунных эффекторных клеток, например, T-клеток, находящихся в индивидууме или собранных из индивидуума, по меньшей мере, транзиторно, повышают.
В других вариантах осуществления популяцию иммунных эффекторных клеток, например, T-клеток, имеющих экспрессию CAR или подлежащих конструированию для экспрессии CAR, можно обрабатывать ex vivo, приводя их в контакт с количеством ингибитора mTOR, повышающим количество PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, или повышающим соотношение PD1-отрицательных иммунных эффекторных клеток, например, T-клеток/PD1-положительных иммунных эффекторных клеток, например, T-клеток.
В одном из вариантов осуществления популяция T-клеток является дефектной по диаглицеролкиназе (DGK). DGK-дефектные клетки включают клетки, не экспрессирующие РНК или белок DGK или имеющие сниженную или ингибированную активность DGK. DGK-дефектные клетки можно получать с помощью генетических подходов, например, вводя средства для РНК-интерференции, например, миРНК, shRNA, мкРНК, для снижения или предотвращения экспрессии DGK. Альтернативно, DGK-дефектные клетки можно получать посредством обработки ингибиторами DGK, представленными в настоящем описании.
В одном из вариантов осуществления популяция T-клеток является Ikaros-дефектной. Ikaros-дефектные клетки включают клетки, не экспрессирующие РНК или белок Ikaros или имеющие сниженную или ингибированную активность Ikaros, Ikaros-дефектные клетки можно получать с помощью генетических подходов, например, вводя средства для РНК-интерференции, например, миРНК, shRNA, мкРНК, для снижения или предотвращения экспрессии Ikaros. Альтернативно, Ikaros-дефектные клетки можно получать посредством обработки ингибиторами Ikaros, например, леналидомидом.
В вариантах осуществления популяция T-клеток является DGK-дефектной и Ikaros-дефектной, например, не экспрессирует DGK и Ikaros или имеет сниженную или ингибированную активность DGK и Ikaros. Такие DGK- и Ikaros-дефектные клетки можно получать любым из способов, представленных в настоящем описании.
В варианте осуществления NK-клетки получают из индивидуума. В другом варианте осуществления NK-клетки являются линией NK-клеток, например, линией клеток NK-92 (Conkwest).
Аллогенный CAR
В вариантах осуществления, представленных в настоящем описании, иммунная эффекторная клетка может являться аллогенной иммунной эффекторной клеткой, например, T-клеткой или NK-клеткой. Например, клетка может являться аллогенной T-клеткой, например, аллогенной T-клеткой без экспрессии функционального T-клеточного рецептора (TCR) и/или лейкоцитарного антигена человека (HLA), например, HLA класса I и/или HLA класса II.
T-клетку без функционального TCR, например, можно конструировать таким образом, что она не экспрессирует какой-либо функциональный TCR на своей поверхности, сконструированный таким образом, что она не экспрессирует одну или более субъединиц, содержащих функциональный TCR (например, сконструированная таким образом, что она не экспрессирует (или проявляет сниженную экспрессию) TCR альфа, TCR бета, TCR гамма, TCR дельта, TCR эпсилон и/или TCR дзета) или сконструированная таким образом, что она продуцирует очень мало функционального TCR на своей поверхности. Альтернативно, T-клетка может экспрессировать, по существу, поврежденный TCR, например, посредством экспрессии мутантных или укороченных форм одной или более субъединиц TCR. Термин "по существу, поврежденный TCR" означает, что этот TCR не будет вызывать побочную иммунную реакцию у хозяина.
T-клетку, представленную в настоящем описании, например, можно конструировать таким образом, что она не экспрессирует функциональный HLA на своей поверхности. Например, T-клетку, представленную в настоящем описании, можно конструировать таким образом, что поверхностная экспрессия клеткой HLA, например, HLA класса 1 и/или HLA класса II, подвержена отрицательной регуляции. В некоторых аспектах отрицательную регуляцию HLA можно осуществлять, снижая или устраняя экспрессию микроглобулина бета-2 (B2M). В некоторых вариантах осуществления в T-клетке может отсутствовать функциональный TCR и функциональный HLA, например, HLA класса I и/или HLA класса II.
Модифицированные T-клетки, у которых отсутствует экспрессия функционального TCR и/или HLA, можно получать любыми подходящими свойствами, включая нокаут или нокдаун одной или более субъединиц TCR или HLA. Например, T-клетка может включать нокдаун TCR и/или HLA с использованием миРНК, shRNA, коротких палиндромных повторов, регулярно расположенных группами (CRISPR), подобной активатору транскрипции эффекторной нуклеазы (TALEN) или эндонуклеазы с цинковыми пальцами (ZFN).
В некоторых вариантах осуществления аллогенная клетка может являться клеткой, не экспрессирующей ингибиторную молекулу или экспрессирующей ее на низких уровнях, например, клеткой, сконструированной любым способом, представленным в настоящем описании. Например, клетка может являться клеткой, не экспрессирующей ингибиторную молекулу или экспрессирующей ее на низких уровнях, например, которая может снижать способность CAR-экспрессирующей клетки вызывать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета. Ингибирование ингибиторной молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка, может оптимизировать свойства CAR-экспрессирующей клетки. В вариантах осуществления можно использовать ингибиторную нуклеиновую кислоту, например, ингибиторную нуклеиновую кислоту, например, дцРНК, например, миРНК или shRNA, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), подобную активатору транскрипции эффекторную нуклеазу (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN), например, как представлено в настоящем описании.
МиРНК и shRNA для ингибирования TCR или HLA
В некоторых вариантах осуществления экспрессию TCR и/или экспрессию HLA можно ингибировать с использованием миРНК или shRNA против нуклеиновой кислоты, кодирующей TCR, и/или HLA, и/или ингибиторную молекулу, представленную в настоящем описании (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета), в клетке, например, T-клетке.
Экспрессии миРНК и shRNA в T-клетках можно достигать с использованием любой общепринятой системы экспрессии, например, такой как лентивирусная система экспрессии.
Примеры shRNA, отрицательно регулирующих экспрессию компонентов TCR, описывают, например, в публикации США № 2012/0321667. Примеры миРНК и shRNA, отрицательно регулирующих экспрессию генов HLA класса I и/или HLA класса II, описывают, например, в патентной публикации США № US2007/0036773.
CRISPR для ингибирования TCR или HLA
Как применяют в настоящем описании, термины "CRISPR", или "CRISPR к TCR и/или HLA", или "CRISPR для ингибирования TCR и/или HLA" относятся к набору коротких палиндромных повторов, регулярно расположенных группами, или системе, содержащей такой набор повторов. Как применяют в настоящем описании, термин "Cas", относится к CRISPR-ассоциированному белку. Система "CRISPR/Cas" относится к системе, полученной из CRISPR и Cas, которую можно использовать для сайленсинга или мутагенеза гена TCR и/или HLA и/или ингибиторной молекулы, представленной в настоящем описании (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозина и TGFR бета).
Природные системы CRISPR/Cas обнаруживают приблизительно в 40% секвенированных геномов эубактерий и 90% секвенированных геномов архей. Grissa et al. (2007) BMC Bioinformatics 8: 172. Эта система является типом прокариотической иммунной системы, придающим устойчивость к чужеродным генетическим элементам, таким как плазмиды и фаги, и представляющим форму приобретенного иммунитета. Barrangou et al. (2007) Science 315: 1709-1712; Marragini et al. ( 2008) Science 322: 1843-1845.
Систему CRISPR/Cas модифицировали для использования в редактировании генов (сайленсинге, усилении или изменении конкретных генов) у эукариот, таких как мыши или приматы. Wiedenheft et al. (2012) Nature 482: 331-8. Это осуществляют посредством встраивания в эукариотическую клетку плазмиды, содержащей специально сконструированный CRISPR и один или более соответствующих Cas.
Последовательность CRISPR, иногда обозначаемая как локус CRISPR, содержит чередующиеся повторы и спейсеры. В природном CRISPR спейсеры, как правило, содержат последовательности, чужеродные для бактерии, такие как последовательность плазмиды или фага, в системе CRISPR/Cas к TCR и/или HLA спейсеры получают из последовательности гена TCR или HLA.
РНК из локуса CRISPR конститутивно экспрессируется и процессируется белками Cas в небольшие РНК. Они содержат спейсер, фланкированный последовательностью повтора. РНК направляет другие белки Cas для сайленсинга экзогенных генетических элементов на уровне РНК или ДНК. Horvath et al. (2010) Science 327: 167-170; Makarova et al. (2006) Biology Direct 1: 7. Таким образом, спейсеры служат в качестве матриц для молекул РНК, аналогично миРНК. Pennisi (2013) Science 341: 833-836.
Т.к. они в природе встречаются во многих разных типах бактерий, точное расположение CRISPR и структура, функция и количество генов Cas и их продукт, до некоторой степени, отличаются от вида к виду. Haft et al. (2005) PLoS Comput. Biol. 1: e60; Kunin et al. (2007) Genome Biol. 8: R61; Mojica et al. (2005) J. Mol. Evol. 60: 174-182; Bolotin et al. (2005) Microbiol. 151: 2551-2561; Pourcel et al. (2005) Microbiol. 151: 653-663 и Stern et al. (2010) Trends. Genet. 28: 335-340. Например, белки Cse (подтип Cas, E. coli) (например, CasA) образуют функциональный комплекс Cascade, процессирующий РНК-транскрипты CRISPR в единицах спейсер-повтор, которые удерживает Cascade. Brouns et al. (2008) Science 321: 960-964. У других прокариот Cas6 процессирует транскрипт CRISPR. Для инактивации фага на основе CRISPR в E. coli необходимы Cascade и Cas3, но не Cas1 или Cas2. Белки Cmr (модуль Cas RAMP) в Pyrococcus furiosus и других прокариотах образуют функциональный комплекс с небольшой РНК CRISPR, распознающей и расщепляющей комплементарную РНК-мишень. Более простая система CRISPR основана на белке Cas9, являющемся нуклеазой с двумя активными участками расщепления, по одному для каждой цепи двойной спирали. Комбинирование Cas9 и модифицированной РНК локуса CRISPR можно использовать в системе для редактирования генов. Pennisi (2013) Science 341: 833-836.
Таким образом, систему CRISPR/Cas можно использовать для редактирования гена TCR и/или HLA (добавления или делеции пары оснований) или встраивания преждевременного стоп-кодона, что, таким образом, снижает экспрессию TCR и/или HLA. Альтернативно, систему CRISPR/Cas можно использовать подобно РНК-интерференции, выключая ген TCR и/или HLA обратимым образом. В клетке млекопитающего, например, РНК может направлять белок Cas к промотору TCR и/или HLA, стерически блокируя РНК-полимеразы.
Можно получать искусственные системы CRISPR/Cas, ингибирующие TCR и/или HLA, с использованием технологии, известной в этой области, например, описываемой в патентной публикации США № 20140068797 и Cong (2013) Science 339: 819-823. Также можно получать другие искусственные системы CRISPR/Cas, известные в этой области, ингибирующие TCR и/или HLA, например, описываемые в Tsai (2014) Nature Biotechnol., 32:6 569-576, патентах США №№ 8871445, 8865406, 8795965, 8771945 и 8697359.
TALEN для ингибирования TCR и/или HLA
Термины "TALEN", или "TALEN к HLA и/или TCR", или "TALEN для ингибирования HLA и/или TCR" относятся к подобной активатору транскрипции эффекторной нуклеазе, искусственной нуклеазе, которую можно использовать для редактирования HLA, и/или гена TCR, и/или ингибиторной молекулы, представленной в настоящем описании (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозина и TGFR бета).
TALEN получают искусственно посредством слияния TAL-эффекторного ДНК-связывающего домена с ДНК-расщепляющим доменом. Можно конструировать подобные активатору транскрипции эффекторы (TALE) так, чтобы они связывали любую желаемую последовательность ДНК, включая часть гена HLA или TCR. Комбинируя сконструированный TALE с ДНК-расщепляющим доменом, можно получать фермент рестрикции, специфичный для любой желаемой последовательности ДНК, включая последовательность HLA или TCR. Затем их можно встраивать в клетку, где их можно использовать для редактирования генома. Boch (2011) Nature Biotech. 29: 135-6 и Boch et al. (2009) Science 326: 1509-12; Moscou et al. (2009) Science 326: 3501.
TALE являются белками, секретируемыми бактериями Xanthomonas. ДНК-связывающий домен содержит повторяющуюся, высококонсервативную последовательность из 33-34 аминокислот, за исключением 12-ой и 13-ой аминокислот. Эти два положения являются высоковариабельными, демонстрируя сильную корреляцию со специфическим распознаванием нуклеотида. Таким образом, их можно конструировать так, чтобы они связывали желаемую последовательность ДНК.
Для получения TALEN белок TALE подвергают слиянию с нуклеазой (N), являющейся эндонуклеазой дикого типа или мутантной эндонуклеазой FokI. Получено несколько мутаций в FokI для ее использования в TALEN, они, например, улучшают специфичность расщепления или активность. Cermak et al. (2011) Nucl. Acids Res. 39: e82; Miller et al. (2011) Nature Biotech. 29: 143-8; Hockemeyer et al. (2011) Nature Biotech. 29: 731-734; Wood et al. (2011) Science 333: 307; Doyon et al. (2010) Nature Methods 8: 74-79; Szczepek et al. (2007) Nature Biotech. 25: 786-793 и Guo et al. (2010) J. Mol. Biol. 200: 96.
Домен FokI функционирует как димер, для него необходимы две конструкции с уникальными ДНК-связывающими доменами для участков в целевом геноме с правильной ориентацией и расстоянием. По-видимому, и количество аминокислотных остатков между ДНК связывающим доменом TALE и расщепляющим доменом FokI, и количество оснований между двумя отдельными участками связывания TALEN являются важными параметрами для достижения высоких уровней активности. Miller et al. (2011) Nature Biotech. 29: 143-8.
TALEN к HLA или TCR можно использовать внутри клетки для получения двухцепочечного разрыва (DSB). В участок разрыва может встраиваться мутация, если механизмы репарации неправильно репарируют разрыв посредством негомологичного соединения концов. Например, при неправильной репарации может встраиваться мутация со сдвигом рамки считывания. Альтернативно, в клетку можно встраивать чужеродную ДНК вместе с TALEN, в зависимости от последовательностей чужеродной ДНК и хромосомной последовательности этот способ можно использовать для коррекции дефекта в гене HLA или TCR или встраивать такой дефект в ген HLA или TCR дикого типа, таким образом, снижая экспрессию HLA или TCR.
TALEN, специфичные для последовательностей в HLA или TCR, можно конструировать любым известным в этой области способом, включая различные схемы с использованием модульных компонентов. Zhang et al. (2011) Nature Biotech. 29: 149-53; Geibler et al. (2011) PLoS ONE 6: e19509.
Нуклеаза с цинковыми пальцами для ингибирования HLA и/или TCR
Термины "ZFN", или "нуклеаза с цинковыми пальцами", или "ZFN к HLA и/или TCR", или "ZFN для ингибирования HLA и/или TCR" относится к нуклеазе с цинковыми пальцами, искусственной нуклеазе, которую можно использовать для редактирования HLA, и/или гена TCR, и/или ингибиторной молекулы, представленной в настоящем описании (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозина и TGFR бета).
Подобно TALEN, ZFN содержит домен нуклеазы FokI (или его производное), слитый с ДНК-связывающим доменом. В случае ZFN ДНК-связывающий домен содержит один или более цинковых пальцев. Carroll et al. (2011) Genetics Society of America 188: 773-782 и Kim et al. (1996) Proc. Natl. Acad. Sci. USA 93: 1156-1160.
Цинковый палец является небольшим структурным мотивом белка, стабилизированным одним или более ионами цинка. Цинковый палец может содержать, например, Cys2His2, и может распознавать последовательность размером приблизительно 3 п.н. Различные цинковые пальцы известной специфичности можно комбинировать для получения полипептидов со множеством пальцев, распознающих последовательности размером приблизительно 6, 9, 12, 15 или 18 п.н. Доступны различные способы селекции и модульной сборки для получения цинковых пальцев (и их комбинаций), распознающих конкретные последовательности, включая фаговый дисплей, дрожжевые одногибридные системы, бактериальные одногибридные и двугибридные системы и клетки млекопитающих.
Подобно TALEN, ZFN должен димеризоваться для расщепления ДНК. Таким образом, пара ZFN необходима для воздействия на непалиндромные участки ДНК. Два отдельных ZFN должны связывать противоположные цепи ДНК так, чтобы их нуклеазы имели правильно расстояние между собой. Bitinaite et al. (1998) Proc. Natl. Acad. Sci. USA 95: 10570-5.
Также подобно TALEN, ZFN может создавать двухцепочечный разрыв в ДНК, который может приводить к мутации со сдвигом рамки считывания при неправильной репарации, приводя к снижению экспрессии и количества HLA и/или TCR в клетке. ZFN также можно использовать с гомологичной рекомбинации для мутагенеза в гене HLA или TCR.
ZFN, специфичные для последовательностей в гене HLA и/или TCR, можно конструировать любым известным в этой области способом. См., например, Provasi (2011) Nature Med. 18: 807-815; Torikai (2013) Blood 122: 1341-1349; Cathomen et al. (2008) Mol. Ther. 16: 1200-7; Guo et al. (2010) J. Mol. Biol. 400: 96; патентную публикацию США № 2011/0158957 и патентную публикацию США № 2012/0060230.
Экспрессия теломеразы
Не желая быть связанными какой-либо конкретной теорией, полагают, что в некоторых вариантах осуществления терапевтическая T-клетка обладает кратковременной выживаемостью у пациента по причине укорачивающихся теломер в T-клетке, таким образом, посредством трансфекции с использованием гена теломеразы можно удлинять теломеры T-клеток и улучшать выживаемость T-клеток у пациента. См. Carl June, "Adoptive T cell therapy for cancer in the clinic", Journal of Clinical Investigation, 117:1466-1476 (2007). Таким образом, в варианте осуществления иммунная эффекторная клетка, например, T-клетка, эктопически экспрессирует субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. В некоторых аспектах настоящее изобретение относится к способу получения CAR-экспрессирующей клетки, включающему приведение клетки в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетку можно приводить в контакт с нуклеиновой кислотой до, одновременно или после приведения в контакт с конструкцией, кодирующей CAR.
В одном из аспектов настоящее изобретение относится к способу получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток). В варианте осуществления способ включает: получение популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток), приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR и приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT, в условиях, делающих возможной экспрессию CAR и теломеразы.
В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, является ДНК. В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, содержит промотор, способный регулировать экспрессию субъединицы теломеразы.
В варианте осуществления hTERT имеет следующую аминокислотную последовательность белка GenBank ID AAC51724.1 (Meyerson et al., ʺhEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalizationʺ Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795):
MPRAPRCRAVRSLLRSHYREVLPLATFVRRLGPQGWRLVQRGDPAAFRALVAQCLVCVPWDARPPPAAPSFRQVSCLKELVARVLQRLCERGAKNVLAFGFALLDGARGGPPEAFTTSVRSYLPNTVTDALRGSGAWGLLLRRVGDDVLVHLLARCALFVLVAPSCAYQVCGPPLYQLGAATQARPPPHASGPRRRLGCERAWNHSVREAGVPLGLPAPGARRRGGSASRSLPLPKRPRRGAAPEPERTPVGQGSWAHPGRTRGPSDRGFCVVSPARPAEEATSLEGALSGTRHSHPSVGRQHHAGPPSTSRPPRPWDTPCPPVYAETKHFLYSSGDKEQLRPSFLLSSLRPSLTGARRLVETIFLGSRPWMPGTPRRLPRLPQRYWQMRPLFLELLGNHAQCPYGVLLKTHCPLRAAVTPAAGVCAREKPQGSVAAPEEEDTDPRRLVQLLRQHSSPWQVYGFVRACLRRLVPPGLWGSRHNERRFLRNTKKFISLGKHAKLSLQELTWKMSVRGCAWLRRSPGVGCVPAAEHRLREEILAKFLHWLMSVYVVELLRSFFYVTETTFQKNRLFFYRKSVWSKLQSIGIRQHLKRVQLRELSEAEVRQHREARPALLTSRLRFIPKPDGLRPIVNMDYVVGARTFRREKRAERLTSRVKALFSVLNYERARRPGLLGASVLGLDDIHRAWRTFVLRVRAQDPPPELYFVKVDVTGAYDTIPQDRLTEVIASIIKPQNTYCVRRYAVVQKAAHGHVRKAFKSHVSTLTDLQPYMRQFVAHLQETSPLRDAVVIEQSSSLNEASSGLFDVFLRFMCHHAVRIRGKSYVQCQGIPQGSILSTLLCSLCYGDMENKLFAGIRRDGLLLRLVDDFLLVTPHLTHAKTFLRTLVRGVPEYGCVVNLRKTVVNFPVEDEALGGTAFVQMPAHGLFPWCGLLLDTRTLEVQSDYSSYARTSIRASLTFNRGFKAGRNMRRKLFGVLRLKCHSLFLDLQVNSLQTVCTNIYKILLLQAYRFHACVLQLPFHQQVWKNPTFFLRVISDTASLCYSILKAKNAGMSLGAKGAAGPLPSEAVQWLCHQAFLLKLTRHRVTYVPLLGSLRTAQTQLSRKLPGTTLTALEAAANPALPSDFKTILD (SEQ ID NO: 284)
В варианте осуществления hTERT имеет последовательность, по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности SEQ ID NO: 284. В варианте осуществления hTERT имеет последовательность SEQ ID NO: 284. В варианте осуществления hTERT содержит делецию (например, не более 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце, или и том, и другом. В варианте осуществления hTERT содержит трансгенную аминокислотную последовательность (например, не более 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце, или и том, и другом.
В варианте осуществления hTERT кодируется последовательностью нуклеиновой кислоты под инвентарным номером GenBank AF018167 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795):
1 caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc
61 cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc
121 tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg
181 gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg
241 cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg
301 cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg
361 cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct
421 acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc
481 gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg
541 tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca
601 ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg
661 cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga
721 ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg
781 ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga
841 cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag
901 ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc
961 agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc
1021 ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc
1081 ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg
1141 agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc
1201 tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc
1261 agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag
1321 cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg
1381 acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt
1441 acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc
1501 acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca
1561 agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca
1621 ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg
1681 ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt
1741 atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga
1801 gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt
1861 cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc
1921 gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag
1981 ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt
2041 tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg
2101 gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc
2161 cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc
2221 aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc
2281 gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc
2341 acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg
2401 agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca
2461 gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg
2521 gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct
2581 gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc
2641 tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa
2701 ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga
2761 agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga
2821 tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg
2881 tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc
2941 gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt
3001 gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct
3061 acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc
3121 atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc
3181 tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg
3241 ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc
3301 tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc
3361 agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg
3421 cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg
3481 agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc
3541 ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct
3601 gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc
3661 tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc
3721 agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc
3781 cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc
3841 caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt
3901 gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg
3961 ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa
4021 aaaaaaa (SEQ ID NO: 285)
В варианте осуществления hTERT кодируется нуклеиновой кислотой, имеющей последовательность, по меньшей мере на 80%, 85%, 90%, 95%, 96, 97%, 98%, или 99% идентичной последовательности SEQ ID NO: 285. В варианте осуществления hTERT кодируется нуклеиновой кислотой SEQ ID NO: 285.
Активация и экспансия T-клеток
T-клетки можно активировать и выращивать, как правило, способами, описываемыми, например, в патентах США №№ 6352694, 6534055, 6905680, 6692964, 5858358, 6887466, 6905681, 7144575, 7067318, 7172869, 7232566, 7175843, 5883223, 6905874, 6797514, 6867041 и публикации патентной заявки США № 20060121005.
Как правило, T-клетки по изобретению можно выращивать посредством приведения в контакт с поверхностью с прикрепленным к ней средством, стимулирующим ассоциированный с комплексом CD3/TCR сигнал, и лигандом, стимулирующим костимуляторную молекулу на поверхности T-клеток. В частности, популяции T-клеток можно стимулировать, как представлено в настоящем описании, например, посредством приведения в контакт с антителом против CD3, или его антигенсвязывающим фрагментом, или антителом против CD2, иммобилизованном на поверхности, или посредством приведения в контакт с активатором протеинкиназы C (например, бриостатином) в комбинации с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности T-клеток используют лиганд, связывающийся со вспомогательной молекулой. Например, популяцию T-клеток можно приводить в контакт с антителом против CD3 и антителом против CD28 в условиях, подходящих для стимуляции пролиферации T-клеток. Для стимуляции пролиферации CD4+ T-клеток или CD8+ T-клеток можно использовать антитело против CD3 и антитело против CD28. Примеры антитела против CD28 включают 9.3, B-T3, XR-CD28 (Diaclone, Besançon, France), которые можно использовать, как и другие способы, общеизвестные в этой области (Berg et al., Transplant Proc. 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med. 190(9):13191328, 1999; Garland et al., J. Immunol Meth. 227(1-2):53-63, 1999).
В определенных аспектах первичный стимуляторный сигнал и костимуляторный сигнал для T-клеток можно обеспечивать разными способами. Например, средства, обеспечивающие каждый сигнал, могут находиться в растворе или их можно соединять с поверхностью. При соединении с поверхностью средства можно соединять с одной поверхностью (т.е. в "цис"-положении) или с отдельными поверхностями (т.е. в "транс"-положении). Альтернативно, одно средство можно соединять с поверхностью и другим средством в растворе. В одном из аспектов средство, обеспечивающее костимуляторный сигнал, связывают с поверхностью клетки, и средство, обеспечивающее первичный сигнал активации, находится в растворе или соединено с поверхностью. В определенных аспектах оба средства могут находиться в растворе. В одном из аспектов средства могут находиться в растворимой форме, а затем перекрестно сшиваться с поверхностью, такой как клетка, экспрессирующая Fc-рецепторы, или антитело, или другое связывающее средство, которое будет связываться со средствами. В связи с этим, см. например, публикации патентных заявок США №№ 20040101519 и 20060034810 в случае искусственных антигенпредставляющих клеток (aAPC), предусмотренных для использования в активации и экспансии T-клеток в настоящем изобретении.
В одном из аспектов два средства иммобилизуют на бусах, как на одной бусине, т.е. "цис", или на отдельных бусах, т.е. "транс". В качестве примера, средство, обеспечивающее первичный сигнал активации, является антителом против CD3 или его антигенсвязывающим фрагментом, и средство, обеспечивающее костимуляторный сигнал, является антителом против CD28 или его антигенсвязывающим фрагментом и оба средства совместно иммобилизуют на одной бусине в эквивалентных молекулярных количествах. В одном из аспектов для экспансии CD4+ T-клеток и выращивания T-клеток используют соотношение 1:1 каждого антитела, связанного с бусами. В определенных аспектах по настоящему изобретению соотношение антител против CD3:CD28, связанных с бусами, используют таким образом, что наблюдают повышение экспансии T-клеток по сравнению с экспансией, наблюдаемой при использовании соотношения 1:1. В одном из конкретных аспектов наблюдают повышение в от приблизительно 1 до приблизительно 3 раз по сравнению с экспансией, наблюдаемой при использовании соотношения 1:1. В одном из аспектов соотношение антител против CD3:CD28, связанных с бусами, находится в диапазоне от 100:1 до 1:100, включая все целые значения между ними. В одном из аспектов настоящего изобретения с частицами связывается больше антитела против CD28, чем антитела против CD3, т.е. соотношение антител против CD3:CD28 составляет менее единицы. В определенных аспектах изобретения соотношение антитела против CD28 и антитела против CD3, связанного с бусами, составляет более 2:1. В одном из конкретных аспектов используют соотношение 1:100 антител против CD3:CD28, связанных с бусами. В одном из аспектов используют соотношение 1:75 антител против CD3:CD28, связанных с бусами. В дополнительном аспекте используют соотношение 1:50 антител против CD3:CD28, связанных с бусами. В одном из аспектов используют соотношение 1:30 антител против CD3:CD28, связанных с бусами. В одном из предпочтительных аспектов используют соотношение 1:10 антител против CD3:CD28, связанных с бусами. В одном из аспектов используют соотношение 1:3 антител против CD3:CD28, связанных с бусами. В еще одном аспекте используют соотношение 3:1 антител против CD3:CD28, связанных с бусами.
Можно использовать соотношения частиц и клеток от 1:500 до 500:1, включая любые целые значения между ними, для стимуляции T-клеток или других клеток-мишеней. Как будет легко понятно специалистам в этой области, соотношение частиц и клеток может зависеть от размера частиц относительно клетки-мишени. Например, бусы небольшого размера могут связываться лишь с несколькими клетками, в то время как более крупные бусы могут связывать множество клеток. В определенных аспектах соотношение клеток и частиц находится в диапазоне от 1:100 до 100:1, включая любые целые значения между ними, и в дополнительных аспектах соотношение включает от 1:9 до 9:1, включая любые целые значения между ними, которые также можно использовать для стимуляции T-клеток. Соотношение частиц, соединенных с антителами против CD3 и против CD28, и T-клеток, приводящее к стимуляции T-клеток, может варьироваться, как указано выше, однако конкретные предпочтительные значения включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 и 15:1, при этом одно предпочтительное соотношение составляет по меньшей мере 1:1 частиц на T-клетку. В одном из аспектов используют соотношение частиц и клеток 1:1 или менее. В одном из конкретных аспектов предпочтительное соотношение частица:клетка составляет 1:5. В дополнительных аспектах соотношение частиц и клеток может варьироваться в зависимости от дня стимуляции. Например, в одном из аспектов соотношение частиц и клеток составляет от 1:1 до 10:1 в первый день, и дополнительные частицы добавляют к клеткам каждый день или через день впоследствии в течение до 10 дней с конечными соотношениями от 1:1 до 1:10 (с учетом количеств клеток в день добавления). В одном из конкретных аспектов соотношение частиц и клеток составляет 1:1 в первый день стимуляции, и его доводят до 1:5 на третий и пятый день стимуляции. В одном из аспектов частицы добавляют ежедневно или через день с учетом конечного соотношения 1:1 в первый день и 1:5 на третий и пятый день стимуляции. В одном из аспектов соотношение частиц и клеток составляет 2:1 в первый день стимуляции, и его доводят до 1:10 на третий и пятый день стимуляции. В одном из аспектов частицы добавляют ежедневно или через день с учетом конечного соотношения 1:1 в первый день и 1:10 на третий и пятый день стимуляции. Специалисту в этой области будет понятно, что множество других соотношений может являться пригодным для использования в настоящем изобретении. В частности, соотношения будут варьироваться в зависимости от размера частиц и размера и типа клеток. В одном из аспектов наиболее типичные соотношения для использования составляют приблизительно 1:1, 2:1 и 3:1 в первый день.
В дополнительных аспектах по настоящему изобретению клетки, такие как T-клетки, комбинируют с бусами, покрытыми средством, затем бусы и клетки разделяют, а затем клетки культивируют. В альтернативном аспекте перед культивированием покрытые средством бусы и клетки не разделяют, а культивируют совместно. В дополнительном аспекте бусы и клетки сначала концентрируют, прилагая силу, такую как сила магнитного поля, что приводит к повышенному лигированию поверхностных клеточных маркеров, таким образом, вызывая стимуляцию клеток.
В качестве примера, белки поверхности клетки можно лигировать, позволяя парамагнитным бусам, к которым присоединяют антитело против CD3 и против CD28 (бусы 3×28), контактировать с T-клетками. В одном из аспектов клетки (например, от 104 до 109 T-клеток) и бусы (например, парамагнитные бусы DYNABEADS® M-450 CD3/CD28 T в соотношении 1:1) комбинируют в буфере, например, PBS (без бивалентных катионов, таких как кальций и магний). И снова, специалистам в этой области будет понятно, что можно использовать любую концентрацию клеток. Например, клетка-мишень может являться очень редкой в образце и составляет лишь 0,01% образца, или целый образец (т.е. 100%) может содержать интересующую клетку-мишень. Таким образом, любое количество клеток находится в контексте настоящего описания. В определенных аспектах желательным может являться значительное снижение объема, в котором смешивают частицы и клетки (т.е. повышение концентрации клеток), для обеспечения максимального контакта клеток и частиц. Например, в одном из аспектов используют концентрацию приблизительно 10 миллиардов клеток/мл, 9 миллионов/мл, 8 миллионов/мл, 7 миллионов/мл, 6 миллионов/мл, 5 миллионов/мл или 2 миллиарда клеток/мл. В одном из аспектов используют более 100 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В еще одном аспекте используют концентрацию клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В дополнительных аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к повышенному выходу клеток, активации клеток и размножению клеток. Кроме того, использование высоких концентраций клеток делает возможным более эффективный захват клеток, которые могут слабо экспрессировать интересующие антигены-мишени, таких как CD28-отрицательных T-клеток. Такие популяции клеток могут иметь терапевтическое значение, и их получение в определенных аспектах будет желательным. Например, использование высокой концентрации клеток делает возможной более эффективную селекцию CD8+ T-клеток, в норме имеющих более слабую экспрессию CD28.
В одном из вариантов осуществления клетки, трансдуцированные с использованием нуклеиновой кислоты, кодирующей CAR, например, CAR, представленной в настоящем описании, выращивают, например, способом, представленным в настоящем описании. В одном из вариантов осуществления клетки выращивают в культуре в течение периода от нескольких часов (например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 часов) до приблизительно 14 дней (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней). В одном из вариантов осуществления клетки выращивают в течение периода от 4 до 9 дней. В одном из вариантов осуществления клетки выращивают в течение периода 8 дней или менее, например, 7, 6 или 5 дней. В одном из вариантов осуществления клетки, например, клетку CAR BCMA, представленную в настоящем описании, выращивают в культуре в течение 5 дней, и полученные клетки являются более активными, чем те же клетки, выращиваемые в культуре в течение 9 дней в тех же условиях культивирования. Активность можно определять, например, по различным функциям T-клеток, например, пролиферации, уничтожению клеток-мишеней, продукции цитокинов, активации, миграции или их комбинациям. В одном из вариантов осуществления клетки, например, клетка CAR BCMA, представленная в настоящем описании, выращиваемые в течение 5 дней, демонстрируют по меньшей мере одно-, дву-, трех- или четырехкратное повышение делений клеток после стимуляции антигеном по сравнению с теми же клетками, выращиваемыми в культуре в течение 9 дней в тех же условиях культивирования. В одном из вариантов осуществления клетки, например, клетки, экспрессирующие CAR BCMA, представленные в настоящем описании, выращивают в культуре в течение 5 дней, и полученные клетки демонстрируют более высокую продукцию провоспалительных цитокинов, например, уровни ИФНγ и/или ГМ-КСФ, по сравнению с теми же клетками, выращиваемыми в культуре в течение 9 дней в тех же условиях культивирования. В одном из вариантов осуществления клетки, например, клетка CAR BCMA, представленная в настоящем описании, выращиваемые в течение 5 дней, демонстрируют по меньшей мере одно-, дву-, трех-, четырех-, пяти-, десятикратное или большее повышение продукции провоспалительных цитокинов, например, уровней ИФНγ и/или ГМ-КСФ, в пг/мл по сравнению с теми же клетками, выращиваемыми в культуре в течение 9 дней в тех же условиях культивирования.
В одном из аспектов настоящего изобретения смесь можно культивировать в течение периода от нескольких часов (приблизительно 3 часов) до приблизительно 14 дней, включая любое почасовое целое значение между ними. В одном из аспектов смесь можно культивировать в течение 21 дня. В одном аспектов изобретения бусы и T-клетки культивируют совместно в течение приблизительно восьми дней. В одном из аспектов бусы и T-клетки культивируют совместно в течение 2-3 дней. Также желательными могут являться несколько циклов стимуляции таким образом, что время культивирования T-клеток может составлять 60 дней или более. Условия, подходящие для культивирования T-клеток, включают соответствующие среды (например, минимальные питательные среды или среды RPMI 1640 или X-vivo 15 (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональную бычью или человеческую сыворотку), интерлейкин-2 (ИЛ-2), инсулин, ИФНγ, ИЛ-4, ИЛ-7, ГМ-КСФ, ИЛ-10, ИЛ-12, ИЛ-15, TGFβ и ФНО или любые другие добавки для роста клеток, известные специалистам в этой области. Другие добавки для роста клеток включают, в качестве неограничивающих примеров, поверхностно-активное вещество, плазманат и восстановители, такие как N-ацетил-цистеин и 2-меркаптоэтанол. Среды могут включать RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer, с дополнительными аминокислотами, пируватом натрия и витаминами, без сыворотки или дополненные соответствующим количеством сыворотки (или плазмы), или определенным набором гормонов, и/или количеством цитокинов, достаточным для роста и экспансии T-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, подлежащие инфузии индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, соответствующей температуры (например, 37°C) и атмосферы (например, воздух с 5% CO2).
В одном из вариантов осуществления клетки выращивают в соответствующих средах (например, средах, представленных в настоящем описании), включающих один или более интерлейкинов, приводящих по меньшей мере к 200-кратному (например, 200-кратному, 250-кратному, 300-кратному, 350-кратному) повышению клеток в течение 14-дневного периода экспансии, например, как измеряют способом, представленным в настоящем описании, таким как проточная цитометрия. В одном из вариантов осуществления клетки выращивают в присутствие ИЛ-15 и/или ИЛ-7 (например, ИЛ-15 и ИЛ-7).
В вариантах осуществления способы, представленные в настоящем описании, например, способы производства CAR-экспрессирующих клеток, включают удаление T-регуляторных клеток, например, CD25+ T-клеток, из популяции клеток, например, с использованием антитела против CD25, или его фрагмента, или CD25-связывающего лиганда, ИЛ-2. Способы удаления T-регуляторных клеток, например, CD25+ T-клеток, из популяции клеток представлены в настоящем описании. В вариантах осуществления способы, например, способы производства, дополнительно включают приведение популяции клеток (например, популяции клеток, в которой T-регуляторные клетки, такие как CD25+ T-клетки, подвергнуты истощению, или популяции клеток, ранее подвергнутых контакту с антителом против CD25, его фрагментом, или CD25-связывающим лигандом) в контакт с ИЛ-15 и/или ИЛ-7. Например, популяцию клеток (например, которую ранее приводили в контакт с антителом против CD25, его фрагментом, или CD25-связывающим лигандом) выращивают в присутствие ИЛ-15 и/или ИЛ-7.
В некоторых вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, приводят в контакт с композицией, содержащей полипептид интерлейкина-15 (ИЛ-15), полипептид рецептора интерлейкина-15 альфа (ИЛ-15Ra) или комбинацию полипептида ИЛ-15 и полипептида ИЛ-15Ra, например, hetIL-15, при производстве CAR-экспрессирующих клеток, например, ex vivo. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, приводят в контакт с композицией, содержащей полипептид ИЛ-15, при производстве CAR-экспрессирующих клеток, например, ex vivo. В вариантах осуществления CAR-экспрессирующие клетки, представленные в настоящем описании, приводят в контакт с композицией, содержащей комбинацию полипептида ИЛ-15 и полипептида ИЛ-15Ra при производстве CAR-экспрессирующих клеток, например, ex vivo. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, приводят в контакт с композицией, содержащей hetIL-15, при производстве CAR-экспрессирующих клеток, например, ex vivo.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, приводят в контакт с композицией, содержащей hetIL-15, при экспансии ex vivo. В варианте осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, приводят в контакт с композицией, содержащей полипептид ИЛ-15, при экспансии ex vivo. В варианте осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, приводят в контакт с композицией, содержащей полипептид ИЛ-15 и полипептид ИЛ-15Ra, при экспансии ex vivo. В одном из вариантов осуществления приведение в контакт приводит к выживанию и пролиферации субпопуляции лимфоцитов, например, CD8+ T-клеток.
T-клетки, подвергнутые стимуляции в течение различных периодов времени, могут проявлять различные характеристики. Например, типичные продукты мононуклеарных клеток крови или аферезной периферической крови содержат популяцию T-хелперов (TH, CD4+), являющуюся большей, чем популяция цитотоксических или супрессорных T-клеток (TC, CD8+). При экспансии T-клеток ex vivo посредством стимуляции рецепторов CD3 и CD28 получают популяцию T-клеток, которая до приблизительно дней 8-9 состоит, главным образом, из TH-клеток, в то время как через приблизительно дней 8-9 популяция T-клеток содержит все большую популяцию TC-клеток. Таким образом, в зависимости от цели лечения предпочтительной может являться инфузия индивидууму популяции T-клеток, содержащих, главным образом, TH-клетки. Аналогично, если выделяют антиген-специфическую субпопуляцию TC-клеток, может быть полезным выращивание этой субпопуляции до большего объема.
Кроме того, в дополнение к маркерам CD4 и CD8, другие фенотипические маркеры значительно варьируются, но, в значительной степени, воспроизводимо в течение экспансии клеток. Таким образом, такая воспроизводимость делает возможной способность адаптировать активированный T-клеточный продукт для конкретных целей.
После конструирования CAR BCMA можно использовать различные анализы для оценки активности молекулы, такие как, в качестве неограничивающих примеров, способность к экспансии T-клеток после стимуляции антигеном, поддержание экспансии T-клеток в отсутствие повторной стимуляции и противораковые активности в соответствующих моделях in vitro и моделях на животных. Анализы для оценки эффектов CAR BCMA подробнее описывают ниже.
Для детекции наличия мономеров и димеров можно использовать анализ вестерн-блоттинга экспрессии CAR в первичных T-клетках. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, T-клетки (смесь 1:1 CD4+ и CD8+ T-клеток), экспрессирующие CAR, выращивают in vitro в течение более чем 10 дней с последующим лизисом и электрофорезом в ПААГ в присутствие SDS в восстановительных условиях. CAR, содержащие полноразмерный цитоплазматический домен TCR-ζ и эндогенную цепь TCR-ζ, определяют посредством вестерн-блоттинга с использованием антитела против цепи TCR-ζ. Те же субпопуляции T-клеток используют для электрофореза в ПААГ в присутствие SDS в невосстановительных условиях, чтобы сделать возможной оценку ковалентного образования димера.
Экспансию in vitro CAR+ T-клеток после стимуляции антигеном можно измерять посредством проточной цитометрии. Например, смесь CD4+ и CD8+ T-клеток стимулируют aAPC αCD3/αCD28 с последующей трансдукцией с использованием лентивирусных векторов, экспрессирующих GFP под контролем промоторов, подлежащих анализу. Примеры промоторов включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK). Флуоресценцию GFP оценивают в день 6 культивирования в субпопуляциях CD4+ и/или CD8+ T-клеток посредством проточной цитометрии. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Альтернативно, смесь CD4+ и CD8+ T-клеток стимулируют магнитными бусами, покрытыми αCD3/αCD28, в день 0 и трансдуцируют с использованием CAR в день 1 с использованием бицистронного лентивирусного вектора, экспрессирующего CAR вместе с eGFP с использованием рибосомальной перепрыгивающей последовательности 2A. Культуры повторно стимулируют BCMA-экспрессирующими клетками, такими как линии клеток множественной миеломы или K562-BCMA, после промывки. Раз в два дня в культуры добавляют экзогенный ИЛ-2 в дозе 100 МЕ/мл. GFP+ T-клетки подсчитывают посредством проточной цитометрии с использованием подсчета с учетом бус. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009).
Также можно измерять поддерживаемую экспансию CAR+ T-клеток в отсутствие повторной стимуляции. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, средний объем T-клеток (фл) измеряют в день 8 культивирования с использованием счетчика частиц Coulter Multisizer III, Nexcelom Cellometer Vision или Millipore Scepter после стимуляции магнитными бусами, покрытыми αCD3/αCD28 в день 0 и трансдукции с использованием указанного CAR в день 1.
Для измерения активности CART также можно использовать модели на животных. Например, можно использовать модель ксенотрансплантата с использованием специфичных к BCMA человека CAR+ T-клеток для лечения первичной множественной миеломы человека у мышей с иммунодефицитом. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, после развития MM мышей случайным образом распределяют по исследуемым группам. Можно инъецировать различные количества BCMA CART-клеток мышам с иммунодефицитом, несущим MM. Животных оценивают на прогрессирование заболевания и опухолевую массу с недельными интервалами. Кривые выживаемости для групп сравнивают с использованием логарифмического рангового критерия. Кроме того, также можно анализировать абсолютные количества CD4+ и CD8+ T-клеток в периферической крови через 4 недели после инъекции T-клеток мышам с иммунодефицитом. Мышам инъецируют клетки множественной миеломы и через 3 недели им инъецируют T-клетки, сконструированные для экспрессии CAR BCMA, например, с помощью бицистронного лентивирусного вектора, кодирующего CAR, связанный с eGFP. T-клетки нормируют по 45-50% исходных GFP+ T-клеток посредством смешивания с ложнотрансдуцированными клетками перед инъекцией и подтверждают посредством проточной цитометрии. Животных оценивают на лейкоз с 1-недельными интервалами. Кривые выживаемости для групп с CAR+ T-клетками сравнивают с использованием логарифмического рангового критерия.
Оценка пролиферации клеток и продукции цитокинов описана ранее, например, в Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, оценку CAR-опосредованной пролиферации осуществляют на планшетах для микротитрования посредством смешивания промытых T-клеток с клетками K562, экспрессирующими BCMA, или другими BCMA-экспрессирующими миеломными клетками, облученными гамма-радиацией перед использованием. Моноклональные антитела против CD3 (клон OKT3) и против CD28 (клон 9.3) добавляют в культуры с клетками KT32-BBL, чтобы они служили в качестве положительного контроля для стимуляции пролиферации T-клеток, т.к. эти сигналы поддерживают длительную экспансию CD8+ T-клеток ex vivo. T-клетки подсчитывают в культурах с использованием флуоресцентных бус CountBright™ (Invitrogen, Carlsbad, CA) и проточной цитометрии по инструкциям производителя. CAR+ T-клетки идентифицируют по экспрессии GFP с использованием T-клеток, сконструированных с использованием CAR-экспрессирующих лентивирусных векторов, связанных с eGFP-2A. В случае CAR+ T-клеток, не экспрессирующих GFP, CAR+ T-клетки определяют с помощью биотинилированного рекомбинантного белка BCMA и вторичного конъюгата авидин-PE. Также одновременно определяют экспрессию CD4+ и CD8+ на T-клетках с помощью специфических моноклональных антител (BD Biosciences). Измерения цитокинов осуществляют в супернатантах, собранных через 24 часа после повторной стимуляции с использованием цитометрического набора с бусами для анализа цитокинов TH1/TH2 человека (BD Biosciences, San Diego, CA) по инструкциям производителя. Флуоресценцию оценивают с использованием проточного цитометра FACScalibur и анализируют данные по инструкциям производителя.
Цитотоксичность можно оценивать с помощью стандартного анализа высвобождения 51Cr. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, клетки-мишени (например, линии K562, экспрессирующие BCMA, и первичные клетки множественной миеломы) нагружают 51Cr (в виде NaCrO4, New England Nuclear, Boston, MA) при 37°C в течение 2 часов с частым перемешиванием, дважды промывают в полной RPMI и высевают на планшеты для микротитрования. Эффекторные T-клетки смешивают с клетками-мишенями в лунках в полной RPMI при различных соотношениях эффекторная клетка:клетка-мишень (E:T). Также подготавливают дополнительные лунки, содержащие только среды (спонтанное высвобождение, SR) или 1% раствор детергента Triton-X 100 (общее высвобождение, TR). Через 4 часа инкубации при 37°C из каждой лунки собирают супернатант. Затем измеряют высвобожденный 51Cr с использованием счетчика гамма-частиц (Packard Instrument Co., Waltham, MA). Каждое условие воспроизводят по меньшей мере в трех параллелях и вычисляют процентную долю лизиса с использованием формулы: % лизиса=(ER-SR)/(TR-SR), где ER представляет собой среднее высвобождение 51Cr для каждого экспериментального условия.
Можно использовать технологии визуализации для оценки специфической миграции и пролиферации CAR в моделях на животных, несущих опухоли. Такие анализы описывают, например, в Barrett et al., Human Gene Therapy 22:1575-1586 (2011). В кратком изложении, мышам NOD/SCID/γc-/- (NSG) или с другим иммунодефицитом инъецируют IV клетки множественной миеломы, а через 7 дней BCMA CART-клетки через 4 часа после электропорации с использованием конструкций CAR. T-клетки стабильно трансфицируют с использованием лентивирусной конструкции для экспрессии люциферазы светлячка и мышей визуализируют на предмет биолюминесценции. Альтернативно, терапевтическую эффективность и специфичность одной инъекции CAR+ T-клеток в модели ксенотрансплантата множественной миеломы можно измерять следующим образом: мышам NSG инъецируют клетки множественной миеломы, трансдуцированные для стабильной экспрессии люциферазы светлячка, с последующей инъекцией в хвостовую вену T-клеток, электропорированных с использованием конструкции CAR BCMA днями позже. Животных визуализируют в различные моменты времени после инъекции. Например, можно получать тепловые карты плотности фотонов положительных на люциферазу светлячка опухолей у типичных мышей в день 5 (за 2 дня до обработки) и день 8 (через 24 часа после CAR+ PBL).
Альтернативно или в комбинации со способами, представленными в настоящем описании, описывают способы и композиции для одного или более из: детекции и/или количественного анализа CAR-экспрессирующих клеток (например, in vitro или in vivo (например, клинического мониторинга)), экспансии и/или активации иммунных клеток и/или CAR-специфической селекции, включающих использование лиганда CAR. В одном примере варианта осуществления лиганд CAR является антителом, связывающимся с молекулой CAR, например, связывающимся с внеклеточным антигенсвязывающим доменом CAR (например, антителом, связывающимся с антигенсвязывающим доменом, например, антиидиотипическим антителом, или антителом, связывающимся с константной областью внеклеточного связывающего домена). В других вариантах осуществления лиганд CAR является молекулой антигена CAR (например, молекулой антигена CAR, как представлено в настоящем описании).
В одном из аспектов описывают способ детекции и/или количественного анализа CAR-экспрессирующих клеток. Например, лиганд CAR можно использовать для детекции и/или количественного анализа CAR-экспрессирующих клеток in vitro или in vivo (например, клинического мониторинга CAR-экспрессирующих клеток у пациента или введения дозы пациенту). Способ включает:
получение лиганда CAR (необязательно, меченого лиганда CAR, например, лиганда CAR, включающего метку, бусину, радиоактивную или флуоресцентную метку);
получение CAR-экспрессирующей клетки (например, получение образца, содержащего CAR-экспрессирующие клетки, такое как производство образца или клинического образца);
приведение CAR-экспрессирующей клетки в контакт с лигандом CAR в условиях, в которых происходит связывание, таким образом, детекция уровня (например, количества) присутствующих CAR-экспрессирующих клеток. Связывание CAR-экспрессирующей клетки с лигандом CAR можно определять стандартными способами, такими как FACS, ELISA и т.п.
В другом аспекте описывают способ экспансии и/или активации клеток (например, иммунных эффекторных клеток). Способ включает:
получение CAR-экспрессирующей клетки (например, первой CAR-экспрессирующей клетки или транзиторно экспрессирующей CAR клетки);
приведение указанной CAR-экспрессирующей клетки в контакт с лигандом CAR, например, лигандом CAR, представленным в настоящем описании), в условиях, в которых происходит экспансия и/или пролиферация иммунных клеток, таким образом, получение популяции активированных и/или подвергнутых экспансии клеток.
В определенных вариантах осуществления лиганд CAR присутствует на (например, иммобилизован или прикреплен) субстрате, например, неприродном субстрате. В некоторых вариантах осуществления субстрат является неклеточным субстратом. Неклеточный субстрат может являться твердой подложкой, выбранной, например, из планшета (например, планшета для микротитрования), мембраны (например, нитроцеллюлозной мембраны), матрицы, чипа или бусины. В вариантах осуществления лиганд CAR присутствует в субстрате (например, на поверхности субстрата). Лиганд CAR можно иммобилизовать, прикреплять или связывать ковалентно или нековалентно (например, перекрестно сшивать) с субстратом. В одном из вариантов осуществления лиганд CAR присоединяют (например, ковалентно присоединяют) к бусине. В указанных выше вариантах осуществления популяцию иммунных клеток можно выращивать in vitro или ex vivo. Способ может дополнительно включать культивирование популяции иммунных клеток в присутствие лиганда молекулы CAR, например, с использованием любых способов, представленных в настоящем описании.
В других вариантах осуществления способ экспансии и/или активации клеток дополнительно включает добавление второй стимуляторной молекулы, например, CD28. Например, лиганд CAR и вторую стимуляторную молекулу можно иммобилизовать на субстрате, например, одной или более бусинах, таким образом, достигая повышенной экспансии и/или активации клеток.
Еще один аспект относится к способу селекции или обогащения CAR-экспрессирующих клеток. Способ включает приведение CAR-экспрессирующей клетки в контакт с лигандом CAR, как представлено в настоящем описании и выбор клеток с учетом связывания с лигандом CAR.
Другие варианты осуществления относятся к способу истощения, снижения и/или цитолиза CAR-экспрессирующих клеток. Способ включает приведение CAR-экспрессирующей клетки в контакт с лигандом CAR, как представлено в настоящем описании и направленное воздействие на клетку с учетом связывания лиганда CAR, таким образом, снижение количества и/или цитолиз CAR-экспрессирующих клеток. В одном из вариантов осуществления лиганд CAR соединяют с токсическим средством (например, токсином или лекарственным средством для абляции клеток). В другом варианте осуществления антиидиотипическое антитело может вызывать активность эффекторных клеток, например, активности ADCC или ADC.
Примеры антител против CAR, которые можно использовать в способах, к которым относится настоящее изобретение, описывают, например, в WO2014/190273 и Jena et al., "Chimeric Antigen Receptor (CAR)-Specific Monoclonal Antibody to Detect CD19-Specific T cells in Clinical Trials", PLOS March 2013 8:3 e57838, содержание которых включено в настоящее описание в качестве ссылок. В одном из вариантов осуществления молекула антиидиотипического антитела распознает молекулу антитела против CD19, например, scFv против CD19. Например, молекула антиидиотипического антитела может конкурировать за связывание с клоном № 136.20.1 CD19-специфического mAb CAR, описываемого в Jena et al., PLOS March 2013 8:3 e57838, может содержать те же CDR (например, одну или более, например, из всех из CDR1 VH, CDR2 VH, CDR3 CH, CDR1 VL, CDR2 VL и CDR3 VL с использованием определения по Kabat, определения по Chothia или комбинации определений по Kabat и Chothia), что и клон № 136.20.1 CD19-специфического mAb CAR, может содержать те же одну или более (например, 2) вариабельных областей, что и клон № 136.20.1CD19-специфического mAb CAR, или может содержать клон № 136.20.1 CD19-специфического mAb CAR. В некоторых вариантах осуществления антиидиотипическое антитело получали способом, описываемом в Jena et al. В другом варианте осуществления молекула антиидиотипического антитела является молекулой антиидиотипического антитела, описываемой в WO2014/190273. В некоторых вариантах осуществления молекула антиидиотипического антитела содержит те же CDR (например, одну или более из, например, всех из CDR1 VH, CDR2 VH, CDR3 CH, CDR1 VL, CDR2 VL и CDR3 VL), что и молекула антитела из WO2014/190273, такая как 136.20.1, может содержать одну или более (например, 2) вариабельные области молекулы антитела из WO2014/190273 или может содержать молекулу антитела из WO2014/190273, такую как 136.20.1. В других вариантах осуществления антитело против CAR связывается с константной областью внеклеточного связывающего домена молекулы CAR, например, как описано в WO2014/190273. В некоторых вариантах осуществления антитело против CAR связывается с константной областью внеклеточного связывающего домена молекулы CAR, например, константной области тяжелой цепи (например, шарнирной области CH2-CH3) или константной области легкой цепи. Например, в некоторых вариантах осуществления антитело против CAR конкурирует за связывание с моноклональным антителом 2D3, описываемым в WO2014/190273, содержит те же CDR (например, одну или более, например, из всех из, CDR1 VH, CDR2 VH, CDR3 CH, CDR1 VL, CDR2 VL и CDR3 VL), что и 2D3, или содержит одну или более (например, 2) вариабельных областей 2D3, или содержит 2D3, как описано в WO2014/190273.
В некоторых аспектах и варианты осуществления композиции и способы в настоящем описании оптимизируют для конкретной субпопуляции T-клеток, например, как описано в патенте США № 62/031699, зарегистрированном 31 июля 2014 года, содержание которого включено в настоящее описание в качестве ссылки в полном объеме. В некоторых вариантах осуществления оптимизированные субпопуляции T-клеток демонстрируют повышенную выживаемость по сравнению с контрольной T-клеткой, например, T-клеткой другого типа (например, CD8+ или CD4+), экспрессирующей ту же конструкцию.
В некоторых вариантах осуществления CD4+ T-клетка содержит CAR, представленный в настоящем описании, где CAR содержит внутриклеточный сигнальный домен, подходящий (например, оптимизированный, например, приводящий к повышенной выживаемости) для CD4+ T-клетки, например, домен ICOS. В некоторых вариантах осуществления CD8+ T-клетка содержит CAR, представленный в настоящем описании, где CAR содержит внутриклеточный сигнальный домен, подходящий (например, оптимизированный, например, приводящий к повышенной выживаемости) для CD8+ T-клетки, например, домен 4-1BB, домен CD28 или другой костимуляторный домен, иной, чем домен ICOS. В некоторых вариантах осуществления CAR, представленный в настоящем описании, содержит антигенсвязывающий домен, представленный в настоящем описании, например, CAR, содержащий антигенсвязывающий домен против BCMA, например, CAR из таблицы 1 или 16).
В одном из аспектов настоящее изобретение относится к способу лечения индивидуума, например, индивидуума со злокачественным новообразованием. Способ включает введение указанному индивидууму эффективного количества:
1) CD4+ T-клеток, содержащих CAR (CARCD4+),
содержащих:
антигенсвязывающий домен, например, антигенсвязывающий домен, представленный в настоящем описании, например, антигенсвязывающий домен против BCMA, например, антигенсвязывающий домен из таблицы 1 или 16;
трансмембранный домен; и
внутриклеточный сигнальный домен, например, первый костимуляторный домен, например, домен ICOS; и
2) CD8+ T-клеток содержащих CAR (CARCD8+), содержащих:
антигенсвязывающий домен, например, антигенсвязывающий домен, представленный в настоящем описании, например, антигенсвязывающий домен против BCMA, например, антигенсвязывающий домен из таблицы 1 или 16;
трансмембранный домен; и
внутриклеточный сигнальный домен, например, второй костимуляторный домен, например, домен 4-1BB, домен CD28 или другой костимуляторный домен, иной, чем домен ICOS;
где CARCD4+ и CARCD8+ отличаются друг от друга.
Необязательно, способ дополнительно включает введение:
3) второй CD8+ T-клетки, содержащей CAR (второй CARCD8+), содержащий:
антигенсвязывающий домен, например, антигенсвязывающий домен, представленный в настоящем описании, например, антигенсвязывающий домен, специфически связывающийся с BCMA, например, антигенсвязывающий домен из таблицы 1 или 16;
трансмембранный домен; и
внутриклеточный сигнальный домен, где второй CARCD8+ содержит внутриклеточный сигнальный домен, например, костимуляторный сигнальный домен, не присутствующий в CARCD8+, и, необязательно, не содержащий сигнальный домен ICOS.
Для оценки конструкций BCMA CAR по изобретению также можно использовать другие анализы, включая описываемые в разделе "Примеры" в настоящем описании, а также известные в этой области.
Терапевтическое применение
BCMA-ассоциированные заболевания и/или нарушения
В одном из аспектов изобретение относится к способам лечения заболевания, ассоциированного с экспрессией BCMA. В одном из аспектов изобретение относится к способам лечения заболевания, где часть опухоли является отрицательной на BCMA, и часть опухоли является положительной на BCMA. Например, CAR по изобретению применим для лечения индивидуумов, подвергаемых лечению заболевания, ассоциированного с повышенной экспрессией BCMA, где у индивидуума, подвергаемого лечению от повышенных уровней BCMA, наблюдают заболевание, ассоциированное с повышенными уровнями BCMA. В вариантах осуществления CAR по изобретению применим для лечения индивидуумов, подвергаемых лечению от заболевания, ассоциированного с экспрессией BCMA, где у индивидуума, подвергаемого лечению, относящемуся к экспрессии BCMA, наблюдают заболевание, ассоциированное с экспрессией BCMA.
В одном из вариантов осуществления изобретение относится к способам лечения заболевания, где BCMA экспрессируется на нормальных клетках и злокачественных клетках, но экспрессируется на более низких уровнях на нормальных клетках. В одном из вариантов осуществления способ дополнительно включает селекцию CAR по изобретению, связывающегося с аффинностью, позволяющей CAR BCMA связывать и уничтожать злокачественные клетки, экспрессирующие BCMA, но уничтожать менее 30%, 25%, 20%, 15%, 10%, 5% или менее нормальных клеток, экспрессирующих BCMA, например, как определяют посредством анализа, представленного в настоящем описании. Например, можно использовать анализ цитолиза, такой как проточная цитометрия на основе 51Cr CTL. В одном из вариантов осуществления CAR BCMA содержит антигенсвязывающий домен, имеющий аффинность связывания KD от 10-4 M до 10-8 M, например, от 10-5 M до 10-7 M, например, 10-6 M или 10-7 M, для антигена-мишени. В одном из вариантов осуществления BCMA-антигенсвязывающий домен имеет аффинность связывания, являющуюся по меньшей мере в пять, 10, 20, 30, 50, 100 или 1000 раз меньшей, чем у референсного антитела, например, антитела, представленного в настоящем описании.
В одном из аспектов изобретение относится к вектору, содержащему CAR BCMA, функционально связанный с промотором для экспрессии в иммунных эффекторных клетках млекопитающих, например, T-клетках или NK-клетках. В одном из аспектов изобретение относится к рекомбинантной иммунной эффекторной клетке, например, T-клетке или NK-клетке, экспрессирующей CAR BCMA, для применения в лечении BCMA-экспрессирующих опухолей, где рекомбинантную иммунную эффекторную клетку (например, T-клетку или NK-клетку), экспрессирующую CAR BCMA, обозначают как CAR BCMA-экспрессирующую клетку (например, BCMA CART или CAR BCMA-экспрессирующую NK-клетку). В одном из аспектов CAR BCMA-экспрессирующая клетка (например, BCMA CART или CAR BCMA-экспрессирующая NK-клетка) по изобретению способна приводить опухолевую клетку в контакт по меньшей мере с одним CAR BCMA по изобретению, экспрессирующимся на ее поверхности, таким образом, что CAR BCMA-экспрессирующая клетка (например, BCMA CART или CAR BCMA-экспрессирующая NK-клетка) направленно воздействует на опухолевую клетку, и рост опухоли ингибируется.
В одном из аспектов изобретение относится к способу ингибирования роста BCMA-экспрессирующей опухолевой клетки, включающему приведение опухолевой клетки в контакт с CAR BCMA-экспрессирующей клеткой (например, BCMA CART или CAR BCMA-экспрессирующей NK-клеткой) по настоящему изобретению таким образом, что CAR BCMA-экспрессирующая клетка (например, BCMA CART или CAR BCMA-экспрессирующая NK-клетка) активируется в ответ на антиген и направленно воздействует на злокачественную клетку, где рост опухоли ингибируется.
В одном из аспектов изобретение относится к способу лечения злокачественного новообразования у индивидуума. Способ включает введение индивидууму CAR BCMA-экспрессирующей клетки (например, BCMA CART или CAR BCMA-экспрессирующей NK-клетки) по настоящему изобретению таким образом, что лечат злокачественное новообразование у индивидуума. Примером злокачественного новообразования, которое можно лечить с помощью CAR BCMA-экспрессирующей клетки (например, BCMA CART или CAR BCMA-экспрессирующей NK-клетки) по изобретению, является злокачественное новообразование, ассоциированное с экспрессией BCMA.
Настоящее изобретение включает тип клеточной терапии, где иммунные эффекторные клетки (например, T-клетки или NK-клетки) генетически модифицируют для экспрессии химерного антигенного рецептора (CAR) и CAR BCMA-экспрессирующую клетку (например, BCMA CART или CAR BCMA-экспрессирующую NK-клетку) инфузируют нуждающемуся в этом реципиенту. Инфузируемая клетка способна уничтожать опухолевые клетки реципиента. В отличие от способов терапии антителами, CAR-модифицированные клетки, например, T-клетки или NK-клетки, способны делиться in vivo, что приводит к длительной выживаемости, приводящей к длительному контролю опухоли. В различных аспектах клетки (например, T-клетки или NK-клетки), вводимые пациенту, или их потомство персистируют у пациента в течение по меньшей мере четырех месяцев, пяти месяцев, шести месяцев, семи месяцев, восьми месяцев, девяти месяцев, десяти месяцев, одиннадцати месяцев, двенадцати месяцев, тринадцати месяцев, четырнадцати месяцев, пятнадцати месяцев, шестнадцати месяцев, семнадцати месяцев, восемнадцати месяцев, девятнадцати месяцев, двадцати месяцев, двадцати одного месяцев, двадцати двух месяцев, двадцати трех месяцев, двух лет, трех лет, четырех лет или пяти лет после введения клетки (например, T-клетки или NK-клетки) пациенту.
Изобретение также включает тип клеточной терапии, где иммунные эффекторные клетки (например, T-клетки или NK-клетки) модифицируют, например, посредством транскрибируемой in vitro РНК, для транзиторной экспрессии химерного антигенного рецептора (CAR), и иммунную эффекторную клетку (например, T-клетку или NK-клетку) инфузируют нуждающемуся в этом реципиенту. Инфузируемая клетка способна уничтожать опухолевые клетки реципиента. Таким образом, в различных аспектах иммунные эффекторные клетки (например, T-клетки или NK-клетки), вводимые пациенту, присутствуют в пациенте в течение менее одного месяца, например, трех недель, двух недель, одной недели, после введения иммунной эффекторной клетки (например, T-клетки или NK-клетки).
Без желания быть связанным какой-либо конкретной теорией, полагают, что противоопухолевый иммунный ответ, вызываемый CAR-модифицированными иммунными эффекторными клетками (например, T-клетками или NK-клетками), может являться активным или пассивным иммунным ответом или, альтернативно, может являться результатом прямого или непрямого иммунного ответа. В одном из аспектов трансдуцированные с помощью CAR иммунные эффекторные клетки (например, T-клетки или NK-клетки) демонстрируют специфическую секрецию провоспалительных цитокинов и мощную цитолитическую активность в ответ на злокачественные клетки человека, экспрессирующие BCMA, являются устойчивыми к ингибированию растворимым BCMA, опосредуют неспецифическое цитолиз и опосредуют регрессирование развившейся опухоли человека. Например, опухолевые клетки, лишенные антигена, в гетерогенной области BCMA-экспрессирующей опухоли могут являться восприимчивыми к непрямому разрушению BCMA-перенаправленными иммунными эффекторными клетками (например, T-клетками или NK-клетками), ранее реагировавшими против смежных антиген-положительных злокачественных клеток.
В одном из аспектов полностью человеческие CAR-модифицированные иммунные эффекторные клетки (например, T-клетки или NK-клетки) по изобретению могут являться типом вакцины для иммунизации ex vivo и/или терапии in vivo у млекопитающего. В одном из аспектов млекопитающее является человеком.
Что касается иммунизации ex vivo, по меньшей мере одно из следующего происходит in vitro перед введением клетки млекопитающему: i) экспансия клеток, ii) встраивание нуклеиновой кислоты, кодирующей CAR, в клетки или iii) криоконсервация клеток.
Способы ex vivo хорошо известны в этой области и более подробно описаны ниже. В кратком изложении, клетки выделяют из млекопитающего (например, человек) и генетически модифицируют (т.е. трансдуцируют или трансфицируют in vitro) с использованием вектора, экспрессирующего CAR, представленный в настоящем описании. CAR-модифицированную клетку можно вводить млекопитающему-реципиенту для достижения терапевтического эффекта. Реципиент-млекопитающее может являться человеком, и CAR-модифицированная клетка может являться аутологичной в отношении реципиента. Альтернативно, клетки могут являться аллогенными, сингенными или ксеногенными в отношении реципиента.
Способ экспансии ex vivo гематопоэтических стволовых клеток и клеток-предшественников описывают в патенте США № 5199942, включенном в настоящее описание в качестве ссылки, его можно применять к клеткам по настоящему изобретению. Другие подходящие способы известны в этой области, таким образом, настоящее изобретение не ограничено конкретным способом экспансии клеток ex vivo. В кратком изложении, культивирование ex vivo и экспансия T-клеток включает: (1) сбор CD34+ гематопоэтических стволовых клеток и клеток-предшественников из периферической крови или эксплантатов костного мозга млекопитающего и (2) экспансию таких клеток ex vivo. В дополнение к факторам роста клеток, описываемым в патенте США № 5199942, для культивирования и экспансии клеток можно использовать другие факторы, такие как flt3-L, ИЛ-1, ИЛ-3 и лиганд c-kit.
В дополнение к использованию вакцины на основе клеток в терминах иммунизации ex vivo, настоящее изобретение также относится к композициям и способам иммунизации in vivo для вызывания иммунного ответа, направленного против антигена у пациента.
Как правило, клетки, активированные и выращенные, как представлено в настоящем описании, можно использовать в лечении и профилактике заболеваний, возникающих у индивидуумов, являющихся иммунокомпрометированными. В частности, CAR-модифицированные иммунные эффекторные клетки (например, T-клетки или NK-клетки) по изобретению используют в лечении заболеваний, нарушений и состояний, ассоциированных с экспрессией BCMA. В определенных аспектах клетки по изобретению используют в лечении пациентов с риском развития заболеваний, нарушений и состояний, ассоциированных с экспрессией BCMA. Таким образом, настоящее изобретение относится к способам лечения или профилактики заболеваний, нарушений и состояний, ассоциированных с экспрессией BCMA, включающим введение нуждающемуся в этом индивидууму терапевтически эффективного количества CAR-модифицированных иммунных эффекторных клеток (например, T-клеток или NK-клеток) по изобретению.
В одном из аспектов CAR-экспрессирующие клетки (например, CART клетки или CAR-экспрессирующие NK-клетки) по изобретению можно использовать для лечения пролиферативного заболевания, такого как злокачественное новообразование, или предракового состояния, такого как миелодисплазия, миелодиспластический синдром или предлейкоз. В одном из аспектов злокачественное новообразование является гемобластозом. Гемобластозные состояния являются типами злокачественного новообразования, такими как лейкоз и злокачественные лимфопролиферативные состояния, поражающие кровь, костный мозг и лимфатическую систему. В одном из аспектов гемобластоз является лейкозом или гематологическим нарушением. Примером заболевания или нарушения, ассоциированного с BCMA, является множественная миелома (также известная как MM) (см. Claudio et al., Blood. 2002, 100(6):2175-86 и Novak et al., Blood. 2004, 103(2):689-94). Множественная миелома, также известная как плазмоклеточная миелома или болезнь Калера, является злокачественным новообразованием, отличающимся накоплением аномальных или злокачественных плазматических B-клеток в костном мозге. Зачастую злокачественные клетки инвазируют смежную кость, разрушая скелетные структуры и приводя к боли в костях и переломам. Большинству случаев миеломы также сопутствует продукция парапротеина (также известного как M-протеин или миеломный белок), являющегося аномальным иммуноглобулином, продуцирующимся в избытке при клональной пролиферации злокачественных плазматических клеток. Уровни парапротеина в сыворотке крови более 30 г/л являются диагностическим признаком множественной миеломы согласно диагностическим критериям International Myeloma Working Group (IMWG) (см. Kyle et al. (2009), Leukemia. 23:3-9). Другие симптомы или признаки множественной миеломы включают сниженную функцию почек или почечную недостаточность, повреждения кости, анемию, гиперкальциемию и неврологические симптомы.
Критерии для различения множественной миеломы и других пролиферативных нарушений из плазматических клеток установлены International Myeloma Working Group (см. Kyle et al. (2009), Leukemia. 23:3-9). Должны быть удовлетворены все три следующих критерия:
- Клональные плазматические клетки костного мозга ≥10%
- Наличие моноклонального белка в сыворотке и/или моче (за исключением пациентов с истинной несекретирующей множественной миеломой)
- Доказательство повреждения органа-мишени, обусловленного лежащим в основе пролиферативным нарушением из плазматических клеток, а именно:
○ Гиперкальциемия: кальций в сыворотке ≥11,5 мг/100 мл
○ Почечная недостаточность: креатинин в сыворотке >1,73 ммоль/л
○ Анемия: нормохромная, нормоцитарная со значением гемоглобина >2 г/100 мл ниже нижнего предела нормы или значением гемоглобина <10 г/100 мл
○ Повреждения костей: литические повреждения, тяжелая остеопения или патологические переломы.
Другие пролиферативные нарушения плазматических клеток, которые можно лечить с использованием композиций и способов, представленных в настоящем описании, включают, в качестве неограничивающих примеров, бессимптомную миелому (вялотекущую множественную миелому или индолентную миелому), моноклональную гаммапатию неустановленной этиологии (MGUS), макроглобулинемию Вальденстрема, плазмоцитомы (например, плазмоклеточную дискразию, солитарную миелому, солитарную плазмоцитому, экстрамедуллярную плазмоцитому и множественную плазмоцитому), системный амилоидоз легких цепей и POEMS-синдром (также известный как синдром Кроу-Фуказа, болезнь Такацуки и PEP-синдром).
Для стадирования множественной миеломы используют две системы стадирования: Международную систему стадирования (ISS) (см. Greipp et al. (2005), J. Clin. Oncol. 23 (15):3412-3420) и Систему стадирования Дюри-Сальмон (DSS) (см. Durie et al. (1975), Cancer 36 (3): 842-854). Две системы стадирования обобщены в таблице ниже:
Таблица 18
Уровень гемоглобина>10 г/дл
Кальций в сыворотке, норма или<12 мг/дл
Рентгенография кости, норма или лишь 1 плазмоцитома
Низкая продукция моноклонального белка (IgG<5 г/дл, IgA<3 г/дл, белок Бенс-Джонса<4 г/дл за 24 часа
IB: 22 месяца
IIB: 354 месяца
Уровень гемоглобина<8,5 г/дл
Кальций в сыворотке, норма или >12 мг/дл
Прогрессирующие остеолитические повреждения
Высокая продукция моноклонального белка (IgG>7 г/дл, IgA>5 г/дл, белок Бенс-Джонса>12 г/дл за 24 часа
IIIB: 24 месяца
*Система стадирования Дюри-Сальмон также включает подклассификацию, обозначающую состояние функции почек. Обозначение "A" или "B" добавляют после номера стадии, где "A" означает относительно нормальную функцию почек (значение креатинина в сыворотке <2,0 мг/дл), и B означает аномальную функцию почек (значение креатинина в сыворотке >2,0 мг/дл).
Стандартное лечение множественной миеломы и ассоциированных заболеваний включает химиотерапию, трансплантацию стволовых клеток (аутологичную или аллогенную), лучевую терапию и другие медикаментозные способы терапии. Часто используемые лекарственные средства против миеломы включают алкилирующие средства (например, бендамустин, циклофосфамид и мелфалан), ингибиторы протеасом (например, бортезомиб), кортикостероиды (например, дексаметазон и преднизон) и иммуномодуляторы (например, талидомид и леналидомид или Revlimid®) или любую их комбинацию. Бифосфонатные лекарственные средства также часто вводят в комбинации со стандартными способами лечения MM для профилактики рарефикации кости. Пациенты старше 65-70 лет являются маловероятными кандидатами для трансплантации стволовых клеток. В некоторых случаях трансплантации двойных аутологичных стволовых клеток являются вариантом для пациентов моложе 60 лет с субоптимальным ответом на первую трансплантацию. Композиции и способы по настоящему изобретению можно вводить в комбинации с любым из прописываемых в настоящее время способов лечения множественной миеломы.
Другим примером заболевания или нарушения, ассоциированного с BCMA, является лимфома Ходжкина и неходжкинская лимфома (См. Chiu et al., Blood. 2007, 109(2):729-39; He et al., J Immunol. 2004, 172(5):3268-79).
Лимфома Ходжкина (HL), также известная как болезнь Ходжкина, является злокачественным новообразованием лимфатической системы, происходящим из лейкоцитов или лимфоцитов. Аномальные клетки при лимфоме называют клетками Рид-Штернберга. При лимфоме Ходжкина злокачественное новообразование распространяется от одной группы лимфоузлов к другому. Лимфому Ходжкина можно подклассифицировать на четыре патологических подтипа в зависимости от морфологии клеток Рид-Штернберга и композиции клеток вокруг клеток Рид-Штернберга (что определяют посредством биопсии лимфоузлов): нодулярную склерозирующую HL, подтип со смешанной клеточностью, лимфоцитарно-богатую или с лимфоцитарным преобладанием, с истощением лимфоцитов. Некоторые лимфомы Ходжкина могут также являться нодулярной лимфомой Ходжкина с преобладанием лимфоцитов или могут являться неопределенными. Симптомы и признаки лимфомы Ходжкина включают безболезненный отек в лимфоузлах шеи, подмышек или паха, высокую температуру, ночную потливость, потерю веса, утомляемость, зуд или боль в животе.
Неходжкинская лимфома (NHL) включает разнообразную группу гемобластозов, включающих любой тип лимфомы, иной, чем лимфома Ходжкина. Подтипы неходжкинской лимфомы классифицируют, главным образом, по морфологии клеток, хромосомным аберрациям и поверхностным маркерам. Подтипы NHL (или NHL-асооциированные злокачественные новообразования) включают B-клеточные лимфомы, в качестве неограничивающих примеров, такие как, лимфома Беркитта, хронический B-клеточный лимфоцитарный лейкоз (B-CLL), B-клеточный пролимфоцитарный лейкоз (B-PLL), хронический лимфоцитарный лейкоз (CLL), диффузную крупноклеточную B-клеточную лимфому (DLBCL) (например, внутрисосудистую крупноклеточную B-клеточную лимфому и первичную медиастинальную B-клеточную лимфому), фолликулярную лимфому (например, лимфому из клеток центра фолликула, фолликулярную мелкоклеточную лимфому с рассеченными ядрами), волосатоклеточный лейкоз, B-клеточную лимфому высокой степени злокачественности (подобную лимфоме Беркитта), лимфоплазмоцитарную лимфому (макроглобулинемию Вальденстрема), лимфому из клеток мантийной зоны, B-клеточные лимфомы маргинальной зоны (например, экстранодальную B-клеточную лимфому маргинальной зоны или лимфому из лимфоидной ткани слизистых оболочек (MALT), нодальную B-клеточную лимфому маргинальной зоны и B-клеточную лимфому маргинальной зоны селезенки), плазмоцитому/миелому, B-лимфобластный лейкоз/лимфому из клеток-предшественников (PB-LBL/L), первичную лимфому центральной нервной системы (ЦНС), первичную внутриглазную лимфому, мелкоклеточную лимфоцитарную лимфому (SLL) и T-клеточные лимфомы, в качестве неограничивающих примеров, такие как, анапластическая крупноклеточная лимфома (ALCL), T-клеточная лимфома/лейкоз взрослых (например, вялотекущая, хроническая, острая и лимфоматозная), лимфангиома, ангиоиммунобластная T-клеточная лимфома, кожные T-клеточные лимфомы (например, фунгоидный микоз, синдром Сезари и т.д.), экстранодальная T-клеточная лимфома/лимфома естественных киллеров (назального типа), интестинальная T-клеточная лимфома энтеропатического типа, крупноклеточный гландулярный лимфоцитарный лейкоз, T-лимфобластная лимфома/лейкоз из клеток-предшественников (T-LBL/L), T-клеточный хронический лимфоцитарный лейкоз/пролимфоцитарный лейкоз (T-CLL/PLL) и неопределенная периферическая T-клеточная лимфома. Симптомы и признаки лимфомы Ходжкина включают безболезненные отеки лимфоузлов шеи, подмышек, или паха, высокую температуру, ночную потливость, потерю веса, утомляемость, зуд, боль в животе, кашель или боль в груди.
Стадирование является одинаковым и для лимфомы Ходжкина, и для неходжкинской лимфомы и относится к степени распространения злокачественных клеток в организме. На стадии I клетки лимфомы находятся в одной группе лимфоузлов. На стадии II клетки лимфомы присутствуют по меньшей мере в двух группах лимфоузлов, но обе группы находятся с одной стороны диафрагмы или в одной части ткани или органа и лимфоузлах вблизи органа на одной стороне диафрагмы. На стадии III клетки лимфомы находятся в лимфоузлах по обеим сторонам диафрагмы или в одной части ткани или органа вблизи этих групп лимфоузлов или в селезенке. На стадии IV клетки лимфомы обнаруживают в нескольких частях по меньшей мере одного органа или ткани, или клетки лимфомы находятся в органе и лимфоузлах на другой стороне диафрагмы. В дополнение к обозначению стадий римскими цифрами стадии также обозначают буквами A, B, E и S, где A относится к пациентам без симптомов, B относится к пациентам с симптомами, E относится к пациентам, у которых лимфому обнаруживают в тканях вне лимфатической системы, и S относится к пациентам, у которых лимфому обнаруживают в селезенке.
Лимфому Ходжкина общепринято лечат с использованием лучевой терапии, химиотерапии или трансплантации гематопоэтических стволовых клеток. Наиболее распространенной терапией для неходжкинской лимфомы является R-CHOP, состоящая из четырех разных химиотерапевтических средств (циклофосфамида, доксорубицина, винкристина и преднизолона) и ритуксимаба (Rituxan®). Другие способы терапии, общеупотребительные для лечения NHL, включают другие химиотерапевтические средства, лучевую терапию, трансплантацию стволовых клеток (аутологичную или аллогенную трансплантацию костного мозга) или биологическую терапию, такую как иммунотерапия. Другие неограничивающие примеры биологических терапевтических средств включают ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), эпратузумаб (LymphoCide®) и алемтузумаб (MabCampath®). Композиции и способы по настоящему изобретению можно вводить в комбинации с любым из прописываемых в настоящее время способов лечения лимфомы Ходжкина или неходжкинской лимфомы.
Экспрессия BCMA также ассоциирована с макроглобулинемией Вальденстрема (WM), также известной как лимфоплазмоцитарная лимфома (LPL). (См. Elsawa et al., Blood. 2006, 107(7):2882-8). Макроглобулинемию Вальденстрема ранее считали относящейся к множественной миеломе, но в последнее время ее классифицируют как подтип неходжкинской лимфомы. WM отличается неконтролируемой пролиферацией B-клеток, приводящей к анемии и продукции избыточных количеств парапротеина или иммуноглобулина M (IgM), что повышает вязкость крови и приводит к синдрому повышенной вязкости крови. Другие симптомы или признаки WM включают высокую температуру, ночную потливость, утомляемость, анемию, потерю веса, лимфаденопатию или спленомегалию, нечеткое зрение, головокружение, носовое кровотечение, кровоточивость десен, необычные кровоподтеки, почечные нарушения или недостаточность, амилоидоз или периферическую невропатию.
Стандартное лечение WM состоит из химиотерапии, в частности, с использованием ритуксимаба (Rituxan®). Можно использовать другие химиотерапевтические лекарственные средства в комбинации, такие как хлорамбуцил (Leukeran®), циклофосфамид (Neosar®), флударабин (Fludara®), кладрибин (Leustatin®), винкристин и/или талидомид. Кортикостероиды, такие как преднизон, также можно вводить в комбинации с химиотерапией. Плазмаферез, или замещение плазмы, является общеупотребительным на всем протяжении лечения пациента для облегчения некоторых симптомов посредством удаления парапротеина из крови. В некоторых случаях трансплантация стволовых клеток является вариантом для некоторых пациентов.
Другим примером заболевания или нарушения, ассоциированного с BCMA, является злокачественное новообразование головного мозга. В частности, экспрессия BCMA ассоциирована с астроцитомой или глиобластомой (см. Deshayes et al, Oncogene. 2004, 23(17):3005-12, Pelekanou et al., PLoS One. 2013, 8(12):e83250). Астроцитомы являются опухолями, возникающими из астроцитов, являющихся типом глиальных клеток в головном мозге. Глиобластома (также известная как мультиформная глиобластома или GBM) является наиболее злокачественной формой астроцитомы, и ее считают наиболее поздней стадией злокачественного новообразования головного мозга (стадией IV). Существует два варианта глиобластомы: гигантоклеточная глиобластома и глиосаркома. Другие астроцитомы включают ювенильную пилоцитарную астроцитому (JPA), фибриллярную астроцитому, плеоморфную ксантоастроцитому (PXA), дизэмбриопластическую нейроэпителиальную опухоль (DNET) и анапластическую астроцитому (AA).
Симптомы или признаки, ассоциированные с глиобластомой или астроцитомой, включают повышенное давление в головном мозге, головные боли, судороги, утрату памяти, изменения поведения, утрату движения или ощущений на одной стороне тела, языковую дисфункцию, когнитивные нарушения, нарушения зрения, тошноту, рвоту и слабость в руках или ногах.
Хирургическое удаление опухоли (или резекция) является стандартным лечением для удаления настолько большого объема глиомы, насколько возможно без повреждения или с минимальным повреждением нормальной окружающей ткани головного мозга. Лучевую терапию и/или химиотерапию часто используют после хирургической операции для супрессии и медленного рецидивирования заболевания из каких-либо оставшихся злокачественных клеток или сопутствующих повреждений. Лучевая терапия включает лучевую терапию всего головного мозга (общепринятую наружную дистанционную лучевую терапию), направленную трехмерную конформную лучевую терапию и направленные радионуклиды. Химиотерапевтические средства, общеупотребительные для лечения глиобластомы, включают темозоломид, гефитиниб или эрлотиниб и цисплатин. Ингибиторы ангиогенеза, такие как бевацизумаб (Avastin®), также общеупотребительны в комбинации с химиотерапией и/или лучевой терапией.
Поддерживающее лечение также часто используют для облегчения неврологических симптомов и улучшения неврологической функции, и его вводят в комбинации с любым из способов терапии злокачественного новообразования, представленных в настоящем описании. Первичные поддерживающие средства включают антиконвульсанты и кортикостероиды. Таким образом, композиции и способы по настоящему изобретению можно использовать в комбинации с любым из стандартных или поддерживающих способов лечения для лечения глиобластомы или астроцитомы.
Несвязанные со злокачественным новообразованием заболевания и нарушения, ассоциированные с экспрессией BCMA, также можно лечить композициями и способами, представленными в настоящем описании. Неограничивающие примеры несвязанных со злокачественным новообразованием заболеваний и нарушений, ассоциированных с экспрессией BCMA, включают: вирусные инфекции, например, ВИЧ, грибковые инфекции, например, C. neoformans, синдром раздраженного кишечника, язвенный колит и нарушения, связанные с иммунными свойствами слизистых оболочек.
CAR-модифицированные иммунные эффекторные клетки (например, T-клетки или NK-клетки) по настоящему изобретению можно вводить в отдельности или в виде фармацевтической композиции в комбинации с дилюентами и/или другими компонентами, такими как ИЛ-2, или другие цитокины, или популяции клеток.
Настоящее изобретение относится к композициям и способам для лечения злокачественного новообразования. В одном из аспектов злокачественное новообразование является гемобластозом, включая, в качестве неограничивающих примеров, гемобластоз, являющийся лейкозом или лимфомой. В одном из аспектов можно использовать CAR-экспрессирующие клетки (например, CART-клетки или CAR-экспрессирующие NK-клетки) по изобретению для лечения злокачественных новообразований, в качестве неограничивающих примеров, таких как, например, острые лейкозы, включая, в качестве неограничивающих примеров, например, острый B-клеточный лимфоидный лейкоз ("BALL"), острый T-клеточный лимфоидный лейкоз ("TALL"), острый лимфоидный лейкоз (ALL), один или более хронических лейкозов, включая, в качестве неограничивающих примеров, например, хронический миелогенный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL), дополнительные гемобластозы или гематологические состояния, включая, в качестве неограничивающих примеров, например, B-клеточный пролимфоцитарный лейкоз, неоплазию из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, MALT-лимфому, лимфому из клеток мантийной зоны, лимфому из клеток маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, плазмобластную лимфому, неоплазию из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", представляющий собой широкий спектр гематологических состояний, объединенных неэффективной продукцией (или дисплазией) миелоидных клеток крови, и т.п. Дополнительные заболевания, ассоциированные с экспрессией BCMA, включают, в качестве неограничивающих примеров, например, атипичные и/или неклассические злокачественные новообразования, злокачественные новообразования, предраковые состояния или пролиферативные заболевания с экспрессией BCMA.
В вариантах осуществления композицию, представленную в настоящем описании, можно использовать для лечения заболевания, включая, в качестве неограничивающих примеров, пролиферативное нарушение из плазматических клеток, например, бессимптомную миелому (вялотекущую множественную миелому или индолентную миелому), моноклональную гаммапатию неустановленной этиологии (MGUS), макроглобулинемию Вальденстрема, плазмоцитомы (например, плазмоклеточную дискразию, солитарную миелому, солитарную плазмоцитому, экстрамедуллярную плазмоцитому, и множественную плазмоцитому), системный амилоидоз легких цепей и POEMS-синдром (также известный как синдром Кроу-Фуказа, болезнь Такацуки и PEP-синдром).
В вариантах осуществления композицию, представленную в настоящем описании, можно использовать для лечения заболевания, включая, в качестве неограничивающих примеров, злокачественное новообразование, например, злокачественное новообразование, представленное в настоящем описании, например, рак предстательной железы (например, кастрационно-резистентный или резистентный к терапии рак предстательной железы или метастазирующий рак предстательной железы), рак поджелудочной железы или рак легких.
Настоящее изобретение также относится к способам ингибирования пролиферации или снижения популяции BCMA-экспрессирующих клеток, способам, включающим приведение популяции клеток, содержащих BMCA-экспрессирующие клетки, в контакт с клеткой, экспрессирующей CAR против BCMA (например, BCMA CART-клеткой или CAR BCMA-экспрессирующей NK-клеткой), по изобретению, связывающиеся с BCMA-экспрессирующей клеткой. В конкретном аспекте настоящее изобретение относится к способам ингибирования пролиферации или снижения популяции злокачественных клеток, экспрессирующих BCMA, способам, включающим приведение популяции BCMA-экспрессирующих злокачественных клеток в контакт с клеткой, экспрессирующей CAR против BCMA (например, BCMA CART-клеткой или CAR BCMA-экспрессирующей NK-клеткой) по изобретению, связывающейся с BCMA-экспрессирующей клеткой. В одном из аспектов настоящее изобретение относится к способам ингибирования пролиферации или снижения популяции злокачественных клеток, экспрессирующих BCMA, способам, включающим приведение популяции BCMA-экспрессирующих злокачественных клеток в контакт с клеткой, экспрессирующей CAR против BCMA (например, BCMA CART-клеткой или CAR BCMA-экспрессирующей NK-клеткой) по изобретению, связывающейся с BCMA-экспрессирующей клеткой. В определенных аспектах клетка, экспрессирующая CAR против BCMA (например, BCMA CART-клетка или CAR BCMA-экспрессирующая NK-клетка) по изобретению снижает количество или процентную долю клеток и/или злокачественных клеток по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95% или по меньшей мере на 99% у индивидуума с миелолейкозом или другим злокачественным новообразованием, ассоциированным с BCMA-экспрессирующими клетками, или модели миелолейкоза или другого злокачественного новообразования, ассоциированного с BCMA-экспрессирующими клетками, на животных относительно отрицательного контроля. В одном из аспектов индивидуум является человеком.
Настоящее изобретение также относится к способам профилактики, лечения и/или контроля заболевания, ассоциированного с BCMA-экспрессирующими клетками (например, гемобластоза или атипичного злокачественного новообразования с экспрессией BCMA), способам, включающим введение нуждающемуся в этом индивидууму клетки, экспрессирующей CAR против BCMA (например, BCMA CART-клетки или CAR BCMA-экспрессирующей NK-клетки) по изобретению, связывающейся с BCMA-экспрессирующей клеткой. В одном из аспектов индивидуум является человеком. Неограничивающие примеры нарушений, ассоциированных с BCMA-экспрессирующими клетками, включают вирусные или грибковые инфекции и нарушения, связанные с иммунными свойствами слизистых оболочек.
Настоящее изобретение также относится к способам профилактики, лечения и/или контроля заболевания, ассоциированного с BCMA-экспрессирующими клетками, способам, включающим введение нуждающемуся в этом индивидууму клетки, экспрессирующей CAR против BCMA (например, BCMA CART-клетки или CAR BCMA-экспрессирующей NK-клетки) по изобретению, связывающейся с BCMA-экспрессирующей клеткой. В одном из аспектов индивидуум является человеком.
Настоящее изобретение относится к способам профилактики рецидива злокачественного новообразования, ассоциированного с BCMA-экспрессирующими клетками, способам, включающим введение нуждающемуся в этом индивидууму клетки, экспрессирующей CAR против BCMA (например, BCMA CART-клетки или CAR BCMA-экспрессирующей NK-клетки) по изобретению, связывающейся с BCMA-экспрессирующей клеткой. В одном из аспектов способы включают введение нуждающемуся в этом индивидууму эффективного количества клетки, экспрессирующей CAR против BCMA (например, BCMA CART-клетки или CAR BCMA-экспрессирующей NK-клетки), представленной в настоящем описании, связывающейся с BCMA-экспрессирующей клеткой, в комбинации с эффективным количеством другого терапевтического средства.
Способы комбинированного лечения
CAR-экспрессирующую клетку, представленную в настоящем описании, можно использовать в комбинации с другими известными средствами и терапевтическими средствами. Как применяют в настоящем описании, введение "в комбинации" означает, что два (или более) различных терапевтических средства вводят индивидууму в течение периода, в течение которого индивидуум страдает нарушением, например, два или более терапевтических средства вводят после диагностирования нарушения у индивидуума и до излечения или устранения нарушения или прекращения лечения по другим причинам. В некоторых вариантах осуществления введение одного терапевтического средства все еще осуществляют, когда начинают введение второго терапевтического средства, таким образом, что существует перекрывание в терминах введения. В настоящем описании иногда ссылаются на "одновременную доставку". В других вариантах осуществления введение одного терапевтического средства заканчивают до начала введения другого терапевтического средства. В некоторых вариантах осуществления каждого случая лечение является более эффективным по причине комбинированного введения. Например, второе лечение является более эффективным, например, наблюдают эквивалентный эффект при меньшем втором лечении, или второе лечение снижает симптомы в большей степени, чем наблюдали бы в случае, если второе лечение проводят в отсутствие первого лечения, или аналогичную ситуацию наблюдают при первом лечении. В некоторых вариантах осуществления введение осуществляют таким образом, что снижение симптома или другого параметра, связанного с нарушением, является большим, чем наблюдали бы при одном лечении, осуществляемом в отсутствие другого. Эффект двух терапевтических средств может являться частично аддитивным, полностью аддитивным или более чем аддитивным. Введение можно осуществлять таким образом, что эффект первого осуществляемого лечения все еще является определяемым, когда проводят второе лечение.
CAR-экспрессирующую клетку, представленную в настоящем описании, и по меньшей мере одно дополнительное терапевтическое средство можно вводить одновременно в одной или отдельных композициях или последовательно. В случае последовательного введения CAR-экспрессирующую клетку, представленную в настоящем описании, можно вводить первой и дополнительное средство можно вводить вторым, или порядок введения может быть обратным.
Терапию CAR и/или другие терапевтические средства или способы можно проводить в течение периодов активного нарушения или в течение периода ремиссии или менее активного заболевания. Терапию CAR можно проводить перед другим лечением, одновременно с лечением, после лечения или в течение ремиссии нарушения.
При введении в комбинации терапевтическое средство CAR и дополнительное средство (например, второе или третье средство) или все из них можно вводить в количестве или дозе, более высокой, более низкой или той же, что и количество или доза каждого средства, используемого в отдельности, например, в качестве монотерапии. В определенных вариантах осуществления вводимое количество или доза терапевтического средства CAR, дополнительного средства (например, второго или третьего средства) или всех из них является более низкой (например, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40% или по меньшей мере 50%), чем количество или доза каждого средства, используемого в отдельности, например, в качестве монотерапии. В других вариантах осуществления количество или доза терапевтического средства CAR, дополнительного средства (например, второго или третьего средства) или всех из них, приводящая к желаемому эффекту (например, лечению злокачественного новообразования), является более низкой (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% более низкой), чем количество или доза каждого средства, используемого в отдельности, например, в качестве монотерапии, необходимая для достижения того же терапевтического эффекта.
В дополнительных аспектах CAR-экспрессирующую клетку, представленную в настоящем описании, можно использовать в схеме лечения в комбинации с хирургическим лечением, химиотерапией, лучевой терапией, иммуносупрессирующими средствами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антитела или другие иммуноабляционные средства, такие как CAMPATH, антитела против CD3 или другие терапевтические средства на основе антител, цитоксин, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228, цитокины и лучевая терапия. Пептидная вакцина, такая как описываемая в Izumoto et al. 2008 J Neurosurg 108:963-971.
В конкретных случаях соединения по настоящему изобретению комбинируют с другими терапевтическими средствами, такими как другие противораковые средства, противоаллергические средства, противорвотные средства (или антиэметики), анальгетики цитопротекторы и их комбинации.
В одном из вариантов осуществления первую CAR-экспрессирующую клетку, представленную в настоящем описании, например, CAR BCMA-экспрессирующую клетку, представленную в настоящем описании, можно использовать в комбинации со второй CAR-экспрессирующей клеткой. В одном из вариантов осуществления вторая CAR-экспрессирующая клетка экспрессирует CAR, содержащий другой связывающий домен против BMCA, например, связывающий домен против BCMA, представленный в настоящем описании, отличающийся от связывающего домена против BCMA в CAR, экспрессируемом первой CAR-экспрессирующей клеткой. В одном из вариантов осуществления вторая CAR-экспрессирующая клетка экспрессирует CAR, содержащий антигенсвязывающий домен против антигена, иного, чем BCMA (например, CD19, CD20, CS-1, легкая каппа-цепь, CD139, антиген Ley или CD38). В одном из вариантов осуществления первую CAR-экспрессирующую клетку, представленную в настоящем описании, например, CAR BCMA-экспрессирующую клетку, представленную в настоящем описании, используют в комбинации со второй CAR-экспрессирующей клеткой, содержащей CAR CD19. В одном из вариантов осуществления CAR BCMA-экспрессирующую клетку, представленную в настоящем описании, используют в комбинации с CAR CD19-экспрессирующей клеткой для лечения BCMA-ассоциированного злокачественного новообразования, представленного в настоящем описании, например, множественной миеломы. В некоторых вариантах осуществления множественная миелома является CD19-отрицательной, например, имеющей подавляющее большинство (например, по меньшей мере, 98%, 99%, 99,5%, 99,9% или 99,95%) неопластических плазматических клеток с CD19-отрицательным фенотипом, например, как определяют посредством проточной цитометрии, RT-ПЦР или и того, и другого. Как показано в примере 17 в настоящем описании, CAR CD19 может быть эффективным даже против CD19-отрицательной множественной миеломы. Не желая быть связанными какой-либо теорией, полагают, что CAR CD19 может действовать на небольшую, но важную CD19-положительную популяцию неопластических клеток, направленно воздействуя на клетку, экспрессирующую уровни CD19, находящиеся ниже порога чувствительности анализов, представленных в настоящем описании, или направленно воздействуя на ненеопластическую клетку, поддерживающую неопластические клетки. В вариантах осуществления CAR CD19 может приводить к удалению B-клеток, например, регуляторных B-клеток.
Например, в одном из вариантов осуществления первую CAR-экспрессирующую клетку, представленную в настоящем описании, например, CAR BCMA-экспрессирующую клетку, и вторую CAR-экспрессирующую клетку, представленную в настоящем описании, например, CAR CD19-экспрессирующую клетку, получают в одной композиции и вводят одновременно. В другом варианте осуществления первую CAR-экспрессирующую клетку, представленную в настоящем описании, например, CAR BCMA-экспрессирующую клетку, и вторую CAR-экспрессирующую клетку, представленную в настоящем описании, например, CAR CD19-экспрессирующую клетку, получают в отдельных композициях и отдельные композиции вводят одновременно или последовательно. Если CAR BCMA-экспрессирующую клетку и вторую CAR-экспрессирующую клетку получают в отдельных композициях, CAR BCMA-экспрессирующую клетку можно вводить первой, а вторую CAR-экспрессирующую клетку можно вводить второй, или порядок введения может быть обратным.
В одном из вариантов осуществления CAR CD19 является CAR CD19, например, гуманизированным CAR CD19, описываемым в WO2014/153270, зарегистрированной 15 марта 2014 года (включенной в настоящее описание в качестве ссылки в полном объеме) или последовательностью, по меньшей мере на 95%, например, 95-99%, идентичной ей. В некоторых вариантах осуществления конструкция CAR CD19 является конструкцией CAR19, представленной в публикации PCT WO2012/079000 (включенной в настоящее описание в качестве ссылки в полном объеме), или последовательностью, по меньшей мере на 95%, например, 95-99%, идентичной ей. В одном из вариантов осуществления связывающий домен против CD19 является scFv, описываемым в WO2012/079000, или последовательностью, по меньшей мере на 95%, например, 95-99%, идентичной ей.
В вариантах осуществления первую CAR-экспрессирующую клетку вводят индивидууму и вторую CAR-экспрессирующую клетку вводят индивидууму. В вариантах осуществления первая CAR-экспрессирующая клетка содержит CAR (например, CAR BCMA или CD19), содержащий костимуляторный домен CD27 и первичный сигнальный домен CD3 дзета (мутантный или дикого типа). В вариантах осуществления вторая CAR-экспрессирующая клетка содержит CAR (например, CAR BCMA), содержащий костимуляторный домен 4-1BB и первичный сигнальный домен CD3 дзета (мутантный или дикого типа). Не желая быть связанными какой-либо теорией, полагают, что в вариантах осуществления первая CAR-экспрессирующая клетка может быть менее токсичной, чем вторая CAR-экспрессирующая клетка, и ее можно использовать для уменьшения объема опухоли.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, можно использовать в комбинации с химиотерапевтическим средством. Примеры химиотерапевтических средств включают антрациклин (например, доксорубицин (например, липосомальный доксорубицин)), алкалоид барвинка (например, винбластин, винкристин, виндезин, винорелбин), алкилирующее средство (например, циклофосфамид, декарбазин, мелфалан, ифосфамид, темозоломид), антитело для иммунных клеток (например, алемтузумаб, гемтузумаб, ритуксимаб, тозитумомаб), антиметаболит (включая, например, антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндезаминазы (например, флударабин)), ингибитор mTOR, агонист глюкокортикоид-индуцированного TNFR-родственного белка (GITR), ингибитор протеасом (например, аклациномицин A, глиотоксин или бортезомиб), иммуномодулятор, такой как талидомид или производное талидомида (например, леналидомид).
Общие химиотерапевтические средства, предлагаемые для применения в способах комбинированного лечения, включают анастрозол (Arimidex®), бикалутамид (Casodex®), блеомицин сульфат (Blenoxane®), бусульфан (Myleran®), инъекцию бусульфана (Busulfex®), капецитабин (Xeloda®), N4-пентоксикарбонил-5-дезокси-5-фторцитидин, карбоплатин (Paraplatin®), кармустин (BiCNU®), хлорамбуцил (Leukeran®), цисплатин (Platinol®), кладрибин (Leustatin®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозинарабинозид (Cytosar-U®), инъекцию липосомального цитарабина (DepoCyt®), дакарбазин (DTIC-Dome®), дактиномицин (Актиномицин D, космеген), даунорубицина гидрохлорид (Cerubidine®), инъекцию липосомального даунорубицина цитрата (DaunoXome®), дексаметазон, доцетаксел (Taxotere®), доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), 5-фторурацил (Adrucil®, Efudex®), флутамид (Eulexin®), тезацитибин, гемцитабин (дифтородезоксицитидин), гидроксимочевину (Hydrea®), идарубицин (Idamycin®), ифосфамид (IFEX®), иринотекан (Camptosar®), L-аспарагиназу (ELSPAR®), лейковорин кальций, мелфалан (Alkeran®), 6-меркаптопурин (Purinethol®), метотрексат (Folex®), митоксантрон (Novantrone®), милотарг, паклитаксел (Taxol®), Phoenix (иттрий-90/MX-DTPA), пентостатин, полифепросан 20 с имплантатом кармустина (Gliadel®), тамоксифена цитрат (Nolvadex®), тенипозид (Vumon®), 6-тиогуанин, тиотепа, тирапазамин (Tirazone®), топотекана гидрохлорид для инъекции (Hycamptin®), винбластин (Velban®), винкристин (Oncovin®) и винорелбин (Navelbine®).
Особенно интересующие противораковые средства для комбинаций с соединениями по настоящему изобретению включают: антрациклины, алкилирующие средства, антиметаболиты, лекарственные средства, ингибирующие кальций-зависимую фосфатазу кальциневрин или p70S6 киназа FK506) или ингибирующие киназу p70S6, ингибиторы mTOR, иммуномодуляторы, антрациклины, алкалоиды барвинка, ингибиторы протеасом, агонисты GITR, ингибиторы протеинтирозинфосфатаз, ингибитор киназы CDK4, ингибитор BTK, ингибитор киназы MKN, ингибитор киназы DGK или онколитический вирус.
Неограничивающие примеры алкилирующих средств включают азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены): урамустин (Aminouracil Mustard®, Chlorethaminacil®, Demethyldopan®, Desmethyldopan®, Haemanthamine®, Nordopan®, Uracil nitrogen mustard®, Uracillost®, Uracilmostaza®, Uramustin®, Uramustine®), хлорметин (Mustargen®), циклофосфамид (Cytoxan®, Neosar®, Clafen®, Endoxan®, Procytox®, RevimmuneTM), ифосфамид (Mitoxana®), мелфалан (Alkeran®), хлорамбуцил (Leukeran®), пипоброман (Amedel®, Vercyte®), триэтиленмеламин (Hemel®, Hexalen®, Hexastat®), триэтилентиофосфоамин, темозоломид (Temodar®), тиотепа (Thioplex®), бусульфан (Busilvex®, Myleran®), кармустин (BiCNU®), ломустин (CeeNU®), стрептозоцин (Zanosar®) и дакарбазин (DTIC-Dome®). Дополнительные неограничивающие примеры алкилирующих средств включают оксалиплатин (Eloxatin®), темозоломид (Temodar® и Temodal®), дактиномицин (также известный как актиномицин-D, Cosmegen®), мелфалан (также известный как L-PAM, L-сарколизин, Alkeran®), алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®), кармустин (BiCNU®), бендамустин (Treanda®), бусульфан (Busulfex® и Myleran®), карбоплатин (Paraplatin®), ломустин (также известный как CCNU, CeeNU®), цисплатин (также известный как CDDP, Platinol® и Platinol®-AQ), хлорамбуцил (Leukeran®), циклофосфамид (Cytoxan® и Neosar®), дакарбазин (также известный как DTIC, DIC и имидазол карбоксамид, DTIC-Dome®), алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®), ифосфамид (Ifex®), преднимустин, прокарбазин (Matulane®), мехлоретамин (также известный как азотистый иприт, мустин и мехлоретамин гидрохлорид, Mustargen®), стрептозоцин (Zanosar®), тиотепа (также известный как тиофосфоамид, TESPA и TSPA, Thioplex®), циклофосфамид (Endoxan®, Cytoxan®, Neosar®, Procytox®, Revimmune®) и бендамустин HCl (Treanda®).
Примеры ингибиторов mTOR включают темсиролимус, ридафоролимус (ранее известный как деферолимус, (1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23, 29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфинат, также известный как AP23573 и MK8669, и описываемый в публикации PCT № WO03/064383), эверолимус (Afinitor® или RAD001), рапамицин (AY22989, Sirolimus®), симапимод (CAS 164301-51-3), эмсиролимус, (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанол (AZD8055), 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-он (PF04691502, CAS 1013101-36-4) и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолин-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серин-(SEQ ID NO: 383), внутренняя соль (SF1126, CAS 936487-67-1) и XL765.
Примеры иммуномодуляторов включают афутузумаб (доступный в Roche®), пэгфилграстим (Neulasta®), леналидомид (CC-5013, Revlimid®), талидомид (Thalomid®), актимид (CC4047) и IRX-2 (смесь цитокинов человека, включая интерлейкин 1, интерлейкин 2 и интерферон γ, CAS 951209-71-5, доступная в IRX Therapeutics).
Примеры антрациклинов включают доксорубицин (Adriamycin® и Rubex®), блеомицин (lenoxane®), даунорубицин (даунорубицина гидрохлорид, дауномицин и рубидомицина гидрохлорид, Cerubidine®), липосомальный даунорубицин (липосомальный даунорубицина цитрат, DaunoXome®), митоксантрон (DHAD, Novantrone®), эпирубицин (Ellence™), идарубицин (Idamycin®, Idamycin PFS®), митомицин C (Mutamycin®), гелданамицин, гербимицин, равидомицин и дезацетилравидомицин.
Примеры алкалоидов барвинка включают винорелбина тартрат (Navelbine®), винкристин (Oncovin®) и виндезин (Eldisine®)), винбластин (также известный как винбластина сульфат, винкалейкобластин и VLB, Alkaban-AQ® и Velban®) и винорелбин (Navelbine®).
Примеры ингибиторов протеасом включают бортезомиб (Velcade®), карфилзомиб (PX-171-007, (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилоксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3-фенилпропан-2-ил)-2-((S)-2-(2-морфолиноацетамидо)-4-фенилбутанамидо)-пентанамид), маризомиб (NPI-0052), иксазомиб цитрат (MLN-9708), деланзомиб (CEP-18770) и O-метил-N-[(2-метил-5-тиазолил)карбонил]-L-серил-O-метил-N-[(1S)-2-[(2R)-2-метил-2-оксиранил]-2-оксо-1-(фенилметил)этил]-L-серинамид (ONX-0912).
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с флударабином циклофосфамидом и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с флударабином, циклофосфамидом и ритуксимабом (FCR). В вариантах осуществления индивидуум имеет CLL. Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления индивидуум содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления индивидуум не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления флударабин вводят в дозе приблизительно 10-50 мг/м2 (например, приблизительно 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 мг/м2), например, внутривенно. В вариантах осуществления циклофосфамид вводят в дозе приблизительно 200-300 мг/м2 (например, приблизительно 200-225, 225-250, 250-275 или 275-300 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с бендамустином и ритуксимабом. В вариантах осуществления индивидуум имеет CLL. Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления индивидуум содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления индивидуум не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления бендамустин вводят в дозе приблизительно 70-110 мг/м2 (например, 70-80, 80-90, 90-100 или 100-110 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и/или кортикостероидом (например, преднизоном). В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP). В вариантах осуществления индивидуум имеет диффузную крупноклеточную B-клеточную лимфому (DLBCL). В вариантах осуществления индивидуум имеет негенерализованную DLBCL локализованной стадии (например, содержит опухоль, имеющую размер/диаметр менее 7 см). В вариантах осуществления индивидуума лечат с помощью лучевой терапии в комбинации с R-CHOP. Например, индивидууму вводят R-CHOP (например, 1-6 циклов, например, 1, 2, 3, 4, 5 или 6 циклов R-CHOP) с последующей лучевой терапией. В некоторых случаях индивидууму вводят R-CHOP (например, 1-6 циклов, например, 1, 2, 3, 4, 5 или 6 циклов R-CHOP) после лучевой терапии.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и ритуксимабом (EPOCH-R). В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с EPOCH-R с индивидуальным подбором дозы (DA-EPOCH-R). В вариантах осуществления индивидуум имеет B-клеточную лимфому, например, агрессивную B-клеточную лимфому с реаранжировкой Myc.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом и/или леналидомидом. Леналидомид ((RS)-3-(4-амино-1-оксо-1,3-дигидро-2H-изоиндол-2-ил)пиперидин-2,6-дион) является иммуномодулятором. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом и леналидомидом. В вариантах осуществления индивидуум имеет фолликулярную лимфому (FL) или лимфому из клеток мантийной зоны (MCL). В вариантах осуществления индивидуум имеет FL, и его ранее не лечили с помощью противораковой терапии. В вариантах осуществления леналидомид вводят в дозе приблизительно 10-20 мг (например, 10-15 или 15-20 мг), например, ежедневно. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с брентуксимабом. Брентуксимаб является конъюгатом антитело-лекарственное средство антитела против CD30 и монометилауристатина E. В вариантах осуществления индивидуум имеет лимфому Ходжкина (HL), например, рецидивирующую или рефрактерную HL. В вариантах осуществления индивидуум имеет CD30+ HL. В вариантах осуществления индивидуума подвергали аутологичной трансплантации стволовых клеток (ASCT). В вариантах осуществления индивидуума не подвергали ASCT. В вариантах осуществления брентуксимаб вводят в дозе приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с брентуксимабом и дакарбазином или в комбинации с брентуксимабом и бендамустином. Дакарбазин является алкилирующим средством с химическим названием 5-(3,3-диметил-1-триазенил)имидазол-4-карбоксамид. Бендамустин является алкилирующим средством с химическим названием 4-[5-[бис(2-хлорэтил)амино]-1-метилбензимидазол-2-ил]бутановая кислота. В вариантах осуществления индивидуум имеет лимфому Ходжкина (HL). В вариантах осуществления индивидуума ранее не подвергали противораковой терапии. В вариантах осуществления возраст индивидуума составляет по меньшей мере 60 лет, например, 60, 65, 70, 75, 80, 85 или более. В вариантах осуществления дакарбазин вводят в дозе приблизительно 300-450 мг/м2 (например, приблизительно 300-325, 325-350, 350-375, 375-400, 400-425 или 425-450 мг/м2), например, внутривенно. В вариантах осуществления бендамустин вводят в дозе приблизительно 75-125 мг/м2 (например, 75-100 или 100-125 мг/м2, например, приблизительно 90 мг/м2), например, внутривенно. В вариантах осуществления брентуксимаб вводят в дозе приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
В некоторых вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором CD20, например, антителом против CD20 (например, моно- или биспецифическим антителом против CD20) или его фрагментом. Неограничивающие примеры антител против CD20 включают ритуксимаб, офатумумаб, окрелизумаб, велтузумаб, обинутузумаб, TRU-015 (Trubion Pharmaceuticals), окаратузумаб и Pro131921 (Genentech). См., например, Lim et al. Haematologica. 95,1(2010):135-43.
В некоторых вариантах осуществления антитело против CD20 содержит ритуксимаб. Ритуксимаб является химерным моноклональным антителом IgG1 каппа мыши/человека, связывающимся с CD20 и вызывающим цитолиз CD20-экспрессирующей клетки, например, как описано в www.accessdata.fda.gov/drugsatfda_docs/label/2010/103705s5311lbl.pdf. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом. В вариантах осуществления индивидуум имеет CLL или SLL.
В некоторых вариантах осуществления ритуксимаб вводят внутривенно, например, в виде внутривенной инфузии. Например, каждая инфузия включает приблизительно 500-2000 мг (например, приблизительно 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1100, 1100-1200, 1200-1300, 1300-1400, 1400-1500, 1500-1600, 1600-1700, 1700-1800, 1800-1900 или 1900-2000 мг) ритуксимаба. В некоторых вариантах осуществления ритуксимаб вводят в дозе от 150 мг/м2 до 750 мг/м2, например, приблизительно 150-175 мг/м2, 175-200 мг/м2, 200-225 мг/м2, 225-250 мг/м2, 250-300 мг/м2, 300-325 мг/м2, 325-350 мг/м2, 350-375 мг/м2, 375-400 мг/м2, 400-425 мг/м2, 425-450 мг/м2, 450-475 мг/м2, 475-500 мг/м2, 500-525 мг/м2, 525-550 мг/м2, 550-575 мг/м2, 575-600 мг/м2, 600-625 мг/м2, 625-650 мг/м2, 650-675 мг/м2 или 675-700 мг/м2, где м2 соответствует площади поверхности тела индивидуума. В некоторых вариантах осуществления ритуксимаб вводят с интервалом введения по меньшей мере 4 дня, например, 4, 7, 14, 21, 28, 35 дней или более. Например, ритуксимаб вводят с интервалом введения по меньшей мере 0,5 недели, например, 0,5, 1, 2, 3, 4, 5, 6, 7, 8 недель или более. В некоторых вариантах осуществления ритуксимаб вводят в дозе и с интервалом введения, представленным в настоящем описании, в течение периода времени, например, по меньшей мере, 2 недели, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 недель или более. Например, ритуксимаб вводят в дозе и с интервалом введения, представленным в настоящем описании, всего в течение по меньшей мере 4 доз на цикл лечения (например, по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или более доз на цикл лечения).
В некоторых вариантах осуществления антитело против CD20 содержит офатумумаб. Офатумумаб является моноклональным антителом IgG1κ человека против CD20 с молекулярной массой приблизительно 149 кДа. Например, офатумумаб получают с использованием трансгенной мыши и гибридомной технологии и экспрессируют и выделяют из линии рекомбинантных клеток мыши (NS0). См., например, www.accessdata.fda.gov/drugsatfda_docs/label/2009/125326lbl.pdf и в описаниях клинических испытаний под идентификационными номерами NCT01363128, NCT01515176, NCT01626352 и NCT01397591. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с офатумумабом. В вариантах осуществления индивидуум имеет CLL или SLL.
В некоторых вариантах осуществления офатумумаб вводят в виде внутривенной инфузии. Например, каждая инфузия включает приблизительно 150-3000 мг (например, приблизительно 150-200, 200-250, 250-300, 300-350, 350-400, 400-450, 450-500, 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1200, 1200-1400, 1400-1600, 1600-1800, 1800-2000, 2000-2200, 2200-2400, 2400-2600, 2600-2800 или 2800-3000 мг) офатумумаба. В вариантах осуществления офатумумаб вводят в исходной дозе приблизительно 300 мг, с последующей дозой 2000 мг, например, приблизительно 11 доз, например, в течение 24 недель. В некоторых вариантах осуществления офатумумаб вводят с интервалом введения по меньшей мере 4 дня, например, 4, 7, 14, 21, 28, 35 дня или более. Например, офатумумаб вводят с интервалом введения по меньшей мере 1 неделя, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 26, 28, 20, 22, 24, 26, 28, 30 недель или более. В некоторых вариантах осуществления офатумумаб вводят в дозе и с интервалом введения, представленным в настоящем описании, в течение периода времени, например, по меньшей мере 1 неделя, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 40, 50, 60 недель или более, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более или 1, 2, 3, 4, 5 лет или более. Например, офатумумаб вводят в дозе и с интервалом введения, представленным в настоящем описании, всего для по меньшей мере 2 доз на цикл лечения (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 20 или более доз на цикл лечения).
В некоторых случаях, антитело против CD20 содержит окрелизумаб. Окрелизумаб является гуманизированным моноклональным антителом против CD20, например, как описано в описаниях клинических испытаний под идентификационными номерами NCT00077870, NCT01412333, NCT00779220, NCT00673920, NCT01194570 и Kappos et al. Lancet. 19,378(2011):1779-87.
В некоторых случаях антитело против CD20 содержит велтузумаб. Велтузумаб является гуманизированным моноклональным антителом против CD20. См., например, описания клинических испытаний под идентификационными номерами NCT00547066, NCT00546793, NCT01101581 и Goldenberg et al. Leuk Lymphoma. 51(5)(2010):747-55.
В некоторых случаях антитело против CD20 содержит GA101. GA101 (также называемое обинутузумабом или RO5072759) является гуманизированным и глико-сконструированным моноклональным антителом против CD20. См., например, Robak. Curr. Opin. Investig. Drugs. 10,6(2009):588-96, описания клинических испытаний под идентификационными номерами: NCT01995669, NCT01889797, NCT02229422 и NCT01414205 и www.accessdata.fda.gov/drugsatfda_docs/label/2013/125486s000lbl.pdf.
В некоторых случаях антитело против CD20 содержит AME-133v. AME-133v (также называемое LY2469298 или окаратузумабом) является гуманизированным моноклональным антителом IgG1 против CD20 с повышенной аффинностью к рецептору FcγRIIIa и повышенной активностью антителозависимой клеточной цитотоксичности (ADCC) по сравнению с ритуксимабом. См., например, Robak et al. BioDrugs 25,1(2011):13-25 и Forero-Torres et al. Clin Cancer Res. 18,5(2012):1395-403.
В некоторых случаях антитело против CD20 содержит PRO131921. PRO131921 является гуманизированным моноклональным антителом против CD20, сконструированным так, чтобы оно имело лучшее связывание с FcγRIIIa и повышенную ADCC по сравнению с ритуксимабом. См., например, Robak et al. BioDrugs 25,1(2011):13-25 и Casulo et al. Clin Immunol. 154,1(2014):37-46 и описание клинических испытаний под идентификационным номером NCT00452127.
В некоторых случаях антитело против CD20 содержит TRU-015. TRU-015 является слитым белком против CD20, полученным из доменов антитела против CD20. TRU-015 меньше моноклональных антител, но сохраняет Fc-опосредованные эффекторные функции. См., например, Robak et al. BioDrugs 25,1(2011):13-25. TRU-015 содержит одноцепочечный вариабельный фрагмент против CD20 (scFv), связанный с шарнирной областью IgG1 человека, доменами CH2 и CH3, но без доменов CH1 и CL.
В некоторых вариантах осуществления антитело против CD20, представленное в настоящем описании, конъюгируют или иным образом связывают с терапевтическим средством, например, химиотерапевтическим средством (например, цитоксаном, флударабином, ингибитором гистондеацетилазы, деметилирующим средством, пептидной вакциной, противоопухолевым антибиотиком, ингибитором тирозинкиназы, алкилирующим средством, ингибитором микротрубочек или антимитотическим средством), противоаллергическим средством, противорвотным средством (или антиэметиком), анальгетиком или цитопротектором, представленным в настоящем описании.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором B-клеточной лимфомы 2 (BCL-2) (например, венетоклаксом, также называемым ABT-199 или GDC-0199;) и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с венетоклаксом и ритуксимабом. Венетоклакс является низкомолекулярным соединением, ингибирующим антиапоптотический белок, BCL-2. Структура венетоклакса (4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид) представлена ниже.
В вариантах осуществления индивидуум имеет CLL. В вариантах осуществления индивидуум имеет рецидивирующий CLL, например, индивидууму ранее проводили противораковую терапию. В вариантах осуществления венетоклакс вводят в дозе приблизительно 15-600 мг (например, 15-20, 20-50, 50-75, 75-100, 100-200, 200-300, 300-400, 400-500 или 500-600 мг), например, ежедневно. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно, например, ежемесячно.
Не будучи связанными какой-либо теорией, полагают, что при некоторых злокачественных новообразованиях B-клетки (например, B-регуляторные клетки) могут супрессировать T-клетки. Кроме того, полагают, что комбинация оксиплатина и средства для истощения B-клеток может снижать размер опухоли и/или устранять опухоли у индивидуума. В некоторых вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании (например, CAR BCMA) вводят в комбинации со средством для истощения B-клеток (например, CAR CD19-экспрессирующей клеткой, CAR CD20-экспрессирующей клеткой, ритуксимабом, окрелизумабом, эпратузумабом или белимумабом) и оксиплатином. В вариантах осуществления злокачественная клетка может являться CD19-отрицательной, или CD19-положительной, или BCMA-отрицательной, или BMCA-положительной. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании (например, CAR BCMA), вводят в комбинации со средством для истощения B-клеток и оксиплатином для лечения злокачественного новообразования, например, злокачественного новообразования, представленного в настоящем описании, например, солидным раком, например, раком предстательной железы, раком поджелудочной железы или раком легких.
В вариантах осуществления CAR-экспрессирующая клетка, представленная в настоящем описании (например, CAR BCMA), может истощать B-клетки (например, B-клетки, имеющие фенотип, подобный плазматической клетке, например, экспрессирующей BCMA, CD19 и/или CD20) у индивидуума. В вариантах осуществления B-клетка может являться CD19-отрицательной, или CD19-положительной, или BCMA-отрицательной, или BMCA-положительной. В некоторых вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании (например, CAR BCMA), вводят в комбинации с оксиплатином. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят в комбинации с оксиплатином и используют для лечения злокачественного новообразования, например, солидного рака, например, рака предстательной железы, рака поджелудочной железы или рака легких. В некоторых вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят в комбинации с онколитическим вирусом. В вариантах осуществления онколитические вирусы способны селективно реплицироваться и запускать гибель или замедлять рост злокачественной клетки. В некоторых случаях онколитические вирусы не имеют эффектов или имеют минимальный эффект в отношении незлокачественных клеток. Онколитический вирус включает, в качестве неограничивающих примеров, онколитический аденовирус, онколитические вирусы простого герпеса, онколитический ретровирус, онколитический парвовирус, онколитический вирус осповакцины, онколитический вирус Синдбис, онколитический вирус гриппа или онколитический РНК-вирус (например, онколитический реовирус, онколитический вирус псевдочумы птиц (NDV), онколитический вирус кори или онколитический вирус везикулярного стоматита (VSV)).
В некоторых вариантах осуществления онколитический вирус является вирусом, например, рекомбинантным онколитическим вирусом, описываемым в US2010/0178684 A1, включенном в настоящее описание в качестве ссылки в полном объеме. В некоторых вариантах осуществления рекомбинантный онколитический вирус содержит последовательность нуклеиновой кислоты (например, гетерологичную последовательность нуклеиновой кислоты), кодирующую ингибитор иммунного или воспалительного ответа, например, как описано в US2010/0178684 A1, включенном в настоящее описание в качестве ссылки в полном объеме. В вариантах осуществления рекомбинантный онколитический вирус, например, онколитический NDV, содержит проапоптотический белок (например, апоптин), цитокин (например, ГМ-КСФ, интерферон-гамма, интерлейкин-2 (ИЛ-2), фактор некроза опухоли), иммуноглобулин (например, антитело против фибронектина ED-B), опухоле-ассоциированный антиген, биспецифический адаптерный белок (например, биспецифическое антитело или фрагмент антитела против белка HN NDV и T-клеточного костимуляторного рецептора, такого как CD3 или CD28, или слитый белок ИЛ-2 человека и одноцепочечного антитела против белка HN NDV). См., например, Zamarin et al. Future Microbiol. 7,3(2012):347-67, включенный в настоящее описание в качестве ссылки в полном объеме. В некоторых вариантах осуществления онколитический вирус является химерным онколитическим NDV, описываемым в US8591881 B2, US2012/0122185 A1, или US2014/0271677 A1, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме.
В некоторых вариантах осуществления онколитический вирус содержит условно реплицирующийся аденовирус (CRAd), сконструированный для репликации исключительно в злокачественных клетках. См., например, Alemany et al. Nature Biotechnol. 18(2000):723-27. В некоторых вариантах осуществления онколитический аденовирус содержит вирус, описываемый в таблице 1 на стр. 725 Alemany et al., включенном в настоящее описание в качестве ссылки в полном объеме.
Неограничивающие примеры онколитических вирусов включают следующие:
Онколитический аденовирус группы B (ColoAd1) (PsiOxus Therapeutics Ltd.) (см., например, описание клинического испытания под идентификационным номером: NCT02053220);
ONCOS-102 (ранее известный как CGTG-102), являющийся аденовирусом, содержащим гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) (Oncos Therapeutics) (см., например, описание клинического испытания под идентификационным номером: NCT01598129);
VCN-01, являющийся генетически модифицированным онколитическим аденовирусом человека, кодирующим гиалуронидазу PH20 человека (VCN Biosciences, S.L.) (см., например, описания клинических испытаний под идентификационными номерами: NCT02045602 и NCT02045589);
Условно реплицирующийся аденовирус ICOVIR-5, являющийся вирусом, полученным из аденовируса человека дикого типа серотипа 5 (Had5), модифицированного для селективной репликации в злокачественных клетках с дисрегулируемым путем ретинобластомы/E2F (Institut Català d'Oncologia) (см., например, описание клинического испытания под идентификационным номером: NCT01864759);
Celyvir, содержащий полученные из костного мозга аутологичные мезенхимальные стволовые клетки (MSC), инфицированные ICOVIR5, онколитическим аденовирусом (Hospital Infantil Universitario Niño Jesús, Madrid, Spain/Ramon Alemany) (см., например, описание клинического испытания под идентификационным номером: NCT01844661);
CG0070, являющийся условно реплицирующимся онколитическим аденовирусом серотипа 5 (Ad5), в котором промотор E2F-1 человека запускает экспрессию важных вирусных генов E1a, таким образом, ограничивая вирусную репликацию и цитотоксичность дефектными по пути Rb опухолевыми клетками (Cold Genesys, Inc.) (см., например, описание клинического испытания под идентификационным номером: NCT02143804); или
DNX-2401 (ранее известный как Delta-24-RGD), являющийся аденовирусом, сконструированным для селективной репликации в дефектных по пути ретинобластомы (Rb) клетках и для более эффективного инфицирования клеток, экспрессирующих конкретные RGD-связывающие интегрины (Clinica Universidad de Navarra, Universidad de Navarra/DNAtrix, Inc.) (см., например, описание клинического испытания под идентификационным номером: NCT01956734).
В некоторых вариантах осуществления онколитический вирус, представленный в настоящем описании, вводят посредством инъекции, например, подкожной, внутриартериальной, внутривенной, внутримышечной, интратекальной или интраперитонеальной инъекции. В вариантах осуществления онколитический вирус, представленный в настоящем описании, вводят внутриопухолево, трансдермально, чресслизисто, перорально, интраназально или посредством легочного введения.
В варианте осуществления клетки, экспрессирующие CAR, представленный в настоящем описании, вводят индивидууму в комбинации с молекулой, снижающей популяцию Treg-клеток. Способы снижения количества (например, истощения) Treg-клеток известны в этой области и включают, например, истощение CD25, введение циклофосфамида, модуляцию функции GITR. Не желая быть связанными какой-либо теорией, полагают, что снижение количества Treg-клеток у индивидуума перед аферезом или перед введением CAR-экспрессирующей клетки, представленной в настоящем описании, снижает количество нежелательных иммунных клеток (например, Treg) в микроокружении опухоли и снижает риск рецидива у индивидуума. В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с молекулой, направленно воздействующей на GITR и/или модулирующей функции GITR, такой как агонист GITR и/или антитело против GITR, истощающее регуляторные T-клетки (Treg). В вариантах осуществления клетки, экспрессирующие CAR, представленный в настоящем описании, вводят индивидууму в комбинации с циклофосфамидом. В одном из вариантов осуществления GITR-связывающие молекулы и/или молекулы, модулирующие функции GITR (например, агонист GITR и/или истощающие Treg антитела против GITR) вводят перед введением CAR-экспрессирующей клетки. Например, в одном из вариантов осуществления агониста GITR можно вводить перед аферезом клеток. В вариантах осуществления циклофосфамид вводят индивидууму перед введением (например, инфузией или реинфузией) CAR-экспрессирующей клетки или перед аферезом клеток. В вариантах осуществления циклофосфамид и антитело против GITR вводят индивидууму перед введением (например, инфузией или реинфузией) CAR-экспрессирующей клетки или перед аферезом клеток. В одном из вариантов осуществления индивидуум имеет злокачественное новообразование (например, солидный рак или гемобластоз, такой как множественная миелома, ALL или CLL). В варианте осуществления индивидуум имеет CLL. В вариантах осуществления индивидуум имеет множественную миелому. В вариантах осуществления индивидуум имеет солидный рак, например, солидный рак, представленный в настоящем описании. Примеры агонистов GITR включают, например, слитые белки GITR и антитела против GITR (например, бивалентные антитела против GITR), такие как, например, слитый белок GITR, описываемый в патенте США № 6111090, европейском патенте № 090505B1, патенте США № 8586023, публикациях PCT №: WO2010/003118 и 2011/090754, или антитело против GITR, описываемое, например, в патенте США № 7025962, европейском патенте № 1947183 B1, патенте США № 7812135, патенте США № 8388967, патенте США № 8591886, европейском патенте № EP 1866339, публикации PCT № WO2011/028683, публикации PCT № WO2013/039954, публикации PCT № WO2005/007190, публикации PCT № WO2007/133822, публикации PCT № WO2005/055808, публикации PCT № WO99/40196, публикации PCT № WO2001/03720, публикации PCT № WO99/20758, публикации PCT № WO2006/083289, публикации PCT № WO2005/115451, патенте США № 7618632 и публикации PCT № WO2011/051726.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором mTOR, например, ингибитором mTOR, представленным в настоящем описании, например, рапалогом, таким как эверолимус. В одном из вариантов осуществления ингибитор mTOR вводят перед CAR-экспрессирующей клеткой. Например, в одном из вариантов осуществления ингибитор mTOR можно вводить перед аферезом клеток.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с агонистом GITR, например, агонистом GITR, представленным в настоящем описании. В одном из вариантов осуществления агониста GITR вводят перед CAR-экспрессирующей клеткой. Например, в одном из вариантов осуществления агониста GITR можно вводить перед аферезом клеток.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором протеинтирозинфосфатазы, например, ингибитором протеинтирозинфосфатазы, представленным в настоящем описании. В одном из вариантов осуществления ингибитор протеинтирозинфосфатазы является ингибитором SHP-1, например, ингибитором SHP-1, представленным в настоящем описании, таким как, например, стибоглюконат натрия. В одном из вариантов осуществления ингибитор протеинтирозинфосфатазы является ингибитором SHP-2.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, можно использовать в комбинации с ингибитором киназы. В одном из вариантов осуществления ингибитор киназы является ингибитором CDK4, например, ингибитором CDK4, представленным в настоящем описании, например, ингибитором CDK4/6, таким как, например, 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-ил-пиридин-2-иламино)-8H-пиридо[2,3-d]пиримидин-7-он гидрохлорид (также обозначаемый как палбоциклиб или PD0332991). В одном из вариантов осуществления ингибитор киназы является ингибитором BTK, например, ингибитором BTK, представленным в настоящем описании, таким как, например, ибрутиниб. В одном из вариантов осуществления ингибитор киназы является ингибитором mTOR, например, ингибитором mTOR, представленным в настоящем описании, таким как, например, рапамицин, аналог рапамицина, OSI-027. Ингибитор mTOR может являться, например, ингибитором mTORC1 и/или ингибитором mTORC2, например, ингибитором mTORC1 и/или ингибитором mTORC2, представленным в настоящем описании. В одном из вариантов осуществления ингибитор киназы является ингибитором MNK, например, ингибитором MNK, представленным в настоящем описании, таким как, например, 4-амино-5-(4-фторанилино)-пиразоло[3,4-d]пиримидин. Ингибитор MNK может являться, например, ингибитором MNK1a, MNK1b, MNK2a и/или MNK2b. В одном из вариантов осуществления ингибитором киназы является двойной ингибитор PI3K/mTOR, представленный в настоящем описании, такой как, например, PF-04695102. В одном из вариантов осуществления ингибитор киназы является ингибитором DGK, например, ингибитором DGK, представленным в настоящем описании, таким как, например, DGKinh1 (D5919) или DGKinh2 (D5794).
В одном из вариантов осуществления ингибитор киназы является ингибитором CDK4, выбранным из алоизина A, флавопиридола или HMR-1275, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4-хроменона, кризотиниба (PF-02341066, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(2R,3S)-2-(гидроксиметил)-1-метил-3-пирролидинил]-4H-1-бензопиран-4-она гидрохлорида (P276-00), 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина (RAF265), индисулама (E7070), росковитина (CYC202), палбоциклиба (PD0332991), динациклиба (SCH727965), N-[5-[[(5-трет-бутилоксазол-2-ил)метил]тио]тиазол-2-ил]пиперидин-4-карбоксамида (BMS 387032), 4-[[9-хлор-7-(2,6-дифторфенил)-5H-пиримидо[5,4-d][2]бензазепин-2-ил]амино]-бензойной кислоты (MLN8054), 5-[3-(4,6-дифтор-1H-бензимидазол-2-ил)-1H-индазол-5-ил]-N-этил-4-метил-3-пиридинметанамина (AG-024322), N-(пиперидин-4-ил)амида 4-(2,6-дихлорбензоиламино)-1H-пиразол-3-карбоновой кислоты (AT7519), 4-[2-метил-1-(1-метилэтил)-1H-имидазол-5-ил]-N-[4-(метилсульфонил)фенил]-2-пиримидинамина (AZD5438) и XL281 (BMS908662).
В одном из вариантов осуществления ингибитор киназы является ингибитором CDK4, например, палбоциклибом (PD0332991), и палбоциклиб вводят в дозе приблизительно 50 мг, 60 мг, 70 мг, 75 мг, 80 мг, 90 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг (например, 75 мг, 100 мг или 125 мг) ежедневно в течение периода времени, например, ежедневно в течение 14-21 дня 28-дневного цикла или ежедневно в течение 7-12 дней 21-дневного цикла. В одном из вариантов осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов введения палбоциклиба.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором циклин-зависимой киназы (CDK) 4 или 6, например, ингибитором CDK4 или ингибитором CDK6, представленным в настоящем описании. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором CDK4/6 (например, ингибитором, направленно воздействующим и на CDK4, и на CDK6), например, ингибитором CDK4/6, представленным в настоящем описании. В варианте осуществления индивидуум имеет MCL. MCL является агрессивным злокачественным новообразованием, плохо отвечающим на доступные в настоящее время способы терапии, т.е., по существу, неизлечим. Во многих случаях MCL в клетках MCL экспрессируется циклин D1 (регулятор CDK4/6) (например, в результате хромосомной транслокации, включающей гены иммуноглобулинов и циклина D1). Таким образом, не будучи связанными какой-либо теорией, полагают, что клетки MCL крайне чувствительны к ингибированию CDK4/6 с высокой специфичностью (т.е. минимальным эффектом в отношении нормальных иммунных клеток). Ингибиторы CDK4/6 в отдельности обладают некоторой эффективностью в лечении MCL, но с их помощью достигают лишь частичной ремиссии с высокой частотой рецидивирования. Примером ингибитора CDK4/6 является LEE011 (также известный как ридоциклиб), структура которого представлена ниже.
Не будучи связанными какой-либо теорией, полагают, что посредством введения CAR-экспрессирующей клетки, представленной в настоящем описании, с ингибитором CDK4/6 (например, LEE011 или другим ингибитором CDK4/6, представленным в настоящем описании) можно достигать более высокой отвечаемости, например, с более высокой частотой ремиссии и/или более низкой частотой рецидивирования, например, по сравнению с ингибитором CDK4/6 в отдельности.
В одном из вариантов осуществления ингибитор киназы является ингибитором BTK, выбранным из ибрутиниба (PCI-32765), GDC-0834, RN-486, CGI-560, CGI-1764, HM-71224, CC-292, ONO-4059, CNX-774 и LFM-A13. В предпочтительном варианте осуществления ингибитор BTK не снижает или ингибирует киназную активность интерлейкин-2-индуцибельной киназы (ITK) и выбран из GDC-0834, RN-486, CGI-560, CGI-1764, HM-71224, CC-292, ONO-4059, CNX-774 и LFM-A13.
В одном из вариантов осуществления ингибитор киназы является ингибитором BTK, например, ибрутинибом (PCI-32765). В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором BTK (например, ибрутинибом). В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ибрутинибом (также называемым PCI-32765). Структура ибрутиниба (1-[(3R)-3-[4-Амино-3-(4-феноксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-она) представлена ниже.
В вариантах осуществления индивидуум имеет CLL, лимфому из клеток мантийной зоны (MCL) или мелкоклеточную лимфоцитарную лимфому (SLL). Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления индивидуум имеет рецидивирующий CLL или SLL, например, индивидууму ранее проводили противораковую терапию (например, ранее проводили одну, две, три или четыре предшествующие противораковые терапии). В вариантах осуществления индивидуум имеет рефрактерный CLL или SLL. В других вариантах осуществления индивидуум имеет фолликулярную лимфому, например, рецидивирующую или рефрактерную фолликулярную лимфому. В некоторых вариантах осуществления ибрутиниб вводят в дозе приблизительно 300-600 мг/день (например, приблизительно 300-350, 350-400, 400-450, 450-500, 500-550 или 550-600 мг/день, например, приблизительно 420 мг/день или приблизительно 560 мг/день), например, перорально. В вариантах осуществления ибрутиниб вводят в дозе приблизительно 250 мг, 300 мг, 350 мг, 400 мг, 420 мг, 440 мг, 460 мг, 480 мг, 500 мг, 520 мг, 540 мг, 560 мг, 580 мг, 600 мг (например, 250 мг, 420 мг или 560 мг) ежедневно в течение периода времени, например, ежедневно в течение 21-дневного цикла или ежедневно в течение 28-дневного цикла. В одном из вариантов осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов введения ибрутиниба. В некоторых вариантах осуществления ибрутиниб вводят в комбинации с ритуксимабом. См., например, Burger et al. (2013) Ibrutinib In Combination With Rituximab (iR) Is Well Tolerated and Induces a High Rate Of Durable Remissions In Patients With High-Risk Chronic Lymphocytic Leukemia (CLL): New, Updated Results Of a Phase II Trial In 40 Patients, Abstract 675, представленный на 55th ASH Annual Meeting and Exposition, New Orleans, LA 7-10 Dec. Не будучи связанными какой-либо теорией, полагают, что добавление ибрутиниба повышает T-клеточный пролиферативный ответ и может сдвигать T-клетки с фенотипа T-хелпера-2 (Th2) к фенотипу T-хелпера-1 (Th1). Th1 и Th2 являются фенотипами T-хелперов, при этом Th1 и Th2 направляют разные пути иммунного ответа. Фенотип Th1 ассоциирован с провоспалительными ответами, например, для цитолиза клеток, такими как ответы на внутриклеточные патогены/вирусы или злокачественные клетки или сохраняющиеся аутоиммунные ответы. Фенотип Th2 ассоциирован с накоплением эозинофилов и противовоспалительными ответами.
В некоторых вариантах осуществления способов, применения и композиций по настоящему изобретению ингибитор BTK является ингибитором BTK, описываемым в международной заявке № WO/2015/079417, включенной в настоящее описание в качестве ссылки в полном объеме. Например, в некоторых вариантах осуществления ингибитор BTK является соединением формулы (I) или его фармацевтически приемлемой солью;
 (I)
(I)
где,
R1 является водородом, C1-C6-алкилом, необязательно замещенным гидроксигруппой;
R2 является водородом или галогеном;
R3 является водородом или галогеном;
R4 является водородом;
R5 является водородом или галогеном;
или R4 и R5 соединены друг с другом и означают связь, -CH2-, -CH2-CH2-, -CH=CH-, -CH=CH-CH2-, -CH2-CH=CH-, или -CH2-CH2-CH2-;
R6 и R7 независимо друг от друга означают H, C1-C6-алкил, необязательно замещенный гидроксилом, C3-C6-циклоалкил, необязательно замещенный галогеном или гидроксигруппой, или галоген;
R8, R9, R, R', R10 и R11 независимо друг от друга означают H, или C1-C6-алкил, необязательно замещенный C1-C6-алкоксигруппой; или любые два из R8, R9, R, R', R10 и R11 вместе с атомом углерода, с которым они соединены, могут образовывать 3-6-членное насыщенное карбоциклическое кольцо;
R12 является водородом или C1-C6-алкилом, необязательно замещенным галогеном или C1-C6-алкоксигруппой;
или R12 и любой из R8, R9, R, R', R10 или R11 вместе с атомами, с которыми они связаны, могут образовывать 4-, 5-, 6- или 7-членное азациклическое кольцо, при этом кольцо можно необязательно замещать галогеном, цианогруппой, гидроксилом, C1-C6-алкилом или C1-C6-алкоксигруппой;
n является 0 или 1; и
R13 является C2-C6-алкенилом необязательно замещенным C1-C6-алкилом, C1-C6-алкоксигруппой или N,N-ди-C1-C6-алкиламиногруппой; C2-C6-алкинилом, необязательно замещенным C1-C6-алкилом или C1-C6-алкоксигруппой, или C2-C6-алкиленилоксидом, необязательно замещенным C1-C6-алкилом.
В некоторых вариантах осуществления ингибитор BTK формулы I выбран из: N-(3-(5-((1-акрилоилазетидин-3-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (E)-N-(3-(6-амино-5-((1-(бут-2-еноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-((1-проиолоилазетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-((1-(бут-2-иноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(5-((1-акрилоилпиперидин-4-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-(2-(N-метилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (E)-N-(3-(6-амино-5-(2-(N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-(2-(N-метилпропиоламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (E)-N-(3-(6-амино-5-(2-(4-метокси-N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(2-((4-амино-6-(3-(4-циклопропил-2-фторбензамидо)-5-фтор-2-метилфенил)пиримидин-5-ил)окси)этил)-N-метилоксиран-2-карбоксамида, N-(2-((4-амино-6-(3-(6-циклопропил-8-фтор-1-оксоизохинолин-2(1H)-ил)фенил)пиримидин-5-ил)окси)этил)-N-метилакриламида, N-(3-(5-(2-акриламидоэтокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-(2-(N-этилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-(2-(N-(2-фторэтил)акриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(5-((1-акриламидоциклопропил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(5-(2-акриламидопропокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(6-амино-5-(2-(бут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(6-амино-5-(2-(N-метилакриламидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-(3-(N-метилакриламидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(6-амино-5-((1-(бут-2-иноил)пирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-2-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она, N-(2-((4-амино-6-(3-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-5-фтор-2-(гидроксиметил)фенил)пиримидин-5-ил)окси)этил)-N-метилакриламида, N-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-амино-5-(((2S,4R)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, 2-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она, N-(3-(5-(((2S,4S)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-Амино-5-(((2S,4S)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(5-(((2S,4R)-1-акрилоил-4-фторпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(6-Амино-5-(((2S,4R)-1-(бут-2-иноил)-4-фторпирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-N-(3-(6-амино-5-((1-пропиолоилазетидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (S)-2-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она, (R)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, (R)-N-(3-(5-((1-акрилоилпиперидин-3-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(5-(((2R,3S)-1-акрилоил-3-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида, N-(3-(5-(((2S,4R)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида или N-(3-(5-(((2S,4S)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида.
Если не указано иное, химические термины, используемые выше в описании ингибитора BTK формулы I, используют в их значении, указанном в международной заявке № WO/2015/079417, включенной в настоящее описание в качестве ссылки в полном объеме.
В одном из вариантов осуществления ингибитор киназы является ингибитором mTOR, выбранным из темсиролимуса, ридафоролимуса (1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R, 23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфината, также известного как AP23573 и MK8669, эверолимуса (RAD001), рапамицина (AY22989), симапимода, (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанола (AZD8055), 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF04691502) и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензoпиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серин-(SEQ ID NO: 383) внутренней соли (SF1126) и XL765.
В одном из вариантов осуществления ингибитор киназы является ингибитором mTOR, например, рапамицином, и рапамицин вводят в дозе приблизительно 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг (например, 6 мг) ежедневно в течение периода времени, например, ежедневно в течение 21-дневного цикла или ежедневно в течение 28-дневного цикла. В одном из вариантов осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов введения рапамицина. В одном из вариантов осуществления ингибитор киназы является ингибитором mTOR, например, эверолимусом, и эверолимус вводят в дозе приблизительно 2 мг, 2,5 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг (например, 10 мг) ежедневно в течение периода времени, например, ежедневно в течение 28-дневного цикла. В одном из вариантов осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов введения эверолимуса.
В одном из вариантов осуществления ингибитор киназы является ингибитором MNK, выбранным из CGP052088, 4-амино-3-(p-фторфениламино)-пиразоло[3,4-d]пиримидина (CGP57380), церкоспорамида, ETC-1780445-2 и 4-амино-5-(4-фторанилино)-пиразоло[3,4-d]пиримидина.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором фосфоинозитол-3-киназы (PI3K) (например, ингибитором PI3K, представленным в настоящем описании, например, иделалисибом или дувелисибом) и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с иделалисибом и ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с дувелисибом и ритуксимабом. Иделалисиб (также называемый GS-1101 или CAL-101, Gilead) является низкомолекулярным соединением, блокирующим дельта-изоформу PI3K. Структура иделалисиба (5-фтор-3-фенил-2-[(1S)-1-(7H-пурин-6-иламино)пропил]-4(3H)-хиназолинона) представлена ниже.
Дувелисиб (также называемый IPI-145, Infinity Pharmaceuticals and Abbvie) является низкомолекулярным соединением, блокирующим PI3K-δ,γ. Структура дувелисиба (8-хлор-2-фенил-3-[(1S)-1-(9H-пурин-6-иламино)этил]-1(2H)-изохинолинонп) представлена ниже.
В вариантах осуществления индивидуум имеет CLL. В вариантах осуществления индивидуум имеет рецидивирующий CLL, например, индивидууму ранее проводили противораковую терапию (например, ранее вводили антитело против CD20 или ранее вводили ибрутиниб). Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления индивидуум содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления индивидуум не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления индивидуум имеет делецию в длинном плече хромосомы 11 (del(11q)). В других вариантах осуществления индивидуум не имеет del(11q). В вариантах осуществления иделалисиб вводят в дозе приблизительно 100-400 мг (например, 100-125, 125-150, 150-175, 175-200, 200-225, 225-250, 250-275, 275-300, 325-350, 350-375 или 375-400 мг), например, BID. В вариантах осуществления дувелисиб вводят в дозе приблизительно 15-100 мг (например, приблизительно 15-25, 25-50, 50-75 или 75-100 мг), например, дважды в сутки. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором киназы анапластической лимфомы (ALK). Неограничивающие примеры киназ ALK включают кризотиниб (Pfizer), церитиниб (Novartis), алектиниб (Chugai), бригатиниб (также называемый AP26113, Ariad), энтректиниб (Ignyta), PF-06463922 (Pfizer), TSR-011 (Tesaro) (см., например, описание клинического испытания под идентификационным номером NCT02048488), CEP-37440 (Teva) и X-396 (Xcovery). В некоторых вариантах осуществления индивидуум имеет солидный рак, например, солидный рак, представленный в настоящем описании, например, рак легких.
Химическим названием кризотиниба является 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-илпиразол-4-ил)пиридин-2-амин. Химическим названием церитиниба является 5-хлор-N2-[2-изопропокси-5-метил-4-(4-пиперидинил)фенил]-N4-[2-(изопропилсульфонил)фенил]-2,4-пиримидиндиамин. Химическим названием алектиниба является 9-этил-6,6-диметил-8-(4-морфолинопиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензo[b]карбазол-3-кабонитрил. Химическим названием бригатиниба является 5-хлор-N2-{4-[4-(диметиламино)-1-пиперидинил]-2-метоксифенил}-N4-[2-(диметилфосфорил)фенил]-2,4-пиримидиндиамин. Химическим названием энтректиниба является N-(5-(3,5-дифторбензил)-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)-2-((тетрагидро-2H-пиран-4-ил)амино)бензамид. Химическим названием PF-06463922 является (10R)-7-амино-12-фтор-2,10,16-триметил-15-оксо-10,15,16,17-тетрагидро-2H-8,4-(метено)пиразоло[4,3-h][2,5,11]-бензоксадиазациклотетрадецин-3-карбонитрил. Химической структурой CEP-37440 является (S)-2-((5-хлор-2-((6-(4-(2-гидроксиэтил)пиперазин-1-ил)-1-метокси-6,7,8,9-тетрагидро-5H-бензo[7]аннулен-2-ил)амино)пиримидин-4-ил)амино)-N-метилбензамид. Химическим названием X-396 является (R)-6-амино-5-(1-(2,6-дихлор-3-фторфенил)этокси)-N-(4-(4-метилпиперазин-1-карбонил)фенил)пиридазин-3-карбоксамид.
В одном из вариантов осуществления ингибитором киназы является двойной ингибитор фосфатидилинозитол-3-киназы (PI3K) и mTOR, выбранный из 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF-04691502), N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевины (PF-05212384, PKI-587), 2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрила (BEZ-235), апитолисиба (GDC-0980, RG7422), 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид (GSK2126458), 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-она малеиновой кислоты (NVP-BGT226), 3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола (PI-103), 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амина (VS-5584, SB2343) и N-[2-[(3,5-диметоксифенил)амино]хиноксалин-3-ил]-4-[(4-метил-3-метоксифенил)карбонил]аминофенилсульфонамида (XL765).
Также можно использовать лекарственные средства, ингибирующие кальций-зависимую фосфатазу кальциневрин (циклоспорин и FK506) или ингибирующие киназу p70S6, важную для индуцируемой фактором роста передачи сигнала (рапамицин). (Liu et al., Cell 66:807-815, 1991; Henderson et al., Immun. 73:316-321, 1991; Bierer et al., Curr. Opin. Immun. 5:763-773, 1993). В дополнительном аспекте композиции клеток по настоящему изобретению можно вводить пациенту в комбинации с (например, до, одновременно или после) трансплантацией костного мозга, T-клеточно-абляционной терапией с использованием химиотерапевтических средств, таких как флударабин, наружной дистанционной лучевой терапией (XRT), циклофосфамидом и/или антителами, такими как OKT3 или CAMPATH. В одном из аспектов композиции клеток по настоящему изобретению вводят после B-клеточно-абляционной терапии, такой как средства, реагирующие с CD20, например, ритуксан. Например, в одном из вариантов осуществления индивидуумов можно подвергать стандартному лечению с использованием химиотерапии высокими дозами с последующей трансплантацией стволовых клеток периферической крови. В определенных вариантах осуществления после трансплантации индивидуумам проводят инфузию выращенных иммунных клеток по настоящему изобретению. В дополнительном варианте осуществления выращенные клетки вводят до или после хирургического вмешательства.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с бифосфонатом, например, памидронатом (Aredia®), золедроновой кислотой или золедронатом (Zometa®, Zomera®, Aclasta® или Reclast®), аледронатом (Fosamax®), ризедронатом (Actonel®), ибандронатом (Boniva®), клодронатом (Bonefos®), этидронатом (Didronel®), тилудронатом (Skelid®), памидронатом (Aredia®), неридронатом (Nerixia®), ранелатом стронция (Protelos® или Protos®) и терипаратидом (Forteo®).
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с кортикостероидом, например, дексаметазоном (например, Decadron®), беклометазоном (например, Beclovent®), гидрокортизоном (также известным как кортизон, гидрокортизон сукцинат натрия, гидрокортизон фосфат натрия и продаваемым под торговыми названиями Ala-Cort®, гидрокортизон фосфат, Solu-Cortef®, Hydrocort Acetate® и Lanacort®), преднизолоном (продаваемым под торговыми названиями Delta-Cortel®, Orapred®, Pediapred® и Prelone®), преднизоном (продаваемым под торговыми названиями Deltasone®, Liquid Red®, Meticorten® и Orasone®), метилпреднизолоном (также известным как 6-метилпреднизолон, метилпреднизолона ацетат, метилпреднизолона сукцинат натрия, продаваемым под торговыми названиями Duralone®, Medralone®, Medrol®, M-Prednisol® и Solu-Medrol®), антигистаминными средствами, такими как дифенгидрамин (например, Benadryl®), гидроксизин и ципрогептадин и бронходилататорами, такими как агонисты бета-адренергических рецептором, альбутерол (например, Proventil®) и тербуталин (Brethine®).
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с иммуномодулятором, например, афутузумабом (доступным в Roche®), пэгфилграстимом (Neulasta®), леналидомидом (CC-5013, Revlimid®), талидомидом (Thalomid®), актимидом (CC4047) и IRX-2 (смесь цитокинов человека, включая интерлейкин 1, интерлейкин 2 и интерферон γ, CAS 951209-71-5, доступная в IRX Therapeutics).
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором протеасом, например, бортезомибом (Velcade®), иксазомибом цитратом (MLN9708, CAS 1201902-80-8), данопревиром (RG7227, CAS 850876-88-9), иксазомибом (MLN2238, CAS 1072833-77-2) и (S)-N-[(фенилметокси)карбонил]-L-лейцил-N-(1-формил-3-метилбутил)-L-лейцинамидом (МГ-132, CAS 133407-82-6).
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с рецептором фактора роста эндотелия сосудов (VEGF), например, бевацизумабом (Avastin®), акситинибом (Inlyta®), бриваниба аланинатом (BMS-582664, (S)-((R)-1-(4-(4-фтор-2-метил-1H-индол-5-илокси)-5-метилпирроло[2,1-f][1,2,4]триазин-6-илокси)пропан-2-ил)2-аминопропаноатом), сорафенибом (Nexavar®), пазопанибом (Votrient®), сунитиниба малатом (Sutent®), цедиранибом (AZD2171, CAS 288383-20-1), варгатефом (BIBF1120, CAS 928326-83-4), форетинибом (GSK1363089), телатинибом (BAY57-9352, CAS 332012-40-5), апатинибом (YN968D1, CAS 811803-05-1), иматинибом (Gleevec®), понатинибом (AP24534, CAS 943319-70-8), тивозанибом (AV951, CAS 475108-18-0), регорафенибом (BAY73-4506, CAS 755037-03-7), ваталаниба дигидрохлоридом (PTK787, CAS 212141-51-0), бриванибом (BMS-540215, CAS 649735-46-6), вандетанибом (Caprelsa® или AZD6474), мотезаниба дифосфатом (AMG706, CAS 857876-30-3, N-(2,3-дигидро-3,3-диметил-1H-индол-6-ил)-2-[(4-пиридинилметил)амино]-3-пиридинкарбоксамидом, описываемым в публикации PCT № WO02/066470), довитинибом димолочной кислоты (TKI258, CAS 852433-84-2), линфанибом (ABT869, CAS 796967-16-3), кабозантинибом (XL184, CAS 849217-68-1), лестауртинибом (CAS 111358-88-4), N-[5-[[[5-(1,1-диметилэтил)-2-оксазолил]метил]тио]-2-тиазолил]-4-пиперидинкарбоксамидом (BMS38703, CAS 345627-80-7), (3R,4R)-4-амино-1-((4-((3-метоксифенил)амино)пирроло[2,1-f][1,2,4]триазин-5-ил)метил)пиперидин-3-олом (BMS690514), N-(3,4-дихлор-2-фторфенил)-6-метокси-7-[[(3aα,5β,6aα)-октагидро-2-метилциклопента[c]пиррол-5-ил]метокси]-4-хиназолинамином (XL647, CAS 781613-23-8), 4-метил-3-[[1-метил-6-(3-пиридинил)-1H-пиразоло[3,4-d]пиримидин-4-ил]амино]-N-[3-(трифторметил)фенил]-бензамидом (BHG712, CAS 940310-85-0) и афлиберцептом (Eylea®).
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с антителом против CD20 или его конъюгатом, например, ритуксимабом (Rituxan® и MabThera®) и тозитумомабом (Bexxar®) и офатумумабом (Arzerra®), ибритумомабом тиуксетаном (Zevalin®) и тозитумомабом.
В одном из вариантов осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с антиконвульсантом, например, антиконвульсантами (антиэпилептическими или противосудорожными лекарственными средствами): альдегидами, например, паральдегидом, ароматическими аллильными спиртами, например, стирипентолом (Diacomit®), барбитуратами, например, фенобарбиталом (Luminal®), метилфенобарбиталом (Mebaral®), барбексаклоном (Maliasin®), бензодиазепинами, например, клобазамом (Onfi®), клоназепамом (Klonopin®), клоразепатом (Tranxene® и Novo-Clopate®), диазепамом (Valium®, Lembrol®, Diastat®), мидазоламом (Versed®), лоразепамом (Ativan® и Orfidal®), нитразепамом (Alodorm®, Arem®, Insoma®), темазепамом (Restoril®, Normison®), ниметзепамом (Erimin®), бромидами, например, бромидом калия, карбаматами, например, фелбаматом (Felbatol®), карбоксамидами, например, карбамазепином (Tegretol®, Equetro®), окскарбазепином (Trileptal®, Oxcarb®), эсликарбазепина ацетатом (Aptiom®), жирными кислотами, например, вальпроатами (вальпроевой кислотой, вальпроатом натрия, дивальпроексом натрия), вигабатрином (Sabril®), прогабидом (Gabren®), тиагабином (Gabitril®), производными фруктозы, например, топираматом (Topamax®), аналогами ГАМК, например, габапентином (Neurontin®), прегабалином (Lyrica®), гидантоинами, например, этотоином (Peganone®), фенитоином (Dilantin®), мефенитоином (Mesantoin®), фосфенитоином (Cerebyx®, Prodilantin®), оксазолидиндионами, например, параметадионом (Paradione®), триметадионом (Tridione®), пропионатами, например, бекламидом (Choracon®, Hibicon®, Posedrine®), пиримидиндионами, например, примидоном (Mysoline®), пирролидинами, например, бриварацетамом, леветирацетамом, селетрацетамом (Keppra®), сукцинимидами, например, этосуксимидом (Zarontin®), фенсуксимидом (Milontin®), месуксимидом (Celontin®, Petinutin®), сульфонамидами, например, ацетазоламидом (Diamox®), султиамом (Ospolot®), метазоламидом (Neptazane®), зонисамидом (Zonegran®), триазинами, например, ламотригином (Lamictal®), мочевинами, например, фенетуридом, фенацемидом (Phenurone®), вальпроиламидами (амидными производными вальпроата), например, вальпромидом (Depamide®), вальноктамидом, антагонистом рецептора AMPA, например, перампанелом (Fycompa®).
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с ингибитором индоламин-2,3-диоксигеназы (IDO). IDO является ферментом, катализирующим деградацию аминокислоты L-триптофана в кинуренин. Многие злокачественные новообразования гиперэкспрессируют IDO, например, рак предстательной железы, колоректальный рак, рак поджелудочной железы, шейки матки, желудка, яичника, головы и легких. pDC, макрофаги и дендритные клетки (DC) могут экспрессировать IDO. Не будучи связанными какой-либо теорией, полагают, что снижение L-триптофана (например, катализируемое IDO) приводит к возникновению иммуносупрессорной среды посредством индуцирования T-клеточной анергии и апоптоза. Таким образом, не будучи связанными какой-либо теорией, полагают, что ингибитор IDO может повышать эффективность CAR-экспрессирующей клетки, представленной в настоящем описании, например, снижая супрессию или гибель CAR-экспрессирующей иммунной клетки. В вариантах осуществления индивидуум имеет солидную опухоль, например, солидную опухоль, представленную в настоящем описании, например, рак предстательной железы, колоректальный рак, рак поджелудочной железы, шейки матки, желудка, яичника, головы и легких. Неограничивающие примеры ингибиторов IDO включают 1-метил-триптофан, индоксимод (NewLink Genetics) (см., например, описания клинических испытаний под идентификационными номерами NCT01191216, NCT01792050), и INCB024360 (Incyte Corp.) (см., например, описания клинических испытаний под идентификационными номерами NCT01604889, NCT01685255).
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с модулятором супрессорных клеток миелоидного происхождения (MDSC). MDSC накапливаются на периферии и в участках опухоли при многих солидных опухолях. Эти клетки супрессируют T-клеточные ответы, таким образом, препятствуя эффективной терапии CAR-экспрессирующими клетками. Не будучи связанными какой-либо теорией, полагают, что введение модулятора MDSC повышает эффективность CAR-экспрессирующей клетки, представленной в настоящем описании. В варианте осуществления индивидуум имеет солидную опухоль, например, солидную опухоль, представленную в настоящем описании, например, глиобластому. Неограничивающие примеры модуляторов MDSC включают MCS110 и BLZ945. MCS110 является моноклональным антителом (mAb) против макрофагального колониестимулирующего фактора (М-КСФ). См., например, описание клинического испытания под идентификационным номером NCT00757757. BLZ945 является низкомолекулярным ингибитором рецептора колониестимулирующего фактора 1 (CSF1R). См., например, Pyonteck et al. Nat. Med. 19(2013):1264-72. Структура BLZ945 представлена ниже.
В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с CD19 CART-клеткой (например, CTL019, например, как описано в WO2012/079000, включенной в настоящее описание в качестве ссылки). В вариантах осуществления индивидуум имеет острый миелолейкоз (AML), например, CD19-положительный AML или CD19-отрицательный AML. В вариантах осуществления индивидуум имеет CD19+-лимфому, например, CD19+-неходжкинскую лимфому (NHL), CD19+ FL или CD19+ DLBCL. В вариантах осуществления индивидуум имеет рецидивирующую или рефрактерную CD19+-лимфому. В вариантах осуществления истощающую лимфоциты химиотерапию проводят индивидууму до, одновременно или после введения (например, инфузии) CD19 CART-клеток. В примере истощающую лимфоциты химиотерапию проводят индивидууму перед введением CD19 CART-клеток. Например, истощающую лимфоциты химиотерапию заканчивают за 1-4 дня (например, 1, 2, 3 или 4 дня) до инфузии CD19 CART-клеток. В вариантах осуществления вводят множество доз CD19 CART-клеток, например, как представлено в настоящем описании. Например, одна доза содержит приблизительно 5×108 CD19 CART-клеток. В вариантах осуществления истощающую лимфоциты химиотерапию проводят индивидууму до, одновременно или после введения (например, инфузии) CAR-экспрессирующей клетки, представленной в настоящем описании, например, не-CAR CD19-экспрессирующей клетки. В вариантах осуществления CD19 CART вводят индивидууму до, одновременно или после введения (например, инфузии) не-CAR CD19-экспрессирующей клетки, например, не-CAR CD19-экспрессирующей клетки, представленной в настоящем описании.
В некоторых вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с CAR CD19-экспрессирующей клеткой, например, CTL019, например, как описано в WO2012/079000, включенной в настоящее описание в качестве ссылки, для лечения заболевания, ассоциированного с экспрессией BCMA, например, злокачественного новообразования, представленного в настоящем описании. Не будучи связанными какой-либо теорией, полагают, что введение CAR CD19-экспрессирующей клетки в комбинации с CAR-экспрессирующей клеткой улучшает эффективность CAR-экспрессирующей клетки, представленной в настоящем описании, посредством направленного воздействия на злокачественные клетки ранних стадий развития, например злокачественные стволовые клетки, модулируя иммунный ответ, истощая регуляторные B-клетки и/или улучшая микроокружение опухоли. Например, CAR CD19-экспрессирующая клетка направленно воздействует на злокачественные клетки, экспрессирующие маркеры ранних стадий развития, например, злокачественные стволовые клетки и CD19-экспрессирующие клетки, в то время как CAR-экспрессирующая клетка, представленная в настоящем описании, направленно воздействует на злокачественные клетки, экспрессирующие маркеры поздних стадий развития, например, BCMA. Этот подход предварительного кондиционирования может улучшать эффективность CAR-экспрессирующей клетки, представленной в настоящем описании. В таких вариантах осуществления CAR CD19-экспрессирующую клетку вводят до, одновременно или после введения (например, инфузии) CAR-экспрессирующей клетки, представленной в настоящем описании.
В вариантах осуществления CAR-экспрессирующая клетка, представленная в настоящем описании, также экспрессирует CAR против CD19, например, CAR CD19. В варианте осуществления клетку, экспрессирующую CAR, представленный в настоящем описании, и CAR CD19 вводят индивидууму для лечения злокачественного новообразования, представленного в настоящем описании, например, AML. В варианте осуществления конфигурации одной или обеих молекул CAR содержат первичный внутриклеточный сигнальный домен и костимуляторный сигнальный домен. В другом варианте осуществления конфигурации одной или обеих молекул CAR содержат первичный внутриклеточный сигнальный домен и два или более, например, 2, 3, 4, 5 или более, костимуляторных сигнальных доменов. В таких вариантах осуществления молекула CAR, представленная в настоящем описании, и CAR CD19 могут содержать одинаковые или разные первичные внутриклеточные сигнальные домены, одинаковые или разные костимуляторные сигнальные домены или одинаковое или разное количество костимуляторных сигнальных доменов. Альтернативно, CAR, представленный в настоящем описании, и CAR CD19 конфигурируют в виде разделенного CAR, в котором одна из молекул CAR содержит антигенсвязывающий домен и костимуляторный домен (например, 4-1BB), в то время как другая молекула CAR содержит антигенсвязывающий домен и первичный внутриклеточный сигнальный домен (например, CD3 дзета).
В некоторых вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят индивидууму в комбинации с полипептидом интерлейкина-15 (ИЛ-15), полипептидом рецептора интерлейкина-15 альфа (ИЛ-15Ra) или комбинацией полипептида ИЛ-15 и полипептида ИЛ-15Ra например, hetIL-15 (Admune Therapeutics, LLC). hetIL-15 является гетеродимерным нековалентным комплексом ИЛ-15 и ИЛ-15Ra. hetIL-15 описывают, например, в US8124084, US2012/0177598, US2009/0082299, US2012/0141413 и US2011/0081311, включенных в настоящее описание в качестве ссылки. В вариантах осуществления het-ИЛ-15 вводят подкожно. В вариантах осуществления индивидуум имеет злокачественное новообразование, например, солидный рак, например, меланому или рак толстого кишечника. В вариантах осуществления индивидуум имеет метастазирующее злокачественное новообразование.
В одном из вариантов осуществления индивидууму можно вводить средство, снижающее или улучшающее побочный эффект, ассоциированный с введением CAR-экспрессирующей клетки. Побочные эффекты, ассоциированные с введением CAR-экспрессирующей клетки, включают, в качестве неограничивающих примеров, CRS и гемофагоцитарный лимфогистиоцитоз (HLH), также обозначаемый как синдром активации макрофагов (MAS). Симптомы CRS включают высокую температуру, тошноту, преходящую гипотензию, гипоксию и т.п. CRS может включать общие клинические признаки и симптомы, такие как высокая температура, утомляемость, анорексия, миалгия, артралгия, тошнота, рвота и головная боль. CRS может включать кожные клинические признаки и симптомы, такие как сыпь. CRS может включать желудочно-кишечные клинические признаки и симптомы, такие как тошнота, рвота и диарея. CRS может включать респираторные клинические признаки и симптомы, такие как тахипноэ и гипоксемия. CRS может включать сердечно-сосудистые клинические признаки и симптомы, такие как тахикардия, расширенное пульсовое давление, гипотензия, повышенный сердечный выброс (ранний) и потенциально сниженный сердечный выброс (поздний). CRS может включать коагуляционные клинические признаки и симптомы, такие как повышенный d-димер, гипофибриногенемия с кровотечением или без него. CRS может включать почечные клинические признаки и симптомы, такие как азотемия. CRS может включать печеночные клинические признаки и симптомы, такие как трансаминит и гипербилирубинемия. CRS может включать неврологические клинические признаки и симптомы, такие как головная боль, изменения психического статуса, дезориентация, бред, затруднения с подбором слов или экспрессивная афазия, галлюцинации, тремор, дисметрия, изменение походки и судороги.
Таким образом, способы, представленные в настоящем описании, могут включать введение индивидууму CAR-экспрессирующей клетки, представленной в настоящем описании, и дополнительное введение одного или более средств для контроля повышенных уровней растворимого фактора, являющихся результатом лечения CAR-экспрессирующими клетками. В одном из вариантов осуществления растворимый фактор, повышенный у индивидуума, является одним или более из ИФНγ, ФНО, ИЛ-2 и ИЛ-6. В варианте осуществления фактор, повышенный у индивидуума, является одним или более из ИЛ-1, ГМ-КСФ, ИЛ-10, ИЛ-8, ИЛ-5 и фракталкина. Таким образом, средство, вводимое для лечения этого побочного эффекта, может являться средством, нейтрализующим один или более из этих растворимых факторов. В одном из вариантов осуществления средство, нейтрализующее одну или более из этих растворимых форм, является антителом или фрагментом антитела. Примеры таких средств включают, в качестве неограничивающих примеров, стероид (например, кортикостероид), ингибитор ФНО и ингибитор ИЛ-6. Примером ингибитора ФНО является молекула антитела против ФНО, такая как, инфликсимаб, адалимумаб, цертолизумаб пегол и голимумаб. Другим примером ингибитора ФНО является слитый белок, такой как этанерцепт. Низкомолекулярные ингибиторы ФНО включают, в качестве неограничивающих примеров, производные ксантина (например, пентоксифиллин) и бупропион. Примером ингибитора ИЛ-6 является молекула антитела против ИЛ-6, такого как тоцилизумаб (toc), сарилумаб, элсилимомаб, CNTO 328, ALD518/BMS-945429, CNTO 136, CPSI-2364, CDP6038, VX30, ARGX-109, FE301 и FM101. В одном из вариантов осуществления молекула антитела против ИЛ-6 является тоцилизумабом. Примером ингибитора на основе ИЛ-1R является анакинра.
В некотором варианте осуществления индивидууму вводят кортикостероид, такой как, помимо прочего, например, метилпреднизолон, гидрокортизон.
В некоторых вариантах осуществления индивидууму вводят сосудосуживающее средство, такое как, например, норэпинефрин, дофамин, фенилэфрин, эпинефрин, вазопрессин или их комбинация.
В варианте осуществления индивидууму можно вводить жаропонижающее средство. В варианте осуществления индивидууму можно вводить анальгетик.
В одном из вариантов осуществления индивидууму можно вводить средство, предотвращающее миграцию CAR BCMA-экспрессирующей клетки в головной мозг, например, натализумаб (TYSABRI®). Экспрессию BCMA, например, его вариант сплайсинга, определяют в некоторых частях головного мозга, например, мозжечке или продолговатом мозге. Не будучи связанными какой-либо теорией, полагают, что предотвращение миграции CAR BCMA-экспрессирующих клеток в головной мозг является предпочтительным для предотвращения взаимодействия каких-либо CAR BCMA-экспрессирующих клеток с BCMA-экспрессирующей тканью головного мозга или воздействия на нее.
В одном из вариантов осуществления индивидууму можно вводить средство, повышающее активность CAR-экспрессирующей клетки. Например, в одном из вариантов осуществления средство может являться средством, ингибирующим ингибиторную молекулу, например, средство является ингибитором контрольных точек. Ингибиторные молекулы, например, белок программируемой смерти 1 (PD1), в некоторых вариантах осуществления может снижать способность CAR-экспрессирующей клетки вызывать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC класса I, MHC класса II, GAL9, аденозин и TGFR бета. Ингибирование ингибиторной молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка может оптимизировать свойства CAR-экспрессирующих клеток. В вариантах осуществления ингибиторную нуклеиновую кислоту, например, ингибиторную нуклеиновую кислоту, например, дцРНК, например, миРНК или shRNA, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), подобную активатору транскрипции эффекторную нуклеазу (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN), например, как представлено в настоящем описании, можно использовать для ингибирования экспрессии ингибиторной молекулы в CAR-экспрессирующей клетке. В варианте осуществления ингибитор является shRNA. В варианте осуществления ингибиторную молекулу ингибируют в CAR-экспрессирующей клетке. В этих вариантах осуществления молекулу дцРНК, ингибирующую экспрессию ингибиторной молекулы, соединяют с нуклеиновой кислотой, кодирующей компонент, например, все компоненты, CAR. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят в комбинации с ингибитором ингибиторной молекулы, например, в комбинации с ингибитором контрольных точек, например, в комбинации с ингибитором PD1 и/или PD-L1. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем, описании вводят в комбинации с ингибитором PD1. В вариантах осуществления CAR-экспрессирующую клетку, представленную в настоящем описании, вводят в комбинации с ингибитором PD-L1.
В варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, ингибирующую экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, функционально связана с промотором, например, промотором, полученным из H1 или U6, таким образом, что молекула дцРНК, ингибирующая экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, экспрессируется, например, экспрессируется в CAR-экспрессирующей клетке. См. например, Tiscornia G., "Development of Lentiviral Vectors Expressing siRNA," Chapter 3, в Gene Transfer: Delivery and Expression of DNA and RNA (eds. Friedmann and Rossi). Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, USA, 2007; Brummelkamp TR, et al. (2002) Science 296: 550-553; Miyagishi M, et al. (2002) Nat. Biotechnol. 19: 497-500. В варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, ингибирующую экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, присутствует в одном векторе, например, лентивирусном векторе, содержащем молекулу нуклеиновой кислоты, кодирующую компонент, например, все компоненты, CAR. В таком варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, ингибирующую экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, находится в векторе, например, лентивирусном векторе, в 5'- или 3'-направлении к нуклеиновой кислоте, кодирующей компонент, например, все компоненты, CAR. Молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, ингибирующую экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, может транскрибироваться в одном или разных направлениях относительно нуклеиновой кислоты, кодирующей компонент, например, все компоненты, CAR. В варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, ингибирующую экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, находится в векторе, ином, чем вектор, содержащий молекулу нуклеиновой кислоты, кодирующую компонент, например, все компоненты, CAR. В варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, ингибирующую экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, транзиторно экспрессируется в CAR-экспрессирующей клетке. В варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, ингибирующую экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, стабильно встраивается в геном CAR-экспрессирующей клетки. На фигурах 41A-41E изображены примеры векторов для экспрессии компонента, например, всех компонентов, CAR в молекуле дцРНК, ингибирующей экспрессию молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток.
Примеры молекул дцРНК, применимых для ингибирования экспрессии молекулы, модулирующей или регулирующей, например, ингибирующей, функцию T-клеток, где молекула, модулирующая или регулирующая, например, ингибирующая, функцию T-клеток, является PD-1, представлены ниже.
В таблице 18 ниже представлены названия средств РНКи PDCD1 (PD1) (полученные из их положения в последовательности гена PDCD1 мыши NM_008798.2) вместе с SEQ ID NO: 286-333, представляющими последовательности ДНК. И смысловые (S), и антисмысловые (AS) последовательности представлены в виде 19-мерных и 21-мерных последовательностей в этой таблице. Также необходимо отметить, что положение (PoS, например, 176) получают из номера положения в последовательности гена PDCD1 мыши NM_008798.2. SEQ ID NO указаны в группах по 12, соответствующих "sense19" SEQ ID NO: 286-297, "sense21" SEQ ID NO: 298-309, "asense21" SEQ ID NO: 310-321, "asense19" SEQ ID NO: 322-333.
Таблица 18. Последовательности shRNA PDCD1 (PD1) мыши
В таблице 19 ниже представлены названия средств РНКи PDCD1 (PD1) (полученные из их положения в последовательности гена PDCD1 человека вместе с SEQ ID NO: 334-381, представляющими последовательности ДНК). И смысловые (S), и антисмысловые (AS) последовательности представлены в виде 19-мерных и 21-мерных последовательностей. SEQ ID NO указаны в группах по 12, соответствующих "sense 19" SEQ ID NO: 334-345, "sense 21" SEQ ID NO: 346-357, "asense 21" SEQ ID NO: 358-369, "asense 19" SEQ ID NO: 370-381.
Таблица 19. Последовательности shRNA PDCD1 (PD1) человека
В одном из вариантов осуществления ингибитор ингибиторного сигнала может являться, например, антителом или фрагментом антитела, связывающимся с ингибиторной молекулой. Например, средство может являться антителом или фрагментом антитела, связывающимся с PD1, PD-L1, PD-L2 или CTLA4 (например, ипилимумабом (также обозначаемым как MDX-010 и MDX-101 и продаваемым как Yervoy®, Bristol-Myers Squibb, тремелимумабом (моноклональное антитело IgG2, доступное в Pfizer, ранее известный как тицилимумаб, CP-675.206)). В варианте осуществления средство является антителом или фрагментом антитела, связывающимся с TIM3. В варианте осуществления средство является антителом или фрагментом антитела, связывающимся с LAG3. В вариантах осуществления средство, повышающее активность CAR-экспрессирующей клетки, например, ингибитор ингибиторной молекулы, вводят в комбинации с аллогенным CAR, например, аллогенным CAR, представленным в настоящем описании (например, описываемым в разделе "Аллогенный CAR" в настоящем описании).
PD-1 является ингибиторным членом семейства рецепторов CD28, также включающим CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Показано, что два лиганда PD-1, PD-L1 и PD-L2, понижающе регулируют активацию T-клеток после связывания с PD-1 (Freeman et al. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 в избытке встречается при злокачественных новообразованиях человека (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммуносупрессию можно реверсировать, ингибируя локальное взаимодействие PD-1 с PD-L1. Антитела, фрагменты антител и другие ингибиторы PD-1, PD-L1 и PD-L2, доступны в этой области и их можно использовать в комбинации с CAR по настоящему изобретению, представленными в настоящем описании. Например, ниволумаб (также обозначаемый как BMS-936558 или MDX1106, Bristol-Myers Squibb) является полностью человеческим моноклональным антителом IgG4, специфически блокирующим PD-1. Ниволумаб (клон 5C4) и другие моноклональные антитела человека, специфически связывающиеся с PD-1, описывают в US8008449 и WO2006/121168. Пидилизумаб (CT-011, Cure Tech) является гуманизированным моноклональным антителом IgG1k, связывающимся с PD-1. Пидилизумаб и другие гуманизированные моноклональные антитела против PD-1 описывают в WO2009/101611. Пембролизумаб (ранее известный как ламбролизумаб, также обозначаемый как MK03475, Merck) является гуманизированным моноклональным антителом IgG4, связывающимся с PD-1. Пембролизумаб и другие гуманизированные антитела против PD-1 описывают в US8354509 и WO2009/114335. MEDI4736 (Medimmune) является моноклональным антителом человека, связывающимся с PDL1, и ингибирует взаимодействие лиганда с PD1. MDPL3280A (Genentech/Roche) является Fc-оптимизированным моноклональным антителом IgG1 человека, связывающимся с PD-L1. MDPL3280A и другие моноклональные антитела человека против PD-L1 описывают в патенте США № 7943743 и патентной публикации США № 2012/0039906. Другие связывающие средства против PD-L1 включают YW243.55.S70 (вариабельные области тяжелой и легкой цепи приведены в SEQ ID NO: 20 и 21 в WO2010/077634) и MDX-1 105 (также обозначаемый как BMS-936559, и, например, связывающие средства против PD-L1, описываемые в WO2007/005874). AMP-224 (B7-DCIg, Amplimmune, например, описываемый в WO2010/027827 и WO2011/066342), является слитым растворимым рецептором PD-L2 Fc, блокирующим взаимодействие между PD-1 и B7-H1. Другие антитела против PD-1 включают AMP 514 (Amplimmune), помимо прочего, например, антитела против PD-1, описываемые в US8609089, US2010028330 и/или US20120114649.
TIM3 (T-клеточный иммуноглобулин-3) также отрицательно регулирует функцию T-клеток, в частности, ИФНγ-секретирующих CD4+ T-хелперов 1 и CD8+ T-цитотоксических 1 клеток, и играет критическую роль в истощении T-клеток. Ингибирование взаимодействия между TIM3 и его лигандами, например, галектином-9 (Gal9), фосфатидилсерином (PS) и HMGB1, может повышать иммунный ответ. Антитела, фрагменты антител и другие ингибиторы TIM3 и его лигандов доступны в этой области, и их можно использовать в комбинации с CAR CD19 или CAR BCMA, представленными в настоящем описании. Например, антитела, фрагменты антител, низкомолекулярные соединения или пептидные ингибиторы, направленно воздействующие на TIM3, связываются с IgV-доменом TIM3 для ингибирования взаимодействия с его лигандами. Антитела и пептиды, ингибирующие TIM3, описывают в WO2013/006490 и US2010/0247521. Другие антитела против TIM3 включают гуманизированные версии RMT3-23 (описываемые в Ngiow et al., 2011, Cancer Res, 71:3540-3551) и клон 8B.2C12 (описываемый в Monney et al., 2002, Nature, 415:536-541). Биспецифические антитела, ингибирующие TIM3 и PD-1, описывают в US2013/0156774.
В других вариантах осуществления средство, повышающее активность CAR-экспрессирующей клетки, является ингибитором CEACAM (например, ингибитором CEACAM-1, CEACAM-3 и/или CEACAM-5). В одном из вариантов осуществления ингибитор CEACAM является молекулой антитела против CEACAM. Примеры антител против CEACAM-1 описывают в WO2010/125571, WO2013/082366 WO2014/059251 и WO2014/022332, например, моноклональное антитело 34B1, 26H7 и 5F4, или их рекомбинантные формы, как описано, например, в US2004/0047858, US7132255 и WO99/052552. В других вариантах осуществления антитело против CEACAM связывается с CEACAM-5, как описано, например, в Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529 (DOI:10:1371/journal.pone.0021146), или перекрестно реагирует с CEACAM-1 и CEACAM-5, как описано, например, в WO2013/054331 и US2014/0271618.
Не желая быть связанными какой-либо теорией, полагают, что клеточные молекулы адгезии раково-эмбрионального антигена (CEACAM), такие как CEACAM-1 и CEACAM-5, по меньшей мере, частично, опосредуют ингибирование противоопухолевого иммунного ответа (см. например, Markel et al. J Immunol. 2002 Mar 15;168(6):2803-10; Markel et al. J Immunol. 2006 Nov 1;177(9):6062-71; Markel et al. Immunology. 2009 Feb;126(2):186-200; Markel et al. Cancer Immunol Immunother. 2010 Feb;59(2):215-30; Ortenberg et al. Mol Cancer Ther. 2012 Jun;11(6):1300-10; Stern et al. J Immunol. 2005 Jun 1;174(11):6692-701; Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529). Например, CEACAM-1 описывают как гетерофильный лиганд TIM-3, играющий роль в TIM-3-опосредованной T-клеточной толерантности и истощении (см. например, WO2014/022332; Huang, et al. (2014) Nature doi:10.1038/nature13848). В вариантах осуществления показано, что совместная блокада CEACAM-1 и TIM-3 повышает противоопухолевый иммунный ответ в моделях ксенотрансплантата колоректального рака (см. например, WO2014/022332; Huang, et al. (2014), выше). В других вариантах осуществления совместная блокада CEACAM-1 и PD-1 снижает T-клеточную толерантность, как описывают, например, в WO2014/059251. Таким образом, ингибиторы CEACAM можно использовать с другими иммуномодуляторами, представленными в настоящем описании (например, ингибиторами против PD-1 и/или против TIM-3), для повышения иммунного ответа против злокачественного новообразования, например, меланомы, рака легких (например, NSCLC), рака мочевого пузыря, рака толстого кишечника, рака яичников и других злокачественных новообразований, как представлено в настоящем описании.
LAG3 (ген активации лимфоцитов-3 или CD223) является молекулой поверхности клетки, экспрессирующейся на активированных T-клетках и B-клетках, которая, как показано, играет роль в истощении CD8+ T-клеток. Антитела, фрагменты антител и другие ингибиторы LAG3 и его лиганды доступны в этой области и их можно использовать в комбинации с CAR CD19 или CAR BCMA, представленными в настоящем описании. Например, BMS-986016 (Bristol-Myers Squib) является моноклональным антителом против LAG3. IMP701 (Immutep) является антагонистическим антителом против LAG3, и IMP731 (Immutep и GlaxoSmithKline) является истощающим LAG3 антителом. Другие ингибиторы LAG3 включают IMP321 (Immutep), являющийся рекомбинантным слитым белком растворимой части LAG3 и Ig, связывающимся с молекулами MHC класса II и активирующим антигенпредставляющие клетки (APC). Другие антитела описывают, например, в WO2010/019570.
В некоторых вариантах осуществления средство, повышающее активность CAR-экспрессирующей клетки, может являться, например, слитым белком, содержащим первый домен и второй домен, где первый домен является ингибиторной молекулой или его фрагментом, и второй домен является полипептидом, ассоциированным с положительным сигналом, например, полипептидом, содержащим внутриклеточный сигнальный домен, как представлено в настоящем описании. В некоторых вариантах осуществления полипептид, ассоциированный с положительным сигналом, может включать костимуляторный домен CD28, CD27, ICOS, например, внутриклеточный сигнальный домен CD28, CD27 и/или ICOS и/или первичный сигнальный домен, например, из CD3 дзета, например, представленный в настоящем описании. В одном из вариантов осуществления слитый белок экспрессируется той же клеткой, экспрессирующей CAR. В другом варианте осуществления слитый белок экспрессируется клеткой, например, T-клеткой или NK-клеткой, не экспрессирующей CAR против BCMA.
В одном из вариантов осуществления средство, повышающее активность CAR-экспрессирующей клетки, представленной в настоящем описании, является miR-17-92.
В одном из вариантов осуществления средство, повышающее активность CAR-экспрессирующей клетки, представленной в настоящем описании, является цитокином. Цитокины обладают важными функциями, относящимися к экспансии, дифференцировке, выживаемости и гомеостазу T-клеток. Цитокины, которые можно вводить индивидууму, которому вводят CAR-экспрессирующие клетки, представленные в настоящем описании, включают: ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-15, ИЛ-18 и ИЛ-21 или их комбинацию. В предпочтительных вариантах осуществления вводимый цитокин является ИЛ-7, ИЛ-15, ИЛ-21 или их комбинацией. Цитокин можно вводить раз в сутки или более раз в сутки, например, дважды в сутки, три раза в сутки или четыре раза в сутки. Цитокин можно вводить в течение нескольких дней, например, цитокин вводят в течение 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 3 недель или 4 недель. Например, цитокин вводят один раз в сутки в течение 7 дней.
В вариантах осуществления цитокин вводят в комбинации с CAR-экспрессирующими T-клетками. Цитокин можно вводить одновременно с CAR-экспрессирующими T-клетками, например, вводить в один и тот же день. Цитокин можно получать в той же фармацевтической композиции, что и CAR-экспрессирующие T-клетки, или можно получать в отдельных фармацевтических композициях. Альтернативно, цитокин можно вводить вскоре после введения CAR-экспрессирующих T-клеток, например, через 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней или 7 дней после введения CAR-экспрессирующих T-клеток. В вариантах осуществления, в которых цитокин вводят по схеме введения, занимающей несколько дней, первый день схемы введения цитокина может являться тем же днем, что и день введения CAR-экспрессирующих T-клеток, или первый день схемы введения цитокина может быть через 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней или 7 дней после введения CAR-экспрессирующих T-клеток. В одном из вариантов осуществления в первый день индивидууму вводят CAR-экспрессирующие T-клетки и во второй день вводят цитокин один раз в сутки в течение следующих 7 дней. В предпочтительном варианте осуществления цитокин для введения в комбинации с CAR-экспрессирующими T-клетками является ИЛ-7, ИЛ-15 или ИЛ-21.
В других вариантах осуществления цитокин вводят через период времени после введения CAR-экспрессирующих клеток, например, по меньшей мере через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год или более после введения CAR-экспрессирующих клеток. В одном из вариантов осуществления цитокин вводят после оценки ответа индивидуума на CAR-экспрессирующие клетки. Например, индивидууму вводят CAR-экспрессирующие клетки в соответствии со схемами введения и лечения, представленными в настоящем описании. Ответ индивидуума на терапию CAR-экспрессирующими клетками оценивают через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год или более после введения CAR-экспрессирующих клеток любым из способов, представленных в настоящем описании, включая ингибирование роста опухоли, снижение циркулирующих опухолевых клеток или регрессирование опухоли. Индивидуумам, не проявляющим достаточный ответ на терапию CAR-экспрессирующими клетками, можно вводить цитокин. Введение цитокина индивидууму, имеющему субоптимальный ответ на терапию CAR-экспрессирующими клетками, улучшает эффективность CAR-экспрессирующих клеток или противораковую активность. В предпочтительном варианте осуществления цитокин, вводимый после введения CAR-экспрессирующих клеток, является ИЛ-7.
Комбинация с низкой, усиливающей иммунитет дозой ингибитора mTOR
В способах, представленных в настоящем описании, используют низкие, усиливающие иммунитет дозы ингибиторов mTOR, например, аллостерических ингибиторов mTOR, включая рапалоги, такие как RAD001. Введение низкой, усиливающей иммунитет дозы ингибитора mTOR (например, дозы, недостаточной для полной супрессии иммунной системы, но достаточной для улучшения иммунной функции) может оптимизировать свойства иммунных эффекторных клеток, например, T-клеток или CAR-экспрессирующих клеток, у индивидуума. Способы измерения ингибирования mTOR, дозы, схемы лечения и подходящие фармацевтические композиции описывают в патентной заявке США № 2015/01240036, включенной, таким образом, в настоящее описание в качестве ссылки.
В варианте осуществления введение низкой, усиливающей иммунитет дозы ингибитора mTOR приводит к одному или более из следующего:
i) снижению количества PD-1-положительных иммунных эффекторных клеток;
ii) повышению количества PD-1-отрицательных иммунных эффекторных клеток;
iii) повышению соотношения PD-1-отрицательных иммунных эффекторных клеток/PD-1-положительных иммунных эффекторных клеток;
iv) повышению количества наивных T-клеток;
v) повышению экспрессии одного или более из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, предшественниках T-клеток памяти;
vi) снижению экспрессии KLRG1, например, на T-клетках памяти, например, предшественниках T-клеток памяти; или
vii) повышению количества предшественников T-клеток памяти, например, клеток с любой или комбинацией следующих характеристик: повышения CD62Lhigh, повышения CD127high, повышения CD27+, снижения KLRG1 и повышения BCL2;
и где любое из указанного выше, например, i), ii), iii), iv), v), vi) или vii), происходит, например, по меньшей мере, транзиторно, например, по сравнению с неподвергнутым лечению индивидуумом.
В другом варианте осуществления введение низкой, усиливающей иммунитет дозы ингибитора mTOR приводит к повышенной или пролонгированной пролиферации или выживаемости CAR-экспрессирующих клеток, например, в культуре или у индивидуума, например, по сравнению с необработанными CAR-экспрессирующими клетками или неподвергнутым лечению индивидуумом. В вариантах осуществления повышенная пролиферация или выживаемость ассоциирована с повышением количества CAR-экспрессирующих клеток. Способы измерения повышенной или пролонгированной пролиферации описывают в примерах 15 и 16. В другом варианте осуществления введение низкой, усиливающей иммунитет дозы ингибитора mTOR приводит к повышенному уничтожению злокачественных клеток CAR-экспрессирующими клетками, например, в культуре или у индивидуума, например, по сравнению с необработанными CAR-экспрессирующими клетками или неподвергнутым лечению индивидуумом. В вариантах осуществления повышенный цитолиз злокачественных клеток ассоциирован со снижением объема опухоли. Способы измерения повышенного цитолиза злокачественных клеток представлены в настоящем описании, например, в примерах 2, 5-6, 8 и 13. В одном из вариантов осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, представленную в настоящем описании, вводят в комбинации с низкой, усиливающей иммунитет дозой ингибитора mTOR, например, аллостерического ингибитора mTOR, например, RAD001, или каталитического ингибитора mTOR. Например, введение низкой, усиливающей иммунитет дозы ингибитора mTOR можно начинать перед введением CAR-экспрессирующей клетки, представленной в настоящем описании, завершать перед введением CAR-экспрессирующей клетки, представленной в настоящем описании, начинать одновременно с введением CAR-экспрессирующей клетки, представленной в настоящем описании, оно может перекрываться с введением CAR-экспрессирующей клетки, представленной в настоящем описании, или его можно продолжать после введения CAR-экспрессирующей клетки, представленной в настоящем описании.
Альтернативно или дополнительно, посредством введения низкой, усиливающей иммунитет дозы ингибитора mTOR можно оптимизировать иммунные эффекторные клетки, подлежащие конструированию для экспрессии молекулы CAR, представленной в настоящем описании. В таких вариантах осуществления введение низкой, усиливающей иммунитет дозы ингибитора mTOR, например, аллостерического ингибитора, например, RAD001, или каталитического ингибитора, начинают или завершают после сбора иммунных эффекторных клеток, например, T-клеток или NK-клеток, подлежащих конструированию для экспрессии молекулы CAR, представленной в настоящем описании, из индивидуума.
В другом варианте осуществления иммунные эффекторные клетки, например, T-клетки или NK-клетки, подлежащие конструированию для экспрессии молекулы CAR, представленной в настоящем описании, например, после забора у индивидуума, или CAR-экспрессирующие иммунные эффекторные клетки, например, T-клетки или NK-клетки, например, перед введением индивидууму, можно культивировать в присутствие низкой, усиливающей иммунитет дозы ингибитора mTOR.
В варианте осуществления введение индивидууму низкой, усиливающей иммунитет дозы ингибитора mTOR включает введение, например, один раз в неделю, например, в лекарственной форме с немедленным высвобождением от 0,1 до 20, от 0,5 до 10, от 2,5 до 7,5, от 3 до 6 или приблизительно 5 мг RAD001 или его биоэквивалентной дозы. В варианте осуществления введение индивидууму низкой, усиливающей иммунитет дозы ингибитора mTOR включает введение, например, один раз в неделю, например, в лекарственной форме с замедленным высвобождением от 0,3 до 60, от 1,5 до 30, от 7,5 до 22,5, от 9 до 18 или приблизительно 15 мг RAD001 или его биоэквивалентной дозы.
В варианте осуществления доза ингибитора mTOR ассоциирована с ингибированием mTOR или обеспечивает ингибирование mTOR по меньшей мере на 5, но не более 90%, по меньшей мере на 10, но не более 90%, по меньшей мере на 15,, но не более 90%, по меньшей мере на 20, но не более 90%, по меньшей мере на 30, но не более 90%, по меньшей мере на 40, но не более 90%, по меньшей мере на 50, но не более 90%, по меньшей мере на 60, но не более 90%, по меньшей мере на 70, но не более 90%, по меньшей мере на 5, но не более 80%, по меньшей мере на 10, но не более 80%, по меньшей мере на 15, но не более 80%, по меньшей мере на 20, но не более 80%, по меньшей мере на 30, но не более 80%, по меньшей мере на 40, но не более 80%, по меньшей мере на 50, но не более 80%, по меньшей мере на 60, но не более 80%, по меньшей мере на 5, но не более 70%, по меньшей мере на 10, но не более 70%, по меньшей мере на 15, но не более 70%, по меньшей мере на 20, но не более 70%, по меньшей мере на 30, но не более 70%, по меньшей мере на 40, но не более 70%, по меньшей мере на 50, но не более 70%, по меньшей мере на 5, но не более 60%, по меньшей мере на 10, но не более 60%, по меньшей мере на 15, но не более 60%, по меньшей мере на 20, но не более 60%, по меньшей мере на 30, но не более 60%, по меньшей мере на 40, но не более 60%, по меньшей мере на 5, но не более 50%, по меньшей мере на 10, но не более 50%, по меньшей мере на 15, но не более 50%, по меньшей мере на 20, но не более 50%, по меньшей мере на 30, но не более 50%, по меньшей мере на 40, но не более 50%, по меньшей мере на 5, но не более 40%, по меньшей мере на 10, но не более 40%, по меньшей мере на 15, но не более 40%, по меньшей мере на 20, но не более 40%, по меньшей мере на 30, но не более 40%, по меньшей мере на 35, но не более 40%, по меньшей мере на 5, но не более 30%, по меньшей мере на 10, но не более 30%, по меньшей мере на 15, но не более 30%, по меньшей мере на 20, но не более 30% или по меньшей мере на 25, но не более 30%.
В варианте осуществления введение индивидууму низкой, усиливающей иммунитет дозы ингибитора mTOR включает введение, например, один раз в неделю, например, в лекарственной форме с немедленным высвобождением от 0,1 до 20, от 0,5 до 10, от 2,5 до 7,5, от 3 до 6 или приблизительно 5 мг RAD001 или его биоэквивалентной дозы. В варианте осуществления введение индивидууму низкой, усиливающей иммунитет дозы ингибитора mTOR включает введение, например, один раз в неделю, например, в лекарственной форме с замедленным высвобождением от 0,3 до 60, от 1,5 до 30, от 7,5 до 22,5, от 9 до 18 или приблизительно 15 мг RAD001 или его биоэквивалентной дозы.
Степень ингибирования mTOR можно выражать в виде степени ингибирования киназы P70 S6, или она может соответствовать ей, например, степень ингибирования mTOR можно определять по уровню снижения киназной активности P70 S6, например, по снижению фосфорилирования субстрата киназы P70 S6. Уровень ингибирования mTOR можно оценивать различными способами, такими как измерение киназной активности P70 S6 с помощью анализа Boulay, как описано в патентной заявке США № 2015/01240036, включенной, таким образом, в настоящее описание в качестве ссылки, или как описано в патенте США № 7727950, включенном, таким образом, в настоящее описание в качестве ссылки, измерение уровня фосфорилированного S6 посредством вестерн-блоттинга или оценка изменения соотношения PD1-отрицательных иммунных эффекторных клеток и PD1-положительных иммунных эффекторных клеток.
Как применяют в настоящем описании, термин "ингибитор mTOR" относится к соединению, или лиганду, или его фармацевтически приемлемой соли, ингибирующим киназу mTOR в клетке. В варианте осуществления ингибитор mTOR является аллостерическим ингибитором. Аллостерические ингибиторы mTOR включают нейтральное трициклическое соединение рапамицин (сиролимус), родственные рапамицину соединения, являющиеся соединениями, имеющими структурное и функциональное сходство с рапамицином, включая, например, производные рапамицина, аналоги рапамицина (также обозначаемые как рапалоги) и другие макролидные соединения, ингибирующие активность mTOR. В варианте осуществления ингибитор mTOR является каталитическим ингибитором.
Рапамицин является известным макролидным антибиотиком, продуцирующим Streptomyces hygroscopicus, имеющим структуру, представленную формулой A.
 (A)
(A)
См., например, McAlpine, J.B., et al., J. Antibiotics (1991) 44: 688; Schreiber, S.L., et al., J. Am. Chem. Soc. (1991) 113: 7433; патент США № 3929992. Существует множество схем нумерации, предложенных для рапамицина. Во избежание путаницы, когда конкретные аналоги рапамицина называют в настоящем описании, названия дают со ссылкой на рапамицин с использованием схемы нумерации по формуле A.
Аналогами рапамицина, применимыми в настоящем изобретении, являются, например, O-замещенные аналоги, в которых гидроксильную группу в циклогексильном кольце рапамицина заменяют OR1, в котором R1 является гидроксиалкилом, гидроксиалкоксиалкилом, ациламиноалкилом или аминоалкилом, например, RAD001, также известный как эверолимус, как описано в US5665772 и WO94/09010, содержание каждого из которых включено в настоящее описание в качестве ссылки.
Другие подходящие аналоги рапамицина включают аналоги, замещенные в положении 26 или 28. Аналог рапамицина может являться эпимером аналога, указанного выше, в частности, эпимером аналога, замещенного в положении 40, 28 или 26, и, необязательно, его можно дополнительно гидрогенизировать, например, как описано в US6015815, WO95/14023 и WO99/15530, содержание которых включено в настоящее описание в качестве ссылок, например, ABT578, также известный как зотаролимус, или аналог рапамицина, описываемый в US7091213, WO98/02441 и WO01/14387, содержание которых включено в настоящее описание в качестве ссылок, например, AP23573, также известный как ридафоролимус.
Примеры аналогов рапамицина, пригодных для использования в настоящем изобретении, из US5665772, включают, в качестве неограничивающих примеров, 40-O-бензил-рапамицин, 40-O-(4'-гидроксиметил)бензил-рапамицин, 40-O-[4'-(1,2-дигидроксиэтил)]бензил-рапамицин, 40-O-аллил-рапамицин, 40-O-[3'-(2,2-диметил-1,3-диоксолан-4(S)-ил)-проп-2'-ен-1'-ил]-рапамицин, (2'E,4'S)-40-O-(4',5'-дигидроксипент-2'-ен-1'-ил)-рапамицин, 40-O-(2-гидрокси)этоксикарбонилметил-рапамицин, 40-O-(2-гидрокси)этил-рапамицин, 40-O-(3-гидрокси)пропил-рапамицин, 40-O-(6-гидрокси)гексил-рапамицин, 40-O-[2-(2-гидрокси)этокси]этил-рапамицин, 40-O-[(3S)-2,2-диметилдиоксолан-3-ил]метил-рапамицин, 40-O-[(2S)-2,3-дигидроксипроп-1-ил]-рапамицин, 40-O-(2-ацетокси)этил-рапамицин, 40-O-(2-никотиноилокси)этил-рапамицин, 40-O-[2-(N-морфолино)ацетокси]этил-рапамицин, 40-O-(2-N-имидазолилацетокси)этил-рапамицин, 40-O-[2-(N-метил-N'-пиперазинил)ацетокси]этил-рапамицин, 39-O-десметил-39,40-O,O-этилен-рапамицин, (26R)-26-дигидро-40-O-(2-гидрокси)этил-рапамицин, 40-O-(2-аминоэтил)-рапамицин, 40-O-(2-ацетаминоэтил)-рапамицин, 40-O-(2-никотинамидоэтил)-рапамицин, 40-O-(2-(N-метил-имидазо-2'-илкарбоэтоксамидо)этил)-рапамицин, 40-O-(2-этоксикарбониламиноэтил)-рапамицин, 40-O-(2-толилсульфонамидоэтил)-рапамицин и 40-O-[2-(4',5'-дикарбоэтокси-1',2',3'-триазол-1'-ил)-этил]-рапамицин.
Известны другие аналоги рапамицина, применимые в настоящем изобретении, которые являются аналогами, в которых гидроксильную группу в циклогексильном кольце рапамицина и/или гидроксигруппу в положении 28 заменяют гидроксиэфирной группой, например, аналоги рапамицина, обнаруживаемые в USRE44768, например темсиролимус.
Другие аналоги рапамицина, применимые в настоящем изобретении, включают аналоги, в которых метоксигруппу в положении 16 заменяют другим заместителем, предпочтительно (необязательно гидрокси-замещенной) алкинилоксигруппой, бензилом, ортометоксибензилом или хлорбензилом, и/или в которых метоксигруппу в положении 39 удаляют вместе с углеродом 39 таким образом, что циклогексильное кольцо рапамицина становится циклопентильным кольцом без метоксигруппы в положении 39, например, как описано в WO95/16691 и WO96/41807, содержание которых включено в настоящее описание в качестве ссылок. Аналоги можно дополнительно модифицировать таким образом, что гидроксигруппа в положении 40 рапамицина является алкилированной, и/или 32-карбонил является восстановленным.
Аналоги рапамицина из WO95/16691 включают, в качестве неограничивающих примеров, 16-деметокси-16-(пент-2-инил)окси-рапамицин, 16-деметокси-16-(бут-2-инил)окси-рапамицин, 16-деметокси-16-(пропаргил)окси-рапамицин, 16-деметокси-16-(4-гидрокси-бут-2-инил)окси-рапамицин, 16-деметокси-16-бензилокси-40-O-(2-гидроксиэтил)-рапамицин, 16-деметокси-16-бензилокси-рапамицин, 16-деметокси-16-орто-метоксибензил-рапамицин, 16-деметокси-40-O-(2-метоксиэтил)-16-пент-2-инил)окси-рапамицин, 39-деметокси-40-дезокси-39-формил-42-нор-рапамицин, 39-деметокси-40-дезокси-39-гидроксиметил-42-нор-рапамицин, 39-деметокси-40-дезокси-39-карбокси-42-нор-рапамицин, 39-деметокси-40-дезокси-39-(4-метил-пиперазин-1-ил)карбонил-42-нор-рапамицин, 39-деметокси-40-дезокси-39-(морфолин-4-ил)карбонил-42-нор-рапамицин, 39-деметокси-40-дезокси-39-[N-метил,N-(2-пиридин-2-ил-этил)]карбамоил-42-нор-рапамицин и 39-деметокси-40-дезокси-39-(p-толуолсульфонилгидразонометил)-42-нор-рапамицин.
Аналоги рапамицина из WO96/41807 включают, в качестве неограничивающих примеров, 32-дезоксо-рапамицин, 16-O-пент-2-инил-32-дезоксо-рапамицин, 16-O-пент-2-инил-32-дезоксо-40-O-(2-гидрокси-этил)-рапамицин, 16-O-пент-2-инил-32-(S)-дигидро-40-O-(2-гидроксиэтил)-рапамицин, 32(S)-дигидро-40-O-(2-метокси)этил-рапамицин и 32(S)-дигидро-40-O-(2-гидроксиэтил)-рапамицин.
Другим подходящим аналогом рапамицина является умиролимус, как описано в US2005/0101624, содержание которой включено в настоящее описание в качестве ссылки.
RAD001, также известный как эверолимус (Afinitor®), имеет химическое название (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-дигидрокси-12-{(1R)-2-[(1S,3R,4R)-4-(2-гидроксиэтокси)-3-метоксициклогексил]-1-метилэтил}-19,30-диметокси-15,17,21,23,29,35-гексаметил-11,36-диокса-4-аза-трицикло[30.3.1.04.9]гексатриаконта-16,24,26,28-тетраен-2,3,10,14,20-пентаон, как описано в US5665772 и WO94/09010, содержание каждого из которых включено в настоящее описание в качестве ссылки.
Дополнительные примеры аллостерических ингибиторов mTOR включают сиролимус (рапамицин, AY-22989), 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]-рапамицин (также известный как темсиролимус или CCI-779) и ридафоролимус (AP-23573/MK-8669). Другие примеры аллостерических ингибиторов mTOR включают зотаролимус (ABT578) и умиролимус.
Альтернативно или дополнительно, обнаружено, что каталитические, АТФ-конкурентные ингибиторы mTOR напрямую направленно воздействуют на киназный домен mTOR и воздействуют на mTORC1 и mTORC2. Они также являются более эффективными ингибиторами mTORC1, чем такие аллостерические ингибиторы mTOR, как рапамицин, т.к. они модулируют рапамицин-резистентные последствия действия mTORC1, такие как фосфорилирование 4EBP1-T37/46 и кэп-зависимая трансляция.
Каталитические ингибиторы включают: BEZ235 или 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидро-имидазо[4,5-c]хинолин-1-ил)-фенил]-пропионитрил или его монотозилатную соль (синтез BEZ235 описывают в WO2006/122806), CCG168 (также известный как AZD-8055, Chresta, C.M., et al., Cancer Res, 2010, 70(1), 288-298) имеющий химическое название {5-[2,4-бис-((S)-3-метил-морфолин-4-ил)-пиридо[2,3d]пиримидин-7-ил]-2-метокси-фенил}-метанол, 3-[2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил]-N-метилбензамид (WO09104019), 3-(2-аминобензo[d]оксазол-5-ил)-1-изопропил-1H-пиразоло[3,4-d]пиримидин-4-амин (WO10051043 и WO2013023184), N-(3-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид (WO07044729 и WO12006552), PKI-587 (Venkatesan, A.M., J. Med.Chem., 2010, 53, 2636-2645), имеющий химическое название 1-[4-[4-(диметиламино)пиперидин-1-карбонил]фенил]-3-[4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил]мочевина, GSK-2126458 (ACS Med. Chem. Lett., 2010, 1, 39-43), имеющий химическое название 2,4-дифтор-N-{2-метокси-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид, 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амин (WO10114484) и (E)-N-(8-(6-амино-5-(трифторметил)пиридин-3-ил)-1-(6-(2-цианопропан-2-ил)пиридин-3-ил)-3-метил-1H-имидазо[4,5-c]хинолин-2(3H)-илиден)цианамид (WO12007926).
Дополнительные примеры каталитических ингибиторов mTOR включают 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-он (WO2006/122806) и Ku-0063794 (Garcia-Martinez JM, et al.,Biochem J., 2009, 421(1), 29-42). Ku-0063794 является специфическим ингибитором мишени рапамицина в клетках млекопитающих (mTOR). WYE-354 является другим примером каталитического ингибитора mTOR (Yu K, et al. (2009). Biochemical, Cellular, and In vivo Activity of Novel ATP-Competitive and Selective Inhibitors of the Mammalian Target of Rapamycin. Cancer Res. 69(15): 6232-6240).
Ингибиторы mTOR, применимые по настоящему изобретению, также включают пролекарства, производные, фармацевтически приемлемые соли или аналоги любого из указанных выше.
Ингибиторы mTOR, такие как RAD001, можно составлять для доставки с учетом способов, хорошо известных в этой области, с учетом конкретных доз, представленных в настоящем описании. В частности, в патенте США № 6004973 (включенном в настоящее описание в качестве ссылки) представлены примеры составов, применимых с ингибиторами mTOR, представленными в настоящем описании.
Способы и биомаркеры для оценки эффективности CAR или пригодности образцов
В другом аспекте изобретение относится к способу оценки или мониторинга эффективности терапии CAR-экспрессирующими клетками (например, терапии BCMACAR) у индивидуума (например, индивидуума, имеющего злокачественное новообразование, например, гемобластоз) или пригодности образца (например, аферезного образца) для терапии CAR (например, терапии BCMACAR). Способ включает определение значения эффективности терапии CAR или пригодности образца, где указанное значение свидетельствует об эффективности или пригодности терапии CAR-экспрессирующими клетками.
В вариантах осуществления значение эффективности терапии CAR или пригодности образца включает измерение одного, двух, трех, четырех, пяти, шести или более (всех) из следующего:
(i) уровня или активности одного, двух, трех или более (например, всех) из покоящихся TEFF-клеток, покоящихся TREG-клеток, T-клеток более ранних стадий развития (например, CD4 или CD8 клеток более ранних стадий развития или гамма/дельта T-клеток), ранних T-клеток памяти или их комбинации в образце (например, аферезном образце или образце произведенного продукта CAR-экспрессирующих клеток);
(ii) уровня или активности одного, двух, трех или более (например, всех) из активированных TEFF-клеток, активированных TREG клетки, T-клеток более поздних стадий развития (например, CD4 или CD8 клеток более поздних стадий развития), поздних T-клеток памяти или их комбинации в образце (например, аферезном образце или образце произведенного продукта CAR-экспрессирующих клеток);
(iii) уровня или активности маркера истощения иммунных клеток, например, одного, двух или более ингибиторов иммунных контрольных точек (например, PD-1, PD-L1, TIM-3 и/или LAG-3) в образце (например, аферезном образце или образце произведенного продукта CAR-экспрессирующих клеток). В одном из вариантов осуществления иммунная клетка имеет истощенный фенотип, например, коэкспрессирует по меньшей мере два маркера истощения, например, коэкспрессирует PD-1 и TIM-3. В других вариантах осуществления иммунная клетка имеет истощенный фенотип, например, коэкспрессирует, по меньшей мере, два маркера истощения, например, коэкспрессирует PD-1 и LAG-3;
(iv) уровня или активности CD27 и/или CD45RO- (например, CD27+ CD45RO-) иммунных эффекторных клеток, например, в популяции CD4+ или CD8+ T-клеток, в образце (например, аферезном образце или образце произведенного продукта CAR-экспрессирующих клеток);
(v) уровня или активности одного, двух, трех, четырех, пяти, десяти, двадцати или более биомаркеров, выбранных из CCL20, ИЛ-17a и/или ИЛ-6, PD-1, PD-L1, LAG-3, TIM-3, CD57, CD27, CD122, CD62L, KLRG1;
(vi) уровня или активности цитокина (например, качества репертуара цитокинов) в образце продукта CAR-экспрессирующей клетки, например, образце продукта BCMA-экспрессирующей клетки; или
(vii) эффективности трансдукции CAR-экспрессирующей клетки в образце произведенного продукта CAR-экспрессирующих клеток.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, терапия CAR-экспрессирующими клетками включает множество (например, популяцию) CAR-экспрессирующих иммунных эффекторных клеток, например, множество (например, популяцию) T-клеток или NK-клеток или их комбинацию. В одном из вариантов осуществления терапия CAR-экспрессирующими клетками является терапией BCMACAR.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, измерение одного или более из (i)-(vii) осуществляют в аферезном образце, полученном из индивидуума. Аферезный образец можно оценивать перед инфузией или реинфузией.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, измерение одного или более из (i)-(vii) осуществляют в образце произведенного продукта CAR-экспрессирующих клеток, например, образце продукта BCMACAR-экспрессирующих клеток. Произведенный продукт CAR-экспрессирующих клеток можно оценивать перед инфузией или реинфузией.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, индивидуума оценивают до, в течение или после проведения терапии CAR-экспрессирующими клетками.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, посредством измерения одного или более из (i)-(vii) оценивают профиль одного или более из экспрессии гена, проточной цитометрии или экспрессии белка.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, способ дополнительно включает идентификацию индивидуума как пациента с ответом на лечение, пациента без ответа на лечение, пациента с рецидивом или пациента без рецидива с учетом измерения одного или более из (i)-(vii).
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с ответом на лечение (например, пациент с полным ответом на лечение) имеет или идентифицирован как имеющий более высокий уровень или активность одного, двух или более (всех) из GZMK, PPF1BP2 или наивных T-клеток по сравнению с пациентом без ответа на лечение.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент без ответа на лечение имеет или идентифицирован как имеющий более высокий уровень или активность одного, двух, трех, четырех, пяти, шести, семи или более (например, всех) из ИЛ-22, ИЛ-2RA, ИЛ-21, IRF8, ИЛ-8, CCL17, CCL22, эффекторных T-клеток или регуляторных T-клеток по сравнению с пациентом с ответом на лечение.
В варианте осуществления пациент с рецидивом является пациентом, имеющим или идентифицированным как имеющий повышенный уровень экспрессии одного или более (например, 2, 3, 4 или всех) из следующих генов по сравнению с пациентами без рецидива: MIR199A1, MIR1203, uc021ovp, ITM2C и HLA-DQB1, и/или сниженные уровни экспрессии одного или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или всех) из следующих генов по сравнению с пациентами без рецидива: PPIAL4D, TTTY10, TXLNG2P, MIR4650-1, KDM5D, USP9Y, PRKY, RPS4Y2, RPS4Y1, NCRNA00185, SULT1E1 и EIF1AY.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с полным ответом на лечение имеет или идентифицирован как имеющий более высокую, например статистически более высокую, процентную долю CD8+ T-клеток по сравнению с референсным значением, например, процентной долей CD8+ T-клеток у пациента без ответа на лечение.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с полным ответом на лечение имеет или идентифицирован как имеющий более высокую процентную долю CD27+ CD45RO- иммунных эффекторных клеток, например, в CD8+ популяции, по сравнению с референсным значением, например, количеством CD27+ CD45RO- иммунных эффекторных клеток у пациента без ответа на лечение.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с полным ответом на лечение или пациент с частичным ответом на лечение имеет или идентифицирован как имеющий более высокую, например, статистически более высокую, процентную долю CD4+ T-клеток по сравнению с референсным значением, например, процентной долей CD4+ T-клеток у пациента без ответа на лечение.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с полным ответом на лечение имеет или идентифицирован как имеющий более высокую процентную долю одного, двух, трех или более (например, всех) из покоящихся TEFF-клеток, покоящихся TREG-клеток, T-клеток более ранних стадий развития (например, CD4 или CD8 клеток более ранних стадий развития или гамма/дельта T-клеток), ранних T-клеток памяти или их комбинации по сравнению с референсным значением, например, покоящихся TEFF-клеток, покоящихся TREG-клеток, T-клеток более ранних стадий развития (например, CD4 или CD8 клеток более ранних стадий развития) или ранних T-клеток памяти у пациента без ответа на лечение количества.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент без ответа на лечение имеет или идентифицирован как имеющий более высокую процентную долю одного, двух, трех или более (например, всех) из активированных TEFF-клеток, активированных TREG-клеток, T-клеток на более поздних стадиях развития (например, CD4 или CD8 клеток на более поздних стадиях развития), поздних T-клеток памяти или их комбинации по сравнению с референсным значением, например, количества активированных TEFF-клеток, активированных TREG-клеток, T-клеток на более поздних стадиях развития (например, CD4 или CD8 клеток на более поздних стадиях развития) или поздних T-клеток памяти у пациента с ответом на лечение.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент без ответа на лечение имеет или идентифицирован как имеющий более высокую процентную долю маркера истощения иммунных клеток, например, одного, двух или более ингибиторов иммунных контрольных точек (например, PD-1, PD-L1, TIM-3 и/или LAG-3). В одном из вариантов осуществления пациент без ответа на лечение имеет или идентифицирован как имеющий более высокую процентную долю PD-1-, PD-L1- или LAG-3-экспрессирующих иммунных эффекторных клеток (например, CD4+ T-клеток и/или CD8+ T-клеток) (например, CAR-экспрессирующих CD4+-клеток и/или CD8+ T-клеток) по сравнению с процентной долей PD-1- или LAG-3-экспрессирующих иммунных эффекторных клеток у пациента с ответом на лечение.
В одном из вариантов осуществления пациент без ответа на лечение имеет или идентифицирован как имеющий более высокую процентную долю иммунных клеток, имеющих истощенный фенотип, например, иммунных клеток, коэкспрессирующих по меньшей мере два маркера истощения, например, коэкспрессирующих PD-1, PD-L1 и/или TIM-3. В других вариантах осуществления пациент без ответа на лечение имеет или идентифицирован как имеющий более высокую процентную долю иммунных клеток, имеющих истощенный фенотип, например, иммунных клеток, коэкспрессирующих по меньшей мере два маркера истощения, например, коэкспрессирует PD-1 и LAG-3.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент без ответа на лечение имеет или идентифицирован как имеющий более высокую процентную долю PD-1/ PD-L1+/LAG-3+ клеток в популяции CAR-экспрессирующих клеток (например, популяции BCMACAR+ клеток) по сравнению с пациентом с ответом (например, пациентом с полным ответом) на терапию CAR-экспрессирующими клетками.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с частичным ответом на лечение имеет или идентифицирован как имеющий более высокие процентные доли PD-1/PD-L1+/LAG-3+ клеток, чем у пациента с ответом на лечение, в популяции CAR-экспрессирующих клеток (например, популяции BCMACAR+ клеток).
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент без ответа на лечение имеет или идентифицирован как имеющий истощенный фенотип PD1/PD-L1+ CAR+ и коэкспрессию LAG3 в популяции CAR-экспрессирующих клеток (например, популяции BCMACAR+ клеток).
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент без ответа на лечение имеет или идентифицирован как имеющий более высокую процентную долю PD-1/PD-L1+/TIM-3+ клеток в популяции CAR-экспрессирующих клеток (например, популяции BCMACAR+ клеток) по сравнению с пациентом с ответом на лечение (например, пациентом с полным ответом на лечение).
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с частичным ответом на лечение имеет или идентифицирован как имеющий более высокую процентную долю PD-1/PD-L1+/TIM-3+ клеток, чем пациент с ответом на лечение, в популяции CAR-экспрессирующих клеток (например, популяции BCMACAR+ клеток).
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, наличие CD8+ CD27+ CD45RO- T-клеток в аферезном образце является положительным прогностическим фактором ответа индивидуума на терапию CAR-экспрессирующими клетками (например, терапию BCMACAR).
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, высокая процентная доля PD1+ CAR+ и LAG3+ или TIM3+ T-клеток в аферезном образце является плохим прогностическим фактором ответа индивидуума на терапию CAR-экспрессирующими клетками (например, терапию BCMACAR).
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, пациент с ответом на лечение (например, пациент с полным или частичным ответом на лечение) имеет один, два, три или более (или все) из следующих профилей:
(i) имеет более высокое количество CD27+ иммунных эффекторных клеток по сравнению с референсным значением, например, количеством CD27+ иммунных эффекторных клеток у пациента без ответа на лечение;
(ii) (i) имеет более высокое количество CD8+ T-клеток по сравнению с референсным значением, например, количеством CD8+ T-клеток у пациента без ответа на лечение;
(iii) имеет более низкое количество иммунных клеток, экспрессирующих один или более ингибиторов контрольных точек, например, ингибитора контрольных точек, выбранного из PD-1, PD-L1, LAG-3, TIM-3, или KLRG-1, или комбинации по сравнению с референсным значением, например, количеством клеток, экспрессирующих один или более ингибиторов контрольных точек, у пациента без ответа на лечение; или
(iv) имеет более высокое количество одного, двух, трех, четырех или более (всех) из покоящихся TEFF-клеток, покоящихся TREG-клеток, наивных CD4 клеток, нестимулированных клеток памяти, или ранних T-клеток памяти, или их комбинации, по сравнению с референсным значением, например, количество покоящихся TEFF-клеток, покоящихся TREG-клеток, наивных CD4 клеток, нестимулированных клеток памяти или ранних T-клеток памяти у пациента без ответа на лечение.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, уровень или активность цитокинов в (vi) выбраны из одного, двух, трех, четырех, пяти, шести, семи, восьми или более (или всех) цитокинов CCL20/MIP3a, ИЛ-17A, ИЛ-6, ГМ-КСФ, ИФНγ, ИЛ-10, ИЛ-13, ИЛ-2, ИЛ-21, ИЛ-4, ИЛ-5, ИЛ-9, ФНО или их комбинации. Цитокин можно выбирать из одного, двух, трех, четырех или более (всех) из ИЛ-17a, CCL20, ИЛ-2, ИЛ-6 или ФНО. В одном из вариантов осуществления повышенный уровень или активность цитокина, выбранного из одного или обоих из ИЛ-17a и CCL20, свидетельствует о повышенной отвечаемости или сниженном рецидивировании.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, эффективность трансдукции 15% или выше в (vii) свидетельствует о повышенной отвечаемости или сниженном рецидивировании.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, эффективность трансдукции менее 15% в (vii) свидетельствует о сниженной отвечаемости или повышенном рецидивировании.
В вариантах осуществления пациента с ответом на лечение, пациента без ответа на лечение, пациента с рецидивом или пациента без рецидива, идентифицированных способами в настоящем описании, можно дополнительно оценивать согласно клиническим критериям. Например, пациент с полным ответом на лечение является индивидуумом, имеющим или идентифицированным как имеющий заболевание, например, злокачественное новообразование, проявляющим полный ответ на лечение, например, полную ремиссию. Полный ответ можно идентифицировать, например, с использованием NCCN Guidelines® или Cheson et al, J Clin Oncol 17:1244 (1999) и Cheson et al., "Revised Response Criteria for Malignant Lymphoma", J Clin Oncol 25:579-586 (2007) (оба из которых включены в настоящее описание в качестве ссылок в полном объеме), как представлено в настоящем описании. Пациент с частичным ответом на лечение является индивидуумом, имеющим или идентифицированным как имеющий заболевание, например, злокачественное новообразование, проявляющим частичный ответ на лечение, например, частичную ремиссию. Частичный ответ можно идентифицировать, например, с использованием NCCN Guidelines®, или критериев Cheson, как представлено в настоящем описании. Пациент без ответа на лечение является индивидуумом, имеющим или идентифицированным как имеющий заболевание, например, злокачественное новообразование, не проявляющим ответ на лечение, например, пациент имеет стабильное заболевание или прогрессирующее заболевание. Пациента без ответа на лечение можно идентифицировать, например, с использованием NCCN Guidelines® или критериев Cheson, как представлено в настоящем описании.
Альтернативно, или в комбинации со способами, представленными в настоящем описании, в ответ на указанное значение осуществляют одно, два, три, четыре или более из:
проведения, например, пациенту с ответом на лечение или пациенту без рецидива терапии CAR-экспрессирующими клетками;
введения измененной дозы терапии CAR-экспрессирующими клетками;
изменения схемы или режима терапии CAR-экспрессирующими клетками;
введения, например, пациенту без ответа на лечение или пациенту с частичным ответом на лечение дополнительного средства в комбинации с терапией CAR-экспрессирующими клетками, например, ингибитора контрольных точек, например, ингибитора контрольных точек, представленного в настоящем описании;
проведения пациенту без ответа на лечение или пациенту с частичным ответом на лечение терапии, повышающей количество T-клеток более ранних стадий развития у индивидуума перед лечением с использованием терапии CAR-экспрессирующими клетками;
модификации способа производства терапевтического средства для терапии CAR-экспрессирующими клетками, например, обогащение T-клеток более ранних стадий развития перед встраиванием нуклеиновой кислоты, кодирующей CAR, или повышения эффективности трансдукции, например, для индивидуума, идентифицированного в качестве пациента без ответа на лечение или пациента с частичным ответом на лечение;
проведения альтернативной терапии, например, для пациента без ответа на лечение, или пациента с частичным ответом на лечение, или пациента с рецидивом; или,
если индивидуум является или идентифицирован как пациент без ответа на лечение или пациент с рецидивом, снижения популяции TREG клеток и/или генной сигнатуры TREG, например, посредством одного или более из истощения CD25, введения циклофосфамида, антитела против GITR или их комбинации.
В определенных вариантах осуществления индивидуума предварительно лечат антителом против GITR. В определенном варианте осуществления индивидуума лечат антителом против GITR перед инфузией или реинфузией.
Биополимерные способы доставки
В некоторых вариантах осуществления одну или более CAR-экспрессирующих клеток, как представлено в настоящем описании, можно вводить или доставлять индивидууму с помощью биополимерного каркаса, например, биополимерного имплантата. Биополимерные каркасы могут поддерживать или повышать доставку, экспансию и/или распространение CAR-экспрессирующих клеток, представленных в настоящем описании. Биополимерный каркас содержит биосовместимый (например, по существу, не индуцирующий воспалительный или иммунный ответ) и/или биодеградируемый полимер, который может являться природным или синтетическим.
Неограничивающие примеры подходящих биополимеров включают агар, агарозу, альгинат, цемент на основе альгината/фосфата кальция (CPC), бета-галактозидазу (β-GAL), 1,2,3,4,6-пентаацетил-α-D-галактозу, целлюлозу, хитин, хитозан, коллаген, эластин, желатин, гиалуроновую кислоту, коллаген, гидроксиапатит, поли(3-гидроксибутират-co-3-гидрокси-гексаноат) (PHBHHx), полилактид, поликапролактон (PCL), сополимер лактида и гликолида (PLG), полиэтилен оксид (PEO), сополимер молочной и гликолевой кислот (PLGA), полипропиленоксид (PPO), поливиниловый спирт (PVA), шелк, соевый белок и изолят соевого белка в отдельности или в комбинации с любой другой композицией полимера, в любой концентрации и в любом соотношении. Биополимер можно удлинять или модифицировать с использованием молекул, способствующих адгезии или миграции, например, коллаген-имитирующих пептидов, связывающихся с рецептором коллагена на лимфоцитах, и/или стимуляторных молекул для повышения доставки, экспансии или функции, например, противораковой активности, клеток, подлежащих доставке. Биополимерный каркас может являться инъецируемым, например, гелевой, или полутвердой, или твердой композицией.
В некоторых вариантах осуществления CAR-экспрессирующие клетки, представленные в настоящем описании, высевают на биополимерный каркас перед доставкой индивидууму. В вариантах осуществления биополимерный каркас дополнительно содержит одно или более дополнительных терапевтических средств, представленных в настоящем описании (например, другую CAR-экспрессирующую клетку, антитело или низкомолекулярное соединение), или средства, повышающие активность CAR-экспрессирующей клетки, например, встроенной или конъюгированной с биополимерами каркаса. В вариантах осуществления биополимерный каркас инъецируют, например, внутриопухолево, или хирургически имплантируют в опухоль или на близком расстоянии от опухоли, достаточном для опосредования противоопухолевого эффекта. Дополнительные примеры биополимерных композиций и способов их доставки описывают в Stephan et al., Nature Biotechnology, 2015, 33:97-101 и WO2014/110591.
Фармацевтические композиции и способы лечения
Фармацевтические композиции по настоящему изобретению могут содержать CAR-экспрессирующую клетку, например, множество CAR-экспрессирующих клеток, как представлено в настоящем описании, в комбинации с одним или более фармацевтически или физиологически приемлемыми носителями, дилюентами или эксципиентами. Такие композиции могут содержать буферы, такие как нейтральный забуференный физиологический раствор, фосфатно-солевой буфер и т.п., углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит, белки, полипептиды или аминокислоты, такие как глицин, антиоксиданты, хелатирующие средства, такие как ЭДТА или глутатион, адъюванты (например, гидроксид алюминия) и консерванты. Композиции по настоящему изобретению в одном из аспектов составляют для внутривенного введения.
Фармацевтические композиции по настоящему изобретению можно вводить способом, соответствующим заболеванию, подлежащему лечению (или профилактике). Количество и частоту введения будут определять с учетом таких факторов, как состояние пациента и тип и тяжесть заболевания пациента, хотя соответствующие дозы можно определять с помощью клинических испытаний.
В одном из вариантов осуществления фармацевтическая композиция, по существу, не содержит, например, нет детектируемых уровней загрязнений, например, выбранных из группы, состоящей из эндотоксина, микоплазмы, репликационно-компетентного лентивируса (RCL), p24, нуклеиновой кислоты VSV-G, gag ВИЧ, остаточных бус, покрытых антителом против CD3/против CD28, антител мыши, смешанных сывороток человека, бычьего сывороточного альбумина, бычьей сыворотки, компонентов сред для культивирования, клеток для упаковки вектора или плазмидных компонентов, бактерий и грибов. В одном из вариантов осуществления бактерия является по меньшей мере одной, выбранной из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumonia и Streptococcus pyogenes группы A.
Если указано "иммунологически эффективное количество", "противоопухолевое эффективное количество", "опухоле-связывающее эффективное количество" или "терапевтическое количество", точное количество композиций по настоящему изобретению для введения может определять лечащий врач с учетом индивидуальных отличий в возрасте, массе тела, размере опухоли, степени инфицирования или метастазирования и состоянии пациента (индивидуума). Как правило, можно указывать, что фармацевтическую композицию, содержащую T-клетки, представленные в настоящем описании, можно вводить в дозе от 104 до 109 клеток/кг массы тела, в некоторых случаях от 105 до 106 клеток/кг массы тела, включая все целые значения в этих диапазонах. Композиции T-клеток также можно вводить множество раз в этих дозах. Клетки можно вводить способами инфузии, известными в области иммунотерапии (см., например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988).
В определенных аспектах желательным может являться введение индивидууму активированных T-клеток, а затем повторный забор крови (или осуществление афереза), активация T-клеток из него по настоящему изобретению и реинфузия пациенту этих активированных и выращенных T-клеток. Этот способ можно осуществлять множество раз каждые несколько недель. В определенных аспектах T-клетки можно активировать из образцов крови от 10 см3 до 400 см3. В определенных аспектах активируют T-клетки из образцов крови 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3.
Введение индивидууму композиций можно осуществлять любым удобным способом, включая ингаляцию аэрозоля, инъекцию, прием внутрь, переливание, имплантацию или трансплантацию. Композиции, представленные в настоящем описании, можно вводить пациенту трансартериально, подкожно, внутрикожно, внутриопухолево, интранодально, интрамедуллярно, внутримышечно, посредством внутривенной (i.v.) инъекции или интраперитонеально. В одном из аспектов композиции T-клеток по настоящему изобретению вводят пациенту посредством внутрикожной или подкожной инъекции. В одном из аспектов композиции CAR-экспрессирующих клеток (например, T-клеток или NK-клеток) по настоящему изобретению вводят посредством i.v. инъекции. Композиции CAR-экспрессирующих клеток (например, T-клеток или NK-клеток) можно инъецировать непосредственно в опухоль, лимфоузел или очаг инфекции.
В конкретном примере аспекта индивидуумов можно подвергать лейкаферезу, при котором лейкоциты собирают, обогащают или истощают ex vivo для селекции и/или выделения интересующих клеток, например, иммунных эффекторных клеток (например, T-клеток или NK-клеток). Эти изоляты иммунных эффекторных клеток (например, T-клеток или NK-клеток) можно выращивать известными в этой области способами и обрабатывать таким образом, что можно встраивать одну или более конструкций CAR по изобретению, таким образом, получая CAR-экспрессирующую клетку (например, CAR T-клетку или CAR-экспрессирующую NK-клетку) по изобретению. Нуждающихся в этом индивидуумов затем можно подвергать стандартному лечению с использованием химиотерапии высокими дозами с последующей трансплантацией стволовых клеток периферической крови. В определенных аспектах после или одновременно с трансплантацией индивидуумам проводят инфузию выращенных CAR-экспрессирующих клеток (например, CAR T-клеток или NK-клеток) по настоящему изобретению. В дополнительном аспекте выращенные клетки вводят до или после хирургического вмешательства.
В вариантах осуществления индивидууму проводят истощение лимфоцитов, например, перед введением одной или более клеток, экспрессирующих CAR, представленный в настоящем описании, например, BCMA-связывающий CAR, представленный в настоящем описании. В вариантах осуществления истощение лимфоцитов включает введение одного или более из мелфалана, цитоксана, циклофосфамида и флударабина.
Доза указанных выше терапевтических средств, подлежащих введению пациенту, будет варьироваться в зависимости от конкретной природы состояния, подвергаемого лечению, и реципиента лечения. Выбор доз для введения человеку можно осуществлять в соответствии с общепринятыми в этой области практиками. Например, доза CAMPATH, как правило, будет находиться в диапазоне от 1 до приблизительно 100 мг в случае взрослого пациента, как правило, вводимая ежедневно в течение периода от 1 до 30 дней. Предпочтительная суточная доза составляет от 1 до 10 мг в сутки, хотя в некоторых случаях можно использовать более высокие дозы до 40 мг в сутки (описываемые в патенте США № 6120766).
В одном из вариантов осуществления CAR встраивают в иммунные эффекторные клетки (например, T-клетки или NK-клетки), например, с использованием транскрипции in vitro, и индивидууму (например, человеку) проводят исходное введение иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток) по изобретению и одно или более последующих введений иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток) по изобретению, где одно или более последующих введений проводят менее чем через 15 дней, например, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 дня после предыдущего введения. В одном из вариантов осуществления индивидууму (например, человеку) проводят несколько введений иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток) по изобретению в неделю, например, проводят 2, 3 или 4 введения иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток) по изобретению в неделю. В одном из вариантов осуществления индивидууму (например, человеку) проводят несколько введений иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток) в неделю (например, 2, 3 или 4 введений в неделю) (также обозначаемых в настоящем описании как цикл), затем неделю не вводят иммунные эффекторные CAR-клетки (например, T-клетки или NK-клетки), а затем индивидууму проводят одно или более дополнительных введений иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток) (например, несколько введений иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток) в неделю). В другом варианте осуществления индивидууму (например, человеку) проводят несколько циклов введения иммунных эффекторных CAR-клеток (например, T-клеток или NK-клеток), и время между каждым циклом составляет менее 10, 9, 8, 7, 6, 5, 4 или 3 дней. В одном из вариантов осуществления иммунные эффекторные CAR-клетки (например, T-клетки или NK-клетки) вводят через день в течение 3 введений в неделю. В одном из вариантов осуществления иммунные эффекторные CAR-клетки (например, T-клетки или NK-клетки) по изобретению вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или более недель.
В одном из аспектов CAR BCMA-экспрессирующие клетки (например, BCMA CART или CAR BCMA-экспрессирующие NK-клетки) получают с использованием лентивирусных векторов, таких как лентивирус. CAR-экспрессирующие клетки (например, CART или CAR-экспрессирующие NK-клетки), полученные таким способом, будут иметь стабильную экспрессию CAR.
В одном из аспектов CAR-экспрессирующие клетки, например, CART, получают с использованием вирусного вектора, такого как гаммаретровирусный вектор, например, гаммаретровирусный вектор, представленный в настоящем описании. CART, полученные с использованием этих векторов, могут иметь стабильную экспрессию CAR.
В одном из аспектов CAR-экспрессирующие клетки (например, CART или CAR-экспрессирующие NK-клетки) транзиторно экспрессируют векторы CAR в течение 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 дней после трансдукции. Транзиторную экспрессию CAR можно осуществлять посредством доставки вектора с РНК CAR. В одном из аспектов CAR РНК трансдуцируют в клетку, например, T-клетку или NK-клетку, посредством электропорации.
Потенциальной проблемой, которая может возникать у пациентов, которых лечат с использованием транзиторно экспрессирующих CAR-экспрессирующих клеток (например, CART или CAR-экспрессирующих NK-клеток) (в частности, CAR-экспрессирующими клетками, несущими scFv мыши (например, CART или CAR-экспрессирующими NK-клетками)), является анафилаксия после многократного лечения.
Не желая быть связанными этой теорией, полагают, что такой анафилактический ответ может быть вызван развивающимся гуморальным ответом пациента против CAR, т.е. антителами против CAR, имеющими изотип против IgE. Полагают, что продуцирующие антитела клетки пациента подвергаются переключению класса с изотипа IgG (не вызывающего анафилаксию) на изотип IgE, когда есть перерыв в воздействии антигена от десяти до четырнадцати дней.
Если пациент имеет высокий риск развития ответа с образованием антител против CAR в течение транзиторной терапии CAR (такой как получаемая посредством трансдукций РНК), перерывы между инфузиями CAR-экспрессирующих клеток (например, CART или CAR-экспрессирующих NK-клеток) не должны длиться более десяти-четырнадцати дней.
ПРИМЕРЫ
Настоящее изобретение далее подробно описано со ссылкой на следующие экспериментальные примеры. Эти примеры представлены исключительно в иллюстративных целях и не предназначены для ограничения, если не указано иначе. Таким образом, настоящее изобретение никоим образом не следует истолковывать как ограниченное следующими примерами, а скорее его следует истолковывать как включающее любые и все варианты, которые становятся очевидными из руководства, представленного в настоящем описании.
Без дальнейшего описания, полагают, что специалист в этой области, используя предшествующее описание и следующие иллюстративные примеры, может получать и применять соединения по настоящему изобретению и осуществлять на практике заявленные способы. В следующих демонстрационных примерах конкретно указаны различные аспекты настоящего изобретения, и их не следует истолковывать как каким-либо образом ограничивающие остальную часть описания.
Пример 1: BCMA экспрессируется в линиях клеток миеломы и первичных образцах
Анализ экспрессии BCMA в линиях клеток миеломы посредством количественной ПЦР
16 линий клеток злокачественных новообразований человека подвергали скринингу на экспрессию РНК BCMA посредством количественной RT-ПЦР. РНК выделяли с помощью набора RNAqueos-4PCR Kit (Ambion, AM-1914) и кДНК синтезировали с помощью iScript Reverse Transcription Supermix для RT-qPCR (BioRad, 170-8841). Относительное количество копий кДНК BCMA количественно анализировали посредством относительной qPCR (qPCR) с помощью BCMA-специфичных праймеров TaqMan ABI и набора зондов (ABI, Hs03045080, лот: 1139777), праймеров и набора зондов TaqMan GUSB (ABI, Hs99999908_M1, лот: 1093869) для нормализации.
Анализ qPCR показал, что все тестируемые линии клеток MM (U266, NCI H929 и RPMI 8226) экспрессируют BCMA. BCMA также определяли в клетках BJAB и LCL (линии лимфобластоидных B-клеток) и клетках CEM (линии T-лимфобластоидных клеток). Ни одна из других не-MM линий клеток не проявляла детектируемую экспрессию BCMA. Этим анализом РНК дополняют определение белка посредством проточной цитометрии для селекции положительных BCMA-экспрессирующих линий клеток, используемых для оценки. Подробные результаты представлены на фигуре 1A.
Сравнение экспрессии BCMA в плазматических клетках и различных образцах множественной миеломы от пациентов посредством анализа РНК представлен на фигуре 1B.
Анализ экспрессии BCMA в линиях клеток множественной миеломы и первичных образцах посредством проточной цитометрии
Линии клеток множественной миеломы (MM) U266, NCI H929 или RPMI 8226 или первичные образцы от пациентов MM (PB или BM) окрашивали с помощью аффинно очищенных PAb против BCMA/TNFRSF17 человека с фикоэритрином, IgG козы (R&D, FAB193P). Первичные образцы от пациентов с множественной миеломой также окрашивали с помощью красителя Live/dead (LifeTechnologies, L34960), CD45-BV421 (Biolegend, 304032), CD38-APCeF780 (eBioscience, 47-0389-42), CD138-APC (eBioscience, 17-1389-42), CD19-PECY7 (eBioscience, E10328-1632), PerCP-eF710 на лямбда-цепь (eBioscience, 46-9990-42) и на легкую каппа-цепь (eBioscience, 11-9970-42). Данные по окрашенным образцам собирали с использованием цитометра BD Fortessa. Проточный цитометрический анализ осуществляли с использованием Flowjo v10 (Tree Star Inc).
BCMA определяли на поверхности всех 3 линий клеток MM, как показано на фигурах 2A, 2B и 2C. Кроме того, BCMA гомогенно экспрессировался на большинстве клональных (каппа- или лямбда-рестрицированных) плазматических клеток у большинства анализируемых пациентов с MM (9 из 10). (фиг. 2D и 2E). Эти результаты, в значительной степени, подтверждают важность BCMA в качестве мишени при MM.
Проточный цитометрический анализ экспрессии BCMA в нормальных клетках периферической крови, выращенных CD3/CD28 T-клетках и стволовых клетках костного мозга
Для исключения возможной неспецифической экспрессии BCMA в нормальных тканях и на T-клетках, экспрессию BCMA в двух образцах костного мозга (BM) и периферической крови (PB) от добровольных здоровых доноров оценивали посредством проточной цитометрии. Мононуклеарные клетки получали посредством разделения в градиенте фиколл-пака (GE Healthcare). Клетки BM метили красителем Live/dead (LifeTechnologies, L34960), затем окрашивали моноклональными антителами против CD34-APC (eBioscience, 17-0349-42, CD38-PECY7 (eBioscience, 25-0389-42), маркеров гематопоэтического ростка человека mix-FITC (eBioscience, 22-7778-72), CD45RA-APC-eF780 (eBioscience, 47-0458-42, CD90-PerCPCy5,5 (eBioscience, 45-0909-41, CD10-BV421 (Biolegend, 312218) и BCMA-PE (R&D, FAB193P). Свежие клетки PB окрашивали в исходный момент времени и после стимуляции и экспансии с бусами CD3/CD28. PB окрашивали моноклональными антителами против CD14-V500 (BD, 561391), CD45-BV421 (Biolegend, 304032), CD3-AF700 (56-0038-42), CD19-PECY7 (eBioscience, E10328-1632) и BCMA-PE (R&D, FAB193P). Клетки дважды промывали и получали данные по окрашиванию с помощью цитометра BD Fortessa. Проточный цитометрический анализ осуществляли с использованием FlowJo v10 (Tree Star Inc).
Не наблюдали доказательств экспрессии BCMA на PBMC. Важно, что T-клетки оставались отрицательными на BCMA в течение экспансии (фиг. 3A). При анализе различных субпопуляций стволовых клеток в BM не наблюдали экспрессию BCMA на незрелых, отрицательных по маркерам ростка CD34-положительных стволовых клетках. В частности, общая лимфоидная клетка-предшественник и гематопоэтические стволовые клетки являлись отрицательными (фиг. 3B).
Анализ экспрессии BCMA в нормальных тканях посредством иммуногистохимии
Три коммерчески доступных антитела (Novus, Sigma) для иммуногистохимии выбирали и титровали на фиксированной в парафине нормальной ткани селезенки. Тканевые микропанели (TMA), включающие ткани 27 здоровых людей, окрашивали посредством иммуногистохимии.
Все 3 антитела демонстрировали положительное окрашивание на нормальных плазматических клетках в лимфоузлах, селезенке и миндалине, в то время как нормальное легкое, поджелудочная железа и щитовидная железа при тестировании являлись отрицательными. Окрашивание, по-видимому, неспецифическое по причине поликлональной природы доступных антител, наблюдали в следующих органах: желудке, слюнной железе, почке, надпочечнике, мозжечке, сердце и аппендиксе. Избранные результаты представлены на фигурах 4A-4E и приведены в таблице 11.
Таблица 11. Экспрессия BCMA, оцениваемая посредством иммуногистохимического окрашивания в нормальных тканях
Эти результаты привели к дальнейшему анализу экспрессии, в частности, с использованием гибридизации in situ RNAscope для подтверждения отсутствия экспрессии BCMA в этих тканях. Избранные результаты представлены на фигуре 4F.
Пример 2: Оценка in vitro CAR, содержащих гуманизированный scFv против BCMA
Конструкции BCMA CAR, полученные из гуманизированного антитела мыши против BCMA
Четыре разных конструкции CAR против BCMA конструировали с использованием последовательностей VL и VH, описываемых в публикации PCT WO2012/163805 (содержание которой включено, таким образом, в настоящее описание в качестве ссылки в полном объеме). Для получения CAR против BCMA последовательности VH и VL синтезировали и соединяли с линкером [Gly-Gly-Gly-Gly-Ser]×4 (SEQ ID NO: 27), получая два одноцепочечных вариабельных фрагмента (scFvs), в которых VH предшествует VL (H2L, SEQ ID NO: 255) или VL предшествует VH (L2H, SEQ ID NO: 257). Лидерную последовательность CD8 также синтезировали и подвергали слиянию с 5'-концом каждого scFv с участком BamHI. Участки рестрикции для XbaI и BspE1 добавляли на 5' и 3'-концы, соответственно, во время синтеза для облегчения клонирования лидерной последовательности CD8-scFv в лентивирусный вектор pTRPE, содержащий шарнирную и TM области CD8 с цитоплазматическими доменами 4-1BB и CD3z. Для клонирования использовали две отдельные конструкции остова CAR, одна из которых содержит шарнирную область CD8 человека, а другая содержит шарнирную область IgG4 человека, для получения 4 конструкций CAR против BCMA, схематически представленных на фигуре 5, обозначенных как pBCMA 1, pBCMA 2, pBCMA 3 и pBCMA 4. Для получения инфекционных супернатантов с лентивирусными векторами 293-T-клетки трансфицировали с помощью следующих плазмид: pTRP-VSV-G (кодирующей оболочку вируса везикулярного стоматита (VSV-G)), pTRP gag/pol (кодирующей gag и pol) и pTRP-Rev с любой из четырех конструкций BCMA CAR, с использованием липофектамина 2000 (Invitrogen).
Последовательность нуклеиновой кислоты гуманизированного scFv против BCMA, в котором VH предшествует VL (H2L, например, pBCMA 2 и pBCMA 4), является следующей:
CAGGTGCAGCTGGTCCAGAGCGGCGCCGAAGTGAAGAAGCCCGGCAGCTCCGTGAAAGTGAGCTGCAAGGCCAGCGGCGGCACCTTCAGCAACTACTGGATGCACTGGGTGAGGCAGGCCCCCGGACAGGGCCTGGAGTGGATGGGCGCCACCTACAGGGGCCACAGCGACACCTACTACAACCAGAAGTTCAAGGGCCGGGTGACCATCACCGCCGACAAGAGCACCAGCACCGCCTACATGGAACTGAGCAGCCTCAGGAGCGAGGACACCGCTGTGTATTACTGCGCCAGGGGCGCCATCTACAACGGCTACGACGTGCTGGACAACTGGGGCCAGGGCACACTAGTGACCGTGTCCAGCGGTGGAGGAGGTAGCGGAGGAGGCGGGAGCGGTGGAGGTGGCTCTGGAGGTGGCGGAAGCGACATCCAGATGACCCAGAGCCCTAGCTCACTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCTCCGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGGCAAGGCCCCCAAGCTGCTGATCTACTACACCTCCAACCTGCACTCCGGCGTGCCCAGCAGGTTCAGCGGAAGCGGCAGCGGCACCGATTTCACCCTGACCATCTCCAGCCTGCAGCCCGAGGACTTCGCCACCTACTACTGCCAGCAGTACAGGAAGCTCCCCTGGACTTTCGGCCAGGGCACCAAACTGGAGATCAAGCGT
(SEQ ID NO: 272)
Соответствующая аминокислотная последовательность гуманизированного scFv против BCMA, в котором Vh предшествует VL (H2L, например, pBCMA 2 и pBCMA 4), является следующей:
Q V Q L V Q S G A E V K K P G S S V K V S C K A S G G T F S N Y W M H W V R Q A P G Q G L E W M G A T Y R G H S D T Y Y N Q K F K G R V T I T A D K S T S T A Y M E L S S L R S E D T A V Y Y C A R G A I Y N G Y D V L D N W G Q G T L V T V S S G G G G S G G G G S G G G G S G G G G S D I Q M T Q S P S S L S A S V G D R V T I T C S A S Q D I S N Y L N W Y Q Q K P G K A P K L L I Y Y T S N L H S G V P S R F S G S G S G T D F T L T I S S L Q P E D F A T Y Y C Q Q Y R K L P W T F G Q G T K L E I K R (SEQ ID NO: 271)
Последовательность нуклеиновой кислоты гуманизированного scFv против BCMA, в котором VL предшествует VH (L2H, например, pBCMA1 и pBCMA3), является следующей:
GACATCCAGATGACCCAGAGCCCTAGCTCACTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCTCCGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGGCAAGGCCCCCAAGCTGCTGATCTACTACACCTCCAACCTGCACTCCGGCGTGCCCAGCAGGTTCAGCGGAAGCGGCAGCGGCACCGATTTCACCCTGACCATCTCCAGCCTGCAGCCCGAGGACTTCGCCACCTACTACTGCCAGCAGTACAGGAAGCTCCCCTGGACTTTCGGCCAGGGCACCAAACTGGAGATCAAGCGTGGTGGAGGAGGTAGCGGAGGAGGCGGGAGCGGTGGAGGTGGCTCTGGAGGTGGCGGAAGCCAGGTGCAGCTGGTCCAGAGCGGCGCCGAAGTGAAGAAGCCCGGCAGCTCCGTGAAAGTGAGCTGCAAGGCCAGCGGCGGCACCTTCAGCAACTACTGGATGCACTGGGTGAGGCAGGCCCCCGGACAGGGCCTGGAGTGGATGGGCGCCACCTACAGGGGCCACAGCGACACCTACTACAACCAGAAGTTCAAGGGCCGGGTGACCATCACCGCCGACAAGAGCACCAGCACCGCCTACATGGAACTGAGCAGCCTCAGGAGCGAGGACACCGCTGTGTATTACTGCGCCAGGGGCGCCATCTACAACGGCTACGACGTGCTGGACAACTGGGGCCAGGGCACACTAGTGACCGTGTCCAGC
(SEQ ID NO: 274)
Соответствующая аминокислотная последовательность гуманизированного scFv против BCMA, в котором VL предшествует VH (L2H, например, pBCMA1 и pBCMA3), является следующей:
DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKLLIYY TSNLHSGVPSRFSGSGSGTD FTLTISSLQP EDFATYYCQQ YRKLPWTFGQ GTKLEIKRGG GGSGGGGSGGGGSGGGGSQV QLVQSGAEVK KPGSSVKVSC KASGGTFSNY WMHWVRQAPG QGLEWMGATYRGHSDTYYNQ KFKGRVTITA DKSTSTAYME LSSLRSEDTA VYYCARGAIYNGYDVLDNWGQGTLVTVSS (SEQ ID NO: 273)
Эти pBCMA-CAR, содержащие гуманизированный scFv против BCMA, используют в экспериментах, подробно описанных ниже и в примере 3.
Эффективная экспрессия BCMA-CAR на T-клетках
Свежие выделенные T-клетки человека от здоровых доноров трансдуцировали с использованием супернатантов лентивирусных векторов, кодирующих pBCMA 1-4 CAR, и экспрессию CAR против BCMA оценивали посредством проточной цитометрии. В кратком изложении, T-клетки культивировали в среде RPMI 1640 с 10% FBS и стимулировали Dynabeads против CD3/против CD28 (Invitrogen). Через 24 часа после стимуляции T-клетки трансдуцировали четырьмя разными супернатантами лентивирусных векторов pBCMA CAR. T-клетки, трансдуцированные с помощью вектора CAR против мезотелина (SS1), использовали в качестве положительного контроля. Ложнотрансдуцированные T-клетки (NTD) использовали в качестве отрицательного контроля. Через 4-6 дней после лентивирусной трансдукции T-клетки окрашивали биотинилированным антителом против протеина L, а затем стрептавидином FITC (BD Biosciences) или биотинилированным антителом козы против мыши и оценивали экспрессию CAR посредством проточной цитометрии (FACSCalibur, BD). Проточный цитометрический анализ осуществляли с использованием Flowjo (Tree Star Inc).
После трансдукции наблюдали, что pBCMA CAR эффективно экспрессировались на поверхность трансдуцированных T-клеток, как показано на фигуре 6.
Продукция цитокинов из T-клеток, экспрессирующих CAR против BCMA (BCMA CART)
Клетки K562, эктопически экспрессирующие BCMA человека (K562-BCMA), получали посредством лентивирусной трансдукции с использованием вектора, поставляемого GeneCopoeia, с последующей селекцией пуромицином. K562-BCMA-специфичные клетки-мишени использовали in vitro для оценки цитотоксичности и продукции цитокинов из pBCMA 1-4 CAR-трансдуцированных T-клеток. T-клетки с pCAR против BCMA или контрольные T-клетки выращивали до конца фазы логарифмического роста, а затем сокультивировали в течение 16 часов с K562-BCMA-специфичными клетками-мишенями, клетками-мишенями K562-мезотелин в качестве положительного контроля или без клеток-мишеней в качестве отрицательного контроля при соотношении 3 к 1 эффекторных клеток и клеток-мишеней. Собирали супернатанты культур и измеряли концентрацию ИФН-гамма и ИЛ-2 с помощью специфического ELISA по инструкциям производителя (R&D).
T-клетки, экспрессирующие все четыре CAR против pBCMA, продуцировали схожие уровни ИФН-гамма и ИЛ-2 при сокультивировании с BCMA-экспрессирующими клетками-мишенями, но не с BCMA-отрицательными клетками-мишенями, как показано на фигуре 7A и 7B.
Цитотоксическая активность BCMA CART в отношении линий клеток миеломы
Способность pBCMA CAR T-клеток уничтожать BCMA-экспрессирующие клетки-мишени оценивали с использованием анализа высвобождения 51Cr. В кратком изложении, клетки-мишени MM метили 51Cr (дихроматом натрия), промывали и сокультивировали с эффекторными pBCMA CAR T-клетками при разных соотношения эффектор/мишень. Супернатанты собирали через 4 часа и помещали их в 96-луночные планшеты Lumaplates (Perkin Elmer). Количество 51Cr, высвобождаемого из меченых клеток-мишеней, измеряли с помощью жидкостного сцинтилляционного счетчика (MicroBeta trilux, Perkin Elmer). Клетки-мишени, инкубируемые в среде в отдельности или с 1% SDS, использовали для определения спонтанного (S) или максимального (M) высвобождения 51Cr. Процентную долю специфического лизиса вычисляли следующим образом: 100×(импульсы/мин при экспериментальном высвобождении-импульсы/мин при S-высвобождении)/(импульсы/мин при M-высвобождении-импульсы/мин при S-высвобождении).
Все четыре типа pBCMA-CAR-трансдуцированных T-клеток были способны индуцировать лизис клеток K562-BCMA и BCMA-экспрессирующих линий клеток множественной миеломы с низкой активностью в отношении BCMA-отрицательных линий клеток, как показано на фигурах 8A, 8B, 8C и 8D. pBCMA-CAR с шарнирной областью CD8 (pBCMA 3 и 4) проявляли более высокую цитотоксичность по сравнению с pBCMA CAR, содержащими шарнирную область IgG4, что позволяет предполагать, что шарнирная область является важным фактором в дизайне CAR для оптимального функционирования.
Пример 3: Оценка in vivo pBCMA-CART в случае множественной миеломы
В зависимости от данных in vitro, подтверждающих повышенную функцию T-клеток, модифицированных с помощью pBCMA 3 и pBCMA 4 CAR, противоопухолевую активность этих CART оценивали в доклинической модели множественной миеломы на животных с использованием линии клеток RPMI 8226. Клетки RPMI 8226 конструировали для экспрессии зеленой люциферазы жука-щелкуна (CB-G Luc+) для отслеживания прогрессирования опухоли с помощью биолюминесцентной визуализации in vivo (IVIS) и программного обеспечения Living Image (Perkin Elmer). Через 4 недели после инъекции CB-G Luc+ реципиентам NSG IV инъецировали клетки RPMI 8226, T-клетки, экспрессирующие pBCMA 3 CAR, pBCMA 4 CAR, CAR CD19 (FMC63 scFv против CD19 с шарнирной областью CD8 человека, цитоплазматическим доменом 4-1BB и CD3z) или CAR SS1 (SS1 scFv против мезотелина с шарнирной областью CD8 человека, цитоплазматический домен 4-1BB и CD3z), IV инъецировали и оценивали опухолевую массу посредством оптической визуализации, а также по появлению клинических признаков заболевания (таблица 12 ниже). Подсчет баллов осуществляли следующим образом: 1 - отсутствие клинических признаков, 2 - небольшие изменения походки/небольшая масса опухоли, 3 - сниженная подвижность/масса опухоли/все еще сохраняется способность ходить, 4 - паралич задних конечностей/большая масса опухоли/конечная точка и 5 - полный паралич конечностей.
Таблица 12. Исследуемые группы и клинические баллы.
T-клетки, экспрессирующие pBCMA-3, и pBCMA 4 CAR T-клетки индуцируют значительное снижение опухолевой массы у мышей, несущих RPMI 8226, а также улучшенную клиническую активность заболевания по сравнению с контрольными T-клетками, направленно воздействующими на мезотелин (обозначенными как SS1) или CD19, как показано на фигуре 9A и 9B.
Эксперименты, описываемые в примерах 2 и 3, предоставляют разумное обоснование идентификации связывающих доменов scFv человека для дополнительных конструкций CAR, описываемых и анализируемых в примерах 4-7.
Пример 4: Получение конструкций CAR человека против BCMA
Специфичные для BCMA человека scFv для конструкций CAR идентифицировали с помощью 3 раундов пэннинга Bio-BCMA на основе бус. В эксперименте 1 использовали фаговую библиотеку SBAL-1Sk (8.4E13). В эксперименте 2 использовали фаговую библиотеку SBAL-3Sk(G1+G2+G4+G5) (1E13). Фаговые лизаты подвергали скринингу на реактивность BCMA посредством ELISA. Идентифицировали 319 положительных совпадений, представляющих собой 135 уникальных последовательностей. Фаговые последовательности преобразовывали в растворимые scFv, которые можно экспрессировать в E. coli. Затем лизаты E. coli подвергали скринингу посредством ELISA и периплазму подвергали скринингу посредством FACs. С помощью анализа FACs идентифицировали 15 совпадений. Затем scFv выделяли из E. coli и очищенные scFv тестировали посредством FACs. 15 scFv подтверждали и обозначали как BCMA-1, BCMA-2, BCMA-3, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-11, BCMA-12, BCMA-13, BCMA-14 и BCMA-15. Последовательности scFv-фрагментов человека против BCMA (SEQ ID NO: 39-52) представлены в таблице 1 (и их названия представлены в таблице 2). Полные конструкции BCMA CAR (SEQ ID NO: 99-113) получали с использованием scFv-фрагментов человека (SEQ ID NO: 39-52) в комбинации с дополнительными последовательностями, представленными в подробном описании, например, лидерной последовательностью, шарнирной областью CD8, трансмембранным доменом CD8, внутриклеточным доменом 4-1BB, внутриклеточным доменом CD27, внутриклеточным доменом CD28, доменом ICOS, доменом CD3 дзета (мутантным), доменом CD3 дзета человек, шарнирной областью IgG4, последовательностями Gly/Ser и/или поли(A)-последовательностями.
Затем scFv-фрагменты CAR клонировали в лентивирусные векторы для получения полноразмерной конструкции CAR в единой колирующей рамке считывания с использованием промотора EF1 альфа для экспрессии (SEQ ID NO: 11).
Аминокислотные последовательности и последовательности нуклеиновой кислоты scFV-доменов против BCMA и молекул CAR BCMA представлены в таблице 1 в подробном описании. В таблице 2 в подробном описании приведены названия конструкций BCMA CAR со ссылкой на номера ID ДНК, также представленные в таблице 1.
Дополнительные рабочие конструкции BCMA CAR также получали с использованием последовательностей VH и VL из публикации PCT № WO2012/0163805 (содержание которой включено, таким образом, в настоящее описание в качестве ссылки в полном объеме), и они основаны на результатах для pBCMA3 и pBCMA4 CAR, описываемых в примерах 2 и 3. Схема рабочих конструкций BCMA (BCMA-3NP и BCMA-4NP) представлена на фигуре 10A. Две конструкции отличаются ориентацией цепей VH и VL (фиг. 10B). Рабочие конструкции BCMA CAR и соответствующие им ID ДНК представлены ниже.
Таблица 3. ID рабочих конструкций CAR
Дополнительные конструкции BCMA CAR также можно получать с использованием последовательностей VH и VL, обнаруживаемых в таблице 16 в подробном описании. Аминокислотные последовательности примеров scFV-доменов, содержащих домены VH и VL и линкерную последовательность, и полноразмерные CAR также представлены в таблице 16.
Получение и вычисление вирусного титра для конструкций BCMA CAR
Лентивирусные супернатанты получали для 15 BCMA-специфичных конструкций CAR, полученных при фаговом скрининге scFv (таблица 2). Также получали супернатанты, содержащие лентивирус, для 2 рабочих конструкций CAR BCMA, BCMA-3NP и BCMA-4NP. Рабочие конструкции, описываемые в этом примере, основаны на конструкциях pBCMA3 и pBCMA4, описываемых выше в примерах 2 и 3.
Для получения лентивирусных супернатантов клетки LentiX-293T высевали в день 0 и трансфицировали в день 1 с использованием реагента для трансфекции липофектамина 2000 (Life Technologies). В случае каждой конструкции используемой плазмидной ДНК являлась: pRSV.REV (экспрессирующая Rev плазмида), pMDLg/p.RRE (экспрессирующая Gag/Pol плазмида), pVSV-G (экспрессирующая гликопротеин VSV плазмида) и вектор CAR для переноса. Смесь для трансфекции заменяли свежей средой в день 2 и вирусный супернатант собирали в дни 3 и 4.
Вирусные супернатанты концентрировали с использованием реагента Lenti-X Concentrator (Clontech) и полученные осадки ресуспендировали в среде для выращивания при 1/10-1/100 исходного объема. Концентрированные вирусные супернатанты аликвотировали и хранили при -80°C.
Вычисление вирусного титра осуществляли посредством трансдукции клеток SupT1 и оценки экспрессии CAR. Клетки SupT1 трансдуцировали в день 1 с использованием 3-кратного серийного разведения вирусных супернатантов с начальной концентрацией 1:300. Экспрессию CAR оценивали в день 5 с использованием антигена BCMA-Fc (R&D Systems) и реагента биотин-протеин L (GenScript). Вирусный титр вычисляли по следующей формуле:
(% CAR+)×(количество клеток SupT1)/(количество вируса (мл))×(разведение)
Средний вирусный титр вычисляли с помощью точек разделения в линейном диапазоне от 1 до 20% CAR-положительных результатов. Вычисления титров для клонов CAR BCMA представлены в таблице 4.
Таблица 4: Титр лентивирусных супернатантов клеток LentiX-293T, трансдуцированных с использованием CAR против BCMA, измеряемый с помощью BCMA-Fc или протеина L.
Все клоны CAR BCMA определяли с помощью антигена BCMA-Fc, но детекция была более слабой при использовании биотина-протеина L в случае ряда клонов (BCMA-1, BCMA-6, BCMA-11). Для вычисления MOI для трансдукции в первичных T-клетках использовали титры на основе детекции BCMA-Fc.
Конструкции BCMA CAR, содержащие scFv человека против BCMA, описываемые в этом примере, используют на всем протяжении экспериментов в примерах 4 и 5. Рабочие конструкции BCMA CAR, описываемые в этом примере, также используют в экспериментах, описываемых в примерах 5, 6 и 7.
Пример 5: Характеризация in vitro рабочих конструкций BCMA CAR
Репортерный анализ JNL рабочих конструкций BCMA CAR
Клетки Jurkat-NFAT-люцифераза (JNL), трансдуцированные с использованием рабочих конструкций BCMA CAR, оценивали на активацию в ответ на BCMA-экспрессирующие линии клеток-мишеней. В день 0 клетки JNL трансдуцировали с помощью BCMA-3NP и BCMA-4NP. Концентрации вируса доводили до MOI 3 и инкубировали в течение ночи. В день 6 после трансдукции CAR BCMA-трансдуцированные клетки JNL инкубировали с клетками-мишенями при соотношения эффектор-мишень (E:T) в диапазоне от 0 до 27. Линиями клеток-мишеней являлись: K562 (отрицательный контроль BCMA) и BCMA-положительные линии клеток множественной миеломы NCI-H929, KMS26 и RPMI 8226. Активацию JNL измеряли с использованием субстрата Bright-Glo (Promega) в день 7. Экспрессию CAR на трансдуцированных JNL оценивали в день 6 с помощью антигена BCMA-Fc (таблица 5). В этом репортерном анализе наблюдали, что рабочие клоны CAR против BCMA активируются в зависимости от мишени (фигура 11).
Таблица 5: Процент экспрессии CAR на клетках JNL
Схема выделения, трансдукции и активации первичных T-клеток с использованием рабочих CAR против BCMA представлена в таблице 6. В день 0 PBMC здоровых людей-доноров (программа донорства крови Novartis Employee Blood Donor program) выделяли из цельной крови посредством экстракции фиколлом и T-клетки выделяли из PBMC посредством отрицательной селекции с использованием набора Pan T Cell Isolation Kit II (Miltenyi Biotec). Выделенные T-клетки стимулировали в течение ночи с помощью бус Dynabeads Human T-Expander CD3/CD28 (Life Technologies) при соотношении бус и клеток 3:1. T-клетки также окрашивали для оценки относительных количеств клеток CD4+ и CD8+ (фигура 12).
Таблица 6: Схема экспансии T-клеток из трансдуцированных с помощью CAR BCMA клонов
В день 1 T-клетки трансдуцировали с помощью BCMA-3NP и BCMA-4NP. Концентрации вируса доводили до MOI 5 и инкубировали в течение ночи. В день 11 из трансдуцированных CART-клеток удаляли бусы и замораживали их в аликвотах в 90% FBS, 10% DMSO. После трансдукции и экспансии T-клетки снова окрашивали для оценки относительных количеств клеток CD4+ и CD8+. Кроме того, экспрессию CAR оценивали с помощью антигена BCMA-Fc (фигура 13).
Анализ пролиферации BCMA
Оценивали пролиферацию BCMA CART-клеток в ответ на BCMA-экспрессирующие клетки-мишени. CART-клетки размораживали в день 0 и инкубировали в течение ночи для восстановления. В день 1 CART-клетки метили с помощью CellTrace CFSE (Life Technologies) и инкубировали с облученными клетками-мишенями при соотношении E:T 1:1. Бусы Dynabeads Human T-Expander CD3/CD28 при соотношении бус и клеток 3:1 включали в качестве положительного контроля. В день 5 измеряли уровни CFSE в CART-клетках (фигура 14). Кроме того, CART-клетки окрашивали с помощью CD3, CD4, CD8 и антигена BCMA-Fc и измеряли посредством проточной цитометрии относительно бус CountBright Absolute Counting Beads (Life Technologies) для определения относительных количеств клеток (фигура 15). Специфическую пролиферацию в ответ на BCMA наблюдали и для BCMA-3NP, и для BCMA-4NP.
Анализ цитолиза BCMA CART-клеток с люциферазой
Оценивали цитолиз BCMA CART-клеток в ответ на BCMA-экспрессирующие клетки-мишени. CART-клетки размораживали в день 0 и инкубировали в течение ночи для восстановления. В день 1 CART-клетки инкубировали с BCMA-экспрессирующими клетками KMS11-люцифераза или клетками-мишенями MM1-S-люцифераза при соотношениях E:T в диапазоне от 0 до 20. Утрату сигнала люциферазы в результате цитолиза клеток измеряли с использованием субстрата Bright-Glo в день 2 и вычисляли специфический лизис по следующей формуле:
Специфический лизис (%)=100-(люминесценция образца/средняя максимальная люминесценция)*100
Результаты цитолиза клеток представлены на фигуре 16, где показано, что рабочие клоны CART имеют специфический цитолитический ответ.
Анализ цитолиза клеток BCMA CART CFSE
Оценивали цитолиз BCMA CART-клеток в ответ на BCMA-экспрессирующие клетки-мишени. CART-клетки размораживали в день 0 и инкубировали в течение ночи для восстановления. В день 1 клетки-мишени метили с помощью CellTrace CFSE (Life Technologies) и инкубировали с CAR BCMA T-клетками при соотношениях E:T в диапазоне от 0 до 10. Линиями клеток-мишеней являлись: K562-BCMA (сконструированные для стабильной экспрессии BCMA), K562 (родительская линия) и BCMA-положительные линии клеток множественной миеломы NCI-H929, KMS26 и RPMI 8226. Утрату CFSE-положительных клеток в результате цитолиза клеток измеряли в день 2 посредством проточной цитометрии относительно бус CountBright Absolute Counting Beads (Life Technologies) для определения относительных количеств клеток (фигура 17). Специфичный цитолиз клеток наблюдали и для BCMA-3NP, и для BCMA-4NP.
Учитывая характеризацию in vitro, рабочие клоны BCMA CAR, BCMA-3NP и BCMA-4NP, выбирали для оценки in vivo в модели диссеминированной опухоли KMS11-люцифераза. UTD (нетрансдуцированные) T-клетки выбирали в качестве отрицательного контроля. Результаты характеризации in vivo дополнительно описаны в примере 5.
Пример 6: Характеризация in vitro BCMA CART
В экспериментах, описываемых в этом примере, используют конструкции CAR, содержащие scFv человека против BCMA из таблицы 1, и рабочие конструкции CAR BCMA.
Репортерный анализ JNL в случае конструкций BCMA CAR
Клетки Jurkat-NFAT-люцифераза (JNL), трансдуцированные с помощью конструкций BCMA CAR, оценивали на активацию в ответ на BCMA-экспрессирующие линии клеток-мишеней. Получали маломасштабные образцы вирусных супернатантов клеток HEK293T для трансдукции клеток JNL. В день 3 после трансдукции CAR BCMA-трансдуцированные клетки JNL инкубировали с клетками-мишенями при соотношении эффектор-мишень (E:T) 6:1. Линиями клеток-мишеней являлись: K562-BCMA (сконструированная для стабильной экспрессии BCMA), K562 (родительская линия) и BCMA-положительные линии клеток множественной миеломы NCI-H929 и RPMI 8226. Активацию JNL измеряли с использованием субстрата Bright-Glo (Promega) в день 4. Экспрессию CAR на трансдуцированных JNL оценивали в день 7 с помощью антигена BCMA-Fc и реагента биотин-протеин L (таблица 7). В этом репортерном анализе наблюдали, что несколько клонов CAR против BCMA активируются в зависимости от мишени (фигура 18).
Таблица 7: Процент экспрессии CAR на клетках JNL
Активность JNL не коррелировала с % экспрессии CAR. С учетом BCMA-специфической активации следующие клоны CAR BCMA выбирали для характеризации в первичных T-клетках: BCMA-1, BCMA-4, BCMA-5, BCMA-7, BCMA-8, BCMA-10, BCMA-12, BCMA-13, BCMA-14 и BCMA-15. С учетом наблюдаемой неспецифической активации в качестве отрицательного контроля выбирали BCMA-6. С учетом наблюдаемого отсутствия активности в качестве отрицательного контроля также выбирали BCMA-9.
Трансдукция первичных T-клеток человека с помощью CAR BCMA
Схема выделения, трансдукции и активации первичных T-клеток с помощью CAR против BCMA представлена в таблице 8. В день 0 PBMC здоровых людей-доноров (программа донорства крови Novartis Employee Blood Donor program) выделяли из цельной крови посредством экстракции фиколлом и T-клетки выделяли из PBMC посредством отрицательной селекции с использованием набора Pan T Cell Isolation Kit II (Miltenyi Biotec). Выделенные T-клетки стимулировали в течение ночи с помощью бус Dynabeads Human T-Expander CD3/CD28 (Life Technologies) при соотношении бус и клеток 3:1. T-клетки также окрашивали для оценки относительных количеств клеток CD4+ и CD8+ (фигура 19).
Таблица 8: Схема экспансии T-клеток из трансдуцированных с помощью CAR BCMA клонов
В день 1 T-клетки трансдуцировали с помощью следующих клонов CAR BCMA: BCMA-1, BCMA-4, BCMA-5, BCMA-6, BCMA-7, BCMA-8, BCMA-9, BCMA-10, BCMA-12, BCMA-13, BCMA-14, BCMA-15, BCMA-3NP и BCMA-4NP. Концентрации вируса доводили до MOI 5 (Таблица 9) и инкубировали в течение ночи.
Таблица 9: Вычисление количества T-клеток, добавляемых на лунку для каждого клона для достижения MOI 5.
на лунку
В день 11 из трансдуцированных CART-клеток удаляли бусы и замораживали их в аликвотах в 90% FBS, 10% DMSO. После трансдукции и экспансии T-клетки снова окрашивали для оценки относительных количеств CD4+ и CD8+ клеток. Кроме того, экспрессию CAR оценивали с помощью антигена BCMA-Fc (фигура 20).
Анализ пролиферации BCMA CART
Оценивали пролиферацию BCMA CART-клеток в ответ на BCMA-экспрессирующие клетки-мишени. CART-клетки размораживали в день 0 и инкубировали в течение ночи для восстановления. В день 1 CART-клетки метили CellTrace CFSE (Life Technologies) и инкубировали с облученными клетками-мишенями при соотношении E:T 1:1. В день 6 измеряли уровни CFSE в CART-клетках (фигура 21).
Кроме того, CART-клетки окрашивали с помощью CD3, CD4 и CD8 и измеряли посредством проточной цитометрии относительно бус CountBright Absolute Counting Beads (Life Technologies) для определения относительных количеств клеток (фигура 22A, 22B, и 22C). Наблюдали специфическую пролиферацию в ответ на BCMA для следующих клонов CART: BCMA-4, BCMA-10, BCMA-12, BCMA-13, BCMA-14 и BCMA-15.
Анализ цитолиза BCMA CART
Оценивали цитолиз BCMA CART-клеток в ответ на BCMA-экспрессирующие клетки-мишени. CART-клетки размораживали в день 0 и инкубировали в течение ночи для восстановления. В день 1 CART-клетки инкубировали с BCMA-экспрессирующими клетками-мишенями KMS11-люцифераза при соотношениях E:T в диапазоне от 0 до 10. Утрату сигнала люциферазы в результате цитолиза клеток измеряли с использованием субстрата Bright-Glo в день 2 и специфический лизис вычисляли по следующей формуле:
Специфический лизис (%)=100-(люминесценция образца/средняя максимальная люминесценция)*100
Результаты анализа цитолиза клеток представлены на фигуре 23A, где каждую конструкцию CAR BCMA сравнивают с BCMA-3NP и BCMA-4NP. Эти результаты свидетельствуют о том, что несколько клонов CART (экспрессирующих scFv человека против BCMA) имеют более высокий цитолитический ответ, чем контрольные конструкции BCMA-3NP и BCMA-4NP. Эти результаты для выбранных CAR BCMA-кандидатов (BCMA-4, BCMA-9, BCMA-10, BCMA-13 и BCMA-15) представлены на графике на фигуре 23B для сравнения мощности цитолиза между CAR-кандидатами. Нетрансдуцированные T-клетки и T-клетки, трансдуцированные с помощью конструкции BCMA-4NP, использовали в качестве отрицательных и положительных контролей, соответственно. Процентную долю цитолиза клеток выбранных клонов BCMA CART (BCMA-4, BCMA-9, BCMA-10, BCMA-13 и BCMA-15) нормализовали по проценту экспрессии CAR для каждой CART, и она представлена на фигуре 23C. Результаты свидетельствуют о том, что все клоны BCMA-4, BCMA-9, BCMA-10, BCMA-13 и BCMA-15 CART имели мощность цитолиза клеток, схожую с BCMA-4NP.
Общие результаты анализов in vitro описываемых выше клонов BCMA CART представлены в таблице 10. Учитывая характеризацию in vitro клонов BCMA CART, BCMA-4, BCMA-10, BCMA-13 и BCMA-15 выбирали для оценки in vivo в модели диссеминированной опухоли KMS11-люцифераза, как описано в примере 7. BCMA-4NP выбирали в качестве положительного контроля. BCMA-9 и UTD (нетрансдуцированные клетки) выбирали в качестве отрицательных контролей.
Таблица 10: Общие результаты характеризации in vitro клонов BCMA CART
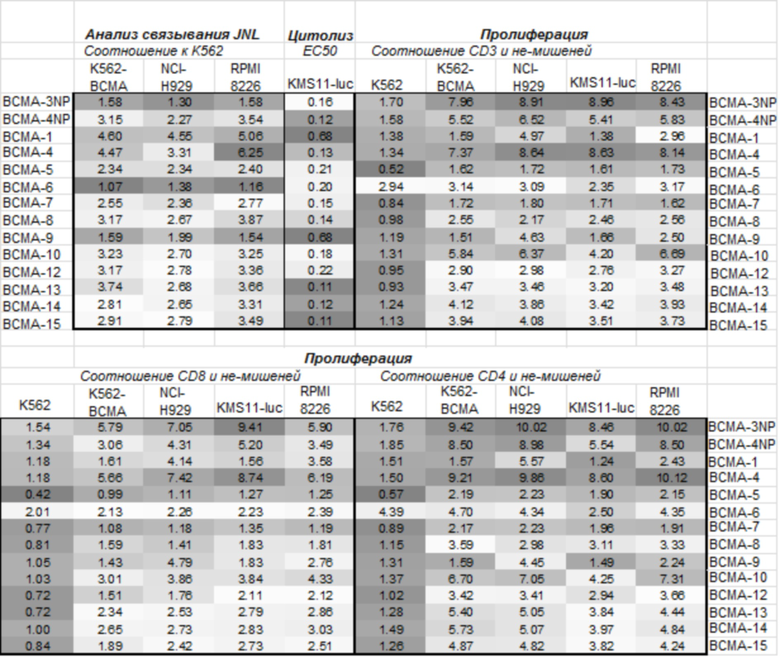
Пример 7: Характеризация in vivo BCMA CART
KMS-11 является линией клеток множественной миеломы человека, полученной из плеврального выпота, и ее можно выращивать в качестве ксенотрансплантата в иммунокомпрометированных мышах. С помощью этого ксенотрансплантата будут имитировать заболевание в костном мозге, как наблюдают у людей, получая модель, с помощью которой тестируют эффективность способов терапии множественной миеломы в кости. Этих мышей можно использовать для тестирования эффективности T-клеток с химерным антигенным рецептором (CAR), специфичных по клеточным маркерам, обнаруживаемым на плазматических клетках и клетках множественной миеломы, таких как B-клеточный антиген созревания (BCMA). Клетки KMS-11 метили репортерным геном люциферазы светлячка и использовали в ортотопической модели множественной миеломы на мышах NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG) для тестирования эффективности CAR T-клеток, специфичных к BCMA.
Экспрессию BCMA тестировали на клетках KMS-11 и эти клетки использовали в анализах in vitro для определения способности BCMA-специфичных CAR T-клеток распознавать и отвечать на мишень. Клетки KMS-11 росли in vivo при внутривенной имплантации через хвостовую вену, и их рост ограничен, главным образом, костным мозгом. Через неделю опухолевые клетки имплантировались, заболевание сдвигалось полностью в кости и начинало расти экспоненциально. При отсутствии лечения мыши начинали проявлять клинические симптомы и паралич задних конечностей через 5-6 недель после имплантации опухоли. Рабочие CAR BCMA T-клетки сначала тестировали на этой модели в исследовании эффективности для определения того, является ли модель подходящей моделью in vivo для тестирования эффективности и противоопухолевой активности CAR BCMA T-клеток. После этого лучшие scFv против BCMA из скрининга in vitro тестировали в этой модели in vivo и подтверждали в повторном исследовании эффективности.
Материалы и способы:
Линия клеток KMS-11: Линию клеток KMS-11 множественной миеломы человека получали из плеврального выпота пациента с множественной миеломой. Затем клетки метили люциферазой светлячка. Эти суспензионные культуры клеток выращивали в RPMI, дополненной 10% термически инактивированной эмбриональной телячьей сыворотки.
Мыши: Мышей NSG (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) возрастом 6 недель получали из Jackson Laboratory (инвентарный номер 005557). Животным позволяли акклиматизироваться к условиям вивария Novartis NIBRI в течение по меньшей мере 3 дней перед экспериментами. С животными обращались в соответствии нормативами и руководствами Novartis ACUC.
Имплантация опухоли: Клетки KMS-11-luc выращивали in vitro в RPMI, дополненной 10% термически инактивированной эмбриональной телячьей сыворотки. Затем клетки переносили в коническую пробирку емкостью 15 мл и дважды промывали холодным стерильным PBS. Затем клетки KMS-11-luc подсчитывали и ресуспендировали в концентрации 10×106 клеток на миллилитр PBS. Клетки помещали на лед и сразу (в пределах одного часа) имплантировали мышам. Клетки KMS-11 инъецировали внутривенно через хвостовую вену в объеме 100 мкл, всего 1×106 клеток на мышь.
Дозирование CAR T-клеток: Мышам вводили 5×106 T-клеток через 7-8 дней после имплантации опухоли. Клетки частично размораживали на водяной бане температурой 37°C, а затем полностью размораживали добавлением 1 мл холодного стерильного PBS в пробирку, содержащую клетки. Размороженные клетки переносили в пробирку Falcon емкостью 15 мл и доводили до конечного объема 10 мл с помощью PBS. Клетки промывали дважды при 1000 об/мин в течение 10 минут каждый раз, а затем подсчитывали с помощью гемоцитометра. CAR T-клетки нормализовали для трансдукции CAR таким образом, что каждая группа имела одинаковую процентную долю CAR+ T-клеток. Затем всего 5×106 клеток ресуспендировали в концентрации 50×106 клеток на мл холодного PBS и держали на льду до введения мышам. Мышам внутривенно через хвостовую вену инъецировали 100 мкл CAR T-клеток в дозе 5×106 T-клеток на мышь.
От пяти до семи мышам на группу вводили 100 мкл PBS в отдельности (PBS), нетрансдуцированные T-клетки (Mock), рабочие CAR BCMA T-клетки (BCMA-3NP или BCMA-4NP) или новые CAR BCMA T-клетки (BCMA-4, BCMA-9, BCMA-10, BCMA-13, BCMA-15). Все T-клетки получали из одного человека-донора параллельно.
Мониторинг животных: Состояние здоровья мышей контролировали ежедневно, включая измерения массы тела дважды в неделю. Процент изменения массы тела вычисляли как (BWнаст.- BWисх.)/(BWисх.)×100%. Опухолевую массу контролировали дважды в неделю посредством биолюминесцентной визуализации. Мышам интраперитонеально инъецировали D-люциферин за 10 минут до анестезирования и визуализации мышей с помощью Xenogen. Вычисляли опухолевую массу, вычисляя биолюминесценцию опухолевых клеток (фотоны/секунду).
Анализ биолюминесценции: Процентные значения исследуемая группа/контроль (T/C) вычисляли с использованием следующей формулы:
% T/C=100×ΔT/ΔC, если ΔT≥0;
% регрессии=100×ΔT/Tисх., если ΔT<0;
где T=средняя биолюминесценция в группе, которой вводили лекарственное средство, в последний день исследования, Tисх.=средняя биолюминесценция в группе, которой вводили лекарственное средство, в исходный день введения дозы, ΔT=средняя биолюминесценция в группе, которой вводили лекарственное средство, в последний день исследования, минус средняя биолюминесценция в группе, которой вводили лекарственное средство, в исходный день введения дозы, C=средняя биолюминесценция в контрольной группе в последний день исследования и ΔC=средняя биолюминесценция в контрольной группе в последний день исследования минус средняя биолюминесценция в контрольной группе в исходный день введения дозы.
Значения T/C в диапазоне 100% до 42% интерпретируют как не соответствующие или соответствующие минимальной противоопухолевой активности, значения T/C, составляющие ≤42% и >10%, интерпретируют как соответствующие противоопухолевой активности или ингибированию роста опухоли. Значения T/C ≤10% или значения регрессии ≥-10% интерпретируют как соответствующие остановке роста опухоли. Значения регрессии <-10% соответствуют регрессированию.
Анализ FACS периферической крови: Также контролировали T-клетки в периферической крови мышей. У мышей еженедельно забирали кровь через хвостовую вену в покрытые ЭДТА пробирки, которые держали на льду. 10-20 мкл крови переносили из пробирок в 96-луночные планшеты на льду. Эритроциты лизировали лизирующим буфером для эритроцитов ACK (Life Technologies, кат. № A10492-01), а затем дважды промывали холодным PBS. Клетки инкубировали со смесью для блокирования Fc человека и мыши (Miltenyi Biotec, кат. № 130-059-901 и 130-092-575) в течение 30 минут, а затем инкубировали с антителом против CD11b мыши (BD Biosciences, кат. № 557960), антителом против CD4 человека (BD Biosciences, кат. № 563550), антителом против CD8 человека (BD Biosciences, кат. № 560347) и антителом BCMA-Fc (R&D Systems, кат. № 193-BC-050), а затем вторичным Ig (Jackson ImmunoResearch). Клетки фиксировали 2% раствором параформальдегида в течение 20 минут, промывали и хранили в PBS+2% FBS в течение ночи перед анализом с помощью BD Fortessa, с последующим анализом с использованием аналитического программного обеспечения FlowJo FACS. Клетки анализировали для определения количества CAR+ CD4+ и CD8+ T-клеток на миллилитр крови в мышах NSG, несущих опухоли KMS-11-luc. Количества T-клеток в крови выражают как среднее ± стандартная ошибка среднего (SEM).
Результаты :
Противоопухолевую активность рабочих CAR BCMA T-клеток (BCMA-3NP и BCMA 4-NP) оценивали и напрямую сравнивали в модели множественной миеломы KMS-11 человека. После имплантации опухоли в день 0 мышей случайным образом распределяли по исследуемым группам и вводили им 5×106 T-клеток внутривенно в день 7. Контролировали опухолевую массу множественной миеломы и здоровье животных до достижения животными контрольной точки. Мышей во всех группах умерщвляли в день 14 после введения CAR T-клеток (день 21 после имплантации опухоли), когда опухолевая масса в контрольных группах при визуализации приближалась к максимальной люминесценции.
Можно наблюдать четкое различие в опухолевой массе между контрольными группами и группами, которым вводили рабочие CAR T-клетки, с P<0,01 в день 14 после введения CAR T-клеток. Оба типа рабочих CAR BCMA T-клеток демонстрировали схожую способность контролировать рост множественной миеломы человека у мышей NSG. Значение % T/C в группе ложнотрансдуцированных T-клеток составляет 212,13%, что свидетельствует о том, что ложнотрансдуцированные T-клетки не обладают противоопухолевой активностью. Значения дельты процента T/C в группах BCMA-3NP и BCMA-4P составляют 1,10% и 2,17%, соответственно, что свидетельствует об остановке роста опухоли после лечения рабочими CAR BCMA T-клетками. Результаты биолюминесцентной визуализации представлены на фигуре 24. Группа, которой вводили PBS, но не вводили какие-либо T-клетки, демонстрирует базовую кинетику роста опухоли KMS-11 у мышей NSG, которых проводили внутривенную имплантацию. Группе ложного введения вводили нетрансдуцированные T-клетки, подвергшиеся той же экспансии in vitro, что и CAR T-клетки. Эти клетки служат в качестве T-клеточного контроля для демонстрации неспецифического ответа T-клеток в этой модели опухоли. В группах, которым вводили PBS и ложнотрансдуцированные T-клетки, наблюдали непрерывное прогрессирование опухоли на всем протяжении эксперимента. Оба типа рабочих CAR BCMA T-клеток контролировали прогрессирование заболевание после инъекций 5×106 T-клеток.
После подтверждения того, что модель KMS-11-luc отвечает на направленное воздействие с помощью CAR BCMA T-клеток, начинали исследование для оценки лучших новых scFv. После имплантации опухоли мышей снова случайным образом распределяли по исследуемым группам и вводили им внутривенно 5×106 T-клеток в день 7. Контролировали опухолевую массу множественной миеломой и здоровье животного до достижения животными конечной точки. Мышей в каждой из групп умерщвляли, когда опухолевая масса в группе при визуализации приближалась к максимальной люминесценции.
Можно наблюдать четкое различие в опухолевой массе между контрольными группами и некоторыми из групп, которым вводили CAR BCMA T-клетки. Рабочие CAR BCMA T-клетки (BMCA-4NP) не контролировали рост опухоли KMS-11, как это было показано ранее. Однако некоторые из новых CAR BCMA T-клеток демонстрировали различные уровни эффективности в этой модели множественной миеломы. Значения % T/C, вычисляемые в конечной точке для каждой группы, свидетельствуют об остановке роста опухоли в группах BCMA-10 и BCMA-13. Группа, которой вводили ложнотрансдуцированные T-клетки, имеет значение % T/C 61,56%, свидетельствующее о том, что ложнотрансдуцированные T-клетки не обладают или обладают минимальной противоопухолевой активностью. Дельта значений процента T/C в группе BCMA-4P составляет 32,03%, что свидетельствует о некоторой минимальной противоопухолевой эффективности после лечения рабочими CAR BCMA T-клетками. В группах BCMA-10 и BCMA-13 наблюдают остановку роста опухоли со значениями T/C 0,07% и 6,04%, соответственно. BCMA-4 демонстрирует исходный контроль роста опухоли, но только при одной дозе T-клеток, вводимой каждой группе, опухоли в этой группе начинали расти. Результаты биолюминесцентной визуализации из первого эксперимента представлены на фигурах 25A. В группе, которой вводили PBS, которой не вводили какие-либо T-клетки, наблюдали базовую кинетику роста опухоли KMS-11 у мышей NSG, которым проводили внутривенную имплантацию. Группе ложного введения вводили нетрансдуцированные T-клетки, подвергнутые той же экспансии in vitro, что и CAR T-клетки. Эти клетки служат в качестве T-клеточного контроля для демонстрации неспецифического ответа T-клеток в этой модели опухоли. В группах, которым вводили PBS и ложнотрансдуцированные T-клетки, наблюдали непрерывное прогрессирование опухоли на всем протяжении эксперимента. Среди групп, которым вводили CAR BCMA T-клетки, BCMA-4, BCMA-10, и BCMA-13 демонстрируют противоопухолевую активность, в то время как рабочие CAR BCMA T-клетки (BCMA-4NP) и BCMA-9 и BCMA-15 не демонстрируют противоопухолевую эффективность. Осуществляли второй эксперимент, и результаты биолюминесцентной визуализации представлены на фигуре 25B. У мышей, которым вводили нетрансдуцированные T-клетки, наблюдали базовую кинетику роста опухоли KMS-11. BCMA-4NP* представляет собой результаты для клонов BCMA-4NP CART в первом эксперименте. Во втором эксперименте BCMA-10, BCMA-13 и BCMA-15 демонстрировали сильную противоопухолевую активность.
В дополнение к мониторингу опухолевой массы посредством биолюминесценции, количества CAR+ T-клеток в каждой группе также контролировали посредством анализа FACS периферической крови. Результаты FACS в этом исследовании представлены на фигуре 26. В группах, в которых наблюдают противоопухолевые эффекты в отношении опухолей KMS-11, также наблюдают экспансию CD4+CAR+ и CD8+CAR+ T-клеток в периферической крови. В группах BCMA-4, BCMA-10 и BCMA-13 наблюдают пик пролиферации CD4+CAR+ между днями 10 и 20 после введения T-клеток. В тех же группах также наблюдают пролонгированную экспансию CD8+CAR+ T-клеток.
Противоопухолевую активность новых трансдуцированных с помощью CAR BCMA T-клеток оценивали в исследовании эффективности на мышах NSG, несущих модель ксенотрансплантата множественной миеломы человека. Эти исследования свидетельствуют о том, что в модели KMS-11-luc воспроизводят множественную миелому человека на мышах NSG, на нее можно направленно воздействовать CAR BCMA T-клетками (фигура 24). После подтверждения того, что эта модель подходит для тестирования CAR BCMA T-клеток, новые CAR BCMA человека тестировали в исследовании эффективности. Это исследование показало, что несколько новых CAR BCMA (BCMA-4, BCMA-10 и BCMA-13) вызывали противоопухолевый ответ в модели ксенотрансплантата множественной миеломы (фигуры 25A). Повторяли эксперимент с опухолью, тестируя BCMA-4, BCMA-10, BCMA-13 и BCMA-15. BCMA-4, BCMA-10, BCMA-13 и BCMA-15 демонстрируют противоопухолевую эффективность посредством ингибирования или снижения роста опухоли в течение по меньшей мере 4 недель (28 дней) после имплантации (фигура 25B).
Кроме того, противоопухолевый ответ коррелирует с экспансией CD4+CAR+ и CD8+CAR+ T-клеток в периферической крови этих мышей (фигуры 26A, B, C, и D). Не наблюдали противоопухолевую эффективность в случае любого из CAR BCMA, если не наблюдали экспансию этих T-клеток. BCMA-10, демонстрирующий наиболее высокую противоопухолевую эффективность в этой модели, также демонстрирует наиболее длительную экспансию CD8+CAR+ T-клеток. Во всех из групп BCMA-4, BCMA-10 и BCMA-13 наблюдают значительное изменение роста опухоли по сравнению с контрольными группами. Отсутствие эффективности, наблюдаемое для рабочих CAR BCMA (BCMA-4NP) и BCMA-9 и BCMA-15 в первом эксперименте с опухолями (фигура 25A), коррелирует с отсутствием экспансии T-клеток в периферической крови у мышей в этих группах. Аналогично, отсутствие эффективности, наблюдаемое в случае BCMA-4NP во втором эксперименте с опухолями (фигура 25B), коррелирует с отсутствием экспансии T-клеток в периферической крови у мышей.
Конечные образцы костного мозга и селезенки также анализировали в конце эксперимента с опухолями in vivo для определения того, демонстрируют ли клоны CART, демонстрирующие противоопухолевую эффективность, различия в способности к приживлению популяции костного мозга по сравнению с группами, не демонстрировавшими противоопухолевую эффективность. Определяли количество CAR-экспрессирующих CD4+ и CD8+ T-клеток в костном мозге (фигуры 27A и 27C) и селезенке (фигуры 27B и 27D) мышей из первого эксперимента. Результаты свидетельствуют о том, что введение BCMA-9 CART приводило к наиболее высокому количеству CAR+ T-клеток (CD4+ и CD8+ T-клеток) в костном мозге и селезенке, что свидетельствует о том, что клетки BCMA-9 CART эффективно подвергаются экспансии in vivo, но не обладают мощностью цитолиза или противоопухолевой активностью. BCMA-10 CART клетки демонстрировали следующее по степени устойчивости приживление T-клеток в костном мозге и селезенке. BCMA-4 и BCMA-15 CART-клетки также обнаруживали в селезенке.
Пример 8: Идентификация лучших конструкций BCMA CAR для терапии
Для идентификации лучших конструкций BCMA CAR получали результаты нескольких анализов in vitro и in vivo. Экспериментальные анализы, примеры, в которых описаны подробности анализов, и количество лучших CAR BCMA, полученных после анализа, представлены в следующей таблице (таблице 13). Результаты анализов анализировали в порядке, представленном в таблице 13, для выбора CAR BCMA-кандидатов, проявляющих специфичность, экспрессию в иммунных эффекторных клетках и активность in vitro и/или in vivo.
Таблица 13. Анализы для выбора CAR BCMA
Количество клеток: >в 20 раз по сравнению с количеством клеток в T=0
Доказательство экспансии CAR+ T-клеток
С учетом анализов in vitro, например, экспрессии трансдуцированных с помощью лентивируса CAR, активации JNL NFAT, экспансии T-клеток, пролиферации T-клеток и цитолиза клеток-мишеней (как описано в примерах 5, 6 и 7), 7 CAR BCMA идентифицировали как лучшие CAR для тестирования на терапевтическую эффективность in vivo и 5 CAR BCMA (BCMA-4, BCMA-9, BCMA-10, BCMA-13 и BCMA-15) тестировали в примере 8. Как описано в примере 8, все из BCMA-4, BCMA-10, BCMA-13 и BCMA-15 демонстрировали противоопухолевую эффективность, при этом BCMA-10 и BCMA-13 воспроизводимо демонстрировали противоопухолевую эффективность в двух отдельных экспериментах in vivo.
Сравнивали лентивирусный титр среди CAR BCMA-кандидатов после автоматизированной продукции вируса и автоматизированной трансдукции клеток SupT1. Осуществляли два независимых анализа лентивирусного титра. В первом тестировании титра анализировали два независимых препарата ДНК (A и B) BMCA-4, BCMA-10, BCMA-13 и BCMA-15 CAR. Во втором тестировании титра анализировали три независимых препарата ДНК (A, B и C) BMCA-4, BCMA-10, BCMA-13 и BCMA-15 CAR. Получение вируса осуществляли в автоматизированном 96-луночном формате. Трансдукцию клеток SupT1 также осуществляли в автоматизированном 96-луночном формате. Экспрессию CAR вручную анализировали посредством FACs и результаты представлены на фигурах 28A и 28B. Все тестируемые CAR BCMA демонстрировали сравнимые уровни и последовательность вирусного титра.
Таким образом, в совокупности, в результате экспериментов in vitro и in vivo, описанных в таблице 13, BMCA-4, BCMA-10, BCMA-13 и BCMA-15 идентифицировали как соответствующие критериям для каждого анализа и являющиеся перспективными для дальнейшего тестирования для терапевтического применения. Затем при использовании более строгих критериев в анализе регрессирования опухоли, в котором далее анализировали только конструкции CAR, воспроизводимо демонстрирующие противоопухолевую эффективность в обоих экспериментах, идентифицировали BCMA-10 и BCMA-13 для дальнейшего терапевтического тестирования.
Пример 9: Характеризация лучших конструкций BCMA CAR
Осуществляли дополнительные анализы для характеризации свойств лучших конструкций BCMA CAR BMCA-4, BCMA-10, BCMA-13 и BCMA-15 CAR, демонстрировавших эффективность in vitro и in vivo в различных анализах, описываемых в примерах 5-8. Выравнивание последовательностей BCMA-10 и BCMA-13 показало, что два CAR имеют идентичные CDR тяжелой цепи и высокую гомологию CDR легкой цепи. Осуществляли конкурентный анализ четырех лучших CAR-кандидатов BMCA-4, BCMA-10, BCMA-13 и BCMA-15 и BCMA-4NP (рабочего CAR) в качестве контроля. BCMA-4NP инкубировали с субстратом BCMA, и он связывался в течение от 50 до 300 секунд после инкубации, как показано на фигуре 29. Добавляли четыре конструкции BCMA CAR и контролировали связывание с субстратом. Как показано на фигуре 29, все четыре конструкции BCMA CAR конкурировали с контрольным BCMA-4NP, что свидетельствует о том, что все четыре CAR BCMA-кандидата связываются с тем же эпитопом, что и рабочий CAR BCMA-4NP. При указанных концентрациях, если CAR-кандидаты связывались с другим эпитопом, ожидаемое изменение RU будет составлять приблизительно 70 RU. Небольшое изменение RU, наблюдаемое при связывании CAR BCMA-кандидатов, являлось результатом незначительной диссоциации контрольного образца BCMA-4NP от BCMA.
Также оценивали аффинность антитела для CAR BCMA-кандидатов: BCMA-4, BCMA-10, BCMA-13 и BMCA-15. Результаты представлены на фигуре 30 и обобщены в таблице ниже.
Таблица 14. Аффинность связывания CAR BCMA
BCMA-10 и BCMA-13 обладают схожими аффинностями и имеют наименьшие аффинности среди тестируемых кандидатов.
Также тестировали селективное связывание CAR BCMA-кандидатов. BCMA является одним из рецепторов в семействе рецепторов ФНО, включающем близкородственных членов семейства BaffR и TACI. BCMA имеет приблизительно 41% гомологии с BaffR и приблизительно 22% гомологии с TACI. T-клетки, экспрессирующие CAR BCMA-кандидаты BCMA-4, BCMA-10, BCMA-13 и BCMA-15, инкубировали с рекомбинантными BCMA, BaffR или TACI, слитыми с Fc-областями. Связывание оценивали посредством окрашивания CAR+ клеток (фигура 31). Результаты свидетельствуют о том, что специфическое связывание наблюдали между всеми BCMA-экспрессирующими T-клетками и рекомбинантными BCMA-Fc, что свидетельствует о том, что конструкции BCMA CAR селективно связываются с BCMA.
Пример 10: Экспрессия BCMA в головном мозге
Результаты анализа ткани с помощью микрочипа, представленные в таблице 11, свидетельствовали о том, посредством иммуногистохимического анализа экспрессию BCMA определяли в мозжечке. Фиксированные формалином, погруженные в парафин (FFPE) ткани головного мозга человека и не являющегося человеком примата окрашивали антителами против BCMA, например, поликлональным антителом кролика USBio (0807-50G), индуцированным против внутриклеточного эпитопа BCMA, и химерным антителом кролика J6MO, распознающим внеклеточный эпитоп BCMA. Окрашивание поликлональным антителом кролика UsBio в ткани головного мозга не являющегося человеком примата (яванского макака) приводило к положительному окрашиванию лазящих волокон мозжечка (фигура 32A) и телец клеток в нижнем оливном ядре (фигура 32B) мозжечка. Окрашивание ткани головного мозга не являющегося человеком примата с использованием J6MO приводило к BCMA-положительному окрашиванию только в нижнем оливном ядре (фигура 32C, окрашивание Ig-контролем на фигуре 32E). Аналогично, окрашивание ткани головного мозга человека с использованием J6MO также приводило к BCMA-положительному окрашиванию только в нижнем оливном ядре (фигура 32D, окрашивание Ig-контролем на фигуре 32F).
Результаты иммуногистохимии подтверждали посредством анализа РНК. Осуществляли гибридизацию in situ ткани головного мозга не являющегося человеком примата и человека. Мозжечок и продолговатый мозг являлись BCMA-отрицательными при детекции мРНК посредством гибридизации in situ (фигуры 33A и 33B). Также осуществляли количественную ПЦР на тканях мозжечка, продолговатого мозга, желудка и почек не являющегося человеком примата (яванского макака) и человека. Результаты qPCR свидетельствуют о том, что мРНК BCMA не определяли в мозжечке и продолговатом мозге человека (фигура 33C) или не являющегося человеком примата (фигура 33D). Потенциальное несоответствие между иммуногистохимическим анализом и анализом РНК может являться результатом разных вариантов сплайсинга BCMA, известных в этой области (Smirnova et al., Mol Immunol, 2008, 45:1179-83).
Анализ RNAseq, с помощью которого можно определять все изоформы и варианты сплайсинга BCMA, осуществляли на нормальных тканях. Результаты свидетельствуют о том, что посредством RNAseq в нормальной ткани определяли небольшую экспрессию BCMA или ее отсутствие (фигура 33E).
Дополнительный анализ осуществляют для определения того, будет ли определяемый белок BCMA доступным для BCMA CART клеток, и определения последствий для терапии BCMA CART. Зонды для ПЦР заново конструировали и повторно оценивали экспрессию вариантов сплайсинга BCMA. Осуществляют RNAseq отдельных клеток в образцах мозжечка. Осуществляют конфокальную микроскопию для визуализации внутриклеточного окрашивания. Мышей также оценивают на эффекты в отношении головного мозга в случае эффективных CART, например, BCMA-10 и BCMA-13. Для предотвращения потенциальной миграции BCMA CART-клеток в головной мозг индивидуумам можно вводить натализумаб.
Пример 11: Терапия BCMA при рецидивирующей/рефрактерной миеломе
В этом примере описывают однокогортное, открытое пилотное исследование для оценки безопасности и осуществимости инфузии аутологичных T-клеток, экспрессирующих BCMA-специфические CAR, при рецидивирующей и/или рефрактерной множественной миеломе. BCMA-CAR содержат тандемные костимуляторные домены TCRζ и 4-1BB (TCRζ /4-1BB), и T-клетки, экспрессирующие BCMA-CAR, обозначают как CAR BCMA T-клетки.
Цели исследования
Первичной целью исследования является определение безопасности и переносимости CAR BCMA T-клеток у пациентов с MM. Вторичные цели включают: описание исходов, включая долю ответов, долю минимальной остаточной болезни (MRD), выживаемость без прогрессирования и общую выживаемость и оценку осуществимости производства CAR BCMA T-клеток. Исследовательские цели включают: характеризацию CAR BCMA T-клеток в отношении их экспансии, выживаемости, хоминга, фенотипа и функции, оценку развития клеточного и/или гуморального иммунитета против CAR BCMA T-клеток, оценку эффекта CAR BCMA T-клеток в отношении компартментов B-клеток и плазматических клеток, включая уровни иммуноглобулинов, определение влияния CAR BCMA T-клеток на системные растворимые иммунные факторы у пациентов, оценку экспрессии BCMA на клетках MM до и после лечения и оценку безопасности и эффективности повторного лечения CAR BCMA T-клетками у пациентов, у которых наблюдают прогрессирование после предшествующего клинического результата.
Длительность исследования
Длительность активного вмешательства и мониторинга составляет приблизительно 2 года. Через 2 года мониторинг отсроченных побочных реакций перейдет в отдельный длительный протокол последующего исследования в соответствии с руководствами FDA. Для протокола потребуется приблизительно 12-18 месяцев для завершения регистрации.
Диагностика и основные критерии включения
Будут включать до 12 поддающихся оценке индивидуумов.
Критерии включения включают взрослых пациентов возрастом >18 с рецидивирующей и/или рефрактерной множественной миеломой после по меньшей мере 3 предшествующих линий терапии, которые должны включать предшествующее алкилирующее средство, ингибитор протеасом (PI) и иммуномодулирующее лекарственное средство (IMiD) (или 2 предшествующих средства, если заболевание является двойным рефрактерным к IMiD (иммуномодулирующему лекарственному средству, талидомиду и леналидомиду) и ингибитору протеасом). Пациенты имеют рецидивирующее заболевание, определяемое как соответствующее критериям IMWG (International Myeloma Working Group) для PD, или являются рефрактерными, как определяют по достижению <PR после последней схемы лечения. Пациенты имеют ограниченный прогноз (ожидаемая выживаемость ≤2 лет) с учетом доступных в настоящее время способов терапии.
Исследуемый продукт, доза, путь, схема лечения
Однократная инфузия CAR BCMA T-клеток, вводимых посредством внутривенной инфузии. Когорте 1 будут вводить 1-5×108 CAR BCMA T-клеток в отдельности, вычисляемых как диапазон 2-50% трансдуцированных клеток из общего количества клеток (дозу клеток в когорте 1 можно снижать до 1-5×107 CAR BCMA T-клеток (когорта -1), если наблюдают неожиданную тяжелую токсичность). Когорте 2 будут вводить циклофосфамид (цитоксан) в дозе 1,5 г/м2, вводимый посредством i.v. инфузии за 1-3 дня до инфузии 1-5×107 CAR BCMA T-клеток. Когорте 3 будут вводить циклофосфамид в дозе 1,5 г/м2, вводимый посредством i.v. инфузии за 1-3 дня до инфузии 1-5×108 CAR BCMA T-клеток.
Учитывают общий объем, подлежащий инфузии, и рекомендуемую скорость инфузии 10-20 мл в минуту. Доза и схемы лечения для каждой когорты обобщены в таблице ниже, и схематическая диаграмма представлена на фигуре 34.
Таблица 15. Общие данные о когортах и дозах
Для профилактики потенциальной миграции T-клеток в головной мозг пациентам можно вводить натализумаб (TYSABRI®).
Мониторинг пациентов
Ответ опухоли будут измерять посредством электрофореза белков сыворотки и мочи и иммунофиксации, биопсии костного мозга и визуализации наличия скелетных повреждений до лечения. Также будут осуществлять неврологические обследования до и после терапии для обеспечения отсутствия неврологических изменений.
Статистическая методология
Статистический анализ будет, главным образом, описательным в соответствии с поисковым характером исследования. Будут использовать описательную статистику для определения относительного приживления, выживаемости и миграции компонентов исследуемого лекарственного средства в кровь и костный мозг. Будут описывать все побочные реакции и получать точные 95%-ные доверительные интервалы для долей побочных реакций вообще и в основных категориях. Анализ других вторичных конечных точек, таких как противоопухолевая активность, также будет описательным и может включать сводную статистику, такую как средние значения и стандартные отклонения или кривые Каплана-Мейер в случае информации о выживаемости.
Пример 12: Секреция цитокинов CART-клетками
Определяли способность CART-клеток секретировать цитокины в ответ на мишень. CART-клетки, содержащие BCMA-10 CAR, или нетрансдуцированные T-клетки сокультивировали с BCMA-положительными (KMS11-luc) или BCMA-отрицательными (U87-luc) клетками-мишенями и измеряли секрецию ИЛ-2, ИФНγ и ФНО в среды. В частности, размороженные CAR T-клетки, содержащие BCMA-10 CAR, или нетрансдуцированные клетки сокультивировали с клетками-мишенями в течение 20 часов при соотношении эффектор:мишень 2,5:1. Клетки-мишени включали BCMA-положительные KMS-11 с люциферазой (KMS11-luc) или BCMA-отрицательные клетки U87 с люциферазой (U87-luc). Эффекторные клетки культивировали в 96-луночных планшетах с U-образным дном с 3×104 клеток-мишеней в общем объеме 200 мкл/лунку в полных T-клеточных средах. Через 20 часов супернатанты удаляли из культур и количественно анализировали секрецию ИФНγ, ИЛ-2 и ФНО посредством цитометрического анализа с использованием бус (BD Bioscience) с помощью FACS по инструкциям производителя. Измерения осуществляли в двух параллелях. Планки погрешностей представляют стандартное отклонение (фигуры 35A-35B). Результаты свидетельствуют о том, что BCMA-10 CART, но не нетрансдуцированные T-клетки, стимулировали с продукцией цитокинов BCMA-экспрессирующими, но не BCMA-отрицательными, клетками-мишенями (фигуры 35A-35B).
Пример 13: Функция BCMA-CART при множественной миеломе
Множественная миелома (MM) является злокачественным новообразованием из плазматических клеток в костном мозге с клиническими признаками, включающими, в качестве наиболее распространенных, анемию, повреждения кожи, хрупкость костей или боль в костях, утомляемость, остеолитические повреждения, гиперкальциемию, почечную недостаточность и рецидивирующую бактериальную инфекцию. Несмотря на тот факт, что современные способы лечения лекарственными средствами, такими как леналидомид, приводят к значительному повышению выживаемости при рецидивирующей MM, заболевание почти всегда является неизлечимым. Медиана 5-летней выживаемости составляет приблизительно 35%. По причине неблагоприятного прогноза необходима эффективная направленная терапия.
Лечение с использованием T-клеток, сконструированных для экспрессии химерных антигенных рецепторов (CAR), может привести к многообещающим способам иммунотерапии гемобластозов, таких как ALL. CAR содержат слитый белок, распознающий белок-мишень поверхности клетки, экспрессирующийся на опухолевой клетке. В исследования дифференциальной экспрессии генов идентифицирован B-клеточный антиген созревания (BCMA, CD269) как высокоспецифичный антиген-мишень в случае злокачественных плазматических клеток и нормальных плазматических клеток, таким образом, BCMA является потенциально применимым антигеном-мишенью для терапии CAR T-клетками. См., например, Carpenter et al. Clin Cancer Res. 19,8(2013):2048-60.
BCMA является членом суперсемейства рецепторов ФНО. Белок кодируется геном TNFRSF17. BCMA экспрессируется в зрелых B-лимфоцитах. Он связывается с суперсемейством факторов некроза опухоли (лигандом), членом 13b (TNFSF13B/TALL-1/BAFF), APRIL и с различными членами семейства TRAF. Взаимодействие между их лигандами приводит к сигналам NF-kappaB и MAPK8/JNK, связанным с развитием B-клеток, длительной выживаемостью в плазме и пролиферацией клеток.
В этом примере описывают преклиническое исследование для оценки функции in vitro и in vivo huBCMA-BBz CAR-трансдуцированных T-клеток (CART-BCMA или BCMA-CART), включающих BCMA10 scFv.
Материалы
T-клетки. T-клетки здоровых доноров получали из University of Pennsylvania CFAR Human Immunology Core (Philadelphia, PA). Клетки получали посредством лейкафереза здоровых доноров-добровольцев.
Среда. Использовали среду RPMI (Gibco), дополненную 10% эмбриональной телячьей сывороткой и профильтрованную (Valley Biomedical), 2 мМ GlutaMax, (Invitrogen), 10 мМ HEPES (Invitrogen), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Gibco).
Бусы CD3/28. Бусы CD3/28 (категории GMP) производили в Clinical Cell and Vaccine Production Facility в University of Pennsylvania.
Плазмиды. Конструкцию huBCMA-BBz CAR, клонируемую в лентивирусный вектор pELPS NVP-MCM998, получали в Novartis.
Антитела. Антитела козы против BCMA человека, меченые PE (Biolegend кат. № 357504), и стрептавидин (BD Biosciences) использовали для детекции экспрессии BCMA на линиях клеток множественной миеломы. В случае экспрессии CAR T-клетками использовали слитый белок BCMA-Fc (R&D Systems, кат. №193-BC-050), а затем антитело против Fc IgG человека с PE (Biolegend, кат. № 409304).
PBS. PBS получали в Gibco.
Упаковка лентивируса. Плазмиды PCL USUG, PRSV Rev, PGAG pol (Nature Technology corp., кат. № NTC RP20) использовали для получения лентивируса huBCMA-BBz посредством трансфекции с использованием липофектамина 2000 (Invitrogen, кат. № 11668027) на клетках 293T.
Линии клеток. Для получения лентивируса использовали эмбриональные клетки почки человека 293T (ATCC кат. № CRL-3216). Для функциональных экспериментов с CART-BCMA клетками использовали линии клеток множественной миеломы RPMI 8226 (ATCC, кат. № CCL-155), MM1S (ATCC, кат. № CRL-2974), U266 (ATCC, кат. № CRL-3216), NCI H929 (ATCC, кат. № CRL-9068) и OPM2 (DSMZ, кат. № ACC-50) и K562 (ATCC, кат. № CCL-256) или клетки K562-BCMA (лентивирусный вектор BCMA от Genecopoeia, кат. № Lv105).
Способы
Получение лентивируса и определение титра. Клетки 293T высевали при 8×106 клеток/на флакон во флакон T150 (Corning Costar, кат. №430825) со средой RPMI1640 (Gibco, кат. №11875-080), дополненной 10% FBS (ATCC, кат. № 30-2020) и стрептомицином/пенициллином (Invitrogen, кат. № 10378-016), и трансфицировали с использованием смеси плазмид для упаковки (Nature Technology corp.) и huBCMA-BBz, кодирующего лентивирусный вектор pELPS, в течение 24 часов. Полученный вирусный препарат хранили при -80°C. Рекомбинантный лентивирус титровали относительно CD4 T.
Трансдукция. T-клетки, полученные из Human Immunology Core, однократно промывали в средах, ресуспендировали при 106 клеток/мл и стимулировали бусами CD3/28 при соотношении клетка:бусы 1:3. Трансдукцию лентивирусом осуществляли в день 2 посредством смешивания лентивирусного вектора с культурами клеток при MOI 3.
Экспансия T-клеток. Стимулируемые T-клетки подпитывали и разделяли каждые 2-3 дня до 0,8×106 клеток/мл в течение 7-9 дней или до тех пор, пока клетки являлись покоящимися, как определяли по снижению скорости деления клеток и снижению среднего объема клеток до <~300 фл.
Культуры клеток. Линии клеток множественной миеломы и линии клеток K562, K562 BCMA культивировали в RPMI с 10% FBS и антибиотиками.
Определение количества клеток. Клетки подсчитывали каждые 3 дня в течение экспансии посредством осторожного смешивания культур и сбора 40 мкл клеток из объема культур и помещали в Accuvettes (Beckman Coulter) с 20 мл буфера Isoton II Diluent Buffer для подсчета с использованием Coulter Multisizer 3 (Beckman Coulter). Результаты этого теста (абсолютное количество клеток и объем клеток) использовали для определения концентрации клеток, общих количеств клеток, скорости роста и объемов разведения.
Анализ высвобождения 51Cr. Способность клеток CART-BCMA уничтожать BCMA-экспрессирующие клетки-мишени оценивали с использованием анализа высвобождения 51Cr. В кратком изложении, клетки-мишени K562-BCMA (или контрольные клетки K562) и линии клеток множественной миеломы метили 51Cr (дихроматом натрия), промывали и сокультивировали с эффекторными CART-BCMA или контрольными нетрансдуцированными T-клетки (NTD) при различных соотношениях эффектор/мишень. Супернатанты собирали через 4 часов и помещали в 96-луночные планшеты Lumaplates (Perkin Elmer). Количество 51Cr, высвобождаемого из меченых клеток-мишеней, измеряли с помощью жидкостного сцинтилляционного счетчика (MicroBeta trilux, Perkin Elmer). Клетки-мишени, инкубируемые в среде в отдельности или с 1% SDS, использовали для определения спонтанного (S) или максимального (M) высвобождения 51Cr. Процентную долю специфического лизиса вычисляли следующим образом: 100×(импульсы/мин при экспериментальном высвобождении-импульсы/мин при S-высвобождении)/(импульсы/мин при M-высвобождении-импульсы/мин при S-высвобождении).
Детекция CAR на трансдуцированных T-клетках. Для оценки трансдукции CART-BCMA T-клетки окрашивали с помощью слитого белка BCMA-Fc (R&D Systems), а затем антителом против Fc IgG человека-PE (Biolengend).
Проточная цитометрия. В случае окрашивания против BCMA линии клеток миеломы человека окрашивали с использованием антитела козы против BCMA человека-PE (Biolegend), а затем стрептавидина (BD Biosciences). Проточную цитометрию во всех экспериментах осуществляли с использованием FlowJo (Tree Star, Inc.).
ELISA. Клетки-мишени K562-BCMA (или контрольные клетки K562) или линии клеток множественной миеломы комбинировали с CAR-трансдуцированными T-клетками при соотношении мишень:эффектор 1:3 в двух параллелях в лунках 96-луночного плоскодонного планшета. Анализ ELISA осуществляли в разведении 1:10 супернатанта, собранного после 16 часов инкубации, с использованием набора ELISA для ИФНγ или ИЛ-2 человека Duoset (R&D) по инструкциям производителя.
Результаты
huBCMA-BBz в высокой степени экспрессировался на трансдуцированных T-клетках.
Свежеочищенные, подвергнутые отрицательной селекции нормальные T-клетки человека активировали in vitro с использованием бус CD3/28 (соотношение клетки:бусы 1:3) и позволяли им делиться. В день 1 после активации клетки трансдуцировали с использованием преклинического лентивирусного вектора, экспрессирующего huBMCA-BBz, или ложно трансдуцировали (контроль NTD). На фигуре 36A показано повышение общего количества T-клеток в течение культивирования. BCMA-CART клетки подсчитывали каждые 3 дня и доводили до соотношения разделенных клеток. T-клетки подсчитывали с использованием Coulter Counter Multisizer III и подпитывали каждые 2 дня до конца цикла экспансии (день 7-9). В день 6 экспансии ex vivo 200 мкл CART-BCMA или контрольных NTD T-клеток окрашивали, как описано в разделе "Способы" выше. Живые популяции клеток гейтировали с использованием FCS относительно SSC. Получение данных проточной цитометрии осуществляли с помощью инструмента BC FACS Canto и анализ данных проточной цитометрии осуществляли с использованием программного обеспечения FlowJo (TreeStar, Inc).
Не наблюдали различий в скоростях пролиферации нетрансдуцированных (NTD) и CART-BCMA клеток, что свидетельствует о том, что лентивирусная экспрессия не влияла на пролиферативный потенциал T-клеток (фигура 36A). Эффективность трансдукции оценивали в день 6 после трансдукции, как описано в разделе "Способы" выше. На фигуре 36B показано, что эффективность трансдукции huBCMA-BBz составляла 49%. Эти результаты свидетельствуют о том, что huBCMA-BBz CAR эффективно экспрессировался на поверхности T-клеток человека.
BCMA экспрессировался на различных уровнях на линиях клеток множественной миеломы.
Поверхностную экспрессию BCMA на линиях клеток множественной миеломы определяли с использованием окрашивания и проточной цитометрии. Живые популяции клеток гейтировали по параметрам FCS/SCC. Получение данных проточной цитометрии осуществляли с помощью инструмента Canto и анализ данных проточной цитометрии осуществляли с использованием программного обеспечения FlowJo. Большинство тестируемых линий клеток множественной миеломы демонстрировали сильную экспрессию BCMA, в то время как клетки RPMI 8226 и контрольные клетки K562-BCMA экспрессировали более низкие уровни на поверхности BCMA (фигура 37). На всех графиках оранжевый сплошной пик представляет изотипический контроль, и синий сплошной пик представляет окрашивание с использованием антитела против BCMA (фигура 37). При окрашивании и проточной цитометрии выявляли экспрессию BCMA на поверхности линий клеток множественной миеломы NCI H929, U266, RPMI 8226, OPM2 и MM1S, а также клеток K562-BCMA. Не определяли BCMA на поверхности линии клеток K562 (фигура 37). Эти результаты свидетельствуют о том, что BCMA экспрессировался несколькими линиями клеток множественной миеломы с уровнями экспрессии, варьирующимися приблизительно на 1 log.
Клетки CART-BCMA продуцировали цитокины и демонстрировали цитотоксические свойства, в частности, в ответ на различные BCMA-экспрессирующие линии клеток множественной миеломы.
Определяли способность клеток CART-BCMA продуцировать цитокины и уничтожать BCMA+ клетки-мишени. Клетки CART-BCMA (трансдуцированные с помощью huBCMA-BBz T-клетки) или контрольные нетрансдуцированные T-клетки (NTD) сокультивировали в двух параллелях в течение 16 часов с K562, K562-BCMA или линиями клеток множественной миеломы (MM1S, OPM2 или U266). Клетки сокультивировали в соотношении T-клеток и клеток-мишеней 3:1. Собирали супернатант, не содержащий клетки, и оценивали продукцию ИЛ-2 или ИФНγ, как описано в разделе "Способы" выше.
Клетки CART-BCMA особенно продуцировали ИЛ-2 или ИФНγ в присутствие K562, сконструированных для экспрессии BCMA (K562-BCMA), по сравнению с неэкспрессирующими антиген клетками K562 дикого типа. Клетки CART-BCMA также были способны продуцировать цитокины в присутствие линий клеток множественной миеломы U266, OPM2 и MM1S (фигуры 38A-38B). Эти результаты свидетельствуют о том, что в присутствие линий BCMA+ клеток-мишеней клетки CART-BCMA продуцировали провоспалительные цитокины.
Другой мерой противоопухолевой эффективности in vitro клеток CART-BCMA является их способность уничтожать BCMA+ клетки-мишени. T-клетки активировали и трансдуцировали, как описано выше, например, в отношении фигур 36A-36B. BCMA10 CAR T-клетки сокультивировали с 51Cr-мечеными линиями клеток K562-BCMA, RPMI 8226 или MM1S в течение 4 часов при соотношения эффектора и мишени (соотношении E:T), указанном на фигурах 39A-39C (E:T 0, 10, 20 или 30) и вычисляли процентную долю лизиса, как описано в разделе "Способы" выше. На фигуре 39A показано, что клетки CART-BCMA особенно уничтожали клетки K562-BCMA. Клетки CART-BCMA также эффективно уничтожали линию клеток множественной миеломы BCMAhigh MM1S и линию клеток BCMAlow RPMI 8226 в 4-часовом анализе цитотоксичности (фигуры 39B, 39C). Эти результаты свидетельствуют о том, что CART-BCMA демонстрировали повышенную цитотоксическую активность (анализ 51Cr) против линий клеток множественной миеломы.
Противоопухолевая активность клеток CART-BCMA in vivo
Используя клетки RPMI 8226, демонстрирующие более низкие уровни экспрессии BCMA по сравнению со многими другими линиями клеток миеломы, разрабатывали мышиную модель для оценки способности CART-BCMA распознавать и устранять опухоли, образуемые линией клеток BCMAlow RPMI 8226, сконструированной для экспрессии зеленой люциферазы жука-щелкуна (CBG) для биолюминесцентной визуализации (BLI). Мышам NOD/SCID/γ-цепь-/- (NSG) с развившимися опухолями из внутривенно введенных RPMI 8226 делали внутривенные инъекции клеток CART-BCMA (N=10) или нетрансдуцированных контрольных T-клеток (NTD) (N=10) в день 30 после инокуляции опухолевых клеток. Мышам NSG, которым пересаживали клетки RPMI-8226, вводили 5×106 T-клеток CART-BCMA в день 30 после инъекции опухолевых клеток. После прогрессирования миеломной опухоли осуществляли BLI in vivo (BLI вентральных и дорзальных областей мыши один раз в неделю) до 9 недель после инфузии T-клеток (через 14 недель после инъекции опухоли).
Нетрансдуцированные T-клетки не могли контролировать опухоли, и всех мышей приходилось умерщвлять по причине прогрессирования заболевания через 10-11 недель после инъекции опухоли (фигура 40A и 40C). В отличие от этого, мыши, которым вводили клетки CART-BCMA, демонстрировали контроль роста опухоли у большинства мышей, что приводило к 80% выживаемости мышей, которым вводили CART-BCMA, через 10 недель после инокуляции опухолевых клеток по сравнению с 0% выживаемости мышей, которым вводили контроль NTD (фигуры 40B и 40C). Эти результаты свидетельствуют о том, что интрамедуллярные опухоли RPMI 8226 ингибировали введением CART-BCMA.
Пример 14: Схема введения BCMA-CART
Терапию клетками BCMA CART, например, терапию клетками BCMA CART, представленную в настоящем описании, можно проводить пациентам, например, пациентам с множественной миеломой, в соответствии со схемой введения, представленной в настоящем описании, например, схемой введения, описываемой далее.
Пред проведением терапии BCMA CART осуществляют лейкаферез у пациента для получения аутологичных T-клеток. Осуществляют производство и/или криоконсервацию T-клеток BCMA lentiCAR. В течение производства пациентам можно проводить терапию для сохранения контроля заболевания. Некоторым пациентам можно проводить терапию с истощением лимфоцитов (например, цитоксаном) перед введением CART-клеток. Например, пациенту проводят химиотерапию с истощением лимфоцитов, например, цитоксаном (например, в дозе 1,5 г/м2). В других схемах введения пациенту не проводят химиотерапию с истощением лимфоцитов. Затем пациентов лечат клетками BCMA CART в соответствии со схемой введения, представленной в настоящем описании.
Схема введения включает фракционирование дозы, например, где конкретную процентную долю общей дозы клеток вводят в первый день лечения, другую процентную долю общей дозы клеток вводят в последующий день лечения, и другую процентную долю общей дозы клеток вводят в еще более поздний день лечения. Например, 10% общей дозы клеток вводят в первый день, 30% общей дозы клеток вводят во второй день и оставшиеся 60% общей дозы клеток вводят в третий день лечения. Например, общая доза клеток включает от 1 до 5×107 или от 1 до 5×108 BCMA-CART-клеток.
В одной схеме введения не проводят химиотерапию с истощением лимфоцитов и вводят общую дозу клеток BCMA-CART от 1 до 5×107 (например, посредством инфузии) с 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения. В другой схеме введения не проводят химиотерапию с истощением лимфоцитов и вводят общую дозу клеток BCMA-CART от 1 до 5×108 (например, посредством инфузии) с 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения. В другой схеме введения химиотерапию с истощением лимфоцитов (цитоксаном в дозе 1,5 г/м2) проводят за три дня до введения BCMA-CART-клеток, а затем вводят общую дозу клеток BCMA-CART от 1 до 5×107 (например, посредством инфузии) с 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения. В другой схеме введения химиотерапию с истощением лимфоцитов (цитоксаном в дозе 1,5 г/м2) проводят за три дня до введения BCMA-CART-клеток, а затем вводят общую дозу клеток BCMA-CART от 1 до 5×108 (например, посредством инфузии) с 10% дозы клеток в день 1 лечения, 30% в день 2 лечения и 60% в день 3 лечения.
Клинические лабораторные анализы осуществляют в дни 1, 2, 4, 7, 14, 21, 28, каждые 4 недели, после введения CART-клеток (при этом день 0 является первым днем введения CART). Оценки множественной миеломы осуществляют до введения CART, в первый день введения CART (день 0) и дни 14, 28 и каждые 4 недели. Аспирацию/биопсию костного мозга (bx) осуществляют до введения CART и в дни 28 и 90 после введения CART. После первых 28 дней лечения CART последующее наблюдение осуществляют каждые 4 недели в течение до 6 месяцев, затем каждые 3 месяца в течение до 2 лет.
Пример 15: Низкая доза RAD001 стимулирует пролиферацию CART в модели культуры клеток
Эффект низких доз RAD001 в отношении пролиферации CART-клеток in vitro оценивали посредством сокультивирования CART-экспрессирующих клеток с клетками-мишенями в присутствие разных концентраций RAD001.
Материалы и способы
Получение CAR-трансдуцированных T-клеток
Лентивирусный вектор для переноса с гуманизированным CAR против CD19 человека (huCART19) использовали для получения геномного материала, упакованного в псевдотипированные лентивирусные частицы VSVg. Аминокислотной и нуклеотидной последовательностью гуманизированного CAR против CD19 человека (huCART19) являются CAR 1, ID 104875, описываемые в публикации PCT № WO2014/153270, зарегистрированной 15 марта 2014 года, и обозначаемые как SEQ ID NO: 85 и 31 в настоящем описании.
Лентивирусный вектор для переноса ДНК смешивают с тремя компонентами для упаковки VSVg env, gag/pol и rev в комбинации с реагентом липофектамином для трансфекции клеток Lenti-X 293T. Среду заменяли через 24 и 30 часов, содержащие вирус среды собирают, фильтруют и хранят при -80°C. CART получают посредством трансдукции свежих или замороженных наивных T-клеток, полученных посредством отрицательной магнитной селекции крови здорового донора или Leukopak. T-клетки активируют посредством инкубации с использованием бус против CD3/против CD28 в течение 24 часов, после чего вирусный супернатант или концентрированный вирус (MOI=2 или 10, соответственно) добавляют в культуры. Модифицированным T-клеткам позволяли расти в течение приблизительно 10 дней. Процентную долю трансдуцированных клеток (экспрессирующих CAR на поверхности клетки) и уровень экспрессии CAR (относительную интенсивность флуоресценции, геометрическое среднее) определяют посредством проточного цитометрического анализа между днями 7 и 9. При комбинации замедленного роста клеток и размера T-клеток, приближающегося к ~350 фл, состояние T-клеток определяют как подлежащее криосохранению для дальнейшего анализа.
Оценка пролиферации CART
Для оценки функциональности CART T-клетки размораживали и подсчитывали и определяли жизнеспособность с помощью Cellometer. Количество CAR-положительных клеток в каждой культуре нормировали с использованием нетрансдуцированных T-клеток (UTD). Влияние RAD001 на CART тестировали при титровании RAD001, начиная с 50 нМ. Линией клеток-мишеней, используемых во всех экспериментах с сокультивированием, является Nalm-6, линия пре-B-клеток острого лимфобластного лейкоза человека (ALL), экспрессирующих CD19 и трансдуцированных для экспрессии люциферазы.
Для измерения пролиферации CART, T-клетки культивируют с клетками-мишенями в соотношении 1:1. Анализ осуществляют в течение 4 дней, когда клетки окрашивают на экспрессию CD3, CD4, CD8 и CAR. Количество T-клеток оценивают посредством проточной цитометрии с использованием бус для подсчета в качестве референса.
Результаты
Способность CART-клеток к пролиферации тестировали в 4-дневном анализе сокультивирования. Количество CAR-положительных CD3-положительных T-клеток (темные столбики) и общее количество CD3-положительных T-клеток (светлые столбики) оценивали после культивирования CAR-трансдуцированных и нетрансдуцированных T-клеток с Nalm-6 (фиг. 43). Клетки huCART19 росли при культивировании в присутствие менее чем 0,016 нМ RAD001 и, в меньшей степени, при более высоких концентрациях соединения. Важно, что и при 0,0032, и при 0,016 нМ RAD001 пролиферация являлась более высокой, чем наблюдали при отсутствии добавления RAD001. Нетрансдуцированные T-клетки (UTD) не демонстрировали детектируемую экспансию.
Пример 16: Низкая доза RAD001 стимулирует экспансию CART in vivo
В этом примере оценивают способность клеток huCAR19 пролиферировать in vivo при различных концентрациях RAD001.
Материалы и способы:
Клетки NALM6-luc: Линию клеток острого лимфобластного лейкоза (ALL) человека NALM6 получали из периферической крови пациента с рецидивирующим ALL. Затем клетки метили люциферазой светлячка. Эти клетки в суспензионной культуре росли в RPMI, дополненной 10% термически инактивированной эмбриональной телячьей сывороткой.
Мыши: Мышей NSG (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) возрастом 6 недель получали в Jackson Laboratory (инвентарный номер 005557).
Имплантация опухоли: Клетки NALM6-luc выращивали in vitro в RPMI, дополненной 10% термически инактивированной эмбриональной телячьей сывороткой. Затем клетки переносили в коническую пробирку емкостью 15 мл и дважды промывали холодным стерильным PBS. Затем клетки NALM6-luc подсчитывали и ресуспендировали в концентрации 10×106 клеток на миллилитр PBS. Клетки помещали на лед и сразу (в пределах одного часа) имплантировали мышам. Клетки NALM6-luc инъецировали внутривенно через хвостовую вену в объеме 100 мкл, всего 1×106 клеток на мышь.
Дозирование CAR T-клеток: Мышам вводили 5×106 CAR T-клеток через 7 дней после имплантации опухоли. Клетки частично размораживали на водяной бане температурой 37°C, а затем полностью размораживали добавлением 1 мл холодного стерильного PBS в пробирку, содержащую клетки. Размороженные клетки переносили в пробирку Falcon емкостью 15 мл и доводили PBS до конечного объема 10 мл. Клетки промывали дважды при 1000 об./мин каждый раз в течение 10 минут, а затем подсчитывали с помощью гемоцитометра. Затем T-клетки ресуспендировали в концентрации 50×106 CAR T-клеток на мл холодного PBS и держали на льду до введения мышам. Мышам внутривенно через хвостовую вену инъецировали 100 мкл CAR T-клеток в дозе 5×106 CAR T-клеток на мышь. Восьми мышам на группу вводили 100 мкл PBS в отдельности (PBS) или T-клетки с гуманизированным CAR CD19.
Введение дозы RAD001: Составляли 50 мг концентрированной микроэмульсии, равные 1 мг RAD001, а затем ресуспендировали в D5W (5% декстрозы в воде) во время введения. Мышам ежедневно перорально вводили (через желудочный зонд) 200 мкл желаемых доз RAD001.
Анализ PK: Мышам ежедневно вводили дозу RAD001, начиная через 7 дней после имплантации опухоли. Группы дозирования являлись следующими: 0,3 мг/кг, 1 мг/кг, 3 мг/кг и 10 мг/кг. У мышей забирали кровь в дни 0 и 14 после первой и последней дозы RAD001 в следующие моменты времени для анализа PK: 15 минут, 30 минут, 1 час, 2 часа, 4 часа, 8 часов, 12 часов и 24 часа.
Результаты:
Экспансию и фармакокинетику RAD001 тестировали на мышах NSG с опухолями NALM6-luc. Ежедневное пероральное введение RAD001 в отдельности не оказывало влияния на рост опухолей NALM6-luc (фигура 44). Фармакокинетический анализ RAD001 показывает, что он достаточно стабилен в крови мышей, несущих опухоли (фигура 45A и 45B). Анализы PK в день 0 и день 14 показывают, что концентрации RAD001 в крови составляют более 10 нм даже через 24 часа после введения при наименьшей тестируемой дозе (0,3 мг/кг).
Учитывая эти дозы, huCAR19 CAR T-клетки вводили с RAD001 и без него для определения пролиферативной способности этих клеток. Наибольшая используемая доза составляла 3 мг/кг с учетом уровней RAD001 в крови через 24 часа после введения. Т.к. концентрация RAD001 составляла более 10 нМ через 24 часа после начальной дозы RAD001, в исследовании in vivo с CAR T-клетками использовали несколько более низких доз RAD001. CAR T-клетки вводили IV за один день до начала ежедневного перорального введения RAD001. Мышей контролировали посредством FACS на экспансию T-клеток.
При наименьших дозах RAD001 наблюдают повышенную пролиферацию CAR T-клеток (фигура 46). Эта повышенная пролиферация является более очевидной и пролонгированной при использовании CD4+ CAR T-клеток, чем CD8+ CAR T-клеток. Однако при использовании CD8+ CAR T-клеток можно наблюдать повышенную пролиферацию в ранние моменты времени после дозы CAR T-клеток.
Пример 17: CAR CD19 T-клетки для применения в лечении множественной миеломы
Даже при использовании современных схем химиотерапии, направленной терапии и аутологичной трансплантации стволовых клеток, миелому считают неизлечимым заболеванием. В этом примере описывают лечение множественной миеломы (MM) с использованием аутологичных T-клеток, направленных против CD19, с химерным антигенным рецептором (лентивирус/CD19:4-1BB:CD3 дзета, также известных как "CART19" или CTL019). В этом примере показано, что способы терапии CAR против CD19 обладают потенциалом для развития устойчивых, длительных ремиссий с учетом направленного воздействия на миеломные стволовые клетки и/или опухолевые клетки, экспрессирующие очень низкие (неопределяемые большинством способов) уровни CD19.
При лечении пациентки с агрессивным вторичным плазмоклеточным лейкозом авторы настоящего изобретения обнаруживали, что CART19, вводимые через два дня после аутологичной трансплантации стволовых клеток, приводили к быстрому выведению плазмоклеточного лейкоза и очень хорошему частичному ответу у пациента, подвергнутого множеству линий химиотерапии. Эта пациентка зависела от переливаний в течение месяцев перед лечением, через два месяца после лечения у нее восстанавливались анализы крови (с количеством тромбоцитов и количеством лейкоцитов в диапазоне нормы) и ей не требовались переливания с тех пор, как ее выписали из больницы после лечения.
Т.к. миеломные клетки, как правило, не экспрессируют CD19, данные о том, что лечение CART19 индуцировало быстрый и значительный опухолевый ответ в этой опухоли, являлись неожиданными. Не желая быть связанными какой-либо конкретной теорией, полагали, что CART19 можно использовать для лечения миеломы: (1) т.к., хотя общепринято считают, что миеломные клетки являются отрицательными по экспрессии CD19 при проточной цитометрии, есть данные, свидетельствующие о том, что миеломные клетки могут экспрессировать очень низкие уровни CD19, таким образом, что экспрессию определяют по РНК, но не посредством проточной цитометрии или иммуногистохимии, и (2) по причине концепции направленного воздействия на клонотипические B-клетки, которые, как считают, являются злокачественными стволовыми клетками, дающими начало множественной миеломе и особенно резистентными к химиотерапии. Существует клональная взаимосвязь между B-клетками и опухолевыми клетками миеломы, но общепринятая терапия миеломы направлена на злокачественные плазматические клетки, а не на B-клетки. Таким образом, CART19 для лечения миеломы направленно воздействует на иную популяцию клеток, чем большинство способов терапии миеломы.
В этом опыте с одним пациентом пациентка имела циркулирующие плазматические клетки, и авторы настоящего изобретения могли тестировать ее опухолевые клетки на экспрессию CD19. Приблизительно 1-2% ее опухолевых клеток экспрессировали антиген CD19. (фиг. 47). Таким образом, предполагают, что CART19 может иметь прямой эффект в отношении каждой небольшой популяции ее опухолевых клеток, очень хороший частичный ответ, хотя его нельзя спрогнозировать с учетом направленного воздействия только на очень небольшую популяцию CD19+ опухолевых клеток.
В этом случае CART19 вводили после аутологичной трансплантации стволовых клеток после высокой дозы мелфалана. Хотя это является стандартной терапией при миеломе, она не приводит к излечению. Кроме того, эту пациентку ранее подвергали тандемным аутологичным трансплантациям стволовых клеток, и у нее был ранний рецидив (<6 месяцев) после трансплантации. Не желая быть связанными какой-либо конкретной теорией, полагают, что использование клеток CART19, как описано в этом примере, может иметь неперекрывающийся механизм при лечении миеломы при комбинировании с аутологичной трансплантацией стволовых клеток.
Пациента с рефрактерной множественной миеломой лечили с использованием CTL019 после миелоабляционной химиотерапии и ASCT. Ремиссию поддерживали несмотря на утрату детектируемого CTL019 и восстановления нормальных CD19-положительных B-клеток, что свидетельствует о том, что для этого ответа не требуется длительная активность CTL019. Кроме того, этого ответа пациента достигали даже при том, что подавляющее большинство (99,95%) неопластических плазматических клеток являлись CD19-отрицательными при проточной цитометрии и RT-ПЦР.
Отсутствие детектируемой экспрессии CD19 в доминантной популяции неопластических плазматических клеток этого пациента позволяет предполагать, что клинически важная мишень CTL019 находится вне этой доминантной CD19-отрицательной популяции. Неопластические плазматические клетки у пациентов с множественной миеломой проявляют генетическую, иммунофенотипическую и функциональную гетерогенность. Конкретные субпопуляции могут потребоваться для выживаемости клона в течение противомиеломной терапии. У описываемого пациента, например, небольшая CD19-экспрессирующая субпопуляция плазматических клеток может являться относительно мелфалан-резистентной, но чувствительной к CTL019. Эти данные позволяют предполагать, что терапевтическое направленное воздействие на небольшую субпопуляцию клонов может приводить к длительному клиническому результату в комбинации с общепринятой противомиеломной терапией.
Альтернативно, клинически важная мишень CTL019 у этого пациента может находиться вне популяции неопластических плазматических клеток. Например, CTL019 может направленно воздействовать на популяцию стволовых клеток, являющуюся относительно небольшой, но дающей начало неопластическим плазматическим клеткам. Таким образом, множественная миелома может являться заболеванием с вовлечением множества поздних типов B-клеток, не только окончательно дифференцированных плазматических клеток, таким образом, что способы терапии, такие как CTL019, направленно воздействующие на B-лимфоциты, могут являться применимыми вспомогательными средствами для способов терапии, напрямую воздействующими на плазматические клетки.
Десять дополнительных пациентов с множественной миеломой будут лечить с использованием CART19 в исследовании фазы I, по меньшей мере трех пациентов лечат до сих пор.
Обоснование дозы
В случае первых 3 пациентов авторы настоящего изобретения наблюдали клиническую активность при дозах в диапазоне от 1,4×l07 до 1,1×109 клеток CART-19. По меньшей мере у первых 3 пациентов, подвергнутых лечению, это наблюдение свидетельствует о том, что нет очевидной взаимосвязи между дозой и ответом. Полный ответ наблюдали у пациентов, которым вводили дозу, отличающуюся в два log раз. Таким образом, в отличие от стандартных лекарственных средств, которые метаболизируются, CAR T-клетки могут иметь широкий диапазон дозозависимого эффекта. Наиболее вероятно, это является результатом того, что CAR T-клетки способны интенсивно пролиферировать в пациентах. Таким образом, авторы настоящего изобретения установили диапазон доз 1-5×108 клеток CART-19 для инфузии. В этом исследовании одного пациента, представленном на основе благотворительно-испытательного использования, пациенту вводили до 5×l08 клеток CART19 без нижнего предела дозы. В случае исследования десяти пациентов им будут вводить 1-5×107 клеток CART-19.
Общий дизайн
Это исследование являлось исследованием одного пациента, предложенным на основе благотворительно-испытательного использования, его моделировали после исследования фазы I для определения того, является ли инфузия аутологичных T-клеток, трансдуцированных для экспрессии CART-19, безопасной. Основными целями исследования являлось определение безопасности, переносимости и потенциала приживления CART-19 T-клеток у пациентов, подвергаемых аутологичной ASCT после раннего рецидива после первой ASCT. Протокол состоит из открытого пилотного исследования.
При поступлении индивидуумов будут подвергать биопсии костного мозга и рутинным лабораторным оценкам и визуализации их MM. Пригодных индивидуумов будут подвергать стационарному аферезу для получения больших количеств мононуклеарных клеток периферической крови (PBMC) для производства CART-19. T-клетки будут очищать от PBMC, трансдуцировать с использованием лентивирусного вектора TCRζ/4-1BB, выращивать in vitro, а затем замораживать для дальнейшего введения. Будут регистрировать количество пациентов, имеющих неподходящие забор, экспансию или производство T-клеток, по сравнению с количеством пациентов, T-клетки которых успешно производили, ожидают, что в этой выборке пациентов осуществимость производства продукта не будет затруднительной.
Индивидуумы, как правило, будут иметь подходящие стволовые клетки периферической крови, хранящиеся с момента мобилизации/забора, осуществляемого при подготовке к их первой ASCT для осуществления двух дополнительных ASCT. Тех, у кого их нет, будут подвергать второй мобилизации/забору до или после их стационарного афереза по схеме лечения в соответствии с решением лечащего врача. Приблизительно через две недели после исходного лейкафереза индивидуумы поступали в больницу, и им вводили высокую дозу мелфалана (день -2) с последующей инфузией аутологичных стволовых клеток двумя днями позже (день 0), и всем индивидуумам будут проводить инфузию CART-19 клеток через двенадцать-четырнадцать дней (день +12-14). Будут включать до 10 пациентов.
Всем индивидуумам будут проводить анализы крови для оценки безопасности и приживления и выживаемости CART-19 клеток через регулярные интервалы до недели 4 исследования. В день +42 и день +100 индивидуумов будут подвергать аспирации/биопсии костного мозга для оценки бремени плазматических клеток костного мозга и миграции клеток CART-19 в костный мозг. Формальную оценку ответа будут осуществлять в день 100 по критериям International Myeloma Working Group (IMWG) и TTP будут контролировать в соответствии с рутинной клинической практикой для пациентов с множественной миеломой. Основным результатом в отношении эффективности, измеряемым в этом исследовании, будет сравнение TTP после исходной ASCT пациента с TTP после ASCT в этом исследовании.
Схема лечения
Терапия рецидивирующей/прогрессирующей множественной миеломы
Перед включением в исследование пациентам можно проводить терапию рецидивирующей/прогрессирующей множественной миеломы в соответствии с решением лечащего врача. Терапию можно продолжать после включения в исследование.
Пациенты должны прекращать всю терапию за две недели перед аферезом и за две недели до введения высокой дозы мелфалана. Если ожидают, что пройдет более двух недель между аферезом и введением высокой дозой мелфалана, пациенты могут возобновлять терапию после афереза по решению их лечащего врача.
Высокая доза мелфалана (день -2)
Пациенты будут поступать в больницу в день -3 или -2, и их будут подвергать обследованию лечащим врачом и рутинным лабораторным тестам, которые будут включать мониторинг параметров на синдром распада опухоли перед началом протокола лечения. Кровь для лабораторных тестов для мониторинга MM (SPEP, количественный анализ иммуноглобулинов и анализ свободных легких цепей в сыворотке) будут забирать перед началом терапии, если такие тесты не будут проводить в течение 7 дней после поступления.
Терапия высокими дозами будет состоять из мелфалана в дозе 200 мг/м2, вводимого внутривенно в течение приблизительно 20 минут в день -2. Дозу мелфалана будут снижать до 140 мг/м2 в случае пациентов возрастом >70 лет или в случае пациентов любого возраста, которые по мнению лечащего врача могут не перенести дозу 200 мг/м2. Всем пациентам будут проводить стандартную профилактику антиэметиками, которая может включать дексаметазон, и стандартную профилактику антибиотиками.
Реинфузия стволовых клеток (день 0)
Инфузию стволовых клеток будут проводить в день 0, по меньшей мере через 18 часов после введения высокой дозы мелфалана. Стволовые клетки будут инфузировать внутривенно в течение приблизительно 20-60 минут после премедикации в соответствии со стандартной институционной практикой. Следует инфузировать по меньшей мере 2×106 CD34+ предшественников/кг массы тела. Кроме того, по меньшей мере 1×106 CD34+ предшественников/кг массы тела должны быть доступными в качестве резервного продукта стволовых клеток для инфузии в случае замедленного приживления или позднего отторжения трансплантата. Необходимо вводить Г-КСФ SQ, начиная со дня +5, в соответствии со стандартной институционной практикой. Другие меры поддерживающей терапии, такие как переливание, будут предпринимать в соответствии со стандартными институционными руководствами.
Инфузия клеток CART19 (день +12-14)
Будут вводить однократную дозу трансдуцированных T-клеток CART-19, состоящую из до 5×107 клеток CART-19. Минимальная приемлемая доза для инфузии клеток, трансдуцированных с использованием вектора CD19 TCRζ4-1BB, составляет 1×107. Клетки CART-19 будут вводить в виде однократной дозы посредством быстрой i.v. инфузии в день +12-14 после инфузии стволовых клеток. Если пациент не соответствует каким-либо из критериев включения, представленным в настоящем описании, в пределах 12-14-дневного окна, инфузию CART-19 можно задерживать после дня +12-14 до тех пор, пока критерии не будут удовлетворены.
Поддерживающая терапия леналидомидом
Индивидуумы, которым проводили и которые переносили поддерживающую терапию леналидомидом после из первой ASCT, будут возобновлять поддерживающую терапию леналидомидом приблизительно в день +100, исходя из того, что нет противопоказаний по решению лечащего врача. Начальная доза будет составлять 10 мг ежедневно, если предыдущий опыт не обусловливает использование альтернативной начальной дозы в случае конкретного пациента. Поддерживающую терапию будут продолжать до прогрессирования заболевания или непереносимости.
Введение исследуемого лекарственного средства
Инфузию будут проводить в изолированном помещении в Rhoads с использованием мер предосторожности в случае подвергнутых иммуносупрессии пациентов. Трансдуцированные T-клетки будут вводить посредством быстрой внутривенной инфузии при скорости потока приблизительно от 10 мл до 20 мл в минуту через безлатексный набор для инфузии типа Y калибра 18 с 3-ходовым клапаном. Длительность инфузии будет зависеть от общего объема, подлежащего инфузии, и рекомендуемой скорости инфузии. Каждый инфузионный пакет снабжен ярлыком, содержащим следующее: "ИСКЛЮЧИТЕЛЬНО ДЛЯ АУТОЛОГИЧНОГО ПРИМЕНЕНИЯ". Кроме того, ярлык будет содержать по меньшей мере два уникальных идентификатора, таких как инициалы индивидуума, дата рождения и номер в исследовании. Перед инфузией два индивидуума будут независимо проверять всю эту информацию в присутствие индивидуума и, таким образом, подтверждать то, что информация соответствует участнику исследования.
Упаковка
Инфузия будет включать однократную дозу 1-5×107 CART19-трансдуцированных клеток с минимальной приемлемой дозой 1×107 клеток CART-19 для инфузии. Каждый пакет будет содержать аликвоту (объем зависит от дозы) сред для криосохранения, содержащих следующие реагенты инфузируемой категории (% об./об.): 31,25% плазмалита A, 31,25% декстрозы (5%), 0,45% NaCl, до 7,5% DMSO, 1% декстрана 40, 5% сывороточного альбумина человека.
Аферез
Аферез большого объема (12-15 литров или 4-6 объемов крови) осуществляют в аферезном центре. В течение этой процедуры получают PBMC для CART-19. При однократном лейкаферезе предполагают собрать по меньшей мере 5×109 лейкоцитов для производства T-клеток CART-19. Исходные лейкоциты крови по требованиям FDA к ретроспективным исследованиям и для исследования также получали и подвергали криосохранению. Ожидают, что клеточный продукт будет готов к выпуску приблизительно через 2-4 недели. Осуществляли количественный анализ субпопуляций лимфоцитов посредством проточной цитометрии, включая определение CD19 и CD20 B-клеток. Осуществляют исходную оценку на антитело человека против VSV-G и против мыши (HAMA). Если индивидууму ранее уже проводили адекватный аферез, продукт которого хранят в соответствии с современными Good Manufacturing Practices в Clinical Cell and Vaccine Production Facility, эти клетки можно использовать в качестве источника клеток для производства CART-19. Использование сохраненного аферезного продукта будет снижать стоимость, время и риск прохождения индивидуумом дополнительного афереза.
Циторедуктивная химиотерапия
Химиотерапия с истощением лимфоцитов будет представлять собой мелфалан в высокой дозе, как представлено в настоящем описании.
Инфузия CART-19
Инфузию будут начинать в день +12-14 после реинфузии стволовых клеток.
В день+12-14 до первой инфузии пациентам будут проводить CBC с дифференциалом и оценку количеств CD3, CD4 и CD8, т.к. химиотерапию, частично, будут проводить для индуцирования лимфопении.
Первую дозу будут вводить с использованием однократной дозы. Клетки размораживают у постели пациента. Размороженные клетки будут вводить с такой высокой скоростью инфузии, которая является переносимой, таким образом, что длительность инфузии будет составлять приблизительно 10-15 минут. Для облегчения смешивания клетки будут вводить одновременно с использованием Y-образного адаптера. Индивидуумам будут проводить инфузию и премедикацию, как представлено в настоящем описании. Будут оценивать основные показатели жизнедеятельности индивидуума и осуществлять пульсоксиметрию перед введением дозы, в конце инфузии и впоследствии каждые 15 минут в течение 1 часа и до тех пор, пока они не станут стабильными и удовлетворительными. Образец крови для определения исходного уровня CART-19 получают каждый раз перед первой инфузией и через период от 20 минут до 4 часов после каждой инфузии (и отсылают в TCSL).
Результаты
Трех пациентов с рефрактерной к лечению множественной миеломой на поздней стадии лечили с использованием CTL019 в этом текущем исследовании. Результаты для двух из этих пациентов свидетельствуют о том, что они оба имели существенные противоопухолевые эффекты в результате терапии CTL019 с учетом первичной оценки эффективности через три месяца. Третий пациент еще не достиг этой временной точки в три месяца. Результаты для двух пациентов более подробно описаны ниже.
В случае первой пациентки с миеломой оценку ответа завершили в день +100 и у нее наблюдали очень хороший ответ на терапию CART19. Осуществляли следующие тесты со следующими результатами:
-SPEP/иммунофиксация: отрицательная
-иммунофиксация в моче: слабая неизмеримая полоса легкой каппа-цепи при иммунофиксации (также присутствует в день 38, что не является новым)
В остальном, пациентка соответствует критериям строгой полной ремиссии, включая:
-соотношение свободных легких цепей в сыворотке: нормальное
-биопсия костного мозга: отрицательная
-иммунофенотипирование IgA: IgA ниже предела определения
В остальном, кроме слабого неизмеримого результата по легкой каппа-цепи при иммунофиксации мочи, пациентка соответствует всем критериям "строгой полной ремиссии". Общие результаты иммунофенотипирования плазматических клеток в 3 момента времени (день -2, день +38, день +103) представлены на фигуре 39 и свидетельствуют о том, что IgA пациента находится ниже предела определения. Общие результаты свидетельствуют о тяжелом миеломном бремени в день -2, не определяемом в дни +38 и +103, что позволяет классифицировать пациентку как "MRD-отрицательную" при анализе посредством проточной цитометрии. В день +103 общие результаты свидетельствуют о восстановлении нормальных, поликлональных, CD19+ плазматических клеток и B-клеток. У пациентки не наблюдали симптомы заболевания или терапии, и она функционировала как нормальный индивидуум.
Вторая подвергаемая лечению пациентка еще не достигла дня +100. Однако в этот момент времени она чувствует себя хорошо, но еще слишком рано для определения эффекта инфузии CTL019.
ЭКВИВАЛЕНТЫ
Описание каждого патента, патентной заявки и публикации, процитированной в настоящем описании, таким образом, включено в настоящее описание в качестве ссылки в полном объеме. Хотя настоящее изобретение описано со ссылкой на конкретные аспекты, очевидно, что специалисты в этой области могут разрабатывать другие аспекты и варианты настоящего изобретения без отклонения от сущности и объема изобретения. Прилагаемую формулу изобретения следует истолковывать как включающую все такие аспекты и эквивалентные варианты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BROGDON, JENNIFER
CHOI, EUGENE
EBERSBACH, HILMAR ERHARD
GLASS, DAVID
HUET, HEATHER
JUNE, CARL H.
MANNICK, JOAN
MILONE, MICHAEL C.
MURPHY, LEON
PLESA, GABRIELA
RICHARDSON, CELESTE
RUELLA, MARCO
SINGH, RESHMA
WANG, YONGQIANG
WU, QILONG
<120> ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ
ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ BCMA
<130> N2067-704510
<140> 14/805,193
<141> 2015-07-21
<150> PCT/CN2014/090501
<151> 2014-11-06
<150> PCT/CN2014/082586
<151> 2014-07-21
<160> 1117
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 2
<211> 45
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 2
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 3
<211> 230
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 3
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 4
<211> 282
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 4
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 5
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 5
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 6
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 6
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 7
<211> 42
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 7
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 8
<211> 48
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 8
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 9
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 9
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 10
<211> 112
<212> PRT
<213> Homo sapiens
<400> 10
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 11
<211> 1184
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 11
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaag gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacctggctg cagtacgtga ttcttgatcc cgagcttcgg gttggaagtg 360
ggtgggagag ttcgaggcct tgcgcttaag gagccccttc gcctcgtgct tgagttgagg 420
cctggcctgg gcgctggggc cgccgcgtgc gaatctggtg gcaccttcgc gcctgtctcg 480
ctgctttcga taagtctcta gccatttaaa atttttgatg acctgctgcg acgctttttt 540
tctggcaaga tagtcttgta aatgcgggcc aagatctgca cactggtatt tcggtttttg 600
gggccgcggg cggcgacggg gcccgtgcgt cccagcgcac atgttcggcg aggcggggcc 660
tgcgagcgcg gccaccgaga atcggacggg ggtagtctca agctggccgg cctgctctgg 720
tgcctggcct cgcgccgccg tgtatcgccc cgccctgggc ggcaaggctg gcccggtcgg 780
caccagttgc gtgagcggaa agatggccgc ttcccggccc tgctgcaggg agctcaaaat 840
ggaggacgcg gcgctcggga gagcgggcgg gtgagtcacc cacacaaagg aaaagggcct 900
ttccgtcctc agccgtcgct tcatgtgact ccacggagta ccgggcgccg tccaggcacc 960
tcgattagtt ctcgagcttt tggagtacgt cgtctttagg ttggggggag gggttttatg 1020
cgatggagtt tccccacact gagtgggtgg agactgaagt taggccagct tggcacttga 1080
tgtaattctc cttggaattt gccctttttg agtttggatc ttggttcatt ctcaagcctc 1140
agacagtggt tcaaagtttt tttcttccat ttcaggtgtc gtga 1184
<210> 12
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 12
atggccctgc ctgtgacagc cctgctgctg cctctggctc tgctgctgca tgccgctaga 60
ccc 63
<210> 13
<211> 135
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 13
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 14
<211> 690
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 14
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 15
<211> 847
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 15
aggtggcccg aaagtcccaa ggcccaggca tctagtgttc ctactgcaca gccccaggca 60
gaaggcagcc tagccaaagc tactactgca cctgccacta cgcgcaatac tggccgtggc 120
ggggaggaga agaaaaagga gaaagagaaa gaagaacagg aagagaggga gaccaagacc 180
cctgaatgtc catcccatac ccagccgctg ggcgtctatc tcttgactcc cgcagtacag 240
gacttgtggc ttagagataa ggccaccttt acatgtttcg tcgtgggctc tgacctgaag 300
gatgcccatt tgacttggga ggttgccgga aaggtaccca cagggggggt tgaggaaggg 360
ttgctggagc gccattccaa tggctctcag agccagcact caagactcac ccttccgaga 420
tccctgtgga acgccgggac ctctgtcaca tgtactctaa atcatcctag cctgccccca 480
cagcgtctga tggcccttag agagccagcc gcccaggcac cagttaagct tagcctgaat 540
ctgctcgcca gtagtgatcc cccagaggcc gccagctggc tcttatgcga agtgtccggc 600
tttagcccgc ccaacatctt gctcatgtgg ctggaggacc agcgagaagt gaacaccagc 660
ggcttcgctc cagcccggcc cccaccccag ccgggttcta ccacattctg ggcctggagt 720
gtcttaaggg tcccagcacc acctagcccc cagccagcca catacacctg tgttgtgtcc 780
catgaagata gcaggaccct gctaaatgct tctaggagtc tggaggtttc ctacgtgact 840
gaccatt 847
<210> 16
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 16
ggtggcggag gttctggagg tggaggttcc 30
<210> 17
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 17
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc 60
accctttact gc 72
<210> 18
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 18
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 19
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 19
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 20
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 20
agagtgaagt tcagcaggag cgcagacgcc cccgcgtaca agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 21
<211> 336
<212> ДНК
<213> Homo sapiens
<400> 21
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 22
<211> 373
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 22
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
145 150 155 160
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
165 170 175
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
180 185 190
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
195 200 205
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
210 215 220
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
225 230 235 240
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
245 250 255
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
260 265 270
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
275 280 285
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
290 295 300
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
305 310 315 320
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
325 330 335
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
340 345 350
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
355 360 365
Ala Leu Pro Pro Arg
370
<210> 23
<211> 1182
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 23
atggccctcc ctgtcactgc cctgcttctc cccctcgcac tcctgctcca cgccgctaga 60
ccacccggat ggtttctgga ctctccggat cgcccgtgga atcccccaac cttctcaccg 120
gcactcttgg ttgtgactga gggcgataat gcgaccttca cgtgctcgtt ctccaacacc 180
tccgaatcat tcgtgctgaa ctggtaccgc atgagcccgt caaaccagac cgacaagctc 240
gccgcgtttc cggaagatcg gtcgcaaccg ggacaggatt gtcggttccg cgtgactcaa 300
ctgccgaatg gcagagactt ccacatgagc gtggtccgcg ctaggcgaaa cgactccggg 360
acctacctgt gcggagccat ctcgctggcg cctaaggccc aaatcaaaga gagcttgagg 420
gccgaactga gagtgaccga gcgcagagct gaggtgccaa ctgcacatcc atccccatcg 480
cctcggcctg cggggcagtt tcagaccctg gtcacgacca ctccggcgcc gcgcccaccg 540
actccggccc caactatcgc gagccagccc ctgtcgctga ggccggaagc atgccgccct 600
gccgccggag gtgctgtgca tacccgggga ttggacttcg catgcgacat ctacatttgg 660
gctcctctcg ccggaacttg tggcgtgctc cttctgtccc tggtcatcac cctgtactgc 720
aagcggggtc ggaaaaagct tctgtacatt ttcaagcagc ccttcatgag gcccgtgcaa 780
accacccagg aggaggacgg ttgctcctgc cggttccccg aagaggaaga aggaggttgc 840
gagctgcgcg tgaagttctc ccggagcgcc gacgcccccg cctataagca gggccagaac 900
cagctgtaca acgaactgaa cctgggacgg cgggaagagt acgatgtgct ggacaagcgg 960
cgcggccggg accccgaaat gggcgggaag cctagaagaa agaaccctca ggaaggcctg 1020
tataacgagc tgcagaagga caagatggcc gaggcctact ccgaaattgg gatgaaggga 1080
gagcggcgga ggggaaaggg gcacgacggc ctgtaccaag gactgtccac cgccaccaag 1140
gacacatacg atgccctgca catgcaggcc cttccccctc gc 1182
<210> 24
<211> 394
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 24
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro
20 25 30
Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly
35 40 45
Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe
50 55 60
Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu
65 70 75 80
Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe
85 90 95
Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val
100 105 110
Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser
115 120 125
Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg
130 135 140
Val Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser
145 150 155 160
Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala
165 170 175
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
180 185 190
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
195 200 205
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
210 215 220
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
225 230 235 240
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
245 250 255
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
260 265 270
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
275 280 285
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
290 295 300
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
305 310 315 320
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
325 330 335
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
340 345 350
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
355 360 365
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
370 375 380
Ala Leu His Met Gln Ala Leu Pro Pro Arg
385 390
<210> 25
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 25
Gly Gly Gly Gly Ser
1 5
<210> 26
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(30)
<223> Эта последовательность может включать повторяющиеся единицы 1-6
'Gly Gly Gly Gly Ser', где некоторые положения могут отсутствовать
<220>
<223> См. замены и предпочтительные варианты осуществления в подробном описании
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 27
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 28
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 29
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 29
Gly Gly Gly Ser
1
<210> 30
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<220>
<221> misc_feature
<222> (1)..(5000)
<223> Эта последовательность может включать 50-5000 нуклеотидов, где
некоторые положения могут отсутствовать
<220>
<223> См. замены и предпочтительные варианты осуществления в подробном описании
<400> 30
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 31
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 31
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt 100
<210> 32
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<220>
<221> misc_feature
<222> (1)..(5000)
<223> Эта последовательность может включать 50-5000 нуклеотидов, где
некоторые положения могут отсутствовать
<400> 32
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1980
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2040
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2100
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2160
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2220
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2280
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2340
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2400
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2460
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2520
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2580
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2640
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2700
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2760
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2820
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2880
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2940
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3000
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3060
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4980
tttttttttt tttttttttt 5000
<210> 33
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<220>
<221> misc_feature
<222> (1)..(5000)
<223> Эта последовательность может включать 100-5000 нуклеотидов, где
некоторые положения могут отсутствовать
<400> 33
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 34
<211> 400
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полинуклеотид
<220>
<221> misc_feature
<222> (1)..(400)
<223> Эта последовательность может включать 100-400 нуклеотидов, где
некоторые положения могут отсутствовать
<220>
<223> См. замены и предпочтительные варианты осуществления в подробном описании
<400> 34
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 400
<210> 35
<211> 2000
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<220>
<221> misc_feature
<222> (1)..(2000)
<223> Эта последовательность может включать 50-2000 нуклеотидов, где
некоторые положения могут отсутствовать
<400> 35
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa 2000
<210> 36
<211> 230
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 36
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 37
<211> 690
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 37
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 38
<211> 40
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(40)
<223> Эта последовательность может включать повторяющиеся единицы 1-10
'Gly Gly Gly Ser', где некоторые положения могут отсутствовать
<220>
<223> См. замены и предпочтительные варианты осуществления в подробном описании
<400> 38
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
20 25 30
Gly Gly Gly Ser Gly Gly Gly Ser
35 40
<210> 39
<211> 246
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 39
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gly Trp Val
35 40 45
Ser Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Ala His Tyr Tyr Gly Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser
130 135 140
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
145 150 155 160
Arg Ala Ser Gln Ser Ile Ser Ser Ser Phe Leu Ala Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Arg Arg
180 185 190
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Ser Ala Val Tyr
210 215 220
Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 40
<211> 244
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 40
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ser Val His Ser Phe Leu Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro
130 135 140
Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
145 150 155 160
Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys
165 170 175
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala
180 185 190
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
210 215 220
Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys
225 230 235 240
Val Glu Ile Lys
<210> 41
<211> 243
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 41
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser
130 135 140
Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser
145 150 155 160
Leu Leu Arg Asn Asp Gly Lys Thr Pro Leu Tyr Trp Tyr Leu Gln Lys
165 170 175
Ala Gly Gln Pro Pro Gln Leu Leu Ile Tyr Glu Val Ser Asn Arg Phe
180 185 190
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Ala Tyr Tyr
210 215 220
Cys Met Gln Asn Ile Gln Phe Pro Ser Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 42
<211> 249
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 42
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Arg Lys Thr Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Asp Asn Phe
20 25 30
Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Asn Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
130 135 140
Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys
145 150 155 160
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asn
165 170 175
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu
180 185 190
Gly Ser Lys Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu His Ile Thr Arg Val Gly Ala Glu Asp
210 215 220
Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe
225 230 235 240
Gly Gln Gly Thr Lys Leu Glu Ile Lys
245
<210> 43
<211> 246
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 43
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asp
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala Arg Gly Pro Arg Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu
130 135 140
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
145 150 155 160
Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Gly Ala Ser
180 185 190
Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr His Phe Thr Leu Thr Ile Asn Ser Leu Gln Ser Glu Asp Ser Ala
210 215 220
Thr Tyr Tyr Cys Gln Gln Ser Tyr Lys Arg Ala Ser Phe Gly Gln Gly
225 230 235 240
Thr Lys Val Glu Ile Lys
245
<210> 44
<211> 247
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 44
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Gly Ile Thr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asn Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Tyr Met Asp Val Trp Gly Lys Gly Thr
100 105 110
Met Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg
115 120 125
Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Leu
130 135 140
Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser
145 150 155 160
Ser Gln Ser Leu Leu Tyr Ser Asn Gly Tyr Asn Tyr Val Asp Trp Tyr
165 170 175
Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser
180 185 190
Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Lys Leu Gln Ile Ser Arg Val Glu Ala Glu Asp Val Gly
210 215 220
Ile Tyr Tyr Cys Met Gln Gly Arg Gln Phe Pro Tyr Ser Phe Gly Gln
225 230 235 240
Gly Thr Lys Val Glu Ile Lys
245
<210> 45
<211> 238
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 45
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Val Ser Pro Gly Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Ser Ser Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
165 170 175
Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala Ser Gly Ile Pro Asp
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Tyr Gly
210 215 220
Ser Ser Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 46
<211> 239
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 46
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Ser Ser Lys Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
165 170 175
Arg Leu Leu Met Tyr Gly Ala Ser Ile Arg Ala Thr Gly Ile Pro Asp
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly
210 215 220
Ser Ser Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 47
<211> 241
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 47
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser
130 135 140
Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Gly Ser Thr Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr
210 215 220
Gly Ser Ser Pro Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
225 230 235 240
Lys
<210> 48
<211> 239
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 48
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Gly Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
130 135 140
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
145 150 155 160
Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
165 170 175
Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val
180 185 190
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
210 215 220
Ser Tyr Thr Leu Ala Phe Gly Gln Gly Thr Lys Val Asp Ile Lys
225 230 235
<210> 49
<211> 239
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 49
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
210 215 220
Ser Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 50
<211> 246
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 50
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Thr Met Val Arg Glu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser
130 135 140
Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser
145 150 155 160
Glu Ser Leu Val His Asn Ser Gly Lys Thr Tyr Leu Asn Trp Phe His
165 170 175
Gln Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile Tyr Glu Val Ser Asn
180 185 190
Arg Asp Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
210 215 220
Tyr Tyr Cys Met Gln Gly Thr His Trp Pro Gly Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 51
<211> 239
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 51
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Arg Leu Thr Gln Ser Pro Ser Pro Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asp
145 150 155 160
Ile Asn Lys Phe Leu Asn Trp Tyr His Gln Thr Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Asp Ala Ser Thr Leu Gln Thr Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
195 200 205
Ser Leu Gln Pro Glu Asp Ile Gly Thr Tyr Tyr Cys Gln Gln Tyr Glu
210 215 220
Ser Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 52
<211> 240
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 52
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Thr Thr Leu Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Gly Ser Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Gly Pro
165 170 175
Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn
210 215 220
Asp Trp Leu Pro Val Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
225 230 235 240
<210> 53
<211> 241
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 53
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser
130 135 140
Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Gly Ser Ser Ser Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Met Tyr Gly Ala Ser Ser Arg Ala Ser Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr
210 215 220
Ala Gly Ser Pro Pro Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
225 230 235 240
Lys
<210> 54
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 54
caagtgcaac tcgtggaatc tggtggagga ctcgtgcaac ccggaagatc gcttagactg 60
tcgtgtgccg ccagcgggtt cactttctcg aactacgcga tgtcctgggt ccgccaggca 120
cccggaaagg gactcggttg ggtgtccggc atttcccggt ccggcgaaaa tacctactac 180
gccgactccg tgaagggccg cttcaccatc tcaagggaca acagcaaaaa caccctgtac 240
ttgcaaatga actccctgcg ggatgaagat acagccgtgt actattgcgc ccggtcgcct 300
gcccattact acggcggaat ggacgtctgg ggacagggaa ccactgtgac tgtcagcagc 360
gcgtcgggtg gcggcggctc agggggtcgg gcctccgggg ggggagggtc cgacatcgtg 420
ctgacccagt ccccgggaac cctgagcctg agcccgggag agcgcgcgac cctgtcatgc 480
cgggcatccc agagcattag ctcctccttt ctcgcctggt atcagcagaa gcccggacag 540
gccccgaggc tgctgatcta cggcgctagc agaagggcta ccggaatccc agaccggttc 600
tccggctccg gttccgggac cgatttcacc cttactatct cgcgcctgga acctgaggac 660
tccgccgtct actactgcca gcagtaccac tcatccccgt cgtggacgtt cggacagggc 720
accaagctgg agattaag 738
<210> 55
<211> 732
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 55
caagtgcaac tcgtcgaatc cggtggaggt ctggtccaac ctggtagaag cctgagactg 60
tcgtgtgcgg ccagcggatt cacctttgat gactatgcta tgcactgggt gcggcaggcc 120
ccaggaaagg gcctggaatg ggtgtcggga attagctgga actccgggtc cattggctac 180
gccgactccg tgaagggccg cttcaccatc tcccgcgaca acgcaaagaa ctccctgtac 240
ttgcaaatga actcgctcag ggctgaggat accgcgctgt actactgctc cgtgcattcc 300
ttcctggcct actggggaca gggaactctg gtcaccgtgt cgagcgcctc cggcggcggg 360
ggctcgggtg gacgggcctc gggcggaggg gggtccgaca tcgtgatgac ccagaccccg 420
ctgagcttgc ccgtgactcc cggagagcct gcatccatct cctgccggtc atcccagtcc 480
cttctccact ccaacggata caactacctc gactggtacc tccagaagcc gggacagagc 540
cctcagcttc tgatctacct ggggtcaaat agagcctcag gagtgccgga tcggttcagc 600
ggatctggtt cgggaactga tttcactctg aagatttccc gcgtggaagc cgaggacgtg 660
ggcgtctact actgtatgca ggcgctgcag accccctata ccttcggcca agggacgaaa 720
gtggagatca ag 732
<210> 56
<211> 729
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 56
gaagtgcaat tgttggaatc tggaggagga cttgtgcagc ctggaggatc actgagactt 60
tcgtgtgcgg tgtcaggctt cgccctgagc aaccacggca tgagctgggt gcggagagcc 120
ccggggaagg gtctggaatg ggtgtccggg atcgtctact ccggttcaac ttactacgcc 180
gcaagcgtga agggtcgctt caccatttcc cgcgataact cccggaacac cctgtacctc 240
caaatgaact ccctgcggcc cgaggacacc gccatctact actgttccgc gcatggagga 300
gagtccgatg tctggggaca gggcactacc gtgaccgtgt cgagcgcctc ggggggagga 360
ggctccggcg gtcgcgcctc cggggggggt ggcagcgaca ttgtgatgac gcagactcca 420
ctctcgctgt ccgtgacccc gggacagccc gcgtccatct cgtgcaagag ctcccagagc 480
ctgctgagga acgacggaaa gactcctctg tattggtacc tccagaaggc tggacagccc 540
ccgcaactgc tcatctacga agtgtcaaat cgcttctccg gggtgccgga tcggttttcc 600
ggctcgggat cgggcaccga cttcaccctg aaaatctcca gggtcgaggc cgaggacgtg 660
ggagcctact actgcatgca aaacatccag ttcccttcct tcggcggcgg cacaaagctg 720
gagattaag 729
<210> 57
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 57
caagtccaac tcgtccagtc cggcgcagaa gtcagaaaaa ccggtgctag cgtgaaagtg 60
tcctgcaagg cctccggcta cattttcgat aacttcggaa tcaactgggt cagacaggcc 120
ccgggccagg ggctggaatg gatgggatgg atcaacccca agaacaacaa caccaactac 180
gcacagaagt tccagggccg cgtgactatc accgccgatg aatcgaccaa taccgcctac 240
atggaggtgt cctccctgcg gtcggaggac actgccgtgt attactgcgc gaggggccca 300
tactactacc aaagctacat ggacgtctgg ggacagggaa ccatggtgac cgtgtcatcc 360
gcctccggtg gtggaggctc cggggggcgg gcttcaggag gcggaggaag cgatattgtg 420
atgacccaga ctccgcttag cctgcccgtg actcctggag aaccggcctc catttcctgc 480
cggtcctcgc aatcactcct gcattccaac ggttacaact acctgaattg gtacctccag 540
aagcctggcc agtcgcccca gttgctgatc tatctgggct cgaagcgcgc ctccggggtg 600
cctgaccggt ttagcggatc tgggagcggc acggacttca ctctccacat cacccgcgtg 660
ggagcggagg acgtgggagt gtactactgt atgcaggcgc tgcagactcc gtacacattc 720
ggacagggca ccaagctgga gatcaag 747
<210> 58
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 58
caagtgcaac ttcaagaatc aggcggagga ctcgtgcagc ccggaggatc attgcggctc 60
tcgtgcgccg cctcgggctt caccttctcg agcgacgcca tgacctgggt ccgccaggcc 120
ccggggaagg ggctggaatg ggtgtctgtg atttccggct ccgggggaac tacgtactac 180
gccgattccg tgaaaggtcg cttcactatc tcccgggaca acagcaagaa caccctttat 240
ctgcaaatga attccctccg cgccgaggac accgccgtgt actactgcgc caagctggac 300
tcctcgggct actactatgc ccggggtccg agatactggg gacagggaac cctcgtgacc 360
gtgtcctccg cgtccggcgg aggagggtcg ggagggcggg cctccggcgg cggcggttcg 420
gacatccagc tgacccagtc cccatcctca ctgagcgcaa gcgtgggcga cagagtcacc 480
attacatgca gggcgtccca gagcatcagc tcctacctga actggtacca acagaagcct 540
ggaaaggctc ctaagctgtt gatctacggg gcttcgaccc tggcatccgg ggtgcccgcg 600
aggtttagcg gaagcggtag cggcactcac ttcactctga ccattaacag cctccagtcc 660
gaggattcag ccacttacta ctgtcagcag tcctacaagc gggccagctt cggacagggc 720
actaaggtcg agatcaag 738
<210> 59
<211> 741
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 59
caagtccaac tggtccagag cggtgcagaa gtgaagaagc ccggagcgag cgtgaaagtg 60
tcctgcaagg cttccgggta caccttctcc aactacggca tcacttgggt gcgccaggcc 120
ccgggacagg gcctggaatg gatggggtgg atttccgcgt acaacggcaa tacgaactac 180
gctcagaagt tccagggtag agtgaccatg actaggaaca cctccatttc caccgcctac 240
atggaactgt cctccctgcg gagcgaggac accgccgtgt actattgcgc ccggggacca 300
tactactact acatggatgt ctgggggaag gggactatgg tcaccgtgtc atccgcctcg 360
ggaggcggcg gatcaggagg acgcgcctct ggtggtggag gatcggagat cgtgatgacc 420
cagagccctc tctccttgcc cgtgactcct ggggagcccg catccatttc atgccggagc 480
tcccagtcac ttctctactc caacggctat aactacgtgg attggtacct ccaaaagccg 540
ggccagagcc cgcagctgct gatctacctg ggctcgaaca gggccagcgg agtgcctgac 600
cggttctccg ggtcgggaag cgggaccgac ttcaagctgc aaatctcgag agtggaggcc 660
gaggacgtgg gaatctacta ctgtatgcag ggccgccagt ttccgtactc gttcggacag 720
ggcaccaaag tggaaatcaa g 741
<210> 60
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 60
gaagtgcaat tgctcgaaac tggaggaggt ctggtgcaac ctggaggatc acttcgcctg 60
tcctgcgccg tgtcgggctt tgccctgtcc aaccatggaa tgagctgggt ccgccgcgcg 120
ccggggaagg gcctcgaatg ggtgtccggc atcgtctact ccggctccac ctactacgcc 180
gcgtccgtga agggccggtt cacgatttca cgggacaact cgcggaacac cctgtacctc 240
caaatgaatt cccttcggcc ggaggatact gccatctact actgctccgc ccacggtggc 300
gaatccgacg tctggggcca gggaaccacc gtgaccgtgt ccagcgcgtc cgggggagga 360
ggaagcgggg gtagagcatc gggtggaggc ggatcagaga tcgtgctgac ccagtccccc 420
gccaccttga gcgtgtcacc aggagagtcc gccaccctgt catgccgcgc cagccagtcc 480
gtgtcctcca acctggcttg gtaccagcag aagccggggc aggcccctag actcctgatc 540
tatggggcgt cgacccgggc atctggaatt cccgataggt tcagcggatc gggctcgggc 600
actgacttca ctctgaccat ctcctcgctg caagccgagg acgtggctgt gtactactgt 660
cagcagtacg gaagctccct gactttcggt ggcgggacca aagtcgagat taag 714
<210> 61
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 61
gaagtgcaat tggtggaaac tggaggagga cttgtgcaac ctggaggatc attgagactg 60
agctgcgcag tgtcgggatt cgccctgagc aaccatggaa tgtcctgggt cagaagggcc 120
cctggaaaag gcctcgaatg ggtgtcaggg atcgtgtact ccggttccac ttactacgcc 180
gcctccgtga aggggcgctt cactatctca cgggataact cccgcaatac cctgtacctc 240
caaatgaaca gcctgcggcc ggaggatacc gccatctact actgttccgc ccacggtgga 300
gagtctgacg tctggggcca gggaactacc gtgaccgtgt cctccgcgtc cggcggtgga 360
gggagcggcg gccgcgccag cggcggcgga ggctccgaga tcgtgatgac ccagagcccc 420
gctactctgt cggtgtcgcc cggagaaagg gcgaccctgt cctgccgggc gtcgcagtcc 480
gtgagcagca agctggcttg gtaccagcag aagccgggcc aggcaccacg cctgcttatg 540
tacggtgcct ccattcgggc caccggaatc ccggaccggt tctcggggtc ggggtccggt 600
accgagttca cactgaccat ttcctcgctc gagcccgagg actttgccgt ctattactgc 660
cagcagtacg gctcctcctc atggacgttc ggccagggga ccaaggtcga aatcaag 717
<210> 62
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 62
gaagtgcaat tggtggagac tggaggagga gtggtgcaac ctggaggaag cctgagactg 60
tcatgcgcgg tgtcgggctt cgccctctcc aaccacggaa tgtcctgggt ccgccgggcc 120
cctgggaaag gacttgaatg ggtgtccggc atcgtgtact cgggttccac ctactacgcg 180
gcctcagtga agggccggtt tactattagc cgcgacaact ccagaaacac actgtacctc 240
caaatgaact cgctgcggcc ggaagatacc gctatctact actgctccgc ccatggggga 300
gagtcggacg tctggggaca gggcaccact gtcactgtgt ccagcgcttc cggcggtggt 360
ggaagcgggg gacgggcctc aggaggcggt ggcagcgaga ttgtgctgac ccagtccccc 420
gggaccctga gcctgtcccc gggagaaagg gccaccctct cctgtcgggc atcccagtcc 480
gtggggtcta ctaaccttgc atggtaccag cagaagcccg gccaggcccc tcgcctgctg 540
atctacgacg cgtccaatag agccaccggc atcccggatc gcttcagcgg aggcggatcg 600
ggcaccgact tcaccctcac catttcaagg ctggaaccgg aggacttcgc cgtgtactac 660
tgccagcagt atggttcgtc cccaccctgg acgttcggcc aggggactaa ggtcgagatc 720
aag 723
<210> 63
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 63
caagtgcaac tcgtggaatc tggtggagga ctcgtgaaac ctggaggatc attgagactg 60
tcatgcgcgg cctcgggatt cacgttctcc gattactaca tgagctggat tcgccaggct 120
ccggggaagg gactggaatg ggtgtcctac atttcctcat ccggctccac catctactac 180
gcggactccg tgaaggggag attcaccatt agccgcgata acgccaagaa cagcctgtac 240
cttcagatga actccctgcg ggctgaagat actgccgtct actactgcgc aagggagagc 300
ggagatggga tggacgtctg gggacagggt accactgtga ccgtgtcgtc ggcctccggc 360
ggagggggtt cgggtggaag ggccagcggc ggcggaggca gcgacatcca gatgacccag 420
tccccctcat cgctgtccgc ctccgtgggc gaccgcgtca ccatcacatg ccgggcctca 480
cagtcgatct cctcctacct caattggtat cagcagaagc ccggaaaggc ccctaagctt 540
ctgatctacg cagcgtcctc cctgcaatcc ggggtcccat ctcggttctc cggctcgggc 600
agcggtaccg acttcactct gaccatctcg agcctgcagc cggaggactt cgccacttac 660
tactgtcagc aaagctacac cctcgcgttt ggccagggca ccaaagtgga catcaag 717
<210> 64
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 64
gaagtgcaat tggtggaatc agggggagga cttgtgcagc ctggaggatc gctgagactg 60
tcatgtgccg tgtccggctt tgccctgtcc aaccacggga tgtcctgggt ccgccgcgcg 120
cctggaaagg gcctcgaatg ggtgtcgggt attgtgtaca gcggtagcac ctactatgcc 180
gcatccgtga aggggagatt caccatcagc cgggacaact ccaggaacac tctgtacctc 240
caaatgaatt cgctgaggcc agaggacact gccatctact actgctccgc gcatggcgga 300
gagtccgacg tctggggaca ggggaccacc gtgaccgtgt ctagcgcgtc cggcggaggc 360
ggcagcgggg gtcgggcatc agggggcggc ggatcggaca tccagctcac ccagtccccg 420
agctcgctgt ccgcctccgt gggagatcgg gtcaccatca cgtgccgcgc cagccagtcg 480
atttcctcct acctgaactg gtaccaacag aagcccggaa aagccccgaa gcttctcatc 540
tacgccgcct cgagcctgca gtcaggagtg ccctcacggt tctccggctc cggttccggt 600
actgatttca ccctgaccat ttcctccctg caaccggagg acttcgctac ttactactgc 660
cagcagtcgt actccacccc ctacactttc ggacaaggca ccaaggtcga aatcaag 717
<210> 65
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 65
caagtgcaac tggtgcaaag cggaggagga ttggtcaaac ccggaggaag cctgagactg 60
tcatgcgcgg cctctggatt caccttctcc gattactaca tgtcatggat cagacaggcc 120
ccggggaagg gcctcgaatg ggtgtcctac atctcgtcct ccgggaacac catctactac 180
gccgacagcg tgaagggccg ctttaccatt tcccgcgaca acgcaaagaa ctcgctgtac 240
cttcagatga attccctgcg ggctgaagat accgcggtgt actattgcgc ccggtccact 300
atggtccggg aggactactg gggacagggc acactcgtga ccgtgtccag cgcgagcggg 360
ggtggaggca gcggtggacg cgcctccggc ggcggcggtt cagacatcgt gctgactcag 420
tcgcccctgt cgctgccggt caccctgggc caaccggcct caattagctg caagtcctcg 480
gagagcctgg tgcacaactc aggaaagact tacctgaact ggttccatca gcggcctgga 540
cagtccccac ggaggctcat ctatgaagtg tccaacaggg attcgggggt gcccgaccgc 600
ttcactggct ccgggtccgg caccgacttc accttgaaaa tctccagagt ggaagccgag 660
gacgtgggcg tgtactactg tatgcagggt acccactggc ctggaacctt tggacaagga 720
actaagctcg agattaag 738
<210> 66
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 66
caagtgcaac tcgtggaatc tggtggagga ctcgtgcaac ccggtggaag ccttaggctg 60
tcgtgcgccg tcagcgggtt tgctctgagc aaccatggaa tgtcctgggt ccgccgggca 120
ccgggaaaag ggctggaatg ggtgtccggc atcgtgtaca gcgggtcaac ctattacgcc 180
gcgtccgtga agggcagatt cactatctca agagacaaca gccggaacac cctgtacttg 240
caaatgaatt ccctgcgccc cgaggacacc gccatctact actgctccgc ccacggagga 300
gagtcggacg tgtggggcca gggaacgact gtgactgtgt ccagcgcatc aggagggggt 360
ggttcgggcg gccgggcctc ggggggagga ggttccgaca ttcggctgac ccagtccccg 420
tccccactgt cggcctccgt cggcgaccgc gtgaccatca cttgtcaggc gtccgaggac 480
attaacaagt tcctgaactg gtaccaccag acccctggaa aggcccccaa gctgctgatc 540
tacgatgcct cgacccttca aactggagtg cctagccggt tctccgggtc cggctccggc 600
actgatttca ctctgaccat caactcattg cagccggaag atatcgggac ctactattgc 660
cagcagtacg aatccctccc gctcacattc ggcgggggaa ccaaggtcga gattaag 717
<210> 67
<211> 720
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 67
gaagtgcaat tggtggaaac tggaggagga cttgtgcaac ctggaggatc attgcggctc 60
tcatgcgctg tctccggctt cgccctgtca aatcacggga tgtcgtgggt cagacgggcc 120
ccgggaaagg gtctggaatg ggtgtcgggg attgtgtaca gcggctccac ctactacgcc 180
gcttcggtca agggccgctt cactatttca cgggacaaca gccgcaacac cctctatctg 240
caaatgaact ctctccgccc ggaggatacc gccatctact actgctccgc acacggcggc 300
gaatccgacg tgtggggaca gggaaccact gtcaccgtgt cgtccgcatc cggtggcgga 360
ggatcgggtg gccgggcctc cgggggcggc ggcagcgaga ctaccctgac ccagtcccct 420
gccactctgt ccgtgagccc gggagagaga gccaccctta gctgccgggc cagccagagc 480
gtgggctcca acctggcctg gtaccagcag aagccaggac agggtcccag gctgctgatc 540
tacggagcct ccactcgcgc gaccggcatc cccgcgaggt tctccgggtc gggttccggg 600
accgagttca ccctgaccat ctcctccctc caaccggagg acttcgcggt gtactactgt 660
cagcagtaca acgattggct gcccgtgaca tttggacagg ggacgaaggt ggaaatcaaa 720
<210> 68
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 68
gaagtgcaat tggtggaatc tggtggagga cttgtgcaac ctggaggatc actgagactg 60
tcatgcgcgg tgtccggttt tgccctgagc aatcatggga tgtcgtgggt ccggcgcgcc 120
cccggaaagg gtctggaatg ggtgtcgggt atcgtctact ccgggagcac ttactacgcc 180
gcgagcgtga agggccgctt caccatttcc cgcgataact cccgcaacac cctgtacttg 240
caaatgaact cgctccggcc tgaggacact gccatctact actgctccgc acacggagga 300
gaatccgacg tgtggggcca gggaactacc gtgaccgtca gcagcgcctc cggcggcggg 360
ggctcaggcg gacgggctag cggcggcggt ggctccgaga tcgtgctgac ccagtcgcct 420
ggcactctct cgctgagccc cggggaaagg gcaaccctgt cctgtcgggc cagccagtcc 480
attggatcat cctccctcgc ctggtatcag cagaaaccgg gacaggctcc gcggctgctt 540
atgtatgggg ccagctcaag agcctccggc attcccgacc ggttctccgg gtccggttcc 600
ggcaccgatt tcaccctgac tatctcgagg ctggagccag aggacttcgc cgtgtactac 660
tgccagcagt acgcggggtc cccgccgttc acgttcggac agggaaccaa ggtcgagatc 720
aag 723
<210> 69
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 69
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gly Trp Val
35 40 45
Ser Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Ala His Tyr Tyr Gly Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 70
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 70
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ser Val His Ser Phe Leu Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 71
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 71
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 72
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 72
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Arg Lys Thr Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Asp Asn Phe
20 25 30
Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Asn Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 73
<211> 123
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 73
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asp
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala Arg Gly Pro Arg Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 74
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 74
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Gly Ile Thr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asn Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Tyr Tyr Tyr Tyr Met Asp Val Trp Gly Lys Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 75
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 75
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 76
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 76
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 77
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 77
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 78
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 78
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Gly Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 79
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 79
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 80
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 80
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Thr Met Val Arg Glu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 81
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 81
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 82
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 82
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 83
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ala Leu Ser Asn His
20 25 30
Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Ser
85 90 95
Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 84
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 84
Asp Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 85
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 85
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 86
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 86
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Arg Asn
20 25 30
Asp Gly Lys Thr Pro Leu Tyr Trp Tyr Leu Gln Lys Ala Gly Gln Pro
35 40 45
Pro Gln Leu Leu Ile Tyr Glu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ala Tyr Tyr Cys Met Gln Asn
85 90 95
Ile Gln Phe Pro Ser Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 87
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 87
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Lys Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu His Ile
65 70 75 80
Thr Arg Val Gly Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 88
<211> 106
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 88
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr His Phe Thr Leu Thr Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Lys Arg Ala Ser
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 89
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 89
Glu Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Tyr Asn Tyr Val Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Lys Leu Gln Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Gly
85 90 95
Arg Gln Phe Pro Tyr Ser Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 90
<211> 106
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 90
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 91
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 91
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Lys
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Met
35 40 45
Tyr Gly Ala Ser Ile Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Ser Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 92
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 92
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Thr
20 25 30
Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 93
<211> 105
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 93
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Leu Ala Phe
85 90 95
Gly Gln Gly Thr Lys Val Asp Ile Lys
100 105
<210> 94
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 94
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 95
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 95
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Glu Ser Leu Val His Asn
20 25 30
Ser Gly Lys Thr Tyr Leu Asn Trp Phe His Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Glu Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Gly Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 96
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 96
Asp Ile Arg Leu Thr Gln Ser Pro Ser Pro Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asp Ile Asn Lys Phe
20 25 30
Leu Asn Trp Tyr His Gln Thr Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Thr Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Gly Thr Tyr Tyr Cys Gln Gln Tyr Glu Ser Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 97
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 97
Glu Thr Thr Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Gly Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asp Trp Leu Pro
85 90 95
Val Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 98
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 98
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Ser Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Met Tyr Gly Ala Ser Ser Arg Ala Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ala Gly Ser Pro
85 90 95
Pro Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 99
<211> 490
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 99
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asn Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Gly Trp Val Ser Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Pro Ala His Tyr Tyr Gly Gly Met
115 120 125
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg
165 170 175
Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Ser Phe Leu
180 185 190
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
195 200 205
Gly Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
225 230 235 240
Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp
245 250 255
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 100
<211> 488
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 100
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Leu Tyr Tyr Cys Ser Val His Ser Phe Leu Ala Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
145 150 155 160
Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys
165 170 175
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
180 185 190
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu
195 200 205
Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp
225 230 235 240
Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe
245 250 255
Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 101
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 101
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
145 150 155 160
Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys
165 170 175
Lys Ser Ser Gln Ser Leu Leu Arg Asn Asp Gly Lys Thr Pro Leu Tyr
180 185 190
Trp Tyr Leu Gln Lys Ala Gly Gln Pro Pro Gln Leu Leu Ile Tyr Glu
195 200 205
Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp
225 230 235 240
Val Gly Ala Tyr Tyr Cys Met Gln Asn Ile Gln Phe Pro Ser Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 102
<211> 493
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 102
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Arg Lys Thr Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ile Phe Asp Asn Phe Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser
85 90 95
Thr Asn Thr Ala Tyr Met Glu Val Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met
115 120 125
Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro
165 170 175
Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly
180 185 190
Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln
195 200 205
Leu Leu Ile Tyr Leu Gly Ser Lys Arg Ala Ser Gly Val Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu His Ile Thr Arg
225 230 235 240
Val Gly Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln
245 250 255
Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
370 375 380
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln
385 390 395 400
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
405 410 415
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
420 425 430
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
435 440 445
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
450 455 460
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
465 470 475 480
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 103
<211> 490
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 103
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Asp Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala
115 120 125
Arg Gly Pro Arg Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
Ala Ser Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
165 170 175
Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
195 200 205
Ile Tyr Gly Ala Ser Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr His Phe Thr Leu Thr Ile Asn Ser Leu Gln
225 230 235 240
Ser Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Lys Arg Ala
245 250 255
Ser Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 104
<211> 491
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 104
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Ser Asn Tyr Gly Ile Thr Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asn Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Pro Tyr Tyr Tyr Tyr Met Asp Val
115 120 125
Trp Gly Lys Gly Thr Met Val Thr Val Ser Ser Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser
165 170 175
Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Tyr Asn
180 185 190
Tyr Val Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu
195 200 205
Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Lys Leu Gln Ile Ser Arg Val Glu
225 230 235 240
Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Gly Arg Gln Phe Pro
245 250 255
Tyr Ser Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 105
<211> 482
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 105
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Val Ser Pro Gly Glu Ser Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala
195 200 205
Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Gly Ser Ser Leu Thr Phe Gly Gly Gly Thr Lys Val
245 250 255
Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
260 265 270
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
275 280 285
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
290 295 300
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
305 310 315 320
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
325 330 335
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
340 345 350
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
355 360 365
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys
370 375 380
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
385 390 395 400
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
405 410 415
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
420 425 430
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
435 440 445
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
450 455 460
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
465 470 475 480
Pro Arg
<210> 106
<211> 483
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 106
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Ser Ser Lys Leu Ala Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Gln Ala Pro Arg Leu Leu Met Tyr Gly Ala Ser Ile Arg Ala
195 200 205
Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Gly Ser Ser Ser Trp Thr Phe Gly Gln Gly Thr Lys
245 250 255
Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 107
<211> 485
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 107
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Gly Ser Thr Asn Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg
195 200 205
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
225 230 235 240
Tyr Cys Gln Gln Tyr Gly Ser Ser Pro Pro Trp Thr Phe Gly Gln Gly
245 250 255
Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 108
<211> 483
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 108
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Tyr Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Glu Ser Gly Asp Gly Met Asp Val Trp
115 120 125
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr
145 150 155 160
Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile
165 170 175
Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser
195 200 205
Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
225 230 235 240
Tyr Tyr Cys Gln Gln Ser Tyr Thr Leu Ala Phe Gly Gln Gly Thr Lys
245 250 255
Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 109
<211> 483
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 109
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser
145 150 155 160
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
165 170 175
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln
195 200 205
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
225 230 235 240
Cys Gln Gln Ser Tyr Ser Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys
245 250 255
Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 110
<211> 490
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 110
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Tyr Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Thr Met Val Arg Glu Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr
145 150 155 160
Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
165 170 175
Ser Cys Lys Ser Ser Glu Ser Leu Val His Asn Ser Gly Lys Thr Tyr
180 185 190
Leu Asn Trp Phe His Gln Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile
195 200 205
Tyr Glu Val Ser Asn Arg Asp Ser Gly Val Pro Asp Arg Phe Thr Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
225 230 235 240
Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly Thr His Trp Pro Gly
245 250 255
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 111
<211> 483
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 111
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Arg Leu Thr Gln Ser
145 150 155 160
Pro Ser Pro Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
165 170 175
Gln Ala Ser Glu Asp Ile Asn Lys Phe Leu Asn Trp Tyr His Gln Thr
180 185 190
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Thr Leu Gln
195 200 205
Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Asn Ser Leu Gln Pro Glu Asp Ile Gly Thr Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Glu Ser Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys
245 250 255
Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 112
<211> 484
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 112
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Thr Thr Leu Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Gly Ser Asn Leu Ala Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Gln Gly Pro Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Ala
195 200 205
Thr Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr
225 230 235 240
Cys Gln Gln Tyr Asn Asp Trp Leu Pro Val Thr Phe Gly Gln Gly Thr
245 250 255
Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro
260 265 270
Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys
275 280 285
Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala
290 295 300
Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu
305 310 315 320
Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys
325 330 335
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
340 345 350
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
355 360 365
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
370 375 380
Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
385 390 395 400
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
405 410 415
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
420 425 430
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
435 440 445
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
450 455 460
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
465 470 475 480
Leu Pro Pro Arg
<210> 113
<211> 485
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 113
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe
35 40 45
Ala Leu Ser Asn His Gly Met Ser Trp Val Arg Arg Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr
65 70 75 80
Ala Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg
85 90 95
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Ser Ala His Gly Gly Glu Ser Asp Val Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Arg Ala Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Ile Gly Ser Ser Ser Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Met Tyr Gly Ala Ser Ser Arg
195 200 205
Ala Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
225 230 235 240
Tyr Cys Gln Gln Tyr Ala Gly Ser Pro Pro Phe Thr Phe Gly Gln Gly
245 250 255
Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 114
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 114
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtgga atctggtgga ggactcgtgc aacccggaag atcgcttaga 120
ctgtcgtgtg ccgccagcgg gttcactttc tcgaactacg cgatgtcctg ggtccgccag 180
gcacccggaa agggactcgg ttgggtgtcc ggcatttccc ggtccggcga aaatacctac 240
tacgccgact ccgtgaaggg ccgcttcacc atctcaaggg acaacagcaa aaacaccctg 300
tacttgcaaa tgaactccct gcgggatgaa gatacagccg tgtactattg cgcccggtcg 360
cctgcccatt actacggcgg aatggacgtc tggggacagg gaaccactgt gactgtcagc 420
agcgcgtcgg gtggcggcgg ctcagggggt cgggcctccg gggggggagg gtccgacatc 480
gtgctgaccc agtccccggg aaccctgagc ctgagcccgg gagagcgcgc gaccctgtca 540
tgccgggcat cccagagcat tagctcctcc tttctcgcct ggtatcagca gaagcccgga 600
caggccccga ggctgctgat ctacggcgct agcagaaggg ctaccggaat cccagaccgg 660
ttctccggct ccggttccgg gaccgatttc acccttacta tctcgcgcct ggaacctgag 720
gactccgccg tctactactg ccagcagtac cactcatccc cgtcgtggac gttcggacag 780
ggcaccaagc tggagattaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 115
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 115
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtcga atccggtgga ggtctggtcc aacctggtag aagcctgaga 120
ctgtcgtgtg cggccagcgg attcaccttt gatgactatg ctatgcactg ggtgcggcag 180
gccccaggaa agggcctgga atgggtgtcg ggaattagct ggaactccgg gtccattggc 240
tacgccgact ccgtgaaggg ccgcttcacc atctcccgcg acaacgcaaa gaactccctg 300
tacttgcaaa tgaactcgct cagggctgag gataccgcgc tgtactactg ctccgtgcat 360
tccttcctgg cctactgggg acagggaact ctggtcaccg tgtcgagcgc ctccggcggc 420
gggggctcgg gtggacgggc ctcgggcgga ggggggtccg acatcgtgat gacccagacc 480
ccgctgagct tgcccgtgac tcccggagag cctgcatcca tctcctgccg gtcatcccag 540
tcccttctcc actccaacgg atacaactac ctcgactggt acctccagaa gccgggacag 600
agccctcagc ttctgatcta cctggggtca aatagagcct caggagtgcc ggatcggttc 660
agcggatctg gttcgggaac tgatttcact ctgaagattt cccgcgtgga agccgaggac 720
gtgggcgtct actactgtat gcaggcgctg cagaccccct ataccttcgg ccaagggacg 780
aaagtggaga tcaagaccac taccccagca ccgaggccac ccaccccggc tcctaccatc 840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg 900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact 960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag 1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac 1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc 1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc 1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa 1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag 1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa 1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt 1440
cacatgcagg ccctgccgcc tcgg 1464
<210> 116
<211> 1461
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 116
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aattgttgga atctggagga ggacttgtgc agcctggagg atcactgaga 120
ctttcgtgtg cggtgtcagg cttcgccctg agcaaccacg gcatgagctg ggtgcggaga 180
gccccgggga agggtctgga atgggtgtcc gggatcgtct actccggttc aacttactac 240
gccgcaagcg tgaagggtcg cttcaccatt tcccgcgata actcccggaa caccctgtac 300
ctccaaatga actccctgcg gcccgaggac accgccatct actactgttc cgcgcatgga 360
ggagagtccg atgtctgggg acagggcact accgtgaccg tgtcgagcgc ctcgggggga 420
ggaggctccg gcggtcgcgc ctccgggggg ggtggcagcg acattgtgat gacgcagact 480
ccactctcgc tgtccgtgac cccgggacag cccgcgtcca tctcgtgcaa gagctcccag 540
agcctgctga ggaacgacgg aaagactcct ctgtattggt acctccagaa ggctggacag 600
cccccgcaac tgctcatcta cgaagtgtca aatcgcttct ccggggtgcc ggatcggttt 660
tccggctcgg gatcgggcac cgacttcacc ctgaaaatct ccagggtcga ggccgaggac 720
gtgggagcct actactgcat gcaaaacatc cagttccctt ccttcggcgg cggcacaaag 780
ctggagatta agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc 840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat 900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc 960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg 1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc 1080
tgttcatgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc 1140
cgcagcgcag atgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat 1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg 1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat 1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc 1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac 1440
atgcaggccc tgccgcctcg g 1461
<210> 117
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 117
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgtcca gtccggcgca gaagtcagaa aaaccggtgc tagcgtgaaa 120
gtgtcctgca aggcctccgg ctacattttc gataacttcg gaatcaactg ggtcagacag 180
gccccgggcc aggggctgga atggatggga tggatcaacc ccaagaacaa caacaccaac 240
tacgcacaga agttccaggg ccgcgtgact atcaccgccg atgaatcgac caataccgcc 300
tacatggagg tgtcctccct gcggtcggag gacactgccg tgtattactg cgcgaggggc 360
ccatactact accaaagcta catggacgtc tggggacagg gaaccatggt gaccgtgtca 420
tccgcctccg gtggtggagg ctccgggggg cgggcttcag gaggcggagg aagcgatatt 480
gtgatgaccc agactccgct tagcctgccc gtgactcctg gagaaccggc ctccatttcc 540
tgccggtcct cgcaatcact cctgcattcc aacggttaca actacctgaa ttggtacctc 600
cagaagcctg gccagtcgcc ccagttgctg atctatctgg gctcgaagcg cgcctccggg 660
gtgcctgacc ggtttagcgg atctgggagc ggcacggact tcactctcca catcacccgc 720
gtgggagcgg aggacgtggg agtgtactac tgtatgcagg cgctgcagac tccgtacaca 780
ttcggacagg gcaccaagct ggagatcaag accactaccc cagcaccgag gccacccacc 840
ccggctccta ccatcgcctc ccagcctctg tccctgcgtc cggaggcatg tagacccgca 900
gctggtgggg ccgtgcatac ccggggtctt gacttcgcct gcgatatcta catttgggcc 960
cctctggctg gtacttgcgg ggtcctgctg ctttcactcg tgatcactct ttactgtaag 1020
cgcggtcgga agaagctgct gtacatcttt aagcaaccct tcatgaggcc tgtgcagact 1080
actcaagagg aggacggctg ttcatgccgg ttcccagagg aggaggaagg cggctgcgaa 1140
ctgcgcgtga aattcagccg cagcgcagat gctccagcct acaagcaggg gcagaaccag 1200
ctctacaacg aactcaatct tggtcggaga gaggagtacg acgtgctgga caagcggaga 1260
ggacgggacc cagaaatggg cgggaagccg cgcagaaaga atccccaaga gggcctgtac 1320
aacgagctcc aaaaggataa gatggcagaa gcctatagcg agattggtat gaaaggggaa 1380
cgcagaagag gcaaaggcca cgacggactg taccagggac tcagcaccgc caccaaggac 1440
acctatgacg ctcttcacat gcaggccctg ccgcctcgg 1479
<210> 118
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 118
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aacttcaaga atcaggcgga ggactcgtgc agcccggagg atcattgcgg 120
ctctcgtgcg ccgcctcggg cttcaccttc tcgagcgacg ccatgacctg ggtccgccag 180
gccccgggga aggggctgga atgggtgtct gtgatttccg gctccggggg aactacgtac 240
tacgccgatt ccgtgaaagg tcgcttcact atctcccggg acaacagcaa gaacaccctt 300
tatctgcaaa tgaattccct ccgcgccgag gacaccgccg tgtactactg cgccaagctg 360
gactcctcgg gctactacta tgcccggggt ccgagatact ggggacaggg aaccctcgtg 420
accgtgtcct ccgcgtccgg cggaggaggg tcgggagggc gggcctccgg cggcggcggt 480
tcggacatcc agctgaccca gtccccatcc tcactgagcg caagcgtggg cgacagagtc 540
accattacat gcagggcgtc ccagagcatc agctcctacc tgaactggta ccaacagaag 600
cctggaaagg ctcctaagct gttgatctac ggggcttcga ccctggcatc cggggtgccc 660
gcgaggttta gcggaagcgg tagcggcact cacttcactc tgaccattaa cagcctccag 720
tccgaggatt cagccactta ctactgtcag cagtcctaca agcgggccag cttcggacag 780
ggcactaagg tcgagatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 119
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 119
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactggtcca gagcggtgca gaagtgaaga agcccggagc gagcgtgaaa 120
gtgtcctgca aggcttccgg gtacaccttc tccaactacg gcatcacttg ggtgcgccag 180
gccccgggac agggcctgga atggatgggg tggatttccg cgtacaacgg caatacgaac 240
tacgctcaga agttccaggg tagagtgacc atgactagga acacctccat ttccaccgcc 300
tacatggaac tgtcctccct gcggagcgag gacaccgccg tgtactattg cgcccgggga 360
ccatactact actacatgga tgtctggggg aaggggacta tggtcaccgt gtcatccgcc 420
tcgggaggcg gcggatcagg aggacgcgcc tctggtggtg gaggatcgga gatcgtgatg 480
acccagagcc ctctctcctt gcccgtgact cctggggagc ccgcatccat ttcatgccgg 540
agctcccagt cacttctcta ctccaacggc tataactacg tggattggta cctccaaaag 600
ccgggccaga gcccgcagct gctgatctac ctgggctcga acagggccag cggagtgcct 660
gaccggttct ccgggtcggg aagcgggacc gacttcaagc tgcaaatctc gagagtggag 720
gccgaggacg tgggaatcta ctactgtatg cagggccgcc agtttccgta ctcgttcgga 780
cagggcacca aagtggaaat caagaccact accccagcac cgaggccacc caccccggct 840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 120
<211> 1446
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 120
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aattgctcga aactggagga ggtctggtgc aacctggagg atcacttcgc 120
ctgtcctgcg ccgtgtcggg ctttgccctg tccaaccatg gaatgagctg ggtccgccgc 180
gcgccgggga agggcctcga atgggtgtcc ggcatcgtct actccggctc cacctactac 240
gccgcgtccg tgaagggccg gttcacgatt tcacgggaca actcgcggaa caccctgtac 300
ctccaaatga attcccttcg gccggaggat actgccatct actactgctc cgcccacggt 360
ggcgaatccg acgtctgggg ccagggaacc accgtgaccg tgtccagcgc gtccggggga 420
ggaggaagcg ggggtagagc atcgggtgga ggcggatcag agatcgtgct gacccagtcc 480
cccgccacct tgagcgtgtc accaggagag tccgccaccc tgtcatgccg cgccagccag 540
tccgtgtcct ccaacctggc ttggtaccag cagaagccgg ggcaggcccc tagactcctg 600
atctatgggg cgtcgacccg ggcatctgga attcccgata ggttcagcgg atcgggctcg 660
ggcactgact tcactctgac catctcctcg ctgcaagccg aggacgtggc tgtgtactac 720
tgtcagcagt acggaagctc cctgactttc ggtggcggga ccaaagtcga gattaagacc 780
actaccccag caccgaggcc acccaccccg gctcctacca tcgcctccca gcctctgtcc 840
ctgcgtccgg aggcatgtag acccgcagct ggtggggccg tgcatacccg gggtcttgac 900
ttcgcctgcg atatctacat ttgggcccct ctggctggta cttgcggggt cctgctgctt 960
tcactcgtga tcactcttta ctgtaagcgc ggtcggaaga agctgctgta catctttaag 1020
caacccttca tgaggcctgt gcagactact caagaggagg acggctgttc atgccggttc 1080
ccagaggagg aggaaggcgg ctgcgaactg cgcgtgaaat tcagccgcag cgcagatgct 1140
ccagcctaca agcaggggca gaaccagctc tacaacgaac tcaatcttgg tcggagagag 1200
gagtacgacg tgctggacaa gcggagagga cgggacccag aaatgggcgg gaagccgcgc 1260
agaaagaatc cccaagaggg cctgtacaac gagctccaaa aggataagat ggcagaagcc 1320
tatagcgaga ttggtatgaa aggggaacgc agaagaggca aaggccacga cggactgtac 1380
cagggactca gcaccgccac caaggacacc tatgacgctc ttcacatgca ggccctgccg 1440
cctcgg 1446
<210> 121
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 121
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aattggtgga aactggagga ggacttgtgc aacctggagg atcattgaga 120
ctgagctgcg cagtgtcggg attcgccctg agcaaccatg gaatgtcctg ggtcagaagg 180
gcccctggaa aaggcctcga atgggtgtca gggatcgtgt actccggttc cacttactac 240
gccgcctccg tgaaggggcg cttcactatc tcacgggata actcccgcaa taccctgtac 300
ctccaaatga acagcctgcg gccggaggat accgccatct actactgttc cgcccacggt 360
ggagagtctg acgtctgggg ccagggaact accgtgaccg tgtcctccgc gtccggcggt 420
ggagggagcg gcggccgcgc cagcggcggc ggaggctccg agatcgtgat gacccagagc 480
cccgctactc tgtcggtgtc gcccggagaa agggcgaccc tgtcctgccg ggcgtcgcag 540
tccgtgagca gcaagctggc ttggtaccag cagaagccgg gccaggcacc acgcctgctt 600
atgtacggtg cctccattcg ggccaccgga atcccggacc ggttctcggg gtcggggtcc 660
ggtaccgagt tcacactgac catttcctcg ctcgagcccg aggactttgc cgtctattac 720
tgccagcagt acggctcctc ctcatggacg ttcggccagg ggaccaaggt cgaaatcaag 780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg 840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt 900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg 960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt 1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg 1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat 1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga 1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg 1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa 1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg 1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg 1440
ccgcctcgg 1449
<210> 122
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 122
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aattggtgga gactggagga ggagtggtgc aacctggagg aagcctgaga 120
ctgtcatgcg cggtgtcggg cttcgccctc tccaaccacg gaatgtcctg ggtccgccgg 180
gcccctggga aaggacttga atgggtgtcc ggcatcgtgt actcgggttc cacctactac 240
gcggcctcag tgaagggccg gtttactatt agccgcgaca actccagaaa cacactgtac 300
ctccaaatga actcgctgcg gccggaagat accgctatct actactgctc cgcccatggg 360
ggagagtcgg acgtctgggg acagggcacc actgtcactg tgtccagcgc ttccggcggt 420
ggtggaagcg ggggacgggc ctcaggaggc ggtggcagcg agattgtgct gacccagtcc 480
cccgggaccc tgagcctgtc cccgggagaa agggccaccc tctcctgtcg ggcatcccag 540
tccgtggggt ctactaacct tgcatggtac cagcagaagc ccggccaggc ccctcgcctg 600
ctgatctacg acgcgtccaa tagagccacc ggcatcccgg atcgcttcag cggaggcgga 660
tcgggcaccg acttcaccct caccatttca aggctggaac cggaggactt cgccgtgtac 720
tactgccagc agtatggttc gtccccaccc tggacgttcg gccaggggac taaggtcgag 780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag 840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg 900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc 960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac 1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca 1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc 1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt 1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg 1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg 1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac 1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag 1440
gccctgccgc ctcgg 1455
<210> 123
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 123
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtgga atctggtgga ggactcgtga aacctggagg atcattgaga 120
ctgtcatgcg cggcctcggg attcacgttc tccgattact acatgagctg gattcgccag 180
gctccgggga agggactgga atgggtgtcc tacatttcct catccggctc caccatctac 240
tacgcggact ccgtgaaggg gagattcacc attagccgcg ataacgccaa gaacagcctg 300
taccttcaga tgaactccct gcgggctgaa gatactgccg tctactactg cgcaagggag 360
agcggagatg ggatggacgt ctggggacag ggtaccactg tgaccgtgtc gtcggcctcc 420
ggcggagggg gttcgggtgg aagggccagc ggcggcggag gcagcgacat ccagatgacc 480
cagtccccct catcgctgtc cgcctccgtg ggcgaccgcg tcaccatcac atgccgggcc 540
tcacagtcga tctcctccta cctcaattgg tatcagcaga agcccggaaa ggcccctaag 600
cttctgatct acgcagcgtc ctccctgcaa tccggggtcc catctcggtt ctccggctcg 660
ggcagcggta ccgacttcac tctgaccatc tcgagcctgc agccggagga cttcgccact 720
tactactgtc agcaaagcta caccctcgcg tttggccagg gcaccaaagt ggacatcaag 780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg 840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt 900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg 960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt 1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg 1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat 1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga 1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg 1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa 1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg 1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg 1440
ccgcctcgg 1449
<210> 124
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 124
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aattggtgga atcaggggga ggacttgtgc agcctggagg atcgctgaga 120
ctgtcatgtg ccgtgtccgg ctttgccctg tccaaccacg ggatgtcctg ggtccgccgc 180
gcgcctggaa agggcctcga atgggtgtcg ggtattgtgt acagcggtag cacctactat 240
gccgcatccg tgaaggggag attcaccatc agccgggaca actccaggaa cactctgtac 300
ctccaaatga attcgctgag gccagaggac actgccatct actactgctc cgcgcatggc 360
ggagagtccg acgtctgggg acaggggacc accgtgaccg tgtctagcgc gtccggcgga 420
ggcggcagcg ggggtcgggc atcagggggc ggcggatcgg acatccagct cacccagtcc 480
ccgagctcgc tgtccgcctc cgtgggagat cgggtcacca tcacgtgccg cgccagccag 540
tcgatttcct cctacctgaa ctggtaccaa cagaagcccg gaaaagcccc gaagcttctc 600
atctacgccg cctcgagcct gcagtcagga gtgccctcac ggttctccgg ctccggttcc 660
ggtactgatt tcaccctgac catttcctcc ctgcaaccgg aggacttcgc tacttactac 720
tgccagcagt cgtactccac cccctacact ttcggacaag gcaccaaggt cgaaatcaag 780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg 840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt 900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg 960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt 1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg 1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat 1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga 1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg 1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa 1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg 1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg 1440
ccgcctcgg 1449
<210> 125
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 125
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactggtgca aagcggagga ggattggtca aacccggagg aagcctgaga 120
ctgtcatgcg cggcctctgg attcaccttc tccgattact acatgtcatg gatcagacag 180
gccccgggga agggcctcga atgggtgtcc tacatctcgt cctccgggaa caccatctac 240
tacgccgaca gcgtgaaggg ccgctttacc atttcccgcg acaacgcaaa gaactcgctg 300
taccttcaga tgaattccct gcgggctgaa gataccgcgg tgtactattg cgcccggtcc 360
actatggtcc gggaggacta ctggggacag ggcacactcg tgaccgtgtc cagcgcgagc 420
gggggtggag gcagcggtgg acgcgcctcc ggcggcggcg gttcagacat cgtgctgact 480
cagtcgcccc tgtcgctgcc ggtcaccctg ggccaaccgg cctcaattag ctgcaagtcc 540
tcggagagcc tggtgcacaa ctcaggaaag acttacctga actggttcca tcagcggcct 600
ggacagtccc cacggaggct catctatgaa gtgtccaaca gggattcggg ggtgcccgac 660
cgcttcactg gctccgggtc cggcaccgac ttcaccttga aaatctccag agtggaagcc 720
gaggacgtgg gcgtgtacta ctgtatgcag ggtacccact ggcctggaac ctttggacaa 780
ggaactaagc tcgagattaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 126
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 126
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtgga atctggtgga ggactcgtgc aacccggtgg aagccttagg 120
ctgtcgtgcg ccgtcagcgg gtttgctctg agcaaccatg gaatgtcctg ggtccgccgg 180
gcaccgggaa aagggctgga atgggtgtcc ggcatcgtgt acagcgggtc aacctattac 240
gccgcgtccg tgaagggcag attcactatc tcaagagaca acagccggaa caccctgtac 300
ttgcaaatga attccctgcg ccccgaggac accgccatct actactgctc cgcccacgga 360
ggagagtcgg acgtgtgggg ccagggaacg actgtgactg tgtccagcgc atcaggaggg 420
ggtggttcgg gcggccgggc ctcgggggga ggaggttccg acattcggct gacccagtcc 480
ccgtccccac tgtcggcctc cgtcggcgac cgcgtgacca tcacttgtca ggcgtccgag 540
gacattaaca agttcctgaa ctggtaccac cagacccctg gaaaggcccc caagctgctg 600
atctacgatg cctcgaccct tcaaactgga gtgcctagcc ggttctccgg gtccggctcc 660
ggcactgatt tcactctgac catcaactca ttgcagccgg aagatatcgg gacctactat 720
tgccagcagt acgaatccct cccgctcaca ttcggcgggg gaaccaaggt cgagattaag 780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg 840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt 900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg 960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt 1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg 1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat 1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga 1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg 1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa 1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg 1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg 1440
ccgcctcgg 1449
<210> 127
<211> 1452
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 127
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aattggtgga aactggagga ggacttgtgc aacctggagg atcattgcgg 120
ctctcatgcg ctgtctccgg cttcgccctg tcaaatcacg ggatgtcgtg ggtcagacgg 180
gccccgggaa agggtctgga atgggtgtcg gggattgtgt acagcggctc cacctactac 240
gccgcttcgg tcaagggccg cttcactatt tcacgggaca acagccgcaa caccctctat 300
ctgcaaatga actctctccg cccggaggat accgccatct actactgctc cgcacacggc 360
ggcgaatccg acgtgtgggg acagggaacc actgtcaccg tgtcgtccgc atccggtggc 420
ggaggatcgg gtggccgggc ctccgggggc ggcggcagcg agactaccct gacccagtcc 480
cctgccactc tgtccgtgag cccgggagag agagccaccc ttagctgccg ggccagccag 540
agcgtgggct ccaacctggc ctggtaccag cagaagccag gacagggtcc caggctgctg 600
atctacggag cctccactcg cgcgaccggc atccccgcga ggttctccgg gtcgggttcc 660
gggaccgagt tcaccctgac catctcctcc ctccaaccgg aggacttcgc ggtgtactac 720
tgtcagcagt acaacgattg gctgcccgtg acatttggac aggggacgaa ggtggaaatc 780
aaaaccacta ccccagcacc gaggccaccc accccggctc ctaccatcgc ctcccagcct 840
ctgtccctgc gtccggaggc atgtagaccc gcagctggtg gggccgtgca tacccggggt 900
cttgacttcg cctgcgatat ctacatttgg gcccctctgg ctggtacttg cggggtcctg 960
ctgctttcac tcgtgatcac tctttactgt aagcgcggtc ggaagaagct gctgtacatc 1020
tttaagcaac ccttcatgag gcctgtgcag actactcaag aggaggacgg ctgttcatgc 1080
cggttcccag aggaggagga aggcggctgc gaactgcgcg tgaaattcag ccgcagcgca 1140
gatgctccag cctacaagca ggggcagaac cagctctaca acgaactcaa tcttggtcgg 1200
agagaggagt acgacgtgct ggacaagcgg agaggacggg acccagaaat gggcgggaag 1260
ccgcgcagaa agaatcccca agagggcctg tacaacgagc tccaaaagga taagatggca 1320
gaagcctata gcgagattgg tatgaaaggg gaacgcagaa gaggcaaagg ccacgacgga 1380
ctgtaccagg gactcagcac cgccaccaag gacacctatg acgctcttca catgcaggcc 1440
ctgccgcctc gg 1452
<210> 128
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 128
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aattggtgga atctggtgga ggacttgtgc aacctggagg atcactgaga 120
ctgtcatgcg cggtgtccgg ttttgccctg agcaatcatg ggatgtcgtg ggtccggcgc 180
gcccccggaa agggtctgga atgggtgtcg ggtatcgtct actccgggag cacttactac 240
gccgcgagcg tgaagggccg cttcaccatt tcccgcgata actcccgcaa caccctgtac 300
ttgcaaatga actcgctccg gcctgaggac actgccatct actactgctc cgcacacgga 360
ggagaatccg acgtgtgggg ccagggaact accgtgaccg tcagcagcgc ctccggcggc 420
gggggctcag gcggacgggc tagcggcggc ggtggctccg agatcgtgct gacccagtcg 480
cctggcactc tctcgctgag ccccggggaa agggcaaccc tgtcctgtcg ggccagccag 540
tccattggat catcctccct cgcctggtat cagcagaaac cgggacaggc tccgcggctg 600
cttatgtatg gggccagctc aagagcctcc ggcattcccg accggttctc cgggtccggt 660
tccggcaccg atttcaccct gactatctcg aggctggagc cagaggactt cgccgtgtac 720
tactgccagc agtacgcggg gtccccgccg ttcacgttcg gacagggaac caaggtcgag 780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag 840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg 900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc 960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac 1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca 1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc 1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt 1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg 1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg 1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac 1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag 1440
gccctgccgc ctcgg 1455
<210> 129
<211> 243
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 129
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Ala Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg His Trp Gln Glu Trp Pro Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Glu Thr Thr Leu Thr Gln Ser Pro
130 135 140
Ala Phe Met Ser Ala Thr Pro Gly Asp Lys Val Ile Ile Ser Cys Lys
145 150 155 160
Ala Ser Gln Asp Ile Asp Asp Ala Met Asn Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Glu Ala Pro Leu Phe Ile Ile Gln Ser Ala Thr Ser Pro Val Pro
180 185 190
Gly Ile Pro Pro Arg Phe Ser Gly Ser Gly Phe Gly Thr Asp Phe Ser
195 200 205
Leu Thr Ile Asn Asn Ile Glu Ser Glu Asp Ala Ala Tyr Tyr Phe Cys
210 215 220
Leu Gln His Asp Asn Phe Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 130
<211> 244
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 130
Val Asn Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Arg Thr Ser Gly
20 25 30
Met Cys Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp
35 40 45
Leu Ala Arg Ile Asp Trp Asp Glu Asp Lys Phe Tyr Ser Thr Ser Leu
50 55 60
Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Asp Asn Gln Val Val
65 70 75 80
Leu Arg Met Thr Asn Met Asp Pro Ala Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Ser Gly Ala Gly Gly Thr Ser Ala Thr Ala Phe Asp Ile Trp
100 105 110
Gly Pro Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser
130 135 140
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
145 150 155 160
Arg Ala Ser Gln Asp Ile Tyr Asn Asn Leu Ala Trp Phe Gln Leu Lys
165 170 175
Pro Gly Ser Ala Pro Arg Ser Leu Met Tyr Ala Ala Asn Lys Ser Gln
180 185 190
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Ala Ser Gly Thr Asp Phe
195 200 205
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
210 215 220
Cys Gln His Tyr Tyr Arg Phe Pro Tyr Ser Phe Gly Gln Gly Thr Lys
225 230 235 240
Leu Glu Ile Lys
<210> 131
<211> 246
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 131
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Thr Ile Ala Ala Val Tyr Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Leu Ser
130 135 140
Leu Pro Val Thr Pro Glu Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu
165 170 175
Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn
180 185 190
Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
210 215 220
Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys
245
<210> 132
<211> 240
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 132
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Ser Pro Ser Val Ser Ala
130 135 140
Ala Pro Gly Tyr Thr Ala Thr Ile Ser Cys Gly Gly Asn Asn Ile Gly
145 150 155 160
Thr Lys Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Leu
165 170 175
Leu Val Ile Arg Asp Asp Ser Val Arg Pro Ser Lys Ile Pro Gly Arg
180 185 190
Phe Ser Gly Ser Asn Ser Gly Asn Met Ala Thr Leu Thr Ile Ser Gly
195 200 205
Val Gln Ala Gly Asp Glu Ala Asp Phe Tyr Cys Gln Val Trp Asp Ser
210 215 220
Asp Ser Glu His Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
225 230 235 240
<210> 133
<211> 241
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 133
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Pro Ser Gly Tyr Thr Val Thr Ser His
20 25 30
Tyr Ile His Trp Val Arg Arg Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asn Pro Ser Gly Gly Val Thr Ala Tyr Ser Gln Thr Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ser Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ser Gly Ser Gly Trp Tyr Phe Asp Phe Trp Gly Arg
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Pro Pro Ser
130 135 140
Val Ser Val Ser Pro Gly Gln Thr Ala Ser Ile Thr Cys Ser Gly Asp
145 150 155 160
Gly Leu Ser Lys Lys Tyr Val Ser Trp Tyr Gln Gln Lys Ala Gly Gln
165 170 175
Ser Pro Val Val Leu Ile Ser Arg Asp Lys Glu Arg Pro Ser Gly Ile
180 185 190
Pro Asp Arg Phe Ser Gly Ser Asn Ser Ala Asp Thr Ala Thr Leu Thr
195 200 205
Ile Ser Gly Thr Gln Ala Met Asp Glu Ala Asp Tyr Tyr Cys Gln Ala
210 215 220
Trp Asp Asp Thr Thr Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val
225 230 235 240
Leu
<210> 134
<211> 245
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 134
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Ala Gly Ile Ala Ala Arg Leu Arg Gly Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln
130 135 140
Ser Pro Ser Ser Val Ser Ala Ser Val Gly Asp Arg Val Ile Ile Thr
145 150 155 160
Cys Arg Ala Ser Gln Gly Ile Arg Asn Trp Leu Ala Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr Ala Ala Ser Asn Leu
180 185 190
Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Ala Asp
195 200 205
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Val Ala Thr Tyr
210 215 220
Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Phe Thr Phe Gly Pro Gly Thr
225 230 235 240
Lys Val Asp Ile Lys
245
<210> 135
<211> 253
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 135
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Gly Tyr Gln Leu Leu Arg Trp Asp Val Gly Leu Leu
100 105 110
Arg Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
145 150 155 160
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
165 170 175
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Leu Tyr
180 185 190
Gly Lys Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
195 200 205
Arg Ser Gly Thr Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
210 215 220
Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Arg Asp Ser Ser Gly Asp His
225 230 235 240
Leu Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
245 250
<210> 136
<211> 248
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 136
Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Ser Phe Tyr Ala
50 55 60
Ile Ser Leu Lys Ser Arg Ile Ile Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Lys Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Ser Ser Pro Glu Gly Leu Phe Leu Tyr Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Asp
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Glu Leu
130 135 140
Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln Thr Ile Arg Ile
145 150 155 160
Thr Cys Gln Gly Asp Ser Leu Gly Asn Tyr Tyr Ala Thr Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr Gly Thr Asn Asn
180 185 190
Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Ala Ser Ser Ser Gly Asn
195 200 205
Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu Asp Glu Ala Asp
210 215 220
Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly His His Leu Leu Phe Gly
225 230 235 240
Thr Gly Thr Lys Val Thr Val Leu
245
<210> 137
<211> 246
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 137
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Glu Gly Ser Gly Ser Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu
130 135 140
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
145 150 155 160
Ser Val Ser Ser Ala Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
165 170 175
Pro Pro Arg Leu Leu Ile Ser Gly Ala Ser Thr Arg Ala Thr Gly Ile
180 185 190
Pro Asp Arg Phe Gly Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His
210 215 220
Tyr Gly Ser Ser Phe Asn Gly Ser Ser Leu Phe Thr Phe Gly Gln Gly
225 230 235 240
Thr Arg Leu Glu Ile Lys
245
<210> 138
<211> 241
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 138
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Arg Tyr
20 25 30
Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr Tyr Ala Asp Ser Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Thr Arg Ala Gly Ser Glu Ala Ser Asp Ile Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu
130 135 140
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
145 150 155 160
Ser Val Ser Asn Ser Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Ile Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Ile Tyr Tyr Cys Gln Gln Phe
210 215 220
Gly Thr Ser Ser Gly Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
225 230 235 240
Lys
<210> 139
<211> 248
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 139
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr
130 135 140
Gln Ser Pro Gly Thr Val Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu
145 150 155 160
Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser Phe Leu Ala Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser
180 185 190
Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Ser Ala
210 215 220
Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp Thr Phe Gly
225 230 235 240
Gln Gly Thr Arg Leu Glu Ile Lys
245
<210> 140
<211> 248
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 140
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr
130 135 140
Gln Ser Pro Ser Thr Leu Ser Leu Ser Pro Gly Glu Ser Ala Thr Leu
145 150 155 160
Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Thr Phe Leu Ala Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ser Ser
180 185 190
Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Thr Ile Arg Arg Leu Glu Pro Glu Asp Phe Ala
210 215 220
Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro Ser Trp Thr Phe Gly
225 230 235 240
Gln Gly Thr Lys Val Glu Ile Lys
245
<210> 141
<211> 239
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 141
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Lys Ala Val Pro Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr Pro Ser Ser Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
210 215 220
Ser Thr Pro Tyr Ser Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
225 230 235
<210> 142
<211> 246
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 142
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Arg Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser His Gln Gly Val Ala Tyr Tyr Asn Tyr Ala Met Asp Val Trp
100 105 110
Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
130 135 140
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
145 150 155 160
Arg Ala Thr Gln Ser Ile Gly Ser Ser Phe Leu Ala Trp Tyr Gln Gln
165 170 175
Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Gln Arg
180 185 190
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Ser Ala Val Tyr
210 215 220
Tyr Cys Gln His Tyr Glu Ser Ser Pro Ser Trp Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Val Glu Ile Lys
245
<210> 143
<211> 241
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 143
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Val Arg Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser
130 135 140
Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser
145 150 155 160
Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro
180 185 190
Asp Arg Phe Ser Gly Asn Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr
210 215 220
Gly Ser Pro Pro Arg Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile
225 230 235 240
Lys
<210> 144
<211> 242
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 144
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ile Pro Gln Thr Gly Thr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu
130 135 140
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
145 150 155 160
Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln
165 170 175
Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile
180 185 190
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His
210 215 220
Tyr Gly Ser Ser Pro Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu
225 230 235 240
Ile Lys
<210> 145
<211> 248
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 145
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Met Ser Arg Glu Asn Asp Lys Asn Ser Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Gly Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr
130 135 140
Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Ser Ala Thr Leu
145 150 155 160
Ser Cys Arg Ala Ser Gln Arg Val Ala Ser Asn Tyr Leu Ala Trp Tyr
165 170 175
Gln His Lys Pro Gly Gln Ala Pro Ser Leu Leu Ile Ser Gly Ala Ser
180 185 190
Ser Arg Ala Thr Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Ala Ile Ser Arg Leu Glu Pro Glu Asp Ser Ala
210 215 220
Val Tyr Tyr Cys Gln His Tyr Asp Ser Ser Pro Ser Trp Thr Phe Gly
225 230 235 240
Gln Gly Thr Lys Val Glu Ile Lys
245
<210> 146
<211> 244
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 146
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ala Leu Val Gly Ala Thr Gly Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Ser Leu Ser Ser Asn Phe Leu Ala Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Ala Pro Gly Leu Leu Ile Tyr Gly Ala Ser Asn Trp Ala Thr
180 185 190
Gly Thr Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
195 200 205
Leu Thr Ile Thr Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys
210 215 220
Gln Tyr Tyr Gly Thr Ser Pro Met Tyr Thr Phe Gly Gln Gly Thr Lys
225 230 235 240
Val Glu Ile Lys
<210> 147
<211> 244
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 147
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Trp Phe Gly Glu Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro
130 135 140
Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
145 150 155 160
Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys
165 170 175
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala
180 185 190
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
210 215 220
Cys Met Gln Ala Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys
225 230 235 240
Val Asp Ile Lys
<210> 148
<211> 251
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 148
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Gly Tyr Asp Ser Ser Gly Tyr Tyr Arg Asp Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val
130 135 140
Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala
145 150 155 160
Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly
180 185 190
Thr Ser Ser Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp
210 215 220
Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Asn Ser Pro Pro Lys Phe
225 230 235 240
Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
245 250
<210> 149
<211> 246
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 149
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Met Gly Trp Ser Ser Gly Tyr Leu Gly Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
130 135 140
Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
145 150 155 160
Arg Ala Ser Gln Ser Val Ala Ser Ser Phe Leu Ala Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Gly Arg
180 185 190
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
210 215 220
Tyr Cys Gln His Tyr Gly Gly Ser Pro Arg Leu Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Val Asp Ile Lys
245
<210> 150
<211> 729
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 150
caagtgcagc ttcaggaaag cggaccgggc ctggtcaagc catccgaaac tctctccctg 60
acttgcactg tgtctggcgg ttccatctca tcgtcgtact actactgggg ctggattagg 120
cagccgcccg gaaagggact ggagtggatc ggaagcatct actattccgg ctcggcgtac 180
tacaacccta gcctcaagtc gagagtgacc atctccgtgg atacctccaa gaaccagttt 240
tccctgcgcc tgagctccgt gaccgccgct gacaccgccg tgtactactg tgctcggcat 300
tggcaggaat ggcccgatgc cttcgacatt tggggccagg gcactatggt cactgtgtca 360
tccgggggtg gaggcagcgg gggaggaggg tccggggggg gaggttcaga gacaaccttg 420
acccagtcac ccgcattcat gtccgccact ccgggagaca aggtcatcat ctcgtgcaaa 480
gcgtcccagg atatcgacga tgccatgaat tggtaccagc agaagcctgg cgaagcgccg 540
ctgttcatta tccaatccgc aacctcgccc gtgcctggaa tcccaccgcg gttcagcggc 600
agcggtttcg gaaccgactt ttccctgacc attaacaaca ttgagtccga ggacgccgcc 660
tactacttct gcctgcaaca cgacaacttc cctctcacgt tcggccaggg aaccaagctg 720
gaaatcaag 729
<210> 151
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 151
caagtcaatc tgcgcgaatc cggccccgcc ttggtcaagc ctacccagac cctcactctg 60
acctgtactt tctccggctt ctccctgcgg acttccggga tgtgcgtgtc ctggatcaga 120
cagcctccgg gaaaggccct ggagtggctc gctcgcattg actgggatga ggacaagttc 180
tactccacct cactcaagac caggctgacc atcagcaaag atacctctga caaccaagtg 240
gtgctccgca tgaccaacat ggacccagcc gacactgcca cttactactg cgcgaggagc 300
ggagcgggcg gaacctccgc caccgccttc gatatttggg gcccgggtac catggtcacc 360
gtgtcaagcg gaggaggggg gtccgggggc ggcggttccg ggggaggcgg atcggacatt 420
cagatgactc agtcaccatc gtccctgagc gctagcgtgg gcgacagagt gacaatcact 480
tgccgggcat cccaggacat ctataacaac cttgcgtggt tccagctgaa gcctggttcc 540
gcaccgcggt cacttatgta cgccgccaac aagagccagt cgggagtgcc gtcccggttt 600
tccggttcgg cctcgggaac tgacttcacc ctgacgatct ccagcctgca acccgaggat 660
ttcgccacct actactgcca gcactactac cgctttccct actcgttcgg acagggaacc 720
aagctggaaa tcaag 735
<210> 152
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 152
gaagtgcagc ttgtcgaatc cgggggggga ctggtcaagc cgggcggatc actgagactg 60
tcctgcgccg cgagcggctt cacgttctcc tcctactcca tgaactgggt ccgccaagcc 120
cccgggaagg gactggaatg ggtgtcctct atctcctcgt cgtcgtccta catctactac 180
gccgactccg tgaagggaag attcaccatt tcccgcgaca acgcaaagaa ctcactgtac 240
ttgcaaatga actcactccg ggccgaagat actgctgtgt actattgcgc caagactatt 300
gccgccgtct acgctttcga catctggggc cagggaacca ccgtgactgt gtcgtccggt 360
ggtggtggct cgggcggagg aggaagcggc ggcggggggt ccgagattgt gctgacccag 420
tcgccactga gcctccctgt gacccccgag gaacccgcca gcatcagctg ccggtccagc 480
cagtccctgc tccactccaa cggatacaat tacctcgatt ggtaccttca gaagcctgga 540
caaagcccgc agctgctcat ctacttggga tcaaaccgcg cgtcaggagt gcctgaccgg 600
ttctccggct cgggcagcgg taccgatttc accctgaaaa tctccagggt ggaggcagag 660
gacgtgggag tgtattactg tatgcaggcg ctgcagactc cgtacacatt tgggcagggc 720
accaagctgg agatcaag 738
<210> 153
<211> 720
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 153
gaagtccagc tcgtggagtc cggcggaggc cttgtgaagc ctggaggttc gctgagactg 60
tcctgcgccg cctccggctt caccttctcc gactactaca tgtcctggat cagacaggcc 120
ccgggaaagg gcctggaatg ggtgtcctac atctcgtcat cgggcagcac tatctactac 180
gcggactcag tgaaggggcg gttcaccatt tcccgggata acgcgaagaa ctcgctgtat 240
ctgcaaatga actcactgag ggccgaggac accgccgtgt actactgcgc ccgcgatctc 300
cgcggggcat ttgacatctg gggacaggga accatggtca cagtgtccag cggaggggga 360
ggatcgggtg gcggaggttc cgggggtgga ggctcctcct acgtgctgac tcagagccca 420
agcgtcagcg ctgcgcccgg ttacacggca accatctcct gtggcggaaa caacattggg 480
accaagtctg tgcactggta tcagcagaag ccgggccaag ctcccctgtt ggtgatccgc 540
gatgactccg tgcggcctag caaaattccg ggacggttct ccggctccaa cagcggcaat 600
atggccactc tcaccatctc gggagtgcag gccggagatg aagccgactt ctactgccaa 660
gtctgggact cagactccga gcatgtggtg ttcgggggcg gaaccaagct gactgtgctc 720
<210> 154
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 154
caagtgcagc tggtgcagag cggggccgaa gtcaagaagc cgggagcctc cgtgaaagtg 60
tcctgcaagc cttcgggata caccgtgacc tcccactaca ttcattgggt ccgccgcgcc 120
cccggccaag gactcgagtg gatgggcatg atcaacccta gcggcggagt gaccgcgtac 180
agccagacgc tgcagggacg cgtgactatg acctcggata cctcctcctc caccgtctat 240
atggaactgt ccagcctgcg gtccgaggat accgccatgt actactgcgc ccgggaagga 300
tcaggctccg ggtggtattt cgacttctgg ggaagaggca ccctcgtgac tgtgtcatct 360
gggggagggg gttccggtgg tggcggatcg ggaggaggcg gttcatccta cgtgctgacc 420
cagccaccct ccgtgtccgt gagccccggc cagactgcat cgattacatg tagcggcgac 480
ggcctctcca agaaatacgt gtcgtggtac cagcagaagg ccggacagag cccggtggtg 540
ctgatctcaa gagataagga gcggcctagc ggaatcccgg acaggttctc gggttccaac 600
tccgcggaca ctgctactct gaccatctcg gggacccagg ctatggacga agccgattac 660
tactgccaag cctgggacga cactactgtc gtgtttggag ggggcaccaa gttgaccgtc 720
ctt 723
<210> 155
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 155
caagtgcagc ttcaggagag cggcccggga ctcgtgaagc cgtcccagac cctgtccctg 60
acttgcaccg tgtcgggagg aagcatctcg agcggaggct actattggtc gtggattcgg 120
cagcaccctg gaaagggcct ggaatggatc ggctacatct actactccgg ctcgacctac 180
tacaacccat cgctgaagtc cagagtgaca atctcagtgg acacgtccaa gaatcagttc 240
agcctgaagc tctcttccgt gactgcggcc gacaccgccg tgtactactg cgcacgcgct 300
ggaattgccg cccggctgag gggtgccttc gacatttggg gacagggcac catggtcacc 360
gtgtcctccg gcggcggagg ttccgggggt ggaggctcag gaggaggggg gtccgacatc 420
gtcatgactc agtcgccctc aagcgtcagc gcgtccgtcg gggacagagt gatcatcacc 480
tgtcgggcgt cccagggaat tcgcaactgg ctggcctggt atcagcagaa gcccggaaag 540
gcccccaacc tgttgatcta cgccgcctca aacctccaat ccggggtgcc gagccgcttc 600
agcggctccg gttcgggtgc cgatttcact ctgaccatct cctccctgca acctgaagat 660
gtggctacct actactgcca aaagtacaac tccgcacctt ttactttcgg accggggacc 720
aaagtggaca ttaag 735
<210> 156
<211> 759
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 156
caagtgcagc tggtccagtc gggcgccgag gtcaagaagc ccgggagctc tgtgaaagtg 60
tcctgcaagg cctccggggg cacctttagc tcctacgcca tctcctgggt ccgccaagca 120
ccgggtcaag gcctggagtg gatgggggga attatcccta tcttcggcac tgccaactac 180
gcccagaagt tccagggacg cgtgaccatt accgcggacg aatccacctc caccgcttat 240
atggagctgt ccagcttgcg ctcggaagat accgccgtgt actactgcgc ccggaggggt 300
ggataccagc tgctgagatg ggacgtgggc ctcctgcggt cggcgttcga catctggggc 360
cagggcacta tggtcactgt gtccagcgga ggaggcggat cgggaggcgg cggatcaggg 420
ggaggcggtt ccagctacgt gcttactcaa cccccttcgg tgtccgtggc cccgggacag 480
accgccagaa tcacttgcgg aggaaacaac attgggtcca agagcgtgca ttggtaccag 540
cagaagccag gacaggcccc tgtgctggtg ctctacggga agaacaatcg gcccagcgga 600
gtgccggaca ggttctcggg ttcacgctcc ggtacaaccg cttcactgac tatcaccggg 660
gcccaggcag aggatgaagc ggactactac tgttcctccc gggattcatc cggcgaccac 720
ctccgggtgt tcggaaccgg aacgaaggtc accgtgctg 759
<210> 157
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 157
gaagtgcagc tccaacagtc aggaccgggg ctcgtgaagc catcccagac cctgtccctg 60
acttgtgcca tctcgggaga tagcgtgtca tcgaactccg ccgcctggaa ctggattcgg 120
cagagcccgt cccgcggact ggagtggctt ggaaggacct actaccggtc caagtggtac 180
tctttctacg cgatctcgct gaagtcccgc attatcatta accctgatac ctccaagaat 240
cagttctccc tccaactgaa atccgtcacc cccgaggaca cagcagtgta ttactgcgca 300
cggagcagcc ccgaaggact gttcctgtat tggtttgacc cctggggcca ggggactctt 360
gtgaccgtgt cgagcggcgg agatgggtcc ggtggcggtg gttcgggggg cggcggatca 420
tcatccgaac tgacccagga cccggctgtg tccgtggcgc tgggacaaac catccgcatt 480
acgtgccagg gagactccct gggcaactac tacgccactt ggtaccagca gaagccgggc 540
caagcccctg tgttggtcat ctacgggacc aacaacagac cttccggcat ccccgaccgg 600
ttcagcgctt cgtcctccgg caacactgcc agcctgacca tcactggagc gcaggccgaa 660
gatgaggccg actactactg caacagcaga gactcctcgg gtcatcacct cttgttcgga 720
actggaacca aggtcaccgt gctg 744
<210> 158
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 158
gaagtgcagc tcgtggagtc aggaggcggc ctggtccagc cgggagggtc ccttagactg 60
tcatgcgccg caagcggatt cactttctcc tcctatgcca tgagctgggt ccgccaagcc 120
cccggaaagg gactggaatg ggtgtccgcc atctcggggt ctggaggctc aacttactac 180
gctgactccg tgaagggacg gttcaccatt agccgcgaca actccaagaa caccctctac 240
ctccaaatga actccctgcg ggccgaggat accgccgtct actactgcgc caaagtggaa 300
ggttcaggat cgctggacta ctggggacag ggtactctcg tgaccgtgtc atcgggcgga 360
ggaggttccg gcggtggcgg ctccggcggc ggagggtcgg agatcgtgat gacccagagc 420
cctggtactc tgagcctttc gccgggagaa agggccaccc tgtcctgccg cgcttcccaa 480
tccgtgtcct ccgcgtactt ggcgtggtac cagcagaagc cgggacagcc ccctcggctg 540
ctgatcagcg gggccagcac ccgggcaacc ggaatcccag acagattcgg gggttccggc 600
agcggcacag atttcaccct gactatttcg aggttggagc ccgaggactt tgcggtgtat 660
tactgtcagc actacgggtc gtcctttaat ggctccagcc tgttcacgtt cggacagggg 720
acccgcctgg aaatcaag 738
<210> 159
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 159
gaagtgcaac tggtggaaac cggtggcggc ctggtgcagc ctggaggatc attgaggctg 60
tcatgcgcgg ccagcggtat taccttctcc cggtacccca tgtcctgggt cagacaggcc 120
ccggggaaag ggcttgaatg ggtgtccggg atctcggact ccggtgtcag cacttactac 180
gccgactccg ccaagggacg cttcaccatt tcccgggaca actcgaagaa caccctgttc 240
ctccaaatga gctccctccg ggacgaggat actgcagtgt actactgcgt gacccgcgcc 300
gggtccgagg cgtctgacat ttggggacag ggcactatgg tcaccgtgtc gtccggcgga 360
gggggctcgg gaggcggtgg cagcggagga ggagggtccg agatcgtgct gacccaatcc 420
ccggccaccc tctcgctgag ccctggagaa agggcaacct tgtcctgtcg cgcgagccag 480
tccgtgagca actccctggc ctggtaccag cagaagcccg gacaggctcc gagacttctg 540
atctacgacg cttcgagccg ggccactgga atccccgacc gcttttcggg gtccggctca 600
ggaaccgatt tcaccctgac aatctcacgg ctggagccag aggatttcgc catctattac 660
tgccagcagt tcggtacttc ctccggcctg actttcggag gcggcacgaa gctcgaaatc 720
aag 723
<210> 160
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 160
caagtgcagc tcgtggaatc gggtggcgga ctggtgcagc cggggggctc acttagactg 60
tcctgcgcgg ccagcggatt cactttctcc tcctacgcca tgtcctgggt cagacaggcc 120
cctggaaagg gcctggaatg ggtgtccgca atcagcggca gcggcggctc gacctattac 180
gcggattcag tgaagggcag attcaccatt tcccgggaca acgccaagaa ctccttgtac 240
cttcaaatga actccctccg cgcggaagat accgcaatct actactgcgc tcgggccact 300
tacaagaggg aactgcgcta ctactacggg atggacgtct ggggccaggg aaccatggtc 360
accgtgtcca gcggaggagg aggatcggga ggaggcggta gcgggggtgg agggtcggag 420
atcgtgatga cccagtcccc cggcactgtg tcgctgtccc ccggcgaacg ggccaccctg 480
tcatgtcggg ccagccagtc agtgtcgtca agcttcctcg cctggtacca gcagaaaccg 540
ggacaagctc cccgcctgct gatctacgga gccagcagcc gggccaccgg tattcctgac 600
cggttctccg gttcggggtc cgggaccgac tttactctga ctatctctcg cctcgagcca 660
gaggactccg ccgtgtatta ctgccagcag taccactcct ccccgtcctg gacgttcgga 720
cagggcacaa ggctggagat taag 744
<210> 161
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 161
gaggtgcagc ttgtggaaac cggtggcgga ctggtgcagc ccggaggaag cctcaggctg 60
tcctgcgccg cgtccggctt caccttctcc tcgtacgcca tgtcctgggt ccgccaggcc 120
cccggaaagg gcctggaatg ggtgtccgcc atctctggaa gcggaggttc cacgtactac 180
gcggacagcg tcaagggaag gttcacaatc tcccgcgata attcgaagaa cactctgtac 240
cttcaaatga acaccctgaa ggccgaggac actgctgtgt actactgcgc acgggccacc 300
tacaagagag agctccggta ctactacgga atggacgtct ggggccaggg aactactgtg 360
accgtgtcct cgggaggggg tggctccggg gggggcggct ccggcggagg cggttccgag 420
attgtgctga cccagtcacc ttcaactctg tcgctgtccc cgggagagag cgctactctg 480
agctgccggg ccagccagtc cgtgtccacc accttcctcg cctggtatca gcagaagccg 540
gggcaggcac cacggctctt gatctacggg tcaagcaaca gagcgaccgg aattcctgac 600
cgcttctcgg ggagcggttc aggcaccgac ttcaccctga ctatccggcg cctggaaccc 660
gaagatttcg ccgtgtatta ctgtcaacag taccactcct cgccgtcctg gacctttggc 720
caaggaacca aagtggaaat caag 744
<210> 162
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 162
gaagtgcagc tcgtggaaac tggaggtgga ctcgtgcagc ctggacggtc gctgcggctg 60
agctgcgctg catccggctt caccttcgac gattatgcca tgcactgggt cagacaggcg 120
ccagggaagg gacttgagtg ggtgtccggt atcagctgga atagcggctc aatcggatac 180
gcggactccg tgaagggaag gttcaccatt tcccgcgaca acgccaagaa ctccctgtac 240
ttgcaaatga acagcctccg ggatgaggac actgccgtgt actactgcgc ccgcgtcgga 300
aaagctgtgc ccgacgtctg gggccaggga accactgtga ccgtgtccag cggcgggggt 360
ggatcgggcg gtggagggtc cggtggaggg ggctcagata ttgtgatgac ccagaccccc 420
tcgtccctgt ccgcctcggt cggcgaccgc gtgactatca catgtagagc ctcgcagagc 480
atctccagct acctgaactg gtatcagcag aagccgggga aggccccgaa gctcctgatc 540
tacgcggcat catcactgca atcgggagtg ccgagccggt tttccgggtc cggctccggc 600
accgacttca cgctgaccat ttcttccctg caacccgagg acttcgccac ttactactgc 660
cagcagtcct actccacccc ttactccttc ggccaaggaa ccaggctgga aatcaag 717
<210> 163
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 163
gaagtgcagc tcgtggagag cgggggagga ttggtgcagc ccggaaggtc cctgcggctc 60
tcctgcactg cgtctggctt caccttcgac gactacgcga tgcactgggt cagacagcgc 120
ccgggaaagg gcctggaatg ggtcgcctca atcaactgga agggaaactc cctggcctat 180
ggcgacagcg tgaagggccg cttcgccatt tcgcgcgaca acgccaagaa caccgtgttt 240
ctgcaaatga attccctgcg gaccgaggat accgctgtgt actactgcgc cagccaccag 300
ggcgtggcat actataacta cgccatggac gtgtggggaa gagggacgct cgtcaccgtg 360
tcctccgggg gcggtggatc gggtggagga ggaagcggtg gcgggggcag cgaaatcgtg 420
ctgactcaga gcccgggaac tctttcactg tccccgggag aacgggccac tctctcgtgc 480
cgggccaccc agtccatcgg ctcctccttc cttgcctggt accagcagag gccaggacag 540
gcgccccgcc tgctgatcta cggtgcttcc caacgcgcca ctggcattcc tgaccggttc 600
agcggcagag ggtcgggaac cgatttcaca ctgaccattt cccgggtgga gcccgaagat 660
tcggcagtct actactgtca gcattacgag tcctcccctt catggacctt cggtcaaggg 720
accaaagtgg agatcaag 738
<210> 164
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 164
gaggtgcagt tggtcgaaag cgggggcggg cttgtgcagc ctggcggatc actgcggctg 60
tcctgcgcgg catcaggctt cacgttttct tcctacgcca tgtcctgggt gcgccaggcc 120
cctggaaagg gactggaatg ggtgtccgcg atttcggggt ccggcgggag cacctactac 180
gccgattccg tgaagggccg cttcactatc tcgcgggaca actccaagaa caccctctac 240
ctccaaatga atagcctgcg ggccgaggat accgccgtct actattgcgc taaggtcgtg 300
cgcgacggaa tggacgtgtg gggacagggt accaccgtga cagtgtcctc ggggggaggc 360
ggtagcggcg gaggaggaag cggtggtgga ggttccgaga ttgtgctgac tcaatcaccc 420
gcgaccctga gcctgtcccc cggcgaaagg gccactctgt cctgtcgggc cagccaatca 480
gtctcctcct cgtacctggc ctggtaccag cagaagccag gacaggctcc gagactcctt 540
atctatggcg catcctcccg cgccaccgga atcccggata ggttctcggg aaacggatcg 600
gggaccgact tcactctcac catctcccgg ctggaaccgg aggacttcgc cgtgtactac 660
tgccagcagt acggcagccc gcctagattc actttcggcc ccggcaccaa agtggacatc 720
aag 723
<210> 165
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 165
gaagtgcagc tgctggagtc cggcggtgga ttggtgcaac cggggggatc gctcagactg 60
tcctgtgcgg cgtcaggctt caccttctcg agctacgcca tgtcatgggt cagacaggcc 120
cctggaaagg gtctggaatg ggtgtccgcc atttccggga gcgggggatc tacatactac 180
gccgatagcg tgaagggccg cttcaccatt tcccgggaca actccaagaa cactctctat 240
ctgcaaatga actccctccg cgctgaggac actgccgtgt actactgcgc caaaatccct 300
cagaccggca ccttcgacta ctggggacag gggactctgg tcaccgtcag cagcggtggc 360
ggaggttcgg ggggaggagg aagcggcggc ggagggtccg agattgtgct gacccagtca 420
cccggcactt tgtccctgtc gcctggagaa agggccaccc tttcctgccg ggcatcccaa 480
tccgtgtcct cctcgtacct ggcctggtac cagcagaggc ccggacaggc cccacggctt 540
ctgatctacg gagcaagcag ccgcgcgacc ggtatcccgg accggttttc gggctcgggc 600
tcaggaactg acttcaccct caccatctcc cgcctggaac ccgaagattt cgctgtgtat 660
tactgccagc actacggcag ctccccgtcc tggacgttcg gccagggaac tcggctggag 720
atcaag 726
<210> 166
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 166
gaagtgcaac tggtggaaac cggtggagga ctcgtgcagc ctggcggcag cctccggctg 60
agctgcgccg cttcgggatt caccttttcc tcctacgcga tgtcttgggt cagacaggcc 120
cccggaaagg ggctggaatg ggtgtcagcc atctccggct ccggcggatc aacgtactac 180
gccgactccg tgaaaggccg gttcaccatg tcgcgcgaga atgacaagaa ctccgtgttc 240
ctgcaaatga actccctgag ggtggaggac accggagtgt actattgtgc gcgcgccaac 300
tacaagagag agctgcggta ctactacgga atggacgtct ggggacaggg aactatggtg 360
accgtgtcat ccggtggagg gggaagcggc ggtggaggca gcgggggcgg gggttcagaa 420
attgtcatga cccagtcccc gggaactctt tccctctccc ccggggaatc cgcgactttg 480
tcctgccggg ccagccagcg cgtggcctcg aactacctcg catggtacca gcataagcca 540
ggccaagccc cttccctgct gatttccggg gctagcagcc gcgccactgg cgtgccggat 600
aggttctcgg gaagcggctc gggtaccgat ttcaccctgg caatctcgcg gctggaaccg 660
gaggattcgg ccgtgtacta ctgccagcac tatgactcat ccccctcctg gacattcgga 720
cagggcacca aggtcgagat caag 744
<210> 167
<211> 732
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 167
gaagtgcagc tgctcgaaac cggtggaggg ctggtgcagc cagggggctc cctgaggctt 60
tcatgcgccg ctagcggatt ctccttctcc tcttacgcca tgtcgtgggt ccgccaagcc 120
cctggaaaag gcctggaatg ggtgtccgcg atttccggga gcggaggttc gacctattac 180
gccgactccg tgaagggccg ctttaccatc tcccgggata actccaagaa cactctgtac 240
ctccaaatga actcgctgag agccgaggac accgccgtgt attactgcgc gaaggcgctg 300
gtcggcgcga ctggggcatt cgacatctgg ggacagggaa ctcttgtgac cgtgtcgagc 360
ggaggcggcg gctccggcgg aggagggagc gggggcggtg gttccgaaat cgtgttgact 420
cagtccccgg gaaccctgag cttgtcaccc ggggagcggg ccactctctc ctgtcgcgcc 480
tcccaatcgc tctcatccaa tttcctggcc tggtaccagc agaagcccgg acaggccccg 540
ggcctgctca tctacggcgc ttcaaactgg gcaacgggaa cccctgatcg gttcagcgga 600
agcggatcgg gtactgactt taccctgacc atcaccagac tggaaccgga ggacttcgcc 660
gtgtactact gccagtacta cggcacctcc cccatgtaca cattcggaca gggtaccaag 720
gtcgagatta ag 732
<210> 168
<211> 733
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 168
gaagtgcagc tgcttgagag cggtggaggt ctggtgcagc ccgggggatc actgcgcctg 60
tcctgtgccg cgtccggttt cactttctcc tcgtacgcca tgtcgtgggt cagacaggca 120
ccgggaaagg gactggaatg ggtgtcagcc atttcgggtt cggggggcag cacctactac 180
gctgactccg tgaagggccg gttcaccatt tcccgcgaca actccaagaa caccttgtac 240
ctccaaatga actccctgcg ggccgaagat accgccgtgt attactgcgt gctgtggttc 300
ggagagggat tcgacccgtg gggacaagga acactcgtga ctgtgtcatc cggcggaggc 360
ggcagcggtg gcggcggttc cggcggcggc ggatctgaca tcgtgttgac ccagtcccct 420
ctgagcctgc cggtcactcc tggcgaacca gccagcatct cctgccggtc gagccagtcc 480
ctcctgcact ccaatgggta caactacctc gattggtatc tgcaaaagcc gggccagagc 540
ccccagctgc tgatctacct tgggtcaaac cgcgcttccg gggtgcctga tagattctcc 600
gggtccggga gcggaaccga ctttaccctg aaaatctcga gggtggaggc cgaggacgtc 660
ggagtgtact actgcatgca ggcgctccag actcccctga ccttcggagg aggaacgaag 720
gtcgacatca aga 733
<210> 169
<211> 753
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 169
caagtgcagc tcgtggagtc aggcggagga ctggtgcagc ccgggggctc cctgagactt 60
tcctgcgcgg catcgggttt taccttctcc tcctatgcta tgtcctgggt gcgccaggcc 120
ccgggaaagg gactggaatg ggtgtccgca atcagcggta gcgggggctc aacatactac 180
gccgactccg tcaagggtcg cttcactatt tcccgggaca actccaagaa taccctgtac 240
ctccaaatga acagcctcag ggccgaggat actgccgtgt actactgcgc caaagtcgga 300
tacgatagct ccggttacta ccgggactac tacggaatgg acgtgtgggg acagggcacc 360
accgtgaccg tgtcaagcgg cggaggcggt tcaggagggg gaggctccgg cggtggaggg 420
tccgaaatcg tcctgactca gtcgcctggc actctgtcgt tgtccccggg ggagcgcgct 480
accctgtcgt gtcgggcgtc gcagtccgtg tcgagctcct acctcgcgtg gtaccagcag 540
aagcccggac aggcccctag acttctgatc tacggcactt cttcacgcgc caccgggatc 600
agcgacaggt tcagcggctc cggctccggg accgacttca ccctgaccat tagccggctg 660
gagcctgaag atttcgccgt gtattactgc caacactacg gaaactcgcc gccaaagttc 720
acgttcggac ccggaaccaa gctggaaatc aag 753
<210> 170
<211> 739
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 170
gaagtccaac tggtggagtc cgggggaggg ctcgtgcagc ccggaggcag ccttcggctg 60
tcgtgcgccg cctccgggtt cacgttctca tcctacgcga tgtcgtgggt cagacaggca 120
ccaggaaagg gactggaatg ggtgtccgcc attagcggct ccggcggtag cacctactat 180
gccgactcag tgaagggaag gttcactatc tcccgcgaca acagcaagaa caccctgtac 240
ctccaaatga actctctgcg ggccgaggat accgcggtgt actattgcgc caagatgggt 300
tggtccagcg gatacttggg agccttcgac atttggggac agggcactac tgtgaccgtg 360
tcctccgggg gtggcggatc gggaggcggc ggctcgggtg gagggggttc cgaaatcgtg 420
ttgacccagt caccgggaac cctctcgctg tccccgggag aacgggctac actgtcatgt 480
agagcgtccc agtccgtggc ttcctcgttc ctggcctggt accagcagaa gccgggacag 540
gcaccccgcc tgctcatcta cggagccagc ggccgggcga ccggcatccc tgaccgcttc 600
tccggttccg gctcgggcac cgactttact ctgaccatta gcaggcttga gcccgaggat 660
tttgccgtgt actactgcca acactacggg gggagccctc gcctgacctt cggaggcgga 720
actaaggtcg atatcaaaa 739
<210> 171
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 171
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Ala Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg His Trp Gln Glu Trp Pro Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 172
<211> 123
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 172
Gln Val Asn Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Arg Thr Ser
20 25 30
Gly Met Cys Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Arg Ile Asp Trp Asp Glu Asp Lys Phe Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Asp Asn Gln Val
65 70 75 80
Val Leu Arg Met Thr Asn Met Asp Pro Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ser Gly Ala Gly Gly Thr Ser Ala Thr Ala Phe Asp Ile
100 105 110
Trp Gly Pro Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 173
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 173
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Thr Ile Ala Ala Val Tyr Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 174
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 174
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 175
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 175
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Pro Ser Gly Tyr Thr Val Thr Ser His
20 25 30
Tyr Ile His Trp Val Arg Arg Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asn Pro Ser Gly Gly Val Thr Ala Tyr Ser Gln Thr Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ser Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ser Gly Ser Gly Trp Tyr Phe Asp Phe Trp Gly Arg
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 176
<211> 123
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 176
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Ala Gly Ile Ala Ala Arg Leu Arg Gly Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 177
<211> 129
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 177
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Gly Tyr Gln Leu Leu Arg Trp Asp Val Gly Leu Leu
100 105 110
Arg Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser
<210> 178
<211> 125
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 178
Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Ser Phe Tyr Ala
50 55 60
Ile Ser Leu Lys Ser Arg Ile Ile Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Lys Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Ser Ser Pro Glu Gly Leu Phe Leu Tyr Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 179
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 179
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Glu Gly Ser Gly Ser Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 180
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 180
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Arg Tyr
20 25 30
Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr Tyr Ala Asp Ser Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Thr Arg Ala Gly Ser Glu Ala Ser Asp Ile Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 181
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 181
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 182
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 182
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 183
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 183
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Lys Ala Val Pro Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 184
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 184
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Arg Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser His Gln Gly Val Ala Tyr Tyr Asn Tyr Ala Met Asp Val Trp
100 105 110
Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 185
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 185
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Val Arg Asp Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 186
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 186
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ile Pro Gln Thr Gly Thr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 187
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 187
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Met Ser Arg Glu Asn Asp Lys Asn Ser Val Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Gly Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 188
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 188
Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ala Leu Val Gly Ala Thr Gly Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 189
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 189
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Trp Phe Gly Glu Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 190
<211> 126
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 190
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Gly Tyr Asp Ser Ser Gly Tyr Tyr Arg Asp Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 191
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 191
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Met Gly Trp Ser Ser Gly Tyr Leu Gly Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 192
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 192
Glu Thr Thr Leu Thr Gln Ser Pro Ala Phe Met Ser Ala Thr Pro Gly
1 5 10 15
Asp Lys Val Ile Ile Ser Cys Lys Ala Ser Gln Asp Ile Asp Asp Ala
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Ala Pro Leu Phe Ile Ile
35 40 45
Gln Ser Ala Thr Ser Pro Val Pro Gly Ile Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Phe Gly Thr Asp Phe Ser Leu Thr Ile Asn Asn Ile Glu Ser
65 70 75 80
Glu Asp Ala Ala Tyr Tyr Phe Cys Leu Gln His Asp Asn Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 193
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 193
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Tyr Asn Asn
20 25 30
Leu Ala Trp Phe Gln Leu Lys Pro Gly Ser Ala Pro Arg Ser Leu Met
35 40 45
Tyr Ala Ala Asn Lys Ser Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Ala Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Tyr Tyr Arg Phe Pro Tyr
85 90 95
Ser Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 194
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 194
Glu Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Glu
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 195
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 195
Ser Tyr Val Leu Thr Gln Ser Pro Ser Val Ser Ala Ala Pro Gly Tyr
1 5 10 15
Thr Ala Thr Ile Ser Cys Gly Gly Asn Asn Ile Gly Thr Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Leu Leu Val Ile Arg
35 40 45
Asp Asp Ser Val Arg Pro Ser Lys Ile Pro Gly Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Met Ala Thr Leu Thr Ile Ser Gly Val Gln Ala Gly
65 70 75 80
Asp Glu Ala Asp Phe Tyr Cys Gln Val Trp Asp Ser Asp Ser Glu His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 196
<211> 106
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 196
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Gly Leu Ser Lys Lys Tyr Val
20 25 30
Ser Trp Tyr Gln Gln Lys Ala Gly Gln Ser Pro Val Val Leu Ile Ser
35 40 45
Arg Asp Lys Glu Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Asn Ser Ala Asp Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Asp Thr Thr Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 197
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 197
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Ile Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 198
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 198
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Leu Tyr
35 40 45
Gly Lys Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
50 55 60
Arg Ser Gly Thr Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Arg Asp Ser Ser Gly Asp His
85 90 95
Leu Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 199
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 199
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Ile Arg Ile Thr Cys Gln Gly Asp Ser Leu Gly Asn Tyr Tyr Ala
20 25 30
Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Thr Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Ala Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly His His
85 90 95
Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 200
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 200
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ala
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Arg Leu Leu
35 40 45
Ile Ser Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Gly
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Ser Ser Phe
85 90 95
Asn Gly Ser Ser Leu Phe Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
100 105 110
Lys
<210> 201
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 201
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Asn Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Ile Tyr Tyr Cys Gln Gln Phe Gly Thr Ser Ser Gly
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 202
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 202
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Val Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 203
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 203
Glu Ile Val Leu Thr Gln Ser Pro Ser Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Thr
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ser Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 204
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 204
Asp Ile Val Met Thr Gln Thr Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Tyr
85 90 95
Ser Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 205
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 205
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Thr Gln Ser Ile Gly Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Gln Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Glu Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 206
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 206
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Asn Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Pro Pro
85 90 95
Arg Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 207
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 207
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 208
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 208
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ala Ser Asn
20 25 30
Tyr Leu Ala Trp Tyr Gln His Lys Pro Gly Gln Ala Pro Ser Leu Leu
35 40 45
Ile Ser Gly Ala Ser Ser Arg Ala Thr Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ala Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Asp Ser Ser Pro
85 90 95
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 209
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 209
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Leu Ser Ser Asn
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Gly Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Asn Trp Ala Thr Gly Thr Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Tyr Tyr Gly Thr Ser Pro
85 90 95
Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 210
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 210
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
100 105 110
<210> 211
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 211
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Thr Ser Ser Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Asn Ser Pro
85 90 95
Pro Lys Phe Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 212
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 212
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ala Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Gly Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly Ser Pro
85 90 95
Arg Leu Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
100 105
<210> 213
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 213
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly
35 40 45
Ser Ile Ser Ser Ser Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Gly Leu Glu Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Ala
65 70 75 80
Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr
85 90 95
Ser Lys Asn Gln Phe Ser Leu Arg Leu Ser Ser Val Thr Ala Ala Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg His Trp Gln Glu Trp Pro Asp Ala
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Thr Thr
145 150 155 160
Leu Thr Gln Ser Pro Ala Phe Met Ser Ala Thr Pro Gly Asp Lys Val
165 170 175
Ile Ile Ser Cys Lys Ala Ser Gln Asp Ile Asp Asp Ala Met Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Glu Ala Pro Leu Phe Ile Ile Gln Ser Ala
195 200 205
Thr Ser Pro Val Pro Gly Ile Pro Pro Arg Phe Ser Gly Ser Gly Phe
210 215 220
Gly Thr Asp Phe Ser Leu Thr Ile Asn Asn Ile Glu Ser Glu Asp Ala
225 230 235 240
Ala Tyr Tyr Phe Cys Leu Gln His Asp Asn Phe Pro Leu Thr Phe Gly
245 250 255
Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 214
<211> 489
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 214
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Asn Leu Arg Glu Ser Gly Pro Ala Leu
20 25 30
Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe
35 40 45
Ser Leu Arg Thr Ser Gly Met Cys Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Ala Arg Ile Asp Trp Asp Glu Asp Lys
65 70 75 80
Phe Tyr Ser Thr Ser Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr
85 90 95
Ser Asp Asn Gln Val Val Leu Arg Met Thr Asn Met Asp Pro Ala Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Arg Ser Gly Ala Gly Gly Thr Ser Ala
115 120 125
Thr Ala Phe Asp Ile Trp Gly Pro Gly Thr Met Val Thr Val Ser Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
165 170 175
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Tyr Asn Asn Leu
180 185 190
Ala Trp Phe Gln Leu Lys Pro Gly Ser Ala Pro Arg Ser Leu Met Tyr
195 200 205
Ala Ala Asn Lys Ser Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
210 215 220
Ala Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
225 230 235 240
Asp Phe Ala Thr Tyr Tyr Cys Gln His Tyr Tyr Arg Phe Pro Tyr Ser
245 250 255
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro
260 265 270
Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu
275 280 285
Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg
290 295 300
Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly
305 310 315 320
Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys
325 330 335
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
340 345 350
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
355 360 365
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
370 375 380
Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu
385 390 395 400
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
405 410 415
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
420 425 430
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
435 440 445
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
450 455 460
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
465 470 475 480
Leu His Met Gln Ala Leu Pro Pro Arg
485
<210> 215
<211> 490
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 215
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Thr Ile Ala Ala Val Tyr Ala Phe Asp
115 120 125
Ile Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr
145 150 155 160
Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Glu Glu Pro Ala Ser Ile
165 170 175
Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
180 185 190
Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
195 200 205
Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
225 230 235 240
Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Tyr
245 250 255
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 216
<211> 484
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 216
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Tyr Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Leu Arg Gly Ala Phe Asp Ile Trp
115 120 125
Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Ser
145 150 155 160
Pro Ser Val Ser Ala Ala Pro Gly Tyr Thr Ala Thr Ile Ser Cys Gly
165 170 175
Gly Asn Asn Ile Gly Thr Lys Ser Val His Trp Tyr Gln Gln Lys Pro
180 185 190
Gly Gln Ala Pro Leu Leu Val Ile Arg Asp Asp Ser Val Arg Pro Ser
195 200 205
Lys Ile Pro Gly Arg Phe Ser Gly Ser Asn Ser Gly Asn Met Ala Thr
210 215 220
Leu Thr Ile Ser Gly Val Gln Ala Gly Asp Glu Ala Asp Phe Tyr Cys
225 230 235 240
Gln Val Trp Asp Ser Asp Ser Glu His Val Val Phe Gly Gly Gly Thr
245 250 255
Lys Leu Thr Val Leu Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro
260 265 270
Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys
275 280 285
Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala
290 295 300
Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu
305 310 315 320
Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys
325 330 335
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
340 345 350
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
355 360 365
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
370 375 380
Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
385 390 395 400
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
405 410 415
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
420 425 430
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
435 440 445
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
450 455 460
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
465 470 475 480
Leu Pro Pro Arg
<210> 217
<211> 485
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 217
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Pro Ser Gly Tyr
35 40 45
Thr Val Thr Ser His Tyr Ile His Trp Val Arg Arg Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Met Ile Asn Pro Ser Gly Gly Val Thr Ala
65 70 75 80
Tyr Ser Gln Thr Leu Gln Gly Arg Val Thr Met Thr Ser Asp Thr Ser
85 90 95
Ser Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Glu Gly Ser Gly Ser Gly Trp Tyr Phe
115 120 125
Asp Phe Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Tyr Val Leu
145 150 155 160
Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln Thr Ala Ser Ile
165 170 175
Thr Cys Ser Gly Asp Gly Leu Ser Lys Lys Tyr Val Ser Trp Tyr Gln
180 185 190
Gln Lys Ala Gly Gln Ser Pro Val Val Leu Ile Ser Arg Asp Lys Glu
195 200 205
Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Asn Ser Ala Asp
210 215 220
Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met Asp Glu Ala Asp
225 230 235 240
Tyr Tyr Cys Gln Ala Trp Asp Asp Thr Thr Val Val Phe Gly Gly Gly
245 250 255
Thr Lys Leu Thr Val Leu Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 218
<211> 489
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 218
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly
35 40 45
Ser Ile Ser Ser Gly Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro
50 55 60
Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr
65 70 75 80
Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr
85 90 95
Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Ala Gly Ile Ala Ala Arg Leu Arg
115 120 125
Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Val Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly Asp
165 170 175
Arg Val Ile Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Trp Leu
180 185 190
Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr
195 200 205
Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
225 230 235 240
Asp Val Ala Thr Tyr Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Phe Thr
245 250 255
Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala Pro
260 265 270
Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu
275 280 285
Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg
290 295 300
Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly
305 310 315 320
Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys
325 330 335
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
340 345 350
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
355 360 365
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
370 375 380
Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu
385 390 395 400
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
405 410 415
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
420 425 430
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
435 440 445
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
450 455 460
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
465 470 475 480
Leu His Met Gln Ala Leu Pro Pro Arg
485
<210> 219
<211> 497
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 219
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly
35 40 45
Thr Phe Ser Ser Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Arg Gly Gly Tyr Gln Leu Leu Arg Trp
115 120 125
Asp Val Gly Leu Leu Arg Ser Ala Phe Asp Ile Trp Gly Gln Gly Thr
130 135 140
Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Gly Gly Gly Gly Ser Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser
165 170 175
Val Ala Pro Gly Gln Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile
180 185 190
Gly Ser Lys Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
195 200 205
Val Leu Val Leu Tyr Gly Lys Asn Asn Arg Pro Ser Gly Val Pro Asp
210 215 220
Arg Phe Ser Gly Ser Arg Ser Gly Thr Thr Ala Ser Leu Thr Ile Thr
225 230 235 240
Gly Ala Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Arg Asp
245 250 255
Ser Ser Gly Asp His Leu Arg Val Phe Gly Thr Gly Thr Lys Val Thr
260 265 270
Val Leu Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
275 280 285
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
290 295 300
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
305 310 315 320
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
325 330 335
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
340 345 350
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
355 360 365
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
370 375 380
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln
385 390 395 400
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
405 410 415
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
420 425 430
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
435 440 445
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
450 455 460
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
465 470 475 480
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
485 490 495
Arg
<210> 220
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 220
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp
35 40 45
Ser Val Ser Ser Asn Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro
50 55 60
Ser Arg Gly Leu Glu Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp
65 70 75 80
Tyr Ser Phe Tyr Ala Ile Ser Leu Lys Ser Arg Ile Ile Ile Asn Pro
85 90 95
Asp Thr Ser Lys Asn Gln Phe Ser Leu Gln Leu Lys Ser Val Thr Pro
100 105 110
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Ser Pro Glu Gly Leu
115 120 125
Phe Leu Tyr Trp Phe Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val
130 135 140
Ser Ser Gly Gly Asp Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly
165 170 175
Gln Thr Ile Arg Ile Thr Cys Gln Gly Asp Ser Leu Gly Asn Tyr Tyr
180 185 190
Ala Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile
195 200 205
Tyr Gly Thr Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Ala
210 215 220
Ser Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala
225 230 235 240
Glu Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly His
245 250 255
His Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 221
<211> 490
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 221
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Val Glu Gly Ser Gly Ser Leu Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln
145 150 155 160
Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser
165 170 175
Cys Arg Ala Ser Gln Ser Val Ser Ser Ala Tyr Leu Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Pro Pro Arg Leu Leu Ile Ser Gly Ala Ser Thr
195 200 205
Arg Ala Thr Gly Ile Pro Asp Arg Phe Gly Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val
225 230 235 240
Tyr Tyr Cys Gln His Tyr Gly Ser Ser Phe Asn Gly Ser Ser Leu Phe
245 250 255
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 222
<211> 485
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 222
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile
35 40 45
Thr Phe Ser Arg Tyr Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Phe Leu Gln Met Ser Ser Leu Arg Asp Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Val Thr Arg Ala Gly Ser Glu Ala Ser Asp Ile
115 120 125
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln
145 150 155 160
Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser
165 170 175
Cys Arg Ala Ser Gln Ser Val Ser Asn Ser Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Ser Arg
195 200 205
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Ile Tyr
225 230 235 240
Tyr Cys Gln Gln Phe Gly Thr Ser Ser Gly Leu Thr Phe Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 223
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 223
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Ile Tyr Tyr Cys Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr
115 120 125
Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Val Ser Leu Ser Pro Gly
165 170 175
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
180 185 190
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
225 230 235 240
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
245 250 255
Ser Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 224
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 224
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Thr Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ala Thr Tyr Lys Arg Glu Leu Arg Tyr
115 120 125
Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Glu Ile Val Leu Thr Gln Ser Pro Ser Thr Leu Ser Leu Ser Pro Gly
165 170 175
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Thr
180 185 190
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr Gly Ser Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg Arg Leu Glu
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr His Ser Ser Pro
245 250 255
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 225
<211> 483
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 225
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Val Gly Lys Ala Val Pro Asp Val Trp
115 120 125
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Thr
145 150 155 160
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
165 170 175
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln
195 200 205
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
225 230 235 240
Cys Gln Gln Ser Tyr Ser Thr Pro Tyr Ser Phe Gly Gln Gly Thr Arg
245 250 255
Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
325 330 335
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
340 345 350
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
355 360 365
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
370 375 380
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
385 390 395 400
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
405 410 415
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
420 425 430
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
435 440 445
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
450 455 460
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
465 470 475 480
Pro Pro Arg
<210> 226
<211> 490
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 226
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe
35 40 45
Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Arg Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala
65 70 75 80
Tyr Gly Asp Ser Val Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Val Phe Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Ser His Gln Gly Val Ala Tyr Tyr Asn Tyr
115 120 125
Ala Met Asp Val Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile
145 150 155 160
Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg
165 170 175
Ala Thr Leu Ser Cys Arg Ala Thr Gln Ser Ile Gly Ser Ser Phe Leu
180 185 190
Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
195 200 205
Gly Ala Ser Gln Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Arg
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu
225 230 235 240
Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Glu Ser Ser Pro Ser Trp
245 250 255
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 227
<211> 485
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 227
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Val Val Arg Asp Gly Met Asp Val Trp
115 120 125
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys
165 170 175
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln
180 185 190
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg
195 200 205
Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Asn Gly Ser Gly Thr Asp
210 215 220
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
225 230 235 240
Tyr Cys Gln Gln Tyr Gly Ser Pro Pro Arg Phe Thr Phe Gly Pro Gly
245 250 255
Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 228
<211> 486
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 228
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Ile Pro Gln Thr Gly Thr Phe Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln
145 150 155 160
Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser
165 170 175
Cys Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln
180 185 190
Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser
195 200 205
Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val
225 230 235 240
Tyr Tyr Cys Gln His Tyr Gly Ser Ser Pro Ser Trp Thr Phe Gly Gln
245 250 255
Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 229
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 229
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Met Ser Arg Glu Asn Asp
85 90 95
Lys Asn Ser Val Phe Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr
100 105 110
Gly Val Tyr Tyr Cys Ala Arg Ala Asn Tyr Lys Arg Glu Leu Arg Tyr
115 120 125
Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
165 170 175
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ala Ser Asn
180 185 190
Tyr Leu Ala Trp Tyr Gln His Lys Pro Gly Gln Ala Pro Ser Leu Leu
195 200 205
Ile Ser Gly Ala Ser Ser Arg Ala Thr Gly Val Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ala Ile Ser Arg Leu Glu
225 230 235 240
Pro Glu Asp Ser Ala Val Tyr Tyr Cys Gln His Tyr Asp Ser Ser Pro
245 250 255
Ser Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 230
<211> 488
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 230
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Thr Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Ala Leu Val Gly Ala Thr Gly Ala Phe
115 120 125
Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu
145 150 155 160
Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Ser Leu Ser Ser Asn Phe Leu Ala Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Ala Pro Gly Leu Leu Ile Tyr Gly Ala
195 200 205
Ser Asn Trp Ala Thr Gly Thr Pro Asp Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Ile Thr Arg Leu Glu Pro Glu Asp Phe
225 230 235 240
Ala Val Tyr Tyr Cys Gln Tyr Tyr Gly Thr Ser Pro Met Tyr Thr Phe
245 250 255
Gly Gln Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 231
<211> 488
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 231
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Val Leu Trp Phe Gly Glu Gly Phe Asp Pro Trp
115 120 125
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys
165 170 175
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
180 185 190
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Leu
195 200 205
Gly Ser Asn Arg Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp
225 230 235 240
Val Gly Val Tyr Tyr Cys Met Gln Ala Leu Gln Thr Pro Leu Thr Phe
245 250 255
Gly Gly Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 232
<211> 495
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 232
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Val Gly Tyr Asp Ser Ser Gly Tyr Tyr
115 120 125
Arg Asp Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr
130 135 140
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
195 200 205
Leu Leu Ile Tyr Gly Thr Ser Ser Arg Ala Thr Gly Ile Ser Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg
225 230 235 240
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Asn
245 250 255
Ser Pro Pro Lys Phe Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
260 265 270
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
275 280 285
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
290 295 300
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
305 310 315 320
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
325 330 335
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
340 345 350
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
355 360 365
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
370 375 380
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln
385 390 395 400
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
405 410 415
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
420 425 430
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
435 440 445
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
450 455 460
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
465 470 475 480
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 233
<211> 490
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 233
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Met Gly Trp Ser Ser Gly Tyr Leu Gly
115 120 125
Ala Phe Asp Ile Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile
145 150 155 160
Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly Glu Arg
165 170 175
Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ala Ser Ser Phe Leu
180 185 190
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
195 200 205
Gly Ala Ser Gly Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
225 230 235 240
Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Gly Ser Pro Arg Leu
245 250 255
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
340 345 350
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
355 360 365
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
370 375 380
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
385 390 395 400
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
405 410 415
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
420 425 430
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
435 440 445
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
450 455 460
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
465 470 475 480
Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 234
<211> 1461
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 234
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agcttcagga aagcggaccg ggcctggtca agccatccga aactctctcc 120
ctgacttgca ctgtgtctgg cggttccatc tcatcgtcgt actactactg gggctggatt 180
aggcagccgc ccggaaaggg actggagtgg atcggaagca tctactattc cggctcggcg 240
tactacaacc ctagcctcaa gtcgagagtg accatctccg tggatacctc caagaaccag 300
ttttccctgc gcctgagctc cgtgaccgcc gctgacaccg ccgtgtacta ctgtgctcgg 360
cattggcagg aatggcccga tgccttcgac atttggggcc agggcactat ggtcactgtg 420
tcatccgggg gtggaggcag cgggggagga gggtccgggg ggggaggttc agagacaacc 480
ttgacccagt cacccgcatt catgtccgcc actccgggag acaaggtcat catctcgtgc 540
aaagcgtccc aggatatcga cgatgccatg aattggtacc agcagaagcc tggcgaagcg 600
ccgctgttca ttatccaatc cgcaacctcg cccgtgcctg gaatcccacc gcggttcagc 660
ggcagcggtt tcggaaccga cttttccctg accattaaca acattgagtc cgaggacgcc 720
gcctactact tctgcctgca acacgacaac ttccctctca cgttcggcca gggaaccaag 780
ctggaaatca agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc 840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat 900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc 960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg 1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc 1080
tgttcatgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc 1140
cgcagcgcag atgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat 1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg 1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat 1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc 1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac 1440
atgcaggccc tgccgcctcg g 1461
<210> 235
<211> 1467
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 235
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtca atctgcgcga atccggcccc gccttggtca agcctaccca gaccctcact 120
ctgacctgta ctttctccgg cttctccctg cggacttccg ggatgtgcgt gtcctggatc 180
agacagcctc cgggaaaggc cctggagtgg ctcgctcgca ttgactggga tgaggacaag 240
ttctactcca cctcactcaa gaccaggctg accatcagca aagatacctc tgacaaccaa 300
gtggtgctcc gcatgaccaa catggaccca gccgacactg ccacttacta ctgcgcgagg 360
agcggagcgg gcggaacctc cgccaccgcc ttcgatattt ggggcccggg taccatggtc 420
accgtgtcaa gcggaggagg ggggtccggg ggcggcggtt ccgggggagg cggatcggac 480
attcagatga ctcagtcacc atcgtccctg agcgctagcg tgggcgacag agtgacaatc 540
acttgccggg catcccagga catctataac aaccttgcgt ggttccagct gaagcctggt 600
tccgcaccgc ggtcacttat gtacgccgcc aacaagagcc agtcgggagt gccgtcccgg 660
ttttccggtt cggcctcggg aactgacttc accctgacga tctccagcct gcaacccgag 720
gatttcgcca cctactactg ccagcactac taccgctttc cctactcgtt cggacaggga 780
accaagctgg aaatcaagac cactacccca gcaccgaggc cacccacccc ggctcctacc 840
atcgcctccc agcctctgtc cctgcgtccg gaggcatgta gacccgcagc tggtggggcc 900
gtgcataccc ggggtcttga cttcgcctgc gatatctaca tttgggcccc tctggctggt 960
acttgcgggg tcctgctgct ttcactcgtg atcactcttt actgtaagcg cggtcggaag 1020
aagctgctgt acatctttaa gcaacccttc atgaggcctg tgcagactac tcaagaggag 1080
gacggctgtt catgccggtt cccagaggag gaggaaggcg gctgcgaact gcgcgtgaaa 1140
ttcagccgca gcgcagatgc tccagcctac aagcaggggc agaaccagct ctacaacgaa 1200
ctcaatcttg gtcggagaga ggagtacgac gtgctggaca agcggagagg acgggaccca 1260
gaaatgggcg ggaagccgcg cagaaagaat ccccaagagg gcctgtacaa cgagctccaa 1320
aaggataaga tggcagaagc ctatagcgag attggtatga aaggggaacg cagaagaggc 1380
aaaggccacg acggactgta ccagggactc agcaccgcca ccaaggacac ctatgacgct 1440
cttcacatgc aggccctgcc gcctcgg 1467
<210> 236
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 236
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agcttgtcga atccgggggg ggactggtca agccgggcgg atcactgaga 120
ctgtcctgcg ccgcgagcgg cttcacgttc tcctcctact ccatgaactg ggtccgccaa 180
gcccccggga agggactgga atgggtgtcc tctatctcct cgtcgtcgtc ctacatctac 240
tacgccgact ccgtgaaggg aagattcacc atttcccgcg acaacgcaaa gaactcactg 300
tacttgcaaa tgaactcact ccgggccgaa gatactgctg tgtactattg cgccaagact 360
attgccgccg tctacgcttt cgacatctgg ggccagggaa ccaccgtgac tgtgtcgtcc 420
ggtggtggtg gctcgggcgg aggaggaagc ggcggcgggg ggtccgagat tgtgctgacc 480
cagtcgccac tgagcctccc tgtgaccccc gaggaacccg ccagcatcag ctgccggtcc 540
agccagtccc tgctccactc caacggatac aattacctcg attggtacct tcagaagcct 600
ggacaaagcc cgcagctgct catctacttg ggatcaaacc gcgcgtcagg agtgcctgac 660
cggttctccg gctcgggcag cggtaccgat ttcaccctga aaatctccag ggtggaggca 720
gaggacgtgg gagtgtatta ctgtatgcag gcgctgcaga ctccgtacac atttgggcag 780
ggcaccaagc tggagatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 237
<211> 1452
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 237
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtcc agctcgtgga gtccggcgga ggccttgtga agcctggagg ttcgctgaga 120
ctgtcctgcg ccgcctccgg cttcaccttc tccgactact acatgtcctg gatcagacag 180
gccccgggaa agggcctgga atgggtgtcc tacatctcgt catcgggcag cactatctac 240
tacgcggact cagtgaaggg gcggttcacc atttcccggg ataacgcgaa gaactcgctg 300
tatctgcaaa tgaactcact gagggccgag gacaccgccg tgtactactg cgcccgcgat 360
ctccgcgggg catttgacat ctggggacag ggaaccatgg tcacagtgtc cagcggaggg 420
ggaggatcgg gtggcggagg ttccgggggt ggaggctcct cctacgtgct gactcagagc 480
ccaagcgtca gcgctgcgcc cggttacacg gcaaccatct cctgtggcgg aaacaacatt 540
gggaccaagt ctgtgcactg gtatcagcag aagccgggcc aagctcccct gttggtgatc 600
cgcgatgact ccgtgcggcc tagcaaaatt ccgggacggt tctccggctc caacagcggc 660
aatatggcca ctctcaccat ctcgggagtg caggccggag atgaagccga cttctactgc 720
caagtctggg actcagactc cgagcatgtg gtgttcgggg gcggaaccaa gctgactgtg 780
ctcaccacta ccccagcacc gaggccaccc accccggctc ctaccatcgc ctcccagcct 840
ctgtccctgc gtccggaggc atgtagaccc gcagctggtg gggccgtgca tacccggggt 900
cttgacttcg cctgcgatat ctacatttgg gcccctctgg ctggtacttg cggggtcctg 960
ctgctttcac tcgtgatcac tctttactgt aagcgcggtc ggaagaagct gctgtacatc 1020
tttaagcaac ccttcatgag gcctgtgcag actactcaag aggaggacgg ctgttcatgc 1080
cggttcccag aggaggagga aggcggctgc gaactgcgcg tgaaattcag ccgcagcgca 1140
gatgctccag cctacaagca ggggcagaac cagctctaca acgaactcaa tcttggtcgg 1200
agagaggagt acgacgtgct ggacaagcgg agaggacggg acccagaaat gggcgggaag 1260
ccgcgcagaa agaatcccca agagggcctg tacaacgagc tccaaaagga taagatggca 1320
gaagcctata gcgagattgg tatgaaaggg gaacgcagaa gaggcaaagg ccacgacgga 1380
ctgtaccagg gactcagcac cgccaccaag gacacctatg acgctcttca catgcaggcc 1440
ctgccgcctc gg 1452
<210> 238
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 238
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtgca gagcggggcc gaagtcaaga agccgggagc ctccgtgaaa 120
gtgtcctgca agccttcggg atacaccgtg acctcccact acattcattg ggtccgccgc 180
gcccccggcc aaggactcga gtggatgggc atgatcaacc ctagcggcgg agtgaccgcg 240
tacagccaga cgctgcaggg acgcgtgact atgacctcgg atacctcctc ctccaccgtc 300
tatatggaac tgtccagcct gcggtccgag gataccgcca tgtactactg cgcccgggaa 360
ggatcaggct ccgggtggta tttcgacttc tggggaagag gcaccctcgt gactgtgtca 420
tctgggggag ggggttccgg tggtggcgga tcgggaggag gcggttcatc ctacgtgctg 480
acccagccac cctccgtgtc cgtgagcccc ggccagactg catcgattac atgtagcggc 540
gacggcctct ccaagaaata cgtgtcgtgg taccagcaga aggccggaca gagcccggtg 600
gtgctgatct caagagataa ggagcggcct agcggaatcc cggacaggtt ctcgggttcc 660
aactccgcgg acactgctac tctgaccatc tcggggaccc aggctatgga cgaagccgat 720
tactactgcc aagcctggga cgacactact gtcgtgtttg gagggggcac caagttgacc 780
gtccttacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag 840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg 900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc 960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac 1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca 1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc 1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt 1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg 1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg 1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac 1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag 1440
gccctgccgc ctcgg 1455
<210> 239
<211> 1467
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 239
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agcttcagga gagcggcccg ggactcgtga agccgtccca gaccctgtcc 120
ctgacttgca ccgtgtcggg aggaagcatc tcgagcggag gctactattg gtcgtggatt 180
cggcagcacc ctggaaaggg cctggaatgg atcggctaca tctactactc cggctcgacc 240
tactacaacc catcgctgaa gtccagagtg acaatctcag tggacacgtc caagaatcag 300
ttcagcctga agctctcttc cgtgactgcg gccgacaccg ccgtgtacta ctgcgcacgc 360
gctggaattg ccgcccggct gaggggtgcc ttcgacattt ggggacaggg caccatggtc 420
accgtgtcct ccggcggcgg aggttccggg ggtggaggct caggaggagg ggggtccgac 480
atcgtcatga ctcagtcgcc ctcaagcgtc agcgcgtccg tcggggacag agtgatcatc 540
acctgtcggg cgtcccaggg aattcgcaac tggctggcct ggtatcagca gaagcccgga 600
aaggccccca acctgttgat ctacgccgcc tcaaacctcc aatccggggt gccgagccgc 660
ttcagcggct ccggttcggg tgccgatttc actctgacca tctcctccct gcaacctgaa 720
gatgtggcta cctactactg ccaaaagtac aactccgcac cttttacttt cggaccgggg 780
accaaagtgg acattaagac cactacccca gcaccgaggc cacccacccc ggctcctacc 840
atcgcctccc agcctctgtc cctgcgtccg gaggcatgta gacccgcagc tggtggggcc 900
gtgcataccc ggggtcttga cttcgcctgc gatatctaca tttgggcccc tctggctggt 960
acttgcgggg tcctgctgct ttcactcgtg atcactcttt actgtaagcg cggtcggaag 1020
aagctgctgt acatctttaa gcaacccttc atgaggcctg tgcagactac tcaagaggag 1080
gacggctgtt catgccggtt cccagaggag gaggaaggcg gctgcgaact gcgcgtgaaa 1140
ttcagccgca gcgcagatgc tccagcctac aagcaggggc agaaccagct ctacaacgaa 1200
ctcaatcttg gtcggagaga ggagtacgac gtgctggaca agcggagagg acgggaccca 1260
gaaatgggcg ggaagccgcg cagaaagaat ccccaagagg gcctgtacaa cgagctccaa 1320
aaggataaga tggcagaagc ctatagcgag attggtatga aaggggaacg cagaagaggc 1380
aaaggccacg acggactgta ccagggactc agcaccgcca ccaaggacac ctatgacgct 1440
cttcacatgc aggccctgcc gcctcgg 1467
<210> 240
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 240
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtcca gtcgggcgcc gaggtcaaga agcccgggag ctctgtgaaa 120
gtgtcctgca aggcctccgg gggcaccttt agctcctacg ccatctcctg ggtccgccaa 180
gcaccgggtc aaggcctgga gtggatgggg ggaattatcc ctatcttcgg cactgccaac 240
tacgcccaga agttccaggg acgcgtgacc attaccgcgg acgaatccac ctccaccgct 300
tatatggagc tgtccagctt gcgctcggaa gataccgccg tgtactactg cgcccggagg 360
ggtggatacc agctgctgag atgggacgtg ggcctcctgc ggtcggcgtt cgacatctgg 420
ggccagggca ctatggtcac tgtgtccagc ggaggaggcg gatcgggagg cggcggatca 480
gggggaggcg gttccagcta cgtgcttact caaccccctt cggtgtccgt ggccccggga 540
cagaccgcca gaatcacttg cggaggaaac aacattgggt ccaagagcgt gcattggtac 600
cagcagaagc caggacaggc ccctgtgctg gtgctctacg ggaagaacaa tcggcccagc 660
ggagtgccgg acaggttctc gggttcacgc tccggtacaa ccgcttcact gactatcacc 720
ggggcccagg cagaggatga agcggactac tactgttcct cccgggattc atccggcgac 780
cacctccggg tgttcggaac cggaacgaag gtcaccgtgc tgaccactac cccagcaccg 840
aggccaccca ccccggctcc taccatcgcc tcccagcctc tgtccctgcg tccggaggca 900
tgtagacccg cagctggtgg ggccgtgcat acccggggtc ttgacttcgc ctgcgatatc 960
tacatttggg cccctctggc tggtacttgc ggggtcctgc tgctttcact cgtgatcact 1020
ctttactgta agcgcggtcg gaagaagctg ctgtacatct ttaagcaacc cttcatgagg 1080
cctgtgcaga ctactcaaga ggaggacggc tgttcatgcc ggttcccaga ggaggaggaa 1140
ggcggctgcg aactgcgcgt gaaattcagc cgcagcgcag atgctccagc ctacaagcag 1200
gggcagaacc agctctacaa cgaactcaat cttggtcgga gagaggagta cgacgtgctg 1260
gacaagcgga gaggacggga cccagaaatg ggcgggaagc cgcgcagaaa gaatccccaa 1320
gagggcctgt acaacgagct ccaaaaggat aagatggcag aagcctatag cgagattggt 1380
atgaaagggg aacgcagaag aggcaaaggc cacgacggac tgtaccaggg actcagcacc 1440
gccaccaagg acacctatga cgctcttcac atgcaggccc tgccgcctcg g 1491
<210> 241
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 241
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctccaaca gtcaggaccg gggctcgtga agccatccca gaccctgtcc 120
ctgacttgtg ccatctcggg agatagcgtg tcatcgaact ccgccgcctg gaactggatt 180
cggcagagcc cgtcccgcgg actggagtgg cttggaagga cctactaccg gtccaagtgg 240
tactctttct acgcgatctc gctgaagtcc cgcattatca ttaaccctga tacctccaag 300
aatcagttct ccctccaact gaaatccgtc acccccgagg acacagcagt gtattactgc 360
gcacggagca gccccgaagg actgttcctg tattggtttg acccctgggg ccaggggact 420
cttgtgaccg tgtcgagcgg cggagatggg tccggtggcg gtggttcggg gggcggcgga 480
tcatcatccg aactgaccca ggacccggct gtgtccgtgg cgctgggaca aaccatccgc 540
attacgtgcc agggagactc cctgggcaac tactacgcca cttggtacca gcagaagccg 600
ggccaagccc ctgtgttggt catctacggg accaacaaca gaccttccgg catccccgac 660
cggttcagcg cttcgtcctc cggcaacact gccagcctga ccatcactgg agcgcaggcc 720
gaagatgagg ccgactacta ctgcaacagc agagactcct cgggtcatca cctcttgttc 780
ggaactggaa ccaaggtcac cgtgctgacc actaccccag caccgaggcc acccaccccg 840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct 900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct 960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc 1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact 1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg 1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc 1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga 1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac 1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc 1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc 1440
tatgacgctc ttcacatgca ggccctgccg cctcgg 1476
<210> 242
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 242
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctcgtgga gtcaggaggc ggcctggtcc agccgggagg gtcccttaga 120
ctgtcatgcg ccgcaagcgg attcactttc tcctcctatg ccatgagctg ggtccgccaa 180
gcccccggaa agggactgga atgggtgtcc gccatctcgg ggtctggagg ctcaacttac 240
tacgctgact ccgtgaaggg acggttcacc attagccgcg acaactccaa gaacaccctc 300
tacctccaaa tgaactccct gcgggccgag gataccgccg tctactactg cgccaaagtg 360
gaaggttcag gatcgctgga ctactgggga cagggtactc tcgtgaccgt gtcatcgggc 420
ggaggaggtt ccggcggtgg cggctccggc ggcggagggt cggagatcgt gatgacccag 480
agccctggta ctctgagcct ttcgccggga gaaagggcca ccctgtcctg ccgcgcttcc 540
caatccgtgt cctccgcgta cttggcgtgg taccagcaga agccgggaca gccccctcgg 600
ctgctgatca gcggggccag cacccgggca accggaatcc cagacagatt cgggggttcc 660
ggcagcggca cagatttcac cctgactatt tcgaggttgg agcccgagga ctttgcggtg 720
tattactgtc agcactacgg gtcgtccttt aatggctcca gcctgttcac gttcggacag 780
gggacccgcc tggaaatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 243
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 243
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aactggtgga aaccggtggc ggcctggtgc agcctggagg atcattgagg 120
ctgtcatgcg cggccagcgg tattaccttc tcccggtacc ccatgtcctg ggtcagacag 180
gccccgggga aagggcttga atgggtgtcc gggatctcgg actccggtgt cagcacttac 240
tacgccgact ccgccaaggg acgcttcacc atttcccggg acaactcgaa gaacaccctg 300
ttcctccaaa tgagctccct ccgggacgag gatactgcag tgtactactg cgtgacccgc 360
gccgggtccg aggcgtctga catttgggga cagggcacta tggtcaccgt gtcgtccggc 420
ggagggggct cgggaggcgg tggcagcgga ggaggagggt ccgagatcgt gctgacccaa 480
tccccggcca ccctctcgct gagccctgga gaaagggcaa ccttgtcctg tcgcgcgagc 540
cagtccgtga gcaactccct ggcctggtac cagcagaagc ccggacaggc tccgagactt 600
ctgatctacg acgcttcgag ccgggccact ggaatccccg accgcttttc ggggtccggc 660
tcaggaaccg atttcaccct gacaatctca cggctggagc cagaggattt cgccatctat 720
tactgccagc agttcggtac ttcctccggc ctgactttcg gaggcggcac gaagctcgaa 780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag 840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg 900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc 960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac 1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca 1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc 1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt 1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg 1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg 1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac 1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag 1440
gccctgccgc ctcgg 1455
<210> 244
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 244
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctcgtgga atcgggtggc ggactggtgc agccgggggg ctcacttaga 120
ctgtcctgcg cggccagcgg attcactttc tcctcctacg ccatgtcctg ggtcagacag 180
gcccctggaa agggcctgga atgggtgtcc gcaatcagcg gcagcggcgg ctcgacctat 240
tacgcggatt cagtgaaggg cagattcacc atttcccggg acaacgccaa gaactccttg 300
taccttcaaa tgaactccct ccgcgcggaa gataccgcaa tctactactg cgctcgggcc 360
acttacaaga gggaactgcg ctactactac gggatggacg tctggggcca gggaaccatg 420
gtcaccgtgt ccagcggagg aggaggatcg ggaggaggcg gtagcggggg tggagggtcg 480
gagatcgtga tgacccagtc ccccggcact gtgtcgctgt cccccggcga acgggccacc 540
ctgtcatgtc gggccagcca gtcagtgtcg tcaagcttcc tcgcctggta ccagcagaaa 600
ccgggacaag ctccccgcct gctgatctac ggagccagca gccgggccac cggtattcct 660
gaccggttct ccggttcggg gtccgggacc gactttactc tgactatctc tcgcctcgag 720
ccagaggact ccgccgtgta ttactgccag cagtaccact cctccccgtc ctggacgttc 780
ggacagggca caaggctgga gattaagacc actaccccag caccgaggcc acccaccccg 840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct 900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct 960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc 1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact 1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg 1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc 1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga 1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac 1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc 1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc 1440
tatgacgctc ttcacatgca ggccctgccg cctcgg 1476
<210> 245
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 245
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaggtgc agcttgtgga aaccggtggc ggactggtgc agcccggagg aagcctcagg 120
ctgtcctgcg ccgcgtccgg cttcaccttc tcctcgtacg ccatgtcctg ggtccgccag 180
gcccccggaa agggcctgga atgggtgtcc gccatctctg gaagcggagg ttccacgtac 240
tacgcggaca gcgtcaaggg aaggttcaca atctcccgcg ataattcgaa gaacactctg 300
taccttcaaa tgaacaccct gaaggccgag gacactgctg tgtactactg cgcacgggcc 360
acctacaaga gagagctccg gtactactac ggaatggacg tctggggcca gggaactact 420
gtgaccgtgt cctcgggagg gggtggctcc ggggggggcg gctccggcgg aggcggttcc 480
gagattgtgc tgacccagtc accttcaact ctgtcgctgt ccccgggaga gagcgctact 540
ctgagctgcc gggccagcca gtccgtgtcc accaccttcc tcgcctggta tcagcagaag 600
ccggggcagg caccacggct cttgatctac gggtcaagca acagagcgac cggaattcct 660
gaccgcttct cggggagcgg ttcaggcacc gacttcaccc tgactatccg gcgcctggaa 720
cccgaagatt tcgccgtgta ttactgtcaa cagtaccact cctcgccgtc ctggaccttt 780
ggccaaggaa ccaaagtgga aatcaagacc actaccccag caccgaggcc acccaccccg 840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct 900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct 960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc 1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact 1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg 1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc 1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga 1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac 1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc 1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc 1440
tatgacgctc ttcacatgca ggccctgccg cctcgg 1476
<210> 246
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 246
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctcgtgga aactggaggt ggactcgtgc agcctggacg gtcgctgcgg 120
ctgagctgcg ctgcatccgg cttcaccttc gacgattatg ccatgcactg ggtcagacag 180
gcgccaggga agggacttga gtgggtgtcc ggtatcagct ggaatagcgg ctcaatcgga 240
tacgcggact ccgtgaaggg aaggttcacc atttcccgcg acaacgccaa gaactccctg 300
tacttgcaaa tgaacagcct ccgggatgag gacactgccg tgtactactg cgcccgcgtc 360
ggaaaagctg tgcccgacgt ctggggccag ggaaccactg tgaccgtgtc cagcggcggg 420
ggtggatcgg gcggtggagg gtccggtgga gggggctcag atattgtgat gacccagacc 480
ccctcgtccc tgtccgcctc ggtcggcgac cgcgtgacta tcacatgtag agcctcgcag 540
agcatctcca gctacctgaa ctggtatcag cagaagccgg ggaaggcccc gaagctcctg 600
atctacgcgg catcatcact gcaatcggga gtgccgagcc ggttttccgg gtccggctcc 660
ggcaccgact tcacgctgac catttcttcc ctgcaacccg aggacttcgc cacttactac 720
tgccagcagt cctactccac cccttactcc ttcggccaag gaaccaggct ggaaatcaag 780
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg 840
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt 900
gacttcgcct gcgatatcta catttgggcc cctctggctg gtacttgcgg ggtcctgctg 960
ctttcactcg tgatcactct ttactgtaag cgcggtcgga agaagctgct gtacatcttt 1020
aagcaaccct tcatgaggcc tgtgcagact actcaagagg aggacggctg ttcatgccgg 1080
ttcccagagg aggaggaagg cggctgcgaa ctgcgcgtga aattcagccg cagcgcagat 1140
gctccagcct acaagcaggg gcagaaccag ctctacaacg aactcaatct tggtcggaga 1200
gaggagtacg acgtgctgga caagcggaga ggacgggacc cagaaatggg cgggaagccg 1260
cgcagaaaga atccccaaga gggcctgtac aacgagctcc aaaaggataa gatggcagaa 1320
gcctatagcg agattggtat gaaaggggaa cgcagaagag gcaaaggcca cgacggactg 1380
taccagggac tcagcaccgc caccaaggac acctatgacg ctcttcacat gcaggccctg 1440
ccgcctcgg 1449
<210> 247
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 247
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctcgtgga gagcggggga ggattggtgc agcccggaag gtccctgcgg 120
ctctcctgca ctgcgtctgg cttcaccttc gacgactacg cgatgcactg ggtcagacag 180
cgcccgggaa agggcctgga atgggtcgcc tcaatcaact ggaagggaaa ctccctggcc 240
tatggcgaca gcgtgaaggg ccgcttcgcc atttcgcgcg acaacgccaa gaacaccgtg 300
tttctgcaaa tgaattccct gcggaccgag gataccgctg tgtactactg cgccagccac 360
cagggcgtgg catactataa ctacgccatg gacgtgtggg gaagagggac gctcgtcacc 420
gtgtcctccg ggggcggtgg atcgggtgga ggaggaagcg gtggcggggg cagcgaaatc 480
gtgctgactc agagcccggg aactctttca ctgtccccgg gagaacgggc cactctctcg 540
tgccgggcca cccagtccat cggctcctcc ttccttgcct ggtaccagca gaggccagga 600
caggcgcccc gcctgctgat ctacggtgct tcccaacgcg ccactggcat tcctgaccgg 660
ttcagcggca gagggtcggg aaccgatttc acactgacca tttcccgggt ggagcccgaa 720
gattcggcag tctactactg tcagcattac gagtcctccc cttcatggac cttcggtcaa 780
gggaccaaag tggagatcaa gaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 248
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 248
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaggtgc agttggtcga aagcgggggc gggcttgtgc agcctggcgg atcactgcgg 120
ctgtcctgcg cggcatcagg cttcacgttt tcttcctacg ccatgtcctg ggtgcgccag 180
gcccctggaa agggactgga atgggtgtcc gcgatttcgg ggtccggcgg gagcacctac 240
tacgccgatt ccgtgaaggg ccgcttcact atctcgcggg acaactccaa gaacaccctc 300
tacctccaaa tgaatagcct gcgggccgag gataccgccg tctactattg cgctaaggtc 360
gtgcgcgacg gaatggacgt gtggggacag ggtaccaccg tgacagtgtc ctcgggggga 420
ggcggtagcg gcggaggagg aagcggtggt ggaggttccg agattgtgct gactcaatca 480
cccgcgaccc tgagcctgtc ccccggcgaa agggccactc tgtcctgtcg ggccagccaa 540
tcagtctcct cctcgtacct ggcctggtac cagcagaagc caggacaggc tccgagactc 600
cttatctatg gcgcatcctc ccgcgccacc ggaatcccgg ataggttctc gggaaacgga 660
tcggggaccg acttcactct caccatctcc cggctggaac cggaggactt cgccgtgtac 720
tactgccagc agtacggcag cccgcctaga ttcactttcg gccccggcac caaagtggac 780
atcaagacca ctaccccagc accgaggcca cccaccccgg ctcctaccat cgcctcccag 840
cctctgtccc tgcgtccgga ggcatgtaga cccgcagctg gtggggccgt gcatacccgg 900
ggtcttgact tcgcctgcga tatctacatt tgggcccctc tggctggtac ttgcggggtc 960
ctgctgcttt cactcgtgat cactctttac tgtaagcgcg gtcggaagaa gctgctgtac 1020
atctttaagc aacccttcat gaggcctgtg cagactactc aagaggagga cggctgttca 1080
tgccggttcc cagaggagga ggaaggcggc tgcgaactgc gcgtgaaatt cagccgcagc 1140
gcagatgctc cagcctacaa gcaggggcag aaccagctct acaacgaact caatcttggt 1200
cggagagagg agtacgacgt gctggacaag cggagaggac gggacccaga aatgggcggg 1260
aagccgcgca gaaagaatcc ccaagagggc ctgtacaacg agctccaaaa ggataagatg 1320
gcagaagcct atagcgagat tggtatgaaa ggggaacgca gaagaggcaa aggccacgac 1380
ggactgtacc agggactcag caccgccacc aaggacacct atgacgctct tcacatgcag 1440
gccctgccgc ctcgg 1455
<210> 249
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 249
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctgctgga gtccggcggt ggattggtgc aaccgggggg atcgctcaga 120
ctgtcctgtg cggcgtcagg cttcaccttc tcgagctacg ccatgtcatg ggtcagacag 180
gcccctggaa agggtctgga atgggtgtcc gccatttccg ggagcggggg atctacatac 240
tacgccgata gcgtgaaggg ccgcttcacc atttcccggg acaactccaa gaacactctc 300
tatctgcaaa tgaactccct ccgcgctgag gacactgccg tgtactactg cgccaaaatc 360
cctcagaccg gcaccttcga ctactgggga caggggactc tggtcaccgt cagcagcggt 420
ggcggaggtt cggggggagg aggaagcggc ggcggagggt ccgagattgt gctgacccag 480
tcacccggca ctttgtccct gtcgcctgga gaaagggcca ccctttcctg ccgggcatcc 540
caatccgtgt cctcctcgta cctggcctgg taccagcaga ggcccggaca ggccccacgg 600
cttctgatct acggagcaag cagccgcgcg accggtatcc cggaccggtt ttcgggctcg 660
ggctcaggaa ctgacttcac cctcaccatc tcccgcctgg aacccgaaga tttcgctgtg 720
tattactgcc agcactacgg cagctccccg tcctggacgt tcggccaggg aactcggctg 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 250
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 250
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc aactggtgga aaccggtgga ggactcgtgc agcctggcgg cagcctccgg 120
ctgagctgcg ccgcttcggg attcaccttt tcctcctacg cgatgtcttg ggtcagacag 180
gcccccggaa aggggctgga atgggtgtca gccatctccg gctccggcgg atcaacgtac 240
tacgccgact ccgtgaaagg ccggttcacc atgtcgcgcg agaatgacaa gaactccgtg 300
ttcctgcaaa tgaactccct gagggtggag gacaccggag tgtactattg tgcgcgcgcc 360
aactacaaga gagagctgcg gtactactac ggaatggacg tctggggaca gggaactatg 420
gtgaccgtgt catccggtgg agggggaagc ggcggtggag gcagcggggg cgggggttca 480
gaaattgtca tgacccagtc cccgggaact ctttccctct cccccgggga atccgcgact 540
ttgtcctgcc gggccagcca gcgcgtggcc tcgaactacc tcgcatggta ccagcataag 600
ccaggccaag ccccttccct gctgatttcc ggggctagca gccgcgccac tggcgtgccg 660
gataggttct cgggaagcgg ctcgggtacc gatttcaccc tggcaatctc gcggctggaa 720
ccggaggatt cggccgtgta ctactgccag cactatgact catccccctc ctggacattc 780
ggacagggca ccaaggtcga gatcaagacc actaccccag caccgaggcc acccaccccg 840
gctcctacca tcgcctccca gcctctgtcc ctgcgtccgg aggcatgtag acccgcagct 900
ggtggggccg tgcatacccg gggtcttgac ttcgcctgcg atatctacat ttgggcccct 960
ctggctggta cttgcggggt cctgctgctt tcactcgtga tcactcttta ctgtaagcgc 1020
ggtcggaaga agctgctgta catctttaag caacccttca tgaggcctgt gcagactact 1080
caagaggagg acggctgttc atgccggttc ccagaggagg aggaaggcgg ctgcgaactg 1140
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc 1200
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga 1260
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac 1320
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc 1380
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc 1440
tatgacgctc ttcacatgca ggccctgccg cctcgg 1476
<210> 251
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 251
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctgctcga aaccggtgga gggctggtgc agccaggggg ctccctgagg 120
ctttcatgcg ccgctagcgg attctccttc tcctcttacg ccatgtcgtg ggtccgccaa 180
gcccctggaa aaggcctgga atgggtgtcc gcgatttccg ggagcggagg ttcgacctat 240
tacgccgact ccgtgaaggg ccgctttacc atctcccggg ataactccaa gaacactctg 300
tacctccaaa tgaactcgct gagagccgag gacaccgccg tgtattactg cgcgaaggcg 360
ctggtcggcg cgactggggc attcgacatc tggggacagg gaactcttgt gaccgtgtcg 420
agcggaggcg gcggctccgg cggaggaggg agcgggggcg gtggttccga aatcgtgttg 480
actcagtccc cgggaaccct gagcttgtca cccggggagc gggccactct ctcctgtcgc 540
gcctcccaat cgctctcatc caatttcctg gcctggtacc agcagaagcc cggacaggcc 600
ccgggcctgc tcatctacgg cgcttcaaac tgggcaacgg gaacccctga tcggttcagc 660
ggaagcggat cgggtactga ctttaccctg accatcacca gactggaacc ggaggacttc 720
gccgtgtact actgccagta ctacggcacc tcccccatgt acacattcgg acagggtacc 780
aaggtcgaga ttaagaccac taccccagca ccgaggccac ccaccccggc tcctaccatc 840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg 900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact 960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag 1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac 1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc 1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc 1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa 1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag 1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa 1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt 1440
cacatgcagg ccctgccgcc tcgg 1464
<210> 252
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 252
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctgcttga gagcggtgga ggtctggtgc agcccggggg atcactgcgc 120
ctgtcctgtg ccgcgtccgg tttcactttc tcctcgtacg ccatgtcgtg ggtcagacag 180
gcaccgggaa agggactgga atgggtgtca gccatttcgg gttcgggggg cagcacctac 240
tacgctgact ccgtgaaggg ccggttcacc atttcccgcg acaactccaa gaacaccttg 300
tacctccaaa tgaactccct gcgggccgaa gataccgccg tgtattactg cgtgctgtgg 360
ttcggagagg gattcgaccc gtggggacaa ggaacactcg tgactgtgtc atccggcgga 420
ggcggcagcg gtggcggcgg ttccggcggc ggcggatctg acatcgtgtt gacccagtcc 480
cctctgagcc tgccggtcac tcctggcgaa ccagccagca tctcctgccg gtcgagccag 540
tccctcctgc actccaatgg gtacaactac ctcgattggt atctgcaaaa gccgggccag 600
agcccccagc tgctgatcta ccttgggtca aaccgcgctt ccggggtgcc tgatagattc 660
tccgggtccg ggagcggaac cgactttacc ctgaaaatct cgagggtgga ggccgaggac 720
gtcggagtgt actactgcat gcaggcgctc cagactcccc tgaccttcgg aggaggaacg 780
aaggtcgaca tcaagaccac taccccagca ccgaggccac ccaccccggc tcctaccatc 840
gcctcccagc ctctgtccct gcgtccggag gcatgtagac ccgcagctgg tggggccgtg 900
catacccggg gtcttgactt cgcctgcgat atctacattt gggcccctct ggctggtact 960
tgcggggtcc tgctgctttc actcgtgatc actctttact gtaagcgcgg tcggaagaag 1020
ctgctgtaca tctttaagca acccttcatg aggcctgtgc agactactca agaggaggac 1080
ggctgttcat gccggttccc agaggaggag gaaggcggct gcgaactgcg cgtgaaattc 1140
agccgcagcg cagatgctcc agcctacaag caggggcaga accagctcta caacgaactc 1200
aatcttggtc ggagagagga gtacgacgtg ctggacaagc ggagaggacg ggacccagaa 1260
atgggcggga agccgcgcag aaagaatccc caagagggcc tgtacaacga gctccaaaag 1320
gataagatgg cagaagccta tagcgagatt ggtatgaaag gggaacgcag aagaggcaaa 1380
ggccacgacg gactgtacca gggactcagc accgccacca aggacaccta tgacgctctt 1440
cacatgcagg ccctgccgcc tcgg 1464
<210> 253
<211> 1485
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 253
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctcgtgga gtcaggcgga ggactggtgc agcccggggg ctccctgaga 120
ctttcctgcg cggcatcggg ttttaccttc tcctcctatg ctatgtcctg ggtgcgccag 180
gccccgggaa agggactgga atgggtgtcc gcaatcagcg gtagcggggg ctcaacatac 240
tacgccgact ccgtcaaggg tcgcttcact atttcccggg acaactccaa gaataccctg 300
tacctccaaa tgaacagcct cagggccgag gatactgccg tgtactactg cgccaaagtc 360
ggatacgata gctccggtta ctaccgggac tactacggaa tggacgtgtg gggacagggc 420
accaccgtga ccgtgtcaag cggcggaggc ggttcaggag ggggaggctc cggcggtgga 480
gggtccgaaa tcgtcctgac tcagtcgcct ggcactctgt cgttgtcccc gggggagcgc 540
gctaccctgt cgtgtcgggc gtcgcagtcc gtgtcgagct cctacctcgc gtggtaccag 600
cagaagcccg gacaggcccc tagacttctg atctacggca cttcttcacg cgccaccggg 660
atcagcgaca ggttcagcgg ctccggctcc gggaccgact tcaccctgac cattagccgg 720
ctggagcctg aagatttcgc cgtgtattac tgccaacact acggaaactc gccgccaaag 780
ttcacgttcg gacccggaac caagctggaa atcaagacca ctaccccagc accgaggcca 840
cccaccccgg ctcctaccat cgcctcccag cctctgtccc tgcgtccgga ggcatgtaga 900
cccgcagctg gtggggccgt gcatacccgg ggtcttgact tcgcctgcga tatctacatt 960
tgggcccctc tggctggtac ttgcggggtc ctgctgcttt cactcgtgat cactctttac 1020
tgtaagcgcg gtcggaagaa gctgctgtac atctttaagc aacccttcat gaggcctgtg 1080
cagactactc aagaggagga cggctgttca tgccggttcc cagaggagga ggaaggcggc 1140
tgcgaactgc gcgtgaaatt cagccgcagc gcagatgctc cagcctacaa gcaggggcag 1200
aaccagctct acaacgaact caatcttggt cggagagagg agtacgacgt gctggacaag 1260
cggagaggac gggacccaga aatgggcggg aagccgcgca gaaagaatcc ccaagagggc 1320
ctgtacaacg agctccaaaa ggataagatg gcagaagcct atagcgagat tggtatgaaa 1380
ggggaacgca gaagaggcaa aggccacgac ggactgtacc agggactcag caccgccacc 1440
aaggacacct atgacgctct tcacatgcag gccctgccgc ctcgg 1485
<210> 254
<211> 1470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 254
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtcc aactggtgga gtccggggga gggctcgtgc agcccggagg cagccttcgg 120
ctgtcgtgcg ccgcctccgg gttcacgttc tcatcctacg cgatgtcgtg ggtcagacag 180
gcaccaggaa agggactgga atgggtgtcc gccattagcg gctccggcgg tagcacctac 240
tatgccgact cagtgaaggg aaggttcact atctcccgcg acaacagcaa gaacaccctg 300
tacctccaaa tgaactctct gcgggccgag gataccgcgg tgtactattg cgccaagatg 360
ggttggtcca gcggatactt gggagccttc gacatttggg gacagggcac tactgtgacc 420
gtgtcctccg ggggtggcgg atcgggaggc ggcggctcgg gtggaggggg ttccgaaatc 480
gtgttgaccc agtcaccggg aaccctctcg ctgtccccgg gagaacgggc tacactgtca 540
tgtagagcgt cccagtccgt ggcttcctcg ttcctggcct ggtaccagca gaagccggga 600
caggcacccc gcctgctcat ctacggagcc agcggccggg cgaccggcat ccctgaccgc 660
ttctccggtt ccggctcggg caccgacttt actctgacca ttagcaggct tgagcccgag 720
gattttgccg tgtactactg ccaacactac ggggggagcc ctcgcctgac cttcggaggc 780
ggaactaagg tcgatatcaa aaccactacc ccagcaccga ggccacccac cccggctcct 840
accatcgcct cccagcctct gtccctgcgt ccggaggcat gtagacccgc agctggtggg 900
gccgtgcata cccggggtct tgacttcgcc tgcgatatct acatttgggc ccctctggct 960
ggtacttgcg gggtcctgct gctttcactc gtgatcactc tttactgtaa gcgcggtcgg 1020
aagaagctgc tgtacatctt taagcaaccc ttcatgaggc ctgtgcagac tactcaagag 1080
gaggacggct gttcatgccg gttcccagag gaggaggaag gcggctgcga actgcgcgtg 1140
aaattcagcc gcagcgcaga tgctccagcc tacaagcagg ggcagaacca gctctacaac 1200
gaactcaatc ttggtcggag agaggagtac gacgtgctgg acaagcggag aggacgggac 1260
ccagaaatgg gcgggaagcc gcgcagaaag aatccccaag agggcctgta caacgagctc 1320
caaaaggata agatggcaga agcctatagc gagattggta tgaaagggga acgcagaaga 1380
ggcaaaggcc acgacggact gtaccaggga ctcagcaccg ccaccaagga cacctatgac 1440
gctcttcaca tgcaggccct gccgcctcgg 1470
<210> 255
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 255
Gln Ile Gln Leu Val Gln Ser Gly Pro Asp Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Phe
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Phe Lys Trp Met
35 40 45
Ala Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Thr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 256
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 256
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe
50 55 60
Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 257
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 257
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asp Glu Asp Thr Ala Ser Tyr Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Leu Asp Phe Trp Gly Gln Gly Thr Ala
100 105 110
Leu Thr Val Ser Ser
115
<210> 258
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 258
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Cys Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 259
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 259
Asp Val Val Met Thr Gln Ser His Arg Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Phe Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Asp Ile Lys
100 105
<210> 260
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 260
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Met Ser Leu Gly
1 5 10 15
Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Ser Val Ile
20 25 30
Gly Ala His Leu Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Glu Asp Asp Val Ala Ile Tyr Ser Cys Leu Gln Ser Arg
85 90 95
Ile Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 261
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 261
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Met Ser Leu Gly
1 5 10 15
Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Thr Ile Leu
20 25 30
Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys Leu Gln Ser Arg
85 90 95
Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 262
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 262
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Met Ser Leu Gly
1 5 10 15
Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Thr Ile Leu
20 25 30
Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys Leu Gln Ser Arg
85 90 95
Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 263
<211> 244
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 263
Gln Ile Gln Leu Val Gln Ser Gly Pro Asp Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Phe
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Phe Lys Trp Met
35 40 45
Ala Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Thr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser
130 135 140
His Arg Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys
145 150 155 160
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ser Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ser Pro Lys Leu Leu Ile Phe Ser Ala Ser Tyr Arg Tyr
180 185 190
Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Ala Asp Phe
195 200 205
Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr
210 215 220
Cys Gln Gln His Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys
225 230 235 240
Leu Asp Ile Lys
<210> 264
<211> 249
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 264
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe
50 55 60
Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys
130 135 140
Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr
145 150 155 160
Phe Thr Asp Tyr Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly
165 170 175
Leu Lys Trp Met Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr
180 185 190
Ala Tyr Asp Phe Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala
195 200 205
Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala
210 215 220
Thr Tyr Phe Cys Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Ser Val Thr Val Ser Ser
245
<210> 265
<211> 243
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 265
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asp Glu Asp Thr Ala Ser Tyr Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Leu Asp Phe Trp Gly Gln Gly Thr Ala
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 266
<211> 243
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 266
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Cys Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 267
<211> 467
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 267
Gln Ile Gln Leu Val Gln Ser Gly Pro Asp Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Phe
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Phe Lys Trp Met
35 40 45
Ala Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Thr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser
130 135 140
His Arg Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys
145 150 155 160
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ser Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ser Pro Lys Leu Leu Ile Phe Ser Ala Ser Tyr Arg Tyr
180 185 190
Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Ala Asp Phe
195 200 205
Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr
210 215 220
Cys Gln Gln His Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys
225 230 235 240
Leu Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
245 250 255
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
260 265 270
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
275 280 285
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
290 295 300
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
305 310 315 320
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
325 330 335
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
340 345 350
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
355 360 365
Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
370 375 380
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
385 390 395 400
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
405 410 415
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
420 425 430
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
435 440 445
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
450 455 460
Pro Pro Arg
465
<210> 268
<211> 472
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 268
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe
50 55 60
Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys
130 135 140
Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr
145 150 155 160
Phe Thr Asp Tyr Ser Ile Asn Trp Val Lys Arg Ala Pro Gly Lys Gly
165 170 175
Leu Lys Trp Met Gly Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr
180 185 190
Ala Tyr Asp Phe Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala
195 200 205
Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Tyr Glu Asp Thr Ala
210 215 220
Thr Tyr Phe Cys Ala Leu Asp Tyr Ser Tyr Ala Met Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Ser Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg
245 250 255
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
260 265 270
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
275 280 285
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
290 295 300
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
305 310 315 320
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
325 330 335
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
340 345 350
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
355 360 365
Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
370 375 380
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
385 390 395 400
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
405 410 415
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
420 425 430
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
435 440 445
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
450 455 460
His Met Gln Ala Leu Pro Pro Arg
465 470
<210> 269
<211> 466
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 269
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Val Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asp Glu Asp Thr Ala Ser Tyr Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Leu Asp Phe Trp Gly Gln Gly Thr Ala
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
245 250 255
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
260 265 270
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
275 280 285
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
290 295 300
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
305 310 315 320
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
325 330 335
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
340 345 350
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys
355 360 365
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
370 375 380
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
385 390 395 400
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
405 410 415
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
420 425 430
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
435 440 445
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
450 455 460
Pro Arg
465
<210> 270
<211> 466
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 270
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Val Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ser Asn Asp Tyr Leu Tyr Ser Cys Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala
130 135 140
Met Ser Leu Gly Lys Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
145 150 155 160
Val Thr Ile Leu Gly Ser His Leu Ile Tyr Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Gln Pro Pro Thr Leu Leu Ile Gln Leu Ala Ser Asn Val Gln Thr
180 185 190
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asp Pro Val Glu Glu Asp Asp Val Ala Val Tyr Tyr Cys
210 215 220
Leu Gln Ser Arg Thr Ile Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
245 250 255
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
260 265 270
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
275 280 285
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
290 295 300
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
305 310 315 320
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
325 330 335
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
340 345 350
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys
355 360 365
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
370 375 380
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
385 390 395 400
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
405 410 415
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
420 425 430
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
435 440 445
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
450 455 460
Pro Arg
465
<210> 271
<211> 249
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 271
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Thr Tyr Arg Gly His Ser Asp Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Ile Tyr Asn Gly Tyr Asp Val Leu Asp Asn Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
130 135 140
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
145 150 155 160
Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn Trp
165 170 175
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Tyr Thr
180 185 190
Ser Asn Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
195 200 205
Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe
210 215 220
Ala Thr Tyr Tyr Cys Gln Gln Tyr Arg Lys Leu Pro Trp Thr Phe Gly
225 230 235 240
Gln Gly Thr Lys Leu Glu Ile Lys Arg
245
<210> 272
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 272
caggtgcagc tggtccagag cggcgccgaa gtgaagaagc ccggcagctc cgtgaaagtg 60
agctgcaagg ccagcggcgg caccttcagc aactactgga tgcactgggt gaggcaggcc 120
cccggacagg gcctggagtg gatgggcgcc acctacaggg gccacagcga cacctactac 180
aaccagaagt tcaagggccg ggtgaccatc accgccgaca agagcaccag caccgcctac 240
atggaactga gcagcctcag gagcgaggac accgctgtgt attactgcgc caggggcgcc 300
atctacaacg gctacgacgt gctggacaac tggggccagg gcacactagt gaccgtgtcc 360
agcggtggag gaggtagcgg aggaggcggg agcggtggag gtggctctgg aggtggcgga 420
agcgacatcc agatgaccca gagccctagc tcactgagcg ccagcgtggg cgacagggtg 480
accattacct gctccgccag ccaggacatc agcaactacc tgaactggta ccagcagaag 540
cccggcaagg cccccaagct gctgatctac tacacctcca acctgcactc cggcgtgccc 600
agcaggttca gcggaagcgg cagcggcacc gatttcaccc tgaccatctc cagcctgcag 660
cccgaggact tcgccaccta ctactgccag cagtacagga agctcccctg gactttcggc 720
cagggcacca aactggagat caagcgt 747
<210> 273
<211> 249
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 273
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Asn Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Arg Lys Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly
100 105 110
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
130 135 140
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
145 150 155 160
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
165 170 175
Gly Ala Thr Tyr Arg Gly His Ser Asp Thr Tyr Tyr Asn Gln Lys Phe
180 185 190
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
195 200 205
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
210 215 220
Ala Arg Gly Ala Ile Tyr Asn Gly Tyr Asp Val Leu Asp Asn Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 274
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 274
gacatccaga tgacccagag ccctagctca ctgagcgcca gcgtgggcga cagggtgacc 60
attacctgct ccgccagcca ggacatcagc aactacctga actggtacca gcagaagccc 120
ggcaaggccc ccaagctgct gatctactac acctccaacc tgcactccgg cgtgcccagc 180
aggttcagcg gaagcggcag cggcaccgat ttcaccctga ccatctccag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tacaggaagc tcccctggac tttcggccag 300
ggcaccaaac tggagatcaa gcgtggtgga ggaggtagcg gaggaggcgg gagcggtgga 360
ggtggctctg gaggtggcgg aagccaggtg cagctggtcc agagcggcgc cgaagtgaag 420
aagcccggca gctccgtgaa agtgagctgc aaggccagcg gcggcacctt cagcaactac 480
tggatgcact gggtgaggca ggcccccgga cagggcctgg agtggatggg cgccacctac 540
aggggccaca gcgacaccta ctacaaccag aagttcaagg gccgggtgac catcaccgcc 600
gacaagagca ccagcaccgc ctacatggaa ctgagcagcc tcaggagcga ggacaccgct 660
gtgtattact gcgccagggg cgccatctac aacggctacg acgtgctgga caactggggc 720
cagggcacac tagtgaccgt gtccagc 747
<210> 275
<211> 132
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 275
Asp Val Pro Asp Tyr Ala Ser Leu Gly Gly Pro Ser Ser Pro Lys Lys
1 5 10 15
Lys Arg Lys Val Ser Arg Gly Val Gln Val Glu Thr Ile Ser Pro Gly
20 25 30
Asp Gly Arg Thr Phe Pro Lys Arg Gly Gln Thr Cys Val Val His Tyr
35 40 45
Thr Gly Met Leu Glu Asp Gly Lys Lys Phe Asp Ser Ser Arg Asp Arg
50 55 60
Asn Lys Pro Phe Lys Phe Met Leu Gly Lys Gln Glu Val Ile Arg Gly
65 70 75 80
Trp Glu Glu Gly Val Ala Gln Met Ser Val Gly Gln Arg Ala Lys Leu
85 90 95
Thr Ile Ser Pro Asp Tyr Ala Tyr Gly Ala Thr Gly His Pro Gly Ile
100 105 110
Ile Pro Pro His Ala Thr Leu Val Phe Asp Val Glu Leu Leu Lys Leu
115 120 125
Glu Thr Ser Tyr
130
<210> 276
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 276
Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe Pro Lys
1 5 10 15
Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu Asp Gly
20 25 30
Lys Lys Phe Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys Phe Met
35 40 45
Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val Ala Gln
50 55 60
Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp Tyr Ala
65 70 75 80
Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala Thr Leu
85 90 95
Val Phe Asp Val Glu Leu Leu Lys Leu Glu Thr Ser
100 105
<210> 277
<211> 93
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 277
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys
85 90
<210> 278
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 278
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 279
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 279
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 280
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 280
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 281
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (78)..(78)
<223> Любая аминокислота
<400> 281
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Xaa Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Xaa Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 282
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 282
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 283
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 283
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 284
<211> 1132
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 284
Met Pro Arg Ala Pro Arg Cys Arg Ala Val Arg Ser Leu Leu Arg Ser
1 5 10 15
His Tyr Arg Glu Val Leu Pro Leu Ala Thr Phe Val Arg Arg Leu Gly
20 25 30
Pro Gln Gly Trp Arg Leu Val Gln Arg Gly Asp Pro Ala Ala Phe Arg
35 40 45
Ala Leu Val Ala Gln Cys Leu Val Cys Val Pro Trp Asp Ala Arg Pro
50 55 60
Pro Pro Ala Ala Pro Ser Phe Arg Gln Val Ser Cys Leu Lys Glu Leu
65 70 75 80
Val Ala Arg Val Leu Gln Arg Leu Cys Glu Arg Gly Ala Lys Asn Val
85 90 95
Leu Ala Phe Gly Phe Ala Leu Leu Asp Gly Ala Arg Gly Gly Pro Pro
100 105 110
Glu Ala Phe Thr Thr Ser Val Arg Ser Tyr Leu Pro Asn Thr Val Thr
115 120 125
Asp Ala Leu Arg Gly Ser Gly Ala Trp Gly Leu Leu Leu Arg Arg Val
130 135 140
Gly Asp Asp Val Leu Val His Leu Leu Ala Arg Cys Ala Leu Phe Val
145 150 155 160
Leu Val Ala Pro Ser Cys Ala Tyr Gln Val Cys Gly Pro Pro Leu Tyr
165 170 175
Gln Leu Gly Ala Ala Thr Gln Ala Arg Pro Pro Pro His Ala Ser Gly
180 185 190
Pro Arg Arg Arg Leu Gly Cys Glu Arg Ala Trp Asn His Ser Val Arg
195 200 205
Glu Ala Gly Val Pro Leu Gly Leu Pro Ala Pro Gly Ala Arg Arg Arg
210 215 220
Gly Gly Ser Ala Ser Arg Ser Leu Pro Leu Pro Lys Arg Pro Arg Arg
225 230 235 240
Gly Ala Ala Pro Glu Pro Glu Arg Thr Pro Val Gly Gln Gly Ser Trp
245 250 255
Ala His Pro Gly Arg Thr Arg Gly Pro Ser Asp Arg Gly Phe Cys Val
260 265 270
Val Ser Pro Ala Arg Pro Ala Glu Glu Ala Thr Ser Leu Glu Gly Ala
275 280 285
Leu Ser Gly Thr Arg His Ser His Pro Ser Val Gly Arg Gln His His
290 295 300
Ala Gly Pro Pro Ser Thr Ser Arg Pro Pro Arg Pro Trp Asp Thr Pro
305 310 315 320
Cys Pro Pro Val Tyr Ala Glu Thr Lys His Phe Leu Tyr Ser Ser Gly
325 330 335
Asp Lys Glu Gln Leu Arg Pro Ser Phe Leu Leu Ser Ser Leu Arg Pro
340 345 350
Ser Leu Thr Gly Ala Arg Arg Leu Val Glu Thr Ile Phe Leu Gly Ser
355 360 365
Arg Pro Trp Met Pro Gly Thr Pro Arg Arg Leu Pro Arg Leu Pro Gln
370 375 380
Arg Tyr Trp Gln Met Arg Pro Leu Phe Leu Glu Leu Leu Gly Asn His
385 390 395 400
Ala Gln Cys Pro Tyr Gly Val Leu Leu Lys Thr His Cys Pro Leu Arg
405 410 415
Ala Ala Val Thr Pro Ala Ala Gly Val Cys Ala Arg Glu Lys Pro Gln
420 425 430
Gly Ser Val Ala Ala Pro Glu Glu Glu Asp Thr Asp Pro Arg Arg Leu
435 440 445
Val Gln Leu Leu Arg Gln His Ser Ser Pro Trp Gln Val Tyr Gly Phe
450 455 460
Val Arg Ala Cys Leu Arg Arg Leu Val Pro Pro Gly Leu Trp Gly Ser
465 470 475 480
Arg His Asn Glu Arg Arg Phe Leu Arg Asn Thr Lys Lys Phe Ile Ser
485 490 495
Leu Gly Lys His Ala Lys Leu Ser Leu Gln Glu Leu Thr Trp Lys Met
500 505 510
Ser Val Arg Gly Cys Ala Trp Leu Arg Arg Ser Pro Gly Val Gly Cys
515 520 525
Val Pro Ala Ala Glu His Arg Leu Arg Glu Glu Ile Leu Ala Lys Phe
530 535 540
Leu His Trp Leu Met Ser Val Tyr Val Val Glu Leu Leu Arg Ser Phe
545 550 555 560
Phe Tyr Val Thr Glu Thr Thr Phe Gln Lys Asn Arg Leu Phe Phe Tyr
565 570 575
Arg Lys Ser Val Trp Ser Lys Leu Gln Ser Ile Gly Ile Arg Gln His
580 585 590
Leu Lys Arg Val Gln Leu Arg Glu Leu Ser Glu Ala Glu Val Arg Gln
595 600 605
His Arg Glu Ala Arg Pro Ala Leu Leu Thr Ser Arg Leu Arg Phe Ile
610 615 620
Pro Lys Pro Asp Gly Leu Arg Pro Ile Val Asn Met Asp Tyr Val Val
625 630 635 640
Gly Ala Arg Thr Phe Arg Arg Glu Lys Arg Ala Glu Arg Leu Thr Ser
645 650 655
Arg Val Lys Ala Leu Phe Ser Val Leu Asn Tyr Glu Arg Ala Arg Arg
660 665 670
Pro Gly Leu Leu Gly Ala Ser Val Leu Gly Leu Asp Asp Ile His Arg
675 680 685
Ala Trp Arg Thr Phe Val Leu Arg Val Arg Ala Gln Asp Pro Pro Pro
690 695 700
Glu Leu Tyr Phe Val Lys Val Asp Val Thr Gly Ala Tyr Asp Thr Ile
705 710 715 720
Pro Gln Asp Arg Leu Thr Glu Val Ile Ala Ser Ile Ile Lys Pro Gln
725 730 735
Asn Thr Tyr Cys Val Arg Arg Tyr Ala Val Val Gln Lys Ala Ala His
740 745 750
Gly His Val Arg Lys Ala Phe Lys Ser His Val Ser Thr Leu Thr Asp
755 760 765
Leu Gln Pro Tyr Met Arg Gln Phe Val Ala His Leu Gln Glu Thr Ser
770 775 780
Pro Leu Arg Asp Ala Val Val Ile Glu Gln Ser Ser Ser Leu Asn Glu
785 790 795 800
Ala Ser Ser Gly Leu Phe Asp Val Phe Leu Arg Phe Met Cys His His
805 810 815
Ala Val Arg Ile Arg Gly Lys Ser Tyr Val Gln Cys Gln Gly Ile Pro
820 825 830
Gln Gly Ser Ile Leu Ser Thr Leu Leu Cys Ser Leu Cys Tyr Gly Asp
835 840 845
Met Glu Asn Lys Leu Phe Ala Gly Ile Arg Arg Asp Gly Leu Leu Leu
850 855 860
Arg Leu Val Asp Asp Phe Leu Leu Val Thr Pro His Leu Thr His Ala
865 870 875 880
Lys Thr Phe Leu Arg Thr Leu Val Arg Gly Val Pro Glu Tyr Gly Cys
885 890 895
Val Val Asn Leu Arg Lys Thr Val Val Asn Phe Pro Val Glu Asp Glu
900 905 910
Ala Leu Gly Gly Thr Ala Phe Val Gln Met Pro Ala His Gly Leu Phe
915 920 925
Pro Trp Cys Gly Leu Leu Leu Asp Thr Arg Thr Leu Glu Val Gln Ser
930 935 940
Asp Tyr Ser Ser Tyr Ala Arg Thr Ser Ile Arg Ala Ser Leu Thr Phe
945 950 955 960
Asn Arg Gly Phe Lys Ala Gly Arg Asn Met Arg Arg Lys Leu Phe Gly
965 970 975
Val Leu Arg Leu Lys Cys His Ser Leu Phe Leu Asp Leu Gln Val Asn
980 985 990
Ser Leu Gln Thr Val Cys Thr Asn Ile Tyr Lys Ile Leu Leu Leu Gln
995 1000 1005
Ala Tyr Arg Phe His Ala Cys Val Leu Gln Leu Pro Phe His Gln
1010 1015 1020
Gln Val Trp Lys Asn Pro Thr Phe Phe Leu Arg Val Ile Ser Asp
1025 1030 1035
Thr Ala Ser Leu Cys Tyr Ser Ile Leu Lys Ala Lys Asn Ala Gly
1040 1045 1050
Met Ser Leu Gly Ala Lys Gly Ala Ala Gly Pro Leu Pro Ser Glu
1055 1060 1065
Ala Val Gln Trp Leu Cys His Gln Ala Phe Leu Leu Lys Leu Thr
1070 1075 1080
Arg His Arg Val Thr Tyr Val Pro Leu Leu Gly Ser Leu Arg Thr
1085 1090 1095
Ala Gln Thr Gln Leu Ser Arg Lys Leu Pro Gly Thr Thr Leu Thr
1100 1105 1110
Ala Leu Glu Ala Ala Ala Asn Pro Ala Leu Pro Ser Asp Phe Lys
1115 1120 1125
Thr Ile Leu Asp
1130
<210> 285
<211> 4027
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 285
caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc 60
cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc 120
tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg 180
gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg 240
cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg 300
cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg 360
cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct 420
acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc 480
gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg 540
tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca 600
ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg 660
cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga 720
ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg 780
ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga 840
cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag 900
ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc 960
agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc 1020
ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc 1080
ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg 1140
agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc 1200
tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc 1260
agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag 1320
cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg 1380
acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt 1440
acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc 1500
acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca 1560
agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca 1620
ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg 1680
ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt 1740
atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga 1800
gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt 1860
cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc 1920
gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag 1980
ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt 2040
tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg 2100
gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc 2160
cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc 2220
aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc 2280
gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc 2340
acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg 2400
agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca 2460
gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg 2520
gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct 2580
gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc 2640
tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa 2700
ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga 2760
agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga 2820
tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg 2880
tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc 2940
gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt 3000
gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct 3060
acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc 3120
atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc 3180
tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg 3240
ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc 3300
tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc 3360
agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg 3420
cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg 3480
agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc 3540
ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct 3600
gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc 3660
tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc 3720
agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc 3780
cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc 3840
caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt 3900
gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg 3960
ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa 4020
aaaaaaa 4027
<210> 286
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 286
ggaggtccct caccttcta 19
<210> 287
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 287
cggaggatct tatgctgaa 19
<210> 288
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 288
cccgcttcca gatcataca 19
<210> 289
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 289
ggagacctca acaagatat 19
<210> 290
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 290
aaggcatggt cattggtat 19
<210> 291
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 291
gcatggtcat tggtatcat 19
<210> 292
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 292
ggtcattggt atcatgagt 19
<210> 293
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 293
cctagtgggt atccctgta 19
<210> 294
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 294
gaggatggac attgttctt 19
<210> 295
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 295
gcatgcaggc tacagttca 19
<210> 296
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 296
ccagcacatg cactgttga 19
<210> 297
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 297
cacatgcact gttgagtga 19
<210> 298
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 298
ctggaggtcc ctcaccttct a 21
<210> 299
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 299
gtcggaggat cttatgctga a 21
<210> 300
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 300
tgcccgcttc cagatcatac a 21
<210> 301
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 301
ctggagacct caacaagata t 21
<210> 302
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 302
tcaaggcatg gtcattggta t 21
<210> 303
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 303
aggcatggtc attggtatca t 21
<210> 304
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 304
atggtcattg gtatcatgag t 21
<210> 305
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 305
gccctagtgg gtatccctgt a 21
<210> 306
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 306
atgaggatgg acattgttct t 21
<210> 307
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 307
gagcatgcag gctacagttc a 21
<210> 308
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 308
ttccagcaca tgcactgttg a 21
<210> 309
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 309
agcacatgca ctgttgagtg a 21
<210> 310
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 310
tagaaggtga gggacctcca g 21
<210> 311
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 311
ttcagcataa gatcctccga c 21
<210> 312
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 312
tgtatgatct ggaagcgggc a 21
<210> 313
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 313
atatcttgtt gaggtctcca g 21
<210> 314
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 314
ataccaatga ccatgccttg a 21
<210> 315
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 315
atgataccaa tgaccatgcc t 21
<210> 316
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 316
atggtcattg gtatcatgag t 21
<210> 317
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 317
gccctagtgg gtatccctgt a 21
<210> 318
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 318
atgaggatgg acattgttct t 21
<210> 319
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 319
gagcatgcag gctacagttc a 21
<210> 320
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 320
ttccagcaca tgcactgttg a 21
<210> 321
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 321
agcacatgca ctgttgagtg a 21
<210> 322
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 322
tagaaggtga gggacctcc 19
<210> 323
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 323
ttcagcataa gatcctccg 19
<210> 324
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 324
tgtatgatct ggaagcggg 19
<210> 325
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 325
atatcttgtt gaggtctcc 19
<210> 326
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 326
ataccaatga ccatgcctt 19
<210> 327
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 327
atgataccaa tgaccatgc 19
<210> 328
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 328
atggtcattg gtatcatga 19
<210> 329
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 329
gccctagtgg gtatccctg 19
<210> 330
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 330
atgaggatgg acattgttc 19
<210> 331
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 331
gagcatgcag gctacagtt 19
<210> 332
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 332
ttccagcaca tgcactgtt 19
<210> 333
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 333
agcacatgca ctgttgagt 19
<210> 334
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 334
ggccaggatg gttcttaga 19
<210> 335
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 335
gcttcgtgct aaactggta 19
<210> 336
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 336
gggcgtgact tccacatga 19
<210> 337
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 337
caggcctaga gaagtttca 19
<210> 338
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 338
cttggaaccc attcctgaa 19
<210> 339
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 339
ggaacccatt cctgaaatt 19
<210> 340
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 340
gaacccattc ctgaaatta 19
<210> 341
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 341
aacccattcc tgaaattat 19
<210> 342
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 342
acccattcct gaaattatt 19
<210> 343
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 343
cccattcctg aaattattt 19
<210> 344
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 344
ctgtggttct attatatta 19
<210> 345
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 345
aaatatgaga gcatgctaa 19
<210> 346
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 346
tctaagaacc atcctggcc 19
<210> 347
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 347
taccagttta gcacgaagc 19
<210> 348
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 348
tcatgtggaa gtcacgccc 19
<210> 349
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 349
tgaaacttct ctaggcctg 19
<210> 350
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 350
ttcaggaatg ggttccaag 19
<210> 351
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 351
aatttcagga atgggttcc 19
<210> 352
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 352
taatttcagg aatgggttc 19
<210> 353
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 353
ataatttcag gaatgggtt 19
<210> 354
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 354
aataatttca ggaatgggt 19
<210> 355
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 355
aaataatttc aggaatggg 19
<210> 356
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 356
taatataata gaaccacag 19
<210> 357
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 357
ttagcatgct ctcatattt 19
<210> 358
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 358
gcggccagga tggttcttag a 21
<210> 359
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 359
gagcttcgtg ctaaactggt a 21
<210> 360
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 360
acgggcgtga cttccacatg a 21
<210> 361
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 361
tgcaggccta gagaagtttc a 21
<210> 362
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 362
tccttggaac ccattcctga a 21
<210> 363
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 363
ttggaaccca ttcctgaaat t 21
<210> 364
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 364
tggaacccat tcctgaaatt a 21
<210> 365
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 365
ggaacccatt cctgaaatta t 21
<210> 366
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 366
gaacccattc ctgaaattat t 21
<210> 367
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 367
aacccattcc tgaaattatt t 21
<210> 368
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 368
ccctgtggtt ctattatatt a 21
<210> 369
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 369
ttaaatatga gagcatgcta a 21
<210> 370
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 370
tctaagaacc atcctggccg c 21
<210> 371
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 371
taccagttta gcacgaagct c 21
<210> 372
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 372
tcatgtggaa gtcacgcccg t 21
<210> 373
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 373
tgaaacttct ctaggcctgc a 21
<210> 374
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 374
ttcaggaatg ggttccaagg a 21
<210> 375
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 375
aatttcagga atgggttcca a 21
<210> 376
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 376
taatttcagg aatgggttcc a 21
<210> 377
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 377
ataatttcag gaatgggttc c 21
<210> 378
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 378
aataatttca ggaatgggtt c 21
<210> 379
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 379
aaataatttc aggaatgggt t 21
<210> 380
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 380
taatataata gaaccacagg g 21
<210> 381
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 381
ttagcatgct ctcatattta a 21
<210> 382
<211> 150
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 382
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 150
<210> 383
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 383
Arg Gly Asp Ser
1
<210> 384
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 384
Asn Tyr Ala Met Ser
1 5
<210> 385
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 385
Asp Tyr Ala Met His
1 5
<210> 386
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 386
Asn His Gly Met Ser
1 5
<210> 387
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 387
Asn Phe Gly Ile Asn
1 5
<210> 388
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 388
Ser Asp Ala Met Thr
1 5
<210> 389
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 389
Asn Tyr Gly Ile Thr
1 5
<210> 390
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 390
Asn His Gly Met Ser
1 5
<210> 391
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 391
Asn His Gly Met Ser
1 5
<210> 392
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 392
Asn His Gly Met Ser
1 5
<210> 393
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 393
Asp Tyr Tyr Met Ser
1 5
<210> 394
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 394
Asn His Gly Met Ser
1 5
<210> 395
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 395
Asp Tyr Tyr Met Ser
1 5
<210> 396
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 396
Asn His Gly Met Ser
1 5
<210> 397
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 397
Asn His Gly Met Ser
1 5
<210> 398
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 398
Asn His Gly Met Ser
1 5
<210> 399
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 399
Ser Ser Tyr Tyr Tyr Trp Gly
1 5
<210> 400
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 400
Thr Ser Gly Met Cys Val Ser
1 5
<210> 401
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 401
Ser Tyr Ser Met Asn
1 5
<210> 402
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 402
Asp Tyr Tyr Met Ser
1 5
<210> 403
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 403
Ser His Tyr Ile His
1 5
<210> 404
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 404
Ser Gly Gly Tyr Tyr Trp Ser
1 5
<210> 405
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 405
Ser Tyr Ala Ile Ser
1 5
<210> 406
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 406
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 407
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 407
Ser Tyr Ala Met Ser
1 5
<210> 408
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 408
Arg Tyr Pro Met Ser
1 5
<210> 409
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 409
Ser Tyr Ala Met Ser
1 5
<210> 410
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 410
Ser Tyr Ala Met Ser
1 5
<210> 411
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 411
Asp Tyr Ala Met His
1 5
<210> 412
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 412
Asp Tyr Ala Met His
1 5
<210> 413
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 413
Ser Tyr Ala Met Ser
1 5
<210> 414
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 414
Ser Tyr Ala Met Ser
1 5
<210> 415
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 415
Ser Tyr Ala Met Ser
1 5
<210> 416
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 416
Ser Tyr Ala Met Ser
1 5
<210> 417
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 417
Ser Tyr Ala Met Ser
1 5
<210> 418
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 418
Ser Tyr Ala Met Ser
1 5
<210> 419
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 419
Ser Tyr Ala Met Ser
1 5
<210> 420
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 420
Asn Phe Gly Met Asn
1 5
<210> 421
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 421
Asp Tyr Ser Ile Asn
1 5
<210> 422
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 422
His Tyr Ser Met Asn
1 5
<210> 423
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 423
His Tyr Ser Met Asn
1 5
<210> 424
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 424
Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 425
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 425
Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 426
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 426
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 427
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 427
Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 428
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 428
Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 429
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 429
Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 430
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 430
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 431
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 431
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 432
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 432
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 433
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 433
Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 434
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 434
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 435
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 435
Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 436
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 436
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 437
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 437
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 438
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 438
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 439
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 439
Ser Ile Tyr Tyr Ser Gly Ser Ala Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 440
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 440
Arg Ile Asp Trp Asp Glu Asp Lys Phe Tyr Ser Thr Ser Leu Lys Thr
1 5 10 15
<210> 441
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 441
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 442
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 442
Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 443
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 443
Met Ile Asn Pro Ser Gly Gly Val Thr Ala Tyr Ser Gln Thr Leu Gln
1 5 10 15
Gly
<210> 444
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 444
Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 445
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 445
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 446
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 446
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Ser Phe Tyr Ala Ile Ser Leu
1 5 10 15
Lys Ser
<210> 447
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 447
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 448
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 448
Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr Tyr Ala Asp Ser Ala Lys
1 5 10 15
Gly
<210> 449
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 449
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 450
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 450
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 451
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 451
Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 452
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 452
Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala Tyr Gly Asp Ser Val Lys
1 5 10 15
Gly
<210> 453
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 453
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 454
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 454
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 455
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 455
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 456
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 456
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 457
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 457
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 458
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 458
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 459
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 459
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 460
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 460
Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 461
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 461
Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe Arg
1 5 10 15
Gly
<210> 462
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 462
Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 463
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 463
Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 464
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 464
Ser Pro Ala His Tyr Tyr Gly Gly Met Asp Val
1 5 10
<210> 465
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 465
His Ser Phe Leu Ala Tyr
1 5
<210> 466
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 466
His Gly Gly Glu Ser Asp Val
1 5
<210> 467
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 467
Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met Asp Val
1 5 10
<210> 468
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 468
Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala Arg Gly Pro Arg Tyr
1 5 10
<210> 469
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 469
Gly Pro Tyr Tyr Tyr Tyr Met Asp Val
1 5
<210> 470
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 470
His Gly Gly Glu Ser Asp Val
1 5
<210> 471
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 471
His Gly Gly Glu Ser Asp Val
1 5
<210> 472
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 472
His Gly Gly Glu Ser Asp Val
1 5
<210> 473
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 473
Glu Ser Gly Asp Gly Met Asp Val
1 5
<210> 474
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 474
His Gly Gly Glu Ser Asp Val
1 5
<210> 475
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 475
Ser Thr Met Val Arg Glu Asp Tyr
1 5
<210> 476
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 476
His Gly Gly Glu Ser Asp Val
1 5
<210> 477
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 477
His Gly Gly Glu Ser Asp Val
1 5
<210> 478
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 478
His Gly Gly Glu Ser Asp Val
1 5
<210> 479
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 479
His Trp Gln Glu Trp Pro Asp Ala Phe Asp Ile
1 5 10
<210> 480
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 480
Ser Gly Ala Gly Gly Thr Ser Ala Thr Ala Phe Asp Ile
1 5 10
<210> 481
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 481
Thr Ile Ala Ala Val Tyr Ala Phe Asp Ile
1 5 10
<210> 482
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 482
Asp Leu Arg Gly Ala Phe Asp Ile
1 5
<210> 483
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 483
Glu Gly Ser Gly Ser Gly Trp Tyr Phe Asp Phe
1 5 10
<210> 484
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 484
Ala Gly Ile Ala Ala Arg Leu Arg Gly Ala Phe Asp Ile
1 5 10
<210> 485
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 485
Arg Gly Gly Tyr Gln Leu Leu Arg Trp Asp Val Gly Leu Leu Arg Ser
1 5 10 15
Ala Phe Asp Ile
20
<210> 486
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 486
Ser Ser Pro Glu Gly Leu Phe Leu Tyr Trp Phe Asp Pro
1 5 10
<210> 487
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 487
Val Glu Gly Ser Gly Ser Leu Asp Tyr
1 5
<210> 488
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 488
Arg Ala Gly Ser Glu Ala Ser Asp Ile
1 5
<210> 489
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 489
Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 490
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 490
Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 491
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 491
Val Gly Lys Ala Val Pro Asp Val
1 5
<210> 492
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 492
His Gln Gly Val Ala Tyr Tyr Asn Tyr Ala Met Asp Val
1 5 10
<210> 493
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 493
Val Val Arg Asp Gly Met Asp Val
1 5
<210> 494
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 494
Ile Pro Gln Thr Gly Thr Phe Asp Tyr
1 5
<210> 495
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 495
Ala Asn Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 496
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 496
Ala Leu Val Gly Ala Thr Gly Ala Phe Asp Ile
1 5 10
<210> 497
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 497
Trp Phe Gly Glu Gly Phe Asp Pro
1 5
<210> 498
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 498
Val Gly Tyr Asp Ser Ser Gly Tyr Tyr Arg Asp Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 499
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 499
Met Gly Trp Ser Ser Gly Tyr Leu Gly Ala Phe Asp Ile
1 5 10
<210> 500
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 500
Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr
1 5 10
<210> 501
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 501
Asp Tyr Ser Tyr Ala Met Asp Tyr
1 5
<210> 502
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 502
Asp Tyr Leu Tyr Ser Leu Asp Phe
1 5
<210> 503
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 503
Asp Tyr Leu Tyr Ser Cys Asp Tyr
1 5
<210> 504
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 504
Arg Ala Ser Gln Ser Ile Ser Ser Ser Phe Leu Ala
1 5 10
<210> 505
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 505
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 506
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 506
Lys Ser Ser Gln Ser Leu Leu Arg Asn Asp Gly Lys Thr Pro Leu Tyr
1 5 10 15
<210> 507
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 507
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asn
1 5 10 15
<210> 508
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 508
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 509
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 509
Arg Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Tyr Asn Tyr Val Asp
1 5 10 15
<210> 510
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 510
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 511
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 511
Arg Ala Ser Gln Ser Val Ser Ser Lys Leu Ala
1 5 10
<210> 512
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 512
Arg Ala Ser Gln Ser Val Gly Ser Thr Asn Leu Ala
1 5 10
<210> 513
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 513
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 514
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 514
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 515
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 515
Lys Ser Ser Glu Ser Leu Val His Asn Ser Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 516
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 516
Gln Ala Ser Glu Asp Ile Asn Lys Phe Leu Asn
1 5 10
<210> 517
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 517
Arg Ala Ser Gln Ser Val Gly Ser Asn Leu Ala
1 5 10
<210> 518
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 518
Arg Ala Ser Gln Ser Ile Gly Ser Ser Ser Leu Ala
1 5 10
<210> 519
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 519
Lys Ala Ser Gln Asp Ile Asp Asp Ala Met Asn
1 5 10
<210> 520
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 520
Arg Ala Ser Gln Asp Ile Tyr Asn Asn Leu Ala
1 5 10
<210> 521
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 521
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 522
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 522
Gly Gly Asn Asn Ile Gly Thr Lys Ser Val His
1 5 10
<210> 523
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 523
Ser Gly Asp Gly Leu Ser Lys Lys Tyr Val Ser
1 5 10
<210> 524
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 524
Arg Ala Ser Gln Gly Ile Arg Asn Trp Leu Ala
1 5 10
<210> 525
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 525
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 526
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 526
Gln Gly Asp Ser Leu Gly Asn Tyr Tyr Ala Thr
1 5 10
<210> 527
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 527
Arg Ala Ser Gln Ser Val Ser Ser Ala Tyr Leu Ala
1 5 10
<210> 528
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 528
Arg Ala Ser Gln Ser Val Ser Asn Ser Leu Ala
1 5 10
<210> 529
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 529
Arg Ala Ser Gln Ser Val Ser Ser Ser Phe Leu Ala
1 5 10
<210> 530
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 530
Arg Ala Ser Gln Ser Val Ser Thr Thr Phe Leu Ala
1 5 10
<210> 531
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 531
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 532
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 532
Arg Ala Thr Gln Ser Ile Gly Ser Ser Phe Leu Ala
1 5 10
<210> 533
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 533
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 534
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 534
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 535
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 535
Arg Ala Ser Gln Arg Val Ala Ser Asn Tyr Leu Ala
1 5 10
<210> 536
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 536
Arg Ala Ser Gln Ser Leu Ser Ser Asn Phe Leu Ala
1 5 10
<210> 537
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 537
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 538
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 538
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 539
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 539
Arg Ala Ser Gln Ser Val Ala Ser Ser Phe Leu Ala
1 5 10
<210> 540
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 540
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ser
1 5 10
<210> 541
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 541
Arg Ala Ser Glu Ser Val Ser Val Ile Gly Ala His Leu Ile His
1 5 10 15
<210> 542
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 542
Arg Ala Ser Glu Ser Val Thr Ile Leu Gly Ser His Leu Ile Tyr
1 5 10 15
<210> 543
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 543
Arg Ala Ser Glu Ser Val Thr Ile Leu Gly Ser His Leu Ile Tyr
1 5 10 15
<210> 544
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 544
Gly Ala Ser Arg Arg Ala Thr
1 5
<210> 545
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 545
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 546
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 546
Glu Val Ser Asn Arg Phe Ser
1 5
<210> 547
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 547
Leu Gly Ser Lys Arg Ala Ser
1 5
<210> 548
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 548
Gly Ala Ser Thr Leu Ala Ser
1 5
<210> 549
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 549
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 550
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 550
Gly Ala Ser Thr Arg Ala Ser
1 5
<210> 551
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 551
Gly Ala Ser Ile Arg Ala Thr
1 5
<210> 552
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 552
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 553
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 553
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 554
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 554
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 555
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 555
Glu Val Ser Asn Arg Asp Ser
1 5
<210> 556
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 556
Asp Ala Ser Thr Leu Gln Thr
1 5
<210> 557
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 557
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 558
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 558
Gly Ala Ser Ser Arg Ala Ser
1 5
<210> 559
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 559
Ser Ala Thr Ser Pro Val Pro
1 5
<210> 560
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 560
Ala Ala Asn Lys Ser Gln Ser
1 5
<210> 561
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 561
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 562
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 562
Asp Asp Ser Val Arg Pro Ser
1 5
<210> 563
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 563
Arg Asp Lys Glu Arg Pro Ser
1 5
<210> 564
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 564
Ala Ala Ser Asn Leu Gln Ser
1 5
<210> 565
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 565
Gly Lys Asn Asn Arg Pro Ser
1 5
<210> 566
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 566
Gly Thr Asn Asn Arg Pro Ser
1 5
<210> 567
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 567
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 568
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 568
Asp Ala Ser Ser Arg Ala Thr
1 5
<210> 569
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 569
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 570
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 570
Gly Ser Ser Asn Arg Ala Thr
1 5
<210> 571
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 571
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 572
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 572
Gly Ala Ser Gln Arg Ala Thr
1 5
<210> 573
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 573
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 574
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 574
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 575
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 575
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 576
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 576
Gly Ala Ser Asn Trp Ala Thr
1 5
<210> 577
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 577
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 578
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 578
Gly Thr Ser Ser Arg Ala Thr
1 5
<210> 579
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 579
Gly Ala Ser Gly Arg Ala Thr
1 5
<210> 580
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 580
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 581
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 581
Leu Ala Ser Asn Leu Glu Thr
1 5
<210> 582
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 582
Leu Ala Ser Asn Val Gln Thr
1 5
<210> 583
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 583
Leu Ala Ser Asn Val Gln Thr
1 5
<210> 584
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 584
Gln Gln Tyr His Ser Ser Pro Ser Trp Thr
1 5 10
<210> 585
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 585
Met Gln Ala Leu Gln Thr Pro Tyr Thr
1 5
<210> 586
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 586
Met Gln Asn Ile Gln Phe Pro Ser
1 5
<210> 587
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 587
Met Gln Ala Leu Gln Thr Pro Tyr Thr
1 5
<210> 588
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 588
Gln Gln Ser Tyr Lys Arg Ala Ser
1 5
<210> 589
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 589
Met Gln Gly Arg Gln Phe Pro Tyr Ser
1 5
<210> 590
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 590
Gln Gln Tyr Gly Ser Ser Leu Thr
1 5
<210> 591
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 591
Gln Gln Tyr Gly Ser Ser Ser Trp Thr
1 5
<210> 592
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 592
Gln Gln Tyr Gly Ser Ser Pro Pro Trp Thr
1 5 10
<210> 593
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 593
Gln Gln Ser Tyr Thr Leu Ala
1 5
<210> 594
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 594
Gln Gln Ser Tyr Ser Thr Pro Tyr Thr
1 5
<210> 595
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 595
Met Gln Gly Thr His Trp Pro Gly Thr
1 5
<210> 596
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 596
Gln Gln Tyr Glu Ser Leu Pro Leu Thr
1 5
<210> 597
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 597
Gln Gln Tyr Asn Asp Trp Leu Pro Val Thr
1 5 10
<210> 598
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 598
Gln Gln Tyr Ala Gly Ser Pro Pro Phe Thr
1 5 10
<210> 599
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 599
Leu Gln His Asp Asn Phe Pro Leu Thr
1 5
<210> 600
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 600
Gln His Tyr Tyr Arg Phe Pro Tyr Ser
1 5
<210> 601
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 601
Met Gln Ala Leu Gln Thr Pro Tyr Thr
1 5
<210> 602
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 602
Gln Val Trp Asp Ser Asp Ser Glu His Val Val
1 5 10
<210> 603
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 603
Gln Ala Trp Asp Asp Thr Thr Val Val
1 5
<210> 604
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 604
Gln Lys Tyr Asn Ser Ala Pro Phe Thr
1 5
<210> 605
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 605
Ser Ser Arg Asp Ser Ser Gly Asp His Leu Arg Val
1 5 10
<210> 606
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 606
Asn Ser Arg Asp Ser Ser Gly His His Leu Leu
1 5 10
<210> 607
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 607
Gln His Tyr Gly Ser Ser Phe Asn Gly Ser Ser Leu Phe Thr
1 5 10
<210> 608
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 608
Gln Gln Phe Gly Thr Ser Ser Gly Leu Thr
1 5 10
<210> 609
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 609
Gln Gln Tyr His Ser Ser Pro Ser Trp Thr
1 5 10
<210> 610
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 610
Gln Gln Tyr His Ser Ser Pro Ser Trp Thr
1 5 10
<210> 611
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 611
Gln Gln Ser Tyr Ser Thr Pro Tyr Ser
1 5
<210> 612
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 612
Gln His Tyr Glu Ser Ser Pro Ser Trp Thr
1 5 10
<210> 613
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 613
Gln Gln Tyr Gly Ser Pro Pro Arg Phe Thr
1 5 10
<210> 614
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 614
Gln His Tyr Gly Ser Ser Pro Ser Trp Thr
1 5 10
<210> 615
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 615
Gln His Tyr Asp Ser Ser Pro Ser Trp Thr
1 5 10
<210> 616
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 616
Gln Tyr Tyr Gly Thr Ser Pro Met Tyr Thr
1 5 10
<210> 617
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 617
Met Gln Ala Leu Gln Thr Pro Leu Thr
1 5
<210> 618
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 618
Gln His Tyr Gly Asn Ser Pro Pro Lys Phe Thr
1 5 10
<210> 619
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 619
Gln His Tyr Gly Gly Ser Pro Arg Leu Thr
1 5 10
<210> 620
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 620
Gln Gln His Tyr Ser Thr Pro Trp Thr
1 5
<210> 621
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 621
Leu Gln Ser Arg Ile Phe Pro Arg Thr
1 5
<210> 622
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 622
Leu Gln Ser Arg Thr Ile Pro Arg Thr
1 5
<210> 623
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 623
Leu Gln Ser Arg Thr Ile Pro Arg Thr
1 5
<210> 624
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 624
Gly Phe Thr Phe Ser Asn Tyr
1 5
<210> 625
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 625
Gly Phe Thr Phe Asp Asp Tyr
1 5
<210> 626
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 626
Gly Phe Ala Leu Ser Asn His
1 5
<210> 627
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 627
Gly Tyr Ile Phe Asp Asn Phe
1 5
<210> 628
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 628
Gly Phe Thr Phe Ser Ser Asp
1 5
<210> 629
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 629
Gly Tyr Thr Phe Ser Asn Tyr
1 5
<210> 630
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 630
Gly Phe Ala Leu Ser Asn His
1 5
<210> 631
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 631
Gly Phe Ala Leu Ser Asn His
1 5
<210> 632
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 632
Gly Phe Ala Leu Ser Asn His
1 5
<210> 633
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 633
Gly Phe Thr Phe Ser Asp Tyr
1 5
<210> 634
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 634
Gly Phe Ala Leu Ser Asn His
1 5
<210> 635
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 635
Gly Phe Thr Phe Ser Asp Tyr
1 5
<210> 636
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 636
Gly Phe Ala Leu Ser Asn His
1 5
<210> 637
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 637
Gly Phe Ala Leu Ser Asn His
1 5
<210> 638
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 638
Gly Phe Ala Leu Ser Asn His
1 5
<210> 639
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 639
Gly Gly Ser Ile Ser Ser Ser Tyr Tyr
1 5
<210> 640
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 640
Gly Phe Ser Leu Arg Thr Ser Gly Met
1 5
<210> 641
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 641
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 642
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 642
Gly Phe Thr Phe Ser Asp Tyr
1 5
<210> 643
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 643
Gly Tyr Thr Val Thr Ser His
1 5
<210> 644
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 644
Gly Gly Ser Ile Ser Ser Gly Gly Tyr
1 5
<210> 645
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 645
Gly Gly Thr Phe Ser Ser Tyr
1 5
<210> 646
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 646
Gly Asp Ser Val Ser Ser Asn Ser Ala
1 5
<210> 647
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 647
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 648
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 648
Gly Ile Thr Phe Ser Arg Tyr
1 5
<210> 649
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 649
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 650
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 650
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 651
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 651
Gly Phe Thr Phe Asp Asp Tyr
1 5
<210> 652
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 652
Gly Phe Thr Phe Asp Asp Tyr
1 5
<210> 653
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 653
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 654
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 654
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 655
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 655
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 656
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 656
Gly Phe Ser Phe Ser Ser Tyr
1 5
<210> 657
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 657
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 658
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 658
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 659
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 659
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 660
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 660
Gly Tyr Thr Phe Thr Asn Phe
1 5
<210> 661
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 661
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 662
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 662
Gly Tyr Thr Phe Arg His Tyr
1 5
<210> 663
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 663
Gly Tyr Thr Phe Thr His Tyr
1 5
<210> 664
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 664
Ser Arg Ser Gly Glu Asn
1 5
<210> 665
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 665
Ser Trp Asn Ser Gly Ser
1 5
<210> 666
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 666
Val Tyr Ser Gly Ser
1 5
<210> 667
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 667
Asn Pro Lys Asn Asn Asn
1 5
<210> 668
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 668
Ser Gly Ser Gly Gly Thr
1 5
<210> 669
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 669
Ser Ala Tyr Asn Gly Asn
1 5
<210> 670
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 670
Val Tyr Ser Gly Ser
1 5
<210> 671
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 671
Val Tyr Ser Gly Ser
1 5
<210> 672
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 672
Val Tyr Ser Gly Ser
1 5
<210> 673
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 673
Ser Ser Ser Gly Ser Thr
1 5
<210> 674
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 674
Val Tyr Ser Gly Ser
1 5
<210> 675
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 675
Ser Ser Ser Gly Asn Thr
1 5
<210> 676
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 676
Val Tyr Ser Gly Ser
1 5
<210> 677
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 677
Val Tyr Ser Gly Ser
1 5
<210> 678
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 678
Val Tyr Ser Gly Ser
1 5
<210> 679
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 679
Tyr Tyr Ser Gly Ser
1 5
<210> 680
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 680
Asp Trp Asp Glu Asp
1 5
<210> 681
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 681
Ser Ser Ser Ser Ser Tyr
1 5
<210> 682
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 682
Ser Ser Ser Gly Ser Thr
1 5
<210> 683
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 683
Asn Pro Ser Gly Gly Val
1 5
<210> 684
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 684
Tyr Tyr Ser Gly Ser
1 5
<210> 685
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 685
Ile Pro Ile Phe Gly Thr
1 5
<210> 686
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 686
Tyr Tyr Arg Ser Lys Trp Tyr
1 5
<210> 687
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 687
Ser Gly Ser Gly Gly Ser
1 5
<210> 688
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 688
Ser Asp Ser Gly Val Ser
1 5
<210> 689
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 689
Ser Gly Ser Gly Gly Ser
1 5
<210> 690
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 690
Ser Gly Ser Gly Gly Ser
1 5
<210> 691
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 691
Ser Trp Asn Ser Gly Ser
1 5
<210> 692
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 692
Asn Trp Lys Gly Asn Ser
1 5
<210> 693
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 693
Ser Gly Ser Gly Gly Ser
1 5
<210> 694
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 694
Ser Gly Ser Gly Gly Ser
1 5
<210> 695
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 695
Ser Gly Ser Gly Gly Ser
1 5
<210> 696
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 696
Ser Gly Ser Gly Gly Ser
1 5
<210> 697
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 697
Ser Gly Ser Gly Gly Ser
1 5
<210> 698
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 698
Ser Gly Ser Gly Gly Ser
1 5
<210> 699
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 699
Ser Gly Ser Gly Gly Ser
1 5
<210> 700
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 700
Asn Thr Tyr Thr Gly Glu
1 5
<210> 701
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 701
Asn Thr Glu Thr Arg Glu
1 5
<210> 702
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 702
Asn Thr Glu Ser Gly Val
1 5
<210> 703
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 703
Asn Thr Glu Thr Gly Glu
1 5
<210> 704
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 704
Ser Pro Ala His Tyr Tyr Gly Gly Met Asp Val
1 5 10
<210> 705
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 705
His Ser Phe Leu Ala Tyr
1 5
<210> 706
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 706
His Gly Gly Glu Ser Asp Val
1 5
<210> 707
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 707
Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met Asp Val
1 5 10
<210> 708
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 708
Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala Arg Gly Pro Arg Tyr
1 5 10
<210> 709
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 709
Gly Pro Tyr Tyr Tyr Tyr Met Asp Val
1 5
<210> 710
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 710
His Gly Gly Glu Ser Asp Val
1 5
<210> 711
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 711
His Gly Gly Glu Ser Asp Val
1 5
<210> 712
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 712
His Gly Gly Glu Ser Asp Val
1 5
<210> 713
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 713
Glu Ser Gly Asp Gly Met Asp Val
1 5
<210> 714
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 714
His Gly Gly Glu Ser Asp Val
1 5
<210> 715
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 715
Ser Thr Met Val Arg Glu Asp Tyr
1 5
<210> 716
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 716
His Gly Gly Glu Ser Asp Val
1 5
<210> 717
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 717
His Gly Gly Glu Ser Asp Val
1 5
<210> 718
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 718
His Gly Gly Glu Ser Asp Val
1 5
<210> 719
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 719
His Trp Gln Glu Trp Pro Asp Ala Phe Asp Ile
1 5 10
<210> 720
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 720
Ser Gly Ala Gly Gly Thr Ser Ala Thr Ala Phe Asp Ile
1 5 10
<210> 721
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 721
Thr Ile Ala Ala Val Tyr Ala Phe Asp Ile
1 5 10
<210> 722
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 722
Asp Leu Arg Gly Ala Phe Asp Ile
1 5
<210> 723
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 723
Glu Gly Ser Gly Ser Gly Trp Tyr Phe Asp Phe
1 5 10
<210> 724
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 724
Ala Gly Ile Ala Ala Arg Leu Arg Gly Ala Phe Asp Ile
1 5 10
<210> 725
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 725
Arg Gly Gly Tyr Gln Leu Leu Arg Trp Asp Val Gly Leu Leu Arg Ser
1 5 10 15
Ala Phe Asp Ile
20
<210> 726
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 726
Ser Ser Pro Glu Gly Leu Phe Leu Tyr Trp Phe Asp Pro
1 5 10
<210> 727
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 727
Val Glu Gly Ser Gly Ser Leu Asp Tyr
1 5
<210> 728
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 728
Arg Ala Gly Ser Glu Ala Ser Asp Ile
1 5
<210> 729
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 729
Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 730
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 730
Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 731
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 731
Val Gly Lys Ala Val Pro Asp Val
1 5
<210> 732
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 732
His Gln Gly Val Ala Tyr Tyr Asn Tyr Ala Met Asp Val
1 5 10
<210> 733
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 733
Val Val Arg Asp Gly Met Asp Val
1 5
<210> 734
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 734
Ile Pro Gln Thr Gly Thr Phe Asp Tyr
1 5
<210> 735
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 735
Ala Asn Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 736
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 736
Ala Leu Val Gly Ala Thr Gly Ala Phe Asp Ile
1 5 10
<210> 737
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 737
Trp Phe Gly Glu Gly Phe Asp Pro
1 5
<210> 738
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 738
Val Gly Tyr Asp Ser Ser Gly Tyr Tyr Arg Asp Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 739
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 739
Met Gly Trp Ser Ser Gly Tyr Leu Gly Ala Phe Asp Ile
1 5 10
<210> 740
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 740
Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr
1 5 10
<210> 741
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 741
Asp Tyr Ser Tyr Ala Met Asp Tyr
1 5
<210> 742
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 742
Asp Tyr Leu Tyr Ser Leu Asp Phe
1 5
<210> 743
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 743
Asp Tyr Leu Tyr Ser Cys Asp Tyr
1 5
<210> 744
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 744
Ser Gln Ser Ile Ser Ser Ser Phe
1 5
<210> 745
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 745
Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 746
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 746
Ser Gln Ser Leu Leu Arg Asn Asp Gly Lys Thr Pro
1 5 10
<210> 747
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 747
Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 748
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 748
Ser Gln Ser Ile Ser Ser Tyr
1 5
<210> 749
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 749
Ser Gln Ser Leu Leu Tyr Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 750
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 750
Ser Gln Ser Val Ser Ser Asn
1 5
<210> 751
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 751
Ser Gln Ser Val Ser Ser Lys
1 5
<210> 752
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 752
Ser Gln Ser Val Gly Ser Thr Asn
1 5
<210> 753
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 753
Ser Gln Ser Ile Ser Ser Tyr
1 5
<210> 754
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 754
Ser Gln Ser Ile Ser Ser Tyr
1 5
<210> 755
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 755
Ser Glu Ser Leu Val His Asn Ser Gly Lys Thr Tyr
1 5 10
<210> 756
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 756
Ser Glu Asp Ile Asn Lys Phe
1 5
<210> 757
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 757
Ser Gln Ser Val Gly Ser Asn
1 5
<210> 758
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 758
Ser Gln Ser Ile Gly Ser Ser Ser
1 5
<210> 759
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 759
Ser Gln Asp Ile Asp Asp Ala
1 5
<210> 760
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 760
Ser Gln Asp Ile Tyr Asn Asn
1 5
<210> 761
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 761
Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 762
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 762
Asn Asn Ile Gly Thr Lys Ser
1 5
<210> 763
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 763
Asp Gly Leu Ser Lys Lys Tyr
1 5
<210> 764
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 764
Ser Gln Gly Ile Arg Asn Trp
1 5
<210> 765
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 765
Asn Asn Ile Gly Ser Lys Ser
1 5
<210> 766
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 766
Asp Ser Leu Gly Asn Tyr Tyr
1 5
<210> 767
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 767
Ser Gln Ser Val Ser Ser Ala Tyr
1 5
<210> 768
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 768
Ser Gln Ser Val Ser Asn Ser
1 5
<210> 769
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 769
Ser Gln Ser Val Ser Ser Ser Phe
1 5
<210> 770
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 770
Ser Gln Ser Val Ser Thr Thr Phe
1 5
<210> 771
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 771
Ser Gln Ser Ile Ser Ser Tyr
1 5
<210> 772
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 772
Thr Gln Ser Ile Gly Ser Ser Phe
1 5
<210> 773
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 773
Ser Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 774
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 774
Ser Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 775
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 775
Ser Gln Arg Val Ala Ser Asn Tyr
1 5
<210> 776
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 776
Ser Gln Ser Leu Ser Ser Asn Phe
1 5
<210> 777
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 777
Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 778
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 778
Ser Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 779
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 779
Ser Gln Ser Val Ala Ser Ser Phe
1 5
<210> 780
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 780
Ser Gln Asp Val Asn Thr Ala
1 5
<210> 781
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 781
Ser Glu Ser Val Ser Val Ile Gly Ala His Leu
1 5 10
<210> 782
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 782
Ser Glu Ser Val Thr Ile Leu Gly Ser His Leu
1 5 10
<210> 783
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 783
Ser Glu Ser Val Thr Ile Leu Gly Ser His Leu
1 5 10
<210> 784
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 784
Gly Ala Ser
1
<210> 785
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 785
Leu Gly Ser
1
<210> 786
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 786
Glu Val Ser
1
<210> 787
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 787
Leu Gly Ser
1
<210> 788
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 788
Gly Ala Ser
1
<210> 789
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 789
Leu Gly Ser
1
<210> 790
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 790
Gly Ala Ser
1
<210> 791
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 791
Gly Ala Ser
1
<210> 792
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 792
Asp Ala Ser
1
<210> 793
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 793
Ala Ala Ser
1
<210> 794
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 794
Ala Ala Ser
1
<210> 795
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 795
Glu Val Ser
1
<210> 796
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 796
Asp Ala Ser
1
<210> 797
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 797
Gly Ala Ser
1
<210> 798
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 798
Gly Ala Ser
1
<210> 799
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 799
Ser Ala Thr
1
<210> 800
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 800
Ala Ala Asn
1
<210> 801
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 801
Leu Gly Ser
1
<210> 802
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 802
Asp Asp Ser
1
<210> 803
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 803
Arg Asp Lys
1
<210> 804
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 804
Ala Ala Ser
1
<210> 805
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 805
Gly Lys Asn
1
<210> 806
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 806
Gly Thr Asn
1
<210> 807
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 807
Gly Ala Ser
1
<210> 808
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 808
Asp Ala Ser
1
<210> 809
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 809
Gly Ala Ser
1
<210> 810
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 810
Gly Ser Ser
1
<210> 811
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 811
Ala Ala Ser
1
<210> 812
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 812
Gly Ala Ser
1
<210> 813
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 813
Gly Ala Ser
1
<210> 814
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 814
Gly Ala Ser
1
<210> 815
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 815
Gly Ala Ser
1
<210> 816
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 816
Gly Ala Ser
1
<210> 817
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 817
Leu Gly Ser
1
<210> 818
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 818
Gly Thr Ser
1
<210> 819
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 819
Gly Ala Ser
1
<210> 820
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 820
Ser Ala Ser
1
<210> 821
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 821
Leu Ala Ser
1
<210> 822
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 822
Leu Ala Ser
1
<210> 823
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 823
Leu Ala Ser
1
<210> 824
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 824
Tyr His Ser Ser Pro Ser Trp
1 5
<210> 825
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 825
Ala Leu Gln Thr Pro Tyr
1 5
<210> 826
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 826
Asn Ile Gln Phe Pro
1 5
<210> 827
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 827
Ala Leu Gln Thr Pro Tyr
1 5
<210> 828
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 828
Ser Tyr Lys Arg Ala
1 5
<210> 829
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 829
Gly Arg Gln Phe Pro Tyr
1 5
<210> 830
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 830
Tyr Gly Ser Ser Leu
1 5
<210> 831
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 831
Tyr Gly Ser Ser Ser Trp
1 5
<210> 832
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 832
Tyr Gly Ser Ser Pro Pro Trp
1 5
<210> 833
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 833
Ser Tyr Thr Leu
1
<210> 834
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 834
Ser Tyr Ser Thr Pro Tyr
1 5
<210> 835
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 835
Gly Thr His Trp Pro Gly
1 5
<210> 836
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 836
Tyr Glu Ser Leu Pro Leu
1 5
<210> 837
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 837
Tyr Asn Asp Trp Leu Pro Val
1 5
<210> 838
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 838
Tyr Ala Gly Ser Pro Pro Phe
1 5
<210> 839
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 839
His Asp Asn Phe Pro Leu
1 5
<210> 840
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 840
Tyr Tyr Arg Phe Pro Tyr
1 5
<210> 841
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 841
Ala Leu Gln Thr Pro Tyr
1 5
<210> 842
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 842
Trp Asp Ser Asp Ser Glu His Val
1 5
<210> 843
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 843
Trp Asp Asp Thr Thr Val
1 5
<210> 844
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 844
Tyr Asn Ser Ala Pro Phe
1 5
<210> 845
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 845
Arg Asp Ser Ser Gly Asp His Leu Arg
1 5
<210> 846
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 846
Arg Asp Ser Ser Gly His His Leu
1 5
<210> 847
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 847
Tyr Gly Ser Ser Phe Asn Gly Ser Ser Leu Phe
1 5 10
<210> 848
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 848
Phe Gly Thr Ser Ser Gly Leu
1 5
<210> 849
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 849
Tyr His Ser Ser Pro Ser Trp
1 5
<210> 850
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 850
Tyr His Ser Ser Pro Ser Trp
1 5
<210> 851
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 851
Ser Tyr Ser Thr Pro Tyr
1 5
<210> 852
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 852
Tyr Glu Ser Ser Pro Ser Trp
1 5
<210> 853
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 853
Tyr Gly Ser Pro Pro Arg Phe
1 5
<210> 854
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 854
Tyr Gly Ser Ser Pro Ser Trp
1 5
<210> 855
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 855
Tyr Asp Ser Ser Pro Ser Trp
1 5
<210> 856
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 856
Tyr Gly Thr Ser Pro Met Tyr
1 5
<210> 857
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 857
Ala Leu Gln Thr Pro Leu
1 5
<210> 858
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 858
Tyr Gly Asn Ser Pro Pro Lys Phe
1 5
<210> 859
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 859
Tyr Gly Gly Ser Pro Arg Leu
1 5
<210> 860
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 860
His Tyr Ser Thr Pro Trp
1 5
<210> 861
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 861
Ser Arg Ile Phe Pro Arg
1 5
<210> 862
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 862
Ser Arg Thr Ile Pro Arg
1 5
<210> 863
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 863
Ser Arg Thr Ile Pro Arg
1 5
<210> 864
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 864
Gly Phe Thr Phe Ser Asn Tyr Ala Met Ser
1 5 10
<210> 865
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 865
Gly Phe Thr Phe Asp Asp Tyr Ala Met His
1 5 10
<210> 866
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 866
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 867
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 867
Gly Tyr Ile Phe Asp Asn Phe Gly Ile Asn
1 5 10
<210> 868
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 868
Gly Phe Thr Phe Ser Ser Asp Ala Met Thr
1 5 10
<210> 869
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 869
Gly Tyr Thr Phe Ser Asn Tyr Gly Ile Thr
1 5 10
<210> 870
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 870
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 871
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 871
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 872
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 872
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 873
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 873
Gly Phe Thr Phe Ser Asp Tyr Tyr Met Ser
1 5 10
<210> 874
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 874
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 875
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 875
Gly Phe Thr Phe Ser Asp Tyr Tyr Met Ser
1 5 10
<210> 876
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 876
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 877
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 877
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 878
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 878
Gly Phe Ala Leu Ser Asn His Gly Met Ser
1 5 10
<210> 879
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 879
Gly Gly Ser Ile Ser Ser Ser Tyr Tyr Tyr Trp Gly
1 5 10
<210> 880
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 880
Gly Phe Ser Leu Arg Thr Ser Gly Met Cys Val Ser
1 5 10
<210> 881
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 881
Gly Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5 10
<210> 882
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 882
Gly Phe Thr Phe Ser Asp Tyr Tyr Met Ser
1 5 10
<210> 883
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 883
Gly Tyr Thr Val Thr Ser His Tyr Ile His
1 5 10
<210> 884
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 884
Gly Gly Ser Ile Ser Ser Gly Gly Tyr Tyr Trp Ser
1 5 10
<210> 885
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 885
Gly Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5 10
<210> 886
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 886
Gly Asp Ser Val Ser Ser Asn Ser Ala Ala Trp Asn
1 5 10
<210> 887
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 887
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 888
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 888
Gly Ile Thr Phe Ser Arg Tyr Pro Met Ser
1 5 10
<210> 889
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 889
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 890
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 890
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 891
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 891
Gly Phe Thr Phe Asp Asp Tyr Ala Met His
1 5 10
<210> 892
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 892
Gly Phe Thr Phe Asp Asp Tyr Ala Met His
1 5 10
<210> 893
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 893
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 894
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 894
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 895
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 895
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 896
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 896
Gly Phe Ser Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 897
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 897
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 898
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 898
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 899
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 899
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 900
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 900
Gly Tyr Thr Phe Thr Asn Phe Gly Met Asn
1 5 10
<210> 901
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 901
Gly Tyr Thr Phe Thr Asp Tyr Ser Ile Asn
1 5 10
<210> 902
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 902
Gly Tyr Thr Phe Arg His Tyr Ser Met Asn
1 5 10
<210> 903
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 903
Gly Tyr Thr Phe Thr His Tyr Ser Met Asn
1 5 10
<210> 904
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 904
Gly Ile Ser Arg Ser Gly Glu Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 905
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 905
Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 906
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 906
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 907
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 907
Trp Ile Asn Pro Lys Asn Asn Asn Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 908
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 908
Val Ile Ser Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 909
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 909
Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 910
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 910
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 911
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 911
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 912
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 912
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 913
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 913
Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 914
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 914
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 915
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 915
Tyr Ile Ser Ser Ser Gly Asn Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 916
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 916
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 917
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 917
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 918
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 918
Gly Ile Val Tyr Ser Gly Ser Thr Tyr Tyr Ala Ala Ser Val Lys Gly
1 5 10 15
<210> 919
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 919
Ser Ile Tyr Tyr Ser Gly Ser Ala Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 920
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 920
Arg Ile Asp Trp Asp Glu Asp Lys Phe Tyr Ser Thr Ser Leu Lys Thr
1 5 10 15
<210> 921
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 921
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 922
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 922
Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 923
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 923
Met Ile Asn Pro Ser Gly Gly Val Thr Ala Tyr Ser Gln Thr Leu Gln
1 5 10 15
Gly
<210> 924
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 924
Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 925
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 925
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 926
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 926
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Ser Phe Tyr Ala Ile Ser Leu
1 5 10 15
Lys Ser
<210> 927
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 927
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 928
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 928
Gly Ile Ser Asp Ser Gly Val Ser Thr Tyr Tyr Ala Asp Ser Ala Lys
1 5 10 15
Gly
<210> 929
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 929
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 930
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 930
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 931
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 931
Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 932
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 932
Ser Ile Asn Trp Lys Gly Asn Ser Leu Ala Tyr Gly Asp Ser Val Lys
1 5 10 15
Gly
<210> 933
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 933
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 934
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 934
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 935
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 935
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 936
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 936
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 937
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 937
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 938
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 938
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 939
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 939
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 940
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 940
Trp Ile Asn Thr Tyr Thr Gly Glu Ser Tyr Phe Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 941
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 941
Trp Ile Asn Thr Glu Thr Arg Glu Pro Ala Tyr Ala Tyr Asp Phe Arg
1 5 10 15
Gly
<210> 942
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 942
Arg Ile Asn Thr Glu Ser Gly Val Pro Ile Tyr Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 943
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 943
Arg Ile Asn Thr Glu Thr Gly Glu Pro Leu Tyr Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 944
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 944
Ser Pro Ala His Tyr Tyr Gly Gly Met Asp Val
1 5 10
<210> 945
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 945
His Ser Phe Leu Ala Tyr
1 5
<210> 946
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 946
His Gly Gly Glu Ser Asp Val
1 5
<210> 947
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 947
Gly Pro Tyr Tyr Tyr Gln Ser Tyr Met Asp Val
1 5 10
<210> 948
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 948
Leu Asp Ser Ser Gly Tyr Tyr Tyr Ala Arg Gly Pro Arg Tyr
1 5 10
<210> 949
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 949
Gly Pro Tyr Tyr Tyr Tyr Met Asp Val
1 5
<210> 950
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 950
His Gly Gly Glu Ser Asp Val
1 5
<210> 951
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 951
His Gly Gly Glu Ser Asp Val
1 5
<210> 952
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 952
His Gly Gly Glu Ser Asp Val
1 5
<210> 953
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 953
Glu Ser Gly Asp Gly Met Asp Val
1 5
<210> 954
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 954
His Gly Gly Glu Ser Asp Val
1 5
<210> 955
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 955
Ser Thr Met Val Arg Glu Asp Tyr
1 5
<210> 956
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 956
His Gly Gly Glu Ser Asp Val
1 5
<210> 957
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 957
His Gly Gly Glu Ser Asp Val
1 5
<210> 958
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 958
His Gly Gly Glu Ser Asp Val
1 5
<210> 959
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 959
His Trp Gln Glu Trp Pro Asp Ala Phe Asp Ile
1 5 10
<210> 960
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 960
Ser Gly Ala Gly Gly Thr Ser Ala Thr Ala Phe Asp Ile
1 5 10
<210> 961
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 961
Thr Ile Ala Ala Val Tyr Ala Phe Asp Ile
1 5 10
<210> 962
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 962
Asp Leu Arg Gly Ala Phe Asp Ile
1 5
<210> 963
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 963
Glu Gly Ser Gly Ser Gly Trp Tyr Phe Asp Phe
1 5 10
<210> 964
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 964
Ala Gly Ile Ala Ala Arg Leu Arg Gly Ala Phe Asp Ile
1 5 10
<210> 965
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 965
Arg Gly Gly Tyr Gln Leu Leu Arg Trp Asp Val Gly Leu Leu Arg Ser
1 5 10 15
Ala Phe Asp Ile
20
<210> 966
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 966
Ser Ser Pro Glu Gly Leu Phe Leu Tyr Trp Phe Asp Pro
1 5 10
<210> 967
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 967
Val Glu Gly Ser Gly Ser Leu Asp Tyr
1 5
<210> 968
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 968
Arg Ala Gly Ser Glu Ala Ser Asp Ile
1 5
<210> 969
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 969
Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 970
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 970
Ala Thr Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 971
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 971
Val Gly Lys Ala Val Pro Asp Val
1 5
<210> 972
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 972
His Gln Gly Val Ala Tyr Tyr Asn Tyr Ala Met Asp Val
1 5 10
<210> 973
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 973
Val Val Arg Asp Gly Met Asp Val
1 5
<210> 974
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 974
Ile Pro Gln Thr Gly Thr Phe Asp Tyr
1 5
<210> 975
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 975
Ala Asn Tyr Lys Arg Glu Leu Arg Tyr Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 976
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 976
Ala Leu Val Gly Ala Thr Gly Ala Phe Asp Ile
1 5 10
<210> 977
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 977
Trp Phe Gly Glu Gly Phe Asp Pro
1 5
<210> 978
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 978
Val Gly Tyr Asp Ser Ser Gly Tyr Tyr Arg Asp Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 979
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 979
Met Gly Trp Ser Ser Gly Tyr Leu Gly Ala Phe Asp Ile
1 5 10
<210> 980
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 980
Gly Glu Ile Tyr Tyr Gly Tyr Asp Gly Gly Phe Ala Tyr
1 5 10
<210> 981
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 981
Asp Tyr Ser Tyr Ala Met Asp Tyr
1 5
<210> 982
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 982
Asp Tyr Leu Tyr Ser Leu Asp Phe
1 5
<210> 983
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 983
Asp Tyr Leu Tyr Ser Cys Asp Tyr
1 5
<210> 984
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 984
Arg Ala Ser Gln Ser Ile Ser Ser Ser Phe Leu Ala
1 5 10
<210> 985
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 985
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 986
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 986
Lys Ser Ser Gln Ser Leu Leu Arg Asn Asp Gly Lys Thr Pro Leu Tyr
1 5 10 15
<210> 987
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 987
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asn
1 5 10 15
<210> 988
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 988
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 989
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 989
Arg Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Tyr Asn Tyr Val Asp
1 5 10 15
<210> 990
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 990
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 991
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 991
Arg Ala Ser Gln Ser Val Ser Ser Lys Leu Ala
1 5 10
<210> 992
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 992
Arg Ala Ser Gln Ser Val Gly Ser Thr Asn Leu Ala
1 5 10
<210> 993
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 993
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 994
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 994
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 995
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 995
Lys Ser Ser Glu Ser Leu Val His Asn Ser Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 996
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 996
Gln Ala Ser Glu Asp Ile Asn Lys Phe Leu Asn
1 5 10
<210> 997
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 997
Arg Ala Ser Gln Ser Val Gly Ser Asn Leu Ala
1 5 10
<210> 998
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 998
Arg Ala Ser Gln Ser Ile Gly Ser Ser Ser Leu Ala
1 5 10
<210> 999
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 999
Lys Ala Ser Gln Asp Ile Asp Asp Ala Met Asn
1 5 10
<210> 1000
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1000
Arg Ala Ser Gln Asp Ile Tyr Asn Asn Leu Ala
1 5 10
<210> 1001
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1001
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 1002
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1002
Gly Gly Asn Asn Ile Gly Thr Lys Ser Val His
1 5 10
<210> 1003
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1003
Ser Gly Asp Gly Leu Ser Lys Lys Tyr Val Ser
1 5 10
<210> 1004
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1004
Arg Ala Ser Gln Gly Ile Arg Asn Trp Leu Ala
1 5 10
<210> 1005
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1005
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 1006
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1006
Gln Gly Asp Ser Leu Gly Asn Tyr Tyr Ala Thr
1 5 10
<210> 1007
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1007
Arg Ala Ser Gln Ser Val Ser Ser Ala Tyr Leu Ala
1 5 10
<210> 1008
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1008
Arg Ala Ser Gln Ser Val Ser Asn Ser Leu Ala
1 5 10
<210> 1009
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1009
Arg Ala Ser Gln Ser Val Ser Ser Ser Phe Leu Ala
1 5 10
<210> 1010
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1010
Arg Ala Ser Gln Ser Val Ser Thr Thr Phe Leu Ala
1 5 10
<210> 1011
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1011
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 1012
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1012
Arg Ala Thr Gln Ser Ile Gly Ser Ser Phe Leu Ala
1 5 10
<210> 1013
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1013
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 1014
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1014
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 1015
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1015
Arg Ala Ser Gln Arg Val Ala Ser Asn Tyr Leu Ala
1 5 10
<210> 1016
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1016
Arg Ala Ser Gln Ser Leu Ser Ser Asn Phe Leu Ala
1 5 10
<210> 1017
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1017
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 1018
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1018
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 1019
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1019
Arg Ala Ser Gln Ser Val Ala Ser Ser Phe Leu Ala
1 5 10
<210> 1020
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1020
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ser
1 5 10
<210> 1021
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1021
Arg Ala Ser Glu Ser Val Ser Val Ile Gly Ala His Leu Ile His
1 5 10 15
<210> 1022
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1022
Arg Ala Ser Glu Ser Val Thr Ile Leu Gly Ser His Leu Ile Tyr
1 5 10 15
<210> 1023
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1023
Arg Ala Ser Glu Ser Val Thr Ile Leu Gly Ser His Leu Ile Tyr
1 5 10 15
<210> 1024
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1024
Gly Ala Ser Arg Arg Ala Thr
1 5
<210> 1025
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1025
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 1026
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1026
Glu Val Ser Asn Arg Phe Ser
1 5
<210> 1027
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1027
Leu Gly Ser Lys Arg Ala Ser
1 5
<210> 1028
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1028
Gly Ala Ser Thr Leu Ala Ser
1 5
<210> 1029
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1029
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 1030
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1030
Gly Ala Ser Thr Arg Ala Ser
1 5
<210> 1031
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1031
Gly Ala Ser Ile Arg Ala Thr
1 5
<210> 1032
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1032
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 1033
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1033
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 1034
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1034
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 1035
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1035
Glu Val Ser Asn Arg Asp Ser
1 5
<210> 1036
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1036
Asp Ala Ser Thr Leu Gln Thr
1 5
<210> 1037
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1037
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 1038
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1038
Gly Ala Ser Ser Arg Ala Ser
1 5
<210> 1039
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1039
Ser Ala Thr Ser Pro Val Pro
1 5
<210> 1040
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1040
Ala Ala Asn Lys Ser Gln Ser
1 5
<210> 1041
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1041
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 1042
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1042
Asp Asp Ser Val Arg Pro Ser
1 5
<210> 1043
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1043
Arg Asp Lys Glu Arg Pro Ser
1 5
<210> 1044
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1044
Ala Ala Ser Asn Leu Gln Ser
1 5
<210> 1045
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1045
Gly Lys Asn Asn Arg Pro Ser
1 5
<210> 1046
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1046
Gly Thr Asn Asn Arg Pro Ser
1 5
<210> 1047
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1047
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 1048
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1048
Asp Ala Ser Ser Arg Ala Thr
1 5
<210> 1049
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1049
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 1050
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1050
Gly Ser Ser Asn Arg Ala Thr
1 5
<210> 1051
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1051
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 1052
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1052
Gly Ala Ser Gln Arg Ala Thr
1 5
<210> 1053
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1053
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 1054
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1054
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 1055
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1055
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 1056
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1056
Gly Ala Ser Asn Trp Ala Thr
1 5
<210> 1057
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1057
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 1058
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1058
Gly Thr Ser Ser Arg Ala Thr
1 5
<210> 1059
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1059
Gly Ala Ser Gly Arg Ala Thr
1 5
<210> 1060
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1060
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 1061
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1061
Leu Ala Ser Asn Leu Glu Thr
1 5
<210> 1062
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1062
Leu Ala Ser Asn Val Gln Thr
1 5
<210> 1063
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1063
Leu Ala Ser Asn Val Gln Thr
1 5
<210> 1064
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1064
Gln Gln Tyr His Ser Ser Pro Ser Trp Thr
1 5 10
<210> 1065
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1065
Met Gln Ala Leu Gln Thr Pro Tyr Thr
1 5
<210> 1066
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1066
Met Gln Asn Ile Gln Phe Pro Ser
1 5
<210> 1067
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1067
Met Gln Ala Leu Gln Thr Pro Tyr Thr
1 5
<210> 1068
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1068
Gln Gln Ser Tyr Lys Arg Ala Ser
1 5
<210> 1069
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1069
Met Gln Gly Arg Gln Phe Pro Tyr Ser
1 5
<210> 1070
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1070
Gln Gln Tyr Gly Ser Ser Leu Thr
1 5
<210> 1071
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1071
Gln Gln Tyr Gly Ser Ser Ser Trp Thr
1 5
<210> 1072
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1072
Gln Gln Tyr Gly Ser Ser Pro Pro Trp Thr
1 5 10
<210> 1073
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1073
Gln Gln Ser Tyr Thr Leu Ala
1 5
<210> 1074
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1074
Gln Gln Ser Tyr Ser Thr Pro Tyr Thr
1 5
<210> 1075
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1075
Met Gln Gly Thr His Trp Pro Gly Thr
1 5
<210> 1076
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1076
Gln Gln Tyr Glu Ser Leu Pro Leu Thr
1 5
<210> 1077
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1077
Gln Gln Tyr Asn Asp Trp Leu Pro Val Thr
1 5 10
<210> 1078
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1078
Gln Gln Tyr Ala Gly Ser Pro Pro Phe Thr
1 5 10
<210> 1079
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1079
Leu Gln His Asp Asn Phe Pro Leu Thr
1 5
<210> 1080
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1080
Gln His Tyr Tyr Arg Phe Pro Tyr Ser
1 5
<210> 1081
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1081
Met Gln Ala Leu Gln Thr Pro Tyr Thr
1 5
<210> 1082
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1082
Gln Val Trp Asp Ser Asp Ser Glu His Val Val
1 5 10
<210> 1083
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1083
Gln Ala Trp Asp Asp Thr Thr Val Val
1 5
<210> 1084
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1084
Gln Lys Tyr Asn Ser Ala Pro Phe Thr
1 5
<210> 1085
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1085
Ser Ser Arg Asp Ser Ser Gly Asp His Leu Arg Val
1 5 10
<210> 1086
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1086
Asn Ser Arg Asp Ser Ser Gly His His Leu Leu
1 5 10
<210> 1087
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1087
Gln His Tyr Gly Ser Ser Phe Asn Gly Ser Ser Leu Phe Thr
1 5 10
<210> 1088
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1088
Gln Gln Phe Gly Thr Ser Ser Gly Leu Thr
1 5 10
<210> 1089
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1089
Gln Gln Tyr His Ser Ser Pro Ser Trp Thr
1 5 10
<210> 1090
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1090
Gln Gln Tyr His Ser Ser Pro Ser Trp Thr
1 5 10
<210> 1091
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1091
Gln Gln Ser Tyr Ser Thr Pro Tyr Ser
1 5
<210> 1092
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1092
Gln His Tyr Glu Ser Ser Pro Ser Trp Thr
1 5 10
<210> 1093
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1093
Gln Gln Tyr Gly Ser Pro Pro Arg Phe Thr
1 5 10
<210> 1094
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1094
Gln His Tyr Gly Ser Ser Pro Ser Trp Thr
1 5 10
<210> 1095
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1095
Gln His Tyr Asp Ser Ser Pro Ser Trp Thr
1 5 10
<210> 1096
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1096
Gln Tyr Tyr Gly Thr Ser Pro Met Tyr Thr
1 5 10
<210> 1097
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1097
Met Gln Ala Leu Gln Thr Pro Leu Thr
1 5
<210> 1098
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1098
Gln His Tyr Gly Asn Ser Pro Pro Lys Phe Thr
1 5 10
<210> 1099
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1099
Gln His Tyr Gly Gly Ser Pro Arg Leu Thr
1 5 10
<210> 1100
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1100
Gln Gln His Tyr Ser Thr Pro Trp Thr
1 5
<210> 1101
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1101
Leu Gln Ser Arg Ile Phe Pro Arg Thr
1 5
<210> 1102
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1102
Leu Gln Ser Arg Thr Ile Pro Arg Thr
1 5
<210> 1103
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1103
Leu Gln Ser Arg Thr Ile Pro Arg Thr
1 5
<210> 1104
<211> 41
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 1104
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 1105
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 1105
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 1106
<211> 35
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 1106
Thr Lys Lys Lys Tyr Ser Ser Ser Val His Asp Pro Asn Gly Glu Tyr
1 5 10 15
Met Phe Met Arg Ala Val Asn Thr Ala Lys Lys Ser Arg Leu Thr Asp
20 25 30
Val Thr Leu
35
<210> 1107
<211> 105
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 1107
acaaaaaaga agtattcatc cagtgtgcac gaccctaacg gtgaatacat gttcatgaga 60
gcagtgaaca cagccaaaaa atccagactc acagatgtga cccta 105
<210> 1108
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 1108
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
1 5 10 15
Lys Gly
<210> 1109
<211> 521
<212> ДНК
<213> Unknown
<220>
<223> Описание неизвестного: полинуклеотид промотора PGK дикого типа
<400> 1109
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat 360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc 420
cgcggcgacg caaagggcct tggtgcgggt ctcgtcggcg cagggacgcg tttgggtccc 480
gacggaacct tttccgcgtt ggggttgggg caccataagc t 521
<210> 1110
<211> 118
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 1110
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtg 118
<210> 1111
<211> 221
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 1111
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac g 221
<210> 1112
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 1112
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccg 324
<210> 1113
<211> 422
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 1113
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat 360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc 420
cg 422
<210> 1114
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<220>
<221> MISC_FEATURE
<222> (1)..(3)
<223> Может присутствовать или не присутствовать
<400> 1114
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 10 15
Glu Asn Pro Gly Pro
20
<210> 1115
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<220>
<221> MISC_FEATURE
<222> (1)..(3)
<223> May or may not be present
<400> 1115
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 1116
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<220>
<221> MISC_FEATURE
<222> (1)..(3)
<223> May or may not be present
<400> 1116
Gly Ser Gly Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp
1 5 10 15
Val Glu Ser Asn Pro Gly Pro
20
<210> 1117
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<220>
<221> MISC_FEATURE
<222> (1)..(3)
<223> May or may not be present
<400> 1117
Gly Ser Gly Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala
1 5 10 15
Gly Asp Val Glu Ser Asn Pro Gly Pro
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИЗБИРАТЕЛЬНОЙ ЭКСПРЕССИИ БЕЛКА | 2017 |
|
RU2795467C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА ПРОТИВ МЕЗОТЕЛИНА ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2714902C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2841244C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2826270C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
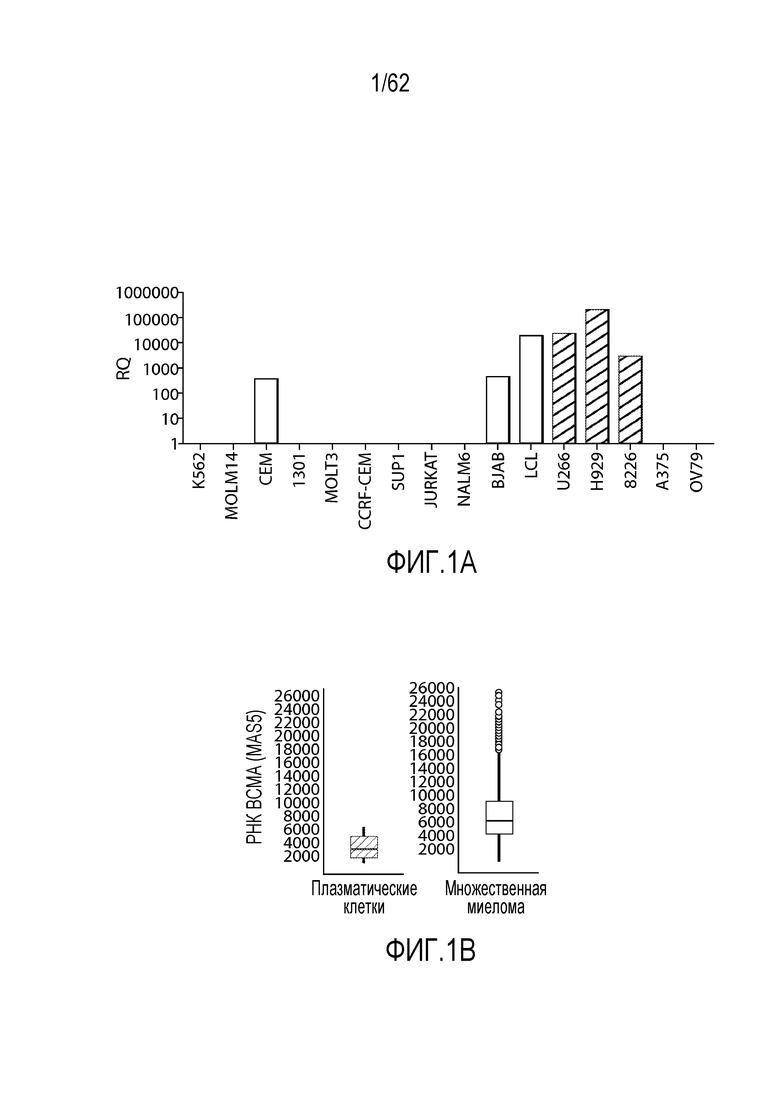
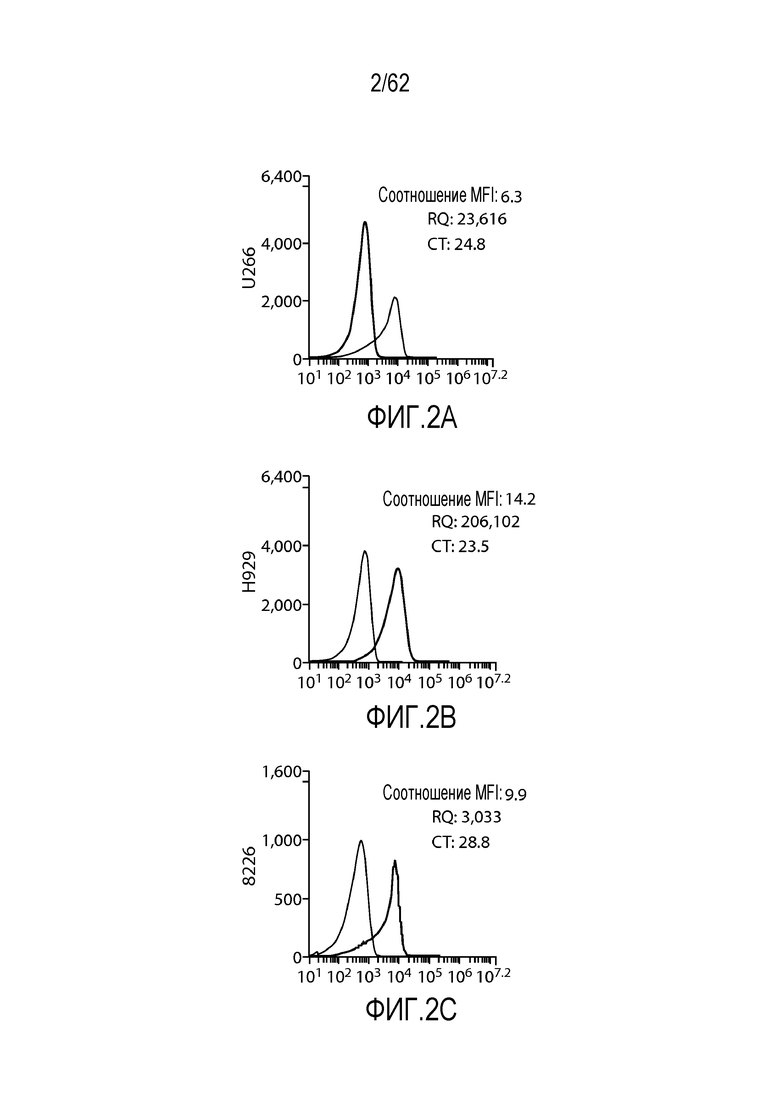
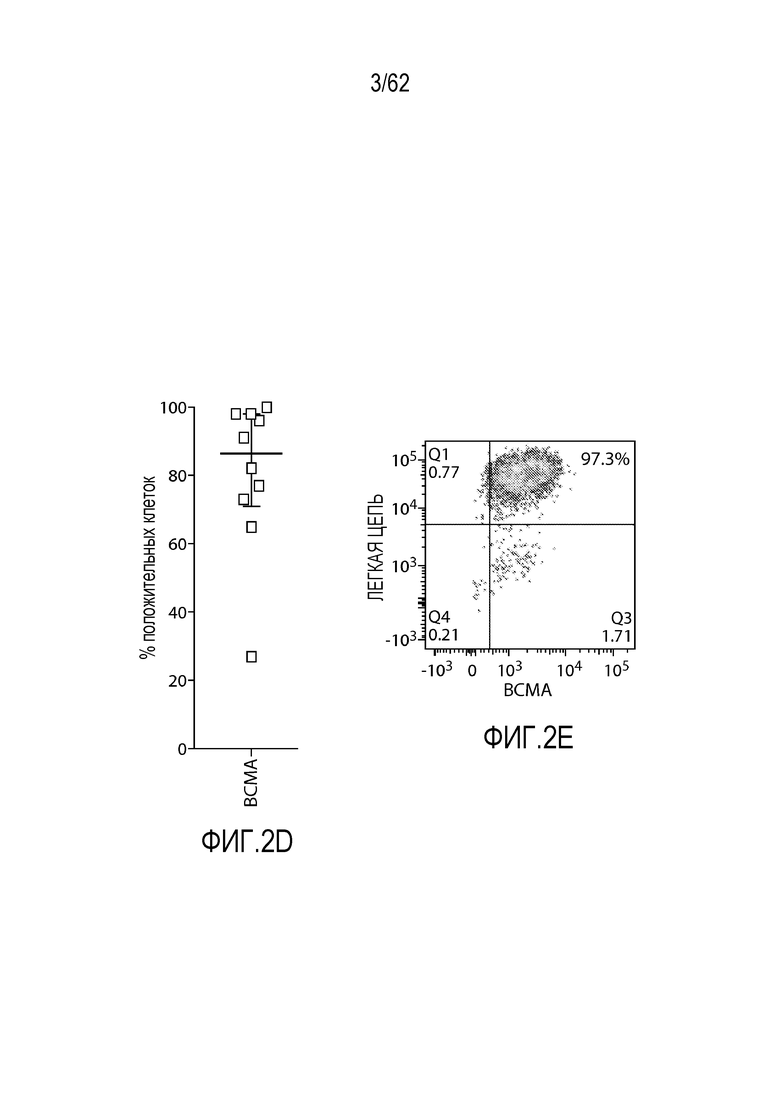

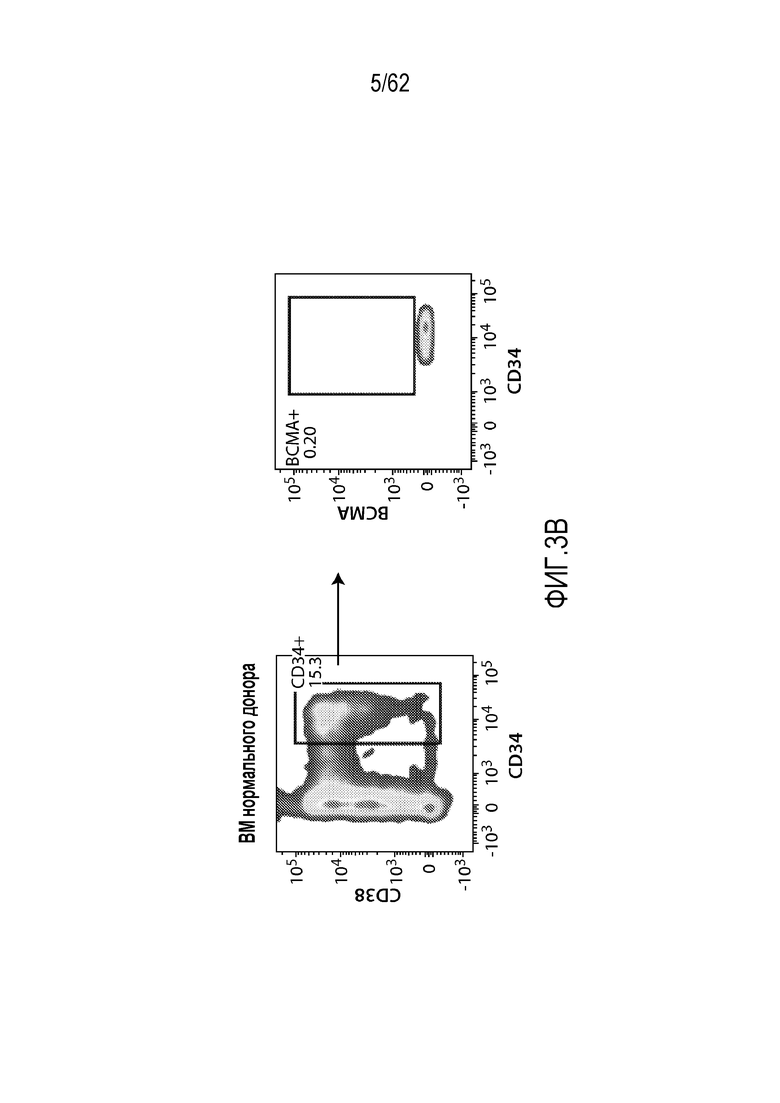
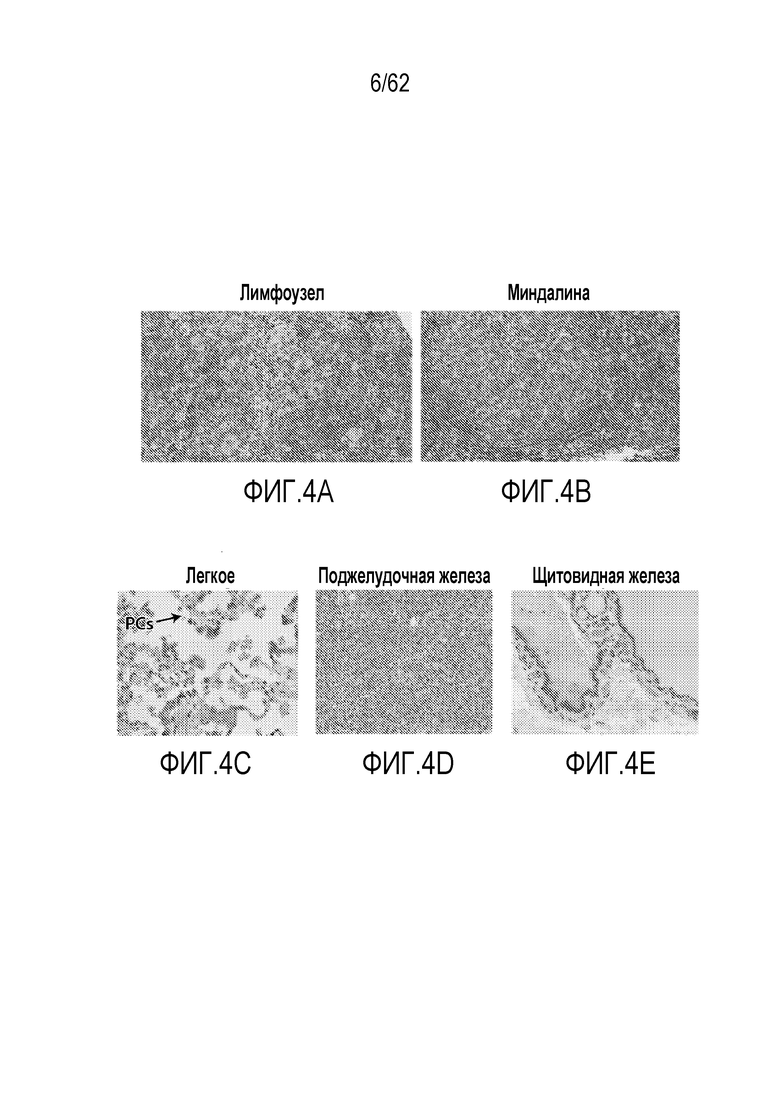

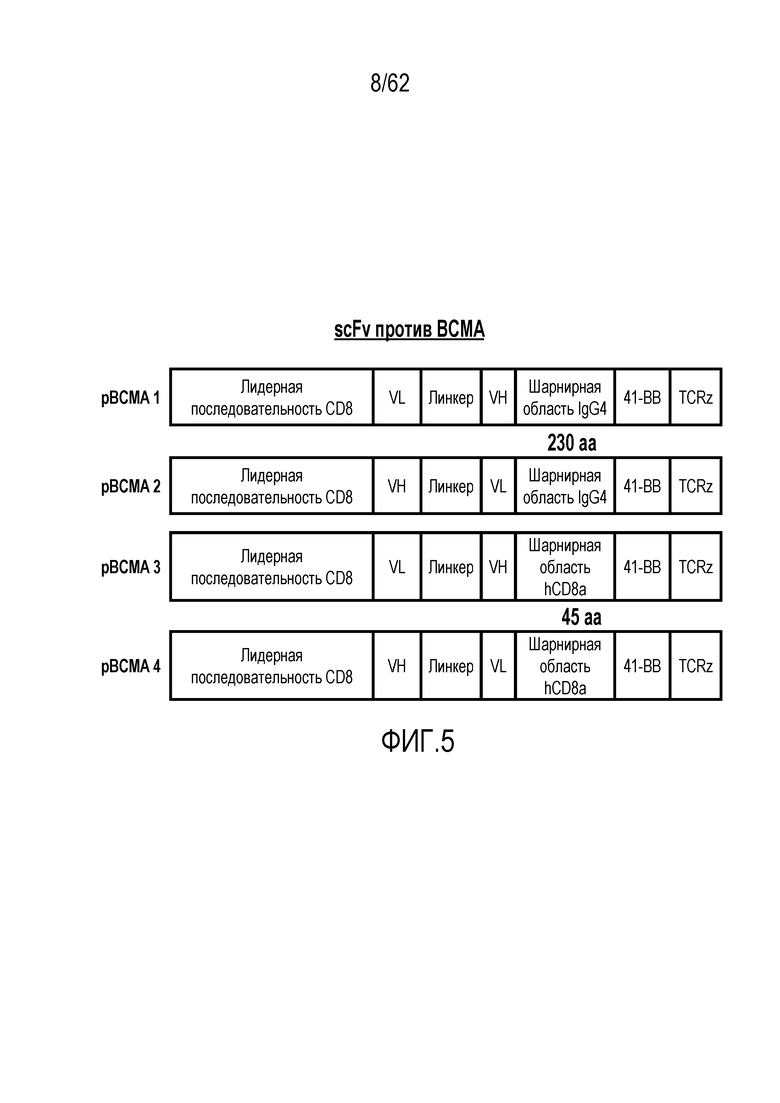
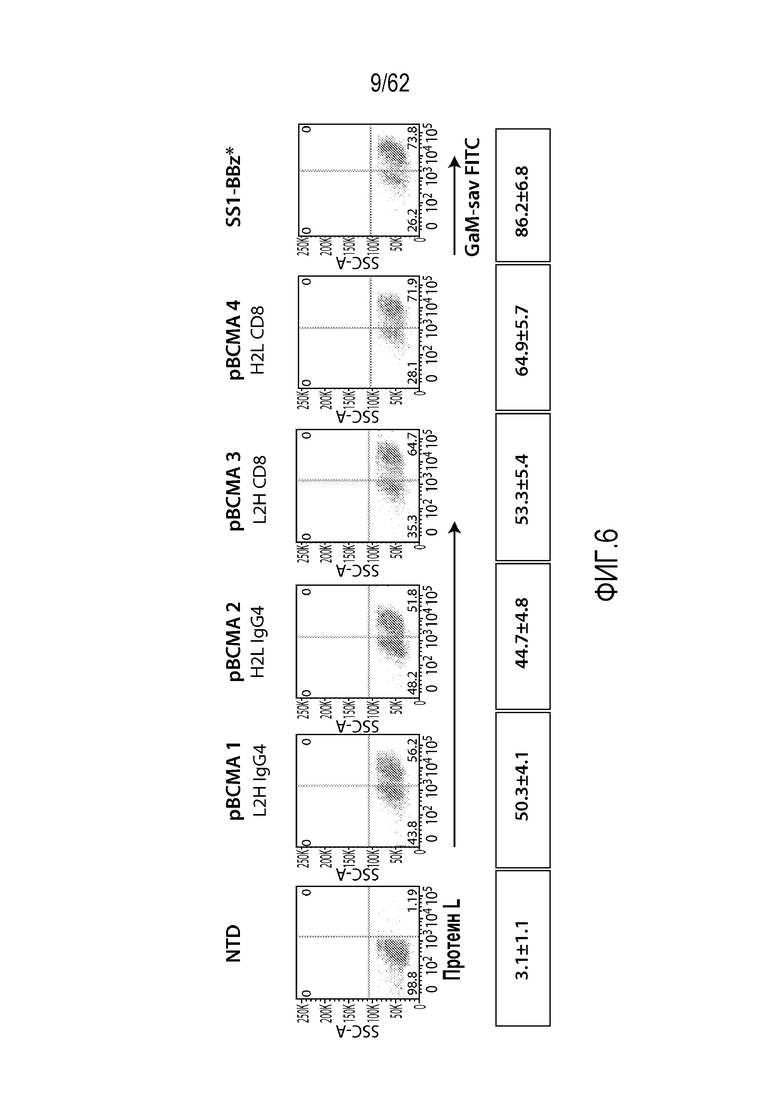
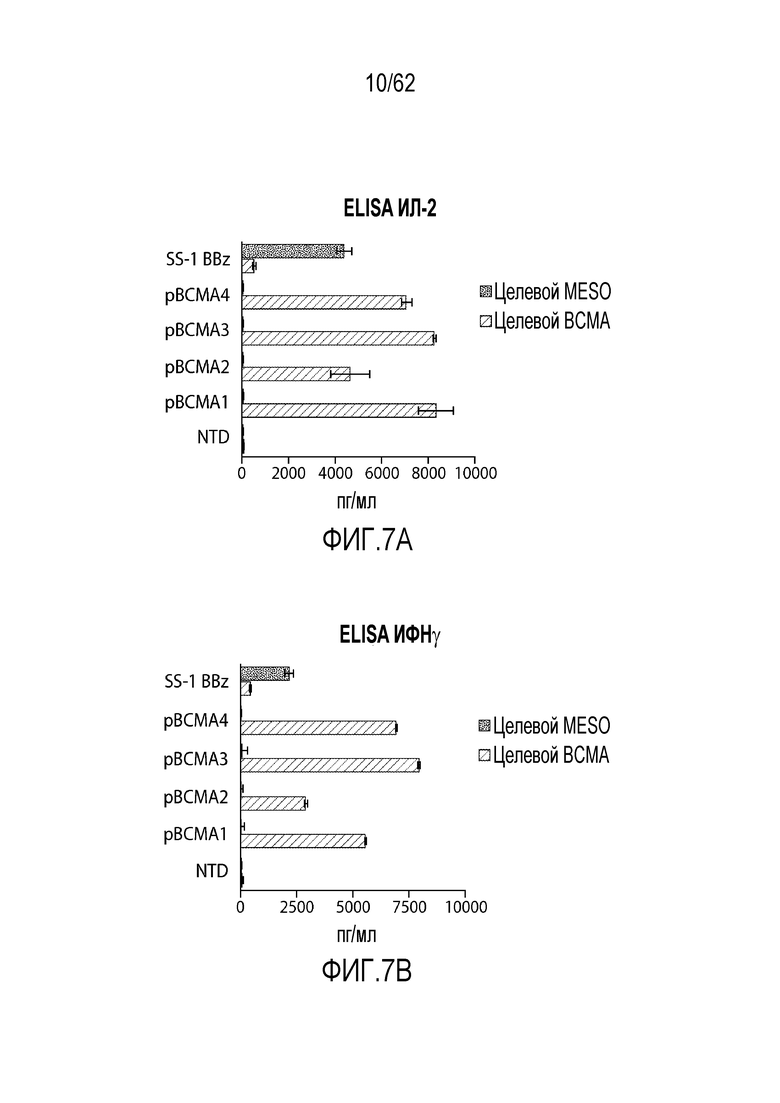
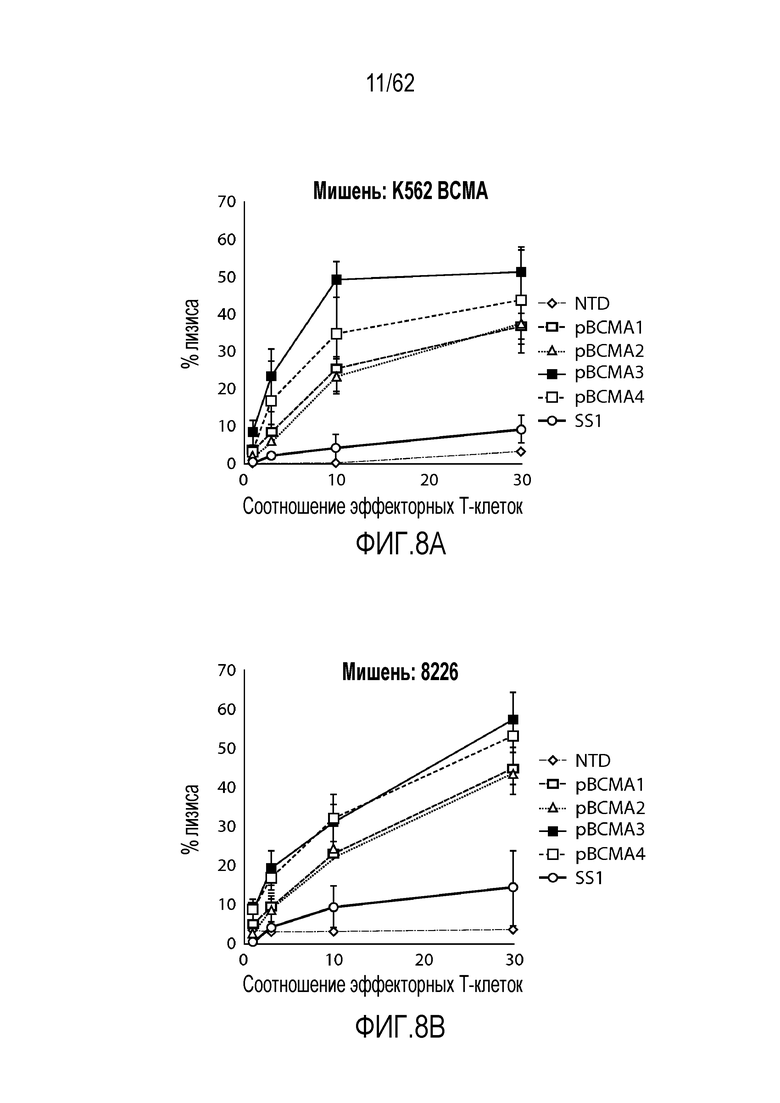
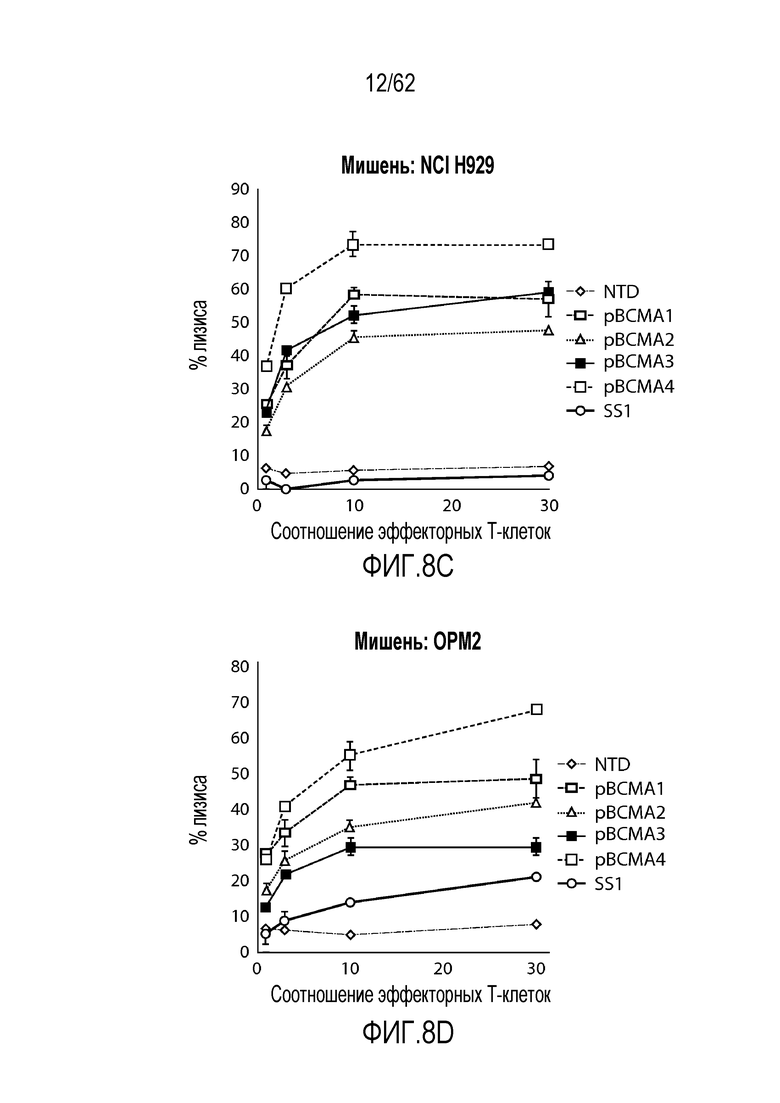
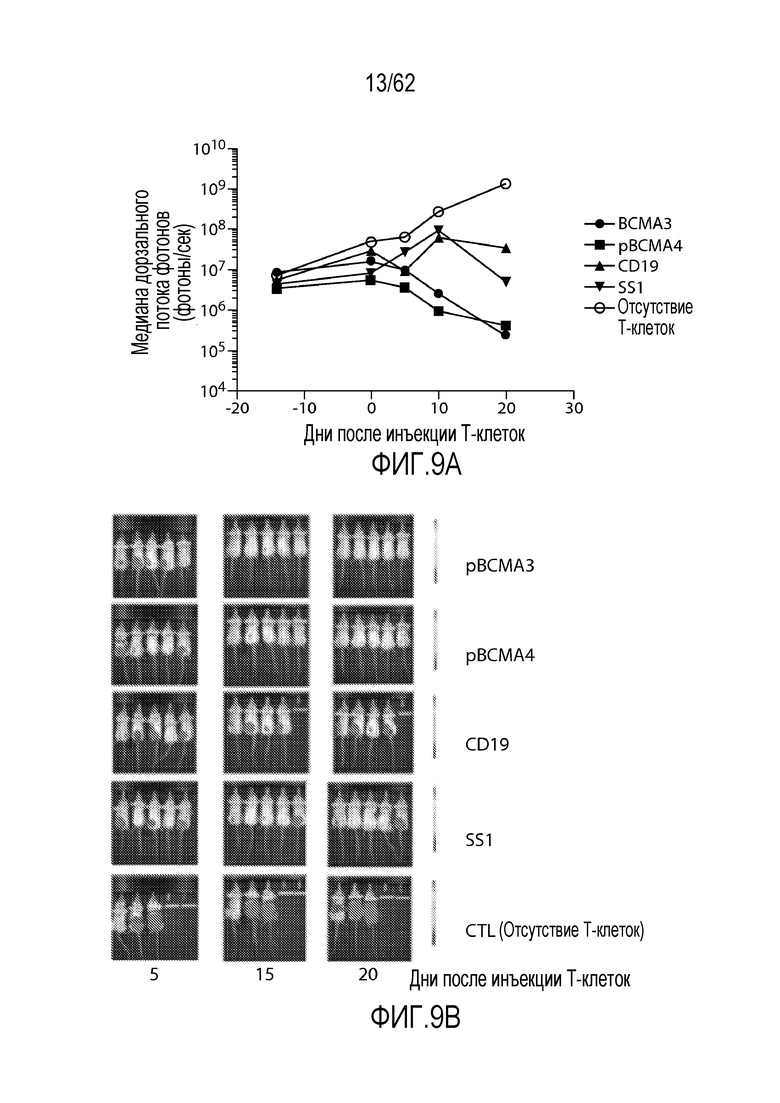
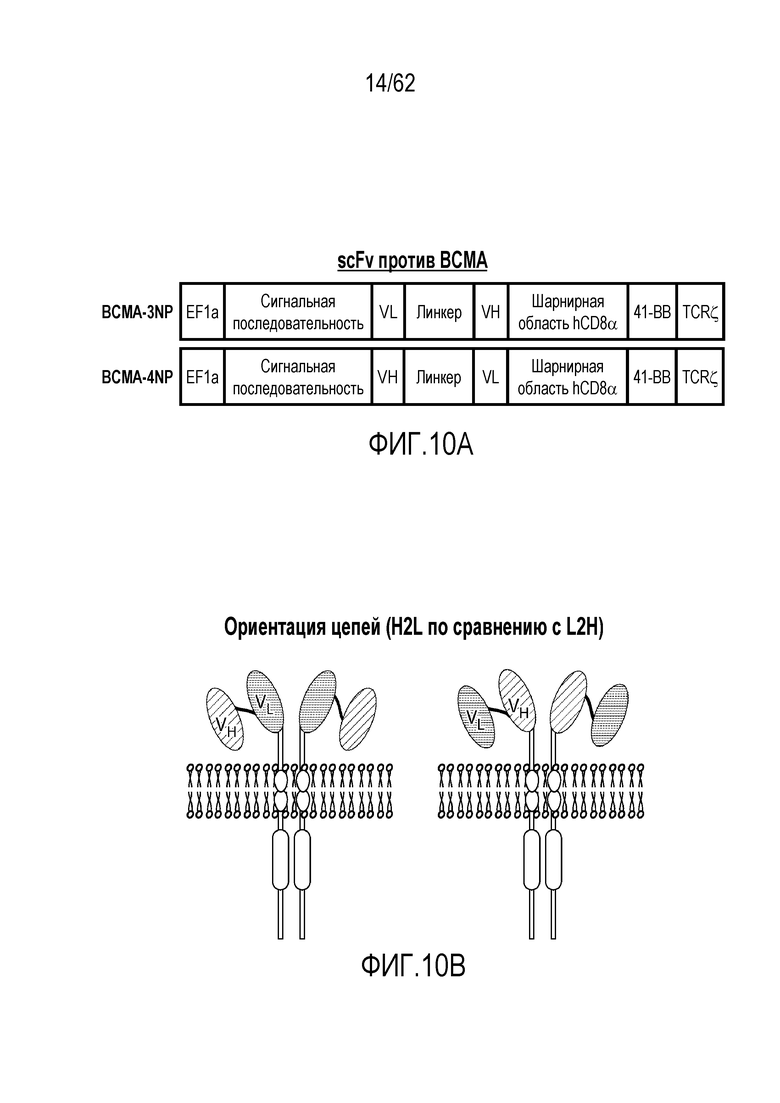
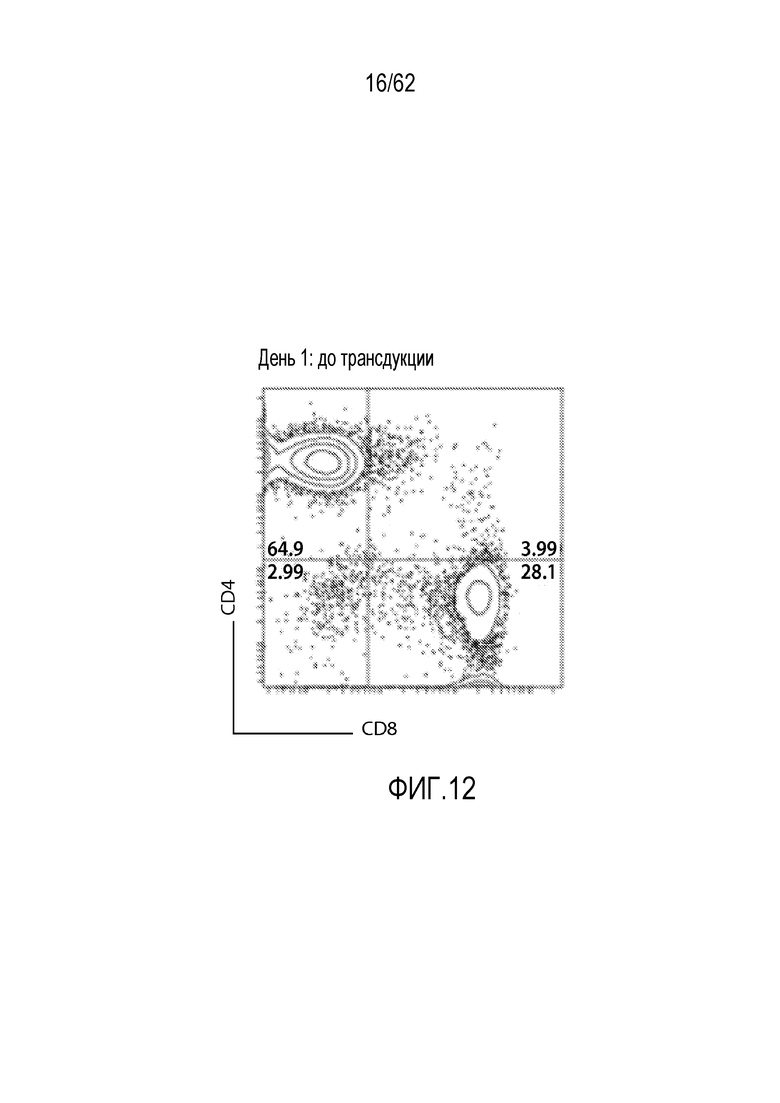
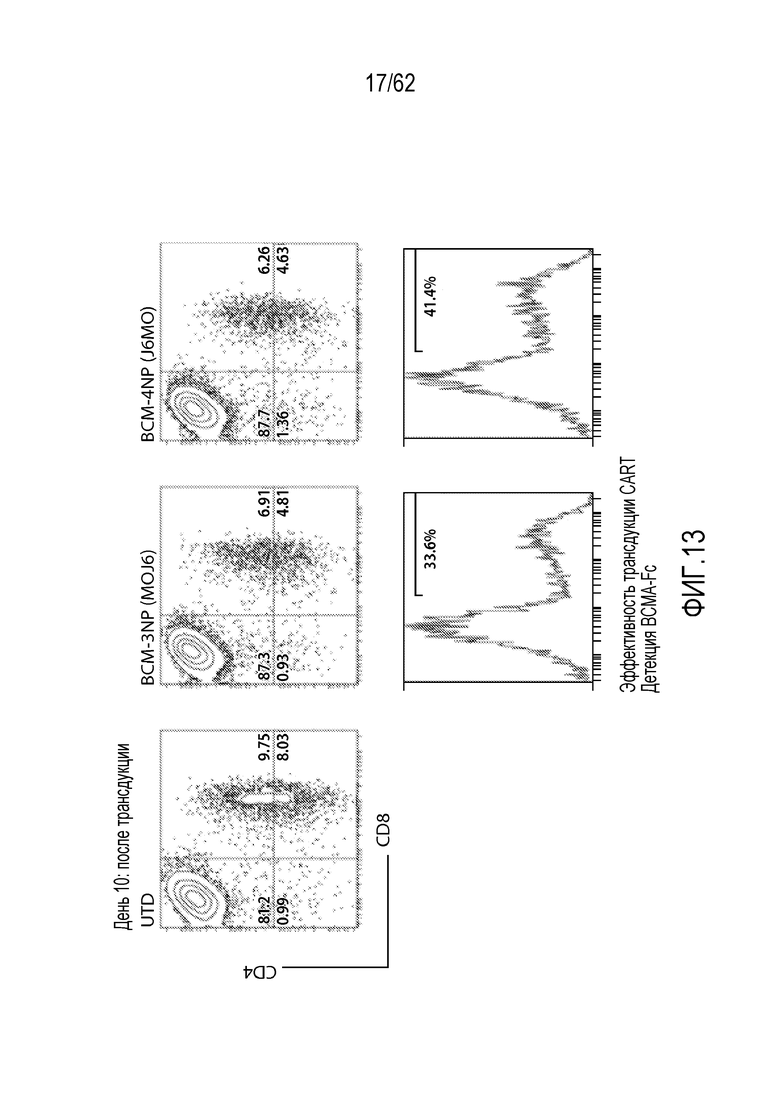
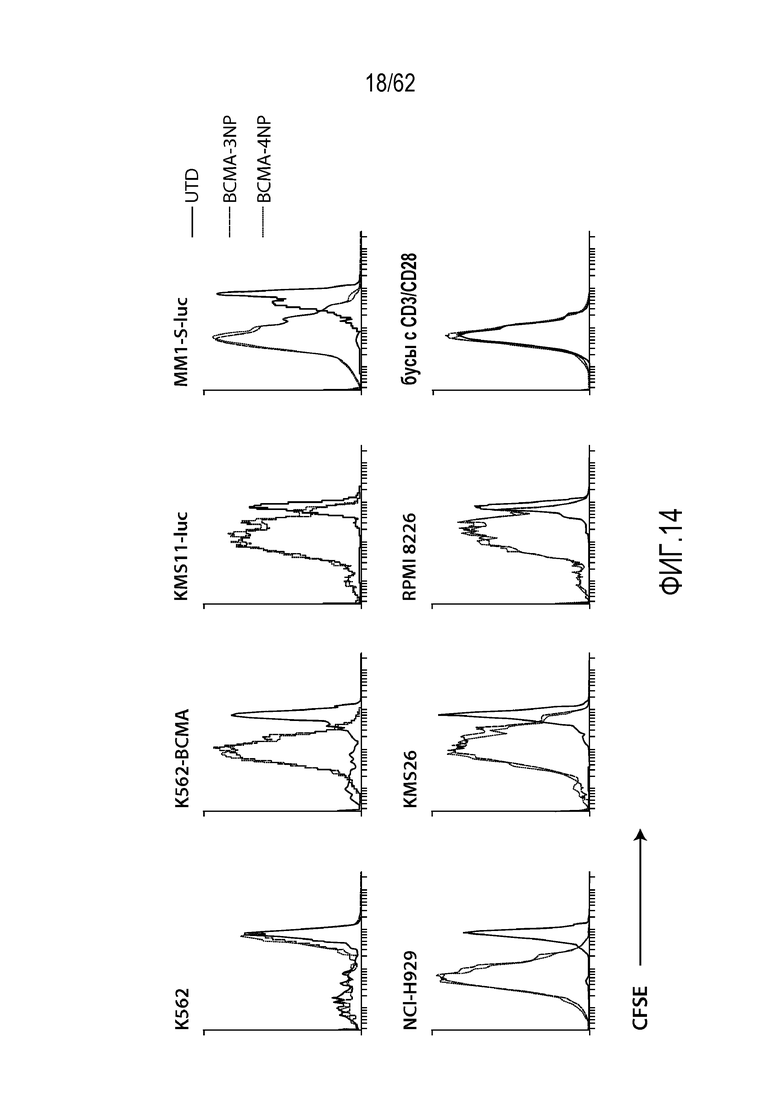
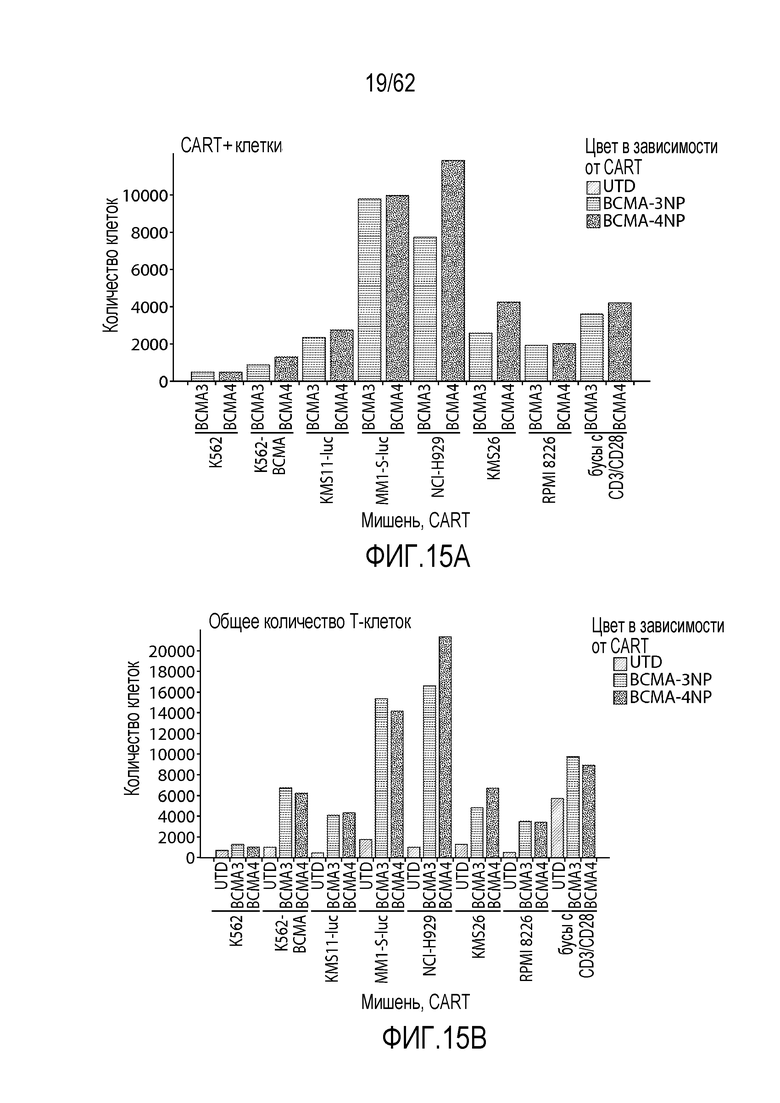
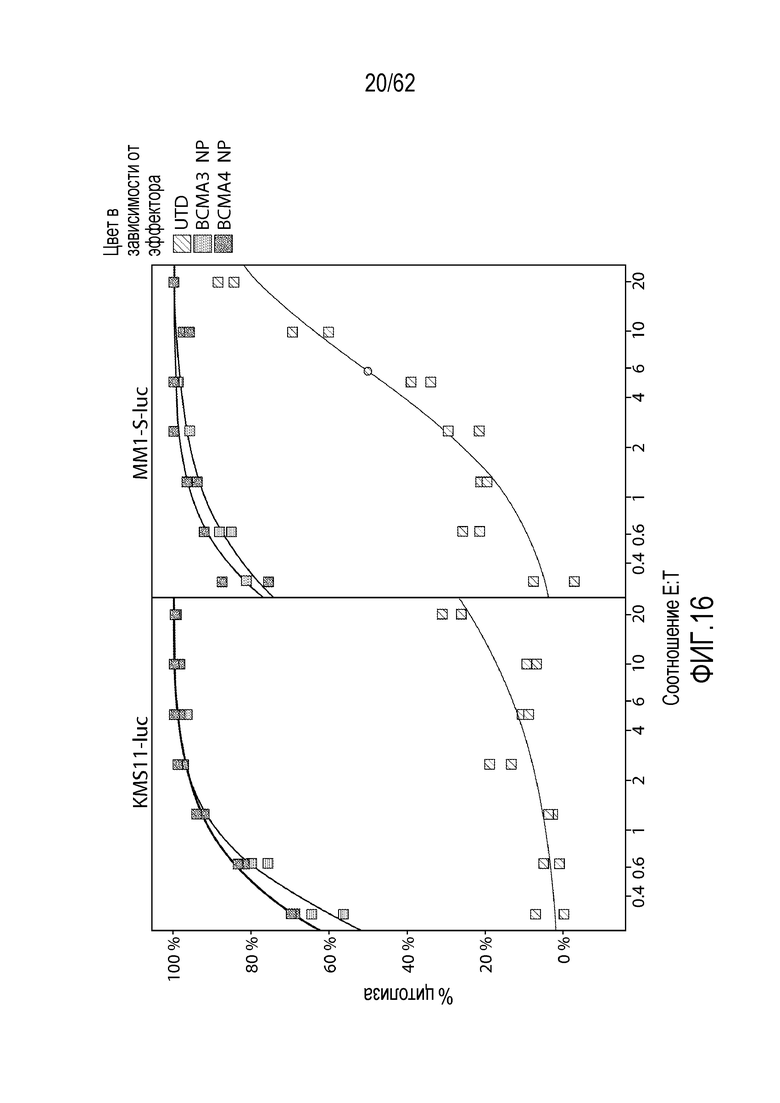
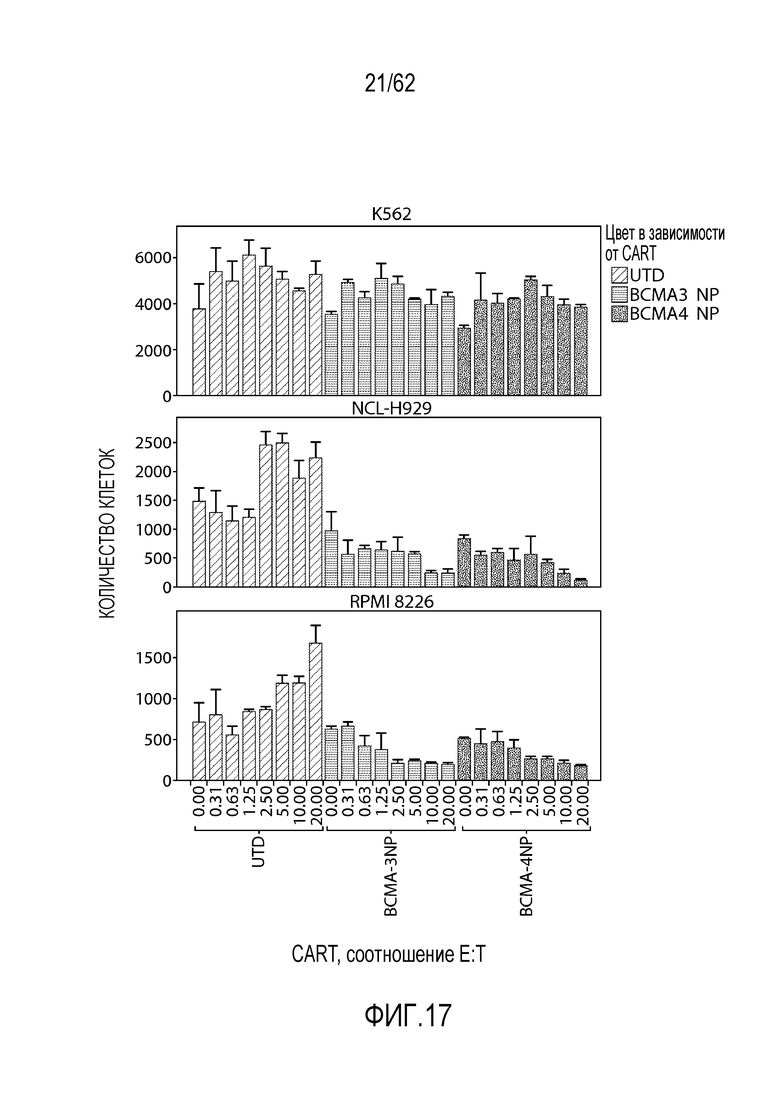
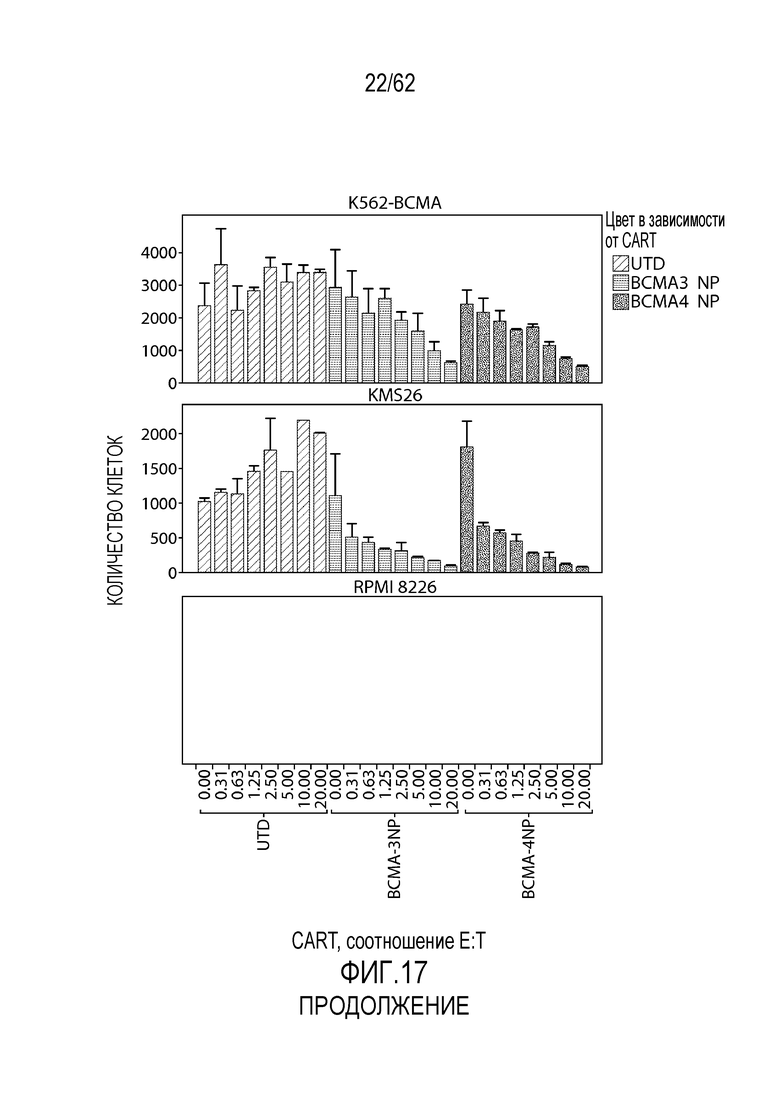
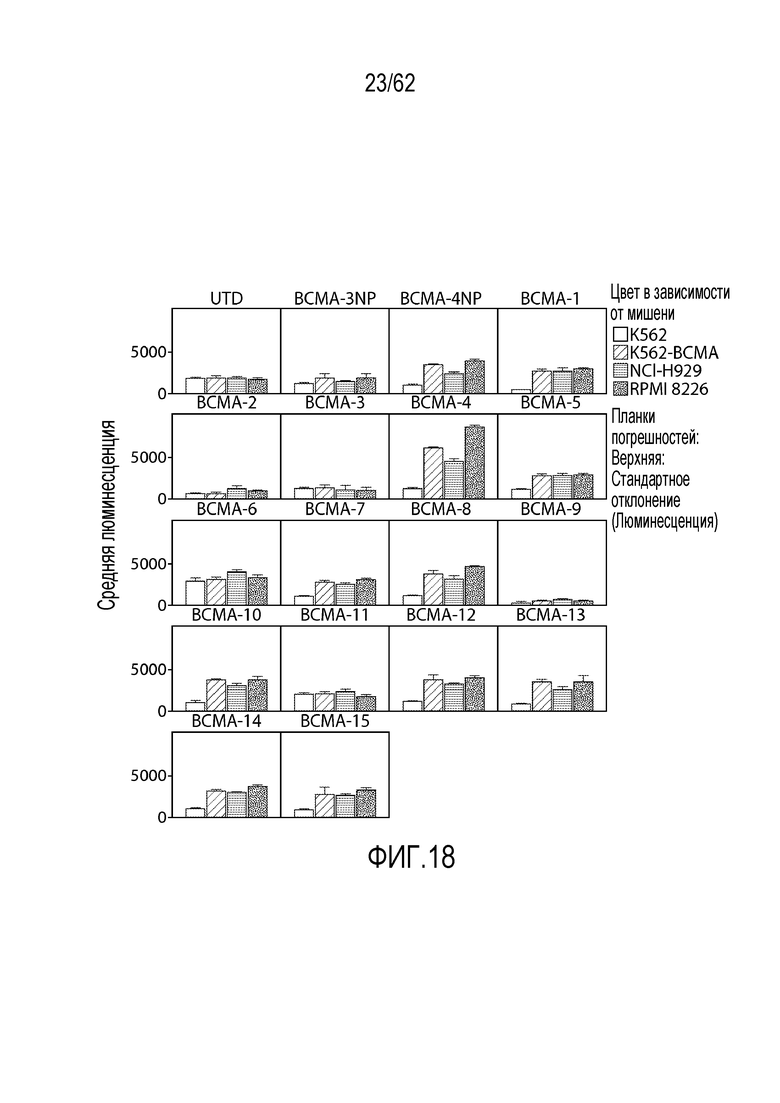
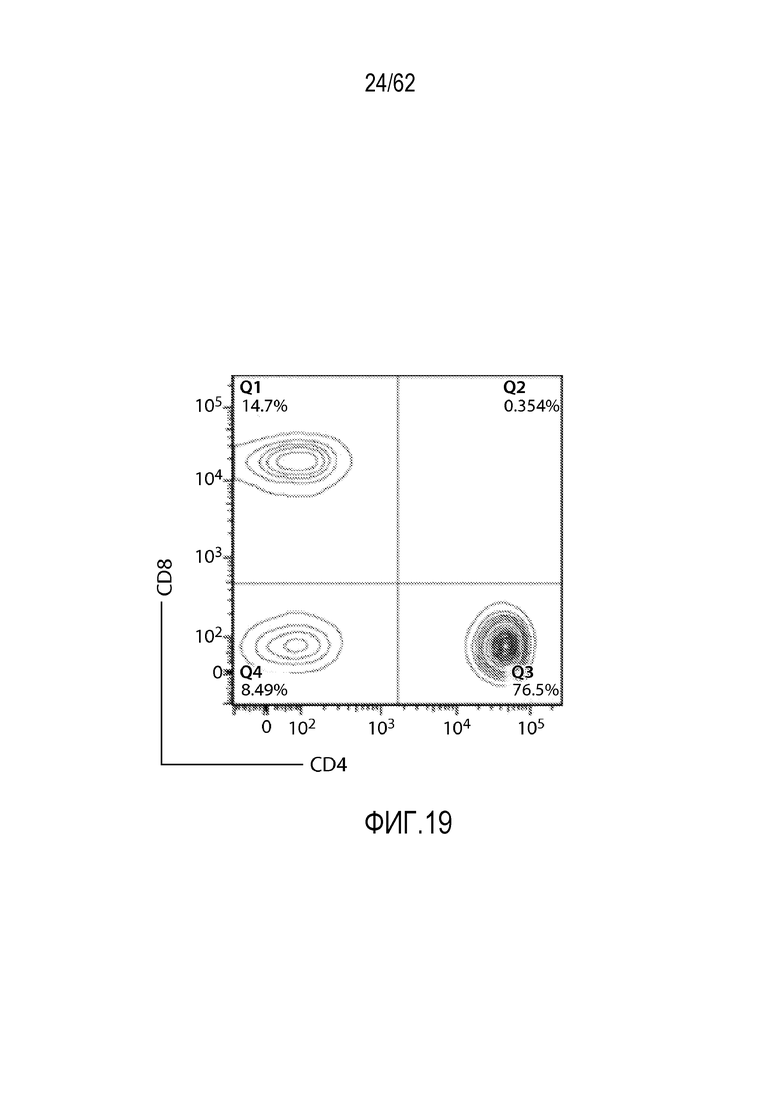
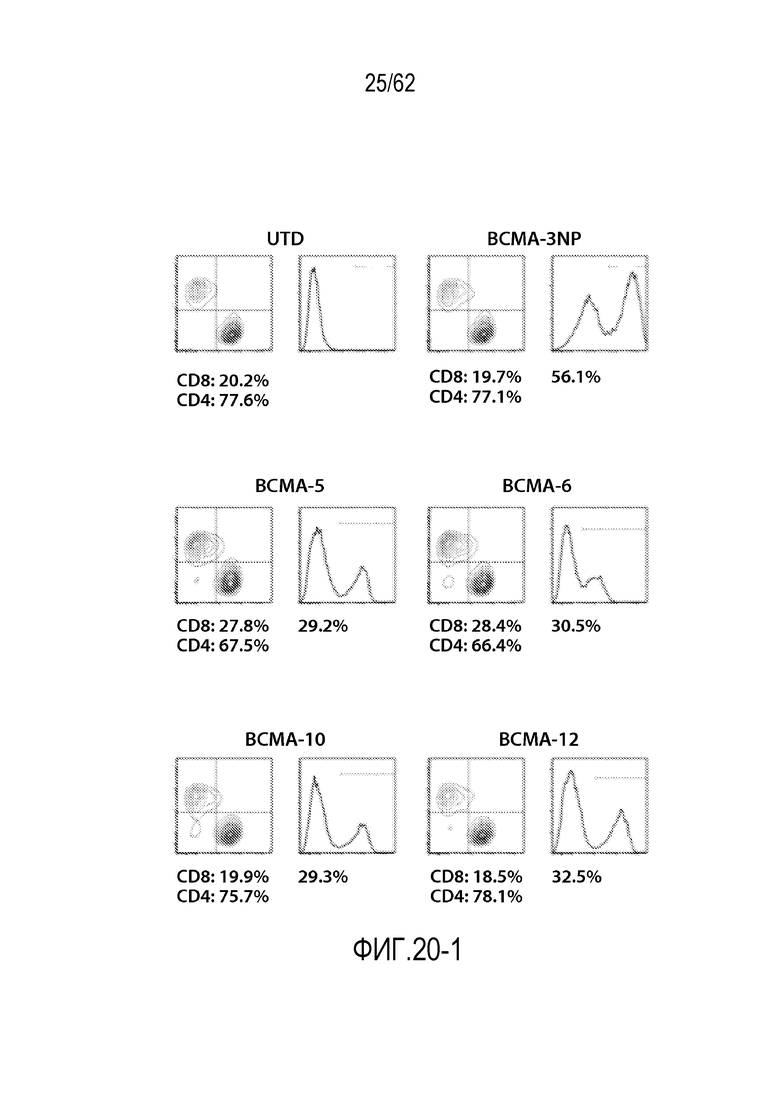
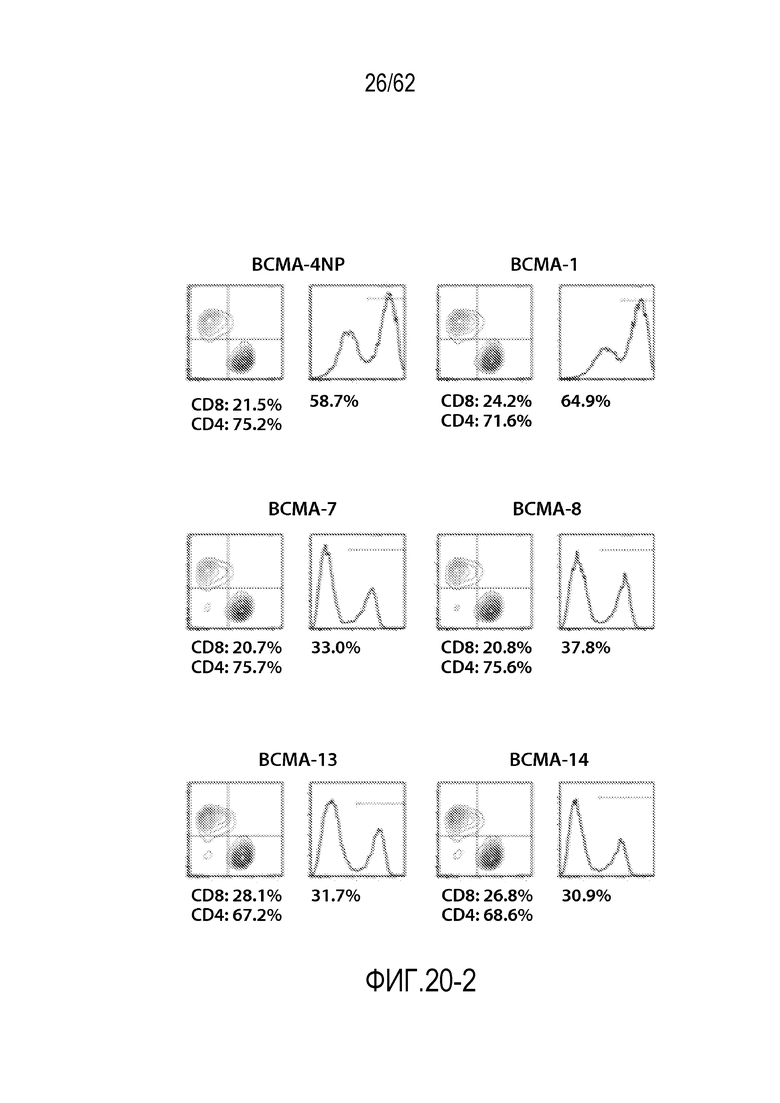
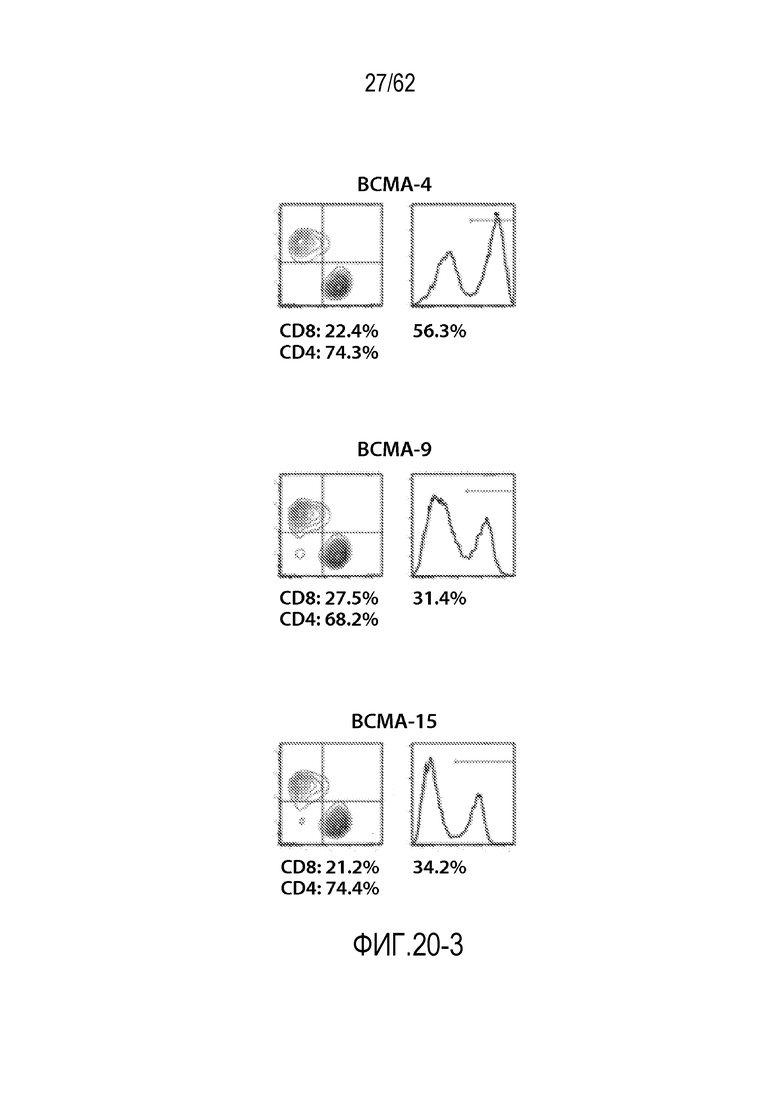
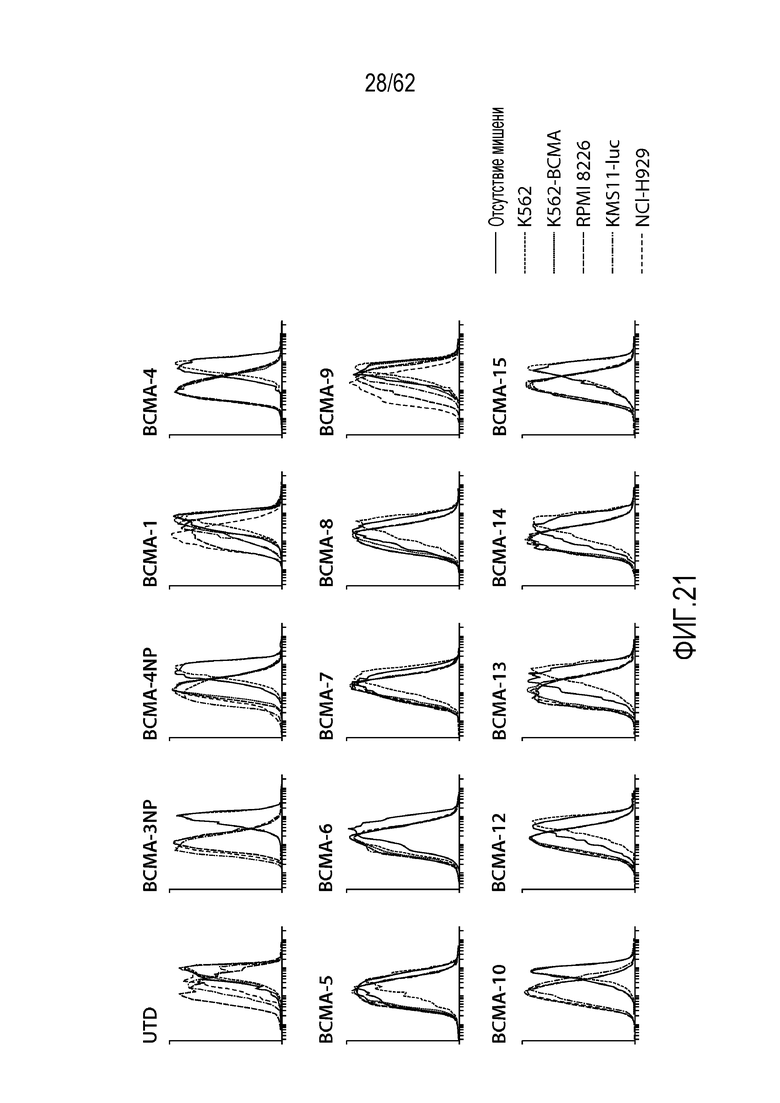
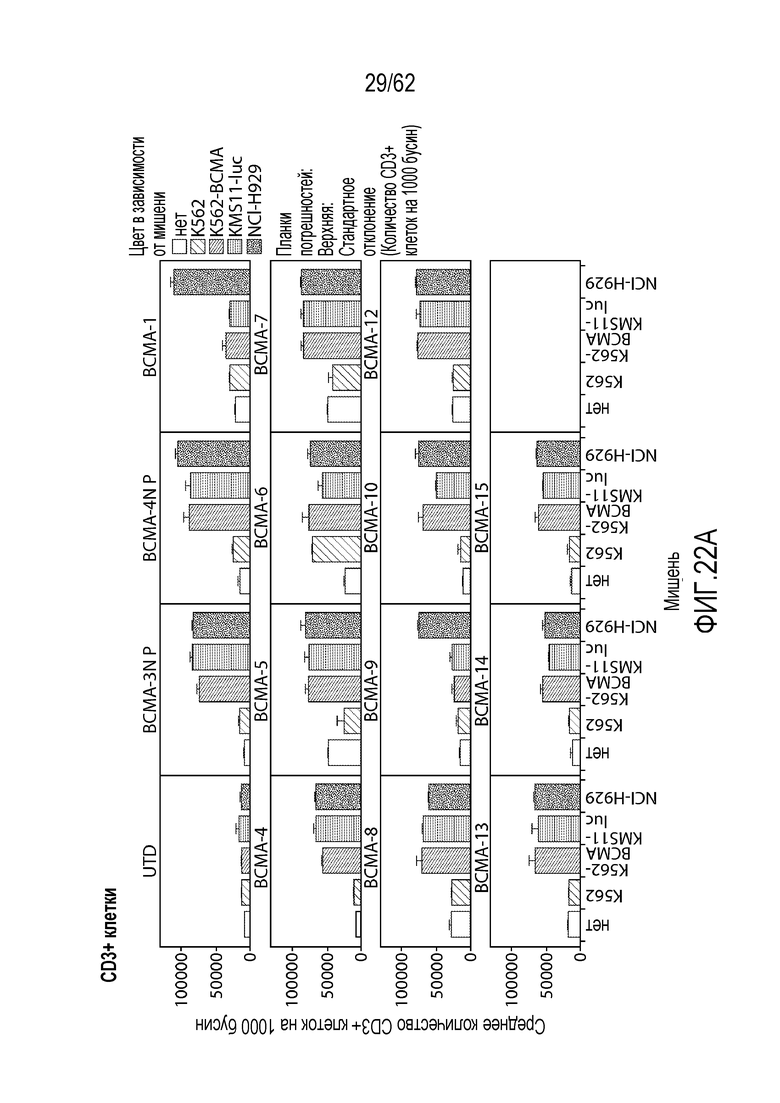
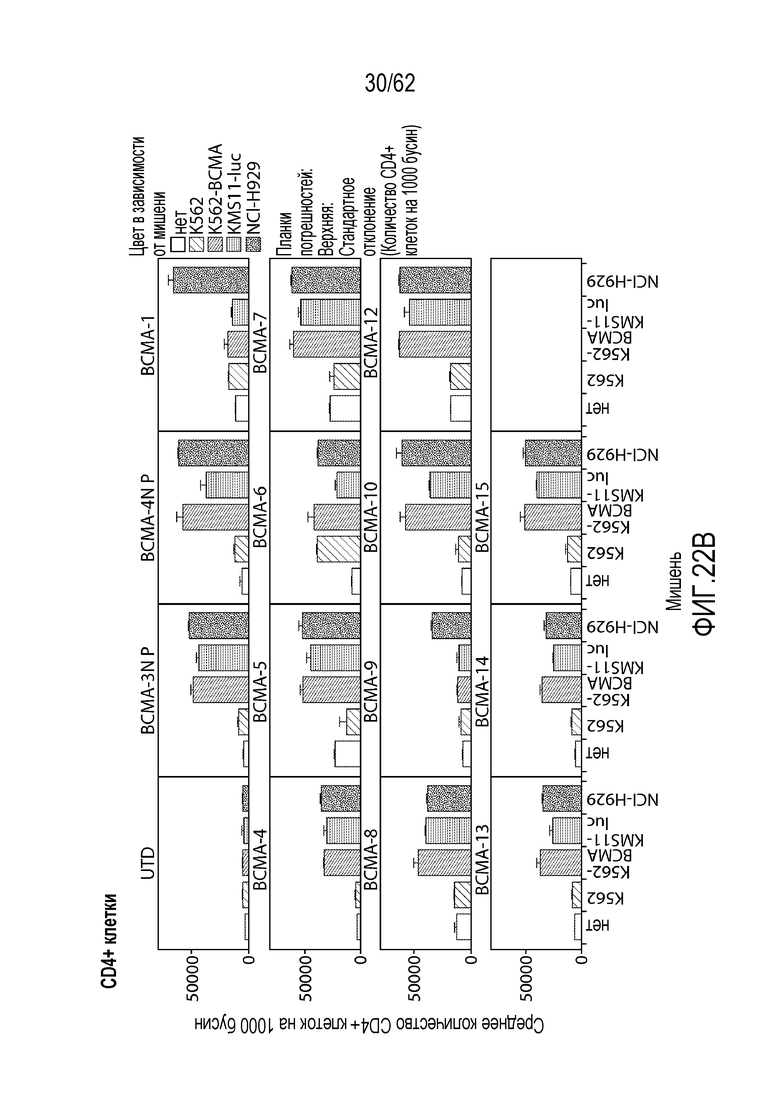
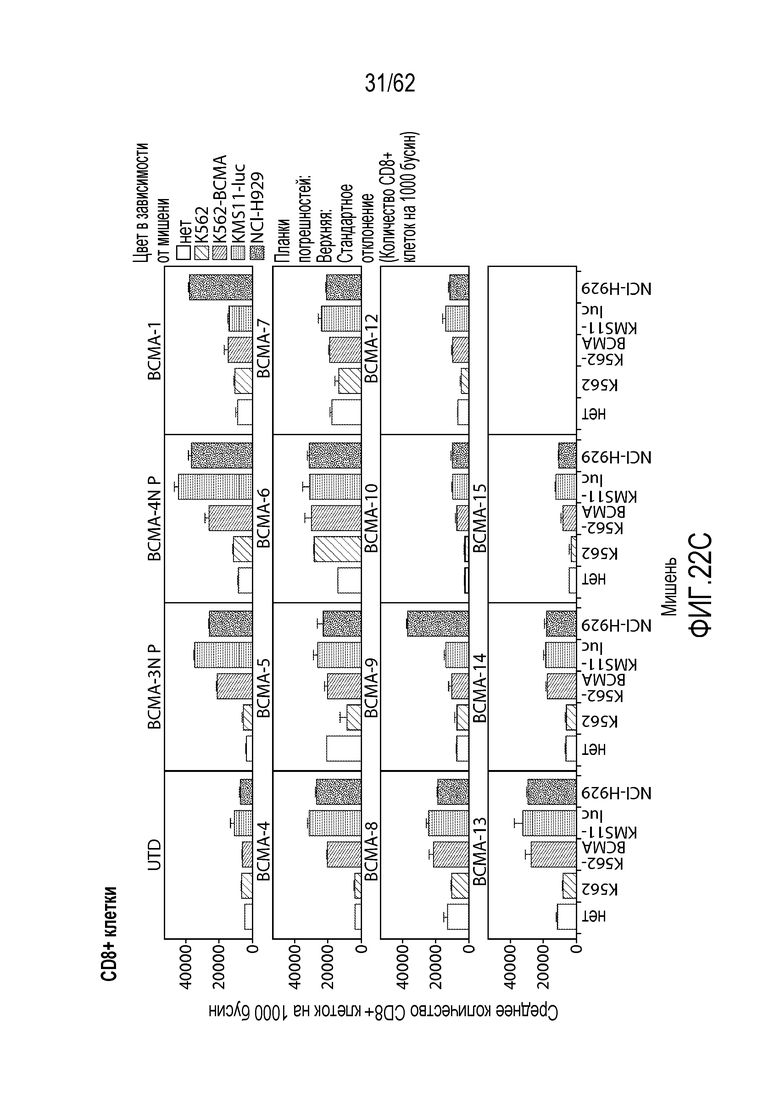
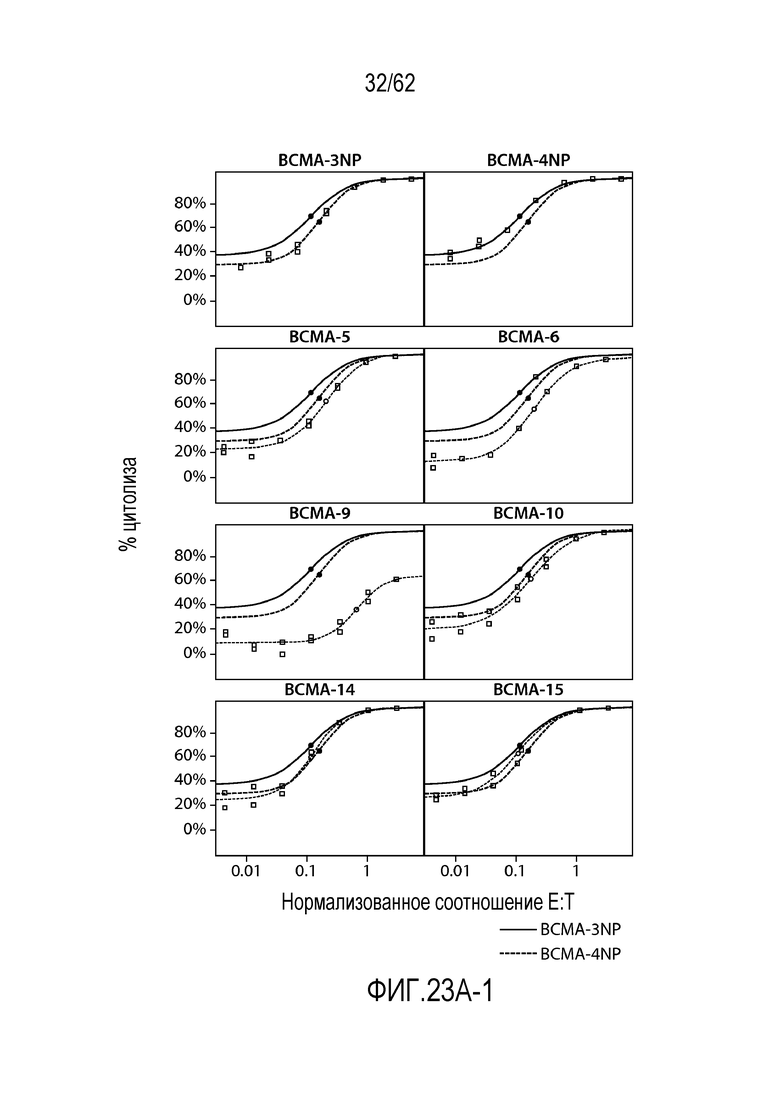
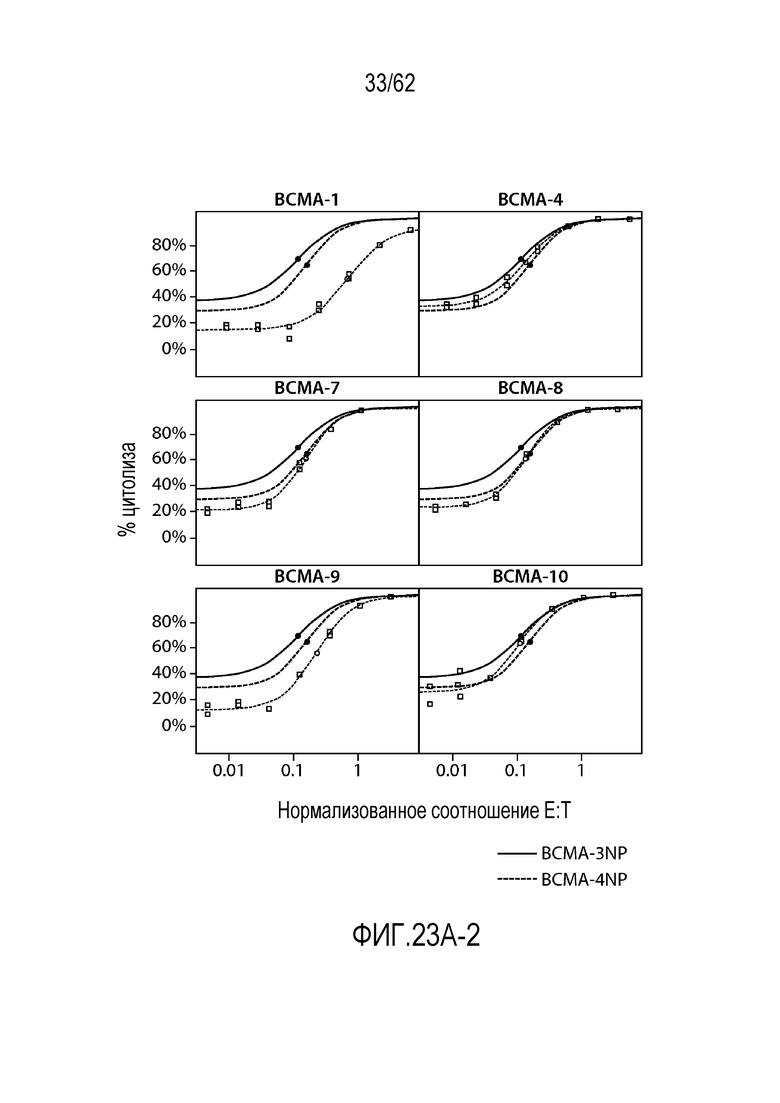
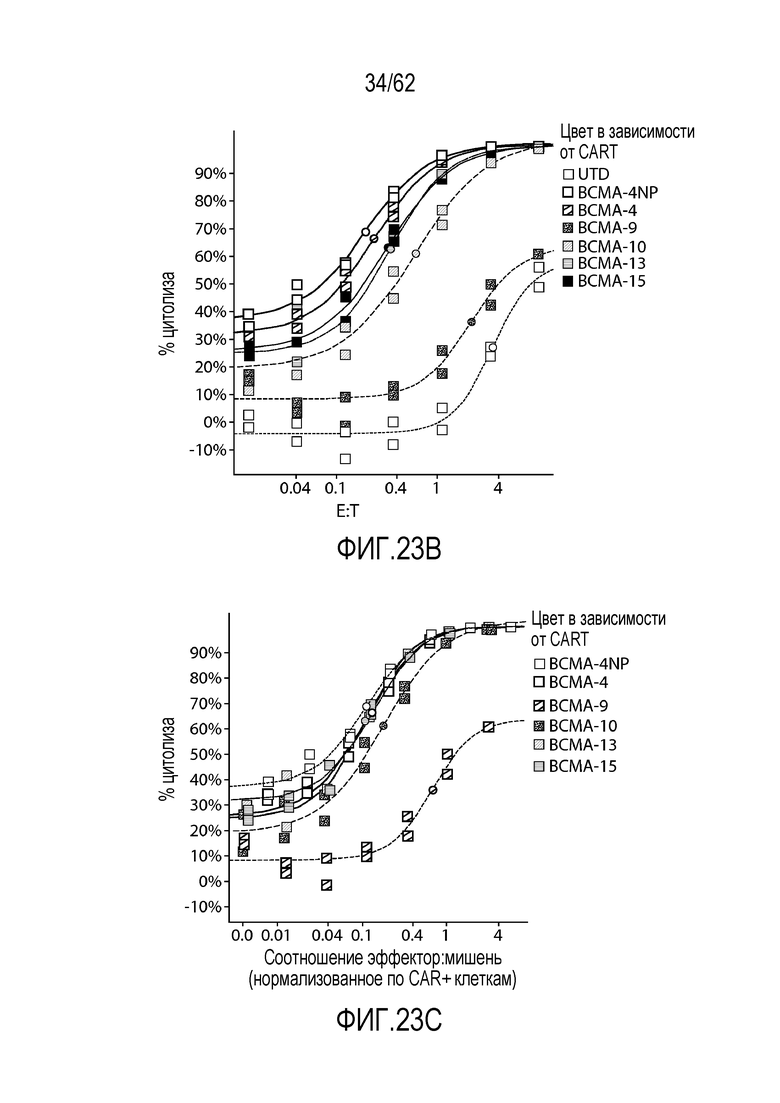
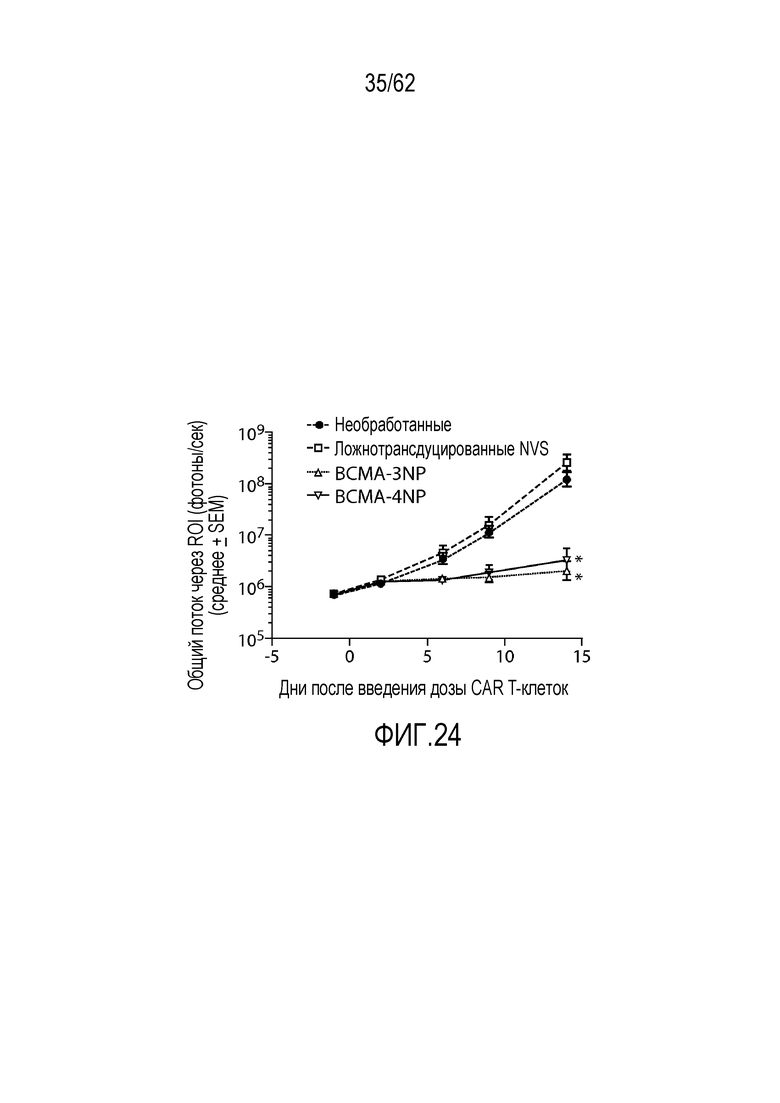
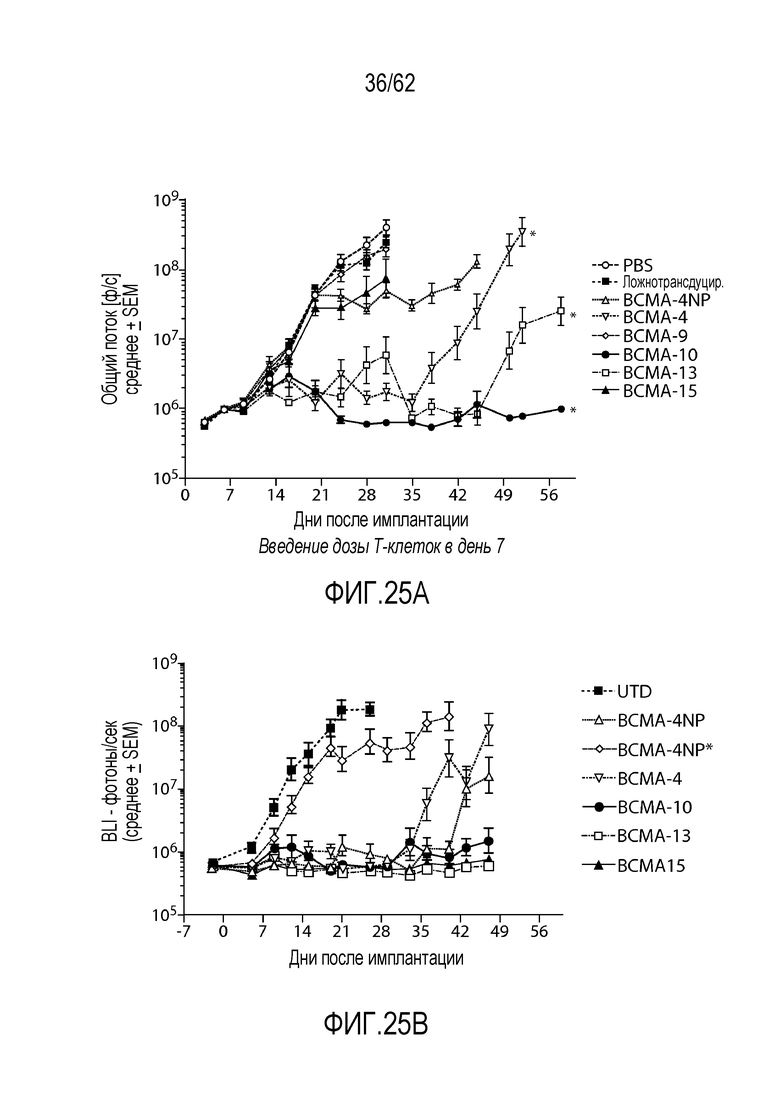
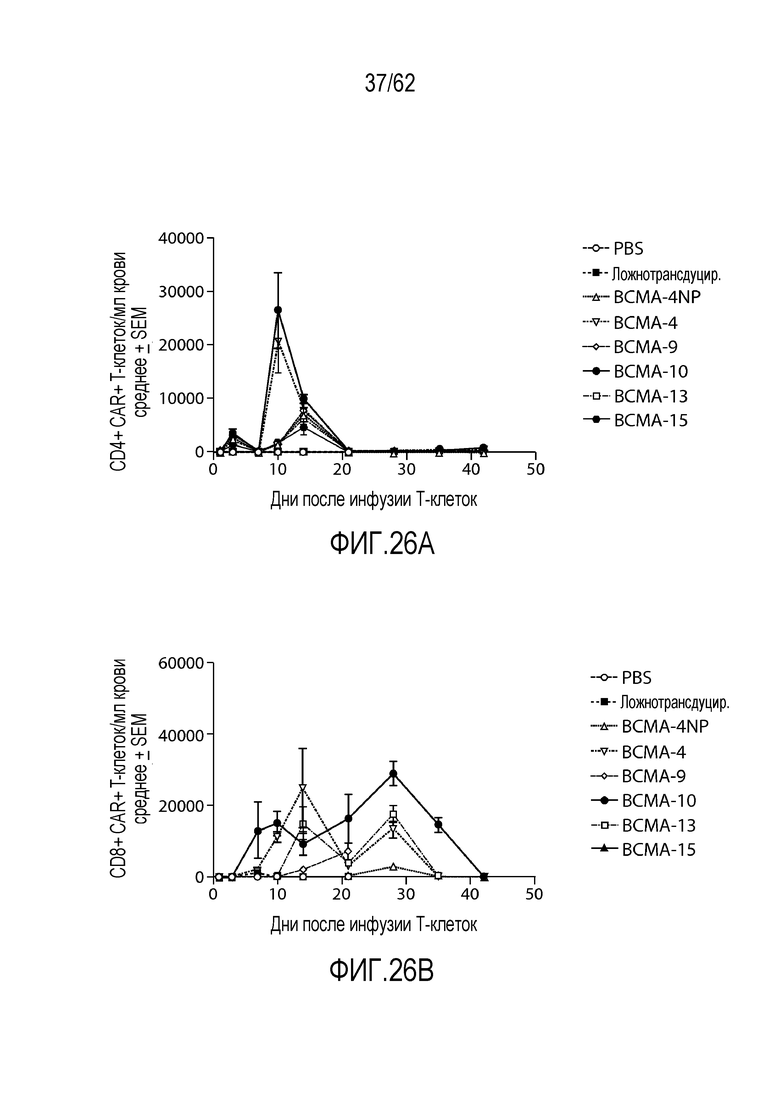
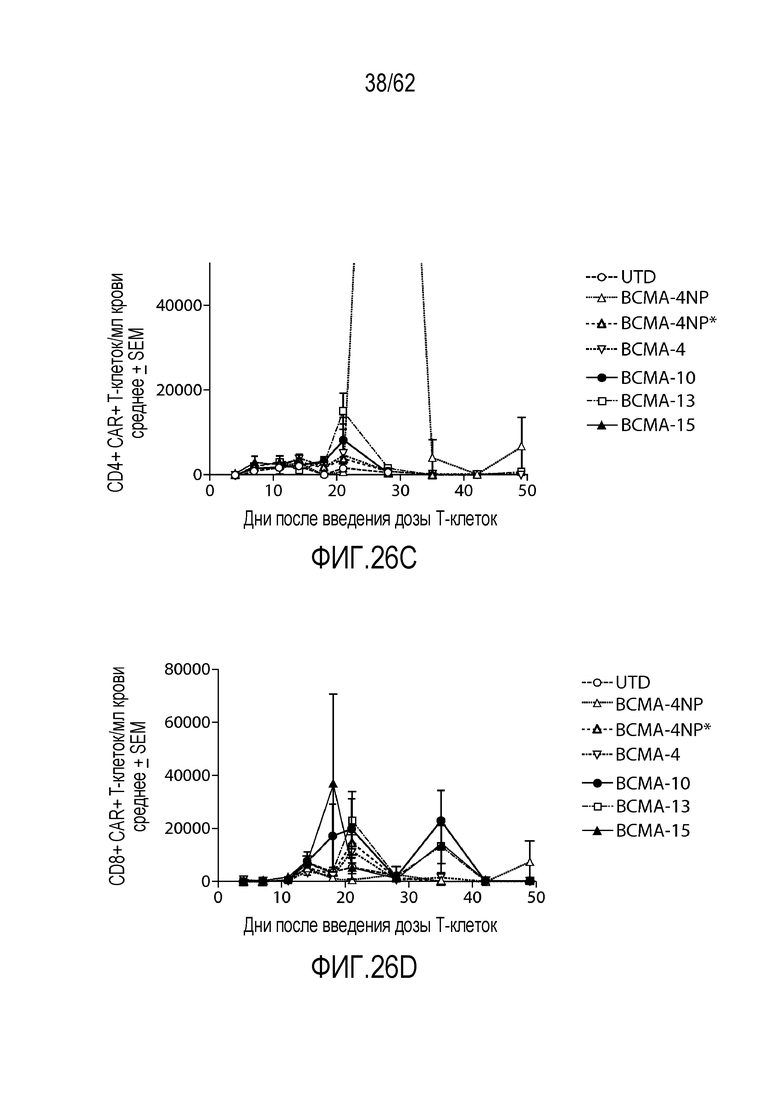
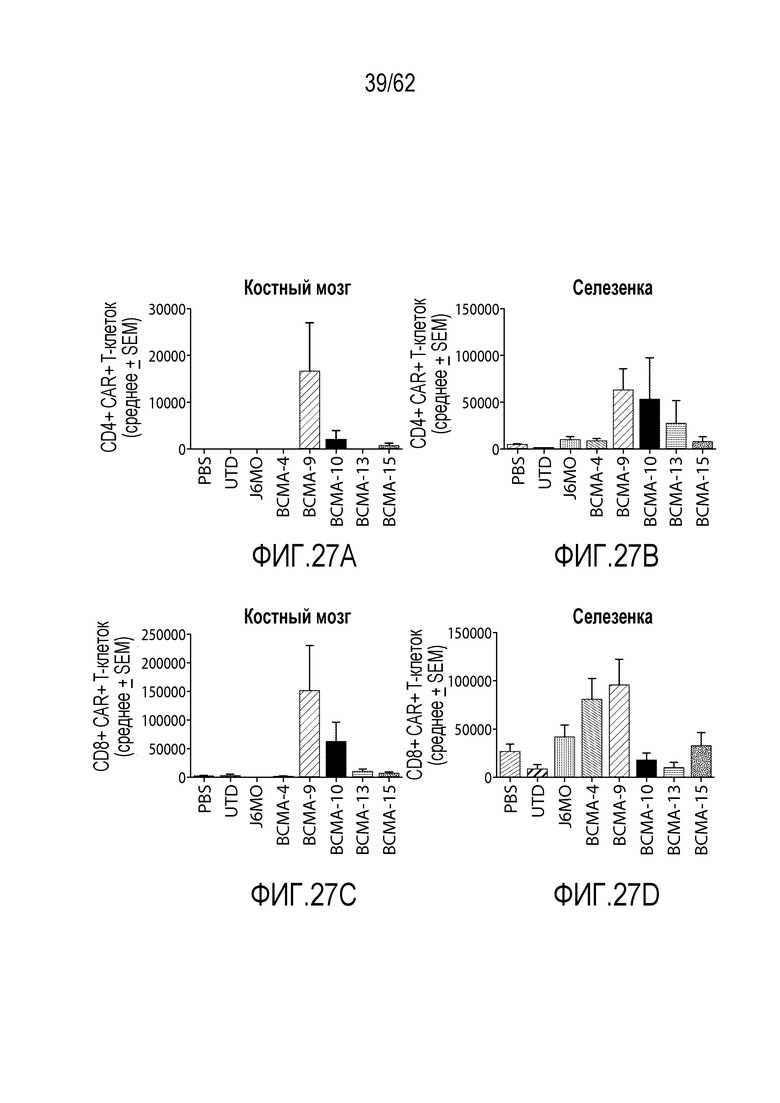
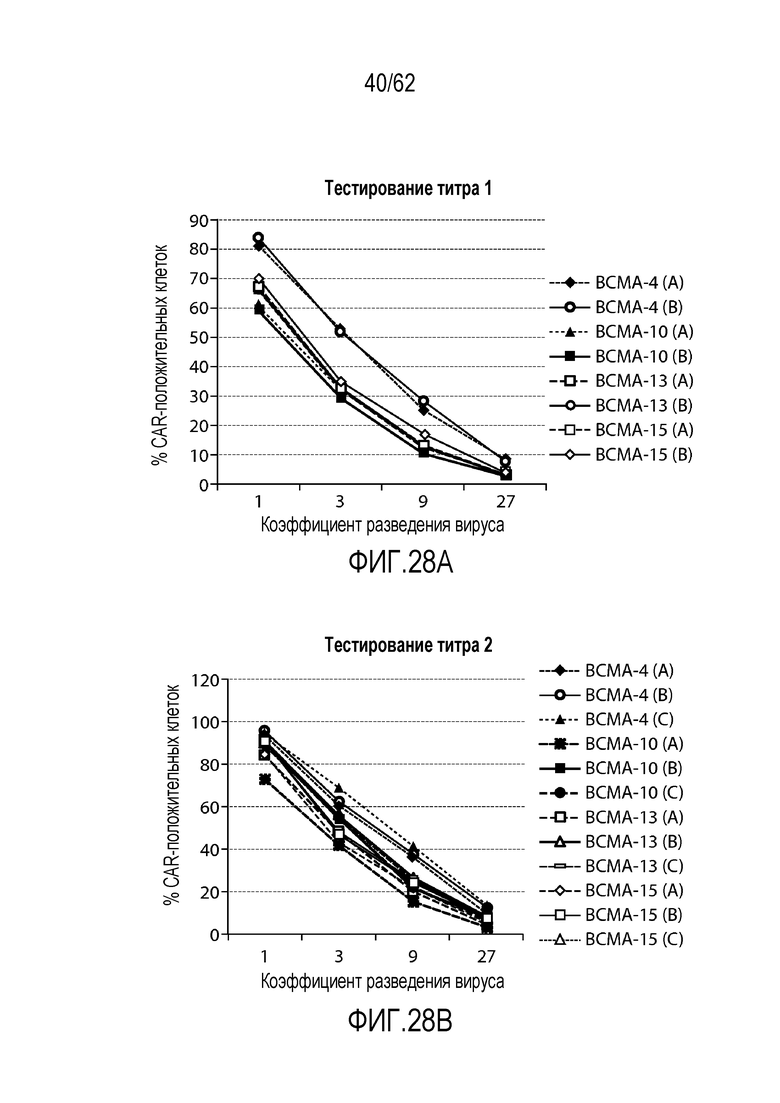
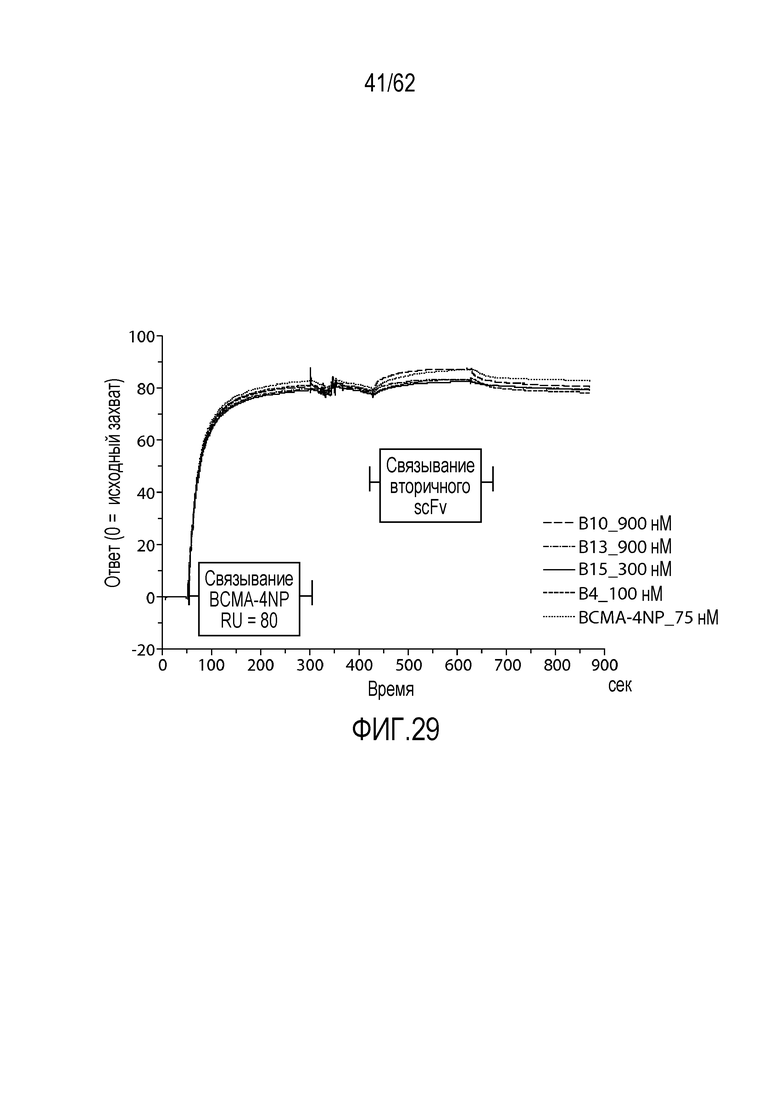
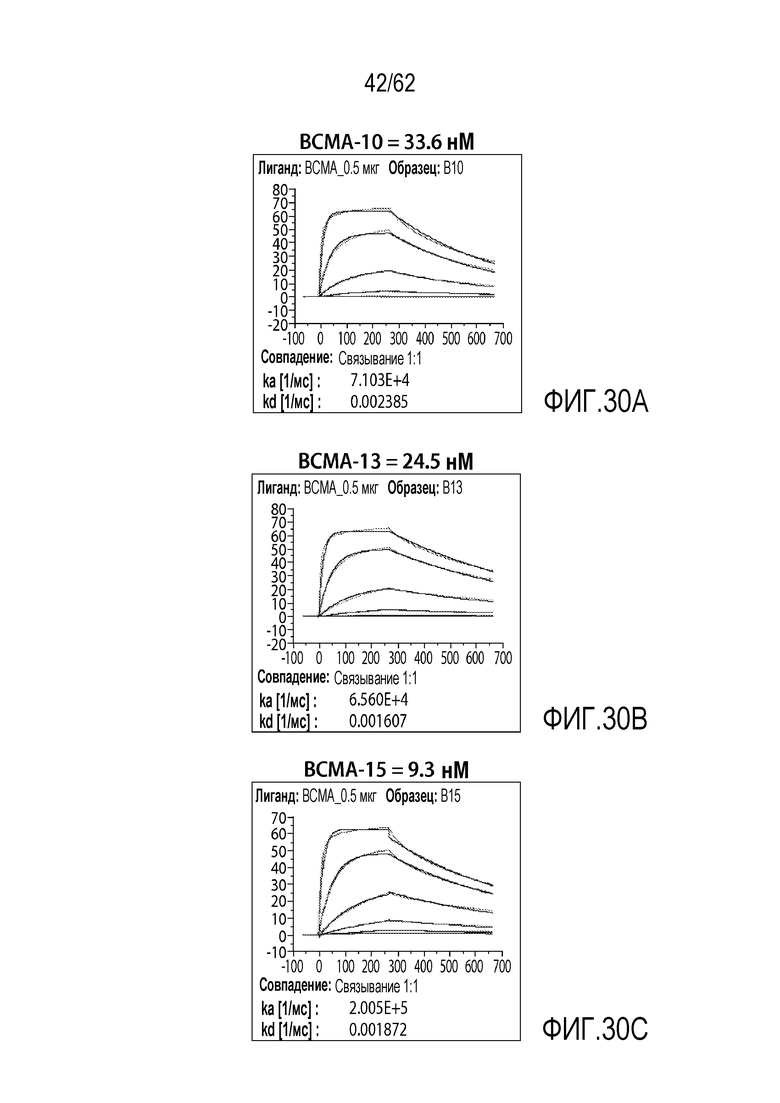
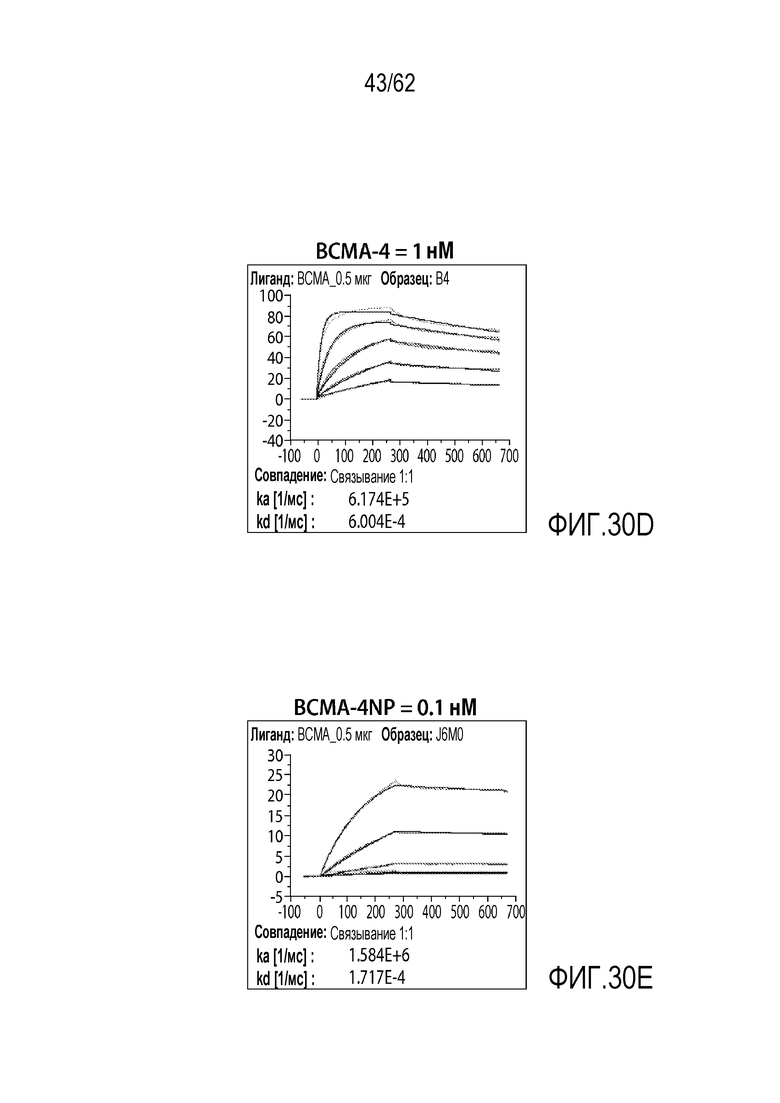
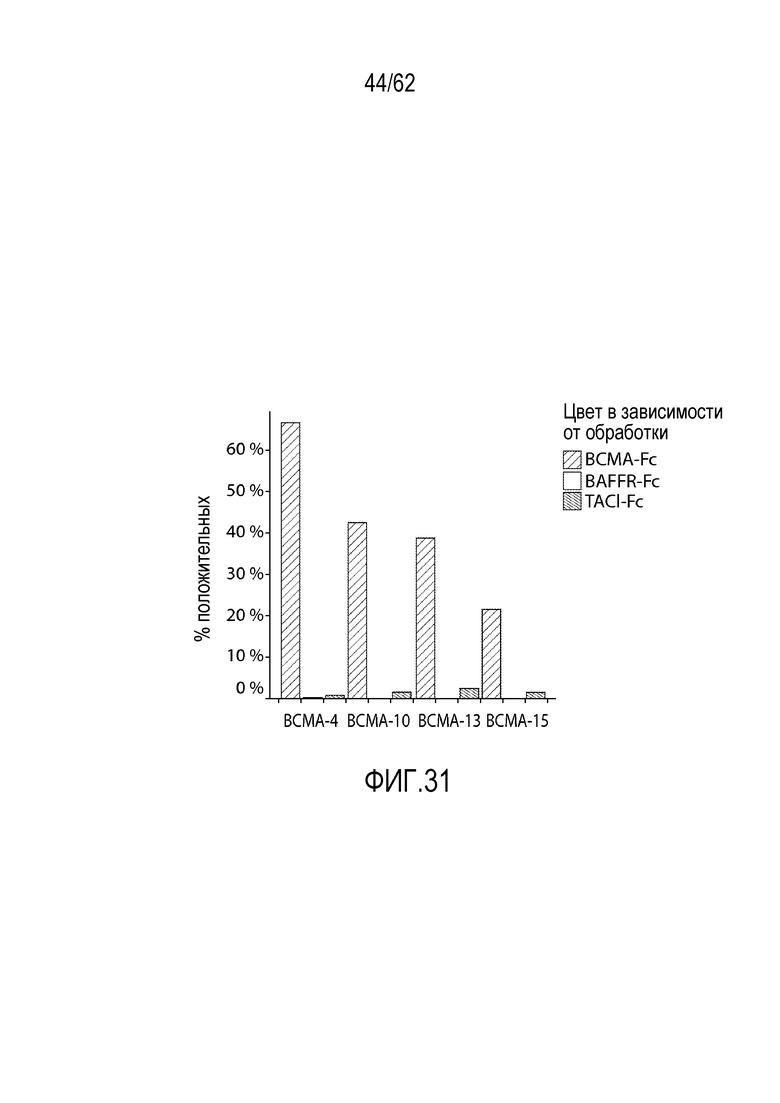


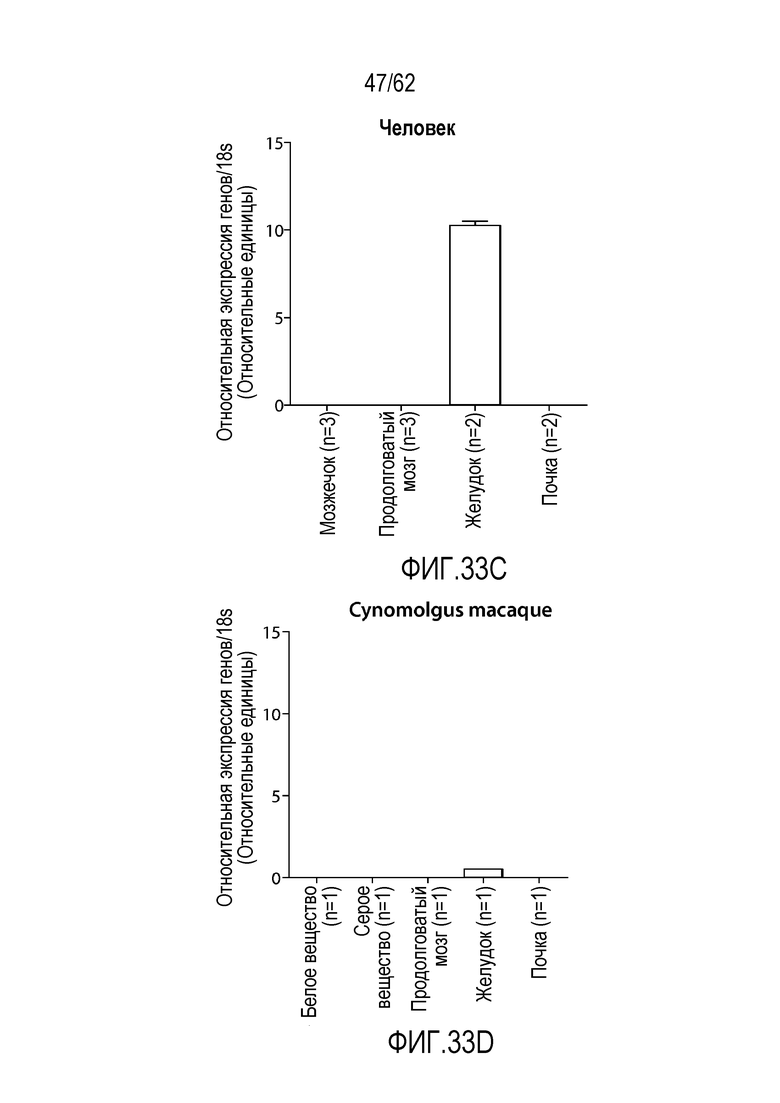

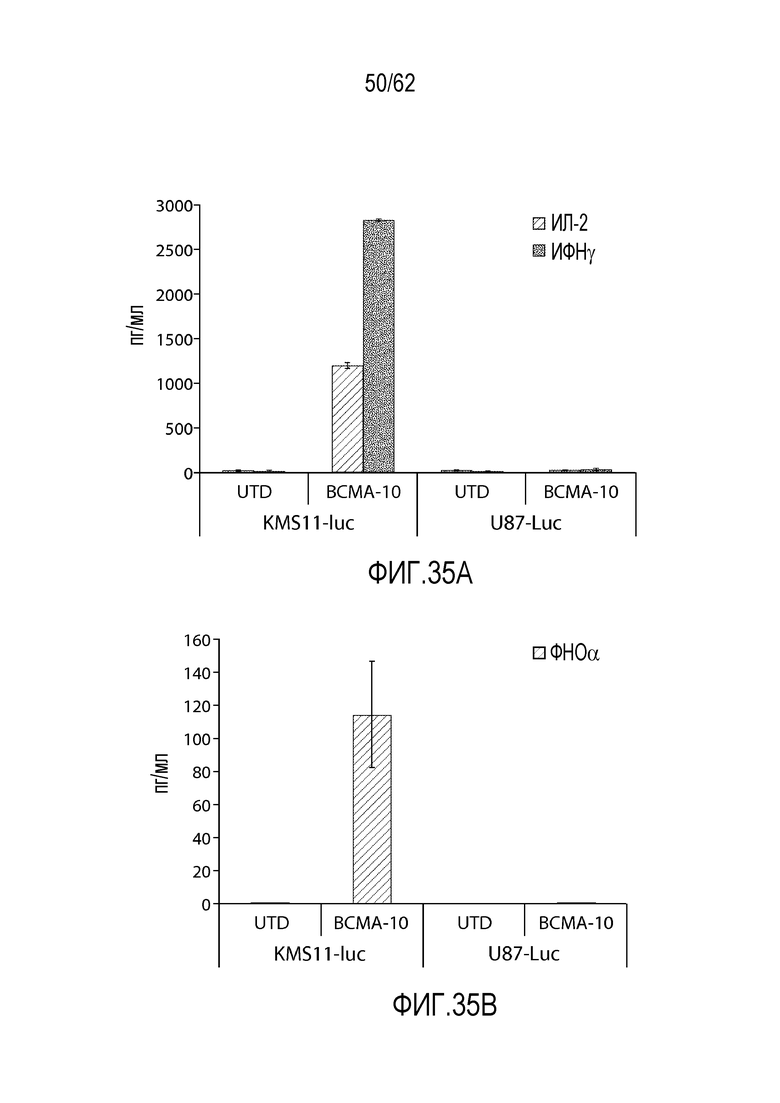
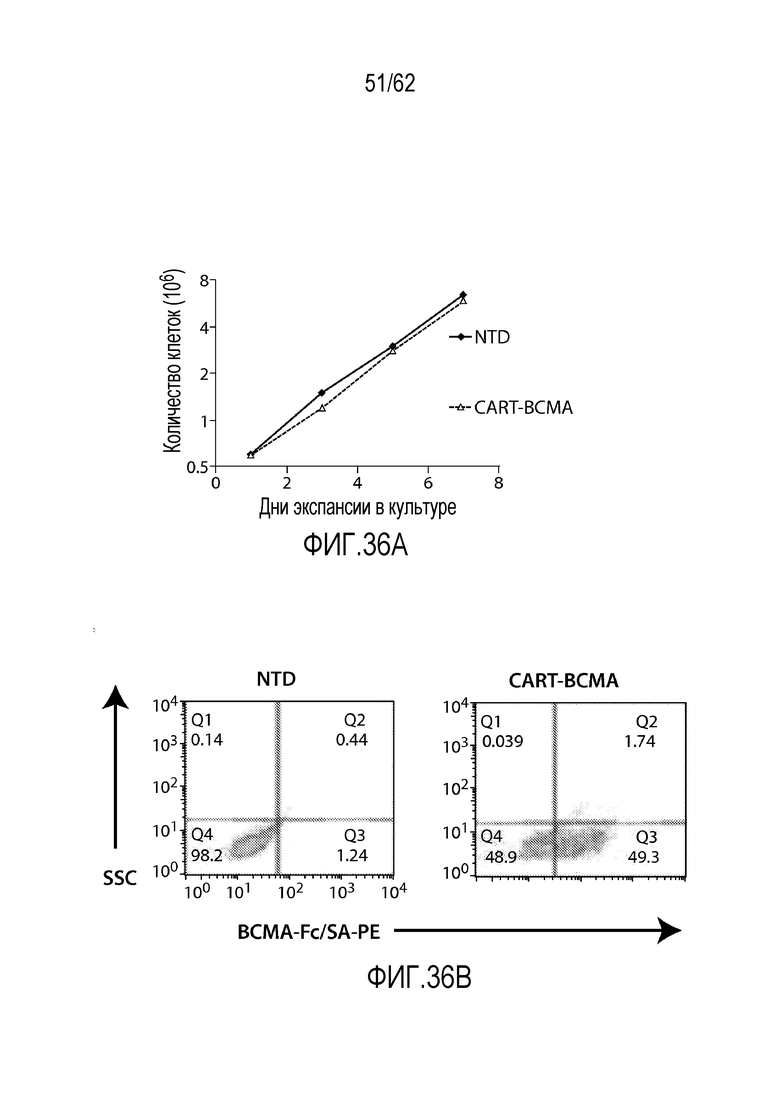
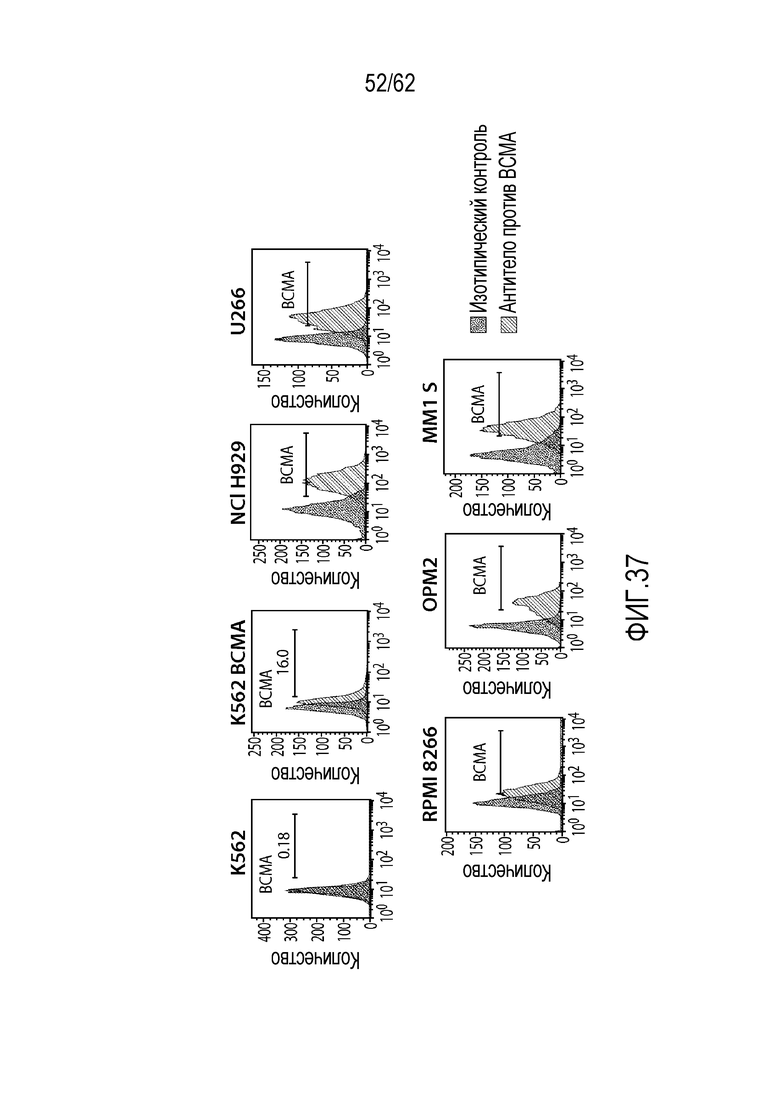
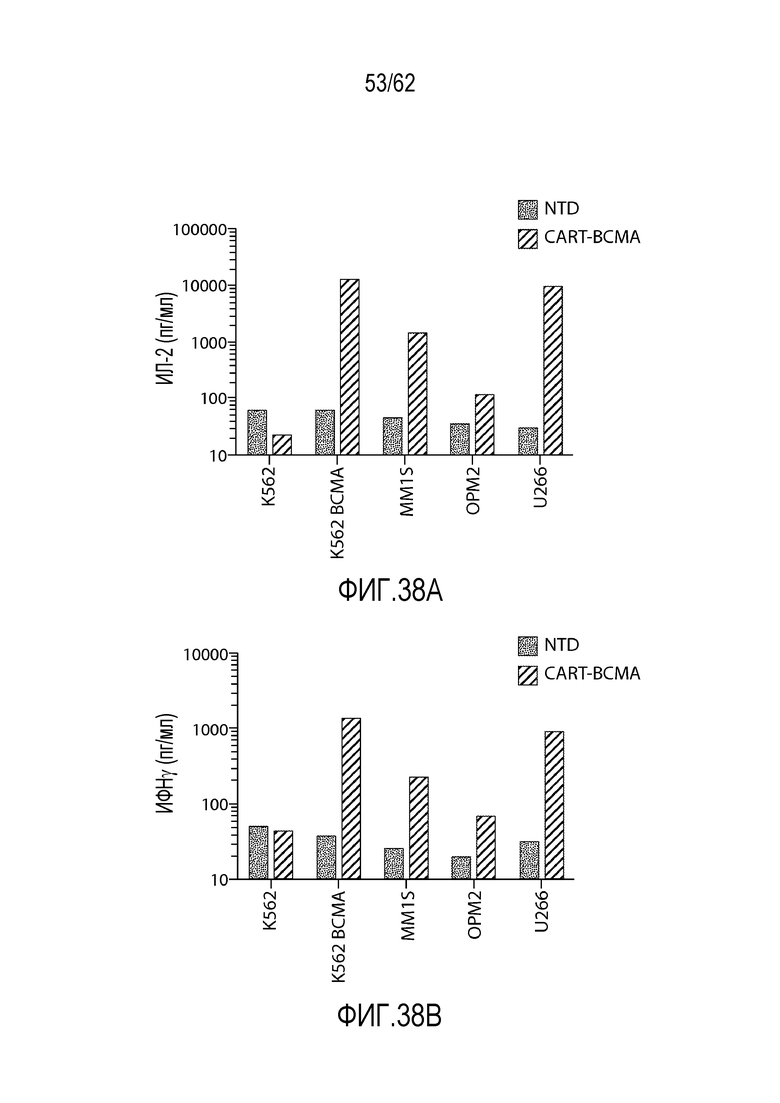
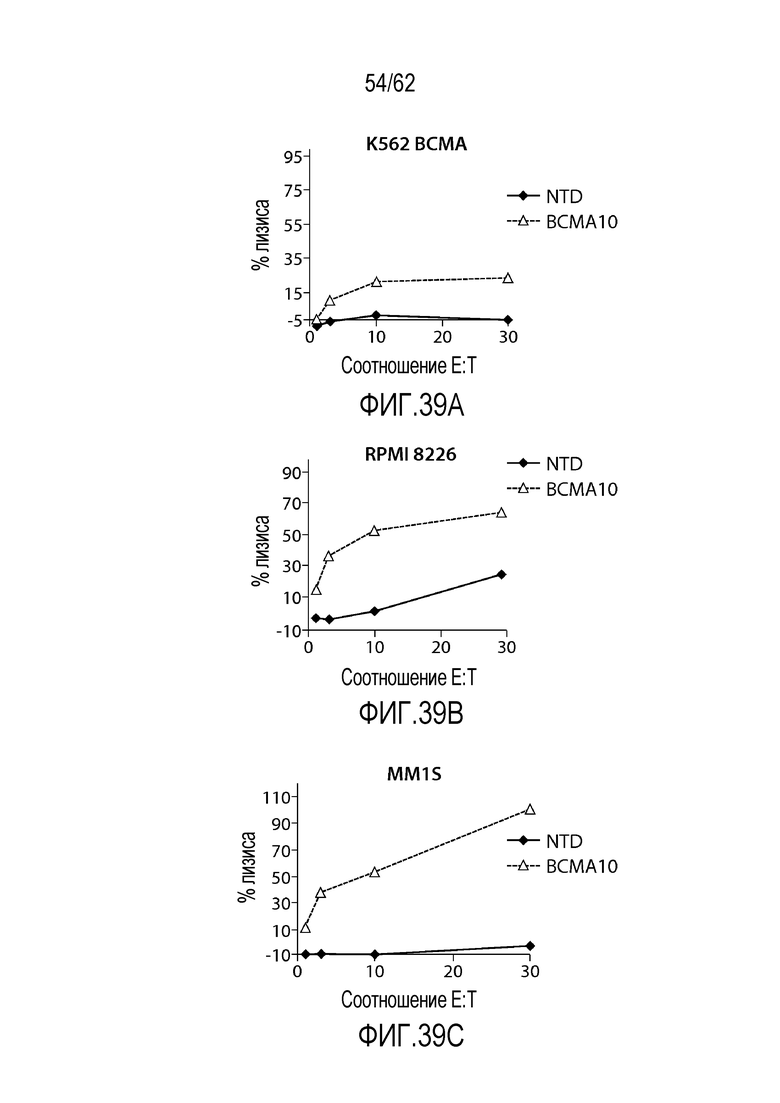
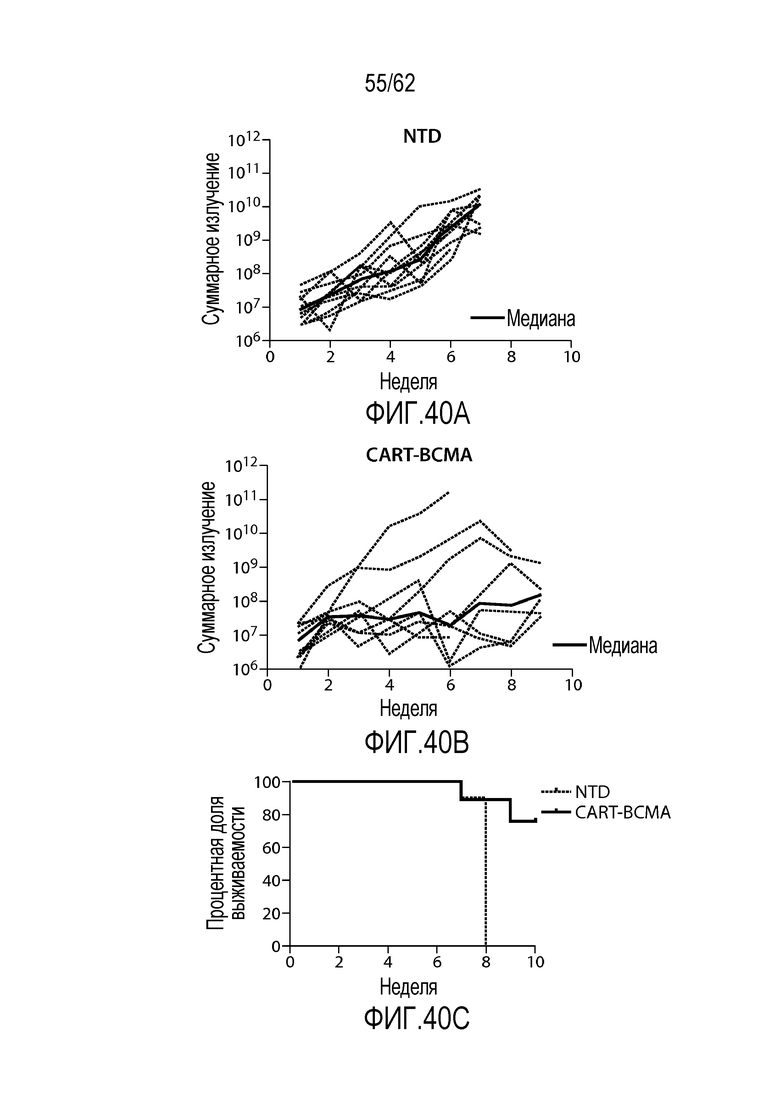
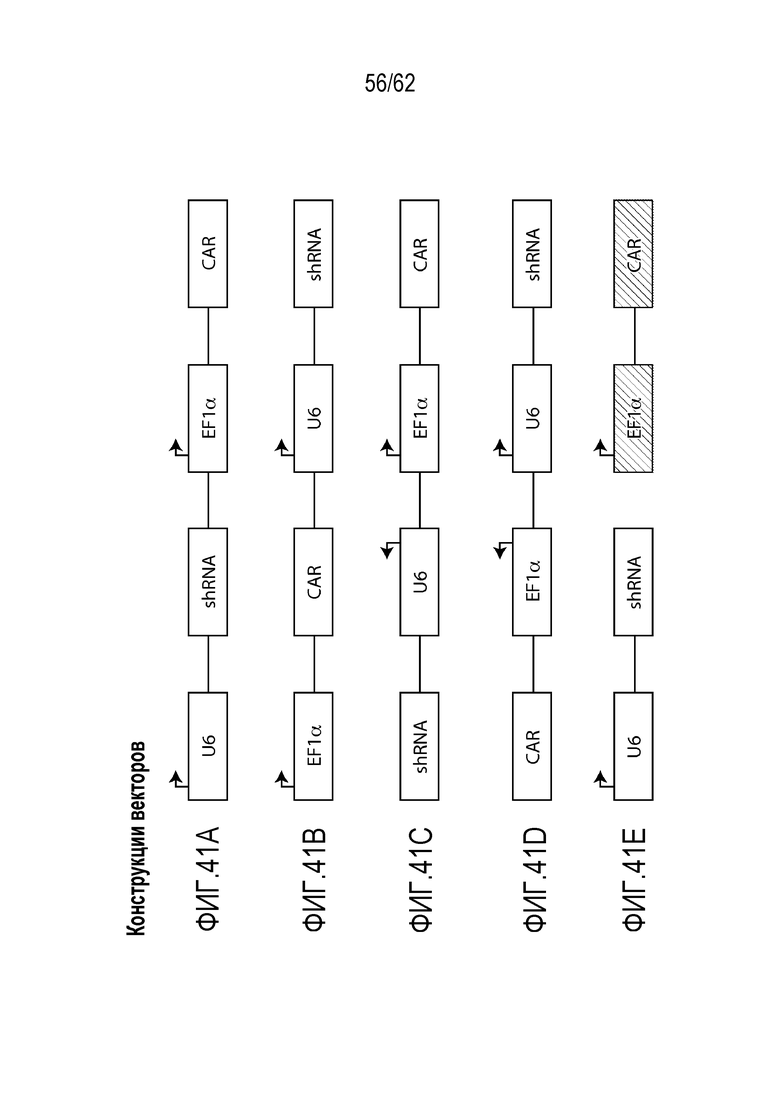
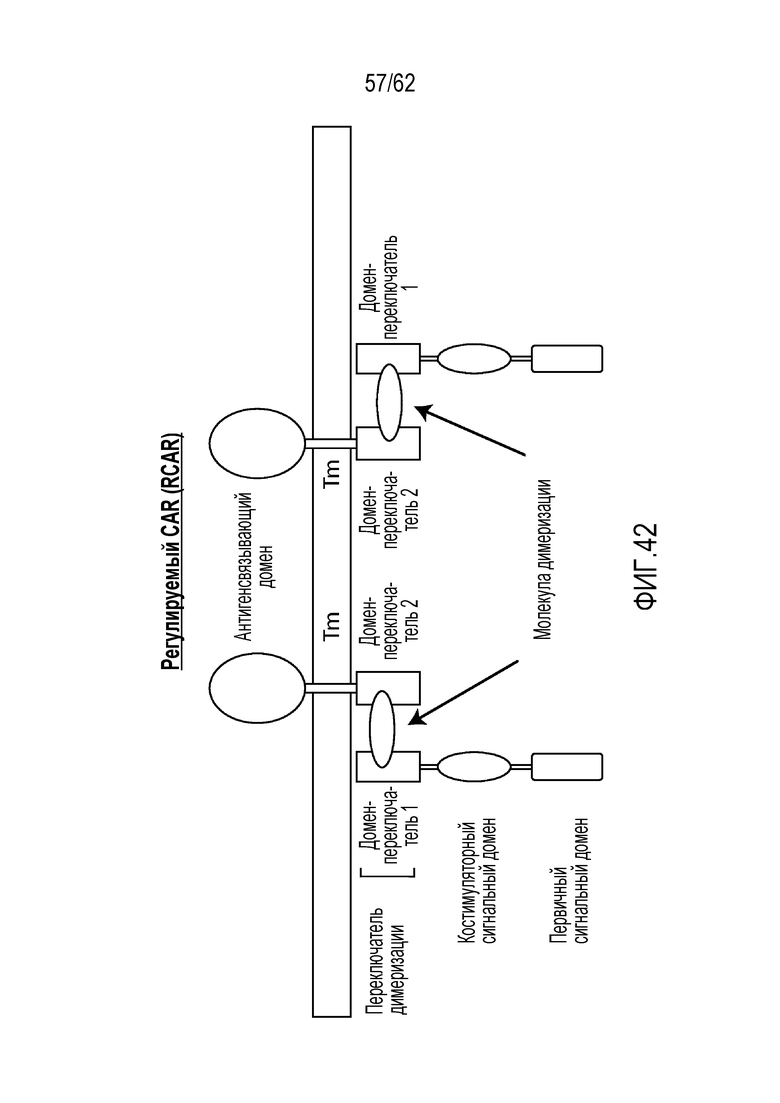
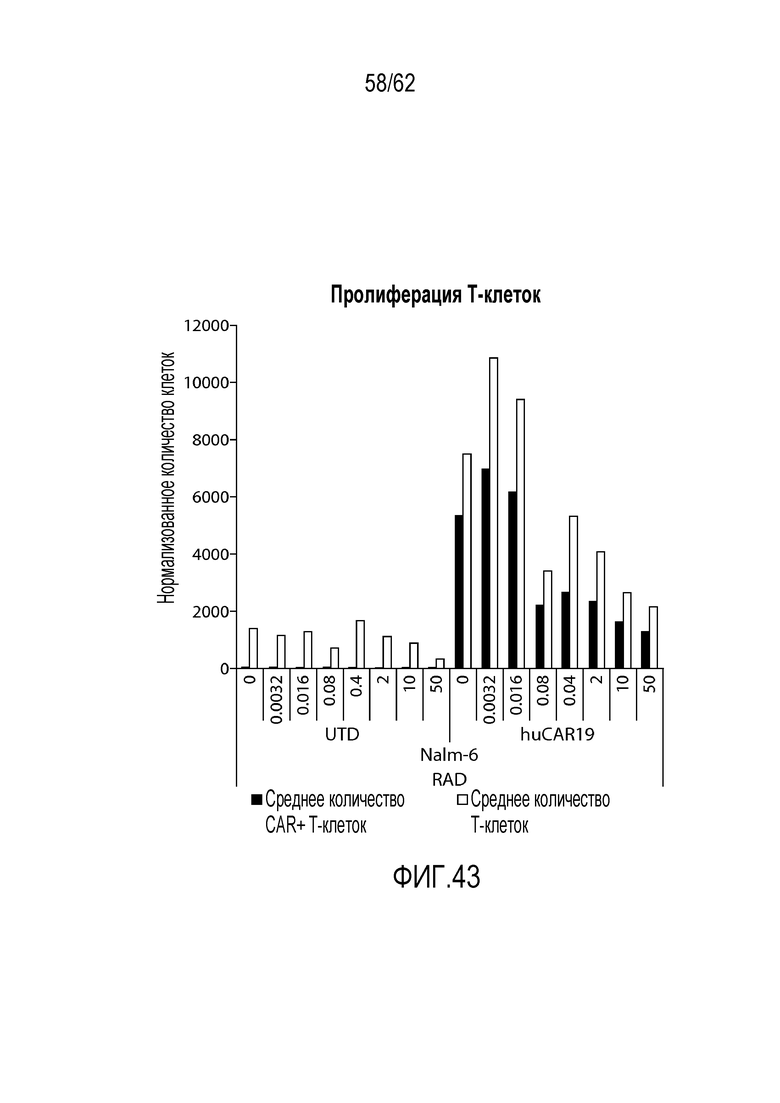
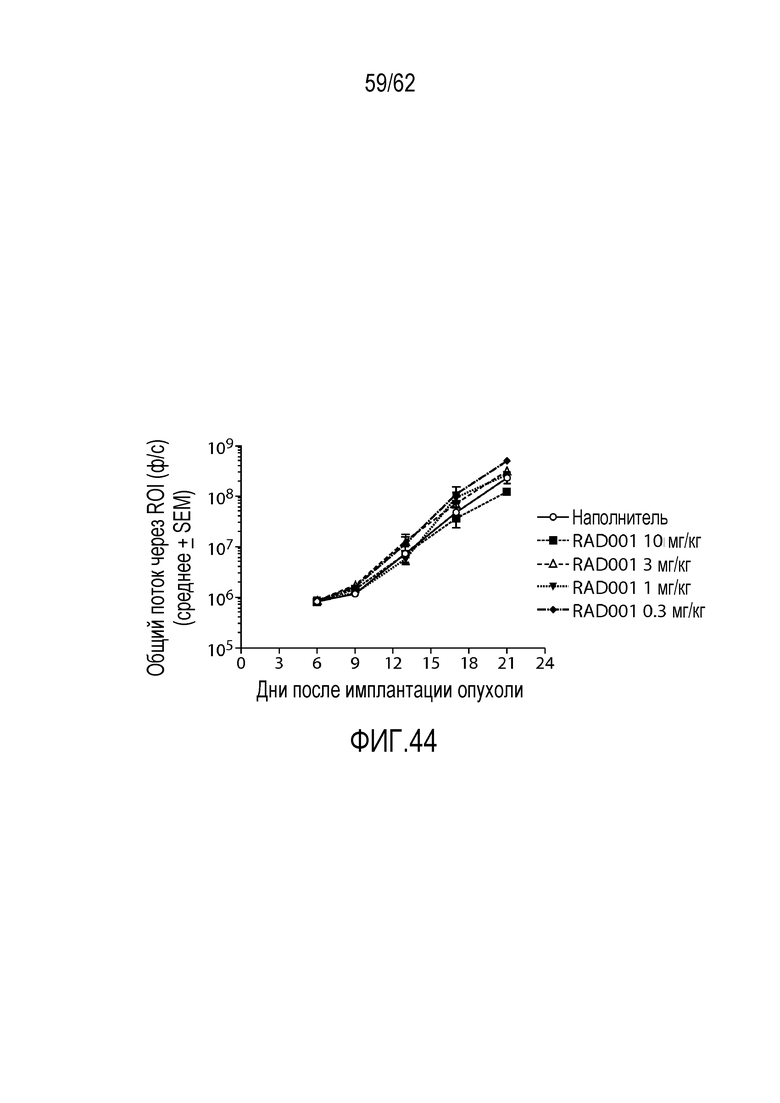
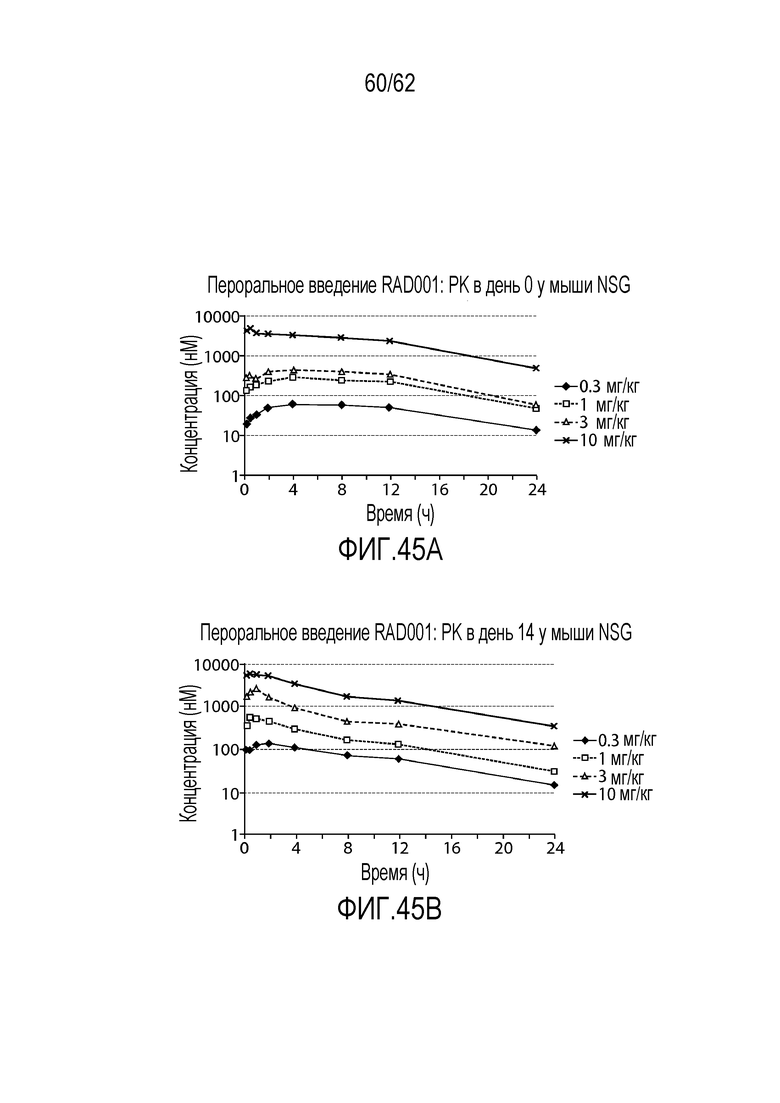
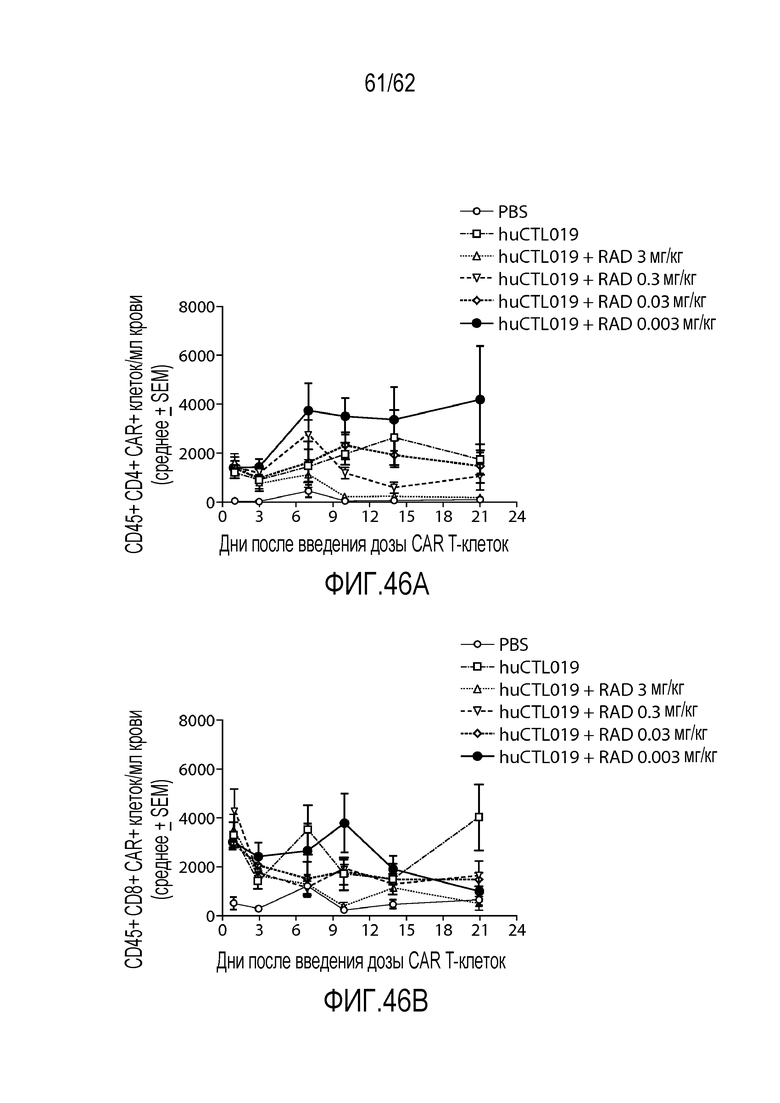
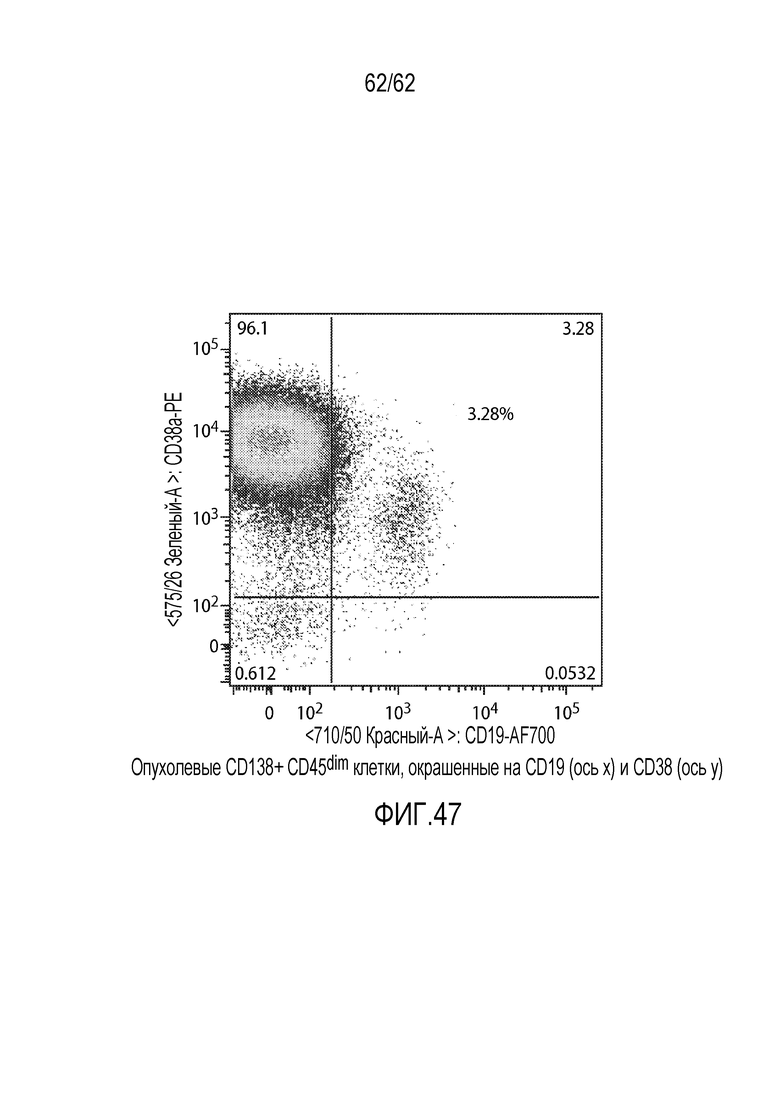
Изобретение относится к области биотехнологии, в частности к выделенной молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR), а также к содержащим ее вектору и клетке. Также раскрыт выделенный полипептид химерного антигенного рецептора (CAR), который связывается с BCMA, а также выделенный связывающий домен против B-клеточного антигена созревания (BCMA), который связывается с BCMA. Изобретение также относится к способу получения иммунной эффекторной клетки, а также к способу получения популяции РНК-сконструированных клеток, предусматривающим использование вышеуказанной молекулы нуклеиновой кислоты. Изобретение эффективно для лечения млекопитающего, имеющего заболевание, ассоциированное с экспрессией BCMA, а также для достижения противоопухолевого иммунитета у млекопитающего, имеющего заболевание, ассоциированное с экспрессией BCMA. 10 н. и 43 з.п. ф-лы, 47 ил., 27 табл., 17 пр.
1. Выделенная молекула нуклеиновой кислоты, кодирующая химерный антигенный рецептор (CAR), где CAR содержит связывающий домен против B-клеточного антигена созревания (BCMA), трансмембранный домен и внутриклеточный сигнальный домен и где указанный связывающий домен против BCMA содержит:
(i) определяющую комплементарность область тяжелой цепи 1 (HC CDR1), содержащую аминокислотную последовательность SEQ ID NO: 394, определяющую комплементарность область тяжелой цепи 2 (HC CDR2), содержащую аминокислотную последовательность SEQ ID NO: 434, определяющую комплементарность область тяжелой цепи 3 (HC CDR3), содержащую аминокислотную последовательность SEQ ID NO: 474, определяющую комплементарность область легкой цепи 1 (LC CDR1), содержащую аминокислотную последовательность SEQ ID NO: 514, определяющую комплементарность область легкой цепи 2 (LC CDR2), содержащую аминокислотную последовательность SEQ ID NO: 554, и определяющую комплементарность область легкой цепи 3 (LC CDR3), содержащую аминокислотную последовательность SEQ ID NO: 594;
(ii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 634, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 674, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 714, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 754, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 794, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 834;
(iii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 874, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 914, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 954, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 994, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1034, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1074;
(iv) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 396, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 436, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 476, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 516, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 556, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 596;
(v) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 636, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 676, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 716, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 756, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 796, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 836;
(vi) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 876, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 916, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 956, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 996, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1036, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1076;
(vii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 398, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 438, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 478, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 518, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 558, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 598;
(viii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 638, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 678, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 718, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 758, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 798, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 838;
(ix) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 878, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 918, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 958, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 998, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1038, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1078;
(x) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 384, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 424, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 464, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 504, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 544, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 584;
(xi) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 624, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 664, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 704, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 744, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 784, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 824; или
(xii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 864, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 904, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 944, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 984, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1024, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1064.
2. Выделенная молекула нуклеиновой кислоты по п. 1, где указанный CAR содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 94, 96, 98 или 84.
3. Выделенная молекула нуклеиновой кислоты по п. 1, где указанный CAR содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, 81, 83 или 69.
4. Выделенная молекула нуклеиновой кислоты по п. 1, где указанный CAR содержит:
(i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 94;
(ii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 81, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 96;
(iii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 83, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 98; или
(iv) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 69, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 84.
5. Выделенная молекула нуклеиновой кислоты по п. 1, где CAR содержит аминокислотную последовательность, выбранную из группы, состоящей SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53 и SEQ ID NO: 39, или аминокислотную последовательность с 95-99% идентичности по отношению к ним.
6. Выделенная молекула нуклеиновой кислоты по п. 1, содержащая нуклеотидную последовательность, выбранную из группы, состоящей SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68 и SEQ ID NO: 54, или нуклеотидную последовательность с 95-99% идентичности по отношению к ним.
7. Выделенная молекула нуклеиновой кислоты по п. 1, где указанный CAR содержит аминокислотную последовательность SEQ ID NO: 109, SEQ ID NO: 111, SEQ ID NO: 113 или SEQ ID NO: 99 или аминокислотную последовательность с 95-99% идентичности по отношению к ним с лидерной последовательностью, содержащей аминокислотную последовательность SEQ ID NO: 1, или без нее.
8. Выделенная молекула нуклеиновой кислоты по п. 1, содержащая нуклеотидную последовательность SEQ ID NO: 124, SEQ ID NO: 126, SEQ ID NO: 128 или SEQ ID NO: 114 или нуклеотидную последовательность с 95-99% идентичности по отношению к ним.
9. Выделенная молекула нуклеиновой кислоты по любому из пп. 1-8, где:
(i) трансмембранный домен содержит трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154;
(ii) трансмембранный домен содержит аминокислотную последовательность SEQ ID NO: 6 или аминокислотную последовательность с 95-99% идентичности по отношению к ней; или
(iii) молекула нуклеиновой кислоты содержит нуклеотидную последовательность SEQ ID NO: 17 или последовательность с 95-99% идентичности по отношению к ней.
10. Выделенная молекула нуклеиновой кислоты по любому из пп. 1-8, где связывающий домен против BCMA соединяют с трансмембранным доменом посредством шарнирной области, где:
(i) шарнирная область содержит аминокислотную последовательность SEQ ID NO: 2 или аминокислотную последовательность с 95-99% идентичности по отношению к ней; или
(ii) молекула нуклеиновой кислоты содержит нуклеотидную последовательность SEQ ID NO: 13 или нуклеотидную последовательность с 95-99% идентичности по отношению к ней.
11. Выделенная молекула нуклеиновой кислоты по любому из пп. 1-8, где внутриклеточный сигнальный домен содержит костимуляторный домен, где:
(i) кодируемый костимуляторный домен содержит функциональный сигнальный домен, полученный из белка, выбранного из группы, состоящей из молекулы MHC класса I, белков рецепторов ФНО, иммуноглобулин-подобных белков, рецепторов цитокинов, интегринов, сигнальных молекул активации лимфоцитов, активирующих рецепторов NK-клеток, BTLA, рецептора Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1, 4-1BB, B7-H3, CDS, ICAM-1, ICOS, GITR, BAFFR, LIGHT, HVEM, KIRDS2, SLAMF7, NKp80, NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1, SLAMF4, CD84, CD96, CEACAM1, CRTAM, Ly9, CD160, PSGL1, CD100, CD69, SLAMF6, SLAM, BLAME, SELPLG, LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающегося с CD83;
(ii) костимуляторный домен содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность с 95-99% идентичности по отношению к ней; или
(iii) молекула нуклеиновой кислоты содержит нуклеотидную последовательность SEQ ID NO: 18 или нуклеотидную последовательность с 95-99% идентичности по отношению к ней.
12. Выделенная молекула нуклеиновой кислоты по любому из пп. 1-8, где:
(i) внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3 дзета;
(ii) внутриклеточный сигнальный домен содержит аминокислотную последовательность SEQ ID NO: 7 и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10 или аминокислотную последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 7 и/или аминокислотную последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10;
(iii) внутриклеточный сигнальный домен содержит аминокислотную последовательность SEQ ID NO: 7 и аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи; или
(iv) молекула нуклеиновой кислоты содержит нуклеотидную последовательность SEQ ID NO: 18 или нуклеотидную последовательность с 95-99% идентичности по отношению к ней и/или нуклеотидную последовательность SEQ ID NO: 20 или SEQ ID NO: 21 или нуклеотидную последовательность с 95-99% идентичности по отношению к ним.
13. Выделенная молекула нуклеиновой кислоты по любому из пп. 1-8, содержащая лидерную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 1.
14. Выделенный полипептид химерного антигенного рецептора (CAR), который связывается с BCMA, кодируемый молекулой нуклеиновой кислоты по любому из пп. 1-8.
15. Выделенный полипептид химерного антигенного рецептора (CAR), который связывается с BCMA, где указанный полипептид CAR содержит связывающий домен против B-клеточного антигена созревания (BCMA), трансмембранный домен и внутриклеточный сигнальный домен, где указанный связывающий домен против BCMA содержит:
(i) определяющую комплементарность область тяжелой цепи 1 (HC CDR1), содержащую аминокислотную последовательность SEQ ID NO: 394, определяющую комплементарность область тяжелой цепи 2 (HC CDR2), содержащую аминокислотную последовательность SEQ ID NO: 434, определяющую комплементарность область тяжелой цепи 3 (HC CDR3), содержащую аминокислотную последовательность SEQ ID NO: 474, определяющую комплементарность область легкой цепи 1 (LC CDR1), содержащую аминокислотную последовательность SEQ ID NO: 514, определяющую комплементарность область легкой цепи 2 (LC CDR2), содержащую аминокислотную последовательность SEQ ID NO: 554, и определяющую комплементарность область легкой цепи 3 (LC CDR3), содержащую аминокислотную последовательность SEQ ID NO: 594;
(ii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 634, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 674, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 714, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 754, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 794, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 834;
(iii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 874, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 914, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 954, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 994, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1034, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1074;
(iv) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 396, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 436, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 476, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 516, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 556, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 596;
(v) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 636, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 676, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 716, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 756, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 796, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 836;
(vi) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 876, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 916, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 956, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 996, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1036, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1076;
(vii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 398, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 438, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 478, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 518, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 558, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 598;
(viii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 638, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 678, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 718, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 758, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 798, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 838;
(ix) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 878, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 918, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 958, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 998, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1038, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1078;
(x) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 384, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 424, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 464, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 504, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 544, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 584;
(xi) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 624, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 664, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 704, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 744, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 784, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 824; или
(xii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 864, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 904, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 944, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 984, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1024, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1064.
16. Выделенный полипептид CAR по п. 15, содержащий вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 94, 96, 98 или 84.
17. Выделенный полипептид CAR по п. 15, содержащий вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, 81, 83 или 69.
18. Выделенный полипептид CAR по п. 15, содержащий:
(i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 94;
(ii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 81, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 96;
(iii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 83, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 98; или
(iv) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 69, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 84.
19. Выделенный полипептид CAR по п. 15, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53 и SEQ ID NO: 39, или аминокислотную последовательность с 95-99% идентичности по отношению к ним.
20. Выделенный полипептид CAR по п. 15, содержащий аминокислотную последовательность SEQ ID NO: 109, SEQ ID NO: 111, SEQ ID NO: 113 или SEQ ID NO: 99 или аминокислотную последовательность с 95-99% идентичности по отношению к ним с лидерной последовательностью, содержащей аминокислотную последовательность SEQ ID NO:1, или без нее.
21. Выделенный полипептид CAR по любому из пп. 15-20, где:
(i) трансмембранный домен содержит трансмембранный домен из белка, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154; или
(ii) трансмембранный домен содержит аминокислотную последовательность SEQ ID NO: 6 или аминокислотную последовательность с 95-99% идентичности по отношению к ней.
22. Выделенный полипептид CAR по любому из пп. 15-20, где связывающий домен против BCMA соединяют с трансмембранным доменом посредством шарнирной области, где шарнирная область содержит аминокислотную последовательность SEQ ID NO: 2 или SEQ ID NO: 36 или аминокислотную последовательность с 95-99% идентичности по отношению к ним.
23. Выделенный полипептид CAR по любому из пп. 15-20, где внутриклеточный сигнальный домен содержит костимуляторный домен, где:
(i) костимуляторный домен содержит функциональный сигнальный домен, полученный из белка, выбранного из группы, состоящей из молекулы MHC класса I, белков рецепторов ФНО, иммуноглобулин-подобных белков, рецепторов цитокинов, интегринов, сигнальных молекул активации лимфоцитов, активирующих рецепторов NK-клеток, BTLA, рецептора Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1, 4-1BB, B7-H3, CDS, ICAM-1, ICOS, GITR, BAFFR, LIGHT, HVEM, KIRDS2, SLAMF7, NKp80, NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1, SLAMF4, CD84, CD96, CEACAM1, CRTAM, Ly9, CD160, PSGL1, CD100, CD69, SLAMF6, SLAM, BLAME, SELPLG, LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, специфически связывающегося с CD83; или
(ii) костимуляторный домен содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность с 95-99% идентичности по отношению к ней.
24. Выделенный полипептид CAR по любому из пп. 15-20, где:
(i) внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3 дзета;
(ii) внутриклеточный сигнальный домен содержит аминокислотную последовательность SEQ ID NO: 7 и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10 или аминокислотную последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 7 и/или аминокислотную последовательность с 95-99% идентичности по отношению к аминокислотной последовательности SEQ ID NO: 9 или SEQ ID NO: 10; или
(iii) внутриклеточный сигнальный домен содержит аминокислотную последовательность SEQ ID NO: 7 и аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной и той же рамке считывания и в виде единой полипептидной цепи.
25. Выделенный полипептид CAR по любому из пп. 15-20, содержащий лидерную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 1.
26. Выделенный связывающий домен против B-клеточного антигена созревания (BCMA), который связывается с BCMA, содержащий:
(i) определяющую комплементарность область тяжелой цепи 1 (HC CDR1), содержащую аминокислотную последовательность SEQ ID NO: 394, определяющую комплементарность область тяжелой цепи 2 (HC CDR2), содержащую аминокислотную последовательность SEQ ID NO: 434, определяющую комплементарность область тяжелой цепи 3 (HC CDR3), содержащую аминокислотную последовательность SEQ ID NO: 474, определяющую комплементарность область легкой цепи 1 (LC CDR1), содержащую аминокислотную последовательность SEQ ID NO: 514, определяющую комплементарность область легкой цепи 2 (LC CDR2), содержащую аминокислотную последовательность SEQ ID NO: 554, и определяющую комплементарность область легкой цепи 3 (LC CDR3), содержащую аминокислотную последовательность SEQ ID NO: 594;
(ii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 634, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 674, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 714, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 754, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 794, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 834;
(iii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 874, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 914, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 954, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 994, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1034, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1074;
(iv) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 396, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 436, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 476, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 516, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 556, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 596;
(v) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 636, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 676, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 716, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 756, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 796, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 836;
(vi) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 876, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 916, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 956, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 996, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1036, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1076;
(vii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 398, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 438, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 478, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 518, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 558, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 598;
(viii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 638, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 678, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 718, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 758, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 798, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 838;
(ix) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 878, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 918, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 958, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 998, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1038, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1078;
(x) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 384, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 424, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 464, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 504, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 544, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 584;
(xi) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 624, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 664, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 704, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 744, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 784, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 824; или
(xii) HC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 864, HC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 904, HC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 944, LC CDR1, содержащую аминокислотную последовательность SEQ ID NO: 984, LC CDR2, содержащую аминокислотную последовательность SEQ ID NO: 1024, и LC CDR3, содержащую аминокислотную последовательность SEQ ID NO: 1064.
27. Выделенный связывающий домен против BCMA по п. 26, содержащий вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 94, 96, 98 или 84.
28. Выделенный связывающий домен против BCMA по п. 26, содержащий вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, 81, 83 или 69.
29. Выделенный связывающий домен против BCMA по п. 26, содержащий:
(i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 94;
(ii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 81, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 96;
(iii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 83, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 98; или
(iv) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 69, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 84.
30. Выделенный связывающий домен против BCMA по п. 26, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53 и SEQ ID NO: 39, или аминокислотную последовательность с 95-99% идентичности по отношению к ним.
31. Вектор для получения полипептида CAR, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид CAR по любому из пп. 15-25, где вектор выбран из группы, состоящей из ДНК-вектора, РНК-вектора, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора.
32. Вектор по п. 31, дополнительно содержащий промотор EF-1, содержащий последовательность SEQ ID NO: 11.
33. Клетка для экспрессии полипептида CAR по любому из пп. 15-25, содержащая молекулу нуклеиновой кислоты по любому из пп. 1-13 или вектор по любому из пп. 31 или 32.
34. Способ получения иммунной эффекторной клетки, включающий трансдукцию иммунной эффекторной клетки с использованием вектора по п. 31 или 32.
35. Способ получения популяции РНК-сконструированных клеток, включающий встраивание транскрибируемой in vitro РНК или синтетической РНК в клетку, где РНК содержит молекулу нуклеиновой кислоты, кодирующую полипептид CAR по любому из пп. 15-25.
36. Способ достижения противоопухолевого иммунитета у млекопитающего, имеющего заболевание, ассоциированное с экспрессией BCMA, включающий введение млекопитающему эффективного количества иммунных эффекторных клеток, содержащих молекулу нуклеиновой кислоты по любому из пп. 1-13 или полипептид CAR по любому из пп. 15-25.
37. Способ по п. 36, где иммунная эффекторная клетка является аутологичной T-клеткой или аллогенной T-клеткой.
38. Способ лечения млекопитающего, имеющего заболевание, ассоциированное с экспрессией BCMA, включающий введение млекопитающему эффективного количества иммунных эффекторных клеток, содержащих молекулу нуклеиновой кислоты по любому из пп. 1-13 или полипептид CAR по любому из пп. 15-25.
39. Способ по п. 38, где заболевание, ассоциированное с экспрессией BCMA, является:
(i) злокачественным новообразованием или предраковым состоянием, выбранным из одного или более из миелодисплазии, миелодиспластического синдрома или предлейкоза; или
(ii) несвязанным со злокачественным новообразованием показанием, ассоциированным с экспрессией BCMA.
40. Способ по п. 38, где заболевание является гемобластозом.
41. Способ по п. 38, где заболевание является острым лейкозом, выбранным из одного или более из острого B-клеточного лимфоидного лейкоза, острого T-клеточного лимфоидного лейкоза, острого лимфоидного лейкоза, хронического миелогенного лейкоза, хронического лимфоцитарного лейкоза, B-клеточного пролимфоцитарного лейкоза, неоплазии из бластных плазмацитоидных дендритных клеток, лимфомы Беркитта, диффузной крупноклеточной B-клеточной лимфомы, фолликулярной лимфомы, волосатоклеточного лейкоза, мелкоклеточной или крупноклеточной фолликулярной лимфомы, злокачественных лимфопролиферативных состояний, MALT-лимфомы, лимфомы из клеток мантийной зоны, лимфомы из клеток маргинальной зоны, множественной миеломы, миелодисплазии и миелодиспластического синдрома, неходжкинской лимфомы, плазмобластной лимфомы, неоплазии из плазмацитоидных дендритных клеток, макроглобулинемии Вальденстрема, рака предстательной железы, рака поджелудочной железы, рака легких, бессимптомной миеломы, моноклональной гаммапатии неустановленной этиологии, макроглобулинемии Вальденстрема, плазмоцитомы, системного амилоидоза легких цепей или POEMS-синдрома или их комбинации.
42. Способ по любому из пп. 38-41, где клетку вводят в комбинации с одним или более из:
(i) средства, повышающего эффективность клетки, содержащей нуклеиновую кислоту CAR или полипептид CAR;
(ii) средства, улучшающего один или более побочный эффект, ассоциированный с введением клетки, содержащей нуклеиновую кислоту CAR или полипептид CAR;
(iii) средства, с помощью которого лечат заболевание, ассоциированное с BCMA.
43. Способ по любому из пп. 38-41, где иммунную эффекторную клетку вводят в комбинации с ингибитором PD-L1, например антителом против PD-L1.
44. Выделенная молекула нуклеиновой кислоты по любому из пп. 1-13, выделенный полипептид CAR по любому из пп. 15-25, вектор по п. 31 или 32 или клетка по п. 33 для применения в качестве лекарственного средства для млекопитающего, имеющего заболевание, ассоциированное с экспрессией BCMA.
45. Выделенная молекула нуклеиновой кислоты по любому из пп. 1-13, выделенный полипептид CAR по любому из пп. 15-25, вектор по п. 31 или 32 или клетка по п. 33 для применения в лечении заболевания, ассоциированного с экспрессией BCMA.
46. Клетка по п. 33, дополнительно экспрессирующая ингибиторную молекулу, содержащую первый полипептид, содержащий по меньшей мере часть ингибиторной молекулы, ассоциированной со вторым полипептидом, содержащим костимуляторный домен и первичный сигнальный домен.
47. Клетка по п. 46, где первый полипептид содержит по меньшей мере часть PD-1.
48. Способ по п. 42, где средство является ингибитором mTOR и индивидууму вводят низкую, усиливающую иммунитет дозу ингибитора mTOR, например RAD001 или рапамицина.
49. Способ по п. 48, где ингибитор mTOR вводят в течение периода времени, достаточного для снижения доли PD-1-положительных T-клеток, повышения доли PD-1-отрицательных T-клеток или повышения соотношения PD-1-отрицательных T-клеток/PD-1-положительных T-клеток в периферической крови индивидуума или в препарате T-клеток, выделенных из индивидуума.
50. Способ по любому из пп. 38-41, где клетку, экспрессирующую молекулу CAR, вводят в комбинации с клеткой, содержащей молекулу CAR CD19.
51. Способ по п. 50, где заболевание, ассоциированное с BCMA, является множественной миеломой.
52. Способ по п. 51, где множественная миелома является CD19-отрицательной множественной миеломой.
53. Способ по любому из пп. 38-41, 51 или 52, где клетку, экспрессирующую молекулу CAR, вводят индивидууму посредством фракционирования дозы, например одного, двух, трех или более отдельных введений частичной дозы,
необязательно, где первую процентную долю общей дозы вводят в первый день лечения, а вторую процентную долю общей дозы вводят в последующий день лечения и, необязательно, третью процентную долю общей дозы вводят в еще более поздний день лечения,
необязательно, где 10% общей дозы клеток вводят в первый день, 30% общей дозы клеток вводят во второй день и остальные 60% общей дозы клеток вводят в третий день лечения и,
необязательно, где общая доза клеток содержит от 1 до 5×107 или от 1 до 5×108 клеток.
| WO 2013154760 A1, 17.10.2013 | |||
| CARPENTER RO et al., B-cell maturation antigen is a promising target for adoptive T-cell therapy of multiple myeloma, Clin Cancer Res., 2013, Vol.19, N.8, pp.2048-2060 | |||
| MAUS MV et al., Antibody-modified T cells: CARs take the front seat for hematologic malignancies, Blood., 2014, Vol.123, N.17, pp.2625-2635 | |||
| RU |
Авторы
Даты
2021-07-15—Публикация
2015-07-21—Подача