Изобретение относится к медицине, а именно онкологии и медицинской генетики, и может быть использовано для прогнозирования клинического течения высокодифференцированных нейроэндокринных опухолей поджелудочной железы у носителей полиморфизмов с.2411С>А rs200615700 в гене ROS1, c.13588G>A rs768143170 в гене KMT2D, c.289G>A rs372430349 в гене FGFR2 и c.967G>A в гене BCR.
Нейроэндокринные опухоли поджелудочной железы (НЭО ПЖ) представляют собой гетерогенную группу новообразований, относительно редкий тип новообразований (1-2% от всех новообразований данной локализации). Учитывая бессимптомность около 40% случаев и результаты посмертных исследований, заболеваемость может достигать 10% (см. Zhang J, Francois R, Iyer R et al (2013) Current understanding of the molecular biology of pancreatic neuroendocrine tumors. J Natl Cancer Inst 105:1005-1017). Их распространенность может расти в следствие большого числа случаев с длительным клиническим течением. Однако не исключены случаи, при которых опухоль быстро прогрессирует и проявляет агрессивные онкологические свойства (см. Wu J, Sun С, Li Е, Wang J et al (2019) Nonfunctional pancreatic neuroendocrine tumours: emerging trends in incidence and mortality. BMC Cancer 19:334).
В 2017 ВОЗ опубликовала классификацию нейроэдокринный новообразований поджелудочной железы, которая внесла существенные коррективы в диагностические критерии и терапевтические стратегии данного заболевания. В частности, был выделен новый подтип опухолей НЭО G3 и внесены изменения в критерии отбора НЭО G1 (см. Chai SM, Brown IS, Kumarasinghe MP (2018) Gastroenteropancreatic neuroendocrine neoplasms: selected pathology review and molecular updates. Histopathology 72:153-167). Тем не менее, даже НЭО, классифицируемые как G1 или G2, иногда склонны к раннему метастазированию, что не укладывается в рамки действующей классификации. Генетические особенности и молекулярные механизмы онкогенеза каждого выделенного подтипа нейроэндокринных опухолей остаются объектом пристального внимания исследователей, широко привлекающих для этих целей NGS-технологию. В результате были открыты новые генетические сигнатуры, обнаружены хромосомные перестройки и нарушения в эпигенетической регуляции экспрессии генов (см. Chou WC, Lin РН, Yeh YC et al (2016) Genes involved in angiogenesis and mTOR pathways are frequently mutated in Asian patients with pancreatic neuroendocrine tumors. Int J Biol Sci 12:1523-1532; см. Scarpa A, Chang DK, Nones K et al (2017) Whole-genome landscape of pancreatic neuroendocrine tumours. Nature 543:65-71; см. Tirosh A, Mukherjee S, Lack J et al (2019) Distinct genome-wide methylation patterns in sporadic and hereditary nonfunctioning pancreatic neuroendocrine tumors. Cancer 125:1247-1257; см. Raj N, Shah R, Stadler Z et al (2018) Real-time genomic characterization of metastatic pancreatic neuroendocrine tumors has prognostic implications and identifies potential germline actionability. JCO Precis Oncol 2:1-18; см. Ji S, Yang W, Liu J et al (2018) High throughput gene sequencing reveals altered landscape in DNA damage responses and chromatin remodeling in sporadic pancreatic neuroendocrine tumors. Pancreatology 18:318-327). Однако в связи с выраженной гетерогенностью высокодифференцированных НЭО ПЖ и популяционными особенностями остается актуальным поиск ассоциаций биомаркеров с клинико-морфологическими данными и отбор биомаркеров для прогнозирования и ранней диагностики.
Существует широкий диапазон прогностических подходов (клинико-инструментальные, иммунологические, генетические, цитологические и др.) определения формы течения онкопатологии, эффективность которых весьма различна для разных типов нозоологий. Так, известен способ прогнозирования эффективности лечения и течения опухолевого процесса у больных раком носоглотки (см. патент RU 2526830 С2, опубл. 27.08.2014 Бюл. №24). Для этого до начала химиолучевого лечения и перед каждым последующим курсом у больных раком носоглотки III-IV стадии определяют в периферической крови значения коэффициентов отношения среднего объема нейтрофилов и среднего объема лимфоцитов к их абсолютному количеству: MVNe/#Ne и MVLy/#Ly. При значениях коэффициентов в динамике лечения свыше 45 констатируют низкую эффективность лечения и отрицательный прогноз течения заболевания при отсутствии клинических признаков манифестации. При значениях указанных коэффициентов ниже 45 констатируют положительный эффект лечения и благоприятный прогноз течения заболевания. Изобретение позволяет определить генерализацию опухолевого процесса при отсутствии клинических признаков манифестации заболевания и скорректировать лечение больных на основании полученных коэффициентов. Вышеуказанный способ не лишен существенного недостатка: он не позволяет сразу определить прогноз течения заболевания, кроме того определение среднего объема нейтрофила является неспецифичным изменением при онкологической патологии и во многом зависит от квалификации лаборантов, получающих исходные показатели.
К другим подходам можно отнести способ определения прогрессии рака органов брюшной полости (см. патент RU 2503409, опубл. 10.01.2014 Бюл. №1). Для этого осуществляют динамическое обследование больного после хирургического лечения. На фоне нутритивно-метаболической терапии 1 раз не менее чем в 28-30 дней определяют изменение состава тела больного с помощью биоимпедансного анализа. При этом оценивают массу тела, индекс массы тела, жировую массу, а также массу внеклеточной жидкости. При уменьшении массы тела, индекса массы тела и/или уменьшении жировой массы с одновременным увеличением массы внеклеточной жидкости по сравнению с предыдущими результатами биоимпедансного анализа у больного определяют прогрессию рака органов брюшной полости. Данный способ имеет существенные недостатки: у пациента крайне затруднительно точно рассчитать массу внеклеточной жидкости, кроме того способ предполагает постоянный контроль за пациентом каждые 30 дней и только по истечение первых 30 дней после операции позволяет определить прогноз течения заболевания.
Из литературных источников известна работа Борисковой М.Е. 2019 г., в которой впервые показана возможность формирования групп риска с использованием онкомаркеров, определяемых на дооперационном этапе. В работе была создана и апробирована новая молекулярно-генетическая панель для диагностики и прогнозирования течения высокодифференцированного рака щитовидной железы. Выявление мутации гена BRAF и снижения уровня экспрессии НИС ниже 1% являются независимыми факторами риска агрессивного течения высокодифференцированного рака щитовидной железы, что обусловливает необходимость определения наличия мутации гена BRAF и уровня экспрессии НИС с целью формирования на дооперационном этапе группы высокого риска рецидива/персистенции заболевания (см. Борискова М.Е. Влияние молекулярно-генетического профиля высокодифференцированного рака щитовидной железы на хирургическую тактику // Диссертация на соискание ученой степени доктора медицинских наук. Санкт-Петербург 2019 г.).
Работа, на наш взгляд, имеет следующие недостатки:
1) определение BRAF мутации не позволяет судить о прогнозе при нейроэндокринных опухолях;
2) использование в панели только одного маркера снижает точность предлагаемого способа определения агрессивности течения опухолевой патологии.
Технический результат - разработка способа, позволяющего своевременно оценить вероятность быстрого прогрессирования опухоли поджелудочной железы, выделить группу риска больных с высоким риском развития метастазирования нейроэндокринной опухоли поджелудочной железы.
Технический результат достигается тем, что проводят генотипирование образца нейроэндокринной опухоли поджелудочной железы и в случае выявления полиморфизмов c.13588G>A rs768143170 KMT2D, c.2411C>А rs200615700 ROS1 прогнозируют положительный прогноз течения заболевания, а при выявлении полиморфизмов c.289G>A rs372430349 FGFR2 и c.967G>A BCR прогнозируют отрицательный прогноз течения заболевания.
Изобретение «Способ прогнозирования клинического течения высокодифференцированных нейроэндокринных опухолей поджелудочной железы» является новым, так как впервые используется генотипирование SNP для прогнозирования риска прогрессирования опухолевого процесса у больных с НЭО ПЖ. Заявленный способ предполагает использование нескольких генетических маркеров, что повышает точность прогноза и не требует значительных затрат времени.
Сущность заявленного способа заключается в генотипировании с.2411С>А rs200615700 в гене ROS1, c.13588G>A rs768143170 в гене KMT2D, c.289G>A rs372430349 в гене FGFR2 и c.967G>A в гене BCR. Наличие мутаций в генах ROS1 и KMT2D определяет вероятность течения НЭО ПЖ без прогрессии, мутации в генах FGFR2 и BCR повышают риск метастазирования и агрессивной формы опухолевого роста. Оценка рисков осуществляется по формулам:
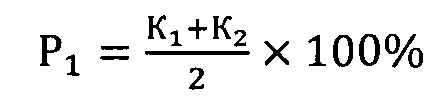
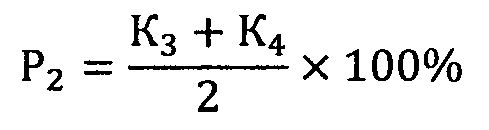
Здесь P1 - вероятность безрецидивной формы НЭО ПЖ, Р2 - вероятность прогрессирования опухоли, К1 - коэффициент для мутации с.2411С>А rs200615700 в гене ROS1, К2 - коэффициент для мутации c.13588G>A rs768143170 в гене KMT2D, К3 - коэффициент для мутации c.289G>A rs372430349 в гене FGFR2 и К4 - коэффициент для мутации c.967G>A в гене BCR. Значение коэффициентов зависит от генотипа: 0 в случае гомозиготы дикого типа, 0,5 - гетерозиготы и 1 - мутантной гомозиготы.
Заявленный способ осуществляется следующим образом и включает следующие этапы:
 Выделение тотальной ДНК из 200 мкл венозной крови или буккального эпителия любым подходящим методом, например, с помощью комплекта реагентов для экстракции ДНК из клинического материала «АмплиПрайм ДНК-сорб В» («АмплиСенс», Россия) согласно инструкции производителя;
Выделение тотальной ДНК из 200 мкл венозной крови или буккального эпителия любым подходящим методом, например, с помощью комплекта реагентов для экстракции ДНК из клинического материала «АмплиПрайм ДНК-сорб В» («АмплиСенс», Россия) согласно инструкции производителя;
 Определение полиморфизмов методом HRM-PCR (High Resolution Melt Polymerase chain reaction) в присутствии красителя EvaGreen® Dye и специфичных праймеров на матрице очищенной ДНК;
Определение полиморфизмов методом HRM-PCR (High Resolution Melt Polymerase chain reaction) в присутствии красителя EvaGreen® Dye и специфичных праймеров на матрице очищенной ДНК;
 Анализ первичных данных с помощью программного продукта амплификатора с определением генотипа относительно референсных образцов.
Анализ первичных данных с помощью программного продукта амплификатора с определением генотипа относительно референсных образцов.
Идентификацию SNP проводят методом HRM-PCR, который представляет собой ПНР в реальном времени с последующим плавлением наработанных ампликонов. Для приготовления рабочей смеси используют компоненты ПНР и неспецифический ДНК-связывающий краситель типа EvaGreen® Dye, 20-кратный водный раствор (Biotium, США). Состав и соотношение компонентов рабочего раствора на один исследуемый образец представлены в таблице 1.
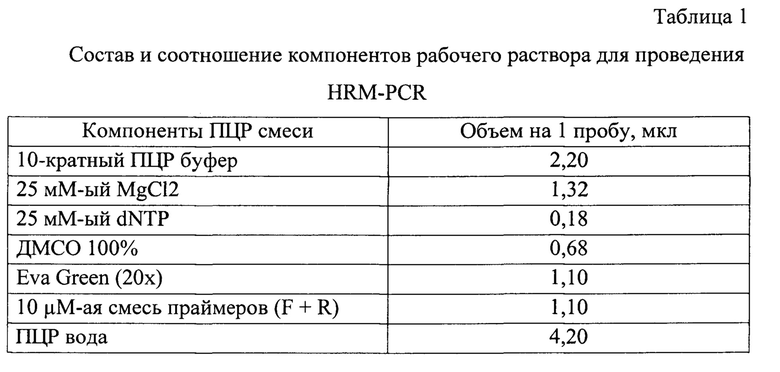

Метод HRM предполагает наличие референсных образцов нормальной гомозиготы, вариантной гетерозиготы и гомозиготы. Характеристики праймеров для HRM и секвенирования указаны в таблице 2.

Проводят генотипирование с.2411С>А rs200615700 в гене ROS1, c.13588G>A rs768143170 в гене KMT2D, c.289G>A rs372430349 в гене FGFR2 и c.967G>A в гене BCR. Наличие мутаций в генах ROS1 и KMT2D определяет вероятность течения НЭО ПЖ без прогрессии, мутации в генах FGFR2 и BCR повышают риск метастазирования и агрессивной формы опухолевого роста. Оценка рисков осуществляется по формулам:
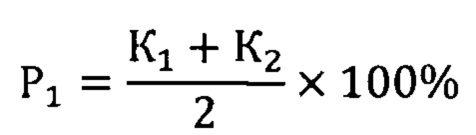
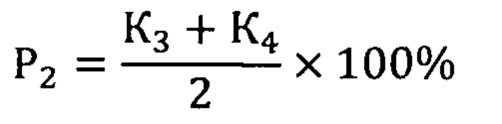
Здесь P1 - вероятность безрецидивной формы НЭО ПЖ, Р2 - вероятность прогрессирования опухоли, К1 - коэффициент для мутации с.2411С>А rs200615700 в гене ROS1, К2 - коэффициент для мутации c.13588G>A rs768143170 в гене KMT2D, К3 - коэффициент для мутации c.289G>A rs372430349 в гене FGFR2 и К4 - коэффициент для мутации c.967G>A в гене BCR. Значение коэффициентов зависит от генотипа: 0 в случае гомозиготы дикого типа, 0,5 - гетерозиготы и 1 - мутантной гомозиготы.
Авторами поведено ретроспективное исследование опухолевых образцов ДНК (парафиновые блоки) 54 пациентов с высокодифференцированными НЭО ПЖ, в возрасте от 31 до 73 лет (медиана возраста 53 года), проходивших лечение на базе ФГБУ «НМИЦ онкологии» Минздрава России в 2011-2018 гг. (см. Табл. 3).
Все образцы были стратифицированы в соответствии с классификацией ВОЗ 2017 г. На основании клинического течения онкопатологии больные были разделены на две группы: 1 группа - пациенты с безрецидивной формой НЭО ПЖ, 2 группа - пациенты с быстрой прогрессией опухоли.
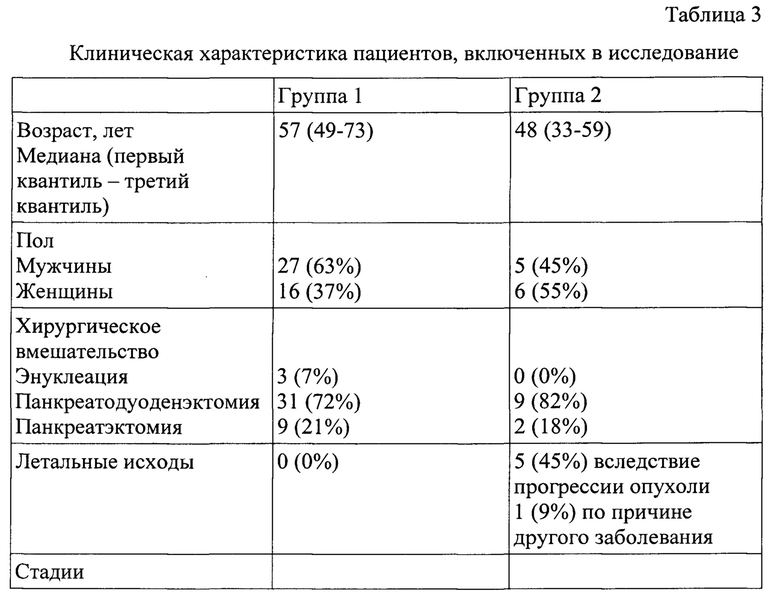

Установлено, что у пациентов с агрессивной формой НЭО ПЖ частота мутаций в генах FGFR2 и BCR была выше, чем у больных с безрецидивной формой, при этом генетических вариантов в генах ROS1 и KMT2D не встречалось.
Работоспособность способа прогнозирования клинического течения высокодифференцированных НЭО ПЖ иллюстрируется следующими клиническими примерами:
Клинический пример 1
Больной К. 62 года, поступил в отделение 19.04.2017 с диагнозом: нейроэндокринная опухоль головки поджелудочной железы St II, T3N0M0, кл.гр.2.
По результату гистологического исследования операционного материала: нейроэндокринная опухоль поджелудочной железы с инвазией клетчатку, сосуды.
При молекулярно-генетическом исследовании выявлен полиморфизм генов KMT2D (гетерозигота), ROS1 (вариантная гомозигота). Мутации в генах FGFR2 и BCR не обнаружены.
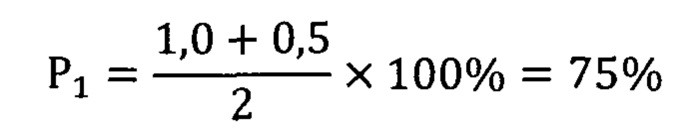
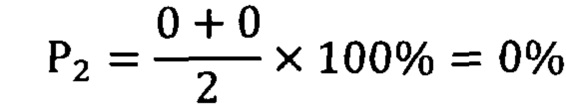
Вероятность безрецидивного клинического течения оценена в 75%, риск опухолевой прогрессии - 0%. В течение 3-х лет больная наблюдалась согласно клиническим стандартам. Химиотерапевтического лечения не проводилось. Последнее обследование проведено 29 апреля 2020 года. Данных за прогрессирование онкологического процесса и развитие метастазов не выявлено.
Клинический пример 2.
Больной И. 57 лет, поступил в отделение 07.11.2018 с диагнозом: нейроэндокринная опухоль головки поджелудочной железы T4N0M0, ст. III, кл.гр.2. Выполнена операция - панкреато-дуоденальная резекция, холецистэктомия. По результату гистологического исследования операционного материала: Морфологическая картина и иммунофенотип (chromograninA+, synaptophysin+, NSE+, CD56+) соответствуют высокодифференцированной нейроэндокринной опухоли, G1.
При молекулярно-генетическом исследовании выявлен полиморфизм генов FGFR2 и BCR.
В марте 2019 года у больного выявлено прогрессирование заболевания: метастатическое поражение 2,3 сегментов печени.
12.03.2019 выполнена операция в объеме гемигепатэктомия слева. Наличие выявленного полиморфизма генов FGFR2 (гетерозигота) и BCR (гетерозигота) явилось прогностическим фактором гематогенного метастазирования, несмотря на морфологический гистологический тип опухоли, который характеризуется относительно благоприятным течением. Статус генов KMT2D и ROS1 соответствовал дикому типу.
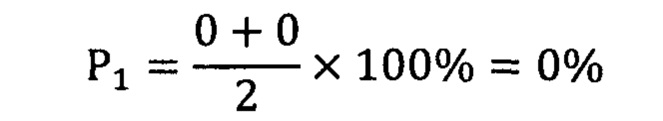
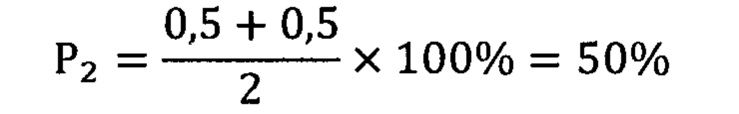
Риск опухолевой прогрессии составил 50%, вероятность безрецидивной формы - 0%. В настоящее время больной находится на курсах адъювантного лечения аналогами соматостатина (ланреотид 120 мг 1 раз в 3 недели.).
Таким образом, технико-экономическая эффективность «Способа прогнозирования клинического течения высокодифференцированных нейроэндокринных опухолей поджелудочной железы» позволяет своевременно оценить вероятность быстрого прогрессирования опухоли с последующим метастазированием и выделить группу риска больных. Применение способа позволяет прогнозировать развитие метастазирования для выбора оптимальной стратегии лечения персонифицировано для каждого пациента.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2019 |
|
RU2732974C1 |
| СПОСОБ ДИАГНОСТИКИ АДЕНОКАРЦИНОМЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С НЕЙРОЭНДОКРИННЫМ КОМПОНЕНТОМ | 2019 |
|
RU2722276C1 |
| Способ прогнозирования клинического течения нейроэндокринных новообразований толстой кишки | 2021 |
|
RU2771421C1 |
| СПОСОБ ЛЕЧЕНИЯ РЕЗЕКТАБЕЛЬНЫХ ПЕРВИЧНЫХ МЕСТНОРАСПРОСТРАНЕННЫХ ЗЛОКАЧЕСТВЕННЫХ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ ГОЛОВКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2016 |
|
RU2625271C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ ГОЛОВКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С МЕТАСТАЗАМИ В ПЕЧЕНЬ | 2016 |
|
RU2625275C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРВИЧНЫХ ЛОКАЛИЗОВАННЫХ ЗЛОКАЧЕСТВЕННЫХ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ ГОЛОВКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2016 |
|
RU2625276C1 |
| СПОСОБ ЛЕЧЕНИЯ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ МАЛОГО РАЗМЕРА | 2019 |
|
RU2714034C1 |
| Способ выбора тактики лечения пациентов с регионарной лимфаденопатией неясного генеза при аденокарциноме желудка | 2020 |
|
RU2740145C1 |
| СПОСОБ ДООПЕРАЦИОННОГО ОПРЕДЕЛЕНИЯ ОБЪЕМА ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ВЫСОКОДИФФЕРЕНЦИРОВАННОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2548783C1 |
| СПОСОБ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА НЕЙРОЭНДОКРИННОЙ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА В ПОДЖЕЛУДОЧНУЮ ЖЕЛЕЗУ ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2019 |
|
RU2725273C1 |
Изобретение относится к области медицины, в частности к онкологии и медицинской генетике, и предназначено для прогнозирования клинического течения высокодифференцированных нейроэндокринных опухолей поджелудочной железы. Проводят генотипирование с.2411C>А rs200615700 в гене ROS1, c.13588G>A rs768143170 в гене KMT2D, c.289G>A rs372430349 в гене FGFR2 и c.967G>A в гене BCR. Наличие мутаций в генах ROS1 и KMT2D определяет вероятность течения высокодифференцированных нейроэндокринных опухолей поджелудочной железы без прогрессии, мутации в генах FGFR2 и BCR повышают риск метастазирования и агрессивной формы опухолевого роста. Изобретение обеспечивает разработку способа, позволяющего своевременно оценить вероятность быстрого прогрессирования опухоли поджелудочной железы, выделить группу риска больных с высоким риском развития метастазирования нейроэндокринной опухоли поджелудочной железы. 3 табл., 2 пр.
Способ прогнозирования клинического течения высокодифференцированных нейроэндокринных опухолей поджелудочной железы, заключающийся в том, что проводят генотипирование с.2411C>А rs200615700 в гене ROS1, c.13588G>A rs768143170 в гене KMT2D, c.289G>A rs372430349 в гене FGFR2 и c.967G>A в гене BCR, наличие мутаций в генах ROS1 и KMT2D определяет вероятность течения высокодифференцированных нейроэндокринных опухолей поджелудочной железы без прогрессии, мутации в генах FGFR2 и BCR повышают риск метастазирования и агрессивной формы опухолевого роста, при этом оценку рисков осуществляют по формулам:
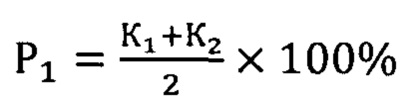
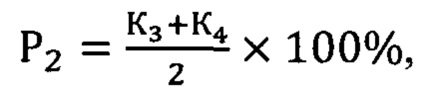
где P1 - вероятность безрецидивной формы высокодифференцированной нейроэндокринной опухоли поджелудочной железы, Р2 - вероятность прогрессирования опухоли, К1 - коэффициент для мутации с.2411С>А rs200615700 в гене ROS1, К2 - коэффициент для мутации c.13588G>A rs768143170 в гене KMT2D, К3 - коэффициент для мутации c.289G>A rs372430349 в гене FGFR2 и К4 - коэффициент для мутации c.967G>A в гене BCR, значение коэффициентов зависит от генотипа: 0 в случае гомозиготы дикого типа, 0,5 - гетерозиготы и 1 - мутантной гомозиготы.
| WO 2004045369 A2, 03.06.2004 | |||
| ГУРЕВИЧ Л | |||
| Е | |||
| и др | |||
| Современные подходы к морфологической диагностике нейроэндокринных опухолей поджелудочной железы и прогнозированию их клинического течения на основе анализа собственной базы данных | |||
| Альманах клинической медицины | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| STARZYNSKA T | |||
| et al | |||
| Differences between Well-Differentiated | |||
Авторы
Даты
2021-05-12—Публикация
2020-07-09—Подача