ПЕРЕКРЕСТНАЯ ССЫЛКА НА СМЕЖНЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США 62/278,780 (поданной 14 января 2016 г.), содержание которой включено в настоящий документ путем ссылки.
Область применения изобретения
[0002] Настоящая заявка относится к композициям, применяемым для криоконсервации клеток, полученных из ткани пуповины человека (клеток hUTC), и к способам криоконсервации клеток hUTC с использованием этих композиций.
Предпосылки создания изобретения
[0003] Клетки или ткани для аллогенного клеточного терапевтического препарата получают от донора, после чего их подвергают дополнительной обработке перед введением пациентам. Процесс приготовления негомологичного препарата клеточной терапии, как правило, включает стадии: размораживание и размножение клеток; концентрирование клеток и удаление нежелательных примесей, таких как сыворотка крови и трипсин, используемые в процессе обработки клеток; восстановление клеток в буферном растворе конечного состава; и криоконсервация клеток или препарата. После доставки в клиническое учреждение криоконсервированный препарат размораживают и вводят реципиенту. Препарат остается в составе для криоконсервации перед и во время введения реципиенту.
[0004] Криоконсервация представляет собой процесс консервации клеток или цельной ткани путем охлаждения до температур ниже нуля. При таких холодных температурах эффективно прекращается любая биологическая активность, включая биохимические реакции, которые могут вызывать гибель клеток. Однако известно, что криоконсервация приводит к повреждению замороженных клеток и таким образом ухудшает выживаемость клеток. Выживаемость клеток во время криоконсервации количественно определяют по показателям восстановления и жизнеспособности клеток после размораживания. На выживаемость клеток во время криоконсервации существенно влияют параметры процесса, такие как, например, состав для криоконсервации, цикл и процедура замораживания, процедура размораживания. Кроме того, явления, которые вызывают повреждение клеток во время криоконсервации, в основном происходят на этапе замораживания и включают в себя (без ограничения) эффекты растворения, внеклеточное образование льда, дегидратацию и внутриклеточное образование льда. Во избежание этого повреждения используют растворы криопротекторов, исключительно предназначенные для консервации клеток. Использование таких криопротекторов защищает клетки от повреждения вследствие замерзания в процессе охлаждения или размораживания.
[0005] Поэтому важно, чтобы конечный состав для криоконсервации, который также используют в качестве несущей среды для доставки препарата, был способен удерживать и поддерживать высокую выживаемость клеток, и сохранять целостность препарата при размораживании. Состав также должен быть безопасным для его введения реципиенту. Более того, состав для криоконсервации должен поддерживать стабильность препарата в течение продолжительного периода.
[0006] Существует потребность в композиции, приемлемой для криоконсервации клеток, полученных из ткани пуповины человека, которая поддерживает функциональность и терапевтическую пользу клеток.
Изложение сущности изобретения
[0007] В одном варианте осуществления изобретения представлена композиция, приемлемая для криоконсервации клеток, полученных из ткани пуповины, содержащая: (1) аминокислоты: L-аргинин, L-глутамин, глицин, L-изолейцин, L-лейцин, L-лизина HCl, L-метионин, L-фенилаланин, L-серин, L-треонин, L-триптофан и L-валин; (2) витамины: D-пантотенат кальция, хлорид холина, фолиевую кислоту, ниацинамид, пиридоксин-HCl, рибофлавин и тиамин-HCl; (3) неорганические соли: хлорид калия по Фарм. США, бикарбонат натрия по Фарм. США, хлорид натрия по Фарм. США и одноосновный фосфат натрия, H2O; и (4) ДМСО, безводную декстрозу по Фарм. США, сахарозу и маннит.
[0008] В определенных вариантах осуществления композиция содержит: (1) от около 37,8 до около 75,6 мг/л L-аргинина, от около 262,8 до около 525,6 мг/л L-глутамина, от около 13,5 до около 27 мг/л L-глицина, от около 47,16 до около 94,32 мг/л L-изолейцина, от около 47,16 до около 94,32 мг/л L-лейцина, от около 65,79 до около 131,58 мг/л L-лизина HCl, от около 13,5 до около 27 мг/л L-метионина, от около 29,7 до около 59,4 мг/л L-фенилаланина, от около 18,9 до около 37,8 мг/л L-серина, от около 42,75 до около 85,5 мг/л L-треонина, от около 7,2 до около 14,4 мг/л L-триптофана и от около 41,85 до около 83,7 мг/л L-валина; (2) от около 0,18 до около 0,36 мг/л рибофлавина и от около 1,8 до около 3,6 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина; (3) от около 360 до около 432 мг/л хлорида калия по Фарм. США, от около 2565 до около 3330 мг/л бикарбоната натрия по Фарм. США, от около 2880 до около 5760 мг/л хлорида натрия по Фарм. США и от около 56,25 до около 112,5 мг/л одноосновного фосфата натрия, H2O; и от около 5 до около 10% ДМСО, от около 855 до около 900 мг/л декстрозы, от около 3081 до около 6160 мг/л сахарозы и от около 1639 до около 3240 мг/л маннита.
[0009] Кроме того, композиция может дополнительно содержать лактобионовую кислоту, глутатион и неорганические соли: хлорида кальция дигидрат (CaCl2*2H2O), хлорид магния (MgCl2*6H2O), бикарбонат калия (KHCO3) и монофосфат калия (KH2PO4). Таким образом, в одном варианте осуществления композиция содержит: (1) по меньшей мере около 37,8 мг/л L-аргинина, по меньшей мере около 262,8 мг/л L-глутамина, по меньшей мере около 13,5 мг/л L-глицина, по меньшей мере около 47,16 мг/л L-изолейцина, по меньшей мере около 47,16 мг/л L-лейцина, по меньшей мере около 65,79 мг/л L-лизина HCl, по меньшей мере около 13,5 мг/л L-метионина, по меньшей мере около 29,7 мг/л L-фенилаланина, по меньшей мере около 18,9 мг/л L-серина, по меньшей мере около 42,75 5 мг/л L-треонина, по меньшей мере около 7,2 мг/л L-триптофана и 41,85 мг/л L-валина; (2) по меньшей мере около 0,18 мг/л рибофлавина и по меньшей мере около 1,8 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина; (3) по меньшей мере около 432 мг/л хлорида калия по Фарм. США, около 2565 мг/л бикарбоната натрия по Фарм. США, около 2880 мг/л хлорида натрия по Фарм. США, по меньшей мере около 56,25 мг/л одноосновного фосфата натрия, гидрата, по меньшей мере около 3,2 мг/л хлорида кальция дигидрата (CaCl2*2H2O), по меньшей мере около 458 мг/л хлорида магния (MgCl2*6H2O), по меньшей мере около 225 мг/л бикарбоната калия (KHCO3) и по меньшей мере около 612 мг/л монофосфата калия (KH2PO4); и (4) от около 5 до около 10% об. ДМСО, по меньшей мере около 855 мг/л безводной декстрозы по Фарм. США, по меньшей мере около 415 мг/л глутатиона; по меньшей мере около 3081 мг/л сахарозы и по меньшей мере около 1639 мг/л маннита.
[0010] В другом варианте осуществления композиция не включает в себя лактобионовую кислоту, глутатион и неорганические соли: хлорида кальция дигидрат (CaCl2*2H2O), хлорид магния (MgCl2*6H2O), бикарбонат калия (KHCO3) и монофосфат калия (KH2PO4). В этом варианте осуществления композиция содержит: (1) по меньшей мере около 75,6 мг/л L-аргинина, по меньшей мере около 525,6 мг/л L-глутамина, по меньшей мере около 27 мг/л L-глицина, по меньшей мере около 94,32 мг/л L-изолейцина, по меньшей мере около 94,32 мг/л L-лейцина, по меньшей мере около 131,58 мг/л L-лизина HCl, по меньшей мере около 27 мг/л L-метионина, по меньшей мере около 59,4 мг/л L-фенилаланина, по меньшей мере около 37,8 мг/л L-серина, по меньшей мере около 85,5 мг/л L-треонина, 14,4 мг/л L-триптофана и по меньшей мере около 83,7 мг/л L-валина; (2) по меньшей мере около 0,36 мг/л рибофлавина и по меньшей мере около 3,6 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина; (3) по меньшей мере около 360 мг/л хлорида калия по Фарм. США, по меньшей мере около 3330 мг/л бикарбоната натрия по Фарм. США, по меньшей мере около 5760 мг/л хлорида натрия по Фарм. США и по меньшей мере около 112,5 мг/л одноосновного фосфата натрия, H2O; и (4) от около 5 до около 10% об. ДМСО, по меньшей мере около 900 мг/л безводной декстрозы по Фарм. США, по меньшей мере около 6160 мг/л сахарозы и по меньшей мере около 3240 мг/л маннита.
[0011] Композиции можно применять в наборах, содержащих клетки, полученные из ткани пуповины, и в способах криоконсервации клеток, полученных из ткани пуповины человека.
[0012] В одном варианте осуществления клетки, полученные из ткани пуповины, выделены из ткани пуповины человека по существу свободными от крови, способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, не продуцируют CD117 или CD45 и не экспрессируют hTERT или теломеразу. В другом варианте осуществления клетки, полученные из ткани пуповины, дополнительно обладают одной или более из следующих ниже характеристик: экспрессируют рецептор 1 окисленных липопротеинов низкой плотности, ретикулон, лиганд 3 рецептора хемокинов и/или хемотаксический белок гранулоцитов; не экспрессируют CD31 или CD34; экспрессируют повышенные по отношению к фибробластам человека, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека уровни интерлейкина-8 или ретикулона-1; и экспрессируют CD10, CD13, CD44, CD73 и CD90.
[0013] В другом варианте осуществления настоящего изобретения представлен способ криоконсервации клеток, полученных из ткани пуповины человека, содержащий последовательные стадии: приготовление композиции для криоконсервации, содержащей клетки, полученные из ткани пуповины, и состав; охлаждение композиции для криоконсервации от исходной температуры около 4°C со скоростью -1,0°C/мин до достижения композицией температуры около -45,0°C; и дальнейшее охлаждение композиции для криоконсервации, пока композиция не достигнет температуры хранения около -120,0°C. Необязательно, способ дополнительно содержит охлаждение композиции для криоконсервации до исходной температуры около 4°C и/или поддержание исходной температуры около 4°C в течение около 15 минут.
[0014] Другие характеристики и преимущества настоящего изобретения станут понятны из следующего ниже подробного описания.
Краткое описание графических материалов
[0015] Приведенное выше краткое описание, а также приведенное ниже подробное описание вариантов осуществления изобретения будут более понятны при изучении вместе с приложенными фигурами. В целях иллюстрирования изобретения на фигурах показаны варианты осуществления настоящего изобретения. Необходимо понимать, однако, что изобретение не ограничивается показанными точными конструкциями, примерами и инструментарием.
[0016] На Фиг. 1 показана выживаемость клеток при комнатной температуре после размораживания.
[0017] На Фиг. 2 показана степень восстановления клеток после размораживания.
[0018] На Фиг. 3 показана жизнеспособность клеток после размораживания. Представленные данные основаны на измерениях прибором CEDEX с применением трипанового синего в качестве красителя.
[0019] На Фиг. 4 показана плотность жизнеспособных клеток после размораживания.
[0020] На Фиг. 5 показаны отек и покраснение конечностей у крыс после внутривенной (в/в) инфузии состава для криоконсервации, содержащего имеющийся в продаже раствор для криоконсервации (CS10). На Фиг. 5 показаны: слева - контрольная крыса и справа - крыса, которой вводили состав, содержащий CS10, с отеком и покраснением на лапках (см. пример 2).
[0021] На Фиг. 6A и 6B показана жизнеспособность клеток hUTC в различных составах после размораживания. Клетки размораживали, отбирали аликвоты и измеряли изменение жизнеспособности во времени на приборе Guava® с набором реагентов ViaCount®. Пробы измеряли в трех повторностях, и результаты наносили на график в виде среднего арифметического ± стандартная ошибка среднего (SEM). На Фиг. 6 показаны результаты для проб, приведенных в таблице 3-1. На Фиг. 6A показаны результаты для проб A-E. На Фиг. 6B показаны результаты для проб A и F-I.
Подробное описание
[0022] В следующем ниже подробном описании иллюстративных вариантов осуществления содержатся ссылки на сопровождающие рисунки, которые являются частью настоящего документа. Эти варианты осуществления описаны достаточно подробно, чтобы дать возможность специалистам в данной области практически применять изобретение, и следует понимать, что можно использовать и другие варианты осуществления, и что логические, структурные, механические, электрические и химические изменения можно вносить без отступления от сущности и объема изобретения. С тем, чтобы исключить чрезмерную детализацию, которая не требуется специалистам в данной области для практического применения описанных в настоящем документе вариантов осуществления, в описании может быть опущена определенная информация, известная специалистам в данной области. Поэтому следующее ниже подробное описание нельзя толковать в ограничительном смысле.
[0023] В настоящем изобретении описаны композиции для криоконсервации и профили замораживания, которые можно применять для криоконсервации клеток, полученных из ткани пуповины человека (hUTC). Кроме того, в данном изобретении описана композиция для криоконсервации для замораживания препарата клеточной терапии, полученного из клеток hUTC. Описываемые состав/композиция (-и): безопасны для введения, на основании исследований на животных; поддерживают высокую жизнеспособность клеток после размораживания; и поддерживают высокую выживаемость клеток во время криоконсервации. Эти композиции необязательно: (a) поддерживают ионный и осмотический баланс и ацидоз; (b) предотвращают набухание клеток; и (с) ограничивают накопление свободных радикалов.
[0024] В данном изобретении описаны составы для криоконсервации клеток hUTC для аллогенной клеточной терапии. Эти составы для криоконсервации поддерживают высокую выживаемость клеток hUTC во время стадии криоконсервации. Более того, на основании изучения биологических моделей, составы, когда их применяют в качестве несущей среды для доставки препарата, не вызывают проявления каких-либо неблагоприятных последствий. Кроме того, составы для криоконсервации поддерживают целостность размороженного препарата (т.е. клеток hUTC) в течение короткого периода времени, так что эти составы приемлемы для введения пациенту.
[0025] Большинство составов для криоконсервации содержат диметилсульфоксид (ДМСО) в интервале от 5% до 10% (об.) для поддержания осмотического баланса между внутриклеточной и внеклеточной средой. ДМСО также ингибирует внутриклеточное образование льда во время криоконсервации. Другие химические вещества, такие как глицерин, этиленгликоль, декстран и гидроксицеллюлоза, или дисахариды сахароза, мальтоза и трегалоза усиливают жизнеспособность клеток в сочетании с ДМСО. Композиции для криоконсервации, описанные в данной заявке, содержат уникальную сбалансированную смесь ДМСО, маннита, сахарозы и лактобионовой кислоты для поддержания осмотического баланса во время замораживания. Дополнительно, композиция содержит аминокислоты, витамины и микродобавки металлов для снабжения клеток питательными веществами.
[0026] В одном варианте осуществления в изобретении описан состав/композиция для криоконсервации, которые поддерживают высокую выживаемость клеток hUTC, и хорошо переносятся после в/в введения в объеме дозы вплоть до приблизительно 10 мл/кг и после инъекции в спинномозговую жидкость (СМЖ) в объеме 100 мкл, что составляет приблизительно 25-33% от общего объема СМЖ крысы (от 300 до 400 мкл).
[0027] В приведенном ниже описании и формуле изобретения применяются различные термины. Такие термины должны иметь обычное для них значение в данной области, если не указано иное. Другие конкретно определенные термины следует толковать согласно приведенным в настоящем документе определениям.
[0028] В одном варианте осуществления клетки, применяемые в настоящем изобретении, по существу, называют постнатальными клетками или клетками, полученными в постнатальный период (клетки PPDC). Более конкретно, данные клетки являются «клетками, полученными из пупка», «клетками, полученными из пуповины» (UDC), «клетками, полученными из ткани пуповины» (UTC) или «клетками, полученными из ткани пуповины человека» (hUTC). Кроме того, данные клетки можно описывать как стволовые клетки или клетки-предшественницы, причем последний термин применяется в широком смысле. Термин «полученный из» применяется для указания того, что клетки были получены из их биологического источника, и были выращены или иным образом обработаны in vitro (например, культивированы в ростовой среде для размножения популяции и/или образования клеточной линии). Манипуляции in vitro с пуповинными стволовыми клетками и уникальные характеристики клеток, полученных из пуповины и составляющих предмет настоящего изобретения, более подробно описаны ниже.
[0029] Стволовые клетки представляют собой недифференцированные клетки, определяемые по способности единичной клетки как к самообновлению, так и к дифференцированию с образованием клеток-потомков, включая самообновляющиеся клетки-предшественницы, необновляющиеся клетки-предшественницы и окончательно дифференцированные клетки. Стволовые клетки также характеризуются по их способности дифференцироваться in vitro в функциональные клетки различных клеточных линий из множества зародышевых листков (энтодермы, мезодермы и эктодермы), также как и давать начало тканям из множества зародышевых листков после трансплантации, и способствовать образованию по существу большинства, если не всех, тканей после инъекции в бластоцисты.
[0030] По своему потенциалу развития стволовые клетки классифицированы на: (1) тотипотентные; (2) плюрипотентные; (3) мультипотентные; (4) олигопотентные; и (5) унипотентные. Тотипотентные клетки способны давать начало всем типам эмбриональных и внеэмбриональных клеток. Плюрипотентные клетки способны давать начало всем типам эмбриональных клеток. Мультипотентные клетки включают таковые, способные давать начало дифференциации подмножества клеточных линий, но только в пределах конкретной ткани, органа или физиологической системы. Например, гемопоэтические стволовые клетки (HSC) могут образовывать клетки-потомки, которые включают HSC (самообновляющиеся), ограниченные клетками крови олигопотентные предшественницы, и все типы и элементы клеток (например, тромбоциты), представляющие собой нормальные компоненты крови. Клетки, которые являются олигопотентными, способны давать начало дифференциации в более ограниченное подмножество клеточных линий, чем мультипотентные стволовые клетки. Клетки, которые являются унипотентными, способны давать начало дифференциации в отдельные клеточные линии (например, сперматогенные стволовые клетки).
[0031] Стволовые клетки также классифицируют на основании источника их получения. Взрослая стволовая клетка по существу представляет собой мультипотентную недифференцированную клетку, которая находится в ткани, содержащей множество дифференцированных типов клеток. Взрослая стволовая клетка способна к самообновлению. В нормальных условиях она также может дифференцироваться с образованием специализированных типов клеток ткани, из которой они происходят, и возможно, тканей других типов. Эмбриональная стволовая клетка представляет собой плюрипотентную клетку из внутренней клеточной массы эмбриона на стадии бластоцисты. Фетальная стволовая клетка представляет собой клетку, происходящую из тканей или оболочек плода. Постнатальная стволовая клетка является мультипотентной или плюрипотентной клеткой, которая, по существу, происходит из внеэмбриональной ткани, доступной после родов, а именно, из пуповины. Обнаружено, что данные клетки обладают признаками, характерными для плюрипотентных стволовых клеток, включая быструю пролиферацию и способность к дифференцированию в клетки многих клеточных линий. Постнатальные стволовые клетки можно получать из крови (например, как клетки, полученные из пуповинной крови) или не из крови (например, как клетки, полученные из отличных от крови тканей пуповины и плаценты).
[0032] Для описания клеток в культуре применяются различные термины. «Клеточная культура» по существу относится к клеткам, взятым из живого организма и выращенным в контролируемых условиях («в культуре», или «культивированным»). «Первичная культура клеток» обозначает культуру клеток, тканей или органов, взятых непосредственно из организма (-ов), до ее первого пересева. Клетки «размножаются» в культуре, когда их помещают в ростовую среду в условиях, способствующих росту и/или делению клеток, что приводит к увеличению популяции клеток. При размножении клеток в культуре скорость пролиферации клеток иногда измеряют длительностью времени, которое необходимо клеткам для удвоения численности. Такое время называют «временем удвоения».
[0033] Термин «клеточная линия», по существу, относится к популяции клеток, формируемой в результате одного или более пересевов первичной клеточной культуры. Каждый цикл пересева называют пассажем. Пересеянные клетки называют клетками, которые «пассированы». Конкретную популяцию клеток, или клеточную линию, иногда описывают или характеризуют числом выполненных с ней пассажей. Например, пересеянную десять раз популяцию культуры клеток можно описывать как культуру десятого пассажа, или культуру P10. Первичную культуру, т.е. первую культуру после выделения клеток из ткани, обозначают P0. После первого пересева клетки описывают как вторичную культуру (P1, или пассаж 1). После второго пересева клетки становятся третичной культурой (P2, или пассаж 2) и т.д. Специалистам в данной области будет понятно, что за период пересева популяция клеток может многократно удваиваться; следовательно, число удвоений популяции в культуре больше, чем номер пассажа. Степень размножения клеток (т.е. число удвоений популяции) за период между пассажами зависит от многих факторов, включая (без ограничения) плотность посева, субстрат, среду, условия роста и продолжительность времени между пассажами.
[0034] «Дифференцировка» представляет собой процесс, при котором неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, такой как, например, нервная или мышечная клетка. «Дифференцированная» клетка представляет собой клетку, занявшую более специализированное («коммитированное») положение в дифференциации клеточной линии. Термин «коммитированная» применительно к процессу дифференцировки относится к клетке, дошедшей в процессе дифференцировки до этапа, от которого в нормальных условиях она продолжит дифференцироваться в конкретный тип клеток или подмножество типов клеток, и не сможет в нормальных условиях дифференцироваться в иной тип клеток либо вернуться к менее дифференцированному типу клеток. «Дедифференцировка» обозначает процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в пределах дифференциации клеточной линии. Используемый в настоящем документе термин «линия дифференцировки» определяет наследственность клетки, т.е. определяет, от какой клетки произошла данная клетка и каким клеткам она может давать начало. Клеточная линия дифференцировки помещает клетку в пределы наследственной схемы развития и дифференцировки.
[0035] В широком смысле клетка-предшественница представляет собой клетку, обладающую способностью к созданию клеток-потомков, которые будут более дифференцированы по сравнению с ней, и при этом сохраняющую способность к восполнению пула клеток-предшественниц. По данному определению сами стволовые клетки также являются клетками-предшественницами, поскольку являются ближайшими предками окончательно дифференцированных клеток. В отношении клеток настоящего изобретения, как более подробно описано ниже, можно применять это широкое определение клеток-предшественниц. В более узком смысле клетку-предшественницу часто определяют как промежуточную клетку в процессе дифференцировки, т.е. она происходит от стволовой клетки и является промежуточным звеном в продукции зрелого типа клеток или подмножества типов клеток. Клетки-предшественницы этого типа по существу не способны к самообновлению. Соответственно, при упоминании клетки данного типа в настоящем документе она будет обозначать «необновляющуюся клетку-предшественницу» или «промежуточную клетку-предшественницу или предковую клетку».
[0036] По существу, «трофический фактор» определяют как вещество, стимулирующее выживаемость, рост, пролиферацию и/или созревание клетки, или стимулирующее повышенную активность клетки.
[0037] Применяемый в настоящем документе термин «стандартные условия роста» относится к культивированию клеток при температуре 37°C в стандартной атмосфере, содержащей 5% CO2, с относительной влажностью около 100%. Хотя описанные выше условия можно применять для культивирования клеток, следует понимать, что опытный специалист в данной области, принимая во внимание возможности культивирования клеток, известные в данной области, вполне может варьировать такие условия.
[0038] Применяемый в настоящем документе термин «выделять» по существу относится к клетке, которую отделили от ее естественной среды. Данный термин включает грубое физическое отделение от естественной среды, например, путем взятия от животного-донора. В предпочтительных вариантах осуществления выделенная клетка не находится в ткани, т.е. клетка отделена от или разобщена с соседними клетками, с которыми она контактирует в нормальных условиях. Предпочтительно вводить клетки в виде суспензии клеток. Применяемый в настоящем документе термин «суспензия клеток» включает клетки, которые контактируют со средой и были разобщены, например, путем осторожного измельчения фрагмента ткани.
[0039] «Опорно-зависимыми клетками» являются клетки, включая клетки млекопитающих, которым необходимо закрепление на поверхности, например, на поверхности флакона для тканевой культуры или поверхности частицы-микроносителя, для размножения в тканевой культуре.
[0040] Применяемый в настоящем документе термин «около», когда он относится к измеряемому значению, такому как количество, длительность времени и т. п., означает изменения в пределах ± 20% или ± 10%, более предпочтительно ± 5%, еще более предпочтительно ± 1%, и еще более предпочтительно ± 0,1% от указанного значения, в зависимости от того, какие изменения подходят для осуществления описываемых способов.
I. Композиции для криоконсервации
[0041] Один аспект настоящего изобретения относится к композициям для криоконсервации клеток, полученных из ткани пуповины человека. Композиции изобретения уникальны тем, что они приемлемы для введения, и что они имеют такой состав, чтобы поддерживать высокую жизнеспособность после размораживания и поддерживать высокую выживаемость клеток во время криоконсервации. Таким образом, клетки можно криоконсервировать в композициях, и композиции можно вводить субъекту после размораживания. Композиции также предотвращают набухание клеток, ограничивают накопление свободных радикалов и поддерживают ацидоз, а также ионный и осмотический баланс.
[0042] В одном варианте осуществления изобретения композиции для криоконсервации содержат выбранные аминокислоты, витамины, неорганические соли и другие компоненты. Один или более из других компонентов может действовать в качестве криопротектора.
A. Аминокислоты
[0043] В одном варианте осуществления изобретения композиция содержит аминокислоты: L-аргинин, L-глутамин, глицин, L-изолейцин, L-лейцин, L-лизина HCl, L-метионин, L-фенилаланин, L-серин, L-треонин, L-триптофан и L-валин.
[0044] В другом варианте осуществления композиция содержит от около 37,8 до около 75,6 мг/л, альтернативно по меньшей мере около 37,8 мг/л, альтернативно по меньшей мере около 75,6 мг/л L-аргинина. В еще одном варианте осуществления композиция содержит от около 262,8 до около 525,6 мг/л, альтернативно по меньшей мере около 262,8 мг/л, альтернативно по меньшей мере около 525,6 мг/л L-глутамина. В другом варианте осуществления композиция содержит от около 13,5 до около 27 мг/л, альтернативно по меньшей мере около 13,5 мг/л, альтернативно по меньшей мере около 27 мг/л глицина. В другом варианте осуществления композиция содержит от около 47,16 до около 94,23 мг/л, альтернативно по меньшей мере около 47,16 мг/л, альтернативно по меньшей мере около 94,32 мг/л L-изолейцина и L-лейцина. В другом варианте осуществления композиция содержит от около 67,79 до около 131,58 мг/л, альтернативно по меньшей мере около 67,79 мг/л, альтернативно по меньшей мере около 131,58 мг/л L-лизина. В еще одном варианте осуществления композиция содержит от около 13,5 до около 27 мг/л, альтернативно по меньшей мере около 13,5 мг/л, альтернативно по меньшей мере около 27 мг/л L-метионина. В еще одном варианте осуществления композиция содержит от около 29,7 до около 59,4 мг/л, альтернативно по меньшей мере около 29,7 мг/л, альтернативно по меньшей мере около 59,4 мг/л фенилаланина. В альтернативном варианте осуществления композиция содержит от около 18,9 до около 37,8 мг/л, альтернативно по меньшей мере около 18,9 мг/л, альтернативно по меньшей мере около 37,8 мг/л серина. В одном варианте осуществления композиция содержит от около 42,75 до около 85,5 мг/л, альтернативно по меньшей мере около 42,75 мг/л, альтернативно по меньшей мере около 85,5 мг/л L-треонина. В альтернативном варианте осуществления композиция содержит от около 7,2 до около 14,4 мг/л, альтернативно по меньшей мере около 7,2 мг/л, альтернативно по меньшей мере около 14,4 мг/л L-триптофана. В еще одном варианте осуществления композиция содержит от около 41,85 до около 83,7 мг/л, альтернативно по меньшей мере около 41,85 мг/л, альтернативно по меньшей мере около 83,7 мг/л L-валина.
[0045] В одном варианте осуществления композиция содержит от около 37,8 до около 75,6 мг/л L-аргинина, от около 262,8 до около 525,6 мг/л L-глутамина, от около 13,5 до около 27 мг/л L-глицина, от около 47,16 до около 94,32 мг/л L-изолейцина, от около 47,16 до около 94,32 мг/л L-лейцина, от около 65,79 до около 131,58 мг/л L-лизина HCl, от около 13,5 до около 27 мг/л L-метионина, от около 29,7 до около 59,4 мг/л L-фенилаланина, от около 18,9 до около 37,8 мг/л L-серина, от около 42,75 до около 85,5 мг/л L-треонина, от около 7,2 до около 14,4 мг/л L-триптофана и от около 41,85 до около 83,7 мг/л L-валина.
[0046] В другом варианте осуществления композиция содержит около 37,8 мг/л L-аргинина, около 262,8 мг/л L-глутамина, около 13,5 мг/л L-глицина, около 47,16 мг/л L-изолейцина, около 47,16 мг/л L-лейцина, около 65,79 мг/л L-лизина HCl, около 13,5 мг/л L-метионина, около 29,7 мг/л L-фенилаланина, около 18,9 мг/л L-серина, около 42,75 5 мг/л L-треонина, около 7,2 мг/л L-триптофана и 41,85 мг/л L-валина.
[0047] В еще одном варианте осуществления композиция содержит около 75,6 мг/л L-аргинина, около 525,6 мг/л L-глутамина, около 27 мг/л L-глицина, около 94,32 мг/л L-изолейцина, около 94,32 мг/л L-лейцина, около 131,58 мг/л L-лизина HCl, около 27 мг/л L-метионина, около 59,4 мг/л L-фенилаланина, около 37,8 мг/л L-серина, около 85,5 мг/л L-треонина, 14,4 мг/л L-триптофана и около 83,7 мг/л L-валина.
B. Витамины
[0048] В другом варианте осуществления композиция дополнительно содержит витамины: D-пантотенат кальция, хлорид холина, фолиевую кислоту, ниацинамид, пиридоксина HCl, тиамина HCl и рибофлавин.
[0049] В одном варианте осуществления композиция содержит от около 1,8 до около 3,6 мг/л, альтернативно по меньшей мере около 1,8 мг/л, альтернативно по меньшей мере около 3,6 мг/л одного или более, предпочтительно каждого из витаминов, D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина. В одном варианте осуществления композиция содержит от около 0,18 до около 0,36 мг/л, альтернативно по меньшей мере около 0,18 мг/л, альтернативно по меньшей мере около 0,36 мг/л рибофлавина.
[0050] В одном варианте осуществления композиция содержит от около 0,18 до около 0,36 мг/л рибофлавина и от около 1,8 до около 3,6 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина.
[0051] В другом варианте осуществления композиция содержит около 0,18 мг/л рибофлавина и около 1,8 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина.
[0052] В альтернативном варианте осуществления композиция содержит около 0,36 мг/л рибофлавина и около 3,6 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина.
C. Неорганические соли
[0053] В еще одном альтернативном варианте осуществления композиция дополнительно содержит неорганические соли: хлорид калия по Фарм. США, бикарбонат натрия по Фарм. США, хлорид натрия по Фарм. США и одноосновный фосфат натрия, H2O. В одном варианте осуществления композиция дополнительно содержит хлорида кальция дигидрат (CaCl2*2H2O), хлорид магния (MgCl2*6H2O), бикарбонат калия (KHCO3) и монофосфат калия (KH2PO4). В другом варианте осуществления композиция для криоконсервации не содержит хлорида кальция дигидрата (CaCl2*2H2O), хлорида магния (MgCl2*6H2O), бикарбоната калия (KHCO3) и монофосфата калия (KH2PO4).
[0054] В другом варианте осуществления композиция содержит от около 360 до около 432 мг/л, альтернативно по меньшей мере около 360 мг/л, альтернативно по меньшей мере около 432 мг/л хлорида калия по Фарм. США. В другом варианте осуществления композиция содержит от около 2565 до около 3330 мг/л, альтернативно по меньшей мере около 2565 мг/л, альтернативно по меньшей мере около 3330 мг/л бикарбоната натрия по Фарм. США. В одном варианте осуществления композиция содержит от около 2880 до около 5760 мг/л, альтернативно по меньшей мере около 2880 мг/л, альтернативно по меньшей мере около 5760 мг/л хлорида натрия по Фарм. США. В другом варианте осуществления композиция содержит от около 56,25 до около 112,5 мг/л, альтернативно по меньшей мере около 56,25 мг/л, альтернативно по меньшей мере около 112,5 мг/л одноосновного фосфата натрия, H2O. В определенных вариантах осуществления композиция дополнительно содержит одно или более из: (a) по меньшей мере около 3,2 мг/л, альтернативно по меньшей мере около 32 мкг/л хлорида кальция дигидрата (CaCl2*2H2O); (b) по меньшей мере около 458 мг/л хлорида магния (MgCl2*6H2O); (c) по меньшей мере около 225 мг/л бикарбоната калия (KHCO3); и (d) по меньшей мере около 612 мг/л монофосфата калия (KH2PO4).
[0055] В альтернативном варианте осуществления композиция содержит от около 360 до около 432 мг/л хлорида калия по Фарм. США, от около 2565 до около 3330 мг/л бикарбоната натрия по Фарм. США, от около 2880 до около 5760 мг/л хлорида натрия по Фарм. США и от около 56,25 до около 112,5 мг/л одноосновного фосфата натрия, H2O.
[0056] В одном варианте осуществления композиция содержит около 360 мг/л хлорида калия по Фарм. США, около 3330 мг/л бикарбоната натрия по Фарм. США, около 5760 мг/л хлорида натрия по Фарм. США и около 112,5 мг/л одноосновного фосфата натрия, H2O. Предпочтительно данная композиция для криоконсервации не содержит хлорида кальция дигидрата (CaCl2*2H2O), хлорида магния (MgCl2*6H2O), бикарбоната калия (KHCO3) и монофосфата калия (KH2PO4).
[0057] В другом варианте осуществления композиция содержит около 432 мг/л хлорида калия по Фарм. США, около 2565 мг/л бикарбоната натрия по Фарм. США, около 2880 мг/л хлорида натрия по Фарм. США, около 56,25 мг/л одноосновного фосфата натрия, H2O, около 32 мкг/л хлорида кальция дигидрата (CaCl2*2H2O), около 458 мг/л хлорида магния (MgCl2*6H2O), около 225 мг/л бикарбоната калия (KHCO3) и около 612 мг/л монофосфата калия (KH2PO4).
[0058] В альтернативном варианте осуществления композиция содержит около 432 мг/л хлорида калия, около 2565 0 мг/л бикарбоната натрия по Фарм. США, около 2880 мг/л хлорида натрия, около 56,25 мг/л одноосновного фосфата натрия, H2O, около 3,2 мкг/л хлорида кальция дигидрата (CaCl2*2H2O), около 458 мг/л хлорида магния (MgCl2*6H2O), около 225 мг/л бикарбоната калия (KHCO3) и около 612 мг/л монофосфата калия (KH2PO4).
D. Другие компоненты
[0059] В другом варианте осуществления композиция дополнительно содержит ДМСО, безводную декстрозу по Фарм. США, сахарозу и маннит. В еще одном варианте осуществления композиция дополнительно содержит лактобионовую кислоту и глутатион.
[0060] Без намерения следовать теории, в определенных вариантах осуществления изобретения лактобионовая кислота, сахароза, маннит, глутатион и/или ДМСО могут действовать как криопротекторы.
[0061] Композиции могут содержать от около 5% до около 10% об. ДМСО. В определенных вариантах осуществления композиции содержат 5%, 7% или 10% об. ДМСО.
[0062] В одном варианте осуществления композиция содержит от около 855 мг/л до около 900 мг/л, альтернативно по меньшей мере около 855 мг/л, альтернативно по меньшей мере около 900 мг/л безводной декстрозы по Фарм. США. В другом варианте осуществления композиция содержит от около 3081 до около 6160 мг/л, альтернативно от около 2460 до около 3695 мг/л, альтернативно по меньшей мере около 2300 мг/л, альтернативно по меньшей мере около 2400 мг/л, альтернативно по меньшей мере около 4900 мг/л, альтернативно по меньшей мере около 3081 мг/л, альтернативно по меньшей мере около 6160 мг/л, альтернативно около 2460 мг/л, альтернативно около 4900 мг/л, альтернативно по меньшей мере около 7400 мг/л, альтернативно от около 5400 до около 8400 мг/л сахарозы. В альтернативном варианте осуществления композиция содержит от около 1310 до около 1967 мг/л, альтернативно от около 2620 до около 3940 мг/л, альтернативно от около 1310 до около 3940 мг/мл, альтернативно по меньшей мере около 1639 мг/л, альтернативно по меньшей мере около 3240 мг/л, альтернативно около 1639 мг/л, альтернативно около 3240 мг/л маннита. В другом варианте осуществления композиция содержит от около 12 000 до около 20 000 мг/л, альтернативно по меньшей мере около 16 000 мг/л, альтернативно около 16123 мг/л, альтернативно около 12 000 мг/л, альтернативно около 16 000 мг/л, альтернативно 19 000 мг/л лактобионовой кислоты. В еще одном варианте осуществления композиция содержит от около 415 до около 500 мг/л, альтернативно от около 329 до около 495 мг/л, альтернативно по меньшей мере около 415 мг/л, альтернативно около 415 мг/л, альтернативно около 329 мг/л, альтернативно около 495 мг/л глутатиона.
[0063] В одном варианте осуществления композиция содержит от около 5 до около 10% об. ДМСО, по меньшей мере около 900 мг/л безводной декстрозы по Фарм. США, от около 4932 до около 7100 мг/л, альтернативно около 6160 мг/л сахарозы и от около 2620 до около 3940 мг/л, альтернативно около 3240 мг/л маннита. Предпочтительно в данном варианте осуществления композиция не содержит (т.е. свободна от) лактобионовой кислоты и глутатиона.
[0064] В другом варианте осуществления композиция содержит от около 5 до около 10% об. ДМСО, по меньшей мере около 855 мг/л безводной декстрозы по Фарм. США, от около 2460 до около 3700 мг/л, альтернативно по меньшей мере около 2460 мг/л сахарозы, от около 1310 до около 2000 мг/л, альтернативно по меньшей мере около 1639 мг/л, альтернативно около 1639 мг/л маннита, от около 12 000 до около 20 000 мг/л, альтернативно по меньшей мере около 16 000 мг/л, альтернативно около 16 000 мг/л лактобионовой кислоты и от около 300 мг/л до около 500 мг/л, альтернативно по меньшей мере около 415 мг/л, альтернативно около 415 мг/л глутатиона.
E. Дополнительные варианты осуществления
[0065] В одном варианте осуществления изобретения композиция, приемлемая для криоконсервации клеток, полученных из ткани пуповины, содержит: аминокислоты: L-аргинин, L-глутамин, глицин, L-изолейцин, L-лейцин, L-лизина HCl, L-метионин, L-фенилаланин, L-серин, L-треонин, L-триптофан и L-валин; витамины: D-пантотенат кальция, хлорид холина, фолиевую кислоту, ниацинамид, пиридоксина HCl, рибофлавин и тиамина HCl; неорганические соли: хлорид калия (Фарм. США), бикарбонат натрия (Фарм. США), хлорид натрия (Фарм. США) и одноосновный фосфат натрия, H2O; и ДМСО, декстрозу (безводную по Фарм. США), сахарозу и маннит.
[0066] В одном варианте осуществления данная композиция содержит: от около 37,8 до около 75,6 мг/л L-аргинина, от около 262,8 до около 525,6 мг/л L-глутамина, от около 13,5 до около 27 мг/л L-глицина, от около 47,16 до около 94,32 мг/л L-изолейцина, от около 47,16 до около 94,32 мг/л L-лейцина, от около 65,79 до около 131,58 мг/л L-лизина HCl, от около 13,5 до около 27 мг/л L-метионина, от около 29,7 до около 59,4 мг/л L-фенилаланина, от около 18,9 до около 37,8 мг/л L-серина, от около 42,75 до около 85,5 мг/л L-треонина, от около 7,2 до около 14,4 мг/л L-триптофана и от около 41,85 до около 83,7 мг/л L-валина; от около 0,18 до около 0,36 мг/л рибофлавина и от около 1,8 до около 3,6 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина; от около 360 до около 432 мг/л хлорида калия (Фарм. США), от около 2565 до около 3330 мг/л бикарбоната натрия (Фарм. США), от около 2880 до около 5760 мг/л хлорида натрия (Фарм. США) и от около 56,25 до около 112,5 мг/л одноосновного фосфата натрия, H2O; и от около 5 до около 10% ДМСО, от около 855 до около 900 мг/л декстрозы, от около 3081 до около 6160 мг/л сахарозы и от около 1639 до около 3240 мг/л маннита.
[0067] В одном варианте осуществления изобретения данная композиция дополнительно не содержит неорганические соли: хлорида кальция дигидрат (CaCl2*2H2O), хлорид магния (MgCl2*6H2O), бикарбонат калия (KHCO3) и монофосфат калия (KH2PO4). В еще одном варианте осуществления композиция также не содержит лактобионовую кислоту и глутатион. В альтернативном варианте осуществления данная композиция свободна от хлорида кальция дигидрата (CaCl2*2H2O), хлорида магния (MgCl2*6H2O), бикарбоната калия (KHCO3), монофосфата калия (KH2PO4), лактобионовой кислоты и глутатиона. Соответственно, в одном варианте осуществления композиция содержит по меньшей мере около 75,6 мг/л L-аргинина, по меньшей мере около 525,6 мг/л L-глутамина, по меньшей мере около 27 мг/л L-глицина, по меньшей мере около 94,32 мг/л L-изолейцина, по меньшей мере около 94,32 мг/л L-лейцина, по меньшей мере около 131,58 мг/л L-лизина HCl, по меньшей мере около 27 мг/л L-метионина, по меньшей мере около 59,4 мг/л L-фенилаланина, по меньшей мере около 37,8 мг/л L-серина, по меньшей мере около 85,5 мг/л L-треонина, 14,4 мг/л L-триптофана и по меньшей мере около 83,7 мг/л L-валина; по меньшей мере около 0,36 мг/л рибофлавина и по меньшей мере около 3,6 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина; по меньшей мере около 360 мг/л хлорида калия, по меньшей мере около 3330 мг/л бикарбоната натрия, по меньшей мере около 5760 мг/л хлорида натрия и по меньшей мере около 112,5 мг/л одноосновного фосфата натрия, H2O; и от около 5 до около 10% об. ДМСО, по меньшей мере около 900 мг/л декстрозы (безводной по Фарм. США), по меньшей мере около 6160 мг/л сахарозы и по меньшей мере около 3240 мг/л маннита.
[0068] В другом варианте осуществления изобретения композиция для криоконсервации клеток, полученных из ткани пуповины, содержит: аминокислоты: L-аргинин, L-глутамин, глицин, L-изолейцин, L-лейцин, L-лизина HCl, L-метионин, L-фенилаланин, L-серин, L-треонин, L-триптофан и L-валин; витамины: D-пантотенат кальция, хлорид холина, фолиевую кислоту, ниацинамид, пиридоксина HCl, рибофлавин и тиамина HCl; неорганические соли: хлорид калия по Фарм. США, бикарбонат натрия по Фарм. США, хлорид натрия по Фарм. США и одноосновный фосфат натрия, H2O, хлорида кальция дигидрат (CaCl2*2H2O), хлорид магния (MgCl2*6H2O), бикарбонат калия (KHCO3) и монофосфат калия (KH2PO4); и ДМСО, декстрозу (безводная по Фарм. США), сахарозу, маннит, лактобионовую кислоту и глутатион.
[0069] В одном варианте осуществления данная композиция содержит: по меньшей мере около 37,8 мг/л L-аргинина, по меньшей мере около 262,8 мг/л L-глутамина, по меньшей мере около 13,5 мг/л L-глицина, по меньшей мере около 47,16 мг/л L-изолейцина, по меньшей мере около 47,16 мг/л L-лейцина, по меньшей мере около 65,79 мг/л L-лизина HCl, по меньшей мере около 13,5 мг/л L-метионина, по меньшей мере около 29,7 мг/л L-фенилаланина, по меньшей мере около 18,9 мг/л L-серина, по меньшей мере около 42,75 5 мг/л L-треонина, по меньшей мере около 7,2 мг/л L-триптофана и 41,85 мг/л L-валина; по меньшей мере около 0,18 мг/л рибофлавина и по меньшей мере около 1,8 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина; по меньшей мере около 432 мг/л хлорида калия по Фарм. США, около 2565 мг/л бикарбоната натрия по Фарм. США, около 2880 мг/л хлорида натрия по Фарм. США, по меньшей мере около 56,25 мг/л одноосновного фосфата натрия, H2O, по меньшей мере около 3,2 мг/л хлорида кальция дигидрата (CaCl2*2H2O), по меньшей мере около 458 мг/л хлорида магния (MgCl2*6H2O), по меньшей мере около 225 мг/л бикарбоната калия (KHCO3) и по меньшей мере около 612 мг/л монофосфата калия (KH2PO4); и от около 5 до около 10% об. ДМСО, по меньшей мере около 855 мг/л декстрозы (безводной по Фарм. США), по меньшей мере около 415 мг/л глутатиона; по меньшей мере около 3081 мг/л сахарозы и по меньшей мере около 1639 мг/л маннита.
[0070] Другие варианты осуществления композиций изобретения представлены в таблице ниже. При ссылке на количества каждого компонента, приведенного в таблице, количества представляют собой лишь приблизительные значения. Изменения ± 20% или ± 10%, более предпочтительно ± 5%, еще более предпочтительно ± 1% и еще более предпочтительно ± 0,1% от указанного значения также охвачены этими вариантами осуществления.
(низкое содержание кальция)
[0071] При ссылке на представленные выше варианты осуществления A и B количества лактобионовой кислоты, глутатиона, ДМСО, безводной декстрозы по Фарм. США, сахарозы и маннита могут изменяться в зависимости от применения композиций. Количество ДМСО может изменяться в интервале от около 5% до около 10% об. В одном варианте осуществления вариант осуществления A содержит 3,2 мг/л хлорида кальция дигидрата (CaCl2*2H2O). Для варианта осуществления A количества лактобионовой кислоты, сахарозы, маннита и глутатиона могут изменяться и включать количества этих компонентов, приведенные в таблице 1-8. Аналогично, для варианта осуществления B количества сахарозы и маннита также могут изменяться и включать количества этих компонентов, приведенные в таблице 1-7.
II. Способы криоконсервации
[0072] В другом аспекте изобретения представлен способ криоконсервации клеток, полученных из ткани пуповины человека, с использованием композиций изобретения для криоконсервации.
[0073] В широком смысле способ криоконсервации содержит стадии приготовления клеток, полученных из ткани пуповины, помещения клеток в композицию изобретения для криоконсервации и охлаждение этих клеток в течение желаемого периода времени для достижения желаемой температуры криоконсервации клеток. Предпочтительная желаемая температура криоконсервации составляет -120°C.
[0074] В одном варианте осуществления способ содержит помещение клеток hUTC в композицию для криоконсервации и выдерживание композиции до достижения исходной температуры 4 °C. После того как композиции, содержащие клетки, достигают исходной температуры, их выдерживают при этой температуре в течение приблизительно 15 минут. После выдерживания при этой температуре в течение приблизительно 15 минут клетки охлаждают со скоростью около -1,0°C/мин до достижения клеточной композицией температуры около -3,0°C. В альтернативном варианте осуществления способ содержит охлаждение клеточной композиции от исходной температуры 4°C со скоростью около -1,0°C/мин до достижения клеточной композицией температуры около -3,0°C. Когда температура клеточной композиции составит около -3,0°C, композицию подвергают дальнейшему охлаждению со скоростью -25,0°C/мин до достижения клеточной композицией температуры около -50,0°C. Когда температура клеточной композиции составит около -50,0°C, композицию нагревают со скоростью 10,0°C/мин до достижения клеточной композицией температуры около -20,0°C. Когда температура клеточной композиции составит около -20,0°C, композицию снова охлаждают со скоростью -1,0 °C/мин до достижения клеточной композицией температуры около -45,0°C. Затем, когда температура клеточной композиции составит около -45,0°C, композицию подвергают дальнейшему охлаждению со скоростью -10,0°C/мин до достижения клеточной композицией температуры хранения около -120,0°C.
[0075] В одном варианте осуществления способ содержит помещение клеток hUTC в композицию для криоконсервации и выдерживание композиции до достижения исходной температуры 4°C. Затем клетки охлаждают со скоростью -1°C/мин от 4°C до -45°C. Затем, когда температура клеточной композиции составит около -45,0°C, композицию подвергают дальнейшему охлаждению до достижения клеточной композицией температуры хранения около -120,0°C.
[0076] Когда клетки доведены до температуры хранения, их можно хранить в течение желаемого периода времени, такого как, например, 2 месяца, 3 месяца, 6 месяцев, 12 месяцев или 24 месяца. Предпочтительно клетки хранят в жидком азоте (таком как, например, морозильная камера с жидким азотом) до их применения.
III. Наборы, содержащие культуральную среду и бессывороточный питательный раствор
[0077] В другом варианте осуществления изобретения представлен набор для криоконсервации клеток, полученных из ткани пуповины. В одном варианте осуществления набор содержит композиции изобретения. Набор может дополнительно содержать клетки и инструкции для криоконсервации. В другом варианте осуществления набор содержит клетки hUTC, криоконсервированные в композиции изобретения, и инструкции по применению клеток hUTC. В одном варианте осуществления клетки hUTC, криоконсервированные в композиции, можно включать в состав для внутривенной (в/в) инфузии.
IV. Клетки, полученные из ткани пуповины человека (hUTC)
[0078] Как обсуждалось выше, композиции, наборы и способы криоконсервации можно применять для криоконсервации выделенных клеток, полученных из ткани пуповины человека (клеток «hUTC» или «UTC»). Популяции клеток hUTC и UTC, приемлемые для применения с композициями, наборами и способами криоконсервации настоящего изобретения, подробно описаны в настоящем документе ниже, а также в патентах США № 7,510,873 и 7,524,489.
A. Выделение и рост клеток, полученных из ткани пуповины
[0079] В соответствии со способами, описанными в настоящем документе, пуповину млекопитающего получают по завершении или вскоре после прерывания доношенной или недоношенной беременности, например, после отделения последа. Постнатальную ткань можно транспортировать с места родов в лабораторию в стерильном контейнере, таком как флакон, лабораторный стакан, чашка для культивирования или пакет. Контейнер может содержать раствор или среду, включая (без ограничения) солевой раствор, такой как модифицированная по Дульбекко среда Игла (DMEM) (также известная как минимально необходимая среда Дульбекко) или фосфатно-солевой буфер (PBS), либо любой раствор, применяемый для транспортировки органов, используемых для трансплантации, такой как раствор, предложенный Висконсинским университетом, или раствор с перфторированным химикатом. В среду или буферный раствор можно добавлять одно или более из антибиотических и/или противогрибковых средств, таких как (без ограничения) пенициллин, стрептомицин, амфотерицин B, гентамицин и нистатин. Постнатальную ткань можно промыть в растворе антикоагулянта, таком как гепаринсодержащий раствор. До извлечения UTC ткань предпочтительно содержать при температуре около 4-10 °C. Еще более предпочтительно не замораживать ткань до извлечения клеток UTC.
[0080] Выделение UTC предпочтительно проводить в асептических условиях. Пуповину можно отделить от плаценты способом, известным в данной области. Альтернативно пуповину и плаценту применяют без отделения. Перед выделением клеток UTC из постнатальной ткани предпочтительно удалить кровь и остатки клеток. Например, постнатальную ткань можно промывать в буферном растворе, включая (без ограничения) фосфатно-солевой буфер. Промывочный буферный раствор может дополнительно содержать одно или более из противогрибковых и/или антибиотических средств, включая (без ограничения) пенициллин, стрептомицин, амфотерицин B, гентамицин и нистатин.
[0081] Постнатальную ткань, содержащую пуповину, или ее фрагмент, или ее секцию, механически измельчают (прилагая режущее или сдвиговое усилие). В предпочтительном в настоящее время варианте осуществления в процедуре выделения клеток также используют процесс ферментативного расщепления. Специалистам в данной области известно множество ферментов, используемых для выделения отдельных клеток из сложных тканевых матриц, чтобы облегчать выращивание клеток в культуре. В продаже доступен выбор расщепляющих ферментов от слабо расщепляющих (например, дезоксирибонуклеазы и нейтральная протеаза, диспаза) до интенсивно расщепляющих (например, папаин и трипсин). Не исчерпывающий перечень ферментов, совместимых с целями настоящего изобретения, включает ферменты с муколитической активностью, металлопротеазы, нейтральные протеазы, сериновые протеазы (такие как трипсин, химотрипсин или эластаза) и дезоксирибонуклеазы. В настоящее время предпочтительными являются ферменты с активностью, выбранной из металлопротеаз, нейтральных протеаз и муколитических ферментов. Например, известно, что коллагеназы используют для выделения различных клеток из тканей. Дезоксирибонуклеазы расщепляют одноцепочечные ДНК и позволяют свести к минимуму агглютинацию клеток в процессе выделения. Предпочтительные способы включают ферментативную обработку, например, с использованием коллагеназы и диспазы, либо коллагеназы, диспазы и гиалуронидазы. В определенных вариантах осуществления на стадии диссоциации используют смесь коллагеназы и нейтральной протеазы (диспазы). В более конкретных вариантах осуществления применяют расщепление в присутствии по меньшей мере одной коллагеназы из Clostridium histolyticum и любого из протеазных ферментов, диспазы и термолизина. В других вариантах осуществления используют расщепление ферментами как с коллагеназной, так и диспазной активностью. Также используют способы, которые включают расщепление ферментом с гиалуронидазной активностью, помимо ферментов с коллагеназной и диспазной активностью. Специалист в данной области определит, что имеется множество способов такой ферментативной обработки для выделения клеток из различных тканей-источников. Например, в быстрых способах можно применять ферментативные смеси для диссоциации тканей, доступные в продаже под торговым наименованием LIBERASE (Roche, г. Индианаполис, штат Индиана, США). Известны и другие источники ферментов, и специалист в данной области также сможет прямо получить такие ферменты из их природных источников. Специалист в данной области также сможет оценивать возможности новых или дополнительных ферментов, или сочетаний ферментов для выделения клеток изобретения. Предпочтительная продолжительность ферментативной обработки составляет 0,5, 1, 1,5 или 2 часа, или более. В других предпочтительных вариантах осуществления ткань инкубируют при температуре 37°C в процессе ферментативной обработки на стадии диссоциации.
[0082] В некоторых вариантах осуществления изобретения постнатальную ткань разделяют на секции, содержащие различные компоненты ткани, такие как, например, неонатальный, неонатальный/материнский и материнский компоненты плаценты. Разделенные секции затем диссоциируют с применением механической и/или ферментативной диссоциации в соответствии со способами, описанными в настоящем документе. Клетки неонатальных или материнских линий дифференцировки можно определять любыми средствами, известными в данной области, например, путем анализа кариотипа или гибридизации in situ на Y-хромосоме.
[0083] Выделенные клетки или ткань пуповины, из которой происходят UTC, можно использовать для зарождения, или посева, клеточных культур. Выделенные клетки переносят в стерильные сосуды для тканевой культуры либо без покрытия, либо с покрытием внеклеточным матриксом или лигандами, такими как ламинин, коллаген (нативный, денатурированный или поперечно сшитый), желатин, фибронектин и другие белки внеклеточного матрикса. В дополнение к описанной в данном документе культуральной среде, клетки UTC можно культивировать в любой культуральной среде, которая способна поддерживать рост клеток, такой как (без ограничения) DMEM (с высоким или низким содержанием глюкозы), улучшенная среда DMEM, среда DMEM/MCDB 201, основная среда Игла, среда Хэма F10 (F10), среда Хэма F12 (F12), модифицированная по Искову среда Дульбекко, ростовая среда для мезенхимальных стволовых клеток (MSCGM), среда DMEM/F12, среда RPMI 1640 и бессывороточная/бессубстратная среда, доступная в продаже под торговым наименованием CELL-GRO-FREE® (Mediatech, Inc., г. Херндон, штат Виргиния, США). В культуральную среду можно дополнительно ввести один или более компонентов, включая, например, эмбриональную бычью сыворотку (FBS), предпочтительно в количестве около 2-15% (об.); лошадиную сыворотку (ES); человеческую сыворотку (HS); бета-меркаптоэтанол (BME или 2-ME), предпочтительно в количестве около 0,001% (об.); один или более факторов роста, например фактор роста тромбоцитов (PDGF), фактор роста эпидермы (EGF), фактор роста фибробластов (FGF), фактор роста эндотелия сосудов (VEGF), инсулиноподобный фактор роста 1 (IGF-1), фактор ингибирования лейкоцитов (LIF) и эритропоэтин (EPO); аминокислоты, включая L-валин; и одно или более из антибиотических и/или противогрибковых средств для борьбы с микробным заражением, такие как пенициллин G, сульфат стрептомицина, амфотерицин B, гентамицин и нистатин, либо по отдельности, либо в сочетании. Культуральная среда может содержать ростовую среду, которая описана в разделе примеров.
[0084] Клетки высевают в сосуды для культивирования с плотностью, позволяющей клеткам расти. В предпочтительном варианте осуществления клетки культивируют в атмосфере с содержанием CO2 от около 0 до около 5% об. В некоторых предпочтительных вариантах осуществления клетки культивируют в атмосфере с содержанием O2 от около 2 до около 25%, предпочтительно в атмосфере с содержанием O2 от около 5 до около 20%. Клетки предпочтительно культивируют при температуре от около 25 до около 40°C, и более предпочтительно культивируют при температуре 37°C. Клетки предпочтительно культивируют в инкубаторе. Среда в сосуде для культивирования может быть неподвижной или перемешиваемой, например, с помощью биореактора. Клетки UTC предпочтительно выращивают в условиях низкого окислительного стресса (например, с добавлением глутатиона, витамина C, каталазы, витамина E, N-ацетилцистеина). Термин «низкий окислительный стресс» обозначает условия отсутствия или минимального повреждения культивируемых клеток свободными радикалами.
[0085] Способы выбора наиболее подходящей культуральной среды, приготовления среды и методов клеточной культуры хорошо известны в данной области и описаны в ряде источников, включая Doyle et al., (eds.), 1995, Cell & Tissue Culture: Laboratory Procedures, John Wiley & Sons, Chichester; и Ho and Wang (eds.), 1991, Animal Cell Bioreactors, Butterworth-Heinemann, Boston, которые включены в настоящий документ путем ссылки.
[0086] После культивирования выделенных клеток или фрагментов ткани в течение достаточного периода клетки UTC прорастают в результате миграции из постнатальной ткани или деления клеток, либо по обеим причинам. В некоторых вариантах осуществления настоящего изобретения UTC пассируют или переносят в отдельный сосуд для культивирования, содержащий свежую среду того же или другого типа, по сравнению с первоначально использованной, в которой популяцию клеток можно размножить митозом. Клетки изобретения можно применять на любой стадии от пассажа 0 до их старения. Клетки предпочтительно пассируют от около 3 до около 25 раз, более предпочтительно пассируют от около 4 до около 12 раз, и предпочтительно пассируют 10 или 11 раз. Для подтверждения выделения клональной популяции клеток можно провести клонирование и/или субклонирование.
[0087] В определенных вариантах осуществления различные виды клеток, находящиеся в постнатальной ткани, фракционируют по субпопуляциям, из которых можно выделять клетки UTC. Фракционирование или отбор можно выполнять с помощью стандартных методов разделения клеток, включая (без ограничения) ферментативную обработку для диссоциации постнатальной ткани на составляющие ее клетки, с последующим клонированием и отбором определенных видов клеток, включая (без ограничения)отбор на основе морфологических и/или биохимических маркеров; выборочный рост желательных клеток (положительный отбор), выборочное разрушение нежелательных клеток (отрицательный отбор); разделение смешанной популяции на основе различной способности клеток к агглютинации, например, с соевым агглютинином; процедуры заморозки-разморозки; различие адгезионных характеристик клеток в смешанной популяции; фильтрование; обычное и зональное центрифугирование; отмучивание с центрифугированием (противоточное центрифугирование); разделение в обычном поле тяжести; противоточное распределение; электрофорез; и сортировку клеток с активацией флуоресценции (FACS). Обзор способов клонального отбора и разделения клеток см. в руководстве Freshney, 1994, Culture of Animal Cells: A Manual of Basic Techniques, 3rd Ed., Wiley-Liss, Inc., New York, которое включено в настоящий документ путем ссылки.
[0088] Культуральную среду заменяют по необходимости, например, путем осторожной аспирации среды из чашки, например, с помощью пипетки, и восполнения количества свежей среды. Инкубацию продолжают до накопления в чашке достаточного числа или плотности клеток. Исходные эксплантированные секции ткани можно извлечь, а оставшиеся клетки трипсинизировать стандартными методами или воспользоваться клеточным скребком. После трипсинизации клетки собирают, переносят в свежую среду и инкубируют как описано выше. В некоторых вариантах осуществления среду заменяют, по меньшей мере, один раз приблизительно через 24 часа после трипсинизации, чтобы удалить плавающие клетки. Оставшиеся в культуре клетки считают клетками UTC.
[0089] Клетки UTC можно подвергать криоконсервации с использованием среди прочего композиций изобретения. Соответственно, клетки UTC для аутогенного переноса (либо для матери, либо для ребенка) можно получить из подходящих постнатальных тканей после рождения ребенка, а затем криоконсервировать их так, чтобы они были доступны в случае возникновения необходимости в трансплантации.
B. Характеристики клеток, полученных из ткани пуповины
[0090] Клетки UTC можно характеризовать, например, по ростовым характеристикам (например, способности к удвоению популяции, времени удвоения, количеству пассажей до старения), анализу кариотипа (например, нормальный кариотип; материнская или неонатальная линия дифференцировки), проточной цитометрии (например, анализ FACS), иммуногистохимически и/или иммуноцитохимически (например, на обнаружение эпитопов), по профилю экспрессии генов (например, с применением матриц генных чипов; полимеразной цепной реакции (например, ПЦР с обратной транскриптазой, ПЦР в реальном времени, обычной ПЦР)), по белковым матрицам, по секреции белков (например, по анализу коагуляции плазмы или анализу среды, кондиционированной плазмацитоидными дендритными клетками (ПДК), например, с применением твердофазного иммуноферментного анализа (ИФА)), реакции смешанной культуры лимфоцитов (например, как меры стимуляции мононуклеарных клеток периферической крови (PBMC)) и/или другими способами, известными в данной области.
[0091] Примеры приемлемых клеток UTC, полученных из ткани пуповины, хранятся в Американской коллекции типовых клеточных культур (ATCC) (10801 University Boulevard, Manassas, VA 20110, США) с 10 июня 2004 г. под следующими номерами доступа ATCC: (1) линии под названием UMB 022803 (P7) был присвоен номер доступа PTA-6067; (2) линии под названием UMB 022803 (P17) был присвоен номер доступа PTA-6068;
[0092] В различных вариантах осуществления клетки UTC обладают одной из более из следующих характеристик роста: (1) для роста в культуре им требуется L-валин; (2) клетки способны расти в атмосфере с содержанием кислорода от около 5% до по меньшей мере около 20%; (3) клетки обладают потенциалом к по меньшей мере около 40 удвоениям в культуре до достижения старения; и (4) клетки закрепляются и размножаются на поверхности сосуда для тканевой культуры с покрытием или без покрытия, причем сосуд для тканевой культуры с покрытием содержит покрытие из желатина, ламинина, коллагена, полиорнитина, витронектина или фибронектина.
[0093] В определенных вариантах осуществления клетки UTC имеют нормальный кариотип, который сохраняется в последующих пассажах клеток. Способы кариотипирования доступны и известны специалистам в данной области.
[0094] В других вариантах осуществления клетки UTC можно характеризовать по продукции определенных белков, включая (1) продукцию по меньшей мере одного из тканевого фактора, виментина и альфа-актина гладких мышц; и (2) продукцией по меньшей мере одного из маркеров клеточной поверхности CD10, CD13, CD44, CD73, CD90, PDGFr-альфа, PD-L2 и HLA-A, B, C, определяемых методом проточной цитометрии. В других вариантах осуществления клетки UTC можно характеризовать по отсутствию продукции по меньшей мере одного из маркеров клеточной поверхности CD31, CD34, CD45, CD80, CD86, CD117, CD141, CD178, B7-H2, HLA-G и HLA-DR, DP, DQ, определяемых методом проточной цитометрии. Особенно предпочтительными являются клетки, которые вырабатывают по меньшей мере два из тканевого фактора, виментина и альфа-актина гладких мышц. Более предпочтительными являются клетки, которые вырабатывают все три белка из тканевого фактора, виментина и альфа-актина гладких мышц.
[0095] В других вариантах осуществления клетки UTC можно характеризовать по экспрессии гена, которая, по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости, повышена для гена, кодирующего, по меньшей мере, один из: интерлейкина-8; ретикулона-1; лиганда-1 хемокина (мотив C-X-C) (активность стимулятора роста меланомы, альфа); лиганда-6 хемокина (мотив C-X-C) (белок-2 хемотаксиса гранулоцитов); лиганда-3 хемокина (мотив C-X-C); и индуцируемого альфа-фактором некроза опухоли белка-3.
[0096] В других вариантах осуществления клетки UTC можно характеризовать по экспрессии гена, которая, по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости, понижена для гена, кодирующего, по меньшей мере, один из: гомеобокса-2 гена низкого роста; белка теплового шока 2, 27 кДа; лиганда-12 хемокина (мотив C-X-C) (фактор-1 клеток стромы); эластина (надклапанный стеноз аорты, синдром Вильямса - Бойрена); мРНК Homo sapiens; кДНК DKFZp586M2022 (из клона DKFZp586M2022); гомеобокса-2 мезенхимы (специфичный гомеобокс гена остановки роста); гомолога-1 гомеобокса гена sine oculis (Drosophila); кристаллина, альфа B; связанного с геном disheveled активатора морфогенеза 2; белка DKFZP586B2420; аналога нейралина-1; тетранектина (связывающего плазминоген белка); src-гомологии 3 (SH3) и богатого цистеином домена; холестерин-25-гидроксилазы; связанного с карликовостью фактора транскрипции-3; рецептора интерлейкина-11, альфа; усилителя проколлаген-C-эндопептидазы; гомолога-7 frizzled (Drosophila); гипотетического гена BC008967; коллагена типа VIII, альфа-1; тенасцина C (гексабрахион); белка-5 гомеобокса гена iroquois; гефестина; интегрина, бета-8; гликопротеина-2 синаптического пузырька; нейробластомы, ген подавления онкогенности-1; связывающего инсулиноподобный фактор роста белка-2, 36 кДа; Homo sapiens кДНК FLJ12280, полноразмерная вставка, клон MAMMA1001744; подобного рецептору цитокинов фактора-1; калиевого канала средней/низкой проводимости, активируемого кальцием, подсемейство N, член 4; интегрина, бета-7; транскрипционного коактиватора с мотивом связывания PDZ (TAZ); гомолога-2 гомеобокса гена sine oculis (Drosophila); белка KIAA1034; мембранного белка-5, связанного с пузырьком (миобревин); содержащего EGF фибулинподобного белка-1 внеклеточного матрикса; белка-3 ранней ростовой реакции; гомеобокса-5 гена distal-less; гипотетического белка FLJ20373; альдокеторедуктазы, семейство 1, член C3 (3-альфа-гидроксистероиддегидрогеназа, тип II) бигликана; транскрипционного коактиватора с мотивом связывания PDZ (TAZ); фибронектина-1; проэнкефалина; интегрина, бета-подобного 1 (с доменами EGF-подобных повторов); Homo sapiens мРНК, полноразмерная вставка кДНК, клон EUROIMAGE 1968422; EphA3; белка KIAA0367; рецептора натрийуретического пептида C/гуанилатциклазы C (рецептор атрионатрийуретического пептида C); гипотетического белка FLJ14054; мРНК Homo sapiens; кДНК DKFZp564B222 (из клона DKFZp564B222); BCL2/подобного взаимодействующему белку-3 аденовируса E1B 19 кДа; AE-связывающего белка-1; и полипептида-1 субъединицы VIIa цитохром С оксидазы (мышечный).
[0097] В других вариантах осуществления клетки UTC во время культивирования можно характеризовать по секреции по меньшей мере одного из MCP-1, IL-6, IL-8, GCP-2, HGF, KGF, FGF, HB-EGF, BDNF, TPO, MIP1b, I309, MDC RANTES, TIMP1. Кроме того, клетки UTC во время культивирования можно характеризовать по отсутствию секреции по меньшей мере одного из TGF-бета-2, ANG2, PDGFbb, MIP1A и VEGF, по обнаружению с помощью ИФА.
[0098] В некоторых вариантах осуществления клетки UTC получают из ткани пуповины по существу свободными от крови, клетки способны к самообновлению и размножению в культуре, для их роста требуется L-валин, они могут расти в атмосфере с содержанием кислорода по меньшей мере около 5% и обладают по меньшей мере одной из следующих характеристик: потенциал для по меньшей мере около 40 удвоений в культуре; закрепление и размножение на поверхности сосуда для тканевой культуры с покрытием или без покрытия, который содержит покрытие из желатина, ламинина, коллагена, полиорнитина, витронектина или фибронектина; продукция виментина и альфа-актина гладких мышц; продукция CD10, CD13, CD44, CD73 и CD90; и экспрессия гена, которая, по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости, повышена для гена, кодирующего интерлейкин-8 и ретикулон-1. В некоторых вариантах осуществления такие клетки UTC не вырабатывают CD45 и CD 117.
[0099] В предпочтительных вариантах осуществления клетка обладает двумя или более из перечисленных выше характеристик роста, продукции белков/маркеров клеточной поверхности, экспрессии генов или секреции веществ. Более предпочтительна клетка, обладающая тремя, четырьмя, пятью или более такими характеристиками. Еще более предпочтительна клетка UTC обладающая шестью, семью, восемью или более такими характеристиками. Еще более предпочтительны в настоящее время клетки, обладающие всеми перечисленными выше характеристиками.
[00100] Среди клеток, которые в настоящее время предпочтительны для применения в целях настоящего изобретения в некоторых его аспектах, имеются постнатальные клетки, обладающие описанными выше характеристиками, и в частности, те клетки, которые имеют нормальные кариотипы и поддерживают нормальные кариотипы в пассажах, и дополнительно те клетки, которые экспрессируют каждый из маркеров CD10, CD13, CD44, CD73, CD90, PDGFr-альфа и HLA-A, B, C, причем клетки вырабатывают иммунологически детектируемые белки, соответствующие перечисленным маркерам. Еще более предпочтительны те клетки, которые, в дополнение к описанному выше, не вырабатывают белки, соответствующие любому из маркеров CD31, CD34, CD45, CD117, CD141 или HLA-DR, DP, DQ, по обнаружению методом проточной цитометрии.
[0100] В одном варианте осуществления клетки UTC выделяют из ткани пуповины человека по существу свободными от крови, клетки способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, не продуцируют CD117 или CD45 и не экспрессируют hTERT или теломеразу. Данные клетки UTC необязательно экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокина и/или хемотаксический белок гранулоцитов; и/или не экспрессируют CD31 или CD34; и/или экспрессируют по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека повышенные уровни интерлейкина-8 или ретикулона-1; и/или экспрессируют CD10, CD13, CD44, CD73 и CD90.
[0101] В другом варианте осуществления клетки UTC выделяют из ткани пуповины человека по существу свободными от крови, клетки способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, экспрессируют CD13 и CD90 и не экспрессируют CD34 и CD117. Необязательно, такие клетки не экспрессируют hTERT или теломеразу. В еще одном варианте осуществления клетки также экспрессируют CD10, CD44 и CD43. В альтернативном варианте осуществления клетки также не экспрессируют CD45 и CD31. Данные клетки UTC необязательно (i) экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокинов и/или хемотаксический белок гранулоцитов; и/или (ii) экспрессируют по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека повышенные уровни интерлейкина-8 или ретикулона-1.
[0102] В другом варианте осуществления клетки UTC выделяют из ткани пуповины человека по существу свободными от крови, клетки способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, экспрессируют CD13, CD90 и HLA-ABC и не экспрессируют CD34, CD117 и HLA-DR. Необязательно, такие клетки также не экспрессируют hTERT или теломеразу. В одном варианте осуществления клетки также экспрессируют CD10, CD44 и CD43. В альтернативном варианте осуществления клетки также не экспрессируют CD45 и CD31. Данные клетки UTC необязательно (i) экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокинов и/или хемотаксический белок гранулоцитов; и/или (ii) экспрессируют по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека повышенные уровни интерлейкина-8 или ретикулона-1.
[0103] В альтернативном варианте осуществления клетки UTC выделяют из ткани пуповины человека по существу свободными от крови, клетки способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке и имеют следующие характеристики: (1) экспрессируют CD10, CD13, CD44, CD90 и HLA-ABC; (2) не экспрессируют CD31, CD34, CD45, HLA-DR и CD117; и (3) не экспрессируют hTERT или теломеразы. В альтернативном варианте осуществления клетки UTC выделяют из ткани пуповины человека по существу свободными от крови, клетки способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке и имеют следующие характеристики: (1) экспрессируют CD10, CD13, CD44, CD90 и HLA-ABC; (2) не экспрессируют CD31, CD34, CD45, HLA-DR и CD117; (3) не экспрессируют hTERT или теломеразу; (4) экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокинов и/или хемотаксический белок гранулоцитов; и (4) экспрессируют по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека повышенные уровни интерлейкина-8 или ретикулона-1.
[0104] В одном варианте осуществления клетки hUTC представлены популяцией клеток, которые могут быть однородными. В некоторых вариантах осуществления клеточная популяция может быть неоднородной. Неоднородная популяция клеток изобретения может содержать по меньшей мере около 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% UTC изобретения. Неоднородные популяции клеток настоящего изобретения могут дополнительно содержать стволовые клетки или другие клетки-предшественницы, такие как миобласты или другие мышечные клетки-предшественницы, а также гемангиобласты, или клетки-предшественницы кровеносных сосудов; или они могут дополнительно содержать полностью дифференцированные клетки скелетных мышц, клетки гладких мышц, перициты или эндотелиальные клетки кровеносных сосудов. В некоторых вариантах осуществления популяция является по существу однородной, т.е. содержит по существу только клетки UTC (предпочтительно по меньшей мере около 96%, 97%, 98%, 99% или более клеток UTC). Однородные популяции клеток настоящего изобретения содержат клетки, полученные из пуповины. Однородные популяции клеток, полученных из пуповины, предпочтительно свободны от клеток материнской линии дифференцировки. Однородности популяции клеток возможно достичь с помощью любого метода, известного в данной области, например, путем сортировки клеток (например, с помощью проточной цитометрии) или путем клонального размножения в соответствии с известными методами. Однородные популяции клеток UTC могут содержать клональную линию клеток из постнатально полученных клеток.
[0105] Без дальнейшего описания предполагается, что любой средний специалист в данной области сможет, пользуясь предыдущим описанием и следующими ниже иллюстративными примерами, реализовать и использовать настоящее изобретение и применять на практике заявленные способы. В связи с этим в следующих рабочих примерах конкретно указываются предпочтительные варианты осуществления настоящего изобретения, и они не должны быть истолкованы как ограничивающие каким-либо образом остальную часть описания.
Примеры
Пример 1
Сравнение сред для замораживания
[0106] Для применения в клинических учреждениях клетки, полученные из ткани пуповины человека (клетки hUTC), необходимо подвергать криоконсервации в составе среды, способном поддерживать высокую выживаемость клеток на стадиях криоконсервации и размораживания клеток. В данном примере описано сравнение двух вариантов осуществления композиций изобретения и показано, что эти композиции способны поддерживать высокую выживаемость клеток на стадиях криоконсервации и размораживания клеток. В таблице 1-1 показан состав композиций, применяемых в данном примере.
Материалы и способы
Клеточная культура
[0107] Клетки hUTC были размножены в биореакторах на гранулах микроносителя. Гранулы собирали, оставляли оседать, и клетки hUTC диссоциировали с гранул путем ферментативного расщепления. Диссоциированные клетки концентрировали и включали в конечные составы для криоконсервации при концентрации клеток 10 × 106 клеток/мл. Отбирали аликвоты клеток в различных составах и переносили их в криопробирки или криопакеты для криоконсервации в морозильной камере с управляемой скоростью замораживания (GDKRYO 750 PLUS-F-115), используя профиль замораживания, приведенный в таблице 1-2. После того как клетки были заморожены, их переносили в морозильную камеру с жидким азотом и хранили до их применения.
[0108] Профиль замораживания, показанный в таблице 1-2, описывает условия в камере для непрерывного снижения температуры пробы на 1 °C/мин от 4°C до -45 °C. Профиль замораживания должен показывать такое непрерывное снижение вокруг точки замерзания раствора клеток, где кристаллизация раствора стимулирует повышение температуры. Такое повышение температуры может ухудшить жизнеспособность клеток. Этот риск уменьшается за счет минимизации переохлаждения и последующего скрытого нагревания с помощью запрограммированного резкого падения температуры в криогенной морозильной камере от -25 °C/мин до -50 °C. В таблице 1-2 ниже приведены показания температуры с датчика камеры; эти температуры отличаются от показаний датчика пробы (погруженного в конечную среду для замораживания). Датчик пробы не испытывает таких изменений температуры.
Оттаивание флакона
[0109] Флаконы извлекали из морозильной камеры для хранения с жидким азотом, а затем погружали в сухой лед для транспортировки в экспериментальную лабораторию на испытания. Флаконы быстро размораживали в заранее подогретой водяной бане при 37°C в течение приблизительно 2-3 минут. Один (1) мл размороженной клеточной суспензии переносили в центрифужную пробирку и добавляли 9 мл подогретой ростовой среды (DMEM+15% FBS (об.)) для подсчета клеток. Один (1) мл клеточной суспензии извлекали и помещали в чашечку для проб прибора Cedex для подсчета клеток. Затем выполняли подсчет клеток на приборе Cedex. Для этого пользовались методом исключения трипанового синего. С помощью показателя плотности жизнеспособных клеток (VCD) оценивали число жизнеспособных клеток и жизнеспособность клеток.
Результаты
Плотность и жизнеспособность жизнеспособных клеток
[0110] Сводные результаты, приведенные в таблицах 1-3 и 1-4, показывают отсутствие статистически значимых различий плотности жизнеспособных клеток и жизнеспособности клеток hUTC сразу после разморозки для криопробирок, которые хранили до 24 месяцев в морозильной камере с жидким азотом.
Выживаемость клеток при комнатной температуре после размораживания
[0111] Для оценки двух составов через различные периоды времени после оттаивания, в моменты 0 (T0), 1 (T1), 2 (T2), 3 (T3) и 4 (T4) часа, использовали реагент ViaCount® на приборе Guava®. Клетки hUTC, замороженные в составе «I (модифицированный)», сохранили большее число живых клеток после 4 часов при комнатной температуре, по сравнению с клетками, замороженными в составе B. Сводные результаты показаны в таблице 1-5 и на Фиг. 1. В таблице 1-5 ID пробы относится к используемому составу (составу B или составу «I (модифицированный)»).
Регенерируемость клеток
[0112] Регенерируемость клеток после размораживания во флаконах T оценивали на клетках, замороженных в пакетах в составах «B» и «I (модифицированный, с низким содержанием Ca)». Клетки высевали во флаконы T75 с плотностью посева 5000 клеток/см2. Для испытания регенерируемости клеток после размораживания использовали ростовую среду 85% DMEM+15% FBS (об.). Клетки ежедневно отделяли от поверхности флакона T с помощью раствора TrypLE и подсчитывали на приборе CEDEX.
[0113] На Фиг. 2 и в таблице 1-6 показаны результаты регенерируемости клеток. Для клеток, замороженных в составе I (модифицированный, с низким содержанием Ca), наблюдалась тенденция к лучшей регенерируемости по сравнению с составом B.
(× 106),
(× 106),
(× 106),
(× 106),
(× 106),
Надежность состава
[0114] В целях оценки надежности этих составов для криоконсервации в отношении поддержания высокой плотности (VCD) и жизнеспособности клеток hUTC за время криоконсервации, исследовали влияние выбранных главных компонентов в составах «B» и «I (модифицированный, с низким содержанием Ca)». Для оценки влияния криопротекторов на криоконсервацию клеток определяли концентрацию главных криопротекторов (см. таблицу 1-7 и таблицу 1-8 ниже). Клетки hUTC, хранившиеся в паровой фазе жидкого азота, размораживали с помощью стандартных операционных процедур и измеряли жизнеспособность клеток (см. таблицу 1-9 ниже и Фиг. 3) и плотность жизнеспособных клеток (см. таблицу 1-10 ниже и Фиг. 4) немедленно после размораживания (T0) и через 2 часа (T2) после размораживания. Результаты этого эксперимента подтвердили, что составы B и I поддерживают жизнеспособность клеток. Плотность жизнеспособных клеток для испытуемых составов поддерживалась в течение двух часов. В таблицах 1-7, 1-9 и 1-10 составы с B-1 по B-5 имеют композицию состава B, приведенную в таблице 1-1, за исключением изменения количеств сахарозы и маннита. Кроме того, в таблицах с 1-8 по 1-10 составы с I-1 по I-10 имеют композицию модифицированного состава I, приведенного в таблице 1-1, за исключением изменения количеств лактобионовой кислоты, сахарозы, маннита и глутатиона.
Пример 2
Безопасность состава для криоконсервации в токсикологических исследованиях
Введение
[0115] Составы для криоконсервации «размораживание и инъекция» можно применять в качестве несущей среды для доставки препарата клеточной терапии реципиентам. Применение составов для размораживания и инъекции приводит к сокращению обработки клеток в клиническом учреждении за счет исключения стадий центрифугирования, промывки и подсчета клеток. В целях применения состава для криоконсервации в качестве несущей среды для прямой доставки препарата клеточной терапии необходимо провести токсикологическое исследование, чтобы характеризовать безопасность в конкретных путях введения и выявить возможные неблагоприятные последствия.
[0116] Поэтому были проведены токсикологические исследования на крысах, в которых растворы для криоконсервации оценивали в качестве возможных несущих сред для клеток и вводили их либо путем внутривенной (в/в) инфузии, либо путем инъекции в спинномозговую жидкость подоболочечным (IT) и интрацистернальным (ICM) путями.
[0117] После в/в инфузии состава для криоконсервации, содержащего имеющийся в продаже раствор для криоконсервации (CryoStor™ CS10), у крыс наблюдали отек и покраснение конечности. CryoStor™ CS10 представляет собой среду для криоконсервации, содержащую 10% диметилсульфоксида (ДМСО). На Фиг. 5 слева показана контрольная крыса, а справа - крыса с отеком и покраснением на лапках, которой вводили состав, содержащий CS10. При испытании широко используемых компонентов раствора для криоконсервации определили, что декстран вызывает отек и покраснение конечностей.
A. Доклиническая оценка безопасности после в/в инфузии композиций для криоконсервации и композиций для криоконсервации, содержащих клетки hUTC
[0118] Цель данного исследования состояла в оценке токсичности после внутривенного введения (i) композиции для криоконсервации в модификации состава I (как описано выше) и (ii) композиции для криоконсервации в модификации состава I с добавлением различных количеств клеток, полученных из ткани пуповины человека (клеток hUTC).
[0119] Восемьдесят самцов и 80 самок крыс линии Crl:CD (SD) случайным образом распределили на 5 групп по варианту дозы (группы I-V), по 16 крыс каждого пола в группе, как указано ниже в таблице плана исследования. Дополнительно в группы III-V распределили 18 самцов и 18 самок крыс, по 6 каждого пола, для подтверждения части исследования, относящейся к экспозиции клеток. Суспензии испытуемого изделия (клетки hUTC в модификации I), контрольный физиологический раствор или несущую среду (модификация I) вводили путем в/в инфузии однократно в дозах 0 (физиологический раствор), 0 (несущая среда), 3 × 106 клеток, 10 × 106 клеток и 30 × 106 клеток. Объем дозы составлял 3 мл для групп I, II и V, 0,3 мл для группы III и 1 мл для группы IV при скорости инфузии 0,1 мл/мин. План исследования кратко изложен ниже в таблице 2-1. Обращаясь к таблице 2-1, несущая среда представляет собой модификацию I (как описано выше в примере 1).
План токсикологического исследования
[0120] Композиции, содержащие несущую среду+клетки hUTC, готовили путем размораживания криоконсервированных клеток при номинальной концентрации 10 × 106 клеток/мл и фильтрования клеток через встроенный фильтр с ячейками 40 мкм. Число и жизнеспособность клеток определяли перед и после фильтрования. Несущую среду (модификация I) и клетки нагревали до комнатной температуры перед дозированием и использовали в течение 45 минут.
[0121] Проверки жизнеспособности крыс проводили дважды в сутки. Клинические наблюдения регистрировали перед, во время и после введения дозы, и ежедневно в течение периода после введения дозы. Массу тела регистрировали в день введения дозы и по меньшей мере один раз в неделю в течение периода после введения дозы, включая день накануне и день вскрытия. Показатели потребления корма регистрировали по меньшей мере один раз в неделю и в день накануне вскрытия. Офтальмологические осмотры проводились ветеринарным офтальмологом у всех крыс перед введением дозы и в пределах 1 недели перед эвтаназией на 28-й день.
[0122] В день запланированного вскрытия у каждой крысы (натощак) отбирали пробы цельной крови из нижней полой вены, немедленно после эвтаназии, и анализировали по гематологическим, клинико-биохимическим и иммунологическим показателям. У всех крыс перед вскрытием отбирали пробы мочи. Массы отдельных органов регистрировали для головного мозга, печени, сердца, легких, левой почки и селезенки, и отбирали пробы ткани для гистопатологического исследования и специфичной к человеческим клеткам ПЦР.
[0123] Всех крыс, предназначенных в часть исследования, относящуюся к экспозиции клеток, подвергали эвтаназии либо через 1 час, либо через 24 часа после введения дозы, и проводили макроскопический осмотр после вскрытия. Для специфичной к человеческим клеткам полимеразной цепной реакции (ПЦР) отбирали следующие органы, с применением асептических методов: головной мозг, печень, сердце, легкие, почки, гонады (яичники и семенники) и селезенку.
[0124] Число и жизнеспособность клеток определяли после объединения размороженных флаконов с клетками, после приготовления составов для дозирования путем фильтрования размороженных препаратов клеток через фильтр 40 мкм, и после завершения в/в инфузий. Средняя жизнеспособность клеток в фильтрованных составах для дозирования не изменялась во время дозирования и составляла 89% как перед, так и после завершения инфузий. Средние концентрации клеток после дозирования составляли 81% от концентрации клеток перед дозированием.
Результаты:
[0125] В/в инфузия несущей среды (модификация I) в фиксированном объеме 3,0 мл, или клеток hUTC в модификации I («несущая среда (модификация I)+hUTC») при дозах, достигавших 30 × 106 hUTC, не вызывала летальных исходов. В течение всего исследования не наблюдалось клинических неблагоприятных явлений, связанных с введением модификации I или несущей среды (модификация I)+hUTC, у самцов или у самок крыс.
[0126] Офтальмологические исследования обнаружили нормальное состояние глаз во всех случаях. Не наблюдалось изменений массы тела, прироста массы тела или показателей потребления корма, связанных с введением модификации I или несущей среды (модификация I)+hUTC.
[0127] Не наблюдалось токсикологически значительных различий по гематологическим, клинико-биохимическим показателям или показателям анализа мочи между группами, получавшими контрольный физиологический раствор, контрольную несущую среду и модификацию I или несущую среду (модификация I)+hUTC.
[0128] Не наблюдалось макроскопических изменений на вскрытии или влияния на массу органов, связанных с введением модификации I или несущей среды (модификация I)+hUTC. Посмертная масса тела и массы органов, и отношения массы головного мозга и посмертной массы тела к массе органов для самцов и самок крыс были по существу сопоставимыми между дозируемыми группами. Не обнаружено гистопатологических изменений, связанных со введением модификации I или несущей среды (модификации I)+hUTC.
[0129] Все пробы сыворотки крови самцов и самок крыс из группы, получавшей несущую среду (модификация I)+hUTC, содержали сывороточные антитела, направленные против модификации I. Пробы сыворотки крови групп, которым вводили инъекции физиологического раствора или модификацию I (несущую среду), не имели обнаружимых уровней сывороточных антител против несущей среды (модификация I)+hUTC. Таким образом, несущая среда (модификация I)+hUTC индуцировала реакцию сывороточных антител у самцов и самок крыс, и считается иммуногенной в данной ксеногенной модели (введение человеческих клеток крысе).
[0130] Экспозицию к несущей среде (модификация I)+hUTC подтверждали на основании результатов анализа методом количественной полимеразной цепной реакции в реальном времени (qRT-ПЦР). Большая часть несущей среды (модификация I)+hUTC была обнаружена в легких вскоре после в/в инфузии и устойчиво сохранялась в течение по меньшей мере 24 часов. Несущая среда (модификация I)+hUTC, обнаруженная в печени, селезенке и сердце через 1 час, быстро выводилась за 24 часа. Не обнаружено различий между самцами и самками крыс по количеству и времени устойчивого сохранения несущей среды (модификация I)+hUTC.
[0131] В итоге, в/в инфузия несущей среды (модификация I)+hUTC в дозах, достигающих 30 × 106 клеток, или несущей среды (модификация I) в фиксированной дозе 3,0 мл, хорошо переносилась самцами и самками крыс и не приводила к летальным исходам или неблагоприятным клиническим явлениям. Не наблюдалось неблагоприятного влияния на органы зрения, или на массу тела, прирост массы тела или потребление корма. Не наблюдалось изменений показателей анализа мочи, гематологии или клинической биохимии, связанных со введением несущей среды (модификация I)+hUTC. Несущая среда (модификация I)+hUTC были обнаружены, в первую очередь, в легких в течение вплоть до 24 часов после введения. Такая преходящая экспозиция была достаточной, чтобы индуцировать антитела к несущей среде (модификация I)+hUTC. Не обнаружено макроскопической патологии на вскрытии, связанной с введением несущей среды (модификация I)+hUTC, или несущей среды (модификация I). Не обнаружено неблагоприятного воздействия несущей среды (модификация I) или несущей среды (модификация I)+hUTC на посмертную массу тела, массу органов или отношения масс органов к посмертной массе тела.
В. Доклиническая оценка безопасности композиций для криоконсервации после введения путем ICM инъекции
[0132] Цель данного исследования состояла в оценке потенциальной токсичности несущей среды (модификация I)+hUTC у крыс после однократной инъекции в cisterna magna, для выявления потенциальной задержанной токсичности и характеристики устойчивости и/или обратимости неблагоприятных явлений в течение 4-недельного периода наблюдения. Крысам линии Sprague Dawley (15/пол/группа) вводили несущую среду (модификация I)+hUTC в номинальных дозах 1 × 106 или 3 × 106 клеток, а контрольным крысам вводили либо 0,9% физиологический раствор, либо несущую среду (модификация I). На 4-й и 29-й дни исследования («ДИ») проводили вскрытие для выявления возможных острых эффектов, связанных с введением несущей среды (модификация I)+hUTC, или несущих сред, и соответственно прекращения эффектов. Дополнительные (дублирующие) животные были включены в исследование для подтверждения экспозиции к несущей среде (модификация I)+hUTC и для оценки потенциального сохранения эффектов.
[0133] Флаконы с несущей средой (модификация I)+hUTC размораживали и использовали без фильтрования. В низкой дозе составы для дозирования либо использовали без разведения, либо разводили в несущей среде (модификация I), если концентрация клеток превышала спецификацию 10 (± 3) × 106. Для введения высокой дозы клеток их концентрировали путем центрифугирования и ресуспендировали в модификации I в объеме, несколько меньше одной трети от исходного объема. После концентрирования определяли число и жизнеспособность клеток, а затем доводили объем до концентрации клеток 30 × 106 клеток/мл добавлением модификации I. Средняя жизнеспособность клеток в составах для дозирования составляла 89% перед дозированием и 78% после введения. План исследования характеризовался ICM введением. План исследования приведен ниже в таблице 2-2.
(число клеток)c
(мкл)
самцов
самцов
b Для оценки экспозиции клеток методом полимеразной цепной реакции (ПЦР) 3 животных/пол групп 1 и 2 подвергали эвтаназии на 1-й день, и 4 животных/пол групп 3 и 4 подвергали эвтаназии соответственно на 1-й день (подтверждение экспозиции клеток), 4-й и 29-й дни (для оценки биораспределения в тканях несущей среды+hUTC методом ПЦР).
c Целевое число клеток.
[0134] Не наблюдалось летальных исходов или изменения клинических признаков, связанных со введением несущей среды (модификация I) или несущей среды (модификация I)+hUTC, за исключением повышенной частоты случаев выделений из поврежденной кожи головы при высокой дозе несущей среды (модификация I)+hUTC. Не наблюдалось связанных со введением несущей среды (модификация I) или несущей среды (модификация I)+hUTC изменений показателей массы тела, потребления корма, результатов батареи функциональных нейроповеденческих тестов, офтальмологических обследований, гематологических, клинико-биохимических показателей или анализа мочи.
[0135] В анализе методом полимеразной цепной реакции (ПЦР) подтвердили наличие человеческих клеток и экспозицию к несущей среде (модификация I)+hUTC в пробах цереброспинальной жидкости, полученных после завершения дозирования. На 4-й день исследования (ДИ) человеческие клетки были обнаружены в головном мозге и в шейной, грудной и поясничной областях спинного мозга. Наибольшее число клеток было обнаружено в головном мозге, но в головном и спинном мозге было обнаружено менее 3% введенной дозы, а в крови клетки не были обнаружены. Человеческие клетки не удалось обнаружить в пробах крови, тканей головного или спинного мозга, полученных на 29-й день исследования (ДИ).
[0136] Несущая среда (модификация I)+hUTC обладает иммуногенностью, на основании результатов анализа сыворотки крови, который показал наличие реакции антител к несущей среде (модификация I)+hUTC на ДИ 29 у крыс, получавших несущую среду (модификация I)+hUTC при обоих уровнях дозы. Все пробы сыворотки крови, полученные перед исследованием, и пробы, полученные от контрольных животных, которым вводили физиологический раствор или несущую среду (модификация I), на 4-й и 29-й дни исследования (ДИ) не содержали сывороточных антител к модификации I.
[0137] При посмертном исследовании на вскрытии не обнаружено изменения массы органов или макроскопических патологических изменений, связанных с введением несущей среды (модификация I) или несущей среды (модификация I)+hUTC. Однако при гистопатологическом исследовании были выявлены изменения в в оболочках головного мозга и спинного мозга (шейной, грудной и поясничной области), связанные со введением несущей среды (модификация I)+hUTC, при обеих номинальных дозах несущей среды (модификация I)+hUTC. Изменения на микроскопическом уровне, отмеченные у крыс, подвергнутых эвтаназии на 4-й и 29-й дни исследования (ДИ), были описаны как воспалительные инфильтраты менингеальных оболочек от минимальной до легкой степени, характеризующиеся наличием или накоплением мононуклеарных клеток, которые были обнаружены вокруг мелких кровеносных сосудов, в менингеальных оболочках. Были также обнаружены фокальные зоны уплотнения менингеальных оболочек.
[0138] В итоге, однократные инъекции в cisterna magna несущей среды (модификация I)+hUTC не сопровождались летальными исходами, клиническими признаками токсичности, или неблагоприятным проявлением показателей клинической патологии или нейроповеденческой оценки. В менингеальных оболочках с фокальными зонами уплотнения менингеальной оболочки наблюдалось развитие антител к несущей среде (модификация I)+hUTC и устойчивые воспалительные инфильтраты мононуклеарных клеток при дозах ≥ 1 × 106 клеток. Иммунный ответ антител и наблюдаемые изменения менингеальных оболочек могут отражать гуморальный и клеточный ответы крысы на ксеногенные клетки человека.
Пример 3
Облегченная среда FBC/DMEM со сниженным содержанием ДМСО
[0139] Прямое введение размороженной суспензии клеток приемлемо для множества применений, включая системное введение. Результаты показали, что состав, содержащий 10% об. ДМСО, поддерживает жизнеспособность клеток во время криоконсервации и после размораживания. ДМСО является важным криопротектором, и он использовался во множестве областей применения для криоконсервации клеток и тканей по терапевтическим показаниям. Был определен состав, который поддерживает жизнеспособность и активность клеток hUTC. Этот состав содержал относительно высокую плотность клеток hUTC (10 миллионов на 1 мл) при концентрации ДМСО 10% (об.), что позволяло осуществлять внутривенное введение высокой дозы клеток и оказалось эффективным для уменьшения опасности ишемического повреждения головного мозга.
[0140] Состав, содержащий 10% ДМСО, приемлем для введения клеток во множестве областей применения, включая такие, при которых клетки вводят внутривенно. Однако в некоторых областях применения уменьшенное количество ДМСО может быть более желательным, когда клетки вводят в некоторые биологические компартменты, например, в пределах ЦНС. Некоторые компартменты обладают уникальной структурой и свойствами, которые могут быть более чувствительными к ДМСО или ограничивать диффузию ДМСО, вследствие чего ткани в этих областях могут подвергаться воздействию уровней ДМСО, которые могут индуцировать некоторые нежелательные реакции.
[0141] С учетом предполагаемого применения клеток hUTC для дополнительных показаний, при которых может потребоваться введение в отдельные компартменты меньшего объема, была проведена серия исследований in vitro, чтобы определить, будут ли составы для криоконсервации (например, составы на основе модификации I, как описано в примере 1 выше) со сниженным содержанием ДМСО поддерживать жизнеспособность и регенерацию клеток hUTC в процессе криоконсервации и стабильность после размораживания. Клетки испытывали в ряде растворов с разными уровнями ДМСО и разными концентрациями клеток.
Способы
[0142] Клетки hUTC были размножены в биореакторах на гранулах микроносителя. Гранулы микроносителя собирали, оставляя их для осаждения, и клетки hUTC диссоциировали с гранул путем ферментативного расщепления. Диссоциированные клетки собирали центрифугированием и промывали физиологическим раствором. Клетки были распределены в общей сложности на 9 составов, описанных в таблице 3-1 ниже. Аликвоты этих суспензий отбирали и переносили во флаконы объемом 1 мл для криоконсервации. Пробы хранили при комнатной температуре в течение около 60 минут, затем замораживали в морозильной камере с управляемой скоростью замораживания. Затем замороженные пробы переносили в сосуд Дьюара с жидким азотом и хранили в нем.
[0143] В таблице 3-1 показаны составы для криоконсервации, оцениваемые в данном исследовании. Составы были основаны на составах FBC/облегченная среда DMEM, к которым затем добавляли ДМСО в подходящей концентрации. Растворы обозначены буквами в первом столбце.
[0144] Флаконы с пробами извлекали из места хранения и быстро размораживали в водяной бане. Отбирали аликвоты и определяли регенерацию и жизнеспособность с помощью набора реагентов ViaCount® и прибора Guava®. Флаконы выдерживали при комнатной температуре, отбирали дополнительные аликвоты через 15-20-минутные интервалы и количественно определяли регенерацию и жизнеспособность клеток с помощью прибора Guava®. Время отбора аликвот регистрировали, и показатели регенерации и жизнеспособности клеток наносили на график зависимости от времени.
[0145] Результаты определения жизнеспособности и регенерации свидетельствуют о том, что составы поддерживают жизнеспособность клеток в процессе криоконсервации и сохраняют их жизнеспособность после размораживания. Результаты показаны на Фиг. 6A и Фиг. 6B. Результаты показывают, что не все составы поддерживали жизнеспособность клеток hUTC в равной степени. Жизнеспособность клеток, включенных в растворы, которые содержали 10%, 7% и 5% ДМСО, была сходной. Самую низкую жизнеспособность наблюдали с 2% ДМСО. Эти результаты демонстрируют важность ДМСО в качестве криопротектора.
ПРИМЕР 4
Выделение клеток
[0146] Выделение клеток пуповины. Пуповины получали в Национальном центре по обмену материалами для исследования заболеваний (NDRI, г. Филадельфия, штат Пенсильвания, США). Ткани были получены после нормальных родов. Протоколы выделения клеток проводили в асептических условиях в ламинарном боксе. Для удаления крови и остатков клеток пуповину промывали в фосфатно-солевом буфере (PBS; Invitrogen, г. Карлсбад, штат Калифорния, США) с добавлением пенициллина в дозе 100 Ед./мл, стрептомицина в дозе 100 мг/мл и амфотерицина B в дозе 0,25 мкг/мл (Invitrogen, г. Карлсбад, штат Калифорния, США). Впоследствии ткани механически диссоциировали в планшетах для тканевой культуры тканей площадью 150 см2 с добавлением 50 мл среды (среды DMEM с низким содержанием глюкозы или среды DMEM с высоким содержанием глюкозы; Invitrogen) до измельчения ткани в мелкую пульпу. Размельченные ткани переносили в конические пробирки на 50 мл (приблизительно по 5 г ткани в пробирку).
[0147] Затем ткань ферментировали в среде DMEM с низким содержанием глюкозы или среде DMEM с высоким содержанием глюкозы, каждая из которых содержала пенициллин в дозе 100 Ед./мл, стрептомицин в дозе 100 мг/мл, амфотерицин B в дозе 0,25 мкг/мл и расщепляющие ферменты. В некоторых вариантах осуществления использовали смесь ферментов коллагеназы и диспазы («C: D») (коллагеназа (Sigma, г. Сент-Луис, штат Миссури, США), 500 Ед./мл; и диспаза (Invitrogen), 50 Ед./мл, в среде DMEM с низким содержанием глюкозы). В других экспериментах использовали смесь коллагеназы, диспазы и гиалуронидазы («C: D: H») (C: D: H=коллагеназа, 500 Ед./мл; диспаза, 50 Ед./мл; и гиалуронидаза (Sigma), 5 Ед./мл, в среде DMEM с низким содержанием глюкозы). Конические пробирки, содержащие ткань, среду и расщепляющие ферменты, инкубировали при температуре 37°C на орбитальном шейкере (Environ, г. Бруклин, штат Нью-Йорк, США) при скорости 225 об./мин. в течение 2 часов.
[0148] После расщепления ткани центрифугировали при 150 × g в течение 5 минут и отсасывали супернатант. Осадок повторно суспендировали в 20 мл ростовой среды (среда DMEM с низким содержанием глюкозы (Invitrogen), 15% (об.) эмбриональной бычьей сыворотки (FBS; определенная эмбриональная бычья сыворотка; партия № AND18475; Hyclone, г. Логан, штат Юта, США), 0,001% (об.) 2-меркаптоэтанола (Sigma), пенициллин в дозе 100 Ед./мл, стрептомицин в дозе 100 мкг/мл и амфотерицин B в дозе 0,25 мкг/мл (каждый от Invitrogen, г. Карлсбад, штат Калифорния, США)). Клеточную суспензию фильтровали через нейлоновый клеточный фильтр BD FALCON с размером пор 70 мкм (BD Biosciences, г. Сан-Хосе, штат Калифорния, США). Фильтр дополнительно промывали 5 мл жидкости, содержащей ростовую среду. Затем клеточную суспензию пропускали через нейлоновый клеточный фильтр с размером пор 40 мкм (BD Biosciences, г. Сан-Хосе, штат Калифорния, США), после чего фильтр дополнительно промывали 5 мл ростовой среды.
[0149] Фильтрат повторно суспендировали в ростовой среде (общий объем 50 мл) и центрифугировали при 150 × g в течение 5 минут. Супернатант отсасывали и клетки повторно суспендировали в 50 мл свежей ростовой среды. Описанную процедуру повторяли еще дважды.
[0150] После последнего центрифугирования супернатант отсасывали и клеточный осадок повторно суспендировали в 5 мл свежей ростовой среды. Число жизнеспособных клеток определяли окрашиванием трипановым синим. Затем клетки культивировали в стандартных условиях.
[0151] Клетки, выделенные из ткани пуповины, высевали с плотностью 5000 клеток/см2 в ростовую среду в покрытых желатином флаконах T75 (Corning Inc., г. Корнинг, штат Нью-Йорк, США). Через два дня из флаконов отсасывали использованную среду и не закрепившиеся клетки. Закрепившиеся клетки трижды промывали PBS для удаления остатков клеток и клеток крови. Затем клетки снова заливали ростовой средой и давали культуре расти до конфлюентности (приблизительно 10 суток от пассажа 0 до пассажа 1). В последующих пассажах (от пассажа 1 до пассажа 2 и т. д.) клетки достигали субконфлюентности (75-85% конфлюентности) за 4-5 суток. Для этих последовательных пассажей клетки высевали с плотностью 5000 клеток/см2. Клетки растили в увлажняемом инкубаторе в атмосфере с 5% диоксида углерода при 37°C.
[0152] В некоторых вариантах осуществления клетки выделяли из постнатальных тканей в среду DMEM с низким содержанием глюкозы после расщепления с использованием LIBERASE (2,5 мг/мл, Blendzyme 3; Roche Applied Sciences, г. Индианаполис, штат Индиана, США) и гиалуронидазы (5 Ед./мл, Sigma). Расщепление ткани и выделение клеток проводили описанным выше способом для расщепления с использованием других протеаз, однако при этом применяли смесь LIBERASE/гиалуронидаза вместо смеси ферментов C: D или C: D: H. Расщепление ткани с помощью LIBERASE позволило выделить из постнатальных тканей популяции клеток, которые быстро размножались.
[0153] Сравнивали процедуры выделения клеток из пуповины с применением разных сочетаний ферментов. Ферменты, которые сравнивали на расщепление, включали: i) коллагеназу; ii) диспазу; iii) гиалуронидазу; iv) смесь коллагеназа: диспаза (C: D); v) смесь коллагеназа: гиалуронидаза (C: H); vi) смесь диспаза: гиалуронидаза (D: H); и vii) смесь коллагеназа: диспаза: гиалуронидаза (C: D: H). При выделении клеток с использованием этих разных условий ферментативного расщепления наблюдались различия (см. таблицу 4-1).
[0154] Предпринимали другие попытки выделения пулов клеток из пуповины различными способами. В одном случае пуповину нарезали и промывали ростовой средой для отделения сгустков крови и студенистого материала. Смесь крови, студенистого материала и ростовой среды собирали и центрифугировали при 150 × g. Осадок повторно суспендировали и высевали в покрытые желатином флаконы с ростовой средой. Данные эксперименты позволили выделить популяцию клеток, которые быстро размножались.
[0155] Клетки также выделяли из проб пуповинной крови, полученных из NDRI. Использовали протокол выделения согласно международной заявке на патент PCT/US2002/029971 от Ho et al. Пробы (50 мл и 10,5 мл соответственно) пуповинной крови (NDRI, г. Филадельфия, штат Пенсильвания, США) смешивали с лизирующим буферным раствором (стерилизованным фильтрованием и содержащим 155 ммоль/л хлорида аммония, 10 ммоль/л бикарбоната калия, 0,1 ммоль/л ЭДТА, забуференным до pH 7,2 (все компоненты от Sigma, г. Сент-Луис, штат Миссури, США)). Клетки лизировали при соотношении пуповинной крови и лизирующего буферного раствора 1: 20. Полученную суспензию клеток в течение 5 секунд встряхивали и затем инкубировали в течение 2 минут при окружающей температуре. Лизат центрифугировали (10 минут при 200 × g). Клеточный осадок ресуспендировали в полноценной минимальной питательной среде (Gibco, г. Карлсбад, штат Калифорния, США), содержащей 10% эмбриональной бычьей сыворотки (Hyclone, г. Логан, штат Юта, США), 4 ммоль/л глутамина (Mediatech, г. Херндон, штат Виргиния), пенициллин в дозе 100 Ед./мл и стрептомицин в дозе 100 мкг/мл (Gibco, г. Карлсбад, штат Калифорния, США). Повторно суспендированные клетки центрифугировали (10 минут при 200 × g), супернатант отсасывали, и клеточный осадок промывали в полной среде. Клетки прямо высевали либо во флаконы T75 (Corning, г. Корнинг, штат Нью-Йорк, США), либо в покрытые ламинином флаконы T75, либо в покрытые фибронектином флаконы T175 (оба от Becton Dickinson, г. Бедфорд, штат Массачусетс, США).
[0156] Для того чтобы определить возможность выделения популяций клеток в разных условиях и их размножения в разных условиях сразу после выделения, клетки расщепляли в ростовой среде с добавлением или без добавления 0,001% (об.) 2-меркаптоэтанола (Sigma, г. Сент-Луис, штат Миссури, США) и с применением сочетания ферментов C: D: H в соответствии с описанными выше процедурами. Все клетки выращивали с добавлением пенициллина в дозе 100 Ед./мл и стрептомицина в дозе 100 мкг/мл. Клетки хорошо закреплялись и размножались между пассажами 0 и 1 при всех исследуемых условиях (табл. 4-2). Для клеток при условиях 5-8 и 13-16 наблюдали хорошую пролиферацию вплоть до 4 пассажей после посева, после чего их криоконсервировали.
[0157] Сочетание ферментов C: D: H обеспечило наилучший выход клеток после выделения и дало клетки, которые размножались в культуре в течение гораздо большего числа поколений, чем при других условиях (таблица 4-1). При применении только коллагеназы или только гиалуронидазы не удавалось получить способную к размножению популяцию клеток. Попытки проверить, специфичен ли этот результат для данной коллагеназы, не предпринимались.
[0158] Клетки закреплялись и хорошо размножались между пассажами 0 и 1 при всех исследуемых условиях ферментативного расщепления и условиях роста (таблица 4-2). Для клеток при экспериментальных условиях 5-8 и 13-16 наблюдали хорошую пролиферацию вплоть до 4 пассажей после посева, и в этот момент клетки криоконсервировали. Все клетки криоконсервировали для проведения дополнительного анализа.
(20 нг/мл)
(20 нг/мл)
(20 нг/мл)
(20 нг/мл)
[0159] Клетки с ядрами быстро закреплялись и росли. Данные клетки анализировали методом проточной цитометрии, и они оказались аналогичными клеткам, полученным способом ферментативного расщепления.
[0160] Препараты содержали эритроциты и тромбоциты. Клетки с ядрами не закреплялись и не делились в течение первых 3 недель. Среду заменяли через 3 недели после посева, но не наблюдали никакого закрепления и роста клеток.
[0161] Популяции клеток можно успешно выделять из ткани пуповины при помощи сочетания ферментов, содержащего коллагеназу (металлопротеаза), диспазу (нейтральная протеаза) и гиалуронидазу (муколитический фермент, который расщепляет гиалуроновую кислоту). Также можно применять смесь LIBERASE, которая представляет собой смесь коллагеназы и нейтральной протеазы. Вместе с гиалуронидазой для выделения клеток также использовали смесь Blendzyme 3, которая представляет собой смесь коллагеназы (4 единицы Вунша/г) и термолизина (1714 единиц казеина/г). Данные клетки легко размножались на протяжении многих пассажей при культивировании в ростовой среде для размножения на покрытом желатином пластике.
[0162] Клетки также выделяли из остаточной крови в пуповинах, но не из пуповинной крови. Наличие клеток в сгустках крови, смытых с ткани, которые закрепляются и растут в применяемых условиях, может быть обусловлено клетками, высвобожденными в процессе рассечения.
ПРИМЕР 5
Анализ кариотипа клеток
[0163] Применяемые в клеточной терапии клеточные линии должны быть предпочтительно однородными и не содержать любых примесей клеток других типов. Человеческие клетки, которые применяются в терапевтических целях, должны иметь нормальное число (46) хромосом с нормальной структурой. Был проведен анализ кариотипов проб клеток для определения линий полученных из пуповины клеток, однородных и не содержащих клеток, происходящих не из ткани пуповины.
[0164] Клетки UTC, полученные из постнатальной ткани новорожденного мальчика, культивировали в ростовой среде. Постнатальную ткань новорожденного мальчика (X, Y) выбрали для возможности различения неонатальных клеток и материнских клеток (X, X). Клетки высевали с плотностью 5000 клеток на кв. сантиметр в ростовую среду во флаконе T25 (Corning, г. Корнинг, штат Нью-Йорк, США) и размножали до степени конфлюентности 80%. Затем содержащий клетки флакон T25 заполняли по горлышко ростовой средой. Пробы доставили курьером в лабораторию клинической цитогенетики (оцениваемое время транспортировки из лаборатории в лабораторию составляет один час). Анализ хромосом был выполнен Центром человеческой и молекулярной генетики в медицинской школе Нью-Джерси, г. Ньюарк, штат Нью-Джерси, США. Клетки анализировали во время метафазы, когда хромосомы видны лучше всего. Из двадцати подсчитанных в метафазе клеток пять клеток анализировали на число кариотипов для нормальной однородной популяции клеток (два). Пробы клеток характеризовали как однородные при наблюдении двух кариотипов. Пробы клеток характеризовали как неоднородные при наблюдении более двух кариотипов. При определении количества кариотипов (четыре), характерного для неоднородной популяции клеток, подсчитывали и анализировали дополнительные клетки в метафазе.
[0165] Все пробы клеток, отправленные для проведения анализа хромосом, были интерпретированы сотрудником цитогенетической лаборатории как имеющие нормальный вид. Три из шестнадцати анализированных клеточных линий показали неоднородный фенотип (XX и XY), указывающий на наличие клеток как неонатального, так и материнского происхождения (таблица 5-1). Каждая из проб клеток был характеризован как однородный (таблица 5-1).
[0166] В результате анализа хромосом идентифицировали клетки UTC, полученные из пуповины, кариотипы которых интерпретировали в лаборатории клинической цитогенетики как имеющие нормальный вид. В результате анализа кариотипа также идентифицировали клеточные линии, не содержащие материнских клеток, как определено по однородному кариотипу.
ПРИМЕР 6
Определение маркеров клеточной поверхности методом проточной цитометрии
[0167] Характеристику белков или «маркеров» клеточной поверхности методом проточной цитометрии можно применять для определения отличительных признаков клеточной линии. Стабильность экспрессии можно определять по множеству доноров и в клетках, которые культивировали и обрабатывали в разных условиях. Линии постнатальных клеток, выделенных из пуповины, характеризовали методом проточной цитометрии, получая профиль экспрессии для идентификации данных клеточных линий.
[0168] Клетки культивировали в ростовой среде в обработанных плазмой флаконах для тканевых культур T75, T150 и T225 (Corning, г. Корнинг, штат Нью-Йорк, США) до конфлюэнтности. Поверхности флаконов для выращивания покрывали желатином путем инкубации с 2% (масса/об.) раствором желатина (Sigma, г. Сент-Луис, штат Миссури, США) в течение 20 минут при комнатной температуре.
[0169] Закрепившиеся клетки во флаконах промывали фосфатно-солевым буфером (PBS) (Gibco, г. Карлсбад, штат Миссури, США) и отделяли с помощью трипсина/ЭДТА (Gibco). Клетки собирали, центрифугировали и ресуспендировали в 3% (об.) FBS в PBS с концентрацией клеток 1×107 клеток/мл. В соответствии со спецификациями производителя, антитело к исследуемому маркеру клеточной поверхности (см. ниже) добавляли к 100 мкл клеточной суспензии и инкубировали смесь в темноте в течение 30 минут при температуре 4°C. После инкубации клетки промывали PBS и центрифугировали для удаления несвязанных антител. Клетки повторно суспендировали в 500 мкл PBS и анализировали методом проточной цитометрии. Анализ методом проточной цитометрии проводили на приборе FACScalibur™ (Becton Dickinson, г. Сан-Хосе, штат Калифорния, США).
[0170] Использовали антитела к маркерам клеточной поверхности, показанные в таблице 6-1.
[0171] Клетки, полученные из пуповины, анализировали на пассажах 8, 15 и 20.
[0172] Для сравнения различий между донорами сравнивали друг с другом клетки, полученные из ткани пуповины от различных доноров. Клетки, полученные из пуповины и культивированные в покрытых желатином флаконах, также сравнивали с клетками, полученными из пуповины и культивированными во флаконах без покрытия.
[0173] Сравнивали результаты четырех процедур, применяемых для выделения и приготовления клеток. Клетки, получали из постнатальной ткани, путем обработки: 1) коллагеназой; 2) коллагеназой/диспазой; 3) коллагеназой/гиалуронидазой; и 4) коллагеназой/гиалуронидазой/диспазой.
[0174] Полученные из пуповины клетки пассажей 8, 15 и 20, по результатам анализа методом проточной цитометрии, все экспрессировали CD10, CD13, CD44, CD73, CD90, PDGFr-альфа и HLA-A, B, C, на что указывала повышенная флуоресценция по сравнению с контролем IgG. Эти клетки были отрицательными по CD31, CD34, CD45, CD117, CD141 и HLA-DR, DP, DQ, на что указывали значения флуоресценции, сопоставимые с контролем IgG.
[0175] Все анализированные методом проточной цитометрии клетки, полученные из пуповины разных доноров, показали положительную продукцию CD10, CD13, CD44, CD73, CD 90, PDGFr-альфа и HLA-A, B, C, на что указывали повышенные значения флуоресценции по сравнению с контролем IgG. Эти клетки были отрицательными по продукции CD31, CD34, CD45, CD117, CD141 и HLA-DR, DP, DQ, на что указывали значения флуоресценции, сопоставимые с контролем IgG.
[0176] Все анализированные методом проточной цитометрии клетки, полученные из ткани пуповины и размноженные в покрытых и не покрытых желатином флаконах, были положительными по продукции CD10, CD13, CD44, CD73, CD 90, PDGFr-альфа и HLA-A, B, C, на что указывали повышенные значения флуоресценции по сравнению с контролем IgG. Эти клетки были отрицательными по продукции CD31, CD34, CD45, CD117, CD141 и HLA-DR, DP, DQ, на что указывали значения флуоресценции, сопоставимые с контролем IgG.
[0177] Анализ клеток, полученных из пуповины, методом проточной цитометрии позволил установить идентичность данных клеточных линий. Эти клетки, полученные из пуповины, были положительными по CD10, CD13, CD44, CD73, CD90, PDGFr-альфа и HLA-A, B, C; и отрицательными по CD31, CD34, CD45, CD117, CD141 и HLA-DR, DP, DQ. Данные отличительные признаки были сопоставимыми между вариациями разных параметров, включая донора, номер пассажа, покрытие поверхности сосуда для культивирования, расщепляющие ферменты и плацентарный слой. На гистограммах значений флуоресценции наблюдались некоторые вариации в средних значениях и диапазонах изменения, но все положительные кривые при всех исследуемых условиях имели нормальный вид, а значения интенсивности флуоресценции превышали значения для контроля IgG, тем самым подтверждая, что клетки содержат однородную популяцию с положительной экспрессией маркеров.
ПРИМЕР 7
Анализ клеток с помощью олигонуклеотидных чипов
[0178] Для сравнения профилей экспрессии генов клеток, полученных из пуповины и плаценты, с профилями экспрессии для фибробластов, мезенхимальных стволовых клеток человека и другой клеточной линии, полученной из костного мозга человека, применяли олигонуклеотидные чипы. Данный анализ позволил характеризовать клетки из постнатальной ткани и идентифицировать уникальные молекулярные маркеры данных клеток.
[0179] Клетки, полученные из постнатальной ткани. Пуповины и плаценту человека получали в Национальном центре по обмену материалами для исследования заболеваний (NDRI, г. Филадельфия, штат Пенсильвания, США) после нормальных родов при доношенной беременности и с согласия пациентки. Ткани были получены, и клетки выделили способом, описанным в примере 5, после расщепления смесью C: D: H. Клетки культивировали в ростовой среде в покрытых желатином пластиковых флаконах для тканевых культур. Культуры инкубировали при температуре 37°C в атмосфере с 5% CO2.
[0180] Фибробласты. Фибробласты дермы человека приобретали у компании Cambrex Incorporated (г. Уолкерсвилл, штат Мэриленд, США; партия № 9F0844) и ATCC CRL-1501 (CCD39SK). Обе линии культивировали в среде DMEM/F12 (Invitrogen, г. Карлсбад, штат Калифорния, США) с добавлением 10% (об.) эмбриональной бычьей сыворотки (Hyclone) и пенициллина/стрептомицина (Invitrogen). Клетки растили на стандартно обработанном для ткани пластике.
[0181] Человеческие мезенхимальные клетки (hMSC). Клетки hMSC приобретали у Cambrex Incorporated (г. Уолкерсвилл, штат Мэриленд, США; партии № 2F1655, 2F1656 и 2F1657) и культивировали в соответствии со спецификациями производителя в среде MSCGM (Cambrex). Клетки растили на стандартном пластике для тканевых культур при температуре 37°C в атмосфере с 5% CO2.
[0182] Клетки костного мозга гребня подвздошной кости человека (клетки ICBM). Костный мозг гребня подвздошной кости человека получили из NDRI с согласия пациента. Костный мозг обрабатывали в соответствии со способом, изложенным Ho, et al. (заявка на международный патент № WO03/025149). Костный мозг смешивали с лизирующим буферным раствором (155 ммоль/л NH4Cl, 10 ммоль/л KHCO3 и 0,1 ммоль/л ЭДТА, pH 7,2) в соотношении 1 часть костного мозга к 20 частям лизирующего буфера. Клеточную суспензию встряхивали, инкубировали на протяжении 2 минут при комнатной температуре и центрифугировали 10 минут при 500 × g. Супернатант отбрасывали, а клеточный осадок ресуспендировали в минимально необходимой среде альфа (Invitrogen), дополненной 10% (об.) эмбриональной бычьей сыворотки и 4 ммоль/л глутамина. Клетки еще раз центрифугировали и клеточный осадок повторно суспендировали в свежей среде. Число жизнеспособных мононуклеарных клеток определяли испытанием на вытеснение трипанового синего (Sigma, г. Сент-Луис, штат Миссури, США). Мононуклеарные клетки высевали в пластиковые флаконы для тканевых культур в количестве 5 × 104 клеток/см2. Клетки инкубировали при 37°C в атмосфере с 5% CO2, либо в условиях стандартной атмосферы O2, либо с 5% O2. Клетки культивировали в течение 5 дней без замены среды. Среду и незакрепившиеся клетки удаляли после 5 дней культивирования. Закрепившиеся клетки поддерживали в культуре.
[0183] Активно растущие культуры клеток извлекали из флаконов с помощью скребка для клеток в холодном фосфатно-солевом буфере (PBS). Эти клетки центрифугировали (5 минут при 300 × g), супернатант сливали, и клеточный осадок промывали в свежем PBS и центрифугировали снова. Супернатант сливали, и клеточный осадок немедленно замораживали и хранили при -80 °C. Клеточную мРНК экстрагировали и транскрибировали в кДНК. Затем кДНК транскрибировали в кРНК и пометили биотином. Меченую биотином кРНК гибридизировали с олигонуклеотидными чипами Affymetrix GENECHIP HG-U133A (Affymetrix, г. Санта-Клара, штат Калифорния, США). Гибридизацию и сбор данных проводили в соответствии со спецификациями производителя. Анализ данных проводили с помощью программного обеспечения версии 1.21 «Анализ значимости биочипов» (Significance Analysis of Microarrays, SAM) (Tusher, V. G. et al., 2001, Proc. Natl. Acad. Sci. USA 98: 5116-5121). Лицензии на аналитическое программное обеспечение можно приобрести в Отделе лицензирования технологий Стэнфордского университета, а более подробную информацию можно получить во всемирной сети на веб-сайте профессора Тибширани с кафедры статистики Стэнфордского университета.
[0184] В данном исследовании анализу подвергли четырнадцать различных популяций клеток. В таблице 7-1 перечислены клетки, информация о их пассировании, субстрате для культуры и средах для культуры. Клеточные линии перечислены вместе с их идентификационными кодами, сведениями о пассаже на момент анализа, ростовым субстратом для клеток и ростовыми средами.
[0185] Данные оценивали с помощью анализа главных компонентов, пользуясь программным обеспечением SAM, как описано выше. В ходе анализа выявлены 290 генов, которые экспрессировались в исследуемых клетках в разных относительных количествах. Данный анализ позволил провести сравнительное сопоставление популяций друг с другом.
[0186] В таблице 7-2 представлены евклидовы расстояния, рассчитанные для сравнения пар клеток. Евклидовы расстояния основаны на сравнении клеток по 290 генам, которые дифференциально экспрессировались в клетках разных типов. Евклидово расстояние обратно пропорционально подобию в экспрессии 290 генов. Евклидово расстояние рассчитывали для этих типов клеток, пользуясь 290 генами, которые по-разному экспрессируются в этих видах клеток. Подобие клеток обратно пропорционально евклидовому расстоянию.
[0187] В таблицах 7-3, 7-4 и 7-5 показана повышенная экспрессия генов в полученных из плаценты клетках (таблица 7-3), в полученных из пуповины клетках (таблица 7-4) и сниженная экспрессия в клетках, полученных из пуповины и плаценты (таблица 7-5).
[0188] В таблицах 7-6, 7-7 и 7-8 показана повышенная экспрессия генов в фибробластах человека (таблица 7-6), в клетках ICBM (таблица 7-7) и в клетках MSC (таблица 7-8).
[0189] Этот пример был выполнен для обеспечения молекулярной характеристики клеток, полученных из пуповины и плаценты. Анализ включал клетки, полученные из трех разных пуповин и трех разных плацент. Исследование также включало две разные линии фибробластов дермы, три линии мезенхимальных стволовых клеток и три линии клеток костного мозга гребня подвздошной кости. Экспрессируемую данными клетками мРНК подвергли анализу с использованием олигонуклеотидного чипа GENECHIP, который содержал олигонуклеотидные зонды для 22 000 генов.
[0190] Анализ позволил обнаружить транскрипты 290 генов, которые присутствуют в различных количествах в пяти этих разных видах клеток. Данные гены включают десять генов, экспрессия которых специфически повышается в клетках, полученных из плаценты, и семь генов, экспрессия которых специфически повышается в клетках, полученных из пуповины. Было обнаружено пятьдесят четыре гена со специфически сниженными уровнями экспрессии в клетках, полученных из плаценты, и клетках, полученных из ткани пуповины.
ПРИМЕР 8
Иммуногистохимическая характеристика клеточных фенотипов
[0191] Проводили иммуногистохимический анализ фенотипов клеток, обнаруженных в ткани пуповины человека.
[0192] Ткань пуповины человека собирали и фиксировали погружением в 4% (масса/об.) раствор параформальдегида в течение ночи при температуре 4 °C. Иммуногистохимический анализ проводили с использованием антител к следующим эпитопам (см. таблицу 8-1): виментину (1: 500; Sigma, г. Сент-Луис, штат Миссури, США), десмину (1: 150, выработанные против кролика; Sigma; или 1: 300, выработанные против мыши; Chemicon, г. Темекула, штат Калифорния, США), альфа-актину гладких мышц (SMA; 1: 400 Sigma), цитокератину 18 (CK18; 1: 400 Sigma), фактору фон Виллебранда (vWF; 1: 200; Sigma) и CD34 (человеческий CD34 класса III; 1: 100; DAKOCytomation, г. Карпинтерия, штат Калифорния, США). Кроме этого, анализировали следующие маркеры: анти-человеческий GRO-альфа-PE (1: 100; Becton Dickinson, г. Франклин-Лейкс, штат Нью-Джерси, США), анти-человеческий GCP-2 (1: 100; Santa Cruz Biotech, г. Санта-Круз, штат Калифорния, США), анти-человеческий рецептор-1 окисленных ЛПНП (ox-LDL R1; 1: 100; Santa Cruz Biotech) и анти-человеческий NOGO-A (1: 100; Santa Cruz Biotech). Фиксированные препараты иссекали скальпелем и помещали в заливочную композицию OCT (Tissue-Tek OCT; Sakura, г. Торранс, штат Калифорния, США) на бане из сухого льда с этанолом. Затем замороженные блоки нарезали на секции толщиной 10 мкм с применением стандартного криостата (Leica Microsystems) и монтировали на предметные стекла для окрашивания.
[0193] Иммуногистохимический анализ проводили аналогично предыдущим исследованиям. (например, Messina et al., Exper. Neurol., 2003; 184; 816-829). Срезы тканей промывали фосфатно-солевым буфером (PBS) и обрабатывали белковым блокирующим раствором, содержащим PBS, 4% (об.) козьей сыворотки (Chemicon, г. Темекула, штат Калифорния, США) и 0,3% (об.) Тритона (Triton X-100, Sigma), в течение 1 часа для доступа к внутриклеточным антигенам. В случаях, когда рассматриваемый эпитоп находился на клеточной поверхности (CD34, ox-LDL R1), Тритон исключали на всех стадиях процедуры, чтобы не допустить потери эпитопа. Кроме того, в случаях, когда первичное антитело было выработано против козы (GCP-2, oкс-LDL R1, NOGO-A), в течение всей процедуры вместо козьей сыворотки применяли 3% (об.) ослиную сыворотку. Затем срезы обрабатывали в течение 4 часов при комнатной температуре первичными антителами, разведенными в блокирующем растворе. Растворы первичных антител сливали и культуры промывали PBS перед добавлением растворов вторичных антител (1 час при комнатной температуре), содержащих блокирующий раствор вместе с конъюгатом козьего антимышиного IgG-Texas Red (1: 250; Molecular Probes, г. Юджин, штат Орегон, США) и/или конъюгатом козьего антикроличьего IgG-Alexa 488 (1: 250; Molecular Probes), либо конъюгатом ослиного антикозьего IgG-FITC (1: 150; Santa Cruz Biotech). Культуры промывали и обрабатывали 10-микромолярным раствором DAPI (Molecular Probes) в течение 10 минут для визуализации клеточных ядер.
[0194] После иммунного окрашивания получали флуоресцентные изображения с использованием соответствующего фильтра флуоресценции на инвертированном эпи-флуоресцентном микроскопе (Olympus, г. Мелвилл, штат Нью-Йорк, США). Положительное окрашивание представляло собой флуоресцентный сигнал выше сигнала контрольного окрашивания. Показательные изображения снимали с помощью цветной цифровой видеокамеры и программы ImagePro (Media Cybernetics, г. Карлсбад, штат Калифорния, США). Для проб с тройным окрашиванием каждое изображение получали с применением только одного эмиссионного фильтра каждый раз. Затем готовили послойные монтажи с использованием программы Adobe Photoshop (Adobe, г. Сан-Хосе, штат Калифорния, США).
[0195] Маркеры виментин, десмин, SMA, CK18, vWF и CD34 экспрессировались подмножеством клеток, присутствующих в пуповине (данные не приведены). В частности, экспрессия vWF и CD34 ограничивалась кровеносными сосудами, находящимися внутри пуповины. Клетки CD34+ находились на самом внутреннем слое (со стороны просвета). Экспрессию виментина обнаружили по всему матриксу и кровеносным сосудам пуповины. Экспрессия SMA ограничивалась матриксом и внешними стенками артерии и вены, но не проходила внутри самих сосудов. CK18 и десмин наблюдались только внутри сосудов, причем экспрессия десмина ограничивалась только средними и внешними слоями.
[0196] Ни один из данных маркеров не обнаружили в ткани пуповины (данные не приведены).
[0197] Маркеры виментин, десмин, альфа-актин гладких мышц, цитокератин 18, фактор фон Виллебранда и CD 34 экспрессируются в клетках пуповины человека. На основании исследований, посвященных характеристике in vitro, было показано, что экспрессируются только виментин и альфа-актин гладких мышц, причем данные свидетельствуют о том, что текущий процесс выделения клеток из пуповины приводит к созданию субпопуляции клеток, или что в выделенных клетках изменяется экспрессия маркеров, вследствие чего в клетках начинают экспрессироваться виментин и альфа-актин гладких мышц.
Пример 9
Секреция трофических факторов
[0198] Проводили измерения секреции выбранных трофических факторов в клетках UTC. Факторы были выбраны, исходя из их ангиогенной активности, например, фактор роста гепатоцитов (HGF) (Rosen et al., Ciba Found. Symp., 1997; 212: 215-26); хемотаксический белок 1 моноцитов (MCP-1) (Salcedo et al., Blood, 2000; 96: 34-40); интерлейкин-8 (IL-8) (Li et al., J. Immunol., 2003; 170: 3369-76); фактор роста кератиноцитов (KGF); основной фактор роста фибробластов (bFGF); фактор роста эндотелия сосудов (VEGF) (Hughes et al., Ann. Thorac. Surg. 2004; 77: 812-8); тканевый ингибитор матриксной металлопротеиназы 1 (TIMP1); ангиопоэтин-2 (ANG2); фактор роста тромбоцитов (PDGFbb); тромбопоэтин (TPO); связывающий гепарин эпидермальный фактор роста (HB-EGF); фактор роста-1-альфа стромы (SDF-1-альфа); нейтротрофической/нейропротекторной активности (нейротрофический фактор из тканей головного мозга (BDNF) (Cheng et al., Dev. Biol., 2003; 258: 319-33); интерлейкин-6 (IL-6); хемотаксический белок-2 гранулоцитов (GCP-2); трансформирующий фактор роста бета-2 (TGFbeta2); или активность хемокинов (белок воспаления 1-альфа макрофагов (MIP1alpha); белок воспаления 1-бета макрофагов (MIP1beta); хемоаттрактант-1 моноцитов (MCP-1); RANTES (хемокин, экспрессируемый и выделяемый нормальными T-клетками при активации); I309; хемокин тимуса, регулируемый активацией (TARC); эотаксин; хемокин макрофагов (MDC); и (IL-8).
[0199] Клетки, полученные из ткани пуповины, а также фибробласты человека, полученные из неонатальной крайней плоти человека, культивировали в ростовой среде в покрытых желатином флаконах T75. На пассаже 11 клетки криоконсервировали и хранили в жидком азоте. После размораживания в клетки добавляли ростовую среду, переносили их в пробирку для центрифугирования на 15 мл и центрифугировали при 150 × g в течение 5 минут. Клеточный осадок ресуспендировали в 4 мл ростовой среды и подсчитывали клетки. Клетки высевали в количестве 5000 клеток/см2 во флаконы T75, каждый из которых содержал по 15 мл ростовой среды, и культивировали в течение 24 часов. Среду заменяли на бессывороточную среду (DMEM с низким содержанием глюкозы (Gibco), 0,1% (масса/об.) альбумина бычьей сыворотки (Sigma), пенициллин (50 Ед./мл) и стрептомицин (50 мкг/мл) (Gibco)) и культивировали в течение 8 часов. В конце инкубации кондиционированную бессывороточную среду собирали центрифугированием при 14 000 × g в течение 5 минут и хранили при -20°C.
[0200] Для определения количества клеток в каждом флаконе клетки промывали в фосфатно-солевом буфере (PBS) и отделяли с помощью 2 мл трипсина/ЭДТА (Gibco). Активность трипсина ингибировали добавлением 8 мл ростовой среды. Клетки центрифугировали при 150 × g в течение 5 минут. Супернатант сливали, а клетки ресуспендировали в 1 мл ростовой среды. Число клеток оценивали, пользуясь гемоцитометром.
[0201] Клетки выращивали при 37°C в 5% CO2 и атмосферной концентрации кислорода. Количество MCP-1, IL-6, VEGF, SDF-1 альфа, GCP-2, IL-8 и TGF-бета-2, продуцированное каждой пробой клеток, определяли методом твердофазного ИФА (R&D Systems, г. Миннеаполис, штат Миннесота, США). Все анализы проводили в соответствии с инструкциями производителя. Представленные значения выражены в пикограммах на мл на миллион клеток (n=2, станд. отклон.).
[0202] Хемокины (MIP1alpha, MIP1beta, MCP-1, RANTES, I309, TARC, эотаксин, MDC, IL8), BDNF и ангиогенные факторы (HGF, KGF, bFGF, VEGF, TIMP1, ANG2, PDGFbb, TPO, HB-EGF) определяли количественно, используя протеомные матрицы Searchlight Proteome Arrays (Pierce Biotechnology Inc.). Протеомные матрицы представляют собой мультиплексные твердофазные сэндвич-системы ИФА для количественного определения от 2 до 16 белков на лунку. Матрицы получают, нанося схему из 2 × 2, 3 × 3 или 4 × 4 разных антител захвата в каждую лунку 96-луночного планшета. После проведения процедуры сэндвич-ИФА снимают изображение всего планшета для получения сигнала хемилюминесценции, генерируемого в каждой точке внутри каждой лунки планшета. Сигнал, генерируемый в каждой точке, пропорционален количеству целевого белка в исходном стандарте или пробе.
[0203] MCP-1 и IL-6 секретировались клетками PPDC, полученными из пуповины, и дермальными фибробластами (таблица 9-1). SDF-1alpha и GCP-2 секретировались фибробластами. GCP-2 и IL-8 секретировались клетками PPDC, полученными из пуповины. Методом анализа ИФА ни в одном типе клеток не обнаружили TGF-бета-2.
[0204] Мультиплексный анализ ИФА Searchlight™. TIMP1, TPO, KGF, HGF, FGF, HBEGF, BDNF, MIP1beta, MCP1, RANTES, I309, TARC, MDC и IL-8 секретировались клетками PPDC, полученными из пуповины (таблицы 9-2 и 9-3). Ang2, VEGF или PDGFbb не были обнаружены.
[0205] Клетки, полученные из пуповины, секретируют множество трофических факторов. Некоторые из этих трофических факторов, такие как HGF, bFGF, MCP-1 и IL-8, играют важную роль в ангиогенезе. Другие трофические факторы, такие как BDNF и IL-6, играют важную роль в регенерации или защите нервной ткани.
ПРИМЕР 10
Анализ активности теломеразы
[0206] Функция теломеразы состоит в синтезе теломерных повторов, которые защищают целостность хромосом и продлевают репликативно-активную жизнь клеток (Liu, K, et al., PNAS, 1999; 96: 5147-5152). Теломераза состоит из двух компонентов: теломеразного РНК-шаблона (hTER) и теломеразной обратной транскриптазы (hTERT). Регулирование теломеразы определяется транскрипцией hTERT, но не hTER. Таким образом, полимеразная цепная реакция (ПЦР) в реальном времени на мРНК hTERT является общепринятым способом определения теломеразной активности клеток.
Выделение клеток
[0207] Для определения выработки теломеразы в клетках, полученных из ткани пуповины человека, провели эксперименты по ПЦР в реальном времени. Клетки, полученные из ткани пуповины человека, были приготовлены в соответствии с приведенными выше примерами, а также примерами, изложенными в патенте США № 7,510,873. По существу, пуповины, полученные в Национальном центре по обмену материалами для исследования заболеваний (г. Филадельфия, штат Пенсильвания, США) после нормальных родов, промывали для удаления крови и остатков клеток и механически диссоциировали. Затем ткань инкубировали с расщепляющими ферментами, включая коллагеназу, диспазу и гиалуронидазу, в культуральной среде при 37°C. Клетки, полученные из ткани пуповины человека, культивировали в соответствии со способами, изложенными в примерах заявки '012. Мезенхимальные стволовые клетки и нормальные фибробласты дермы кожи (cc2509 партия № 9F0844) получили у компании Cambrex, г. Уолкерсвилл, штат Мэриленд, США. Клеточную линию плюрипотентных клеток тестикулярной эмбриональной карциномы (тератомы) человека nTera-2 (NTERA-2 cl.Dl) (См. Plaia et al., Stem Cells, 2006; 24(3): 531-546) приобрели в Американской коллекции клеточных культур (г. Манассас, штат Вирджиния, США) и культивировали в соответствии со способами, изложенными в патенте США № 7,510,873.
Выделение всей РНК
[0208] РНК экстрагировали из клеток, пользуясь набором RNeasy® (Qiagen, г. Валенсия, штат Калифорния, США). РНК элюировали 50 мкл обработанной DEPC воды и хранили при температуре -80 °C. Обратную транскрипцию РНК проводили с применением случайных гексамеров, применяя реагенты для обратной транскрипции TaqMan® (Applied Biosystems, г. Фостер-Сити, штат Калифорния, США) при температуре 25°C в течение 10 минут, при 37°C в течение 60 минут, и при 95°C в течение 10 минут. Пробы хранили при -20°C.
ПЦР в реальном времени
[0209] ПЦР проводили на пробах кДНК с использованием продуктов для экспрессии генов Assays-on-Demand™ компании Applied Biosystems (также известные как наборы для определения экспрессии генов TaqMan®) в соответствии с инструкциями производителя (Applied Biosystems). Этот доступный в продаже набор широко применяют для анализа теломеразы в человеческих клетках. Вкратце, hTert (ген теломеразы человека) (Hs00162669) и GAPDH человека (внутренний контроль) смешивали с кДНК и универсальным мастер-миксом для ПЦР TaqMan®, при этом применяли секвенатор 7000 с программным обеспечением ABI Prism 7000 SDS (Applied Biosystems). Условия термоциклирования были исходно 50°C в течение 2 минут и 95°C в течение 10 минут с последующими 40 циклами при 95°C в течение 15 секунд и 60°C в течение 1 минуты. Данные ПЦР анализировали в соответствии с рекомендациями производителя.
[0210] Клетки, полученные из ткани пуповины человека (номер доступа ATCC PTA-6067), фибробласты и мезенхимальные стволовые клетки анализировали на hTert и 18S РНК. Как показано в таблице 10-1, hTert и, следовательно, теломеразу не обнаружили в клетках, полученных из ткани пуповины человека.
[0211] Aнализировали клетки, полученные из ткани пуповины человека (изолят 022803, номер доступа ATCC PTA-6067), и клетки nTera-2, и результаты показали отсутствие экспрессии теломеразы в двух партиях клеток, полученных из ткани пуповины человека, тогда как клеточная линия тератомы экспрессировала теломеразу на высоком уровне (таблица 10-2).
[0212] Следовательно, можно сделать вывод о том, что клетки настоящего изобретения, полученные из ткани пуповины человека, не экспрессируют теломеразу.
[0213] Тогда как изобретение было описано и иллюстрировано со ссылкой на различные конкретные материалы, процедуры и примеры, следует понимать, что изобретение не ограничено конкретными сочетаниями материала и процедур, выбранных для этой цели. Многочисленные изменения, касающиеся таких деталей изобретения, будут очевидными для специалистов в данной области. Подразумевается, что все описания и примеры представлены только в качестве иллюстрации и находятся в пределах сущности и объема настоящего изобретения, что отражено в нижеприведенной формуле изобретения. Все ссылки, патенты и заявки на патенты, приведенные в этой заявке, полностью включены в этот документ путем ссылки.
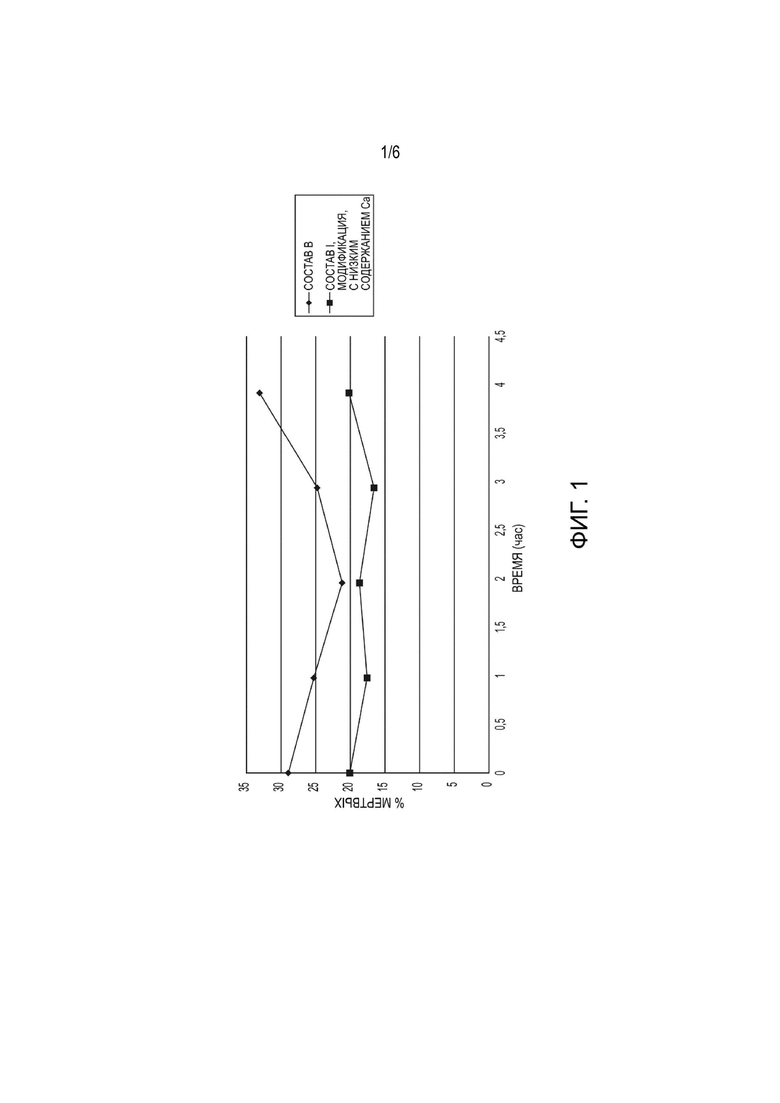




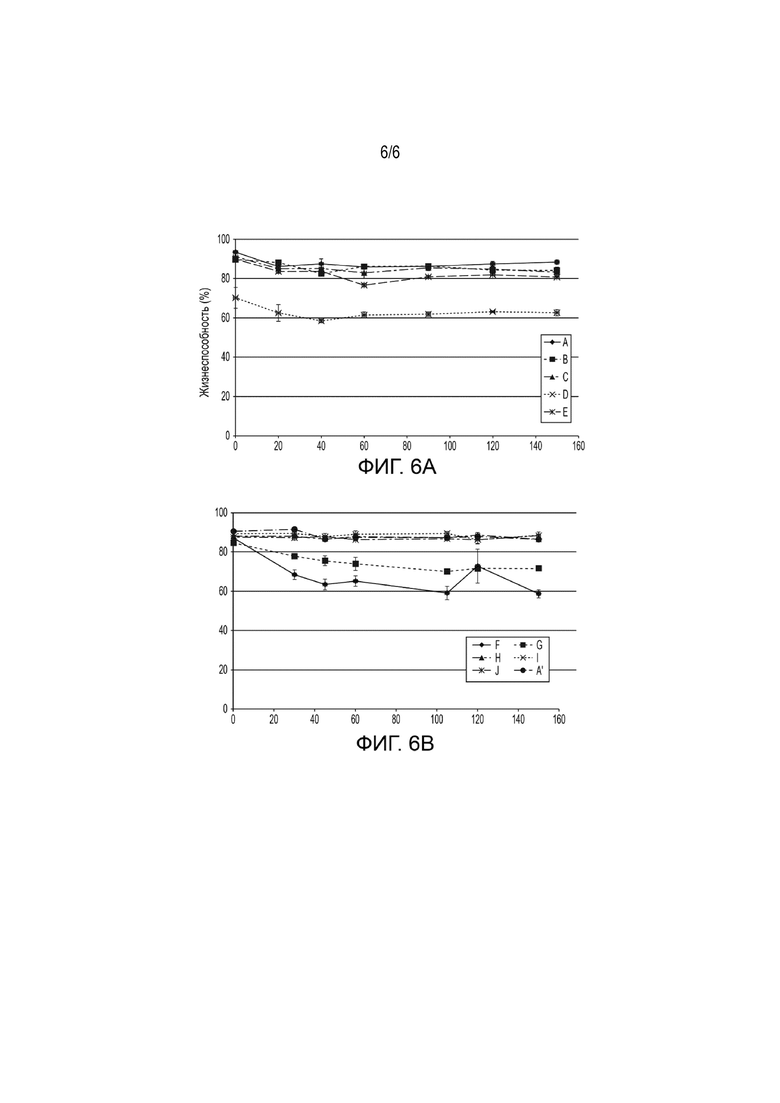
Группа изобретений относится к биотехнологии и медицине. Предложены композиция для криконсервирования клеток, полученных из ткани пуповины человека, содержащая аминокислоты, неорганические соли, ДМСО, лактобионовую кислоту, глутадион, декстрозу, сахарозу и маннит (варианты); набор, содержащий указанную композицию; способ криоконсервации клеток, включающий охлаждение указанной композиции и клеток, полученных из ткани пуповины человека, со скоростью -1,0°C/мин до достижения температуры около -45,0°C и дальнейшим охлаждением до достижения температуры хранения около -120,0°C (варианты). Изобретения обеспечивают выживаемость клеток при криоконсервации и сохранение целостности препарата при размораживании. 5 н. и 9 з.п. ф-лы, 32 табл, 10 пр., 7 ил.
1. Композиция для криоконсервации клеток, полученных из ткани пуповины, причем указанная композиция содержит:
аминокислоты: L-аргинин, L-глутамин, глицин, L-изолейцин, L-лейцин, L-лизина HCl, L-метионин, L-фенилаланин, L-серин, L-треонин, L-триптофан и L-валин;
витамины: D-пантотенат кальция, хлорид холина, фолиевую кислоту, ниацинамид, пиридоксина HCl, рибофлавин и тиамина HCl;
неорганические соли: хлорид калия по Фарм. США, бикарбонат натрия по Фарм. США, хлорид натрия по Фарм. США и одноосновный фосфат натрия, H2O;
неорганические соли: хлорида кальция дигидрат (CaCl2*2H2O), хлорид магния (MgCl2*6H2O), бикарбонат калия (KHCO3) и монофосфат калия (KH2PO4); и
ДМСО, лактобионовую кислоту, глутатион, декстрозу, сахарозу и маннит.
2. Композиция по п. 1, содержащая:
по меньшей мере около 37,8 мг/л L-аргинина, по меньшей мере около 262,8 мг/л L-глутамина, по меньшей мере около 13,5 мг/л L-глицина, по меньшей мере около 47,16 мг/л L-изолейцина, по меньшей мере около 47,16 мг/л L-лейцина, по меньшей мере около 65,79 мг/л L-лизина HCl, по меньшей мере около 13,5 мг/л L-метионина, по меньшей мере около 29,7 мг/л L-фенилаланина, по меньшей мере около 18,9 мг/л L-серина, по меньшей мере около 42,75 5 мг/л L-треонина, по меньшей мере около 7,2 мг/л L-триптофана и 41,85 мг/л L-валина;
по меньшей мере около 0,18 мг/л рибофлавина и по меньшей мере около 1,8 мг/л каждого из витаминов: D-пантотената кальция, хлорида холина, фолиевой кислоты, ниацинамида, пиридоксина HCl и тиамина;
по меньшей мере около 432 мг/л хлорида калия по Фарм. США, около 2565 мг/л бикарбоната натрия по Фарм. США, около 2880 хлорида натрия по Фарм. США, около 56,25 мг/л одноосновного фосфата натрия, H2O, около 3,2 мкг/л хлорида кальция дигидрата (CaCl2*2H2O), около 458 мг/л хлорида магния (MgCl2*6H2O), около 225 мг/л бикарбоната калия (KHCO3) и около 612 мг/л монофосфата калия (KH2PO4); и
от около 5 до около 10 об.% ДМСО, по меньшей мере около 855 мг/л декстрозы, по меньшей мере около 415 мг/л глутатиона; по меньшей мере около 3081 мг/л сахарозы; и по меньшей мере около 1639 мг/л маннита.
3. Композиция для криоконсервации клеток, полученных из ткани пуповины, причем указанная композиция содержит:
аминокислоты: L-аргинин, L-глутамин, глицин, L-изолейцин, L-лейцин, L-лизина HCl, L-метионин, L-фенилаланин, L-серин, L-треонин, L-триптофан и L-валин;
витамины: D-пантотенат кальция, хлорид холина, фолиевую кислоту, ниацинамид, пиридоксина HCl, рибофлавин и тиамина HCl;
неорганические соли: хлорид калия по Фарм. США, бикарбонат натрия по Фарм. США, хлорид натрия по Фарм. США и одноосновный фосфат натрия, H2O;
неорганические соли: хлорида кальция дигидрат (CaCl2*2H2O), хлорид магния (MgCl2*6H2O), бикарбонат калия (KHCO3) и монофосфат калия (KH2PO4); и
от около 5 до около 10 об.% ДМСО, от около 12 000 до около 20 000 мг/л лактобионовой кислоты, от около 329 до около 495 мг/л глутатиона, декстрозу, от около 2460 до около 3695 мг/л сахарозы и от около 1310 до около 1967 мг/л маннита.
4. Композиция по любому из пп. 1-3, в которой клетки, полученные из ткани пуповины, выделены из ткани пуповины человека по существу свободными от крови, способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, не продуцируют CD117 или CD45 и не экспрессируют hTERT или теломеразу.
5. Композиция по п. 4, в которой клетки, полученные из ткани пуповины, дополнительно содержат одну или более из следующих характеристик:
экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокина и/или хемотаксический белок гранулоцитов;
не экспрессируют CD31 или CD34;
экспрессируют повышенные по отношению к фибробластам человека, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека уровни интерлейкина-8 или ретикулона-1; и
экспрессируют CD10, CD13, CD44, CD73 и CD90.
6. Набор, содержащий композицию по любому из пп. 1-3 и клетки, полученные из ткани пуповины, причем клетки, полученные из ткани пуповины, выделены из ткани пуповины человека по существу свободными от крови, способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, не продуцируют CD117 или CD45 и не экспрессируют hTERT или теломеразу.
7. Набор по п. 6, в котором клетки, полученные из ткани пуповины, дополнительно содержат одну или более из следующих характеристик:
экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокина и/или хемотаксический белок гранулоцитов;
не экспрессируют CD31 или CD34;
экспрессируют повышенные по отношению к фибробластам человека, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека уровни интерлейкина-8 или ретикулона-1; и
экспрессируют CD10, CD13, CD44, CD73 и CD90.
8. Способ криоконсервации клеток, полученных из ткани пуповины человека, включающий:
обеспечение состава, содержащего композицию для криоконсервации по п. 1 или 2 и клетки, полученные из ткани пуповины;
охлаждение композиции для криоконсервации от исходной температуры около 4°C со скоростью -1,0°C/мин до достижения композицией температуры около -45,0°C; и
дополнительное охлаждение композиции для криоконсервации до тех пор, пока композиция не достигнет температуры хранения около -120,0°C;
причем клетки, полученные из ткани пуповины, выделены из ткани пуповины человека по существу свободными от крови, способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, не продуцируют CD117 или CD45 и не экспрессируют hTERT или теломеразу.
9. Способ по п. 8, который дополнительно включает охлаждение композиции для криоконсервации до исходной температуры около 4°C и/или поддержание исходной температуры около 4°C в течение около 15 минут.
10. Способ по п. 8, в котором клетки, полученные из ткани пуповины, дополнительно содержат одну или более из следующих характеристик:
экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокина и/или хемотаксический белок гранулоцитов;
не экспрессируют CD31 или CD34;
экспрессируют повышенные по отношению к фибробластам человека, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека уровни интерлейкина-8 или ретикулона-1; и
экспрессируют CD10, CD13, CD44, CD73 и CD90.
11. Способ криоконсервации клеток, полученных из ткани пуповины человека, включающий
обеспечение состава, содержащего композицию для криоконсервации по п. 3 и клетки, полученные из ткани пуповины;
охлаждение композиции для криоконсервации от исходной температуры около 4°C со скоростью -1,0°C/мин до достижения композицией температуры около -45,0°C; и
дополнительное охлаждение композиции для криоконсервации до тех пор, пока композиция не достигнет температуры хранения около -120,0°C;
причем клетки, полученные из ткани пуповины, выделены из ткани пуповины человека по существу свободными от крови, способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцировке, не продуцируют CD117 или CD45 и не экспрессируют hTERT или теломеразу.
12. Способ по п. 11, который дополнительно включает охлаждение композиции для криоконсервации до исходной температуры около 4°C и/или поддержание исходной температуры около 4°C в течение около 15 минут.
13. Способ по п. 11, в котором композиция обеспечивает экзотермическую реакцию вокруг точки замерзания состава около -45,0°C, и причем способ дополнительно включает охлаждение композиции для криоконсервации при температуре около -45,0°C со скоростью -25,0°C/мин до тех пор, пока состав не достигнет температуры около -50,0°C.
14. Способ по любому из пп. 11-13, в котором клетки, полученные из ткани пуповины, дополнительно включают одну или более из следующих характеристик:
экспрессируют рецептор-1 окисленных липопротеинов низкой плотности, ретикулон, лиганд-3 рецептора хемокина и/или хемотаксический белок гранулоцитов;
не экспрессируют CD31 или CD34;
экспрессируют повышенные по отношению к фибробластам человека, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека уровни интерлейкина-8 или ретикулона-1; и
экспрессируют CD10, CD13, CD44, CD73 и CD90.
| US 2011014701 A1, 20.01.2011 | |||
| US 2014170748 A1, 19.06.2014 | |||
| EMEKLI-ALTURFAN E., et al | |||
| "Effect of Sample Storage on Stability of Salivary Glutathione, Lipid Peroxidation Levels, and Tissue Factor Activity", Journal of Clinical Laboratory Analysis | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| ZAMBELLI A., et al | |||
| "Clinical toxicity of cryopreserved circulating | |||
Авторы
Даты
2021-05-19—Публикация
2017-01-06—Подача