Перекрестные ссылки на родственные заявки
[0001] Данная заявка истребует приоритет, предоставляемый в связи с подачей Предварительной заявки на патент США № 62/352,968 (поданной 21 июня 2016 года), которая в полном объеме включена в настоящий документ посредством ссылки.
Область техники
[0002] Настоящее изобретение относится к способам продуцирования функциональных панкреатических бета-клеток in vitro и популяциям, получаемым в результате дифференцировки плюрипотентных стволовых клеток. В частности, изобретение относится к бета-клеткам или популяции бета-клеток, которые демонстрируют реакцию в виде митохондриального дыхания/активности и реакцию в виде двухфазной секреции инсулина.
Предпосылки создания изобретения
[0003] Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета 1-го типа и нехватка островков Лангерганса, выполненных с возможностью трансплантации, заставили обратить внимание на разработку источников инсулин-продуцирующих клеток, или бета (β)-клеток, подходящих для приживления трансплантата. Один подход представляет собой генерацию функциональных бета-клеток из плюрипотентных стволовых клеток, таких как эмбриональные стволовые клетки или индуцированные плюрипотентные клетки.
[0004] При эмбриональном развитии позвоночных плюрипотентная клетка дает начало группе клеток, содержащих три зародышевых листка (эктодерму, мезодерму и энтодерму), в ходе процесса, известного как гаструляция. Ткани, такие как ткань щитовидной железы, вилочковой железы, поджелудочной железы, кишечника и печени, будут развиваться из энтодермы посредством промежуточной стадии.
[0005] D'Amour et al. описали производство обогащенных культур дефинитивной энтодермы, полученной из человеческих эмбриональных стволовых клеток, при наличии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005, 23:1534-1541; патент США № 7,704,738). Трансплантация этих клеток под капсулу почки у мышей приводила к дифференцировке в более зрелые клетки с характеристиками ткани энтодермы (патент США № 7,704,738). Дефинитивные энтодермальные клетки, полученные из человеческих эмбриональных стволовых клеток, можно дополнительно дифференцировать в PDX1-положительные клетки после добавления FGF-10 и ретиноевой кислоты (заявка на патент США № 2005/0266554). Последующая трансплантация этих клеток-предшественников панкреатических клеток в жировое тело иммунодефицитных мышей привела к образованию функционализированных панкреатических эндокринных клеток с последующей 3-4-месячной стадией созревания (патенты США № 7,534,608 и № 7,993,920).
[0006] Для индуцирования панкреатических эндокринных клеток-предшественников используют низкомолекулярные ингибиторы. Например, низкомолекулярные ингибиторы рецептора TGF-β и рецепторов BMP (Development 2011, 138:861-871; Diabetes 2011, 60:239-247) применяют для увеличения числа панкреатических эндокринных клеток. Кроме того, для генерации дефинитивных энтодермальных клеток или клеток-предшественников панкреатических энтодермальных клеток также применяют низкомолекулярные активаторы (Curr. Opin. Cell Biol. 2009, 21:727-732; Nature Chem. Biol. 2009, 5:258-265).
[0007] В целом процесс дифференцировки клеток-предшественников в функциональные β-клетки развивается через различные стадии, и были улучшены протоколы генерации панкреатических клеток из клеток-предшественников, таких как человеческие плюрипотентные стволовые клетки. Несмотря на эти продвижения в исследованиях, каждая стадия в процессе дифференцировки клеток-предшественников является уникальной задачей. Таким образом, сохраняется необходимость в дополнительной разработке протокола дифференцировки с целью продуцирования функциональных панкреатических эндокринных клеток и, в частности, функциональных бета-клеток. В частности, желательно обеспечивать способ генерации in vitro реагирующих на глюкозу инсулинпродуцирующих клеток, выполненных с возможностью быстрой и регулируемой стимулируемой глюкозой секреции (GSIS), наблюдаемой в функциональных бета-клетках. А именно, желательно обеспечивать способ получения in vitro функциональных бета-клеток, показывающих увеличение митохондриального дыхания/активности с последующей первой фазой и второй фазой секреции инсулина.
[0008] GSIS начинается с импорта глюкозы в бета-клетку посредством глюкозного транспортера (член 1 семейства 2 носителей растворенных веществ; SLC2A1; часто называемый глюкозным транспортером 1; GLUT1 для человеческих бета-клеток) и метаболизма глюкозы до пирувата посредством процесса, называемого гликолизом. Импорт пирувата в митохондрии, его метаболизм посредством TCA (трикарбоновая кислота) и последующей активации цепи переноса электронов (ETC, называемая в настоящем документе «митохондриальной активностью» или «митохондриальным дыханием») тесно связаны с экзоцитозом инсулина для обеспечения быстрого высвобождения инсулина в нужном количестве.
[0009] Показано, что функциональные бета-клетки внутри островка при внезапном увеличении концентрации глюкозы секретируют инсулин в две последовательные фазы (Henquin et al. Diabetologia (2009) 52(5):739-751). Амплитуду и продолжительность обеих фаз регулируют кинетикой внутриклеточного Ca2+ сигнала или дополнительной секрецией факторов сопряжения. Первая фаза (1-я) секреции инсулина представляет собой экзоцитоз небольшого пула связанных и легко высвобождаемых гранул инсулина. Вторая фаза (2-я) секреции инсулина, меньшей амплитуды, но большей продолжительности, представляет собой перемещение гранул из резервного пула гранул и их фиксацию/подготовку для высвобождения. Двухфазную GSIS, представляющую собой ключевой маркер созревания бета-клеток, не обнаруживают до постнатальной фазы развития человека и отличают от монофазной GSIS, наблюдаемой в незрелых бета-клетках (Otonkoski et al. Diabetes (1988) 37:286-291).
[0010] При диабете 2-го типа 1-я фаза GSIS отсутствует; а 2-я фаза GSIS также снижена. Сообщается, что при диабете 1-го типа, при котором число бета-клеток значительно снижают посредством аутоиммунной атаки, отсутствует устойчивая двухфазная GSIS (Krogvold et al. Diabetes (2015) 64: 2506-2512).
Краткое изложение сущности изобретения
[0011] Как указано и полностью описано, в настоящем изобретении предложены способы продуцирования in vitro функциональных бета-клеток (функциональных панкреатических бета-клеток) и популяций клеток, полученных в результате дифференцировки плюрипотентных стволовых клеток. В частности, изобретение относится к генерации функциональных панкреатических бета-клеток (инсулинпродуцирующих клеток) или популяции функциональных бета-клеток, которые демонстрируют реакцию в виде митохондриального дыхания/активности и реакцию в виде двухфазной секреции инсулина.
[0012] Один аспект настоящего изобретения представляет собой способ дифференцировки плюрипотентных стволовых клеток в функциональные бета-клетки. Конкретный аспект настоящего изобретения представляет собой способ дифференцировки панкреатических энтодермальных клеток в функциональные бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A1. В вариантах осуществления способ включает культивирование панкреатических эндокринных клеток в культуральной среде в которую добавили одну или более малых молекул из UNC0638, UNC0642, UCN0646, TC-E5003, A366, PF03814735, ZM447439, SB747651A, PFI1, LY303511, MS436, AZT, DEZA, пироксамида, CI9994 или MC1568.
[0013] Один вариант осуществления настоящего изобретения представляет собой полученную in vitro популяцию функциональных панкреатических бета-клеток, экспрессирующих одногормональный инсулин, PDX1, NKX6.1 и MAFA и полученных путем дифференцировки панкреатических эндокринных клеток in vitro. В некоторых вариантах осуществления популяция функциональных бета-клеток также совместно экспрессирует UCN3 и SLC2A1. В вариантах осуществления увеличивают экспрессию MAFA по сравнению с незрелыми бета-клетками. В вариантах осуществления популяцию функциональных бета-клеток in vitro получают путем культивирования панкреатических эндокринных клеток в среде, в которую добавили одну или более малых молекул из UNC0638, UNC0642, UCN0646, TC-E5003, A366, PF03814735, ZM447439, SB747651A, PFI1, LY303511, MS436, AZT, DEZA, пироксамида, CI9994 или MC1568.
[0014] Дополнительный вариант осуществления изобретения представляет собой способ дифференцировки плюрипотентных стволовых клеток в функциональные бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A, включающий стадии дифференцировки плюрипотентных стволовых клеток в панкреатические эндокринные клетки; и дифференцировки панкреатических эндокринных клеток в функциональные бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A1. В вариантах осуществления увеличивают экспрессию MAFA по сравнению с незрелыми бета-клетками. В вариантах осуществления способ включает культивирование панкреатических эндокринных клеток в культуральной среде в которую добавили одну или более малых молекул из UNC0638, UNC0642, UCN0646, TC-E5003, A366, PF03814735, ZM447439, SB747651A, PFI1, LY303511, MS436, AZT, DEZA, пироксамида, CI9994 или MC1568.
[0015] В каждом из вариантов осуществления, описанных выше, в культуральную среду дополнительно добавляют одно или более из ZM447439, гепарина, N-ацетилцистеина и состава I. В указанных выше вариантах осуществления в культуральную среду дополнительно добавляют один или более из T3, T4 и их аналога. В указанных выше вариантах осуществления в культуральную среду добавляют ингибитор ALK5. В некоторых указанных выше вариантах осуществления культуральная среда не содержит ингибитора ALK5. В указанных выше вариантах осуществления изобретения в культуральную среду добавляют AZT или DEZA. В некоторых указанных выше вариантах осуществления в культуральную среду добавляют AZT и DEZA.
[0016] В вариантах осуществления изобретения, описанных выше, в среду дополнительно добавляют ингибитор гамма-секретазы. В некоторых из указанных выше вариантов осуществления в культуральную среду добавляют T3. В некоторых из вариантов осуществления T3 относится к диапазону от 1 нМ до 1 мкМ. В конкретных вариантах осуществления T3 относится к диапазону от 1 нМ до 100 нМ.
[0017] Дополнительно в вариантах осуществления изобретения, описанных выше, функциональные бета-клетки получают посредством поэтапной дифференцировки одной или более из клеток, выбранных из группы: клетки, экспрессирующие маркеры, характерные для дефинитивной энтодермы; клетки, экспрессирующие маркеры, характерные для клеток первичной кишечной трубки; клетки, экспрессирующие маркеры, характерные для энтодермальных клеток передней кишки; клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных клеток; панкреатические эндокринные клетки-предшественники; и клетки, экспрессирующие маркеры, характерные для незрелых бета-клеток (панкреатических эндокринных клеток).
[0018] В каждом из вариантов осуществления, описанных выше, способ включает культивирование клеток на поверхности раздела воздух-жидкость. В некоторых вариантах осуществления, описанных выше, способ включает культивирование клеток в суспензии, например скоплений клеток в суспензии.
[0019] В указанных выше вариантах осуществления дифференцированная функциональная бета-клетка экспрессирует MAFA на более высоком уровне, чем незрелая бета-клетка. В вариантах осуществления дифференцированная функциональная бета-клетка экспрессирует UCN3 на более высоком уровне, чем незрелая бета-клетка. В некоторых указанных выше вариантах осуществления повышают экспрессию MAFA и UCN3 по сравнению с экспрессией в незрелой бета-клетке.
[0020] В указанных выше вариантах осуществления изобретения популяция функциональных бета-клеток показывает стимулированную глюкозой секрецию инсулина и глюкозозависимое митохондриальное дыхание. В описанных выше вариантах осуществления стимулированная глюкозой секреция инсулина и глюкозозависимое митохондриальное дыхание аналогичны подобным в человеческих островковых клетках. В вариантах осуществления изобретения, описанных выше, функциональные бета-клетки секретируют инсулин во множестве фаз.
[0021] В вариантах осуществления, глюкозозависимое митохондриальное дыхание имеет максимальную реакцию в виде увеличения скорости потребления кислорода после стимуляции глюкозой в диапазоне от около 20% до около 80% сверх исходной скорости потребления кислорода (OCR). В вариантах осуществления реакция в виде увеличения скорости потребления кислорода происходила через по меньшей мере 15 минут после стимуляции глюкозой.
[0022] В указанных выше вариантах осуществления стимулированная глюкозой секреция инсулина представляет собой быструю двухфазную секрецию инсулина в ответ на стимуляцию глюкозой. В вариантах осуществления в первой фазе двухфазной секреции инсулина наблюдается увеличение секреции от по меньшей мере четырех раз до по меньшей мере восьми раз по сравнению с секрецией на исходном уровне, а во второй фазе двухфазной секреции инсулина наблюдается увеличение секреции от по меньшей мере двух до по меньшей мере четырех раз по сравнению с секрецией на исходном уровне. В вариантах осуществления секреция инсулина происходит в интервале от по меньшей мере пяти минут до по меньшей мере десяти минут после стимуляции глюкозой.
[0023] В некоторых вариантах осуществления способ дифференцировки плюрипотентных стволовых клеток включает стадии: дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для дефинитивной энтодермы («клетки стадии 1»); дифференцировки клеток стадии 1 в клетки, экспрессирующие маркеры, характерные для клеток первичной кишечной трубки («клетки стадии 2»); дифференцировки клеток стадии 2 в клетки, экспрессирующие маркеры, характерные для энтодермальных клеток передней кишки («клетки стадии 3»); дифференцировки клеток стадии 3 в клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных клеток («клетки стадии 4»); дифференцировки клеток стадии 4 в панкреатические энтодермальные/эндокринные клетки-предшественники (клетки, экспрессирующие маркеры, характерные для одной или более из панкреатических энтодермальных клеток и панкреатических эндокринных клеток-предшественников; «стадия 5»); дифференцировки клеток стадии 5 в незрелые бета-клетки (панкреатические эндокринные клетки; «стадия 6»); и дифференцировки клеток стадии 6 в функциональные бета-клетки (панкреатические эндокринные клетки; «стадия 7»).
[0024] В вариантах осуществления способ дифференцировки включает дифференцировку плюрипотентных стволовых клеток в клетки стадии 1 путем культивирования плюрипотентных стволовых клеток в среде, в которую добавили соединение MCX и GDF-8.
[0025] В вариантах осуществления способ включает дифференцировку клеток стадии 1 в клетки стадии 2 путем культивирования клеток стадии 1 в среде, в которую добавили FGF7 и аскорбиновую кислоту.
[0026] В вариантах осуществления способ включает дифференцировку клеток стадии 2 в клетки стадии 3 путем культивирования клеток стадии 2 в среде, в которую добавили FGF7, ретиноевую кислоту, SANT-1, активатор PKC, ингибитор BMP и аскорбиновую кислоту.
[0027] В вариантах осуществления способ включает дифференцировку клеток стадии 3 в клетки стадии 4 путем культивирования клеток стадии 3 в среде, в которую добавили FGF7, ретиноевую кислоту, SANT-1, активатор PKC, ингибитор BMP и аскорбиновую кислоту.
[0028] В вариантах осуществления способ включает дифференцировку клеток стадии 4 в клетки стадии 5 путем культивирования клеток стадии 4 в среде, в которую добавили SANT-1, активатор PKC, ингибитор BMP, аскорбиновую кислоту. В вариантах осуществления в среду дополнительно добавляют один или более из T3, T4 или их аналога. В некоторых вариантах осуществления в среду дополнительно добавляют ингибитор ALK5.
[0029] В вариантах осуществления способ включает культивирование клеток стадии 5 в панкреатические эндокринные клетки путем культивирования клеток стадии 5 в среде, в которую добавляют ингибитор BMP, аскорбиновую кислоту, один или более из T3, T4 или их аналога. В вариантах осуществления в среду добавляют T3. В некоторых вариантах осуществления T3 относится к диапазону от 1 нМ до 1 мкМ. В определенных вариантах осуществления T3 относится к диапазону от 1нМ до 100нМ. В некоторых вариантах осуществления в среду дополнительно добавляют ингибитор ALK 5. В других вариантах осуществления в культуральную среду не добавляют ингибитор ALK5. В некоторых вариантах осуществления в среду дополнительно добавляют ингибитор гамма-секретазы. В определенных вариантах осуществления в среду добавляют одно или более из ZM447439, гепарина, N-ацетилцистеина и состава I. В вариантах осуществления в культуральную среду добавляют AZT или DEZA. В некоторых вариантах осуществления в культуральную среду добавляют AZT и DEZA. В вариантах осуществления способ включает культивирование клеток на поверхности раздела воздух-жидкость. В некоторых вариантах осуществления способ включает культивирование клеток в суспензии, например скоплений клеток в суспензии.
[0030] В каждом из вариантов осуществления способа дифференцировки, описанных выше, панкреатические энтодермальные клетки («клетки стадии 4») можно подвергать криоконсервации. В некоторых вариантах осуществления способ дифференцировки панкреатических энтодермальных клеток в панкреатические эндокринные клетки-предшественники включает культивирование криоконсервированных клеток.
[0031] В каждом из описанных выше вариантов осуществления плюрипотентные стволовые клетки могут представлять собой человеческие плюрипотентные стволовые клетки, такие как человеческие эмбриональные стволовые клетки. В одном варианте осуществления плюрипотентные стволовые клетки могут представлять собой человеческие клетки H1 или H9.
[0032] Другой вариант осуществления изобретения представляет собой способ дифференцировки плюрипотентных стволовых клеток в функциональные бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A, включающий: (a) дифференцировку плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для дефинитивной энтодермы, и полученные путем культивирования плюрипотентных стволовых клеток в среде, в которую добавили активин А и WNT3A; (b) дифференцировку клеток, экспрессирующих маркеры, характерные для дефинитивной энтодермы, в незрелые бета-клетки; и (c) дифференцировку незрелых бета-клеток в функциональные бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A1, путем культивирования незрелых бета-клеток в среде, в которую добавили одно или более из UNC0638, UNC0642, UCN0646, TC-E5003, A366, PF03814735, ZM447439, SB747651A, PFI1, LY303511, MS436, AZT, DEZA, пироксамида, CI9994 или MC1568. Плюрипотентные стволовые клетки, использованные в данном способе, могут представлять собой человеческие плюрипотентные стволовые клетки, такие как человеческие эмбриональные стволовые клетки. В одном варианте осуществления плюрипотентные стволовые клетки представляют собой человеческие клетки CyT49.
[0033] Данные функциональные бета-клетки могут иметь глюкозозависимое митохондриальное дыхание или стимулируемую глюкозой секрецию инсулина этих функциональных бета-клеток как в человеческих островковых клетках. Функциональные бета-клетки могут также секретировать инсулин во множестве фаз.
[0034] В определенных вариантах осуществления этого способа культуральная среда не содержит ингибитора ALK5. В некоторых вариантах осуществления в культуральную среду дополнительно добавляют гепарин, N-ацетилцистеин, состав I и один или более из T3, T4 или их аналога. В других вариантах осуществления в культуральную среду добавляют T3. В альтернативных вариантах осуществления в среду добавляют ZM447439, гепарин, N-ацетилцистеин и один или более из T3, T4 или их аналога, и она не содержит ингибитора ALK5. В среду можно добавлять T3, AZT или DEZA.
[0035] Способ может включать культивирование незрелых бета-клеток на поверхности раздела воздух-жидкость, в скоплениях в суспензии, в роллерных флаконах или на микроносителях. В одном варианте осуществления способ включает в себя культивирование незрелых бета-клеток в роллерных флаконах. В другом варианте осуществления способ включает в себя культивирование незрелых бета-клеток в роллерных флаконах на микроносителях.
[0036] Дифференцировка плюрипотентных стволовых клеток в незрелые бета-клетки в способе может включать в себя: (a) дифференцировку плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для дефинитивной энтодермы («клетка стадии 1»), путем культивирования плюрипотентных стволовых клеток в среде, в которую добавили активин А и WNT3A; (b) дифференцировку клеток стадии 1 в клетки, экспрессирующие маркеры, характерные для клеток первичной кишечной трубки («клетки стадии 2»); (c) дифференцировку клеток стадии 2 в клетки, экспрессирующие маркеры, характерные для энтодермальных клеток передней кишки («клетки стадии 3»); (d) дифференцировку клеток стадии 3 в клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных клеток («клетки стадии 4»); (e) дифференцировку клеток стадии 4 в панкреатические эндокринные клетки-предшественники («стадия 5»); и (f) дифференцировку клеток стадии 5 в незрелые бета-клетки. В определенных вариантах осуществления стадии e. и f. включают в себя культивирование на поверхности раздела воздух-жидкость, в скоплениях в суспензии, в роллерных флаконах или на микроносителях. В других вариантах осуществления стадии e. и f. включают в себя культивирование клеток в роллерных флаконах. В еще одних вариантах осуществления стадии e. и f. включают в себя культивирование незрелых бета-клеток в роллерных флаконах на микроносителях.
[0037] В определенных вариантах осуществления способ включает дифференцировку клеток стадии 1 в клетки стадии 2 путем культивирования клеток стадии 1 в среде, в которую добавили FGF7 и аскорбиновую кислоту. В других вариантах осуществления способ также включает дифференцировку клеток стадии 2 в клетки стадии 3 путем культивирования клеток стадии 2 в среде, в которую добавили FGF7, ретиноевую кислоту, SANT-1, активатор PKC и аскорбиновую кислоту. В определенных вариантах осуществления в среде отсутствует ингибитор BMP. В еще одном варианте осуществления способ включает дифференцировку клеток стадии 3 в клетки стадии 4 путем культивирования клеток стадии 3 в среде, в которую добавили FGF7, ретиноевую кислоту, SANT-1, активатор PKC и аскорбиновую кислоту. Кроме того, в определенных вариантах осуществления в среде отсутствует ингибитор BMP.
[0038] В другом варианте осуществления способ включает дифференцировку клеток стадии 4 в клетки стадии 5 путем культивирования клеток стадии 4 в среде, в которую добавили SANT-1, активатор PKC, ингибитор BMP и аскорбиновую кислоту. В среду можно дополнительно добавлять один или более из T3, T4 или их аналога.
[0039] В альтернативном варианте осуществления способ включает культивирование клеток стадии 5 в незрелые бета-клетки путем культивирования клеток стадии 5 в среде, в которую добавили ингибитор BMP, аскорбиновую кислоту, один или более из T3, T4 или их аналога. В среду можно дополнительно добавлять ингибитор ALK 5 или ингибитор гамма-секретазы. Способ может также включать дифференцировку незрелых бета-клеток в функциональные бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A, путем культивирования незрелых бета-клеток в среде, не содержащей ингибитор ALK5 и в которую добавили ZM447439, AZT, N-ацетилцистеин, DEZA, состав I и один или более из Т3, Т4 или их аналога.
[0040] В каждом из вариантов осуществления способа дифференцировки, описанных выше, культура может представлять собой суспензионную культуру или суспензионную культуру клеточных агрегатов. В определенных вариантах осуществления можно выполнять культивирование в роллерных флаконах, на микроносителях или на микроносителях в роллерных флаконах.
Краткое описание графических материалов
[0041] На ФИГ. 1A-1H показаны результаты скрининга малых молекул, которые усиливают экспрессию MAFA или UCN3 на стадии 7. На ФИГ. 1A-1D показано, что экспрессия MAFA на стадии 7 была значительно усилена по сравнению с S6D7 или необработанными или обработанными DMSO культурами на стадии 7 после лечения UNC0638 (селективный ингибитор метилтрансферазы лизинов гистонов G9a и GLP), UNC0646 (мощный и селективный ингибитор G9a/GLP), UNC0642 (мощный и селективный ингибитор метилтрансферазы лизинов гистонов G9a и GLP), TC-E5003 (селективный ингибитор метилтрансферазы аргининов PRMT1), A366 (мощный и селективный ингибитор метилтрансферазы лизинов гистонов G9a/GLP), PF03814735 (ингибитор киназы Aurora A и B), ZM447439 (ингибирует киназу Aurora B), дигидрохлорид SB747651A (мощный ингибитор MSK1; кроме того, ингибирует другие киназы группы AGC), PFI1 (ингибитор бромодомена BET), LY303511 (ингибитор BRD2, BRD3 и BRD4), MS436 (мощный и селективный ингибитор бромодомена BRD4) и MC1568 (селективно ингибирует HDAC класса II (IIa)). На ФИГ. 1E-1H показано, что экспрессия UCN3 на стадии 7 увеличена по сравнению с S6D7 или необработанными или обработанными DMSO культурами на стадии 7 после добавления 5-азацитидина (AZT) (ингибитор ДНК-метилтрансферазы), пироксамида (ингибитор гистондеацетилазы) и CI994 (ингибитор гистондеацетилазы). Все условия S7D7; Скопления на поверхности раздела воздух-жидкость (ALI).
[0042] На ФИГ. 2A и 2B показана надежность выбранных малых молекул в качестве активаторов MAFA или UCN3, так как их эффект сохраняли при различных протоколах подготовки стадии 7. Обнаружено, что 3-деазанепланоцин А (DEZA) является эффективным активатором MAFA, но не UCN3 (ФИГ. 2A). Подтверждено, что AZT является активатором UCN3, но не MAFA во время стадии 7 (ФИГ. 2B). Все условия S7D7; Скопления на ALI.
[0043] На ФИГ. 3A-3M показано увеличение генной экспрессии после семи дней улучшенной подготовки стадии 7 группы маркеров созревания в скоплениях клеток ALI до уровней, наблюдаемых в человеческих островках. Улучшения, использованные во время дифференцировки стадии 7, включают в себя: (i) удаление ингибитора II ALK5; (ii) снижение концентрации T3; (iii) добавление DEZA; (iv) добавление AZT; (v) добавление ZM; (vi) снижение концентрации глюкозы до 5,56 мМ; и (vii) добавление определенного коктейля витаминов, заменимых аминокислот, липидов, пирувата натрия и следовых элементов (состав I - таблица XII). На ФИГ. 3A показано, что INHBB был выше уровня экспрессии, наблюдаемого в человеческих островках, в условиях использования ингибитора II ALK5, и удаление ингибитора ALK5 в отсутствии или в присутствии AZT/DEZA уменьшало INHBB до уровней, наблюдаемых в человеческих островках. На ФИГ. 3B показано увеличение экспрессии INHA до уровней человеческих островков в скоплениях на ALI при удалении ингибитора II ALK5. Хотя экспрессию MAFA и SLC2A1, показанную на ФИГ. 3C и 3D соответственно, уменьшают при удалении ингибитора II ALK5, добавление AZT/DEZA восстанавливает экспрессию MAFA и SLC2A1 до уровней человеческих островков. Экспрессию UCN3 (ФИГ. 3E), G6PC2 (каталитическая субъединица 2 глюкозо-6-фосфатазы; ФИГ. 3F) и PDK1 (киназа 1 пируватдегидрогеназы; ФИГ. 3G) увеличивали до уровней, наблюдаемых в человеческих островках или превышающих их, при добавлении AZT/DEZA и удалении ингибитора II ALK5 в скоплениях на ALI. Экспрессию INS (инсулин; ФИГ. 3H), GJD2 (белок межклеточных щелевых контактов, дельта 2; также CX36/коннексин 36; ФИГ. 3I), SIX2 (гомеобокс SIX 2; ФИГ. 3J) и PDX1 (ФИГ. 3K) постепенно скачкообразно увеличивали сначала после удаления ингибитора II ALK5, а затем после добавления AZT/DEZA. Экспрессия NKX6.1 (ФИГ. 3L) и GLP1R (рецептор глюкагоноподобного пептида 1; ФИГ. 3M) существенно не изменялась при различных условиях, но их экспрессия в скоплениях на ALI постоянно находилась на уровнях, наблюдаемых в человеческих островках или превышающих их. Все условия S7D7; Скопления на ALI.
[0044] На ФИГ. 4A-4E показана генерация клеток C-ПЕПТИДА, в скоплениях клеток ALI, которые на основании присутствия белка совместно экспрессируют маркеры созревания: PDX1 (ФИГ. 4A), NKX6.1 (ФИГ. 4B), MAFA (ФИГ. 4C), SLC2A1 (ФИГ. 4D) и UCN3 (ФИГ. 4E) на S7D7. Типовое окрашивание человеческих островков показано в левой колонке. Условие без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR001 показано в средней колонке. Условие без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR004 показано в правой колонке. Все условия S7D7; Скопления на ALI.
[0045] На ФИГ. 5A-5F показана генерация клеток C-ПЕПТИДА в S7D7, которые показывают схожую с человеческими островками кинетику глюкозозависимого митохондриального дыхания на ALI, в особенности при специфичных для стадии 7 условиях «без ALK5, с низким T3, ZM, H, NAC, AZT, DEZA, FI, BLAR001». На ФИГ. 5A показано, что человеческие островки быстро реагировали на высокую концентрацию D-глюкозы, как видно на основании OCR, равной 123,3% ± 12,92 по сравнению с исходным уровнем через 15 минут после инъекции («п/и»), и сохраняли высокую OCR во времени (131,5% ± 11,32; 72 мин п/и). С другой стороны, в скоплениях на ALI S6D7, которые обогащали незрелыми С-ПЕПТИДположительными клетками, не было стремительной реакции OCR на высокую концентрацию D-глюкозы (104,4% ± 3,37; 15 мин п/и), и они показывают относительно слабую реакцию OCR во времени (113,3% ± 4,51; 72 мин п/и). На ФИГ. 5D показано, что внутри группы скопления на ALI S7D7 только при условии «без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR001» наблюдалась схожая с человеческими островками кинетика глюкозозависимого митохондриального дыхания (112,4% ± 3,25-15 мин п/и; 129,5% ± 3,78-72 мин п/и). Условия скопления на ALI S7D7, при которых кинетика глюкозозависимого митохондриального дыхания выполнена с возможностью неотличимости от незрелых скоплений на ALI S6D7: «ALK5, T3, ZM, H, NAC, FI, BLAR001» (100,3% ± 4,04-15 мин п/и; 107,8% ± 6,51 -72 мин п/и) (ФИГ. 5B); «без ALK5, с низким T3, ZM, H, NAC, FI, BLAR001» (96,9% ± 3,06-15 мин п/и; 109,0% ± 4,58-72 мин п/и) (ФИГ. 5C); «без ALK5, с низким T3, ZM, H, NAC, FI, BLAR004» (103,4% ± 4,76-15 мин п/и; 113,6% ± 6,72-72 мин п/и) (ФИГ. 5E); и «без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR004» (102,1% ± 4,04-15 мин п/и; 112,7% ± 3,38-72 мин п/и) (ФИГ. 5F).
[0046] На ФИГ. 6A-6L показаны скопления клеток Aggrewell™, дифференцированные в суспензионной культуре до незрелых панкреатических бета-клеток. На ФИГ. 6A показана процедура, с помощью которой (i) свежий монослой S4D3 или криоконсервированные клетки S4D3 собирали (ii) посредством способа Aggrewell™ в (iii) скопления клеток. На ФИГ. 6B показано, что в скоплениях S4D5 Aggrewell™ обнаружили высокое содержание белка факторов транскрипции (ТФ) панкреатической энтодермы PDX1 (сверху слева) и NKX6.1 (сверху посередине), но низкое содержание белка ТФ эндокринной ткани NEUROD1 (сверху справа); колебание размещающих линию дифференцировки непанкреатической энтодермы ТФ SOX2 (снизу посередине) и CDX2 (снизу справа). На ФИГ. 6C цитометрия посредством сортировки клеток с активацией флуоресценции (FACS) показала, что 99,3±0,1% клеток были PDX1+ (слева), 84,4±0,1% - NKX6.1+ (посередине), но 2,2±0,4% - NKX6.1+ NEUROD1+ (справа) или 1,35±0,55% - NKX6.1+ CHGA+ (посередине) (скопления Aggrewell™ S4DS). На ФИГ. 6D показано сохранение устойчивых характеристик панкреатической энтодермы в скоплениях Aggrewell™ S4D4, полученных из криоконсервированных клеток S4D3, за счет сохранения высокой генной экспрессии PDX1 (сверху слева), NKX6.1 (сверху справа) и низкой экспрессии NEUROD1 (снизу слева) и CHGA (снизу справа) по сравнению с монослоем S4D3. На ФИГ. 6E показана процедура, с помощью которой (i) свежий монослой S4D3 или криоконсервированные клетки S4D3 собирали (ii) посредством способа Aggrewell™ в скопления клеток и (iii) дифференцировали в суспензионной культуре до (iv) незрелых бета-клеток посредством S6D6. Анализ FACS скоплений Aggrewell™ S6D6 показывает устойчивый профиль белка незрелых бета-клеток, так как 78,5±1,87% клеток были NKX6.1+ CHGA+ (слева, ФИГ. 6F), 73,6±4,34% - NKX6.1+ NEUROD1+ (справа, ФИГ. 6F) и 38,4±5,96% - NKX6.1+ ИНСУЛИН+ (слева, ФИГ. 6G). Большая часть ИНСУЛИН-положительной популяции (50,2±6,92% от общего числа клеток были ИНСУЛИН+) была NKX6.1+ (слева, ФИГ. 6G) и не ГЛЮКАГОН-положительной (7,43±1,49% ИНСУЛИН+ ГЛЮКАГОН+; (справа, ФИГ. 6G). На ФИГ. 6H показано посредством IF, что в S6D6 большинство C-ПЕПТИД-положительных клеток в скоплениях Aggrewell™ были как PDX1+ (слева), так и NKX6.1+ (посередине). На ФИГ. 6I показано, что присутствие белка ТФ привратника созревания MAFA (справа) уже легко обнаруживали в S6D6 и его экспрессировали на большем уровне, чем в предыдущих скоплениях на ALI в S6D6-S6D7 (Nature Biotechnology, 2014 (32) 11, 1121-1133) (см. также ФИГ. 3C для сравнения с ALI S7D7). Экспрессия ИНСУЛИНА (ФИГ. 6J), PDX1 (ФИГ. 6K) и NKX6.1 (ФИГ. 6L) была выше, чем в предыдущих скоплениях на ALI в S6D6-S6D7.
[0047] На ФИГ. 7A-7M показана генерация скоплений S7D7 Aggrewell™ с помощью суспензионной культуры для созревания панкреатических бета-клеток. На ФИГ. 7A показана процедура, с помощью которой (i) свежий монослой S4D3 или криосохраненные клетки собирали в скопления Aggrewell™, подготовленные в суспензионной культуре посредством прохождения через (ii и iii) стадии 5, 6 и 7 для генерации (iv) скоплений Aggrewell™ S7D7. Скопления Aggrewell™ S7D7, культивированные в условиях «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC DEZA AZT FI BLAR001» во время стадии 7, сохраняли профиль белка бета-клеток на исходном уровне (ФИГ. 7B-7C). 89% клеток были NKX6.1+ CHGA+ (слева, ФИГ. 7B), 77,7% - NKX6.1+ NEUROD1+ (справа, ФИГ. 7B) и 40,8% - NKX6.1+ ИНСУЛИН+ (слева, ФИГ. 7C). Большая часть ИНСУЛИН-положительной популяции (46,4% от общего числа клеток были ИНСУЛИН+) была NKX6.1+ (слева, ФИГ. 7C) и не ГЛЮКАГОН-положительной (3,9% ИНСУЛИН+ ГЛЮКАГОН+; (справа, ФИГ. 7C). Генная экспрессия маркеров созревания MAFA (ФИГ. 7D), UCN3 (ФИГ. 7E), SLC2A1 (ФИГ. 7F), G6PC2 (ФИГ. 7G), ИНСУЛИН (ФИГ. 7H) и NKX6.1 (ФИГ. 7I) находилась на уровнях человеческих островков в скоплениях S7D7 Aggrewell™, подготовленных в условиях стадии 7 «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC DEZA AZT FI BLAR001 или BLAR004», или превышала их. Уровни экспрессии S7D7 маркера созревания, такого как MAFA (ФИГ. 3C), G2PC2 (ФИГ. 3F), ИНСУЛИН (ФИГ. 3H) и NKX6.1 (ФИГ. 3L), гораздо выше в Aggrewell™ («БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC DEZA AZT FI BLAR001 или BLAR004», чем в скоплениях на ALI. На ФИГ. 7J-7M показано, что добавление DEZA и AZT к условиям стадии 7 «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC FI BLAR004» приводило к генерации большого числа не продуцирующих ГЛЮКАГОН (ФИГ. 7J; снизу справа) клеток С-ПЕПТИДА, которые на основании присутствия белка совместно экспрессировали PDX1 в S7D7 (ФИГ. 7J; снизу слева), NKX6.1 (ФИГ. 7J; снизу посередине), MAFA (ФИГ. 7K; снизу слева), UCN3 (ФИГ. 7K; снизу посередине) и SLC2A1 (ФИГ. 7K; снизу справа). На ФИГ. 7L-7M показана генерация посредством обработки в условиях «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC FI BLAR004» стадии 7 клеток С-ПЕПТИДА, которые на основании присутствия белка совместно экспрессировали маркеры созревания S7D7: PDX1 (ФИГ. 7L; снизу слева), NKX6.1 (ФИГ. 7L; снизу посередине), MAFA (ФИГ. 7M; снизу слева), SLC2A1 (ФИГ. 7M; снизу справа), но не ГЛЮКАГОН (ФИГ. 7L; снизу справа) или UCN3 (ФИГ. 7M; снизу посередине).
[0048] На ФИГ. 8A-8I показана генерация зрелых панкреатических бета-клеток, полученных из плюрипотентных стволовых клеток, с помощью суспензионной культуры, со схожей с человеческими островками кинетикой глюкозозависимого митохондриального дыхания и GSIS. На ФИГ. 8A-8B показано, что человеческие островковые клетки и быстро реагировали на высокую концентрацию D-глюкозы, как видно на основании OCR, равной 123,3% ± 12,92 по сравнению с исходным уровнем через 15 минут п/и, и сохраняли высокую OCR во времени (131,5% ± 11,32; 72 мин п/и). В скоплениях на ALI S6D7, которые обогащали незрелыми С-ПЕПТИД-положительными клетками, не было стремительной реакции OCR на высокую концентрацию D-глюкозы (104,4% ± 3,37; 15 мин п/и), и они показывают относительно слабую реакцию OCR во времени (113,3% ± 4,51; 72 мин п/и). Схожую с человеческими островками кинетику глюкозозависимого митохондриального дыхания наблюдали в условиях «без ALK5, с низким T3, ZM, H, NAC, FI, BLAR004» в S7D13 в контексте скоплений Aggrewell™ в суспензии (110,7% ± 2,46-15 мин п/и; 125,9% ± 2,27-72 мин п/и) (ФИГ. 8A). Скопления Aggrewell™ в условиях «без ALK5, с низким T3, ZM, H, NAC, AZT, DEZA, FI, BLAR004» в суспензии потребляли больше кислорода в ответ на стимуляцию высокой концентрацией глюкозы, чем человеческие островки (162,0% ± 11,51-15 мин п/и; 177,1% ± 0,99-72 мин п/и) (ФИГ. 8B). На ФИГ. 8C показано, что зрелые бета-клетки внутри человеческих островков показали способность к осуществлению множества циклов быстрой двухфазной секреции инсулина в ответ на стимуляцию глюкозой. Человеческие островки продемонстрировали способность к осуществлению множества циклов «включения-выключения» секреции инсулина. Все исследованные условия показывали сильную реакцию в виде секреции инсулина на KCl (ФИГ. 8C-8I). Добавление эксендина-4 не увеличивало амплитуду реакции в виде GSIS в показанных человеческих островках, но было включено для сравнения с профилями GSIS ALI или Aggrewell™ (ФИГ. 8D). Скопления на ALI S7D21, обработанные во время стадии 7 в условиях «без ALK5, с низким T3, ZM, H, NAC FI», либо в BLAR001 (ФИГ. 8E), либо в BLAR004 (ФИГ. 8F), показали первую (~4-10-кратное увеличение в первой фазе первой реакции в виде GSIS), но не вторую, и относительно медленную реакцию в виде двухфазной GSIS. Скопления на ALI не были способны блокировать вторую фазу секреции инсулина при реперфузии 300 млмМ D-глюкозы после стимуляции. Скопления S7D14 Aggrewell™, обработанные во время стадии 7 в условиях «без ALK5, с низким T3, ZM, H, NAC, FI BLAR004», показали сильную первую двухфазную GSIS (~5-кратное увеличение в первую фазу первой реакции в виде GSIS), с последующими способностью полностью блокировать GSIS и слабой второй монофазной реакцией (ФИГ. 8G). После добавления DEZA и AZT к условиям «без ALK5, с низким T3, ZM, H, NAC, FI BLAR004» скопления S7D14 Aggrewell™ показали множество циклов схожей с человеческими островками двухфазной GSIS (~5-7-кратное увеличение в первой фазе первой реакции в виде GSIS) и способность полностью блокировать GSIS между повышениями концентрации глюкозы (ФИГ. 8H-8I).
[0049] На ФИГ. 9A-9Q показана генерация панкреатической энтодермы, полученной из CyT49 hESC, во множестве типов суспензионной культуры. На ФИГ. 9A показан постадийный протокол дифференцировки для генерации панкреатической энтодермы, полученной из CyT49 hESC. Для каждой стадии указаны важные факторы транскрипции (ФТ). На ФИГ. 9B показано число полученных клеток S4D3 по отношению к исходному числу hESC в миллионах клеток на мл. На ФИГ. 9C показаны выходы S4D3 для 0,1 фосфатно-солевого буферного раствора (PBS) Mini и 0,5 фосфатно-солевого буферного раствора (PBS) Mini. Например, для суспензионной культуры типа 0,5 PBS получено 4,08±0,854 клеток на одну клетку hESC, что существенно больше, чем PEC-01 д12 (2,23±0,090). На ФИГ. 9C показано приблизительно 6-кратное увеличение общего выхода клеток S4D3 (в миллионах клеток) при увеличении объема среды со 100мл (0,1 PBS) до 500мл (0,5 PBS). На ФИГ. 9D и 9E показаны фазово-контрастные изображения и диаметр (в мкм) агрегатов S4D3 из суспензионных культур следующих типов: 2-литровый роллерный флакон (ФИГ. 9D справа), 0,1 PBS (ФИГ. 9E посередине) и 0,5 PBS (ФИГ. 9E справа); полученные в 2-литровом роллерном флаконе PEC-01 д12 (ФИГ. 9D слева) и PEC-01 д15 (ФИГ. 9E слева) показаны в качестве примеров предшествующего уровня техники. Агрегаты S4D3, полученные в суспензионной культуре 0,1 PBS и 0,5 PBS, единообразно меньше, чем агрегаты, полученные в роллерном флаконе. На ФИГ. 9F-9L показана генная экспрессия для агрегатов S4D3. Генная экспрессия NKX6.1 (ФИГ. 9F), PTF1A (ФИГ. 9G), PDX1 (ФИГ. 9H), SOX2 (ФИГ. 9I), CDX2 (ФИГ. 9J), NEUROD1 (ФИГ. 9K) и CHGA (ФИГ. 9L) по отношению к CyT49 hESC показана для агрегатов S4D3, полученных в 2-литровом роллерном флаконе, 0,1 PBS и 0,5 PBS и PEC-01 д15, полученных в 2-литровом роллерном флаконе. На ФИГ. 9F-9L показана устойчивая индукция генной программы панкреатической энтодермы и одновременное ограничение экспрессии альтернативных линий дифференцировки энтодермы и ранней панкреатической эндокринной дифференцировки по отношению к PEC-01 д15 (предшествующий уровень техники). На ФИГ. 9N-9P показана сильная белковая колокализация маркеров панкреатической энтодермы (например, PDX1, NKX6.1), но не белковых маркеров альтернативных линий дифференцировки энтодермы (например, SOX2, CDX2) и маркеров эндокринной дифференцировки (например, CHGA) для агрегатов S4D3, полученных посредством нового протокола в 2-литровом роллерном флаконе (ФИГ. 9N), 0,1 PBS (ФИГ. 9O) и 0,5 PBS (ФИГ. 9P), по отношению к агрегатам PEC-01 д12 (ФИГ. 9M), полученных в 2-литровом роллерном флаконе, и агрегатам PEC-01 д15 (ФИГ. 9Q).
[0050] На Фиг. 10A-10AB показана генерация инсулинпродуцирующих клеток, полученных из CyT49 hESC, во множестве типов суспензионной культуры. На ФИГ. 10A показан описанный постадийный протокол дифференцировки для генерации нефункциональных инсулинпродуцирующих клеток, полученных из CyT49 hESC. Для каждой стадии указаны важные факторы транскрипции (ФТ), начиная с исходного числа клеток, полученных из S4D3 CyT49 hESC в условиях стадии 5. На ФИГ. 10B показано число полученных клеток S6D7 по отношению к исходному числу hESC в миллионах клеток на мл. Например, для суспензионной культуры типа 0,5 PBS, в которой используют 2,4±0,169 клеток S6D7, полученных по новому протоколу, на одну клетку hESC. На ФИГ. 1°C показан выход S6D7 из культур 0,1 PBS и 0,5 PBS. На ФИГ. 1°C показано приблизительно 7,5-кратное увеличение общего выхода клеток S6D7 (в миллионах клеток) при увеличении объема среды со 100мл (0,1 PBS) до 500мл (0,5 PBS). На ФИГ. 10D показаны фазово-контрастные изображения агрегатов S5D3 из суспензионных культур типа 2-литрового роллерного флакона (ФИГ. 10D слева), 0,1 PBS (ФИГ. 10D посередине) и 0,5 PBS (ФИГ. 10D справа). На ФИГ. 10E показаны фазово-контрастные изображения агрегатов S6D7 из суспензионных культур типа 2-литрового роллерного флакона (ФИГ. 10E слева), 0,1 PBS (ФИГ. 10E посередине) и 0,5 PBS (ФИГ. 10E справа) с указанием диаметра агрегата под каждой фотографией. На ФИГ. 10F показаны фазово-контрастные изображения агрегатов S7D13 из суспензионных культур типа 2-литрового роллерного флакона (ФИГ. 10F слева) и 0,1 PBS (ФИГ. 10F справа). Суспензионная культура 0,1 PBS и 0,5 PBS поддерживает плотную архитектуру агрегатов в течение стадии 7. С другой стороны, агрегаты стадии 6-7 распадаются с образованием клеточных пластов в суспензионной культуре в 2-литровом роллерном флаконе. На ФИГ. 10G-10N показывают генные экспрессии в S4D3, S5D3, S6D7 и S7D7. На ФИГ. 10G-10N показано, что способы получения суспензионных культур с использованием нового протокола индуцировали появление устойчивой генной сигнатуры в панкреатической моногормональной инсулинпродуцирующей клетке; Способы получения суспензионной культуры в 2-литровом роллерном флаконе, 0,1PBS и 0,5 PBS приблизительно одинаково индуцировали экспрессию PDX1 (ФИГ. 10G), NKX6.1 (ФИГ. 10H), CHGA (ФИГ. 10I), NEUROD1 (ФИГ. 10J), NGN3 (ФИГ. 10K), ИНСУЛИНА (ФИГ. 10L), MAFA (ФИГ. 10M) и ГЛЮКАГОНА (ФИГ. 10N). На ФИГ. 10O-10T показано постадийное формирование белковой колокализации маркеров инсулинпродуцирующих клеток, таких как CHGA, NKX6.1, ИНСУЛИН, но не ГЛЮКАГОН, на S5D3 в 0,5 PBS (ФИГ. 10O-10P), на S6D7 в 2-литровом роллерном флаконе (ФИГ. 10Q), на S6D7 в 0,1 PBS (ФИГ. 10R), на S7D13 в 2-литровом роллерном флаконе (ФИГ. 10S) и на S7D14 в 0,1 PBS (ФИГ. 10T). На ФИГ. 10U показана частота встречаемости клеток NKX6.1, совместно экспрессирующих CHGA, ИНСУЛИН или ГЛЮКАГОН, а также частота встречаемости клеток, совместно экспрессирующих ИНСУЛИН и ГЛЮКАГОН, среди полученных из PEC-01 клеток S6D7. На ФИГ. 10U показана большая распространенность полигормональных инсулинпродуцирующих клеток и, следовательно, низкие количества моногормональных инсулин-положительных клеток в полученных из PEC-01 агрегатах S6D7 в 2-литровом роллерном флаконе. На ФИГ. 10V показана колокализация ГЛЮКАГОНА и NKX6.1 для: полученных из PEC-01 клеток S6D7; S7D14 в 0,1PBS и S7D13 в роллерном флаконе (РФ). На ФИГ. 10V показано, что все ИНСУЛИН+ ГЛЮКАГОН+ клетки являются отрицательными в отношении присутствия NKX6.1 во всех исследованных условиях (полученные из PEC-01 клетки S6D7; S7D14 в 0,1PBS и S7D13 в РФ с использованием нового протокола). На ФИГ. 10W-10AB показана белковая колокализация маркеров инсулинпродуцирующих клеток, таких как СИНАПТОФИЗИН (панэндокринный маркер), NKX6.1, ИНСУЛИН и MAFA на S6D7 в 0,1 PBS (ФИГ. 10W-10X), на S7D16 в 0,1 PBS (ФИГ. 10Y-10Z) и на S7D23 в 2-литровом роллерном флаконе (ФИГ. 10AA-10AB). После проведения стадии 7 наблюдали устойчивую белковую колокализацию СИНАПТОФИЗИНА, NKX6.1, ИНСУЛИНА и MAFA, характерную для нефункциональных моногормональных инсулинпродуцирующих клеток.
Подробное описание изобретения
[0051] Следующее подробное описание изобретения будет более понятно при изучении вместе с приложенными фигурами. Фигуры обеспечены для иллюстрации определенных вариантов осуществления изобретения. Однако изобретение не ограничивают приведенными точными конструкциями, примерами и устройствами. Для ясности описания, а не в целях ограничения, подробное описание изобретения разделено на подразделы, описывающие или иллюстрирующие конкретные элементы, варианты осуществления или области применения настоящего изобретения.
A. Определения
[0052] Стволовые клетки представляют собой недифференцированные клетки, образованные со способностью, на одноклеточном уровне, к самообновлению и дифференцировке. Стволовые клетки могут продуцировать клетки-потомки, включая самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцировки из множества зародышевых листков (энтодермы, мезодермы и эктодермы). Стволовые клетки также дают начало тканям множества зародышевых листков после трансплантации и после инъекции в бластоцисты и по существу способствуют образованию большинства, если не всех, тканей. Стволовые клетки классифицируют по потенциалу развития. Плюрипотентные стволовые клетки выполнены с возможностью обеспечения зарождения всех видов эмбриональных клеток.
[0053] Дифференцировка представляет собой процесс, посредством которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает признаки специализированной клетки, например нервной клетки или мышечной клетки. Дифференцированная клетка представляет собой клетку, занявшую более специализированное («коммитированное») положение в пределах клеточной линии дифференцировки. Термин «коммитированная» применительно к процессу дифференцировки относится к клетке, дошедшей в процессе дифференцировки до стадии, от которой в нормальных условиях она продолжит дифференцироваться в конкретный тип клеток или подмножество типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток либо вернуться к менее дифференцированному типу клеток. «Дедифференцировка» обозначает процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в пределах клеточной линии дифференцировки. В контексте настоящего документа выражение «клеточная линия дифференцировки» означает наследственность клетки, т. е. то, из каких клеток произошла данная клетка и каким клеткам она может дать начало. Клеточная линия дифференцировки помещает клетку в пределы наследственной схемы развития и дифференцировки. Маркер, специфичный для линии дифференцировки, относится к характеристике, специфически ассоциированной с фенотипом клеток интересующей линии дифференцировки, и его можно применять для оценки дифференцировки некоммитированной клетки в клетки интересующей линии дифференцировки.
[0054] В контексте настоящего документа термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов, которые дифференциально экспрессируются в интересующей клетке. В данном контексте под дифференциальной экспрессией понимают повышенный уровень положительного маркера и пониженный уровень отрицательного маркера по сравнению с недифференцированной клеткой или клеткой на другой стадии дифференцировки. Обнаруживаемый уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками так, что позволяет идентифицировать интересующую клетку и отличать ее от других клеток с помощью любого из множества способов, известных в данной области.
[0055] В настоящем документе термины «плотность клеток» и «плотность посева» применяются взаимозаменяемо и относятся к числу клеток, высеваемых на единицу площади поверхности твердого или полутвердого плоского или криволинейного субстрата.
[0056] В настоящем документе термин «суспензионная культура» относится к культуре клеток, отдельным клеткам или кластерам, суспендированным в среде, а не соединенным с какой-либо поверхностью.
[0057] В настоящем документе клетка является «положительной по» установленному маркеру, «положительной» или обозначается со знаком «+», если установленный маркер обнаруживают в клетке в достаточном количестве. Аналогично клетка является «отрицательной по» установленному маркеру, «отрицательной» или обозначается со знаком «-», если установленный маркер не обнаруживают в клетке в достаточном количестве. В частности, положительность при цитометрии посредством сортировки клеток с активацией флуоресценции (FACS), как правило, означает уровень более чем около 2%, в то время как отрицательный предел для FACS, как правило, составляет менее около 1%. Положительность при цитометрии с помощью полимерной цепной реакции (ПЦР), как правило, означает около или менее 30 циклов (Cts); при этом отрицательность для ПЦР, как правило, составляет более около 31 цикла.
[0058] При попытках воспроизвести дифференцировку плюрипотентных стволовых клеток в функционализированные панкреатические эндокринные клетки в статичных клеточных культурах in vitro процесс дифференцировки часто рассматривают как прохождение через несколько последовательных стадий. В частности, процесс дифференцировки обычно рассматривают как прохождение через множество стадий. В этой поэтапной дифференцировке «стадия 1» обозначает первую стадию в процессе дифференцировки, то есть дифференцировку плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы («клетки стадии 1»). «Стадия 2» обозначает вторую стадию, то есть дифференцировку клеток, экспрессирующих маркеры, характерные для дефинитивных энтодермальных клеток, в клетки, экспрессирующие маркеры, характерные для клеток первичной кишечной трубки («клетки стадии 2»). «Стадия 3» обозначает третью стадию, то есть дифференцировку клеток, экспрессирующих маркеры, характерные для клеток первичной кишечной трубки, в клетки, экспрессирующие маркеры, характерные для энтодермальных клеток передней кишки («клетки стадии 3»). «Стадия 4» обозначает четвертую стадию, то есть дифференцировку клеток, экспрессирующих маркеры, характерные для энтодермальных клеток передней кишки, в клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных клеток («клетки стадии 4»). «Стадия 5» обозначает пятую стадию, то есть дифференцировку клеток, экспрессирующих маркеры, характерные для панкреатических энтодермальных клеток, в клетки, экспрессирующие маркеры, характерные для одного или обоих из панкреатических энтодермальных клеток и панкреатических эндокринных клеток-предшественников (совместно обозначаемых как «клетки стадии 5» или альтернативно «панкреатические энтодермальные/эндокринные клетки-предшественники»). «Стадия 6» обозначает шестую стадию, то есть дифференцировку клеток, экспрессирующих маркеры, характерные для панкреатических эндокринных клеток-предшественников, в клетки, экспрессирующие маркеры, характерные для незрелых бета-клеток («клетки стадии 6»). В процессе и с целью продуцирования клеток и популяций клеток изобретения применяют седьмую стадию - «стадию 7», которая относится к дифференцировке клеток, экспрессирующих маркеры, характерные для незрелых бета-клеток (панкреатические эндокринные клетки), в клетки, экспрессирующие маркеры, характерные для функциональных бета-клеток, и которые обладают более зрелым фенотипом по сравнению с клетками стадии 6. Под «функциональными бета-клетками, имеющими более зрелый фенотип» или «клетками стадии 7» подразумевают панкреатическую эндокринную клетку, которая, по сравнению с клеткой стадии 6, не только представляет собой одногормональную инсулин+, MAFA+, NKX6.1+, UCN3+, SLC2A1+ и PDX1+ клетку, но также экспрессирует MAFA на более высоком уровне, чем менее зрелая панкреатическая эндокринная клетка, в частности незрелая бета-клетка.
[0059] Необходимо отметить, что не все клетки в отдельно взятой популяции проходят через эти стадии с одинаковой скоростью. Следовательно, в клеточных культурах in vitro нередко обнаруживают наличие клеток, менее или более дифференцированных по сравнению с большинством клеток, присутствующих в популяции, особенно на более поздних стадиях дифференцировки. Например, нередко наблюдают появление маркеров, характерных для панкреатических эндокринных клеток, во время стадии 5 культивирования клеток. Для иллюстративных нужд настоящего изобретения в настоящем документе описаны характеристики различных типов клеток, связанных с определенными выше стадиями.
[0060] В настоящем документе «дефинитивная энтодерма» обозначает клетки, обладающие характеристиками клеток, происходящих от эпибласта при гаструляции, и формирующие желудочно-кишечный тракт и его производные. Дефинитивные энтодермальные клетки экспрессируют по меньшей мере один из следующих маркеров: FOXA2 (также известный как ядерный фактор гепатоцитов 3-β (HNF3-β)), GATA4, SOX17, CXCR4, Brachyury, Cerberus, OTX2, goosecoid, C-Kit, CD99 и MIXL1. Маркеры, характерные для дефинитивных энтодермальных клеток, представляют собой CXCR4, FOXA2 и SOX17. Таким образом, дефинитивные энтодермальные клетки могут характеризоваться экспрессией CXCR4, FOXA2 и SOX17. Кроме того, в зависимости от длительности времени, на протяжении которого клеткам позволяют оставаться на стадии 1, можно наблюдать рост в HNF4α.
[0061] В настоящем документе «клетки первичной кишечной трубки» обозначают клетки, полученные из дефинитивной энтодермы и которые могут стать источником образования всех энтодермальных органов, таких как легкие, печень, поджелудочная железа, желудок и кишечник. Клетки кишечной трубки могут характеризоваться по существу растущей экспрессией HNF4α, выше, чем экспрессия дефинитивных энтодермальных клеток. Например, рост экспрессии HNF4α в мРНК в десять-сорок раз можно наблюдать на стадии 2.
[0062] В настоящем документе «энтодермальные клетки передней кишки» обозначают клетки, которые становятся источником образования пищевода, легких, желудка, печени, поджелудочной железы, желчного пузыря и части двенадцатиперстной кишки. Энтодермальные клетки передней кишки экспрессируют по меньшей мере один из следующих маркеров: PDX1, FOXA2, CDX2, SOX2 и HNF4α. Энтодермальные клетки передней кишки могут характеризоваться ростом экспрессии PDX1 по сравнению с клетками кишечной трубки. Например, более пятидесяти процентов клеток в культурах стадии 3 типично экспрессируют PDX1.
[0063] В настоящем документе «панкреатические энтодермальные клетки» обозначают клетки, экспрессирующие по меньшей мере один из следующих маркеров: PDX1, NKX6.1, HNF1β, PTF1α, HNF6, HNF4α, SOX9, NGN3, гастрин; HB9 или PROX1. Панкреатические энтодермальные клетки могут характеризоваться отсутствием у них существенной экспрессии CDX2 или SOX2.
[0064] В настоящем документе «панкреатические эндокринные клетки-предшественники» обозначают панкреатические энтодермальные клетки, способные стать панкреатической клеткой, экспрессирующей гормоны. Панкреатические эндокринные клетки-предшественники экспрессируют по меньшей мере один из следующих маркеров: NGN3; NKX2.2; NeuroD1; ISL1; PAX4; PAX6; или ARX. Панкреатические эндокринные клетки-предшественники могут характеризоваться экспрессией NKX2.2 и NeuroD1.
[0065] В настоящем документе «панкреатические эндокринные клетки» обозначают клетки, выполненные с возможностью экспрессирования по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина, грелина и панкреатического полипептида. Кроме того, к этим гормонам маркеры, характерные для панкреатических эндокринных клеток, включают в себя один или более из NeuroD1, ISL1, PDX1, NKX6.1, PAX4, ARX, NKX2.2, HB9 и PAX6.
[0066] «Бета-клетки («β-клетки») представляют собой панкреатические эндокринные клетки, выполненные с возможностью экспрессирования инсулина, но не глюкагона, соматостатина, грелина и панкреатического полипептида. Панкреатические эндокринные клетки, экспрессирующие маркеры β-клеток, могут характеризоваться экспрессией инсулина и по меньшей мере одного из следующих факторов транскрипции: PDX1, NKX2.2, NKX6.1, NeuroD1, ISL1, HNF3β, HB9, MAFA и PAX6.
[0067] «Функциональные бета-клетки» представляют собой панкреатические эндокринные клетки, которые отображают хорошо изученные процессы, которые обеспечивают быструю и регулируемую стимулированную глюкозой секрецию инсулина (GSIS), в частности увеличение митохондриального дыхания/активности с последующей первой фазой и второй фазой секреции инсулина («двухфазная GSIS»). Более конкретно, функциональные бета-клетки показывают по меньшей мере одну из следующих характеристик двухфазной GSIS: (i) сопряжение митохондриального дыхания/активности с секрецией инсулина; (ii) быстрая реакция в виде секреции инсулина в случае увеличения потребности (в настоящем документе определяется как высокая концентрация глюкозы); (iii) способность к быстрому прекращению секреции инсулина после уменьшения потребности; (iv) способность к осуществлению множества циклов «включения-выключения» секреции инсулина; (v) способность к секретированию нужного количества инсулина в соответствии с потребностью; и (vi) способность к реагированию на множество стимуляторов секреции инсулина (например, эксендин-4 или аминокислоты L-глутамин и L-аргинин). Функциональные β-клетки могут характеризоваться по экспрессии инсулина и по меньшей мере одного из следующих факторов транскрипции: PDX1, NKX2.2, NKX6.1, NeuroD1, ISL1, HNF3β, HB9, PAX6, MAFA, SLC2A1, UCN3 и GLP1R.
[0068] «Незрелые бета-клетки» представляют собой панкреатические эндокринные клетки, которые не отображали глюкозозависимое митохондриальное дыхание/активность и двухфазную GSIS. Незрелые бета-клетки, экспрессирующие маркеры β-клеток, могут характеризоваться экспрессией инсулина и по меньшей мере одного из следующих факторов транскрипции: PDX1, NKX2.2, NKX6.1, NeuroD1, ISL1, HNF3β, HB9, MAFA и PAX6.
[0069] В настоящем документе «поверхность раздела воздух-жидкость» или «ALI» обозначает поверхность раздела воздух-жидкость, которая присутствует в открытом сосуде для культивирования или сосуде для культивирования, частично наполненном средой. Хотя в настоящем документе для удобства применяют термин «воздух», изобретение не ограничивают смесью газов и композиций, находящихся в окружающей среде. Изобретение детально рассматривает и включает в себя газообразные смеси, имеющие композиции, отличные от окружающей среды, включая, например, смеси, обогащенные определенным компонентом или в которых содержание определенного компонента понижено или исключено.
[0070] В настоящем документе взаимозаменяемо применяют выражения «д1», «1д» и «день 1»; «д2», «2д» и «день 2» и так далее. Эти комбинации цифр и букв обозначают конкретный день инкубации на различных стадиях в процессе постадийного протокола дифференцировки настоящей заявки.
[0071] Первая фаза (1-я) секреции инсулина представляет собой быстрый экзоцитоз небольшого пула связанных и легко высвобождаемых гранул инсулина в случае резкого увеличения концентрации глюкозы.
[0072] Вторая фаза (2-я) секреции инсулина меньшей амплитуды, но большей продолжительности, чем 1-я фаза секции инсулина, представляет собой перемещение гранул из резервного пула гранул и их связывание/подготовку для высвобождения.
[0073] OCR определяют как скорость потребления кислорода и является индикатором митохондриального дыхания, в частности, посредством цепи переноса электронов (ETC); прямая мера митохондриальной активности.
[0074] Выражение «эффективное количество» или «терапевтическое количество» или их эквиваленты в настоящем документе означают количество соединения, которое должно присутствовать для обеспечения некоторой степени дифференцировки hESCs или дополнительной дифференцировки частично дифференцированных hESC, например подвергнутых воздействию одной или более предшествующих стадий дифференцировки. В дополнительных примерах соединение может присутствовать в культуральной среде hESC или может быть добавлено к hESC во время любой из стадий выращивания. В некоторых вариантах осуществления соединение, агент, малая молекула или ростовой фактор используют для получения дефинитивной энтодермы, передней кишки, клеточных линий дифференцировки панкреатической передней кишки и панкреатической энтодермы, включая панкреатические гормонсекретирующие клетки. В определенных примерах можно подвергать стволовые клетки воздействию соединения, агента, малой молекулы или фактора роста перед любой дифференцировкой или во время первой стадии дифференцировки, а в других примерах можно дифференцировать стволовую клетку до клетки промежуточного типа, такой как, например, клетка дефинитивной энтодермы, а затем подвергать воздействию соединения, агента, малой молекулы или фактора роста.
[0075] Термины «соединения», «низкомолекулярные соединения» или их эквиваленты изобретения означают соединения, соответствующие общей формуле, описанной в настоящем документе (например, в таблице XI), и включают в себя любые специфические соединения в пределах этой формулы, структура которых описана в настоящем документе, или их аналоги. Можно идентифицировать соединения изобретения по их химической структуре или химическому названию. В случае противоречия между химической структурой и химическим названием идентичность соединения определяет химическая структура. Соединения изобретения могут содержать один или более хиральных центров или двойных связей и, следовательно, могут существовать в виде стереоизомеров, таких как изомеры с двойной связью (т. е. геометрические изомеры), энантиомеры или диастереомеры. Таким образом, химические структуры, показанные в настоящем документе, охватывают все возможные энантиомеры и стереоизомеры указанных соединений, включая стереоизомерически чистую форму (например, геометрически чистую, энантиомерно чистую или диастереомерически чистую) и энантиомерные и стереоизомерные смеси. Энантиомерные и стереоизомерные смеси можно разделять на составляющие их энантиомеры или стереоизомеры с использованием методов разделения или методов хирального синтеза, хорошо известных специалисту в данной области. Соединения изобретения также включают в себя меченные изотопами соединения, в которых один или более атомов имеют атомную массу, отличную от атомной массы соединения, обычно обнаруживаемого в природе. Примеры изотопов, которые можно включать в соединения изобретения, включают в себя, без ограничений, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl. Следует дополнительно понимать, что при изображении частичных структур соединений изобретения скобки указывают на точку прикрепления частичной структуры к оставшейся части молекулы.
B. Характеристики плюрипотентных стволовых клеток
[0076] Плюрипотентные стволовые клетки могут экспрессировать одно или более из указанных антител: TRA-1-60 и TRA-1-81 (Thomson et al. 1998, Science 282:1145-1147). Дифференцировка плюрипотентных стволовых клеток in vitro приводит к потере экспрессии TRA-1-60 и TRA-1-81. Недифференцированные плюрипотентные стволовые клетки, как правило, имеют щелочнофосфатазную активность, которую можно обнаруживать путем фиксации клеток 4%-м раствором параформальдегида и впоследствии путем выращивания с использованием набора щелочнофосфатазных субстратов, который продается под товарным знаком VECTOR® Red, в соответствии с описанием производителя (Vector Laboratories, Inc., г. Берлингейм, штат Калифорния). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют OCT4 и TERT, определенные с помощью полимерной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
[0077] Другое желательное фенотипическое свойство выращенных плюрипотентных стволовых клеток представляет собой потенциал дифференцировки в клетки всех трех зародышевых листков: в энтодермальные, мезодермальные и эктодермальные ткани. Плюрипотентность стволовых клеток можно подтверждать, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксации образующихся тератом с помощью 4% параформальдегида и впоследствии их гистологического исследования на наличие клеточных типов, происходящих от этих трех зародышевых листков. В альтернативном варианте осуществления можно определять плюрипотентность по созданию эмбриоидных телец и оцениванию эмбриоидных телец на наличие маркеров, связанных с тремя зародышевыми листками.
[0078] Выращенные линии плюрипотентных стволовых клеток можно кариотипировать с помощью стандартного метода G-бэндинга и сравнивать с опубликованными кариотипами соответствующих видов приматов. Желательно получать клетки, имеющие «нормальный кариотип», т. е. эуплоидные клетки, в которых все хромосомы человека присутствуют и не имеют видимых изменений.
C. Источники плюрипотентных стволовых клеток
[0079] Любые плюрипотентные стволовые клетки можно применять в способах изобретения. Примерные типы плюрипотентных стволовых клеток, которые можно применять, включают в себя стабильные линии плюрипотентных клеток, в том числе преэмбриональной ткани (такой как бластоцист), эмбриональной или фетальной ткани, взятой в любой момент во время беременности, как правило, но не обязательно, до срока приблизительно от 10 до 12 недель беременности. Неограничивающие примеры представляют собой стабильные линии человеческих эмбриональных стволовых клеток (hESC) или человеческих эмбриональных зародышевых клеток, такие как линии человеческих эмбриональных стволовых клеток H1 (код NIH: WA01), H7 (код NIH: WA07), H9 (код NIH: WA09) (WiCell Research Institute, г. Мэдисон, штат Висконсин, США) и SA002 (Cellartis AB Corporation, г. Гетеборг, Швеция).
[0080] Клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток, также являются приемлемыми. Индуцированные плюрипотентные клетки (IPS) или перепрограммированные плюрипотентные клетки, полученные из зрелых соматических клеток с помощью принудительной экспрессии ряда факторов транскрипции, относящихся к плюрипотенции, таких как OCT4, NANOG, SOX2, KLF4 и ZFP42 (Annu Rev Genomics Hum Genet 2011, 12:165-185; см. также IPS, Cell, 126(4): 663-676), также можно применять. Эмбриональные стволовые клетки человека, которые используют в способах изобретения, также можно получать, как описано Thomson et al. (патент США № 5,843,780; Science, 1998, 282:1145-1147; Curr Top Dev Biol 1998, 38:133-165; Proc Natl Acad Sci U.S.A. 1995, 92:7844-7848). Мутантные линии человеческих эмбриональных стволовых клеток, такие как BG01v (BresaGen, г. Атенс, штат Джорджия), или клетки, полученные из зрелых человеческих соматических клеток, такие как клетки, описанные в Takahashi et al., Cell 131: 1-12 (2007), также можно применять. В определенных вариантах осуществления можно получать плюрипотентные стволовые клетки, приемлемые для применения в настоящем изобретении, в соответствии со способами, описанными в: Li et al. (Cell Stem Cell 4: 16-19, 2009); Maherali et al. (Cell Stem Cell 1: 55-70, 2007); Stadtfeld et al. (Cell Stem Cell 2: 230-240); Nakagawa et al. (Nature Biotechnol 26: 101-106, 2008); Takahashi et al. (Cell 131: 861-872, 2007); и заявке на патент США № 2011/0104805. В определенных вариантах осуществления плюрипотентные стволовые клетки, приемлемые для применения в настоящем изобретении, можно считать «интактными» и получать в соответствии со способами, описанными в: Gafni et al. (Nature, 504:282, 2013) и Ware et al. (PNAS, 111: 4484-4489, 2014). Все эти ссылки, патенты и заявки на патенты полностью включены в настоящий документ путем ссылки, в частности, поскольку они относятся к выделению, культивированию, размножению и дифференцировке плюрипотентных клеток.
[0081] Другие источники плюрипотентных стволовых клеток включают в себя индуцированные плюрипотентные стволовые клетки (IPS, Cell, 126(4): 663-676). Еще одни источники приемлемых клеток включают в себя клетки, полученные из ткани пуповины человека, клетки, полученные из амниотической жидкости человека, клетки, полученные из плаценты человека, и человеческие партеноты. В одном варианте осуществления клетки, полученные из ткани пуповины человека, можно получать способом, описанным в патенте США № 7,510,873. В другом варианте осуществления клетки, полученные из ткани плаценты, можно получать с использованием способов, описанных в публикации заявки на патент США № 2005/0058631. В другом варианте осуществления клетки, полученные из амниотической жидкости, можно получать с помощью способов, описанных в заявке на патент США № 2007/0122903. Описания каждой из этих заявок на патент полностью включены в настоящий документ путем ссылки, поскольку они относятся к выделению и характеризации клеток. В определенных вариантах осуществления плюрипотентные стволовые клетки могут иметь не эмбриональное происхождение.
D. Размножение и культивирование плюрипотентных стволовых клеток
[0082] В заявленном изобретении можно применять множество различных известных способов размножения и культивирования плюрипотентных стволовых клеток. Например, плюрипотентные стволовые клетки можно наносить на приемлемый культуральный субстрат. В одном варианте осуществления приемлемый культуральный субстрат представляет собой компонент внеклеточного матрикса, такой как компоненты, полученные из базальной мембраны, или компонент, который может участвовать в лиганд-рецепторном взаимодействии с адгезивными молекулами. Приемлемый культуральный субстрат представляет собой восстановленную базальную мембрану, продаваемую под товарным знаком MATRIGEL™ (Corning Incorporated, г. Корнинг, штат Нью-Йорк, США). MATRIGEL™ представляет собой препарат из опухолевой клетки Энгельбрета-Холма-Суорма, выполненный с возможностью растворения, который при комнатной температуре превращается в гель с образованием восстановленной базальной мембраны.
[0083] В качестве альтернативы приемлемыми являются и другие компоненты внеклеточного матрикса и смеси компонентов, известные в данной области. В зависимости от типа пролиферирующих клеток данные компоненты могут включать в себя по отдельности или в различных комбинациях ламинин, фибронектин, протеогликан, энтактин, гепарансульфат и т. п.
[0084] Плюрипотентные стволовые клетки можно наносить на субстрат с приемлемым распределением и при наличии среды, которая поддерживает выживаемость, размножение и сохранение желательных характеристик клеток. Все эти характеристики улучшаются при тщательном подходе к распределению при посеве и могут быть без труда определены специалистом в данной области. Приемлемые культуральные среды можно получать из следующих компонентов, модифицированная по способу Дульбекко среда Игла (DMEM), продаваемая под товарным знаком GIBCO® (№ по каталогу 11965-092) компанией Life Technologies Corporation, г. Гранд Айленд, штат Нью-Йорк, США; нокаутирующая модифицированная по способу Дульбекко среда Игла (KO DMEM), продаваемая под товарным знаком GIBCO® (№ по каталогу 10829-018) компанией Life Technologies Corporation; основная среда Хэма F12/50% DMEM; 200 мМ L-глутамин, продаваемый под товарным знаком GIBCO® (№ по каталогу 25030-081) компанией Life Technologies; раствор заменимых аминокислот, продаваемый под товарным знаком GIBCO® (№ по каталогу 11140-050) компанией Life Technologies; β-меркаптоэтанол, Sigma-Aldrich Company, LLC, г. Сент-Луис, штат Миссури, США (№ по каталогу M7522); человеческий рекомбинантный основной фактор роста фибробластов (bFGF), продаваемый под товарным знаком GIBCO® (№ по каталогу 13256-029) компанией Life Technologies. Размножение в больших объемах и управляемые процессы дифференцировки человеческих эмбриональных стволовых клеток также можно получать с помощью суспендирующих биореакторов.
E. Дифференцировка плюрипотентных стволовых клеток
[0085] По мере того как плюрипотентные клетки дифференцируются в функциональные β-клетки, они дифференцируются через различные стадии, каждая из которых может характеризоваться наличием или отсутствием определенных маркеров. Дифференцировки клеток на этих стадиях достигают путем создания специфических условий культивирования, включая наличие или отсутствие определенных факторов, добавленных в культуральную среду. В целом эта дифференцировка может включать в себя дифференцировку плюрипотентных стволовых клеток по линии дифференцировки дефинитивной энтодермы и в дефинитивные энтодермальные клетки. Эти клетки можно впоследствии дополнительно дифференцировать в клетки первичной кишечной трубки, которые, в свою очередь, можно впоследствии дифференцировать в энтодермальные клетки передней кишки. Энтодермальные клетки передней кишки можно дифференцировать в панкреатические энтодермальные клетки, которые впоследствии можно дополнительно дифференцировать в панкреатические эндокринные клетки-предшественники или панкреатические энтодермальные/панкреатические эндокринные клетки-предшественники. Эти клетки можно дифференцировать в панкреатические клетки, продуцирующие или секретирующие гормоны. В настоящей заявке предложена постадийная дифференцировка плюрипотентных стволовых клеток в панкреатические эндокринные клетки, предпочтительно путем культивирования клеток на поверхности раздела воздух-жидкость или в суспензии, которая присутствует в пределах сосуда для культивирования, частично наполненного средой, в особенности путем культивирования клеток на поверхности раздела воздух-жидкость или в суспензии на одной или более из стадий от 5 до 7.
[0086] Один или более из гормонов щитовидной железы трийодтиронина (Т3) и тироксина (Т4) и их аналогов, отдельно или дополнительно в комбинации с ингибитором ALK-5, можно применять для культивирования клеток на одной или более из стадий от 1 до 7 дифференцировки и предпочтительно на каждой из стадий от 5 до 7. В альтернативном варианте осуществления ингибитор ALK-5 можно применять отдельно на одной или более стадиях дифференцировки, но предпочтительно на каждой из стадий от 5 до 7 и более предпочтительно на каждой из стадий от 5 до 6. Более предпочтительно один или более из гормонов щитовидной железы или их аналогов и ингибитор ALK5 применяют на одной или более стадиях дифференцировки, предпочтительно на каждой из стадий от 5 до 7 и более предпочтительно на каждой из стадий от 5 до 6. Приемлемые аналоги гормонов щитовидной железы могут включать в себя, без ограничений: GC-1 (Sobertirome) (продаваемый компанией R&D Systems, Inc., г. Миннеаполис, штат Миннесота, США); 3,5-дийодтриопропионовую кислоту (DIPTA); KB-141, обсуждаемый в J. Steroid Biochem. Mol. Biol., 2008(111): 262-267 и Proc. Natl. Acad. Sci. US 2003, 100: 10067-10072; MB07344, обсуждаемый в Proc. Natl. Acad. Sci. US 2007, 104: 15490-15495; T0681, обсуждаемый в J. Lipid Res., May 2009, 50:938 и Endocr. Pract. 2012, 18(6): 954-964, описания которых полностью включены в настоящий документ путем ссылки. Используемые ингибиторы ALK5 включают в себя: ингибитор II ALK5 (Enzo Life Sciences, Inc., г. Фармингдейл, штат Нью-Йорк, США), который также представляет собой предпочтительный ингибитор ALK5; ALK5 I (Axxora, Inc., г. Сан-Диего, штат Калифорния, США), SD208 (R&D Systems); ингибитор трансформирующего фактора роста бета (TGF-β) SB431542 (Xcess Biosciences, Inc., г. Сан-Диего, штат Калифорния, США); ITD-1 (Xcess Biosciences); LY2109761 (Xcess Biosciences); A83-01 (Xcess Biosciences); LY2157299 (Xcess Biosciences); ингибитор рецептора TGF-β V (EMD Millipore Chemical, г. Гибстаун, штат Нью-Джерси, США);ингибитор рецептора TGF-β I (EMD Millipore); ингибитор рецептора TGF-β IV (EMD Millipore); ингибитор рецептора TGF-β VII (EMD Millipore); ингибитор рецептора TGF-β VIII (EMD Millipore); ингибитор рецептора TGF-β II (EMD Millipore); ингибитор рецептора TGF-β VI (EMD Millipore); и ингибитор рецептора TGF-β VI (EMD Millipore).
[0087] В дополнительных предпочтительных вариантах осуществления изобретения способы включают в себя обработку клеток на одной или более стадиях, но предпочтительно обработку клеток во время стадии 7 дифференцировочной средой, которая включает в себя один или оба из антиоксиданта, такого как витамин Е, ацетилцистеин, витамин С, антиоксидантная добавка (№ по каталогу A1345, компания Sigma-Aldrich, г. Сент-Луис, штат Миссури, США), глутатион, супероксиддисмутаза, каталаза и т. п. и их комбинации. В других предпочтительных вариантах осуществления при выполнении стадии 6 применяют ингибитор гамма-секретазы, который может представлять собой ингибитор гамма-секретазы XX (EMD Millipore), ингибитор гамма-секретазы XXI (EMD Millipore), ингибитор гамма-секретазы XVI (EMD Millipore), N-[(3,5-дифторфенил)ацетил]-L-аланил-2-фенил]глицин-1,1-диметиловый эфир (DAPT) (№ по каталогу 2634, Tocris Bioscience, г. Бристоль, Великобритания), и т. п. и их комбинации. Используемые количества ингибитора гамма-секретазы могут составлять от около 50 до 5000 нМ, предпочтительно от около 50 до 500 нМ. Количество антиоксиданта может составлять от около 0,1 до 100 мкМ, альтернативно от около 0,1 до 20 мкМ и предпочтительно от около 1 до 10 мкМ. Альтернативно используемые количества антиоксиданта могут составлять от около 100 нМ до 5 мМ, от около 1000 нМ до 2 мМ и предпочтительно от около 0,1 до 1 мМ.
[0088] В вариантах осуществления изобретения конкретные малые молекулы применяют в среде на одной или более стадиях дифференцировки, предпочтительно на стадии 6 и 7. Интересующие малые молекулы представляют собой молекулы, выполненные с возможностью ингибирования киназы Aurora, киназы p90 рибосомального белка S6 или рецептора метилтрансферазы DOT1L, и их предпочтительно применяют вместе с антиоксидантами, которые уменьшают окислительный стресс культивированных клеток. Особый интерес представляют ингибитор II киназы Aurora и ингибитор II киназы p90 рибосомального белка S6 (RSK). Ингибитор II киназы Aurora представляет собой соединение, выполненное с возможностью проникновения в клетку, известное под названием (4-(4'-бензамидоанилино)-6,7-диметоксихиназолин). Ингибитор II RSK представляет собой рацемическую смесь дигидроптеридинона 2-(3,5-дифтор-4-гидроксианилино)-8-изопентил-5,7-диметил-7H-птеридин-6-она. Другие интересующие ингибиторы киназы Aurora включают в себя ZM447439 и PF03814735. Также интерес представляют ингибиторы рецептора протеин-метилтрансферазы DOT1L, в особенности EPZ-5676. EPZ-5676 представляет собой S-аденозилметиониновый (SAM) ингибитор протеин-метилтрансферазы DOT1L. Данное соединение представляет собой ингибитор метилтрансферазы DOT1L (подобный блокатору теломерного сайленсинга 1), который, как показано, ингибирует пролиферацию клеток. Он известен под такими химическими названиями, как 9H-пурин-6-амин, 9-[5-дезокси-5-[[цис-3-[2-[6-(1,1-диметилэтил)-1H-бензимидазол-2-ил]этил]циклобутил](1-метилэтил)амино]-β-D-рибофуранозил]- и (2R,3R,4S,5R)-2-(6-аминопурин-9-ил)-5-[[[3-[2-(6-трет-бутил-1H-бензимидазол-2-ил)этил]циклобутил]-пропан-2-иламино]метил]оксолан-3,4-диол. Интересующие ингибиторы дополнительно представляют собой ингибитор ДНК-метилтрансферазы, такой как 5-азацитидин (AZT), ингибиторы гистондеацетилазы, такие как пироксамид и CI994. Дополнительные интересующие малые молекулы включают в себя UNC0638, UNC0646, UNC0642 и A366 (ингибиторы метилтрансферазы лизинов гистонов G9a и GLP), TC-E5003 (ингибитор PRMT1 метилтрансферазы аргининов), SB747651A дигидрохлорид (ингибитор MSK1; также ингибирует другие киназы группы AGC), PFI1 (ингибитор бромодомена BET), LY303511 (ингибитор BRD2, BRD3 и BRD4), MS436 (ингибитор бромодомена BRD4) и MC1568 (селективно ингибирует HDAC класса II) и 3-деазанепланоцин А (DEZA).
[0089] В предпочтительном варианте осуществления изобретения малая молекула применяют в среде на одной или более из стадий 6 и 7 и более предпочтительно на стадии 7. Используемое количество малых молекул можно определять путем выбора количества, демонстрирующего наибольшую экспрессию маркеров созревания, но не производящего токсических эффектов. Как правило, используемые количества будут составлять от около 500 нМ до 10 мкМ, альтернативно от около 500 нМ до 5 мкМ и предпочтительно от около 500 нМ до 2 мкМ.
Дифференцировка плюрипотентных клеток в клетки, экспрессирующие маркеры, характерные для панкреатических эндокринных клеток со зрелым фенотипом (функциональных бета-клеток)
[0090] Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. Маркеры плюрипотентных стволовых клеток включают в себя, например, экспрессию одного или более из следующих компонентов: ABCG2, cripto, FOXD3, CONNEXIN43, CONNEXIN45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, TRA-1-60, TRA-1-81. Они могут быть обнаружены посредством ОТ-ПЦР.
[0091] Примеры плюрипотентных стволовых клеток включают в себя линию H9 человеческих эмбриональных стволовых клеток (код NIH: WA09), линию H1 человеческих эмбриональных стволовых клеток (код NIH: WA01), линию H7 человеческих эмбриональных стволовых клеток (код NIH: WA07) и линию SA002 человеческих эмбриональных стволовых клеток. Также приемлемыми являются клетки, экспрессирующие по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, CONNEXIN43, CONNEXIN45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, TRA-1-60 и TRA-1-81.
[0092] Для применения в настоящем изобретении приемлемой является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии дифференцировки дефинитивной энтодермы. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии дифференцировки дефинитивной энтодермы, представляет собой клетку-предшественник первичной полоски. В альтернативном аспекте клетка, экспрессирующая маркеры, характерные для линии дифференцировки дефинитивной энтодермы, представляет собой клетку мезэнтодермы. В альтернативном аспекте клетка, экспрессирующая маркеры, характерные для линии дифференцировки дефинитивной энтодермы, представляет собой дефинитивную энтодермальную клетку.
[0093] Также для применения в настоящем изобретении приемлемой является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии дифференцировки панкреатической энтодермы. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии дифференцировки панкреатической энтодермы, представляет собой панкреатическую энтодермальную клетку, в которой экспрессия PDX1 и NKX6.1 по существу превышает экспрессию CDX2 и SOX2. В определенных вариантах осуществления более 30% клеток экспрессируют PDX1 и NKX6.1 и менее 30% клеток экспрессируют CDX2 или SOX2 при измерении с помощью FACS. В частности, используемыми являются клетки, в которых экспрессия PDX1 и NKX6.1 по меньшей мере в два раза превышает экспрессию CDX2 или SOX2.
[0094] Также приемлемой для применения в настоящем изобретении является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для панкреатической эндокринной линии дифференцировки. В одном аспекте изобретения клетка, экспрессирующая маркеры, характерные для панкреатической эндокринной линии дифференцировки, представляет собой панкреатическую эндокринную клетку. Панкреатической эндокринной клеткой может быть панкреатическая клетка, экспрессирующая гормоны, способная к экспрессии по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина, грелина или панкреатического полипептида. В предпочтительном варианте осуществления панкреатическая эндокринная клетка представляет собой инсулин-продуцирующую β-клетку.
[0095] В определенных вариантах осуществления изобретения для получения клеток, экспрессирующих маркеры, характерные для функциональных бета-клеток (панкреатических эндокринных бета-клеток зрелого фенотипа), используют протокол, начинающийся с плюрипотентных стволовых клеток. В данный протокол включены:
[0096] Наряду с тем, что изобретение в определенных вариантах осуществления включает в себя дифференцировку плюрипотентных стволовых клеток (например, клеток, предшествующих стадии 1) в клетки стадии 7, изобретение также включает в себя дифференцировку клеток других стадий в клетки стадии 7. В частности, изобретение включает в себя дифференцировку клеток стадии от 4 до 7. Хотя способ описан в отдельных стадиях, обработка, так же как и прохождение клеток через процесс дифференцировки, может быть последовательной или непрерывной. Дифференцировку плюрипотентных стволовых клеток в клетки стадии 6 или стадии 7 можно выполнять в суспензионных культурах.
[0097] Эффективность дифференцировки можно определять путем воздействия на обрабатываемую популяцию клеток агентом, таким как антитело, который специфически распознает белковый маркер, экспрессированный интересующими дифференцированными клетками. Способы оценивания экспрессии белковых маркеров и маркеров нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Эти способы включают в себя ОТ-ПЦР, Нозерн-блоттинг, гибридизацию in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)), а также иммунологические анализы, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, экспрессированных на интактных клетках - способ проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
[0098] Дифференцированные клетки можно также дополнительно очищать. Например, после обработки плюрипотентных стволовых клеток с применением способов настоящего изобретения дифференцированные клетки можно очищать путем воздействия на обрабатываемую популяцию клеток агентом, таким как антитело, который специфически распознает белковый маркер, характерно экспрессируемый очищенными дифференцированными клетками. В определенных вариантах осуществления дифференцированные клетки не очищают.
[0099] Любую приемлемую среду для выращивания, содержащую достаточные количества витаминов, минералов, солей, глюкозы, аминокислот и белков-носителей, выполненных с возможностью соответствия для дифференцировки клеток, можно использовать для различных стадий от 1 до 7. Предпочтительно применяют следующие среды: стадия 1 - MCDB-131 (продаваемая компанией Life Technologies Corporation, г. Гранд Айленд, штат Нью-Йорк, США) или RPMI (продаваемая компанией Sigma-Aldrich); стадия 2 - MCDB-131 или модифицированная по способу Дульбекко среда Игла F12 (DMEM-F12); стадия от 3 до 5 - MCDB-131, BLAR (таблица I и таблица IV) или DMEM; и стадии 6 и 7 - BLAR или CMRL (Life Technologies). Предпочтительно концентрацию глюкозы в среде поддерживают на уровне равном или более предпочтительно меньшем, чем около 10 мМ, для стадий от 1 до 4 и большем, чем около 10 мМ, для стадий от 5 до 7. Для стадии 7 среда предпочтительно содержит достаточное количество витаминов, заменимых аминокислот, липидов, пирувата натрия и следовых элементов, например состава I.
[0100] Плюрипотентные стволовые клетки можно дифференцировать в клетки, экспрессирующие маркеры, характерные для дефинитивных энтодермальных клеток, способами, известными специалистам в данной области, или способами, предложенными в изобретении. Способы, используемые для дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной энтодермы, описаны в: D'Amour et al., Nature Biotechnology 23, 1534-1541 (2005); Shinozaki et al., Development 131, 1651-1662 (2004); McLean et al., Stem Cells 25, 29-38 (2007); и D'Amour et al., Nature Biotechnology 24, 1392-1401 (2006). Дополнительные приемлемые способы дифференцировки описаны в: заявке на патент США № 2007/0254359; заявке на патент США 2009/0170198; заявке на патент США 2011/0091971; заявке на патент США 2010/0015711; заявке на патент США 2012/0190111; заявке на патент США 2012/0190112; и заявке на патент США 2012/0196365. Эти описания полностью включены в настоящий документ путем ссылки, поскольку они относятся к дифференцировке плюрипотентных стволовых клеток в дефинитивные энтодермальные клетки.
[0101] В одном варианте осуществления плюрипотентные клетки обрабатывают приемлемой средой для выращивания, предпочтительно MCDB-131 или RPMI. В среду предпочтительно добавляют ростовой фактор дифференцировки, такой как ростовой фактор дифференцировки 8 (GDF8), и ингибитор киназы гликогенсинтазы-3 β (GSK3β), такой как циклические анилин-пиридинотриазиновые соединения, описанные в заявке на патент США 2010/0015711 (полностью включенной в настоящий документ путем ссылки), для индуцирования дифференцировки в клетки, экспрессирующие маркеры, характерные для дефинитивных энтодермальных клеток. Предпочтительным ингибитором GSK3β является 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он (соединение MCX). Обработка может включать в себя приведение плюрипотентных стволовых клеток в контакт со средой, в которую добавили от около 50 нг/мл до около 150 нг/мл, альтернативно от около 75 нг/мл до около 125 нг/мл, предпочтительно около 100 нг/мл GDF8. Обработка может также включать в себя приведение клеток в контакт с от около 0,1 до около 5 мкМ, альтернативно от около 0,5 до около 2,5 мкМ, предпочтительно около 1 мкМ соединения МСХ. Плюрипотентные клетки можно культивировать на протяжении от около двух до пяти дней, предпочтительно от около двух до трех дней для облегчения дифференцировки в клетки, экспрессирующие маркеры, характерные для дефинитивных энтодермальных клеток.
[0102] В предпочтительном варианте осуществления клетки культивируют в присутствии GDF8 и соединения МСХ на протяжении одного дня с последующим культивированием в присутствии GDF8 и более низкой концентрации соединения МСХ на протяжении одного дня с последующим культивированием в присутствии GDF8 на протяжении одного дня без добавления соединения МСХ. В частности, клетки культивируют в присутствии GDF8 и около 1мкМ соединения МСХ на протяжении одного дня с последующим культивированием в присутствии GDF8 и около 0,1мкМ соединения МСХ на протяжении одного дня с последующим культивированием в присутствии GDF8 на протяжении одного дня без добавления соединения МСХ. В альтернативном варианте осуществления клетки можно культивировать в присутствии GDF8 и около 1мкМ соединения МСХ на протяжении одного дня, с последующим культивированием в присутствии GDF8 и около 0,1мкМ соединения МСХ на протяжении одного дня.
[0103] В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в среде, содержащей активин А, но не содержащей сыворотку, впоследствии культивировать клетки с активином А и сывороткой с последующим культивированием клеток с активином А и сывороткой в другой концентрации, как описано в D'Amour et al., Nature Biotechnology 23, 1534-1541 (2005). В качестве альтернативы плюрипотентные стволовые клетки можно дифференцировать в клетки, экспрессирующие маркеры, характерные для дефинитивных энтодермальных клеток, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А, но не содержащей сыворотку, с последующим культивированием клеток с активином A и сывороткой, как описано в D'Amour et al., Nature Biotechnology, 2005. Плюрипотентные стволовые клетки можно также дифференцировать в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной энтодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А и WNT-лиганд, но не содержащей сыворотку, с последующим удалением WNT-лиганда и культивированием клеток с активином A и сывороткой, как описано в D'Amour et al., Nature Biotechnology 24, 1392-1401 (2006).
[0104] В одном варианте осуществления изобретения плюрипотентные стволовые клетки обрабатывают активином А и WNT3A для получения клеток, экспрессирующих маркеры, характерные для дефинитивных энтодермальных клеток. Обработка может включать в себя контакт плюрипотентных стволовых клеток с активином А в концентрации от около 50 нг/мл до около 150 нг/мл, альтернативно от около 75 нг/мл до около 125 нг/мл, альтернативно около 100 нг/мл. Обработка также может включать в себя приведение клеток в контакт с WNT3A в концентрации от около 10 нг/мл до около 50 нг/мл, альтернативно от около 15 нг/мл до около 30 нг/мл, альтернативно около 20 нг/мл. Плюрипотентные клетки можно культивировать в течение приблизительно трех дней для получения дефинитивных энтодермальных клеток. В одном варианте осуществления плюрипотентные клетки культивируют в присутствии активина А и WNT3A на протяжении одного дня с последующим культивированием в присутствии активина А (без присутствия WNT3A).
[0105] Чтобы определить образование клеток, экспрессирующих маркеры, характерные для дефинитивных энтодермальных клеток, клетки можно исследовать на наличие маркеров до и после выполнения конкретного протокола. Плюрипотентные стволовые клетки, как правило, не экспрессируют таких маркеров. Таким образом, можно обнаруживать дифференцировку плюрипотентных клеток, когда клетки начинают экспрессировать маркеры, характерные для дефинитивной энтодермы.
[0106] Клетки, экспрессирующие маркеры, характерные для дефинитивных энтодермальных клеток, можно дополнительно дифференцировать в клетки, экспрессирующие маркеры, характерные для клеток кишечной трубки в среде для выращивания, такой как MCDB-131 или DMEM-F12. В одном варианте осуществления формирование клеток, экспрессирующих маркеры, характерные для клеток кишечной трубки, включает в себя культивирование клеток, экспрессирующих маркеры, характерные для дефинитивных энтодермальных клеток, со средой, содержащей фактор роста фибробластов (FGF), предпочтительно FGF7 или FGF10, для дифференцировки клеток. Например, клеточная культура может включать в себя от около 10 нг/мл до около 75 нг/мл, альтернативно от около 25 нг/мл до около 75 нг/мл, еще альтернативно от около 30 нг/мл до около 60 нг/мл, альтернативно около 50 нг/мл фактора роста фибробластов, предпочтительно FGF7 или FGF10, более предпочтительно FGF7 и наиболее предпочтительно около 25 нг/мл FGF7. Клетки можно культивировать в этих условиях на протяжении от двух до трех дней, предпочтительно около двух дней.
[0107] В другом варианте осуществления формирование клеток, экспрессирующих маркеры, характерные для клеток кишечной трубки, включает в себя культивирование клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной энтодермы, с фактором роста фибробластов, предпочтительно FGF7 или FGF10, и аскорбиновой кислотой (витамином С). Культуральная среда может включать в себя от около 0,1 мМ до около 0,5 мМ аскорбиновой кислоты, альтернативно от около 0,2 мМ до около 0,4 мМ аскорбиновой кислоты, альтернативно около 0,25 мМ аскорбиновой кислоты. Клеточная культура может также включать в себя от около 10 нг/мл до около 35 нг/мл, альтернативно от около 15 нг/мл до около 30 нг/мл, альтернативно около 25 нг/мл фактора роста фибробластов, предпочтительно FGF7 или FGF10, более предпочтительно FGF7. Например, клеточная культура может включать в себя около 0,25 мМ аскорбиновой кислоты и около 25 нг/мл FGF7. В одном варианте осуществления клетки стадии 1 обрабатывают FGF7 и аскорбиновой кислотой на протяжении 2 дней.
[0108] Клетки первичной кишечной трубки, полученные на стадии 2, можно дополнительно дифференцировать в клетки стадии 3 или клетки, экспрессирующие маркеры, характерные для энтодермы передней кишки, путем культивирования этих клеток в среде для выращивания, такой как MCDB-131, DMEM или специализированной среде, такой как BLAR (таблица I). В среду можно добавлять: (i) фактор роста фибробластов, предпочтительно FGF7 или FGF10, более предпочтительно FGF7; (ii) ретиноевую кислоту (RA); (iii) антагонист сигнального пути Sonic Hedgehog (SHH) (такой как антагонист Smoothened 1 (SANT-1), который представляет собой 1-пиперазинамин, N-[(3,5-диметил-1-фенил-1H-пиразол-4-ил)метилен]-4-(фенилметил)- или ((E)-4-бензил-N-((3,5-диметил-1-фенил-1H-пиразол-4-ил),этилен-пиперазин-1-амин), HPI-1, который представляет собой 2-метоксиэтил 1,4,5,6,7,8-гексагидро-4-(3гидроксифенил)-7-(2-метоксифенил)-2-метил-5-оксо-3-хинолинкарбоксилат и предпочтительно SANT-1; (iv) активатор протеинкиназы С (PKC), такой как ((2S,5S)-(E,E)-8-(5-(4-(трифторметил)фенил)-2,4-пентадиеноиламино)бензолактам) (TPB), форбол-12,13-дибутират(PDBu), форбол-12-миристат-13-ацетат (PMA) или индолактам V (ILV) и предпочтительно TPB; (v) ингибитор костного морфогенетического белка (BMP), такой как LDN-193189, ноггин или хордин и предпочтительно LDN-193189; и (vi) аскорбиновую кислоту. В альтернативном варианте осуществления можно также применять ингибитор рецептора Smoothened (SMO) (такой как MRT10 (N[[[3-бензоиламино)фенил]амино]тиоксометил]-3,4,5-триметоксибензамид)) или циклопамин. Например, клеточная культура может включать в себя от около 100 нМ до около 500 нМ, альтернативно от около 100 нМ до около 400 нМ, альтернативно около 200 нМ активатора PKC. Клетки можно культивировать в присутствии этих факторов роста, низкомолекулярных агонистов и антагонистов на протяжении от около двух до четырех дней, предпочтительно от около двух до трех дней, более предпочтительно около двух дней.
[0109] В альтернативном варианте осуществления клетки стадии 3 можно получать из клеток стадии 2 путем культивирования этих клеток в культуральной среде, в которую добавили ингибитор рецептора SMO, SANT-1, ретиноевую кислоту и ноггин. Клетки можно культивировать на протяжении от приблизительно двух до четырех дней, предпочтительно около двух дней.
[0110] В одном варианте осуществления в среду добавляют: от около 10 нг/мл до около 35 нг/мл, альтернативно от около 15 нг/мл до около 30 нг/мл, альтернативно около 25 нг/мл фактора роста фибробластов, предпочтительно FGF7 или FGF10, более предпочтительно FGF7; от около 0,1 мМ до около 0,5 мМ аскорбиновой кислоты, альтернативно от около 0,2 мМ до около 0,4 мМ, альтернативно около 0,25 мМ аскорбиновой кислоты; от около 0,1 мкМ до около 0,4 мкМ SANT-1; от около 100 до около 300 нМ TPB; и от около 50 нМ до около 200 нМ, и около 100 нМ LDN-193189. В другом варианте осуществления в среду добавляют около 25 нг/мл FGF-7, около 1 мкМ ретиноевой кислоты, около 0,25 мкМ SANT-1, около 200 нМ ТРВ, около 100 нМ LDN-193189 и около 0,25 мкМ аскорбиновой кислоты.
[0111] В одном варианте осуществления в среду добавляют от около 0,1 мкМ до около 0,3 мкМ SANT-1, от около 0,5 мкМ до около 3 мкМ ретиноевой кислоты и от около 75 нг/мл до около 125 нг/мл ноггина.
[0112] В одном варианте осуществления способы изобретения включают в себя получение клеток стадии 4 путем обработки клеток стадии 3 дифференцировочной средой, которая может представлять собой любую приемлемую среду для выращивания и предпочтительно представляет собой MCDB-131, DMEM или специализированную среду, такую как BLAR (таблица I). В среду можно добавлять один или более из следующих компонентов: (а) ингибитор ALK5, выбранный из группы, состоящей из: ингибитора V рецептора TGF-β, ингибитора I рецептора TGF-β, ингибитора IV рецептора TGF-β, ингибитора VII рецептора TGF-β, ингибитора VIII рецептора TGF-β, ингибитора II рецептора TGF-β, ингибитора VI рецептора TGF-β, ингибитора рецептора TGF-β III, ингибитора рецептора TGF-β SB431542, SD-208, ITD-1, LY2109761, A83-01, LY2157299, ALK5 I и ингибитора II ALK5; (b) гормон щитовидной железы, выбранный из группы, состоящей из Т3, Т4, аналогов Т3, аналогов Т4 и их смесей; (с) антагонист сигнального пути Sonic Hedgehog (SHH), выбранный из SANT-1 или HIP-1; (d) ингибитор рецептора ВМР, выбранный из LDN-193189, ноггина или хордина; (e) активатор PKC, выбранный из TPB, PDBu, PMA и ILV; (f) фактор роста фибробластов, выбранный из FGF-7 или FGF-10; (g) ретиноевая кислота; и (h) аскорбиновая кислота;. Например, в среду для выращивания, такую как MCDB131 или и предпочтительно BLAR, можно добавлять антагонист сигнального пути Sonic Hedgehog (SHH) (такой как SANT-1 или HPI-1), ингибитор ВМР (такой как LDN-193189, ноггин или хордин), аскорбиновую кислоту и активатор PKC (такой как TPB, PDBu, PMA или ILV) для обеспечения приемлемой дифференцировочной среды.
[0113] Культивирование клеток стадии 3 в такой среде на протяжении от около двух до четырех дней, предпочтительно от около двух до трех дней, более предпочтительно около трех дней, как правило, является достаточным для дифференцировки клеток стадии 3 в клетки стадии 4. В другом варианте осуществления в среду можно добавлять ингибитор SMO и антагонист сигнального пути Sonic Hedgehog (SHH). В предпочтительном варианте осуществления клетки стадии 3 можно обрабатывать средой, в которую добавили около 0,25 мкМ SANT-1; около 100 нМ RA; около 2 нг/мл FGF7; около 100 нM LDN-193189; около 0,25 мМ аскорбиновой кислоты; и около 200 нM TPB в течение трех дней.
[0114] На стадии 4 клетки можно культивировать на поверхности раздела воздух-жидкость либо в течение всей стадии, либо через от 2 до 3 дней после плоскостного культивирования. В частности, в настоящем изобретении обеспечивают клеточную культуру in vitro для дифференцировки клеток, полученных из плюрипотентных стволовых клеток на поверхности раздела воздух-жидкость, содержащую: (а) сосуд для культивирования; (b) объем среды для выращивания в пределах указанного сосуда, достаточный для заполнения только части объема сосуда; (с) воздух в пределах сосуда, который заполняет часть сосуда, свободную от среды; (d) пористый субстрат, размещенный на поверхности раздела между средой и воздухом; и (е) клетки, полученные из плюрипотентных стволовых клеток, расположенные на поверхности субстрата таким образом, что среда контактирует только с частью поверхности клеток. В альтернативном варианте осуществления можно выполнять стадию 4 полностью в плоской культуре.
[0115] В альтернативном варианте осуществления на стадии 4 через от около 2 до 3 дней развития плоской культуры можно объединять клетки в скопления клеток. В частности, в настоящем изобретении обеспечивают клеточную культуру in vitro для дифференцировки клеток, полученных в виде агрегированных клеток, таких как скопления клеток, содержащие: (a) сосуд для культивирования, который облегчает агрегацию клеток или формирование скоплений клеток; (b) объем среды для выращивания (культуральной среды) внутри указанного сосуда; и (с) клетки, полученные из плюрипотентных стволовых клеток, расположенные внутри сосуда так, чтобы индуцировать их агрегацию и образование скоплений. В вариантах осуществления сосуд представляет собой планшет с лунками или микролунками, такой как планшеты Aggrewell™ (планшеты с микролунками; STEMCELL Technologies Inc., г. Ванкувер, Канада). В частности, скопления клеток получали в планшетах с микролунками для образования агрегатов клеток одинаковых размера и формы, например с помощью планшетов Aggrewell™. В вариантах осуществления засевают от около 500 до 2000 клеток на одну лунку или микролунку для получения агрегированных клеток или скоплений клеток. В частности, засевают от около 50 до около 3000 клеток на одну лунку или микролунку, предпочтительно от около 50 до около 2000 клеток, от около 50 до 1000 клеток, от около 50 до около 900 клеток, от около 50 до около 800 клеток, от около 100 до около 800 клеток, от около 250 до около 800 клеток или от около 500 до около 800 клеток. Более предпочтительно засевают от около 700 до около 800 клеток на одну лунку или микролунку.
[0116] В дополнительном варианте осуществления скопления клеток, образованные способом агрегирования клеток, можно дополнительно культивировать в суспензии (суспензионная культура), включая удаление агрегированных клеток или скоплений клеток из лунок или микролунок и посев агрегированных клеток/скоплений клеток в сосуд для суспензионной культуры. В вариантах осуществления агрегированные клетки/скопления клеток засевают в суспензионную культуру с плотностью клеток от около 0,75×106 клеток/мл до около 2,0×106 клеток/мл, предпочтительно от около 1×106 клеток/мл до около 2,0×106 клеток/мл, более предпочтительно от около 1,5×106 клеток/мл до около 2,0×106 клеток/мл. Можно использовать любую систему суспензионной культуры, известную специалистам в данной области, для культивирования в суспензионной культуре агрегированных клеток. В частности, система суспензионной культуры может включать в себя посев агрегированных клеток или скоплений клеток во флакон, такой как центрифужная пробирка или вращающаяся колба.
[0117] В дополнительном варианте осуществления клетки по завершении стадии 4 (после 2 или 3 суток в культуре) можно обрабатывать ингибитором Rho-ассоциированной киназы (ROCK), таким как Y27632 ((1R,4r)-4-((R)-1-аминоэтил)-N-(пиридин-4-ил)циклогексанкарбоксамид), GSK269962 (N-[3-[[2-(4-амино-1,2,5-оксадиазол-3-ил)-1-этил-1H-имидазо[4,5-c]пиридин-6-ил]окси]фенил]-4-[2-(4-морфолинил)этокси]бензамид), H1152 ((S)-(+)-2-метил-1-[(4-метил-5-изохинолинил)сульфонил]гомопиперазин, 2 HCl,) и SR3677 (N-[2-[2-(диметиламино)этокси]-4-(1H-пиразол-4-ил)фенил-2,3-дигидро-1,4-бензодиоксин-2-карбоксамиддигидрохлорид). В определенных вариантах осуществления можно применять от около 1 до 20 мкМ, от около 1 до 15 мкМ, от около 1 до 10 мкМ или около 10 мкМ ингибитора ROCK.
[0118] В определенных вариантах осуществления настоящего изобретения только клетки поздней стадии 4, например клетки, которые были культивированы в течение от 1 до 2 дней или от 1 до 3 дней в адгезивных плоских культурах, можно затем культивировать на поверхности раздела воздух-жидкость или культивировать до получения агрегированных клеток, например скоплений клеток, для завершения стадии 4. В одном варианте осуществления изобретения клетки поздней стадии 4, которые обработали ингибитором ROCK, культивируют на поверхности раздела воздух-жидкость. В вариантах осуществления высевают от 0,5 до около 0,75×105 клеток/микролитров для культивирования на поверхности раздела воздух-жидкость; альтернативно высевают приблизительно от 2 до 6×106 клеток для культивирования на поверхности раздела воздух-жидкость. В другом варианте осуществления клетки поздней стадии 4, которые обработали ингибитором ROCK, культивируют до агрегирования клеток с образованием агрегированных клеток, таких как скопления клеток. В вариантах осуществления клетки засевают в сосуд, который облегчает агрегирование клеток или скоплений клеток (трехмерные агрегаты клеток). В некоторых вариантах осуществления сосуд представляет собой планшет с лунками или микролунками. В частности, скопления клеток получают в планшетах с микролунками с образованием агрегатов клеток одинаковых размера и формы, например с помощью планшетов Aggrewell™ (STEMCELL Technologies Inc., г. Ванкувер, Канада). В вариантах осуществления засевают от около 50 до 3000 клеток на одну лунку или микролунку для получения агрегированных клеток или скоплений клеток. В частности, засевают от около 50 до около 3000 клеток на одну лунку или микролунку, предпочтительно засевают от около 50 до около 2000 клеток, от около 50 до 1000 клеток, от 50 до 900 клеток, от 50 до 800 клеток, от 100 до 800 клеток, от 250 до 800 клеток или от около 500 до около 800 клеток. Более предпочтительно засевают от около 700 до 800 клеток на одну лунку или микролунку. В другом варианте осуществления агрегированные клетки или скопления клеток дополнительно культивируют в суспензии. В определенных вариантах осуществления адгезивные клетки в плоской культуре можно обрабатывать раствором для разъединения клеток, таким как раствор, содержащий протеолитические и коллагенолитические ферменты, такой как TrypLE™, Accutase™ или Dispase™, перед культивированием на поверхности раздела воздух-жидкость или культивированием для агрегирования клеток, например образования скоплений клеток.
[0119] В альтернативном варианте осуществления можно получать клетки стадии 4 из клеток стадии 3 путем обработки клеток стадии 3 дифференцировочной средой, содержащей среду для выращивания, в которую добавили ингибитор ALK5, ноггин и активатор РКС, такой как ТРВ. В определенных вариантах осуществления в среду можно добавлять около 0,1 мкМ ингибитора ALK5, около 100 нг/мл ноггина и около 500 нМ ТРВ. Клеточная культура может быть в однослойном формате. Обработка может длиться в целом около трех дней. В определенных вариантах осуществления можно обрабатывать клетки в течение двух дней, а затем в последний день можно обрабатывать клетки протеолитическими ферментами, коллагенолитическими ферментами или обоими ферментами для получения суспензии отдельных клеток. Полученные клетки можно засевать на поверхность раздела воздух-жидкость или засевать для генерации агрегированных клеток или скоплений клеток. Можно агрегировать одиночные клетки в скопления клеток, имеющие диаметр менее около 100 мкм с последующим культивированием в присутствии ингибитора ALK5 и LDN-193189. В определенных вариантах осуществления можно культивировать клеточные кластеры, имеющие диаметр менее около 100 мкм в среде, в которую добавили около 200 нМ ингибитора ALK5 и около 100 нМ LDN-193189. В альтернативном варианте осуществления культивирование клеток стадии 4 на поверхности раздела воздух-жидкость или в суспензии может значительно увеличивать экспрессию маркеров панкреатической энтодермы и маркеров, относящихся к эндокринным клеткам.
[0120] В одном варианте осуществления способы изобретения включают генерацию клеток стадии 5 путем обработки клеток стадии 4 дифференцировочной средой, которая может представлять собой любую приемлемую среду для выращивания и предпочтительно представляет собой MCDB-131, DMEM или специализированную среду, такую как BLAR (таблица I). В среду можно добавлять один или более из следующих компонентов: (а) ингибитор ALK5, выбранный из группы, состоящей из: ингибитора V рецептора TGF-β, ингибитора I рецептора TGF-β, ингибитора IV рецептора TGF-β, ингибитора VII рецептора TGF-β, ингибитора VIII рецептора TGF-β, ингибитора II рецептора TGF-β, ингибитора VI рецептора TGF-β, ингибитора III рецептора TGF-β, ингибитора рецептора TGF-β SB431542, SD-208, ITD-1, LY2109761, A83-01, LY2157299, ALK5 I и ингибитора II ALK5; (b) гормон щитовидной железы, выбранный из группы, состоящей из Т3, Т4, аналогов Т3, аналогов Т4 и их смесей; (с) антагонист сигнального пути Sonic Hedgehog (SHH), выбранный из SANT-1 или HIP-1; (d) ингибитор рецептора ВМР, выбранный из LDN-193189, ноггина или хордина; (e) ретиноевая кислота; (f) аскорбиновая кислота; (g) гепарин; и (h) сульфат цинка, и культивирование клеток предпочтительно на поверхности раздела воздух-жидкость в течение от около двух до четырех дней, предпочтительно около трех дней для дифференцировки клеток в клетки стадии 5. В другом варианте осуществления в среду для выращивания также добавляют один или оба из ингибитора SMO (такого как MRT10 или циклопамин) и фактора роста фибробластов, выбранного из FGF-7 или FGF-10. Обработку клеток стадии 4 выполняют в течение от около двух до четырех дней предпочтительно около трех дней для дифференцировки клеток в клетки стадии 5.
[0121] В предпочтительном варианте осуществления клетки стадии 4 дифференцируют в клетки стадии 5 путем обработки клеток средой, в которую добавили от около 0,1 мкМ до около 0,4 мкМ SANT-1 и предпочтительно около 0,25 мкМ SANT-1, около 50 нМ RA, от около 0,1 мМ до около 0,5 мМ аскорбиновой кислоты, альтернативно от около 0,2 мМ до около 0,4 мМ и предпочтительно около 0,25 мМ аскорбиновой кислоты, от около 50 нМ до около 200 нМ и предпочтительно около 100 нМ LDN-193189, около 1 мкМ Т3 и около 10 000 нМ ингибитора ALK5, более предпочтительно ингибитора II ALK5. В еще одном варианте осуществления клетки необязательно также обрабатывают от около 1 до 15 мкМ, альтернативно от около 1 до 10 мкМ, альтернативно от около 5 до 10 мкМ, предпочтительно около 10 мкМ сульфата цинка (ZnSO4) и от около 1 до 100 мкг/мл, предпочтительно около 10 мкг/мл гепарина. Обработку клеток стадии 4 выполняют в течение от около двух до четырех дней, предпочтительно около 3 дней для дифференцировки клеток в клетки стадии 5.
[0122] В еще одном варианте осуществления способы изобретения включают получение клеток стадии 5 путем обработки клеток стадии 4 средой, в которую добавили гепарин, ингибитор SMO или антагонист сигнального пути Sonic Hedgehog (SHH), RA, ингибитор рецептора BMP и ингибитор ALK5, и культивирование клеток на поверхности раздела воздух-жидкость на протяжении около 3 дней для дифференцировки клеток в клетки стадии 5. В альтернативном варианте осуществления в среду можно добавлять как ингибитор SMO, так и антагонист сигнального пути Sonic Hedgehog (SHH), а также RA, ингибитор рецептора ВМР и ингибитор ALK5. Таким образом, в одном варианте осуществления клетки стадии 4 можно дифференцировать в клетки стадии 5 путем обработки клеток стадии 4 средой, в которую добавили гепарин, ZnSO4, ингибитор SMO или антагонист сигнального пути Sonic Hedgehog (SHH), RA, LDN-193189 и ингибитор II ALK5. В альтернативном варианте осуществления в среду можно добавлять как ингибитор SMO, так и антагонист сигнального пути Sonic Hedgehog (SHH). В одном варианте осуществления клетки стадии 4 дифференцируют в клетки стадии 5 путем обработки клеток средой, в которую добавили около 10 мкг/мл гепарина, около 0,25 мкМ SANT-1, около 50 нМ RA, около 50 нМ LDN-193189, около 10 нМ Т3 и около 1000 нМ ингибитора ALK5. Приемлемые ингибиторы ALK5 включают в себя, без ограничений, SD-208, ингибитор II ALK5, ингибитор V рецептора TGF-β, ингибитор I рецептора TGF-β, ингибитор IV рецептора TGF-β, ингибитор VII рецептора TGF-β, ингибитор VIII рецептора TGF-β, ингибитор II рецептора TGF-β, ингибитор VI рецептора TGF-β, ингибитор III рецептора TGF-β и их комбинации. Обработку клеток стадии 4 выполняют в течение от около двух до четырех дней, предпочтительно около 3 дней для дифференцировки клеток в клетки стадии 5.
[0123] В предпочтительном варианте осуществления ингибитор ALK5 представляет собой ингибитор II ALK5. В другом предпочтительном варианте осуществления применяют около 10 000 нМ ингибитора II ALK5. В альтернативном предпочтительном варианте осуществления клетки стадии 4 обрабатывают средой, в которую добавили около 10 мкг/мл гепарина, около 0,25 мкМ SANT-1, около 50 нМ RA, около 100 нМ LDN-193189 и около 10 000 нМ (10 мМ) ингибитора II ALK5. В еще одном альтернативном варианте осуществления способы изобретения включают обработку клеток стадии 4 средой, в которую добавили ингибитор SMO или антагонист сигнального пути Sonic Hedgehog (SHH), RA и ингибитор ALK5, и культивирование клеток предпочтительно на поверхности раздела воздух-жидкость или в суспензии на протяжении от около двух до четырех дней, предпочтительно около 3 дней для дифференцировки клеток в клетки стадии 5. В альтернативном варианте осуществления в среду можно добавлять как ингибитор SMO, так и антагонист сигнального пути Sonic Hedgehog (SHH). В одном варианте осуществления клетки стадии 4 дифференцируют в клетки стадии 5 путем обработки клеток средой, в которую добавили около 0,25 мкМ SANT-1, около 50 нМ RA, около 50 нМ LDN-193189, около 1 мкМ T3 и около 1000 нМ ингибитора ALK5.
[0124] Количество клеток, посеянных для культивирования на поверхности раздела воздух-жидкость, может варьироваться. Например, для культивирования клеток на поверхности раздела воздух-жидкость капли суспензии одиночных клеток, содержащей от около 0,5 до 6×105 клеток/мкл, можно высеивать на пористый субстрат (например, фильтр). Суспензия может содержать от около 2×105 клеток/мкл до около 6×105 клеток/мкл; от около 4×105 клеток/мкл до около 6×105 клеток/мкл; от около 5×105 клеток/мкл до около 6×105 клеток/мкл; от около 5×105 клеток/мкл до около 6×105 клеток/мкл; от около 2×105 клеток/мкл до около 5×105 клеток/мкл; от около 2×105 клеток/мкл до около 4×105 клеток/мкл; или около 3×105 клеток/мкл, которые можно высеивать на пористый субстрат, такой как фильтр, размещенный на поверхности раздела воздух-жидкость. В некоторых вариантах осуществления капли суспензии одиночных клеток, содержащие от около 0,5×105 клеток/мкл до около 0,75×105 клеток/мкл; от около 0,6×105 клеток/мкл до около 0,75×105 клеток/мкл; или от около 0,5×105 клеток/мкл до около 0,6×105 клеток/мкл, высеивают на пористую подложку для культивирования на ALI.
[0125] В случае суспензионной культуры скопления клеток получают в планшетах с микролунками, которые впоследствии засевают в систему суспензионной культуры. В вариантах осуществления планшеты Aggrewell™ используют для индуцирования агрегации, в котором засевают от около 50 до 3000 клеток на одну лунку или микролунку для получения агрегированных клеток или скоплений клеток. В частности, засевают от около 50 до около 3000 клеток на одну лунку или микролунку, предпочтительно от около 50 до около 2000 клеток, от около 50 до 1000 клеток, от около 50 до около 900 клеток, от около 50 до около 800 клеток, от около 100 до около 800 клеток, от около 250 до около 800 клеток или от около 500 до около 800 клеток. Более предпочтительно засевают от около 700 до около 800 клеток на одну лунку или микролунку. Агрегированные клетки/скопления клеток засевают в суспензионную культуру с плотностью клеток от около 0,75×106 клеток/мл до около 2,0×106 клеток/мл, предпочтительно от около 1×106 клеток/мл до около 2,0×106 клеток/мл, от около 1,25×106 клеток/мл до около 2,0×106 клеток/мл и более предпочтительно от около 1,5×106 клеток/мл до около 2,0×106 клеток/мл.
[0126] В другом варианте осуществления способы изобретения включают обработку клеток стадии 4 средой, в которую добавили ингибитор рецептора ВМР (например, LDN-193189, ноггин или хордин) и ингибитор ALK5, на протяжении около 1 дня для дифференцировки клеток стадии 4 в клетки стадии 5. Например, в среду можно добавлять около 100 нМ LDN-193189, и около 100 нМ ингибитора ALK5, и около 1 мкМ Т3. Клетки могут находиться в адгезивной плоской культуре или в форме скоплений. В определенных вариантах осуществления клетки можно обрабатывать раствором для разъединения клеток, таким как раствор, содержащий протеолитические и коллагенолитические ферменты, перед культивированием на поверхности раздела воздух-жидкость или культивированием с образованием агрегированных клеток или скоплений клеток.
[0127] В соответствии с вышеупомянутым способом в изобретении дополнительно обеспечивают клеточную культуру для дифференцировки клеток, экспрессирующих маркеры, характерные для панкреатической энтодермы, в клетки, экспрессирующие маркеры, характерные для панкреатических эндокринных клеток-предшественников (панкреатических энтодермальных/панкреатических эндокринных клеток-предшественников), содержащую: (а) сосуд для культивирования; (b) объем среды для выращивания в пределах указанного сосуда, достаточный для заполнения только части объема указанного сосуда; (с) воздух в пределах указанного сосуда, который заполняет часть указанного сосуда, свободную от указанной среды; (d) пористый субстрат, размещенный на поверхности раздела между указанной средой и указанным воздухом; и (е) клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных клеток, полученные из плюрипотентных стволовых клеток, расположенных на поверхности указанного субстрата так, что указанная среда контактирует только с частью поверхности указанных клеток.
[0128] В соответствии с вышеупомянутым способом в альтернативном варианте осуществления изобретения дополнительно обеспечивают клеточную культуру для дифференцировки клеток, экспрессирующих маркеры, характерные для панкреатической энтодермы, в клетки, экспрессирующие маркеры, характерные для панкреатических эндокринных клеток-предшественников (панкреатических энтодермальных/панкреатических эндокринных клеток-предшественников), содержащую: (a) сосуд для культивирования, который облегчает агрегацию клеток или формирование скоплений клеток; (b) объем среды для выращивания (культуральной среды) внутри указанного сосуда; (с) клетки, полученные из плюрипотентных стволовых клеток, расположенные внутри сосуда так, чтобы индуцировать их агрегирование и образование скоплений; и (d) полученные скопления клеток, расположенные в суспензии (суспензионная культура). В вариантах осуществления сосуд для агрегирования клеток представляет собой планшет с лунками или микролунками, такой как планшеты Aggrewell™ (планшеты с микролунками; STEMCELL Technologies Inc., г. Ванкувер, Канада). В вариантах осуществления система суспензионной культуры может включать в себя посев агрегированных клеток или скоплений клеток в сосуд для суспензионной культуры, такой как флакон, например центрифужная пробирка или вращающаяся колба.
[0129] В одном варианте осуществления способы изобретения включают получение клеток стадии 6 путем обработки клеток стадии 5 дифференцировочной средой, которая может представлять собой любую приемлемую среду для выращивания, предпочтительно такую как MCDB-131 или CMRL и более предпочтительно специализированную среду, такую как BLAR (таблица I). В среду можно добавлять один или более из следующих компонентов:
(а) ингибитор ALK5, выбранный из группы, состоящей из: ингибитора V рецептора TGF-β, ингибитора I рецептора TGF-β, ингибитора IV рецептора TGF-β, ингибитора VII рецептора TGF-β, ингибитора VIII рецептора TGF-β, ингибитора II рецептора TGF-β, ингибитора VI рецептора TGF-β, ингибитора III рецептора TGF-β, ингибитора рецептора TGF-β SB431542, SD-208, ITD-1, LY2109761, A83-01, LY2157299, ALK5 I и ингибитора II ALK5; (b) гормон щитовидной железы, выбранный из группы, состоящей из Т3, Т4, их аналогов и их смесей; (c) ингибитор рецептора ВМР, предпочтительно выбранный из LDN-193189, ноггина или хордина; (d) ингибитор гамма-секретазы, такой как ингибитор XX гамма-секретазы, ингибитор XXI гамма-секретазы, ингибитор XVI гамма-секретазы или DAPT; (e) аскорбиновая кислота; (f) гепарин; и (g) сульфат цинка. Клетки можно культивировать, предпочтительно на поверхности раздела воздух-жидкость или в суспензионной культуре, в течение от около двух до четырех, предпочтительно около трех дней для дифференцировки клеток стадии 5 в клетки стадии 6. В среду можно необязательно дополнительно добавлять один или более из антагониста сигнального пути Sonic Hedgehog (SHH), ингибитора рецептора Smoothened, фактора роста фибробластов и ретиноевой кислоты.
[0130] В предпочтительном варианте осуществления клетки стадии 5 можно дифференцировать в клетки стадии 6 путем обработки средой, в которую добавили около 50 нМ RA, около 0,25 мМ аскорбиновой кислоты, около 100 нМ LDN-193189, около 10 000 нМ ингибитора ALK5 и предпочтительно ингибитора II ALK5, 1 мкМ Т3, около 100 нМ ингибитора гамма-секретазы в течение около семи дней. Альтернативно клетки стадии 5 можно дифференцировать в клетки стадии 6 путем обработки клеток средой, в которую добавили около 0,25 мкМ SANT-1, около 50 нМ RA, около 0,25 мМ аскорбиновой кислоты, около 1000 нМ ингибитора ALK5 и 1 мкМ T3 в течение около трех дней. Клетки можно культивировать в такой среде на протяжении дополнительных двух дней или более, если это желательно.
[0131] Альтернативно клетки стадии 5 можно дифференцировать в клетки стадии 6 путем обработки средой, в которую добавили гепарин, ингибитор SMO или антагонист сигнального пути Sonic Hedgehog (SHH), ингибитор ВМР, Т3, Т4, их аналоги и их смеси и ингибитор ALK5, и культивирования предпочтительно на поверхности раздела воздух-жидкость или в суспензионной культуре в течение от около одного до семи дней, альтернативно около шести дней, альтернативно около семи дней. В альтернативном варианте осуществления в среду можно добавлять как ингибитор SMO, так и антагонист сигнального пути Sonic Hedgehog (SHH). Например, клетки можно культивировать в среде, в которую добавили около 10 мкг/мл гепарина, около 0,25 мкМ SANT-1, около 100 нМ LDN-193189, около 1000 нМ Т3 и от около 500 до около 10 000 нМ, альтернативно около 500 нМ, альтернативно около 1000 мМ и альтернативно около 10 000 нМ ингибитора ALK5. Приемлемые ингибиторы ALK5 включают в себя, без ограничений, SD-208, ингибитор II ALK5, ингибитор V рецептора TGF-β, ингибитор I рецептора TGF-β, ингибитор IV рецептора TGF-β, ингибитор VII рецептора TGF-β, ингибитор VIII рецептора TGF-β, ингибитор II рецептора TGF-β, ингибитор VI рецептора TGF-β, ингибитор III рецептора TGF-β и их комбинации.
[0132] В предпочтительном варианте осуществления ингибитор ALK5 представляет собой ингибитор II ALK5. В более предпочтительном варианте осуществления применяют около 10 000 нМ (10 мМ) ингибитора II ALK5. Соответственно, в одном варианте осуществления клетки стадии 5 можно дифференцировать в клетки стадии 6 путем обработки средой, в которую добавили гепарин, ингибитор SMO или антагонист сигнального пути Sonic Hedgehog (SHH), ингибитор ВМР, Т3, Т4, их аналоги и их смеси и ингибитор ALK5, и культивирования предпочтительно на поверхности раздела воздух-жидкость или в суспензии предпочтительно в течение около семи дней. В альтернативном варианте осуществления в среду можно добавлять как ингибитор SMO, так и антагонист сигнального пути Sonic Hedgehog (SHH). В определенных вариантах осуществления клетки можно обрабатывать раствором для разъединения клеток, таким как раствор, содержащий протеолитические и коллагенолитические ферменты, перед культивированием на поверхности раздела воздух-жидкость или в суспензии.
[0133] В другом варианте осуществления клетки стадии 5 можно дифференцировать в клетки стадии 6 путем обработки средой, в которую добавили гепарин, ингибитор SMO или антагонист сигнального пути Sonic Hedgehog (SHH), ингибитор ВРМ, Т3 и ингибитор II ALK5, и культивирования на поверхности раздела воздух-жидкость на протяжении от около 5 дней до около 7 дней, альтернативно около 5 дней, альтернативно около 6 дней, альтернативно около 7 дней В этих вариантах осуществления в среду можно добавлять около 10 мкг/мл гепарина, около 0,25 мкМ SANT-1, около 100 нМ LDN-193189, около 1000 нМ Т3 и около 10 000 нМ ингибитора II ALK5. В определенных вариантах осуществления в среду можно дополнительно добавлять сульфат цинка (ZnSO4). Например, в среду можно дополнительно добавлять около 10 мМ ZnSO4. В альтернативном варианте осуществления в среду можно добавлять как ингибитор SMO, так и антагонист сигнального пути Sonic Hedgehog (SHH).
[0134] В особенно предпочтительном варианте осуществления изобретения в среду добавляют один или более из ингибитора киназы Aurora, предпочтительно ингибитора II киназы Aurora, ингибитора RSK, предпочтительно ингибитора II RSK и ингибитора протеин-метилтрансферазы DOT1L, предпочтительно EPZ-5676. Добавленное количество может составлять от около 100 до 5000 нМ, альтернативно от около 1000 до 5000 нМ, альтернативно от около 2000 до 5000 нМ, альтернативно от около 3000 до 5000 нМ и предпочтительно от около 1000 до 2000 нМ для киназы Aurora и ингибиторов RSK и от около 100 до 1000 нМ для ингибитора DOT1L и более предпочтительно от около 1 мкМ до около 10 нМ.
[0135] В соответствии с вышеупомянутым способом в изобретении дополнительно обеспечивают клеточную культуру для дифференцировки клеток, экспрессирующих маркеры, характерные для панкреатических энтодермальных/эндокринных клеток-предшественников, в клетки, экспрессирующие маркеры, характерные для незрелых бета-клеток, содержащую: (а) сосуд для культивирования; (b) объем среды для выращивания в пределах указанного сосуда, достаточный для заполнения только части объема указанного сосуда; (с) воздух в пределах указанного сосуда, который заполняет часть указанного сосуда, свободную от указанной среды; (d) пористый субстрат, размещенный на поверхности раздела между указанной средой и указанным воздухом; и (e) клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных/эндокринных клеток-предшественников, полученные из плюрипотентных стволовых клеток, расположенных на поверхности указанного субстрата так, что указанная среда контактирует только с частью поверхности указанных клеток.
[0136] В соответствии с вышеуказанным способом в альтернативном варианте осуществления изобретения дополнительно обеспечивают клеточную культуру для дифференцировки клеток, экспрессирующих маркеры, характерные для панкреатических эндокринных клеток-предшественников (или панкреатических энтодермальных/эндокринных клеток-предшественников), в клетки, экспрессирующие маркеры, характерные для незрелых бета-клеток, содержащую: (a) сосуд для культивирования, который облегчает агрегацию клеток или формирование скоплений клеток; (b) объем среды для выращивания (культуральной среды) внутри указанного сосуда; (с) клетки, полученные из плюрипотентных стволовых клеток, расположенные внутри сосуда так, чтобы индуцировать их агрегирование и образование скоплений; и (d) полученные скопления клеток, расположенные в суспензии (суспензионная культура). В вариантах осуществления сосуд для агрегирования клеток представляет собой планшет с лунками или микролунками, такой как планшеты Aggrewell™. В вариантах осуществления система суспензионной культуры может включать в себя посев агрегированных клеток или скоплений клеток в сосуд для суспензионной культуры, такой как флакон, например центрифужная пробирка или вращающаяся колба.
[0137] В одном варианте осуществления клетки стадии 5, полученные в соответствии с вариантами осуществления изобретения, используют и дифференцируют в клетки стадии 6, при этом в других вариантах осуществления в данном способе для получения клеток стадии 6 и 7 можно использовать клетки стадии 5, полученные в соответствии с другими протоколами.
[0138] В варианте осуществления способы изобретения приводят к образованию клеток стадии 6, которые являются положительными в отношении единственного гормона. Таким образом, в одном варианте осуществления способы изобретения приводят к получению клеток стадии 6, которые совместно экспрессируют NKX6.1, инсулин, хромогранин и PDX1. В другом варианте осуществления способы изобретения приводят к получению клеток стадии 6, которые совместно экспрессируют NKX6.1 и инсулин. В определенных вариантах осуществления изобретения способ включает применение специализированной среды (см. таблицу I) на стадиях от 4 до 6, или начиная от поздней стадии 4 до стадии 6, или на стадиях 5 и 6. Среду можно заменять каждый день или альтернативно через день.
[0139] В другом варианте осуществления изобретение относится к способу образования клеток стадии 6, совместно экспрессирующих NKX6.1 и хромогранин, включающему культивирование клеток стадии 4, предпочтительно клеток поздней стадии 4, в клетки стадии 6 на поверхности раздела воздух-жидкость или в суспензии. В еще одном варианте осуществления изобретение относится к способу образования клеток стадии 6, положительных в отношении единственного гормона инсулина и экспрессирующих NKX6.1, путем культивирования клеток стадии 4, предпочтительно клеток поздней стадии 4, в клетки стадии 6 на поверхности раздела воздух-жидкость или в суспензии.
[0140] В одном варианте осуществления способы изобретения включают обработку клеток стадии 6 дифференцировочной средой, которая может представлять собой любую приемлемую среду для выращивания, предпочтительно такую как MCDB-131 или CMRL или и более предпочтительно специализированную среду, такую как BLAR001 (таблица I) или BLAR004 (таблица IV) в течение семи дней.
[0141] В среду добавляют один или более из следующих компонентов: 2,7 г/1000 мл бикарбоната натрия с добавлением ITS-X в разведении 1: 200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 нМ T3 (низкий Т3); 1 мМ N-ацетилцистеина (NAC); 0,5 мкМ ZM447439 (ZM); и следующие компоненты, которые входят в состав I (FI) (таблица XII) - среда RPMI с витаминной добавкой в разведении 1: 200; среда MEM с добавлением заменимых аминокислот в разведении 1: 200; концентрат липидов с определенным химическим составом в разведении 1: 2000; пируват натрия в разведении 1: 200; следовые элементы А (г. Корнинг, № по каталогу 25-021) в разведении 1: 2000; следовые элементы B (г. Корнинг, № по каталогу 25-022) в разведении 1: 2000. Дополнительные соединения, которые можно добавлять для выполнения стадии 7, включают около 10 нМ T3 (низкий Т3); 5 мкМ 5-азацитидина (AZT) (Sigma Aldrich, № по каталогу A2385); или около 1 мкМ 3-деазанепланоцина А (DEZA) (Biovision, Inc., № по каталогу 2060). В вариантах осуществления для получения клеток стадии 7 среда не содержит ингибитора ALK5.
[0142] В одном варианте осуществления клетки стадии 6 можно дифференцировать в клетки стадии 7 путем обработки средой, в которую добавили около 10 нМ Т3, около 0,5 мкМ одного или более из ингибитора II киназы Aurora и около 1 мМ N-ацетилцистеина. В альтернативном варианте осуществления клетки стадии 6 можно дифференцировать в клетки стадии 7 путем обработки средой, в которую добавили гепарин, Т3, Т4, их аналоги или их смеси, антиоксиданты и ингибитор киназы Aurora или их смеси, и культивирования на поверхности раздела воздух-жидкость или в суспензионных культурах в течение от около семи до двадцати одного дня, альтернативно от около семи до десяти дней, предпочтительно около семи дней.
[0143] В соответствии с вышеупомянутым способом в изобретении дополнительно обеспечивают клеточную культуру для дифференцировки клеток, экспрессирующих маркеры, характерные для панкреатических эндокринных клеток-предшественников, в клетки, экспрессирующие маркеры, характерные для функциональных бета-клеток, содержащую: (а) сосуд для культивирования; (b) объем среды для выращивания в пределах указанного сосуда, достаточный для заполнения только части объема указанного сосуда; (с) воздух в пределах указанного сосуда, который заполняет часть указанного сосуда, свободную от указанной среды; (d) пористый субстрат, размещенный на поверхности раздела между указанной средой и указанным воздухом; и (e) клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных/эндокринных клеток-предшественников, полученные из плюрипотентных стволовых клеток, расположенных на поверхности указанного субстрата так, что указанная среда контактирует только с частью поверхности указанных клеток.
[0144] В одном варианте осуществления клетки стадии 6, культивированные в соответствии с вариантами осуществления изобретения, используют и дифференцируют в клетки стадии 7, при этом в других вариантах осуществления в данном способе для получения клеток стадии 7 можно использовать клетки стадии 6, культивированные в соответствии с другими протоколами. В другом варианте осуществления способы изобретения приводят к образованию клеток стадии 7, которые являются положительными в отношении единственного гормона. Таким образом, в одном варианте осуществления способы изобретения приводят к получению клеток стадии 7, которые совместно экспрессируют NKX6.1, хромогранин, PDX1, UCN3, SLC2A1 и MAFA. В другом варианте осуществления способы изобретения приводят к получению клеток стадии 7, которые совместно экспрессируют NKX6.1, PDX1, инсулин, UCN3, SLC2A1 и MAFA. В еще одном варианте осуществления образуется популяция клеток, в которой каждая клетка из по меньшей мере около 10%, альтернативно по меньшей мере около 20%, альтернативно по меньшей мере около 30%, альтернативно по меньшей мере около 40%, альтернативно по меньшей мере около 50%, альтернативно по меньшей мере около 60%, альтернативно по меньшей мере около 70%, альтернативно по меньшей мере около 80% или альтернативно по меньшей мере около 90% популяции клеток экспрессирует инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA.
[0145] В некоторых вариантах осуществления по меньшей мере 10% клеток итоговой клеточной популяции экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA. В других вариантах осуществления по меньшей мере 20% клеток популяции экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA. В других вариантах осуществления по меньшей мере 30% клеток популяции экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA. В еще других вариантах осуществления по меньшей мере 40% клеток популяции экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA. В еще одних вариантах осуществления по меньшей мере 50% клеток популяции экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA. В еще одних вариантах осуществления по меньшей мере 60%, 70%, 80% или 90% клеток экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA. В альтернативных вариантах осуществления по меньшей мере 91, 92, 93, 94, 95, 96, 97, 98 или 99% клеток популяции экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA.
[0146] В определенных и предпочтительных вариантах осуществления изобретения способ использует специализированную среду BLAR (таблица I) на стадиях от 4 до 7, или начиная от поздней стадии 4 до стадии 7, или на стадиях 5, 6 и 7. Среду можно предпочтительно заменять каждый день или альтернативно через день.
[0147] В другом варианте осуществления изобретение относится к способу образования клеток стадии 7, совместно экспрессирующих NKX6.1, PDX1, MAFA, UCN3, SLC2A1 и хромогранин, включающему культивирование клеток стадии 4, предпочтительно клеток поздней стадии 4, в клетки стадии 7 на поверхности раздела воздух-жидкость или в суспензии. В еще одном варианте осуществления изобретение относится к способу образования клеток стадии 7, положительных в отношении единственного гормона инсулина (функциональные бета-клетки) и экспрессирующих NKX6.1, PDX1, UCN3, SLC2A1 и MAFA, путем культивирования клеток стадии 4, предпочтительно клеток поздней стадии 4, в клетки стадии 7 на поверхности раздела воздух-жидкость или в суспензии.
[0148] Хотя настоящее изобретение предусматривает культивирование на поверхности раздела воздух-жидкость на всех стадиях пути от плюрипотентной клетки до панкреатической эндокринной клетки, в изобретении обеспечено образование клеток стадии от 1 до 4 в плоской или погруженной культуре и клеток стадии 5, 6 и 7 путем культивирования клеток на поверхности раздела воздух-жидкость или в суспензионной культуре. В других вариантах осуществления настоящее изобретение относится к способу поэтапной дифференцировки плюрипотентных клеток, включающему культивирование клеток на стадиях 4, 5 и 6 на поверхности раздела воздух-жидкость. В определенных вариантах осуществления клетки, культивированные в течение стадий от 4 до 7, можно культивировать на поверхности раздела воздух-жидкость. В других вариантах осуществления на поверхности раздела воздух-жидкость или в суспензии культивируют только клетки от поздней стадии 4 до стадии 6 или клетки стадии 5 и стадии 6. В еще одном альтернативном варианте осуществления стадии от 1 до 4 выполняют путем культивирования клеток в плоских культурах, а стадии от 5 до 7 или стадии от 6 до 7 или только стадию 7 выполняют путем культивирования в суспензионной культуре.
[0149] Культивирование в течение одной или всех из стадий 5, 6 и 7 дополнительно выполняют в присутствии одного или более из Т3, Т4, их аналогов и ингибитора ALK5 или одного или более из Т3, Т4 и их аналогов; или ингибитора ALK5. В предпочтительных вариантах осуществления культивирование в течение одной или более и всех из стадий 5, 6 и 7 предпочтительно выполняют в присутствии Т3 и ингибитора ALK5 и более предпочтительно в присутствии Т3 и ингибитора II ALK5. В более предпочтительных вариантах осуществления культивирование во время стадии 7 выполняют в присутствии T3 в низкой концентрации. В предпочтительных вариантах осуществления культивирование во время стадии 7 выполняют без добавления ингибитора ALK5.
[0150] При культивировании клеток на поверхности раздела воздух-жидкость (ALI) клетки можно культивировать на пористом субстрате так, что клетки находятся в контакте с воздухом на верхней стороне и с клеточной культуральной средой на нижней стороне. Например, можно добавлять достаточный объем среды на дно сосуда для культивирования, содержащего пористый субстрат (например, фильтрующую вставку), так, что среда будет контактировать с нижней поверхностью клеток, расположенных на субстрате, но не будет герметизировать или погружать их. Приемлемые пористые субстраты можно формировать из любого материала, который не окажет отрицательного влияния на рост и дифференцировку клеток. Примеры пористых субстратов изготавливают из полимеров, таких как полиэтилентерефталат (РЕТ), полиэфир или поликарбонат. Приемлемые пористые субстраты могут быть с покрытием или без покрытия. В одном варианте осуществления покрытие может представлять собой MATRIGEL™. В другом варианте осуществления изобретения пористый субстрат представляет собой пористую фильтрующую вставку, которую можно покрывать MATRIGEL™. В другом варианте осуществления изобретения пористый субстрат представляет собой фильтрующую вставку без покрытия. Пористость субстрата должна быть достаточной для поддержания жизнеспособности клетки и стимуляции дифференцировки клеток.
[0151] Культивирование клеток на поверхности раздела воздух-жидкость включает в себя посев клеток на пористый субстрат, такой как пористая фильтрующая вставка. В определенных вариантах осуществления размер пор в субстрате может находиться в диапазоне от около 0,3 до около 3 мкм. Можно выполнять посев путем высвобождения одиночных клеток из однослойных культур или скоплений клеток из однослойных культур в суспензию и последующего аликвотирования суспензии из одиночных клеток или взвешенной клеточной культуры на пористый субстрат на поверхности раздела воздух-жидкость. Клетки можно засевать на пористый субстрат из суспензии, имеющей от около 1000 клеток/мкл до около 100 000 клеток/мкл. Клетки можно высеивать в виде капель клеточной суспензии, содержащей отдельные клетки или агрегаты или скопления клеток. В определенном варианте осуществления клетки можно культивировать на поверхности раздела воздух-жидкость с использованием способов, изложенных в публикации заявки на патент США № 2014/0186305, описание которой включено в настоящий документ, так как она относится к культивированию и дифференцировке плюрипотентных стволовых клеток на поверхности раздела воздух-жидкость.
[0152] Среду можно менять или обновлять через день или предпочтительно каждый день. Клетки, выросшие на верхней стороне пористого субстрата, по существу не являются одиночными клетками, но чаще они находятся в форме пласта или существуют в виде агрегированного скопления клеток. Клетки, культивированные на ALI, могут испытывать большее давление кислорода по сравнению с клетками, погруженными в среду.
[0153] В определенных вариантах осуществления способы изобретения можно выполнять путем культивирования и дифференцировки клеток в виде скоплений в суспензионной культуре. Примерные приемлемые способы для получения суспензионной культуры и дифференцировки плюрипотентных стволовых клеток описаны в заявках на патент США № 2014/0242693 и 2014/0295552, описания которых включены в настоящий документ, так как они относятся к культивированию и дифференцировке плюрипотентных стволовых клеток с использованием скоплений в суспензии. В конкретных вариантах осуществления настоящего изобретения обеспечивают клеточную культуру in vitro, включающую дифференцировку клеток, полученных в виде агрегированных клеток, таких как скопления клеток, включающую посев клеток в сосуд для культивирования, который облегчает агрегирование клеток или образование скоплений клеток, содержащий среду для выращивания (культуральную среду) так, что клетки индуцируют агрегирование и образование скоплений. В вариантах осуществления сосуд, используемый для индуцирования агрегирования клеток, представляет собой планшет с лунками или микролунками, такой как планшеты Aggrewell™. Полученные агрегированные клетки или скопления клеток дополнительно культивируют в суспензии (суспензионная культура), включая удаление агрегированных клеток/скоплений клеток из микролунок и их посев в сосуд для суспензионной культуры так, чтобы дифференцировать агрегированные клетки в суспензии.
[0154] Варианты осуществления настоящего изобретения включают в себя образование клеток, начиная от поздней стадии 4 до стадии 7, предпочтительно клеток стадий от 5 до 7, на поверхности раздела воздух-жидкость или в суспензии. Клетки можно получать путем дифференцировки плюрипотентных столовых клеток или путем дополнительного дифференцировки клеток стадий 3, 4, 5 или 6. Клетки стадии 4 можно культивировать полностью на поверхности раздела воздух-жидкость или клетки можно культивировать в погруженной плоской культуре во время раннего периода стадии 4 (от около одного до двух дней) и впоследствии культивировать на поверхности раздела воздух-жидкость или в суспензии во время позднего периода стадии 4 (от около второго до третьего дня). Стадию 4 предпочтительно выполняют не на ALI или в суспензии, а в погруженной культуре.
[0155] В одном варианте осуществления настоящего изобретения предложен способ получения клеток, экспрессирующих маркеры, характерные для функциональных бета-клеток, из плюрипотентных стволовых клеток, включающий: культивирование плюрипотентных стволовых клеток; дифференцировку плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для панкреатической энтодермы; и дифференцировку клеток, экспрессирующих маркеры, характерные для панкреатической энтодермы, в клетки, экспрессирующие маркеры, характерные для панкреатических эндокринных клеток, путем культивирования на поверхности раздела воздух-жидкость или в суспензии. Способ может включать обработку средой, в которую добавили: (i) T3, T4 или их аналоги; (ii) ингибитор ALK5; или как (i), так и (ii). Способ может включать дифференцировку клеток, экспрессирующих маркеры, характерные для клеток энтодермы передней кишки (клетки стадии 3), в клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных клеток (клетки стадии 4), путем обработки средой, в которую добавили: (i) один или оба из Т3, Т4 или их аналогов; (ii) ингибитор ALK5; или как (i), так и (ii); и культивирование в плоской культуре. Способ может также включать дифференцировку клеток, экспрессирующих маркеры, характерные для панкреатических энтодермальных клеток (клетки стадии 4), в клетки, экспрессирующие маркеры, характерные для незрелых бета-клеток (клетки стадии 6), путем обработки средой, в которую добавили: (i) один или оба из Т3, Т4 или их аналогов; (ii) ингибитор ALK5; или как (i), так и (ii); и культивирование в плоской культуре или культивирование на поверхности раздела воздух-жидкость или в суспензии. Способ дополнительно включает дифференцировку клеток стадии 6 в клетки, экспрессирующие маркеры, характерные для функциональных бета-клеток, и которые имеют более зрелый фенотип по сравнению с клетками стадии 6 (клетки стадии 7), путем обработки средой, в которую добавили: (i) один или оба из Т3, Т4 или их аналогов; (ii) ингибитор ALK5; или как (i), так и (ii); а также один или более из ингибитора киназы Aurora, ингибитора RSK и ингибитора протеин-метилтрансферазы DOT1L и необязательно антиоксиданта, такого как витамин Е или ацетилцистеин. Предпочтительное количество ацетилцистеина составляет от около 0,1 до около 2 мМ. Предпочтительное количество витамина Е составляет от около 0,1 до около 10 мкМ. В еще одном варианте осуществления способ дополнительно включает выполнение стадии 6 путем обработки клеток стадии 5 средой, в которую добавили: (i) один или оба из Т3, Т4 или их аналогов; (ii) ингибитор ALK5 или; как (i), так и (ii); а также один или более из ингибитора гамма-секретазы, ингибитора RSK и ингибитора протеин-метилтрансферазы DOT1L. В еще одном варианте осуществления стадию 6 выполняют путем обработки клеток стадии 5 средой, в которую добавили: (i) один или оба из Т3, Т4 или их аналогов; (ii) ингибитор ALK5; или как (i), так и (ii); а также один или более из ингибитора гамма-секретазы, ингибитора RSK и ингибитора протеин-метилтрансферазы DOT1L с последующим выполнением стадии 7 путем обработки средой, в которую добавили: (i) один или оба из Т3, Т4 или их аналогов; (ii) ингибитор ALK5; или как (i), так и (ii); а также один или более из ингибитора киназы Aurora, ингибитора RSK, ингибитора протеин-метилтрансферазы DOT1L и необязательно антиоксиданта, такого как витамин Е или ацетилцистеин.
[0156] Один вариант осуществления изобретения представляет собой способ образования функциональных бета-клеток (панкреатических эндокринных клеток, экспрессирующих маркеры, характерные для зрелого фенотипа) (клетки стадии 7), включающий дифференцировку клеток, экспрессирующих маркеры, характерные для панкреатических энтодермальных клеток (клетки стадии 4), в клетки, экспрессирующие маркеры, характерные для клеток стадии 7, путем культивирования на поверхности раздела воздух-жидкость или в суспензии. Клетка, экспрессирующая маркеры, характерные для функциональных бета-клеток более зрелого фенотипа, экспрессирует PDX1 и по меньшей мере один из следующих факторов транскрипции: NKX2.2, NKX6.1, NeuroD1, ISL1, HNF3β, MAFA, UCN3, SLC2A1, PAX4, HB9 и PAX6. В одном из вариантов осуществления методы изобретения приводят к образованию клеток стадии 6, которые являются положительными для NKX6.1, PDX1, HB9 и MAFA. Предпочтительно по меньшей мере во время стадий от 5 до 7 способ включает обработку средой, в которую добавили T3, T4 или их аналоги, ингибитор ALK5 или и то и другое. Клетки стадии 6 могут быть клетками, которые являются положительными для NKX6.1, PDX1, HB9 и MAFA. В других вариантах осуществления клетки стадии 6 или 7 являются положительными для одного гормона. Например, клетки стадии 6 и 7 могут представлять собой клетки, которые: (a) совместно экспрессируют NKX6.1 и хромогранин; (b) совместно экспрессируют NKX6.1 и инсулин; и (c) совместно экспрессируют NKX6.1, PDX1, MAFA и единственный гормон инсулин. Клетки стадии 7 экспрессируют единственный гормон инсулин и MAFA на повышенных уровнях и содержат большее число клеток внутри популяции клеток по сравнению с клетками стадии 6.
[0157] В другом варианте осуществления изобретения предложен способ увеличения числа клеток, положительных в отношении единственного гормона (например, клетки, которые совместно экспрессируют NKX6.1 и инсулин, или клетки, которые совместно экспрессируют NKX6.1 и хромогранин, путем культивирования и дифференцировки популяции клеток, совместно экспрессирующих PDX1 и NKX6.1, предпочтительно на поверхности раздела воздух-жидкость или в суспензии. В другом варианте осуществления панкреатические энтодермальные клетки, культивированные на поверхности раздела воздух-жидкость или в суспензии, дополнительно дифференцируют до функциональных бета-клеток путем обработки соединением, выбранным из следующего: ингибитор ALK5, ингибитор ВМР, ингибитор гамма-секретазы, Эфрин лиганды, ингибитор EphB, ингибитор РКС, ингибитор EGFr, ретиноевая кислота, витамин С, Т3/Т4, глюкоза, регуляторы клеточного цикла, регуляторы WNT, ингибитор SHH, ингибитор Aurora, антиоксиданты, витамин Е, ацетилцистеин или их комбинации.
[0158] В дополнительных вариантах осуществления настоящее изобретение относится к способу поэтапного дифференцировки плюрипотентных клеток, который включает культивирование клеток стадии от 4 до 6 в среде, содержащей достаточные количества: (i) одного или более из Т3, Т4 или их аналогов; (ii) ингибитор ALK5; или как (i), так и (ii); и дополнительное культивирование клеток стадии 6 в среде, которая необязательно содержит один или более из ингибитора киназы Aurora, ингибитора RSK, и ингибитора протеин-метилтрансферазы DOT1L, и антиоксиданта для генерации функциональных бета-клеток (панкреатические эндокринные клетки зрелого фенотипа) и популяций функциональных бета-клеток, которые экспрессируют инсулин, PDX1, NKX6.1, UCN3, SLC2A1 и MAFA.
[0159] Клетки стадии 6 и 7, полученные в соответствии со способами, описанными в настоящем документе, также хорошо подходят для применения в соединениях, используемых для скрининга, из-за их влияния на секрецию панкреатических гормонов и эндокринных маркеров. В частности, клетки стадии от 4 до 7, культивированные на ALI или в суспензионной культуре, выполнены с возможностью тестирования в различных формах для культивирования, содержащих от 384 до 6 лунок. Такие формы позволяют оценивать множество малых молекул или биологических препаратов в различных дозах и временных интервалах в отношении последующей экспрессии маркеров панкреатических энтодермальных клеток, панкреатических эндокринных клеток-предшественников, панкреатических эндокринных клеток и панкреатических бета-клеток. Такое оценивание можно выполнять путем измерения экспрессии генов с помощью ПЦР, экспрессии белков с помощью FACS, или иммуноокрашивания, или с помощью ИФА в отношении секреции факторов клетками, подвергнутыми воздействию малых молекул/биологических препаратов.
F. Клетки, выполненные с возможностью получения способами изобретения
[0160] В изобретении обеспечивают клетки стадии 7 или популяцию клеток стадии 7, которую можно получать способом изобретения. В определенных вариантах осуществления клетки или популяции клеток не очищают после дифференцировки. В определенных вариантах осуществления эти клетки стадии 7 экспрессируют единственный гормон инсулин и являются PDX1-, NKX6.1-, UCN3-, SLC2A1- и MAFA-положительными; кроме того, эти клетки имеют более высокий уровень экспрессии MAFA, чем клетки стадии 6. Клетки экспрессируют UCN3 на более высоком уровне, чем клетки стадии 6 (незрелые бета-клетки). Полученная популяция клеток имеет более высокий процент MAFA-положительных и экспрессирующих единственный гормон инсулин клеток, чем клетки стадии 6. В изобретении также обеспечивают инсулин-положительную клетку или популяцию инсулин-положительных клеток, экспрессирующую маркеры, характерные для функциональных бета-клеток (панкреатические эндокринные клетки зрелого фенотипа), которая характеризуется экспрессией NKX6.1 (предпочтительно более около 30%), экспрессией PDX1 (предпочтительно более около 30%), экспрессией UCN3 (предпочтительно более около 10%), экспрессией SLC2A1 (предпочтительно более около 10%) и экспрессией MAFA (предпочтительно более около 10%).
[0161] В вариантах осуществления изобретения клетки или популяции клеток стадии 7 представляют собой инсулинпродуцирующие клетки или популяцию инсулинпродуцирующих клеток. Инсулинпродуцирующие клетки представляют собой функционально зрелые бета-клетки, которые показывают реакцию в виде митохондриального дыхания/активности и GSIS на глюкозу, аналогичную подобной в человеческих островковых клетках. В вариантах осуществления изобретения функционально зрелые бета-клетки получают в суспензионной культуре.
[0162] В вариантах осуществления функциональные бета-клетки показывают стимулированную глюкозой секрецию инсулина и глюкозозависимое митохондриальное дыхание. В вариантах осуществления стимулированная глюкозой секреция инсулина и глюкозозависимое митохондриальное дыхание аналогичны подобным в человеческих островковых клетках. В вариантах осуществления изобретения функциональная бета-клетка секретирует инсулин во множестве фаз.
[0163] В вариантах осуществления глюкозозависимое митохондриальное дыхание имеет максимальную реакцию в виде увеличения скорости потребления кислорода после стимуляции глюкозой в диапазоне от около 20% до около 80% сверх исходной скорости потребления кислорода, предпочтительно от около 20% до около 70%, от около 20% до около 60%, более предпочтительно около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75% или около 80%. В вариантах осуществления реакция в виде увеличения скорости потребления кислорода происходит по меньшей мере по истечении от 10 минут до около 15 минут после стимуляции глюкозой, предпочтительно по истечении около 10 минут, около 11 минут, около 12 минут, около 13 минут, около 14 минут, около 15 минут. В вариантах осуществления более высокую скорость потребления кислорода по сравнению с исходной OCR сохраняют в течение от по меньшей мере 60 минут до по меньшей мере 80 минут, предпочтительно от по меньшей мере 70 минут до по меньшей мере 80 минут, более предпочтительно по меньшей мере 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 минут.
[0164] В указанных выше вариантах осуществления стимулированная глюкозой секреция инсулина представляет собой быструю двухфазную секрецию инсулина в ответ на стимуляцию глюкозой. В вариантах осуществления в первой фазе двухфазной секреции инсулина наблюдается увеличение секреции от по меньшей мере четырех до по меньшей мере восьми раз по сравнению с секрецией на исходном уровне, предпочтительно по меньшей мере увеличение в четыре раза, увеличение в пять раз, увеличение в шесть раз, увеличение в семь раз или увеличение в восемь раз по сравнению с секрецией на исходном уровне. В вариантах осуществления во второй фазе двухфазной секреции инсулина наблюдается увеличение секреции от по меньшей мере двух раз до по меньшей мере четырех раз по сравнению с секрецией на исходном уровне, предпочтительно по меньшей мере увеличение в два раза, увеличение в три раза или увеличение в четыре раза по сравнению с секрецией на исходном уровне. В вариантах осуществления секреция инсулина происходит в интервале от по меньшей мере пяти минут до по меньшей мере десяти минут после стимуляции глюкозой, предпочтительно через по меньшей мере 5 минут, через по меньшей мере 6 минут, через по меньшей мере 7 минут, через по меньшей мере 8 минут, через по меньшей мере 9 минут или через по меньшей мере 10 минут после стимуляции глюкозой.
[0165] В таблице А и В показаны примерные условия культивирования, приемлемые для применения в вариантах осуществления изобретения. В таблицах A и B, представленных ниже, «MCX» является «соединением МСХ», «АА» представляет собой активин, «ALK5 инг.» является ингибитором ALK5, «RA» представляет собой ретиноевую кислоту, «Вит. С» является аскорбиновой кислотой, «инг.» представляет собой ингибитор, «акт.» - активатор. В некоторых вариантах осуществления можно комбинировать любую одну обработку на одной стадии (т. е. на любой из стадий 1, 2, 3, 4, 5, 6 или 7) с любым одним видом обработки на других стадиях (т. е. на любой одной из стадий 1, 2, 3, 4, 5, 6 или 7). В других вариантах осуществления клетки стадии 4, полученные способами, отличными от приведенных в таблице А, можно дифференцировать в клетки стадии от 5 до 7 с использованием условий культивирования, показанных в таблице В. В других вариантах осуществления клетки стадии 5, полученные способами, отличными от приведенных в таблицах А и В, можно дифференцировать в клетки стадии 6 или стадии 7 с использованием условий культивирования, показанных в таблице В. В еще одних вариантах осуществления клетки стадии 6, полученные способами, отличными от приведенных в таблицах А и В, можно дифференцировать в клетки стадии 7 с использованием условий культивирования, показанных в таблице В.
меньшей мере
2% FAF-BSA
в альтернативном варианте осуществления клетки перемещают в скопления; скопления клеток или роллерные флаконы
ZnSO4
инг ALK5
Замена гормона T3 гормоном T4 или аналогом гормона щитовидной железы
AZT
DEZA
[0166] Публикации, цитируемые в настоящем документе, полностью включены в настоящий документ путем ссылки. Настоящее изобретение дополнительно иллюстрируют, без ограничений, следующими неограничивающими примерами.
ПРИМЕРЫ
[0167] Поставщики материалов и соединений, использованных в следующих примерах, приведены в таблице Х.
Пример 1.
Скрининг и идентификация малых молекул, которые усиливают экспрессию MAFA или UCN3
[0168] Следующий пример относится к идентификации малых молекул, которые могут улучшать статус созревания панкреатической бета-клетки посредством увеличения генной экспрессии маркеров зрелой бета-клетки, включая MAFA (гомолог А онкогена мышечно-апоневротической фибросаркомы v-maf) или UCN3 (урокортин 3). Клетки линии человеческих эмбриональных стволовых клеток H1 (H1-hESC) со средой EZ8 при пассаже 28 засевали в виде отдельных клеток с плотностью 0,094×106 клеток/см2 на MATRIGEL™ в разведении 1: 30 на чашки Петри с покрытием в модифицированную по способу Дульбекко среду Игла со смесью питательных веществ F-12 (DMEM-F12), содержащую GlutaMAX™ в разведении 1: 100 (концентрация 1X), 0,25 мМ аскорбиновой кислоты, 100 нг/мл фактора 2 роста фибробластов (FGF2), 1 нг/мл трансформирующего фактора роста бета (TGFβ), инсулин-трансферрин-селен-этаноламин (ITS-X) в разведении 1: 100, не содержащий жирных кислот 2%-й бычий сывороточный альбумин (FAF-BSA) и 20 нг/мл инсулиноподобного фактора-1 роста (IGF-1), в которую добавили 10 мкМ ингибитора Rock Y-27632 (соединение Y). Соединение Y добавляли только в течение первых 24 часов после посева. Спустя сорок восемь часов после посева культуры промывали в неполном фосфатно-солевом буферном растворе без магния или кальция (PBS).
[0169] Для ФИГ. 1A-1H культуры дифференцировали, используя следующий протокол. На протяжении стадий с 1 по 4 протокола культуры поддерживали в виде плоских адгезивных культур.
а. Стадия 1 (3 дня). Клетки культивировали в течение одного дня в следующей среде стадии 1: среда MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия (Sigma-Aldrich Co. LLC, г. Сент-Луис, штат Миссури, США, № по каталогу 5761) и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в разведении 1: 100 (концентрация 1Х), 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл ростового фактора 8 дифференцировки (GDF8) и 1,5 мкМ 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло [19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-она (соединение MCX). Впоследствии клетки культивировали в течение дополнительного дня в среде MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 0,1 мкМ соединения MCX. Впоследствии клетки культивировали в течение дополнительного дня в MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы и 100 нг/мл GDF8.
b. Стадия 2 (2 дня). Клетки обрабатывали в течение двух дней средой MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, 1X GlutaMAX™, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 0,25 мМ аскорбиновой кислоты и 50 нг/мл фактора 7 роста фибробластов (FGF7).
c. Стадия 3 (2 дня). Клетки обрабатывали в течение двух дней специализированной средой BLAR001 (см. таблицу I), которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 25 нг/мл FGF7; 0,25 мкМ SANT-1 (N-[(3,5-диметил-1-фенил-1H-пиразол-4-ил)метилен]-4-(фенилметил)-1-пиперазинамин); 1 мкM ретиноевой кислоты (RA); 0,25 мМ аскорбиновой кислоты; 300 нМ активатора PKC ((2S, 5S-(E,E)-8-(5-(4-трифторметил)фенил-2,4,-пентадиеноиламино)бензолактам (TPB); и ингибитор рецептора костного морфогенетического белка (BMP) LDN-193189-HCl (LDN-HCl) в течение двух дней. Концентрация LDN-HCl, используемая в первый день стадии 3, составляла 100 нМ, а во второй день стадии 3-10 нМ.
d. Стадия 4 (3 дня). Клетки обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 2% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 50 нМ LDN-HCl; 0,25 мМ аскорбиновой кислоты; и 200 нM TPB в течение трех дней. В конце стадии 4 (3 дня) клетки, культивированные на плоских чашках Петри, высевали на поверхности раздела воздух-жидкость (ALI). В частности, клетки обрабатывали в течение 4 часов 10 мкМ Y-27632, полоскали PBS и обрабатывали в течение приблизительно 2 минут ферментом TrypLE™ Express Enzyme в концентрации 1X с последующим удалением фермента и удалением клеток с поверхности MATRIGEL™ путем аккуратного постукивания по флакону. Полученную клеточную суспензию высевали с плотностью 0,5-1,0×106 клеток (аликвотами объемом 5 мкл) на пористые фильтры-вкладыши для клеточной культуры с размером пор 0,4 мкм или 3,0 мкм, расположенные на планшетах размером 10 см. 8,0 мл среды добавляли на дно каждой вставки, а на верхушку или верхнюю часть фильтра дополнительную среду не добавляли. Среду меняли ежедневно в течение стадий 5, 6 и 7.
e. Стадия 5 (3 дня). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 0,25 мкM SANT-1; 50 нM RA; 100 нМ LDN-HCl; 1 мкМ T3 в форме 3,3´, 5-трийод-L-тиронина натриевой соли; 10 мкМ 2-(3-(6-метилпиридин-2-ил)-1H-пиразол-4-ил)-1,5-нафтиридина (ингибитор II ALK5 или ALK5) в течение трех дней.
f. Стадия 6 (7 дней). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина; 10 мкМ ZnSO4; 100 нМ LDN-HCl; 1 мкМ T3; 10 мкM ингибитора II ALK5; и 100 нМ (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамида («ингибитор гамма-секретазы XX») в течение семи дней.
g. Стадия 7 (7 дней). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 1 мкМ T3; 10 мкM ингибитора II ALK5; 1 мМ N-ацетилцистеина (NAC).
Кроме того, в течение стадии 7 (S7) для ФИГ. 1A-1H клетки обрабатывали 20 мМ D-глюкозы с витаминной добавкой BME (разведение 1: 100 концентрации 100X) и подвергали воздействию всех 79 малых молекул, перечисленных и описанных в таблице XI. Из 79 малых молекул следующие соединения индуцировали экспрессию MAFA или UCN3: (i) зебуларин; (ii) ломегуатриб; (iii) 5-азацитидин; (iv) митоксантрона дигидрохлорид; (v) EGCG; (vi) физетин; (vii) SGI 1027; (viii) темозоломид; (ix) L002; (x) C646; и (xi) SGC0946.
[0170] Культуры дифференцировали для ФИГ. 2A-2B с использованием следующего протокола: во время стадии от 1 до 4 протокола культуры поддерживали на плоских адгезивных культурах.
а. Стадия 1 (3 дня). Клетки культивировали в течение одного дня в следующей среде стадии 1: среда MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в разведении 1: 100 (концентрация 1Х), 4,5 мМ D-глюкозы для получения концентрации D-глюкозы 10 мМ, 100 нг/мл ростового фактора 8 дифференцировки (GDF8) и 1,5 мкМ 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло [19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-она (соединение MCX). Впоследствии клетки культивировали в течение дополнительного дня в среде MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 0,1 мкМ соединения MCX. Впоследствии клетки культивировали в течение дополнительного дня в MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы и 100 нг/мл GDF8.
b. Стадия 2 (2 дня). Клетки обрабатывали в течение двух дней средой MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, 1X GlutaMAX™, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 0,25 мМ аскорбиновой кислоты и 50 нг/мл фактора 7 роста фибробластов (FGF7).
c. Стадия 3 (2 дня). Клетки обрабатывали в течение двух дней специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; 1X GlutaMAX™; 1% FAF-BSA; 25 нг/мл FGF7; 0,25 мкМ SANT-1 (N-[(3,5-диметил-1-фенил-1H-пиразол-4-ил)метилен]-4-(фенилметил)-1-пиперазинамин); 1 мкM ретиноевой кислоты (RA); 0,25 мМ аскорбиновой кислоты; 300 нМ активатора PKC ((2S, 5S-(E,E)-8-(5-(4-трифторметил)фенил-2,4,-пентадиеноиламино)бензолактам (TPB); и ингибитор рецептора костного морфогенетического белка (BMP) LDN-193189-HCl (LDN-HCl) в течение двух дней. Концентрация LDN-HCl, используемая в первый день стадии 3, составляла 100 нМ, а во второй день стадии 3-50 нМ.
d. Стадия 4 (3 дня). Клетки обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 1% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 70 нМ LDN-HCl; 0,25 мМ аскорбиновой кислоты; и 200 нM TPB в течение трех дней. В конце стадии 4 (3 дня) клетки, культивированные на плоских чашках Петри, высевали на поверхности раздела воздух-жидкость (ALI). В частности, клетки обрабатывали в течение 4 часов 10 мкМ Y27632, полоскали PBS и обрабатывали в течение приблизительно 2 минут ферментом TrypLE™ Express Enzyme в концентрации 1X с последующим удалением фермента и удалением клеток с поверхности MATRIGEL™ путем аккуратного постукивания по флакону. Полученную клеточную суспензию высевали с плотностью 0,5-1,0×106 клеток (аликвотами объемом 5 мкл) на пористые фильтры-вкладыши для клеточной культуры с размером пор 0,4 мкм или 3,0 мкм, расположенные в планшетах размером 10 см. 8,0 мл среды добавляли на дно каждой вставки, а на верхушку или верхнюю часть фильтра дополнительную среду не добавляли. Среду меняли ежедневно в течение стадий 5, 6 и 7.
e. Стадия 5 (3 дня). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 0,25 мкM SANT-1; 50 нM RA; 100 нМ LDN-HCl; 1 мкМ T3 в форме 3,3´, 5-трийод-L-тиронина натриевой соли; 10 мкМ 2-(3-(6-метилпиридин-2-ил)-1H-пиразол-4-ил)-1,5-нафтиридина (ингибитор II ALK5 или ALK5) в течение трех дней.
f. Стадия 6 (7 дней). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 100 нМ LDN-HCl; 1 мкМ T3; 10 мкM ингибитора II ALK5; и 100 нМ (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамида («ингибитор гамма-секретазы XX») в течение семи дней.
g. Стадия 7 (7 дней). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 нМ T3 (низкий Т3); 1 мМ N-ацетилцистеина (NAC).
Для ФИГ. 2A и 2B в течение семи дней дополнительно добавляли 0,5 мкМ ZM447439 (ZM); и следующие компоненты, которые входят в состав I (FI) (таблица XII) - среда RPMI с витаминной добавкой в разведении 1: 200; среда MEM с добавлением заменимых аминокислот в разведении 1: 200; концентрат липидов с определенным химическим составом в разведении 1: 2000; пируват натрия в разведении 1: 200; следовые элементы А в разведении 1: 2000; и следовые элементы В в разведении 1: 2000. Дополнительные соединения, добавленные во время стадии 7, включали в себя или 5 мкМ 5-азацитидина (AZT); или 1 мкМ или 10 мкМ 3-деазанепланоцина А (DEZA).
[0171] В вариантах осуществления, описанных в настоящем документе, используют среду BLAR собственного изготовления, а именно среду BLAR001 или BLAR004. Среда BLAR была впервые описана в PCT/US13/75939 и заявке на патент США № 13/998,884, поданных 18 декабря 2013 г., которые испрашивают преимущество в соответствии с заявкой 61/747,662, поданной 31 декабря 2012 г.; а впоследствии снова в публикации Rezania et al. (2014) Nature Biotech, 32 (11) 1124-1134, дополнительная таблица 3 (опубликовано онлайн 11 сентября 2014 г.), ссылки на которую полностью включены в настоящий документ. BLAR001 и BLAR004 отличаются по концентрациям или уровням перечисленных агентов или эксципиентов.
[0172] Как правило, в вариантах осуществления настоящего изобретения дифференцировку человеческих плюрипотентных клеток выполняют, как по существу описано выше в стадиях 1-7. На стадии 7 добавляли различные малые молекулы и оценивали их влияние с помощью количественной ПЦР в реальном времени. В таблице II перечислены малые молекулы и их мишени. Эти малые молекулы оценивали и добавляли 2 мкМ каждой молекулы на стадии7. Химические названия и структуры соединений, исследованных в данном примере, показаны в таблице XI.
[0173] Количественный анализ и определение характеристик дифференцированных клеток. Для количественного анализа экспрессии генов на различных стадиях клетки человеческих островков, H1-hESC, 7-го дня 6-й стадии (S6D7) и от 7-го дня 7-й стадии до 14-го дня 7-й стадии (S7D7-S7D14) собирали в виде скоплений на ALI, как по существу описано в публикации Rezania et al (2014), выше. Экспрессию генов оценивали с использованием специально изготовленных матриц Taqman Arrays (Applied Biosystems, г. Фостер Сити, штат Калифорния, США). Данные анализировали с использованием программного обеспечения Sequence Detection (Applied Biosystems, г. Фостер Сити, штат Калифорния, США) и нормализовали, используя GAPDH в качестве конститутивного гена недифференцированных клеток H1-hESC, применяя метод ΔΔCt. Информация о праймерах представлена в таблице III.
Таблица III. Перечень праймеров для количественной ПЦР в реальном времени (RT-qPCR)
[0174] ФИГ. 1A-1D представляют собой графики, показывающие данные количественного анализа ПЦР в реальном времени экспрессии MAFA после обработки малыми молекулами, в котором различные малые молекулы увеличивают экспрессию MAFA по сравнению с S6D7 или необработанными или обработанными DMSO культурами на стадии 7 (S7D7). Добавление UNC0638 (ФИГ. 1A; селективный ингибитор метилтрансферазы лизинов гистонов G9a и GLP), UNC0646 (ФИГ. 1A; мощный и селективный ингибитор G9a/GLP), UNC0642 (ФИГ. 1A; мощный и селективный ингибитор метилтрансферазы лизинов гистонов G9a и GLP), TC-E5003 (ФИГ. 1B; селективный ингибитор метилтрансферазы аргининов PRMT1), A366 (ФИГ. 1B; мощный и селективный ингибитор метилтрансферазы лизинов гистонов G9a/GLP), PF03814735 (ФИГ. 1B; ингибитор киназы Aurora А и В), ZM447439 (ФИГ. 1B; ингибирует киназу Aurora В), дигидрохлорид SB747651A (ФИГ. 1B; мощный ингибитор MSK1; также ингибирует другие киназы группы AGC), PFI1 (ФИГ. 1B; ингибитор бромодомена BET), LY303511 (ФИГ. 1B; ингибитор BRD2, BRD3 и BRD4), MS436 (ФИГ. 1B; мощный и селективный ингибитор бромодомена BRD4) и MC1568 (ФИГ. 1C; селективно ингибирует HDAC класса II (IIa)) значительно усиливает экспрессию MAFA по сравнению с S6D7 или необработанными или обработанными DMSO культурами на стадии 7. ФИГ. 1E-1H представляют собой графики, на которых показаны данные количественного анализа ПЦР в реальном времени экспрессии UCN3 после обработки малыми молекулами, добавления 5-азацитидина (AZT) (ФИГ. 1E; ингибитор ДНК-метилтрансферазы), пироксамида (ФИГ. 1G; ингибитор гистондеацетилазы), и CI994 (ФИГ. 1G; ингибитор гистондеацетилазы) значительно усиливает экспрессию UCN3 по сравнению с S6D7 или необработанными или обработанными DMSO культурами на стадии 7.
[0175] На ФИГ. 2A и 2B показана надежность выбранных малых молекул в качестве активаторов MAFA или UCN3, так как их эффект сохраняют при различных протоколах подготовки стадии 7.
[0176] Условия культивирования, показанные на ФИГ. 2A и 2B, отличаются от подобных на ФИГ. 1 следующими изменениями в стадии 7 (S7): (i) удаление ингибитора II ALK5 (ALK5); (ii) снижение концентрации T3 (низкий T3); (iii) добавление ZM447439 (ZM); и (iv) добавление коктейля витаминов, следовых элементов, липидов и аминокислот (состав I - таблица XII). А именно, исследовали следующее исходное условие: (1) без ингибитора II ALK5 (ALK5); (2) с низким T3; (3) с низким ZM; (4) с низким H; (5) с низким NAC; (6) FI; и BLAR 001. Подтверждено, что AZT является активатором UCN3 (ФИГ. 2B), но не MAFA (ФИГ. 2A) во время стадии 7. В дополнение к исследованию малых молекул обнаружено, что 3-деазанепланоцин А (DEZA; ФИГ. 2A) является эффективным активатором экспрессии MAFA, но не UCN3 (ФИГ. 2B), даже в присутствии ZM447439.
[0177] Таким образом, данный пример демонстрирует идентификацию малых молекул, которые усиливают экспрессию одного из маркеров созревания MAFA или UCN3 во время стадии 7.
Пример 2.
Генерация эндокринных клеток с увеличенной экспрессией маркеров созревания и со схожей с человеческими островками кинетикой глюкозозависимого митохондриального дыхания на поверхности раздела воздух-жидкость
[0178] В следующем примере показана генерация клеток С-ПЕПТИДА (короткий полипептид из 31 аминокислоты, соединяющий А и В цепи инсулина в молекуле проинсулина), которые совместно экспрессируют следующие маркеры созревания, PDX1 (панкреатический и дуоденальный гомеобокс 1); NKX6.1 (гомеобокс 1 NK6); MAFA UCN3; SLC2A1 (член 1 семейства 2 переносчиков растворенных веществ; также называют GLUT1/глюкозным транспортером 1); и он показывает кинетику глюкозозависимого митохондриального дыхания, аналогичную подобным в человеческих островковых клетках. Клетки линии человеческих эмбриональных стволовых клеток H1 (H1-hESC) (со средой EZ8 при пассаже 28 засевали в виде отдельных клеток с плотностью 0,094×106 клеток/см2 на MATRIGEL™ на чашки Петри с покрытием в разведении 1: 30 в модифицированную по способу Дульбекко среду Игла со смесью питательных веществ F-12 (DMEM-F12), которая содержит GlutaMAX™ в разведении 1: 100 (концентрация 1X), 0,25 мМ аскорбиновой кислоты, 100 нг/мл фактора 2 роста фибробластов (FGF2), 1 нг/мл трансформирующего фактора роста бета (TGFβ), инсулин-трансферрин-селен-этаноламин (ITS-X) в разведении 1: 100, не содержащий жирных кислот 2%-й бычий сывороточный альбумин (FAF-BSA) и 20 нг/мл инсулиноподобного фактора-1 роста (IGF-1), в которую добавили 10 мкМ ингибитора Rock Y-27632 (соединение Y). Спустя сорок восемь часов после посева культуры промывали в неполном фосфатно-солевом буферном растворе без магния или кальция (PBS).
[0179] Для ФИГ. 3A-3M, 4A-4E и 5A-5F культуры дифференцировали, используя следующий протокол. На протяжении стадий с 1 по 4 протокола культуры поддерживали в виде плоских адгезивных культур.
а. Стадия 1 (3 дня). Клетки культивировали в течение одного дня в следующей среде стадии 1: среда MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в разведении 1: 100 (концентрация 1Х), 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл ростового фактора дифференцировки 8 (GDF8) и 1,5 мкМ 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло [19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-она (соединение MCX). Впоследствии клетки культивировали в течение дополнительного дня в среде MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 0,1 мкМ соединения MCX. Впоследствии клетки культивировали в течение дополнительного дня в MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы и 100 нг/мл GDF8.
b. Стадия 2 (2 дня). Клетки обрабатывали в течение двух дней средой MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, 1Х GlutaMAX™, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 0,25 мМ аскорбиновой кислоты и 50 нг/мл фактора 7 роста фибробластов (FGF7).
c. Стадия 3 (2 дня). Клетки обрабатывали в течение двух дней специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; 1X GlutaMAX™; 1% FAF-BSA; 25 нг/мл FGF7; 0,25 мкМ SANT-1 (N-[(3,5-диметил-1-фенил-1H-пиразол-4-ил)метилен]-4-(фенилметил)-1-пиперазинамин); 1 мкM ретиноевой кислоты (RA); 0,25 мМ аскорбиновой кислоты; 300 нМ активатора PKC ((2S, 5S-(E,E)-8-(5-(4-трифторметил)фенил-2,4,-пентадиеноиламино)бензолактам (TPB); и ингибитор рецептора костного морфогенетического белка (BMP) LDN-193189-HCl (LDN-HCl) в течение двух дней. Концентрация LDN-HCl, используемая в первый день стадии 3, составляла 100 нМ, а во второй день стадии 3-50 нМ.
d. Стадия 4 (3 дня) и перемещение ALI в S4D3. Клетки обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 1% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 70 нМ LDN-HCl; 0,25 мМ аскорбиновой кислоты; и 200 нM TPB в течение трех дней. В конце стадии 4 (3 дня) клетки, культивированные на плоских чашках Петри, высевали на поверхности раздела воздух-жидкость (ALI). Для перемещения ALI клетки обрабатывали в течение 4 часов 10 мкМ соединения Y, полоскали PBS и обрабатывали в течение приблизительно 2 минут ферментом TrypLE™ Express Enzyme в концентрации 1X с последующим удалением фермента и удалением клеток с поверхности MATRIGEL™ путем аккуратного постукивания по флакону. Полученную клеточную суспензию высевали с плотностью 0,5-1,0×106 клеток (аликвотами объемом 5 мкл) на пористые фильтры-вкладыши для клеточной культуры с размером пор 0,4 мкм или 3,0 мкм, расположенные в планшетах размером 10 см. 8,0 мл среды добавляли на дно каждой вставки, а на верхушку или верхнюю часть фильтра дополнительную среду не добавляли. Среду меняли ежедневно в течение стадий 5, 6 и 7.
e. Стадия 5 (3 дня). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 0,25 мкM SANT-1; 50 нM RA; 100 нМ LDN-HCl; 1 мкМ T3 в форме 3,3´, 5-трийод-L-тиронина натриевой соли (Sigma Aldrich, № по каталогу T6397); 10 мкМ 2-(3-(6-метилпиридин-2-ил)-1H-пиразол-4-ил)-1,5-нафтиридина (ингибитор II ALK5 или ALK5) в течение трех дней.
f. Стадия 6 (7 дней). Клетки обрабатывали на поверхности раздела воздух-жидкость (ALI) специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 100 нМ LDN-HCl; 1 мкМ T3; 10 мкM ингибитора II ALK5; и 100 нМ (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамида («ингибитор XX гамма-секретазы») (в течение семи дней.
g. Стадия 7 (7 дней). Клетки на ALI обрабатывали двумя видами специализированной среды BLAR: BLAR001 и BLAR004. Первая среда представляет собой среду BLAR001 (список компонентов приведен в таблице I), которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 нМ T3 (низкий Т3); 1 мМ N-ацетилцистеина (NAC); 0,5 мкМ ZM447439 (ZM); и следующие компоненты, которые входят в состав I (FI) - среда RPMI с витаминной добавкой в разведении 1: 200; среда MEM с добавлением заменимых аминокислот в разведении 1: 200; концентрат липидов с определенным химическим составом в разведении 1: 2000; пируват натрия в разведении 1: 200; следовые элементы А в разведении 1: 2000; следовые элементы В в разведении 1: 2000 в течение семи дней. Дополнительные соединения, добавленные во время стадии 7, включали в себя одно из 1 мкМ T3 или 10 нМ T3 (низкий T3); 10 мкM ингибитора II ALK5; 5 мкМ 5-азацитидина (AZT); или 1 мкМ или 10 мкМ 3-деазанепланоцина А (DEZA).
Вторая среда представляла собой среду BLAR004 (список компонентов приведен в таблице IV), которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 1 мМ N-ацетилцистеина (NAC); 0,5 мкМ ZM447439 (ZM); и следующие компоненты, которые входят в состав I (FI) - среда RPMI с витаминной добавкой в разведении 1: 200; среда MEM с добавлением заменимых аминокислот в разведении 1: 200; концентрат липидов с определенным химическим составом в разведении 1: 2000; пируват натрия в разведении 1: 200; следовые элементы А в разведении 1: 2000; следовые элементы В в разведении 1: 2000 в течение семи дней. Дополнительные соединения, добавленные во время стадии 7, включали в себя одно из 1 мкМ T3 или 10 нМ T3 (низкий T3); 10 мкM ингибитора II ALK5; 5 мкМ 5-азацитидина (AZT); или 1 мкМ или 10 мкМ 3-деазанепланоцина А (DEZA).
[0180] Определение характеристик и количественный анализ дифференцированных клеток. Для количественного анализа экспрессии генов на различных стадиях клетки человеческих островков, H1-hESC, 7-го дня 6-й стадии (S6D7) и от 7-го дня 7-й стадии до 14-го дня 7-й стадии (S7D7-S7D14) собирали в виде скоплений на ALI, как описано в публикации Rezania et al., Nature Biotechnology, 2014; 32(11): 1121-1133. Экспрессию генов оценивали с использованием специально изготовленных матриц Taqman Arrays (Applied Biosystems, г. Фостер Сити, штат Калифорния, США). Данные анализировали с использованием программного обеспечения Sequence Detection (Applied Biosystems, г. Фостер Сити, штат Калифорния, США) и нормализовали, используя GAPDH в качестве конститутивного гена недифференцированных клеток H1-hESC, применяя метод ΔΔCt. Информация о праймерах представлена в таблице V.
[0181] Для количественного анализа колокализации белков на различных стадиях клетки человеческих островков и клетки S7D7 собирали в виде скоплений клеток на ALI и анализировали посредством иммунофлуоресценции (IF). Клетки, полученные из H1-hESC, подготавливали и окрашивали, как по существу описано в публикации Rezania et al. (2014) выше, и с использованием антител, перечисленных в таблице VI настоящего документа. Для получения срезов из замороженного материала клетки промывали PBS с последующей фиксацией в течение ночи в 4% PFA при 4 °C. После фиксации 4% PFA удаляли, клетки дважды промывали PBS и инкубировали в течение ночи при 4°C в 30% растворе сахарозы. Пробы криоконсервировали в растворе OCT и срезы толщиной 5 мкм помещали на предметные стекла Superfrost plus (VWR International, LLC, г. Рэднор, штат Пенсильвания, США, № по каталогу 48311-703).
[0182] Для выполнения иммунофлуоресцентного окрашивания первичные антитела добавляли в соответствующих разведениях в течение ночи при 4 °C, при этом вторичные антитела добавляли в течение 30 минут при комнатной температуре с последующим промыванием PBS и добавлением прикрепляющегося реагента Vectastain с DAPI (Vector Laboratories Inc., г. Берлингейм, штат Калифорния, США, № по каталогу H-1200). Срезы визуализировали с использованием флуоресцентного микроскопа Nikon Ti (Nikon Instruments, Inc., г. Мелвилл, штат Нью-Йорк, США).
(№ по каталогу ab8297).
(№ по каталогу ab92517).
(№ по каталогу AF2419).
(№ по каталогу LP9872).
(Извлечение антигена)
(№ по каталогу ab115730).
(№ по каталогу NBP1-49672).
(№ по каталогу NBP1-80732).
(Извлечение антигена)
(№ по каталогу 16508)
(№ по каталогу ab16667).
(Извлечение антигена)
(№ по каталогу sc-17320)
(№ по каталогу MU392A-UC).
(№ по каталогу A21202).
(№ по каталогу A10040).
(№ по каталогу A11056).
[0183] Для количественного анализа глюкозозависимой митохондриальной активности на различных стадиях собирали зрелые человеческие островки, скопления на ALI S6D7 и скопления на ALI S7D7 и измеряли их скорость потребления кислорода (OCR) на внеклеточном поточном анализаторе XFe24 (Seahorse Bioscience, № по каталогу 102238-100) до и после инъекции 20 мМ D-глюкозы. Скопления на ALI удаляли из условий стадии 7 и инкубировали в течение 2 часов при 37°C и в не содержащей CO2 среде, и в среде, выполненной с возможностью достижения исходного уровня OCR. Среда для предварительной инкубации содержит 1 мМ D-глюкозы, 1 мМ L-глутамина и 1 мМ пирувата натрия в основной среде XF. После предварительной инкубации скопления на ALI помещали на аппарат Seahorse, в котором выполняли следующие измерения: (i) OCR на исходном уровне 3 раза (перед введением D-глюкозы); и (ii) 5 раз после введения D-глюкозы (время инкубации после введения: 72 минуты). Все измерения OCR нормализовали в соответствии с содержанием ДНК в отдельных пробах скоплений на ALI или Aggrewell в центрифужных пробирках. ДНК выделяли с помощью набора QIAamp DNA MicroKit (Qiagen, № по каталогу 56304), а содержание ДНК измеряли с помощью спектрофотометра для УФ и видимой областей спектра NanoDrop 8000 (Thermo Scientific, № по каталогу ND8000).
[0184] На ФИГ. 3A-3M показано увеличение генной экспрессии (после семи дней обработки в условиях стадии 7) группы маркеров созревания в скоплениях клеток ALI до уровней, наблюдаемых в человеческих островках. Маркер созревания определяют в настоящем документе как ген, участвующий в положительной стимуляции быстрой стимулированной глюкозой секреции инсулина (GSIS). В следующем списке подробно описаны изменения в протоколе дифференцировки стадии 7, которые выполняли для улучшения генной экспрессии маркеров созревания к S7D7 в скоплениях на ALI: (i) удаление ингибитора II ALK5; (ii) снижение концентрации T3; (iii) добавление DEZA; (iv) добавление AZT; (v) добавление ZM; (vi) снижение концентрации глюкозы до 5,56 мМ; и (vii) добавление определенного коктейля витаминов, заменимых аминокислот, липидов, пирувата натрия и следовых элементов (состав I-FI). Аналогичные наблюдения и результаты получили в отношении профиля генной экспрессии генов созревания для условий как с BLAR001, так и BLAR004 во время стадии 7. На ФИГ. 3A показано, что INHBB экспрессировали на уровне, превышающем наблюдаемый в человеческих островках в условиях, в которых используют ингибитор II ALK5. Результаты показывают, что в клетках S7 ингибирование TGFB1 (трансформирующий фактор 1 роста бета) с помощью ингибитора II ALK5 приводит к отрицательному профилю сигнализации TGF-бета, который ингибирует процессы GSIS. Обнаружено, что удаление ингибитора ALK5 в отсутствии или в присутствии AZT/DEZA приводило к уменьшению экспрессии INHBB до уровней, наблюдаемых в человеческих островках, таким образом указывая на нивелирование влияния отрицательной сигнализации TGF-бета на GSIS во время стадии 7. Кроме того, на ФИГ. 3B показано увеличение экспрессии INHA до уровней человеческих островков в скоплениях на ALI при удалении ингибитора II ALK5.
[0185] Хотя экспрессию MAFA и SLC2A1, показанную на ФИГ. 3C и 3D соответственно, согласно полученным данным уменьшили при удалении ингибитора II ALK5, добавление AZT/DEZA восстанавливает экспрессию MAFA и SLC2A1 до уровней человеческих островков. Экспрессию UCN3 (ФИГ. 3E), G6PC2 (каталитическая субъединица 2 глюкозо-6-фосфатазы; ФИГ. 3F) и PDK1 (киназа 1 пируватдегидрогеназы; ФИГ. 3G) увеличивали до уровней, наблюдаемых в человеческих островках или превышающих их, при добавлении AZT/DEZA и удалении ингибитора II ALK5 в скоплениях на ALI. Экспрессию INS (инсулин; ФИГ. 3H), GJD2 (белок межклеточных щелевых контактов, дельта 2; также CX36/коннексин 36; ФИГ. 3I), SIX2 (гомеобокс SIX 2; ФИГ. 3J) и PDX1 (ФИГ. 3K) согласно полученным данным постепенно скачкообразно увеличивали сначала после удаления ингибитора II ALK5, а затем после добавления AZT/DEZA. Изменений экспрессии NKX6.1 (ФИГ. 3L) и GLP1R (рецептор глюкагоноподобного пептида 1; ФИГ. 3M) не наблюдали при различных условиях, но их экспрессия в скоплениях на ALI постоянно находилась на уровнях, наблюдаемых в человеческих островках или превышающих их.
[0186] На ФИГ. 4A-4E показана генерация клеток C-ПЕПТИДА в скоплениях клеток ALI, которые на основании присутствия белка совместно экспрессируют следующие маркеры созревания: PDX1 (ФИГ. 4A), NKX6.1 (ФИГ. 4B), MAFA (ФИГ. 4C), SLC2A1 (ФИГ. 4D) и UCN3 (ФИГ. 4E) на S7D7. Для каждого из ФИГ 4A-4E иммунофлуоресцентное окрашивание показано в виде отдельных каналов с С-ПЕПТИДОМ в верхнем ряду и интересующим белком созревания в нижнем ряду. Типовое окрашивание человеческих островков показано в левой колонке, условие «без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR001» - в средней колонке, а условие «без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR004» - в правой колонке. Большая часть (если не все) С-ПЕПТИД-положительных клеток также были положительными в отношении PDX1 (ФИГ. 4A) и NKX6.1 (ФИГ. 4B), как и человеческие островковые клетки. Значительная часть С-ПЕПТИД-положительных клеток также были положительными в отношении MAFA (ФИГ. 4C), SLC2A1 (ФИГ. 4D) и UCN3 (ФИГ. 4E) как в условиях с BLAR001, так и с BLAR004. Однако экспрессию MAFA, SLC2A1 и UCN3 не ограничивали C-ПЕПТИД-положительными клетками.
[0187] На ФИГ. 5A-5E показана генерация клеток C-ПЕПТИДА в S7D7, которые показывают схожую с человеческими островками кинетику глюкозозависимого митохондриального дыхания на поверхности раздела воздух-жидкость (ALI), в особенности при специфичных для стадии 7 условиях «без ALK5, с низким T3, ZM, H, NAC, AZT, DEZA, FI, BLAR001». Митохондриальное дыхание или активность, представленные с использованием скорости потребления кислорода (OCR), измеряли на исходном уровне и после введения 20 мМ D-глюкозы. Пять измерений OCR в течение 72-минутного периода были сделаны после введения 20 мМ D-глюкозы, а измерения показаны в виде процентной доли OCR по сравнению с исходным уровнем, нормализованной по содержанию ДНК в каждой отдельной пробе. На ФИГ. 5A показано, что человеческие островки (черная линия с кружками) быстро реагировали на высокую концентрацию D-глюкозы, как видно на основании OCR, равной 123,3% ± 12,92 по сравнению с исходным уровнем через 15 минут (мин) после инъекции («п/и»), и сохраняли высокую OCR во времени (131,5% ± 11,32; 72 мин п/и). С другой стороны, в скоплениях на ALI S6D7 (серая линия с треугольниками), которые обогащали незрелыми С-ПЕПТИД-положительными клетками, согласно полученным данным не было стремительной реакции OCR на высокую концентрацию D-глюкозы (104,4% ± 3,37; 15 мин п/и), и они показывают относительно слабую реакцию OCR во времени (113,3% ± 4,51; 72 мин п/и). На ФИГ. 5D показано, что внутри группы скопления на ALI S7D7 только при условии «без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR001» (серая линия с квадратами) согласно полученным данным наблюдалась схожая с человеческими островками кинетика глюкозозависимого митохондриального дыхания (112,4% ± 3,25-15 мин п/и; 129,5% ± 3,78-72 мин п/и). Обнаружено, что следующие условия в скоплениях S7D7 на ALI обеспечивают глюкозозависимую митохондриальную кинетику, аналогичную подобной в незрелых скоплениях на ALI S6D7: ALK5, T3, ZM, H, NAC, FI, BLAR001 (100,3% ± 4,04-15 мин п/и; 107,8% ± 6,51 -72 мин п/и) (ФИГ. 5B); без ALK5, с низким T3, ZM, H, NAC, FI, BLAR001 (96,9% ± 3,06-15 мин п/и; 109,0% ± 4,58-72 мин п/и) (ФИГ. 5C); без ALK5, с низким T3, ZM, H, NAC, FI, BLAR004 (103,4% ± 4,76-15 мин п/и; 113,6% ± 6,72-72 мин п/и) (ФИГ. 5E); и без ALK5, с низким T3, ZM, H, NAC, AZT/DEZA, FI, BLAR004 (102,1% ± 4,04-15 мин п/и; 112,7% ± 3,38-72 мин п/и) (ФИГ. 5F).
[0188] Таким образом, этот пример демонстрирует, что выполнение усовершенствований в условиях стадии 7 улучшает статус созревания полученных из hESC созревающих бета-клеток на ALI. В частности, в этом примере показана генерация на ALI клеток C-ПЕПТИДА, которые совместно экспрессируют множество маркеров созревания бета-клеток и обладают специфическими для бета-клеток функциональными возможностями, схожими с человеческими островками, такими как глюкозозависимое митохондриальное дыхание.
Пример 3.
Генерация полноценных панкреатических энтодермальных и незрелых бета-клеток в форме скоплений клеток, выполненных с возможностью подчинения суспензионной культуре, выполненной с возможностью изменения
[0189] В следующем примере показана генерация полноценных панкреатических энтодермальных или незрелых бета-клеток в форме скоплений клеток Aggrewell™, выполненных с возможностью подчинения суспензионной культуре, выполненной с возможностью изменения. Суспензионная культура, используемая в данном примере, представляла собой скопления клеток Aggrewell™, культивированные в центрифужных пробирках («скопления Aggrewell™ в центрифужных пробирках»). Клетки линии человеческих эмбриональных стволовых клеток H1 (H1-hESC) со средой EZ8 при пассаже 28 засевали в виде отдельных клеток с плотностью 0,094×106 клеток/см2 на MATRIGEL™ на чашки Петри с покрытием в разведении 1: 30 в модифицированную по способу Дульбекко среду Игла со смесью питательных веществ F-12 (DMEM-F12), которая содержит GlutaMAX™ в разведении 1: 100 (концентрация 1X), 0,25 мМ аскорбиновой кислоты, 100 нг/мл фактора 2 роста фибробластов (FGF2), 1 нг/мл трансформирующего фактора роста бета (TGFβ), инсулин-трансферрин-селен-этаноламин (ITS-X) в разведении 1: 100, не содержащий жирных кислот 2%-й бычий сывороточный альбумин (FAF-BSA) и 20 нг/мл инсулиноподобного фактора-1 роста (IGF-1), и в которую добавили 10 мкМ ингибитора Rock Y-27632 (соединение Y). Соединение Y добавляли только в течение первых 24 часов после посева. Через сорок восемь часов после посева культуры промывали в неполном PBS (обозначается как «-/-», что значит фосфатно-солевой буферный раствор без магния или кальция).
[0190] Для ФИГ. 6A-6L культуры дифференцировали, используя следующий протокол. Скопления клеток ALI S6D6, показанные на ФИГ. 6I-6L культивировали, как описано выше, за исключением того, что в день 3 стадии 4 скопления клеток Aggrewell™ получали либо из свежего монослоя S4D3, либо из криоконсервированных клеток S4D3 (как более подробно описано ниже) путем культивирования в течение дополнительных 48 часов (день 5 стадии 4 или S4D5). В ходе выполнения протокола дифференцировки среду меняли ежедневно.
а. Стадия 1 (3 дня). Клетки культивировали в течение одного дня в следующей среде стадии 1: среда MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в разведении 1: 100 (концентрация 1Х), 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл ростового фактора 8 дифференцировки (GDF8) и 1,5 мкМ 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло [19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-она (соединение MCX) (ингибитор GSK-3β). Впоследствии клетки культивировали в течение дополнительного дня в среде MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 0,1 мкМ соединения MCX. Впоследствии клетки культивировали в течение дополнительного дня в MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы и 100 нг/мл GDF8.
b. Стадия 2 (2 дня). Клетки обрабатывали в течение двух дней средой MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, 1X GlutaMAX™, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 0,25 мМ аскорбиновой кислоты и 50 нг/мл фактора 7 роста фибробластов (FGF7).
c. Стадия 3 (2 дня). Клетки обрабатывали в течение двух дней специализированной средой BLAR001 (см. таблицу I), которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; 1X GlutaMAX™; 1% FAF-BSA; 25 нг/мл FGF7; 0,25 мкМ SANT-1 (N-[(3,5-диметил-1-фенил-1H-пиразол-4-ил)метилен]-4-(фенилметил)-1-пиперазинамин); 1 мкМ ретиноевой кислоты (RA) (Sigma Aldrich, № по каталогу R2625); 0,25 мМ аскорбиновой кислоты; 300 нМ активатора PKC (2S,5S-(E,E)-8-(5-(4-трифторметил)фенил-2,4,-пентадиеноиламино)бензолактам (TPB); и ингибитор рецептора костного морфогенетического белка (BMP) LDN-193189-HCl (LDN-HCl) в течение двух дней. Концентрации LDN-HCl, используемые в первый день стадии 3, составляли 100 нМ, а во второй день стадии 3-10 нМ.
d. Стадия 4 (3 дня). Клетки обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 1% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 70 нМ LDN-HCl; 0,25 мМ аскорбиновой кислоты; и 200 нM TPB в течение трех дней.
e. Криоконсервация монослоя в день 3 стадии 4. Криоконсервированные клеточные банки из монослоя S4D3 получали с использованием следующей процедуры. Если говорить кратко, монослой S4D3 обрабатывали в течение 4 часов 10 мкМ соединения Y. Впоследствии клетки высвобождали с помощью фермента TrypLE™ Express Enzyme в виде суспензии отдельных клеток с последующей нейтрализацией фермента с помощью среды для «высвобождения» (полная среда стадии 4, подробно описанная в «разделе k», в которую добавили 4 кЕд/мл ДНКазы I и 10 мкМ соединения Y). Отдельные клетки осаждали, ресуспендировали в холодной среде для «высвобождения» и подсчитывали с помощью прибора Nucleocounter® NC-100. Холодную среду для «криоконсервации» (60% KSR; 15% BLAR001; 5% HEPES (концентрация 1M); 20% DMSO) добавляли в соотношении от 1 к 1 к суспензии отдельных клеток в холодной среде для «высвобождения». 5,0×106 клеток в 4,5 мл среды для «криоконсервации/высвобождения» в соотношении 1 к 1 добавляли в одиночный флакон для криоконсервации объемом 5 мл. Флакон (-ы) переносили в программируемый криозамораживатель (CRF) (Planar PLC, № по каталогу Kryo 360), в котором клетки замораживали с использованием следующей схемы замораживания и длительно хранили в жидком азоте. Процедура замораживания в CRF показана в таблице VII.
f. Размораживание криоконсервированных клеток монослоя S4D3: Замороженные флаконы объемом 5 мл, содержащие 5,0×106 клеток монослоя, размораживали в водяной бане с температурой 37°C в течение 2 минут. Клетки собирали в среду после S4D3 (подробно описанную в разделе «g») и добавляли с плотностью приблизительно 787 клеток на одну лунку Aggrewell™ планшета Aggrewell™ 400EX.
g. Стадия 4 (2 дня) для перемещения скопления Aggrewell™. Для генерации скопления Aggrewell™ клетки монослоя дня 3 стадии 4 или размороженные криоконсервированные клетки дня 3 стадии 4 обрабатывали соединением Y в течение 4 часов, промывали PBS и обрабатывали в течение 3 минут раствором аккутазы для разъединения клеток с последующим удалением фермента и удалением клеток с поверхности MATRIGEL™ путем аккуратного постукивания по флакону. Полученную суспензию клеток добавляли с плотностью приблизительно 787 клеток на одну лунку Aggrewell™ планшета Aggrewell™ 400EX, а планшет осторожно центрифугировали при 100 x г для генерации скоплений Aggrewell™. Количество клеток в одном скоплении может варьироваться от 50 до 3000 клеток. Для перемещения клеток монослоя дня 3 стадии 4 в скопления Aggrewell™ и культивирования через 48 часов после агрегации использовали следующую среду («среда после S4D3»): Клетки обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 1% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 70 нМ LDN-HCl; 0,25 мМ аскорбиновой кислоты; и 200 нM TPB в течение двух дней. Десять (10) мкМ соединения Y и 2 мкг/мл человеческого рекомбинантного ламинина добавляли в среду только в течение первых 24 часов. Через два дня (S4D5) скопления Aggrewell™ удаляли из лунок планшетов Aggrewell™ и переносили в центрифужные пробирки PBS0.1MAG («Скопления Aggrewell в суспензии»).
h. Стадия 5 (3 дня). Скопления Aggrewell™ S4D5 извлекали из планшетов Aggrewell™ 400EX и переносили в центрифужные пробирки PBS0.1MAG с плотностью клеток 1,5-2,0 миллиона клеток/мл при скорости вращения 27 об./мин (оборотов в минуту) в среду стадии 5 на три дня. Клетки обрабатывали специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 0,25 мкM SANT-1; 50 нM RA; 100 нМ LDN-HCl; 1 мкМ T3 в форме 3,3´, 5-трийод-L-тиронина натриевой соли; и 10 мкМ 2-(3-(6-метилпиридин-2-ил)-1H-пиразол-4-ил)-1,5-нафтиридина («ингибитор II ALK5» или «ALK5»). 4 кЕд/мл ДНКазыI и 5 мкМ соединения Y добавляли только в день 1 стадии 5.
i. Стадия 6 (от 6 до 8 дней). Скопления Aggrewell™ обрабатывали в специализированной среде BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 100 нМ LDN-HCl; 1 мкМ T3; 10 мкМ ингибитора II ALK5) и 100 нМ (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамида («ингибитор XX гамма-секретазы»).
[0191] Количественный анализ и определение характеристик дифференцированных клеток. Для количественного анализа колокализации белка на различных стадиях скопления Aggrewell™ S4D5 и скопления Aggrewell™ S6D6 собирали и анализировали посредством иммунофлуоресценции (IF). Использовали процедуру определения характеристик и реагенты, описанные в таблице VI примера 2.
[0192] Для количественного анализа экспрессии генов на различных стадиях скопления Aggrewell™ дня 5 стадии 4 и скопления Aggrewell™ дня 6 стадии 6 собирали и анализировали посредством количественной полимеразной цепной реакции с обратной транскриптазой (кПЦР-РВ), как описано в публикации Nature Biotechnology, (32) 11, 1121-1133. Использовали процедуру определения характеристик и реагенты, описанные в таблице V примера 2.
[0193] Для количественного анализа колокализации белка скопления Aggrewell™ дня 5 стадии 4 и скопления Aggrewell™ дня 6 стадии 6 собирали и анализировали посредством проточной цитометрии с активацией флуоресценции (FACS). Окрашивание в анализе FACS проводили, как описано в Nature Biotechnology, 2014 (32) 11, 1121-1133, и использовали антитела, перечисленные в таблице VII. Дифференцированные клетки инкубировали в TrypLE™ Express в течение 5-10 минут при 37 °C, высвобождали в суспензию отдельных клеток, после чего их дважды промывали буферным раствором для окрашивания, представляющим собой PBS, содержащий 0,2% BSA. Внутриклеточное окрашивание антителами проводили с использованием фиолетового флуоресцентного реактивного красителя LIVE/DEAD при 4°C в течение 30 минут с последующей однократной промывкой холодным PBS. Фиксацию клеток выполняли в 300 мкл буферного раствора Cytofix/Cytoperm с последующей двукратной промывкой в буферном растворе Perm/Wash. Впоследствии клетки инкубировали с соответствующими антителами при 4°C в течение 30 минут (для неконъюгированных антител) или 1 часа (для конъюгированных антител), а затем дважды отмывали и анализировали на приборе BD FACS Canto II с применением программного обеспечения BD FACS Diva, регистрируя по меньшей мере 30 000 событий. Нежизнеспособные клетки при анализе FACS исключали и проводили дискриминирование, используя изотипические антитела («IgG»).
анти-KI67
[0194] На ФИГ. 6A показана процедура, с помощью которой (i) свежий монослой S4D3 или криоконсервированные клетки S4D3 собирали (ii) посредством способа Aggrewell™ в (iii) скопления клеток. На ФИГ. 6B показано, что в скоплениях Aggrewell™ S4D5 обнаруживали наличие большого количества белков ТФ панкреатической энтодермы PDX1 (сверху слева) и NKX6.1 (сверху посередине), но низкого количества эндокринного ТФ NEUROD1 (сверху справа), колебание размещающих линию дифференцировки непанкреатической энтодермы ТФ SOX2 (снизу посередине) и CDX2 (снизу справа). Анализ FACS (ФИГ. 6C) показывает, что 99,3±0,1% клеток были PDX1+ (слева), 84,4±0,1% NKX6.1+ (посередине), но 2,2±0,4% NKX6.1+ NEUROD1+ (справа) или 1,35±0,55% NKX6.1+ CHGA+ (посередине). На ФИГ. 6D показано сохранение устойчивых характеристик панкреатической энтодермы в скоплениях Aggrewell™ S4D4, полученных из криоконсервированных клеток S4D3, за счет сохранения высокой генной экспрессии PDX1 (сверху слева), NKX6.1 (сверху справа) и низкой экспрессии NEUROD1 (снизу слева) и CHGA (снизу справа) по сравнению с монослоем S4D3. В целом скопления Aggrewell™ S4D5 показывали более выраженные характеристики неэндокринной панкреатической энтодермы, чем предшествующие клетки стадии 4, описанные в Nature Biotechnology, 2014 (32) 11, 1121-1133. Результаты являются значимыми, так как скопления Aggrewell™ обеспечивают исходную точку, выполненную с возможностью изменения, от которой можно начинать основанную на суспензионной культуре дифференцировку до бета-клеток.
[0195] На ФИГ. 6E показана процедура, с помощью которой (i) свежий монослой S4D3 или криоконсервированные клетки S4D3 собирали (ii) посредством способа Aggrewell™ в скопления клеток, и (iii) дифференцировали в суспензионной культуре до (iv) незрелых бета-клеток посредством S6D6. Анализ FACS скоплений Aggrewell™ S6D6 показал профиль белка незрелых бета-клеток, так как 78,5±1,87% клеток были NKX6.1+ CHGA+ (слева, ФИГ. 6F), 73,6±4,34% NKX6.1+ NEUROD1+ (справа, ФИГ. 6F) и 38,4±5,96% NKX6.1+ ИНСУЛИН+ (слева, ФИГ. 6G). Большая часть ИНСУЛИН-положительной популяции (50,2±6,92% от общего числа клеток были ИНСУЛИН+) была NKX6.1+ (слева, ФИГ. 6G) и не ГЛЮКАГОН-положительной (7,43±1,49% ИНСУЛИН+ ГЛЮКАГОН+; (справа, ФИГ. 6G). На ФИГ. 6H показано посредством IF, что в S6D6 большинство C-ПЕПТИД-положительных клеток в скоплениях Aggrewell™ были как PDX1+ (слева), так и NKX6.1+ (посередине). Неожиданно было обнаружено, что присутствие белка ТФ привратника созревания MAFA (справа) уже легко обнаруживали в S6D6, и его экспрессировали на большем уровне, чем в предыдущих скоплениях на ALI в S6D6-S6D7 (Nature Biotechnology, 2014 (32) 11, 1121-1133) (ФИГ. 6I; см. также ФИГ. 3C для сравнения с ALI S7D7). Аналогично экспрессия ИНСУЛИНА (ФИГ. 6J), PDX1 (ФИГ. 6K) и NKX6.1 (ФИГ. 6L) была выше, чем в предыдущих скоплениях на ALI в S6D6-S6D7. Результаты подтверждают, что скопления Aggrewell™ S4D5 можно культивировать в суспензионной культуре до состояния незрелых бета-клеток, создавая подготовленную исходную точку, выполненную с возможностью изменения, для основанной на суспензионной культуре дифференцировки до функциональных зрелых бета-клеток.
[0196] Таким образом, данный пример показывает, что клетки стадии 4 можно подвергать агрегированию в скопления клеток, сохраняя их фенотип панкреатической энтодермы. Более того, эти скопления клеток стадии 4 можно дополнительно дифференцировать до фенотипа полноценных незрелых бета-клеток (стадия 6) с помощью суспензионной культуры, выполненной с возможностью изменения.
Пример 4.
Генерация суспензионной культуры эндокринных клеток с увеличенной экспрессией маркера созревания бета-клеток и белковым профилем, аналогичным подомному в зрелых человеческих островковых клетках
[0197] В следующем примере показана генерация суспензионной культуры клеток С-ПЕПТИДА, которые показывают совместную экспрессию и наличие белков следующих маркеров созревания, PDX1, NKX6.1, MAFA, UCN3 и SLC2A1. Клетки клеточной линии H1-hESC, культивированные со средой EZ8, при пассаже 28 засевали в виде отдельных клеток с плотностью 0,094×106 клеток/см2 на MATRIGEL™ на чашки Петри с покрытием в разведении 1:30 в среду DMEM-F12, содержащую GlutaMAX™ в разведении 1:100 (концентрация 1X), 0,25 мМ аскорбиновой кислоты, 100 нг/мл FGF2, 1 нг/мл TGFβ, ITS-X в разведении 1:100, 2% FAF-BSA и 20 нг/мл IGF-1, в которую добавили 10 мкМ соединения Y. Соединение Y добавляли только в течение первых 24 часов после посева. Через сорок восемь часов после посева культуры промывали в PBS (-/-).
[0198] Для ФИГ. 7A-7M культуры дифференцировали, используя следующий протокол. На протяжении стадий с 1 по 4 протокола культуры поддерживали в виде плоских адгезивных культур. Начиная с монослоя S4D3 или криоконсервированных клеток S4D3, скопления клеток Aggrewell™ получали и культивировали в течение дополнительных 48 часов (день 5 стадии 4 или S4D5). В ходе выполнения протокола дифференцировки среду меняли ежедневно. Во время стадий 5, 6 и 7 скопления Aggrewell™ культивировали в суспензионной культуре, как описано в примере 3, за исключением того, что стадия 6 протекала более 7 дней, а не 6 дней.
а. Стадия 1 (3 дня). Клетки культивировали в течение одного дня в следующей среде стадии 1: среда MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в разведении 1:100 (концентрация 1X), 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 1,5 мкМ соединения MCX. Впоследствии клетки культивировали в течение дополнительного дня в среде MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 0,1 мкМ ингибитора GSK-3β. Впоследствии клетки культивировали в течение дополнительного дня в MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы и 100 нг/мл GDF8.
b. Стадия 2 (2 дня). Клетки обрабатывали в течение двух дней средой MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, 1X GlutaMAX™, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 0,25 мМ аскорбиновой кислоты и 50 нг/мл FGF7.
c. Стадия 3 (2 дня). Клетки обрабатывали в течение двух дней специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; 1X GlutaMAX™; 1% FAF-BSA; 25 нг/мл FGF7; 0,25 мкМ SANT-1; 1 мкM RA; 0,25 мМ аскорбиновой кислоты; 300 нM TPB); и LDN-HCl в течение двух дней. Концентрация LDN-HCl, используемая в первый день стадии 3, составляла 100 нМ, а во второй день стадии 3-10 нМ.
d. Стадия 4 (3 дня). Клетки обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 1% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 70 нМ LDN-HCl; 0,25 мМ аскорбиновой кислоты; и 200 нM TPB в течение трех дней.
Криоконсервация монослоя в день 3 стадии 4. Криосохраненные клеточные банки из монослоя S4D3 получали с использованием процедуры, описанной в примере 3 и таблице VII.
e. Размораживание криоконсервированных клеток монослоя S4D3. Замороженные флаконы объемом 5 мл, содержащие 5,0 X106 клеток монослоя S4D3, размораживали, как описано в примере 3.
f. Стадия 4 (2 дня) для перемещения скопления Aggrewell™. Скопления Aggrewell™ получали из клеток монослоя дня 3 стадии 4 или размораживали криоконсервированные клетки дня 3 стадии 4, как описано в примере 3.
g. Стадия 5 (3 дня). Скопления Aggrewell™ S4D5 извлекали из планшетов Aggrewell™ 400EX и переносили в центрифужные пробирки PBS0.1MAG с плотностью клеток 1,5-2,0 миллиона клеток/мл при скорости вращения 27 об./мин (оборотов в минуту) в среду стадии 5 на три дня. Клетки обрабатывали специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1:200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 0,25 мкM SANT-1; 50 нM RA; 100 нМ LDN-HCl; 1 мкМ T3; и 10 мкМ ингибитора II ALK5. 4 кЕд/мл ДНКазыI и 5 мкМ соединения Y добавляли только в день 1 стадии 5.
h. Стадия 6 (7 дней). Скопления Aggrewell™ обрабатывали в специализированной среде BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 100 нМ LDN-HCl; 1 мкМ T3; 10 мкМ ингибитора II ALK5 и 100 нМ ингибитора XX гамма-секретазы.
i. Стадия 7 (от 6 до 7 дней). Скопления Aggrewell™ обрабатывали в специализированной среде BLAR001 или BLAR004, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H), 10 нМ T3 (низкий T3); 1 мМ NAC; 0,5 мкМ ZM); и следующие компоненты, которые входят в состав I (FI) - среда RPMI с витаминной добавкой в разведении 1: 200; среда MEM с добавлением заменимых аминокислот в разведении 1:200; концентрат липидов с определенным химическим составом в разведении 1:2000; пируват натрия в разведении 1:200; следовые элементы А в разведении 1:2000; следовые элементы В в разведении 1:2000 в течение семи дней. Дополнительные соединения, добавленные во время стадии 7, включали в себя 4 мкМ AZT; или 1 мкМ DEZA. Для большей ясности скопления Aggrewell™ в суспензии культивировали во время стадии 7 в двух условиях, используя концентрации, описанные выше (в среде, основанной на BLAR001 или BLAR004): (i) без ALK5, с низким T3, ZM, H, NAC; (ii) без ALK5, с низким T3, ZM, H, NAC, AZT, DEZA.
[0199] На стадиях 5, 6 и 7 клеточные культуры обрабатывали, начиная или со скоплений Aggrewell™ S4D5, или со скоплений на ALI, перемещенных в S4D3. Скопления Aggrewell™ S4D5 извлекали из планшетов Aggrewell™ 400EX и переносили в центрифужные пробирки PBS0.1MAG с плотностью клеток 1,5-2,0 миллиона клеток/мл при скорости вращения 27 об./мин (оборотов в минуту).
[0200] Количественный анализ и определение характеристик дифференцированных клеток. Скопления Aggrewell™ стадии 7 и человеческие островки оценивали посредством IF, FACS и кПЦР-РВ, как описано в примерах 2 и 3.
[0201] На ФИГ. 7A показана процедура, с помощью которой (i) свежий монослой S4D3 или криосохраненные клетки собирали в скопления Aggrewell™, подготовленные в суспензионной культуре посредством прохождения через (ii и iii) стадии 5, 6 и 7 для генерации (iv) скоплений Aggrewell™ S7D7. Так же, как скопления Aggrewell™ S6D6 (ФИГ. 6F-6G), скопления Aggrewell™ S7D7, культивированные в условиях «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC DEZA AZT FI BLAR001» во время стадии 7, сохраняли профиль белка бета-клеток на исходном уровне (ФИГ. 7B-7C). 89% клеток были NKX6.1+ CHGA+ (слева, ФИГ. 7B), 77,7% - NKX6.1+ NEUROD1+ (справа, ФИГ. 7B) и 40,8% - NKX6.1+ ИНСУЛИН+ (слева, ФИГ. 7C). Большая часть ИНСУЛИН-положительной популяции (46,4% от общего числа клеток были ИНСУЛИН+) была NKX6.1+ (слева, ФИГ. 7C) и не ГЛЮКАГОН-положительной (3,9% ИНСУЛИН+ ГЛЮКАГОН+; (справа, ФИГ. 7C).
[0202] В дополнение к профилю бета-клеток на исходном уровне генная экспрессия маркеров созревания MAFA (ФИГ. 7D), UCN3 (ФИГ. 7E), SLC2A1 (ФИГ. 7F), G6PC2 (ФИГ. 7G), ИНСУЛИН (ФИГ. 7H) и NKX6.1 (ФИГ. 7I) находилась на уровнях человеческих островков в скоплениях S7D7 Aggrewell™, подготовленных в условиях стадии 7 «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC DEZA AZT FI BLAR001 или BLAR004», или превышала их. Уровни экспрессии в S7D7 маркеров созревания, таких как: MAFA (ФИГ. 3C); G2PC2 (ФИГ. 3F); ИНСУЛИН (ФИГ. 3H); и NKX6.1 (ФИГ. 3L) были значительно выше в скоплениях Aggrewell™ («БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC DEZA AZT FI BLAR001 или BLAR004»), чем в скоплениях на ALI.
[0203] В действительности, ФИГ. 7J-7M показывают, что добавление DEZA и AZT к условиям стадии 7 «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC FI BLAR004» приводило к генерации большого числа не продуцирующих ГЛЮКАГОН (ФИГ. 7J; снизу справа) клеток С-ПЕПТИДА, которые на основании присутствия белка совместно экспрессировали PDX1 в S7D7 (ФИГ. 7J; снизу слева), NKX6.1 (ФИГ. 7J; снизу посередине), MAFA (ФИГ. 7K; снизу слева), UCN3 (ФИГ. 7K; снизу посередине) и SLC2A1 (ФИГ. 7K; снизу справа). Для каждой фигуры иммунофлуоресцентное окрашивание показано в виде отдельных каналов с С-ПЕПТИДОМ в верхнем ряду. Так как экспрессию MAFA, SLC2A1 и UCN3 не ограничивают С-ПЕПТИДположительными клетками, ожидают, что по меньшей мере около 10% популяции клеток будут показывать совместную экспрессию С-ПЕПТИДА, PDX1, NKX6.1, MAFA, SLC2A1 и UCN3. В противоположность этому на ФИГ. 7L-7M показана генерация посредством обработки в условиях «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC FI BLAR004» стадии 7 клеток С-ПЕПТИДА, которые на основании присутствия белка совместно экспрессировали частичный набор маркеров созревания к S7D7: PDX1 (ФИГ. 7L; снизу слева), NKX6.1 (ФИГ. 7L; снизу посередине), MAFA (ФИГ. 7M; снизу слева), SLC2A1 (ФИГ. 7M; снизу справа), но не ГЛЮКАГОН (ФИГ. 7L; нижний правый) и UCN3 (ФИГ. 7M; снизу посередине). Обработка скоплений Aggrewell™ в условиях «БЕЗ ALK5 С НИЗКИМ T3 ZM H NAC DEZA AZT FI BLAR004» стадии 7 приводило к генерации большого числа зрелых бета-клеток, схожих со зрелыми островками взрослого человека, согласно оцениванию по экспрессии генов и наличию белка.
[0204] Таким образом, данный пример демонстрирует, что скопления клеток стадии 4 можно дополнительно дифференцировать в суспензионной культуре до функциональных бета-клеток посредством изменений условий обработки стадии 7. В частности, в примере 4 показана генерация С-ПЕПТИД-положительных клеток внутри скоплений клеток в суспензионной культуре, которые совместно экспрессируют маркеры созревания бета-клеток, необходимые для обеспечения соответствующих функциональных возможностей бета-клеток.
Пример 5.
Генерация суспензионной культуры эндокринных клеток, имеющих кинетику глюкозозависимого митохондриального дыхания и стимулированной глюкозой секреции инсулина, аналогичную подобной в зрелых человеческих островках
[0205] В следующем примере показана генерация функционально зрелых бета-клеток с использованием суспензионной культуры со схожей с человеческими островками кинетикой глюкозозависимого митохондриального дыхания и стимулированной глюкозой секреции инсулина (GSIS). Условия культивирования такие же, как в примере 4. Клетки клеточной линии H1-hESC, культивированные со средой EZ8, при пассаже 28 засевали в виде отдельных клеток с плотностью 0,094×106 клеток/см2 на MATRIGEL™ на чашки Петри с покрытием в разведении 1:30 в среду DMEM-F12, которая содержит GlutaMAX™ в разведении 1:100 (концентрация 1X), 0,25 мМ аскорбиновой кислоты, 100 нг/мл FGF2, 1 нг/мл TGFβ, ITS-X в разведении 1:100, 2% FAF-BSA, 20 нг/мл IGF-1, в которую добавили 10 мкМ соединения Y. Соединение Y добавляли только в течение первых 24 часов после посева. Через сорок восемь часов после посева культуры промывали в PBS (-/-).
[0206] Для ФИГ. 8A-8I культуры дифференцировали, используя следующий протокол. На протяжении стадий с 1 по 4 протокола культуры поддерживали в виде плоских адгезивных культур. Начиная с монослоя S4D3 или криоконсервированных клеток S4D3, скопления клеток Aggrewell™ получали и культивировали в течение дополнительных 48 часов (день 5 стадии 4 или S4D5). В ходе выполнения протокола дифференцировки среду меняли ежедневно. На стадиях 5, 6 и 7 скопления Aggrewell™ культивировали в суспензионной культуре, как описано в примере 3. Скопления на ALI, показанные на ФИГ. 8E-8F, культивировали, как описано в примере 2. Вкратце:
а. Стадия 1 (3 дня). Клетки культивировали в течение одного дня в следующей среде стадии 1: среда MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в разведении 1:100 (концентрация 1X), 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 1,5 мкМ соединения MCX. Впоследствии клетки культивировали в течение дополнительного дня в среде MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл GDF8 и 0,1 мкМ ингибитора GSK-3β. Впоследствии клетки культивировали в течение дополнительного дня в MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы и 100 нг/мл GDF8.
b. Стадия 2 (2 дня). Клетки обрабатывали в течение двух дней средой MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, 1X GlutaMAX™, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 0,25 мМ аскорбиновой кислоты и 50 нг/мл FGF7.
c. Стадия 3 (2 дня). Клетки обрабатывали в течение двух дней специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1:200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; 1X GlutaMAX™; 1% FAF-BSA; 25 нг/мл FGF7; 0,25 мкМ SANT-1; 1 мкM RA; 0,25 мМ аскорбиновой кислоты; 300 нM TPB); и LDN-HCl в течение двух дней. Концентрация LDN-HCl, используемая в первый день стадии 3, составляла 100 нМ, а во второй день стадии 3-10 нМ.
d. Стадия 4 (3 дня). Клетки обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1:200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 1% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 70 нМ LDN-HCl; 0,25 мМ аскорбиновой кислоты; и 200 нM TPB в течение трех дней.
e. Криоконсервация монослоя в день 3 стадии 4. Криосохраненные клеточные банки из монослоя S4D3 получали с использованием процедуры, описанной в примере 3 и таблице VII.
f. Размораживание криоконсервированных клеток монослоя S4D3: Замороженные флаконы объемом 5 мл, содержащие 5,0 X106 клеток монослоя S4D3, размораживали, как описано в примере 3. Можно применять аналогичную процедуру для перемещения скоплений на ALI или Aggrewell™.
g. Стадия 4 (2 дня) для перемещения скопления Aggrewell™ или перемещения скопления на ALI. Скопления Aggrewell™ получали из клеток монослоя дня 3 стадии 4 или размораживали криоконсервированные клетки дня 3 стадии 4, как описано в примере 3. Скопления на ALI получали из клеток дня 3 стадии 4, как описано в примере 2.
Так же как в примере 4, на стадиях 5, 6 и 7 клеточные культуры обрабатывали, начиная или со скоплений Aggrewell™ S4D5, или со скоплений на ALI, перемещенных в S4D3. Скопления Aggrewell™ S4D5 извлекали из планшетов Aggrewell™ 400EX и переносили в центрифужные пробирки PBS0.1MAG с плотностью клеток 1,5-2,0 миллиона клеток/мл при скорости вращения 27 об./мин (оборотов в минуту).
h. Стадия 5 (3 дня). Скопления Aggrewell™ или ALI обрабатывали специализированной средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия, и в которую добавили ITS-X в разведении 1:200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 0,25 мкM SANT-1; 50 нM RA; 100 нМ LDN-HCl; 1 мкМ T3; и 10 мкМ ингибитора II ALK5 в течение трех дней. 4 кЕд/мл ДНКазыI и 5 мкМ соединения Y добавляли только в день 1 стадии 5 в скопления Aggrewell™.
i. Стадия 6 (7 дней). Скопления Aggrewell™ или ALI обрабатывали в специализированной среде BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия, в которую добавили ITS-X в разведении 1:200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 100 нМ LDN-HCl; 1 мкМ T3; 10 мкМ ингибитора II ALK5 и 100 нМ гамма-секретазы XX.
j. Стадия 7 (от 7 до 14 дней). Скопления Aggrewell™ или ALI обрабатывали в специализированной среде BLAR001 или BLAR004, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1:200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H), 10 нМ T3 (низкий T3); 1 мМ NAC; 0,5 мкМ ZM); и следующие компоненты, которые входят в состав I (FI) - среда RPMI с витаминной добавкой в разведении 1:200; среда MEM с добавлением заменимых аминокислот в разведении 1:200; концентрат липидов с определенным химическим составом в разведении 1:2000; пируват натрия в разведении 1:200; следовые элементы А в разведении 1:2000; следовые элементы В в разведении 1:2000 в течение семи дней. Дополнительные соединения, добавленные во время стадии 7, включали в себя 4 мкМ AZT; или 1 мкМ DEZA. Для большей ясности скопления Aggrewell™ или ALI в суспензии культивировали во время стадии 7 в двух условиях, используя концентрации, описанные выше (в среде, основанной на BLAR001 или BLAR004): (i) без ALK5, с низким T3, ZM, H, NAC; (ii) без ALK5, с низким T3, ZM, H, NAC, AZT, DEZA. ФИГ. 8A, 8B, 8H, 8I: Во время стадии 7 скопления Aggrewell в суспензии культивировали до S7D13 или S7D14 в двух условиях: (i) без ALK5, с низким T3, 0,5 мкМ ZM, 10 мкг/мл H, 1 мМ NAC; (ii) от S7D1 до S7D5 - без ALK5, с низким T3, 0,5 мкМ ZM, 10 мкг/мл H, 1 мМ NAC; 5 мкМ AZT; 1 мкМ DEZA; от S7D6 до S7D13 или S7D14 - без ALK5, с низким T3, 0,5 мкМ ZM, 10 мкг/мл H, 1 мМ NAC.
[0207] Количественный анализ и определение характеристик дифференцированных клеток. Для количественного анализа глюкозозависимой митохондриальной активности скоплений на ALI S6D7 характеризовали скопления Aggrewell™ стадии 7 и зрелые человеческие островки с помощью устройства Seahorse XFe24, как описано в примере 2. Скопления на ALI/Aggrewell™ или человеческие островки собирали и измеряли их скорость потребления кислорода (OCR) на внеклеточном поточном анализаторе XFe24 до и после введения 20 мМ D-глюкозы. Скопления на ALI/Aggrewell™ или человеческие островки удаляли из условий стадии 7 и инкубировали в течение 2 часов при 37°C и в не содержащей CO2 среде, и в среде, выполненной с возможностью достижения исходного уровня OCR. Среда для предварительной инкубации содержит 1 мМ D-глюкозы, 1 мМ L-глутамина и 1 мМ пирувата натрия в основной среде XF. После предварительной инкубации скопления на ALI/Aggrewell™ или человеческие островки помещали на аппарат Seahorse, в котором выполняли следующие измерения: (i) OCR на исходном уровне 3 раза (перед введением D-глюкозы); (ii) 5 раз после введения D-глюкозы (время инкубации после введения: 72 минуты). Все измерения OCR нормализовали в соответствии с содержанием ДНК в отдельных пробах. ДНК выделяли с помощью набора QIAamp DNA MicroKit, а содержание ДНК измеряли с помощью спектрофотометра для УФ и видимой областей спектра NanoDrop 8000.
[0208] Для количественного анализа глюкозозависимой секреции инсулина скопления на ALI стадии 7, скопления Aggrewell™ и зрелые человеческие островки характеризовали с помощью клеточной перфузионной системы (BioRep Technologies, г. Майами, штат Флорида, США, № по каталогу PERI4-02). Если говорить кратко, для нормализации секреции инсулина по исходному уровню скопления на ALI/Aggrewell™ или человеческие островки переносили в теплый (37 °C) буферный раствор Кребса (таблица IX). Клетки помещали в перфузионные камеры (BioRep Technologies, № по каталогу PERI-CHAMBER) и непрерывно перфузировали (скорость потока 100 мкл/мин) четырьмя последовательными буферными растворами Кребса, в которые добавили одно из: (i) 3 мМ D-глюкозы; (ii) 16,7 мМ D-глюкозы ± 100 нг/мл эксендина-4 (Ex4); и (iii) 25 мМ KCl с 3 мМ D-глюкозы. На каждой фигуре указаны конкретные протоколы перфузии. Пробы перфузата собирали каждую минуту и определяли концентрации белка С-ПЕПТИДА (в единицах нг/мл) с помощью твердофазного ИФА для С-ПЕПТИДА (Mercodia, г. Уппсала, Швеция, № по каталогу 10-1136-01).
[0209] На ФИГ. 8A и 8B показана митохондриальная реакция скоплений Aggrewell™ S7D13 в суспензии на введение 20 мМ D-глюкозы. На ФИГ. 8A и 8B показано, что человеческие островки (черная линия с кружками) и быстро реагировали на высокую концентрацию D-глюкозы, как видно на основании OCR, равной 123,3% ± 12,92 по сравнению с исходным уровнем через 15 минут (мин) после инъекции («п/и»), и сохраняли высокую OCR во времени (131,5% ± 11,32; 72 мин п/и). С другой стороны, в скоплениях на ALI S6D7 (серая линия с треугольниками), которые обогащали незрелыми С-ПЕПТИДположительными клетками, не было стремительной реакции OCR на высокую концентрацию D-глюкозы (104,4% ± 3,37; 15 мин п/и), и они показывают относительно слабую реакцию OCR во времени (113,3% ± 4,51; 72 мин п/и). Схожую с человеческими островками кинетику глюкозозависимого митохондриального дыхания наблюдали в условиях «без ALK5, с низким T3, ZM, H, NAC, FI, BLAR004» в S7D13 в контексте скоплений Aggrewell™ в суспензии (110,7% ± 2,46-15 мин п/и; 125,9% ± 2,27-72 мин п/и) (серая линия с квадратами) (ФИГ. 8A); В противоположность этому, скопления на ALI S7D7 в условиях «без ALK5, с низким T3, ZM, H, NAC, FI BLAR001 или BLAR004» не отображали кинетику глюкозозависимого митохондриального дыхания на уровне человеческих островков (ФИГ. 5C и 5E). Кроме того, скопления Aggrewell™ в условиях «без ALK5, с низким T3, ZM, H, NAC, AZT, DEZA, FI, BLAR004» в суспензии потребляли значительно больше кислорода в ответ на стимуляцию высокой концентрацией глюкозы, чем человеческие островки (162,0% ± 11,51-15 мин п/и; 177,1% ± 0,99-72 мин п/и) (серая линия с квадратами) (ФИГ. 8B); DEZA и AZT вводили только во время первых четырех дней обработки стадии 7, предполагая, что функциональная митохондриальная способность к реагированию, полученная за счет AZT и DEZA, оставалась стабильной в скоплениях Aggrewell™ стадии 7 в течение по меньшей мере 10 дней.
[0210] На ФИГ. 8C показано, что зрелые бета-клетки внутри человеческих островков демонстрировали способность к осуществлению множества циклов быстрой двухфазной секреции инсулина в ответ на стимуляцию глюкозой. Вторая реакция в виде двухфазной GSIS была менее выраженной по сравнению с первой (первая фаза первой реакции в виде GSIS была приблизительно в 7-8 раз сильнее). Кроме того, человеческие островки демонстрировали способность к осуществлению множества циклов «включения-выключения» секреции инсулина и способность к массивному высвобождению гранул инсулина при KCl-опосредованной деполяризации мембраны. Все исследованные условия показывали сильную реакцию в виде секреции инсулина на KCl (ФИГ. 8C-8I). Добавление эксендина-4 (Ex4) не увеличивало амплитуду реакции в виде GSIS в показанных человеческих островках, но было включено для сравнения с профилями GSIS ALI или Aggrewell™ (ФИГ. 8D). Скопления на ALI S7D8-S7D10, обработанные во время стадии 7 в условиях «без ALK5, с низким T3, ZM, H, NAC FI», либо в BLAR001 (ФИГ. 8E), либо в BLAR004 (ФИГ. 8F), показали одну (~4-10-кратное увеличение в первой фазе первой реакции в виде GSIS), но не вторую, и относительно медленную реакцию в виде двухфазной GSIS. Кроме того, скопления на ALI не были способны блокировать вторую фазу секреции инсулина при реперфузии 3 мМ D-глюкозы после стимуляции. В противоположность этому, скопления S7D14 Aggrewell™, обработанные во время стадии 7 в условиях «без ALK5, с низким T3, ZM, H, NAC, FI BLAR004», показали сильную первую двухфазную GSIS (~5-кратное увеличение в первую фазу первой реакции в виде GSIS), а затем продемонстрировали способность полностью блокировать GSIS и показали слабую вторую монофазную реакцию (ФИГ. 8G). После добавления DEZA и AZT к условиям «без ALK5, с низким T3, ZM, H, NAC, FI BLAR004» скопления S7D14 Aggrewell™ показали множество циклов схожей с человеческими островками двухфазной GSIS (~5-7-кратное увеличение в первой фазе первой реакции в виде GSIS) и способность полностью блокировать GSIS между повышениями концентрации глюкозы (ФИГ. 8H-8I). На ФИГ. 8H и 8I представлено два биологических повторения условия «без ALK5, с низким T3, ZM, H, NAC, DEZA, AZT BLAR004» для скопления Aggrewell™ S7D14. На ФИГ. 8H-8I DEZA и AZT вводили только во время первых четырех дней обработки стадии 7, предполагая, что устойчивые реакции в виде двухфазной GSIS, полученные за счет AZT и DEZA, оставались стабильными в скоплениях Aggrewell™ стадии 7 в течение по меньшей мере 10 дней.
[0211] Таким образом, в примере 5 показана генерация полученных из hESC функциональных бета-клеток (стадия 7) с использованием клеточной агрегации и суспензионной культуры, имеющих схожую с человеческими островками кинетику глюкозозависимого митохондриального дыхания и GSIS.
(6-(4-(2-(пиперидин-1-ил)этокси)фенил)-3-(пиридин-4-ил)пиразоло[1,5-a]пиримидин, гидрохлорид, рецептор BMP)
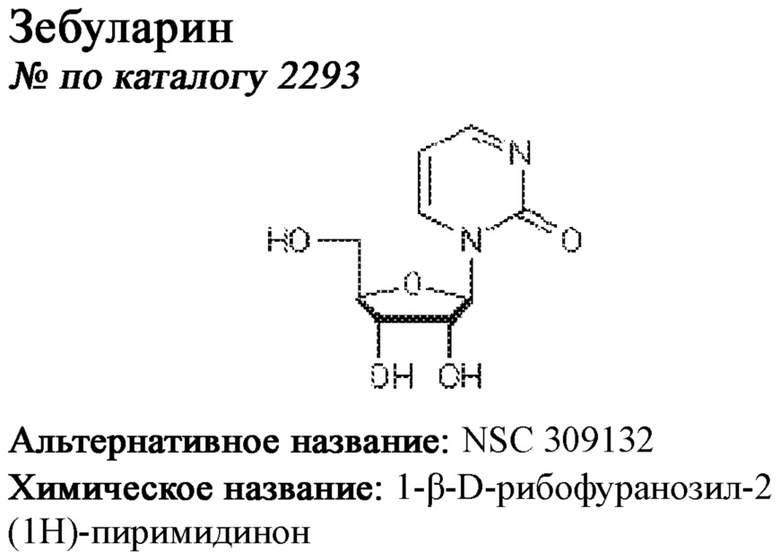
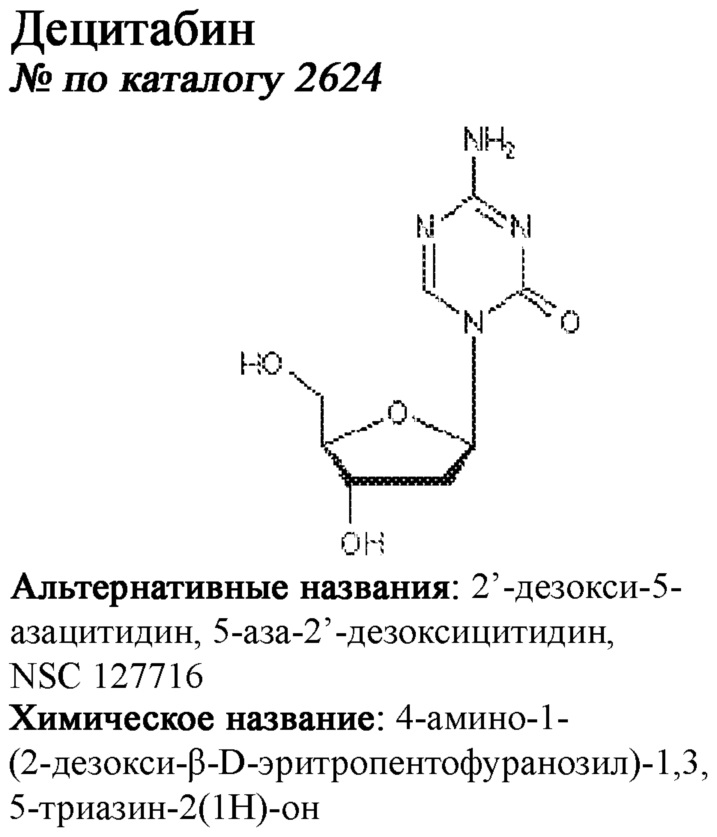
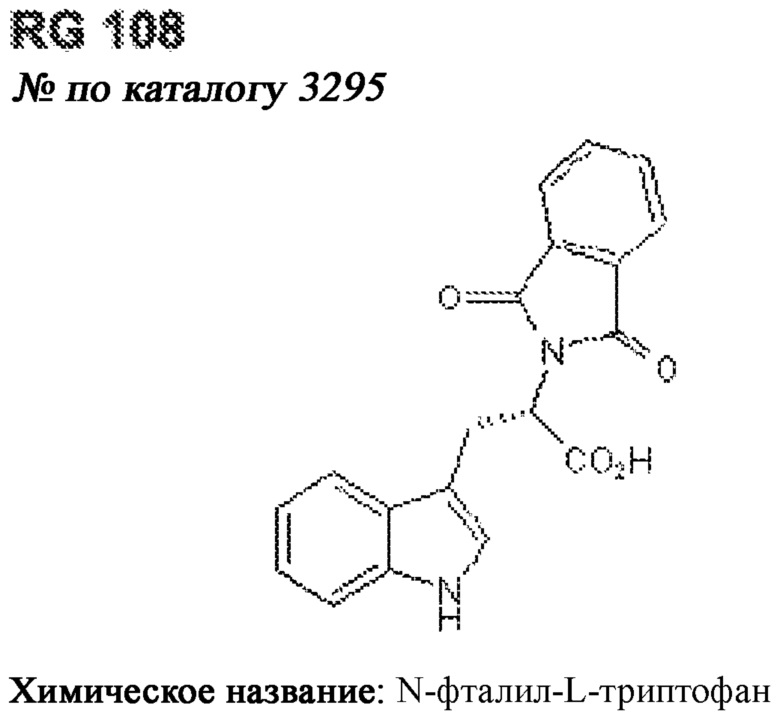
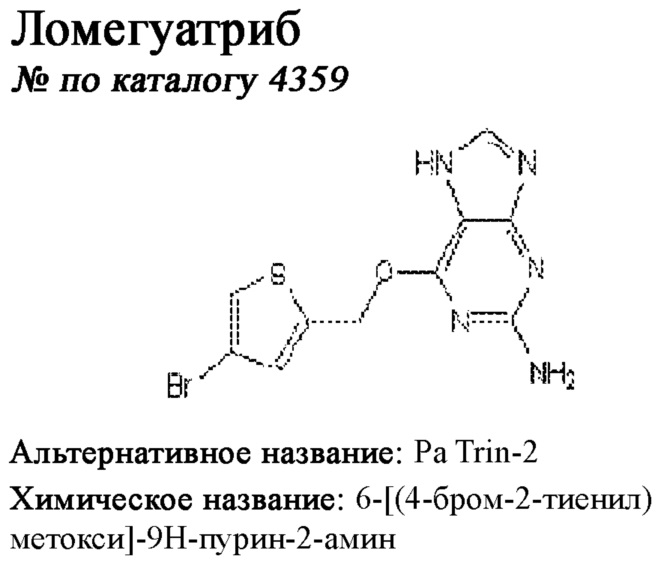
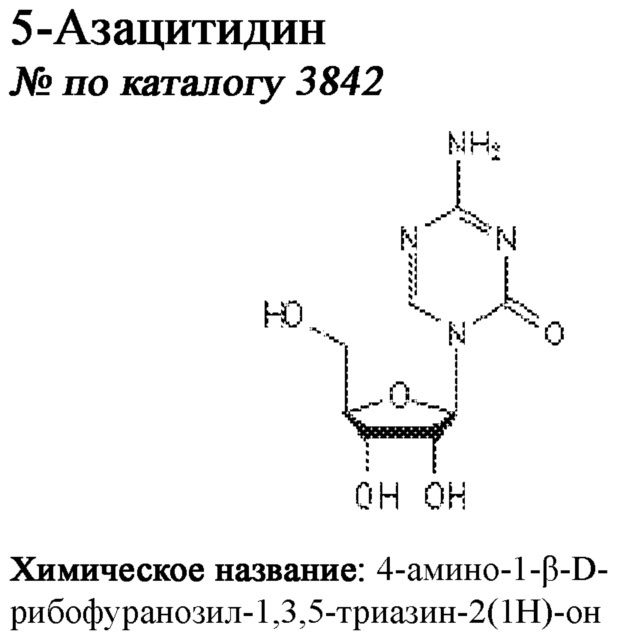
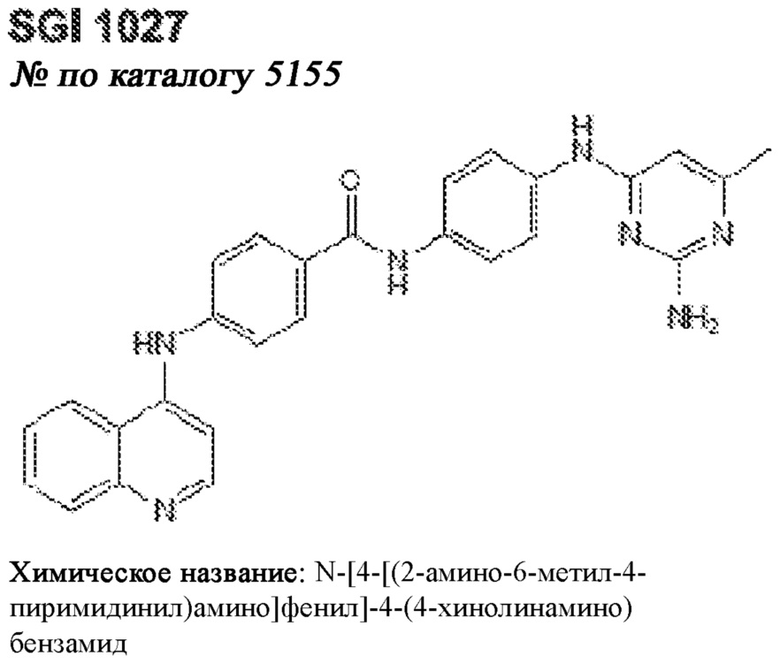
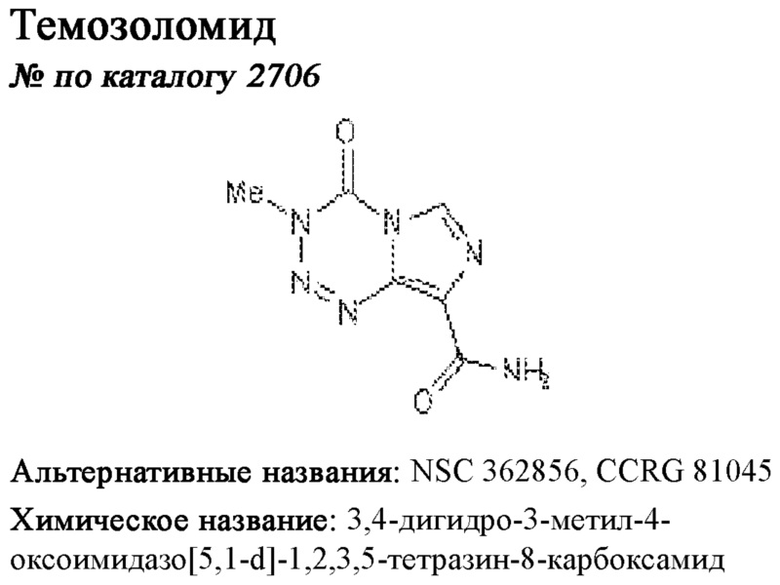
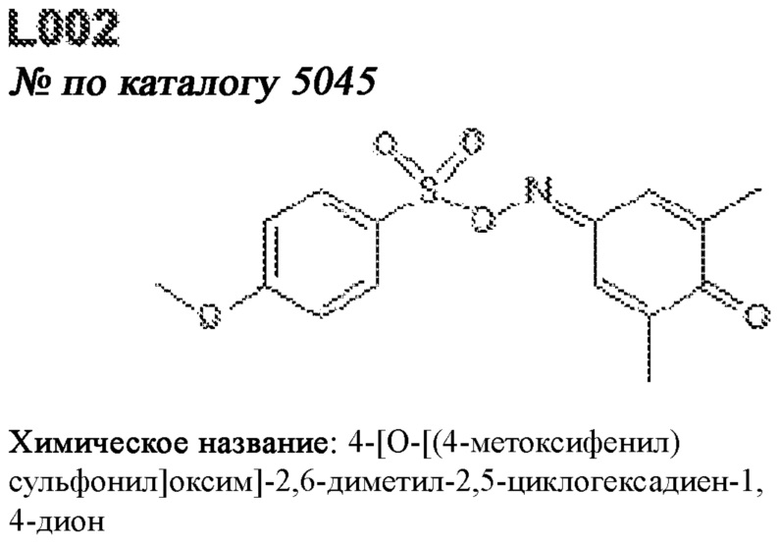
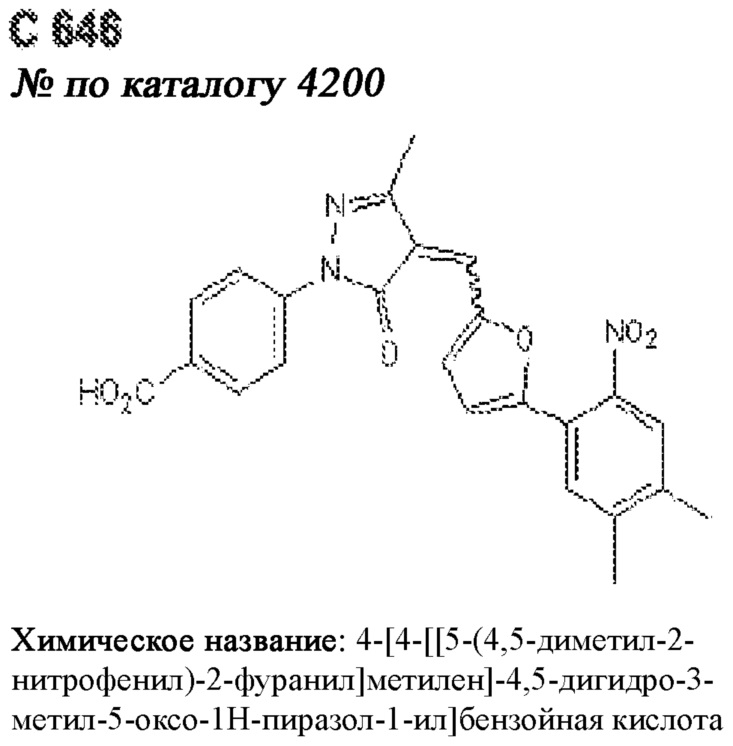
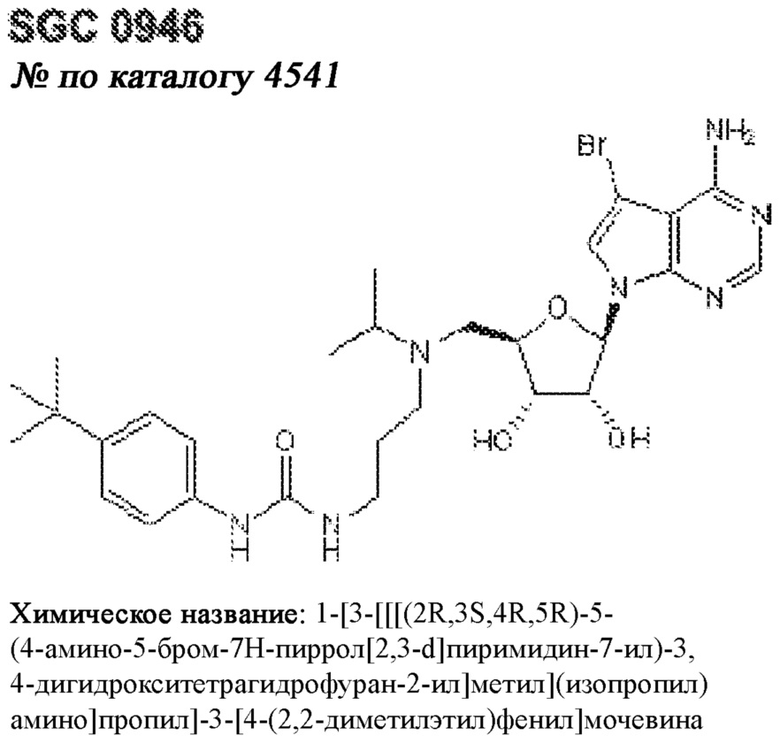
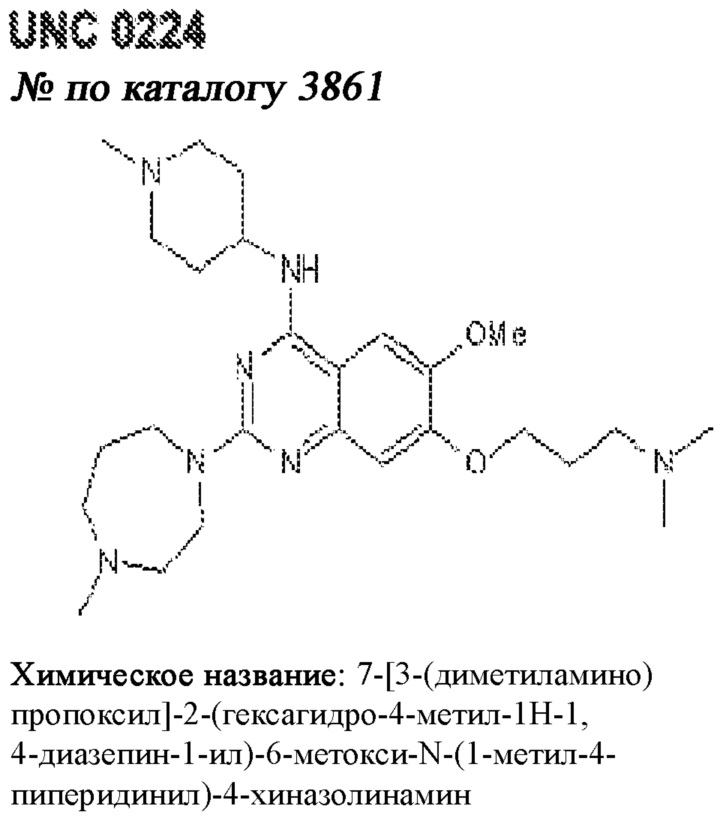
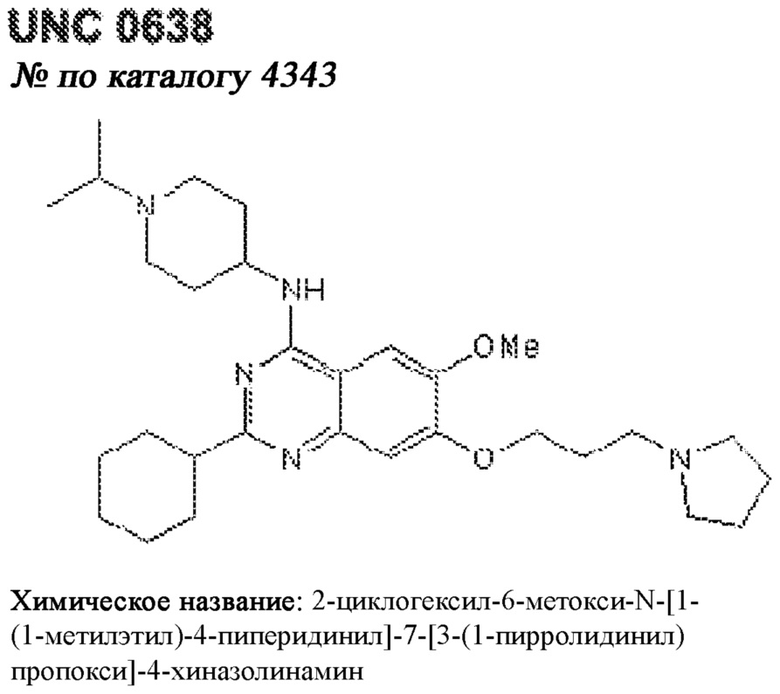
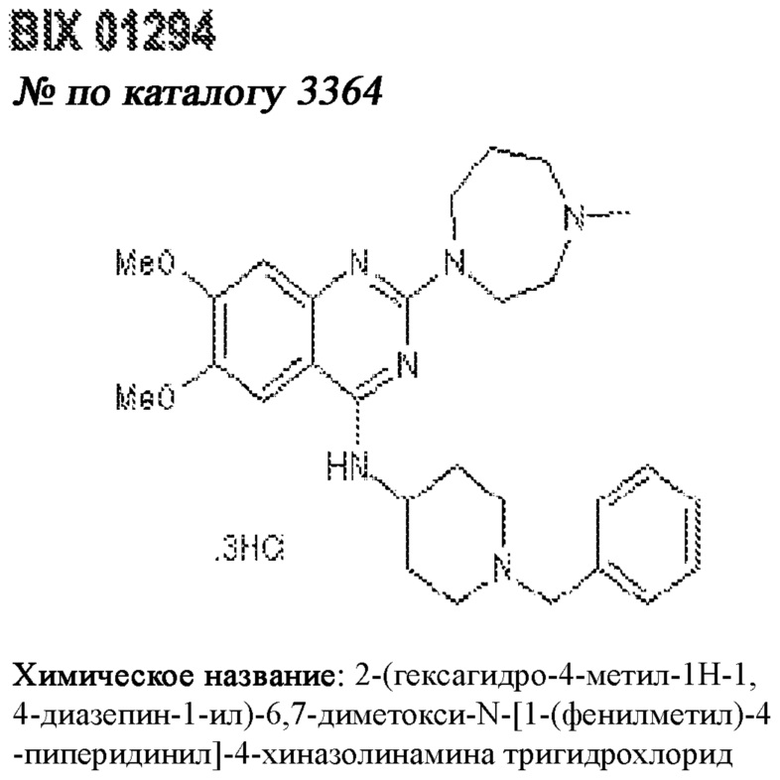
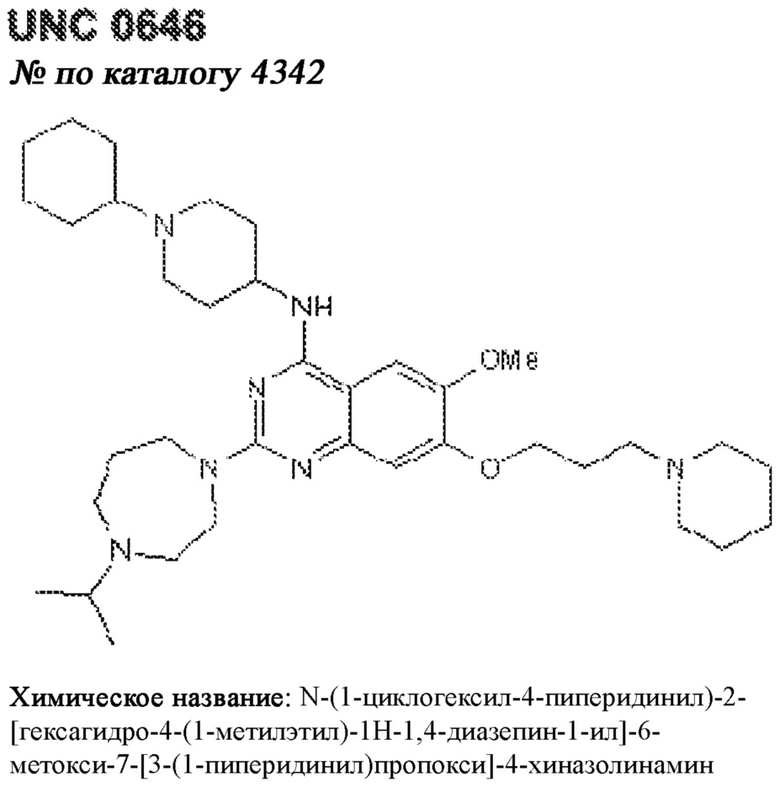
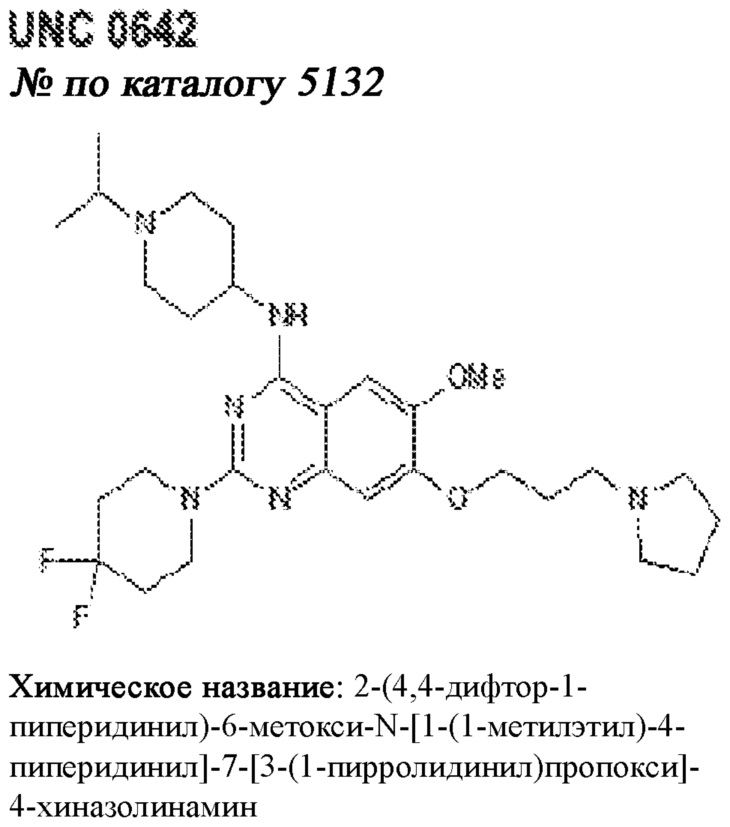
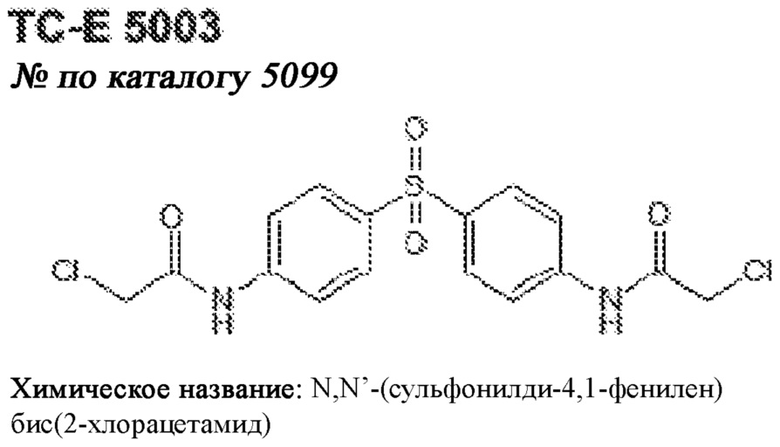
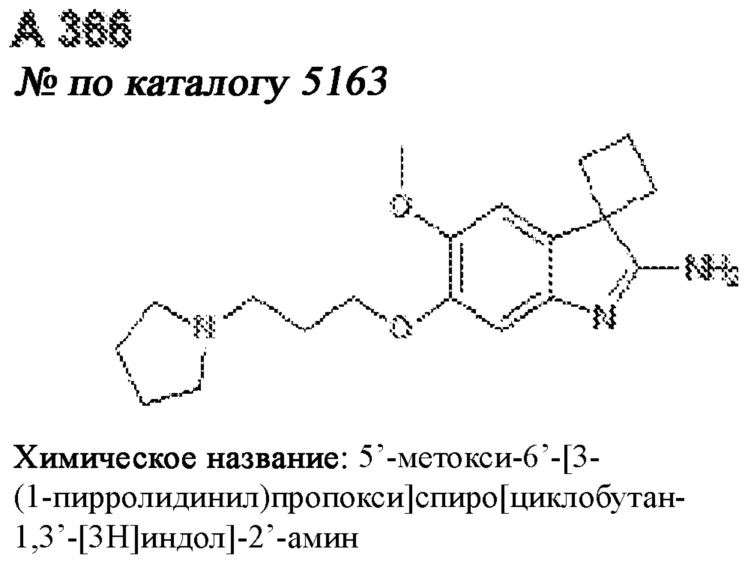
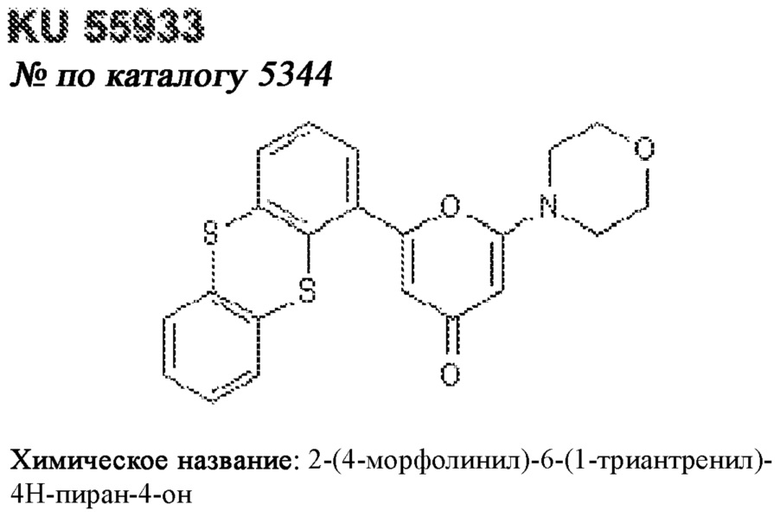
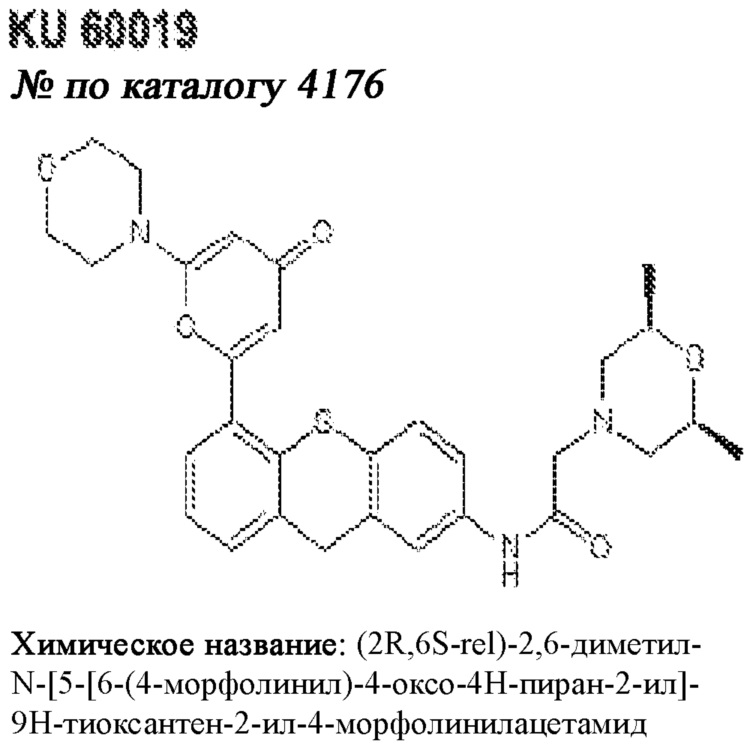
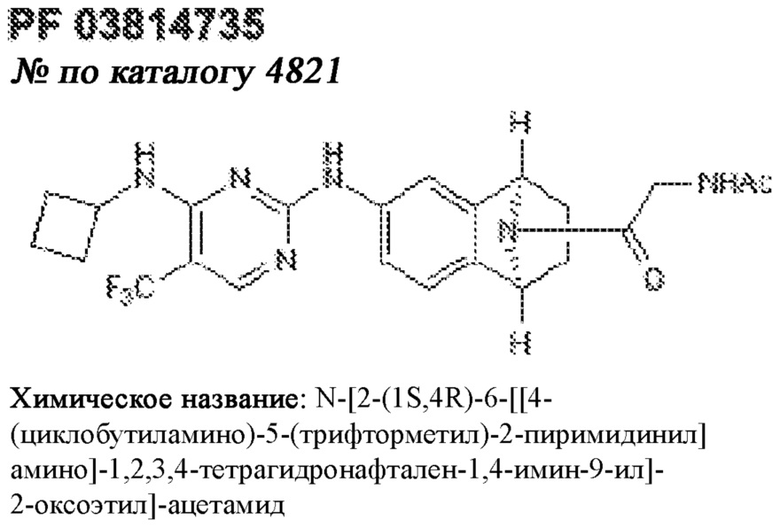
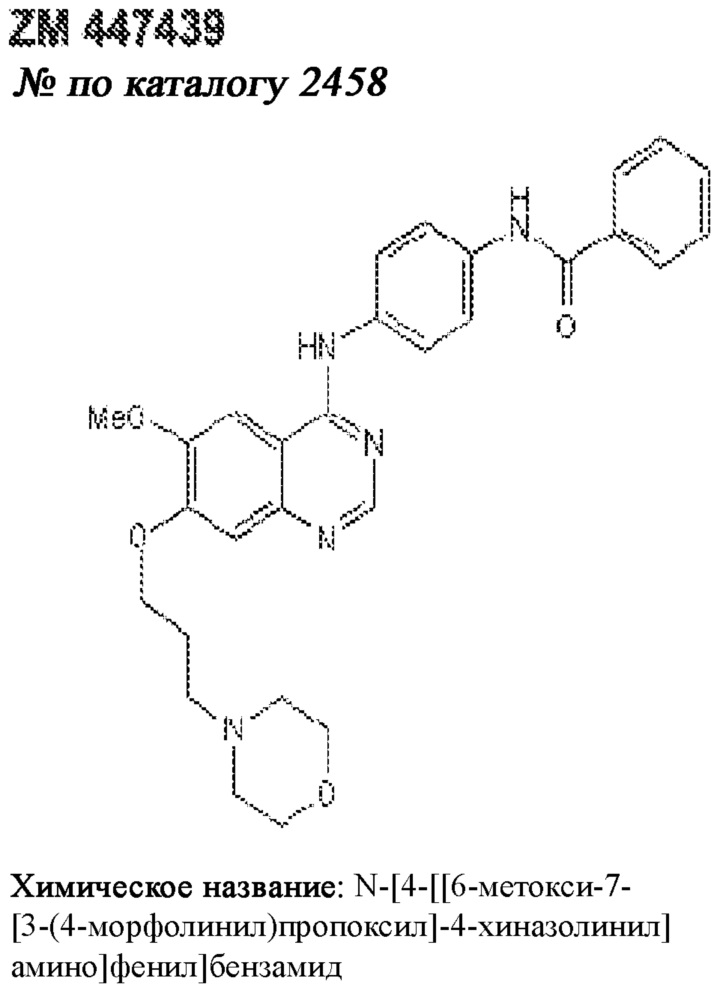
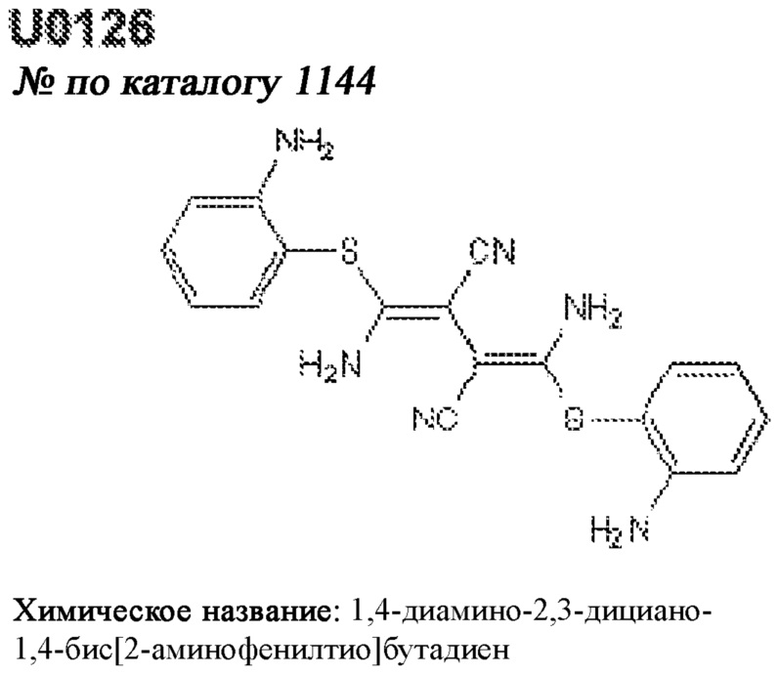
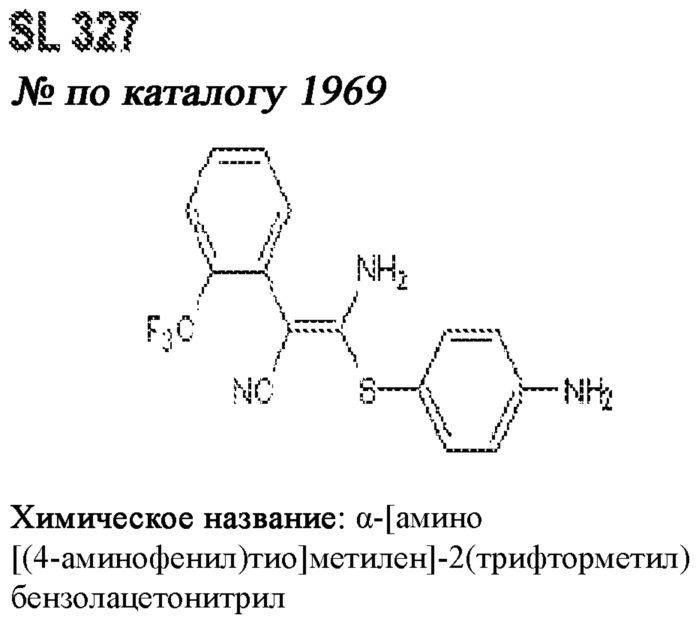
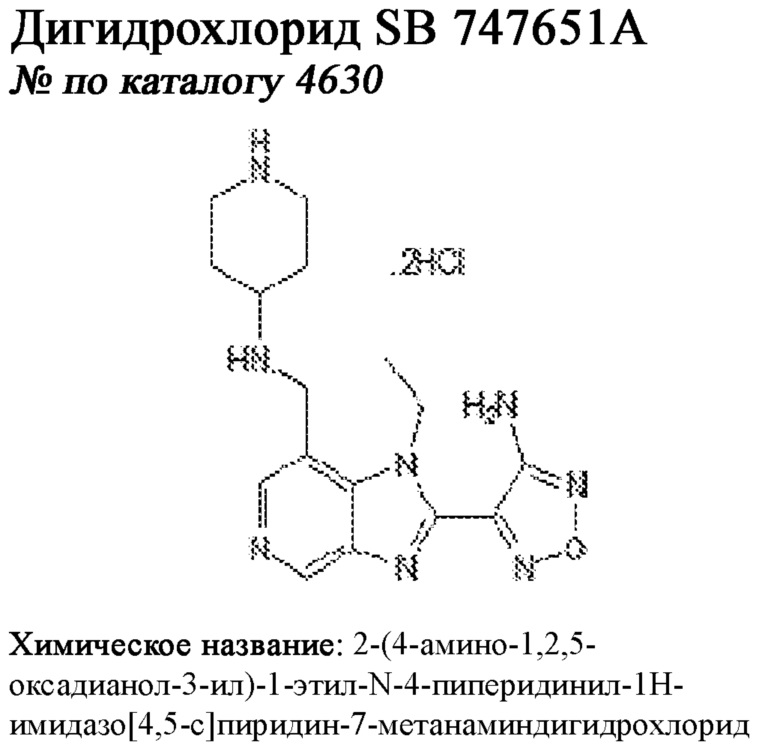
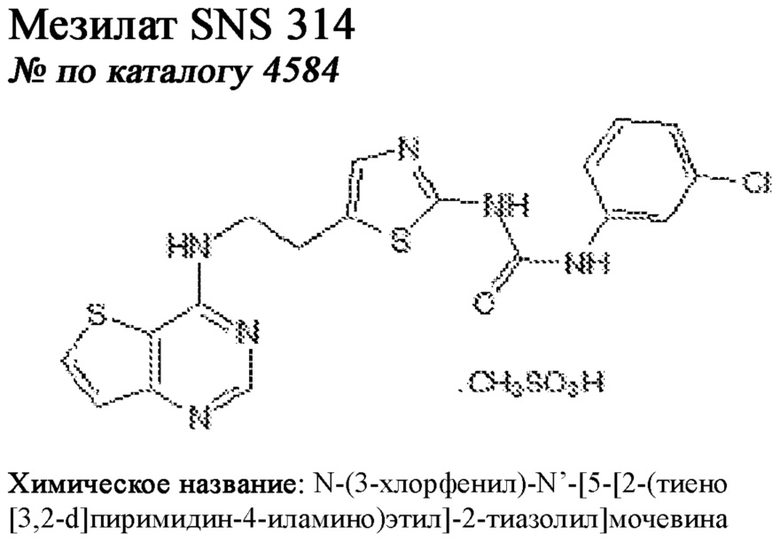
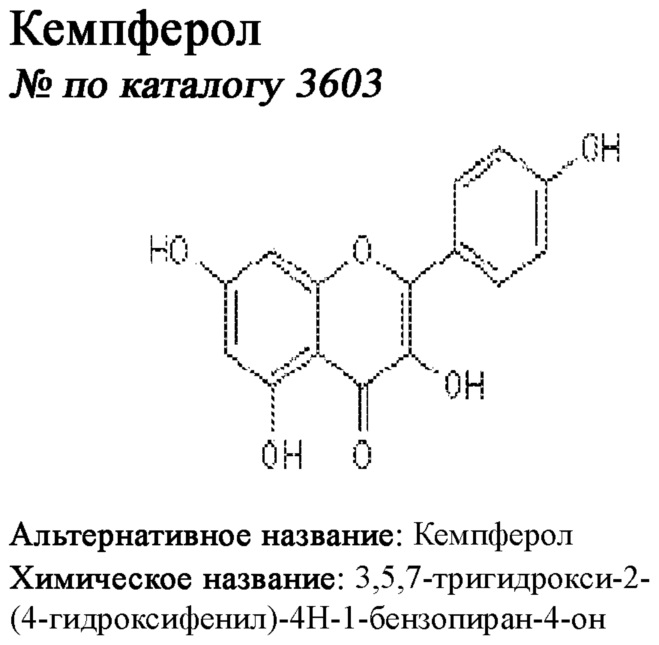
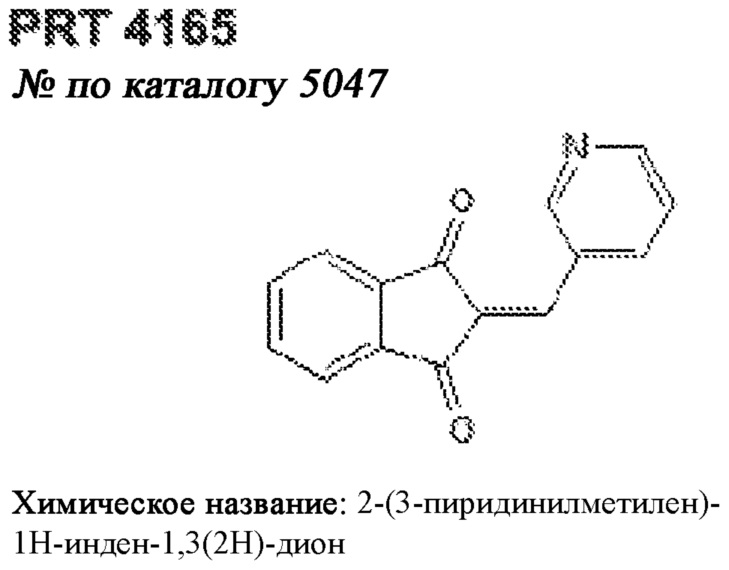
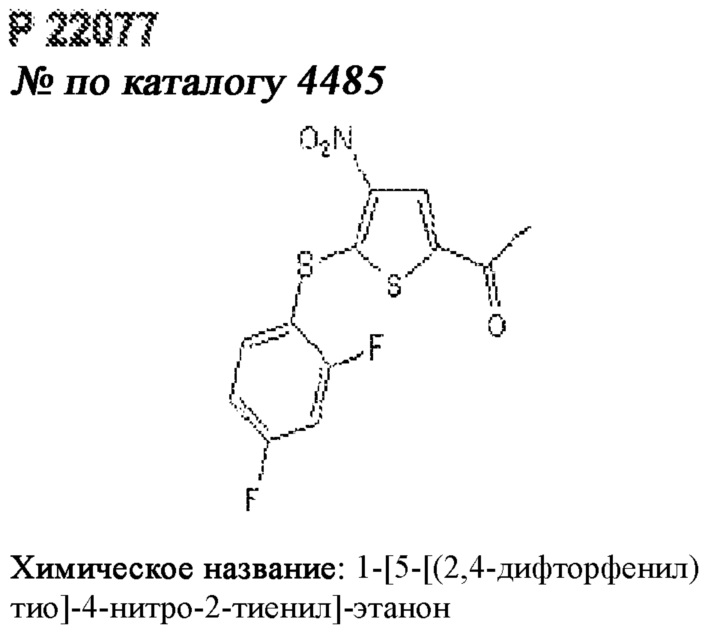
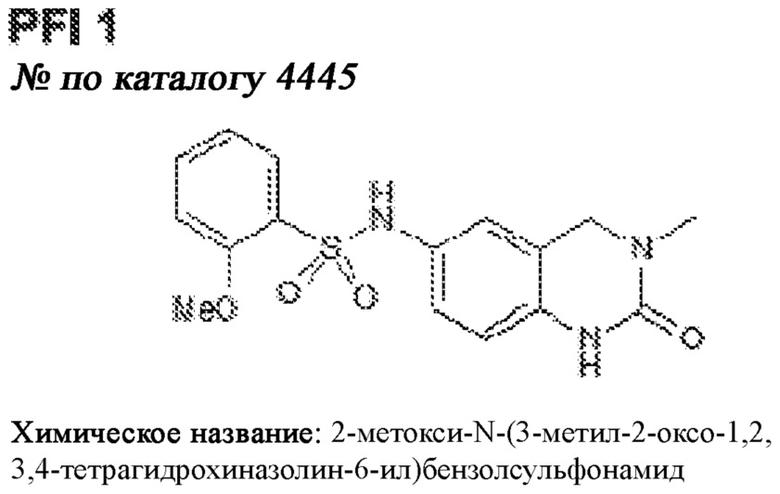
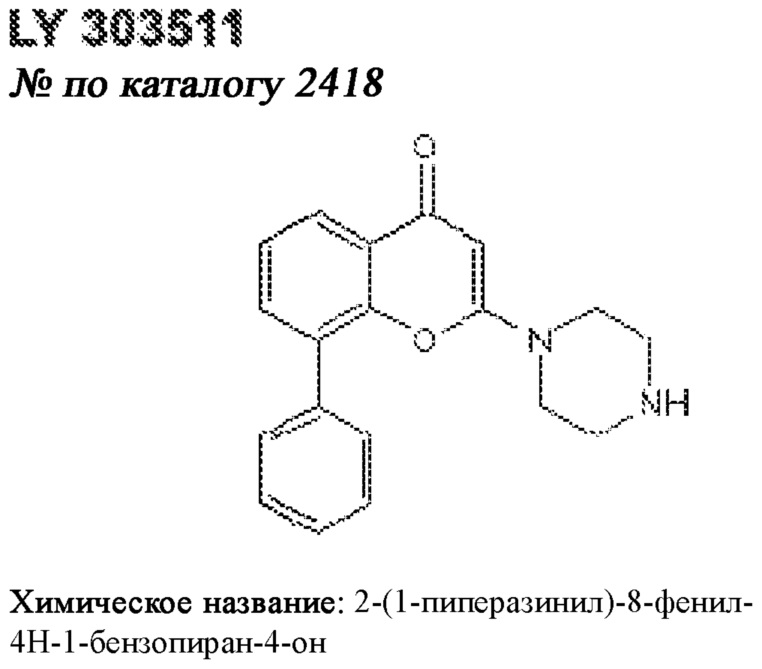
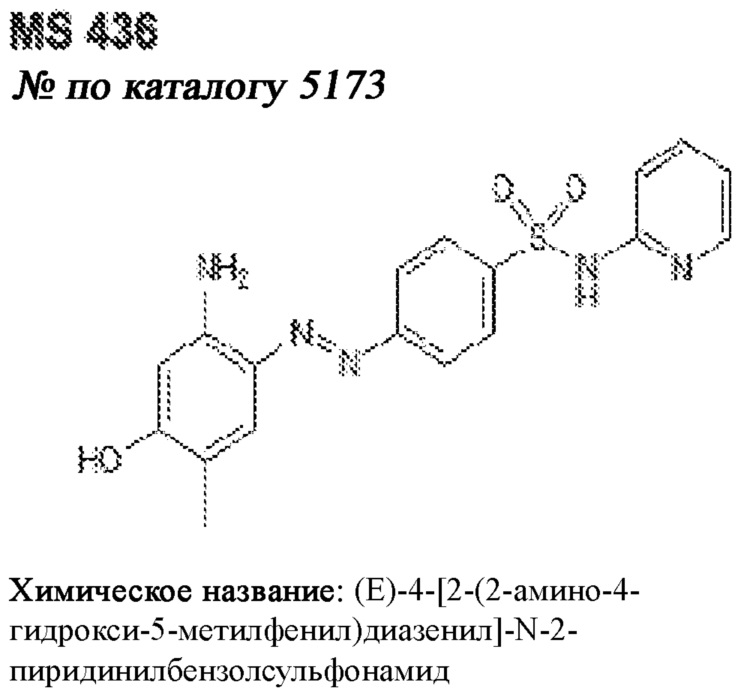
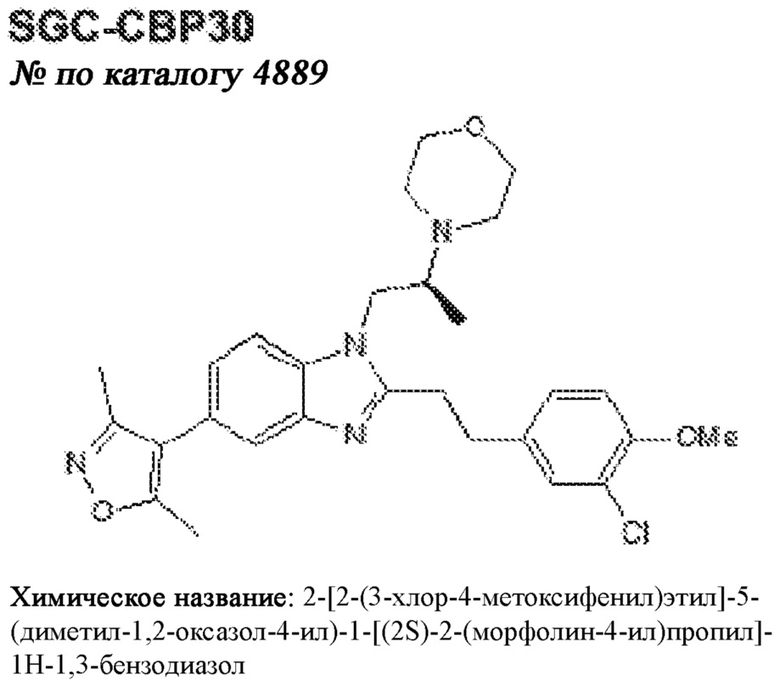
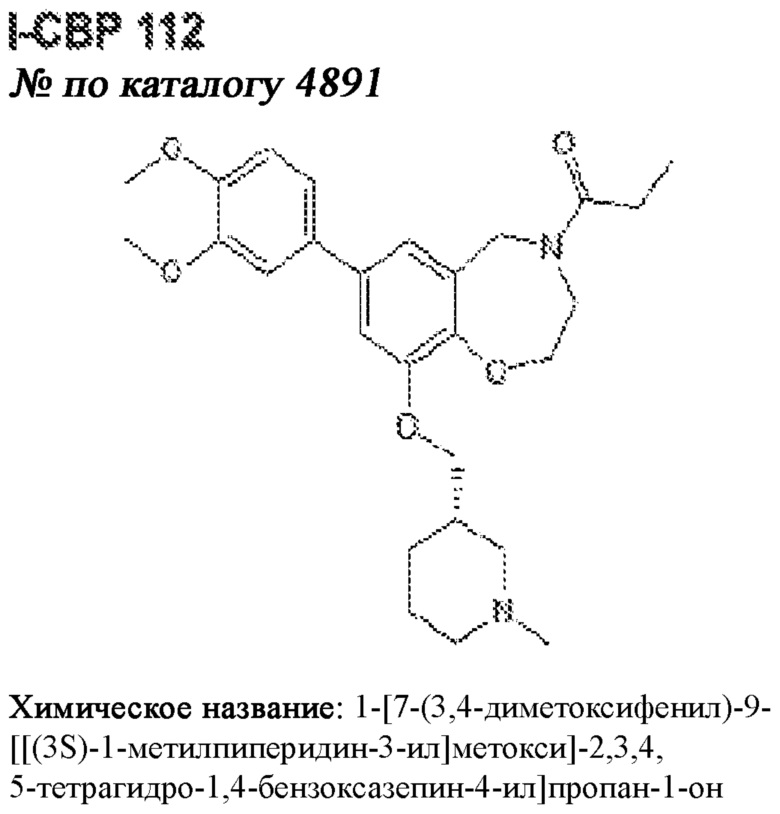
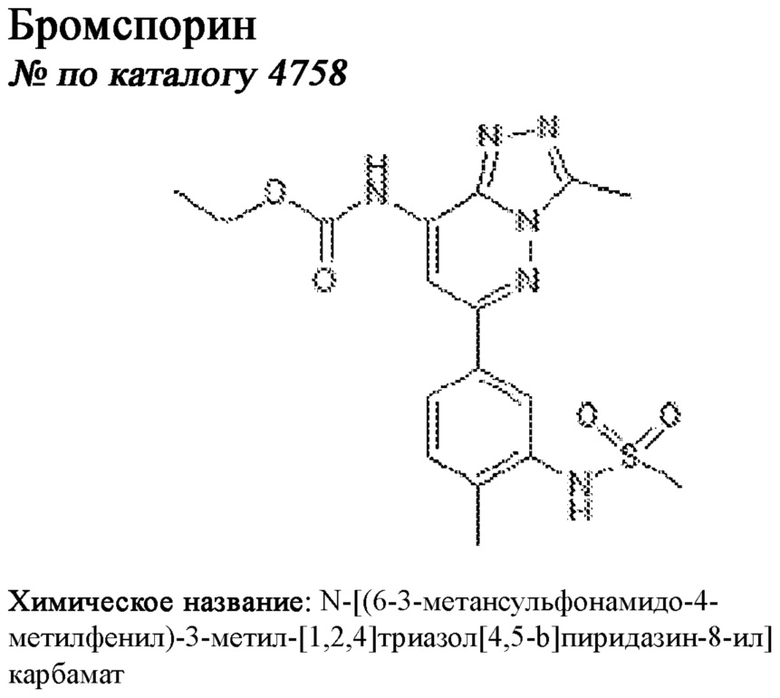
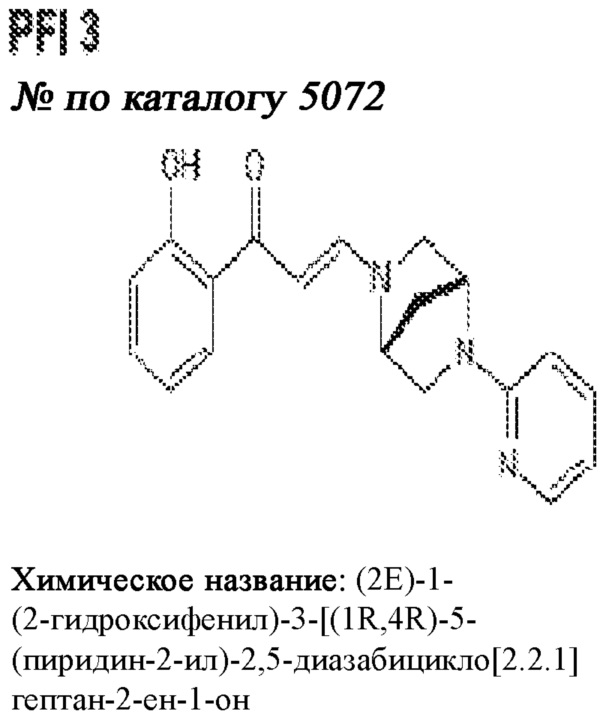
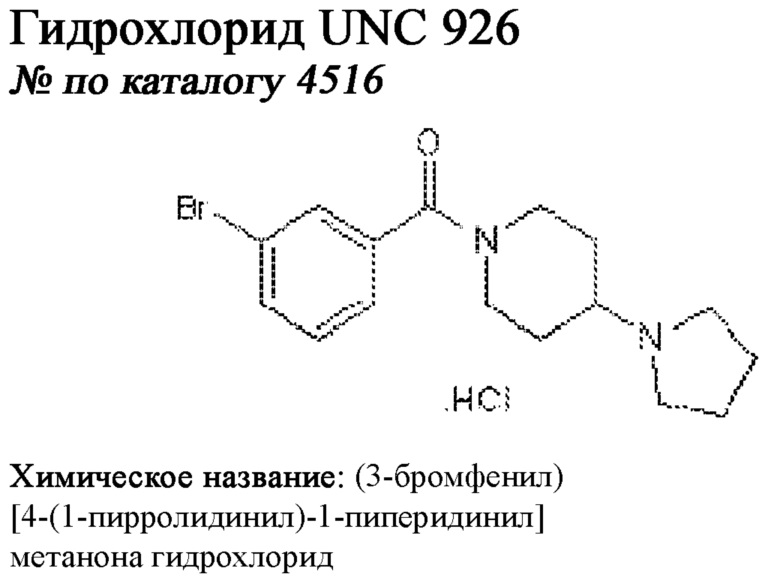
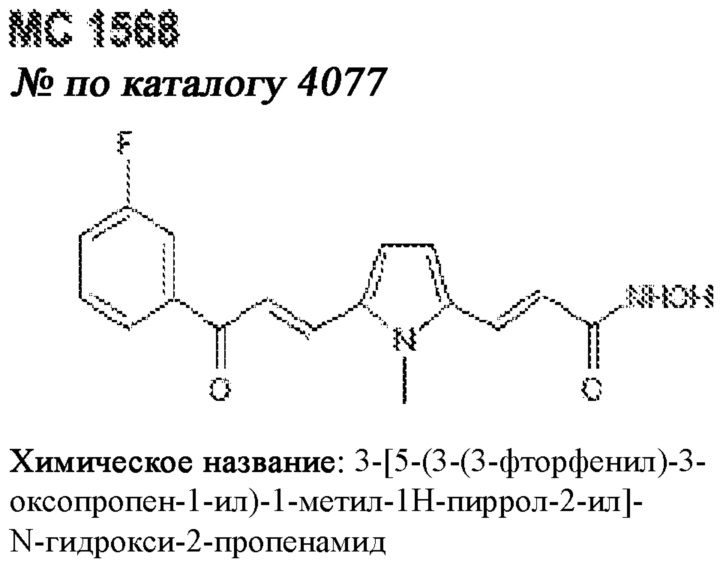
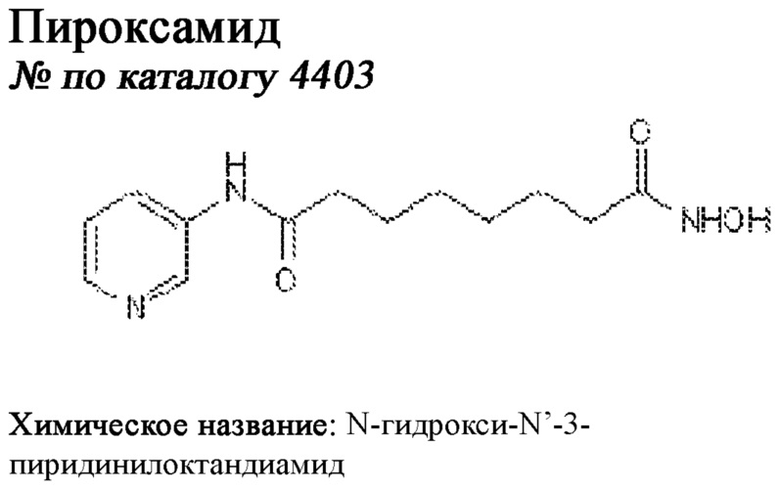
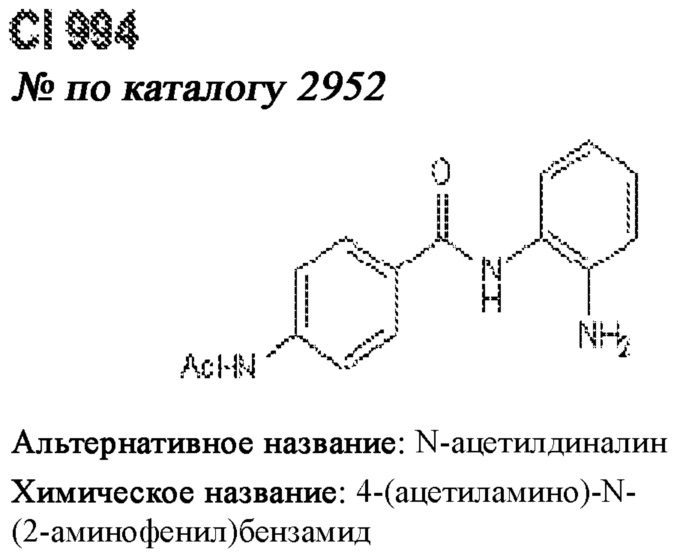
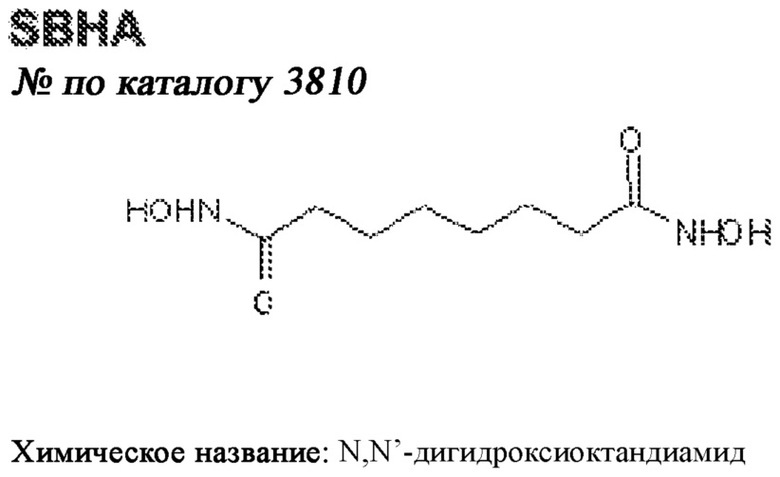
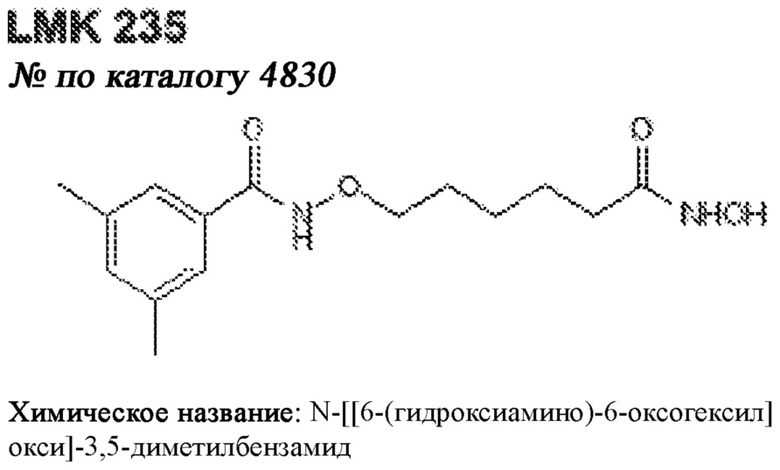
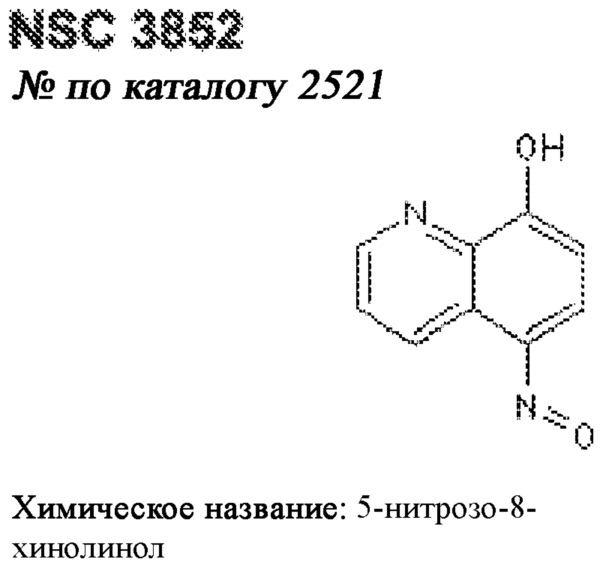
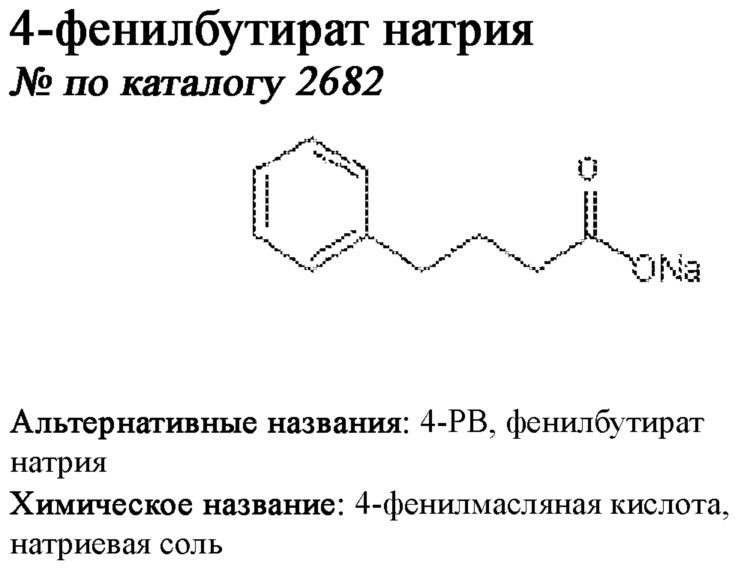
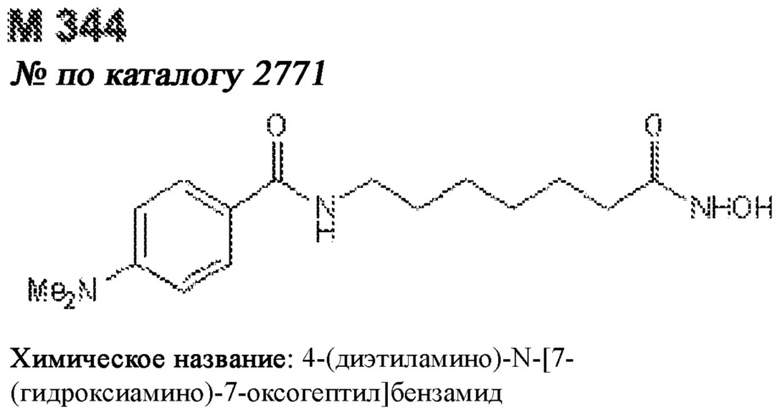

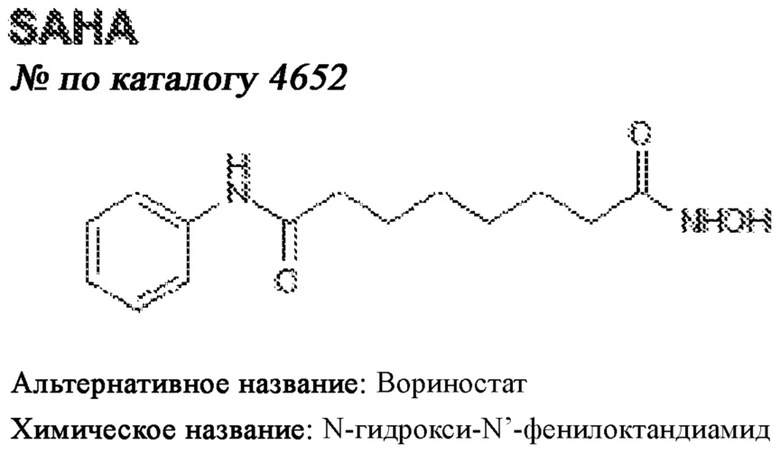
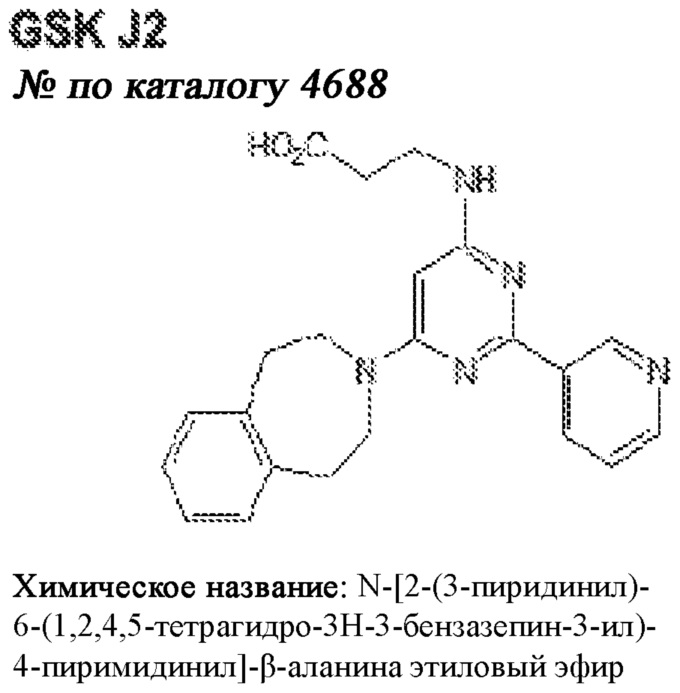
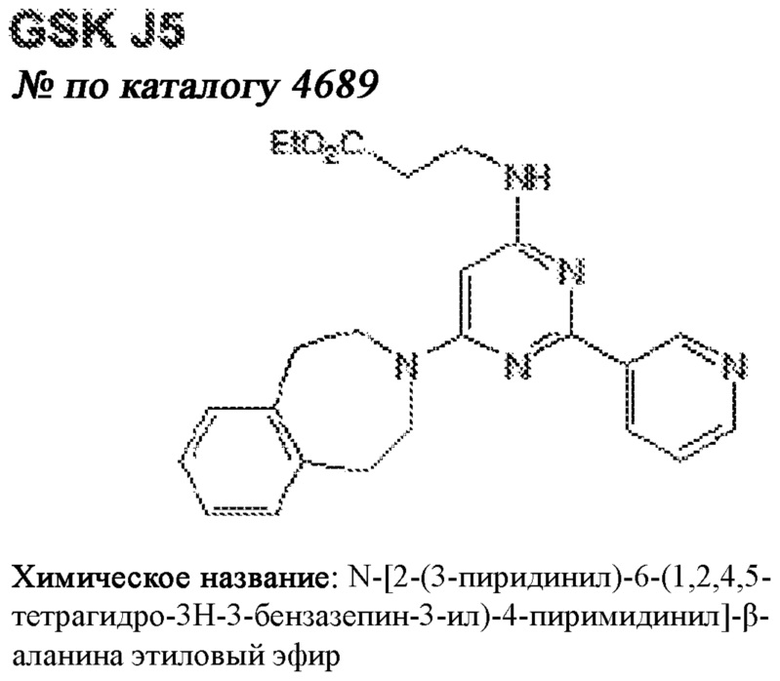
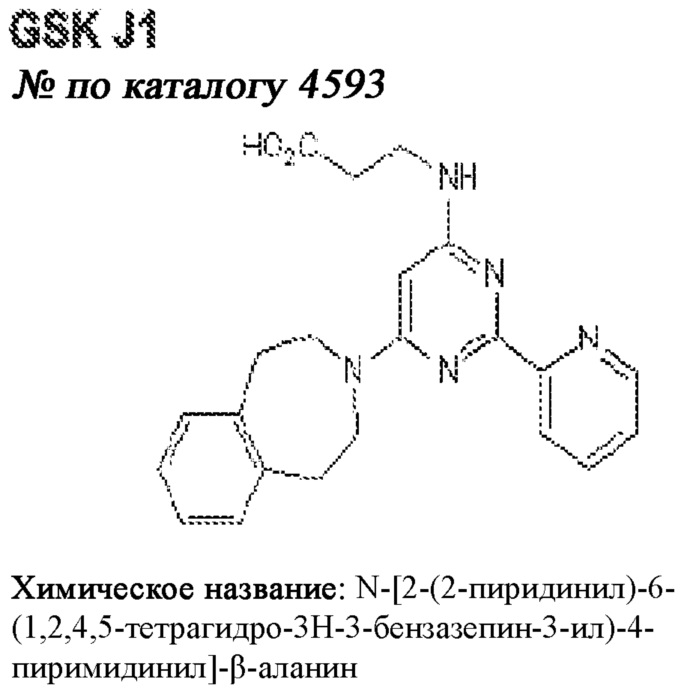
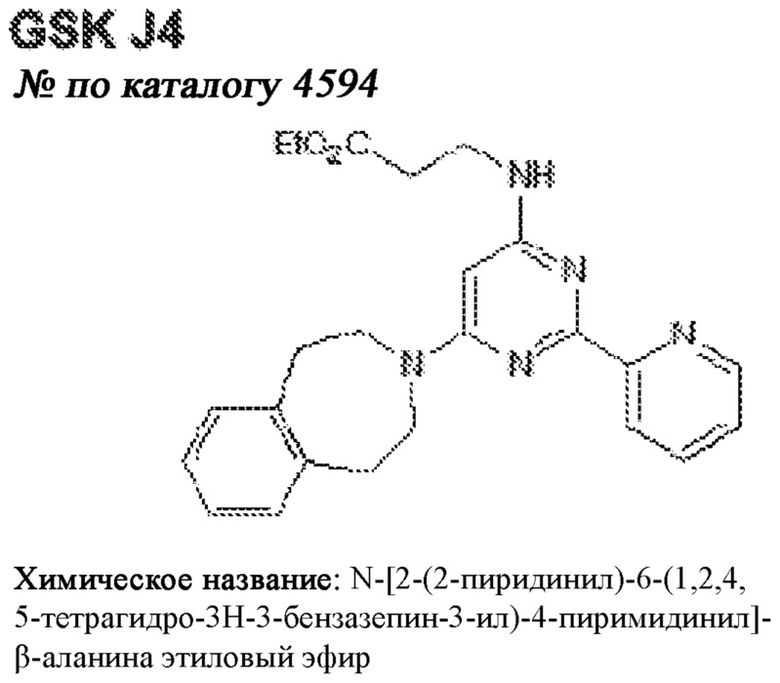

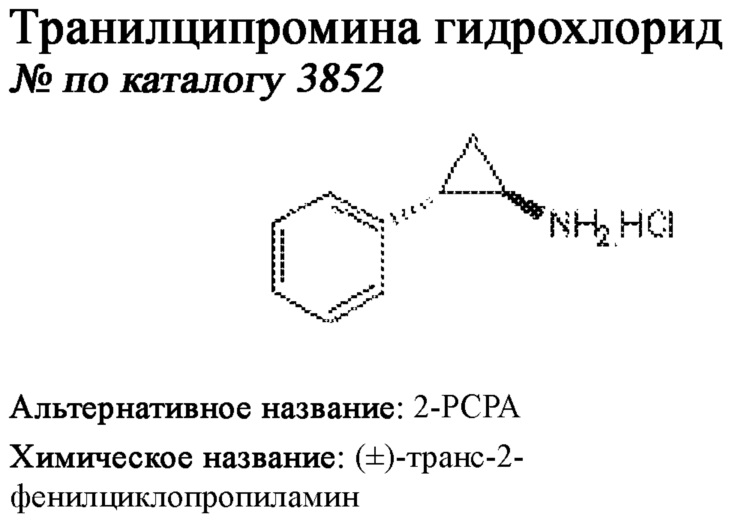
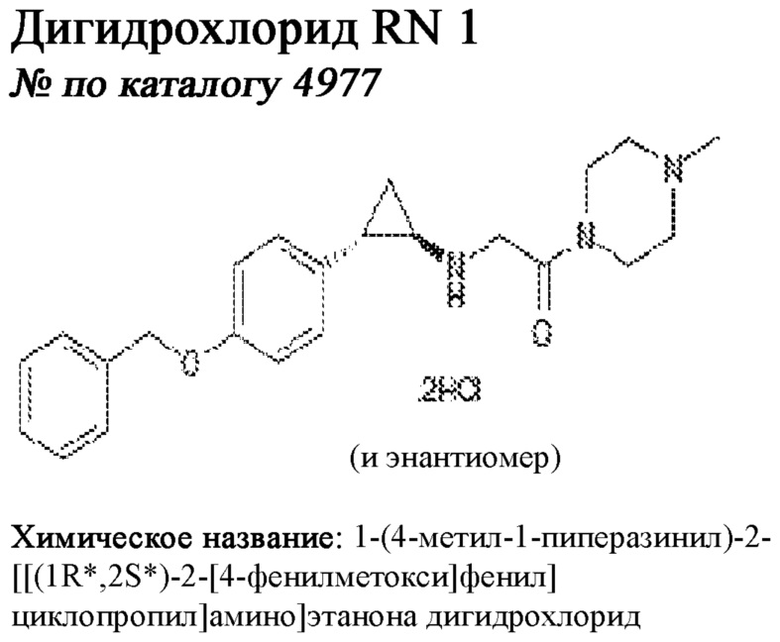
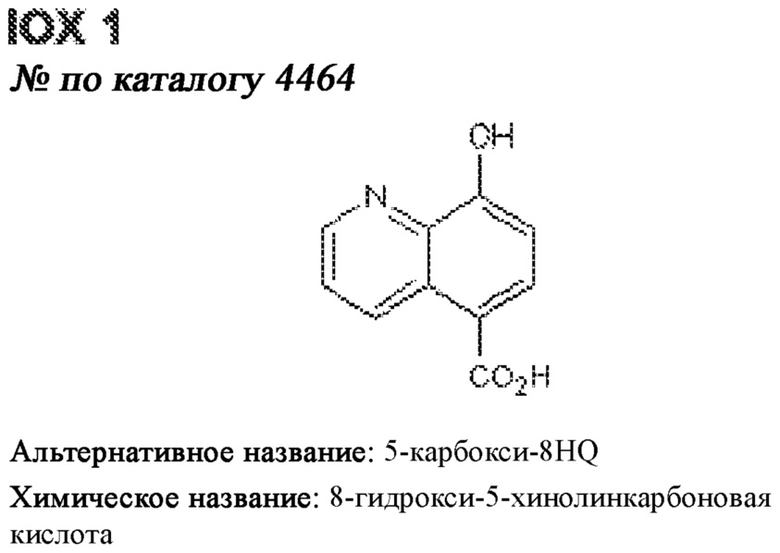
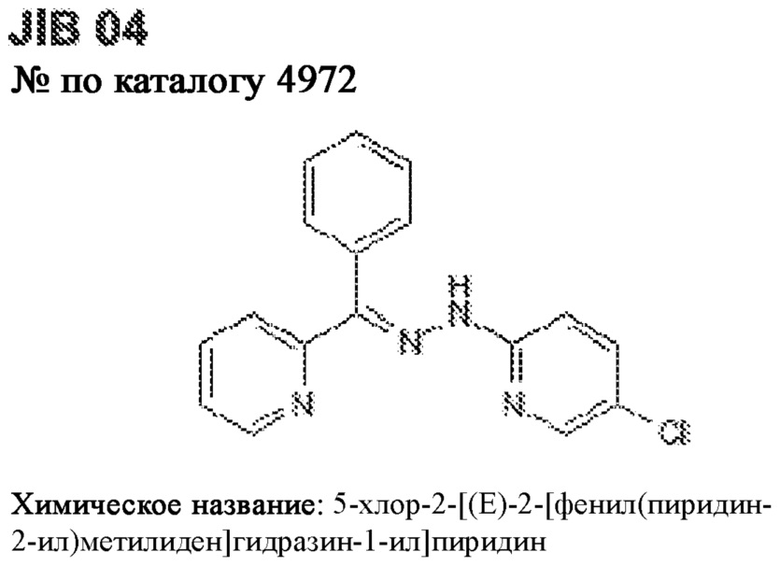
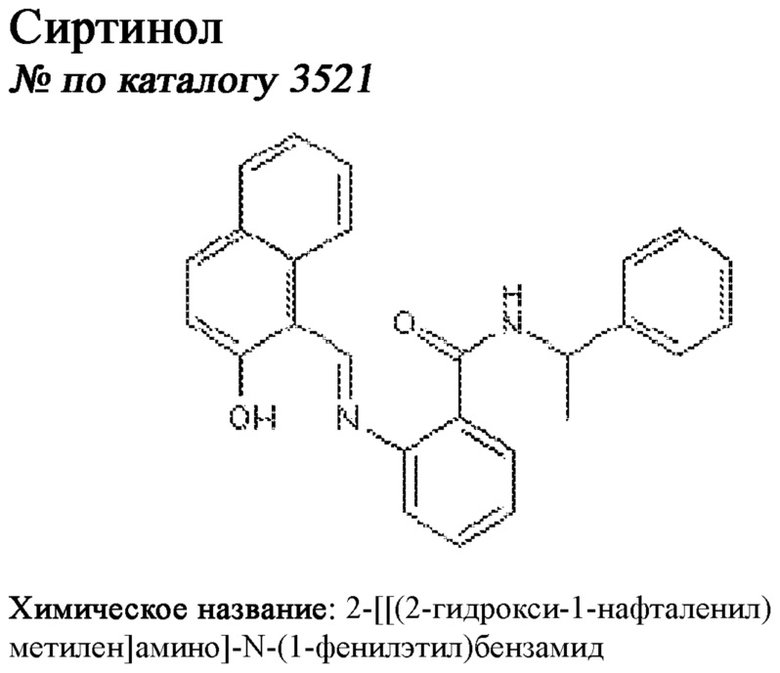
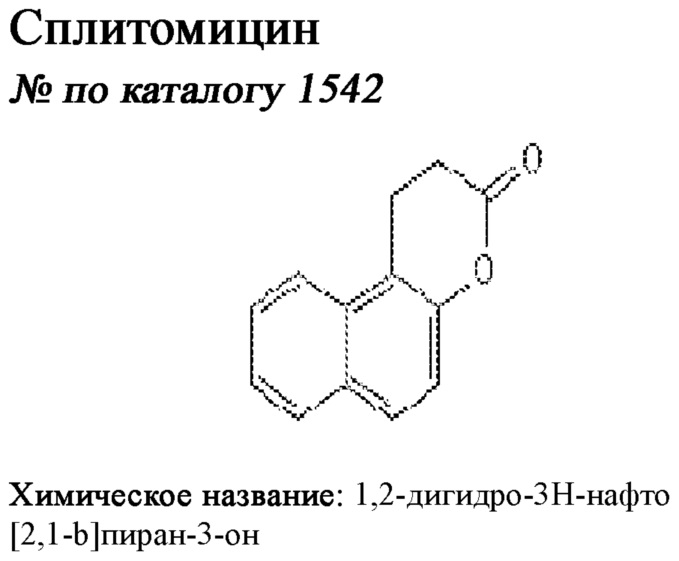

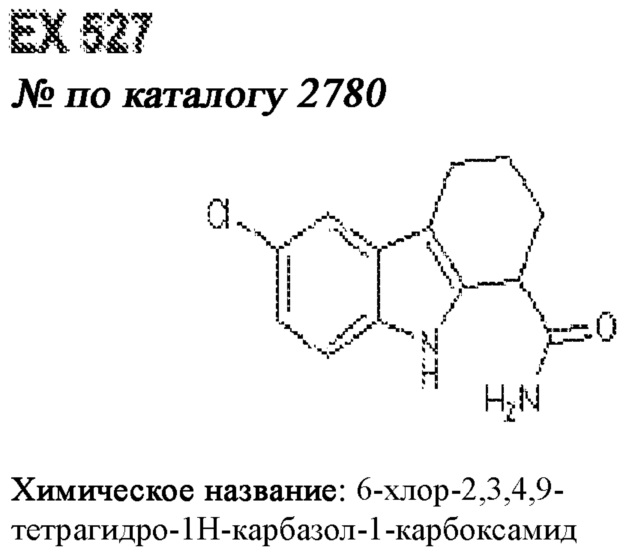
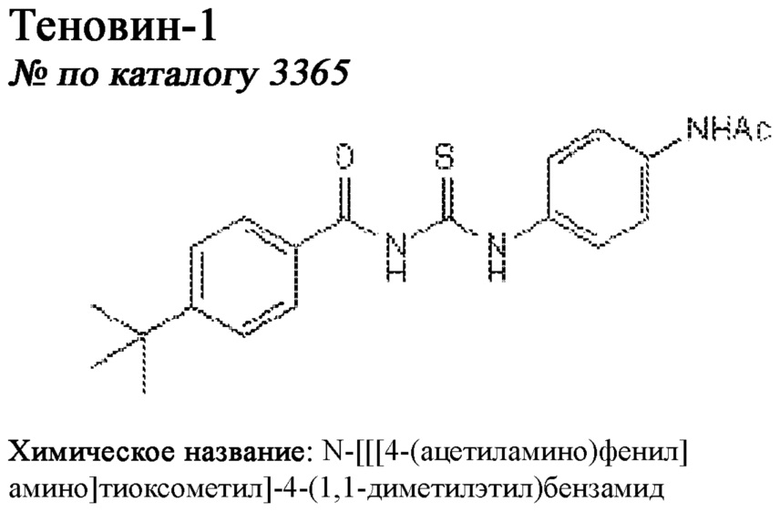
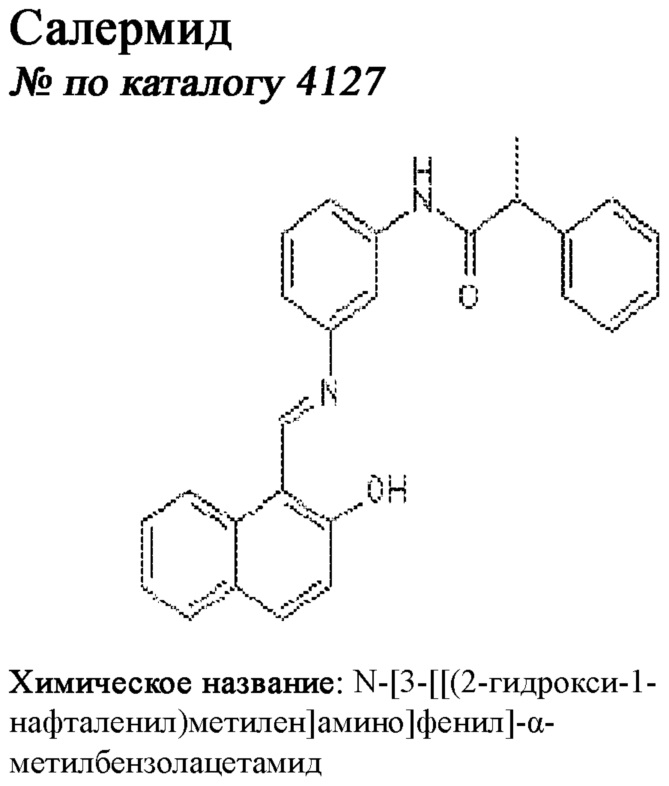
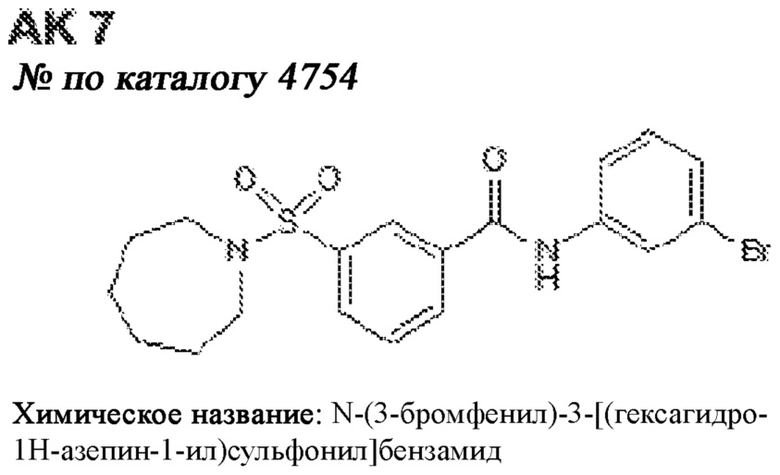
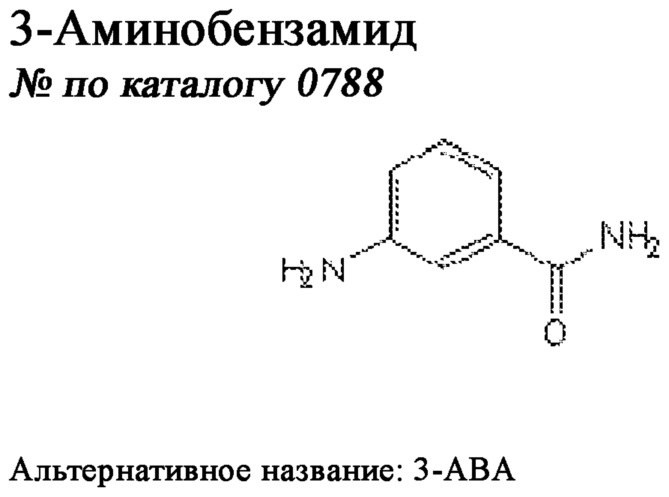
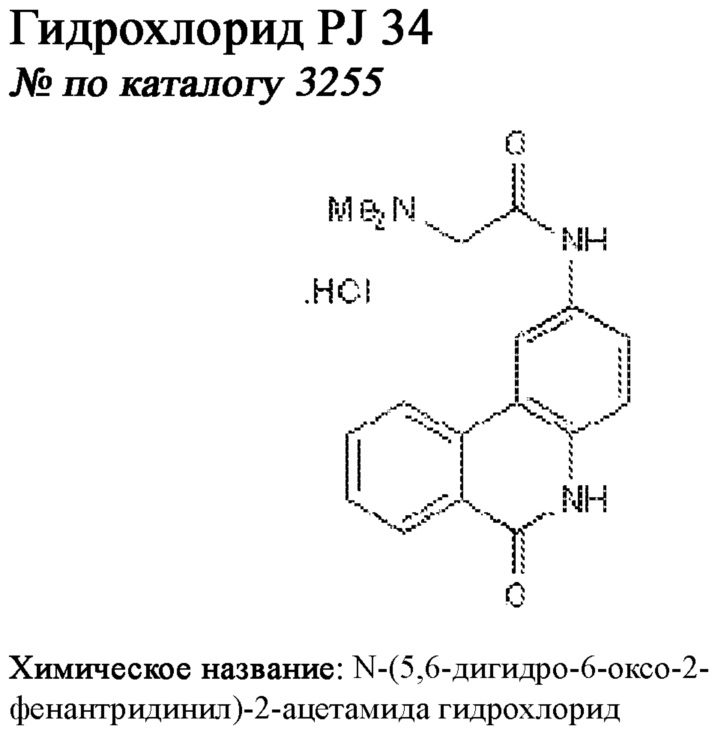
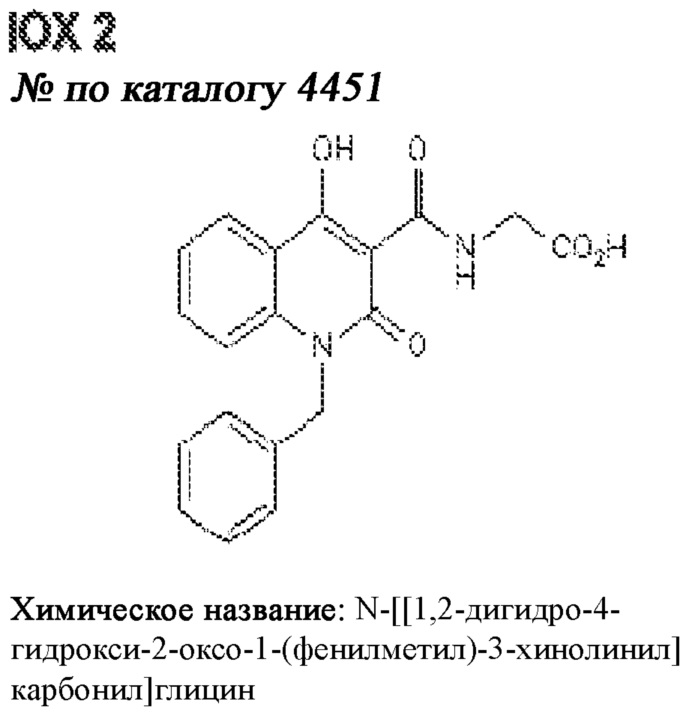
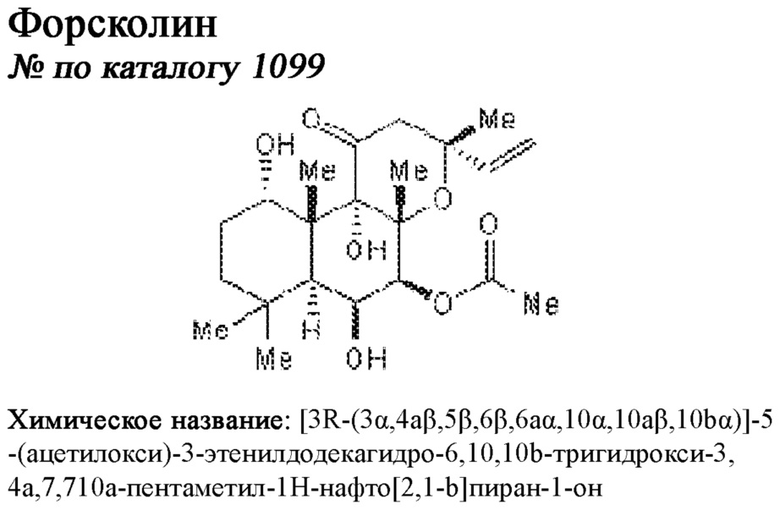
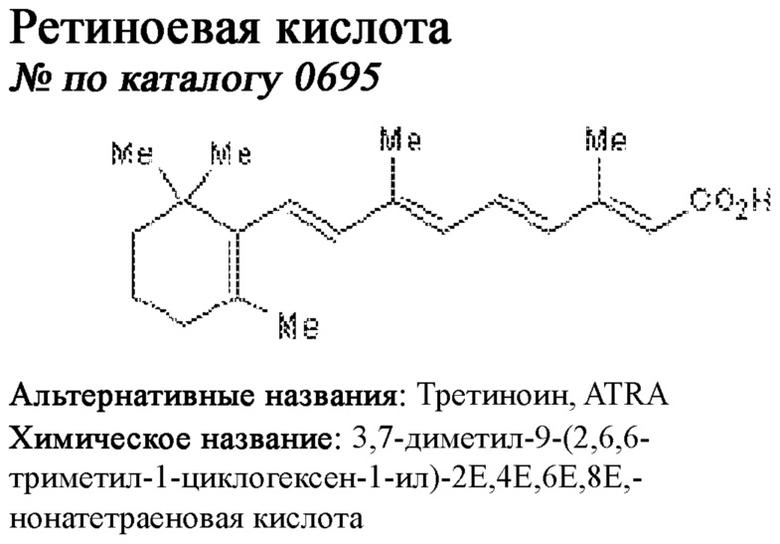
1:200
1:200
1:2000
1:200
1:2000
1:2000
[0212] В приведенных выше примерах описаны различные малые молекулы, которые, как правило, выполняют функцию ингибиторов клеточного цикла, но неожиданно в настоящем изобретении было обнаружено, что они индуцируют экспрессию ключевых маркеров зрелых бета-клеток, включая PDX1, NKX6.1, MAFA, UCN3 и SLC2A1.
Пример 6.
Генерация панкреатической энтодермы, полученной из hESC CyT49, во множестве типов суспензионной культуры
[0213] В следующем примере показана усовершенствованная генерация панкреатических энтодермальных клеток, полученных из человеческих эмбриональных стволовых клеток, в частности линии человеческих эмбриональных стволовых клеток CyT49 (hESC), с использованием протокола дифференцировки во множестве типов суспензионной культуры (роллерный флакон и вертикальный вращающийся биореактор PBS Biotech MagLift™). В таблице XIII перечислены конкретные улучшения, примененные к полученной из hESC CyT49 панкреатической энтодерме. В частности, панкреатическая энтодерма, полученная из hESC CyT49, показывает меньшую распространенность как альтернативных энтодермальных, так и эндокринных линий дифференцировки, что является важным требованием для дополнительной эффективной генерации инсулинпродуцирующих клеток и более характерно для полученной из hESC H1 панкреатической энтодермы (пример 3). Более того, время, необходимое для генерации панкреатической энтодермы, полученной из hESC CyT49, уменьшают на 5 дней. Новый протокол получения панкреатической энтодермы, полученной из hESC CyT49, можно использовать в таких типах, как роллерный флакон и биореактор, что позволяет осуществлять как горизонтальное, так и вертикальное масштабирование производства.
(Пример 3)
(Пример 6)
В таблице XIV описаны основные изменения, примененные к протоколу дифференцировки для генерации улучшенной панкреатической энтодермы, полученной из hESC CyT49. Основные различия включают в себя отсутствие ингибирования BMP во время стадий 3-4 и применение MCDB131 (стадии 1-2) и BLAR001 (стадии 3-4) в качестве основных сред.
[0214] Клетки линии человеческих эмбриональных стволовых клеток CyT49 (CyT49-hESC; регистрация NIH 0041) при пассаже 27 рабочего клеточного банка 4A (WCB4A) засевали в виде отдельных клеток с плотностью 0,033×106 клеток/см2 на обработанные тканевой культурой чашки Петри в модифицированную по способу Дульбекко среду для выращивания Игла со смесью питательных веществ F-12, содержащую GlutaMAX™ в разведении 1: 100Х (DMEM-F12; Life Technologies, г. Карлсбад, штат Калифорния, США, № по каталогу 10565), добавку XenoFree (XF) Knockout Serum Replacement (KSR; Life Technologies, № по каталогу 12618) в разведении 1: 10 («концентрация 10%»), среда MEM с добавлением заменимых аминокислот в разведении 1: 100 («концентрация 1X») пенициллин-стрептомицин в разведении 1: 100 («концентрация 1X»), 10 нг/мл человеческого активина A (R&D Systems, г. Миннеаполис, штат Миннесота, США, № по каталогу 338-AC) и 10 нг/мл человеческого херегулина-бета (PeproTech, г. Роки-Хилл, штат Нью-Джерси, США № по каталогу 100-03). Человеческий сывороточный альбумин в разведении 1: 10 («концентрация 10%»; Valley Biomedical, г. Винчестер, штат Вирджиния, № по каталогу HP-1022) использовали только в течение первых 24 часов после посева. Через девяносто шесть часов после посева сливающиеся культуры hESC CyT49 пересевали в упомянутую выше среду для выращивания. В альтернативном варианте осуществления сливающиеся hESC CyT49 высвобождали в виде суспензии отдельных клеток путем обработки Accumax (Innovative Cell Technologies, г. Сан-Диего, штат Калифорния, № по каталогу AM105) (3 минуты при 37 °C) и агрегировали со скоростью 31 об./мин и при концентрации один миллион клеток на мл в роллерных флаконах (Corning, г. Корнинг, штат Нью-Йорк, США, № по каталогу CLS431644) в среде DMEM-F12, содержащей GlutaMAX в разведении 1: 100X (Life Technologies, № по каталогу 10565), пенициллин-стрептомицин в концентрации 1Х, добавку StemPro® в разведении 1: 50 (Life Technologies, № по каталогу ME130070L1), 10 нг/мл человеческого активина А, 10 нг/мл человеческого херегулина-бета 1 и 200 нг/мл LR3-IGF1 (Cell Sciences, г. Ньюберипорт, штат Массачусетс, США, № по каталогу LRM001).
[0215] Для ФИГ. 9A-9Q культуры дифференцировали с использованием следующего протокола (показан на Фиг. 9A) в форме суспензионной культуры. На стадиях от 1 до 4 протокола суспензионные культуры находились в 2-литровых роллерных флаконах (RB) при 31 об./мин, вертикальных вращающихся биореакторах 0,1 PBS Mini или 0,5 PBS Mini MagLift™ (PBSBiotech, г. Камарильо, штат Калифорния, США) при 45 об./мин. «0,1PBS» относится к вертикальному вращающемуся биореактору Mini MagLift™ объемом 100 мл, а «0,5PBS» относится к вертикальному вращающемуся биореактору Mini MagLift™ объемом 500 мл. Агрегаты hESC CyT49 помещали в концентрации приблизительно 0,18-0,36 миллиона клеток на мл в среду объемом 500 мл в 2-литровом роллерном флаконе, среду объемом 100 мл биореактора 0,1 PBS Mini или среду объемом 500 мл биореактора 0,5 PBS Mini.Среду для культивирования клеток меняли ежедневно.
а. Стадия 1 (2 дня). Недифференцированные агрегаты ES культивировали в течение одного дня в следующей среде стадии 1: среда MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в разведении 1: 100 (концентрация 1X), 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл человеческого активина А, 50 нг/мл мышиного Wnt3A (R and D Systems, № по каталогу 1324-WN) и ITS-X (инсулин-трансферрин-селен-этаноламин; ThermoFisher Scientific, г. Уолтем, штат Массачусетс, США, № по каталогу 51500056) в разведении 1: 10 000. Впоследствии клетки культивировали в течение дополнительного дня в среде MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 100 нг/мл человеческого активина А и ITS-X в разведении 1: 10 000.
b. Стадия 2 (3 дня). Агрегаты обрабатывали в течение двух дней средой MCDB-131, которая содержит 2,7 г/1000 мл бикарбоната натрия и в которую добавили 0,5% FAF-BSA, GlutaMAX™ в концентрации 1Х, 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы, 0,25 мМ аскорбиновой кислоты и 50 нг/мл фактора 7 роста фибробластов (FGF7; PeproTech, № по каталогу AF-100-19).
c. Стадия 3 (2 дня). Агрегаты обрабатывали в течение двух дней специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; 1X GlutaMAX™; 0,25% FAF-BSA; 25 нг/мл FGF7; 0,25 мкМ SANT-1 (N-[(3,5-диметил-1-фенил-1H-пиразол-4-ил)метилен]-4-(фенилметил)-1-пиперазинамин); 1 мкM ретиноевой кислоты (RA); 0,25 мМ аскорбиновой кислоты; и 300 нМ активатора PKC ((2S, 5S-(E,E)-8-(5-(4-трифторметил)фенил-2,4,-пентадиеноиламино)бензолактам (TPB); в течение двух дней.
d. Стадия 4 (3 дня). Агрегаты обрабатывали специализированной средой BLAR001, которая содержит 3,6 г/1000 мл бикарбоната натрия и в которую добавили ITS-X в разведении 1: 200; 4,5 мМ D-глюкозы для получения концентрации 10 мМ D-глюкозы; GlutaMAX™ в концентрации 1Х; 0,25% FAF-BSA; 0,25 мкМ SANT-1; 50 нM RA; 2 нг/мл FGF7; 0,25 мМ аскорбиновой кислоты; и 300 нM TPB в течение трех дней.
В патентах США № 8,445,273; 8,895,300, полностью включенных в настоящий документ путем ссылки, описаны PEC-01 («панкреатическая энтодермальная клетка - 01») д15, полученные с использованием по меньшей мере протокола, описанного ниже. Агрегаты CyT49 hESC вносили в объеме гранул агрегата (APV) от 1,0 мкл до 2,0 мкл на мл. Стадии от 1 до 4 приведенного ниже протокола поддерживали в виде суспензионных культур в 2-литровых роллерных флаконах в объеме 500 мл при вращении со скоростью 31 об./мин.
а. Стадия 1 (2 дня; д1-д2). Недифференцированные агрегаты ES обрабатывали в течение одного дня средой RPMI1640 (Life Technologies, № по каталогу 21870-076), в которую добавили GlutaMAX™ в концентрации 1Х; 0,2%-ю эмбриональную бычью сыворотку (FBS; HyClone, г. Логан, штат Юта, США, № по каталогу SH30070.03); пенициллин-стрептомицин в концентрации 1X; в разведении 1: 5000 ITS (Invitrogen, г. Уолтем, штат Массачусетс, США, № по каталогу 41400); 100 нг/мл активина A; и 50 нг/мл Wnt3A. Впоследствии клетки культивировали в течение дополнительного дня в среде RPMI1640, в которую добавили GlutaMAX™ в концентрации 1Х; 0,2%-ю эмбриональную бычью сыворотку; пенициллин-стрептомицин в концентрации 1X; ITS в разведении 1: 5000; 100 нг/мл активина A; и 50 нг/мл Wnt3A.
b. Стадия 2 (3 дня; д3-д5). Агрегаты обрабатывали в течение одного дня средой RPMI1640, в которую добавили GlutaMAX™ в концентрации 1Х; 0,2%-ю эмбриональную бычью сыворотку; пенициллин-стрептомицин в концентрации 1X; ITS в разведении 1: 1000; 25 нг/мл человеческого FGF7; и 2,5 мкМ ингибитора IV трансформирующего фактора роста бета (TGF-β; EMD Bioscience, г. Биллерика, штат Массачусетс, № по каталогу 616454). Впоследствии клетки культивировали в течение двух дополнительных дней в среде RPMI1640, в которую добавили GlutaMAX™ в концентрации 1Х; 0,2%-ю эмбриональную бычью сыворотку; пенициллин-стрептомицин в концентрации 1X; ITS в разведении 1: 1000; и 25 нг/мл человеческого FGF7.
c. Стадия 3 (3 дня; д6-д8). Агрегаты обрабатывали в течение трех дней средой DMEM с высоким содержанием глюкозы (Invitrogen, № по каталогу 11960-051), в которую добавили добавку B-27 в разведении 1: 50 (Invitrogen, № по каталогу 17504-044); пенициллин-стрептомицин в концентрации 1X; GlutaMAX™ в концентрации 1Х; ITS в разведении 1: 1000; 3 нМ TTNPB («4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталенил)-1-пропенил]бензоевая кислота»; «Sigma-Aldrich», Сент-Луис, штат Миссури, США, № по каталогу T3757); 0,25 мкМ KAAD-циклопамина («3-кето-N-аминоэтил-N'-аминокапроилдигидроциннамоил циклопамин»; Toronto Research Chemicals, г. Норт-Йорк, Канада, № по каталогу K171000); и 50 нг/мл человеческого Ноггина (R and D Systems, № по каталогу 3344-NG).
d. Стадия 4 (3 дня; д9-д12; д12 называется «PEC-01 д12»). Агрегаты обрабатывали в течение трех дней средой DMEM с высоким содержанием глюкозы, в которую добавили добавку B-27 в разведении 1: 50; пенициллин-стрептомицин в концентрации 1X; GlutaMAX™ в концентрации 1Х; 50 нг/мл человеческого эпидермального фактора роста (EGF; PeproTech, № по каталогу AF-100-15); 50 нг/мл FGF7; и 50 нг/мл человеческого Ноггина.
e. Криоконсервация в д12. Агрегаты ресуспендировали в среде DMEM с высоким содержанием глюкозы, в которую добавили GlutaMAX™ в концентрации 1Х; концентрация 15% DMSO («диметилсульфоксид»; Origen Biomedical, г. Остин, штат Техас, США, № по каталогу CP-10); концентрация 60% KSR, не содержащей XF; и 25 мМ буферного раствора HEPES («N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота»; (ThermoFisher Scientific, № по каталогу 15630080). Агрегаты д12 криоконсервировали в программируемом криозамораживателе (CRF; Planer PLC, Шеппертон Санбери-на-Темзе, Великобритания, № по каталогу Kryo 560-16) с использованием следующего протокола: (1) начальная температура -2,0 °C; (2) от -2,0 °C/мин до -9,0 °C; (3) при -9,0°C в течение 10 минут и инициирование замораживания вручную; (4) от -0,2 °C/мин до 40 °C; (5) от -25 °C/мин до -150 °C; (6) перенос в жидкий азот для хранения.
f. После криоконсервации до PEC-01 (3 дня; д13-д15). Агрегаты обрабатывали в течение трех дней средой DMEM с высоким содержанием глюкозы, в которую добавили добавку B-27 в разведении 1: 50; пенициллин-стрептомицин в концентрации 1X; GlutaMAX™ в концентрации 1Х; 50 нг/мл человеческого эпидермального фактора роста (EGF; PeproTech, № по каталогу AF-100-15); 50 нг/мл FGF7; и 50 нг/мл человеческого Ноггина. В первый день в среду добавляли только 10Ед/мл ДНКазы I (Roche, г. Базель, Швейцария, № по каталогу 04536282001).
[0216] Определение характеристик дифференцированных клеток. Для количественного анализа генной экспрессии с помощью способов с применением суспензионной культуры в 2-литровом роллерном флаконе, 0,1 PBS или 0,5 PBS, CyT49-hESC, агрегаты дня 3 стадии 4 (S4D3) и PEC-01 д15 собирали, как описано в Nature Biotechnology, 2014, (32) 11, 1121-1133. Экспрессию генов оценивали с использованием специально изготовленных матриц Taqman Arrays (Applied Biosystems, г. Фостер Сити, штат Калифорния, США). Данные анализировали с использованием программного обеспечения Sequence Detection (Applied Biosystems, г. Фостер Сити, штат Калифорния, США) и нормализовали, используя GAPDH в качестве конститутивного гена недифференцированных клеток CyT49-hESC, применяя метод ΔΔCt. Информация о праймерах представлена в таблице XV.
[0217] Для количественного анализа колокализации белков с помощью способов с применением суспензионной культуры в 2-литровом роллерном флаконе, 0,1 PBS или 0,5 PBS, CyT49-hESC, агрегаты дня 3 стадии 4 (S4D3) и PEC-01 д15 собирали и анализировали посредством проточной цитометрии с активацией флуоресценции (FACS). Окрашивание в анализе FACS проводили, как описано в Nature Biotechnology, 2014 (32) 11, 1121-1133, и использовали антитела, перечисленные в таблице XVI. Дифференцированные клетки инкубировали в Accumax (Innovative Cell Technologies, г. Сан-Диего, штат Калифорния, США, № по каталогу AM105) в течение 20 минут при комнатной температуре, высвобождали в суспензию отдельных клеток, после чего их дважды промывали буферным раствором autoMACS Running Buffer (г. Бергиш, Германия, Miltenyl Biotec, № по каталогу 120-091-221), фиксированным в 4% параформальдегиде (4% PFA; Sigma Aldrich, № по каталогу 158127) в течение 30 минут при комнатной температуре с последующими двумя промывками в буферном растворе autoMACS Running Buffer. Впоследствии клетки инкубировали с соответствующими антителами (таблица XVI) перед анализом на приборе BD FACS Canto II с применением программного обеспечения BD FACS Diva, регистрируя по меньшей мере 30 000 событий. Нежизнеспособные клетки при анализе FACS исключали и проводили дискриминирование, используя изотипические антитела («IgG»).
анти-NKX6.1
[0218] Для количественного анализа выходов клеток с помощью способов с применением суспензионной культуры в 2-литровом роллерном флаконе, 0,1 PBS или 0,5 PBS CyT49-hESC и агрегаты дня 3 стадии 4 (S4D3) собирали и подсчитывали на приборе Nucleocounter® NC-100 (Chemometec, Аллерод, Дания, № по каталогу NC-100).
[0219] На ФИГ. 9A показано, как дифференцировали CyT49 hESC до панкреатической энтодермы (например, S4D3) с использованием нового протокола. PEC-01 д12 и PEC-01 д15 приводят в настоящем документе в качестве примеров предшествующего уровня техники. Способы с применением суспензионной культуры использовали на основании их совместимости с промышленной генерацией инсулинпродуцирующих клеток посредством применения панкреатической энтодермы в качестве промежуточного материала, а именно использовали 2-литровый роллерный флакон, вертикальные вращающиеся биореакторы 0,1 PBS или 0,5 PBS. Хотя способ с 2-литровым роллерным флаконом можно использовать для горизонтального масштабирования получения панкреатических энтодермальных клеток, он не является идеальным для возможного промышленного производства инсулинпродуцирующих клеток. Система вертикального вращающегося биореактора PBS Biotech MagLift™ представляет собой альтернативную систему вертикального масштабирования, которая может обеспечивать возможность постепенного улучшения продукции инсулинпродуцирующих клеток с одновременным увеличением объема и сохранением малого/компактного размера агрегатов с течением времени. На ФИГ. 9B показано, что, как ожидалось, выходы клеток в S4D3 показывали значительное увеличение числа клеток по отношению к внесенным hESC. Отношение клеток S4D3 к внесенным hESC было схожим при всех способах с применением суспензионной культуры при использовании нового протокола; 4,30±0,782 для 2-литрового роллерного флакона, 3,27±0,585 для 0,1PBS 4,08±0,854 для 0,5PBS и значительно увеличено по сравнению с предшествующим уровнем техники (2,23±0,090 PEC-01 д12 клеток на одну внесенную клетку hESC). Кроме того, на ФИГ. 9C мы продемонстрировали, что описанный протокол дифференцировки может быть выполнен с возможностью эффективного вертикального масштабирования с использованием системы вертикального вращающегося биореактора PBS MagLift™. При увеличении объема среды со 100 мл (0,1PBS) до 500 мл (0,5PBS) наблюдали приблизительно 6-кратное увеличение выхода S4D3 (ФИГ. 9C). Кроме того, применение формы суспензии 0,1PBS (~150±33,2 мкм) или 0,5PBS (~153±37,6 мкм) приводило к образованию одинаково меньших агрегатов S4D3 по сравнению с агрегатами в роллерном флаконе S4D3 (~274±92,5 мкм) и PEC-01 д12 (~259±55,3 мкм). Криоконсервация, размораживание и дополнительное трехдневное культивирование PEC-01 д12 были необходимы для уменьшения размера агрегатов PEC-01 до уровня, наблюдаемого для 0,1PBS и 0,5PBS (PEC-01 д15; ~191±45,4 мкм) (ФИГ. 9D-9E). Продемонстрировано, что устойчивого фенотипа панкреатической энтодермы достигали с использованием нового протокола дифференцировки клеток, полученных из CyT49 hESC, при всех способах с применением суспензионной культуры. Каждый из NKX6.1 (ФИГ. 9F), PTF1A (ФИГ. 9G), PDX1 (ФИГ. 9H) значительно индуцировали при использовании способов с 2-литровым роллерным флаконом, 0,1PBS, 0,5PBS, так же, как с PEC-01 д15. В отличие от протокола дифференцировки PEC-01 д15, который приводил к повышению экспрессии SOX2 (альтернативная линия дифференцировки энтодермы; ФИГ. 9I), NEUROD1 (ранняя эндокринная дифференцировка; ФИГ. 9K) и CHGA (ранняя эндокринная дифференцировка; ФИГ. 9L), новый протокол дифференцировки снижал экспрессию этих маркеров непанкреатической энтодермы при всех исследованных способах с применением суспензионной культуры в CyT49. В действительности такое увеличение непанкреатической энтодермы снижает эффективность продукции панкреатической энтодермы, как было оценено по уровню белка. По отношению к PEC-01 д12 (~38,0%; ФИГ. 9M), колокализацию белков между PDX1 и NKX6.1 увеличивали при всех новых способах с применением суспензионной культуры S4D3, в которых используют новый протокол дифференцировки полученных из CyT49 hESC клеток; 2-литровый роллерный флакон ~64,6% (ФИГ. 9N), 0,1PBS ~48,9% (ФИГ. 9O) и 0,5PBS ~65,3% (ФИГ. 9P). Более того, ~49% PDX1+ NKX6.1+ панкреатической энтодермы, наблюдаемой в PEC-01 д12, также экспрессировали SOX2+ (ФИГ. 9M), в отличие от всех новых способов с применением суспензионной культуры S4D3, в которых используют новый протокол дифференцировки полученных из CyT49 hESC клеток; 2-литровый роллерный флакон ~2,0% (ФИГ. 9N), 0,1PBS ~10,0% (ФИГ. 9O) и 0,5PBS ~6,2% (ФИГ. 9P). Относительно низкую процентную долю панкреатической энтодермы, наблюдаемую в PEC-01 д12, также подтверждали увеличением распространенности ранней эндокринной дифференцировки (~49,6%; ФИГ. 9M) по сравнению с новыми способами с применением суспензионной культуры S4D3; 2-литровый роллерный флакон ~26,9% (ФИГ. 9N), 0,1PBS ~26,6% (ФИГ. 9O) и 0,5PBS ~30,2% (ФИГ. 9P). Криоконсервация, размораживание и 3-дневное дополнительное культивирование клеток PEC-01 д12 были необходимы для небольшого увеличения колокализации PDX1 и NKX6.1 (PEC-01 д15; ~47,5%; ФИГ. 9Q) путем уменьшения SOX2 (~22,5%; ФИГ. 9Q) и CHGA (~42,5%; ФИГ. 9Q). Колокализация белков между NKX6.1 и CDX2 была низкой при всех исследованных условиях (ФИГ. 9M-9Q), что было отражено низкой экспрессией гена CDX2 в S4D3 во всех типах суспензионной культуры (ФИГ. 9J).
Пример 7.
Генерация инсулинпродуцирующих клеток, полученных из hESC CyT49, во множестве типов суспензионной культуры
[0220] В следующем примере показана усовершенствованная генерация панкреатических инсулинпродуцирующих клеток, полученных из линии человеческих эмбриональных стволовых клеток (hESC) CyT49 с использованием нового протокола дифференцировки во множестве типов суспензионной культуры (роллерный флакон, вертикальные вращающиеся биореакторы 0,1 PBS и 0,5 PBS Biotech MagLift™). В таблице XVII перечислены конкретные улучшения, примененные к полученным из hESC CyT49 инсулинпродуцирующим клеткам. Хотя новый протокол дифференцировки аналогичен по длительности с получением инсулинпродуцирующих клеток (предшествующий уровень техники - Stem Cells Transl Med, 2015 (10) 4, 1214-1222) из клеток PEC-01 или клеток, схожих с PEC-01, при этом новый протокол, использованный для продуцирования инсулин-положительных клеток из hESC CyT49, показывает увеличенную продукцию клеток, продуцирующих единственный гормон инсулин (только INS+), посредством значительного снижения полигормональных инсулинпродуцирующих клеток (и INS+, GCG+) и наличия белка PDX1, NKX6.1, CHGA, MAFA в клетках, продуцирующих единственный гормон инсулин. Отсутствие экспрессии GCG и индукция экспрессии NKX6.1, MAFA в клетках, положительных в отношении единственного гормона инсулина, является обязательным требованием для возможного приобретения функциональных возможностей, характерных для человеческих островков (примеры 2-5). Более того, новый протокол получения инсулинпродуцирующих клеток, полученных из hESC CyT49, впервые показывает способность к вертикальному масштабированию в биореакторе, что является обеспечением лучшей возможности осуществления, чем горизонтальное масштабирование с использованием роллерного флакона, возможного промышленного производства инсулинпродуцирующих клеток (пример 7).
(Пример 2-4)
(Пример 7)
[0221] В таблице XVIII описаны основные изменения, примененные к протоколу дифференцировки для генерации улучшенной панкреатической энтодермы, полученной из hESC CyT49. Основные различия включают в себя малые молекулы и используемые основные среды. Аббревиатуры включают в себя: Nic - никотинамид; MG - Matrigel; GSI - ингибитор гамма-секретазы; ROCKi - Rho-ассоциированный ингибитор протеинкиназы.
(Пример 2-4)
(Пример 7)
[0222] Клетки линии человеческих эмбриональных стволовых клеток CyT49 (CyT49-hESC; регистрация NIH 0041) при пассаже 27 рабочего клеточного банка клеток 4A (WCB4A) засевали и сохраняли, как описано в примере 6. Кроме того, агрегацию и дифференцировку hESC CyT49 на стадиях 1-4 выполняли, как описано в примере 6.
[0223] Для ФИГ. 10A-10AB культуры дополнительно дифференцировали в течение стадий 5-7 с использованием следующего протокола (показан на Фиг. 10A) в форме суспензионной культуры. На стадиях от 5 до 7 протокола суспензионные культуры поддерживали роллерных флаконах (RB) при 31 об./мин, вертикальных вращающихся биореакторах 0,1 PBS Mini или 0,5 PBS Mini MagLift™ при 45 об./мин. «0,1PBS» относится к вертикальному вращающемуся биореактору Mini MagLift™ объемом 100 мл, а «0,5PBS» относится к вертикальному вращающемуся биореактору Mini MagLift™ объемом 500 мл. Следует отметить, что протокол дифференцировки стадии 7 называется основной обработкой, так как коктейль для индуцирования функциональных возможностей, характерных для инсулинпродуцирующих клеток, не включен в настоящий документ и является предметом другого изобретения. В течение стадий 5-6 среду меняли ежедневно, а на стадии 7 среду меняли через день.
а. Стадия 5 (3 дня). Полученные из CyT49 S4D3 (пример 6 - новый протокол получения из клеток hESC CyT49) или PEC-01 д15 агрегаты обрабатывали средой BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия, в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 0,25 мкM SANT-1; 50 нM RA; 100 нМ LDN-HCl; 1 мкМ T3; и 10 мкМ ингибитора II ALK5.
b. Стадия 6 (7 дней). Агрегаты обрабатывали в специализированной среде BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия, в которую добавили ITS-X в разведении 1: 200; 14,5 мМ D-глюкозы для достижения конечной концентрации 20 мМ D-глюкозы; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H); 10 мкМ ZnSO4; 100 нМ LDN-HCl; 1 мкМ T3; 10 мкМ ингибитора II ALK5 и 100 нМ ингибитора XX гамма-секретазы. Агрегаты S5D3 в суспензионной культуре 0,5 PBS переносили в суспензионную культуру 0,1 PBS для выполнения стадий 6-7.
c. Стадия 7 (от 7 до 23 дней). Агрегаты обрабатывали в специализированной среде BLAR001, которая содержит 2,7 г/1000 мл бикарбоната натрия, и в которую добавили ITS-X в разведении 1: 200; 1X GlutaMAX™; 2% FAF-BSA; 10 мкг/мл гепарина (H), 10 нМ T3 (низкий T3); 1 мМ NAC); и следующие компоненты, которые входят в состав I (FI) - среда RPMI с витаминной добавкой в разведении 1: 200; среда MEM с добавлением заменимых аминокислот в разведении 1: 200; концентрат липидов с определенным химическим составом в разведении 1: 2000; пируват натрия в разведении 1: 200; следовые элементы А в разведении 1: 2000; следовые элементы В в разведении 1: 2000.
[0224] Определение характеристик дифференцированных клеток. Для количественного анализа генной экспрессии с помощью способов с применением суспензионной культуры в роллерном флаконе, 0,1 PBS или 0,5 PBS, CyT49-hESC, агрегаты дня 3 стадии 4 (S4D3), дня 3 стадии 5 (S5D3), дня 7 стадии 6 (S6D7) и дня 7 стадии 7 (S7D7) собирали, как описано в Nature Biotechnology, 2014, (32) 11, 1121-1133 и примере 1. Информация о праймерах представлена в таблице XIX.
[0225] Для количественного анализа колокализации белков с помощью способов с применением суспензионной культуры в роллерном флаконе, 0,1 PBS или 0,5 PBS, CyT49-hESC, агрегаты дня 3 стадии 5 (S5D3), дня 7 стадии 5 (S6D7), дня 13 стадии 7 (S7D13) и дня 7 стадии 14 (S7D14) собирали и анализировали посредством проточной цитометрии с активацией флуоресценции (FACS), как описано в примере 1. Список антител, используемых в анализе FACS, приведен в таблице XX.
анти-NKX6.1
[0226] Для количественного анализа выходов клеток с помощью способов с применением суспензионной культуры в роллерном флаконе, 0,1 PBS или 0,5 PBS CyT49-hESC и агрегаты дня 7 стадии 6 (S6D7) собирали и подсчитывали на приборе Nucleocounter® NC-100 (Chemometec, Аллерод, Дания, № по каталогу NC-100).
[0227] Для количественного анализа колокализации белков с помощью способов с применением суспензионной культуры в роллерном флаконе, 0,1 PBS или 0,5 PBS, агрегаты дня 7 стадии 6 (S6D7), дня 16 стадии 7 (S7D16) и дня 23 стадии 7 (S7D23) собирали и анализировали посредством иммунофлуоресценции (IF). Полученные из CyT49-hESC агрегаты получали, как описано в публикации Nature Biotechnology, 2014, (32) 11, 1121-1133 и в предыдущих примерах, и с использованием антител, перечисленных в таблице XXI настоящего документа.
(№ по каталогу 8138BF).
(№ по каталогу LP9872).
(Извлечение антигена)
(№ по каталогу NB120-16659).
(№ по каталогу LP9878).
[0228] На ФИГ. 10A показан новый протокол, используемый для дифференцировки полученных из S4D3 CyT49 hESC на стадиях 5-7 до инсулинпродуцирующих клеток. В частности, инсулинпродуцирующие клетки, полученные способами настоящего изобретения, показывали совместную экспрессию и наличие белков PDX1, NKX6.1, CHGA, ИНСУЛИНА и MAFA, но не ГЛЮКАГОНА. На ФИГ. 10B показано, что выходы клеток в S6D7 были приблизительно равными изначально внесенным количествам hESC для способов с применением суспензионной культуры в 2-литровом роллерном флаконе (RB) (отношение S6D7 к внесенным hESC 0,95±0,31) и 0,1 PBS (отношение S6D7 к внесенным hESC 0,92±0,23). Удивительно, что культивирование в суспензионной культуре с использованием 0,5 PBS показывало наибольшие клеточные выходы в S6D7; из одной внесенной клетки hESC получали 2,4±0,169 клеток S6D7. Более того, было продемонстрировано (см. ФИГ. 10C), что протокол дифференцировки на стадиях 5-7 может быть выполнен с возможностью эффективного вертикального масштабирования с использованием системы вертикального вращающегося биореактора MagLift™. При увеличении объема среды со 100 мл (0,1 PBS) до 500 мл (0,5 PBS) наблюдали приблизительно 7,5-кратное увеличение выхода S6D7 (ФИГ. 10C). Кроме того, использование суспензии типа 0,1 PBS или 0,5 PBS приводило к получению одинаково меньших агрегатов S5D3 (ФИГ. 10D), S6D7 (ФИГ. 10E) и S7D13-S7D14 (ФИГ. 10F) по сравнению с агрегатами, основанными на 2-литровых роллерных флаконах. Если говорить кратко, агрегаты S6D7 культивировали в суспензионной культуре согласно описанному протоколу с использованием роллерных флаконов, имевших следующие диаметры; RB ~265±79,0 мкм (ФИГ. 10E слева), 0,1PBS ~190±59,9 мкм (ФИГ. 10E посередине) и 0,5PBS ~227±59,0 мкм (ФИГ. 10E справа). Кроме того, использование вертикальных вращающихся биореакторов PBS Mini MagLift™ позволяло поддерживать малый размер агрегатов и архитектуру в течение S7D14 (ФИГ. 10F), требуемые для обеспечения функциональных возможностей, характерных для человеческих островков (пример 7). С другой стороны, агрегаты S7D13 в суспензии в 2-литровом роллерном флаконе в конечном счете теряли свою агрегированную архитектуру и образовывали разъединенные клеточные листы (ФИГ. 10F). Показано, что способы получения суспензионных культур с использованием нового протокола индуцировали появление устойчивой генной сигнатуры в панкреатической инсулинпродуцирующей клетке; RB, 0,1 PBS и 0,5 PBS индуцируют сохранение/увеличение экспрессии факторов транскрипции бета-клеток PDX1 (ФИГ. 10G), NKX6.1 (ФИГ. 10H); эндокринных маркеров/факторов транскрипции CHGA (ФИГ. 10I), NEUROD1 (ФИГ. 10J), NGN3 (ФИГ. 10K); бета-клеточного гормона ИНСУЛИНА (ФИГ. 10L); и фактора транскрипции раннего созревания бета-клеток MAFA (ФИГ. 10M). С другой стороны, при дифференцировке агрегатов PEC-01 д15 в инсулинпродуцирующие клетки с использованием нового протокола дифференцировки в 2-литровых роллерных флаконах («полученные из PEC-01») наблюдали значительную индукцию совместной экспрессии ГЛЮКАГОНА и ИНСУЛИНА (ФИГ. 10L, 10N). В действительности анализ наличия белка показал, что, как описано ранее в Nature Biotechnology, 2014, (32) 11, 1121-1133, новый протокол дифференцировки индуцировал образование устойчивых панкреатических эндокринных клеток-предшественников (стадия 5), приводящих к получению клеток, продуцирующих единственный гормон инсулин (стадии 6-7) в линии hESC CyT49. На ФИГ. 10O показано, что к S5D3 приблизительно 54,1% агрегатов, культивированных в 0,5PBS, были CHGA+ NKX6.1+ (увеличение с ~1% CHGA+ NKX6.1+ в S4D3 для всех типов суспензии; ФИГ. 9N-9P) в результате эндокринной дифференцировки с высокой скоростью, подтверждаемой увеличением PAX4+ CHGA+ клеток в S5D3. PAX4 представляет собой ген, являющийся прямой мишенью для NGN3 (индуктор эндокринной дифференцировки в поджелудочной железе). К S7D13-S7D14 общее число NKX6.1+ ИНСУЛИН+ клеток значительно увеличилось во всех типах суспензии; с приблизительно 15,4% в S5D3 (ФИГ. 10P) до ~40,3% в RB в S6D7 (ФИГ. 10Q); ~44,7% в 0,1PBS в S6D7 (ФИГ. 10R); ~51,8% в RB в S7D13 (ФИГ. 10S); и ~48,9% в 0,1PBS в S7D14 (ФИГ. 10T). Аналогичным образом к S7D13-S7D13 увеличили процентную долю NKX6.1+ CHGA+ клеток с ~1% в S4D3 (ФИГ. 9N-9P) до ~81,0% в RB в S6D7 (ФИГ. 10Q); ~88,7% в 0,1PBS в S6D7 (ФИГ. 10R); ~79,6% в RB в S7D13 (ФИГ. 10S); и ~80,9% в 0,1PBS в S7D14 (ФИГ. 10T). Показано, что большинство NKX6.1+ ИНСУЛИН+ клеток, полученных с помощью нового протокола на стадии 7, были моногормональными и не продуцировали альфа-клеточный гормон ГЛЮКАГОН; ~18,8% ИНСУЛИН+ ГЛЮКАГОН+ в RB в S6D7 (ФИГ. 10Q); ~14,4% в 0,1PBS в S6D7 (ФИГ. 10R); ~7,7% в RB в S7D13 (ФИГ. 10S); и ~6,5% в 0,1PBS в S7D14 (ФИГ. 10T). Более того, продемонстрировано, что полигормональные клетки составляли только малую долю от общего числа клеток стадии 7 (ФИГ. 10S-10T), и, вероятно, происходили из популяции CHGA+ NKX6.1-, в которой число полученных из CyT49 клеток S4D3 по существу больше, чем число полученных из H1 клеток S4D3 (пример 3). Удивительно, что полученные из PEC-01 агрегаты в 2-литровых роллерных флаконах в S6D7 показывали колокализацию между ИНСУЛИНОМ и ГЛЮКАГОНОМ, равную ~41,9%. Во всех исследованных условиях клетки ГЛЮКАГОН+ ИНСУЛИН+ не были NKX6.1+, как показано для полученных из PEC-01 агрегатов в 2-литровом роллерном флаконе в S6D7 и полученных из S4D3 по новому протоколу 0,1PBS в S7D14, 2-литровом роллерном флаконе в S7D13 (ФИГ. 10V). Устойчивая индукция инсулинпродуцирующих эндокринных клеток была подтверждена иммунофлуоресцентным анализом (IF-анализом). Агрегаты, культивированные в RB или 0,1 PBS, показали значительное увеличение числа СИНАПТОФИЗИН+ NKX6.1+ ИНСУЛИН+ клеток в S6D7 (0,1 PBS - ФИГ. 10W) и S7D16-D23 (RB - ФИГ. 10AA; 0,1 PBS - ФИГ. 10Y). Более того, фактор транскрипции раннего созревания MAFA уже индуцировали в 0,1 PBS в S6D7 (ФИГ. 10X), и он начал совместно экспрессироваться в ИНСУЛИН-положительных клетках на стадии 7 в RB в S7D23 (ФИГ. 10AB) и 0,1 PBS в S7D16 (ФИГ. 10Z).
[0229] Хотя изобретение было описано и проиллюстрировано ссылками на различные конкретные материалы, процедуры и примеры, следует понимать, что изобретение не ограничивают конкретными комбинациями материалов и процедур, выбранными для этой цели. Многочисленные изменения, касающиеся таких деталей изобретения, будут очевидными для специалистов в данной области. Подразумевается, что все описания и примеры представлены только в качестве иллюстрации и находятся в пределах сущности и объема настоящего изобретения, что отражено в нижеприведенной формуле изобретения. Все ссылки, патенты и заявки на патенты, приведенные в этой заявке, полностью включены в этот документ путем ссылки.
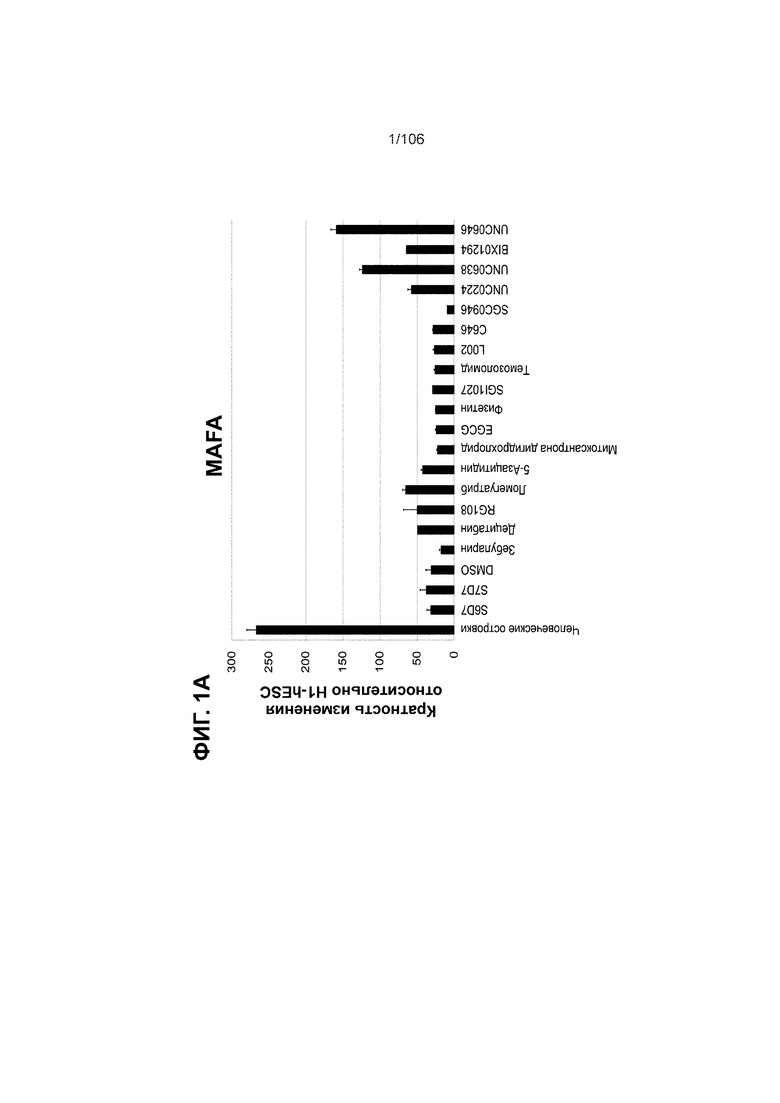
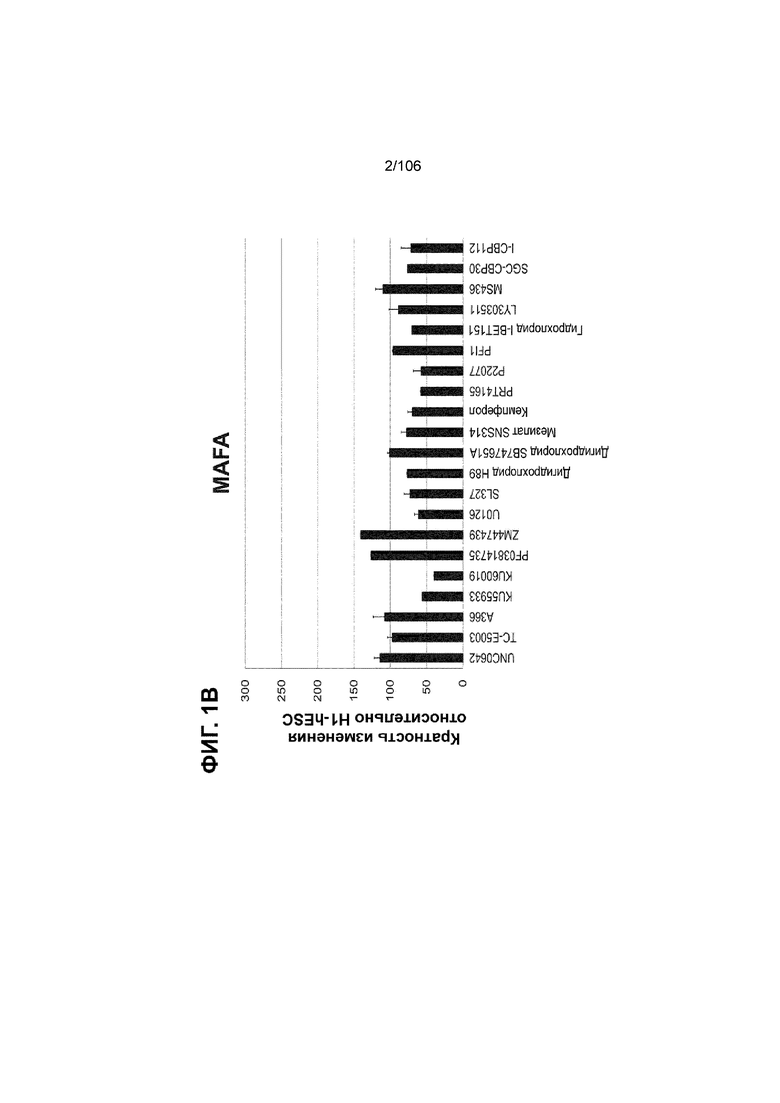
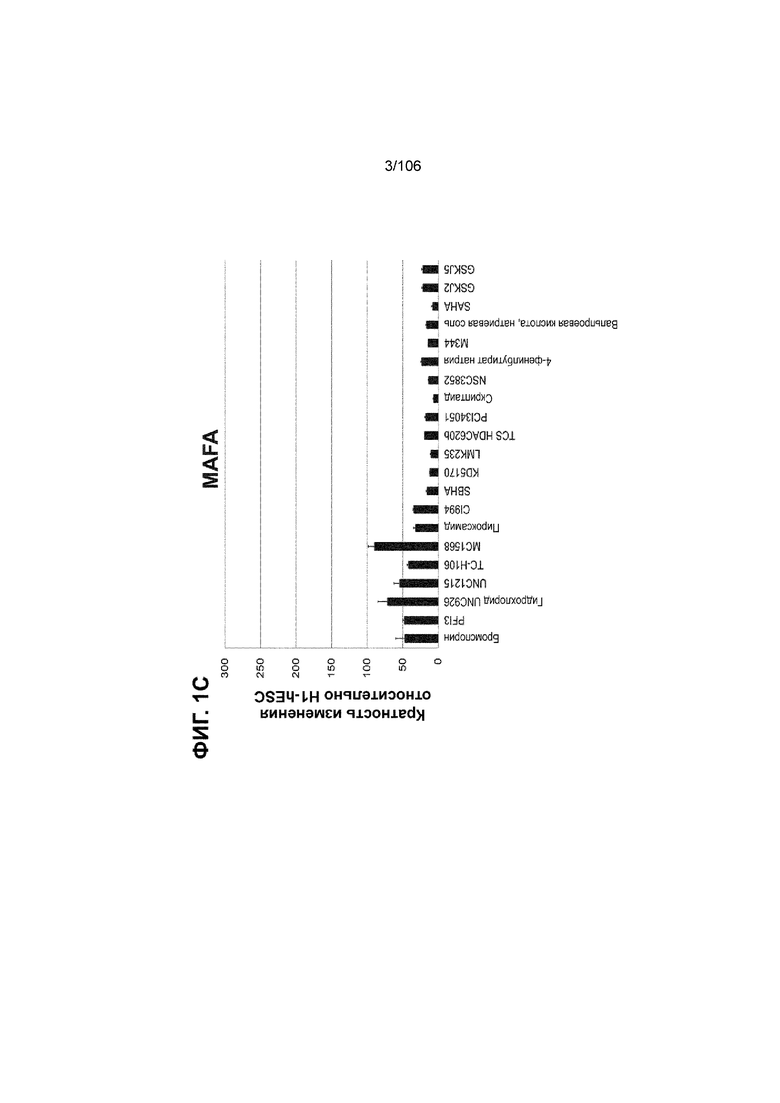



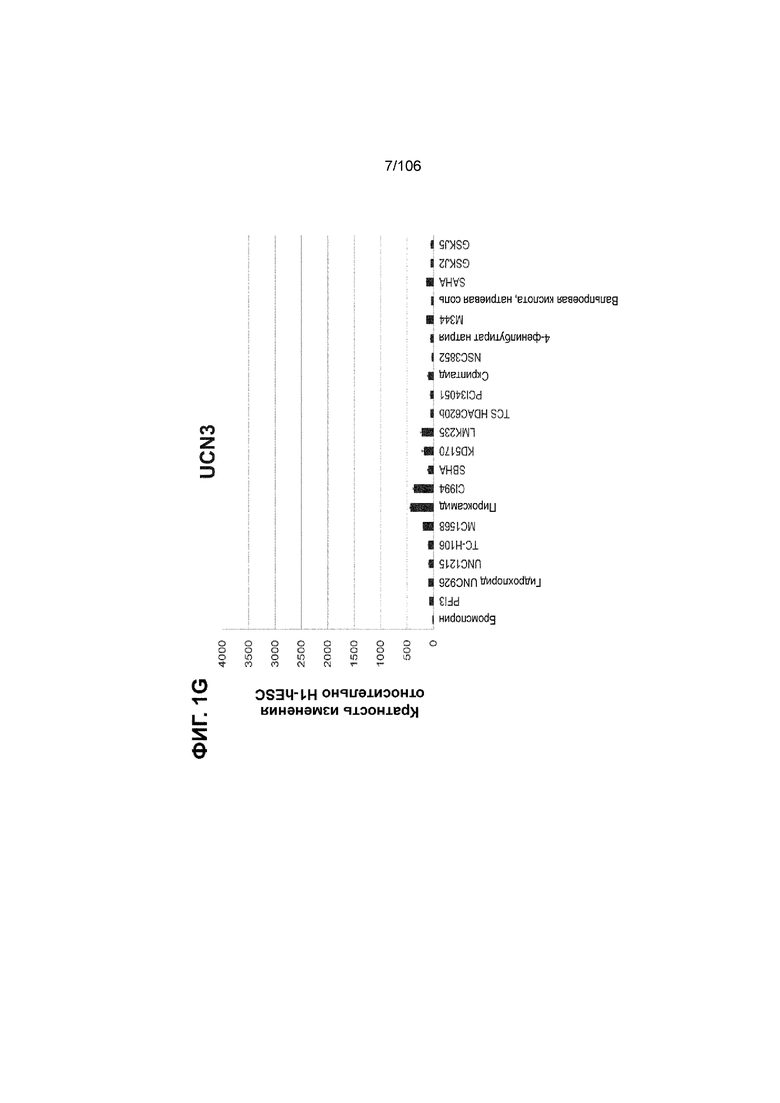

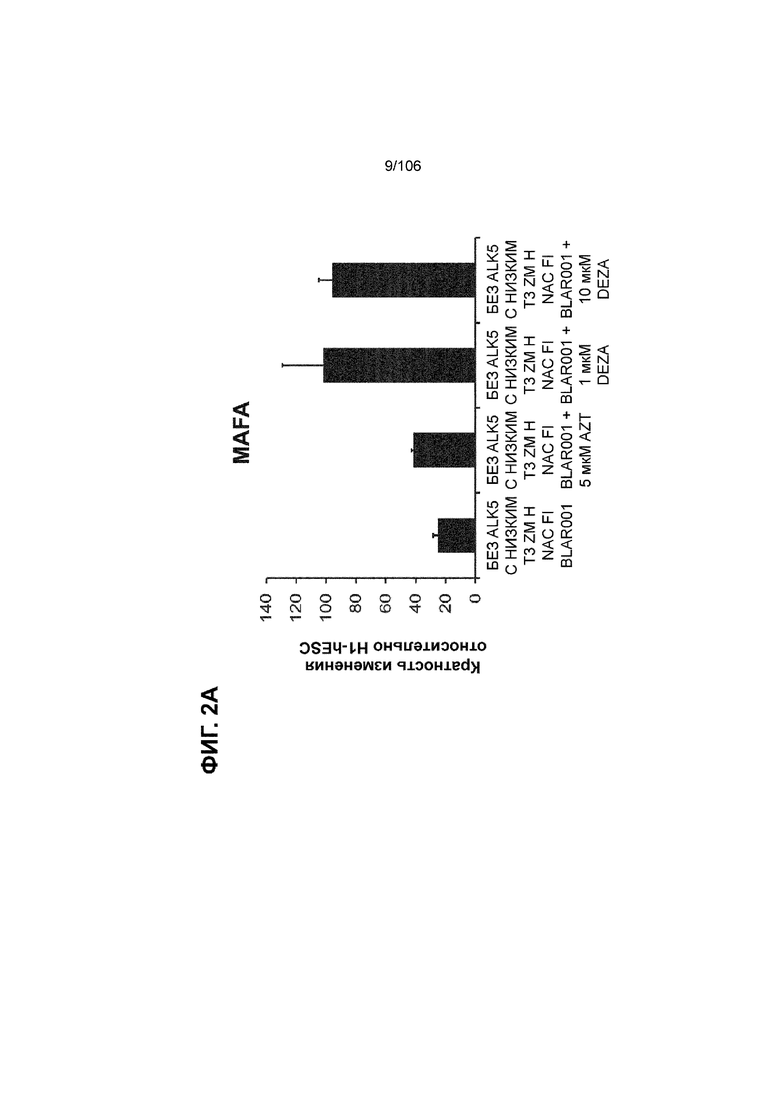
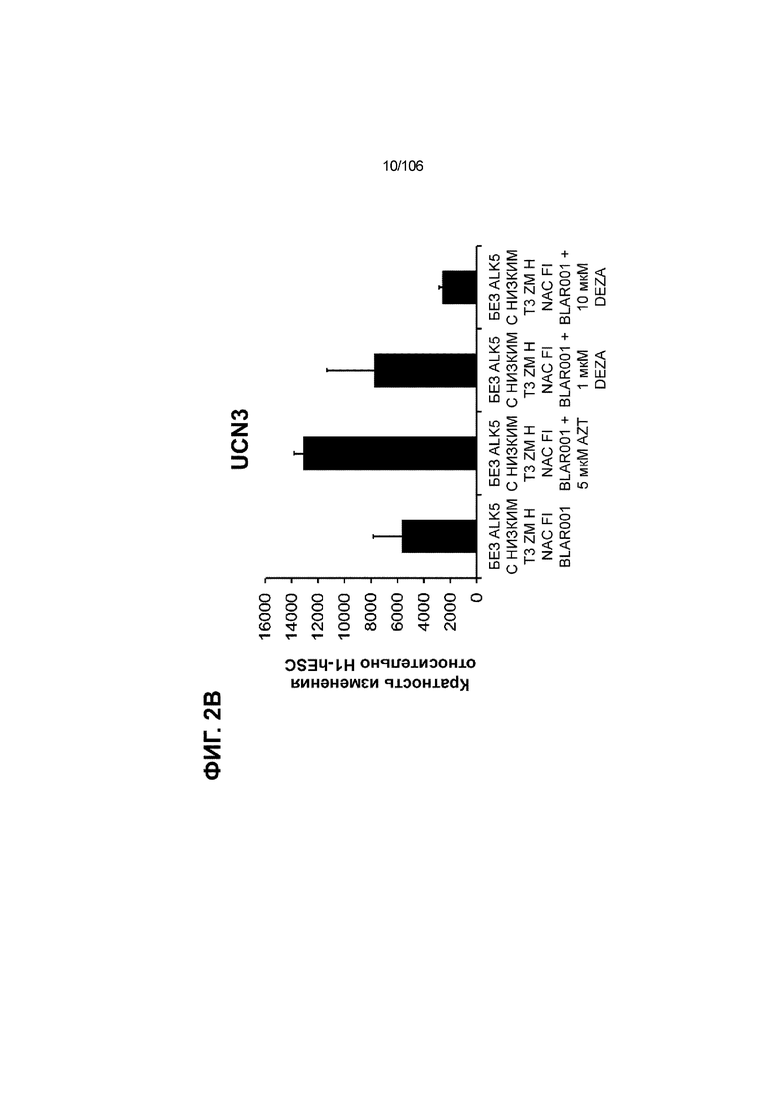
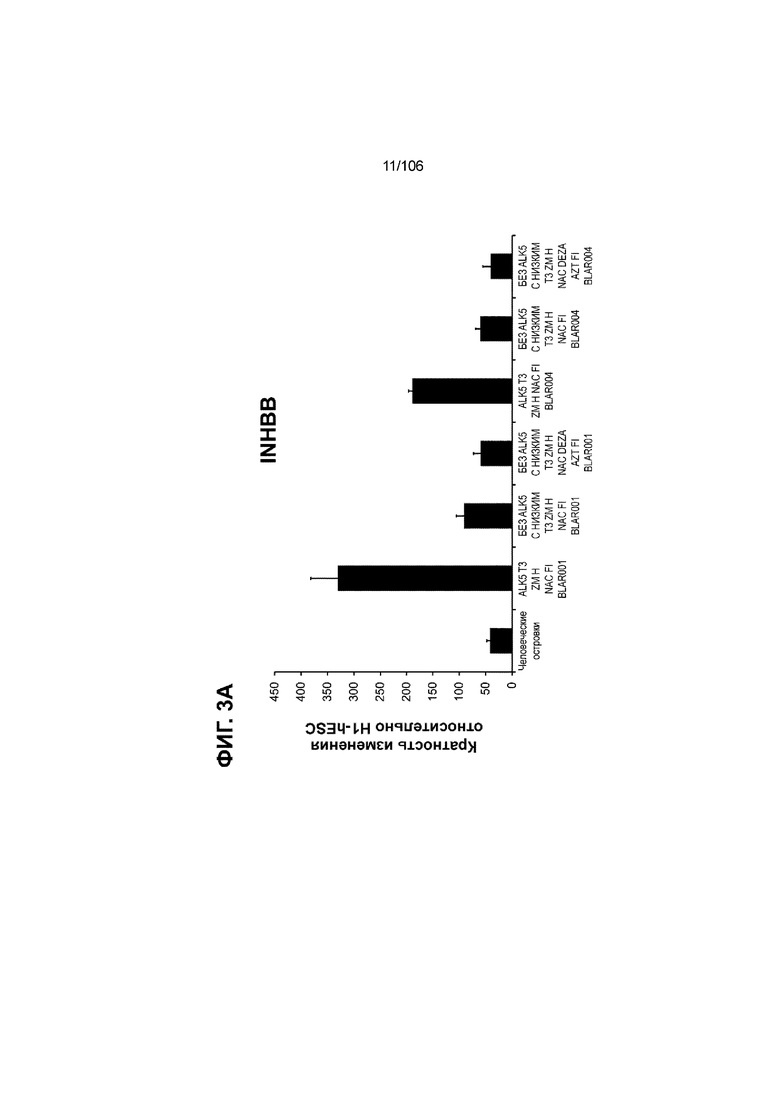
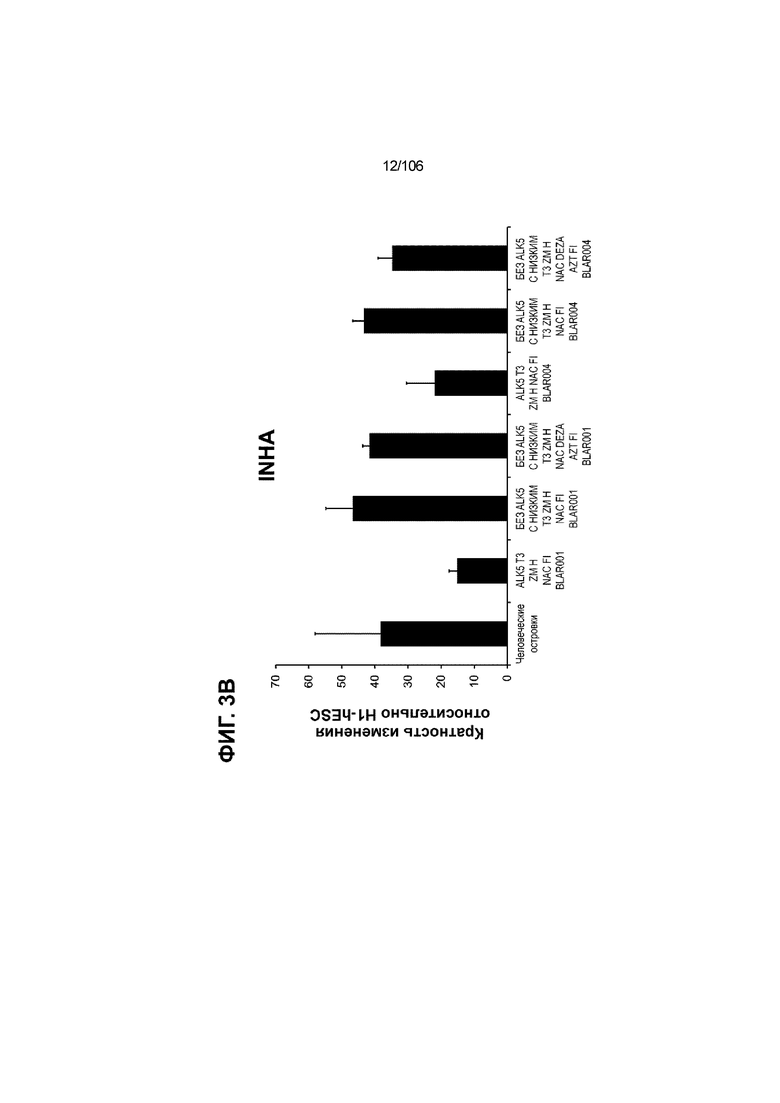
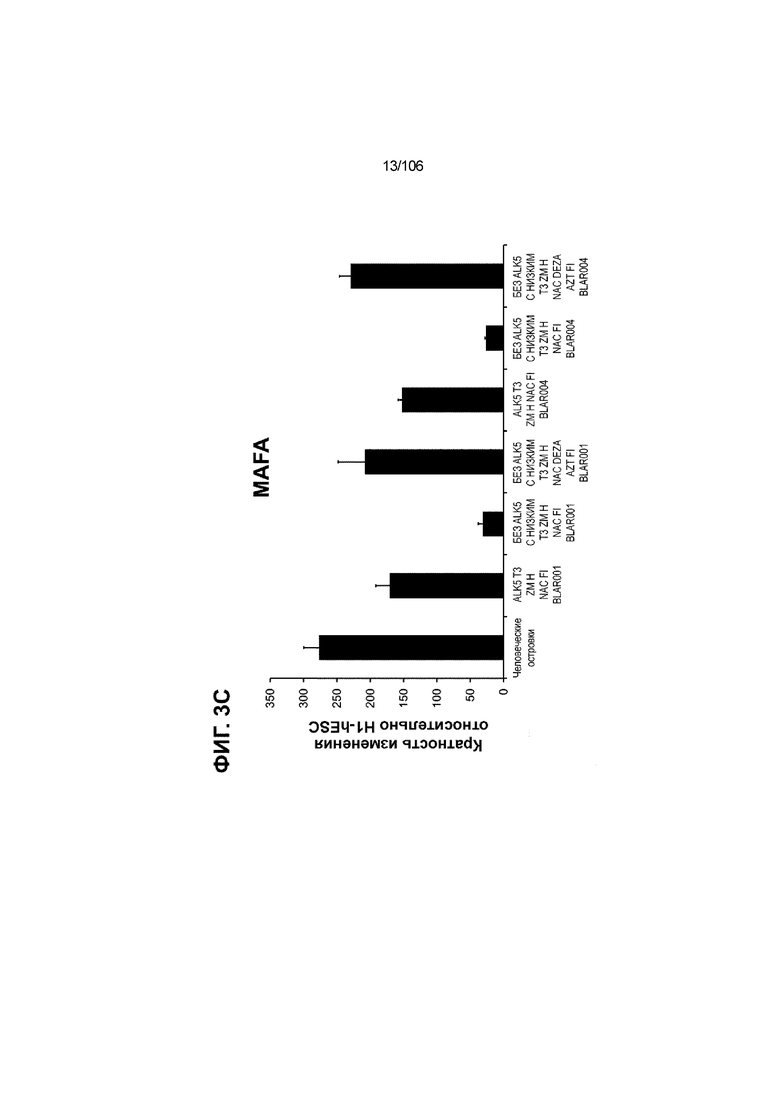
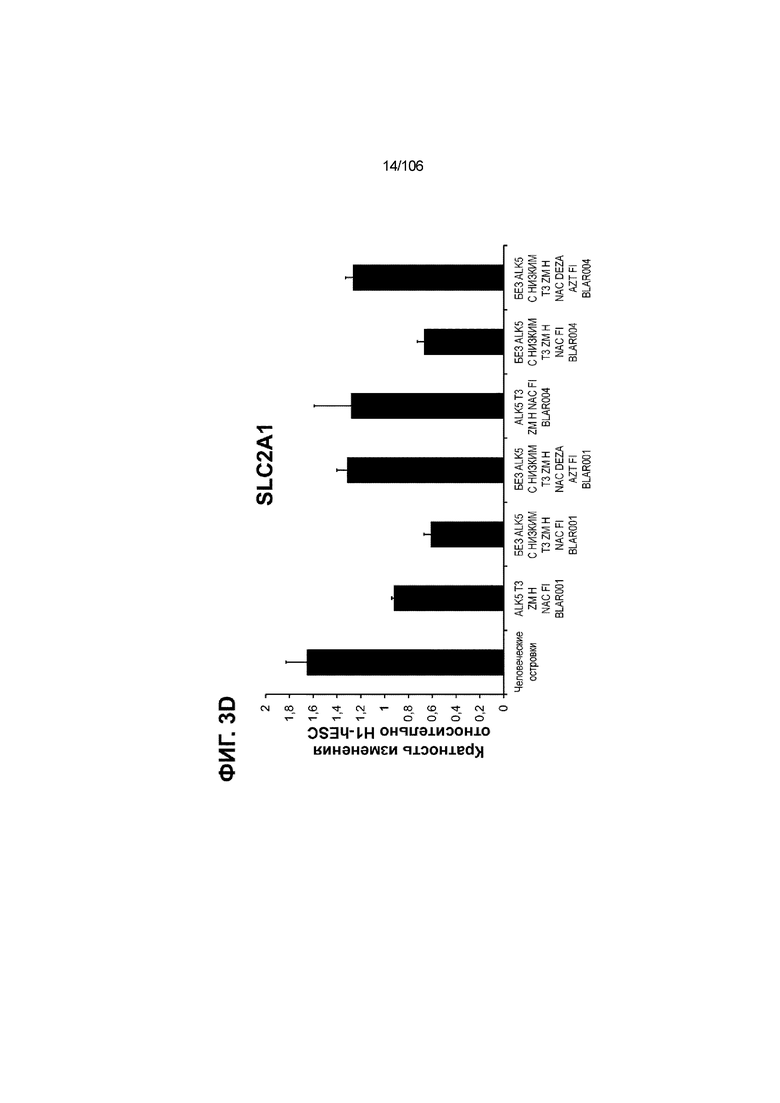
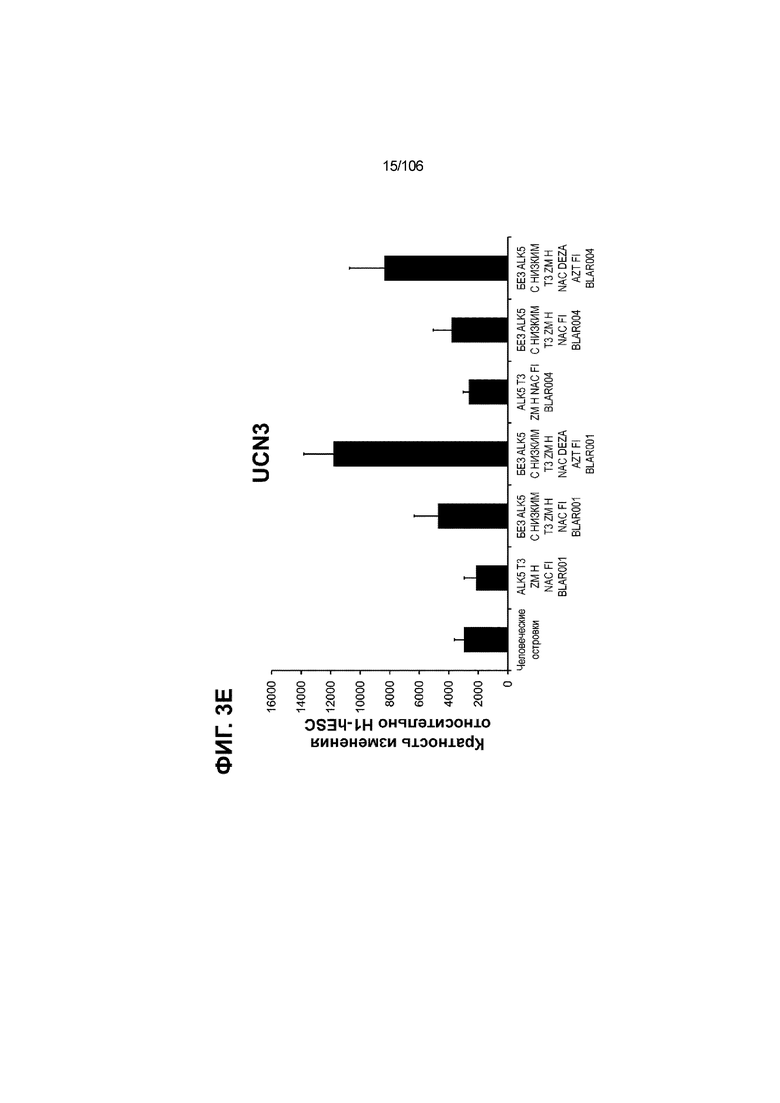
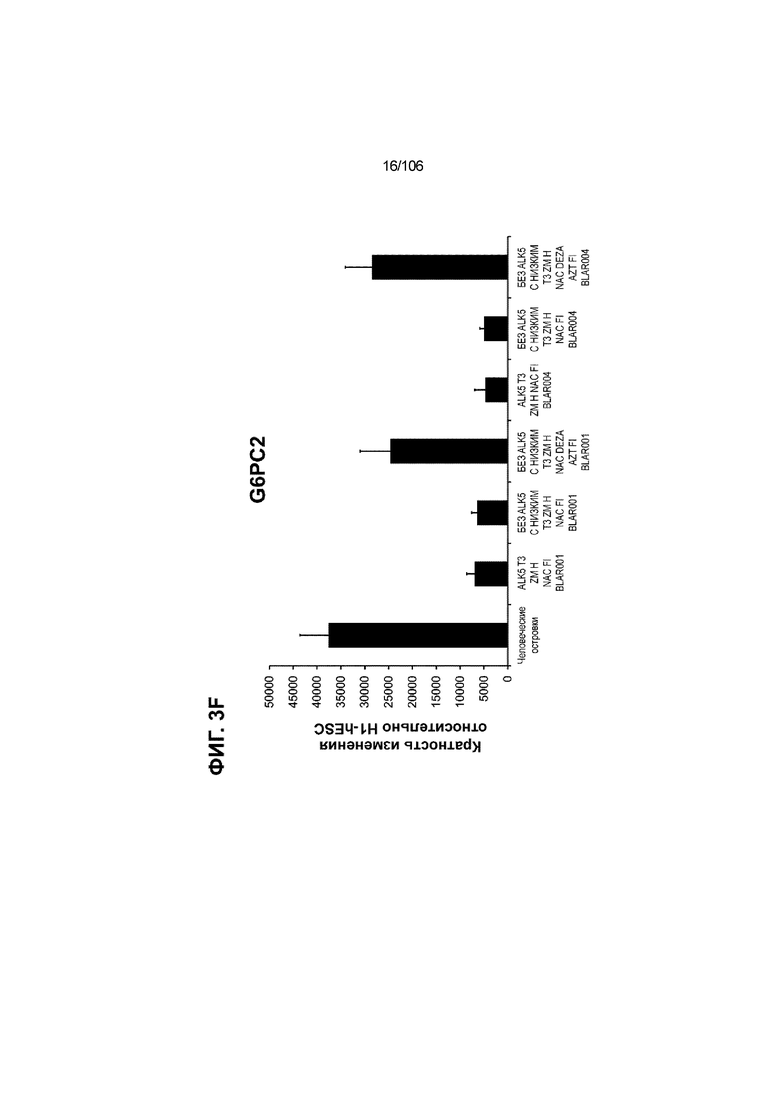
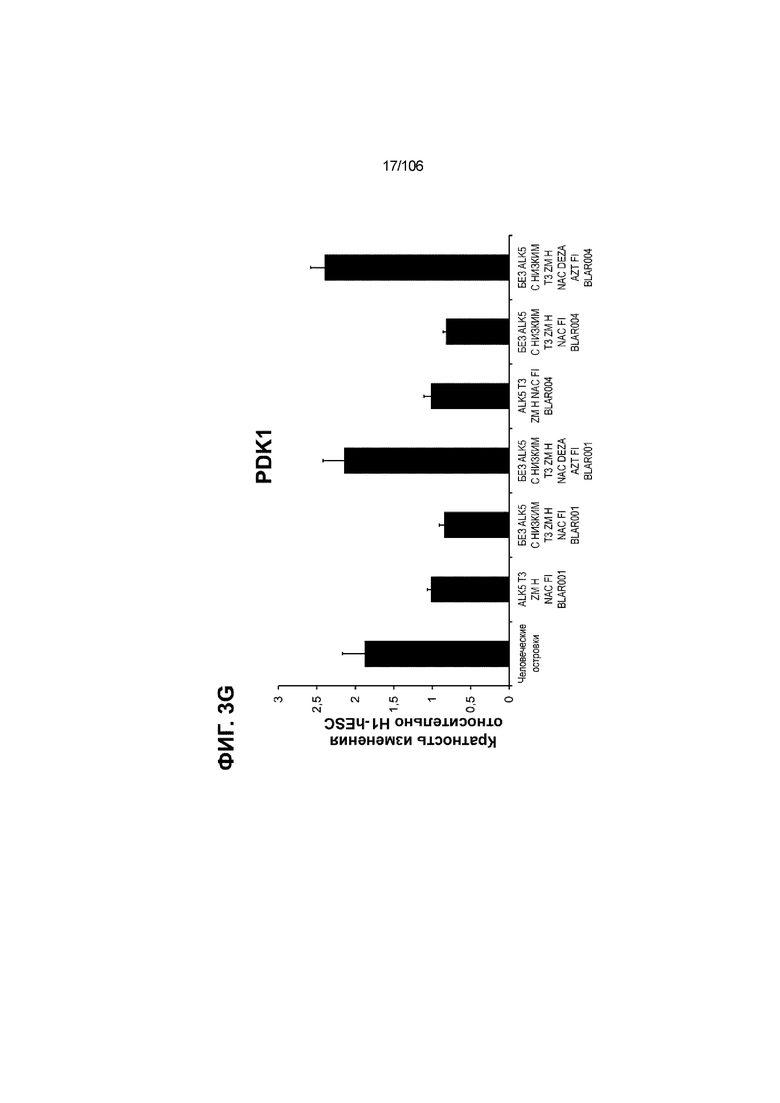
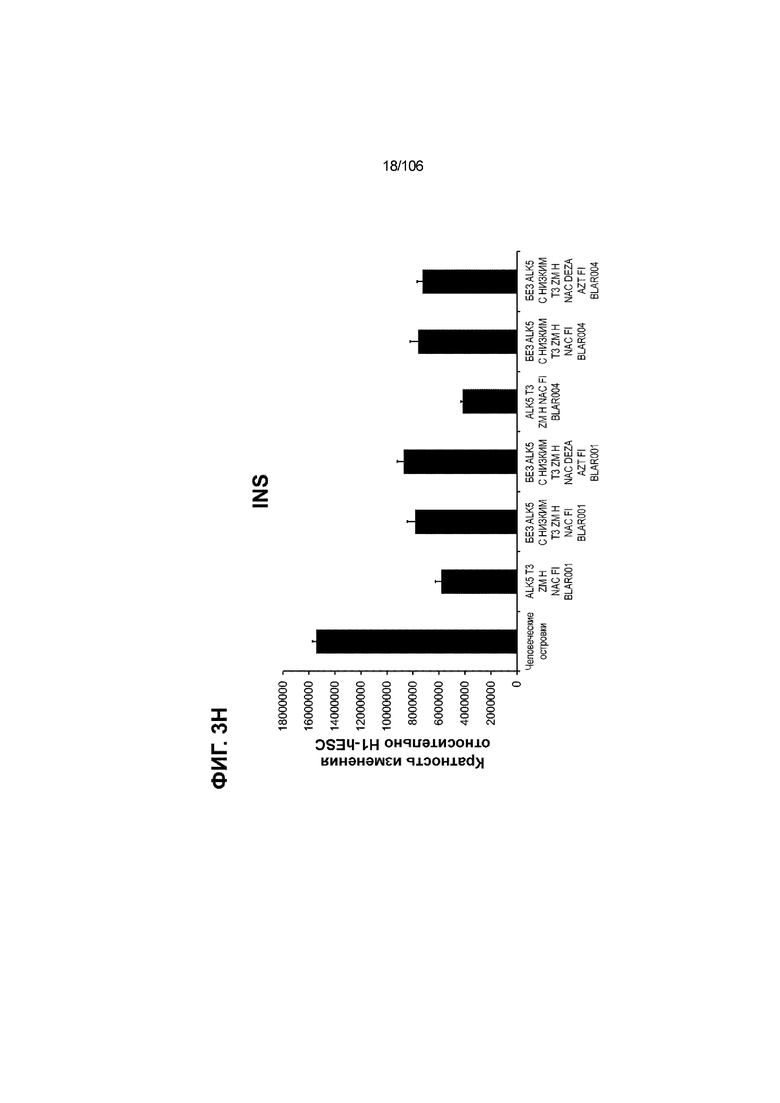
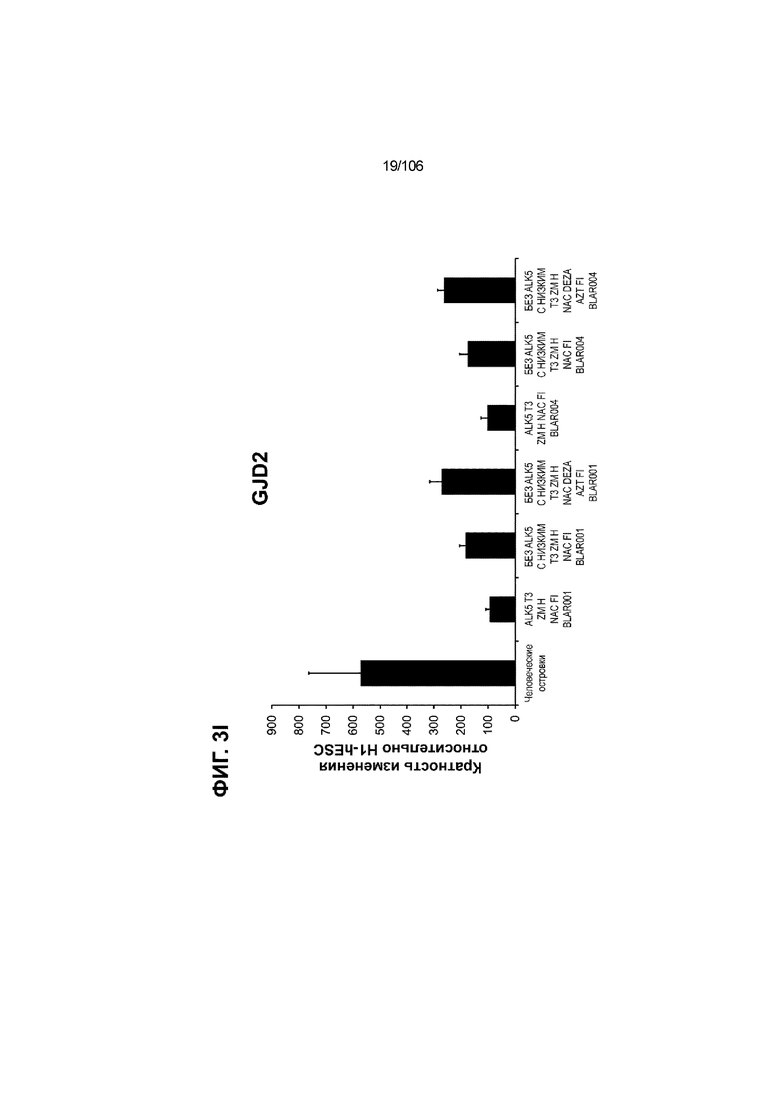
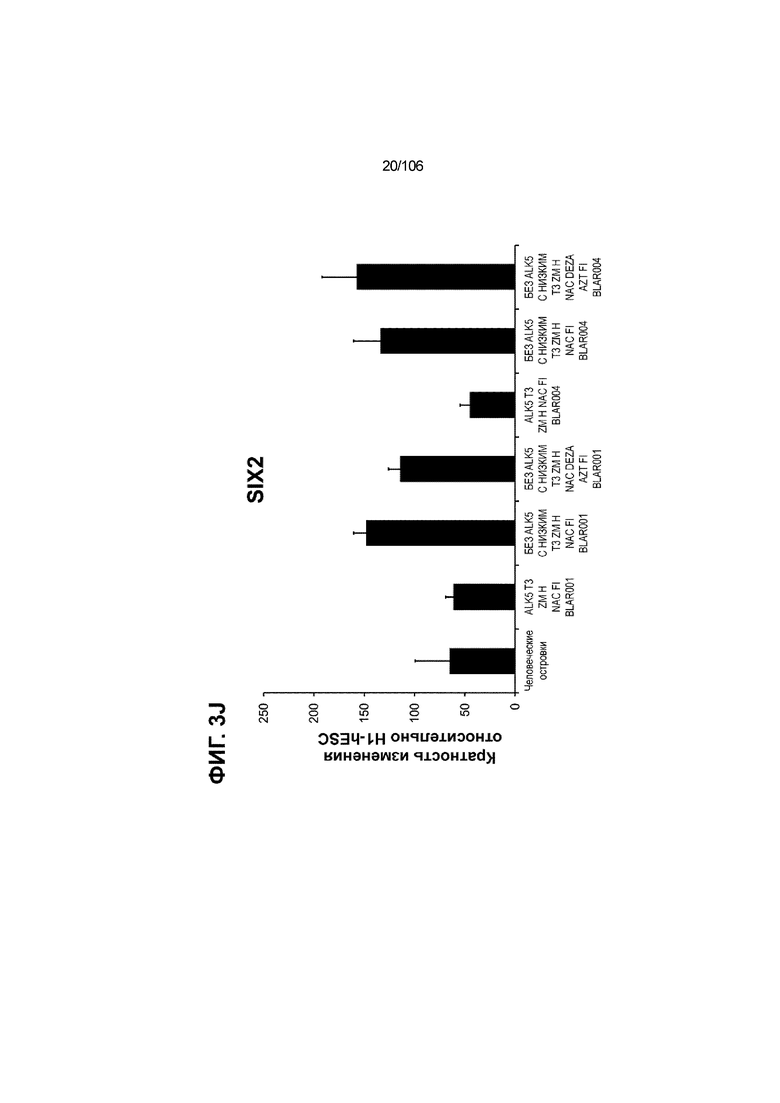
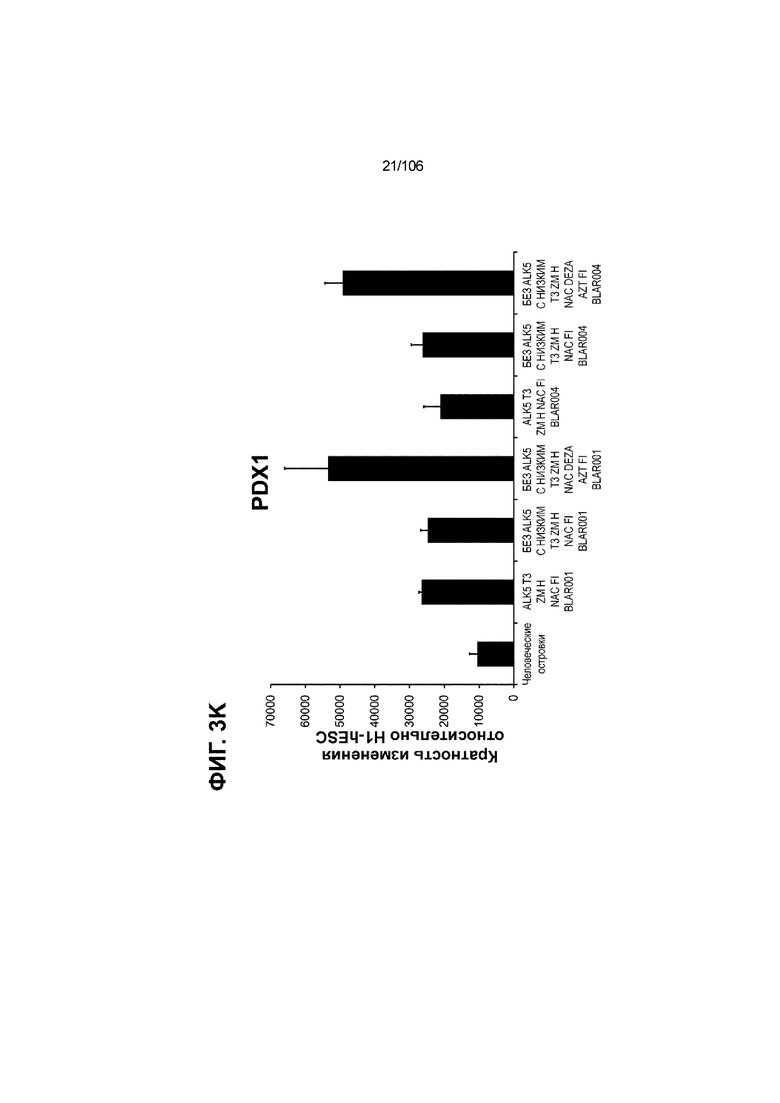
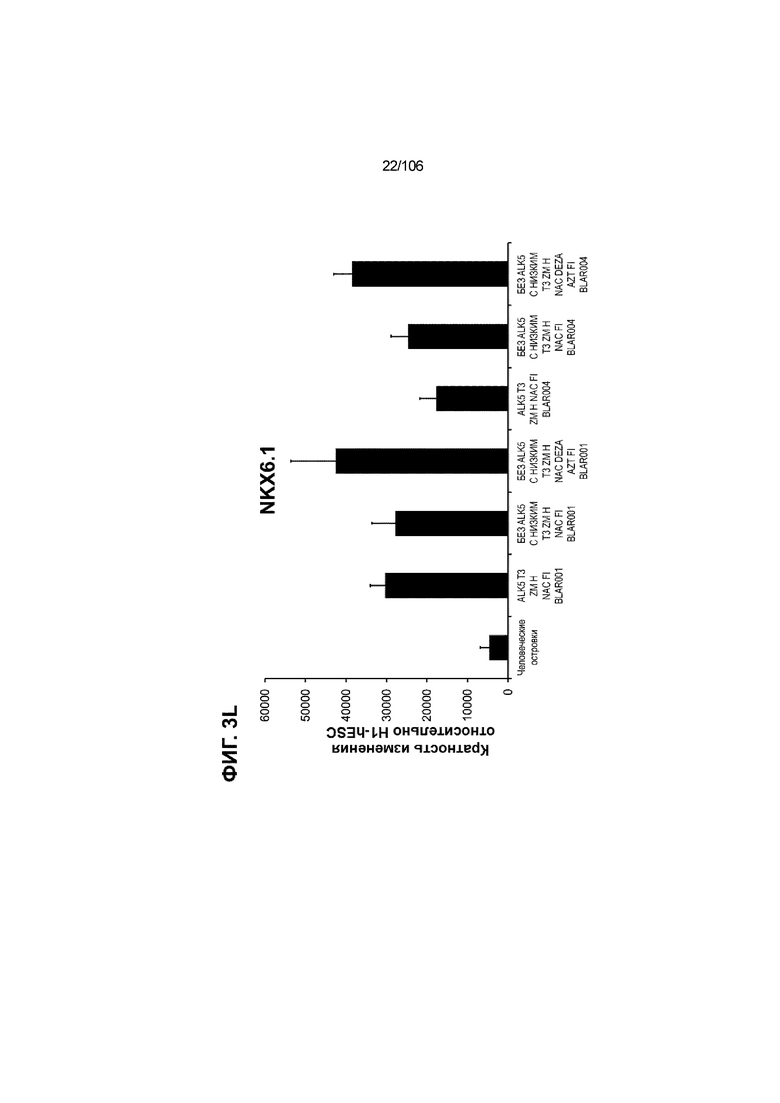
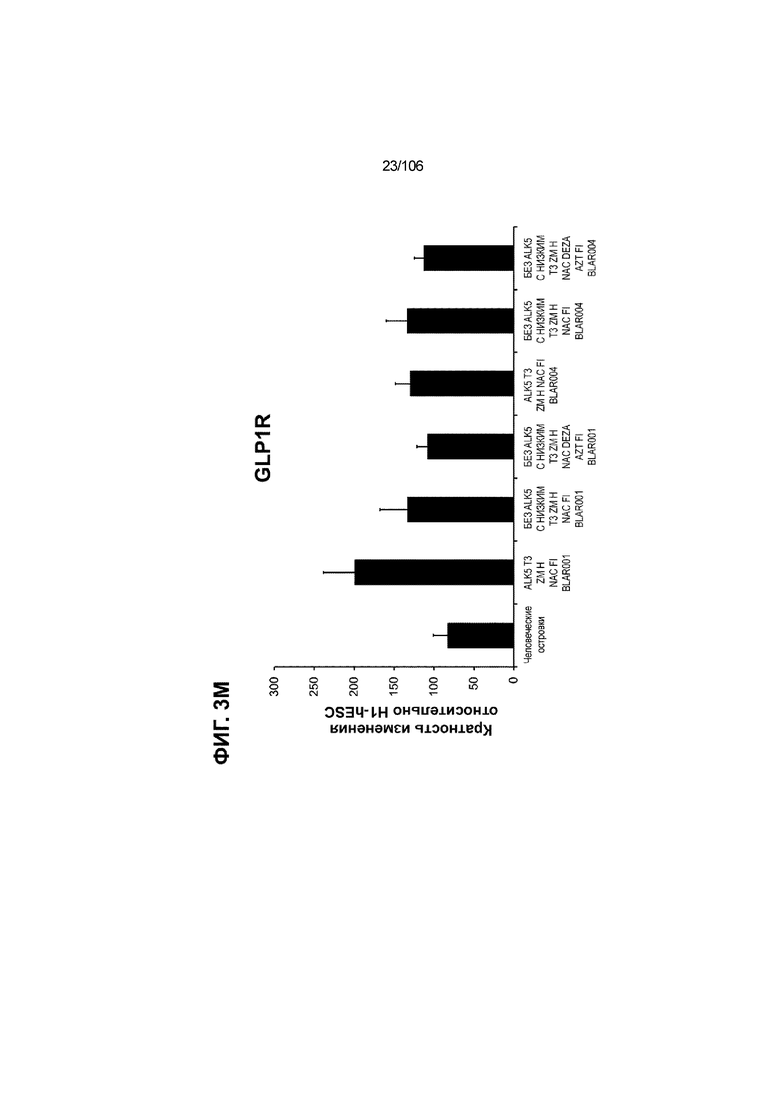
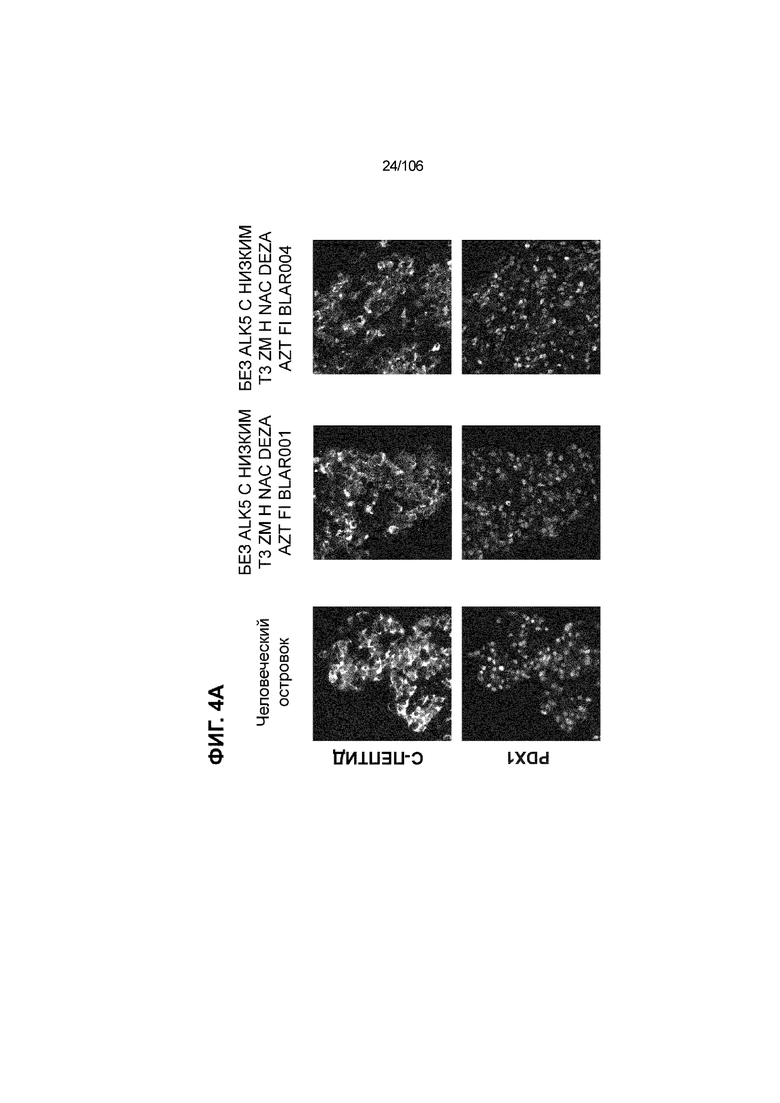
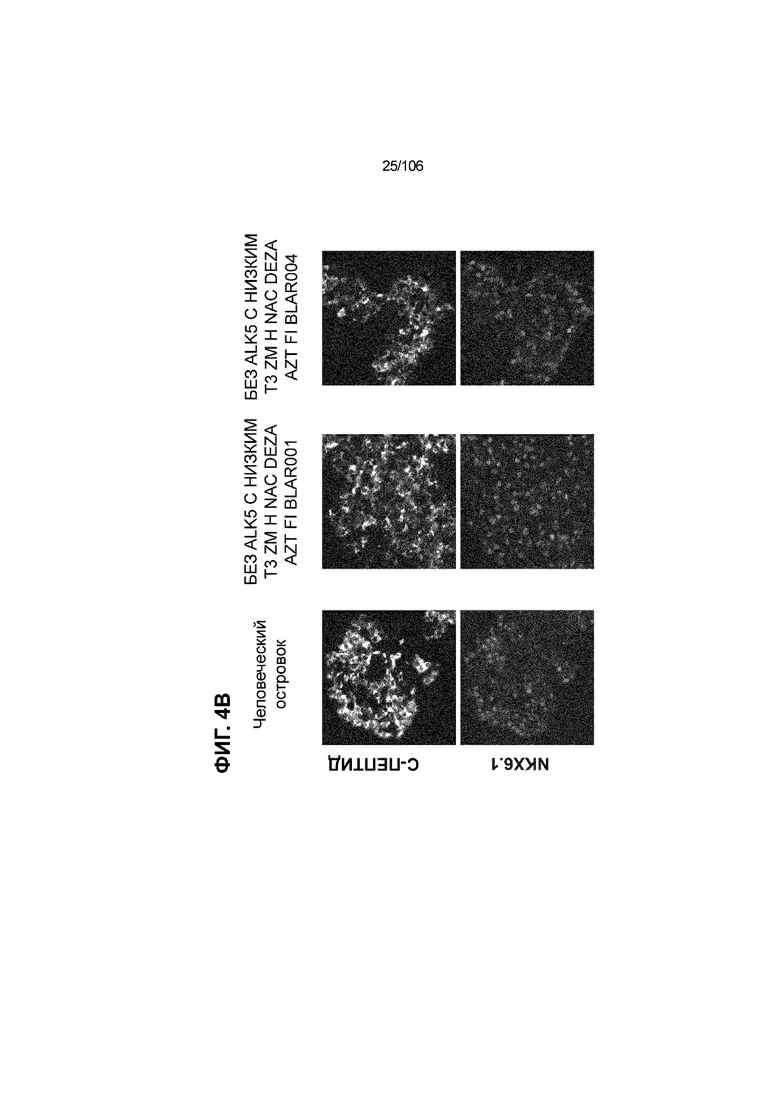
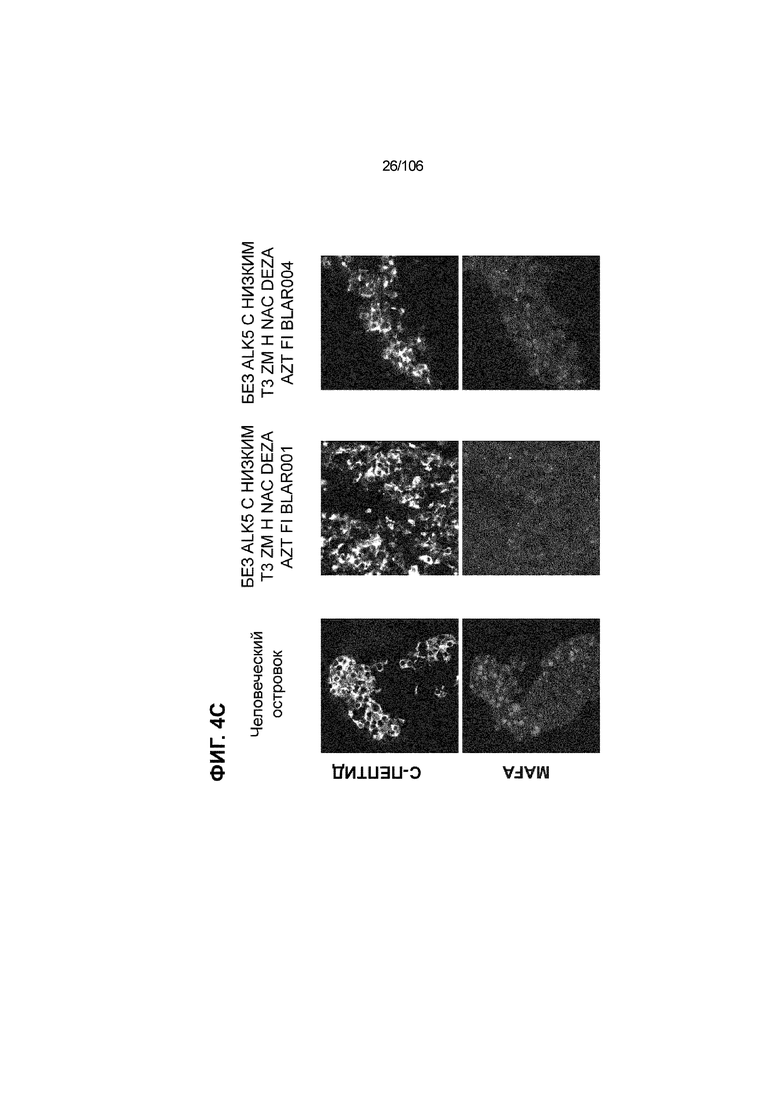
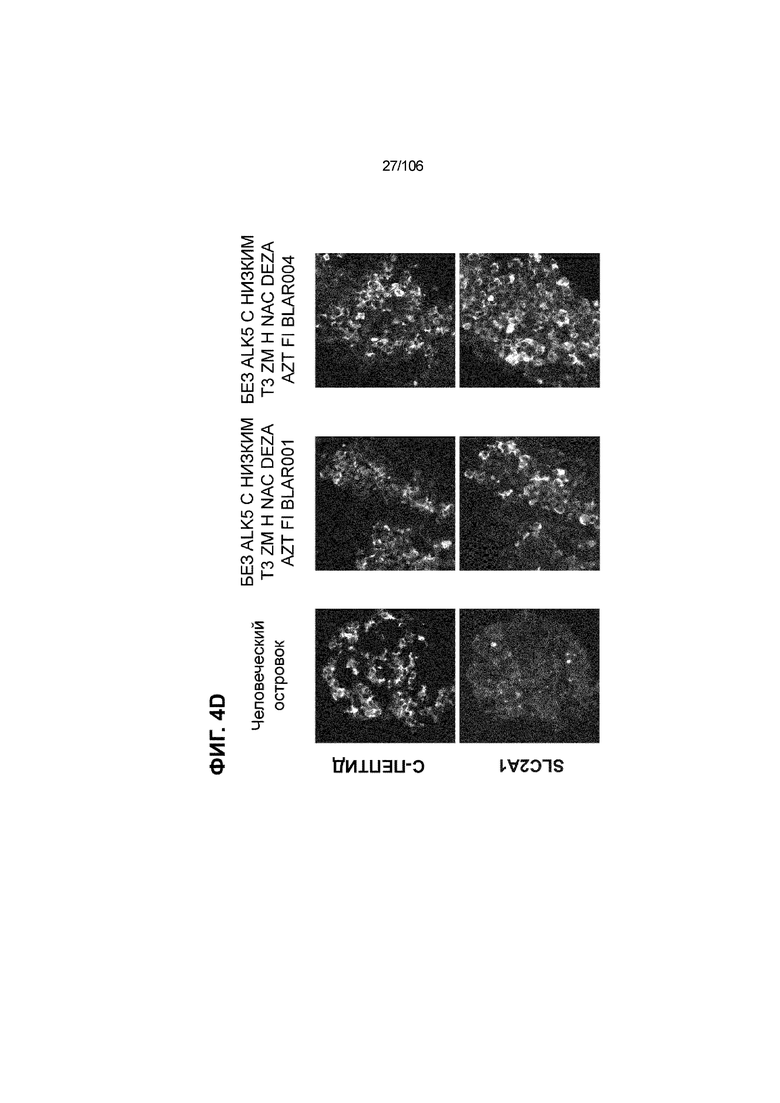
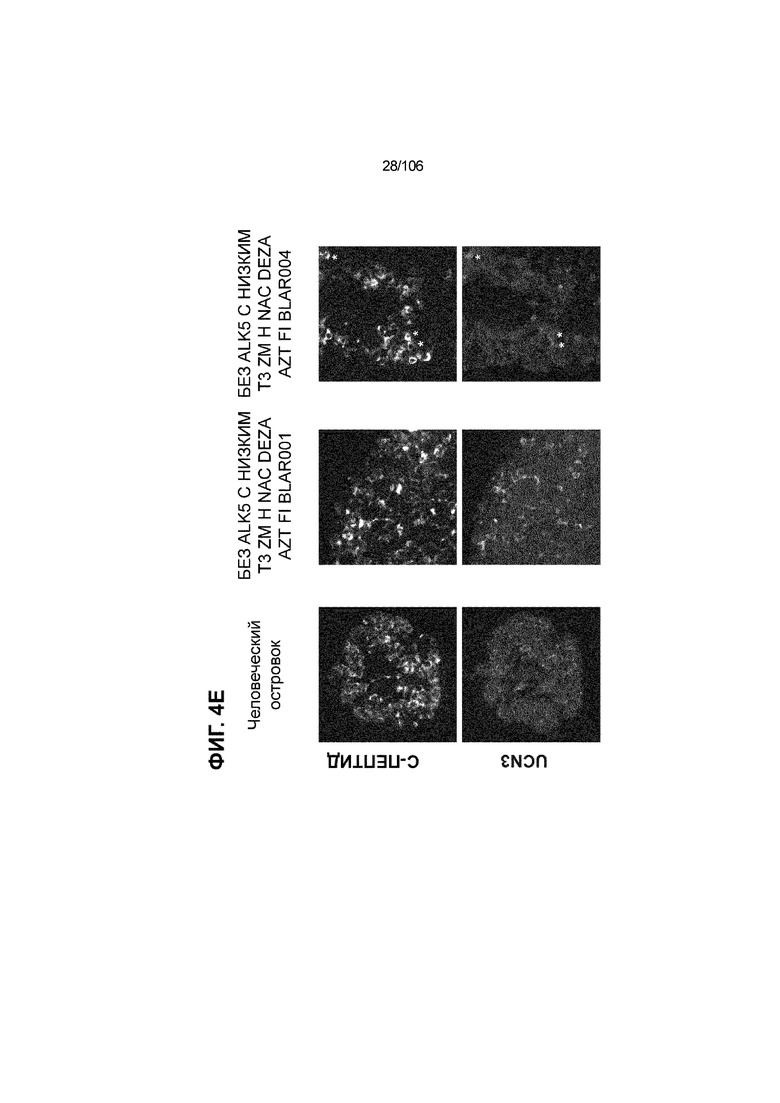
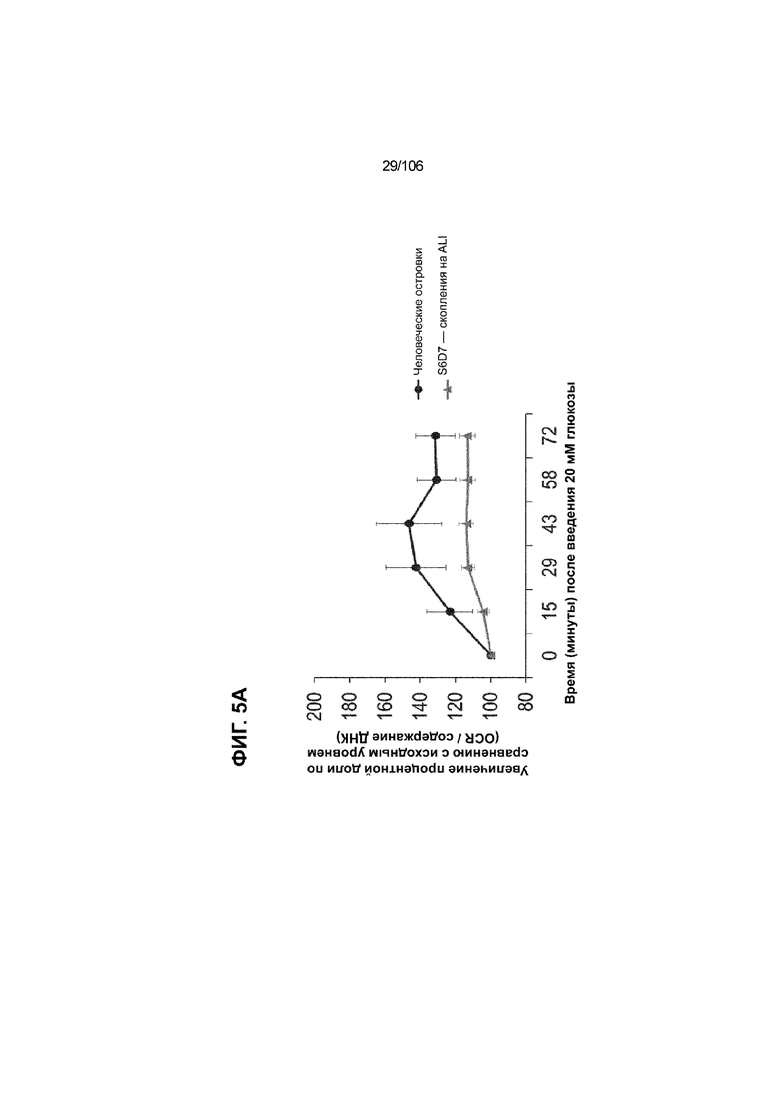
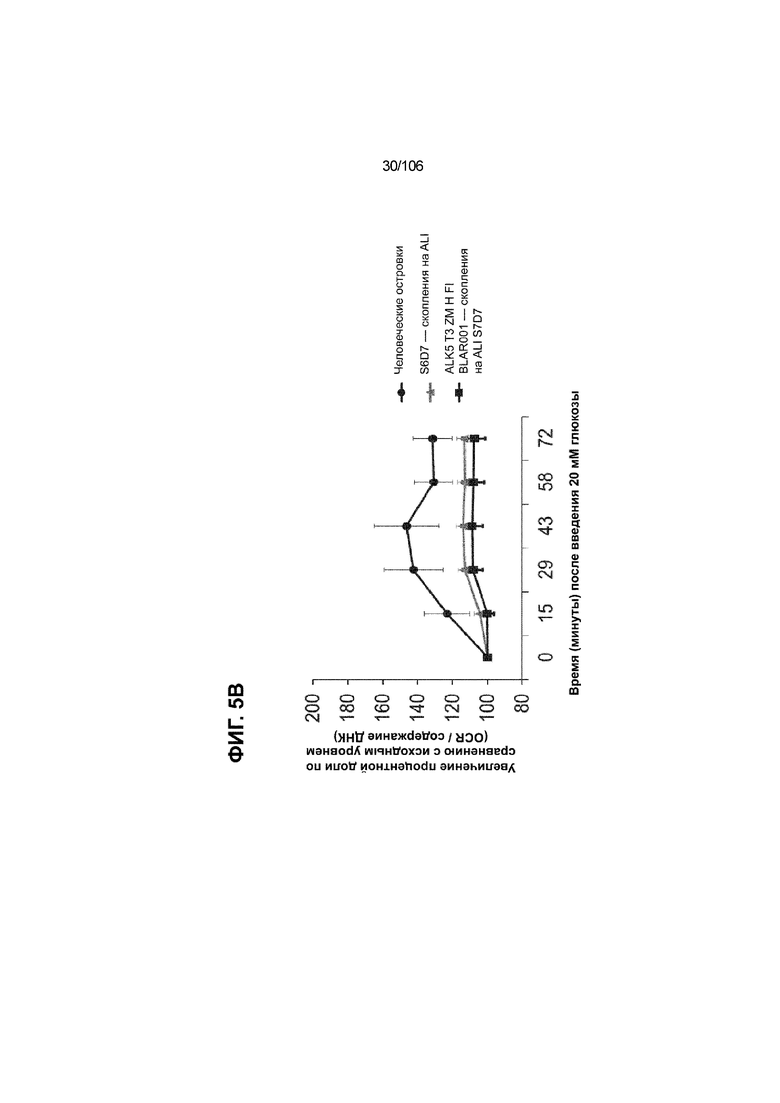
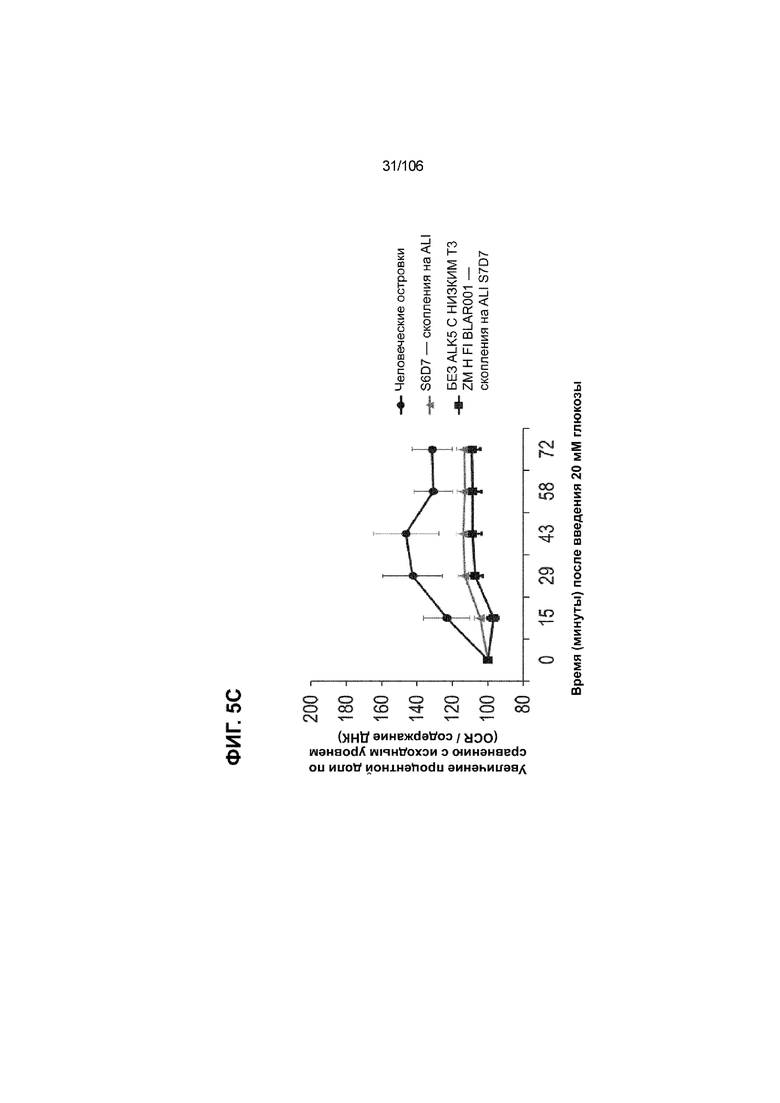
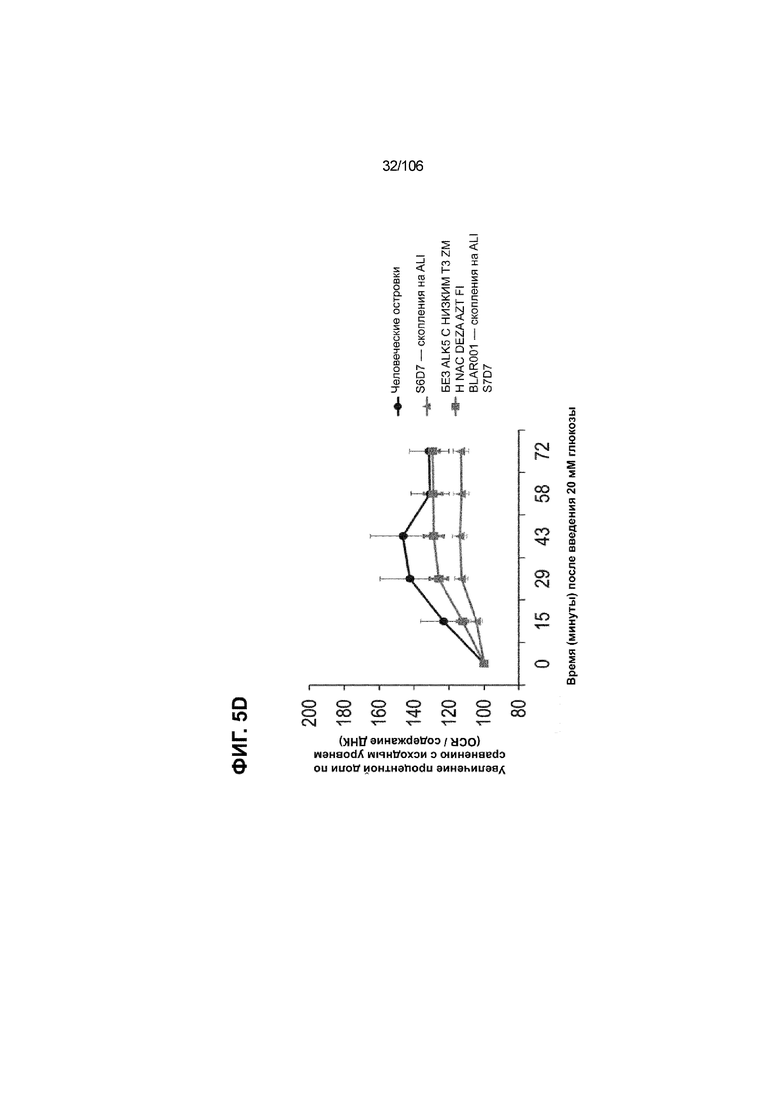
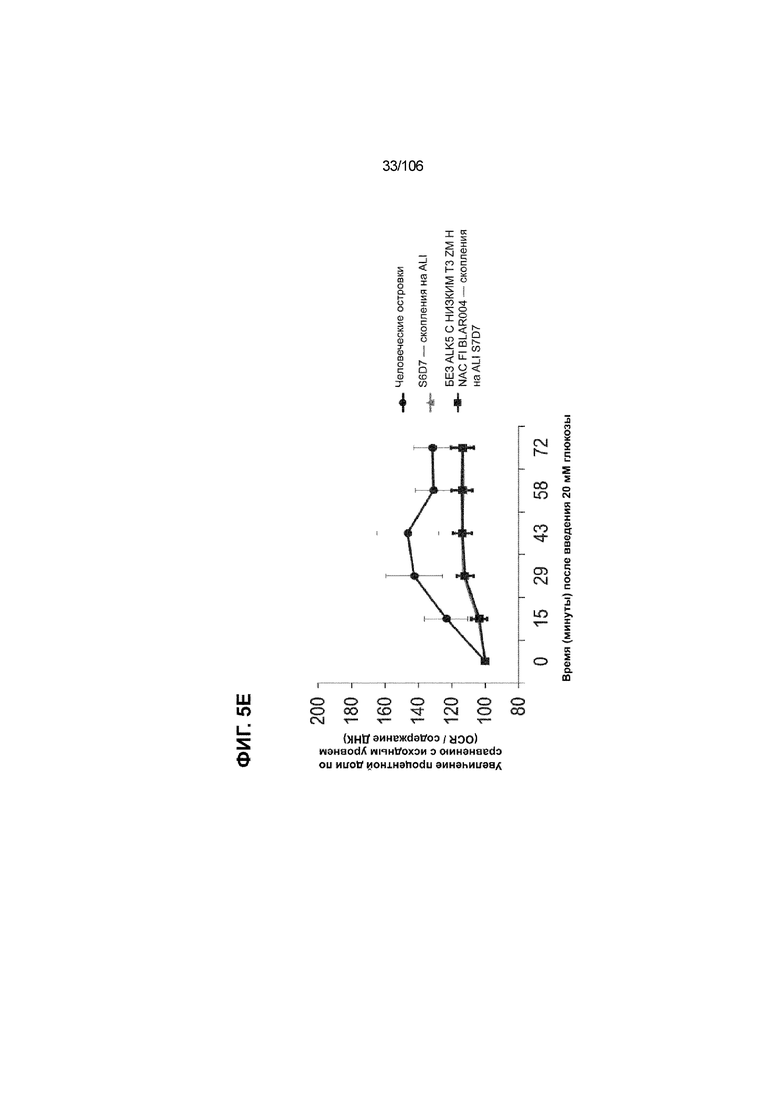
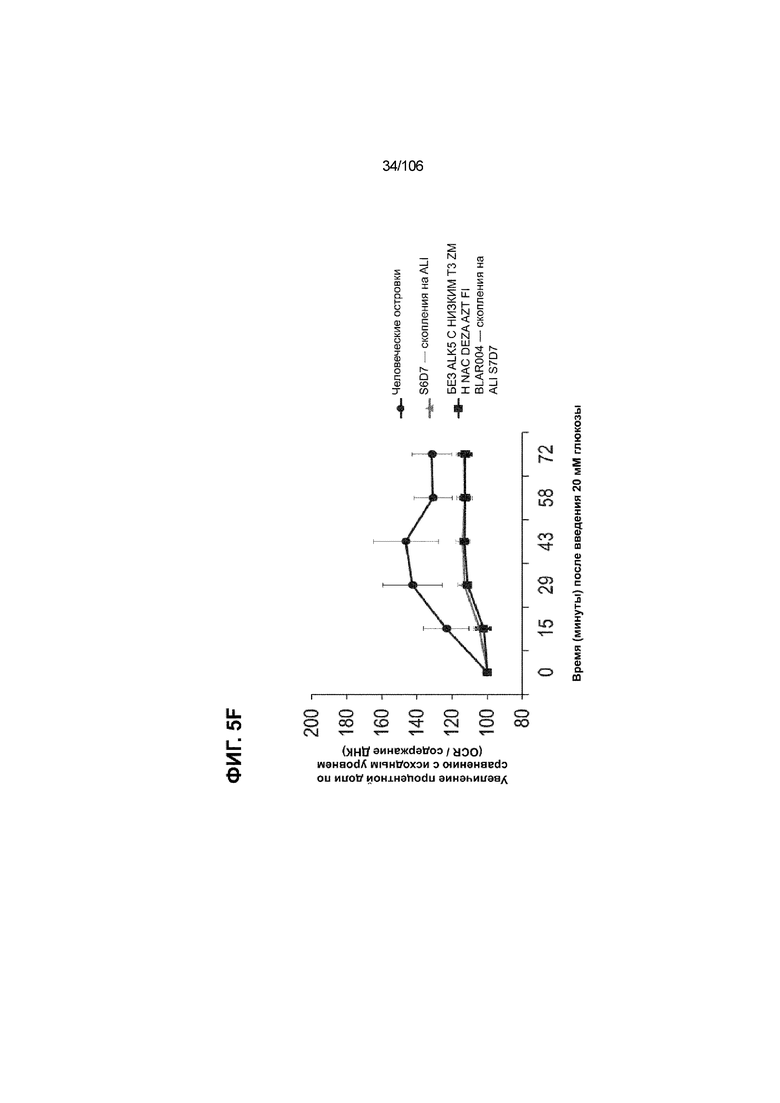
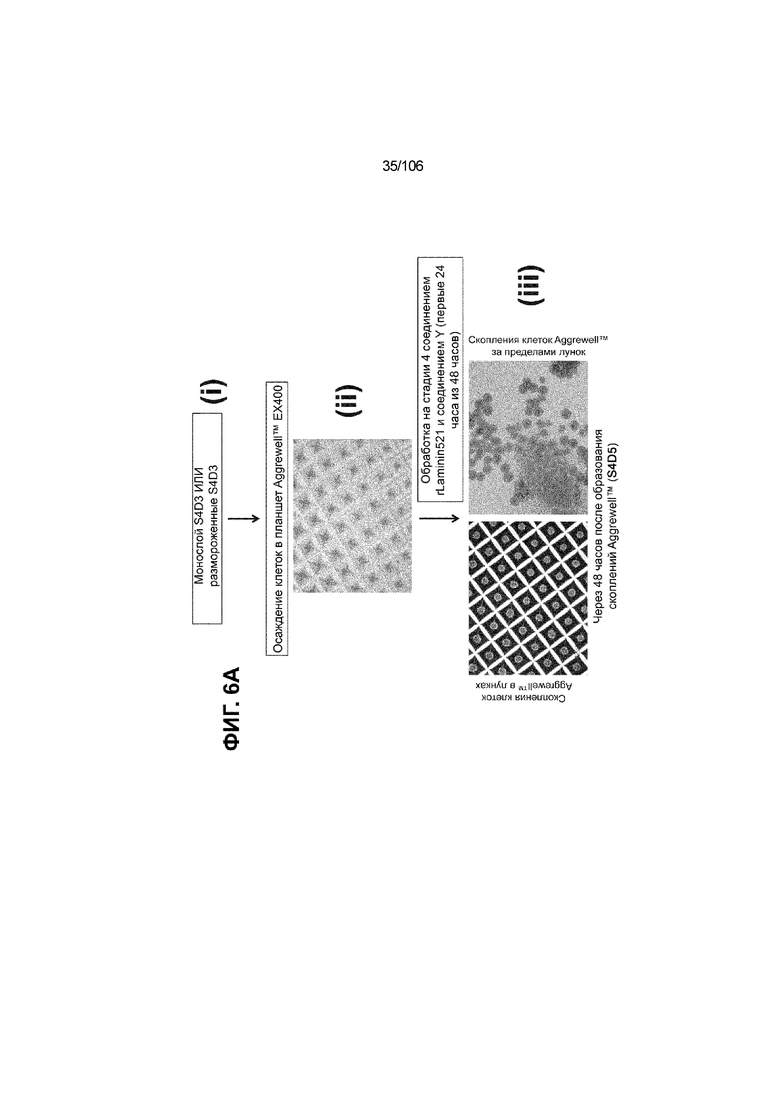
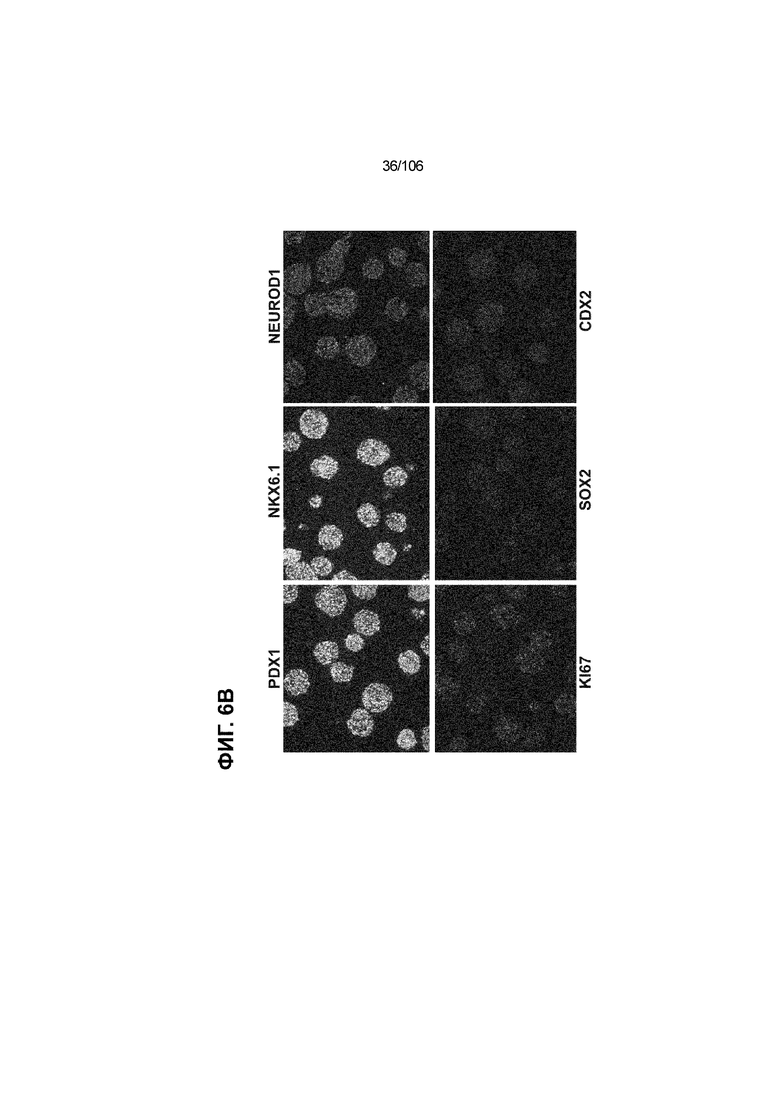
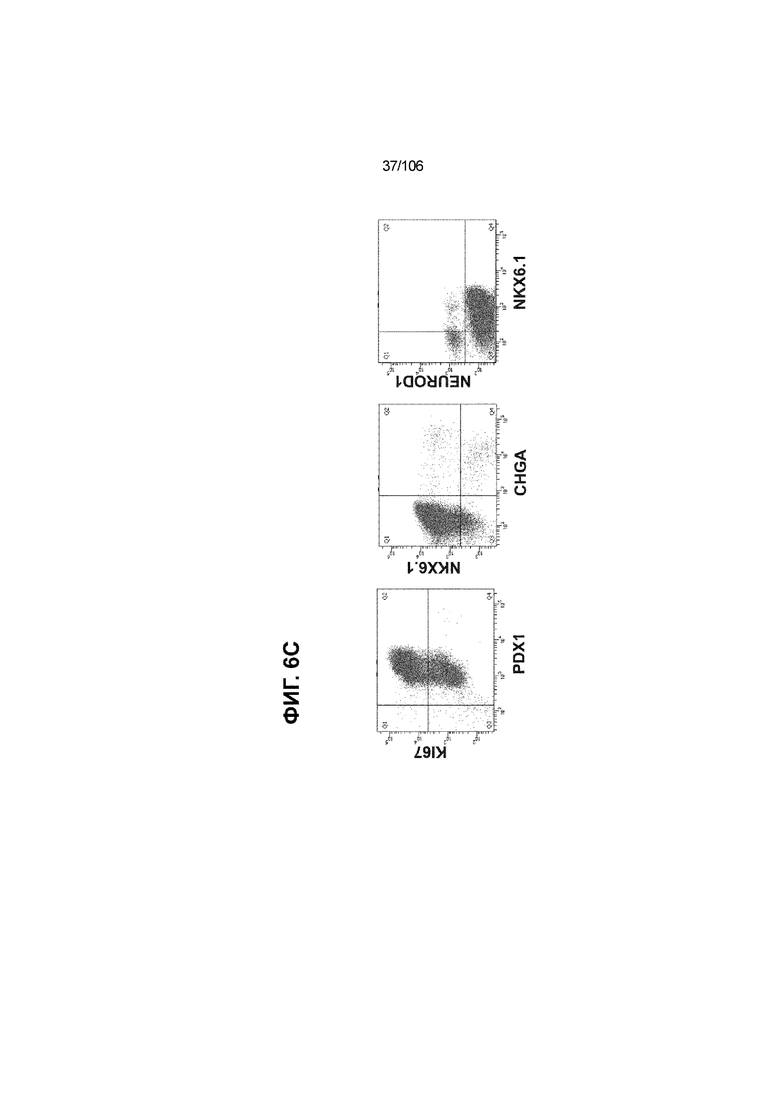
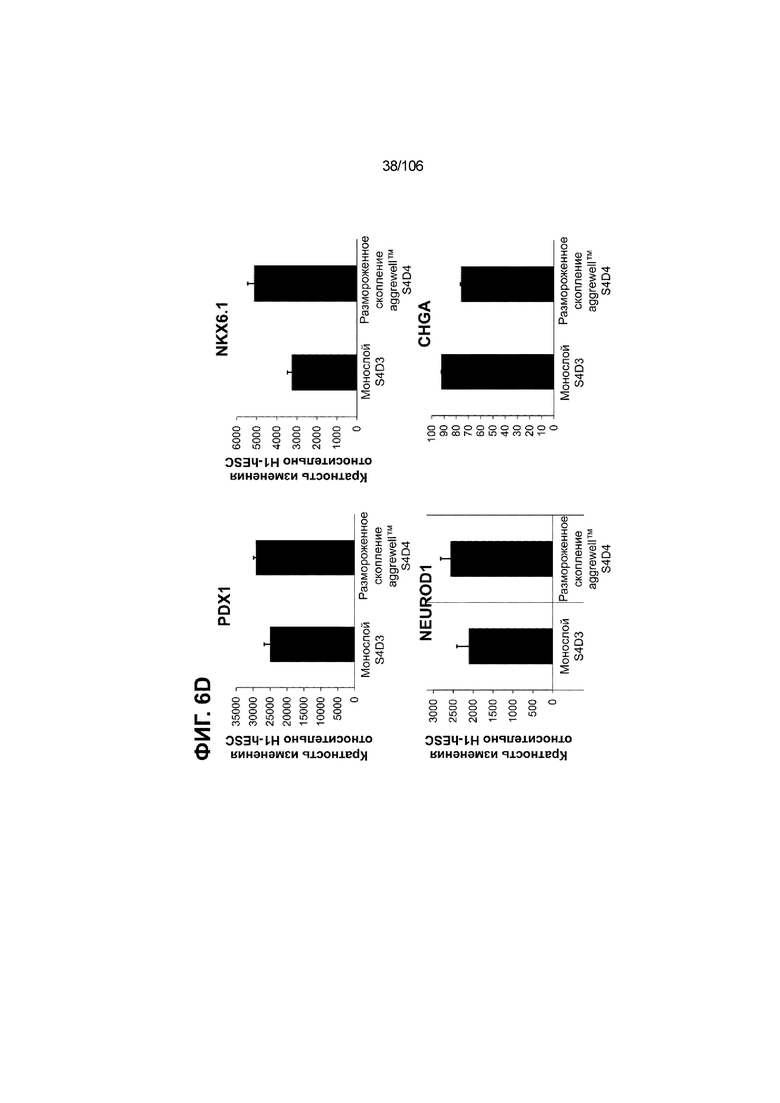
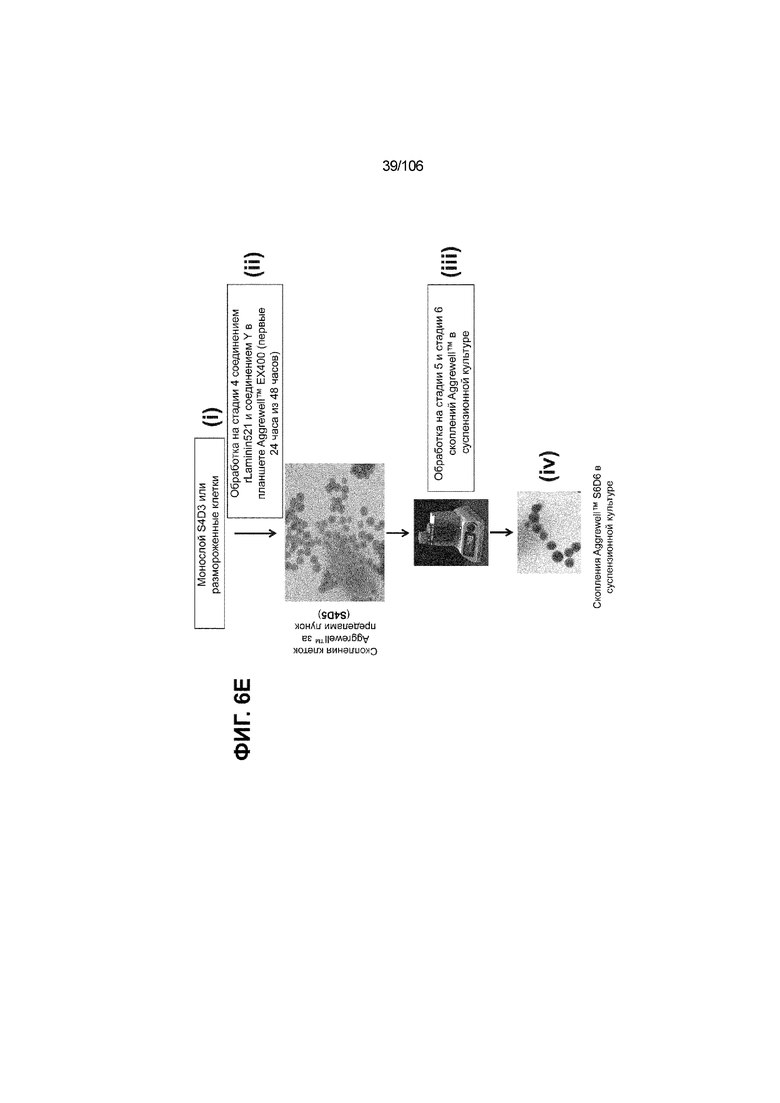
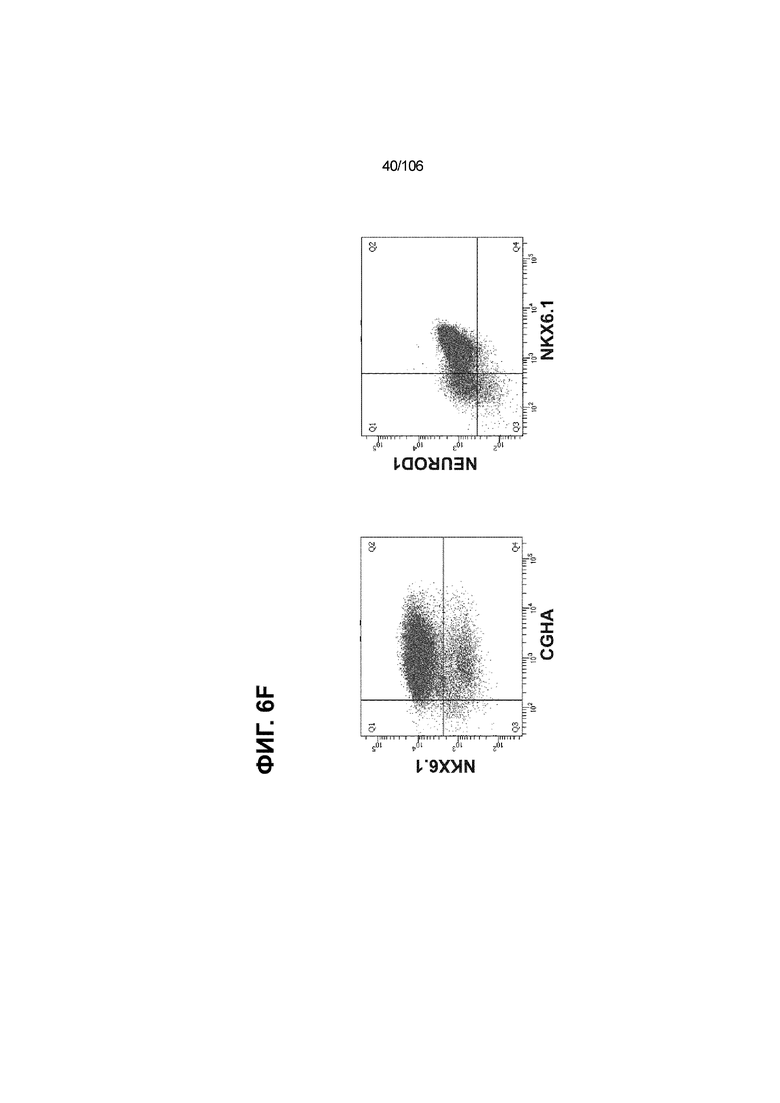
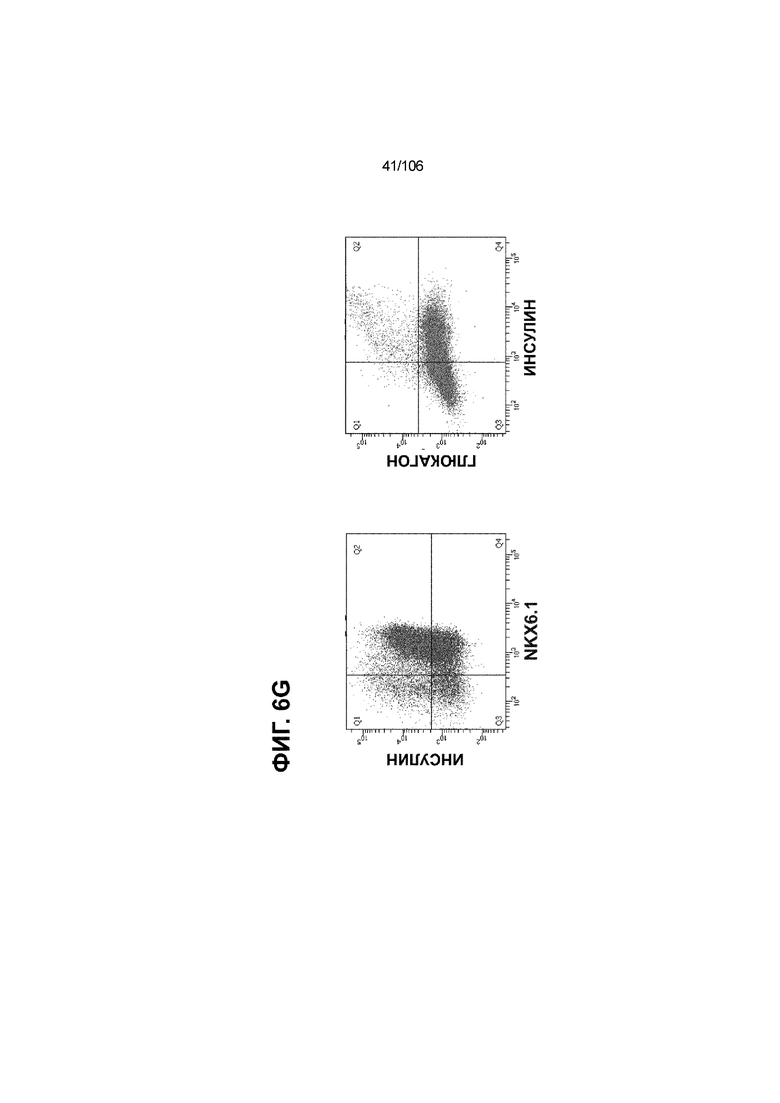
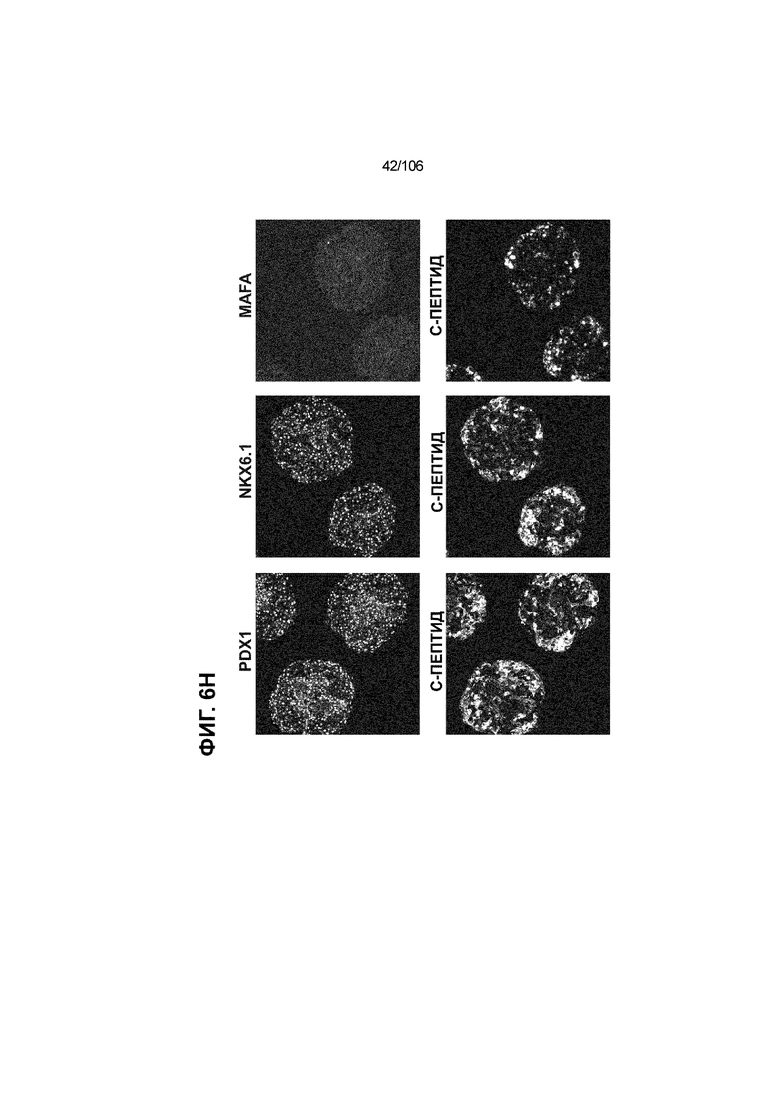
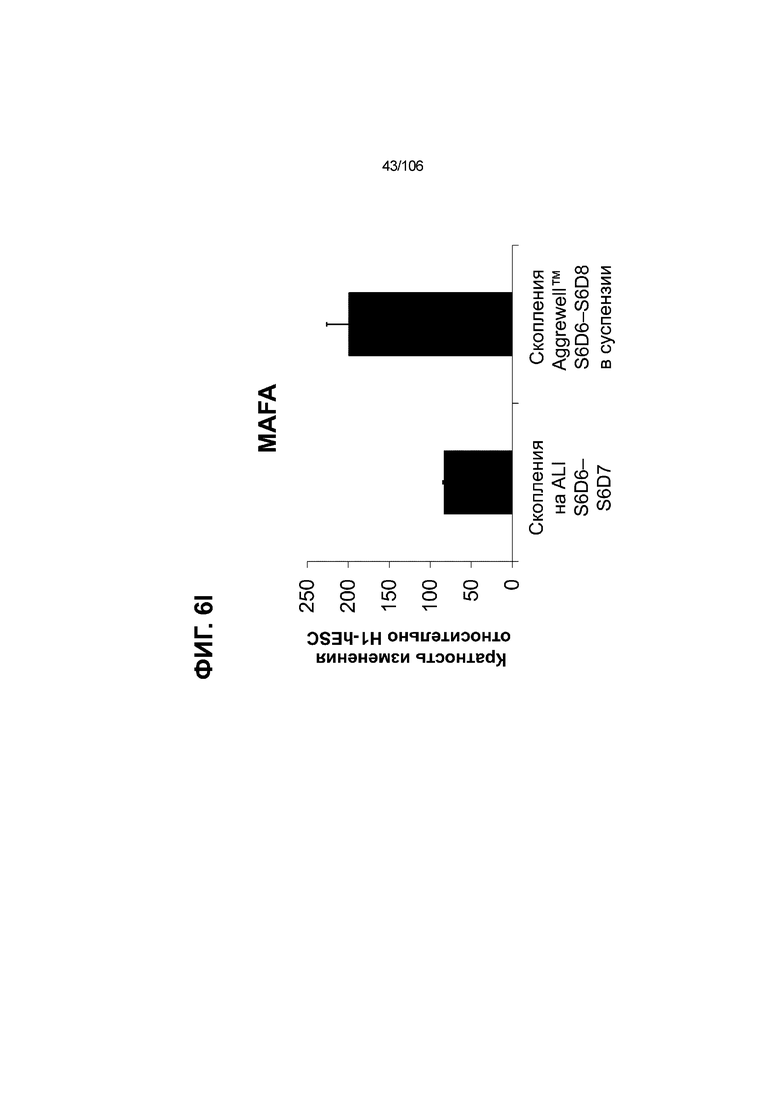
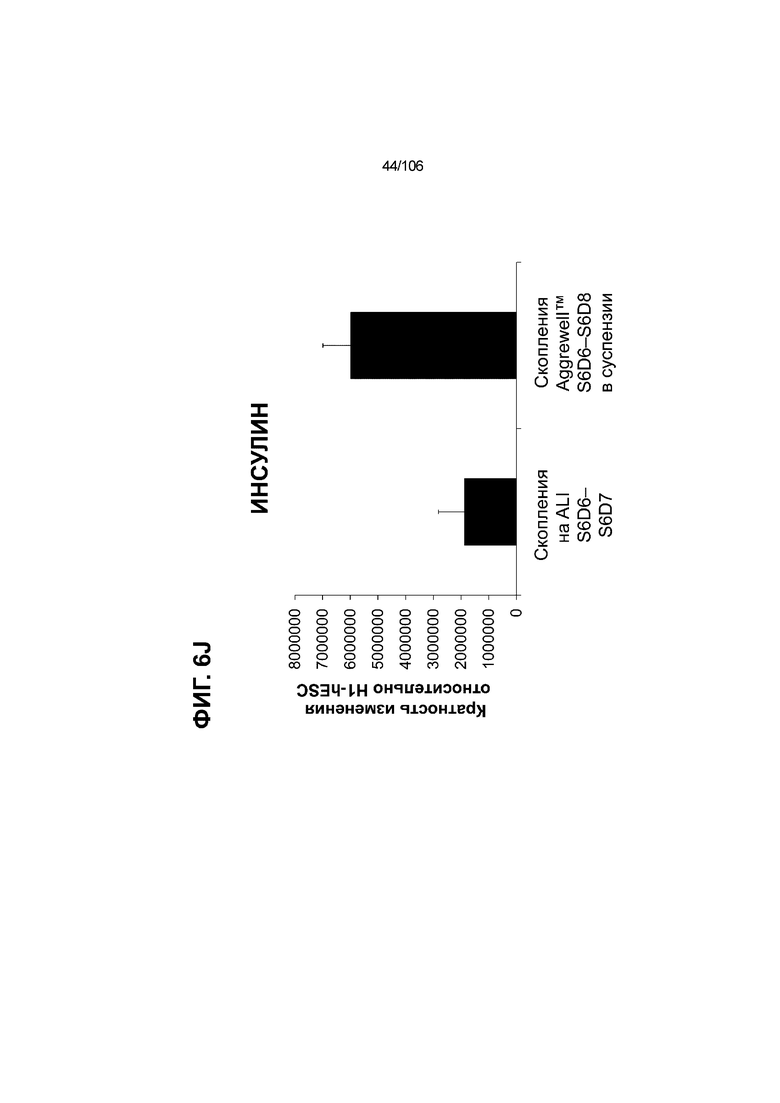
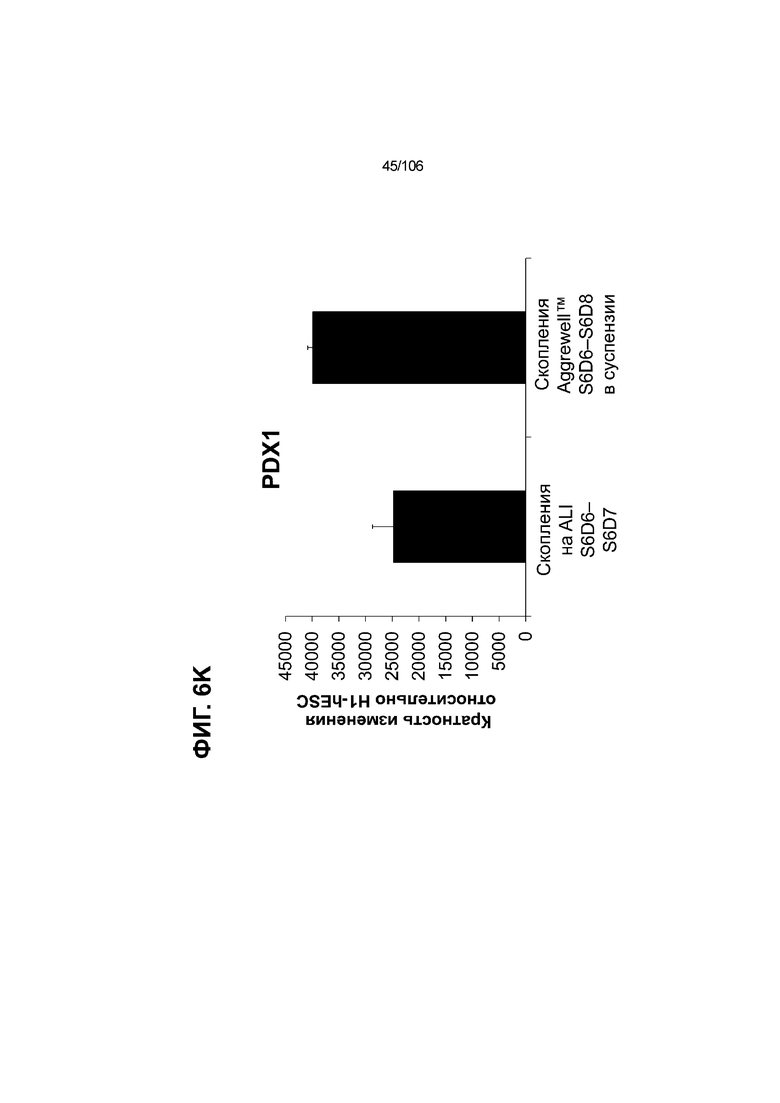
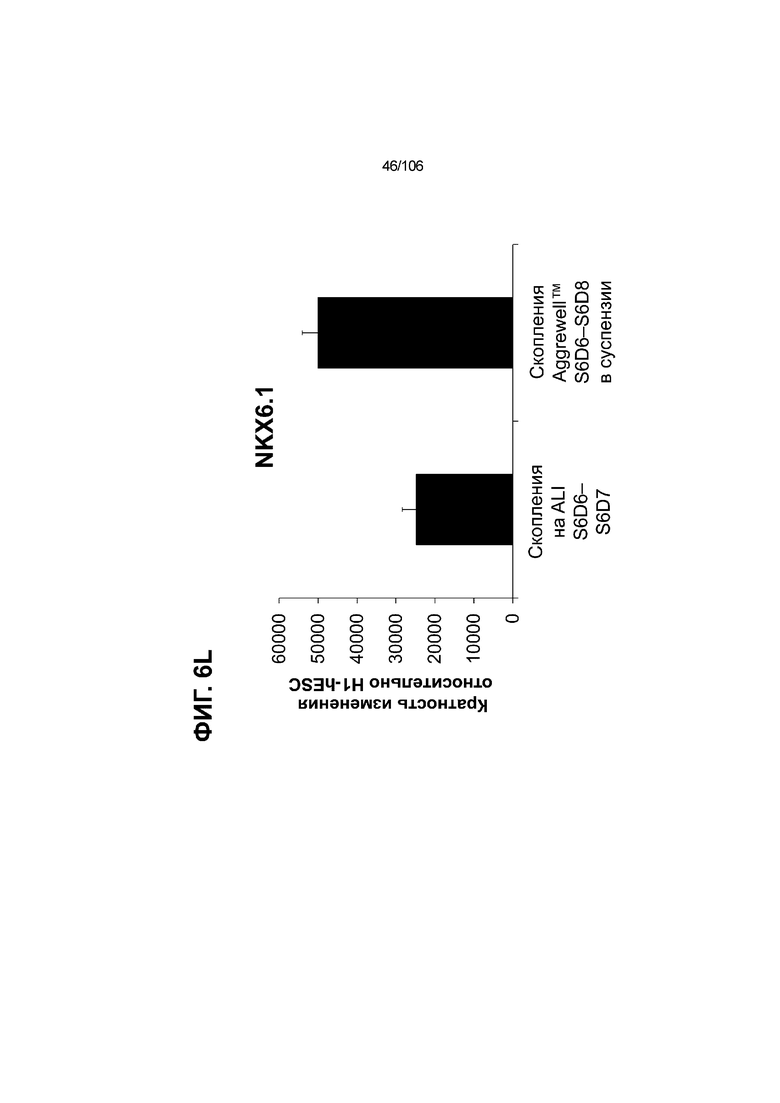
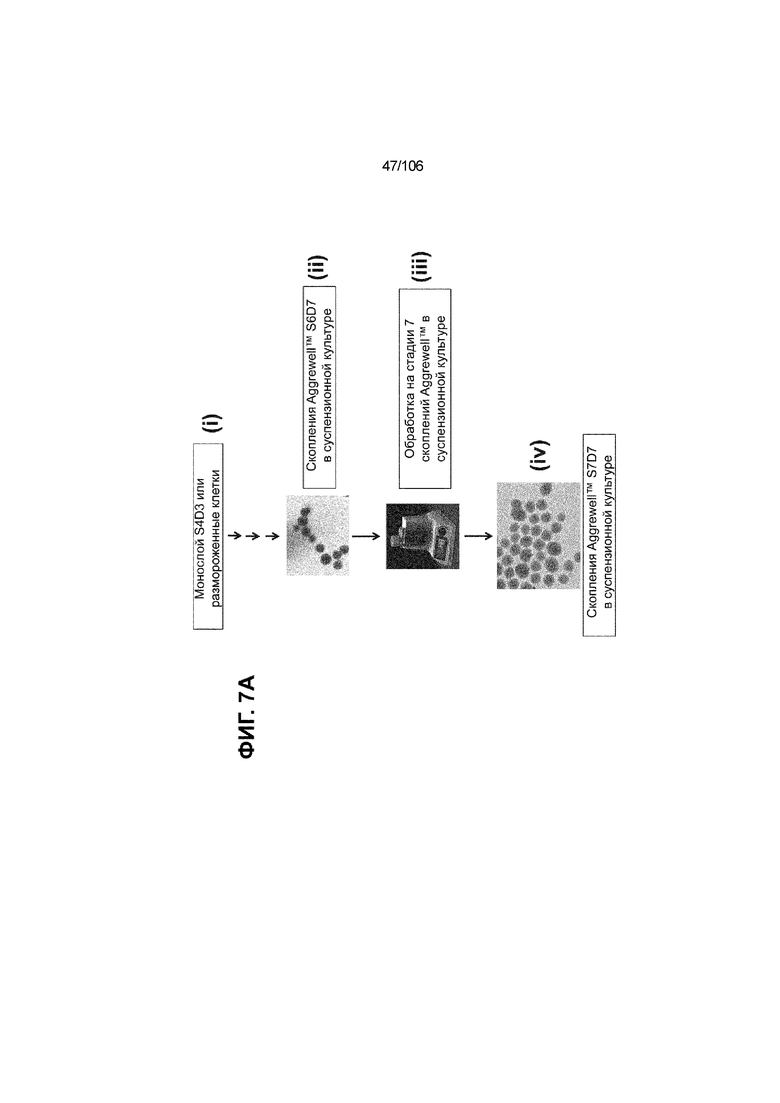
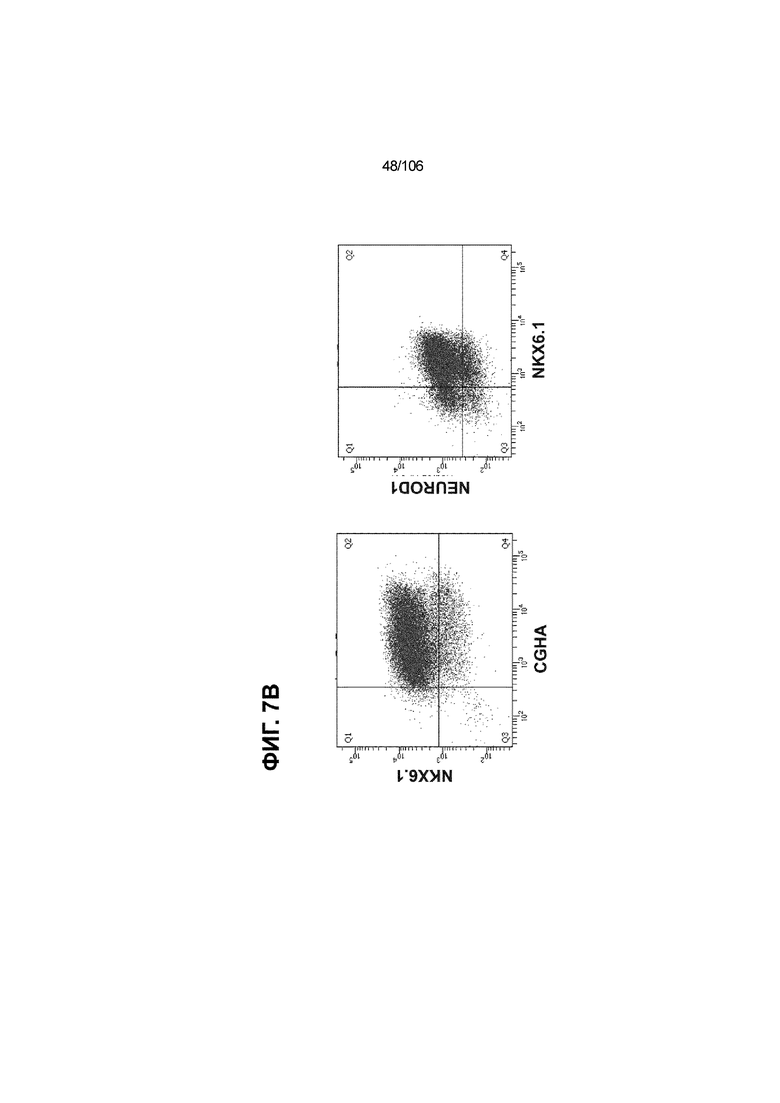

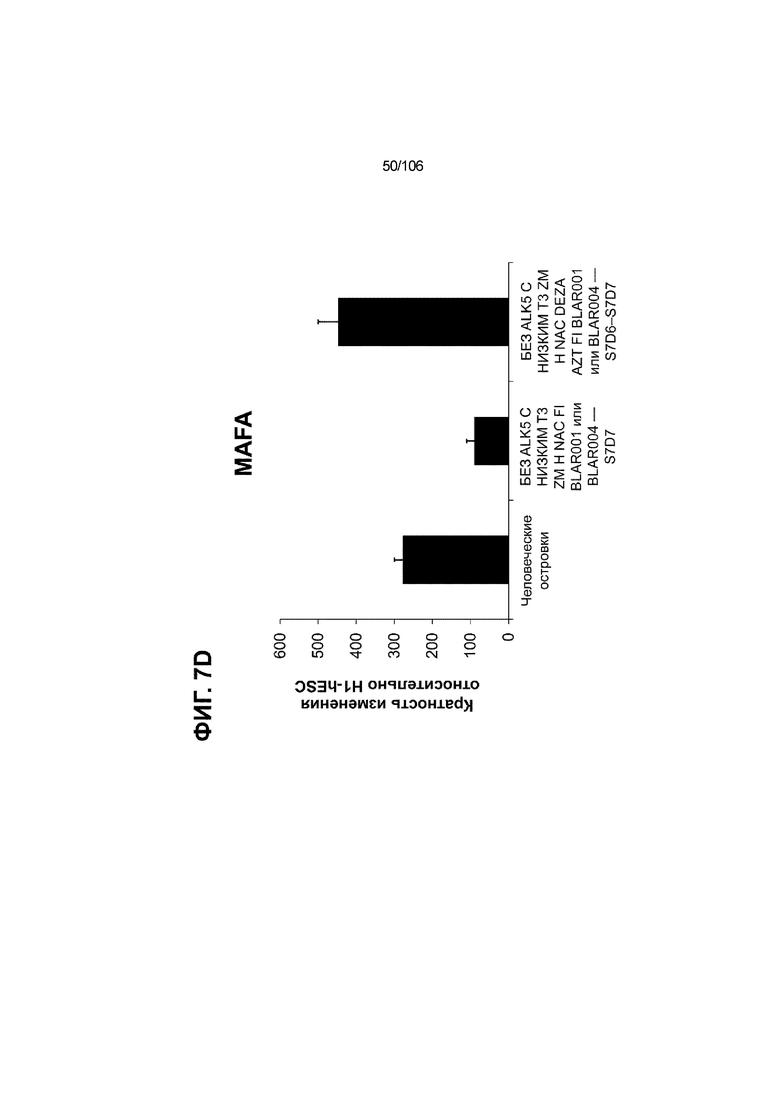


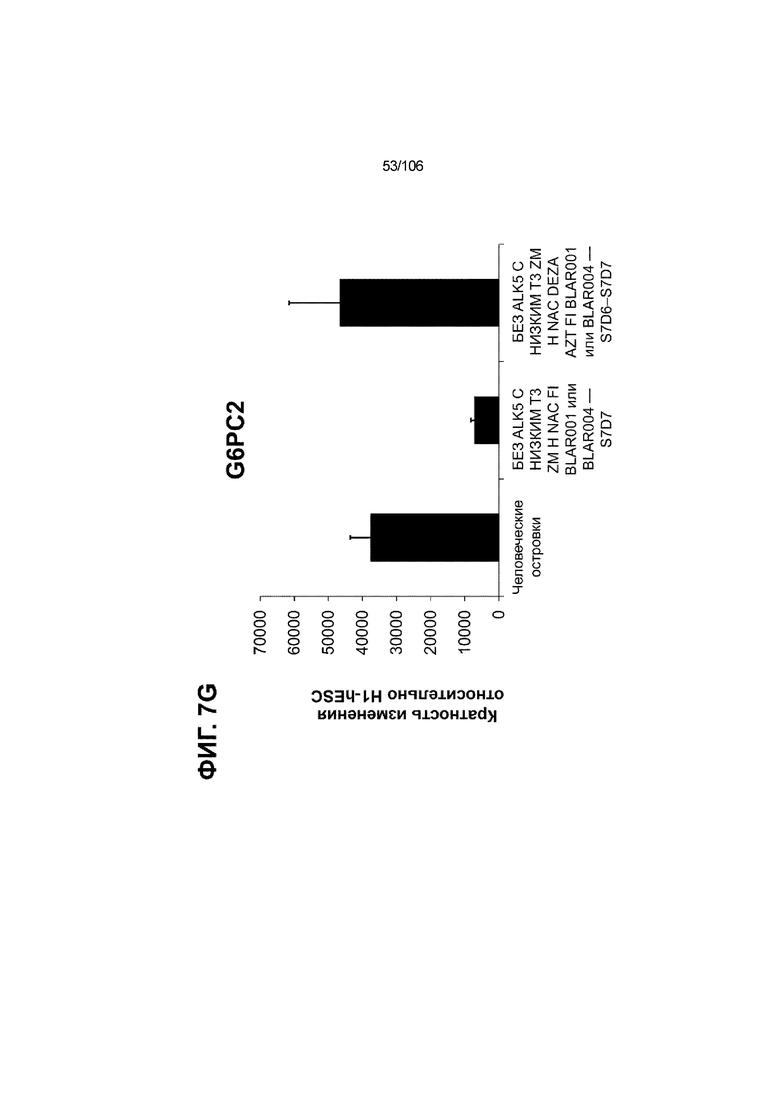
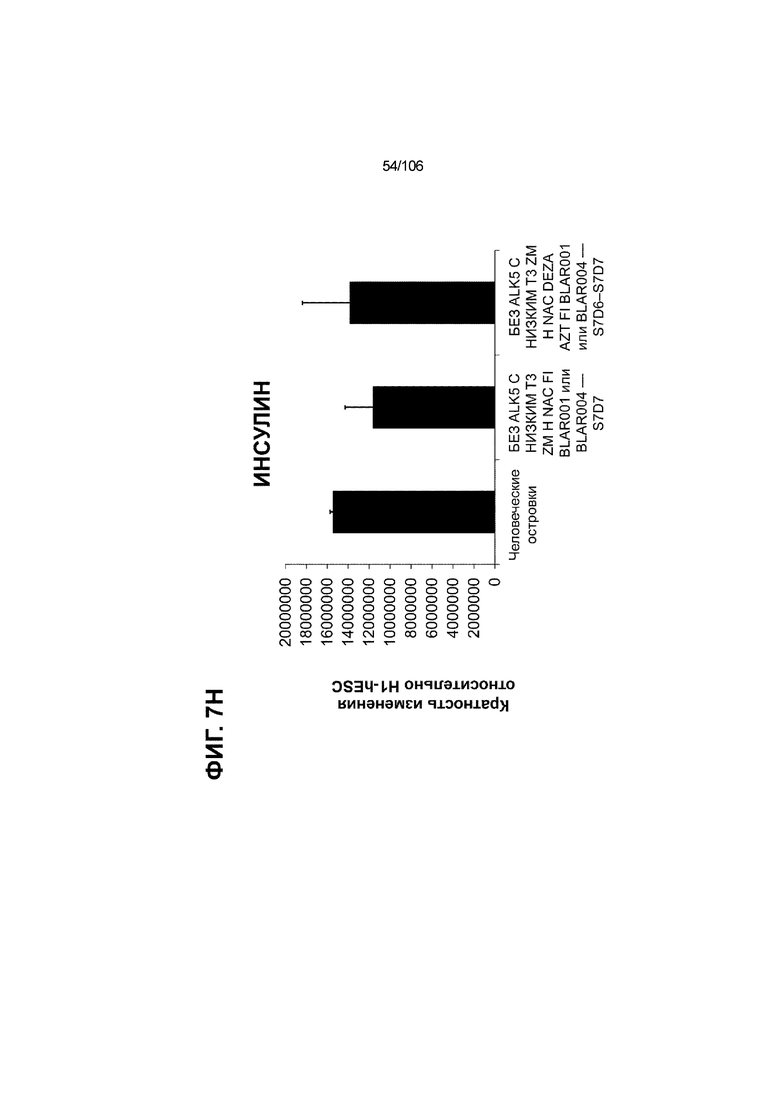
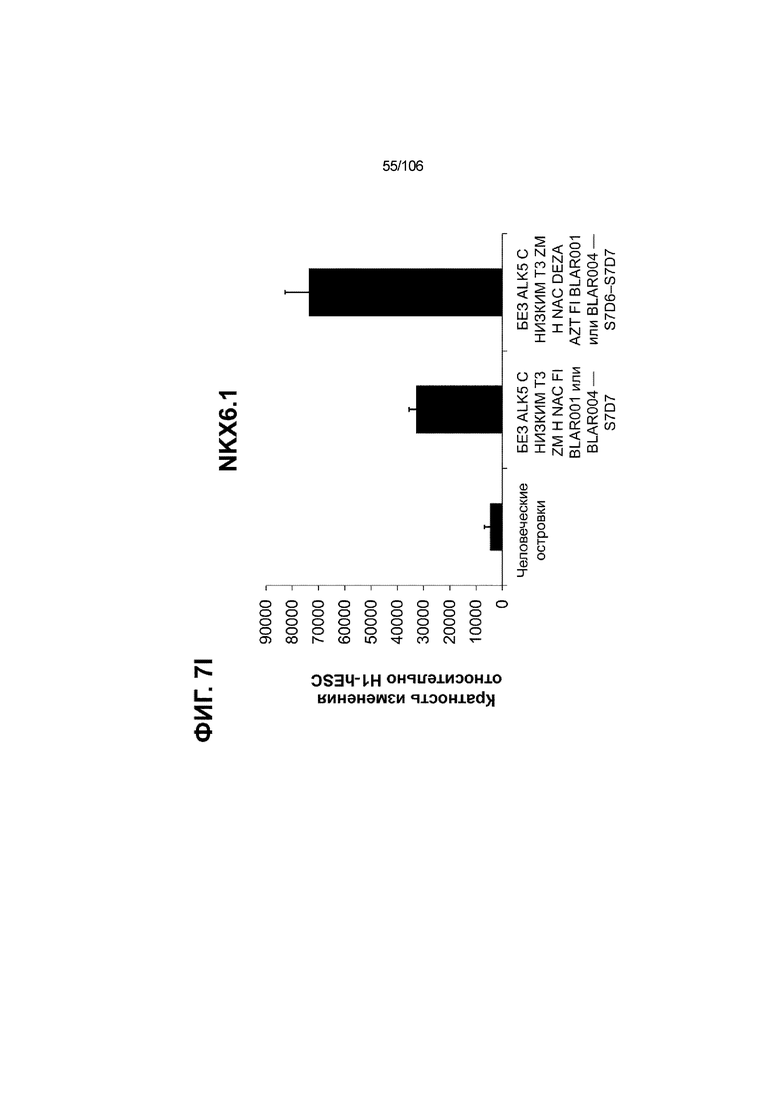
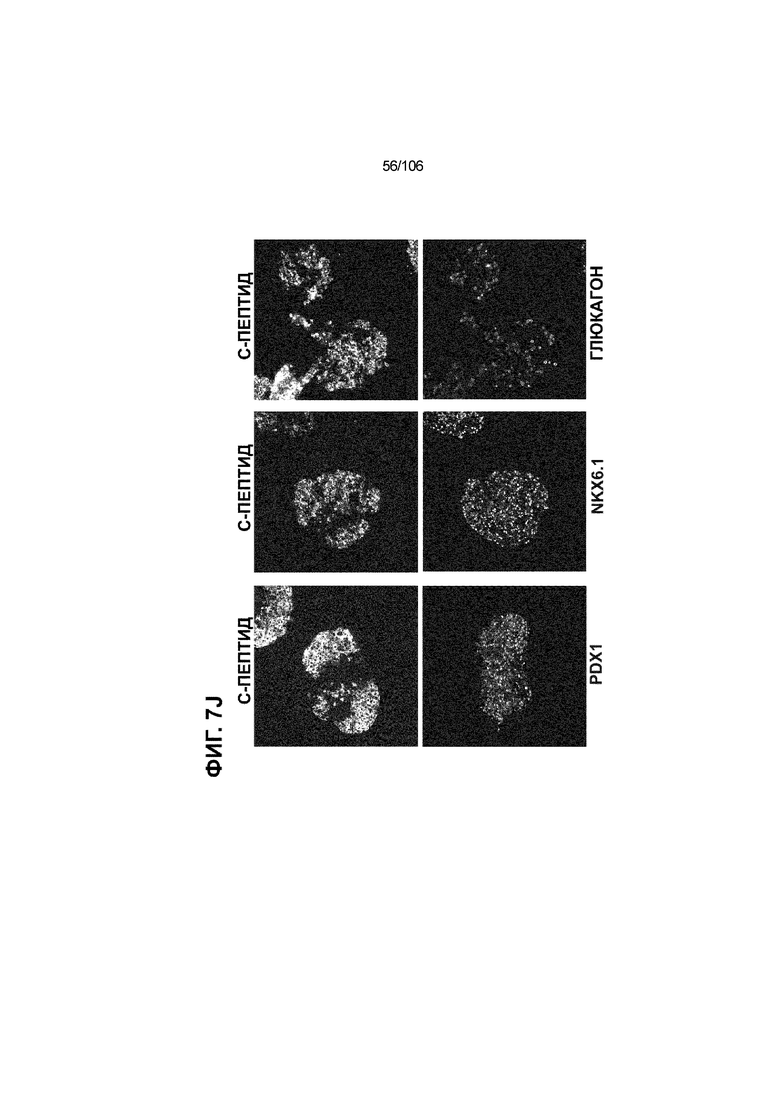
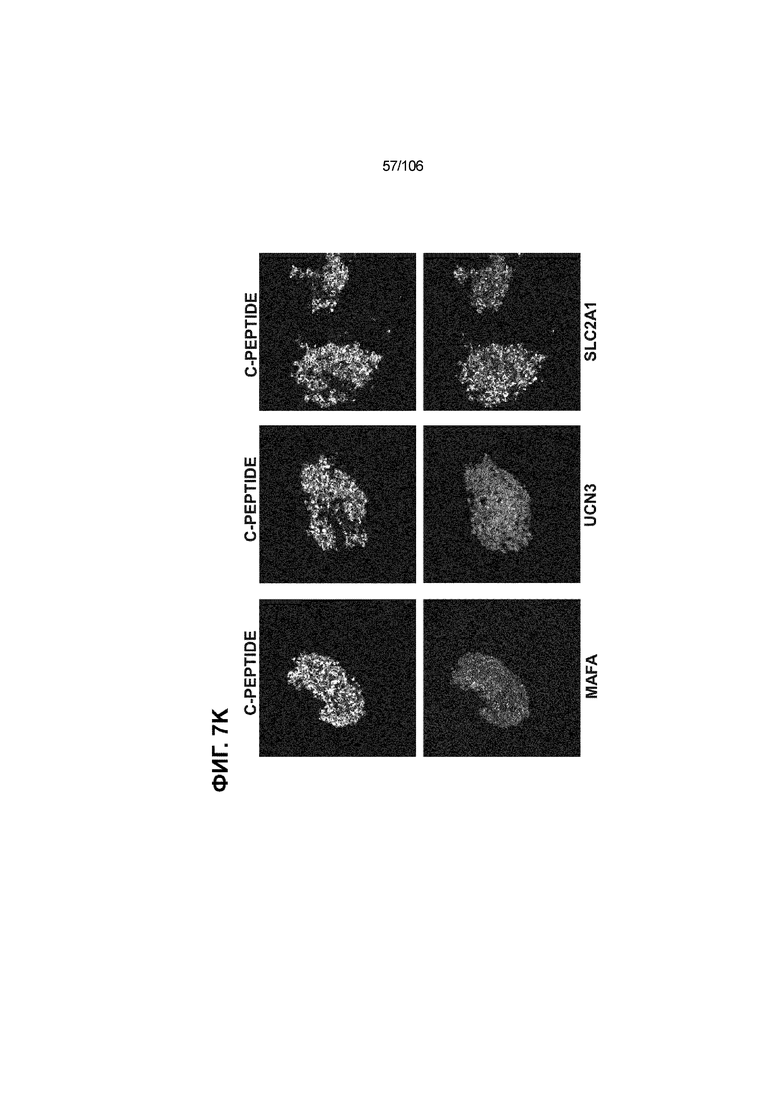
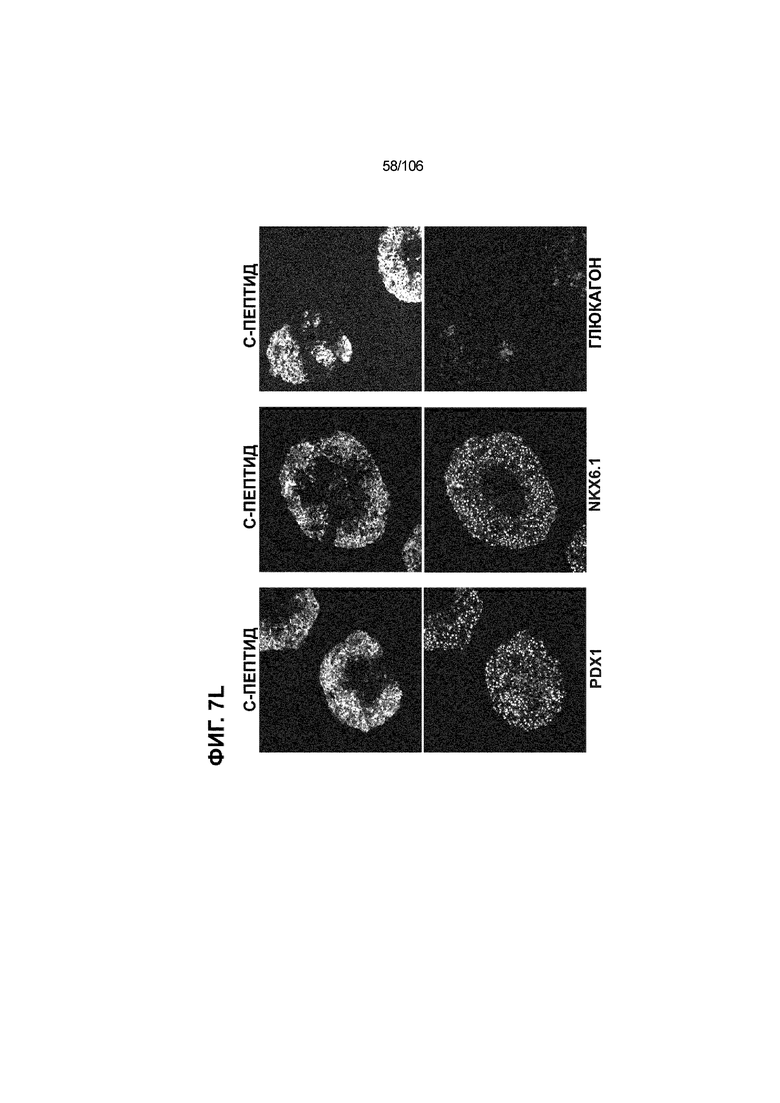
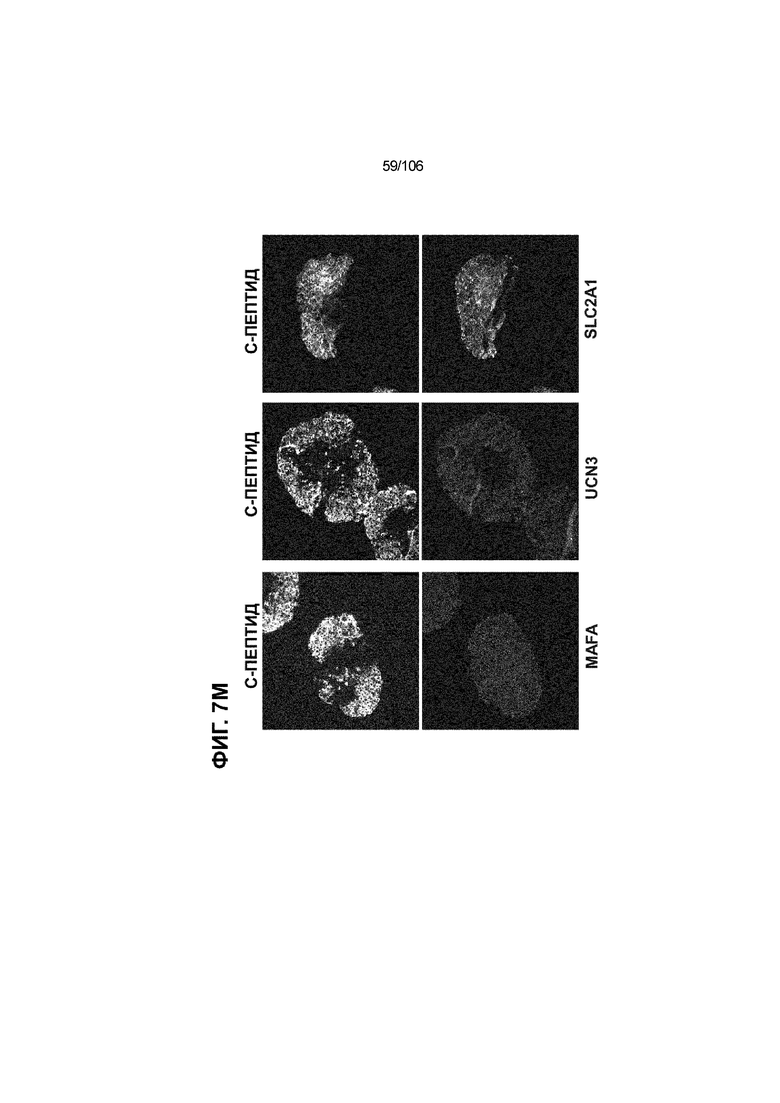
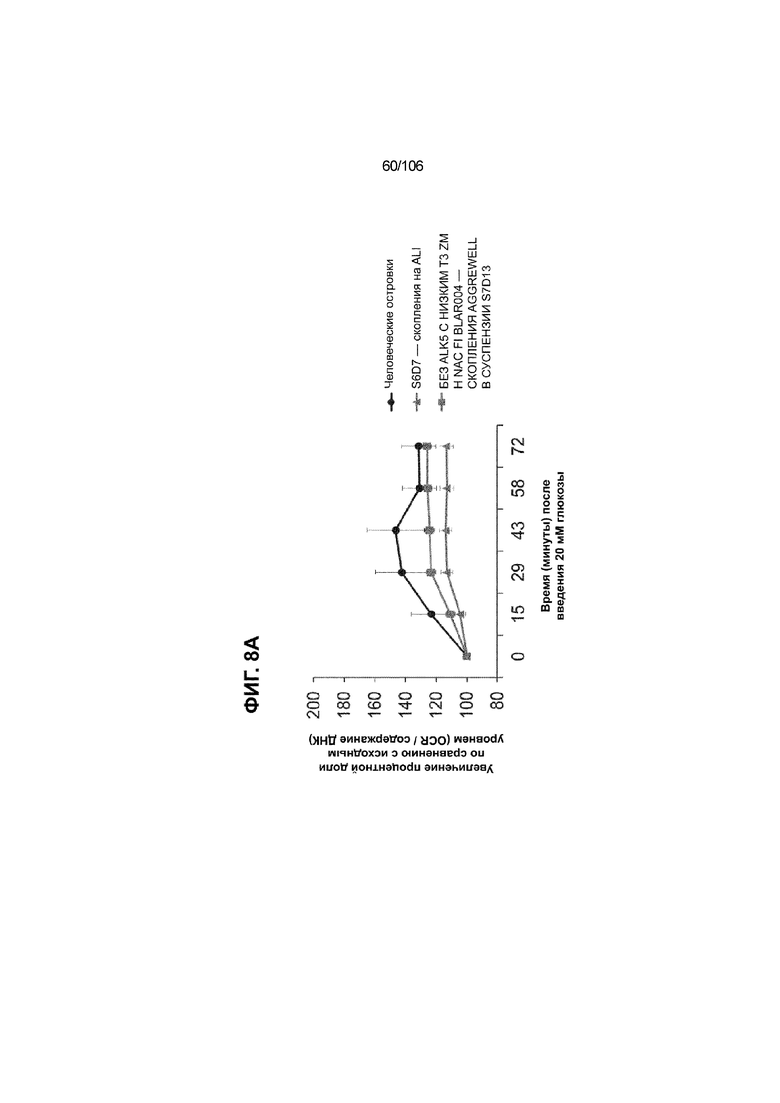
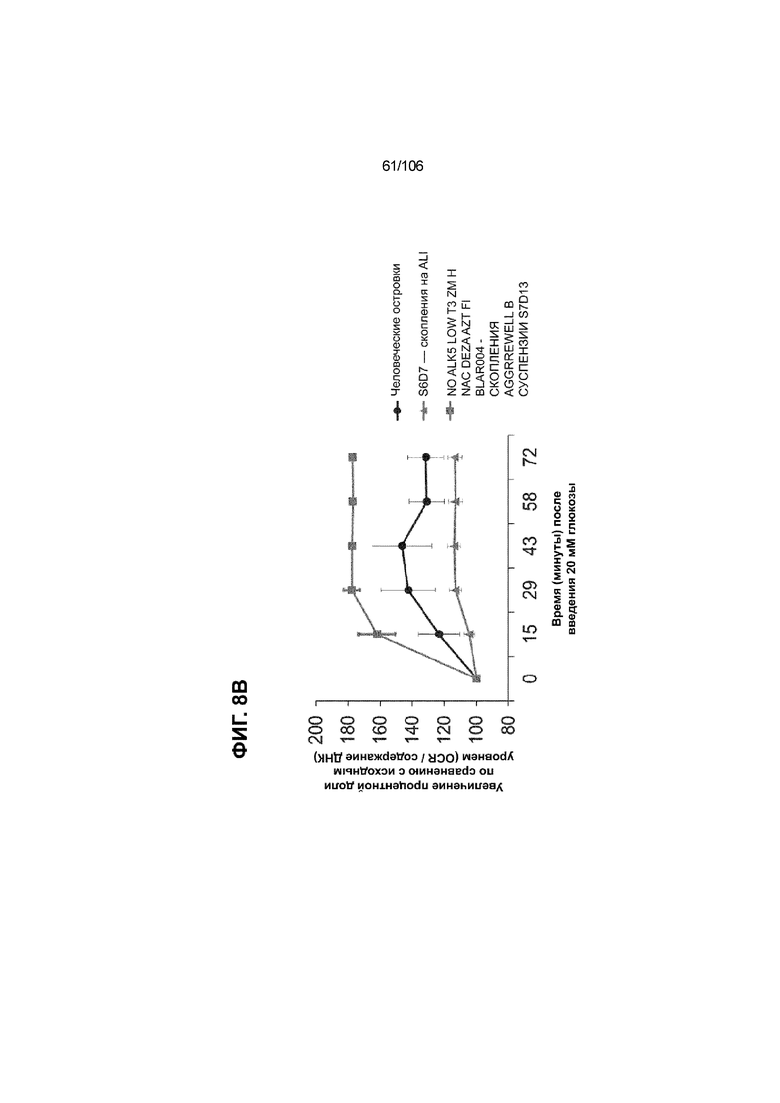
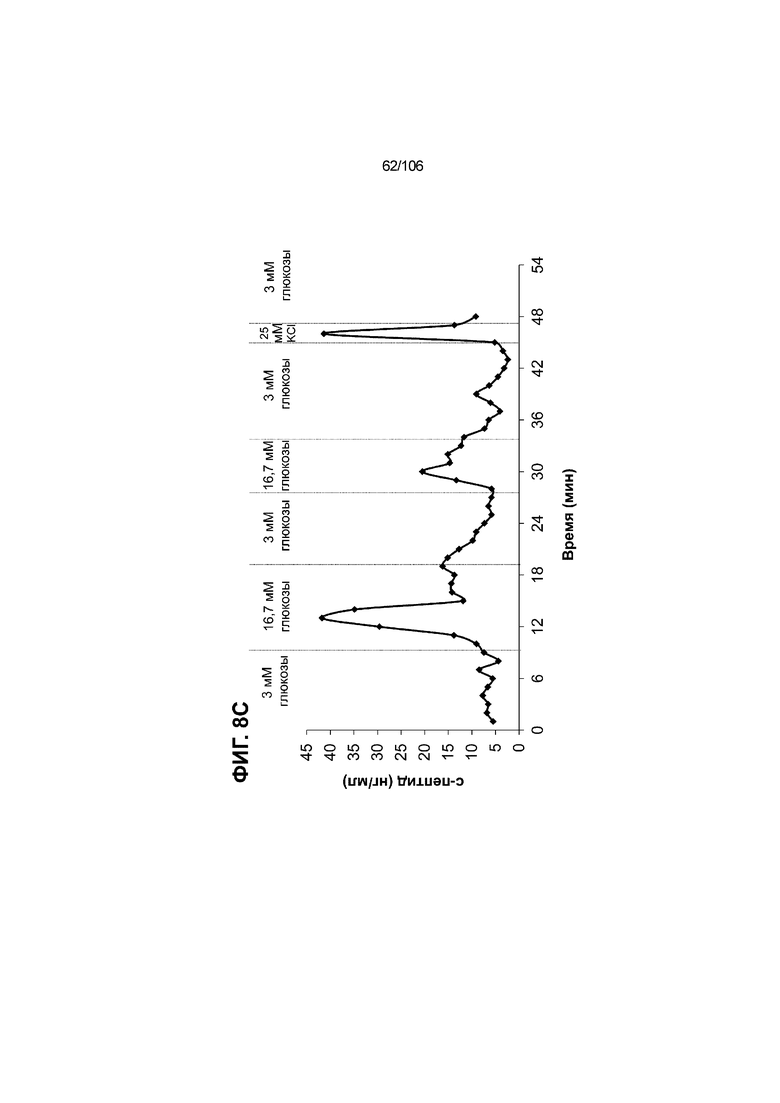
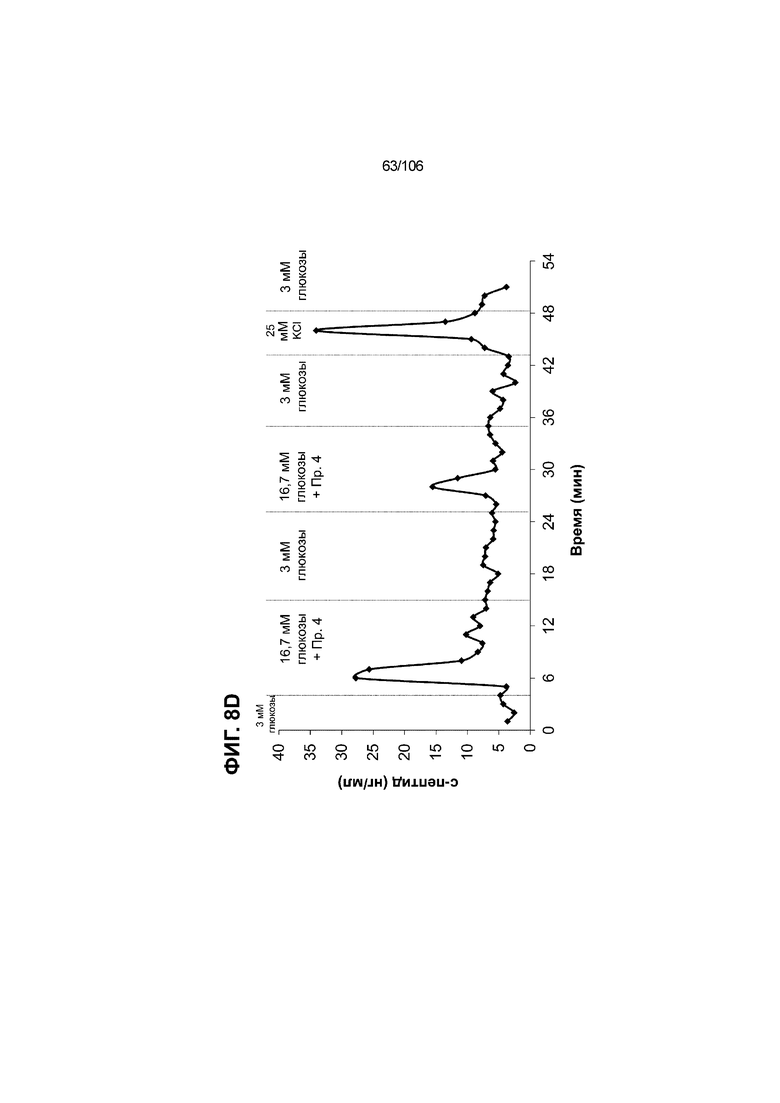
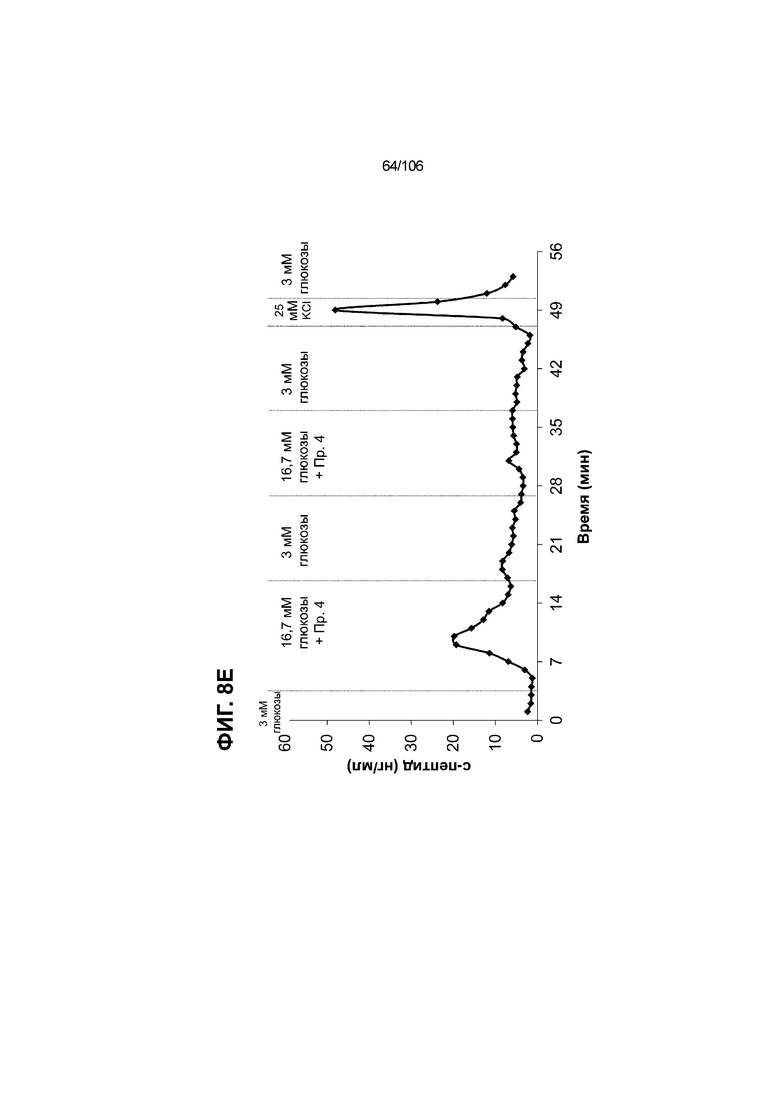
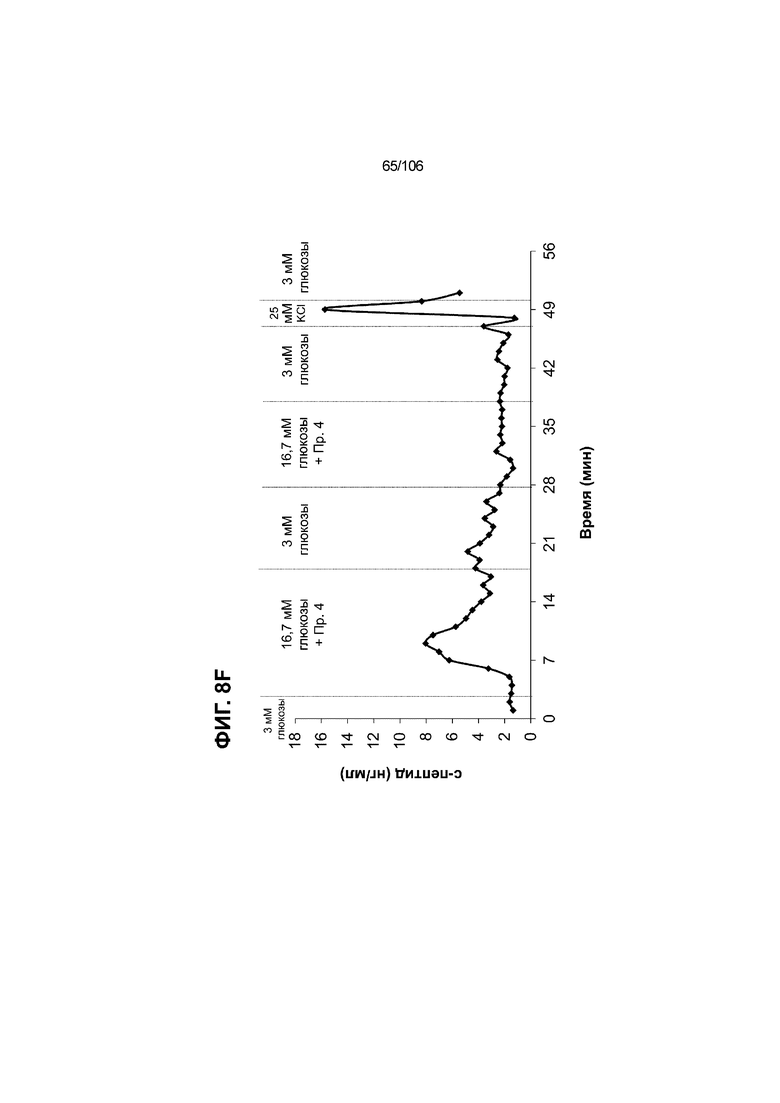
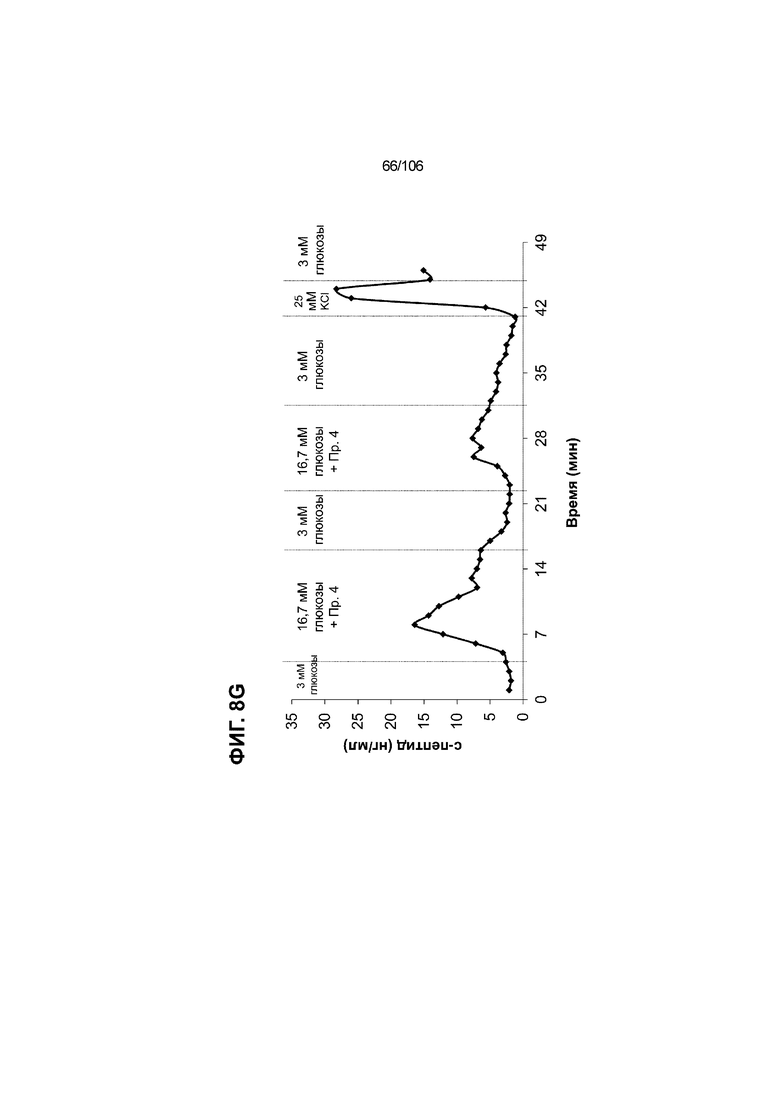
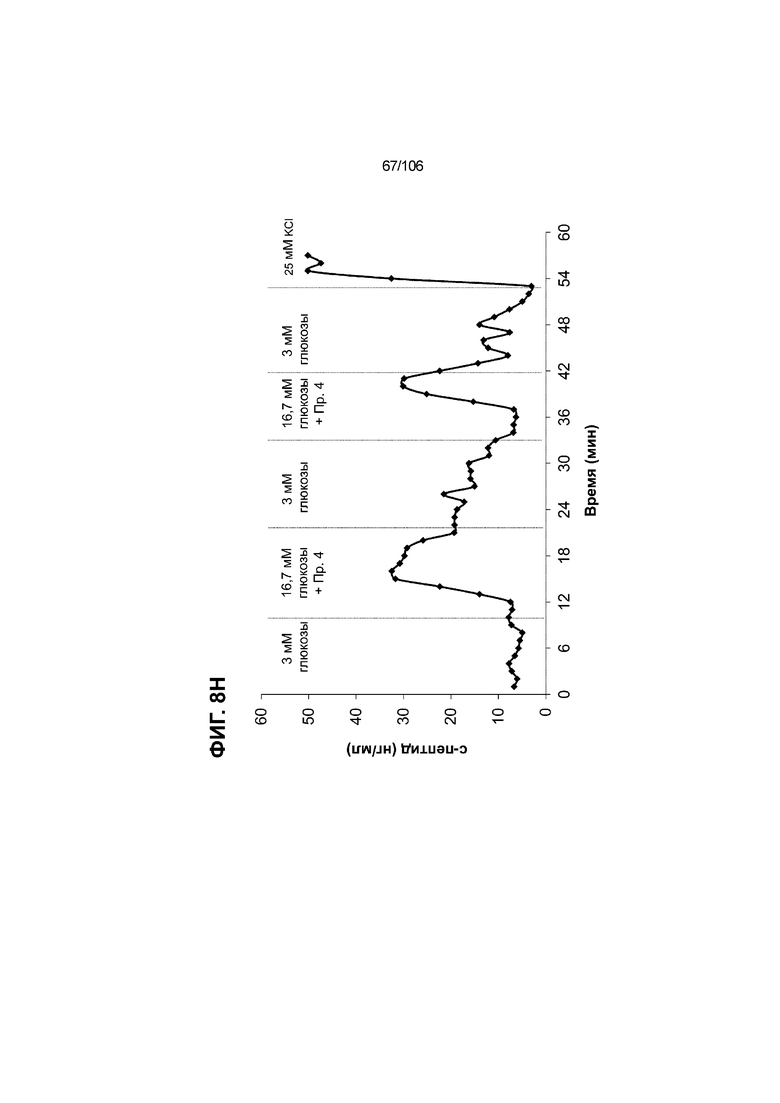
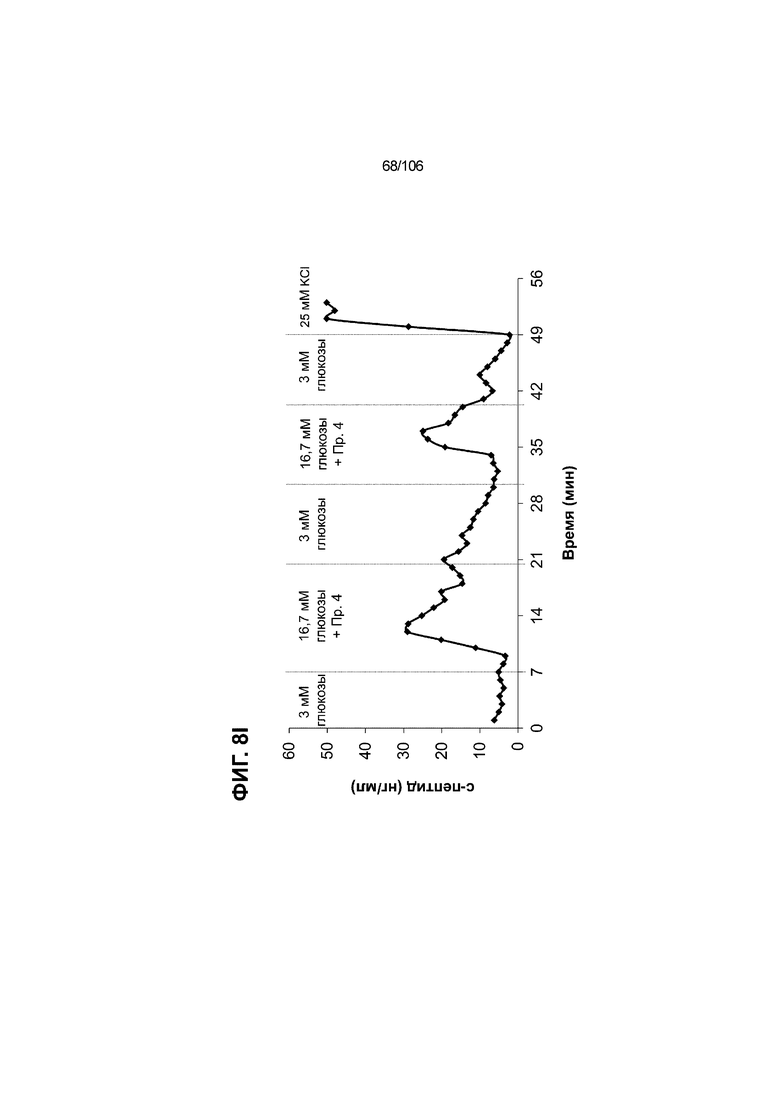
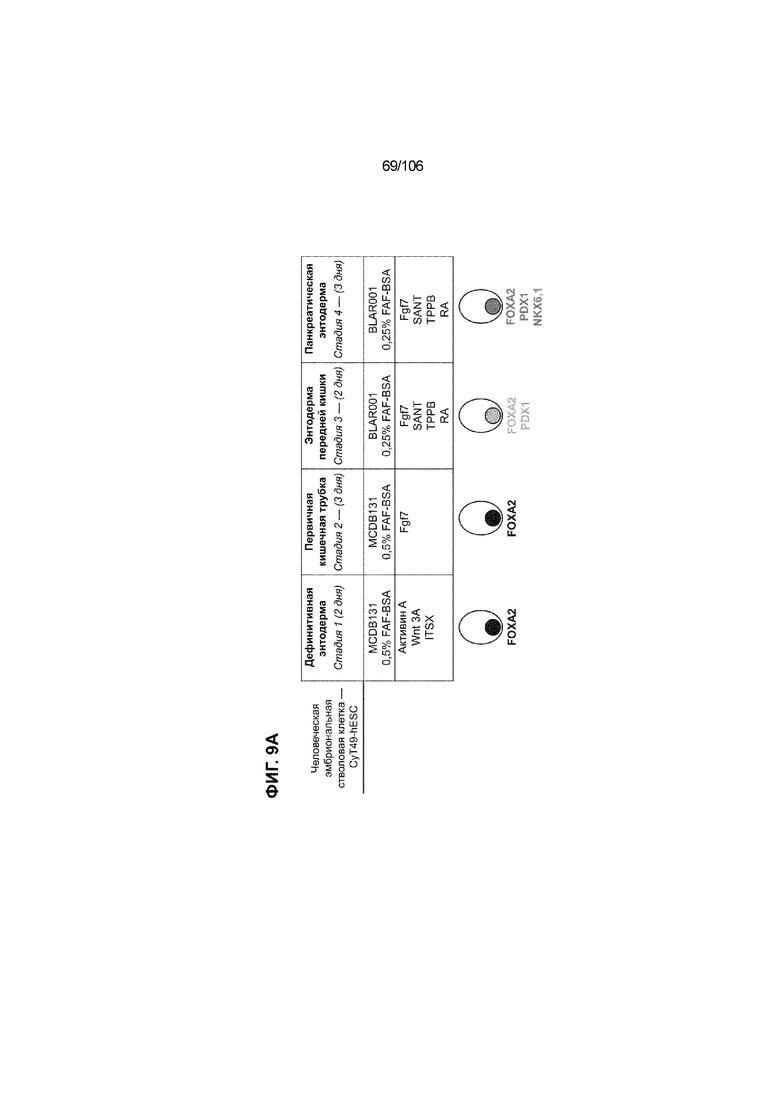





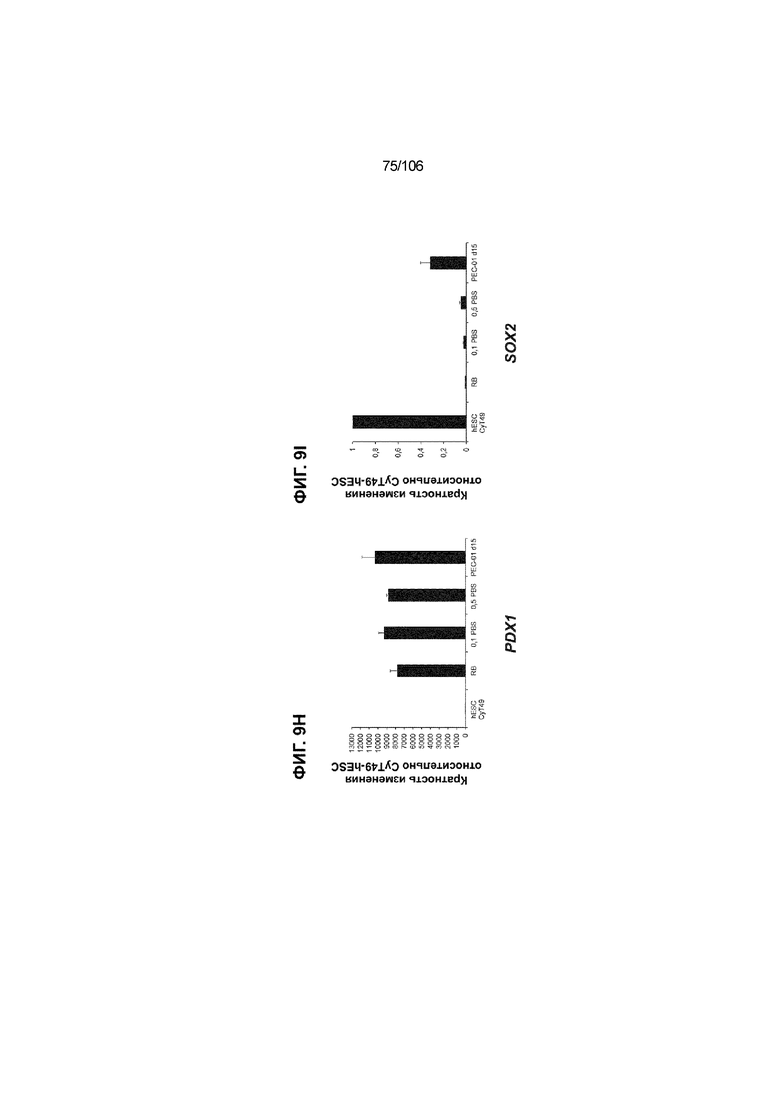
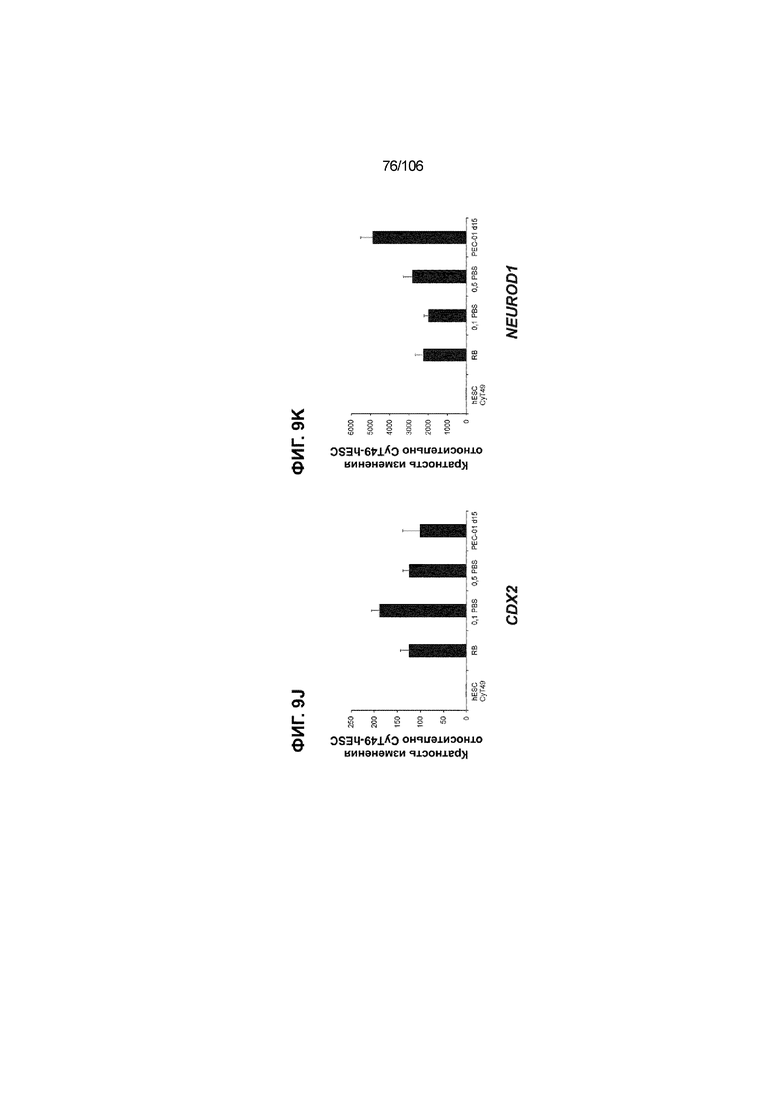
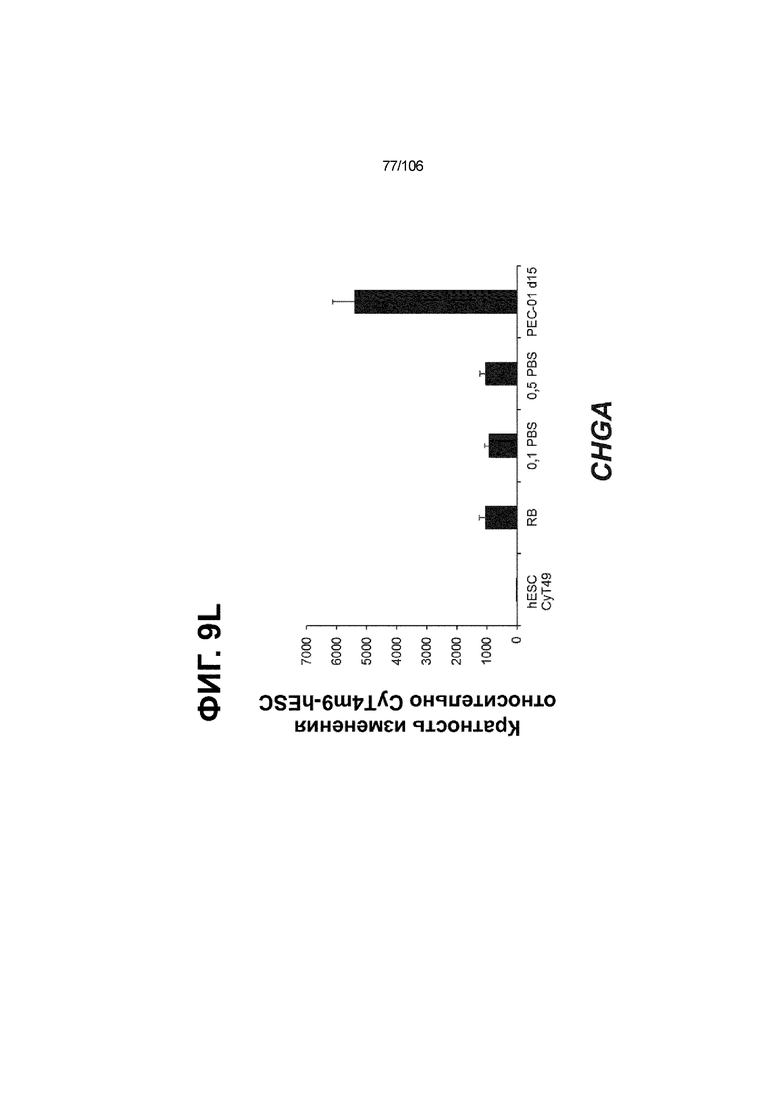





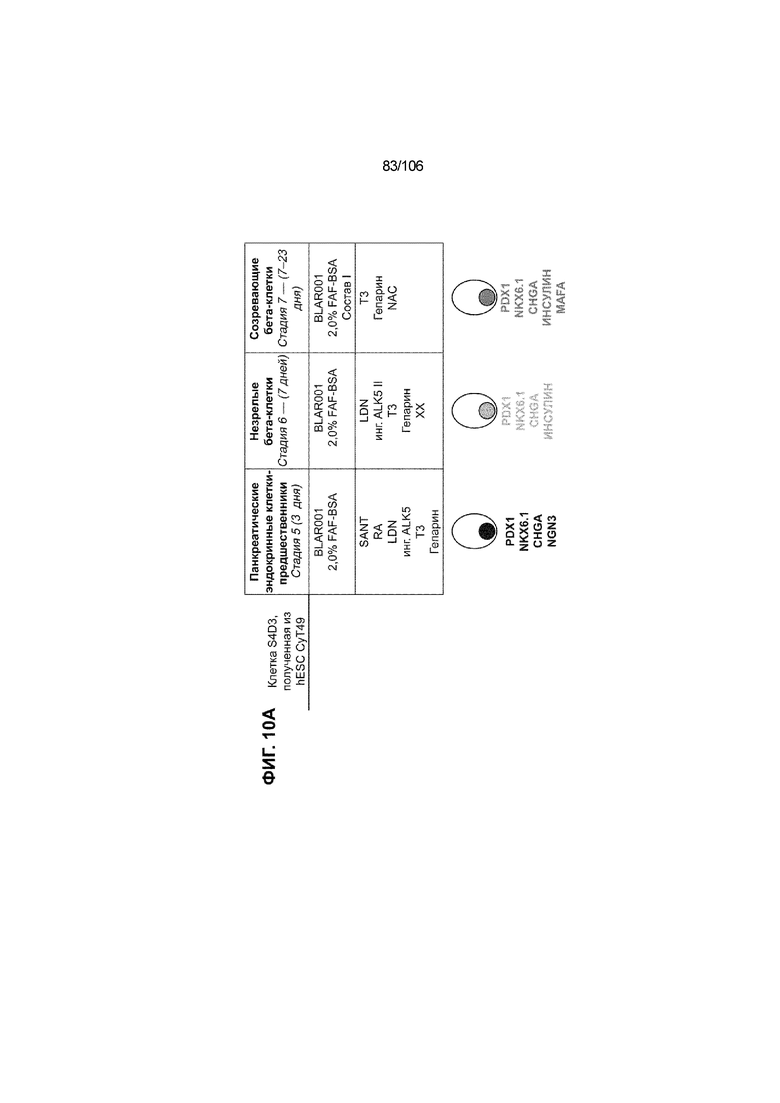
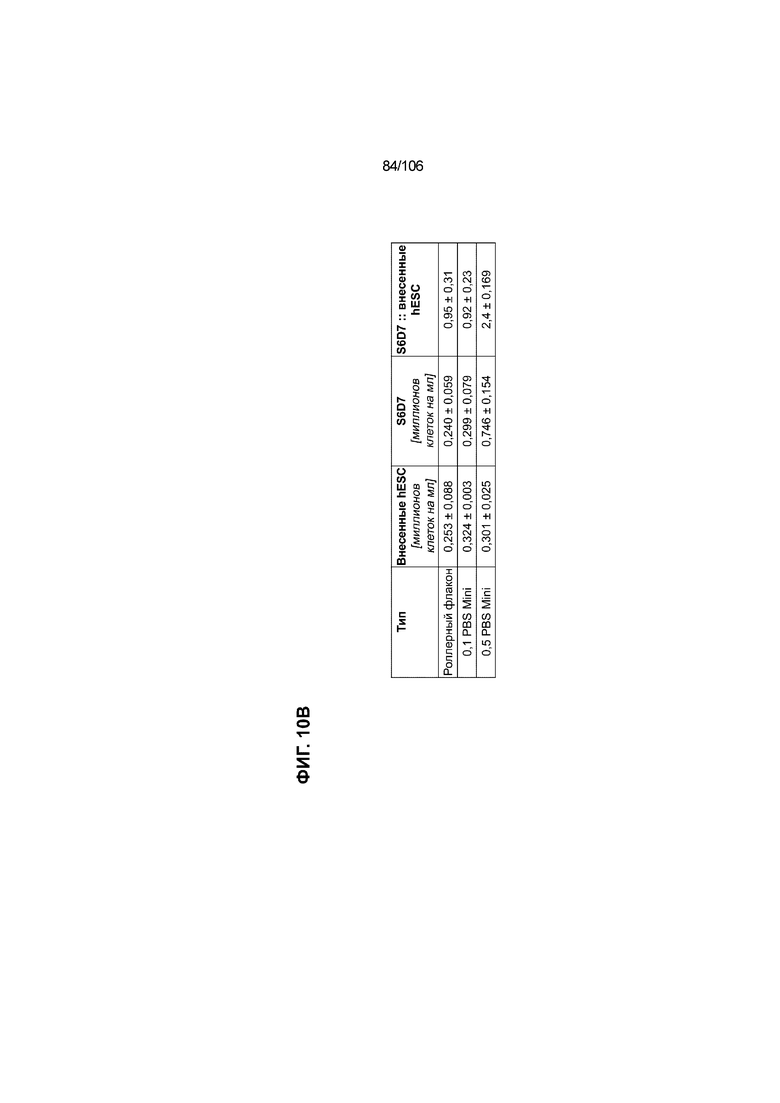
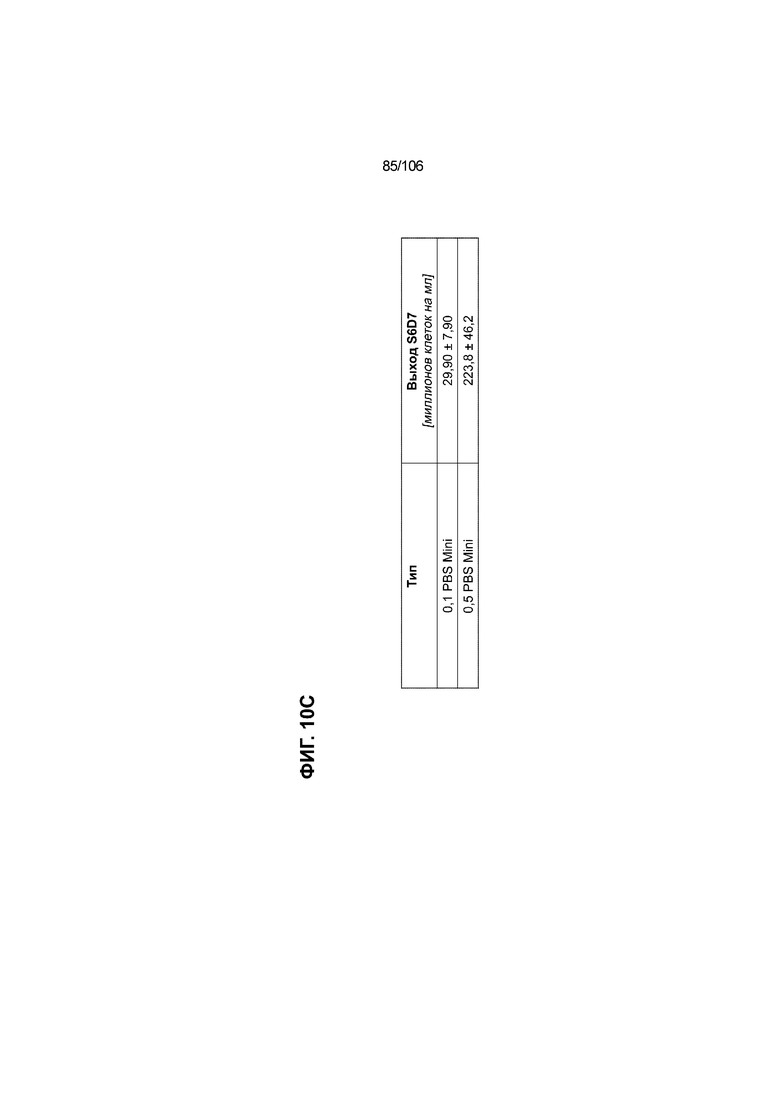

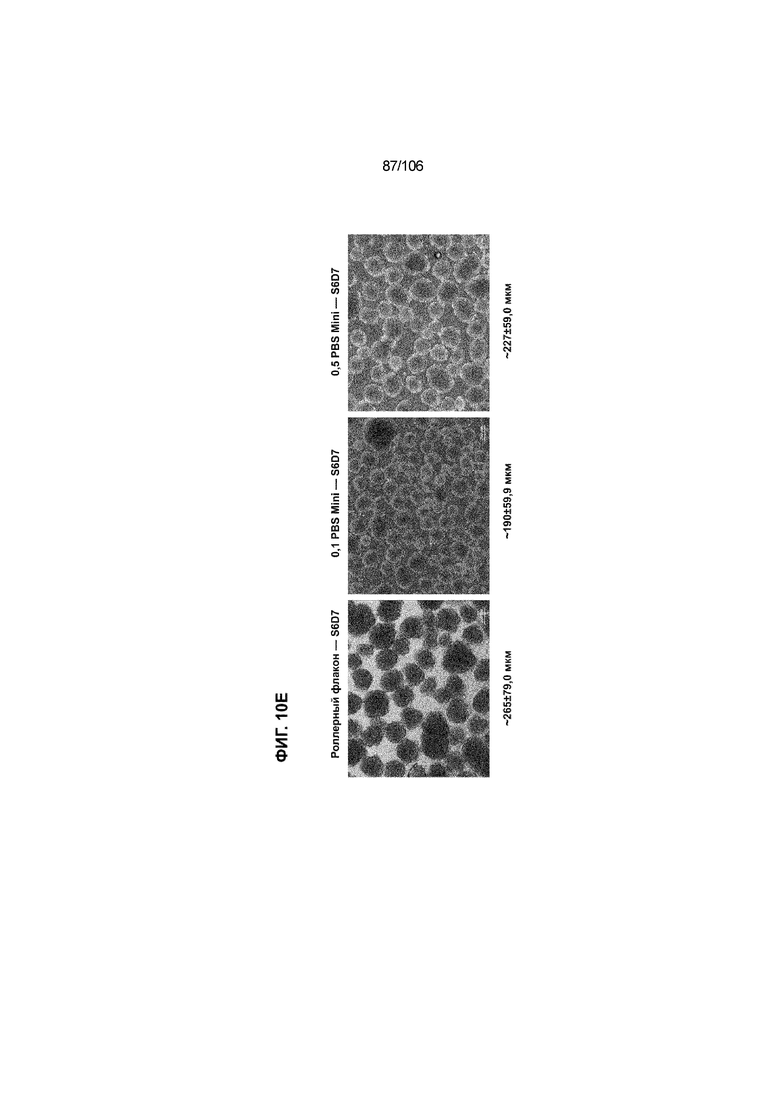
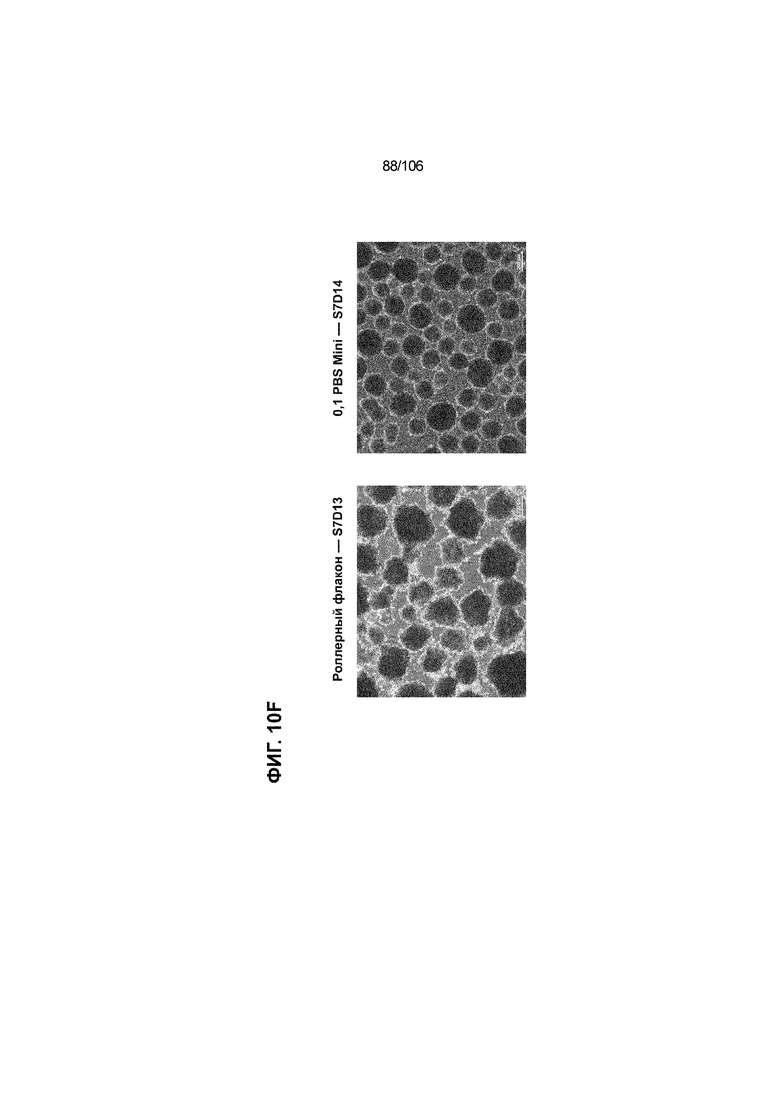
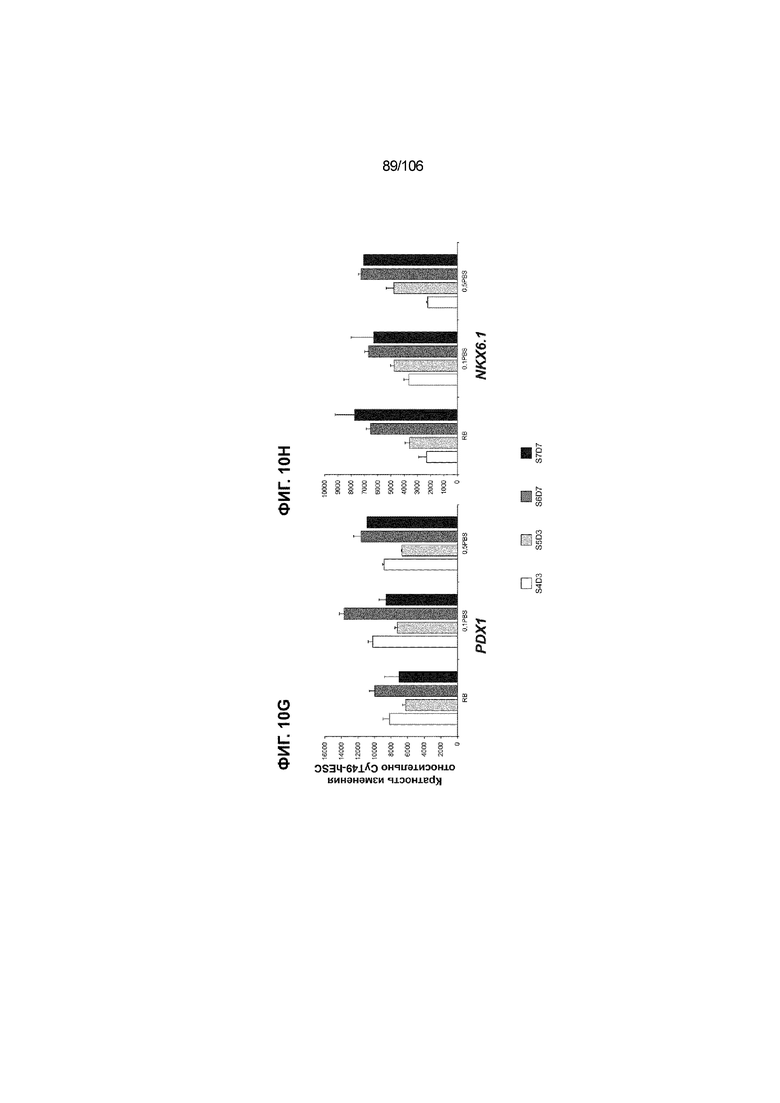
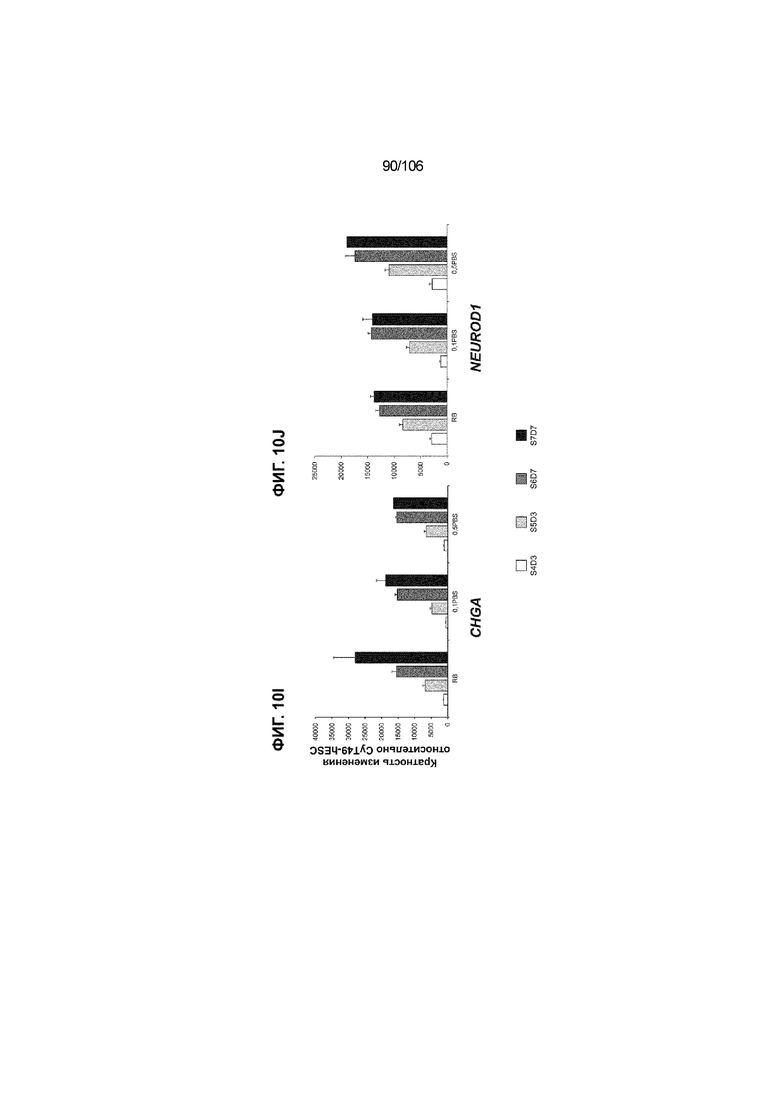

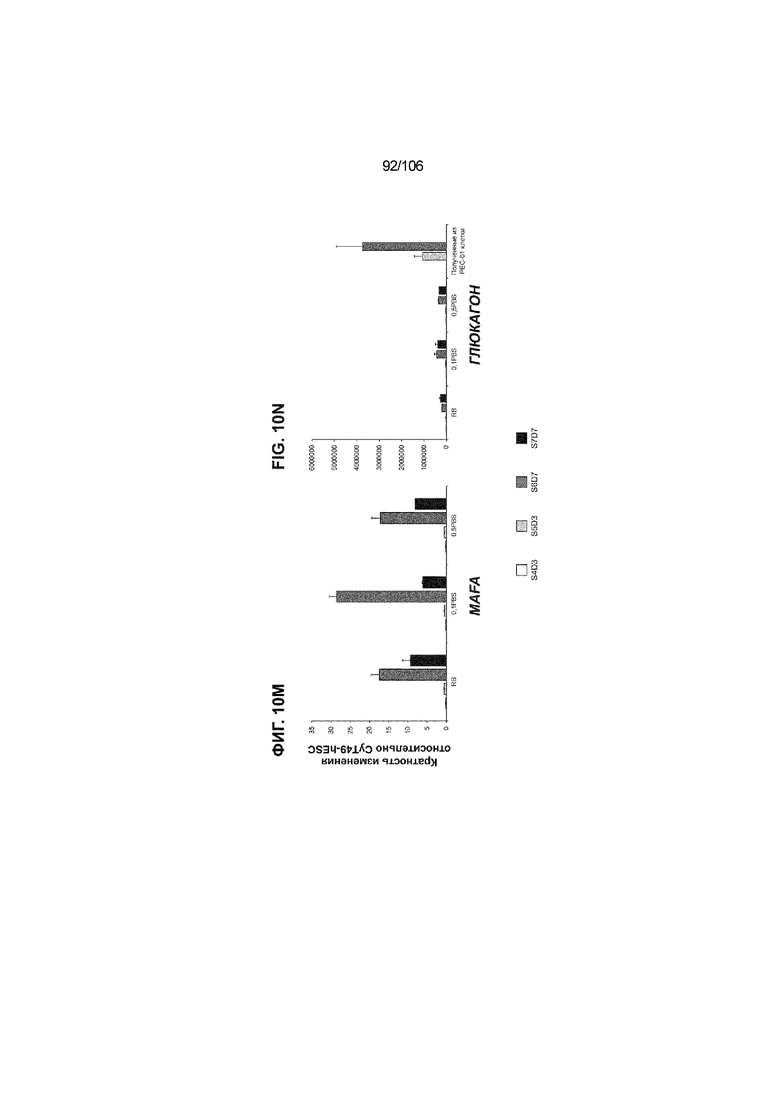

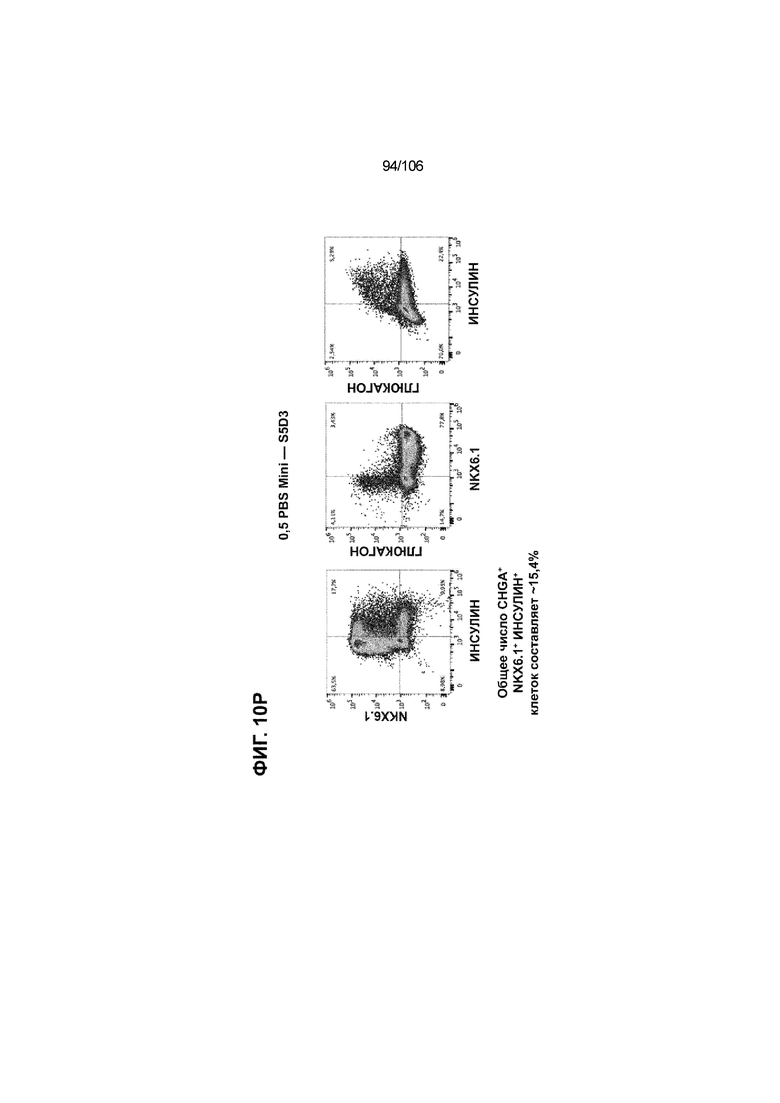




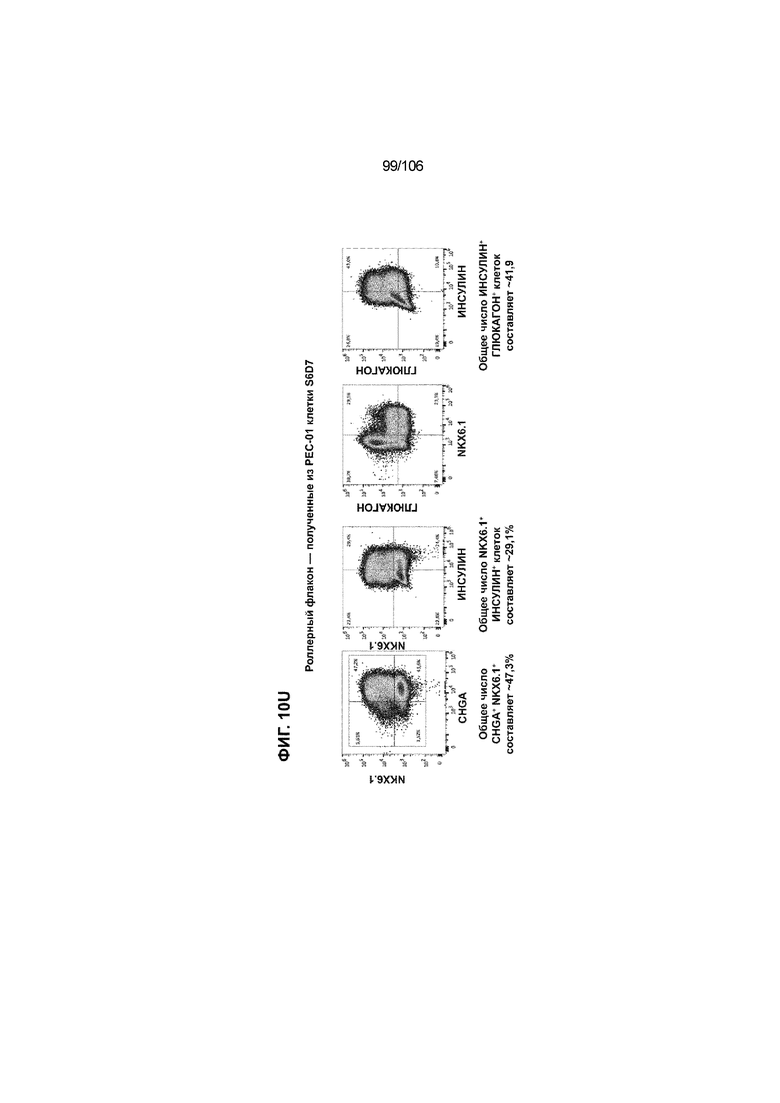

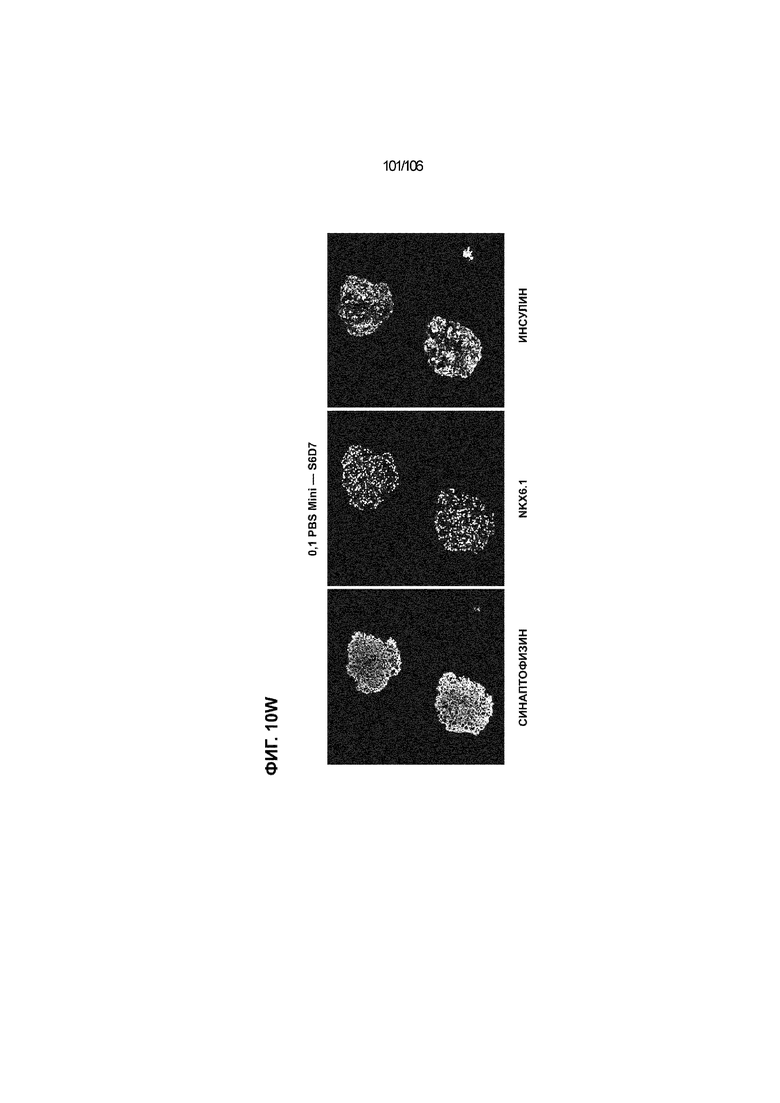
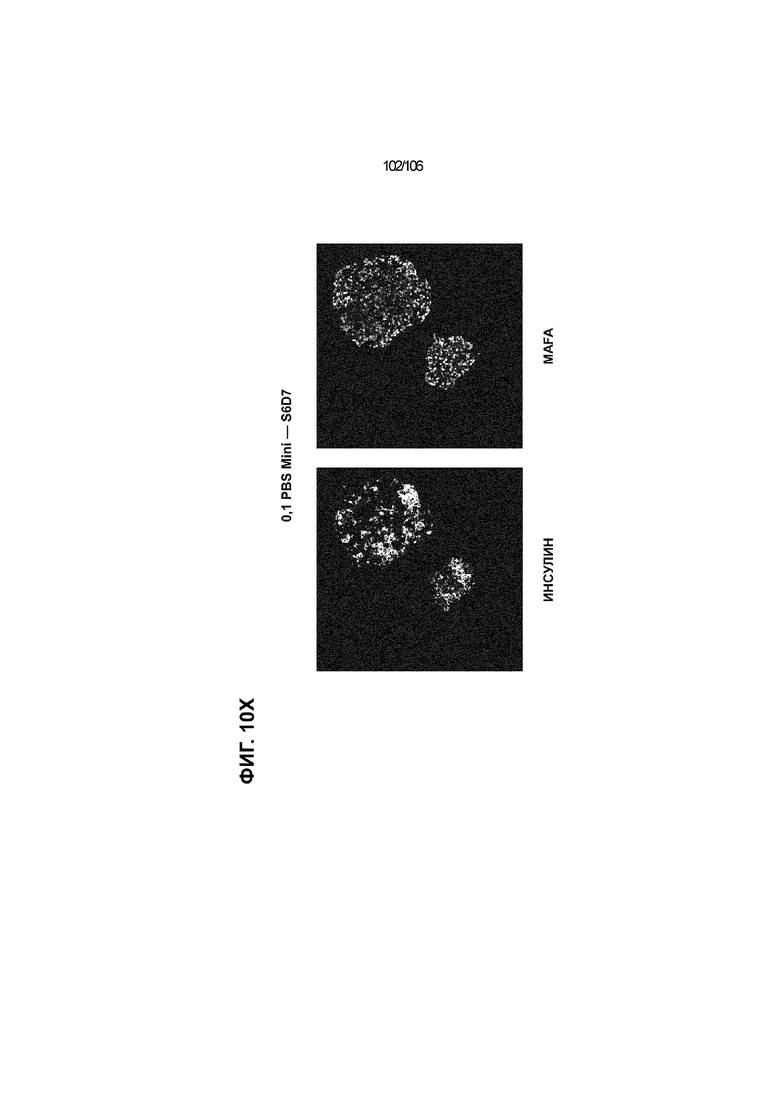
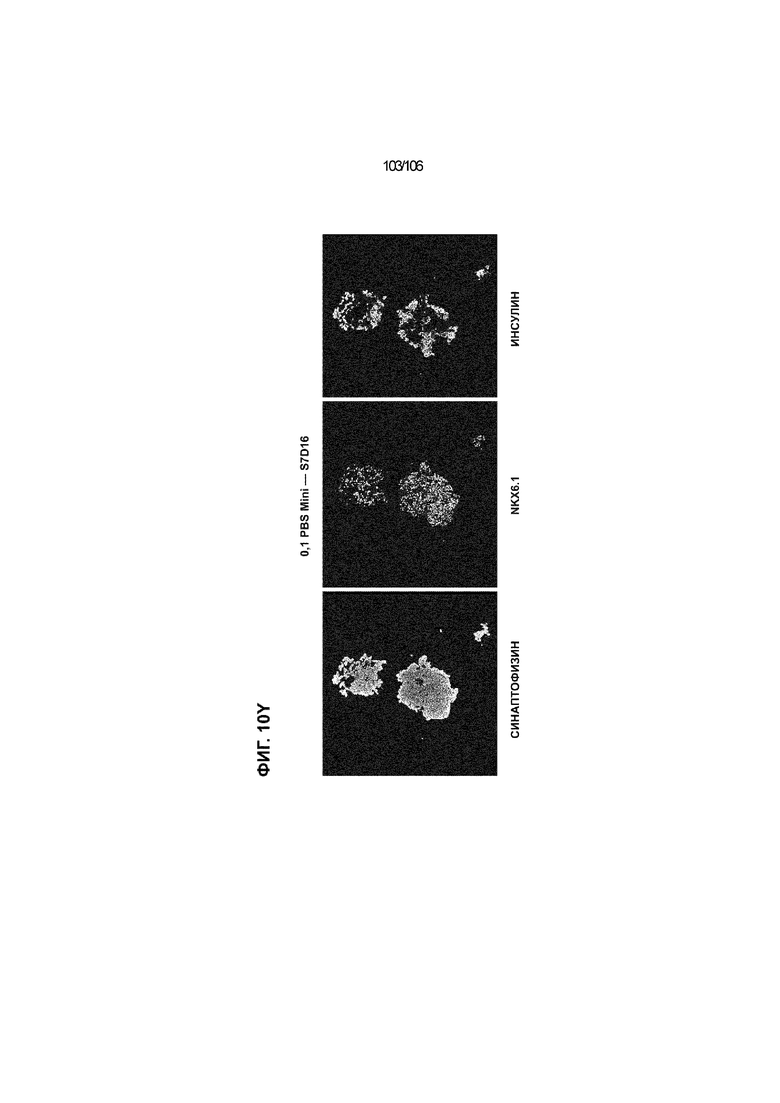
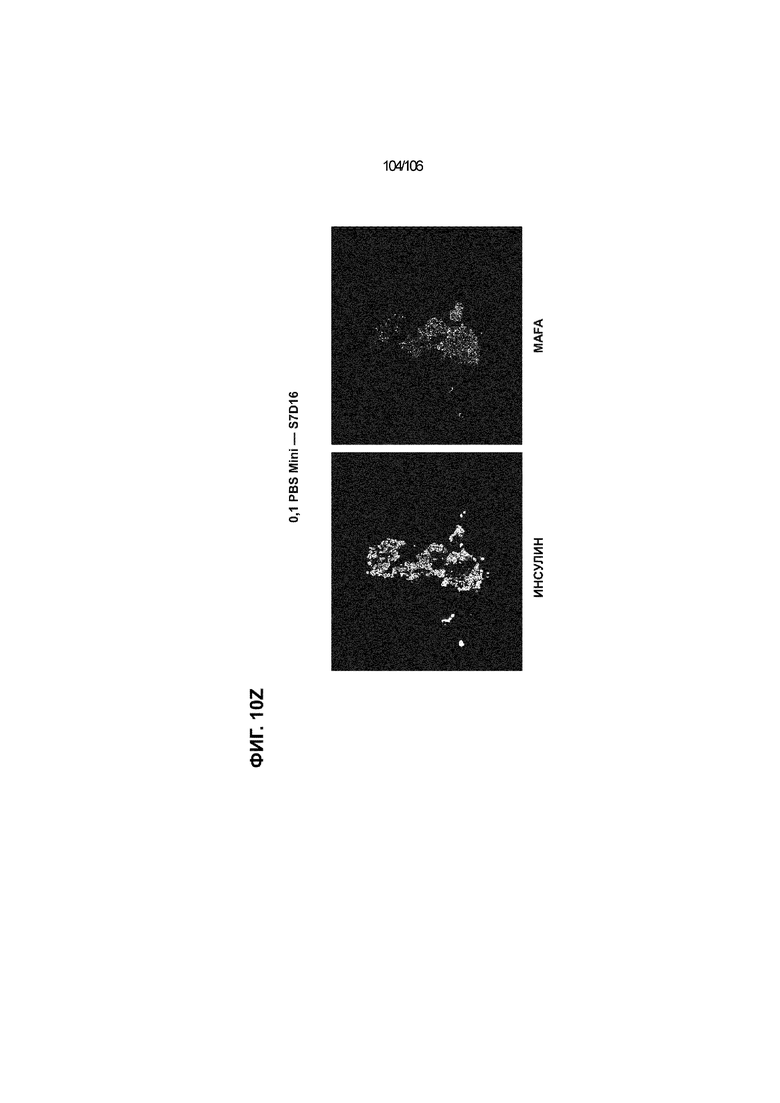
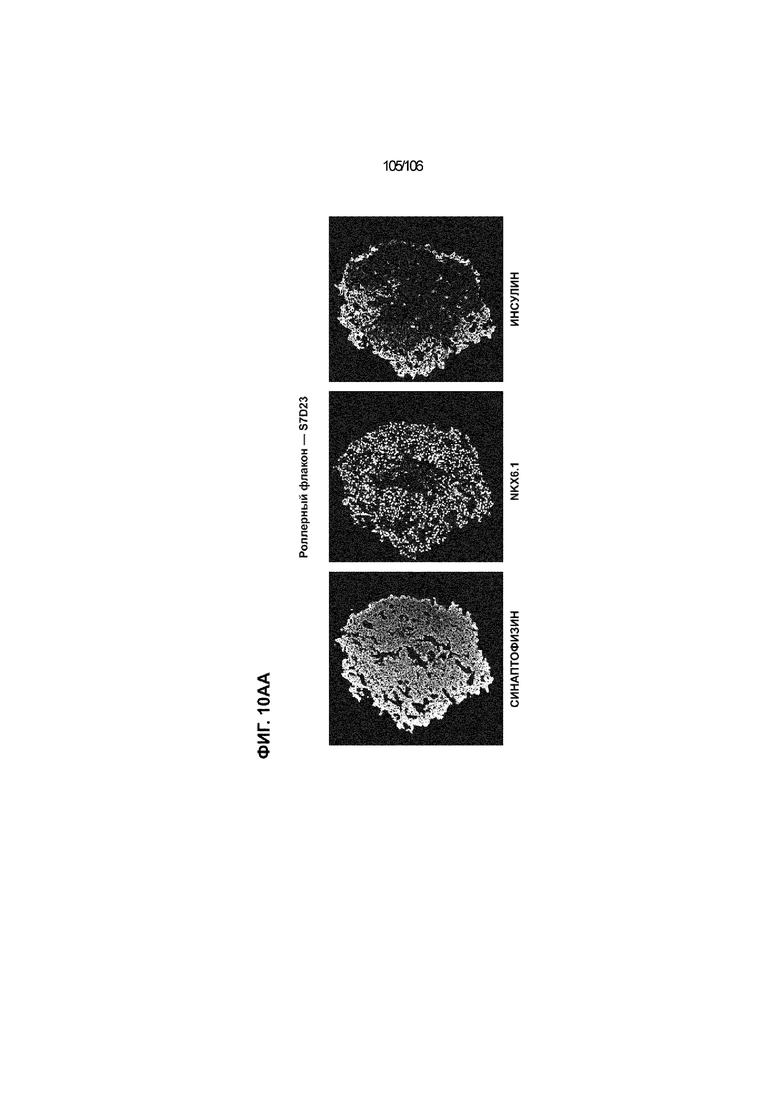
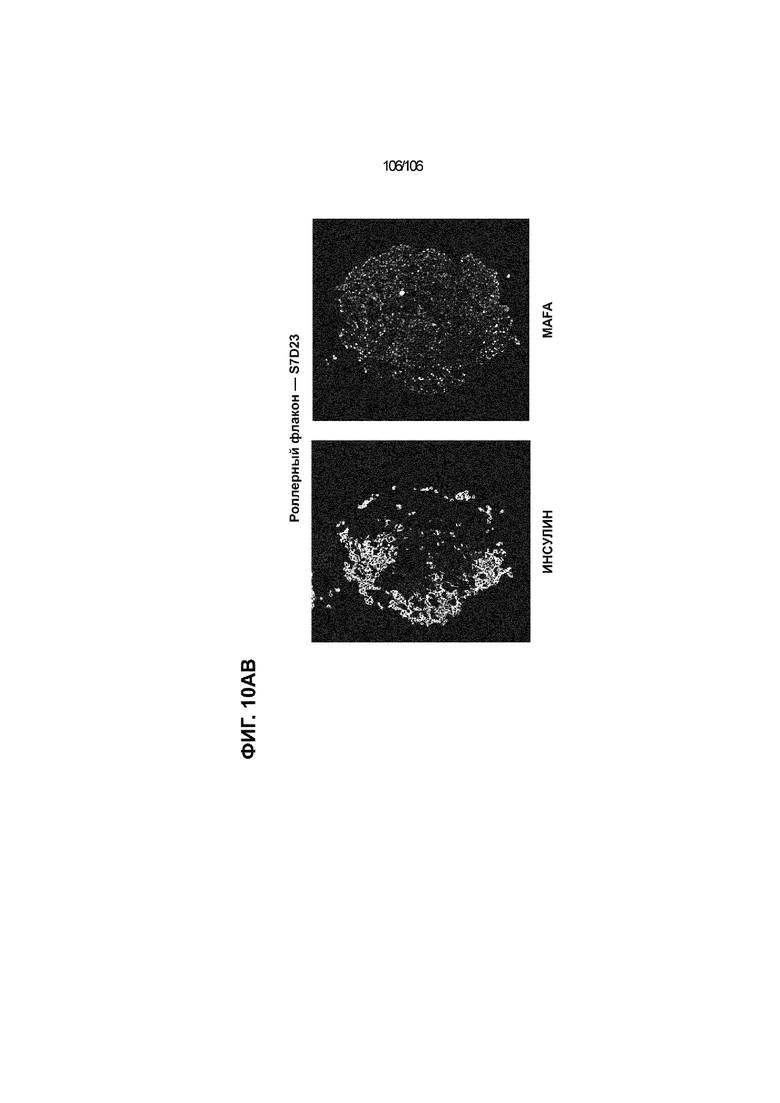
Настоящее изобретение относится к области биотехнологии. Предложен способ доведения незрелой панкреатической бета-клетки до зрелой панкреатической бета-клетки, экспрессирующей PDX1, NKX6.1, MAFA, UCN3 и SLC2A1. Кроме того, рассмотрен способ дифференцировки плюрипотентных стволовых клеток в зрелые бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A. Данное изобретение может найти дальнейшее применение в заместительной клеточной терапии для лечения сахарного диабета. 2 н. и 41 з.п. ф-лы, 10 ил., 23 табл., 7 пр.
1. Способ доведения незрелой панкреатической бета-клетки до зрелой панкреатической бета-клетки, экспрессирующей PDX1, NKX6.1, MAFA, UCN3 и SLC2A1, включающий:
культивирование незрелой панкреатической бета-клетки в среде, в которую добавили одно или более из UNC0638, UNC0642, UNC0646, TC-E5003, A366, PF03814735, ZM447439, SB747651A, PFI1, LY303511, MS436, AZT, DEZA, пироксамида, CI994 или MC1568, в результате которого незрелая панкреатическая бета-клетка переходит в зрелую панкреатическую бета-клетку.
2. Способ по п. 1, где в среду дополнительно добавляют i) гепарин, ii) N-ацетилцистеин и iii) один или более из T3, T4 и их аналога.
3. Способ по п. 1, где среда не содержит ингибитор ALK5.
4. Способ по п. 1, где в среду дополнительно добавляют ингибитор ALK5.
5. Способ по п. 1, где в среду добавляют
i) ZM447439;
ii) гепарин;
iii) N-ацетилцистеин; и
iv) одно или более из T3, T4 и их аналога;
и где среда не содержит ингибитор ALK5.
6. Способ по п. 5, где в среду добавляют T3.
7. Способ по п. 6, где в среду добавляют AZT.
8. Способ по п. 7, где в среду добавляют DEZA.
9. Способ по п. 1, где незрелую бета-клетку получают посредством поэтапной дифференцировки клеток дефинитивной энтодермы, клеток первичной кишечной трубки, клеток энтодермы передней кишки, панкреатических энтодермальных клеток или панкреатических эндокринных клеток-предшественников.
10. Способ по п. 1, где способ включает культивирование незрелой панкреатической бета-клетки на поверхности раздела воздух-жидкость.
11. Способ по п. 1, где способ включает культивирование незрелой панкреатической бета-клетки в скоплениях в суспензии.
12. Способ дифференцировки плюрипотентных стволовых клеток в зрелые бета-клетки, экспрессирующие PDX1, NKX6.1, MAFA, UCN3 и SLC2A, включающий:
a) дифференцировку плюрипотентных стволовых клеток в клетки дефинитивной энтодермы;
b) дифференцировку клеток дефинитивной энтодермы со стадии a) в клетки первичной кишечной трубки;
c) дифференцировку клеток первичной кишечной трубки со стадии b) в клетки энтодермы передней кишки;
d) дифференцировку клеток энтодермы передней кишки со стадии c) в панкреатические энтодермальные клетки;
e) дифференцировку панкреатических энтодермальных клеток со стадии d) в панкреатические эндокринные клетки-предшественники;
f) дифференцировку панкреатических эндокринных клеток-предшественников со стадии e) в незрелые бета-клетки; и
g) культивирование незрелых бета-клеток со стадии f) в среде, в которую добавили одно или более из UNC0638, UNC0642, UNC0646, TC-E5003, A366, PF03814735, ZM447439, SB747651A, PFI1, LY303511, MS436, AZT, DEZA, пироксамида, CI994 или MC1568 для доведения незрелых бета-клеток до зрелых бета-клеток, экспрессирующих PDX1, NKX6.1, MAFA, UCN3 и SLC2A1.
13. Способ по п. 12, где зрелые бета-клетки показывают глюкозозависимое митохондриальное дыхание.
14. Способ по п. 12, где зрелые бета-клетки показывают стимулированную глюкозой секрецию инсулина.
15. Способ по п. 12, где зрелые бета-клетки секретируют инсулин во множестве фаз.
16. Способ по п. 12, где в среду дополнительно добавляют:
i) гепарин;
ii) N-ацетилцистеин; и
iii) одно или более из T3, T4 и их аналога.
17. Способ по п. 12, где среда не содержит ингибитор ALK5.
18. Способ по п. 12, где в среду дополнительно добавляют T3.
19. Способ по п. 12, где в среду добавляют
i) ZM447439;
ii) гепарин;
iii) N-ацетилцистеин; и
iv) одно или более из T3, T4 и их аналога, и
где среда не содержит ингибитор ALK5.
20. Способ по п. 19, где в среду добавляют T3.
21. Способ по п. 20, где в среду дополнительно добавляют AZT.
22. Способ по п. 21, где в среду дополнительно добавляют DEZA.
23. Способ по п. 12, где способ включает культивирование незрелых бета-клеток на поверхности раздела воздух-жидкость.
24. Способ по п. 12, где способ включает культивирование незрелых бета-клеток в скоплениях в суспензии.
25. Способ по п. 12, где стадия a) включает дифференцировку плюрипотентных стволовых клеток в клетки дефинитивной энтодермы путем культивирования плюрипотентных стволовых клеток в среде, в которую добавили соединение MCX и GDF-8.
26. Способ по п. 12, где стадия b) включает дифференцировку клеток дефинитивной энтодермы в клетки первичной кишечной трубки путем культивирования клеток дефинитивной энтодермы в среде, в которую добавили FGF7 и аскорбиновую кислоту.
27. Способ по п. 12, где стадия c) включает дифференцировку клеток первичной кишечной трубки в клетки энтодермы передней кишки путем культивирования клеток первичной кишечной трубки в среде, в которую добавили FGF7, ретиноевую кислоту, SANT-1, активатор PKC, ингибитор BMP и аскорбиновую кислоту.
28. Способ по п. 12, где стадия d) включает дифференцировку клеток энтодермы передней кишки в панкреатические энтодермальные клетки путем культивирования клеток энтодермы передней кишки в среде, в которую добавили FGF7, ретиноевую кислоту, SANT-1, активатор PKC, ингибитор BMP и аскорбиновую кислоту.
29. Способ по п. 12, где стадия e) включает дифференцировку панкреатических энтодермальных клеток в панкреатические эндокринные клетки-предшественники путем культивирования панкреатических энтодермальных клеток в среде, в которую добавили SANT-1, активатор PKC, ингибитор BMP и аскорбиновую кислоту.
30. Способ по п. 29, где в среду дополнительно добавляют одно или более из T3, T4 или их аналога.
31. Способ по п. 12, где стадия f) включает культивирование панкреатических эндокринных клеток-предшественников до незрелых бета-клеток путем культивирования панкреатических эндокринных клеток-предшественников в среде, в которою добавляют i) ингибитор BMP, ii) аскорбиновую кислоту и iii) одно или более из T3, T4 и их аналога.
32. Способ по п. 31, где в среду дополнительно добавляют ингибитор ALK 5 или ингибитор гамма-секретазы.
33. Способ по п. 12, где стадия g) включает культивирование незрелых бета-клеток в среде, которая не содержит ингибитор ALK5 и в которую добавляют ZM447439, AZT, N-ацетилцистеин, DEZA, Состав I и одно или более из T3, T4 и их аналога.
34. Способ по п. 33, где зрелые бета-клетки показывают глюкозозависимое митохондриальное дыхание.
35. Способ по п. 33, где зрелые бета-клетки показывают стимулированную глюкозой секрецию инсулина.
36. Способ по п. 34, где глюкозозависимое митохондриальное дыхание имеет реакцию в виде увеличения скорости потребления кислорода после стимуляции глюкозой в диапазоне от около 20% до около 80% сверх исходной скорости потребления кислорода.
37. Способ по п. 36, где реакция в виде увеличения скорости потребления кислорода происходила через по меньшей мере 15 минут после стимуляции глюкозой.
38. Способ по п. 35, где стимулированная глюкозой секреция инсулина включает двухфазную секрецию инсулина в ответ на стимуляцию.
39. Способ по п. 38, где в первой фазе двухфазной секреции инсулина наблюдается увеличение секреции от по меньшей мере четырех до по меньшей мере восьми раз по сравнению с секрецией на исходном уровне, а во второй фазе наблюдается увеличение секреции от по меньшей мере двух раз до по меньшей мере четырех раз по сравнению с секрецией на исходном уровне.
40. Способ по п. 38, где секреция инсулина происходит в интервале от по меньшей мере пяти минут до по меньшей мере десяти минут после стимуляции глюкозой.
41. Способ по п. 6, где в среду добавляют T3 в количестве 1 нМ-100 нМ.
42. Способ по п. 30, где в среду добавляют T3 в количестве 1 нМ-1 мкM.
43. Способ по п. 12, где плюрипотентные стволовые клетки представляют собой человеческие клетки H1 или H9.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| PAGLIUCA FW, MELTON DA | |||
| "How to make a functional β-cell", Development, 2013, Vol | |||
| Способ закалки пил | 1915 |
|
SU140A1 |
| Четырехтактный многоцилиндровый двигатель внутреннего горения | 1923 |
|
SU2472A1 |
| PAGLIUCA FW et al | |||
| "Generation of functional human pancreatic β cells in vitro", Cell, 2014, Vol | |||
| Катодное реле | 1918 |
|
SU159A1 |
| Способ получения сульфокислот из нефтяных масел | 1911 |
|
SU428A1 |
Авторы
Даты
2021-07-28—Публикация
2017-06-14—Подача