Изобретение относится к медицине и может быть использовано для стимулирования роста и регенерации клеток для лечения обморожений.
Обморожение одна из наиболее часто встречающихся травм в условиях холодного климата, которая нередко приводит к потере конечностей. Основное повреждающее действие при криотравме оказывает последовательность патологических процессов, развивающихся в результате нарушения (ишемии) и последующего восстановления (реперфузии) кровообращения органа или конечности. Стандартная терапия обморожений ставит целью недопущение формирования тромбов и обширного некроза, снижение воспалительного ответа, препятствие инфицированию раны через поврежденные покровы, а также способствование скорейшему заживлению пострадавших тканей [1].
В настоящее время одним из перспективных методов лечения обширных повреждений мягких тканей является трансплантация пациенту аллогенных или аутологичных мезенхимальных стволовых/стромальных клеток (МСК), которые обладают выраженными иммуномодулирующими, антиапоптотическими, противовоспалительными и регенеративными свойствами [2]. В частности, МСК вырабатывают целый ряд противовоспалительных молекул и цитокинов, включая простогландин Е2 (PGE2), трансформирующий ростовой фактор бета (TGFβ), фактор роста гепатоцитов (HGF), интерлейкин 10 (IL10) и другие [3]. Эти молекулы угнетают действие цитотоксических Т-лимфоцитов и естественных киллеров (NK), способствуют дифференцировке моноцитов в М2 макрофаги, а также стимулируют образование Т-регуляторных клеток, что снижает иммунно-опосредованное повреждение тканей. Показаны многочисленные примеры того, что обработка ран аллогенными МСК снижала количество и продукцию провоспалительных цитокинов, а также ускоряла процесс заживления [4]. Помимо противовоспалительного эффекта, МСК экспрессируют антиапоптотические и проангиогенные факторы, включая фактор роста фибробластов (FGF-2), фактор роста эндотелия сосудов (VEGF) и многие другие [3,5]. Наконец, МСК могут подвергаться трансдифференцировке и замещать собой поврежденные клетки, хотя точный вклад этого процесса в заживление ран остается предметом дискуссии [2]. Следует подчеркнуть, что разработанных технологий применения МСК для терапии обморожений к настоящему моменту не существует.
В настоящее время в России и других странах запатентовано несколько технологий для лечения ран различной этиологии с помощью клеточных продуктов на основе МСК. Ниже приведен ряд примеров.
В частности, было показано, что применение мезенхимальных стволовых клеток жировой ткани (МСК ЖТ) при лечении ожогов кожи II-III степеней в комплексе с раневыми покрытиями значительно сокращают сроки [6]. Вышеприведенные данные позволяют говорить о высоких перспективах применения мезенхимальных стволовых клеток для лечения обморожений и ожогов.
Стволовые и прогениторные клетки, выделенные из костного мозга, предложено использовать для стимулирования роста и регенерации клеток [7]. В экспериментальной части описания данного изобретения приведены примеры использования композиций после криодеструкции.
МСК, выделенные из жировой ткани костного мозга, использовали с целью стимуляции ангиогенеза и нейрогенеза для лечения целого ряда заболеваний человека, таких, как трофические язвы, в том числе у больных диабетом, при заболеваниях пародонта, обширных ожогах, ишемии нижних конечностей, аллопециях, а также при повреждениях нервной системы [8]. В основе приведенного изобретения лежит факт, что основными действующими веществами в среде культивирования мезенхимальных стромальных клеток из жировой ткани, оказывающими регенеративный эффект на восстановление структуры и функции поврежденных органов и тканей являются VEGF, HGF, ангиопоэтин и ангиогенин, поскольку блокирующие антитела к этим факторам роста ингибируют общий стимулирующий эффект, который оказывает среда культивирования.
Известна композиция для раневых покрытий, включающие МСК [9], обеспечивает эффективное лечение кожных повреждений кожи. В данной композиции достигается увеличение жизнеспособности МСК (способствующих ангиогенезу), которая достигается с помощью их одновременного введения с эластиноподобными полипептидами.
Также известен способ индукции миграции стволовых клеток жировой ткани [10], включающий следующие стадии: (а) примирование стволовых клеток жировой ткани взрослых смесью, содержащей хемокин или фактор роста препаратом композиции; (b) внутривенное ведение композиции in vivo в участок, который не находится в прямом контакте с пораженным. При этом в данном способе используют композицию, которая содержит в качестве активного ингредиента человеческие мезенхимальные стволовые клетки из жировой ткани взрослых в количестве от 1×107 до 1×1010, которые экспрессируют на клеточной поверхности рецептор хемокина или фактора роста, или секреторный продукт из этих стволовых клеток включает рецептор хемокина или фактора роста; где секретируемый продукт стволовых клеток жировой ткани взрослых представляет собой адипонектин; и где человеческие стволовые клетки жировой ткани взрослых подвергаются первичному воздействию смесью, содержащей хемокин или фактор роста, и фармацевтически приемлемый носитель. Данная композиция может быть применена в качестве клеточного терапевтического средства благодаря более эффективной миграции стволовых клеток к пораженному участку.
При этом известен способ регенерации кожного покрова [11], включающий трансплантацию в дно раны аллогенных мезенхимальных мультипотентных стромальных клеток (ММСК) в виде суспензии при помощи инъекций на глубину 0,1-0,3 мм с частотой 10 инъекций на 1 см, объемом каждой инъекции 0,05-0,1 мл. При этом в ходе данного способа моделируют дермальный матрикс, изготовленный из кожи донора-трупа, по форме раны и перфорируют для создания путей раневого отделяемого, укладывают на дно раны, затем рану укрывают стерильной марлевой повязкой.
Также известен способ регенерации кожного покрова аллогенными стволовыми клетками человека [12]. В ходе осуществления данного способа выполняют раннюю хирургическую некрэктомию и одномоментную кожную пластику с пересадкой трансплантата. При этом вводят аллогенные адипогенные мезенхимальные стволовые клетки по периметру ожоговой раны и субфасциально под пересаженный трансплантат. В частном случае дополнительно проводят внутримышечное введение аллогенных адипогенных мезенхимальных стволовых клеток. Аллогенные адипогенные мезенхимальные стволовые клетки вводят вначале на 2-3 сутки после травмы, затем при первой перевязке.
На сегодняшний день отсутствует эффективный способ лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга с высокой эффективностью стимулирования роста и регенерации клеток.
Технической проблемой является необходимость разработки эффективного способа лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга.
Технический результат состоит в обеспечении эффективного стимулирования роста и регенерации клеток для лечения обморожений.
Технический результат достигается за счет способа лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга и выращенных в условиях гипоксии, в ходе которого окружающие здоровые ткани в области повреждения инфильтруют мезенхимальными стволовыми клетками на стадии острого воспаления, при этом используют клетки, прошедшие не более 4 пассажей всего или не более 2-х с момента разморозки.
Мезенхимальные стволовые клетки для настоящего способа лечения получают следующим образом.
Мезенхимальные стволовые клетки сначала выделяют из красного костного мозга лабораторных животных (крыс), а затем размножают и замораживают.
Получение клеток костного мозга проводится под общей анестезией в условиях операционной. Животное после внутримышечной инъекции препарата золетила помещают на операционный стол и обрабатывают кожу антисептическим раствором. Кожу от тазобедренного до голеностопного сустава удаляют. Далее разрушают тазобедренный сустав, выделяют бедренную кость так, чтобы не была повреждена суставная поверхность бедра. Подопытное животное подвергается эвтаназии.
Выделенный комплекс, включающий в себя кости голени и бедренную кость, обрабатывают 70% раствором этилового спирта. Затем удаляют все мышцы с кости. Данные кости повторно обрабатывают 70% этиловым спиртом. Стерильным инструментом срезают эпифизы бедренной кости. Далее полость диафиза промывают стерильным раствором DMEMA, а полученную суспензию клеток костного мозга помещают в отдельную стерильную пробирку. Пробирку помещают в стерильный пакет и доставляют в лабораторию для последующего выделения мезенхимальных стволовых клеток и начала процесса культивирования.
Выделение клеток костного мозга.
Транспортный контейнер с поступившим образцом с соблюдением правил асептики переносят в ламинарный шкаф (NU-440) для выделения мезенхимальных стволовых клеток костного мозга. Далее проводят регистрацию образца. Все процедуры выделения, культивирования и криоконсервации выполняют в асептических условиях в ламинарном шкафу (NU-440 или аналогичный). Суспензию клеток костного мозга в асептических условиях переносят в стерильные 50 мл центрифужные пробирки с крышками (Corning, США, кат. №430829, или аналогичные). Пробирки для центрифугирования помещают в настольную центрифугу (Rotina, или аналогичную) и центрифугируют при 2000 об/мин в течение 5 минут при температуре +20 Со (g=700). После центрифугирования в ламинарном шкафе супернатант сливают, а осадок ресуспендируют в лизирующем буфере в соотношении 1:10. Пробирку закрывают крышкой и переносят в настольную центрифугу. Удаленный супернатант подвергают утилизации. Суспензию клеток в лизирующем буфере осаждают в настольной центрифуге при 1500 об/мин в течение 5 минут при +20Со (g=390). В ламинарном шкафу после центрифугирования надосадочную жидкость удаляют и утилизируют. Осадок клеток ресуспендируется в среде для культивирования DMEM с добавлением 10% эмбриональной телячьей сыворотки (фирма Gibco или аналогичная). Определение содержания жизнеспособных клеток.
К 50 мкл суспензии клеток костного мозга добавляют 150 мкл раствора трипанового синего, аккуратно перемешивают, инкубируют 5 мин при температуре +20±2°С. Анализируют путем микроскопии в проходящем свете и определяют процентное содержание жизнеспособных клеток по формуле:
Жизнеспособность=100% (число неокрашенных клеток) / общее число клеток.
Культивирование клеток.
Суспензию клеток в среде для культивирования DMEM высеивают для культивирования на чашки Петри d=140 мм в концентрации 2.5-3.0*106 кл/мл. Чашки Петри маркируют и помещают в мультигазовый СО2-инкубатор при 37°С в атмосферу с 5% СО2, 21% О2 и 95% влажности на 24 часа. Смену среды при культивировании клеток проводят каждые 3 суток до достижения клетками 70% монослоя. Утилизация отходов производства осуществляется в соответствии с «Санитарными правилами и нормами СанПиН 2.1.7.728-99».
Криоконсервация клеток. Клетки, находящиеся в фазе логарифмического роста, снимают с пластиковой подложки обрабатывая 0,25% трипсина в растворе Версена. Клетки в количестве 5×105-1×107 клеток ресуспендируют в 1 мл раствора BamBanker и помещают в криопробирки для замораживания. Замораживание клеток проводят при -80°С в специальном контейнере (CoolCell LX или аналогичный). Замороженные клетки хранят при -80°С или при -196°С в условиях жидкого азота. Оттаивание проводят в течение 5 минут на водяной бане (37°С). Далее смешивают 1 мл клеточной суспензии с 10 мл свежей культуральной среды, а после центрифугирования удаляют супернатант.
Общая схема подготовки мезенхимальных стволовых клеток для введения лабораторным животным.
Экспериментальные образцы первичных мезенхимальных стволовых клеток животных (200 тыс.клеток в 1 мл) извлекают из жидкого азота и сразу же размораживают на водяной бане при 37°С, придерживая криопробирку пинцетом. После обработки криопробирки 70%-ным этанолом ее стерильно открывают под ламинаром, перемешивают носиком и переносят содержимое на 75 см2 культуральный флакон с 20 мл среды DMEM с 10%) эмбриональной телячьей сыворотки. МСК культивируют в условиях гипоксии (в атмосфере 5% кислорода, 5% углекислого газа при 37°С) до достижения монослоя. В день введения удаляют культуральную среду, трижды промывают клетки 3-4 мл PBS. Добавляют 3 мл 0.05% раствора трипсина для снятия клеток с подложки. После того, как клетки открепятся от подложки, процесс трипсинизации останавливают путем добавления 5-7 мл питательной среды. Клетки аккуратно перемешивают для получения суспензии одиночных клеток и собирают в стерильные 15-мл центрифужные пробирки. После сбора клеток суспензию центрифугируют при 500g в течение 5 минут. Удаляют супернатант, после чего дважды промывают 5-6 мл PBS (рН 7.4) для удаления следов трипсина и культуральной среды путем центрифугирования при 500g в течение 5 минут. Далее МСК ресуспендируют в 2-4 мл раствора 0.9% хлорида натрия (раствор для введения) и подсчитывают концентрацию клеток в 1 мл с помощью камеры Горяева. Далее разбавляют суспензию дополнительным объемом раствора для введения до достижения концентрации 200 тыс.клеток в мл. Из полученной суспензии после перемешивания отбирают по 1 мл и вводят лабораторным животным. Общая методика лечения.
После получения обморожения здоровые ткани в области повреждения на стадии острого воспаления (от одного до пяти дней после повреждения) инфильтруют мезенхимальными стволовыми клетками, выделенными из красного костного мозга. При этом используют культивированные в течение небольшого времени мезенхимальные стволовые клетки (не более 4 пассажей всего или не более 2-х с момента разморозки). Кроме того, используют популяции МСК, которые являются «чистыми», т.е не содержат других клеток. Доля CD90, CD105, CD73 и CD29-положительных клеток в клеточном продукте превышает 90%, а доля CD11b, CD14, CD45 и CD34 -положительных клеток не превышает 5%. Также используют МСК, способные к дифференцировке по остеогенному, хондрогенному и адипогенному направлениям.
Заявляемое изобретение поясняется примером.
Было проведено экспериментальное изучение специфической активности (эффективности) МСК на модели местного отморожения III-IV степени у животных.
Экспериментальные исследования проводили следующим образом.
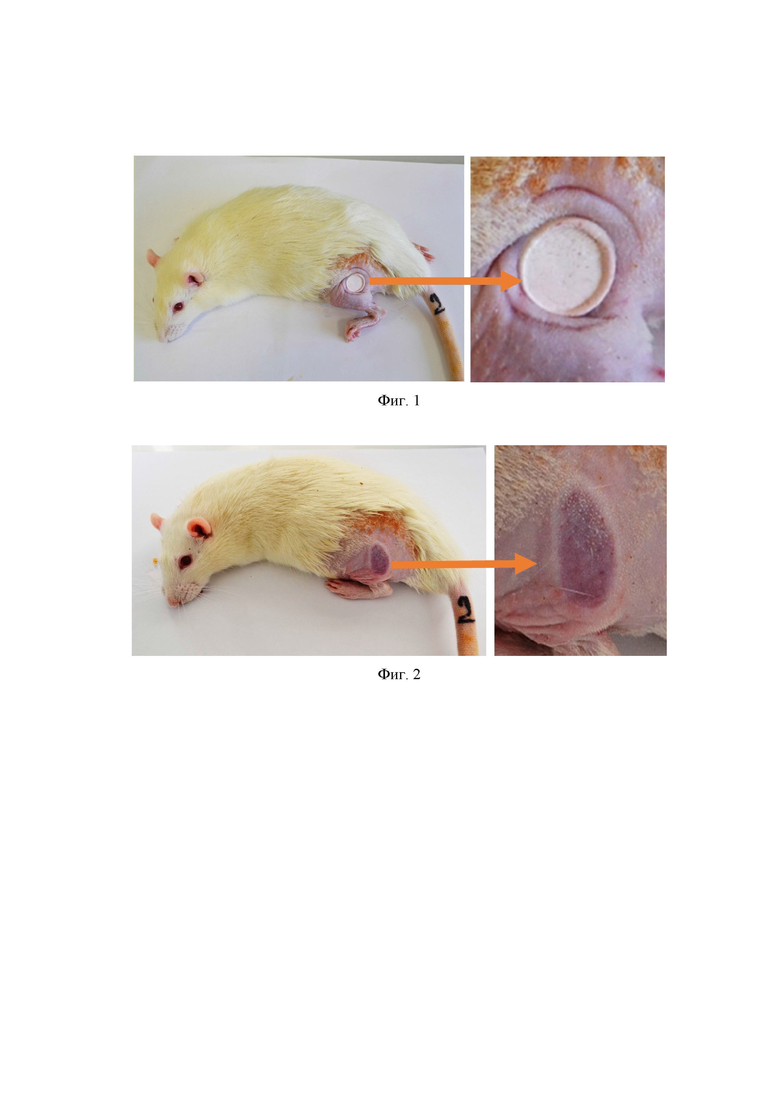
В начале осуществляли депиляцию участка задней ноги у 40 крыс Wistar (самцы массой 180-200 г., возраст 11-13 недель) под наркозом. Затем проводили инкубацию животных в камере с содержанием кислорода 15% при 4°С в течение суток, что имитирует условия арктической гипоксии. Далее наносили криотравму 38 животным спустя 24 ч экспозиции в камере. На фигуре 1 представлено изображение оледеневших тканей в области местного отморожения на бедре крысы сразу после холодовой аппликации (справа - вид области отморожения крупным планом).
Фигура 2 иллюстрирует развитие отека тканей в виде кольца вокруг зоны отморожения на бедре крысы через 20 минут после аппликации металлического стержня (справа - вид области отморожения крупным планом).
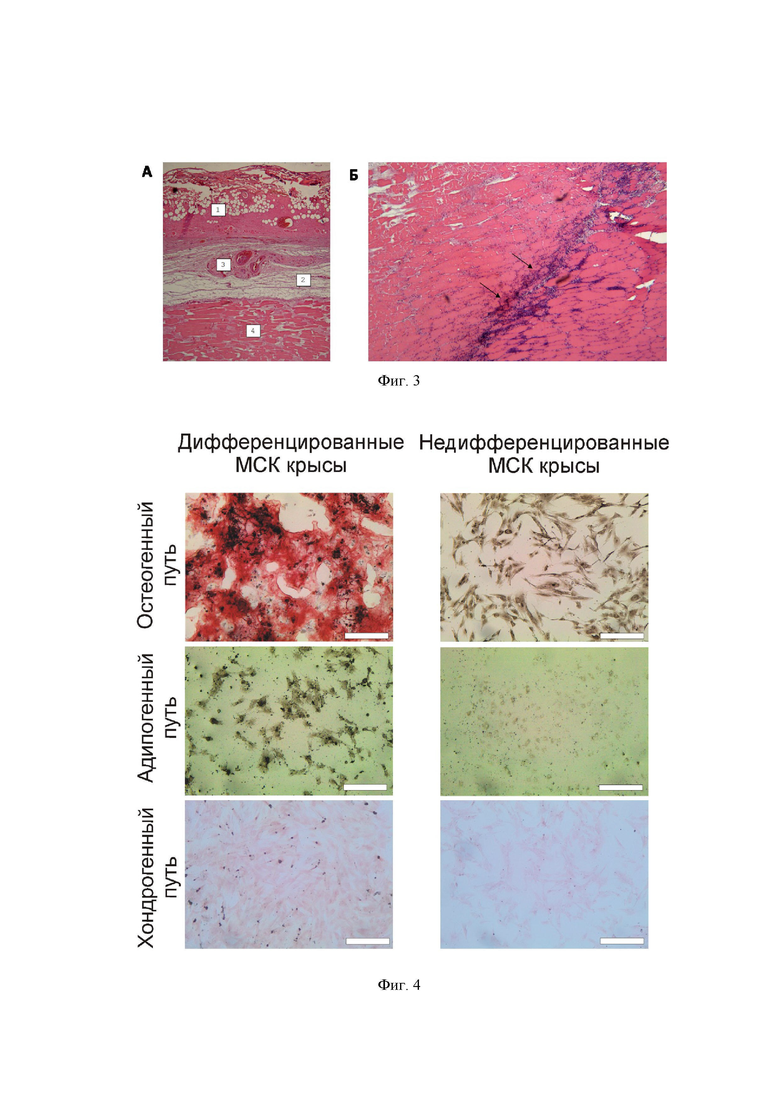
На фигуре 3 приведены данные по гистологии раны, а именно:
A, гистологический срез раны спустя 24 ч после нанесения (Н&Е окраска). 1 -область некроза дермы с вакулизированными клетками; 2 - разрыхленная соединительная ткань; 3 - тромбоз кровеносного сосуда; 4 - некроз мышечной ткани.
B, демаркационная линия некротического очага мышечной ткани и лейкоциты на ее границе (черные стрелки). Н&Е окраска.
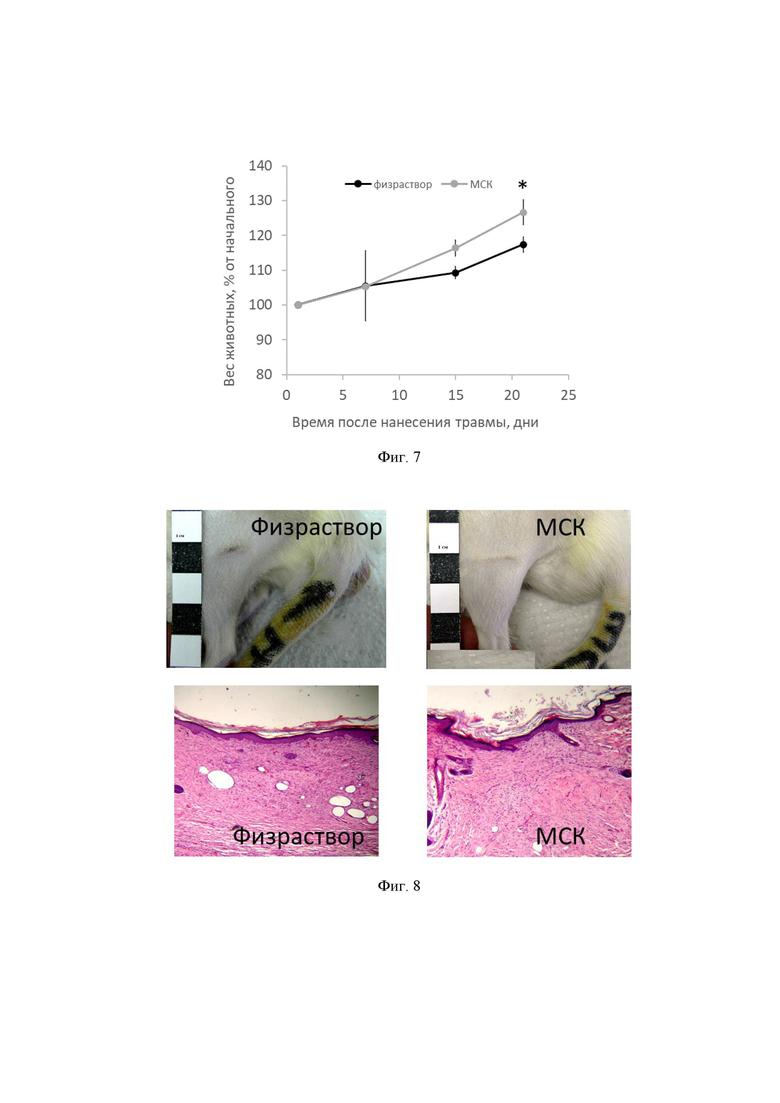
После процедур с нанесением травмы всех животных продолжали держать в камере в условиях гипоксии и пониженной температуры в течение следующих суток. Через сутки после нанесения травмы 19 животным был введен 1 мл физраствора (нелеченная контрольная группа, группа 1), другим 19 животным введено 2 млн МСК в 1 мл (леченная МСК опытная группа, группа 2). Фенотип вводимых экспериментальных образцов МСК крысы соответствовал следующим показателям: CD90 - 98,5%, CD105 - 97,8%, CD73 - 98,59%, CD29 - 98,6%, CD44 - 90,2%, CD11b - 1,16%, CD14 - 1,55%, CD45 - 0,3%, CD34 - 4,73%. Следует отметить, что популяцию МСК принято считать «чистой» (т.е. не содержащей других клеток), если в клеточной популяции значения доля CD90, CD105, CD73 и CD29-положительных клеток превышает 90%, а доля CD11b, CD14, CD45 и CD34-положительных клеток не превышает 5%. Еще одним обязательным требованием к качеству клеточного продукта на основе МСК является способность этих клеток к дифференцировке по остеогенному, хондрогенному и адипогенному направлениям. Фигура 4 демонстрирует изображения дифференцированных МСК по данным путям в сравнении с недифференцированным контролем. Остеогенная дифференцировка подтверждается окраской красителем ализариновым красным, хондрогенная - сафранином О, а адипогенная - суданом 3.
Таким образом, использованные в эксперименте МСК полностью соответствовали предъявляемым к ним требованиям по чистоте клеточной популяции и функциональным свойствам.
С момента введения МСК или физраствора всех животных содержали при комнатной температуре в условиях гипоксии. На 5-е сутки с момента нанесения травмы, а также в день закрытия раны по несколько (на 5-й день - 3, в последний день - 7) животных из групп 1 и 2 были эвтаназированы, ткани вокруг раны вырезаны и использованы для анализа гистологии. Еще 9 животных из каждой группы эвтаназировали на 5-й, 9-й и 16-й день, отбирая ткани вокруг раны для анализа экспрессии в ране факторов роста и цитокинов, что позволило оценить ход раневого процесса на молекулярном уровне. В качестве параметра заживления были измерены площади ран, определен день схода струпа и проведена гистологическая оценка раны после ее закрытия.
Фигура 5 демонстрирует профиль экспрессии цитокина интерлейкина 6 (IL-6), фактора роста эндотелия сосудов (VEGFA) и трансформирующего фактора роста бета (TGFbeta) в холодовой ране на стадиях пролиферации (5 и 9 день) и созревания (16 день). Оказалось, что лечение ран с помощью МСК приводит к увеличению экспрессии VEGFA и TGFbeta, которые способствуют ускоренному ангиогенезу и подавлению воспаления, соответственно. Кроме того, уровень провоспалительного цитокина IL-6 был снижен в ранах, леченных МСК, что свидетельствует об их антивоспалительном эффекте.
Гистологический анализ на 5-й день после травмы не выявил существенных различий в морфологии кожи в области раны у обеих групп, хотя было обнаружено, что мышечная ткань в у группы животных, леченных МСК, регенерирует быстрее.
Фигура 6 демонстрирует менее выраженный фиброз и большую толщину.
При дальнейшем наблюдении за крысами отмечали сроки десквамации первичного струпа и отмечали полноту эпителизации. Следует отметить, что наблюдалась тенденция к ускорению десквамации струпа и полной эпителизации раны у животных, леченных МСК (таблицы 1 и 2).

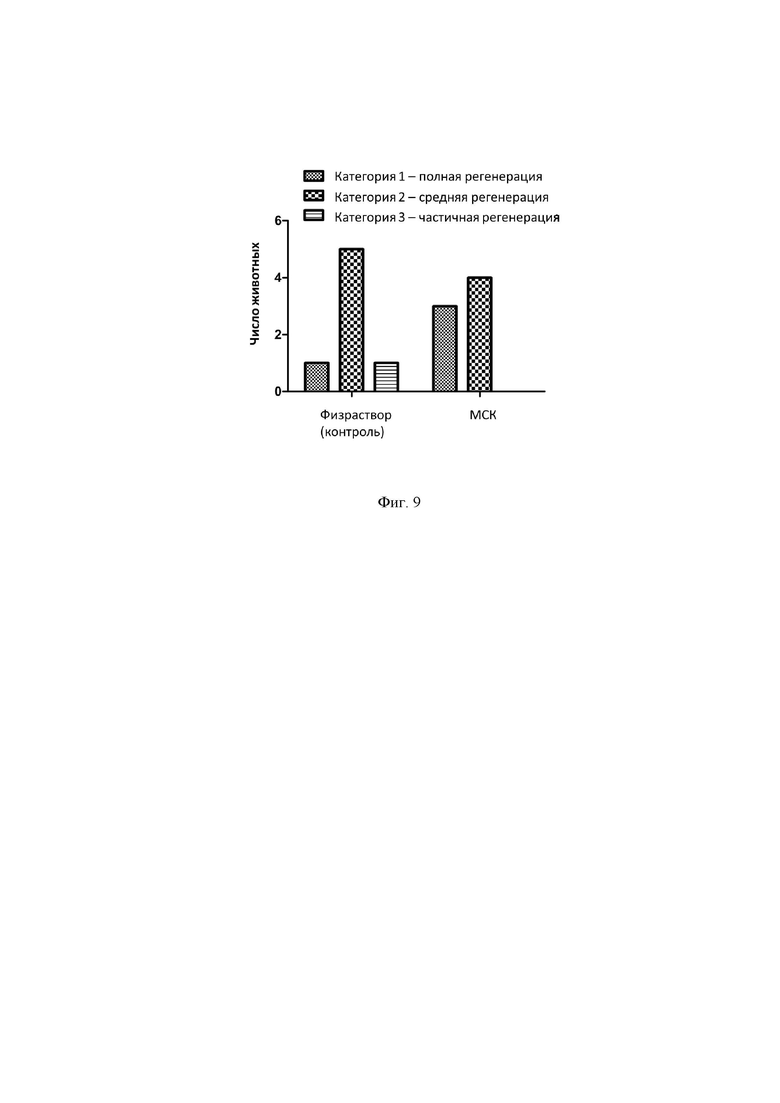
Важно отметить, что на протяжении всего срока эксперимента крысы из подопытной группы (леченной МСК) набирали вес быстрее, чем в контрольной группе, что говорит об их положительном общем состоянии. Фигура 7 демонстрирует изменение веса животных обеих групп после нанесения травмы и лечения (*р<0,05 согласно U-тесту Манн-Уитни).
К 23-му дню после нанесения раны у крыс во всех группах была определена полная эпителизация ран по внешним (визуально макроскопически оцениваемым) признакам, а именно: отсутствие вторичного струпа или его минимальный размер - менее 3 мм в наибольшем измерении, отсутствие припухлости в области рубца. В этот срок исследования всех подопытных и контрольных крыс подвергли эвтаназии углекислым газом, а ткани области раны иссекли для гистологического исследования. Фигура 8 демонстрирует внешний вид раны и гистологию кожи на 23-й день после нанесения холодовай травмы у крыс, которым вводили физраствор (контроль) и МСК.
Оценка гистологии ран у двух групп на 23-й день проводили следующим образом. Препараты ран согласно гистологическим особенностям относили к одной из трех категорий: 1) категория 1 (полная регенерация) - Полная эпителизация поверхности раны с наличием ороговевшего слоя. Слой новообразованного эпителия высокой степени зрелости, тонкий, с большим количеством волосяных фолликулов и сальных желез. Раневой дефект имеет малый объем (площадь) и полностью заполнен плотной волокнистой соединительной тканью с высокой степенью дегидратации; 2) категория 2 (средняя регенерация) Полная эпителизация поверхности раны с наличием ороговевшего слоя. Средняя часть покрывающего рану эпителия менее зрелая, местами имеет утолщения. Ближе к обеим наблюдаемым сторонам раны имеются единичные новообразованные волосяные фолликулы и сальные железы. Рубцовая ткань имеет неравномерную плотность и очаги васкуляризации; 3) категория 3 (частичная регенерация) Полная эпителизация поверхности раны с наличием местами ороговевшего слоя. Волосяные фолликулы и сальные железы отсутствуют. Рубцовая ткань имеет неравномерную плотность и признаки воспаления (очаги диффузной васкуляризации). Фигура 9 демонстрирует количественное распределение животных в обоих группах согласно морфологическому состоянию раны. Как видно из распределения, лечение МСК приводит к увеличению числа животных с полной регенерацией и отсутствию особей с частичной регенерацией.
Список источников
1. S.E. Mcintosh, L. Freer, С.К. Grissom, P.S. Auerbach, G.W. Rodway, A. Cochran, G.G. Giesbrecht, M. McDevitt, C.H. Imray, E.L. Johnson, P. Pandey, J. Dow, P.H. Hackett, Wilderness Medical Society Practice Guidelines for the Prevention and Treatment of Frostbite: 2019 Update, Wilderness & Environmental Medicine. (2019). doi:10.1016/j.wem.2019.05.002.
2. F.E. Figueroa, F. Carrion, S. Villanueva, M. Khoury, Mesenchymal Stem Cell treatment for autoimmune diseases: a critical review, Biological Research. 45 (2012) 269-277. doi:10.4067/S0716-97602012000300008.
3. S. Regmi, S. Pathak, J.O. Kim, C.S. Yong, J.-H. Jeong, Mesenchymal stem cell therapy for the treatment of inflammatory diseases: challenges, opportunities, and future perspectives, European Journal of Cell Biology. (2019).
4. M. Kucharzewski, E. Rojczyk, K. Wilemska-Kucharzewska, R. Wilk, J. Hudecki, M.J. Los, Novel trends in application of stem cells in skin wound healing, European Journal of Pharmacology. 843 (2019) 307 315. doi:10.1016/j.ejphar.2018.12.012.
5. J.R. Ferreira, G.Q. Teixeira, S.G. Santos, M.A. Barbosa, G. Almeida-Porada, R.M. Goncalves, Mesenchymal Stromal Cell Secretome: Influencing Therapeutic Potential by Cellular Pre-conditioning, Front Immunol. 9 (2018). doi:10.3389/fimmu.2018.02837.
6. Зиновьев E.B. и др. Опыт применения стволовых клеток при лечении ожогов кожи // Педиатр, Изд-во "Эко-Вектор", Санкт-Петербург, 2018, Т. 9, №4, с. 12-27.
7. Композиция для стимулирования роста и регенерации клеток, (варианты), а также способ ее получения (варианты): патент RU2391990, Российская Федерация, заявка 2008146216, заявл. 25.11.2008, опубл. 20.06.2010.
8. Способ стимуляции регенеративных процессов в ишемизированных тканях: патент RU2497529, Российская Федерация, заявка RU2011145033, заявл. 08.11.2011 опубл. 10.11.2013.
9. Композиция для заживления ран, содержащая стволовые клетки и эластиноподобные полипептиды: заявка US2016129045, Соединенные Штаты Америки, заявл. 29.10.2014, опубл. 12.05.2016.
10. Способ индукции миграции стволовых клеток жировой ткани: патент US8808682, Соединенные Штаты Америки, заявка KR20090101117, заявл.-23.10.2009, опубл. 19.08.2014.
11. Способ восстановления кожного покрова у пациентов с обширными ранами с дефектом мягких тканей (варианты): патент RU2526814, Российская Федерация, заявка RU2013127322, заявл. 17.06.2013, опубл. 27.08.2014.
12. Способ биотехнологического восстановления кожного покрова аллогенными стволовыми клетками человека: патент RU2687007, Российская Федерация, заявка RU2017131907, заявл. 12.09.2017, опубл. 06.05.2019.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ биотехнологического восстановления кожного покрова аллогенными стволовыми клетками человека | 2017 |
|
RU2687007C2 |
| Способ получения и ведения мезенхимальных стволовых клеток из костного материала млекопитающих | 2023 |
|
RU2821926C1 |
| АДГЕЗИВНЫЕ КЛЕТКИ ЖИРОВОЙ ТКАНИ ИЛИ ПЛАЦЕНТЫ И ИХ ИСПОЛЬЗОВАНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2008 |
|
RU2709780C2 |
| СПОСОБ УСКОРЕННОГО ФОРМИРОВАНИЯ КОСТНОЙ МОЗОЛИ У МЛЕКОПИТАЮЩИХ | 2009 |
|
RU2404242C1 |
| МУЛЬТИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ, ПОЛУЧЕННЫЕ ИЗ ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА, И СОДЕРЖАЩИЕ ИХ КЛЕТОЧНЫЕ ТЕРАПЕВТИЧЕСКИЕ АГЕНТЫ | 2005 |
|
RU2409665C2 |
| Способ стимулирования регенерации спинного мозга при помощи везикул, полученных из мезенхимных стволовых клеток жировой ткани | 2020 |
|
RU2739912C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2018 |
|
RU2721532C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2017 |
|
RU2675930C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСТРОЙ РЕАКЦИИ ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА ПОСЛЕ ТРАНСПЛАНТАЦИИ АЛЛОГЕННОГО КОСТНОГО МОЗГА | 2010 |
|
RU2454247C1 |
| ЛЕЧЕНИЕ ИНСУЛЬТА С ИСПОЛЬЗОВАНИЕМ ИЗОЛИРОВАННЫХ ПЛАЦЕНТАРНЫХ КЛЕТОК | 2009 |
|
RU2558778C2 |

Изобретение относится к медицине. Способ лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга и выращенных в условиях гипоксии, заключается в том, что окружающие здоровые ткани в области повреждения инфильтруют мезенхимальными стволовыми клетками на стадии острого воспаления, при этом используют клетки, прошедшие не более 4-х пассажей всего или не более 2-х с момента разморозки, при этом используют мезенхимальные стволовые клетки, в клеточной популяции которых доля CD90, CD105, CD73 и CD29-положительных клеток превышает 90%, а доля CD11b, CD14, CD45 и CD34-положительных клеток не превышает 5%, кроме того, используют мезенхимальные стволовые клетки, способные к дифференцировке по остеогенному, хондрогенному и адипогенному направлениям. Изобретение обеспечивает стимулирование роста и регенерацию клеток для лечения обморожений и ожогов. 2 табл., 9 ил.
Способ лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга и выращенных в условиях гипоксии, в ходе которого окружающие здоровые ткани в области повреждения инфильтруют мезенхимальными стволовыми клетками на стадии острого воспаления, при этом используют клетки, прошедшие не более 4-х пассажей всего или не более 2-х с момента разморозки, при этом используют мезенхимальные стволовые клетки, в клеточной популяции которых доля CD90, CD105, CD73 и CD29-положительных клеток превышает 90%, а доля CD11b, CD14, CD45 и CD34-положительных клеток не превышает 5%, кроме того, используют мезенхимальные стволовые клетки, способные к дифференцировке по остеогенному, хондрогенному и адипогенному направлениям.
| СПОСОБ ЛЕЧЕНИЯ ОТМОРОЖЕНИЙ ПО ПРИНЦИПУ СВЧ-НАГРЕВА | 2007 |
|
RU2360713C2 |
| МАТЕРИАЛ СТВОЛОВЫХ КЛЕТОК, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2708329C2 |
| СПОСОБ ЛЕЧЕНИЯ ДЛИТЕЛЬНО НЕЗАЖИВАЮЩЕЙ РАНЫ И/ИЛИ РАНЕВОЙ ПОЛОСТИ | 2012 |
|
RU2512681C2 |
| АРХИРЕЕВ С.О | |||
| и др | |||
| НОВЫЙ МЕТОД В ЛЕЧЕНИИ ДЛИТЕЛЬНО НЕЗАЖИВАЮЩИХ, ИНФИЦИРОВАННЫХ РАН С ИСПОЛЬЗОВАНИЕМ СРЕДЫ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК / Материалы 2 Международного Конгресса "РАНЫ И РАНЕВЫЕ ИНФЕКЦИИ С КОНФЕРЕНЦИЕЙ: ПРОБЛЕМЫ АНЕСТЕЗИИ И ИНТЕНСИВНОЙ ТЕРАПИИ | |||
Авторы
Даты
2021-05-26—Публикация
2020-09-30—Подача