Область техники, к которой относится изобретение
Настоящее изобретение касается мультипотентных стволовых клеток взрослого человека (далее взрослые стволовые клетки), полученных из жировой ткани человека, и более конкретно, мультипотентных взрослых стволовых клеток, полученных из жировой ткани молочной железы человека, которые можно поддерживать в недифференцированном состоянии в течение длительного периода времени за счет формирования сфер и которые имеют высокую пролиферативную активность. Кроме того, настоящее изобретение касается способа выделения и поддержания взрослых стволовых клеток, способа дифференцировки взрослых стволовых клеток в нервные клетки, жировые клетки, клетки хряща, остеогенные клетки и высвобождающие инсулин бета-клетки поджелудочной железы, клеточного терапевтического агента для лечения остеоартрита, остеопороза и диабета и клеточного терапевтического агента для формирования ткани молочной железы.
Предшествующий уровень техники
Биотехнология 21-го века предоставляет возможность новых решений проблем, связанных с продуктами питания, окружающей средой и со здоровьем человека, конечной целью этих решений является процветание человека. В последние годы технологию использования стволовых клеток рассматривают как новый способ лечения неизлечимых болезней. Ранее для лечения неизлечимых болезней человека предлагались трансплантация органов, генная терапия и т.д., но их эффективное использование не было достигнуто из-за иммунного отторжения, ограничений в поставке органов, недостаточного развития векторов и недостаточного знания генов, приводящих к болезни.
Поэтому с ростом интереса к исследованиям стволовых клеток было установлено, что тотипотентные стволовые клетки, способные формировать все органы путем пролиферации и дифференцировки, могут обеспечить не только лечение большинства болезней, но также и существенно излечивать поражения органов. Кроме того, многие ученые высказали предположение, что стволовые клетки можно использовать для регенерации всех органов и лечения неизлечимых болезней, включая болезнь Паркинсона, различные виды рака, диабет и повреждения спинного мозга.
Стволовые клетки представляют собой клетки, обладающие не только способностью к самовоспроизведению, но также и способностью дифференцироваться, по меньшей мере, в две разные клетки, и могут быть разделены на тотипотентные стволовые клетки, плюрипотентные стволовые клетки и мультипотентные стволовые клетки.
Тотипотентные стволовые клетки представляют собой клетки, имеющие тотипотентные свойства, способные к развитию в одного полноценного индивидуума, и эти свойства характерны для клеток до стадии 8 бластоцитов после оплодотворения ооцита сперматозоидом. Когда эти клетки выделены и пересажены в матку, каждая из них может развиться в одного полноценного индивидуума.
Плюрипотентные стволовые клетки представляют собой клетки, способные к развитию в различные клетки и ткани, происходящие из эктодермальных, мезодермальных и эндодермальных листков, и получаемые из внутренней массы клеток, расположенных внутри бластоцисты, образующейся спустя 4-5 дней после оплодотворения. Эти клетки называются "эмбриональными стволовыми клетками" и могут дифференцироваться в различные другие клетки тканей, но не могут сформировать новые целые организмы.
Мультипотентные стволовые клетки представляют собой стволовые клетки, способные к дифференцировке только в клетки, характерные для определенных тканей и органов, содержащих эти клетки, и вовлечены не только в рост и развитие различных тканей и органов в эмбриональном, неонатальном и взрослом периодах жизни, но также и в поддержание гомеостаза взрослой ткани, и выполняют функцию стимулирования регенерации при повреждении ткани. Тканеспецифичные мультипотентные клетки все вместе называют "взрослыми стволовыми клетками".
Взрослые стволовые клетки получают путем отбора клеток из различных органов человека и развития клеток в стволовые клетки, которые характеризуются тем, что они дифференцируются только в определенные ткани. Однако недавно были проведены исключительно успешные эксперименты по дифференцировке взрослых стволовых клеток в различные ткани, включая клетки печени.
Мультипотентные стволовые клетки были впервые выделены из взрослого костного мозга (Jiang et al., 5 Nature, 418:41, 2002) и затем также были найдены в других различных взрослых тканях (Verfaillie, Trends Cell Biol, 12:502, 2002). Другими словами, хотя костный мозг представляет собой наиболее широко известный источник стволовых клеток, мультипотентные стволовые клетки были также найдены в коже, кровеносных сосудах, мышцах и мозге (Tomas et al., Nat. Cell Biol., 3:778, 2001; Sampaolesi et al., Science, 301:487, 2003; Jiang et al., Exp. Hematol, 30:896, 10 2002). Однако стволовые клетки во взрослых тканях, таких как костный мозг, встречаются очень редко, и такие клетки являются трудными для культивирования без индукции дифференцировки, их также трудно культивировать в отсутствие специально подобранной среды. А именно, изолированные стволовые клетки очень трудно поддержать в условиях in vitro.
Недавно было обнаружено, что жировая ткань представляет собой новый источник мультипотентных стволовых клеток (Cousin et al, BBRC, 301:1016, 2003; Miranville et al., Circulation, 110:349, 2004; Gronthos et al., J. Cell Physiol, 189:54, 2001; Seo et al., BBRC, 328:258, 2005). А именно, сообщалось, что группа недифференцированных клеток входит в состав жировой ткани человека, полученной при липосакции, и способна дифференцироваться в жировые клетки, остеогенные клетки, миобласты и хондробласты (Zuk et al., Tissue Eng., 7:211, 2001; Rodriguez et al., BBRC, 315:255, 2004). Эта жировая ткань обладает тем преимуществом, что она может быть извлечена в больших количествах и, таким образом, она привлекает внимание как новый источник стволовых клеток, который лишен существующих недостатков.
Кроме того, недавние исследования с использованием модельных экспериментов на животных указывают, что полученные из жировой ткани клетки обладают способностью восстанавливать мышцы и стимулировать дифференцировку кровеносных сосудов в нервной ткани. Таким образом, эти полученные из жировой ткани клетки привлекают внимание как новый источник стволовых клеток.
Стволовые клетки, полученные из жировой ткани, известные до настоящего времени, включают взрослые стволовые клетки, полученные из жировой ткани человека, которые могут дифференцироваться в эпителиальные клетки (Brzoska et al., BBRC, 330:142, 2005), взрослые стволовые клетки, полученные из жировой ткани человека, которые могут дифференцироваться в остеогенные и жировые клетки (Сао et al., BBRC, 332:370, 2005), взрослые стволовые клетки, полученные из жировой ткани человека, которые могут дифференцироваться в нервные клетки (Safford et al, BBRC, 294:371, 2002), стволовые клетки, полученные из жировой ткани крысы, которые могут дифференцироваться в жировые клетки (Ogawa et al., BBRC, 319:511, 2004), стволовые клетки, полученные из жировой ткани крысы, которые могут дифференцироваться в остеогенные и хондрогенные клетки (Ogawa et al., BBRC, 313:871, 2004), стволовые клетки, полученные из жировой ткани человека, которые могут дифференцироваться в клетки хряща (Biomaterials, 10 25:3211, 2004), стволовые клетки, полученные из жировой ткани крысы, которые могут дифференцироваться в нервные клетки (Fujimura et al., BBRC, 333:116, 2005), и стволовые клетки, полученные из жировой ткани, которые могут дифференцироваться в костные клетки, клетки хряща, нервные клетки или мышечные клетки (US Patent No.6,777,231).
Однако большинство стволовых клеток, полученных из жировой ткани, известных до настоящего времени, являются стволовыми клетками, полученными из жировой ткани животных, не являющихся людьми. Даже если они являются стволовыми клетками, полученными из жировой ткани человека, они ограничиваются клетками, происходящими из тканей, полученных при липосакции брюшного жира, и виды клеток, которые могут быть дифференцированы из этих стволовых клеток, также ограничены. В частности, изолированные стволовые клетки имеют низкую скорость пролиферации и их трудно поддерживать в недифференцированном состоянии в течение длительного периода времени и, таким образом, они имеют ограничения в применении.
Соответственно этому, авторы настоящего изобретения предприняли значительные усилия для получения мультипотентных взрослых стволовых клеток, которые имеют высокую скорость пролиферации, могут поддерживаться в недифференцированном состоянии в течение длительного периода времени путем формирования сфер и могут дифференцироваться в большее количество различных клеток, и в результате обнаружили, что мультипотентные стволовые клетки, выделенные из жировой ткани человека, могут дифференцироваться в различные клетки, включая остеогенные клетки, хондрогенные клетки, нервные клетки, астроциты, жировые клетки и выделяющие инсулин бета-клетки поджелудочной железы, имеют очень высокую скорость пролиферации и могут поддерживаться в недифференцированном состоянии в течение длительного периода времени путем формирования сфер, таким образом, выполнив настоящее изобретение.
Раскрытие изобретения
Таким образом, целью настоящего изобретения было предоставить мультипотентные взрослые стволовые клетки, полученные из жировой ткани человека, которые имеют высокую скорость пролиферации и могут поддерживаться в недифференцированном состоянии в течение длительного периода времени путем формирования сфер, а также способ их получения.
Другая цель настоящего изобретения состоит в том, чтобы предоставить способ дифференцировки указанных мультипотентных стволовых клеток в нервные клетки, астроциты, клетки хряща, остеогенные клетки, жировые клетки и высвобождающие инсулин бета-клетки поджелудочной железы, а также клеточные терапевтические агенты, содержащие указанные дифференцированные клетки или взрослые стволовые клетки.
Для достижения вышеупомянутых целей настоящее изобретение в одном аспекте предоставляет способ получения взрослых стволовых клеток, включающий культивирование клеток, полученных из жировой ткани человека, в среде, содержащей N-ацетил-L-цистеин (NAC), и последующий отбор культивированных клеток, то есть взрослых стволовых клеток, которые характеризуются следующим: (а) демонстрируют положительные иммунологические реакции на CD73, CD90, CD29, CD44 и CD105 и отрицательные иммунологические реакции на CD33, CD34, CD45, CD4, CD31, CD62p, CD14 и HLA-DR; (b) растут с прикреплением к пластиковому материалу, демонстрируя веретенообразную морфологию и формируя сферы в среде, содержащей CORM-2, что делает возможным их поддержание в недифференцированном состоянии в течение длительного периода времени; и (с) обладают способностью дифференцироваться в клетки мезодермального происхождения.
В настоящем изобретении NAC-содержащая среда дополнительно содержит аскорбиновую кислоту, кальций, rEGF, BPE, инсулин и гидрокортизон.
В другом аспекте настоящее изобретение предоставляет способ поддержания взрослых стволовых клеток в недифференцированном состоянии, включающий культивирование взрослых стволовых клеток, полученных указанным выше способом, в среде, содержащей CORM-2, для формирования сфер.
В настоящем изобретении среда, содержащая CORM-2, предпочтительно представляет собой бессывороточную среду, которая дополнительно содержит раствор противогрибковых антибиотиков, гидрокортизон, инсулин, rEGF, FGF, B27 и β-меркаптоэтанол.
В еще одном аспекте настоящее изобретение предоставляет взрослые стволовые клетки, полученные указанным выше способом, которые характеризуются следующим: (а) демонстрируют положительные иммунологические реакции на CD73, CD90, CD29, CD44 и CD105 и отрицательные иммунологические реакции на CD33, CD34, CD45, CD4, CD31, CD62p, CD 14 и HLA-DR; (b) растут с прикреплением к пластиковому материалу, демонстрируя веретенообразную морфологию и формируя сферы в среде, содержащей CORM-2, что делает возможным их поддержание в недифференцированном состоянии в течение длительного периода времени; и (с) обладают способностью дифференцироваться в клетки мезодермального происхождения.
В настоящем изобретении взрослые стволовые клетки предпочтительно культивируются в недифференцированном состоянии, по меньшей мере, в течение 16 пассажей, и клетки мезодермального происхождения предпочтительно представляют собой клетки хряща, остеогенные клетки, нервные клетки, астроциты, жировые клетки и высвобождающие инсулин бета-клетки поджелудочной железы.
В еще одном аспекте настоящее изобретение предоставляет способ дифференцировки взрослых стволовых клеток в нервные клетки, включающий следующие стадии: (а) преинкубацию взрослых стволовых клеток в среде DMEM, содержащей ВМЕ и FBS; и (b) обработку проинкубированной смеси DMSO и ВНА, чтобы вызвать дифференцировку в нервные клетки. Кроме того, настоящее изобретение предоставляет клеточный терапевтический агент для лечения нервного заболевания, который содержит указанные дифференцированные нервные клетки в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет способ дифференцировки взрослых стволовых клеток в клетки хряща, включающий культивирование взрослых стволовых клеток в среде α-МЕМ, содержащей TFG-β1, L-аскорбат-2-фосфат и инсулин. Кроме того, настоящее изобретение предоставляет клеточный терапевтический агент для лечения остеоартрита, который содержит указанные дифференцированные клетки хряща в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет способ дифференцировки взрослых стволовых клеток в остеогенные клетки, включающий смешивание взрослых стволовых клеток с трикальцийфосфатом (TCP) и изотрансплантацию указанной смеси. Кроме того, настоящее изобретение предоставляет клеточный терапевтический агент для лечения костного дефицита, который содержит указанные дифференцированные остеогенные клетки в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет способ дифференцировки взрослых стволовых клеток в жировые клетки, включающий культивирование взрослых стволовых клеток в среде α-МЕМ, содержащей дексаметазон, индометацин, инсулин и IBMX. Кроме того, настоящее изобретение предоставляет клеточный терапевтический агент для формирования ткани молочной железы, который содержит указанные дифференцированные жировые клетки в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет способ дифференцировки взрослых стволовых клеток в бета-клетки поджелудочной железы, высвобождающие инсулин, включающий следующие стадии: (а) культивирование взрослых стволовых клеток в среде DMEM с низким содержанием глюкозы, содержащей никотинамид, β-меркаптоэтанол и FBS в течение 12-72 часов; и (b) последующее культивирование данных клеток среде DMEM с высоким содержанием глюкозы, содержащей никотинамид, β-меркалтоэтанол и FBS в течение 4-7 дней. Кроме того, настоящее изобретение предоставляет клеточный терапевтический агент для лечения диабета, который содержит указанные дифференцированные бета-клетки поджелудочной железы, высвобождающие инсулин, в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет клеточный терапевтический агент для лечения нервного заболевания, содержащий взрослые стволовые клетки, обладающие способностью дифференцировки в нервные клетки, в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет клеточный терапевтический агент для лечения диабета, содержащий взрослые стволовые клетки, обладающие способностью дифференцировки в бета-клетки поджелудочной железы, высвобождающие инсулин в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет клеточный терапевтический агент для лечения остеоартрита, содержащий взрослые стволовые клетки, обладающие способностью дифференцировки в клетки хряща, в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет клеточный терапевтический агент для лечения костного дефицита, содержащий взрослые стволовые клетки, обладающие способностью дифференцировки в остеогенные клетки, в качестве активных ингредиентов.
В еще одном аспекте настоящее изобретение предоставляет клеточный терапевтический агент для формирования ткани молочной железы, содержащий взрослые стволовые клетки, имеющие способность дифференцирования в жировые клетки, как активные компоненты.
Упомянутые выше и другие цели, особенности и воплощения настоящего изобретения станут более понятыми из приведенного далее описания осуществления изобретения и прилагаемой формулы изобретения.
Краткое описание чертежей
Фигура 1 демонстрирует фотографии мультипотентных стволовых клеток, полученных из жировой ткани человека согласно настоящему изобретению, сделанные при 100-кратном увеличении.
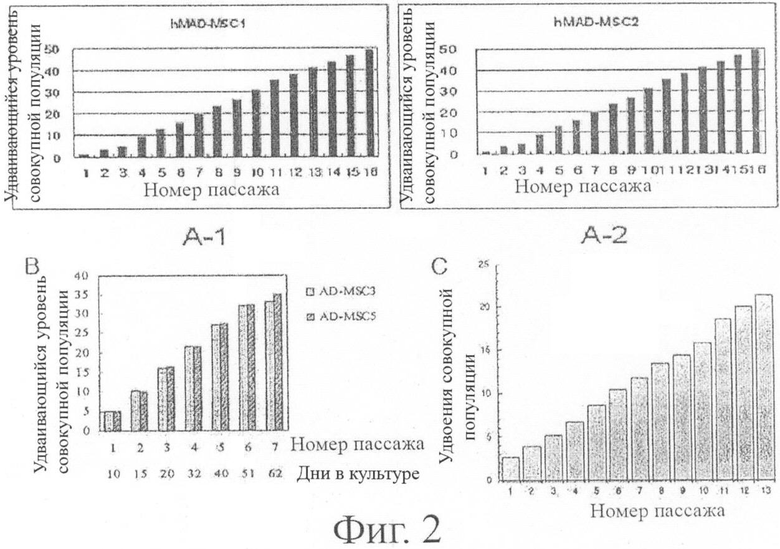
Фигура 2 демонстрирует скорость удваивания числа клеток в растущей популяции (CPDL) мультипотентных стволовых клеток, полученных из жировой ткани человека согласно настоящему изобретению. А-1 и А-2: мультипотентные стволовые клетки, полученные из жировой ткани человека согласно настоящему изобретению; и В и С: стволовые клетки, полученные из жировой ткани, согласно известному уровню техники.
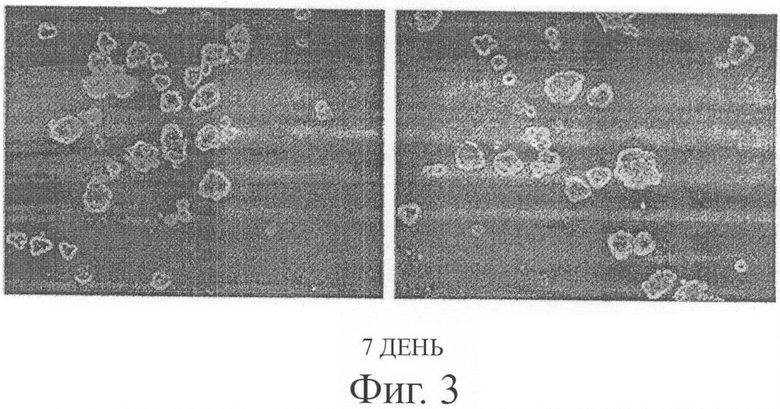
Фигура 3 демонстрирует фотографии сфер, образующихся через 7 дней после культивирования мультипотентных стволовых клеток, полученных из жировой ткани молочной железы человека согласно настоящему изобретению, сделанные при 200-кратном увеличении.
Фигура 4 представляет собой фотографию, сделанную при 200-кратном увеличении, для демонстрации формы сферы, образованной при пролиферации стволовой клетки в агаре.
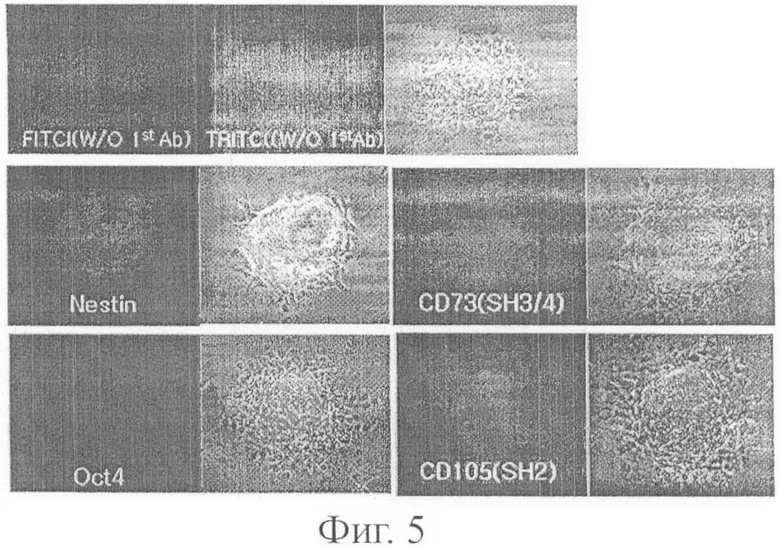
Фигура 5 показывает фотографии, сделанные при 100-кратном увеличении, которые демонстрируют экспрессию нестина (Nestin), Oct4, SH2, SH3/4 в мультипотентных стволовых клетках настоящего изобретения, полученных из жировой ткани человека, которые культивировались в виде сфер в среде МЕВМ, содержащей CORM-2, после чего проводилось иммунное окрашивание.
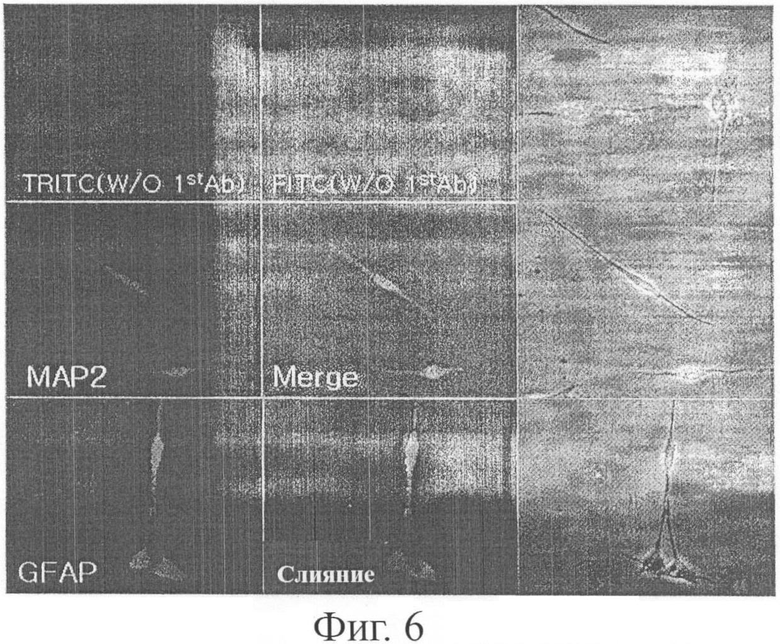
Фигура 6 показывает, что мультипотентные стволовые клетки, полученные из жировой ткани человека согласно настоящему изобретению, дифференцировались в нервные клетки и астроциты.
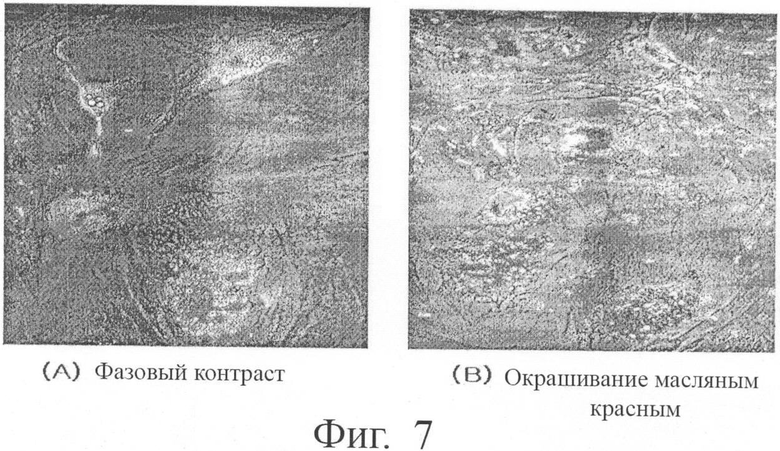
Фигура 7 показывает фотографии жировых клеток, дифференцированных из мультипотентных стволовых клеток, полученных из жировой ткани человека согласно настоящему изобретению, сделанные при 200-кратном увеличении. А: дифференциальный фазовый контраст; и В: окрашивание масляным красным О (oil red О).
Фигура 8 показывает фотографии клеток хряща, дифференцированных из мультипотентных стволовых клеток, полученных из жировой ткани человека согласно настоящему изобретению, сделанные при 100-кратном увеличении. А: дифференциальный фазовый контраст; и В: результаты окрашивания алциановым голубым (alcian blue) демонстрируют дифференцировку в клетки хряща.
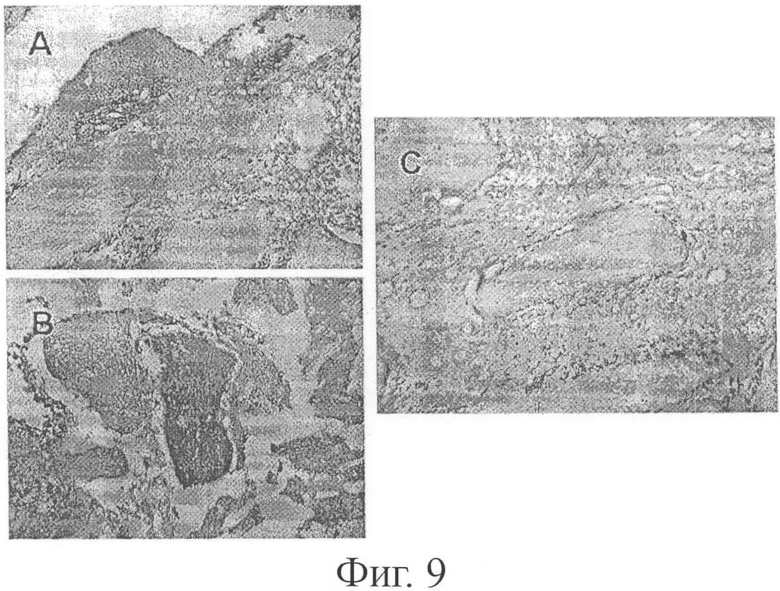
Фигура 9 показывает остеогенные клетки, дифференцированные из мультипотентных стволовых клеток, полученных из жировой ткани человека согласно настоящему изобретению. А: группа, обработанная одним TCP; В: группа, обработанная смесью стволовых клеток костного мозга и TCP; и С: группа, обработанная смесью TCP и стволовых клеток, полученных из жировой ткани.
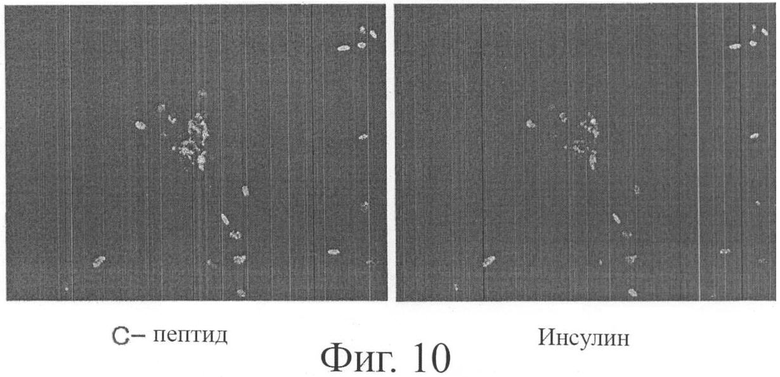
Фигура 10 показывает результаты иммунного окрашивания для бета-клеток поджелудочной железы, высвобождающих инсулин, дифференцированных из мультипотентных стволовых клеток, полученных из жировой ткани человека согласно настоящему изобретению.
Осуществление изобретения и предпочтительные воплощения
Настоящее изобретение касается мультипотентных стволовых клеток, выделенных из жировой ткани молочной железы человека.
В настоящем изобретении мультипотентные стволовые клетки были сначала выделены и очищены из жировой ткани молочной железы человека следующим способом. Изолированная человеческая жировая ткань была промыта PBS, тонко порезана и затем подвергнута перевариванию в среде DMEM с добавлением коллагеназы типа 1 (1 мг/мл) при 37°С в течение 2 часов. После промывки PBS ткань центрифугировалась при 1000 об/мин в течение 5 минут. Супернатант был удален, а осадок, оставшийся на дне, был промыт PBS и затем отцентрифугирован при 1000 об/мин в течение 5 минут. Полученный осадок был пропущен через сито с размером отверстий 100 мкм для удаления остатков ткани и затем промыт PBS. Затем осадок был проинкубирован в среде DMEM (10% FBS, 2 мМ NAC, 0,2 мМ аскорбиновой кислоты). На следующий день неприкрепленные клетки были отмыты при помощи PBS, и оставшиеся клетки культивировались в среде K-NAC (среда Keratinocyte-SFM + 2 мМ NAC + 0,2 мМ аскорбиновой кислоты + 0,09 мМ кальция + 5 нг/мл rEGF + 50 мкг/мл ВРЕ + 5 мкг/мл инсулина + 74 нг/мл гидрокортизона), при этом среда заменялась через каждые два дня. Таким образом был получен раствор мультипотентных стволовых клеток из жировой ткани молочной железы человека.
Была проанализирована скорость пролиферации мультипотентных стволовых клеток, полученных из жировой ткани молочной железы человека, в результате чего было обнаружено, что CPDL постепенно увеличивался до числа пассажей 16, что указывает на то, что стволовые клетки имеют высокую скорость пролиферации.
В то же время для получения культуры стволовых клеток в виде сфер, 5×104-1×105 клеток/мл изолированных мультипотентных стволовых клеток, полученных из жировой ткани, было посеяно в каждую лунку 6-луночного планшета, которая содержала среду МЕВМ (10 мкМ CORM-2 (димер трикарбонилдихлорорутения (II)), В27, 5 мл раствора противогрибковых антибиотиков (100Х), 1 мкг/мл гидрокортизона, 5 мкг/мл инсулина, 20 нг/мл EGF, 40 нг/мл FGF и β-меркаптоэтанол), в результате чего они начали формировать сферические структуры через 3 дня после посева. Это позволяет предполагать, что стволовые клетки имеют высокую скорость пролиферации, оставаясь при этом в недифференцированном состоянии.
Способы получения мультипотентных стволовых клеток, экспрессирующих желательные поверхностные антигены, из жидкой питательной среды стволовых клеток, полученных из жировой ткани человека, как описано выше, включают способ FACS с использованием проточного цитометра с функцией сортировки (Int. Immunol, 10 (3): 275, 1998), использующий магнитные гранулы, и пэннинг, использующий антитело, специфически распознающее мультипотентные стволовые клетки (J. Immunol, 141 (8): 2797, 1998). Кроме того, способы получения мультипотентных стволовых клеток из большого количества питательной среды культуры включают способ, где антитела, специфически распознающие молекулы, экспрессированные на поверхности клеток (в дальнейшем называемые "поверхностные антигены"), применяются по одному или в комбинации на колонках.
Способы сортировки с использованием проточной цитометрии могут включать придание заряда каплям воды и способ захвата клеток. В любом из этих способов антитело, специфически узнающее антиген на поверхности клетки, является флуоресцентно меченым, интенсивность флуоресценции, испускаемой от антитела, связанного с молекулой, экспрессированной на поверхности клетки, преобразуется в электрический сигнал, в результате чего может быть количественно оценено количество экспрессированного антигена. Также можно разделить клетки, экспрессирующие множество поверхностных антигенов, путем комбинации разных типов флуоресценции, используемых для мечения антител. Примеры флуоресцентных меток, которые могут применяться в этом случае, включают FITC (флуоресцеинизотиоцианат), РЕ (фикоэритрин), АРС (алло-фикоцианин), TR (Техас Красный), Су 3, CyChrome, Красный 613, Красный 670, ТРИ-Колор, Quantum Red и т.д.
Способы FACS, использующие проточный цитометр, включают: способ, где накапливается вышеупомянутая питательная среда для стволовых клеток, из которой клетки удаляют, например, центрифугированием, и окрашивают непосредственно антителами; и способ, где клетки культивируются и выращиваются в подходящей среде и затем окрашиваются антителами. Окрашивание клеток выполняется путем смешивания первичного антитела, распознающего поверхностный антиген в исследуемом образце клеток, и инкубированием этой смеси на льду в течение от 30 минут до 1 часа. Когда первичное антитело является флуоресцентно меченым, клетки выделяют с помощью проточного цитометра после промывки. Когда первичное антитело не является флуоресцентно меченым, клетки реагируют с первичным антителом и флуоресцентно меченым вторичным антителом, способным связываться с первичным антителом, смешиваются после промывки, и инкубируются в ледяной воде в течение от 30 минут до 1 часа. После промывания клетки, окрашенные первичными и вторичными антителами, выделяются с помощью поточного цитометра.
Различные поверхностные антигены могут включать ассоциированные с гематопоэзом антигены, поверхностные антигены мезенхимальных клеток и антигены, специфические для нейронов нервной системы. Ассоциированные с гематопоэзом антигены включают CD34, CD45 и т.д., поверхностные антигены мезенхимальных клеток включают SH-2, SH-3 и т.д., и антигены, специфические для нейронов нервной системы, включают NSE, GFAP и т.д. Применение антител, распознающих описанные выше поверхностные антигены, по одному или в комбинации позволяет получить желательные клетки.
Выделенные мультипотентные взрослые стволовые клетки согласно настоящему изобретению были проанализированы с применением проточного цитометра, и в результате продемонстрировали положительные ответы на CD73, CD90, CD29, CD44 и CD105. Кроме того, мультипотентные стволовые клетки продемонстрировали отрицательные иммунологические ответы на CD33, CD34, CD45, CD4, CD31, CD62p, CD14 и HLA-DR.
Кроме того, было обнаружено, что изолированные мультипотентные взрослые стволовые клетки согласно настоящему изобретению представляют собой мультипотентные стволовые клетки, которые могут дифференцироваться в нервные клетки, астроциты, остеогенные клетки, клетки хряща, жировые клетки и высвобождающие инсулин бета-клетки поджелудочной железы.
Сведения, подтверждающие возможность осуществления изобретения
Далее настоящее изобретение будет описано более подробно с помощью примеров. Однако необходимо понимать, что данные примеры приводятся только с целью иллюстрации и не могут рассматриваться как ограничивающие рамки настоящего изобретения.
Пример 1. Выделение мультипотентных стволовых клеток из жировой ткани
Жировую ткань выделяли из ткани женской молочной железы, предоставленной Центром рака молочной железы Национального университета Сеула (Breast Cancer Center, Seoul National University), ткань промывали PBS и затем тонко измельчали. Измельченную ткань обрабатывали коллагеназой типа 1 (1 мг/мл) в среде DMEM при 37°С в течение 2 часов. Обработанную ткань промывали PBS и затем центрифугировали при 1000 об/мин в течение 5 минут. Супернатант удаляли, а осадок, оставшийся на дне, промывали PBS и затем центрифугировали при 1000 об/мин в течение 5 минут. Полученный осадок отфильтровывали через сито с размером отверстий 100 мкм для удаления неразрушенной ткани и затем промывали PBS. Полученные клетки инкубировали в среде DMEM (10% FBS, 2 мМ NAC, 0,2 мМ аскорбиновой кислоты). На следующий день неприкрепленные клетки промывали PBS и культивировали в среде Keratinocyte-SFM (содержащей 2 мМ NAC, 0,2 мМ аскорбиновой кислоты, 0,09 мМ кальция, 5 нг/мл rEGF, 50 нг/мл ВРЕ, 5 нг/мл инсулина и 74 нг/мл гидрокортизона), при этом среду заменяли через каждые два дня, в результате чего были получены мультипотентные стволовые клетки. Фигура 1 показывает фотографии мультипотентных стволовых клеток из жировой ткани человека, выделенных как описано выше, сделанные при 100-кратном увеличении.
Пример 2. Исследование скорости пролиферации стволовых клеток из жировой ткани
Жировую ткань получали из каждого из нескольких образцов ткани молочной железы человека согласно способу выделения, описанному в примере 1. Для исследования скорости пролиферации мультипотентных стволовых клеток, полученных из выделенной жировой ткани молочной железы человека, 2×105 клеток отбирали в колбу Т-75 и затем измеряли CPDL (уровень удваивания совокупной популяции), который выражали как функцию от числа пассажей. CPDL (cumulative population doubling level) представляет собой индекс, отражающий скорость пролиферации клеток и рассчитываемый по следующему уравнению:
CPDL=ln(Nf/Ni)/ln2, где Ni: исходное число посеянных клеток; и Nf: конечное число клеток.
В результате проведенного анализа, как показано в "А-1" и "А-2" на фигуре 2, взрослые стволовые клетки (hMAD-MCS1 и hMAD-MCS2) согласно настоящему изобретению имели CPDL примерно 50 при числе пассажей 16.
В то же время "В" и "С" на Фигуре 2 демонстрируют значения CPDL для ранее известных стволовых клеток, полученных из жировой ткани человека (Lin et al., Stem Cells and Development, 14:92, 2005; Zuk et al. Tissue Eng., 7:211, 2001) как функцию от числа пассажей. Как показано на Фигуре 2, значения CPDL для этих клеток были 30-35 и 21 при числе пассажей 7 и 13 соответственно.
Эти результаты позволяют предполагать, чтоб взрослые стволовые клетки согласно настоящему изобретению имеют очень высокую скорость пролиферации.
Пример 3. Иммунологические характеристики мультипотентных стволовых клеток из жировой ткани
Мультипотентные стволовые клетки из жировой ткани, полученные в примере 1, промывали PBS и обрабатывали трипсином. Обработанные клетки собирали и центрифугировали при 1000 об/мин в течение 5 минут. Супернатант удаляли, а осадок затем промывали смесью 2% FBS и PBS с последующим центрифугированием при 1000 об/мин в течение 5 минут. Супернатант удаляли, клетки суспендировали в PBS, и 1×105 клеток из каждого образца помещали в лунки планшета. Антитела (конъюгированные с R-фикоэритрином моноклональные антитела мыши против белка человека) вносили в каждую лунку и инкубировали на льду в течение 40 минут. После инкубации среду центрифугировали при 1000 об/мин в течение 5 минут. Супернатант удаляли, а клетки промывали PBS и центрифугировали при 1000 об/мин в течение 5 минут. Супернатант удаляли еще раз, и клетки промывали PBS и центрифугировали при 1000 об/мин в течение 5 минут. После удаления супернатанта клетки фиксировали 1% параформальдегидом и анализировали с помощью проточного цитометра.
В результате, как показано в таблице 1, взрослые стволовые клетки из жировой ткани согласно настоящему изобретению демонстрировали положительные ответы в 91% на CD73, 97% на CD90, 96% на CD29, 83% на CD44 и 80% на CD105. Кроме того, стволовые клетки настоящего изобретения демонстрировали отрицательные иммунологические ответы на все CD33, CD34, CD45, CD4, CD31, CD62p, CD14 и HLA-DR.
Пример 4. Формирование сфер из мультипотентных стволовых клеток из жировой ткани
Мультипотентные стволовые клетки из жировой ткани молочной железы человека (5×104-1×105/мл), полученные в примере 1, высевали в каждую лунку 6-луночного планшета, содержащего бессывороточную среду МЕВМ, содержащую 10 мкМ CORM-2,5 мл раствора противогрибковых антибиотиков (100Х), 1 нг/мл гидрокортизона, 5 мкг/мл инсулина, 20 нг/мл EGF, 40 нг/мл FGF, B27 и β-меркаптоэтанол. В результате клетки начали формировать сферические структуры через 3-7 дней после посева, и как показано на фигуре 3 и фигуре 4, клетки пролиферировали с образованием сфер даже на 7-10 день после посева.
Кроме того, стволовые клетки согласно настоящему изобретению культивировали в агаре. В результате, как показано на фигуре 4, из клеток сформировались сферы.
В то же время 5×104 стволовых клеток, полученных в примере 1, высевали в каждую лунку 24-луночного планшета и подсчитывали число сфер при каждом пассаже (см. таблицу 2). В результате, как показано в таблице 2, клетки поддерживали сферическое состояние, что указывает на то, что клетки могут пролиферировать и поддерживаться в течение длительного периода времени. Кроме того, как показано на фигуре 5, Oct4 был положительно экспрессирован, что указывает на то, что клетки имеют высокую скорость пролиферации при их поддержании в недифференцированном состоянии.
Пример 5. Анализ иммунного окрашивания стволовых клеток из жировой ткани
Стволовые клетки из жировой ткани в виде сфер, полученные в примере 4, три раза промывали PBS и 4% параформальдегидом в PBS в течение 30 минут. После трехкратного промывания PBS сферы инкубировали с PBS, содержащим 0,1% Тритона Х-100, в течение 10 минут. После трехкратного промывания PBS сферы инкубировали с 10% NGS в течение 1 часа и затем с PBS, содержащим первичное антитело, в течение ночи. После трехкратного промывания PBS сферы инкубировали с вторичным антителом в темной комнате в течение 1 часа. После трехкратного промывания PBS сферы использовали для анализа.
В результате, как показано на фигуре 5, мультипотентные стволовые клетки в виде сфер согласно настоящему изобретению продемонстрировали положительные ответы на все нестины, которые могут рассматриваться как маркеры нервных клеток-предшественников, Oct4, который может рассматриваться как маркер недифференцированных клеток, и SH2 (CD105) и SH3/4 (CD73), которые являются маркерами мезенхимальных стволовых клеток.
Пример 6. Дифференцировка мультипотентных стволовых клеток из жировой ткани в нервные клетки и астроциты
Мультипотентные стволовые клетки из жировой ткани, полученные в примере 1, проинкубировали в среде DMEM с добавлением 1 мМ ВМЕ и 10% FBS в течение 24 часов. После преинкубации стволовые клетки инкубировали в среде для индукции дифференцировки нервных клеток, содержащей 1% диметилсульфоксида и 100 мкМ ВНА (бутилгидроксианизол, butylated hydrxyanisole), в течение 90 минут для индукции дифференцировки в нервные клетки с последующим иммунным окрашиванием (фигура 6). В результате, как показано на фигуре 6, мультипотентные стволовые клетки из жировой ткани человека согласно настоящему изобретению продемонстрировали положительные ответы на GFAP (глиальный фибриллярный кислый белок), который является антигеном, специфическим для астроцитов в нервной системе, и МАР2 (ассоциированный с микротрубочками белок 2), который является специфическим для нервных клеток.
Фотографии в первом ряду на фигуре 6 показывают результаты для группы отрицательного контроля, которые демонстрируют, что дифференцированные клетки не обладают флуоресценцией FITC и TRITC. Фотография МАР2 на левой стороне второго ряда демонстрирует красную флуоресценцию TRITC, указывая на то, что МАР2 был экспрессирован. На фазово-контрастной фотографии и фотографии Merge было обнаружено, что красная флуоресценция представляла собой флуоресценцию, испускаемую клетками, в которых был экспрессирован МАР2. Кроме того, фотография GFAP на левой стороне третьего ряда демонстрировала зеленую флуоресценцию FITC, и на фазово-контрастной фотографии и фотографии Merge было видно, что зеленая флуоресценция представляла собой флуоресценцию, испускаемую клетками, в которых был экспрессирован GFAP. Эти результаты позволяют предполагать, что мультипотентные стволовые клетки из жировой ткани человека согласно настоящему изобретению дифференцировались в нервные клетки и астроциты.
Пример 7. Дифференцировка мультипотентных стволовых клеток из жировой ткани в жировые клетки
Мультипотентные стволовые клетки из жировой ткани, полученные в примере 1, инкубировали в среде MEM, содержащей 5% FBS, 1 мкМ дексаметазона, 200 мкМ индометацина, 10 мкг/мл инсулина и 0,5 мМ IBMX (3-изобутил-1-метилксантина) в течение 2 недель для индукции дифференцировки в жировые клетки, после чего их анализировали с использованием метода окрашивания масляным красным О. В результате, как показано на фигуре 7, было видно, что мультипотентные стволовые клетки из жировой ткани человека дифференцировались в жировые клетки.
Пример 8. Дифференцировка мультипотентных стволовых клеток из жировой ткани в клетки хряща
Мультипотентные стволовые клетки из жировой ткани (10 клеток/мл), полученные в примере 1, высевались в центр каждой лунки 24-луночного планшета в количестве 10 мкл. Затем клетки инкубировали в среде α-МЕМ, содержащей 5% FBS, 10 нг/мл TFG-β1, 50 мкМ L-аскорбат-2-фосфата и 6,25 мкг/мл инсулина в течение 2 недель для индукции дифференцировки в клетки хряща. Затем с использованием метода окрашивания с алциановым голубым анализировали, произошла ли дифференцировка мультипотентных стволовых клеток в клетки хряща. В результате, как показано на фигуре 8, было установлено, что мультипотентные стволовые клетки из жировой ткани человека дифференцировались в клетки хряща.
Пример 9. Дифференцировка мультипотентных стволовых клеток из жировой ткани в остеогенные клетки
Взрослые стволовые клетки из жировой ткани (10 клеток/мл), полученные в примере 1, смешивали с TCP (трикальцийфосфатом) и изотрансплантировали подкожно собакам. Через 14 дней ткань обрабатывали и анализировали с использованием метода окрашивания Н&Е. В результате, как показано на фигуре 9, было показано, что группа (А), обработанная только TCP, продемонстрировала проникновение воспалительных клеток в область вокруг TCP, а группа (В), обработанная смесью TCP и стволовых клеток костного мозга, продемонстрировала воспалительные ответы, остающиеся интактными вокруг TCP. Однако в группе (С), обработанной смесью TCP и стволовых клеток из жировой ткани, большинство TCP было поглощено и наблюдался типичный начальный остеогенез, а также наблюдались остеобласт-подобные клетки, многоядерные остеокласт-подобные клетки и костное межклеточное вещество. Эти результаты показывают, что мультипотентные стволовые клетки из жировой ткани человека дифференцировались в остеогенные клетки.
Пример 10. Дифференцировка мультипотентных стволовых клеток из жировой ткани в высвобождающие инсулин бета-клетки поджелудочной железы
Мультипотентные стволовые клетки из жировой ткани, полученные в примере 1, инкубировали в среде DMEM с низким содержанием глюкозы, содержащей 10 моль/л никотинамида, 1 ммоль/л β-меркаптоэтанола и 10% FBS, в течение 24 часов и затем инкубировали в среде DMEM с высоким содержанием глюкозы, содержащей 10 ммоль/л никотинамида, 1 ммоль/л β-меркаптоэтанола и 5% FBS, в течение 5 дней для индукции дифференцировки в высвобождающие инсулин бета-клетки поджелудочной железы. После индукции дифференцировки клетки анализировали иммунным окрашиванием, и результаты показаны на фигуре 10. Как показано на фигуре 10, в клетках присутствовали С-пептид и инсулин. Как известно в данной области техники, проинсулин, который разделяется на инсулин и С-пептид, продуцируется в высвобождающих инсулин бета-клетках поджелудочной железы. Таким образом, вышеупомянутые результаты показывают, что мультипотентные стволовые клетки из жировой ткани согласно настоящему изобретению дифференцировались в высвобождающие инсулин бета-клетки поджелудочной железы.
Хотя настоящее изобретение было подробно описано только в отношении определенных характеристик, для квалифицированных специалистов в данной области техники должно быть очевидно, что это описание касается только предпочтительного воплощения и не ограничивает рамки настоящего изобретения. Таким образом, основные рамки настоящего изобретения будут определяться прилагаемой формулой изобретения и ее эквивалентами.
Промышленная применимость
Как подробно описано выше, хотя мультипотентные стволовые клетки согласно настоящему изобретению представляют собой взрослые стволовые клетки, они могут дифференцироваться в большее количество различных видов клеток, чем это было показано ранее для взрослых стволовых клеток из жировой ткани. В частности, взрослые мультипотентные стволовые клетки настоящего изобретения способны дифференцироваться в нервные клетки, астроциты, жировые клетки, хондрогенные клетки, остеогенные клетки или высвобождающие инсулин бета-клетки поджелудочной железы, и являются эффективными при лечении остеопороза, остеоартрита, заболеваний нервов, диабета и т.д., и также полезны для формирования ткани молочной железы. Кроме того, взрослые стволовые клетки настоящего изобретения формируют сферы в бессывороточной среде, так что они могут быть выделены с высокой чистотой, могут поддерживаться в недифференцированном состоянии в течение длительного периода времени и обладают высокой скоростью пролиферации. Таким образом, взрослые стволовые клетки настоящего изобретения полезны в качестве клеточных терапевтических агентов.



Настоящее изобретение относится к области клеточной биологии и может быть использовано в трансплантологии и тканевой инженерии. Предложен способ получения взрослых стволовых клеток с мультипотентными свойствами, предусматривающий выделение их из бурой жировой ткани человека и культивирование в питательной среде, включающей N-ацетил-L-цистеин, а также способ длительного поддержания этих клеток в недифференцированном состоянии за счет формирования сфер в CORM-2-содержащей среде. Взрослые стволовые клетки, получаемые предложенным способом, характеризуются высокой скоростью пролиферации, положительным иммунологическим ответом на CD73, CD90, CD29, CD44 и CD105, отрицательным иммунологическим ответом на CD33, CD34, CD45, CD4, CD31, CD62p, CD14 и HLA-DR и способностью к дифференцировке в клетки мезодермального происхождения. В частности, показана возможность получения из взрослых стволовых клеток по изобретению нервных клеток, хрящевых клеток, остеогенных клеток, жировых клеток и продуцирующих инсулин β-клеток поджелудочной железы. 8 н. и 4 з.п. ф-лы, 15 ил., 2 табл.
1. Способ получения взрослых стволовых клеток, включающий стадии:
(a) культивирования выделенных клеток, происходящих из бурой жировой ткани человека, в среде DMEM (модифицированной Дюльбекко среде Игла), содержащей N-ацетил-L-цистеин (NAC);
(b) удаления неприкрепленных клеток из культуры; и
(c) культивирования остальных прикрепленных клеток в среде K-SFM (бессывороточной среде для кератиноцитов), содержащей NAC, для получения взрослых стволовых клеток.
2. Способ получения взрослых стволовых клеток по п.1, в котором среда K-SFM, содержащая NAC, дополнительно содержит аскорбиновую кислоту, кальций, rEGF, BPE, инсулин и гидрокортизон.
3. Способ поддержания взрослых стволовых клеток в недифференцированном состоянии, включающий культивирование взрослых стволовых клеток, полученных способом по п.1 или 2, в среде, содержащей CORM-2, до образования сфер.
4. Способ по п.3, в котором CORM-2-содержащая среда представляет собой бессывороточную среду, которая дополнительно содержит раствор противогрибкового антибиотика, гидрокортизон, инсулин, rEGF, FGF, B27 и β-меркаптоэтанол.
5. Взрослые стволовые клетки, полученные способом по п.1 и характеризующиеся тем, что они
(а) проявляют положительные иммунологические ответы на CD73, CD90, CD29, CD44 и CD105 и отрицательные иммунологические ответы на CD33, CD34, CD45, CD4, CD31, CD62p, CD14 и HLA-DR;
(b) растут с прикреплением к пластиковому материалу, проявляют веретенообразную морфологию и поддерживаются в недифференцированном состоянии в течение долгого времени путем образования сфер в среде, содержащей CORM-2, и
(c) обладают способностью к дифференцировке в клетки мезодермального происхождения.
6. Взрослые стволовые клетки по п.5, которые подвергаются культивированию в недифференцированном состоянии в течение по меньшей мере 16 пересевов.
7. Взрослые стволовые клетки по п.5, где клетки мезодермального происхождения выбираются из группы, состоящей из хрящевых клеток, остеогенных клеток, нервных клеток, астроцитов, жировых клеток и продуцирующих инсулин β-клеток поджелудочной железы.
8. Способ дифференцировки взрослых стволовых клеток, полученных по п.1, в нервные клетки, включающий стадии:
(а) предварительной инкубации взрослых стволовых клеток, полученных по п.1, в среде DMEM, содержащей ВМЕ и FBS, с образованием преинкубированной культуральной жидкости, и
(b) обработки преинкубированной культуральной жидкости DMSO и ВНА для индукции дифференцировки взрослых стволовых клеток в нервные клетки.
9. Способ дифференцировки взрослых стволовых клеток, полученных по п.1, в хрящевые клетки, включающий культивирование взрослых стволовых клеток, полученных по п.1, в среде α-МЕМ, содержащей TGF-β, L-аскорбат-2-фосфат и инсулин.
10. Способ дифференцировки взрослых стволовых клеток, полученных по п.1, в остеогенные клетки, включающий смешивание взрослых стволовых клеток, полученных по п.1, с трехзамещенным фосфатом кальция (TCP) и изотрансплантацию смеси.
11. Способ дифференцировки взрослых стволовых клеток, полученных по п.1, в жировые клетки, включающий культивирование взрослых стволовых клеток, полученных по п.1, в среде α-МЕМ, содержащей дексаметазон, индометацин, инсулин и IBMX.
12. Способ дифференцировки взрослых стволовых клеток, полученных по п.1, в продуцирующие инсулин β-клетки поджелудочной железы, включающий стадии:
(a) культивирования взрослых стволовых клеток, полученных по п.1, в среде DMEM с низким содержанием глюкозы, содержащей никотинамид, β-меркаптоэтанол и FBS, в течение 12-72 ч; и
(b) последующего культивирования этих клеток в среде DMEM с высоким содержанием глюкозы, содержащей никотинамид, β-меркаптоэтанол и FBS в течение 4-7 дней.
| ZUK ЕТ AL., Tissue Eng., 7, р.211, 2001 | |||
| LIN ЕТ AL., Stem Cell and Development, 87 (1), 29-42, 2001 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ВЫДЕЛЕНИЯ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2004 |
|
RU2252252C1 |
Авторы
Даты
2011-01-20—Публикация
2005-12-20—Подача