ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет предварительной заявки на патент США № 62/196771, поданной 24 июля 2015 года, и предварительной заявки на патент США № 62/197469, поданной 27 июля 2015 года, которые включены в данный документ посредством ссылки в полном объеме.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область техники
Настоящее изобретение в целом относится к новым способам лечения или профилактики дисфункции иммунной системы. Более конкретно, настоящее изобретение относится к способам лечения или профилактики состояний или нарушений, ассоциированных с: дисфункцией иммунной системы; аномальной экспрессией антигена созревания B-клеток (BCMA); и/или улучшения эффективности лечения нарушений, характеризующихся дисфункцией иммунной системы или аномальной экспрессией BCMA, путем предупреждения выделения BCMA с помощью одного или более модуляторов гамма-секретазы или их производных или других соединений, которые блокируют выделение BCMA.
Введение
В-клетки имеют патогенную значимость и служат терапевтической мишенью при генерализованных иммунопатологических заболеваниях, таких как аутоиммунное заболевание, включая без ограничения системную красную волчанку (SLE), и гематологические злокачественные новообразования, включая без ограничения множественную миелому (MM).
Представители надсемейства рецепторов фактора некроза опухолей (TNFR) и их лиганды играют критическую роль в регуляции иммунной системы и, в частности, контролируют пролиферацию, дифференцировку и апоптоз В-клеток. К ним относятся рецепторы смерти (CD95, TNFR1, DR4, DR5), которые вызывают апоптоз, и рецепторы, лишенные домена смерти (CD30, CD40, TNFR2), которые способствуют пролиферации, дифференцировке и выживанию клеток. Представители семейства TNF, принадлежащие к сети лиганд-рецептор фактора активации В-клеток (BAFF, также называемого zTNF4, BLyS, TALL-1, THANK, TNFSF13B), были тесно связаны с гомеостазом В-клеток.
Сеть лиганд-рецептор BAFF контролирует свойства В-клеток. BAFF можно распознать с помощью рецепторов BAFF-R (также называемых BR3), трансмембранного активатора и партнера кальциевого модулятора и лиганда циклофилина (TACI) и антигена созревания B-клеток (BCMA); эти BAFF-рецепторы экспрессируются преимущественно на В-клетках в зависимости от времени и стадии созревания; передача сигналов BAFF через каждый из этих рецепторов опосредует множество функций В-клеток. Неспособность В-клеток принимать сигналы, опосредуемые BAFF, резко ухудшает созревание В-клеток и поддержание популяций зрелых В-клеток. Напротив, избыточная передача сигнала BAFF в B-клетках значительно увеличивает количество периферических В-клеток и связана с хроническими воспалительными нарушениями, аутоиммунными заболеваниями и некоторыми злокачественными новообразованиями.
Авторы настоящего изобретения ранее продемонстрировали, что BCMA присутствует в сыворотке пациентов с различными В-клеточными злокачественными новообразованиями, например, MM, хроническим лимфоцитарным лейкозом (CLL), макроглобулинемией Вальденстрема (WM) и B-клеточными неходжкинскими лимфомами (NHL). Кроме того, авторы настоящего изобретения обнаружили, что уровни BCMA увеличиваются в сыворотке пациентов с MM, CLL и WM по сравнению с нормальными здоровыми субъектами, не страдающими этими видами рака. Авторы настоящего изобретения также показали, что присутствие BCMA в сыворотке способствует патологическому процессу при различных В-клеточных злокачественных новообразованиях по меньшей мере потому, что BCMA сыворотки может взаимодействовать с BAFF и блокировать его, что, в свою очередь, может уменьшить активность BCMA и других BAFF-рецепторов на здоровых В-клетках и нарушить нормальную иммунную функцию. Таким образом, в данной области техники существует потребность в средствах для снижения уровней BCMA сыворотки, чтобы предотвратить блокирование BAFF и, возможно, других B-клеточных лигандов.
Краткое описание
Настоящее изобретение в целом обеспечивает новое и синергическое лечение состояний и нарушений, связанных с дисфункцией иммунной системы.
В различных вариантах осуществления в настоящем изобретении предусматривают способы лечения или профилактики дисфункции иммунной системы у субъекта, включающие введение субъекту одного или более модуляторов гамма-секретазы или их производного или других соединений, которые блокируют выделение BCMA.
В различных вариантах осуществления в настоящем изобретении предусматривают способы лечения или профилактики дисфункции иммунной системы, аномальной экспрессии BCMA и/или выделения BCMA из клеток, которые экспрессируют этот белок, у субъекта, включающие введение субъекту одного или более модуляторов гамма-секретазы или их производного или другие соединения, которые блокируют выделение BCMA. В определенных вариантах осуществления настоящее изобретение предусматривает способы снижения выделения BCMA из плазматической клетки, включающие этапы, на которых один или более модуляторов гамма-секретазы или их производное вводят субъекту с дисфункцией иммунной системы, где необязательно дисфункция иммунной системы обусловлена экспрессией BCMA.
В различных вариантах осуществления в настоящем изобретении предусматривают способы снижения выделения BCMA из плазматических и/или B-клеток, включающие введение субъекту одного или более модуляторов гамма-секретазы или их производного.
В различных вариантах осуществления в настоящем изобретении предусматривают способы повышения эффективности лечения субъекта, который проходит лечение состояния или нарушения, связанного с В-клетками, или другого заболевания, связанного с аномальной экспрессией BCMA, включающие введение одного или более модуляторов гамма-секретазы или их производного в дополнение к существующему лечению, предоставляемому субъекту.
В определенных вариантах осуществления в настоящем изобретении предусматривают способы повышения эффективности лечения субъекта, который проходит лечение состояния или нарушения, связанного с В-клетками, или другого заболевания, связанного с аномальной экспрессией BCMA, включающие, включающие введение одного или более модуляторов гамма-секретазы или их производного в дополнение к существующему лечению, предоставляемому субъекту.
В различных вариантах осуществления дисфункция иммунной системы представляет собой состояние или нарушение, связанное с В-клетками.
В конкретном варианте осуществления состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из MM, CLL, WM, B-клеточной неходжкинской лимфомы, плазмоцитомы, лимфомы Ходжкина, фолликулярных лимфом, лимфом из мелких клеток с нерасщепленным ядром, эндемической лимфомы Беркитта, спорадической лимфомы Беркитта, лимфомы краевой зоны, экстранодальной лимфомы лимфоидной ткани слизистых оболочек, нодальной моноцитоидной В-клеточной лимфомы, селезеночной лимфомы, мантийноклеточной лимфомы, крупноклеточной лимфомы, диффузной смешанно-клеточной лимфомы, иммунобластной лимфомы, первичной медиастинальной В-клеточной лимфомы, В-клеточной лимфангиомы легких, мелкоклеточной лимфоцитарной лимфомы, пролиферации В-клеток неопределенного злокачественного потенциала, лимфоматоидного гранулематоза, посттрансплантационного лимфопролиферативного расстройства, иммунорегуляторного расстройства, ревматоидного артрита, миастении, идиопатической тромбоцитопенической пурпуры, антифосфолипидного синдрома, болезни Чагаса, болезни Грейвса, гранулематоза Вегенера, узелкового полиартериита, синдрома Шегрена, пемфигуса обыкновенного, склеродермии, рассеянного склероза, антифосфолипидного синдрома, связанного с ANCA васкулита, болезни Гудпасчера, болезни Кавасаки, аутоиммунной гемолитической анемии и быстро прогрессирующего гломерулонефрита, болезни тяжелой цепи, первичного или иммуноцитарного амилоидоза или моноклональной гаммапатии неясного генеза.
В одном варианте осуществления состояние или нарушение, связанное с В-клетками, представляет собой злокачественное новообразование, связанное с В-клетками.
В конкретном варианте осуществления состояние или нарушение, связанное с В-клетками, представляет собой злокачественное новообразование, связанное с плазматическими клетками.
В одном варианте осуществления состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из MM, WM, CLL и B-клеточной неходжкинской лимфомы.
В определенном варианте осуществления состояние или нарушение, связанное с В-клетками, представляет собой ММ.
В конкретном варианте осуществления состояние или нарушение, связанное с В-клетками, представляет собой аутоиммунное заболевание.
В определенном варианте осуществления состояние или нарушение, связанное с В-клетками, представляет собой системную красную волчанку.
В конкретном варианте осуществления состояние или нарушение, связанное с В-клетками, представляет собой ревматоидный артрит.
В дополнительном варианте осуществления состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из идиопатической тромбоцитопенической пурпуры, миастении и аутоиммунной гемолитической анемии.
В конкретном варианте осуществления модулятор гамма-секретазы выбран из группы, состоящей из ингибитора секретазы I (GSI I) Z-Leu-Leu-норлейцина; ингибитора γ-секретазы II (GSI II); ингибитора γ-секретазы III (GSI III), N-бензилоксикарбонил-Leu-лейциналя, N-(2-нафтоил)-Val-фенилаланиналя; ингибитора γ-секретазы III (GSI IV); ингибитора γ-секретазы III (GSI V), N-бензилоксикарбонил-Leu-фенилаланиналя; ингибитора γ-секретазы III (GSI VI), 1-(S)-эндо-N-(1,3,3)-триметилбицикло[2.2.1]гепт-2-ил)-4-фторфенилсульфонамида; ингибитора γ-секретазы III (GSI VII), ментилоксикарбонил-LL-CHO; ингибитора γ-секретазы III (GSI IX), (DAPT), сложного трет-бутилового эфира N-[N-(3,5-дифторфенацетил-L-аланил)]-S-фенилглицина; ингибитора γ-секретазы X (GSI X), сложного трет-бутилового эфира {1S-бензил-4R-[1-(1S-карбамоил-2-фенэтилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрокси-5-фенилпентил}карбаминовой кислоты; ингибитора γ-секретазы XI (GSI XI), 7-амино-4-хлор-3- метоксиизокумарина; ингибитора γ-секретазы XII (GSI XII), Z-Ile-Leu-CHO; ингибитора γ-секретазы XIII (GSI XIII), Z-Tyr-Ile-Leu-CHO; ингибитора γ-секретазы XIV (GSI XIV), Z-Cys(t-Bu)-Ile-Leu-CHO; ингибитора γ-секретазы XVI (GSI XVI), сложного метилового эфира N-[N-3,5-дифторфенацетил]-L-аланил-S-фенилглицина; ингибитора γ-секретазы XVII (GSI XVII); ингибитора γ-секретазы XIX (GSI XIX), бензо[e][1,4]диазепин-3-ил)-бутирамида; ингибитора γ-секретазы XX (GSI XX), (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамида; ингибитора γ-секретазы XXI (GSI XXI), (S,S)-2-[2-(3,5-дифторфенил)-ацетиламино]-N-(1-метил-2-оксо-5-фенил-2-,3-дигидро-1H-бензо[e][1,4]диазепин-3-ил)-пропионамида; ингибитора гамма(40)-секретазы I, N-транс-3,5-диметоксициннамоил-Ile-лейциналя; ингибитора гамма(40)-секретазы II, N-трет-бутилоксикарбонил-Gly-Val-валиналя, изовалерил-V V-Sta-A-Sta-OCH3; MK-0752 (Merck); MRK-003 (Merck); семагацестата/LY450139 (Eli Lilly); RO4929097; PF-03084014; BMS-708163; MPC-7869 (модификатор γ-секретазы), YO-01027 (дибензазепин), соединения E ([(2S)-2-{[(3,5-дифторфенил)ацетил]амино}-N-[(3S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил]пропанамид], доступен от Alexis Biochemicals), LY411575 (Eli Lilly and Co.), L-685458 (Sigma-Aldrich), BMS-289948 (4-хлор-N-(2,5-дифторфенил)-N-((1R)-{4-фтор-2-[3-(1H-имидазол-1-ил)пропил]фенил}этил)бензолсульфонамида гидрохлорид) и BMS-299897 (4-[2-((1R)-1-{[(4-хлорфенил)сульфонил]-2,5-дифторанилино}этил)-5-фторфенил]бутановая кислота) (Bristol Myers Squibb).
В определенном варианте осуществления модулятор гамма-секретазы или другое соединение, которое блокирует выделение BCMA, внутривенно вводят субъекту.
В определенном варианте осуществления модулятор гамма-секретазы или другое соединение, которое блокирует выделение BCMA, перорально вводят субъекту.
В одном варианте осуществления субъект получает лечение или ранее получал лечение с применением лучевой терапии, химиотерапии, трансплантации, иммунотерапии, гормональной терапии или фотодинамической терапии.
В конкретном варианте осуществления субъект получает лечение или ранее получал лечение состояния или нарушения, связанного с В-клетками, которое нацелено в отношении BCMA на B-клетках.
В конкретном варианте осуществления у субъекта есть гематологическое злокачественное новообразование с обнаруживаемыми уровнями BCMA сыворотки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Сопроводительные графические материалы, включенные в настоящее описание и образующие его часть, иллюстрируют несколько вариантов осуществления раскрытых способов и композиций и вместе с описанием служат для пояснения принципов раскрытых способов.
На ФИГ. 1A и 1B показана диаграмма, изображающая модель того, как активность гамма-секретазы способствует выделению BCMA клетками MM.
На ФИГ. 1A показан сценарий, при котором активность гамма-секретазы способствует выделению BCMA (темно-серые полукруги) из опухолевых клеток MM (опухолевая клетка MM; слева). Когда происходит выделение BCMA, оно высвобождает внеклеточную часть BCMA из опухолевой клетки MM. Выделенный BCMA взаимодействует с BAFF (светло-серые круги), предотвращая активацию интактного BCMA с помощью BAFF на нормальных B-клетках (нормальная B-клетка; справа), что снижает выработку антител нормальными B-клетками.
На ФИГ. 1B показан сценарий, при котором активность гамма-секретазы снижается с помощью ингибитора гамма-секретазы. Снижение активности гамма-секретазы уменьшает выделение BCMA (темно-серые полукруги) из опухолевых клеток MM (опухолевая клетка MM; слева). Обычно BAFF (светло-серые круги) взаимодействует с интактным BCMA на незлокачественных B-клетках (нормальная B-клетка; справа), что приводит к нормальной выработке антител.
На ФИГ. 2 показан график уровней BCMA в надосадочной жидкости культивируемых клеток опухоли LAGκ-1A, полученных из ксенотрансплантата человеческой MM, который выращивали у мышей с тяжелым комбинированным иммунодефицитом и инкубировали с различными концентрациями ингибитора гамма-секретазы E424354 в течение 48 часов. Уровни BCMA в надосадочной жидкости показаны для клеток, культивируемых при концентрациях (справа налево) 0 (контроль), 256 пM, 1,28 нM, 6,4 нM, 32 нM, 160 нM, 800 нM, 4 мкM и 20 мкM E424354.
На ФИГ. 3 показан график уровней BCMA в надосадочной жидкости культивируемых клеток опухоли LAGκ-1A, инкубированных с различными концентрациями ингибитора гамма-секретазы E424354 в течение 72 часов. Уровни BCMA в надосадочной жидкости показаны для клеток, культивируемых при концентрациях (справа налево) 0 (контроль), 256 пM, 1,28 нM, 6,4 нM, 32 нM, 160 нM, 800 нM, 4 мкM и 20 мкM E424354.
На ФИГ. 4 показан график уровней BCMA в надосадочной жидкости культивируемых при более высокой плотности клеток опухоли LAGκ-1A, инкубированных с различными концентрациями ингибитора гамма-секретазы E424354 в течение 48 часов. Уровни BCMA в надосадочной жидкости показаны для клеток, культивируемых при концентрациях (справа налево) 0 (контроль), 256 пM, 1,28 нM, 6,4 нM, 32 нM, 160 нM, 800 нM, 4 мкM и 20 мкM E424354.
На ФИГ. 5 показан график уровней BCMA в надосадочной жидкости клеток опухоли LAGκ-1A, культивируемых при более высокой плотности клеточной популяции и инкубированных с различными концентрациями ингибитора гамма-секретазы E424354 в течение 72 часов. Уровни BCMA в надосадочной жидкости показаны для клеток, культивируемых при концентрациях (справа налево) 0 (контроль), 256 пM, 1,28 нM, 6,4 нM, 32 нM, 160 нM, 800 нM, 4 мкM и 20 мкM E424354.
На ФИГ. 6 показан график уровней BCMA в надосадочной жидкости клеток опухоли LAGκ-1A, культивируемых при более высокой плотности и инкубированных с различными концентрациями ингибитора гамма-секретазы E424354 в течение 5 дней. Уровни BCMA в надосадочной жидкости показаны для клеток, культивируемых при концентрациях (справа налево) 0 (контроль), 256 пM, 1,28 нM, 6,4 нM, 32 нM, 160 нM, 800 нM, 4 мкM и 20 мкM E424354.
На ФИГ. 7 показан график, демонстрирующий процент жизнеспособных клеток опухоли LAGκ-1A, определяемый с помощью анализа MTS, после инкубации с различными концентрациями ингибитора гамма-секретазы E424354 в течение 24 часов. Процент жизнеспособных клеток показан для клеток, культивируемых при концентрациях (слева направо) 0 (контроль), 20 мкM, 4 мкM, 800 нM, 160 нM, 32 нM, 6,4 нM, 1,28 нM и 256 пM E424354.
На ФИГ. 8 показан график, демонстрирующий процент жизнеспособных клеток опухоли LAGκ-1A, определяемый с помощью анализа MTS, после инкубации с различными концентрациями ингибитора гамма-секретазы E424354 в течение 48 часов. Процент жизнеспособных клеток показан для клеток, культивируемых при концентрациях (слева направо) 0 (контроль), 20 мкM, 4 мкM, 800 нM, 160 нM, 32 нM, 6,4 нM, 1,28 нM и 256 пM E424354.
На ФИГ. 9 показан график, демонстрирующий процент жизнеспособных клеток опухоли LAGκ-1A, определяемый с помощью анализа MTS, после инкубации с различными концентрациями ингибитора гамма-секретазы E424354 в течение 72 часов. Процент жизнеспособных клеток показан для клеток, культивируемых при концентрациях (слева направо) 0 (контроль), 20 мкM, 4 мкM, 800 нM, 160 нM, 32 нM, 6,4 нM, 1,28 нM и 256 пM E424354.
На ФИГ. 10 показан график, демонстрирующий процент жизнеспособных клеток опухоли LAGκ-1A, определяемый с помощью анализа MTS, после инкубации с различными концентрациями ингибитора гамма-секретазы E424354 в течение 5 дней. Процент жизнеспособных клеток показан для клеток, культивируемых при концентрациях (слева направо) 0 (контроль), 20 мкM, 4 мкM, 800 нM, 160 нM, 32 нM, 6,4 нM, 1,28 нM и 256 пM E424354.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
A. Общее описание
Антиген созревания В-клеток (BCMA) экспрессируется на поверхности плазматических клеток и регулирует их выживание. BCMA обнаруживается в сыворотке пациентов с несколькими различными типами В-клеточных злокачественных новообразований, и уровни BCMA в сыворотке коррелируют с активностью заболевания и общей выживаемостью этих пациентов. Гамма-секретаза участвует в расщеплении связанного с мембраной BCMA и выделении внеклеточного домена BCMA в сыворотку. Не желая быть связанными какой-либо конкретной теорией, предполагают, что модуляторы гамма-секретазы будут уменьшать, предотвращать или блокировать расщепление BCMA и его выделение, тем самым предотвращая ассоциированную дисфункцию иммунной системы, например, аутоиммунное заболевание или гематологическое злокачественное новообразование. Кроме того, предполагают, что применение ингибиторов гамма-секретазы для предотвращения выделения BCMA также повысит эффективность средств для терапии, которые в настоящее время находятся на стадии клинического развития и нацелены на патологические В-клетки, экспрессирующие BCMA.
Не ограничиваясь теорией, в конкретных вариантах осуществления предусмотрена модель, в которой активность гамма-секретазы способствует выделению BCMA из патогенных В-клеток у субъекта, что, в свою очередь, способствует дисфункции иммунной системы у субъекта (см. ФИГ. 1A). Согласно этой модели активность гамма-секретазы в патогенных В-клетках (например, опухолевых клетках множественной миеломы) способствует выделению BCMA, при котором высвобождается внеклеточная часть BCMA (называемая в данном документе как растворимый BCMA или сывороточный BCMA) из B-клеток. Растворимый BCMA может блокировать циркулирующие лиганды BCMA, например, BAFF, что, в свою очередь, может предотвращать или снижать взаимодействие лигандов BCMA с BCMA на нормальных, непатогенных B-клетках. Согласно этой модели уменьшенные взаимодействия между лигандами BCMA, например, BAFF, и BCMA, присутствующим на поверхности нормальных, непатогенных В-клеток, нарушают нормальное функционирование иммунной системы, например выработку нормальных поликлональных антител.
Не ограничиваясь теорией, определенные варианты осуществления предусматривают модель, в которой снижение активности гамма-секретазы у субъекта, например, путем введения ингибитора гамма-секретазы, предотвращает выделение BCMA из патогенных B-клеток. Это позволяет лигандам BAFF и APRIL оставаться несвязанными, поскольку уровни растворимого BCMA теперь уменьшены; и, как результат, позволяют им выполнять свои нормальные функции по стимуляции В-клеток к выработке антител. Таким образом, обработка ингибитором гамма-секретазы должна лечить или предотвращать дисфункцию иммунной системы у субъекта (см. ФИГ. 1B). Согласно этой модели снижение активности гамма-секретазы предотвращает или уменьшает выделение BCMA патогенными В-клетками, например опухолевыми клетками MM, что, в свою очередь, уменьшает количество растворимого BCMA. Определенные варианты осуществления предусматривают, что снижение количества растворимого BCMA восстанавливает нормальные взаимодействия между лигандами BCMA, например, BAFF, и BCMA, присутствующим на поверхности нормальных, непатогенных B-клеток, тем самым восстанавливая нормальную иммунную функцию, например, выработку нормальных поликлональных антител (см. ФИГ. 1B).
Не ограничиваясь теорией, некоторые варианты осуществления предусматривают модель, в которой снижение активности гамма-секретазы в патогенных В-клетках (например, опухолевых клетках множественной миеломы) уменьшит количество BCMA, выделенного патогенными В-клетками, и тем самым увеличит количество BCMA, экспрессированного патогенными В-клетками (см. ФИГ. 1B). В определенных вариантах осуществления эта модель предполагает, что снижение активности гамма-секретазы в патогенных В-клетках повышает или улучшает эффективность терапевтического средства, которое связывается с BCMA и/или связывается с клетками, экспрессирующими этот рецептор клеточной поверхности, которое вводят для лечения состояния или нарушения, связанного с В-клетками. Терапевтические средства, которые связываются с BCMA и/или клеткой, экспрессирующей BCMA, включают без ограничения терапевтические антитела против BCMA или их фрагменты, конъюгаты антитела против BCMA и лекарственного средства и Т-клетки с химерными антигенными рецепторами (CAR-T-клетки), которые связываются с BCMA.
В различных вариантах осуществления настоящего изобретения, помимо прочего, предусматриваются средства для лечения иммунной системы, включающие один или более модуляторов гамма-секретазы или другие соединения, которые предотвращают выделение BCMA.
Все публикации, патенты и заявки на патенты, цитируемые в данном документе, включены в данный документ посредством ссылки в полном объеме.
B. Определения
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, как это обычно понимает специалист в данной области техники, к которой принадлежит настоящее изобретение. Хотя любые способы и материалы, подобные или эквивалентные описанным в данном документе, могут быть использованы в практике или тестировании настоящего изобретения, предпочтительные варианты осуществления композиций, способов и материалов описаны в данном документе. Для целей настоящего изобретения ниже определены следующие термины.
Форму единственного числа используют в данном документе для обозначения одного или более (т. e. по меньшей мере одного) грамматических объектов данной заявки. В качестве примера "элемент" означает один элемент или более элементов.
Используемый в данном документе термин «приблизительно» или «примерно» относится к количественному параметру, уровню, значению, числу, частоте, проценту, величине, размеру, количеству, массе или длине, которая изменяется на вплоть до 30, 25, 20, 25, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% от эталонного количественного параметра, уровня, значения, числа, частоты, процента, величины, размера, количества, массы или длины. В конкретных вариантах осуществления термины «приблизительно» или «примерно», предшествующие числовому значению, указывают значение плюс или минус диапазон 15%, 10%, 5% или 1%.
По всему настоящему описанию, если контекст не требует иного, слова «содержать», «содержит» и «содержащий» будут пониматься как подразумевающие включение заявленного этапа или элемента или группы этапов или элементов, но не исключение любого другого этапа или элемента или группы этапов или элементов. Выражение «состоящий из» подразумевает с включением и ограничивается тем, что следует за фразой «состоящий из». Таким образом, фраза «состоящий из» указывает, что перечисленные элементы являются необходимыми или обязательными и что никакие другие элементы не могут присутствовать. Выражение «состоящий по сути из» подразумевает включение любых элементов, перечисленных после фразы, и ограничивается другими элементами, которые не мешают или не способствуют активности или действию, указанным в настоящем раскрытии для перечисленных элементов. Таким образом, фраза «состоящий по сути из» указывает, что перечисленные элементы необходимы или обязательны, но что никакие другие элементы не являются факультативными и могут присутствовать или не присутствовать в зависимости от того, влияют ли они на активность или действие перечисленных элементов.
Ссылка по всему настоящему описанию на «один вариант осуществления», «вариант осуществления», «другой вариант осуществления», «конкретный вариант осуществления», «связанный вариант осуществления», «определенный вариант осуществления», «дополнительный вариант осуществления» или «еще один вариант осуществления» или их комбинации означает, что конкретный признак, структура или характеристика, описанные в связи с вариантом осуществления, включены по меньшей мере в один вариант осуществления настоящего изобретения. Таким образом, появление вышеперечисленных фраз в разных местах по всему настоящему описанию не обязательно относится к одному и тому же варианту осуществления. Более того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим способом в одном или более вариантах осуществления.
Термины «получать лечение», «лечение» и подобные используются в данном документе в общем смысле относительно получения желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения заболевания и/или может быть терапевтическим с точки зрения частичного или полного излечения заболевания и/или неблагоприятного воздействия, связанного с этим заболеванием. Термин «лечение», используемый в данном документе, охватывает любое лечение заболевания у млекопитающего и включает в себя: предотвращение возникновения заболевания у субъекта, который может быть предрасположен к заболеванию, но еще не установлено его наличие; ингибирование заболевания, т. e. прекращение его развития; или ослабление заболевания, т. e. обеспечение регрессии заболевания. Терапевтическое средство можно вводить до, во время или после начала заболевания или повреждения. Особый интерес представляет лечение существующего заболевания, когда лечение стабилизирует или уменьшает нежелательные клинические симптомы пациента.
Используемая в данном документе фраза «улучшение по меньшей мере одного симптома» относится к уменьшению одного или более симптомов заболевания или состояния, от которого субъект получает лечение. В конкретных вариантах осуществления заболевание или патологическое состояние, подвергаемое лечению, является состоянием или нарушением, связанным с В-клетками, при котором один или более улучшенных симптомов включают без ограничения слабость, усталость, одышку, легкое образование синяков и кровоточивость, частые инфекции, увеличенные лимфатические узлы, вздутый или болезненный живот (из-за увеличенных органов брюшной полости), боли в костях или суставах, переломы, незапланированную потерю веса, плохой аппетит, ночную потливость, устойчивую слабую лихорадку и снижение мочеиспускания (из-за нарушения функции почек). В конкретных вариантах осуществления заболевание или состояние, подвергаемое лечению, представляет собой множественную миелому, где один или более улучшенных симптомов включают боли в костях.
Используемое в данном документе выражение «предотвращать» и подобные слова, такие как «предотвращенный», «предотвращение» и т. д., указывают на подход к предотвращению, ингибированию или уменьшению вероятности возникновения или рецидива заболевания или состояния. Это также относится к задержке манифестации или рецидива заболевания или состояния или задержке возникновения или рецидива симптомов заболевания или состояния. Используемое в данном документе выражение «профилактика» и подобные слова также включают снижение интенсивности, эффекта, симптомов и/или бремени заболевания или состояния до манифестации или рецидива заболевания или состояния.
Используемый в данном документе термин «количество» относится к «количеству, эффективному для» или «эффективному количеству» клеток, достаточному для достижения полезного или желаемого профилактического или терапевтического результата, включая клинические результаты. В одном варианте осуществления эффективное количество относится к количеству ингибитора гамма-секретазы или его производного, достаточному для предотвращения, улучшения одного симптома заболевания или лечения заболевания, например, состояния или нарушения, связанного с В-клетками, предусматриваемых в настоящем документе.
«Профилактически эффективное количество» относится к количеству ингибитора гамма-секретазы или его производного, эффективному для достижения желаемого профилактического результата. Как правило, но не обязательно, так как профилактическая доза используется у субъектов на более ранней стадии заболевания или до него, профилактически эффективное количество меньше терапевтически эффективного количества.
«Терапевтически эффективное количество» ингибитора гамма-секретазы или его производного может варьироваться в зависимости от таких факторов, как состояние болезни, возраст, пол и вес индивидуума и средство для получения желаемого ответа у индивидуума. Терапевтически эффективное количество также относится к такому, при котором любые токсичные или вредные эффекты средства перевешиваются терапевтически благоприятными эффектами. Термин «терапевтически эффективное количество» включает количество, которое эффективно для «лечения» субъекта (например, пациента).
Используемые в данном документе термины «достаточные условия» или «при достаточных условиях» относятся к условиям для лечения субъекта одним или более средствами или композициями, предусмотренными в данном документе. В одном варианте осуществления «достаточные условия» включают введение достаточного количества, например, эффективного количества ингибитора гамма-секретазы или его производного субъекту, нуждающемуся в этом.
Используемые в данном документе термины «способствование», «усиление», «стимуляция» или «увеличение» в целом относятся к способности композиций, предусмотренных в данном документе, производить или вызывать больший физиологический ответ (т. e. измеримый эффект) по сравнению с ответом, вызываемым носителем или контрольной молекулой/композицией. Один такой измеримый физиологический ответ включает без ограничения увеличение цитолиза и/или уменьшение опухоли, увеличение выживаемости, повышение эффективности лечения по сравнению с нормальными субъектами, субъектами без лечения или с контрольным лечением. Физиологический ответ может быть увеличен по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 125%, 150%, 175%, 200% или больше по сравнению с ответом, измеренным у нормальных субъектов, субъектов без лечения или с контрольным лечением. «Повышенный» или «усиленный» ответ или свойство обычно является «статистически значимым» и может включать увеличение в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные дроби между ними и выше 1, например, 1,5, 1,6, 1,7, 1,8 и т. д.) относительно производимого нормальными субъектами, субъектами без лечения или с контрольным лечением.
Используемые в данном документе термины «снижение» или «понижение» или «уменьшение» или «сокращение» или «ослабление» относятся в целом к способности предусматриваемых композиций производить или вызывать меньший физиологический ответ (т. e. ниже расположенные эффекты) по сравнению с ответом, вызываемым носителем или контрольной молекулой/композицией, например, сниженное выделение BCMA. Физиологический ответ, например, выделение BCMA, может быть снижен по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 125%, 150%, 175%, 200% или больше по сравнению с ответом, измеренным у нормальных субъектов, субъектов без лечения или с контрольным лечением. «Уменьшенный» или «сниженный» ответ обычно является «статистически значимым» ответом и может включать уменьшение в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные дроби между ними и выше 1, например, 1,5, 1,6, 1,7, 1,8 и т. д.) ответа, производимого нормальными субъектами, субъектами без лечения или с контрольным лечением.
Выражение «дисфункция иммунной системы» означает любое нарушение или состояние иммунной системы. В различных вариантах осуществления дисфункция иммунной системы относится к нарушениям или состояниям иммунной системы, связанным с аномальными или патологическими уровнями растворимого BCMA в сыворотке или плазме субъекта. В различных вариантах осуществления дисфункция иммунной системы относится к нарушениям или состояниям иммунной системы, связанным с аномальными или патологическими уровнями экспрессии BCMA на иммунных клетках субъекта. Дисфункции иммунной системы включают нарушения как В-клеток, так и Т-клеток. Не желая быть связанными какой-либо конкретной теорией, предполагают, что существует множество различных типов дисфункции иммунной системы, которые можно лечить композициями и способами, предусмотренными в данном документе, поскольку измененный уровень экспрессии растворимого BCMA будет изменять эффекты его лигандов BAFF и APRIL на В-клетки и Т-клетки. В конкретных вариантах осуществления дисфункция иммунной системы встречается у пациентов с состояниями или нарушениями, связанными с В-клетками.
«Гематологическое злокачественное новообразование» представляет собой тип рака, который поражает кровь, костный мозг или лимфатические узлы. Гематологические злокачественные новообразования могут возникать из двух основных линий кроветворных клеток: линий миелоидных или лимфоидных клеток. Линия миелоидных клеток обычно производит гранулоциты, эритроциты, тромбоциты, макрофаги и тучные клетки, тогда как линии лимфоидных клеток производят В-клетки, Т-клетки, клетки естественных киллеров и плазматические клетки. Лимфомы, лимфоцитарные лейкозы и миелома происходят из линии лимфоидных клеток. Иллюстративные примеры гематологических злокачественных новообразований, которые можно лечить предусмотренными в данном документе композициями, включают миеломы, лейкозы и лимфомы. Другие иллюстративные примеры гематологических злокачественных опухолей, которые подходят для лечения в конкретных вариантах осуществления предусмотренных в данном документе способов, включают без ограничения MM, WM, острый миелоидный лейкоз (AML), хронический миелоидный лейкоз (CML), острый лимфатический лейкоз (ALL), CLL, болезнь Ходжкина, неходжкинскую лимфому, миелодиспластический синдром (MDS) или миелопролиферативные заболевания. Обычно гематологические злокачественные новообразования не формируют солидных опухолей.
Используемое в данном документе выражение «субъект», «субъект, нуждающийся в лечении», «субъект, нуждающийся в этом», «индивидуум» или «пациент» включает любое животное, которое проявляет симптом заболевания, нарушения или состояния, которое можно лечить композициями, предусмотренными в данном документе. В конкретных вариантах осуществления заболевание, нарушение или состояние относится к гематологическому злокачественному новообразованию, например, множественной миеломе. К подходящим субъектам относятся лабораторные животные (такие как мышь, крыса, кролик или морская свинка), сельскохозяйственные животные (такие как лошади, коровы, овцы, свиньи) и домашние животные или комнатные животные (такие как кошка или собака). В конкретных вариантах осуществления субъектом является млекопитающее. В определенных вариантах осуществления субъект - это примат, не являющийся человеком, и в предпочтительных вариантах осуществления субъектом является человек.
Термин «рецидив» относится к диагнозу возвращения или признакам и симптомам возвращения рака после периода улучшения или ремиссии.
Термин «ремиссия», также известный как «клиническая ремиссия», включает как частичную, так и полную ремиссию. При частичной ремиссии некоторые, но не все признаки и симптомы рака исчезли. При полной ремиссии все признаки и симптомы рака исчезли, хотя рак все еще может находиться в организме.
Термин «рефрактерный» относится к раку, который резистентен к терапии с использованием определенного терапевтического средства или не реагирует на нее. Рак может быть рефрактерным с начала лечения (т. e. не реагировать на первоначальное воздействие терапевтического средства) или в результате развития резистентности к терапевтическому средству либо в ходе первого периода лечения, либо во время последующего периода лечения.
Термин «средство» относится к природному или синтетическому полипептиду, полинуклеотиду, углеводу, жирной кислоте, химическому соединению или малой органической молекуле. В конкретных вариантах осуществления средство содержит модулятор гамма-секретазы.
C. Модуляторы гамма-секретазы
В различных вариантах осуществления субъекту вводят один или более модуляторов гамма-секретазы, например, ингибитор гамма-секретазы, или его производное, для предотвращения, лечения или улучшения по меньшей мере одного симптома дисфункции иммунной системы, состояния или нарушения, связанного с В-клетками, и/или для предотвращения выделения BCMA на B-клетках.
Выражение «модулятор гамма-секретазы» относится к соединению или средству, которое модулирует, увеличивает или уменьшает активность гамма-секретазы. К модуляторам гамма-секретазы относятся ингибиторы гамма-секретазы, которые уменьшают или снижают активность гамма-секретазы.
Описаны многочисленные ингибиторы гамма-секретазы. См., например, патенты США №№ 6756511; 6890956; 6984626; 7049296; 7101895; 7138400; 7144910; 7183303; Bihel et al. 2004; Best et al. 2006; Davies et al. 2007; El-Gendy and Adejare 2004; Laras et al. 2005; McLendon et al. 2000; Prasad et al. 2007; Shearman et al. 2000; и Tomita et al. 2004; каждый из которых включен в данный документ посредством ссылки в полном объеме.
Иллюстративные примеры модуляторов и ингибиторов гамма-секретазы включают без ограничения ингибитор секретазы I (GSI I) Z-Leu-Leu-норлейцин; ингибитор γ-секретазы II (GSI II); ингибитор γ-секретазы III (GSI III), N-бензилоксикарбонил-Leu-лейциналь, N-(2-нафтоил)-Val-фенилаланиналь; ингибитор γ-секретазы III (GSI IV); ингибитор γ-секретазы III (GSI V), N-бензилоксикарбонил-Leu-фенилаланиналь; ингибитор γ-секретазы III (GSI VI), 1-(S)-эндо-N-(1,3,3)-триметилбицикло[2.2.1]гепт-2-ил)-4-фторфенилсульфонамид; ингибитор γ-секретазы III (GSI VII), ментилоксикарбонил-LL-CHO; ингибитор γ-секретазы III (GSI IX), (DAPT), сложный трет-бутиловый эфир N-[N-(3,5-дифторфенацетил-L-аланил)]-S-фенилглицина; ингибитора γ-секретазы X (GSI X), сложный трет-бутиловый эфир {1S-бензил-4R-[1-(1S-карбамоил-2-фенэтилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрокси-5-фенилпентил}карбаминовой кислоты; ингибитор γ-секретазы XI (GSI XI), 7-амино-4-хлор-3-метоксиизокумарин; ингибитор γ-секретазы XII (GSI XII), Z-Ile-Leu-CHO; ингибитор γ-секретазы XIII (GSI XIII), Z-Tyr-Ile-Leu-CHO; ингибитор γ-секретазы XIV (GSI XIV), Z-Cys(t-Bu)-Ile-Leu-CHO; ингибитор γ-секретазы XVI (GSI XVI), сложный метиловый эфир N-[N-3,5-дифторфенацетил]-L-аланил-S-фенилглицина; ингибитор γ-секретазы XVII (GSI XVII); ингибитор γ-секретазы XIX (GSI XIX), бензо[e][1,4]диазепин-3-ил)-бутирамида; ингибитор γ-секретазы XX (GSI XX), (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамид; ингибитор γ-секретазы XXI (GSI XXI), (S,S)-2-[2-(3,5-дифторфенил)-ацетиламино]-N-(1-метил-2-оксо-5-фенил-2-,3-дигидро-1H-бензо[e][1,4]диазепин-3-ил)-пропионамид; ингибитор гамма(40)-секретазы I, N-транс-3,5-диметоксициннамоил-Ile-лейциналь; ингибитор гамма(40)-секретазы II, N-трет-бутилоксикарбонил-Gly-Val-валиналь, изовалерил-V V-Sta-A-Sta-OCH3; MK-0752 (Merck); MRK-003 (Merck); семагацестат/LY450139 (Eli Lilly); RO4929097; PF-03084014; BMS-708163; MPC-7869 (модификатор γ-секретазы), YO-01027 (дибензазепин), соединение E ([(2S)-2-{[(3,5-дифторфенил)ацетил]амино}-N-[(3S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил]пропанамид], доступен от Alexis Biochemicals), LY411575 (Eli Lilly and Co.), L-685458 (Sigma-Aldrich), BMS-289948 (4-хлор-N-(2,5-дифторфенил)-N-((1R)-{4-фтор-2-[3-(1H-имидазол-1-ил)пропил]фенил}этил)бензолсульфонамида гидрохлорид) и BMS-299897 (4-[2-((1R)-1-{[(4-хлорфенил)сульфонил]-2,5-дифторанилино}этил)-5-фторфенил]бутановая кислота) (Bristol Myers Squibb).
В конкретных вариантах осуществления модулятор или ингибитор гамма-секретазы, пригодный для применения в композициях и способах, предусмотренных в данном документе, включает любое средство, которое прямо или косвенно ингибирует расщепление BCMA с помощью гамма-секретазы или гамма-секретазной активности. В определенных вариантах осуществления ингибитор гамма-секретазы может уменьшать активность гамма-секретазы в клетке на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 100% по сравнению с клеткой, которая не контактировала с ингибитором гамма-секретазы. В определенных вариантах осуществления модулятор или ингибитор гамма-секретазы может уменьшать уровни гамма-секретазы в клетке на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 100% по сравнению с клеткой, которая не контактировала с модулятором или ингибитором гамма-секретазы.
В конкретных вариантах осуществления модулятор или ингибитор гамма-секретазы может уменьшать расщепление или выделение BCMA на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 100% по сравнению с уровнем в клетке или клетках, которые не контактировали с модулятором или ингибитором гамма-секретазы.
В конкретных вариантах осуществления модулятор или ингибитор гамма-секретазы может уменьшать BCMA, обнаруживаемый в сыворотке субъекта, которому вводили один или более ингибиторов гамма-секретазы, на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 100% по сравнению с сывороткой субъекта, которому не вводили один или более модуляторов или ингибиторов гамма-секретазы.
В конкретных вариантах осуществления введение модулятора или ингибитора гамма-секретазы субъекту может увеличивать взаимодействие между BAFF и BCMA на непатогенной В-клетке субъекта на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 100%, приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 2,5 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 30 раз, приблизительно в 40 раз, приблизительно в 50 раз, приблизительно в 100 раз или более чем в 100 раз (включая все диапазоны и значения между ними) по сравнению с сывороткой субъекта, которому не вводили один или более модуляторов или ингибиторов гамма-секретазы.
В определенных вариантах осуществления модулятор или ингибитор гамма-секретазы может уменьшать расщепление или выделение BCMA в патогенной В-клетке. Используемое в данном документе выражение «патогенная В-клетка» относится к В-клетке, которая, как известно или предположительно, способствует по меньшей мере одному признаку или симптому состояния или нарушения, связанного с В-клетками. В некоторых вариантах осуществления патогенная В-клетка продуцирует аутоантитела. В определенных вариантах осуществления патогенная В-клетка представляет собой тип раковой клетки. В некоторых вариантах осуществления В-клетка является раковой клеткой ММ, раковой клеткой CLL, раковой клеткой WM, раковой клеткой неходжкинской лимфомы или раковой клеткой лимфомы Ходжкина.
В конкретных вариантах осуществления модулятор или ингибитор гамма-секретазы может увеличивать количество BCMA, обнаруживаемое в патогенной В-клетке, на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 100%, приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 2,5 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 30 раз, приблизительно в 40 раз, приблизительно в 50 раз, приблизительно в 100 раз или более чем в 100 раз (включая все диапазоны и значения между ними) по сравнению с сывороткой субъекта, которому не вводили один или более модуляторов или ингибиторов гамма-секретазы.
D. Фармацевтические композиции и составы
Композиции (т. e. лекарственные препараты), предусмотренные в данном документе, включают без ограничения фармацевтические композиции. Выражение «фармацевтическая композиция» относится к составу композиции с одним или более фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами, обычно приемлемыми в данной области техники для доставки соединения или лекарственного средства млекопитающему, например, человеку. В конкретных вариантах осуществления фармацевтические композиции содержат модуляторы гамма-секретазы или их производные, составленные с одним или более фармацевтически приемлемыми носителями, разбавителями и/или вспомогательными веществами. Следует также понимать, что при желании композиции по настоящему изобретению можно вводить и в комбинации с другими средствами, такими как, например, нуклеиновые кислоты, белки, малые молекулы или фармацевтически активные средства, вспомогательные средства для терапии и т. д., до тех пор, пока не будет достигнут желаемый терапевтический эффект. Практически нет ограничений на другие реагенты, которые также могут быть включены в композиции, при условии, что дополнительные реагенты не оказывают неблагоприятного воздействия на необходимую противораковую терапию.
В конкретных вариантах осуществления композиции включают фармацевтически приемлемые составы с терапевтически эффективными количествами модуляторов гамма-секретазы или их производных; или пролекарств, сольватов, стереоизомеров, рацематов или таутомеров модуляторов гамма-секретазы или их производных, составленных с одним или более фармацевтически приемлемыми носителями (добавками), другими активными средствами и/или разбавителями.
Фраза «фармацевтически приемлемый» относится к тем соединениям, материалам, композициям и/или лекарственным формам, которые в пределах обоснованного медицинского суждения подходят для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соизмеримых с разумным соотношением выгоды/риска. Используемый в данном документе термин «фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество» включает без ограничения адъювант, носитель, вспомогательное вещество, глидант, подсластитель, разбавитель, консервант, краситель/красящее вещество, усилитель вкуса, поверхностно-активное вещество, смачивающее средство, диспергирующее средство, суспендирующее средство, стабилизатор, изотоническое средство, растворитель, поверхностно-активное вещество или эмульгатор, который был одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США как приемлемый для применения у людей или домашних животных. Иллюстративные фармацевтически приемлемые носители включают без ограничения сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; трагакант; солод; желатин; тальк; какао-масло, воски, животные и растительные жиры, парафины, кремнийорганические соединения, бентониты, кремниевую кислоту, оксид цинка; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные средства, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический физиологический раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и любые другие совместимые вещества, используемые в фармацевтических составах.
В конкретных вариантах осуществления соединения, предусмотренные в данном документе, существуют в форме свободного основания или кислоты и могут быть превращены в их фармацевтически приемлемые соли путем обработки подходящим неорганическим или органическим основанием или кислотой способами, известными специалисту в данной области техники. «Фармацевтически приемлемая соль» включает как кислые, так и основные аддитивные соли. Выражение «фармацевтически приемлемая кислая аддитивная соль» относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными, и которые образуются с неорганическими кислотами, такими как без ограничения хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органическими кислотами, такими как без ограничения уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламовая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксоглутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, муциновая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглутаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота и тому подобное.
Выражение «фармацевтически приемлемая основная аддитивная соль» относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом нежелательными. Эти соли получают путем добавления неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают без ограничения соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и тому подобное. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают без ограничения соли первичных, вторичных и третичных аминов, замещенные амины, включая встречающиеся в природе замещенные амины, циклические амины и основные ионообменные смолы, такие как аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и тому подобное. Особенно предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
Соли соединений по настоящему изобретению могут быть превращены в форму их свободного основания или кислоты стандартными методами.
В композициях также могут присутствовать смачивающие средства, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красящие средства, противоадгезивные средства, средства для покрытия, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты.
Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и тому подобное; (2) жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и тому подобное; и (3) металл-хелатирующие средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, ортофосфорная кислота и тому подобное.
В конкретных вариантах осуществления предусмотренная в данном документе фармацевтическая композиция составлена таким образом, чтобы содержащиеся в ней активные ингредиенты были биодоступными после введения композиции субъекту. В одном варианте осуществления фармацевтические композиции могут быть получены путем комбинирования модулятора гамма-секретазы или его производного с соответствующим фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом и могут быть составлены в виде препаратов в твердой форме, полутвердой форме, жидкости, гелях и микросферах. Однако в определенных вариантах осуществления указанные соединения могут быть просто растворены или суспендированы в стерильной воде физиологического раствора, растворе Рингера или 0,9% NaCl.
Твердые составы композиций, предусмотренных в данном документе, включают драже, капсулы, пилюли и гранулы, необязательно с риской или полученные с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия. Твердые лекарственные формы также могут быть составлены так, чтобы обеспечить медленное или контролируемое высвобождение соединения. Таким образом, твердые составы могут включать в себя любой материал, который способен обеспечить желаемый профиль высвобождения соединения, включая без ограничения гидроксипропилметилцеллюлозу в различных пропорциях или другие полимерные матрицы, липосомы и/или микросферы.
С покрытием, гелевые или инкапсулированные составы модуляторов гамма-секретазы или их производных также могут быть составлены для доставки с пульсирующим, непрерывным или замедленным высвобождением. Например, один способ пульсирующего высвобождения может быть достигнут путем наслаивания нескольких покрытий из модуляторов гамма-секретазы или их производных или путем включения модуляторов гамма-секретазы или их производных в разные области состава, имеющие разное время высвобождения.
Предусмотренные в данном документе жидкие лекарственные формы включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Кроме того, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, включая без ограничения воду или другие растворители; солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль; масла (в частности, хлопковое, арахисовое, кукурузное, проростков, оливковое, касторовое и кунжутное масло); глицерин; тетрагидрофуриловый спирт; полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси.
Суспензионные составы включают без ограничения этоксилированные изостеариловые спирты; сложные полиоксиэтиленовые эфиры сорбита и сорбитана; микрокристаллическую целлюлозу; метагидроксид алюминия; бентонит; агар-агар; трагакант и их смеси.
Инъекционные составы-депо могут быть получены путем формирования микроинкапсулированных матриц композиции в биоразлагаемых полимерах. Примеры биоразлагаемых полимеров включают без ограничения сополимер лактида и гликолида, поли(ортоэфиры) и поли(ангидриды). Соотношение композиции и полимера и природа конкретного используемого полимера могут влиять на скорость высвобождения модуляторов гамма-секретазы или их производных из композиции. Инъекционные составы-депо также могут быть получены путем захвата лекарственного средства в липосомы или микроэмульсии.
Подходящую текучесть жидких, суспензионных и других составов соединений можно поддерживать путем применения материалов для покрытия, таких как лецитин; путем поддержания требуемого размера частиц в случае дисперсий или путем применения поверхностно-активных веществ.
Составы могут также включать противозагрязняющие средства для предотвращения загрязнения микроорганизмами. Противозагрязняющие средства могут включать без ограничения антибактериальные и противогрибковые средства, например парабены, хлорбутанол, фенол, сорбиновую кислоту, антибиотики и тому подобное.
Составы можно также стерилизовать, например, путем фильтрации через удерживающий бактерии фильтр или путем введения стерилизующих средств в форме стерильных твердых составов, которые можно растворить в стерильной воде или в какой-либо другой стерильной среде непосредственно перед применением или приготовлением состава.
Составы также могут быть свободны от эндотоксина. Используемый в данном документе термин «свободный от эндотоксина» относится к композициям или составам, которые содержат не более чем следовые количества (то есть количества, не имеющие неблагоприятных физиологических эффектов для субъекта) эндотоксина и предпочтительно необнаруживаемые количества эндотоксина. Под выражением «по сути свободный от эндотоксина» подразумевается, что на дозу клеток присутствует меньше эндотоксина, чем это допускается FDA для биологии, что составляет 5 EU/кг массы тела общего эндотоксина в день, что для среднего человека массой 70 кг составляет 350 EU на общую дозу клеток. В одном варианте осуществления термин «свободный от эндотоксина» относится к композиции или составу, который на по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% свободен от эндотоксина. Эндотоксины представляют собой токсины, связанные с определенными бактериями, обычно грамотрицательными бактериями, хотя эндотоксины можно найти у грамположительных бактерий, таких как Listeria monocytogenes. Наиболее распространенными эндотоксинами являются липополисахариды (LPS) или липоолигосахариды (LOS), обнаруженные во внешней мембране различных грамотрицательных бактерий, которые представляют собой центральную патогенетическую особенность в способности этих бактерий вызывать заболевание. Небольшое количество эндотоксина у людей может вызвать помимо других неблагоприятных физиологических эффектов лихорадку, снижение артериального давления и активацию воспаления и коагуляции. Поэтому часто желательно удалить почти все или все следы эндотоксина из контейнеров с лекарственными средствами, поскольку даже небольшие количества могут оказывать неблагоприятное воздействие на людей.
Фармацевтические композиции могут дополнительно содержать один или более компонентов, которые повышают биодоступность активных ингредиентов композиции, например, усилители проникновения, стабилизирующие средства и один или более компонентов, которые обеспечивают медленное или контролируемое высвобождение модулятора гамма-секретазы или его производного в композицию, например, биосовместимые полимеры и/или гели.
В конкретных вариантах осуществления композиции, содержащие усилители проникновения, будут облегчать доставку композиции через биологические барьеры. «Усилитель проникновения» или «усилитель проницаемости» включает полиол, такой как полиэтиленгликоль (PEG), глицерол (глицерин), мальтит, сорбит и т. д.; моноэтиловый эфир диэтиленгликоля, азон, хлорид бензалкония (ADBAC), хлорид цетилпиридиния, бромид цетилметиламмония, декстрансульфат, лауриновую кислоту, ментол, метоксисалицилат, олеиновую кислоту, фосфатидилхолин, полиоксиэтилен, полисорбат 80, гликолят натрия, лаурилсульфат натрия, салицилат натрия, таурохолат натрия, тауродезоксихолат натрия, сульфоксиды, дезоксихолат натрия, таурохолат натрия и поверхностно-активные вещества, такие как лаурилсульфат натрия, лаурет-9, хлорид цетилпиридиния и моноалкиловые эфиры полиоксиэтилена, бензойные кислоты, такие как салицилат и метоксисалицилат натрия, жирные кислоты, такие как лауриновая кислота, олеиновая кислота, ундекановая кислота и метилолеат, жирные спирты, такие как октанол и нонанол, лаурокапрам, циклодекстрины, тимол, лимонен, мочевину, хитозан и другие природные и синтетические полимеры.
Подходящие полиолы для включения в растворы включают глицерин и сахарные спирты, такие как сорбит, маннит или ксилит, полиэтиленгликоль и их производные. В некоторых вариантах осуществления композиция дополнительно включает консервант. Общепринятые консерванты, такие как хлорид бензалкония и эдэтат динатрия (EDTA), включают в композиции по настоящему изобретению в концентрациях, достаточных для эффективного противомикробного действия, приблизительно 0,0001-0,1% в расчете на массу композиции.
В конкретных вариантах осуществления композиции содержат стабилизаторы для увеличения терапевтического времени жизни композиций in vivo. Иллюстративные стабилизаторы включают жирные кислоты, жирные спирты, спирты, сложные эфиры длинноцепочечных жирных кислот, длинноцепочечные эфиры, гидрофильные производные жирных кислот, поливинилпирролидоны, поливиниловые эфиры, поливиниловые спирты, углеводороды, гидрофобные полимеры, влагопоглощающие полимеры и их комбинации. В дополнительных вариантах осуществления выбранный стабилизатор изменяет гидрофобность состава (например, олеиновая кислота, воски) или улучшает смешивание различных компонентов в составе (например, этанол), влияет на уровень влажности состава (например, PVP или поливинилпирролидон), влияет на подвижность фазы (вещества с температурой плавления выше комнатной температуры, такие как длинноцепочечные жирные кислоты, спирты, сложные эфиры, простые эфиры, амиды и т. д. или их смеси, воски) и/или улучшает совместимость составов с инкапсулирующими материалами (например, олеиновая кислота или воск). В других вариантах осуществления стабилизаторы присутствуют в достаточных количествах для ингибирования деградации модуляторов гамма-секретазы или их производных в композиции. Примеры таких стабилизирующих средств включают без ограничения: (a) от приблизительно 0,5% до приблизительно 2% мас./об. глицерина, (b) от приблизительно 0,1% до приблизительно 1% мас./об. метионина, (c) от приблизительно 0,1% до приблизительно 2% мас./об. монотиоглицерина, (d) от приблизительно 1 мM до приблизительно 10 мM EDTA, (e) от приблизительно 0,01% до приблизительно 2% мас./об. аскорбиновой кислоты, (f) от 0,003% до приблизительно 0,02% мас./об. полисорбата 80, (g) от 0,001% до приблизительно 0,05% мас./об. полисорбата 20, (h) аргинин, (i) гепарин, (j) декстрансульфат, (k) циклодекстрины, (l) пентозанполисульфат и другие гепариноиды, (m) двухвалентные катионы, такие как магний и цинк; или (n) их комбинации.
В конкретных вариантах осуществления композиции составлены в виде составов с контролируемым высвобождением. В целом, составы лекарственных средств с контролируемым высвобождением обеспечивают контроль над высвобождением лекарственного средства с учетом места высвобождения и времени высвобождения in vivo. Контролируемое высвобождение включает в себя немедленное высвобождение, отсроченное высвобождение, непрерывное высвобождение, замедленное высвобождение, вариабельное высвобождение, пульсирующее высвобождение и бимодальное высвобождение. К преимуществам контролируемого высвобождения относятся: менее частое введение дозы; более эффективное использование лекарственного средства; локализованная доставка лекарственного средства путем размещения устройства доставки или состава на месте лечения in vivo; и возможность вводить и высвобождать два или более разных лекарственных средств, каждое из которых имеет уникальный профиль высвобождения, или высвобождать то же лекарственное средство с разной скоростью или в течение разной продолжительности времени с помощью одной единицы дозирования.
Композиции с контролируемым высвобождением могут быть получены путем составления композиций с биосовместимыми полимерами, средствами регуляции вязкости, гелями, красками, пенами, ксерогелями, микрочастицами, гидрогелями, нанокапсулами и термообратимыми гелями или их комбинациями. В конкретных вариантах осуществления полимер или гели являются биоразлагаемыми. Свойства высвобождения часто контролируются конкретной комбинацией полимеров или гелей, используемых для составления композиции. Эти способы хорошо известны в данной области техники.
Иллюстративные полимеры, пригодные для составления композиций по настоящему изобретению, включают без ограничения полиамиды, поликарбонаты, полиалкилены (полиэтиленгликоль (PEG)), полимеры акриловых и метакриловых сложных эфиров, поливиниловые полимеры, полигликолиды, полисилоксаны, полиуретаны и их сополимеры, целлюлозы, полипропилен, полиэтилены, полистирол, полимеры молочной кислоты и гликолевой кислоты, полиангидриды, поли(орто)эфиры, поли(бутиловая кислота), поли(валериановая кислота), сополимер лактида и капролактона, полисахариды, белки, полигиалуроновые кислоты, полицианоакрилаты и их комбинации, смеси или сополимеры.
В конкретных вариантах осуществления полимер представляет собой триблок-сополимеры типа ABA или BAB или их смеси, где A-блоки являются относительно гидрофобными и содержат биоразлагаемые сложные полиэфиры или поли(ортоэфир), а B-блоки являются относительно гидрофильными и содержат полиэтиленгликоль (PEG). Биоразлагаемый, гидрофобный полимерный блок А содержит сложный полиэфир или поли(ортоэфир), где сложный полиэфир синтезируют из мономеров, выбранных из группы, состоящей из D,L-лактида, D-лактида, L-лактида, D,L-молочной кислоты, D-молочной кислоты, L-молочной кислоты, гликолида, гликолевой кислоты, ε-капролактона, ε-гидроксигексановой кислоты, γ-бутиролактона, γ-гидроксимасляной кислоты, δ-валеролактона, δ-гидроксивалериановой кислоты, гидроксимасляных кислот, яблочной кислоты и их сополимеров.
Иллюстративные средства регуляции вязкости, пригодные для применения в составах композиций, включают без ограничения гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, поливинилпирролидон, карбоксиметилцеллюлозу, поливиниловый спирт, хондроитинсульфат натрия, гиалуронат натрия, аравийскую камедь (гуммиарабик), агар, силикат алюминия и магния, альгинат натрия, стеарат натрия, ламинарию, бентонит, карбомер, каррагенан, карбопол, ксантан, целлюлозу, микрокристаллическую целлюлозу (MCC), камедь рожкового дерева, хитин, карбоксиметилированный хитозан, карраген, декстрозу, фурцелларан, желатин, камедь гхатти, гуаровую камедь, гекторит, лактозу, сахарозу, мальтодекстрин, маннит, сорбит, мед, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, камедь стеркулии, ксантановую камедь, трагакант, этилцеллюлозу, этилгидроксиэтилцеллюлозу, этилметилцеллюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксиэтилметилцеллюлозу, гидроксипропилцеллюлозу, поли(гидроксиэтилметакрилат), оксиполижелатин, пектин, полигелин, повидон, пропиленкарбонат, сополимер метилвинилового эфира/малеинового ангидрида (PVM/MA), поли(метоксиэтилметакрилат), поли(метоксиэтоксиэтилметакрилат), гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу (HPMC), натрийкарбоксиметилцеллюлозу (CMC), диоксид кремния или поливинилпирролидон (PVP: повидон).
Подходящие гелеобразующие средства для применения при получении гелеобразного состава включают без ограничения разновидности целлюлозы, производные целлюлозы, простые эфиры целлюлозы (например, карбоксиметилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксиметилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу), гуаровую камедь, ксантановую камедь, камедь бобов рожкового дерева, альгинаты (например, альгиновую кислоту), силикаты, крахмал, трагакант, карбоксивиниловые полимеры, каррагенан, парафин, вазелин, глицериновые гели, соединения, полученные из глицерина, конъюгированные или сшитые гели, матрицы, гидрогели и полимеры, а также желатины и их производные, и различные нативные и синтетические гидрогели и полученные из гидрогелей соединения, и любые их комбинации или смеси.
В конкретном варианте осуществления композиции, предусмотренные в данном документе, содержат эффективное количество одного или более модуляторов гамма-секретазы или их производных отдельно или в комбинации с одним или несколькими другими терапевтическими средствами или способами воздействия. Таким образом, композиции можно вводить индивидуально или в комбинации друг с другом и/или с другими известными методами лечения рака, такими как лучевая терапия, химиотерапия, трансплантация, иммунотерапия, гормональная терапия, фотодинамическая терапия и т. д. Композиции можно также вводить в комбинации с антибиотиками. Такие терапевтические средства могут быть приняты в данной области в качестве стандартного лечения для конкретного состояния, описываемого в данном документе, такого как конкретная форма рака. Иллюстративные предусмотренные терапевтические средства включают цитокины, факторы роста, NSAID, DMARD, противовоспалительные средства, химиотерапевтические средства, радиотерапевтические средства, терапевтические антитела или другие активные и вспомогательные средства.
В определенных вариантах осуществления композиции, предусмотренные в данном документе, могут вводиться в сочетании с любым количеством химиотерапевтических средств. Иллюстративные примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламиновую смолу; хлорметины, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид мехлорэтамин оксида, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин и его пегилированные составы, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, циностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства для угнетения функции надпочечников, такие как аминоглутетимид, митотан, трилостан; заменитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; эльформитин; эллиптиний ацетат; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксаны, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси) и доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Энтони, Франция); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); производные ретиноевой кислоты, такие как Targretin™ (бексаротен), Panretin™ (алитретиноин); ONTAK™ (денилейкин дифтитокс); эсперамицины, капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных. Также в это определение включены анти-гормональные средства, которые действуют, чтобы регулировать или ингибировать действие гормонов на рак, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и госерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных.
В сочетании с композициями, предусмотренными в данном документе, можно использовать множество других терапевтических средств. В одном варианте осуществления композиции, предусмотренные в данном документе, вводят с нестероидными противовоспалительными лекарственными средствами (NSAID), включая аспирин, ибупрофен, напроксен, метотрексат, сульфасалазин, лефлуномид, анти-TNF-препараты, циклофосфамид и микофенолят.
Другие иллюстративные NSAID выбирают из группы, состоящей из ибупрофена, напроксена, напроксена натрия, ингибиторов СОХ-2, таких как VIOXX® (рофекоксиб) и CELEBREX® (целекоксиб), и сиалилатов. Иллюстративные анальгетики выбирают из группы, состоящей из ацетаминофена, оксикодона, трамадола или пропоксифена гидрохлорида. Иллюстративные глюкокортикоиды выбирают из группы, состоящей из кортизона, дексаметазона, гидрокортизона, метилпреднизолона, преднизолона или преднизона. Иллюстративные модификаторы биологического ответа включают молекулы, направленные против маркеров клеточной поверхности, ингибиторы цитокинов, такие как антагонисты TNF, адалимумаб (HUMIRA®) и инфликсимаб (REMICADE®), ингибиторы хемокинов и ингибиторы адгезивных молекул. Модификаторы биологического ответа включают моноклональные антитела, а также рекомбинантные формы молекул. Иллюстративные DMARD включают азатиоприн, циклофосфамид, циклоспорин, метотрексат, пеницилламин, лефлуномид, сульфасалазин, гидроксихлорохин, золото (пероральное (ауранофин) и внутримышечное) и миноциклин. Иллюстративные примеры терапевтических антител, подходящих для комбинации с композициями, предусмотренными в данном документе, включают, без ограничения, бавитуксимаб, бевацизумаб (авастин), биватузумаб, блинатумомаб, конатумумаб, даратумумаб, дулиготумаб, дацетузумаб, далотузумаб, элотузумаб (HuLuc63), гемтузумаб, ибритумомаб, индатуксимаб, инотузумаб, лорвотузумаб, лукатумумаб, милатузумаб, моксетумомаб, окаратузумаб, офатумумаб, ритуксимаб, силтуксимаб, тепротумумаб и ублитуксимаб.
В конкретных вариантах осуществления композиции, предусмотренные в данном документе, вводят с ингибиторами протеасомы. Термин «ингибитор протеасомы» относится к любому веществу, которое прямо или косвенно ингибирует протеасому 20S и/или 26S или их активность. В конкретных вариантах осуществления ингибирование протеасом является специфическим, т. e. ингибитор протеасомы ингибирует протеасомную активность при концентрации, которая ниже, чем концентрация ингибитора, необходимая для получения другого, несвязанного биологического эффекта. Иллюстративные примеры ингибиторов протеасомы, которые можно вводить с композициями, описанными в данном документе, включают без ограничения бортезомиб (Velcade, PS-341), карфилзомиб (Kyprolis), опрозомиб (ONX 0912), деланзомиб (CEP-18770), иксазомиба цитрат (MLN9708), маризомиб (NPI-0052; салиноспорамид A), дигидроэпонемицин, эпоксомицин, ONX-914 (PR-957), сиринголин A, TMC-95A, аргрин A, дисульфирам, эпигаллокатехин-3-галлат, MG-132, лактацистин, HBX41108, MG-262, MG-115, AM114, MLN2238, AM114, глиотоксин, P005091, PSI, омуралид, AdaAhx3L3VS, полугидрат соли 8-гидроксихинолингемисульфата и класто-лактацистин β-лактон.
В определенных вариантах осуществления композиции, предусмотренные в данном документе, вводят со стероидами, например, глюкокортикоидами или агонистами глюкокортикоидных рецепторов. Иллюстративные примеры глюкокортикоидов и агонистов глюкокортикоидных рецепторов, пригодных для применения в композициях и способах, предусмотренных в данном документе, включают без ограничения медризон, алклометазон, алклометазона дипропионат, амцинонид, беклометазон, беклометазон дипропионат, бетаметазон, бетаметазон бензоат, бетаметазон валерат, будесонид, циклесонид, клобетазол, клобетазол бутират, клобетазол пропионат, клобетазон, клокортолон, клопреднол, кортизол, кортизон, кортивазол, дефлазакорт, дезонид, дезоксиметазон, дезоксикортон, дезоксиметазон, дексаметазон, дифлоразон, дифлоразон диацетат, дифлукортолон, дифлукортолон валерат, дифторкортолон, дифлупреднат, флуклоролон, флуклоролон ацетонид, флудроксикортид, флуметазон, флуметазон, флуметазон пивалат, флунизолид, флунизолид гемигидрат, флуоцинолон, флуоцинолон ацетонид, флуоцинонид, флуокортин, флуокортинбутил, флуокортолон, фторкортизон, фторметолон, флуперолон, флупредниден, флупредниден ацетат, флупреднизолон, флутиказон, флутиказон пропионат, формокортал, галцинонид, галометазон, гидрокортизон, гидрокортизон ацетат, гидрокортизон ацепонат, гидрокортизон бутепрат, гидрокортизон бутират, лотепреднол, мепреднизон, 6a-метилпреднизолон, метилпреднизолон, метилпреднизолон ацетат, метилпреднизолон ацепонат, мометазон, мометазон фуроат, мометазон фуроата моногидрат, параметазон, предникарбат, преднизолон, преднизон, преднилиден, римексолон, тиксокортол, триамцинолон, триамцинолон ацетонид и улобетазол, а также их комбинации.
В конкретных вариантах осуществления композиции, предусмотренные в данном документе, вводят с одним или более иммуномодулирующими лекарственными средствами (IMiD). Иллюстративные IMiD включают талидомид и его производные. Термин «талидомид» относится к лекарственным средствам или фармацевтическим составам, содержащим активное соединение талидомида 2-(2,6-диоксопиперидин-3-ил)-1H-изоиндол-1,3(2H)-дион. Выражение производные талидомида относится к структурным вариантам талидомида, которые имеют сходную биологическую активность, таким как, например, без ограничения, леналидомид (REVLIMID™) ACTIMID™ (Celgene Corporation) и POMALYST™ (Celgene Corporation) и соединения, раскрытые в US5712291, WO02068414 и WO2008154252, каждый из которых включен в данный документ посредством ссылки в полном объеме. Иллюстративные примеры IMiD, которые можно вводить с композициями, предусмотренными в данном документе, включают без ограничения талидомид, леналидомид, помалидомид, линомид, CC-1088, CDC-501 и CDC-801.
В определенных вариантах осуществления композиции, описанные в данном документе, вводят в сочетании с одним или более цитокинами. Термин «цитокин» относится к белкам, высвобождаемым одной клеточной популяцией, которые действуют на другую клетку в качестве межклеточных медиаторов. Иллюстративными примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В число цитокинов входят гормоны роста, такие как гормон роста человека, фактор роста печени; фактор некроза опухоли-альфа и -бета; антимюллеров гормон; ингибин; активин; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и-гамма; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1альфа, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; IL-15, фактор некроза опухоли, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и KIT-лиганд (KL). Используемый в данном документе термин цитокин включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с нативной последовательностью.
В конкретных вариантах осуществления композиции, предусмотренные в данном документе, включают концентрацию одного или более фармацевтически активных ингредиентов (т. e. модулятора или ингибитора гамма-секретазы или его производного и, необязательно его фармацевтически приемлемых солей, пролекарств, сольватов, стереоизомеров, рацематов или таутомеров) от приблизительно 0,01% до приблизительно 90%, от приблизительно 0,01% до приблизительно 50%, от приблизительно 0,1% до приблизительно 70%, от приблизительно 0,1% до приблизительно 50%, от приблизительно 0,1% до приблизительно 40%, от приблизительно 0,1% до приблизительно 30%, от приблизительно 0,1% до приблизительно 20%, от приблизительно 0,1% до приблизительно 10% или от приблизительно 0,1% до приблизительно 5% каждого активного ингредиента по массе композиции.
В определенных вариантах осуществления композиции, описанные в данном документе, имеют концентрацию каждого активного фармацевтического средства от приблизительно 1 до приблизительно 50%, от приблизительно 5 до приблизительно 50%, от приблизительно 10% до приблизительно 40% или от приблизительно 10% до приблизительно 30% активного ингредиента или его фармацевтически приемлемой соли, пролекарства, сольвата, стереоизомера, рацемата или таутомера по массе композиции.
В некоторых вариантах осуществления составы содержат концентрацию активного фармацевтического ингредиента от приблизительно 0,1 до приблизительно 70 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 70 мг/мл, от приблизительно 0,5 до приблизительно 50 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 1 мг до приблизительно 70 мг/мл, от приблизительно 1 мг до приблизительно 50 мг/мл, от приблизительно 1 мг/мл до приблизительно 20 мг/мл, от приблизительно 1 мг/мл до приблизительно 10 мг/мл или от приблизительно 1 мг/мл до приблизительно 5 мг/мл активного средства или его фармацевтически приемлемой соли, пролекарства, сольвата, стереоизомера, рацемата или таутомера по объему состава.
В одном варианте осуществления составы дополнительно обеспечивают немедленное высвобождение одного или более фармацевтически активных ингредиентов (т. e. модулятора или ингибитора гамма-секретазы или его производных или их фармацевтически приемлемых солей, пролекарств, сольватов, стереоизомеров, рацематов или таутомеров) из композиции или в течение 1 минуты, или в течение 5 минут, или в течение 10 минут, или в течение 15 минут, или в течение 30 минут, или в течение 60 минут, или в течение 90 минут.
В другом варианте осуществления терапевтически эффективное количество по меньшей мере одного фармацевтически активного ингредиента высвобождается из композиции немедленно или в течение 1 минуты, или в течение 5 минут, или в течение 10 минут, или в течение 15 минут, или в течение 30 минут, или в течение 60 минут, или в течение 90 минут.
В еще одном варианте осуществления композиция составлена в виде состава с замедленным высвобождением. В определенных вариантах осуществления диффузия по меньшей мере одного фармацевтически активного ингредиента из состава происходит в течение периода времени, превышающего 5 минут, 15 минут, 30 минут, 1 час, 4 часа, 6 часов, 12 часов, 18 часов, 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 10 дней, 12 дней, 14 дней, 18 дней, 21 день, 25 дней, 30 дней, 45 дней, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 9 месяцев или 1 год.
В конкретных вариантах осуществления терапевтически эффективное количество по меньшей мере одного фармацевтически активного ингредиента высвобождается из состава в течение периода времени, превышающего 5 минут, 15 минут, 30 минут, 1 час, 4 часа, 6 часов, 12 часов, 18 часов, 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 10 дней, 12 дней, 14 дней, 18 дней, 21 день, 25 дней, 30 дней, 45 дней, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 9 месяцев или 1 год.
В дополнительных вариантах осуществления состав одновременно обеспечивает состав с немедленным высвобождением и с замедленным высвобождением. В конкретных вариантах осуществления состав содержит составы с немедленным высвобождением и с замедленным высвобождением в соотношении 0,25:1, соотношении 0,5:1, соотношении 1:1, соотношении 1:2, соотношении 1:3, 1:4, соотношении 1:5, соотношении 1:7, соотношении 1:10, соотношении 1:15 или соотношении 1:20. В дополнительном варианте осуществления состав обеспечивает немедленное высвобождение первого фармацевтически активного ингредиента и замедленное высвобождение второго фармацевтически активного ингредиента или другого терапевтического средства.
В дополнительных вариантах осуществления состав обеспечивает составы с немедленным высвобождением и с замедленным высвобождением одного или более фармацевтически активных ингредиентов в соотношении 0,25:1, соотношении 0,5:1, соотношении 1:1, соотношении 1:2, соотношении 1:3, 1:4, соотношении 1:5, соотношении 1:7, соотношении 1:10, соотношении 1:15 или соотношении 1:20.
Комбинацию композиций или составов немедленного высвобождения, отсроченного высвобождения и/или замедленного высвобождения можно комбинировать с другими фармацевтическими средствами, а также с вспомогательными веществами, разбавителями, стабилизаторами, средствами-носителями и другими компонентами, раскрытыми в другом месте данного документа. Таким образом, в зависимости от компонентов композиции, желаемой консистенции или вязкости или выбранного способа доставки альтернативные аспекты раскрытых в данном документе вариантов воплощения соответствующим образом комбинируют с вариантами осуществления с немедленным высвобождением, отсроченным высвобождением и/или замедленным высвобождением.
Дополнительные способы составления композиций известны специалисту в данной области техники, например, как описано в Physicians Desk Reference, 62nd ed. Ораделл, Нью-Джерси: Medical Economics Co., 2008; Goodman & Gilman's The Pharmacological Basis of Therapeutics, Eleventh Edition. McGraw-Hill, 2005; Remington: The Science and Practice of Pharmacy, 20th Ed. Балтимор, Мериленд: Lippincott Williams & Wilkins, 2000; и The Merck Index, Fourteenth Edition. Уайтхаус Стейшен, Нью-Джерси: Merck Research Laboratories, 2006; каждый из которых включен в данный документ посредством ссылки в соответствующих частях.
E. Введение
В конкретных вариантах осуществления предусматривается способ лечения субъекта с состоянием или нарушением, связанным с В-клетками, или предотвращения выделения BCMA из В-клетки у субъекта, включающий введение субъекту модулятора гамма-секретазы или его производного. Композиции, предусмотренные в данном документе, могут вводиться в виде одного или более твердых веществ, полутвердых веществ, гелей или жидкостей или их комбинации. Например, модулятор гамма-секретазы или его производное и другие фармацевтически активные средства могут быть индивидуально составлены для внутривенного введения в жидкой лекарственной форме или для перорального введения в виде одной таблетки или капсулы или в виде комбинации одной или более таблеток, капсул или других лекарственных форм. Конкретная доза/схема введения меняется в зависимости от веса, пола, возраста и здоровья человека; состава, биохимической природы, биологической активности, биодоступности и побочных эффектов средств, а также количества и идентичности средств в полной схеме лечения.
Используемые в данном документе термины «введение», «вводить» или «способ введения» относятся к доставке одного или более соединений или композиций субъекту парентерально, энтерально или местно. Иллюстративные примеры парентерального введения включают без ограничения внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную и внутригрудинную инъекцию и инфузию. Иллюстративные примеры энтерального введения включают без ограничения пероральное, ингаляционное, интраназальное, сублингвальное и ректальное введение. Иллюстративные примеры местного введения включают без ограничения трансдермальное и вагинальное введение.
В конкретных вариантах осуществления средство или композицию вводят субъекту парентерально, необязательно путем внутривенного введения или перорального введения.
В различных вариантах осуществления разработка подходящих схем введения и лечения для использования конкретных композиций, предусмотренных в данном документе, в различных схемах лечения, включая, например, пероральное, парентеральное, внутривенное, интраназальное и внутримышечное введение и состав, хорошо известна в данной области. В определенных вариантах осуществления модулятор гамма-секретазы вводят субъекту внутривенно. В конкретных вариантах осуществления модулятор гамма-секретазы вводят субъекту внутримышечно. В некоторых вариантах осуществления модулятор гамма-секретазы вводят субъекту сублингвально. В конкретных вариантах осуществления модулятор гамма-секретазы вводят субъекту подкожно.
В конкретных вариантах осуществления модулятор гамма-секретазы или его производное вводят субъекту перорально. Средство можно вводить субъекту в дозе в диапазоне приблизительно 1-100 мг, приблизительно 1-50 мг, приблизительно 50-100 мг, приблизительно 1-5 мг, приблизительно 5-10 мг, приблизительно 10-15 мг, приблизительно 15-20 мг, приблизительно 20-30 мг, приблизительно 30-40 мг, приблизительно 40-50 мг, приблизительно 50-60 мг, приблизительно 60-70 мг, приблизительно 70-80 мг, приблизительно 80-90 мг или приблизительно 90-100 мг или более. В определенных вариантах осуществления средство вводят в дозе приблизительно 1 мг, приблизительно 2 мг, приблизительно 2,5 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 50 мг или приблизительно 100 мг или более. В некоторых вариантах осуществления настоящего изобретения пероральную дозу средства вводят субъекту по меньшей мере один раз в течение цикла лечения, по меньшей мере один раз за 28-дневный цикл лечения, по меньшей мере раз в неделю, по меньшей мере каждый второй день, по меньшей мере раз в день или по меньшей мере два раза в день.
В конкретных вариантах осуществления модулятор гамма-секретазы или его производное вводят внутривенно. Средство можно вводить внутривенно в дозе приблизительно 0-100 мг, приблизительно 1-50 мг, приблизительно 50-100 мг, приблизительно 1-10 мг, приблизительно 10-20 мг, приблизительно 20-30 мг, приблизительно 30-40 мг, приблизительно 40-50 мг, приблизительно 50-60 мг, приблизительно 60-70 мг, приблизительно 70-80 мг, приблизительно 80-90 мг или приблизительно 90-100 мг или более. В определенных вариантах осуществления внутривенная доза средства составляет приблизительно один мг, приблизительно два мг, приблизительно три мг, приблизительно четыре мг, приблизительно пять мг, приблизительно шесть мг, приблизительно семь мг, приблизительно восемь мг, приблизительно девять мг, приблизительно десять мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг или приблизительно 100 мг или более. Дозы средств можно доставлять внутривенно в любых фармацевтически приемлемых носителях для инъекций или инфузий, известных в данной области.
В некоторых вариантах осуществления средство можно вводить внутривенно в дозе приблизительно 0-100 мг/м2, приблизительно 1-50 мг/м2, приблизительно 50-100 мг/м2, приблизительно 1-10 мг/м2, приблизительно 10-20 мг/м2, приблизительно 20-30 мг/м2, приблизительно 30-40 мг/м2, приблизительно 40-50 мг/м2, приблизительно 50-60 мг/м2, приблизительно 60-70 мг/м2, приблизительно 70-80 мг/м2, приблизительно 80-90 мг/м2 или приблизительно 90-100 мг/м2 или более. В определенных вариантах осуществления внутривенная доза средства составляет приблизительно один мг/м2, приблизительно два мг/м2, приблизительно три мг/м2, приблизительно четыре мг/м2, приблизительно пять мг/м2, приблизительно шесть мг/м2, приблизительно семь мг/м2, приблизительно восемь мг/м2, приблизительно девять мг/м2, приблизительно десять мг/м2, приблизительно 15 мг/м2, приблизительно 20 мг/м2, приблизительно 25 мг/м2, приблизительно 30 мг/м2, приблизительно 35 мг/м2, приблизительно 40 мг/м2, приблизительно 45 мг/м2, приблизительно 50 мг/м2, приблизительно 60 мг/м2, приблизительно 70 мг/м2, приблизительно 80 мг/м2, приблизительно 90 мг/м2 или приблизительно 100 мг/м2 или более.
В некоторых вариантах осуществления средство можно вводить внутривенно в дозе приблизительно 0-10 мг/кг, приблизительно 0-5 мг/кг, приблизительно 5-10 мг/кг, приблизительно 0-1 мг/кг, приблизительно 1-2 мг/кг, приблизительно 2-3 мг/кг, приблизительно 3-4 мг/кг, приблизительно 4-5 мг/кг, приблизительно 5-6 мг/кг, приблизительно 6-7 мг/кг, приблизительно 7-8 мг/кг, приблизительно 8-9 мг/кг или приблизительно 9-10 мг/кг или более. В определенных вариантах осуществления внутривенная доза средства составляет приблизительно 0,05 мг/кг, приблизительно 0,1 мг/кг, приблизительно 0,15 мг/кг, приблизительно 0,2 мг/кг, приблизительно 0,25 мг/кг, приблизительно 0,3 мг/кг, приблизительно 0,35 мг/кг, приблизительно 0,4 мг/кг, приблизительно 0,45 мг/кг, приблизительно 0,5 мг/кг, приблизительно 0,55 мг/кг, приблизительно 0,6 мг/кг, приблизительно 0,65 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,75 мг/кг, приблизительно 0,8 мг/кг, приблизительно 0,85 мг/кг, приблизительно 0,9 мг/кг, приблизительно 0,95 мг/кг, приблизительно один мг/кг, приблизительно два мг/кг, приблизительно три мг/кг, приблизительно четыре мг/кг, приблизительно пять мг/кг, приблизительно шесть мг/кг, приблизительно семь мг/кг, приблизительно восемь мг/кг, приблизительно девять мг/кг или приблизительно десять мг/кг или более.
В некоторых вариантах осуществления модулятор гамма-секретазы или его производное вводят по меньшей мере один раз в течение цикла лечения. В некоторых вариантах осуществления модулятор гамма-секретазы или его производное вводят субъекту в одни и те же дни. В некоторых вариантах осуществления модулятор гамма-секретазы или его производное вводят субъекту в разные дни. В некоторых вариантах осуществления модулятор гамма-секретазы или его производное вводят субъекту в те же дни и в разные дни в соответствии с графиком лечения.
В конкретных вариантах осуществления средство вводят субъекту в ходе одного или более циклов лечения. Цикл лечения может составлять по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере 14, по меньшей мере 21, по меньшей мере 28, по меньшей мере 48 или по меньшей мере 96 дней или более. В одном варианте осуществления цикл лечения составляет 28 дней. В определенных вариантах осуществления средства вводят в течение одного и того же цикла лечения или одновременно с другими циклами лечения, назначенными для каждого средства. В различных вариантах осуществления цикл лечения определяется медицинским работником на основании состояния и потребностей субъекта.
В некоторых вариантах осуществления средство вводят в течение по меньшей мере одного дня, по меньшей мере двух дней, по меньшей мере трех дней, по меньшей мере четырех дней, по меньшей мере пяти дней, по меньшей мере шести дней, по меньшей мере семи дней, по меньшей мере восьми дней, по меньшей мере девяти дней, по меньшей мере десяти дней, по меньшей мере одиннадцати дней, по меньшей мере двенадцати дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня или всех 28 дней 28-дневного цикла лечения. В конкретных вариантах осуществления средство вводят субъекту один раз в день. В других конкретных вариантах осуществления средство вводят два раза в день. В определенных вариантах осуществления средство вводят более двух раз в день.
В конкретных вариантах осуществления средство вводят на 1-й день, 2-й день, 8-й день, 9-й день, 15-й день и 16-й день 28-дневного цикла лечения. В некоторых вариантах осуществления модулятор гамма-секретазы или его производное вводят на 1-й день, 2-й день, 8-й день, 9-й день, 15-й день и 16-й день 28-дневного цикла лечения.
Количество введений композиции субъекту, нуждающемуся в этом, зависит от выбора медицинского специалиста, нарушения, тяжести нарушения и ответа субъекта на состав. В некоторых вариантах осуществления раскрытую в данном документе композицию вводят один раз субъекту, нуждающемуся в этом, с легким течением острого заболевания. В некоторых вариантах осуществления раскрытую в данном документе композицию вводят более одного раза субъекту, нуждающемуся в этом, с умеренным или тяжелым течением острого заболевания. В случае, когда состояние субъекта не улучшается, по усмотрению врача композицию можно вводить хронически, то есть в течение длительного периода времени, в том числе на протяжении всей жизни субъекта, чтобы улучшить или иным образом контролировать или ограничить симптомы заболевания или состояния субъекта.
В случае, когда состояние субъекта улучшается, по усмотрению врача композицию можно вводить непрерывно или дозу вводимого лекарственного средства можно временно снизить или временно приостановить на определенный период времени (т. e., «лекарственные каникулы»). Продолжительность лекарственных каникул варьируется от 2 дней до 1 года, в том числе только в качестве примера 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 10 дней, 12 дней, 15 дней, 20 дней, 28 дней, 35 дней, 50 дней, 70 дней, 100 дней, 120 дней, 150 дней, 180 дней, 200 дней, 250 дней, 280 дней, 300 дней, 320 дней, 350 дней и 365 дней. Снижение дозы во время лекарственных каникул может составлять от 10 до 100%, в том числе только в качестве примера 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% и 100%.
F. Способы
В различных вариантах осуществления настоящего изобретения предусматриваются средства для терапии, направленные на В-клетки, включающие введение одного или более модуляторов гамма-секретазы субъекту.
В одном варианте осуществления предусмотренные в данном документе способы включают лечение или профилактику состояния или нарушения, связанного с В-клетками, у субъекта, включающие введение субъекту одного или более модуляторов гамма-секретазы или их производного.
В другом дополнительном аспекте настоящее изобретение обеспечивает способы лечения, или профилактики, или задержки опосредованного В-клетками состояния. Способ включает в себя этапы, на которых субъекту, для которого желательно такое лечение или профилактика или задержка, вводят композицию по настоящему изобретению в количестве, достаточном для лечения, предотвращения или задержки опухолегенного или иммунорегуляторного состояния у субъекта. В некоторых вариантах осуществления субъектом является человек. В других вариантах осуществления субъектом является млекопитающее кроме человека. В некоторых вариантах осуществления введение композиции по настоящему изобретению уменьшает или предотвращает опосредованное гамма-секретазой расщепление BCMA у субъекта, что может привести к одному или более из гибели клеток, ингибирования, уменьшения или прекращения пролиферации клеток.
Иллюстративные примеры состояний или нарушений, связанных с В-клетками, подходящих для лечения с помощью предусмотренных в данном документе композиций или способов, включают, без ограничения, аутоиммунные заболевания, включающие неадекватную активность В-клеток, и В-клеточные лимфомы. В-клеточные лимфомы включают, без ограничения, ММ, плазмоцитому, WM, CLL, лимфому Ходжкина, фолликулярные лимфомы, лимфомы из мелких клеток с нерасщепленным ядром, эндемическую лимфому Беркитта, спорадическую лимфому Беркитта, лимфому краевой зоны, экстранодальную лимфому лимфоидной ткани слизистых оболочек, нодальную моноцитоидную В-клеточную лимфому, селезеночную лимфому, мантийноклеточную лимфому, крупноклеточную лимфому, диффузную смешанно-клеточную лимфому, иммунобластную лимфому, первичную медиастинальную В-клеточную лимфому, В-клеточную лимфангиому легких, мелкоклеточную лимфоцитарную лимфому, лимфоматоидный гранулематоз и посттрансплантационное лимфопролиферативное расстройство, первичный или иммуноцитарный амилоидоз и моноклональную гаммапатию неясного генеза (MGUS).
Иллюстративные примеры состояний или нарушений, связанных с В-клетками, подходящих для лечения с помощью предусмотренных в данном документе композиций или способов, включают, без ограничения, нарушения, которые являются аутоиммунными по своей природе, такие как, например, системная красная волчанка, ревматоидный артрит, миастения, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, антифосфолипидный синдром, болезнь Шагаса, болезнь Грейва, гранулематоз Вегенера, узелковый полиартериит, синдром Шегрена, пемфигус обыкновенный, склеродермия, рассеянный склероз, антифосфолипидный синдром, связанный с ANCA васкулит, болезнь Гудпасчера, болезнь Кавасаки, болезнь тяжелой цепи и быстро прогрессирующий гломерулонефрит.
Иллюстративные примеры гематологических злокачественных новообразований, подходящих для лечения с помощью композиций и способов, предусмотренных в данном документе, включают без ограничения MM, WM, лейкоз или лимфому. Лейкозы могут включать, без ограничения, ALL, AML, CLL, CML, острый моноцитарный лейкоз. Лимфомы могут включать без ограничения лимфомы Ходжкина, такие как лимфома Ходжкина с нодулярным склерозом, лимфома Ходжкина смешанноклеточного подтипа, лимфома Ходжкина с обогащением лимфоцитами и лимфома Ходжкина с исчерпанием лимфоцитов; и неходжкинскую лимфому, такую как диффузная крупноклеточная В-клеточная лимфома, первичная медиастинальная В-клеточная лимфома, фолликулярная лимфома, CLL, мантийноклеточная лимфома, В-клеточные лимфомы краевой зоны, лимфома Беркитта, лимфоплазматическая лимфома, первичная лимфома центральной нервной системы, Т-клеточные лимфомы и WM. Плазмоклеточные дискразии включают без ограничения множественную миелому.
В различных вариантах осуществления также предусматриваются способы предотвращения или уменьшения выделения BCMA из В-клеток, которые включают введение субъекту, одного или более модуляторов гамма-секретазы или их производного. Предотвращение или уменьшение выделения B-клеток из BCMA с увеличением количества BCMA, обнаруживаемого на B-клетках, и снижением или уменьшением количества BCMA, которое обнаруживается в сыворотке. Не желая быть связанными какой-либо конкретной теорией, предполагают, что уменьшение выделения будет усиливать другие средства для терапии, которые нацелены в отношении BCMA, экспрессируемые на B-клетках, поскольку, если BCMA выделяется, больше не будет эффективного целенаправленного воздействия на B-клетку, однако, если выделение блокируется или уменьшается, большее количество BCMA будет экспрессироваться на поверхности В-клеток, тем самым повышая эффективность средств для терапии, которые нацелены в отношении BCMA, экспрессируемый на B-клетках. Терапевтические средства, которые связываются с BCMA и/или клеткой, экспрессирующей BCMA, включают без ограничения терапевтические антитела против -BCMA или их фрагменты, конъюгаты антитела против BCMA и лекарственного средства и Т-клетки с химерными антигенными рецепторами (CAR-T-клетки), которые связываются с BCMA.
В некоторых вариантах осуществления модулятор гамма-секретазы вводят субъекту, проходящему терапию, которая нацелена в отношении BCMA. В определенных вариантах осуществления терапия, которая нацелена в отношении BCMA, включает введение терапевтического средства, которое связывается с BCMA. В конкретных вариантах осуществления средство связывается с BCMA, экспрессируемым В-клетками. В некоторых вариантах осуществления В-клетки являются патогенными В-клетками. В некоторых вариантах осуществления введение ингибитора гамма-секретазы увеличивает связывание терапевтического средства с патогенными В-клетками, экспрессирующими BCMA, на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 100%, приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 2,5 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 30 раз, приблизительно в 40 раз, приблизительно в 50 раз, приблизительно в 100 раз или более чем в 100 раз (включая все диапазоны и значения между ними) по сравнению со связыванием терапевтического средства с патогенными В-клетками в отсутствие ингибитора гамма-секретазы.
В конкретных вариантах осуществления модулятор гамма-секретазы вводят субъекту, проходящему терапию, которая нацелена в отношении BCMA. В некоторых вариантах осуществления терапия, которая нацелена в отношении BCMA, включает введение средства, уменьшающего количество патогенных В-клеток, поскольку они экспрессируют BCMA. В некоторых вариантах осуществления введение ингибитора гамма-секретазы дополнительно уменьшает количество патогенных В-клеток, поскольку они экспрессируют BCMA, у субъекта, проходящего терапию, которая нацелена в отношении BCMA, на приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95% или приблизительно 100% (включая все диапазоны и значения между ними) по сравнению с сокращением патогенных В-клеток, достигаемым при терапии, которая нацелена в отношении BCMA, в отсутствие ингибитора гамма-секретазы.
В различных вариантах осуществления способы, предусмотренные в данном документе, включают в себя повышение эффективности терапии у субъекта, получающего лечение состояния или нарушения, связанного с В-клетками, при этом способ включает этапы, на которых субъекту вводят один или более модуляторов гамма-секретазы или их производное в дополнение к существующему лечению, предоставляемому субъекту. Способы лечения состояния или нарушений, связанных с В-клетками, включают без ограничения лучевую терапию, химиотерапию, трансплантацию, иммунотерапию, ингибиторы протеасомы, иммуномодуляторы, гормональную терапию или фотодинамическую терапию.
В определенных вариантах осуществления один или более модуляторов гамма-секретазы вводят субъекту для повышения эффективности терапии или лечения состояния или нарушения, связанного с В-клетками, которое является аутоиммунным по своей природе. Средства для терапии состояний B-клеток, которые являются по своей природе аутоиммунными, включают без ограничения кортикостероиды (например, преднизон, преднизолон и метилпреднизолон), модифицирующие болезнь противоревматические лекарственные средства (DMARD; например, метотрексат, гидроксихлорохин, сульфасалазин, лефлуномид, циклофосфамид и азатиоприн), ингибиторы JAK (например, тофациниб и руксолитиниб) и биопрепараты (например, тоцилизумаб, церолизумаб, этанерцепт, адалимумаб, анакинра, абатацепт, инфликсимаб, ритуксимаб), нестероидные противовоспалительные лекарственные средства (NSAID; например аспирин, ибупрофен и напроксен), ингибиторы ацетилхолинэстеразы (например, физостигмин, неостигмин, пиридостигмин, амбеноний, демекарий, ривастигмин, фенантрен, галантамин, донепезил, такрин и эдрофоний), цитостатики (например, аналоги фолиевой кислоты, такие как метотрексат, аналоги пуринов, такие как азатиоприн и меркаптопурин, и аналоги пиримидинов, такие как фторурацил), лекарственные средства, которые действуют на иммунофилины (например, циклоспорин, такролимус и сиролимус), и интерфероны, такие как IFN-бета.
В различных вариантах осуществления один или более модуляторов гамма-секретазы вводят субъекту для повышения эффективности терапии или лечения состояния или нарушения, связанного с В-клетками, которое является гематологическим злокачественным новообразованием. Способы лечения гематологических злокачественных новообразований включают без ограничения лучевую терапию и химиотерапию (например, комбинированную химиотерапию, такую как MOPP (комбинация мустаргена, онковина (также известного как винкристин), преднизона и прокарбазина (также известного как матулан)), ABVD (комбинация адриамицина, блеомицина, винбластина и дакарбазина) и CHOP (циклофосфамид, доксорубицин, винкристин, преднизолон), лечение алкилирующими средствами, такими как мелфалан, циклофосфамид, нитрозомочевины, тетразины, азиридины, цисплатины и производные, и неклассическими алкилирующими средствами, такими как бендамустин; цитостатики (например, аналоги фолиевой кислоты, такие как метотрексат, аналоги пуринов, такие как азатиоприн и меркаптопурин, и аналоги пиримидинов, такие как фторурацил), лечение антимикротубулярными средствами, такими как винкристин и винбластин, таксаны, паклитаксел, доцетаксел и лиган, лечение ингибиторами топоизомеразы, такими как иринотекан, топотекан, камптотецин, этопозид, доксорубицин, митоксантрон и тенипозид, ингибиторы протеасомы, такие как бортезомиб, карфилзомиб и иксазомиб, и иммуномодулирующие средства, такие как талидомид, леналидомид и помалидомид.
В определенных вариантах осуществления предусматривается, что повышение эффективности терапии может быть легко определено и/или идентифицировано специалистом в данной области. В некоторых вариантах осуществления улучшение эффективности терапии в отношении состояния или нарушения, связанного с В-клетками, представляет собой улучшение, облегчение, уменьшение интенсивности и/или снижение по меньшей мере одного признака или симптома состояния или нарушения, связанного с В-клетками, подвергаемого лечению, по сравнению с терапией без одного или более модуляторов гамма-секретазы. В некоторых вариантах осуществления субъекту, который получает терапию в отношении состояния или нарушения, связанного с В-клетками, вводят ингибитор гамма-секретазы, и по меньшей мере один признак или симптом состояния или нарушения, связанного с В-клетками, дополнительно снижается с использованием данной терапии по сравнению с лечением при помощи только данной терапии. Симптомы состояния или нарушения, связанного с В-клетками, включают без ограничения общую слабость и усталость, анемию, головокружение, частую или необъяснимую лихорадку и инфекцию, потерю веса или потерю аппетита, чрезмерное и необъяснимое образование синяков, одышку, увеличенные лимфатические узлы, печень или селезенку, отек кожи, воспаление суставов, тромбы, кожную сыпь, желтуху, кожный зуд, боль в суставах, бессонницу, чувствительность к теплу, мышечную слабость, тремор, паралич, затруднение речи, затруднение дыхания.
В конкретных вариантах осуществления улучшенная эффективность терапии включает в себя облегчение, смягчение, уменьшение интенсивности и/или снижение по меньшей мере одного нежелательного побочного эффекта терапии. Таким образом, в определенных вариантах осуществления один или более модуляторов гамма-секретазы вводят субъекту, получающему терапию в отношении состояния или нарушения, связанного с В-клетками, для смягчения, облегчения, уменьшения интенсивности и/или снижения по меньшей мере одного нежелательного побочного эффекта терапии. Примеры нежелательных побочных эффектов будут легко идентифицированы специалистами в данной области и включают без ограничения повышенный риск или заболеваемость инфекцией, повышенный риск или заболеваемость лихорадкой, иммуносупрессию, снижение иммунной функции и снижение выработки антител.
В некоторых вариантах осуществления ингибитор гамма-секретазы вводят субъекту, получающему терапию в отношении состояния или нарушения, связанного с В-клетками, и количество опухолей и/или объем опухоли снижается по сравнению с лечением при помощи только данной терапии. В конкретных вариантах осуществления модулятор гамма-секретазы вводят субъекту, получающему терапию в отношении состояния или нарушения, связанного с В-клетками, и количество раковых клеток у субъекта снижается по сравнению с лечением при помощи только данной терапии. В различных вариантах осуществления модулятор гамма-секретазы вводят субъекту, получающему терапию в отношении состояния или нарушения, связанного с В-клетками, при этом вероятность ремиссии состояния или нарушения, связанного с В-клетками, увеличивается с добавлением модулятора гамма-секретазы по сравнению с лечением при помощи только данной терапии. В определенных вариантах осуществления модулятор гамма-секретазы вводят субъекту, получающему терапию в отношении состояния или нарушения, связанного с В-клетками, и вероятность выживания увеличивается по сравнению с вероятностью выживания только в результате данной терапии.
Примеры
Пример 1. Обработка опухолевых клеток LAGκ-1A ингибитором гамма-секретазы вызывает снижение уровней BCMA в надосадочной жидкости
Клетки получали из опухоли множественной миеломы человека LAGκ-1A, которую удаляли из задней лапы мыши с тяжелым комбинированным иммунодефицитом (SCID). Одиночные клетки отделяли от опухоли, суспендировали и культивировали в 24-луночных или 96-луночных планшетах для культивирования клеток. Для определения концентраций BCMA клетки опухоли LAGκ-1A культивировали при количестве клеток 5 x 105 клеток или 2 x 106 клеток на лунку в 24-луночном планшете.
Через два часа к клеточной среде добавляли ингибитор гамма-секретазы E424354 от Lilly Pharmaceuticals (Индианаполис, Индиана). Клетки инкубировали с E424354 при концентрациях 256 пM - 20 мкM или без него. В частности, испытывали концентрации 256 пM, 1,28 нM, 6,4 нM, 32 нM, 160 нM, 800 нM, 4 мкM и 20 мкM E424354. Клетки инкубировали при этих концентрациях E424354 в течение 48 часов, 72 часов или 5 дней. Затем после инкубации клетки центрифугировали и собирали надосадочную жидкость. Образцы надосадочной жидкости анализировали с помощью твердофазного иммуноферментного анализа (ELISA) для BCMA, полученного от R&D Systems, Миннеаполис, Миннесота, США (кат. № DY193E). Образцы сыворотки разбавляли 1:50 и проводили анализ ELISA BCMA в соответствии с протоколом изготовителя. Планшеты ELISA анализировали с использованием считывателя планшетов µQuant (Biotek Industries, Уинуски, Вермонт, США), установленного на 450 нм, с программным обеспечением KC Junior. Значения представляют собой среднее по трем образцам их каждой пробы. Этот набор ELISA BCMA не реагирует перекрестно с рекомбинантным человеческим APRIL или BAFF, рекомбинантным человеческим TACI/Fc или рекомбинантным мышиным BCMA/Fc или мышиным BCMA.
Уровни BCMA в надосадочной жидкости были снижены в образцах, собранных из культивированных клеток опухоли LAGκ-1A, обработанных ингибитором гамма-секретазы, по сравнению с образцами из клеток опухоли LAGκ-1A, обработанных контролем с носителем. Когда клетки опухоли LAGκ-1A, культивированные при плотности 5 x 105 клеток на лунку, инкубировали с ингибитором гамма-секретазы в течение 48 часов (ФИГ. 2) или 72 часов (ФИГ. 3), или когда клетки опухоли LAGκ-1A, культивированные при плотности 2 x 106 клеток на лунку, инкубировали с ингибитором гамма-секретазы в течение 48 часов (ФИГ. 4), 72 часов (ФИГ. 5) или 5 дней (ФИГ. 6), наблюдали более низкие уровни BCMA в надосадочной жидкости по сравнению с контролем. При всех проверенных условиях (то есть, плотности клеток, концентрации E424354 и времени инкубации) обнаружили более низкие уровни BCMA в надосадочной жидкости образцов, собранных из клеток, обработанных E424354, по сравнению с клетками без E424354 (контрольные). Эффект ингибитора гамма-секретазы проявлялся даже при очень низких (пикомолярных) концентрациях ингибитора гамма-секретазы.
Анализы MTS проводили для оценки эффектов E424354 на клеточный рост и жизнеспособность клеток. Клетки опухоли LAGκ-1A культивировали при 5 x 104 клеток на лунку в 96-луночном планшете. Клетки культивировали в течение двух часов при 37°C с 5% CO2 до добавления E424354. Клетки инкубировали в E424354 в течение 24 часов (ФИГ. 7), 48 часов (ФИГ. 8), 72 часов (ФИГ. 9) или 5 дней (ФИГ. 10). При всех испытанных концентрациях и длительности воздействия лекарственного средства клетки опухоли LAGκ-1A, обработанные ингибитором гамма-секретазы, не показали никаких цитотоксических эффектов, оцениваемых с использованием анализа пролиферации клеток MTS, указывая на то, что сниженные уровни BCMA в надосадочной жидкости из клеток, обработанных ингибитором гамма-секретазы E424354, не были вызваны гибелью клеток. В совокупности эти данные предоставляют подтверждение способности ингибитора грамма-секретазы предотвращать выделение BCMA из опухолевых клеток миеломы.
Хотя вышеприведенное изобретение было описано более подробно с помощью иллюстрации и примера для ясности понимания, специалисту в данной области техники будет понятно, что в свете идей настоящего изобретения могут быть сделаны определенные изменения и модификации без отклонения от сущности или объема настоящего изобретения, предусмотренного в данном документе.
В целом, в следующей формуле изобретения используемые условия не должны толковаться как ограничивающие формулу изобретения конкретными вариантами осуществления, раскрытыми в описании и формуле изобретения, но должны толковаться как включающие все возможные варианты осуществления вместе с полным объемом эквивалентов, на который распространяется эта формула изобретения. Соответственно, данная формула изобретения не ограничена настоящим раскрытием.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С BCMA РАКОВЫХ ЗАБОЛЕВАНИЙ И АУТОИММУННЫХ РАССТРОЙСТВ | 2018 |
|
RU2799762C2 |
| Способы лечения кохлеарной синаптопатии | 2017 |
|
RU2757276C2 |
| СПОСОБЫ, ТЕРАПИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2021 |
|
RU2831425C1 |
| ЛЕЧЕНИЕ ПИЩЕВОДА БАРРЕТТА | 2006 |
|
RU2432163C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ BCMA И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2785658C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812322C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2017 |
|
RU2754507C2 |
| ИММУНОМОДИФИЦИРУЮЩИЕ ЧАСТИЦЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2794261C2 |
| УЛУЧШЕННЫЕ КОМПОЗИЦИИ НА ОСНОВЕ T-КЛЕТОК | 2015 |
|
RU2719030C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АПИЛИМОДА | 2016 |
|
RU2738934C2 |



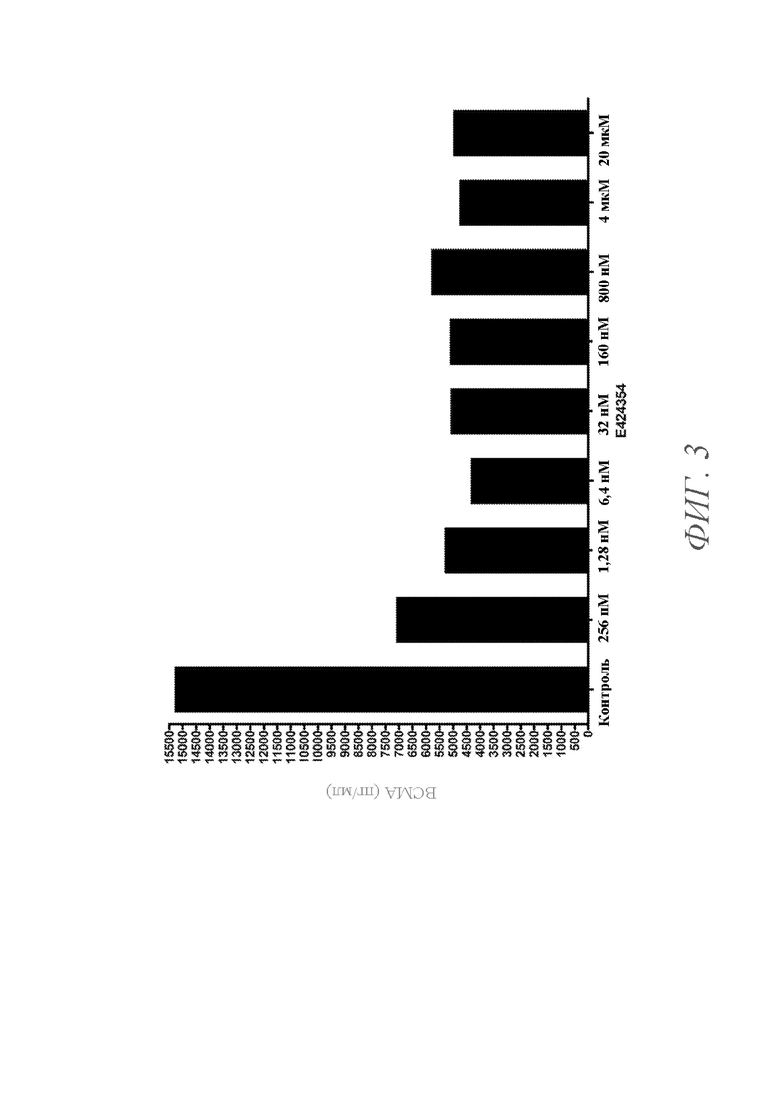

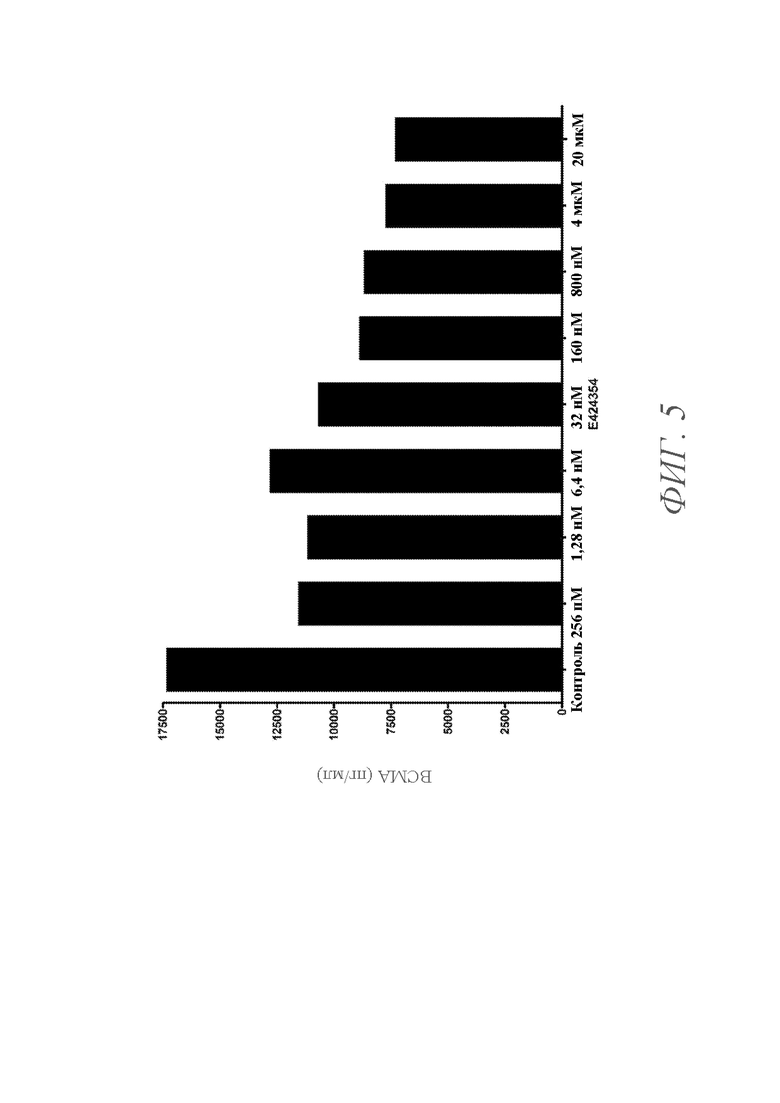
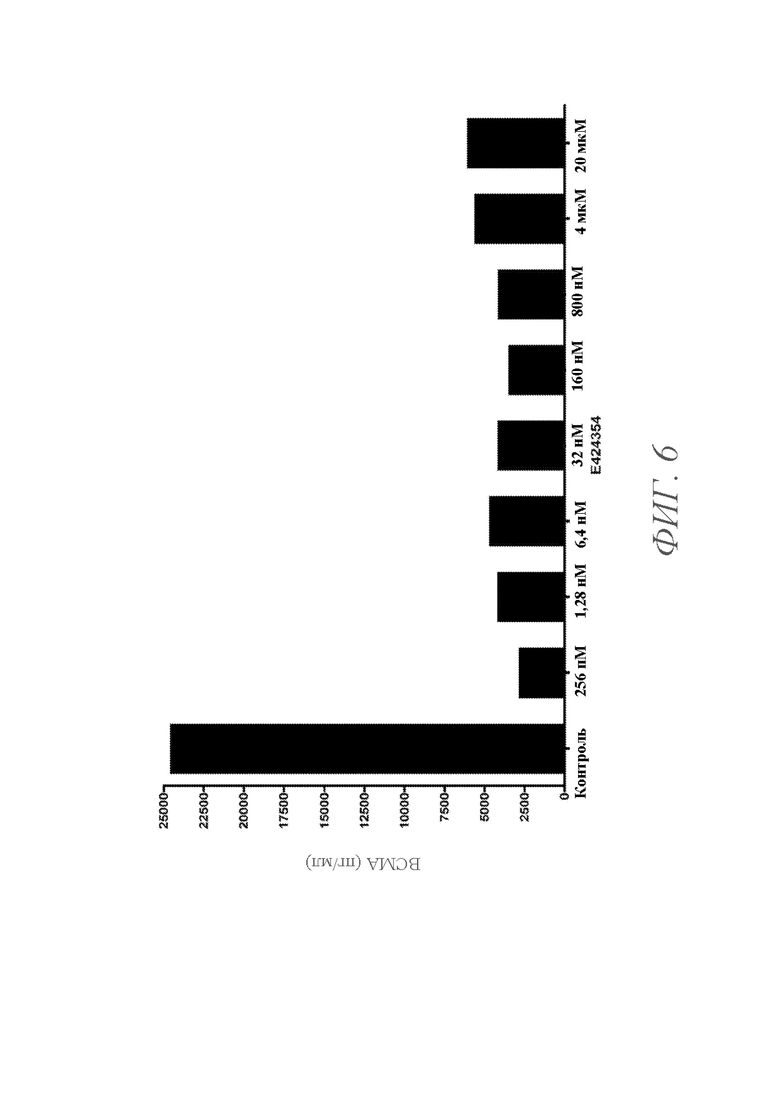
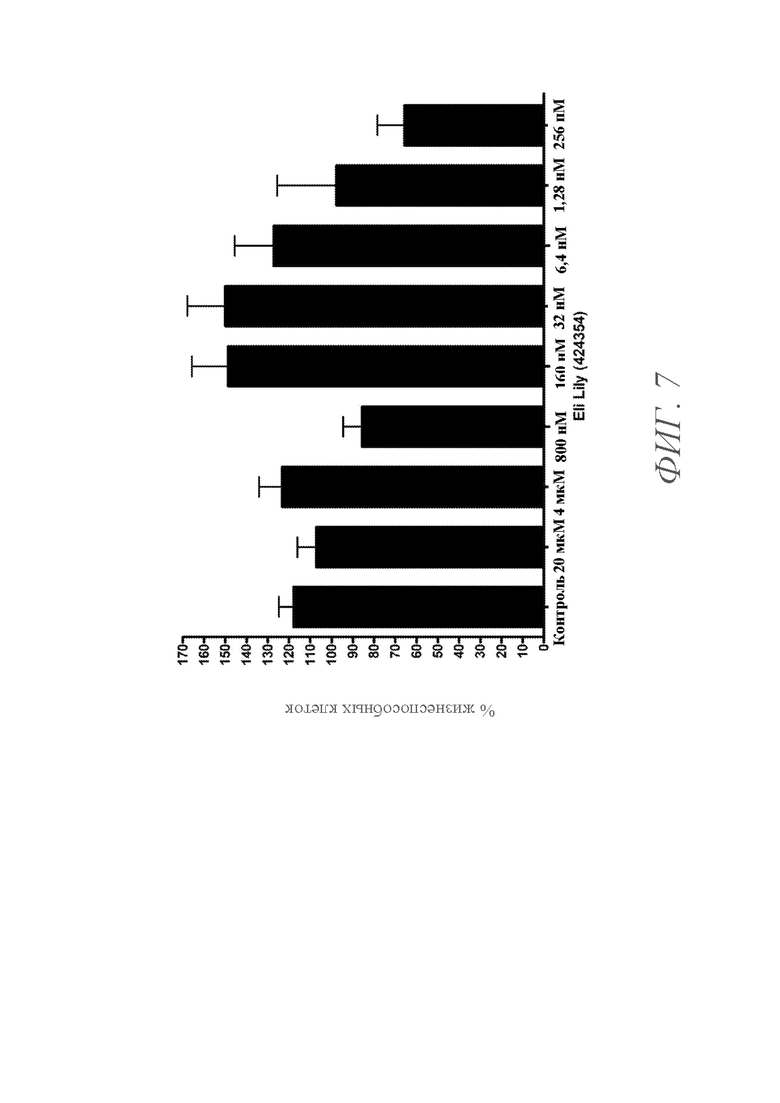



Группа изобретений относится к лечению состояния или нарушения, связанного с В-клетками. Способ лечения состояния или нарушения, связанного с В-клетками, у субъекта включает введение субъекту одного или более ингибиторов гамма-секретазы и введение терапевтического средства, которое связывается с BCMA, выбранного из группы, состоящей из антитела против BCMA или его фрагмента, конъюгата антитела против BCMA и лекарственного средства, и Т-клетки с химерным антигенным рецептором (CAR-T-клетки), которая связывается с BCMA. Также раскрыт способ повышения эффективности терапии у субъекта, получающего лечение терапевтическим средством, которое связывается с BCMA, состояния или нарушения, связанного с В-клетками. Группа изобретений обеспечивает повышение эффективности терапевтических средств, направленных против BCMA. 2 н. и 30 з.п. ф-лы, 1 пр., 11 ил.
1. Способ лечения состояния или нарушения, связанного с В-клетками, у субъекта, включающий введение субъекту одного или более ингибиторов гамма-секретазы и введение терапевтического средства, которое связывается с BCMA, выбранного из группы, состоящей из антитела против BCMA или его фрагмента, конъюгата антитела против BCMA и лекарственного средства, и Т-клетки с химерным антигенным рецептором (CAR-T-клетки), которая связывается с BCMA.
2. Способ по п. 1, где состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из MM, WM, CLL, B-клеточной неходжкинской лимфомы, плазмоцитомы, лимфомы Ходжкина, фолликулярных лимфом, лимфом из мелких клеток с нерасщепленным ядром, эндемической лимфомы Беркитта, спорадической лимфомы Беркитта, лимфомы краевой зоны, экстранодальной лимфомы лимфоидной ткани слизистых оболочек, нодальной моноцитоидной В-клеточной лимфомы, селезеночной лимфомы, мантийноклеточной лимфомы, крупноклеточной лимфомы, диффузной смешанно-клеточной лимфомы, иммунобластной лимфомы, первичной медиастинальной В-клеточной лимфомы, В-клеточной лимфангиомы легких, мелкоклеточной лимфоцитарной лимфомы, пролиферации В-клеток неопределенного злокачественного потенциала, лимфоматоидного гранулематоза, посттрансплантационного лимфопролиферативного расстройства, иммунорегуляторного расстройства, ревматоидного артрита, миастении, идиопатической тромбоцитопенической пурпуры, антифосфолипидного синдрома, болезни Чагаса, болезни Грейвса, гранулематоза Вегенера, узелкового полиартериита, синдрома Шегрена, пемфигуса обыкновенного, склеродермии, рассеянного склероза, антифосфолипидного синдрома, связанного с ANCA васкулита, болезни Гудпасчера, болезни Кавасаки, аутоиммунной гемолитической анемии и быстро прогрессирующего гломерулонефрита, болезни тяжелой цепи, первичного или иммуноцитарного амилоидоза или моноклональной гаммапатии неясного генеза.
3. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, представляет собой злокачественное новообразование, связанное с В-клетками.
4. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, представляет собой злокачественное новообразование, связанное с плазматическими клетками.
5. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из MM, WM, CLL и B-клеточной неходжкинской лимфомы.
6. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, представляет собой множественную миелому.
7. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, представляет собой аутоиммунное заболевание.
8. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, представляет собой системную красную волчанку.
9. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, представляет собой ревматоидный артрит.
10. Способ по п. 1 или 2, где состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из идиопатической тромбоцитопенической пурпуры, миастении и аутоиммунной гемолитической анемии.
11. Способ по любому из пп. 1-10, где ингибитор гамма-секретазы выбран из группы, состоящей из ингибитора секретазы I (GSI I) Z-Leu-Leu-норлейцина; ингибитора γ-секретазы II (GSI II); ингибитора γ-секретазы III (GSI III), N-бензилоксикарбонил-Leu-лейциналя, N-(2-нафтоил)-Val-фенилаланиналя; ингибитора γ-секретазы III (GSI IV); ингибитора γ-секретазы III (GSI V), N-бензилоксикарбонил-Leu-фенилаланиналя; ингибитора γ-секретазы III (GSI VI), 1-(S)-эндо-N-(1,3,3)-триметилбицикло[2.2.1]гепт-2-ил)-4-фторфенилсульфонамида; ингибитора γ-секретазы III (GSI VII), ментилоксикарбонил-LL-CHO; ингибитора γ-секретазы III (GSI IX), (DAPT), сложного трет-бутилового эфира N-[N-(3,5-дифторфенацетил-L-аланил)]-S-фенилглицина; ингибитора γ-секретазы X (GSI X), сложного трет-бутилового эфира {1S-бензил-4R-[1-(1S-карбамоил-2-фенэтилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрокси-5-фенилпентил}карбаминовой кислоты; ингибитора γ-секретазы XI (GSI XI), 7-амино-4-хлор-3-метоксиизокумарина; ингибитора γ-секретазы XII (GSI XII), Z-Ile-Leu-CHO; ингибитора γ-секретазы XIII (GSI XIII), Z-Tyr-Ile-Leu-CHO; ингибитора γ-секретазы XIV (GSI XIV), Z-Cys(t-Bu)-Ile-Leu-CHO; ингибитора γ-секретазы XVI (GSI XVI), сложного метилового эфира N-[N-3,5-дифторфенацетил]-L-аланил-S-фенилглицина; ингибитора γ-секретазы XVII (GSI XVII); ингибитора γ-секретазы XIX (GSI XIX), бензо[e][1,4]диазепин-3-ил)-бутирамида; ингибитора γ-секретазы XX (GSI XX), (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамида; ингибитора γ-секретазы XXI (GSI XXI), (S,S)-2-[2-(3,5-дифторфенил)-ацетиламино]-N-(1-метил-2-оксо-5-фенил-2-,3-дигидро-1H-бензо[e][1,4]диазепин-3-ил)-пропионамида; ингибитора гамма(40)-секретазы I, N-транс-3,5-диметоксициннамоил-Ile-лейциналя; ингибитора гамма(40)-секретазы II, N-трет-бутилоксикарбонил-Gly-Val-валиналя-изовалерил-V V-Sta-A-Sta-OCH3; MK-0752 (Merck); MRK-003 (Merck); семагацестата/LY450139 (Eli Lilly); RO4929097; PF-03084,014; BMS-708163; MPC-7869 (модификатор γ-секретазы), YO-01027 (дибензазепин), соединения E ([(2S)-2-{[(3,5-дифторфенил)ацетил]амино}-N-[(3S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил]пропанамид], доступен от Alexis Biochemicals), LY411575 (Eli Lilly and Co.), L-685,458 (Sigma-Aldrich), BMS-289948 (4-хлор-N-(2,5-дифторфенил)-N-((1R)-{4-фтор-2-[3-(1H-имидазол-1-ил)пропил]фенил}этил)бензолсульфонамида гидрохлорид) и BMS-299897 (4-[2-((1R)-1-{[(4-хлорфенил)сульфонил]-2,5-дифторанилино}этил)-5-фторфенил]бутановая кислота) (Bristol Myers Squibb).
12. Способ по любому из пп. 1-11, где ингибитор гамма-секретазы вводят субъекту внутривенно.
13. Способ по любому из пп. 1-12, где ингибитор гамма-секретазы вводят субъекту перорально.
14. Способ по любому из пп. 1-13, где субъект получает лечение или ранее получал лечение с применением лучевой терапии, химиотерапии, трансплантации, иммунотерапии, гормональной терапии или фотодинамической терапии.
15. Способ по любому из пп. 1-14, где субъект получает лечение или ранее получал лечение состояния или нарушения, связанного с B-клетками, нацеленное в отношении BCMA на B-клетках.
16. Способ по любому из пп. 1-15, где субъект имеет рефрактерное гематологическое злокачественное новообразование.
17. Способ повышения эффективности терапии у субъекта, получающего лечение терапевтическим средством, которое связывается с BCMA, состояния или нарушения, связанного с В-клетками, при этом способ включает введение субъекту одного или более ингибиторов гамма-секретазы в дополнение к существующему лечению, предоставляемому субъекту,
при этом терапевтическое средство, которое связывается с BCMA, выбрано из группы, состоящей из антитела против BCMA или его фрагмента, конъюгата антитела против BCMA и лекарственного средства, и Т-клетки с химерным антигенным рецептором (CAR-T-клетки), которая связывается с BCMA.
18. Способ по п. 17, где состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из MM, WM, CLL, B-клеточной неходжкинской лимфомы, плазмоцитомы, лимфомы Ходжкина, фолликулярных лимфом, лимфом из мелких клеток с нерасщепленным ядром, эндемической лимфомы Беркитта, спорадической лимфомы Беркитта, лимфомы краевой зоны, экстранодальной лимфомы лимфоидной ткани слизистых оболочек, нодальной моноцитоидной В-клеточной лимфомы, селезеночной лимфомы, мантийноклеточной лимфомы, крупноклеточной лимфомы, диффузной смешанно-клеточной лимфомы, иммунобластной лимфомы, первичной медиастинальной В-клеточной лимфомы, В-клеточной лимфангиомы легких, мелкоклеточной лимфоцитарной лимфомы, пролиферации В-клеток неопределенного злокачественного потенциала, лимфоматоидного гранулематоза, посттрансплантационного лимфопролиферативного расстройства, иммунорегуляторного расстройства, ревматоидного артрита, миастении, идиопатической тромбоцитопенической пурпуры, антифосфолипидного синдрома, болезни Чагаса, болезни Грейвса, гранулематоза Вегенера, узелкового полиартериита, синдрома Шегрена, пемфигуса обыкновенного, склеродермии, рассеянного склероза, антифосфолипидного синдрома, связанного с ANCA васкулита, болезни Гудпасчера, болезни Кавасаки, аутоиммунной гемолитической анемии и быстро прогрессирующего гломерулонефрита, болезни тяжелой цепи, первичного или иммуноцитарного амилоидоза или моноклональной гаммапатии неясного генеза.
19. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, представляет собой злокачественное новообразование, связанное с В-клетками.
20. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, представляет собой злокачественное новообразование, связанное с плазматическими клетками.
21. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из MM, WM, CLL и B-клеточной неходжкинской лимфомы.
22. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, представляет собой множественную миелому.
23. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, представляет собой аутоиммунное заболевание.
24. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, представляет собой системную красную волчанку.
25. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, представляет собой ревматоидный артрит.
26. Способ по п. 17 или 18, где состояние или нарушение, связанное с В-клетками, выбрано из группы, состоящей из идиопатической тромбоцитопенической пурпуры, миастении и аутоиммунной гемолитической анемии.
27. Способ по любому из пп. 17-26, где ингибитор гамма-секретазы выбран из группы, состоящей из ингибитора секретазы I (GSI I) Z-Leu-Leu-норлейцина; ингибитора γ-секретазы II (GSI II); ингибитора γ-секретазы III (GSI III), N-бензилоксикарбонил-Leu-лейциналя, N-(2-нафтоил)-Val-фенилаланиналя; ингибитора γ-секретазы III (GSI IV); ингибитора γ-секретазы III (GSI V), N-бензилоксикарбонил-Leu-фенилаланиналя; ингибитора γ-секретазы III (GSI VI), 1-(S)-эндо-N-(1,3,3)-триметилбицикло[2.2.1]гепт-2-ил)-4-фторфенилсульфонамида; ингибитора γ-секретазы III (GSI VII), ментилоксикарбонил-LL-CHO; ингибитора γ-секретазы III (GSI IX), (DAPT), сложного трет-бутилового эфира N-[N-(3,5-дифторфенацетил-L-аланил)]-S-фенилглицина; ингибитора γ-секретазы X (GSI X), сложного трет-бутилового эфира {1S-бензил-4R-[1-(1S-карбамоил-2-фенэтилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрокси-5-фенилпентил}карбаминовой кислоты; ингибитора γ-секретазы XI (GSI XI), 7-амино-4-хлор-3-метоксиизокумарина; ингибитора γ-секретазы XII (GSI XII), Z-Ile-Leu-CHO; ингибитора γ-секретазы XIII (GSI XIII), Z-Tyr-Ile-Leu-CHO; ингибитора γ-секретазы XIV (GSI XIV), Z-Cys(t-Bu)-Ile-Leu-CHO; ингибитора γ-секретазы XVI (GSI XVI), сложного метилового эфира N-[N-3,5-дифторфенацетил]-L-аланил-S-фенилглицина; ингибитора γ-секретазы XVII (GSI XVII); ингибитора γ-секретазы XIX (GSI XIX), бензо[e][1,4]диазепин-3-ил)-бутирамида; ингибитора γ-секретазы XX (GSI XX), (S,S)-2-[2-(3,5-дифторфенил)ацетиламино]-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)пропионамида; ингибитора γ-секретазы XXI (GSI XXI), (S,S)-2-[2-(3,5-дифторфенил)-ацетиламино]-N-(1-метил-2-оксо-5-фенил-2-,3-дигидро-1H-бензо[e][1,4]диазепин-3-ил)-пропионамида; ингибитора гамма(40)-секретазы I, N-транс-3,5-диметоксициннамоил-Ile-лейциналя; ингибитора гамма(40)-секретазы II, N-трет-бутилоксикарбонил-Gly-Val-валиналя-изовалерил-V V-Sta-A-Sta-OCH3; MK-0752 (Merck); MRK-003 (Merck); семагацестата/LY450139 (Eli Lilly); RO4929097; PF-03084,014; BMS-708163; MPC-7869 (модификатор γ-секретазы), YO-01027 (дибензазепин), соединения E ([(2S)-2-{[(3,5-дифторфенил)ацетил]амино}-N-[(3S)-1-метил-2-оксо-5-фенил-2,3-дигидро-1H-1,4-бензодиазепин-3-ил]пропанамид], доступен от Alexis Biochemicals), LY411575 (Eli Lilly and Co.), L-685,458 (Sigma-Aldrich), BMS-289948 (4-хлор-N-(2,5-дифторфенил)-N-((1R)-{4-фтор-2-[3-(1H-имидазол-1-ил)пропил]фенил}этил)бензолсульфонамида гидрохлорид) и BMS-299897 (4-[2-((1R)-1-{[(4-хлорфенил)сульфонил]-2,5-дифторанилино}этил)-5-фторфенил]бутановая кислота) (Bristol Myers Squibb).
28. Способ по любому из пп. 17-27, где ингибитор гамма-секретазы вводят субъекту внутривенно.
29. Способ по любому из пп. 17-28, где ингибитор гамма-секретазы вводят субъекту перорально.
30. Способ по любому из пп. 17-29, где субъект получает лечение или ранее получал лечение с применением лучевой терапии, химиотерапии, трансплантации, иммунотерапии, гормональной терапии или фотодинамической терапии.
31. Способ по любому из пп. 17-30, где субъект получает лечение или ранее получал лечение состояния или нарушения, связанного с B-клетками, нацеленное в отношении BCMA на B-клетках.
32. Способ по любому из пп. 17-31, где субъект имеет рефрактерное гематологическое злокачественное новообразование.
| US 20080058316, 06.03.2008 | |||
| Laurent S | |||
| et al | |||
| γ-Secretase directly sheds the survival receptor BCMA from plasma cells // Nat Commun | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Chen F | |||
| et al | |||
| Gamma-secretase inhibitor enhances the cytotoxic effect of bortezomib in multiple myeloma // Cell Oncol (Dordr) | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Li M | |||
| et al | |||
| Combined inhibition of Notch | |||
Авторы
Даты
2021-05-28—Публикация
2016-07-22—Подача