Изобретение относится к медицине, а именно к офтальмологии, и может быть использовано в лечении посттравматического воспаления роговицы.
В настоящее время разработаны различные методы лечения посттравматического воспаления роговицы.
Известны способы лечения инфекционных кератитов, включающие воздействие лазерным излучением на инфекционный очаг роговицы (RU 2352367). Фотодинамическую терапию проводят с использованием геля в качестве фотосенсибилизатора, содержащего октакатионный фталоцианин цинка в концентрации 1-3 мг/мл, который предварительно наносят на роговицу. Через 30-40 минут после аппликации гелем роговую оболочку и конъюнктивальную полость промывают, на поверхность роговицы воздействуют лазерным излучением с длиной волны 675 нм со световой дозой 20-60 Дж/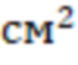 продолжительностью 5 минут. Способ позволяет уничтожить возбудителя с максимальной сохранностью окружающих тканей самой роговицы. Способ имеет следующие недостатки: данный метод обеспечивает лечение кератитов только грибковой этиологии и является малоэффективным относительно бактериальных возбудителей.
продолжительностью 5 минут. Способ позволяет уничтожить возбудителя с максимальной сохранностью окружающих тканей самой роговицы. Способ имеет следующие недостатки: данный метод обеспечивает лечение кератитов только грибковой этиологии и является малоэффективным относительно бактериальных возбудителей.
Известен способ лечения кератитов воздействием физического фактора (RU 2270704). Данный способ предусматривает лазерную инфракрасную термотерапию инфильтрата роговицы. Длина волны 810 нм, мощность излучения 1000-1250 мВт, диаметр пятна в фокальной плоскости от 2 до 3 мм, экспозиция излучения 3 секунды. Проводят 1-3 сеанса с интервалом 3-7 дней. Способ позволяет избежать выраженного астигматизма, коагулирующего эффекта и развития глубокого помутнения роговицы. Однако данный способ эффективен только в отношении вирусных кератитов и не применим для лечения кератитов бактериальной этиологии.
Наиболее близким к предлагаемому способу является способ обработки бактериальных поражений роговицы глаза путем воздействия низкотемпературной плазмы на очаг поражения (RU 2191044). Способ заключается в воздействии на область поверхности язвы потоков низкотемпературной плазмы с плотностью потока энергии 0,4-0,8 Вт/см2 с удельной экспозицией 40-50 с/см2 на площадь поверхности. Способ позволяет повысить эффективность лечения за счет подавления роста бактерий.
Согласно этому методу изъязвленное бактериальное поражение роговицы глаз диаметром до 3 мм, глубиной до средних слоев роговицы, с уровнем гипопиона до 3-4 мм, обрабатывается низкотемпературной плазмой плотностью потока энергии 0,6 Вт/см2 в течение 45 с. Обработка проводится ежедневно, до появления клинического улучшения.
Результаты были оценены после двух обработок и показали, что поверхность язвы очистилась от гнойного содержимого, рассосался гипопион и «шлейф» экссудата в передней камере.
Недостатками указанного метода являются: длительность экспозиции – на очаг поражения воздействуют потоком низкотемпературной плазмы в течение 40-50 сек., кратность применения – обработка производится ежедневно до появления клинического улучшения.
Новой технической задачей изобретения является повышение эффективности лечения посттравматического кератита и усиление репаративной регенерации тканей роговицы.
Для решения поставленной задачи для лечения посттравматического воспаления роговицы выполняют однократное воздействие продолжительностью 10 секунд низкотемпературной плазмы атмосферного давления с напряжением 25 кВ, частотой – 5 кГц на расстоянии от очага инфекции 7 мм.
Применение предлагаемого способа обеспечивает купирование воспалительного процесса, усиление репаративной регенерации тканей роговицы и сокращение сроков лечения посттравматического кератита, что в дальнейшем позволит успешно использовать данный метод в кабинетах неотложной офтальмологической помощи.
Способ осуществляется следующим образом.
На область травматического повреждения однократно воздействуют потоком низкотемпературной плазмы атмосферного давления с напряжением 25 кВ и частотой – 5 кГц на расстоянии от очага инфекции не более 7 мм и продолжительностью 10 секунд. Предлагаемый способ обеспечивает купирование воспалительного процесса, усиление репаративной регенерации тканей роговицы и сокращение сроков лечения посттравматического кератита.
Способ апробирован на 36 крысах линии Wistar- массой 230-250 гр. Каждому животному в условиях операционной моделировали корнеальное ранение с последующей обсеменением тканей роговицы Staphylococcus aureus (100000 ед/мл).
Через неделю от начала эксперимента животные были поделены на следующие группы:
1 группа – группа животных модели заболевания;
2 группа – животные, которым воздействовали на корнеальный очаг низкотемпературной плазмой атмосферного давления с напряжением 25 кВ и частотой – 5 кГц на расстоянии от очага инфекции 7 мм продолжительностью 10 секунд;
3 группа – контрольная группа животных, которым проводили инстилляцию роговицы антибактериальными и антисептическими средствами (Тобрекс по 1 к 3 раза в день, Сульфацил Натрия по 1 к 3 раза в день).
В ходе эксперимента проводили наружный осмотр, фоторегистрацию. Забор материалов для гистологического исследования проводили на 1, 3, 7, 10 сутки.
Для оценки морфологических изменений энуклеированные глаза фиксировали в 12% нейтральном формалине в течение 24 часов. После 24-часового промывания в проточной воде материал обезвоживали в спиртах восходящей концентрации, просветляли в О-ксилоле и заливали в парафин. После приготовления срезов толщиной 4-6 мкм препараты окрашивали гематоксилином и эозином.
Цифровые фотографии гистологических срезов роговицы энуклеированных глаз анализировали в ходе морфометрического исследования с использованием компьютерной программы ImageJ 1.46. За единицу измерения принимали 1 мм2 роговицы и конъюнктивы. С помощью метода точечного счета Г.Г. Автандилова (1960 г.) с использованием Plugins «Grid» в гистологических препаратах рассчитывали удельный объем (%) пространств между коллагеновыми волокнами, которые расценивали как развитие отека, новообразованных сосудов и клеточной инфильтрации.
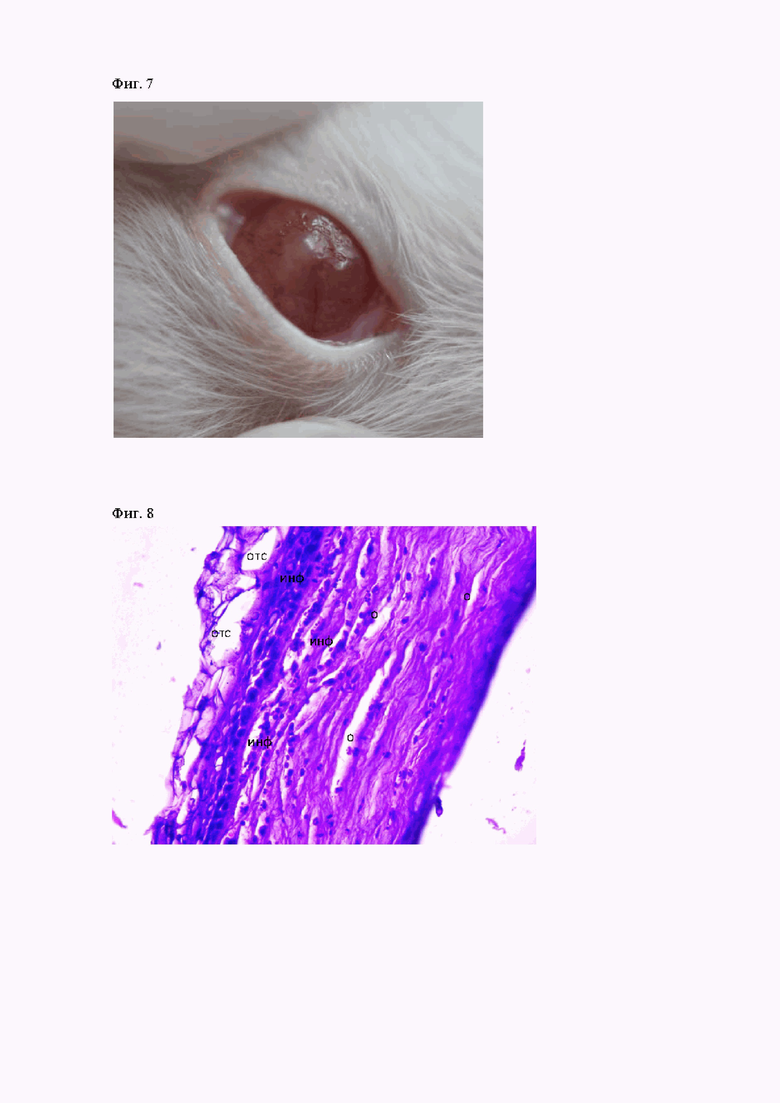
В ходе наружного осмотра через неделю после моделирования корнеального ранения с последующей обсеменением тканей роговицы Staphylococcus aureus и на 1-е сутки от начала лечения у всех животных наблюдались слезотечение, светобоязнь, инъекция сосудов конъюнктивы, отёчность роговицы и формирование очага в зоне повреждения роговой оболочки (фиг. 1). На 3-е сутки от начала лечения у животных второй группы сохранялась инъекция сосудов конъюнктивы, корнеальный очаг заметно уменьшился в размерах (фиг 2). У животных третьей группы наблюдались слезотечение, инъекция сосудов конъюнктивы, отечность роговицы и очаг в зоне повреждения роговой оболочки (фиг. 3). На 7-е сутки от начала лечения у животных второй группы роговица прозрачная, местами со слабо выраженным отеком, замечено формирование посттравматического рубца в зоне повреждения роговой оболочки (фиг. 4). У животных третьей группы в эти же сроки наблюдались умеренно выраженная отечность роговицы и инъекция сосудов конъюнктивы, корнеальный очаг заметно уменьшился в размерах. На 10-е сутки от начала лечения у животных второй группы роговица прозрачная со сформированным посттравматическим рубцом (фиг. 5). У животных третьей группы в эти же сроки наблюдались слабо выраженная отечность роговицы, новообразованные сосуды и формирование посттравматического рубца в зоне повреждения роговой оболочки (фиг. 6). У животных первой группы на протяжении всего эксперимента сохранялись слезотечение, светобоязнь, инъекция сосудов конъюнктивы, отёчность роговицы, очаг в зоне повреждения роговой оболочки (фиг. 7).
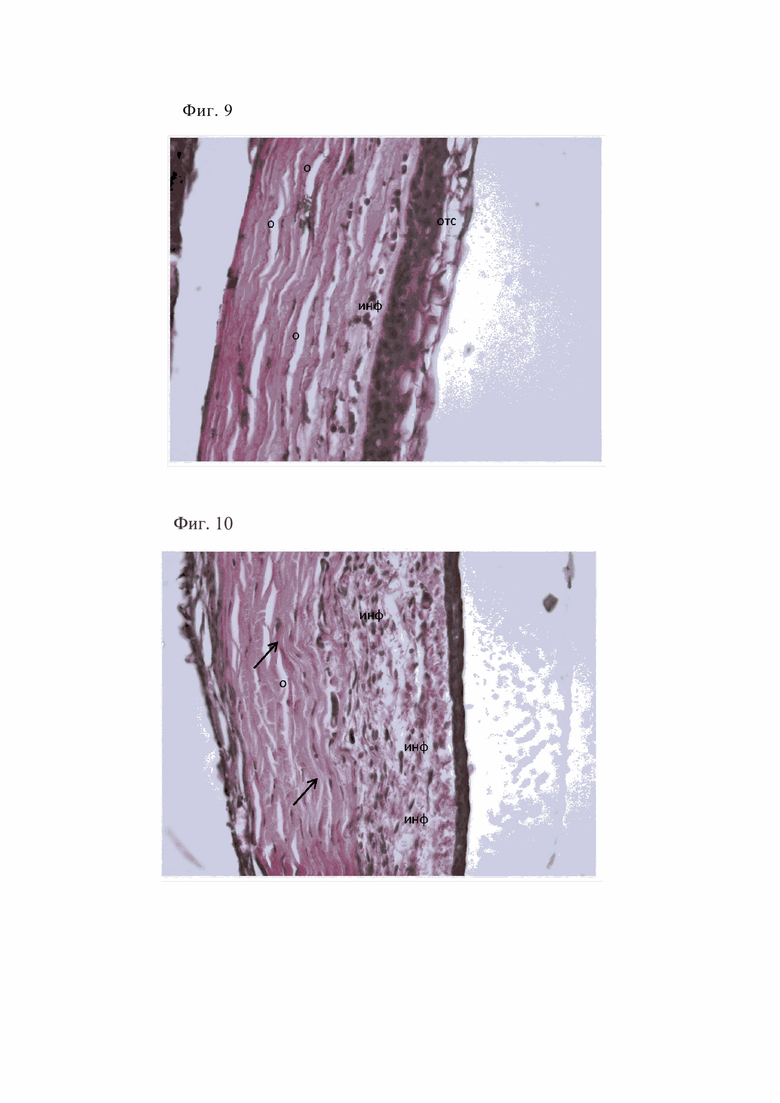
В ходе морфологических исследований через неделю после моделирования корнеального ранения с последующей обсеменением тканей роговицы Staphylococcus aureus передний эпителий был частично отслоен. Боуменова мембрана неравномерно визуализировалась на всем протяжении, местами утолщена. Коллагеновые волокна с повышено извитым ходом располагались рыхло, формируя щели, которые можно расценить как отек, удельным объемом 27,7%. В строме лейкоцитарная инфильтрация (удельным объемом 15,7%), более выраженная в передней 1/3 собственного вещества, представлена лимфоцитами и нейтрофилами (фиг. 8). Десцеметова мембрана визуализировалась на всем протяжении. Эндотелий был представлен одним слоем клеток, местами слущенным.
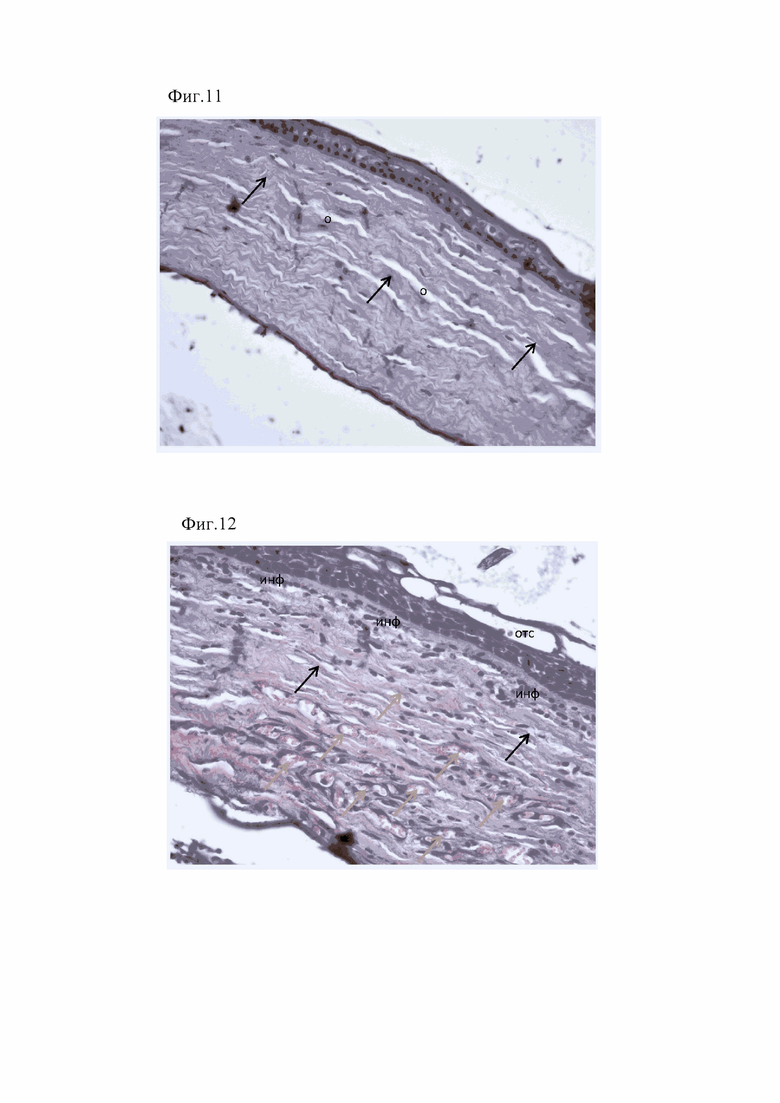
На 3-е сутки от начала лечения у животных второй группы передний эпителий был частично отслоен. Боуменова мембрана визуализировалась на всем протяжении, местами утолщена. Коллагеновые волокна располагались рыхло, формируя щели, удельным объемом 20,8%. В строме лейкоцитарная инфильтрация (удельным объемом 14,17 %), более выраженная в передней 1/3 собственного вещества близи Боуменовой мембраны, представлена лимфоцитами (фиг. 9). Десцеметова мембрана визуализировалась на всем протяжении. Эндотелий был представлен одним слоем клеток, местами слущенным.
У животных третьей группы в эти же сроки передний эпителий был также частично отслоен. Боуменова мембрана неравномерно визуализировалась на всем протяжении, местами утолщена. Коллагеновые волокна с повышено извитым ходом располагались рыхло. Отек удельным объемом 23,6%, p>0,05. В передней 1/3 стромы выраженная лейкоцитарная инфильтрация (удельным объемом 18,6%, p<0,05), представленная в большей мере лимфоцитами и нейтрофилами (фиг. 10). Десцеметова мембрана не равномерно визуализировалась, утолщена. Эндотелий был представлен одним слоем клеток, местами слущенным.
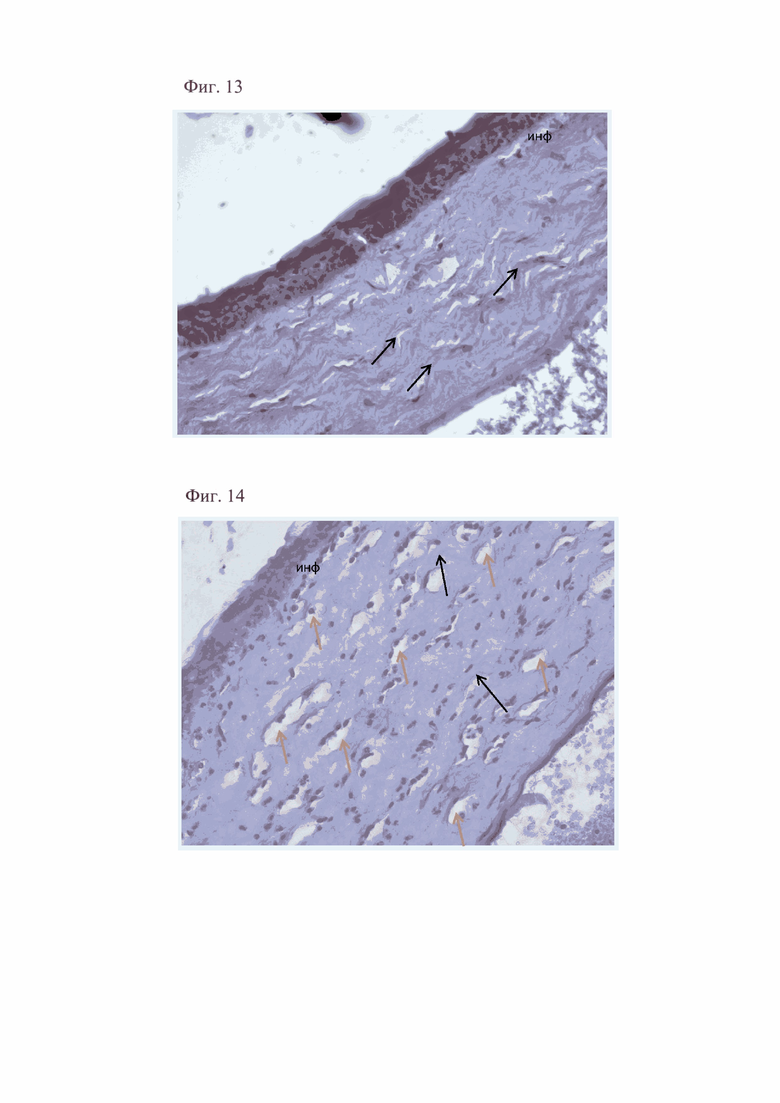
На 7-е сутки от начала лечения у животных второй группы передний эпителий был представлен пластом клеток. Боуменова мембрана визуализировалась на всем протяжении. Коллагеновые волокна с умеренно повышенным извитым ходом формировали щели, удельным объемом 14,2%. В строме слабо выраженная лейкоцитарная инфильтрация (удельным объемом 6,4%) и умеренно выраженным отеком удельным объемом 10,1% (фиг. 11). Встречались единичные тонкостенные сосуды, удельным объемом 2,2%. Десцеметова мембрана визуализировалась на всем протяжении. Эндотелий был представлен одним слоем клеток.
У животных третьей группы в эти же сроки передний эпителий был также частично отслоен. Боуменова мембрана визуализировалась на всем протяжении, местами утолщена. Коллагеновые волокна с повышено извитым ходом располагались рыхло. Удельный объем отека составил 20,4%, p<0,05. В строме выраженная лейкоцитарная инфильтрация (удельным объемом 23,2%, p<0,05), представленная лимфоцитами и нейтрофилами (фиг. 12), и новообразованные сосуды удельным объемом 10,7%, p<0,05. Десцеметова мембрана не равномерно визуализировалась, утолщена. Эндотелий был представлен одним слоем клеток.
На 10-е сутки от начала лечения у животных второй группы передний эпителий был представлен пластом клеток. Боуменова мембрана визуализировалась на всем протяжении. Коллагеновые волокна с умеренно повышенным ходом. В собственном веществе слабо выраженная лейкоцитарная инфильтрация (удельным объемом 5,6%) (фиг. 13). Встречались единичные тонкостенные сосуды, удельным объемом 3,1%. Десцеметова мембрана визуализировалась на всем протяжении. Эндотелий был представлен одним слоем клеток.
У животных третьей группы в эти же сроки эпителий был представлен пластом клеток. Боуменова мембрана визуализировалась на всем протяжении, местами утолщена. Коллагеновые волокна с повышено извитым ходом располагались рыхло. Удельный объем отека составил не более 13,1%, p<0,05. В строме умеренно выраженная лейкоцитарная инфильтрация удельным объемом 10,1% (p<0,05) и множественные новообразованные сосуды удельным объемом 12,6%, p<0,05 (фиг. 14). Десцеметова мембрана визуализировалась равномерно. Эндотелий был представлен одним слоем клеток.
Таким образом, результаты экспериментального исследования показали, что однократная обработка области посттравматического воспаления роговицы воздействием низкотемпературной плазмы атмосферного давления с напряжением 25 кВ, частотой – 5 кГц на расстоянии от очага инфекции 7 мм продолжительностью 10 секунд снижает выраженность воспаления, ускоряет репаративную регенерацию, что приводит к сокращению сроков лечения.
Фигура. 1. Инъекция сосудов конъюнктивы, отёчность роговицы и формирование очага воспалительного процесса в зоне травматического повреждения роговой оболочки у животного первой группы на 7-е сутки от начала эксперимента
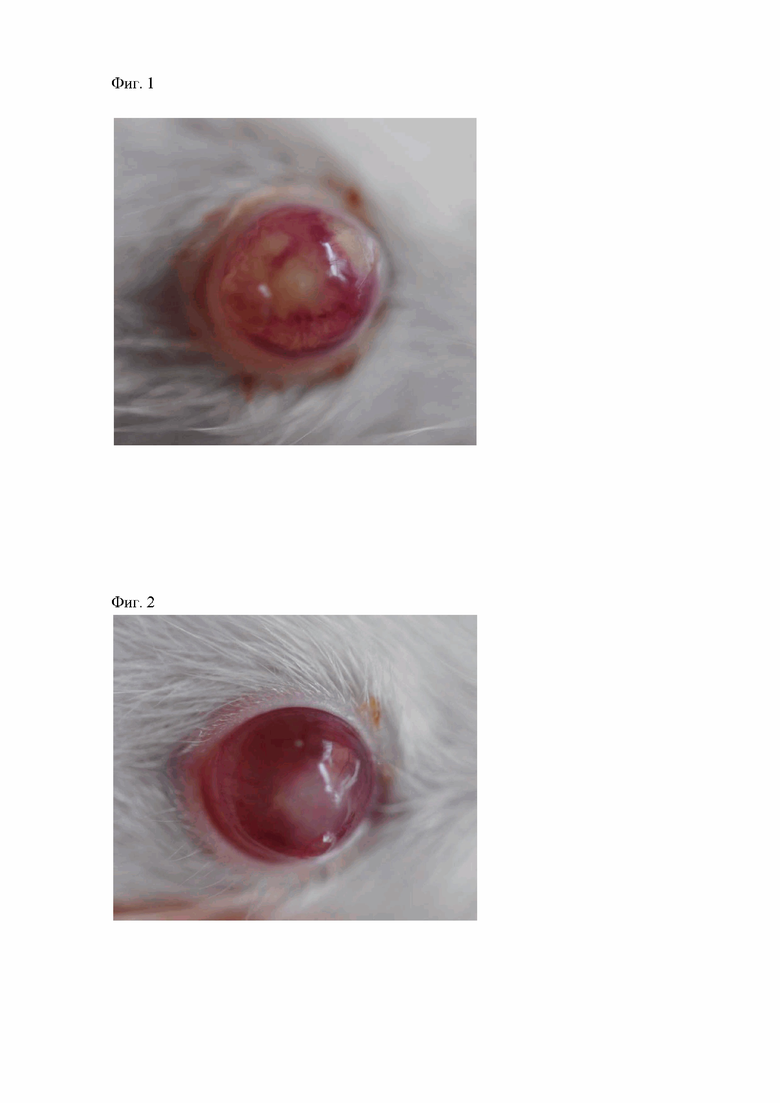
Фигура 2. Инъекция сосудов конъюнктивы, очаг воспалительного процесса в зоне повреждения роговой оболочки у животных второй группы на 3-е сутки от начала лечения.
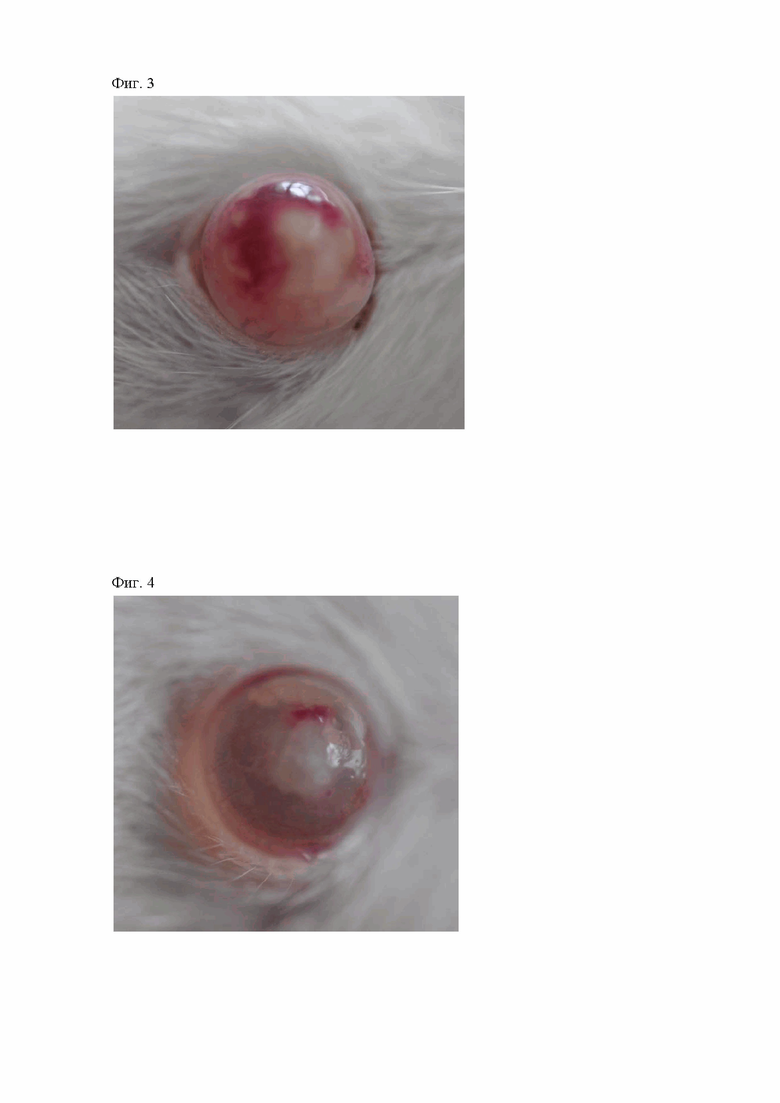
Фигура 3. Инъекция сосудов конъюнктивы, отечность роговицы и очаг в зоне повреждения роговой оболочки у животных третьей группы на 3-е сутки от начала лечения.
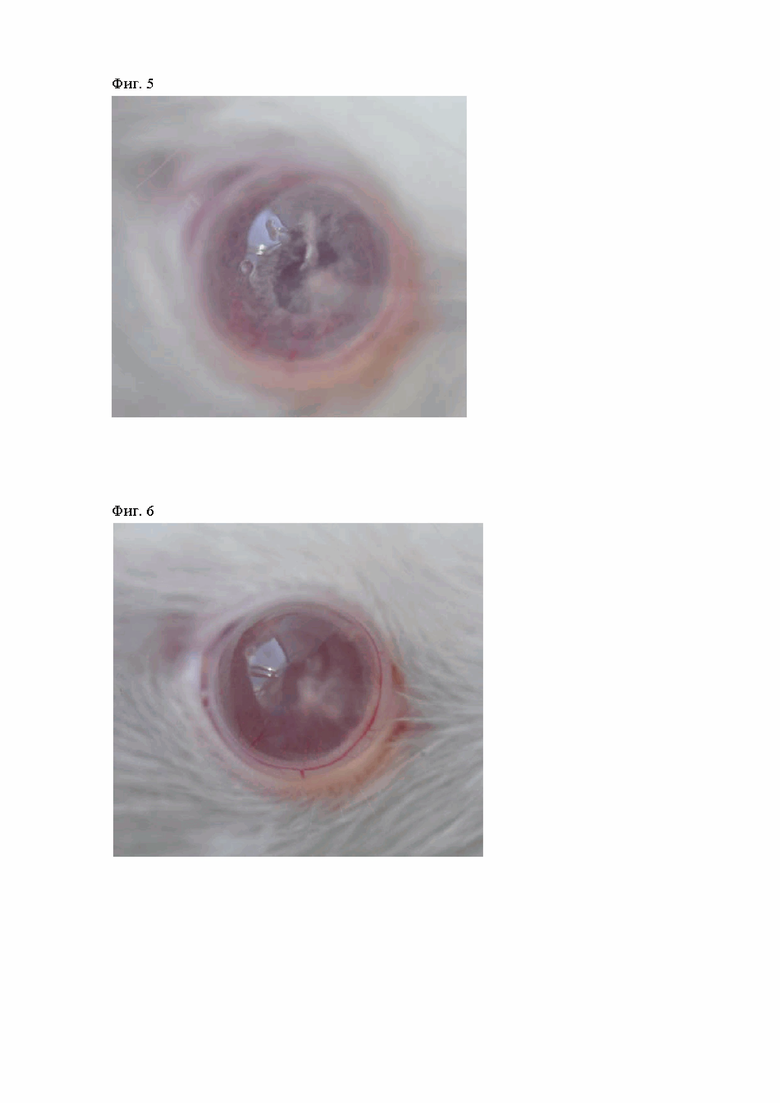
Фигура 4. Формирование посттравматического рубца в зоне повреждения роговой оболочки у животных второй группы на 7-е сутки от начала лечения.
Фигура 5. Прозрачная роговица со сформированным посттравматическим рубцом у животных второй группы на 10-е сутки от начала лечения.
Фигура 6. Новообразованные сосуды, слабо выраженная отечность роговицы у животных третьей группы на 10-е сутки от начала лечения.
Фигура 7. Инъекция сосудов конъюнктивы, отёчность и очаг в зоне повреждения роговицы у животных первой группы на 10-е сутки от начала лечения.
Фигура 8. Частичная отслойка эпителия (отс), отек роговицы (о), лейкоцитарная инфильтрация стромы роговицы (инф) через неделю после моделирования корнеального ранения с последующим обсеменением тканей роговицы Staphylococcus. Окраска гематоксилином и эозином. х400.
Фигура 9. Частичная отслойка эпителия (отс), отек роговицы (о), лейкоцитарная инфильтрация (инф) в строме роговицы у животных второй группы на 3-е сутки от начала лечения. Окраска гематоксилином и эозином. х400.
Фигура 10. Извитость коллагеновых волокон (указаны стрелками), отек в собственном веществе (о), выраженная лейкоцитарная инфильтрация (инф) в передней 1/3 стромы роговицы, у животных третьей группы на 3 сутки. Окраска гематоксилином и эозином. х400.
Фигура 11. Извитость коллагеновых волокон (указаны стрелками), отек (о) и слабо выраженная лейкоцитарная инфильтрация в строме (инф) роговицы у животных второй группы на 7-е сутки от начала лечения. Окраска гематоксилином и эозином. х400.
Фигура 12. Частичная отслойка эпителия (отс), извитость коллагеновых волокон (указаны черными стрелками), выраженная лейкоцитарная инфильтрация (инф), множественные новообразованные сосуды (указаны желтыми стрелками) в строме роговицы у животных третьей группы на 7-е сутки от начала лечения. Окраска гематоксилином и эозином. х400.
Фигура 13. Извитость коллагеновых волокон (указаны стрелками), слабо выраженная лейкоцитарная инфильтрация в собственном веществе (инф) в роговице у животных второй группы на 10-е сутки от начала лечения. Окраска гематоксилином эозином. х400.
Фигура 14. Извитость коллагеновых волокон (указаны черными стрелками), умеренно выраженная лейкоцитарная инфильтрация (инф), множественные новообразованные сосуды (указаны желтыми стрелками) у животных третьей группы на 10-е сутки от начала лечения. х400.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ БИОПОКРЫТИЯ ПОРАЖЕННОЙ РОГОВИЦЫ | 2023 |
|
RU2813951C1 |
| СПОСОБ ДИАГНОСТИКИ БУЛЛЕЗНОЙ КЕРАТОПАТИИ | 2014 |
|
RU2552295C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭНДОТЕЛИАЛЬНО-ЭПИТЕЛИАЛЬНОЙ ДИСТРОФИИ РОГОВИЦЫ | 2015 |
|
RU2594447C1 |
| СПОСОБ ЭКСПЕРИМЕНТАЛЬНОГО МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2021 |
|
RU2764121C1 |
| СПОСОБ ЛЕЧЕНИЯ КОНЪЮНКТИВО-КЕРАТИТОВ У КОШЕК | 2006 |
|
RU2308959C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ТРАВМАТИЧЕСКИХ ИНФЕКЦИЙ ПЕРЕДНЕГО ОТДЕЛА ГЛАЗА | 1996 |
|
RU2142288C1 |
| ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГЕРПЕТИЧЕСКИХ КЕРАТИТОВ И КЕРАТОКОНЪЮКТИВИТОВ | 1995 |
|
RU2104002C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2012 |
|
RU2480845C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭНДОТЕЛИАЛЬНО-ЭПИТЕЛИАЛЬНОЙ ДИСТРОФИИ РОГОВИЦЫ | 2015 |
|
RU2601317C1 |
| СПОСОБ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ РОГОВИЦЫ | 1996 |
|
RU2127571C1 |
Изобретение относится к медицине, а именно к офтальмологии. Выполняют воздействие низкотемпературной плазмой атмосферного давления. Осуществляют однократное воздействие низкотемпературной плазмой на расстоянии от очага инфекции 7 мм с напряжением 25 кВ, частотой 5 кГц и продолжительностью экспозиции 10 секунд. Способ позволяет повысить эффективность лечения посттравматического кератита и усилить репаративную регенерацию тканей роговицы. 14 ил.
Способ лечения посттравматического воспаления роговицы, включающий воздействие низкотемпературной плазмой атмосферного давления, отличающийся тем, что осуществляют однократное воздействие низкотемпературной плазмой на расстоянии от очага инфекции 7 мм с напряжением 25 кВ, частотой 5 кГц и продолжительностью экспозиции 10 секунд.
| СПОСОБ ЛЕЧЕНИЯ ЯЗВЕННЫХ БАКТЕРИАЛЬНЫХ ПОРАЖЕНИЙ РОГОВИЦЫ ГЛАЗА | 2000 |
|
RU2191044C2 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ КЕРАТИТОВ | 2007 |
|
RU2352367C1 |
| СПОСОБ ЛЕЧЕНИЯ ГЛУБОКОГО КЕРАТИТА | 2004 |
|
RU2270704C1 |
| Alhabshan R | |||
| et al | |||
| Effects of In-vivo Application of Cold Atmospheric Plasma on Corneal Wound Healing in New Zealand White Rabbits | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Leonardi A | |||
| et al | |||
| Ros Production by a New Low-temperature Plasma Source for the Treatment of | |||
Авторы
Даты
2021-05-31—Публикация
2020-08-07—Подача