Предлагаемое изобретение относится к медицине, а именно к офтальмологии, и может быть использовано для изучения научных исследований бактериальных процессов в роговице.
Известен способ моделирования микст-инфекции (вирусного и бактериального поражения) роговицы (Авторское свидетельство СССР 1784227, кл. A61F 9/00, 1992 г.), заключающийся во введении вируса простого герпеса в дозе не менее 104-105 в центр роговицы, а через 48-72 часа - культуру золотистого стафилококка в дозе 6,5 - 12,5 млн микробных тел в строму роговицы на расстоянии 1-4 мм от лимба. Однако этот способ имеет существенные недостатки: низкая частота (31%) воспроизведения герпес-стафилококковой язвы роговицы на фоне высокой частоты поражения сосудистого тракта (78%) и развитие эндофтальмита (44%), не позволяющего использовать модель воспроизводимого заболевания для изучения его патогенеза и отбора наиболее эффективных лекарственных средств и их сочетаний.
Также известен способ моделирования герпес-стафилококковой язвы роговой оболочки в эксперименте, заключающийся в заражении роговой оболочки глаза одновременно вирусом простого герпеса и культурой золотистого стафилококка путем одновременного их введения в переднюю камеру глаза экспериментального животного в дозе не менее 1000 ТЦД50/0,1 мл вируса простого герпеса и 2 млн микробных тел золотистого стафилококка (Способ моделирования герпес-стафилококковой язвы роговой оболочки, Мальханов В.Б., Идиятуллина Г.К., Гимранов P.M., Хафизов Г.Г., Шевчук Н.Е, пат. №2187843, заяв. 13.06.1997, опубл. 20.08.2002 г.). Исследования роговой оболочки проводили на 3-5 сутки инфицирования.
Этот способ является травматичным и представляет проникающее колотое ранение роговицы, так как сопровождается введением агентов в переднюю камеру, нарушением внутриглазных структур, вовлечением в воспалительный процесс переднего отдела сосудистого тракта. Способ исключает чистоту получения кератита роговицы в связи с вхождением в переднюю камеру. Кроме того, учитывая правила и нормативы этического обращения с животными необходима помощь анестезиолога и дача наркоза для предупреждения болевых ощущений животного.
Известен способ создания экспериментальной модели бактериального кератита путем введения 20 мкл бактериальной суспензии в роговицу с помощью иглы 30 G (Mucoadhesive polymer extracted from tamarind seed improves the intraocular penetration and efficacy of rufloxacin in topical treatment of experimental bacterial keratitis / E.Ghelardi [et al.] // Antimicrobial Agents and Chemotherapy. - 2004. - Vol.48. - P. 3396-3401). Недостатком данного способа является развитие ограниченного абсцесса роговицы, а не кератита. Не указаны объективные данные, свидетельствующие об образовании кератита, сроки его возникновения.
Известен способ получения экспериментальной модели бактериального кератита (Волкович Т. К., Самсонова И. В., Новости хирургии том 18, №3, 2010 г., стр.26-31). Экспериментальным животным после местной анестезии в оптической зоне выполняли послойную трепанацию роговицы трепаном диаметром 5 мм до 1/3 толщины стромы. Далее роговицу инфицировали возбудителем путем инстилляции в конъюнктивальную полость бактериальной суспензии лабораторного штамма Staphylococcus aureus. Предварительно живую культуру разводили физиологическим раствором до 3 единиц McFarland, что соответствовало 105-106 Мт/мл. Для заражения поврежденной поверхности роговицы использовали 1 мл культуры. Недостаток способа: малая раневая поверхность кератотомии, способная к быстрой адаптации и заживлению, учитывая высокую регенераторную способность кроликов. Кроме того, малый участок соприкосновения с бактериальной инфекцией под влиянием слезы может быстро освободиться от нее и исключить условия для возникновения кератита. Вызывает сомнение возможность развития кератита через одни сутки при таком методе воспроизведения.
Прототипом предлагаемого изобретения является экспериментальная модель воспалительного инфильтрата роговицы кроликов, на которой изучалась терапевтическая эффективность глазных капель Тамерит. После местной анестезии глаз кролика 1% раствором дикаина под операционным микроскопом скальпелем с алмазным лезвием делали надрез роговицы обоих глаз примерно на ½ толщины ее стромы, отступя от верхнего лимба на 2 мм на 12 - 13 часах. Затем образовывали в толще роговицы полость, тотально расслаивая строму с помощью микрохирургического шпателя, а затем в эту полость инсулиновым шприцом вводили 0,1 мл взвеси суспензии Staphylococcus aureus (штамм №6538-р, получен из микробиологической лаборатории института) в разведении по стандарту мутности 10 ед. (Лорткипанидзе М.М., Особенности клиники и современная терапия атопического кератоконъюнктивита. Автореферат, диссертация на соискание ученой степени к.м.н., Москва, 2007 г.). Недостатком модели является излишне глубокое проникновение в роговицу, формирование полости в глубоком слое стромы, вызывая тем самым значительное травматическое повреждение, с возможным образованием абсцесса.
Технический результат при использовании изобретения - формирование патогенетически обоснованной модели заболевания в эксперименте, приближенной к клинической практике.
Указанный технический результат достигается тем, что в способе моделирования бактериального кератита, включающем введение бактериальной суспензии штамма Staphylococcus aureus в толщу роговицы в дозе 0,1 мл, согласно изобретению дополнительно проводят деэпителизацию роговицы с последующим закапыванием бактериальной суспензии на поверхность деэпителизированной роговицы, а введение суспензии в толщу роговицы производят в сформированный в передней 1/3 стромы карман.
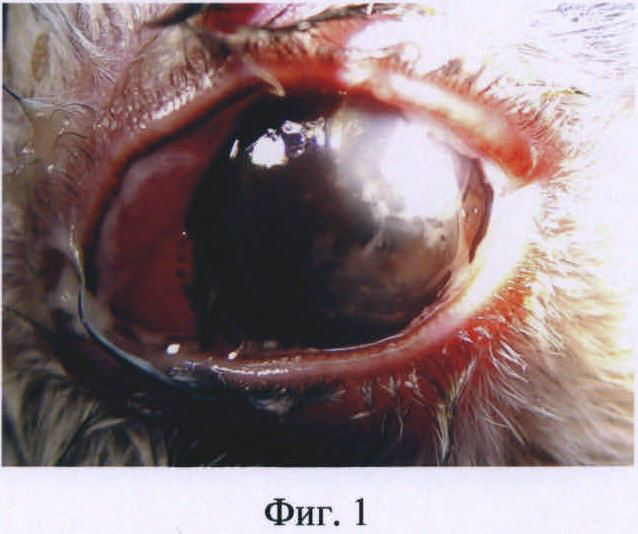
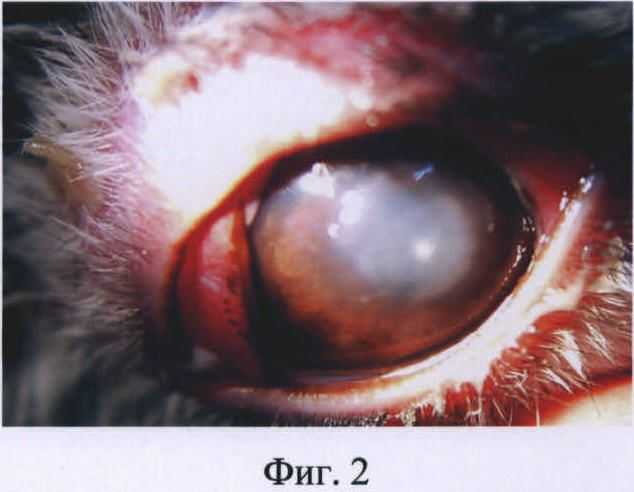
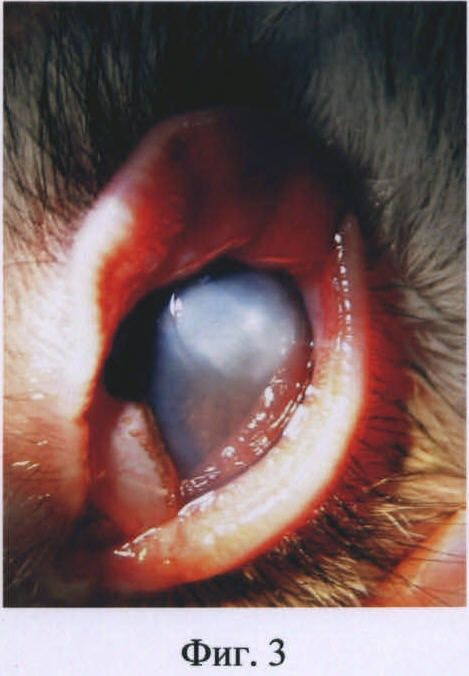
Изобретение иллюстрируется следующими фигурами: на фиг.1 представлена фотография глаза кролика на первые сутки после введения бактериальной суспензии Staphylococcus aureus; на фиг.2 - то же, на вторые сутки после инфицирования; на фиг.3 - то же, на пятые сутки после инфицирования.
Способ моделирования кератита выполняется следующим образом. После внутримышечного обезболивания кролика ксилазином (2,0 мл) и предварительной эпибульбарной анестезии 0,5% раствором инокаина проводят трепанацию на глубину 1/3 стромы и деэпителизацию роговицы. В области трепанации лезвием делают одиночный надрез стромы, через который шпателем проходят в переднюю 1/3 стромы роговицы. В сформированный карман вводят бактериальную суспензию в объеме 0,1 мл (106 Мт/мл), придавливая рану шпателем. На поверхность деэпителизированной роговицы закапывают несколько капель бактериальной суспензии. Двойное вхождение бактериального агента на роговицу интрастромально и поверхностно способствует быстрому развитию бактериального кератита. Это важно для предупреждения процесса регенерации роговицы, который у кроликов идет интенсивнее и быстрее по времени, чем у человека. Эта методика образования экспериментальной модели приближена к механизму возникновения и развития бактериального кератита в практической офтальмологии, особенно травматической этиологии.
Заявляемый способ моделирования бактериального кератита способствует формированию патогенетически обоснованной модели заболевания, учитывающей внедрение инфекционного агента снаружи и в толщу роговицы, снижение повреждения за счет меньшей площади травматизации стромы роговицы, так как чаще при развитии кератита заинтересованы передние слои. В предлагаемой модели не формируется большая полость, а создается узкий карман, отсепарованный микрошпателем, для введения инфекционного агента. Большая часть роговицы остается неповрежденной, не происходит грубой травматизации роговицы, эпителий снимается для быстрого формирования кератита. Такие манипуляции приближены к механизму наиболее частого развития кератита различной этиологии в клинической практике.
Сущность изобретения поясняется следующим примером. Эксперимент выполнен на кролике весом 3 кг. После внутримышечного обезболивания кролика ксилазином (2,0 мл) и предварительной эпибульбарной анестезии 0,5% раствором инокаина проводят трепанацию на 1/3 стромы и деэпителизацию роговицы. Лезвием делают одиночный надрез стромы в области трепанации, затем шпателем через надрез формируют узкий карман на глубине передней 1/3 стромы роговицы. В сформированный карман вводят бактериальную суспензию в объеме 0,1 мл (106 Мт/мл). Шпателем придавливают входное отверстие в роговице. На поверхность деэпителизированной роговицы закапывают бактериальную суспензию в объеме нескольких капель. Двойное вхождение бактериального агента на роговицу интрастромально и поверхностно способствует быстрому развитию бактериального кератита.
Для динамического наблюдения за состоянием роговицы и переднего отрезка глаза проводили фотографирование. Биомикроскопически исследовали состояние роговицы: сроки образования и характер инфильтрата, локализация, размеры распространения воспалительного инфильтрата по площади и в глубину.
Клинически заболевание развивалось через сутки после двойного введения бактериальной суспензии. Объективно у кролика определялись признаки бактериального кератита. Присутствовали симптомы слезотечения, блефароспазма. Глазная щель была закрыта, наблюдался выраженный отек век, обильное гнойное отделяемое на веках и в конъюнктивальной полости, выраженная перикорнеальная и смешанная инъекция конъюнктивы, воспалительный очаг в оптической зоне роговицы. Имелся отек роговицы, инфильтрация поверхностных слоев стромы. Передняя камера была средней глубины, влага прозрачная, радужка без изменений (фиг.1).
На вторые сутки наблюдалась более выраженная клиническая картина бактериального кератита: обильное гнойное отделяемое на веках, выраженная перикорнеальная инъекция конъюнктивы, отек роговицы усилился, поверхностные слои роговицы деэпителизированы, появился инфильтрат в центре с нечеткими границами. Передняя камера средней глубины, влага ее прозрачная (фиг.2).
На пятые сутки выявились выраженный хемоз конъюнктивы, более глубокий очаг инфильтрации стромы роговицы (фиг.3).
Все клинические признаки говорили за развитие бактериального кератита при предложенном способе его моделирования.
Полученная экспериментальная модель имеет большое значение для научных целей и практического здравоохранения. Изучение новых противовоспалительных инстиляционных средств, которые появляются в большом количестве в аптечной сети, требуют изучения и обоснования применения их в медицинской практике. Экспериментальная модель будет использоваться для изучения влияния различных факторов физического воздействия и медикаментозных средств на роговицу при воспалении, в том числе при UV-кросслинкинге и воздействии других видов излучения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭКСПЕРИМЕНТАЛЬНОГО МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2021 |
|
RU2764121C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ВНУТРИГЛАЗНОГО ИНФЕКЦИОННОГО ПРОЦЕССА | 2018 |
|
RU2700403C1 |
| Способ моделирования инфекционного поражения роговицы | 1990 |
|
SU1784227A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ИЗОЛИРОВАННОГО НЕВРИТА ЗРИТЕЛЬНОГО НЕРВА | 2012 |
|
RU2504020C1 |
| Способ создания экспериментальной модели грибкового кератита у кроликов | 2020 |
|
RU2746647C1 |
| Способ лечения посттравматического воспаления роговицы | 2020 |
|
RU2748717C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГЕРПЕС-СТАФИЛОКОККОВОЙ ЯЗВЫ РОГОВОЙ ОБОЛОЧКИ | 1997 |
|
RU2187843C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ТРАВМАТИЧЕСКИХ ИНФЕКЦИЙ ПЕРЕДНЕГО ОТДЕЛА ГЛАЗА | 1996 |
|
RU2142288C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ КЕРАТИТОВ | 2007 |
|
RU2352367C1 |
| Способ создания экспериментальной модели грибкового кератоувеита у кроликов | 2021 |
|
RU2768476C1 |
Изобретение относится к медицине, а именно к офтальмологии, и касается моделирования бактериального кератита. Для этого производят трепанацию роговицы на глубину передней 1/3 стромы и формируют карман, в который вводят бактериальную суспензию штамма Staphylococcus aureus в дозе 0,1 мл. Дополнительно проводят деэпителизацию роговицы с последующим закапыванием бактериальной суспензии. Способ обеспечивает формирование модели кератита, приближенного к клинической практике при исключении значительного повреждения роговицы, что создает удобные условия для изучения лечебных факторов воздействия при кератитах различной этиологии. 3 ил., 1 пр.
Способ моделирования бактериального кератита, включающий введение бактериальной суспензии штамма Staphylococcus aureus в толщу роговицы в дозе 0,1 мл, отличающийся тем, что дополнительно проводят деэпителизацию роговицы с последующим закапыванием бактериальной суспензии на поверхность деэпителизированной роговицы, а введение суспензии в толщу роговицы производят в сформированный в передней 1/3 стромы карман.
| ЛОРТКИПАНИДЗЕ М.М | |||
| Особенности клиники и современная терапия атопического кератоконъюнктивита: Автореф | |||
| дис | |||
| на соиск | |||
| учен | |||
| степ | |||
| канд | |||
| мед | |||
| наук, 2007 | |||
| СПОСОБ МОДЕЛИРОВАНИЯ ГРИБКОВОГО КЕРАТИТА У КРОЛИКОВ | 2007 |
|
RU2346338C1 |
| СПОСОБ ИМПЛАНТАЦИИ ВНУТРИРОГОВИЧНОЙ ЛИНЗЫ | 2003 |
|
RU2256430C1 |
| US 6924413 В2, 02.08.2005 | |||
| ВОЛКОВИЧ Т.К | |||
| и др | |||
| - Новости хирургии, 2010, т.18, №3, с.26-31 | |||
| TUNGSIRIPAT Т, Fluoroquinolone therapy in | |||
Авторы
Даты
2013-04-27—Публикация
2012-02-27—Подача