[0001] Настоящая заявка испрашивает приоритет Временной заявки на патент США № 62/060828, поданной 7 октября 2014 года, которая включена в настоящий документ в качестве ссылки во всей своей полноте.
Область техники, к которой относится изобретение
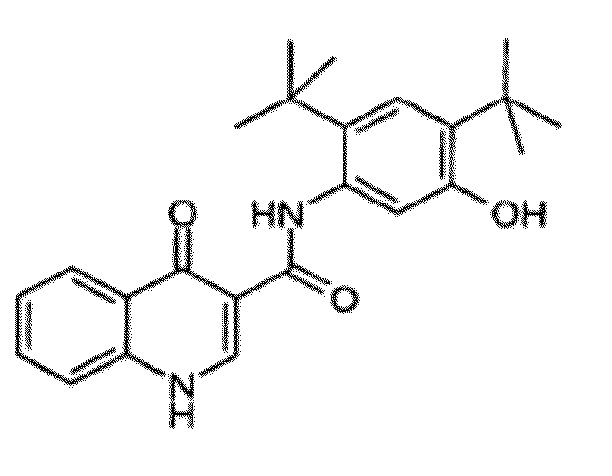
[0002] Настоящее изобретение, в целом, относится к сокристаллам N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида (Соединение 1), к их фармацевтическим композициям и к способам их использования.
Уровень техники
[0003] Кистозный фиброз (CF) представляет собой наследственное генетическое заболевание, которому подвержены приблизительно 30000 детей и взрослых в Соединенных Штатах Америки и приблизительно 30000 детей и взрослых в Европе. Несмотря на прогресс в лечении CF, лечения не существует.
[0004] CF вызывается мутациями гена регулятора трансмембранной проводимости при кистозном фиброзе (CFTR), который кодирует эпителиальный хлоридный ионный канал, ответственный за помощь при регуляции поглощения и выделения соли и воды в различных тканях. Низкомолекулярные лекарственные средства известные в качестве потенциирующих факторов, которые повышают вероятность открывание каналов CFTR, представляют собой одну из потенциальных терапевтических стратегий при лечении CF. Потенциирующие факторы этого типа описаны в заявке WO 2006/002421, которая включается в настоящий документ в качестве ссылки во всей своей полноте. Другая потенциальная терапевтическая стратегия включает применение низкомолекулярных лекарственных средств, известных в качестве корректоров CF, которые увеличивают количество и усиливают функционирование каналов CFTR. Корректоры этого типа описаны в заявке WO 2005/075435, которая включается в настоящий документ в качестве ссылки во всей своей полноте.
[0005] Конкретно, CFTR представляет собой медиируемый cAMP/ATP анионный канал, который экспрессируется в разнообразных типах клеток, включая поглощающие и секреторные эпителиальные клетки, где он регулирует поток анионов через мембрану, а также активность других ионных каналов и белков. В эпителиальных клетках, нормальное функционирование CFTR является критически важным для поддержания транспорта электролитов в организме, включая ткани респираторных и дигестивных органов. CFTR состоит приблизительно из 1480 аминокислот, которые кодируют белок, состоящий из тандемного повтора трансмембранных доменов, каждый из них содержит шесть трансмембранных спиралей и нуклеотид-связывающий домен. Оба трансмембранных домена связаны большим, полярным, регуляторным (R)-доменом с множеством сайтов фосфорилирования, которые регулируют активность канала и направленную миграцию клеток.
[0006] Ген, кодирующий CFTR, идентифицирован и секвенирован (смотри Gregory, R. J. et al. (1990) Nature 347:382-386; Rich, D. P. et al. (1990) Nature 347:358-362), (Riordan, J. R. et al. (1989) Science 245:1066-1073). Дефект в этом гене вызывает мутации в CFTR, дающие в результате кистозный фиброз ("CF"), наиболее распространенное фатальное генетическое заболевание у людей. Кистозным фиброзом страдает приблизительно один из каждых 2500 младенцев в Соединенных Штатах Америки. В общей популяции в Соединенных Штатах Америки, до 10 миллионов людей несут единственную копию дефектного гена без видимых признаков заболевания. В противоположность этому, индивидуумы с двумя копиями гена, ассоциируемого с CF, страдают от истощающего и фатального влияния CF, включая хроническое заболевание легких.
[0007] У пациентов с CF, мутации в CFTR, эндогенно экспрессируемые в эпителии респираторных органов, приводят к уменьшению секретирования апикального аниона, вызывая дисбаланс в транспорте ионов и текучих сред. Возникающее в результате уменьшение транспорта анионов вносит вклад в повышенную аккумуляцию слизи в легких и сопровождающие ее микробные инфекции, которые, в конечном счете вызывают, смерть пациентов с CF. В дополнение к респираторному заболеванию, пациенты с CF, как правило, страдают от желудочно-кишечных проблем и недостаточности поджелудочной железы, которые, если остаются нелеченными, приводят к смерти. В дополнение к этому, большинство мужчин с кистозным фиброзом являются бесплодными, и среди женщин с кистозным фиброзом фертильность уменьшается. В противоположность острому воздействию двух копий гена, ассоциируемого с CF, индивидуумы с единственной копией гена, ассоциируемого с CF, демонстрируют повышенную стойкость к холере и к обезвоживанию, возникающему в результате диареи, возможно, это объясняет относительно высокую частоту гена CF в популяции.
[0008] Анализ генной последовательности CFTR хромосом CF показывает множество мутаций, вызывающих заболевания (Cutting, G. R. et al. (1990) Nature 346:366-369; Dean, M. et al. (1990) Cell 61:863:870; и Kerem, B-S. et al. (1989) Science 245:1073-1080; Kerem, B-S et al. (1990) Proc. Natl. Acad. Sci. USA 87:8447-8451). К настоящему времени, идентифицировано более 1000 мутаций, вызывающих заболевание в CF (http://www.genet.sickkids.на.ca/cftr/app). Наиболее преобладающая мутация представляет собой делецию фенилаланина в положении 508 последовательности аминокислот CFTR, и обычно она упоминается как ΔF508-CFTR. Эта мутация встречается приблизительно в 70% случаев кистозного фиброза и ассоциируется с тяжелым заболеванием.
[0009] Делеция остатка 508 в ΔF508-CFTR предотвращает правильное складывание формирующегося белка. Это дает в результате неспособность мутантного белка к выходу из ER и к направленной миграции в плазматическую мембрану. В результате, количество каналов, присутствующих в мембране, гораздо меньше, чем наблюдается в клетках, экспрессирующих CFTR дикого типа. В дополнение к ослаблению направленной миграции, мутация дает в результате дефектный механизм открывания каналов. Вместе, уменьшение количества каналов в мембране и дефектный механизм открывания каналов приводят к уменьшению транспорта анионов через эпителий, приводящему к дефектному транспорту ионов и текучих сред. (Quinton, P. M. (1990), FASEB J. 4: 2709-2727). Однако исследования показали, что уменьшенное количество ΔF508-CFTR в мембране является функциональным, хотя оно и меньше чем для CFTR дикого типа. (Dalemans et al. (1991), Nature Lond. 354: 526-528; Denning et al., выше; Pasyk and Foskett (1995), J. Cell. Biochem. 270: 12347-50). В дополнение к ΔF508-CFTR, другие мутации CFTR, вызывающие заболевание, которые дают в результате дефектную направленную миграцию, синтез и/или механизм открывания каналов, могли бы ап- или даун-регулироваться для изменения секреции анионов и модификации хода и/или тяжести заболевания.
[0010] Хотя CFTR переносит множество молекул, в дополнение к анионам, ясно, что эта роль (транспорт анионов) представляет собой один из элементов в важном механизме транспортировки ионов и воды через эпителий. Другие элементы включают эпителиальный Na+ канал (ENaC), Na+/2Cl-/K+ сопереносчик, Na+-K+-ATPазный насос и K+ каналы базолатеральных мембран, которые являются ответственными за поглощение хлорида в клетке.
[0011] Эти элементы работают вместе для достижения направленного транспорта через эпителий посредством их селективного экспрессирования и локализации в клетке. Поглощение хлорида имеет место посредством координируемой активности ENaC и CFTR, присутствующих на апикальной мембране, и Na+-K+-ATPазного насоса и ионных каналов Cl-, экспрессируемых на базолатеральной поверхности клетки. Вторичный активный транспорт хлорида с внутренней стороны приводит к аккумуляции внутриклеточного хлорида, который может затем пассивно покидать клетку через Cl- каналы, приводя в результате к векторному транспорту. Расположение Na+/2Cl-/K+ сопереносчика, Na+-K+-ATPазного насоса и K+ каналов базолатеральных мембран на базолатеральной поверхности и CFTR на внутренней стороне координирует секрецию хлорида посредством CFTR на внутренней стороне. Поскольку вода, вероятно, никогда не транспортирует активно сама себя, ее поток через эпителий зависит от малых трансэпителиальных осмотических градиентов, генерируемых объемным потоком натрия и хлорида.
[0012] Как обсуждается выше, считается, что делеция остатка 508 в ΔF508-CFTR предотвращает правильное складывание формирующегося белка, приводя в результате к неспособности этого мутантного белка к выходу из ER (эндоплазматического ретикулума) и к направленной миграции в плазматической мембране. В результате, в плазматической мембране присутствуют недостаточные количества зрелого белка и транспорт хлорида в эпителиальных тканях значительно уменьшается. Фактически, это клеточное явление дефектного процессинга в ER переносчиков ABC с помощью механизмов ER, как показано, является основной причиной не только заболевания CF, но и широкого спектра других изолированных и унаследованных заболеваний.
[0013] N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид (Соединение 1) представляет собой сильнодействующий и селективный потенциирующий фактор форм дикого типа и мутантных форм CFTR (включая, но, не ограничиваясь эти, например, ΔF508 CFTR, R117H CFTR, G551D CFTR, G178R CFTR, S549N CFTR, S549R CFTR, G551S CFTR, G970R CFTR, G1244E CFTR, S1251N CFTR, S1255P CFTR, и G1349D CFTR) CFTR человека. N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид является пригодным для лечения пациентов в возрасте от 6 лет и старше с кистозным фиброзом и с одной из следующих мутаций гена CFTR: G551D CFTR, G1244E CFTR, G1349D CFTR, G178R CFTR, G551S CFTR, S1251N CFTR, S1255P CFTR, S549N CFTR, S549R CFTR или R117H CFTR.
[0014] Соответственно, стабильные биологически доступные формы Соединения 1, которые можно легко получить, включая сокристаллы, содержащие N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид, и их фармацевтические композиции, могут быть пригодными для использования при разработке продуктов и/или способов лечения пациентов, страдающих CF.
[0015] В одном из аспектов, настоящее изобретение предлагает сокристалл, содержащий Соединение 1 и соформер, где Соединение 1 представлено следующей формулой:
и соформер выбирают из следующих структурных формул:
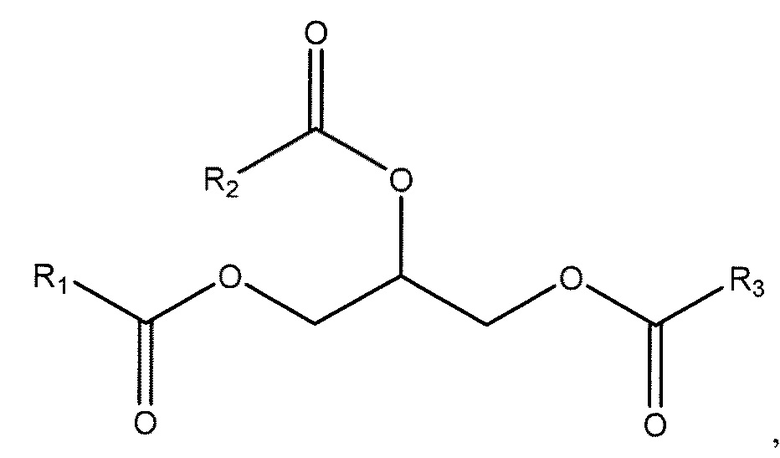
где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы.
[0016] В некоторых вариантах осуществления, сокристалл выделяется.
[0017] В некоторых вариантах осуществления, в сокристалле, стехиометрия Соединения 1 по отношению к соформеру находится в диапазоне от 2:1 до 6:1.
[0018] В некоторых вариантах осуществления, стехиометрия Соединения 1 по отношению к соформеру в сокристалле составляет 6:1.
[0019] В некоторых вариантах осуществления, стехиометрия Соединения 1 по отношению к соформеру в сокристалле составляет примерно 6:примерно 1.
[0020] В некоторых вариантах осуществления, стехиометрия Соединения 1 по отношению к соформеру в сокристалле составляет 3:1.
[0021] В некоторых вариантах осуществления, стехиометрия Соединения 1 по отношению к соформеру в сокристалле составляет примерно 3:примерно 1.
[0022] В некоторых вариантах осуществления, Соединение 1 может образовывать гексамерные супермолекулы (гексамеры) в сокристалле, где каждый из гексамеров содержит шесть молекул Соединения 1, связанных водородными связями, как показано на Фигуре 1.
[0023] В некоторых вариантах осуществления, сокристаллы могут обеспечивать концентрацию Соединения 1 больше чем 0,4 мг/мл, при растворении в модельной желудочно-кишечной среде после еды (FeSSIF).
[0024] В некоторых вариантах осуществления, сокристаллы могут обеспечивать концентрацию Соединения 1 больше чем 0,4 мг/мл при растворении в модельной желудочно-кишечной среде после еды (FeSSIF), и эта концентрация поддерживается в течение, по меньшей мере, 10 часов.
[0025] В некоторых вариантах осуществления, сокристаллы отличаются тем, что они имеют картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0026] В некоторых других вариантах осуществления, сокристаллы отличаются тем, что они имеют спектр 13C ssNMR (твердотельного ЯМР) с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0 и 119,4.
[0027] В нескольких других вариантах осуществления, сокристаллы отличаются тем, что они имеют спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 130,5 и 119,4.
[0028] Другой аспект настоящего изобретения предлагает фармацевтические композиции, содержащие терапевтически эффективное количество Соединения 1 и фармацевтически приемлемый носитель или эксципиент, где, по меньшей мере, 30% Соединения 1 присутствует в форме сокристаллов, описанных в настоящем документе.
[0028] В некоторых вариантах осуществления, фармацевтическая композиция дополнительно содержит дополнительный терапевтический агент.
[0029] Например, в одном из вариантов осуществления, дополнительный терапевтический агент выбирают из муколитического агента, бронходилатора, антибиотика, противоинфекционного агента, противовоспалительного агента, модулятора CFTR иного, чем Соединение 1, или питательного агента или их сочетаний. В другом варианте осуществления, дополнительный терапевтический агент представляет собой модулятор CFTR иной, чем Соединение 1.
[0030] Кроме того, в качестве примера, в одном из вариантов осуществления, модулятор CFTR представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту или (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид.
[0031] В другом аспекте, настоящее изобретение предлагает способ лечения или облегчения тяжести заболевания у пациента, где указанное заболевание выбирают из кистозного фиброза, наследственной эмфиземы, COPD или болезни сухого глаза, способ включает стадию введения пациенту эффективного количества любого из сокристаллов, представленных в настоящем документе. Например, в одном из вариантов осуществления, заболевание представляет собой кистозный фиброз.
[0032] В некоторых вариантах осуществления, способ дополнительно включает совместное введение одного или нескольких дополнительных терапевтических агентов субъекту. Например, в одном из вариантов осуществления, дополнительный терапевтический агент представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил) циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту или (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид. В другом варианте осуществления, дополнительный терапевтический агент вводится одновременно с сокристаллом, до этого или после этого.
[0033] Другой аспект настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы, включающий стадию:
объединения Соединения 1 и соформера с образованием сокристалла.
[0034] Один из аспектов настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы.
[0035] Другой аспект настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы.
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер; и
(b) нагрева смеси до 80°C.
[0036] Кроме того, другой аспект настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы,
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер; и
(b) нагрева смеси до температуры, которая примерно на 5-10°C выше, чем температура плавления соформера.
[0037] Один из аспектов настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы;
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер;
(b) нагрева смеси;
(c) охлаждения смеси и
(d) повторения стадий (b) и (c).
[0038] Другой аспект настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы,
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер;
(b) нагрева смеси до 80°C;
(c) охлаждения смеси до 40°C и
(d) повторения стадий (b) и (c).
[0039] В некоторых вариантах осуществления, смесь, содержащая Соединение 1 и соформер, нагревается в течение 12 часов. В других вариантах осуществления, смесь, содержащая Соединение 1 и соформер, нагревается в течение, по меньшей мере, 12 часов. В некоторых вариантах осуществления, смесь, содержащая Соединение 1 и соформер, нагревается в течение 24 часов. В других вариантах осуществления, смесь, содержащая Соединение 1 и соформер, нагревается в течение, по меньшей мере, 24 часов.
[0040] В некоторых вариантах осуществления, сокристаллы, описанные в настоящем документе, такие как сокристаллы Соединения 1:триглицерида, могут демонстрировать несколько преимуществ. Например, сокристаллы Соединения 1:триглицерида могут демонстрировать лучшее поддержание перенасыщения, чем как беспримесная аморфная, так и твердая аморфная диспергированная форма Соединения 1 (SDD Соединения 1) в течение продолжительных периодов времени. Кроме того, в качестве примера, in-vivo сокристаллы Соединения 1:триглицерида могут метаболизироваться в тонком кишечнике с помощью липидэстеразы (липаз), которые удаляли бы эффективно триглицериды и дополнительно повышали бы концентрацию Соединения 1 в соответствии с принципом Ле-Шателье.
[0041] В некоторых вариантах осуществления, сокристаллы, описанные в настоящем документе, такие как сокристаллы Соединения 1:триглицерида, могут иметь следующие преимущества по сравнению с твердой аморфной диспергированной формой (SDD Соединения 1) Соединения 1: (1) сокристаллы могут приготавливаться, храниться и использоваться при условиях, когда они являются термодинамически стабильными; (2) может быть разработана контролируемая кристаллизация, которая может понизить уровни потенциальных примесей (примеси включают, но, не ограничиваясь этим, растворитель); (3) может быть разработан способ приготовления, который является более эффективным и экономичным (например, при приготовлении можно использовать меньше растворителя, и можно разработать более дешевый способ, чем сушка распылением); и (4) может не потребоваться стабилизирующего полимера для приготовления сокристаллов.
Краткое описание чертежей
[0042] Фигура 1 показывает структурные особенности сокристалла Соединения 1:триглицерида в некоторых вариантах осуществления. Фигура 1 (слева) показывает гексамер (шесть молекул Соединения 1), который присутствует в сокристалле Соединения 1:триглицерида. Фигура 1 (справа) показывает гексамер, состоящий из двух тримеров (A и B), каждый из которых образуется из трех молекул Соединения 1 (тример A: A1, A2 и A3; и тример B: B1, B2 и B3).
[0043] Фигура 2 показывает примеры водородной связи в сокристалле Соединения 1:триглицерида в некоторых вариантах осуществления. Фигура 2 (слева) показывает тример A Соединения 1 и водородных связей, которые могут присутствовать между молекулами Соединения 1 (A1, A2 и A3) в тримере [R3,3(18) >b>b>b]. Фигура 2 (справа) изображает водородные связи, которые могут присутствовать в молекуле Соединения 1 [S1,1(6)a], и водородные связи, которые могут присутствовать между двумя молекулами Соединения 1 из двух тримеров (A и B) [R2,2(20) >c>c]. Тримеры A и B образуют гексамер.
[0044] Фигура 3 представляет собой иллюстративную картину порошковой дифракции рентгеновского излучения (XRPD) Соединения 1:глицерилтриоктаноата.
[0045] Фигура 4 представляет собой иллюстративный спектр 13C спектроскопии твердотельного ядерного магнитного резонанса (13C ssNMR) Соединения 1:глицерилтриоктаноата.
[0046] Фигура 5 представляет собой иллюстративную кривую термогравиметрического анализа (TGA) Соединения 1:глицерилтриоктаноата.
[0047] Фигура 6 представляет собой иллюстративную термограмму дифференциальной сканирующей калориметрии (DSC) Соединения 1:глицерилтриоктаноата.
[0048] Фигура 7 представляет собой иллюстративный спектр 1H ядерного магнитного резонанса (1H ЯМР) Соединения 1:глицерилтриоктаноата в DMSO-d6.
[0049] Фигура 8 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтриолеата.
[0050] Фигура 9 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтриолеата.
[0051] Фигура 10 представляет собой иллюстративную кривую TGA Соединения 1:глицерилтриолеата.
[0052] Фигура 11 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтриолеата.
[0053] Фигура 12 представляет собой иллюстративный спектр 1H ЯМР Соединения 1:глицерилтриолеата в ацетоне-d6.
[0054] Фигура 13 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтрилинолеата.
[0055] Фигура 14 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтрилинолеата.
[0056] Фигура 15 представляет собой иллюстративную кривую TGA Соединения 1:глицерилтрилинолеата.
[0057] Фигура 16 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтрилинолеата.
[0058] Фигура 17 представляет собой иллюстративный спектр 1H ЯМР Соединения 1:глицерилтрилинолеата в ацетоне-d6.
[0059] Фигура 18 представляет собой иллюстративную дифракционную картину XPRD сокристаллов Соединения 1 с глицерилтриацетатом.
[0060] Фигура 19 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:триацетина.
[0061] Фигура 20 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтриацетина.
[0062] Фигура 21 представляет собой иллюстративную дифракционную картину XPRD сокристаллов Соединения 1 с глицерилтрибутиратом.
[0063] Фигура 22 представляет собой иллюстративную дифракционную картину XRPD сокристаллов Соединения 1 с глицерилтристеаратом.
[0064] Фигура 23 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтристеарата.
[0065] Фигура 24 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтристеарата.
[0066] Фигура 25 представляет собой иллюстративную дифракционную картину XRPD сокристаллов Соединения 1 с глицерилтрипальмитатом.
[0067] Фигура 26 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтрипальмитата.
[0068] Фигура 27 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтрипальмитата.
[0069] Фигура 28 представляет собой иллюстративную дифракционную картину XRPD сокристаллов Соединения 1 с глицерилтридодеканоатом.
[0070] Фигура 29 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтридодеканоата.
[0071] Фигура 30 представляет собой иллюстративную дифракционную картину XRPD сокристаллов Соединения 1 с глицерилтримиристатом.
[0072] Фигура 31 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтримиристата.
[0073] Фигура 32 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтримиристата.
[0074] Фигура 33 представляет собой иллюстративную дифракционную картину XRPD сокристаллов Соединения 1 с глицерилтригексаноатом.
[0075] Фигура 34 представляет собой иллюстративную дифракционную картину XRPD сокристаллов Соединения 1 с глицерилтридеканоатом.
[0076] Фигура 35 представляет собой иллюстративный спектр 13C ssNMR Соединения 1: глицерилтридеканоата.
[0077] Фигура 36 представляет собой сравнение иллюстративных профилей растворения в FeSSIF Соединения 1:глицерилтриоктаноата (черные кружки) Соединения 1:глицерилтриолеата (черные квадраты) и Соединения 1:глицерилтрилинолеата (черные треугольники) с аморфным Соединением 1 (черные ромбики), высушенной распылением дисперсии (SDD) Соединения 1 (черные перевернутые основанием вверх треугольники).
[0078] Фигура 37 представляет собой иллюстративные дифракционные картины XRPD сокристаллов Соединения 1 с различными чистыми триглицеридами и сокристаллов, выделенных из смеси препарата детского питания и Соединения.
Подробное описание вариантов осуществления
Определения
[0079] Как используется в настоящем документе, должны применяться следующие определения, если не указано иного.
[0080] Как используется в настоящем документе, каждая из форм единственного числа означает ʺодин или несколькоʺ.
[0081] Термин ʺABC-переносчикʺ, как используется в настоящем документе, означает ABC-транспортный белок или его фрагмент, содержащий домен связывания, где указанный белок или его фрагмент присутствует in vivo или in vitro. Термин ʺдомен связыванияʺ, как используется в настоящем документе, означает домен ABC-переносчика, который может связываться с модулятором. Смотри, например, Hwang, T. C. et al., J. Gen. Physiol. (1998): 111(3), 477-90.
[0082] Как используется в настоящем документе, ʺCFTRʺ используется для обозначения регулятора трансмембранной проводимости при кистозном фиброзе.
[0083] Как используется в настоящем документе, ʺмутацииʺ могут относиться к мутациям гена CFTR или белка CFTR. ʺмутация CFTRʺ относится к мутации гена CFTR, и ʺмутация CFTRʺ относится к мутации белка CFTR. Генетический дефект или мутация, или изменение в нуклеотидах в гене, как правило, приводит в результате к мутации белка CFTR, транслируемого с этого гена. Генетические дефекты или мутации включают, но, не ограничиваясь этим, ΔF508 CFTR, R117H CFTR, G551D CFTR, G178R CFTR, S549N CFTR, S549R CFTR, G551S CFTR, G970R CFTR, G1244E CFTR, S1251N CFTR, S1255P CFTR, и G1349D CFTR или ΔF508 CFTR, R117H CFTR, G551D CFTR, G178R CFTR, S549N CFTR, S549R CFTR, G551S CFTR, G970R CFTR, G1244E CFTR, S1251N CFTR, S1255P CFTR и G1349D CFTR (смотри, например, http://www.genet.sickkids.на.ca/app относительно мутаций CFTR).
[0084] Как используется в настоящем документе, ʺмутация ΔF508ʺ или ʺмутация F508delʺ представляет собой конкретную мутацию в белке CFTR. Эта мутация представляет собой делецию трех нуклеотидов, которые составляют кодон для аминокислоты фенилаланина в положении 508, дающую в результате белок CFTR, в котором отсутствует этот остаток фенилаланина. Мутировавший белок CFTR обычно упоминается как ʺF508delʺ.
[0085] Термин ʺмутация открывания канала CFTRʺ, как используется в настоящем документе, означает мутацию CFTR, которая приводит в результате к продуцированию белка CFTR, для которого преобладающий дефект представляет собой низкую вероятность открывания канала по сравнению с нормальным CFTR (Van Goor, F., Hadida S. and Grootenhuis P., ʺPharmacological Rescue of Mutant CFTR function for the Treatment of Cystic Fibrosisʺ, Top. Med. Chem. 3: 91-120 (2008)). Мутации открывания каналов включают, но, не ограничиваясь этим, G551D, G178R, S549N, S549R, G551S, G970R, G1244E, S1251N, S1255P и G1349D.
[0086] Как используется в настоящем документе, пациент, который является ʺгомозиготнымʺ по отношению к конкретной мутации, например, F508del, имеет такую же мутацию в каждом аллеле.
[0087] Как используется в настоящем документе, пациент, который является ʺгетерозиготнымʺ по отношению к конкретной мутации, например, F508del, имеет эту мутацию в одном аллеле и другую мутацию в другом аллеле.
[0088] Как используется в настоящем документе, термин ʺмодуляторʺ относится к соединению, которое повышает активность такого соединения, как белок. Например, модулятор CFTR представляет собой соединение, которое повышает активность CFTR. Повышение активности, полученное в результате действия модулятора CFTR, может осуществляться посредством корректорного механизма, механизма потенциирующего фактора или посредством двойного механизма, корректорного механизма и механизма потенциирующего фактора.
[0089] Как используется в настоящем документе, термин ʺкорректор CFTRʺ относится к соединению, которое увеличивает количество функционального белка CFTR на поверхности клеток, приводя в результате к увеличению транспорта ионов.
[0090] Как используется в настоящем документе, термин ʺпотенциирующий фактор CFTRʺ относится к соединению, которое увеличивает активность по отношению к каналам белка CFTR, расположенного на поверхности клетки, приводя в результате к увеличению транспорта ионов.
[0091] Термин ʺкристаллическийʺ относится к твердым материалам, содержащим атомы, молекулы и/или ионы, расположенные в виде упорядоченных геометрических структур или решеток. Кристаллические твердые тела показывают определенные температуры плавления и имеют четкий дальний порядок.
[0092] Термин ʺсокристаллʺ, как используется в настоящем документе, означает кристаллический объект, содержащий, по меньшей мере, две молекулы, либо при стехиометрическом, либо при нестехиометрическом отношении. Кроме того, сокристалл может необязательно содержать ионы.
[0093] Сокристаллы, как правило, содержат активный фармацевтический ингредиент (API) и соформер. Соформер, как правило, может связываться посредством водородной связи непосредственно с API, или он может связываться посредством водородной связи с дополнительной молекулой, которая связывается с API. Могут также присутствовать другие режимы молекулярного распознавания, включая, пи-пакетирование, комплексообразование гость-хозяин и взаимодействия Ван-дер-Ваальса.
[0094] Как используется в настоящем документе, термин ʺсоформерʺ или альтернативно ʺсоформер сокристаллаʺ, относится к такой молекуле, как триглицерид в сокристалле ином, чем API. Соформер может подвергаться или не подвергаться каким-либо изменениям после образования сокристалла вместе с API.
[0095] ʺСоединение 1:триглицеридʺ относится к сокристаллам, содержащим Соединение 1 и триглицерид. Например, ʺСоединение 1:глицерилтриоктаноатʺ используется в настоящем документе по отношению к сокристаллам, содержащим Соединение 1 и глицерилтриоктаноат. ʺСоединение 1:глицерилтриолеатʺ используется в настоящем документе по отношению к сокристаллам, содержащим Соединение 1 и глицерилтриолеат. ʺСоединение 1:глицерилтрилинолеатʺ используется в настоящем документе по отношению к сокристаллам, содержащим Соединение 1 и глицерилтрилинолеат.
[0096] Как используется в настоящем документе, термин ʺактивный фармацевтический ингредиентʺ или ʺAPIʺ относится к биологически активному соединению.
[0097] Термин ʺчистыйʺ, как используется в настоящем документе, означает химически чистый или не содержащий примесей, детектируемых с помощью рутинного химического анализа, например, с помощью ВЭЖХ.
[0098] ʺПо существу чистыйʺ, как используется в настоящем документе, означает чистоту, по меньшей мере, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% целевого материала в смеси.
[0099] Как используется в настоящем документе, термин ʺвыделенныйʺ, как для выделенного сокристалла, относится к сокристаллу, который выделен из других материалов, таких как другие кристаллические материалы, которые могут отличаться от целевого сокристалла с помощью рутинного анализа, такого как XRPD. В некоторых вариантах осуществления, сокристаллы могут изолироваться или выделяться из других материалов посредством фильтрования или центрифугирования. В некоторых вариантах осуществления, выделенный сокристалл может иметь чистоту, по меньшей мере, 50%. В некоторых вариантах осуществления, выделенный сокристалл может содержать примеси, такие как, в качестве неограничивающих примеров, остаточный соформер, растворитель или другие материалы, присутствующие в среде, в которой получают сокристалл, удаление которых из сокристалла может быть сложным. В других вариантах осуществления, выделенный сокристалл может быть по существу чистым.
[0100] Как используется в настоящем документе, термин ʺалифатическая группаʺ охватывает замещенные или незамещенные алкильные, алкенильные и алкинильные группы. ʺАлкильнаяʺ группа относится к насыщенной алифатической углеводородной группе, содержащей 1-29 атомов углерода. Алкильная группа может быть прямоцепной или разветвленной. Как используется в настоящем документе, ʺалкенильнаяʺ группа относится к алифатической углеродной группе, которая содержит 2-29 атомов углерода и двойную связь. Подобно алкильной группе, алкенильная группа может быть прямоцепной или разветвленной. Как используется в настоящем документе, ʺалкинильнаяʺ группа относится к алифатической углеродной группе, которая содержит 2-29 атомов углерода и имеет тройную связь. Алкинильная группа может быть прямоцепной или разветвленной.
[0101] Как используется в настоящем документе, термин ʺиндуцированиеʺ, при индуцировании активности CFTR, относится к увеличению активности CFTR, либо с помощью корректорного механизма, либо с помощью механизма потенциирующего фактора, либо с помощью другого механизма.
[0102] Термин ʺмодуляцияʺ, как используется в настоящем документе, означает увеличение или уменьшение, например, активности, на измеримую величину.
[0103] Термин ʺуменьшение CFTRʺ или ʺуменьшение функции CFTRʺ, как используется в настоящем документе, означает уменьшение CFTR по сравнению с нормальной величиной или уменьшение функции CFTR по сравнению с нормальной функцией.
[0104] Термины ʺпациентʺ, ʺсубъектʺ или ʺиндивидуумʺ используются взаимозаменяемо и относятся либо к человеку, либо к животному иному, чем человек. Термин включает млекопитающих, таких как люди.
[0105] Термины ʺэффективная дозаʺ или ʺэффективное количествоʺ используются в настоящем документе взаимозаменяемо и относятся к такому количеству, которое оказывает желаемое воздействие, для которого оно вводится (например, улучшение CF или симптома CF или облегчение тяжести CF или симптома CF). Точное количество будет зависеть от цели лечения, и оно может оцениваться специалистами в данной области с использованием известных методик (смотри, например, Lloyd (1999) Art, Science and Technology of Pharmaceutical Compounding).
[0106] Как используется в настоящем документе, термины ʺлечениеʺ, ʺлеченныйʺ, и тому подобное, как правило, означают улучшение CF или улучшение его симптомов или облегчение тяжести CF или его симптомов у субъекта. ʺЛечениеʺ, как используется в настоящем документе, включает, но, не ограничиваясь этим, следующее: ускорение роста субъекта, увеличение набора массы тела, уменьшение количества слизи в легких, улучшение функции поджелудочной железы и/или печени, уменьшение частоты инфекционных заболеваний, связанных с инфекцией дыхательных путей и/или уменьшение количества приступов кашля или одышки. Улучшение или облегчение тяжести любого из этих состояний может легко оцениваться в соответствии со стандартными способами и методиками, известными в данной области.
[0107] Как используется в настоящем документе, термин ʺв сочетании сʺ, когда он относится к двум или более соединениям или агентам, означает, что порядок введения включает соединения или агенты, которые вводятся пациенту одновременно друг с другом до или после введения одного из них.
Сокристаллы
[0108] Настоящее изобретение предлагает сокристаллы, содержащие N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид (Соединение 1), имеющие структурную формулу:

Соединение 1
[0109] Соединение 1 описывается в Международной публикации PCT WO2006002421 и имеет молекулярную формулу C24H28N2O3.
[0110] В одном из аспектов, настоящее изобретение предлагает сокристалл, содержащий Соединение 1 и соформер, где соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы.
[0111] В некоторых вариантах осуществления, сокристалл выделяется.
[0112] В некоторых вариантах осуществления, R1, R2 и R3 независимо представляют собой C7-29 алифатические группы.
[0113] В некоторых вариантах осуществления, соформер имеет среднюю молекулярную массу в пределах от 470 до 1400 Дальтон.
[0114] В некоторых вариантах осуществления, соформер выбирают из глицерилтриолеата, глицерилтристеарата, глицерилтригексаноата, глицерилтридеканоата, глицерилтриоктаноата, глицерилтримиристата, глицерилтрипальмитата, глицерилтрибутирата, глицерилтрилинолеата, глицерилтридодеканоата, глицерилтрипальмитолеата, глицерилтриэруката, глицерилтрипропионата, пальмитодиолеина, триарахидонина, глицерилтрилинолената, триэруцина, глицерилтриарахидата, глицерилтри(цис-13-докозеноата), глицерилтрипетроселината, глицерилтрибехената, глицерилтриелаидата, глицерилтриацетата (триацетина), глицерилтрибутирата.
[0115] В некоторых вариантах осуществления, соформер выбирают из:

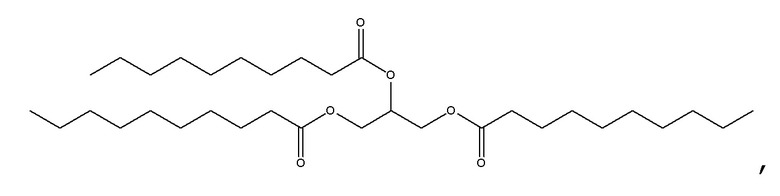
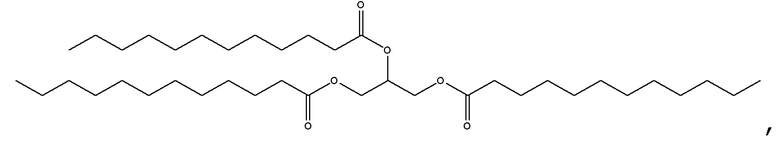
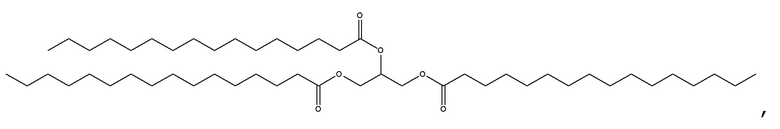
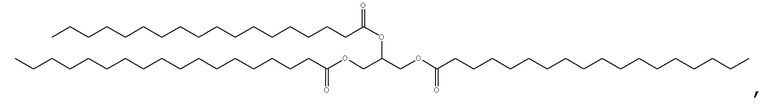
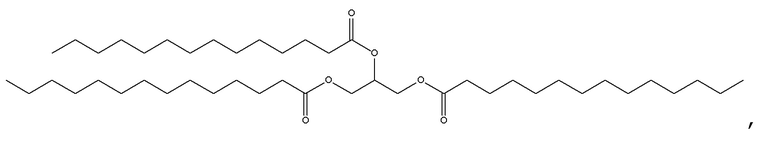
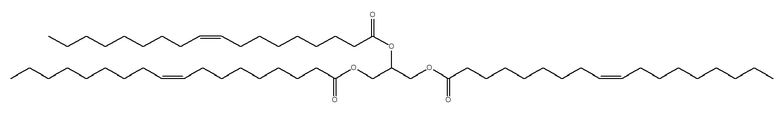 и
и
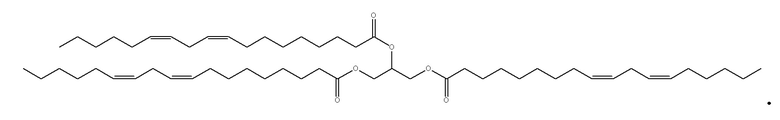
[0116] В некоторых вариантах осуществления, соформер выбирают из: глицерилтриолеата, глицерилтристеарата, глицерилтригексаноата, глицерилтридеканоата, глицерилтриоктаноата, глицерилтримиристата, глицерилтрипальмитата, глицерилтрилинолеата, глицерилтридодеканоата, глицерилтрипальмитолеата, глицерилтриэруката, пальмитодиолеина, триарахидонина, глицерилтрилинолената, триэруцина, глицерилтриарахидата, глицерилтри(цис-13-докозеноата), глицерилтрипетроселината, глицерилтрибехената и глицерилтриелаидата.
[0117] В некоторых вариантах осуществления, соформер выбирают из глицерилтриоктаноата, глицерилтриолеата, глицерилтрилинолеата, глицерилтригексаноата, глицерилтристеарата, глицерилтридеканоата, глицерилтрипальмитата, глицерилтримиристата, глицерилтрипальмитата, глицерилтристеарата и глицерилтридодеканоата.
[0118] В некоторых вариантах осуществления, соформер выбирают из глицерилтриацетата и глицерилтрибутирата.
[0119] В некоторых вариантах осуществления, в сокристалле присутствует только один соформер. В качестве неограничивающих примеров, сокристалл Соединения 1 содержит только глицерилтриоктаноат, только глицерилтриолеат, только глицерилтрилинолеат, только глицерилтригексаноат, только глицерилтристеарат, только глицерилтридеканоат, только глицерилтрипальмитат, только глицерилтридодеканоат, только глицерилтриацетат или только глицерилтрибутират.
[0120] В некоторых вариантах осуществления, в сокристалле присутствуют несколько, например, два, три, четыре, пять или шесть триглицеридов. В качестве неограничивающих примеров, сокристалл Соединения 1 содержит два триглицерида, например, (i) глицерилтриоктаноат и глицерилтриолеат; (ii) глицерилтриолеат и глицерилтрилинолеат; или (iii) глицерилтриоктаноат и глицерилтрилинолеат.
[0121] В некоторых вариантах осуществления, в сокристалле, стехиометрия Соединения 1 по отношению к соформеру находится в пределах от 2:1 до 6:1. В одном из вариантов осуществления, в сокристалле, стехиометрия Соединения 1 по отношению к соформеру находится в пределах от 3:1 до 6:1. В одном из вариантов осуществления, в сокристалле, стехиометрия Соединения 1 по отношению к соформеру находится в пределах от 4:1 до 6:1. В одном из вариантов осуществления, в сокристалле, стехиометрия Соединения 1 по отношению к соформеру находится в пределах от 5:1 до 6:1.
[0122] В одном из вариантов осуществления, в сокристалле, стехиометрия Соединения 1 по отношению к соформеру составляет примерно 6:примерно 1. В одном из вариантов осуществления, в сокристалле, стехиометрия Соединения 1 по отношению к соформеру составляет 6:1.
[0123] В качестве неограничивающих примеров, сокристалл Соединения 1 содержит соформер, выбранный из глицерилтриолеата, глицерилтрилинолеата, глицерилтристеарата и глицерилтрипальмитата, и стехиометрия Соединения 1 по отношению к соформеру в сокристалле составляет примерно 6:примерно 1. Кроме того, в качестве неограничивающих примеров, в одном из вариантов осуществления, сокристалл содержит Соединение 1 и глицерилтриолеат, где стехиометрия Соединения 1 по отношению к глицерилтриолеату составляет примерно 6:примерно 1. В другом варианте осуществления, сокристалл содержит Соединение 1 и глицерилтрилинолеат, где стехиометрия Соединения 1 по отношению к глицерилтрилинолеату составляет примерно 6:примерно 1. В другом варианте осуществления, сокристалл содержит Соединение 1 и глицерилтристеарат, где стехиометрия Соединения 1 по отношению к глицерилтристеарату составляет примерно 6:примерно 1. В другом варианте осуществления, сокристалл содержит Соединение 1 и глицерилтрипальмитат, где стехиометрия Соединения 1 по отношению к глицерилтрипальмитату составляет примерно 6:примерно 1. В любом из указанных выше вариантов осуществления, отношение или стехиометрия Соединения 1 по отношению к соформеру в Соединении 1:триглицериде составляет 6:1.
[0124] В некоторых вариантах осуществления, стехиометрия Соединения 1 по отношению к соформеру в сокристалле составляет примерно 3:примерно 1. В одном из вариантов осуществления, стехиометрия Соединения 1 по отношению к соформеру в сокристалле составляет 3:1.
[0125] В качестве неограничивающих примеров, сокристалл Соединения 1 содержит соформер, выбранный из глицерилтриоктаноата, глицерилтридодеканоата и глицерилтридеканоата, и стехиометрия Соединения 1 по отношению к триглицериду в сокристалле составляет примерно 3:примерно 1.
[0126] Кроме того, в качестве неограничивающих примеров, в одном из вариантов осуществления, настоящее изобретение предлагает сокристалл, содержащий Соединение 1 и глицерилтриоктаноат, где стехиометрия Соединения 1 по отношению к глицерилтриоктаноату составляет примерно 3:примерно 1. В другом варианте осуществления, настоящее изобретение предлагает сокристалл, содержащий Соединение 1 и глицерилтридодеканоат, где стехиометрия Соединения 1 по отношению к глицерилтридодеканоату составляет примерно 3:примерно 1. В другом варианте осуществления, настоящее изобретение предлагает сокристалл, содержащий Соединение 1 и глицерилтридеканоат, где стехиометрия Соединения 1 по отношению к глицерилтридеканоату составляет примерно 3:примерно 1. В любом из указанных выше вариантов осуществления, отношение или стехиометрия Соединения 1 по отношению к триглицеридному соформеру в Соединении 1:триглицериде составляет 3:1.
[0127] В некоторых вариантах осуществления, R1, R2 и R3 независимо представляют собой C7-29 алифатическую группу, и Соединение 1 может присутствовать в сокристалле в форме гексамера.
[0128] В некоторых вариантах осуществления, Соединение 1 может присутствовать в сокристалле в форме гексамера, где каждый из гексамеров содержит шесть молекулы Соединения 1, связанных водородными связями, как показано на Фигуре 1.
[0129] В некоторых вариантах осуществления, Соединение 1 может присутствовать в сокристалле в форме гексамера, где каждый из гексамеров содержит шесть молекул Соединения 1, связанных водородными связями, как показано на Фигуре 1, и где, кроме того, R1, R2 и R3 независимо представляют собой C7-29 алифатические группы.
[0130] В качестве неограничивающего примера, как показано на Фигуре 2 (слева), в одном из вариантов осуществления, три молекулы Соединения 1 (A1, A2, A3) могут быть связаны тремя водородными связями с образованием тримера Соединения 1, и два тримера Соединения 1 могут дополнительно связываться с помощью дополнительных, например, шести, водородных связей с образованием гексамера Соединения 1, где каждая из молекул Соединения 1 в данном тримере связывается с соответствующей молекулой Соединения 1 во втором тримере с помощью двух водородных связей, как показано на Фигуре 2 (справа). В одном из вариантов осуществления, внутримолекулярные водородные связи присутствуют в гексамере Соединения 1, как показано на Фигуре 2 (справа).
[0131] В одном из вариантов осуществления, молекулы Соединения 1 могут связываться с помощью одной или нескольких из следующих водородных связей с образованием гексамера:
[0132] S1,1(6) a;
[0133] R2,2(20) >c>c;
[0134] R3,3(18) >b>b>b;
[0135] R4,4(28) >b>c>b>c;
[0136] R4,4(30) >b>c>b<c;
[0137] R4,4(32) >b<c>b<c;
[0138] R5,5(36) >b>b<c<b<c;
[0139] R5,5(36) >b>b<c<b>c;
[0140] R5,5(36) >b>b>c<b<c;
[0141] R5,5(36) >b>b>c<b>c;
[0142] R6,6(40) >b>b>c>b>b>c;
[0143] R6,6(42) >b>b>c>b>b<c;
[0144] R6,6(44) >b>b<c>b>b<c.
[0145] Описание обозначений множества графов можно найти в Bernstein, J., Davis, R. E., Shimoni, L. & Chang, N.-L, ʺPatterns in Hydrogen Bonding: Functionality and Graph Set Analysis in Crystals,ʺ Angew. Chem. Int. Ed. Engl. 34, 1555-1573 (1995); W. D. S. Motherwell, G. P. Shields, and F. H. Allen, ʺAutomated assignment of graph-set descriptors for crystallographically symmetric molecules,ʺ Acta. Cryst. B56, 466-473 (2000), и M. C. Etter, ʺEncoding and decoding hydrogen-bond patterns of organic compounds,ʺ Acc. Chem. Res., 23, 120-126 (1990).
[0146] В другом варианте осуществления, гексамер Соединения 1 в сокристалле Соединения 1:триглицерида стабилизируется благодаря присутствию соформера триглицерида.
[0147] В некоторых вариантах осуществления, сокристаллы могут обеспечивать концентрацию Соединения 1 больше чем 0,4 мг/мл, при растворении в модельной желудочно-кишечной среде после еды (FeSSIF).
[0148] В некоторых вариантах осуществления, сокристаллы могут обеспечивать концентрацию Соединения 1 больше чем 0,4 мг/мл при растворении в модельной желудочно-кишечной среде после еды (FeSSIF) и концентрация поддерживается в течение, по меньшей мере, 10 часов.
[0149] В некоторых вариантах осуществления, сокристаллы отличаются тем, что они имеют картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0150] В некоторых вариантах осуществления, сокристаллы отличаются тем, что они имеют картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 10,9, 16,9 и 18,0.
[0151] В некоторых вариантах осуществления, сокристаллы отличаются тем, что они имеют картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 10,9, 16,9, 18,0 и 23,8.
[0152] В некоторых других вариантах осуществления, сокристаллы отличаются тем, что они имеют спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0 и 119,4.
[0153] Также, в некоторых вариантах осуществления, сокристаллы отличаются тем, что они имеют спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 130,5 и 119,4.
[0154] Настоящее изобретение также предлагает сокристалл, содержащий Соединение 1 и соформер сокристалла, выбранный из группы, состоящей из глицерилтриоктаноата, глицерилтриолеата и глицерилтрилинолеата, где Соединение 1 представлено следующей структурной формулой:

[0155] В некоторых вариантах осуществления, сокристалл, описанный в предыдущем абзаце, растворяется в модельной желудочно-кишечной среде после еды (FeSSIF) с получением концентрации Соединения 1 больше чем 0,4 мг/мл, и эта концентрация поддерживается в течение, по меньшей мере, 10 часов.
[0156] В одном из вариантов осуществления, соформер сокристалла представляет собой глицерилтриоктаноат.
[0157] В одном из вариантов осуществления, стехиометрия Соединения 1 по отношению к глицерилтриоктаноату составляет 3:1.
[0158] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0159] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,1, 10,9, 16,9, 18,0 и 23,8.
[0160] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0 и 119,4.
[0161] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 186,7±0,5°C.
[0162] В некоторых вариантах осуществления, соформер сокристалла представляет собой глицерилтриолеат.
[0163] В одном из вариантов осуществления, стехиометрия Соединения 1 по отношению к глицерилтриолеату составляет 6:1.
[0164] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0165] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 10,9, 16,9, 18,1 и 23,8.
[0166] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 130,5 и 119,4.
[0167] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 197,5±0,5°C.
[0168] В некоторых вариантах осуществления, соформер сокристалла представляет собой глицерилтрилинолеат.
[0169] В одном из вариантов осуществления, стехиометрия Соединения 1 по отношению к глицерилтрилинолеату составляет 6:1.
[0170] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0171] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,2, 10,9, 17,0, 18,1 и 23,8.
[0172] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,5, 155,0, 130,6 и 119,3.
[0173] В одном из вариантов осуществления, сокристалл отличается тем, что он имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 182,3±0,5°C.
[0174] В альтернативных вариантах осуществления, дейтерий (2H) может вводиться в Соединение 1 для манипуляций окислительным метаболизмом Соединения с помощью первичного кинетического изотопного эффекта. Первичный кинетический изотопный эффект представляет собой изменение скорости химической реакции, которая возникает в результате обмена ядер изотопов, что, в свою очередь, вызывается изменением энергий основного состояния, необходимых для образования ковалентной связи, после этого изотопного обмена. Обмен более тяжелого изотопа обычно дает в результате понижение энергии основного состояния для химической связи, и таким образом, это вызывает уменьшение разрыва связей, ограничивающих скорость реакции. Если разрыв связи осуществляется в области седловой точки или вблизи нее, вдоль пути реакции с множеством продуктов, отношения распределения продуктов могут существенно изменяться. Для объяснения: если дейтерий связывается с атомом углерода в необмениваемом положении, типичными являются разницы скоростей 2-7 кМ/кД. Если это разница скоростей успешно применяется относительно Соединения 1, профиль этого соединения in vivo может драматически модифицироваться и это может приводить в результате к улучшению фармакокинетических свойств. Относительно дополнительного обсуждения, смотри S. L. Harbeson and R. D. Tung, Deuterium In Drug Discovery and Development, Ann. Rep. Med. Chem. 2011, 46, 403-417, которая включается в настоящий документ в качестве ссылки во всей своей полноте.
[0175] При обнаружении и разработке терапевтических агентов, специалист в данной области пытается оптимизировать фармакокинетические параметры, в то же время, сохраняя желаемые свойства in vitro. Разумно предположить, что многие соединения с плохими фармакокинетическими профилями склонны к окислительному метаболизму. Анализы микросом печени in vitro, доступные в настоящее время, дают ценную информацию о ходе окислительного метаболизма этого типа, что, в свою очередь, делает возможным рациональное конструирование дейтерированных соединений Соединения 1 с улучшенной стабильностью благодаря их стойкости к такому окислительному метаболизму. При этом получаются значительные улучшения фармакокинетических профилей Соединения 1, и они могут быть выражены количественно в терминах увеличения половинного времени жизни in vivo (t1/2), концентрации при максимальном терапевтическом воздействии (Cmax), площади под кривой доза-реакция (AUC) и биологической доступности; и в терминах уменьшения полного выведения дозы и стоимости материалов.
[0176] Например, в одном из альтернативных вариантов осуществления, по меньшей мере, один атом водорода в Соединении 1 заменяется атомом дейтерия с получением дейтерированного соединения. В одном из альтернативных вариантов осуществления, одна или обе трет-бутильных группы в Соединении 1 заменяются d9-трет-бутилом. В другом альтернативном варианте осуществления, трет-бутильная группа, находящаяся рядом с группой OH в Соединении 1, заменяется d9-трет-бутилом (Соединением 2). Сокристаллы Соединения 2 могут образовываться с использованием способов, описанных в настоящем документе. Специалист в данной области понял бы, что картина XRPD сокристалла Соединения 2 и триглицерида или сокристалла любого другого из дейтерированных соединений в этих альтернативных вариантах осуществления и триглицерида имела бы такие же характерные пики, как и сокристалл Соединения 1:триглицерида. Определение половинного времени жизни делает возможным благоприятное и точное определение той степени, до которой улучшается стойкость к окислительному метаболизму.
[0177] В некоторых альтернативных вариантах осуществления, обмен дейтерий-водород в Соединении 1 может также использоваться для достижения благоприятной модификации спектра метаболитов исходного соединения с целью уменьшения количества или устранения нежелательных токсичных метаболитов. Например, если возникает токсичный метаболит из-за окислительного расщепления связи углерод-водород (C-H), разумно предположить, что дейтерированное соединение сильно уменьшит или устранит образование нежелательного метаболита, даже если конкретное окисление не представляет собой стадии, определяющей скорость реакции. Дополнительная информация о состоянии в данной области относительно обмена дейтерий-водород можно найти, например, в Hanzlik et al., J. Org. Chem. 55, 3992-3997, 1990, Reider et al., J. Org. Chem. 52, 3326-3334, 1987, Foster, Adv. Drug Res. 14, 1-40, 1985, Gillette et al, Biochemistry 33(10) 2927-2937, 1994 и Jarman et al. Carcinogenesis 16(4), 683-688, 1993.
[0178] Соединение 1:глицерилтриоктаноат
[0179] Сокристалл, содержащий Соединение 1 и глицерилтриоктаноат, ниже упоминается как ʺСоединение 1:глицерилтриоктаноатʺ.
[0180] Характеризация Соединения 1:глицерилтриоктаноата подробно описывается ниже в разделе Примеры. Фигура 3 представляет собой иллюстративную картину порошковой дифракции рентгеновского излучения (XRPD) Соединения 1:глицерилтриоктаноата. Фигура 4 представляет собой иллюстративный спектр спектроскопии твердотельного ядерного магнитного резонанса (13C ssNMR) Соединения 1:глицерилтриоктаноата. Фигура 5 представляет собой иллюстративную кривую термогравиметрического анализа (TGA) Соединения 1:глицерилтриоктаноата. Фигура 6 представляет собой иллюстративную термограмму дифференциальной сканирующей калориметрии (DSC) Соединения 1:глицерилтриоктаноата. Фигура 7 представляет собой иллюстративный спектр 1H ядерного магнитного резонанса (1H ЯМР) Соединения 1:глицерилтриоктаноата в DMSO-d6.
[0181] В одном из вариантов осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения (XRPD) с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,1, 10,9, 12,0, 12,5, 13,2, 13,7, 15,0, 16,2, 16,9, 18,0, 19,3, 20,2, 21,7, 22,5, 23,8, 25,8, 27,0, 27,6, 28,3, 30,0, 31,0 и 32,6.
[0182] В одном из вариантов осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0183] В другом варианте осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,1, 10,9, 16,9, 18,0 и 23,8.
[0184] Еще в одном варианте осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,1, 10,9, 12,0, 12,5, 13,2, 13,7, 15,0, 16,2, 16,9, 18,0, 19,3, 20,2, 21,7, 22,5, 23,8, 25,8, 27,0, 27,6, 28,3, 30,0, 31,0 и 32,6.
[0185] В другом варианте осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения по существу такое же, как показано на Фигуре 3. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0186] В одном из вариантов осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет спектр твердотельного ядерного магнитного резонанса (13C ssNMR) с одним или несколькими характерными пиками, выраженными в м.д. ±0,1, выбранными из: 178,6, 172,9, 171,6, 169,9, 165,1, 155,0, 143,2, 139,4, 137,3, 134,6, 133,0, 126,0, 119,4, 117,7, 112,1, 67,3, 64,0, 62,0, 59,6, 54,2, 35,8, 34,8, 31,7, 30,5, 23,5 и 14,6.
[0187] В одном из вариантов осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0 и 119,4.
[0188] В другом варианте осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 134,6, 126,0, 119,4 и 35,8.
[0189] Еще в одном варианте осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 172,9, 171,6, 169,9, 165,1, 155,0, 143,2, 139,4, 137,3, 134,6, 133,0, 126,0, 119,4, 117,7, 112,1, 67,3, 64,0, 62,0, 59,6, 54,2, 35,8, 34,8, 31,7, 30,5, 23,5 и 14,6.
[0190] В одном из вариантов осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 186,7°C. В других вариантах осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 186,7±0,2°C. В других вариантах осуществления, Соединение 1:глицерилтриоктаноат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 186,7±0,5°C.
[0191] В некоторых вариантах осуществления, отношение или стехиометрия Соединения 1 по отношению к глицерилтриоктаноату в Соединении 1:глицерилтриоктаноат составляет 3:1. В некоторых вариантах осуществления, отношение или стехиометрия Соединения 1 по отношению к глицерилтриоктаноату в Соединении 1:глицерилтриоктаноате составляет примерно 3:примерно 1.
[0192] Соединение 1:глицерилтриолеат
[0193] Сокристалл, содержащий Соединение 1 и глицерилтриолеат, ниже упоминается как ʺСоединение 1:глицерилтриолеатʺ.
[0194] Характеризация Соединения 1:глицерилтриолеата подробно описывается ниже в разделе Примеры. Фигура 8 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтриолеата. Фигура 9 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтриолеата. Фигура 10 представляет собой иллюстративную кривую TGA Соединения 1:глицерилтриолеата. Фигура 11 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтриолеата. Фигура 12 представляет собой иллюстративный спектр 1H ЯМР Соединения 1:глицерилтриолеата в ацетоне-d6.
[0195] В одном из вариантов осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 9,8, 10,4, 10,9, 12,0, 12,7, 13,3, 13,8, 15,1, 16,3, 16,9, 18,1, 18,5, 19,4, 19,9, 20,2, 21,2, 21,8, 22,6, 23,8, 26,0, 27,0, 27,8, 28,5, 30,0, 30,7 и 32,7.
[0196] В одном из конкретных вариантов осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0197] В другом варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 10,9, 16,9, 18,1 и 23,8.
[0198] Еще в одном варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 9,8, 10,9, 12,0, 12,7, 13,3, 13,8, 15,1, 16,3, 16,9, 18,1, 18,5, 19,4, 19,9, 20,2, 21,2, 21,8, 22,6, 23,8, 26,0, 27,0, 27,8, 28,5, 30,0, 30,7 и 32,7. В одном из вариантов осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 9,8, 10,4, 10,9, 12,0, 12,7, 13,3, 13,8, 15,1, 16,3, 16,9, 18,1, 18,5, 19,4, 19,9, 20,2, 21,2, 21,8, 22,6, 23,8, 26,0, 27,0, 27,8, 28,5, 30,0, 30,7 и 32,7.
[0199] В другом варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 8. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0200] В одном из вариантов осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет спектр твердотельного ядерного магнитного резонанса (13C ssNMR) с одним или несколькими характерными пиками, выраженными в м.д. ±0,1, выбранными из: 178,6, 172,9, 171,6, 169,9, 165,0, 155,0, 142,9, 139,3, 137,4, 134,5, 133,0, 130,5, 127,3, 126,0, 119,4, 117,7, 112,1, 67,2, 63,9, 59,6, 35,8, 34,8, 31,7, 30,5, 28,2, 24,6, 23,6 и 14,7.
[0201] В одном из вариантов осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 130,5 и 119,4.
[0202] В другом варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 134,5, 130,5, 126,0, 119,4 и 35,8.
[0203] Еще в одном варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 172,9, 171,6, 169,9, 165,0, 155,0, 142,9, 139,3, 137,4, 134,5, 133,0, 130,5, 127,3, 126,0, 119,4, 117,7, 112,1, 67,2, 63,9, 59,6, 35,8, 34,8, 31,7, 30,5, 28,2, 24,6, 23,6 и 14,7.
[0204] В одном из вариантов осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 197,5°C. В другом варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 197,5±0,2°C. В другом варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 197,5±0,5°C.
[0205] В некоторых вариантах осуществления, отношение или стехиометрия Соединения 1 по отношению к глицерилтриолеату в Соединении 1:глицерилтриолеате составляет 6:1. В некоторых вариантах осуществления, отношение или стехиометрия Соединения 1 по отношению к глицерилтриолеату в Соединении 1:глицерилтриолеате составляет примерно 6:примерно 1.
[0206] Соединение 1:глицерилтрилинолеат
[0207] Сокристалл, содержащий Соединение 1 и глицерилтрилинолеат, ниже упоминается как ʺСоединение 1:глицерилтрилинолеатʺ.
[0208] Характеризация Соединения 1:глицерилтрилинолеата подробно описывается ниже в разделе Примеры. Фигура 13 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтрилинолеата. Фигура 14 представляет собой иллюстративный спектр 13C ssNMR Соединения 1:глицерилтрилинолеата. Фигура 15 представляет собой иллюстративную кривую TGA Соединения 1:глицерилтрилинолеата. Фигура 16 представляет собой иллюстративную термограмму DSC Соединения 1:глицерилтрилинолеата. Фигура 17 представляет собой иллюстративный 1H ЯМР спектр Соединения 1:глицерилтрилинолеата в ацетоне-d6.
[0209] В одном из вариантов осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,2, 10,9, 12,0, 12,5, 13,8, 15,1, 16,3, 17,0, 18,1, 19,4, 20,2, 21,8, 22,6, 23,8, 25,9, 27,1, 27,8, 28,4 и 32,7.
[0210] В одном из конкретных вариантов осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0211] В другом варианте осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,2, 10,9, 17,0, 18,1 и 23,8.
[0212] Еще в одном варианте осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,2, 10,9, 12,0, 12,5, 13,8, 15,1, 16,3, 17,0, 18,1, 19,4, 20,2, 21,8, 22,6, 23,8, 25,9, 27,1, 27,8, 28,4 и 32,7.
[0213] В другом варианте осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 13. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0214] В одном из вариантов осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет спектр твердотельного ядерного магнитного резонанса (13C ssNMR) с одним или несколькими характерными пиками, выраженными в м.д. ±0,1, выбранными из: 178,6, 172,8, 171,5, 169,8, 165,1, 155,0, 142,9, 139,3, 137,4, 134,4, 133,1, 130,6, 126,0, 119,4, 117,6, 112,0, 86,5, 67,2, 63,9, 59,7, 35,8, 34,8, 31,7, 30,6, 28,2 и 14,8.
[0215] В одном из вариантов осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 130,6 и 119,4.
[0216] В другом варианте осуществления, Соединение 1:глицерилтриолеат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 134,4, 130,6, 126,0, 119,4 и 35,8.
[0217] Еще в одном варианте осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 172,8, 171,5, 169,8, 165,1, 155,0, 142,9, 139,3, 137,4, 134,4, 133,1, 130,6, 126,0, 119,4, 117,6, 112,0, 86,5, 67,2, 63,9, 59,7, 35,8, 34,8, 31,7, 30,6, 28,2 и 14,8.
[0218] В одном из вариантов осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 182,3°C. В другом варианте осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 182,3±0,2°C. В другом варианте осуществления, Соединение 1:глицерилтрилинолеат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 182,3±0,5°C.
[0219] В некоторых вариантах осуществления, отношение или стехиометрия Соединения 1 по отношению к глицерилтрилинолеату в Соединении 1: глицерилтрилинолеат составляет 6:1. В некоторых вариантах осуществления, отношение или стехиометрия Соединения 1 по отношению к глицерилтрилинолеату в Соединении 1:глицерилтрилинолеат составляет примерно 6:примерно 1.
[0220] Соединение 1:триацетин
[0221] Сокристалл, содержащий Соединение 1 и глицерилтриацетат (триацетин), ниже упоминается как ʺСоединение 1:глицерилтриацетатʺ или ʺСоединение 1:триацетинʺ.
[0222] Характеризация Соединения 1:триацетина подробно описывается ниже в разделе Примеры. Фигура 18 представляет собой иллюстративную картину XRPD Соединения 1:триацетина. Фигура 19 представляет собой спектр 13C ssNMR Соединения 1:триацетина. Фигура 20 представляет собой термограмму DSC Соединения 1:триацетина.
[0223] В одном из вариантов осуществления, Соединение 1:триацетин отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 4,9, 9,5, 9,8 и 14,7.
[0224] В одном из вариантов осуществления, Соединение 1:триацетин отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 4,9, 9,5, 9,8, 14,7, 16,5, 18,2 и 23,1.
[0225] В другом варианте осуществления, Соединение 1:триацетин отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 18. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0226] В одном из вариантов осуществления, Соединение 1:триацетин отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,2, 155,1, 154,8, 119,7 и 119,2.
[0227] В одном из вариантов осуществления, Соединение 1:триацетин отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,2, 155,1, 154,8, 134,1, 125,9, 125,6, 119,7, 119,2 и 35,3.
[0228] В одном из вариантов осуществления, Соединение 1:триацетин отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,2, 165,4, 164,3, 155,1, 154,8, 154,1, 149,4, 146,8, 145,6, 140,0, 134,1, 133,2, 132,3, 127,0, 125,9, 125,6, 124,3, 120,6, 119,7, 119,2, 118,3, 117,6, 111,9, 111,1, 110,4, 35,3, 35,0, 31,8, 29,8, 21,9, 20,4 и 18,9.
[0229] В одном из вариантов осуществления, Соединение 1:триацетин отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 123,9°C (положение пика), который соответствует плавлению сокристалла Соединения 1:глицерилтриацетина. За этим событием следует другая эндотерма при 141,9°C и еще одна эндотерма при 193,8°C.
[0230] Соединение 1:глицерилтрибутират
[0231] Сокристалл, содержащий Соединение 1 и глицерилтрибутират, ниже упоминается как ʺСоединение 1:глицерилтрибутиратʺ.
[0232] Характеризация Соединения 1:глицерилтрибутирата подробно описывается ниже в разделе Примеры. Фигура 21 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтрибутирата.
[0233] В одном из вариантов осуществления, Соединение 1:глицерилтрибутират отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 6,8, 9,5 и 22,6.
[0234] В одном из вариантов осуществления, Соединение 1:глицерилтрибутират отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 4,8, 4,9, 6,8, 9,5, 9,6, 14,3, 18,0, 19,0, 19,8, 21,4, 22,6 и 23,8.
[0235] В другом варианте осуществления, Соединение 1:глицерилтрибутират отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 21. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0236] Соединение 1:глицерилтристеарат
[0237] Сокристалл, содержащий Соединение 1 и глицерилтристеарат, ниже упоминается как ʺСоединение 1:глицерилтристеаратʺ.
[0238] Характеризация Соединения 1:глицерилтристеарата подробно описывается ниже в разделе Примеры. Фигура 22 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтристеарата. Фигура 23 представляет собой спектр 13C ssNMR Соединения 1:глицерилтристеарата. Фигура 24 представляет собой термограмму DSC Соединения 1:глицерилтристеарата.
[0239] В одном из вариантов осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,6, 6,9 и 11,0.
[0240] В одном из вариантов осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,6, 6,2, 6,9, 9,3, 11,0, 17,0 и 18,2.
[0241] В одном из вариантов осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,6, 5,4, 6,2, 6,9, 9,3, 11,0, 12,1, 12,6, 13,4, 13,9, 15,4, 16,4, 17,0, 18,2, 18,5, 19,4, 20,0, 20,4, 21,8, 23,8, 26,0, 27,0, 28,4, 29,1, 29,9, 31,2 и 32,8.
[0242] В другом варианте осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 22. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0243] В одном из вариантов осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,5, 155,0 и 119,5.
[0244] В одном из вариантов осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,5, 155,0, 134,4, 126,1, 119,5 и 35,7.
[0245] В одном из вариантов осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,5, 172,9, 171,6, 169,9, 165,0, 155,0, 143,6, 139,4, 137,2, 135,1, 134,4, 133,0, 127,3, 126,1, 119,5, 117,6, 112,0, 67,3, 64,1, 59,6, 35,7, 34,7, 31,7, 30,6, 23,6 и 14,8.
[0246] В одном из вариантов осуществления, Соединение 1:глицерилтристеарат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 55,1°C, который соответствует эвтектическому плавлению сокристалла Соединения 1:глицерилтристеарата и глицерилтристеарата. За этим событием следует другая эндотерма при 71,3°C, соответствующая плавлению беспримесного глицерилтристеарата. Перекрывающиеся эндотерма при 201,3°C и экзотерма при 208,1°C соответствуют плавлению сокристалла и кристаллизации беспримесного Соединения 1, соответственно. Другая эндотерма при 284,7°C соответствует плавлению беспримесной формы Соединения 1.
[0247] Соединение 1:глицерилтрипальмитат
[0248] Сокристалл, содержащий Соединение 1 и глицерилтрипальмитат, ниже упоминается как ʺСоединение 1:глицерилтрипальмитатʺ.
[0249] Характеризация Соединения 1:глицерилтрипальмитата подробно описывается ниже в разделе Примеры. Фигура 25 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтрипальмитата. Фигура 26 представляет собой спектр 13C ssNMR Соединения 1:глицерилтрипальмитата. Фигура 27 представляет собой термограмму DSC Соединения 1:глицерилтрипальмитата.
[0250] В другом варианте осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 11,0.
[0251] В одном из вариантов осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,3, 17,0, 18,2 и 23,7.
[0252] В одном из вариантов осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,9, 9,3, 11,0, 13,8, 15,1, 16,3, 17,0, 18,2, 19,4, 19,9, 20,3, 21,8 и 23,7.
[0253] В другом варианте осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 25. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0254] В одном из вариантов осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,4, 155,0, 144,0 и 119,6.
[0255] В одном из вариантов осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,4, 155,0, 134,5, 126,0, 119,6 и 35,7.
[0256] В одном из вариантов осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,4, 173,0, 169,9, 165,0, 155,0, 144,0, 139,5, 137,2, 134,5, 133,0, 127,2, 126,0, 119,6, 117,5, 112,0, 67,2, 64,0, 59,7, 35,7, 34,6, 31,7, 30,6, 23,7 и 14,8.
[0257] В одном из вариантов осуществления, Соединение 1:глицерилтрипальмитат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 47,7°C (пик), который соответствует эвтектическому плавлению сокристалла ивакафтора:глицерилтрипальмитата и глицерилтрипальмитата. За этим событием следует другая эндотерма при 63,0°C (пик), соответствующая плавлению беспримесного глицерилтрипальмитата. Перекрывающиеся эндотерма при 174,9°C (пик) и экзотерма при 186,7°C (пик) соответствуют плавлению сокристалла и кристаллизации беспримесного ивакафтора, соответственно. Другая эндотерма при 266,2°C (пик) соответствует плавлению беспримесной формы ивакафтора.
[0258] Соединение 1:глицерилтридодеканоат
[0259] Сокристалл, содержащий Соединение 1 и глицерилтридодеканоат, ниже упоминается как ʺСоединение 1:глицерилтридодеканоатʺ.
[0260] Характеризация Соединения 1:глицерилтридодеканоата подробно описывается ниже в разделе Примеры. Фигура 28 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтридодеканоата. Фигура 29 представляет собой спектр 13C ssNMR Соединения 1:глицерилтридодеканоата.
[0261] В одном из вариантов осуществления, Соединение 1:глицерилтридодеканоат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 4,4, 6,1, 6,9, 8,6, 9,3, 11,0, 12,1, 12,6, 13,2, 13,8, 15,0, 16,3, 17,0, 18,1, 19,5, 20,3, 21,9, 23,3, 23,9, 24,8 и 30,2.
[0262] В другом варианте осуществления, Соединение 1:глицерилтридодеканоат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 11,0.
[0263] В другом варианте осуществления, Соединение 1:глицерилтридодеканоат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,1, 6,9, 9,3, 11,0, 17,0, 18,1 и 23,3.
[0264] В другом варианте осуществления, Соединение 1:глицерилтридодеканоат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 28. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0265] В одном из вариантов осуществления, Соединение 1:глицерилтридодеканоат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,4, 155,0 и 119,6.
[0266] В одном из вариантов осуществления, Соединение 1:глицерилтридодеканоат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,4, 155,0, 134,6, 126,1, 119,6 и 35,6.
[0267] В одном из вариантов осуществления, Соединение 1:глицерилтридодеканоат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,4, 173,1, 171,5, 169,8, 165,0, 155,0, 143,0, 139,4, 137,2, 134,6, 133,0, 127,3, 126,1, 119,6, 117,6, 112,1, 67,1, 63,9, 59,7, 35,6, 31,7, 30,6 и 23,6.
[0268] Соединение 1:глицерилтримиристат
[0269] Сокристалл, содержащий Соединение 1 и глицерилтримиристат, ниже упоминается как ʺСоединение 1:глицерилтримиристатʺ.
[0270] Характеризация Соединения 1:глицерилтримиристата подробно описывается ниже в разделе Примеры. Фигура 30 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтримиристата. Фигура 31 представляет собой спектр 13C ssNMR Соединения 1:глицерилтримиристата. Фигура 32 представляет собой термограмму DSC Соединения 1:глицерилтримиристата.
[0271] В одном из вариантов осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,8 и 10,9.
[0272] В одном из вариантов осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,8, 9,2, 10,9, 16,9 и 18,0.
[0273] В одном из вариантов осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,0, 6,8, 7,4, 8,3, 9,2, 9,9, 10,9, 12,0, 12,5, 13,2, 13,7, 14,9, 16,2, 16,9, 17,6, 18,0, 18,5, 19,4, 20,0, 21,2, 22,1, 23,2, 24,1, 25,1, 26,4, 27,2, 27,7, 28,3, 29,2, 29,7, 31,0 и 32,7.
[0274] В другом варианте осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 30. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0275] В одном из вариантов осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,1, 155,0 и 119,9,
[0276] В одном из вариантов осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,1, 155,0, 134,6, 126,0, 119,9 и 35,6.
[0277] В одном из вариантов осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,1, 171,4, 169,8, 165,0, 155,0, 142,9, 139,5, 137,2, 134,6, 133,1, 127,3, 126,0, 119,9, 117,4, 112,0, 67,0, 63,7, 61,4 и 35,6.
[0278] В одном из вариантов осуществления, Соединение 1:глицерилтримиристат отличается тем, что оно имеет эндотермический пик дифференциальной сканирующей калориметрии (DSC) при 59,2°C, который соответствует плавлению глицерилтримиристата. За этим событием следует экзотерма при 134,4°C, которая перекрывается с эндотермой. За этим событием следует экзотерма при 171,3°C соответствующая кристаллизации беспримесного Соединения 1. Другая эндотерма при 280,1°C соответствует плавлению беспримесной формы Соединения 1.
[0279] Соединение 1:глицерилтригексаноат
[0280] Сокристалл, содержащий Соединение 1 и глицерилтригексаноат, ниже упоминается как ʺСоединение 1:глицерилтригексаноатʺ.
[0281] Характеризация Соединения 1:глицерилтригексаноата подробно описывается ниже в разделе Примеры. Фигура 33 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтригексаноата.
[0282] В одном из вариантов осуществления, Соединение 1:глицерилтригексаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 6,5, 9,2 и 21,4.
[0283] В одном из вариантов осуществления, Соединение 1:глицерилтригексаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 4,7, 6,5, 9,2, 14,5, 17,4, 18,7, 19,9, 21,4 и 24,4.
[0284] В одном из вариантов осуществления, Соединение 1: глицерилтригексаноат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 4,7, 6,5, 9,2, 9,9, 11,8, 12,5, 14,5, 15,1, 15,6, 17,4, 18,7, 19,9, 21,4, 23,0, 24,4, 25,2, 26,5, 28,3, 29,1, 30,5 и 35,6.
[0285] В другом варианте осуществления, Соединение 1:глицерилтригексаноат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 33. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0286] Соединение 1:глицерилтридеканоат
[0287] Сокристалл, содержащий Соединение 1 и глицерилтридеканоат, ниже упоминается как ʺСоединение 1:глицерилтридеканоатʺ.
[0288] Характеризация Соединения 1:глицерилтридеканоата подробно описывается ниже в разделе Примеры. Фигура 34 представляет собой иллюстративную картину XRPD Соединения 1:глицерилтридеканоата. Фигура 35 представляет собой спектр 13C ssNMR Соединения 1:глицерилтридеканоата.
[0289] В одном из вариантов осуществления, Соединение 1:глицерилтридеканоат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
[0290] В одном из вариантов осуществления, Соединение 1:глицерилтридеканоат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,1, 6,9, 9,2, 10,9, 16,9, 18,1 и 23,9.
[0291] В одном из вариантов осуществления, Соединение 1:глицерилтридеканоат отличается тем, что оно имеет картину порошковой дифракции рентгеновского излучения с одним или несколькими характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,1, 6,9, 9,2, 10,9, 11,8, 12,1, 12,6, 13,2, 13,8, 14,9, 16,3, 16,9, 18,1, 18,5, 19,4, 19,8, 20,3, 21,7, 23,4, 23,9, 25,2, 25,8, 27,2 и 28,4.
[0292] В другом варианте осуществления, Соединение 1:глицерилтридеканоат отличается тем, что оно имеет картину дифракции на порошках XRPD по существу такую же, как показано на Фигуре 34. Картины порошковой дифракции рентгеновского излучения получают при комнатной температуре с использованием излучения Cu K альфа.
[0293] В одном из вариантов осуществления, Соединение 1:глицерилтридеканоат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,5, 155,0 и 119,5.
[0294] В одном из вариантов осуществления, Соединение 1:глицерилтридеканоат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,5, 155,0, 134,9, 126,1 и 35,7.
[0295] В одном из вариантов осуществления, Соединение 1:глицерилтридеканоат отличается тем, что оно имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,5, 171,6, 169,9, 165,0, 155,0, 143,3, 139,5, 137,2, 134,9, 133,0, 127,3, 126,1, 119,5, 117,6, 112,1, 67,2, 64,0, 59,8, 35,7, 34,7, 31,7, 30,5 и 25,8, 23,5.
Сравнение растворения
[0296] Сравнение профилей растворения в FeSSIF Соединения 1:глицерилтриоктаноата, Соединения 1:глицерилтриолеата и Соединения 1:глицерилтрилинолеата с аморфным Соединением 1 и SDD Соединения 1 (это аморфное Соединение 1, диспергированное в HPMCAS (гидроксипропилметилцеллюлоза ацетатсукцинат или гипромеллоза ацетатсукцинат) (то есть высушенная распылением дисперсия (SDD)) показано на Фигуре 36. Соединение 1 имеет пероральную биологическую доступность с ограниченной растворимостью, и поддержание высокой концентрации раствора в FeSSIF требуется для любой твердой формы Соединения 1 с тем, чтобы она была жизнеспособной для разработки пероральной дозированной формы. Сокристаллы Соединения 1:триглицерида имеют сходные друг с другом рабочие характеристики в терминах доли растворения и поддержания высоких концентраций раствора в FeSSIF. Сокристаллы Соединения 1:триглицерида также показывают лучшее поддержание перенасыщения, чем как беспримесная аморфная, так и твердая аморфная диспергированная форма Соединения 1 (SDD Соединения 1), в течение более продолжительных периодов времени. Кроме того, in-vivo сокристаллы Соединения 1:триглицерида должны метаболизироваться в тонком кишечнике под действием липидэстеразы (липаз), которая эффективно удаляла бы триглицериды и дополнительно повышала бы концентрацию Соединения 1 в соответствии с принципом Ле-Шателье.
[0297] В дополнение к этому, сокристаллы кристаллического Соединения 1:триглицерида могут иметь следующие преимущества по сравнению с твердой аморфной диспергированной формой Соединения 1 (SDD Соединения 1): (1) сокристаллы могут приготавливаться, храниться и использоваться при условиях, когда они являются термодинамически стабильными; (2) может быть разработана контролируемая кристаллизация, которая может понижать уровни потенциальных примесей (примеси включают, но, не ограничиваясь этим, растворитель); (3) может быть разработан способ приготовления, который является более эффективным и экономичным (например, можно использовать меньше растворителя при приготовлении, и может быть разработан более дешевый способ, чем сушка распылением); и (4) не требуется стабилизирующего полимера для сокристаллов.
[0298] В одном из вариантов осуществления, сокристалл растворяется в модельной желудочно-кишечной среде после еды (FeSSIF) с получением концентрации Соединения 1 больше чем 0,4 мг/мл. В другом варианте осуществления, сокристалл растворяется в модельной желудочно-кишечной среде после еды (FeSSIF) с получением концентрации Соединения 1 больше чем 0,4 мг/мл, и эта концентрация поддерживается в течение, по меньшей мере, 10 часов. В другом варианте осуществления, сокристалл растворяется в модельной желудочно-кишечной среде после еды (FeSSIF) при температуре 37°C с получением концентрации Соединения 1 больше чем 0,4 мг/мл, и эта концентрация поддерживается в течение, по меньшей мере, 10 часов. В некоторых вариантах осуществления, сокристалл растворяется в модельной желудочно-кишечной среде после еды (FeSSIF) с получением концентрации Соединения 1 больше чем 0,4 мг/мл в течение 2 часов. В другом варианте осуществления, сокристалл растворяется в модельной желудочно-кишечной среде после еды (FeSSIF) с получением концентрации Соединения 1 больше чем 0,4 мг/мл, и эта концентрация поддерживается в течение, по меньшей мере, 10 часов без необходимости в стабилизирующем полимере. В некоторых вариантах осуществления, стабилизирующий полимер представляет собой HPMCAS.
Способы получения форм сокристаллов
[0299] В одном из аспектов, настоящее изобретение направлено на способ получения сокристаллов, содержащих Соединение 1 и соформер, где сокристалл выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы, где Соединение 1 представлено следующей структурной формулой:

включающий стадию:
перемешивания или смешивания Соединения 1 и соформера с образованием сокристалла.
[0300] В некоторых вариантах осуществления, R1, R2 и R3 независимо представляют собой C7-29 алифатическую группу.
[0301] В некоторых вариантах осуществления, соформер имеет среднюю молекулярную массу в пределах между 470 и 1400 Дальтон.
[0302] В некоторых вариантах осуществления, соформер выбирают из глицерилтриолеата, глицерилтристеарата, глицерилтридеканоата, глицерилтригексаноата, глицерилтридеканоата, глицерилтриоктаноата, глицерилтримиристата, глицерилтрипальмитата, глицерилтрибутирата, глицерилтрилинолеата, глицерилтридодеканоата, глицерилдеканоата, глицерилтрипальмитолеата, глицерилтриэруката, глицерилтрипропионата, пальмитодиолеина, триарахидонина, глицерилтрилинолената, триэруцина, глицерилтриарахидата, глицерилтри(цис-13-докозеноата), глицерилтрипетроселината, глицерилтрибехената, глицерилтриелаидата и триацетина.
[0303] В некоторых вариантах осуществления, соформер выбирают из








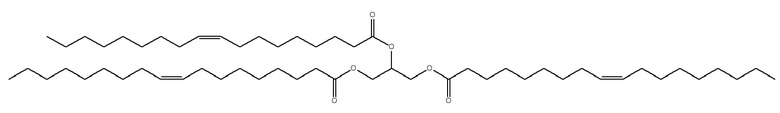 и
и

[0304] В одном из вариантов осуществления, Соединение 1 является беспримесным и аморфным. В другом варианте осуществления, соформер является беспримесным. В одном из вариантов осуществления, Соединение 1 и соформер перемешивают в течение, по меньшей мере, 0,5 часа. В другом варианте осуществления, Соединение 1 и соформер перемешивают в течение 18 часов. Еще в одном варианте осуществления, Соединение 1 и соформер перемешивают в течение, по меньшей мере, 18 часов. В одном из вариантов осуществления, Соединение 1 и соформер перемешивают в течение более 0,5 часа (включая, но, не ограничиваясь этим, 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов или 18 часов). В другом варианте осуществления, Соединение 1 и соформер перемешивают при 40°C. В другом варианте осуществления, Соединение 1 и соформер перемешивают примерно при 40°C. Еще в одном варианте осуществления, Соединение 1 и соформер перемешивают при 35-45°C (например, при 35°C, 36°C, 37°C, 38°C, 39°C, 40°C, 41°C, 42°C, 43°C, 44°C или 45°C). В одном из вариантов осуществления, Соединение 1 и соформер перемешивают в течение, по меньшей мере, 18 часов при 40°C. В одном из вариантов осуществления, Соединение 1 и соформер перемешивают в течение, по меньшей мере, 0,5 часа при 40°C. В одном из вариантов осуществления, Соединение 1 и соформер перемешивают в течение, по меньшей мере, 18 часов при 40°C.
[0305] В качестве неограничивающих примеров, в одном из вариантов осуществления, Соединение 1 и глицерилтриоктаноат перемешивают в течение, по меньшей мере, 0,5 часа; еще в одном варианте осуществления, Соединение 1 и глицерилтриоктаноат перемешивают в течение 0,5 часа; еще в одном варианте осуществления, Соединение 1 и глицерилтриоктаноат перемешивают в течение, по меньшей мере, 0,5 часа при 40°C; также, еще в одном варианте осуществления, Соединение 1 и глицерилтриоктаноат перемешивают в течение 0,5 часа при 40°C.
[0306] В одном из вариантов осуществления, настоящее изобретение предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер,
[0307] где Соединение 1 представлено следующей структурной формулой:

где соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы,
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и триглицерид с образованием сокристалла; и
(b) сбора сокристаллов посредством фильтрования.
[0308] В другом варианте осуществления, способ необязательно дополнительно включает стадии:
(c) сбора маточной жидкости;
(d) перемешивания Соединения 1 вместе с собранной маточной жидкостью в течение, по меньшей мере, 18 часов и
(e) сбора сокристаллов.
[0309] Один из аспектов настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

и где соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы;
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер; и
(b) нагрева смеси.
[0310] В одном из вариантов осуществления, Соединение 1 и соформер нагревают примерно до 80°C. В одном из вариантов осуществления, Соединение 1 и соформер нагревают до 80°C. В другом варианте осуществления, Соединение 1 и соформер нагревают примерно до 80°C в течение 12 часов. Еще в одном варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 12 часов. В другом варианте осуществления, Соединение 1 и соформер нагревают примерно до 80°C в течение 24 часов. Еще в одном варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 24 часов.
[0311] Один из аспектов настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы,
включающий стадии:
(c) приготовления смеси, содержащей Соединение 1 и соформер; и
(d) нагрева смеси до 80°C.
[0312] Еще в одном варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 12 часов. Еще в одном варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 24 часов.
[0313] Кроме того, другой аспект настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы.
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер; и
(b) нагрева смеси до температуры, которая примерно на 5-10°C выше, чем температура плавления соформера.
[0314] Один из аспектов настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

где соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы,
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер;
(b) нагрева смеси;
(c) охлаждения смеси и
(d) повторения стадии (b) и (c).
[0315] В одном из вариантов осуществления, Соединение 1 и соформер нагревают примерно до 80°C. В другом варианте осуществления, Соединение 1 и соформер нагревают примерно до 80°C и охлаждают примерно до 40°C. В одном из вариантов осуществления, Соединение 1 и соформер нагревают до 80°C. В другом варианте осуществления, Соединение 1 и соформер нагревают до 80°C и охлаждают до 40°C. В другом варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 12 часов. В другом варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 24 часов. Еще в одном варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 12 часов и охлаждают примерно до 40°C. В другом варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 12 часов. Еще в одном варианте осуществления, Соединение 1 и соформер нагревают до 80°C в течение 24 часов и охлаждают примерно до 40°C. В любом из указанных выше вариантов осуществления, стадии нагрева и охлаждения повторяют.
[0316] Другой аспект настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой:

где соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы,
включающий стадии:
(a) приготовления смеси, содержащей Соединение 1 и соформер;
(b) нагрева смеси примерно до 80°C;
(c) охлаждения смеси и
(d) повторения стадии (b) и (c).
[0317] В другом варианте осуществления, Соединение 1 и соформер охлаждают до 40°C.
[0318] Другой аспект настоящего изобретения предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер, где Соединение 1 представлено следующей структурной формулой

где соформер выбирают из следующих структурных формул:

где R1, R2 и R3 независимо представляют собой C1-29 алифатические группы,
включающий стадии:
(a) добавления Соединение 1 и триглицерида;
(b) нагрева примерно до 80°C;
(c) охлаждения примерно до 40°C и
(d) повторения стадии (b) и (c).
[0319] В некоторых вариантах осуществления, сокристаллы могут быть получены посредством суспендирования Соединения 1 и соформера в пригодном для использования растворителе при такой композиции суспензии, при которой сокристалл является стабильным на тройной фазовой диаграмме, например: посредством совместного измельчения Соединения 1 и соформера, посредством совместного измельчения Соединения 1 и соформера и добавления малого количества соответствующего растворителя, посредством совместного измельчения Соединения 1 и соформера и последующего отжига, посредством совместного измельчения Соединения 1 и соформера и последующего отжига при повышенной температуре, посредством совместного измельчения Соединения 1 и соформера и последующего отжига при повышенной влажности, посредством совместного измельчения Соединение 1 и соформера и последующего отжига при повышенной температуре и влажности, посредством смешивания Соединения 1 и соформера при температуре, когда, по меньшей мере, соформер является жидким, посредством смешивания Соединения 1 и соформера при температуре, когда, по меньшей мере, соформер является жидким, и последующего охлаждения после периода кристаллизации, посредством экструдирования Соединения 1 и соформера при температуре и композиции соформера, при которых сокристалл является стабильным, или посредством растворения Соединения 1 и соформера в пригодном для использования растворителе и выпаривания растворителя. Сокристаллы могут быть получены сходным образом с множеством соформеров.
[0320] В одном из вариантов осуществления, сокристаллы собирают посредством центробежного фильтрования при температуре выше температуры плавления соформера.
[0321] В другом варианте осуществления, сокристаллы промывают после фильтрования для удаления избытка соформера.
[0322] Сокристаллы, полученные с помощью любого из способов, указанных выше, выделяют или очищают. Сокристаллы являются чистыми, как измерено с помощью ВЭЖХ. В одном из вариантов осуществления, сокристалл составляет более 99% (масс/масс). В другом варианте осуществления, сокристаллы Соединения 1:триглицерида составляют более 99,5% (масс/масс). В одном из вариантов осуществления, сокристаллы Соединения 1:триглицерида составляют 99,5% (масс/масс). В другом варианте осуществления, сокристаллы Соединения 1:триглицерида составляют 99,6% (масс/масс). В другом варианте осуществления, сокристаллы Соединения 1:триглицерида составляют 99,7% (масс/масс). В другом варианте осуществления, сокристаллы Соединения 1:триглицерида составляют 99,8% (масс/масс). В другом варианте осуществления, сокристаллы Соединения 1:триглицерида составляют 99,9% (масс/масс)). В одном из вариантов осуществления, сокристаллы Соединения 1:глицерилтриоктаноата составляют 99,9% (масс/масс). В другом варианте осуществления, сокристаллы Соединения 1:глицерилтриолеата составляют 99,9% (масс/масс). Еще в одном варианте осуществления, сокристаллы Соединения 1:глицерилтрилинолеата составляют 99,5% (масс/масс). Предел детектирования для примесей с помощью ВЭЖХ составляет 0,005%.
[0323] Настоящее изобретение также предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер сокристалла, выбранный из группы, состоящей из глицерилтриоктаноата, глицерилтриолеата и глицерилтрилинолеата, где Соединение 1 представлено следующей структурной формулой

включающий стадию:
перемешивания Соединения 1 и соформера сокристалла с образованием сокристалла.
[0324] В некоторых вариантах осуществления, соформер сокристалла представляет собой глицерилтриоктаноат.
[0325] В некоторых вариантах осуществления, соформер сокристалла представляет собой глицерилтриолеат.
[0326] В некоторых вариантах осуществления, соформер сокристалла представляет собой глицерилтрилинолеат.
[0327] Настоящее изобретение также предлагает способ получения сокристаллов, содержащих Соединение 1 и соформер сокристалла, выбранный из группы, состоящей из глицерилтриоктаноата, глицерилтриолеата и глицерилтрилинолеата, где Соединение 1 представлено следующей структурной формулой

включающий стадии:
добавления Соединения 1 и соформера вместе; и
нагрева.
Применение, приготовление и введение
[0328] Фармацевтически приемлемые композиции
[0329] В одном из аспектов настоящего изобретения, предлагаются фармацевтически приемлемые композиции, где эти композиции содержат сокристаллы по любому из вариантов осуществления, описанных выше, и фармацевтически приемлемый носитель или эксципиент.
[0330] В некоторых вариантах осуществления, по меньшей мере, 30% Соединения 1, присутствующего в фармацевтически приемлемых композициях, находится в форме сокристаллов Соединения 1:триглицерида, описанных в настоящем документе. В качестве неограничивающего примера, по меньшей мере, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 92,5%, 95%, 97,5%, 98% или 99% Соединения 1 присутствуют в форме сокристаллов Соединения 1:триглицерида, описанных в настоящем документе.
[0331] В определенных вариантах осуществления, эти композиции необязательно дополнительно содержат один или несколько дополнительных терапевтических агентов.
[0332] Как описано выше, фармацевтически приемлемые композиции по настоящему изобретению дополнительно содержат фармацевтически приемлемый носитель, вспомогательное вещество или инертное вещество, которое, как используется в настоящем документе, включает любые и все растворители, разбавители или другое жидкое инертное вещество, добавки для диспергирования или суспендирования, поверхностно-активные агенты, изотонические агенты, загущающие или эмульгирующие агенты, консерванты, твердые связующие вещества, смазывающие вещества, и тому подобное, в соответствии с конкретной желаемой дозированной формой. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) описывает различные носители, используемые при приготовлении фармацевтически приемлемых композиций и известные технологии для их приготовления. За исключением случаев, когда обычная среда носителя несовместима с соединениями по настоящему изобретению, например, из-за оказания любого нежелательного биологического воздействия или иного взаимодействия отрицательным образом с любым другим компонентом (компонентами) фармацевтически приемлемой композиции, ее использование как предполагается, находится в рамках настоящего изобретения. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но, не ограничиваясь этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, смеси частичных глицеридов растительных насыщенных жирных кислот, воду, соли или электролиты, такие как протамин сульфат, динатрий гидрофосфат, калий гидрофосфат, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, блок-полимеры полиэтилен-полиоксипропилен, шерстяной жир, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошок смолы трагаканта; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; воду, не содержащую пирогенов; изотонический солевой раствор, а также другие нетоксичные совместимые смазывающие вещества, такие как натрий лаурилсульфат и стеарат магния, а также окрашивающие агенты, агенты для облегчения высвобождения, агенты для нанесения покрытий, подслащивающие, ароматизирующие и парфюмерные агенты, консерванты и антиоксиданты, также могут присутствовать в композиции, на основе суждения того, кто ее приготавливает.
[0333] Применения соединений и фармацевтически приемлемых композиций
[0334] В дополнение к кистозному фиброзу, модуляция активности CFTR может быть полезной при других заболеваниях, не вызываемых непосредственно мутациями CFTR, таких как секреторные заболевания и другие заболевания, связанные со складыванием белков, медиируемым CFTR. Они включают, но, не ограничиваясь этим, хроническое обструктивное легочное заболевание (COPD), болезнь сухого глаза и синдром Шегрена. COPD характеризуется ограничением поступления воздуха, которое является прогрессирующим и не обратимым полностью. Ограничение поступления воздуха вызывается гиперсекрецией слизи, эмфиземой и бронхиолитом. Активаторы мутантного CFTR или CFTR дикого типа предлагают потенциальное лечение гиперсекреции слизи и ослабленного мукоцилиарного выделения, что является обычным при COPD. Конкретно, повышение секреции анионов на CFTR может облегчать транспорт текучей среды в жидкости на поверхности дыхательных путей для гидратации слизи и оптимизации вязкости околоресничной текучей среды. Это приводило бы к улучшению мукоцилиарного выведения и уменьшению симптомов, ассоциируемых с COPD. Болезнь сухого глаза характеризуется уменьшением продуцирования слезной жидкости и аномальными профилями липидов, белков и муцина слезной пленки. Имеется много причин для сухости глаз, некоторые из них включают возраст, глазную хирургию методом ЛАСИК, артрит, медикаментозное лечение, химические/термические ожоги, аллергии и такие заболевания, как кистозный фиброз и синдром Шегрена. Увеличение секреции анионов с помощью CFTR усилило бы транспорт текучих сред от корнеальных эндотелиальных клеток и секреторных желез, окружающих глаз, для увеличения гидратации роговицы. Это помогло бы облегчить симптомы, ассоциируемые с болезнью сухого глаза. Синдром Шегрена представляет собой аутоиммунное заболевание, при котором иммунная система воздействует на железы, продуцирующие влагу по всему организму, включая глаз, ротовую полость, кожу, респираторную ткань, печень, вагину и кишечник. Симптомы включают, заболевание сухого глаза, ротовой полости и вагины, а также заболевание легких. Заболевание также ассоциируется с ревматоидным артритом, системной красной волчанкой, системным склерозом и полимиозитом/дерматомиозитом. Дефектная направленная миграция белков, как предполагается, вызывает это заболевание, для которого возможности лечения являются ограниченными. Вещества, усиливающие или индуцирующие активность CFTR, могут гидратировать различные органы, на которые влияет заболевание, и помогать в облегчении ассоциируемых с ним симптомов.
[0335] В одном из аспектов, настоящее изобретение предлагает способ лечения или облегчения тяжести заболевания у пациента, включающий введение указанному пациенту сокристаллов по любому из вариантов осуществления, описанных выше, и указанное заболевание выбирают из кистозного фиброза, астмы, COPD,вызываемого курением, хронического бронхита, риносинусита, констипации, панкреатита, недостаточности поджелудочной железы, мужского бесплодия, вызываемого врожденным билатеральным отсутствием семявыводящих протоков (CBAVD), легкого легочного заболевания, идиопатического панкреатита, аллергического бронхопульмонарного аспергиллеза (ABPA), заболевания печени, наследственной эмфиземы, наследственного гемохроматоза, дефицитов коагуляции и фибринолиза, таких как дефицит белка C, наследственной ангиоэдемы Типа 1, дефицитов процессинга липидов, таких как наследственная гиперхолестеринемия, хиломикронемии Типа 1, абеталипопротеинемии, заболевания лизосомальной аккумуляции, такие как заболевание I-клеток/псевдосиндром Гурлера, мукополисахаридозы, болезнь Тея/Сакса, болезнь Криглера-Найяра типа II, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит миелопероксидазы, первичный гипопаратиреоидизм, меланома, гликаноз CDG типа 1, врожденный гипертиреоидизм, незавершенный остеогенез, наследственная гипофибриногенемия, дефицит ACT, несахарный диабет (DI), нейрогипофизарный DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий надъядерный паралич, болезнь Пика, нескольких полиглютаминных неврологических расстройств, таких как болезнь Хантингтона, спинально-церебеллярная атаксия типа I, спинальная и бульбарная мышечная атрофия, дентарупропаллидолуизиновая атрофия и миотоническая дистрофия, а также губчатая энцефалопатия, такая как наследственная болезнь Крейтцфельда-Якоба (вызываемая дефектом процессинга прионного белка), болезнь Фабри, синдром Штройслера-Шайнкера, COPD, болезнь сухого глаза или болезнь Шегрена, остеопороз, остеопения, срастание перелома и рост костей (включая восстановление костей, регенерацию костей, уменьшение резорпции костей и увеличение отложения костей), синдром Горэма, хлоридных каналопатий, таких как врожденная миотония (формы Томсена и Беккера), синдром Бартера типа III, болезнь Дента, эпилепсия, гиперэкплексия, заболевания лизосомальной аккумуляции, синдром Ангельмана и первичная цилиарная дискинезия (PCD), это термин для наследственных расстройств структуры и/или функции ресничек, включая PCD с обратным расположением внутренних органов (также известную как синдром Картагенера), PCD без обратного расположения внутренних органов и цилиарную аплазию. В некоторых вариантах осуществления, сокристалл представляет собой сокристалл Соединения 1:триглицерида, как описано в настоящем документе.
[0336] В некоторых вариантах осуществления, способ включает лечение или облегчение тяжести кистозного фиброза у пациента, включающий введение указанному пациенту сокристалла по любому из вариантов осуществления, описанного выше. В некоторых вариантах осуществления, сокристалл представляет собой сокристалл Соединения 1:триглицерида, как описано в настоящем документе. В определенных вариантах осуществления, пациент имеет мутантные формы CFTR человека. В других вариантах осуществления, пациент имеет одну или несколько из следующих мутаций: ΔF508, R117H и G551D CFTR человека. В одном из вариантов осуществления, способ включает лечение или облегчение тяжести кистозного фиброза у пациента, имеющего мутацию ΔF508 CFTR человека, включающий введение указанному пациенту сокристаллов Соединения 1:триглицерида, описанных в настоящем документе. В одном из вариантов осуществления, способ включает лечение или облегчение тяжести кистозного фиброза у пациента, имеющего мутацию G551D CFTR человека, включающий введение указанному пациенту сокристаллов Соединения 1:триглицерида, описанных в настоящем документе. В одном из вариантов осуществления, способ включает лечение или облегчение тяжести кистозного фиброза у пациента, имеющего мутацию ΔF508 CFTR человека в одном аллеле, включающий введение указанному пациенту сокристаллов Соединения 1:триглицерида, описанных в настоящем документе. В одном из вариантов осуществления, способ включает лечение или облегчение тяжести кистозного фиброза у пациента, имеющего мутацию ΔF508 CFTR человека в обоих аллелях, включающий введение указанному пациенту сокристаллов Соединения 1:триглицерида, описанных в настоящем документе. В одном из вариантов осуществления, способ включает лечение или облегчение тяжести кистозного фиброза у пациента, имеющего мутацию G551D CFTR человека в аллеле, включающий введение указанному пациенту сокристаллов Соединения 1:триглицерида, описанных в настоящем документе. В одном из вариантов осуществления, способ включает лечение или облегчение тяжести кистозного фиброза у пациента, имеющего мутацию G551D CFTR человека в обоих аллелях, включающий введение указанному пациенту сокристаллов Соединения 1:триглицерида, описанных в настоящем документе.
[0337] В другом аспекте, настоящее изобретение предлагает способ лечения или облегчения тяжести состояния, заболевания или расстройства, обусловленного мутацией CFTR. В определенных вариантах осуществления, настоящее изобретение предлагает способ лечения состояния, заболевание или расстройства, обусловленного дефицитом активности CFTR, этот способ включает введение композиции, содержащей сокристаллы по любому из вариантов осуществления, описанных выше, субъекту, предпочтительно, млекопитающему, нуждающемуся в этом. В некоторых вариантах осуществления, сокристалл представляет собой сокристалл Соединения 1:триглицерида, как описано в настоящем документе.
[0338] В определенных вариантах осуществления, настоящее изобретение предлагает способ лечения заболеваний, ассоциируемых с понижением функции CFTR, вызываемым мутациями гена, кодирующего CFTR, или факторами окружающей среды (например, курением). Эти заболевания включают кистозный фиброз, хронический бронхит, рецидивирующий бронхит, острый бронхит, мужское бесплодие, вызываемое врожденным билатеральным отсутствием семявыводящих протоков (CBAVD), женское бесплодие, вызываемое врожденным отсутствием матки и вагины (CAUV), идиопатический хронический панкреатит (ICP), идиопатический рецидивирующий панкреатит, идиопатический острый панкреатит, хронический риносинусит, первичный склерозирующий холангит, аллергический бронхопульмонарный аспергиллез, диабет, болезнь сухого глаза, констипацию, аллергический бронхопульмонарный аспергиллез (ABPA), заболевания костей (например, остеопороз) и астму, способ включает введение указанному пациенту сокристаллов по любому из вариантов осуществления, описанных выше. В некоторых вариантах осуществления, сокристаллы представляют собой сокристаллы Соединения 1:триглицерида, как описано в настоящем документе.
[0339] В определенных вариантах осуществления, настоящее изобретение предлагает способ лечения заболеваний, ассоциируемых с нормальной функцией CFTR. Эти заболевания включают хроническое обструктивное легочное заболевание (COPD), хронический бронхит, рецидивирующий бронхит, острый бронхит, риносинусит, констипацию, панкреатит, включая хронический панкреатит, рецидивирующий панкреатит и острый панкреатит, недостаточность поджелудочной железы, мужское бесплодие, вызываемое врожденным билатеральным отсутствием семявыводящих протоков (CBAVD), легкое легочное заболевание, идиопатический панкреатит, заболевание печени, наследственную эмфизему, камни в желчном пузыре, заболевание гастроэзофагеального рефлюкса, злокачественные образования желудочного-кишечного тракта, воспалительное заболевание кишечника, констипацию, диабет, артрит, остеопороз и остеопению, этот способ включает введение указанному пациенту сокристаллов по любому из вариантов осуществления, описанных выше. В некоторых вариантах осуществления, сокристаллы представляют собой сокристаллы Соединения 1:триглицерида, как описано в настоящем документе.
[0340] В определенных вариантах осуществления, настоящее изобретение предлагает способ лечения заболеваний, ассоциируемых с нормальной функцией CFTR, включающих наследственный гемохроматоз, дефициты коагуляции фибринолиза, такие как дефицит белка C, наследственную ангиоэдему Типа 1, дефициты процессинга липидов, такие как наследственная гиперхолестеринемия, хиломикронемии Типа 1, абеталипопротеинемию, заболевания лизосомальной аккумуляции, такие как заболевание I-клеток /псевдоболезнь Гурлера, мукополисахаридозы, болезнь Сандхофа/Тея-Сакса, болезнь Криглера-Найяра типа II, полиэндокринопатию/гиперинсулинемию, сахарный диабет, карликовость Ларона, дефицит миелопероксидазы, первичный гипопаратиреоидизм, меланому, гликаноз CDG типа 1, врожденный гипертиреоидизм, незавершенный остеогенез, наследственную гипофибриногенемию, дефицит ACT, несахарный диабет (DI), нейрогипофизарный DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий надъядерный паралич, болезнь Пика, несколько полиглютаминных неврологических расстройств, таких как болезнь Хантингтона, спинально-церебеллярная атаксия типа I, спинальная и бульбарная мышечная атрофия, дентарупропаллидолуизиновая атрофия и миотоническая дистрофия, а также губчатая энцефалопатия, такая как наследственная болезнь Крейтцфельда-Якоба (вызываемая дефектом процессинга прионного белка), болезнь Фабри, синдром Штройслера-Шайнкера, синдром Горэма, хлоридные каналопатии, врожденную миотонию (формы Томсена и Беккера), синдром Бартера типа III, болезнь Дента, эпилепсию, гиперэкплексию, заболевания лизосомальной аккумуляции, синдром Ангельмана, первичную цилиарную дискинезию (PCD), PCD с обратным расположением внутренних органов (известную также как синдром Картагенера), PCD без обратного расположения внутренних органов и цилиарную аплазию, или болезнь Шегрена, способ включает стадию введения указанному млекопитающему эффективного количества сокристаллов по любому из вариантов осуществления, описанных выше. В некоторых вариантах осуществления, сокристаллы представляют собой сокристаллы Соединения 1:триглицерида, как описано в настоящем документе.
[0341] В соответствии с альтернативным вариантом осуществления, настоящее изобретение предлагает способ лечения кистозный фиброз, включающий стадию введения указанному млекопитающему композиции, способ включает стадию введения указанному млекопитающему эффективного количества композиции, содержащей сокристаллы Соединения 1:триглицерида, описанного в настоящем документе.
[0342] В соответствии с настоящим изобретением ʺэффективное количествоʺ сокристаллов Соединения 1:триглицерида или его фармацевтически приемлемой композиции представляет собой количество, эффективное при лечении или облегчении тяжести одного или нескольких заболеваний, расстройств или состояний, как перечисляется выше.
[0343] Сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, или их фармацевтически приемлемая композиция могут вводиться с использованием любого количества и любого способа введения эффективного при лечении или облегчении тяжести одного или нескольких заболеваний, расстройств или состояний, как перечисляется выше.
[0344] В определенных вариантах осуществления, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, или их фармацевтически приемлемая композиция являются пригодными для использования при лечении или облегчении тяжести кистозного фиброза у пациентов, которые демонстрируют остаточную активность CFTR в апикальной мембране респираторного и нереспираторного эпителия. Присутствие остаточной активности CFTR YF эпителиальной поверхности можно легко детектировать с использованием способов, известных в данной области, например, стандартных электрофизиологических, биохимических или гистохимических методик. Такие способы идентифицируют активность CFTR с использованием in vivo или ex vivo электрофизиологических методик измерения концентраций Cl- в поту или слюне, или ex vivo биохимических или гистохимических методик для мониторинга их плотности на поверхности клеток. С использованием таких способов, остаточная активность CFTR может легко детектироваться у пациентов гетерозиготных или гомозиготных по отношению к множеству различных мутаций, включая пациентов гомозиготных или гетерозиготных по отношению к наиболее распространенной мутации ΔF508.
[0345] В другом варианте осуществления, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, или их фармацевтически приемлемая композиция являются пригодными для использования при лечении или облегчении тяжести кистозного фиброза у пациентов, которые имеют остаточную активность CFTR индуцируемую или усиливаемую с использованием фармакологических способов или генной терапии. Такие способы увеличивают количество CFTR, присутствующих на поверхности клетки, тем самым индуцируя отсутствующую до этого активность CFTR у пациента или повышая существующий уровень остаточной активности CFTR у пациента.
[0346] В одном из вариантов осуществления, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, или их фармацевтически приемлемая композиция, являются пригодными для использования при лечении или облегчении тяжести кистозного фиброза у пациентов с определенными генотипами, демонстрирующих остаточную активность CFTR, например, с мутациями класса III (ослабление регуляции или открывания каналов), с мутациями класса IV (изменение проводимости) или с мутациями класса V (уменьшение синтеза) (Lee R. Choo-Kang, Pamell., Zeitlin, Type I, II, III, IV, and V cystic fibrosis Transmembrane Comductance Regulator Defects and Opportunities of Therapy; Current Opinion in Pulmonary Medicine 6:521-529, 2000). Другие генотипы пациентов, которые демонстрируют остаточную активность CFTR, включают пациентов гомозиготных по отношению к одному из этих классов или гетерозиготных, с любым другим классом мутаций, включая мутации класса I, мутации класса II или мутации, для которых классификация отсутствует.
[0347] В одном из вариантов осуществления, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, или их фармацевтически приемлемая композиция являются пригодными для использования при лечении или облегчении тяжести кистозного фиброза у пациентов с определенными клиническими фенотипами, например, с умеренным-легким клиническим фенотипом, который, как правило, коррелирует с величиной остаточной активности CFTR в апикальной мембране эпителия. Такие фенотипы включают пациентов, демонстрирующих недостаточность поджелудочной железы, или пациентов с диагнозом идиопатический панкреатит и врожденное билатеральное отсутствие семявыводящих протоков, или легкое легочное заболевание.
[0348] Точное необходимое количество будет изменяться от субъекта к субъекту, оно зависит от биологического вида, возраста и общего состояния субъекта, от тяжести инфекции, от конкретного агента, от его режима введения, и тому подобное. Соединения по настоящему изобретению предпочтительно приготавливаются в дозированной единичной форме для простоты введения и однородности дозировки. Выражение ʺдозированная единичная формаʺ, как используется в настоящем документе, относится к физически отдельной единице агента, соответствующей для пациента, который должен лечиться. Однако будет понятно, что общее ежедневное применение соединений и композиций по настоящему изобретению будет определяться наблюдающим врачом в рамках его медицинского суждения. Конкретный уровень эффективной дозы для любого конкретного пациента или организма будет зависеть от множества факторов, включая расстройство, которое лечатся, и тяжесть этого расстройств; активность конкретного используемого соединения; конкретную используемую композицию; возраста, массу тела, общее состояние здоровья, пол и диету пациента; время введения, способ введения и скорость выделения конкретного используемого соединения; продолжительность лечения; лекарственные средства, используемые в сочетании или одновременно с конкретным используемым соединением, и от подобных факторов, хорошо известных в области медицины. Термин "пациент", как используется в настоящем документе, означает животное, предпочтительно, млекопитающее, а наиболее предпочтительно, человека.
[0349] Фармацевтически приемлемые композиции по настоящему изобретению могут вводиться людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местным образом (например, в виде порошков, мазей, капель или пластыря), буккально, в виде перорального или назального спрея или чего-либо подобного, в зависимости от тяжести инфекции, которая лечится. В определенных вариантах осуществления, соединения по настоящему изобретению могут вводиться перорально или парентерально при уровнях дозировки примерно от 0,01 мг/кг примерно до 50 мг/кг, а предпочтительно, примерно от 0,5 мг/кг примерно до 25 мг/кг массы тела субъекта в день, один или несколько раз в день, для получения желаемого терапевтического воздействия.
[0350] Жидкие дозированные формы для перорального введения включают, но, не ограничиваясь этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области, такие, например, как вода, или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масло, масло из проростков семян, оливковое, касторовое и кунжутное масло), глицерол, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, и их смеси. Кроме инертных разбавителей, пероральные композиции могут также включать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие, ароматизирующие и парфюмерные агенты.
[0351] Препараты для инъекций, например, стерильные водные или масляные суспензии для инъекций, могут приготавливаться в соответствии с литературой, с использованием соответствующих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций может также представлять собой стерильный раствор, суспензию или эмульсию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых инертных веществ и растворителей, которые можно использовать, находится вода, раствор Рингера, U.S.P., и изотонический раствор хлорида натрия. В дополнение к этому, стерильные фиксированные масла обычно используются в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое мягкое фиксированное масло, включая синтетические моно- или диглицериды. В дополнение к этому, при приготовлении препаратов для инъекций используют жирные кислоты, такие как олеиновая кислота.
[0352] Препараты для инъекций можно стерилизовать, например, посредством фильтрования через фильтр, удерживающий бактерии, или посредством введения стерилизующих агентов в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной среде для инъекций перед использованием.
[0353] Для пролонгирования воздействия соединения по настоящему изобретению, часто бывает желательным замедлять поглощение соединения от подкожной или внутримышечной инъекции. Это можно осуществить посредством использования жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Скорость поглощения соединения при этом зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристалла и его кристаллической формы. Альтернативно, замедленное поглощение парентерально вводимой формы соединения осуществляется посредством растворения или суспендирования соединения в масляном инертном веществе. Формы депо для инъекций получают посредством формирования матриц для микроинкапсулирования соединения в биодеградируемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения соединения к полимеру и от природы конкретно используемого полимера, скорость высвобождения соединения может контролироваться. Примеры других биодеградируемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). Препараты депо для инъекций также приготавливают посредством захвата соединения в липосомах или микроэмульсиях, которые являются совместимыми с тканями организма.
[0354] Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть получены посредством смешивания соединения по настоящему изобретению с соответствующими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск, для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела, и по этой причине, они плавятся в прямой кишке или вагинальной полости и высвобождают активное соединение.
[0355] Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах, активное соединение смешивается с инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальций фосфат, и/или a) с наполнителями или расширителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннитол и кремниевая кислота, b) со связующими веществами, такими, например, как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и смола акации, c) с увлажняющими веществами, такими как глицерол, d) с разрыхляющими агентами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, e) с агентами, замедляющими растворение, такими как парафин, f) с ускорителями поглощения, такими как соединения четвертичного аммония, g) со смачивающими агентами, такими, например, как цетиловый спирт и глицерол моностеарат, h) с поглотителями, такими как каолин и бентонитная глина и i) со смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, натрий лаурилсульфат и их смеси. В случае капсул, таблеток и пилюль, дозированная форма может также содержать буферные агенты.
[0356] Твердые композиции подобного типа могут также использоваться в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей, и тому подобное. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул могут приготавливаться с покрытиями и оболочками, такими как энтеральные покрытия и другие покрытия, хорошо известные в области фармацевтических препаратов. Они могут необязательно содержать замутняющие агенты, а также могут иметь такую композицию, что они высвобождают активный ингредиент (ингредиенты) только или преимущественно в определенной части желудочно-кишечного тракта, необязательно, замедленным образом. Примеры матричных композиций, которые можно использовать, включают полимерные вещества и воски. Твердые композиции сходного типа могут также использоваться в качестве наполнителей в мягких и твердых наполненных желатиновых капсулах с использованием таких эксципиентов как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей, и тому подобное.
[0357] Активные соединения могут также находиться в микроинкапсулированной форме вместе с одним или несколькими эксципиентами, как отмечено выше. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул могут приготавливаться с покрытиями и оболочками, такими как энтеральные покрытия, покрытия для контроля высвобождения и другие покрытия, хорошо известные в области фармацевтических препаратов. В таких твердых дозированных формах активное соединение может подмешиваться вместе с инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также содержать дополнительные вещества иные, чем инертные разбавители, например, таблетирующие смазывающие вещества и другие таблетирующие добавки, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, дозированные формы могут также содержать буферные агенты. Они могут необязательно содержать замутняющие агенты и могут также иметь такую композицию, что они высвобождают активный ингредиент (ингредиенты) только или преимущественно в определенной части желудочно-кишечного тракта, необязательно, замедленным образом. Примеры матричных композиций, которые можно использовать, включают полимерные вещества и воски.
[0358] Дозированные формы для местного или трансдермального введения соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, препараты для ингаляций или пластыри. Активный компонент подмешивается в стерильных условиях вместе с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, по потребности. Офтальмологический препарат, ушные капли и глазные капли так же, как предполагается, находятся в рамках настоящего изобретения. В дополнение к этому, настоящее изобретение предполагает использование трансдермальных пластырей, которые имеют дополнительное преимущество обеспечения контролируемой доставки соединения в организм. Такие дозированные формы приготавливают посредством растворения или диспергирования соединения в соответствующей среде. Усилители поглощения могут также использоваться для увеличения потока соединения через кожу. Его скорость может контролироваться либо посредством создания мембраны, контролирующей скорость, либо посредством диспергирования соединения в полимерной матрице или геле.
[0359] Также, будет понятно, что сокристаллы по любому из вариантов осуществления, описанных выше (например, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе), или их фармацевтически приемлемая композиция, могут использоваться при сочетанной терапии, то есть, сокристаллы по любому из вариантов осуществления, описанных выше (например, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе), или их фармацевтически приемлемая композиция могут вводиться до одной или нескольких желательных терапевтических или медицинских процедур, одновременно с ними или после них. Конкретное сочетание различных видов терапии (терапевтического лечения или процедур) для использования в сочетанном режиме будет учитывать совместимость желаемого терапевтического лечения и/или процедур и желаемое терапевтическое воздействие, которое должно быть достигнуто. Также, будет очевидным, что используемые виды терапии могут достигать желаемого воздействия для этого же расстройства (например, соединение по настоящему изобретению может вводиться одновременно с другим агентом, используемым для лечения этого же расстройства), или они могут достигать других воздействий (например, контроля каких-либо отрицательных воздействий). Как используется в настоящем документе, дополнительные терапевтические агенты, которые обычно вводятся при лечении или предотвращении конкретного заболевания или состояния, известны как ʺсоответствующие заболеванию или состоянию, которое лечитсяʺ.
[0360] В одном из вариантов осуществления, дополнительный терапевтический агент выбирают из муколитического агента, бронходилатора, антибиотика, противоинфекционного агента, противовоспалительного агента, модулятора CFTR иного, чем соединение по настоящему изобретению или питательного агента.
[0361] В одном из вариантов осуществления, дополнительный терапевтический агент представляет собой соединение, которое стабилизирует присутствие CFTR на поверхности клетки, такое как активаторы передачи сигналов Rac1, для которых фактор роста гепатоцитов (HGF) является одним из примеров.
[0362] В одном из вариантов осуществления, дополнительный терапевтический агент представляет собой антибиотик. Иллюстративные антибиотики, пригодные для использования в настоящем документе, включают тобрамицин, включая порошок тобрамицина для ингаляций (TIP), азитромицин, кайстон, азтреонам, включая аэрозольную форму азтреонама, амикацин, включая его липосомные препараты, ципрофлоксацин, включая его препараты, пригодные для введения посредством ингаляции, левофлоксацин, включая его аэрозольные препараты, и сочетания двух антибиотиков, например, фосфомицина и тобрамицина.
[0363] В другом варианте осуществления, дополнительный терапевтический агент представляет собой муколитик. Иллюстративные муколитики пригодные для использования в настоящем документе включают Pulmozyme®.
[0364] В другом варианте осуществления, дополнительный терапевтический агент представляет собой бронходилатор. Иллюстративные бронходилаторы включают альбутерол, метапротенерол сульфат, пирбутерол ацетат, салметерол или тетрабулин сульфат.
[0365] В другом варианте осуществления, дополнительный терапевтический агент является эффективным при восстановлении жидкости на поверхности дыхательных путей легких. Такие агенты улучшают движение соли в клетки и из них, делая возможным повышение гидратирования слизи в дыхательных путях легких, и, следовательно, она выводится легче. Такие иллюстративные агенты включают гипертонический солевой раствор, денуфосол тетранатрий ([[(3S,5R)-5-(4-амино-2-оксипиримидин-1-ил)-3-гидроксиоксолан-2-ил]метокси-гидроксифосфорил][[[(2R,3S,4R,5R)-5-(2,4-диоксипиримидин-1-ил)-3,4-дигидроксиоксолан-2-ил]метокси-гидроксифосфорил]окси-гидроксифосфорил]гидрофосфат) или бронхитол (препарат маннитола для ингаляций).
[0366] В другом варианте осуществления, дополнительный терапевтический агент представляет собой противовоспалительный агент, то есть, агент, который может уменьшить воспаление в легких. Такие иллюстративные агенты пригодные для использования в настоящем документе включают ибупрофен, докозагексаеновую кислоту (DHA), силденафил, глутатион для инъекций, пиоглитазон, гидроксихлорохин или симвастатин.
[0367] В другом варианте осуществления, дополнительный терапевтический агент представляет собой соединение, которое усиливает или индуцирует активность CFTR иного, чем сокристаллы Соединения 1. Такие иллюстративные агенты включают аталурен (ʺPTC124®ʺ; 3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]бензойную кислоту), синапултид, ланковутид, депелестат (ингибитор рекомбинантой эластаза нейтрофилов человека) и кобипростон (7-{(2R,4aR,5R,7aR)-2-[(3S)-1,1-дифтор-3-метилпентил]-2-гидрокси-6-оксооктагидроциклопента[b]пиран-5-ил}гептановую кислоту).
[0368] В другом варианте осуществления, дополнительный терапевтический агент представляет собой питательный агент. Иллюстративные питательные агенты включают панкрелипазу (заменитель фермента поджелудочной железы), включая Pancrease®, Pancreacarb®, Ultrase® или Creon®, Liprotomase® (ранее Trizytek®), Aquadeks® или глутатион для ингаляций. В одном из вариантов осуществления, дополнительный питательный агент представляет собой панкрелипазу.
[0369] В другом варианте осуществления, дополнительный терапевтический агент представляет собой соединение, выбранное из гентамицина, куркумина, циклофосфамида, 4-фенилбутирата, миглустата, фелодипина, нимодипина, Philoxin B, генистеина, Apigenin, соединений, усиливающих или индуцирующих действие cAMP/cGMP, таких как ролипрам, силденафил, милринон, тадалафил, амринон, изопротеренол, альбутерол и алметерол, деоксиспергуалин, ингибиторы HSP 90, ингибиторы HSP 70, ингибиторы протеосом, такие как эпоксомицин, лактацистин, и тому подобное.
[0370] В другом варианте осуществления, дополнительный терапевтический агент уменьшает активность блокаторов эпителиальных натриевых каналов (ENaC), либо непосредственно блокируя канал, либо опосредованно, модулируя протеазы, что приводит к увеличению активности ENaC (например, сеинпротеаз, канал-активирующих протеаз). Такие иллюстративные агенты включают камостат (трипсиноподобный ингибитор протеаз), QAU145, 552-02, GS-9411, INO-4995, Aerolytic и амилорид. Дополнительные терапевтические агенты, которые уменьшают активность блокаторов эпителиальных натриевых каналов (ENaC), можно найти, например, в публикации PCT № WO2009/074575, полное содержание которой включается в настоящий документ во всей своей полноте.
[0371] Среди других заболеваний, описанных в настоящем документе, сочетания модуляторов CFTR, такие как сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, и агентов, которые уменьшают активность ENaC, используются при лечении синдрома Лиддла, кистозного фиброза, первичной цилиарной дискинезии, хронического бронхита, хронического обструктивного легочного заболевания, астмы, инфекции респираторного тракта, карциномы легких, ксеростомии и сухого кератоконъюнктивита, инфекций респираторного тракта (острых и хронических; вирусных и бактериальных) и карциномы легких.
[0372] Сочетания модуляторов CFTR, таких как сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, и агентов, которые уменьшают активность ENaC, также являются пригодными для использования при лечении заболеваний, медиируемых блокадой эпителиальных натриевых каналов, они также включают заболевания иные, чем респираторные заболевания, которые ассоциируются с аномальным регулированием текучих сред в эпителии, возможно, включая аномальную физиологию защитных поверхностных жидкостей на их поверхности, например, ксеростомию (сухость во рту) или сухой кератоконъюнктивит (сухой глаз). Кроме того, блокада эпителиальных натриевых каналов в почках могла бы использоваться для облегчения диуреза и тем самым вызывать гипотоническое воздействие.
[0373] Хроническое обструктивное легочное заболевание включает хронический бронхит или одышку, связанную с ним, эмфизему, а также осложнение гиперреактивности дыхательных путей после другой лекарственной терапии, в частности, другой ингаляционной лекарственной терапии. В некоторых вариантах осуществления, сочетания модуляторов CFTR, таких как сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, и агентов, которые уменьшают активность ENaC, являются пригодными для использования при лечении бронхита, не важно, какого типа или генеза, включая, например, острый, арахиновый, катаральный, крупозный, хронический или гнойный туберкулезный бронхит.
[0374] В другом варианте осуществления, дополнительный терапевтический агент представляет собой модулятор CFTR иной, чем сокристаллы Соединения 1:триглицерида, описанные в настоящем документе, то есть, агент, который имеет воздействие модулирования активности CFTR. Такие иллюстративные агенты включают аталурен ("PTC124®"; 3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]бензойную кислоту), синапултид, ланковутид, депелестат (ингибитор рекомбинантной эластазы нейтрофилов человека), кобипростон (7-{(2R,4aR,5R,7aR)-2-[(3S)-1,1-дифтор-3-метилпентил]-2-гидрокси-6-оксооктагидроциклопента[b]пиран-5-ил}гептановую кислоту), (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил) циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту, или (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид. В одном из вариантов осуществления, дополнительный терапевтический агент представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил) циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту или (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид. В другом варианте осуществления, дополнительный терапевтический агент представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил) циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту. В другом варианте осуществления, дополнительный терапевтический агент представляет собой (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид.
[0375] В одном из вариантов осуществления, дополнительный терапевтический агент представляет собой модулятор CFTR иной, чем соединение по настоящему изобретению.
[0376] Количество дополнительного терапевтического агента, присутствующего в композициях по настоящему изобретению, не будет превышать то количество, которое обычно вводилось бы в композиции, содержащей этот терапевтический агент в качестве единственного активного агента. Предпочтительно, количество дополнительного терапевтического агента в композициях, описываемых в настоящем документе, будет находиться в пределах примерно от 50% до 100% от количества, обычно присутствующего в композиции, содержащей этот агент в качестве единственного терапевтически активного агента.
[0377] Сокристаллы по любому из вариантов осуществления, описанных выше (например, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе), или их фармацевтически приемлемая композиция могут также вводиться в композиции для покрытия имплантируемого медицинского устройства, такого как протезы, искусственные клапаны, сосудистые трансплантаты, стенты и катетеры. Соответственно, в другом аспекте, настоящее изобретение включает композицию для покрытия имплантируемого устройства, содержащую соединение по настоящему изобретению, как описано выше, в целом и в классах и подклассах, в настоящем документе, и носитель пригодный для использования при нанесении покрытия на указанное имплантируемое устройство. Еще в одном аспекте, настоящее изобретение включает имплантируемое устройство, покрытое композицией, содержащей соединение по настоящему изобретению, как описано выше, в целом и в классах и подклассах, в настоящем документе, и носитель, пригодный для использования при нанесении покрытия на указанное имплантируемое устройство. Пригодные для использования покрытия и общее приготовление имплантируемых устройств с покрытиями описаны в патентах США №№ 6099562; 5886026; и 5304121. Покрытия, как правило, представляют собой биологически совместимые полимерные материалы, такие как полимер в виде гидрогеля, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этилен-винилацетат и их смеси. Эти покрытия могут необязательно дополнительно покрываться соответствующим наружным покрытием из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их сочетаний для придания композиции характеристик контролируемого высвобождения.
[0378] В одном из вариантов осуществления, настоящее изобретение описывает набор, содержащий таблетку по настоящему изобретению, и отдельный терапевтический агент или его фармацевтическую композицию. В одном из вариантов осуществления, дополнительный терапевтический агент представляет собой корректор CFTR. В другом варианте осуществления, терапевтический агент представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил) циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту или (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид. В другом варианте осуществления, терапевтический агент представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту. В другом варианте осуществления, терапевтический агент представляет собой (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид. В другом варианте осуществления, таблетка и терапевтический агент находятся в отдельных контейнерах. В другом варианте осуществления, наборы по настоящему изобретению относятся к наборам, где соединения или фармацевтические композиции по настоящему изобретению и один или несколько дополнительных терапевтических агентов находятся в отдельных контейнерах. В одном из вариантов осуществления, отдельные контейнеры представляют собой бутылки. В другом варианте осуществления, отдельные контейнеры представляют собой флаконы. В другом варианте осуществления, отдельные контейнеры представляют собой блистерные упаковки. В другом варианте осуществления, контейнер представляет собой бутылку, флакон или блистерную упаковку или их сочетание.
[0379] Другой аспект настоящего изобретения относится к модулированию активности CFTR в биологическом образце или у пациента (например, in vitro или in vivo), этот способ включает введение пациенту сокристаллов или приведение указанного биологического образца в контакт с сокристаллами по любому из вариантов осуществления, описанных выше (например, с сокристаллами Соединения 1:триглицерида, описанными в настоящем документе), или с их фармацевтически приемлемой композицией. Термин ʺбиологический образецʺ, как используется в настоящем документе, включает, без ограничения, клеточные культуры или их экстракты; материал биопсии, полученный от млекопитающего, или их экстракты и кровь, слюну, мочу, фекалии, семенную жидкость, слезы или другие телесные жидкости или их экстракты.
[0380] Модуляция CFTR в биологическом образце является пригодной для использования для различных целей, которые известны специалистам в данной области. Примеры таких целей включают, но, не ограничиваясь этим, исследование CFTR в биологических и патологических явлениях и сравнительную оценку новых модуляторов CFTR.
[0381] Еще в одном варианте осуществления, предлагается способ модуляции активности анионного канала in vitro или in vivo, включающий стадию приведения в контакт указанного канала с сокристаллами Соединения 1:триглицерида, описанными в настоящем документе, или с их фармацевтически приемлемыми композициями. В некоторых вариантах осуществления, анионный канал представляет собой хлоридный канал или бикарбонатный канал. В других вариантах осуществления, анионный канал представляет собой хлоридный канал.
[0382] В соответствии с одним из альтернативных вариантов осуществления, настоящее изобретение предлагает способ увеличения количества функциональных CFTR в мембране клетки, включающий стадию приведения в контакт указанной клетки с сокристаллами по любому из вариантов осуществления, описанных выше (например, с сокристаллами Соединения 1:триглицерида, описанными в настоящем документе), или с их фармацевтически приемлемой композицией.
[0383] В соответствии с другим вариантом осуществления, активность CFTR измеряется с помощью измерения трансмембранного потенциала. Средства для измерения потенциала на мембране в биологическом образце могут использовать любой из известных в данной области способов, такой как оптический анализ мембранного потенциала или другие электрофизиологические методы.
[0384] Оптический анализ мембранного потенциала использует чувствительные к напряжению сенсоры FRET (на основе метода резонансного переноса энергии флуоресценции), описанные Gonzalez and Tsien (смотри, Gonzalez, J. E. and R. Y. Tsien (1995) "Voltage sensing by fluorescence resonance energy transfer in single cells." Biophys J 69(4): 1272-80, and Gonzalez, J. E. and R. Y. Tsien (1997); "Improved indicators of cell membrane потенциал that use fluorescence resonance energy transfer" Chem Biol 4(4): 269-77) в сочетании с инструментами для измерений флуоресценции, такими как Voltage/Ion Probe Reader (VIPR) (cмотри, Gonzalez, J. E., K. Oades, et al. (1999) "Cell-based assays and instrumentation for screening ion-channel targets" Drug Discov Today 4(9): 431-439).
[0385] Эти анализы, чувствительные к напряжению, основываются на изменениях резонансного переноса энергии флуоресценции (FRET) между мембранорастворимым, чувствительным к напряжению DiSBAC2(3) и флуоресцентным фосфолипидом, CC2-DMPE, который присоединяется к наружному слою плазматической мембраны и действует в качестве донора FRET. Изменения мембранного потенциала (Vm) заставляет отрицательно заряженный DiSBAC2(3) перераспределяться в плазматической мембране, и величина переноса энергии от CC2-DMPE изменяется соответствующим образом. Изменения испускания флуоресценции можно отслеживать с использованием VIPRTM II, который представляет собой объединенный манипулятор для жидкостей и флуоресцентный детектор, сконструированный для осуществления скрининга на основе клеток в 96- или 384-луночных микротитровальных планшетах.
[0386] В другом аспекте, настоящее изобретение предлагает набор для использования при измерении активности CFTR или его фрагмента в биологическом образце in vitro или in vivo, содержащий (i) композицию, содержащую любые из сокристаллов по вариантам осуществления, описанным выше (например, сокристаллы Соединения 1:триглицерида, описанные в настоящем документе); и (ii) инструкции a) для приведения в контакт композиции с биологическим образцом и b) для измерения активности указанного CFTR или его фрагмента. В одном из вариантов осуществления, набор дополнительно содержит инструкцию a) для приведения в контакт дополнительной композиции с биологическим образцом; b) для измерения активности указанного CFTR или его фрагмента в присутствии указанного дополнительного соединения и c) для сравнения активности CFTR в присутствии дополнительного соединения с плотностью CFTR в присутствии сокристаллов по любому из вариантов осуществления, описанных выше (например, сокристаллов Соединения 1:триглицерида, описанных в настоящем документе). В некоторых вариантах осуществления, набор используется для измерения плотности CFTR.
[0387] В другом аспекте, настоящее изобретение предлагает набор для использования при измерении активности CFTR или его фрагмента в биологическом образце in vitro или in vivo, содержащий:
(i) композицию, содержащую сокристаллы по любому из вариантов осуществления, описанных выше (например, сокристаллы Соединения 1:триглицерида);
(ii) инструкции:
(a) для приведения в контакт композиции с биологическим образцом;
(b) для измерения активности указанного CFTR или его фрагмента.
[0388] В одном из вариантов осуществления, набор дополнительно содержит инструкции:
i. для приведения в контакт дополнительной композиции с биологическим образцом;
ii. для измерения активности указанного CFTR или его фрагмента в присутствии указанного дополнительного соединения; и
iii. для сравнения активности CFTR или его фрагмента в присутствии дополнительного соединения с плотностью CFTR или его фрагмента в присутствии сокристаллов по любому из вариантов осуществления, описанных выше (например, сокристаллов Соединения 1:триглицерида).
[0389] В другом варианте осуществления, стадия сравнения активности указанного CFTR или его фрагмента обеспечивает меру плотности указанного CFTR или его фрагмента.
[0390] Чтобы изобретение, описанное в настоящем документе, могло быть понято полнее, приводятся следующие далее примеры. Необходимо понять, что эти примеры приводятся только для иллюстративных целей, и они не должны рассматриваться как ограничивающие это описание каким-либо образом.
Примеры
[0391] Начальное приготовление Соединения 1
[0392] Соединение 1 приготавливают, как описано в WO 2010/18162, US 2010/0267768 и патенте США 8476442, которые включаются в настоящий документ в качестве ссылок. Приготовление также описывается ниже.
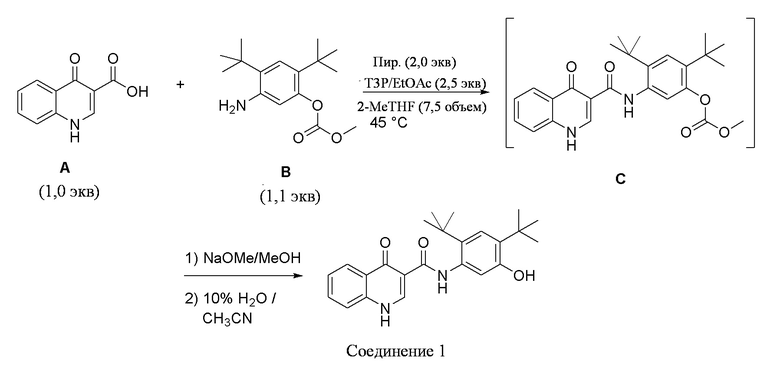
[0393] Соединение A (1,0 экв.) и Соединение B (1,1 экв.) загружают в реактор. Добавляют 2-MeTHF (4,0 объема, Соединение A) затем 50% раствор T3P® в EtOAc (2,5 экв.). Емкость с загрузкой T3P промывают 2-MeTHF (3,5 объема). Затем загружают пиридин (2,0 экв.). Полученную в результате суспензию нагревают до 45,0-50,0°C и выдерживают при этой температуре в течение 15 часов. Отбирают образец, и проверяют завершение реакции с помощью ВЭЖХ. После завершения реакции, полученную в результате смесь охлаждают до 20,0°C±5,0°C. Загружают 2-MeTHF (12,5 объемов) для разбавления смеси. Реакционную смесь промывают водой (10,0 объемов) 3 раза. Загружают 2-MeTHF для доведения общего объема реакции до 40,0 объемов (загружают ~16,5 объемов). Остаточную воду удаляют посредством непрерывной дистилляции при 35,0°C±5°C от 40 объемов до 30 объемов с помощью 2-MeTHF до тех пор, пока исследование для контроля в ходе процесса с использованием метода Карла Фишера не покажет, что содержание воды не больше чем 1,0% масс/масс. Раствор охлаждают до 20,0°C±5,0°C. В этот раствор загружают NaOMe/MeOH (1,7 экв.) для осуществления гидролиза карбоната. Реакционную смесь перемешивают в течение не менее 1,0 часа, и проверяют завершение реакции с помощью ВЭЖХ. После завершения, реакцию гасят 1 н HCl/H2O (10,0 объемов) и промывают 0,1 н HCl (10,0 объемов). Органический раствор окончательно фильтруют для удаления каких-либо частиц и помещают во вторую колбу. Фильтрованный раствор концентрируют при 25,0°C±5,0°C при пониженном давлении до 20 объемов, добавляют CH3CN до 40 объемов, и концентрируют раствор при 25,0°C±5,0°C до 20 объемов. Добавление CH3CN и концентрирование повторяют еще 2 раза в течение, в целом, 3 добавлений CH3CN и 4 концентрирований до 20 объемов. После конечного концентрирования до 20 объемов, загружают 16,0 объемов CH3CN, а затем 4,0 объема H2O для получения конечной концентрации 40 объемов 10% H2O/CH3CN по отношению к Соединению A. Эту суспензию нагревают с обратным холодильником в течение 5 часов. Суспензию охлаждают до 20,0°C±5,0°C и фильтруют. Осадок на фильтре промывают с CH3CN (5 объемов) 2 раза. Полученный в результате твердый продукт сушат в вакуумной печи при 50,0°C±5,0°C до достижения постоянной массы.
[0394] Приготовление беспримесного аморфного Соединения 1
[0395] Следующий раствор приготавливают посредством перемешивания Соединения 1, как приготовлено выше, в 90% MEK/10% воды в соответствии с Таблицей A.
Таблица A
[0396] Сушку распылением осуществляют в Buchi Mini Spray Dryer B-290 с осушителем B-296 и Inert Loop B-295 с использованием параметров, используемых в Таблице B. Систему насыщают растворителем, который должен распыляться, дают возможность для уравновешивания входной и выходной температуры перед сушкой распылением. Порошок из емкости для сбора и циклона объединяют в мелкой чашке и сушат в вакуумной печи при легкой продувке азотом в течение 7 дней. Затем аморфный материал сушат в вакуумной печи при 75-80°C и при давлении приблизительно 0,1 мм. рт. ст. до тех пор, пока концентрация MEK не уменьшится до <1,0% масс/масс согласно 1H ЯМР (50 часов). Материал удаляют в вакууме после охлаждения в атмосфере N2 при 50°C.
[0397] Таблица B: Параметры сушки распылением
[0398] Приготовление сокристаллов Соединения 1
[0399] Способ 1: Все сокристаллы чистого Соединения 1 получают посредством суспендирования или перемешивания беспримесного аморфного Соединения 1 в беспримесном триглицериде при нагрузке твердых продуктов 5%-10% масс/объем в течение, по меньшей мере, 18 часов при 40°C или при температуре на 5°C-10°C выше температуры плавления триглицерида в синтезаторе HEL Polyblock. Завершение преобразования определяют по двойному лучепреломлению суспендированных частиц с помощью микроскопии поляризованного света. Сырые сокристаллы выделяют с помощью центробежного фильтрования с использованием 2-мл центрифугирующих устройств Millipore.
[0400] В некоторых случаях маточную жидкость собирают для получения дополнительных сокристаллов Соединения 1 для увеличения выхода по отношению к триглицериду. Это достигается посредством суспендирования или перемешивания беспримесного аморфного Соединения 1 при отношении 5%-10% масс/объем в маточной жидкости в течение, по меньшей мере, 18 часов. Маточную жидкость используют для дополнительных преобразований не более двух раз. Сырые сокристаллы от последующих преобразований объединяют в 2-мл центрифугирующих устройствах, и добавляют гептан при отношении 1,5-2 объем/масс. После небольшого вихревого перемешивания смеси, гептан фильтруют с помощью центробежного фильтрования и твердые продукты собирают. Избыток гептана удаляют с помощью сушки в вакууме при 40-45°C в течение, по меньшей мере, 18 часов. Содержание гептана проверяют периодически с помощью 1H ЯМР в состоянии раствора, и сушку продолжают до тех пор, пока гептан не будет находиться на приемлемом уровне, например, до тех пор, пока больше не будет уменьшения перекрывания наблюдаемого резонанса CH3 триглицерида и гептана.
[0401] Способ 2: Приблизительно 50 мг беспримесного аморфного Соединения 1 добавляют приблизительно к 1 г триглицерида, нагревают до 80°C и поддерживают при этой температуре в течение, по меньшей мере, 1 часа. Затем раствор охлаждают до температуры выше температуры плавления триглицерида для кристаллизации сокристаллов Соединения 1. Для улучшения качества и размера кристаллов систему нагревают снова до 80°C и охлаждают. Циклирование температуры повторяют до тех пор, пока не будут получены кристаллы размеров пригодных для анализа. Все сокристаллы Соединения 1 выделяют посредством центробежного фильтрования при температурах выше температуры плавления триглицерида.
[0402] Характеризация сокристаллов Соединения 1
[0403] Используемые методики характеризации:
[0404] Анализ порошковой дифракции рентгеновского излучения (XPRD): картину XRPD получают при комнатной температуре в режиме отражения с использованием дифрактометра Pananalytical Empyrean II или Bruker D8 Advance. Образцы порошков помещают в держатель образца Pananalytical из нержавеющей стали или в держатель образца с мелкой полостью Bruker и вращают при 15 об/мин, соответственно. Параметры инструментов перечислены в Таблице, ниже.
Empyrean
[0405] Спектроскопия 13C твердотельного ядерного магнитного резонанса (13C ssNMR): спектрометр Bruker-Biospin Advance III 400 МГц с широким отверстием для образца, снабженный 4-мм датчиком HFX Bruker-Biospin, используют для всех экспериментов 13C ssNMR. Образцы набивают в 4-мм роторы из ZrO2 и вращают при условиях вращения под магическим углом (MAS) при угловой скорости вращения 12,5 кГц. Время контакта CP для эксперимента с углеродным CPMAS устанавливают при 2 мсек. Используют CP протонный импульс с линейным увеличением (от 50% до 100%). Согласование Хартмана-Хана оптимизируют на внешнем эталонном образце (глицине). Используют последовательность развязки TPPM15 при напряжении поля приблизительно 100 кГц. Релаксационное запаздывание устанавливают при 5 сек во всех экспериментах 13C CPMAS. Значения T1 для 1H измеряют с использованием последовательности восстановления насыщения. Все спектры сравниваются с внешним эталоном при сильнопольном резонансе адамантина при 29,5 м.д.. Температуру образца контролируют при 275°K.
[0406] Термогравиметрический анализ (TGA): Термогравиметрический анализ (TGA) осуществляют на термогравиметрическом анализаторе TA Instruments model Q5000 V3.8. Приблизительно 5-15 мг твердого образца помещают в платиновый поддон для образца и нагревают в потоке образца 60 мл/мин и в потоке 40 мл/мин азота для дополнения до полного объема при 10°C/мин от температуры окружающей среды до 350°C. Все термограммы анализируют с использованием программного обеспечения Universal Analysis 2000 V4.4A, TA Instruments.
[0407] Дифференциальная сканирующая калориметрия (DSC): трассировки DSC получают с использованием калориметра DSC Q2000 TA Instruments, снабженного программным обеспечением Universal Analysis 2000. Количество сокристалла Соединения 1, составляющее 0,5-2 мг, отвешивают в алюминиевый поддон и герметизируют с помощью крышки с булавочным проколом. Образцы нагревают от температуры окружающей среды до 350°C или 300°C при 10°C/мин.
[0408] Спектроскопии ядерного магнитного резонанса 1H в растворе (1H ЯМР): спектрометр Bruker AdvanceIII Nanobay 400 МГц с узким отверстием для образца, снабженный 5-мм широкополосным датчиком Bruker-Biospin, используют для всех экспериментов. Приблизительно по 0,5-2 мг образцов сокристаллов Соединения 1 растворяют в 0,65 мл ацетона-d6 (для Соединения 1:глицерилтриолеата и Соединения 1:глицерилтрилинолеата) или DMSO-d6 (для Соединения 1:глицерилтриоктаноата) в 5-мм пробирке для ЯМР. Выбирают релаксационное запаздывание 60 сек для сведения к минимуму дифференциальной релаксации 1H между различными положениями протонов в Соединении 1 и триглицериде. Все спектры сравнивают с эталоном с использованием внутреннего стандарта тетраметилсилана при 0,0 м.д..
[0409] Все спектры 1H ЯМР в состоянии раствора согласуются с присутствием как Соединения 1, так и соответствующего триглицеридного соформера, и соответствуют химически чистым сокристаллам. Значительные сдвиги отсутствуют в спектрах растворенных сокристаллов, как для Соединения 1, так и для триглицеридов, по сравнению с индивидуальными спектрами чистых компонентов. Это дает доказательство диссоциации компонентов сокристаллов в растворе и подтверждает слабую ассоциацию Соединения 1 и триглицерида в твердом теле. Отношение интегральной интенсивности для протонов в Соединении 1:глицерилтриоктаноате в спектрах 1H ЯМР показывают стехиометрию 3:1 (Соединение 1:триглицерид) в сокристалле, при этом интегральная интенсивность Соединения 1:глицерилтриолеата и интегральные интенсивности Соединения 1:глицерилтрилинолеата показывают стехиометрию 6:1 (Соединение 1:триглицерид) в соответствующих сокристаллах. Стехиометрия, определяемая с помощью 1H ЯМР в состоянии раствора, согласуется со стехиометрией, определяемой посредством термогравиметрического анализа, для сокристаллов Соединения 1:глицерилтриоктаноата.
[0410] Результаты 1H ЯМР согласуются с анализом сокристаллов с помощью высокоэффективной жидкостной хроматографии. При анализах величины определены как 72,1% (масс:масс), 72,4% (масс:масс) и 68,6% (масс:масс) для сокристаллов Соединения 1, для Соединения 1:глицерилтриоктаноата, Соединения 1:глицерилтриолеата и Соединения 1:трилинолеата. Примеси, как обнаружено, составляют меньше 0,5% в целом, согласно УФ детектированию.
[0411] Анализ с помощью масс-спектрометрии: анализ с помощью масс-спектрометрии осуществляют так, как показано для каждого комплекса ниже.
[0412] Рентгеновский структурный анализ монокристаллов: монокристаллы получают посредством растворения 56 мг аморфного Соединения 1 в 1000 мг триглицерида в печи, установленной на 80°C. При кристаллизации, удаляют несколько кристаллов для рентгеновского анализа монокристаллов. Данные дифракции получают на источнике синхротронного излучения ESFR с длиной волны 0,70158Å при температуре 100°K (reference number Phil Pattison 130813). Структура разрешается и уточняется с использованием программы SHELX (Sheldrick, G.M., Acta Cryst., (2008) A64, 112-122).
[0413] Характеризация Соединения 1:глицерилтриоктаноата
[0414] XRPD для Соединения 1:глицерилтриоктаноата:
[0415] Иллюстративная картина порошковой дифракции рентгеновского излучения (XRPD) для Соединения 1:глицерилтриоктаноата на Фигуре 3 получается с использованием дифрактометра Panalytical Empyrean II. Репрезентативные пики XRPD для Соединения 1:глицерилтриоктаноата, как наблюдается на картине XRPD, приведены в Таблице C, ниже. Все пики, перечисленные ниже, составляют больше 5% от максимальной интенсивности пика.
[0416] Таблица C
[0417] 13C ssNMR для Соединения 1:глицерилтриоктаноата:
[0418] Иллюстративный спектр спектроскопии 13C твердотельного ядерного магнитного резонанса (13C ssNMR) Соединения 1:глицерилтриоктаноата показан на Фигуре 4. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтриоктаноата приведены в Таблице D, ниже.
[0419] Таблица D
(±0,1 м.д.)
[0420] TGA для Соединения 1:глицерилтриоктаноата:
[0421] Иллюстративная кривая термогравиметрического анализа (TGA) Соединения 1:глицерилтриоктаноата показана на Фигуре 5. Потеря массы 28,3% соответствующая испарению глицерилтриоктаноата, для Соединения 1:глицерилтриоктаноата наблюдается от 150°C до 300°C. Молярное отношение Соединения 1 к глицерилтриоктаноату, вычисленное на основе потерь массы материала, составляет 1:3,1.
[0422] DSC для Соединения 1:глицерилтриоктаноата:
[0423] Иллюстративная термограмма дифференциальной сканирующей калориметрии (DSC) для Соединения 1:глицерилтриоктаноата показана на Фигуре 6. Термограмма имеет эндотерму при 186,7°C, что соответствует плавлению Соединения 1:глицерилтриоктаноата. Ошибка измерения на термограмме составляет ±0,2°C. За этой эндотермой следует экзотерма, соответствующая перекристаллизации до беспримесной формы Соединения 1, которое затем плавится при более позднем эндотермическом событии.
[0424] 1H ЯМР для Соединения 1:глицерилтриоктаноата:
[0425] Иллюстративный спектр 1H ядерного магнитного резонанса (1H ЯМР) Соединения 1:глицерилтриоктаноата в DMSO-d6 показан на Фигуре 7.
[0426] Таблица E и Таблица F приводят данные 1H ЯМР и приписывают атомы водорода Соединению 1 и глицерилтриоктаноату, соответственно. Система нумерации, используемая для приписывания атомов водорода в Соединении 1, является следующей:
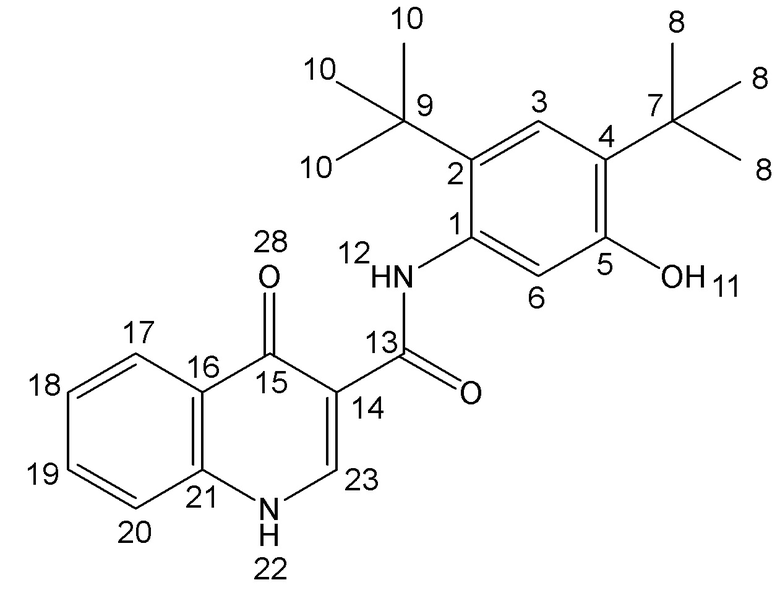
[0427] Система нумерации, используемая для приписывания атомов водорода в глицерилтриоктаноате, является следующей:

[0428] Таблица E
[0429] Таблица F
(перекрываются)
(перекрываются)
[0430] Интегрирование калибруется для получения 2,00 единиц для объединенной интегральной интенсивности для положений 3 и 6 Соединения 1.
[0431] Анализ с помощью масс-спектрометрии: Точную массу Соединения 1:глицерилтриоктаноата определяют на времяпролетном масс-спектрометре Agilent 6210. Образец растворяют приблизительно до 0,1 мг/мл в MeOH и инжектируют с помощью прямого инжектирования в поток с использованием поршневого насоса. Резьбовую заглушку с нулевым объемом используют для анализа с прямым инжектированием.
[0432] Обнаружены следующие массы, и подтверждают идентичность молекулярных компонентов Соединения 1:глицерилтриоктаноата:
[0433] Соединение 1: HRMS (ESI-TOF) m/z: [M+H]+; Вычислено для C24H29N2O3+ 393,2173; Найдено 393,2179.
[0434] Глицерилтриоктаноат: HRMS (ESI-TOF) m/z: [M+NH3]+; Вычислено для C27H54NO6+ 488,3947; Найдено 488,3951
[0435] Молекулярные ионы и точные массы для Соединения 1:глицерилтриоктаноата:
[0436] Характеризация Соединения 1:глицерилтриолеата
[0437] XRPD для Соединения 1:глицерилтриолеата:
[0438] Иллюстративная картина XRPD для Соединения 1:глицерилтриолеата, показанная на Фигуре 8, получается с использованием дифрактометра Panalytical Empyrean II. Репрезентативные пики для Соединения 1:глицерилтриолеата, как наблюдается на картине XRPD, приведены в Таблице G, ниже. Все пики, перечисленные ниже, составляют больше 5% от максимальной интенсивности пика.
[0439] Таблица G
[0440] 13C ssNMR для Соединения 1:глицерилтриолеата:
[0441] Иллюстративный спектр 13C ssNMR для Соединения 1:глицерилтриолеата показан на Фигуре 9. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтриолеата приведен в Таблице H, ниже.
[0442] Таблица H
(±0,1 м.д.)
[0443] TGA для Соединения 1:глицерилтриолеата:
[0444] Иллюстративная кривая TGA Соединения 1:глицерилтриолеата показана на Фигуре 10. Потеря массы 1,1% для Соединения 1:глицерилтриолеата наблюдается от 150°C до 300°C. Испарения глицерилтриолеата не наблюдается из-за его высокой температуры кипения.
[0445] DSC для Соединения 1:глицерилтриолеата:
[0446] Иллюстративная термограмма DSC Соединения 1:глицерилтриолеата показана на Фигуре 11. Термограмма имеет эндотерму при 197,5°C, что соответствует плавлению Соединения 1:глицерилтриолеата. Ошибка при измерении эндотермы составляет ±0,2°C. За этим эндотермическим событием следует экзотерма, соответствующая кристаллизации беспримесной формы Соединения 1. Наблюдают другую эндотерму, соответствующую плавлению этой беспримесной формы Соединения 1. Наблюдают более позднюю экзотермическую перекристаллизацию до второй беспримесной формы Соединения 1. Более поздняя эндотерма соответствует плавлению этой второй формы Соединения 1.
[0447] 1H ЯМР для Соединения 1:глицерилтриолеата:
[0448] Иллюстративный спектр 1H ЯМР Соединения 1:глицерилтриолеата показан на Фигуре 12.
[0449] Таблица I и Таблица J приводят данные 1H ЯМР и приписывают атомы водорода Соединению 1 и глицерилтриолеату, соответственно. Система нумерации, используемая для приписывания атомов водорода в Соединении 1, является такой, как показано ранее, выше.
[0450] Система нумерации, используемая для приписывания атомов водорода в глицерилтриолеате, является следующей:
[0451] Таблица I
[0452] Таблица J
[0453] Интегрирование калибруется для получения 2,00 единиц для объединенной интегральной интенсивности для положений 3 и 6 Соединения 1. Медленный H-D обмен в положении 22 Соединения 1 дает в результате при наблюдении как дублет (положение 22 H), так и синглет (положение 22 D) для H23, для Соединения 1.
[0454] Анализ с помощью масс-спектрометрии Соединения 1:глицерилтриолеата:
[0455] Точная масса этого комплекса определяется на масс-спектрометре Thermo LTQ Orbi Trap XL. Образец растворяется приблизительно до 0,1 мг/мл в MeOH и вливается с помощью прямого инжектирования в поток с использованием поршневого насоса при скорости 50 мкл/сек. Собирают 50 результатов сканирования с использованием анализатора FTMS при настройках разрешения 30000.
[0456] Обнаружены следующие массы, и они подтверждают идентичность молекулярных компонентов Соединения 1:глицерилтриолеата:
[0457] Соединение 1: HRMS (ESI-TOF) m/z: [M+H]+; Вычислено для C24H29N2O3+ 393,2173; Найдено 393,2170.
[0458] Глицерилтриолеат: HRMS (ESI-TOF) m/z: [M+Соединение 1+H]+; Вычислено для C81H133N2O9+ 1278,0006; Найдено 1277,9991.
[0459] Молекулярные ионы и точные массы Соединения 1:глицерилтриолеата:
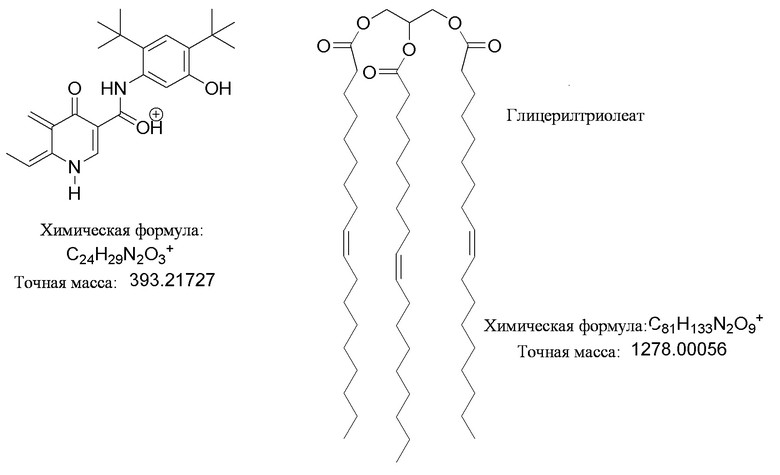
[0460] Характеризация Соединения 1:глицерилтрилинолеата
[0461] XRPD для Соединения 1:глицерилтрилинолеата:
[0462] Иллюстративная картина XRPD для Соединения 1:глицерилтрилинолеата, показанная на Фигуре 13, получается с использованием дифрактометра Panalytical Empyrean II. Репрезентативные пики для Соединения 1:глицерилтрилинолеата, как наблюдается на картине XRPD, приведены в Таблице K, ниже. Все пики, перечисленные ниже, составляют больше 5% от максимальной интенсивности пика.
[0463] Таблица K
[0464] 13C ssNMR для Соединения 1:глицерилтрилинолеата:
[0465] Иллюстративный спектр 13C ssNMR для Соединения 1:глицерилтрилинолеата показан на Фигуре 14. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтрилинолеата приведен в Таблице L, ниже.
[0466] Таблица L
(±0,1 м.д.)
[0467] TGA для Соединения 1:глицерилтрилинолеата:
[0468] Иллюстративная кривая TGA Соединения 1:глицерилтрилинолеата показана на Фигуре 15. Потеря массы 1,7% наблюдается для Соединения 1:глицерилтрилинолеата от 40°C до 190°C. Испарение глицерилтрилинолеата не наблюдается из-за его высокой температуры кипения.
[0469] DSC для Соединения 1:глицерилтрилинолеата:
[0470] Иллюстративная термограмма DSC для Соединения 1:глицерилтрилинолеата показана на Фигуре 16. Термограмма Соединения 1:глицерилтрилинолеата на Фигуре 16 имеет эндотерму при 182,3°C, что соответствует плавлению Соединения 1:глицерилтрилинолеата. Ошибка при измерении эндотермы составляет ±0,2°C. За этим эндотермическим событием следует экзотерма, соответствующая кристаллизации беспримесной формы Соединения 1. Наблюдается другая эндотерма, соответствующая плавлению этой беспримесной формы. Наблюдается более поздняя экзотермическая перекристаллизация до второй беспримесной формы Соединения 1. Более поздняя эндотерма соответствует плавлению этой второй форме Соединения 1.
[0471] 1H ЯМР для Соединения 1:глицерилтрилинолеата:
[0472] Иллюстративный спектр 1H ЯМР Соединения 1:глицерилтрилинолеата показан на Фигуре 17.
[0473] Таблица M и Таблица N приводят данные 1H ЯМР и приписывают атомы водорода Соединению 1 и глицерилтрилинолеату, соответственно. Система нумерации, используемая для приписывания атомов водорода в Соединении 1, показана ранее, выше. Интегрирование калибруется для получения 2,00 единиц объединенной интегральной интенсивности для положений 3 и 6 Соединения 1.
[0474] Система нумерации для приписывания атомов водорода в глицерилтрилинолеате является следующей:
[0475] Таблица M
[0476] Таблица N
(м.д.)
[0477] Интегрирование калибруется для получения 2,00 единиц для объединенной интегральной интенсивности для положений 3 и 6 Соединения 1. Медленный обмен H-D в положении 22 Соединения 1 дает при наблюдении как дублет (положение 22 H), так и синглет (положение 22 D) для H23, для Соединения 1.
[0478] Анализ с помощью масс-спектрометрии для Соединения 1:глицерилтрилинолеата:
[0479] Точная масса этого комплекса определяется на масс-спектрометре LTQ Orbi Trap XL. Образец растворяют приблизительно до 0,1 мг/мл в MeOH и вливают с помощью прямого инжектирования в поток с использованием поршневого насоса при скорости 2 мкл/сек. Собирают 50 результатов сканирования с использованием анализатора FTMS при настройке разрешения 30000.
[0480] Обнаружены следующие массы, и они подтверждают идентичность молекулярных компонентов Соединения 1:глицерилтрилинолеата:
[0481] Соединение 1: HRMS (ESI-TOF) m/z: [M+H]+; Вычислено для C24H29N2O3+ 393,2173; Найдено 393,2176.
[0482] Глицерилтрилинолеат: HRMS (ESI-TOF) m/z: [M+Соединение 1+H]+; Вычислено для C81H127N2O9+ 1271,9536; Найдено 1271,9541
[0483] Молекулярные ионы и точные массы Соединения 1:глицерилтрилинолеата:
[0484] Характеризация Соединения 1:триацетина
[0485] XRPD для Соединения 1:триацетина:
[0486] Иллюстративная картина XRPD для Соединения 1:триацетина, показанная на Фигуре 18, получается с использованием дифрактометра Panalytical Empyrean II. Репрезентативные пики для Соединения 1:триацетина, как наблюдается на картине XRPD, приведены в Таблице O, ниже. Все пики, перечисленные ниже, составляют больше 5% от максимальной интенсивности пика.
[0487] Таблица O
[0488] 13C ssNMR для Соединения 1:триацетина:
[0489] Иллюстративный спектр 13C ssNMR для Соединения 1:триацетина показан на Фигуре 19. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтриацетата приведен в Таблице P, ниже.
[0490] Таблица P
(±0,1 м.д.)
[0491] DSC для Соединения 1:триацетина:
[0492] Иллюстративная термограмма DSC для Соединения 1:триацетина показана на Фигуре 20. Термограмма Соединения 1:триацетина показывает эндотерму при 123,9°C, что соответствует плавлению сокристаллов Соединения 1:глицерилтриацетина. За этим событием следует другая эндотерма при 141,9°C и еще одна эндотерма при 193,8°C.
[0493] Характеризация Соединения 1:глицерилтрибутирата
[0494] XRPD для Соединения 1:глицерилтрибутирата:
[0495] Иллюстративная картина XRPD для Соединения 1:глицерилтрибутирата, показанная на Фигуре 21, получается с использованием дифрактометра Panalytical Empyrean II. Репрезентативные пики для Соединения 1:глицерилтрибутирата, как наблюдается на картине XRPD, приведены в Таблице Q, ниже. Все пики, перечисленные ниже, составляют больше 5% от максимальной интенсивности пика.
[0496] Таблица Q
[0497] Характеризация Соединения 1:глицерилтристеарата
[0498] XRPD для Соединения 1:глицерилтристеарата:
[0499] Иллюстративная картина XRPD для Соединения 1:глицерилтристеарата, показанная на Фигуре 22, получается с использованием дифрактометра Bruker D8 Advance. Репрезентативные пики для Соединения 1:глицерилтристеарата, как наблюдается на картине XRPD, приведены в Таблице R, ниже. Все пики, перечисленные ниже, составляют 1% или больше от максимальной интенсивности пика.
[0500] Таблица R
[0501] 13C ssNMR для Соединения 1:глицерилтристеарата:
[0502] Иллюстративный спектр 13C ssNMR для Соединения 1:глицерилтристеарата показан на Фигуре 23. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтристеарата приведен в Таблице S, ниже.
[0503] Таблица S
(±0,1 м.д.)
[0504] DSC для Соединения 1:глицерилтристеарата:
[0505] Иллюстративная термограмма DSC для Соединения 1:глицерилтристеарата показана на Фигуре 24. Термограмма Соединения 1:глицерилтристеарата на Фигуре 24 имеет эндотерму при 55,1°C, что соответствует эвтектическому плавлению сокристалла Соединения 1:глицерилтристеарата и глицерилтристеарата. За этим событием следует другая эндотерма при 71,3°C, соответствующая плавлению беспримесного глицерилтристеарата. Перекрывающиеся эндотерма при 201,3°C и экзотерма при 208,1°C (пик) соответствуют плавлению сокристалла и кристаллизации беспримесного Соединения 1, соответственно. Другая эндотерма при 284,7°C соответствует плавлению беспримесной формы Соединения 1.
[0506] Характеризация Соединения 1:глицерилтрипальмитата
[0507] XRPD для Соединения 1:глицерилтрипальмитата:
[0508] Иллюстративная картина XRPD для Соединения 1:глицерилтрипальмитата, показанная на Фигуре 25, получается с использованием дифрактометра Bruker D8 Advance. Репрезентативные пики для Соединения 1:глицерилтрипальмитата, как наблюдается на картине XRPD, приведены в Таблице T, ниже. Все пики, перечисленные ниже, составляют больше чем 1% от максимальной интенсивности пика.
[0509] Таблица T
[0510] 13C ssNMR для Соединения 1:глицерилтрипальмитата:
[0511] Иллюстративный спектр 13C ssNMR для Соединения 1:глицерилтрипальмитата показан на Фигуре 26. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтрипальмитата приведен в Таблице U, ниже.
[0512] Таблица U
(±0,1 м.д.)
[0513] DSC для Соединения 1:глицерилтрипальмитата:
[0514] Иллюстративная термограмма DSC для Соединения 1:глицерилтрипальмитата показана на Фигуре 27. Термограмма Соединения 1:глицерилтрипальмитата на Фигуре 27 имеет эндотерму при 47,7°C, что соответствует эвтектическому плавлению сокристалла Соединения 1:глицерилтрипальмитата и глицерилтрипальмитата. За этим событием следует другая эндотерма при 63,0°C, соответствующая плавлению беспримесного глицерилтрипальмитата. Перекрывающиеся эндотерма при 174,9°C и экзотерма при 186,7°C соответствуют плавлению сокристалла и кристаллизации беспримесного Соединения 1, соответственно. Другая эндотерма при 266,2°C соответствует плавлению беспримесной формы Соединения 1.
[0515] Характеризация Соединения 1:глицерилтридодеканоата
[0516] XRPD для Соединения 1:глицерилтридодеканоата:
[0517] Иллюстративная картина XRPD для Соединения 1:глицерилдодеканоата, показанная на Фигуре 28, получается с использованием дифрактометра Bruker D8 Advance. Репрезентативные пики для Соединения 1:глицерилтридодеканоата, как наблюдается на картине XRPD, приведены в Таблице V, ниже. Все пики, перечисленные ниже, составляют 1% или больше от максимальной интенсивности пика.
[0518] Таблица V
[0519] 13C ssNMR для Соединения 1:глицерилтридодеканоата:
[0520] Иллюстративный спектр 13C ssNMR для Соединения 1:глицерилтридодеканоата показан на Фигуре 29. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтридодеканоата приведен в Таблице W, ниже.
[0521] Таблица W
(±0,1 м.д.)
[0522] Рентгеноструктурный анализ монокристаллов Соединения 1:глицерилтридодеканоата
[0523] Репрезентативные данные рентгеноструктурного анализа монокристаллов Соединения 1:глицерилтридодеканоата приводятся в Таблицах X-i X-vii.
[0524] Таблица X-i: Данные для кристаллов
[0525] Таблица X-ii: Сбор данных
[0526] Таблица X-iii: Уточнение
[0527] Таблица X-iv: Специальные детали
[0528] Таблица X-v: Безразмерные атомные координаты и параметры изотропного или эквивалентного изотропного замещения (Å2)
[0529] Таблица X-vi: Параметры атомного замещения(Å2)
Таблица X-vii: Геометрические параметры (Å,°) для (hexe)
Коды симметрии: (i) -y+1, x-y+1, z; (ii) -x+y, -x+1, z.
[0530] Характеризация Соединения 1:глицерилтримиристата
[0531] XRPD для Соединения 1: глицерилтримиристата:
[0532] Иллюстративная картина XRPD для Соединения 1:глицерилтримиристата, показанная на Фигуре 30, получается с использованием дифрактометра Panalytical Empyrean II. Репрезентативные пики для Соединения 1:глицерилтримиристата, как наблюдается на картине XRPD, приведены в Таблице X, ниже. Все пики, перечисленные ниже, составляют больше чем 1% от максимальной интенсивности пика.
[0533] Таблица X
[0534] 13C ssNMR для Соединения 1:глицерилтримиристата:
[0535] Иллюстративный спектр 13C ssNMR для Соединения 1:глицерилтримиристата показан на Фигуре 31. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтримиристата приведен в Таблице Y, ниже.
[0536] Таблица Y
(±0,1 м.д.)
[0537] DSC для Соединения 1:глицерилтримиристата:
[0538] Иллюстративная термограмма DSC для Соединения 1:глицерилтристеарата показана на Фигуре 32. Термограмма Соединения 1:глицерилтримиристата на Фигуре 32 имеет эндотерму при 59,2°C, что соответствует плавлению глицерилтримиристата. За этим событием следует экзотерма при 134,4°C, которая перекрывается с эндотермой. За этим событием следует экзотерма при 171,3°C соответствующая кристаллизации беспримесного Соединения 1. Другая эндотерма при 280,1°C соответствует плавлению беспримесной формы Соединения 1.
[0539] Характеризация Соединения 1:глицерилтригексаноата
[0540] XRPD для Соединения 1:глицерилтригексаноата:
[0541] Иллюстративная картина XRPD для Соединения 1:глицерилтригексаноата, показанная на Фигуре 33, получается с использованием дифрактометра Panalytical Empyrean II. Репрезентативные пики для Соединения 1:глицерилтригексаноата, как наблюдается на картине XRPD, приведены в Таблице Z, ниже. Все пики, перечисленные ниже, составляют больше чем 1% от максимальной интенсивности пика.
[0542] Таблица Z
[0543] Характеризация Соединения 1:глицерилтридеканоата
[0544] XRPD для Соединения 1: глицерилтридеканоата:
[0545] Иллюстративная картина XRPD для Соединения 1:глицерилтридеканоата, показанная на Фигуре 34, получается с использованием дифрактометра Bruker D8 Advance. Репрезентативные пики для Соединения 1:глицерилтридеканоата, как наблюдается на картине XRPD, приведены в Таблице AA, ниже. Все пики, перечисленные ниже, составляют больше чем 1% от максимальной интенсивности пика.
[0546] Таблица AA
[0547] 13C ssNMR для Соединения 1:глицерилтридеканоата:
[0548] Иллюстративный спектр 13C ssNMR для Соединения 1:глицерилтридеканоата показан на Фигуре 35. Cписок некоторых пиков 13C ssNMR для Соединения 1:глицерилтридодеканоата приведен в Таблице AB, ниже.
[0549] Таблица AB
(±0,1 м.д.)
[0550] Анализ с помощью ВЭЖХ сокристаллов Соединения 1-триглицерида
[0551] Приготовление образца
[0552] 30 мг образцов сокристаллов Соединения 1-триглицерида взвешиваются и количественно переносятся в 100-мл волюметрические колбы из темного стекла. Добавляют 50 мл разбавителя, и препарат образца обрабатывают ультразвуком в течение 15 минут. Затем каждый препарат образца встряхивают на механическом шейкере в течение 30 минут при 200 движений/сек. Добавляют еще 40 мл разбавителя, и препарат образца встряхивают на механическом шейкере в течение 30 минут при 200 движений/сек. Препарат образца Соединения 1-глицерилтриоктаноата, который полностью растворился, получает возможность ля возвращения к комнатной температуре, затем его разбавляют до полного объема разбавителем и тщательно перемешивают. Препараты образцов Соединения 1-глицерилтриолеата и Соединения 1-глицерилтрилинолеата полностью не растворяются. Эти два образца препаратов, каждый, обрабатывают ультразвуком в течение 15 минут, а затем встряхивают в течение 30 минут при 200 движений/сек. Эти два препарата образцов по-прежнему не растворяются. К каждому из них добавляют 8 мл ацетонитрила, и препараты образцов обрабатывают ультразвуком в течение 15 минут и затем встряхивают в течение 30 минут при 200 движений/сек. Эти два препарата образцов по-прежнему не растворяются. К каждому из них добавляют 1 мл метанола и эти два препарат образцов обрабатывают ультразвуком в течение 15 минут, а затем встряхивают в течение 30 минут при 200 движений/сек. Эти два препарата образцов по-прежнему не растворяются. Препараты образцов получают возможность для возвращения к комнатной температуре, их разбавляют до полного объема метанолом и тщательно перемешивают. Оба препарата образцов являются мутными. Аликвоту раствора фильтруют через 0,45-мкм фильтр Whatman из PVDF. Первые 2 мл фильтрата сливают перед сбором во флаконы из темного стекла для ВЭЖХ, для анализов.
[0553] Препараты образцов приготавливают для метода ВЭЖХ, описанного ниже.
[0554] Метод ВЭЖХ
[0555] Образцы анализируют с использованием параметров метода, описанных ниже. Подвижная фаза A представляет собой 0,1% раствор фосфорной кислоты в воде. Подвижная фаза B представляет собой 0,1% раствор фосфорной кислоты в ацетонитриле. Таблица AC, ниже, показывает используемую программу для программирования градиента.
[0556] Таблица AC: Программа программирования градиента для метода ВЭЖХ.
[0557] ВЭЖХ осуществляют с использованием колонки Waters Symmetry Shield RP18, 4,6×50 мм, 3,5 мкм (P/N 186000177) на инструменте ВЭЖХ Agilent 1260. Разбавитель представляет собой ацетонитрил:вода 70:30. Скорость потока составляет 1,5 мл/минут. Температура колонки составляет 35°C. Используемая смесь для промывки с помощью плунжера представляет собой 90:10 (ацетонитрил:вода). Объем инжектирования составляет 10 мкл. Длина волны детектора составляет 235 нМ. Время сбора данных составляет 10,0 минут. Температура флакона представляет собой температуру окружающей среды, или она равна 25°C. Время опыта составляет 16 минут. Используемый поршневый фильтр представляет собой 0,45-мкм PVDF Syringe Filter. Стабильность, как образца, так и стандарта, составляет 2 дня. Приготавливают и используют два стандарта Соединения 1 (75,12 мг Соединения 1 в 250 мл разбавителя и 75,29 мг Соединения 1 в 250 мл разбавителя).
[0558] Чистоту определяют для каждого сокристалла посредством суммирования относительных интегральных интенсивностей пиков примесей и вычитания из 100%. Сокристаллы Соединения 1:глицерилтриоктаноата и сокристаллы Соединения 1:глицерилтриолеата составляют, каждые, 99,9% (масс/масс). Сокристаллы Соединения 1:глицерилтрилинолеата составляют 99,5% (масс/масс). Предел детектирования для примесей посредством ВЭЖХ составляет 0,005%.
[0559] Стехиометрия каждого сокристалла также определяется из этого анализа с помощью ВЭЖХ. Как показано в Таблице AD, ниже, определенная стехиометрия согласуется с результатами 1H ЯМР в состоянии раствора и термогравиметрического анализа.
Таблица AD
% масс:масс
% масс:масс Ивакафтора
% масс:масс Ивакафтора
Ивакафтора
[0560] Анализы активности
[0561] A. Протокол 1
[0562] Анализы для детектирования и измерения свойств соединений относительно потенциирования ΔF508-CFTR
[0563] Оптические способы измерения мембранного потенциала для анализа модуляции ΔF508-CFTR свойств соединений
[0564] Анализ использует чувствительные к напряжению флуоресцентные красители для измерения изменений мембранного потенциала с использованием устройства для считывания флуоресцентных планшетов (например, FLIPR III, Molecular Devices, Inc.) в качестве показателя повышения количества функционального ΔF508-CFTR в клетках NIH 3T3. Движущая сила реакции представляет собой образование градиентов хлоридных ионов в сопряжении с активацией каналов посредством единственной стадии добавления жидкости после того как клетки предварительно обрабатывают соединениями, а после этого нагружают красителем, чувствительным к напряжению.
[0565] Идентификация потенциирующих соединений
[0566] Для идентификации потенциирующих факторов ΔF508-CFTR, разработан формат анализа HATS с двойным добавлением. Этот анализ HATS использует флуоресцентные красители, чувствительные к напряжению, для измерения изменений мембранного потенциала на FLIPR III, в качестве измерения для повышения открывания каналов (проводимости) ΔF508 CFTR в температурно-корректированных ΔF508 CFTR клетках NIH 3T3. Движущая сила реакции представляет собой градиент ионов Cl- в сопряжении с активацией каналов форсколином на одной стадии добавления жидкости с использованием устройства для считывания флуоресцентных планшетов, такого как FLIPR III, после того как клетки предварительно обрабатывают потенциирующими соединениями (или контролем с инертным веществом DMSO), а впоследствии нагружают красителем для наблюдения перераспределения.
[0567] Растворы
[0568] Раствор для ванны №1: (в мМ) NaCl 160, KCl 4,5, CaCl2 2, MgCl2 1, HEPES 10, pH 7,4 с помощью NaOH.
[0569] Раствор для ванны не содержащий хлоридов: хлоридные соли в растворе для ванны №1 (выше) замещены глюконатными солями.
[0570] Культура клеток
[0571] Фибробласты NIH3T3 мыши, стабильно экспрессирующие ΔF508-CFTR, используются для оптических измерений мембранного потенциала. Клетки поддерживаются при 37°C при 5% CO2 и 90% влажности в среде Игла, модифицированной Дюльбеко, дополненной 2 мМ глютамина, 10% фетальной сыворотки теленка, 1 × NEAA, β-ME, 1 × пен/стреп и 25 мМ HEPES, в 175-см2 флаконах для культур. Для всех оптических анализов, клетки высевают при ~20000/лунка в 384-луночные планшеты, покрытые Matrigel, и культивируют в течение 2 часов при 37°C перед культивированием при 27°C в течение 24 часов для анализа потенциирующих факторов. Для анализов коррекции, клетки культивируют при 27°C или 37°C с соединениями и без них в течение 16-24 часов.
[0572] Электрофизиологические анализы для исследования свойств соединений относительно модуляции ΔF508-CFTR.
[0573] Анализ с использованием камеры Уссинга
[0574] Эксперименты с использованием камеры Уссинга осуществляют на поляризованных эпителиальных клетках дыхательных путей, экспрессирующих ΔF508-CFTR, для дополнительной характеризации модуляторов ΔF508 CFTR, идентифицируемых при оптических анализах. Эпителий дыхательных путей без CF и с CF выделяют из бронхиальной ткани, культивируют, как описано ранее (Galietta, L.J.V., Lantero, S., Gazzolo, A., Sacco, O., Romano, L., Rossi, G.A., & Zegarra-Moran, O. (1998) In vitro Cell. Dev. Biol. 34, 478-481), и помещают на фильтры Costar® SnapwellTM, которые предварительно покрывают средой для кондиционирования NIH3T3. Через четыре дня апикальную среду удаляют, и клетки выращивают на границе раздела воздух-жидкость в течение >14 дней перед использованием. Это дает в результате монослой полностью дифференцированных цилиндрических клеток, которые являются реснитчатыми, эти особенности являются характерными для эпителия дыхательных путей. HBE без CF выделяют у некурящих, которые не имеют никакого известного заболевания легких. CF-HBE выделяют у пациентов гомозиготных по отношению к ΔF508-CFTR.
[0575] HBE, выращенные на вставках для культивирования клеток Costar® Snapwell™, устанавливают в камере Уссинга (Physiologic Instruments, Inc., San Diego, CA), и трансэпителиальное удельное сопротивление и ток короткого замыкания в присутствии градиента Cl- от базолатеральной до апикальной поверхности (ISC) измеряют с использованием системы с фиксацией потенциала (Department of Bioengineering, University of Iowa, IA). Вкратце, HBE исследуют при условиях регистрации с фиксацией потенциала (Vhold=0 мВ) при 37°C. Базолатеральный раствор содержит (в мМ) 145 NaCl, 0,83 K2HPO4, 3,3 KH2PO4, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH доводят до 7,35 с помощью NaOH), и апикальный раствор содержит (в мМ) 145 NaGluconate, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH доводят до 7,35 с помощью NaOH).
[0576] Идентификация потенциирующих соединений
[0577] Типичный протокол использует градиент концентрации Cl- на мембране от базолатеральной до апикальной поверхности. Для установления этого градиента, используют нормальные растворы Рингера на базолатеральной мембране, при этом апикальный NaCl заменяется эквимолярным раствором глюконата натрия (который титруют до pH 7,4 с помощью NaOH) для получения большого градиента концентрации Cl- на эпителии. Форсколин (10 мкМ) и все исследуемые соединения добавляют на апикальную сторону вставок для культивирования клеток. Эффективность предполагаемых потенциирующих факторов для ΔF508-CFTR сравнивают с эффективностью известного потенциирующего фактора, генистеина.
[0578] Регистрация с фиксацией потенциала
[0579] Общий поток Cl- в клетках ΔF508-NIH3T3 отслеживают с использованием конфигурации для регистрации с перфорацией и фиксацией потенциала, как описано ранее (Rae, J., Cooper, K., Gates, P., & Watsky, M. (1991) J. Neurosci. Methods 37, 15-26). Регистрацию с фиксацией потенциала осуществляют при 22°C с использованием усилителя для фиксации потенциала Axopatch 200B (Axon Instruments Inc., Foster City, CA). Раствор в пипетке содержит (в мМ) 150 N-метил-D-глюкамина (NMDG)-Cl, 2 MgCl2, 2 CaCl2, 10 EGTA, 10 HEPES и 240 мкг/мл амфотерицина-B (pH доводится до 7,35 с помощью HCl). Внеклеточная среда содержит (в мМ) 150 NMDG-Cl, 2 MgCl2, 2 CaCl2, 10 HEPES (pH доводится до 7,35 с помощью HCl). Генерацию импульсов, получение данных и анализ осуществляют с использованием PC, снабженного интерфейсом Digidata 1320 A/D, в сочетании с Clampex 8 (Axon Instruments Inc.). Для активации ΔF508-CFTR, в ванну добавляют 10 мкМ форсколина и 20 мкМ генистеина, и отношение ток-напряжение отслеживают каждые 30 сек.
[0580] Идентификация потенциирующх соединений
[0581] Способность потенциирующих факторов ΔF508-CFTR к повышению макроскопического тока Cl- ΔF508-CFTR (IΔF508) в клетках NIH3T3, стабильно экспрессирующих ΔF508-CFTR, также исследуют с использованием методик регистрации с перфорацией и фиксацией потенциала. Потенциирующие факторы, идентифицированные из оптических анализов, показывают зависимое от дозы повышение IΔF508 с сильнодействием и эффективностью, которые сходны с наблюдаемыми при оптических анализах. Во всех исследуемых клетках, потенциал реверсии до применения потенциирующего фактора и во время него составляет примерно -30 мВ, что представляет собой вычисленное ECl (-28 мВ).
[0582] Культура клеток
[0583] Фибробласты NIH3T3 мыши, стабильно экспрессирующие ΔF508-CFTR, используются для регистрации на цельных клетках. Клетки поддерживают при 37°C в 5% CO2 и при 90% влажности в среде Игла, модифицированной Дюльбеко, дополненной 2 мМ глютамина, 10% фетальной сыворотки теленка, 1 × NEAA, β-ME, 1 × пен/стреп и 25 мМ HEPES, в 175-см2 флаконах для культур. Для регистрации на цельных клетках, 2500-5000 клеток высевают на покровные стекла, покрытые поли-L-лизином, и культивируют в течение 24-48 часов при 27°C перед использованием для исследования активности потенциирующих факторов; и инкубируют вместе с корректирующим соединением или без него при 37°C для измерения активности корректоров.
[0584] Регистрация на отдельных каналах
[0585] Активность открывания каналов wt-CFTR и температурно-корректированного ΔF508-CFTR, экспрессируемых в клетках NIH3T3, наблюдают с использованием регистрации на фрагментах мембран, вырезанных по всей толщине мембраны, как описано ранее (Dalemans, W., Barbry, P., Champigny, G., Jallat, S., Dott, K., Dreyer, D., Crystal, R.G., Pavirani, A., Lecocq, J-P., Lazdunski, M. (1991) Nature 354, 526-528), с использованием усилителя для фиксации потенциала Axopatch 200B (Axon Instruments Inc.). Пипетка содержит (в мМ): 150 NMDG, 150 аспарагиновой кислоты, 5 CaCl2, 2 MgCl2 и 10 HEPES (pH доводится до 7,35 с помощью Tris основания). Ванна содержит (в мМ): 150 NMDG-Cl, 2 MgCl2, 5 EGTA, 10 TES и 14 Tris основания (pH доводится до 7,35 с помощью HCl). После вырезания, как wt-, так и ΔF508-CFTR активируются посредством добавления 1 мМ Mg-ATP, 75 нМ каталитической субъединицы cAMP-зависимой протеинкиназы (PKA; Promega Corp. Madison, WI) и 10 мМ NaF для ингибирования протеинфосфатаз, что предотвращает обнуление тока. Потенциал пипетки поддерживается при 80 мВ. Активность канала анализируется по фрагментам мембран, содержащим≤2 активных каналов. Максимальное количество одновременных открываний определяет количество активных каналов в ходе эксперимента. Для определения амплитуды тока через отдельный канал, данные, зарегистрированные за 120 сек активности ΔF508-CFTR, фильтруют ʺoff-lineʺ при 100 Гц, а затем используют для построения гистограмм амплитуды для всех точек, которые подгоняются с помощью множества Гауссовых функций с использованием программного обеспечения Bio-Patch Analysis (Bio-Logic Comp. France). Общий микроскопический ток и вероятность открывания (Po) определяют за 120 сек активности канала. Значение Po определяют с использованием программного обеспечения Bio-Patch или из соотношения Po=I/i(N), где I=средний ток, i=амплитуда тока через отдельный канал и N=количество активных каналов во фрагменте.
[0586] Культура клеток
[0587] Фибробласты NIH3T3 мыши, стабильно экспрессирующие ΔF508-CFTR, используются для регистрации с фиксацией потенциала на вырезанном фрагменте мембраны. Клетки поддерживают при 37°C в 5% CO2 и при 90% влажности в среде Игла, модифицированной Дюльбеко, дополненной 2 мМ глютамина, 10% фетальной сыворотки теленка, 1 × NEAA, β-ME, 1 × пен/стреп и 25 мМ HEPES, в 175-см2 флаконах для культур. Для регистрации отдельных каналов, 2500-5000 клеток высевают на покровные стекла, покрытые поли-L-лизином, и культивируют в течение 24-48 часов при 27°C перед использованием.
[0588] Активность соединения 1
[0589] Соединения по настоящему изобретению являются пригодными в качестве модуляторов переносчиков кассет связывания ATP. Таблица AD, ниже, иллюстрирует EC50 и относительную эффективность определенных вариантов осуществления в Таблице 1. В Таблице AE, ниже, применяются следующие обозначения. EC50: ʺ+++ʺ означает <10 мкМ; ʺ++ʺ означает в пределах между 10 мкМ и 25 мкМ; ʺ+ʺ означает в пределах между 25 мкМ и 60 мкМ. % Эффективности: ʺ+ʺ означает <25%; ʺ++ʺ означает в пределах между 25% и 100%; ʺ+++ʺ означает >100%.
Таблица AE
[0590]
[0591] B. Протокол 2
[0592] Анализы для детектирования и измерения потенциирования ΔF508-CFTR свойств соединений
[0593] Оптические способы измерения мембранного потенциала для анализа модуляции ΔF508-CFTR свойств соединений
[0594] Анализ использует чувствительные к напряжению флуоресцентные красители для измерения изменений мембранного потенциала с использованием устройства для считывания флуоресцентных планшетов (например, FLIPR III, Molecular Devices, Inc.) в качестве показателя повышения количества функционального ΔF508-CFTR в клетках NIH 3T3. Движущая сила реакции представляет собой образование градиентов хлоридных ионов в сопряжении с активацией каналов посредством единственной стадии добавления жидкости после того, как клетки предварительно обрабатывают соединениями, а после этого нагружают красителем, чувствительным к напряжению.
[0595] Идентификация потенциирующих соединений
[0596] Для идентификации потенциирующих факторов ΔF508-CFTR, разработан формат анализа HATS с двойным добавлением. Этот анализ HATS использует флуоресцентные красители, чувствительные к напряжению, для измерения изменений мембранного потенциала на FLIPR III в качестве измерения для повышения открывания каналов (проводимости) ΔF508 CFTR в температурно-корректированных ΔF508 CFTR клетках NIH 3T3. Движущая сила реакции представляет собой градиент ионов Cl- в сопряжении с активацией каналов форсколином на одной стадии добавления жидкости с использованием устройства для считывания флуоресцентных планшетов, такого как FLIPR III, после того как клетки предварительно обрабатывают потенциирующими соединениями (или контролем с инертным веществом DMSO), а впоследствии нагружают красителем для его перераспределения.
[0597] Растворы
[0598] Раствор в ванне № 1: (в мМ) NaCl 160, KCl 4,5, CaCl2 2, MgCl2 1, HEPES 10, pH 7,4 с помощью NaOH.
[0599] Раствор для ванны, не содержащий хлоридов: хлоридные соли в растворе для ванны №1 (выше) замещены глюконатными солями.
[0600] Культура клеток
[0601] Фибробласты NIH3T3 мыши, стабильно экспрессирующие ΔF508-CFTR, используются для оптических измерений мембранного потенциала. Клетки поддерживают при 37°C в 5% CO2 и при 90% влажности в среде Игла, модифицированной Дюльбеко, дополненной 2 мМ глютамина, 10% фетальной сыворотки теленка, 1 × NEAA, β-ME, 1 × пен/стреп, и 25 мМ HEPES в 175-см2 флаконах для культур. Для всех оптических анализов, клетки высевают при ~20000/лунка в 384-луночные планшеты, покрытые Matrigel, и культивируют в течение 2 часов при 37°C перед культивированием при 27°C в течение 24 часов для анализа потенциирующих факторов. Для анализов коррекции, клетки культивируют при 27°C или 37°C с соединениями и без них в течение 16-24 часов.
[0602] Электрофизиологические анализы для исследования свойств соединений относительно модуляции ΔF508-CFTR
[0603] Анализ с использованием камеры Уссинга
[0604] Эксперименты с использованием камеры Уссинга осуществляют на поляризованных эпителиальных клетках дыхательных путей, экспрессирующих ΔF508-CFTR, для дополнительной характеризации модуляторов ΔF508 CFTR, идентифицируемых при оптических анализах. Эпителий дыхательных путей без CF и с CF выделяют из бронхиальной ткани, культивируют, как описано ранее (Galietta, L.J.V., Lantero, S., Gazzolo, A., Sacco, O., Romano, L., Rossi, G.A., & Zegarra-Moran, O. (1998) In vitro Cell. Dev. Biol. 34, 478-481), и помещают на фильтры Costar® SnapwellTM, которые предварительно покрывают средой для кондиционирования NIH3T3. Через четыре дня апикальную среду удаляют, и клетки выращивают на границе раздела воздух-жидкость в течение >14 дней перед использованием. Это дает в результате монослой полностью дифференцированных цилиндрических клеток, которые являются реснитчатыми, эти особенности являются характерными для эпителия дыхательных путей. HBE без CF выделяют у некурящих, которые не имеют никакого известного заболевания легких. CF-HBE выделяют у пациентов гомозиготных по отношению к ΔF508-CFTR.
[0605] HBE, выращенные на вставках для культивирования клеток Costar® Snapwell™, устанавливают в камере Уссинга (Physiologic Instruments, Inc., San Diego, CA), и трансэпителиальное удельное сопротивление и ток короткого замыкания в присутствии градиента Cl- от базолатеральной до апикальной поверхности (ISC) измеряют с использованием системы с фиксацией потенциала (Department of Bioengineering, University of Iowa, IA). Вкратце, HBE исследуют при условиях регистрации с фиксацией потенциала (Vhold=0 мВ) при 37oC. Базолатеральный раствор содержит (в мМ) 145 NaCl, 0,83 K2HPO4, 3,3 KH2PO4, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH доводится до 7,35 с помощью NaOH), и апикальный раствор содержит (в мМ) 145 NaGluconate, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH доводится до 7,35 с помощью NaOH).
[0606] Идентификация потенциирующих соединений
[0607] Типичный протокол использует градиент концентрации Cl- на мембране от базолатеральной до апикальной поверхности. Для установления этого градиента, используют нормальные растворы Рингера на базолатеральной мембране, при этом апикальный NaCl заменяется эквимолярным раствором глюконата натрия (который титруют до pH 7,4 с помощью NaOH) для получения большого градиента концентрации Cl- на эпителии. Форсколин (10 мкМ) и все исследуемые соединения добавляют на апикальную сторону вставок для культивирования клеток. Эффективность предполагаемых потенциирующих факторов для ΔF508-CFTR сравнивают с эффективностью известного потенциирующего фактора, генистеина.
[0608] Регистрация с фиксацией потенциала
[0609] Общий поток Cl- в клетках ΔF508-NIH3T3 отслеживают с использованием конфигурации для регистрации с перфорацией и фиксацией потенциала, как описано ранее (Rae, J., Cooper, K., Gates, P., & Watsky, M. (1991) J. Neurosci. Methods 37, 15-26). Регистрацию с фиксацией потенциала осуществляют при 22°C с использованием усилителя для фиксации потенциала Axopatch 200B (Axon Instruments Inc., Foster City, CA). Раствор в пипетке содержит (в мМ) 150 N-метил-D-глюкамина (NMDG)-Cl, 2 MgCl2, 2 CaCl2, 10 EGTA, 10 HEPES и 240 мкг/мл амфотерицина-B (pH доводится до 7,35 с помощью HCl). Внеклеточная среда содержит (в мМ) 150 NMDG-Cl, 2 MgCl2, 2 CaCl2, 10 HEPES (pH доводится до 7,35 с помощью HCl). Генерацию импульсов, получение данных и анализ осуществляют с использованием PC, снабженного интерфейсом Digidata 1320 A/D, в сочетании с Clampex 8 (Axon Instruments Inc.). Для активации ΔF508-CFTR, в ванну добавляют 10 мкМ форсколина и 20 мкМ генистеина, и отношение ток-напряжение отслеживают каждые 30 сек.
[0610] Идентификация потенциирующих соединений
[0611] Способность потенциирующих факторов ΔF508-CFTR к повышению макроскопического тока Cl- ΔF508-CFTR (IΔF508) в клетках NIH3T3, стабильно экспрессирующих ΔF508-CFTR, также исследуют с использованием методик регистрации с перфорацией и фиксацией потенциала. Потенциирующие факторы, идентифицированные из оптических анализов, показывают зависимое от дозы повышение IΔF508 с сильнодействием и эффективностью, которые сходны с наблюдаемыми в оптических анализах. Во всех исследуемых клетках, потенциал реверсии до применения потенциирующего фактора и во время него составляет примерно -30 мВ, что представляет собой вычисленное ECl (-28 мВ).
[0612] Культура клеток
[0613] Фибробласты NIH3T3 мыши, стабильно экспрессирующие ΔF508-CFTR, используются для регистрации на цельных клетках. Клетки поддерживают при 37°C в 5% CO2 и при 90% влажности в среде Игла, модифицированной Дюльбеко, дополненной 2 мМ глютамина, 10% фетальной сыворотки теленка, 1 × NEAA, β-ME, 1 × пен/стреп, и 25 мМ HEPES в 175-см2 флаконах для культур. Для регистрации на цельных клетках, 2500-5000 клеток высевают на покровные стекла, покрытые поли-L-лизином, и культивируют в течение 24-48 часов при 27°C перед использованием для исследования активности потенциирующих факторов; и инкубируют вместе с корректирующим соединением или без него при 37°C для измерения активности корректоров.
[0613] Регистрация на отдельных каналах
[0615] Активность открывания каналов wt-CFTR и температурно-корректированного ΔF508-CFTR, экспрессируемых в клетках NIH3T3, наблюдают с использованием регистрации на фрагментах мембран, вырезанных по всей толщине мембраны, как описано ранее (Dalemans, W., Barbry, P., Champigny, G., Jallat, S., Dott, K., Dreyer, D., Crystal, R.G., Pavirani, A., Lecocq, J-P., Lazdunski, M. (1991) Nature 354, 526-528), с использованием усилителя для фиксации потенциала Axopatch 200B (Axon Instruments Inc.). Пипетка содержит (в мМ): 150 NMDG, 150 аспарагиновой кислоты, 5 CaCl2, 2 MgCl2 и 10 HEPES (pH доводится до 7,35 с помощью Tris основания). Ванна содержит (в мМ): 150 NMDG-Cl, 2 MgCl2, 5 EGTA, 10 TES, и 14 Tris основания (pH доводится до 7,35 с помощью HCl). После вырезания, как wt-, так и ΔF508-CFTR активируются посредством добавления 1 мМ Mg-ATP, 75 нМ каталитической субъединицы cAMP-зависимой протеинкиназы (PKA; Promega Corp. Madison, WI) и 10 мМ NaF для ингибирования протеинфосфатаз, что предотвращает обнуление тока. Потенциал пипетки поддерживается при 80 мВ. Активность канала анализируется по фрагментам мембран, содержащим≤2 активных каналов. Максимальное количество одновременных открываний определяет количество активных каналов в ходе эксперимента. Для определения амплитуды тока через отдельный канал, данные, зарегистрированные за 120 сек активности ΔF508-CFTR, фильтруют ʺoff-lineʺ при 100 Гц, а затем используют для построения гистограмм амплитуды для всех точек, которые подгоняются с помощью множества Гауссовых функций с использованием программного обеспечения Bio-Patch Analysis (Bio-Logic Comp. France). Общий микроскопический ток и вероятность открывания (Po) определяют за 120 сек активности канала. Значение Po определяют с использованием программного обеспечения Bio-Patch или из соотношения Po=I/i(N), где I=средний ток, i=амплитуда тока через отдельный канал и N=количество активных каналов во фрагменте.
[0616] Культура клеток
[0617] Фибробласты NIH3T3 мыши, стабильно экспрессирующие ΔF508-CFTR, используются для регистрации с фиксацией потенциала на вырезанном фрагменте мембраны. Клетки поддерживают при 37°C в 5% CO2 и 90% влажности в среде Игла, модифицированной Дюльбеко, дополненной 2 мМ глютамина, 10% фетальной сыворотки теленка, 1 × NEAA, β-ME, 1 × пен/стреп и 25 мМ HEPES, в 175-см2 флаконах для культур. Для регистрации отдельных каналов, 2500-5000 клетки высевают на покровные стекла, покрытые поли-L-лизином, и культивируют в течение 24-48 часов при 27°C перед использованием.
[0618] Растворение
[0619] Растворение в желудочно-кишечной среде после еды (FeSSIF)
[0620] Исследование растворимости сокристаллов Соединения 1 осуществляют в 50-мл бутылках из темного стекла, помещенных в емкости с кожухом. Температуру в емкости с кожухом контролируют с помощью ванны/охладителя для воды Iso Temp 360 и устанавливают ее при 37°C. По двадцать миллилитров модельных желудочно-кишечных сред после еды помещают в бутылки и дают им возможность для уравновешивания при 37°C в течение одного часа, перемешивая при этом при 125 об/мин. Предварительно взвешенные количества (смотри Таблицу AD, целевая концентрация Соединения 1 ~1 мг/мл) сокристаллов Соединения 1:триглицерида добавляют затем в каждую бутылку и дают им возможность для перемешивания при 37°C в течение исследования растворения. Одномикролитровые образцы собирают в выбранные моменты времени (5 и 30 минут, и 1, 2, 3, 4, 6, 16 и 24 часов). Образцы фильтруют с использованием 0,45-мкм поршневых фильтров из PTFE Millex®-LH и анализируют с помощью ВЭЖХ относительно уровней концентрации.
[0621] Исследования растворения SDD Соединения 1 и аморфного Соединения 1 осуществляют в системе растворения Varian VK700. Температура ванны для растворения контролируется и поддерживается при 37°C. Пять сотен миллилитров модельной желудочно-кишечной среды помещают в емкости для растворения и дают им возможность для уравновешивания при 37°C при перемешивании. Предварительно взвешенные количества (целевая концентрация Соединения 1 ~1 мг/мл) Соединения 1 добавляют затем в каждую емкость и дают им возможность для перемешивания при 37°C в течение исследования растворения. Три миллилитровых образца собирают в выбранные моменты времени (0,5, 1, 1,5, 3, 6, 9, 12, 18, 24, 48 часов). Образцы фильтруют с использованием 25 мм Whatman с 0,45-мкм поршневыми фильтрами из PTFE и анализируют с помощью ВЭЖХ относительно уровней концентрации.
[0622] Таблица AF: Массы соединения, добавляемые в каждую емкость для растворения
[0623] Фигура 36 показывает сравнение профилей растворения до 24 часов Соединения 1:глицерилтриоктаноата, Соединения 1:глицерилтриолеата и Соединения 1:глицерилтрилинолеата с аморфным Соединением 1 и SDD Соединения 1 в FeSSIF.
[0624] Твердые материалы, выделенные из смеси препарата для детского питания и аморфного Соединения 1
[0625] Усиленный препарат детского питания Abbot Iron смешивают с аморфным Соединением 1 при приблизительном отношении твердых продуктов 7% масс/объем (то есть, это составляет 7 г аморфного Соединения 1 в 100 мл разбавленного препарата). Суспензию суспендируют при условиях окружающей среды, и твердые продукты выделяют с помощью вакуумного фильтрования. Извлеченные твердые материалы сушат на воздухе в течение, по меньшей мере, 1 часа до анализа.
[0626] Фигура 37 показывает иллюстративные картины малоуглового XRPD для сокристаллов Соединения 1 с различными чистыми триглицеридами и твердыми материалами, выделенными из смеси препарата для детского питания и Соединения 1. На основании данных, показанных на Фигуре 37, твердые материалы, выделенные из смеси препарата для детского питания и Соединения 1, могут состоять либо из смеси различных сокристаллов Соединения 1:триглицеридов, либо из сокристаллов Соединения 1 с некоторым набором триглицеридов в кристаллической структуре.
[0627] В дополнение к этому, на основании интенсивности сигнала ароматического Соединения 1 в спектрах 13C CPMAS, среднее количество 22% Соединения 1 присутствует в форме твердых материалов, выделенных из смеси препарата для детского питания, в течение контактов, продолжающихся в пределах от 1 часа до 24 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТВЕРДЫЕ ФОРМЫ N-(4-(7-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-7-ИЛ)-2-(ТРИФТОРМЕТИЛ)ФЕНИЛ)-4-ОКСО-5-(ТРИФТОРМЕТИЛ)-1,4-ДИГИДРОХИНОЛИН-3-КАРБОКСАМИДА | 2010 |
|
RU2568608C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОДУЛЯТОРОВ РЕГУЛЯТОРА ТРАНСМЕМБРАННОЙ ПРОВОДИМОСТИ КИСТОЗНОГО ФИБРОЗА | 2010 |
|
RU2553989C2 |
| СОЕДИНЕНИЯ, ПРИГОДНЫЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ATR КИНАЗЫ | 2014 |
|
RU2687276C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ CFTR ЗАБОЛЕВАНИЙ | 2014 |
|
RU2718044C2 |
| ТВЕРДЫЕ ФОРМЫ (R)-1-(2,2-ДИФТОРБЕНЗО[d][1,3]ДИОКСОЛ-5-ИЛ)-N-(2,3-ДИГИДРОКСИПРОПИЛ)-6-ФТОР-2-(1-ГИДРОКСИ-2-МЕТИЛПРОПАН-2-ИЛ)-1H-ИНДОЛ-5-ИЛ)ЦИКЛОПРОПАНКАРБОКСАМИДА | 2011 |
|
RU2573830C2 |
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ-IV | 2012 |
|
RU2598072C2 |
| ТВЕРДЫЕ ФОРМЫ (R)-1-(2, 2-ДИФТОРБЕНЗО[d][1, 3]ДИОКСОЛ-5-ИЛ)-N-(1-(2, 3-ДИГИДРОКСИПРОПИЛ)-6-ФТОР-2-(1-ГИДРОКСИ-2-МЕТИЛПРОПАН-2-ИЛ)-1H-ИНДОЛ-5-ИЛ)ЦИКЛОПРОПАНКАРБОКСАМИДА | 2011 |
|
RU2711481C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ ATR КИНАЗЫ (ВАРИАНТЫ) | 2014 |
|
RU2720408C2 |
| СОЕДИНЕНИЯ, ПРИГОДНЫЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ATR КИНАЗЫ | 2020 |
|
RU2750148C1 |
| ТВЕРДЫЕ ФОРМЫ N-(7-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-7-ИЛ-)-2-(ТРИФТОРМЕТИЛ)ФЕНИЛ)-4-ОКСО-5-(ТРИФТОРМЕТИЛ)-1,4-ДИГИДРОХИНОЛИН-3-КАРБОКСАМИДА | 2009 |
|
RU2518479C2 |
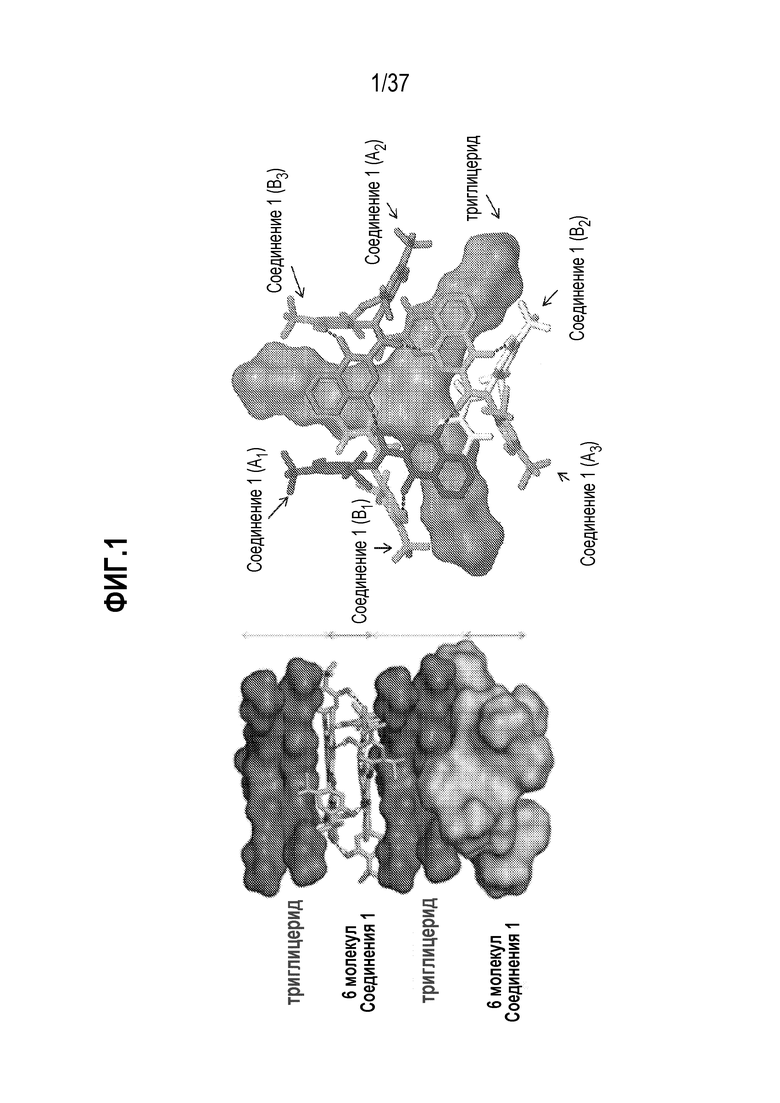
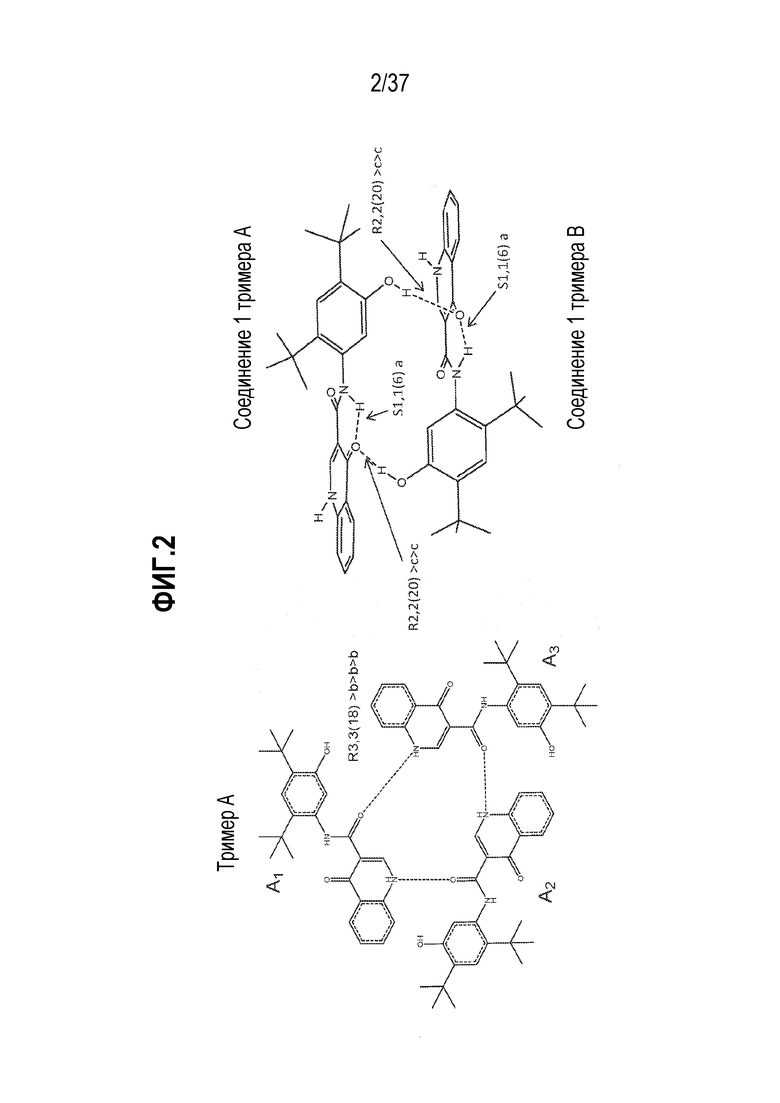
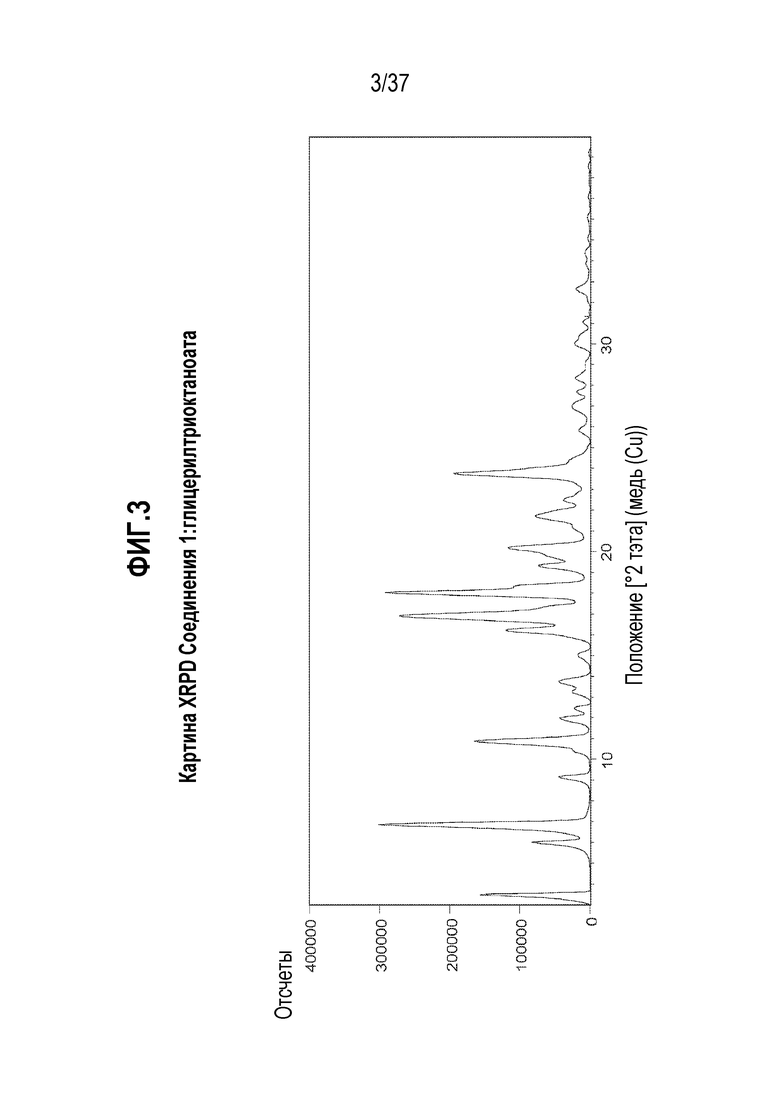
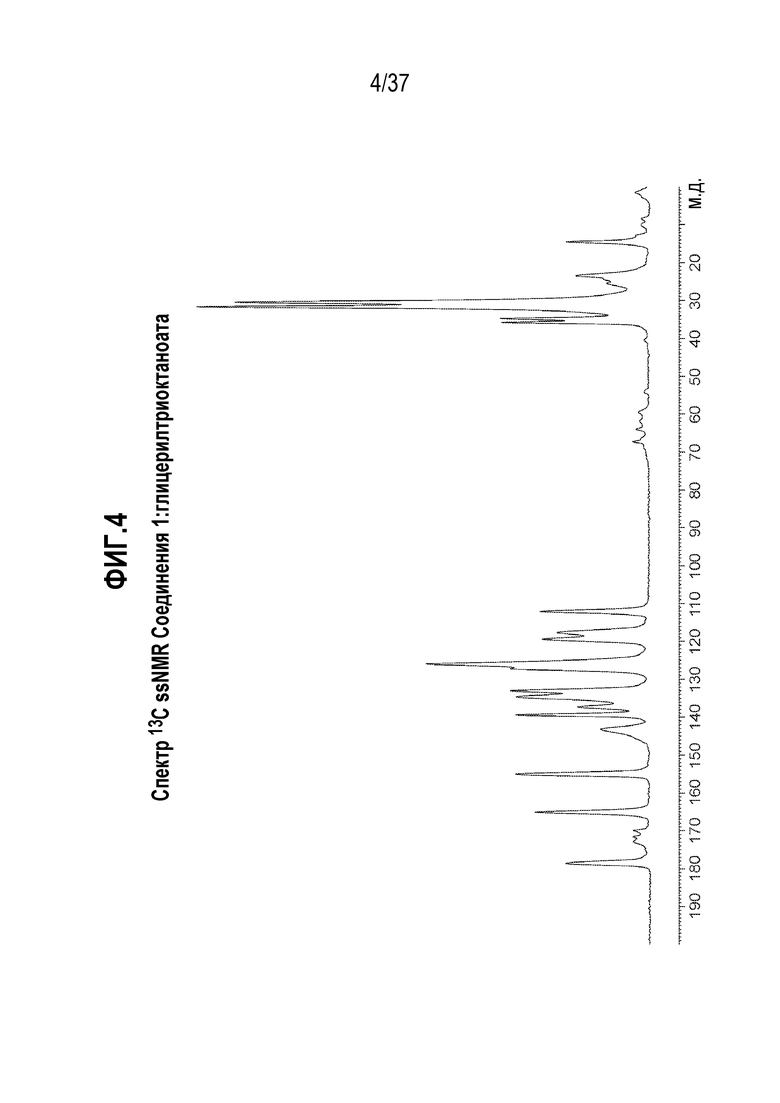
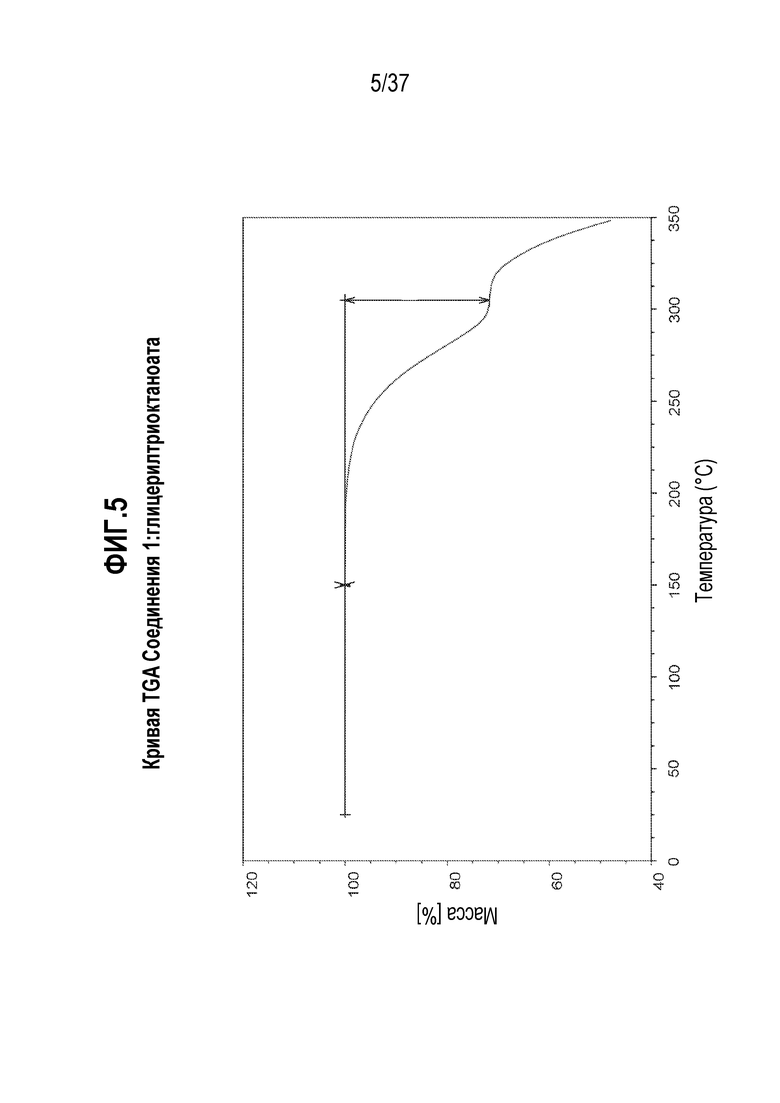
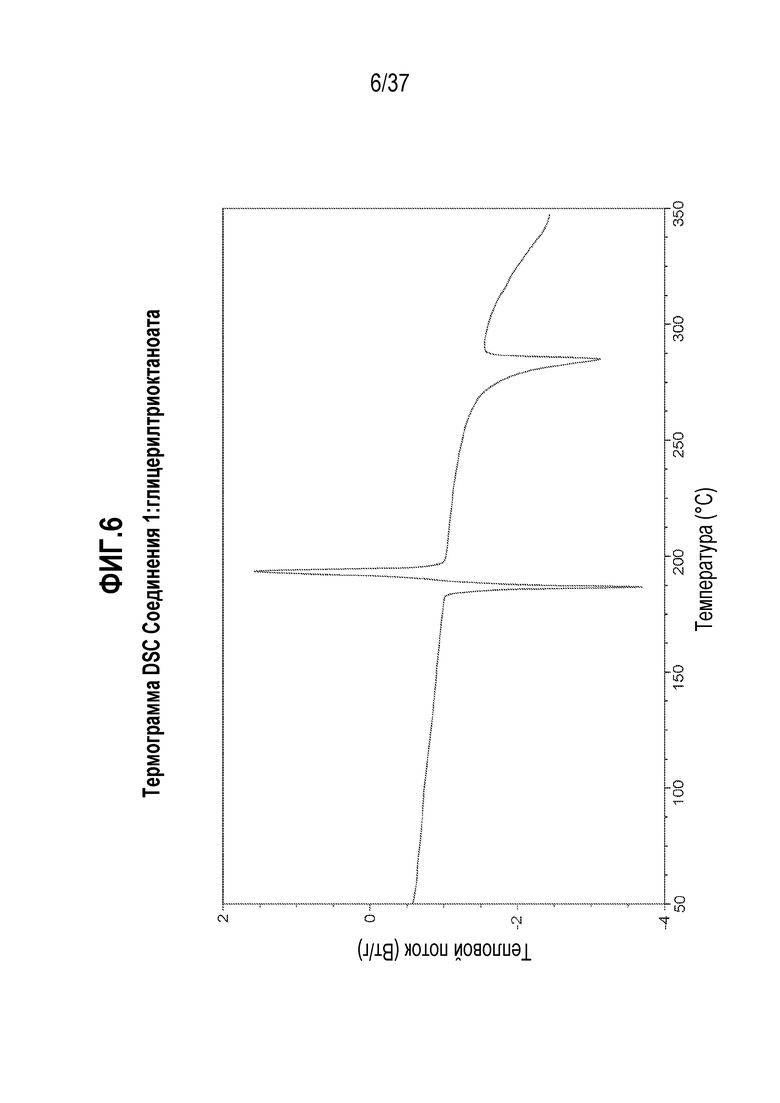
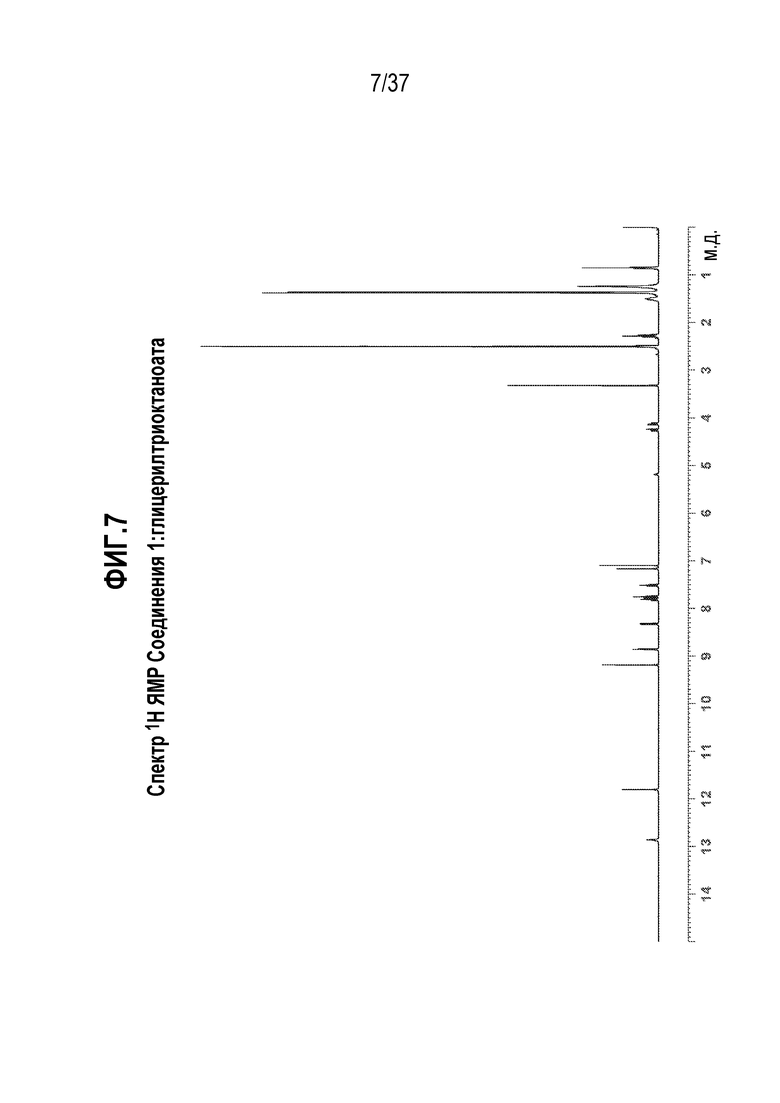
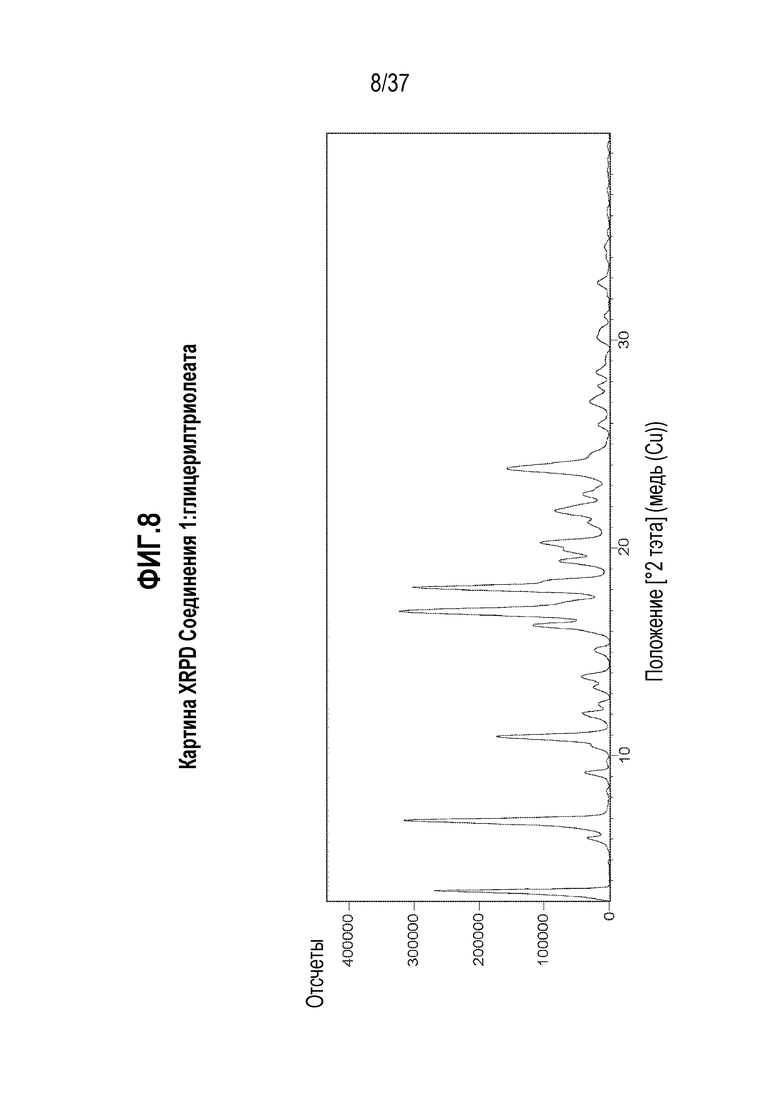

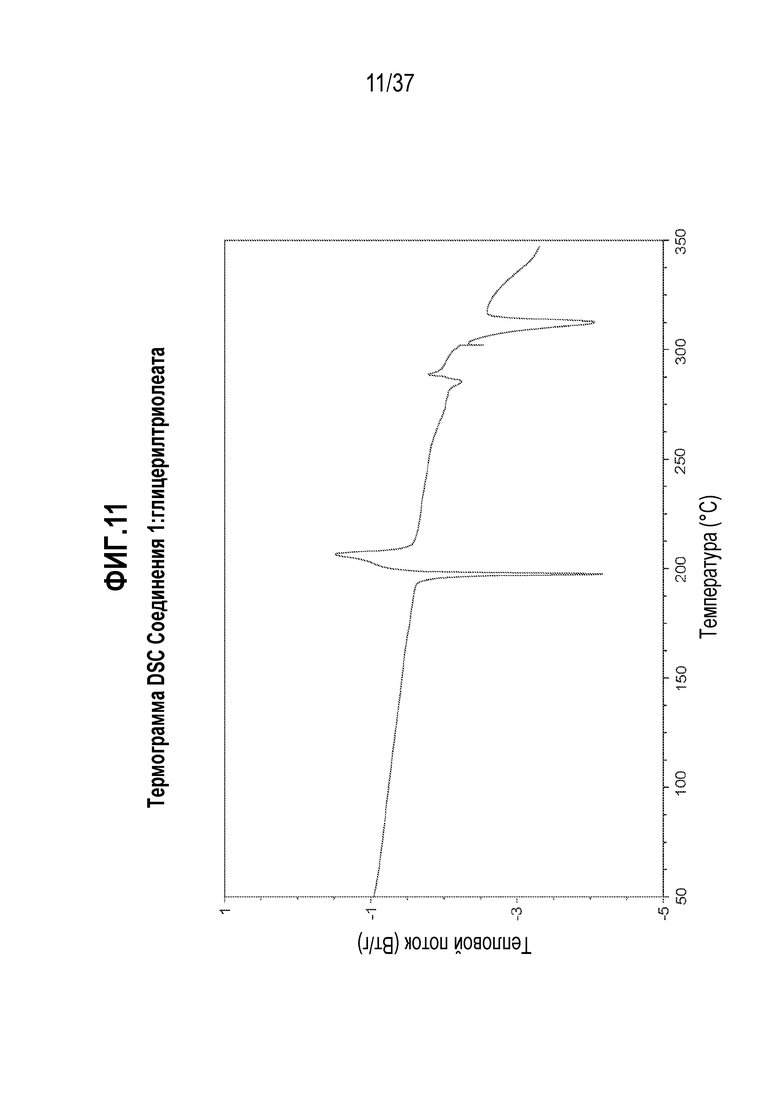
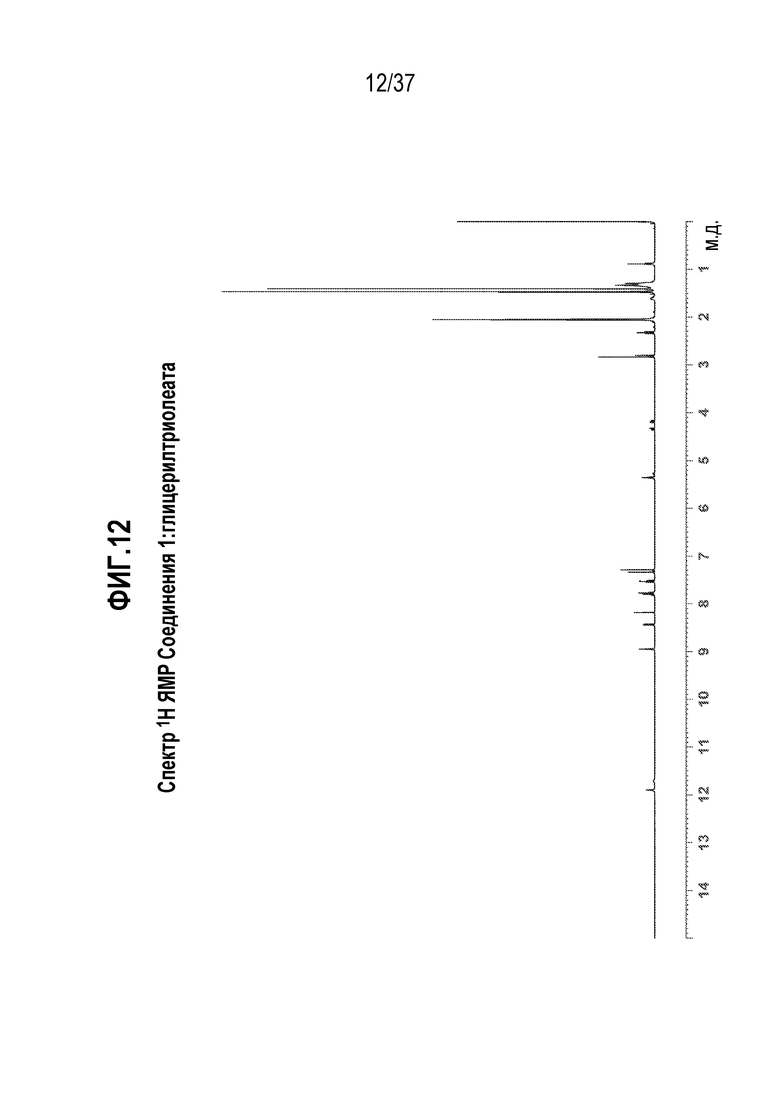
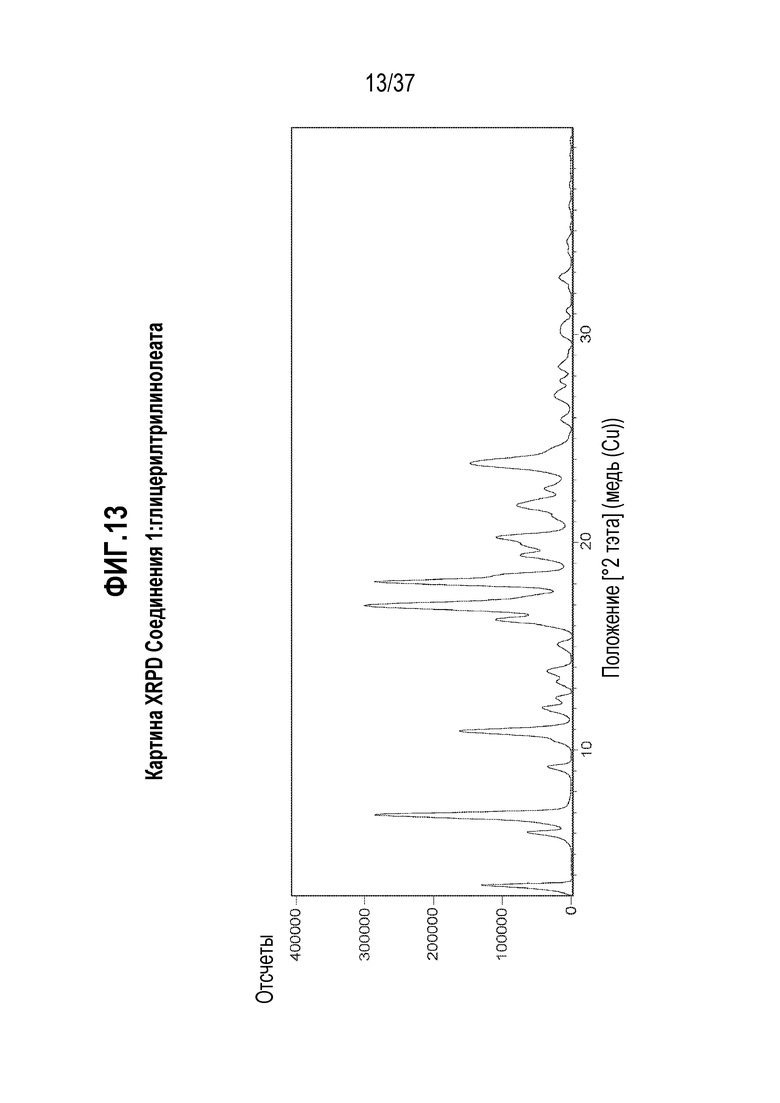
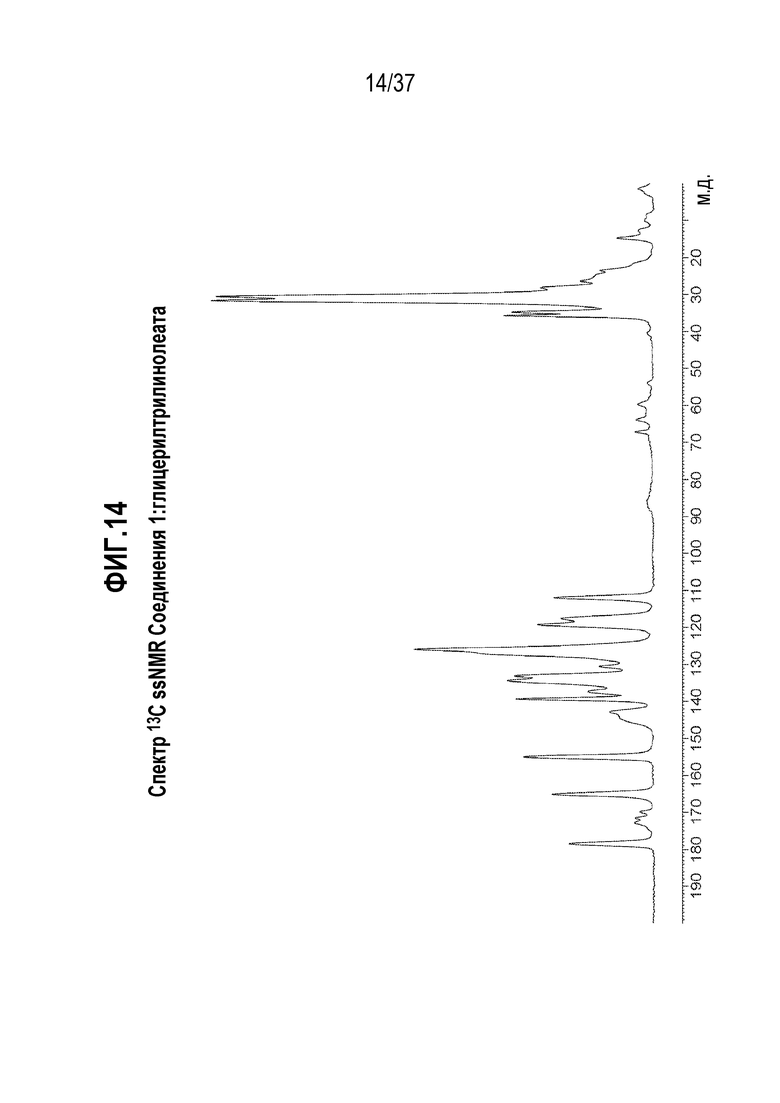
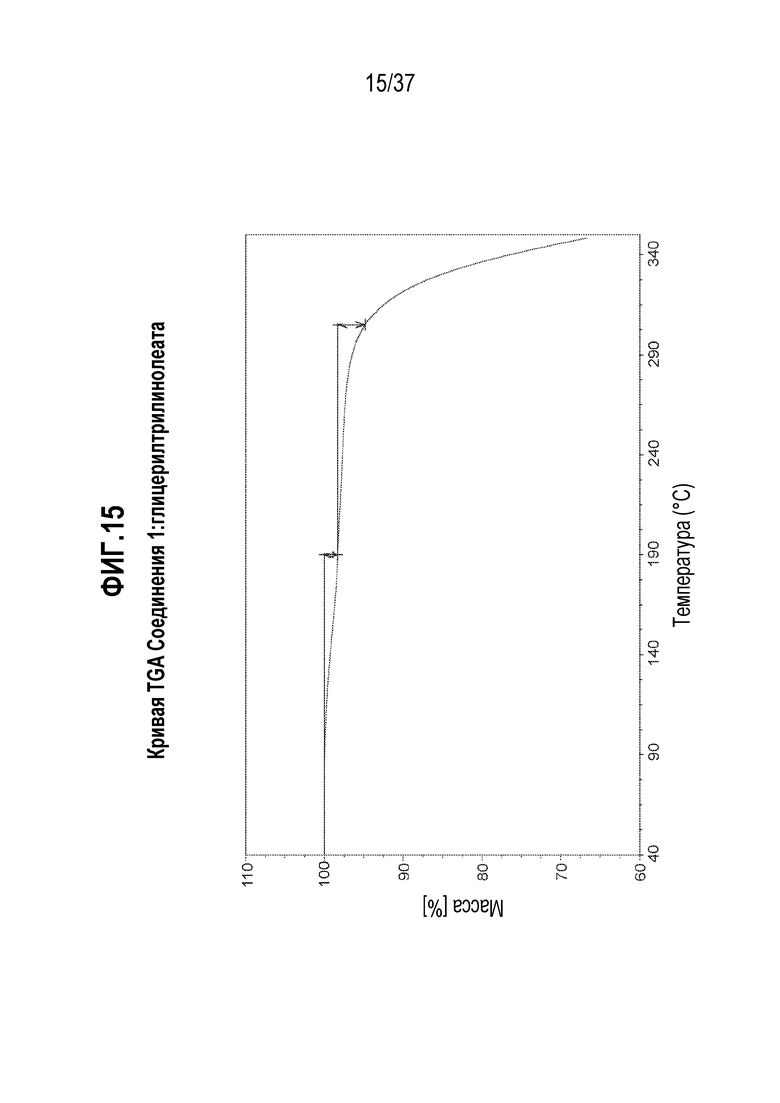
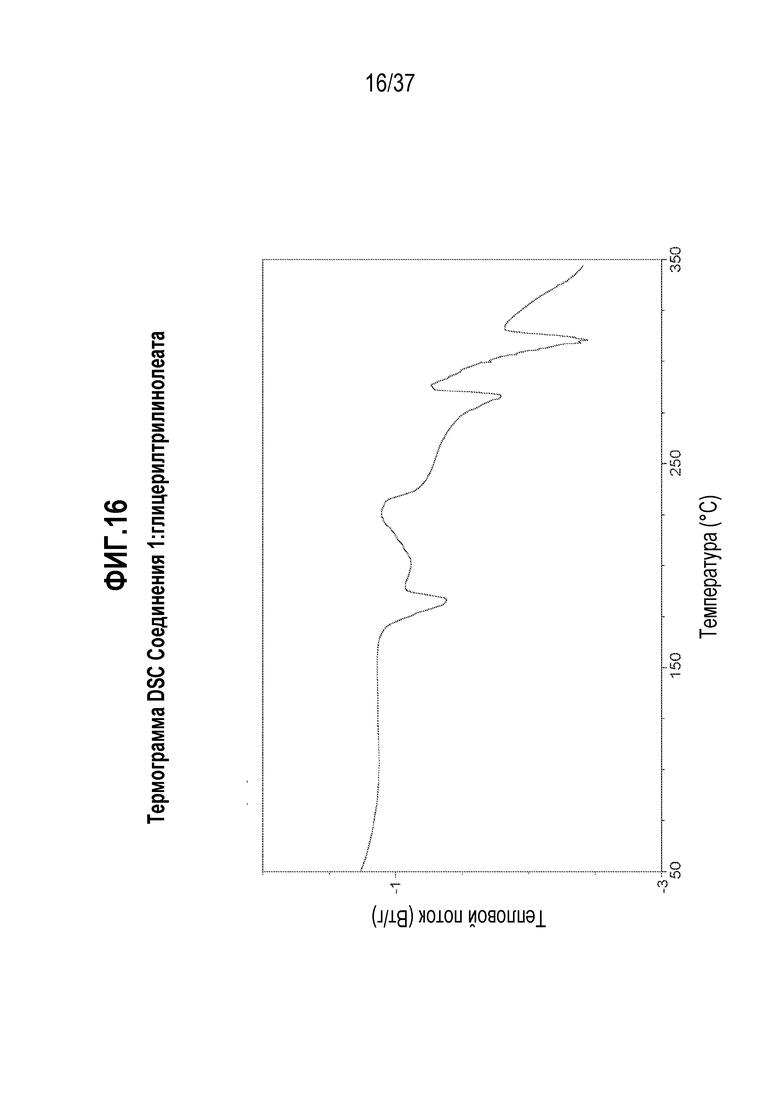
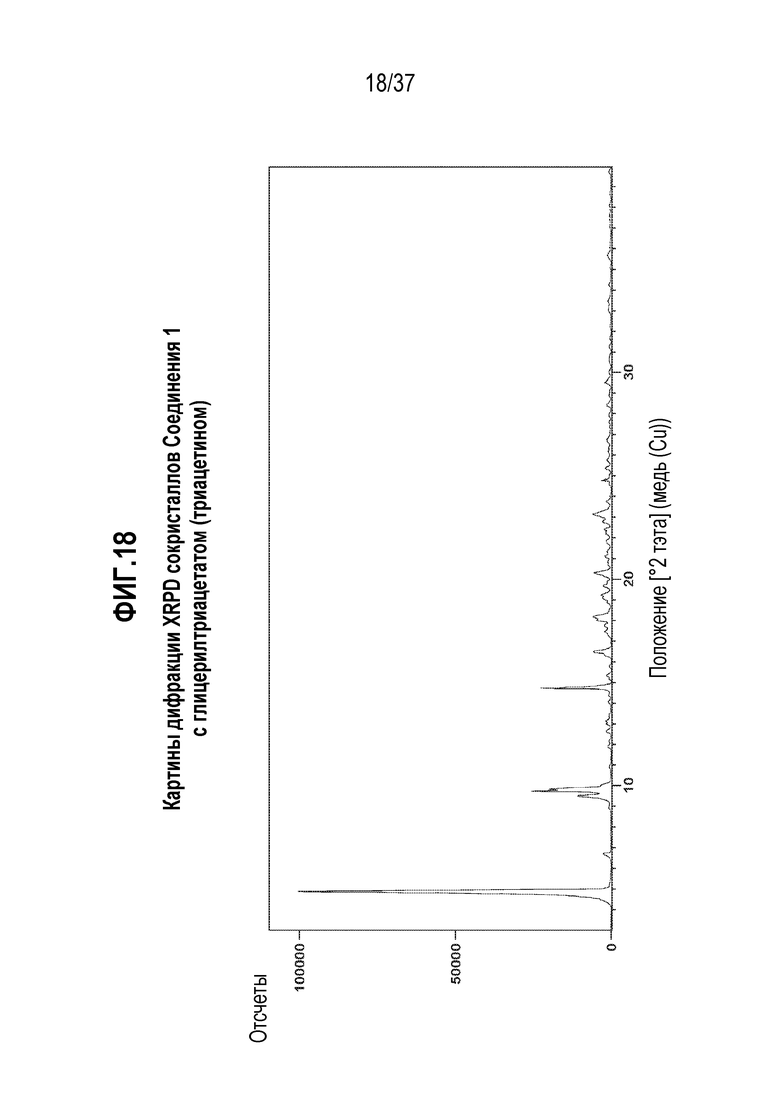
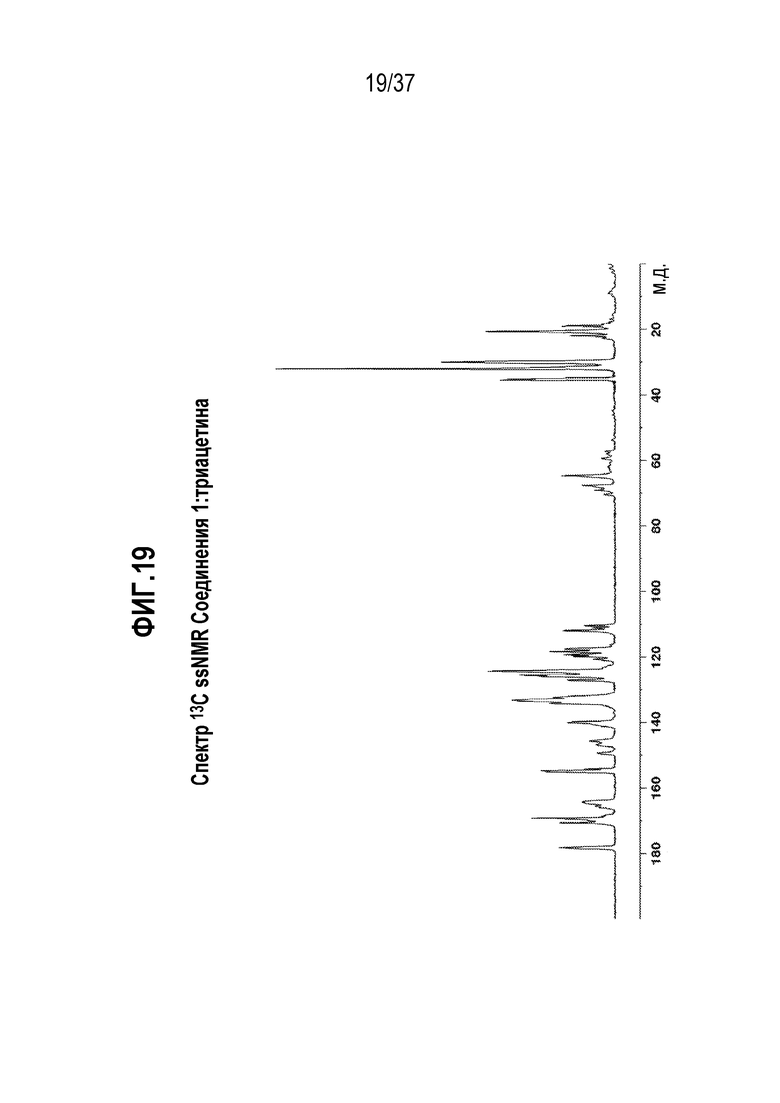
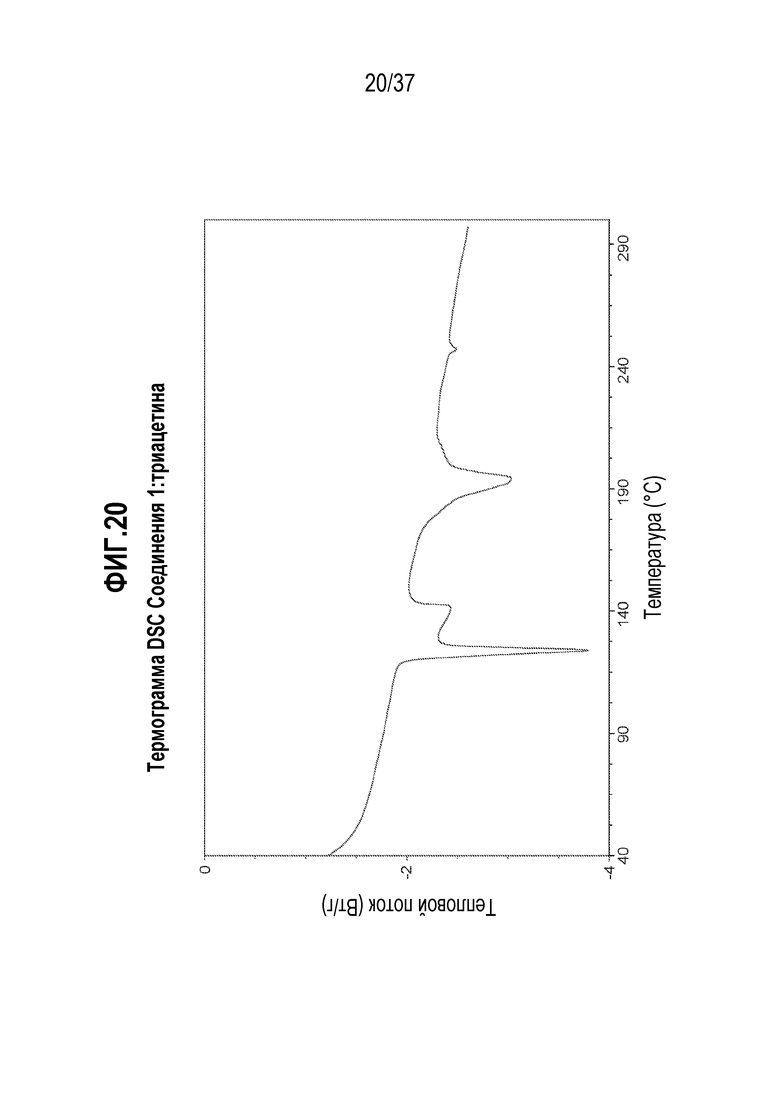
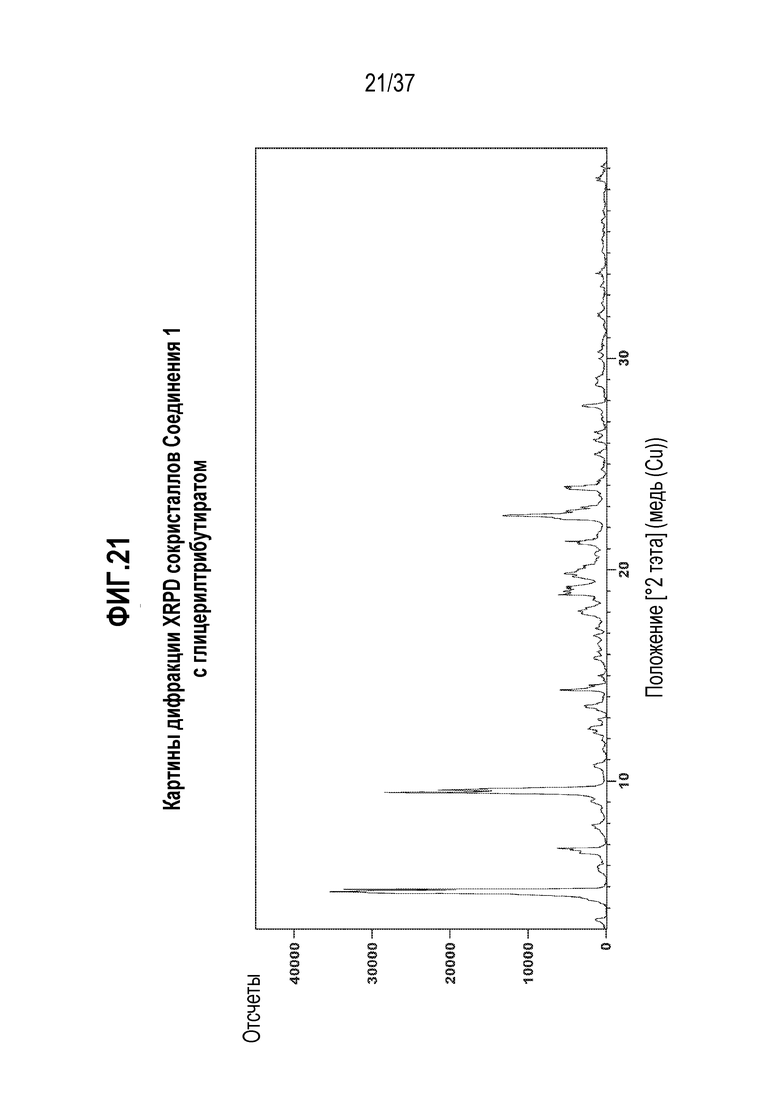
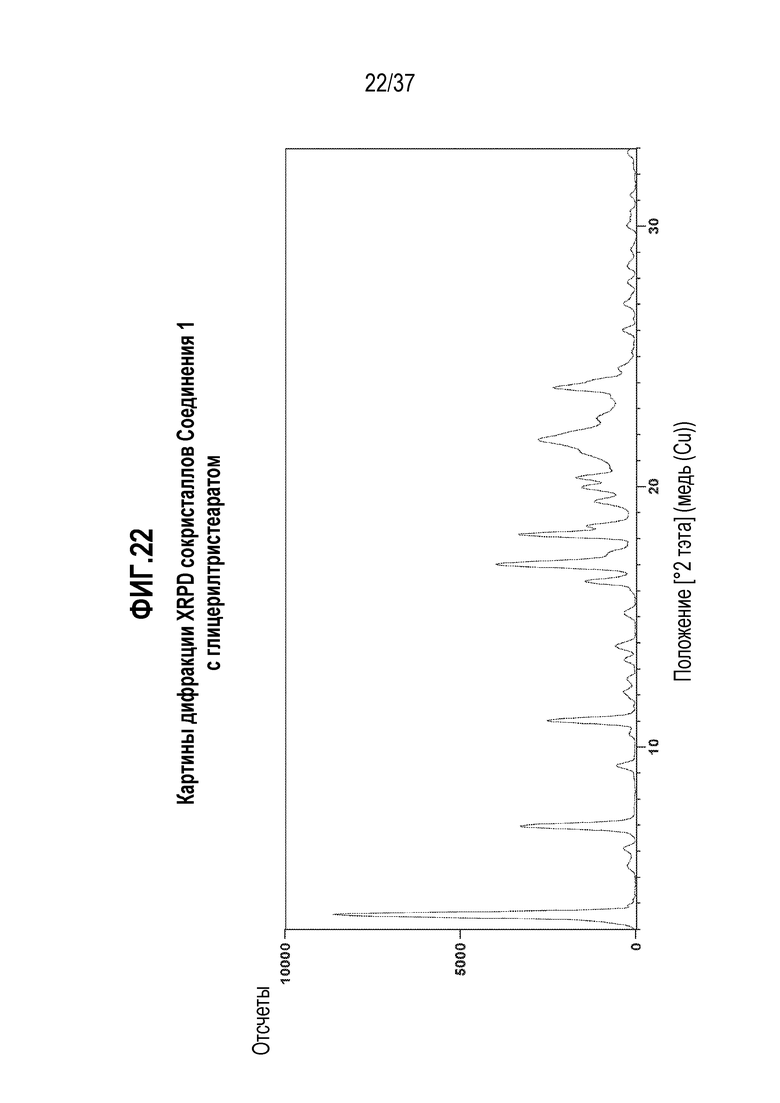
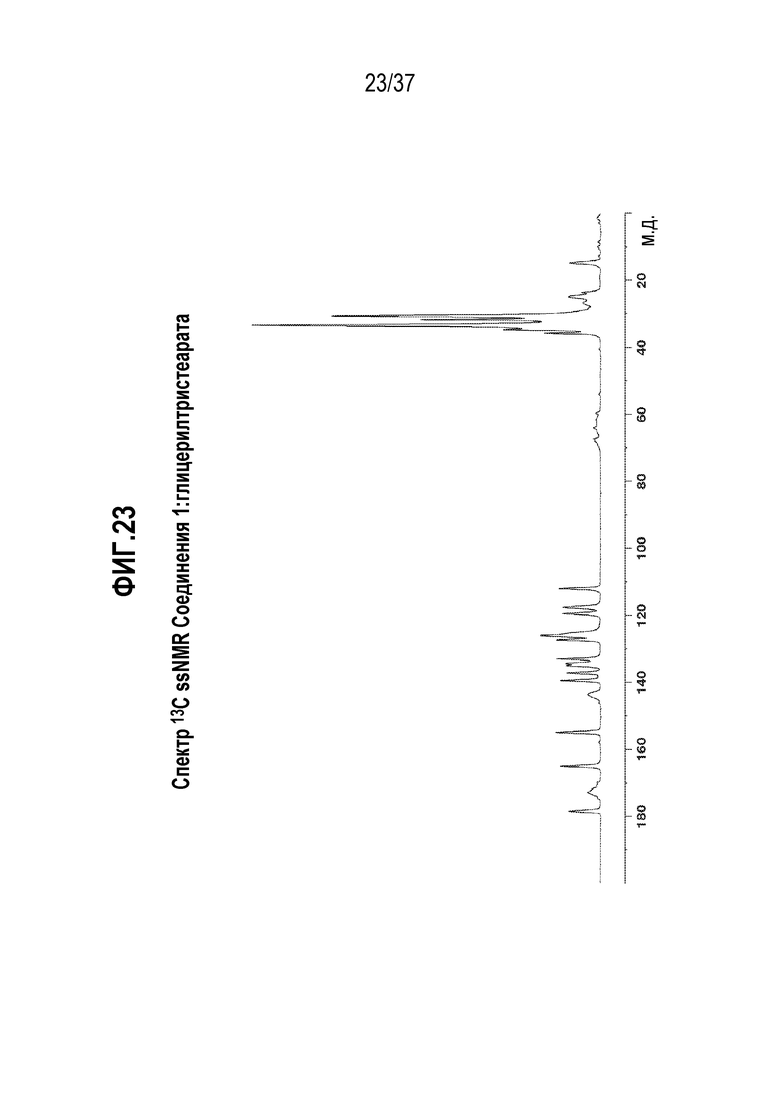
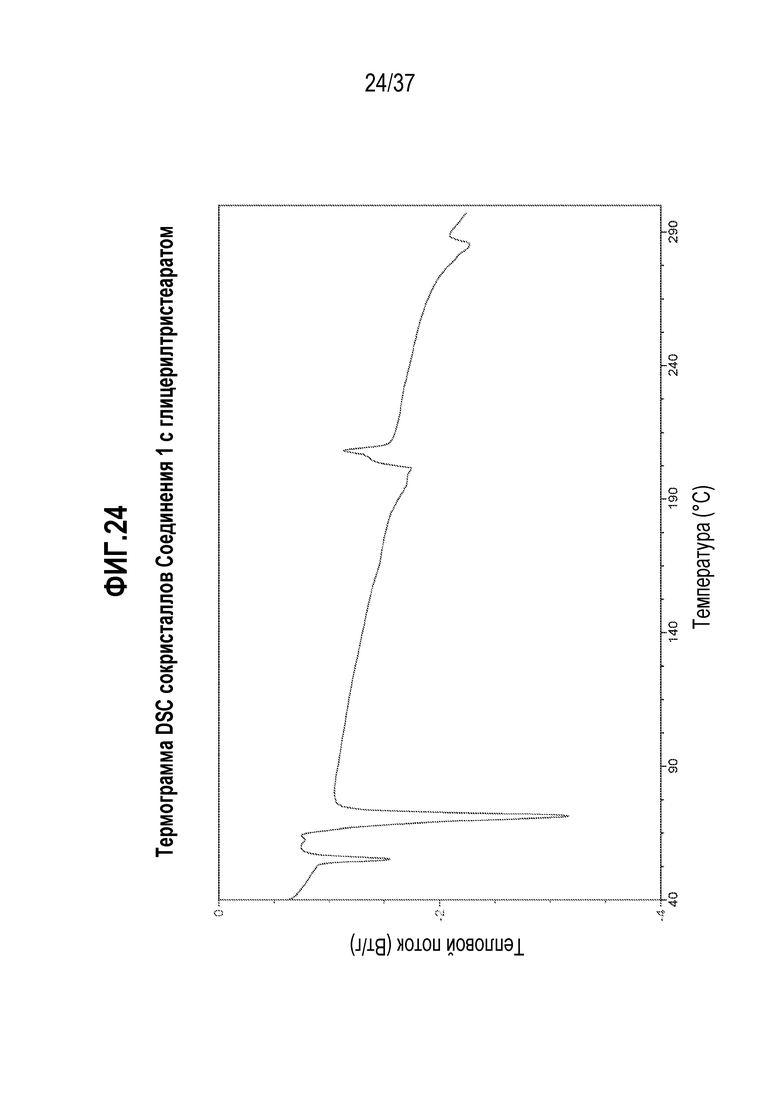
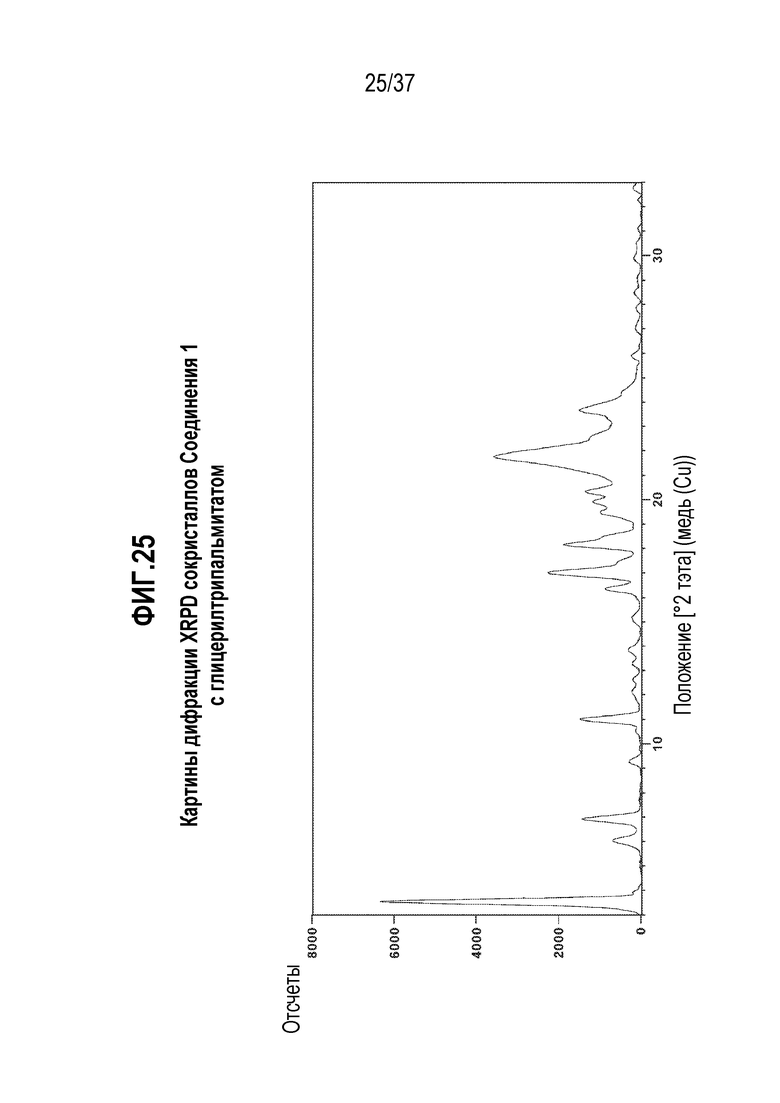
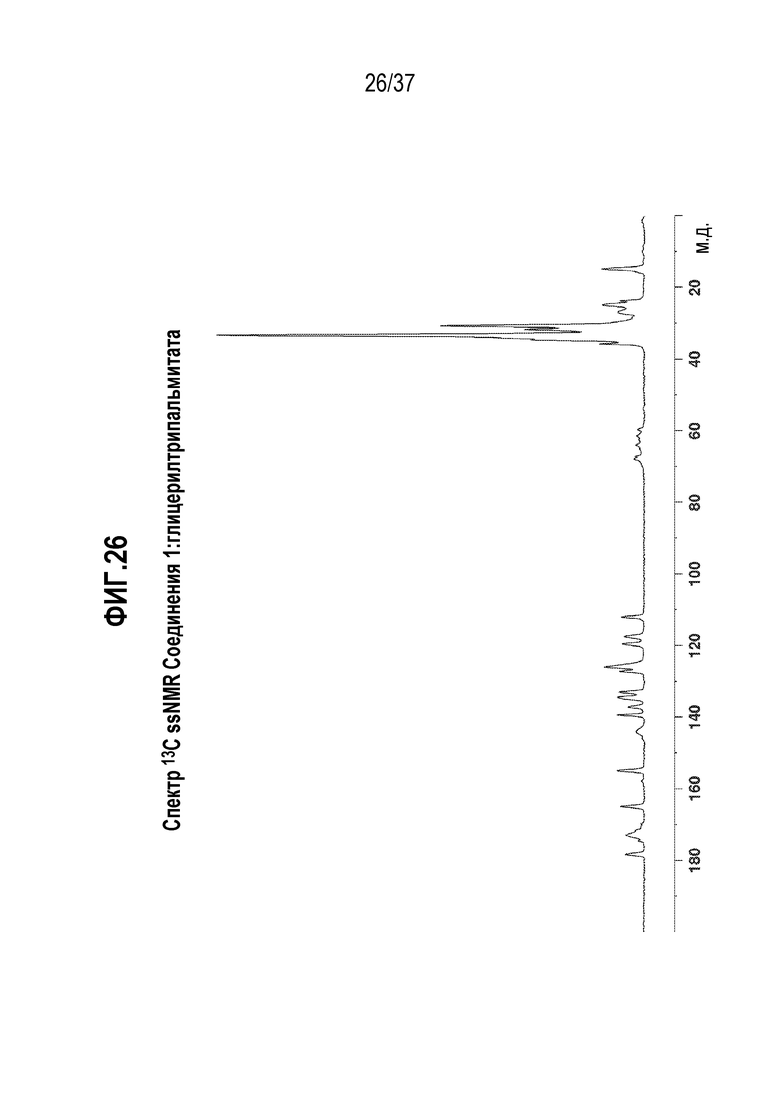
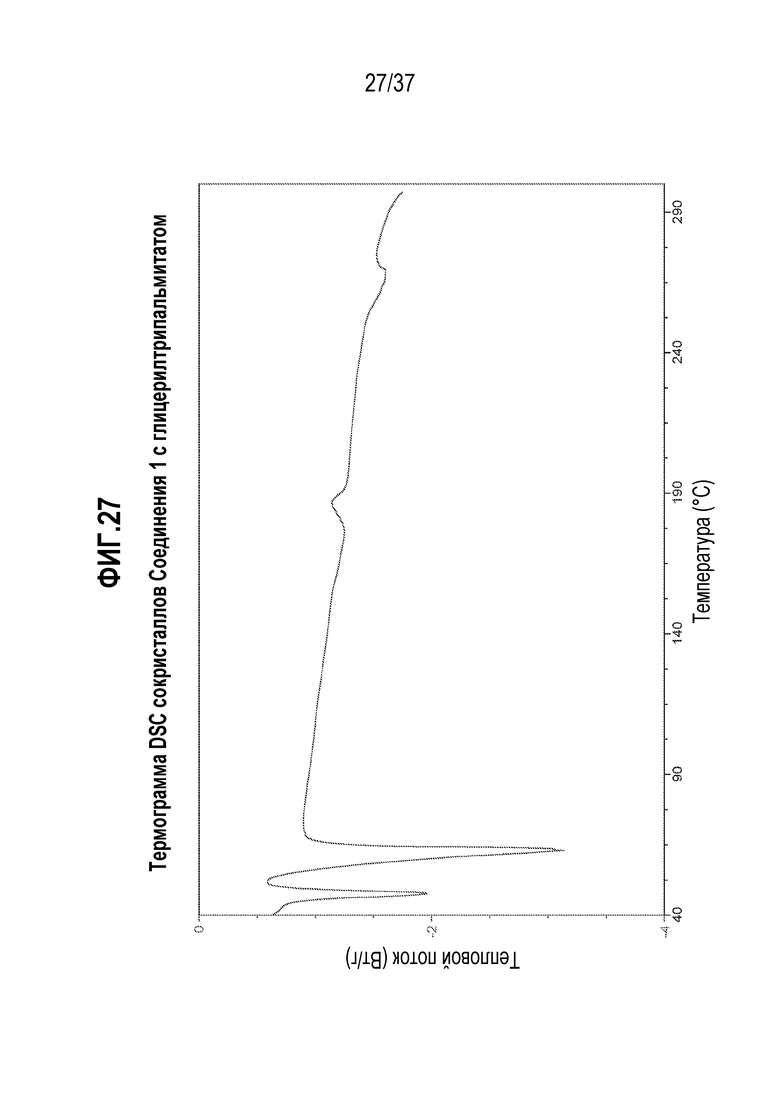
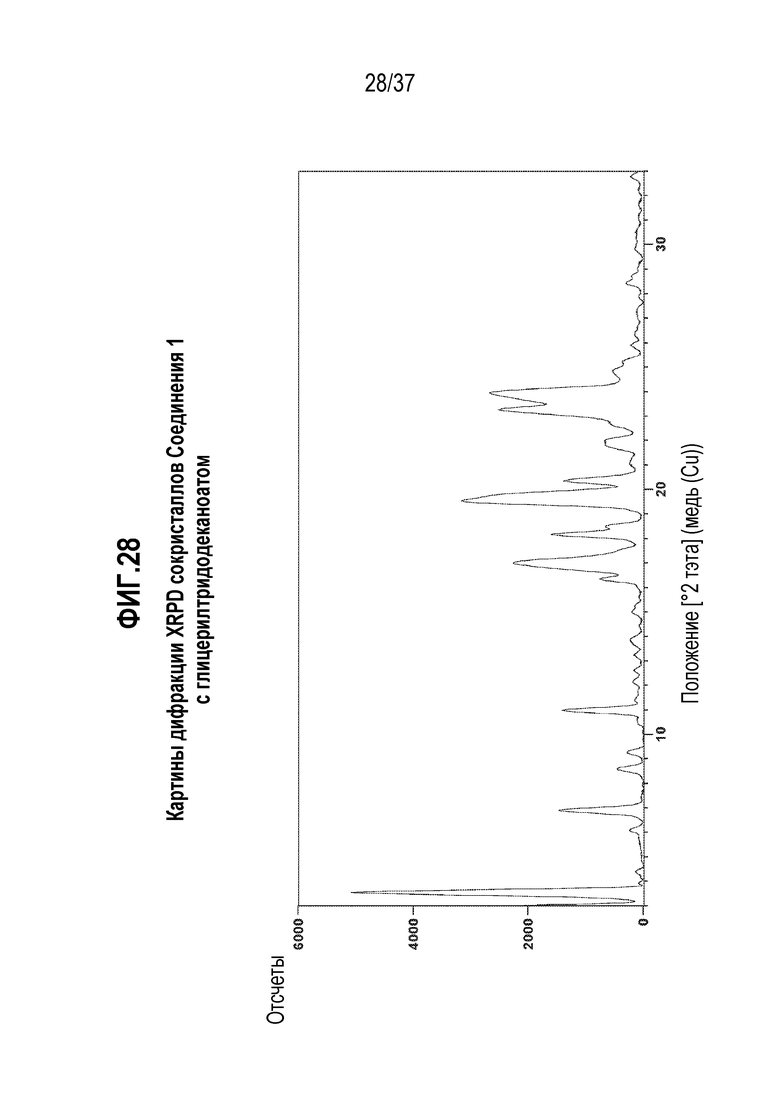
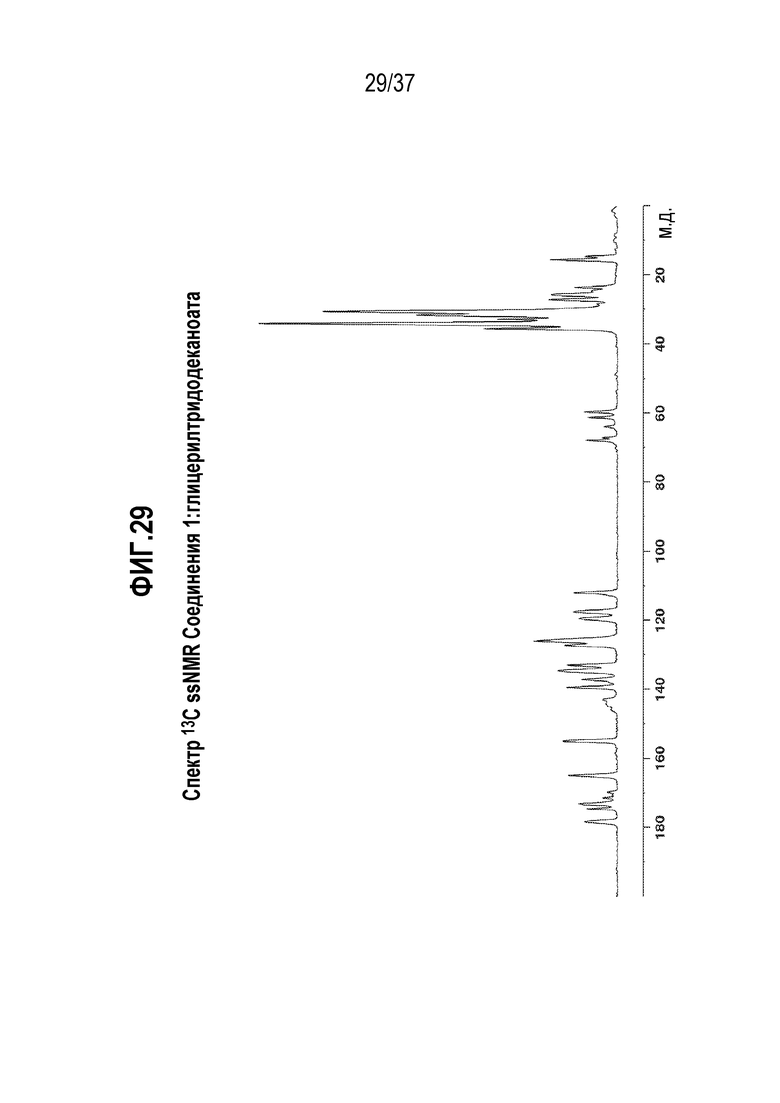
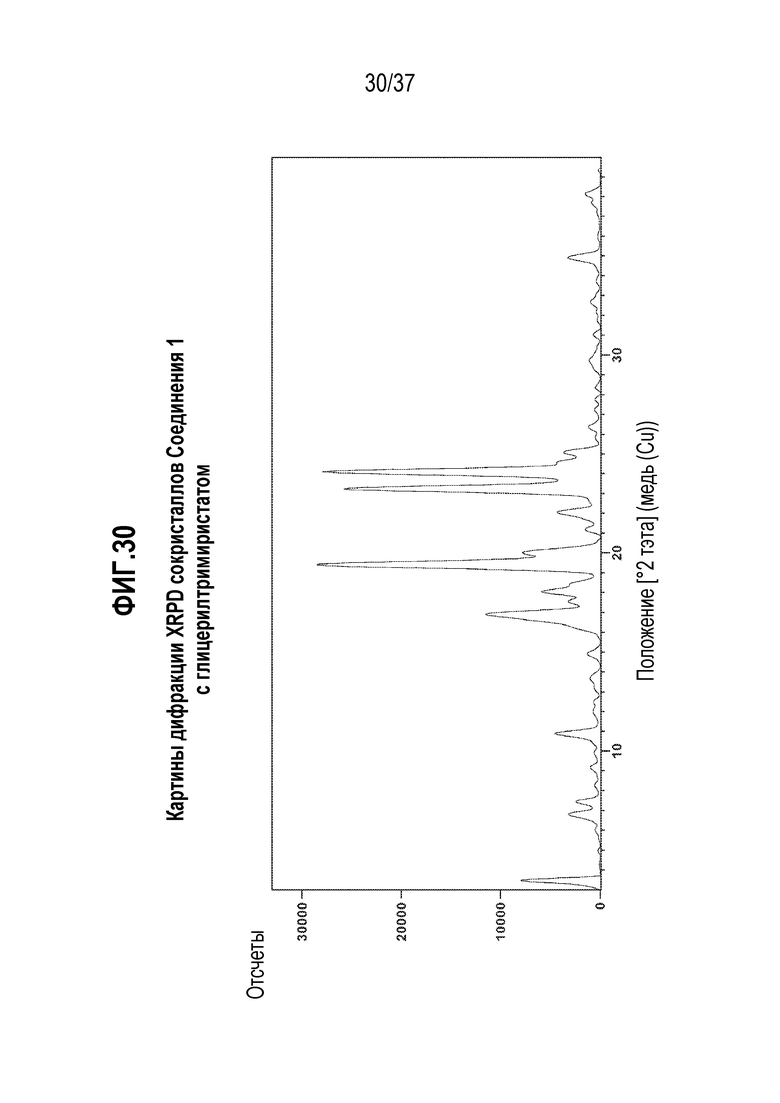
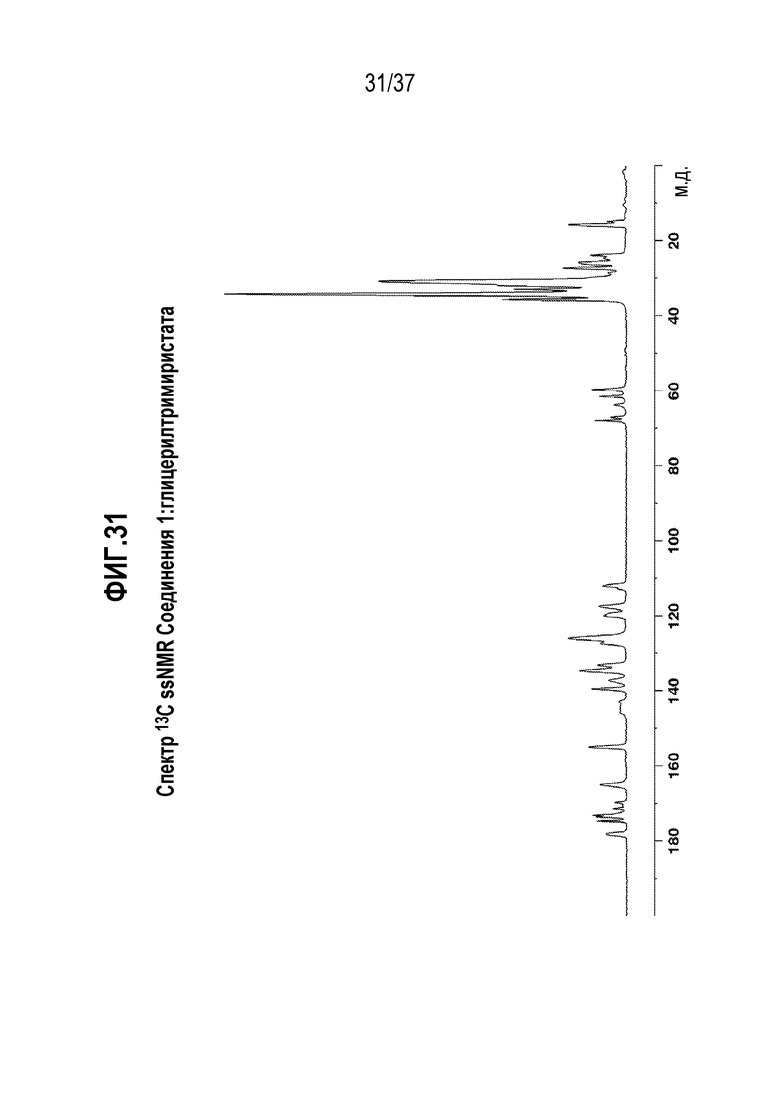
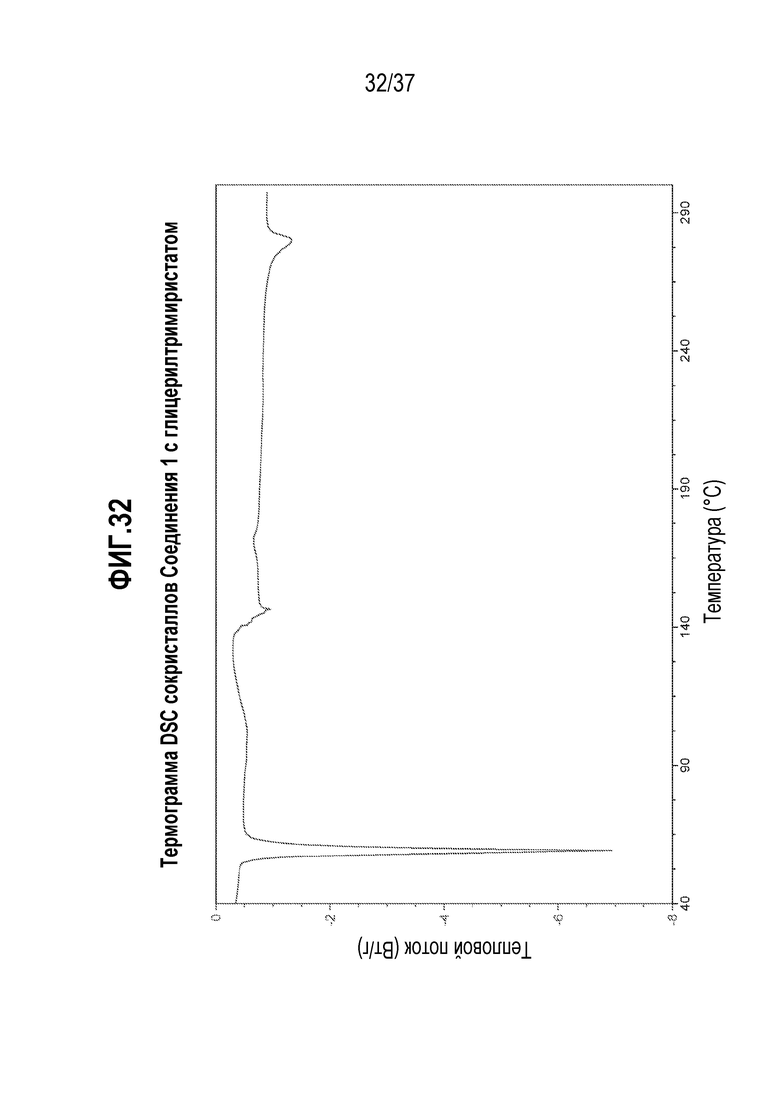
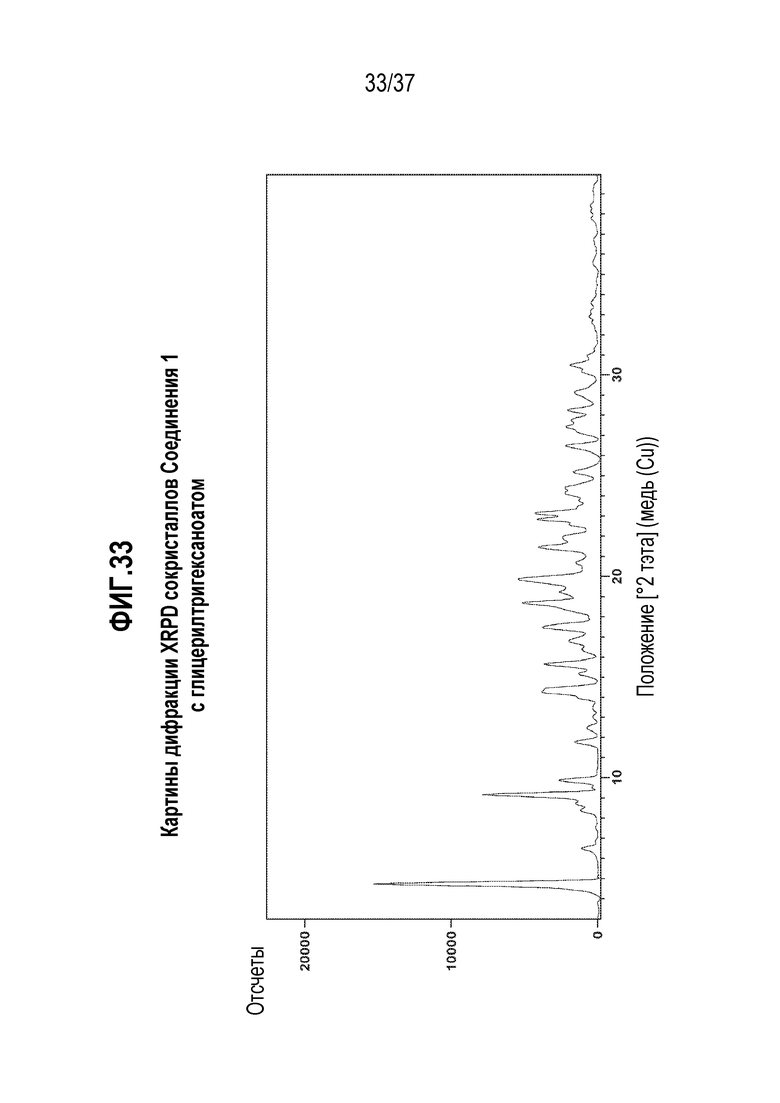
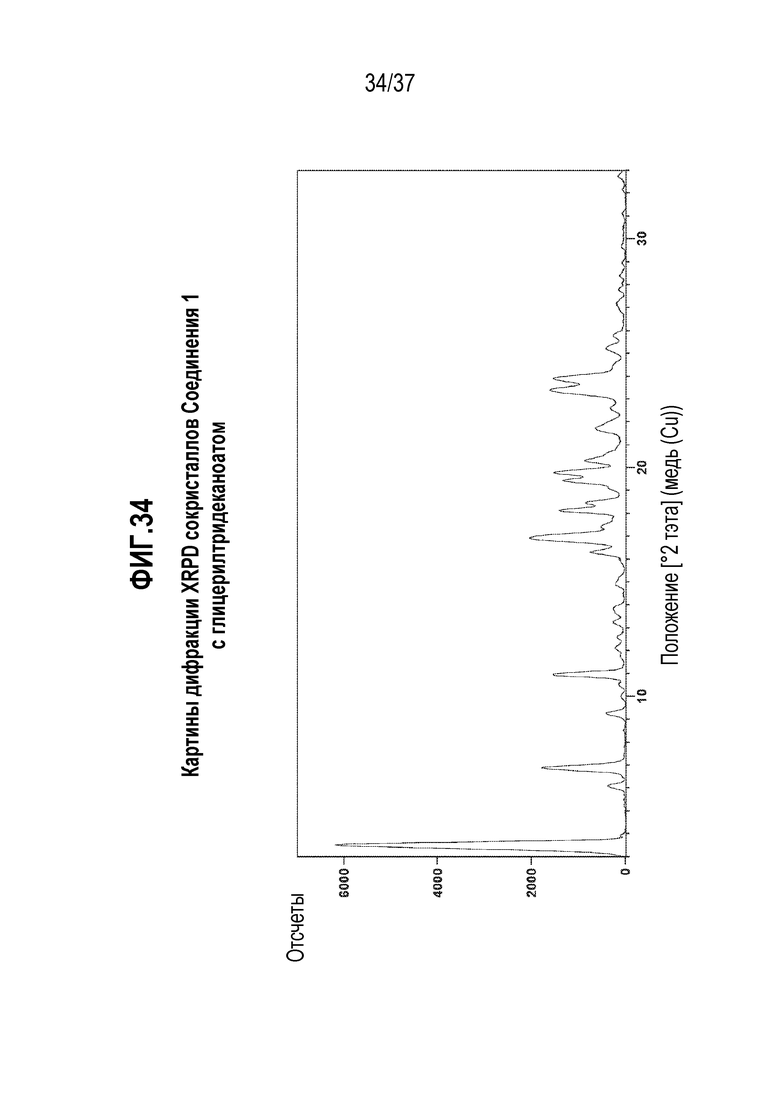
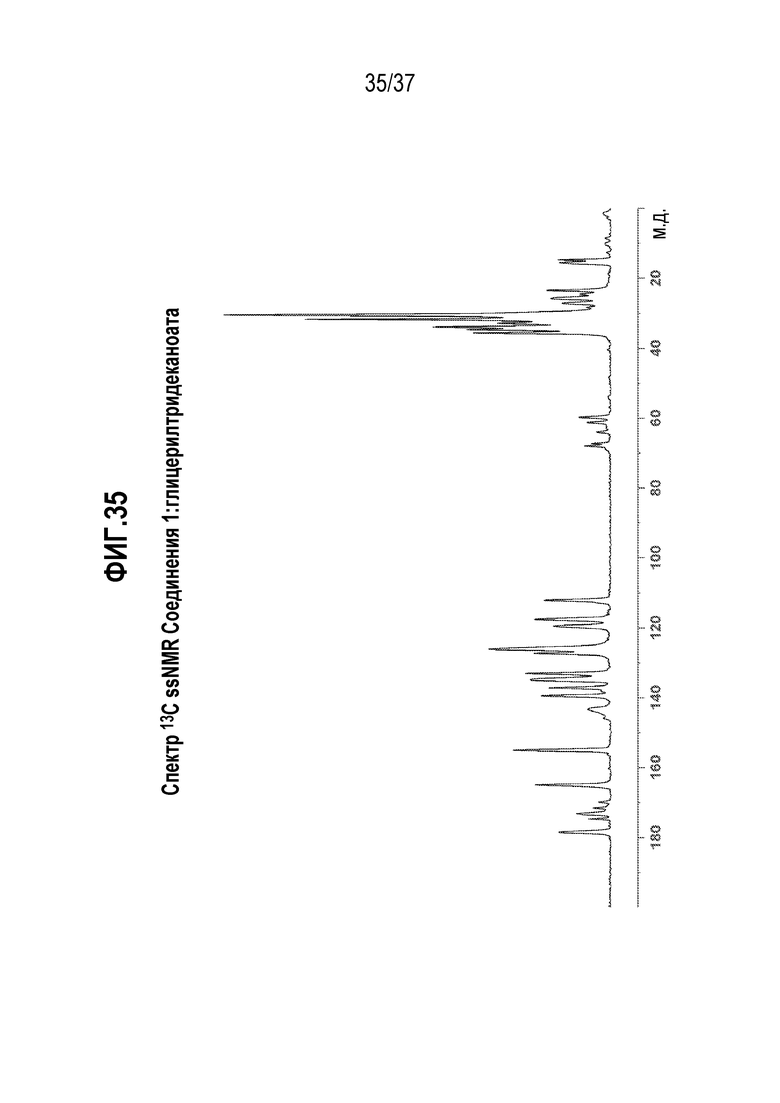
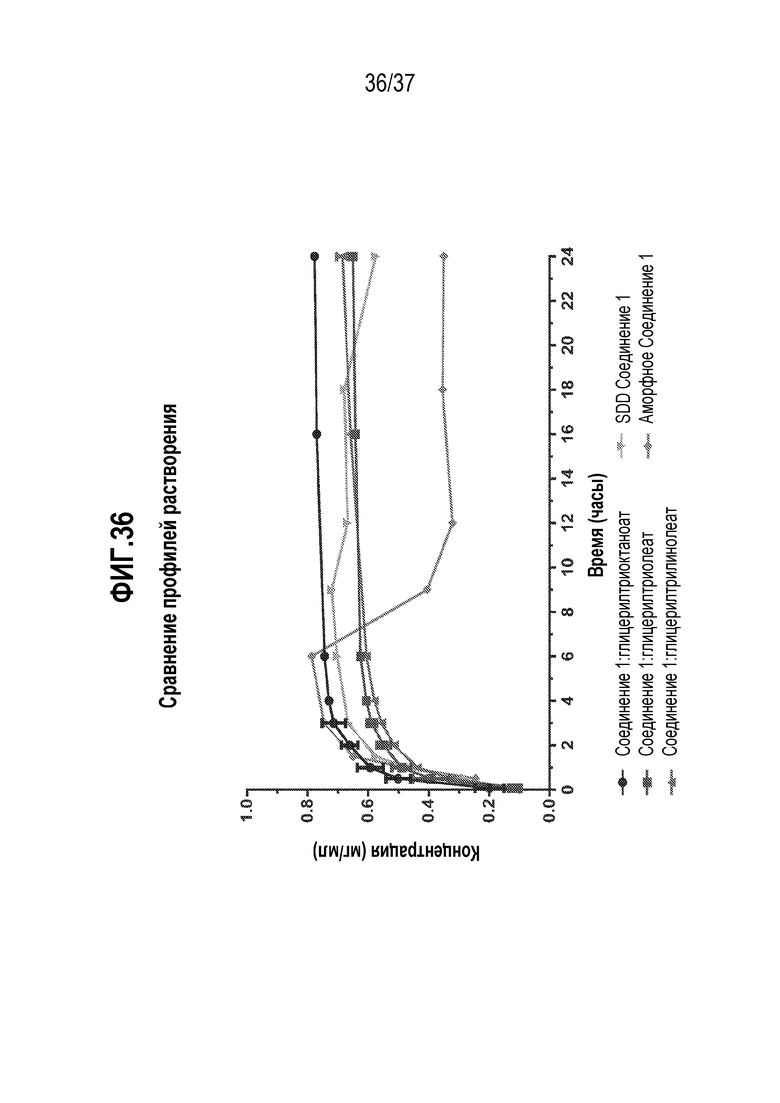
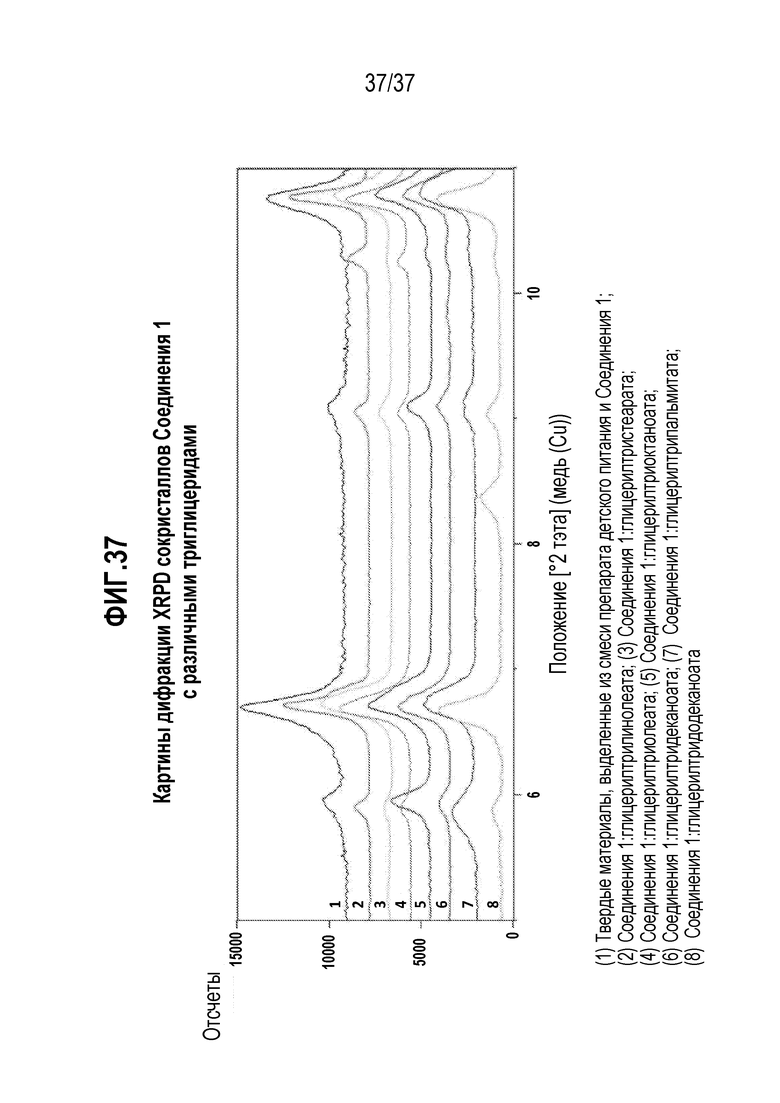
Изобретение относится к сокристаллам, содержащим N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид (Соединение 1), где Соединение 1 представлено следующей структурной формулой:
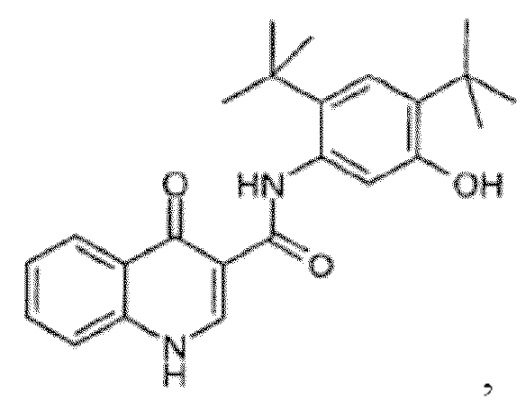
и только один триглицерид, где триглицерид выбирают из глицерилтриолеата, глицерилтриоктаноата и глицерилтрилинолеата, а также к способам их получения и способам лечения с их помощью кистозного фиброза. 4 н. и 7 з.п. ф-лы, 37 ил.
1. Сокристалл, содержащий Соединение 1 и только один триглицерид, где триглицерид выбирают из глицерилтриолеата, глицерилтриоктаноата и глицерилтрилинолеата,
и где Соединение 1 представлено следующей структурной формулой:
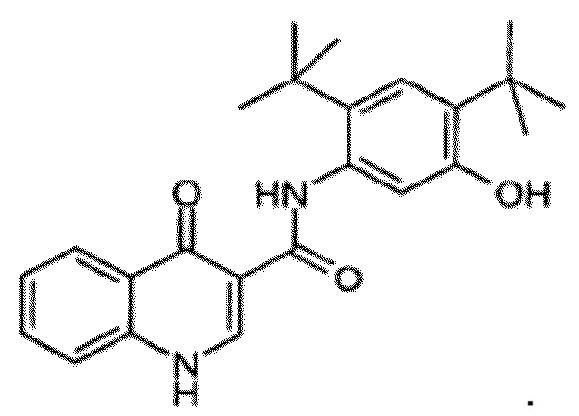
2. Сокристалл по п.1, отличающийся тем, что имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9 и 10,9.
3. Сокристалл по п.1, отличающийся тем, что имеет картину порошковой дифракции рентгеновского излучения с характерными пиками, выраженными в градусах 2-тэта±0,2, в следующих положениях: 3,5, 6,9, 9,2, 10,9, 16,9, 18,0 и 23,8.
4. Сокристалл по любому из п.1, отличающийся тем, что имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0 и 119,4.
5. Сокристалл по п.1, где триглицерид выбирают из глицерилтриолеата и глицерилтрилинолеата и
где сокристалл отличается тем, что имеет спектр 13C ssNMR с характерными пиками, выраженными в м.д. ±0,1, в следующих положениях: 178,6, 155,0, 130,5 и 119,4.
6. Сокристалл по п.1, где стехиометрия Соединения 1 по отношению к триглицериду составляет 3:1.
7. Сокристалл по п.1, где стехиометрия Соединения 1 по отношению к триглицериду составляет 6:1.
8. Сокристалл по п.1, где Соединение 1 формирует гексамер в сокристалле.
9. Сокристалл, содержащий Соединение 1 и триглицерид, где триглицерид выбирают из глицерилтриолеата, глицерилтриоктаноата и глицерилтрилинолеата,
и где Соединение 1 представлено следующей структурной формулой:
где сокристалл получают с помощью способа, включающего стадии:
(а) приготовления смеси, содержащей Соединение 1 и триглицерид; и
(b) нагрева смеси, где смесь нагревают при 40°C или при температуре на 5 -10°C выше температуры плавления триглицерида; или
где смесь нагревают до 80°C в течение по меньшей мере 1 часа.
10. Способ лечения или облегчения тяжести заболевания у пациента, где указанное заболевание представляет собой кистозный фиброз, причём способ включает стадию введения пациенту терапевтически эффективного количества сокристалла по п.1.
11. Способ получения сокристаллов, содержащих Соединение 1 и триглицерид,
где Соединение 1 представлено следующей структурной формулой:
и где триглицерид выбирают из глицерилтриолеата, глицерилтриоктаноата и глицерилтрилинолеата,
включающий стадии:
(с) приготовления смеси, содержащей Соединение 1 и триглицерид; и
(d) нагрева смеси, где смесь нагревают при 40°C или при температуре на 5 -10°C выше температуры плавления триглицерида; или
где смесь нагревают до 80°C в течение по меньшей мере 1 часа.
| WO 2007079139 A2, 12.07.2007 | |||
| Rodríguez-Spong, B | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| General principles of pharmaceutical solid polymorphism A supramolecular perspective | |||
| Advanced Drug Delivery Reviews, 56(3), 241-274 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| WO 2014118805 A1, 07.08.2014 | |||
| RU 2010114732 A, 20.10.2011 | |||
| Ning Shan, Michael J | |||
| Zaworotko, "The role of cocrystals in | |||
Авторы
Даты
2021-06-07—Публикация
2015-10-07—Подача