Изобретение относится к области химии и касается получения новых производных гуанина.
Валацикловир представляет L-валиновый эфир ацикловира. В организме человека валацикловир быстро и полностью превращается в ацикловир, под воздействием фермента валацикловилгидролазы. Ацикловир широко используется для лечения и профилактики вирусных инфекций (Goodman and Gilman's, The Pharmacological Basis of Therapeutics, стр. 1193-1198, 9th ed., 1996 г.). Структурная формула валацикловира ([1-валин, 2-[(2-амино-1,6-дигидро-6-оксо-9Н-пурин-9-ил)метокси]этиловый эфир], CAS No. 124832-26-4):
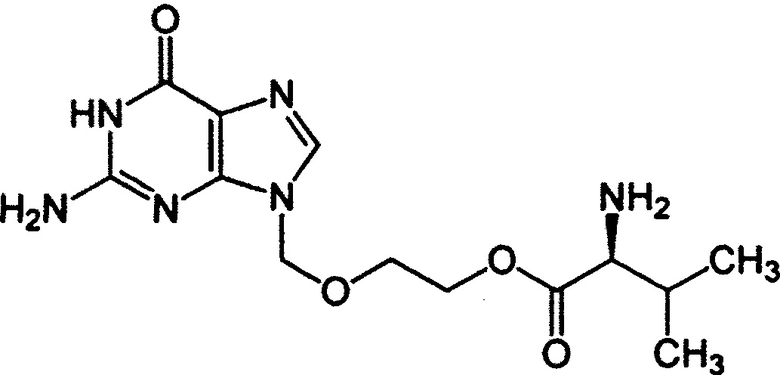
Из патента СССР SU 1634138 A3 известен способ получения валацикловира, обладающего противовирусными свойствами.
Принимая во внимание необходимость в разработке новых противовирусных средств и наличие противовирусных свойств у валацикловира (также являющегося производным гуанина, как и заявляемые соединения), существует необходимость в синтезе новых производных гуанина, которые могли бы быть эффективными противовирусными средствами.
Задачей настоящего изобретения является расширение арсенала химических производных гуанина.
Известны следующие патенты и заявки, которые составляют уровень техники заявленного изобретения:
- из заявки США US 20080281099 А1 и международной заявки WO 2005/073233 А1 - известен способ очистки валацикловира гидрохлорида;
- из международной заявки WO 2005/085247 А1 - известны кристаллические формы валакцикловира гидрохлорида;
- из международной заявки WO 2018/122626 А1 - известны производные пальмитиновой кислоты;
- из заявки США US 4957924 В1 - известно соединение валацикловир и его производные;
- из заявки США US 5686611 В1 - известны производные валацикловира (см. пример 6,7,8,14,18,37);
- из заявок США US 6825348 В2 и US 7553812 В2 - известны производные валацикловира.
Наиболее близким техническим решением к заявленному изобретению является соединение N-формил-валацикловир, описанное в патенте США US 7629461 В2.
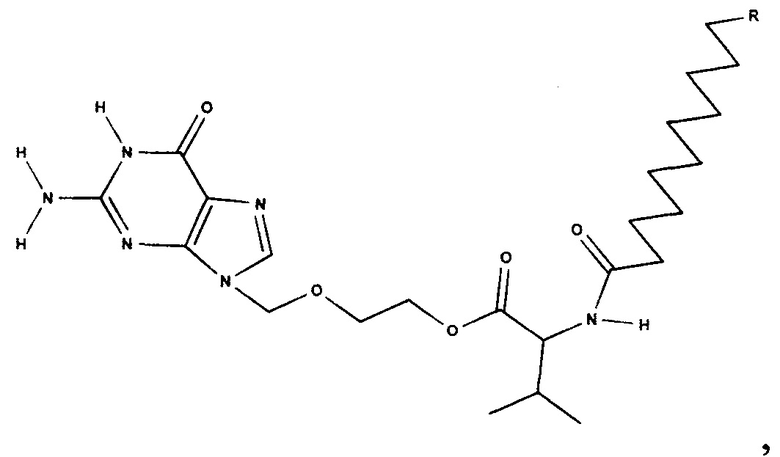
Для решения поставленной задачи предложены соединения со следующей структурной формулой:
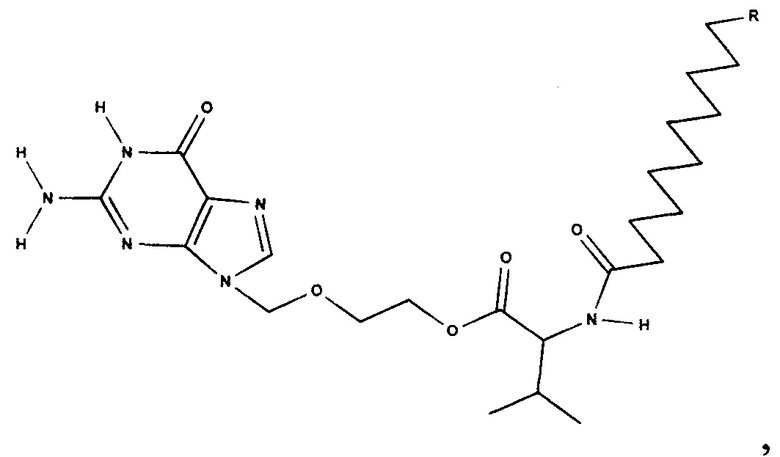
В качестве R может быть использован С1-С6 алкил. «Алкил» означает алифатическую углеводородную линейную группу с 1-6 атомами углерода в цепи.
Изобретение может быть проиллюстрировано примерами его осуществления, подтверждающими промышленную применимость и способствующими более точному и полному пониманию его сути. Специалисту в данной области очевидны возможные модификации и замены, которые не выходят за рамки объема притязаний, указанных в формуле изобретения. Приведенные примеры подтверждают, но не ограничивают заявленное изобретение.
Пример 1. Способ получения Nα-пальмитоил-валацикловира.
В трехгорлую плоскодонную колбу емкостью 200 мл, снабженную магнитным перемешивающим элементом в тефлоновой оболочке, погружным термометром, капельной воронкой и хлоркальциевой трубкой, поместили 7,40 г (0,020 моля) валацикловира гидрохлорида и добавили 25 мл N-метилпирролидона. При этом, взятый валацикловир гидрохлорид практически полностью растворился. После этого колбу с содержимым погрузили в охлаждающую баню со льдом и реакционную смесь охладили до ~5°С. Далее к реакционной смеси при энергичном перемешивании добавили 4,20 г (0,0415 моля) триэтиламина, наблюдая при этом выпадение белого осадка гидрохлорида триэтиламина, после чего из капельной воронки медленно, по каплям стали прибавлять 5,61 г (0,020 моля) пальмитоилхлорида, следя за тем, чтобы температура реакционной смеси не поднималась выше 7°С. Прибавление хлорангидрида пальмитиновой кислоты продолжалось в течение 20 минут. После завершения прибавления пальмитоилхлорида реакционную смесь перемешивали при температуре 5-7°С еще в течение получаса, а затем охлаждающую баню убрали, температуру реакционной смеси довели до комнатной и смесь перемешивали в этих условиях еще 2 часа. Далее содержимое реакционной колбы количественно перенесли при перемешивании в стакан, содержащий 250 мл деионизированной воды. После этого выпал обильный творожистый осадок белого цвета, который отфильтровали на фильтр со стеклянной пористой пластинкой. Осадок на фильтре тщательно промыли водой (3×15 мл) и высушили до постоянного веса в вакуум-эксикаторе (при остаточном давлении 1 мм ртутного столба) над пятиокисью фосфора. В итоге получили 11,27 г белого мелкокристаллического вещества (рассчитанный теоретический выход целевого пальмитоил-валацикловира 11,25 г), которое по данным элементного анализа, ЯМР и ИК-спектроскопии представляло собой желаемый Nα-пальмитоил-валацикловир с небольшой (~5%) примесью Nα-пальмитоил-валина (что можно было ожидать с учетом того, что исходный валацикловира гидрохлорид содержал по данным ЯМР-спектроскопии примесь гидрохлорида валина).
Для очистки продукт реакции перекристаллизовали из смеси тетрагидрофуран-диметилформамид. После перекристаллизации получили 5,65 г мелкокристаллического вещества белого цвета, которое по результатам: элементного анализа (см. табл. 1), ЯМР и ИК- спектроскопии было идентифицировано как Nα-пальмитоил-валацикловир.

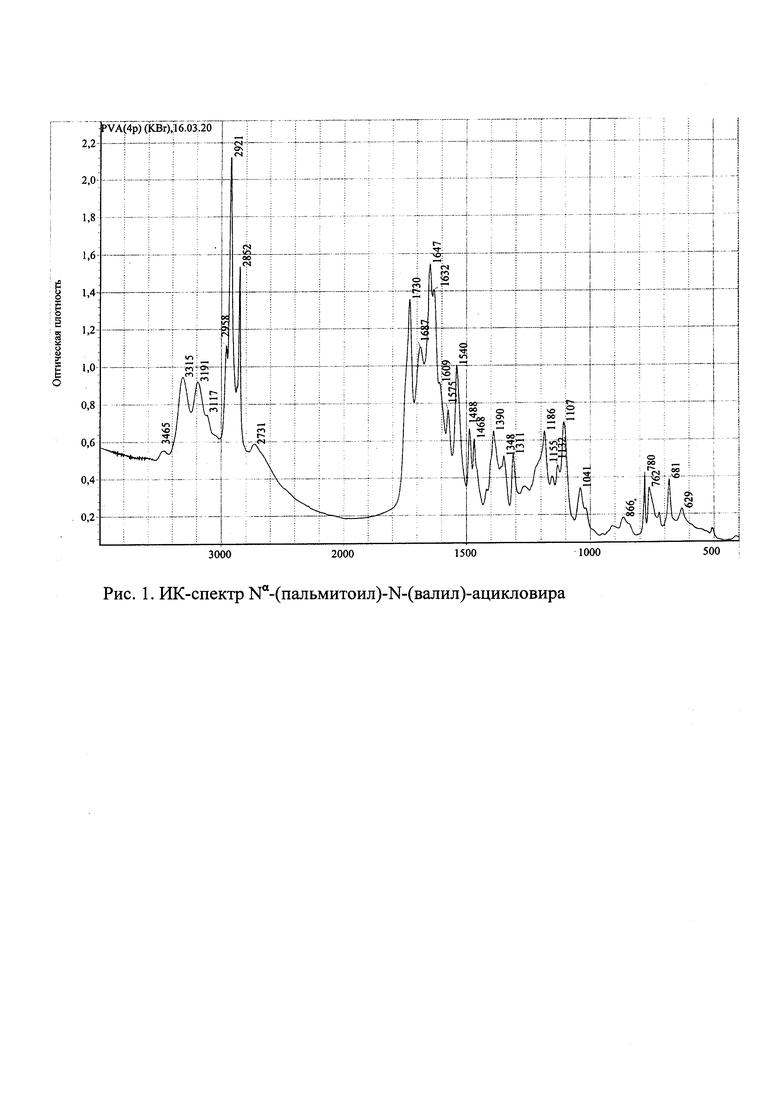
ИК-спектр Nα-пальмитоил-валацикловира (для таблетки с KBr) представлен на рис. 1: небольшой сглаженный пик в области 3465 см-1 (обертон валентных колебаний сложноэфириого карбонила); полоса поглощения средней интенсивности с максимумом 3315 см-1 (валентные колебания N-H гуанидиновой группировки ацикловира); полоса поглощения средней интенсивности 3191 см-1 (валентные колебания N-H амидной группы пальмитоил-валацикловира); узкий неразрешенный пик средней интенсивности 2958 см-1 и узкий интенсивный пик 2921 см-1 (валентные колебания С-Н метальной группы); очень узкий интенсивный пик 2852 см-1 (валентные колебания С-Н метиленовых групп); небольшой сглаженный пик 2731 см-1 (обертон деформационных колебаний ОН); узкий интенсивный пик 1730 см-1 (валентные колебания сложноэфирной карбонильной группы: С=O валацикловира); узкий неразрешенный пик средней интенсивности 1687 см-1 и довольно интенсивные полосы поглощения 1647 см-1 и 1632 см-1 (валентные колебания карбонильных групп амидных группировок пальмитоил-валацикловира - полоса Амид I); узкий неразрешенный пик малой интенсивности 1575 см-1 и узкий пик средней интенсивности 1540 см-1 (деформационные колебания: N-H амидных групп пальмитоил-валацикловира - полоса Амид II); частокол узких полос поглощения в области 1488, 1468, 1390, 1348 и 1311 см-1 (деформационные колебания С-Н); частокол полос поглощения малой и средней интенсивности 1186, 1155, 1132 и 1107 см-1 (валентные колебания С-O связей).
Структурная формула Nα-пальмитоил-валацикловира:
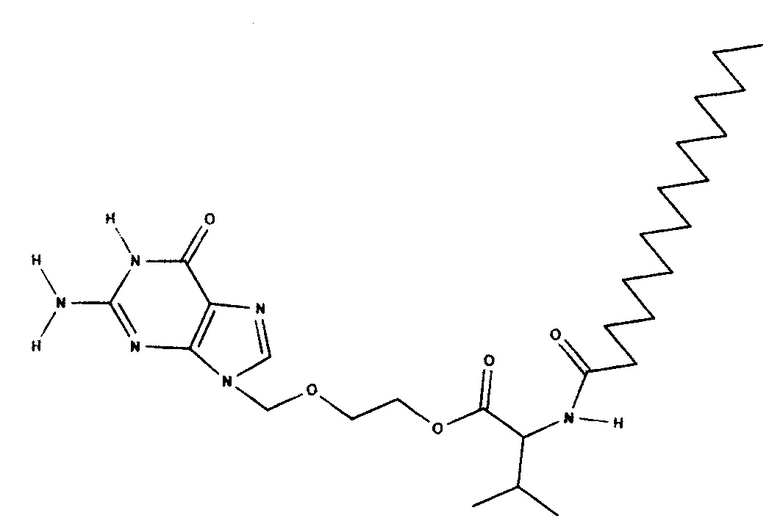
ЯМР-спектр Н1 Nα-пальмитоил-валацикловира был записан на приборе Bruker AVANCE 400 с максимальной рабочей частотой 400 Мгц и величиной магнитного поля 9,37 Т в растворе de-DMSO с примерной концентрацией 40 мг на 0,9 мл.
Уточненные численные величины химических сдвигов были получены путем коррекции наблюдаемых сигналов с сигналом DMSO в спектре и приведены в ррш, фазовая корректировка не проводилась. δH (400MHz, d6-DMSO): 10.66 (s, 1H, H7); 8.03 (d, J 7.6 Hz, 1H, H20); 7.81 (s, 1H, H2), 6.54 (s, 2H, H21); 5.35 (s, 2H, H10); 4.22 (d, J 11.6 Hz, 1H, H13a); 4.12 (dd, J1 6.8 Hz, J2 6.8 Hz, 2H, H13b, H13); 3.66 (s, 2H, H12); 2.14 (dd, J1 6.8Hz, J2 7.6 Hz, J3 7.6 Hz, 2H, H36); 1.94 (dd, J1 6.4 Hz, J2 6.4 Hz, J3 6.4 Hz, 1H, H17); 1.58-1.38 (br s, 2H, H23); 1.38-1.06 (br s, 24H, H24-H35); 0.82 (dist t, J1 7.6 Hz, J2 3.6 Hz, 9H, H18, H19, H37).
δC (100MHz, d6-DMSO): 172.59 C22; 171.60 C15; 156.69 C8; 153.83 C6; 151.33 C4; 137.55 C2; 116.43 C9; 71.67 C10; 66.41 C13; 62.93 C12; 57.11 C16; 34.73 C23; 31.22 C35; 29.66 C17; 28.98 C28-C33; 28.89 C27; 28.68 C34; 28.64 C26; 28.50 C25; 25.21 C24; 22.02 C36; 18.77 C18; 18.01 C19; 13.86 C37.
Пример 2. Способ получения Nα-лауроил-валацикловира.
В соответствии с способом получения Nα-лауроил-валацикловира, приведенном в примере 1, для получения Nα-лауроил-валацикловира были произведены следующие действия: к охлажденному раствору 7,40 г (0,020 моля) полугидрата гидрохлорида валацикловира в 25 мл N-метилпирролидона прибавили при перемешивании сначала 4,20 г (0,0415 моля) триэтиламина, наблюдая при этом выпадение белого осадка гидрохлорида триэтиламина, а затем из капельной воронки стали медленно прибавлять 4,38 г (0,020 моля) лауроилхлорида, следя за тем, чтобы температура реакционной смеси находилась в пределах 5-7°С. После завершения прибавления лауроилхлорида и последующего перемешивания реакционной смеси сначала при охлаждении, а затем при комнатной температуре, реакционную суспензию количественно перенесли при перемешивании в 250 мл воды. Выпавший при этом белый творожистый осадок отфильтровали на фильтр со стеклянной пористой пластинкой, осадок на фильтре тщательно промыли водой и высушили в вакуум-эксикаторе над пятиокисью фосфора до постоянного веса. В итоге получили 10,14 г белого мелкокристаллического продукта (рассчитанный теоретический выход Nα-лауроил-валацикловира - 10,12 г), который очищали перекристаллизацией из смеси тетрагидрофуран-диметилформамид. В результате перекристаллизации получили 6,02 г белого порошкообразного продукта, который по данным элементного анализа и ЯМР-спектроскопии был идентифицирован как целевой Nα-лауроил-валацикловир.

Структурная формула Nα-лауроил-валацикловира:
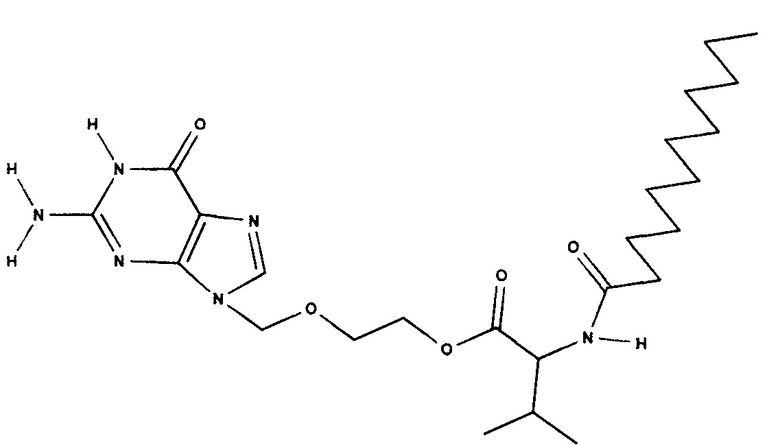
ЯМР-спектр Н1 Nα-лауроил-валацикловира был записан на приборе Bruker AVANCE 400 с максимальной рабочей частотой 400 Мгц и величиной магнитного поля 9,37 Т. в растворе de-DMSO с примерной концентрацией 40 мг на 0,9 мл.
Уточненные численные величины химических сдвигов были получены путем коррекции наблюдаемых сигналов с сигналом DMSO в спектре и приведены в ppm, фазовая корректировка не проводилась. δH (400MHz, d6-DMSO): 10.66 (br. s, 1H, H6); 8.02 (d, J 7.6 Hz, 1H, H20); 7.81 (s, 1H, H2), 6.54 (s, 2H, H21); 5.35 (s, 2H, H10); 4.21 (dist d, J 11.6 Hz, 1H, H13a); 4.12 (dist dd, JH16 6.0 Hz, JH13 11.8 Hz, 2H, H13b, H16); 3.66 (s, 2H, H12); 2.13 (quart, J1 7.3Hz, J2 15.0 Hz, 2H, H23); 1.94 (m, J1 6.32 Hz, J2 12.61 Hz, 1H, H17); 1.58-1.38 (br. s, 2H, H24); 1.38-1.06 (br. s, 16H, H25-H32); 0.82 (dist t, J ~3.6 Hz, 9H, H18, H19, H33).
δC (100MHz, d6-DMSO): 172.59 C22; 171.60 C15; 156.69 C5; 153.83 C7; 151.33 C9; 137.55 C2; 116.43 C4; 71.67 C10; 66.41 С13; 62.93 C12; 57.11 C16; 33.56 C23; 31.34 C31; 29.66 C17; 29.03 C28-C29; 28.87 C27; 28.77 C30; 28.69 C26; 28.50 C25; 24.10 C24; 22.11 C32; 18.77,18.01 C18, C19; 13.48 C33.
Пример 3. Способ получения Nα-миристоил-валацикловира.
В соответствии с способами получения, приведенным в примерах 1 и 2: при использовании в качестве ацилирующего агента 4,94 г (0,020 моля) хлорангидрида миристиновой кислоты (миристоилхлорида) получили 10,72 г белого порошкообразного продукта (рассчитанный теоретический выход Nα-миристоильного производного валацикловира = 10,68 г), перекристаллизация которого из смеси тетрагидрофуран-диметилформамид дала 5,84 г мелкокристаллического вещества белого цвета, которое по данным элементного анализа и ЯМР-спектроскопии было идентифицировано как целевой продукт - Nα-миристоил-валацикловир.
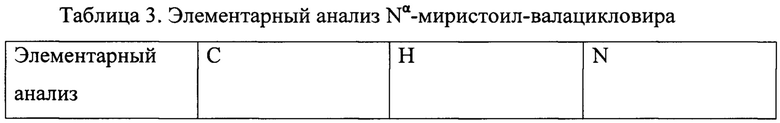
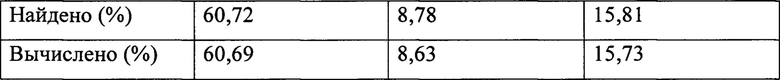
Структурная формула Nα-миристоил-валацикловира:
ЯМР-спектр Н1 Nα-миристоил-валацикловира был записан на приборе Bruker AVANCE 400 с максимальной рабочей частотой 400 Мгц и величиной магнитного поля 9,37 Т. в растворе de-DMSO с примерной концентрацией 40 мг на 0,9 мл.
Уточненные численные величины химических сдвигов были получены путем коррекции наблюдаемых сигналов с сигналом DMSO в спектре и приведены в ppm, фазовая корректировка не проводилась.
δH (400MHz, (d6-DMSO): 10.66 (br. s, 1H, H6); 8.02 (d, J 7.6 Hz, 1H, H20); 7.81 (s, 1H, H2), 6.54 (s, 2H, H21); 5.35 (s, 2H, Н10); 4.21 (dist d, J 11.6 Hz, 1H, H13); 4.12 (dist dd, JH13 6.0 Hz, JH13 11.8 Hz, 2H, H13b, H16); 3.66 (s, 2H, H12); 2.13 (quart, J1 7.3Hz, J2 15.0 Hz, 2H, H23); 1.94 (m, J1 6.32 Hz, J2 12.61 Hz, 1H, H17); 1.58-1.38 (br. s, 2H, H24); 1.38-1.06 (br. s, 20H, H25-H34); 0.82 (dist t, J ~3.6 Hz, 9H, H18, H19, H35).
δC (100MHz, d6-DMSO): 172.59 C22; 171.60 C15; 156.69 C5; 153.83 C7; 151.33 C9; 137.55 C2; 116.43 C4; 71.67 C10; 66.41 C13; 62.93 C12; 57.11. C16; 33.55 C23; 31.34 C33; 29.66 C17; 29.07 C25-C28; 28.84 C29 28.77 C30; 28.66 C31; 28.48 C32; 24.09 C24; 22.09 C34; 18.77,18.01 C18, C19; 13.47 C35.
Пример 4. Способ получения Nα-стеароил-валацикловира.
В соответствии с способами получения, приведенным в примерах 1 и 2: при использовании в качестве ацилирующего агента 6,06 г (0,020 моля) хлорангидрида стеариновой кислоты (стеароилхлорида) получили 11,84 г белого комковатого продукта (рассчитанный теоретический выход Nα-стеароильного производного валацикловира - 11,80 г), перекристаллизация которого из смеси тетрагидрофуран-диметилформамид дала 6,5 г мелкокристаллического порошкообразного продукта белого цвета, который по данным элементного анализа и ЯМР-спектроскопии был идентифицирован как целевой продукт - Nα-стеароил-валацикловир.

Структурная формула Nα-стеароил-валацикловира:
ЯМР-спектр Н1 Nα-стеароил-валацикловира был записан на приборе Bruker AVANCE 400 с максимальной рабочей частотой 400 Мгц и величиной магнитного поля 9,37 Т. в растворе de-DMSO с примерной концентрацией 40 мг на 0,9 мл.
Уточненные численные величины химических сдвигов были получены путем коррекции наблюдаемых сигналов с сигналом DMSO в спектре и приведены в ррт, фазовая корректировка не проводилась.
δH (400MHz, d6-DMSO): 10.66 (br. s, 1H, H6); 8.02 (d, J 7.6 Hz, 1H, H20); 7.81 (s, 1H, H2), 6.54 (s, 2H, H21); 5.35 (s, 2H, H10); 4.21 (dist d, J 11.6 Hz, 1H, H13a); 4.12 (dist dd, JH16 6.0 Hz, JH13 11.8 Hz, 2H, H13b, H16); 3.66 (s, 2H, H12); 2.13 (quart, J1 7.3Hz, J2 15.0 Hz, 2H, H23); 1.94 (m, J1 6.32 Hz, J2 12.61 Hz, 1H, H17); 1.58-1.38 (br. s, 2H, H24); 138- 1.06 (br. s, 28H, H25-H38); 0.82 (dist t, J ~3.6 Hz, 9H, H18, H19, H39).
δC (100MHz, d6-DMSO): 172.59 C22; 171.60 C15; 156.69 C5; 153.83 C7; 151.33 C9; 137.55 C2; 116.43 C4; 71.67 С10; 66.41 C13; 62.93 C12; 57.11 C16; 33.57 C23; 31.39 C37; 29.66 C17; 29.13 C28-C35; 28.89 C27; 28.83 C36; 28.69 C26; 28.53 C25; 24.12 C24; 22.12 C38 18-77, 18.01 C18, C19; 13.47 C39.
| название | год | авторы | номер документа |
|---|---|---|---|
| Анелированные 9-гидрокси-1,8-диоксо-1,3,4,8-тетрагидро-2Н-пиридо[1,2-a]пиразин-7-карбоксамиды - ингибиторы интегразы ВИЧ, способы их получения и применения | 2019 |
|
RU2717101C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИСПИРОИНДОЛИНОНОВ | 2018 |
|
RU2682678C1 |
| НОВЫЕ ДИСПИРО-ИНДОЛИНОНЫ, ИНГИБИТОРЫ MDM2/p53 ВЗАИМОДЕЙСТВИЯ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2015 |
|
RU2629750C2 |
| Способ получения пептида Ac-His-Ala-Glu-Glu-NH | 2021 |
|
RU2767030C1 |
| ПРОИЗВОДНОЕ ЦИНКОВОГО МЕТАЛЛОКОМПЛЕКСА ХЛОРИНА-e И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2691754C1 |
| Дихлорацетаты замещенных N4-[2-(диметилфосфорил)фенил]-N2-(2-метокси-4-пиперидин-1-илфенил)-5-хлорпиримидин-2,4-диаминов в качестве модуляторов ALK и EGFR, предназначенных для лечения рака | 2015 |
|
RU2606951C1 |
| СОЕДИНЕНИЕ ПЕПТИДНОЙ ПРИРОДЫ, ОБЛАДАЮЩЕЕ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С ПСМА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2823164C2 |
| ПИРАЗОЛ-ЗАМЕЩЕННЫЕ ПИРИДИНЫ С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2022 |
|
RU2823567C2 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе производных пентафуранозилнуклеозидов | 2019 |
|
RU2748103C1 |
| Хиральные 18-сульфопроизводные дегидроабиетана и способ их получения | 2020 |
|
RU2726793C1 |
Изобретение относится к области химии, конкретно к новым производным гуанина указанной ниже формулы, которые могут найти применение в качестве противовирусных средств. В формуле R представляет собой С1-С6 алкил. 4 табл., 4 пр., 1 ил.
Производные гуанина, представляющие собой соединения формулы
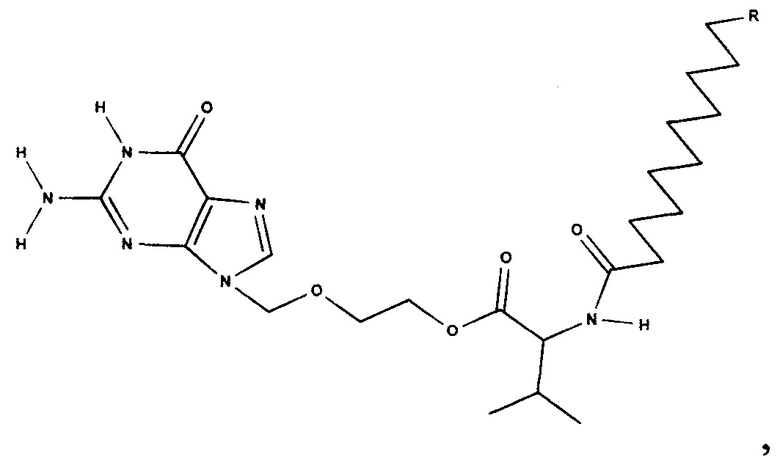 ,
,
где R представляет собой С1-С6 алкил.
| Способ получения производных гуанина или их кислотно-аддитивных фармацевтически приемлемых солей | 1988 |
|
SU1634138A3 |
| US 7629461 B2, 08.12.2009 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| (3S)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин и (3R)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин, обладающие противовирусной активностью | 2016 |
|
RU2644351C1 |
Авторы
Даты
2021-07-05—Публикация
2020-05-18—Подача