Область техники, к которой относится настоящая заявка
Настоящее изобретение относится к новым пиразол-замещенным пиридинам с противораковой активностью, к их применению для лечения рака, а также к фармацевтической композиции, содержащей указанные соединения.
Уровень техники
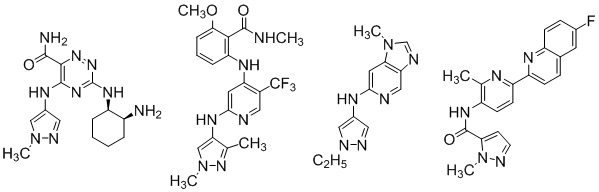
Пиразолы являются хорошо известными фармакофорами, которые проявляют широкий спектр биологической активности, в частности, противовирусную [Документ 1], противовоспалительную [Документ 2] противосудорожную [Документ 3] противогрибковую [Документ 4] а также противораковую [Документ 5]. Несколько биологически активных пиразол замещенных 1,2,4-триазинов [Документ 6] и пиридинов [Документы 7 и 8] показаны ниже.
Сущность изобретения
В первом аспекте настоящее изобретение относится к соединениям формулы (I) и их фармацевтически приемлемым солям:
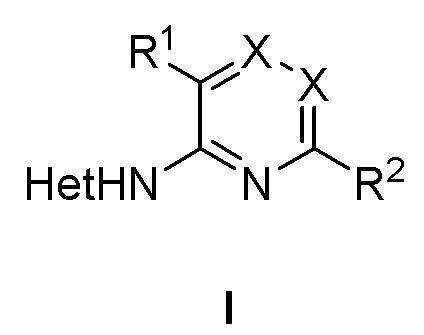
где в формуле (I)
R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
R2 представляет собой С1-6 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
каждый Х представляет собой N или CH; и
Het представляет собой пиразолил.
В предпочтительном варианте соединение формулы (I) представляет собой соединение формулы (Ia)
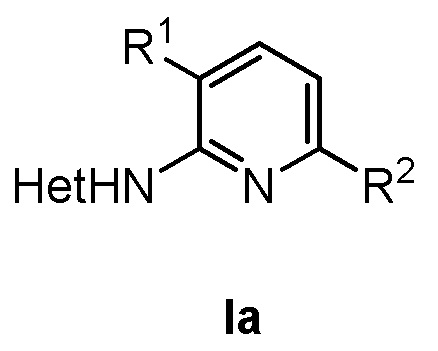
где в формуле (Ia)
R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
R2 представляет собой С1-6 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; и
Het представляет собой пиразолил.
В предпочтительном варианте осуществления в формуле (I)
R1 представляет собой фенил, 4-бромфенил, толил или 4-метоксифенил;
R2 представляет собой метил, тиофенил, фуранил, пирролил, пиридил, фенил, 4-хлорфенил, 4-метоксифенил или толил;
Х представляет собой CH; и
Het представляет собой пиразол-4-ил.
В предпочтительном варианте соединение формулы (I) выбрано из группы, состоящей из следующих соединений:
3-(4-бромфенил)-6-(4-хлорфенил)-N-(пиразол-4-ил)-пиридин-2-амин
3-фенил-N-(пиразол-4-ил)-6-p-толилпиридин-2-амин
3-(4-метоксифенил)-N-(пиразол-4-ил)-6-p-толилпиридин-2-амин
6-(4-метоксифенил)-N-(пиразол-4-ил)-3-p-толилпиридин-2-амин
6-(4-хлорфенил)-N-(пиразол-4-ил)-3-p-толилпиридин-2-амин
N-(пиразол-4-ил)-5-фенил-2,2′-бипиридин-6-амин
N-(пиразол-4-ил)-5-p-толил-2,2′-бипиридин-6-амин
5-(4-метоксифенил)-N-(пиразол-4-ил)-2,2′-бипиридин-6-амин
6-(фуран-2-ил)-3-фенил-N-(пиразол-4-ил)пиридин-2-амин
3-фенил-N-(пиразол-4-ил)-6-(тиофен-2-ил)пиридин-2-амин
3-фенил-N-(пиразол-4-ил)-6-(1H-пиррол-2-ил)пиридин-2-амин и
6-метил-3-фенил-N-(пиразол-4-ил)пиридин-2-амин.
Соединения настоящего изобретения могут образовывать фармацевтически приемлемые соли с подходящими анионами или катионами. Примерами кислот, которые могут давать подходящий анион, могут быть хлороводородная, бромоводородная, йодоводородная, серная, фосфорная, метансульфоновая, толуолсульфоновая кислоты.
Примерами подходящий оснований, которые могут давать подходящий анион, могут быть гидрокссид натрия, гидроксид калия, гидроксид аммония, траэтиамин.
Во втором аспекте настоящее изобретение относится к фармацевтической композиции, содержащей эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, наполнитель или разбавитель.
Данная композиция может быть использована для лечения пролиферативных заболеваний, таких как рак. В конкретном варианте рак выбирают из глиобластомы, рака молочной железы, рака печени.
В третьем аспекте настоящее изобретение относится к способу синтеза соединений формулы (Ia), включающему нагревание соединения формулы (Ib) с источником ацетилена в соответствии со схемой
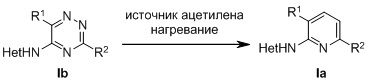 ,
,
где в формуле (Ia) и в формуле (Ib)
R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
R2 представляет собой С1-6 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; и
Het представляет собой пиразолил.
В предпочтительном варианте температура реакции составляет 180-250°С, более предпочтительно 200-240°С, и наиболее предпочтительно около 215°С.
Нагревание можно проводить в любом подходящем высококипящем растворителе, таком как галогенированный бензол, в частности, дихлорбезол, такой как о-дихлорбензол, п-дихлорбензол или м-дихлорбензол.
Реакция может проводится при атмосферном давлении или, в случае если температура реакции превышает температуру кипения выбранного растворителя, то реакция может проводится под давлением, превышающем атмосферное давление. Без ограничения давление может быть таким, которое применяется в данной области техники, например, от 1 до 50 атмосфер, предпочтительно от 1 до 25 атмосфер или от 1 до 10 атмосфер.
Реакция может проводится в воздушной атмосфере или в атмосфере инертного газа, такого как азот, аргон или любой другой инертный газ.
Время реакции может составлять от 30 минут до 72 часов, в частности, от 3 часов до 50 часов, от 10 до 40 часов, наиболее предпочтительно около 36 часов.
В четвертом аспекте настоящее изобретение относится к соединению формулы (Ib)
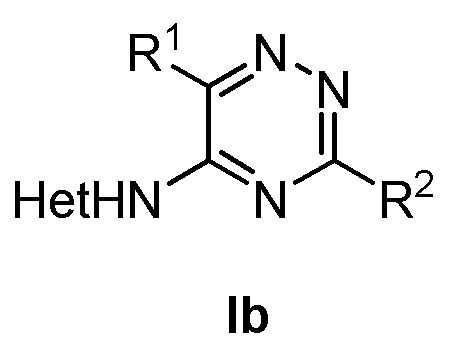
где в формуле (Ib)
R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
R2 представляет собой С1-6 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси.
Примеры
Все реагенты были приобретены из коммерческих источников и использовались без дополнительной очистки. Для колоночной хроматографии использовали силикагель 60 (Kieselgel 60, 230-400 меш). Спектры ЯМР регистрировали на спектрометре Bruker Avance-400, 298 K, цифровое разрешение ± 0,01 м.д., с использованием ТМС в качестве внутреннего стандарта и (спектрометр Bruker Avance-600, 298 K, цифровое разрешение ± 0,01 м.д., с использованием остаточных сигналов растворителя в качестве внутреннего стандарта). УФ-Vis спектры регистрировали на спектрофотометре Lambda 45 (Perkin Elmer). Масс-спектрометрические исследования проводили на квадрупольном времяпролетном масс-спектрометре Agilent 6545 Q-TOF LC/MS (Agilent Technologies, США) с источником ионизации электрораспылением в режиме положительных (отрицательных) ионов. Для ввода образца использовалась хроматографическая система Agilent 1290 Infinity II. Элементный анализ проводили на CHN-анализаторе РЕ 2400 II (Perkin Elmer).
XRD-анализ проводили на оборудовании Центра коллективного пользования "Спектроскопия и анализ органических соединений" Института органического синтеза имени Постовского Российской академии наук (Уральское отделение). Эксперименты проводились на автоматизированном рентгеновском дифрактометре "Xcalibur 3" с CCD детектором по стандартной методике (МоКα-облучение, графитовый монохроматор, ω-сканы с шагом 1° при Т= 295(2) К). Применялась эмпирическая коррекция поглощения. Определение и уточнение структур проводилось с использованием пакета программ Olex. Неразрешенный сольват обрабатывался с помощью маски растворителя. Структуры были определены методом собственных фаз в программе ShelXT и уточнены в ShelXL полноматричным методом наименьших квадратов для неводородных атомов. Н-атомы на связях С-Н были помещены в расчетные позиции, Н-атомы на связях N-H были уточнены независимо в изотропном приближении.
Соединения формулы (II) были получены по следующей схеме
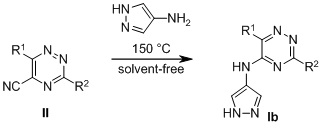
Пример 1. Синтез 6-арил-1,2,4-триазин-5-карбонитрилов формулы (II)
6-Арил-1,2,4-триазин-5-карбонитрилы формулы (II) были получены по описанной ранее методике [Документ Д9]
6-(4-Бромфенил)-3-(4-хлорфенил)-5-циано-1,2,4-триазин (Исходное Соединение 1). Выход 1120 мг (3.01 ммоль, 60%). 1Н ЯМР (400 МГц, CDCl3): δ 7.58-7.63 (м, 2H, CHarom), 8.54-8.60 (м, 2H, CHarom), 7.79-7.85 (м, 2H, CHarom), 8.01-8.08 (м, 2H, CHarom). ESI-MS, m/z: найдено 370.96, вычислено 370.97 (М+Н)+. Найдено, %: C 51.59, H 2.13, N 15.23. C16H8BrClN4. Вычислено, %: C 51.71, H 2.17, N 15.08.
6-Фенил-3-(p-толил)-5-циано-1,2,4-триазин (Исходное Соединение 2). Выход 750 мг (2.75 ммоль, 55%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.46 (с, 3H, Me), 7.48-7.50 (м, 2H, Tol), 7.69-7.71 (м, 3H, Ph), 8.06-8.08 (м, 2H, Ph), 8.39-8.41 (м, 2H, Tol). ESI-MS, m/z: найдено 273.11, вычислено 273.11 (М+Н)+. Найдено, %: C 74.98, H 4.44, N 20.58. C17H12N4. Вычислено, %: C 74.92, H 4.39, N 20.51.
6-(4-Метоксифенил)-3-(p-толил)-5-циано-1,2,4-триазин (Исходное Соединение 3). Выход 780 мг (2.58 ммоль, 51%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.49 (с, 3H, C6H4Me), 3.94 (с, 3H, MeO), 7.16-7.21 (м, 2H, C6H4MeO), 8.05-8.10 (м, 2H, C6H4MeO), 7.38-7.43 (м, 2H, C6H4MeO), 8.38-8.44 (м, 2H, C6H4Me). ESI-MS, m/z: найдено 303.12, вычислено 303.12 (М+Н)+. Найдено, %: C 71.64, H 4.63, N 18.68. C18H14N4O. Вычислено, %: C 71.51, H 4.67, N 18.53.
3-(4-Метоксифенил)-6-(p-толил)-5-циано-1,2,4-триазин (Исходное Соединение 4). Выход 850 мг (2.81 ммоль, 56%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.50 (с, 3H, C6H4Me), 3.92 (с, 3H, MeO), 7.12-7.19 (м, 2H, C6H4MeO), 8.43-8.50 (м, 2H, C6H4MeO), 7.44-7.50 (м, 2H, C6H4MeO), 7.93-8.00 (м, 2H, C6H4Me). ESI-MS, m/z: найдено 303.12, вычислено 303.12 (М+Н)+. Найдено, %: C 71.43, H 4.59, N 18.40. C18H14N4O. Вычислено, %: C 71.51, H 4.67, N 18.53.
3-(4-Хлорфенил)-6-(p-толил)-5-циано-1,2,4-триазин (Исходное Соединение 5). Выход 900 мг (2.93 ммоль, 59%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.46 (с, 3H, C6H4Me), 7.49-7.54 (м, 2H, C6H4Cl), 8.47-8.52 (м, 2H, C6H4Cl), 7.72-7.77 (м, 2H, C6H4Me), 7.96-8.01 (м, 2H, C6H4Me). ESI-MS, m/z: найдено 307.08, вычислено 307.08 (М+Н)+. Найдено, %: C 66.42, H 3.83, N 18.42. C17H11ClN4. Вычислено, %: C 66.56, H 3.61, N 18.26.
6-Фенил-3-(2-пиррол-2-ил)-5-циано-1,2,4-триазин (Исходное Соединение 6). Выход 720 мг (2.91 ммоль, 58%). 1Н ЯМР (400 МГц, DMSO-d6): 6.29-6.34 (м, 1H, пиррол), 7.10-7.14 (м, 1H, пиррол), 7.19-7.22 (м, 1H, пиррол), 7.61-7.67 (м, 3H, Ph), 7.98-8.03 (м, 2H, Ph), 12.25 (уш. с, 1H, NH). ESI-MS, m/z: найдено 248.09, вычислено 248.09 (М+Н)+. Найдено, %: C 68.17, H 3.80, N 28.47. C14H9N5. Вычислено, %: C 68.01, H 3.67, N 28.32.
Пример 2. Синтез 5-ариламино-1,2,4-триазинов формулы Ib
Общая методика получения 5-ариламино-1,2,4-триазинов формулы Ib
Смесь соответствующего 5-циано-1,2,4-триазина 1 (0,3 ммоль) и соответствующего анилина (0,33 ммоль) перемешивали при 150 °C в течение 8 ч в атмосфере аргона. Продукты использовали на следующем этапе без дополнительной очистки. Аналитические образцы были получены методом флэш-хроматографии (смесь хлорформа и этилацетата (9:1) в качестве элюента, Rf 0,3).
6-(4-Бромфенил)-3-(4-хлорфенил)-N-(1H-пиразол-4-ил)-1,2,4-триазин-5-амин (Соединение 1). Выход 90 мг (0.21 ммоль, 70%). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.55-7.60 (м, 2H, C6H4Cl), 7.68-7.73 (м, 2H, C6H4Br), 7.73-7.78 (м, 2H, C6H4Br), 8.39-8.45 (м, 2H, C6H4Cl), 9.43 (уш. с, 1H, NH), 12.65 (уш. с, 1H, NH(пиразолил)). ESI-MS, m/z: найдено 427.00, вычислено 427.00 (М+Н)+.
6-Фенил-N-(1H-пиразол-4-ил)-3-p-толил-1,2,4-триазин-5-амин (Соединение 2). Выход 72 мг (0.22 ммоль, 73%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.46 (с, 3H, Me), 7.33-7.38 (м, 2H, C6H4Me), 7.54-7.62 (м, 3H, Ph), 7.74-7.79 (м, 2H, C6H4Me), 8.29-8.31 (м, 2H, Ph), 9.27 (уш. с, 1H, NH), 12.55 (уш. с, 1H, NH(пиразолил)). ESI-MS, m/z: найдено 329.15, вычислено 328.15 (М+Н)+.
6-(4-Метоксифенил)-N-(1H-пиразол-4-ил)-3-p-толил-1,2,4-триазин-5-амин (Соединение 3). Выход 71 мг (0.20 ммоль, 66%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.46 (с, 3H, C6H4Me), 3.91 (с, 3H, OMe), 7.09-7.15 (м, 2H, C6H4OMe), 7.32-7.38 (м, 2H, C6H4Me), 7.67-7.72 (м, 2H, C6H4Me), 8.26-8.32 (м, 2H, C6H4OMe), 9.20 (уш. с, 1H, NH), 12.52 (уш. с, 1H, NH(пиразолил)). ESI-MS, m/z: найдено 359.16, вычислено 359.16 (М+Н)+.
3-(4-Метоксифенил)-N-(1H-пиразол-4-ил)-6-p-толил-1,2,4-триазин-5-амин (Соединение 4). Выход 80 мг (0.22 ммоль, 74%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.48 (м, 3H, C6H4Me), 3.89 (с, 3H, OMe), 7.04-7.09 (м, 2H, C6H4OMe), 7.35-7.42 (м, 2H, C6H4Me), 7.62-7.67 (м, 2H, C6H4Me), 7.89-8.05 (м, 2H, CH (пиразолил)), 8.33-8.38 (м, 2H, C6H4OMe), 9.16 (уш. с, 1H, NH), 12.52 (уш. с, 1H, NH (пиразолил)). ESI-MS, m/z: найдено 359.16, вычислено 359.16 (М+Н)+.
3-(4-Хлорфенил)-N-(1H-пиразол-4-ил)-6-p-толил-1,2,4-триазин-5-амин (Соединение 5). Выход 73 мг (0.20 ммоль, 67%). 1Н ЯМР (400 МГц, DMSO-d6): δ 2.48 (с, 3H, Me), 7.38-7.42 (м, 2H, C6H4Cl), 7.55-7.59 (м, 2H, C6H4Me), 7.64-7.67 (м, 2H, C6H4Me), 7.75-8.28 (м, 2H, CH (пиразолил)), 8.39-8.42 (м, 2H, C6H4Cl, 9.35 (уш. с, 1H, NH)), 12.64 (уш. с, 1H, NH (пиразолил)). ESI-MS, m/z: найдено 363.11, вычислено 363.11 (М+Н)+.
6-Фенил-N-(1H-пиразол-4-ил)-3-(пиридин-2-ил)-1,2,4-триазин-5-амин (Соединение 6). Выход 70 мг (0.22 ммоль, 74%). 1Н ЯМР (400 МГц, CDCl3): δ 7.45-7.48 (м, 1H, H-5 (пиридил)), 7.60-7.66 (м, 3H, Ph), 7.79-7.84 (м, 2H, Ph), 7.90 (ддд, 1H, 3J = 7.6 Гц, 7.6 Гц, 4J = 1.8 Гц, H-4 (пиридил)), 8.14-8.24 (м, 2H, CH (пиразолил)), 8.58-8.62 (м, 1H, H-3 (пиридил)), 8.85-8.88 (м, 1H, H-6 (пиридил)). ESI-MS, m/z: найдено 316.13, вычислено 316.13 (М+Н)+.
N-(1H-пиразол-4-ил)-3-(пиридин-2-ил)-6-(p-толил)-1,2,4-триазин-5-амин (Соединение 7). Выход 67 мг (0.20 ммоль, 68%). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.38-7.44 (м, 2H, C6H4Me), 7.51-7.57 (м, 1H, H-5 (пиридил)), 7.68-7.74 (м, 2H, C6H4Me), 7.96-8.02 (м, 1H, H-4 (пиридил)), 8.47-8.52 (м, 1H, H-3 (пиридил)), 8.83-8.88 (м, 1H, H-6 (пиридил)), 9.46 (уш. с, 1H, NH), 12.53 (уш. с, 1H, NH (пиразолил)). ESI-MS, m/z: найдено 330.15, вычислено 330.15 (М+Н)+.
6-(4-Метоксифенил)-N-(1H-пиразол-4-ил)-3-(пиридин-2-ил)-1,2,4-триазин-5-амин (Соединение 8). Выход 79 мг (0.23 ммоль, 76%). 1Н ЯМР (400 МГц, DMSO-d6): δ 3.91 (с, 3H, OMe), 7.11-7.17 (м, 2H, C6H4OMe), 7.50-7.55 (м, 1H, H-5 (пиридил)), 7.71-7.76 (м, 2H, C6H5OMe), 7.94-8.00 (м, 1H, H-4 (пиридил)), 8.44-8.49 (м, 1H, H-3 (пиридил)), 8.81-8.85 (м, 1H, H-6 (пиридил)), 9.45 (уш. с, 1H, NH), 12.54 (уш. с, 1H, NH(пиразолил)). ESI-MS, m/z: найдено 346.14, вычислено 346.14 (М+Н)+.
3-(Фуран-2-ил)-N-(1H-пиразол-4-ил)-6-фенил-1,2,4-триазин-5-амин (Соединение 9). Выход 67 мг (0.22 ммоль, 74%). 1Н ЯМР (500 МГц, DMSO-d6): δ 6.76 (дд, 1H, 3J = 3.4 Гц, 3.6 Гц, H-4 (фурил)), 7.40 (дд, 1H, 3J = 3.4 Гц, 4J = 0.8 Гц, H-3 (фурил)), 7.54-7.62 (м, 3H, Ph), 7.70-7.76 (м, 2H, Ph), 7.88-8.50 (м, 2H, CH (пиразолил)), 8.01-8.03 (м, 1H, H-5 (фурил)), 9.52 (уш. с, 1H, NH), 12.75 (уш. с, 1H, NH (пиразолил)). ESI-MS, m/z: найдено 305.12, вычислено 305.12 (М+Н)+.
6-Фенил-N-(1H-пиразол-4-ил)-3-(тиофен-2-ил)-1,2,4-триазин-5-амин (Соединение 10). Выход 64 мг (0.20 ммоль, 67%). 1Н ЯМР (500 МГц, DMSO-d6): δ 7.26-7.30 (м, 1H, H-4 (тиенил)), 7.55-7.63 (м, 3H, Ph), 7.70-7.76 (м, 2H, Ph), 7.82-7.85 (м, 1H, H-3 (тиенил)), 7.91 (м, 1H, CH (пиразолил)), 8.00-8.04 (м, 1H, H-5 (тиенил)), 8.23 (м, 1H, CH (пиразолил)), 9.51 (уш. с, 1H, NH), 12.77 (уш. с, 1H, NH (пиразолил)). ESI-MS, m/z: найдено 321.09, вычислено 321.09 (М+Н)+.
6-Фенил-N-(1H-пиразол-4-ил)-3-(пиррол-2-ил)-1,2,4-триазин-5-амин (Соединение 11). Выход 61 мг (0.20 ммоль, 67%). 1Н ЯМР (500 МГц, DMSO-d6): δ 6.24-6.27 (м, 1H, H-4 (пирролил)), 6.96-6.98 и 6.99-7.02 (оба м, 1H, H-3 (пирролил) и H-5 (пирролил)), 7.53-7.61 (м, 3H, Ph), 7.68-7.72 (м, 2H, Ph), 7.85 (м, 1H, CH (пиразолил)), 8.27 (м, 1H, CH (пиразолил)), 9.25 (уш. с, 1H, NH), 11.80 (уш. с, 1H, NH (пирролил)), 12.67 (уш. с, 1H, NH (пиразолил)). ESI-MS, m/z: найдено 304.13, вычислено 304.13 (М+Н)+.
3-Метил-6-фенил-N-(1H-пиразол-4-ил)-1,2,4-триазин-5-амин (Соединение 12). Выход 50 мг (0.20 ммоль, 66%). 1Н ЯМР (500 МГц, DMSO-d6): δ 2.55 (с, 3H, Me), 7.52-7.60 (м, 3H, Ph), 7.62-7.69 (м, 2H, Ph), 7.70-7.83 (м, 2H, CH (пиразолил)), 9.23 (уш. с, 1H, NH), 12.67 (уш. с, 1H, NH (пиразолил)). ESI-MS, m/z: найдено 253.12, вычислено 253.12 (М+Н)+.
Пример 3. Синтез N-(1H-пиразол-4-ил)-пиридин-2-аминов формулы Ia
Общая методика получения N-(пиразол-4-ил)-пиридин-2-аминов формулы Ia
Соответствующий 1,2,4-триазин формулы lb (0,35 ммоль) суспендировали в 1,2-дихлорбензоле (25 мл), затем добавили 2,5-норборнадиен (0,18 мл, 1,75 ммоль). Полученную смесь перемешивали в автоклаве при 215°С в течение 36 ч в атмосфере аргона. Растворитель удаляли выпариванием при пониженном давлении. Продукты выделяли с помощью колоночной хроматографии (смесь хлорформа и этилацетата (9:1) в качестве элюента, Rf 0,5). Аналитически чистые образцы были получены перекристаллизацией из этанола.
3-(4-Бромфенил)-6-(4-хлорфенил)-N-(1H-пиразол-4-ил)-пиридин-2-амин (Соединение 13). Выход 110 мг (0.26 ммоль, 74%). 1Н ЯМР (400 МГц, CDCl3): δ 6.37 (уш. с, 1H, NH), 7.24 (д, 1H, 3J = 8.0 Гц, H-5 (пиридил)), 7.38-7.42 (м, 2H, C6H4Cl), 7.44-7.49 (м, 3H, C6H4Br, H-4 (пиридил)), 7.68-7.73 (м, 2H, C6H4Cl), 7.95 (уш. с, 2H, CH (пиразолил)), 7.97-8.01 (м, 2H, C6H4Cl). 13C ЯМР (100 МГц, CDCl3): δ 109.7, 119.5, 121.5, 122.3, 124.3 (уш, 2C), 127.0, 127.8, 129.7, 131.7, 133.8, 135.1, 137.0, 137.3, 150.7, 153.2. ESI-MS, m/z: найдено 425.02, вычислено 425.02 (М+Н)+. Найдено, %: C 56.39, H 3.27, N 13.09. C20H14BrClN4. Вычислено, %: C 56.43, H 3.31, N 13.16.
3-Фенил-N-(1H-пиразол-4-ил)-6-p-толилпиридин-2-амин (Соединение 14). Выход 78 мг (0.24 ммоль, 68%). 1Н ЯМР (400 МГц, CDCl3): δ 2.42 (с, 3H, Me), 6.48 (уш. с, 1H, NH), 7.23 (д, 1H, 3J = 7.6 Гц, H-5 (пиридил)), 7.28-7.31 (м, 2H, C6H4Me), 7.43-7.47 (м, 2H, Ph, H-4 (пиридил)), 7.48-7.51 (м, 2H, Ph), 7.52-7.55 (м, 2H, Ph)) 7.93-7.95 (м, 2H, C6H4OMe), 7.96 (уш. с, 2H, CH (пиразолил)). 13C ЯМР (100 МГц, CDCl3): δ 21.3, 110.8, 121.2, 126.7 (2C), 128.2, 129.0, 129.5, 129.5, 130.9, 132.5, 136.9, 137.4, 138.3, 138.7, 151.4, 155.1. ESI-MS, m/z: найдено 327.16, вычислено 327.16 (М+Н)+. Найдено, %: C 77.30, H 5.47, N 17.03. C21H18N4. Вычислено, %: C 77.28, H 5.56, N 17.17.
3-(4-Метоксифенил)-N-(1H-пиразол-4-ил)-6-p-толилпиридин-2-амин (Соединение 15). Выход 82 мг (0.23 ммоль, 65%). 1Н ЯМР (400 МГц, CDCl3): δ 2.42 (с, 3H, Me), 3.89 (с, 3H, OMe), 6.48 (уш. с, 1H, NH), 7.04-7.07 (м, 2H, C6H4OMe), 7.20 (д, 1H, 3J = 8.0 Гц, H-5 (пиридил)), 7.27-7.30 (м, 2H, C6H4Me), 7.39-7.43 (м, 3H, C6H5Me, H-4 (пиридил)), 7.92-7.95 (м, 2H, C6H4OMe), 7.97 (с, 2H, C-H (пиразолил)). 13C ЯМР (100 МГц, CDCl3): δ 21.3, 55.4, 110.7, 115.0, 121.0, 124.1, 126.7 (2C), 129.4, 129.5, 130.2, 137.0, 138.2, 138.6, 151.7, 154.8, 159.5. ESI-MS, m/z: найдено 357.16, вычислено 357.17 (М+Н)+. Найдено, %: C 74.06, H 5.71, N 15.81. C22H20N4O. Вычислено, %: C 74.14, H 5.66, N 15.72.
6-(4-Метоксифенил)-N-(1H-пиразол-4-ил)-3-p-толилпиридин-2-амин (Соединение 16). Выход 86 мг (0.24 ммоль, 69%). 1Н ЯМР (400 МГц, CDCl3): δ 2.45 (с, 3H, Me), 3.88 (с, 3H, OMe), 6.49 (уш. с, 1H, NH), 6.99-7.03 (м, 2H, C6H4OMe), 7.18 (д, 1H, 3J = 8.0 Гц, H-5 (пиридил)), 7.32-7.35 (м, 2H, C6H4Me), 7.36-7.39 (м, 2H, C6H4Me), 7.41 (д, 1H, 3J = 8.0 Гц, H-4 (пиридил)), 7.95 (уш. с, 2H, CH (пиразолил)), 7.97-8.01 (м, 2H, C6H4OMe). 13C ЯМР (100 МГц, CDCl3): δ 21.7, 54.3, 109.2, 113.1, 119.8, 124.5 (уш, 2C), 127.0, 127.1, 127.9, 129.2, 131.5, 133.4, 137.0, 137.2, 150.6, 153.6, 159.2. ESI-MS, m/z: найдено 357.17, вычислено 357.17 (М+Н)+. Найдено, %: C 74.12, H 5.59, N 15.80. C22H20N4O. Вычислено, %: C 74.14, H 5.66, N 15.72. Данные для кристалла C22H20N4O (M = 356.42 г/моль): триклинная пространственная группа P-1, a = 5.5866(8) Å, b = 9.6159(13) Å, c = 19.475(3) Å α= 84.453(11)°, β = 86.310(11)°, γ = 73.684(12)°, V = 998.6(2) Å3, Z = 2, T = 295(2) K, μ(Mo Kα) = 0.075 мм-1, Dcalc = 1.185 г/см3, получено 9073 отражений (6.958° ≤ 2Θ ≤ 58.248°), 4740 независимых (Rint= 0.0719, Rsigma= 0.1431) которые были использованы во всех вычислениях. Итоговая R1= 0.0740, wR2= 0.1545 (I > 2σ (I)) и R1= 0.2077, wR2= 0.2265, GooF = 0.918.
6-(4-Хлорфенил)-N-(1H-пиразол-4-ил)-3-p-толилпиридин-2-амин (Соединение 17). Выход 76 мг (0.21 ммоль, 60%). 1Н ЯМР (400 МГц, CDCl3): δ 2.45 (с, 3H, Me), 6.52 (уш. с, 1H, NH), 7.18 (д, 1H, 3J = 7.6 Гц, H-5 (пиридил)), 7.31-7.40 (м, 4H, C6H4Me), 7.40-7.46 (м, 3H, C6H4Cl, H-4 (пиридил)), 7.88-7.94 (уш. с, 2H, CH (пиразолил)), 7.94-7.99 (м, 2H, C6H4Cl). 13C ЯМР (100 МГц, CDCl3): δ 20.3, 109.7, 120.9, 124.1 (уш, 2C), 127.0, 127.8, 127.8, 129.2, 129.3, 133.2, 133.5, 137.2, 137.2, 137.3, 151.0, 152.6. ESI-MS, m/z: найдено 361.12, вычислено 361.11 (М+Н)+. Найдено, %: C 69.86, H 4.71, N 15.51. C21H17ClN4. Вычислено, %: C 69.90, H 4.75, N 15.53.
N-(1H-Пиразол-4-ил)-5-фенил-2,2′-бипиридин-6-амин (Соединение 18). Выход 75 мг (0.24 ммоль, 68%). 1Н ЯМР (400 МГц, CDCl3): δ 6.48 (уш. с, 1H, NH), 7.28-7.32 (м, 1H, H-5′ (пиридил)), 7.44-7.48 (м, 1H, Ph), 7.49-7.57 (м, 5H, Ph, H-5 (пиридил)), 7.83 (ддд, 1H, 3J = 7.6 Гц, 3J = 7.6 Гц, 4J = 1.8 Гц, H-4 (пиридил)), 7.92 (д, 1H, 3J = 7.6 Гц, H-4 (пиридил)), 7.94-7.96 (уш. с, 2H, CH (пиразолил)), 8.34-8.37 (м, 1H, H-3′ (пиридил)), 8.68-8.70 (м, 1H, H-6′ (пиридил)). 13C ЯМР (100 МГц, CDCl3): δ 111.8, 121.0, 123.3, 123.4, 123.5, 125.5 (уш, 2C), 128.3, 129.0, 129.5, 136.9, 137.4, 138.6, 149.1, 151.8, 153.6, 156.6. ESI-MS, m/z: найдено 314.14, вычислено 314.14 (М+Н)+. Найдено, %: C 72.76, H 4.97, N 22.33. C19H15N5. Вычислено, %: C 72.83, H 4.82, N 22.35.
N-(1H-Пиразол-4-ил)-5-p-толил-2,2′-бипиридин-6-амин (Соединение 19). Выход 72 мг (0.22 ммоль, 63%). 1Н ЯМР (400 МГц, CDCl3): δ 2.45 (с, 3H, Me), 6.55 (уш. с, 1H, NH), 7.25-7.29 (м, 1H, H-5′ (пиридил)), 7.32-7.36 (м, 2H, C6H4Me), 7.38-7.42 (м, 2H, C6H4Me) 7.52 (д, 1H, 3J = 8.0 Гц, H-5 (пиридил)), 7.77-7.82 (м, 1H, H-4′ (пиридил)), 7.91 (д, 1H, 3J = 8.0 Гц, H-4 (пиридил)), 7.96 (уш. с, 2H, CH (пиразолил)), 8.35-8.38 (м, 1H, H-3′ (пиридил)), 8.68-8.71 (м, 1H, H-6′ (пиридил)). 13C ЯМР (100 МГц, CDCl3): δ 21.3, 111.8, 121.0, 123.4, 125.3, 125.4 (уш, 2C), 128.2, 128.9, 129.1, 130.2, 134.4, 136.9, 138.2, 138.5, 149.1, 151.9, 153.4, 156.7. ESI-MS, m/z: найдено 328.15, вычислено 328.16 (М+Н)+. Найдено, %: C 73.42, H 5.16, N 21.43. C20H17N5. Вычислено, %: C 73.37, H 5.23, N 21.39.
5-(4-Метоксифенил)-N-(1H-пиразол-4-ил)-2,2′-бипиридин-6-амин (Соединение 20). Выход 86 мг (0.25 ммоль, 71%). 1Н ЯМР (400 МГц, CDCl3): δ 3.91 (с, 3H, OMe), 6.51 (уш. с, 1H, NH), 7.06-7.10 (м, 2H, C6H4OMe), 7.29-7.32 (м, 1H, H-5' (пиридил)), 7.43-7.46 (м, 2H, C6H4OMe), 7.52 и 7.91 (оба д, 1H, 3J = 7.6 Гц, H-5 и H-4 (пиридил)), 7.83 (ддд, 1H, 3J = 7.6 Гц, 3J = 7.6 Гц, 4J = 1.6 Гц, H-4' (пиридил)), 7.97 (уш. с, 2H, CH (пиразолил)), 8.35-8.38 (м, 1H, H-3' (пиридил)), 8.69-8.72 (м, 1H, H-6' (пиридил)). 13C ЯМР (100 МГц, CDCl3): δ 111.9, 114.9, 121.0, 123.2, 123.4, 123.7, 125.4 (уш, 2C), 129.4, 130.2, 137.0, 138.5, 149.0, 152.0, 153.1, 156.5, 159.7. ESI-MS, m/z: найдено 344.15, вычислено 344.15 (М+Н)+. Найдено, %: C 69.92, H 4.96, N 20.43. C20H17N5O. Вычислено, %: C 69.96, H 4.99, N 20.40.
6-(Фуран-2-ил)-3-фенил-N-(1H-пиразол-4-ил)пиридин-2-амин (Соединение 21). Выход 69 мг (0.23 ммоль, 65%). 1Н ЯМР (500 МГц, CDCl3): δ 6.50 (уш. с, 1H, NH), 6.55 (дд, 1H, 3J = 3.4 Гц, 3.6 Гц, H-4 (фурил), 7.00-7.02 (м, 1H, H-3 (фурил)), 7.22 (д, 1H, 3J = 7.6 Гц, H-5 (пиридил)), 7.43 (д, 1H, 3J = 7.6 Гц, H-4(пиридил)), 7.45-7.50 (м, 3H, Ph), 7.51-7.56 (м, 3H, Ph, H-5 (фурил)), 7.98 (уш. с, 2H, CH (пиразолил)). 13C ЯМР (400 МГц, CDCl3): δ 108.2, 109.0, 111.9, 121.5, 123.7, 124.9 (уш, 2C), 128.2, 129.0, 129.5, 137.4, 138.1, 142.9, 146.7, 151.6, 154.3. ESI-MS, m/z: найдено 303.13, вычислено 303.12 (М+Н)+. Найдено, %: C 71.57, H 4.72, N 18.71. C18H15N4O. Вычислено, %: C 71.51, H 4.67, N 18.53.
3-Фенил-N-(1H-пиразол-4-ил)-6-(тиофен-2-ил)пиридин-2-амин (Соединение 22). Выход 73 мг (0.23 ммоль, 66%). 1Н ЯМР (500 МГц, CDCl3): δ 6.51 (уш. с, 1H, NH), 7.12 (дд, 1H, 3J = 5.0 Гц, 3.5 Гц, H-4 (тиенил)), 7.19 (д, 1H, 3J = 7.8 Гц, H-5 (пиридил)), 7.37 (дд, 1H, 3J = 5.0 Гц, 4J = 1.0 Гц, H-3 (тиенил), 7.40 (д, 1H, 3J = 7.8 Гц, H-4 (пиридил)), 7.43-7.49 (м, 3H, Ph), 7.51-7.55 (м, 2H, Ph), 7.57 (дд, 1H, 3J = 3.5 Гц, 4J = 1.0 Гц, H-3 (тиенил), 8.00 (уш. с, 2H, CH (пиразолил)). 13C ЯМР (400 МГц, CDCl3): δ 109.0, 121.4, 123.9, 124.9, 125.0, 126.7, 128.0, 128.2, 129.0, 129.2, 129.5, 137.4, 138.1, 145.8, 149.9, 151.3. ESI-MS, m/z: найдено 319.11, вычислено 319.10 (М+Н)+. Найдено, %: C 67.92, H 4.43, N 17.61. C18H14N4S. Вычислено, %: C 67.90, H 4.43, N 17.60.
3-Фенил-N-(1H-пиразол-4-ил)-6-(1H-пиррол-2-ил)пиридин-2-амин (Соединение 23). Выход 72 мг (0.24 ммоль, 68%). 1Н ЯМР (500 МГц, CDCl3): δ 6.29-6.33 (м, 2H, NH, H-4 (пирролил)), 6.68-6.73 (м, 1H, H-3 (пирролил)), 6.88-6.91 (м, 1H, H-5 (пирролил)), 7.07 (д, 1H, 3J = 7.8 Гц, H-5 (пиридил)), 7.37 (д, 1H, 3J = 7.8 Гц, H-4 (пиридил)), 7.39-7.45 (м, 1H, Ph), 7.45-7.54 (м, 4H, Ph), 7.78 (уш. с, 2H, CH (пиразолил)), 9.31 (уш. с, 1H, NH (пиразолил)). 13C ЯМР (400 МГц, CDCl3): δ 106.9, 108.7, 110.3, 119.4, 119.6, 123.4, 126.5 (уш, 2C), 128.0, 129.1, 129.5, 132.0, 137.7, 138.5, 148.0, 151.9. ESI-MS, m/z: найдено 302.15, вычислено 302.14 (М+Н)+. Найдено, %: C 71.71, H 5.03, N 23.26. C18H15N5. Вычислено, %: C 71.74, H 5.02, N 23.24.
6-Метил-3-фенил-N-(1H-пиразол-4-ил)пиридин-2-амин (Соединение 24). Выход 60 мг (0.24 ммоль, 69%). 1Н ЯМР (500 МГц, CDCl3): δ 2.52 (с, 1H, CH3), 6.38 (уш. с, 1H, NH), 6.65 (д, 1H, 3J = 7.6 Гц, H-5 (пиридил)), 7.28 (д, 1H, 3J = 7.5 Гц, H-4 (пиридил)), 7.41-7.46 (м, 3H, Ph), 7.49-7.53 (м, 2H, Ph), 7.90 (уш. с, 2H, CH (пиразолил)). 13C ЯМР (400 МГц, CDCl3): δ 24.3, 113.2, 119.7, 123.8, 125.0, 125.1, 127.9, 129.1, 129.4, 137.8, 137.9, 151.5, 156.1. ESI-MS, m/z: найдено 251.13, вычислено 251.13 (М+Н)+. Найдено, %: C 71.96, H 5.63, N 22.36. C15H14N4. Вычислено, %: C 71.98, H 5.64, N 22.38.
Пример 3. Молекулярный докинг
Поскольку некоторые пиридины и 1,2,4-триазины, присоединенные к пиразолу, были заявлены в качестве кандидатов на противораковые препараты, эксперименты по молекулярному докингу были проведены с использованием моделей целевых белков JAK1, SYK и FAK1.
Молекулярный докинг проводился с использованием программного обеспечения ArgusLab 4.0.1. Предварительно из Protein Data Bank были выгружены комплексы белок-лиганд: [Документ 10].
1) SYK в виде комплекса с 1,2,4-триазиновым производным CHEMBL3416025[Документ 11] с активностью IC50 = 2...274 нМ (PDB ID: 4RX7) [Документ 12].
2) FAK1 в комплексе с 1,2,4-триазиновым производным CHEMBL2409605 с активностью IC50 = 400 нМ (PDB ID: 4C7T) [Документ 13].
3) JAK1 в комплексе с пиридиновым производным CHEMBL4640981 с активностью IC50 = 774 нМ (PDB ID:6 W8L) [Документ 14].
Во всех комплексах, после подготовки, протокол докинга был проверен путем редокинга нативных лигандов в качестве наномолярных ингибиторов.
Согласно результатам докинга, стандартное отклонение (RMSD) нативных лигандов в комплексах 4RX7, 4C7T, 6W8L составило 1,29, 0,97 и 1,08 Å, соответственно.
Результаты молекулярного докинга ряда изученных лигандов, подготовленные в программе DataWarrior [Документ 15], с рассчитанным количественным показателем активности - свободной энергией связывания (δG) и приведены в таблице 1.
Почти все соединения, согласно данным докинга, оказались более активными по сравнению с наномолярными ингибиторами целевых белков, использованными в качестве эталонных соединений.
Пример 4. Данные биологических испытаний
Клеточная культура
Противораковый анализ проводили на культивированных клетках глиобластомы человека (A-172, ATCC CRL 1620), протоковой карциномы молочной железы человека (Hs578T, ATCC HTB 126), карциномы печени человека (Hep G2, ATCC HB 8065) и эмбриональных почек человека (Hek-293, ATCC CRL 1573), полученных из Коллекции культур клеток позвоночных (Институт цитологии РАН, Санкт-Петербург). Клетки культивировали с использованием среды DMEM/F-12, содержащей 10% фетальной бычьей сыворотки при 37°C, 5% CO2 и 98% влажности. Субкультивирование с 0,25% раствором трипсина проводили, когда культура достигала ≥90% конфлюентности.
Оценка жизнеспособности
Соединения 14 и 24 растворяли в ДМСО. Растворы разбавляли культуральной средой DMEM/F-12 с 10% фетальной бычьей сывороткой до исследуемых концентраций: 8, 16, 32, 64, 128, 256, 512, 1024 мкМ. Во всех случаях концентрация ДМСО в конечном растворе не превышала 1%.
Клетки высевали в 96-луночные планшеты при концентрации 4 × 103 клеток на лунку. Через 24 часа в лунки добавляли тестовые соединения 14 и 24 в заданном диапазоне концентраций. Затем клетки инкубировали в течение 24 часов, после чего к культурам добавляли раствор МТТ (3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолия бромид) в количестве 20 мкл (5 мг/мл) в лунку. Через 2,5 часа среду удаляли из лунок и добавляли 200 мкл смеси ДМСО и изопропанола, 1:1. Оптическую плотность измеряли на планшетном спектрофотометре при длине волны 570 нм.
Статистический анализ
Статистическую обработку данных проводили в программе RStudio (версия 1.4.1106 © 2009-2021 RStudio, PBC) с использованием пакета R (версия 4.0.3). Индекс цитотоксичности (IC50) рассчитывали путем построения кривых "доза-ответ" с использованием пакета drc. Попарное сравнение проводили с использованием T-статистики с поправкой Хольма.
Поскольку соединения формулы Ia и формулы Ib обладают близкой структурой и, согласно расчетным данным (см. Таблицу 2) характеризуются близким сродством к ферментам, опосредующим противораковую активность, разумно предположить, что все заявленные соединения будут иметь заявленную активность.
Литература
[Документ 1] G. Ouyang, X.-J. Cai, Z. Chen, B.-A. Song, P. S. Bhadury, S. Yang, L.-H. Jin, W. Xue, D.-Y. Hu, S. Zeng, J. Agric. Food Chem. 2008, 56, 10160-10167.
[Документ 2] N. Gokhan-Kelekci, S. Yabanoglu, E. Kupeli, U. Salgin, O. Ozgen, G. Ucar, E. Yesilada, E. Kendi, A. Yesilada, A. A. Bilgin, Bioorg. Med. Chem. 2007, 15, 5775-5786.
[Документ 3] D. Kaushik, S. A. Khan, G. Chawla, S. N. Kumar, Eur. J. Med. Chem. 2010, 45, 3943-3949.
[Документ 4] A. Balbia, M. Anzaldi, C. Macciò, C. Aiello, M. Mazzei, R. Gangemi, P. Castagnola, M. Miele, C. Rosano, M. Viale, Eur. J. Med. Chem. 2011, 46, 5293-5309.
[Документ 5] C. B. Vicentini, C. Romagnoli, E. Andreotti, D. Mares, J. Agric. Food Chem. 2007, 55, 10331-10338.
[Документ 6] Z. J. Jia, B. Kane, J. Rose, S. M. Bauer, Y. Song, Q. Xu, A. Pandey, WO2013/192049, 2013.
[Документ 7] B. C. Barlaam, K. M. Foote, P. Ple, WO2009/153589, 2009.
[Документ 8] C. Menet, B. Schmitt, R. Geney, K. Doyle, J. Peach, N. Palmer, G. Jones, D. Hardy, J. Duffy, WO2013/117649, 2013.
[Документ 9] D. N. Kozhevnikov, V. N. Kozhevnikov, I. S. Kovalev, V. L. Rusinov, O. N. Chupakhin, G. G. Aleksandrov, Russ. J. Org. Chem. 2002, 38, 744-750.
[Документ 10] H. M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T. N. Bhat, H. Weissig, I. N. Shindyalov, P. E. Bourne, Nucleic Acids Res. 2000, 28, 235-242.
[Документ 11] A. Gaulton, A. Hersey, M. Nowotka, A. P. Bento, J. Chambers, D. Mendez, P. Mutowo, F. Atkinson, L. J. Bellis, E. Cibrián-Uhalte, M. Davies, N. Dedman, A. Karlsson, M. Paula Magariños, J. P. Overington, G. Papadatos, I. Smit, A. R. Leach, Nucleic Acids Res. 2017, 45, D945-D954.
[Документ 12] G. Thoma, A. B. Smith, M. J. van Eis, E. Vangrevelinghe, J. Blanz, R. Aichholz, A. Littlewood-Evans, C. C. Lee, H. Liu, H.-G. Zerwes, J. Med. Chem. 2015, 58, 1950-1963.
[Документ 13] P. Dao, R. Jarray, N. Smith, Y. Lepelletier, J. Le Coq, D.Lietha, R. Hadj-Slimane, J.-P. Herbeuval, C. Garbay, F. Raynaud, H. Chen, Cancer Lett. 2014, 348, 88-99.
[Документ 14] A. Fensome, C. M. Ambler, E. Arnold, M. E. Banker, J. D. Clark, M. E. Dowty, I. V. Efremov, A. Flick, B. S. Gerstenberger, R. S. Gifford, A. Gopalsamy, M. Hegen, J. Jussif, D. C. Limburg, T. H. Lin, B. S. Pierce, R. Sharma, J. I. Trujillo, F. F. Vajdos, F. Vincent, Z.-K. Wan, L. Xing, X. Yang, X. Yang, Bioorg. Med. Chem. 2020, 28, 115481-115491.
[Документ 15] T. Sander, J. Freyss, M. von Korff, C. Rufener, J. Chem. Inf. Model. 2015, 55, 460-473.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ, АКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2013 |
|
RU2666538C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| ИНГИБИТОРЫ ГЛИКОЛАТОКСИДАЗЫ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2805308C2 |
| ТРИАРИЛЬНЫЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ PD-L1 ЗАБОЛЕВАНИЙ | 2020 |
|
RU2840345C2 |
| АНТИПРОЛИФЕРАТИВНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2811969C2 |
| СОЕДИНЕНИЯ ИМИДАЗОТРИАЗИНОНА | 2011 |
|
RU2603140C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2826628C1 |
| ЕВРОПИЕВЫЙ КОМПЛЕКС МОНОНАТРИЕВОЙ СОЛИ 2,2',2'',2'''-(2,2'-((5'-(4-АМИНОФЕНИЛ)-2,2'-БИПИРИДИН-6-ИЛ)МЕТИЛАЗАДИИЛ)БИС-(ЭТАН-2,1-ДИИЛ))-БИС(АЗАТРИИЛ)ТЕТРАУКСУСНОЙ КИСЛОТЫ | 2020 |
|
RU2791044C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ MAT2A И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2809987C2 |
| Производные пиримидина - ингибиторы репродукции вирусов, относящихся к роду Orthoflavivirus | 2023 |
|
RU2831118C1 |
Настоящее изобретение относится к соединению формулы (Iа) или его фармацевтически приемлемой соли
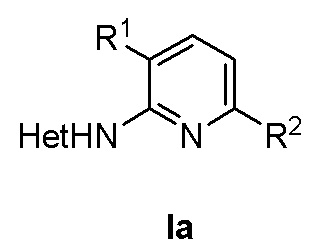 , где в формуле (Ia) R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; R2 представляет собой С1-3 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; и Het представляет собой пиразол-4-ил, а также к способу получения соединений формулы (Ia) и к фармацевтической композиции, содержащей соединение формулы (Ia). Технический результат: получены новые соединения, которые могут быть использованы для лечения рака, такого как глиобластома человека, протоковая карцинома молочной железы человека, карцинома печени человека и эмбриональных почек человека. 4 н. и 2 з.п. ф-лы, 2 табл., 4 пр.
, где в формуле (Ia) R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; R2 представляет собой С1-3 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; и Het представляет собой пиразол-4-ил, а также к способу получения соединений формулы (Ia) и к фармацевтической композиции, содержащей соединение формулы (Ia). Технический результат: получены новые соединения, которые могут быть использованы для лечения рака, такого как глиобластома человека, протоковая карцинома молочной железы человека, карцинома печени человека и эмбриональных почек человека. 4 н. и 2 з.п. ф-лы, 2 табл., 4 пр.
1. Соединение формулы (Iа) или его фармацевтически приемлемая соль
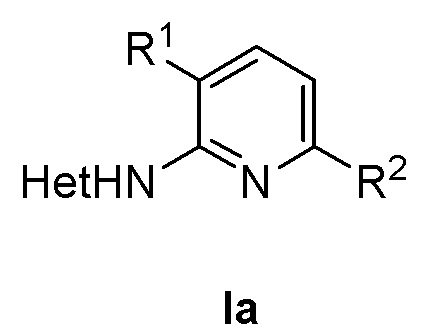
где в формуле (Ia)
R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
R2 представляет собой С1-3 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; и
Het представляет собой пиразол-4-ил.
2. Соединение по п.1, где
R1 представляет собой фенил, 4-бромфенил, толил или 4-метоксифенил;
R2 представляет собой метил, тиофенил, фуранил, пирролил, пиридил, фенил, 4-хлорфенил, 4-метоксифенил или толил; и
Het представляет собой пиразол-4-ил.
3. Соединение по п.1, выбранное из группы, состоящей из следующих соединений:
3-(4-бромфенил)-6-(4-хлорфенил)-N-(пиразол-4-ил)-пиридин-2-амин
3-фенил-N-(пиразол-4-ил)-6-p-толилпиридин-2-амин
3-(4-метоксифенил)-N-(пиразол-4-ил)-6-p-толилпиридин-2-амин
6-(4-метоксифенил)-N-(пиразол-4-ил)-3-p-толилпиридин-2-амин
6-(4-хлорфенил)-N-(пиразол-4-ил)-3-p-толилпиридин-2-амин
N-(пиразол-4-ил)-5-фенил-2,2′-бипиридин-6-амин
N-(пиразол-4-ил)-5-p-толил-2,2′-бипиридин-6-амин
5-(4-метоксифенил)-N-(пиразол-4-ил)-2,2′-бипиридин-6-амин
6-(фуран-2-ил)-3-фенил-N-(пиразол-4-ил)пиридин-2-амин
3-фенил-N-(пиразол-4-ил)-6-(тиофен-2-ил)пиридин-2-амин
3-фенил-N-(пиразол-4-ил)-6-(1H-пиррол-2-ил)пиридин-2-амин и
6-метил-3-фенил-N-(пиразол-4-ил)пиридин-2-амин.
4. Фармацевтическая композиция для лечения рака, выбранного из глиобластомы человека, протоковой карциномы молочной железы человека, карциномы печени человека и эмбриональных почек человека, содержащая эффективное количество соединения по любому из пп.1-3 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, наполнитель или разбавитель.
5. Способ получения соединений формулы (Ia), включающий нагревание соединения формулы (Ib) при 200-240°С в растворителе, представляющем собой галогенированный бензол, с 2,5-норборнадиеном в соответствии со схемой
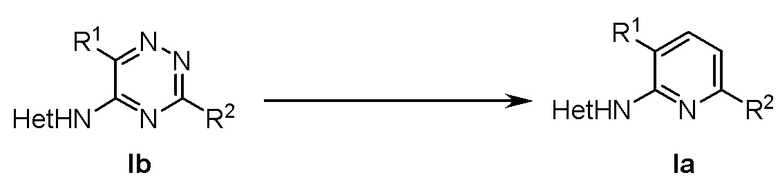 ,
,
где в формуле (Ia) и в формуле (Ib)
R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
R2 представляет собой С1-3 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; и
Het представляет собой пиразол-4-ил.
6. Соединение формулы (Ib)
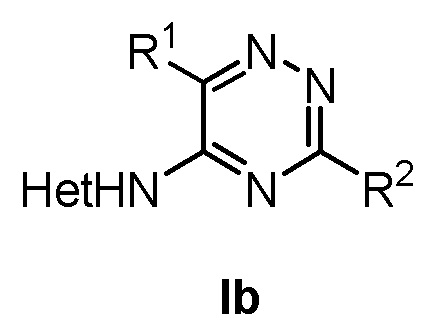 ,
,
где в формуле (Ib)
R1 представляет собой фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси;
R2 представляет собой С1-3 алкил, 5-6-членный гетероарил, содержащий 1 гетероатом, выбранный из азота, кислорода и серы, или фенил, необязательно замещенный группой, выбранной из галогена, С1-6 алкила и С1-6 алкилокси; и
Het представляет собой пиразол-4-ил.
| WO 2013192049 A2, 27.12.2013 | |||
| ЗАМЕЩЕННЫЙ 2-АМИНОПИРИДИН В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ | 2014 |
|
RU2671212C2 |
| Alexey P | |||
| Krinochkin et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J | |||
| Org | |||
| Chem., 19.05.2022. | |||
Авторы
Даты
2024-07-24—Публикация
2022-11-16—Подача