Изобретение относится к медицине, а именно к новым фармацевтическим лекарственным средствам, обладающим комплексным антиангиогенным и гипоксия-ориентированным цитотоксическим действием, которые могут оказывать терапевтический эффект на неоплазии, невосприимчивые к антиангиогенным средствам из-за развития стойкой гипоксической резистентности.
В настоящее время лечение злокачественных новообразований находится в числе приоритетных задач современной химиотерапии. Так, онкологическая ситуация в мире в целом остается неблагополучной как в экономически развитых, так и в развивающихся странах. Ежегодно наблюдается тенденция к увеличению числа онкобольных, при этом на 18 миллионов новых случаев рака больше половины требуют химиотерапии либо в самостоятельном, либо в адъювантном режиме (Bray, F.; Ferlay, J.; Soerjomataram, I.; Siegel, R.L.; Torre, L.A.; Jemal, A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA-Cancer J. Clin. 2018, 68, 394–424).
Однако значимая эффективность химиотерапии регистрируется лишь при лечении неоплазий, имеющих порог резистентности ниже, чем нормальные органы и ткани. Например, при герминогенных опухолях, лимфоме Ходжкина, остром лимфобластном лейкозе.
В последнее время большое количество исследований посвящено изучению нового класса веществ – таргетных, или молекулярно-ориентированных препаратов, направленно действующих на определенные молекулы-мишени в опухолевой клетке. Ингибирование таких мишеней приводит к угнетению опухолевого роста, метастазирования, ангиогенеза, инвазии, механизмов резистентности и индукции. Большинство специалистов сходятся во мнении, что таргетные препараты принципиально изменят возможности современной лекарственной терапии нечувствительных к классическим цитостатикам неоплазий.
Приоритетными на сегодняшний день считаются терапевтические подходы, направленные на подавление опухолевого ангиогенеза. Так, известен бевацизумаб – моноклональное антитело IgG1 к фактору роста эндотелия сосудов (VEGF), одобренный для лечения глиобластомы, рака молочной железы, почки и др. (Diaz, R.J., Ali, S., Qadir, M.G. et al. The role of bevacizumab in the treatment of glioblastoma. J Neurooncol. 2017. 133, 455–467).
Известны также таргетные противоопухолевые средства – эрлотиниб, гефитиниб, цетуксимаб – ингибиторы тирозинкиназы, используемые для терапии метастатического колоректального рака и ряда других неоплазий с мутациями в генах рецепторов EGRF (Переводчикова Н.И., Горбунова В.А. Таргетные препараты и их клиническое использование: введение в проблему. Эффективная фармакотерапия, онкология гематология и радиология. 2009. 2: 6-13).
Однако одним из существенных недостатков перечисленных антиангиогенных таргетных средств является их высокая токсичность. Так, трастузумаб обладает значительной кардиотоксичностью, что ограничивает возможности его применения в комбинации с антрациклинами, а при использовании бевацизумаба описано тяжелое побочное явление – гастроинтестинальные перфорации (Селиверстова Д. В., Евсина О. В. Кардиотоксичность химиотерапии. Сердце: журнал для практикующих врачей. 2016.Т. 15. № 1:50-57).
Известно также антиангиогенное средство природного происхождения по патенту WO 2004/045380 A2, содержащее в качестве действующего вещества димерный макроциклический танин, выделенный из побегов и соцветий и обладающее антиангиогенным действием.
Однако существенным недостатком данного средства является отсутствие селективности в отношении рецепторов фактора роста эндотелия сосудов, что обусловливает его низкий противоопухолевый эффект.
Клинические результаты использования как селективных, так и мультикиназных ангиостатических препаратов на сегодняшний день остаются весьма скромными, что связано с существенным ослаблением противоопухолевого влияния вследствие изменения опухолевого метаболизма в сторону аэробного гликолиза на фоне развития гипоксии, обусловленной использованием данного класса препаратов.
В последние годы предпринимаются активные попытки использовать гипоксию в терапевтических целях, в частности, наиболее привлекательной мишенью для ингибирования аэробного гликолиза является вторая изоформа первого в каскаде реакций гликолиза фермента гесксокиназа-2 (HK-2).
В настоящее время в ряде исследований показано, что одним из перспективных путей для преодоления гипоксической резистентности неоплазий, имеющих гликолитический фенотип, может являться использование 3-бромпирувата (далее 3BP) со структурной формулой:
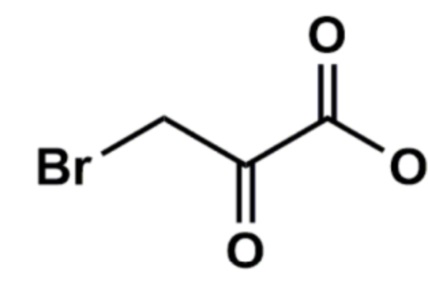 .
.
3BP на фоне дефицита кислорода способна отделять гексокиназу 2 (HK2) от митохондриального потенциалозависимого анионного комплекса опухолевых клеток, тем самым индуцируя образование активных форм кислорода и впоследствии вызывая гибель опухолевых клеток (Куликов В.А., Беляева Л.Е. Метаболизм раковой клетки как терапевтическая мишень. Вестник Витебского медицинского государственного университета. 2016.Т. 15. № 6:7-20; Tengjiao F., Guohui S., Xiaodong S., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers. 2019. Vol.11. 317).
Первые исследования 3ВР в качестве противоопухолевого агента показали его значительную цитотоксичность в отношении множественных опухолевых клеток in vitro и заметное подавление роста опухолевых узлов на моделях in vivo (Kim, W.; Yoon, J.H.; Jeong, J.M.; Cheon, G.J.; Lee, T.S.; Yang, J.I.; Park, S.C.; Lee, H.S. Apoptosis-inducing antitumor efficacy of hexokinase II inhibitor in hepatocellular carcinoma. Mol. Cancer Ther. 2007, 6, 2554–2562; Ko, Y.H.; Pedersen, P.L.; Geschwind, J.F. Glucose catabolism in the rabbit VX2 tumor model for liver cancer: Characterization and targeting hexokinase. Cancer Lett. 2001, 173, 83–91.).
Однако при дальнейшем изучении в ряде клинических и экспериментальных исследований in vivo описаны существенные недостатки использования данного соединения в качестве монотерапии – значительная токсичность 3ВР в отношении желудочно-кишечного тракта и пищеварительных желез (Chang, J.M.; Chung, J.W.; Jae, H.J.; Eh, H.; Son, K.R.; Lee, K.C.; Park, J.H. Local toxicity of hepatic arterial infusion of hexokinase II inhibitor, 3-bromopyruvate: In vivo investigation in normal rabbit model. Acad. Radiol. 2007, 14, 85–92; Ko, Y.H.; Verhoeven, H.A.; Lee, M.J.; Corbin, D.J.; Vogl, T.J.; Pedersen, P.L. A translational study “case report” on the small molecule “energy blocker” 3-bromopyruvate (3BP) as a potent anticancer agent: From bench side to bedside. J. Bioenerg. Biomembr. 2012, 44, 163–170).
Прототипом предлагаемого технического решения является «Вазоконстрикторное средство» по патенту на изобретение RU 2475479 (20.02.2013) с общей структурной формулой:
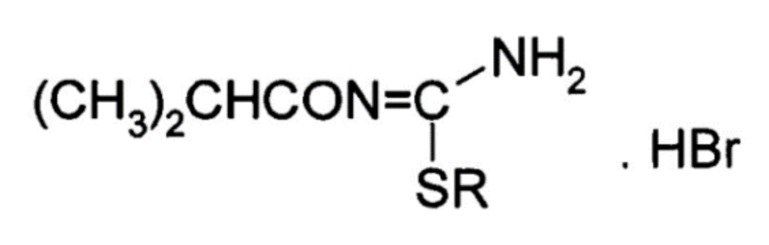 , где R=(CH3)2CH;
, где R=(CH3)2CH;
– гидробромид 1-изобутаноил-2-изопропилизотиомочевины (далее – соединение Т1023).
Противоопухолевая эффективность данного прототипа была ранее исследована и запатентована (RU 2503450) авторами предлагаемого изобретения.
Соединение Т1023 является эффективным ингибитором синтаз оксида азота (далее NOS), в дозе 20-120 мг/кг вызывает выраженное вазоконстрикторное действие, способное создавать гипоксию в тканях опухоли и таким образом реализовывать свое противоопухолевое действие.
Недостатком прототипа является снижение его противоопухолевой эффективности при его субхроническом применении, что обусловлено высокой пластичностью злокачественных новообразований и их способностью адаптироваться к гипоксии.
Техническим результатом предлагаемого изобретения является создание средства для повышения селективности цитотоксического соединения, оказывающего воздействие на гликолиз, по отношению к патологической клетке и обеспечить более высокую противоопухолевую эффективность в отношении резистентных к химиотерапии неоплазиям.
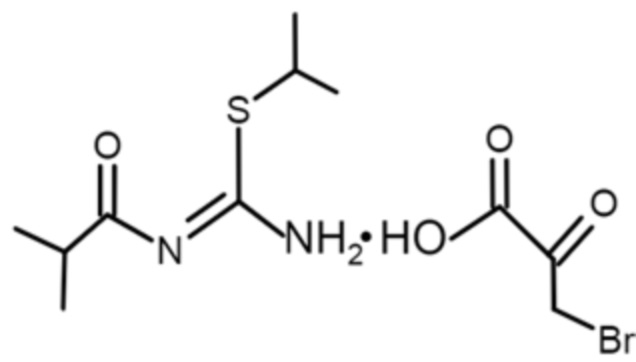
Технический результат достигается тем, что в качестве действующего вещества содержит 3-бромпируват 1-изобутаноил-2-изопропилизотиомочевины со структурной формулой:
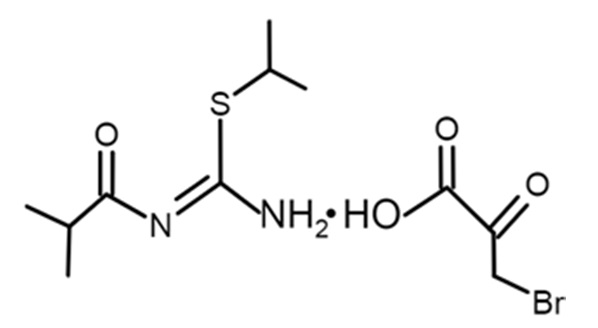
Причем средство обладает NOS-ингибирующей и HK2-ингибируюшей активностью, оказывает антиангиогенное и гипоксия-ориентированное цитотоксическое действие при дозах действующего вещества 10-50 мг/кг. Средство содержит 0,1-5% действующего вещества в составе растворов для инъекций или инфузий, а также содержит 1-50 мг действующего вещества в составе твердых лекарственных форм. Средство применяется при дозах действующего вещества 10-50 мг/кг в качестве монотерапии или в составе фармацевтической композиции для химиотерапии, или в сочетании с лучевой терапией.
Авторами предлагаемого изобретения показана перспективность совмещения 3BP и соединения Т1023 в виде нового комплексного таргетного средства для лечения онкологических заболеваний.
Изобретение поясняется подробным описанием, примерами достижения заявленного технического результата и таблицами.
Химический синтез соединения Т1097, его токсикологические свойства и противоопухолевая активность, а также достижение заявленного технического результата приведены ниже в примерах.
Синтез соединения Т1097.
Пример 1
Получение промежуточного соединения Т1023
Смесь 6 г (40 ммоль) изобутаноилтиомочевины, 9,8 г (80 ммоль) изопропилбромида и 15 мл сухого ацетонитрила в запаянной ампуле нагревают на кипящей водяной бане в течение 20 часов. Растворитель упаривают, остаток отфильтровывают и перекристаллизовывают из 4-метил-2-пентанона. Выход 3,6 г (33%).
Тпл 129-131°С. Спектр ПМР (DMSO-d6) δ 1,1 (д, 6Н); 1,36 (д, 6Н); 2,73 (м, 1Н); 4,1 (м, 1Н); 10,9 (ушир.т, 2Н).
Вычислено, %: С 35,69; Н 6,37; N 10,41 C8H16N2OS•HBr
Найдено, %: С 35,76; Н 6,51; N 10,45
В результате получен гидробромид 1-изобутаноил-2-изопропилизотиомочевины (Проскуряков С.Я., Верховский Ю.Г., Филимонова М.В. и др. Антигипотензивное средство. Патент РФ на изобретение RU 2353614. Дата публикации: 27.04.2009).
Пример 2
Получение соединения Т1097.
2 г гидробромида – N-изобутаноил-S-изопропилизотиомочевины (Т1023) растворяют в 10 мл воды, по каплям добавляют концентрированный водный раствор аммиака до рН 8 и экстрагируют дважды диэтиловым эфиром (2х10 мл). Сушат безводным Na2SO4 в течение получаса, а затем упаривают растворитель в вакууме. Выход основания 1,3 г.
Растворяют основание в 10 мл диэтилового эфира и добавляют к нему раствор 1,15 г 3-бромпировиноградной кислоты в 5 мл диэтилового эфира. Охлаждают. Выделившийся осадок отфильтровывают и трехкратно промывают 10 мл диэтилового эфира. Сушат в вакууме без нагревания. Выход 2 г (81,3%). Хранят в холодильнике в защищенном от света месте.
Тпл 70-72°С.
Вычислено, %: С 37,18; Н 5,40; N 7,89 C11H19BrN2O4S.•
Найдено, %: С 37,67; Н 5,50; N 7,88
В результате получают 3-бромпирувата N-изобутаноил-S-изопропилизотиомочевины (соединение Т1097).
В доступной научной и патентной литературе способы получения 3-бромпирувата N-изобутаноил-S-изопропилизотиомочевины и его свойства не описаны, что свидетельствует о том, что данное соединение получено нами впервые.
Пример 3
Токсическая характеристика соединения Т1097.
Токсичность соединения Т1097 исследована на самцах белых беспородных мышей по тесту «острой» токсичности в возрасте 2-2,5 месяца с массой тела 22-25 г при однократном внутрибрюшинном введении (Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова - М.: Гриф и К, 2012). Рабочие растворы Т1097 изготавливали на основе 0,9% асептического раствора хлорида натрия (Дальхимфарм, РФ). Наблюдение за животными осуществляли в течение 14 суток. Расчет показателей «острой» токсичности проводили по методу Прозоровского.
Результаты исследования токсикометрических свойств соединений показали, что, как и Т1023, соединение Т1097 по ГОСТ 12.1.007-76 относится к третьему классу токсичности и опасности (умеренно токсично). Показатель его средней смертельной дозы (ЛД50) составил для мышей 41 мг/кг (Табл. 1).
Таблица 1
Показатели острой токсичности соединений Т1097 и Т1023 для аутбредных мышей при однократном внутрибрюшинном введении
* – ранее полученные показатели «острой» токсичности Т1023
** – показатели «острой» токсичности 3BP по данным литературы
Сопоставление показателей «острой» токсичности соединений Т1023, 3ВР и комплексного соединения Т1097 свидетельствует, что его показатели токсичности обусловлены и значимо не отличаются от показателя токсичности 3ВР.
Пример 4
Сравнительная оценка противоопухолевой активности соединения Т1097 и 3ВР в эквимолярных дозах на модели асцитной карциномы Эрлиха (КЭ).
Целью эксперимента являлось сравнительное изучение влияния 3BP и 1097 в эквимолярных дозах при их хроническом применении на рост солидной КЭ у мышей.
Исследование выполнено на 100 самках мышей-гибридов F1 (СВА х C57Bl/6j) в возрасте 2-2,5 месяцев с массой тела 19-22 г, распределенных методом рандомизации в 5 экспериментальных групп: контрольную и четыре опытных, по 20 особей в каждой. Всем животным трансплантировали КЭ по методике, описанной в Руководстве по проведению доклинических исследований лекарственных средств (2012). Контрольные животные в дальнейшем не получали каких-либо экспериментальных воздействий. Животным опытных групп с 6-х по 20-е сутки роста КЭ проводили ежедневое в/б введение, соответственно, Т1097 17 мг/кг и 13 мг/кг, 3ВР 8 мг/кг и 6 мг/кг, что соответствует эквимолярным Т1023 дозам – 13 мг/кг и 10 мг/кг, соответственно. Растворы Т1097 и 3ВР изготавливали на основе 0,9% асептического раствора хлорида натрия (Дальхимфарм, РФ). Противоопухолевые эффекты изучали по методике, описанной в Руководстве по проведению доклинических исследований лекарственных средств (2012).
Результаты эксперимента показали, что при использованных схемах введения и дозах Т1097 и 3ВР оказывали сходное противоопухолевое действие (Табл.2). При этом противоопухолевый эффект Т1097 и 3ВР при их хроническом парентеральном введении развивался быстро – уже на 3 сутки курсового применения. Практически в течение всего срока наблюдения действие этих соединений сопровождалось статистически достоверным противоопухолевым эффектом.
В целом максимальный противоопухолевый эффект развивался к 17 суткам применения Т1097 и 3ВР, торможение роста опухолевых узлов составляло примерно 35-40%. Но использование 3ВР в выбранных дозах сопровождалось значимыми токсическими эффектами у экспериментальных животных (Табл.2).
Начальные этапы развития противоопухолевого эффекта соединения Т1097 были подобны действию 3ВР. Однако при хроническом введении Т1097 в дозе 17 мг/кг наблюдалось более стабильное усиление эффекта (ТРО = 40%), чем при дозе 13 мг/кг (ТРО=35%). Причем, при дозе 17 мг/кг Т1097 реализует эффекты существенно более выраженно, чем 3ВР в эквимолярной дозе (8 мг/кг).
Таблица 2
Влияние 3BP и Т1097 в эквимолярных дозах на рост солидной карциномы Эрлиха у самок мышей F1 (СВА х C57Bl/6j)
сутки
ежедневно
ежедневно
ежедневно
ежедневно
Примечания. Показатели объема нормированы на исходный объем опухолей перед началом воздействий на 7-е сутки роста. 1 – статистически достоверное различие (р< 0,05) по Q-критерию Данна с контрольной группой (1). В группах n = 20.
Пример 5
Противоопухолевая эффективность соединения Т1097.
Исследование выполнено на 40 самках мышей-гибридов F1 (СВА х C57Bl/6j) в возрасте 2-2,5 месяцев с массой тела 19-22 г, распределенных методом рандомизации в 2 экспериментальные по 20 особей в каждой. Всем животным трансплантировали суспензию солидной карциномы Эрлиха (КЭ) по методике, описанной в Руководстве по проведению доклинических исследований лекарственных средств (2012). Контрольные животные в дальнейшем не получали каких-либо экспериментальных воздействий. Животным опытной группы с 7-х по 20-е сутки роста КЭ проводили ежедневое в/б введение Т1097 в дозе 17 мг/кг. Раствор Т1097 изготавливали на основе 0,9% асептического раствора хлорида натрия (Дальхимфарм, РФ). Противоопухолевые эффекты изучали по методике, описанной в Руководстве по проведению доклинических исследований лекарственных средств (2012).
Данные динамики опухолевого роста (Табл. 3.) свидетельствуют о том, что комплексное соединение Т1097 вызывает выраженное и стабильное торможение роста карциномы Эрлиха на 50-60%, в результате чего средний объем опухоли в опытной группе в течение всего периода применения Т1097 является статистически достоверно ниже, чем в контроле.
Таблица 3
Влияние Т1097 на рост солидной карциномы Эрлиха у самок
мышей F1 (СВА х C57Bl/6j)
сутки
ежедневно
Примечания. Показатели объема нормированы на исходный объем опухолей перед началом воздействий на 7-е сутки роста. 1 – статистически достоверное различие (р < 0,05) по U-критерию Манна-Уитни с контрольной группой (1). В группах n = 20.
Более того, противоопухолевое действие Т1097 достаточно долговременное – в течение недели после окончания курса противоопухолевой терапии сохраняются статистически значимые эффекты.
Доказательство достижения технического результата.
Заявленный технический результат предлагаемого изобретения заключается в обеспечении более выраженного, стабильного и длительного противоопухолевого эффекта соединения Т1097, а также отсутствием развития резистентности опухоли к воздействию в сравнении с прототипом (Т1023).
В токсикологических исследованиях установлено (см. пример 3), что соединение Т1097 по ГОСТ 12.1.007-76 относится к третьему классу токсичности и опасности (умеренно токсично). Показатель его средней смертельной дозы (ЛД50) составил для мышей 41 мг/кг. Сопоставление показателей «острой» токсичности соединений Т1023, 3ВР и комплексного соединения Т1097 свидетельствует, что его показатели токсичности обусловлены и значимо не отличаются от показателя токсичности 3ВР.
В исследованиях на опухолевой модели солидной карциномы Эрлиха (см. пример 4) комплексное соединение Т1097 проявляет выраженные дозозависимые противоопухолевые свойства в системе in vivo, причем его противоопухолевый эффект превышает аналогичный эффект 3ВР в эквимолярной дозе. Результаты исследования (см. пример 5) свидетельствуют о том, что хроническое воздействие Т1097 не сопровождается развитием резистентности опухоли к воздействию и позволяют рекомендовать соединение Т1097 для практического применения как самостоятельное противоопухолевое средство.
Заявленный технический результат позволяет повысить селективность цитотоксического соединения, оказывающего воздействие на гликолиз, по отношению к патологической клетке, например, злокачественной клетке, путем использования комбинированного соединения, сочетающего в одной молекуле NOS-ингибирующее антиангиогенное и HK2-ингибирующее гипоксия-ориентированное цитотоксическое действие.
Следовательно, соединение Т1097 – 3-бромпируват 1-изобутаноил-2-изопропилизотиомочевины можно рассматривать как комплексное средство для таргетной терапии злокачественных новообразований, способное расширить возможности метода лекарственной терапии злокачественных образований.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2018 |
|
RU2699558C2 |
| Способ лечения меланомы in vivo | 2023 |
|
RU2824428C2 |
| Комплексное антиангиогенное и гипоксия-ориентированное противоопухолевое средство | 2022 |
|
RU2804771C1 |
| РАДИОЗАЩИТНОЕ ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО | 2020 |
|
RU2733883C2 |
| Способ фармакологической защиты от ионизирующих излучений | 2017 |
|
RU2663465C1 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ПОЛУЧЕНИЯ РАДИОЗАЩИТНОГО СРЕДСТВА 1-ИЗОБУТАНОИЛ-2-ИЗОПРОПИЛИЗОТИОМОЧЕВИНЫ ГИДРОБРОМИДА | 2023 |
|
RU2806650C1 |
| ПРОИЗВОДНЫЕ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2022 |
|
RU2782931C2 |
| Средство для терапии опухолей | 2019 |
|
RU2726801C1 |
| Способ проведения фотодинамической терапии солидной карциномы Эрлиха мышей | 2021 |
|
RU2774589C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОВ ПАРАНЕОПЛАСТИЧЕСКИХ ПРОЦЕССОВ И ХИМИОТЕРАПИИ, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2447888C1 |
Изобретение относится к гипоксия-ориентированному противоопухолевому средству, включающему в качестве действующего вещества 3-бромпируват 1-изобутаноил-2-изопропилизотиомочевины формулы (I), в дозах 10-20 мг/кг, содержащему 0,1-2% действующего вещества в составе растворов для инъекций или инфузий и 1-50 мг действующего вещества в составе твердых лекарственных форм. 3 табл., 5 пр.
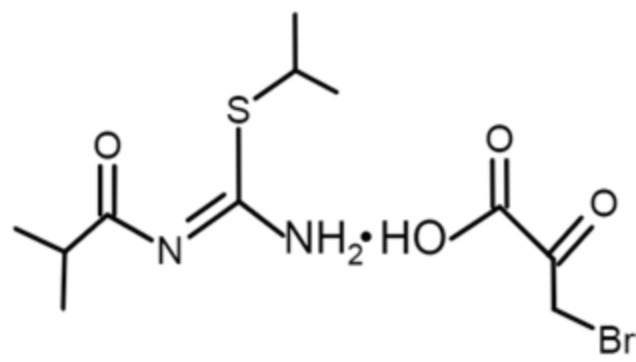 (I)
(I)
Гипоксия-ориентированное противоопухолевое средство, отличающееся тем, что в качестве действующего вещества содержит 3-бромпируват 1-изобутаноил-2-изопропилизотиомочевины, при дозах действующего вещества 10-20 мг/кг, содержащее 0,1-2% действующего вещества в составе растворов для инъекций или инфузий и 1-50 мг действующего вещества в составе твердых лекарственных форм, со структурной формулой:
| WO 2020071961 A1, 09.04.2020 | |||
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2012 |
|
RU2503450C1 |
| WO 2006020403 A2, 23.02.2006 | |||
| ВАЗОКОНСТРИКТОРНОЕ СРЕДСТВО | 2011 |
|
RU2475479C1 |
| КУЛИКОВ В.А., БЕЛЯЕВА Л.Е "МЕТАБОЛИЗМ РАКОВОЙ КЛЕТКИ КАК ТЕРАПЕВТИЧЕСКАЯ МИШЕНЬ", Вестник ВГМУ, 2016, Том 15, N6, стр | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2021-07-16—Публикация
2020-09-15—Подача