Изобретение относится к медицине, а именно к онкологии и офтальмологии, и может быть использовано для применения соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол для лечения карциномы Эрлиха, саркомы 37, лимфосаркомы ЛИО-1, меланомы В16, трансплантированных в нижнее веко мышей в эксперименте.
Опухоли век являются наиболее распространенными новообразованиями в повседневной офтальмологической практике и охватывают широкий спектр доброкачественных и злокачественных новообразований. Примерно 5-10% всех видов рака кожи и 15% всех опухолей лица образуются на веках (Deprez М, Uffer S. Clinicopathological features of eyelid skin tumors. A retrospective study of 5504 cases and review of literature // Am J Dermatopathol. - 2009; 31(3):256-262). При больших размерах опухоли век могут вызывать выраженные деформации, вывороты век с развитием несмыкания глазной щели - лагофтальма, что негативно отражается на зрительных функциях, а также создает косметический дефект. При злокачественных опухолях век в случае отсутствии своевременной терапии возможен даже летальный исход.
Несмотря на доступность диагностики опухолей кожи век, частота, обращения в запущенных стадиях болезни достигает 12-15%. По гистогенезу среди злокачественных опухолей век превалирует базальноклеточный рак (94,7%), реже встречаются плоскоклеточный и метатипический рак (4%), аденокарцинома мейбомиевой железы (0,7%), меланома кожи (0,6%) (Бровкина А.Ф., Панова И.Е., Саакян С.В. Офтальмоонкология: новое за последние два десятилетия // Вестник офтальмологии. - 2014; 130(6):13-19). Среди других опухолей век встречаются лимфома, а также злокачественные мезенхимальные опухоли век (фибросаркома и ангиосаркома).
В лечении злокачественных опухолей век используют хирургический способ, криодеструкцию, лазеротерапию, лучевую и фотодинамическую терапию. Однако высока частота рецидивов. Применимость этих методов локальной терапии ограничивается небольшими размерами опухоли; в случае распространенных опухолей век после хирургического лечения и гамма-терапии требуется пластика для замещения дефектов (Бровкина А.Ф., Панова И.Е., Саакян С.В. Офтальмоонкология: новое за последние два десятилетия. // Вестник офтальмологии. 2014. Т. 130. №6.: 13-19; Груша Я.О., Исмаилова Д.С., Ризопуло Э.Ф. Хирургическое лечение злокачественных новообразований век эпителиального происхождения // Опухоли головы и шеи. - 2012; №2: 24-29).
Химиотерапия не занимает видного места в лечении опухолей век, ее использование ограничивается чувствительными опухолями или локальным применением (Бровкина А.Ф., Офтальмоонкология: руководство для врачей. М: Медицина. - 2002, 424.; Silverman N.; Shinder R. What’s New in Eyelid Tumors//Asia-Pacific Journal of Ophthalmology. - 2017; 6(2):143-152).
Известен способ лечения злокачественных опухолей в эксперименте, заключающийся в применении соединения 2-[3-(2-хлорэтил)-2-нитрозоуреидо]-1,3-пропандиол и характеризующийся высоким терапевтическим эффектом на широком спектре перевиваемых опухолей у мышей и крыс (Патенты РФ №2068843 и №2695787). Однако доказательств активности этого соединения при опухолях век не имеется.
Задачей изобретения является создание высокоэффективного способа лечения злокачественных новообразований век.
Техническим результатом заявляемого изобретения является значительное угнетение роста трансплантированных в нижнее веко опухолей у мышей.
Технический результат достигается тем, что мышам с трансплантированными под кожу нижнего века опухолями вводят 2-[3-(2-хлорэтил)-2-нитрозоуреидо]-1,3-пропандиол в дозе 15 или 20 мг/кг однократно внутрибрюшинно.
Сущность изобретения заключается в высокой противоопухолевой активности применения соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол в эксперименте на мышах с трансплантированными в веко опухолях различного гистогенеза (карциноме Эрлиха, саркоме 37, лимфосаркоме ЛИО-1 и меланоме В16).
Способ иллюстрируется фиг. 1-16, где:
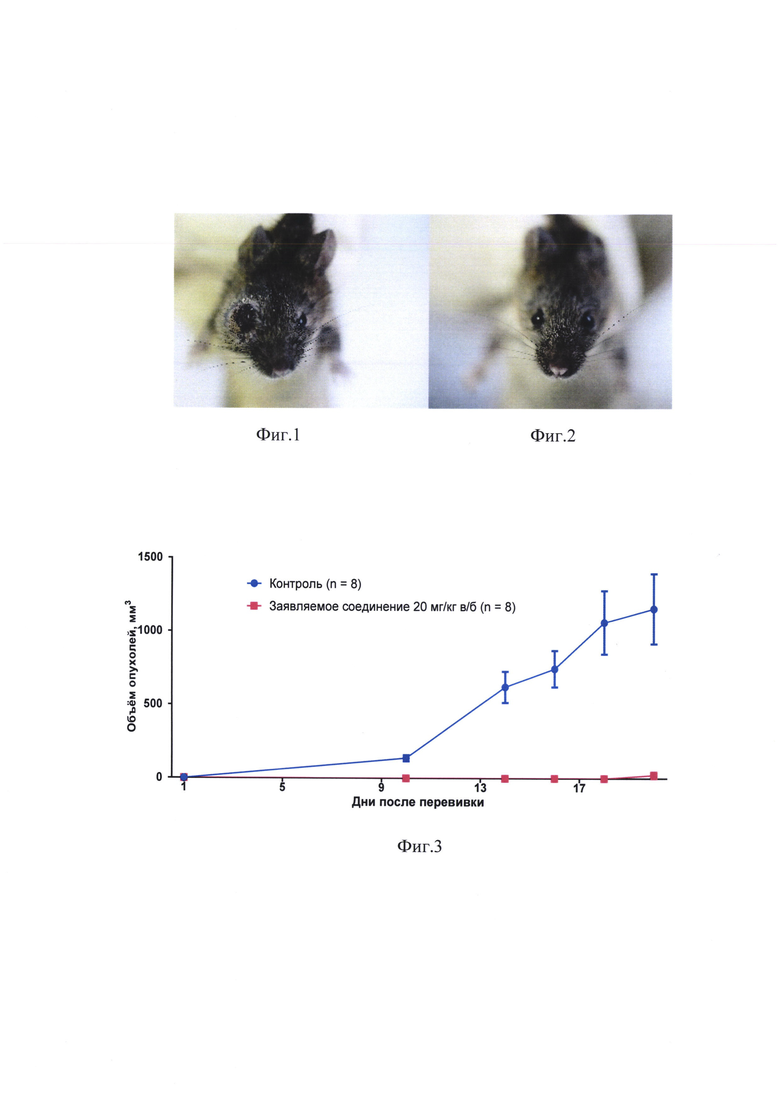
на фиг. 1, 2 - влияние заявляемого соединения на рост карциномы Эрлиха, перевитой в нижнее веко. Мышам линии 129/SN под кожу правого нижнего века перевита карцинома Эрлиха. К 15 дню опыта опухоли имеются у всех мышей (n=8) в контроле и отсутствуют у всех мышей (n=8), которым через 24 часа после перевивки было ведено заявляемое соединение (20 мг/кг в/б);
на фиг. 3 - влияние заявляемого соединения на рост карциномы Эрлиха, трансплантированной в нижнее веко;
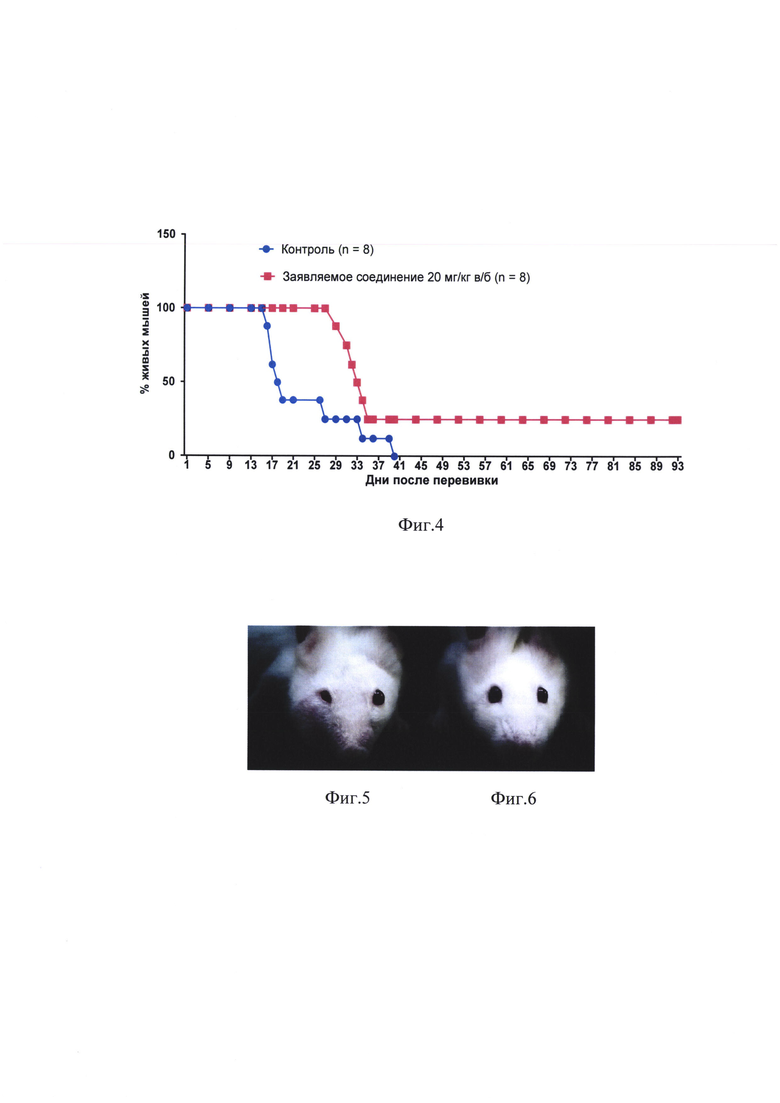
на фиг. 4 - влияние заявляемого соединения на выживаемость мышей с трансплантированной в нижнее веко карциномой Эрлиха;
на фиг. 5, 6 - влияние заявляемого соединения на рост саркомы 37, трансплантированной в нижнее веко. Мышам линии BALB/c под кожу правого нижнего века перевита саркома 37. К 15 дню опыта опухоли имеются у всех мышей (n=10) в контроле и отсутствуют у всех мышей (n=9), которым через 24 часа после перевивки был веден хлонизол (20 мг/кг в/б);
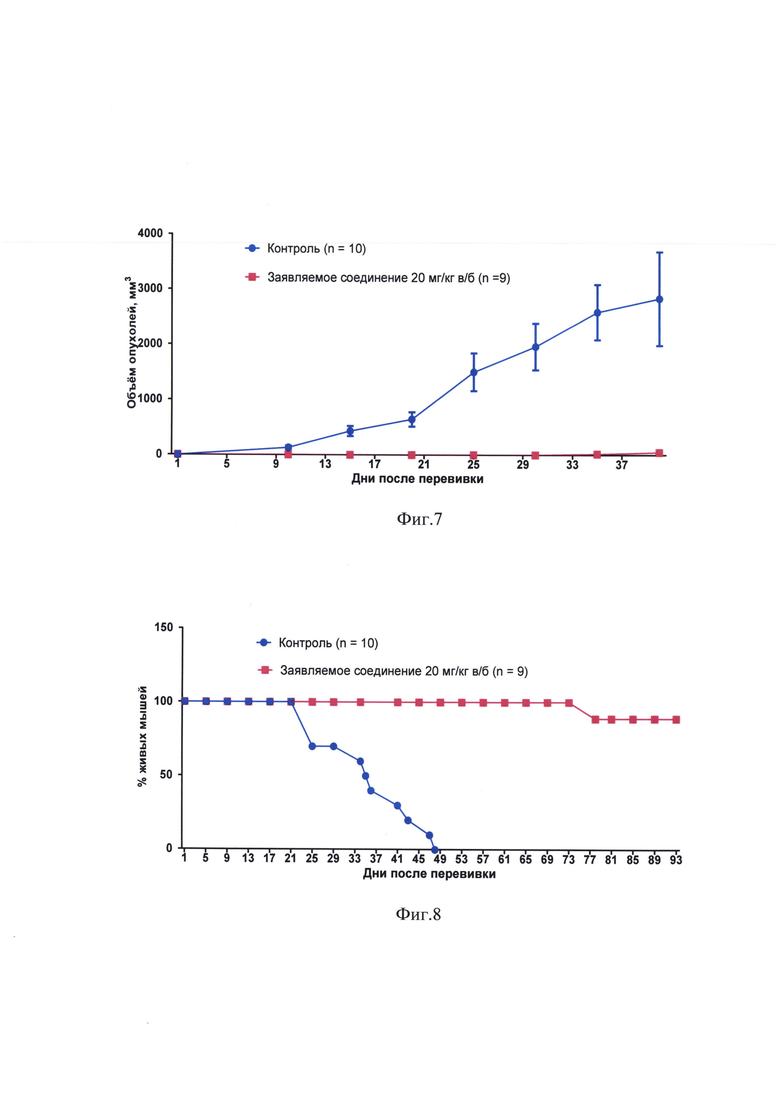
на фиг. 7 - влияние заявляемого соединения на рост саркомы 37, трансплантированной в нижнее веко;
на фиг. 8 - влияние заявляемого соединения на выживаемость мышей с трансплантированной в нижнее веко саркомой 37;
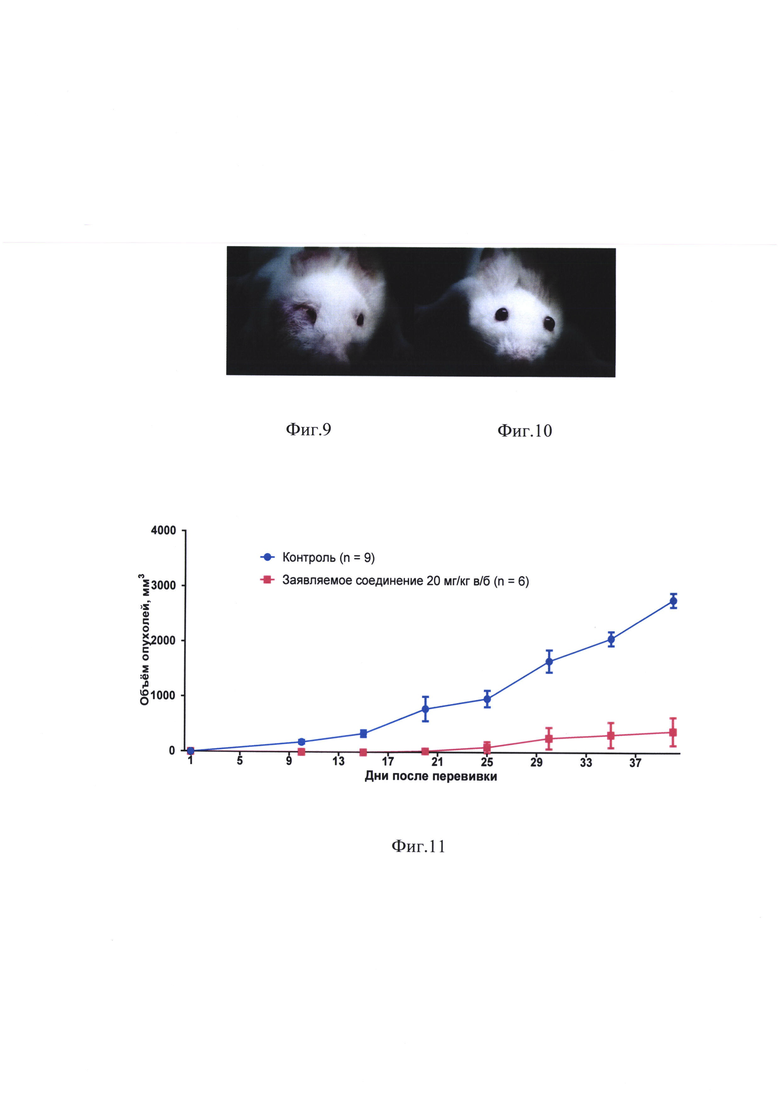
на фиг. 9, 10 - влияние заявляемого соединения на рост лимфосаркомы ЛИО-1, трансплантированной в нижнее веко. Мышам линии BALB/c под кожу правого нижнего века перевита лимфосаркома ЛИО-1. К 15 дню опыта опухоли имеются у всех мышей (n=10) в контроле и отсутствуют у всех мышей (n=6), которым через 24 часа после перевивки был веден хлонизол (20 мг/кг в/б);
фиг. 11 - влияние заявляемого соединения на выживаемость мышей с лимфосаркомой ЛИО-1, трансплантированной в нижнее веко;
фиг. 12 - влияние заявляемого соединения на рост меланомы В16, трансплантированной в нижнее веко. Мышам линии C57BL/6 под кожу правого нижнего века перевита меланома В16. К 15 дню опыта опухоли имеются у всех мышей (n=10) в контроле и отсутствуют у всех мышей (n=8), которым через 24 часа после перевивки был веден хлонизол (15 мг/кг в/б);
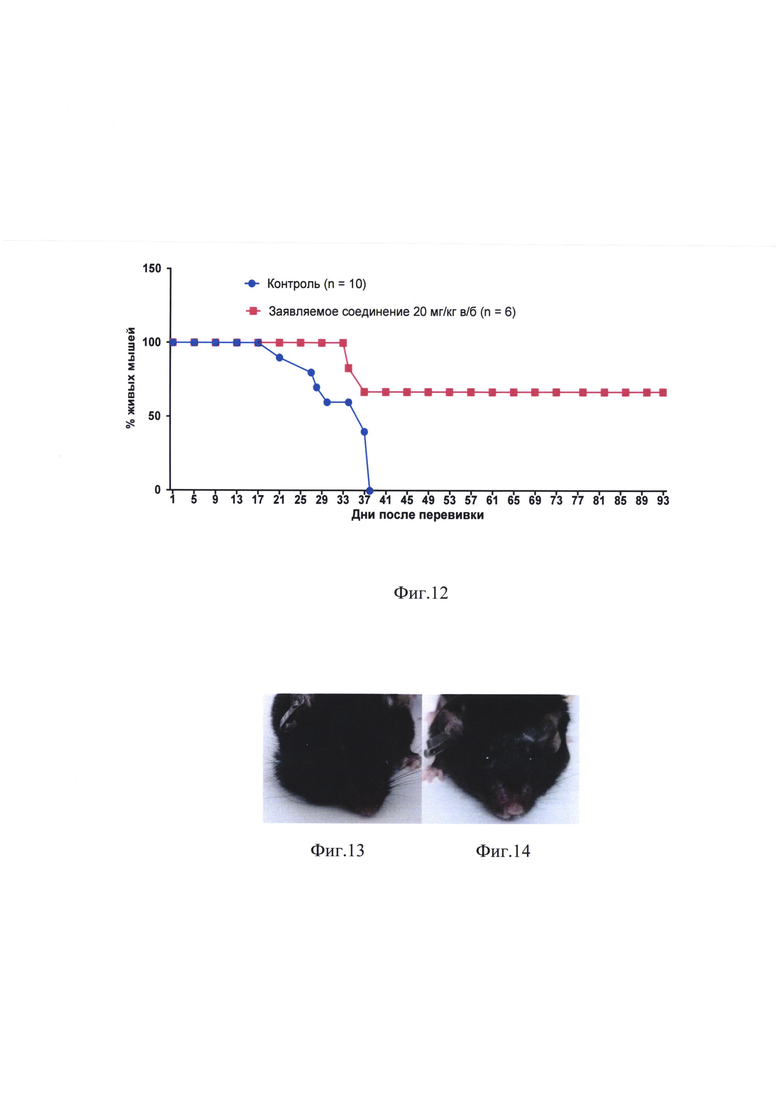
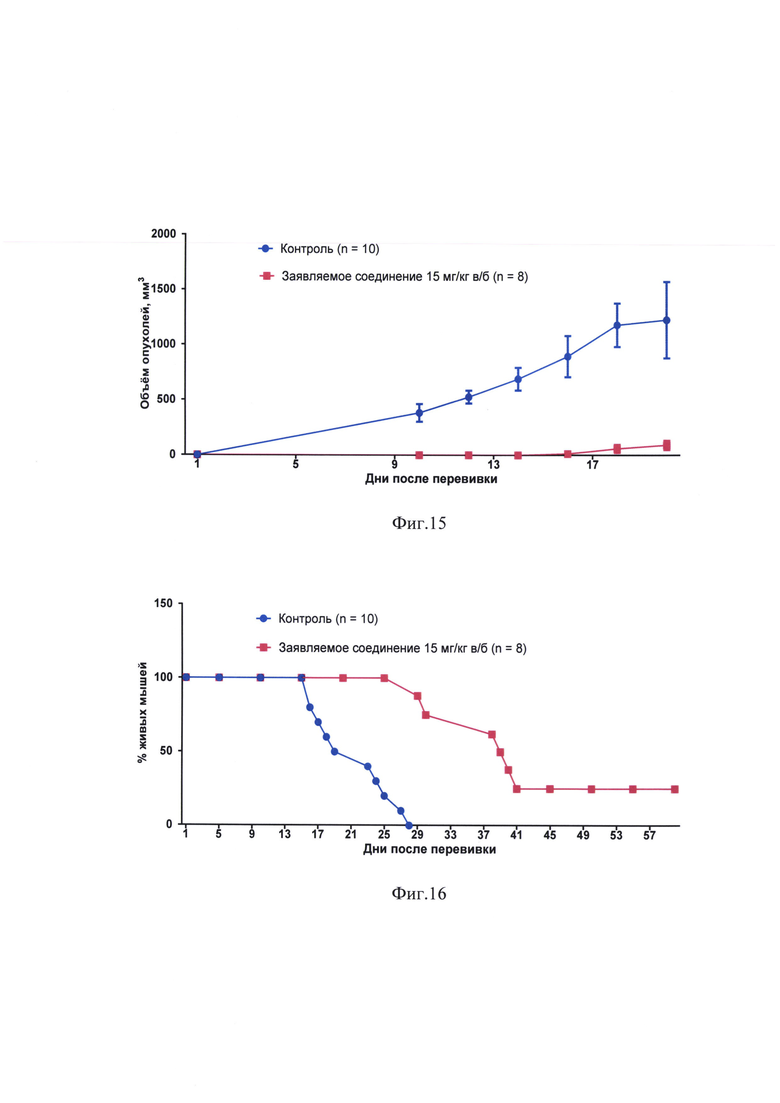
фиг. 13, 14 - влияние заявляемого соединения на рост меланомы В16, трансплантированной в нижнее веко. Мышам линии C57BL/6 под кожу правого нижнего века перевита меланома В16. К 15 дню опыта опухоли имеются у всех мышей (n=10) в контроле и отсутствуют у всех мышей (n=8), которым через 24 часа после перевивки был веден хлонизол (15 мг/кг в/б);
фиг. 15 - влияние заявляемого соединения на рост меланомы В16, трансплантированной в нижнее веко;
фиг. 16 - влияние заявляемого соединения на выживаемость мышей с меланомой В16, трансплантированной в нижнее веко.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1. Влияние соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол (заявляемого соединения) на рост мышиной карциномы Эрлиха, трансплантированной в нижнее веко.
Исследование проведено на 16 мышах линии 129/SN самцах. Всем мышам под кожу правого нижнего века была трансплантирована карцинома Эрлиха посредством инъекции взвеси опухолевых клеток в 0,9% растворе натрия хлорида. Инъекция производилась в направлении от наружного угла глаза к внутреннему тонкой иглой (29G), через которую вводили 0,05 мл взвеси, содержащей 106 клеток карциномы Эрлиха.
После трансплантации опухоли мыши были рандомизированы на 2 группы:
I. Контроль (n=8);
II. Заявляемое соединение 20 мг/кг внутрибрюшинно через 24 часа после перевивки опухоли (n=8).
За мышами вели ежедневное наблюдение.
К 10 дню после перевивки у всех 8 мышей контрольной группы развились четко определяемые опухоли в области правого нижнего века; ни у кого из 8 мышей, получивших заявляемое соединение, опухолей не было. На 15 день при наличии опухолей у всех 8 мышей контрольной группы ни у одной из 8 мышей, получивших заявляемое соединение, опухоли все еще не было (фиг. 1, 2). Лишь на 20 день в этой группе опухоль появилась у 1 из 8 мышей, на 40 день опухоли имелись у 6 мышей. У 2 из 8 мышей, получивших заявляемое соединение, опухоли отсутствовали свыше 90 дней наблюдения.
Измерение объемов опухолей, производившееся с 10 до 20 день после перевивки, свидетельствовало о значительном противоопухолевом эффекте заявляемого соединения (фиг. 3). Торможение роста опухоли под влиянием заявляемого соединения достигало 100% (табл. 1). 
Примечание: карцинома Эрлиха была перевита под кожу правого нижнего века, заявляемое соединение было введено в дозе 20 мг/кг внутрибрюшинно через 24 часа после перевивки; Т% - процент торможения роста опухоли, р - достоверность к контролю.
Введение заявляемого соединения обусловило выраженное увеличение продолжительности жизни животных по сравнению с контролем (фиг. 4). Анализ выживаемости по log rank (Mantel-Cox) тесту показал статистически достоверное увеличение выживаемости в группе заявляемого соединения в сравнении с контролем (р=0,0464, χ2=3,968).
Медиана продолжительности жизни под влиянием заявляемого соединения у мышей с перевитой под кожу нижнего века карциномой Эрлиха возросла по сравнению с контролем на 84% (табл. 2).
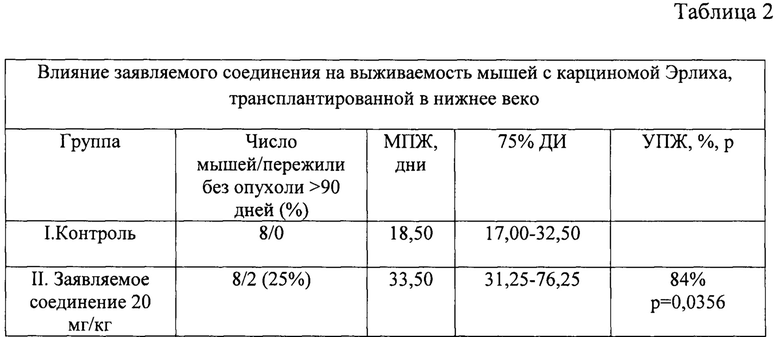
Обозначения: МПЖ - медиана продолжительности жизни, 75% ДИ - 75% доверительный интервал, УПЖ - увеличение медианы продолжительности жизни.
Все мыши контрольной группы погибли от опухоли к 40 дню после перевивки. Из 8 животных, получивших заявляемое соединение, от опухоли погибли 6 мышей (75%), а 2 мыши (25%) прожили без рецидива свыше 90 дней, что может рассматриваться как излечение.
Пример 2. Влияние соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол (заявляемого соединения) на рост мышиной саркомы 37, трансплантированной в нижнее веко.
Исследование проведено на 19 мышах самках линии BALB/c. Всем мышам под кожу правого нижнего века была трансплантирована саркома 37 посредством инъекции взвеси опухолевых клеток в 0,9% растворе натрия хлорида. Всем мышам под кожу правого нижнего века была трансплантирована карцинома Эрлиха посредством инъекции взвеси опухолевых клеток в 0,9% растворе натрия хлорида. Инъекция производилась в направлении от наружного угла глаза к внутреннему тонкой иглой (29G), через которую вводили 0,05 мл взвеси, содержащей 106 клеток саркомы 37.
После трансплантации опухоли мыши были рандомизированы на 2 группы:
I. Контроль (n=10);
II. Заявляемое соединение 20 мг/кг внутрибрюшинно через 24 часа после перевивки опухоли (n=9).
За мышами вели ежедневное наблюдение.
На 10 день после перевивки у всех 10 мышей контрольной группы развились опухоли нижнего века; ни у одной из 9 мышей, получивших заявляемое соединение, опухолей еще не было (р<0,001). Такая же картина наблюдалась и на 15 день после перевивки (фиг. 5, 6).
В группе мышей, получивших заявляемое соединение, опухоли полностью отсутствовали до 35 дня после перевивки, когда опухоль была обнаружена у 1 мыши из 9 (табл. 3, фиг. 7). 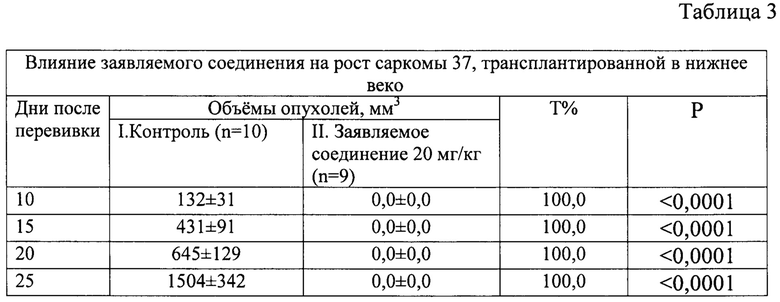
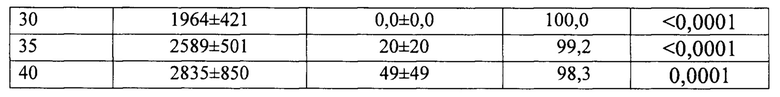
Примечание: саркома 37 была перевита под кожу правого века, хлонизол был введен в дозе 20 мг/кг внутрибрюшинно через 24 часа после перевивки; Т% - процент торможения роста опухоли, р - достоверность к контролю.
Заявляемое соединение значительно увеличило продолжительность жизни мышей с трансплантированной под кожу нижнего века саркомой 37 (фиг. 8).
Анализ выживаемости по log rank (Mantel-Cox) тесту показал статистически достоверное увеличение выживаемости в группе заявляемого соединения в сравнении с контролем (р<0,0001; χ2=20,20).
Медиана продолжительности жизни у мышей, получивших заявляемое соединение, более чем на 154% превысила медиану продолжительности жизни контрольных мышей (табл. 4).
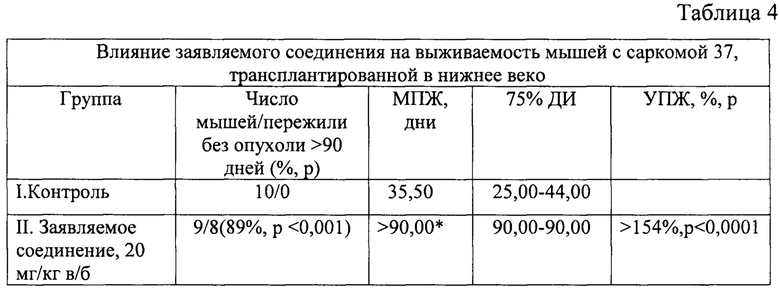
Обозначения: МПЖ - медиана продолжительности жизни, 75% ДИ - 75% доверительный интервал, УПЖ - увеличение продолжительности жизни; * - наблюдение свыше 90 дней.
Пример 3. Влияние соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол (заявляемого соединения) на рост лимфосаркомы ЛИО-1, трансплантированной в нижнее веко.
Исследование проведено на 16 мышах самках линии BALB/c. Всем мышам под кожу правого нижнего века была трансплантирована лимфосаркома ЛИО-1 посредством инъекции взвеси опухолевых клеток в 0,9% растворе натрия хлорида. Инъекция производилась в направлении от наружного угла глаза к внутреннему тонкой иглой (29G), через которую вводили 0,05 мл взвеси, содержащей 106 клеток лимфосаркомы ЛИО-1.
После трансплантации опухоли мыши были рандомизированы на 2 группы:
I. Контроль (n=10);
II. Заявляемое соединение 20 мг/кг внутрибрюшинно через 24 часа после перевивки опухоли (n=6).
За всеми мышами вели ежедневное наблюдение.
На 10 день после перевивки у всех 10 мышей контрольной группы развились опухоли нижнего века. Ни у одной из 6 мышей, получивших заявляемое соединение, опухолей не было до 20 дня (фиг. 9, 10). На 20 день в этой группе опухоль развилась у 1 мыши из 6 и только на 30 день наблюдения опухоль была обнаружена еще у одной мыши.
Торможение роста опухоли под влиянием заявляемого соединения в различные сроки после перевивки составляло 84-100%) (табл. 5).
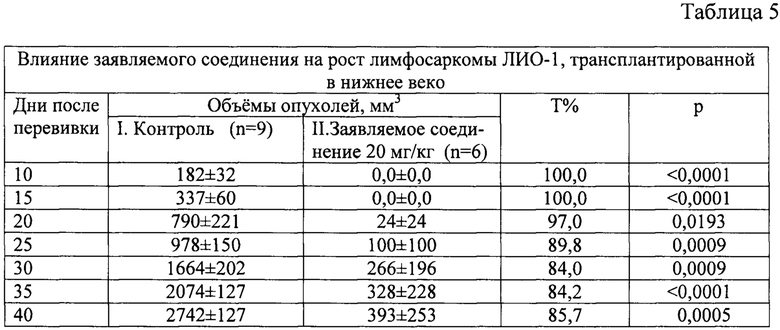
Примечание: саркома 37 была перевита под кожу правого века, хлонизол был введен в дозе 20 мг/кг внутрибрюшинно через 24 часа после перевивки; Т% - процент торможения роста опухоли, р - достоверность к контролю.
Влияние заявляемого соединения на выживаемость мышей с трансплантированной в нижнее веко лимфосаркомой ЛИО-1 отображают фиг. 11 и табл. 6.
Анализ выживаемости по log rank (Mantel-Cox) тесту показал статистически достоверное увеличение выживаемости в группе заявляемого соединения в сравнении с контролем (р=0,0122; χ2=6,281).
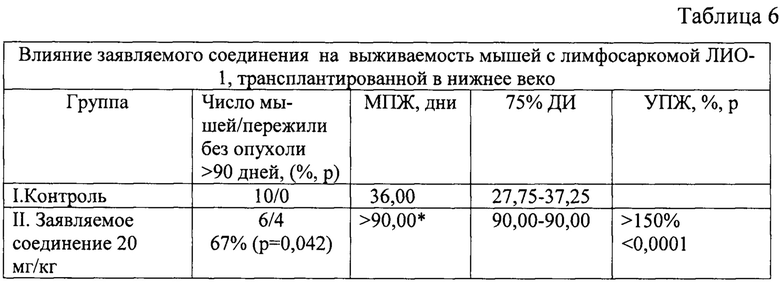
Обозначения: МПЖ - медиана продолжительности жизни, 75% ДИ - 75% доверительный интервал, УПЖ - увеличение продолжительности жизни; * - наблюдение продолжалось свыше 90 дней.
Медиана выживаемости мышей, получивших заявляемое соединение, не была достигнута. Из 6 животных этой группы 4 мыши (67%) пережили без признаков опухолевого роста свыше 90 дней, что может расцениваться как излечение.
Пример 4. Влияние соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол (заявляемого соединения) на рост меланомы В16, трансплантированной в нижнее веко
Исследование проведено на 18 мышах самках линии C57BL/6. Всем мышам под кожу правого нижнего века была трансплантирована меланома В16 посредством инъекции 10% -ной взвеси измельченной опухолевой ткани в 0,9% растворе натрия хлорида. Инъекция производилась в направлении от наружного угла глаза к внутреннему тонкой иглой (29 G), через которую вводили 0,05 мл взвеси опухоли.
После трансплантации опухоли мыши были рандомизированы на 2 группы:
I. Контроль (n=10);
II. Заявляемое соединение 5 мг/кг внутрибрюшинно через 24 часа после перевивки опухоли (n=8).
За мышами вели ежедневное наблюдение.
На 7 день после перевивки у всех мышей контрольной группы имелись четко определяемые визуально опухоли нижнего века. Ни у кого из животных, получивших заявляемое соединение, опухолей не было до 16 дня после перевивки (фиг. 13, 14). Всего в этой группе из 8 мышей опухоли век развились у 6. Торможение роста опухоли составляло в разные сроки от 92 до 100% (табл. 7).
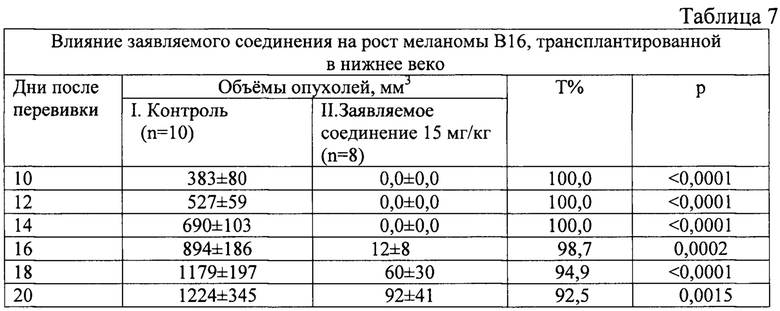
Обозначения: Т% - процент торможения роста опухоли, р - достоверность к контролю.
Динамику роста опухолей представляет фиг. 15, динамику выживаемости - фиг. 16.
Все 10 мышей контрольной группы погибли к 28 дню после перевивки опухоли. В группе животных, получивших заявляемое соединение, 6 мышей из 8 погибли от опухоли с 29 по 37 день. Две мыши (25%) прожили без опухоли свыше 60 дней.
Увеличение медианы продолжительности жизни мышей с перевитой в нижнее веко меланомой В16 под влиянием заявляемого соединения составило по сравнению с контролем 67% (табл. 8). Анализ выживаемости по log rank (Mantel-Cox) тесту показал статистически достоверное увеличение выживаемости в группе заявляемого соединения в сравнении с контролем (р<0,0001; χ2=17,46).

Обозначения: МПЖ - медиана продолжительности жизни, 75% ДИ - 75% доверительный интервал, УПЖ - увеличение продолжительности жизни.
Заявляемый способ позволяет достигнуть значительного угнетения роста трансплантированных в нижнее веко опухолей у мышей. При опухолях различного гистогенеза (карцинома Эрлиха, саркома 37, лимфосаркома ЛИО-1, меланома В16) применение 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиола вызывало достигавшее 100% угнетение роста опухолей век и увеличение медианы продолжительности жизни животных соответственно на 84% (р=0,0356),>154% (р<0,0001),>150% (р<0,0001) и 67% (р=0,0065). У мышей с трансплантированными под кожу нижнего века саркомой 37 и лимфосаркомой ЛИО-1 однократное введение 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиола в дозе 20 мг/кг обусловило полное излечение соответственно 89% (р<0,001) и 67% (р=0,042) животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СОЕДИНЕНИЯ 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛ ПЕРОРАЛЬНО ДЛЯ ЛЕЧЕНИЯ МЕЛАНОМЫ В16, ОПУХОЛИ ЭРЛИХА, САРКОМЫ 180, САРКОМЫ 37, ЛИМФОСАРКОМЫ ЛИО-1 И КАРЦИНОСАРКОМЫ WALKER 256 В ЭКСПЕРИМЕНТЕ НА МЫШАХ И КРЫСАХ | 2020 |
|
RU2733643C1 |
| СПОСОБ СИНТЕЗА 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2678846C1 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЯ 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГЛАЗНИЦЫ В ЭКСПЕРИМЕНТЕ У МЫШЕЙ С ТРАНСПЛАНТИРОВАННОЙ ВНУТРИГЛАЗНИЧНО КАРЦИНОМОЙ ЭРЛИХА | 2023 |
|
RU2815639C1 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЯ 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛ ДЛЯ ЛЕЧЕНИЯ HER2-ПОЛОЖИТЕЛЬНЫХ ОПУХОЛЕЙ В ЭКСПЕРИМЕНТЕ | 2018 |
|
RU2695787C1 |
| 2-/3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО/-1,3-ПРОПАНДИОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2068843C1 |
| 5-ОКСИМЕТИЛ-5-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-2-ЦИКЛОГЕКСИЛ-1,3-ДИОКСАН, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2000 |
|
RU2179555C1 |
| 4(5)-(3-НИТРО-4-(3,3-ДИМЕТИЛТРИАЗЕНО-1)ФЕНИЛ)ИМИДАЗОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1982 |
|
SU1074091A1 |
| Способ создания полинеоплазии со стимуляцией опухолевого роста в условиях первичного иммунодефицита в эксперименте | 2021 |
|
RU2751930C1 |
| ДИГИДРОХЛОРИД 1-(3-НИТРО-4-МЕТОКСИБЕНЗИЛ)-2-[БИС-(2-ХЛОРЭТИЛ)АМИНОМЕТИЛ]ИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 1981 |
|
SU976654A1 |
| Способ модификации развития аденокарциномы в эксперименте | 2020 |
|
RU2743960C1 |
Изобретение относится к применению соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол для лечения карциномы Эрлиха, саркомы 37, лимфосаркомы ЛИО-1, меланомы В16, трансплантированных в нижнее веко мышей в эксперименте в дозе 15 или 20 мг/кг однократно внутрибрюшинно. Заявленное применение 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиола позволяет достигнуть 100%-ного угнетения роста опухолей век и увеличения медианы продолжительности жизни животных соответственно на 84%, >154%, >150% и 67%. У мышей с трансплантированными под кожу нижнего века саркомой 37 и лимфосаркомой ЛИО-1 однократное введение 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиола в дозе 20 мг/кг обусловило полное излечение соответственно 89% и 67% животных. 16 ил., 8 табл., 4 пр.
Применение соединения 2-[3-(2-хлорэтил)-3-нитрозоуреидо]-1,3-пропандиол для лечения карциномы Эрлиха, саркомы 37, лимфосаркомы ЛИО-1, меланомы В16, трансплантированных в нижнее веко мышей в эксперименте в дозе 15 или 20 мг/кг однократно внутрибрюшинно.
| 2-/3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО/-1,3-ПРОПАНДИОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2068843C1 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЯ 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛ ПЕРОРАЛЬНО ДЛЯ ЛЕЧЕНИЯ МЕЛАНОМЫ В16, ОПУХОЛИ ЭРЛИХА, САРКОМЫ 180, САРКОМЫ 37, ЛИМФОСАРКОМЫ ЛИО-1 И КАРЦИНОСАРКОМЫ WALKER 256 В ЭКСПЕРИМЕНТЕ НА МЫШАХ И КРЫСАХ | 2020 |
|
RU2733643C1 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЯ 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛ ДЛЯ ЛЕЧЕНИЯ HER2-ПОЛОЖИТЕЛЬНЫХ ОПУХОЛЕЙ В ЭКСПЕРИМЕНТЕ | 2018 |
|
RU2695787C1 |
| СПОСОБ СИНТЕЗА 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2678846C1 |
| WO 2003075934 A1, 18.09.2003. | |||
Авторы
Даты
2021-07-22—Публикация
2020-10-13—Подача