ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая заявка на патент испрашивает приоритет на основании предварительной заявки на патент США № 62/162280, поданной 15 мая 2015 г., которая включена в данный документ посредством ссылки.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ МАТЕРИАЛА, ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ
[002] В данный документ включен посредством ссылки во всей своей полноте машиночитаемый перечень нуклеотидных/аминокислотных последовательностей, поданный одновременно с настоящей заявкой и определенный следующим образом: (текстовый) файл ASCII размером 103701 байт под названием "UCASE-100WO1SequenceListing.TXT," созданный 12 мая 2016 г.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[003] Функциональная уриказа может быть найдена в широком спектре организмов, таких как археи, бактерии и эукариоты. Однако у человека и некоторых приматов уриказа не экспрессируется. Отсутствие экспрессии уриказы у человека приводит к более высоким уровням мочевой кислоты в системном кровотоке, а в некоторых случаях к состояниям гиперурикемии, таким как подагра и синдром лизиса опухоли.
[004] Подагра поражает более 8 миллионов американцев и представляет собой воспалительную форму артрита с болезненным и тяжелым течением, которая определяется по превышению уровней мочевой кислоты в сыворотке крови сверх растворимости мочевой кислоты в жидкостях организма. Повреждения, причиняемые подагрой, могут привести к хронической боли, функциональным нарушениям при работе и в быту, а также к ухудшению качества жизни, связанного со здоровьем (см., например, Wertheimer, et al., Curr Ther Res Clin Exp., 75: 1-4 (2013)).
[005] Синдром лизиса опухоли (TLS) обычно встречается у пациентов с массивными, быстро пролиферующими и отвечающими на лечение опухолями. TLS представляет собой потенциально летальное осложнение противоракового лечения, которое возникает при уничтожении большого количества раковых клеток и высвобождения продуктов деградации, что приводит к резкому увеличению уровня мочевой кислоты в системном кровотоке.
[006] Существуют различные механизмы действия для контроля гиперурикемии, такие как ингибиторы ксантиноксидазы (фермента, который превращает ксантин в мочевую кислоту), урикозурические лекарственные средства (молекулы, которые ингибируют URAT1) и лечение уриказой.
[007] Две уриказы, Krystexxa® и Elitek®, являются клинически одобренными. Krystexxa® (пеглотиказа) представляет собой пегилированную уриказу, одобренную для лечения хронической подагры у взрослых пациентов c рефрактерностью к традиционной терапии. Krystexxa® представляет собой химерный белок из последовательности уриказы свиньи и павиана, который является гиперпегилированным (~ 440 кДа PEG на тетрамер). Krystexxa® вводят путем внутривенной (IV) инфузии в течение 2-часового периода. Во время фазы 3 клинических испытаний у 26% пациентов наблюдались инфузионные реакции, и у 6,5% пациентов наблюдались реакции, характеризующиеся как анафилаксия (Baraf et al., Arthritis Res Ther., 15(5):R137 (2013) и Strand et al., J Rheumatol., 39(7): 1450-1457 (2012). Krystexxa® содержит особое предостережение относительно анафилаксии и инфузионных реакций (см. инструкцию по применению препарата Krystexxa®). Поэтому пациенты обычно предварительно принимают антигистаминные препараты или кортикостероиды перед IV-инфузией, а затем их контролируют после инфузии. Предварительный примем, IV-инфузия и контроль после инфузии занимают приблизительно 6-8 часов в лечебном учреждении, проводящем IV-манипуляции.
[008] Elitek® (расбуриказа) представляет собой модифицированную рекомбинантную уриказу Aspergillus flavus, которая показана для первичного контроля уровней мочевой кислоты в плазме крови у пациентов детского и взрослого возраста с лейкемией, лимфомой и солидными опухолевыми злокачественными новообразованиями, получающих противораковую терапию, которая, как ожидается, приведет к лизису опухоли и последующему повышению уровня мочевой кислоты в плазме крови. У человека Elitek® характеризуется периодом полувыведения 16-21 часов, и его нужно вводить ежедневно путем IV-инфузии. Подобно Krystexxa®, Elitek® также имеет особое предостережение относительно анафилаксии и гемолиза (особенно у пациентов с дефицитом G6PD). Частота дозирования (ежедневно), способ введения (IV), иммуногенность и стоимость делают Elitek® непривлекательным вариантом лечения хронического подагры.
[009] Принимая во внимание вышесказанное, в данной области техники существует потребность в разработке более безопасных, более удобных и менее иммуногенных вариантов лечения гиперурикемии. Настоящее изобретение, описанное в данном документе, удовлетворяет эту потребность.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] Для преодоления значительных и известных побочных эффектов от средств для лечения из предшествующего уровня техники был оценен потенциал множества последовательностей уриказы и были выполнены конкретные и значимые улучшения в этих последовательностях с тем, чтобы получить улучшенные уриказы, которые являются более безопасными, менее иммуногенными и более подходящими, чем существующие методы терапии.
[0011] В некоторых аспектах в данном документе охватывается ряд различных последовательностей уриказы. Уриказа может содержать аминокислотную последовательность, которая по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична любой из SEQ ID NO: 1-34, где последовательность не является любой из SEQ ID NO: 27-33.
[0012] В некоторых вариантах осуществления уриказа по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 1 или по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 2.
[0013] В некоторых вариантах осуществления уриказа представляет собой последовательность, которая отличается от любой из SEQ ID NO: 1-34 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 35 (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотам). Например, уриказа может отличаться от SEQ ID NO: 1 или SEQ ID NO: 2 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 35.
[0014] В некоторых аспектах уриказа представляет собой последовательность, которая отличается от любой из SEQ ID NO: 1-34 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 14 (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, или 14 аминокислотам). Например, уриказа может отличаться от SEQ ID NO: 1 или SEQ ID NO: 2 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 14. В определенных аспектах уриказа представляет собой SEQ ID NO: 1 или SEQ ID NO: 2. В определенных вариантах осуществления уриказа представляет собой любую из SEQ ID NO: 3-26 или 34.
[0015] В соответствии с настоящим описанием также предусмотрены способы лечения гиперурикемии, подагры (включая различные формы подагры) и синдрома лизиса опухоли.
[0016] Дополнительные цели и преимущества частично будут изложены в следующем описании и частично будут очевидны из описания или могут быть изучены на практике. Цели и преимущества будут реализованы и достигнуты посредством элементов и комбинаций, конкретно указанных в прилагаемой формуле изобретения.
[0017] Следует понимать, что как вышеприведенное общее описание, так и нижеследующее подробное описание являются лишь иллюстративными и пояснительными и не ограничивают формулу изобретения.
[0018] Сопроводительные графические материалы, включенные в настоящее описание и образующие его часть, иллюстрируют один (несколько) вариант (вариантов) осуществления и вместе с описанием служат для пояснения принципов, описанных в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0019] На фигуре 1 показан анализ SDS-PAGE растворимых (S) и нерастворимых (P) белков, присутствующих в клеточных лизатах клеток E. coli, экспрессирующих различные уриказы.
[0020] На фигурах 2A-B показаны данные дифференциальной сканирующей калориметрии в отношении стабильности для уриказы Deinococcus geothermalis (фигура 2A) и уриказы Deinococcus radiodurans (фигура 2B).
[0021] Фигура 3 представляет собой линейный график, на котором показаны результаты анализов активности уриказы при различных концентрациях субстрата (UA). Сплошными линиями показано сглаживание кинетики согласно уравнению Михаэлиса-Ментен.
[0022] Фигура 4 представляет собой линейный график, показывающий адгезию клеток M21 к иммобилизованному фибронектину, Fab9mCys или вариантам уриказы.
[0023] Фигура 5 представляет собой линейный график, на котором показаны результаты анализов активности уриказы при различных концентрациях субстрата (UA). Сплошными и пунктирными линиями показано сглаживание кинетики согласно уравнению Михаэлиса-Ментен.
[0024] Фигура 6 представляет собой гистограмму, показывающую частоты HLA-DRB1 в исследуемой популяции (доноров) по сравнению с европеоидной популяцией.
[0025] На фигурах 7А-С приведены данные отдельных доноров по оценке иммуногенности ex vivo. Фигура 7А представляет собой график рассеяния, показывающий индекс стимуляции для буфера (отрицательный контроль) по сравнению с KLH (положительный контроль). Фигура 7В представляет собой график рассеяния, показывающий индекс стимуляции для буфера (отрицательный контроль) по сравнению с тестируемой уриказой. Фигура 7С представляет собой гистограмму, показывающую средний индекс стимуляции (SI) для буфера, KLH и уриказы.
[0026] На фигурах 8А-В показан анализ различных N-концевых усечений уриказы. На фигуре 8А представлен анализ SDS-PAGE 3 вариантов уриказы с N-концевым усечением (V1, V2 и V3) по сравнению с SGD-уриказой. Фигура 8В представляет собой линейный график, на котором показаны результаты анализов активности уриказы при различных концентрациях субстрата (UA). Сплошными линиями показано сглаживание кинетики согласно уравнению Михаэлиса-Ментен.
[0027] Фигуры 9A-B представляют собой линейные графики, на которых показаны результаты анализов активности уриказы при различных концентрациях субстрата (UA). Сплошными линиями показано сглаживание кинетики согласно уравнению Михаэлиса-Ментен. На фигуре 9А показаны результаты анализов активности уриказы, проведенных в присутствии DTT для уриказ с двумя Cys и тремя Cys (без PEG). На фигуре 9В показаны результаты анализов активности уриказы для дипегилированных и трипегилированных уриказ.
[0028] На фигурах 10A-D показан анализ дипегилированной уриказы. На фигуре 10A показаны трехмерные доступные для растворителя сайты в тетрамерной кристаллической структуре уриказы Arthrobacter globiformis (код доступа в PDB: 2YZB). На фигуре 10B представлен анализ SDS-PAGE непегилированной и дипегилированной уриказы. На фигуре 1C представлен анализ очищенной дипегилированной уриказы с помощью обращенно-фазовой хроматографии. Фигура 10D представляет собой линейный график, на котором показаны результаты анализов активности уриказы при различных концентрациях субстрата (UA). Сплошными и пунктирными линиями показано сглаживание кинетики согласно уравнению Михаэлиса-Ментен.
[0029] Фигуры 11A-B представляют собой графики, показывающие фармакокинетические данные для пегилированной уриказы. На фигуре 11A показаны фармакокинетические данные у крыс для дипегилированной и трипегилированной уриказы. На фигуре 11B показаны фармакокинетические данные у собак для дипегилированной уриказы.
[0030] На фигурах 12A-C показаны анализы активности и стабильности дипегилированной уриказы ex vivo с использованием человеческой сыворотки крови. На фигуре 12A показано сравнение активности дипегилированной уриказы и Krystexxa® в 50% человеческой сыворотке крови при 37oC. На фигуре 12B показана активность дипегилированной уриказы, которую инкубировали в человеческой сыворотке крови при 37°C в течение различных промежутков времени. На фигуре 12C показана активность дипегилированной уриказы в ответ на повторные дозы UA.
[0031] На фигуре 13 показан анализ эффективности пегилирования при различном времени инкубации с использованием RP-HPLC. RP-HPLC использовали для измерения конъюгации PEG, что приводит к хорошо разрешенным пикам, которые соответствуют видам с разной степенью конъюгации.
[0032] На фигурах 14А-В показаны графики поверхности отклика, демонстрирующие влияние концентрации реагентов на общую эффективность пегилирования для моментов времени от 10 минут до 2 часов. На фигуре 14А показаны данные на основе анализа "полностью пегилированной субъединицы" (т. е. 3 из 3 функционализированных сайтов конъюгации на мономер), непосредственно получаемые из записи самописца в анализе RP-HPLC. На фигуре 14B показан анализ данных при вычислении полной дериватизации на основании уравнения (1).
[001]
ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0033] В таблице 1 представлен перечень определенных последовательностей, упоминаемых в данном документе.
где
Xaa1 представляет собой либо R, либо любую природную аминокислоту, за исключением C;
Xaa2 представляет собой либо G, либо любую природную аминокислоту, за исключением C;
Xaa3 представляет собой либо D, либо любую природную аминокислоту, за исключением C.
Xaa5DHDHAFSRNKSEVRTAVLEISGXaa6EQAIVAGIEGLTVLKSTGSEFHGFPRDKYTTLQETTDRILATDVSARWRYNTVEVDFDAVYASVRGLLLKAFAETHSLALQQTMYEMGRAVIETHPEIDEIKMSLPNKHHFLVDLQPFGQDNPNEVFYAADRPYGLIEATIQREGSRADhpiwsniagf
где
Xaa1 либо присутствует, либо отсутствует, и если присутствует, то представляет собой T;
Xaa2 представляет собой либо T, либо C;
Xaa3 представляет собой либо N, либо C;
Xaa4 представляет собой либо R, либо S;
Xaa5 представляет собой либо N, либо C;
Xaa6 представляет собой либо S, либо C;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
где
Xaa1 представляет собой либо T, либо C;
Xaa2 представляет собой либо N, либо C;
Xaa3 представляет собой либо N, либо C;
Xaa4 представляет собой либо S, либо C;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
где
Xaa1 представляет собой либо T, либо C;
Xaa2 представляет собой либо N, либо C;
Xaa3 представляет собой либо N, либо C;
Xaa4 представляет собой либо S, либо C;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
Xaa5Xaa6HDHAFSRNKSEVRTAVLEISGXaa7EQAIVAGIEGLTVLKSTGSEFHGFPRDKYTTLQETTDRILATDVSARWRYNTVXaa8VDFDAVYASVRGLLLKAFAETHSLALQQTMYEMGRAVIETH Xaa9EIDEIKMSLPNKHHFLVDLQPFGQDNPNEVFYAADRPYGLIEATIQRXaa10GSXaa11ADhpiwsniagf
где
Xaa1 либо присутствует, либо отсутствует, и если присутствует, то представляет собой T;
Xaa2 представляет собой либо T, либо C;
Xaa3 представляет собой либо N, либо C;
Xaa4 представляет собой либо R, либо S;
Xaa5 представляет собой либо N, либо C;
Xaa6 представляет собой либо D, либо C;
Xaa7 представляет собой либо S, либо C;
Xaa8 представляет собой либо E, либо C;
Xaa9 представляет собой либо P, либо C;
Xaa10 представляет собой либо E, либо C;
Xaa11 представляет собой либо R, либо C;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
Xaa5Xaa6HDHAFSRNKSEVRTAVLEISGXaa7EQAIVAGIEGLTVLKSTGSEFHGFPRDKYTTLQETTDRILATDVSARWRYNTVXaa8VDFDAVYASVRGLLLKAFAETHSLALQQTMYEMGRAVIETH Xaa9EIDEIKMSLPNKHHFLVDLQPFGQDNPNEVFYAADRPYGLIEATIQRXaa10GSXaa11ADhpiwsniagf
где
Xaa1 либо присутствует, либо отсутствует, и если присутствует, то представляет собой T;
Xaa2 представляет собой либо T, либо C;
Xaa3 представляет собой либо N, либо C;
Xaa4 представляет собой любую встречающуюся в природе аминокислоту, за исключением C;
Xaa5 представляет собой либо N, либо C;
Xaa6 представляет собой либо D, либо C;
Xaa7 представляет собой либо S, либо C;
Xaa8 представляет собой либо E, либо C;
Xaa9 представляет собой либо P, либо C;
Xaa10 представляет собой либо E, либо C;
Xaa11 представляет собой либо R, либо C;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
Xaa4Xaa5HDHAFSRNKSEVRTAVLEISGXaa6EQAIVAGIEGLTVLKSTGSEFHGFPRDKYTTLQETTDRILATDVSARWRYNTVXaa7VDFDAVYASVRGLLLKAFAETHSLALQQTMYEMGRAVIETH Xaa8EIDEIKMSLPNKHHFLVDLQPFGQDNPNEVFYAADRPYGLIEATIQRXaa9GSXaa10ADhpiwsniagf
где
Xaa1 представляет собой либо T, либо C;
Xaa2 представляет собой либо N, либо C;
Xaa3 представляет собой любую встречающуюся в природе аминокислоту, за исключением C;
Xaa4 представляет собой либо N, либо C;
Xaa5 представляет собой либо D, либо C;
Xaa6 представляет собой либо S, либо C;
Xaa7 представляет собой либо E, либо C;
Xaa8 представляет собой либо P, либо C;
Xaa9 представляет собой либо E, либо C;
Xaa10 представляет собой либо R, либо C;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
Xaa5Xaa6HDHAFSRNKSEVRTAVLEISGXaa7EQAIVAGIEGLTVLKSTGSEFHGFPRDKYTTLQETTDRILATDVSARWRYNTVXaa8VDFDAVYASVRGLLLKAFAETHSLALQQTMYEMGRAVIETH Xaa9EIDEIKMSLPNKHHFLVDLQPFGQDNPNEVFYAADRPYGLIEATIQRXaa10GSXaa11ADhpiwsniagf
где
Xaa1 либо присутствует, либо отсутствует, и если присутствует, то представляет собой T;
Xaa2 представляет собой либо T, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa3 представляет собой либо N, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa4 представляет собой любую встречающуюся в природе аминокислоту, за исключением C;
Xaa5 представляет собой либо N, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa6 представляет собой либо D, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa7 представляет собой либо S, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa8 представляет собой либо E, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa9 представляет собой либо P, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa10 представляет собой либо E, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa11 представляет собой либо R, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
Xaa4Xaa5HDHAFSRNKSEVRTAVLEISGXaa6EQAIVAGIEGLTVLKSTGSEFHGFPRDKYTTLQETTDRILATDVSARWRYNTVXaa7VDFDAVYASVRGLLLKAFAETHSLALQQTMYEMGRAVIETH Xaa8EIDEIKMSLPNKHHFLVDLQPFGQDNPNEVFYAADRPYGLIEATIQRXaa9GSXaa10ADhpiwsniagf
где
Xaa1 представляет собой либо T, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa2 представляет собой либо N, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa3 представляет собой любую встречающуюся в природе аминокислоту, за исключением C;
Xaa4 представляет собой либо N, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa5 представляет собой либо D, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa6 представляет собой либо S, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa7 представляет собой либо E, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa8 представляет собой либо P, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa9 представляет собой либо E, либо любую природную или не встречающуюся в природе аминокислоту, применимую для сайт-специфической конъюгации;
Xaa10 представляет собой либо R, либо любую природную или не встречающуюся в природе аминокислоту, применяемую для сайт-специфической конъюгации;
и где по меньшей мере один, два, три или четыре цистеина включены в последовательность, и где одна или несколько обозначенных строчными буквами аминокислот на C-конце (hpiwsniagf) являются необязательными.
(содержит необязательную N-концевую His-метку и необязательный короткий линкер, оба обозначенные строчными буквами) (усечение C-конца с his-меткой)
где
Xaa1 представляет собой либо R, либо любую природную аминокислоту, за исключением C;
Xaa2 представляет собой либо G, либо любую природную аминокислоту, за исключением C;
Xaa3 представляет собой либо D, либо любую природную аминокислоту, за исключением C.
где
Xaa1 представляет собой либо R, либо любую природную аминокислоту, за исключением C;
Xaa2 представляет собой либо G, либо любую природную аминокислоту, за исключением C;
Xaa3 представляет собой либо D, либо любую природную аминокислоту, за исключением C.
(Содержит 11 аминокислот на C-конце)
где
Xaa1 представляет собой либо R, либо любую природную аминокислоту;
Xaa2 представляет собой либо G, либо любую природную аминокислоту;
Xaa3 представляет собой либо D, либо любую природную аминокислоту.
(содержит 11 аминокислот на C-конце) (в другом варианте осуществления RGD может представлять собой SGD)
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0034] Уратоксидаза (уриказа EC 1.7.3.3, uox) представляет собой гомотетрамерный фермент, состоящий из четырех идентичных субъединиц размером 34 кДa. Фермент отвечает за начальную стадию, которая запускает каскад реакций превращения мочевой кислоты в более растворимый и легко экскретируемый продукт аллантоин. Вкратце, уриказа катализирует реакцию взаимодействия мочевой кислоты (UA) с O2 и H2O с образованием 5-гидроксиизоурата (HIU) и выделением H2O2. HIU представляет собой нестабильный продукт, который подвергается неферментативному гидролизу до 2-оксо-4-гидрокси-4-карбокси-5-уреидоимидазолина (OHCU) и затем спонтанно декарбоксилирует с образованием рацемического аллантоина. У видов, которые содержат функциональную уриказу, экспрессируются два дополнительных фермента (гидролаза HIU и декарбоксилаза OHCU), которые быстрее катализируют эту реакцию с получением (s)-аллантоина. Функциональная уриказа может быть найдена в широком спектре организмов: археи, бактерии и эукариоты. Однако у человека и некоторых приматов уриказа не экспрессируется. Отсутствие экспрессии уриказы объясняется тремя генетическими мутациями: нонсенс-мутацией в кодоне 33 (оказывает воздействие на орангутанов, горилл, шимпанзе и человека), другой нонсенс-мутацией в кодоне 187 (оказывает воздействие на шимпанзе и человека) и мутацией в акцепторном сайте сплайсинга в интроне 2 (оказывает воздействие на шимпанзе и человека). Был выдвинут ряд гипотез для объяснения эволюционного устранения уриказной активности и соответствующего увеличения уровней UA. К ним относится идея о том, что увеличение уровней UA (мощного антиоксиданта и поглотителя кислородных радикалов) привело к сокращению случаев возникновения заболевания, ассоциированного со свободными радикалами кислорода (рака), и увеличению продолжительности жизни. Кроме того, тот факт, что UA структурно напоминает нейростимуляторы, такие как кофеин и теобромин, привел к предположению, что увеличение уровней UA могло привести к продвижению в интеллектуальном/когнитивном развитии. Наконец, было высказано предположение, что увеличение уровня мочевой кислоты привело к поддержанию уровней артериального давления, требуемого гоминидами, и способствовало ему, принимая во внимание потребление растительного рациона с очень низким содержанием солей (1-2 миллиона лет назад). Независимо от эволюционного преимущества, которое могло быть достигнуто, отсутствие экспрессии уриказы у человека привело к более высоким уровням UA в системном кровотоке, а в некоторых случаях к состояниям гиперурикемии, таким как подагра и синдром лизиса опухоли.
[0035] Подагра поражает более 8 миллионов американцев и представляет собой воспалительную форму артрита с болезненным и тяжелым течением, которая определяется по превышению уровней UA в сыворотке крови сверх растворимости UA в жидкостях организма. Уровни UA в сыворотке крови, составляющие выше 6,8 мг/дл, могут приводить к образованию кристаллов UA в тканях, что вызывает острый воспалительный ответ. Острые приступы подагрического артрита (обострения) и хроническое воспаление, при котором кристаллы UA откладываются в фиброзных тканях, характеризуются болезненным и тяжелым течением. Повреждения, причиняемые подагрой, могут привести к хронической боли, функциональным нарушениям при работе и в быту, а также к ухудшению качества жизни, связанного со здоровьем (Wertheimer, et al., выше).
[0036] Синдром лизиса опухоли (TLS) обычно встречается у пациентов с массивными, быстро пролиферующими и отвечающими на лечение опухолями. TLS представляет собой потенциально летальное осложнение противоракового лечения, которое возникает при уничтожении большого количества раковых клеток и высвобождения продуктов деградации. Пурины нуклеиновых кислот метаболизируются до UA, приводя к резкому увеличению уровня UA в системном кровотоке. В тяжелых случаях кристаллы UA образовываются в почечных канальцах, вызывая UA-нефропатию (острую почечную недостаточность). О TLS сообщалось в широком спектре типов опухолей (Ikeda, et al., Drugs, Diseases & Procedures, Medscape (Dec. 3, 2014)).
[0037] Существуют различные механизмы действия для контроля гиперурикемии. Ингибиторы ксантиноксидазы (фермента, который превращает ксантин в UA) клинически предписывают с 1960-х годов. Наиболее распространенный из них, аллопуринол, применяется более чем 2 миллионами пациентов с подагрой в США. Тем не менее, у многих пациентов сохраняются уровни UA выше допустимых, указывая на то, что гиперурикемия представляет собой не просто проблему выработки UA. Более поздние исследования показали, что уровни UA у пациентов можно также контролировать путем ингибирования URAT1, фермента, ответственного за рециркуляцию UA. Урикозурические лекарственные средства (молекулы, которые ингибируют URAT1) действуют на проксимальные канальцы в почках, где они препятствуют абсорбции UA из почки обратно в кровь. Урикозурические лекарственные средства, такие как бензбромарон и лезинурад, стимулируют экскрецию UA. Наконец, было показано, что лечение уриказой быстро снижает уровни UA в периферическом кровотоке путем окисления UA до более растворимого продукта аллантоина. Две уриказы, Krystexxa® и Elitek®, являются клинически одобренными.
[0038] Krystexxa® (пеглотиказа) представляет собой пегилированную уриказу, одобренную для лечения хронической подагры у взрослых пациентов c рефрактерностью к традиционной терапии. Krystexxa® представляет собой химерный белок из последовательности уриказы свиньи и павиана, который является гиперпегилированным (~ 440 кДа PEG на тетрамер). Krystexxa® вводят путем внутривенной (IV) инфузии в течение 2-часового периода. Во время фазы 3 клинических испытаний у 26% пациентов наблюдались инфузионные реакции, и у 6,5% пациентов наблюдались реакции, характеризующиеся как анафилаксия (Baraf et al., Arthritis Res Ther., 15(5):R137 (2013) и Strand et al., J Rheumatol., 39(7): 1450-1457 (2012). Krystexxa® содержит особое предостережение относительно анафилаксии и инфузионных реакций (см. инструкцию по применению препарата Krystexxa®). Поэтому пациенты обычно предварительно принимают антигистаминные препараты или кортикостероиды перед IV-инфузией, а затем их контролируют после инфузии. Предварительный примем, IV-инфузия и контроль после инфузии занимают приблизительно 6-8 часов в лечебном учреждении, проводящем IV-манипуляции. Частота обработки составляет раз в две недели. В фазе 3 клинических испытаний у большого процента пациентов появлялись антитела к лекарственному средству (~ 92%) и у примерно 40% пациентов наблюдалась положительная первичная конечная точка (снижение уровней UA ниже 6 мг/дл в течение 6 месяцев). Несмотря на инфузионные реакции, ответ на лекарственное средство и неудобный режим дозирования, в клинических испытаниях и в исследованиях отдельных случаев наблюдались поразительные результаты, демонстрирующие уменьшение или разрешение подагрических узелков (отложений кристаллов мочевой кислоты). Цифровые фотографии пациентов с узелковой подагрой (на руках или ногах) до и после нескольких обработок Krystexxa® продемонстрировали потенциал уриказы в разрешении содержания подагрических узелков и UA.
[0039] Elitek® (расбуриказа) представляет собой модифицированную рекомбинантную уриказу Aspergillus flavus, которая показана для первичного контроля уровней мочевой кислоты в плазме крови у пациентов детского и взрослого возраста с лейкемией, лимфомой и солидными опухолевыми злокачественными новообразованиями, получающих противораковую терапию, которая, как ожидается, приведет к лизису опухоли и последующему повышению уровня мочевой кислоты в плазме крови. У человека Elitek® характеризуется периодом полувыведения 16-21 часов, и его нужно вводить ежедневно путем IV-инфузии. Подобно Krystexxa®, Elitek® также имеет особое предостережение относительно анафилаксии и гемолиза (особенно у пациентов с дефицитом G6PD). Частота дозирования (ежедневно), способ введения (IV), иммуногенность и стоимость делают Elitek® непривлекательным вариантом лечения хронического подагры.
[0040] Принимая во внимание вышесказанное, в данной области техники существует потребность в разработке улучшенных уриказ, которые являются более безопасными, более удобными и менее иммуногенными, чем уриказы, которые доступны в настоящее время. Настоящее изобретение, описанное в данном документе, удовлетворяет эту потребность.
I. Улучшенные последовательности уриказы
[0041] В некоторых аспектах в данном документе охватывается ряд различных последовательностей уриказы. Уриказа, описанная в данном документе, может содержать аминокислотную последовательность, которая по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична любой из SEQ ID NO: 1-34, где последовательность не является любой из SEQ ID NO: 27-33. В одном варианте осуществления уриказа имеет аминокислотную последовательность под любым из SEQ ID NO: 1-26 или 34. В другом варианте осуществления уриказа содержит аминокислотную последовательность, которая по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична любой из SEQ ID NO: 1-34, где последовательность уриказы не является встречающейся в природе последовательностью уриказы.
[0042] В некоторых вариантах осуществления уриказа по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 1 или по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 2.
[0043] В некоторых вариантах осуществления уриказа представляет собой последовательность, которая отличается от любой из SEQ ID NO: 1-34 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 35 (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотам). Например, уриказа может отличаться от SEQ ID NO: 1 или SEQ ID NO: 2 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 35.
[0044] В некоторых аспектах уриказа представляет собой последовательность, которая отличается от любой из SEQ ID NO: 1-34 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 14 (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, или 14 аминокислотам). Например, уриказа может отличаться от SEQ ID NO: 1 или SEQ ID NO: 2 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 14. В определенных аспектах уриказа представляет собой SEQ ID NO 1 или SEQ ID NO: 2. В определенных вариантах осуществления уриказа представляет собой любую из SEQ ID NO: 3-26 или 34. Уриказа может "отличаться от" любой из SEQ ID NO: 1-34 за счет содержания добавления, делеции или замены в аминокислотной последовательности. Способы внесения аминокислотных добавлений, делеций и замен хорошо известны из уровня техники.
[0045] В некоторых вариантах осуществления уриказа содержит усечение на N- и/или С-конце, при этом усеченная уриказа сохраняет ферментативную активность. В одном варианте осуществления приблизительно 1-15 (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, или 15) аминокислот усекаются с N-конца. В другом варианте осуществления приблизительно 1-20 (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20) аминокислот усекаются с C-конца. В еще одном варианте осуществления приблизительно 1-15 (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, или 15) аминокислот усекаются с N-конца и приблизительно 1-20 (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20) аминокислот усекаются с C-конца. В одном варианте осуществления уриказа представляет собой уриказу с любой из SEQ ID NO: 27-34, где уриказа содержит усечение на N- и/или C-конце, как описано выше, при этом усеченная уриказа сохраняет ферментативную активность. В дополнительном варианте осуществления вышеупомянутая усеченная уриказа содержит от приблизительно 1 до приблизительно 14 (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, или 14) дополнительных аминокислотных изменений (например, добавлений, делеций или замен). Способы анализа ферментативной активности уриказы известны из уровня техники (например, анализ образования продукта и истощения субстрата), и любой подходящий способ, известный из уровня техники, можно применять для измерения ферментативной активности уриказ, описанных в данном документе.
[0046] В некоторых вариантах осуществления уриказа по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 27-33. В некоторых аспектах уриказа отличается от любой из SEQ ID NO: 27-33 по аминокислотам, количество которых составляет от приблизительно 1 до приблизительно 35 (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотам).
[0047] В одном варианте осуществления уриказа по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности с номером доступа в NCBI D0VWQ1, WP_011525965, WP_010887803, WP_013581210.1, WP_011682147, WP_013569963 или ADG06709. В некоторых аспектах уриказа отличается от любой из последовательностей с номером доступа в NCBI D0VWQ1, WP_011525965, WP_010887803, WP_013581210.1, WP_011682147, WP_013569963 или ADG06709 по приблизительно 1-35 аминокислотам (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотам).
[0048] В некоторых вариантах осуществления уриказа на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 27. В некоторых аспектах уриказа отличается от SEQ ID NO: 27 по приблизительно 1-35 аминокислотам (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотам).
[0049] В некоторых вариантах осуществления уриказа по меньшей мере на приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 28. В некоторых аспектах уриказа отличается от SEQ ID NO: 28 по приблизительно 1-35 аминокислотам (например, по приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотам).
[0050] В данной области техники хорошо известно, что процессинг экспрессированных белков может приводить к отщеплению N-концевого остатка метионина, котрансляционной модификации, которая может иметь место как у прокариотических, так и у эукариотических хозяев (Sherman, et al., Bioessays, 3: 27-31 (1985)). Этот процессинг, который осуществляется ферментативным путем с помощью метионинаминопептидазы, зависит от идентичности аминокислотного остатка, смежного с аминоконцом. Метионин эффективно удаляется из белков, когда второй остаток представляет собой глицин или аминокислоту с небольшой боковой цепью, такую как аланин (Hirel et al., Proc. Natl. Acad. Sci. U.S.A., 86: 8247-8251 (1989) и Huang et al., Biochemistry, 26: 8242-8246 (1987)). Однако N-концевой метионин не отщепляется, когда смежным остатком является аминокислота с крупной боковой цепью. Различная степень отщепления может иметь место, когда второй остаток представляет собой аминокислоту среднего размера, такую как треонин или аспарагин (Hirel et al., выше). Таким образом, в некоторых вариантах осуществления метионин в положении 1 уриказы отщепляется, так что подвергнутая процессингу форма уриказы не содержит метионин в положении 1. В другом варианте осуществления в уриказе сохраняется метионин в положении 1. С целью предотвращения отщепления метионина в положении 1 уриказа может содержать одну или несколько аминокислотных замен или делеций после N-концевого метионина. Подобные замены или делеции будут разработаны таким образом, чтобы крупная аминокислота находилась в последовательности во втором положении. Примерами крупных аминокислот являются глутамин, глутаминовая кислота, фенилаланин, метионин, лизин, тирозин, триптофан и аргинин. Например, в некоторых аспектах уриказа может не содержать треонин в положении 2, и при этом в положении 2 обеспечена либо делеция, либо замена, где нумерация приведена относительно SEQ ID NO: 27. В некоторых вариантах осуществления последовательность уриказы была модифицирована с тем, чтобы она содержала аланин или другую небольшую аминокислоту в положении 2 (т. е. аминокислоту, следующую за N-концевым метионином). Примерами небольших аминокислот являются глицин, аланин, серин, пролин, треонин, валин и цистеин, но предпочтение отдается наименьшим из них (глицину и аланину), чтобы ограничить возможность частичного процессинга (Hirel et al., выше).
[0051] В некоторых вариантах осуществления последовательность уриказы конъюгируют или сливают рекомбинантным путем с синтетическим или биосинтетическим полимером с целью продления периода полувыведения белка и/или уменьшения иммуногенности. Иллюстративными полимерами, которые можно применять в настоящем изобретении, являются полиэтиленгликоль (PEG), полимеры фосфорилхолина (см., например, публикацию заявки на патент США № 2013/0034517), полимеры пептидных повторов, таких как последовательности "PAS" или "X-TEN" (см., например, Schlapschy et al., Protein Eng. Des. Sel. 26: 489-501 (2013), Schellenberger et al., Nat. Biotechnol., 27: 1186-1190 (2009) и Podust et al., Protein Eng. Des. Sel., 26: 743-753 (2013)), или полимеры на основе углеводов, такие как гепарозан (см., например, публикацию Международной заявки на патент WO 2014/060397) или гидроксиэтилкрахмал (см., например, EP 2270036). В других вариантах осуществления последовательность уриказы может быть слита рекомбинантным путем с полипептидами, что продлевает период полувыведения из циркулирующего кровотока путем снижения скорости почечного клиренса. Такие партнеры по слиянию хорошо известны в данной области техники и включают средства, которые непосредственно связывают неонатальный Fc-рецептор (FcRn) рН-зависимым образом (например, Fc-область иммуноглобулинов или сывороточный альбумин), или, в качестве альтернативы, связываются с встречающимся в природе FcRn-связывающим фрагментом (например, полипептиды, которые связываются с сывороточным альбумином). В другом варианте осуществления последовательность уриказы может быть конъюгирована или слита рекомбинантным путем с одним или несколькими повторами С-концевого пептидного фрагмента, полученного из бета-субъединицы хорионического гонадотропина человека (см., например, патент США № 6225449).
[0052] В некоторых вариантах осуществления синтетический или биосинтетический полимер конъюгируют с N- и/или С-концом уриказы с целью продления периода полувыведения белка и/или уменьшения иммуногенности.
[0053] В некоторых вариантах осуществления последовательность уриказы модифицируют для образования 1-6 (например, 1, 2, 3, 4, 5 или 6) поверхностно доступных сайтов для конъюгации. Например, в некоторых вариантах осуществления последовательность уриказы модифицируют с тем, чтобы она содержала 1, 2, 3, 4, 5 или 6 поверхностно доступных остатков цистеина, с которыми можно конъюгировать полимер (например, PEG). В некоторых вариантах осуществления встречающаяся в природе последовательность уриказы, которая не содержит ни одного цистеина или содержит только несколько цистеинов, обеспечивает полезную исходную последовательность, так что цистеины можно вставить в подходящие поверхностно доступные места. В других вариантах осуществления последовательность уриказы модифицируют с тем, чтобы она содержала 1, 2, 3, 4, 5 или 6 поверхностно доступных не встречающихся в природе аминокислот, с которыми можно конъюгировать полимер.
[0054] В некоторых вариантах осуществления встречающуюся в природе последовательность уриказы модифицируют с обеспечением мутации некоторых или всех существующих цистеинов (посредством делеции и/или замены) на альтернативные аминокислоты. В некоторых вариантах осуществления новые цистеины вводят в требуемых местах (посредством добавления и/или замены), чтобы обеспечить сайт-специфическую конъюгацию полимеров или полипептидов, которые могут модифицировать фармакокинетическое поведение. В одном варианте осуществления выбор подходящей аминокислоты для замены на Cys осуществляют с помощью выравнивания представляющей интерес уриказы с другими последовательностями уриказы с целью определения различия природных аминокислот в эквивалентном положении во всех уриказах. Затем выбирают отличную от цистеина аминокислоту на основании ее встречаемости в представляющем интерес положении в других уриказах. В другом варианте осуществления выбор подходящей аминокислоты для замены на Cys осуществляют путем анализа кристаллической структуры этой конкретной уриказы с целью определения того, какие аминокислотные остатки являются поверхностно доступными. Затем выбирают одну или несколько поверхностно доступных аминокислот, и модифицируют их на цистеин. В некоторых случаях цистеины в окончательной модифицированной последовательности уриказы располагаются в поверхностно доступных положениях, так что эти цистеины можно пегилировать.
[0055] В некоторых вариантах осуществления уриказа содержит от приблизительно 1 до приблизительно 6 цистеинов, в частности приблизительно 1, 2, 3, 4, 5 или 6 цистеинов. В одном варианте осуществления уриказа содержит приблизительно 2 цистеина.
[0056] В определенных вариантах осуществления уриказа содержит фрагмент PEG, присоединенный к остатку (остаткам) цистеина. Контроль количества и расположения остатков цистеина позволяет контролировать количество сайтов присоединения PEG и оптимальные свойства полученного конъюгата, включая биофизические характеристики и ферментативную активность.
[0057] Полиэтиленгликоль (PEG) представляет собой полиэфирное соединение со структурой H-(O-CH2-CH2)n-OH. Реагентами на основе PEG, наиболее типично применяемыми для конъюгации белка, являются производные монометоксиполи(этиленгликоля), характеризующиеся структурой CH3-O-(CH2-CH2-O)n-X, где X содержит линейный линкер и реакционноспособную функциональную группу (линейный PEG). В некоторых случаях Х может содержать элемент разветвления, так что реагент на основе PEG содержит одну реакционноспособную функциональную группу и более чем одну полимерную цепь PEG (разветвленный PEG) или более чем одну реакционноспособную функциональную группу и полимерные цепи PEG (раздвоенный PEG). Реагенты на основе PEG могут включать приблизительно 5, 10, 20, 40, 60 и 80 кДа общего полимера PEG.
[0058] В некоторых вариантах осуществления тиол-реакционноспособные PEG можно применять для взаимодействия с тиольной группой на по меньшей мере одном цистеине. Например, можно применять PEG-малеимид, а также PEG-ортопиридилдисульфид, PEG-винилсульфон и PEG-йодацетамид. В других вариантах осуществления тиол-реакционноспособные PEG могут иметь линейную или разветвленную структуру с одним тиол-реакционноспособным фрагментом или могут иметь раздвоенную структуру с двумя или более реакционноспособными группами на молекулу PEG.
[0059] Таким образом, из уровня техники известны различные подходы, и любой подходящий способ, известный из уровня техники, можно применять для пегилирования цистеина (цистеинов) в уриказе.
[0060] В некоторых вариантах осуществления уриказа содержит цистеин по меньшей в мере одном из следующих положений: 11C, 33C, 119C и 142C, где нумерация положений приведена относительно SEQ ID NO: 27.
[0061] В одном варианте осуществления уриказа содержит цистеин по меньшей мере в одном из следующих положений: 11C, 33C, 119C, 120C, 142C, 196C, 238C, 286C и 289C, где нумерация положений приведена относительно SEQ ID NO: 27.
[0062] В качестве главного семейства рецепторов клеточной адгезии интегрины, как известно, играют ключевую роль в межклеточных взаимодействиях и взаимодействиях клетка-внеклеточный матрикс. Было показано, что трипептид Arg-Gly-Asp (RGD) в фибронектине опосредует клеточную адгезию посредством связывания интегрина. Синтетические пептиды, содержащие мотив RGD, были получены специально для нацеливания альфа(v)-интегрина на интернализацию посредством интегринзависимого эндоцитоза в качестве потенциального средства лечения рака. Предположительно, интегринсвязывающий мотив (RGD) может быть проблематичным для терапевтического средства, которое, как ожидается, будет функционировать в периферическом кровотоке. Таким образом, в определенных аспектах настоящего изобретения уриказа не содержит последовательность RGD.
[0063] Способы мутирования аминокислот хорошо известны из уровня техники и такие способы можно применят для мутации одной или нескольких аминокислот в RGD на любую другую встречающуюся в природе аминокислоту. В одном варианте осуществления аргинин в мотиве RGD мутируют в серин, так что уриказа содержит SGD вместо RGD. В другом варианте осуществления аргинин, глицин и/или аспарагиновую кислоту в мотиве RGD мутируют в любую другую встречающуюся в природе аминокислоту, так что уриказа не содержит мотив RGD. В одном варианте осуществления ряд аминокислотных последовательностей уриказы выравнивают с применением способов, известных из уровня техники, для определения наиболее высококонсервативного остатка в аминокислотных положениях, где присутствует мотив RGD, и одну или несколько аминокислот, присутствующих в мотиве RGD, мутируют в аминокислотный остаток, который наиболее консервативен в этом конкретном аминокислотном положении. Например, если G и D в мотиве RGD являются высококонсервативными, то только R будут мутировать в аминокислотный остаток, который наиболее высококонсервативен в этом конкретном положении (например, серин).
[0064] Способы получения нуклеотидных последовательностей, кодирующих аминокислотные последовательности уриказы, раскрытые в данном документе, хорошо известны из уровня техники, так что обычный специалист в данной области техники сможет легко получить последовательность нуклеиновой кислоты, кодирующую аминокислотные последовательности уриказы, раскрытые в данном документе. Таким образом, в одном варианте осуществления настоящее изобретение предусматривает последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность уриказы, раскрытую в данном документе. Подходящие векторы экспрессии известны и доступны из уровня техники, так что настоящее изобретение также охватывает вектор, содержащий последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность уриказы, раскрытую в данном документе. В еще одном варианте осуществления настоящее изобретение охватывает линию клеток, содержащую вектор экспрессии. Линия клеток может быть линией эукариотических или прокариотических клеток. В предпочтительном варианте осуществления линия клеток представляет собой линию прокариотических клеток, таких как E. coli, коринебактерий или Рseudomonas fluorescens. В другом варианте осуществления линия клеток представляет собой линию эукариотических клеток, таких как Saccharomyces cerevisiae, клетки насекомых и т. д. Также можно применять линии клеток млекопитающих, таких как клетки яичника китайского хомячка (CHO).
[0065] В одном варианте осуществления настоящее изобретение охватывает композицию, содержащую уриказу, описанную в данном документе. В одном аспекте уриказа в композиции образует тетрамер. В некоторых аспектах по меньшей мере 93% (например, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%) мономеров уриказы, присутствующих в композиции, являются монопегилированными (например, один фрагмент PEG присутствует в каждом мономере). В некоторых аспектах по меньшей мере 93% (например, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%) мономеров уриказы, присутствующих в композиции, являются дипегилированными (например, два фрагмента PEG присутствуют в каждом мономере). В некоторых аспектах по меньшей мере 93% (например, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%) мономеров уриказы, присутствующих в композиции, являются трипегилированными (например, три фрагмента PEG присутствуют в каждом мономере).
[0066] В другом варианте осуществления настоящее изобретение охватывает статистическую модель для определения эффективности пегилирования олигомерного белка, такого как тетрамер белка уриказы, описанного в данном документе. Настоящее изобретение также предусматривает статистическую меру для выведения полной функционализации олигомерного белка из данных, полученных в легко доступных анализах, которые вызывают диссоциацию нековалентно связанных субъединиц, как описано в примере 14 в данном документе.
[0067] В другом варианте осуществления настоящее изобретение охватывает статистический подход, основанный на мультиномиальном распределении, который позволяет вычислять полную конъюгацию белка для олигомерных белков, когда размер и природа белка или биофизические свойства конъюгата не позволяют проводить анализ в нативных условиях.
II. Способы лечения
[0068] В некоторых аспектах настоящее изобретение охватывает способ лечения пациента с гиперурикемией, включающий введение любой из уриказ, описанных в данном документе, и за счет этого снижать уровень мочевой кислоты и/или содержания кристаллов UA. У пациента может иметься любое количество состояний, приводящих к гиперурикемии. Например, у пациента может иметься подагра, такая как без ограничения хроническая рефрактерная подагра, узелковая подагра и/или высокое содержание UA. В качестве другого примера у пациента может иметься синдром лизиса опухоли, или он может быть подвержен риску его развития.
[0069] В некоторых аспектах данного способа уриказу можно вводить подкожно. В других аспектах ее можно вводить внутривенно или внутримышечно.
[0070] Для определенных способов лечения у пациента до лечения уровень UA в сыворотке крови может составлять выше 6,8 мг/дл, а после лечения уровень UA в сыворотке крови может составлять ниже 6,8 мг/дл.
[0071] В некоторых вариантах осуществления уриказа или способ лечения не ассоциированы с анафилаксией. В одном варианте осуществления уриказа или способ лечения являются неиммуногенными.
ПРИМЕРЫ
Пример 1. Выбор фермента уриказы
[0072] Выравнивали более 200 последовательностей уриказы из общедоступных баз данных, включая уриказы млекопитающих, растений, микробов и т. д. Уриказ-кандидатов с последовательностями, доступными в базах данных, выбирали с применением собственных критериев, которые включали (без ограничения) благоприятные биологические свойства (такие как экспрессия в E. coli, растворимость при нейтральном рН, активность при нейтральном рН), низкая идентичность или сходство последовательности с другими последовательностями (различие), низкое содержание эндогенного Cys и организмы, обладающие представляющими интерес свойствами, которые предполагают, что их уриказа будет иметь благоприятные свойства (экстремофильные, термофильные, ацидофильные и т. д.).
[0073] После этого процесса выбрали следующие 7 последовательностей-кандидатов для дальнейшего исследования: уриказа Arthrobacter globiformis (SEQ ID NO: 27), уриказа Deinococcus geothermalis (SEQ ID NO: 28), уриказа Deinococcus radiodurans (SEQ ID NO: 29), уриказа Granulicella tundricola (SEQ ID NO: 30), уриказа Solibacter usitatus (SEQ ID NO: 31), уриказа Terriglobus saanensis (SEQ ID NO: 32) и уриказа Kyrpidia tusciae (SEQ ID NO: 33). Кроме того, в качестве 8-й последовательности, консенсусную последовательность уриказы также разрабатывали на основании выравнивания множества последовательностей уриказы. Консенсусная последовательность представлена под SEQ ID NO: 34. Как показано в таблице 2 ниже, между выбранными 8 последовательностями было значительное различие.
[0074] Таблица 2. Сравнение идентичности последовательностей уриказы
Пример 2. Концепция скрининга
[0075] Концепцию предварительного скрининга применяли для идентификации кандидатов для дополнительной оптимизации. Клонировали 8 последовательностей уриказы, описанных в примере 1, с аминоконцевой His-меткой и экспрессировали в E. coli. Каждую конструкцию уриказы оценивали в отношении уровня экспрессии и, в частности, экспрессии растворимых форм. E. coli, экспрессирующую уриказу, подвергали лизису и растворимый материал отделяли от нерастворимого материала (осадка). Лизаты разделяли с помощью SDS-PAGE и белки визуализировали путем окрашивания кумасси синим. Как показано на фигуре 1, большинство уриказ присутствовало на высоком уровне в нерастворимом (Р) материале. Химера, происходящая от свиньи-павиана, по-видимому, почти полностью экспрессировалась во фракцию осадка (P) (нерастворимую) (фигура 1, дорожка 9). Экспрессию растворимых в цитозоле форм (S) рассматривали как благоприятное свойство. Затем 8 уриказ очищали от лизатов клеток E. coli с помощью аффинной хроматографии на Ni. Выход белка определяли путем измерения поглощения при 280 нм. Размер белка подтверждали масс-спектрометрией и образование тетрамера подтверждали с помощью эксклюзионной хроматографии и детектирования светорассеяния (см. таблицу 3 ниже).
[0076] Таблица 3. Анализ с помощью масс-спектрометрии и SEC-LS
(кДа)
(кДа)
(кДа)
(кДа)
[0077] Три уриказы исключали из дальнейшей оценки на основании неблагоприятных результатов экспрессии, растворимости или очистки, а именно Solibacter usitatus, Kyrpidia tusciae и Granulicella tundricola.
[0078] Измерения с помощью дифференциальной сканирующей калориметрии (DSC) проводили для оценки термостабильности (см. таблицу 4 ниже). Для каждой уриказы наблюдали два перехода. Terriglobus saanensis и Deinococcus radiodurans демонстрировали температурный переход (TM1), который был ниже требуемого, и поэтому эти две уриказы исключали из пула кандидатов. На фигурах 2A и 2B показаны два примера результатов DSC (уриказа Deinococcus geothermalis (фигура 2A) и уриказа Deinococcus radiodurans (фигура 2B)).
[0079] Таблица 4. Стабильность при дифференциальной сканирующей калориметрии
[0080] Пять уриказ (SEQ ID NO: 27, 28, 29, 32 и 34) оценивали в отношении характеристики, представляющей собой растворимость при нейтральном pH, и активности по показателю образования продукта (H2O2) при pH 9,0 и 7,4. В анализе образования продукта образование аллантоина пропорционально образованию H2O2, которое связано с колориметрической катализируемой пероксидазой хрена реакцией. Появление пероксида водорода можно измерить по увеличению поглощения при 540 нм. Что касается активности уриказы, результаты анализов образования продукта были соразмерными результатам анализов истощения субстрата. Однако анализ образования продукта не позволяет проводить непрерывный контроль активности фермента с течением времени. Анализы истощения субстрата подходили намного лучше для оценки кинетических параметров, таких как Vmax и Km.
[0081] Истощение субстрата (UA) является другим распространенным способом оценки активности уриказы. В анализе истощения субстрата уриказу, UA и фосфатный буфер инкубировали в течение 1 часа при заданной температуре (обычно 30oC). Затем уриказу разбавляли до 1 мкг/мл и объединяли с UA согласно кривой (400 мкМ, разведенные 1:1,6 до 23,8 мкМ) в 0,1 М фосфатном буфере (PB), рН 7,4. В некоторых анализах к анализируемой смеси добавляли 1 мМ DTT. Температуру считывателя от Molecular Devices устанавливали равной 30oC. Значения измерения поглощения при 292 нм регистрировали каждые 20 секунд в течение 10 минут. Скорость распада UA рассчитывали с помощью программного обеспечения SoftMax Pro. Vmax и Km рассчитывали для этих уриказ (см. таблицу 5 ниже). Данные показаны на фигуре 3. Каждая кривая представляет удельную активность по 4320 экспериментальных точках.
[0082] Таблица 5. Vmax, Km и kcat/Km
[0083] На основании кинетических параметров для дальнейшего исследования выбирали две уриказы, Deinococcus geothermalis, которая характеризовалась улучшенной в 2 раза Vmax по сравнению с Krystexxa® (10,8 по сравнению с 5,7), и Arthrobacter globiformis, которая характеризовалась улучшенной в 2 раза Km по сравнению с Krystexxa® (55,7 по сравнению с 116,3). Обе уриказы характеризовались в приблизительно 2 раза лучшим отношением kcat/Km по сравнению с Krystexxa®. Наконец, хотя консенсусная уриказа проявляла благоприятную кинетику, консенсусная последовательность была на 61,7% идентичной уриказе Arthrobacter globiformis, тогда как уриказы Deinococcus geothermalis и Arthrobacter globiformis только на 41,2% идентичны друг другу, что указывает на большее различие между последними двумя. Высокая степень различия считается преимущественной, и поэтому для дальнейшего исследования выбирали уриказы Deinococcus geothermalis и Arthrobacter globiformis.
Пример 3. Моделирование доз позволяет предположить, что kcat является наиболее важным кинетическим параметром
[0084] Для пациентов с подагрой и синдромом лизиса опухоли, как правило, характерны насыщающие уровни UA (> 6,8 мг/дл, 408 мкM). Поэтому было выдвинуто предположение, что Vmax (kcat) является наиболее важным кинетическим параметром для терапевтической уриказы. Модели доз создавали на основании улучшения в отношении kcat (Arthrobacter Globiformis) или Km (Deinococcus geothermalis). Хотя моделирование предсказало, что улучшенная Km (Deinococcus geothermalis) не обеспечит преимущества по величине или частоте дозирования, моделирование предсказало, что улучшенная kcat (Arthrobacter globiformis) обеспечит преимущество с точки зрения величины и частоты дозирования. Таким образом, результаты моделирования дозы позволяют предположить, что kcat является наиболее важным кинетическим параметром для терапевтической уриказы.
Пример 4. Иммуногенность, определенная на основании анализов перекрывающихся пептидов
[0085] Поскольку было доказано, что иммуногенность является проблемой при клиническом применении доступных в настоящее время уриказ, обе уриказы Arthrobacter Globiformis и Deinococcus geothermalis подвергли скринингу в отношении предполагаемой Т-клеточной иммуногенности с помощью анализа EpiScreen™. Последовательности обоих ферментов уриказ анализировали с применением перекрывающихся пептидов в отношении присутствия CD4+ T-клеточных эпипов (анализ картирования Т-клеточных эпитопов EpiScreen™). В общей сложности 93 перекрывающихся 15-мерных пептида, охватывающих последовательность уриказы Arthrobacter Globiformis, и 94 для уриказы Deinococcus geothermalis тестировали в сопоставлении с когортой из 54 здоровых доноров, отобранных в скрининге для представления профиля гаплотипов HLA-DRB1. CD4+ Т-клеточные ответы против отдельных пептидов измеряли с применением анализов пролиферации с включением 3H-тимидина и результаты применяли для составления карты Т-клеточных эпитопов двух последовательностей уриказы. Предполагаемый Т-клеточный эпитоп считался тогда, когда у 3 или более донорских образцов выявляли в анализе показатель индекса стимуляции CD4 более 2,00. В общей сложности пять предполагаемых Т-клеточных эпитопов идентифицировали в последовательности Arthrobacter globiformis. В этом случае никакие пептиды не вызывали Т-клеточный ответ более чем в 4 донорских образцах (< 10%). Кроме того, величина индекса стимуляции для каждого положительного пептида была относительно низкой, указывая на то, что пептиды могут не быть сильными Т-клеточными эпитопами. Т-клеточный анализ последовательности Deinococcus geothermalis с перекрывающимися пептидами свидетельствует о существовании шести предполагаемых эпитопов. Некоторые из этих пептидов вызывали положительный Т-клеточный ответ у более чем 10% отобранных в скрининге доноров и величина ответа (индекс стимуляции) была больше.
[0086] С учетом этих результатов и улучшенного Vmax для уриказы Arthrobacter globiformis было принято решение дополнительно оптимизировать эту последовательность.
Пример 5. Эволюция последовательности для уриказы Arthrobacter globiformis
A. Эволюция исходной последовательности
[0087] SEQ ID NO: 22 модифицировали с добавлением N-концевой His-метки и короткого линкера и с усечением 11 аминокислот на C-конце с целью удаления C-концевого Cys с получением SEQ ID NO: 21.
B. Изменение RGD на SGD
[0088] В качестве главного семейства рецепторов клеточной адгезии интегрины, как известно, играют ключевую роль в межклеточных взаимодействиях и взаимодействиях клетка-внеклеточный матрикс. Было показано, что трипептид RGD в фибронектине опосредует клеточную адгезию посредством мотива RGD. Предположительно, интегринсвязывающий мотив (RGD) может быть проблематичным для терапевтического средства, которое, как ожидается, будет функционировать в периферическом кровотоке. Каждая из SEQ ID NO: 21 и SEQ ID NO: 22 содержала мотив RGD. Анализ адгезии опухолевых клеток M21 проводили для определения того, является ли RGD поверхностно доступным. Клетки M21 использовали потому, что они экспрессируют αvβ3- и αvβ5-интегрины. RGD-содержащим фибронектиновым субстратом, PBS (отрицательный контроль) или тестируемым продуктом покрывали планшет для ELISA при 0-100 мкг/мл в течение ночи в PBS. Флуоресцентно меченые (кальцеин-AM) клетки M21 инкубировали в течение 1 часа при 37°C на покрытых планшетах. Несвязанные клетки отмывали и связанные клетки измеряли с помощью общей флуоресценции. Fab9mCys представляет собой IgG, который содержит RGD в петле CDR-H3, и служит в качестве положительного контроля наряду с фибронектином. Результаты, показанные на фигуре 4, иллюстрируют, что содержащая RGD уриказа Arthrobacter Globiformis связывает клетки M21. Эти данные свидетельствуют, что RGD в уриказе Arthrobacter Globiformis является поверхностно доступным.
[0089] С использованием базы данных по более чем 200 выровненным уриказам было определено, что глицин (G) и аспартат (D) в мотиве RGD являются высококонсервативными остатками во всех выровненных уриказах. Однако аргинин (R) не соответствовал высококонсервативному положению, и консенсусным остатком в этом положении является серин (S). Поэтому использовали сайт-направленный мутагенез для замещения R в мотиве RGD на S, тем самым делая из RGD SGD. С помощью этой модификации удаляли потенциальный интегринсвязывающий мотив, за счет чего получали уриказу, имеющую SEQ ID NO: 20, где His-метка и линкер на N-конце последовательности, как показано, являются необязательными.
C. Оценка модификации SGD
[0090] Мутацию RGD на SGD оценивали в отношении ее влияния на результат экспрессии, растворимости, очистки и т. д. Хотя мутация SGD, по-видимому, немного уменьшала экспрессию растворимых форм, условия культивирования можно оптимизировать для улучшения экспрессии растворимых форм.
[0091] Мутация RGD на SGD показала заметное снижение в анализе связывания интегрина (см. фигуру 4). Обе уриказы оценивали в отношении активность при рН 7,4. Мутация SGD, по-видимому, характеризовалась сопоставимой активностью (см. фигуру 5).
Пример 6. Оценка иммуногенности модифицированной уриказы Arthrobacter globiformis
A. Анализ на иммуногенность LONZA (Epibase®)
[0092] Хотя уриказа Arthrobacter globiformis (SEQ ID NO: 22) имела 5 предполагаемых на основании анализа EpiScreen Т-клеточных эпитопов, ни один из них не вызывал сильного ответа более чем у 10% донорских образцов. Кроме того, известно, что анализ Т-клеточных эпитопов с синтетическими перекрывающимися пептидами дает завышенное предсказание эпитопов MHC класса 2. Это, вероятно, связано с тем, что не все потенциальные варианты пептидов будут существовать в эндогенном процессе распада белкового терапевтического средства в эндосомах. Поэтому модифицированную уриказу Arthrobacter globiformis (SEQ ID NO: 18) подвергали скринингу в виде холопротеина в анализе на иммуногенность Epibase®. Анализ Epibase® представляет собой анализ на Т-клеточную иммуногенность с PBMC человека, применяемый для оценки "риска иммуногенности". Хотя этот анализ не всегда может предсказать клиническую иммуногенность, его можно применять для идентификации белков с "высоким риском" и "низким риском" на основании количества клеток-респондеров и общей величины ответа (индекс стимуляции). В этом анализе образцы PBMC от 202 нормальных доноров применяли для скрининга Т-клеточной иммуногенности уриказы-кандидата относительно отрицательного контроля (буфер) и положительного контроля (KLH). В данном случае 202 донора отбирали для представления частот HLA-DRB1 в европеоидной популяции (см. фигуру 6). PBMC из замороженных запасов оттаивали и добавляли в 96-луночный планшет при плотности 3×105 клеток на лунку. Тестируемые продукты добавляли в среду при 30 мкг/мл (буфер, KLH, SEQ ID NO: 18). Каждое тестируемое условие выполняли в 8 повторностях (n=8). PBMC инкубировали в течение 7 дней. На 7-й день PBMC метили по поверхностным маркерам CD3+ и CD4+. Пролиферирующие CD4+ T-клетки идентифицировали с помощью проточной цитометрии. Значения индексов стимуляции (SI) описывают отношение пролиферирующих CD3+CD4+ T-клеток в лунках, обработанных антигеном, в сравнении с необработанными лунками. Значения SI > 2 считаются положительными, что подтверждается p-значением < 0,05. В анализе на иммуногенность популяции также проводили определение путем расчета величины Т-клеточного ответа для всей популяции.
[0093] Результаты были следующими: отрицательный контроль - 0/202 донорских образцов (0%) ответили со средним SI=1,0 в популяции; уриказа-кандидат - 1/202 донорских образцов (0,5%) ответил со средним SI=1,03 в популяции; положительный контроль - 181/202 доноров (91%) ответил со средним SI=4,2. Данные отдельных доноров показаны на фигурах 7A-C. На фигуре 7А показано, что индекс стимуляции буфера (отрицательного контроля) составляет 1,0, а KLH (положительный контроль) имеет 91% ответ (SI > 2). Для KLH средний общий SI=4,2. На фигуре 7В показана уриказа-кандидат при сравнении с контролем буфера. Частота ответа 4% или менее в этом анализе считается "низким риском", и предыдущий скрининг других соединений с потенциальной клинической применимостью дает частоты в диапазоне 20-25% иммуногенности. На фигуре 7C показано, что индекс стимуляции буфера составляет 1,0, индекс стимуляции KLH составляет 4,2, а индекс стимуляции уриказы-кандидата составляет 1,03. Хотя этот анализ не всегда может предсказать клиническую иммуногенность, его можно применять для оценки риска иммуногенности, и эти данные свидетельствуют о том, что оцениваемая уриказа имеет "низкий риск" клинической иммуногенности. Учитывая, что последовательность белка уриказы, которую тестировали, имеет микробное происхождение (Arthrobacter globiformis), это довольно удивительный результат.
Пример 7. Удаление His-метки
[0094] N-концевую His-метку добавляли к N-концу последовательностей уриказы с целью обеспечения эффективного способа очистки белков уриказы, которые были получены (т. е. аффинной очистки на Ni). Хотя His-метка обеспечивает преимущества во время обнаружения, особенно в сфере очистки, желательно удалить His-метку перед получением лекарственного продукта.
Пример 8. Оптимизация N-конца
[0095] Хорошо известно, что когда белки экспрессируются в E. coli, N-концевой метионин может быть удален Met-аминопептидазой в зависимости от второго остатка, следующего за метионином. Если малый остаток находится во втором положении, то обычно происходит отщепление. Если крупный остаток находится во втором положении, то отщепление не происходит. При этом, если второй остаток не является ни крупным, ни особенно малым, то Met-аминопептидаза может функционировать с отщеплением некоторых Met, но не всех, образуя гетерогенное лекарственное вещество. Получали три N-концевых варианта и анализировали в отношении экспрессии, растворимости, отщепления метионина и активности с целью определения оптимальной N-концевой последовательности.
[0096] Исходной последовательностью для этого процесса была SEQ ID NO: 12, и из нее получали три варианта. SEQ ID NO: 13 (вариант 1) характеризовался делецией Thr2. SEQ ID NO: 14 (вариант 2) характеризовался делецией Thr2-Ala5, и при этом ожидали, что N-концевой Met будет сохранен. SEQ ID NO: 15 (вариант 3) характеризовался делецией Thr2-Thr9, и при этом ожидали, что N-концевой Met будет подвергнут процессингу.
[0097] Три N-концевых варианта уриказы клонировали, экспрессировали в E. coli и очищали. Каждая конструкция экспрессировалась в растворимой фракции аналогично конструкциям с His-меткой. Из-за отсутствия His-метки разрабатывали процедуру очистки для этих конструкций. Вкратце, она включала стадию ионообменной хроматографии на Q (буфер A: PBS, pH 7,8, 5 мM DTT; буфер B: 10x PBS, pH 7,2) с последующей эксклюзионной хроматографией (SEC). Фракции из SEC прогоняли на SDS-PAGE и белки визуализировали путем окрашивания кумасси синим. Фракции, содержащие высокие уровни уриказы, объединяли для дальнейших анализов. На фигуре 8А показана окрашенная кумасси синим SDS-PAGE очищенных препаратов по сравнению с His-меченой конструкцией (обозначена SGD). Было обнаружено, что в вариантах 1 и 3 N-концевой метионин был подвергнут процессингу (удален), тогда как в варианте 2 был обнаружен сохраненный N-концевой метионин. Весь процессинг выглядит однородным.
[0098] На фигуре 8B показана активность V1, V2 и V3. Варианты 1 и 2 обладали значительно лучшей активностью, чем вариант 3. Вариант 1 выбирали для дальнейшей разработки.
Пример 9. Специфическое пегилирование
[0099] Модификацию терапевтических белков полиэтиленгликолем (PEG) можно выполнить либо как случайное присоединение к выбранным остаткам белка (например, боковым цепям лизина), либо сайт-специфически в уникальном заранее определенном сайте. Последний подход имеет то преимущество, что химию конъюгации можно лучше контролировать и изготовлять согласованно с получением высокогомогенного пегилированного продукта с определенной биологической активностью. Среди способов сайт-специфического присоединения наиболее широко применяемый подход представляет собой связывание с неспаренными остатками цистеина, и он обычно включает введение одного или нескольких свободных остатков цистеина в последовательность белка. Сайты для введения Cys можно тщательно отбирать во избежание какого-либо негативного влияния на биологическую активность или биофизические свойства продукта-конъюгата после модификации с помощью PEG.
[00100] Последовательность уриказы Arthrobacter globiformis, описанная в SEQ ID NO: 27, особенно хорошо подходит для сайт-специфической модификации на основе цистеина, поскольку она содержит только один нативный C-концевой остаток Cys. C-концевой участок усекали (SEQ ID NO: 18 и 20), так что белок не содержал Cys. Таким образом, модификацию этого белка с помощью Cys-реакционноспособных реагентов легко ограничить сайтами, где были введены остатки Cys. Для выбора потенциальных сайтов введения остатков Cys в последовательность уриказы Arthrobacter globiformis учитывали следующие критерии:
i. сайты должны находиться на доступной для растворителя поверхности белка, чтобы обеспечить эффективное взаимодействие с тио-реакционноспособным реагентом на основе PEG;
ii. сайты не должны находиться близко к активным центрам фермента, чтобы избежать риска влияния на активность; и
iii. сайты не должны находиться в непосредственной близости друг к другу, так что пегилирование одного сайта стерически не препятствует пегилированию других сайтов.
[00101] Более того, учитывая тетрамерную природу уриказы, расстояния внутри и между субъединицами в идеале следует рассматривать в случае ii. и iii.
[00102] Для вычисления параметров, соответствующих этим соображениям, использовали трехмерную структуру уриказы Arthrobacter globiformis. Сообщалось об ограниченном числе различных структур уриказы, и одна из них представляет собой кристаллическую структуру уриказы Aricrobacter globiformis, связанной с субстратом мочевой кислоты (код доступа в PDB: 2YZB) (см. фигуру 10A). Атомные координаты для этой структуры использовали при вычислении следующего набора параметров:
i. площадь поверхности доступной для растворителя области для каждого аминокислотного остатка в этой уриказе и
ii. атомные расстояния между атомом Cα каждой боковой цепи и атомом C5 субстрата мочевой кислоты (расстояние Cα-C5).
[00103] Для идентификации предпочтительных положений в уриказе Arthrobacter globiformis для замещения цистеином изначально были установлены следующие критерии. Во-первых, идентифицировали остатки с общей площадью доступной для растворителя поверхности > 100 Å2 и с расстоянием Cα-C5 > 25 Å (т. e. до каждого C5 в 4 молекулах мочевой кислоты, связанных с тетрамером уриказы). Во-вторых, в качестве дополнительного ограничения для любого указанного остатка уриказы эти критерии должны соблюдаться во всех четырех субъединицах. Из 287 аминокислотных остатков в каждой субъединице уриказы только 9 удовлетворяли этим критериям. Это были Thr11; Asn33; Asn119; Asp120; Ser142; Glu196; Pro238; Glu286 и Arg289. Затем учитывали третий критерий путем вычисления матрицы атомных расстояний между парами атомов Cα в этом наборе остатков по тетрамерной структуре (см. таблицу 6). Из этого анализа выбирали Thr11, Asn33, Glu196 и Asn119 в качестве предпочтительных остатков для замещения цистеином, поскольку их атомы Cα в тетрамере хорошо разделены (≥ 19,5 Å для всех пар).
[00104] Таблица 6 ниже представляет собой матрицу, показывающую атомные расстояния (в Å) между выбранными атомами Cα в структуре уриказы 2YZB. Субъединицы обозначены буквой, т. е. -A, -B, -C, -D. Из-за чрезвычайно симметричной природы тетрамера представленный ниже набор расстояний является достаточным, чтобы охарактеризовать все пары расстояний в тетрамере (например, расстояние от T11-A до T11-B эквивалентно расстоянию от T11-C до T11-D; T11-A до T11-C эквивалентно T11-B до T11-D; T11-A до T11-D эквивалентно T11-B до T11-C).
Пример 10. Содержащие цистеин варианты уриказы для сайт-специфического пегилирования
[00105] Создавали ряд различных комбинаций из 1, 2, 3 и 4 остатков Cys на мономер уриказы. Их анализировали в отношении экспрессии, растворимости, чистоты и активности как до, так и после пегилирования. Из-за гидрофильной природы Cys эти конструкции имеют тенденцию к агрегации (за счет дисульфидной связи), за исключением случаев, когда их поддерживают в восстановительных условиях. Это требует присутствия восстанавливающего средства (DTT или другого) во время процедур очистки и анализа. После пегилирования Cys больше нет необходимости в восстанавливающем средстве. Все тестируемые пермутации Cys-содержащих конструкций могут быть экспрессированы, очищены, и они продемонстрировали хорошую активность как до, так и после пегилирования.
[00106] На фигуре 10A показаны трехмерные доступные для растворителя сайты в тетрамерной кристаллической структуре уриказы Arthrobacter globiformis (код доступа в PDB: 2YZB) (1). Показана каждая мономерная субъединица тетрамерного фермента уриказы и идентифицированы остатки, выбранные для замещения цистеином (T11, N33, S142). Эти боковые цепи чрезвычайно поверхностно доступны, удалены друг от друга и удалены от каждого активного центра в тетрамере. Два Cys-содержащих варианта (T11C, N33C (SEQ ID NO: 17) и T11C, N33C, S142C (SEQ ID NO: 16)) анализировали в отношении экспрессии, растворимости, чистоты и активности как до, так и после пегилирования. На фигуре 9A показана активность уриказы без Cys (SEQ ID NO: 20), с двумя Cys (T11C, N33C) (SEQ ID NO: 17) и с тремя Cys (T11C, N33C и S142C) (SEQ ID NO: 16). Все анализы проводили в присутствии DTT для устранения потенциального дисульфидного связывания.
Пример 11. Оптимизация пегилирования
[00107] Для долгосрочного подавления UA посредством уриказы необходимо, чтобы молекула была модифицирована каким-либо способом для продления периода полувыведения. Коммерчески доступная расбуриказа, которая не является пегилированной и не обладает свойствами конъюгата в отношении продления периода полувыведения, имеет период полувыведения у человека, составляющий 16-21 часов, что требует ежедневного IV введения при синдроме лизиса опухоли (Ueng et al. 2005). Пегилирование доклинически использовалось для продления периода полувыведения ряда уриказ. Krystexxa® представляет собой гиперпегилированную уриказу, которая содержит ~ 44 × 10 кДа молекул PEG(~ 440 кДа общего PEG на тетрамер), конъюгированных с поверхностью активного тетрамера. Исходя из литературных данных, на ранней стадии разработки Krystexxa® было выдвинуто предположение, что PEG эффективно маскирует уриказу, которая является чужеродным белком, и делает ее менее иммуногенной (Hershfield et al., 2010 PNAS). Доклинические исследования проводили для максимального повышения количества PEG на поверхности уриказы при сохранении ферментативной активности. Было установлено, что 44 X 10 кДа PEG на тетрамер является максимальным количеством PEG, которое можно конъюгировать с уриказой и сохранить ферментативную активность. Конъюгации PEG достигали путем случайного пегилирования первичных аминов. Данные клинических испытаний Krystexxa® демонстрируют, что у ~ 90% пациентов развивалась реакция на лекарственное средство Krystexxa® (Lipsky et al., 2014 Research and therapy of Arthritis Research & therapy). Большой процент реакции на лекарственное средство, по-видимому, относится к PEG, а не к белку. Наиболее убедительным является тот факт, что антитела от пациентов, у которых развилась реакция на лекарственное средство (PEG), связываются с пегилированными белками, отличными от уриказы, демонстрируя, что имеет место реакция на PEG, а не на белок или область контакта белок-PEG. До этих испытаний общепринятым мнением было то, что мотив PEG в пегилированном терапевтическом средстве вряд ли является иммуногенным. Подавляющее большинство пегилированных терапевтических средств содержит только достаточное количество PEG, чтобы продлить период полувыведения, и они не являются "гиперпегилированными" как Krystexxa®. Одна из гипотез заключается в том, что количество PEG в Krystexxa® привело к иммуногенности PEG, ассоциированной с лекарственным средством. Размер тетрамера Krystexxa® составляет приблизительно 136 кДа с примерно 440 кДа PEG, конъюгированного с поверхностью. Это дает молекулу размером ~ 576 кДа, который является небывалым для пегилированных терапевтических средств. Поэтому конструировали ограниченное количество остатков Cys для сайт-специфического пегилирования, как описано в примере 10.
[00108] Уриказы с двумя (двумя Cys) или тремя (тремя Cys) цистеинами первоначально получали с His-меткой для облегчения очистки. На фигуре 9А показано, что эти уриказы с двумя Cys и тремя Cys сохраняют уриказную ферментативную активность.
[00109] Условия реакции дипегилирования оптимизировали путем изменения времени, рН, концентрации фосфата, NaCl, белка, PEG и TCEP. Было показано, что более высокие концентрации PEG улучшают эффективность пегилирования и более высокая концентрация TCEP несколько снижает эффективность пегилирования. Другие переменные оказывали очень маленькое влияние на эффективность пегилирования. В нижеприведенной таблице 7 показаны переменные, которые тестировали для оптимизации пегилирования и достижения оптимальных условий.
[00110] Таблица 7. Оптимизация пегилирования
[00111] На Фигуре 9B показано, что дипегилированные и трипегилированные уриказы сохраняют уриказную ферментативную активность.
[00112] Анализ дипегилированного материала с помощью SDS-PAGE (фигура 10B) подтвердил, что большая часть белка была однородно конъюгирована с PEG. Анализ дипегилированного материала с помощью обращенно-фазовой хроматографии свидетельствует, что 92,6% было дипегилированным, 4,4% было монопегилированным и наблюдалось небольшое количество сверхпегилированного материала (~ 3%) (фигура 10С). Пегилирование, по-видимому, не влияло на ферментативную активность. Дипегилированный материал характеризовался аналогичной степенью окисления UA по сравнению с непегилированным ферментом (фигура 10D). Сопоставимые результаты получали для трипегилированного материала (данные не показаны). В этих способах анализа нарушается четвертичная структура уриказы, но в виде гомотетрамера преобладающий продукт в нативном состоянии для дипегилированной уриказы предположительно будет иметь цепи PEG размером 8 × 10 кДа, тогда как для трипеггилированной уриказы предположительно будет иметь цепи PEG размером 12×10 кДа.
[00113] С учетом идентифицированных оптимизированных условий пегилирования (см. таблицу 7) дипегилированную и трипегилированную уриказы без his-метки получали, очищали и анализировали в отношении эффективности пегилирования и активности фермента. Эти пегилированные молекулы дополнительно анализировали в исследованиях PK in vivo.
Пример 12. PK in vivo для дипегилированных и трипегилированных уриказ
[00114] В исследовании на крысах оценивали две пегилированные уриказы (дипегилированную по T11C, N33C и трипегилированную по T11C, N33C и S142C). Исследование на крысах выбирали потому, что имело место предшествующее тестирование PK пегилированных уриказ у крыс (Zhang et al, 2012 International Journal of Pharmaceutics). В данном анализе применяли SEQ ID NO: 16 и 17. Фармакокинетику in vivo определяли у крыс как для дипегилированной, так и для трипегилированной уриказ. 4 крысам в каждой группе вводили IV дозу 5 мг/кг и собирали 10 образцов (день -1), через 0,5, 2, 4, 8, 24, 48, 72, 96 и окончательный через 144 часа после инъекции. Цельную кровь собирали в пробирки для отделения сыворотки крови и замораживали. Сыворотку крови анализировали на остаточную активность уриказы и данные аппроксимировали к титрационной кривой. Удельная ферментативная активность уриказы, которую вводили крысам (до введения дозы), и уриказы, которую измеряли в сыворотке крови (после введения дозы), была сопоставимой, свидетельствуя о том, что активность сохранялась во время исследования in vivo. На фигуре 11А продемонстрировано, что ди- и трипегилированные уриказы имеют значительно более длительный период полувыведения, чем непегилированная уриказа. Непегилированная уриказа характеризовалась в этом исследовании периодом полувыведения, составляющим 2-3 часа (фигура 11А, треугольники). Как ди-, так и трипегилированные уриказы демонстрировали монофазные профили. Период полувыведения, объем распределения (Vd) и скорость выведения для каждой уриказы показаны в таблице 8 ниже. Коэффициент вариации выражен в процентах в круглых скобках.
[00115] Таблица 8. PK у крыс для дипегилированной и трипегилированной уриказы
[00116] Результаты, показанные в таблице 8, указывают, что дипегилированная и трипегилированная формы показали очень похожие фармакокинетические профили с небольшим преимуществом трипегилированной над дипегилированной. Однако дипегилированную форму рассматривали несколько более пригодной в отношении изготовления и анализа, и поэтому для дальнейшего тестирования выбирали дипегилированную форму по T11C, N33C. При существенно меньшем содержании PEG, чем в Krystexxa®, дипегилированная уриказа может быть предпочтительной с точки зрения иммуногенности.
[00117] Фармакокинетическое поведение Krystexxa® также оценивали в таком же исследовании PK у крыс. В отличие от ди- и трипегилированных уриказ Krystexxa® не демонстрировала монофазного выведения, а сложный профиль, в котором Krystexxa® быстро выводилась в первые 2 часа с последующим более постепенным профилем выведения (фигура 11А, квадраты). Профиль выведения Krystexxa® отчетливо отличается от профиля ди- и трипегилированных уриказ.
[00118] PK дипегилированной уриказы, вводимой SC, исследовали на собаках. Исследование на собаках выбирали потому, что имело место предшествующее тестирование PK пегилированной уриказы у собак (Pegloticase/Krystexxa® FDA BLA № 125293, раздел 2.6.5.4.1). Собакам вводили SC дозу 3 и 10 мг/кг и образцы сыворотки крови или крови собирали в различные моменты времени и анализировали в отношении уриказной активности (PK) или уровня мочевой кислоты (PD). Удельная ферментативная активность уриказы, которую вводили собакам (до введения дозы), и уриказы, которую измеряли в сыворотке крови (после введения дозы), была сопоставимой, свидетельствуя о том, что активность сохранялась во время исследования in vivo. На фигуре 11В продемонстрировано, что дипегилированная уриказа, вводимая собакам с помощью SC пути введения, имела период полувыведения 1,81 ± 0,31 дня для 3 мг/кг (n=3) и 1,82 ± 0,22 дня для 10 мг/кг (n=3). Наблюдали существенное снижение (~ 85%) уровней UA и, по-видимому, оно было пропорционально уровням уриказы в сыворотке крови (фигура 11B). Уровни UA в крови возвращались к нормальным, как только уровни уриказы исчерпывались.
Пример 13. Оценка активности и стабильности еx vivo
[00119] Активность дипегилированной уриказы (SEQ ID NO:1) оценивали в 50% человеческой сыворотке крови (цельная кровь содержит ~ 50% сыворотки крови) при 37°C для имитации комплекса среды и температуры матрикса in vivo. Анализ проводили следующим образом. UA, фосфатный буфер и сыворотку крови нагревали до 37oC. Все стадии реакции проводили при 37oC. Уриказу разбавляли до 8 мкг/мл в сыворотке крови в течение 20-30 минут для истощения эндогенной мочевой кислоты в образце человеческой сыворотки крови. Затем добавляли равный объем титрованной UA в фосфатном буфере и реакцию останавливали через 0, 1, 2, 4 или 6 минут с помощью 50% хлорной кислоты. Было показано, что хлорная кислота осаждает белок, но не осаждает UA (Sakuma et al., 1987 Clinical Chemistry и Stove et al., 2007 Clinical Chemistry). Осадок осаждали центрифугированием и 100 мкл надосадочной жидкости переносили в планшет для анализа в УФ-спектре. Поглощение измеряли при 292 нМ. Скорость рассчитывали путем построения графика наклона по 4 временным точкам при каждой концентрации UA с применением программного обеспечения SoftMax Pro. На фигуре 12A показано сравнение активности дипегилированной уриказы и Krystexxa® в 50% человеческой сыворотке крови при 37oC.
[00120] Также проводили анализ стабильности в человеческой сыворотке крови. Дипегилированную уриказу инкубировали в 50% человеческой сыворотке крови в течение 0, 0,5, 1, 2, 4 или 24 часов при 37°C и затем анализировали в отношении активности. Дипегилированная уриказа сохраняла активность в каждой точке, свидетельствуя о том, что белок стабилен в 50% человеческой сыворотке крови в течение по меньшей мере 24 часов и сохраняет свою активность оксидазы UA. На фигуре 12В показаны результаты эксперимента по стабильности в сыворотке крови.
[00121] Наконец, активность дипегилированной уриказы изучали с использованием повторных доз (повторной нагрузки) UA при 37oC. Вкратце, UA (100 мкМ) и дипегилированную уриказу (1 мкг/мл) объединяли в объеме 100 мкл (прозрачный 96-луночный планшет для анализа в УФ-спектре) при 37oC. Поглощение при 292 нм контролировали в течение 10 минут. 2,5 мкл 2000 мкМ UA добавляли в 100 мкл лунки ("повторная нагрузка") и контролировали поглощение при 292 нм в течение дополнительных 10 мин. Процесс повторяли и активность (наклон кривой истощения UA) оставалась относительно постоянной для каждой "повторной нагрузки". На фигуре 12C показаны результаты этого исследования.
Пример 14. Определение эффективности конъюгации PEG
[00122] Если в биомолекуле присутствует несколько сайтов конъюгации, реакции конъюгации зачастую приводят к гетерогенной смеси продуктов, которые характеризуются различной степенью функционализации и/или различными сайтами модификации. Как правило, это относится к неспецифическим реакциям сочетания первого порядка, таким как конъюгации белков, нацеленные на ε-аминогруппы остатков лизина. Однако, даже если выбран подход сайт-специфической конъюгации, например, в часто используемом подходе нацеливания на сконструированные остатки цистеина, реакция может не завершиться, например, из-за стерических ограничений. Это также приводит к распределению конъюгированных белков с различной степенью дериватизации. Поскольку виды биологической активности могут значительно варьировать в зависимости от степени модификации, необходимо тщательно характеризовать конечный продукт в отношении модификации, чтобы удостовериться, что биоконъюгат изготовлен надлежащим образом и согласно требованиям.
[00123] Несколько аналитических подходов можно использовать для характеризации общей дериватизации биоконъюгатов, в том числе масс-спектрометрию или способы, основанные на HPLC. Однако для важного класса биоконъюгаций, которые включают присоединение полимеров, таких как поли(этиленгликоль) (PEG), к белкам, большинство этих методик становятся сложными для конъюгатов, содержащих несколько присоединенных полимеров. Из-за размера и распределения заряда полимера и белка, а также полидисперсности PEG, масс-спектрометрические подходы, основанные на электрораспылительной ионизации (ESI), как правило, не осуществимы, и MALDI MS часто приводит к широкому непрерывному масс-спектру. Для меньших по размеру пегилированных белков и/или в случае небольшого количества сайтов конъюгации (N < 3) методики, основанные на HPLC, в нативных условиях (на основании исключении размера или ионного обмена) могут по-прежнему обеспечивать достаточное разрешение для различения отдельных видов. Однако эти методики, как правило, не осуществимы или характеризуются недостаточным разрешением в случае более крупных по размеру белков с несколькими сайтами конъюгации. В значительной степени гидратированный полимер PEG придает большой гидродинамический радиус белковым конъюгатам, что препятствует разделению на основе SEC с достаточным разрешением, и экранирование поверхностных зарядов ослабляет электростатическое взаимодействие со смолами IEX. В этом случае обращенно-фазовую (RP) HPLC зачастую выбирают в качестве способа для точного контроля за реакцией и характеризации продукта. Однако в случае олигомерных белков эта методика, как правило, приводит к диссоциации субъединиц и обеспечивает описание только лишь мономерной единицы, что дает частичное понимание о функционализации молекул, которое может быть недостоверным в отношении попыток по оптимизации процесса. Для точного количественного определения истинного статуса конъюгации олигомерного биотерапевтического средства для оптимизации процесса и характеризации продукта необходимо понять взаимосвязь между степенью модификации на уровне мономера и итоговой полной дериватизацией на уровне четвертичной структуры.
[00124] План эксперимента
[00125] Функционализированный малеимидом PEG-10 (10 кДа, Sunbright MA-100) получали от NOF. Все компоненты буфера и реагенты приобретали в Sigma (Сент-Луис, Миссури) или Avantor Performance Materials (Сентер Вэлли, Пенсильвания). Реакции пегилирования уриказы с тремя Cys проводили в натрий-фосфатном буфере, рН 7,0. Реакции пегилирования гасили в выбранные моменты времени путем добавления DTT до конечной концентрации 10 мМ и анализировали с помощью аналитической обращенно-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC) с применением колонки YMC-Pack Protein-RP (250×2,0 мм, S-5 мкм) от YMC America (Аллентаун, Пенсильвания, США) с помощью системы HPLC1200 от Agilent. Подвижная фаза А представляла собой 0,1% TFA в воде, и подвижная фаза В состояла из 0,1% TFA в ацетонитриле. Образец элюировали линейным градиентом увеличения подвижной фазы В со скоростью потока 0,4 мл/мин. Профили элюирования контролировали с помощью УФ-поглощения при 280 нм.
[00126] Двухуровневый план Бокса-Бенкена использовали с целью максимизации пегилирования белка. Концентрацию белка (1-3 мг/мл), PEG-10 (0,5-1 мМ) и восстанавливающего средства TCEP (0-0,5 мМ) изменяли для уриказ с двумя Cys и тремя Cys, содержащих 8 или 12 сайтов конъюгации на тетрамер соответственно, тогда как рН, концентрацию ионов соли и фосфатного буфера поддерживали при фиксированных значениях. Данные анализировали после сбора в выбранные моменты времени в диапазоне от 10 минут до 4 часов. Все эффекты второго порядка, а также время рассматривали как категориальные переменные, что приводило к плану с 64 экспериментами для скрининговых исследований каждого варианта белка в 1 цикле и 60 дополнительными экспериментами из расчета на один вариант белка для второго цикла исследований по оптимизации. Анализ данных выполняли с помощью программного обеспечения JMP 10.
[00127] Статистическая модель
[00128] Создавали статистическую меру для выведения полной дериватизации олигомерного белка из данных, полученных в легко доступных анализах (например, обратно-фазовой (RP) HPLC), которые вызывают диссоциацию не ковалентно связанных субъединиц. Для белка (или биомолекулы), содержащего n субъединиц, который имеет m потенциальных сайтов конъюгации в каждой субъединице. Допустим pi, где i=0, …, m, представляет собой экспериментально наблюдаемую долю субъединиц, имеющих i сайтов конъюгации, тогда  . Вероятность
. Вероятность 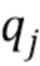 наблюдения олигомерного белка с j общим количеством конъюгированных сайтов может быть сформулирована с использованием следующей таблицы мультиномиальных вероятностей.
наблюдения олигомерного белка с j общим количеством конъюгированных сайтов может быть сформулирована с использованием следующей таблицы мультиномиальных вероятностей.
[00129] Таблица 9
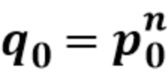
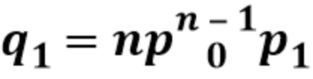
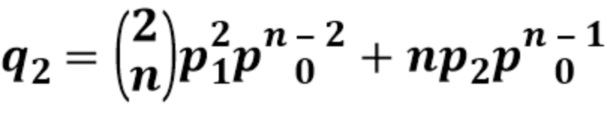


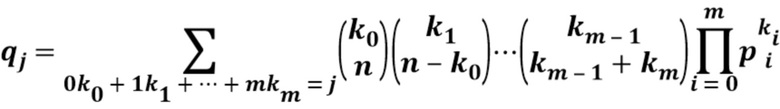


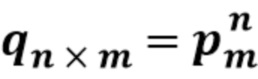
[00130] где ki, i=0, …, m представляет собой количество субъединиц, которые имеют точно i конъюгированных сайтов, и совокупность этих субъединиц имеет суммарно j конъюгированных сайтов, и при этом 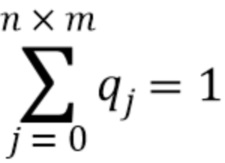 . Среднюю полную дериватизацию молекулы тогда легко записать в виде:
. Среднюю полную дериватизацию молекулы тогда легко записать в виде:
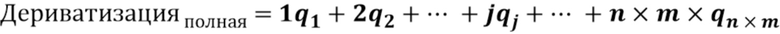 (Ур. 1).
(Ур. 1).
[00131] Нормализация этого значения к общему количеству доступных сайтов конъюгации (n x m) дает эффективность конъюгации.
[00132] Для биохимически и фармацевтически важных классов димерных, тримерных и тетрамерных белков расчеты подробно описаны ниже.
[00133] Таблица 10. Расчет полной дериватизации для димерного белка (n=2) с m=2 или 3 сайта конъюгации на субъединицу
1. Введение экспериментально наблюдаемых сайтов конъюгации на субъединицу в таблицу Excel выглядит следующим образом
p0, p1,...p3: Экспериментально наблюдаемые доли субъединиц с 0, 1,... 3 конъюгированными молекулами. Для m=2 сайта конъюгации на субъединицу заполните поля A2, B2, C2; для 3 сайтов конъюгации на субъединицу заполните поля A2, B2, C2, D2.
*: E2=Проверка суммы=SUM(A2:D2). Суммарно доли должны быть равны значению 1, например 100%.
[00134] 2. Расчеты мультиномиальных вероятностей и полной дериватизации
Составьте таблицу Excel следующим образом
Если белок имеет только m=2 сайта конъюгации на субъединицу, поля B15 и B16 не будут заполнены.
**: поле B17 (проверка суммы) должно равняться 1
***: (n x m), общее количество сайтов конъюгации, здесь необходим ввод в числовой форме.
[00135] Таблица 11. Расчет полной дериватизации для тримерного белка (n=3) с m=2 или 3 сайта конъюгации на субъединицу
1. Введение экспериментально наблюдаемых сайтов конъюгации на субъединицу в таблицу Excel выглядит следующим образом
p0, p1,...p3: Экспериментально наблюдаемые доли субъединиц с 0, 1,... 3 конъюгированными молекулами. Для m=2 сайта конъюгации на субъединицу заполните поля A2, B2, C2; для 3 сайтов конъюгации на субъединицу заполните поля A2, B2, C2, D2.
*: E2=Проверка суммы=SUM(A2:D2). Суммарно доли должны быть равны значению 1, например 100%.
[00136] 2. Расчеты мультиномиальных вероятностей и полной дериватизации
Составьте таблицу Excel следующим образом
Если белок имеет только m=2 сайта конъюгации на субъединицу, поля B17-B19 не будут заполнены.
**: сумма в поле B20 (проверка суммы) должна равняться 1
***: (n x m), общее количество сайтов конъюгации, здесь необходим ввод в числовой форме.
[00137] Таблица 12. Расчет полной дериватизации для тетрамерного белка (n=4) с m=2 или 3 сайта конъюгации на субъединицу
[00138] 1. Введение экспериментально наблюдаемых сайтов конъюгации на субъединицу в таблицу Excel выглядит следующим образом
p0, p1,...p3: Экспериментально наблюдаемые доли субъединиц с 0, 1,... 3 конъюгированными молекулами. Для m=2 сайта конъюгации на субъединицу заполните поля A2, B2, C2; для 3 сайтов конъюгации на субъединицу заполните поля A2, B2, C2, D2.
*: E2=Проверка суммы=SUM(A2:D2). Суммарно доли должны быть равны значению 1, например 100%.
[00139] 2. Расчеты мультиномиальных вероятностей и полной дериватизации
Составьте таблицу Excel следующим образом
(nxm)***
Если белок имеет только m=2 сайта конъюгации на субъединицу, поля B19-B22 не будут заполнены.
**: сумма в поле B23 (проверка суммы) должна равняться 1
***: (n x m), общее количество сайтов конъюгации, здесь необходим ввод в числовой форме.
[00140] Вышеприведенные данные описывают статистическую меру для выведения полной функционализации олигомерного белка из данных, полученных в легко доступных анализах, которые вызывают диссоциацию нековалентно связанных субъединиц. Вышеприведенные данные иллюстрируют этот способ с использованием конъюгации гомотетрамерного белка уриказы с поли(этиленгликолем) (PEG) в качестве модели системы. Ковалентная модификация терапевтических белков с помощью PEG является в настоящее время общепринятым подходом для увеличения периода полувыведения in vivo, снижения иммуногенности, улучшения растворимости и снижения восприимчивости к протеолитическому распаду. Однако данный способ в равной степени применим к другим способам биоконъюгации олигомеров, которые приводят к частичной функционализации при фиксированном количестве сайтов конъюгации.
[00141] Тетрамерный белок уриказы (n=4), изученный в данном документе, имеет общую массу > 100 кДа. Сайты конъюгации в фиксированном количестве вводили путем конструирования свободных остатков цистеина, которые обеспечивают возможность пегилирования с помощью функционализированного малеимидом PEG. Следующее обсуждение посвящено варианту белка с m=3 сайтами конъюгации на субъединицу, приводящими к общему количеству из 12 возможных сайтов конъюгации для тетрамера. Как описано выше, из-за размера белка и количества сайтов конъюгации все способы анализа, которые характеризуют продукт-биоконъюгат с достаточным разрешением, основаны на методиках, в которых диссоциируют нековалентно связанный олигомер на отдельные субъединицы. Фигура 13 иллюстрирует анализ реакции с течением времени с использованием RP HPLC, которая приводит к получению хорошо разрешенных пиков, соответствующим видам с различной степенью конъюгации, которые можно легко количественно определить путем интегрирования. Таким образом, результаты анализа представляют собой относительные количества мономера с разными степенями функционализации: доли p0, p1, p2, p3 субъединиц, содержащих 0, 1, 2 или 3 присоединенные цепи PEG. Из этих значений рассчитывают отдельные вероятности q0, q1, q2, q3,.... q12 для тетрамерного белка с 0, 1, 2, 3,... 12 присоединенными цепями PEG в соответствии с приведенной выше таблицей мультиномиальных вероятностей в виде:
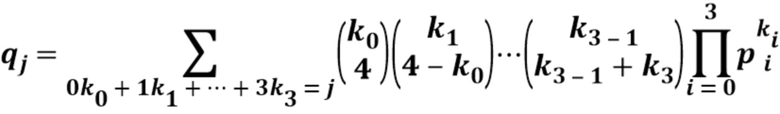
Для этого примера уравнение 1 принимает следующий вид:
Дериватизацияполная=1q1+2q2+3q3 +...+ 12q12.
В таблице 13 проиллюстрированы результаты этого анализа и перечислены относительные количества по-разному пегилированных субъединиц, полученные на основе анализа RP HPLC, вместе с вычисленной полной дериватизацией, рассчитанной по уравнению (1), и эффективностью пегилирования.
[00142] Таблица 13. Анализ данных эксперимента, проиллюстрированного на фигуре 13
[p0, %]
[p1, %]
[p2, %]
[p3, %]
(общее количество конъюгированных сайтов)
*Этот белок имеет в общей сложности 12 возможных сайтов конъюгации.
[00143] Данные иллюстрируют, что вычисленная полная дериватизация является ценным инструментом для разработчиков процессов, который позволяет сразу измерять полную модификацию белка. Например, после момента времени 10 минут выбранное условие реакции дает 28,9% субъединиц с 3 (из 3) функционализированными сайтами конъюгации. Однако, учитывая тот факт, что остальные субъединицы частично конъюгированы (15,9% с 1 цепью PEG, 53,9% с 2 цепями PEG), и подавая эти данные в мультиномиальное распределение в соответствии с уравнением 1, можно сразу понять, что средняя полная дериватизация белка действительно составляет 8,4 из 12 сайтов конъюгации в целом, что составляет 70,1%.
[00144] Чтобы дополнительно проиллюстрировать значение учета полной дериватизации молекулы для оптимизации процесса, это значение использовали в качестве параметра отклика для подхода планирования эксперимента (DOE) с целью оптимизации условий реакции, которые обеспечивали бы максимальное пегилирование белка. Эти результаты сравнивали с данными анализа при выборе выходных экспериментальных данных в виде конъюгации для отдельных субъединиц. Как описано в экспериментальном разделе, использовали план Бокса-Бенкена. На фигурах 14А и 14В показаны графики поверхности отклика для первого цикла исследований, демонстрирующие влияние концентрации реагента на общую эффективность пегилирования для моментов времени от 10 минут до 2 часов. Тогда как на фигуре 14А показаны данные на основе анализа "полностью пегилированной субъединицы" (т. е. 3 из 3 функционализированных сайтов конъюгации на мономер), непосредственно получаемые из записи самописца в анализе RP-HPLC, на фигуре 14B проиллюстрирован анализ данных при вычислении полной дериватизации на основании уравнения (1). Обе панели показывают, что эффективность пегилирования увеличивается с увеличением концентрации PEG. Однако выводы для этих двух разных способов анализа различаются. Если, например, целью является эффективность конъюгации > 90%, анализ, изложенный на фигуре 14А, может заставить разработчиков процесса добавлять по меньшей мере в 2 раза высшую концентрацию PEG и инкубировать в течение более длительного времени реакции по сравнению с анализом, основанного на полной дериватизации (фигура 14B). Это очевидное различие становится более выраженным при наличии большего количества сайтов конъюгации на одну субъединицу. Выбор только максимальной конъюгации на субъединицу в качестве параметра отклика вместо полной вычисленной дериватизации не дает истинного представления о функционализации олигомерной молекулы и может быть недостоверным. Учитывая высокую стоимость PEG и других реагентов для конъюгации, оптимизация процесса на основании полной дериватизации может привести к значительному сокращению затрат (а также времени).
[00145] Этот пример обеспечивает применимый статистический подход, основанный на мультиномиальном распределении, который позволяет вычислять полную конъюгацию белка для олигомерных белков, когда размер и природа белка или биофизические свойства конъюгата не позволяют проводить анализ в нативных условиях. Количественное описание полной дериватизации молекулы, рассчитанное в соответствии с уравнением (1), будет служить основанием как для усилий по оптимизации процесса, так и для точной характеризации конъюгата для обязательной отчетности, и, как можно надеяться, поможет в успешном переводе новых биоконъюгатов в клиническую практику.
Список литературы
[00146] Aly, M., Turkish Journal of Biology, 37, (2013) 520-529.
[00147] Anderson, A., Journal of Experimental Sciences, 2 (2011) 05-08.
[00148] Batista-Viera, F., J. Carlsson, Preparative Biochemistry, 7 (1977) 102-110.
[00149] Bongaerts, G.P., Biochim Biophys Acta, 27 (1978) 348-58.
[00150] Chen, R, Biochim. Biophys. Acta., 660 (1981) 293-298.
[00151] Chen, Y., African Journal of Biotechnology, 9 (2010) 4788-4795.
[00152] Chun, Z., Biosci. Biotechnol. Biochem. 74 (2010) 1298-1301.
[00153] da Silva Freitas, D., International Journal of Pharmaceutics 387 (2010) 215-222.
[00154] Davidson, J.N., Journal of Biochemistry, 32, (1938) 1386.
[00155] Davidson, J.N., Nature, 141, (1938) 790.
[00156] Davis S., Lancet. 8241 (1981) 281-283.
[00157] Fayyadh, M. Current Research in Microbiology and Biotechnology, 2 (2014) 384-390.
[00158] Geweely, N., Australian Journal of Basic and Applied Sciences, 10 (2011) 220-230.
[00159] Giffard, M., PloS ONE, 6 (2011) 1-9.
[00160] Habeeb, A.F., Anal. Biochem., 14 (1966), 328-336.
[00161] Holmberg, C.G., Journal of Biochemistry, 33 (1939) 1901-1906.
[00162] Hongoh, Y., Insect Biochemistry and Molecular Biology, 30 (2000) 173-182.
[00163] Ikeda, A., et al., Tumor Lysis Syndrome Clinical Presentation, Medscape (Dec. 3, 2014).
[00164] Itaya, K., Agr. Biol. Chem, 31 (1967) 1256-1264.
[00165] Liu, J., Annals of the New York Academy Sciences, 750 (2006) 477-481.
[00166] Lucas, K, Archives of Biochemistry and Biophysics, 11 (1983) 190-7.
[00167] Mabrouk, A., Gate2Biotech, 2, (2010) 1-13.
[00168] Machida, Y., Agricultural and Biological Chemistry, 44 (1980) 2811-2815.
[00169] Montalbini, P., Plant Science. 147 (1999) 139-147.
[00170] Nanda, P., International Journal of Pharmaceutical Technology, 1 (2011) 2277-3436.
[00171] Nanda, P., Research in Biotechnology, 3 (2012) 35-46.
[00172] Ortlund, Proceedings of the National Academy of Sciences of the United States, 10 (2014) 3763-3768.
[00173] Pfrimer, P., Journal of Biomedicine and Biotechnology, (2010) 1-6.
[00174] Poovizh, T., Internation Journal of Advanced Research, 2 (2014) 34-40.
[00175] Redondo, J, Planta, 202 (1997) 3.
[00176] Salleh, A.B., Pertanika, 3 (1980) 97-102.
[00177] Sherman, M. et al., Adv. Drug. Deliv. Rev. 60 (2008) 59-68.
[00178] Tian, H., Journal of Pharmacy and Pharmacology, 65 (2013) 53-63.
[00179] Watanabe, T., Analytical Biochemistry, 89 (1978) 343-347.
[00180] Watanabe, T., Analytical Biochemistry, 86 (1978) 357-362.
[00181] Wertheimer, A., et al., A Revised Estimate of the Burden of Illness of Gout, Curr Ther Res Clin Exp 75:1-4 (2013).
[00182] Zhang, C., PLOS ONE, 7 (2012).
ЭКВИВАЛЕНТЫ
[00183] Изложенное выше письменное описание считается достаточным, чтобы дать возможность специалисту в данной области техники реализовать на практике варианты осуществления. В изложенных выше описании и примерах подробно определены некоторые варианты осуществления и описан наилучший способ осуществления, предполагаемый авторами настоящего изобретения. Однако будет понятно, что независимо от того, насколько подробно изложенное выше может быть представлено в тексте, вариант осуществления можно реализовать на практике множеством способов, и его следует истолковывать в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.
[00184] В контексте данного документа термин "приблизительно" относится к числовому значению, в том числе, например, целым числам, долям и процентным значениям, не зависимо от того, указано ли это прямо или нет. Термин "приблизительно" в целом относится к диапазону числовых значений (например, +/-5-10% от указанного диапазона), который обычный специалист в данной области техники будет рассматривать, как эквивалентный указанному значению (например, как таковой, что имеет такое же действие или результат). Когда такие термины, как "по меньшей мере" и "приблизительно" предшествуют перечню числовых значений или диапазонов, эти термины модифицируют все значения или диапазоны, указанные в перечне. В некоторых случаях термин "приблизительно" может включать в себя числовые значения, которые округлены до первого значащего знака.

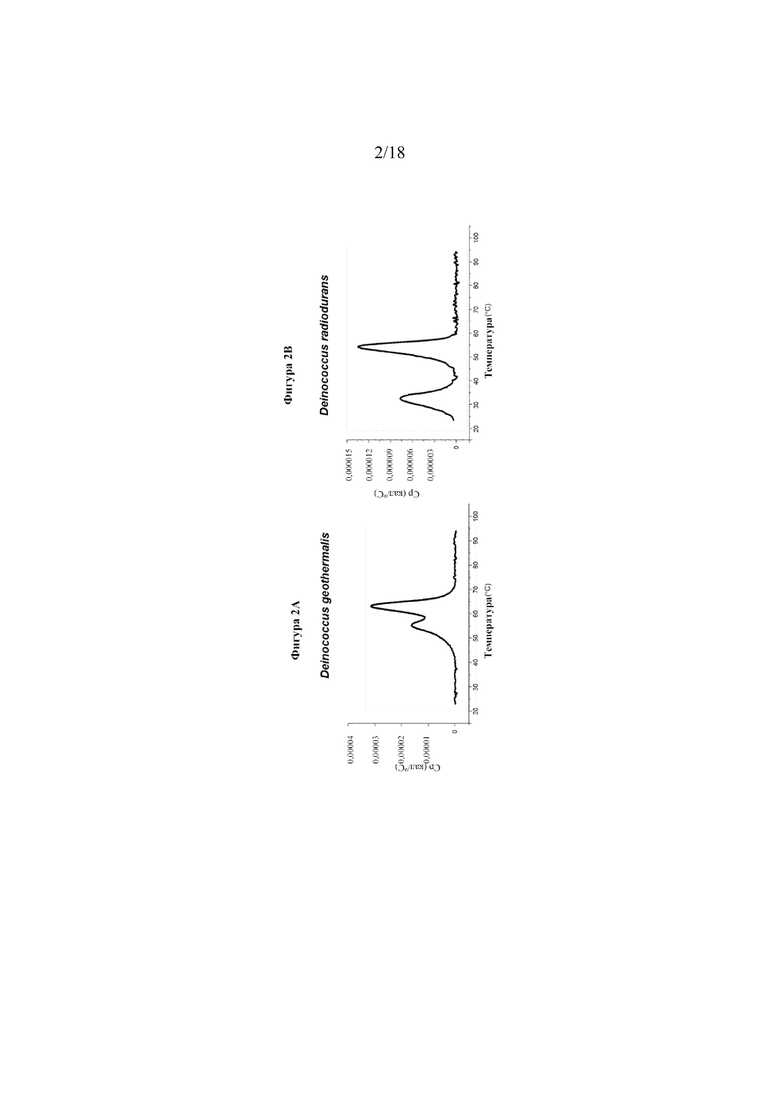
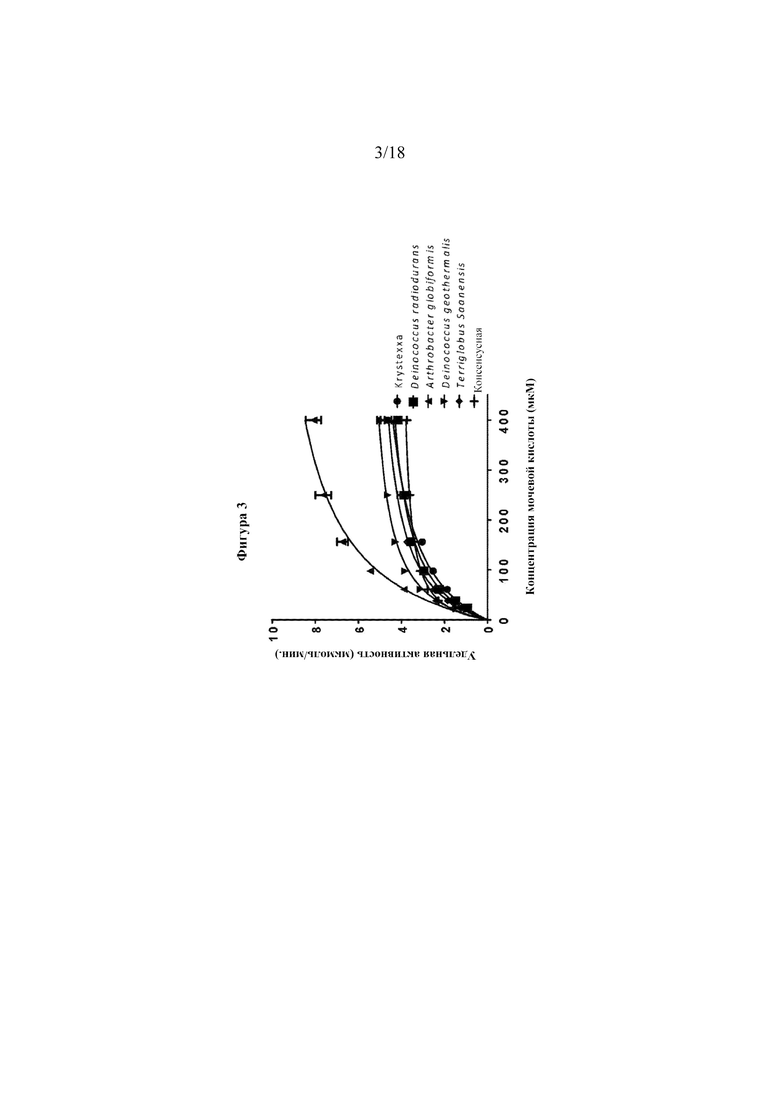
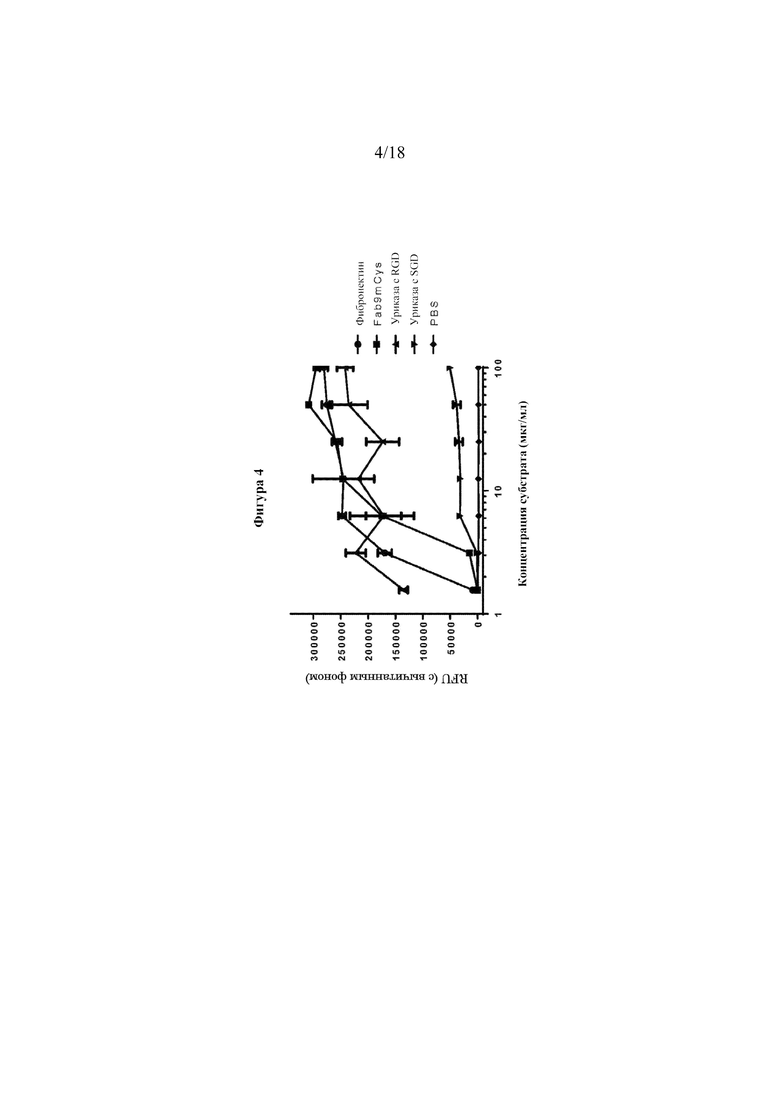
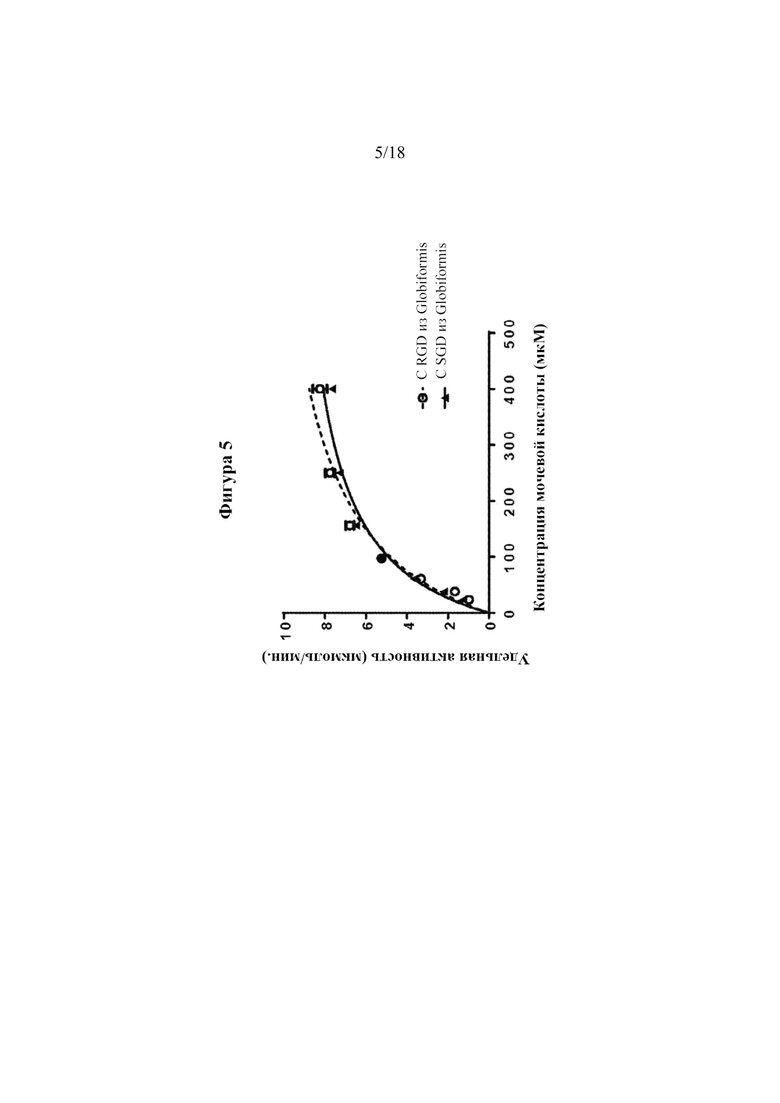

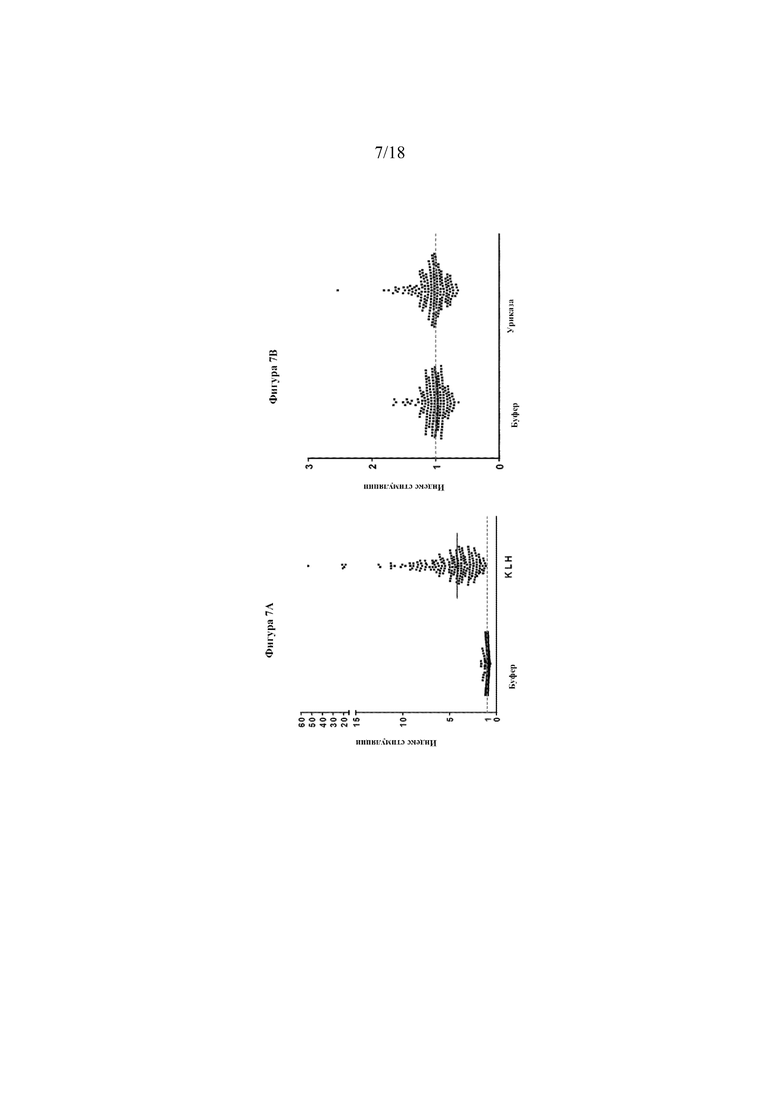
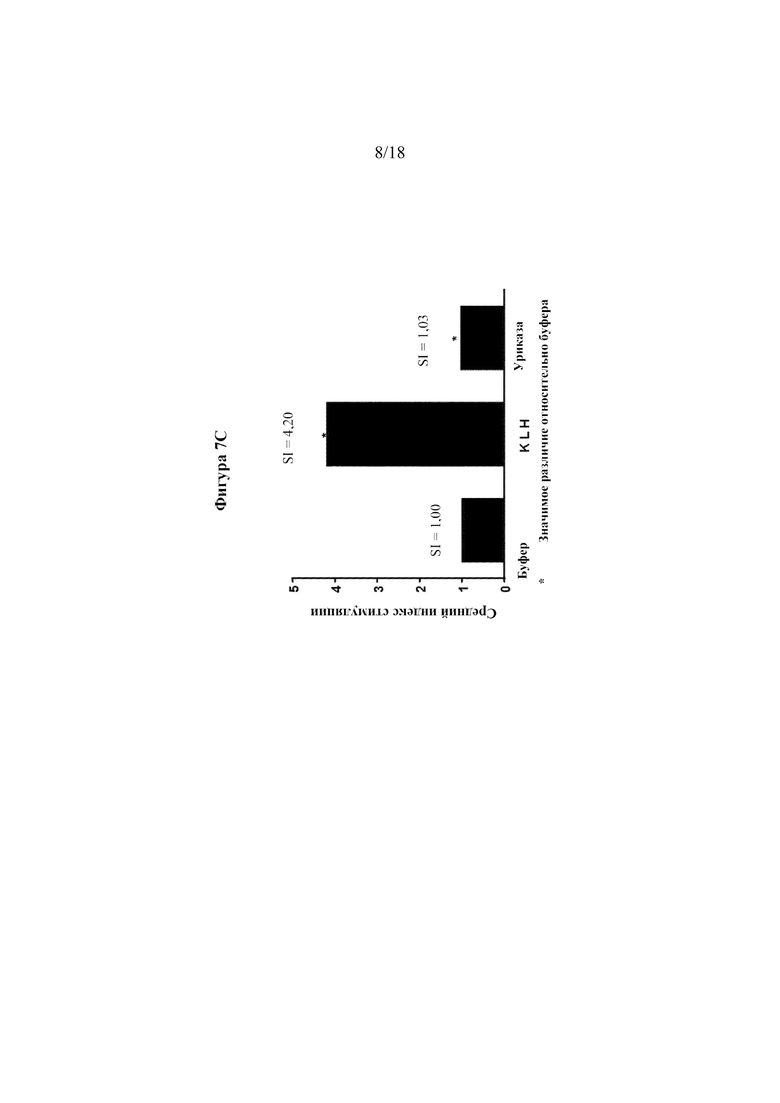
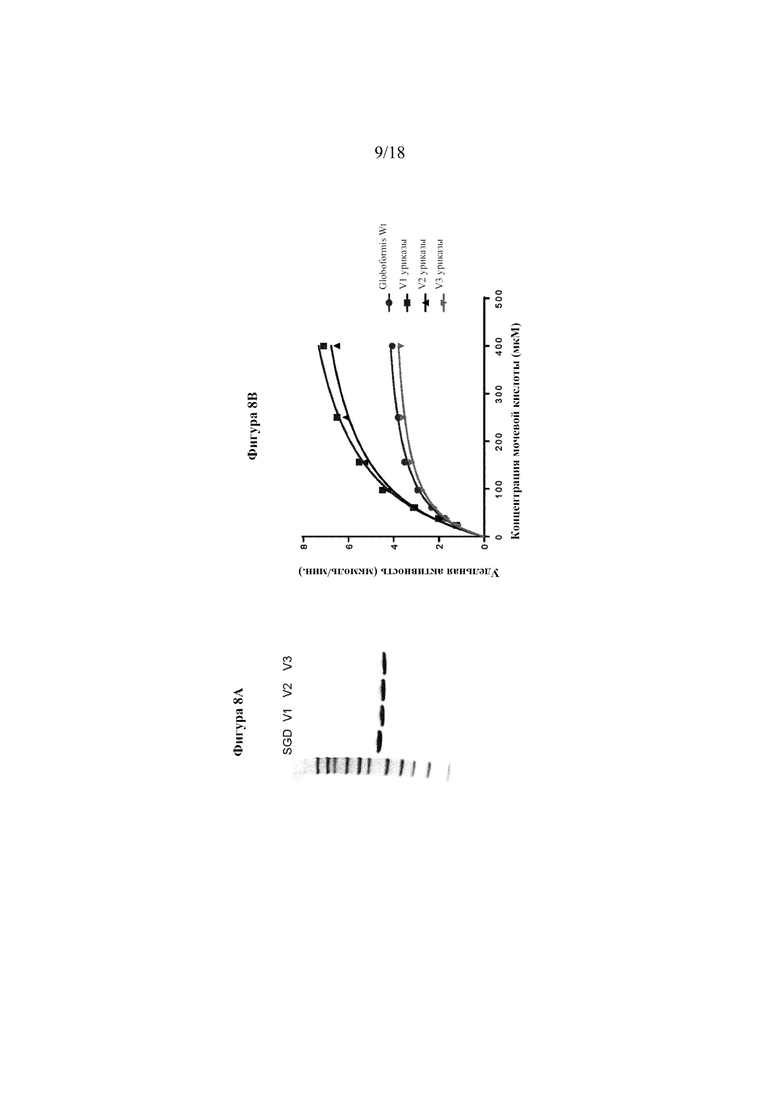
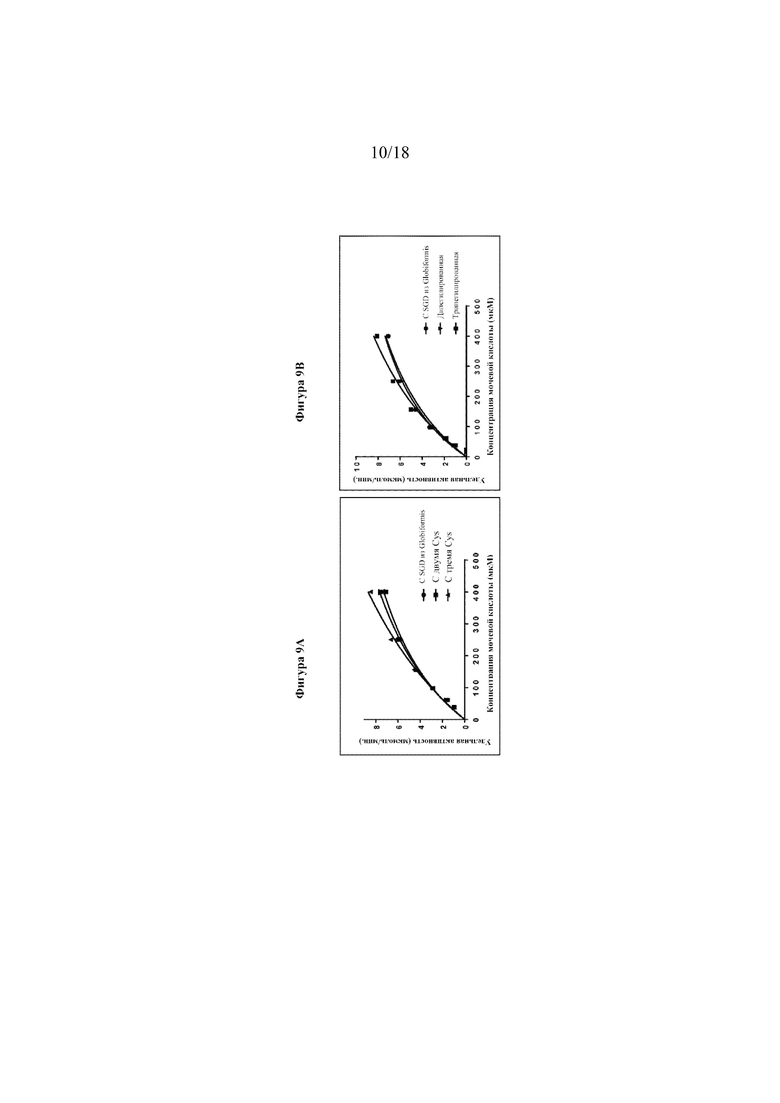

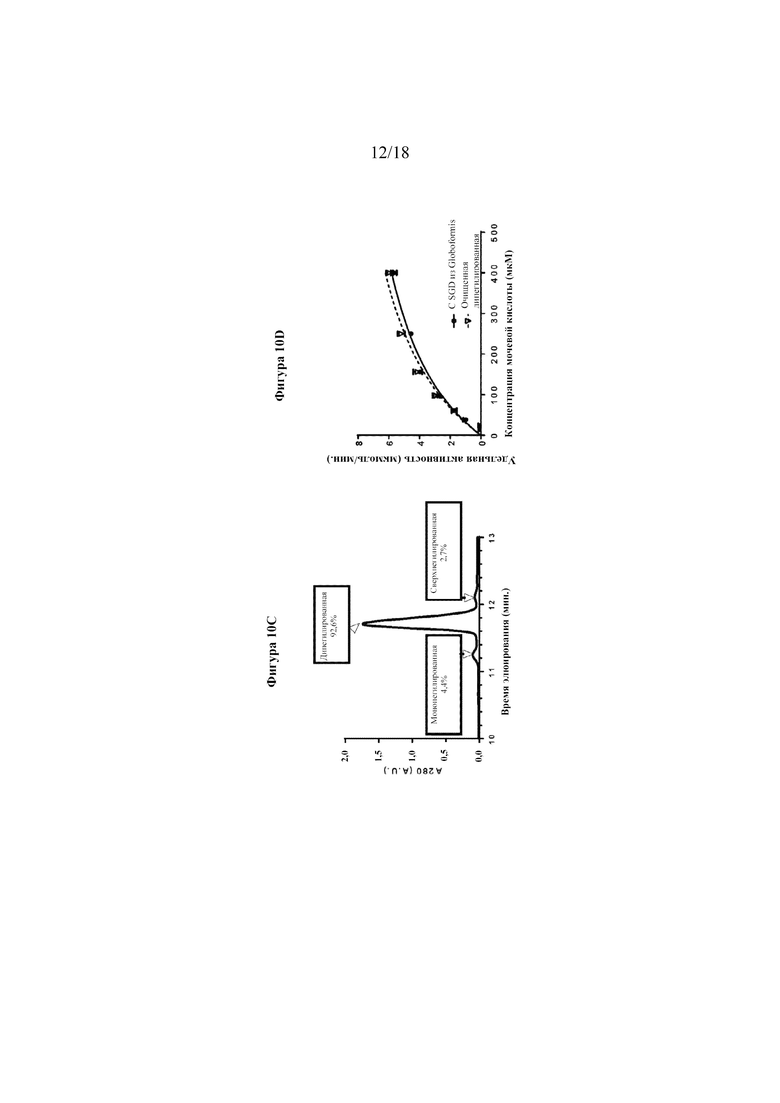
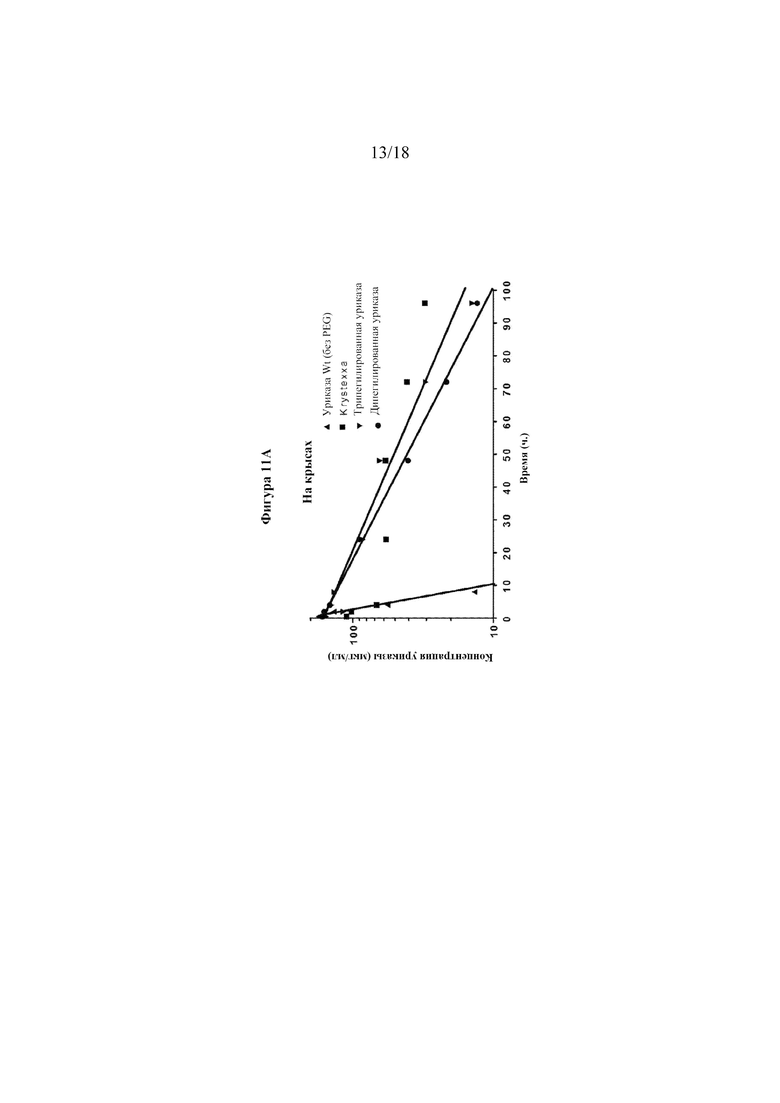
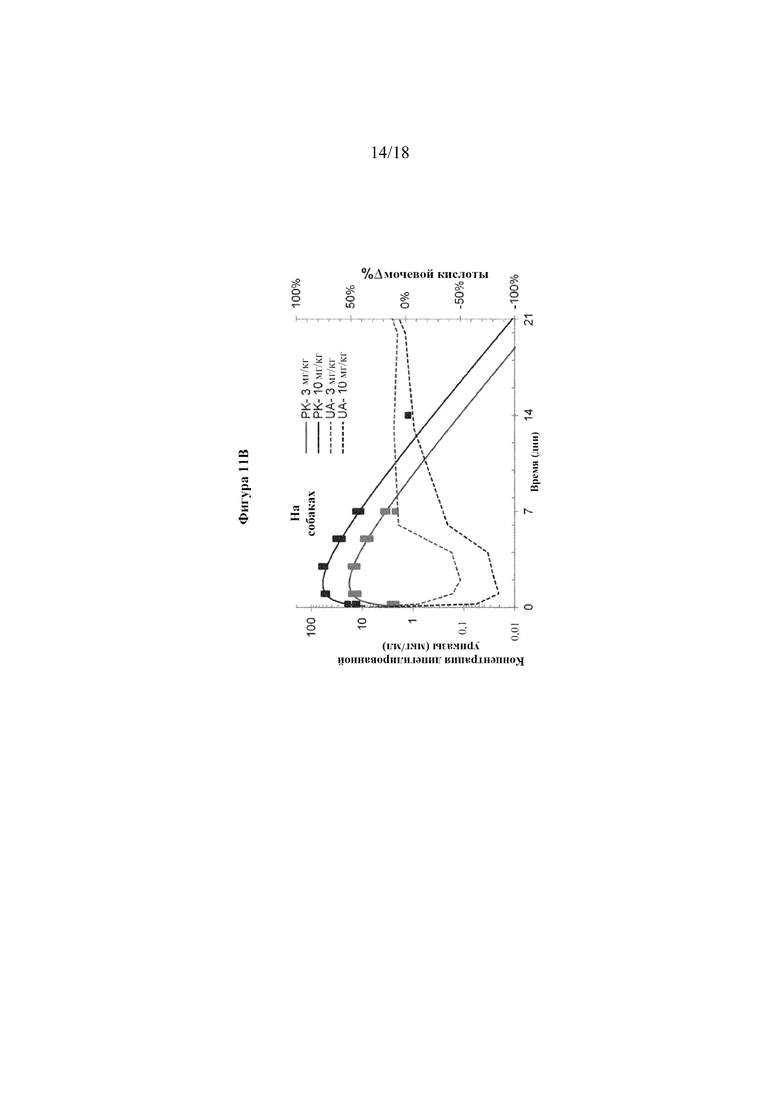
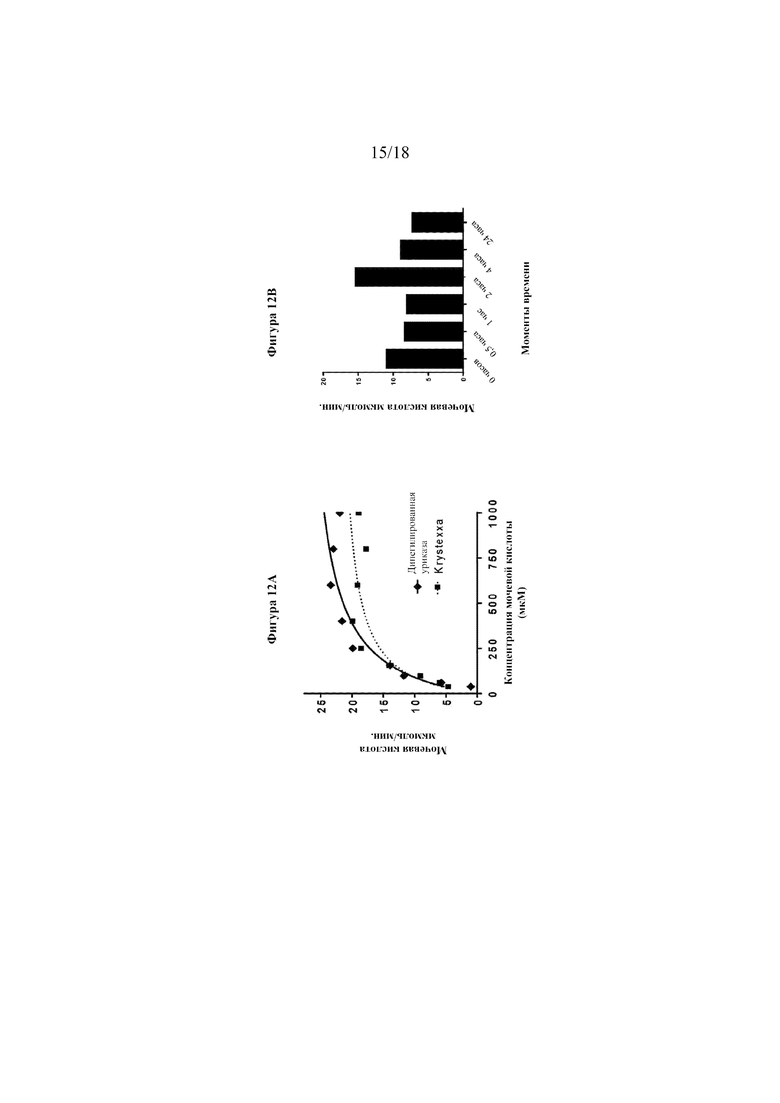
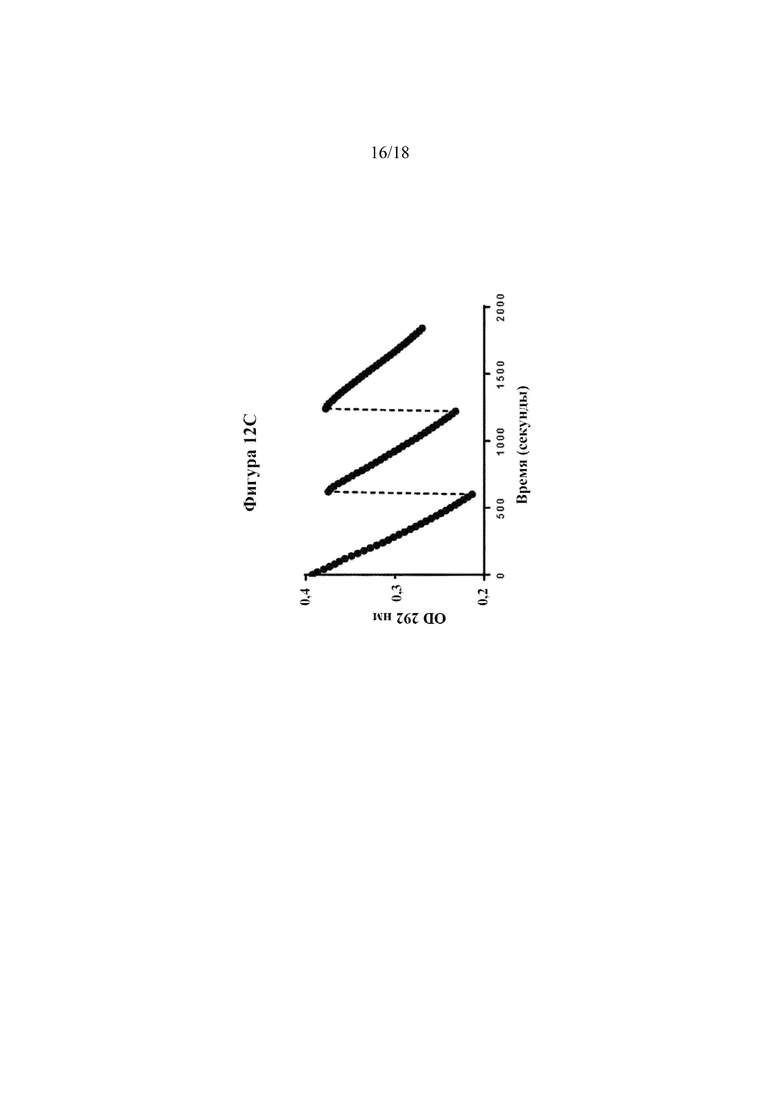
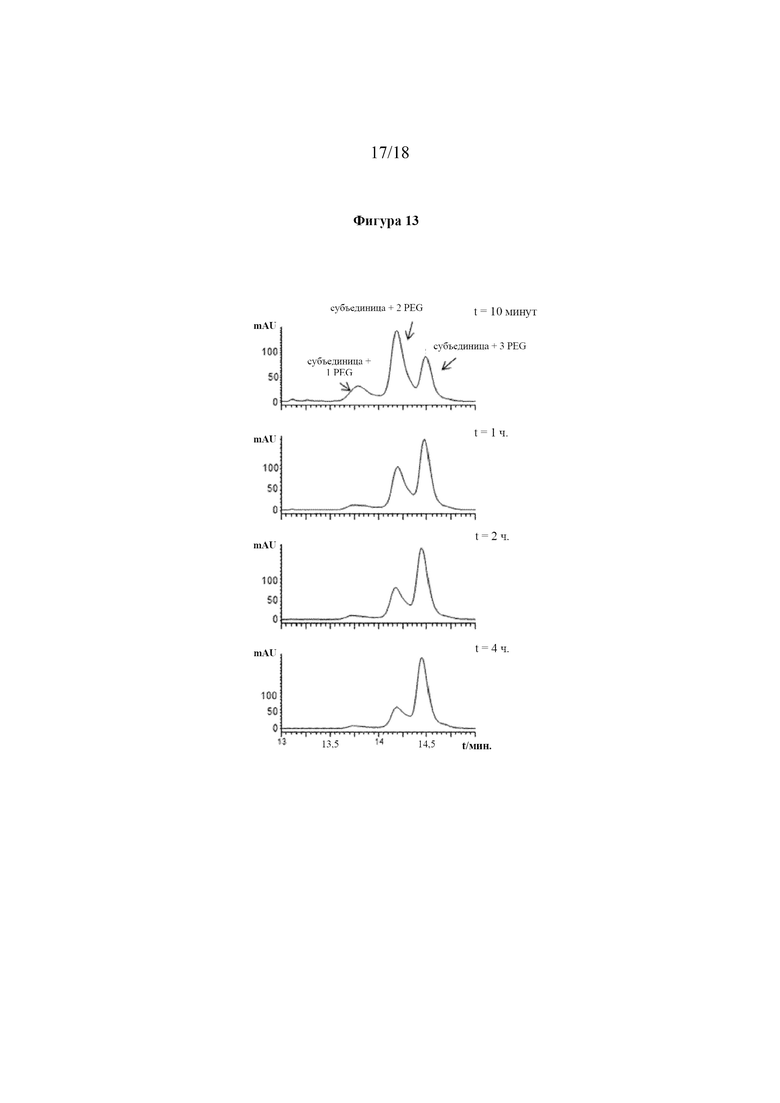
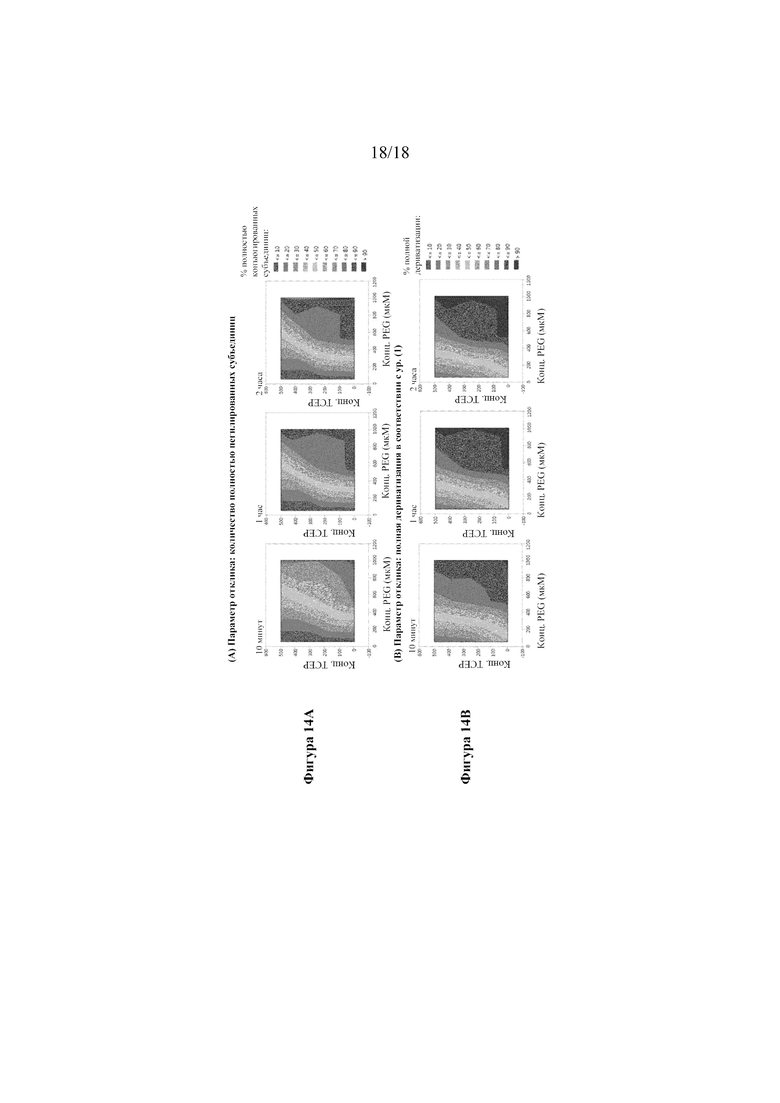
Изобретение относится к биотехнологии и представляет собой мономер уриказы, содержащий: (a) аминокислотную последовательность, имеющую по меньшей мере 95% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 1 и содержащей два остатка цистеина в положениях 11 и 33, где нумерация положений приведена относительно аминокислотной последовательности SEQ ID NO: 27; (b) две молекулы полиэтиленгликоля (ПЭГ), где каждый ПЭГ конъюгирован с каждым остатком цистеина; (c) делецию остатка треонина в положении 2, где нумерация положений приведена относительно аминокислотной последовательности SEQ ID NO: 27; и (d) усечение С-конца относительно аминокислотной последовательности SEQ ID NO: 27, где указанное усечение удаляет C-концевой остаток цистеина, присутствующий в SEQ ID NO: 27, и где указанная уриказа сохраняет ферментативную активность. Изобретение касается также фармацевтической композиции для снижения уровней мочевой кислоты у пациента с гиперурикемией, содержащей эффективное количество мономера уриказы согласно изобретению. Изобретение позволяет эффективно снижать уровень мочевой кислоты у пациентов с гиперурикемией. 3 н. и 7 з.п. ф-лы, 14 ил., 13 табл., 14 пр.
1. Мономер уриказы, содержащий:
(a) аминокислотную последовательность, имеющую по меньшей мере 95% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 1 и содержащей два остатка цистеина в положениях 11 и 33, где нумерация положений приведена относительно аминокислотной последовательности SEQ ID NO: 27;
(b) две молекулы полиэтиленгликоля (ПЭГ), где каждый ПЭГ конъюгирован с каждым остатком цистеина;
(c) делецию остатка треонина в положении 2, где нумерация положений приведена относительно аминокислотной последовательности SEQ ID NO: 27; и
(d) усечение С-конца относительно аминокислотной последовательности SEQ ID NO: 27, где указанное усечение удаляет C-концевой остаток цистеина, присутствующий в SEQ ID NO: 27,
и где указанная уриказа сохраняет ферментативную активность.
2. Мономер уриказы по п. 1, где мономер уриказы не содержит мотив RGD.
3. Мономер уриказы по п. 1, где мономер уриказы содержит аминокислотную последовательность собой SEQ ID NO 1.
4. Мономер уриказы по п. 1, где каждая из молекул ПЭГ имеет молекулярный вес 10 кДа.
5. Мономер уриказы по п. 4, где указанный ПЭГ представляет собой функционализированный малеимидом PEG-10.
6. Фармацевтическая композиция для снижения уровней мочевой кислоты у пациента с гиперурикемией, содержащая эффективное количество мономера уриказы по п. 1.
7. Способ снижения уровней мочевой кислоты и/или содержания кристаллов уратов у пациента с гиперурикемией, включающий введение фармацевтической композиции по п. 6.
8. Способ по п. 7, где у пациента с гиперурикемией имеется подагра или синдром лизиса опухоли.
9. Способ по п. 8, где у пациента с гиперурикемией имеется хроническая рефрактерная подагра и/или узелковая подагра.
10. Способ по п. 7, где фармацевтическую композицию вводят подкожно или внутривенно.
| ВАРИАНТНАЯ ФОРМА УРАТ-ОКСИДАЗЫ И ЕЕ ИСПОЛЬЗОВАНИЕ | 2006 |
|
RU2435847C2 |
| SUZUKI K et.al Molecular cloning and expression of uricase gene from Arthrobacter globiformis in Escherichia coli and characterization of the gene product, J Biosci Bioeng | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Database UniProtKB/Swiss-Prot: D0VWQ1.1, 01.04.2015 Найдено в | |||
Авторы
Даты
2021-07-28—Публикация
2016-05-13—Подача