Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для подкожных инъекций, которую вводят индивидууму с избыточным весом или ожирением для снижения массы тела индивидуума, и, в особенности, к композиции для подкожных инъекций, включающей содержащие лекарственное средство мицеллы, и куркуминоид или куркуминоиды, инкапсулированные в мицеллах, и композицию для подкожных инъекций применяют для снижения веса.
Уровень техники
Под ожирением понимается такое состояние организма, при котором чрезмерно накапливаются жировые отложения, что негативно влияет на здоровье и что может привести к сокращению продолжительности жизни и различным проблемам со здоровьем. Согласно определению ожирения, данному Всемирной организацией здравоохранения (ВОЗ), лица с индексом массы тела (ИМТ) выше 25 имеют избыточный вес, а лица с ИМТ выше 30 – ожирение. В некоторых странах Восточной Азии применяют более строгие стандарты, например, Министерство здравоохранения и социального обеспечения Тайваня объявило в апреле 2002 года, что тайваньские взрослые с ИМТ ≥ 27 страдают ожирением или с 24 ≥ ИМТ <27 имеют избыточный вес.
Статистические данные показывают, что численность населения с избыточным весом и ожирением во всем мире в 2014 году превысила 2,7 миллиарда человек, причем примерно 13% населения страдали ожирением. Вероятность того, что эти индивидуумы с ожирением, могут страдать от сопутствующих заболеваний, таких как сердечнососудистые заболевания, гиперлипидемия, диабет и рак, была значительно выше, чем у обычных людей. В отчете ВОЗ об исследованиях также указывалось, что среди болезней, вызывающих риски летального исхода во всем мире, избыточный вес и ожирение занимают 6-е место. Данные исследований показывают, что в 2013 году, по меньшей мере, более 3,4 миллиона взрослых умерли от хронических заболеваний, вызванных избыточным весом или ожирением, при этом затраты на медицину в 44% случаев диабета и 23% случаев ишемической болезни сердца, связаны с ожирением. Кроме того, возраст людей, страдающих ожирением, постепенно снижается. По данным ВОЗ, в 2011 году во всем мире насчитывалось около 40 миллионов детей в возрасте до пяти лет с избыточным весом. Согласно отчету, опубликованному в 2007 году Школой общественного здравоохранения Блумберга при Университете Джона Хопкинса, в котором указывается, что в 2015 году примерно 75% взрослых США будут иметь избыточный вес, при этом из них 41% будет классифицирован как страдающие ожирением. С ростом развивающихся стран глобальная популяция лиц, страдающих ожирением, будет быстро расти, и ожирение станет одним из основных распространенных заболеваний. Центры контроля и профилактики заболеваний США (CDC) указывают, что популяция взрослых, страдающих ожирением, в США составляет более 72 миллионов, а 40% населения мира, страдающего от ожирения, находится в Азиатско-Тихоокеанском регионе. Доля взрослых с избыточным весом и ожирением в Китае резко возросла с 25% в 2002 году до 38,5% в 2010 году; прогнозируют, что в 2015 году от 50% до 57% населения Китая будет иметь избыточный вес.
Ожирение является проблемой здравоохранения, которая вызывает серьезную обеспокоенность во всем мире, и исследования показывают, что причины ожирения очень сложны с вовлечением множества факторов. Появляется все больше и больше доказательств, которые также показывают, что ожирение представляет собой внутреннее нарушение обмена веществ, не представляющее собой простую проблему, которая может быть улучшена с помощью самоконтроля, а сложный симптом, связанный с внутренней регуляцией аппетита и энергетическим обменом. Ожирение не только увеличивает уровень смертности и приводит к огромным медицинским затратам, но также влияет на качество жизни человечества. Хотя причина ожирения не полностью установлена, считается, что она связана с генетическими, метаболическими, биохимическими, культурными и духовно-социальными факторами. Исследования показывают, что многие причины смерти, включая рак, сердечнососудистые заболевания, цереброваскулярные заболевания, диабет, хронические заболевания нижних дыхательных путей, хронические заболевания печени и цирроз печени, гипертонические заболевания, заболевания почек и т.д., коррелируют с ожирением, что свидетельствует о том, что проблема ожирения стала чрезвычайно важной проблемой во всем мире. В последние годы распространенность ожирения становится все выше и выше, метаболические синдромы, вызванные метаболическими нарушениями, такими как высокое кровяное давление (гипертония), высокий уровень сахара в крови (гипергликемия), резистентность к инсулину и дислипидемия, будут сопровождаться ожирением, которое будет легко приводить к таким заболеваниям, как диабет, сердечнососудистые заболевания, атеросклероз, цереброваскулярные заболевания и рак, которые вызывают инсульт, инфаркт миокарда и даже смерть.
Механизмы действия современных синтетических препаратов для похудения можно разделить на две категории, которые включают подавление аппетита и блокирование части кишечной абсорбции пищевых жиров, соответственно. Среди них подавление аппетита является основным механизмом коммерческих лекарственных препаратов для похудения, предлагаемых на рынке в прошлом и в настоящее время. Этот тип лекарственных препаратов включает сибутрамин (Reductil®), лорказерин, Qsymia® и контрав и др., которые имеют серьезные побочные эффекты и определенную степень риска сердечнососудистых заболеваний. Взять, например, лекарственный препарат для похудения сибутрамин (Reductil®), который был отозван с рынка, его рыночная доля когда-то достигала 70 процентов; однако было доказано, что он повышает риск возникновения сердечнососудистых заболеваний. Поэтому в 2010 году лекарственные препараты для похудения, содержащие ингредиент сибутрамин, были отозваны с рынков ЕС, США, Австралии и Тайваня.
Лекарственный препарат для похудения, который блокирует часть кишечной абсорбции пищевых жиров, – это орлистат; он представляет собой специфический и обратимый ингибитор желудочно-кишечной липазы, благодаря ингибированию липазы, выделяемой из поджелудочной железы и кишечника, кишечная абсорбция жира, поступающего с пищей, снижается на 25-30%. Из-за того, что основной механизм действия орлистата заключается в блокировании всасывания жира, во время приема лекарственного препарата могут возникать побочные эффекты со стороны желудочно-кишечного тракта, такие как жирный стул, повышенное количество испражнений, вздутие кишечника и т.д., что может помешать всасыванию жирорастворимых витаминов; в зарубежных странах отмечено также несколько случаев серьезных побочных эффектов, таких как повреждение печени, камни в желчном пузыре и т.п.
Следовательно, современные синтетические препараты, применяемые для похудения, по-прежнему обладают в разной степени рисками в отношении сердечнососудистой системы и проблемами безопасности; на рынке требуются безопасные лекарства для похудения с низким уровнем побочных эффектов, без риска сердечнососудистых заболеваний, которые могут эффективно снижать вес и жировые отложения, а также могут одновременно снижать риск сердечнососудистых заболеваний.
Документ «Пищевые полифенолы и ожирение», опубликованный Мохсеном Мейдани (Mohsen Meydani) и другими, раскрывает, что общий прирост массы тела крысы может быть уменьшен при пероральном приеме куркумина. Однако пероральная доза куркумина, раскрытая в этом документе, составляла от 250 до 10000 мг/кг, и ее влияние на потерю веса было ограниченным.
Следовательно, на рынке все еще существует потребность в фармацевтической композиции для снижения веса, которая может эффективно снижать массу тела при низкой дозировке, низких побочных эффектах и хорошей безопасности. В условиях высокого спроса со стороны, как потребителей, так и врачей, разработка фармацевтической композиции для снижения веса для преодоления ограничений современных технологий должна стать проблемой, которую необходимо остро обсуждать и решать.
Непатентная ссылка
Mohsen Meydani et al, «Dietary Polyphenols и Obesity», Nutrients, 2010, 2:735-751.
Раскрытие изобретения
Ввиду недостатка известного уровня техники, настоящее изобретение обеспечивает фармацевтическую композицию для снижения массы тела, в которой фармацевтическая композиция включает содержащие лекарственное средство мицеллы, образованные из производного полиоксиэтиленового касторового масла или производных полиоксиэтиленового касторового масла и куркуминоида или куркуминоидов, инкапсулированных в содержащие лекарственное средство мицеллы. Фармацевтическая композиция для снижения массы тела может быть применена для снижения веса и обладает преимуществами низкой дозировки, высокой стабильности, низких побочных эффектов и замедленного высвобождения.
Настоящее изобретение после введения может способствовать апоптозу в адипоцитах всего организма, тем самым достигая цели снижения массы тела. Настоящее изобретение в значительной степени решает проблемы предшествующего уровня техники, такие как высокая дозировка и множество побочных эффектов; и значительно улучшает эффект снижения массы тела по сравнению с пероральными препаратами для похудения. Настоящее изобретение пригодно для введения с помощью подкожной инъекции или подкожной инъекции в жировой слой субъекту с избыточным весом или ожирением без необходимости или без помощи какого-либо хирургического вмешательства или оборудования. Предпочтительно, его вводят субъекту, ИМТ которого больше или равен 24; предпочтительно, его вводят субъекту, ИМТ которого больше 25; предпочтительно, его вводят субъекту, ИМТ которого больше или равен 27; и предпочтительно, его вводят субъекту, ИМТ которого больше 30.
В настоящем изобретении термин «избыточный вес» относится к тому, что ИМТ взрослого человека больше или равен 24 и меньше 27; и термин «ожирение» относится к тому, что ИМТ взрослого человека больше или равен 27. Предпочтительно, термин «избыточный вес» означает, что ИМТ взрослого человека превышает 25; и термин «ожирение» относится к тому, что ИМТ взрослого человека превышает 30.
В настоящем изобретении термин «экстракт куркумы» относится к смеси ингредиентов, получаемой экстракцией любым растворителем и любым способом экстракции, коммерчески доступному экстракту куркумы, любой смеси, содержащей, по меньшей мере, 75% (% масс.) куркумина, любой смеси, содержащей, по меньшей мере, 75% (% масс.) куркуминоида или куркуминоидов или коммерчески доступного куркумина.
В настоящем изобретении термин «ресвератрол» относится к ресвератролу, полученному путем экстракции из натуральных растений, или коммерчески доступному ресвератролу. Предпочтительно, чистота ресвератрол составляет от 90% до 100% (% масс.).
В настоящем изобретении термин «экстракт зеленого чая» относится к смеси ингредиентов зеленого чая, экстрагированной любым растворителем, и любым способом экстракции, или коммерчески доступному экстракту зеленого чая, и, предпочтительно, к любой смеси, содержащей, по меньшей мере, 45% (% масс.) эпигаллокатехина галлата (EGCG), к любой смеси, содержащей, по меньшей мере, 90% (% масс.) катехинов или коммерчески доступного эпигаллокатехина галлата (EGCG).
В настоящем изобретении термин «мицелла» относится к микроструктуре, образованной из производного полиоксиэтиленового касторового масла или производных полиоксиэтиленового касторового масла, каждое из этих полиоксиэтиленовых производных имеет гидрофильный конец и гидрофобный (липофильный) конец, и молекулы производного полиоксиэтиленового касторового масла расположены таким образом, что гидрофильные концы обращены наружу, а гидрофобные (липофильные) концы направлены внутрь, образуя микроструктуру. Предпочтительно, микроструктура представляет собой сферическую структуру, сфероидальную структуру или другие микроструктурные структуры.
В настоящем изобретении термин «содержащие лекарственное средство мицеллы» относится к мицеллам, содержащим куркуминоид или куркуминоиды. Предпочтительно, содержащие лекарственное средство мицеллы относятся к мицеллам, содержащим куркумин; и это значит, что содержащие лекарственное средство мицеллы относятся к мицеллам, инкапсулирующим или содержащим куркуминоид или куркуминоиды. Предпочтительно, содержащие лекарственное средство мицеллы относятся к мицеллам, инкапсулирующим или содержащим куркумин.
Предпочтительно, содержащие лекарственное средство мицеллы равномерно распределены в фармацевтической композиции.
В фармацевтической композиции по настоящему изобретению, если общая концентрация куркуминоида или куркуминоидов, инкапсулированных в содержащие лекарственное средство мицеллы выражена в мг/г, она представляет собой суммарные миллиграммы куркуминоида или куркуминоидов во всех содержащих лекарственное средство мицеллах, содержащиеся на грамм фармацевтической композиции.
В фармацевтической композиции по настоящему изобретению общая концентрация куркуминоида или куркуминоидов, инкапсулированных в содержащие лекарственное средство мицеллы, может быть измерена, например, с помощью процедуры, описанной следующим образом:
фильтрование фармацевтической композиции через фильтрующую мембрану 0,2 мкм для получения фильтрата и осадков куркуминоида или куркуминоидов, которые не были инкапсулированы в содержащие лекарственное средство мицеллы;
получение раствора образца путем разбавления фильтрата ДМСО для растворения содержащих лекарственное средство мицелл в фильтрате с помощью ДМСО и, следовательно, для дальнейшего стимулирования высвобождения в раствор образца куркуминоида или куркуминоидов, первоначально инкапсулированных в содержащих лекарственное средство мицеллах;
определение концентрации куркуминоида или куркуминоидов в растворе образца с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ, например, ВЭЖХ-УФ); и
вычисление общей концентрации куркуминоида или куркуминоидов, инкапсулированных в содержащие лекарственное средство мицеллы, в фармацевтической композиции, применяя концентрацию куркуминоида или куркуминоидов в растворе образца.
В настоящем изобретении термин «первые содержащие лекарственное средство мицеллы» относятся к мицеллам, содержащим куркуминоид или куркуминоиды; и, предпочтительно, содержащие лекарственное средство мицеллы относятся к мицеллам, содержащим куркумин. То есть первые содержащие лекарственное средство мицеллы относятся к мицеллам, инкапсулирующим или содержащим куркуминоид или куркуминоиды; и, предпочтительно, первые содержащие лекарственное средство мицеллы относятся к мицеллам, инкапсулирующим или содержащим куркумин.
В настоящем изобретении термин «вторые содержащие лекарственное средство мицеллы» относятся к мицеллам, содержащим ресвератрол. То есть вторые содержащие лекарственное средство мицеллы относятся к мицеллам, инкапсулирующим или содержащим ресвератрол.
В настоящем изобретении термин «куркуминоид» представляет собой общий термин для куркумина, деметоксикуркумина и бисдеметоксикуркумина.
В настоящем изобретении термин «катехины» представляет собой общий термин для обозначения эпигаллокатехина галлата, эпикатехина, эпикатехина галлата, эпигаллокатехина, галлокатехина галлата, галлокатехина, катехина галлата, катехина.
В настоящем изобретении термин «состояние без осадков», как применен в настоящем документе, относится к состоянию, в котором нет осадков, которые можно было бы наблюдать невооруженным глазом, то есть без помощи искусственных инструментов.
В настоящем изобретении фармацевтически приемлемый водный раствор представляет собой, по меньшей мере, одно из следующего: воду для инъекций, водный раствор для инъекций, физиологический раствор и другой фармацевтически приемлемый водный раствор или их комбинации.
В настоящем изобретении местный анестетик представляет собой, по меньшей мере, одно из следующего: амиды, сложные эфиры пара-аминобензойной кислоты, аминоэфиры и другие местные анестетики или их комбинации. Предпочтительно, один из амидов представляет собой, по меньшей мере, одно из следующего: дибукаин, лидокаин, мепивакаина HCl, бупивацина HCl, пиррокаина HCl, прилокаина HCl, дигаммакаин и оксетазаин или их комбинации. Предпочтительно, один из сложных эфиров пара-аминобензойной кислоты представляет собой, по меньшей мере, одно из следующего: бутакаин, диметокаин и тутокаин или их комбинацию. Предпочтительно, один из аминоэфиров представляет собой, по меньшей мере, одно из следующего: хинизокаин и прамокаин или их комбинацию.
В настоящем изобретении антиоксидант представляет собой, по меньшей мере, одно из следующего: бета-каротин, лютеин, ликопен, билирубин, витамин А, витамин С (аскорбиновой кислоты), витамин Е, мочевую кислоту, оксид азота, нитроксид, пируват, каталазу, супероксиддисмутазу, глутатионпероксидазу, N-ацетилцистеин, нарингенин и другие антиоксиданты или их комбинации.
В настоящем изобретении фармацевтическая композиция сохраняется в состоянии без осадков в течение не менее 24-х часов, если ее подвергают ускоренному испытанию на стабильность при 25°C ± 2°C, относительной влажности (RH) 60% ± 5% и при отсутствии прямого света.
Или фармацевтическая композиция сохраняется в состоянии без осадков в течение, по меньшей мере, 6 месяцев, если ее подвергают ускоренному испытанию на стабильность при 25°C ± 2°C, относительной влажности (RH) 60% ± 5% и при отсутствии прямого света.
В настоящем изобретении, если концентрация кремофора ЭЛП указана в процентах, то она представляет собой грамм кремофора ЭЛП, содержащегося в расчете на 100 мл раствора.
Настоящее изобретение обеспечивает применение фармацевтической композиции для получения композиции для подкожных инъекций для введения пациенту с избыточным весом или ожирением для снижения массы тела субъекта; фармацевтическая композиция включает:
фармацевтически приемлемый водный раствор;
множество содержащих лекарственное средство мицелл, которые равномерно распределены в фармацевтически приемлемом водном растворе; при этом каждая содержащая лекарственное средство мицелла представляет собой микроструктуру, образованную из фармацевтически приемлемого производного полиоксиэтиленового касторового масла, и значение гидрофильно-липофильного баланса (значение ГЛБ) производного полиоксиэтиленового касторового масла больше 10; и
куркуминоид или куркуминоиды, инкапсулированные в содержащие лекарственное средство мицеллы;
при этом общая концентрация куркуминоида или куркуминоидов, инкапсулированных в содержащие лекарственное средство мицеллы, равна от 0,2 до 120 мг/г.
Предпочтительно, фармацевтически приемлемый водный раствор дополнительно содержит ингредиент катехинов.
Предпочтительно, общая концентрация куркуминоида или куркуминоидов в содержащих лекарственное средство мицеллах равна от 0,4 до 167 мг/г; или, общая концентрация куркуминоида или куркуминоидов в содержащих лекарственное средство мицеллах равна от 0,5 до 111 мг/г; или, общая концентрация куркуминоида или куркуминоидов в данных содержащих лекарственное средство мицеллах равна от 2 до 91 мг/г.
Предпочтительно, концентрация ингредиента катехинов равна от 0,04 до 835 мг/г.
Предпочтительно, концентрация ингредиента катехинов равна от 0,15 до 733 мг/г.
Предпочтительно, ингредиент катехинов представляет собой, по меньшей мере, одно из следующего: эпигаллокатехина галлат, эпикатехин, эпикатехина галлат, эпигаллокатехин, галлокатехина галлат, галлокатехин, катехина галлат и катехин или их комбинации.
Предпочтительно, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в составе для подкожных инъекций равно от 50:1 до 1:20,
Предпочтительно, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в составе для подкожных инъекций равно от 30:1 до 1:10; или, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в фармацевтической композиции равно от 10:1 до 1:4; или, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в фармацевтической композиции равно от 7:1 до 1:4.
Предпочтительно, диаметр содержащих лекарственное средство мицелл равен от 3 до 50 нм.
Предпочтительно, диаметр содержащих лекарственное средство мицелл равен от 5 до 20 нм.
Предпочтительно, доза введения состава для подкожных инъекций была равна от 0,15 до 40 мг на килограмм для инъекции.
Предпочтительно, доза введения состава для подкожных инъекций была равна от 0,25 до 25 мг на килограмм для инъекции.
Предпочтительно, частота введения состава для подкожных инъекций в месте введения равна от 1 до 6 раз каждые от 1 до 90 дней.
Предпочтительно, один укол или более состава для подкожных инъекций вводят в месте введения на одно введение.
Предпочтительно, массовое отношение куркуминоида или куркуминоидов к производному полиоксиэтиленового касторового масла равно от 1:5 до 1:750,
Предпочтительно, массовое отношение куркуминоида или куркуминоидов к производному полиоксиэтиленового касторового масла равно от 1:20 до 1:150,
Предпочтительно, производное полиоксиэтиленового касторового масла представляет собой, по меньшей мере, одно из следующего: коллифор ELP (также известный, как кремофор ELP), кремофор RH 40, и другие производные полиоксиэтиленового касторового масла или их комбинации.
Предпочтительно, фармацевтическая композиция дополнительно содержит, по меньшей мере, одно из следующего: сорастворитель, суспендирующее средство и вспомогательное вещество в масляной фазе или их комбинация.
Предпочтительно, микроструктура образована из производного полиоксиэтиленового касторового масла и, по меньшей мере, одно из следующего: вспомогательное вещество в масляной фазе и сорастворитель.
Предпочтительно, куркуминоид представляет собой куркумин.
Настоящее изобретение дополнительно обеспечивает применение фармацевтической композиции для получения состава для подкожных инъекций для введения субъекту с избыточным весом или ожирением для снижения массы тела субъекта; фармацевтическая композиция включает:
множество первых содержащих лекарственное средство мицелл, и множество вторых содержащих лекарственное средство мицелл, в которых каждые из первых содержащих лекарственное средство мицелл представляют собой микроструктуру, которая сформирована из фармацевтически приемлемого производного полиоксиэтиленового касторового масла, и значение гидрофильно-липофильного баланса (значение ГЛБ) производного полиоксиэтиленового касторового масла было больше 10;
куркуминоид или куркуминоиды были инкапсулированы в первые содержащие лекарственное средство мицеллы; и
ресвератрол был инкапсулирован во вторые содержащие лекарственное средство мицеллы; в которых общая концентрация куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы была равна от 0,2 до 167 мг/г,
при этом фармацевтически приемлемое производное полиоксиэтиленового касторового масла и куркуминоид или куркуминоиды совместно формируют множество содержащих куркуминоид мицелл, и фармацевтически приемлемое поверхностно-активное вещество и ресвератрол совместно формируют множество содержащих ресвератрол мицелл.
Предпочтительно, общая концентрация ресвератрола, инкапсулированного во вторые содержащие лекарственное средство мицеллы была равна от 0,2 до 733 мг/г.
Предпочтительно, сумма общей концентрации куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы, и общей концентрации ресвератрола, инкапсулированного во вторые содержащие лекарственное средство мицеллы, была равна от 0,4 до 900 мг/г.
Предпочтительно, отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы, к общей массе ресвератрола, инкапсулированного во вторые содержащие лекарственное средство мицеллы, было равно от 50:1 до 1:30.
Предпочтительно, отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы, к общей массе ресвератрола, инкапсулированного во вторые содержащие лекарственное средство мицеллы, было равно от 30:1 до 1:10.
Предпочтительно, отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы, к общей массе ресвератрола, инкапсулированного во вторые содержащие лекарственное средство мицеллы, было равно от 20:1 до 1:20.
Предпочтительно, отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы, к общей массе ресвератрола, инкапсулированного во вторые содержащие лекарственное средство мицеллы, было равно от 20:1 до 1:8.
Предпочтительно, дозировка введения состава для подкожных инъекций была равна от 0,15 до 40 мг на килограмм для инъекции.
Предпочтительно, дозировка введения состава для подкожных инъекций была равна от 0,25 до 25 мг на килограмм для инъекции.
Предпочтительно, дозировка введения состава для подкожных инъекций была равна от 0,4 до 25 мг на килограмм для инъекции.
Предпочтительно, дозировка введения состава для подкожных инъекций была равна от 0,5 до 20 мг на килограмм для инъекции.
Предпочтительно, дозировка введения состава для подкожных инъекций была равна от 0,02 до 20 мг на см2 для инъекции.
Предпочтительно, дозировка введения состава для подкожных инъекций была равна от 0,04 до 16 мг на см2 для инъекции.
Предпочтительно, частота введения состава для подкожных инъекций была равна от 1 до 12 раз в месте введения для каждого от 1 до 90 дней.
Предпочтительно, частота введения состава для подкожных инъекций была равна от 1 до 6 раз в месте введения для каждого от 1 до 90 дней.
Предпочтительно, частота введения состава для подкожных инъекций была равна от 1 до 6 раз в месте введения для каждого от 1 до 60 дней.
Предпочтительно, отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы, к общей массе производного полиоксиэтиленового касторового масла было равно от 1:5 до 1:750.
Предпочтительно, фармацевтическая композиция дополнительно содержит, по меньшей мере, одно из следующего: сорастворитель, суспендирующее средство и вспомогательное вещество в масляной фазе, или их комбинацию.
Предпочтительно, микроструктура была образована из производного полиоксиэтиленового касторового масла и, по меньшей мере, одного из следующего: вспомогательное вещество в масляной фазе и сорастворитель.
Предпочтительно, каждая из вторых содержащих лекарственное средство мицелл представляет собой вторую микроструктуру, образованную из фармацевтически приемлемого второго производного полиоксиэтиленового касторового масла, и значение гидрофильно-липофильного баланса (значение ГЛБ) второго производного полиоксиэтиленового касторового масла было больше 10.
Предпочтительно, производное полиоксиэтиленового касторового масла представляет собой, по меньшей мере, одно из следующего: кремофор ELP, кремофор RH 40 и другие производные полиоксиэтиленового касторового масла или их комбинацию; или второе производное полиоксиэтиленового касторового масла представляет собой, по меньшей мере, одно из следующего: коллифор ELP (также известный, как кремофор ELP), кремофор RH 40 и другие производные полиоксиэтиленового касторового масла или их комбинацию.
Предпочтительно, куркуминоид представляет собой куркумин.
Предпочтительно, фармацевтическая композиция дополнительно содержит сорастворитель для повышения растворимости лекарственных средств.
Предпочтительно, сорастворитель представляет собой, по меньшей мере, одно из следующего: полиэтиленгликоль, пропиленгликоль, этанол и другие сорастворители или их комбинацию.
Предпочтительно, полиэтиленгликоль представляет собой, по меньшей мере, одно из следующего: PEG 200, PEG 400, PEG 600 и другие полиэтиленгликоли или их комбинацию.
Предпочтительно, фармацевтическая композиция дополнительно содержит суспендирующее средство для уменьшения скорости оседания лекарственных средств или мицелл.
Предпочтительно, суспендирующее средство представляет собой, по меньшей мере, одно из следующего: альгинат натрия, глицерин, карбоксиметилцеллюлозу натрия, манит и другие суспендирующие средства или их комбинацию.
Предпочтительно, фармацевтическая композиция дополнительно содержит в масляной фазе вспомогательное вещество для увеличения стабильности фармацевтической композиции и растворимости лекарственных средств.
Предпочтительно, вспомогательное вещество в масляной фазе представляет собой, по меньшей мере, одно из следующего: ненасыщенные жирные кислоты, глицерин, триглицериды и другие вспомогательные вещества в масляной фазе или их комбинацию.
Предпочтительно, ненасыщенные жирные кислоты включают, по меньшей мере, одно из следующего: олеиновая кислота, касторовое масло, кунжутное масло, хлопковое масло, соевое масло, сафлоровое масло, кукурузное масло и другие ненасыщенные жирные кислоты или их комбинацию.
Предпочтительно, триглицериды включают, по меньшей мере, одно из следующего: триглицериды со средней длиной цепи и другие триглицериды, или их комбинацию.
Предпочтительно, фармацевтически приемлемый водный раствор включает местный анестетик.
Предпочтительно, фармацевтически приемлемый водный раствор включает антиоксидант.
Настоящее изобретение дополнительно обеспечивает способ снижения массы тела субъекта с избыточным весом или ожирением, включающий введение композиции для подкожных инъекций субъекту с избыточным весом или ожирением, в котором состав для подкожных инъекций содержит:
фармацевтически приемлемый водный раствор;
множество содержащих лекарственное средство мицелл, которые равномерно распределены в фармацевтически приемлемом водном растворе, при этом каждая содержащая лекарственное средство мицелла представляет собой микроструктуру, образованную из фармацевтически приемлемого производного полиоксиэтиленового касторового масла, и значение гидрофильно-липофильного баланса (значение ГЛБ) производного полиоксиэтиленового касторового масла было больше чем 10; и
куркуминоид или куркуминоиды, инкапсулированные в содержащие лекарственное средство мицеллы;
при этом общая концентрация куркуминоида или куркуминоидов, инкапсулированных в содержащие лекарственное средство мицеллы, равна от 0,2 до 167 мг/г.
Предпочтительно, фармацевтически приемлемый водный раствор дополнительно содержит ингредиент катехинов.
Предпочтительно, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в составе для подкожных инъекций равно от 50:1 до 1:20.
Предпочтительно, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в составе композиции для подкожных инъекций равно от 30:1 до 1:10; или, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в составе для подкожных инъекций равно от 10:1 до 1:4; или, массовое отношение куркуминоида или куркуминоидов к ингредиенту катехинов в составе для подкожных инъекций равно от 7:1 до 1:4.
Настоящее изобретение дополнительно обеспечивает способ снижения массы тела субъекта с избыточным весом или ожирением, включающий введение состава для подкожной инъекции субъекту с избыточным весом или ожирением, в котором композиция для подкожных инъекций включает:
множество первых содержащих лекарственное средство мицелл и множество вторых содержащих лекарственное средство мицелл, при этом каждая их первых содержащих лекарственное средство мицелл представляет собой микроструктуру, образованную из фармацевтически приемлемого производного полиоксиэтиленового касторового масла, и значение гидрофильно-липофильного баланса (значение ГЛБ) производного полиоксиэтиленового касторового масла было больше 10;
куркуминоид или куркуминоиды были инкапсулированы в первые содержащие лекарственное средство мицеллы; и
ресвератрол был инкапсулирован во вторые содержащие лекарственное средство мицеллы;
при этом общая концентрация куркуминоида или куркуминоидов, инкапсулированных в первые содержащие лекарственное средство мицеллы, была равна от 0,2 до 167 мг/г.
Краткое описание чертежей
Фигура 1A: Гистограмма, демонстрирующая эффект комплексной фармацевтической композиции куркумин-экстракт зеленого чая, введенной различными путями, на относительный общий прирост массы крыс.
Фигура 1B: Гистограмма, демонстрирующая эффект комплексной фармацевтической композиции куркумин-экстракт зеленого чая, введенной различными путями, на относительную массу висцерального жира крыс.
Фигура 2A: Гистограмма, демонстрирующая эффект отношения куркумина к экстракту зеленого чая на относительный общий прирост массы крыс.
Фигура 2B: Гистограмма, демонстрирующая эффект отношения куркумина к экстракту зеленого чая на относительную массу висцерального жира крыс.
Фигура 3A: Гистограмма, демонстрирующая эффект дозировки комплексной фармацевтической композиции куркумин-экстракт зеленого чая на относительный общий прирост массы крыс.
Фигура 3B: Гистограмма, демонстрирующая эффект дозировки комплексной фармацевтической композиции куркумин-экстракт зеленого чая на относительную массу висцерального жира крыс.
Фигура 4A: Гистограмма, демонстрирующая эффект частоты введения комплексной фармацевтической композиции куркумин-экстракт зеленого чая на общий прирост массы крыс.
Фигура 4B: Гистограмма, демонстрирующая эффект частоты введения комплексной фармацевтической композиции куркумин-экстракт зеленого чая на относительную массу висцерального жира крыс.
Фигура 5A: Гистограмма, демонстрирующая эффект отношения куркумина к ресвератролу на относительный общий прирост массы крыс.
Фигура 5B: Гистограмма, демонстрирующая эффект отношения куркумина к ресвератролу на относительный висцеральный жир крыс.
Фигура 6A: Гистограмма, демонстрирующая эффект дозировки комплексной фармацевтической композиции куркумин-ресвератрол на относительный общий прирост массы крыс.
Фигура 6B: Гистограмма, демонстрирующая эффект дозировки комплексной фармацевтической композиции куркумин-ресвератрол на относительную массу висцерального жира крыс.
Фигура 7A: Гистограмма, демонстрирующая эффект частоты введения комплексной фармацевтической композиции куркумин-ресвератрол на относительный общий прирост массы крыс.
Фигура 7B: Гистограмма, демонстрирующая эффект частоты введения комплексной фармацевтической композиции куркумин-ресвератрол на относительную массу висцерального жира крыс.
Осуществление изобретения
Ввиду недостатка предшествующего уровня техники изобретатель, согласно результатам исследований и многолетнему опыту, считает, что можно создать разновидность фармацевтической композиции, содержащей низкие дозы куркуминоида, которая сможет снизить массу тела и висцерального жира субъекта и будет обладать преимуществами высокой стабильности, высокой биодоступности для жировой ткани, низких побочных эффектов и длительного высвобождения.
Ниже приведены подробные описания воплощений настоящего изобретения, и технология и особенности настоящего изобретения. Однако воплощения не предназначены для ограничения настоящее изобретение, и, для специалиста в данной области техники любое изменение или модификация, которые не выходят за рамки сущностей, раскрытых в настоящем документе, должны входить в объем формулы изобретения настоящего изобретения.
В описании следующих воплощений, термин «экстракт зеленого чая» означает смесь, содержащую, по меньшей мере, 45% (% масс.) галлата эпигаллокатехина (EGCG) или смесь любого типа, содержащую, по меньшей мере, 90% (% масс.) катехинов.
Эксперимент 1: Влияние низких доз фармацевтических композиций, вводимых различными путями, на количество висцерального жира и массу тела крыс
Получение жидкости для перорального применения куркумин-экстракт зеленого чая: Соответствующее количество куркумина и экстракта зеленого чая добавляли к соответствующему количеству стерильной воды, очищенной обратным осмосом, и хорошо перемешивали, и получали жидкость для перорального применения куркумин-экстракт зеленого чая, в котором общая концентрация куркумина и экстракта зеленого чая была равна100 мг/мл, и массовое отношение куркумина к экстракту зеленого чая было равно 4:1.
Получение комплексной фармацевтической композиции куркумин-экстракт зеленого чая: 0,8 г куркумина и 150-200 мл дихлорметана смешивали, и перемешивали при 150-500 rpm при комнатной температуре до тех пор, пока куркумин полностью не растворялся. Добавляли 30 г коллифора ELP (также известного, как ELP) и хорошо перемешивали при 100-300 rpm для испарения дихлорметана. После того, как дихлорметан полностью улетучивался, медленно добавляли физиологический раствор для инъекции для получения общего объема, равного 200 мл, в котором физиологический раствор для инъекции включал 0,2 г экстракта зеленого чая. Раствор хорошо перемешивали для получения комплексной фармацевтической композиции куркумин-экстракт зеленого чая, включавшей ELP. Комплексная фармацевтическая композиция куркумин-экстракт зеленого чая, включавшая ELP, включала содержавшие лекарственное средство мицеллы, общая концентрация куркумина и экстракта зеленого чая была равна 5 мг/мл, массовое отношение куркумина к экстракту зеленого чая было равно 4:1, и концентрация коллифора ELP была равна примерно 15%.
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 24 крысы получали нормальную диету (продукт компании «Research Diets», Inc.) в течение недели, чтобы вес тела крыс достиг 175-200 г, затем крысы получали диету с высоким содержанием жиров («Research Diets», Inc.; #D12492) в течение 14-ти дней, чтобы ввести их в режим ожирения животных, что позволило увеличить вес их тела до 400-450 г, и, после этого, крыс случайным образом распределяли на пяти группам, то есть на контрольную группу, группу перорального введения (группу PO), группу внутрибрюшинных инъекций (группу IP), группу подкожных инъекций (группу SC) и группу подкожных инъекций в жировой слой (группу IA), соответственно; статистической разницы в массе тела между группами не было. При этом контрольная группа включала 8 крыс, и каждая из группы перорального введения, группы внутрибрюшинного введения, группы подкожной инъекции и группы подкожных инъекций в жировой слой включала по 4 крысы. Массу тела каждой крысы регистрировали перед испытанием и обозначали как «предэкспериментальная масса тела» каждой крысы.
Группа перорального введения (PO-группа): Жидкости для перорального применения куркумин-экстракт зеленого чая вводили крысе через оральный зонд со дня 1 эксперимента, один раз в день, последовательно в течение 14-ти дней, в дозировке, равной 2 мл на килограмм массы тела (2 мл/кг) на одно введение через оральный зонд, допуская, что дозировка введения, которую следует вводить каждый раз, была равна 160 мг куркумина и 40 мг экстракта зеленого чая на килограмм массы тела (общая концентрация куркумина и экстракта зеленого чая, введенная на килограмм массы тела, была равна 2 мл/кг × 100 мг/мл = 200 мг/кг, при этом массовое отношение куркумина к экстракту зеленого чая было равно 4:1, и соответственно, куркумин, введенный на килограмм массы тела, был равен 200 мг/кг ÷ 5 × 4 = 160 мг, и экстракт зеленого чая, введенный на килограмм массы тела, был равен 200 мг/кг ÷ 5 × 1 = 40 мг).
Группа внутрибрюшинных инъекций (IP-группа): Комплексную фармацевтическую композицию куркумин-экстракт зеленого чая вводили крысе с помощью внутрибрюшинной инъекции, и места введения находились на правой части живота крыс. Одно введение осуществляли на день 1, день 3, день 5, день 7, день 9, день 11, в общей сложности 6 введений, с дозировкой 4 мл на килограмм массы тела (4 мл/кг) для инъекции на одно введение, допуская, что дозировка введения, которую следует вводить каждый раз, была равна 16 мг куркумина и 4 мг экстракта зеленого чая на килограмм массы тела (общая концентрация куркумина и экстракта зеленого чая, введенная на килограмм массы тела была равна 4 мл/кг × 5 мг/мл = 20 мг/кг, при этом массовое отношение куркумина к экстракту зеленого чая было равно 4:1, и, следовательно, куркумин, введенный на килограмм, был равен 20 мг/кг ÷ 5 × 4 = 16 мг, и экстракт зеленого чая, введенный на килограмм массы тела, был равен 20 мг/кг ÷ 5 × 1 = 4 мг).
Группа подкожных инъекций (SC-группа): Комплексную фармацевтическую композицию куркумин-экстракт зеленого чая вводили крысе с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одно введение осуществляли на день 1, день 3, день 5, день 7, день 9, и день 11, в общей сложности 6 введений, с дозировкой 4 мл на килограмм массы тела (4 мл/кг) для инъекции на одно введение, допуская, что дозировка введения, которую следует вводить каждый раз, была равна 16 мг куркумина и 4 мг экстракта зеленого чая на килограмм массы тела.
Группа подкожных инъекций в жировой слой (IA-группа): Комплексную фармацевтическую композицию куркумин-экстракт зеленого чая вводили крысе с помощью подкожной инъекции в жировой слой, и места введения находились в двусторонних нижних паховых жировых подушках крыс. Одно введение осуществляли на день 1, день 3, день 5, день 7, день 9, день 11, в общей сложности 6 введений, с дозировкой 4 мл на килограмм массы тела (4 мл/кг) для инъекции на одно введение, допуская, что дозировка введения, которую следует вводить каждый раз, была равна 16 мг куркумина и 4 мг экстракта зеленого чая на килограмм массы тела.
Контрольная группа: Контрольную группу разделяли на контрольную группу с пероральным введением и контрольную группу с введением в виде инъекции, с 4 крысами в каждой группе. Стерильную, очищенную с помощью обратного осмоса воду вводили крысе в контрольной группе с пероральным введением через оральный зонд, один раз в день через оральный зонд, и с дозировкой для перорального введения через зонд, равной 2 мл на килограмм массы тела (2 мл/кг) через оральный зонд. Введение через оральный зонд выполняли последовательно в течение 14-ти дней. Физиологический раствор для инъекции вводили крысе в контрольной группой с введением в виде инъекции с помощью инъекции, и одно введение осуществляли на день 1, день 3, день 5, день 7, день 9 и день 11 в эксперименте, в общей сложности 6 введений. Дозировка для каждой инъекции была равна 4 мл на килограмм массы тела (4 мл/кг). Данные для контрольной группы с пероральным введением и контрольной группы с введением в виде инъекции объединяли в контрольную группу, поскольку результаты показали, что не было существенной разницы в данных между двумя группами.
Крыс кормили диетой с высоким содержанием жиров в течение всего эксперимента. Изменения их массы регистрировали ежедневно, а потребление пищи и воды регистрировало еженедельно. Эксперимент длился 20 дней, и крыс умерщвляли с помощью CO2 на день 21. И, массу тела каждой крысы регистрировали и обозначали как «пост-экспериментальная масса тела» каждой крысы.
«Общий прирост массы» каждой крысы получали путем вычитания ее «пре-экспериментальной масса тела» из ее «пост-экспериментальной массы тела». «Относительный общий прирост массы» получали путем деления общего прироста массы крыс в каждой группе на общий прирост массы крыс в контрольной группе.
Эпидидимальный жир, перинефральный жир и брыжеечный жир крыс иссекали и взвешивали, и их сумма представляла собой массу висцерального жира. Массу висцерального жира каждой группы делили на массу висцерального жира контрольной группы и получали «относительная массу висцерального жира».
Данные представляли как среднее ± SD и анализировали с помощью одностороннего ANOVA. Статистические результаты были показаны в виде букв. Разные буквенные символы указывают на статистически значимое различие (р <0,05), а идентичные буквенные символы указывают на отсутствие статистически значимого различия (р> 0,05).
Пожалуйста, обратитесь к фигуре 1A и фигуре 1B. Фигура 1A представляет собой гистограмму, демонстрирующую эффект комплексной фармацевтической композиции куркумин-экстракт зеленого чая, введенной различными путями, на относительный общий прирост массы крыс. Фигура 1B представляет собой гистограмму, демонстрирующую эффект комплексной фармацевтической композиции куркумин-экстракт зеленого чая, введенной различными путями, на относительную массу висцерального жира крыс.
Результаты, приведенные на фигуре 1A, показывают, что относительный общий прирост массы крыс в контрольной группе был равен 100,1±9,4%, относительный общий прирост массы крыс в группе перорального введения был равен 96,2±12,4%, относительный общий прирост массы крыс в группе внутрибрюшинных инъекций был равен 97,8±10,1%, относительный общий прирост массы крыс в группе подкожных инъекций в жировой слой был равен 80,8±6,5%, относительный общий прирост массы крыс в группе подкожных инъекций был равен 72,9±10,6%. Среди них не было никаких существенных различий в относительном общем приросте массы между крысами в группе перорального введения и крысами в контрольной группе, что указывает на то, что масса тела крыс не может быть уменьшена путем введения комплексной фармацевтической композиции куркумин-экстракт зеленого чая с помощью перорального введения; не было никаких существенных различий в относительном общем приросте массы между крысами в группе внутрибрюшинных инъекций и крысами в контрольной группе, что указывает на то, что масса тела крыс также не может быть уменьшена путем введения комплексной фармацевтической композиции куркумин-экстракт зеленого чая с помощью внутрибрюшинной инъекции; относительный общий прирост массы крыс в группе подкожных инъекций в жировой слой достоверно отличался (р <0,05) от этого показателя в контрольной группе, и относительный общий прирост массы крыс в группе подкожных инъекций в жировой слой был снижен на 19,3%; относительный общий прирост массы крыс в группе подкожных инъекций достоверно отличался (р <0,05) от этого показателя в контрольной группе, и относительный общий прирост массы крыс в группе подкожных инъекций был снижен на 27,2%. Результаты показывают, что при введении низкой дозы комплексной фармацевтической композиции куркумин-экстракт зеленого чая с помощью подкожной инъекции в жировой слой или подкожной инъекции можно эффективно снижать массу тела крыс с избыточным весом или ожирением, и эффект введения с помощью подкожной инъекции был самым лучшим.
Результаты, приведенные на фигуре 1B, показывают, что относительная масса висцерального жира крыс в контрольной группе была равна 100,0±18,8 %, относительная масса висцерального жира крыс в группе перорального введения была равна 88,3±5,9%, относительная масса висцерального жира крыс в группе внутрибрюшинных инъекций была равна 79,7±10,1%, относительная масса висцерального жира крыс в группе подкожных инъекций в жировой слой была равна 71,1±11,0%, относительная масса висцерального жира крыс в группе подкожных инъекций была равна 56,5±13,1%. Среди них, не было никаких существенных различий в количестве относительного висцерального жира между крысами в контрольной группе и крысами в группе перорального введения, что указывает на то, что висцеральный жир крыс не может быть уменьшен путем введения комплексной фармацевтической композиции куркумин-экстракт зеленого чая с помощью перорального введения; относительная масса висцерального жира крыс в группе внутрибрюшинных инъекций достоверно отличался (р <0,05) от этого показателя в контрольной группе, однако, относительная масса висцерального жира крыс в группе внутрибрюшинных инъекций была снижена лишь на 20,3%; относительная масса висцерального жира крыс в группе подкожных инъекций в жировой слой достоверно отличалась (р <0,05) от этого показателя в контрольной группе, и относительная масса висцерального жира крыс в группе подкожных инъекций в жировой слой была снижена на 28,9%; и относительная масса висцерального жира крыс в группе подкожных инъекций достоверно отличалась (р <0,05) от этого показателя в контрольной группе, и относительная масса висцерального жира крыс в группе подкожных инъекций была снижена на 43,5%. Результаты показывают, что относительная масса висцерального жира крыс с избыточным весом или ожирением может быть снижена введением низких доз комплексной фармацевтической композиции куркумин-экстракт зеленого чая с помощью внутрибрюшинной инъекции, подкожной инъекции в жировой слой или подкожной инъекции, при этом эффект введения с помощью подкожной инъекции в жировой слой и введения с помощью подкожной инъекции был предпочтительным, и уменьшение жира с помощью подкожной инъекции было еще более значительным, чем с помощью внутрибрюшинной инъекции (p<0,05).
Традиционно, говоря в общем, лекарственные препараты могут достигать всех частей организма крыс быстрее с помощью внутрибрюшинной инъекции, чем с помощью подкожной инъекции, для дальнейшего достижения эффекта, например, снижения массы или снижения висцерального жира, во всем организме. Однако результаты настоящего изобретения показывают, что, по сравнению с внутрибрюшинной инъекцией, введением низких доз фармацевтической композиции настоящего изобретения крысам с избыточным весом или ожирением с помощью подкожной инъекции можно достоверно (p<0,05), достичь более заметного эффекта снижения массы и снижения висцерального жира, то есть, введение низкой дозы фармацевтической композиции настоящего изобретения с помощью подкожной инъекции имеет непредвиденные эффекты.
Эксперимент 2: Влияние комплексной фармацевтической композиции куркумин-экстракт зеленого чая на разные группы
Комплексную фармацевтическую композицию куркумин-экстракт зеленого чая вводили по отдельности крысам, а именно нормальным и страдающим ожирением крысам, для оценки эффекта комплексной фармацевтической композиции куркумин-зеленый чай на разные группы крыс.
Получение комплексной фармацевтической композиции куркумин-экстракт зеленого чая: 0,6 г куркумина и от 150 до 200 мл дихлорметана смешивали, и перемешивали при 150-500 rpm при комнатной температуре до полного растворения куркумина. Добавляли 30 г коллифора ELP (также известного, как ELP) и хорошо перемешивали при 100-300 rpm для испарения дихлорметана. После того, как дихлорметан улетучивался полностью, медленно добавляли физиологический раствор для инъекции для получения общего объема, равного 200 мл, при этом физиологический раствор для инъекции включал 0,4 г экстракта зеленого чая. Раствор хорошо перемешивали для получения комплексной фармацевтической композиции куркумин-экстракт зеленого чая. Комплексная фармацевтическая композиция куркумин-экстракт зеленого чая, включавшая ELP, включала содержавшие лекарственное средство мицеллы, общая концентрация куркумина и экстракта зеленого чая была равна 5 мг/мл, массовое отношение куркумина к экстракту зеленого чая было 3:2, и концентрация коллифора ELP была равна примерно 15%.
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 16 крыс содержали на нормальной диете в течение недели до достижения массы тела крыс 175-200 г. Крыс разделяли на 4 группы, то есть, контрольная группа с нормальной диетой, контрольная группа с диетой с высоким содержанием жиров, группа с нормальной диетой-комплексной фармацевтической композицией с экстрактом зеленого чая, и группа с диетой с высоким содержанием жиров-комплексной фармацевтической композицией с экстрактом зеленого чая. Затем, крыс в контрольной группе с нормальной диетой и в группе с нормальной диетой-комплексной фармацевтической композицией экстракта зеленого чая непрерывно кормили нормальной диетой в течение 14-ти дней, и, в то же время, крыс контрольной группы с диетой с высоким содержанием жиров и с диетой с высоким содержанием жиров-комплексной фармацевтической композицией экстракта зеленого чая содержали на диете с высоким содержанием жиров в течение 14-ти дней, чтобы ввести крыс контрольной группы с диетой с высоким содержанием жиров и группы с диетой с высоким содержанием жиров-комплексной фармацевтической композицией экстракта зеленого чая в режим ожирения животных, и давали массе их тела увеличиться до 400-450 г. После этого, вводили подкожные инъекции следующим образом.
В контрольной группе с нормальной диетой и в контрольной группе с диетой с высоким содержанием жиров: физиологический раствор крысе вводили с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одно введение осуществляли на день 1, день 3, день 5, день 7, день 9, и день 11, в общей сложности 6 введений, и дозировка для инъекции была равна 4 мл на килограмм массы тела (4 мл/кг).
В группе с нормальной диетой-комплексной фармацевтической композицией экстракта зеленого чая и в группе диетой с высоким содержанием жиров-комплексной фармацевтической композицией экстракта зеленого чая: комплексную фармацевтическую композицию куркумин-экстракт зеленого чая крысе вводили с помощью подкожной инъекции, места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одно введение осуществляли на день 1, день 3, день 5, день 7, день 9 и день 11, в общей сложности 6 введений, и дозировка для инъекции была равна 4 мл на килограмм массы тела (4 мл/кг), допуская, что дозировка введения, которую следует вводить каждый раз, была равна 12 мг куркумина и 8 мг ресвератрола на килограмм массы тела. (Общая концентрация куркумина к экстракту зеленого чая, введенного на килограмм массы тела, была равна 4 мл/кг × 5 мг/мл = 20 мг/кг, при этом массовое отношение куркумина к экстракту зеленого чая было равно 3:2; и, следовательно, куркумин, введенный на килограмм массы тела был равен 20 мг/кг ÷ 5 × 3 = 12 мг, и экстракт зеленого чая, введенный на килограмм массы тела, был равен 20 мг/кг ÷ 5 × 2 = 8 мг).
Нормальную диету последовательно давали крысам в контрольной группе с нормальной диетой и с нормальной диетой-комплексной фармацевтической композицией экстракта зеленого чая в течение эксперимента, и диету с высоким содержанием жиров давали крысам контрольной группы с диетой с высоким содержанием жиров и группы с диетой с высоким содержанием жиров-комплексной фармацевтической композицией экстракта зеленого чая. Эксперимент проводили в общей сложности 20 дней, и крыс умерщвляли с помощью CO2 на день 21.
Экспериментальные результаты показали, что по сравнению с контрольной группой с нормальной диетой, как относительный общий прирост массы, так и относительная масса висцерального жира крыс в группе с нормальной диетой-комплексной фармацевтической композицией экстракта зеленого чая достоверно не снижались, что указывает на то, что фармацевтическая композиция настоящего изобретения не может снижать массу тела нормальных крыс, и не может снижать массу висцерального жира у нормальных крыс. По сравнению с контрольной группой с диетой с высоким содержанием жиров, как относительный общий прирост массы, так и относительная масса висцерального жира крыс в группе с диетой с высоким содержанием жиров-комплексной фармацевтической композицией экстракта зеленого чая достоверно снижались (p<0,05), что указывает на то, что фармацевтическая композиция настоящего изобретения может снижать массу тела крыс с избыточным весом или ожирением, и также может снижать массу висцерального жира крыс с избыточным весом или ожирением.
Приведенные выше результаты показывают, что фармацевтические композиции настоящего изобретения имеют эффект на массу тела и снижение висцерального жира только на определенные группы, то есть, они могут воздействовать на массу тела и снижение висцерального жира только на группы с избыточным весом или страдающих ожирением.
Эксперимент 3: Получение фармацевтических композиций настоящего изобретения
Эксперимент 3-1: Получение простой фармацевтической композиции с куркуминоидом:
(a) первую навеску куркуминоида или куркуминоидов и растворитель смешивали, и перемешивали при 150-500 rpm при комнатной температуре до полного растворения куркумина;
(b) Вторую навеску фармацевтически приемлемого поверхностно-активного вещества добавляли, и хорошо перемешивали при 100-300 rpm для испарения растворителя, при этом значение гидрофильно-липофильного баланса (значение ГЛБ) поверхностно-активного вещества было больше чем 10; и
(c) После полного испарения растворителя, третью навеску фармацевтически приемлемого водного раствора медленно добавляли для получения содержавших лекарственное средство мицелл; и
(d) Смесь фильтровали через 0,2 мкм фильтрующую мембрану, и фильтрат, включавший содержащие лекарственное средство мицеллы, хранили в темноте и холодильнике;
При этом на стадии (c), содержащая лекарственное средство мицелла представляла собой микроструктуру, образованную из поверхностно-активного вещества, и куркуминоид или куркуминоиды был/были инкапсулированы в содержащую лекарственное средство мицеллу; и третья навеска была больше чем или равна 0 г.
Предпочтительно, рабочая процедура стадии (с) представляла собой следующее: после полного испарения растворителя, медленно добавляли третью навеску фармацевтически приемлемого водного раствора, и хорошо перемешивали для формирования содержащих лекарственное средство мицелл.
Предпочтительно, на стадии (a), точка кипения растворителя была ниже, чем у чистой воды.
Предпочтительно, на стадии (a), растворитель представлял собой гидрофильный растворитель.
Предпочтительно, гидрофильный растворитель представляет собой, по меньшей мере, одно из следующего: метанол, этанол, ацетон и другие гидрофильные растворители, или их комбинацию.
Предпочтительно, растворитель на стадии (a) представлял собой липофильный (гидрофобный) растворитель.
Предпочтительно, липофильный (гидрофобный) растворитель представляет собой, по меньшей мере, одно из следующего: эфир, бензол, хлороформ, этилацетат, дихлорметан, гексан и другие липофильные (гидрофобные) растворители, или их комбинацию.
Предпочтительно, на стадии (b), поверхностно-активное вещество представляло собой неионное поверхностно-активное вещество.
Предпочтительно, неионное поверхностно-активное вещество представляло собой, по меньшей мере, одно из следующего: полисорбат 80 (Твин 80), 2-гидроксиэтил-12-гидроксиоктадеканоат (солутол HS 15), производные полиоксиэтиленового касторового масла и другие неионное поверхностно-активные вещества, или их комбинацию.
Предпочтительно, производное полиоксиэтиленового касторового масла представляло собой, по меньшей мере, одно из следующего: коллифор ELP (также известный, как кремофор ELP), кремофор RH 40, и другие производные полиоксиэтиленового касторового масла, или их комбинацию.
Предпочтительно, на стадиях (a) и (b), массовое отношение куркуминоида или куркуминоидов первой навески к поверхностно-активному веществу второй навески было равно от 1:5 до 1:500.
Предпочтительно, на стадиях (a) и (b), массовое отношение куркумина первой навески к поверхностно-активному веществу второй навески было равно от 1:20 до 1:150,
Предпочтительно, на стадиях (a) и (c), массовое отношение куркуминоида или куркуминоидов первой навески фармацевтически приемлемому водному раствору третьей навески было равно от 1:400 до 3:50.
Предпочтительно, на стадии (c), фармацевтически приемлемый водный раствор представлял собой воду для инъекции, водный раствор для инъекции или нормальный физиологический раствор.
Предпочтительно, на стадии (c), фармацевтически приемлемый водный раствор включал местный анестетик.
Предпочтительно, на стадии (c), фармацевтически приемлемый водный раствор включал антиоксидант.
Эксперимент 3-2: Получение комплексной фармацевтической композиции куркуминоид - другое липофильное лекарственное средство.
Настоящее изобретение обеспечивает первый способ получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство, и комплексная фармацевтическая композиция куркуминоид-другое липофильное лекарственное средство включает содержащие лекарственное средство мицеллы и содержащие второе липофильное лекарственное средство мицеллы. Процедура первого получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство была следующей:
(A) Стадии получения мицеллярного субблока, содержащего лекарственное средство, для приготовления мицеллярного субблока, содержащего лекарственное средство;
(B) Стадии получения содержащего второе липофильное лекарственное средство мицеллярного субблока, для получения мицеллярного субблока, содержащего второе липофильное лекарственное средство; и
(C) Смешивание мицеллярного субблока, содержащего лекарственное средство, с мицеллярным субблоком, содержащим второе липофильное лекарственное средство, для получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство;
при этом стадия (A) получения мицеллярного субблока, содержащего лекарственное средство, включает следующие стадии от (a2) до (d2):
(a2) Куркуминоид или куркуминоиды и первый растворитель смешивали, и перемешивали при 150-500 rpm при комнатной температуре до полного растворения куркуминоида или куркуминоидов;
(b2) Фармацевтически приемлемое первое поверхностно-активное вещество добавляли, и хорошо перемешивали при 100-300 rpm для испарения первого растворителя, при этом значение гидрофильно-липофильного баланса (значение ГЛБ) первого поверхностно-активного вещества было больше чем 10;
(c2) После полного испарения первого растворителя, получали содержащие лекарственное средство мицеллы; и
(d2) Смесь фильтровали через 0,2 мкм фильтрующую мембрану, и фильтрат представлял собой мицеллярный субблок, содержавший лекарственное средство, включавший содержащие лекарственное средство мицеллы;
и, стадия (B) для получения мицеллярного субблока, содержавшего второе липофильное лекарственное средство, включала следующие стадии от (a3) до (d3):
(a3) Второе липофильное лекарственное средство и второй растворитель смешивали, и перемешивали при 200-500 rpm при комнатной температуре до полного растворения второго липофильного лекарственного средства;
(b3) Фармацевтически приемлемое второе поверхностно-активное вещество добавляли, и хорошо перемешивали при 100-300 rpm для испарения второго растворителя, при этом значение гидрофильно-липофильного баланса (значение ГЛБ) второго поверхностно-активного вещества было больше чем 10;
(c3) После полного испарения второго растворителя, получали содержавшие второе липофильное лекарственное средство мицеллы; и
(d3) Смесь фильтровали через 0,2 мкм фильтрующую мембрану, и фильтрат представлял собой содержавший второе липофильное лекарственное средство мицеллярный субблок, включавший содержащие второе липофильное лекарственное средство мицеллы.
При этом на стадии (c2), содержавшая лекарственное средство мицелла представляла собой микроструктуру, образованную из первого поверхностно-активного вещества, и куркуминоид или куркуминоиды был инкапсулирован/были инкапсулированы в содержащую лекарственное средство мицеллу. На стадии (c3), содержавшая второе липофильное лекарственное средство мицелла представляла собой микроструктуру, образованную из второго поверхностно-активного вещества, и второе липофильное лекарственное средство было инкапсулировано в содержащую второе липофильное лекарственное средство мицеллу.
Предпочтительно, последовательность операций на стадии (c2) была следующей: После полного испарения первого растворителя, медленно добавляли фармацевтически приемлемый водный раствор и хорошо перемешивали для формирования содержащих лекарственное средство мицелл.
Предпочтительно, последовательность операций на стадии (c3) была следующей: После полного испарения второго растворителя, медленно добавляли фармацевтически приемлемый водный раствор и хорошо перемешивали для формирования содержащих второе липофильное лекарственное средство мицелл.
Предпочтительно, второе липофильное лекарственное средство представляет собой, по меньшей мере, одно из следующего: кверцетин, синефрин, пуэрарин, ресвератрол и другое липофильное лекарственное средство, за исключением куркумина, или их комбинацию.
Предпочтительно, на стадии (a2) и/или на стадии (a3), точка/точки кипения первого растворителя и/или второго растворителя находится/находятся ниже чем точка кипения чистой воды.
Предпочтительно, на стадии (a2) и/или на стадии (a3), первый растворитель и/или второй растворитель представляют собой/представляет собой гидрофильный растворитель.
Предпочтительно, гидрофильный растворитель представляет собой, по меньшей мере, одно из следующего: метанол, этанол, ацетон и другие гидрофильные растворители, или их комбинацию.
Предпочтительно, на стадии (a2) и/или на стадии (a3), первый растворитель и/или второй растворитель представляют собой/представляет собой липофильный растворитель.
Предпочтительно, липофильный (гидрофобный) растворитель представляет собой, по меньшей мере, одно из следующего: эфир, бензол, хлороформ, этилацетат, дихлорметан, гексан и другие липофильные (гидрофобные) растворители, или их комбинацию.
Предпочтительно, на стадии (b2) и/или (b3), первое поверхностно-активное вещество и/или второе поверхностно-активное вещество представляют собой/представляет собой неионное поверхностно-активное вещество.
Предпочтительно, неионное поверхностно-активное вещество представляет собой, по меньшей мере, одно из следующего: полисорбат 80 (Твин 80), 2-гидроксиэтил-12-гидроксиоктадеканоат (солутол HS 15), производные полиоксиэтиленового касторового масла и другие неионное поверхностно-активное вещества, или их комбинацию.
Предпочтительно, производное полиоксиэтиленового касторового масла представляет собой, по меньшей мере, одно из следующего: коллифор ELP (также известный, как кремофор ELP), кремофор RH 40, и другие производные полиоксиэтиленового касторового масла, или их комбинацию.
Предпочтительно, массовое отношение куркуминоида или куркуминоидов ко второму липофильному лекарственному средству было равно от 30:1 до 1:10.
Предпочтительно, на стадиях (a2) и (b2), массовое отношение куркуминоида или куркуминоидов и первого поверхностно-активного вещества было равно от 1:4 до 1:500.
Предпочтительно, на стадиях (a3) и (b3), массовое отношение второго липофильного лекарственного средства ко второму поверхностно-активному веществу было равно от 1:4 до 1:500.
Предпочтительно, на стадии (c2) и/или (c3), фармацевтически приемлемый водный раствор представляет собой воду для инъекции, водный раствор для инъекции или нормальный физиологический раствор.
Предпочтительно, на стадии (c2) и/или (c3), фармацевтически приемлемый водный раствор включает местный анестетик.
Предпочтительно, местный анестетик представляет собой, по меньшей мере, одно из следующего: амиды, сложные эфиры парааминобензойной кислоты и аминоэфиры, или их комбинацию.
Предпочтительно, амиды представляют собой, по меньшей мере, одно из следующего дибукаин, лидокаин, мепивакаин HCl, бупивацин HCl, пиррокаин HCl, прилокаин HCl, дигаммакаин и оксетазаин или их комбинацию.
Предпочтительно, сложные эфиры парааминобензойной кислоты представляют собой, по меньшей мере, одно из следующего бутакаин, диметокаин и тутокаин или их комбинацию.
Предпочтительно, аминоэфиры представляют собой, по меньшей мере, одно из следующего хинизокаин и прамокаин, или их комбинацию.
Предпочтительно, на стадии (c2) и/или (c3), фармацевтически приемлемый водный раствор включает антиоксидант.
Предпочтительно, антиоксидант представляет собой, по меньшей мере, одно из следующего: бета-каротин, лютеин, ликопен, билирубин, витамин А, витамин С (аскорбиновую кислоту), витамин Е, мочевую кислоту, оксид азота, нитроксид, пируват, каталазу, супероксиддисмутазу, глутатионпероксидазы, N-ацетилцистеин и нарингенин или их комбинацию.
Настоящее изобретение обеспечивает второй способ получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство, и второй способ получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство, более сокращенный по сравнению с первым способом получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство; и процедуру второго получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство осуществляют следующим образом:
(a4) Куркуминоид или куркуминоиды, второе липофильное лекарственное средство, и растворитель смешивали, и перемешивали при 200-500 rpm до полного растворения куркуминоида или куркуминоидов;
(b4) Фармацевтически приемлемое поверхностно-активное вещество добавляли и хорошо перемешивали при 100-300 rpm для испарения растворителя, при этом значение гидрофильно-липофильного баланса (значение ГЛБ) поверхностно-активного вещества было больше чем 10;
(c4) Сразу после полного испарения растворителя, фармацевтически приемлемый водный раствор медленно добавляли и хорошо перемешивали для формирования содержащих лекарственное средство мицелл и содержащих второе липофильное лекарственное средство мицелл; и
(d4) Смесь фильтровали через 0,2 мкм фильтрующую мембрану, и фильтрат, включавший содержащие лекарственное средство мицеллы и содержащие второе липофильное лекарственное средство мицеллы хранили в темноте и в холодильнике.
Типы и диапазоны растворителей, поверхностно-активных веществ, фармацевтически приемлемых водных растворов и вторых липофильных лекарственных средств, примененные во втором способе получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство, были такими же, как примененные в первом способе получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство. Кроме того, диапазоны относительных соотношений ингредиентов, примененных во втором способе получения куркуминоид-другое липофильное лекарственное средство комплексной фармацевтической композиции, были такими же, как примененные в первом способе получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство.
Предпочтительно, фармацевтически приемлемые водные растворы включают местный анестетик и/или антиоксидант.
Предпочтительно, типы и диапазоны местного анестетика и/или антиоксиданта второго способа получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство были такими же, как примененные в первом способе получения комплексной фармацевтической композиции куркуминоид-другое липофильное лекарственное средство.
Эксперимент 3-3: Получение комплексной фармацевтической композиции куркуминоид-водорастворимое лекарственное средство
(a5) Куркуминоид или куркуминоиды и растворитель смешивали и перемешивали при 150-500 rpm при комнатной температуре до полного растворения куркуминоида или куркуминоидов;
(b5) Фармацевтически приемлемое поверхностно-активное вещество добавляли и хорошо перемешивали при 100-300 rpm для испарения растворителя, при этом значение гидрофильно-липофильного баланса (значение ГЛБ) поверхностно-активного вещества было больше чем 10;
(c5) После полного испарения растворителя, первые фармацевтически приемлемый водный раствор медленно добавляли и хорошо перемешивали при 100-300 rpm для образования содержащих лекарственное средство мицелл; и
(d5) Смесь фильтровали через 0,2 мкм фильтрующую мембрану, и фильтрат, включавший содержащие лекарственное средство мицеллы, хранили в темноте и в холодильнике;
при этом первый фармацевтически приемлемый водный раствор включал водорастворимое лекарственное средство.
Предпочтительно, первые фармацевтически приемлемый водный раствор включал местный анестетик.
Предпочтительно, местный анестетик представляет собой, по меньшей мере, одно из следующего: амиды, сложные эфиры парааминобензойной кислоты и аминоэфиры, или их комбинацию.
Предпочтительно, амиды представляют собой, по меньшей мере, одно из следующего дибукаин, лидокаин, мепивакаин HCl, бупивацин HCl, пиррокаин HCl, прилокаин HCl, дигаммакаин и оксетазаин или их комбинацию.
Предпочтительно, сложные эфиры парааминобензойной кислоты представляют собой, по меньшей мере, одно из следующего бутакаин, диметокаин и тутокаин или их комбинацию.
Предпочтительно, аминоэфиры представляют собой, по меньшей мере, одно из следующего хинизокаин и прамокаин, или их комбинацию.
Предпочтительно, первый фармацевтически приемлемый водный раствор включает антиоксидант.
Предпочтительно, антиоксидант представляет собой, по меньшей мере, одно из следующего: бета-каротин, лютеин, ликопен, билирубин, витамин А, витамин С (аскорбиновую кислоту), витамин Е, мочевая кислота, оксид азота, нитроксид, пируват, каталазу, супероксиддисмутазу, глутатионпероксидазы, N-ацетилцистеин и нарингенин или их комбинацию.
Предпочтительно, на стадии (a5), точка кипения растворителя была ниже, чем у чистой воды.
Предпочтительно, на стадии (a5), растворитель представлял собой гидрофильный растворитель.
Предпочтительно, гидрофильный растворитель представляет собой, по меньшей мере, одно из следующего: метанол, этанол, ацетон и другие гидрофильные растворители, или их комбинацию.
Предпочтительно, растворитель на стадии (a5) представлял собой липофильный (гидрофобный) растворитель.
Предпочтительно, липофильный (гидрофобный) растворитель представляет собой, по меньшей мере, одно из следующего: эфир, бензол, хлороформ, этилацетат, дихлорметан, гексан и другие липофильный (гидрофобный) растворители, или их комбинацию.
Предпочтительно, на стадии (b5), поверхностно-активное вещество представляло собой неионное поверхностно-активное вещество.
Предпочтительно, неионное поверхностно-активное вещество представляет собой, по меньшей мере, одно из следующего: полисорбат 80 (Твин 80), 2-гидроксиэтил-12-гидроксиоктадеканоат (солутол HS 15), производные полиоксиэтиленового касторового масла, и другие неионное поверхностно-активное вещества, или их комбинацию.
Предпочтительно, производное полиоксиэтиленового касторового масла представляет собой, по меньшей мере, одно из следующего: коллифор ELP (также известный, как кремофор ELP), кремофор RH 40, и другие производные полиоксиэтиленового касторового масла, или их комбинацию.
Предпочтительно, между стадиями (c5) и (d5), дополнительно включали следующие стадии:
(c51) добавление второго фармацевтически приемлемого водного раствора и хорошее перемешивание для полного растворения второго фармацевтически приемлемого водного раствора.
Предпочтительно, гидрофильное лекарственное средство растворяли в первом фармацевтически приемлемом водном растворе, содержащая лекарственное средство мицелла представляла собой микроструктуру, образованную с помощью поверхностно-активного вещества, и куркуминоид или куркуминоиды был инкапсулирован/были инкапсулированы в содержащую лекарственное средство мицеллу.
Предпочтительно, водорастворимое лекарственное средство в первом фармацевтически приемлемом водном растворе представляло собой, по меньшей мере, одно из следующего: экстракт зеленого чая, эпигаллокатехина галлат, эпикатехин, эпикатехина галлат, эпигаллокатехин, галлокатехина галлат, галлокатехин, катехина галлат, катехин, кафеин, карнитин, L-карнитин, синефрин, хлорогеновую кислоту и другие водорастворимые лекарственные средства, или их комбинацию.
Предпочтительно, на стадиях (a5) и (c5), массовое отношение куркуминоида или куркуминоидов к водорастворимому лекарственному средству было равно от 30:1 до 1:10.
Предпочтительно, на стадиях от (a5) до (c5), в расчете на 1 единицу массы, обозначенную как общая масса куркуминоида или куркуминоидов и водорастворимого лекарственного средства, масса поверхностно-активного вещества была равна от 0,24 до 70 единиц массы; или массовое отношение общей массы куркуминоида или куркуминоидов и водорастворимого лекарственного средства к поверхностно-активному веществу было равно от 4:1 до 1:70.
Предпочтительно, на стадиях (a5), (c5), и (c51), в расчете на 1 единицу массы, обозначенную как общая масса куркуминоида или куркуминоидов и водорастворимого лекарственного средства, общая масса первого фармацевтически приемлемого водного раствора и второго фармацевтически приемлемого водного раствора была от 16 до 400 единиц массы.
Предпочтительно, на стадиях (c5) и (c51), первый фармацевтически приемлемый водный раствор и второй фармацевтически приемлемый водный раствор представляют собой воду для инъекций, водный раствор для инъекций или нормальный физиологический раствор.
Эксперимент 4: Определение качества фармацевтических композиций
Эксперимент 4-1: Анализ композиций
Фармацевтическую композицию оставляли стоять в течение, по меньшей мере, 20-ти минут. Если композиция не разделялась на слои, то ее дополнительно анализировали с помощью анализатора размера частиц.
Включала ли фармацевтическая композиция мицеллы, определяли с помощью анализатора размера частиц. Если диаметр частиц фармацевтической композиции после анализа с помощью анализатора размера частиц, был меньше, чем 250 нм, то раствор фармацевтической композиции признавали чистым и прозрачным, если при наблюдении невооруженным глазом и при освещении раствора фармацевтической композиции лазером можно было наблюдать световой пучок, тогда это указывало на то, что фармацевтическая композиция включала мицеллы.
Если мицеллы присутствовали в фармацевтической композиции, то полученная фармацевтическая композиция представляла собой фармацевтическую композицию для снижения массы тела и телесного жира в настоящем изобретении.
Предпочтительно, если фармацевтическая композиция не разделялась на слои и не содержала осадков после отстаивания, то полученная фармацевтическая композиция представляла собой предпочтительную фармацевтическую композицию настоящего изобретения.
Эксперимент 4-2: Определение стабильности фармацевтических композиций путем анализа распределения диаметра частиц
Распределение диаметра частиц и коэффициент полидисперсности (PDI) определяли с помощью анализатора размера частиц (приобретен у компании «Malvern»). Если PDI был меньше, чем 0,4, то это показывает, что стабильность фармацевтической композиции была хорошая, то есть мицеллы в фармацевтической композиции могут существовать стабильно.
Эксперимент 4-3: Определение стабильности фармацевтических композиций с помощью ускоренного теста на стабильность
Условия хранения фармацевтической композиции настоящего изобретения – от 2 до 8°C. Для того чтобы протестировать стабильность фармацевтических композиций, автор изобретения помещал фармацевтические композиции в окружение с относительно высокой температурой и относительно высокой влажностью (температура 25°C±2°C, относительная влажность 60%±5%) для ускоренного теста на стабильность, и наблюдал, как долго мицеллы в фармацевтической композиции были в состоянии стабильно существовать в условиях относительно высокой температуры, и применял это для расчета срока годности фармацевтической композиции при от 2 до 8°C, основанного на уравнении ускоренного теста на стабильность, как подробно описано ниже.
Если фармацевтическая композиция имеет срок годности n месяцев в условиях 25°C, тогда срок годности фармацевтической композиции в условиях 5°C будет в 2((25-5)/10) раз больше n месяцев. То есть срок годности фармацевтической композиции в условиях 5°C будет в 22 раза больше n месяцев, то есть в 4 раза больше.
Например, если срок годности фармацевтической композиции равен 6 месяцам в условиях 25°C, то срок годности фармацевтической композиции в условиях 5°C будет равен 24 месяцам (6 месяца × 4 раза = 24 месяца.)
Предпочтительно, фармацевтическая композиция сохраняется в состоянии без осадков в течение, по меньшей мере, 24-х часов, если ее подвергают ускоренному тесту на стабильность в условиях температуры, равной 25°C±2°C, относительной влажности, равной 60%±5%, и при отсутствии прямого света.
Предпочтительно, фармацевтическая композиция сохраняется в состоянии без осадков в течение, по меньшей мере, 6-ти месяцев, если ее подвергают ускоренному тесту на стабильность в условиях температуры, равной 25°C±2°C, относительно влажности, равной 60%±5%, и при отсутствии прямого света.
Предпочтительно, фармацевтическая композиция сохраняется в состоянии без осадков в течение, по меньшей мере, 24-х месяцев в условиях температуры, равной от 2 до 8°C.
Эксперимент 5: Максимальная нагрузка лекарственным средством содержащих лекарственное средство мицелл, образованных из различных неионных поверхностно-активных веществ
Поскольку максимальная нагрузка лекарственным средством содержащих лекарственное средство мицелл напрямую влияет на объем инъекции, то это сильно влияет на объем лекарственного средства, вызывая побочные эффекты и неудобство, которое нужно претерпевать при локализованном подкожном расположении при однократном введении. Таким образом, в данном эксперименте, исследовали максимальную нагрузку лекарственным средством куркумин внутри содержащих лекарственное средство мицелл, в расчете на единицу фармацевтической композиции, образованной из различных неионных поверхностно-активных веществ, чтобы определить, какое из неионных поверхностно-активных веществ будет наилучшим вспомогательным веществом для получения фармацевтических композиций настоящего изобретения.
Четыре неионных поверхностно-активных вещества были выбраны для данного эксперимента. Эти четыре неионные поверхностно-активные вещества представляли собой коллифор ELP (также известный, как кремофор ELP, сокращен как ELP), коллифор HS-15 (HS-15), кремофор RH 40 (сокращен как RH 40) и полисорбат 80 (также известный, как Tween 80).
В данном эксперименте было 4 группы, а именно группа ELP, группа HS-15, группа RH40 и группа Tween 80.
Экспериментальная процедура:
(a’) 2,0 г (пример первой навески) куркумина смешивали с 300-500 мл дихлорметана, и перемешивали при 150-500 rpm при комнатной температуре до полного растворения куркумина.
(b’) 18,0 г (пример второй навески) одного из упомянутых выше неионные поверхностно-активные веществ добавляли к раствору, и перемешивали при 100-300 rpm для испарения дихлорметана; и
(c’) После полного испарения растворителя получали композицию, с общей массой всего 20 г; 2 г композиции отвешивали, и 8 г (пример третьей навески) физиологического раствора для инъекции медленно добавляли и хорошо перемешивали для получения композиции для тестирования. Концентрация куркумина в композиции для тестирования была равна 20 мг/г, и концентрация неионного поверхностно-активного вещества была равна 18%.
Композициям для тестирования из группы ELP, группы HS-15, группы RH40 и группы Tween 80 давали отстояться в течение, по меньшей мере, 20-ти минут, чтобы увидеть, произошло ли разделение. Если разделение происходило, то это показывает, что концентрация куркумина была слишком высокой и, таким образом, вызывала разрыв мицеллы в композиции для тестирования, то есть, такое неионное поверхностно-активное вещество не может быть применено для получения фармацевтических композиций настоящего изобретения, в которых концентрация куркумина равна 20 мг/г.
Экспериментальные результаты показали, что композиции для тестирования в группе HS-15 и группе RH40 разделились на слои, и только композиции для тестирования из группы ELP и из группы Tween 80 не разделились. Следовательно, максимальная нагрузка лекарственным средством куркумин внутри содержащих лекарственное средство мицелл, образованных из HS-15 и RH40 в расчете на грамм фармацевтических композиций, была в обоих случаях меньше, чем 20 мг/г. Максимальная нагрузка лекарственным средством куркумин внутри содержащих лекарственное средство мицелл, образованных из ELP и Tween 80, в расчете на грамм фармацевтических композиций была больше или равна 20 мг/г.
Однако поскольку Tween 80 токсичен, согласно различным национальным фармакопеям, концентрация Tween 80 в инъекции ограничена до менее чем 0,4%, чтобы избежать неблагоприятных эффектов или токсичности. Таким образом, максимальная нагрузка лекарственным средством куркумин внутри содержащих лекарственное средство мицелл, образованных из Tween 80, в расчете на грамм фармацевтических композиций должна быть равна 0,44 мг/г в качестве верхнего предела. (Расчет: 20 мг/г × (0,4% /18%) = 0,44 мг/г.)
Для того чтобы определить максимальную нагрузку лекарственным средством ELP, автор изобретения дополнительно провел эксперименты и определил, что максимальная нагрузка лекарственным средством ELP в расчете на грамм фармацевтической композиции была больше или равна 167 мг куркумина.
Приведенные выше результаты показали, что ELP представлял собой наилучшее вспомогательное вещество для получения фармацевтических композиций настоящего изобретения. Максимальная нагрузка лекарственным средством куркумин в содержащие лекарственное средство мицеллы, образованные из ELP, может достигать 167 мг в расчете на грамм фармацевтических композиций, в то время как максимальная нагрузка лекарственным средством куркумин в содержащих лекарственное средство мицеллах, образованных из других неионных поверхностно-активных веществ, в расчете на грамм фармацевтических композиций была меньше чем 20 мг/г (пожалуйста, обратитесь к таблице 1).
Для того чтобы определить, какие из содержащих лекарственное средство мицелл, образованных из неионного поверхностно-активного вещества HS-15 и RH40, имеют самый низкий верхний предел нагрузки лекарственным средством для куркумина в расчете на единицу фармацевтической композиции, автор изобретения дополнительно применил те неионные поверхностно-активные вещества для получения фармацевтических композиций настоящего изобретения, в которых концентрация куркумина была равна 10 мг/г. Результаты показали, что все из ELP, HS-15, RH40 и Tween 80 могут быть применены для получения фармацевтических композиций настоящего изобретения с 10 мг/г куркумина, и фармацевтические композиции настоящего изобретения с 10 мг/г куркумина были прозрачными, без разделения, и измеренные диаметры частиц были равны 15,95±0,24 нм, 88,23±116,06 нм, 21,63±9,34 нм, 11,37±0,13 нм, соответственно, и значения PDI были равны 0,32±0,02, 0,48±0,27, 0,26±0,09, 0,33±0,04, соответственно.
Среди них, если для получения фармацевтической композиции настоящего изобретения применяли HS-15 с концентрацией куркумина, равной 10 мг/г, то значение PDI полученной фармацевтической композиции было больше 0,4, что не соответствует определению настоящего изобретения мицелл в фармацевтической композиции в отношении стабильности. Следовательно, среди неионных поверхностно-активных веществ, выбранных для данного эксперимента, HS-15 имеет самый низкий верхний предел нагрузки лекарственного средства (пожалуйста, обратитесь к таблице 1).
Таблица 1. Максимальная нагрузка лекарственным средством содержащих лекарственное средство мицелл, образованных из различных неионных поверхностно-активных веществ
Эксперимент 6: Получение фармацевтических композиций с коллифором ELP (ELP)
Для того чтобы определить, как соответствующее отношение куркумина к коллифору ELP (ELP), так и максимальную нагрузку лекарственным средством, при получении фармацевтических композиций в настоящем изобретении с ELP, в данном эксперименте применяли различные соотношения куркумина к коллифору ELP (также известному, как кремофор ELP, сокращен как ELP) для получения серий фармацевтических композиций настоящего изобретения, и проводили анализ их стабильности.
В данном эксперименте было 9 групп, то есть с 1ой по 9ую группу. Способ получения фармацевтической композиции в каждой группе был по существу такой же, как экспериментальная процедура в эксперименте 5, и только масса куркумина (первая навеска на стадии (a')), масса ELP (вторая навеска на стадии (b')) и масса физиологического раствора для инъекции (третья навеска на стадии (c')) отличались. В данном эксперименте, руководство по добавлению навески куркумина (первая навеска), навески ELP (вторая навеска) и навески физиологического раствора для инъекции (третья навеска) были такими, как показано в таблице 2.
Таблица 2. Образец подготовки проб для получения фармацевтических композиций с ELP
(массовое отношение)
В данном эксперименте, отношения куркумина к ELP (массовое отношение) в от первой группе до девятой группы было равно 1:4, 1:5, 1:8, 1:10, 1:20, 1:40, 1:100, 1:150 и 1:500, соответственно, и конечные концентрации куркумина в фармацевтических композициях, полученных в от первой до девятой группы, были равны 200 мг/г, 167 мг/г, 111 мг/г, 91 мг/г, 47,62 мг/г, 7,5 мг/г, 3 мг/г, 2 мг/г и 0,5 мг/г, соответственно. То есть, в способе получения фармацевтической композиции в от первой до девятой группы, массовые отношения куркумина на стадии (a') к ELP на стадии (b') (отношения первой навески ко второй навеске) были равны 1:4, 1:5, 1:8, 1:10, 1:20, 1:40, 1:100, 1:150 и 1:500, соответственно, и что после добавления третьей навески физиологического раствора для инъекции на стадии (c'), конечные концентрации куркумина в полученных фармацевтических композициях были равны 200 мг/г, 167 мг/г, 111 мг/г, 91 мг/г, 47,62 мг/г, 7,5 мг/г, 3 мг/г, 2 мг/г и 0,5 мг/г, соответственно. При этом если конечная концентрация лекарственного средства была представлена как мг/г, то это указывало на количество миллиграммов куркумина на грамм фармацевтической композиции.
Анализатор размера частиц применяли для определения того, присутствуют ли мицеллы в фармацевтических композициях, и измеряли диаметр частиц мицелл.
Для оценки стабильности фармацевтических композиций, измеряли распределение диаметра частиц и коэффициент полидисперсности (PDI) с помощью анализатора размера частиц. Содержание куркумина в мицеллах анализировали с помощью высокоэффективной жидкостной хроматографии (HPLC; например, HPLC-UV) и обозначали как «исходное содержание лекарственного средства».
Фармацевтические композиции подвергали ускоренному тесту на стабильность для наблюдения, имеет ли место разделение, если фармацевтические композиции хранили в условиях хранения с высокой температурой (25±2°C) в течение 3-х месяцев. Содержание лекарственного средства в мицеллах анализировали с помощью высокоэффективной жидкостной хроматографии (HPLC; например, HPLC-UV), и обозначали как «содержание лекарственного средства после укоренного теста на стабильность». «Процент содержания лекарственного средства» рассчитывали путем деления «содержания лекарственного средства после укоренного теста на стабильность» на «исходное содержание лекарственного средства». Если процент содержания лекарственного средства был больше чем или равна 95%, это показывало, что стабильность фармацевтической композиции была отличной.
Пожалуйста, обратитесь к таблице 3. Таблица 3 представляет собой результат анализа стабильности фармацевтических композиций. Таблица 3 показывает присутствие мицелл в от второй до девятой фармацевтических композициях. Следовательно, все фармацевтические композиции, полученные с отношениями куркумин к ELP, равными от 1:5 до 1:500, представляют собой в настоящем изобретении фармацевтические композиции для снижения массы тела и висцерального жира.
Таблица 3. Анализ стабильности фармацевтических композиций
(нм)
В приведенной выше таблице, пустые ячейки указывают на то, что содержимое не было проанализировано.
В терминах стабильности, если отношения куркумина к ELP были равны 1:4 и 1:5, то оба PDI были больше чем 0,4. Если отношения куркумина к ELP были равны от 1:8 до 1:500, то каждый PDI был меньше, чем 0,4. Таким образом, с целью получения фармацевтической композиции с лучшей стабильностью, отношение куркумина к ELP должно быть меньше одной пятой (1/5). То есть, с целью получения фармацевтической композиции с лучшей стабильностью, в расчете на 1 единицу массы, определенную как масса куркумина, масса ELP должна быть больше чем 5 единиц массы. Предпочтительно, в расчете на 1 единицу массы, определенную как масса куркумина, масса ELP была равна от 8 до 500 единиц массы. Предпочтительно, в расчете на 1 единицу массы, определенную как масса куркумина, масса ELP была равна от 20 до 150 единиц массы.
На основе данных таблицы 3, если фармацевтические композиции с пятой по восьмою группы хранили при 25°C в течение 3-х месяцев, то процентное содержание лекарственного средства куркумин в каждом образце было больше чем 95%, и оно не показывало существенной тенденции к снижению по сравнению с исходным содержанием лекарственного средства. Данный результат показывает, что фармацевтические композиции обладают отличной стабильностью, и, основываясь на уравнении ускоренного теста на стабильность, фармацевтические композиции можно хранить при от 2 до 8°C в холодильнике в течение, по меньшей мере, 24-х месяцев.
Эксперимент 7: Эффект концентрации содержащих лекарственное средство мицелл на стабильность фармацевтической композиции и эффективность снижения массы
В соответствии с контекстом изобретения в заявке автора изобретения на патент Тайваня номер 105127451, автор изобретения считает, что концентрация содержащих лекарственное средство мицелл может повлиять на стабильность, эффективность снижения массы и безопасность фармацевтической композиции по настоящему изобретению. Таким образом, серии фармацевтических композиций, имеющие разные концентрации содержащих лекарственное средство мицелл, получали таким же способом получения, и определяли стабильность, эффективность снижения массы и безопасность измерений (возникает ли язва в месте введения).
Эксперимент 7-1: Получение фармацевтической композиции
В данном эксперименте было 12 пробирок с фармацевтической композицией, то есть от первой до двенадцатой пробирки. Способ получения фармацевтической композиции первой пробирки был следующим:
18 мг (пример первой навески) куркумина смешивали с от 80 до 140 мл дихлорметана, и перемешивали при 150-500 rpm при комнатной температуре до полного растворения. К раствору добавляли 90 г (пример второй навески) коллифора ELP (также известного, как кремофор ELP), и перемешивали при 100-300 rpm для испарения дихлорметан. После полного испарения дихлорметана медленно добавляли физиологический раствор для инъекций до достижения конечного объема 180 мл, для образования содержащих лекарственное средство мицеллы и для получения первой пробирки фармацевтической композиции для данного эксперимента. Не происходило осаждения куркумина в фармацевтической композиции, только что полученной данным способом, и удельный вес фармацевтической композиции был равен примерно 1 мг/мл; следовательно, в фармацевтической композиции первой пробирки общая концентрация куркумина, инкапсулированного в содержащие лекарственное средство мицеллы, была равна 0,1 мг/мл (18 мг ÷ 180 г = 0,1 мг/г)
Способ получения фармацевтической композиции в от второй до двенадцатой пробирки был примерно таким же, как способ получения фармацевтической композиции в первой пробирке, за исключением разницы в массе куркумина (первая навеска) и массе ELP (вторая навеска); однако массовое отношение куркумина к коллифору ELP было также равно 1:5. Руководство по добавлению навески куркумина (первая навеска) и навески ELP (вторая навеска) при получении от первой до двенадцатой фармацевтической композиции приведено в таблице 4.
Таблица 4. Образец подготовки проб для получения фармацевтической композиции с ELP
(г)
(г)
(мг/г)
Эксперимент 7-2: Анализ стабильности фармацевтических композиций
Анализатор размера частиц применяли для определения того, присутствуют ли мицеллы в фармацевтических композициях, и измеряли диаметр частиц мицелл.
Для оценки стабильность фармацевтических композиций, распределение диаметра частиц и коэффициент полидисперсности (PDI) измеряли с помощью анализатора размера частиц. Содержание куркумина в мицеллах анализировали с помощью высокоэффективной жидкостной хроматографии (HPLC; например, HPLC-UV) и обозначали как «исходное содержание лекарственного средства».
Фармацевтические композиции подвергали ускоренному тесту на стабильность для наблюдения того, имеет ли место разделение, если фармацевтические композиции хранили в условиях хранения с высокой температурой (25±2°C) в течение 3-х месяцев. Содержание лекарственного средства в мицеллах анализировали с помощью высокоэффективной жидкостной хроматографии (HPLC; например, HPLC-UV), и обозначали как «содержание лекарственного средства после укоренного теста на стабильность». «Процент содержания лекарственного средства» рассчитывали путем деления «содержания лекарственного средства после укоренного теста на стабильность» на «исходное содержание лекарственного средства». Если процент содержания лекарственного средства был больше чем или равен 95%, то это показывает, что стабильность фармацевтической композиции была отличной.
Результаты анализа на стабильность фармацевтических композиций. Пожалуйста, обратитесь к таблице 5.
В результате анализа с помощью анализатора размера частиц от первой до одиннадцатой пробирки с фармацевтической композицией, содержавшей лекарственное средство, получили, что измеренный диаметр частиц был меньше, чем 250 нм, и значение PDI было меньше чем 0,4, после этого раствор фармацевтической композиции признавали чистым и прозрачным, раствор не разделялся и не содержал осадков после отстаивания, если раствор фармацевтической композиции освещали лазером, то можно было наблюдать световой пучок, и фармацевтическая композиция сохранялась в состоянии без осадков в течение, по меньшей мере, 24-х часов, если ее подвергали воздействию температуры 25°C±2°C и относительной влажности, равной 60%±5%. Следовательно, если общая концентрация куркумина, инкапсулированного в содержащие лекарственное средство мицеллы, находилась в диапазоне от 0,1 до 167 мг/г, то фармацевтическая композиция обладала стабильностью. Однако анализом с помощью анализатора размера частиц было установлено, что значение PDI в содержавшей лекарственное средство фармацевтической композиции в двенадцатой пробирке, было больше чем 0,4, следовательно, если общая концентрация куркумина, инкапсулированного в содержащих лекарственное средство мицеллах, была равна 175 мг/г, то фармацевтическая композиция не обладала стабильностью.
Эксперимент 7-3: Эффективность фармацевтической композиции в отношении снижения массы
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 52-х крыс содержали на нормальной диете в течение 1-ой недели, давая возможность их массе достичь 175-200 г, и затем они получали диету с высоким содержанием жиров, для перевода в состояние животного, страдающего ожирением. Крыс разделяли на 13 групп, а именно контрольная группа, первая группа, вторая группа, третья группа, четвертая группа, пятая группа, шестая группа, седьмая группа, восьмая группа, девятая группа, десятая группа, одиннадцатая группа, двенадцатая группа, по четыре крысы на группу, не делая статистической разницы для массы в каждой группе крыс. После этого, вводили подкожные инъекции следующим образом.
От первой до двенадцатой группы: крысам в от первой до двенадцатой группе вводили фармацевтическую композицию из от первой до двенадцатой пробирки по эксперименту 7-1 с помощью подкожной инъекции, и место инъекции находилось за ухом на спине, над лопаткой или под лопаткой крыс, соответственно.
Контрольная группа: контрольной группе крыс вводили физиологический раствор для инъекции с помощью подкожной инъекции, и место инъекции находилось за ухом на спине, над лопаткой или под лопаткой крыс.
Во время эксперимента крысам последовательно давали диету с высоким содержанием жиров, в течение 20-ти дней, и крыс умерщвляли с помощью CO2 на день 21. Крыс, которым вводили фармацевтическую композицию с помощью инъекции, осматривали для обнаружения состояния появления язвы в месте введения, и рассчитывали «относительный общий прирост массы» и «относительную массу висцерального жира».
Пожалуйста, обратитесь к таблице 5 для эффективности фармацевтической композиции в отношении снижения массы.
Таблица 5. Результаты эффективности снижения массы и стабильности содержащих лекарственное средство мицелл фармацевтической композиции в разных концентрациях
Экспериментальные результаты показывают, что по сравнению с контрольной группой, «относительный общий прирост массы» и «относительная масса висцерального жира» крыс первой группы достоверно не снизились (p>0,05), и «относительный общий прирост массы» и «относительная масса висцерального жира» крыс второй группы тоже достоверно не снизились (p>0,05. Однако «относительный общий прирост массы» и «относительная масса висцерального жира» крыс во всех группах, от третьей до двенадцатой, снизились достоверно (p<0,05). Следовательно, в фармацевтической композиции, если общая концентрация куркумина, инкапсулированного в содержащие лекарственное средство мицеллы, находится в диапазоне от 0,4 до 200 мг/г, то его эффект на массу тела и снижение висцерального жира у крыс может быть достигнут.
Приведенные выше результаты показывают, что в фармацевтической композиции, если общая концентрация куркумина, инкапсулированного в содержащие лекарственное средство мицеллы, была больше чем или равна 0,4 мг/г, то его эффект на массу тела и снижение висцерального жира у крыс может быть достигнут; с другой стороны, если общая концентрация куркумина, инкапсулированного в содержащие лекарственное средство мицеллы была меньше чем или равна 167 мг/г, то может поддерживаться стабильность мицелл. Следовательно, в фармацевтической композиции в настоящем изобретении, если общая концентрация куркумина, инкапсулированного в содержащие лекарственное средство мицеллы, находится в диапазоне от 0,4 до 167 мг/г, то как стабильность, так и эффекты на снижение массы могут быть достигнуты. Предпочтительно, в фармацевтической композиции по настоящему изобретению общая концентрация куркумина, инкапсулированного в содержащие лекарственное средство мицеллы, была равна от 0,4 до 111 мг/г.
Эксперимент 8: Эффекты разного отношения куркумин-экстракт зеленого чая в комплексной фармацевтической композиции на массу и массу висцерального жира крыс
В настоящем эксперименте было 12 пробирок комплексной фармацевтической композиции с куркумином-экстрактом зеленого чая, то есть пробирка с куркумином, пробирка с экстрактом зеленого чая, пробирка с 1’ по 4’, пробирка с 6’ по 7’, пробирка 9’ и пробирка с 11’ по 13’. Получение каждой пробирки было по существу таким же, как экспериментальная процедура в эксперименте 1; единственное отличие заключалось в отношении куркумина к экстракту зеленого чая, и концентрация кремофора ELP была 15%. Отношение куркумина к экстракту зеленого чая показано в таблице 6.
Таблица 6. Массовое отношение и общая концентрация куркумина и экстракта зеленого чая в комплексных фармацевтических композициях с куркумином-экстрактом зеленого чая
(массовое отношение)
(мг/мл)
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 52-х крыс содержали на нормальной диете в течение трех дней, давая возможность их массе достичь 175-200 г, и затем кормили диетой с высоким содержанием жиров в течение 21-го дня, для стимуляции состояния животного, страдающим ожирением, и для увеличения массы тела до 400-500 г. Затем, крыс случайным образом распределяли по 13-ти группам, а именно, контрольная группа, получавшая диету с высоким содержанием жиров, группа куркумина, группа экстракта зеленого чая, группа от OIG1 до OIG4, группа от OIG6 до OIG7, группа OIG 9 и группа от OIG11 до OIG13, по четыре крысы на группу, для которых не было никакой статистической разницы в массе в каждой группе крыс. Способ введения лекарственных средств был следующим.
Контрольная группа, получавшая диету с высоким содержанием жиров: крысам вводили физиологический раствор для инъекций с помощью подкожной инъекции; и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию вводили каждый день на день 1, день 3, день 5, день 7, день 9 и день 11 в эксперименте, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг).
Группа куркумина, группа экстракта зеленого чая, группа от OIG1 до OIG4, группа от OIG6 до OIG7, группа OIG9 и группа от OIG11 до OIG13: фармацевтическую композицию в пробирке с куркумином, группы экстракта зеленого чая, пробирки от 1’ до 4’, пробирки от 6’ до 7’, пробирки 9’ и пробирки от 11’ до 13’ вводили крысе в группе куркумина, группе экстракта зеленого чая, группе от OIG1 до OIG4, группе от OIG6 до OIG7, группе OIG9 и группе от OIG11 до OIG13, соответственно, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию вводили в день на день 1, день 3, день 5, день 7, день 9, день 11, в общей сложности 6 инъекции, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг), чтобы сделать дозу на одну инъекцию равной 20 мг лекарственного средства на килограмм массы тела (общая концентрация куркумина и экстракта зеленого чая, введенная на килограмм, была равна 4 мл/кг × 5 мг/мл = 20 мг/кг).
Диету с высоким содержанием жиров давали постоянно в течение эксперимента в течение 20-ти дней, и крысу умерщвляли с помощью CO2 на день 21, и рассчитывали «относительный общий прирост массы» и «относительную массу висцерального жира».
Результаты, приведенные на фигуре 2A, показывают, что относительный общий прирост массы крыс в контрольной группе, получавшей диету с высоким содержанием жиров, равен 100,0±18,5%, относительный общий прирост массы крыс в группе куркумина равен 92,1±11,3%, относительный общий прирост массы крыс в группе экстракта зеленого чая равен 95,4±5,6%, относительный общий прирост массы крыс в группе от OIG1 до OIG4, группе от OIG6 до OIG7, группе OIG9 и группе от OIG11 до OIG13 равен 85,1±13,6%, 68,4±3,1%, 61,0±5,6%, 62,3±3,3%, 59,3±5,4%, 64,4±4,8%, 63,5±8,1%, 67,7±5,3%, 80,8±7,9% и 49,4±14,3%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, общий прирост массы крыс в группе куркумина и в группе экстракта зеленого чая достоверно не снижался (p>0,05), что указывает на то, что если крысу просто обеспечивать куркумином или экстрактом зеленого чая, то масса крысы не может быть достоверно снижена в условиях настоящего эксперимента (p>0,05). Однако по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительный общий прирост массы крыс в группе от OIG1 до OIG4, группе от OIG6 до OIG7, группе OIG9 и группе от OIG11 до OIG13 во всех случаях достоверно снижался (p<0,05), что указывает на то, что если отношение куркумина к экстракту зеленого чая находится в диапазоне от 50:1 до 1:20, то масса тела крысы может быть достоверно снижена. Кроме того, по сравнению с группой куркумина или группой экстракта зеленого чая, общий прирост массы крыс в группе от OIG2 до OIG4, группе от OIG6 до OIG7, группе OIG9, группе OIG11 и группе OIG13 во всех случаях был достоверно снижен (p<0,05), что указывает на то, что если отношение куркумина к экстракту зеленого чая находится в диапазоне от 30:1 до 1:10, то присутствует синергизм. Предпочтительно, если отношение куркумина к экстракту зеленого чая находится в диапазоне то 10:1 до 1:4, то присутствует предпочтительный синергизм.
Результаты, приведенные на фигуре 2B, показывают, что относительная масса висцерального жира крыс в контрольной группе, получавшей диету с высоким содержанием жиров, равна 100,0±33,4%, относительная масса висцерального жира крыс в группе куркумина равна 89,7±19,9%, относительная масса висцерального жира крыс в группе экстракта зеленого чая равна 93,7±15,2%, относительная масса висцерального жира крыс в группе от OIG1 до OIG4, группе от OIG6 до OIG7, группе OIG9 и группе от OIG11 до OIG13 равна 84,3±26,1%, 61,9±14,2%, 63,5±7,5%, 50,1±5,0%, 56,0±9,6%, 64,5±13,6%, 58,9±15,6%, 57,6±15,6%, 77,4±10,1%, и 52,8±9,1%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительная масса висцерального жира крыс в группе куркумина и группе экстракта зеленого чая не была достоверно снижена (p>0,05), что указывает на то, что если просто обеспечивать куркумином или экстрактом зеленого чая, то висцеральный жир у крыс не может быть достоверно снижен в условиях настоящего эксперимента (p>0,05). Однако по сравнению с крысами контрольной группы, получавшей диету с высоким содержанием жиров, относительная масса висцерального жира крыс в группе от OIG2 до OIG4, в группе от OIG6 до OIG7, группе OIG9 и группе OIG11 и в группе OIG13 во всех случаях достоверно снижалась (p<0,05), что указывает на то, что если отношение куркумина к экстракту зеленого чая находится в диапазоне от 30:1 до 1:10, то висцеральный жир крыс может быть достоверно снижен. Кроме того, по сравнению с группой куркумина или группой экстракта зеленого чая, относительная масса висцерального жира крыс в группе OIG2, в группе OIG4, в группе OIG6, в группе OIG9, в группе OIG11 и в группе OIG13 во всех случаях была достоверно снижена (p<0,05), что указывает на то, что если отношение куркумина к экстракту зеленого чая находится в диапазоне от 30:1 до 1:10, то присутствует синергизм. Предпочтительно, отношение куркумина к экстракту зеленого чая равно от 7:1 до 1:1.
Эксперимент 9: Эффекты различных дозировок комплексной фармацевтической композиции куркумин-экстракт зеленого чая на массу тела и массу висцерального жира крыс
Получение комплексной фармацевтической композиции куркумин-экстракт зеленого чая было таким же, как процедура, описанная для пробирки 13’ в эксперименте 8, то есть отношение куркумина к экстракту зеленого чая было равно 3:2, и концентрация кремофора ELP была равна 15%.
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 20 крыс содержали на нормальной диете в течение трех дней, давая возможность их массе достичь 175-200 г, и затем крыс распределяли по 5-ти группам; а именно, нормальная контрольная группа, контрольная группа, получавшая диету с высоким содержанием жиров, группа с низкой дозировкой, группа со средней дозировкой и группа с высокой дозировкой. Затем, крыс в нормальной контрольной группе содержали на нормальной диете непрерывно суммарно в течение 21-го дня, и, в то же время, крыс в контрольной группе, получавшей диету с высоким содержанием жиров, группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой содержали на диете с высоким содержанием жиров в течение 21-го дня, для стимуляции состояния животного, страдающего ожирением и позволяли массе тела увеличиваться вплоть до 400-450 г. После этого, подкожные инъекции вводили следующим образом.
Нормальная контрольная группа и контрольная группа, получавшая диету с высоким содержанием жиров: физиологический раствор для инъекции вводили крысе в нормальной контрольной группе и в контрольной группе, получавшей диету с высоким содержанием жиров, с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9 и день 11 в эксперименте, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 8 мл на килограмм массы тела (8 мл/кг).
Группа с низкой дозировкой: комплексную фармацевтическую композицию куркумин-экстракт зеленого чая настоящего эксперимента вводили крысе с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9 и день 11 в эксперименте, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 2 мл на килограмм массы тела (2 мл/кг), чтобы сделать дозу введения на инъекцию равной 6 мг куркумина и 4 мг экстракта зеленого чая на килограмм массы тела.
Группа со средней дозировкой: Способ и частота введения инъекции были такими же, как для группы с низкой дозировкой, с единственным изменением в дозировке инъекции. Доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг), чтобы сделать дозировку введения на инъекцию равной 12 мг куркумина и 8 мг экстракта зеленого чая на килограмм массы тела.
Группа с высокой дозировкой: Способ и частота введения инъекции были такими же, как для группы с низкой дозировкой, с единственным изменением в дозировке инъекции. Доза на одну инъекцию была равна 8 мл на килограмм массы тела (8 мл/кг), чтобы сделать дозу введения на инъекцию равной 24 мг куркумина и 16 мг экстракта зеленого чая на килограмм массы тела.
Диету с высоким содержанием жира последовательно давали на протяжении эксперимента, в течение 20-ти дней, крыс умерщвляли с помощью CO2 на день 21, и рассчитывали «относительный общий прирост массы» и «относительную массу висцерального жира» крыс в каждой группе.
Результаты, приведенные на фигуре 3A, показывают, что относительный общий прирост массы крыс в нормальной контрольной группе был равен 57,4±8,6%, относительный общий прирост массы крыс в контрольной группе, получавшей диету с высоким содержанием жиров, был равен 100,0±11,2%, относительный общий прирост массы крыс в группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой был равен 81,0±10,6%, 72,7±13,4%, и 59,6±12,1%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительный общий прирост массы крыс в группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой, во всех случаях был достоверно снижен (p<0,05), что указывает на то, что все различные дозировки комплексной фармацевтической композиции куркумин-экстракт зеленого чая могут достоверно снижать массу тела крыс, при этом эффект снижения массы на группу с высокой дозировкой был наилучшим.
Результаты, приведенные на фигуре 3B, показывают, что относительная масса висцерального жира крыс в нормальной контрольной группе была равна 37,0±5,2%, относительная масса висцерального жира крыс в контрольной группе, получавшей диету с высоким содержанием жиров, была равна 100,0±32,2%, относительная масса висцерального жира крыс в группе с низкой дозировкой, в группе со средней дозировкой, и в группе с высокой дозировкой была равна 66,8±18,0%, 68,0±21,0%, и 55,2±26,1%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительная масса висцерального жира крыс в группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой во всех случаях могла быть достоверно снижена (p<0,05), что указывает на то, что все различные дозировки комплексной фармацевтической композиции куркумин-экстракт зеленого чая могут снижать количество висцерального жира у крыс, при этом эффект в группе с высокой дозировкой был наилучшим.
Представленные выше эксперименты продемонстрировали, что комплексная фармацевтическая композиция куркумин-экстракт зеленого чая имеет значительный эффект на снижение массы и висцерального жира, если дозировка комплексной фармацевтической композиции куркумин-экстракт зеленого чая была равна 10 мг/кг, и чем выше была дозировка, тем более значительным был эффект.
Как свидетельствует опыт автора изобретения, если вводимая доза, подходящая для крыс, равна от 10 мг/кг до 40 мг/кг, то вводимая доза, подходящая для людей, равна от 0,1 до 80 мг/кг. Предпочтительно, дозировка введения для людей равна от 10 до 40 мг/кг.
Предпочтительно, дозировка введения для человека равна от 0,02 до 20 мг/см2. Предпочтительно, дозировка введения для человека равна от 0,04 до 16 мг/см2. Предпочтительно, дозировка введения для человека равна 0,2 до 12 мг/см2. Предпочтительно, дозировка введения для человека равна от 0,4 до 8 мг/см2.
Предпочтительно, дозировка введения для человека равна от 0,01 до 40 мг на килограмм массы тела. Предпочтительно, дозировка введения для человека равна от 0,4 до 40 мг на килограмм массы тела. Предпочтительно, дозировка введения для человека равна от 0,8 до 20 мг на килограмм массы тела.
Эксперимент 10: Эффект частоты введения комплексной фармацевтической композиции куркумин-экстракт зеленого чая на массу тела и массу висцерального жира крыс
Получение комплексной фармацевтической композиции куркумин-экстракт зеленого чая было таким же, как процедура для пробирки 13’ в эксперименте 8; то есть отношение куркумина к экстракту зеленого чая было равно 3:2 и концентрация кремофора ELP была равна 15%.
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 20 крыс содержали на нормальной диете в течение трех дней, давая возможность их массе достичь примерно 175-200 г, и затем крыс распределяли по 5-ти группам, а именно, нормальная контрольная группа, контрольная группа, получавшая диету с высоким содержанием жиров, группа с низкой частотой, группа с умеренной частотой и группа с высокой частотой. Затем, крыс в нормальной контрольной группе кормили нормальной диетой непрерывно в течение 21-го дня, и, в то же время, крыс в контрольной группе, получавшей диету с высоким содержанием жиров, группе с низкой частотой, группе с умеренной частотой и группе с высокой частотой содержали на диете с высоким содержанием жиров в течение 21-го дня, для стимуляции состояния животного, страдающего ожирением для увеличения массы тела вплоть до 400 до 450 г. После этого, подкожную инъекцию вводили следующим образом.
Нормальная контрольная группа и контрольная группа, получавшая диету с высоким содержанием жиров: физиологический раствор для инъекции вводили крысам в нормальной контрольной группе и контрольной группе, получавшей диету с высоким содержанием жиров, с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, день 11, день 13, день 15 в эксперименте, в общей сложности 8 инъекций, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг).
Группа с низкой частотой: комплексную фармацевтическую композицию куркумин-экстракт зеленого чая настоящего эксперимента вводили крысе с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день на день 1, день 3, день 5, и день 7 в эксперименте, в общей сложности 4 инъекции, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг), чтобы сделать дозу введения на инъекцию равной 12 мг куркумина и 8 мг экстракта зеленого чая на килограмм массы тела.
Группа с умеренной частотой: Способ и дозировка инъекции введения были такими же, как для группы с низкой частотой, с единственным изменением в частоте введения инъекции. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9 и день 11 в эксперименте, в общей сложности 6 инъекций.
Группа с высокой частотой: Способ и дозировка инъекции введения были такими же, как для группы с низкой частотой, с единственным изменением в частоте введения инъекции. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, день 11, день 13, и день 15 в эксперименте, в общей сложности 8 инъекций.
Диету с высоким содержанием жира последовательно давали на протяжении эксперимента, в течение 20-ти дней, крыс умерщвляли с помощью CO2 на день 21, и рассчитывали «относительный общий прирост массы» и «относительную массу висцерального жира» крыс в каждой группе.
Результаты, приведенные на фигуре 4A, показывают, что относительный общий прирост массы крыс в нормальном контроле был равен 57,6±12,1%, относительный общий прирост массы крыс в контрольной группе, получавшей диету с высоким содержанием жиров, был равен 100,0±9,2%, относительный общий прирост массы крыс в группе с низкой частотой, группе с умеренной частотой и группе с высокой частотой был равен 82,1±12,3%, 75,7±20,9%, и 54,7±13,4%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительный общий прирост массы крыс в группе с низкой частотой, группа с умеренной частотой, и группа с высокой частотой во всех случаях достоверно снижался (p<0,05), что указывает на то, что разная частота введения во всех случаях может снижать массу тела крыс достоверно, при этом группа с высокой частотой имеет наилучший эффект снижения массы.
Результаты, приведенные на фигуре 4B, показывают, что относительная масса висцерального жира крыс в нормальной контрольной группе была равна 38,7±7,4%, относительная масса висцерального жира крыс в контрольной группе, получавшей диету с высоким содержанием жиров, равна 100,0±16,2%, относительная масса висцерального жира крыс в группе с низкой частотой, группе с умеренной частотой и группе с высокой частотой равна 75,9±18,5%, 69,0±6,2% и 55,8±10,9%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительная масса висцерального жира крыс в группе с низкой частотой, группе с умеренной частотой и группе с высокой частотой во всех случаях могла быть достоверно снижена (p<0,05), что указывает на то, что разная частота введения может достоверно снижать массу висцерального жира крыс, при этом в группе с высокой частотой получили наилучший эффект.
Представленные выше эксперименты продемонстрировали, что комплексная фармацевтическая композиция куркумин-экстракт зеленого чая имеет значительный эффект на снижение массы и внутреннего жира, если частота введения комплексной фармацевтической композиции куркумин-экстракт зеленого чая составляет 4 раза, и чем выше частота введения, тем более значительно выражен эффект.
Как свидетельствует опыт автора изобретения, если частота введения, подходящая для крыс, равна от 4 до 8 раз, то частота введения, подходящая для людей, равна от 1 до 16 раз. Предпочтительно, частота введения, подходящая для людей, равна от 1 до 6 раз.
Предпочтительно, частота введения, подходящая для людей, равна от 1 до 12 раз каждые от 1 до 90 дней. Предпочтительно, частота введения, подходящая для людей, равна от 1 до 6 раз каждые от 1 до 90 дней. Или, предпочтительно, частота введения, подходящая для людей, равна от 3 до 60 раз каждые от 1 до 90 дней; и, предпочтительно, частота введения, подходящая для человека, равна от 6 до 42 раз каждые от 1 до 60 дней.
Эксперимент 11: Эффект комплексной фармацевтической композиции куркумин-ресвератрол, введенной разным группам
Комплексную фармацевтическую композицию куркумин-ресвератрол в настоящем эксперименте вводили крысам, которых кормили нормальной диетой и диетой с высоким содержанием жиров, соответственно, для оценки эффекта комплексной фармацевтической композиции куркумин-ресвератрол на крыс в разных группах.
Получение комплексной фармацевтической композиции куркумин-ресвератрол: смешивали 0,8 г куркумина, 0,2 г ресвератрола и 150-200 мл дихлорметана, и перемешивали при 150 до 500 rpm при комнатной температуре до полного растворения куркумина. Добавляли 30 г коллифора ELP (также известного, как ELP), и хорошо перемешивали при 100-300 rpm для испарения дихлорметана. После полного испарения дихлорметана, медленно добавляли физиологический раствор для инъекции для достижения общего объема 200 мл. Раствор хорошо перемешивали и получали комплексный раствор куркумин-ресвератрол, включавший ELP. Комплексный раствор куркумин-ресвератрол, включавший ELP, включал первые и второе мицеллы, концентрация куркумина была равна 4 мг/мл, концентрация ресвератрола была равна 1 мг/мл, и концентрация коллифора ELP (ELP) была приблизительно равна 15% (% по масс.), и массовое отношение куркумина, ресвератрола и ELP было равно 4: 1: 200,
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 16 крыс содержали на нормальной диете в течение 1-ой недели, давая возможность их массе достичь 175 до 200 г, затем крыс распределяли по 4-м группам, а именно, контрольная группа с нормальной диетой, контрольная группа, получавшая диету с высоким содержанием жиров, группа с нормальной диетой-комплексной фармацевтической композицией с ресвератролом и группа с диетой с высоким содержанием жиров-комплексной фармацевтической композицией с ресвератролом. Затем, крыс в контрольной группе с нормальной диетой и в группе с нормальной диетой-комплексной фармацевтической композицией с ресвератролом содержали на нормальной диете непрерывно в течение 14-ти дней. В то же время, крыс контрольной группы, получавших диету с высоким содержанием жиров, и группы диеты с высоким содержанием жиров-комплексной фармацевтической композицией с ресвератролом содержали на диете с высоким содержанием жиров в течение 14-ти дней, для стимуляции состояния животного, страдающего ожирением, и для увеличения массы тела вплоть до 400-450 г. После этого подкожные инъекции вводили следующим образом.
Контрольная группа с нормальной диетой и контрольная группа, получавшая диету с высоким содержанием жиров: физиологический раствор для инъекций вводили крысе с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, и день 11, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг).
Группа с нормальной диетой-комплексной фармацевтической композицией с ресвератролом и группа с диетой с высоким содержанием жиров-комплексной фармацевтической композицией с ресвератролом: комплексную фармацевтическую композицию куркумин-ресвератрол вводили крысе с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, день 11, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг), так чтобы сделать дозу на одну инъекцию равной 16 мг куркумина и 4 мг ресвератрола на килограмм массы тела (общая концентрация куркумина и экстракта зеленого чая, введенная на килограмм была равна 4 мл/кг × 5 мг/мл = 20 мг/кг, при этом массовое отношение куркумина к ресвератролу было равно 4:1, следовательно, введенный куркумин на килограмм массы тела был равен 20 мг/кг ÷ 5 × 4 = 16 мг, и введенный ресвератрол на килограмм массы тела был равен 20 мг/кг ÷ 5 × 1 = 4 мг).
Нормальную диету постоянно давали крысам в контрольной группе с нормальной диетой и в группе с нормальной диетой-комплексной фармацевтической композицией с ресвератролом на протяжении эксперимента, и диету с высоким содержанием жиров давали крысам контрольной группы, получавшей диету с высоким содержанием жиров, и в группе с диетой с высоким содержанием жиров-комплексной фармацевтической композицией с ресвератролом. Эксперимент проводили в общей сложности 20 дней, и крыс умерщвляли с помощью CO2 на день 21.
Экспериментальные результаты показали, что, по сравнению с контрольной группой с нормальной диетой, относительная масса висцерального жира крыс в группе с нормальной диетой-комплексной фармацевтической композицией с ресвератролом достоверно не снижалась, что указывает на то, что фармацевтическая композиция настоящего изобретения не может снижать массу тела нормальных крыс, и не может снижать массу висцерального жира нормальных крыс. По сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительный общий прирост массы и относительная масса висцерального жира крыс в группе с диетой с высоким содержанием жиров-комплексной фармацевтической композицией с ресвератролом во всех случаях достоверно снижались (p<0,05), что указывает на то, что фармацевтическая композиция настоящего изобретения может снижать массу тела крыс с избыточным весом или ожирением, и также может снижать массу висцерального жира крыс с избыточным весом или ожирением.
Представленные выше эксперименты продемонстрировали, что фармацевтическая композиция настоящего изобретения может иметь эффект только на снижение массы тела и массы висцерального жира у определенных групп, то есть, может оказывать эффект только на снижение массы тела и висцерального жира в группах с избыточным весом или страдающих ожирением.
Эксперимент 12: Эффект разных отношений комплексной композиции куркумин-ресвератрол на массу тела и массу висцерального жира крыс
Комплексную фармацевтическую композицию куркумин-ресвератрол по настоящему изобретению разделили на 12 пробирок, а именно, пробирка с куркумином, пробирка с ресвератролом и пробирка от 1’’ до 10’’, и получение композиции в каждой пробирке было по существу таком же, как экспериментальная процедура в эксперименте 11. Единственными отличиями были отношения куркумина к ресвератролу. Кроме того, концентрация коллифора ELP была равна 15%. Отношения куркумина к ресвератролу были такими, как показано в таблице 7.
Таблица 7. Массовые отношения и общие концентрации куркумина к ресвератролу в комплексных фармацевтических композициях куркумин-ресвератрол
(массовое отношение)
(мг/мл)
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 52-х крыс содержали на нормальной диете в течение трех дней, давая возможность их массе достичь 175-200 г, и затем кормили диетой с высоким содержанием жиров в течение 21-го дня для стимуляции состояния животного, страдающего ожирением, и для увеличения массы тела вплоть до 400-450 г. Крыс случайным образом разделяли на 13 групп, а именно, контрольная группа, получавшая диету с высоким содержанием жиров, группа куркумина, группа ресвератрола, и группа от OIR1 до OIR10, соответственно, по четыре крысы на группу, и не было никакой статистической разницы в массе в каждой группе крыс. Подкожные инъекции вводили следующим образом.
Контрольная группа, получавшая диету с высоким содержанием жиров: физиологический раствор для инъекции вводили крысам контрольной группы с высоким содержанием жиров с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, день 11, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг).
Группа куркумина, группа ресвератрола и группа от OIR1 до OIR10: фармацевтические композиции пробирки с куркумином, пробирки с ресвератролом и пробирки с 1’’ до 10’’ вводили крысе в группе куркумина, группе ресвератрола и группе от OIR1 до OIR10, соответственно, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, и день 11, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг) чтобы сделать дозу на одну инъекцию равной 20 мг на килограмм массы тела (общая концентрация куркумина и ресвератрола, введенная на килограмм массы тела, была равна 4 мл/кг × 5 мг/мл = 20 мг/кг).
Диету с высоким содержанием жиров последовательно давали на протяжении эксперимента, в течение 20-ти дней, крыс умерщвляли с помощью CO2 на день 21, и рассчитывали «относительный общий прирост массы» и «относительную массу висцерального жира».
Результаты, приведенные на фигуре 5A, показывают, что относительный общий прирост массы крыс в контрольной группе, получавшей диету с высоким содержанием жиров, был равен 100,0±11,1%, относительный общий прирост массы крыс в группе куркумина был равен 102,4±13%, относительный общий прирост массы крыс в группе ресвератрола был равен 96,3±3,2%, и относительный общий прирост массы крыс в группе от OIR1 до OIR10 были равны 104,4±9,7%, 81,7±7,6%, 74,2±13,4%, 73,7±11,2%, 60,4±6,3%, 75,4±6,1%, 80,2±7,1%, 79,5±7,5%, 80,9±11,2% и 86,3±2,8%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, разницы в относительном общем приросте массы крыс в группе куркумина и группе ресвератрола достоверно не снижались (p>0,05), что указывает на то, что если обеспечивают только куркумином или ресвератролом, то масса крысы не может быть достоверно снижена в условиях настоящего эксперимента. Однако по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительный общий прирост массы крыс в группе от OIR2 до OIR9 во всех случаях был достоверно снижен (p<0,05), что указывает на то, что если отношение куркумина к ресвератролу находится в диапазоне от 20:1 до 1:20, то масса тела крысы может быть достоверно снижена. Кроме того, по сравнению с группой куркумина или группой ресвератрола, относительный общий прирост массы крыс в группе от OIR2 до OIR9 во всех случаях был достоверно снижен (p<0,05), что указывает на то, что если отношение куркумина к ресвератролу находится в диапазоне от 20:1 до 1:20, то присутствует синергизм. Предпочтительно, если отношение куркумина к ресвератролу равно 4:1, присутствует предпочтительный синергизм.
Результаты, приведенные на фигуре 5B, показывают, что относительная масса висцерального жира крыс в контрольной группе, получавшей диету с высоким содержанием жиров, была равна 100,0±24,2%, относительная масса висцерального жира крыс в группе куркумина была равна 122,2±25,2%, относительная масса висцерального жира крыс в группе ресвератрола была равна 92,5±41,7%, и относительная масса висцерального жира крыс в группе от OIR1 до OIR10 была равна 105,8±15,4%, 83,6±17,1%, 79,4±14%, 76,9±11%, 60,5±18,2%, 72,7±10,4%, 73±12,1%, 68,4±5,2%, 86,1±17,1% и 75,8±6,3%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительная масса висцерального жира крыс в группе куркумина и группе экстракта ресвератрола достоверно не снижалась (p>0,05), что указывает на то, что обеспечение только куркумином или ресвератролом не может достоверно снижать висцеральный жир у крыс в условиях настоящего эксперимента. Однако по сравнению с группой куркумина и ресвератрола, относительная масса висцерального жира крыс в группе от OIR2 до OIR10 имела тенденцию к дальнейшему снижению, что указывает на то, что при той же суммарной концентрации лекарственного средства, совместное введение куркумина и ресвератрола крысам может способствовать достижению эффекта снижения количества висцерального жира крысы.
Эксперимент 13: Эффекты различных дозировок комплексной композиции куркумин-ресвератрол на массу тела и массу висцерального жира крыс
Получение комплексной фармацевтической композиции куркумин-ресвератрол настоящего эксперимента было таким же, как процедура для композиции пробирки 5’’ в эксперименте 12, то есть отношение куркумина к ресвератролу было равно 4:1 и концентрация коллифора ELP была равна о15%.
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 20 крыс содержали на нормальной диете в течение трех дней, давая возможность их массе достичь примерно 175-200 г, и затем крыс распределяли по 5-ти группам, а именно, нормальная контрольная группа, контрольная группа, получавшая диету с высоким содержанием жиров, группа с низкой дозировкой, группа со средней дозировкой и группа с высокой дозировкой. Затем, крыс в нормальной контрольной группе непрерывно кормили нормальной диетой в течение 21-го дня. В то же время, крыс в контрольной группе, получавшей диету с высоким содержанием жиров, группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой содержали на диете с высоким содержанием жиров в течение 21-го дня для стимуляции состояния животного, страдающим ожирением, и для увеличения массы тела вплоть до 400-450 г. После этого, подкожные инъекции вводили следующим образом.
Нормальная контрольная группа и контрольная группа, получавшая диету с высоким содержанием жиров: физиологический раствор для инъекций вводили крысе в нормальной контрольной группе и в контрольной группе, получавшей диету с высоким содержанием жиров с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, день 11, в общей сложности 6 инъекций, и доза на одну инъекцию была равна 8 мл на килограмм массы тела (8 мл/кг).
Группа с низкой дозировкой: комплексную фармацевтическую композицию куркумин-ресвератрол настоящего изобретения вводили крысе с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, и день 11, в общей сложности 6 инъекций, и доза на одну инъекцию была равна введению 2 мл на килограмм массы тела (2 мл/кг), чтобы сделать дозу на одну инъекцию равной 8 мг куркумина и 2 мг ресвератрола на килограмм массы тела.
Группа со средней дозировкой: Способ и частота введения были такими же, как для группы с низкой дозировкой, с единственным изменением в дозировке инъекции. Доза на одну инъекцию была равна введению 4 мл на килограмм массы тела (4 мл/кг), чтобы сделать дозу на инъекцию равной 16 мг куркумина и 4 мг ресвератрола на килограмм массы тела.
Группа с высокой дозировкой: Способ и частота введения были такими же, как для группы с низкой дозировкой, с единственным изменением в дозировке инъекции. Доза на одну инъекцию была равна введению 8 мл на килограмм массы тела (8 мл/кг), чтобы сделать дозу на инъекцию равной 32 мг куркумина и 8 мг ресвератрола на килограмм массы тела.
Диету с высоким содержанием жира последовательно давали на протяжении эксперимента, в течение 20-ти дней и крыс умерщвляли с помощью CO2 на день 21. Рассчитывали «относительный общий прирост массы» и «относительную массу висцерального жира» крыс в каждой группе.
Результаты, приведенные на фигуре 6A, показывают, что относительный общий прирост массы крыс в нормальной контрольной группе был равен 57,4±8,6%, относительный общий прирост массы крыс в контрольной группе, получавшей диету с высоким содержанием жиров, был равен 100,0±11,2%, относительный общий прирост массы крыс в группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой был равен 76,2±6,7%, 62,4±9,1% и 48,7±10,1%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительный общий прирост массы крыс в группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой во всех случаях достоверно снижался (p<0,05), что указывает на то, что различные дозировки комплексной фармацевтической композиции куркумин-ресвератрол во всех случаях могут достоверно снижать массу тела крыс, при этом, эффект снижения массы на группу с высокой дозировкой был наилучшим.
Результаты, приведенные на фигуре 6B, показывают, что относительная масса висцерального жира крыс в нормальной контрольной группе была равна 37,0±5,2%, относительная масса висцерального жира крыс в контрольной группе, получавшей диету с высоким содержанием жиров, была равна 100,0±32,2%, относительная масса висцерального жира крыс в группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой была равна 68,1±15,2%, 56,0±15,7%, и 46,9±7,2%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительная масса висцерального жира крыс в группе с низкой дозировкой, группе со средней дозировкой и группе с высокой дозировкой во всех случаях достоверно снижалась (p<0,05), что указывает на то, что различные дозировки комплексной фармацевтической композиции куркумин-ресвератрол во всех случаях могут эффективно снижать массу висцерального жира крыс, при этом группа с высокой дозировкой показала наилучший эффект.
Приведенные выше эксперименты демонстрируют, что комплексная фармацевтическая композиция куркумин-ресвератрол обладает значительным эффектом снижения массы и снижения висцерального жира, если дозировка комплексной фармацевтической композиции куркумин-ресвератрол была от 10 мг/кг, и чем выше была дозировка, тем более значительным был эффект.
Как свидетельствует опыт автора изобретения, если вводимые дозировки, подходящие для крыс, равны от 10 мг/кг до 40 мг/кг, то вводимые дозировки, подходящие для людей, равны от 0,1 до 80 мг/кг. Предпочтительно, дозировка введения для людей равна от 10 до 40 мг/кг.
Предпочтительно, дозировка введения для людей равна инъекции от 0,02 до 20 мг на см2. Предпочтительно, дозировка введения для людей равна инъекции от 0,04 до 16 мг на см2. Предпочтительно, дозировка введения для людей равна инъекции от 0,2 до 12 мг на см2. Предпочтительно, дозировка введения для людей равна инъекции от 0,4 до 8 мг на см2.
Предпочтительно, дозировка введения для людей равна инъекции от 0,01 до 40 мг на килограмм. Предпочтительно, дозировка введения для людей равна инъекции от 0,4 до 40 мг на килограмм. Предпочтительно, дозировка введения для людей равна инъекции от 0,8 до 20 мг на килограмм.
Эксперимент 14: Эффект частоты введения комплексной композиции куркумин-ресвератрол на массу тела и массу висцерального жира крыс
Получение комплексной фармацевтической композиции куркумин-ресвератрол настоящего эксперимента было таким же, как процедура для пробирки 5’’ в эксперименте 12, а именно, отношение куркумина к ресвератролу было равно 4:1, и концентрация кремофора ELP была равна 15%.
Для эксперимента применяли шестинедельных самцов крыс Sprague-Dawley. 20 крыс содержали на нормальной диете в течение трех дней, давая возможность их массе достичь 175-200 г, и затем крыс распределяли по 5-ти группам, а именно, нормальная контрольная группа, контрольная группа, получавшая диету с высоким содержанием жиров, группа с низкой частотой, группа с умеренной частотой и группа с высокой частотой. Затем, крыс в нормальной контрольной группе содержали на нормальной диете непрерывно в течение 21-го дня. В то же время, крыс в контрольной группе, получавшей диету с высоким содержанием жиров, группу с низкой частотой, группу с умеренной частотой и группу с высокой частотой содержали на диете с высоким содержанием жиров непрерывно в течение 21-го дня, для стимуляции состояния животного, страдающего ожирением, и для увеличения массы тела вплоть до 400-450 г. После этого, подкожные инъекции вводили следующим образом.
Нормальная контрольная группа и контрольная группа, получавшая диету с высоким содержанием жиров: физиологический раствор для инъекции вводили крысам в нормальной контрольной группе и в контрольной группе, получавшей диету с высоким содержанием жиров с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5, день 7, день 9, день 11, день 13, и день 15, в общей сложности 8 инъекции, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг).
Группа с низкой частотой: комплексную фармацевтическую композицию куркумин-ресвератрол по настоящему эксперименту вводили крысам с помощью подкожной инъекции, и места введения находились за ухом на спине, над лопаткой или под лопаткой крыс. Одну инъекцию в день вводили на день 1, день 3, день 5 и день 7 в эксперименте, в общей сложности 4 инъекции, и доза на одну инъекцию была равна 4 мл на килограмм массы тела (4 мл/кг), чтобы сделать дозу введения на инъекцию равной 16 мг куркумина и 4 мг ресвератрола на килограмм массы тела.
Группа с умеренной частотой: Способ и дозировка введения были такими же, как для группы с низкой частотой, с единственным изменением в частоте введения. Введение проводили один раз в день на день 1, день 3, день 5, день 7, день 9 и день 11 в эксперименте, в общей сложности 6 введений.
Группа с высокой частотой: Способ и дозировка введения были такими же, как для группы низкой частотой, с единственным изменением в частоте введения. Введение проводили один раз в день на день 1, день 3, день 5, день 7, день 9, день 11, день 13 и день 15 в эксперименте, в общей сложности 8 введений.
Диету с высоким содержанием жира последовательно давали на протяжении эксперимента, в течение 20-ти дней, крыс умерщвляли с помощью CO2 на день 21, и в каждой группе рассчитывали «относительный общий прирост массы» и «относительную массу висцерального жира» крыс.
Результаты, приведенные на фигуре 7A, показывают, что относительный общий прирост массы крыс в нормальной контрольной группе был равен 57,6±12,1%, относительный общий прирост массы крыс в контрольной группе, получавшей диету с высоким содержанием жиров, был равен 100,0±9,2%, относительный общий прирост массы крыс в группе с низкой частотой, группе с умеренной частотой и группе с высокой частотой был равен 87,5±15,8%, 66,2±13,0% и 53,7±11,7%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительный общий прирост массы крыс в группе с высокой частотой достоверно снижался (p<0,05), что указывает на то, что масса тела крысы может быть достоверно снижена, если частота введения была равна 8.
Результаты, приведенные на фигуре 7B, показывают, что относительная масса висцерального жира крыс в нормальной контрольной группе была равна 38,7±7,4%, относительная масса висцерального жира крыс в контрольной группе, получавшей диету с высоким содержанием жиров, была равна 100,0±16,2%, относительная масса висцерального жира крыс в группе с низкой частотой, группе с умеренной частотой и группе с высокой частотой была равна 72,2±13,7%, 66,8±4,5%, и 58,6±10,0%, соответственно. Среди них, по сравнению с контрольной группой, получавшей диету с высоким содержанием жиров, относительная масса висцерального жира крыс в группе с низкой частотой, группе с умеренной частотой и группе с высокой частотой во всех случаях достоверно снижалась (p<0,05), что указывает на то, что разная частота введения во всех случаях может достоверно снижать количество висцерального жира крысы, при этом эффект группы с высокой частотой был наилучшим.
Приведенные выше эксперименты демонстрируют, что комплексная фармацевтическая композиция куркумин-ресвератрол имеет значительный эффект снижения висцерального жира, если частота введения составляет четыре раза, и значительный эффект на снижение массы может быть достигнут, если частота введения составляет восемь раз.
Как свидетельствует опыт автора изобретения, если частота введения, подходящая для крыс, равна от 4 до 8 раз, то частота введения, подходящая для людей, равна от 1 до 16 раз. Предпочтительно, частота введения для людей равна от 1 до 6 раз.
Предпочтительно, частота введения для людей равна от 1 до 12 раз в течение от 1 до 90 дней. Предпочтительно, частота введения для людей равна от 1 до 6 раз в течение от 1 до 90 дней. Или, предпочтительно, частота введения для людей равна от 3 до 60 раз в течение от 1 до 90 дней; предпочтительно, частота введения для людей равна от 6 до 42 раз в течение от 1 до 60 дней.
Как показано на примерах настоящего изобретения, простая фармацевтическая композиция с куркумином, комплексная фармацевтическая композиция куркумин-ресвератрол, комплексная фармацевтическая композиция куркумин-экстракт зеленого чая, комплексная фармацевтическая композиция куркумин-другое липофильное лекарственное средство и комплексная фармацевтическая композиция куркумин-гидрофильное (водорастворимое) лекарственное средство, обеспеченная настоящим изобретением, и другие фармацевтические композиции, обеспеченные настоящим изобретением, все могут снижать массу тела и количество висцерального жира. Следовательно, простая фармацевтическая композиция с куркумином, комплексная фармацевтическая композиция куркумин-ресвератрол, комплексная фармацевтическая композиция куркумин-экстракт зеленого чая, комплексная фармацевтическая композиция куркумин-другое липофильное лекарственное средство и комплексная фармацевтическая композиция куркумин-гидрофильное лекарственное средство, обеспеченная настоящим изобретением, и другие фармацевтическая композиции, обеспеченные настоящим изобретением могут быть применены для получения подкожных имплантируемых устройств, подкожных имплантатов, растворов для имплантированной инфузии, крема или пластырей, которые могут быть введены субъекту для снижения массы тела или телесного жира субъекта.
Предпочтительно, простая фармацевтическая композиция с куркумином, комплексная фармацевтическая композиция куркумин-ресвератрол, комплексная фармацевтическая композиция куркумин-экстракт зеленого чая, комплексная фармацевтическая композиция куркумин-другое липофильное лекарственное средство и комплексная фармацевтическая композиция куркумин-гидрофильное лекарственное средство, обеспеченная настоящим изобретением, и другие фармацевтическая композиции, обеспеченные настоящим изобретением, могут снижать массу тела или телесный жир субъекта с помощью подкожной инъекции или подкожной инъекции в жировой слой. Таким образом, простая фармацевтическая композиция с куркумином, комплексная фармацевтическая композиция куркумин-ресвератрол, комплексная фармацевтическая композиция куркумин-экстракт зеленого чая, комплексная фармацевтическая композиция куркумин-другое липофильное лекарственное средство и комплексная фармацевтическая композиция куркумин-гидрофильное лекарственное средство, и другие фармацевтическая композиции, обеспеченные настоящим изобретением, могут быть применены для получения композиции для подкожной инъекции в жировой слой или композиции для подкожных инъекций для снижения массы тела или телесного жира.
Приведенные выше описания представляют собой просто предпочтительные воплощения настоящего изобретения и не предназначены для ограничения объема патентной заявки настоящего изобретения. Следовательно, любое изменение или модификация, которые не отступают от сущностей, раскрытых в настоящем документе, должны быть включены в объем патентной заявки настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Геропротекторная кормовая добавка | 2021 |
|
RU2770470C1 |
| СОЛЮБИЛИЗАТ С КУРКУМИНОМ И ПРИ НЕОБХОДИМОСТИ ПО МЕНЬШЕЙ МЕРЕ С ОДНИМ ДРУГИМ АКТИВНЫМ ВЕЩЕСТВОМ | 2018 |
|
RU2752078C1 |
| НУТРИЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2017 |
|
RU2654868C1 |
| Водорастворимая композиция на основе куркумина | 2023 |
|
RU2816692C1 |
| КОМПОЗИЦИЯ ДЛЯ УХОДА ЗА СУСТАВОМ | 2014 |
|
RU2657434C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ФИТОНУТРИЕНТОВ С ПОВЫШЕННОЙ БИОДОСТУПНОСТЬЮ, ОБЛАДАЮЩАЯ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2494733C1 |
| КОМПОЗИЦИИ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ОБЛЕГЧЕНИЯ СИНДРОМОВ МНОЖЕСТВЕННЫХ ФАКТОРОВ РИСКА | 2001 |
|
RU2291707C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ | 2012 |
|
RU2631597C2 |
| СРЕДСТВО И СПОСОБ КОМПЛЕКСНОЙ ТЕРАПИИ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ | 2012 |
|
RU2548731C2 |
| СПОСОБ УЛУЧШЕНИЯ ТЕРАПЕВТИЧЕСКОЙ ЭФФЕКТИВНОСТИ КУРКУМИНОИДОВ И ИХ АНАЛОГОВ | 2008 |
|
RU2491084C2 |
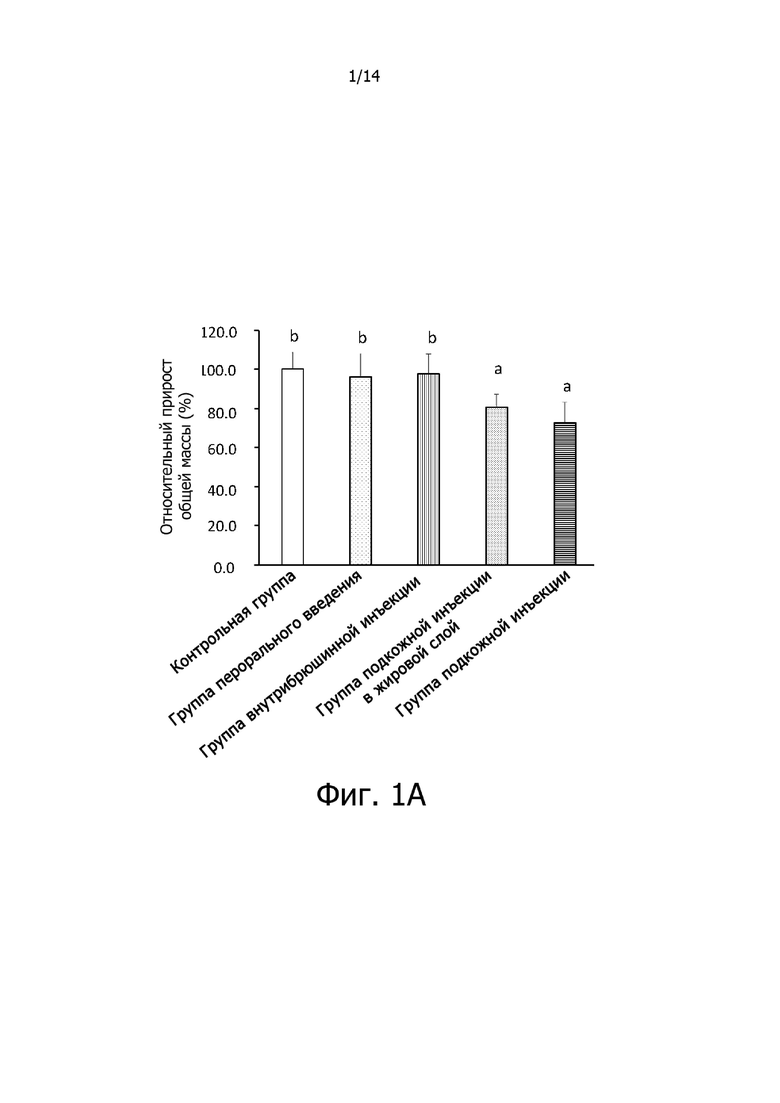
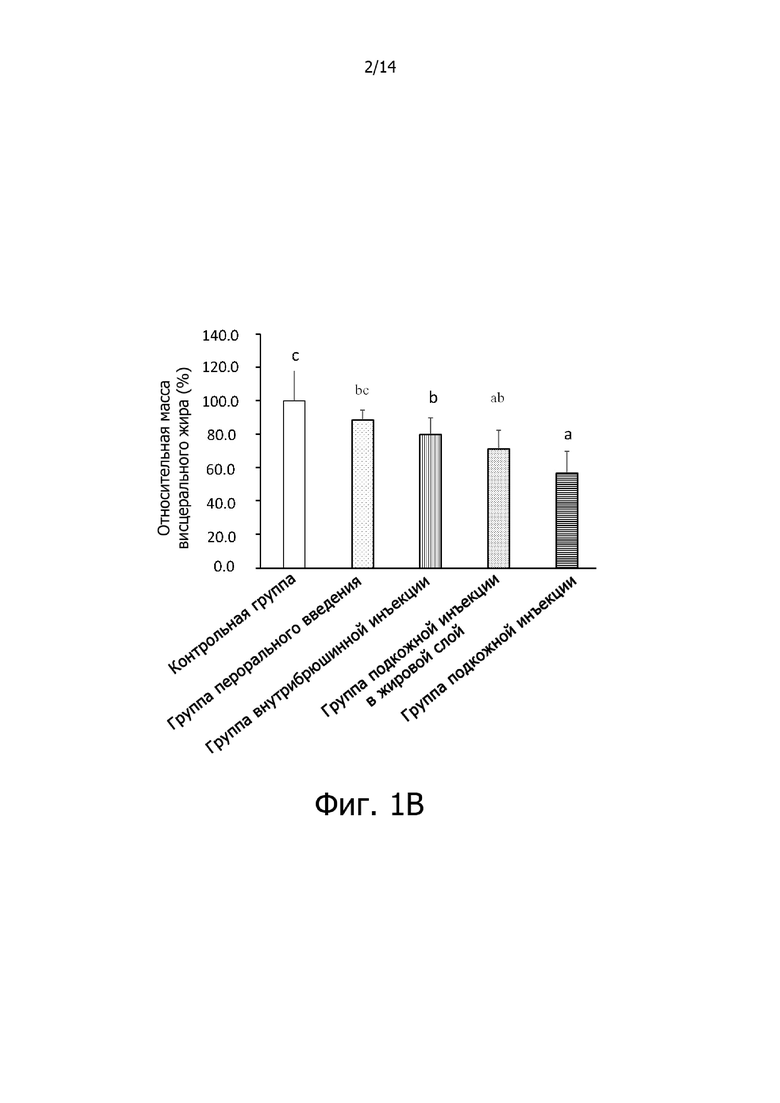
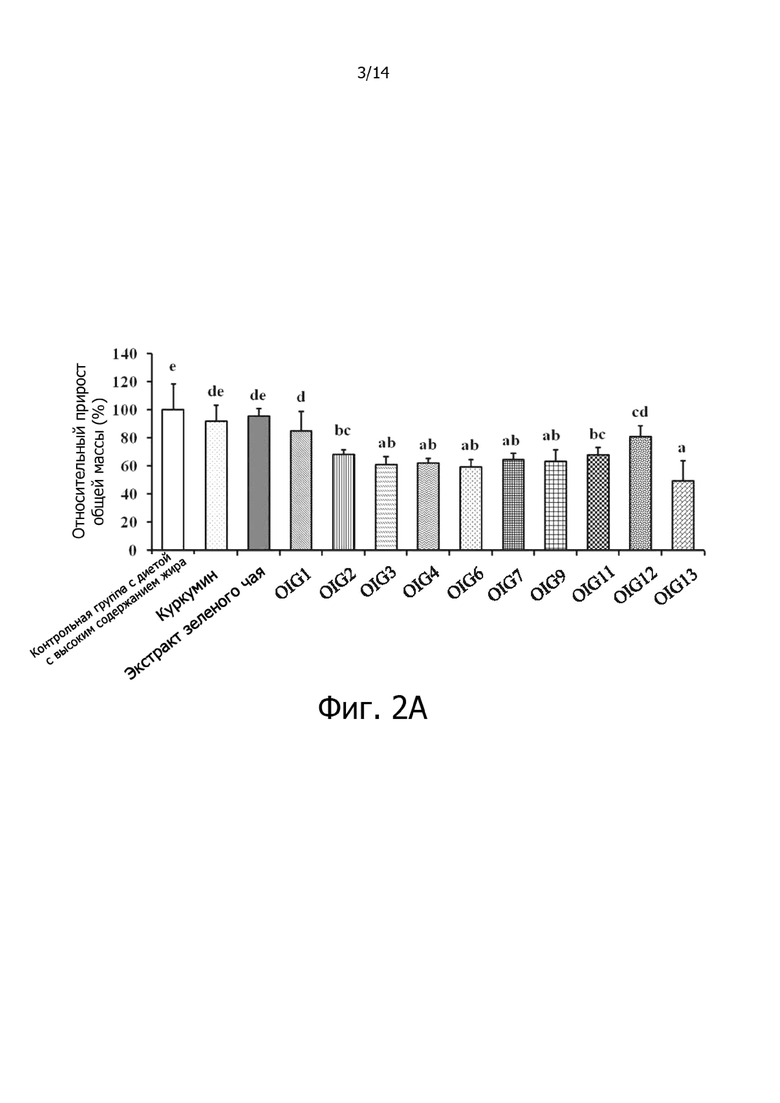
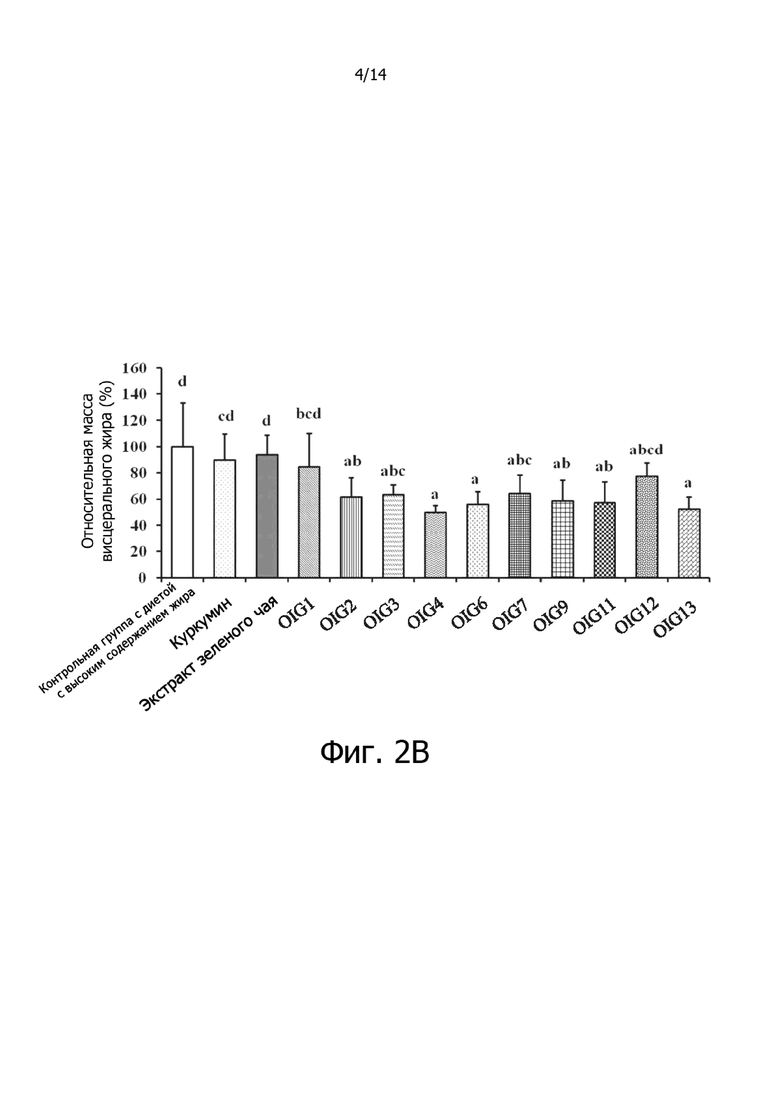
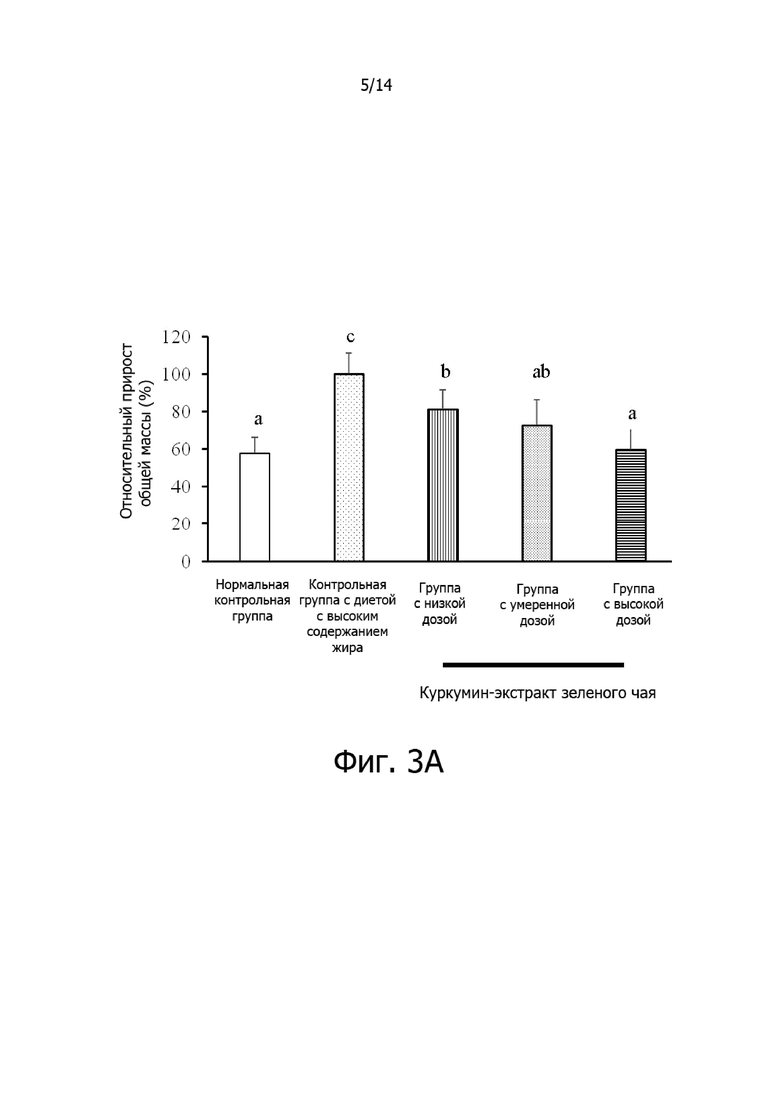
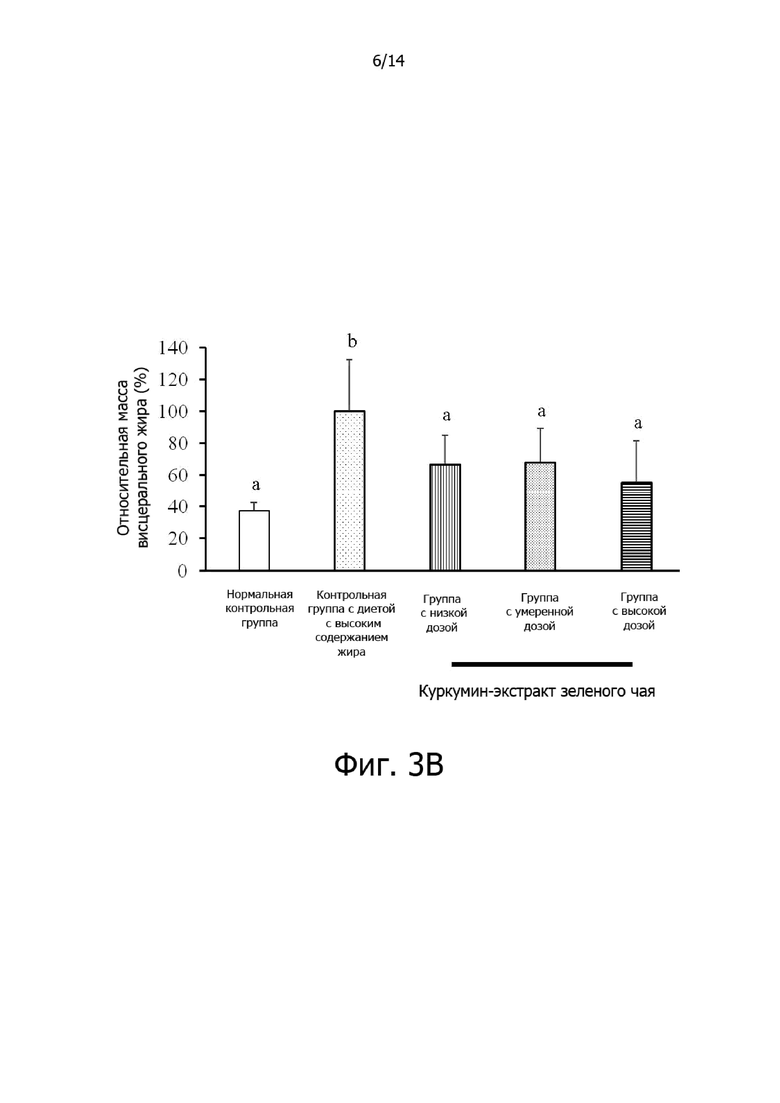
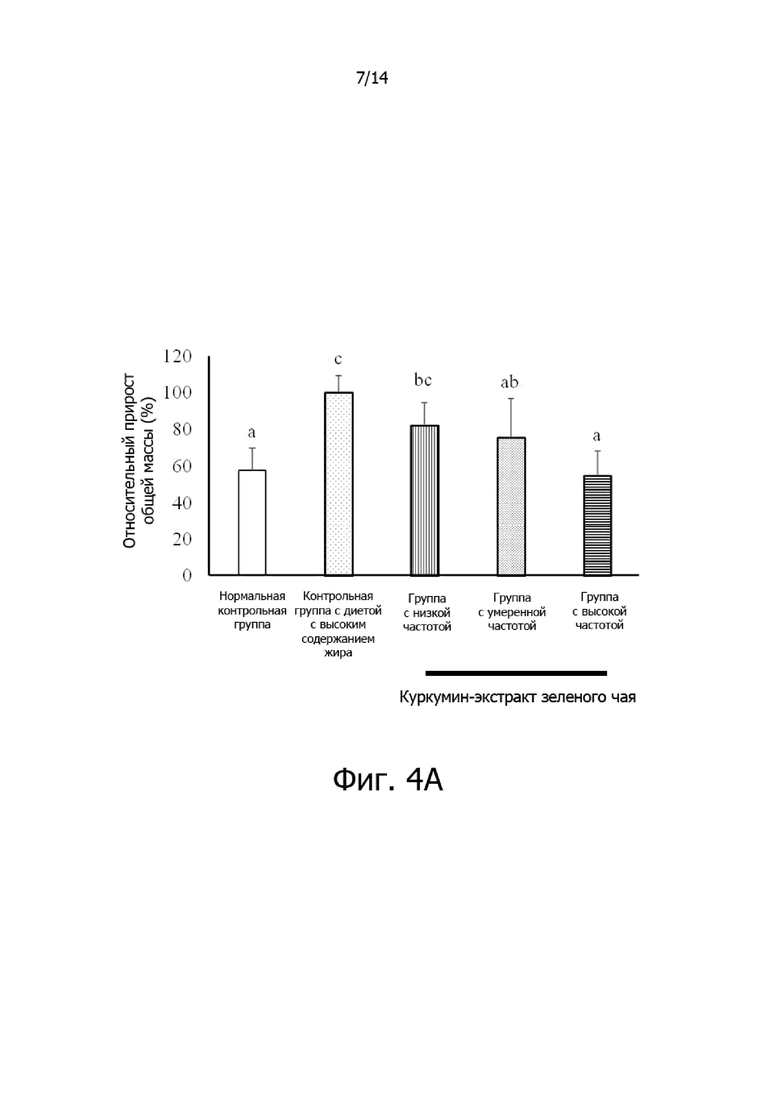
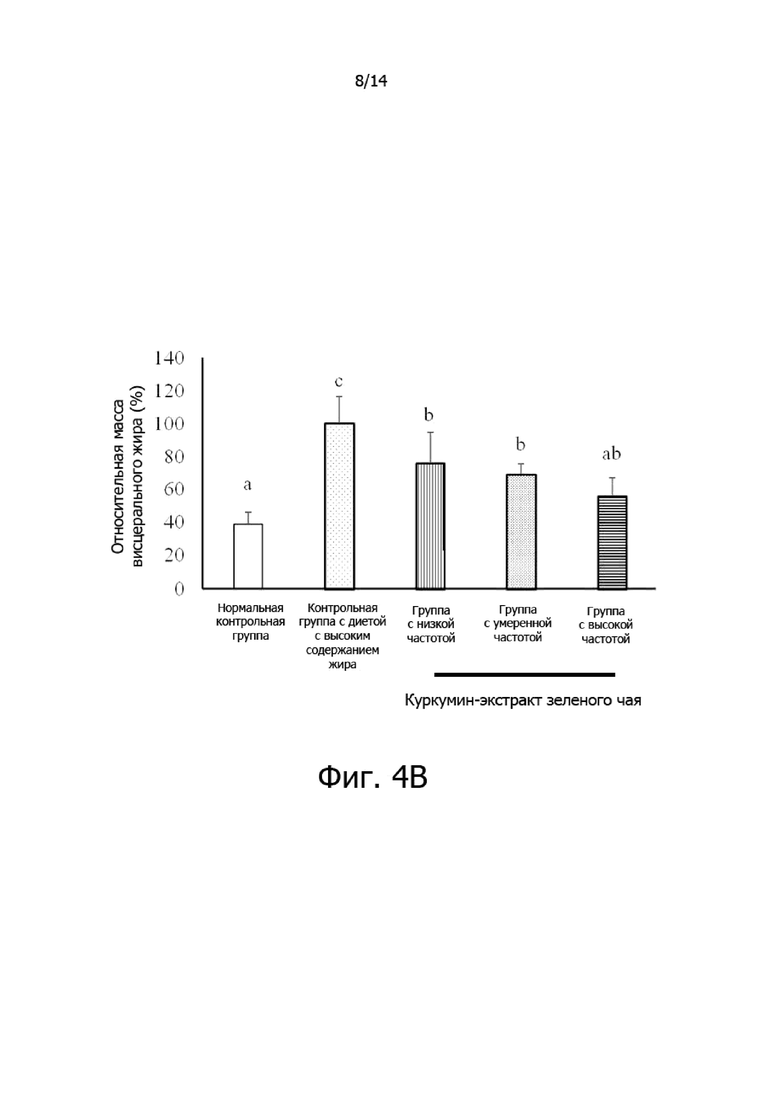
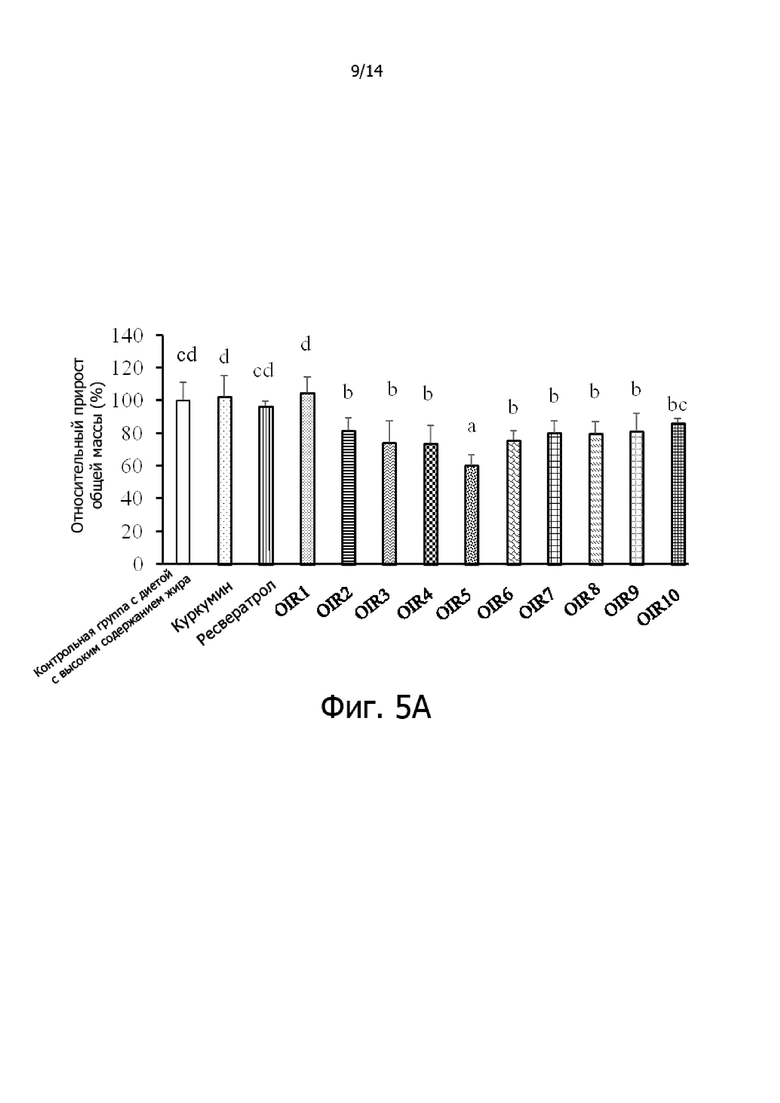
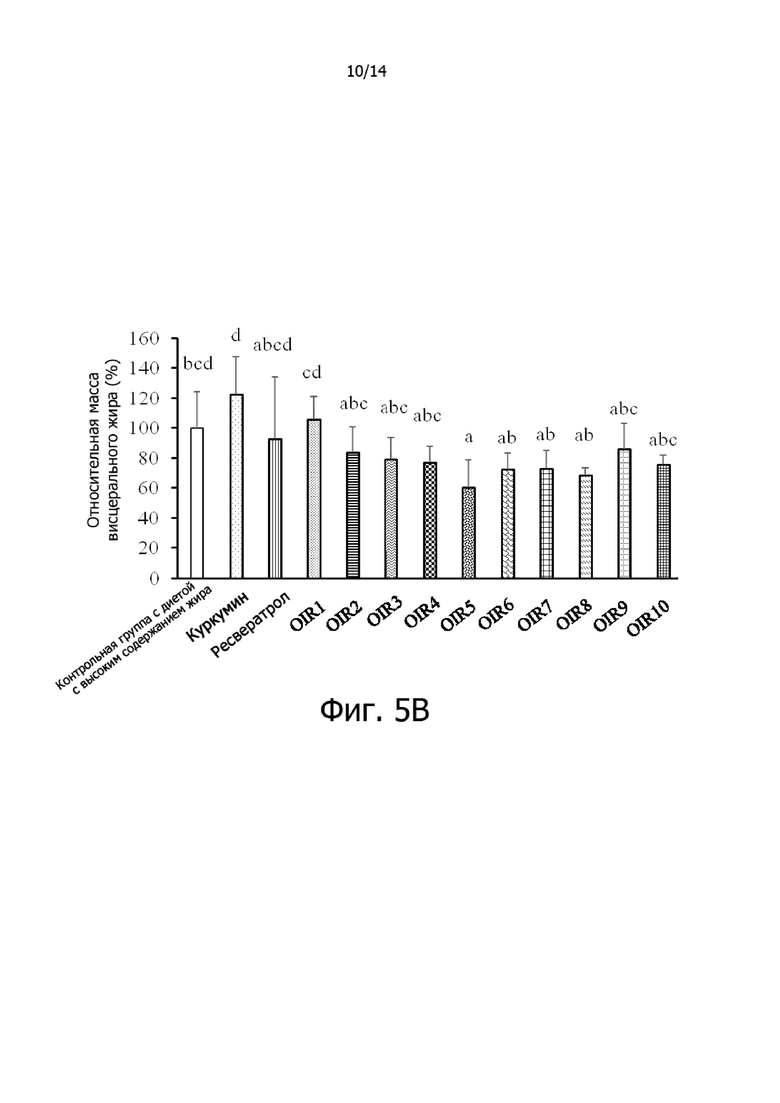
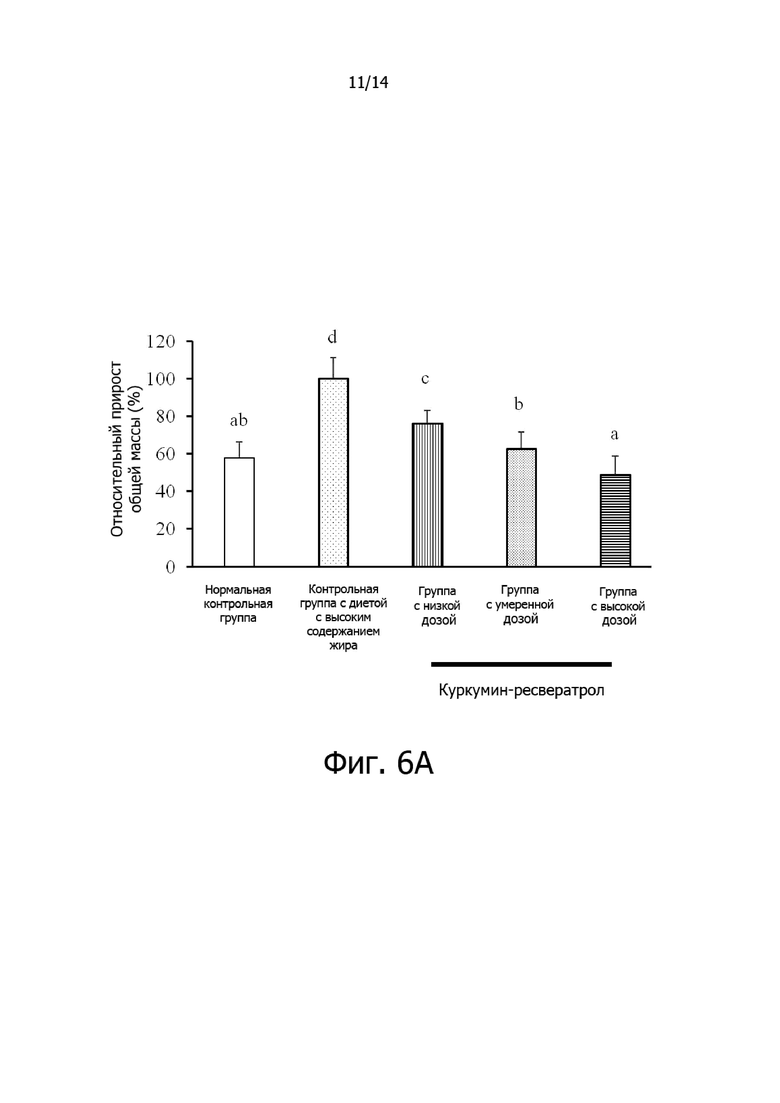
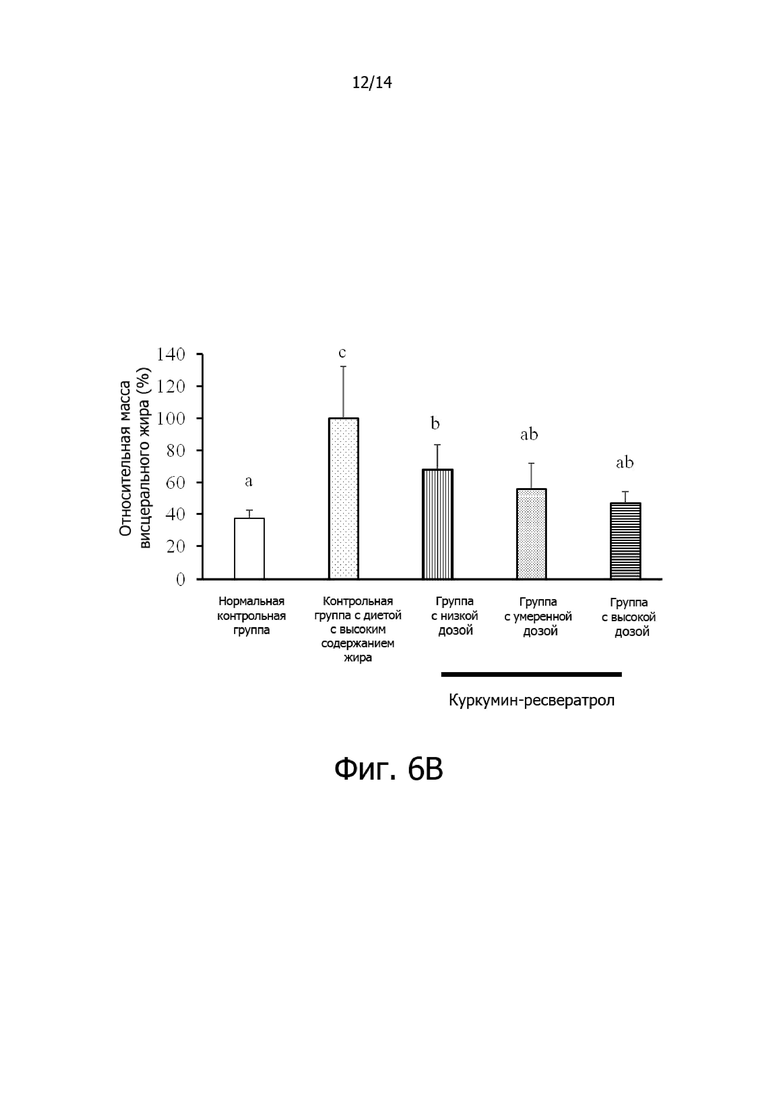
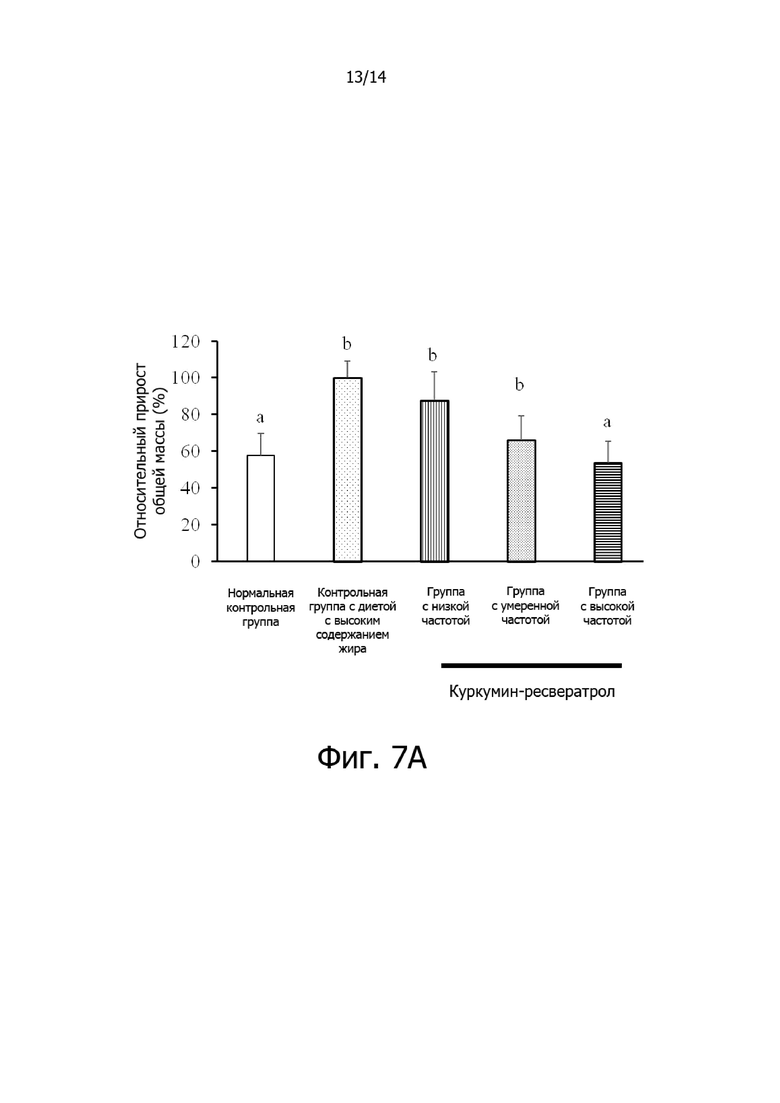
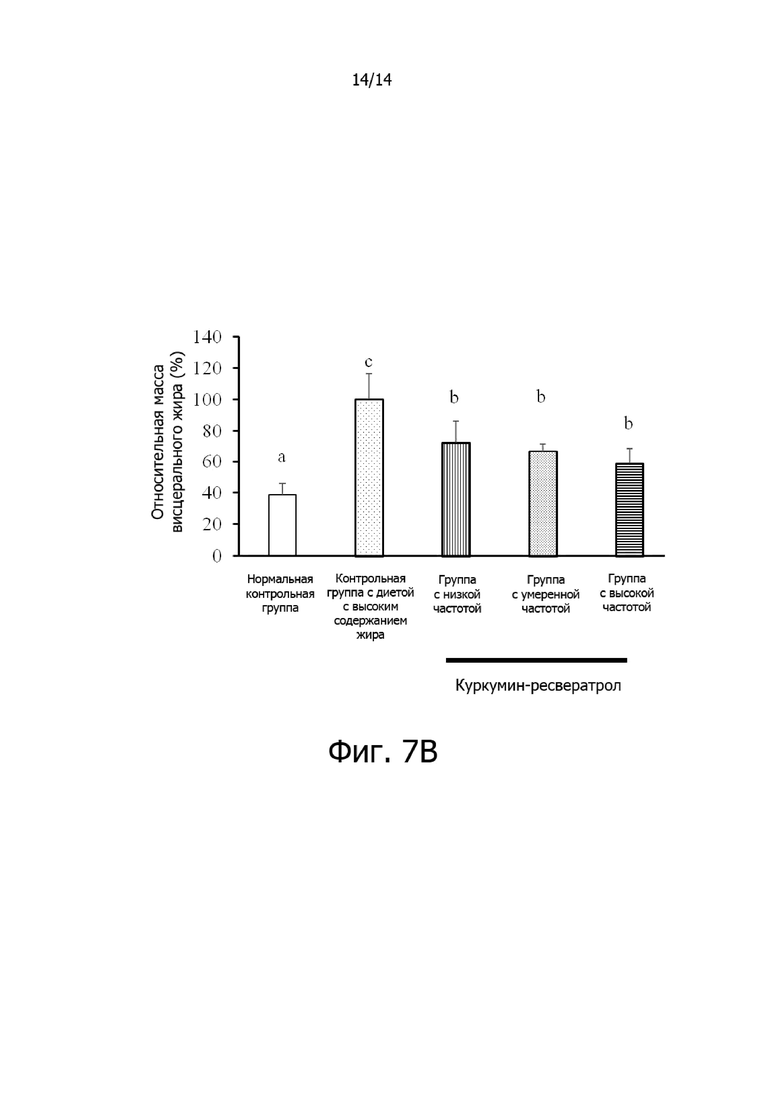
Группа изобретений относится к области фармацевтики, а именно к композициям для подкожных инъекций для снижения массы тела субъекта с избыточной массой или ожирением. Предложено применение композиции, включающей куркуминоид или куркуминоиды и фармацевтически приемлемое производное полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоат, образующие множество содержащих куркуминоид мицелл, которые равномерно распределены в фармацевтически приемлемом водном растворе, в производстве состава для подкожных инъекций для снижения массы тела субъекта с избыточной массой или ожирением. При этом значение гидрофильно-липофильного баланса (значение ГЛБ) фармацевтически приемлемого производного полиоксиэтиленового касторового масла больше 10, а общая концентрация куркуминоида или куркуминоидов в содержащих куркуминоиды мицеллах в составе для подкожных инъекций равна от 0,4 до 167 мг/г. Предложен также вариант применения указанной композиции, содержащей дополнительно ресвератрол. Группа изобретений также относится к способам снижения массы тела субъекта с избыточной массой или ожирением, включающим введение указанных составов для подкожных инъекций. Группа изобретений позволяет снижать массу тела и висцерального жира у субъектов с избыточным весом или страдающих ожирением, и имеет преимущества низких доз, высокой стабильности, высокой биодоступности для жировой ткани, незначительных побочных эффектов и замедленного высвобождения. 4 н. и 26 з.п. ф-лы, 7 ил., 7 табл., 14 пр.
1. Применение композиции, включающей:
куркуминоид или куркуминоиды,
фармацевтически приемлемое производное полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоат, при этом значение гидрофильно-липофильного баланса (значение ГЛБ) фармацевтически приемлемого производного полиоксиэтиленового касторового масла больше 10, и
фармацевтически приемлемый водный раствор,
фармацевтически приемлемое производное полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоат и куркуминоид или куркуминоиды вместе образуют множество содержащих куркуминоид мицелл, содержащие куркуминоид мицеллы равномерно распределены в фармацевтически приемлемом водном растворе,
причем общая концентрация куркуминоида или куркуминоидов в содержащих куркуминоиды мицеллах в составе для подкожных инъекций равна от 0,4 до 167 мг/г,
в производстве состава для подкожных инъекций для снижения массы тела субъекта с избыточной массой или ожирением.
2. Применение по п. 1, при котором фармацевтически приемлемый водный раствор дополнительно включает катехины.
3. Применение по п. 1, при котором общая концентрация куркуминоида или куркуминоидов в содержащих куркуминоиды мицеллах в композиции для подкожных инъекций равна от 0,5 до 111 мг/г, или общая концентрация куркуминоида или куркуминоидов в содержащих куркуминоиды составах для подкожных инъекций равна от 2 до 91 мг/г.
4. Применение по п. 2, при котором концентрация катехинов в составе для подкожных инъекций равна от 0,04 до 835 мг/г.
5. Применение по п. 4, при котором концентрация катехинов в составе для подкожных инъекций равна от 0,15 до 733 мг/г.
6. Применение по п. 2, при котором катехины представляют собой по меньшей мере одно из следующего эпигаллокатехина галлат, эпикатехин, эпикатехина галлат, эпигаллокатехин, галлокатехин галлат, галлокатехин, катехин галлат и катехин, или их комбинацию.
7. Применение по п. 2, при котором массовое отношение куркуминоида или куркуминоидов к катехинам в составе для подкожных инъекций равно от 50:1 до 1:20.
8. Применение по п. 7, при котором массовое отношение куркуминоида или куркуминоидов к катехинам в составе для подкожных инъекций равно от 30:1 до 1:10, или массовое отношение куркуминоида или куркуминоидов к катехинам в составе для подкожных инъекций равно от 10:1 до 1:4, или массовое отношение куркуминоида или куркуминоидов к катехинам в композиции для подкожных инъекций равно от 7:1 до 1:4.
9. Применение по п. 1, при котором массовое отношение куркуминоида или куркуминоидов к производному полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоату равно в составе для подкожных инъекций от 1:5 до 1:750.
10. Применение по п. 1, при котором производное полиоксиэтиленового касторового масла представляет собой по меньшей мере одно из следующего: полиоксил-35 касторовое масло, полиоксил-40 гидрированное касторовое масло или их комбинацию.
11. Применение по п. 1, при котором композиция дополнительно включает по меньшей мере одно из следующего: сорастворитель, суспендирующее средство и вспомогательное вещество в масляной фазе, или их комбинацию.
12. Применение по п. 11, при котором микроструктура содержащей куркуминоид мицеллы в совокупности образована из производного полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоата и по меньшей мере одного из следующего: вспомогательное вещество в масляной фазе и сорастворитель.
13. Применение по п. 1, при котором куркуминоид представляет собой куркумин.
14. Способ снижения массы тела субъекта с избыточной массой или ожирением, включающий введение субъекту состава для подкожных инъекций, охарактеризованного в пп. 1-13, где доза введения состава для подкожных инъекций равна от 0,15 до 40 миллиграмм на килограмм для инъекции.
15. Способ по п. 14, в котором доза введения состава для подкожных инъекций равна от 0,25 до 25 миллиграмм на килограмм для инъекции.
16. Способ по п. 14 или 15, в котором частота введения состава для подкожных инъекций в месте введения субъекта равна от 1 до 6 раз каждые от 1 до 90 дней.
17. Применение композиции включающей:
куркуминоид или куркуминоиды,
ресвератрол,
фармацевтически приемлемое производное полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоат, значение гидрофильно-липофильного баланса (значение ГЛБ) фармацевтически приемлемого производного полиоксиэтиленового касторового масла больше 10, и
фармацевтически приемлемое поверхностно-активное вещество,
фармацевтически приемлемое производное полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоат и куркуминоид или куркуминоиды совместно формируют множество содержащих куркуминоид мицелл, и фармацевтически приемлемое поверхностно-активное вещество и ресвератрол совместно формируют множество содержащих ресвератрол мицелл,
причем общая концентрация куркуминоида или куркуминоидов, инкапсулированных в содержащие куркуминоиды мицеллы, в составе для подкожных инъекций равна от 0,4 до 167 мг/г,
в производстве состава для подкожных инъекций для снижения массы тела субъекта с избыточным весом или ожирением.
18. Применение по п. 17, при котором общая концентрация ресвератрола, инкапсулированного в содержащие ресвератрол мицеллы в составе для подкожных инъекций, равна от 0,2 до 733 мг/г.
19. Применение по п. 17, при котором сумма общей концентрации куркуминоида или куркуминоидов, инкапсулированных в содержащие куркуминоиды мицеллы, и общая концентрация ресвератрола, инкапсулированного в содержащие ресвератрол мицеллы, в составе для подкожных инъекций равна от 0,6 до 900 мг/г.
20. Применение по п. 17, при котором отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в содержащие куркуминоиды мицеллы, к общей массе ресвератрола, инкапсулированного в содержащие ресвератрол мицеллы, в составе для подкожных инъекций равна от 50:1 до 1:30.
21. Применение по п. 20, при котором отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в содержащие куркуминоиды мицеллы, к общей массе ресвератрола, инкапсулированного в содержащие ресвератрол мицеллы, в составе для подкожных инъекций равна от 20:1 до 1:20.
22. Применение по п. 17, при котором отношение общей массы куркуминоида или куркуминоидов, инкапсулированных в содержащие куркуминоиды мицеллы, к общей массе производного полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоата в составе для подкожных инъекций равно от 1:5 до 1:750.
23. Применение по п. 17, при котором композиция дополнительно включает по меньшей мере одно из следующего: сорастворитель, суспендирующее средство и вспомогательное вещество в масляной фазе или их комбинацию.
24. Применение по п. 23, при котором микроструктура содержащей куркуминоид мицеллы совместно образуется из производного полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоата и по меньшей мере одного из следующего: вспомогательное вещество в масляной фазе и сорастворитель.
25. Применение по п. 17, при котором фармацевтически приемлемое поверхностно-активное вещество представляет собой фармацевтически приемлемое второе производное полиоксиэтиленового касторового масла или 2-гидроксиэтил-12-гидроксиоктадеканоат, и значение гидрофильно-липофильного баланса (значение ГЛБ) второго производного полиоксиэтиленового касторового масла больше 10.
26. Применение по п. 17 или 25, при котором производное полиоксиэтиленового касторового масла представляет собой по меньшей мере одно из следующего: полиоксил-35 касторовое масло, полиоксил-40 гидрированное касторовое масло или их комбинацию, или второе производное полиоксиэтиленового касторового масла представляет собой по меньшей мере одно из следующего: полиоксил-35 касторовое масло, полиоксил-40 гидрированное касторовое масло или их комбинацию.
27. Применение по п. 17, при котором куркуминоид представляет собой куркумин.
28. Способ снижения массы тела субъекта с избыточной массой или ожирением, включающий введение субъекту состава для подкожных инъекций, охарактеризованного в пп. 17-27, где доза введения состава для подкожных инъекций равна от 0,15 до 40 миллиграмм на килограмм для инъекции.
29. Способ по п. 28, в котором доза введения состава для подкожных инъекций равна от 0,25 до 25 миллиграмм на килограмм для инъекции.
30. Способ по п. 28 или 29, в котором частота введения состава для подкожных инъекций в месте введения субъекта равна от 1 до 6 раз каждые от 1 до 90 дней.
| WO 2016029870 A1, 03.03.2016 | |||
| US 20150306165 A1, 29.10.2015 | |||
| US 20050267221 A1, 01.12.2005 | |||
| US 20090324703 A1, 31.12.2009 | |||
| WO 2010106191 A1, 23.09.2010 | |||
| HU L | |||
| et al | |||
| Enhancement of Oral Bioavailability of Curcumin by a Novel Solid Dispersion System | |||
| AAPS PharmSciTech., 2015 Dec, 16(6), pp.1327-34, doi: 10.1208/s12249-014-0254-0., Epub 2015 Mar |
Авторы
Даты
2021-08-17—Публикация
2017-08-25—Подача