Область техники
Настоящее изобретение относится к области биотехнологии и, в частности, к микрокапсулам, содержащим пробиотики и обеспечивающим поддержание их активности, и к способу их получения.
Предпосылки изобретения
Кишечник представляет собой самый большой из органов пищеварения и органов выведения токсинов в организме человека; состояние кишечника определяет цвет лица и красоту человека. В развернутом состоянии площадь желудочно-кишечного тракта организма человека по величине соответствует площади теннисного корта, при этом тонкая кишка в длину составляет приблизительно 4-6 метров, а толстая кишка в длину составляет приблизительно 1,5 метра. Кишечник также является наибольшим органом иммунной системы в организме человека, содержит наибольшую микроэкологическую систему в организме человека и обеспечивает приблизительно 80% иммунитета, при этом вес нормальной микрофлоры в нем составляет приблизительно 1,5 кг, количество микроорганизмов достигает 100 триллионов, а количество видов микрофлоры составляет 500-1000. Кишечник организма человека фактически представляет собой органическую структуру, основанную на симбиозе самих органов с находящимися в них популяциями микроорганизмов, при этом в кишечнике сохраняется динамическое равновесие полезной микрофлоры и вредной микрофлоры, что может способствовать перевариванию пищи, возникновению иммунных факторов и усилению аутоиммунной реакции организма; способствовать синтезу некоторых витаминов, улучшать усвоение лактозы, оберегать организм человека от вредного воздействия патогенных микроорганизмов, содействовать перистальтике кишечника и тормозить гниение внутри кишечника. Кишечный барьер является важным биологическим барьером организма человека; дисбаланс микрофлоры кишечника приводит к повреждению кишечного барьера, и сквозь него проникают вредные бактерии или эндотоксины, что вызывает воспалительную реакцию и разного рода недомогания. Результаты современных медицинских исследований говорят нам, что «старение начинается с кишечника» и «рак кишечника, рак молочной железы, пороки сердца, гипертония, старческое слабоумие и другие серьезные заболевания у взрослых тесно связаны со здоровьем кишечника».
По мере развития общества образ жизни и структура питания людей претерпевают колоссальные изменения; длительное использование компьютеров, мобильных телефонов и других электронных устройств, большое давление на работе, позднее засыпание при работе сверхурочно, очень редкие занятия спортом или физическими упражнениями, регулярное употребление сырой, холодной, острой и прочей вызывающей раздражение пищи, нерегулярное питание или чрезмерное употребление алкоголя будут приводить к недостаточному кровоснабжению желудочно-кишечного тракта, снижению иммунитета и уменьшению численности полезной микрофлоры кишечника, что вызовет ухудшение состояния здоровья.
Пробиотики представляют собой полезные микроорганизмы, обладающие биологической активностью; после приема в достаточном количестве они могут улучшать микроэкологическое равновесие в кишечнике хозяина и, кроме того, оказывать на здоровье хозяина благотворное влияние. В последние годы отрасль производства пробиотиков стремительно развивается, и они уже применяются в лекарственных средствах, пищевых продуктах, продуктах для поддержания здоровья и во многих других областях. В области медицины пробиотики в основном применяют для лечения диареи, запора, вагинита и других заболеваний; в пищевой промышленности пробиотики широко применяются с целью обеспечения брожения для получения пищевых продуктов с особым вкусом, например традиционных йогуртов, кисломолочных напитков, маринадов, столового уксуса, китайской водки и т. п.; в промышленности по производству продуктов для поддержания здоровья пробиотики производят в виде таблеток, капсул, гранул, порошков и т. п. для реализации разнообразных функций в отношении поддержания здоровья.
Чтобы пробиотики полностью выполняли свои функции по поддержанию здоровья и обеспечивали пробиотические функции, при потреблении человеком, они должны сохранять достаточную биологическую активность, при этом количество потребляемых живых клеток пробиотиков должно составлять 106 КОЕ/г, а согласно официальному стандарту, предложенному Всемирной организацией по продовольствию, по меньшей мере 106-107 КОЕ/г. Сегодня живые пробиотические бактерии, находящиеся в жидкой среде, при температуре 4°С или ниже могут храниться 3-14 дней; при применении традиционного способа инкапсулирования пробиотических бактерий в сухое обезжиренное молоко их срок хранения при температуре 4°С обычно составляет 42 дня, и очень трудно добиться явного улучшения. В качестве пробиотиков широко применяют лактобактерии (например, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus bulgaricus и т. п.), стрептококки (например, Streptococcus thermophilus и т. п.) и бифидобактерии (например, Bifidobacterium bifidum, Bifidobacterium infantis, Bifidobacterium longum, Bifidobacterium breve, Bifidobacterium adolescentis и т. п.), которые при хранении легко поддаются воздействию внешней среды и инактивируются, поэтому то, как поддерживать активность соответствующих штаммов и увеличить срок хранения, стало технически тяжелой задачей, общепризнанной в отношении подобной продукции.
Суть изобретения
Техническая задача, решаемая с помощью настоящего изобретения, заключается в предоставлении с учетом предшествующего уровня техники микрокапсул, содержащих пробиотики, которые могут обеспечивать уменьшение отрицательного влияния факторов среды на активность пробиотиков и более длительное поддержание активности соответствующих штаммов, и как следствие повышают качество пробиотического препарата.
Еще одна техническая задача, решаемая с помощью настоящего изобретения, заключается в предоставлении с учетом предшествующего уровня техники способа получения указанных микрокапсул, содержащих пробиотики, которые могут обеспечивать уменьшение отрицательного влияния факторов среды на активность пробиотиков и более длительное поддержание активности соответствующих штаммов, и как следствие повышают качество пробиотического препарата.
Техническое решение, применяемое согласно настоящему изобретению для решения указанных технических задач, является следующим: микрокапсулы, содержащие пробиотики и обеспечивающие поддержание их активности, которые содержат содержимое и материал стенки, покрывающий содержимое снаружи, при этом указанный содержимое представляет собой пробиотики, характеризующиеся тем, что указанный материал стенки содержит первый материал стенки, покрывающий содержимое снаружи, и второй материал стенки, покрывающий первый материал стенки снаружи.
Указанный первый материал стенки содержит следующие компоненты: казеин, мальц-экстракт и ксилоолигосахарид;
указанный второй материал стенки содержит следующие компоненты: полисахарид Tremella fuciformis, полисахарид Bletilla striata, полисахарид Atractylodes macrocephala, гуаровую камедь и пектин.
После разбавления указанных первого и второго материалов стенки стерилизованной водой в качестве растворителя, где количество воды в 3-5 раз больше массы материалов стенки, с получением смешанных растворов осуществляют инкапсулирование.
В указанном решении массовое соотношение указанных пробиотиков и первого материала стенки составляет 1:(0,5-2); по весу в указанном первом материале стенки казеин составляет 5-15 частей, мальц-экстракт составляет 1-6 частей и ксилоолигосахарид составляет 0,5-3 части. Массовое соотношение указанных пробиотиков и второго материала стенки составляет 1:(0,5-1,5); по весу в указанном втором материале стенки полисахарид Tremella fuciformis составляет 2-8 частей, полисахарид Bletilla striata составляет 2-5 частей, полисахарид Atractylodes macrocephala составляет 3-6 частей, гуаровая камедь составляет 0,2-0,6 части и пектин составляет 0,6-1,2 части. Согласно настоящему изобретению за счет лучшего регулирования массового соотношения пробиотических бактерий и первого материала стенки и второго материала стенки, а также соотношения компонентов в каждом из материалов стенки, обеспечивается хорошая биологическая активность соответствующих штаммов в полученных микрокапсулах, возможность полного покрытия пробиотиков материалом стенки и предотвращение уменьшения количества живых бактерий или их напрасного расхода; в то же время повышается стабильность микрокапсул при сублимационной сушке, хранении в условиях высокой температуры и в процессе производственной обработки, повышается выживаемость содержащихся в них штаммов, улучшается активность штаммов, а также снижаются напрасные расходы и объем полученной некондиционной продукции. Размер частиц у микрокапсул, содержащих пробиотики, полученных указанным способом получения, составляет 75-150 мкм; распределение частиц по размерам является равномерным, а массу можно регулировать; степень инкапсулирования в микрокапсулы больше чем 96%.
Предпочтительно указанные пробиотики представляют собой одно или более из лактобактерий, бифидобактерий и стрептококков, при этом лактобактерии могут представлять собой Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus bulgaricus и другие штаммы; стрептококки могут представлять собой Streptococcus thermophilus и другие штаммы; бифидобактерии могут представлять собой Bifidobacterium bifidum, Bifidobacterium infantis, Bifidobacterium longum, Bifidobacterium breve, Bifidobacterium adolescentis и другие штаммы.
Способ получения указанных микрокапсул, содержащих пробиотики и обеспечивающих поддержание их активности, который характеризуется тем, что включает следующие этапы, на которых
(1) культуральную среду с активированной обогатительной культурой пробиотических бактерий подвергают обработке центрифугированием и после обработки удаляют супернатант с получением пробиотических бактерий;
(2) казеин, мальц-экстракт и ксилоолигосахарид добавляют в воду и перемешивают с получением смешанного раствора первого материала стенки; указанные пробиотические бактерии добавляют в смешанный раствор первого материала стенки и перемешивают с получением бактериальной суспензии; бактериальную суспензию с помощью распылителя медленно впрыскивают в раствор галловой кислоты с pH, равным 3,0-5,0, отстаивают 5-20 мин, собирают преципитат в виде микрогранул и промывают собранные микрогранулы в стерилизованной воде с pH 3,8-4,2;
(3) полисахарид Tremella fuciformis, полисахарид Bletilla striata, полисахарид Atractylodes macrocephala, гуаровую камедь и пектин добавляют в воду и перемешивают с получением смешанного раствора второго материала стенки, и полученные на этапе (2) микрогранулы вводят в смешанный раствор второго материала стенки и перемешивают с получением бактериальной суспензии; затем бактериальную суспензию с помощью распылителя медленно впрыскивают в раствор лактата кальция при концентрации 0,05-0,5 моль/л с обеспечением отверждения, промывают и фильтруют с получением микрокапсул;
(4) указанные микрокапсулы подвергают сублимационной сушке под вакуумом с получением сухого порошка, состоящего из микрокапсул, содержащих пробиотики.
Культуральная среда, используемая для указанной культуральной среды для пробиотических бактерий, представляет собой жидкую культуральную среду MRS, при этом температура культивирования составляет 36-40°С, время культивирования составляет 24-36 ч, температура при центрифугировании составляет 0-10°С, скорость вращения при центрифугировании составляет 4000-6000 об./мин, а время центрифугирования составляет 5-12 мин.
Растворитель, используемый для указанных смешанных растворов и промывочной жидкости, представляет собой стерилизованную воду; указанные культуральную среду MRS, смешанные растворы материалов стенки, раствор галловой кислоты и раствор лактата кальция подвергают высокотемпературной стерилизации влажным теплом, при этом температура стерилизации составляет 115-125°С, и время стерилизации составляет 15-30 мин.
Размер частиц у микрокапсул, содержащих пробиотики, полученных указанным способом получения, составляет 75-150 мкм; распределение частиц по размерам является равномерным, а массу можно регулировать, при этом степень инкапсулирования в микрокапсулы больше чем 92%, поэтому полученные микрокапсулы характеризуются отличной активностью штамма, могут выдерживать изменения многочисленных факторов среды, таких как свет, тепло, кислород, ионы металлов, величина pH и т. п., и обладают хорошей стабильностью.
Предпочтительно для указанной обработки центрифугированием на этапе (1) скорость вращения при центрифугировании составляет 4000-6000 об./мин, а время центрифугирования составляет 5-12 мин.
Предпочтительно для указанной сублимационной сушки под вакуумом на этапе (4) начальная температура предварительного замораживания составляет от -30 до -40°С, а скорость предварительного замораживания составляет 0,4-0,8°С/мин; конечная температура предварительного замораживания составляет -60°С; давление в сушильной камере составляет 40-100 Па; температура нагревательной плиты составляет 30-40°С; время сушки составляет 12-20 ч.
Предпочтительно способ получения указанного мальц-экстракта включает следующее:
(a) измельчение: проросший ячмень или высушенный ячмень измельчают с помощью технологии сверхтонкого измельчения в ультратонкий порошок проросшего ячменя или порошок высушенного ячменя с размером частиц 90-110 мкм;
(b) смешивание: порошок проросшего ячменя или высушенного ячменя в определенных пропорциях смешивают с дистиллированной водой с получением белковой дисперсии и pH дисперсии доводят до 6-7;
(c) ферментативное расщепление: дисперсию нагревают и поддерживают ее температуру в диапазоне 40-50°С; затем в дисперсию соответственно добавляют α-амилазу, β-амилазу и диспазу и после равномерного перемешивания подвергают ферментативному расщеплению продолжительностью от 2 ч до 4 ч, при этом α-амилазу добавляют в количестве, составляющем от 0,3% до 0,5% от содержания субстрата, β-амилазу добавляют в количестве, составляющем от 0,1% до 0,3% от содержания субстрата, и диспазу добавляют в количестве, составляющем от 0,2 до 0,4% от содержания субстрата; после завершения ферментативного расщепления выполняют высокотемпературную инактивацию ферментов;
(d) центробежную фильтрацию: прошедший инактивацию ферментов жидкий продукт ферментативного расщепления подвергают центрифугированию для удаления примесей, при этом поддерживают скорость вращения при центрифугировании 12000-16000 об./мин, а скорость подачи материала перистальтическим насосом составляет 1,5-3,5 л/мин; собирают супернатант, включают устройство мембранной фильтрации и подвергают супернатант фильтрации через микропористую фильтрующую мембрану, при этом толщина фильтрующей мембраны составляет 90-150 мкм, размер выделяемых частиц составляет 4-8 мкм, и рабочее давление составляет 0,01-0,2 МПа; обеспечивают прозрачность фильтрата путем отстаивания и удаляют остаток;
(e) концентрирование под вакуумом: фильтрат подвергают концентрированию под вакуумом, при этом температура концентрирования составляет 65-85°С, а степень вакуума составляет от -0,07 до -0,09 МПа, с получением концентрированного раствора, при этом относительная плотность удерживается в диапазоне 1,04-1,08;
(f) распылительную сушку: указанный концентрированный раствор подвергают распылительной сушке, при этом технологические параметры являются следующими: температура форсунок составляет 175-190°С, температура на выходе составляет 80-95°С, а скорость подачи материала составляет 1,5-3,5 л/мин; с получением указанного мальц-экстракта.
В качестве сырья для указанного мальц-экстракта отбирают высококачественный проросший ячмень/высушенный ячмень, из которого путем измельчения, смешивания и ферментативного расщепления получают сусло, а затем подвергают таким технологическим операциям, как центробежная фильтрация, концентрирование под вакуумом и распылительная сушка, с получением высококачественного мальц-экстракта. Поскольку в степень ферментативного расщепления мальц-экстракта достигает 90% или более, повышается энергоэффективность усвоения и использования организмом указанного экстракта, вплоть до того что переваривание не нужно или оно происходит в незначительной степени, и усвоение может происходить сразу.
Предпочтительно указанный полисахарид Bletilla striata/полисахарид Atractylodes macrocephala получают посредством следующих этапов:
(a) динамическая противоточная экстракция: измельченные Bletilla striata/Atractylodes macrocephala добавляют в воду, количество которой в 8-10 раз превышает вес сырья, и при 90-100°С проводят динамическую противоточную экстракцию с получением экстракта, при этом экстракцию проводят 1-3 раза, и продолжительность каждой экстракции составляет 1-3 часа;
(b) центрифугирование: экстракт подвергают центрифугированию с получением осветленного раствора;
(c) осаждение спиртом после концентрирования: осветленный раствор подвергают концентрированию под вакуумом, при этом относительная плотность удерживается в диапазоне 1,10-1,20; в концентрированный раствор добавляют пищевой спирт, при этом содержание спирта в смеси достигает 40-80%, тщательно и равномерно перемешивают и отстаивают в течение ночи; из супернатанта рекуперируют растворитель; и осадок сохраняют для последующего использования;
(d) ионный обмен: полисахарид, полученный с помощью осаждения спиртом, растворяют в 4-8-кратном количестве дистиллированной воды и после тщательного перемешивания и растворения фильтруют; полученный после фильтрования фильтрат пропускают через ионообменную колонку и колонку с активированным углем, проводят обработку для удаления примесей и обесцвечивания;
(e) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергают концентрированию под вакуумом, при этом температура концентрирования составляет 60-80°С, а степень вакуума составляет от -0,07 до -0,09 МПа, с получением концентрированного раствора полисахарида, при этом относительная плотность удерживается в диапазоне 1,03-1,06;
(f) распылительная сушка: концентрированный раствор полисахарида после стерилизации и фильтрования подвергают распылительной сушке, при этом технологические параметры являются следующими: температура форсунок составляет 170-185°С, температура на выходе составляет 75-95°С, а скорость подачи материала составляет 2,0-4,0 л/мин, с получением указанного полисахарида Bletilla striata/полисахарида Atractylodes macrocephala.
Степень экстракции полисахарида в случае полисахарида Bletilla striata/полисахарида Atractylodes macrocephala соответственно составляет 35% и 8% или более. Полисахарид Bletilla striata/полисахарид Atractylodes macrocephala получают путем осуществления в отношении Bletilla striata/Atractylodes macrocephala таких технологических операций, как измельчение, динамическая противоточная экстракция, центрифугирование, осаждение спиртом после концентрирования, ионный обмен, концентрирование под вакуумом и распылительная сушка. Динамическая противоточная экстракция делает возможным полное использование градиента концентрации жидкой и твердой фаз; постепенно активные составляющие распространяются в экстракт, у которого начальная концентрация сравнительно низкая, и экстракт выходного продукта достигает сравнительно высокой равновесной концентрации; можно как обеспечить определенную степень экстракции экстрагируемого вещества, так и экономить источники энергии, сократить время экстракции и значительно уменьшить объем работы и потребление энергии, связанные с последующей операцией концентрирования, чем можно полностью решить проблему периодически останавливаемой экстракции в одном резервуаре, широко используемой сегодня.
Предпочтительно указанный полисахарид Tremella fuciformis получают посредством следующих этапов:
(a) ферментативное расщепление: с помощью технологии сверхтонкого измельчения Tremella fuciformis измельчают с получением ультратонкого порошка Tremella fuciformis с размером частиц 90-110 мкм; добавляют воду, количество которой в 30-50 раз превышает вес сырья, и 0,5-2% пектиназы; проводят ферментативное расщепление при постоянной температуре 40-50°С в течение 30-90 мин; нагревают до 95°С или больше для инактивации ферментов;
(b) экстракция: проводят экстракцию при поддержании температуры в диапазоне 95-100°С; фильтруют через сито 500 меш с получением экстракта полисахарида Tremella fuciformis, при этом экстракцию проводят 1-2 раза и продолжительность каждой экстракции составляет 1-3 часа;
(c) ионный обмен: полученный после фильтрования экстракт полисахарида Tremella fuciformis пропускают через ионообменную колонку и колонку с активированным углем, проводят обработку для удаления примесей и обесцвечивания;
(d) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергают концентрированию под вакуумом, при этом температура концентрирования составляет 60-80°С, а степень вакуума составляет от -0,07 до -0,09 МПа, с получением концентрированного раствора полисахарида Tremella fuciformis, при этом относительная плотность удерживается в диапазоне 1,02-1,04;
(e) сублимационная сушка под вакуумом: из концентрированного раствора полисахарида Tremella fuciformis с помощью технологии сублимационной сушки под вакуумом получают порошок полисахарида Tremella fuciformis, при этом начальная температура предварительного замораживания составляет от -35 до -45°С, скорость предварительного замораживания составляет 0,2-0,5°С/мин; конечная температура предварительного замораживания составляет -65°С; давление в сушильной камере составляет 50-120 Па; температура нагревательной плиты составляет 30-40°С; и время сушки составляет 16-24 ч.
указанный полисахарид Tremella fuciformis получают путем проведения в отношении Tremella fuciformis таких технологических операций, как измельчение, ферментативное расщепление, экстракция, ионный обмен, концентрирование под вакуумом и сублимационная сушка под вакуумом. Степень экстракции полисахарида в случае полисахарида Tremella fuciformis достигает 36% или больше.
По сравнению с аналогами, известными из уровня техники, преимущества настоящего изобретения заключаются в том, что в микрокапсулах, содержащих пробиотики и обеспечивающих поддержание их активности, согласно настоящему изобретению применяется структура из комбинированного материала стенки, образованного первым материалом стенки и вторым материалом стенки; при этом первый материал стенки представляет собой полисахаридный комплексный гель с белками растительного происхождения, полученный из казеина, мальц-экстракта и ксилоолигосахарида, что может хорошо предотвращать повреждение содержимого светом, теплом, кислородом, ионами металлов и т. п. и активно способствовать стабильности инкапсулированных веществ; второй материал стенки представляет собой соединение на основе растительных полисахаридов, полученное из полисахарида Tremella fuciformis, полисахарида Bletilla striata, полисахарида Atractylodes macrocephala, гуаровой камеди и пектина, что может в значительной степени уменьшать влияние технологии обработки сублимационной сушкой под вакуумом на биологическую активность штамма пробиотиков в качестве содержимого; в то же время, когда первый материал стенки снаружи покрыт вторым материалом стенки, первый материал стенки, содержащий большое количество белков, может усиливать эффект второго материала стенки в отношении образования пленки и инкапсулирования и тем самым в целом повышать эксплуатационные качества комбинированного материала стенки, чтобы комбинированный материал стенки обеспечивал лучшую защиту активности содержимого и значительно повышал стабильность содержимого, чтобы полученные микрокапсулы обладали высокой кислотоустойчивостью и за счет этого могли выдерживать испытание с использованием желудочной кислоты, а бактерии могли высвобождаться и размножаться в определенных участках кишечника, что повышало бы биодоступность пробиотиков.
В способе получения согласно настоящему изобретению применяют динамическую противоточную экстракцию, концентрирование под вакуумом, ферментативное расщепление для отделения и очистки, ионный обмен, микроинкапсуляцию, сублимационную сушку под вакуумом с получением микрокапсул, содержащих пробиотики; за счет того, что для получения микрокапсул одновременно используют натуральное сырье и пробиотики, возможно максимальное сохранение биологической активности пробиотиков, улучшение эксплуатационных качеств пробиотиков и увеличение срока их хранения. Во многих традиционных способах инкапсулирования пробиотиков в микрокапсулы в качестве материала стенки капсулы применяют аравийскую камедь, полиамид, поливиниловый спирт, полиэтиленгликоль, альгинат натрия и карбоксиметилцеллюлозу натрия, при этом такие материалы для инкапсулирования характеризуются высокой механической прочностью и низкими массообменными характеристиками, и, в частности, некоторые из таких сырьевых материалов обладают определенной токсичностью, поэтому существует риск в отношении безопасности определенных пищевых продуктов, тогда как применение натурального сырья согласно настоящему изобретению улучшает условия хранения пробиотиков, и тем самым реализуются цели по поддержанию активности штамма и улучшению работы желудочно-кишечного тракта.
В частности, Bletilla striata представляет собой сушеный клубень растения, который богат на вязкий полисахарид, горький, сладкий, терпкий, слегка охлаждающий на вкус, и ассоциирована с меридианами легких, печени и желудка. Ее действие заключается в сдерживании и остановке кровотечения, снятии отека и способствовании восстановлению тканей, поэтому она применяется при внешних и внутренних кровоточащих ранах, нарывах и язвах, растрескивании кожи. Она обладает хорошим лечебным действием в отношении повреждений желудочно-кишечного тракта и язвы желудка и может защищать слизистую оболочку желудка и обеспечивать ее восстановление. Atractylodes macrocephala представляет собой сушеный корень растения, который богат на полисахарид, горький, сладкий, теплый на вкус, и ассоциирован с меридианом селезенки и желудка. Его действие заключается в укреплении селезенки, осушении сырости, устранении задержки жидкости, подавлении потоотделения и предотвращении выкидыша. Применяется при недостаточности селезенки, снижении аппетита, вздутии живота, диарее, функциональной диспепсии, учащенном сердцебиении, водянке, потливости, беспокойстве зародыша и может укреплять селезенку и желудок. Tremella fuciformis представляет собой плодовое тело Tremella fuciformis, гриба из отдела базидиомицетов, который богат на вязкий полисахаридный компонент, имеет сладкий и легкий на вкус, по природе является неядовитым и как тонизирует почки, является полезным для органов пищеварения, укрепляет желудок, так и благотворно действует на ци и кровь, подкрепляет инь легких и приводит в порядок кожу лица, а также может укреплять иммунитет организма человека и повышать переносимость радио- и химиотерапии у больных раком. Казеин представляет собой белок, связывающий фосфор и кальций, и в большом количестве содержится в молоке млекопитающих, в том числе в коровьем, козьем и женском; казеин является как источником аминокислот, так и источником кальция и фосфора; при переваривании в желудке казеин образует сгустки. Казеин можно применять для лечения зубного кариеса, лечения и профилактики остеопороза и рахита, регулирования кровяного давления, лечения железодефицитной анемии, невритов, вызванных дефицитом магния, и обеспечивать другие физиологические действия, и он может способствовать высокоэффективному усваиванию организмом человека минералов и микроэлементов. Мальц-экстракт представляет собой натуральный пищевой продукт, для которого в качестве сырья отбирается высококачественный проросший ячмень (высушенный ячмень) и который изготавливается целиком из зерновых культур, содержит витамины, минералы и растворимые пищевые волокна, богат на глюкозу, мальтозу, олигосахариды, низкомолекулярные белковые пептиды, различные незаменимые для организма человека аминокислоты и заменимые аминокислоты, а также содержит активные полисахариды, представляющие собой β-декстран, которые являются натуральными питательными веществами. ксилоолигосахарид представляет собой пребиотик, функциональный углеводный полимер, образованный из 2-7 молекул ксилозы путем их соединения β-1,4-гликозидными связями; ксилоолигосахарид очень трудно расщепляется пищеварительными ферментами организма человека, и он снижает количество возникающих токсичных продуктов ферментации и ферментов вредных бактерий, подавляет патогенные микроорганизмы и диарею, защищает печень, снижает уровень холестерина в сыворотке крови, снижает кровяное давление, укрепляет иммунитет организма, стимулирует перистальтику кишечника с обеспечением предотвращения запора, способствует размножению полезных бактерий в желудочно-кишечном тракте животных и обеспечивает улучшение в отношении равновесия бактериальной флоры. Гуаровая камедь представляет собой высокоочищенный природный полисахарид, экстрагированный из выращиваемого в большом количестве бобового растения гуар. Гуаровая камедь представляет собой природный высокомолекулярный гидроколлоид и принадлежит к природным галактоманнанам, природным загустителям. Пектины в большом количестве присутствуют в плодах, корнях и листьях растений и являются компонентами клеточной стенки. Пектины после растворения в воде образуют молочно-белый, вязкий коллоидный раствор, проявляют слабую кислотность, высокую теплостойкость и могут образовывать обладающий упругостью гель.
В настоящем изобретении применяются лекарственные средства китайской медицины, подкрепляющие инь легких, благотворно влияющие на органы пищеварения и укрепляющие желудок, такие как Tremella fuciformis, Bletilla striata, Atractylodes macrocephala и т. д.; в сочетании с казеином, мальц-экстрактом, ксилоолигосахаридом, а также пектином, гуаровой камедью и прочим сырьем природного происхождения они могут обеспечивать хорошую микроинкапсуляцию, что существенно повышает активность штамма пробиотиков, увеличивает срок хранения и повышает устойчивость пробиотиков к действию желудочной кислоты, могут обеспечивать беспрепятственную доставку в кишечник с последующим высвобождением; одновременно с обеспечением улучшения в отношении экологического равновесия в кишечнике и желудке белки и активные полисахариды в материалах стенки могут предоставлять пробиотикам достаточно питательных веществ, что может дополнительно благотворно влиять на органы пищеварения и укреплять желудок.
Настоящее изобретение за счет применения технологии инкапсулирования в двухслойные микрокапсулы из натурального сырья оставляет позади традиционные технологии, в которых инкапсулирование выполняют в однослойные микрокапсулы для пробиотиков. Сначала пробиотические бактерии покрывают белками, ксилоолигосахаридом, мальц-экстрактом и др. с получением стабильного ядра конденсации; затем осуществляют второе инкапсулирование, нанося на указанное ядро конденсации натуральные растительные полисахариды и натуральные высокомолекулярные соединения; с помощью технологии отверждения снаружи пробиотиков можно получить стабильную оболочку микрокапсулы. Микрокапсулы, содержащие пробиотики, полученные с помощью указанной технологии инкапсулирования в двухслойные микрокапсулы, характеризуются очень стабильной биологической активностью штамма и могут выдерживать разъедающее действие желудочной кислоты; после повышения величины pH в кишечнике оболочки капсул естественным образом полностью и быстро растворяются с высвобождением большого количества пробиотиков, при этом степень высвобождения в кишечном соке достигает 86% или более, и в кишечник доставляется достаточно питательных веществ. Пробиотики после инкапсулирования в микрокапсулы характеризуются стабильной биологической активностью и продолжительным сохранением жизнеспособности, при этом в отношении стойкости к высокой температуре, стойкости к замораживанию, стойкости к действию света и стойкости к высокой активности кислорода их характеристики являются еще более замечательными, и по сравнению с продукцией в виде пробиотиков, которые не были инкапсулированы в микрокапсулы, их срок хранения увеличивается в 2,5 раза или более.
Согласно настоящему изобретению в материале стенки капсулы применяется полисахарид Bletilla striata, полисахарид Tremella fuciformis, полисахарид Atractylodes macrocephala и ксилоолигосахарид, которые в качестве комплекса полисахаридов вводятся в систему материала стенки, при этом вязкий полисахарид Bletilla striata может сдерживать и останавливать кровотечение, снимать отек, защищать и восстанавливать слизистую оболочку желудочно-кишечного тракта; полисахарид Tremella fuciformis благотворно действует на ци и кровь, тонизирует почки, полезен для органов пищеварения и укрепляет желудок; полисахарид Atractylodes macrocephala может укреплять селезенку и желудок; экстракт из этих лекарственных средств китайской медицины комбинируется с сильнодействующим пребиотиком в виде ксилоолигосахарида и одновременно с поддержанием активности штамма в микрокапсулах, содержащих пробиотики, также может защищать желудочно-кишечный тракт, способствовать быстрому размножению пробиотиков, что в большей степени повышает реальное действие и биодоступность указанных микрокапсул.
Способ получения микрокапсул, содержащих пробиотики, согласно настоящему изобретению характеризуется довольно широкой применимостью и подходит для производства микрокапсул, содержащих одно или более из таких пробиотиков, как лактобактерии, бифидобактерии и стрептококки, при этом операции выполняются просто и легко, процесс простой и стабильный, массу можно регулировать, эффективность производства высокая и экономическая добавленная стоимость высокая, поэтому он является подходящим для крупномасштабного промышленного производства.
Описание прилагаемых графических материалов
На фиг. 1 представлен график изменения количества живых пробиотических бактерий в йогурте в пределах срока хранения в примере осуществления 6 настоящего изобретения;
На фиг. 2 представлен график изменения выживаемости в кислой среде пробиотических бактерий и живых бактерий в порошке, состоящем из микрокапсул, согласно настоящему изобретению;
На фиг. 3 представлен график результатов ускоренного испытания активности пробиотических бактерий и штамма в порошке, состоящем из микрокапсул, согласно настоящему изобретению.
Конкретные примеры осуществления
Ниже со ссылками на прилагаемые графические материалы настоящее изобретение описано более подробно с помощью примеров осуществления.
Пример осуществления 1
В этом примере осуществления микрокапсулы, содержащие пробиотики и обеспечивающие поддержание их активности, содержали содержимое и материал стенки, покрывающий содержимое снаружи, при этом содержимое представлял собой пробиотики; материал стенки содержал первый материал стенки, покрывающий содержимое снаружи, и второй материал стенки, покрывающий первый материал стенки снаружи; первый материал стенки содержал следующие компоненты: казеин, мальц-экстракт и ксилоолигосахарид; второй материал стенки содержал следующие компоненты: полисахарид Tremella fuciformis, полисахарид Bletilla striata, полисахарид Atractylodes macrocephala, гуаровую камедь и пектин; пробиотики представляли собой Lactobacillus acidophilus; после 4-кратного разбавления указанных первого и второго материалов стенки стерилизованной водой в качестве растворителя с получением смешанных растворов, осуществляли инкапсулирование. Массовое соотношение бактерий Lactobacillus acidophilus и первого материала стенки составляло 1:1; в первом материале стенки казеин составлял 12 частей, мальц-экстракт составлял 6 частей, ксилоолигосахарид составлял 0,5 части. Массовое соотношение бактерий Lactobacillus acidophilus и второго материала стенки составляло 1:1,5; во втором материале стенки полисахарид Tremella fuciformis составлял 3 части, полисахарид Bletilla striata составлял 5 частей, полисахарид Atractylodes macrocephala составлял 3 части, гуаровая камедь составляла 0,2 части, пектин составлял 1 часть.
В этом примере осуществления мальц-экстракт получали путем проведения в отношении проросшего ячменя (высушенного ячменя) таких технологических операций, как измельчение, смешивание, ферментативное расщепление, центробежная фильтрация, концентрирование под вакуумом и распылительная сушка, при этом конкретные этапы получения являются следующими:
(a) измельчение: проросший ячмень или высушенный ячмень с помощью технологии сверхтонкого измельчения измельчали в ультратонкий порошок с размером частиц приблизительно 100 мкм;
(b) смешивание: порошок проросшего ячменя или порошок высушенного ячменя в определенных пропорциях смешивали с дистиллированной водой с получением белковой дисперсии и pH дисперсии доводят до 6,5;
(c) ферментативное расщепление: осуществляли нагревание и поддерживали температуру равной 45°С; затем в дисперсию соответственно добавляли α-амилазу, β-амилазу и диспазу и после равномерного перемешивания подвергали ферментативному расщеплению продолжительностью 2 ч, при этом α-амилазу добавляли в количестве, составляющем 0,3% от содержания субстрата, β-амилазу добавляли в количестве, составляющем 0,3% от содержания субстрата, и диспазу добавляли в количестве, составляющем 0,2% от содержания субстрата; после завершения ферментативного расщепления выполняли высокотемпературную инактивацию ферментов;
(d) центробежная фильтрация: прошедший инактивацию ферментов жидкий продукт ферментативного расщепления подвергали центрифугированию для удаления примесей, при этом поддерживали скорость вращения при центрифугировании 14000 об./мин, а скорость подачи материала перистальтическим насосом составляла 2,5 л/мин; собирали супернатант, включали устройство мембранной фильтрации и подвергали супернатант фильтрации через микропористую фильтрующую мембрану, при этом толщина фильтрующей мембраны составляла 90 мкм, размер выделяемых частиц составлял 8 мкм, и рабочее давление составляло 0,1 МПа; обеспечивали прозрачность фильтрата путем отстаивания и удаляли остаток;
(e) концентрирование под вакуумом: фильтрат подвергали концентрированию под вакуумом, при этом температура концентрирования составляла 75°С, а степень вакуума составляла -0,08 МПа, с получением концентрированного раствора, при этом относительная плотность удерживалась равной 1,04;
(f) распылительная сушка: указанный концентрированный раствор подвергали распылительной сушке, при этом технологические параметры являлись следующими: температура форсунок составляла 175°С, температура на выходе составляла 90°С, а скорость подачи материала составляла 2,5 л/мин, с получением мальц-экстракта, соответствующего требованиям качества.
Поскольку степень ферментативного расщепления указанного мальц-экстракта достигает 90% или более, повышается энергоэффективность усвоения и использования организмом указанного экстракта, вплоть до того что переваривание не нужно или оно происходит в незначительной степени, и усвоение может происходить сразу.
В этом примере осуществления полисахарид Bletilla striata и полисахарид Atractylodes macrocephala получали одинаковым способом получения, в котором Bletilla striata/Atractylodes macrocephala подвергали таким технологическим операциям, как измельчение, динамическая противоточная экстракция, центрифугирование, осаждение спиртом после концентрирования, ионный обмен, концентрирование под вакуумом и распылительная сушка. Конкретный процесс получения являлся следующим:
(a) динамическая противоточная экстракция: измельченные Bletilla striata или Atractylodes macrocephala, добавляли в воду, количество которой в 10 раз превышало вес сырья, и при 95°С проводили динамическую противоточную экстракцию с получением экстракта, при этом экстракцию проводили 2 раза и продолжительность каждой экстракции составляла 2 часа;
(b) центрифугирование: экстракт подвергали центрифугированию с получением осветленного раствора;
(c) осаждение спиртом после концентрирования: осветленный раствор подвергали концентрированию под вакуумом, при этом относительная плотность удерживалась равной 1,12; в концентрированный раствор добавляли пищевой спирт, при этом содержание спирта в смеси достигало 50%, тщательно и равномерно перемешивали и отстаивали в течение ночи; из супернатанта рекуперировали растворитель; осадок сохраняли для последующего использования;
(d) ионный обмен: полисахарид, полученный с помощью осаждения спиртом, растворяли в 6-кратном количестве дистиллированной воды и после тщательного перемешивания и растворения фильтровали; полученный после фильтрования фильтрат пропускали через ионообменную колонку и колонку с активированным углем, проводили обработку для удаления примесей и обесцвечивания;
(e) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергали концентрированию под вакуумом, при этом температура концентрирования составляла 60°С, а степень вакуума составляла -0,09 МПа, с получением концентрированного раствора полисахарида, при этом относительная плотность удерживалась на уровне 1,04;
(f) распылительная сушка: концентрированный раствор полисахарида после стерилизации и фильтрования подвергали распылительной сушке, при этом технологические параметры являлись следующими: температура форсунок составляла 180°С, температура на выходе составляла 85°С, а скорость подачи материала составляла 2,0 л/мин, с получением полисахарида Bletilla striata или полисахарида Atractylodes macrocephala.
Степень экстракции полисахарида в случае полисахарида Bletilla striata и полисахарида Atractylodes macrocephala соответственно составляла 35,2% и 8,28%.
В этом примере осуществления полисахарид Tremella fuciformis получали путем проведения в отношении Tremella fuciformis таких технологических операций, как измельчение, ферментативное расщепление, экстракция, ионный обмен, концентрирование под вакуумом и сублимационная сушка под вакуумом. Конкретный процесс получения являлся следующим:
(a) ферментативное расщепление: в ультратонкий порошок измельченной Tremella fuciformis добавляли воду, количество которой в 50 раз превышало вес сырья, и 0,5% пектиназы; проводили ферментативное расщепление при постоянной температуре 50°С в течение 60 мин; нагревали до 95°С или больше для инактивации ферментов;
(b) экстракция: проводили экстракцию при поддержании температуры равной 95°С; фильтровали через сито 500 меш с получением экстракта полисахарида Tremella fuciformis, при этом экстракцию проводили 2 раза и продолжительность каждой экстракции составляла 2 часа;
(c) ионный обмен: полученный после фильтрования экстракт полисахарида Tremella fuciformis пропускают через ионообменную колонку и колонку с активированным углем, проводят обработку для удаления примесей и обесцвечивания;
(d) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергали концентрированию под вакуумом, при этом температура концентрирования составляла 65°С, а степень вакуума составляла -0,09 МПа, с получением концентрированного раствора полисахарида Tremella fuciformis, при этом относительная плотность удерживалась на уровне 1,02;
(e) сублимационная сушка под вакуумом: из концентрированного раствора полисахарида Tremella fuciformis с помощью технологии сублимационной сушки под вакуумом получали порошок полисахарида Tremella fuciformis, при этом начальная температура предварительного замораживания составляла -45°С, скорость предварительного замораживания составляла 0,2°С/мин; конечная температура предварительного замораживания составляла -65°С; давление в сушильной камере составляло 50 Па; температура нагревательной плиты составляла 30°С; время сушки составляло 24 ч.
Степень экстракции полисахарида в случае полисахарида Tremella fuciformis достигала 37,4%.
В этом примере осуществления способ получения микрокапсул, содержащих пробиотики и обеспечивающих поддержание их активности, являлся следующим.
(1) Культивирование и выделение штамма: штамм Lactobacillus acidophilus высевали в жидкую культуральную среду MRS для активации обогатительной культуры, при этом температура культивирования составляла 37°С, а время культивирования составляло 24 ч указанную культуральную среду подвергали низкотемпературной обработке центрифугированием, удаляли супернатант и собирали полученные бактерии Lactobacillus acidophilus, при этом температура при центрифугировании составляла 4°С, скорость вращения при центрифугировании составляла 5000 об./мин, а время центрифугирования составляло 10 мин.
(2) Покрытие первым материалом стенки: указанные бактерии Lactobacillus acidophilus добавляли в смешанный раствор первого материала стенки и тщательно перемешивали с получением бактериальной суспензии, при этом время перемешивания составляло 8 мин; затем указанную бактериальную суспензию с помощью центробежного распылителя медленно впрыскивали в раствор галловой кислоты с pH 4,0; отстаивали 15 мин, собирали преципитат в виде микрогранул и несколько раз промывали стерилизованной водой, pH которой был отрегулирован до 4,0.
(3) Покрытие вторым материалом стенки: указанные микрогранулы вводили в смешанный раствор второго материала стенки, равномерно перемешивали в течение 5 мин с получением бактериальной суспензии; затем указанную бактериальную суспензию с помощью центробежного распылителя медленно впрыскивали в 0,2 моль/л раствор лактата кальция, оставляли с обеспечением отверждения на 30 мин, промывали и фильтровали с получением микрокапсул.
(4) Сублимационная сушка под вакуумом: указанные микрокапсулы подвергали сублимационной сушке под вакуумом с получением сухого порошка, состоящего из микрокапсул с Lactobacillus acidophilus, при этом начальная температура предварительного замораживания составляла -35°С, скорость предварительного замораживания составляла 0,6°С/мин; конечная температура предварительного замораживания составляла -60°С; давление в сушильной камере составляло 60 Па; температура нагревательной плиты составляла 35°С; время сушки составляло 18 ч.
Растворитель, используемый для указанных смешанных растворов и промывочной жидкости, представлял собой стерилизованную воду; указанные культуральную среду MRS, смешанные растворы материалов стенки, раствор галловой кислоты и раствор лактата кальция подвергали высокотемпературной стерилизации влажным теплом, при этом температура стерилизации составляла 121°С, и время стерилизации составляло 20 мин. В полученном указанным способом получения сухом порошке, состоящем из микрокапсул с Lactobacillus acidophilus, количество живых бактерий составляло 1,92×1011 КОЕ/мл, размер частиц составлял 100 мкм, распределение частиц по размерам являлось равномерным, а массу можно было регулировать, при этом степень инкапсулирования в микрокапсулы составляла больше 92%, поэтому полученные микрокапсулы характеризовались отличной активностью штамма, могли выдерживать изменения многочисленных факторов среды, таких как свет, тепло, кислород, ионы металлов, величина pH и т. п., и обладали хорошей стабильностью.
Пример осуществления 2. В этом примере осуществления способ получения микрокапсул, содержащих пробиотики и обеспечивающих поддержание их активности, является таким же, как и в примере осуществления 1, и разница заключается в том, что в этом примере осуществления пробиотики представляли собой Bifidobacterium longum; после 5-кратного разбавления указанных первого и второго материалов стенки стерилизованной водой в качестве растворителя с получением смешанных растворов, осуществляли инкапсулирование. Массовое соотношение пробиотиков и первого материала стенки составляло 1:0,75; в первом материале стенки казеин составлял 15 частей, мальц-экстракт составлял 6 частей, ксилоолигосахарид составлял 3 части. Массовое соотношение пробиотиков и второго материала стенки составляло 1: 1,2; во втором материале стенки полисахарид Tremella fuciformis составлял 8 частей, полисахарид Bletilla striata составлял 5 частей, полисахарид Atractylodes macrocephala составлял 6 частей, гуаровая камедь составляла 0,6 части, пектин составлял 1,2 части.
В этом примере осуществления мальц-экстракт получали путем проведения в отношении проросшего ячменя (высушенного ячменя) таких технологических операций, как измельчение, смешивание, ферментативное расщепление, центробежная фильтрация, концентрирование под вакуумом и распылительная сушка, при этом конкретные этапы получения являются следующими:
(a) измельчение: проросший ячмень или высушенный ячмень с помощью технологии сверхтонкого измельчения измельчали в ультратонкий порошок с размером частиц приблизительно 110 мкм;
(b) смешивание: порошок проросшего ячменя или порошок высушенного ячменя в определенных пропорциях смешивали с дистиллированной водой с получением белковой дисперсии и pH дисперсии доводят до 6,0;
(c) ферментативное расщепление: осуществляли нагревание и поддерживали температуру равной 40°С; затем в дисперсию соответственно добавляли α-амилазу, β-амилазу и диспазу и после равномерного перемешивания подвергали ферментативному расщеплению продолжительностью 2 ч, при этом α-амилазу добавляли в количестве, составляющем 0,4% от содержания субстрата, β-амилазу добавляли в количестве, составляющем 0,2% от содержания субстрата, и диспазу добавляли в количестве, составляющем 0,3% от содержания субстрата; после завершения ферментативного расщепления выполняли высокотемпературную инактивацию ферментов;
(d) центробежная фильтрация: прошедший инактивацию ферментов жидкий продукт ферментативного расщепления подвергали центрифугированию для удаления примесей, при этом поддерживали скорость вращения при центрифугировании 14000 об./мин, а скорость подачи материала перистальтическим насосом составляла 3,0 л/мин; собирали супернатант, включали устройство мембранной фильтрации и подвергали супернатант фильтрации через микропористую фильтрующую мембрану, при этом толщина фильтрующей мембраны составляла 90 мкм, размер выделяемых частиц составлял 6 мкм, и рабочее давление составляло 0,15 МПа; обеспечивали прозрачность фильтрата путем отстаивания и удаляли остаток;
(e) концентрирование под вакуумом: фильтрат подвергали концентрированию под вакуумом, при этом температура концентрирования составляла 80°С, а степень вакуума составляла -0,08 МПа, с получением концентрированного раствора, при этом относительная плотность удерживалась равной 1,05;
(f) распылительная сушка: указанный концентрированный раствор подвергали распылительной сушке, при этом технологические параметры являлись следующими: температура форсунок составляла 180°С, температура на выходе составляла 85°С, а скорость подачи материала составляла 2,0 л/мин, с получением мальц-экстракта, соответствующего требованиям качества.
Поскольку степень ферментативного расщепления указанного мальц-экстракта достигает 90% или более, повышается энергоэффективность усвоения и использования организмом указанного экстракта, вплоть до того что переваривание не нужно или оно происходит в незначительной степени, и усвоение может происходить сразу.
В этом примере осуществления полисахарид Bletilla striata и полисахарид Atractylodes macrocephala получали одинаковым способом получения, в котором Bletilla striata/Atractylodes macrocephala подвергали таким технологическим операциям, как измельчение, динамическая противоточная экстракция, центрифугирование, осаждение спиртом после концентрирования, ионный обмен, концентрирование под вакуумом и распылительная сушка. Конкретный процесс получения являлся следующим:
(a) динамическая противоточная экстракция: измельченные Bletilla striata или Atractylodes macrocephala добавляли в воду, количество которой в 9 раз превышало вес сырья, и при 95°С проводили динамическую противоточную экстракцию с получением экстракта, при этом экстракцию проводили 2 раза и продолжительность каждой экстракции составляла 1,5 часа;
(b) центрифугирование: экстракт подвергают центрифугированию с получением осветленного раствора;
(c) осаждение спиртом после концентрирования: осветленный раствор подвергали концентрированию под вакуумом, при этом относительная плотность удерживалась равной 1,10; в концентрированный раствор добавляли пищевой спирт, при этом содержание спирта в смеси достигало 60%, тщательно и равномерно перемешивали и отстаивали в течение ночи; из супернатанта рекуперировали растворитель; осадок сохраняли для последующего использования;
(d) ионный обмен: полисахарид, полученный с помощью осаждения спиртом, растворяли в 6-кратном количестве дистиллированной воды и после тщательного перемешивания и растворения фильтровали; полученный после фильтрования фильтрат пропускали через ионообменную колонку и колонку с активированным углем, проводили обработку для удаления примесей и обесцвечивания;
(e) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергали концентрированию под вакуумом, при этом температура концентрирования составляла 70°С, а степень вакуума составляла -0,09 МПа, с получением концентрированного раствора полисахарида, при этом относительная плотность удерживалась на уровне 1,03;
(f) распылительная сушка: концентрированный раствор полисахарида после стерилизации и фильтрования подвергали распылительной сушке, при этом технологические параметры являлись следующими: температура форсунок составляла 180°С, температура на выходе составляла 85°С, а скорость подачи материала составляла 2,0 л/мин, с получением полисахарида Bletilla striata или полисахарида Atractylodes macrocephala.
Степень экстракции полисахарида в случае полисахарида Bletilla striata и полисахарида Atractylodes macrocephala соответственно составляла 35,4% и 8,24%.
В этом примере осуществления полисахарид Tremella fuciformis получали путем проведения в отношении Tremella fuciformis таких технологических операций, как измельчение, ферментативное расщепление, экстракция, ионный обмен, концентрирование под вакуумом и сублимационная сушка под вакуумом. Конкретный процесс получения являлся следующим:
(a) ферментативное расщепление: в ультратонкий порошок измельченной Tremella fuciformis добавляли воду, количество которой в 50 раз превышало вес сырья, и 1% пектиназы; проводили ферментативное расщепление при постоянной температуре 50°С в течение 80 мин; нагревали до 95°С или больше для инактивации ферментов;
(b) экстракция: проводили экстракцию при поддержании температуры равной 95°С; фильтровали через сито 500 меш с получением экстракта полисахарида Tremella fuciformis, при этом экстракцию проводили 2 раза и продолжительность каждой экстракции составляла 2 часа;
(c) ионный обмен: полученный после фильтрования экстракт полисахарида Tremella fuciformis пропускают через ионообменную колонку и колонку с активированным углем, проводят обработку для удаления примесей и обесцвечивания;
(d) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергали концентрированию под вакуумом, при этом температура концентрирования составляла 65°С, а степень вакуума составляла -0,09 МПа, с получением концентрированного раствора полисахарида Tremella fuciformis, при этом относительная плотность удерживалась на уровне 1,02;
(e) сублимационная сушка под вакуумом: из концентрированного раствора полисахарида Tremella fuciformis с помощью технологии сублимационной сушки под вакуумом получали порошок полисахарида Tremella fuciformis, при этом начальная температура предварительного замораживания составляла -40°С, скорость предварительного замораживания составляла 0,3°С/мин; конечная температура предварительного замораживания составляла -65°С; давление в сушильной камере составляло 50 Па; температура нагревательной плиты составляла 35°С; время сушки составляло 24 ч.
Степень экстракции полисахарида в случае полисахарида Tremella fuciformis достигала 36,9%.
В этом примере осуществления способ получения микрокапсул, содержащих пробиотики и обеспечивающих поддержание их активности, являлся следующим.
(1) Культивирование и выделение штамма: штамм Bifidobacterium longum высевали в жидкую культуральную среду MRS для активации обогатительной культуры, при этом температура культивирования составляла 36°С, а время культивирования составляло 36 ч. указанную культуральную среду подвергали низкотемпературной обработке центрифугированием, удаляли супернатант и собирали полученные бактерии Bifidobacterium longum, при этом температура при центрифугировании составляла 10°С, скорость вращения при центрифугировании составляла 4000 об./мин, а время центрифугирования составляло 8 мин.
(2) Покрытие первым материалом стенки: указанные бактерии Bifidobacterium longum добавляли в смешанный раствор первого материала стенки; время перемешивания составляло 10 мин; затем указанную бактериальную суспензию с помощью центробежного распылителя медленно впрыскивали в раствор галловой кислоты с pH 3,6; отстаивали 10 мин, собирали преципитат в виде микрогранул и несколько раз промывали стерилизованной водой, pH которой был отрегулирован до 4,0.
(3) Покрытие вторым материалом стенки: указанные микрогранулы вводили в смешанный раствор второго материала стенки, равномерно перемешивали в течение 8 мин с получением бактериальной суспензии; затем указанную бактериальную суспензию с помощью центробежного распылителя медленно впрыскивали в 0,15 моль/л раствор лактата кальция, оставляли с обеспечением отверждения на 50 мин, промывали и фильтровали с получением микрокапсул.
(4) Сублимационная сушка под вакуумом: указанные микрокапсулы подвергали сублимационной сушке под вакуумом с получением сухого порошка, состоящего из микрокапсул с Bifidobacterium longum, при этом начальная температура предварительного замораживания составляла -30°С, скорость предварительного замораживания составляла 0,8°С/мин; конечная температура предварительного замораживания составляла -60°С; давление в сушильной камере составляло 80 Па; температура нагревательной плиты составляла 30°С; время сушки составляло 20 ч.
Растворитель, используемый для указанных смешанных растворов и промывочной жидкости, представлял собой стерилизованную воду; указанные культуральную среду MRS, смешанные растворы материалов стенки, раствор галловой кислоты и раствор лактата кальция подвергали высокотемпературной стерилизации влажным теплом, при этом температура стерилизации составляла 125°С, и время стерилизации составляло 15 мин. В полученном указанным способом получения сухом порошке, состоящем из микрокапсул с Bifidobacterium longum, количество живых бактерий составляло 1,39×1011 КОЕ/мл, размер частиц составлял 80 мкм, распределение частиц по размерам являлось равномерным, а массу можно было регулировать, при этом степень инкапсулирования в микрокапсулы составляла более 92%, поэтому полученные микрокапсулы характеризовались отличной активностью штамма, могли выдерживать изменения многочисленных факторов среды, таких как свет, тепло, кислород, ионы металлов, величина pH и т. п., и обладали хорошей стабильностью.
Пример осуществления 3
В этом примере осуществления способ получения таблеток на основе микрокапсул, содержащих пробиотики, является следующим.
Полученные согласно указанным примерам осуществления 1 и 2 порошок, состоящий из микрокапсул с Lactobacillus acidophilus, и порошок, состоящий из микрокапсул с Bifidobacterium longum, перемешивали друг с другом в соотношении 2:1; отвешивали микрокристаллическую целлюлозу в количестве, составляющем 10% от общего веса указанного порошка, состоящего из микрокапсул, содержащих пробиотики; в указанную смесь вводили стеарат магния в количестве 1%, перемешивали в течение 5 мин и с применением этих частиц выполняли таблетирование из расчета 0,45 г/таблетка с получением таблеток на основе микрокапсул, содержащих пробиотики. После истечения срока хранения указанных таблеток, составляющего 2 года, общее количество живых бактерий составляло 31% от количества в момент производства, при этом активность штамма являлась хорошей, а выживаемость - сравнительно высокой.
Пример осуществления 4
В этом примере осуществления способ получения капсул на основе микрокапсул, содержащих пробиотики, является следующим.
Полученные согласно указанным примерам осуществления 1 и 2 порошок, состоящий из микрокапсул с Lactobacillus acidophilus, и порошок, состоящий из микрокапсул с Bifidobacterium longum, перемешивали друг с другом в соотношении 1:1; отвешивали мальтодекстрин в количестве, составляющем 15% от общего веса указанного порошка, состоящего из микрокапсул, содержащих пробиотики; в указанную смесь вводили стеарат магния в количестве 1,5%, перемешивали в течение 5 мин и этими частицами заполняли капсулы № 0 из расчета 0,35 г/капсула с получением капсул на основе микрокапсул, содержащих пробиотики. После истечения срока хранения указанных капсул, составляющего 2 года, общее количество живых бактерий составляло 34% от количества в момент производства, при этом активность штамма являлась хорошей, а выживаемость - сравнительно высокой.
Пример осуществления 5
В этом примере осуществления способ получения гранул на основе микрокапсул, содержащих пробиотики, является следующим:
полученные согласно указанным примерам осуществления 1 и 2 порошок, состоящий из микрокапсул с Lactobacillus acidophilus, и порошок, состоящий из микрокапсул с Bifidobacterium longum, перемешивали друг с другом в соотношении 3:1; отвешивали ксилоолигосахарид в количестве, составляющем 1% от общего веса указанного порошка, состоящего из микрокапсул, содержащих пробиотики, и мальтодекстрин в количестве 25%; в указанную смесь вводили диоксид кремния в количестве 1%, перемешивали в течение 5 мин и этими частицами заполняли упаковочные пакеты из алюминиевой фольги из расчета 5 г/мешочек с получением гранул на основе микрокапсул, содержащих пробиотики. После истечения срока хранения указанных гранул, составляющего 2 года, общее количество живых бактерий составляло 29% от количества в момент производства, при этом активность штамма являлась хорошей, а выживаемость — сравнительно высокой.
Пример осуществления 6
В этом примере осуществления способ получения йогурта с микрокапсулами, содержащими пробиотики, является следующим:
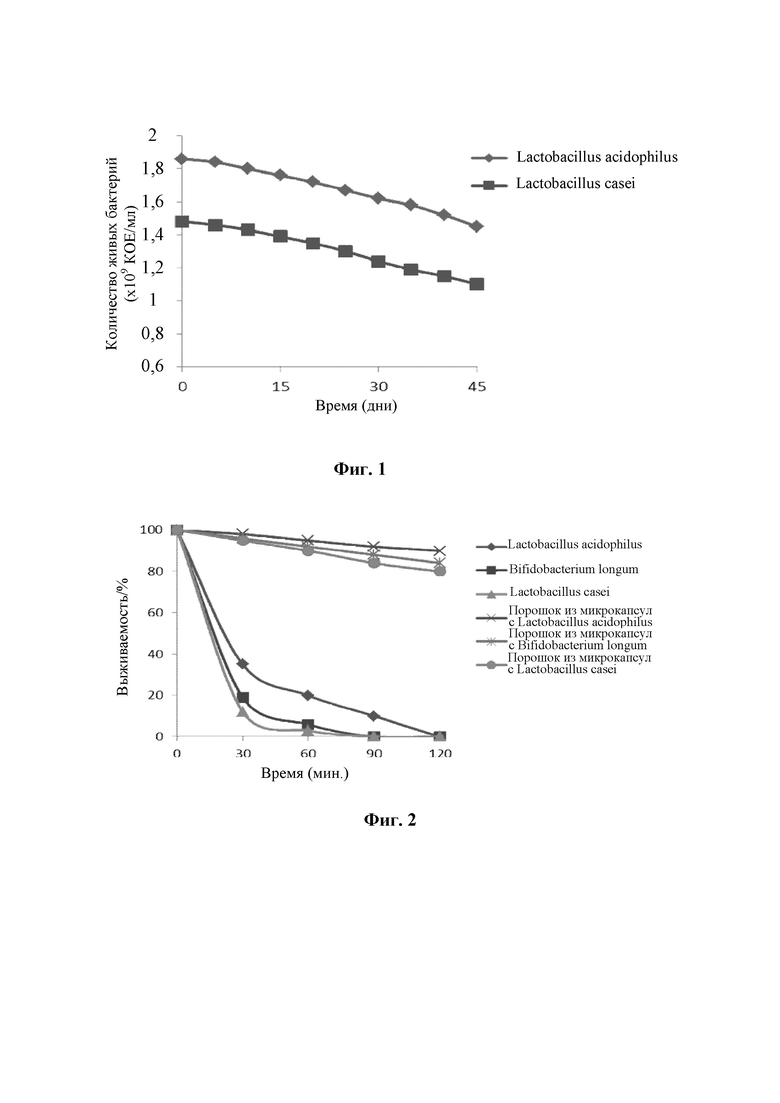
в приготовленный йогурт добавляли полученные согласно указанным примерам осуществления 1 и 2 порошок, состоящий из микрокапсул с Lactobacillus acidophilus, и порошок, состоящий из микрокапсул с Lactobacillus casei, при этом добавляемое количество каждого из них составляло 1% от веса йогурта, и равномерно перемешивали с получением йогурта с содержащими пробиотики микрокапсулами; осуществляли отбор образцов йогуртов в разные моменты срока хранения и определяли количество живых пробиотических бактерий двух видов, находящихся в них, что отображало изменение количества живых пробиотических бактерий в пределах срока хранения йогурта, в который были добавлены содержащие пробиотики микрокапсулы; из фиг. 1 можно понять, что количество живых бактерий Lactobacillus acidophilus и Lactobacillus casei демонстрировало тенденцию к изменению по времени.
pH йогурта является сравнительно низким и не подходит для выживаемости большинства пробиотиков; благодаря влиянию особого инкапсулирующего слоя микрокапсул согласно настоящему изобретению, микрокапсулы, содержащие пробиотики, в йогурте будут образовывать агрегат, обеспечивающий адекватную защиту находящихся внутри пробиотиков, вплоть до их попадания после питья в тонкую кишку, в которой pH значительно повышается, и явление агрегации постепенно исчезает, при этом оболочки капсул распадаются на белки, полисахариды и другие питательные вещества, и пробиотики полностью высвобождаются с обеспечением необходимого действия в кишечнике.
Начальное количество живых бактерий Lactobacillus acidophilus, составлявшее 1,86×109 КОЕ/мл, понижалось до 1,45×109 КОЕ/мл, то есть понижалось только на 22,1%. Начальное количество живых бактерий Lactobacillus casei, составлявшее 1,48×109 КОЕ/мл, понижалось до 1,1×109 КОЕ/мл, то есть понижалось только на 25,7%. Из приведенных выше данных можно понять, что выживаемость пробиотиков в пределах срока хранения йогурта являлась сравнительно высокой, и количество живых бактерий в нем не снижалось даже на один порядок.
Согласно настоящему изобретению, в отношении устойчивости к действию кислоты, устойчивости к длительному хранению и теплостойкости микрокапсул, содержащих пробиотики, полученных согласно примерам осуществления 1 и 2, также проводили следующие испытания.
1.1. Испытание микрокапсул, содержащих пробиотики, на устойчивость
Согласно настоящему изобретению основные компоненты оболочек микрокапсул, содержащих пробиотики, представляют собой белки и сложные растительные полисахариды, при этом образованные ими агрегатные структуры не растворяются в кислой среде и могут защищать пробиотики, составляющие содержимое, беспрепятственно проходить через желудочный сок и попадать в кишечник, в котором они растворяются с обеспечением колонизации; питательные вещества, высвобождающиеся из оболочек капсул, могут быстро обеспечивать пробиотические бактерии пищей, в результате чего пробиотики будут быстро размножаться. Поэтому цель инкапсулирования в микрокапсулы заключается в ограждении пробиотиков от прямого контакта с внешней неблагоприятной средой, контроле места и времени высвобождения пробиотиков, а также в возможности обеспечения пробиотиков источником питательных веществ, что в значительной степени способствует стабильному сохранению активности штамма и повышает биодоступность пробиотиков.
В этом испытании на устойчивость к действию кислоты в качестве материалов для испытания использовали бактерии Lactobacillus acidophilus, Bifidobacterium longum, Lactobacillus casei, не инкапсулированные в микрокапсулы, и сухой порошок, состоящий из микрокапсул; среда для проведения испытания материала представляла собой раствор искусственной желудочной кислоты (pH 2,1); акцент делали на исследовании влияния инкапсулирования в микрокапсулу на выживаемость штамма в кислой среде; результаты показаны на фиг. 2. Из фиг. 2 можно понять, что не инкапсулированные в микрокапсулы пробиотические бактерии в сильнокислой среде быстро погибают, и их выживаемость является очень низкой, тогда как инкапсулированные в микрокапсулы пробиотики характеризуются превосходной кислотоустойчивостью и сравнительно высокой выживаемостью. Из вышеприведенного можно понять, что инкапсулирование в микрокапсулы согласно настоящему изобретению может заметно улучшать кислотоустойчивость штамма, а также повышать выживаемость и активность штамма.
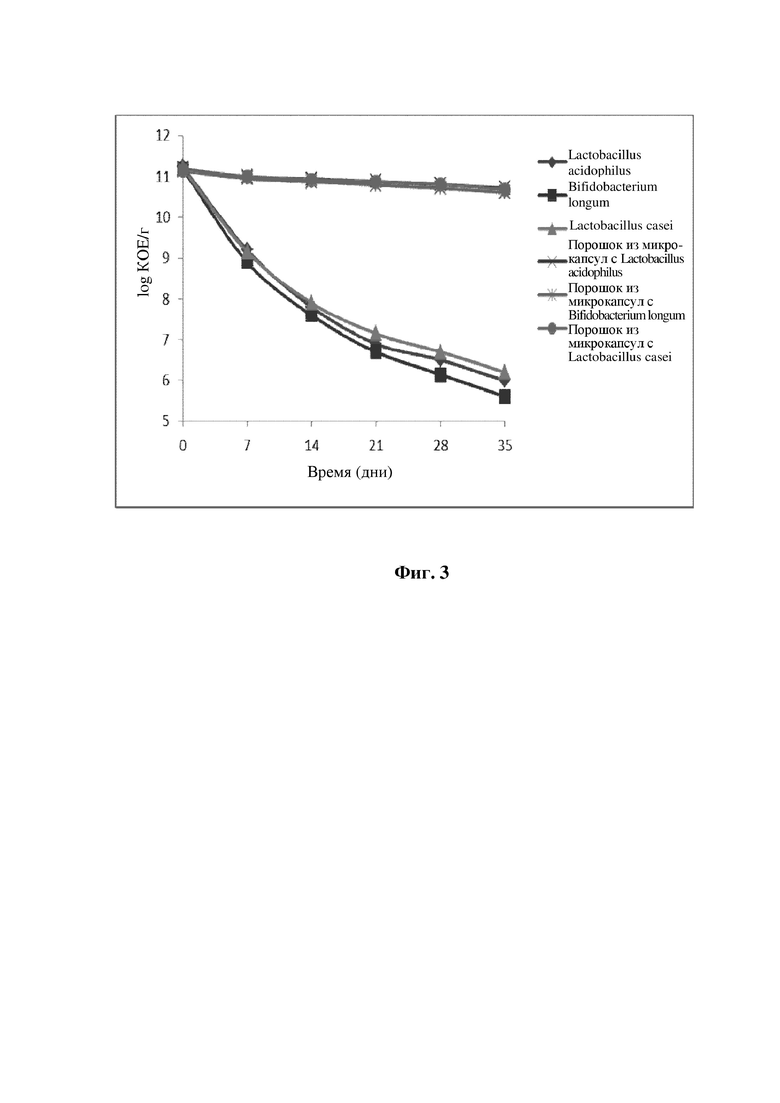
1.2. Испытание микрокапсул, содержащих пробиотики, на устойчивость к длительному хранению
В этом испытании на устойчивость к длительному хранению в качестве материалов для испытания использовали бактерии Lactobacillus acidophilus, Bifidobacterium longum, Lactobacillus casei, не инкапсулированные в микрокапсулы, и сухой порошок, состоящий из микрокапсул; акцент делали на исследовании влияния инкапсулирования в микрокапсулу на выживаемость штамма, помещенного в условия ускоренного испытания (40°С, влажность 75%) на 35 дней; результаты показаны на фиг. 3. Из фиг. 3 можно понять, что в случае трех порошков, состоящих из микрокапсул, содержащих пробиотики, после 5 недель в условиях ускоренного испытания количество живых бактерий соответствующего штамма снизилось только на 1 логарифмическую величину, и выживаемость штамма являлась сравнительно высокой, тогда как в случае не инкапсулированные в микрокапсулы трех видов пробиотических бактерий минимальные потери составили 5-6 логарифмических величин или более, и выживаемость штамма являлась сравнительно низкой. Из вышеприведенного можно понять, что инкапсулирование в микрокапсулы согласно настоящему изобретению может заметно повышать выживаемость штамма и поддерживать активность штамма.
1.3. Испытание микрокапсул, содержащих пробиотики, на теплостойкость
Настоящее изобретение, кроме того что характеризуется превосходной устойчивостью к действию кислоты и устойчивостью к длительному хранению, также обладает отличной устойчивостью к высокой температуре и характеризуется сравнительно хорошей теплоустойчивостью. В качестве материалов для испытания использовали порошок, состоящий из микрокапсул с Lactobacillus acidophilus, порошок, состоящий из микрокапсул с Bifidobacterium longum, и порошок, состоящий из микрокапсул с Lactobacillus casei; акцент делали на исследовании изменений выживаемости штамма в условиях разной температуры с течением времени; конкретные данные представлены в нижеследующей таблице 1.
Таблица1. Результаты испытания теплостойкости микрокапсул, содержащих пробиотики
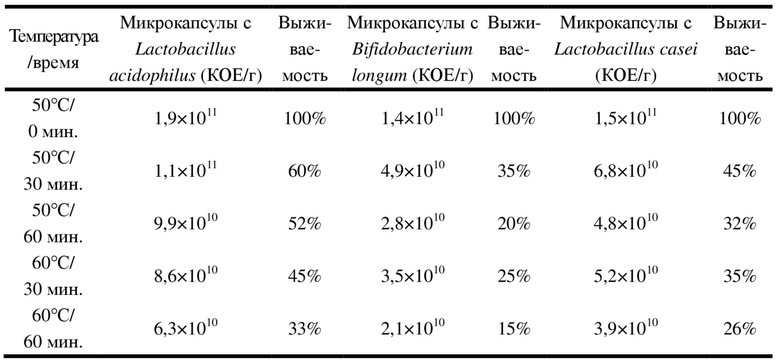
Из данных в таблице 1 можно понять, что пробиотики после инкапсулирования в микрокапсулы характеризовались отличной устойчивостью к высокой температуре, и, после того как их подвергали жестким испытаниям согласно технологии производства, могли по-прежнему характеризоваться сравнительно высокой выживаемостью, при этом штамм характеризовался отличной активностью и хорошей теплоустойчивостью, и настоящее изобретение может иметь более широкие перспективы практического применения в промышленности.
Представленное выше представляет собой только предпочтительные примеры осуществления настоящего изобретения и поэтому вовсе не ограничивает объем заявленного изобретения; по той же причине любые эквивалентные изменения в конструкции или процессе, выполненные на основании содержания формулы настоящего изобретения, или усовершенствования и улучшения, внесенные без отклонения от принципов настоящего изобретения, или непосредственное либо опосредованное применение в других соответствующих областях техники входят в объем правовой охраны настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМА ИНКАПСУЛИРОВАНИЯ ДЛЯ ЗАЩИТЫ ПРОБИОТИКОВ ВО ВРЕМЯ ОБРАБОТКИ | 2012 |
|
RU2577980C2 |
| СПОСОБ ПРОИЗВОДСТВА КАПСУЛИРОВАННОЙ ФОРМЫ ПРОБИОТИЧЕСКОЙ ПИЩЕВОЙ ДОБАВКИ | 2021 |
|
RU2795965C1 |
| LACTOBACILLUS RHAMNOSUS RHT-3201, КОНЪЮГИРОВАННЫЕ С ПОЛИСАХАРИДНЫМ ПОЛИМЕРНЫМ СВЯЗУЮЩИМ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ АТОПИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2671209C2 |
| ПРОДУКТ ПИТАНИЯ ИЗ ЗЛАКОВ, СОДЕРЖАЩИЙ ПРОБИОТИЧЕСКИЙ МИКРООРГАНИЗМ, ПРОДУКТ ПИТАНИЯ ИЗ ЗЛАКОВ, СОДЕРЖАЩИЙ МЕТАБОЛИТЫ, ПРОДУЦИРОВАННЫЕ ПРОБИОТИЧЕСКИМИ МИКРООРГАНИЗМАМИ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2302747C2 |
| СПОСОБ ПРОИЗВОДСТВА ПРОБИОТИЧЕСКОГО ПРЕПАРАТА НА ОСНОВЕ СПОРООБРАЗУЮЩИХ ШТАММОВ Bac. subtilis И Bac. licheniformis | 2010 |
|
RU2432392C1 |
| МИКРОИНКАПСУЛИРОВАННАЯ ПРОБИОТИЧЕСКАЯ СУБСТАНЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2593327C2 |
| Синбиотическая композиция для подавления микробных возбудителей кишечных инфекций и способ ее получения | 2021 |
|
RU2782196C1 |
| ПРОБИОТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ВОССТАНОВЛЕНИЯ И ПОДДЕРЖАНИЯ СБАЛАНСИРОВАННОЙ МИКРОФЛОРЫ КИШЕЧНИКА У ДЕТЕЙ И МЛАДЕНЦЕВ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2018 |
|
RU2767400C2 |
| СПОСОБ ПРОИЗВОДСТВА КАПСУЛИРОВАННОЙ ФОРМЫ АНТИМИКРОБНОГО ПРЕПАРАТА ДЛЯ ТЕРАПИИ ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2020 |
|
RU2743696C1 |
| ПРОБИОТИЧЕСКИЕ БАКТЕРИИ, ОБЛАДАЮЩИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ, И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2572698C2 |
Группа изобретений относится к биотехнологии. Предложена микрокапсула, содержащая пробиотики и обеспечивающая поддержание их активности, и способ ее получения. Микрокапсула содержит пробиотики. При этом первый материал стенки микрокапсулы содержит казеин, мальц-экстракт и ксилоолигосахарид. Второй материал стенки содержит полисахарид Tremella fuciformis, полисахарид Bletilla striata, полисахарид Atractylodes macrocephala, гуаровую камедь и пектин в заданных соотношениях. Способ получения микрокапсулы предусматривает центрифугирование культуральной среды, содержащей пробиотические бактерии, удаление супернатанта с получением пробиотических бактерий. Перемешивают казеин, мальц-экстракт, ксилоолигосахарид и воду в заданных количествах с получением смешанного раствора первого материала стенки. При этом пробиотические бактерии добавляют в смешанный раствор первого материала стенки и перемешивают с получением бактериальной суспензии. Полученную бактериальную суспензию медленно впрыскивают в раствор галловой кислоты, отстаивают в течение 5-20 мин, собирают преципитат в виде микрогранул и промывают собранные микрогранулы в стерилизованной воде. Добавляют полисахарид Tremella fuciformis, полисахарид Bletilla striata, полисахарид Atractylodes macrocephala, гуаровую камедь и пектин в воду и перемешивают с получением смешанного раствора второго материала стенки. В полученный раствор вводят микрогранулы и перемешивают с получением бактериальной суспензии. Затем бактериальную суспензию медленно впрыскивают в раствор лактата кальция при концентрации 0,05-0,5 моль/л с обеспечением отверждения, промывают и фильтруют с получением микрокапсул с последующей их сублимационной сушкой. Группа изобретений позволяет уменьшить отрицательное влияние окружающей среды на активность пробиотиков и повысить качество пробиотического препарата. 2 н. и 7 з.п. ф-лы, 3 ил., 1 табл., 6 пр.
1. Микрокапсула, содержащая пробиотики и обеспечивающая поддержание их активности, которая содержит содержимое и материал стенки, покрывающий содержимое снаружи, при этом указанное содержимое представляет собой пробиотики, где указанный материал стенки содержит первый материал стенки, покрывающий содержимое снаружи, и второй материал стенки, покрывающий первый материал стенки снаружи;
при этом указанный первый материал стенки содержит следующие компоненты: казеин, мальц-экстракт и ксилоолигосахарид;
указанный второй материал стенки содержит следующие компоненты: полисахарид Tremella fuciformis, полисахарид Bletilla striata, полисахарид Atractylodes macrocephala, гуаровую камедь и пектин;
при этом массовое соотношение указанных пробиотиков и указанного первого материала стенки составляет 1:(0,5-2), при этом по весу в указанном первом материале стенки казеин составляет 5-15 частей, мальц-экстракт составляет 1-6 частей, а ксилоолигосахарид составляет 0,5-3 части; массовое соотношение указанных пробиотиков и указанного второго материала стенки составляет 1:(0,5-1,5), при этом по весу в указанном втором материале стенки полисахарид Tremella fuciformis составляет 2-8 частей, полисахарид Bletilla striata составляет 2-5 частей, полисахарид Atractylodes macrocephala составляет 3-6 частей, гуаровая камедь составляет 0,2-0,6 части, а пектин составляет 0,6-1,2 части.
2. Микрокапсула по п. 1, изготовленная путем инкапсулирования в указанные первый и второй материалы стенки посредством их разбавления стерилизованной водой в качестве растворителя с получением смешанных растворов, при этом количество стерилизованной воды, используемой при разбавлении указанных первого и второго материалов стенки с получением смешанных растворов, в 3-5 раз превышает количество материалов стенки.
3. Микрокапсула по п. 1 или 2, где указанные пробиотики представляют собой одно или более из лактобактерий и бифидобактерий.
4. Способ получения микрокапсулы, содержащей пробиотики и обеспечивающей поддержание их активности, по любому из пп. 1-3, где способ включает следующие этапы, на которых
(1) культуральную среду с активированной обогатительной культурой пробиотических бактерий подвергают обработке центрифугированием и после обработки удаляют супернатант с получением пробиотических бактерий;
(2) казеин, мальц-экстракт и ксилоолигосахарид добавляют в воду и перемешивают с получением смешанного раствора первого материала стенки; при этом указанные пробиотические бактерии добавляют в смешанный раствор первого материала стенки и перемешивают с получением бактериальной суспензии; указанную бактериальную суспензию с помощью распылителя медленно впрыскивают в раствор галловой кислоты, pH которого составляет 3,0-5,0, отстаивают в течение 5-20 мин, собирают преципитат в виде микрогранул и промывают собранные микрогранулы в стерилизованной воде, pH которой составляет 3,8-4,2;
(3) полисахарид Tremella fuciformis, полисахарид Bletilla striata, полисахарид Atractylodes macrocephala, гуаровую камедь и пектин добавляют в воду и перемешивают с получением смешанного раствора второго материала стенки, и полученные на этапе (2) микрогранулы вводят в смешанный раствор второго материала стенки и перемешивают с получением бактериальной суспензии; затем бактериальную суспензию с помощью распылителя медленно впрыскивают в раствор лактата кальция при концентрации 0,05-0,5 моль/л с обеспечением отверждения, промывают и фильтруют с получением микрокапсул;
(4) указанные микрокапсулы подвергают сублимационной сушке под вакуумом с получением сухого порошка, состоящего из микрокапсул, содержащих пробиотики;
при этом массовое соотношение указанных пробиотиков и указанного первого материала стенки составляет 1:(0,5-2), при этом по весу в указанном первом материале стенки казеин составляет 5-15 частей, мальц-экстракт составляет 1-6 частей, а ксилоолигосахарид составляет 0,5-3 части; массовое соотношение указанных пробиотиков и указанного второго материала стенки составляет 1:(0,5-1,5), при этом по весу в указанном втором материале стенки полисахарид Tremella fuciformis составляет 2-8 частей, полисахарид Bletilla striata составляет 2-5 частей, полисахарид Atractylodes macrocephala составляет 3-6 частей, гуаровая камедь составляет 0,2-0,6 части, а пектин составляет 0,6-1,2 части.
5. Способ по п. 4, где для указанной обработки центрифугированием на этапе (1) скорость вращения при центрифугировании составляет 4000-6000 об/мин, а время центрифугирования составляет 5-12 мин.
6. Способ по п. 4, где для указанной сублимационной сушки под вакуумом на этапе (4) начальная температура предварительного замораживания составляет от -30 до -40°С, а скорость предварительного замораживания составляет 0,4-0,8°С/мин; конечная температура предварительного замораживания составляет -60°С; давление в сушильной камере составляет 40-100 Па; температура нагревательной плиты составляет 30-40°С; время сушки составляет 12-20 ч.
7. Способ по п. 4, где указанный мальц-экстракт получают посредством следующих этапов:
(a) измельчение: проросший ячмень или высушенный ячмень измельчают с помощью технологии сверхтонкого измельчения в ультратонкий порошок проросшего ячменя или высушенного ячменя с размером частиц 90-110 мкм;
(b) смешивание: порошок проросшего ячменя или высушенного ячменя смешивают с дистиллированной водой с получением белковой дисперсии, и pH дисперсии доводят до 6-7;
(c) ферментативное расщепление: дисперсию нагревают и поддерживают ее температуру в диапазоне 40-50°С; затем в дисперсию соответственно добавляют α-амилазу, β-амилазу и диспазу и после равномерного перемешивания подвергают ферментативному расщеплению продолжительностью от 2 ч до 4 ч, при этом α-амилазу добавляют в количестве, составляющем от 0,3% до 0,5% от содержания субстрата, β-амилазу добавляют в количестве, составляющем от 0,1% до 0,3% от содержания субстрата, и диспазу добавляют в количестве, составляющем от 0,2 до 0,4% от содержания субстрата; после завершения ферментативного расщепления выполняют высокотемпературную инактивацию ферментов;
(d) центробежная фильтрация: прошедший инактивацию ферментов жидкий продукт ферментативного расщепления подвергают центрифугированию для удаления примесей, при этом поддерживают скорость вращения при центрифугировании 12000-16000 об/мин, а скорость подачи материала перистальтическим насосом составляет 1,5-3,5 л/мин; собирают супернатант, включают устройство мембранной фильтрации и подвергают супернатант фильтрации через микропористую фильтрующую мембрану, при этом толщина фильтрующей мембраны составляет 90-150 мкм, размер выделяемых частиц составляет 4-8 мкм, и рабочее давление составляет 0,01-0,2 МПа; обеспечивают прозрачность фильтрата путем отстаивания и удаляют остаток;
(e) концентрирование под вакуумом: фильтрат подвергают концентрированию под вакуумом, при этом температура концентрирования составляет 65-85°С, а степень вакуума составляет от -0,07 до -0,09 МПа, с получением концентрированного раствора, при этом относительная плотность удерживается в диапазоне 1,04-1,08;
(f) распылительная сушка: указанный концентрированный раствор подвергают распылительной сушке, при этом технологические параметры являются следующими: температура форсунок составляет 175-190°С, температура на выходе составляет 80-95°С, а скорость подачи материала составляет 1,5-3,5 л/мин, с получением указанного мальц-экстракта.
8. Способ по п. 4, где указанный полисахарид Bletilla striata/полисахарид Atractylodes macrocephala получают посредством следующих этапов:
(a) динамическая противоточная экстракция: измельченные Bletilla striata/Atractylodes macrocephala добавляют в воду, количество которой в 8-10 раз превышает вес сырья, и при 90-100°С проводят динамическую противоточную экстракцию с получением экстракта, при этом экстракцию проводят 1-3 раза, и продолжительность каждой экстракции составляет 1-3 часа;
(b) центрифугирование: экстракт подвергают центрифугированию с получением осветленного раствора;
(c) осаждение спиртом после концентрирования: осветленный раствор подвергают концентрированию под вакуумом, при этом относительная плотность удерживается в диапазоне 1,10-1,20; в концентрированный раствор добавляют пищевой спирт, при этом содержание спирта в смеси достигает 40-80%, тщательно и равномерно перемешивают и отстаивают в течение ночи; из супернатанта рекуперируют растворитель; и осадок сохраняют для последующего использования;
(d) ионный обмен: полисахарид, полученный с помощью осаждения спиртом, растворяют в 4-8-кратном количестве дистиллированной воды и после тщательного перемешивания и растворения фильтруют; полученный после фильтрования фильтрат пропускают через ионообменную колонку и колонку с активированным углем, проводят обработку для удаления примесей и обесцвечивания;
(e) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергают концентрированию под вакуумом, при этом температура концентрирования составляет 60-80°С, а степень вакуума составляет от -0,07 до -0,09 МПа, с получением концентрированного раствора полисахарида, при этом относительная плотность удерживается в диапазоне 1,03-1,06;
(f) распылительная сушка: концентрированный раствор полисахарида после стерилизации и фильтрования подвергают распылительной сушке, при этом технологические параметры являются следующими: температура форсунок составляет 170-185°С, температура на выходе составляет 75-95°С, а скорость подачи материала составляет 2,0-4,0 л/мин, с получением указанного полисахарида Bletilla striata/полисахарида Atractylodes macrocephala.
9. Способ по п. 4, где указанный полисахарид Tremella fuciformis получают посредством следующих этапов:
(a) ферментативное расщепление: с помощью технологии сверхтонкого измельчения Tremella fuciformis измельчают с получением ультратонкого порошка Tremella fuciformis с размером частиц 90-110 мкм; добавляют воду, количество которой в 30-50 раз превышает вес сырья, и 0,5-2% пектиназы; проводят ферментативное расщепление при постоянной температуре 40-50°С в течение 30-90 мин; и нагревают до 95°С или больше для инактивации ферментов;
(b) экстракция: проводят экстракцию с поддержанием температуры в диапазоне 95-100°С; фильтруют через сито 500 меш с получением экстракта полисахарида Tremella fuciformis, при этом экстракцию проводят 1-2 раза и продолжительность каждой экстракции составляет 1-3 часа;
(c) ионный обмен: полученный после фильтрования экстракт полисахарида Tremella fuciformis пропускают через ионообменную колонку и колонку с активированным углем, проводят обработку для удаления примесей и обесцвечивания;
(d) концентрирование под вакуумом: раствор, полученный после осуществления ионного обмена, подвергают концентрированию под вакуумом, при этом температура концентрирования составляет 60-80°С, а степень вакуума составляет от -0,07 до -0,09 МПа, с получением концентрированного раствора полисахарида Tremella fuciformis, при этом относительная плотность удерживается в диапазоне 1,02-1,04;
(e) сублимационная сушка под вакуумом: из концентрированного раствора полисахарида Tremella fuciformis с помощью технологии сублимационной сушки под вакуумом получают порошок полисахарида Tremella fuciformis, при этом начальная температура предварительного замораживания составляет от -35 до -45°С, скорость предварительного замораживания составляет 0,2-0,5°С/мин; конечная температура предварительного замораживания составляет -65°С; давление в сушильной камере составляет 50-120 Па; температура нагревательной плиты составляет 30-40°С; и время сушки составляет 16-24 ч.
| CN 106723233 A, 31.05.2017 | |||
| СПОСОБ ИНКАПСУЛЯЦИИ КРЕАТИНА, ОБЛАДАЮЩЕГО СУПРАМОЛЕКУЛЯРНЫМИ СВОЙСТВАМИ | 2014 |
|
RU2538695C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ БИОПАГА-Д В ПЕКТИНЕ | 2014 |
|
RU2561586C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ | 1996 |
|
RU2107542C1 |
| МУСАБАЕВА Б.Х | |||
| и др | |||
| Получение микрокапсул противотуберкулезных препаратов на основе биополимеров и полиэлектролитов, Фармация и фармакология, 2017 2(5), с | |||
| Способ получения суррогата олифы | 1922 |
|
SU164A1 |
Авторы
Даты
2021-09-17—Публикация
2018-05-09—Подача