Уровень техники
Эпителий представляет собой специализированную и поляризованную ткань, которая образует выстилку внутренних и внешних поверхностей тела. Клетки, составляющие эпителий, плотно упакованы и могут образовывать один или несколько слоев. Эпителий может быть толщиной в одну клетку (однослойный эпителий) или в две или более клеток (стратифицированный эпителий). Различные типы эпителия, как однослойного, так и стратифицированного, распознаются по их форме и функции, и включают плоский эпителий, кубический эпителий, столбчатый эпителий и переходный эпителий.
Обычно тонкий слой соединительной ткани, называемый базальной мембраной, отделяет эпителий от подлежащей ткани. Эта базальная мембрана обеспечивает структурную опору эпителия и соединяет его с соседними структурами. Базальная мембрана действует как подложка, на которой эпителий может расти и восстанавливаться после травм. Эпителиальная ткань иннервирована, но лишена сосудов, и эпителий должен питаться веществами, диффундирующими из кровеносных сосудов в подлежащей ткани. Базальная мембрана действует как избирательно проницаемая мембрана, определяющая, какие вещества смогут попасть в эпителий.
Дифференцировка эпителия в процессе развития тесно связана с упорядоченной последовательностью морфогенетических событий. В нескольких экспериментальных исследованиях было особо отмечено, что эти процессы развития зависят от взаимных эпителиально-мезенхимальных взаимодействий.
Существует значительный интерес к разработке in vitro моделей тканей эпителиального барьера, которые повторяют организацию и сдерживающее поведение, наблюдаемые in vivo, и которые, например, можно применять для неинвазивного, быстрого, экономичного и воспроизводимого тестирования и/или скрининга новых кандидатов в лекарственные средства, химикаты и продукты питания. Однако, когда клетки культивируют ex vivo на двумерных пластиковых субстратах, некоторые важные сигналы теряются. Полученные ткани во многих случаях не проявляют морфологических характеристик соответствующей эквивалентных тканей in vivo, отсутствуют многие специализированные дифференцированные типы клеток.
Усилия по устранению этих ограничений привели к разработке 3D-моделей на основе клеточной культуры, в которых клетки выращивают внедренными во внеклеточный матрикс.
Этот подход усиливает проявление дифференцированных функций и улучшает организацию тканей (Pampaloni et al. (2007). Nat Rev Mol Cell Biol 8: 839-84).
В частности, был достигнут большой прогресс в области культур органоидов. Органоид представляет собой трехмерную заготовку органа, обычно состоящую из наиболее специализированных клеток, которые также имеются в организме человека. На практике в среде in vitro имитируется культивирование и дифференцировка ткани в ходе эмбрионального развития, так что стволовые клетки дифференцируются в различные дифференцированные клетки. Хорошо известным примером таких органоидов являются малые кишечные органоиды (Shoichi Date and Toshiro Sato, Mini-Gut Organoids: Reconstitution of the Stem Cell Niche, Annu. Rev. Cell Dev. Biol., 2015, Vol.31: 269-289). Коктейль из факторов роста и сигнальных молекул, таких как агонисты пути Wnt (например, Wnt3a, R-спондин, CHIR99021), ингибиторы пути BMP/TGF (например, ноггин), ЭФР и среда экстракта базальной мембраны (матригель или аналогичный), обеспечивает культивирование первичных кишечных крипт, поддержание соответствующей ниши стволовых клеток и потенциал дифференцировки клеток, например, на бокаловидные клетки, энтероциты и энтероэндокринные клетки. Это приводит к получению трехмерной структуры, имеющей вторичные морфологические компоненты кишки, включая формирование крипт и ворсинок. Аналогичные трехмерные культуры были созданы для культивирования тканей первичного человеческого пищевода, желудка, толстой кишки, печени и поджелудочной железы.
В последнее время был достигнут огромный прогресс в выращивании органоидов мозга из индуцированных плюрипотентных стволовых клеток. Долгосрочное культивирование суспендированных сфероидов при непрерывном встряхивании позволяет получить так называемый минимозг со специализированными разделами, такими как характерные структуры переднего и заднего мозга. Совсем недавно был достигнут прорыв в культуре почечного клубочка, с применением протокол» комплексной культуры, начиная с индуцированных плюрипотентных стволовых клеток на системах Transwell, которые, как и в предыдущем примере, позволяют получить высокоспециализированные клетки, присутствующие в клубочках почек человека.
Недостатком таких методов получения органоидов является отсутствие структурного контроля над этими мини-органами. В частности, отсутствует независимый апикально-базальный доступ из-за сфероидальных форм. Было предпринята попытка применить протоколы органоидов для создания плоских поляризованных тканей на мембранах Transwell, позволяющих получить апикально-базальный доступ, но достигнутый успех пока сильно ограничен, возможно, из-за того, что для роста органоидов важен контекст внеклеточного матрикса, а добавление этого фактора не позволяет получить герметичный барьер.
Были разработаны статические модели in vitro с применением культивирования эпителиальных клеток из разных источников по отдельности или в сочетании с поддерживающими клетками (фидерными слоями или мезенхимальными клетками, такими как фибробласты) на полупроницаемой мембране с применением системы Transwell. К сожалению, эти модели демонстрируют низкое трансэпителиальное электрическое сопротивление (TEER), высокую проницаемость для обычно не проникающих маркерных молекул, низкую экспрессию и функциональность транспортеров (например, Р-гликопротеинового эффлюксного насоса) и кратковременную жизнеспособность. Это может ограничивать их ценность в качестве модели.
В качестве опоры для культур многих типов эмбриональных и взрослых стволовых клеток обычно используются фидерные слои. Например, эмбриональные фибробласты мыши (MEF) часто используются для поддержки культуры эмбриональных стволовых клеток (ESC). Поддержание другого типа стволовых клеток, гемопоэтических стволовых клеток (HSC), может быть достигнуто и усилено совместным культивированием со стромальными мезенхимальными стволовыми клетками.
Как правило, фидерные клетки состоят из слоя клеток, которые являются митотически неактивными и служат в качестве замещающих нишевых клеток, секретирующих необходимые факторы роста и цитокины, которые важны для поддержания желаемого фенотипа клеток целевого типа. Фидерные клетки поддерживают рост других клеток не только путем высвобождения факторов роста в культуральную среду, но также путем обеспечения поддержки внеклеточного матрикса, усиливая желаемые взаимодействия внеклеточный матрикс-клетка. Взаимодействие стволовых клеток с микроокружением регулирует механизм самообновления и способность стволовых клеток к дифференцировке. Но, как уже упоминалось, при использовании системы Transwell эти модели, к сожалению, демонстрируют низкое трансэпителиальное электрическое сопротивление (TEER), высокую проницаемость для обычно не проникающих маркерных молекул, низкую экспрессию и функциональность транспортеров (например, Р-гликопротеинового эффлюксного насоса) и короткую жизнеспособность, которые ограничивают их ценность в качестве модели, даже в сочетании с фидерными слоями.
Кроме того, современные методы и средства не позволяют проводить высокопроизводительные исследования, такие как анализ абсорбции, транспорта и/или секреции, по различным эпителиальным тканям. Например, известные планшеты Transwell не пригодны для измерения абсорбции, транспорта и/или секреции на образце эпителиальной ткани, так как образец такой ткани не будет достаточно прилипать к мембранам планшета Transwell.
Таким образом, существует потребность в разработке более адекватной и предиктивной модели культивирования эпителия человека, в которой пролиферация и дифференцировка клеток имитируют ситуацию in vivo. В свете этого были бы весьма желательными продукты, составы, способы получения и использования усовершенствованных эпителиальных моделей in vitro, но они пока не доступны. В частности, в данной области техники имеется очевидная потребность в надежных, эффективных и воспроизводимых способах, позволяющих обеспечить такие модели эпителиального барьера in vitro с независимым базально-апикальным доступом и, например, содержащих большинство специализированных клеток, также присутствующих в эквивалентной ткани in vivo. Эти модели могут применяться, например, в высокопроизводительном скрининге, исследованиях адсорбции, транспорта и токсичности лекарственного средства, моделировании заболеваний, взаимодействии, например, с микробными культурами и/или моделями для изучения потребления питательных веществ. Соответственно, техническая проблема, лежащая в основе настоящего изобретения, заключается в обеспечении таких продуктов, составов, способов и применений для удовлетворения любой из вышеупомянутых потребностей. Эта техническая проблема решается с помощью вариантов реализации, охарактеризованных в формуле изобретения и в нижеприведенном описании.
Описание
Чертежи
Фигура 1: Примеры устройства для культивирования эпителиальной трубки (без соблюдения масштаба): вид снизу.
Фигура 2: Примеры устройства для культивирования эпителиальной трубки (без соблюдения масштаба): смотровое окно крупным планом.
Фигура 3: Примеры устройства для культивирования эпителиальной трубки (без соблюдения масштаба): вертикальное поперечное сечение фигуры 2.
Фигуры 4 и 5: Этап в способе культивирования эпителиальной трубки: предшественник геля ВКМ, содержащий мезенхимальные клетки, вводят в гелевую дорожку с фиг. 2/3, закрепляют на барьере капиллярного давления и дают застыть. ВКМ может представлять собой, например, Matrigel (фактор роста, восстановленный или невосстановленный), коллаген I, коллаген IV, фибриноген, фибронектин или их комбинации, а также синтетический ВКМ.
Фигуры 6 и 7: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 4/5, когда эпителиальные клетки вводят в первый перфузионный канал (и при необходимости вводят ростовую среду во второй перфузионный канал).
Фигуры 8 и 9: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 6/7, когда устройство с фиг. 3 размещено вертикально, так что эпителиальные клетки оседают на поверхности геля. После адгезии эпителиальных клеток запускают поток среды (не показано).
Фигуры 10 и 11: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 8/9, когда эпителиальным клеткам дают пролиферировать и выстилать стенки канала и поверхность геля с образованием трубочки.
Фигуры 12 и 13: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 10/11, когда мезенхимальным клеткам дают взаимодействовать с эпителиальными клетками, а эпителию дают возможность дифференцироваться; дифференцировка может привести к появлению регулярной морфологической картины: в данном случае - криптообразных структур.
Фигуры 14 и 15: Этап в способе культивирования эпителиальной трубки: предшественник геля ВКМ вводят в гелевую дорожку с фиг. 2/3, закрепляют на барьере капиллярного давления и дают застыть.
Фигуры 16 и 17: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 14/15, когда мезенхимальные клетки вводят в первый перфузионный канал (и при необходимости вводят ростовую среду во второй перфузионный канал).
Фигура 18 и 19: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 16/17, когда устройство с фиг. 3 размещено вертикально таким образом, что мезенхимальные клетки оседают на поверхности геля. После адгезии эпителиальных клеток может быть индуцирован поток среды (не показано).
Фигура 20 и 21: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 18/19, когда мезенхимальным клеткам дают пролиферировать и выстилать стенки канала и поверхность геля.
Фигура 22: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 20/21, когда эпителиальные клетки вводят в первый перфузионный канал (и при необходимости используют другую среду).
Фигура 23: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 22, когда устройство с фиг. 3 размещено вертикально таким образом, что эпителиальные клетки оседают на мезенхимальных клетках, осажденных на поверхности геля. После адгезии мезенхимальных клеток может быть запущен поток среды (не показано).
Фигура 24: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 23, когда эпителиальным клеткам дают пролиферировать и выстилать стенки канала и поверхность геля, чтобы образовать трубочку, имеющую плотные контакты.
Фигуры 25 и 26: Этап в способе культивирования эпителиальной трубки после этапа, описанного на фиг. 24, когда мезенхимальным клеткам дают взаимодействовать с эпителиальными клетками, а эпителию дают возможность дифференцироваться; дифференцировка может привести к появлению регулярной морфологической картины: в данном случае - криптообразных структур и куполов.
Фигура 27: Альтернативный вариант реализации к фиг. 1, с одной гелевой дорожкой и одной перфузионной дорожкой.
Фигура 28: Альтернативный вариант реализации к фиг. 1, с 2 гелевыми дорожками, которые заполняют из одного впускного отверстия (при необходимости могут быть отдельные впускные отверстия)
Фигура 29: 1. Фазово-контрастные изображения после последовательного посева мезенхимальных и эпителиальных клеток в устройстве OrganoPlate® (MIMETAS) с 3 дорожками с шириной дорожки 400 микрон, в соответствии с фиг. 1.
Фигура 30: Результаты конфокальной микроскопии после посева мезенхимальных/эпителиальных клеток в OrganoPlate® (MIMETAS) с 2 дорожками с шириной дорожки 400 микрон, показывающие трубчатую структуру
Определения
Часть этого раскрытия содержит материалы, защищенные авторскими правами (такие как, помимо прочего, диаграммы, фотографии устройств или любые другие аспекты поданных документов, для которых защита авторских прав заявки доступна или может быть доступка в какой-либо юрисдикции). Обладатель авторского права не имеет возражений против факсимильного воспроизведения кем-либо патентного документа или раскрытия патента, представленного в патентном фонде или записях Патентного ведомства, но в остальном сохраняет за собой все авторские права.
В описании и формуле изобретения используются различные термины, относящиеся к способам, составам, применениям и другим аспектам настоящего изобретения. Такие термины должны иметь свое обычное значение в уровне техники, к которому относится настоящее изобретение, если не указано иное. Другие специально определенные термины должны толковаться в соответствии с определением, представленным в настоящей заявке. Хотя для испытания настоящего изобретения на практике применяться любые способы и материалы, аналогичные или эквивалентные описанным в настоящей заявке, ниже описаны предпочтительные материалы и способы.
Термины в форме единственного числа также включают обозначаемые понятия во множественном числе, если содержание явно не указывает на иное. Так, например, указание на "клетку" включает в себя комбинацию двух или более клеток и тому подобное.
"Примерно" и "приблизительно": эти термины, применительно измеримой величине, такой как количество, продолжительность, и тому подобному, подразумевают охват отклонений размером ±20% или ±10%, более предпочтительно ±5%, еще более предпочтительно ±1% и еще более предпочтительно ±0,1% от указанного значения, поскольку такие отклонения допустимы для реализации раскрытых способов.
"Включающий" (содержащий): этот термин толкуется как включающий и неограничивающий, и не исчерпывающий. В частности, этот термин и его варианты означают, что указанные признаки, этапы или компоненты включены в состав чего-либо. Этот термин не должен интерпретироваться, как исключающий присутствие других признаков, этапов или компонентов.
"Иллюстративный": этот термин означает "служащий примером, образцом или иллюстрацией" и не должен толковаться как исключение других конфигураций, раскрытых в настоящем документе.
Подробное описание
Предполагается, что любой способ, применение или композиция, описанные в настоящей заявке, могут быть реализованы в отношении любого другого способа, применения или композиции, описанных в настоящей заявке. Варианты реализации, обсуждаемые в контексте способов, применения и/или композиций по изобретению, применяться в отношении любого другого способа, применения или композиции, описанных в настоящей заявке. Таким образом, вариант реализации, относящийся к одному способу, применению или композиции, может также применяться к другим способам, применениям и составам по изобретению.
Авторы настоящего изобретения неожиданно обнаружили, что техническая задача, лежащая в основе настоящего изобретения, может быть решена с помощью способа микрожидкостного культивирования клеток, описанного в настоящей заявке.
Микрожидкостное культивирование клеток становится все более важной технологией. Эта технология находит свое применение в скрининге лекарств, культивировании тканей, скрининге токсичности и биологических исследованиях. Основным преимуществом микрожидкостного культивирования клеток является то, что оно может добавлять такие характеристики как перфузионный поток, улучшенное совместное культивирование и устойчивые градиенты, к традиционным способам культивирования клеток, а также может обеспечивать более качественные данные, снижение потребления реагентов и затрат.
Многочисленные аспекты, связанные с микрожидкостными системами, устройствами, способами и производством обсуждаются на предшествующем уровне техники, включая такие патентные документы, как WO 2008/079320, WO 2013/151616, WO 2010/086179, WO 2012/120101, или коммерчески доступны, например у таких производителей, как Mimetas, Лейден, Нидерланды (например, платформа OrganoPlate, www.mimetas.com). Принимая во внимание, что из этих заявок и документов не должны выводиться никакие конкретные ограничения для любых пунктов формулы изобретения, представленных в настоящей заявке, эти документы содержат полезный справочный материал, относящийся к конкретным вариантам реализации.
Высококачественные образцы препаратов важны для многих клинических, исследовательских и других приложений. Культивирование, исследование и визуализация клеток становятся все более ценными в области открытия лекарств, диагностики и анализа болезней, а также ряда других терапевтических и экспериментальных работ. Существенно важно, что с помощью микрожидкостной технологии культивирования клеток могут быть получены образцы in vitro, с большей точностью отражающие их характеристики in vivo. Такие образцы in vitro могут потенциально способствовать реализации широкого спектра молекулярных и клеточных применений.
Техническая задача, лежащая в основе настоящего изобретения, заключена в области способов и систем культивирования клеток, которые способны обеспечить культуры in vitro эпителиальных клеток, которые более точно отражают их характеристики in vivo. Это может включать полярность (экспрессия апикальных и базолатеральных белков, таких как транспортерные и канальные белки (например, ОАТ2/3, МАТЕ 1/2, NKCCl), экспрессию и функционирование связанных со структурой белков (например, виллин в щеточной кайме, актин), мембранные рецепторы (например, РЭФР/ErbB), адгезионные контакты, фокальные контакты, морфологию клеток и формирование клеточных слоев (форма и внешний вид, размеры, микроворсинки, реснички, конфлюентность) и функции (барьерная функция, экспрессия рецепторов клеточной поверхности, усвоение и секреция).
Наиболее важно, что эти модели предпочтительно демонстрируют дифференцировку клеток в специализированные клетки в определенных местах, при этом предпочтительно поддерживая ниши стволовых клеток в других определенных местах. Примеры таких специализированных клеток в тонком кишечнике включают энтероциты, бокаловидные клетки, клетки Панета, в подоцитах почек - различные специализированные клетки кубического эпителия, в пигментном эпителии сетчатки - палочки, колбочки, биполярные клетки, ганглиозные клетки, в легком -плоские альвеолярные клетки I типа, большие альвеолярные клетки II типа. Дифференцировка клеток в характерных местах не только приводит к получению специализированных клеток с различными функциями и поведением, но также во многих случаях изменяет форму ткани, придавая ей характерную морфологию. Примерами являются структуры, содержащие крипты и ворсинки, и продукция муцинов в тонком кишечнике, альвеолы в легких, клубочки, дистальные и проксимальные канальцы и петли Генле в почках, пигментный слой и слои палочек и колбочек в сетчатке. Мы будем называть эти характерные формы вторичной морфологией, чтобы отличить их от первичной морфологии, такой как плоские блинообразные клеточные слои в системе Transwell и прикрепленные к поверхности клеточные культуры или трубчатые структуры ткани в условиях in vivo или в микрожидкостных системах.
Получение образцов in vitro, которые как можно лучше соответствуют их аналогам in vivo, очень важно.
В данной области техники уже предлагались некоторые способы, использующие системы микрожидкостного культивирования клеток, микрокамеры или микрожидкостные устройства. Большинство других систем используют стандартные культуральные планшеты и применяют различные барьерные вставки в попытке культивировать эпителиальные клетки, которые более точно отражают их характеристики in vivo (например, проницаемые подложки Transwell). Однако имеющиеся в настоящее время системы пока не выглядят удовлетворительными, как в отношении производства образцов эпителиальных клеток in vitro, которые имели бы достаточно близкие характеристики с аналогами in vivo, так и в отношении ряда аспектов, необходимых для простых в использовании, высокопроизводительных или автоматизированных способов применения.
Авторы настоящего изобретения неожиданно обнаружили, что проблемы в данной области техники могут быть решены путем обеспечения способа культивирования и/или мониторинга эпителиальных клеток с применением системы микрожидкостного культивирования клеток, содержащей сеть микрожидкостных каналов.
Способ, предлагаемый в настоящем изобретении, позволяет получать трубчатую структуру в микрожидкостном устройстве, способную демонстрировать вторичную морфологию, и обеспечивает специализированные, поляризованные и дифференцированные клетки. Этот процесс может проходить по схеме, которая, по-видимому, напоминает организацию тканей in vivo. Вкратце, это достигается за счет выстилки эпителиальных клеток мезенхимальными клетками и, в предпочтительном варианте реализации, использования геля, например, геля внеклеточного матрикса, который дополнительно организует вторичную морфологию, в отличие от тех способов в данной области техники, например, систем Transwell, в которых применяется жесткая структура.
Таким образом, в соответствии с первым аспектом настоящего изобретения предложен способ культивирования и/или мониторинга эпителиальных клеток с применением системы микрожидкостного культивирования клеток, содержащей сеть микрожидкостных каналов, причем этот способ включает следующие этапы:
a) мезенхимальные клетки вводят в сеть микрожидкостных каналов, причем мезенхимальные клетки вводят в сеть микрожидкостных каналов:
a1) с применением водной среды; или
а2) с применением предшественника геля, при этом предшественнику геля дают возможность застыть в сети микрожидкостных каналов, занимая, таким образом, по меньшей мере часть этой сети микрожидкостных каналов;
b) в случае этапа a1) и предпочтительно в случае этапа а2), мезенхимальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта мезенхимальными клетками;
c) эпителиальные клетки вводят в сеть микрожидкостных каналов, содержащую мезенхимальные клетки; и
d) эпителиальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть поверхности (стенки) сети микрожидкостных каналов не будет покрыта эпителиальными клетками и/или пока по меньшей мере часть мезенхимальных клеток не будет покрыта эпителиальными клетками.
В качестве альтернативы, предложен способ культивирования и/или мониторинга эпителиальных клеток с применением системы микрожидкостного культивирования клеток, содержащей сеть микрожидкостных каналов, причем этот способ включает следующие этапы:
А1.1) предшественник геля, предпочтительно, предшественник геля - внеклеточного матрикса, вводят в сеть микрожидкостных каналов, например, в часть сети микрожидкостных каналов, например, в объем полостей.
А1.2) гелю дают возможность затвердеть или застыть;
А1.3) водят мезенхимальные клетки в другую часть сети микрожидкостных каналов, которая не покрыта гелем ВКМ; или
А2) клетки смешивают с предшественником геля и дают возможность возможности этому предшественнику геля застыть в сети микрожидкостных каналов, занимая, таким образом, по меньшей мере, часть этой сети микрожидкостных каналов;
B) в случае этапа al) и предпочтительно в случае этапа а2), мезенхимальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта мезенхимальными клетками;
C) эпителиальные клетки вводят в сеть микрожидкостных каналов, содержащую мезенхимальные клетки; и
D) эпителиальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть поверхности (стенки) сети микрожидкостных каналов не будет покрыта эпителиальными клетками и/или пока по меньшей мере часть мезенхимальных клеток не будет покрыта эпителиальными клетками.
Хотя в описании и формуле изобретения описывается первый способ, описанный выше (например, с этапами а) - d), специалист понимает, что любой способ, применение или композиция, описанные в настоящей заявке, могут аналогичным образом быть реализованы применительно к способу, представленному альтернативной формулировкой (например, с эатпами А) - D)).
В способе по настоящему изобретению в сети микрожидкостных каналов культивируют клетки мезенхимального происхождения с образованием первой группы клеток, образующих слой или пласт. После того, как мезенхимальным клеткам дали покрыть по меньшей мере часть поверхностей микрожидкостной сети и/или геля, в сеть микрожидкостных каналов вводят эпителиальные клетки, предпочтительно внутрь слоя или пласта мезенхимальных клеток (то есть вдали от (искусственной) стенки микрожидкостного канала). Эпителиальным клеткам (и мезенхимальным клеткам) дают возможность пролиферировать и/или дифференцироваться, предпочтительно по меньшей мере до достижения конфлюентности.
В способе по настоящему изобретению обеспечивается слой эпителиальных клеток, который находится в непосредственном контакте со слоем мезенхимальных клеток, возможно, с промежуточным эквивалентом базальной пластинки, который секретируют два типа клеток, и это больше напоминает ситуацию in vivo по сравнению с способами, описанными в данной области ранее. Например, мезенхимальные клетки и/или базальная пластинка могут находиться в непосредственном контакте с эпителиальными клетками без присутствия каких-либо искусственных, неприродных или введенных извне мембран, таких как мембраны, используемые в системах Transwell. В то же время, в способе по настоящему изобретению эпителиальные клетки имеют уменьшенный контакт с искусственной (например, пластиковой или стеклянной) стенкой (поверхностью) сети микрожидкостных каналов системы микрожидкостного культивирования клеток.
Кроме того, при применении геля внеклеточного матрикса дополнительно организуется вторичная морфология клеток, в отличие от способов в данной области, которые используют, например, системы Transwell, обеспечивающие жесткую структуру искусственной пористой мембраны толщиной по меньшей мере 10 мкм.
Без привязки к какой-либо теории, авторы настоящего изобретения предполагают, что пролиферация и дифференцировка клеток зависит от двунаправленной коммуникации между эпителиальными клетками и мезенхимальными клетками и что эта коммуникация улучшается способом по изобретению, в частности, благодаря отсутствию таких жестких структур, как применяемые в системах Transwell, и/или путем предотвращения или уменьшения контакта эпителиальных клеток с жесткими стенками используемого культурального устройства и/или путем создания в полом микрожидкостном канале (то есть в сети микрожидкостных каналов) (микро)окружения, способствующего клеточной пролиферации и дифференцировки, что в большей степени похоже на ситуацию in vivo.
Без привязки к какой-либо конкретной теории, мы предполагаем, что присутствие мезенхимальных клеток является инструктивным для эпителия. Обмен сигнальными молекулами, например, морфогенами, в частности, приводит к образованию характерных комбинаций таких молекул, например, морфогенов. Особая комбинация таких молекул в определенном месте может привести к поддержанию соответствующей ниши стволовых клеток, в то время как другая комбинация морфогенов в другом определенном месте приводит к дифференцировке в конкретные подтипы. Под морфогеном обычно понимают вещество, регулирующее характер развития ткани в процессе морфогенеза и положения различных специализированных типов клеток в ткани. Более конкретно, морфоген может быть сигнальной молекулой, которая действует непосредственно на клетки, вызывая специфические клеточные ответы в зависимости от своей локальной концентрации.
Не желая привязываться к какой-либо конкретной теории, мы предполагаем, что специфические комбинации сигнальных молекул, в частности морфогенов, встречаются с более или менее регулярными промежутками. Термин "регулярный" в настоящей заявке следует интерпретировать в биологическом контексте, то есть означающим такую регулярность, как полосы зебры, или пятна на шкуре пантеры: не точную регулярность, но явственный рисунок.
Морфогены, которые имеют решающее значение для образования такой картины, включают, помимо прочего, члены семейства Wnt, члены семейства белков hedgehog, ноггин, белок морфогенеза костей, эпителиальные факторы роста (ЭФР), факторы роста фибробластов (ФРФ) и белки Dickkopf (DKK).
Важными элементами в образовании таких регулярный структур являются внеклеточный матрикс или базальная пластинка (мембрана), поскольку они способны связывать определенные морфогенные факторы, обеспечивая их локальную концентрацию, позволяя другим факторам диффундировать.
В контексте настоящего изобретения микрожидкостная сеть представляет собой полый объем, ограниченный двумя боковыми стенками (поверхностями), нижней подложкой и верхней подложкой, замыкающими сеть каналов. Обе боковые стенки, верхнюю подложку и нижнюю подложку при контакте с сетью микрожидкостных каналов можно называть стенками. Кроме того, эта сеть каналов, соединена с впускным отверстием, обычно отверстием в верхней подложке, которое используется для заполнения сети извне. Кроме того, должно присутствовать отводное отверстие, которое при заполнении сети первой текучей средой (как правило, жидкостью) позволяет вытеснять текучую среду, которая уже присутствует в сети (как правило, воздух). Сеть каналов может содержать один микрожидкостный канал или несколько микрожидкостных каналов, которые соединены друг с другом. Сеть микрожидкостных каналов также может быть подключена к дополнительным впускным или выпускным отверстиям.
На первом этапе реализации способа в сеть микрожидкостных каналов системы микрожидкостного культивирования клеток вводят мезенхимальные клетки.
Мезенхимальные клетки, которые могут применяться в настоящем изобретении, могут быть клетками любого типа мезенхимального происхождения. Мезенхимальная клетка или по меньшей мере одна или несколько мезенхимальных клеток включают фибробласты, миофибробласты, гладкомышечные клетки, адипоциты, хондробласты, остеобласты и стромальные клетки из разных областей тела, включая костный мозг, простату, сердце, легкие, кишечник, почки, кровеносные сосуды и сухожилия. В предпочтительном варианте мезенхимальные клетки представляют собой фибробласты или миофибробласты. Мезенхимальные клетки могут находиться в пролиферативном состоянии или быть митотически неактивны. Мезенхимальные клетки могут быть дифференцированными мезенхимальными клетками или мезенхимальными клетками-предшественниками. Под мезенхимальной клеткой-предшественником подразумевается мультипотентная клетка мезенхимального происхождения, например, клетка, способная дифференцироваться в различные линии мезенхимального происхождения. Во избежание неопределенности, под мезенхимальными клетками мы подразумеваем клетки мезенхимального происхождения.
Мезенхимальные клетки могут быть неонатальными или взрослыми клетками. В предпочтительном варианте мезенхимальные клетки представляют собой клетки млекопитающих, более предпочтительно - мезенхимальные клетки человека. Мезенхимальные клетки могут быть только что выделенными клетками или несколько раз пересеваемыми клетками. Мезенхимальные клетки могут быть первичными клетками или (иммортализованной) клеточной линией. Мезенхимальные клетки могут быть выделены из здоровых или патологических тканей, включая опухоли. Мезенхимальные клетки могут содержать более одного типа мезенхимальных клеток. Мезенхимальные клетки также могут быть получены с помощью методов получения стволовых клеток, таких как методы получения индуцированных плюрипотентных стволовых клеток. Мезенхимальные клетки также могут быть получены из эпителия путем индукции эпителиально-мезенхимального перехода (ЭМП).
В предпочтительном варианте реализации мезенхимальные клетки выбраны из миофибробластов, фибробластов, адипоцитов, хондробластов, остеобластов, гладкомышечных клеток и стромальных клеток, причем, предпочтительно, мезенхимальные клетки представляют собой клетки млекопитающих, предпочтительно - клетки человека.
Клетки можно вводить в сеть микрожидкостных каналов любыми подходящими способами. Например, клетки могут быть введены с применением водной среды, обычно - клеточной культуральной среды. Клеточные культуральные среды должны быть способны доставлять все питательные вещества и другие соединения, которые необходимы для роста и/или пролиферации клеток, но они предпочтительно не должны содержать соединения, которые могут быть вредными для роста и/или пролиферации клеток.
Клетки могут быть диспергированы в указанной среде и введены в микрожидкостный канал, с обеспечением возможности проникновения среды в сеть микрожидкостных каналов. Обычно можно использовать пипетку для введения клеток в среде во впускное отверстие и обеспечения возможности заполнения сети микрожидкостных каналов под действием капиллярных сил. В качестве альтернативы, клетки в среде могут быть введены в сеть микрожидкостных каналов посредством активной закачки. Специалисту в данной области техники должно быть понятно, что после введения клеток в сеть микрожидкостных каналов, клеткам следует дать осесть и начать дифференцировку и/или пролиферацию. Осаждение клеток может происходить на одной из поверхностей. В предпочтительном варианте используемая водная среда представляет собой среду, подходящую для пролиферации и/или дифференцировки мезенхимальных клеток. Составы таких сред широко известны в данной области, и может быть использована любая подходящая ростовая среда, при желании - с добавлением дополнительных факторов (роста). После того, как клетки осели и, возможно, прикрепились к стенкам геля (при его наличии), например, геля внеклеточного матрикса и/или сети микрожидкостных каналов, обеспечивают подходящую ростовую среду, поставляющую мезенхимальным клеткам питательные вещества и кислород, позволяя им пролиферировать и/или дифференцироваться. Ростовая среда может подаваться в потоке или без потока. В случае потока ростовая среда может также удалять или разбавлять отходы метаболизма, вырабатываемые клетками.
В качестве альтернативы, мезенхимальные клетки могут быть введены в сеть микрожидкостных каналов с применением предшественника геля. Клетки можно диспергировать/суспендировать в указанном предшественнике геля и ввести в сеть микрожидкостных каналов, с обеспечением возможности попадания предшественника геля в сеть микрожидкостных каналов и заполнения остальных областей сети с помощью методов формирования рисунка, таких как, например, барьер капиллярного давления. Затем предшественнику геля дают застыть (затвердеть) в определенных участках микрожидкостного канала, так чтобы он занял по меньшей мере часть сети микрожидкостных каналов. В отношении термина "занял" («занятия») в отношении по меньшей мере части сети микрожидкостных каналов специалисту должно быть понятно, что не требуется присутствия геля во всей сети микрожидкостных каналов, но он предпочтительно должен занимать определенные области сети, так чтобы другие отдельные области оставались доступными для введения дополнительного геля или ростовой среды, например для создания перфузионного потока. Следует также понимать, что гель не должен блокировать прохождение ростовой среды через сеть микрожидкостных каналов.
Предшественник геля может быть подан в канал, как описано выше. После того, как гель подан, стимулируют его застывание перед введением дополнительной жидкости. Подходящие гели (предшественники) хорошо известны в данной области. В качестве примера, предшественник геля может быть гидрогелем и, как правило, представляет собой гель внеклеточного матрикса (ВКМ). ВКМ может, например, содержать коллаген, фибриноген, фибронектин и/или экстракты базальной мембраны, как, например, Matrigel или синтетический гель. Предшественник геля может, например, вводиться во впускное отверстие пипеткой (обычно это репитер-пипетка, такая как Eppendorf Multipette® М4 (Eppendorf AG, Германия, номер по каталогу 4982000.012) в сочетании с наконечниками Eppendorf Combitips advanced ® (Eppendorf AG, Германия, номер по каталогу 0030089.405).
Таким образом, гель может содержать экстракт базальной мембраны, ткани человека или животных или полученные из культуры клеток внеклеточные матриксы, полученные из тканей животных внеклеточные матриксы, синтетические внеклеточные матриксы, гидрогели, коллаген, мягкий агар, яичный белок и коммерчески доступные продукты, такие как Matrigel.
Базальные мембраны, содержащие базальную пластинку, представляют собой тонкие внеклеточные матриксы, которые подстилают эпителиальные клетки in vivo и состоят из внеклеточных матриксов, таких как белок и протеогликаны. Хотя слой эпителиальных клеток, многослойный или однослойный, предотвращает вторжение экзогенного материала извне подобно барьеру, сама базальная мембрана также действует как физический барьер. Таким образом, эпителиальные клетки, содержащие эпителиальную ткань, взаимодействуют с базальной мембраной образуя твердый барьер и защищая внутреннюю жизнедеятельность.
Они состоят из коллагена IV, ламинина, энтактина, гепарансульфидных протеогликанов и многих других второстепенных компонентов (Quaranta et al., Curr. Opin. Cell Biol., 6, 674-681, 1994). Эти компоненты по отдельности, а также интактные базальные мембраны биологически активны и способствуют адгезии, миграции и, во многих случаях, росту и дифференцировке клеток. Примером геля, содержащего базальную мембрану, является Матригель (Matrigel) (US 4829000). Этот материал биологически высокоактивен in vitro в качестве субстрата для эпителиальных клеток.
Многие различные подходящие гели для применения в способе по изобретению являются коммерчески доступными и включают, помимо прочего, гели, содержащие Matrigel rgf, ВМЕ1, BME1rgf, BME2, BME2rgf, ВМЕ3 (все - варианты Matrigel) коллаген I, коллаген IV, смеси коллагена I и IV или смеси коллагена I и IV и коллагена II и III), пураматрикс, гидрогели, Cell-Tak, коллаген I, коллаген IV, Matrigel® Matrix, фибронектин, желатин, ламинин, остеопонтин, полилизин (PDL, PLL), PDL/LM и PLO/LM, PuraMatrix® или витронектин. В одном предпочтительном варианте реализации компоненты матрикса получают в виде коммерчески доступного матрикса Corning® MATRIGEL® Matrix (Corning, Нью-Йорк 14831, США).
Матрикс MATRIGEL® извлекают из саркомы мыши Engelbreth-Holm-Swarm ("EHS"), опухоли богатой базальной мембраной. Основными компонентами матрикса являются ламинин, коллаген IV, энактин и гепарансульфат-протеогликан ("HSPG"). Матрикс также содержит факторы роста, матриксные металлопротеиназы (коллагеназы) и другие протеиназы (активаторы плазминогена), а также некоторые пока не определенные компоненты внеклеточного матрикса. При комнатной температуре MATRIGEL® Matrix застывает, образуя восстановленную базальную мембрану.
В предпочтительном варианте гель (предшественник) представляет собой экстракт базальной мембраны, компонент внеклеточного матрикса, коллаген, коллаген I, коллаген IV, фибронектин, ламинин, витронектин, D-лизин, энтактин, гепарансульфидные протеогликаны или их комбинации./pct
Предшественник геля подают во впускное отверстие, и он разносится по микрожидкостной сети капиллярными силами, возможно, при содействии силы тяжести. Гель можно иммобилизовать, опять-таки в качестве примера, например, с помощью технологии PhaseGuide, которая по существу представляет собой барьер капиллярного давления, который охватывает всю ширину сети микрожидкостных каналов и вызывает застывание геля. После образования геля подают подходящую ростовую среду, которая обеспечивает питательные вещества и кислород для мезенхимальной клетки в геле, позволяя мезенхимальным клеткам пролиферировать и/или дифференцироваться. Ростовую среду можно подавать в потоке или без потока. В случае потока ростовая среда может также удалять или разбавлять отходы метаболизма, вырабатываемые клетками.
Формирование рисунка (паттерна) предшественника геля, например, предшественника геля ВКМ, может быть выполнено различными способами, включая фотолитографию и с помощью методов капиллярного давления. Функционирование и формирование рисунка капиллярных барьеров ранее были описаны заявителями, например, в WO2014038943. Барьеры капиллярного давления не следует понимать как стенку или полость, заполненную предшественником геля, но скорее как состоящую из элементов, которые благодаря поверхностному натяжению не дают предшественнику геля растекаться. Эта концепция называется менисковой фиксацией. Таким образом, в микрожидкостном канале будет достигнуто устойчивое удержание жидкостных менисков, состоящих из предшественника геля (ВКМ).
Предлагаемый барьер капиллярного давления может, например, состоять из выступа материала, выступающего из нижней подложки, или канавки, выступающей в нижнюю подложку. Боковая стенка выступа имеет некоторый угол с верхней частью этого выступа, который предпочтительно является максимально большим. Чтобы обеспечить качественный барьер, этот угол должен быть больше 70°, как правило около 90°. То же самое относится к углу между боковой стенкой гребня и верхней стороной нижней подложки.
Альтернативным способом создания барьера капиллярного давления является нанесение на нижнюю подложку полоски материала, который значительно более гидрофобен, чем окружающий материал. Последний действует как ограничитель растекания из-за капиллярной силы/поверхностного натяжения. Это предотвращает вытекание жидкости за пределы барьера капиллярного давления и позволяет сформировать устойчивый ограниченный мениск в сети микрожидкостных каналов. Таким образом, в конкретных вариантах реализации барьеры капиллярного давления, в частности, выбирают из выступа, канавки, отверстия или гидрофобной полоски материала или их комбинаций. В другом варианте барьеры капиллярного давления могут быть образованы ребрами, расположенными с определенными промежутками, которые выстилают область, которая должна быть занята гелем.
Альтернативный способ селективного формирования рисунка предшественника геля (ВКМ) включает применение временного слоя или съемной структуры, которые присутствуют в сети микрожидкостных каналов при введении предшественника геля и удаляются после застывания геля.
В качестве альтернативы, в геле может присутствовать светочувствительный сшивающий агент, способствующий застыванию геля при воздействии, например, УФ-света. Маскирование источника света позволяет получить избирательное застывание предшественника геля и удалить незастывший предшественник геля из тех областей, которые не должны быть покрыты гелем.
После введения мезенхимальных клеток в сеть микрожидкостных каналов, с помощью либо водной среды, предпочтительно ростовой среды, либо геля (предшественника), мезенхимальным клеткам дают пролиферировать и/или дифференцироваться в сети микрожидкостных каналов. Пролиферацию мезенхимальных клеток продолжают в течение некоторого периода времени, пока по меньшей мере часть сети микрожидкостных каналов не будут покрыта мезенхимальными клетками. При внесении клеток в культуру в микрожидкостном канале они как правило образуют трубчатую структуру, которую можно перфузировать потоком через просвет этой трубчатой структуры (то есть с той стороны клеток, которая обращена от стенки канала).
Другими словами, после введения мезенхимальных клеток в сеть микрожидкостных каналов, мезенхимальным клеткам дают возможность расти, дифференцироваться, размножаться и делиться, чтобы позволить клеткам образовывать в сети микрожидкостных каналов пласт, слой, группу клеток.
В вариантах реализации, в которых гель не присутствует в сети микрожидкостных каналов, клетки могут образовывать пласт, слой, группу клеток, которые по меньшей мере частично прикреплены к (жесткой) стенке канала.
В некоторых вариантах реализации, которые будут подробно описаны ниже, часть сети микрожидкостных каналов содержит гель, причем предшественник геля не был введен с мезенхимальными клетками и когда, например, мезенхимальные клетки вводят в канал с применением водной среды. В таких вариантах реализации мезенхимальные клетки могут образовывать группу или пласт или слой клеток на геле, присутствующем в сети микрожидкостных каналов, а также на (жесткой) стенке канала, не образованной гелем (например, на пластиковой или стеклянной стенке сети микрожидкостных каналов, в зависимости от того, из какого типа материала сделана эта стенка).
В вариантах реализации, когда мезенхимальные клетки вводят в канал с применением предшественника геля, клеткам дают возможность расти, делиться, пролиферировать и/или дифференцироваться в геле и/или расти за пределы геля, в сеть микрожидкостных каналов.
Что касается покрытия сети микрожидкостных каналов клетками, оно включает присутствие мезенхимальных клеток только в геле, только в канале и как в геле, так и в канале. В предпочтительном варианте реализации мезенхимальные клетки покрывают всю площадь микрожидкостного канала, где клетки были введены (и, таким образом, могут образовывать трубчатую структуру). Это можно назвать 100-процентной конфлюентностью. Конфлюентность - это термин, обычно используемый в качестве оценки количества адгезивных клеток в микрожидкостном устройстве, обозначающий долю поверхности, покрытую клетками. Например, 50-процентная конфлюентность означает, что клетками покрыта приблизительно половина поверхности. Когда говорят, что слой конфлюэнтный, клетками покрыто около 100 процентов поверхности геля, и места для роста клеток в виде монослоя больше не осталось.
100% конфлюентности или покрытия клетками сети микрожидкостных каналов (в области, где клетки были введены или мониторируются) не требуется, и более низкий процент покрытия, например, 10, 20, 30, 40, 50, 60, 70, 80 или 90 процентов, может подходить для применения в настоящем изобретении. Например, мезенхимальные клетки могут присутствовать только в геле. В этом последнем случае мезенхимальные клетки не являются обязательно или предпочтительно выращенными на стенках канала, но предпочтительно - внутри (ВКМ) геля в виде кластеров клеток.
Как будет понятно специалистам в данной области техники, в вариантах реализации, в которых мезенхимальные клетки вводят в сеть микрожидкостных каналов с помощью предшественника геля, нет необходимости в пролиферации и/или дифференцировке мезенхимальных клеток перед введением эпителиальных клеток на следующего этапа способа по настоящему изобретению. Также возможно введение эпителиальных клеток в канал после застывания геля, содержащего мезенхимальные клетки, и обеспечение возможности совместной пролиферации и/или дифференцировки мезенхимальных и эпителиальных клеток.
Однако в предпочтительном варианте мезенхимальным клеткам дают возможность пролиферировать и дифференцироваться до введения эпителиальных клеток в систему культивирования. Длительность этого периода зависит от различных факторов, таких как тип введенных мезенхимальных клеток, способ введения, количество введенных клеток, состав ростовой среды, используемый для пролиферации и/или дифференцировки клеток, температуры и т.д. Например, этот период может составлять по меньшей мере 20 минут, по меньшей мере один час по меньшей мере 6 часов, по меньшей мере 12 часов, по меньшей мере 24 часа, по меньшей мере один, два, три или четыре дня. Как правило, этот период составляет не более 14 дней. Специалисты в данной области техники без затруднений установят условия культивирования, подходящие для применения в настоящем изобретении.
Затем в сеть микрожидкостных каналов, где уже присутствуют мезенхимальные клетки, вводят эпителиальные клетки.
Эпителиальные клетки, которые могут применяться в настоящем изобретении, могут быть клетками любого типа с эпителиальными характеристиками или способными дифференцироваться в клетки, обладающие этими характеристиками. Как правило, эпителиальные клетки имеют эктодермальное или энтодермальное происхождение. При упоминании эпителиальных клеток мы также имеем в виду клетки-предшественники и стволовые клетки со способностью дифференцироваться в эпителиальные клетки в соответствии с настоящим изобретением.
Эпителиальная клетка или одна или несколько эпителиальных клеток могут представлять собой однослойный эпителий, например однослойный плоский эпителий, такой как мезотелий или эндотелий. В качестве альтернативы, эпителиальные клетки могут представлять собой стратифицированный эпителий, такой как эпидермальная клетка или столбчатая эпителиальная клетка. Такие клетки могут включать эпителиальные клетки почек, толстой кишки, тонкого кишечника, легкого, сетчатки. Эпителиальные клетки могут представлять собой дифференцированные эпителиальные клетки или эпителиальные клетки-предшественники. Под эпителиальной клеткой-предшественником подразумевается мультипотентная клетка, обладающая эпителиальным потенциалом, например, клетка, способная дифференцироваться в эпителиальную клетку.
Эпителиальные клетки могут быть неонатальными или взрослыми клетками. В предпочтительном варианте эпителиальные клетки представляют собой клетки млекопитающих, более предпочтительно - эпителиальные клетки человека. Эпителиальные клетки могут быть только что выделенными клетками или несколько раз пересеянными клетками. Эпителиальные клетки могут быть первичными клетками или (иммортализованной) клеточной линией. Эпителиальные клетки могут быть выделены из здоровых или патологических тканей. Эпителиальные клетки могут содержать более одного типа эпителиальных клеток. В некоторых вариантах реализации два или более типов эпителиальных клеток смешивают в различных соотношениях и дают им возможность расти на мезенхимальных клетках.
В предпочтительном варианте эпителиальные клетки выбраны из клеток однослойного эпителия, клеток однослойного плоского эпителия, клеток стратифицированного эпителия или клеток столбчатого эпителия, причем в предпочтительном варианте эпителиальные клетки представляют собой клетки млекопитающих, предпочтительно - клетки человека.
В предпочтительном варианте реализации эпителиальные клетки, применяемые в способе по изобретению, получают из культивируемого in vitro органоида, например, как описано в US2012/0196312. Клетки в таком органоиде могут быть обработаны до введения в сеть микрожидкостного канала, чтобы получить, например, отдельные клетки или скопления клеток (например, из 2-50 клеток, предпочтительно - не более 20, 10 клеток).
В некоторых вариантах реализации эпителиальная клетка и мезенхимальная клетка имеют одинаковое происхождение, то есть получены из одного и того же типа животных или из одного и того же животного. В предпочтительном варианте эпителиальные клетки и мезенхимальные клетки происходят из одной и той же части тела.
В некоторых вариантах реализации эпителиальная клетка и мезенхимальная клетка происходят из разных источников, то есть из разных типов животных, или из разных частей тела одного и того же типа животных или одного и того же животного. В некоторых вариантах реализации эпителиальная клетка происходит из патологической ткани, а мезенхимальная клетка - из здоровой ткани. В некоторых вариантах реализации мезенхимальные клетки происходят из патологической ткани, а эпителиальные клетки - из здоровой ткани. В некоторых вариантах реализации клетки получают из опухоли.
Также предложено на этапе а) вводить различные типы мезенхимальных клеток и/или на этапе с) вводить различные типы эпителиальных клеток в один и тот же микрожидкостный канал. Это позволяет изучать более сложные эпителиальные системы, например, позволяет изучать взаимодействие между различными типами эпителиальных клеток, между эпителиальными клетками из здоровых и патологических тканей.
Эпителиальные клетки могут быть введены в сеть микрожидкостных каналов любыми подходящими способами. В предпочтительном варианте клетки могут быть введены с применением водной среды. Клетки могут быть диспергированы в указанной среде и введены в микрожидкостный канал, с возможности проникновения среды в сеть микрожидкостных каналов, содержащую мезенхимальную клетку. Специалисту в данной области техники должно быть понятно, что после введения клеток в сеть микрожидкостных каналов клеткам следует дать осесть и начать пролиферацию. В предпочтительном варианте чтобы используемая водная среда представляла собой среду, подходящую для пролиферации эпителиальных клеток и предпочтительно эпителиальных и мезенхимальных клеток. Составы таких сред широко известны в данной области, и может быть использована любая подходящая ростовая среда, при желании - с добавлением дополнительных факторов (роста). После того, как эпителиальные клетки осели и прикрепились, обеспечивают подходящую ростовую среду, поставляющую клеткам питательные вещества и кислород, позволяя эпителиальным клеткам (и мезенхимальным клеткам) пролиферировать и/или дифференцироваться. Ростовая среда может подаваться в потоке или без потока. В случае потока ростовая среда может также удалять или разбавлять отходы метаболизма, вырабатываемые клетками.
После введения эпителиальных клеток в сеть микрожидкостных каналов, содержащую мезенхимальные клетки, клеткам дают возможность пролиферировать и/или дифференцироваться в сети микрожидкостных каналов. При культивировании в микрожидкостном канале они, как правило, образуют трубчатую структуру, которая может быть перфузирована с помощью потока через просвет трубчатой структуры (то есть с той стороны клеточного слоя, которая обращена от стенки канала).
Трубчатая структура подразумевает, что клетки выстилают большую часть поверхностей канала перфузионного потока, которые не покрыты гелем ВКМ, а также поверхность самого геля ВКМ, которая обращена к каналу перфузионного потока, в который введена суспензия эпителиальных клеток. Трубчатая структура как правило образуется по всей длине канала от одного впускного отверстия до другого. Кроме того, впускное отверстие позволяет получить доступ к внутренней части или просвету трубки. В случае потока среды поток подается на просветную сторону эпителиальной трубки. Как правило это совпадает с апикальной стороной эпителия.
Пролиферацию эпителиальных клеток продолжают в течение периода времени, пока по меньшей мере часть биологического материала, образованного введенными мезенхимальными клетками и включающего их, не будет покрыта биологическим материалом, образованным введенными эпителиальными клетками и включающим их. Другими словами, мезенхимальные клетки и эпителиальные клетки культивируют в течение периода, позволяющего сформировать слой эпителиальных клеток, который находится в тесном контакте с мезенхимальными клетками, включая любую базальную пластинку или структуру, подобную базальной пластинке, образованную во время культивирования мезенхимальных и эпителиальных клеток. Например, этот период может составлять по меньшей мере 20 минут, по меньшей мере один час по меньшей мере 6 часов, по меньшей мере 12 часов, по меньшей мере 24 часа, по меньшей мере один, два, три или четыре дня. Как правило, этот период составляет не менее 6 часов, не менее 22 часов или по меньшей мере один, два или четыре дня. Обычно этот период составляет не более 14 дней.
Что касается покрытия каналов мезенхимальными клетками, в предпочтительном варианте реализации эпителиальные клетки покрывают всю область, покрытую мезенхимальными клетками. Однако 100-процентное покрытие мезенхимальными клетками сети микрожидкостных каналов (в области, в которую клетки введены или отслеживаются) не является необходимым, и более низкий процент покрытия в соответствии с примером 10, 20, 30, 40, 50, 60, 70, 80 или 90 процентов, может подходить для применения в настоящем изобретении. Однако в настоящем изобретении по меньшей мере часть эпителиальных клеток должна находиться в тесном контакте по меньшей мере с частью мезенхимальных клеток и/или какой-либой базальной пластинкой и/или подобной базальной пластинке структурой, образованной во время культивирования клеток.
В качестве примера мезенхимальные клетки могут присутствовать только на поверхности геля, который присутствует в микрожидкостном канале, и/или в геле и на поверхности геля в тех вариантах реализации, в которых мезенхимальные клетки вводят в канал с помощью предшественника геля, как подробно описано в настоящей заявке. Считается, что эпителиальные клетки покрывают по меньшей мере часть мезенхимальных клеток, когда по меньшей мере часть области с мезенхимальными клетками на поверхности геля или вблизи от нее покрыта эпителиальными клетками.
Как более подробно описано ниже, и в очень предпочтительном варианте реализации мезенхимальные клетки образуют трубчатую структуру в сети микрожидкостных каналов, внутри которой эпителиальным клеткам дают возможность пролиферировать, тем самым в предпочтительном варианте реализации образуется трубчатая структура внутри указанной трубчатой структуры мезенхимальных клеток, в которой мезенхимальные клетки по меньшей мере частично покрыты эпителиальными клетками. В таком варианте реализации, как и в предыдущем случае, мезенхимальные клетки и/или любая базальная пластинка или подобная базальной пластинке структура, образованная во время культивирования клеток, находятся в тесном контакте с эпителиальными клетками.
Было обнаружено, что в настоящем изобретении эпителиальные клетки и/или мезенхимальные клетки с большей точностью имитируют эпителиальные и/или мезенхимальные клетки, встречающиеся in vivo, например, по сравнению с некоторыми способами из предшествующего уровня техники. Это может проявляться в экспрессии клетками определенных генов, характерных для ситуации in vivo, в морфологии, которая более близко напоминает морфологию in vivo, улучшенной функцией эпителиального барьера, наличием и функцией апикальной и базолатеральной мембраны или даже наличием ворсинок, крипт, ресничной ткани, слоя слизистой оболочки и/или наличием по-разному дифференцированных клеток в пласте или слое эпителиальных клеток. Этот слой эпителиальных клеток может секретировать и/или поглощать различные типы материалов в среде и из среды. Что особенно важно, клетки могут дифференцироваться в различные линии ткани соответствующего происхождения.
В рамках способа по настоящему изобретению также возможно ввести предшественник геля в сеть микрожидкостных каналов и позволить предшественнику геля застывать в сети микрожидкостных каналов, тем самым занимая по меньшей мере часть сети микрожидкостных каналов. В некоторых вариантах реализации предшественник геля может содержать мезенхимальные клетки, как описано выше, однако также предполагается, что в сеть микрожидкостных каналов можно вводить гель, который не содержит мезенхимальные клетки.
В качестве примера, предшественник геля можно ввести в канал и дать ему застыть до введения мезенхимальных клеток в сеть микрожидкостных каналов, например, с применением водной среды.
В этих вариантах реализации стенки сети микрожидкостных каналов частично образованы гелем. Как и в предыдущем примере, вводимый предшественник геля может содержать или не содержать мезенхимальные клетки.
В случае введения геля без мезенхимальных клеток, присутствующих в нем, мезенхимальные клетки могут быть введены в канал с применением водной среды, предпочтительно ростовой среды, которая обеспечивает питательные вещества и кислород. С помощью этой среды клетки можно вводить в канал, тем самым осаждая их на гель и давая мезенхимальным клеткам сформировать пласт, группу или слой клеток, например, на геле.
Как указывалось ранее, при внесении клеток они как правило, но не обязательно, образуют трубчатую структуру, перфузию которой можно осуществлять с помощью потока через просвет этой трубчатой структуры (то есть с той стороны клеток, которая обращена от стенки канала). Таким образом, в некоторых вариантах реализации сначала в канал вводят гель, так что после застывания в канал могут быть введены мезенхимальные клетки с помощью среды, например культуральной среды, чтобы дать клеткам контактировать с гелем и образовать на геле слой клеток (например, пласт или трубчатую структуру или сосуд). Затем в канал могут быть введены эпителиальные клетки с помощью среды, например культуральной среды, чтобы дать эпителиальным клеткам контактировать с мезенхимальными клетками и образовать на мезенхимальных клетках слой клеток (например, пласт или трубчатую структуру или сосуд), создавая таким образом апикальную и базолатеральную стороны.
Термин "трубчатая структура" употреблен в широком смысле, поскольку не ожидается, что клетки мезенхимального происхождения образуют плотный слой, как это имеет место для эпителия. В то время как эпителий, как известно, образует плотные контакты, имеет форму брусчатки с щеточной каймой и ворсинками, клетки мезенхимального происхождения, фибробласты и миофибробласты образуют рыхлую сеть без плотных контактов. Эпителий экспрессирует маркеры эпителиальных клеток, такие как Е-кадгерин и виллин, тогда как мезенхимальные клетки экспрессируют маркеры мезенхимальных клеток, такие как α-SMA и виментин.
И в варианте реализации, в котором для введения мезенхимальных клеток используют предшественник геля, и в варианте реализации, в котором предшественник геля не используют для введения мезенхимальных клеток, может быть нанесен рисунок из нескольких гелей, примыкающих один к другому. Несколько гелей могут быть нанесены путем инъекции предшественников гелей, с остановкой продвижения предшественников с помощью барьера капиллярного давления, вызывая застывание предшественников в разных частях сети (канала) последовательно или параллельно. Суспендирование первого типа клеток в первом предшественнике геля, а затем второго типа клеток во втором предшественнике геля, приводит к так называемой стратифицированной совместной культуре, в которой типы клеток культивируются рядом друг с другом. Гель предпочтительно находится в контакте с одной или более стенками канала/осажден на одной или более стенках канала.
Гели определяются как существенно разбавленная перекрестно-сшитая система, которая остается на месте после застывания, но допускает внутренний поток через гель. Гель часто представляет собой нетекучую коллоидную сеть или полимерную сеть, которая расширяется по всему своему объему при разбавлении жидкостью. Гидрогель, или водный гель, представляет собой гель, в котором увеличивающим объем агентом является вода. В контексте способа по изобретению гелеобразный материал может представлять собой водосодержащий гель, который предпочтительно нерастворим в воде, но содержит воду, благодаря чему имеет двух- или трехмерную опорную структуру. В настоящем изобретении применяемый гель допускает диффузию вещества в указанном геле и через него.
Выбор геля, применяемого в изобретении, не ограничивается специально, при условии, что его слой обладает вышеуказанными свойствами и позволяет формировать слой клеток на геле. Обычно применяемые гели включают гели биологического происхождения, содержащие коллаген, ламинин, фибронектин, фибриноген, матригель и/или агарозу и синтетические гели на основе нескольких каркасов, таких как ПЭГ (полиэтиленгликоли), пептиды, PLLA (поли-L-лактид), PLGA (сополимер молочной и гликолевой кислот).
Для формирования рисунка геля, то есть для заполнения части микрожидкостного канала гелем, можно применять несколько способов, включая, помимо прочего, литографию фотоотверждаемых гелей, основанное на капиллярной силе формирование рисунка с применением, например, ребер, гидрофобных накладок или элементов phaseguide(TM), а также селективное осаждение.
В предпочтительном варианте гель наносят в виде рисунка, предпочтительно с применением барьера капиллярного давления, с помощью УФ-печати или посредством втягивания иглы после застывания, или с помощью удаления защитного слоя после застывания.
Как подробно описано выше, мезенхимальные клетки, введенные на этапе а), могут быть диспергированы/суспендированы в предшественнике геля или могут быть введены в сеть микрожидкостных каналов с применением водной среды, предпочтительно, и когда гель (например, гель, в котором нет диспергированных мезенхимальных клеток) присутствует в непосредственной близости.
В предпочтительном варианте реализации способа по настоящему изобретению на этапе b) мезенхимальные клетки пролиферируют до тех пор, пока в сети микрожидкостных каналов и/или в геле не образуется по меньшей мере группа/слой/пласт мезенхимальных клеток. Мезенхимальные клетки, культивируемые способом по настоящему изобретению, могут образовывать пласт или слой клеток. Такой пласт или слой могут представлять собой монослой, но могут также состоять из более чем одного слоя и иметь различную толщину вдоль пласта. Такой пласт или слой может быть любого размера.
В предпочтительном варианте на этапе b) мезенхимальным клеткам дают пролиферировать до тех пор, пока в сети микрожидкостных каналов не образуется по меньшей мере трубчатая структура мезенхимальных клеток. В контексте настоящего изобретения трубчатая структура мезенхимальных клеток представляет собой структуру, образованную клетками, растущими от впускного отверстия до выпускного отверстия из сети микрожидкостных каналов, тем самым выстилая большую часть поверхностей канала и/или геля. Специалисты в данной области техники понимают, что эта структура не обязательно должна представлять собой полностью "круглую" трубку, но может иметь фактически любую форму, например, продиктованную формой стенки сети микрожидкостных каналов и/или гелем. Вместе с тем эта трубчатая структура не обязательно должна соответствовать форме канала, но может принимать правильную или неправильную форму любого типа, в том числе, в качестве примера, представлять собой трубку круглой или более прямоугольной формы.
В предпочтительном варианте мезенхимальные клетки образуют трубчатую структуру, в соответствии с определением, данным в контексте изобретения, поскольку это позволяет вводить эпителиальные клетки в указанную трубчатую структуру и покрывать ими, также в виде трубчатой структуры, мезенхимальные клетки. Было обнаружено, что такая "трубка в трубке" или ткань в виде двойной трубки близко похожа на ткань in vivo по фенотипическим характеристикам, таким как характеристики, раскрытые в настоящей заявке.
Что касается эпителиальных клеток, аналогичным образом и предпочтительно на этапе d) эпителиальным клеткам дают пролиферировать до тех пор, пока в сети микрожидкостных каналов не образуется по меньшей мере группа/слой/пласт эпителиальных клеток. Специалист в данной области техники понимает, что эпителиальные клетки могут покрывать часть сети микрожидкостных каналов, например, стенку иди поверхность, включая любой гель, если он присутствует, не покрытый мезенхимальными клетками, но также часть мезенхимальных клеток будет покрыта эпителиальными клетками. Эпителиальные клетки, культивируемые способом по настоящему изобретению, могут образовывать пласт или слой клеток, который в зависимости от типа используемых эпителиальных клеток либо представляет собой монослой, либо образован из разных слоев (например, как это может происходить, когда используются клетки стратифицированной эпителиальной ткани). Такой слой может иметь разную толщину вдоль пласта. Пласт или слой может быть любого размера.
В предпочтительном варианте на этапе d) эпителиальным клеткам дают пролиферировать до тех пор, пока в сети микрожидкостных каналов не образуется по меньшей мере трубчатая структура эпителиальных клеток. В контексте настоящего изобретения трубчатая структура эпителиальных клеток представляет собой структуру, образованную клетками, растущими от впускного отверстия до выпускного отверстия из сети микрожидкостных каналов, тем самым выстилая большую часть поверхностей канала и/или геля, покрытых или не покрытых мезенхимальными клетками. Специалисты в данной области техники понимают, что эта структура не обязательно должна представлять собой полностью "круглую" трубку, но может иметь фактически любую форму, например, определяемую формой стенки сети микрожидкостных каналов и/или геля и/или формой мезенхимальных клеток. Вместе с тем эта трубчатая структура в не обязательно должна соответствовать форме канала или форме пласта мезенхимальных клеток, но может принимать правильную или неправильную форму любого типа, в том числе, в качестве примера, представлять собой трубку круглой или более прямоугольной формы.
Если мезенхимальные клетки на этапе а) вводят в геле (т.е. вводят с применением предшественника геля), предпочтительно, чтобы на этапе d) способа эпителиальным клеткам давали пролиферировать до тех пор, пока по меньшей мере группа/слой/пласт эпителиальных клеток не покроет по меньшей мере часть геля, который занимает по меньшей мере часть сети микрожидкостных каналов.
Однако в предпочтительном варианте как мезенхимальные клетки, так и эпителиальные клетки образуют трубчатую структуру в контексте настоящего изобретения, при этом слой эпителиальных клеток характеризуется образованием плотных контактов, а слой мезенхимальных клеток - рыхлой сетью клеток. Таким образом, предлагается способ по настоящему изобретению, в котором на этапе d) эпителиальные клетки образуют трубчатую структуру внутри трубчатой структуры, образованной мезенхимальными клетками. Также в этом варианте реализации мезенхимальные клетки, по меньшей мере частично, покрыты эпителиальными клетками или, иначе говоря, эпителиальные клетки выстланы, по меньшей мере частично, мезенхимальными клетками. Предполагается, что благодаря такому тесному контакту между мезенхимальными клетками и эпителиальными клетками коммуникация между клетками, например, посредством секретируемых факторов или сигнальных молекул, таких как члены семейства Wnt, семейства hedgehog (Sonic hedgehog, Indian hedgehog), ноггин, BMP, R-спондин, семейства Notch и других, будет оптимизирована по сравнению, например, с методами, использующими системы Transwell или содержащими другие типы подложек, фильтров или мембран.
В зависимости от обстоятельств может быть предпочтительным, чтобы ростовая среда в полом микрожидкостном канале (то есть в сети микрожидкостных каналов) не текла или текла, причем указанный поток может быть однонаправленным или двунаправленным. В частности, в случае получения трубчатой структуры из мезенхимальных клеток или эпителиальных клеток, или, предпочтительно, из обоих видов клеток, может быть предпочтительным подавать поток ростовой среды через просвет этой трубчатой структуры.
В качестве примера подача такого потока может дополнительно запустить формирование у эпителиальных клеток фенотипа, похожего на ситуацию in vivo, например, когда в ситуации in vivo поток жидкости также воздействует на эпителиальные клетки.
В другом примере такой поток можно применять для введения или удаления какого-то вещества в среде, например, лекарственных средств, влияние которых на функционирование или реакцию эпителия исследуют.
Специалист в данной области техники понимает, что ростовая среда, используемая в способе по изобретению, не имеет особых ограничений по составу. В зависимости от обстоятельств, например, от применяемых клеток, может быть желательно дополнить ростовую среду определенными факторами (сигнальными молекулами, факторами роста, ингибиторами и/или активаторами сигнальных путей), такими как Wnt, ноггин, ЭФР/ФРФ, лиганды Notch и/или R-спондин и другие, описанных в настоящей заявке. Известно, что эти факторы являются инструктивными для поддержания ниши стволовых клеток эпителия, что, в свою очередь, важно для пролиферации и дифференцировки исходных клеток в сублинии рассматриваемого эпителия. Например, для случая небольших кишечных органоидов было установлено, что добавление этих факторов к клеткам, суспендированным в матригеле, приводит к образованию интактных структур крипт-ворсинок, состоящих из стволовых клеток, энтероцитов, бокаловидных клеток, клеток Панета, энтероэндокринных клеток.
Один или несколько таких факторов можно обеспечивать на этапе культивирования мезенхимальных клеток и/или на этапе культивирования как мезенхимальных клеток, так и эпителиальных клеток.
Один или несколько таких факторов могут присутствовать в течение всего культивирования клеток или только в течение ограниченного периода времени (например, в течение 1-24 часов, 48 часов, 72 часов, 1, 2, 3, 4, 5, 6, 7 или более дней).
Один или несколько таких факторов можно обеспечивать (доставлять) клеткам с апикальной стороны эпителиальных клеток, или с базолатеральной стороны эпителиальных клеток, или с обеих сторон.
Один или более таких факторов могут представлять собой ингибитор или активатор одного или более сигнальных путей, описанных в настоящей заявке (например, сигнальные пути hedgehog, сигнальные пути Wnt, сигнальные пути BMP). Также предполагается, что сначала клетки обрабатывают ингибитором определенного сигнального пути, а затем - активатором того же пути или наоборот. Также предполагается, что клетки обрабатывают на апикальной стороне активатором, и на боковой стороне - ингибитором того же пути или наоборот. Можно использовать один или более факторов одновременно.
Также предполагается применять градиент концентрации одного или более таких факторов, например, от апикальной до базолатеральной стороны или вдоль полого канала от впускного отверстия до выпускного отверстия. Такой градиент может быть линейным или нелинейным. Концентрация фактора может меняться в зависимости от этапа культивирования. Эти факторы могут подаваться в сеть с применением ростовой среды или посредством геля, например, быть диспергированными в геле перед культивированием или вводиться в гель во время культивирования.
Что касается факторов, можно использовать любую комбинацию из одного, двух, трех, четырех или более факторов, нацеленных на один, два, три или более сигнальных путей.
Неограничивающие, но предпочтительные примеры факторов, которые могут быть нацелены на сигнальные пути, их ингибиторов и активаторов (например, факторов), включают:
- активаторы и ингибиторы белка морфогенеза костей (BMP). Белки BMP представляют собой группу важнейших морфогенетических сигналов, регулирующих архитектуру тканей во всем организме.
Примеры подходящих ингибиторов сигнализации BMP включают, помимо прочего, молекулы, участвующие в ингибировании сигнализации BMP, опосредуемой связыванием BMP (белка морфогенеза костей) с рецептором BMP, включая ингибиторы, такие как ноггин (Ноггин, также известный как NOG, представляет собой белок, участвующий в развитии многих тканей организма, включая нервную ткань, мышцы и кости, например, в концентрации 10-500 нг/мл), хордин и фоллистатин. Другие примеры низкомолекулярных ингибиторов BMP, имеющих такие свойства, включают соединение, которое ингибирует ВМР2, ВМР4, ВМР6 или ВМР7, способное активировать транскрипционный фактор SMAD1, SMAD5 или SMAD8, такое как дорсоморфин (РВ Yu et al. (2007), Circulation, 116: 11 60, RB Yu et al. (2008), Nat. Chem. Biol., 4: 33-41, J. Hao et al. (2008), PLoS ONE (www.plozone.org), 3 (8): e2904). Кроме того, примеры ингибитора рецептора киназы BMP типа I включают LDN-193189 (то есть 4-(6-(4-(пиперазин-1-ил)фенил)пиразоло[1,5-а] пиримидин-3-ил)хинолон, Yu РВ et al. Nat Med, 14: 1363-9, 2008). Соединение LDN-193189 можно приобрести, например, у производителя Stemgent.
Примеры подходящих активаторов сигнализации BMP включают BMP (принадлежащий к суперсемейству трансформирующего фактора роста-бета (TGFB), например ВМР1, ВМР2, ВМР4, ВМР7 (например, в концентрации от 0,1 нг/мл до 250 нг/мл среды).
- Активаторы и ингибиторы сигнализации Wnt. Сигнальные пути Wnt представляют собой группу путей сигнальной трансдукции, состоящих из белков, которые передают сигналы в клетку через рецепторы клеточной поверхности. Охарактеризованы три сигнальных пути Wnt: канонический путь Wnt, неканонический путь планарной полярности клеток и неканонический путь Wnt/кальций. Все три пути активируются путем связывания лиганда белка Wnt с рецептором семейства Frizzled, который передает биологический сигнал белку Dishevelled внутри клетки. Wnt включает разнообразное семейство секретируемых липид-модифицированных сигнальных гликопротеинов длиной 350-400 аминокислот. Тип модификации липидов, встречающейся в этих белках, представляет собой пальмитоилирование цистеинов в консервативном паттерне из 23-24 цистеиновых остатков.
Примеры подходящих активаторов Wnt включают, помимо прочего, BML-284; 2-амино-4-[3,4-(метилендиокси)бензиламино]-6-(3-метоксифенил)пиримидин или ингибитор DKK1; (1-(4-(нафталин-2-ил)пиримидин-2-ил)пиперидин-4-ил)метанамин и белки семейства R-спондинов, включая R-спондин-1 (например, в концентрациях 0,01-5 мкг/мл среды) и белки семейства сайтов интеграции MMTV типа Wingless, включая Wnt3a и другие (например, в концентрации по меньшей мере 50, 100, 500, 1000 нг/мл, например, от 50 до 1000 нг/мл).
Примеры ингибиторов сигнализации Wnt включают XAV-939, ингибитор PORCN Wnt-C59 (С59), LGK-974, ICG-001, IWP-2, IWP-L6 и многие другие.
- Также подходящими являются ингибиторы и/или активаторы GSKbeta. Киназа гликогенсинтазы-3 (GSK-3) представляет собой серин-треонинкиназу, нацеленную на пролин, которая первоначально была идентифицирована как фосфорилирующий и инактивирующий агент гликогенсинтазы. Две изоформы, альфа (GSK3A) и бета, показывают высокую степень гомологии с аминокислотами. GSK3B участвует в энергетическом обмене, развитии нейронов и формировании структуры тела.
Неограничивающие примеры ингибиторов GSKbeta включают CHIR-99021 (СТ99021), SB216763, CHIR-98014, Тидеглусиб, ацетоксим и AZD2858, LiCl (например, в концентрации 0,1 мМ - 100 мМ). CHIR 99021 или CHIR 98014 можно, например, использовать в концентрации по меньшей мере от приблизительно 1 мкМ до приблизительно 20 мкМ в среде.
- Другим примером является эпидермальный фактор роста или ЭФР, который представляет собой фактор роста, стимулирующий рост, пролиферацию и дифференцировку клеток посредством связывания с его рецептором РЭФР. ЭФР человека представляет собой белок массой 6045 Да с 53 аминокислотными остатками. ЭФР можно использовать, например, в концентрации 5-200 нг/ мл, предпочтительно 10-100 нг/мл, например 50 нг/мл.
- Активаторы и ингибиторы пути Notch. Сигнальный путь Notch представляет собой высококонсервативную систему клеточной сигнализации, присутствующую в большинстве многоклеточных организмов. Млекопитающие обладают четырьмя различными Notch-рецепторами, называемыми NOTCH1, NOTCH2, NOTCH3 и NOTCH4. Notch-рецептор представляет собой трансмембранный рецепторный белок, пронизывающий мембрану один раз. Сигнальный путь Notch способствует пролиферативной сигнализации при нейрогенезе, и белок Numb ингибирует его активность способствуя нейронной дифференцировки. Сигнальный путь Notch важен для межклеточной коммуникации, которая включает механизмы регуляции генов, контролирующие процессы клеточной дифференцировки во время эмбриональной и взрослой жизни. Примеры модуляторов пути Notch включает ингибиторы гамма-секретазы, такие как DAPT (например, в концентрации 0,1-50 мкМ) и/или FLI-06, LY411575, дибензазепин, Семагацестат, L658 и другие.
- Другим примером являются факторы роста фибробластов или ФРФ, которые представляют собой семейство факторов роста, члены которого участвуют в ангиогенезе, заживлении ран, эмбриональном развитии и различных эндокринных сигнальных путях. ФРФ представляют собой гепаринсвязывающие белки, и было показано, что взаимодействие с гепарансульфат-протеогликанами, ассоциированными с клеточной поверхностью, является важнейшим для трансдукции сигнала ФРФ. ФРФ являются ключевыми игроками в процессах пролиферации и дифференцировки широкого спектра клеток и тканей.
- Другим примером такого фактора является трансформирующий фактор роста бета (TGF-β), который представляет собой многофункциональный цитокин, принадлежащий к суперсемейству TGF-β, включающему три различные изоформы (TGF-β 1-3) и многие другие сигнальные белки.
- Эндотелии -1
- PDGF-B и PDGF-A, субъединицы А и субъединицы В тромбоцитарного фактора роста. Члены этого семейства являются митогенными факторами для клеток мезенхимального происхождения и характеризуются мотивом из восьми цистеинов.
- Активаторы и ингибиторы сигнализации Hedgehog, включая белки hedgehog. Путь сигнализации Hedgehog представляет собой путь сигнализации, который передает информацию в клетки, необходимые для правильного развития. Млекопитающие имеют трех гомологов Hedgehog, DHH, IHH и SHH, из которых наиболее изученным является Sonic (SHH). Подходящие белковые факторы для использования в настоящем изобретении включают Shh, Ihh и Hh, например, в концентрациях 0,01-10 мг/мл, предпочтительно 0,1-1 мг/мл или ниже). Ингибиторы включают LDE 225, саридегиб, BMS 833923, LEQ 506, PF-04449913 и TAK-441.
Эти факторы известны специалисту, и он знает, как использовать их в контексте настоящего изобретения.
Недавно было показано, что использование фидерных слоев мезенхимального происхождения (в данном случае - митотически инактивированных фибробластов 3Т3) способствует росту органоидов на плоских субстратах Transwell без использования Матригеля (X. Wang, Y. Yamamoto, L.H. Wilson, Т. Zhang, B.E. Howitt, M.A. Farrow, F. Kern, G. Ning, Y. Hong, C.C. Khor, et al., Nature, 522 (2015), стр. 173-178). Также оказалось возможным дифференцировать клетки в основные субтипы тонкого кишечника. Однако жесткая подложка Transwell не допускала свободной генерации вторичной морфологии, и авторы настоящего изобретения считают, что дифференцировка является ограниченной из-за этого, а также из-за отсутствия потока.
Способ по настоящему изобретению позволяет культивировать эпителиальные клетки в присутствии мезенхимального фидерного слоя, в предпочтительном варианте реализации, вплотную к гелю, например, гелю внеклеточного матрикса, обеспечивая тем самым полную гибкость для формирования вторичной морфологии, в дополнение к выращиванию трубчатых структур с четкой апикально-базальной ориентацией и с возможностью перфузии. Для клеток, контактирующих с гелем, наблюдается полное отсутствие (жесткой) стенки или фильтра (например, тканого фильтра).
Как подробно описано выше, предпочтительно, чтобы эпителиальный пласт или трубчатая структура были выстланы мезенхимальными клетками, причем эти мезенхимальные клетки были расположены между стенками сети микрожидкостных каналов и эпителиальными клетками. Другими словами, также предусмотрено, что по меньшей мере часть мезенхимальных клеток может быть расположена между стенкой сети микрожидкостных каналов и эпителиальными клетками.
Также предусмотрено, что на этапе d) эпителиальным клеткам позволяют образовывать слой клеток с апикальной и базолатеральной стороной, причем базолатеральная сторона обращена к мезенхимальным клеткам. Важным для апикально-базальной поляризации является наличие ВКМ/базальной пластинки. Также использование перфузионного потока обеспечивает хорошо поляризованные трубочки.
Апикальной мембраной поляризованной клетки является поверхность плазматической мембраны, которая обращена внутрь просвета. Базолатеральной мембраной поляризованной клетки является поверхность плазматической мембраны, которая образует ее базальную и боковую поверхности. In vivo, она обращена к интерстицию и вовне от просвета. В настоящем изобретении базолатеральная мембрана представляет собой мембрану, которая обращена к мезенхимальной клетке (клеткам) и/или гелю, например, гелю внеклеточного матрикса или находится в тесном контакте с ними. Эпителиальные клетки образуют плотные контакты друг с другом, что дает прочно сцепленную мембрану. Каждый домен плазматической мембраны имеет индивидуальный белковый состав, включая специфические транспортеры, которые реализуют транспорт определенных соединений через мембраны либо в базальном, либо в апикальном направлении.
Как упоминалось выше, по меньшей мере часть мезенхимальных клеток находится в плотном (или прямом) контакте по меньшей мере с частью эпителиальных клеток. В контексте настоящего изобретения это означает, что эпителиальные клетки и мезенхимальные клетки связаны друг с другом либо непосредственно, либо через присутствие базальной пластинки, которая образуется между клетками во время культивирования в соответствии с настоящим изобретением. Как правило, расстояние между пластом мезенхимальных клеток и пластом эпителиальных клеток равно или меньше толщины базальной пластинки (например, предпочтительно менее 100 мкм, более предпочтительно - в пределах 10 мкм). Специалист в данной области техники понимает, что базальная пластинка является структурной и функциональной границей между эпителиальными клетками и, в контексте настоящего изобретения, мезенхимальными клетками, важной в механизмах роста и контроля эпителиальных клеток. Толщина базальной пластинки может варьировать в зависимости от, например, типа или местоположения эпителия и состояния организма, и может иметь толщину, например, 30-300 нм, например, 100 нм (см., например, Dockery et al. Hum.Repr.Update (1998) 4 (5): 486-495), то есть эти значения меньше, чем мембраны и фильтры, уже используемые в данной области.
Также предусмотрено, что способ по изобретению дополнительно включает воздействие на эпителиальные клетки воздухом путем удаления водной среды, присутствующей в сети микрожидкостных каналов, содержащей эпителиальные клетки. Воздействие воздухом (воздействие воздуха) может быть реализовано после того, как мезенхимальным клеткам и эпителиальным клеткам дали возможность пролиферировать, предпочтительно с образованием трубчатой структуры. Этот вариант реализации особенно предпочтителен при применении эпителиальных клеток, которые в условиях in vivo также подвергаются воздействию воздуха, например, в легких, коже или кишечнике.
Специалист в данной области техники понимает, что эпителиальные клетки могут быть подвергнуты широкому спектру условий, помимо воздействия воздуха, которые могут включать воздействие других газов, жидкостей, лекарственных средств и соединений, пищевых компонентов. Предполагается, что клетки могут быть подвергнуты даже воздействию бактерий, как, например, в просвете желудочно-кишечного тракта или влагалищном эпителии.
Также предусмотрено, что система микрожидкостного культивирования клеток может содержать культуральную камеру, в которую вводят мезенхимальные клетки на этапе а) и эпителиальные клетки на этапе с). Таким образом, такая камера образует сеть микрожидкостных каналов).
В предпочтительном варианте реализации сеть микрожидкостных каналов, в которую вводят клетки, характеризуется наличием первой части, сконструированной с возможностью доступа жидкости к клеткам, и/или второй части, сконструированной с возможностью отведения жидкости от указанных клеток, предпочтительно в направлении и от культуральной камеры, содержащей мезенхимальные клетки и эпителиальные клетки. Это позволяет пропускать ростовую среду через канал и по поверхности клеток, присутствующих в канале, например, в культуральной камере.
Что касается геля, когда он присутствует, такой гель может быть подан в сеть микрожидкостных каналов или в канал, примыкающий к сети микрожидкостных каналов, причем указанный гель должен находиться в непосредственном контакте с указанной сетью микрожидкостных каналов. В обоих случаях гель таким образом покрывает или образует часть стенки сети микрожидкостных каналов, в которую вводят клетки.
Возможен даже случай, когда рядом с гелем присутствует еще одна сеть микрожидкостных каналов, которая находится в контакте с гелем, но в которой указанный канал не находится в непосредственном контакте с микрожидкостным каналом, содержащим эпителиальные клетки. Например, если гель присутствует в канале, который находится рядом с каналом, в который будут введены клетки, гель, таким образом, образует часть стенки этого канала. На другой стороне геля может присутствовать еще один канал, и это может, например, использоваться для обеспечения геля питательными веществами или соединениями или использоваться для сбора материалов, секретируемых клетками.
В качестве альтернативы, гель может присутствовать на двух сторонах перфузионного канала. Этот вариант реализации имеет то преимущество, что максимальная поверхность геля имеет контакт с трубкой. Гель можно вводить из нескольких впускных отверстий или одного общего впускного отверстия. В частности, при работе с барьерами капиллярного давления, таким как элементы phaseguide, мениск предшественника геля при формировании мениска растягивается в перфузионный канал, так что в поперечном сечении появляется дугообразный мениск. Это может быть выгодным для получения более сферического поперечного сечения формируемой трубочки.
Также предусмотрено, что в способе по настоящему изобретению система микрожидкостного культивирования клеток обеспечивает непрерывный оптический путь к клеткам в сети микрожидкостных каналов и/или к гелю и/или к другой сети микрожидкостных каналов. Это позволит обеспечить непрерывное измерение, мониторинг или наблюдение за клетками, культивируемыми в полом канале/сети микрожидкостных каналов. Способ по настоящему изобретению может также включать фиксацию множества изображений клеток, геля и/или сети микрожидкостных каналов в системе микрожидкостного культивирования во время культивирования, либо в процессе использования культивируемых клеток способом по настоящему изобретению.
Также предусмотрено, что одновременно с любым из этапов а) - d) или после него клетки приводят в контакт с исследуемым соединением. Исследуемым соединением может быть любой тип соединения, например лекарственное средство, материал, встречающийся в пище или в крови. Предполагается даже, что такое исследуемое соединение может представлять собой бактерии, вирусы или эукариотические клетки (включая, например, клетки крови). Воздействие такого соединения на функцию эпителия может быть определено путем сравнения с условиями в отсутствие такого соединения.
Как понятно специалисту, клетки, полученные в микрожидкостной системе способом по настоящему изобретению, могут применяться в самых разных условиях. Например, для оценки транспорта через эпителиальный барьер, исследований токсичности, совместной культуры с микробиомом, исследований усвоения пищи, исследований воспаления, реализации моделей заболеваний, таких как воспалительное заболевание кишечника, кистозный фиброз, ХОБЛ, астма, рак, для механистических исследований функции эпителия в норме и при патологии и тому подобного. Специалист в данной области техники понимает, как использовать клетки, культивируемые в соответствии с настоящим изобретением, в контексте таких экспериментальных условий. Применение микрожидкостных систем в соответствии с настоящим изобретением позволяет выполнять надежное высокопроизводительное тестирование.
Также предложена композиция или система, содержащая систему микрожидкостного культивирования клеток с сетью микрожидкостных каналов, содержащих внутреннюю группу клеток и внешнюю группу клеток, где внутренняя группа клеток по меньшей мере частично покрыта указанной внешней группой клеток, и где клетки внутренней группы представляют собой эпителиальные клетки, а клетки внешней группы представляют собой мезенхимальные клетки, причем, предпочтительно, внутренняя группа клеток и внешняя группа клеток взаимодействуют или находятся в непосредственном контакте. Другими словами, также предлагается устройство для микрожидкостного культивирования клеток, содержащее слой мезенхимальных клеток и слой эпителиальных клеток, находящихся в тесном контакте друг с другом, и как описано в настоящей заявке. В предпочтительном варианте мезенхимальные клетки и эпителиальные клетки находятся в форме трубчатой структуры, как определено в настоящей заявке..
Также предложен способ культивирования и/или мониторинга эпителиальных клеток с применением системы микрожидкостного культивирования клеток, содержащей сеть микрожидкостных каналов, включающий следующие этапы:
a) смесь эпителиальных и мезенхимальных клеток вводят в сеть микрожидкостных каналов, причем эту смесь клеток вводят в сеть микрожидкостных каналов с применением водной среды;
b) мезенхимальным клеткам и эпителиальным клеткам дают возможность пролиферировать, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта клетками.
Наконец, предложена система микрожидкостного культивирования клеток, содержащая мезенхимальные клетки и эпителиальные клетки, причем в предпочтительном варианте, мезенхимальные клетки и эпителиальные клетки образуют трубчатую структуру, или система микрожидкостного культивирования клеток, содержащая мезенхимальные клетки и эпителиальные клетки, получаемые способом культивирования и/или мониторинга эпителиальных клеток по настоящему изобретению.
Специалист в данной области техники должен понимать, что такая система микрожидкостного культивирования клеток с мезенхимальными клетками и эпителиальными клетками дает важные преимущества. С такой системой потребители могут, например, получить готовые к работе системы (например, для тестирования), которые уже содержат соответствующие клетки, или системы, которые требуют только ограниченного дополнительного культивирования и обработки. Это улучшает воспроизводимость и качество экспериментальных данных, полученных при использовании клеток, культивируемых способом по изобретению. Понятно, что такая система микрожидкостного культивирования клеток может, таким образом, содержать мезенхимальные и эпителиальные клетки, которые могут находиться на любой стадии развития, как описано в настоящей заявке.
Специалист в данной области понимает, что в отношении различных вариантов реализации и предпочтений для этого способа может быть сделана отсылка на различные варианты реализации и предпочтения, описанные в настоящей заявке, в описании и формуле изобретения, насколько это применимо к данному способу.
Далее, после описания настоящего изобретения в целом, оно будет более понятным с помощью ссылки на следующие примеры, которые приведены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения.
Примеры
Пример 1
Материалы и методы
Во время формирования структуры в процессе развития кишечного тракта, а также для создания оси "крипта-ворсинка" могут потребоваться сигналы Hedgehog, Wnt и BMP. In vivo кишечные эпителиальные клетки взаимодействуют с нижележащей мезенхимой и зависят от ее сигналов. Кишечные мезенхимальные клетки динамически вносят вклад в эпителиально-мезенхимальные взаимодействия, регулируя эпителиальную пролиферацию и дифференцировку.
Чтобы создать ось "крипта-ворсинка" в микрожидкостной модели кишечного тракта, мы использовали культуры кишечных органоидов, которые были созданы из образцов кишечной ткани человека, как описано ранее (Sato, Т. et al., 2011, Gastroenterol). Могут также использоваться органоиды из тканей мыши, собак, кошек и т.д.
Органоиды внедряли в 10-50 мкл ВКМ (например, Matrigel, предпочтительно матригель, ВМЕ (экстракт базальной мембраны Cultrex, ВМЕ2), высевали в 48- или 24-луночный планшет и вокрывали 250-750 мкл базальной среды, состоящей из среды Игла в модификации Дульбекко/ F12, с добавкой пенициллина/стрептомицина, 1х Глютамакса, 10 ммоль/л HEPES, 1х N2, 1x В27 (все производства Life Technologies), 50 нг/мл мышиного ЭФР, 1 ммоль/л N-ацетилцистеина (Sigma), 100 нг/мл мышиного ноггина, 1 мкг/мя человеческого R-спондина-1, 1 мМ гастрина, 10 мМ никотинамида, 10 мкМ SB202190, 500 нМ A83-01, 50% Wnt3a-кондиционированной среды или 200 (300, 400, 500 или более) нг/мл рекомбинантного белка Wnt3a (R&D). Всю среду меняли каждые 2-3 дня, а органоиды пассировали 1:2 (или 1:3, 1:4, 1:5) каждую неделю. Для моделирования развития кишечного тракта, мы использовали мезенхимальные клетки, предпочтительно из кишечного тракта (например, эмбриональные фибробласты мыши, фибробласты мыши, фибробласты человека, фибробласты кишечника, клетки гладкой мускулатуры, миофибробласты кишечника, предпочтительно человека), и высевали их в варианте 2 дорожек или 3 дорожек в гель (который может представлять собой, например, коллаген I, IV, Hystem с, матригель) с плотностью 1Е6 или 5Е6 или 10Е6 или 15Е6 или 20Е6 клеток/мл в ВКМ или высевали в комбинацию ВКМ со средой, состоящей из 10 или 15% FCS (фетальная телячья сыворотка) в среде DMEM (или ЕМЕМ или RPMI), с добавкой пенициллина/стрептомицина, lx NEAA, 1 х Глютамакса. Соотношение между ВКМ и средой может быть, например, 9:1 или 8:1 или 7:1 или 6:1 или 5:1 или 3:1 или 2:1 или 1:1.
В другом эксперименте вплотную к ВКМ вводят мезенхимальные клетки, например, из кишечного тракта (фибробласты кишечника, миофибробласты кишечника, предпочтительно человека). После приблизительно 0-72 часов или более инкубации мезенхимальных клеток в соседний с мезенхимальными клетками канал вводят эпителиальные клетки кишечного органоида.
Структура подстилающей мезенхимы может иметь важное значение для структурирования эпителиальных клеток и образования крипт.Во время развития кишечного тракта мезенхимальные клетки концентрируются в перикриптических областях, которые будут давать сигналы для образования крипт в кишечном эпителии. Одним из главных факторов, производимых мезенхимальными концентрированными клетками, помогающих образованию крипт, являются белки Wnt.
Было обнаружено, что кишечные мезенхимальные клетки могут быть мобилизованы для образования концентрированных кластеров клеток путем обеспечения хемотаксических сигналов, таких как TGFβ эндотелии 1, PDGF-B, PDGFA и белки Hedgehog (Shh, Ihh, Hh). Кишечные мезенхимальные клетки производят много различных типов белков Wnt. В одном эксперименте мезенхимальные клетки в соответствии с настоящим способом могут быть высеяны в гелесодержащую смолу, пропитанную одной из комбинаций этих сигналов. Например, гранулы Affi-gel (Bio Rad, 153-7302) пропитывали hrSHH (например, 0,1-1 мг/мл в PBS, R&D Systems, 1845-SH) и засевали мезенхимальными клетками в геле для достижения необходимых концентраций клеток. Затем клетки кишечных органоидов (отдельные клетки или 2-5-клеточные кластеры, полученные с применением TrypLE в течение 5 минут) вводили в ближайший канал в ВКМ или вплотную к ВКМ. Клетки можно высевать с плотностью клеток 1Е6, или 5Е6, или 10Е6, или 15Е6, или 20Е67 мл.
При использовании варианта микрожидкостного культурального устройства с 3 дорожками с одним типом ВКМ в средней дорожке мезенхимальные клетки могут быть введены в гель с концентрирующими сигналами на бусинах (агарозные бусины пропитывают хемоаттрактантом/сигнальной молекулой). Затем в один из соседних каналов вводят эпителиальные клетки.
Поляризованные эпителиальные клетки зависят от межклеточного контакта и при нарушении контакта претерпевают апоптоз. Поэтому может быть важным обеспечить ингибиторы киназы ROCK во время и после диссоциации эпителиальных клеток, чтобы увеличить их выживаемость. В предпочтительном варианте использовать ингибитор ROCK Y27632 в концентрации 10 мкМ.
Эпителиальные клетки первоначально поддерживают в базальной среде апикально и базально в течение, например, 1, или 2, или 3, или 4 дней. Затем из среды в канале эпителиальных клеток удаляют белок Wnt3a, тогда как в среду дистального канала добавляют дополнительный Wnt3a. Это может быть особенно выгодным при культивировании эпителиальных структур из кишечных стволовых клеток, поскольку белки Wnt будут обеспечивать сигнал для сохранения крипто-подобных структур на одной стороне трубки, а уменьшенные концентрации сигналов Wnt в другом канале будут поддерживать дифференцировку эпителиального барьера.
Воссоздание в таком устройстве клеточного микроокружения и градиентов сигналов, например, сигналов Wnt, присутствующих in vivo в кишечнике, оказалось полезным для формирования функциональной ткани кишечника. Например, рекомбинантный белок Wnt3a в концентрации по меньшей мере 100 нг/мл или более является предпочтительным для создания градиента такого сигнала. Для усиления эффекта этой обработки такой же градиент должен быть создан для белка R-спондина (например, R-спондина 1) в концентрации, например, 50 нг/мл. Для создания такого градиента можно также использовать кондиционированную Wnt3a среду и кондиционированную R-спондином 1 среду. Концентрации для среды, кондиционированной R-спондином, могут предпочтительно составлять 10% или более. Концентрации для среды, кондиционированной Wnt3a, могут предпочтительно составлять 50% или более и предпочтительно не менее 30%
Малая молекула CHIR, ингибитор GSKp, активирует канонический путь Wnt. Молекула CHIR может заменить использование белков Wnt3a или R-спондина 1 во время начальной фазы размножения кишечного эпителия в устройстве, например, при использовании в концентрации 3 мкМ или более. Молекула CHIR может быть нежелательна для создания градиента сигнализации Wnt, так как эта небольшая молекула способна быстро диффундировать в культуре в отличие от белков. Вместо CHIR можно использовать другой ингибитор GSKβ, LiCl, в концентрации, например, от 1 мМ до 30 мМ,.
Подстилающая мезенхима продуцирует и высвобождает in vivo сигнальные молекулы Bmp (например, ВМР4). Сигнализация BMP обеспечивает сигнал дифференцировки для стволовых клеток кишечника. Таким образом, может оказаться целесообразным воссоздать градиент ингибиторов BMP (например, ноггина) чтобы поддержать активную пролиферацию компартмента стволовых клеток (который ингибируется BMP) и обеспечить сегрегацию и дифференцировку клеток кишечного тракта аналогично соответствующим клеткам in vivo.
Содержащая ноггин среда может быть обеспечена с одной стороны устройства, например, подана ко "дну" крипт. Градиенты этих сигналов могут быть созданы, например, после того, как эпителиальные клетки достигли конфлюентности (или до этого). Среда, обедненная ноггином, может быть обеспечена (подана) с апикальной стороны сконструированной трубки. Этот способ может быть особенно полезен для созревания кишечной выстилки, когда желательны специфические проявления этого дифференцированного состояния, такие как продукция муцинов на апикальной стороне.
ЭФР может также иметь важное значение для поддержания кишечных стволовых клеток и клеток-предшественников in vivo и in vitro. Кроме того, при добавлении апикально (например, в составе грудного молока) он способен защитить от апоптоза и некроза развивающийся кишечник у новорожденных. Таким образом, добавление ЭФР, например, а концентрации не менее 10 нг/мл и не более 100 нг/мл, предпочтительно 50 нг/мл, может продолжаться в течение всего периода культивирования для поддержки пролиферации эпителиальных клеток и ингибирования апоптоза в этих клетках.
Активность пути Notch важна для пролиферативного состояния кишечного эпителия, и при ингибировании, например, ингибиторами γ-секретазы, это может привести к терминальной дифференцировки ткани кишечника, например, в бокаловидные клетки. Поэтому может быть полезно введение коротким импульсом ингибиторов пути Notch с целью усиления созревания бокаловидных клеток для продукции муцинов. Таким образам после начальной пролиферации эпителиальных клеток в устройстве может быть предпочтительным применение ингибитора γ-секретазы (например, DAPT 10 мкМ).
Спустя, например, 3 дня после посева эпителиальных клеток или после того, как эпителиальный слой клеток достигнет конфлюентности, к среде с апикальной стороны может быть добавлен ингибитор γ-секретазы, чтобы вызвать остановку роста и созревание бокаловидных клеток. Среда может быть обедненной ингибитором γ-секретазы для предотвращения потери ниши стволовых клеток (крипты), предпочтительно в пределах, например, 5 дней непрерывного культивирования в присутствии ингибитора γ-секретазы (например, после 12 ч, или 24, или 48 ч и так далее). Эта обработка может улучшить продуцирование слизистого слоя зрелыми бокаловидными клетками, в то время как короткая обработка ингибитором Notch и обработка сильными агонистами Wnt с базальной стороны (ближе к криптам) могут обеспечить сохранение ниши стволовых клеток.
Такое последовательное высевание двух типов клеток с последующими периодами обработки агонистами и ингибиторами критически важных путей обеспечит успешное развитие зрелого трубчатого кишечного миниоргана.
Пример 2- Последовательный посев мезенхимальных и эпителиальных клеток Для этого эксперимента использовали устройство OrganoPlate® (MIMETAS) в 3-дорожечном варианте, с дорожками шириной 400 микрон, как показано на фигуре 1. Кишечные миофибробласты, высеянные в гель ВКМ (см. ниже), в концентрации 5000 клеток/эксперимент, инъецировали в дорожку геля (103). После этого клетки Сасо-2 в среде ЕМЕМ (как описано ниже) инъецировали в перфузионную дорожку (102) в концентрации 20000 клеток/эксперимент.Затем клетки Сасо-2 культивировали в течение 7 дней (в присутствии миофибробластов). В третьем микрожидкостном канале (106) присутствовала среда smGM (ростовая среда для гладкомышечной ткани, Lonza). На 7-й день методом фазового контраста были сделаны изображения, результат которых показан на фигурах 29А и 29 В.
Из этих фигур видно, что клетки Сасо-2 вошли в гелевую дорожку, содержащую мифибробласты, взаимодействуя с миофибробластами и образовав слой сверху. Кроме того, этот эксперимент показывает, что там, где клетки Сасо-2 и миофибробласты взаимодействуют, формируется вторичная морфология и организация. Стрелки указывают на такие структуры, которые похожи, например, на морфологию крипт или ворсинок, присутствующую в толстой кишке или тонком кишечнике, и очень близки к ситуации in vivo.
Среда ЕМЕМ:
ЕМЕМ (АТСС, кат. №30-2003) Пенициллин/стрептомицин 1% (Sigma, кат. №Р4333)
MEM, раствор неосновных аминокислот (100Х) 1% (Gibco, кат. №11140-050) Инактивированная нагреванием фетальная бычья сыворотка FBS HI 10% (Gibco, кат. №16140-071).
Гель ВКМ:
Коллаген I 5 мг/мл (коллаген I из хвостов крыс AMSbio Cultrex 3D, 5 мг/мл, №3447-020-01)
i. 1М HEPES (Life Technologies 15630-122)
ii. NaHCO3 37 г/л (Sigma S5761-500G))
SmGM-2, Ростовая среда для гладкомышечной ткани -2 Полная среда SmGM-2:
- Базальная среда SmBM (Lonza, СС-3156)
- SmGM™-2 SingleQuots™, добавки и факторы роста (чЭФР, инсулин, ФРФ-В, FBS и гентамицин/амфотерицин В)
Пример 3. Трубки из мезенхимальных/эпителиальных клеток
Для этого эксперимента использовали OrganoPlate® (MIMETAS) в 2-дорожечном варианте, с дорожками шириной 400 микрон.
Клетки, смесь 4:1 эндотелиальных клеток vvHUVEC-RFP (Angiocrine, клеточный пассаж 4) в ростовой среде для эндотелиальных клеток MV2 (Promocel, кат №: С-22022); и перицитов сосудов мозга (Sciencell, клеточный пассаж 4) в ростовой среде для перицитов (Sciencell); в общей начальной концентрации 5000 клеток/мкл культивировали поместив устройство OrganoPlate® в 2-дорожечном варианте на перфузионную качалку (угол наклона 7°, цикл качания 8 минут).
После 3 дней культивирования клетки окрашивали с помощью реактива Actin-Green. Изображения сформированной трубки были получены с применением конфокальной микроскопии (Leica, TCS SP5 STED). 3D-проекция была создана с применением плагина 3D-просмотрщика Fiji (Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772..). Результаты показаны на рис. 31. Как можно видеть, мезенхимальные клетки и эндотелиальные клетки способны сформировать трубку, содержащую как эндотелиальные клетки, так и перициты.
На основании полного описания настоящего изобретения специалистам в данной области техники будет понятно, что то же самое может быть реализовано в широком диапазоне эквивалентных параметров, концентраций и условий без отступления от сущности и объема настоящего изобретения и без излишних экспериментов.
Хотя это изобретение описано в связи с конкретными вариантами его реализации, следует понимать, что оно допускает дальнейшие модификации. Предполагается, что эта заявка охватывает любые варианты, применения или адаптации изобретений, соответствующие, в целом, принципам настоящего изобретения, и включает такие отступления от настоящего раскрытия, которые лежат в пределах известной или общепринятой практики в области техники, к которой относится изобретение, и которые применимы к изложенным выше существенным признакам, представленным в объеме прилагаемой формулы изобретения.
Все цитируемые в настоящей заявке документы, в том числе журнальные статьи или аннотации, опубликованные или соответствующие патентные заявки, патенты или любые другие документы, полностью включены в настоящую заявку посредством ссылки, включая все данные, таблицы, графические материалы и текст, представленные в цитируемых документах. Кроме того, все содержание документов, цитируемых в цитируемых в настоящей заявке документах, также полностью включено в настоящую заявку посредством ссылки. Указание на известные этапы способа, этапы общепринятых способов, известные способы или общепринятые способы никоим образом не является признанием того, что какой-либо аспект, описание или вариант реализации настоящего изобретения раскрыты, следуют из уровня техники, или что в уровне техники имеются указания на них.
Вышеизложенное описание конкретных вариантов реализации настолько полно раскрывает общий характер изобретения, что другие лица могут, применяя знания в пределах данной области техники (включая содержание цитируемых в настоящей заявке ссылок), легко модифицировать и/или адаптировать для различных применений такие конкретные варианты реализации без излишних экспериментов, не отступая от общей концепции настоящего изобретения. Следовательно, предполагается, что такие адаптации и модификации будут находиться в пределах толкования и диапазона эквивалентов раскрытых вариантов реализации исходя из представленных в настоящей заявке идей и методологических принципов. Следует понимать, что формулировки или терминология в настоящей заявке предназначены для описания, а не ограничения, так что терминология или формулировки настоящего описания должны интерпретироваться квалифицированным специалистом в свете идей и методологических принципов, представленных в настоящей заявке, в сочетании со знанием специалиста обычной квалификации в данной области техники.
| название | год | авторы | номер документа |
|---|---|---|---|
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ЭПИТЕЛИАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ОРГАНОИДОВ, СОДЕРЖАЩИХ УКАЗАННЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2010 |
|
RU2555545C2 |
| БИОСИНТЕТИЧЕСКИЕ СИСТЕМЫ ПРОКСИМАЛЬНОГО КАНАЛЬЦА И СПОСОБЫ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2620947C2 |
| ОРГАНОИД ПЕЧЕНИ, ВАРИАНТЫ ЕГО ПРИМЕНЕНИЯ И СПОСОБ КУЛЬТИВИРОВАНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2579995C2 |
| КУЛЬТУРАЛЬНАЯ СРЕДА СТВОЛОВЫХ КЛЕТОК | 2012 |
|
RU2714256C2 |
| УСТРОЙСТВО И СПОСОБЫ ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2017 |
|
RU2741806C2 |
| ИЗМЕРЕНИЯ БАРЬЕРНОЙ ФУНКЦИИ | 2016 |
|
RU2752085C2 |
| МЕЗЕНХИМАЛЬНЫЕ СТРОМАЛЬНЫЕ КЛЕТКИ И СПОСОБЫ ПОЛУЧЕНИЯ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ПУПОВИНЫ | 2018 |
|
RU2793467C2 |
| СПОСОБ ПРИВИВКИ КЛЕТОК ПЕЧЕНИ СУБЪЕКТУ С ЗАБОЛЕВАНИЕМ ИЛИ ДИСФУНКЦИЕЙ ПЕЧЕНИ | 2011 |
|
RU2736955C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИСКУССТВЕННОГО ЗАЧАТКА ЗУБА IN VITRO И ПОЛУЧЕННЫЙ ИМ ИСКУССТВЕННЫЙ ЗАЧАТОК ЗУБА | 2013 |
|
RU2638783C2 |
| ДИКЕТОНЫ И ГИДРОКСИКЕТОНЫ В КАЧЕСТВЕ АКТИВАТОРА СИГНАЛЬНОГО ПУТИ КАТЕНИНА | 2011 |
|
RU2592694C2 |
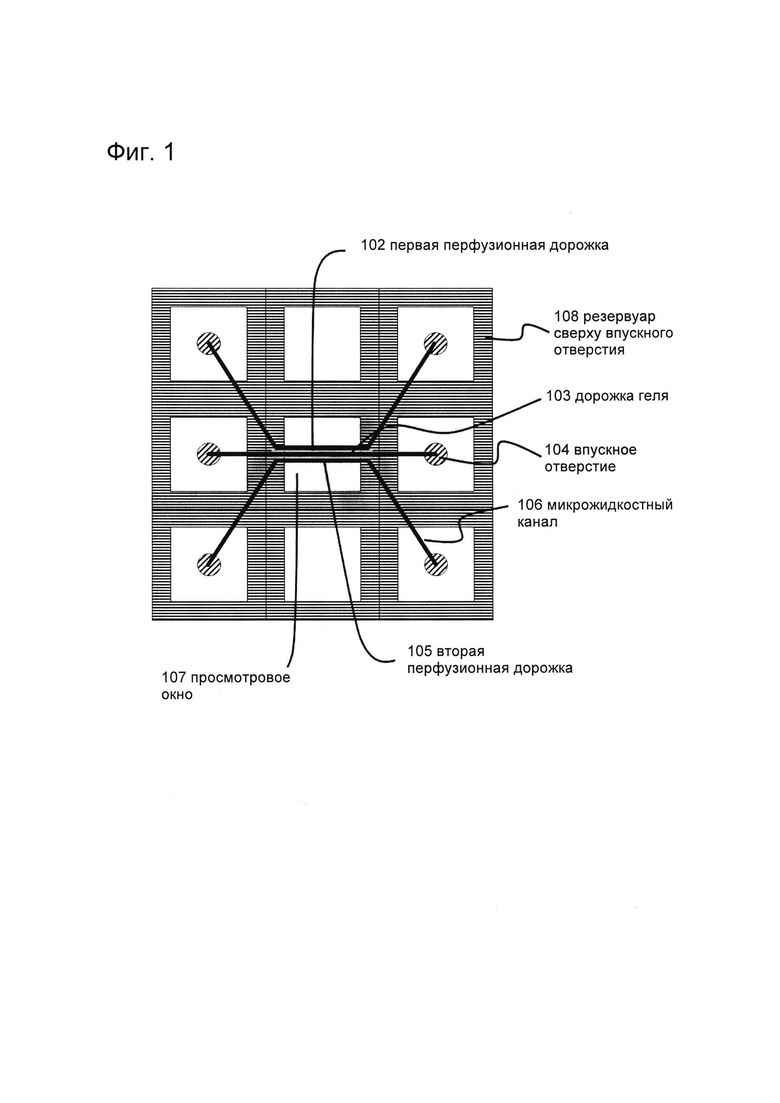
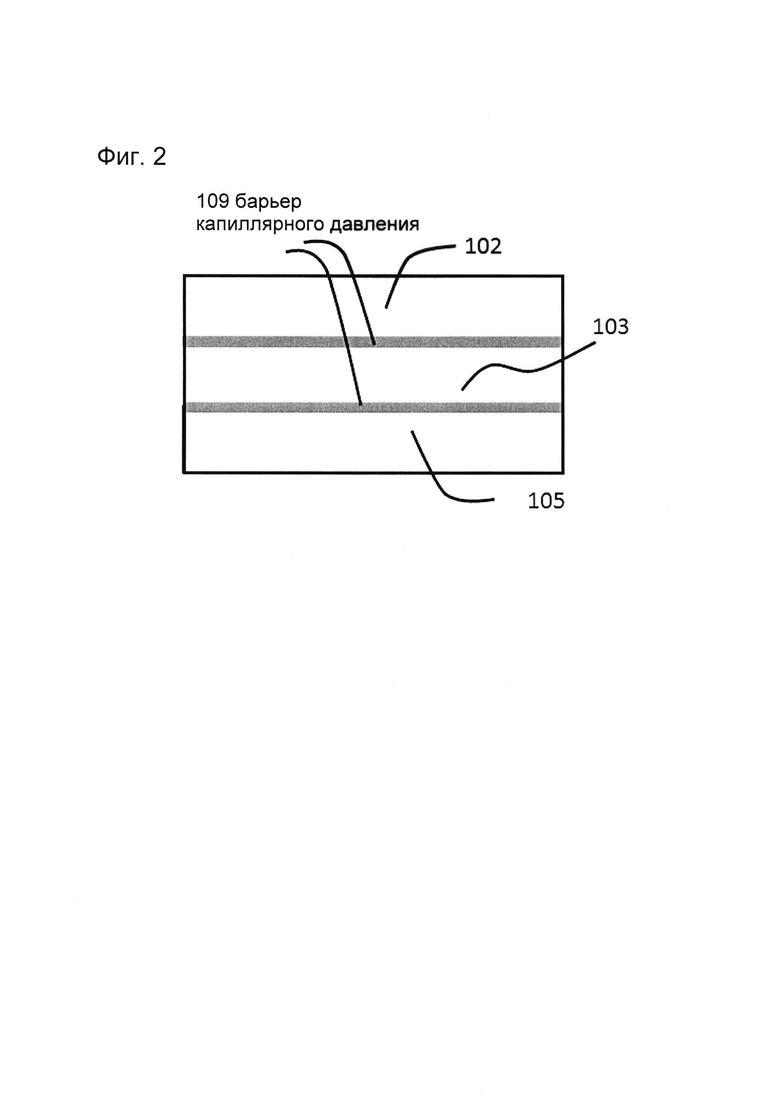
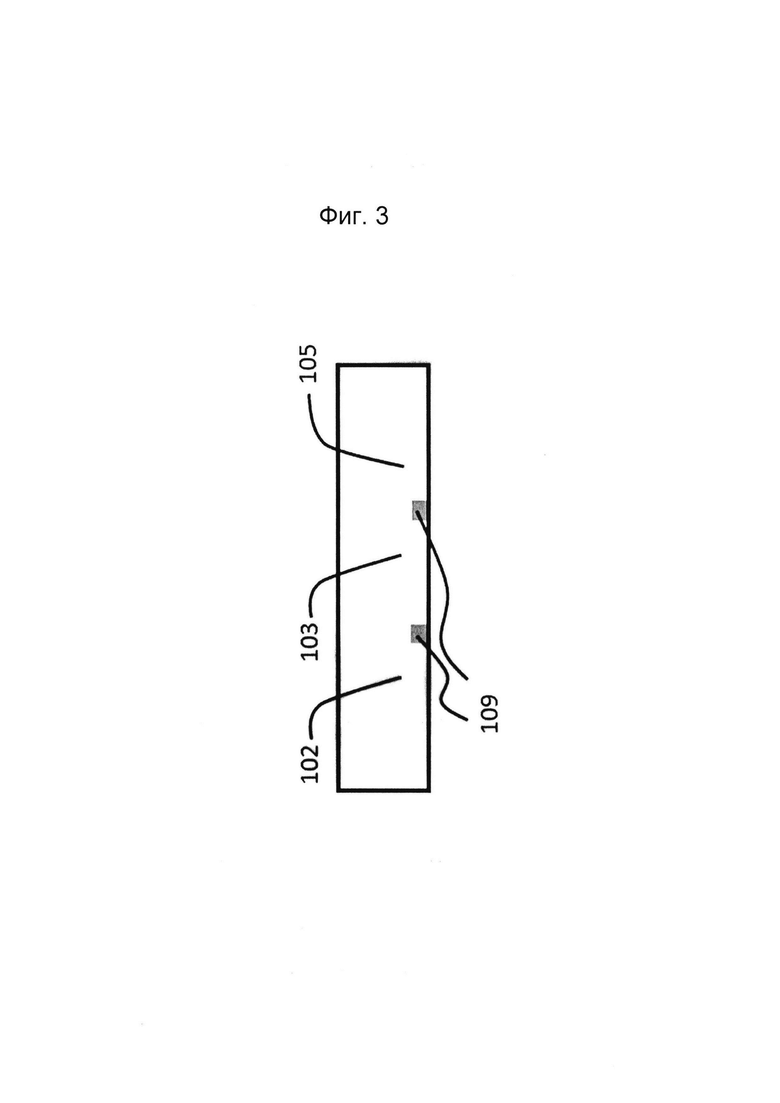
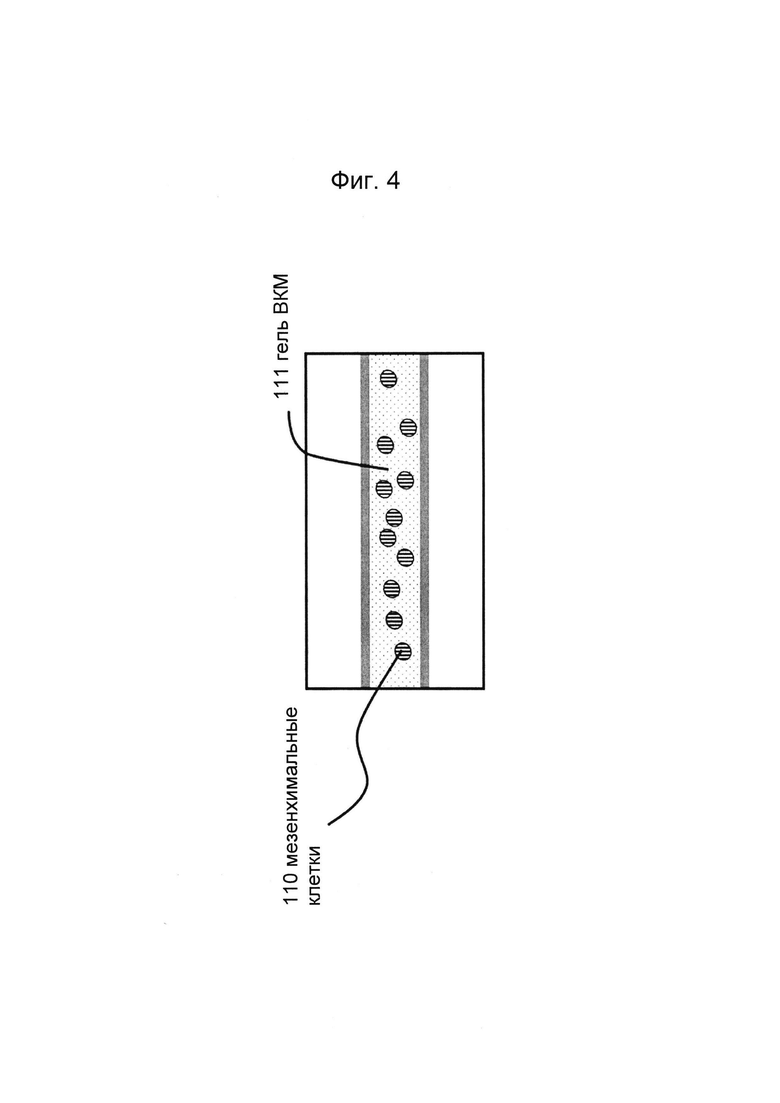
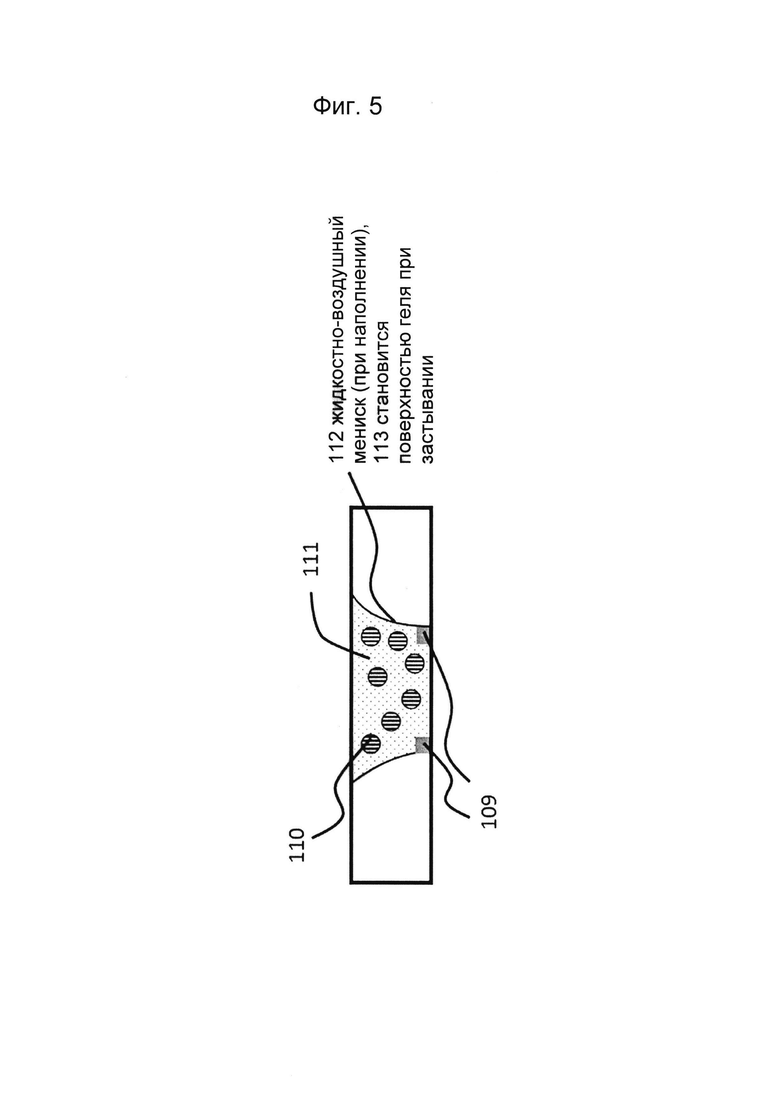
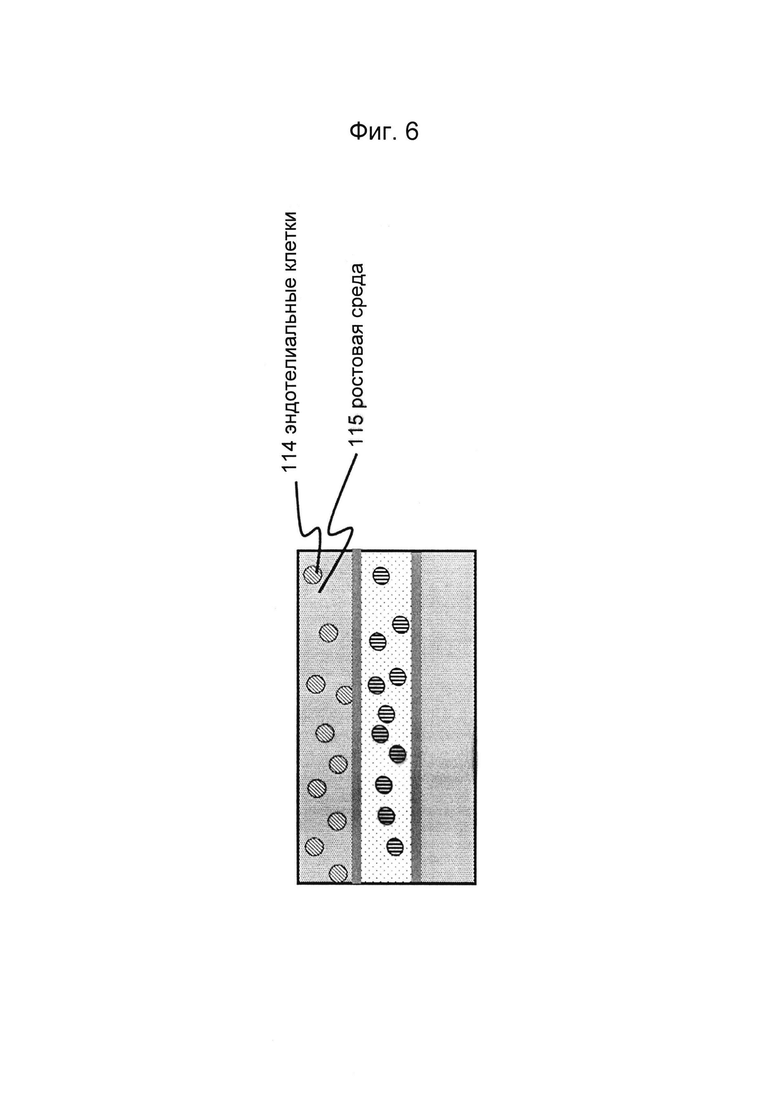
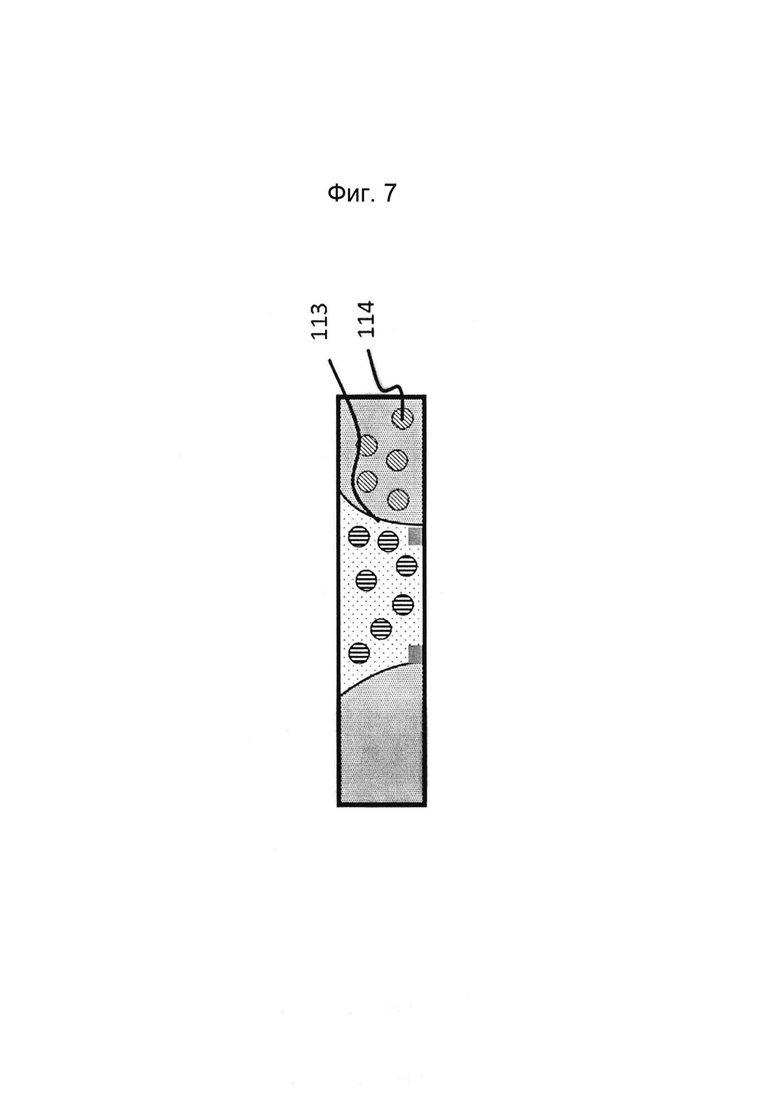
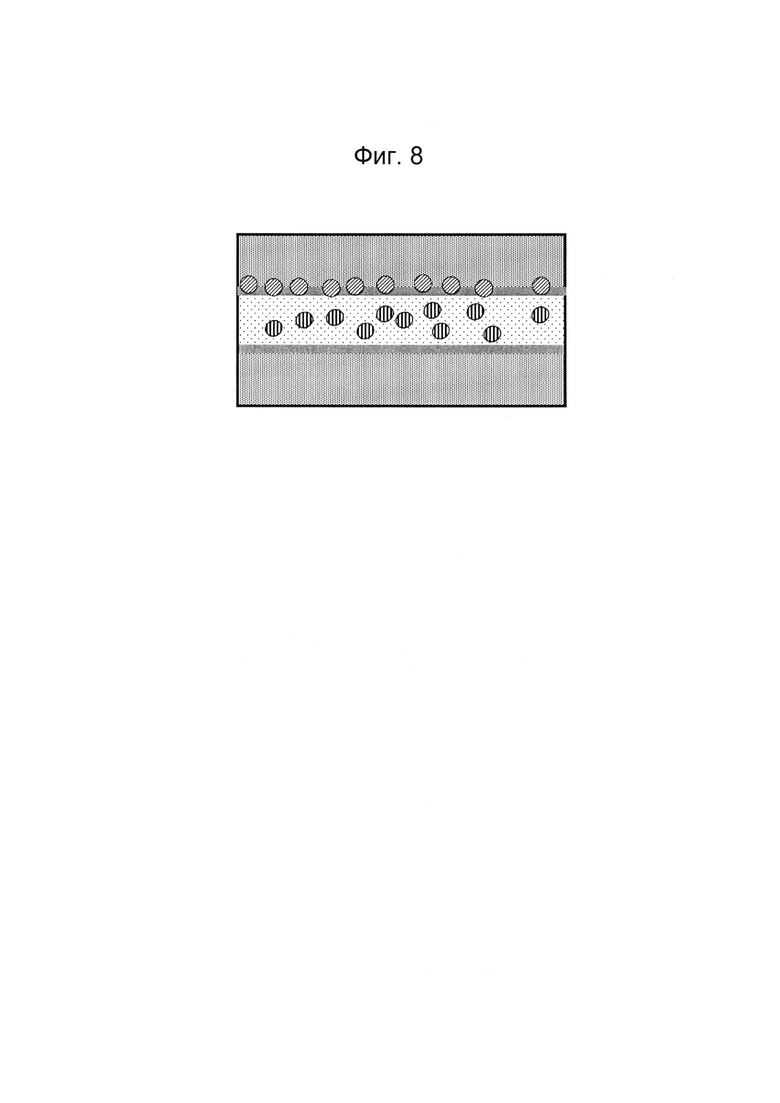
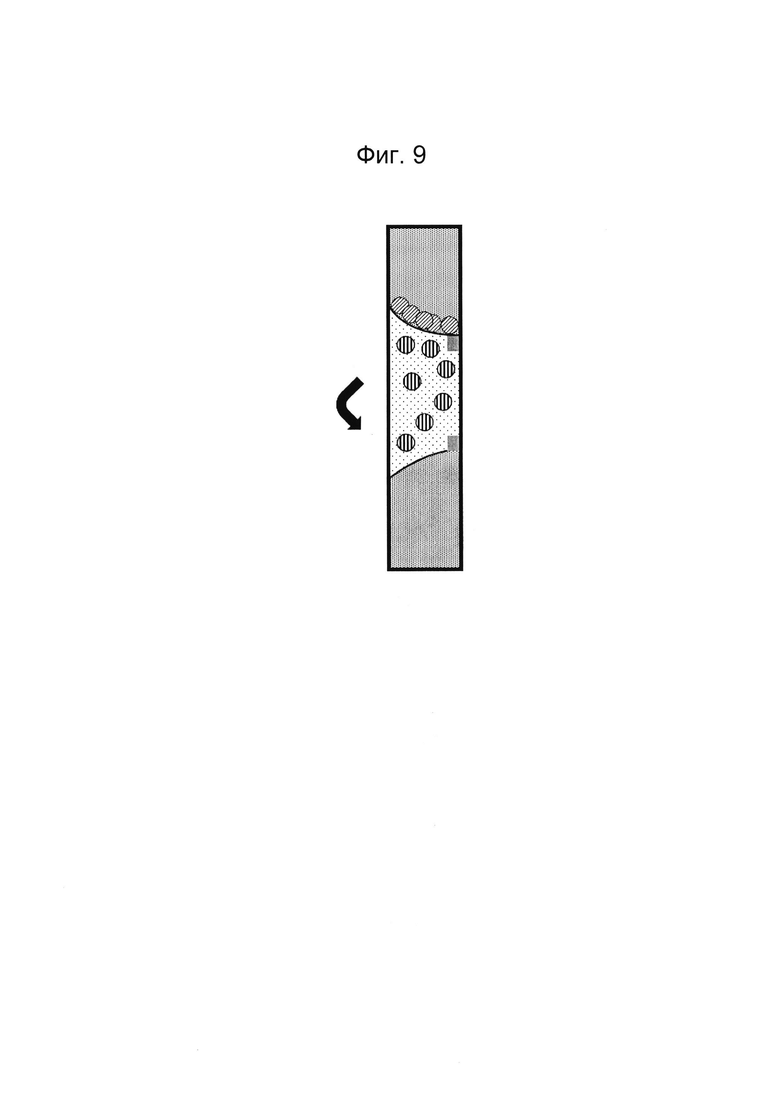
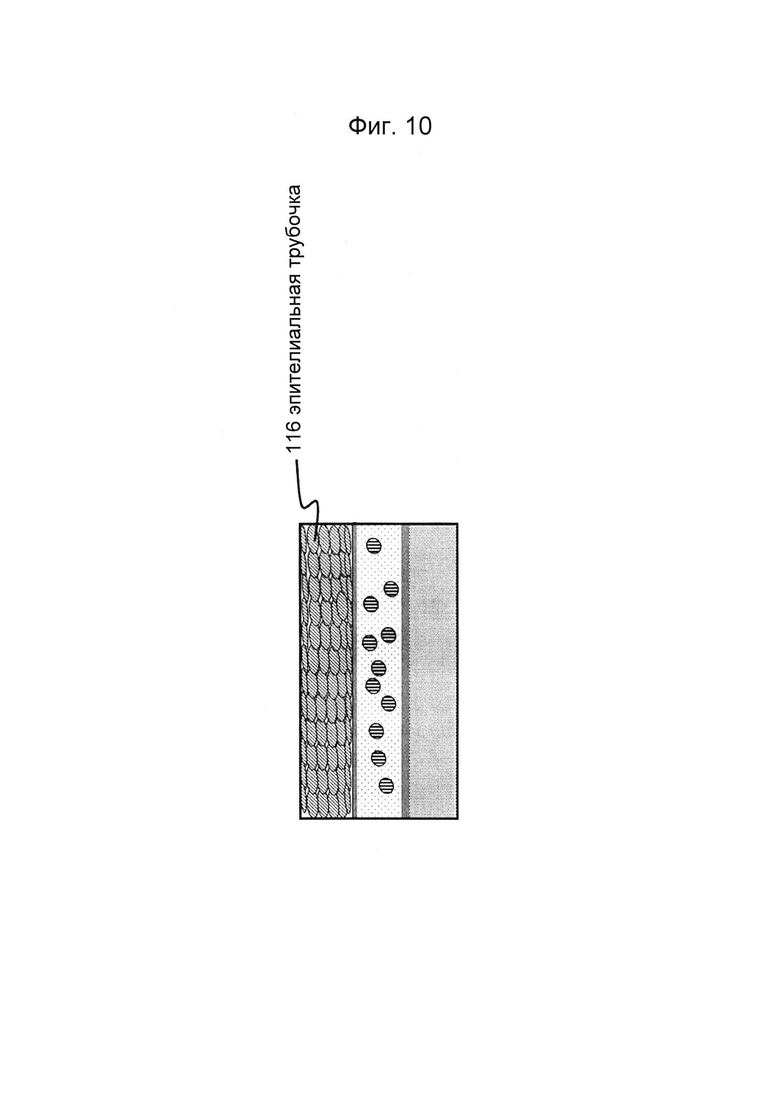
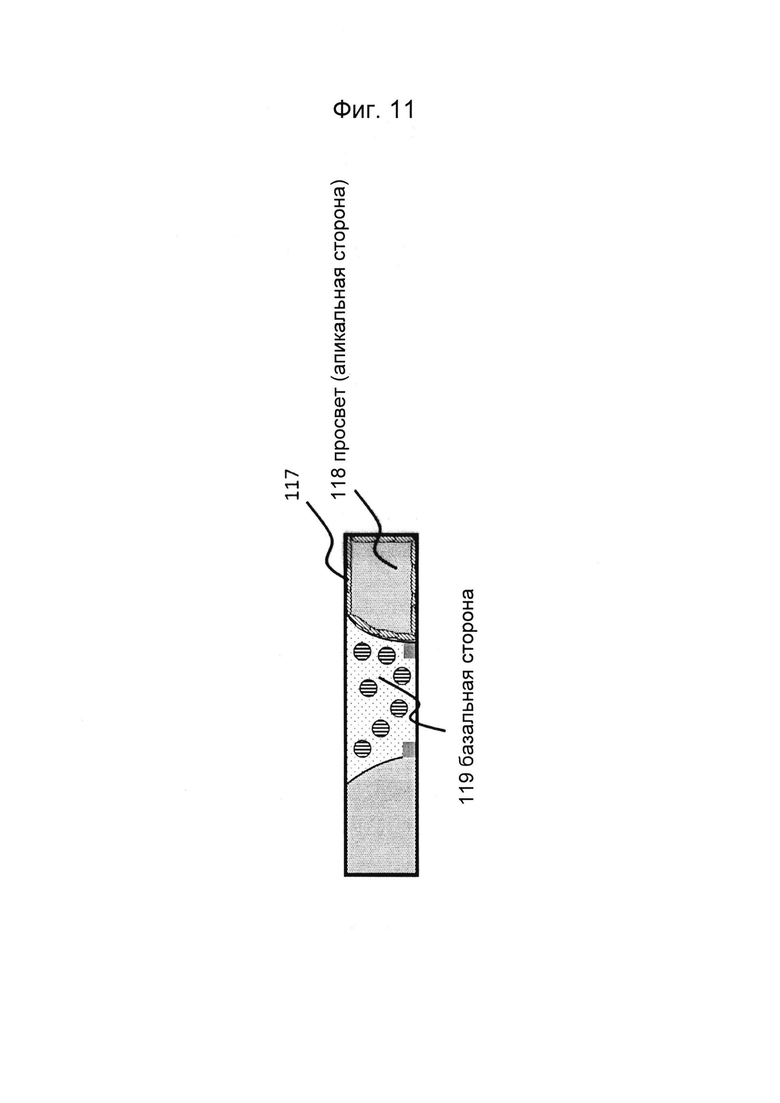
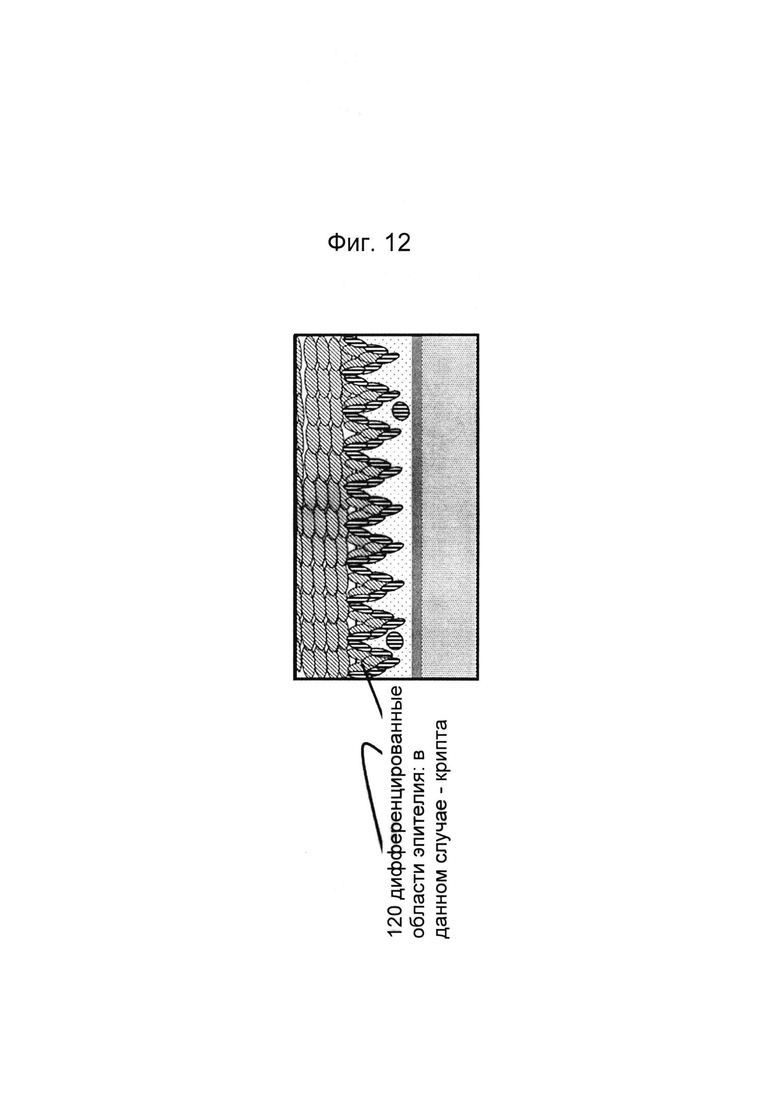
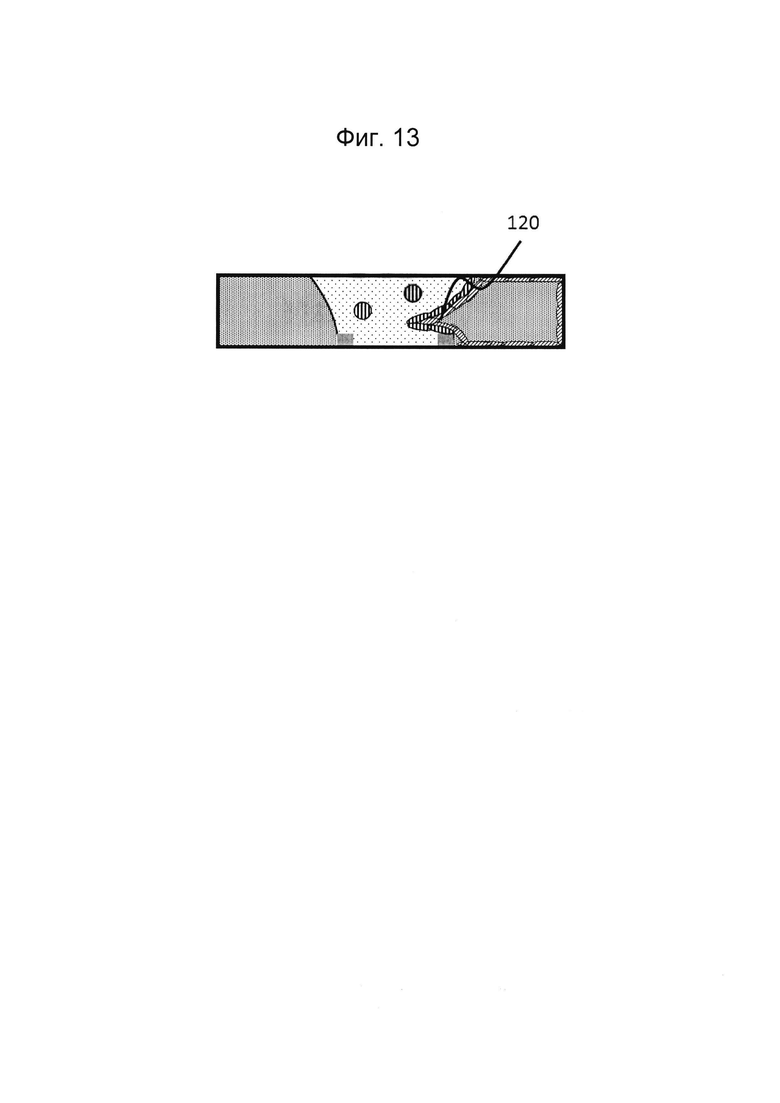
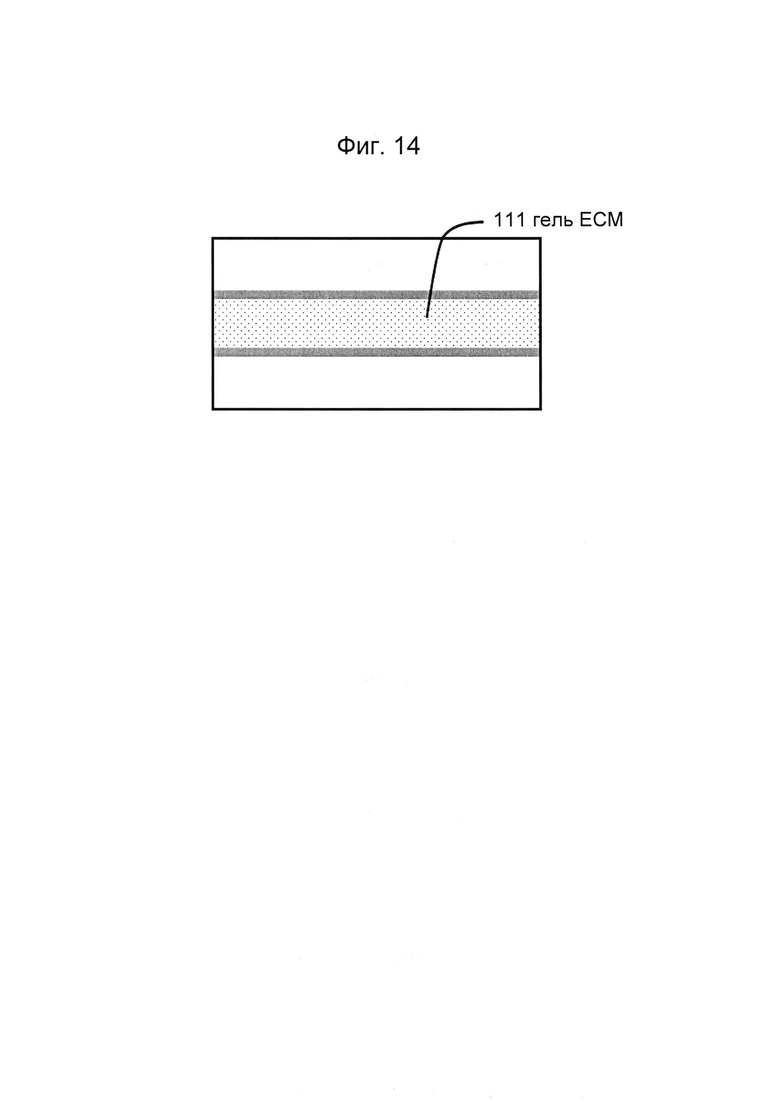
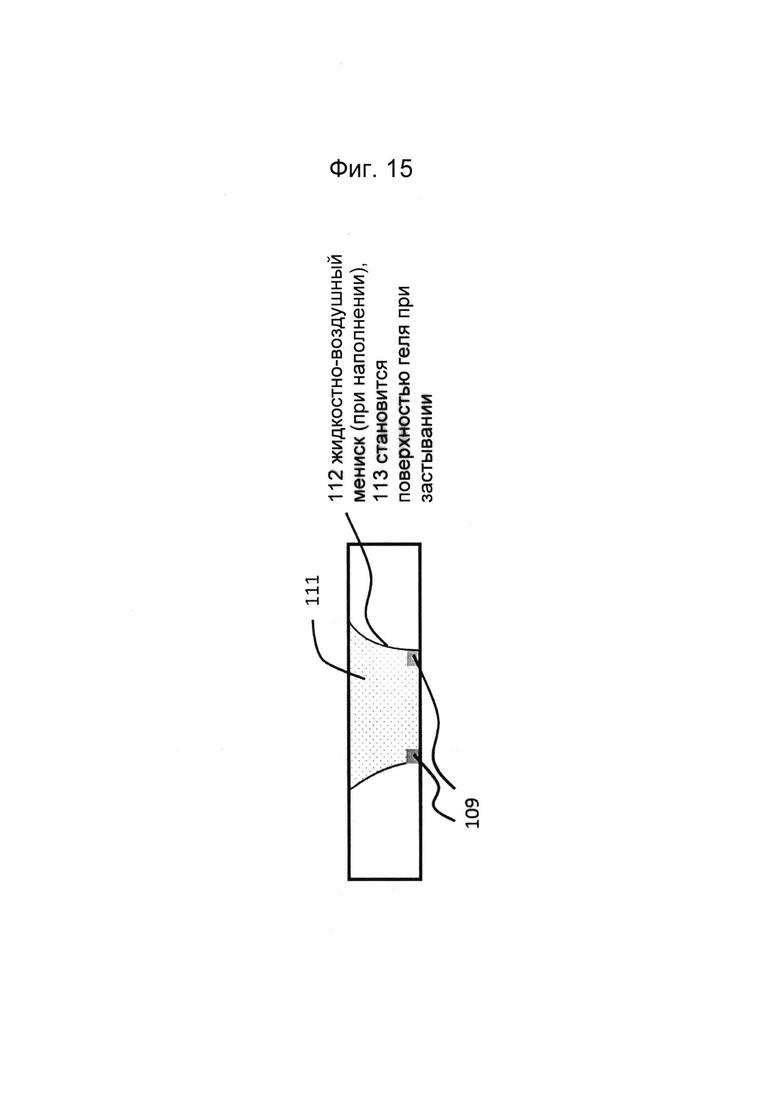
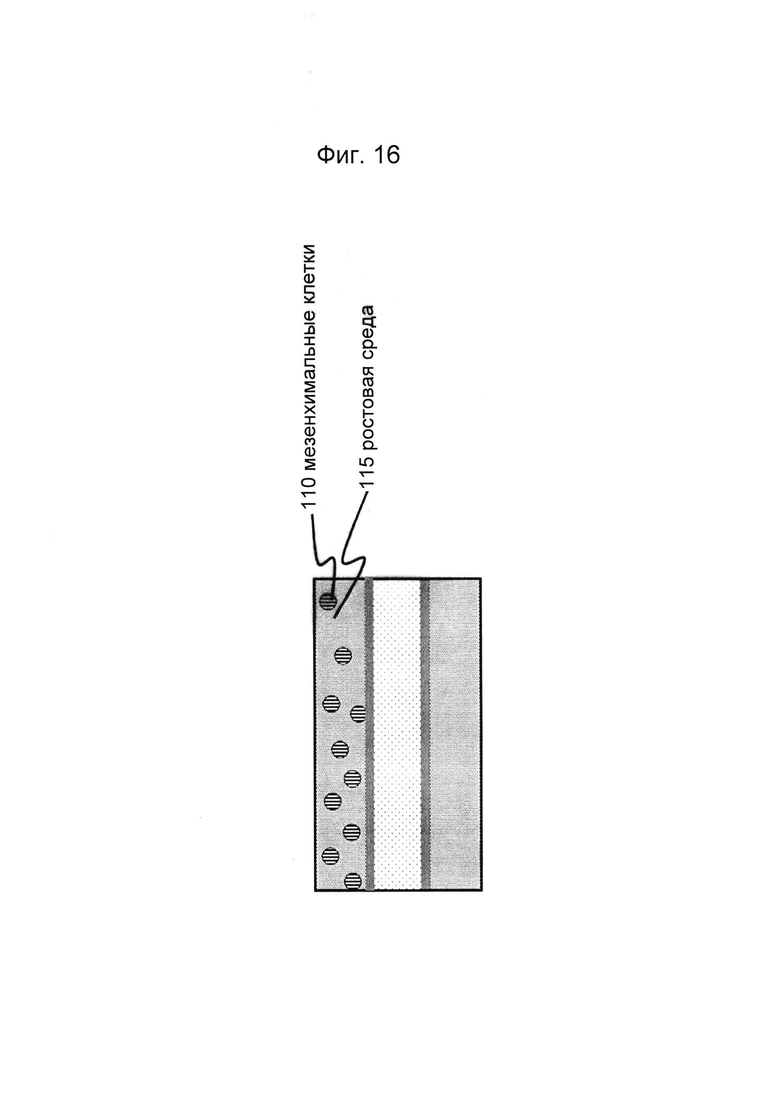
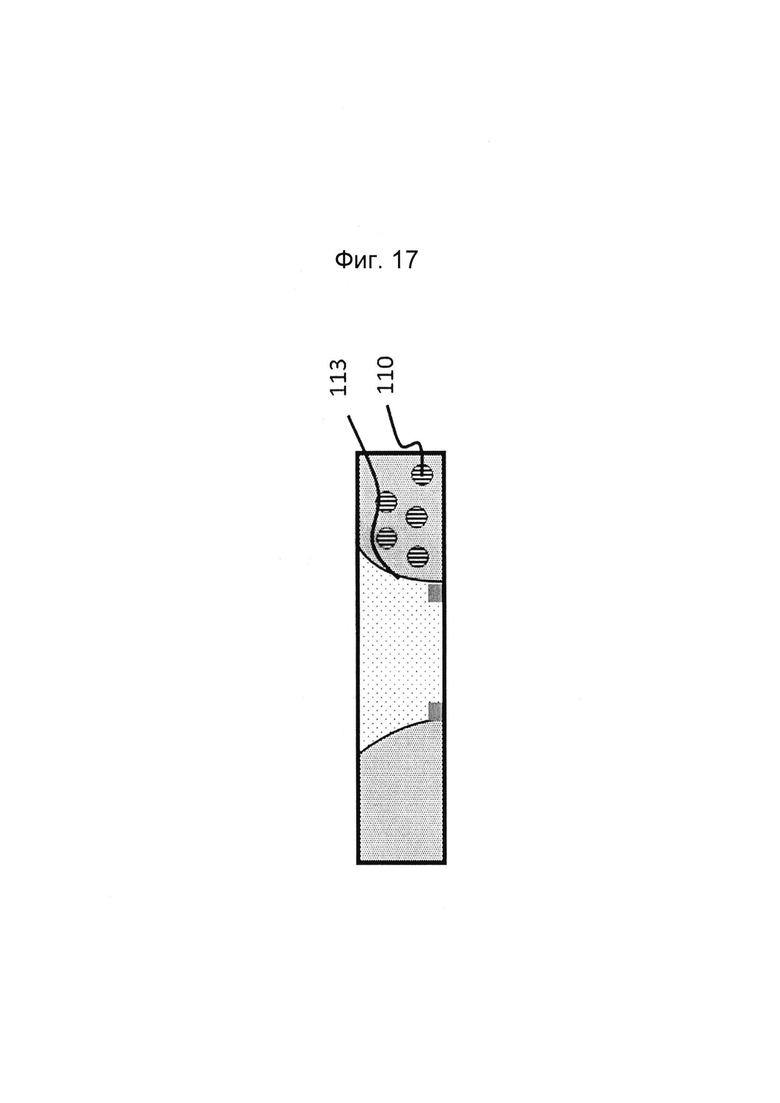
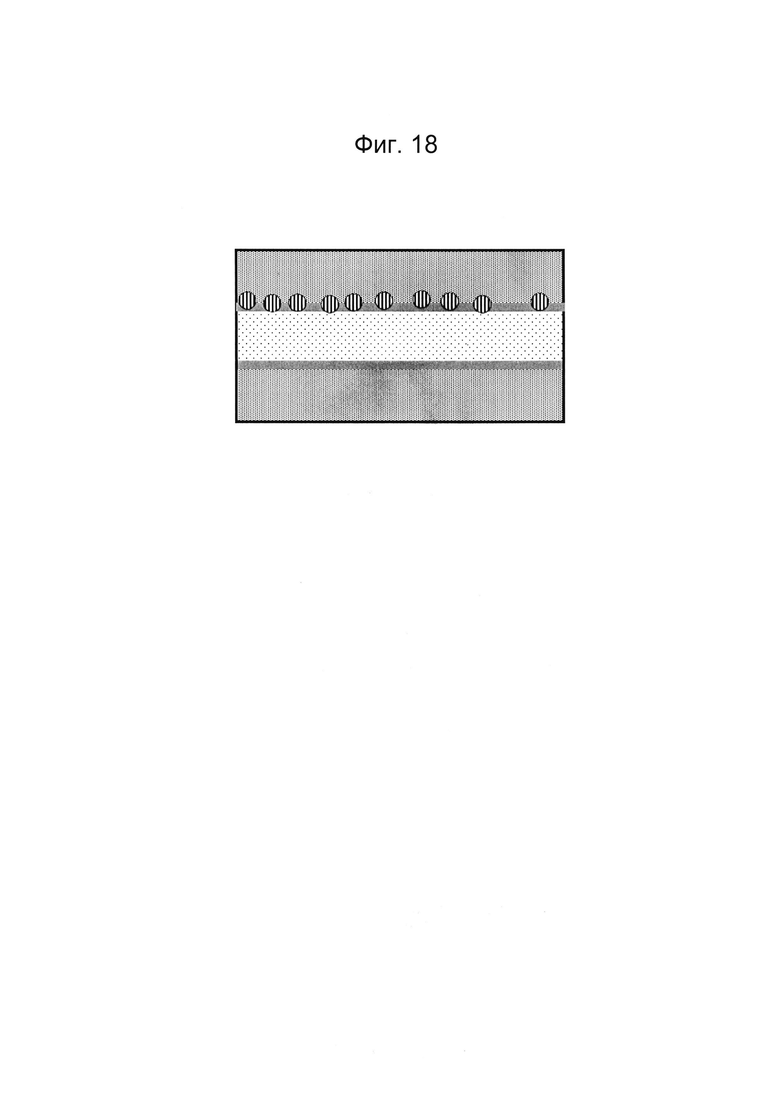
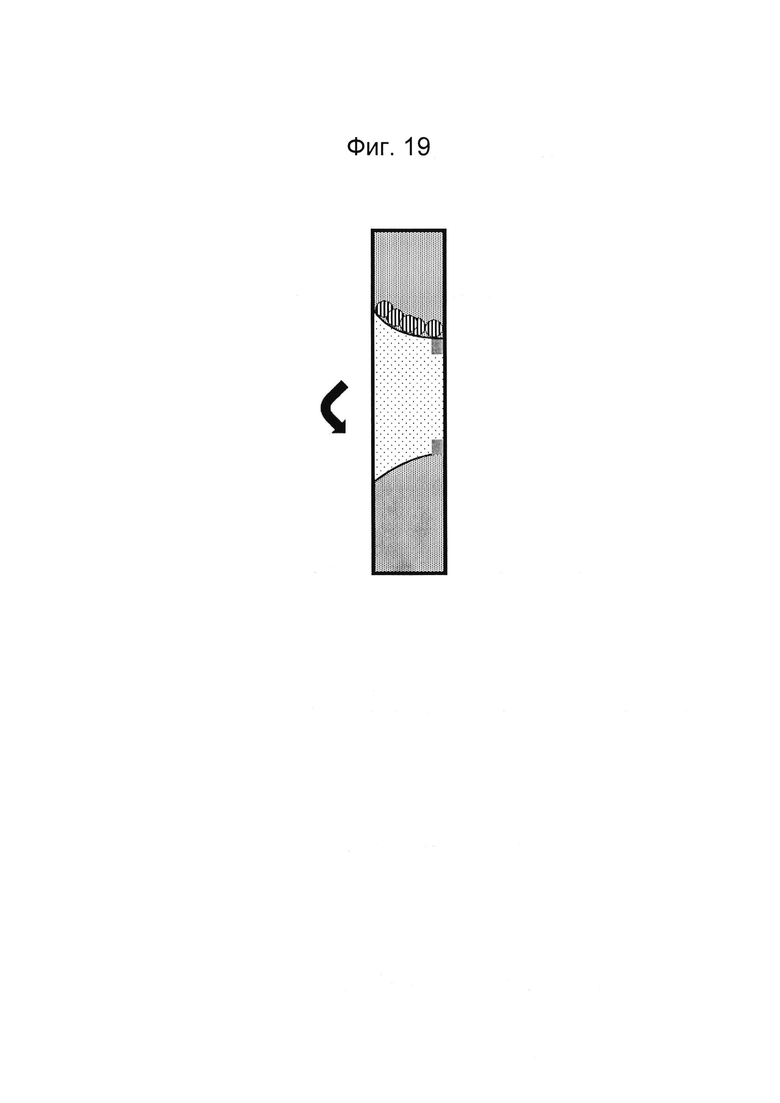
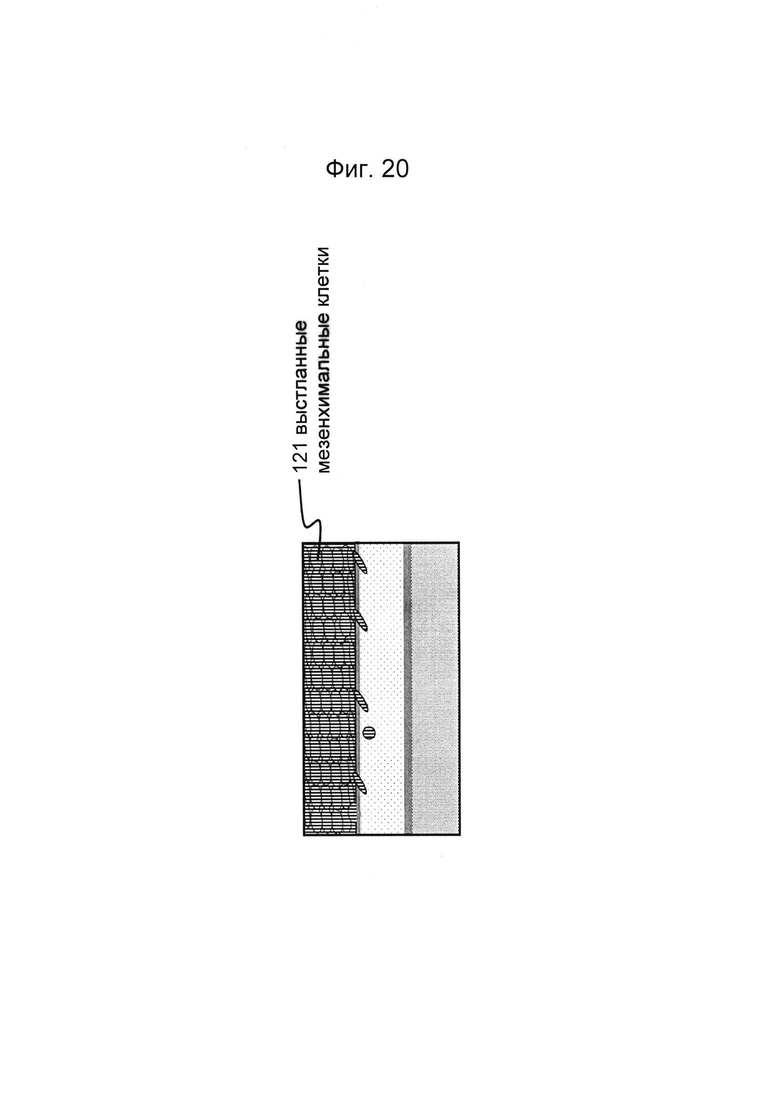
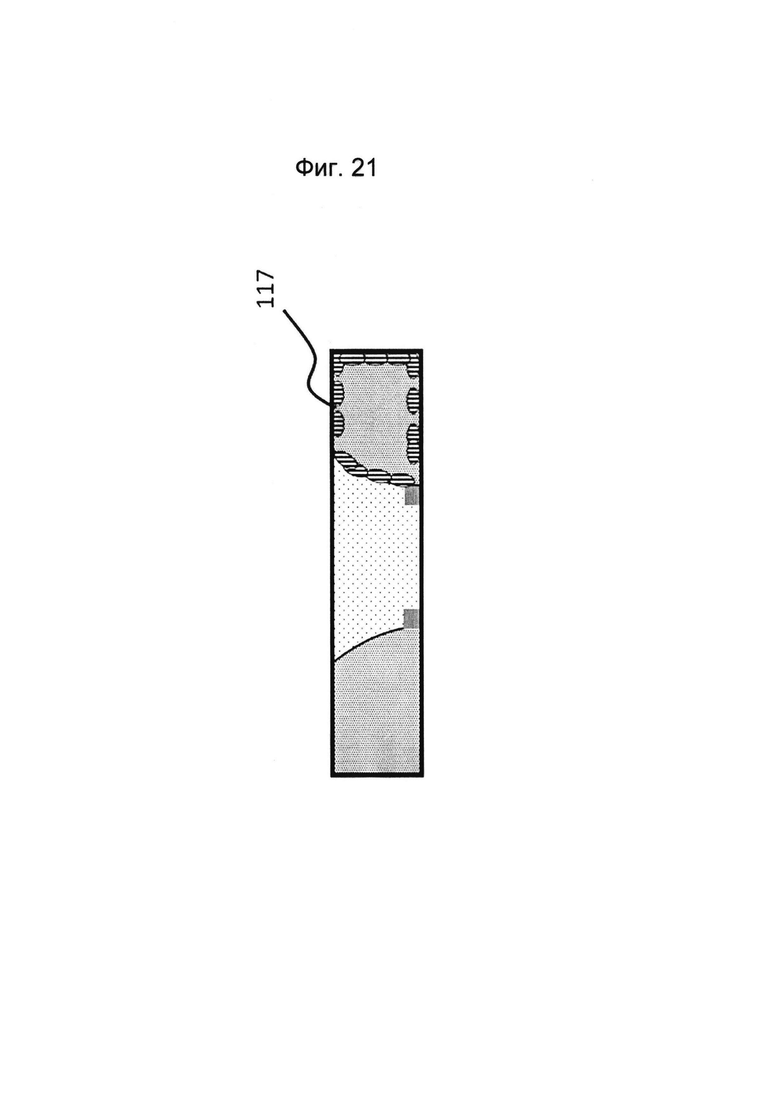
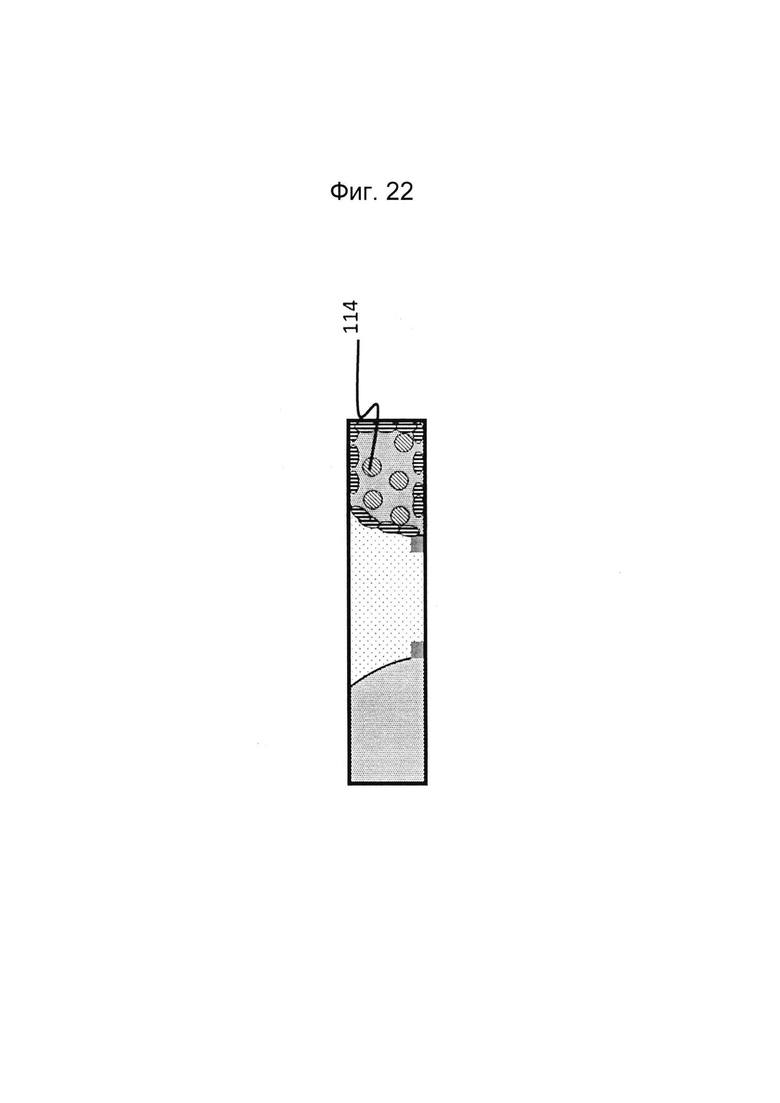
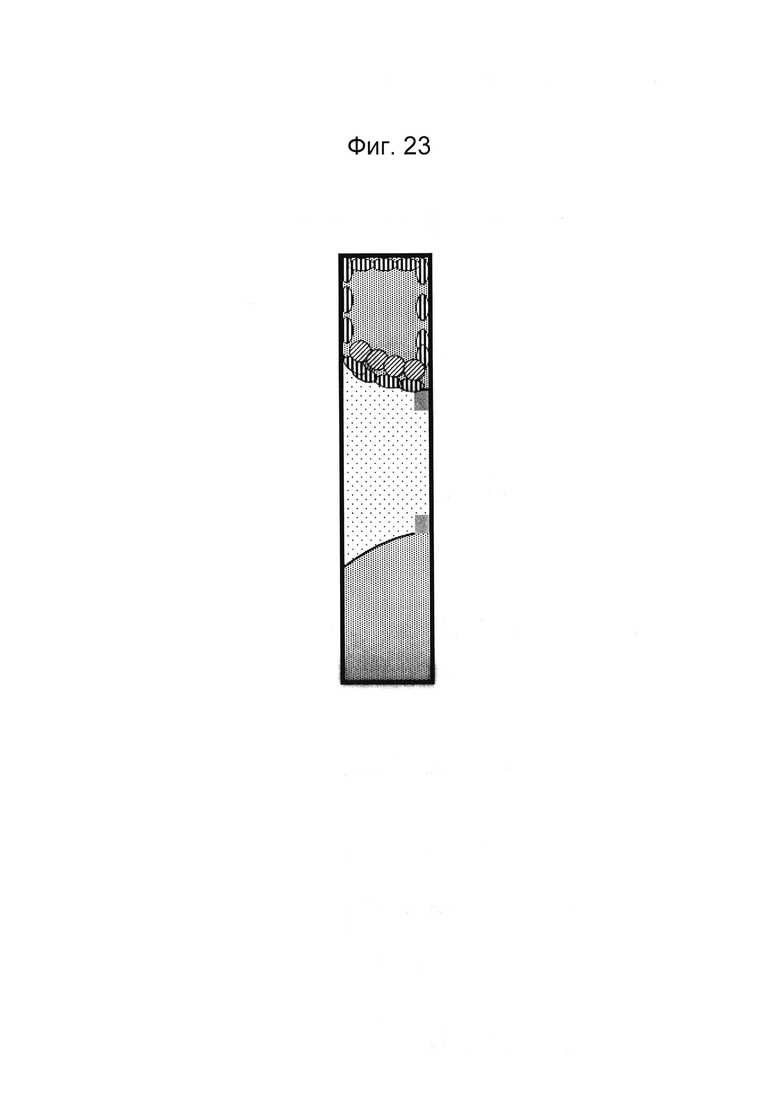
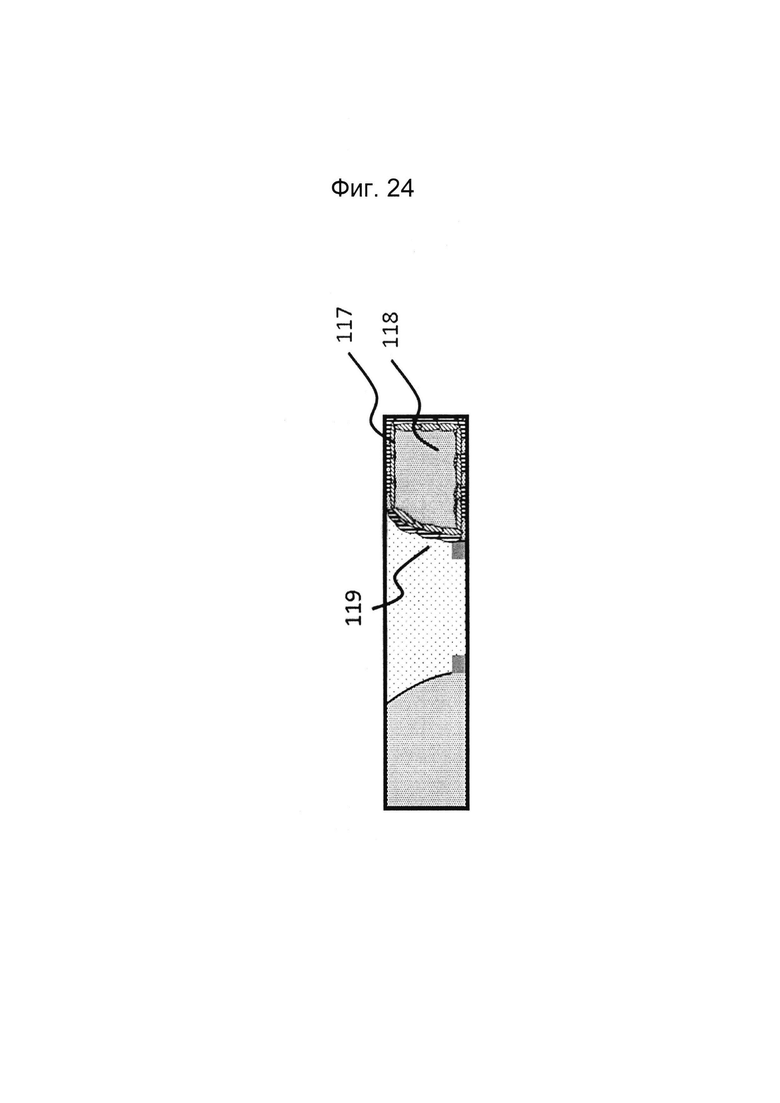
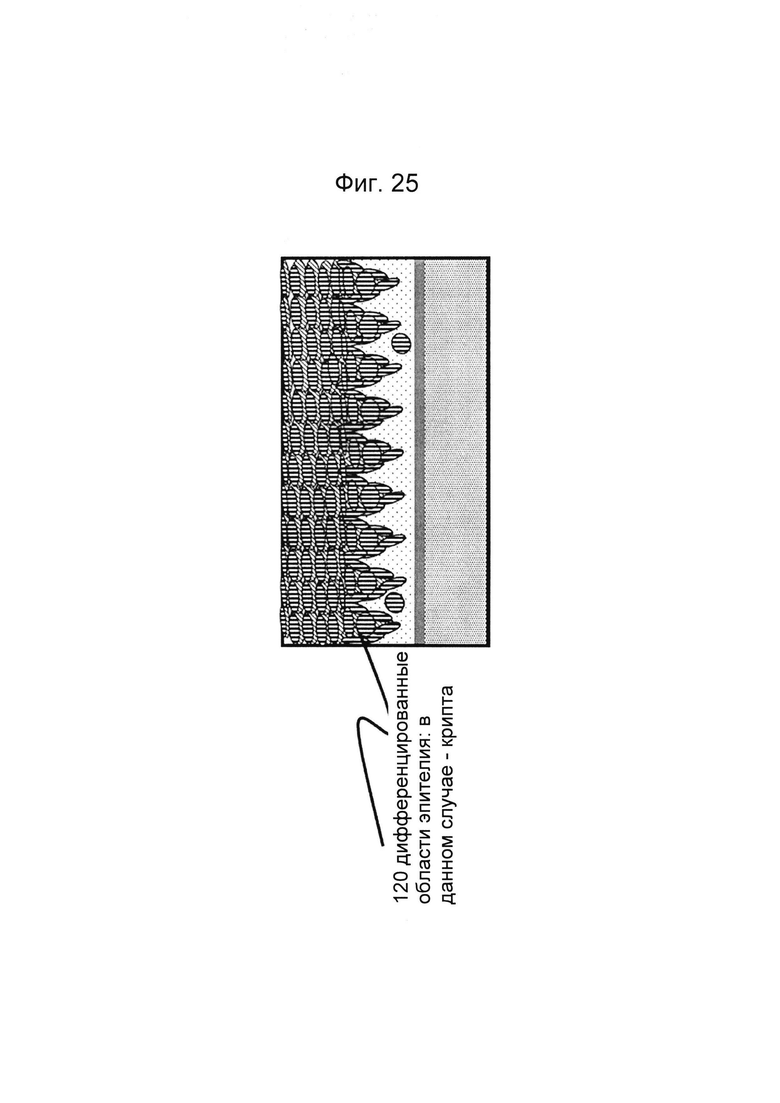
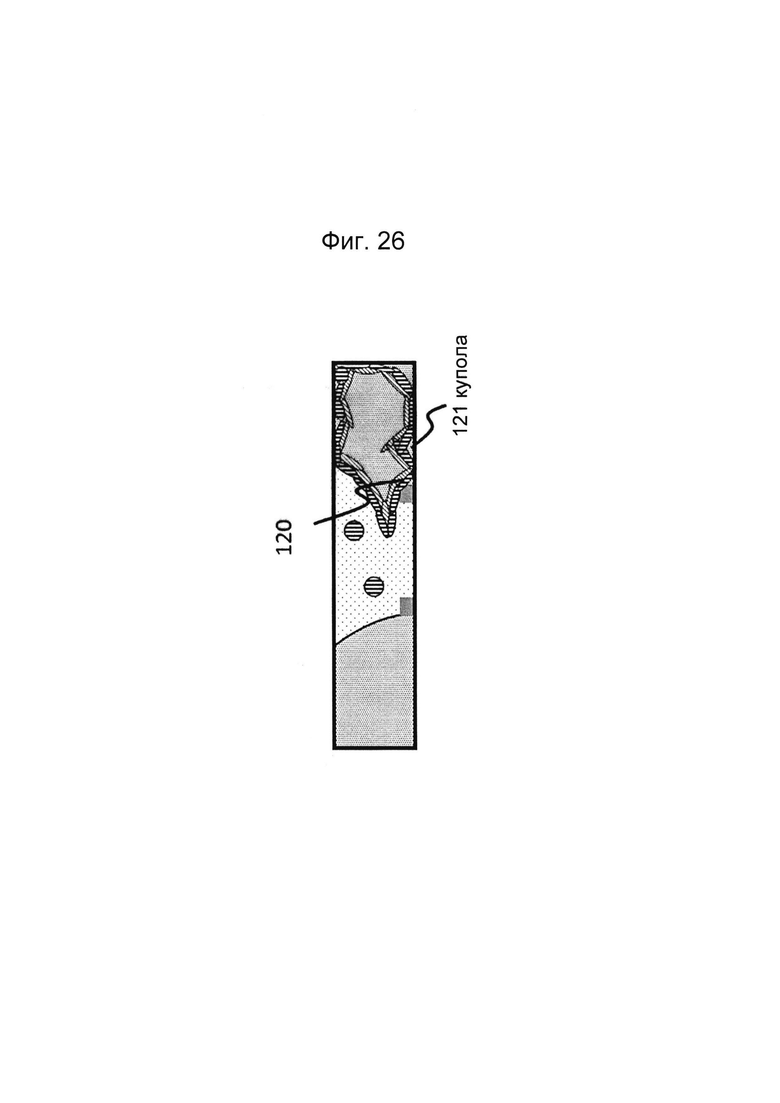
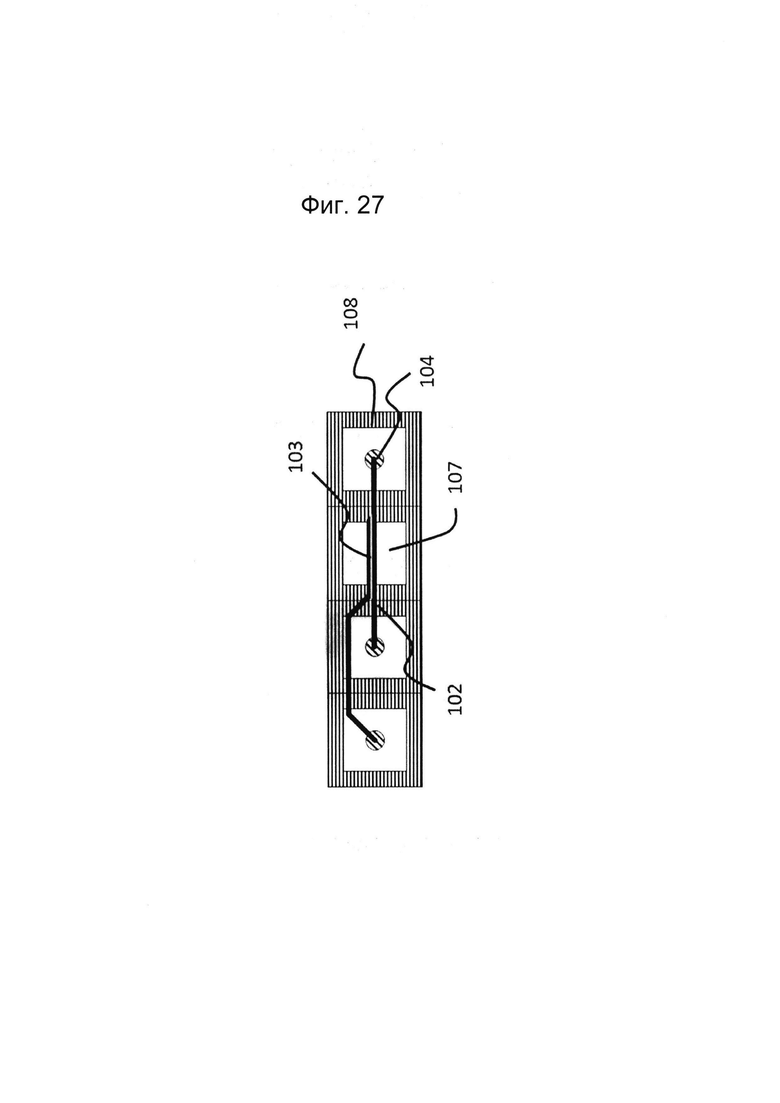
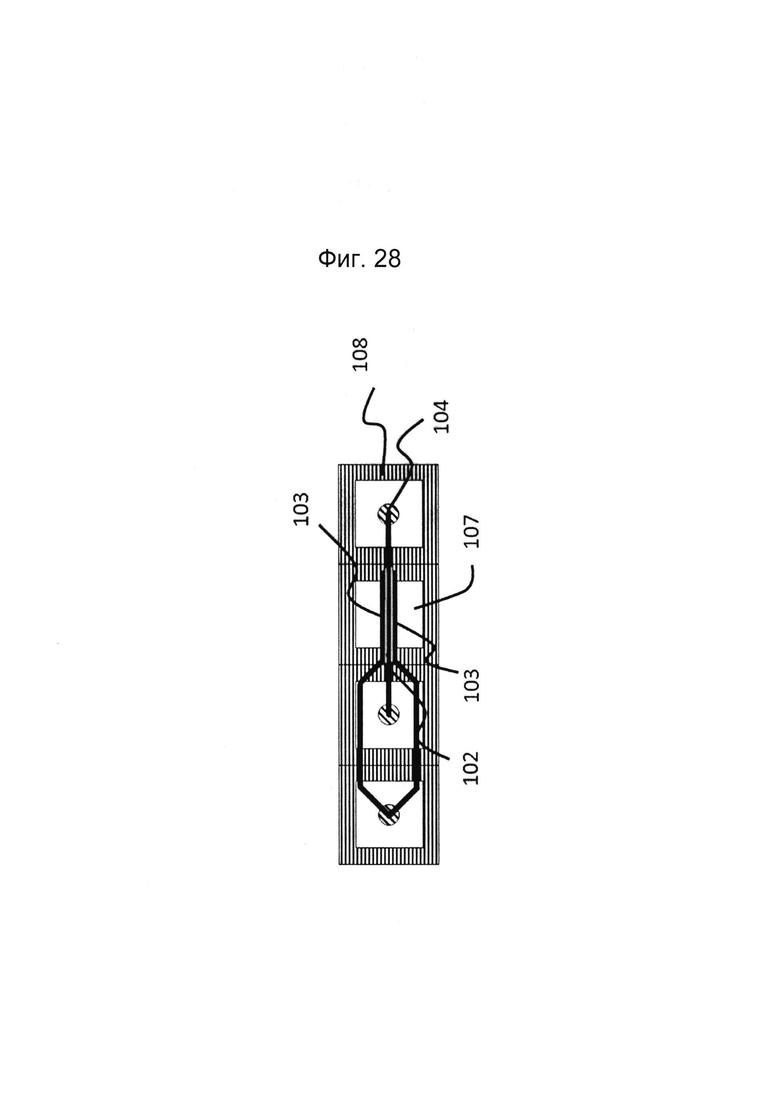


Настоящее изобретение относится к способу культивирования эпителиальных клеток с применением системы микрожидкостного культивирования клеток, содержащей сеть микрожидкостных каналов. Способ включает следующие этапы: a) мезенхимальные клетки вводят в сеть микрожидкостных каналов a1) с применением водной среды; или a2) с применением предшественника гидрогеля, при этом предшественнику гидрогеля дают возможность застыть в сети микрожидкостных каналов, занимая, таким образом, по меньшей мере часть сети микрожидкостных каналов; b) в случае этапа а1) и предпочтительно в случае этапа а2) мезенхимальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта мезенхимальными клетками; c) эпителиальные клетки вводят в сеть микрожидкостных каналов, содержащую мезенхимальные клетки; и d) эпителиальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта эпителиальными клетками и/или пока по меньшей мере часть мезенхимальных клеток не будет покрыта эпителиальными клетками. Предлагается применение клеток в системе микрожидкостного культивирования клеток для оценки транспорта через эпителиальный барьер, исследований токсичности, совместной культуры с микробиомом, исследований усвоения пищи, исследований воспаления, реализации моделей заболеваний, таких как воспалительное заболевание кишечника, кистозный фиброз, ХОБЛ, астма, рак, для механистических исследований функции эпителия в норме и при патологии. Предлагается система микрожидкостного культивирования клеток с сетью микрожидкостных каналов, содержащих внутреннюю группу клеток и внешнюю группу клеток. Внутренняя группа клеток по меньшей мере частично покрыта указанной внешней группой клеток. Клетки внутренней группы представляют собой эпителиальные клетки, а клетки внешней группы представляют собой мезенхимальные клетки. Предпочтительно внутренняя группа клеток и внешняя группа клеток взаимодействуют или находятся в непосредственном контакте. Система микрожидкостного культивирования клеток, содержащая сеть микрожидкостных каналов, содержащую мезенхимальные клетки и эпителиальные клетки, полученные способом культивирования эпителиальных клеток. Система микрожидкостного культивирования клеток, содержащая сеть микрожидкостных каналов, содержащую мезенхимальные клетки и эпителиальные клетки. Мезенхимальные клетки и эпителиальные клетки образуют трубчатую структуру. Изобретение позволяет усовершенствовать модели эпителия, подходящие для широкого спектра приложений, включая, помимо прочего, высокопроизводительный скрининг и анализ эпителия в норме и при патологии. 6 н. и 29 з.п. ф-лы, 30 ил., 2 пр.
1. Способ культивирования эпителиальных клеток с применением системы микрожидкостного культивирования клеток, содержащей сеть микрожидкостных каналов, причем этот способ включает следующие этапы:
a) мезенхимальные клетки вводят в сеть микрожидкостных каналов, причем мезенхимальные клетки вводят в сеть микрожидкостных каналов:
a1) с применением водной среды; или
a2) с применением предшественника гидрогеля, при этом предшественнику гидрогеля дают возможность застыть в сети микрожидкостных каналов, занимая, таким образом, по меньшей мере часть сети микрожидкостных каналов;
b) в случае этапа а1) и предпочтительно в случае этапа а2) мезенхимальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта мезенхимальными клетками;
c) эпителиальные клетки вводят в сеть микрожидкостных каналов, содержащую мезенхимальные клетки; и
d) эпителиальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта эпителиальными клетками и/или пока по меньшей мере часть мезенхимальных клеток не будет покрыта эпителиальными клетками.
2. Способ по любому из предыдущих пунктов, в котором предшественник гидрогеля вводят в сеть микрожидкостных каналов и дают этому предшественнику гидрогеля застыть в сети микрожидкостных каналов, занимая, таким образом, по меньшей мере часть этой сети микрожидкостных каналов.
3. Способ по любому из предшествующих пунктов, в котором гидрогель наносят в виде рисунка, предпочтительно с помощью барьера капиллярного давления, с помощью УФ-печати или посредством втягивания иглы после застывания, или с помощью защитного слоя, удаляемого после застывания.
4. Способ по любому из предыдущих пунктов, в котором мезенхимальные клетки, введенные на этапе а), диспергируют/суспендируют в предшественнике гидрогеля.
5. Способ по любому из предшествующих пунктов, в котором на этапе а) мезенхимальные клетки вводят в сеть микрожидкостных каналов с применением водной среды, предпочтительно совместно с гидрогелем.
6. Способ по любому из предыдущих пунктов, в котором на этапе b) мезенхимальные клетки пролиферируют и/или дифференцируются до тех пор, пока в сети микрожидкостных каналов не образуется по меньшей мере группа/слой/пласт мезенхимальных клеток.
7. Способ по любому из предыдущих пунктов, в котором на этапе b) мезенхимальные клетки пролиферируют и/или дифференцируются до тех пор, пока в сети микрожидкостных каналов не образуется по меньшей мере трубчатая структура из мезенхимальных клеток.
8. Способ по любому из предыдущих пунктов, в котором мезенхимальные клетки и/или эпителиальные клетки дезагрегируют при введении.
9. Способ по любому из предыдущих пунктов, в котором на этапе d) эпителиальные клетки пролиферируют и/или дифференцируются до тех пор, пока в сети микрожидкостных каналов не образуется по меньшей мере группа/слой/пласт эпителиальных клеток.
10. Способ по любому из предыдущих пунктов, в котором на этапе d) эпителиальные клетки пролиферируют и/или дифференцируются до тех пор, пока в сети микрожидкостных каналов не образуется по меньшей мере трубчатая структура из эпителиальных клеток.
11. Способ по любому из предыдущих пунктов, в котором на этапе d), если мезенхимальные клетки были введены на этапе а) в гидрогеле, эпителиальные клетки пролиферируют и/или дифференцируются до тех пор, пока по меньшей мере группа/слой/пласт эпителиальных клеток не будет покрывать по меньшей мере часть гидрогеля, занимающего по меньшей мере часть сети микрожидкостных каналов.
12. Способ по любому из предыдущих пунктов, в котором через просвет трубчатой структуры подают поток ростовой среды, причем указанный поток может быть однонаправленным или двунаправленным.
13. Способ по любому из предыдущих пунктов, в котором клетки культивируют в присутствии ростовой среды, содержащей по меньшей мере один из факторов Wnt, ноггин, ЭФР/ФРФ и/или R-спондин.
14. Способ по любому из предыдущих пунктов, в котором по меньшей мере часть мезенхимальных клеток расположена между стенкой сети микрожидкостных каналов и эпителиальными клетками.
15. Способ по любому из предыдущих пунктов, в котором на этапе d) эпителиальные клетки образуют трубчатую структуру внутри трубчатой структуры, образованной мезенхимальными клетками.
16. Способ по любому из предшествующих пунктов, в котором на этапе d) эпителиальным клеткам дают образовать слой клеток с апикальной и базолатеральной стороной, причем базолатеральная сторона обращена к мезенхимальным клеткам.
17. Способ по любому из предшествующих пунктов, в котором по меньшей мере часть мезенхимальных клеток находится в непосредственном контакте по меньшей мере с частью эпителиальных клеток и/или в котором расстояние между пластом мезенхимальных клеток и пластом эпителиальных клеток равно толщине или меньше толщины базальной пластинки.
18. Способ по любому из предыдущих пунктов, в котором мезенхимальные клетки выбраны из миофибробластов, фибробластов, адипоцитов, хондробластов, остеобластов, гладкомышечных клеток и стромальных клеток, причем, предпочтительно, мезенхимальные клетки представляют собой клетки млекопитающих, предпочтительно клетки человека.
19. Способ по любому из предыдущих пунктов, в котором эпителиальные клетки выбраны из клеток однослойного эпителия, клеток однослойного плоского эпителия, клеток стратифицированного эпителия или клеток столбчатого эпителия, причем в предпочтительном варианте эпителиальные клетки представляют собой клетки млекопитающих, предпочтительно клетки человека.
20. Способ по любому из предыдущих пунктов, в котором мезенхимальные клетки и/или эпителиальные клетки представляют собой первичные клетки.
21. Способ по любому из предыдущих пунктов, причем этот способ дополнительно включает воздействие на эпителиальные клетки воздухом посредством удаления водной среды, присутствующей в сети микрожидкостных каналов, содержащей эпителиальные клетки.
22. Способ по любому из предыдущих пунктов, в котором система микрожидкостного культивирования клеток содержит культуральную камеру, в которую вводят мезенхимальные клетки на этапе а) и эпителиальные клетки на этапе с).
23. Способ по любому из предыдущих пунктов, в котором сеть микрожидкостных каналов характеризуется наличием первой части, выполненной с возможностью подачи жидкости к клеткам, и/или второй части, выполненной с возможностью отвода жидкости от указанных клеток, предпочтительно в направлении к культуральной камере и от культуральной камеры, содержащей мезенхимальные клетки и эпителиальные клетки.
24. Способ по любому из предыдущих пунктов, в котором, если присутствует гидрогель, этот гидрогель подают в сеть микрожидкостных каналов или в канал, примыкающий к сети микрожидкостных каналов, причем указанный гидрогель находится в непосредственном контакте с указанной сетью микрожидкостного канала.
25. Способ по любому из предыдущих пунктов, в котором рядом с гидрогелем присутствует дополнительный полый микрожидкостный канал, который находится в контакте с гидрогелем, но указанный канал не находится в непосредственном контакте с микрожидкостным каналом, содержащим эпителиальные клетки.
26. Способ по любому из предыдущих пунктов, в котором в один и тот же микрожидкостный канал на этапе а) вводят различные типы мезенхимальных клеток, и/или на этапе с) вводят различные типы эпителиальных клеток.
27. Способ по любому из предшествующих пунктов, в котором гидрогель представляет собой экстракт базальной мембраны, компонент внеклеточного матрикса, коллаген, коллаген I, коллаген IV, фибронектин, ламинин, витронектин, D-лизин, энтактин, гепарансульфидные протеогликаны или их комбинации.
28. Способ по любому из предыдущих пунктов, в котором система микрожидкостного культивирования клеток обеспечивает непрерывный оптический путь к клеткам в сети микрожидкостных каналов, и/или к гидрогелю, и/или к другой сети микрожидкостных каналов.
29. Способ по любому из предыдущих пунктов, который дополнительно включает регистрацию множества изображений клеток, гидрогеля и/или сетей микрожидкостных каналов в системе микрожидкостного культивирования.
30. Способ по любому из предыдущих пунктов, в котором одновременно с или после любого из этапов а)-d) клетки приводят в контакт с исследуемым соединением.
31. Применение клеток в системе микрожидкостного культивирования клеток, полученной с применением способа по любому из предыдущих пунктов, для оценки транспорта через эпителиальный барьер, исследований токсичности, совместной культуры с микробиомом, исследований усвоения пищи, исследований воспаления, реализации моделей заболеваний, таких как воспалительное заболевание кишечника, кистозный фиброз, ХОБЛ, астма, рак, для механистических исследований функции эпителия в норме и при патологии.
32. Cистема микрожидкостного культивирования клеток с сетью микрожидкостных каналов, содержащих внутреннюю группу клеток и внешнюю группу клеток, где внутренняя группа клеток по меньшей мере частично покрыта указанной внешней группой клеток, и где клетки внутренней группы представляют собой эпителиальные клетки, а клетки внешней группы представляют собой мезенхимальные клетки, причем, предпочтительно, внутренняя группа клеток и внешняя группа клеток взаимодействуют или находятся в непосредственном контакте.
33. Способ культивирования эпителиальных клеток с применением системы микрожидкостного культивирования клеток, содержащей сеть микрожидкостных каналов, причем этот способ включает следующие этапы:
a) смесь эпителиальных и мезенхимальных клеток вводят в сеть микрожидкостных каналов, причем смесь клеток вводят в сеть микрожидкостных каналов с применением водной среды;
b) мезенхимальным клеткам и эпителиальным клеткам дают возможность пролиферировать и/или дифференцироваться, предпочтительно до тех пор, пока по меньшей мере часть сети микрожидкостных каналов не будет покрыта клетками.
34. Система микрожидкостного культивирования клеток, содержащая сеть микрожидкостных каналов, содержащую мезенхимальные клетки и эпителиальные клетки, причем мезенхимальные клетки и эпителиальные клетки образуют трубчатую структуру.
35. Система микрожидкостного культивирования клеток, содержащая сеть микрожидкостных каналов, содержащую мезенхимальные клетки и эпителиальные клетки, полученные способом культивирования эпителиальных клеток по одному из предыдущих пунктов.
| BAUER M | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Электромагнитный счетчик электрических замыканий | 1921 |
|
SU372A1 |
| BAUER M | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Электромагнитный счетчик электрических замыканий | 1921 |
|
SU372A1 |
| SUNG K.E | |||
| et al | |||
Авторы
Даты
2021-09-30—Публикация
2017-03-09—Подача