Изобретение относится к области биотехнологии, клинической микробиологии, в частности к микологии, и может использоваться для выделения дрожжевых грибов вида Malassezia furfur (M.furfur) из клинического материала различных типов, что необходимо для корректной диагностики заболеваний, вызванных M.furfur. Кроме того, изобретение может быть полезно в научно-исследовательских целях при изучении грибов M.furfur.
Грибковые заболевания широко распространены среди иммуносупрессивных пациентов, в особенности у глубоконедоношенных новорожденных с очень низкой (ОНМТ) и экстремально низкой массой тела (ЭНМТ) при рождении. Тенденции к уменьшению заболеваемости микозами в настоящее время не отмечается [1]. Естественные обитатели кожных покровов, с которыми обычно ассоциированы грибковые заболевания кожи, стали выступать как внутрибольничные возбудители системных микозов [3], [4]. К числу таких возбудителей относят дрожжевые грибы рода Malassezia из семейства Malasseziaceae, ранее известные как Pityrosporum. Большинство видов Malassezia являются диморфными грибами, которые способны существовать в дрожжевой и мицеллярной формах. В культуре in vitro преобладает дрожжевая форма, но у некоторых видов образуются гифы. Грибы рода Malassezia могут расти в аэробных, микроаэрофильных и анаэробных условиях, формировать биопленки на поверхностях различных материалов, что особенно актуально в условиях отделения реанимации и интенсивной терапии, поскольку пребывание в стационарах данного профиля сопряжено с проведением большого количества инвазивных процедур, использованием сосудистых катетеров и искусственных имплантов [5]. Различные виды Malassezia выделяют в составе нормальной микрофлоры человека и некоторых теплокровных животных, но они могут являться и причиной грибковых заболеваний [1], [6]. Такие заболевания кожи, как отрубевидный лишай, фолликулит, себорейный и атопический дерматиты, распространены повсеместно, и ведущая роль в их этиологии принадлежит Malassezia [2].
В мировой литературе описаны случаи фунгемии, вызванной M.furfur, у пациентов с иммунодефицитом: взрослых и детей [3], [4].
Основным фактором риска фунгемии, ассоциированной с M.furfur, у иммуносупрессивных пациентов является проведение парентерального питания липидными растворами. Это связано с особенностями метаболизма гриба, для поддержания жизнедеятельности которого необходимы липиды [9], [10]. Наиболее вероятным источником инфицирования центральных венозных катетеров M.furfur является колонизированная кожа [6].
Роль M.furfur в возникновении гематогенной грибковой инфекции у иммуносупрессивных пациентов, таких как онкологические больные, пациенты хирургического профиля, новорожденные с ОНМТ и ЭНМТ при рождении, остается во многом недооцененной [3], [4].
Колонизация кожи новорожденных M.furfur может происходить уже в родовспомогательном учреждении [8], [11]. Контакт с родителями и медицинским персоналом способствует колонизации и, как следствие, развитию инфекции у детей. В связи с этим актуальным представляется проведение динамического микробиологического контроля за колонизацией M.furfur новорожденных, находящихся на лечении в отделениях хирургии, реанимации и интенсивной терапии. В отделениях хирургии, реанимации и интенсивной терапии новорожденных (ОРИТН) для профилактики генерализованной грибковой инфекции используют антимикотические препараты, в частности флуконазол. Известно, что длительное использование притивомикробных препаратов, в том числе противогрибковых, способствует селекции штаммов микроорганизмов с высоким уровнем резистентности. Селекция штаммов с высоким уровнем устойчивости распространяется и на малассезию. Учитывая особенности пациентов отделений реанимации и хирургии новорожденных (незрелость иммунной системы, низкая масса тела, длительное парентеральное питание через ЦВК) велика вероятность колонизации кожных покровов, слизистых оболочек и центральных венозных катетеров дрожжевыми грибами разной природы (грибами родов Candida, Malassezia), часто имеющей смешенный характер. В связи с этим представляется актуальным проведение динамического микробиологического контроля за колонизацией M.furfur новорожденных, особенно своевременная индикация штаммов с высоким уровнем МПК к флуконазолу (мониторинг нарастания резистентности).
Существует ряд трудностей, связанных с культивированием M.furfur. В исследовании Ершова П.П. [12] приведены сведения о питательных потребностях грибов рода Malassezia и условиях для их культивирования. Показано, что для роста грибов рода Malassezia необходимо наличие в питательной среде жирных кислот с длиной цепи С12-С24, которые грибы рода Malassezia не способны синтезировать самостоятельно. За исключением потребности в липидах, грибы рода Malassezia не нуждаются в микроэлементах, витаминах, электролитах, не способны ферментировать сахара. В качестве единственного источника азота они используют соли аммония. Также дрожжи успешно ассимилируют мочевину, креатин, креатинин, практически все аминокислоты, за исключением цистеина. У грибов рода Malassezia отсутствует потребность в углеводах, а в качестве единственного источника углерода могут выступать липиды. Для культуральной диагностики грибов рода Malassezia различными авторами предложен ряд питательных сред. Наилучшие ростовые свойства проявила среда Леминга - Нотмана (Leeming & Notman), в состав которой входит бактериологический пептон, глюкоза, дрожжевой экстракт, бычья желчь, глицерол, глицерола моностеарат, твин-60, цельное коровье молоко и агар-агар. Температурный оптимум культивирования посевов составлял 34°С, срок культивирования 14 суток. Многие авторы используют в своих исследованиях для выделения грибов рода Malassezia модифицированную среду Диксона. В состав среды входят мальтозный экстракт, пептон, бычья желчь, Твин-40, глицерин, олеиновая кислота и агар-агар. Температура культивирования - 32-37°С. В настоящее время предложено несколько питательных сред для культивирования грибов рода Malassezia, однако нет единого мнения, какая из них является оптимальной для рутинных диагностических исследований. Немаловажным фактором для повседневной диагностической практики является доступность среды, простота изготовления, стабильность ее состава.
Из-за особенностей метаболизма (в качестве единственного источника энергии использует липиды) M.furfur не растет на обычных средах для культивирования грибов, так как такие среды не отвечают ее питательным потребностям. В частности, на среде Сабуро M.furfur дает едва заметный рост колоний, что в совокупности с возможным ростом других грибов на этой среде делает выделение M.furfur практически невозможным [13], [14]. Другая широко используемая в клинической микробиологии питательная среда, среда Диксона, подходит для выделения M.furfur, так как отвечает всем потребностям данного гриба [13], [15], но не подавляет рост других дрожжевых грибов.
В качестве наиболее близкого аналога принята модифицированная питательная среда Диксона, содержащая 3,6% солодового экстракта, 0,6% пептона, 2,0% высушенной бычьей желчи, 1,0% Твина 40, 0,2% глицерина, 0,2% олеиновой кислоты, 1,2% агара, дистиллированная вода остальное, pH около 6,0 (Guillot J., Breugnot С, de Barros M., Chermette R.. «Usefulness of modified Dixon's medium for quantitative culture of Malassezia species from canine skin» J Vet Diagn Invest 10:384-386, 1998). Известен также способ приготовления модифицированной среды Диксона (Dr David Ellis. Dixon's Agar fox Malassezia furfur. Mycology Online - The University of Adelaide https://mycology.adelaide.edu.au/laboratory/dixon/), заключающийся в том, что все ингредиенты размешивают в течение 10-15 минут в половинном количестве дистиллированной воды, доводят объем среды дистиллированной водой до 100%, далее полученную питательную среду автоклавируют 30 минут при температуре 121°С, после чего ее охлаждают и разливают в чашки Петри.
Описанная выше среда Диксона (mDixon) и другие среды используются для выделения всех видов Malassezia.
Таким образом, известные из уровня техники питательные среды для культивирования грибов либо не адаптированы для выделения M.furfur, либо адаптированы, но не являются селективными и не способны подавлять рост других дрожжевых грибов, что затрудняет диагностику микозов. Данные о наличии селективных сред для выделения грибов M.furfur не найдены. В связи с этим является актуальной разработка питательной среды, селективной для выделения грибов вида M.furfur, особенно с высоким уровнем резистентности к флуконазолу.
Технической проблемой, которая решается заявленным изобретением, является создание питательной среды, обеспечивающей эффективное селективное выделение M.furfur из клинического материала различных типов при ингибировании роста других дрожжевых грибов.
Указанная техническая проблема решается следующим образом.
Заявленное изобретение представляет собой селективную питательную среду для выделения грибов вида M.furfur, готовую к использованию и разлитую в чашки Петри. За основу разработанной среды взята среда Диксона, к которой добавлен антимикотический препарат флуконазол, подавляющий рост большинства дрожжевых грибов, культивируемых на среде, однако данный препарат не ингибирует рост клинических изолятов M.furfur, имеющих на фоне профилактического применения флуконазола высокий уровень минимальной подавляющей концентрации (МПК) к этому препарату. Таким образом, на предлагаемой питательной среде устойчивая к флуконазолу M.furfur успешно культивируется, а другие дрожжевые грибы, чувствительные к флуконазолу, не растут.
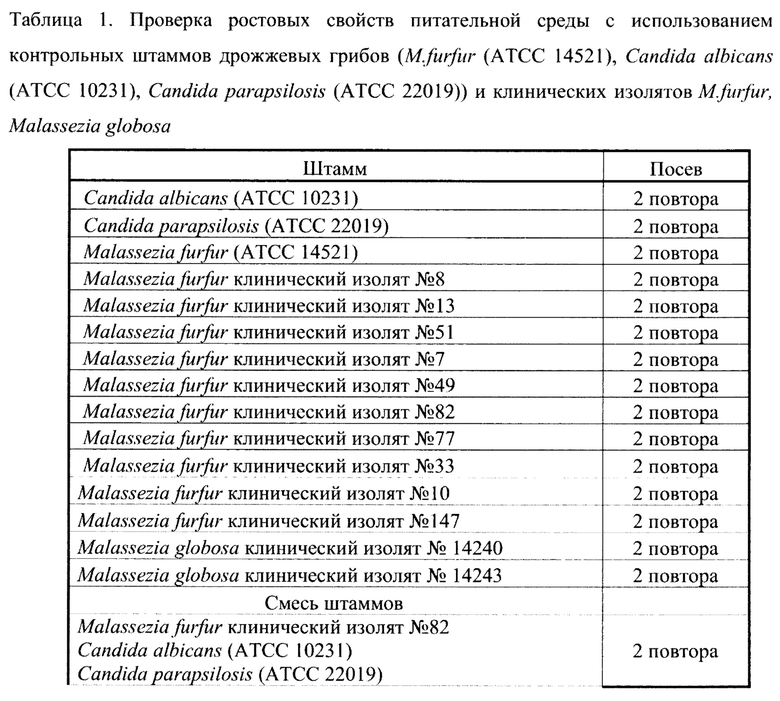
Для проверки возможности выявления клинических изолятов M.furfur с помощью предлагаемой селективной среды использованы штаммы, выделенные от пациентов ОРИТН и контрольный штамм M.furfur (АТСС 14521), с низким значением МПК к флуконазолу (отрицательный контроль).
На основании собственных данных, полученных при исследовании МПК флуконазола 28 клинических изолятов M.furfur, выделенных у новорожденных (МПК >256 мкг/мл), и данных литературы о резистентности M.furfur [16], а также прочих дрожжевых грибов (минимальная ингибирующая концентрация флуконазола, преимущественно не превышает значения 32 мкг/мл) определена оптимальная концентрация флуконазола, которая подавляет рост большинства дрожжевых грибов и не препятствует росту клинических изолятов М. furfur. Эффективность предлагаемой концентрации флуконазола (32 мг/л) была показана экспериментальным путем при исследовании образцов биоматериала, полученного от новорожденных. Таким образом, предметом изобретения является селективная питательная среда.
Состав предлагаемой питательной среды из расчета на 1 л готовой среды:
- экстракт солода - 36 г/л;
- пептон - 6 г/л;
- соли желчных кислот - 20 г/л;
- твин 40-10 мл/л;
- глицерол - 2 мл/л;
- олеиновая кислота - 2 мл/л;
- агар-агар - 12 г/л;
- левомицетин - 0,8 г/л;
- вода дистиллированная - до 1 л
- флуконазол - 32 мг/л; -pH-5,8-6,1.
Техническим результатом, достигаемым при использовании заявленного изобретения, является простота и надежность эффективного и селективного выделения дрожжевых грибов вида M.furfur из клинического материала различных типов на фоне ингибирования роста других дрожжевых грибов, что способствует корректной диагностике заболеваний, обусловленных M.furfur.
Рекомендуемый порядок приготовления среды.
Пример приготовления 1 л питательной среды.
- Наливают в емкость для приготовления среды 0,5 л дистиллированной воды.
- При перемешивании добавляют в емкость для приготовления среды с дистиллированной водой все компоненты в произвольном порядке.
- Тщательно перемешивают и доводят объем раствора дистиллированной водой до 1,0 л.
- Тщательно перемешивают раствор еще в течение 10-15 мин.
- Полученный раствор автоклавируют 30 минут при температуре 121°С.
- После автоклавирования раствор охлаждают до температуры 55°С.
- Готовую питательную среду перемешивают и разливают по чашкам
Петри диаметром 90 мм, высота слоя среды: 4-5 мм.
Флуконазол может быть добавлен после автоклавирования с соблюдением указанной выше концентрации этого ингредиента в готовой питательной среде.
Хранение готовой среды в чашке Петри: 2 месяца при температуре 4-8°С.
Использование изобретения осуществляется следующим образом.
На поверхность питательной среды в чашке Петри наносится образец биологического материала, взятый из предполагаемого очага инфекции. Чашку с засеянным биологическим материалом помещают в инкубатор при температуре 37°С на 48 часов. После инкубирования выросшие колонии оценивают визуально. На данной питательной среде колонии M.furfur более крупные, чем на среде Сабуро. Колонии гриба кремового цвета и с поверхности агара снимаются целиком, как капля застывшего воска. После визуального осмотра проводят микроскопическое исследование. К исследуемому образцу выросшей на агаре культуры, нанесенному на предметное стекло, добавляют одну каплю 20% раствора КОН и, если необходимо, 1 каплю раствора калькофлуора белого, покрывают покровным стеклом, слегка фиксируют подогрев на спиртовке или оставляют на воздухе на 30-40 минут. Просматривают препарат сначала методом светлопольной микроскопии, а затем, при необходимости, в ультрафиолетовом свете, используя специально подобранные возбуждающий и барьерный фильтры. Колонии M.furfur состоят из почкующихся дрожжевых клеток эллиптической формы с монополярным почкованием. Истинный мицелий отсутствует. Элементы гриба флуоресцируют желто-зеленым или голубовато-белым светом (в зависимости от сочетания фильтров) на тусклом красноватом фоне. При необходимости для видовой идентификации применяют метод биохимической идентификации с помощью бактериологического анализатора, например, Vitek-2 Compact (BioMerieux, Франция), а также метод секвенирования по Сенгеру видоспецифического участка 26S рРНК.
Достижение указанного технического результата подтверждается следующими примерами.
ПРИМЕР 1. Проверка ростовых свойств питательной среды на контрольных штаммах M. furfur (АТСС 14521), Candida albicans (АТСС 10231), Candida parapsilosis (АТСС 22019) и клинических изолятах М. furfur, Malassezia globosa.
Исследования проводили при концентрации флуконазола в готовой питательной среде 32 мг/л. Флуконазол разводили в диметилсульфоксиде ранее речь шла о водном растворе. Готовили 600 мл среды. Для эксперимента использовали суспензии исследуемых штаммов грибов в физиологическом растворе (инокулюм) с конечной концентрацией 106 КОЕ/мл.
Проводили посевы штаммов как указано в таблице 1 Проверка ростовых свойств питательной среды с использованием контрольных штаммов дрожжевых грибов (M.furfur (АТСС 14521), Candida albicans (АТСС 10231), Candida parapsilosis (АТСС 22019)) и клинических изолятов M.furfur, Malassezia globosa
Методика посева:
- для каждого штамма в стерильном физиологическом растворе готовили суспензию мутностью 0,5 по стандарту МакФарланда, соответствующую концентрации дрожжей 106 КОЕ/мл;
- посев проводили путем переноса 0,5 - 1 мл суспензии в чашку Петри, равномерно распределяли по поверхности агара и удаляли избыток суспензии;
- инкубировали культуры в аэробных условиях в термостате при температуре 35±2°С, в течение 48 часов;
- визуально оценивали рост штаммов грибов на питательной среде;
- параллельно была высеяна смесь штаммов: M.furfur клинический изолят №82, Candida albicans (С.albicans) (АТСС 10231) и Candida parapsilosis (C.parapsilosis) (АТСС 22019) в разведении 106 КОЕ/мл стандартной пластиковой петлей.
Среда является эффективной, если она способна ингибировать рост контрольных штаммов С.albicans (АТСС 10231) и C.parapsilosis (АТСС 22019), а также способна обеспечивать появление видимого невооруженным глазом роста колоний M.furfur.
Результаты эксперимента представлены в таблице №2 Результаты оценки ростовых свойств питательной среды с использованием контрольных штаммов дрожжевых грибов (M.furfur (АТСС 14521), С.albicans (АТСС 10231), C.parapsilosis (АТСС 22019) и клинических изолятов M.furfur и Malassezia globosa.
Из таблицы №2 следует, что через 48 часов культивирования на испытуемой среде выросли все десять (100,0%) клинических изолятов M.furfur. Исключение составил контрольный штамм M.furfur (АТСС 14521). Malassezia globosa (М.globosa) и дрожжевые грибы рода Candida: С.albicans (АТСС 10231) и C.parapsilosis (АТСС 22019) на предлагаемой питательной среде не выросли. Отсутствие роста контрольного штамма M.furfur (АТСС 14521) можно объяснить его чувствительностью к флюконазолу (в ходе исследования установлено, что МПК штамма составляет 2 мкг/мл). Указанный штамм может использоваться как отрицательный контроль для предлагаемой среды и для оценки ее стабильности. Таким образом, эксперимент продемонстрировал ингибирующий эффект питательной среды с концентрацией флуконазола 32 мг/л в отношении М.globosa и наиболее частых возбудителей кандидозной инфекции, а также подтвердил высокую эффективность ее использования для селективного выделения клинических изолятов M.furfur.
ПРИМЕР 2. Эксперимент по использованию опытной серии питательной среды в клинических исследованиях.
Исследования проводились на базе лаборатории микробиологии Отдела микробиологии, клинической фармакологии и эпидемиологии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский Центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации (ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России). Использовалась первая опытная серия среды, произведенная автоматизированным способом в ООО «Центральная фабрика готовых сред» (ЦФГС, г. Москва).
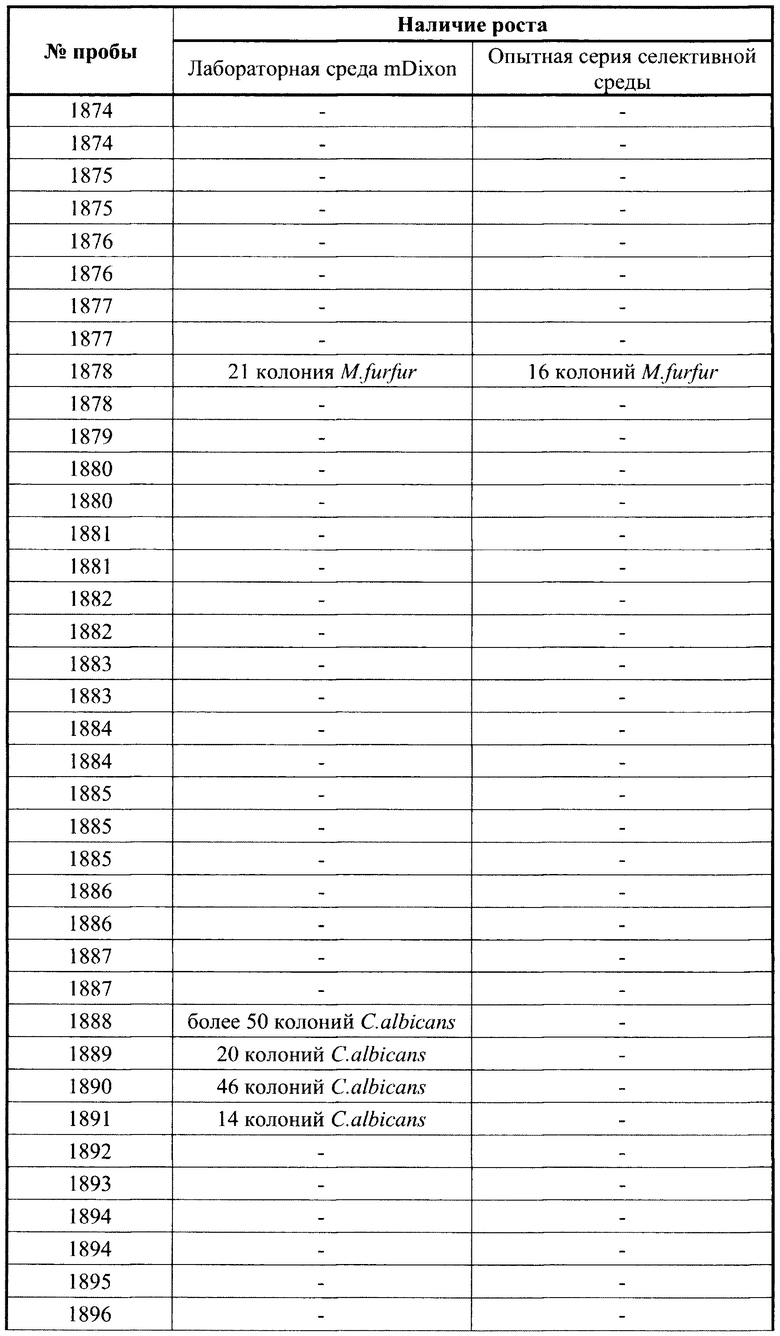
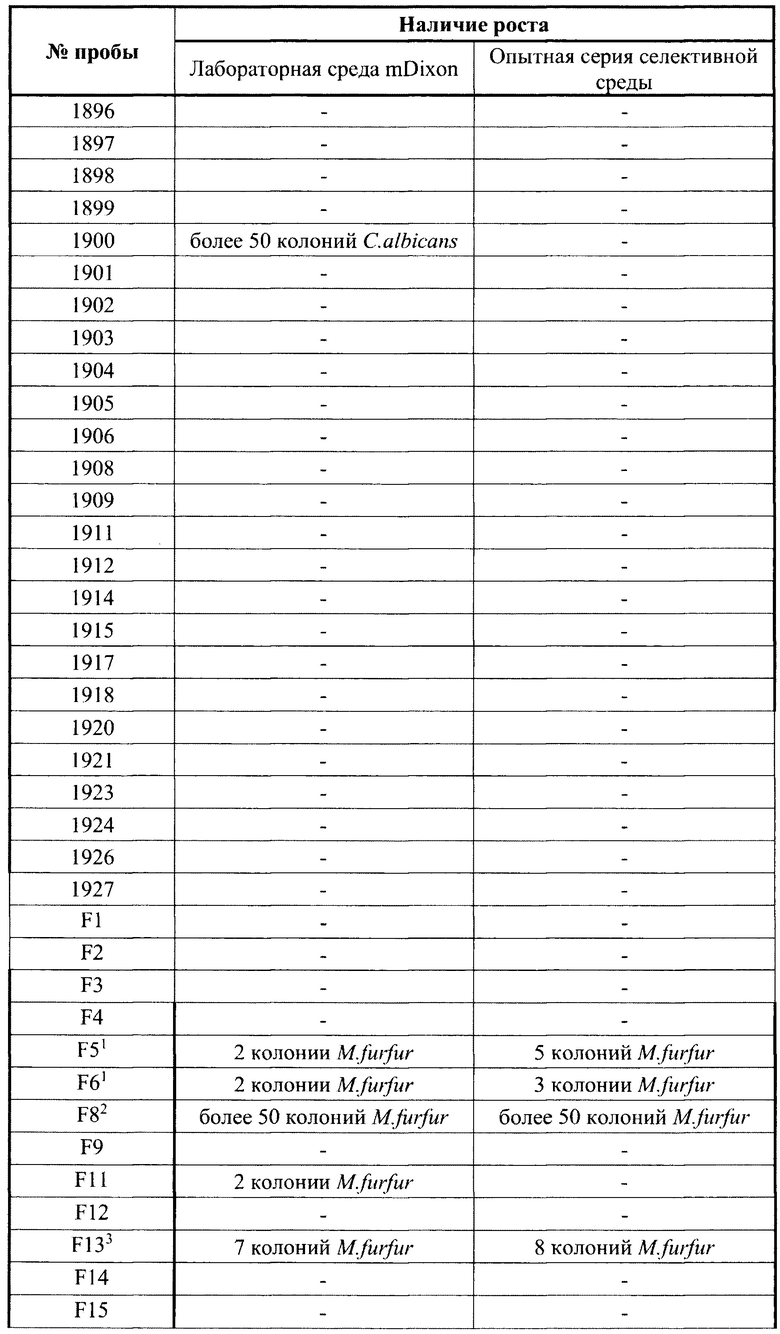
Методика. Образцы биоматериала (пробы), полученные от пациентов, высевались на приготовленную модифицированную среду по прописи Диксона, в лаборатории ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России (далее лабораторная среда mDixon) и параллельно на заявленную селективную питательную среду. Проба представляла собой образцы биоматериала, взятые хлопковым микробиологическим тампоном в транспортную среду AMIES (COPAN, Италия). Высев на питательные среды в чашках Петри проводился методом секторного посева. Результаты представлены в таблице 3 Сравнительные данные по частоте выделения M.furfur и дрожжевых грибов рода Candida из образцов клинического материала на лабораторной среде mDixon и опытной серии селективной питательной среды.
При проведении эксперимента исследован биоматериал, полученный от 235 пациентов отделений реанимации и хирургии новорожденных. Суммарно М. furfur обнаружена у 23 детей. На лабораторной среде mDixon у 22 пациентов выделена только M.furfur и у 16 пациентов - различные виды грибов рода Candida (C.orthopsilosis, С.albicans. C.glabrata, C.lusitaniae). При параллельном посеве биоматериала на предлагаемую селективную питательную среду у 21 пациента выделена M.furfur, а дрожжевые грибы рода Candida не обнаружены. Совпадение результатов по выделению M.furfur на обеих питательных средах отмечено у 20 пациентов (86,9%). Эффективность лабораторной среды mDixon при выделении M.furfur составила 95,6%, а предлагаемой селективной питательной среды - 91,3%. В 3-х случаях несовпадения высеваемости M.furfur отмечена крайне низкая степень обсемененности биоматериала этим микроорганизмом (выделено по 2 колонии), что допускает погрешность при прямом посеве тампоном без предварительного использования среды накопления. Ингибиция грибов рода Candida на испытуемой среде отмечена в 100,0% случаев. Данный эксперимент позволяет сделать вывод об эффективности предлагаемой питательной среды для обнаружения M.furfur. в том числе в биоматериале, колонизированном различными видами грибов рода Candida.
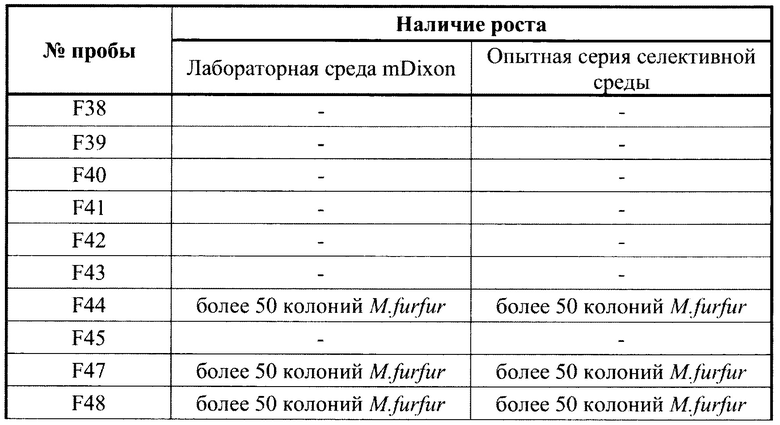
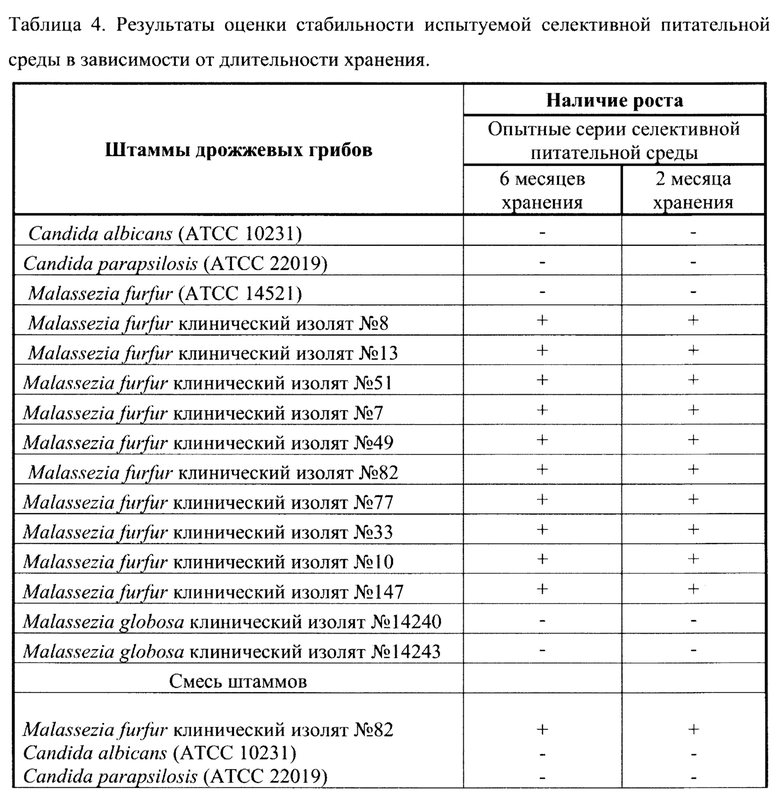
ПРИМЕР 3. Эксперимент по изучению стабильности 2-х опытных серий питательной среды.
Для оценки стабильности предлагаемой селективной питательной среды исследованы 2 опытные партии, длительность хранения которых составила соответственно 2 и 6 месяцев со дня приготовления. Проверены ростовые качества и селективность питательной среды с помощью штаммов дрожжевых грибов M.furfur, М.globosa, контрольных штаммов С.albicans (АТСС 10231) и C.parapsilosis (АТСС 22019) (таблица 1). Результаты оценки стабильности испытуемой селективной питательной среды в зависимости от длительности хранения представлены в таблице 4 Результаты оценки стабильности испытуемой селективной питательной среды в зависимости от длительности хранения.
Результаты эксперимента показали, что ростовые качества обеих партий питательной среды даже по истечении обозначенного при изготовлении срока годности (2 месяца) сохраняются на высоком уровне, так же, как и ингибирующий эффект (за счет стабильности флуконазола) в отношении штаммов М.globosa, контрольного штамма М. furfur (АТСС 14521) и контрольных штаммов С.albicans (АТСС 10231) и C.parapsilosis (АТСС 22019). При этом сохраняется селективность для выделения клинических штаммов M.furfur с высоким уровнем МПК к флуконазолу (>32 мкг/мл), формирующимся при применении этого антимикотика для профилактики грибковой инфекции у новорожденных.
Литература
1. Острейков И.Ф., Мельникова Н.И., Бабаев Б.Д., Штатное М.К. Грибковая инфекция у детей с хирургической патологией в ОИТ. Анестезиология и реаниматология. 2017; Т. 62(4), С. 310-315.
2. Bell SG. Micafungin. Neonatal Network. 2011; V. 30(5), P. 329-333.
3. Антонов А.Г., Никитина И.В., Митрохин С.Д. Клинические рекомендации по профилактике и лечению грибковых инфекций у новорожденных в условиях отделения реанимации и интенсивной терапии. Неонатология. 2013; №2, С. 80-88.
4. Ostrosky-Zeichner L, Sable С, Sobel J, et al. Multicenter retrospective development and validation of a clinical prediction rule for nosocomial invasive candidiasis in the intensive care setting. Eur. J. Clin. Microbiol. Infect. Dis. 2007; V. 26, P. 271-276.
5. Lucignano B, Ranno S, Liesenfeld O, et al. Multiplex PCR allows rapid and accurate diagnosis of bloodstream infections in newborns and children with suspected sepsis. Journal of Clinical Microbiology; 2011; V. 49(6), P. 2252-2258.
6. Barton M. Invasive candidiasis in low birth weight preterm infants: risk factors, clinical course and outcome in a prospective multicenter study of cases and their matched controls. BMC Infect. Dis. 2014; V. 14, P. 327.
7. Greenberg RG, Benjamin DK. Neonatal candidiasis: diagnosis, prevention, and treatment. J. Infect. 2014; V. 69, P. 19-22.
8. Любасовская Л.А., Припутневич T.B., Анкирская A.C., и др. Особенности микробной колонизации новорожденных в отделении реанимации и интенсивной терапии. Рос. вестн. перинатологии и педиатрии. 2013; №3, С. 87-91.
9. Aliaga S, Clark R, Laughon M, et al. Changes in the incidence of candidiasis in neonatal intensive care units. Pediatrics. 2014; V. 133(2), P. 236-242.
10. Веселое A.B. Эмпирическая, превентивная и профилактическая терапия инвазивных микозов: современное состояние. Клиническая микробиология и антимикробная химиотерапия. 2009; Т. 11(4), С. 286-304.
11. Бережнова И.А. Инфекционные болезни: Учеб. пособие. - М.: РИОР, 2007. - 319 с.
12. Ершов П.П. Этиологическая значимость дрожжевых грибов рода Malassezia при кожных заболеваниях животных. Диссертация на соискание ученой степени кандидата ветеринарных наук. Москва - 2008. (https://myzooplanet.ru/zabolevaniy-jivotnyih-lechenie/etiologicheskaya-znachimost-drojjevyih-gribov.html).
13. Богданова Т.В., Блинов Н.П. Морфолого-физиологические характеристики дрожжевых организмов - Malassezia species (Malassez, 1874) Baillon, 1889 (обзор). Проблемы медицинской микологии. 2011; Т. 13(1), С. 3-13.
14. Овчинников Р.С, Маноян М.Г., Ершов П.П., Гайнуллина А.Г. Грибы рода Malassezia в заболеваниях животных. Микология. Vetpharma. 2013; Т. 1, С. 30-36.
15. Prohić A, Jovovicć-Sadikovicć Т, Kuskunović-Vlahovljak S, Baljić R. Distribution of Malassezia species in patients with different dermatological disorders and healthy individuals. Acta Dennatovenerol Croat. 2016; V. 24(4), P. 274-281.
16. Cafarchia C, latta R., Immediato D., Puttilli M. R. and Otranto D. Azole susceptibility of Malassezia pachydermatis and Malassezia furfur and tentative epidemiological cutoff values. Medical Mycology, 2015, 53, 743-748.





| название | год | авторы | номер документа |
|---|---|---|---|
| СЕЛЕКТИВНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ГРИБОВ ВИДА Malassezia furfur | 2020 |
|
RU2774370C2 |
| Штамм Bacillus mojavensis Lhv-97, обладающий фунгицидной и бактерицидной активностью | 2017 |
|
RU2648163C1 |
| Способ получения 2,3,16,17,18,19-гексагидроолигомицина А и его применение для ингибирования роста дрожжей рода Candida | 2016 |
|
RU2623087C1 |
| Штамм Streptomyces sp. YVZ014 - продуцент антибиотика лизолипина X | 2023 |
|
RU2817695C1 |
| Штамм дрожжевого гриба вида Candida duobushaemulonii, предназначенный для использования в качестве референтного для фенотипической идентификации при лабораторной диагностике кандидозов | 2024 |
|
RU2832872C1 |
| 3,5-Замещенные производные тиазолидин-2,4-диона, обладающие противомикробной активностью | 2018 |
|
RU2690161C1 |
| Четвертичная аммониевая соль, обладающая антимикотической и антибактериальной активностью | 2018 |
|
RU2666544C1 |
| Идентификация дрожжеподобного гриба Candida auris | 2022 |
|
RU2791966C1 |
| Способ выявления и оценки уровня патогенности возбудителей оппортунистических инфекций у женщин репродуктивного возраста и новорожденных детей для прогнозирования течения и развития осложнений инфекционных заболеваний | 2016 |
|
RU2638453C1 |
| СПОСОБЫ ХАРАКТЕРИЗАЦИИ МИКРООРГАНИЗМОВ НА ТВЕРДЫХ И ПОЛУТВЕРДЫХ СРЕДАХ | 2009 |
|
RU2523903C2 |
Изобретение относится к области биотехнологии, клинической микробиологии, в частности микологии, и может быть использовано с целью оптимизации питательных сред для селективного культивирования дрожжевого гриба вида Malassezia furfur (М.furfur). Питательная среда содержит экстракт солода, пептон, соли желчных кислот, твин 40, глицерол, олеиновую кислоту, агар-агар, левомицитин, флуконазол и дистиллированную воду в заданных количествах. Изобретение позволяет повысить эффективность выделения гриба вида Malassezia furfur. 4 табл., 3 пр.
Питательная среда для выделения грибов вида Malassezia furfur, содержащая экстракт солода, пептон, соли желчных кислот, твин-40, глицерол, олеиновую кислоту и агар-агар, отличающаяся тем, что она дополнительно содержит левомицетин и флуконазол при следующем соотношении компонентов:
pH - 5,8-6,1.
| BARROS M., et.al., Usefulness of modified Dixons medium for quantitative of Malassezia species from canine skin, J | |||
| Vet Diagn Invest, 10, p | |||
| Переносный ветряный двигатель | 1922 |
|
SU384A1 |
| РОДЧЕНКО Ю.В., и др | |||
| Malassezia furfur в отделениях реанимации и интенсивной терапии новорожденных | |||
| Обзор литературы | |||
| Проблемы медицинской микологии, 2019, N3, Т.21, с.9-14 | |||
| БАЧУРСКАЯ Н.С | |||
| и др., | |||
Авторы
Даты
2021-10-04—Публикация
2021-02-11—Подача