Область техники
Изобретение относится к микробной биотехнологии, микробиологической промышленности и касается штамма микроорганизма вида Streptomyces sp.YVZ014, продуцирующего лизолипин X - ароматический поликетидный антибиотик с широким спектром антибиотического действия.
Изобретение может быть использовано для получения антибиотика лизолипина X, обладающего антибактериальной активностью в отношении различных возбудителей с множественной лекарственной устойчивостью [Lopez Р, Hornung A, Welzel K, et al. Isolation of the lysolipin gene cluster of Streptomyces tendae Tü 4042. Gene. 2010 Aug 1; 461(1-2):5-14. doi: 10.1016/j.gene.2010.03.016].
Уровень техники
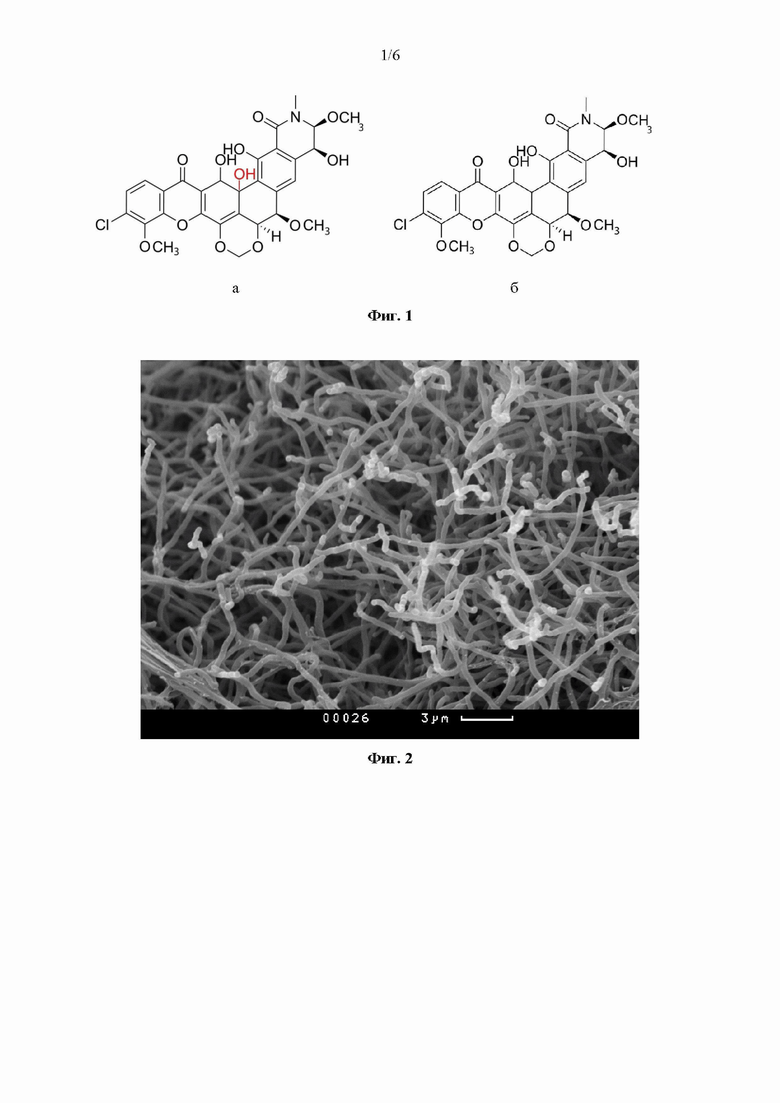
Первые данные о выделении и описании новых ароматических поликетидов, названных лизолипинами X (Фиг. 1а) и I (Фиг. 16), выделенными из культуральной жидкости штамма. Streptomyces violaceoniger Tü 96, были опубликованы в 1975 году [Drautz Н, Keller-Schierlein W, Zähner Н. Stoffwechselprodukte von Mikroorganismen 149. Mitteilung. Lysolipin I, ein neues Antibioticum aus Streptomyces violaceoniger [Metabolic products of microorganisms, 149. Lysolipin I, a new antibiotic from streptomyces violaceoniger (author's transl)]. Arch Microbiol. 1975 Dec 31; 106(3): 175-90. German. doi: 10.1007/BF00446521; Drautz H, Keller-Schierlein W, Zähner H. Lysolipin I, a new inhibiting substance of bacterial cell wall synthesis. Pathologia et Microbiologia (1975), 42(4), 236], а позднее лизолипин I также был обнаружен в ферментационной жидкости штамма Streptomyces tendae Tü 4042 [Blum S, Groth I, Rohr J, et al. Biosynthetic capacities of actinomycetes. 5. Dioxolides, novel secondary metabolites from Streptomyces tendae. J Basic Microbiol. 1996; 36(1): 19-25. doi: 10.1002/jobm.3620360105]. Было показано, что лизолипин X конечный продукт биосинтеза химически нестабилен и под действием света или пониженного рН легко трансформируется в дегидратированную форму - лизолипин I [Bockholt Н, Udvarnoki G, Rohr J, et al. Biosynthetic studies on the xanthone antibiotics lysolipins X and I. J Organic Chem. 1994;59(8):2064 2069. doi:10.1021/jo00087a021].
Это высокоактивное природное вещество, способное в низкой концентрации, например, при минимальной ингибирующей концентрации (МИК) 0,0025 мкг/мл, подавлять рост многих грамположительных и некоторых грамотрицательных бактерий, однако ингибирование энтеробактерий отмечено при более высоких концентрациях и в случае, если у них была нарушена целостность мембраны. Также была отмечена антимикотическая активность лизолипина X в концентрации 3-10 мкг/мл [Drautz et al., 1975, по ссылкам выше] и цитостатическое действие на развитие опухолевых клеток [Pultar Т. Lysolipin X und I - Fermentation, Isolierung, Biologische Wirkung und Interaktion mit Mg2+. PhD thesis at the University of Tubingen (Ger). 1988, цит.по Lopez P, Hornung A, Welzel K, et al. Isolation of the lysolipin gene cluster of Streptomyces tendae Tü 4042. Gene. 2010;461(1-2):5 14. doi: 10.1016/j.gene.2010.03.016]. В 2010 году был полностью описан биосинтетический кластер генов, участвующих в синтезе лизолипина, размером 42 тысяч пар нуклеотидов, содержащий 42 гена, кодирующих поликетидсинтазу типа II (llpF, llpE, llpD), циклазы (llpCI-CIII), метилтрансферазы (llpMI-MVI), галогеназу (llpH), амидотрансферазу (llpA), ферредоксин (llpK), транспортер (llpN) и регуляторные белки (llpRI-RV). Кроме того, в кластере генов биосинтеза лизолипина присутствовали 15 генов, кодирующих ферменты, участвующие в окислительно-восстановительных модификациях молекулы-предшественника поликетида (llpOI-OVIII, llpZI-ZIV, llpU, llpL и llpS). Наличие большого количества оксидоредуктаз объясняет тот факт, что лизолипин является одним из наиболее сильно модифицированных ароматических поликетидов [Lopez Р, Hornung А, Welzel K, et al. Isolation of the lysolipin gene cluster of Streptomyces tendae Tü 4042. Gene. 2010 Aug 1; 461(1-2):5-14. doi: 10.1016/j.gene.2010.03.016].
Ароматические ксантоны - лизолипины, - обладают высокой аффинностью к липидам. Drautz с коллегами предположили, что антибактериальное действие лизолипина X может быть обусловлено взаимодействием с бактопренолом (С55-изопреноидом): липидным переносчиком мономеров пептидогликана, который вовлечен в биосинтез клеточной стенки.
Основываясь на литературных данных, лизолипины обладают значительным потенциалом, чтобы стать селективными, специфичными препаратами, ориентированными на ограниченную группу чувствительных микроорганизмов, как грамположительного, так и грамотрицательного типа. Так, в собственных исследованиях нами было установлено, что лизолипины способны подавлять развитие ряда клинических изолятов Klebsiella pneumonia, Acinetobacter baumanii, Enterococcus faecium, Staphylococcus aureus, обладающих лекарственной устойчивостью к карбопенемам.
Кроме того, данные метаболиты и/или их продуценты могут быть использованы как основа для разработки биологических средств защиты растений было показано, что лизолипины эффективны против возбудителя рака цитрусовых Xanthomonas citri subsp.citri [Rodrigues JP, Peti APF, Figueiro FS, et al. Bioguided isolation, characterization and media optimization for production of Lysolipins by actinomycete as antimicrobial compound against Xanthomonas citri subsp.citri. Mol Biol Rep.2018 Dec;45(6):2455-2467. doi: 10.1007/s11033-018-4411-5].
Известны несколько продуцентов лизолипинов, принадлежащие к роду Streptomyces:
Streptomyces violaceoniger Tü 96 (NRRL 8097) [Drautz et al., 1975 по ссылкам выше],
Streptomyces tendae Tü 4042 [Lopez et al., 2010 по ссылке выше]
Streptomyces sp. Caat 1-54 [Rodrigues et al., 2018 по ссылке выше].
Из-за нестабильности молекулы лизолипина X, которая и является непосредственно продуктом биосинтеза актиномицетов, и ее самопроизвольного перехода в лизолипин I, в культуральной жидкости продуцентов, как правило, присутствуют сразу оба соединения. Поскольку в результате данной модификации антагонистическая активность штамма, и в частности его антифунгальное действие, только возрастает, исследователи часто определяют продуктивность штамма по сумме лизолипинов [Drautz et al., 1975 по ссылкам выше].
Так, для штамма S. violaceaniger Tü 96 (NRRL 8097) продуктивность составила 10-30 мг/л смеси лизолипинов X и I [Bockholt et al., 1994 по ссылке выше]; для штамма Streptomyces sp. Caat 1-54 [Rodrigues et al., 2018 по ссылке выше] оценка продуктивности не проводилась.
К серьезным недостаткам выше указанных штаммов - продуцентов лизолипина, можно отнести малую продуктивность при выработке целевого антибиотика.
Технической задачей, на решение которой направлено настоящее изобретение, является решение как минимум одной из вышеуказанных в уровне техники проблем.
Сущность изобретения
Технической решением является использование описанного признаками в пунктах формулы изобретения.
Одной из возможных технических задач, на решение которой может быть направлено настоящее изобретение, являлось получение бактериального штамма, способного продуцировать ферментационную жидкость с высоким содержанием суммарной смеси лизолипинов X и I. Техническим результатом настоящего изобретения является продуктивность штамма-продуцента не менее 40 мг/л смеси лизолипинов X и I в культуральной жидкости.
Задача может решаться тем, что выделен и охарактеризован штамм Streptomyces sp.YVZ014.
Штамм Streptomyces sp.YVZ014 был выделен при поверхностном посеве на овсяный агар [Shirling ЕВ & Gottlieb D. Methods for Characterization of Streptomyces Species. Int J System Bacteriol. 1966;16(3):313-340. doi: 10.1099/00207713-16-3-313] из образца известковой породы, отобранного вблизи центрального входа в Воронцовскую пещеру в Сочинском Национальном парке (43.611273° с.ш., 39.930594° в.д.) в июле 2022 года.
Штамм депонирован во Всероссийской Коллекции Микроорганизмов ФГБУ «ФИЦ «Пущинский Научный Центр Биологических Исследований Российской Академии Наук» (Россия, 142290, Московская обл., Пущино, пр. Науки, 5, ИБФМ) под регистрационным номером ВКМ Ac-3003D, дата депонирования 27.08.2023.
Идентификация штамма Streptomyces sp.YVZ014 основывалась на методологии полифазной таксономии, сочетающей анализ данных секвенирования нуклеотидных последовательностей гена 16s рРНК и сопоставления этих данных с последовательностями, депонированными в базе GenBank [https://www.ncbi.nlm.nih.gov/genbank, дата обращения 20.10.2023], наряду с изучением фенотипических признаков: культуральных, морфологических и физиологических. Данный подход в настоящее время считается абсолютно надежным для идентификации мицелиальных актинобактерий на уровне рода и в большинстве случаев достаточным для определения видовой принадлежности.
Штамм Streptomyces sp. YVZ014 ВКМ Ac-3003D характеризуется культурально-морфологическими и физиолого-биохимическими признаками, согласующимися с таковыми, приведенными для представителей данного таксона [Bergey's Manual of Systematics of Archaea and Bacteria, 2015, doi: 10.1002/9781118960608].
Культурально-морфологические признаки
Культуральные характеристики штамма Streptomyces sp.YVZ014 ВКМ Ac-3003D описаны на спектре твердых питательных сред (Фиг. 8), рекомендованных для фенотипического описания актиномицетов в рамках Международного проекта по изучению стрептомицетов International Streptomyces Project [Shirling, Gottlieb, 1966 по ссылке выше].
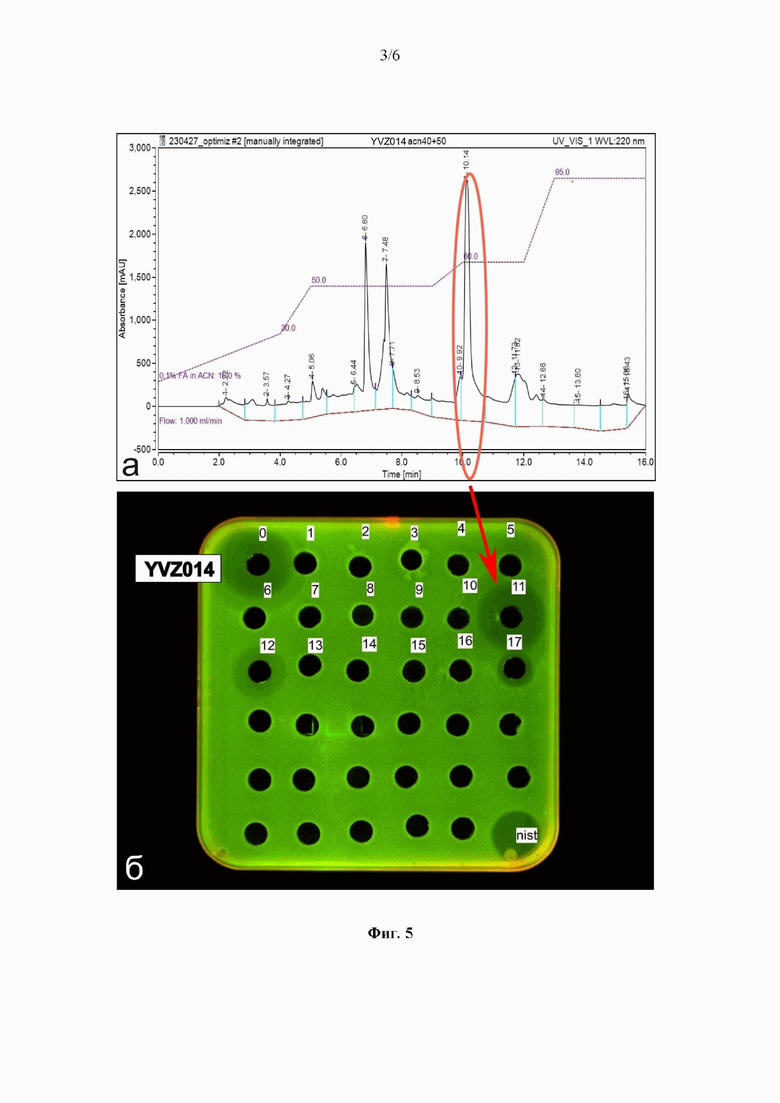
Изучение морфологии Streptomyces sp YVZ014 ВКМ Ac-3003D на 14 сутки роста на минеральном агаре Гаузе 1 [Гаузе ГФ, Преображенская ТП, Свешникова МА, и др. Определитель актиномицетов. Роды Streptomyces, Streptoverticillium, Chainia; Наука: Москва, 1983] с помощью сканирующего электронного микроскопа (Фиг. 2) позволило установить, что штамм образует разветвленный субстратный мицелий, на воздушном мицелии диаметром 0,40-0,45 мкм формируются прямые, слабо извитые цепочки гладких неподвижных спор 0,56-0,60 мкм в диаметре.
Физиолого-биохимические признаки
Штамм является мезофильным, поскольку растет в аэробных условиях, в диапазоне температуры от 20 до 45°С, с оптимумом роста при 30±2°С.
Способен образовывать кислоту при росте на глюкозе, галактозе, мальтозе, маннитоле, маннозе, раффинозе, сахарозе, сорбитоле, трегалозе, фруктозе; слабее использует: инозит, ксилозу. Не использует арабинозу, лактозу, рамнозу (Фиг. 3).
Способен к гидролизу казеина, крахмала, карбоксиметилцеллюлозы.
В качестве источника азота использует нитратные, аммонийные соединения, гидролизаты белков, аминокислоты.
Чувствителен к антибиотикам: эритромицину (5 мкг), левофлоксацину (5 мкг), ванкомицину (5 мкг) и амоксициллину (20 мкг).
Образует антибиотик лизолипин X, активный в отношении отдельных грамположительных и грамотрицательных бактерий и дрожжевых грибов.
Штамм Streptomyces sp.YVZ014 ВКМ Ac-3003D не патогенен.
Хранение и поддержание жизнеспособности штамма
Штамм можно хранить при +4°С и поддерживать путем пересева раз в 3-4 недели в пробирки со скошенным овсяным агаром.
Длительное хранение штамма при температуре от -20 до -80°С может быть обеспечено культивированием в жидкой питательной среде, содержащей глюкозу, гидролизат белков, дрожжевой экстракт, минеральные соли в течение 3-5 суток, и последующим разливом культуральной жидкости в специальные емкости для хранения при низких температурах с добавлением веществ-криопротекторов и соблюдением условий стерильности.
Изобретение иллюстрируется следующими графическими материалами:
На Фиг. 1 изображена структурная формула молекул лизолипина X (Фиг. 1а) и I (Фиг. 1б).
На Фиг. 2 представлена электронная микрофотография мицелия и спор штамма Streptomyces sp. YVZ014 ВКМ Ac-3003D, сделанная на 14-е сутки роста культуры на минеральном агаре 1 при 28°С (Cambridge Instruments CamScan S2).
На Фиг. 3 отражена способность штамма Streptomyces sp.YVZ014 ВКМ Ac-3003D образовывать кислоту при росте на среде с различными источниками углерода (слева направо): глюкоза, сорбитол, фруктоза, лактоза, галактоза, трегалоза, арабиноза, среда без источника углерода, раффиноза, маннитол, сахароза, рамноза, мальтоза, манноза, ксилоза, инозит.
На Фиг. 4 представлены результаты тестирования исходной (кж) и подкисленной (+к) культуральной жидкости штамма Streptomyces sp.YVZ014 и экстрактов, элюированных водными растворами ацетонитрила (0-100%), на дрожжевом тестовом организме Candida albicans АТСС 10231, референсный антибиотик нистатин (Nist).
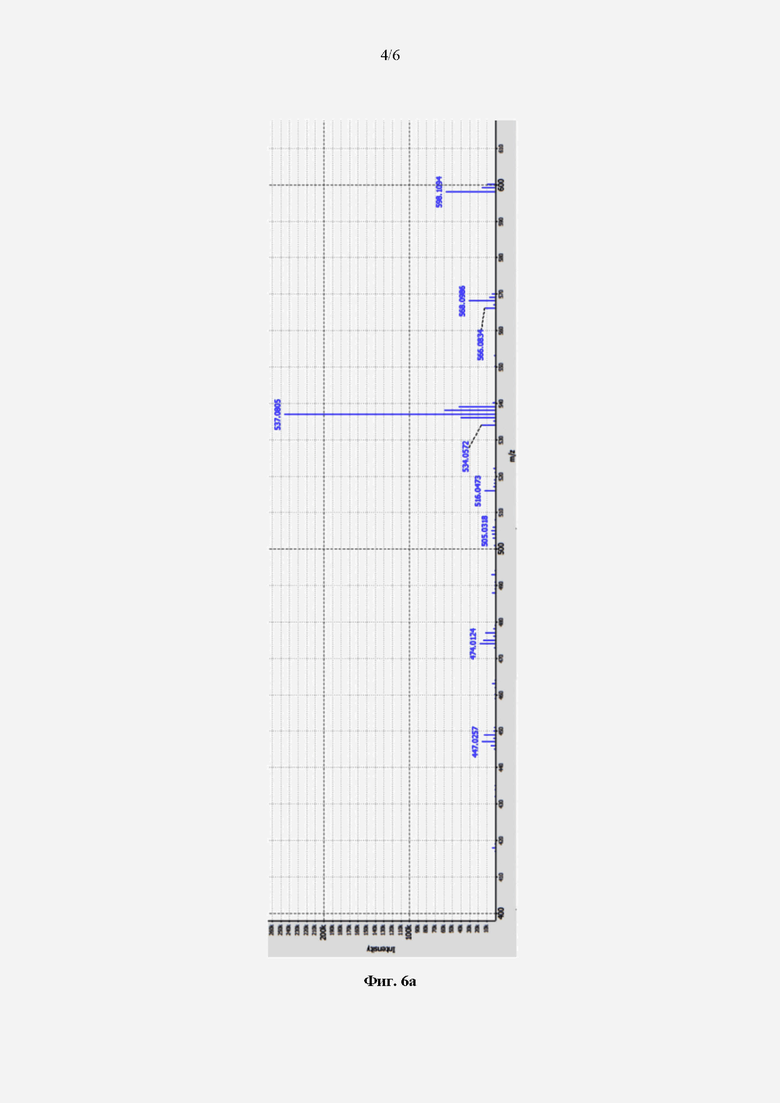
На Фиг. 5а представлены результаты ВЭЖХ-анализа активных экстрактов, извлеченных 40-50% водными растворами ацетонитрила из культуральной жидкости Streptomyces sp.YVZ014 ВКМ Ac-3003D. Красным овалом на хроматограмме отмечен пик, детектированный на 11-й минуте, принадлежащий веществу, ингибирующему рост Candida albicans АТСС 10231 (Фиг. 5б).
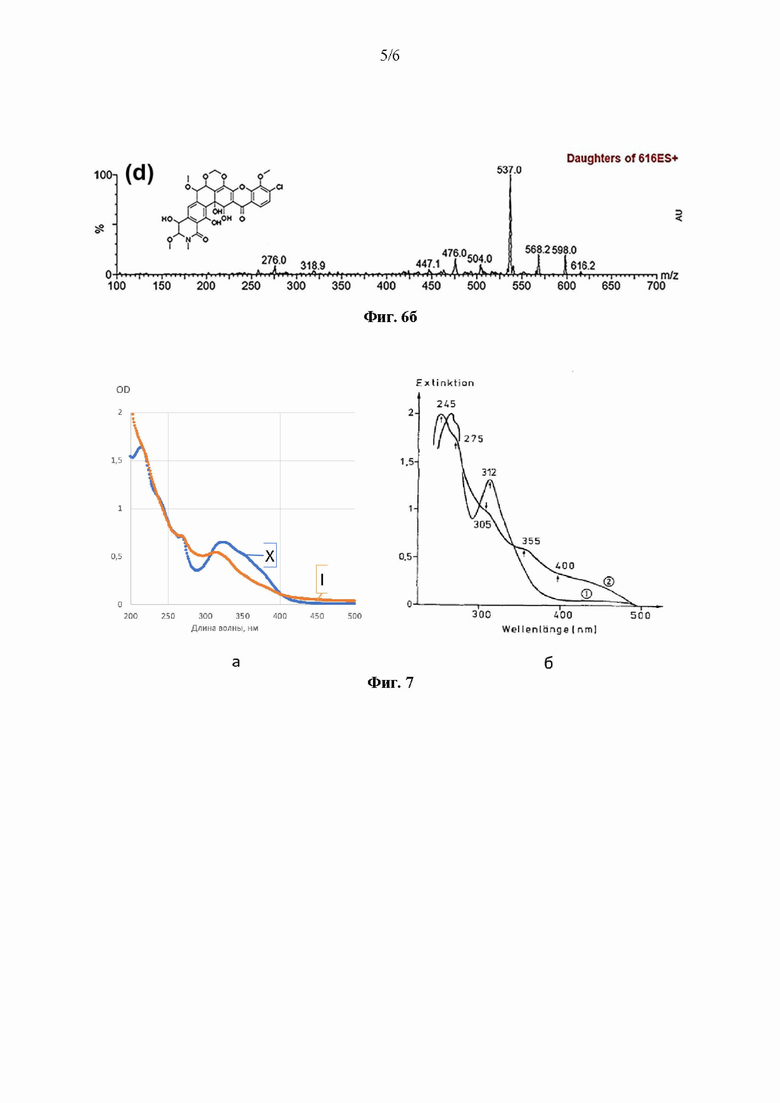
На Фиг. 6а представлен спектр фрагментации первоначального («родительского») иона с m/z 616,119, полученный путем тандемной масс-спектрометрии высокого разрешения с применением времяпролетного детектора из ВЭЖХ-образца «11-10,14 min», обладавшего максимальной антибиотической активностью. По оси абсцисс отношение массы к заряду (m/z), по оси ординат интенсивность сигнала. На Фиг. 6б представлен спектр фрагментации вещества, описанного как лизолипин X (из работы Rodrigues et al., 2018 по ссылке выше).
На Фиг. 7 представлены спектры оптического поглощения активных компонентов (лизолипина X и I) в ультрафиолетовой и видимой областях: определенных для Streptomyces sp. YVZ014 ВКМ Ac-3003D (Фиг. 7а) и для штамма Streptomyces violaceoniger Tü 96 [Drautz et al., 1975 по ссылкам выше].
На Фиг. 8 представлены культуральные характеристики штамма Streptomyces sp. YVZ014 ВКМ Ac-3003D.
Примеры осуществления изобретения
Сущность и практическая применимость настоящего изобретения поясняется следующими примерами:
Штамм Streptomyces sp. YVZ014 ВКМ Ac-3003D культивируют в жидкой питательной среде следующего состава: глюкоза - 10 г, пептон - 10 г, гидролизат казеина - 2 г, дрожжевой экстракт - 2 г, NaCl - 6 г, вода - 1 л, при 28°С. Затем в 3-5 суточную культуральную жидкость в качестве криопротектора асептически вводят стерильный раствор 50% глицерола в объемном соотношении 1:1. Полученную смесь раскапывают по криопробиркам и помещают на хранение при температуре 80°С.
Пример 1. Выделение и культивирование Streptomyces sp.YVZ014 ВКМ Ac-3003D
Для исследования отбирали образцы известковой породы из Воронцовской пещеры в Сочинском Национальном парке (43.611273° с. ш., 39.930594° в.д.) в июле 2022 года в стерильные контейнеры, транспортировали в лабораторию и сразу производили посев из серии десятикратных разведений, приготовленных с использованием стерильной водопроводной воды. Использовали питательную среду следующего состава (г/л): овсяная мука - 50,0; СаСО3 - 2,5; агар - 20. Для ограничения роста грибов и грамотрицательных бактерий в среды перед разливом добавляли нистатин (150 мкг/мл) и налидиксовую кислоту (50 мкг/мл) соответственно. Засеянные чашки Петри инкубировали при 28°С в течение двух недель.
Выросшие колонии мицелиальных прокариот выделяли в отдельные изоляты, среди которых проводили скрининг методом агаровых блоков на антагонистическую активность в отношении дрожжевого гриба Candida albicans АТСС 10231. Для культивирования дрожжевого штамма использовали агаризованную среду ГПДА следующего состава (г/л): глюкоза - 20, пептон - 10, дрожжевой экстракт - 5, агар - 20. После 24 часов инкубирования при 37°С на газоне гриба отмечали наличие зон ингибирования роста вокруг агаровых блоков с культурами продуцентов. Таким образом, был выявлен штамм YVZ014, вызывавший угнетение роста тест-организма.
Пример 2. Получение лизолипина X с использованием нового штамма-продуцента
Пример 2.1. Культивирование штамма-продуцента
Клетки Streptomyces sp.YVZ014 ВКМ Ac-3003D выращивали в 100 мл жидкой питательной среды следующего состава (г/л): сахароза - 12,5, солодовый экстракт - 6, дрожжевой экстракт - 3, NaCl - 2,9, вода - остальное (рН после автоклавирования при 1 атм составляет 7,0-7,2). Культивирование производили в 250 мл конических колбах при 30°С и перемешивании на орбитальном шейкере в течение 3 суток. Полученную культуральную жидкость с клетками продуцента в концентрации 106 кл/мл использовали как посевной материал, засевая им в объеме внесения 5-10% конические колбы общим объемом 750 мл, содержащие 100-150 мл жидкой питательной среды вышеприведенного состава. Засеянные колбы в течение 12 суток инкубировали на шейкере при 30°С.
К концу ферментации содержание лизолипина в культуральной жидкости составляло 46,5 мг/л.
По окончании срока ферментации культуральную жидкость с клетками микроорганизмов сливали из колб и центрифугировали 10 минут при скорости 4500 об/мин, чтобы отделить кондиционированную культуральную жидкость от клеточной биомассы.
Пример 2.2. Подготовка хроматографической колонки. В чистую и сухую колонку для обращенно-фазной хроматографии помещали 1 мл (0,3 г) сухого сорбента LPS-500H (сополимер дивинилбензола/ гидрофильного мономера), заливали 15 мл 50% (об/об) раствора ацетонитрила в воде, после полного просачивания через сорбент заливали 15 мл 10% об/об раствора ацетонитрила в воде и в заключение трижды промывали колонку дистиллированной водой. Данная процедура применяется для гарантированной очистки сорбента от посторонних соединений.
Пример 2.3. Идентификация и выделение лизолипина X из культуральной жидкости
Освобожденную от биомассы с помощью центрифугирования кондиционированную культуральную жидкость (к/ж) Streptomyces sp.YVZ014 ВКМ Ac-3003D наносили на хроматографическую колонку с подготовленным как описано в Примере 2.2. сорбентом. Просочившуюся через колонку жидкость собирали и оценивали ее активность на вышеуказанном тест-организме. Первоначально, было установлено, что активное вещество в исходной культуральной жидкости неэффективно связывается с сорбентом при данных условиях, поэтому культуральную жидкость подкисляли (+к) путем внесения в нее до 0,1% по объему трифторуксусной кислоты и повторно наносили на колонку с сорбентом. Вторично прошедшую через колонку жидкость (проскок) также собирали и контролировали наличие в ней активного вещества.
Затем колонку промывали дистиллированной водой, а после этого элюировали водными растворами ацетонитрила с возрастающей концентрацией (0, 10, 20, 30, 40, 50, 75, 100% (об/об)), которые также тестировали на способность угнетать рост Candida albicans АТСС 10231 (Фиг. 4).
Фракции, экстрагированные 40 и 50% растворами ацетонитрила, продемонстрировали наибольшую антагонистическую активность, поэтому они были объединены и подвергнуты дальнейшему разделению с помощью высокоэффективной хроматографии высокого давления (Фиг. 5) на ВЭЖХ-системе Vanquish Flex UHPLC System, используя детектор Diode Array (ThermoFisher Scientific), оснащенный колонкой Luna® 5 μm С18(2) 100 Å, 250 × 4.6 mm (Phenomenex)). Все полученные пробы тестировали на дрожжевом штамме Candida albicans АТСС 10231 как описано в Примере 1, определяли активную фракцию и концентрировали ее при помощи роторного испарителя.
Идентификацию активного вещества проводили методом хроматомасс-спектрометрии высокого разрешения, с использованием масс-спектрометра Bruker maXis II 4G ETD, хроматографа UltiMate 3000, оснащенного колонкой Acclaim RSLC 120 C18 2.2um 2.1x100mm. Масс-спектры обрабатывали с использованием программ OpenChrom Lablicate Edition (1.4.0.202201211106), TOPPView v. 2.6.0 [Kohlbacher O, Reinert K, Gröpl C, et al. TOPP-- the OpenMS proteomics pipeline. Bioinformatics. 2007 Jan 15; 23(2):e191-7. doi: 10.1093/bioinformatics/bt1299]. Структура активного вещества была установлена с использованием GNPS [Wang М, Carver JJ, Phelan VV, et al. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking. Nat Biotechnol. 2016 Aug 9; 34(8):828-837. doi: 10.1038/nbt.3597], NPAtlas [van Santen JA, Poynton EF, Iskakova D, et al. The Natural Products Atlas 2.0: a database of microbially-derived natural products. Nucleic Acids Res. 2022 Jan 7; 50(D1):D1317-D1323. doi: 10.1093/nar/gkab941; van Santen JA, Jacob G, Singh AL, et al. The Natural Products Atlas: An Open Access Knowledge Base for Microbial Natural Products Discovery. ACS Cent Sci. 2019 Nov 27; 5(11):1824-1833. doi: 10.1021/acscentsci.9b00806], Dictionary of Natural Products databases (Фиг. 6 a, б).
В соответствии с точной молекулярной массой (615,1143530 г/моль) был определен атомарный состав и молекулярная формула активного вещества (C29H26ClNO12), а с помощью открытой базы данных GNPS-LIBRARY проведена его идентификация. Время удержания на гидрофобной колонке (оценочная гидрофобность) и оптический спектр поглощения (Фиг. 7) лизолипина X и I из литературных источников использованы в качестве данных сравнения, подтверждающих масс-спектрометрическую идентификацию.
Таким образом, установлено, что фракция, полученная экстракцией 40-50% v/v водным раствором ацетонитрила из культуральной жидкости Streptomyces sp.YVZ014 ВКМ Ac-3003D, ингибирует рост дрожжевого гриба Candida albicans АТСС 10231 и представлена на 38% смесью лизолипинов X и I.
Вес сухого остатка активной фракции, полученной из 0,5 л ферментационной среды с помощью твердофазной экстракции, составил около 93 мг, а суммарное количество лизолипинов, оцененное с помощью коэффициента экстинкции [Drautz et al., 1975 по ссылкам выше], составило 23,25 мг. Таким образом, продуктивность штамма Streptomyces sp. YVZ014 ВКМ Ac-3003D составила 46,5 мг/л.
Все публикации, патенты и заявки на патенты включены в настоящий документ посредством ссылки. Хотя в вышеприведенном описании это изобретение было описано в отношении некоторых предпочтительных вариантов его осуществления, и многие детали были изложены в целях иллюстрации, для специалистов в данной области техники будет очевидно, что изобретение допускает дополнительные варианты осуществления и что некоторые детали, описанные в данном документе, могут значительно изменяться без отклонения от сущности изобретения.
Использование терминов в единственном числе в контексте описания изобретения должно толковаться как охватывающее как единственное, так и множественное число, если иное не указано в данном документе или явно не противоречит контексту. Термины «состоящий из», «имеющий», «включающий» и «содержащий» следует толковать как неограничивающие термины, т.е. означающие «включая, но не ограничиваясь», если не указано иное. Перечисление диапазонов значений в данном документе просто предназначено для использования в качестве сокращенного способа индивидуальной ссылки на каждое отдельное значение, попадающее в этот диапазон, если здесь не указано иное, и каждое отдельное значение включено в спецификацию, как если бы оно было отдельно изложено в данном документе. Все способы, описанные в данном документе, могут выполняться в любом подходящем порядке, если иное не указано в данном документе или иным образом явно не противоречит контексту. Использование любых и всех примеров или иллюстративного языка (например, «такой как»), представленных в данном документе, предназначено просто для лучшего описания изобретения и не налагает ограничения на объем изобретения, если иное не заявлено. Никакие формулировки в описании не следует истолковывать как указывающие на какой-либо не заявленный элемент как существенный для практического применения изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Streptomyces sp. YVZ013 - продуцент антибиотика поликетомицина | 2023 |
|
RU2813975C1 |
| Штамм Streptomyces rochei MP21 - продуцент антибиотика кирромицина | 2022 |
|
RU2798207C1 |
| Штамм Streptomyces sp. YVZ012 - продуцент суругамида А | 2023 |
|
RU2821907C1 |
| Штамм Streptomyces sp., выделенный из байкальских эндемичных амфипод - продуцент антибиотика актифенола | 2018 |
|
RU2704862C1 |
| Штамм Streptomyces mirabilis KB13 - продуцент дутомицина | 2022 |
|
RU2798195C1 |
| Штамм Streptomyces hygroscopicus 18 - продуцент нафтохиноновых антибиотиков - астолидов А и В с противогрибковой и цитотоксической активностью и способ их получения | 2018 |
|
RU2681828C1 |
| Средство для продуцирования органических соединений, обладающих антибактериальной и антигрибковой активностью | 2021 |
|
RU2774192C2 |
| Штамм актиномицета Streptomyces pratensis - продуцент антибиотиков, используемый для защиты овощных культур от мягкой гнили, вызываемой фитопатогенными бактериями Pectobacterium caratovorum | 2022 |
|
RU2798572C1 |
| ШТАММ STREPTOMYCES HYGROSCOPICUS BKM AC-2737D - ПРОДУЦЕНТ АНТИБИОТИКА РАПАМИЦИНА И СПОСОБ УВЕЛИЧЕНИЯ ЕГО ПРОДУКТИВНОСТИ | 2018 |
|
RU2679051C1 |
| Штамм Streptomyces sp. YVZ020 ВКМ Ас-3001D - продуцент метаболитов, обладающих фитостимулирующим и фитозащитным действием против возбудителя бактериоза Clavibacter michiganensis | 2024 |
|
RU2840021C1 |


Изобретение относится к области биотехнологии и касается штамма микроорганизма Streptomyces sp. YVZ014 – продуцента антибиотика лизолипина X – природного соединения, обладающего избирательной антагонистической активностью в отношении ряда патогенных микроорганизмов. Штамм депонирован во Всероссийской Коллекции Микроорганизмов ФГБУ «ФИЦ «Пущинский Научный Центр Биологических Исследований Российской Академии Наук» (Россия, 142290, Московская обл., Пущино, пр. Науки, 5, ИБФМ) под регистрационным номером ВКМ Ас-3003D. 8 ил., 2 пр.
Штамм Streptomyces sp. YVZ014, депонированный во Всероссийской Коллекции Микроорганизмов ФГБУ «ФИЦ «Пущинский Научный Центр Биологических Исследований Российской Академии Наук» под регистрационным номером ВКМ Ас-3003D, – продуцент антибиотика лизолипина X.
| BLUM S | |||
| et al | |||
| Biosynthetic capacities of actinomycetes | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Dioxolides, novel secondary metabolites from Streptomyces tendae | |||
| J Basic Microbiol | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| BOCKHOLT H | |||
| et al | |||
| Biosynthetic studies on the xanthone antibiotics lysolipins X and I | |||
| J Organic Chem | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| RU | |||
Авторы
Даты
2024-04-18—Публикация
2023-12-05—Подача