Изобретение относится к медицине, в частности к экспериментальной фармакологии.
Прототипом заявленного решения является способ коррекции неврологического дефицита солями гамма-оксимасляной кислоты при моделировании травматического повреждения головного мозга у крыс (Литвинов, А.А. Церебропротекторные свойства солей гамма-оксимасляной кислоты и некоторые аспекты механизма их действия: дис. … к-та фарм. наук : 14.03.06 / А.А. – Литвинов. – Волгоград, 2015. – 196 с. (98-101)). Механизм их действия заключается в том, что, являясь производными ГАМК (гамма-аминомаслянной кислоты), которая является естественным медиатором, оказывают влияние на дофаминергическую и ГАМК-ергическую системы, обладают антигипоксическим действием, снижают интенсивность процессов перекисного окисления липидов и повышение активности ключевых ферментов антиоксидантной системы, таких как супероксиддисмутазы, каталазы. Помимо этого соли ГОМК приводят к усилению утилизации глюкозы мозгом и снижению скорости и степени агрегации тромбоцитов (Литвинов, А.А. Церебропротекторные свойства солей гамма-оксимасляной кислоты и некоторые аспекты механизма их действия: дис. … к-та фарм. наук : 14.03.06 / А.А. – Литвинов. – Волгоград, 2015. – 196 с. (29-33, 164-165)).
Вторичные повреждения головного мозга при травматическом повреждении могут достигать 2/3 от общей зоны поражения [Zhang X., Satchell M.A., Clark R.S.B., Nathaniel P.D., Kochanek P.M., Graham S.H. Apoptosis // In: Clark R.S.B, Kochanek P.M., editor. In Brain Injury. Boston: Kluwer Academic Publishers. – 2001. – Р. 199–230.] и [Robertson G., Crocker S., Nicholson D. Neuroprotection by the inhibition of apoptosis.// Brain Pathol. – 2000. – Vol. 10, № 2. – P. 283-292]. Основными факторами, определяющими степень вторичного повреждения нервной ткани при травматическом повреждении головного мозга, являются эксайтотоксичность (токсическое влияние высокого содержания «возбуждающих» аминокислот), воспаление, образование реактивных свободных радикалов кислорода, активация перекисного окисления липидов и запуск механизмов «программируемой» гибели клеток (апоптоза):
1. Кабанов А.А. Нейропротекция при травмах центральной нервной системы // Лечебное дело. – 2011. – № 2. – С. 59-68.
2. Крылов В.В., Пурас Ю.В. Патофизиологические механизмы вторичного повреждения мозга при черепно-мозговой травме // Неврологический журнал. – 2013. – № 4. – С. 4-7.
3. Мороз В.В., Кармен Н.Б., Маевский Е.И. Механизмы вторичного повреждения нейронов при тяжелой черепно-мозговой травме (часть 2) // Общая реаниматология. – 2011. – VII, 5. – С. 42-45.
Неотъемлемой частью эксайтотоксичности является перегрузка клетки кальцием, образование свободных радикалов, открытие метахондриальной макропоры через которые выходят протеолитические ферменты апоптоза.
Соответственно, другим путем коррекции неврологического дефицита при травматическом повреждении головного мозга может являться снижение перекисного окисления липидов за счет снижения активности 3-кетоацил КоА-тиолазы, препятствие перегрузке клетки Са2+; подавление апоптоза, уменьшении явлений местного воспаления.
Поэтому способ коррекции неврологического дефицита солями гамма-оксимасляной кислоты при моделировании травматического повреждения головного мозга у крыс является не удовлетворительным.
Задачей изобретения является создание эффективного способа коррекции неврологического дефицита при экспериментальной модели травматического повреждения головного мозга, включающего использование триметазидина.
Задача решается способом коррекции неврологического дефицита при экспериментальной модели травматического повреждения головного мозга с использованием триметазидна.
Это приводит к выраженной коррекции неврологического дефицита при моделируемой патологии.
Положительные эффекты триметазидина можно связать со следующими свойствами.
1. Тримезидин блокируя 3-кетоацил КоА-тиолазы предотвращает β-окисление жирных кислот [Lopaschuk G.D., Barr R., Thomas P.D., Dyck J.R. Beneficial effects of trimetazidine in ex vivo working ischemic hearts are due to a stimulation of glucose oxidation secondary to inhibition of longchain 3-ketoacyl coenzyme a thiolase // Circ. Res. – 2003. – Vol. 93 (3). – P. 33–37] и [Belardinelli R., Solenghi M., Volpe L., Purcaro A. Trimetazidine improves endothelial dysfunction in chronic heart failure: an antioxidant effect // Europ. Heart J. – 2007. – Vol. 28, N 9. – Р. 1102–1108]. Это приводит к снижению образования свободных радикалов.
2. Препятствует перегрузке клетки Са2+ [Cruz C, Zaoui A, Ayoub S et al. Alterations des myoxites isoles des ventricules de Coeur de rat adulte: protection par la trimetazidine. Concours Medical 1987; 36 (Suppl.): 3470–5.] и [Renaud JF. Internal pH, Na and Ca regulation by trimetazidine during cardiac cell acidosis. Cardiovasc Drugs Ther 1988; 1: 677–86].
3. Препятствует открытию митохондриальной поры, что предотвращает выход через нее протеолитических ферментов участвующих в процессах апоптоза [Argaud L., Gomez L., Gateau-Roesch O. et al. Trimetazidine inhibits mitochondrial permeability transition pore opening and prevents lethal ischemia-reperfusion injury // J. Mol. Cell Cardiol. – 2005. – Vol. 39 (6). – P. 893–899] и [Ruixing Y., Wenwu L., Al-Ghazali R. Trimetazidine inhibits cardiomyocyte apoptosis in a rabbit model of ischemia-reperfusion // Transl. Res. – 2007. – Vol. 149 (3). – P. 152–160].
4. Уменьшает явления воспаления за счет снижения активации и миграции нейтрофилов [Tritto I., Wang P., Kuppusamy P. et al. The anti-anginal drug trimetazidine reduces neutrophil-mediated cardiac reperfusion injury // J. Cardiovasc. Pharmacol. – 2005. – Vol. 46 (1). – P. 89–98].
СПОСОБ ОСУЩЕСТВЛЯЕТСЯ СЛЕДУЮЩИМ ОБРАЗОМ
Травматическое повреждение головного мозга вызвали (ЧМТ) у крыс мужского пола с массой тела 270±20 г. [Соколова Т.Ф., Редькин Ю.В. Способ нанесения дозированной закрытой черепно-мозговой травмы у белых крыс // Вопросы нейрохирургии. –1986. – № 2. – С. 68–6]). Воспроизводилась травма, соответствующая средней степени тяжести (по шкале оценки McGraW в модификации И.В. Ганнушкиной, 2,5-5,5 балла). Триметазидин (Предуктал МВ – ЗАО Сервье, Россия) начинали вводить за 2 часа до моделирования экспериментального травматического повреждения головного мозга, внутрижелудочно в дозе 6,6 мг/кг в сутки, доза была разделена на 2 приема, с интервалом 12 часов, терапия проводилась на протяжении всего периода эксперимента (7 суток).
Оценивался неврологический дефицит животных по шкале оценки McGraW в модификации И.В. Ганнушкиной, по шкале Garsia и по шкале Combs и D'Alecy на 1-е, 3-е и 7-е сутки после травматического повреждения головного мозга.
Шкала McGraw в модификации И.В. Ганнушкиной (McGraw C.P., Pashayan A.G., Wendel O.T. Cerebral infarction in the Mongolian gerbil exacerbated by phenoxybenzamine treatment // Stroke. – 1976. – № 7(5). – Р. 485-488; Ганнушкина И.В. Мозговое кровообращение при разных видах циркуляторной гипоксии мозга // Вестник Российской Академии медицинских наук. – 2000. – № 9. – С. 22-27). Неврологическому дефициту легкой степени соответствовала оценка в 0,5-2,5 балла, средней – 2,5-5,5 балла и тяжелой – 5,5-10 баллов. При наличии у животного нескольких разных проявлений неврологического дефицита баллы суммировались. Оценочная бальная шкала McGraw в модификации И.В. Ганнушкиной, адаптированная нами для работы с группой из десяти животных, представлена в таблице 2.1.
Таблица 2.1. Шкала McGraw в модификации И.В. Ганнушкиной
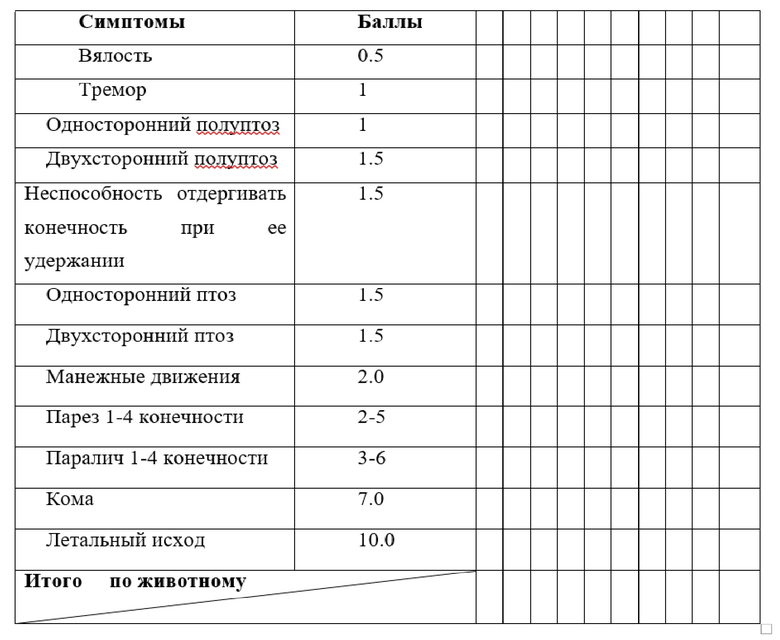
Шкала оценки неврологического дефицита крыс Garcia [Garcia J.H, Wagner S., Liu K.F, Hu X.J. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats. Statistical validation // Stroke. – 1995. – Apr, № 26(4). – Р. 627-634] является балльной шкалой, использующейся для оценки наличия асимметрии в движениях и реакциях экспериментального животного. Суммарный бал в ней определяется как сумма баллов по результатам в 6-и тестов. При этом в каждом тесте ноль баллов говорит о максимальной степени выраженности нарушений, а 3 балла – об их полном отсутствии неврологических нарушений. Между тестами делалась пауза в 2-3 минуты для отдыха животного.
Описание отдельных тестов, входящих в шкалу, и методики их проведения Garcia
Тест спонтанной активности. Длительность исследования – 5 минут, исследование в условиях клетки, в которой животное содержалось. Активность животного оценивается по способности подходить ко всем 4 стенкам клетки. Результат оценки:
3 балла – животное свободно передвигается по клетке кругами и исследует как минимум 3 стенки;
2 балла – движение животного затруднены, но оно достигает стенок клетки, колеблется перед движением, периодически занимает стойку у одного края клетки;
1 балл – животное едва двигается по клетке, не достигая стенок;
0 баллов – животное не двигается.
Симметрия при движении четырех лап. Животное берут за хвост и удерживают в воздухе, оценивается симметрия движения лап. Результат оценки:
3 балла – движения лап симметричны с обеих сторон;
2 балла – лапы на одной стороне вытягиваются несколько медленнее, чем на другой;
1 балл – движения лап с одной стороны сохранены только минимальные движения лап;
0 балл – движения лап отсутствуют.
Вытягивание передних лап. Животное держат за хвост, передние лапы опираются на поверхность (стол), задние висят в воздухе. Оценивают симметрию вытягивания передних лап. Результат оценки:
3 балла – передние лапы вытягиваются свободно, животное пытается ими шагать симметрично;
2 балла – одна из лап вытянута не до конца, движения нарушены;
1 балл – одна из передних конечностей движется минимально;
0 баллов – конечность с одной из сторон не движется совсем.
Залезание по сетке. Животное помещают на сетку и оценивают способность карабкаться по ней вверх и способность удерживаться при попытке снять за хвост. Результат оценки:
3 балла – животное легко забирается по вертикально расположенной сетке и крепко держится за нее при попытке снять;
2 балла – ограничение движения конечностей на одной из сторон не позволяют животному забираться и удерживаться на сетке;
1 балл – животное не может вскарабкаться на прутья совсем;
0 баллов – животное не удерживается на сетке.
Проприорецепция тела животного. Оценивается реакция животного на прикосновение тупой палочкой к сторонам тела животного, палочка должна находиться вне поля зрения животного. Результат оценки:
3 балла – реакция в виде поворота головы, симметрична с обеих сторон;
2 балла – животное медленнее реагирует с одной из сторон;
1 балл – животное совсем не реагирует на прикосновение с одной стороны.
Реакция на прикосновение к вибриссам. Прикосновение тупой палочкой к вибриссам, палочка не должна попадать в поле зрения животного. Результат оценки:
3 балла – животное реагирует поворотом головы, реакции симметрично с обеих сторон тела;
2 балла – животное медленнее реагирует на прикосновение к вибриссам с одной из сторон;
1 балл – животное полностью не реагирует на прикосновение с одной из сторон.
Шкала оценки неврологического дефицита Combs и D'Alecy [Combs D.J., D'Alecy L.G. Motor performance in rats exposed to severe forebrain ischemia: effect of fasting and 1,3-butanediol // Stroke. – 1987. – Vol. 18, № 2. – 503-511].
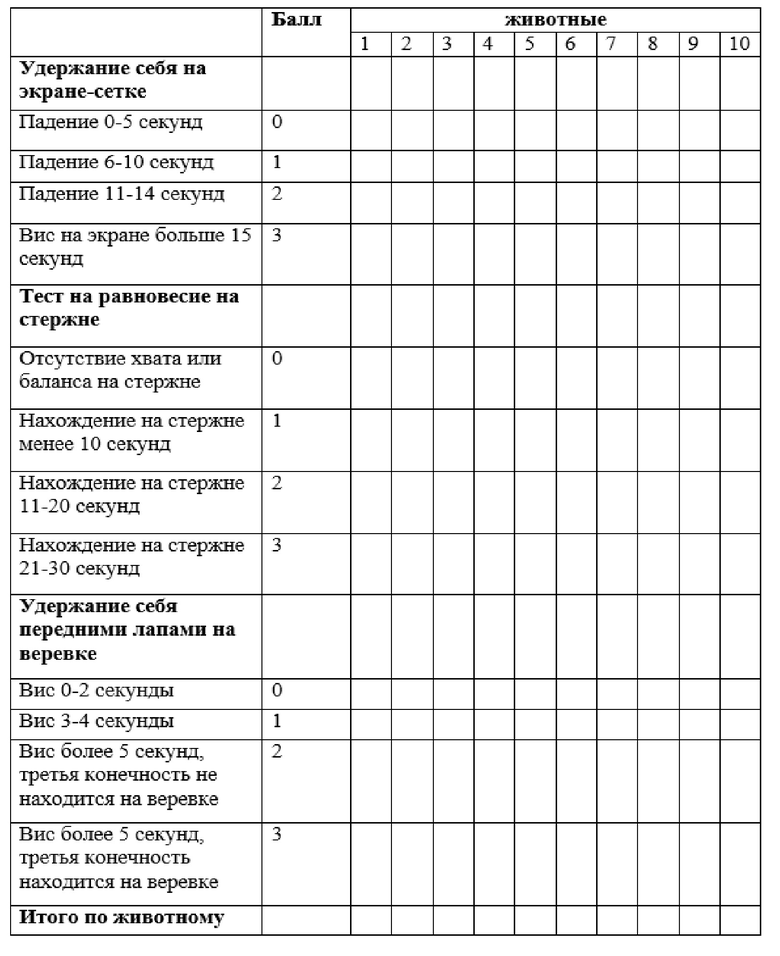
Шкала состоит из трех оценочных тестов, определяющих: мышечную силу, цепкость-тягу и равновесие. Эти тесты позволяют оценить состояние экстрапирамидной системы, наличие нарушений в ее функциях. Итоговый бал определяется суммой баллов по всем тестам, 0 баллов свидетельствует о максимальной степени выраженности неврологических нарушений, а 9 баллов – об отсутствии неврологического дефицита.
Для отдыха животного тесты проводились с 2-3-минутным интервалом, для снижения вероятности получения неверного значения (случайность или субъективизм экспериментатора), каждый двигательный тест проводился дважды для каждого животного. Шкала оценки неврологического дефицита Combs и D'Alecy (1987), адаптированная нами для работы с группой из десяти животных, представлена в таблице 2.2.
Описание тестов и трактовки полученных результатов.
Тест на мышечную силу. Для проведения теста использовался проволочный экран размером 15×30 см, с размером ячейки 6×6 мм, который мог совершать отклонение от горизонтального положения до вертикального. Экран располагался в вертикальной позиции на высоте 70 см от поролоновой подложки (для уменьшения риска получить травму при падении с экрана). Животное изначально располагали на горизонтальном экране, затем его переводили в вертикальное положение и оценивали время до падения животного. Время проведения теста составляло 15 секунд.
Тест на равновесие. Использовался деревянный стержень диаметром 2,5 см, который устанавливался на высоте 40 сантиметров над поролоновой подложкой (для уменьшения риска получить травму при падении со стержня). Животное помещалось на стержень и засекалось время до падения животного. Время проведения теста составляло 0,5 минуты.
Тест на цепкость-тягу. При помощи теста, определяется цепкость экспериментального животного, оценивается способность крысы удерживаться передними лапами на горизонтально закрепленной веревке, это показывает мышечную силу животного. Тест, исследующий силу мышечной тяги животного, говорит о способности животного подтягивать задние конечности на веревку, показывает, как мышечную силу, так и координацию. Веревку диаметром 5 мм натягивали горизонтально на высоте 70 см от поролоновой подложки (для уменьшения риска получить травму при падении с веревки). Передние конечности животного помещали на веревку, задние оставляли в висячем положении. Хронометрировали время до падения животного, и способность животного подтягивать задние лапы на веревку.
Таблица 2.2. Шкала оценки неврологического дефицита Combs и D'Alecy (1987)
Статистическая обработка результатов исследования
Степень выраженности нарушений выражали в баллах (шкала оценки McGraW в модификации И.В. Ганнушкиной, по шкале Garsia и по шкале Combs и D'Alecy). Для выявления различий при межгрупповых сравнениях использовали U-критерий Манна-Уитни. Результаты считали достоверными при p≤0,05.
ПРИМЕР КОНКРЕТНОГО ВЫПОЛНЕНИЯ.
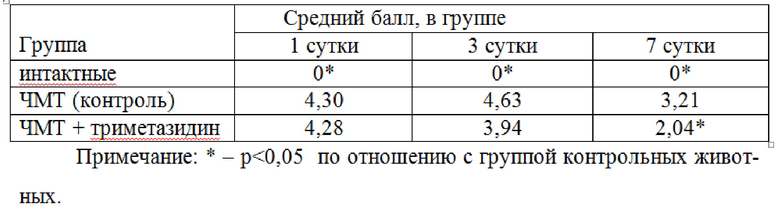
Результаты оценки коррекции неврологического дефицита триметазидином у животных с травматическим повреждением головного мозга с использованием шкалы оценки McGraW в модификации И.В. Ганнушкиной представлены в таблице 1. Из последней следует, что моделирование травматического повреждения головного мозга (группа ЧМТ (контроль)) приводит к выраженному нарушению неврологического статуса со статистически достоверным различием по отношению к группе интактных животных (p<0,05). Ведение триметазидина (группа ЧМТ+триметазидин) приводило к частичной статистически достоверной коррекции неврологического дефицита на 7 сутки.
Таблица 1.
Оценка коррекции неврологического дефицита триметазидином по шкале McGraw в модификации И.В. Ганнушкиной.
Результаты оценки коррекции неврологического дефицита триметазидином у животных с травматическим повреждением головного мозга с использованием шкалы Garsia представлены в таблице 2. Из последней следует, что моделирование травматического повреждения головного мозга (группа ЧМТ (контроль)) приводит к выраженному нарушению неврологического статуса со статистически достоверным различием по отношению к группе интактных животных (p<0,05). Ведение триметазидина (группа ЧМТ+триметазидин) приводило к частичной статистически достоверной коррекции неврологического дефицита на 7 сутки.
Таблица 2
Оценка коррекции неврологического дефицита триметазидином по шкале Garsia.
Примечание: * – p<0,05 по отношению с группой контрольных животных.
Результаты оценки коррекции неврологического дефицита триметазидином у животных с травматическим повреждением головного мозга с использованием шкалы Combs и D'Alecy представлены в таблице 3. Из последней следует, что моделирование травматического повреждения головного мозга (группа ЧМТ (контроль)) приводит к выраженному нарушению неврологического статуса со статистически достоверным различием по отношению к группе интактных животных (p<0,05). Ведение триметазидина (группа ЧМТ+триметазидин) приводило к частичной статистически достоверной коррекции неврологического дефицита на 7 сутки.
Таблица 3
Оценка коррекции неврологического дефицита триметазидином по шкале Combs и D'Alecy.
Примечание: * – p<0,05 по отношению с группой контрольных животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ коррекции неврологического дефицита 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при травматическом повреждении головного мозга | 2021 |
|
RU2758433C1 |
| Способ коррекции патологии 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при травматическом повреждении головного мозга | 2021 |
|
RU2766785C1 |
| Способ коррекции морфологических изменений при травматическом повреждении головного мозга | 2021 |
|
RU2758545C1 |
| Способ коррекции неврологического статуса 2-этил-6-метил-3- гидрокси пиридиния-N-ацетиламиноацетатом при повреждении головного мозга вследствие внутримозгового кровоизлияния в эксперименте | 2022 |
|
RU2786315C1 |
| Способ коррекции ишемии головного мозга субстанцией рапиталама в эксперименте | 2019 |
|
RU2711906C1 |
| СПОСОБ ПРОФИЛАКТИКИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ | 2018 |
|
RU2696203C1 |
| СПОСОБ ПРОФИЛАКТИКИ ИШЕМИИ ГОЛОВНОГО МОЗГА | 2017 |
|
RU2642961C1 |
| Способ коррекции поведенческого статуса 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при травматическом повреждении головного мозга | 2021 |
|
RU2756325C1 |
| Способ коррекции поведенческого статуса 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при повреждении головного мозга | 2021 |
|
RU2763012C1 |
| Нейрореабилитационное средство на основе 6-оксо-1-фенил-2-(фениламино)-1,6-дигидропиримидин-4-олята натрия | 2018 |
|
RU2675694C1 |
Изобретение относится к медицине, в частности к экспериментальной фармакологии, и может быть использовано для коррекции неврологического дефицита при травматическом повреждении головного мозга. Способ коррекции неврологического дефицита при травматическом повреждении головного мозга включает воспроизведение травматического повреждения головного мозга у крыс мужского пола с массой тела 270±20 г. Для коррекции неврологического дефицита триметазидин вводят внутрижелудочно в дозе 6,6 мг/кг в сутки, разделенной на 2 приема с интервалом 12 часов с 1 по 7 день эксперимента включительно. Причем триметазидин начинают вводить за 2 часа до моделирования экспериментального травматического повреждения головного мозга. Изобретение обеспечивает создание эффективного способа коррекции неврологического дефицита при экспериментальной модели травматического повреждения головного мозга, включающего использование триметазидина. 5 табл., 1 пр.
Способ коррекции неврологического дефицита при травматическом повреждении головного мозга, включающий воспроизведение травматического повреждения головного мозга у крыс мужского пола с массой тела 270±20 г, отличающийся тем, что для коррекции неврологического дефицита триметазидин вводят внутрижелудочно в дозе 6,6 мг/кг в сутки, разделенной на 2 приема с интервалом 12 часов с 1 по 7 день эксперимента включительно, причем триметазидин начинают вводить за 2 часа до моделирования экспериментального травматического повреждения головного мозга.
| Способ коррекции нарушения микроциркуляции в плаценте триметазидином при ADMA-подобной модели преэклампсии | 2018 |
|
RU2696196C1 |
| АЛЕКСЕЕВА Н.С | |||
| и др | |||
| Опыт применения триметазидина у больных с кохлеовестибулярными синдромами / Атмосфера | |||
| Нервные болезни, 2007, 3, стр | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| КОЗИОЛОВА Н.А | |||
| и др | |||
| ВЛИЯНИЕ ТРИМЕТАЗИДИНА НА ПОКАЗАТЕЛИ ФИЛЬТРАЦИОННОЙ И ТУБУЛОИНТЕРСТИЦИАЛЬНОЙ ФУНКЦИЙ ПОЧЕК У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА И ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ | |||
Авторы
Даты
2021-10-27—Публикация
2021-03-29—Подача