Изобретение относится к медицине, в частности к экспериментальной фармакологии.
Прототипом заявленного решения является способ коррекции поведенческого статуса солями гамма-оксимасляной кислоты при моделировании травматического повреждения головного мозга у крыс. (Литвинов, А.А. Церебропротекторные свойства солей гамма-оксимасляной кислоты и некоторые аспекты механизма их действия: дис. … к-та фарм. наук : 14.03.06 / А.А. – Литвинов. – Волгоград, 2015. – 196 с. (62-67). Механизм их действия заключается в том, что являясь производными ГАМК (гамма-аминомаслянной кислоты), которая является естественным медиатором, оказывают влияние на дофаминергическую и ГАМК-ергическую системы, обладают антигипоксическим действием, снижают интенсивность процессов перекисного окисления липидов и повышение активности ключевых ферментов антиоксидантной системы, таких как супероксиддисмутазы, каталазы. Помимо этого, соли ГОМК приводят к усилению утилизации глюкозы мозгом и снижению скорости и степени агрегации тромбоцитов. (Литвинов, А.А. Церебропротекторные свойства солей гамма-оксимасляной кислоты и некоторые аспекты механизма их действия: дис. … к-та фарм. наук : 14.03.06 / А.А. – Литвинов. – Волгоград, 2015. – 196 с. (29-33, 160-167).
Вторичные повреждения головного мозга при травматическом повреждении могут достигать 2/3 от общей зоны поражения [Zhang X., Satchell M.A., Clark R.S.B., Nathaniel P.D., Kochanek P.M., Graham S.H.Apoptosis // In: Clark R.S.B, Kochanek P.M., editor. In Brain Injury. Boston: Kluwer Academic Publishers. – 2001. – Р. 199–230.]и[Robertson G., Crocker S., Nicholson D.Neuroprotection by the inhibition of apoptosis.// BrainPathol. – 2000. – Vol. 10, № 2. – P. 283-292.]. Основными факторами определяющие степень вторичного повреждения нервной ткани при травматическом повреждении головного мозга являются эксайтотоксичность (токсическое влияние высокого содержания «возбуждающих» аминокислот), воспаление, образование реактивных свободных радикалов кислорода, активация перекисного окисления липидов и запуск механизмов “программируемой” гибели клеток (апоптоза):
1. Кабанов А.А. Нейропротекция при травмах центральной нервной системы // Лечебное дело. – 2011. – №2. – С.59-68.
2. Крылов В.В., Пурас Ю.В. Патофизиологические механизмы вторичного повреждения мозга при черепно-мозговой травме // Неврологический журнал. – 2013. – № 4. – С.4-7.
3. Мороз В.В., Кармен Н.Б., Маевский Е.И. Механизмы вторичного повреждения нейронов при тяжелой черепно-мозговой травме (часть 2) // Общая реаниматология. – 2011. – VII, 5. – С.42-45.
Неотъемлемой частью эксайтотоксичности является перегрузка клетки кальцием, образование свободных радикалов, открытие метахондриальной макропоры через которые выходят протеолитические ферменты апоптоза.
Поэтому способ коррекции неврологического статуса солями гамма-оксимасляной кислоты при моделировании травматического повреждения головного мозга у крыс является не удовлетворительным.
Задачей изобретения является создание эффективного способа коррекции поведенческого статуса при экспериментальной модели травматического повреждения головного мозга (а именно черепно-мозговой травмы - ЧМТ), включающего использование нового производного этилтиадиазола ЛХТ 12-18 - 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноата.
Синтез нового соединения осуществляли путем взаимодействия эквимолярных количеств 2-амино-5-этил-1,3,4-тиодиазола с N-ацетил-аминоэтановой кислотой.
В трехгорлую колбу, снабженную мешалкой, термометром и обратным холодильником, загружают 65 мл пропанола-2. Затем при перемешивании постепенно добавляют 2,58 г (0,02 м) 2-амино-5-этил-1,3,4-тиодиазола, к раствору постепенно добавляют 2,34 г (0,02 м) N-ацетил-аминоэтановой кислоты. Реакционную массу перемешивают при 45-50°С в течение 30 минут. Полученный раствор фильтруют, в вакууме отгоняют пропанол-2,полученный осадок перекристаллизовывают из смеси пропанола-2:ацетон (9:1). Осадок сушат до постоянной массы. Получают 3,98 г (81 %) белого кристаллического порошка с Т плав. = 159 — 161°С.
Найдено, %: С 39,01; Н 5,76; N 22,77; S 12,98
C8H14N4SO3 м.м. 246,29
Вычислено, %: С 39,02; Н 5,73; N 22,75;S 13,02; О 19,48
ИК, ν, см-1: 3405, 3210 (NH). 2970, 2890 (СН), 2420 (N+), 1590 (C=N), 1560 (COO-).
УФ: 0,002% раствор в воде максимум поглощения при 238±2 нм.
ТСХ: на пластинах Silicagel УФ 254 в системе растворителей этанол:хлороформ:аммиак-3:1:1 (одно пятно)
Задача решается способом коррекции поведенческого статуса при экспериментальной модели травматического повреждения головного мозга- ЧМТ, с использованием 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноата. Это приводит к выраженной коррекции поведенческого статуса при моделируемой патологии.
Техническим результатом предлагаемого изобретения является коррекции поведенческого статуса новым производным этилтиадиазола 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при травматическом повреждении головного мозга - ЧМТ, обладающего антиоксидантной и антигипоксической активностью и блокирующем активацию свободнорадикальных процессов, а также перекисного окисления липидов клеточных мембран, при острых нарушений регионального и общего кровообращения. Способ приводит к выраженной коррекции последствий травматического повреждения головного мозга.
СПОСОБ ОСУЩЕСТВЛЯЕТСЯ СЛЕДУЮЩИМ ОБРАЗОМ
Травматическое повреждение головного мозга вызвали (ЧМТ) у крыс мужского пола с массой тела 270±20 г [Соколова Т.Ф., Редькин Ю.В. Способ нанесения дозированной закрытой черепно-мозговой травмы у белых крыс // Вопросы нейрохирургии. –1986. – № 2. – С. 68–6]). В работе была воспроизведена техника моделирования черепно-мозговой травмы у крыс при помощи метода свободного падения груза массой 155 г с высоты 0,6 м. Установка содержит стойку, которая состоит из полой трубы длинной 1,1 м, зажатой в штативе в вертикальном положении. У нижнего края трубы располагается боек со стопором. В полость трубы на заданную высоту размещали груз. Локализацию удара осуществляли согласно анатомии головного мозга у крыс. Место осуществления удара локализировалось в лобно-теменно-височной области левого полушария ГМ. Голову грызуна жестко не закрепляли. Данная модель позволяет воспроизвести модель ЧМТ максимально приближенную к аналогичной у человека.
Воспроизводилась травма, соответствующая средней степени тяжести. 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноата (ВНЦ БАВ, Россия, Старая Купавна), производное этилтиадиазола – ЛХТ 12-18 вводили в дозе 50 мг/кг (подбор дозы осуществлялся экспериментальным путем), за 30 мин до моделирования патологии. Вещество растворяли с помощью 1% крахмального раствора и вводили внутрижелудочно через металлический зонд с гладкой оливой на конце. Далее осуществляли моделирование патологии.
Спустя 48 часов после моделирования ЧМТ проводили оценку показателей поведенческого статуса с помощью тестов «Открытое поле» и «Rota-rod» [Мартынова О.В., Анциферов О.В., Мартынов М.А., Череватенко Р.Ф., Нестерова Н.И., Нестеров А.В. Исследование нейродинамических нарушений у крыс при черепно-мозговой травме. Научные результаты биомедицинских исследований. 2019, 5(3): 50-63].
Тест «Открытое поле». Данный поведенческий тест активно используется для регистрации особенностей поведенческих реакций в фармакологии, психогенетике. Основная задача этого тестирования заключается в изучении двигательного компонента ориентировочной реакции и эмоциональной реактивности грызунов. Установка для методики «открытого поля» имеет большое число модификаций, а параметры определения в данном тесте зависят от целей исследования. У грызунов без патологий исследовательское поведение преобладает над страхом, поэтому если посадить грызуна на арену, при нормальных показателях горизонтальной и вертикальной активности, исследовательское поведение доминирует над эмоцией страха (грумингом и уровнем дефекации). Анализ поведенческого статуса с оценкой ориентировочно-исследовательской активности крыс исследовали в установке «открытое поле» (Open Field LE800S, PanLabHarvardApparatus, Испания) 10 минут. Освещение в помещение производили лампой мощностью 100 Вт, которая висела на высоте 1,5 м от низа арены. Грызунов помещали в «открытое поле» по периферии арены. После каждого животного арену протирали влажной тряпкой. Для анализа полученных данных использовалась программа Smart v.3.0.03. (PanlabHarvardApparatus, Испания). Результаты полученных данных были обобщены.
Для статистических расчетов теста «Открытое поле» были взяты следующие показатели: горизонтальная активность в центре, горизонтальная активность на периферии, стойки, норковый рефлекс, количество актов дефекации, количество актов уринации, груминг.
Тест Rota-rod направлен на характеристику моторной координации движений. В данном эксперименте использовали постоянную скорость вращения стержня – 20 об/мин. Регистрировали латентный период (ЛП) первого падения (время первого падения животного с вращающегося стержня) и суммарное время удержания на вращающемся стержне за 3 попытки.
Исходя из поставленной цели, все животные были распределены по следующим группам (n=13):
1. Интактная группа (животные с пероральным введением натрия хлорида в эквивалентных дозах).
2. Моделирование экспериментальной ЧМТ (контроль).
3. Моделирование экспериментальной ЧМТ+ ЛХТ 12-18.
ЛХТ 12-18 вводили в дозе 50 мг/кг (подбор дозы осуществлялся экспериментальным путем), за 30 мин до моделирования патологии. Соединение растворяли с помощью натрия хлорида и вводили внутрижелудочно через зонд.
Спустя двое суток производили оценку показателей поведенческого статуса. При статистической обработке данных рассчитывается среднее значение, величину стандартного отклонения. Различия считаются достоверными при p<0,05.
ПРИМЕР КОНКРЕТНОГО ВЫПОЛНЕНИЯ.
Оценку влияния ЛХТ 12-18 в дозе 50 мг/кг на поведенческий статус животных после моделирования черепно-мозговой травмы исследовали с применением теста «Открытое поле» и «Rota-rod».
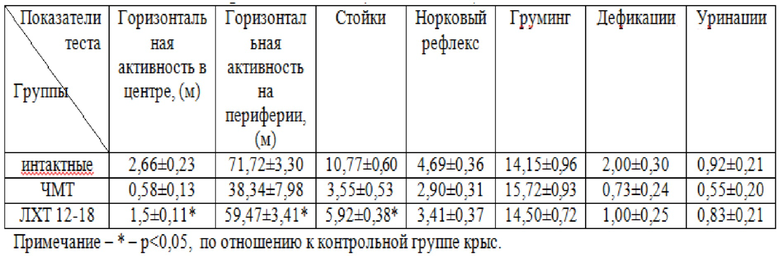
В тесте «Открытое поле» была проведена оценка двигательной и ориентировочно-исследовательской активности интактных животных, животных после моделирования ЧМТ без фармакологической коррекции и с фармакологической коррекцией производными этилтиадиазола, данные представлены в таблице 1.
Тестирование крыс с ЧМТ в тесте «Открытое поле» через 72 часа после моделирования травмы показало, что у животных, без фармакологической коррекции, двигательная и ориентировочно-исследовательская активность в сравнении с интактной группой была ниже в 2 раза и 3 раза соответственно; движение по площадке установки носило хаотичный характер с крайне редкими заглядываниями в норки и стойками, крысы не исследовали всю площадь тестовой установки.
Двигательная активность существенно снижалась во всех экспериментальных группах относительно интактных животных. Статистически значимо препятствовало снижению двигательной активности у животных на фоне ЧМТ соединение ЛХТ 12-18, при р<0,05 в сравнении с показателями контрольной группы.
В контрольной группе животных наблюдалось самое большое снижение показателя ориентировочно-исследовательской активности (таблица 1). Значения норкового рефлекса в группе с коррекцией ЛХТ 12-18 снижалось не существенно, относительно контрольной группы животных. Количество стоек в группе животных, получавших соединение ЛХТ 12-18 в дозе 50 мг/кг, увеличивалось в 1,5 раза статистически значимо (р<0,05), относительно группы контроля. Количество актов дефекации и уринации снижалось статистически не значимо. Такой показатель, как груминг статистически значимо отличался от контроля во всех экспериментальных группах (р<0,05).
Таблица 1
Влияние ЛХТ 12-18 на показатели ориентировочно- исследовательского поведения в тесте «открытое поле», (М±m; n=13)
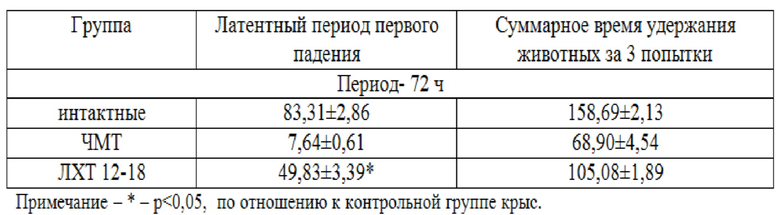
При проведении теста «Rota-rod» в контрольной группе фиксировали снижение времени удержания животных на вращающемся стержне за 1 попытку (латентный период) и 3 попытки, в сравнение с интактной группой (таблица 2). Моделирование ЧМТ у животных группы контроля вызвало проявление значительных нарушений координации. Определялась регрессия суммарного времени удержания относительно интактной группы. Статистически значимо увеличивался показатель времени удержания за 1 попытку на стержне с применением ЛХТ 12-18 в дозе 50 мг/кг (р<0,05), в сравнение с контролем. Наиболее высокие показатели в данном тесте за 1 попытку удержания регистрировали в в группе с коррекцией ЛХТ 12-18 –в 7 раз выше, чем в контроле.
Суммарное время удержания животных на стержне за 3 попытки статистически значимо отличалось в группе с применением ЛХТ 12-18 (в 1,5 раза дольше) в дозе 50 мг/кг, в сравнение с контролем (р<0,05).
Таблица 2
Влияние ЛХТ 12-18 на показатели активности крыс в тесте «Rota-rod», (М±m; n=13)
Таким образом, по результатам оценки поведенческого статуса по двум тестам было выявлено у крыс с введением производного этилтиадиазола ЛХТ 12-18 - 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноата в дозе 50 мг/кг самые высокие показатели активности. Данное соединение существенно препятствовало снижению поведенческой активности после моделирования черепно-мозговой травмы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ коррекции поведенческого статуса 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при повреждении головного мозга | 2021 |
|
RU2763012C1 |
| Способ коррекции патологии 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при травматическом повреждении головного мозга | 2021 |
|
RU2766785C1 |
| Способ коррекции неврологического дефицита 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при травматическом повреждении головного мозга | 2021 |
|
RU2758433C1 |
| Способ лечения черепно-мозговой травмы и средство для его осуществления | 2023 |
|
RU2826364C1 |
| СПОСОБ ПРОФИЛАКТИКИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ | 2018 |
|
RU2696203C1 |
| Способ коррекции неврологического дефицита при травматическом повреждении головного мозга | 2021 |
|
RU2758245C1 |
| Способ коррекции морфологических изменений при травматическом повреждении головного мозга | 2021 |
|
RU2758545C1 |
| Способ регенерации клеток головного мозга с восстановлением его функций | 2023 |
|
RU2816789C1 |
| Способ коррекции ишемии головного мозга субстанцией рапиталама в эксперименте | 2019 |
|
RU2711906C1 |
| СПОСОБ IN VIVO ОПРЕДЕЛЕНИЯ БИОСОВМЕСТИМОСТИ СКАФФОЛДОВ ДЛЯ НЕЙРОТРАНСПЛАНТАЦИИ | 2021 |
|
RU2812608C2 |
Настоящее изобретение относится к медицине, а именно к способу коррекции поведенческого статуса при травматическом повреждении головного мозга, включающему моделирование черепно-мозговой травмы у крыс свободным падением груза массой 155 г с высоты 0,6 м, характеризующемуся тем, что для коррекции патологии вводят внутрижелудочно через зонд 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноат в дозе 50 мг/кг, однократно, за 30 мин до моделирования патологии. Настоящее изобретение обеспечивает коррекцию поведенческого статуса новым производным этилтиадиазола 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноатом при травматическом повреждении головного мозга - ЧМТ, обладающим антиоксидантной и антигипоксической активностью и блокирующим активацию свободно-радикальных процессов, а также перекисное окисление липидов клеточных мембран при острых нарушениях регионального и общего кровообращения. 2 табл., 1 пр.
Способ коррекции поведенческого статуса при травматическом повреждении головного мозга, включающий моделирование черепно-мозговой травмы у крыс свободным падением груза массой 155 г с высоты 0,6 м, характеризующийся тем, что для коррекции патологии вводят внутрижелудочно через зонд 2-амино-5-этил-1,3,4-тиодиазолия-N-ацетил-аминоэтаноат в дозе 50 мг/кг, однократно, за 30 мин до моделирования патологии.
| Литвинов А.А., Церебропротекторные свойства солей гаммаоксимасляной кислоты и некоторые аспекты механизма их действия / Диссертация на соискание ученой степени кандидата фармацевтических наук, 2015, с.196 | |||
| Мартынова О.В | |||
| и др., Исследование нейродинамических нарушений у крыс при черепно-мозговой травме / Научные результаты биомедицинских |
Авторы
Даты
2021-09-29—Публикация
2021-04-01—Подача