Предлагаемое изобретение относится к медицине, биотехнологии, регенеративной медицине, тканевой инженерии, в частности, к способам получения пористых полимерных материалов, предназначенных для замещения и восстановления дефектов кости, в том числе может быть использовано для формирования костной крошки.
Одним из основных направлений современной регенеративной медицины и биотехнологий является разработка тканезамещающих материалов для восстановления поврежденных тканей и органов. Частичная замена костей, разрушенных из-за онкологических заболеваний, травм или хирургического вмешательства, остается важной медицинской проблемой. Только в России ежегодно проводится более 70 тысяч операций по восстановлению целостности поврежденной костной ткани. Использование костнозамещающих материалов и имплантатов на их основе позволяет восстанавливать повреждения костной ткани в тех случаях, когда естественной способности к регенерации недостаточно. Как известно, «золотым стандартом» костнопластической хирургии является использование аутотрансплантатов, однако, такой подход невозможен при массивных повреждениях кости и требует дополнительных операций, что значительно увеличивает риск осложнений у пациента. Другим широко востребованным материалом для костной пластики являются аллотрансплантаты - биологический материал по своим характеристикам максимально приближенный к тканям реципиента. В тоже время, в клинике часто наблюдается дефицит аллогенных костно-замещающих материалов, как и при использовании любого донорского материала. В связи с этим возникает потребность в разработке костно-замещающих материалов искусственного происхождения, которые будут доступны, недороги в производстве и способны удовлетворить потребности клиники. Так, например, известен способ получения полимерного материала в виде сферических частиц из сополимера метилметакрилата и стирола методом суспензионной полимеризации ( et al., Synthesis and characterization of poly (methyl methacrylate-styrene) copolymeric beads for bone cements // Latin American Applied Research. 2005. Vol. 35, №3. P. 175-182). Указанный способ позволяет получать полимерный материал в виде сферических частиц с молекулярной массой и размером подходящими для использования в качестве костно-замещающего материала. Однако этот способ не позволяет получить пористые частицы, что ограничивает его применяемость областью получения полимерных частиц, использующихся в качестве наполнителей, например, в костных цементах. Еще одним недостатком известного способа получения полимерных частиц является его длительность, трудоемкость и энергозатратность. Полимеризация проводится в течение 24 часов. В течение всего времени реакционная смесь поддерживается в разогретом состоянии при температуре 80-120°C. При этом, температура смеси в реакторе увеличивается по сложному нелинейному закону, отклонения от которого могут приводить к изменению свойств полимера и размера частиц. Практическая реализация указанного технологического режима требует использования высокопроизводительной и дорогостоящей аппаратуры.
et al., Synthesis and characterization of poly (methyl methacrylate-styrene) copolymeric beads for bone cements // Latin American Applied Research. 2005. Vol. 35, №3. P. 175-182). Указанный способ позволяет получать полимерный материал в виде сферических частиц с молекулярной массой и размером подходящими для использования в качестве костно-замещающего материала. Однако этот способ не позволяет получить пористые частицы, что ограничивает его применяемость областью получения полимерных частиц, использующихся в качестве наполнителей, например, в костных цементах. Еще одним недостатком известного способа получения полимерных частиц является его длительность, трудоемкость и энергозатратность. Полимеризация проводится в течение 24 часов. В течение всего времени реакционная смесь поддерживается в разогретом состоянии при температуре 80-120°C. При этом, температура смеси в реакторе увеличивается по сложному нелинейному закону, отклонения от которого могут приводить к изменению свойств полимера и размера частиц. Практическая реализация указанного технологического режима требует использования высокопроизводительной и дорогостоящей аппаратуры.
Материалы, предназначенные для замещения дефектов кости и формирования соответствующих имплантатов, должны отвечать ряду требований: отсутствие цитотоксичности, биосовместимость, способность обеспечивать полную замену костного дефекта и инициировать процессы регенерации костной ткани. Последнее предполагает новые требования для разрабатываемых материалов. Так, материалы должны обеспечивать наличие клеточной адгезии, которая позволит клеткам заселить материал/ имплантат и, впоследствии, обеспечить в месте дефекта формирование новой ткани. Наиболее перспективными для костной пластики являются неметаллические биоактивные материалы, сочетающие биологическую совместимость с живой тканью организма и долговечность, т.е. характеризующиеся медленной скоростью биодеградации. К таким материалам относятся биостабильные полимеры, которые используются в офтальмологии, стоматологии в качестве пломбировочных материалов, при операциях на костной системе в качестве фрагментов, замещающих разрушенные или удаленные части костей, конструктивных элементов искусственных суставов, крепежей, соединяющих костные разломы. Известно, что заселение клетками материала будет невозможно, если материал или формируемый на его основе имплантат не будут обладать поверхностью, способствующей адгезии клеток, и пористостью. Так, например, геометрия поверхности материала, размеры, количество пор и канальцев, обеспечивающих внутренние коммуникации между порами, могут оказывать влияние на клеточную пролиферацию, остеогенную индукцию и остеокондуктивные свойства. Наличие пор в материале (структуре скаффолда, имплантате) может обеспечивать трехмерный рост клеток с формированием множественных отростков и межклеточных контактов с образованием густой клеточной сети. Известно, что твердые пористые структуры с размером пор 10-15 мкм имеют поверхность с более высокими адгезивными свойствами по отношению к клеткам, чем материалы такого же состава без системы пор. Асимметрия и наличие вогнутостей на поверхности пористых материалов увеличивают смачиваемость субстрата, и, следовательно, повышают клеточную адгезию и выживание (Mour М. et al. Advances in Porous Biomaterials for Dental and Orthopaedic Applications // Materials 2010, 3, 2947-2974; doi:10.3390/ma3052947). Развитая система пор позволяет создать условия для поддержания нормального метаболизма, пролиферации и дифференцировки клеток, обеспечивая возможность газообмена и циркуляции жидкостей и, как следствие, последующей васкуляризации и ремоделирования регенерирующей ткани (Пат. №2695061 РФ, Способ характеристики пористости скаффолдов и/или клеточно-инженерных конструкций // Егорихина М.Н., Рубцова Ю.П., Бугрова М.Л. - №201912633; Заяв. 25.04.2019; Опубл. 19.07.2019; Бюл. №20). Примером может служить биоактивный микропористый материал, имитирующий натуральные костные структуры (Пат. №2349289 Композиция, биоактивный микропористый материал, имитирующий натуральные костные структуры, и способ его изготовления // Мастрюкова Д.Л. - №2007119647/15; Заяв. 28.05.2007; Опубл. 20.03.2009; Бюл. №8), для получения которого используется композиция, содержащая размельченное в порошок медицинское стекло, порошок гидроксиапатита и карбонатный порообразующий агент, зерна цеолита, гранулированные совместно с гидроксиапатитом. Получаемый на основе данной композиции материал обладает пористостью и хорошей биосовместимостью. Однако его существенным недостатком является крайне сложный состав исходной композиции и способ получения конечного материала, требующий обязательного ограничения поверхности контакта цеолита со стеклом прослойками инертного по отношению к стеклу гидроксиапатита, термической обработки с разделением этапов спекания и вспенивания в интервале от 600 до 1000°C (сначала медленно нагревают до температуры 600-750°C, затем ускоренно до температуры 800-1000°C, выдерживая при этой температуре 5-60 минут). Еще одним примером пористых материалов, предназначенных для замещения костной ткани, может служить композиционный материал, содержащий пористую матрицу из волокон кристаллического углерода (Пат. №2522248, Композиционный материал для замещения костной ткани // Готесман М., Денисов А.С., Змеев Ю.А., Осоргин Ю.К., Скрябин В.Л., Удинцев П.Г. - №2012132508/15; Заяв. 27.07.2012; Опубл. 10.02.2014; Бюл. №19). Существенным недостатком способа получения данного материала является многоэтапность и высокая трудоемкость процесса получения материала, а также необходимость использования при его изготовлении высокотоксичных веществ (таких как бакелит - фенолформальдегидный связующий агент), что требует особых условий обеспечения техники безопасности и может приводить к проявлению выраженной токсичности получаемого материала.
Таким образом, несмотря на большое количество разработок в области решения вопроса дефицита костно-замещающих материалов, пока не найдено оптимального решения, позволяющего из простой и доступной по составу композиции, путем использования доступных, не опасных, малотрудоемких манипуляций реализовать способ получения пористого костно-замещающего материала, позволяющего формировать в том числе, имплантаты, и обладающего отсутствием цитотоксичности и поверхностью с высокоадгезивными свойствами по отношению к клеткам и позволяющему клеткам его заселять.
В качестве прототипа выбран способ получения матрицы для клеточной трансплантологии (Патент РФ №2521194 Мухина И.В., Цыбусов С.Н., Ведунова М.В., Трифонова А.С., Треушников В.М., Колмогоров Ю.Н., Треушников В.В., Сорокина О.В. Матрица для клеточной трансплантологии // - №2011146519/15; Заяв. 16.11.2011; Опубл. 27.05.2013; Бюл. №15) заключающийся в том, что в реакционную колбу, снабженную мешалкой, последовательно вводят компоненты: олигоуретанметакрилат; октилметакрилат; 2,2-диметокси-2-фенилацетофенон; 2,4-дитретбутилортохинон. Полученную смесь перемешивают при комнатной температуре в течение 40 мин до полного растворения. После перемешивания композицию отфильтровывают и откачивают с помощью вакуумного насоса при давлении 0,5-1 мм рт. ст. до полного прекращения газовыделения. На гидрофобную подложку, с установленной по краю прокладкой, формирующей толщину пластины, наливают композицию. Затем накрывают фотошаблоном, содержащим прозрачный рисунок на непрозрачном для УФ-света фоне (отверстия перфораций соответствуют непрозрачному фону, остальное - прозрачному), и плотно сжимают. Полученную конструкцию облучают УФ-светом с длиной волны 320-380 нм со стороны фотошаблона в течение времени, оптимального для воспроизведения заданной геометрии. После облучения фотошаблон и подложку разъединяют. Полученную полимерную пластину промывают в подходящем растворителе от остатков неотвержденной композиции и сушат до полного удаления растворителя. При реализации способа, выбранного в качестве прототипа, получают матрицу в виде плоской пластины со сквозными отверстиями с хорошей адгезивной способностью, являющуюся биосовместимой и биорезорбируемой.
Способ, представленный в прототипе, не позволяет получить полимерный материал, содержащий в своем объеме открытые поры. Этот существенный недостаток значительно снижает функциональность материала / матрицы, получаемой путем реализации способа, описанного в прототипе, так как отсутствие системы пор не позволит осуществляться газообмену и обмену жидкостями и заселить материал клеткам и, таким образом, вряд ли возможно его применение в качестве костно-замещающего материала, который позволяет нарастить на месте дефекта новую ткань. Значительным недостатком способа является использование УФ-излучения, что требует кварцевых стекол для использования в качестве подложек и дополнительных мер безопасности для работающего персонала. Кроме того, излучение видимого диапазона претерпевает меньшее рассеивание в полимеризующемся слое композиции по сравнению с УФ. Это обеспечивает более однородное протекание процесса полимеризации и, соответственно, формирование однородной по свойствам полимерной пластины с открытыми порами.
Задача предполагаемого изобретения - усовершенствование способа за счет получения полимерного материала для замещения дефектов кости, обладающего пористостью, отсутствием цитотоксичности, биосовместимостью, адгезивной поверхностью по отношению к клеткам, позволяющего клеткам поддерживать жизнеспособность и характерную морфологию.
Технический результат - разработка способа получения полимерного материала, содержащего в своем объеме открытые поры, предназначенного для замещения костных дефектов менее трудоемким, более быстрым, безопасным и доступным способом.
Технический результат достигается за счет того, что в способе, включающем фотополимеризацию композиции, содержащей полифункциональный мономер винилового ряда, инициатор фотополимеризации, промывку полимера от непрореагировавшего мономера и высушивание полимера, используется фотополимеризующаяся композиция, содержащая полифункциональный мономер, фотоинициирующую систему, чувствительную в видимом диапазоне спектра, и неполимеризационноспособный порообразующий компонент, в качестве которого берут соединение с формулой СпШп+10Н где п=Т-8 или смесь таких соединений, что обеспечивает формирование полимерной пластины с открытыми порами со средним размером в интервале 10-15 мкм при следующем соотношении компонентов (мас.%):
Где в качестве третичного амина берут триэтиламин или N,N-диметициклогексиламин, или N.N-диметилэтаноламин, или N.N-диэтилэтаноламин, или их смесь. Фотополимеризация происходит в реакторе прозрачном к инициирующему полимеризацию видимому излучению, облучение композиции в реакторе производят до ее отверждения, удаление неполимеризационноспособного порообразующего компонента из полученного полимера с открытыми порами в объеме полимера проводят путем промывки в органическом растворителе, нерастворяющем полимер, с последующим его удалением за счет испарения.
Способ получения полимерного материала для замещения дефектов кости и формирования костнозамещающих имплантов осуществляют следующим образом:
1. В реакционную емкость, снабженную мешалкой, последовательно вводят компоненты фотополимеризующейся композиции в следующем соотношении, маc.%:
2. Полученную смесь перемешивают без доступа света при комнатной температуре в течение 40 мин до полного растворения компонентов и отфильтровывают.
3. Собирают форму для фотополимеризации, состоящую из двух силикатных стекол с прокладкой между ними требуемой толщины, и заливают в нее фотополимеризующуюся композицию.
4. Форму с композицией облучают источником видимого излучения при освещенности 50 кЛк до образования мутного твердого полимера.
5. Форму разбирают, полученную полимерную пластину промывают в подходящем растворителе от остатков неотвержденной композиции и сушат до полного удаления растворителя.
Способ поясняется следующими рисунками.
Рис. 1. Культура МСК (объектив 5х, окуляр 10х; световая микроскопия), культивирование в эксперименте 24 часа (а) совместное культивирование с образцами материала №1, (б) контрольная культура.
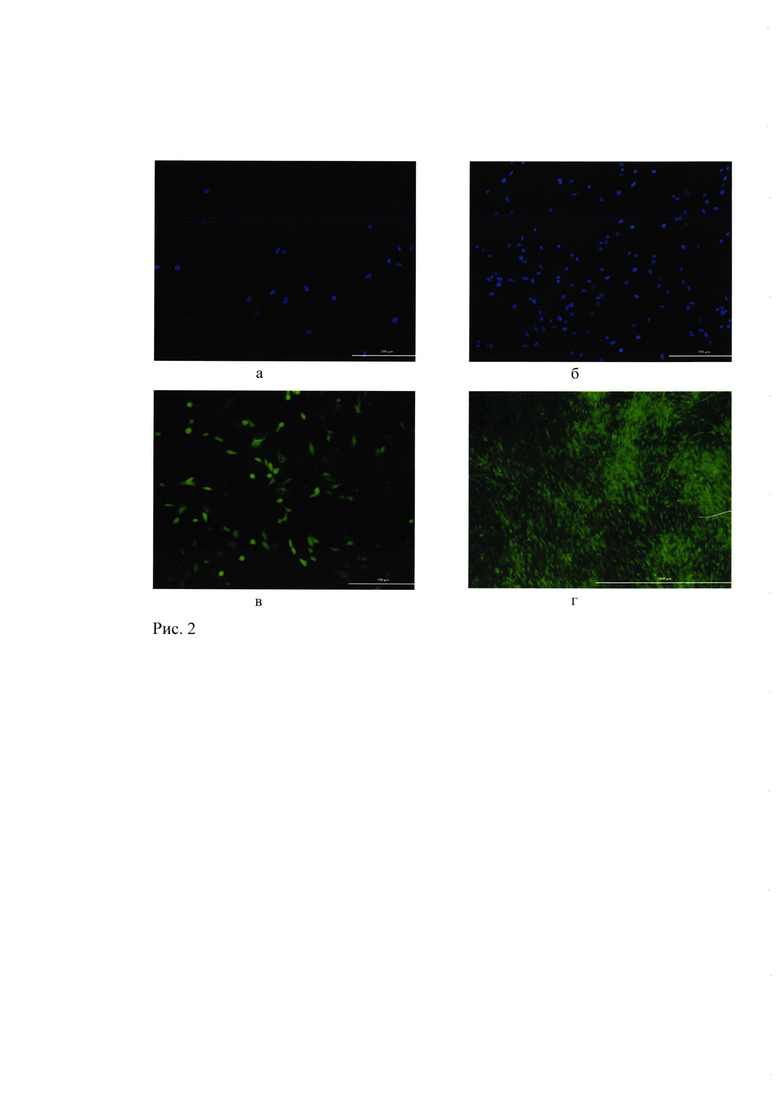
Рис. 2. МСК на поверхности образцов материала №1. (а) 24 часа культивирования, (б) 72 часа культивирования; окрашивание ядер (синий) флуорохромом Hoechst 3334 (100х увеличение), (в) 72 часа культивирования (100х увеличение), (г) 7 суток культивирования (50х увеличение); окрашивание специфическим флуоресцентным красителем Calcein AM (зеленый) - окрашиваются только жизнеспособные клетки.
Рис. 3. Культура ДФЧ (объектив 20х, окуляр 10х; фазово-контрастная микроскопия), культивирование в эксперименте 72 часа (а) совместное культивирование с образцами материала, (б) контрольная культура.
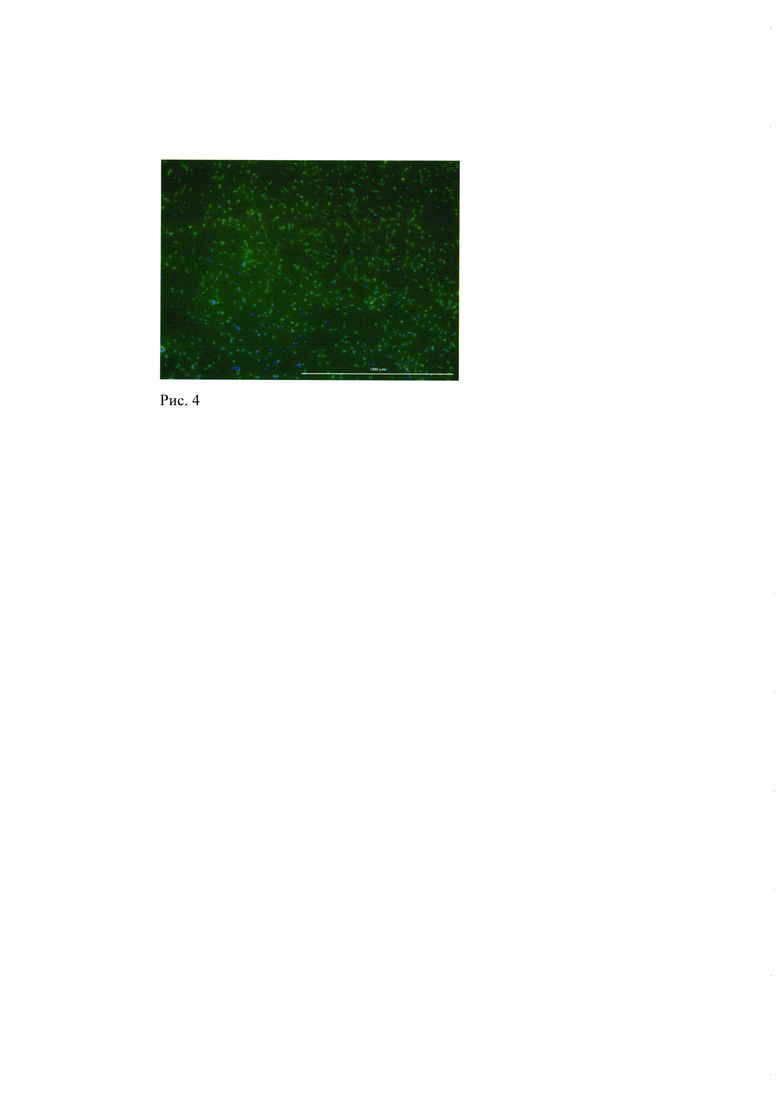
Рис. 4. МСК высеянные на поверхность образцов материала. 24 часа культивирования, окрашивание ядер (синий) флуорохромом Hoechst 3334, окрашивание специфическим флуоресцентным красителем Calcein AM (зеленый) - окрашиваются только жизнеспособные клетки (50х увеличение).
Рис. 5. МСК высеянные на поверхность образцов материала. 24 часа культивирования, окрашивание ядер (синий) флуорохромом Hoechst 3334 (50х увеличение).
Также способ поясняется примерами его реализации.
Пример 1
Пористый полимерный материал для замещения дефектов кости и формирования костнозамещающих имплантов получали из фотополимеризующейся композиции, которую готовили последовательным смешением в реакционной емкости, снабженной мешалкой, 2 г диметакрилата этиленгликоля, 5.832 г 1-бутанола, 0.008 г 3,6-ди-трет-бутилбензохинон-1,2 и 0.16 г N,N-диметилциклогексиламина. В ходе реализации представленного способа (п.2-5), была получена пластина пористого полимерного материала. Пористость и средний размер пор в полученном полимерной пластине (материал №1) определены методом ртутной порометрии (PASCAL EVO 140/440 ULTRA MACRO, Thermo Fisher Scientific): пористость 77.6%; доля открытых взаимосвязанных пор составляет 0.98; средний размер пор 12.1 мкм.
Полученная пластина материала №1 размолота в агатовой ступке, фракционирована и определены поровые характеристики крошки костно-замещающего пористого полимерного материала размером 0.25-0.65 мм (материал №2) и 0.65-1.15 мм (материал №3). Материал №2: пористость 76.4%, доля открытых взаимосвязанных пор составляет 0.97; средний размер пор 12.4 мкм. Материал №3: пористость 76.7%; доля открытых взаимосвязанных пор составляет 0.97; средний размер пор 12.3 мкм.
Была проведена оценка материала №1, полученного, согласно представленному способу, на цитотоксичность с помощью МТТ-теста. Для этого образцы материала №1 заливались средой α-МЕМ с антибиотиками и 2% телячьей эмбриональной сыворотки на сутки и помещались в CO2 инкубатор (37°C, 5% СО2). Экстракт над образцами отбирали спустя 1 и 7 суток. Мезенхимальные стволовые клетки жировой ткани человека (МСК) в концентрации 1×105 были засеяны на лунки плоскодонного 96 луночного планшета в среде α-МЕМ с антибиотиками и 10% инактивированной телячьей эмбриональной сыворотки и культивировались в стандартных условиях в течение 3 дней. После 3 дней культивирования ростовая среда над клетками заменялась экстрактом от образцов в разной концентрации (1:1; 1: 2; 1:4). Через 24 часа среда в лунках заменялась раствором МТТ (1 мг/мл) и клетки инкубировались с МТТ еще 4 часа. Через 4 часа инкубации супернатант аспирировали, добавляли ДМСО (200 мкл) и измеряли оптическую плотность при 540 нм. Относительную интенсивность роста определяли по следующей формуле: ОИР (%) = (средняя ОП в тестовой культуре / средняя ОП в контроле) × 100. Полученные данные оценивали, ориентируясь на шкалу оценки цитотоксичности (S. Shanmugam, В Copal / Antimicrobial and cytotoxicity evaluation of aliovalent substituted hydroxyapatite // Applied Surface Science, 2014, 303; 277-281. http://dx.doi.org/10.1016/j.apsusc.2014.02.166). Установлено, что экстракт, отобранный от образцов материала №1, не оказывал цитотоксического действия на клетки (Таблица 1), что подтверждает отсутствие цитотоксических свойств материала №1 - уровень цитотоксичности 0-1.

Для исследования образцов материала №1 на биосовместимость использовали тест прямого контакта. Для этого образцы переносили на культуру МСК и заливали 5 мл полной ростовой среды. МСК за 24 часа до начала эксперимента высевали на культуральные чашки (60 mm × 15 mm, Corning, USA) с плотностью 20 тыс/см2. МСК с образцами материала культивировали в CO2 инкубаторе при стандартных условиях. Контролем служила культура МСК, культивируемая в тех же условиях и той же концентрации, но без образцов. Через 24 часа после начала взаимодействия с образцами оценивали состояние культивируемых клеток. Было установлено, что после совместного культивирования с образцами материала №1 МСК не отличались от контрольной культуры (Рис. 1). Клетки были морфологически однородны, типичной преимущественно веретенообразной и реже звездчатой формы, характеризовались четкими контурами, выраженными отростками, по центру клеток фиксировались овальные ядра с плотными ядрышками, клетки образовывали субконфлюэнтный монослой. Жизнеспособность клеток составляла 98-99%. Результаты этого исследования подтверждают биосовместимость материала полученного представленным способом.
Для оценки адгезивных свойств и дополнительных биологических характеристик взаимодействия клеток с материалом №1 на поверхность представленного материала высевали МСК. Образцы с МСК культивировали в стандартных условиях в CO2 инкубаторе. Показано, что через 24 часа клетки хорошо определялись на поверхности материала (Рис. 2а). Через 72 часа культивирования количество клеток на поверхности материала значительно увеличивалось, что свидетельствует о поддержании клетками пролиферативной активности при взаимодействии с материалом (Рис. 2б). Клетки характеризовались высокой жизнеспособностью (Рис. 2в). На 7 сутки культивирования вся поверхность образцов материала была заселена клетками с высокой жизнеспособностью (Рис. 2г). Клетки на поверхности материала сохраняли типичные для МСК морфологические характеристики и к 7 суткам формировали конфлюэнтный монослой.
Размолотый материал №1 в виде крошки (материал №2 и №3) проявлял те же свойства - отсутствие цитотоксичности, биосовместимость, адгезивность поверхности в отношении клеток, что и материал №1 в виде пластины.
Таким образом, предлагаемый способ позволяет получить костнозамещающий материал в виде пластины или, при ее помоле, материал в виде крошки с размером частиц от 0.25 до 1.15 мм с системой открытых связанных пор размером - 12 мкм, занимающей - 77% общего объема материала. Материал характеризуется отсутствием цитотоксичности, хорошей биосовместимостью, поверхность материала позволяет клеткам адгезировать; культивирование клеток на поверхности материала не оказывает негативного влияния на их жизнеспособность, морфологию и пролиферативную активность, что подтверждает перспективность использования данного материала в клинической практике в качестве костнозамещающего материала.
Пример 2.
Пористый полимерный материал для замещения дефектов кости и формирования костнозамещающих имплантов получали из фотополимеризующейся композиции, которую готовили последовательным смешением в реакционной емкости, снабженной мешалкой, 6 г диметакрилата этиленгликоля, 13.89 г этанола или его смеси с метанолом в весовом соотношении 9:1, 0.01 г 3,6-ди-трет-бутилбензохинон-1,2 и 0.1 г триэтиламина, или N,N-диметициклогексиламина, N,N-диметилэтаноламина, или N,N-диэтилэтаноламина, или смеси N,N-диметициклогексиламина с N,N-диметилэтаноламином.
В ходе реализации представленного способа (п. 2-5), были получены пластины пористых полимерных материалов.
Пористость и средний размер пор в полученных полимерных пластинах определены методом ртутной порометрии (PASCAL EVO 140/440 ULTRA MACRO, Thermo Fisher Scientific). Результаты приведены в Таблице 2.

Была проведена оценка образцов материала, полученного, согласно представленного способа, состава 1, на цитотоксичность с помощью МТТ-теста. Для этого образцы материала заливались средой α-МЕМ с антибиотиками и 2% телячьей эмбриональной сыворотки на сутки и помещались в CO2 инкубатор (37°C, 5% CO2). Экстракт над образцами отбирали спустя 1 и 7 суток. Мезенхимальные стволовые клетки жировой ткани человека (МСК) в концентрации 1×105 были засеяны на лунки плоскодонного 96 луночного планшета в среде α-МЕМ с антибиотиками и 10% инактивированной телячьей эмбриональной сыворотки и культивировались в стандартных условиях в течение 3 дней. После 3 дней культивирования ростовая среда над клетками заменялась экстрактом от образцов в разной концентрации (1:1; 1:2; 1:4). Через 24 часа среда в лунках заменялась раствором МТТ (1 мг/мл) и клетки инкубировались с МТТ еще 4 часа. Через 4 часа инкубации супернатант аспирировали, добавляли ДМСО (200 мкл) и измеряли оптическую плотность при 540 нм. Относительную интенсивность роста определяли по следующей формуле:
ОИР (%) = (средняя ОП в тестовой культуре / средняя ОП в контроле) × 100. Полученные данные оценивали, ориентируясь на шкалу оценки цитотоксичности (S. Shanmugam, В Copal / Antimicrobial and cytotoxicity evaluation of aliovalent substituted hydroxyapatite // Applied Surface Science, 2014, 303; 277-281. http://dx.doi.Org/10.1016/j.apsusc.2014.02.166). Установлено, что экстракт, отобранный от образцов материала, не оказывал цитотоксического действия на клетки (Таблица 3), уровень цитотоксичности соответствовал 0-1.

Для исследования образцов материала на биосовместимость использовали тест прямого контакта. Для этого образцы переносили на культуру дермальных фибробластов человека (ДФЧ) и заливали 5 мл полной ростовой среды. ДФЧ за 24 часа до начала эксперимента высевали на культуральные чашки (60 mm × 15 mm, Corning, USA) с плотностью 20 тыс./см2. ДФЧ с образцами материала культивировали в CO2 инкубаторе при стандартных условиях. Контролем служила культура ДФЧ культивируемая в тех же условиях и той же концентрации, но без образцов. Через 72 часа оценивали состояние ДФЧ. Было установлено, что после совместного культивирования с образцами материала культура ДФЧ не отличались от контрольной культуры (Рис. 3). Клетки были морфологически однородны (преимущественно веретенообразной формы, с четкими контурами, выраженными отростками, по центру клеток фиксировались овальные ядра с плотными ядрышками) и образовывали субконфлюэнтный монослой. Жизнеспособность клеток составляла 98-99%. Результаты этого исследования подтверждают биосовместимость материала, полученного представленным способом.
Для оценки адгезивных свойств и дополнительных биологических характеристик взаимодействия клеток с материалом на поверхность представленного материала высевали МСК. Образцы с МСК культивировали в стандартных условиях в CO2 инкубаторе. Показано, что через 24 часа клетки хорошо адгезировали к поверхности материала и равномерно заселяли поверхность образца. Клетки характеризовались высокой жизнеспособностью и проявляли характерные для МСК морфологические характеристики (Рис. 4).
Таким образом, предлагаемый способ позволяет получить костнозамещающий материал в виде пластины с системой открытых связанных пор с пористостью 71.2-75.3%; средним размером пор 10.7-15.5 мкм. Материал характеризуется отсутствием цитотоксичности, хорошей биосовместимостью, поверхность материала позволяет клеткам адгезировать. Материал не оказывает негативного влияния на жизнеспособность клеток и их морфологию, что подтверждает перспективность использования данного материала в клинической практике в качестве костно-замещающего материала.
Пример 3.
Пористый полимерный материал для замещения дефектов кости и формирования костнозамещающих имплантов получали из фотополимеризующейся композиции, которую готовили последовательным смешением в реакционной емкости, снабженной мешалкой 1.5 г диметакрилата этиленгликоля, 8.197 г 1-бутанола, 0.003 г 3,6-ди-трет-бутилбензохинон-1,2 и 0.3 г N,N-диэтилэтаноламина. В ходе реализации представленного способа (п. 2-4) была проведена фотополимеризация композиции в форме. При разборе формы полимер распался на отдельные куски.
Не соответствие соотношения компонентов фотополимеризующейся композиции, тому которое описано в представленном способе может приводить к формированию полимерного материала с механическими свойствами, не позволяющими извлечь его из формы, что не позволяет проводить с ним дальнейшую работу и соответственно исключает возможность его использования в качестве костно-замещающего материала.
Пример 4.
Пористый полимерный материал для замещения дефектов кости и формирования костнозамещающих имплантов получали из фотополимеризующейся композиции которую готовили последовательным смешением в реакционной емкости, снабженной мешалкой 4.5 г диметакрилата этиленгликоля, 5.43 г 1-бутанола, 0.03 г 3,6-ди-трет-бутилбензохинон-1,2 и 0.04 г N,N-циклогексиламина. В ходе реализации представленного способа (п. 2-5) была получена пластина пористого полимерного материала размером 80×80×1.5 мм. Пористость и средний размер пор в полученном полимерной пластине определены методом ртутной порометрии (PASCAL EVO 140/440 ULTRA MACRO, Thermo Fisher Scientific): пористость 60.7%, т.е. доля открытых взаимосвязанных пор составляет 0.99; средний размер пор 3.9 мкм.
Не соответствие соотношения компонентов фотополимеризующейся композиции, тому которое описано в представленном способе может приводить к уменьшению среднего размера пор, что может приводить к затруднению при осуществлении газообмена и обмена жидкостями и, как следствие, отрицательно сказаться на возможности васкуляризации и ремоделирования регенерирующей костной ткани после имплантации материала.
Для оценки адгезивных свойств материала на его поверхность высевали МСК. Образцы с МСК культивировали в стандартных условиях в CO2 инкубаторе. Показано, что через 24 часа лишь единичные клетки адгезировали к поверхности материала, равномерного заселения поверхности образца клетками не наблюдали (Рис. 5). Низкая клеточная адгезия и отсутствие равномерного заселения образцов материала клетками in vitro свидетельствует о том, что при имплантации такого материала в костную ткань in vivo вряд ли позволит клеткам реципиента заселить материал, соответственно это исключает полноценное ремоделирование поврежденной костной ткани.
Таким образом, предложенный способ, позволяет получить пористый полимерный костнозамещающий материал со средним размером пор в интервале 10-15 мкм. Получаемый согласно способу материал имеет высокую биосовместимость и демонстрирует отличные адгезивные свойства поверхности по отношению к поверхностно зависимым клеткам, позволяя им заселять его структуру, что предполагает высокий регенеративный потенциал материала и изготовленных из него имплантатов при замещении дефектов кости.
Фотополимеризация слоя композиции, содержащей полифункциональный мономер и неполимеризационноспособный порообразующий агент, сопровождается гетерофазным разделением композиции в процессе ее полимеризации. Это приводит к светорассеиванию инициирующего излучения на границах раздела фаз и снижению интенсивности излучения по толщине слоя. Светорассеивание уменьшается с увеличением длины волны инициирующего излучения, соответственно, инициирование полимеризации видимым излучением предпочтительнее по сравнению с ультрафиолетовым излучением (УФ). Использование для отверждения полимера видимого света вместо УФ излучения повышает безопасность реализации способа для персонала, не требует использования специализированых источников УФ излучения и кварцевых стекол в качестве материала реактора, что значительно удешевляет и упрощает способ, а также повышает его доступность.
В качестве фотоинициаторов полимеризации, чувствительных в видимом диапазоне спектра, описанный способ позволяет использовать известные, доступные и относительно не дорогие системы о-бензохинон - амин. Они обладают чувствительностью к излучению до 600 нм и обеспечивают более однородное протекание процесса в слое фотополимеризующейся композиции.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОТОПОЛИМЕРИЗУЮЩАЯСЯ КОМПОЗИЦИЯ ДЛЯ ОДНОСТАДИЙНОГО ПОЛУЧЕНИЯ ПОЛИМЕРНОГО НАНОПОРИСТОГО МАТЕРИАЛА С ГИДРОФОБНОЙ ПОВЕРХНОСТЬЮ ПОР, НАНОПОРИСТЫЙ ПОЛИМЕРНЫЙ МАТЕРИАЛ С СЕЛЕКТИВНЫМИ СОРБИРУЮЩИМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ОДНОСТАДИЙНОГО ФОРМИРОВАНИЯ НА ЕГО ОСНОВЕ ВОДООТДЕЛЯЮЩИХ ФИЛЬТРУЮЩИХ ЭЛЕМЕНТОВ И СПОСОБ ОЧИСТКИ ОРГАНИЧЕСКИХ ЖИДКОСТЕЙ ОТ ВОДЫ | 2013 |
|
RU2525908C1 |
| ФОТОПОЛИМЕРИЗУЮЩАЯСЯ КОМПОЗИЦИЯ ДЛЯ ОДНОСТАДИЙНОГО ПОЛУЧЕНИЯ ПОЛИМЕРНОГО НАНОПОРИСТОГО МАТЕРИАЛА С ГИДРОФОБНОЙ ПОВЕРХНОСТЬЮ ПОР, НАНОПОРИСТЫЙ ПОЛИМЕРНЫЙ МАТЕРИАЛ С СЕЛЕКТИВНЫМИ СОРБИРУЮЩИМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ОДНОСТАДИЙНОГО ФОРМИРОВАНИЯ НА ЕГО ОСНОВЕ ВОДООТДЕЛЯЮЩИХ ФИЛЬТРУЮЩИХ ЭЛЕМЕНТОВ И СПОСОБ ОЧИСТКИ ОРГАНИЧЕСКИХ ЖИДКОСТЕЙ ОТ ВОДЫ | 2013 |
|
RU2537860C2 |
| ПОРИСТЫЙ ПОЛИМЕРНЫЙ ТРЕХМЕРНЫЙ ОБЪЕКТ СЛОЖНОЙ ФОРМЫ И СПОСОБ ИЗГОТОВЛЕНИЯ ПОРИСТОГО ПОЛИМЕРНОГО ТРЕХМЕРНОГО ОБЪЕКТА СЛОЖНОЙ ФОРМЫ | 2020 |
|
RU2783378C2 |
| ТКАНЕВЫЕ КОНСТРУКЦИИ, ПОЛУЧЕННЫЕ С ПОМОЩЬЮ БИОИНЖЕНЕРИИ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2645473C2 |
| КОСТНОЗАМЕЩАЮЩИЙ МАТЕРИАЛ | 2012 |
|
RU2518753C1 |
| МАТРИЦА ДЛЯ КЛЕТОЧНОЙ ТРАНСПЛАНТОЛОГИИ | 2011 |
|
RU2521194C2 |
| СПОСОБ БЛОЧНОЙ ФОТОПОЛИМЕРИЗАЦИИ, ФОТОПОЛИМЕРИЗУЮЩАЯСЯ КОМПОЗИЦИЯ | 1994 |
|
RU2138070C1 |
| ХИРУРГИЧЕСКИЙ МАТЕРИАЛ (ВАРИАНТЫ) | 2010 |
|
RU2433836C1 |
| БИОАКТИВНЫЙ РЕЗОРБИРУЕМЫЙ ПОРИСТЫХ 3D-МАТРИКС ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2533457C1 |
| БИОТРАНСПЛАНТАТ НА ОСНОВЕ ПЕНОКЕРАМИЧЕСКИХ НОСИТЕЛЕЙ СИСТЕМЫ ОКСИД ЦИРКОНИЯ - ОКСИД АЛЮМИНИЯ И МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА ЧЕЛОВЕКА ДЛЯ ВОССТАНОВЛЕНИЯ ПРОТЯЖЕННЫХ ДЕФЕКТОВ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2386453C1 |



Изобретение относится к медицине, биотехнологии, регенеративной медицине, тканевой инженерии, в частности к способу получения полимерного материала для замещения дефектов кости и формирования костнозамещающих имплантатов. Способ включает фотополимеризацию композиции, содержащей полифункциональный мономер винилового ряда, инициатор фотополимеризации, промывку полимера от непрореагировавшего мономера и высушивание полимера. Полимеризацию проводят под действием видимого излучения, при этом фотополимеризующаяся композиция содержит диметакрилат этиленгликоля, 3,6-ди-трет-бутилбензохинон-1,2 и третичный амин в качестве фотоинициирующей системы, чувствительной в видимом диапазоне спектра, и неполимеризационноспособный порообразующий компонент, в качестве которого берут соединение с формулой CnH2n+1OH, где n=1-8 или смесь таких соединений, что обеспечивает формирование пластины полимера с открытыми порами со средним размером в интервале 10-15 мкм при следующем соотношении компонентов (мас.%): диметакрилатэтиленгликоля 20-40; неполимеризационноспособный порообразующий компонент 57.8-79.45; 3,6-ди-трет-бутилбензохинон-1,2 0.05-0.2; третичный амин 0.5-2.0. Технический результат – получение простой и доступной по составу композиции путем использования доступных, не опасных, малотрудоемких манипуляций, позволяющей формировать имплантаты, обладающие отсутствием цитотоксичности и поверхностью с высокоадгезивными свойствами по отношению к клеткам и позволяющему клеткам его заселять. 3 з.п. ф-лы, 4 пр., 3 табл., 5 ил.
1. Способ получения полимерного материала для замещения дефектов кости и формирования костнозамещающих имплантов, включающий фотополимеризацию композиции, содержащей полифункциональный мономер винилового ряда, инициатор фотополимеризации, промывку полимера от непрореагировавшего мономера и высушивание полимера, отличающийся тем, что полимеризацию проводят под действием видимого излучения, при этом фотополимеризующаяся композиция содержит диметакрилат этиленгликоля, 3,6-ди-трет-бутилбензохинон-1,2 и третичный амин в качестве фотоинициирующей системы, чувствительной в видимом диапазоне спектра, и неполимеризационноспособный порообразующий компонент, в качестве которого берут соединение с формулой CnH2n+1OH где n=1-8 или смесь таких соединений, что обеспечивает формирование пластины полимера с открытыми порами со средним размером в интервале 10-15 мкм при следующем соотношении компонентов (мас.%):
2. Способ по п. 1, отличающийся тем, что в качестве третичного амина берут N,N-диметициклогексиламин, N,N-диметилэтаноламин, N,N-диэтилэтаноламин, триэтаноламин или их смесь, взятых в любом соотношении.
3. Способ по пп. 1, 2, отличающийся тем, что фотополимеризацию композиции проводят в реакторе, прозрачном к инициирующему полимеризацию видимому излучению.
4. Способ по пп. 1-3, отличающийся тем, что для удаления неполимеризационноспособного порообразующего компонента или смеси порообразующих компонентов пористый полимер промывают в органическом растворителе, не растворяющем полимер с последующим его удалением за счет испарения.
| МАТРИЦА ДЛЯ КЛЕТОЧНОЙ ТРАНСПЛАНТОЛОГИИ | 2011 |
|
RU2521194C2 |
| KOVILIN R.S | |||
| et al., Biocompatible non-toxic porous polymeric materials based on carbonate - and phthalate - containing dimethacrylates, Chemistry Select, 2019, no.4, p | |||
| Автоматический регулятор температуры помещений | 1923 |
|
SU4147A1 |
| КОМПОЗИЦИЯ, БИОАКТИВНЫЙ МИКРОПОРИСТЫЙ МАТЕРИАЛ, ИМИТИРУЮЩИЙ НАТУРАЛЬНЫЕ КОСТНЫЕ СТРУКТУРЫ, И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2007 |
|
RU2349289C1 |
| Способ упрочнения полимерных скаффолдов из полилактида | 2018 |
|
RU2686106C1 |
| МАТРИЦА ДЛЯ РЕГЕНЕРАЦИИ МЯГКИХ ТКАНЕЙ | 2013 |
|
RU2526182C1 |
| ИМПЛАНТАТ ДЛЯ ПЛАСТИКИ ДЕФЕКТОВ ТВЕРДОЙ МОЗГОВОЙ ОБОЛОЧКИ | 2009 |
|
RU2436596C2 |
Авторы
Даты
2021-11-02—Публикация
2020-07-13—Подача