ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/347725, поданной 24 мая 2010 г., предварительной заявки на патент США №61/337938, поданной 12 февраля 2010 г., и предварительной заявки на патент США №61/295073, поданной 14 января 2010 г.; содержание каждой из которых полностью и непосредственно включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Кость, хрящ, сухожилия, связки, мышцы, жировая ткань и строма костного мозга являются примерами мезенхимальных тканей (т.е. тканей, развивающихся из мезенхимальных стволовых клеток).
Мезенхимальные ткани могут повреждаться во время хирургических операций или же их заболевание может развиваться в результате генетического нарушения или внешних воздействий.
Соответственно, существует потребность в новых способах терапии для восстановления больных или поврежденных тканей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке описаны биоинженерные конструкции, содержащие внеклеточный матрикс (ВКМ) в формах, оптимизированных для конкретного терапевтического применения. Некоторые конструкции состоят из внеклеточного матрикса, синтезируемого культивируемыми мезенхимальными стволовыми клетками (МСК). Некоторые конструкции также содержат клетки, синтезирующие указанный матрикс. В некоторых конструкциях указанные клетки девитализированы. В других конструкциях клетки, синтезирующие внеклеточный матрикс, удалены для получения бесклеточных (децеллюляризованных) конструкций.
Некоторые конструкции имеют толщину по меньшей мере приблизительно 30 мкм. Некоторые конструкции включают поры со средним диаметром в диапазоне от 10 до 100 мкм. Некоторые конструкции обладают средней Fmax, равной по меньшей мере 0,4 Н. Некоторые конструкции обладают пределом прочности на растяжение (UTS), равным по меньшей мере 0,4 МПа. Некоторые конструкции обладают по меньшей мере 0,4-кратным допуском упругой деформации относительно начальной длины.
ВКМ в указанных конструкциях может затем быть обработан (например, быть дегидратирован, сшит перекрестными связями, сокращен, микронизирован, стерилизован и т.д.) или скомбинирован с другими биологически активными веществами или вспомогательными материалами (например, шелком, адгезивом и т.д.) для получения терапевтических продуктов.
Также описаны способы получения и модификации указанных биоинженерных конструкций, включая способы контроля толщины конструкции, размера пор и состава.
Описанные в настоящей заявке биоинженерные конструкции могут вводиться пациентам для увеличения жизнеспособности, стимуляции роста и/или восстановления мягкой ткани, в том числе для лечения хронических или острых ран.
Другие характеристики и преимущества будут ясны из приведенных ниже подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1А-1В приведен анализ зависимости формирования внеклеточного матрикса от времени с применением МСК в период с 5 по 12 день (Фиг.1А) или с 12 по 18 день (Фиг.1 В), n=9 (3 независимых конструкции на группу с тремя измерениями для каждой конструкции). Приведены линия тренда и уравнение касательной.
На Фиг.2 показана корреляция между увеличением толщины биоинженерной конструкции как функции от увеличивающейся концентрации ТФР-альфа. В отсутствие ТФР-альфа: 0 нг/мл; 1,5х:30 нг/мл ТФР-альфа; 5х:100 нг/мл ТФР-альфа; и 10х:200 нг/мл ТФР-альфа, n=9 (3 независимых конструкции на группу с тремя измерениями для каждой конструкции), за исключением 1,5х и 10х, где n=6 (2 независимых конструкции на группу и 3 измерения для каждой конструкции).
На Фиг.3 показана корреляция между уменьшением толщины биоинженерной конструкции как функции от увеличения концентрации простагландина 2 (ПГЕ2) при постоянном количестве ТФР-альфа 20 нг/мл. Без ПГЕ2: 0 нг/мл; 5х:19 нг/мл ПГЕ2; 10х:38 нг/мл ПГЕ2; и 50х: 190 нг/мл ПГЕ2. n=9 (3 независимых конструкции на группу с тремя измерениями для каждой конструкции).
На Фиг.4 показана корреляция между увеличением толщины биоинженерной конструкции как функции от увеличивающейся концентрации ТФР-альфа и плотности посева клеток среди биоинженерных конструкций, получаемых из МСК различных клеточных типов (ДФЧ, неонатальных фибробластов кожи человека; HUCPVC, периваскулярных клеток пуповины человека; КМ-МСК: мезенхимальных стволовых клеток, полученных из костного мозга; и Pre-Adipo: преадипоцитов). Применяли культуральную среду с заданным химическим составом, описанную в примере 1 (например, 200 нг/мл ТФР-альфа) и густота посева составляла 30×106 клеток на 75 мм вкладыш, что эквивалентно 9,6×106 клеткам на 24 мм вкладыше. Измерения толщины матрикса, полученного из окрашенных гематоксилином - эозином срезов, фиксированных после 18 дней культивирования. Столбцы (среднее±стандартное отклонение, n=12) соответствуют средней толщине n=3 независимых конструкций, измеренной в 4 различных местоположениях.
На Фиг.5А-5 В показаны типичные окрашенные гематоксилином-эозином, окрашенные трехцветно по Goldner-Masson (MTG) срезы и SEM-снимки срезов биоинженерных конструкций, полученных из МСК клеток разных типов (ДФЧ; неонатальные фибробласты кожи человека; HUCPVC; периваскулярные клетки пуповины человека; КМ-МСК; мезенхимальные стволовые клетки, полученные из костного мозга; и Pre-Adipo: преадипоциты) после 18 дней культивирования. Применяли культуральную среду с заданным химическим составом, описанную в примере 1 (например, 200 нг/мл ТФР-альфа), плотность посева составляла 30×106 клеток на 75 мм вкладыш, что эквивалентно 9,6×106 клеток на 24 мм вкладыш. Снимки получали при увеличении 20х.
На Фиг.6А-6С показаны типичные Fmax, предел прочности на растяжение (UTS), и характеристики модуля упругости биоинженерных конструкций, получаемых из МСК клеток разных типов (ДФЧ-02; неонатальные фибробласты кожи человека; HUC-02; периваскулярные клетки пуповины человека; МСК-02: мезенхимальные стволовые клетки, полученные из костного мозга; и PAD-02 (ПАД-02): преадипоциты) после 18 дней культивирования. Применяли культуральную среду с заданным химическим составом, описанную в примере 1 (например, 200 нг/мл ТФР-альфа), плотность посева составляла 30×106 клеток на 75 мм вкладыш, что эквивалентно 9,6×106 клеток на 24 мм вкладыш. Столбцы (среднее±стандартное отклонение, n=9) соответствуют среднему Fmax, UTS и модулю упругости для 3 независимых конструкций, каждый из которых был протестирован трижды.
На Фиг.7А-7 В обобщены различия внеклеточного матрикса и адгезивных компонентов (Фиг.7А; 17 положительно регулируемых генов в происходящих из HUCPVC биоинженерных конструкциях, чем 2-кратно относительно происходящих из ДФЧ) и ростовых факторов (Фиг.7В; 8 положительно регулируемых генов в происходящих из HUCPVC биоинженерных конструкциях, чем 2-кратно относительно происходящих из ДФЧ) между происходящими из HUCPVC и происходящими из ДФЧ биоинженерными конструкциями.
На Фиг.8A-8D показаны результаты сравнения изменений во времени уровней IL-6 (ИЛ-6), IL-8 (ИЛ-8) и ФРЭС в кондиционированной среде, полученной от различных происходящих из МСК и происходящих из ДФЧ биоинженерных конструкций на основе результатов СВА-анализа. Среднее и стандартные отклонения вычисляют в среднем исходя из n=3 кондиционированных образцов среды. Также представлено количественное определение уровней ГК, проведенное с помощью ИФА-анализа.
На Фиг.9 показаны результаты анализа клеточной миграции. Непрямой 2-D анализ миграции для сравнения степени закрытия как функции от кондиционированной среды, собранной в различных вариантах реализации. Анализ выполняется на кератиноцитах, культивируемых на кондиционированной ДФЧ-02 и HUCPVC VCT-02 конструкциями среде, собранной из на 5 день и 18 день. Фигура состоит из репрезентативных
светлопольных изображений кератиноцитов, окрашенных кислым фуксином после 24 часов индукции в кондиционированной среде, а также графического представления
уровней степени сокращения, отражающего максимальное закрытие в образцах 5-дневной
кондиционированной HUCPVC VCT-02 среды.
На Фиг.10А-10С показаны результаты анализа мультилинейного потенциала, проведенного на происходящих из МСК (HUC-02) и происходящих из ДФЧ (ДФЧ-02) биоинженерных конструкциях, и выделенных из них клетках. На Фиг.10А представлены данные относительно генной экспрессии в клетках в составе биоинженерных конструкций, индуцированных с применением остеогенной индукционной среды с применением панели остеогенных генов. На Фиг.10В показаны данные относительно генной экспрессии в клетках, выделенных из биоинженерных конструкций, индуцированных с применением остеогенной индукционной среды с применением панели остеогенных генов. На Фиг.10С показаны результаты окрашивания масляным красным О клеток в составе биоинженерных конструкций, индуцированных с применением адипогенной индукционной среды.
На Фиг.11А-11Е показаны репрезентативные гистологические срезы и количественное определение окрашенного гладкомышечного альфа-актина (αSMA) из происходящих на 100% из МСК биоинженерных конструкций (Фиг. 11А), происходящих на 50% из HUCPVC и на 50% из ДФЧ биоинженерных конструкций (Фиг.11В), происходящих на 10% из HUCPVC и на 90% из ДФЧ биоинженерных конструкций (Фиг.11С), и из на 100% происходящих из ДФЧ биоинженерных конструкций (Фиг.11D) через 1 неделю после подкожной имплантации безтимусным мышам. Темные участки обозначают позитивное окрашивание на αSMA. На Фиг. 11Е показано количественное определение кровеносных сосудов в области имплантата на основе позитивного окрашивания на αSMA. Для анализа использовали животных общим числом 2 на группу
(n=2). Число αSMA-позитивных сосудов подсчитывали вручную с применением микроскопа с объективом 40х. Указанное число позитивных сосудов затем нормализовали по области имплантата.
На Фиг.12 показаны независимые гистологические изображения биоинженерных конструкций, зафиксированных в формалине непосредственно после культивирования.
На Фиг.13 показаны независимые гистологические изображения биоинженерных конструкций, которым позволили пройти контролируемое сокращение перед фиксацией в формалине.
На Фиг.14A-14G показаны результаты управления размерами пор во внеклеточных матриксах биоинженерных конструкций. На Фиг.14А приведены различные применения биоинженерных конструкций в соответствии с различными величинами среднего диаметра пор. На Фиг.14 В показан количественный анализ среднего диаметра пор со стандартными отклонениями из биоинженерных конструкций, прошедших контролируемое сокращение, лиофилизированных при конечных температурах замораживания -40°С со скоростью 0,1°С в минуту, и либо не сшитых, либо сшитых посредством ЭДК, либо сшитых с применением DHT. На Фиг.14С показан репрезентативный гистологический срез, количественно проанализированный на Фиг.14С.На Фиг.14D показан репрезентативный гистологический срез биоинженерной конструкции, доведенной до конечных температур замораживания -10°С со скоростью 0,5°С в минуту. На Фиг.14Е представлены репрезентативные гистологические срезы биоинженерных конструкций, прошедших контролируемое сокращение и затем либо высушенных на воздухе (верхний ряд), либо лиофилизированных при конечной температуре замораживания - 40°С (нижний ряд). На Фиг.14F показаны происходящие из МСК биоинженерные конструкции с естественными порами, тогда как на Фиг.14G показано, что такой средний диаметр пор может быть увеличен лиофилизацией.
На Фиг.15А-15Е показаны эффекты добавления ОФРФ к культуральной среде с заданным химическим составом на биофизические свойства биоинженерных конструкций. На Фиг.15А показано, что добавление ОФРФ уменьшает толщину биоинженерной конструкции. На Фиг.15 В приведены результаты анализа зависимости «доза-эффект» для ОФРФ, где при увеличении количества добавленного ОФРФ уменьшались уровни аккумуляции подтипов коллагена. На Фиг.15С показаны относительные уровни и кислото- и пепсинорастворимого коллагена (выделено черным) относительно общего количества коллагена и другого коллагена (серый). Сульфатированный гликозаминогликан (сГАГ; Фиг.15D) и гиалуроновая кислота (ГК; Фиг.15Е) аккумулировались в биоинженерных конструкциях с добавлением ОФРФ в меньших количествах по сравнению с контролями.
На Фиг.16 показаны фибробласты кожи человека, мигрировавшие через пористые шелковые каркасы и равномерно распределенные по всему указанному шелковому каркасу.
На Фиг.17A-17D показаны окрашенные эндотелиальные клетки пупочной вены человека на пористых шелковых каркасах с девитализированными фибробластами кожи человека и соответствующий внеклеточный матрикс, in vitro. Анализ ангиогенеза in vitro проводили, исследуя упорядочение окрашенных ЭКПВЧ в вариантах реализации с шелковым каркасом. ЭКПВЧ культивировали на шелковых каркасах в течение 11 дней и получали флуоресцентные снимки. Упорядочение ЭКПВЧ не заметно на шелковом каркасе (Фиг.17А) или шелковом каркасе, предварительно кондиционированном в матриксной среде (Фиг.17В), но хорошо выражено в шелковом каркасе с живыми фибробластами кожи человека (ДФЧ) (Фиг.17С) и шелковом каркасе с девитализированными ДФЧ (Фиг.17D).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем документе описаны биоинженерные конструкции, содержащие внеклеточные матриксы (ВКМ), обладающие определенной толщиной, размером пор и составом. Известно, что ВКМ секретируется определенными клетками и состоит в основном из фибриллярных белков, полисахаридов и других неосновных компонентов. В его компоненты входят структурные элементы, такие как коллаген и эластин, адгезивные белки, такие как гликопротеины фибронектин, ламинин, витронектин, тромбоспондин I и танасцины, а также протеогликаны, такие как декорин, бигликан, хондроитинсульфат и гепаринсульфат, и гликозаминогликаны (GAG), такие как гиалуроновая кислота (ГК).
Различные ВКМ могут синтезироваться разными клетками. По сравнению с фибробластами, обнаружено, например, что МСК синтезируют пористый ВКМ. Кроме того, определенные белки, связанные с васкуляризацией (например, ФРЭСα, ФРЭСС, PDGF(ФPT)-β, РЕСАМ1, CDH5, ANGPT1, ММР2, TIMP1, TIMP3), а также определенные факторы роста и адгезивные белки, такие как гиалуронан, гепарин, IL-6 (ИЛ-6), IL-8 (ИЛ-8), витронектин (VTN), колониестимулирующий фактор 3 (КСФ-3), НМКА1, и CXCL1, по-видимому, синтезируются в больших количествах в ВКМ, продуцируемом МСК, по сравнению с продуцируемым фибробластами (см., например, Фиг.7).
Основным преобладающим компонентом внеклеточного матрикса, продуцируемого фибробластами, является фибриллярный коллаген, в частности, коллаген I типа. Однако клетки также продуцируют другие фибриллярные и нефибриллярные
коллагены, включая коллаген типов II, III, IV, V, VI, VII, VIII, IX, X, XI, XII, XIII, XIV, XV, XVI, XVII, XVIII, XIX и другие.
Иерархическая сеть этих компонентов ВКМ обеспечивает естественную среду, в которой клетки могут выжить и нормально функционировать. Условия культивирования клеток и пост-культуральные методы, описанные в настоящем документе, могут быть применены к типам клеток, способным синтезировать и секретировать внеклеточный матрикс для получения биоинженерных конструкций с определенными биофизическими качествами.
I. Контроль толщины биоинженерной конструкции
Толщина ВКМ может быть оптимизирована под конкретное применение in vivo. Например, более толстые биоинженерные конструкции могут подходить для участков организма, испытывающих механические возмущения (например, коленей) или для любых применений, когда необходимо, чтобы конструкция продолжала существование in vivo в течение длительного отрезка времени.
Большая толщина ВКМ обеспечивает связующие тканеподобные свойства, придающие устойчивость к физическим повреждениям, таким как разрывы или растрескивание. Подходящие ВКМ должны иметь толщину по меньшей мере приблизительно 30 мкм, 40 мкм, 50 мкм, 60 мкм, 70 мкм, 80 мкм, 90 мкм, 100 мкм, 110 мкм, 120 мкм, 130 мкм, 140 мкм, 150 мкм, 160 мкм, 170 мкм, 180 мкм, 190 мкм, 200 мкм, 220 мкм, 240 мкм, 260 мкм, 280 мкм, 300 мкм, 320 мкм, 340 мкм, 360 мкм, 380 мкм, 400 мкм, 450 мкм, 500 мкм, 550 мкм, 600 мкм, 650 мкм, 700 мкм, 750 мкм, 800 мкм, 850 мкм, 900 мкм, 950 мкм или большую, для применения в испытаниях или в клинической практике, в тех случаях, когда такие толщины являются подходящими.
а. Биоинженерные конструкции, получаемые из мезенхимальных стволовых клеток (МСК)
Мезенхимальные стволовые клетки (МСК; также известные как мезенхимальные клетки-предшественники) представляют собой клетки, способные расти в культуре и дифференцироваться в мезенхимальные тканевые клетки, в том числе костные, хрящевые, сухожильные, связочные, мышечные, жировые и костномозговой стромы. МСК неэффективно синтезируют, секретируют и/или организуют компоненты внеклеточного матрикса (т.е. продуцирование эндогенного внеклеточного матрикса) при обычных условиях культивирования. В то же время, при условиях культивирования, описанных далее в настоящем документе, они способны существовать в эффективно секретируемом
внеклеточном матриксе без компонентов экзогенного матрикса (т.е. компонентов матрикса, не продуцируемых культивируемьми клетками, а вводимых другими способами).
МСК могут быть получены из нескольких источников, включая, но не ограничиваясь перечисленными, костный мозг, пуповину, плаценту, амнион и другие соединительные ткани (такие как мышцы, жировая ткань, кость, сухожилие и хрящ). Например, пуповинные МСК могут быть выделены из пуповинной крови, субэндотелия пупочной вены и вартонова студня. MCS также могут быть выделены из трех областей: периваскулярной области (пуповинных периваскулярных клеток или UCPVC), межсосудистой области, плаценты, амниона и субамниона (Troyer and Weiss, 2007). Как вариант, происходящие из костного мозга МСК могут быть получены из костного мозга и включают негемопоэтические мультипотентные клетки, поддерживают экспансию гемопоэтических стволовых клеток, и могут дифференцироваться в различные соединительные ткани.
Могут применяться клетки человека, а также клетки других видов млекопитающих, включая, но не ограничиваясь перечисленными, лошадиные, собачьи, свиные, бычьи, овечьи или грызунов (например, мыши или крысы). Указанные клетки могут быть получены как первичные клетки из соответствующих тканей или, более предпочтительно, из серийно пересеваемых клеток либо пересевом из стабилизированных клеточных культур или банков, прошедших скрининг на отсутствие вирусного или бактериального загрязнения и проверку чистоты. Кроме того, в настоящем изобретении также могут применяться клетки, трансфицированные спонтанно, химически или при помощи вирусов, рекомбинантные клетки или генетически сконструированные клетки. Указанные клетки могут также быть рекомбинантными или сконструированными генетически. Например, указанные клетки могут быть сконструированы таким образом, чтобы продуцировать и доставлять рекомбинантные клеточные продукты, такие как факторы роста, гормоны, пептиды или белки, в организм пациента, непрерывно в течение определенного периода времени либо по мере необходимости, в ответ на биологические, химически или температурные сигналы, в зависимости от условий, имеющих место в организме пациента. Конструирование может обеспечить долгосрочную или краткосрочную экспрессию генного продукта. Долгосрочная экспрессия требуется в том случае, если культивируемую тканевую конструкцию имплантируют или применяют у пациента для доставки терапевтических продуктов пациенту непрерывно на протяжении определенного периода времени. В свою очередь, краткосрочная экспрессия требуется в тех случаях, когда после излечения раны генные продукты культивируемого тканевого продукта уже не нужны или
больше не являются желательными на данном участке. Клетки могут также быть генетически сконструированы таким образом, чтобы экспрессировать белки или различные типы компонентов внеклеточного матрикса, либо «нормальные», но интенсивно экспрессируемые, либо модифицированные определенным образом, придающим биоинженерному комплексу, содержащему внеклеточный матрикс и живые клетки, терапевтические преимущества для более успешного излечения ран, облегченной или направленной неоваскуляризации, или минимизации формирования рубцов или келоида.
Для эффективной секреции внеклеточного матрикса нужной толщины МСК могут культивироваться в течение нескольких дней или недель (например, 18, 19, 20, 21, 22, 23, 24, 25 дней или дольше) в среде неопределенного состава или в среде с заданным химическим составом. В системе с заданным химическим составом можно применять полученные от человека клетки, но в ней отсутствуют химически неидентифицированные и полученные не от человека биологические компоненты или клетки. Указанные культуры поддерживают в инкубаторе для обеспечения необходимых для культуры клеток условий среды с контролируемой температурой, влажностью и газовой смесью, отвечающих общеизвестным параметрам среды. Например, в указанном инкубаторе может поддерживаться температура от приблизительно 34°С до приблизительно 38°С (например, 37±1°С), атмосфера с приблизительно 5-10±1% СО2 и относительная влажность (Rh) приблизительно 80-90%. Как вариант, клетки могут культивироваться в условиях гипоксии. Указанные клетки могут временно находиться в условиях обычных комнатных температуры, воздуха и влажности во время подкормки, посева или других манипуляций с клетками.
Независимо от типа клеток культуральная среда состоит из питательной основы, как правило, дополненной другими компонентами. Питательные основы, как правило, содержащие такие питательные вещества, как глюкоза, неорганические соли, источник энергии, аминокислоты и витамины, хорошо известны в области техники культивирования клеток животных. Примеры включают, не ограничиваясь перечисленными, модифицированную по Дульбекко среду Игла (DMEM); минимальную питательную среду (MEM); Ml99; RPMI 1640; среда Дульбекко, модифицированная по способу Исков (EDMEM). Минимальная питательная среда (MEM) и Ml99 требуют дополнительных добавок в виде предшественников фосфолипидов и заменимых аминокислот. Коммерчески доступные обогащенные витаминами смеси, содержащие дополнительные аминокислоты, нуклеиновые кислоты, кофакторы ферментов, предшественники фосфолипидов и неорганические соли, включают среду Хэма F-12
(Ham's F-12), среду Хэма F-10 (Ham's F-10), NCTC 109 и NCTC 135. Могут применяться также смеси указанных сред, например, DMEM и среда Хэма F-12 в соотношении от 3:1 до 1:3, соответственно.
Составы культуральных сред и введение дополнительных средовых добавок для МСК и дополнительных клеточных типов, таких как фибробласты или эпителиальные клетки, могут быть подобраны в соответствии с общеизвестными в данной области техники способами культивирования (см., например, патент США №5712163 Parenteau, международная публикация WO 95/31473, международная публикация WO 00/29553, международная публикация WO 2009/070720, Ham and McKeehan, Methods in Enzymology, 58:44-93 (1979), Bottenstein et al., Meth. Enzym., 58:94-109 (1979); все перечисленные источники включены в настоящий документ во всей полноте посредством данной ссылки). Например, полученные из МСК биоинженерные конструкции могут культивироваться в среде с добавлением агентов, способствующих синтезу и отложению матрикса указанными клетками. Можно применять культуральную среду с заданным химическим составом, свободную от неидентифицированных экстрактов органов или тканей животных, таких как сыворотка, экстракт гипофиза, экстракт гипоталамуса, плацентарный экстракт или эмбриональный экстракт, или белки и факторы, секретируемые питающими клетками. Такие среды могут быть свободны от неидентифицированных компонентов и биологических компонентов, получаемых из животных источников, но не от человека, для уменьшения риска случайного заражения и инфицирования вирусом животного или межвидовым вирусом. Вместо применения таких экстрактов органов или тканей животных могут применяться искусственные или рекомбинантные функциональные эквиваленты.
В ходе настоящего исследования установлено, что трансформирующий фактор роста альфа (ТФР-α), синтезируемый в макрофагах, клетках мозга и кератиноцитах и индуцирующий развитие эпителия, в выраженной степени стимулирует синтез, секрецию и организацию компонентов внеклеточного матрикса клетками МСК. ТФР-α представляет собой небольшой (-50 остатков) белок с 30% структурной гомологией ЭФР и конкурирует за тот же поверхностно-связанный рецепторный сайт. Он задействован в заживлении ран и способствует фенотипическим изменениям определенных клеток. ТФР-α или длинноцепочечный ТФР-α могут быть добавлены в среду в количестве от приблизительно 0,0005 мкг/мл до приблизительно 0,30 мкг/мл, от приблизительно 0,0050 мкг/мл до приблизительно 0,03 мкг/мл, или от приблизительно 0,01 мкг/мл до приблизительно 0,02 мкг/мл. Согласно некоторым вариантам реализации количество добавленного ТФР альфа составляет 10 нг/мл, 20 нг/мл, 30 нг/мл, 40 нг/мл, 50 нг/мл, 60 нг/мл, 70 нг/мл, 80 нг/мл, 90
нг/мл, 100 нг/мл, 120 нг/мл, 130 нг/мл, 140 нг/мл, 150 нг/мл, 160 нг/мл, 170 нг/мл, 180 нг/мл, 190 нг/мл, 200 нг/мл или больше.
Напротив, простагландин Е2 (ПГЕ2) образуется в результате действия простагландин Е-синтаз на простагландин Н2 (PGH2), и авторами обнаружено, что он ингибирует синтез, секрецию и организацию внеклеточных матриксов клетками МСК в том случае, если присутствует в относительно больших концентрациях. Таким образом, добавление ПГЕ2 (например, в форме 16,16-ПГЕ2) можно использовать для регуляции толщины внеклеточного матрикса и может варьировать от приблизительно 0,000038 мкг/мл до приблизительно 0,760 мкг/мл, от приблизительно 0,00038 мкг/мл до приблизительно 0,076 мкг/мл, или приблизительно 0,038 мкг/мл. Согласно некоторым вариантам реализации количество добавленного ПГЕ2 составляет 10 нг/мл, 20 нг/мл, 30 нг/мл, 40 нг/мл, 50 нг/мл, 60 нг/мл, 70 нг/мл, 80 нг/мл, 90 нг/мл, 100 нг/мл, 120 нг/мл, 130 нг/мл, 140 нг/мл, 150 нг/мл, 160 нг/мл, 170 нг/мл, 180 нг/мл, 190 нг/мл, 200 нг/мл или больше.
Сходным образом, в ходе настоящего исследования обнаружено, что основной фактор роста фибробластов (ОФРФ) ингибирует синтез, секрецию и организацию компонентов внеклеточного матрикса клетками, такими как фибробласты. В частности, уровни пепсинорастворимого коллагена, сульфатированных гликозаминогликанов (сГАГ) и гиалуроновой кислоты (А) уменьшаются при увеличении уровней ОФРФ, и уровни каждого компонента могут уменьшаться на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или больше относительно контроля. Такие различия в композиции компонентов внеклеточного матрикса в дальнейшем дают порошковые формы после высушивания на воздухе и легко измельчаемый порошок при лиофилизации. Такие порошковые формы обладают сниженной вязкостью и в результате способны проходить через иглы шприцов калибра 23, 24, 25, 26, 27, 28, 29, 30 или тоньше. Таким образом, для регуляции толщины и состава внеклеточного матрикса можно использовать добавление ОФРФ в количестве от приблизительно 10 нг/мл, 15 нг/мл, 20 нг/мл, 25 нг/мл, 30 нг/мл, 35 нг/мл, 40 нг/мл, 45 нг/мл, 50 нг/мл, 55 нг/мл, 60 нг/мл, 65 нг/мл, 70 нг/мл, 75 нг/мл, 80 нг/мл, 85 нг/мл, 90 нг/мл, 95 нг/мл, 100 нг/мл или более.
Аскорбат или его производное (например, натрия аскорбат, аскорбиновая кислота или одно из более стабильных химически производных, такое как n-гидрат соли магния фосфата L-аскорбиновой кислоты) можно применять в качестве добавки, способствующей гидроксилированию пролина и секреции проколлагена, растворимого предшественника откладываемых молекул коллагена. Аскорбат также повышающе регулирует синтез коллагена I и III типов.
Инсулин может применяться в качестве добавки, способствующей усвоению глюкозы и аминокислот, что обеспечивает долгосрочные преимущества при многократном пересеве. Добавление инсулина или инсулиноподобного фактора роста (ИФР) необходимо для долгосрочного культивирования, так как в этом случае может происходить потеря способности клеток к усвоению глюкозы и аминокислот и деградация клеточного фенотипа. Инсулин может быть получен из животных источников, как, например, бычий, от человека, или при помощи рекомбинантных методов, как, например, рекомбинантный инсулин человека. Соответственно, инсулин человека удовлетворяет критерию компонента с заданным химическим составом, полученного от человека, а не из другого животного биологического источника. Добавление инсулина рекомендовано при серийном культивировании, и его добавляют в среду в широком диапазоне концентраций. Предпочтительным является диапазон концентраций от приблизительно 0,1 мкг/мл до приблизительно 500 мкг/мл, приблизительно 5 мкг/мл - приблизительно 400 мкг/мл, и приблизительно 375 мкг/мл. Подходящие концентрации при добавлении инсулиноподобного фактора роста, такого как ИФР-1 ИФР-2, и т.п., могут быть легко определены специалистом в данной области техники для типов клеток, выбранных для культивирования.
Трансферрин может применяться в качестве добавки для регуляции транспорта железа. Железо представляет собой важный следовой элемент, обнаруживаемый в сыворотке, но в больших количествах оно может быть токсичным в отсутствие хелатирования трансферрином. Трансферрин может добавляться в диапазоне концентраций от приблизительно 0,05 до приблизительно 50 мкг/мл или приблизительно 5 мкг/мл.
Трийодтиронин (Т3) можно применять в качестве добавки для регуляции клеточного метаболизма и может добавляться в диапазоне концентраций от приблизительно 0 до приблизительно 400 рМ, от приблизительно 2 до приблизительно 200 рМ, или в концентрации приблизительно 20 рМ.
Этаноламин или о-фосфорил-этаноламин, либо и тот, и другой, представляющие собой фосфолипиды, могут применяться в качестве добавки, способствующей синтезу жирных кислот, в частности, при культивировании в бессывороточной среде. Этаноламин и о-фосфорил-этаноламин могут добавляться в диапазоне концентраций от приблизительно 10-6 до приблизительно 10-2 М или приблизительно 1×10-4 М.
Селенистую кислоту можно применять в качестве добавки, обеспечивающей наличие указанного следового элемента в бессывороточной среде. Селенистая кислота
может добавляться в диапазоне концентраций от приблизительно 10-9 М до приблизительно 10-7М, или приблизительно 5,3×10-8М.
Добавление аминокислот может экономить энергию клеток за счет освобождения клеток от необходимости синтезировать эти составляющие элементы белков. Например, могут быть добавлены пролин и глицин, а также гидроксилированная форма пролина, гидроксипролин, представляющие собой основные аминокислоты, составляющие структуру коллагена. Кроме того, аминокислота L-глутамин присутствует в некоторых питательных основах и может быть добавлена в тех случаях, когда она отсутствует или ее количество недостаточно. L-глутамин может также быть добавлен в виде стабильной формы, такой как продаваемая под маркой GlutaMAX-1™ (Gibco BRL, Grand Island, NY). GlutaMAX-1™ представляет собой стабильную дипептидную форму b-аланил-L-глутамина, может применяться наравне с L-глутамином и добавляется в эквимолярных концентрациях в качестве заменителя L-глутамина. Во время хранения и при инкубации указанный дипептид предохраняет L-глутамин от разложения, которое может приводить к нестабильности эффективной концентрации L-глутамина в среде. Как правило, в основную среду добавляют предпочтительно от приблизительно 1 мМ до приблизительно 6 мМ, более предпочтительно - от приблизительно 2 мМ до приблизительно 5 мМ, и наиболее предпочтительно - 4 мМ L-глутамина или GlutaMAX-l™.
Для достижения определенных показателей культуры могут также применяться дополнительные добавки, такие как один или более простагландин, трансформирующие факторы роста (включая трансформирующие факторы роста альфа или бета), фактор роста кератиноцитов (ФРК), фактор роста соединительной ткани (ФРСТ), манноза-6-фосфат (М6Ф) или их комбинации. Например, известно, что и ТФР-β1, и ТАП повышающе регулируют синтез коллагена (Raghow et al., J.Clin. Invest., 79:1285-1288 (1987) и Pardes et al., J.Invest. Derm., 100:549 (1993)).
Кроме того, эпидермальный фактор роста (ЭФР) может применяться в качестве добавки, способствующей установлению культуры за счет роста и заселения клеток. Можно применять нативную или рекомбинантную форму ЭФР. Формы ЭФР человека, нативные или рекомбинантные, предпочтительны для применения в среде при получении эквивалента кожи, не содержащего полученные не от человека биологические компоненты. ЭФР представляет собой необязательный компонент и может быть добавлен в концентрации приблизительно от 1 до 15 нг/мл или приблизительно от 5 до 10 нг/мл.
Гидрокортизон можно применять в качестве добавки, способствующей формированию фенотипа кератиноцитов и, соответственно, усиливающей признаки дифференцировки, такие как содержание инволюкрина и трансглутаминазы
кератиноцитов (Rubin et al., J.Cell Physiol., 138:208-214 (1986)). Таким образом, гидрокортизон представляет собой желательную добавку в тех случаях, когда такие свойства полезны, например, при формировании графтов из пласта кератиноцитов или кожных конструкций. Гидрокортизон может добавляться в диапазоне концентраций от приблизительно 0,01 мкг/мл до приблизительно 4,0 мкг/мл или приблизительно от 0,4 мкг/мл до 16 мкг/мл.
Фактор роста кератиноцитов (ФРК) можно применять в качестве добавки для поддержки эпидермизации в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 0,150 мкг/мл, от приблизительно 0,0025 мкг/мл до приблизительно 0,100 мкг/мл, от приблизительно 0,005 мкг/мл до приблизительно 0,015 мкг/мл, или 5 мкг/мл.
Манноза-6-фосфат (М6Ф) можно применять в качестве добавки для поддержки эпидермизации в концентрации от приблизительно 0,0005 мг/мл до приблизительно 0,0500 мг/мл.
Нейтральные полимеры могут применяться в качестве добавки, стимулирующей стабильность образования и отложения коллагена между образцами. Например, известно, что полиэтиленгликоль (ПЭГ) in vitro способствует переходу растворимого предшественника проколлагена, продуцируемого культивируемыми клетками, в откладывающуюся в матриксе форму коллагена. ПЭГ для тканевых культур добавляется в диапазоне от приблизительно 1000 до приблизительно 4000 MW (молекулярный вес), приблизительно 3400 - приблизительно 3700 MW, приблизительно 5% по весу или менее, от приблизительно 0,01% по весу до приблизительно 0,5% по весу, от приблизительно 0,025% по весу до приблизительно 0,2% по весу, или приблизительно 0,05% по весу. Другие нейтральные полимеры для культур, такие как декстран, предпочтительно декстран Т-40, или поливинилпирролидон (ПВП), предпочтительно в диапазоне 30000-40000 MW, могут также применяться в концентрациях приблизительно 5% по весу или меньших, от приблизительно 0,01% по весу до приблизительно 0,5% по весу, от приблизительно 0,025% по весу до приблизительно 0,2% по весу, или приблизительно 0,05% по весу. Другие агенты для клеточных культур и совместимые с клетками агенты, стимулирующие образование и отложение коллагена, хорошо известны специалистам в данной области техники.
Культуральные подложки и/или перфузия
Высевание клеток на пористую мембрану (т.е. культуральный вкладыш) определенного диаметра может способствовать увеличению толщины биоинженерной конструкции, увеличивая скорость продуцирования внеклеточного матрикса за счет
максимизации площади поверхности с доступом к питательным веществам из культуральной среды. Поры проходят и через верхнюю, и через и нижнюю поверхности мембраны, обеспечивая либо двусторонний контакт среды с развивающейся тканевой конструкцией, либо контакт только с нижней стороны культуры. Среда может также контактировать только с нижней стороной формирующегося из культивируемой ткани конструкции, так что верхняя сторона может контактировать с воздухом, как в случае получения культивируемой кожной конструкции. Как правило, указанная мембрана крепится к одному концу трубчатого элемента или каркаса, который вставляется внутрь и соединяется с основой, такой как чашка Петри или чашка для культивирования, которая может быть накрыта крышкой. Если используют указанные типы сосудов для культивирования, тканевая конструкция формируется с одной стороны мембраны {например, с верхней стороны) и культура контактирует со средой и с нижней, и с верхней поверхности. Размеры пор достаточно малы для того, чтобы не позволять прорастания клеток через мембрану, но достаточно велики для свободного перемещения питательных веществ, содержащихся в культуральной среде, к нижней поверхности указанной биоинженерной конструкции, например, за счет капиллярных сил. Например, диаметр пор может составлять приблизительно менее чем 7 мкм, от приблизительно 0,1 мкм до приблизительно 7 мкм, от приблизительно 0,2 мкм до приблизительно 6 мкм, или от приблизительно 0,4 мкм до приблизительно 5 мкм. Максимальный размер пор зависит не только от размеров клеток, но также и от способности клеток менять форму и проникать через мембрану. Важно, чтобы тканеподобная конструкция прикреплялась к поверхности, но не внедрялась и не окружала подложку, чтобы ее можно было отделить, например, при помощи минимального усилия на отрыв. Размер и форма формирующегося тканевой конструкции определяются размером поверхности сосуда или мембраны, на которой ее выращивают. Подложки могут быть округлыми, квадратными, прямоугольными или остроконечными, иметь закругленные углы или неправильную форму. Подложки могут также быть плоскими или представлять собой форму для получения объемной конструкции для взаимодействия с раной или имитации физической структуры нативной ткани. При большей площади поверхности ростовой подложки на поверхность высевают пропорционально большее количество клеток; необходим также больший объем среды для промывания и питания клеток. Когда биоинженерная тканевая конструкция полностью сформирована, ее отделяют, отслаивая от мембраны подложки. Подложки могут быть предварительно обработаны перед посевом клеток для улучшения связывающих свойств подложки посредством увеличения поверхностной энергии.
Предварительная обработка может включать, не ограничиваясь перечисленными, обработку СООН и длинными NF2 группами.
Перфузия культуральной подложки, обеспечивающая воздействие на формирующийся биоинженерный слой механических сил, имитирующее воздействие сил in vivo, может также увеличивать толщину и прочность биоинженерной конструкции. Способы перфузии хорошо известны в данной области техники и включают, не ограничиваясь перечисленными, перемешивание среды с применением магнитной мешалки или автоматической лопастной мешалки расположенных под держателем подложек, содержащим культуральную мембрану или рядом с ним; перекачка среды внутри культуральной емкости или резервуара или прокачка через нее/него; аккуратное встряхивание культуральной емкости на качающейся или поворотной платформе; или перекатывание, если используется культуральная роллерная бутыль. Другие механические воздействия могут быть представлены вибрацией, сгибанием, колебанием или растяжением указанной пористой мембраны во время культивирования.
Во время культивирования клетки секретируют молекулы эндогенного матрикса и организуют секретируемые молекулы матрикса с формированием трехмерной тканеподобной структуры, но не проявляют значимой сократительной способности, которая могла бы привести к сокращению формирующейся биоинженерной конструкции и ее отслаиванию от культуральной подложки. Подходящие поверхности для роста клеток, на которых могут культивироваться клетки, могут быть представлены любым биологически совместимым материалом, к которому могут присоединяться клетки, обеспечивая возможность прикрепления для формирования указанного биоинженерной конструкции. В качестве поверхности для роста клеток могут применяться такие материалы, как стекло; нержавеющая сталь; полимеры, включая поликарбонат, поли(эфирсульфоны) (ПЭС), полистирол, поливинилхлорид, поливинилиден, полидиметилсилоксан, фторполимеры и фторированный этилен-пропилен; кремниевые подложки, включая кварцевое стекло, поликремний или кремниевые кристаллы. Поверхностные материалы для роста клеток могут быть химически обработаны или модифицированы, электростатически заряжены или покрыты биопрепаратами, такими как поли-L-лизин или пептиды. Примером химической обработки, приводящей к формированию электростатически заряженной поверхности, может служить обработка СООН и длинными NH2 группами. Примером покрытия пептидом является покрытие RGD-пептидом. Поверхности для роста клеток могут быть обработаны искусственными или полученными от человека формами внеклеточного матрикса, что способствует прикреплению продуцирующих матрикс клеток, обеспечивая указанным клеткам
естественную поверхность для прикрепления, ориентации и биохимической сигнализации. Применение в этом аспекте искусственных или полученных от человека форм внеклеточного матрикса является временным, так как с течением времени он замещается клетками культуры. Покрытие из указанных искусственных или полученных от человека форм внеклеточного матрикса при нанесении на поверхность для роста клеток варьирует от молекул матрикса, распределенных по поверхности, до покрытия толщиной в одну молекулу, или до сплошной тонкой пленки, имеющей толщину в диапазоне от нанометров до микрометров.
Для нанесения покрытия на культуральную подложку могут применяться искусственные или природные формы фибронектина. Указанные подходящие для применения формы фибронектина включают, не ограничиваясь перечисленными: фибронектин человека, фибронектин плазмы крови человека, рекомбинантный фибронектин или искусственные формы, такие как пронектин, который представляет собой повторяющуюся пептидную последовательность, получаемую и синтезируемую из фрагмента природного фибронектина человека. На подложку могут быть нанесены покрытия из природного, продуцируемого клеточными культурами или рекомбинантного коллагена.
Культивируемые биоинженерные конструкции не нуждаются в синтетических или биорассасываемых элементах, например, сетках, для формирования и для поддержания целостности; однако такие элементы могут применяться. Сетчатые элементы могут быть представлены тканым, вязаным или войлокоподобным материалом. В системах, где применяются сетки, клетки культивируют на сетчатом элементе и они растут с обеих сторон и внутри пустот сетки, окружая ее и включая сетку в состав культивируемой тканевой конструкции. Физическая структура и объем готовой конструкции, сформированной при помощи способов, включающих применение подобной сетки, поддерживаются за ее счет.
Шелковые каркасы могут обеспечивать механическую поддержку при минимальном иммунном ответе или при полном отсутствии иммунного ответа со стороны организма хозяина. Диаметр пор пористого каркаса из фиброина шелка может варьировать от приблизительно 10 микрон до приблизительно 150 микрон, от 30 микрон до приблизительно 45 микрон, от 50 микрон до 100 микрон, или от 80 микрон до 150 микрон.
Средний диаметр пор шелковых каркасов может регулироваться варьированием процента растворителя. Волокна шелка могут быть смешаны с органическим растворителем, таким как этанол или ДМСО. При помощи увеличения количества
органического растворителя размер пор шелковых каркасов может быть селективно уменьшен в зависимости от требуемой степени пористости. Например, при растворении 4% шелка в 1% этанола образуется шелковый каркас со средним диаметром пор 50-100 микрон. Размер пор от 50 до 100 микрон требуется для облегчения инфильтрации фибробластами и более быстрой васкуляризации конструкции in vivo. Большие средние диаметры пор шелкового каркаса (например, приблизительно 80-150 микрон) могут быть получены растворением 3% шелка в 0,5% этанола. В случае более серьезных ожоговых ран желательно, чтобы средний диаметр пор шелкового каркаса составлял приблизительно 80-150 микрон, поскольку больший размер пор позволяет удалять раневой экссудат из ложа раны.
Фиброин шелка может быть получен либо из природного, либо из рекомбинантного источника. Предпочтительный природный источник фиброина шелка получают из обезклеенных шелковых волокон коконов тутового шелкопряда. Раствор фиброина шелка смешивают с водорастворимым органическим растворителем, например, спиртом, выбранным из группы, состоящей из этилового спирта, метилового спирта, изопропилового спирта, пропанола, бутанола; или с диметилсульфоксидом (ДМСО) или ацетоном. Указанный раствор фиброина шелка затем выкладывают или заливают в форму или непосредственно в культуральный вкладыш, включающий пористую/проницаемую культуральную мембрану, обеспечивающую двусторонний контакт культуральной среды как с верхней, так и с нижней плоскостью указанной мембраны и пористым каркасом из фиброина шелка. Указанный раствор затем на некоторое время замораживают, затем размораживают и промывают для удаления остатка растворителя. Затем пористые каркасы из фиброина шелка автоклавируют, облучают гамма-лучами или стерилизуют электронным пучком для получения стерильного каркаса из фиброина шелка. После стерилизации указанный пористый каркас из фиброина шелка можно применять в качестве культуральной подложки для культивирования клеток с применением описанных в настоящем документе способов. После культивирования клеток на таких пористых каркасах из фиброина шелка указанные клетки могут быть девитализированы с применением описанных в настоящем документе способов. К указанным конструкциям с пористым каркасом из фиброина шелка могут быть добавлены и другие элементы, такие как слой силикона.
Шелковые каркасы могут быть кондиционированы веществами, полезными для стимуляции заживления ран. Например, влажные или сухие шелковые каркасы могут быть инкубированы с раствором, содержащим один или более белок, в течение 5-10 минут, так что конечное количество адсорбированного белка находится в диапазоне от 1
микрограмма до 1 миллиграмма. Частично лиофилизированные шелковые каркасы и биоинженерные конструкции, содержащие шелковые каркасы, (например, высушенные замораживанием в течение 3 часов при 0°С) и замороженные при -20°С перед инкубацией с белковыми растворами, по-видимому, максимизируют количество адсорбируемого белка. Далее, автоклавирование шелкового каркаса перед использованием для клеточной культуры, по-видимому, способствует разложению in vivo и, соответственно, уменьшению продолжительности существования.
с. Высевание клеток
Высевание с суперконфлюэнтностью (т.е. более чем со 100% конфлюэнтностью) увеличивает скорость формирования внеклеточного матрикса за счет пропуска фазы клеточного роста. Соответственно, клетки могут непосредственно высеваться с суперконфлюэнтностью от 100% конфлюэнтности до приблизительно 900% конфлюэнтности, в том числе в диапазоне от приблизительно 300% до приблизительно 600% конфлюэнтности для немедленного продуцирования внеклеточного матрикса. Суперконфлюэнтность также может быть рассчитана исходя из плотности посева клеток на площадь культуральной поверхности и может составлять, например, 1×105, 2×105, 3×105, 4×105, 5×105, 6×105, 7×105, 8×105, 9×105, 1×106 или более клеток на см2. Например, могут применяться вкладыши диаметром 75 мм с приблизительной площадью культуральной поверхности 44 см. Высевание суперконфлюэнтного количества клеток (например, 3×106 клеток) на такой вкладыш дает начальную плотность посева приблизительно 6,8×105 клеток/см2. Приблизительно 7,5×10б клеток могут высеваться на прямоугольный вкладыш 10 см × 10 см для достижения начальной плотности посева приблизительно 7,5×105 клеток/см2.
Как вариант, клетки могут высеваться в субконфлюэнтных количествах и пролиферировать до стимулирования синтеза и организации внеклеточного матрикса. Субконфлюэнтная плотность клеток может быть достигнута высеванием от приблизительно 1×105 клеток/см2 до приблизительно 6,8×105 клеток/см2, от приблизительно 3×105 клеток/см2 до приблизительно 6,8×105 клеток/см2, или приблизительно 6,8×105 клеток/см2 (клеток на квадратный сантиметр площади поверхности).
d. Контролируемое сокращение
Толщина биоинженерной конструкции может быть увеличена освобождением от 35 культуральной подложки, чтобы она могла свободно сократиться. Такое «контролируемое
сокращение» или «свободное сокращение» можно отслеживать в реальном времени и его можно остановить после достижения необходимых степени сокращения и толщины. Живые клетки в указанной биоинженерной конструкции оказывают сжимающие действие на эндогенный внеклеточный матрикс, ослабляемое за счет прикрепления указанной биоинженерной конструкции к культуральной подложке. На этапе свободного сокращения данное сжимающее действие, обеспечиваемое указанными клетками, эффективно увеличивает общую механическую прочность и толщину конструкции по сравнению с полученными сходным образом конструкциями, не прошедшими через свободное сокращение после культивирования. Контролируемое сокращение может быть индуцировано отделением биоинженерной конструкции от культуральной подложки, например, с применением механических способов, таких как отрывание или поднятие с подложки, стряхивание с подложки или изгибание подложки. Отделение указанной биоинженерной конструкции также может достигаться изменением температуры в культуре, в особенности в случае применения термочувствительной подложки, или с применением химических методов.
Контролируемое сокращение измеряется временем, увеличением толщины и уменьшением площади поверхности, характеризуемым уменьшением диаметра либо уменьшением или ширины и длины конструкции. Сокращение матрикса клетками предположительно организует волокна эндогенного матрикса таким образом, что они увеличивают общую прочность матрикса (например, надежность удержания шва), но не до такой степени, чтобы матрикс потерял форму, деформировался, сморщился или потерял приблизительную плоскостность своей конфигурации. Другими словами, плоскостной аспект матрикса сохраняется, но общая площадь поверхности уменьшается, а толщина увеличивается. Если свободное сокращение измеряют по общему увеличению толщины биоинженерной конструкции, подсчитывают процент увеличения толщины или фактический прирост толщины. Если свободное сокращение измеряют по уменьшению площади поверхности, подсчитывают процент уменьшения площади поверхности или измеряют фактическое уменьшение по одному или более измерению. Сокращение может быть измерено подсчетом процента уменьшения площади поверхности тканевого матрикса, например, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или более, или находящегося в любом диапазоне между указанными. Сокращение может быть остановлено в нужный момент девитализацией клеток, например, согласно описанию ниже в настоящем документе.
е. Гибридные биоинженерные конструкции
Происходящие от МСК биоинженерные конструкции могут также содержать дополнительные типы клеток, способные синтезировать, секретировать и организовывать внеклеточный матрикс, для увеличения толщины внеклеточного матрикса. Такие типы клеток могут быть представлены фибробластами, стромальными клетками, гладкомышечными клетками, хондроцитами и другими соединительнотканными клетками мезенхимального происхождения. Фибробласты могут быть получены из нескольких источников, включая, но не ограничиваясь перечисленными, неонатальную крайнюю плоть, дерму, сухожилие, легкое, пуповину, хрящ, уретру, строму роговицы, слизистую оболочку полости рта и кишку. Могут применяться гибридные смеси нормальных клеток из двух или более источников, например, гибридная смесь аутологичных и аллогенных клеток; смеси нормальных и генетически модифицированных или трансфицированных клеток; смеси клеток, получаемых из различных типов тканей или органов; или смеси клеток двух или более видов или источников ткани.
Указанный по меньшей мере один дополнительный тип клеток может быть добавлен в виде отдельного слоя, либо смешан с остальными типами. Для включающих слои биоинженерных конструкций первый тип клеток высевают на культуральную подложку, а второй тип клеток затем высевают поверх первого слоя клеток. Смешанные конструкции могут быть образованы в результате варьирования начальных пропорций высеваемых по меньшей мере двух типов клеток, по крайней мере отчасти основанного на требованиях к качествам конструкции, необходимым для терапевтического эффекта. Например, первый тип клеток может быть представлен МСК и может составлять 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или более начальной смеси высеваемых клеток. Фибробласты, например, неонатальные фибробласты, дермальные фибробласты, папиллярные фибробласты, ретикулярные фибробласты или их комбинация, могут представлять второй тип клеток и составлять оставшуюся долю начальной смеси высеваемых клеток. Общее количество клеток при первом посеве может составлять от 1,0×105 до 1,0×106 на см2.
Для получаемых в результате смешивания биоинженерных конструкций начальные плотности посева могут также быть определены исходя из числа клеток в момент посева, при этом необходимая общая клеточная масса рассчитывается на момент посева как: аХ+bY=Z; где Х=Y=Z и а+b=1, но b>0 и а<1. Например, требуемая плотность посева клеток равна Z и Z=2,1×105 клеток/см2 (приблизительно), и аХ и bY обозначают количество фибробластов и мезенхимальных клеток-предшественников, соответственно, в общем количестве клеток на квадратный сантиметр засеваемой площади, обозначенной Z. Таким образом, если и фибробласты, и МСК составляют по 50% от общего количества высеваемых клеток, уравнение будет выглядеть как: аХ+bY=Z клеток/см2, где (0,5)(2,1×105 клеток)+(0,5)(2,1×105 клеток)=2,1×105 клеток обоих типов /см2. Решение этого уравнения позволяет определить начальную плотность посева обоих указанных по меньшей мере двух типов клеток: 1,05×105 фибробластов +1,05×105 мезенхимальных клеток-предшественников =2,1×105 клеток обоих типов/см2. При использовании этого уравнения для посева могут применяться следующие значения: а=0 и b=1; а=0,1 и b=0,9; а=0,2 и b=0,8; а=0,3 и b=0,7; а=0,5 и b=0,5; а=0,8 и b=0,2.
Как вариант, гибридные биоинженерные конструкции могут быть получены при помощи фибробластов и МСК при постоянном X (т.е. число фибробластов остается постоянным), где общее число фибробластов в общей клеточной массе определяют на момент посева согласно уравнению: аХ+bY=Z; где X=Y, а=1, b>0 и b<1, и Z=вычисленная плотность посева общей массы клеток. Например, если X=2,1 х 105 фибробластов, а при посеве требуется 50% МСК, указанное уравнение будет выглядеть как: аХ+bY=Z, где (1)(2,1×105 клеток)+(0,5)(2,1×105 клеток)=Z клеток обоих типов/см. Решение этого уравнения позволяет определить начальную плотность посева обоих указанных по меньшей мере двух типов клеток: 2,1×105 фибробластов +1,05×105 мезенхимальных клеток-предшественников =3,15×10 клеток обоих типов /см. При использовании этого уравнения для посева могут применяться следующие значения: а=1 и b=2; а=1 и b=1; а=1 и b=0,9; а=1 и b=0,8; а=1 и b=0,7; а=1 и b=0,5; а=1 и b=0,2.
II. Контроль размеров пор биоинженерной конструкции
Структура некоторых конструкций может быть пористой. Пористость может быть измерена как доля площади поверхности, занятой порами, на гистологическом изображении, относительно общей площади поверхности указанного изображения. Некоторые конструкции могут обладать по меньшей мере 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или большей пористостью.
Для формирования пористого внеклеточного матрикса и/или регулирования размера пор во внеклеточном матриксе биоинженерных конструкций может быть задан средний размер поры. Наряду с типом и/или степенью поперечного связывания могут выбираться и контролироваться определенные средние размеры пор для получения конструкций с различными показателями продолжительности существования и/или
инфильтрации клеток in vivo, варьирующие от «быстро биоремоделируемых» до «умеренно биоремоделируемых» и «длительно биоремоделируемых» биоинженерных конструкций для индивидуализированных терапевтических применений. Кроме того, меньшие размеры пор могут конструироваться для усиления барьерных функций в тех случаях, когда требуется предотвращение или подавление инфильтрации клеток, например, нежелательных типов хозяйских клеток.
Средний размер пор (диаметр) может быть сконструирован варьированием конечной температуры, при которой происходит лиофилизация, также называемая сублимационной сушкой. В ходе этого процесса биоинженерные конструкции замораживают таким образом, что водные составляющие указанной биоинженерной конструкции замерзают, после чего указанную биоинженерную конструкцию помещают в вакуум для удаления замерзшей воды (льда) из конструкции. Лиофилизация приводит к образованию пористой структуры и раскрытию пор за счет удаления кристаллов льда, формирующихся в матриксе, а температура замораживания определяет конечный средний размер пор. Соответственно, при проведении лиофилизации при более низких температурах замерзания образуются поры меньшего размера, в то время как при проведении лиофилизации при более высоких температурах замерзания образуются поры большего размера. Таким образом, согласно одному из вариантов реализации, указанная температура может варьировать от -100°С до 0°С и средний размер поры составляет менее чем 5-10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более микрон (мкм) по мере повышения температуры замораживания. Согласно одному из вариантов реализации, средний размер поры менее чем 5, 10, 15, 20, 25 или 30 мкм, либо принадлежащий любому диапазону между указанными размерами, может быть получен при температуре замораживания -40°С. Согласно другому варианту реализации средний размер пор, составляющий по меньшей мере 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более мкм, или принадлежащий любому диапазону между указанными размерами, может быть получен при температуре замораживания -10°С. Уменьшение скорости достижения температуры замораживания может повышать однородность размера пор. Соответственно, уменьшение скорости замораживания на 10, 5, 4, 3, 2, 1; 0,9; 0,8; 0,7; 0,6; 0,5; 0,4; 0,3; 0,3; 0,1 или менее °С в минуту, или на значение в любом диапазоне между указанными температурами, может повышать однородность пор конструкции.
III. Контроль состава биоинженерной конструкции
Внеклеточные матриксы биоинженерных конструкций, предложенных в соответствии с настоящим изобретением, содержат компоненты, подходящие для лечения и заживления ран.
а. Девитализированные биоинженерные конструкции
Предложенные в настоящем изобретении биоинженерные конструкции могут быть девитализированы для прекращения жизнедеятельности клеток без их удаления, и/или децеллюляризованы для удаления клеток, в зависимости от конечного применения при лечении пациента. Девитализацию или децеллюляризацию можно осуществлять на мембране культурального вкладыша, либо после того как биоинженерную конструкцию отделили от культурального вкладыша.
Биоинженерные конструкции могут быть девитализированы несколькими способами. Один из способов девитализации клеток в биоинженерной конструкций состоит в удалении всей или практически всей жидкости из конструкции при помощи физических методов. Способы удаления жидкости включают дегидратацию на воздухе, высушивание замораживанием или сублимационную сушку. Для дегидратации конструкции путем высушивания на воздухе культуральную среду удаляют из сосуда, в котором изготавливают биоинженерную конструкцию и указанной биоинженерной конструкции просто позволяют терять влагу в течение достаточного для гибели клеток времени. Условия дегидратации варьируют в отношении температуры и относительной влажности. Температуры дегидратации могут варьировать от температур выше температуры замерзания до температуры денатурации коллагена (измеряемой при помощи дифференциальной сканирующей калориметрии, или «ДСК") в указанной биоинженерной конструкции, например, от приблизительно 0°С до приблизительно 60°С, или соответствовать средней комнатной температуре (например, от приблизительно 18°С до приблизительно 22°С). Предпочтительны более низкие уровни относительной влажности, например, в диапазоне от приблизительно 0% до приблизительно 60%; однако предпочтительными также являются и уровни относительной влажности, сравнимые с влажностью помещения, от приблизительно 10% отн.вл. до приблизительно 40% отн.вл. Если дегидратацию проводят высушиванием на воздухе при нормальных комнатных температуре и влажности, влажность указанной биоинженерной конструкции составит от приблизительно 10% до приблизительно 40% по весу, или меньше. Как вариант, биоинженерную конструкцию можно высушить замораживанием (т.е. лиофилизирован), при этом указанную конструкцию замораживают и затем помещают в вакуум для
удаления жидкости. Например, биоинженерные конструкции могут быть взяты непосредственно из культуры и заморожены (например, при температуре от -80°С до 0°С или в любом диапазоне между указанными температурами), и лиофилизированы в течение ночи, например в течение от приблизительно 1 до приблизительно 15 часов, или более. Как вариант, биоинженерные конструкции сначала могут быть высушены на воздухе в течение приблизительно восьми часов, а затем последовательно заморожены и лиофилизированы. После высушивания в обычных условиях или посредством сублимационной сушки указанную биоинженерную конструкцию девитализируют, но сохраняют девитализированные клетки и остатки клеток. Лиофилизация может также придавать качества, отличные от тех, которые могут возникать при дегидратации в обычных условиях. Такие качества, согласно одному из вариантов реализации, заключаются в более пористой и открытой структуре фиброзного матрикса.
Для девитализации клеток биоинженерной конструкции можно применять также химические методы. Для осмотической остановки клеток можно применять воду. Биоинженерные конструкции могут быть погружены в стерильную чистую воду на время, достаточное для гипотонического набухания, вызывающего лизис клеток. После лизиса клеток указанная биоинженерная конструкция может быть девитализирована, но все еще содержать девитализированные клетки и остатки клеток. При использовании воды она может быть смешана с другими веществами, такими как надуксусная кислота, перекись водорода, соли, или их комбинацией. Например, можно применять девитализирующий раствор надуксусной кислоты в воде в концентрации от приблизительно 0,05% до приблизительно 3% по объему. Указанный девитализирующий агент может быть забуферен или может содержать высокую концентрацию соли для предотвращения избыточного набухания указанной биоинженерной конструкции при остановке клеток. Как вариант, в качестве девитализирующих агентов согласно настоящему изобретению можно применять органические растворители и растворы органических растворителей. Органические растворители способны замещать воду в биоинженерной конструкции, останавливая и таким образом девитализируя клетки указанной биоинженерной конструкции. Указанный органический растворитель, применяемый для удаления воды, может представлять собой такой растворитель, который не оставляет остатков после удаления из конструкции, включая, но не ограничиваясь перечисленными, спирты (например, этиловый спирт и изопропиловый спирт) и ацетон. Например, биоинженерные конструкции можно погружать в стерильный этиловый спирт на время, достаточное для замещения воды в указанной биоинженерной конструкции и девитализации клеток. Этиловый спирт может быть удален перед помещением на воздух на время, достаточное
для испарения абсорбированного указанной биоинженерной конструкцией этилового спирта. После испарения растворителя в конструкции остаются девитализированные клетки и остатки клеток, и конструкцию дегидратируют.
Другие способы девитализации клеток включают обработку биоинженерных конструкций ультрафиолетовым излучением или гамма-радиацией. Указанные способы могут применяться в сочетании с гипотоническим набуханием при обработке водой, или с другими химическими методами девитализации, либо с воздухом и замораживанием.
b. Децеллюляризованные биоинженерные конструкции
Децеллюляризация приводит к удалению продуцирующих внеклеточный матрикс клеток, синтезирующих компоненты эндогенного внеклеточного матрикса биоинженерных конструкций, из готовой конструкции. В одном из способов децеллюляризации применяется погружение или аккуратное перемешивание в ходе последовательной химической обработки для удаления клеток, остатков клеток и остаточных клеточных ДНК и РНК. Другие не-коллагеновые и не-эластиновые компоненты внеклеточного матрикса, такие как гликопротеины, гликозаминогликаны, протеогликаны, липиды и другие не-коллагеновые белки, присутствующие в ВКМ, могут также быть удалены или их количество может быть уменьшено при помощи агентов и способов, применяемых для децеллюляризации. Например, указанную биоинженерную конструкцию можно сначала обработать контактированием с эффективным количеством хелатирующего агента, предпочтительно имеющего физиологическую щелочную реакцию, для контроля пределов набухания клеточного матрикса. Хелатирующие агенты стимулируют удаление клеток, клеточного дебриса и структур базальной мембраны из матрикса, уменьшая концентрацию дивалентных катионов. Щелочная обработка может отделять гликопротеины и гликозаминогликаны от коллагеновой ткани и омылять липиды. Известные в данной области техники хелатирующие агенты, которые могут применяться, включают, не ограничиваясь перечисленными, этилендиаминтетрауксусную кислоту (ЭДТА) и этиленбис(оксиэтиленитрило)тетрауксусная кислота (ЭГТА). ЭДТА может быть подщелочена добавлением гидроксида натрия (NaOH), гидроксида кальция Са(ОН)2, карбоната натрия или пероксида натрия. Концентрации ЭДТА или ЭГТА могут составлять от приблизительно 1 до приблизительно 200 мМ, от приблизительно 50 до приблизительно 150 мМ, или приблизительно 100 мМ. Концентрация NaOH может составлять от приблизительно 0,001 до приблизительно 1 М, от приблизительно 0,001 до приблизительно 0,10 М, или приблизительно 0,01 М (например, 100 мМ ЭДТА/10 мМ NaOH в воде). Другие щелочные или основные агенты могут быть подобраны
специалистом в данной области техники для доведения рН хелатирующего раствора до диапазона эффективных основных значений рН. Конечный рН указанного основного хелатирующего раствора должен находиться в диапазоне от приблизительно 8 до приблизительно 12, или от приблизительно 11,1 до приблизительно 11.8.
Указанную биоинженерную конструкцию можно затем привести в контакт с эффективным количеством кислотного раствора, необязательно содержащего соль. Обработка кислотой может стимулировать удаление гликопротеинов, гликозаминогликанов, не-коллагеновых белков и нуклеиновых кислот. Путем обработки солью можно контролировать набухание коллагенового матрикса во время обработки кислотой и стимулировать удаление некоторых гликопротеинов и протеогликанов из коллагенового матрикса. Могут применяться кислотные растворы, известные в данной области техники, которые могут включать, не ограничиваясь перечисленными, соляную кислоту (НС1), уксусную кислоту (СН3СООН) и серную кислоту (H2SO4). Например, соляную кислоту (НС1) можно применять в концентрации от приблизительно 0,5 до приблизительно 2 М, от приблизительно 0,75 до приблизительно 1,25 М, или около 1 М. Конечный рН указанного кислотного/солевого раствора должен находиться в диапазоне от приблизительно 0 до приблизительно 1, от приблизительно 0 до 0,75, или от приблизительно 0,1 до приблизительно 0,5. Соляная кислота и другие сильные кислоты наиболее эффективны для разрушения молекул нуклеиновых кислот, в то время как более слабые кислоты менее эффективны. Подходящие соли представляют собой предпочтительно неорганические соли и включают, не ограничиваясь перечисленными, хлористые соли, такие как хлорид натрия (NaCl), хлорид кальция (CaCl2) и хлорид калия (КС1). Например, хлористые соли могут применяться в концентрации от приблизительно 0,1 до приблизительно 2 М, от приблизительно 0,75 до приблизительно 1.25 М, и около 1 М (например, 2 М НС1/1 М NaCl в воде).
Биоинженерную конструкцию можно затем привести в контакт с эффективным количеством солевого раствора, предпочтительно забуференного приблизительно до физиологического рН. Указанный забуференный солевой раствор нейтрализует материал, при этом уменьшая набухание. Подходящие соли представляют собой предпочтительно неорганические соли и включают, не ограничиваясь перечисленными, хлористые соли, такие как хлорид натрия (NaCl), хлорид кальция (СаС12), и хлорид калия (КС1); и азотистые соли, такие как сульфат аммония (NH3SO4). Например, хлористые соли могут применяться в концентрации от приблизительно 0,1 до приблизительно 2 М, от приблизительно 0,75 до приблизительно 1,25М, или приблизительно 1М. Буферные агенты известны специалистам в данной области техники и включают, не ограничиваясь
перечисленными, фосфатные и боратные растворы. Например, можно применять фосфатно-солевой буфер (ФСБ), где фосфат содержится в концентрации от приблизительно 0,001 до приблизительно 0,02 М, а концентрация соли составляет от приблизительно 0,07 до приблизительно 0,3 М в солевом растворе (например, 1 М хлорида натрия (NaCl)/10 мМ фосфатно-солевого буфера (ФСБ)). Значение рН должно находиться в диапазоне от приблизительно 5 до приблизительно 9, от приблизительно 7 до приблизительно 8, или от приблизительно 7,4 до приблизительно 7,6.
После очищающей химической обработки биоинженерную конструкцию можно отмыть от химических очищающих агентов посредством осуществления контакта с эффективным количеством промывочного агента. Агенты, такие как вода, изотонические солевые растворы (например, ФСБ) и забуференные растворы с физиологическим рН могут быть приведены в контакт с указанной биоинженерной конструкцией на время, достаточное для удаления очищающих агентов. Этапы очищения в виде приведения указанной биоинженерной конструкции в контакт с щелочным хелатирующим агентом и приведения указанной биоинженерной конструкции в контакт с кислотным раствором, содержащим соль, могут быть выполнены в любом порядке для достижения практически одинакового очищающего эффекта.
с. Многослойные и/или сшитые биоинженерные конструкции
ВКМ может быть сшит с применением сшивающего агента для контроля скорости биоремоделирования, либо увеличения продолжительности существования при имплантации или внедрении в живой организм. Его можно сшивать перекрестными связями и применять в виде однослойной конструкции, или можно комбинировать или подвергать манипуляциям для создания конструкций различных типов. При помощи поперечных связей могут быть сшиты биоинженерные пласты или их фрагменты.
Некоторые биоинженерные конструкции содержат два или более совмещенных пласта ВКМ, связанных между собой и образующих плоскую конструкцию. Используемый в настоящем документе термин «связанные коллагеновые слои» означает слои, составленные из двух или более биоинженерных пластов одного и того же или различного происхождения или формы, обработанные таким образом, что указанные слои размещены один над другим и достаточно прочно скреплены за счет слипания слоев и/или химического связывания. В частности, указанные биоинженерные конструкции могут содержать любое количество слоев, например, от 2 до 20 слоев или от 2 до 10 слоев, причем число слоев зависит от прочности и объема, необходимых для конечного назначения конструкции. Как вариант, так как конечный размер многослойной структуры
может быть ограничен размерами пластов матрикса, указанные слои могут входить в составную структуру, формируя плоскую конструкцию с площадью поверхности большей, чем размеры какого-либо из индивидуальных пластов матрикса, но не содержащую слоев, полностью покрывающих всю поверхность структуры.
Для формирования многослойной биоинженерной конструкции из пластов матрикса сначала может быть заложен стерильный жесткий каркасный элемент, такой как жесткий лист из поликарбоната. Если указанные пласты матрикса еще не гидратированы, например, после проведения девитализации или децеллюляризации, их гидратируют в водных растворах, таких как вода или фосфатно-солевой буфер. Пласты матрикса могут промокаться стерильной абсорбирующей тканью для впитывания лишней воды из материала. Первый пласт матрикса может быть выложен на лист поликарбоната и разглажен по указанному листу поликарбоната вручную для устранения любых пузырьков воздуха, складок и морщин. Второй пласт матрикса может быть выложен сверху на первый пласт и также разглажен вручную для устранения любых пузырьков воздуха, складок и морщин. Послойное структурирование может продолжаться до тех пор, пока не будет достигнуто необходимое для конкретного применения количество слоев.
После послойной укладки необходимого количества пластов матрикса указанные пласты могут быть совместно дегидратированы. Дегидратация может скреплять компоненты слоев внеклеточного матрикса, такие как коллагеновые волокна, за счет удаления воды из пространства между волокнами соседних пластов матрикса. Указанные слои могут быть дегидратированы либо при открытой лицевой поверхности на первом каркасном элементе, либо между первым каркасным элементом и вторым каркасным элементом, например, вторым листом поликарбоната, помещенным на верхний слой до высушивания и прикрепленным к первому каркасному элементу для сохранения плоской поверхностной структуры, с применением или без применения сжатия. Для облегчения дегидратации указанный каркасный элемент может быть пористым, что позволяет воздуху и воде поступать к дегидратируемым слоям. Указанные слои могут быть высушены на воздухе, в вакууме или химическим способом, например, с применением ацетона или спирта, такого как этиловый спирт или изопропиловый спирт. Дегидратация высушиванием на воздухе может быть проведена при комнатной влажности от приблизительно 0% Rh до приблизительно 60% Rh, или меньшей; или влажности от приблизительно 10% до приблизительно 40% по весу, или меньшей. Дегидратация может быть легко осуществлена размещением совмещенных слоев матрикса в потоке стерильного воздуха в шкафу с ламинарным потоком на время от по меньшей мере приблизительно 1 часа до 24 часов при нормальной комнатной температуре,
приблизительно 20°С, и комнатной влажности. При дегидратации, проводимой с применением вакуума или химического способа, слои будут дегидратированы до меньшего влагосодержания, чем при высушивании воздухом.
Дегидратированные слои могут быть необязательно регидратированы или, как вариант, регидратированы и вновь дегидратированы. Как упомянуто выше, дегидратация скрепляет компоненты внеклеточного матрикса из соседних слоев матрикса, а сшивание этих слоев приводит к образованию химических связей между указанными компонентами, связывая указанные слои. Для регидратации указанных слоев их совместно отделяют от пористого каркасного элемента и регидратируют в водном агенте для регидратации, предпочтительно, в воде, переносом их в контейнер, содержащий водный агент для регидратации, на время от по меньшей мере приблизительно 10 до приблизительно 15 минут при температуре от приблизительно 4°С до приблизительно 20°С, для регидратации слоев без их разделения или расслоения. Указанные слои матрикса затем сшиваются при контакте уложенных слоями пластов матрикса со сшивающим агентом, предпочтительно химическим сшивающим агентом, предохраняющим слои матрикса от биоремоделирования.
Сшивание обеспечивает конструкции прочность и устойчивость и увеличивает ее пригодность для ручных манипуляций. Можно применять различные типы известных в данной области техники сшивающих агентов, такие как карбодиимиды, генипин, трансглутаминаза, рибоза и другие сахара, нордигидрогваяретовая кислота (NDGA), окислительные агенты, ультрафиолетовое (УФ) излучение и дегидротермальные (DHT) способы. Кроме химических сшивающих агентов слои могут быть связаны биосовместимыми клеями на основе фибрина или адгезивами для применения в медицине, такими как полиуретан, винилацетат или полиэпоксиды. Одним из биосовместимых адгезивов является фиброин шелка, представляющий собой 4-8% раствор фиброина шелка, распределяемый в области связывания между соседними слоями тканевого матрикса и активируемый при помощи метилового спирта. Биосовместимые клеи или адгезивы могут применяться для связывания сшитых или несшитых слоев, или же совместно и тех, и других.
Одним из подходящих сшивающих агентов является 1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорид (ЭДК). К сшивающему агенту ЭДК может быть добавлен сульфо-N-гидроксисукцинимид согласно описанию у Staros, J.V., Biochem. 21, 3950-3955, 1982. Согласно наиболее предпочтительному способу ЭДК растворяют в воде в концентрации от приблизительно 0,1 мМ до приблизительно 100 мМ, от приблизительно 1,0 мМ до приблизительно 10 мМ, или приблизительно 1,0 мМ.
Помимо воды для растворения ЭДК можно применять фосфатно-солевой буфер или (2-[N-морфолино]этансульфоновая кислота) (MES-буфер). В указанный раствор могут быть добавлены и другие агенты, например, ацетон или спирт, в количестве до 99% по объему в воде (как правило, 50%) для более однородного и эффективного перекрестного сшивания. Указанные агенты удаляют из слоев воду, скрепляя волокна матрикса, что способствует сшиванию этих волокон. Доля указанных агентов в воде в составе сшивающего агента может применяться для регуляции сшивания. Сшивающий раствор ЭДК готовят непосредственно перед применением, так как ЭДК теряет активность с течением времени. Для приведения сшивающего агента в контакт со слоями матрикса гидратированные и связанные слои матрикса переносят в контейнер, например, в плоскую кювету, и указанный сшивающий агент аккуратно наливают в кювету таким образом, чтобы слои матрикса были покрыты и свободно плавали, а под слоями матрикса или между ними не образовывались пузырьки воздуха. Контейнер накрывают и слои матрикса оставляют для формирования перекрестных связей приблизительно на 4-24 часа или на время от 8 до приблизительно 16 часов при температуре от приблизительно 4°С до приблизительно 20°С. Сшиванием можно управлять при помощи температуры, например, при более низких температурах сшивание проходит более эффективно, так как процесс замедляется. И напротив, сшивание проходит менее эффективно при более высоких температурах, так как ЭДК менее стабилен.
После сшивания сшивающий агент выливают и утилизируют, сшитые многослойные матриксные конструкции промывают, приводя в контакт с промывочным агентом (например, водой) для удаления остатков сшивающего агента, например, троекратно приводя сшитые многослойные матриксные конструкции в контакт с равными объемами стерильной воды на любой период времени в диапазоне от одной минуты до сорока пяти минут для каждой отмывки.
Как вариант, биоинженерные конструкции могут быть сшиты с применением дегидротермальных (DHT) способов сшивания, формирующих ковалентные связи между смежными карбокси- и аминогруппами белковых волокон за счет реакции конденсации при контролируемом нагревании имплантатов под вакуумом (как правило, сухой нагрев при 120°С, до 24 ч). При такой обработке молекулы воды удаляются из индивидуальных волокон, что часто приводит к комплексным изменениям группировки аминокислотных молекул в цепи коллагена и к вероятности окислительного повреждения. Для определенных применений в регенеративной медицине DHT может быть предпочтительнее химического сшивания, так как при этом процессе в имплантат не попадают потенциально цитотоксические или вызывающие воспаление химические
вещества, способные стимулировать иммунный ответ у пациента.
DHT может придавать высокую прочность коллагеновым матриксам (~50 МПа), однако известно, что он частично денатурирует волокна коллагена благодаря перегруппировке аминокислотных молекул коллагеновых волокон. Большее число поперечных сшивок, образующихся в материале, как правило, обеспечивает большую прочность при контакте материала с пищеварительными ферментами. В то же время, известно, что определенные белковые ферменты осуществляют расщепление только по специфическим участкам-мишеням, которые не экспонированы на поверхности тройных спиральных доменов коллагеновых волокон в том случае или до тех пор, пока белок не денатурирован. Степень денатурации в результате сшивания коллагеновых имплантатов может быть минимизирована с тем, чтобы избежать возможного быстрого разложения матриксов неспецифическими протеазами после имплантации пациенту. Степень DHT-сшивания в коллагеновых матриксах, как правило, определяют по изменениям температур усадки, механической нагрузки или чувствительности к расщеплению ферментами (например, коллагеназой, трипсином и т.д.) коллагеновых волокон. Эффекты высушивания и термической обработки коллагена можно наблюдать также с применением рентгенодифракции, позволяющей увидеть изменения осевой упаковки молекул коллагена в волокнах при дегидратации. Многослойным и/или сшитым биоинженерным конструкциям можно придавать форму, соответствующую различным конструктивным параметрам, например, трубчатую, с помощью хорошо известных техник (см., например, патент США №5712163 (Parenteau), международную публикацию WO 95/31473, международную публикацию WO 00/29553 и международную публикацию WO 2009/070720).
d. Комбинированные продукты
В ВКМ могут быть добавлены различные материалы для увеличения биологической активности или функции при размещении in vivo.
Например, внутрь или на поверхность биоинженерных конструкций, их слоев и/или каркасов могут быть введены или нанесены противомикробные агенты, лекарственные средства, факторы роста, цитокины, генетический материал и клеточные культуры.
В том случае, если биоинженерные конструкции контактируют с кровью, при использовании, например, в системе кровообращения, им можно придать нетромбогенные свойства с применением гепарина, наносимого на все поверхности конструкции или только с одной стороны плоской конструкции, либо аблюминально на трубчатую
конструкцию. Гепарин можно наносить на конструкцию с применением множества общеизвестных техник. К примеру, гепарин можно наносить на конструкцию с применением следующих трех способов. Во-первых, на протез наносят раствор бензалкония гепарина (ВА-Нер) в изопропиловом спирте, вертикально заполняя просвет протеза или погружая протез в указанный раствор, а затем высушивают его. Эта процедура приводит к ионному связыванию комплекса ВА-Нер с коллагеном. Во-вторых, для активирования гепарина и последующего ковалентного связывания гепарина с коллагеновым волокном можно применять ЭДК. В-третьих, ЭДК можно применять для активирования коллагена, последующего ковалентного связывания протамина с коллагеном, и затем связывания гепарина с протамином.
По меньшей мере на одну поверхность биоинженерных конструкций могут наноситься синтетические материалы. Синтетический материал может иметь форму пласта, накладываемого на указанную биоинженерную конструкцию или размещаемого на ней для формирования синтетического слоя на биоинженерном слое. Один из классов синтетических материалов, предпочтительно биологически совместимых синтетических материалов, представлен полимерами. Такие полимеры включают, не ограничиваясь перечисленными, следующие: поли(уретаны), поли(силоксаны) или силиконы, поли(этилен), поли(винилпирролидон), поли(2-гидроксиэтилметакрилат), поли(N-винилпирролидон), поли(метилметакрилат), поли (виниловый спирт), поли (акриловая кислота), полиакриламид, поли(этилен-ко-винил ацетат), поли(этиленгликоль), поли(метакриловая кислота), полилактиды (ПМК), полигликолиды (ПГА), поли (лактид-ко-гликолид-ы) (PLGA), полиангидриды и полиортоэфиры или любые другие сходные синтетические полимеры, которые могут быть получены и являются биологически совместимыми. Термин «биологически совместимые, синтетические полимеры» также включает сополимеры, их смеси и любые другие комбинации вышеприведенных полимеров друг с другом или с другими полимерами в широком смысле. Использование таких полимеров зависит от конкретных применений и необходимых характеристик. Например, биологически совместимые синтетические материалы могут также быть биологически разлагаемыми, то есть при имплантации в организм пациента они со временем биоразлагаются. После их размещения на биоинженерной конструкции комбинированная конструкция содержит биологически разлагаемый слой и биоремоделируемый слой. Более подробное обсуждение таких полимеров и типов полимеров приведено в источнике: Brannon-Peppas, Lisa, «Polymers in Controlled Drug Delivery)) («Полимеры для управляемой доставки лекарственных средств»), Medical
Plastics and Biomaterials, November 1997, включенном в настоящий документ посредством ссылки в том же объеме, как если бы он был приведен здесь полностью.
Примером еще одного синтетического материала, который можно применять в качестве подложки, является силикон. Силиконовый слой в виде пористой или микропористой мембраны или непористой пленки накладывается и прикрепляется к матриксной конструкции. При применении для заживления ран силиконовый слой можно применять для ручных манипуляций с матриксной конструкцией, наложения его на кожную рану и закрытия границ раны, запечатывая матриксную конструкцию для заживления раны. Силикон также образует влагоудерживающий барьер, предотвращающий высыхание раны. После успешного формирования ткани в зажившей ране, как правило, приблизительно через 21 день, силикон аккуратно отделяют от краев зажившей или заживающей раны щипцами.
Также в биоинженерные конструкции могут добавляться белки. Примеры подходящих белков внеклеточного матрикса включают, не ограничиваясь перечисленными, коллаген, фибрин, эластин, ламинин и фибронектин, протеогликаны. Фибриноген в сочетании с тромбином образует фибрин. Гиалуронан (также называемый гиалуроновой кислотой или гиалуронатом) представляет собой несульфатированный гликозаминогликан, широко распространенный в соединительных, эпителиальных и нервных тканях. Это один из главных компонентов внеклеточного матрикса, вносящий важный вклад в пролиферацию и миграцию клеток и применяющийся для уменьшения послеоперационной адгезии. Существует множество типов каждого из таких белков, встречающихся в природе, а также типов, которые могут быть получены или которые получают синтетическим путем или с применением генной инженерии. Коллаген может быть представлен множеством форм и типов. Термин «белок» также включает, не ограничиваясь перечисленными, фрагменты, аналоги, консервативные замены аминокислот и замены на не встречающиеся в природе аминокислоты, относящиеся к любому из перечисленных белков. Термин «остаток» относится к аминокислоте (D или L) или миметику аминокислоты, включенной(ному) в белок посредством амидной связи. Такая аминокислота может представлять собой встречающуюся в природе аминокислоту или, если не указаны ограничения, может включать известные аналоги природных аминокислот, функционирующие сходным с встречающимися в природе аминокислотами образом (т.е. миметики аминокислот). Кроме того, миметики амидной связи включают модификации пептидного остова, хорошо известные специалистам в данной области техники. Например, пептиды могут применяться для усиления клеточных эффектов (например, инфильтрации фибробластов кожи человека в шелковый каркас и увеличения способности к рекрутингу хозяйских клеток, таких как эпителиальные клетки). Такие пептиды могут представлять собой ROD, Gofoger, ламинины 1-10 и пронсктин. В частности, ламинин 5 и ламинин 10 особенно успешно увеличивают инфильтрацию/миграцию эпителиальных клеток. Пептиды могут также применяться для стимуляции миграции эндотслиальных клеток. В частности, пептиды, такие как тромбин и фибриноген, могут увеличивать миграцию эндотелиальных клеток, особенно в случаях, когда полезна неоваскуляризация.
Молекула клеточной адгезии может также быть внедрена внутрь или на поверхность полимерного матрикса для локального прикрепления каркасной композиции к ткани и предотвращения диффузии указанной биоинженерной конструкции. Такие молекулы внедряют в полимерный матрикс до полимеризации матрикса или после полимеризации матрикса. Примеры молекул клеточной адгезии включают, не ограничиваясь перечисленными, пептиды, белки и полисахариды, такие как фибронектин, ламинин, коллаген, тромбоспондин 1, витронектин, эластин, танасцин, аггрекан, агрин, сиалопротеин кости, белок хрящевого матрикса, фибриноген, фибрин, фибулин, муцины, энтактин, остеопонтин, плазминоген, рестриктин, серглицин, SPARC/остеонектин, версикан, фактор фон Виллебранда, полисахарид гепарансульфат, коннексины, коллаген, ROD (Arg-Gly-Asp) и YIGSR (Tyr-Ile-GIy-Scr-Arg) пептиды и циклические пептиды, гликозаминогликаны (ГАГ), гиалуроновую кислоту (ГК), хондроитин-6-сульфат, лиганды интегринов, селектины, кадгерины и представители суперсемейства иммуноглобулинов. Другие примеры включают нейрональные молекулы клеточной адгезии (НМКА), молекулы межклеточной адгезии (ММА), молекулу адгезии сосудистых клеток (МАСК-1), молекулу адгезии тромбоцит-эндотелиальных клеток (РЕСАМ-1), L1 и СНLl.
Белки и пептилы ВКМ и их роль в функционировании клетки
и других клеток
Дополнительные примеры подходящих молекул клеточной адгезии приведены ниже.
Аминокислотные последовательности, специфические для связывания протеогликанов белков внеклеточного матрикса
В частности, предпочтительными молекулами клеточной адгезии являются пептиды или циклические пептиды, содержащие аминокислотную последовательность аргинин-глицин-аспарагиновая кислота (RGD), известную как лиганд прикрепления клеток и обнаруживаемую в различных природных молекулах внеклеточного матрикса. Полимерный матрикс с такой модификацией обеспечивает клеточно-адгезивные свойства каркаса и способствует длительному выживанию систем на основе клеток млекопитающих, а также поддержанию роста клеток.
Факторы роста также могут вводиться в биоинженерные конструкции и/или на поверхность каркасных структур. Такие вещества включают КМБ, костный морфогенетический белок; ВКМ, белки внеклеточного матрикса или их фрагменты; ЭФР, эпидермальный фактор роста; ФРФ-2, фактор роста фибробластов 2; ФРН, фактор роста нервов; PDGF (ФРТ), тромбоцитарный фактор роста; P1GF, плацентарный фактор роста; ТФР, трансформирующий фактор роста, ФРЭС, фактор роста эндотелия сосудов, ФХМ1 и IL4 (ИЛ-4). Молекулы, обеспечивающие адгезию «клетка к клетке» (кадгерины, интегрины, ALCAM, НМКА, протеазы, Notch-лиганды) необязательно добавляют к каркасной композиции. Типовые факторы роста и лиганды приведены в таблицах ниже. Факторы роста, применяемые для ангиогенеза
Факторы роста, применяемые для конструирования тканей
эндотелиальных клеток
rH=«рекомбинантный человеческий»
Иммобилизованные лиганды, применяемые для конструирования тканей
Способствует адгезии, пролиферации и дифференцировке миобластов, Усиливает адгезию и пролиферацию эндотелиальных клеток
* Последовательности приведены с использованием однобуквенных обозначений аминокислот. ММП= матриксная металлопротеиназа.
Для стимуляции формирования кровеносных сосудов in vivo, девитализированные биоинженерные конструкции могут быть пропитаны белками, такими как тромбоцитарный фактор роста (ФРТ), фактор роста фибробластов (ФРФ), фактор роста гепатоцитов/ рассеивающий фактор (ФРГ/SF), инсулиноподобный фактор роста (ИФР), фактор роста эндотелия сосудов (ФРЭС) и другие виды про-ангиогенных факторов. Согласно одному из аспектов 50 мкг порошка рекомбинантного ФРТ-ВВ человека ресуспендировали в 0,5 мл 4 мМ НС1, и затем дополнительно добавляли 0,5 мл фосфатно-солевого буфера (ФСБ). Полученным 1 мл раствора пропитывали девитализированную биоинженерную конструкцию перед имплантацией в полнослойную рану у бестимусных и нормальных мышей. Кроме того, 50 мкг рекомбинантного основного фактора роста фибробластов человека (ОФРФ) ресуспендировали в 1 мл ФСБ. Биоинженерные конструкции пропитывали 1 мл раствора ОФРФ в течение 5 минут перед имплантацией в полнослойную рану у бестимусных и нормальных мышей. Согласно другому варианту реализации 50 мкг рекомбинантного ФРТ-ВВ человека ресуспендировали в 0,5 мл 4 мМ HCL, после чего смешивали с 0,5 мл ресуспендированного в ФСБ рекомбинантного ОФРФ человека. Биоинженерные конструкции пропитывали полученным 1 мл раствором в течение пяти минут перед имплантацией в полнослойную рану у бестимусных и нормальных мышей. Согласно другому варианту реализации биоинженерные конструкции получают согласно Примеру 12. Кондиционированная культуральная среда может быть собрана при любой из многочисленных смен среды в течение времени культивирования. В частности, кондиционированную культуральную среду собирали после 11 дня и концентрировали (например, 100-кратно). Затем девитализированные биоинженерные конструкции, предложенные в настоящем изобретении, пропитывали в концентрированной кондиционированной среде непосредственно перед имплантацией.
В культуральную среду с заданным химическим составом могут также быть введены добавки для выборочного усиления требуемых качеств внеклеточного матрикса и/или для достижения требуемых результатов in vivo. Культуральная среда с заданным химическим составом содержит следующие компоненты:
Для увеличения количества гиалуроновой кислоты (ГК) в указанной биоинженерной конструкции и стимуляции формирования новых кровеносных сосудов in vivo, к указанной культуральной среде с заданным химическим составом может быть также добавлено 2-кратное количество длинного ТФР-α (40 нг/мл). Дополнительно к указанной культуральной среде с заданным химическим составом могут быть также добавлены 25 нг/мл ФРТ на 5 день, 25 нг/мл ОФРФ на 10 день и 25 нг/мл фактора роста гепатоцитов (ФРГ) на 15 день. Как вариант, к указанной культуральной среде с заданным химическим составом добавлены 2-кратное количество длинного ТФР-α (40 нг/мл), 25 нг/мл ОФРФ на 5день, 25 нг/мл ФРТ на 10 день и 25 нг/мл ОФРФ на 15 день. Дополнительный вариант состава среды с заданным химическим составом включает 2-кратное количество длинного ТФР-α (40 нг/мл), 25 нг/мл ФРТ на 5 день, 25 нг/мл ОФРФ на 10 день и 25 нг/мл ФРГ на 15 день.
Как вариант, биоинженерные конструкции, предложенные в настоящем изобретении, могут быть получены таким образом, чтобы содержать увеличенные уровни сульфатированных гликозаминогликанов (сГАГ), добавлением в культуральную среду с заданным химическим составом длинного ТФР-α до 10-кратного содержания (200 нг/мл).
В частности, при сравнении биоинженерных конструкций, полученных добавлением в культуральную среду с заданным химическим составом длинного ТФР-α до 10 - кратного содержания (200 нг/мл) и IX ТФР-α (20 нг/мл), приблизительно 1100 мкг сГАГ/конструкцию обнаруживается в биоинженерных конструкциях, полученных в среде с добавлением 10-кратного количества длинного ТФР-α (200 нг/мл), в отличие от 600 мкг сГАГ/ конструкцию в биоинженерных конструкциях, полученных в среде с добавлением IX ТФР-α (20 нг/мл). Следует отметить, что изменения в составе средовых добавок, описанные в настоящем документе, могут применяться для обработки шелкового каркаса, засеянного ДФЧ или без ДФЧ, без отступления от объема изобретения.
Биоинженерные конструкции могут быть подвергнуты модификациям поверхности для увеличения адгезивности или характеристик прикрепления к ткани. Поверхностная модификация, обеспечивающая адгезивные «средства», может затрагивать апикальную, базальную или обе противолежащие поверхности, увеличивая связывание конструкции при тесном контакте с тканями и органами пациента in vivo. Увеличивающие адгезивность «средства» могут представлять собой что-либо одно или более из следующих: (а) Включение множества самоорганизованных микроструктур и/или наноструктур, формирующихся на и выступающих из указанной биоинженерной поверхности; (b) добавление биосовместимого и биологически разлагаемого адгезивного материала, например, пленки, геля, гидрогеля, жидкости или клея, связанного, покрывающего или наносимого непосредственно на биоинженерную поверхность; или (с) получаемая электропрядением липкая волокнистая подложка, которая накладывается или наносится на указанную биоинженерную поверхность.
Увеличивающие адгезивность «средства» могут быть ограничены одной внешней поверхностью (базальной или апикальной, в зависимости от предпочтительного дизайна конструкции). Такую адгезивную конструкцию можно применять для восстановления органов, придания объема, укрепления или реконструкции. Указанная адгезивная конструкция не должна прикрепляться к окружающим смежным с раной тканям, только непосредственно к поверхности органа, нуждающегося в заживлении. В то же время, и базальная, и апикальная поверхности могут обладать увеличивающими адгезивность «средствами», одинаковыми или различными на каждой поверхности, в зависимости от предполагаемого терапевтического применения композиции (например, предназначенной для удержания внутренних тканей или органов в непосредственной близости друг от друга, или, как вариант, для плотного прижатия ткани пациента к поверхности экзогенного имплантируемого терапевтического устройства или сенсора).
Для получения различных вариантов реализации могут применяться определенные
способы изготовления, и в случае, если после изготовления они содержат самоорганизующиеся микро- и/или нано-структуры, и если они включают биосовместимые и биологически разлагаемые адгезивные материалы. Так, по форме имплантат может представлять собой округлый, овальный, эллиптический, треугольный лоскут, прямоугольник или квадрат того или иного размера, в зависимости от предполагаемого терапевтического применения (например, длинные, узкие прямоугольники для определенных применений, сходные с форматом ленты, когда длина композиции значительно больше, чем ее ширина, например, для наложения на кость или другой орган, тогда как в других случаях требуются лоскуты более близкой к квадрату формы, например, для коррекции грыжи. Указанный имплантат может быть в дальнейшем при необходимости обрезан хирургом для подгонки к конкретному размеру и форме дефекта у пациента. Кроме того, указанные полоса или лоскут могут содержать одно или более лекарственное средство для предотвращения бактериальной инфекции, например, коллоидное серебро или микробные токсины, и для предотвращения послеоперационного кровотечения, например, фибриноген или тромбин. Согласно еще одному варианту реализации указанная конструкция может быть митотически инактивирована гамма-излучением, обработкой митомицином-С или любыми другими известными в данной области техники способами перед доставкой, что позволит донорским клеткам продолжать секретировать заживляющие биологические факторы, но предотвратит долгосрочный энграфтмент в организме пациента. По меньшей мере фрагмент указанного адгезионного изделия может обладать силой адгезии, равной или превышающей приблизительно 0,05 Н на квадратный сантиметр расчетной площади при измерении согласно стандартам ASTM (Американского общества по испытанию материалов) D4501, D4541 или D6862-04.
Адгезивные средства включают множество самоорганизующихся микроструктур, образующихся на базальной поверхности указанных биоинженерных конструкций, продуцируемых комплексом фибробластов и/или мезенхимальных клеток-предшественников, образуемым клетками и секретируемым ими внеклеточным матриксом, воспроизводящих модифирированную пористую поверхность мембран культуральных вкладышей биореактора. Фактически, засеваемая поверхность функционирует в качестве микрошаблона, содержащего многочисленные сконструированные пустоты или полые структуры, куда при культивировании заселяются клетки и затем секретируют белки, липиды, ГАГ и другие факторы матрикса, наполняющие эти полости, таким образом создавая выступы или тканевые «застежки», покрывающие всю базальную поверхность или фрагмент базальной поверхности
указанных биоинженерных конструкций, представляющие собой зеркальное отображение наномерного рельефа засеваемой поверхности после удаления указанных биоинженерных конструкций из биореактора. Микрорельеф засеваемых поверхностей может быть сформирован с применением разнообразных известных в данной области техники методов, включая, но не ограничиваясь перечисленными, литографию, нанопрядение, микротравление и фотолитографию, сопровождаемых травлением или наномолдингом. Могут быть получены выступы различных форм и размеров, включая конусы, шипы, цилиндры, призмы, пирамиды, многоугольники, фигурные канавки, чашечные присоски или формы, имитирующие наномерный рельеф щетинок и пластинок, обнаруживаемых на нижней стороне лап гекконов. Указанные выступы могут включать второй, третий или дополнительные наборы выступов, расположенных на основных выступах базальной или апикальной поверхности указанной биоинженерной конструкции. Выступы являются неотъемлемой характеристикой указанных биоинженерных конструкций, они могут быть однородными по форме и размерам на поверхности или могут образовывать комбинации форм и размеров, в зависимости от предназначения и необходимого уровня адгезивности. Указанные выступы могут образовывать на поверхности различные паттерны и могут быть распределены с различной плотностью. Плотность выступов, или число выступов на единицу площади, варьирует от приблизительно 10 выступов/см2 до приблизительно 1×10 выступов/см. Указанные выступы могут образовывать паттерн, либо могут быть расположены упорядоченно, неупорядоченно или в случайном порядке, в зависимости от предназначения полосы или лоскута. Согласно некоторым вариантам реализации указанные выступы имеют среднюю высоту менее чем приблизительно 1000 мкм. Указанные выступы могут иметь среднюю высоту от приблизительно 0,2 мкм до приблизительно 150 мкм. Указанные выступы могут иметь среднюю ширину верхней части от приблизительно 0,05 мкм до приблизительно 150 мкм. Указанные выступы могут иметь среднюю ширину основания от приблизительно 0,05 мкм до приблизительно 150 мкм. Среднее расстояние «от центра до центра» указанных выступов может составлять от приблизительно 0,2 мкм до приблизительно 500 мкм. Указанные выступы могут иметь среднее отношение ширины верхней части и основания от приблизительно 0,1:1 до приблизительно 500:1. Указанные выступы могут иметь среднее отношение ширины основания к ширине верхней части от приблизительно 1000:1 до приблизительно 0,1:1. Согласно некоторым вариантам реализации указанные самоорганизующиеся выступы могут быть способны к пронизыванию ткани пациента при установке хирургом.
Как вариант, указанные увеличивающие адгезивность свойства представляют собой адгезивный материал, либо наносимый на поверхность биореактора перед
начальным высеванием клеток, либо, как вариант, наносимый непосредственно на поверхность самособираемых биоинженерных конструкций после завершения культивирования, но до окончательного размещения (т.е. после удаления жидкой ростовой среды, но до установки изделий). Важными чертами подходящих для целей настоящего изобретения адгезивов являются биоразлагаемость, биологическая совместимость, гибкость, эластичность, способность к формированию прочных связей с поверхностью ткани (даже во влажных или мокрых средах). Указанный адгезивный материал должен быть способен к формированию химической связи с поверхностью конструкции из клеточного матрикса, такой как ковалентная или не-ковалентная связь, реализуемая за счет ван-дер-ваальсовых, электростатических или водородных взаимодействий. Указанный адгезивный материал может быть добавлен на поверхность конструкции распылением, раскатыванием или погружением. Для формирования адгезивной поверхности могут применяться различные адгезивные материалы, известные в данной области техники, включая, но не ограничиваясь перечисленными, целлюлозу, карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу или их комбинации. Другие материалы, применяемые для адгезивной поверхности могут включать, не ограничиваясь перечисленными, поли(глицерин себацинат) (PGS), поли(глицерин себацинат акрилат) (PGSA), поли(лактик-со-гликолевая кислота) (PLGA), поликапролактон (ПКЛ), полигликолид (ПГА), полимолочная кислота (ПМК), поли-3-гидроксибутират (ПГБ), сложные фосфоэфиры полиаминов, полиуретан, парилен-С, кератин, углеродные нанотрубки, поли(ангидрид), поливинилпирролидон, полипропиленгликоль, гиалуроновую кислоту, декстраны, коллаген, хитин, хитозан, фиброин шелка, гликозаминогликаны, фибрин, фибриноген или т.п.
Увеличивающие адгезивность средства могут также быть получены из нановолокон или микроволокон, которым свойственны адгезивные качества, наносимых посредством электропрядения непосредственно на поверхность самособираемых конструкций после завершения культивирования, но до окончательного размещения (т.е. после удаления жидкой ростовой среды, но до установки изделий). Получаемые электропрядением нановолокна или микроволокна могут представлять собой, не ограничиваясь перечисленными, коллаген, поли(лактик-со-гликолевую кислоту) (PLGA), поликапролактон (ПКЛ), полигликолид (ПГА), полимолочную кислоту (ПМК), и их комбинации.
e. Сетчатые биоинженерные конструкции
Биоинженерные конструкции могут быть также обеспечены в сетчатом виде перед имплантированием пациенту, нуждающемуся в обработке раны. При применении для заживления ран формирование сетчатости улучшает совместимость с раневым ложем и обеспечивает возможность отведения раневого экссудата из-под имплантата. Под термино «обеспечены в сетчатом виде» понимается механический способ, с помощью которого ткань перфорируют с получением прорезей для формирования сетеподобной структуры. Сетчатые конструкции могут быть расправлены растягиванием поверхности с тем, чтобы прорези открылись, и затем размещены в раневом ложе. Расправленные сетчатые конструкции обеспечивают максимальное покрытие раневой поверхности. Как вариант, сетчатые конструкции могут быть размещены без растягивания, в виде пласта с нерасправленными прорезями. Указанная сетчатая конструкция может быть установлена сам по себе или же вместе с собственной кожей пациента, взятой с другого участка тела. Конструкции также могут иметь перфорации или фенестрации, а также поры, полученные другими способами. Фенестрации могут быть получены вручную с применением лазера, щипцов, скальпеля, иглы или пина. Биоинженерные конструкции могут также быть получены с отверстиями, соединяющими обе плоскости конструкции. Отверстия представляют собой перфорации, организованные упорядоченно или в случайном порядке. Ткань также может надрезаться или перфорироваться вручную при помощи скальпеля или иглы.
f. Заключительная стерилизация биоинженерных конструкций
Конструкции могут быть подвергнуты заключительной стерилизации с применением известных в данной области техники способов. Предпочтительным способом стерилизации является приведение конструкций в контакт со стерильной 0,1% надуксусной кислотой (НУК), нейтрализуемой достаточным количеством 10 N гидроксида натрия (NaOH), согласно патенту США №5460962, раскрытие сущности которого включено в настоящий документ. Дезинфекция проводится в контейнере на качающейся платформе, например, в 1 л контейнерах Nalge, в течение 16-20 часов (например, 18 часов). Затем конструкции могут быть троекратно промыты стерильной водой, по 10 минут на каждую отмывку.
Конструкции могут быть стерилизованы гамма-излучением. Конструкции могут быть запакованы в контейнеры, изготовленные из подходящего для гамма-излучения материала и запечатаны с применением вакуум-закаточного устройства, после чего контейнеры, в свою очередь, помещают в герметичные пакеты для гамма-излучения от 15,0 до 40,0 кГр.
Гамма-излучение существенно, но не пагубно, уменьшает подверженность конструкции деградации, модуль Юнга и температуру усадки. Механические свойства после обработки гамма-излучением по-прежнему подходят для ряда применений, и гамма-излучение представляет собой предпочтительный способ стерилизации, так как широко применяется для имплантируемых медицинских изделий.
V. СПОСОБЫ ЛЕЧЕНИЯ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ
Биоинженерные конструкции, содержащие или не содержащие клетки, могут быть введены пациенту, например, для лечения поврежденного или больного органа или ткани, для заживления указанных органа или ткань и/или восстановления его/ее надлежащей функциональности. Биоинженерные конструкции, предложенные в настоящем изобретении, обладают такими свойствами, что, будучи имплантированы пациенту в терапевтически эффективном количестве, индуцируют сайт-специфичные заживление и регенерацию ткани. Терапевтически эффективное количество конструкции можно обеспечить пациенту за одно или более введений или аппликаций. Благодаря потенциалу дифференцировки мезенхимальных клеток-предшественников, включение таких мультипотентных клеточных популяций увеличивает скорость и качество заживления костей, хрящей, сухожилий, связок, мышц и кожи). Указанные биоинженерные конструкции предположительно будут оказывать ангиогенное, противовоспалительное, остеогенное, адипогенное или фиброгенное действие, или комбинацию этих действий, при имплантировании рядом или в контакте с получающей подходящее для этого участка имплантации лечение тканью или органом.
Биоинженерные конструкции, предложенные в настоящем изобретении, обладают ангиогенными свойствами, то есть индуцируют рост новых кровеносных сосудов, важный для заживления ран и формирования грануляционной ткани в кожных ранах, и для других хирургических применений указанных биоинженерных конструкций. Ангиогенез определяют, например, посредством стандартных гистологических техник (например, при помощи окрашивания α-SMA) или других методов анализа согласно приведенным в настоящем документе описаниям.
Биоинженерные конструкции, предложенные в настоящем изобретении, обладают противовоспалительными свойствами после имплантирования, т.о. инфильтрация хозяйских воспалительных клеток минимизирована, следовательно, хозяйские клетки скорее будут мигрировать в имплантированную биоинженерную конструкцию для биоремоделирования указанной конструкции и восстановления ткани организма. Миграция клеток хозяина из ткани организма в имплантированную биоинженерную
конструкцию представляет собой часть регенеративного ответа. Гистологические техники могут применяться для определения уровней инфильтрации воспалительных клеток и миграции клеток организма-хозяина. Биоинженерные конструкции, предложенные в настоящем изобретении, также обладают остеогенными свойствами, то есть на получающем лечение участке происходит формирование новой кости. Остеогенез измеряют определением новой соединительной и оссифицирующейся ткани, усиленных клеточной активности и обмена веществ вновь формирующейся ткани. Стандартные гистологические техники и другие техники могут применяться для измерения клеточного эффекта, а также плотности кости и площади поверхности кости на получающем лечение участке. Указанные биоинженерные конструкции предположительно обладают адипогенностью, формируя новую жировую ткань при имплантировании в получающий лечение участок. Фиброгенные свойства указанных биоинженерных конструкций можно оценить при имплантировании в получающий лечение участок. Биоинженерные конструкции, предложенные в соответствии с настоящим изобретением, подходят для разнообразных терапевтических применений при лечении человека и не-человека (т.е. в ветеринарии).
Настоящее изобретение охватывает медицинские применения и способы лечения пациентов, нуждающихся в заживлении ран с применением биоинженерных конструкций, предложенных в настоящем изобретении, для лечения хирургических ран; ожоговых ран; хронических ран; диабетических язв нижних конечностей; трофических язв; пролежневых язв (наряду с лечением отрицательным давлением и без такого лечения); артериальных язв; туннельных ран, таких как туннелирующие из полости хронической раны; синусов (например, пилонидальный синус, послеоперационные зияния) и свищей (например, анальные, кожно-брюшные, влагалищно-пузырные, ороантральные, бронхоплевральные).
Другие медицинские применения и способы лечения пациентов, нуждающихся в лечении, включают сердечные применения, применения на твердых и мягких тканей полости рта (например, лечение рецессии гингивальной ткани, направленная регенерация костной ткани для устранения дефектов кости или восстановления поврежденной кости, направленная регенерация и восстановление соединительных тканей полости рта),
Дополнительные медицинские применения и методы лечения с применением указанных биоинженерных конструкций включают косметические применения, в том числе дермальные филлеры для мягких тканей (например, для контурирования в косметологии), применения для реконструкции груди (например, для увеличения, подтяжки груди и/или мастопексии) и неврологические применения, например, лоскуты для восстановления твердой мозговой оболочки или имплантаты для реконструкции
периферического нерва, оболочки для пучков нервных волокон или трубки для направленной регенерации нервов.
Другие применения указанных биоинженерных конструкций включают, не ограничиваясь перечисленными, применение на линиях шва или в открытых ранах для улучшения закрытия и прочности при определенных хирургических процедурах, когда просачивание воздуха или жидкостей может быть пагубным для здоровья пациента и требуются дополнительные коррекционные хирургические процедуры для предотвращения осложнений, таких как инфекция, образование абсцесса или внутреннее кровотечение (например, при шунтировании желудка; колостомиях; резекциях толстого и тонкого кишечника; для сосудистых графтов; для сосудистых имплантатов; графтов для коронарного шунтирования; при абдоминопластике; в полостной хирургии (например, при лапаротомии); при кесаревом сечении; в области трахеостомии; в области имплантирования катетера; для закрытия повреждений перикарда, плевры и твердых мозговых оболочек); применение в профилактических целях для заживления или предотвращения разрывов органов (например, стабилизации нестабильных бляшек; разрывы брюшной аорты/ аневризмы; язвенные прободения желудка или тонкого кишечника; болезнь Крона; воспалительное заболевание кишечника); «отверстия», нуждающиеся в заполнении для восстановления клеточного роста (например, недержание мочи; восстановление носа или перегородок; свищи прямой кишки; стомы; разрывы мышц; разрывы хрящей; материал для покрытия суставов; коррекция грыж мягких тканей и мышечных стенок);
Далее, применения указанных биоинженерных конструкций включают, не ограничиваясь перечисленными, протезирование и реконструкцию костей (например, сложные переломы; остеотомии; искусственная периостальная мембрана; покрытие для культи ампутированных конечностей и ампутированных придатков); восстановление и регенерация кардиоваскулярной ткани (после инфаркта миокарда; при застойной сердечной недостаточности); ишемию миокарда; инсульт; периферическую артериальную болезни; невропатии; ишемическую болезнь сердца); применения для реконструкции нервов; для регенерации печени (фиброз; острый, подострый и хронический гепатит; цирроз; фульминантная печеночная недостаточность; покрытие наружной поверхности после трансплантации доли); для регенерации почек при острой почечной недостаточности; для закрытия хирургических ран; предотвращения послеоперационной
брюшинной адгезии; покрытие для кардиоваскулярных стентов и стентов слюнных или желчных протоков.
Указанные биоинженерные конструкции могут наноситься или имплантироваться в получающий лечение участок приведением его в контакт с поврежденной или больной тканью, заполнением пустот в ткани или помещением туда, где ткань пациента отсутствует или более не существует. Нанесение или имплантирование указанных биоинженерных конструкций может осуществляться прижатием непосредственно к поверхности органа, обертыванием вокруг всей поверхности органа или прикреплением к получающему лечение участку с применением хирургических адгезивов, шовного материала или скобок. Указанные биоинженерные конструкции могут также устанавливаться в виде плоского пласта или в свернутом виде, вкладываться или инъецироваться в получающий лечение участок. Указанную биоинженерную конструкцию можно доставлять во время открытых хирургических процедур, подкожно или лапароскопически проведением указанной конструкции через канюлю к дефекту. Независимо от способа доставки указанное устройство стимулирует регенеративные целебные процессы за счет локальной доставки строительных блоков для восстановления и соединений для клеточной сигнализации в подходящих физиологических концентрациях, включая клетки вместе с их комплексной системой секретируемых цитокинов, белков ВКМ, гликозаминогликанов, липидов, реорганизующих матрикс ферментов и составляющих коллагена, которые могут быть реорганизованы для нужд раненого органа или могут обеспечивать локальный рекрутинг эндогенных регенеративных клеток хозяина. Как вариант, указанные биоинженерные конструкции включают генетически модифицированные клетки, которые должны осуществлять локальную клеточную генную терапию в определенных органах нуждающегося в этом пациента. Указанная конструкция может также включать лекарственное средство, функционируя как средство доставки малых молекул терапевтических средств, биологических терапевтических средств или фармацевтических средств для внутренней, местной, продленной доставки и доставки с медленным высвобождением терапевтических средств нуждающемуся в этом пациенту.
Следующие примеры приведены для лучшего понимания практических применений настоящего изобретения и никоим образом не должны интерпретироваться как ограничивающие объем настоящего изобретения. Для специалистов в данной области
техники очевидно, что в описанные здесь способы могут быть внесены различные модификации без отступления от сущности и объема настоящего изобретения.
ПРИМЕРЫ
Пример 1: Биоинженерная конструкция, продуцируемая мезенхимальными стволовыми клетками (МСК)
Получение биоинженерных конструкций, содержащих мезенхимальные стволовые клетки, выращенные в условиях для продуцирования слоя внеклеточного матрикса, синтезируемого и собираемого указанными мезенхимальными стволовыми клетками, проиллюстрировано с применением периваскулярных клеток пуповины человека (HUCPVC). В частности, специалистам прежде не удавалось задать подготовительные условия, позволяющие МСК синтезировать и собирать компоненты внеклеточного матрикса сколько-нибудь существенной толщины. Перед засеванием HUCPVC культуральные вкладыши покрывали приблизительно 5 мкг/см фибронектина из плазмы человека. Указанные биоинженерные конструкции получали первичным высеванием 3×106 HUCPVC на 24 мм вкладыш. После высевания указанных клеток на культуральный вкладыш с пористой мембраной во вкладыше указанные клетки поддерживались в культуре в течение 18 дней, с заменой культуральной среды на свежую на 5, 8, 12, и 15 день, в следующей культуральной среде с заданным химическим составом:
Готовые биоинженерные конструкции производят внеклеточные матриксы толщиной по меньшей мере 30 микрон. Для исследования корреляции между толщиной полученного из МСК биоинженерной конструкции и продолжительности культивирования проводили анализ зависимости формирования внеклеточного матрикса от времени. На Фиг.1А и 1В продемонстрировано, что самые значительные утолщения биоинженерных конструкций могут быть достигнуты через двенадцать дней культивирования.
Для дальнейшего определения факторов, вносящих вклад в эффективный синтез и организацию внеклеточного матрикса мезенхимальными стволовыми клетками, оценивали роль ТФР-альфа и простагландина 2. На Фиг.2 продемонстрирована корреляция между увеличением толщины биоинженерной конструкции как функции от увеличивающейся концентрации ТФР-альфа в культуральной среде после культивирования 3×106 HUCPVC на 24 мм вкладыше в течение 18 дней. На Фиг.3 продемонстрирована корреляция между уменьшающейся толщиной биоинженерной конструкции как функции от увеличивающейся концентрации простагландина 2 в культуральной среде после культивирования 3×106 HUCPVC на 24 мм вкладыше в течение 18 дней. Таким образом, количество внеклеточного матрикса, синтезированного и
организованного мезенхимальными стволовыми клетками, может модулироваться при помощи компонентов культуральной среды и, в частности, могут быть получены существенные толщины конечной биоинженерной конструкции. Кроме того, добавки в культуральную среду могут давать синергетический эффект совместно с увеличенной плотностью посева (например, суперконфлюэнтные плотности, содержащие от 3×106 до 10×106 клеток или больше на 24 мм вкладыш), давая еще большую толщину внеклеточных матриксов происходящих из МСК биоинженерных конструкций, включая происходящие из HUCPVC, происходящие из МСК костного мозга и преадипоцитов (Фиг.4). Согласно одному из конкретных вариантов осуществления суперконфлюэнтный посев клеток осуществляли с применением 30×106 клеток на 75 мм вкладыш, что эквивалентно 9,6×106 клеткам на 24 мм вкладыш.
Пример 2: Биофизические свойства биоинженерных конструкций, продуцируемых мезенхимальными стволовыми клетками (МСК)
Кроме продуцирования значимых количеств синтезируемого и организуемого внеклеточного матрикса мезенхимальными стволовыми клетками для получения биоинженерной конструкции существенной толщины, такие биоинженерные конструкции обладают дополнительными биофизическими свойствами, отличающими их от внеклеточных матриксов, образуемых другими типами клеток.
Происходящие из МСК биоинженерные конструкции, высеянные с суперконфлюэнтностью и культивировавшиеся в течение 18 дней в соответствии со способами и культуральной средой, описанными в Примере 1, демонстрируют значимые различия в организации коллагена и общей морфологии матрикса от сходным образом культивированных происходящих из ДФЧ биоинженерных конструкций (за исключением применения 20 нг/мл ТФР-альфа). В частности, указанный внеклеточный матрикс содержит поры, менее плотный, и включает агрегаты коллагеновых пучков (Фиг.5А-5 В). Таким образом, происходящие из МСК биоинженерные конструкции обладают пористостью, которая может быть выражена как процент поверхности, занятой на гистологическом препарате порами, от общей поверхности гистологического препарата. Такой пористый внеклеточный матрикс во многих случаях подходит для заживления ран, так как при имплантации в рану он позволяет увеличивать миграцию и инфильтрацию хозяйских клеток и связанных с ангиогенезом молекул. В то же время такие пористые внеклеточные матриксы должны обладать механической целостностью, позволяющей врачу с минимальными трудностями установить указанную биоинженерную конструкцию. Поэтому для оценки некоторых механических свойств проводили
механическое тестирование происходящих из МСК и происходящих из ДФЧ биоинженерных конструкций. В частности, Fmax (также известная как максимальная нагрузка /максимальная сила, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 N) представляет собой максимальную нагрузку, которая может быть приложена к материалу, не приводящую к его разрушению. Предел прочности на разрыв (также известный как UTS, например, 5,10, 15, 20, 25, 30, 35, 40, 45, 50 Н/см2) представляет собой максимальное давление, которое может выдержать образец без разрушения. Модуль упругости (также известный как растяжимость, например, 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 деформация/начальная длина) представляет собой меру упругой жесткости материала в линейной области, где материал возвращается в начальное состояние, если нагрузку снимают. На Фиг.6А-6С показано, что происходящие из МСК биоинженерные конструкции имеют механическую прочность, сходную с таковой происходящих из ДФЧ биоинженерных конструкций, несмотря на более пористый внеклеточный матрикс, и происходящие из HUCPVC биоинженерные конструкции имеют почти такие же характеристики механической прочности и толщины.
Биоинженерная конструкция, имеющая пористый внеклеточный матрикс с большой механической прочностью, также подходит для лечения ран, позволяя диффузию факторов роста в область размещения, способствующую заживлению ран. Для того, чтобы охарактеризовать различия в компонента внеклеточного матрикса, адгезивных компонентах и/или факторах роста, присутствующих в происходящих из МСК биоинженерных конструкциях и конструкциях, полученных с применением других типов клеток, проводили количественный ПЦР (КПЦР) анализ с применением кДНК, выделенных из происходящих из МСК, высеянных с суперконфлюэнтностью и культивировавшихся в течение 18 дней конструкций (в соответствии со способами и на культуральной среде согласно Примеру 1) или происходящих из фибробластов кожи человека (ДФЧ) биоинженерных конструкций, высеянных с суперконфлюэнтностью и культивировавшихся в течение 18 дней (в соответствии со способами и на культуральной среде согласно Примеру 1, за исключением того, что в указанную культуральную среду добавляли 20 нг/мл длинного ТФР-α). Праймеры для ПЦР в реальном времени из набора для анализа ВКМ и молекул адгезии человека (Human ЕСМ and Adhesion Molecules Array) (SuperArray PAHS-013A) и факторов роста человека (Human Growth Factor Array) (SuperArray PAHS-041A) согласно протоколу производителя. На Фиг.7 обобщены различия в факторах роста между происходящими из МСК и происходящими из ДФЧ биоинженерными конструкциями. Например, увеличение экспрессии коллагена в происходящих из HUCPVC биоинженерных конструкциях согласуется с
характеристиками коллагеновых пучков, наблюдаемых на Фиг.5. В происходящих из HUCPVC биоинженерных конструкциях также наблюдалось увеличение экспрессии CXCL6, молекулы хемоаттрактанта; KDR, индикатора ФРЭС-индуцированной пролиферации, миграции, тубулярного морфогенеза и формирования эндотелиальных ростков; и ламинина альфа 5 (LAMA5), индикатора организации эмбриональных клеток. Эти результаты свидетельствуют о том, что, помимо существенных толщин внеклеточного матрикса, получаемых с применением происходящих из МСК биоинженерных конструкций, такие конструкции также демонстрируют положительную регуляцию генов, подходящую для лечения раневой области, например, увеличивают скорость заживления и способствуют ангиогенезу (Фиг.7).
Кроме того, были выполнены анализы на основе белков для определения уровней IL-6 (ИЛ-6), IL-8 (ИЛ-8) и ФРЭС с помощью системы Cytometric Bead Array (СВА) от Becton Dickinson с применением происходящих из МСК биоинженерных конструкций, высеянных с суперконфлюэнтностью и культивировавшихся в течение 18 дней (в соответствии со способами и на культуральной среде согласно Примеру 1), или происходящих из фибробластов кожи человека (ДФЧ) биоинженерных конструкций, высеянных с суперконфлюэнтностью и культивировавшихся в течение 18 дней (в соответствии со способами и на культуральной среде согласно Примеру 1, за исключением того, что в культуральную среду добавляли 20 нг/мл длинного ТФР-α), согласно протоколу производителя. На Фиг.8А-8С показано сравнение изменений во времени уровней IL-6, IL-8 и ФРЭС в кондиционированной среде, полученной от происходящих из МСК и происходящих из ДФЧ биоинженерных конструкций. Экспрессия IL-6 в происходящих из МСК биоинженерных конструкций достигала максимума в начале культивирования и на 5 день культивирования происходящих из HUCPVC биоинженерных конструкций более чем 9-кратно превышала экспрессию в происходящих из ДФЧ биоинженерных конструкциях (Фиг.8А). Помимо роли в иммунном ответе IL-6 также секретируется остеобластами, что способствует формированию остеокластов. Экспрессия IL-8 была также существенно выше в происходящих из МСК биоинженерных конструкциях по сравнению с происходящими из ДФЧ биоинженерными конструкциями в течение всего периода культивирования (Фиг.8В). Помимо роли в иммунном ответе IL-8 также секретируется эпителиальными клетками как мощный ангиогенный фактор, действующий посредством связывания с такими рецепторами, как CXCR1 и CXCR2. Сходным образом, ФРЭС представляет собой еще один мощный ангиогенный фактор, и его экспрессия существенно выше в происходящих из МСК биоинженерных конструкциях по сравнению с происходящими из
ДФЧ биоинженерными конструкциями на протяжении ранних фаз культивирования (Фиг.8С). Предположительно, понижение определяемых уровней ФРЭС в культуральной среде происходит ввиду высоких уровней экспрессии клетками HUCPVC и другими МСК KDR, представляющего собой рецептор ФРЭС и секвестрирующего указанные молекулы в указанной биоинженерной конструкции таким образом, что это препятствует обнаружению в среде. Кроме того, КСФ-3 и витронектин повышающе регулируются в происходящих из HUCPVC биоинженерных конструкциях по сравнению с происходящими из ДФЧ биоинженерными конструкциями. Также проводили анализ ИФА на образцах кондиционированной среды, взятых при культивировании происходящих из ДФЧ и происходящих из МСК биоинженерных конструкций в соответствии со способами, приведенными в Примере 1 (т.е. 10х ТФР-альфа в обоих случаях) для количественного определения уровней синтеза гиалуронана (ГК) через 5 и 18 дней. На Фиг.8D показано, что уровни ГК в культуральной среде происходящих из HUCPVC биоинженерных конструкций увеличивались от 4,333 нг/мл на 5 день до 5,615 нг/мл на 18 день, тогда как уровни ГК в культуральной среде происходящих из ДФЧ биоинженерных конструкций уменьшались от 4,664 нг/мл на 5 день до 4,085 нг/мл на 18день. Кроме того, в происходящих из МСК биоинженерных конструкциях обнаруживалось 38-кратное количество витронектина, 21- кратное количество КСФ-3, 15-кратное количество НМКА1 и 4-кратное количество CXCL1 относительно происходящих из ДФЧ биоинженерных конструкций.
Наконец, происходящие из МСК биоинженерные конструкции, высеянные с суперконфлюэнтностью и культивировавшиеся в течение 18 дней в соответствии со способами и на культуральной среде согласно Примеру 1, давали кондиционированную среду, содержащую компоненты, увеличивающие способность клеток к миграции относительно происходящих из ДФЧ биоинженерных конструкций, культивировавшихся в идентичных условиях, за исключением того, что в культуральную среду добавляли 20 нг/мл длинного ТФР-α (Фиг.9).
Пример 3: Характеристики потенциала биоинженерных конструкций, продуцируемых мезенхимальными стволовыми клетками (МСК) в отношении множественных линий дифференцировки
Проводились анализы для определения характеристик потенциала клеток, выделенных из биоинженерных конструкций, продуцируемых МСК, а также МСК в естественной среде биоинженерных конструкций в отношении множественных линий дифференцировки («мультилинейного» потенциала). Происходящие из МСК
биоинженерные конструкции высевали с суперконфлюэнтностью и культивировались в течение 18 дней в соответствии со способами и на культуральной среде согласно Примеру 1. На 18 день указанные биоинженерные конструкции либо расщепляли коллагеназой для определения клеточной массы и высвобождения клеток для анализа мультилинейного потенциала, либо непосредственно культивировали в индукционной среде. Для каждой группы индуцированных клеток и биоинженерных конструкций поддерживались неиндуцированные контрольные группы клеток МСК и биоинженерных конструкций, где вместо индукционной среды использовали среду альфа-MEM с добавлением 10% эмбриональной бычьей сыворотки (ЭБС). Замену среды осуществляли каждые 2-3 дня. Кроме того, для каждой из индуцированных групп клеток и биоинженерных конструкций поддерживались происходящие из ДФЧ контрольные группы клеток и биоинженерные конструкции.
Для анализа остеогенной индукции биоинженерные конструкции культивировали непосредственно в остеогенной индукционной среде, и клетки, полученные при обработке коллагеназой, высевались с плотностью 20000 клеток/см2 в 12-луночные планшеты для остеогенной индукции. Определенную культуральную среду, описанную в Примере 1, заменяли на 18 день культивирования следующей остеогенной индукционной средой: полная основная среда DMEM с добавлением 10-3 М дексаметазона (DEX), 1М β-глицерофосфата (BGP) и 50 мг/мл аскорбиновой кислоты (АА). Индуцирующее остеогенную дифференцировку культивирование проводили в течение нескольких дней перед анализом генной экспрессии Runx2 (транскрипционного фактора, экспрессируемого на поздних стадиях дифференцировки остеобластов), ЩФ (ALP; щелочной фосфатазы) и остеокальцина (ОС) с применением РНК, выделенной из указанных биоинженерных конструкций или культивированных клеток. В индуцированных происходящих из МСК биоинженерных конструкций наблюдалось 8-кратное увеличение экспрессии ЩФ по сравнению с неиндуцированными происходящими из МСК биоинженерными конструкциями (Фиг.10А). Кроме того, наблюдалось 11-кратное увеличение экспрессии Runx2 в выделенных из происходящих из МСК биоинженерных конструкций клеток, индуцированных в остеогенной индукционной среде, относительно таких клеток, не индуцированных в остеогенной индукционной среде (Фиг.10В). Таким образом, с помощью средовых сигналов может быть индуцирована остеогенная дифференцировка МСК в интактной биоинженерной конструкции или МСК, выделенных из таких конструкций.
Для анализа адипогенной индукции биоинженерные конструкции культивировали непосредственно в адипогенной индукционной среде, а клетки, полученные после
обработки коллагеназой, высевались плотностью 20,000 клеток/см в 12-луночные планшеты для адипогенной индукции. Определенную культуральную среду, описанную в Примере 1, заменяли на 18 день культивирования следующей адипогенной индукционной средой: полная основная среда DMEM с добавлением 10-3 М дексаметазона (DEX), 10 мг/мл инсулина и 0,5 мМ 3-изобутил-1-метилксантина (IBMX). Индуцирующее остеогенную дифференцировку культивирование проводили в течение нескольких дней перед анализом нейтральных триглицеридов и липидов из указанных биоинженерных конструкций или культивированных клеток с применением стандартного окрашивания масляным красным О. Только среди выделенных из происходящих из МСК биоинженерных конструкций клеток, индуцированных в адипогенной индукционной среде, наблюдалось существенное по сравнению с не индуцированными в адипогенной индукционной среде клетками количество позитивно окрашенных клеток (Фиг.10С). Таким образом, адипогенная дифференцировка МСК в составе интактной биоинженерной конструкции или выделенных из таких конструкций может быть индуцирована при помощи средовых сигналов.
Таким образом, при помощи средовых сигналов может быть индуцирована дифференцировка МСК в составе интактной биоинженерной конструкции, а также выделенных из такой конструкции, в направлении нескольких клеточных линий, в то время как в одной из субпопуляций поддерживается потенциал, подобный потенциалу стволовых клеток.
Пример 4: Характеристики in vivo васкуляризации биоинженерных конструкций, продуцируемых мезенхимальными стволовыми клетками (МСК)
Целью настоящего испытания было имплантирование биоинженерных конструкций, полученных с помощью описанных в Примере 1 способов, бестимусным мышами, и анализ ответа in vivo после подкожной имплантации. В частности, для качественного и количественного анализа васкуляризации внутри конструкции у мышей применяли окрашивание альфа-гладкомышечного актина (ccSMA). Конструкции имплантировали подкожно модельным 8-недельным самкам бестимусной мыши Swiss.
Через 1 неделю после подкожного имплантирования различных биоинженерных конструкций умерщвляли по 5 животных от каждой группы из перечисленных в нижеприведенной таблице:
Область имплантата извлекали и обрабатывали для гистологического исследования. В частности, гистологические препараты от n=2 животных из каждой группы окрашивали αSMA. На Фиг.11A-11D показаны репрезентативные срезы из αSMA-окрашенных срезов происходящих на 100% из HUCPVC биоинженерных конструкций, происходящих на 50% из HUCPVC и на 50% из ДФЧ биоинженерных конструкций, происходящих на 10% из HUCPVC и на 90% из ДФЧ биоинженерных конструкций и происходящих на 100% из ДФЧ биоинженерных конструкций, соответственно. Все биоинженерные конструкции получали согласно описанию в Примере 1, за исключением того, что на 100% происходящие из ДФЧ конструкции культивировали с добавлением 20 нг/мл ТФР-альфа. Биоинженерные конструкции на Фиг.11А, по-видимому, содержат более существенное количество αSMA-позитивных участков в области имплантата по сравнению с конструкциями на Фиг.11В-11D. Окрашивание на αSMA специфически связано с областями вокруг вновь формирующихся сосудов, как хорошо видно на Фиг.11А при увеличении 40х. Количественное определение αSMA показало, что в области имплантации на 100% происходящих из HUCPVC биоинженерных конструкций содержится большее количество сосудов по сравнению с другими группами (Фиг.11D). Без связи с конкретной теорией, HUCPVC
способны секретировать цитокины/факторы роста, такие как описанные выше в Примерах 2 и 3, обладающие паракринной активностью, рекрутируя эндотелиальные клетки мышей, из которых в дальнейшем образуются новые сосуды. Кроме того, матрикс и связанная с ним структура, генерируемые HUCPVC, могут обеспечить более подходящую временную матрицу для рекрутинга и инфильтрации клеток в область имплантата, что приводит к более выраженному по сравнению с другими группами формированию сосудов в течение 1 недели. Дополнительно для дальнейшего подтверждения увеличенной способности происходящих из HUCPVC биоинженерных конструкций к стимуляции ангиогенеза могут проводиться стандартные исследования ангиогенеза, такие как анализ способности конструкций формировать или поддерживать трубки из эндотелиальных клеток {например, анализ формирования сосудов при ангиогенезе от Millipore) и анализ генной экспрессии биомаркеров ангиогенеза (например, анализ ангиогенеза с помощью ИФА от Q-Plex и наборы для анализа белкового профиля при ангиогенезе (Proteome Profiler Array) от R&D Systems).
Пример 5: Контролируемое сокращение биоинженерных конструкций
Биоинженерные конструкции получали высеванием неонатальных фибробластов крайней плоти человека на 75 мм мембранные вкладыши с обработанными плазмой (СООН) ПЭС-мембранами, имеющими 5-микронные поры. Начальная плотность посева составляла 30 млн клеток на мембранный вкладыш. Клетки суспензировали в культуральной среде с заданным химическим составом (не содержащей неидентифицированных полученных не от человека компонентов); 20 мл суспензии высевали непосредственно на вкладыш, и ПО мл среды в культуральный резервуар для двустороннего выращивания клеток. Указанная среда содержала: базовую 3:1 смесь DMEM, 2 мМ L-глутамина (Invitrogen Inc.), 4 мМ GlutaMAX (Gibco BRL, Grand Island, NY) и добавки: 5 нг/мл рекомбинантного эпидермального фактора роста человека (Upstate Biotechnology, Lake Placid, NY), 1×10-4 M этаноламина (Fluka, Ronkonkoma, NY cat. #02400, чистый по стандарту ACS), 1×10-4 M о-фосфорил-этаноламина (Sigma, St. Louis, MO), 5 мкг/мл трансферрина (Sigma, St. Louis, MO), 20 пМ трийодтиронина (Sigma, St. Louis, МО) и 6,78 нг/мл селена (Sigma Aldrich Fine Chemicals Company, Milwaukee, WI), 50 нг/мл L-аскорбиновой кислоты (WAKO Chemicals USA, Inc.), 0,2 мкг/мл L-пролина (Sigma, St. Louis, MO), 0,1 мкг/мл глицина (Sigma, St. Louis, MO), 20 нг/мл ТФР-альфа (т.е. lx ТФР-альфа) и 10 нМ ПГЕ2. Клетки культивировали таким образом на протяжении 18 дней до сбора биоинженерных конструкций. Согласно некоторым вариантам реализации 2-кратное количество ТФР-альфа или больше может быть предпочтительным.
Некоторые биоинженерные конструкции немедленно фиксировали в формалине для гистологического анализа, с тем, чтобы предотвратить естественное сокращение (Фиг.12), в то время как остальные биоинженерные конструкции подвергались контролируемому сокращению, как подробнее описано ниже.
В частности, для отделения биоинженерных конструкций от мембраны Transwell применяли стерильные щипцы, оставляя свободно плавающие конструкции в сосуде для культивирования. Для получения пористой биоинженерной конструкции, в то же время сохраняющей высокую механическую прочность, указанные биоинженерные конструкции подвергали контролируемому сокращению, возвращая свободно плавающие конструкции в инкубатор и позволяя указанным биоинженерным конструкциям естественным образом сокращаться на протяжении двух часов. По прошествии двух часов среду удаляли, промывали деионизированной обратным осмосом (RODI) водой, и фиксировали в формалине для гистологического анализа (Фиг.13). Биоинженерные конструкции, прошедшие контролируемое сокращение (Фиг.12), демонстрируют приблизительно 2-кратное увеличение средней толщины биоинженерной конструкции (например, средние толщины 400-800 мкм против средних толщин 200-300 мкм) относительно не прошедших контролируемое сокращение (Фиг.13).
Согласно другому варианту реализации после двух часов инкубации в свободно плавающем состоянии биоинженерные конструкции затем пропитывали 1 мМ раствором ЭДК при 4°С в течение ночи; как вариант, указанную конструкцию можно пропитать 0,2 мМ ЭДК, 0,5 мМ ЭДК, 5 мМ ЭДК или 10 мМ ЭДК в культуральном сосуде без отступления от объема настоящего изобретения. После сшивки посредством ЭДК указанную конструкцию троекратно промывали RODI- водой, осушали и выкладывали. После промывания RODI-водой указанные биоинженерные конструкции охлаждали от комнатной температуры (~20°С) со скоростью 0,5°С в минуту на протяжении 2 часов до достижения конечной температуры замораживания -40°С. После достижения биоинженерной конструкцией температуры -40°С указанную биоинженерную конструкцию выдерживали при -40°С в течение по меньшей мере 2 часов. Все биоинженерные конструкции затем помещали в вакуум менее 200 мторр в аппарате для лиофилизации и обрабатывали в течение двадцати четырех часов при 0°С.Следует понимать, что цикл замораживания может быть проведен в подходящем аппарате для лиофилизации или в любом замораживающем устройстве, например, в замораживающей камере с регулируемой скоростью. Следует понимать, что указанные биоинженерные конструкции могут подвергаться действию вакуума от 0 мторр до 350 мторр без отступления от объема настоящего изобретения. Согласно альтернативному варианту
реализации указанную конструкцию оставляли для высушивания на воздухе на 8 часов после сшивания ЭДК без прохождения лиофилизации (т.е. высушивания замораживанием).
Согласно другому варианту реализации после двух часов инкубации в свободно плавающем состоянии среду удаляли, и биоинженерные конструкции промывали MES-буфером до тех пор, пока указанные конструкции не теряли розовую окраску. Указанные конструкции затем пропитывали деионизированной обратным осмосом (RODI) водой в течение приблизительно одного часа, затем осушали и выкладывали. После отмывки RODI водой указанные биоинженерные конструкции охлаждали от комнатной температуры (~20°С) со скоростью 0,5°С в минуту на протяжении 2 часов до достижения конечной температуры замораживания -40°С. После достижения указанной биоинженерной конструкцией температуры -40°С указанную биоинженерную конструкцию выдерживали при -40°С в течение 2 часов. Затем все конструкции подвергали действию вакуума менее 200 мторр в аппарате для лиофилизации в течение двадцати четырех часов при 0°С. Указанные биоинженерные конструкции затем помещали в вакуумную печь на 24 часа при 100°С для формирования дегидротермальных перекрестных связей (DHT) в указанных биоинженерных конструкциях. Согласно некоторым вариантам реализации может быть предпочтительна лиофилизация при отсутствии стадий сшивания.
Пример 6: Биоинженерные конструкции обладают остеогенными и барьерными свойствами In Vivo
Биоинженерные конструкции, такие как полученные с применением способов, описанных в Примере 5 (т.е. сшитые с помощью ЭДК, сшитые с помощью DHT и несшитые биоинженерные конструкции, совместно именуемые в этом Примере «тестовые конструкции"), в дополнение к негативному контролю (отсутствие конструкций) и положительному контролю (25x25 мм стандартная биорассасывающаяся барьерная мембрана Bioguide, содержащая мембрану из свиного коллагена типов I и III от Osteohealth, One Luitpold Drive, P.O. Box 9001, Shirley, NY 11967) имплантировали в каждый из четырех квадрантов челюсти Геттингенских мини-пигов (правый верхнечелюстной, левый верхнечелюстной, правый нижнечелюстной и левый нижнечелюстной).
А именно, четырех взрослых самцов карликовой свиньи содержали совместно в отдельном помещении в течение всего исследования при температуре 22+/- 2°С. Каждая из свиней была анестезирована на период 8 часов, в течение которого подготавливались и
обрабатывались все костные дефекты. Хирургическая процедура по установлению каждой конструкции занимала приблизительно 2 часа. Второй и четвертый премоляры удалялись после 1) поднятия полной толщины десневого лоскута, 2) отделения корней с применением многолопастного бора, и 3) разреза периодонтальной связки скальпелем Orban. Перед удалением буккальные пластинки окружающей зубы альвеолярной кости были перфорированы круглым бором в нескольких точках и разрезались соединением при помощи карбидного фиссурного бора отверстий, сделанных при помощи круглого бора. Буккальную пластинку удаляли хирургически с применением полуклинообразного долота и костных ножниц для создания костных дефектов (1,2 см каждый). Все конструкции представляли собой участки 25×25 мм и помещались на выбранные случайным образом 4 верхнечелюстных и 4 нижнечелюстных участка таким образом, чтобы перекрывать мезиальные, дистальные и апикальные границы дефекта на 2-3 мм. Чтобы связать границы конструкции с окружающими мягкими тканями десны хозяина, использовали лигатуры. Все хирургические процедуры проводились в асептических условиях с применением общей анестезии и эндотрахеальной интубации, обеспеченных ветеринарной службой LASC.
Через 4, 8 и 12 недель отобранных животных умерщвляли, тестовые/контрольные участки изымали вместе с прилегающей костью в виде блоков и фиксировали в 10% растворе формалина. Половину блоков из каждой группы декальцифицировали с применением декальцифицирующего агента. После декальцификации и дегидратации блоки погружали в парафин, изготавливали и окрашивали гематоксилин-эозином 5 последовательных 5 мкм срезов для световой микроскопии и идентификации клеточного состава воспалительного инфильтрата, а также для гистопатологического и гистоморфологического исследования. Срезы также окрашивали трехцветной окраской по Массону для определения нового отложения коллагена и формирования новой кости. Вторую половину блоков фиксировали в 4% растворе формалина после очистки от вышележащих мягких тканей, дегидратировали в спирте восходящей концентрации и заливали в метилметакрилат для последующего окрашивания толуидиновым синим для оценки новых костных и коллагеновых отложений. Структуру альвеолярной кости и состав вновь образовавшихся тканей после лечения дефектов исследовали посредством количественной компьютерной микротомографии (MicroCT). Сканограммы MicroCT были получены с применением системы Scanco microCT 80 (Scanco Medical, Bassersdorf, Switzerland) в лаборатории развития ортопедической и экспериментальной биомеханики (Orthopaedic and Development Biomechanics laboratory) инженерно-механического отделения (Department of Mechanical Engineering) университета Бостона. Непосредственно
перед сканированием челюсти 4 мини-пигов извлекали из хранилища и позволяли нагреться до комнатной температуры.
Тестовые участки, получавшие лечение с применением тестовых конструкций, демонстрировали более высокую клеточную активность и обмен веществ во вновь формирующихся тканях, т.е. соединительной и остеоидной тканях). Через 8 недель области дефектов заполнялись здоровой соединительной тканью и высокоорганизованной вновь сформированной остеоидной тканью, и контуры буккальной кости почти полностью восстанавливались. Через 12 недель указанные тестовые участки, получавшие лечение с применением тестовых конструкций, демонстрировали почти полное заживление с хорошим соединением вновь сформированной кости со старой костью, в то время как на некоторых срезах был виден продолжающийся процесс заживления с некоторым количеством остеокластов на костной поверхности, что свидетельствует об обмене веществ в кости.
Пример 7: Контроль размера пор биоинженерных конструкций
Средний размер поры во внеклеточном матриксе указанных биоинженерных конструкций, предложенных в настоящем изобретении, может быть смоделирован таким образом, чтобы формировался плотный или пористый внеклеточный матрикс. Наряду с типом и/или степенью сшивания может выбираться и контролироваться определенный средний размер пор для получения конструкций с разными уровнями продолжительности существования in vivo и/или клеточной инфильтрации, варьирующих от «быстро биоремоделируемых» к «умеренно биоремоделируемым» и «длительно биоремоделируемым» биоинженерным конструкциям для индивидуализированных терапевтических применений (Фиг.14А). Происходящие из ДФЧ биоинженерные конструкции, полученные в соответствии со способами, приведенными в Примере 5, анализировались после 18 дней культивирования для определения характеристик размера и распределения пор. На Фиг.13 показано, что такие биоинженерные конструкции, которые не были лиофилизированы, практически не имеют пор. Далее биоинженерные конструкции подвергались контролируемому сокращению, лиофилизации, и либо не сшивались, либо были сшиты посредством ЭДК или с применением DHT в соответствии со способами, приведенными в Примере 5. Инструмент «magic wand» («волшебная палочка») программы для анализа изображений Scandium® (Olympus) использовали для статистического анализа длин и площадей пор на репрезентативных гистологических срезах. Так как поры не являются правильными окружностями, диаметр поры подсчитывали, исходя из допущения, что измеряемый участок указанной поры является
окружностью. Для измерений использовали по два гистологических среза на группу. Фиг.14 В показывает, что доведение до конечной температуры замораживания -40°С со скоростью 0,5°С в минуту давало средние размеры пор от 15 до 20 мкм. Кроме того, Фиг.14С также демонстрирует, что средний размер поры определяется указанной конечной температурой замораживания независимо от степени сшивания. В отличие от этого, как показано на Фиг.14D, доведение указанных биоинженерных конструкций до конечной температуры замораживания -10°С, то есть до более высокой температуры замораживания по сравнению с -40°С, со скоростью 0,5°С в минуту дает средние размеры пор по меньшей мере 50 мкм (например, в диапазоне от 30 мкм до 100 мкм). Фиг.14Е также демонстрирует, что указанный средний размер поры не зависит от контролируемого сокращения. А именно, происходящие из ДФЧ биоинженерные конструкции, полученные в соответствии со способами, приведенными в Примере 5, и просто высушенные на воздухе после контролируемого сокращения, имели плотный матрикс с очень маленькими порами, если поры вообще присутствовали). Напротив, биоинженерные конструкции, полученные таким способом, как показанные на Фиг.14В, имели средние размеры пор от 15 до 20 мкм. Сходным образом, средний размер поры происходящих из МСК биоинженерных конструкций, полученных в соответствии со способами, приведенными в Примере 1 (Фиг.14F), могут быть увеличены при контролируемом сокращении, отмывке, замораживании от комнатной температуры до -20°С и лиофилизации (Фиг.14G).
Пример 8: контроль толщины биоинженерной конструкции и состава ВКМ
ДФЧ высевались с суперконфлюэнтностью (т.е. 30×106 клеток на 75 мм вкладыш) и культивировались в течение 18 дней в соответствии со способами, приведенными в Примере 1, за исключением того, что использовали 20 нг/мл ТФР-альфа. В среду добавляли также гепарин в количестве 5 мкг/мл. Для проверки действия основного фактора роста фибробластов (ОФРФ; Peprotech Inc.) на получаемые биоинженерные конструкции добавляли и поддерживали на культуральной среде ОФРФ либо при первичном посеве, либо через 5 дней культивирования. Фиг.15А показывает, что добавление в культуральную среду с заданным химическим составом 20 нг/мл ОФРФ значительно уменьшает толщины биоинженерных конструкций, которые легче рвались при захвате щипцами по сравнению с контролем. Добавление гепарина не оказывало эффекта на толщину биоинженерных конструкций. Биоинженерные конструкции, полученные с применением 2 нг/мл ОФРФ имели толщины, сходные с толщинами необработанных контролей.
Меньшая толщина биоинженерных конструкций с добавлением ОФРФ означает,
что внеклеточный матрикс содержит меньше белков матрикса, меньше гликозаминогликанов, или меньше и тех, и других. На Фиг.15 В приведены результаты анализа зависимости "доза-эффект" от ОФРФ, показывающие, что аккумуляция коллагена уменьшалась при увеличении количеств добавленных ОФРФ. Так как популяции коллагена образуются последовательно во время синтеза внеклеточного матрикса (т.е. обратимо сшитый кислоторастворимый коллаген, затем пепсинорастворимый коллаген, необратимо сшитый и выделяемый путем разрыва перекрестных связей пепсином, и затем ДСН-растворимый коллаген, высокосшитый и нерастворимый ни в кислоте, ни в пепсине), каждую из указанных популяций коллагена выделяли из контроля и из биоинженерных конструкций с добавлением ОФРФ с применением стандартной методики. Общее количество аккумулированного коллагена в указанных биоинженерных конструкциях с добавлением ОФРФ ниже, чем в контролях, и особенно выражен дефицит аккумуляции пепсинорастворимого коллагена (Фиг.15В). Отдельно гепарин не влиял на аккумуляцию коллагена.
Количества кислото- и пепсинорастворимого коллагена независимо анализировали и количественно определяли с помощью анализа коллагена SIRCOL в биоинженерных конструкциях с Фиг.15В. Так как SDS-растворимый коллаген не имеет тройной спиральной структуры, анализ Sircol не выявляет этот класс коллагена. На Фиг.15С приведены сравнительные уровни кислото- и пепсинорастворимого коллагена (черный) относительно общего количества коллагена и других коллагенов (серый). Объединенное количество кислото- и пепсинорастворимого коллагена в биоинженерных конструкций с добавлением 20 нг/мл или 100 нг/мл ОФРФ составляло 20% и 35%, соответственно, от контрольного количества.
Для определения общего числа белковых сшивок в указанных биоинженерных конструкциях с добавлением ОФРФ относительно контролей проводили дифференциальную сканирующую калориметрию (ДСК). Площадь пика для биоинженерных конструкций с добавлением ОФРФ при посеве или после 5 дней культивирования уменьшалась или равнялась нулю относительно контролей с добавлением только гепарина, что свидетельствует о меньшем числе перекрестных связей в указанных биоинженерных конструкциях с добавлением ОФРФ.
Помимо изменения количества коллагена сульфатированные гликозаминогликаны (сГАГ), отвечающие за связывание факторов роста и помогающие регулировать гидратацию ВКМ, а также гиалуроновая кислота (ГК), аккумулировались в биоинженерных конструкциях с добавлением ОФРФ в меньших количествах по сравнению с контролями (Фиг.15D и 15Е). Гистологические пробы окрашиванием
независимо подтвердили, что биоинженерные конструкции с добавлением ОФРФ менее плотные, содержат меньше сГАГ (окрашивание альциановым синим) и меньше эластических волокон (окрашивание по Ван Гизону).
Изменения в составе внеклеточного матрикса приводили к тому, что биоинженерные конструкции с добавлением ОФРФ превращались в порошок при дегидратации, что означает, что такие конструкции могут легко быть микронизированы размалыванием. Биоинженерные конструкции, полученные с применением 20 нг/мл растрескивались при лиофилизации в сублиматоре с контролируемой температурой, но фрагменты оставались такими же гибкими, как и контрольные образцы. В то же время указанные фрагменты также имели меньшую толщину и были существенно более пористыми, чем контрольные образцы. Непосредственно перед лиофилизацией указанные биоинженерные конструкции с добавлением ОФРФ помещали в морозильную камеру с температурой -80°С на 2 часа. Следует понимать, что указанные биоинженерные конструкции с добавлением ОФРФ могут храниться в морозильной камере при температурах в диапазоне от -10°С до -80°С в течение любого периода времени от 1 часа до 3 дней без отступления от объема настоящего изобретения. Как вариант, указанные биоинженерные конструкции с добавлением ОФРФ могут быть извлечены из культуры и помещены непосредственно в лиофилизатор. Все биоинженерные конструкции с добавлением ОФРФ затем подвергали воздействию вакуума менее 200 мторр в аппарате для лиофилизации и обрабатывали в течение двадцати четырех часов при 0°С. Следует понимать, что указанные биоинженерные конструкции могут быть подвергнуты воздействию вакуума от 0 мторр до 350 мторр без отступления от объема настоящего изобретения. Согласно другому варианту реализации указанные биоинженерные конструкции с добавлением ОФРФ могут быть высушены на воздухе в течение ночи при комнатной температуре вместо обработки в лиофилизаторе.
Высушенные на воздухе порошковые или лиофилизированные биоинженерные конструкции с добавлением ОФРФ, а также контроли, были микронизированы перемалыванием либо с применением ступки и пестика при комнатной температуре, либо с помощью мельницы для ткани, в которой указанные конструкции были заморожены в жидком азоте. Одинаковые количества измельченных конструкций регидратировали в фосфатно-солевом буфере (ФСБ) в микроцентрифужной пробирке в течение 10 минут до видимой жидкой консистенции. Регидратированные конструкции с добавлением ОФРФ обладали существенно меньшей вязкостью и плавали свободнее по сравнению с контрольными образцами. Это обеспечивало увеличение способности указанных регидратированных конструкций с добавлением ОФРФ проходить через инъекционную
иглу (т.е. они были способны проходить через иглы 23 размера и 27 размера, но не через иглы 30 размера, в то время как контроли не были способны проходить через какие-либо из перечисленных инъекционных игл). Так как сканирующая электронная микроскопия при увеличении 1000х выявила, что частицы измельченных конструкций с добавлением ОФРФ имеют такие же размеры, что и в контролях, предположительно, прохождению контрольных частиц через инъекционные иглы препятствует их вязкость. Предполагается также, что с применением тканевых мельниц более тонкого помола может быть получен меньший или более однородный размер частиц, с тем, чтобы указанные регидратированные конструкции с добавлением ОФРФ были способны проходить даже через инъекционные иглы меньшего калибра.
Пример 9: Пористые шелковые каркасы для применения в биоинженерных конструкциях
Пористые каркасы на основе шелка получали из обесклеенного шелкового волокна коконов тутового шелкопряда. Волокна шелка растворяли в 9 М растворе LiBr в концентрации 6-10 весовых % в течение 6-10 часов, при перемешивании, в комнатных условиях. Указанный раствор диализировали в воде с применением целлюлозной диализной мембраны на протяжении 3 дней, заменяя воду каждые 10 часов. Водный раствор фиброина концентрировали выдерживанием раствора в целлюлозной диализной мембране. Нерастворимые фрагменты удаляли центрифугированием на 20,000 об/мин в течение 30 минут. Конечная концентрация раствора шелка составляла приблизительно 7,5-8%.
Основной раствор шелка затем использовали для получения рабочего раствора шелка с концентрацией 6%-8%. Указанный рабочий раствор применяли для получения пористого шелкового каркаса. Сначала указанный рабочий раствор смешивали с 1-6% раствором этанола в различном объемном соотношении для получения конечных концентраций шелка, варьирующих от 3% до 5% и конечных концентраций этанола, варьирующих от 0,5% до 2%. Затем указанную смесь выливали в чашку Петри и помещали в замораживающую камеру с температурой -20°С по меньшей мере на 10 часов. Через 10 часов раствор шелка помещали в комнатную температуру и оставляли для оттаивания с получением пористого шелкового каркаса. Затем оттаявшие шелковые каркасы промывали в RODI воде в течение 3 дней для удаления остатков растворителя. После промывания верхний тонкий слой может быть удален с поверхности каркасов. Шелковые каркасы могут быть стерилизованы автоклавированием готового каркаса, или применением автоклавированного раствора шелка, смешанного со стерильным
фильтрованным раствором этанола, или применением стерильного фильтрованного раствора шелка, смешанного со стерильным фильтрованным раствором этанола.
Для стимуляции формирования кровеносных сосудов in vivo пористые шелковые каркасы могут быть пропитаны белками, такими как тромбоцитарный фактор роста (ФРТ), фактор роста фибробластов (ФРФ), фактор роста гепатоцитов/рассеивающий фактор (ФРГ/SF), инсулиноподобный фактор роста (ИФР), фактор роста эндотелия сосудов (ФРЭС) и другие виды проангиогенных факторов. Согласно одному из аспектов 50 мкг порошка рекомбинантного ФРТ-ВВ человека ресуспендировали в 0,5 мл 4 мМ НС1, и затем разбавляли дополнительными 0,5 мл фосфатно-солевого буфера (ФСБ). Полученные 1 мл раствора использовали для пропитки 6x6 мм шелкового каркаса перед имплантацией в полнослойную рану у бестимусных и нормальных мышей. Кроме того, 50 мкг рекомбинантного основного фактора роста фибробластов (ОФРФ) человека ресуспендировали в 1 мл ФСБ. 6x6 мм пористые шелковые каркасы пропитывали 1 мл раствора ОФРФ в течение 5 минут перед имплантацией в полнослойную рану у бестимусных и нормальных мышей. Также 50 мкг рекомбинантного ФРТ-ВВ человека ресуспендировали в 0,5 мл 4 мМ HCL, а затем смешивали с 0,5 мл ресуспендированного в ФСБ рекомбинантного ОФРФ человека. Пористые шелковые каркасы пропитывали полученным 1 мл раствора в течение пяти минут перед имплантацией в полнослойную рану у бестимусных и нормальных мышей. Кроме того, шелковые каркасы могут культивироваться с клетками в культуральной среде с заданным химическим составом с добавлением 25 нг/мл ФРТ на 5 день, 25 нг/мл ОФРФ на 10 день, и 25 нг/мл фактора роста гепатоцитов (ФРГ) на 15 день. Как вариант, в указанную культуральную среду с заданным химическим составом добавляют 25 нг/мл ОФРФ на 5 день, 25 нг/мл ФРТ на 10 день и 25 нг/мл ОФРФ на 15 день; или 25 нг/мл ФРТ на 5 день, 25 нг/мл ОФРФ на 10 день и 25 нг/мл ФРГ на 15 день. Кондиционированная культуральная среда, которой обрабатывают биоинженерные конструкции на 11 день согласно Примеру 10, также может быть сконцентрированной (например, 100-кратно), а шелковые каркасы могут быть пропитаны указанной кондиционированной средой.
Согласно одному из вариантов реализации, фибробласты кожи человека высевались на пористый шелковый каркас. А именно, фибробласты кожи человека изначально высевали с плотностью приблизительно 30×106 и культивировали в среде с заданным химическим составом в течение 11 дней. Следует понимать, что, как вариант, ДФЧ могут высеваться на шелковый каркас с исходной плотностью посева приблизительно 5×106. Указанная среда с заданным химическим составом содержала: основную 3:1 смесь DMEM и среды Хэма F-12 (Quality Biologies, Gaithersburg, MD), 4 мМ
GlutaMAX (Gibco BRL, Grand Island, NY) и добавки: 5 нг/мл рекомбинантного эпидермального фактора роста человека (Upstate Biotechnology, Lake Placid, NY), 1×10-4 M этаноламина (Fluka, Ronkonkoma, NY cat. #02400, степень чистоты ACS), 1×10-4 M o-фосфорил-этаноламина (Sigma, St. Louis, MO), 5 мкг/мл трансферрина (Sigma, St. Louis, MO), 13,5 пг/мл трийодтиронина (Sigma, St. Louis, МО), и 6,78 нг/мл селена (Sigma Aldrich Fine Chemicals Company, Milwaukee, WI), 50 нг/мл L-аскорбиновой кислоты (WAKO Chemicals USA, Inc.), 0,2 мкг/мл L-пролина (Sigma, St. Louis, MO), 0,1 мкг/мл глицина (Sigma, St. Louis, MO), 20 нг/мл ТФР-альфа и 10 нМ ПГЕ2. Как видно из Фиг.16, фибробласты кожи человека способны мигрировать сквозь шелковые каркасы и равномерно распределяются по всему шелковому пласту.
Для получения необходимых характеристик готовых биоинженерных конструкций, культивируемых на пористых шелковых каркасах, может быть произведен ряд модификаций.
Согласно другому варианту реализации шелковые каркасы с культивируемыми ДФЧ девитализировали отмыванием указанных содержащих культивируемые ДФЧ шелковых каркасов в воде для инъекций (WFI). Показано, что шелковые каркасы со средним диаметром пор 50-100 микрон, засеянные ДФЧ, и получаемые из них девитализированные WFI биоинженерные конструкции эффективны для применений, требующих усиленного ангиогенного ответа. В частности, на Фиг.17(d) показаны окрашенные эндотелиальные клетки пупочной вены человека на шелковых каркасах с девитализированными фибробластами in vitro. Указанные окрашенные эндотелиальные клетки образуют упорядоченные трубки на шелковых каркасах, - свидетельство того, что шелковые каркасы с девитализированными фибробластами позволяют эффективное прикрепление и выживание эндотелиальных клеток.
Согласно другому варианту реализации биоинженерные конструкции, содержащие пористые шелковые каркасы и девитализированные ДФЧ, затем сшивались посредством ЭДК для получения биоинженерной тканевой конструкции с увеличенной продолжительностью существования in vivo (например, в раневом ложе ожоговой раны).
Шелковые каркасы могут также быть импрегнированы подходящими молекулами. Шелковые каркасы погружали в прекондиционированную культуральную среду с заданным химическим составом, предварительно собранную (пост-культурально) от эндогенно продуцированных биоинженерных тканевых конструкций, для обогащения указанных шелковых каркасов. В частности, приблизительно 30 млн фибробластов кожи человека культивировали на 0,4 мкм пористой мембране с порами и культивировали в среде с заданным химическим составом в течение 11 дней. Указанная среда с заданным
химическим составом содержит: основную 3:1 смесь DMEM и среды Хэма F-12 (Quality Biologies, Gaithersburg, MD), 4 мМ GlutaMAX (Gibco BRL, Grand Island, NY) и добавки: 5 нг/мл рекомбинантного эпидермального фактора роста человека (Upstate Biotechnology, Lake Placid, NY), 1×10-4 M этаноламина (Fluka, Ronkonkoma, NY cat. #02400, степень чистоты ACS), 1×10-4 M о-фосфорил-этаноламина (Sigma, St. Louis, MO), 5 мкг/мл трансферрина (Sigma, St. Louis, MO), 13,5 пМ трийодтиронина (Sigma, St. Louis, МО) и 6,78 нг/мл селена (Sigma Aldrich Fine Chemicals Company, Milwaukee, WI), 50 нг/мл L-аскорбиновой кислоты (WAKO Chemicals USA, Inc.), 0,2 мкг/мл L-пролина (Sigma, St. Louis, MO), 0,1 мкг/мл глицина (Sigma, St. Louis, MO), 20 нг/мл ТФР-альфа и 10 нМ ПГЕ2. После 11 дней культивирования кондиционированную среду собирали и пропитывали указанной кондиционированной средой шелковые каркасы в течение 12 часов.
Также с одной или с обеих сторон шелкового каркаса может быть размещен слой силикона в качестве барьера для предотвращения инфекции, в то же время позволяющего транспорт газообразных молекул, например, кислорода. Например, на шелковые каркасы с девитализированными фибробластами кожи человека наносили силиконовое покрытие. Указанное силиконовое покрытие оптимизировали варьированием соотношения концентраций мономера и сшивающего вещества при полимеризации силикона. Соотношение мономера и сшивающего вещества может варьировать от приблизительно 5:1 до приблизительно 20:1. Для влажной шелковой губки оптимальное соотношение мономера и сшивающего вещества составляет приблизительно 5:1. Кроме того, собственно получаемую биоинженерную конструкцию можно затем покрыть слоем силикона.
Стимуляция миграции эпителиальных клеток может быть достигнута погружением указанных шелковых каркасов в раствор фосфатно-солевого буфера и ламинина 5 приблизительно на 1 час. В зависимости от профиля пористости шелкового каркаса указанный каркас может погружаться в раствор ламинина 5 раствор на время до 4 часов. Шелковый каркас, конъюгированный с ламинином 5 можно применять in vivo для стимуляции миграции эпителиальных клеток.
Пример 10: Многослойные конструкции из ДФЧ и МСК
Неонатальные фибробласты крайней плоти человека (полученные от Organogenesis, Inc. Canton, MA) высевались с плотностью 5×105 клеток/162 см2 в обработанные для тканевых культур колбы (Costar Corp., Cambridge, MA, cat # 3150) и выращивались в культуральной среде. Указанная ростовая среда состояла из: среды Игла в модификации Дульбекко (DMEM) (состав с высокой концентрацией глюкозы, без L-глутамина,
Bio Whittaker, Walkersville, MD) с добавлением 10% сыворотки новорожденных телят (NBCS) (HyClone Laboratories, Inc., Logan, Utah) и 4 мМ L-глутамина (BioWhittaker, Walkersville, MD). Указанные клетки содержались в инкубаторе при 37±1°С в атмосфере с 10±1% СО2. Указанную среду заменяли свежеприготовленной средой каждые два-три дня. После 8 дней культивирования клетки достигали конфлюэнтности, то есть указанные клетки формировали плотный монослой на дне колбы для тканевой культуры, и среду отсасывали из культуральной колбы. Для промывки монослоя стерильно фильтрованный фосфатно-солевой буфер добавляли на дно каждой культуральной колбы и затем отсасывали из колб. Клетки отсоединяли от колбы, добавляя 5 мл трипсина-версена-глутамина (BioWhittaker, Walkersville, MD) в каждую колбу и аккуратно покачивая, чтобы удостовериться, что монослой полностью покрыт. Культуры возвращали в инкубатор. Как только клетки отсоединялись, в каждую колбу добавляли по 5 мл SBTI (соевого ингибитора трипсина) и смешивали с суспензией для остановки действия трипсин-версена. Суспензию клеток извлекали из колб и равномерно распределяли по стерильным коническим пробиркам. Клетки собирали центрифугированием при приблизительно 800-l000×g в течение 5 минут.
Клетки ресуспендировали с применением свежей среды до концентрации 3,0×106 клеток/мл, и высевали на обработанные вкладыши для тканевых культур диаметром 24 мм с порами размером 0,4 микрона (TRANSWELL®, Corning Costar) в шестилуночный планшет с плотностью 1,0×106 клеток/вкладыш. Следует понимать, что при использовании 75 мм вкладыша следует брать плотность посева клеток 10×106. Если используется вкладыш диаметром 24 мм, берется приблизительно 1×106 клеток на 24 мм вкладыш. Следует понимать, что HUCPVC добавляли к указанной суспензии в виде процента от количества фибробластов. Например, для получения многослойной 24 мм конструкции, содержащей 50% HUCPVC, 5×105 HUCPVC высевали на 1,0×106 неонатальных фибробластов крайней плоти человека, ранее высеянных на пористую мембрану. И фибробласты, и HUCPVC погружали в 3 мл среды для синтеза матрикса, содержащей:
Указанные клетки поддерживали в инкубаторе при 37±1°С в атмосфере 10±1% СО2 и культивировали на среде для синтеза матрикса в течение 11 дней с периодической, каждые 3-4 дня, заменой среды.
Указанные зафиксированные в формалине образцы заливали в парафин, получали 5 мкм срезы и окрашивали гематоксилином-эозином (Н&Е) согласно процедурам, известным в данной области техники. С помощью окрашенных Н&Е слайдов измеряли толщину 10 случайным образом отобранных микроскопических полей с применением 10Х окуляра с сеткой 10 мм/100 мкм.
Пример 11: Получение биоинженерных конструкций смешиванием ДФЧ и МСК
Конструкцию, содержащую продуцированный фибробластами и HUCPVC слой внеклеточного матрикса, формировали в системе с полностью культуральной средой с заданным химическим составом. 1×105 неонатальных фибробластов кожи человека высевали в составе смешанной популяции клеток с 9×105 мезенхимальных клеток-предшественников на 24 мм культуральный вкладыш. Необходимо понимать, что начальная плотность посева фибробластов может варьировать от приблизительно 1×105 до приблизительно 9×105, и начальная плотность посева мезенхимальных клеток-предшественников может также варьировать от приблизительно 1×105 до приблизительно 9×105, в рамках объема настоящего изобретения. HUCPVC получали при
пассаже 2, и доводили до пассажа 7 перед первичным высеванием на культуральный вкладыш. Следует понимать, что указанные HUCPVC могут применяться на стадии любого другого пассажа при условии сохранения мультипотентности клеток.
Указанная среда с заданным химическим составом для продуцирования матрикса содержала:
Фибробласты и мезенхимальные клетки-предшественники культивировали на среде для продуцирования матрикса в течение 11 дней с периодической, каждые 3-4 дня, заменой среды, с получением в результате эндогенно продуцированного внеклеточного матрикса.
Пример 12: Получение эпидермального слоя на биоинженерных конструкциях
Эпидермальные клетки-предшественники человека (HEP; кератиноциты) высевают на биоинженерные конструкции, описанные в любом из Примеров 1-8. HEP высевают после культивирования указанных биоинженерных конструкций в течение приблизительно 11 дней. Предпочтительной является плотность посева приблизительно 3,5×105-1,2×106 клеток/ конструкцию, хотя настоящим изобретением также предусмотрены и другие начальные плотности посева. На 11 день указанные кожные конструкции с HEP обрабатывают средой, содержащей приблизительно:
На 13 день индуцируют дифференцировку HEP с применением дифференцировочной среды, содержащей следующие компоненты:
На 15 день состав среды заменяют, чтобы индуцировать кератинизацию развивающегося эпителиального слоя в среде, содержащей примерно:
Кератинизирующую среду заменяют каждые 2-3 дня. Биоинженерные конструкции развиваются и поддерживаются с 22 по 35 день включительно и содержатся на поддерживающей среде с заменой каждые 2-3 дня на свежую поддерживающую среду, содержащую:
После окончательного формирования биоинженерных конструкций указанные культивированные биоинженерные конструкции содержат смешанный биоинженерный слой эндогенно продуцированных белков внеклеточного матрикса, фибробластов и/или мезенхимальных клеток-предшественников с дифференцированным эпителиальным слоем, расположенным наверху указанного биоинженерной конструкции.
Пример 13: Травление биоинженерных тканевых конструкций для улучшения инфильтрации клеток
Биоинженерные тканевые конструкции могут быть модифицированы для улучшения прикрепления клеток и инфильтрации клеток в глубину системы пор эндогенно продуцируемых тканевых конструкций. Такие эндогенно продуцируемые конструкции могут быть получены первичным посевом приблизительно 30 млн фибробластов кожи человека на 0,4 мкм пористую мембрану и культивирования на среде с заданным химическим составом в течение 11 дней. Указанная среда с заданным химическим составом содержит: основную смесь 3:1 DMEM и среды Хэма F-12 (Quality Biologies, Gaithersburg, MD), 4 мМ GlutaMAX (Gibco BRL, Grand Island, NY) и добавки: 5 нг/мл рекомбинантного эпидермального фактора роста человека (Upstate Biotechnology, Lake Placid, NY), 1 x 10-4 M этаноламина (Fluka, Ronkonkoma, NY cat. #02400 степень чистоты ACS), 1×10-4 M о-фосфорил-этаноламина (Sigma, St. Louis, MO), 5 мкг/мл трансферрина (Sigma, St. Louis, MO), 20 пМ трийодтиронина (Sigma, St. Louis, МО), и 6,78 нг/мл селена (Sigma Aldrich Fine Chemicals Company, Milwaukee, WI), 50 нг/мл L-аскорбиновой кислоты(WAKO Chemicals USA, Inc.), 0,2 мкг/мл L-пролина (Sigma, St. Louis, MO), 0,1 мкг/мл глицина (Sigma, St. Louis, MO), 20 нг/мл ТФР-альфа и 10 нМ ПГЕ2. После 11 дней культивирования поверхность указанных биоинженерных тканевых конструкций может быть протравлена для удаления клеточного дебриса. Это может осуществляться нанесением раствора 1% уксусной кислоты для удаления тонкого слоя коллагена с верхней поверхности указанной биоинженерной конструкции. Травление может обеспечивать лучшую инфильтрацию клеток, что может быть полезно для применения при ожогах.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОИНЖЕНЕРНЫЙ КОНСТРУКТ ДЛЯ ИМПЛАНТАЦИИ ТКАНИ И СПОСОБ ИЗГОТОВЛЕНИЯ НАЗВАННОГО БИОИНЖЕНЕРНОГО КОНСТРУКТА (ВАРИАНТЫ) | 2008 |
|
RU2461622C2 |
| Способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека | 2022 |
|
RU2813729C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ ХРЯЩЕВОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2301677C1 |
| Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека | 2019 |
|
RU2716594C1 |
| ГЕПАРАНСУЛЬФАТЫ | 2013 |
|
RU2700877C2 |
| Биокомпозитный сфероид для восстановления костей и способ его получения | 2020 |
|
RU2744732C1 |
| Носитель для культивирования клеток человека и животных | 2017 |
|
RU2663131C1 |
| СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЯ РОТОВОЙ ПОЛОСТИ БОЛЬНОГО (ВАРИАНТЫ) | 2007 |
|
RU2498808C9 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2004 |
|
RU2265445C1 |
| СПОСОБ ТЕРАПИИ КОСМЕТИЧЕСКИХ ДЕФЕКТОВ КОЖИ | 2024 |
|
RU2831472C1 |

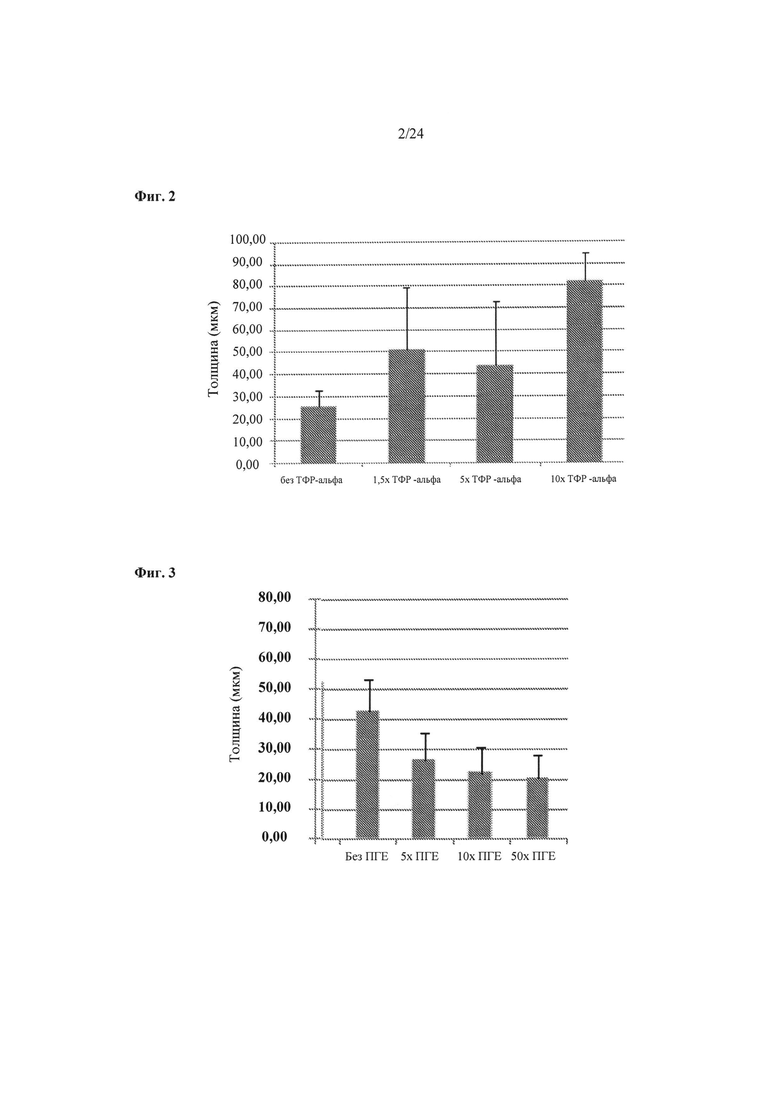
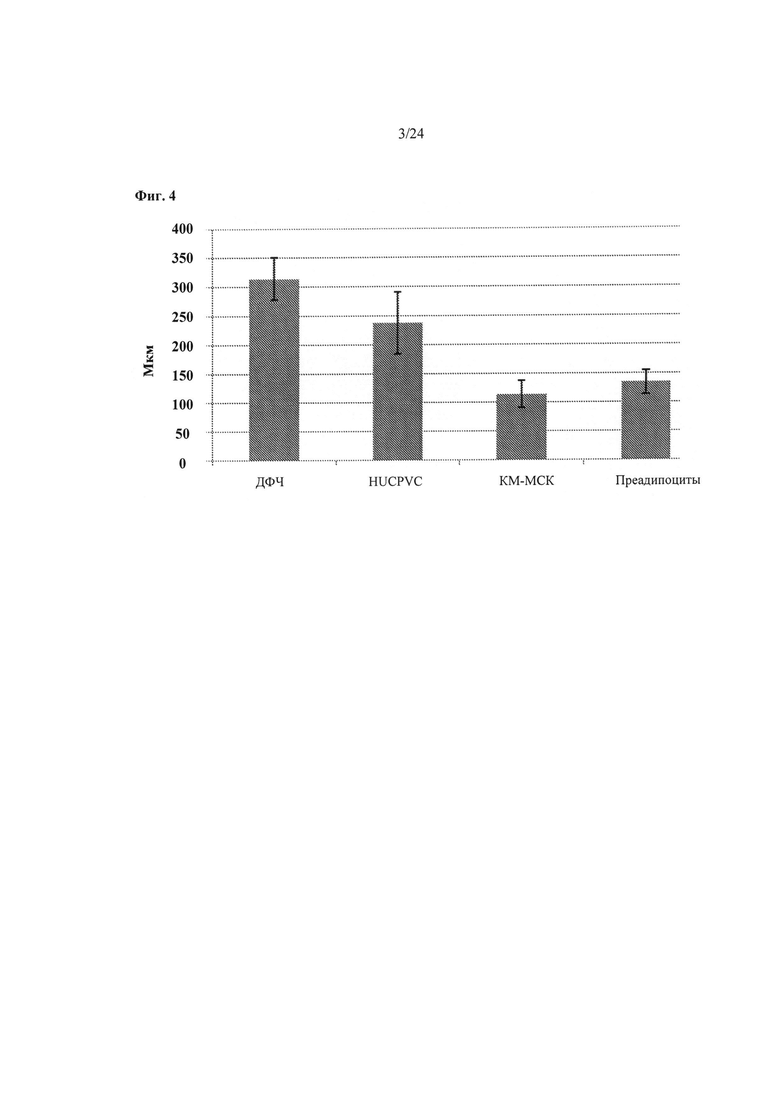
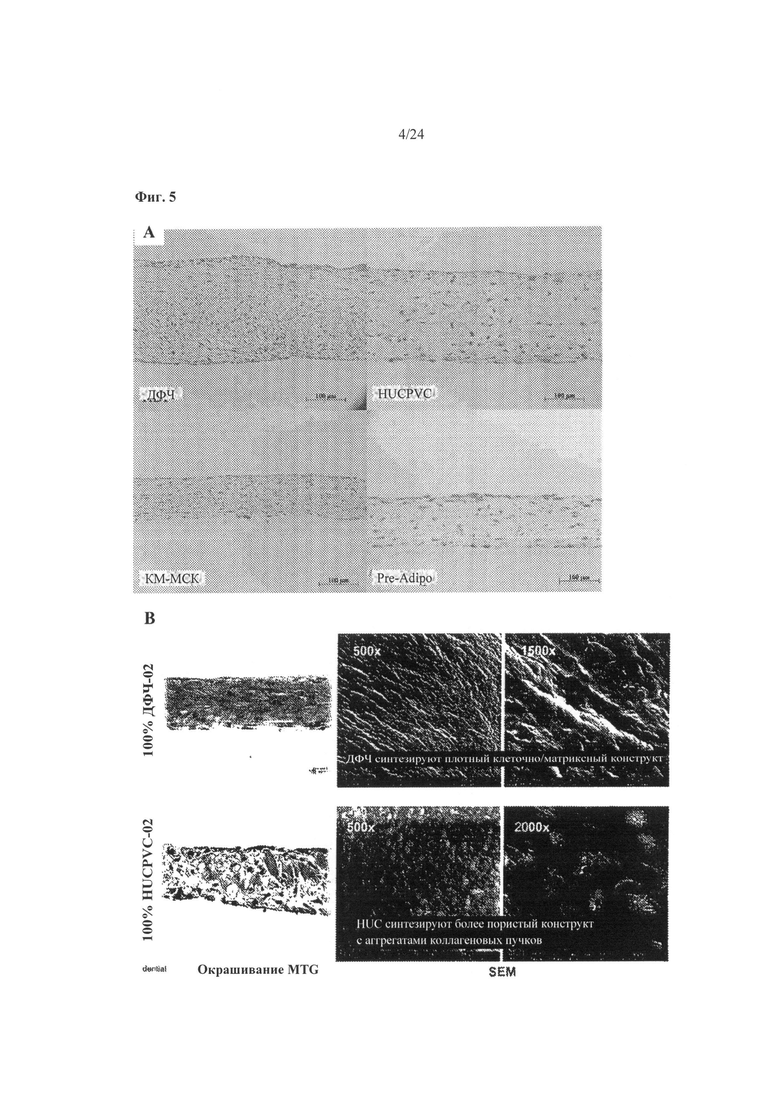


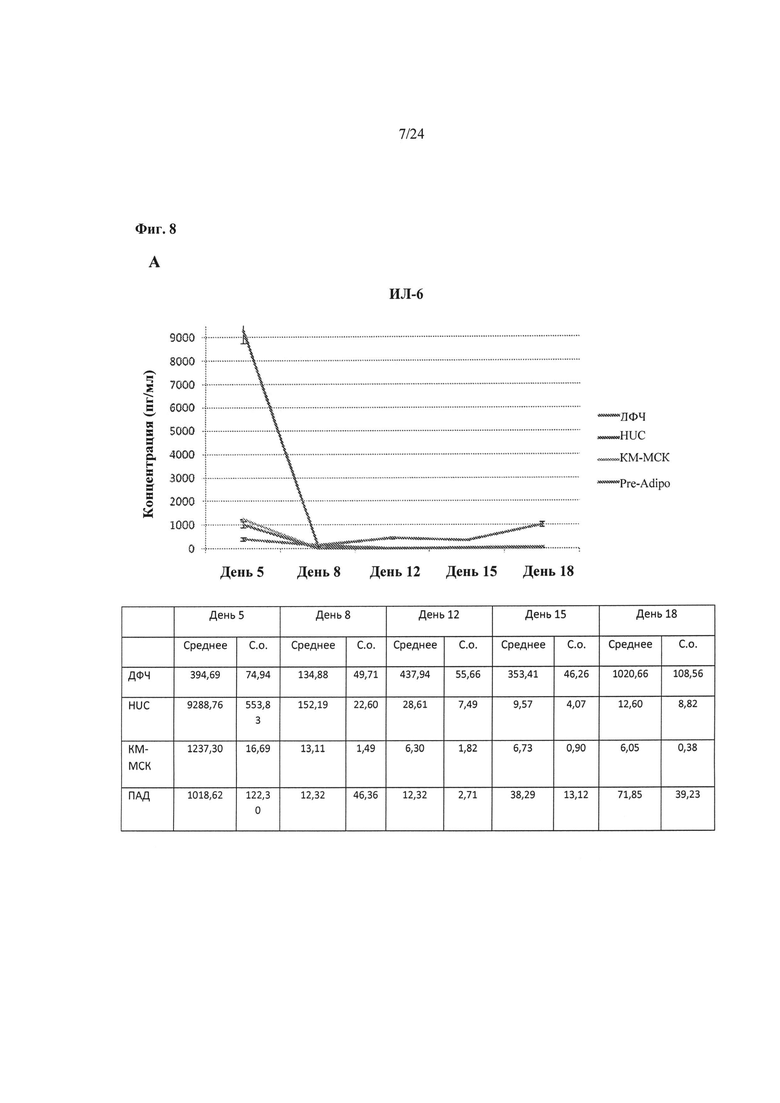
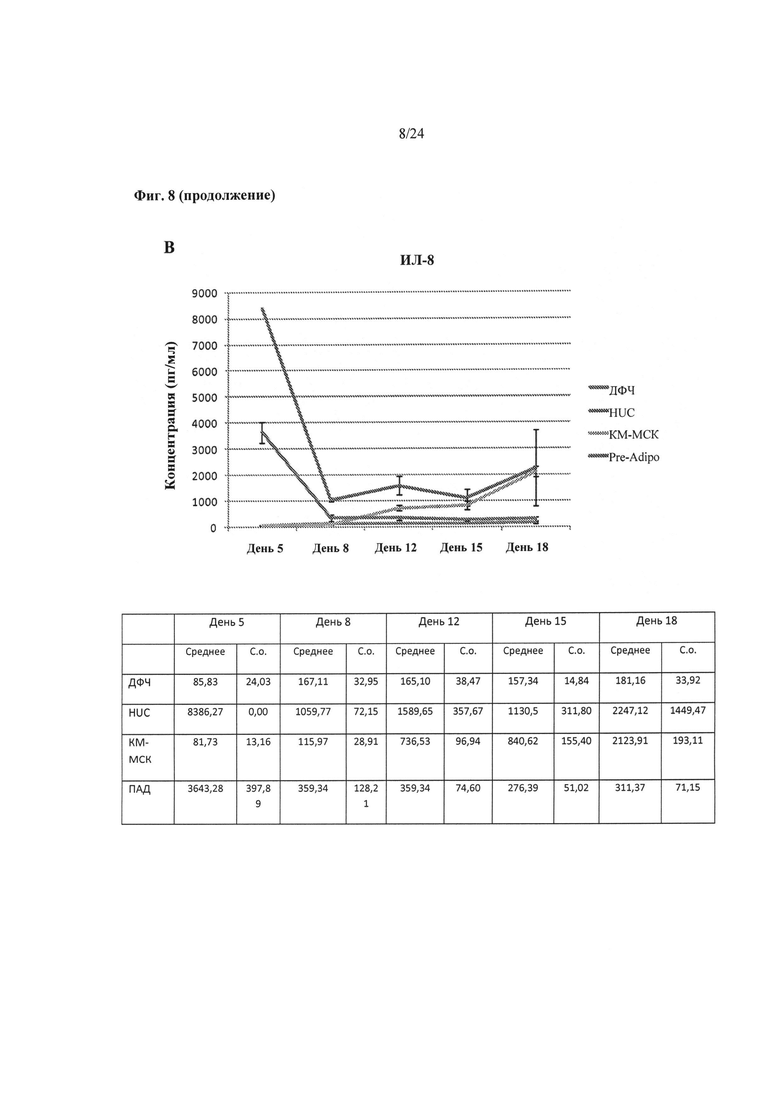
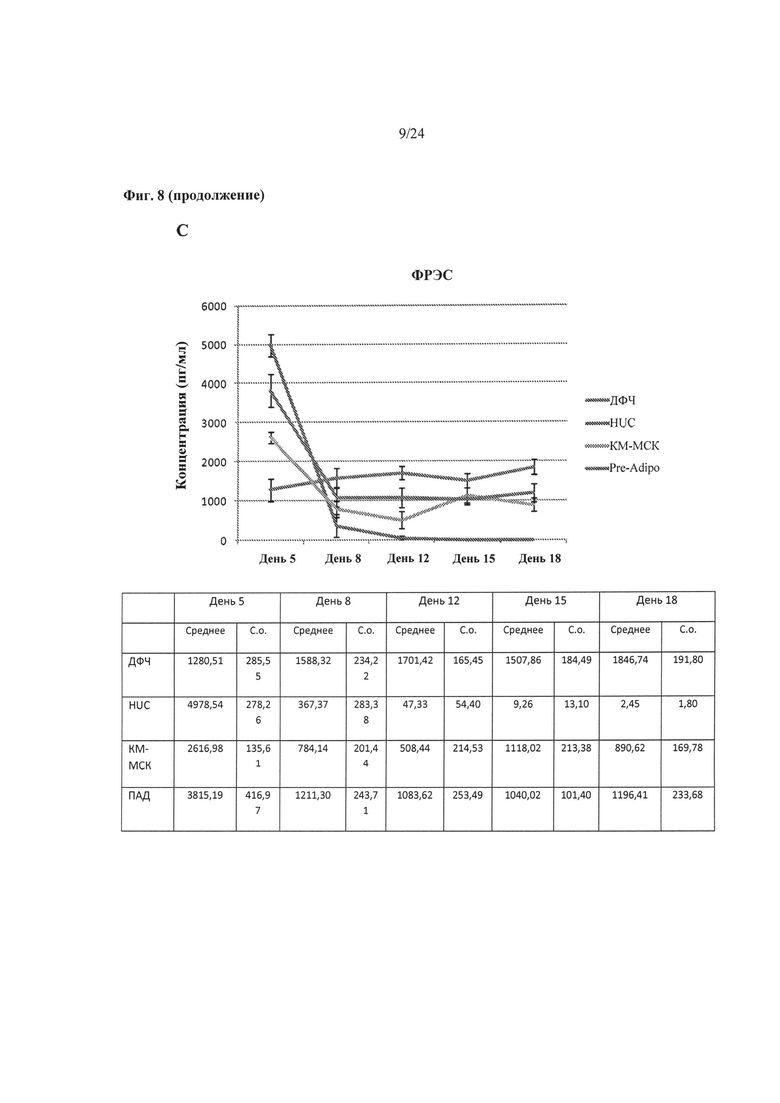
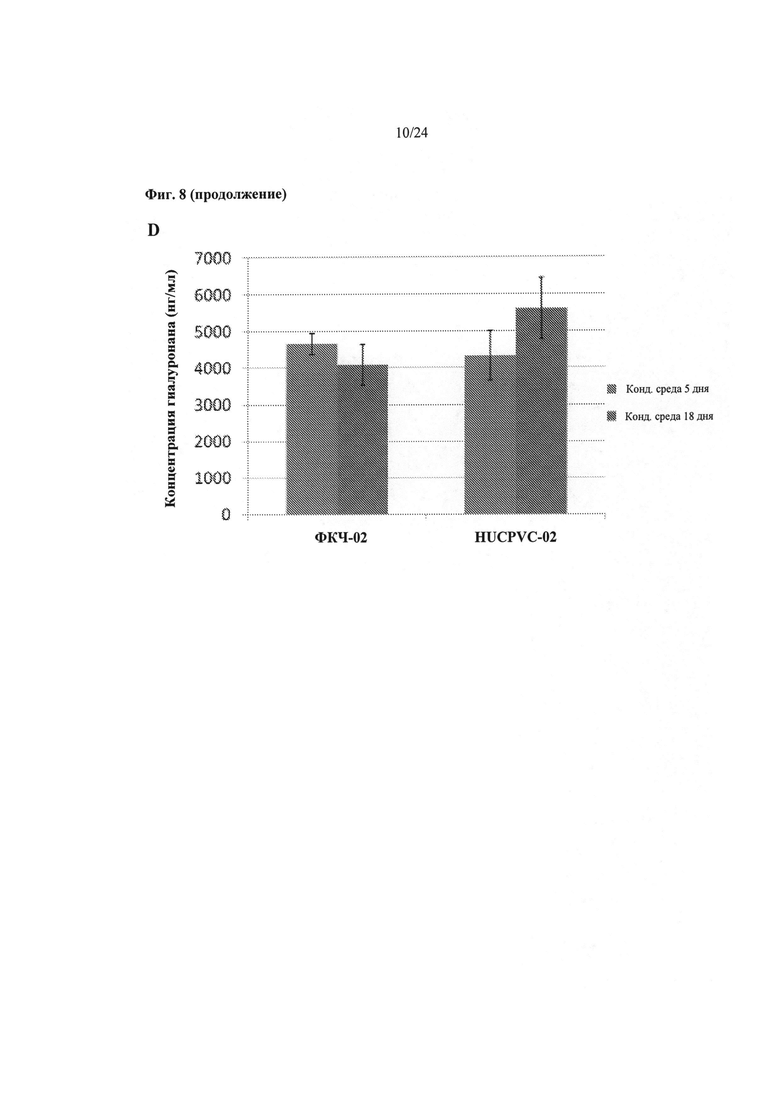
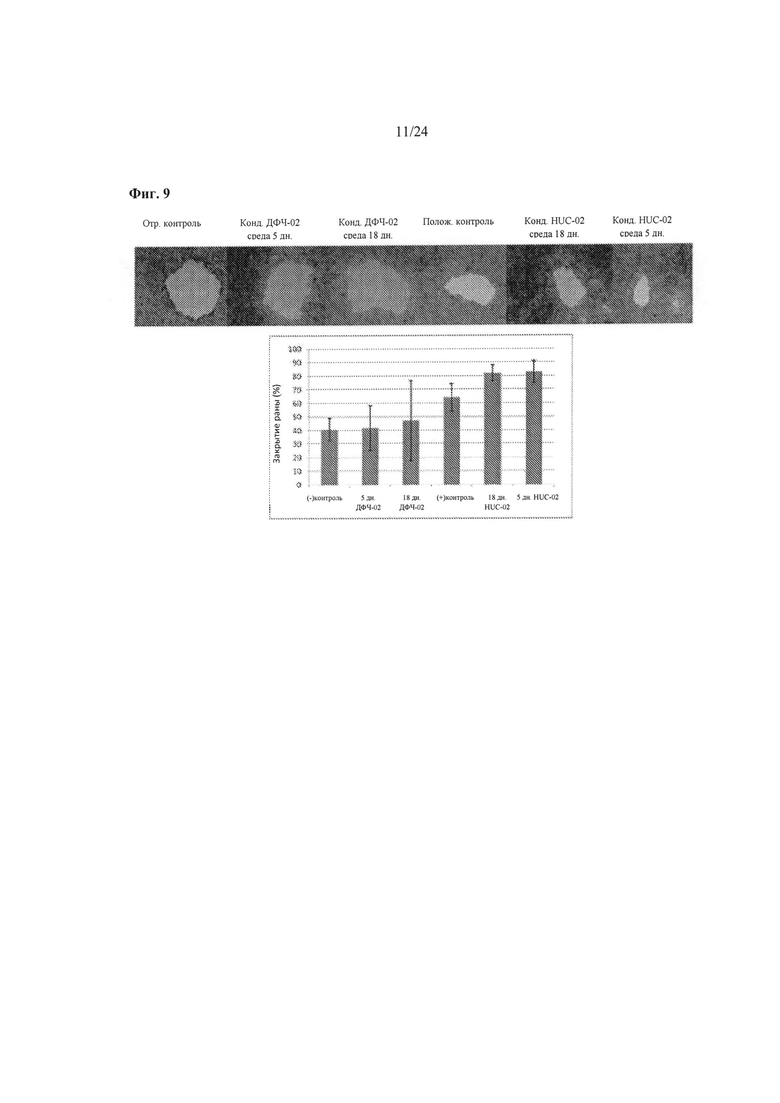

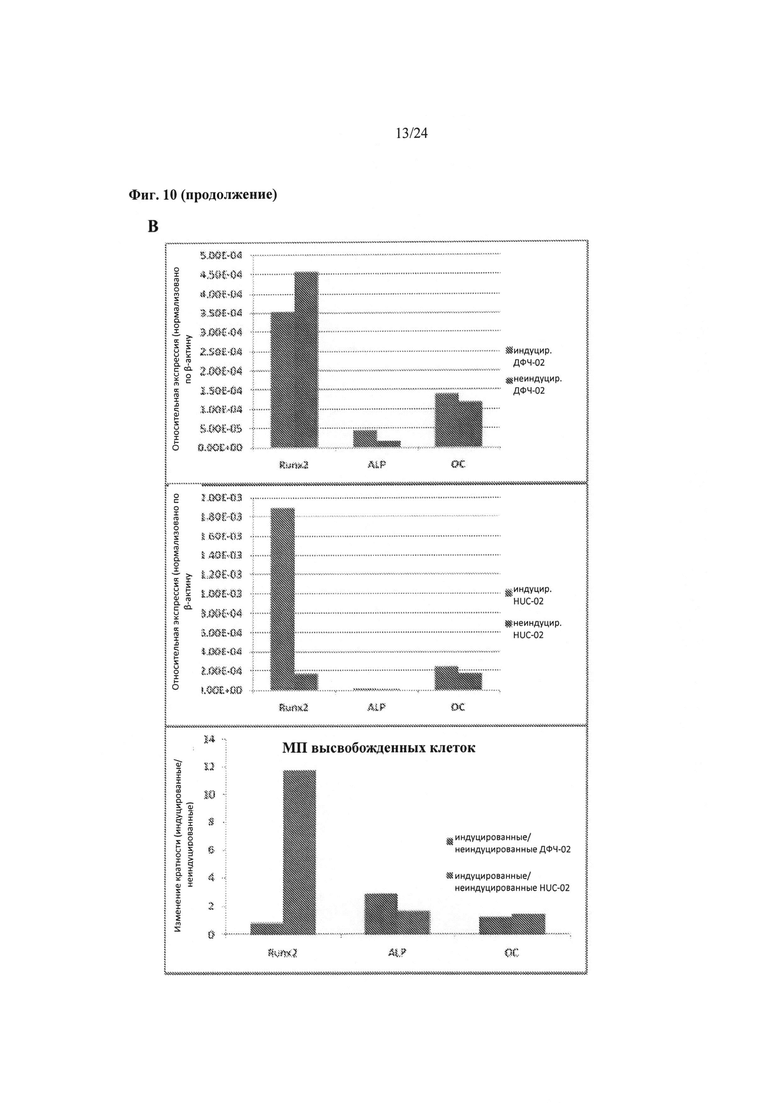
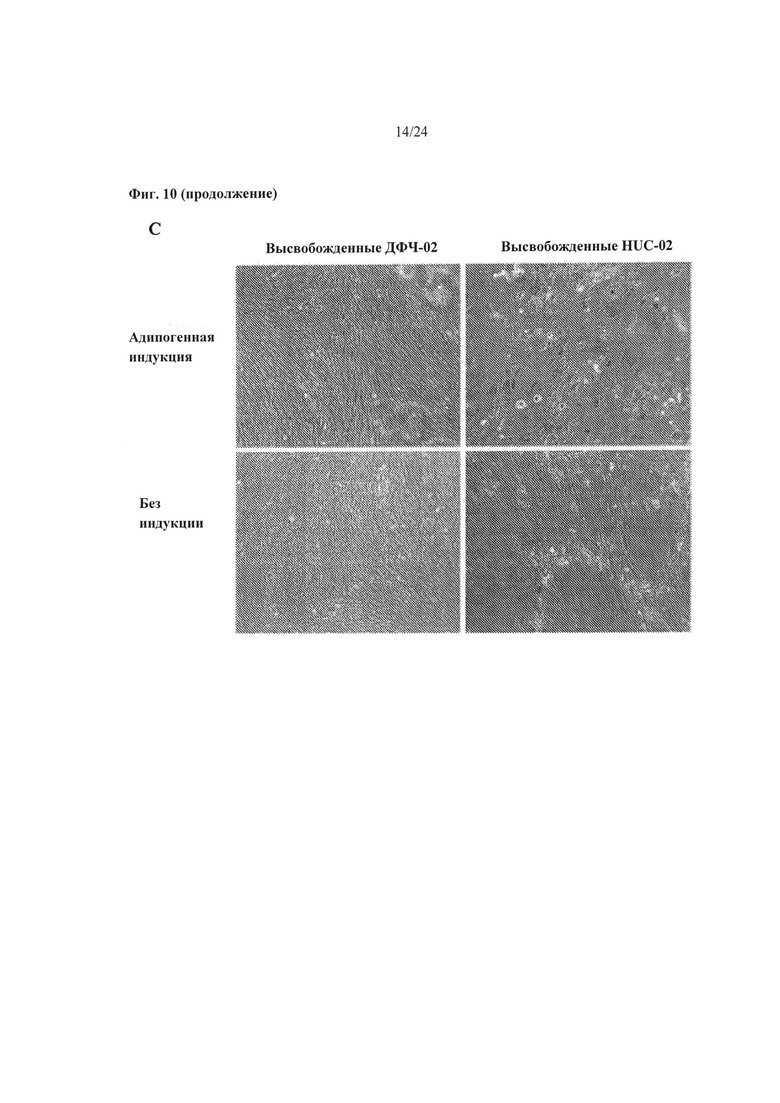
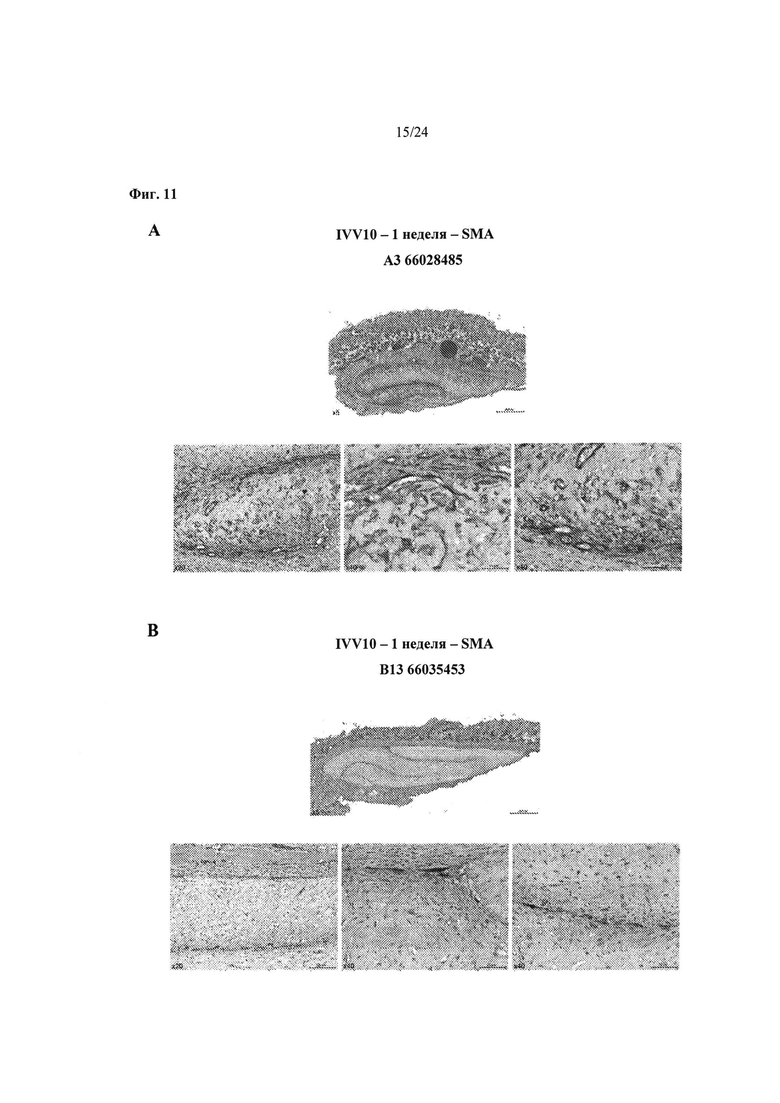
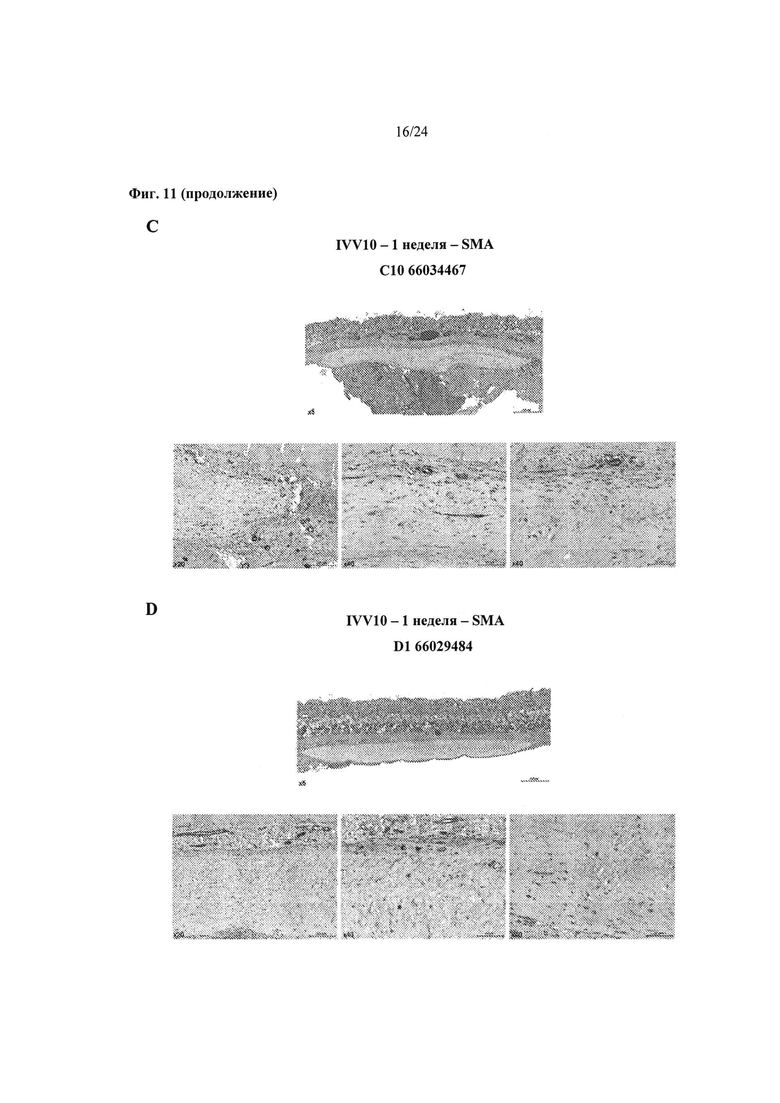
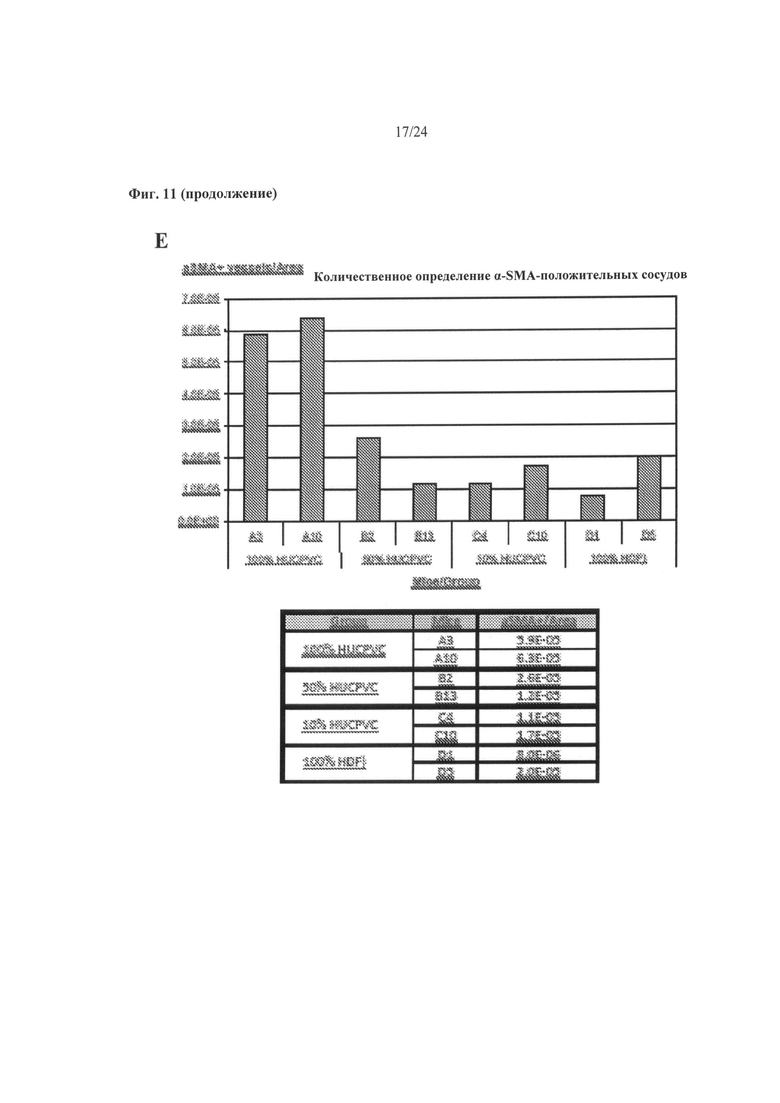
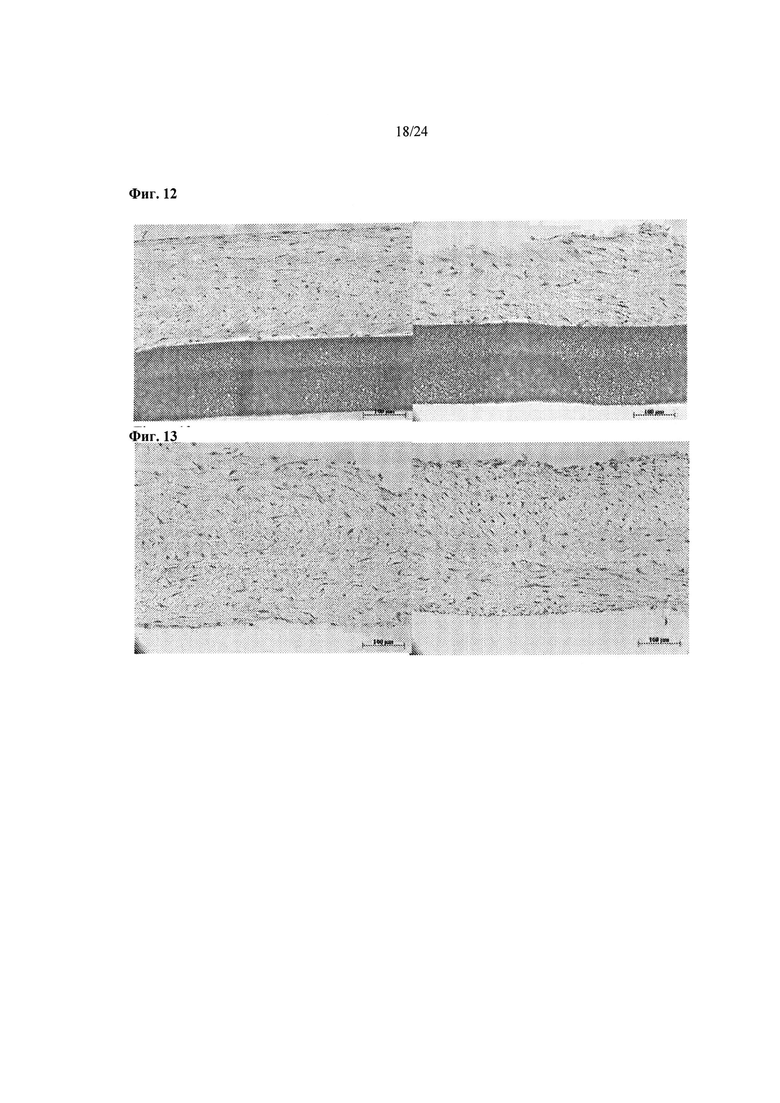

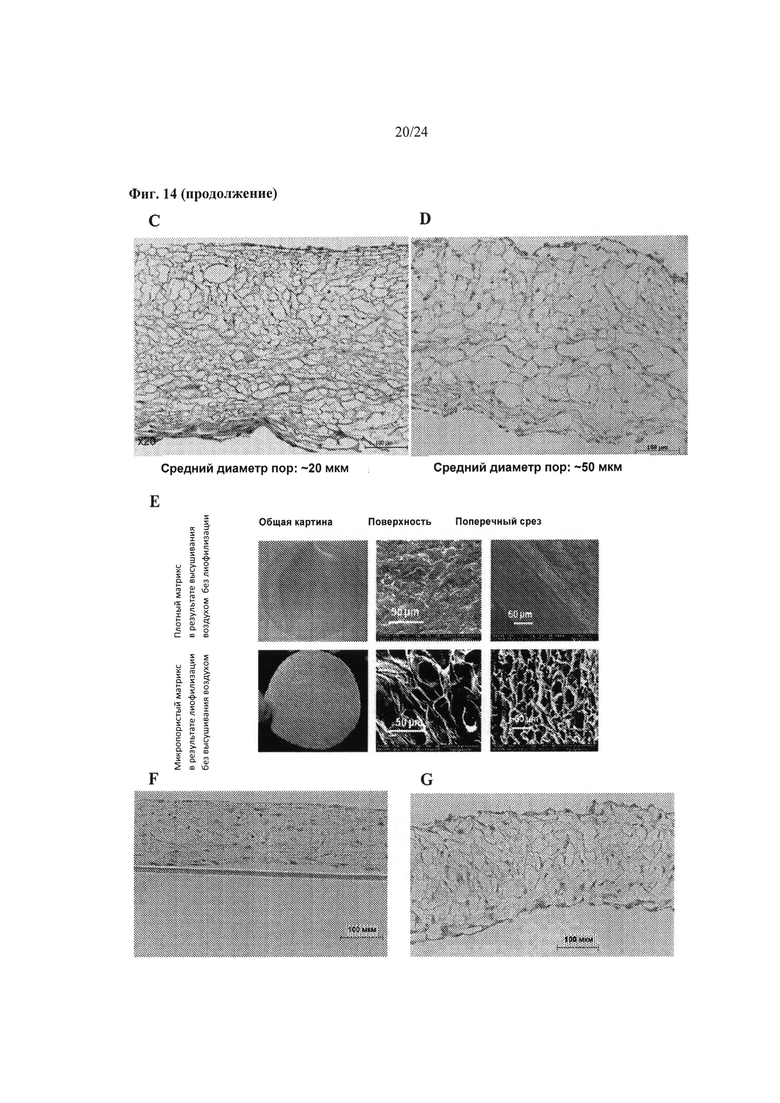

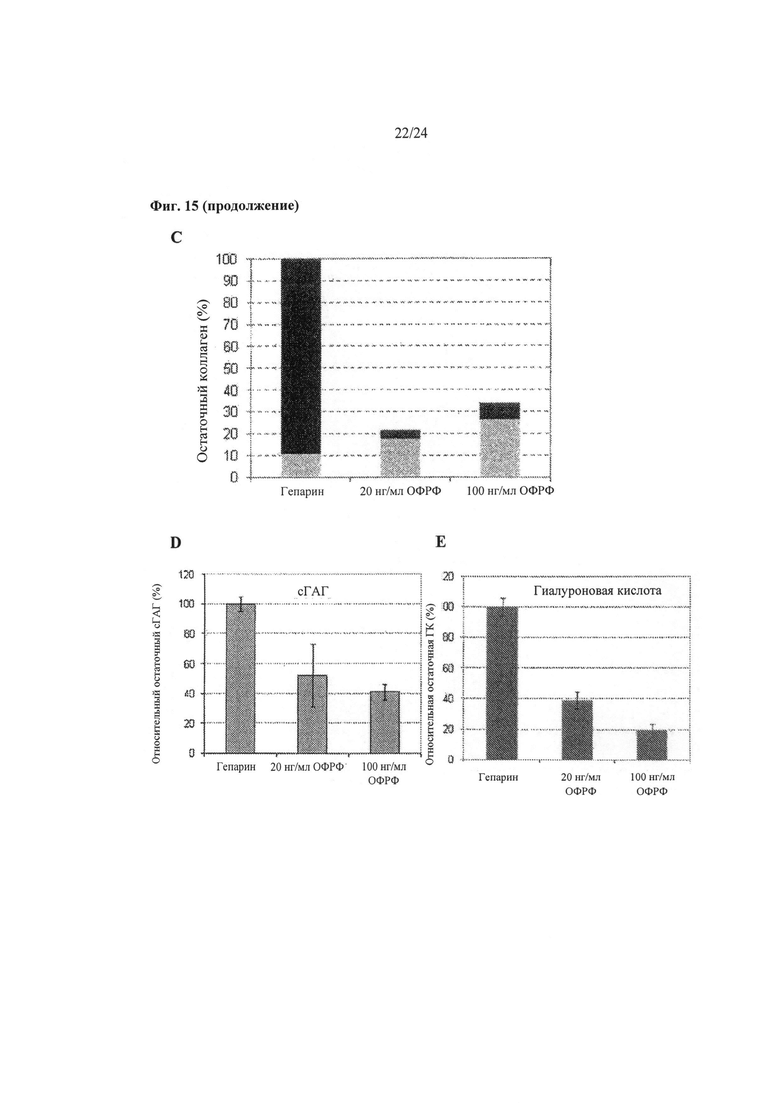
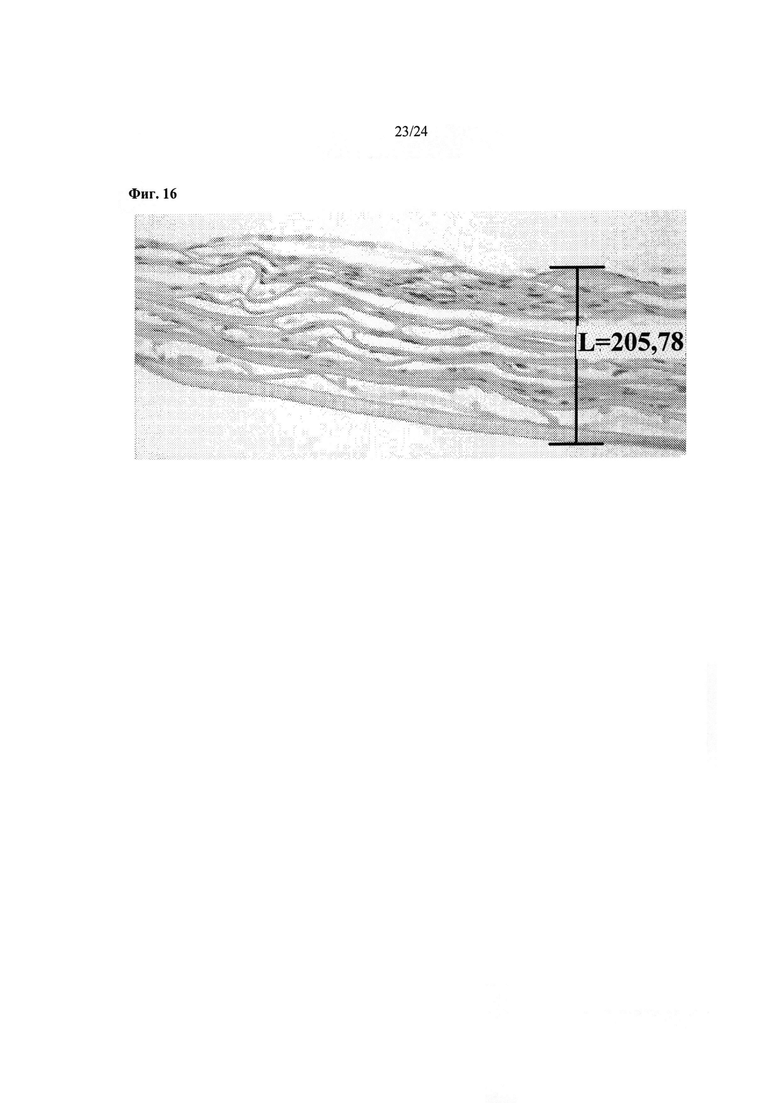

Изобретение относится к биотехнологии. Описана биоинженерная конструкция для восстановления больных или поврежденных тканей. Указанная конструкция содержит мезенхимальные стволовые клетки и слой внеклеточного матрикса, продуцируемый указанными клетками, при этом указанные мезенхимальные клетки не являются производными эмбриона человека и выращены в условиях среды с заданным химическим составом, свободной от i) сыворотки животных и экстрактов тканей животных и ii) свободной от привнесенных вирусов животных или межвидовых вирусов, для получения указанного слоя внеклеточного матрикса, который синтезируют и собирают указанные мезенхимальные стволовые клетки. Указанная культуральная среда содержит (i) основную питательную среду, (ii) трансформирующий фактор роста альфа (ТФР-α), (iii) инсулин, (iv) L-глютамин или производное L-глютамина, и (v) аскорбат или производное аскорбата. Изобретение может быть использовано в терапии, направленной на восстановление больных или поврежденных тканей. 15 з.п. ф-лы, 17 ил., 13 пр.
1. Биоинженерная конструкция для восстановления больных или поврежденных тканей, содержащая мезенхимальные стволовые клетки и слой внеклеточного матрикса, продуцируемый указанными клетками, при этом указанные мезенхимальные клетки не являются производными эмбриона человека и выращены в условиях среды с заданным химическим составом, свободной от i) сыворотки животных и экстрактов тканей животных и ii) свободной от привнесенных вирусов животных или межвидовых вирусов, для получения указанного слоя внеклеточного матрикса, который синтезируют и собирают указанные мезенхимальные стволовые клетки, при этом указанная культуральная среда содержит (i) основную питательную среду, (ii) трансформирующий фактор роста альфа (ТФР-α), (iii) инсулин, (iv) L-глютамин или производное L-глютамина, и (v) аскорбат или производное аскорбата.
2. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанные мезенхимальные стволовые клетки получают из костного мозга, пуповины, плаценты, амниона, мышц, жировой ткани, кости, сухожилия или хряща.
3. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанные мезенхимальные стволовые клетки представляют собой пуповинные мезенхимальные стволовые клетки.
4. Биоинженерная конструкция по п. 3, отличающаяся тем, что указанные пуповинные мезенхимальные стволовые клетки выделены из пуповинной крови, субэндотелия пупочной вены или вартонова студня.
5. Биоинженерная конструкция по п. 3, отличающаяся тем, что указанные пуповинные мезенхимальные стволовые клетки представляют собой периваскулярные клетки пуповины человека (HUCPVC).
6. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанные мезенхимальные стволовые клетки представляют собой мезенхимальные стволовые клетки человека.
7. Биоинженерная конструкция по любому из пп. 1-6, отличающаяся тем, что указанные мезенхимальные стволовые клетки смешаны с фибробластами.
8. Биоинженерная конструкция по п. 7, отличающаяся тем, что указанные мезенхимальные стволовые клетки и фибробласты присутствуют по меньшей мере в двух отдельных слоях.
9. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанная биоинженерная конструкция имеет поры с диаметром в диапазоне от 10 микрон до 150 микрон, причем указанные поры могут иметь диаметр в диапазоне от 50 микрон до 100 микрон или от 80 микрон до 100 микрон.
10. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанная биоинженерная конструкция характеризуется средним Fmax, составляющим по меньшей мере 0,4 Н.
11. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанная биоинженерная конструкция имеет предел прочности на растяжение (UTS), равный по меньшей мере 0,4 МПа.
12. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанная биоинженерная конструкция характеризуется по меньшей мере 0,4-кратным допуском упругой деформации относительно начальной длины.
13. Биоинженерная конструкция по п. 1, отличающаяся тем, что клетки указанной биоинженерной конструкции девитализированы.
14. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанная биоинженерная конструкция дополнительно содержит одно или более из следующего: гиалуронан, КСФ-3, витронектин, гепарин, НМКА1, CXCL1, IL-6 (ИЛ-6), IL-8 (ИЛ-8), ФРЭС-А, ФРЭС-С, PDGF (ФРТ)-β, РЕСАМ1, CDH5, ANGPT1, ММР2, TIMP1 и TIMP3.
15. Биоинженерная конструкция по п. 1, отличающаяся тем, что указанная биоинженерная конструкция дополнительно содержит противомикробный агент, фармацевтическое лекарственное средство, фактор роста, цитокин, пептид или белок.
16. Биоинженерная конструкция по п. 1, отличающаяся тем, что площадь поверхности указанной биоинженерной конструкции сокращается по меньшей мере на 50% при высвобождении указанной биоинженерной конструкции из культурального субстрата.
| Xiao-Dong Chen MD, Extracellular Matrix Made by Bone Marrow Cells Facilitates Expansion of Marrow-Derived Mesenchymal Progenitor Cells and Prevents Their Differentiation Into Osteoblasts, Journal of Bone and Mineral Research, Volume 22, Issue 12, pages 1943-1956 | |||
| Способ определения толщины поверхностного твердого слоя металлических изделий | 1949 |
|
SU86455A1 |
Авторы
Даты
2018-02-21—Публикация
2011-01-14—Подача