Область техники, к которой относится изобретение
Данное раскрытие относится к области эволюции белков. Конкретно, данное раскрытие относится к способу создания условно активного химерного антигенного рецептора из белка дикого типа. Условно активный химерный антигенный рецептор обратимо или необратимо инактивирован в нормальном для дикого типа физиологическом условии, но активен в аномальных условиях.
Уровень техники
Существует значительный объем литературы, описывающий возможность эволюционирования белков, в особенности, ферментов, по ряду разнообразных характеристик. Например, ферменты могут быть эволюционированы так, чтобы сохранять стабильность при работе при различных условиях, таких как при повышенной температуре. В ситуациях, когда происходит усовершенствование активности при повышенной температуре, значительная часть усовершенствования может быть отнесена к более высокой кинетической активности, которая обычно описывается правилом Q10, согласно которому предполагается, что в случае фермента, скорость обмена удваивается для каждого увеличения на 10 градусов Цельсия.
Кроме того, существуют примеры естественных мутаций, которые дестабилизируют белки в их нормальных рабочих условиях. Определенные мутанты могут быть активными при пониженной температуре, но на пониженном уровне по сравнению с белками дикого типа. Это также обычно описывают снижением в активности согласно правилу Q10 или аналогичным правилам.
Желательно создать полезные молекулы, которые активируются в зависимости от условий. Например, желательно создать молекулы, которые практически неактивны в условиях работы дикого типа, но активны в других условиях, отличных от условий работы дикого типа, на уровне, который равен или превосходит уровень дикого типа в условиях работы дикого типа, или которые активируются или инактивируются в определенных микроокружениях, или которые активируются или инактивируются через некоторое время. Помимо температуры, другие условия, для которых эти белки могут быть эволюционированы или оптимизированы, включают pH, осмотическое давление, осмоляльность, окислительный стресс и концентрацию электролита. Другие желательные свойства, которые могут быть оптимизированы при изменении, включают химическую устойчивость и устойчивость к протеолизу.
Опубликовано множество стратегий по эволюционированию или конструированию молекул. Однако такое конструирование или эволюционирование белка, которое позволяет сделать его неактивным или практически неактивным (менее чем 10% активности и, предпочтительно, менее чем 1% активности) в условиях работы дикого типа, при сохранении активности равной или улучшении ее по сравнению с соответствующим ему белком дикого типа в условии, отличном от условий работы дикого типа, требует, чтобы дестабилизирующая мутация (дестабилизирующие мутации) сосуществовали с мутациями, увеличивающими активность, которые не противодействуют дестабилизирующему эффекту. Ожидается, что дестабилизация могла бы снизить активности белка сильнее, чем эффекты, предсказанные стандартными правилами, такими как Q10. Следовательно, способность к эволюционированию белков, которые эффективно работают, например, при пониженной температуре и в то же время остаются инактивированными при нормальном для соответствующего белка дикого типа условии работы, создает неожиданный новый класс белков.
Химерные антигенные рецепторы (CARs) применяют в лечении рака. US 2013/0280220 раскрывает способы и композиции, обеспечивающие усовершенствованные клетки, кодирующие химерный антигенный рецептор, который специфичен для двух или нескольких антигенов, включая антигены опухоли. Клетки, экспрессирующие химерный антигенный рецептор, могут быть применены в клеточной терапии. Такая клеточная терапия может быть пригодна для любого заболевания, хотя в конкретных воплощениях клеточная терапия предназначена для лечения рака, включая рак, включающий солидные опухоли.
Настоящее изобретение обеспечивает сконструированные условно активные химерные антигенные рецепторы, которые неактивны или менее активны в нормальном физиологическом условии, но активны в аномальном физиологическом условии.
Во всей данной заявке, на различные публикации ссылаются по автору и дате. Раскрытия данных публикаций включены в настоящий документ путем отсылки во всей своей полноте в данной заявке для того, чтобы более полно описать состояние данной области техники, известное специалистам в данной области техники по состоянию на дату раскрытия описанного и заявленного в настоящем документе.
Краткое описание чертежей
На фигуре 1 изображено схематичное представление химерного антигенного рецептора в соответствии с одним из воплощений настоящего изобретения. ASTR представляет собой антиген-специфическую нацеливающую область, L представляет собой линкер, ESD представляет собой внеклеточный спейсерный домен, TM - это трансмембранный домен, CSD представляет собой ко-стимулирующий домен и ISD представляет собой внутриклеточный сигнальный домен.
Фигуры 2 и 3 показывают, что экспрессируемые условно активные антитела по примеру 1, в виде бивалентных или моновалентных антител, существенно не изменяют селективность данных антител при pH ниже 6,0 и при pH выше 7,4.
Фигура 4 представляет собой профиль эксклюзионной хроматографии, показывающий, что условно активные антитела по примеру 2 не агрегируют.
Фигура 5 показывает скорости ассоциации и диссоциации условно активных антител по примеру 2, измеренные способом поверхностного плазмонного резонанса (SPR).
Фигуры 6A-6B показывают селективность условно активных антител, измеренную с помощью способа SPR по примеру 2.
Фигура 7A показывает, что CAR-T клетки не оказывают влияния на популяцию клеток CHO, которые не экспрессируют целевой антиген X1 CAR-T клеток. Молекула CAR в CAR-T клетках по данному примеру включала антитело против целевого антигена X1, хотя это антитело не было условно активным (сравнительный пример A).
Фигура 7B показывает, что CAR-T клетки уменьшают популяцию клеток CHO-63, которые экспрессируют целевой антиген X1 CAR-T клеток. Данные CAR-Т-клетки представляют собой те же самые клетки, которые были применены для генерации данных, показанных на фигуре 7A (сравнительный пример A).
Фигура 8A показывает, что CAR-T клетки не оказывают влияния на популяцию клеток CHO, которые не экспрессируют целевой антиген X1 CAR-T клеток. Молекула CAR в CAR-T клетках по данному примеру 3 включала условно активное антитело против целевого антигена X1.
Фигура 8B показывает, что CAR-T клетки уменьшают популяцию клеток CHO-63, которые экспрессируют целевой антиген X1 CAR-T клеток, как проверено в примере 3. Данные CAR-Т-клетки представляют собой те же самые клетки, которые были применены для генерации данных, показанных на фигуре 8A.
Фигуры 9A-9B показывают высвобождение цитокина, индуцированное связыванием CAR-T-клеток с целевым антигеном X1, как описано в примере 3.
Фигура 10 показывает условно активные антитела против целевого антигена X2.
Фигура 11A показывает цитотоксический эффект, индуцированный CAR-T-клетками, связавшимися с клетками Дауди, которые экспрессируют целевой антиген X2, и цитотоксический эффект, индуцированный CAR-T-клетками на клетки HEK293, которые не экспрессируют целевой антиген X2, как описано в примере 4.
Фигуры 12A-12B показывают высвобождение цитокинов, вызванное связыванием CAR-T-клеток с целевым антигеном X1, как описано в примере 5.
Фигуры 13A-13B показывают высвобождение цитокинов, вызванное связыванием CAR-T-клеток с целевым антигеном X2, как описано в примере 5.
Фигура 14 показывает условно активные антитела против целевого антигена X3, которые подходят для построения CAR-T-клеток.
Раскрытие изобретения
В одном из аспектов, настоящее изобретение обеспечивает химерный антигенный рецептор (CAR) для связывания с целевым антигеном. CAR включает, по меньшей мере, одну антиген-специфическую нацеливающую область. CAR представляет собой антитело, превращенное из антитела дикого типа или его фрагмента. CAR включает трансмембранный домен; домен внутриклеточной сигнализации; и имеет, по меньшей мере, одно из следующего: (a) снижение в активности связывания целевого антигена в анализе при нормальном физиологическом условии по сравнению с антителом дикого типа или его фрагментом, и (b) увеличение в активности связывания целевого антигена при анализе в аномальном условии по сравнению с антителом дикого типа или его фрагментом. Нормальные и аномальные условия представляют собой одни и те же условия, имеющие разные значения.
В еще одном аспекте, настоящее изобретение обеспечивает химерный антигенный рецептор для связывания с целевым антигеном. CAR включает, по меньшей мере, одну антиген-специфическую нацеливающую область, эволюционировавшую из белка дикого типа или его домена. CAR также имеет, по меньшей мере, одно из: (a) снижение в активности при анализе в нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена, и (b) увеличение в активности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена. Нормальные и аномальные условия представляют собой одни и те же условия, имеющие разные значения. Аномальное условие представляет собой состояние, присутствующее в микроокружении опухоли, внеклеточной жидкости головного мозга, нише для стволовых клеток, лимфатическом узле, миндалине, аденоиде, синусе или синовиальной жидкости. CAR дополнительно содержит трансмембранный домен и внутриклеточный сигнальный домен.
В еще одном аспекте, настоящее изобретение обеспечивает химерный антигенный рецептор для связывания с целевым антигеном. CAR включает трансмембранный домен; внутриклеточный сигнальный домен и, по меньшей мере, две антиген-специфические нацеливающие области, связанные условным линкером. Условный линкер имеет первую конформацию при аномальном условии, которая презентирует, по меньшей мере, две антиген-специфические нацеливающие области таким образом, что имеет более высокую аффинность связывания целевого антигена, по сравнению с аффинностью связывания второй конформации того же условного линкера, которая имеет место при нормальном физиологическом условии.
В еще одном аспекте, химерный антигенный рецептор имеет одну или обе из двух антиген-специфических нацеливающих областей, которые эволюционировали из белка дикого типа или его домена. CAR также имеет, по меньшей мере, одно из следующего: (a) снижение в активности при анализе при нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена, и (b) увеличение в активности в анализе при аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена.
В еще одном аспекте, настоящее изобретение обеспечивает химерный антигенный рецептор для связывания с целевым антигеном. CAR включает трансмембранный домен; внутриклеточный сигнальный домен; и, по меньшей мере одну антиген-специфическую нацеливающую область, которая связывается с целевым антигеном; внеклеточный спейсерный домен, по меньшей мере, имеет первую конформацию при аномальном условии, по меньшей мере, для одной антиген-специфической нацеливающей области, что обеспечивает более высокую аффинность связывания целевого антигена по сравнению со второй конформацией антиген-специфического внеклеточного спейсерного домена, которая имеет место при нормальном физиологическом условии.
В еще одном аспекте, химерный антигенный рецептор имеет антиген-специфическую нацеливающую область, эволюционировавшую из белка дикого типа или его домена. CAR также имеет, по меньшей мере, одно из следующего: (a) снижение в активности в анализе при нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена, и (b) увеличение в активности в анализе при аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена. Нормальные и аномальные условия представляют собой одни и те же условия, имеющие разные значения.
В еще одном аспекте, настоящее изобретение обеспечивает химерный антигенный рецептор для связывания с целевым антигеном. CAR включает, по меньшей мере одну антиген-специфическую нацеливающую область, которая связывается с целевым антигеном; внеклеточный спейсерный домен с повышенной устойчивостью к убиквитинилированию при аномальном условии по сравнению с нормальным физиологическим условием; трансмембранный домен; и внутриклеточный сигнальный домен.
В другом аспекте, настоящее изобретение обеспечивает вектор экспрессии, включающий полинуклеотидную последовательность, кодирующую химерный антигенный рецептор изобретения. Вектор экспрессии выбирают из лентивирусных векторов, гамма-ретровирусных векторов, векторов пенящих вирусов, векторов аденоассоциированных вирусов, аденовирусных векторов, векторов поксвирусов, векторов вируса герпеса, сконструированных гибридных вирусов и опосредованных транспозонами векторов.
Еще в одном аспекте, настоящее изобретение обеспечивает генетически сконструированную цитотоксическую клетку, которая включает полинуклеотидную последовательность, кодирующую химерный антигенный рецептор изобретения. Цитотоксическая клетка может представлять собой T-клетку и может быть выбрана из наивной T-клетки, центральной T-клетки памяти и эффекторной T-клетки памяти.
Еще в одном аспекте, настоящее изобретение обеспечивает фармацевтическую композицию, включающую химерный антигенный рецептор, вектор экспрессии и/или генетически сконструированную цитотоксическую клетку изобретения, и фармацевтически приемлемое вспомогательное вещество.
Еще в одном аспекте, настоящее изобретение обеспечивает способ лечения рака у субъекта, включающий стадию введения вектора экспрессии, включающего полинуклеотидную последовательность, кодирующую химерный антигенный рецептор изобретения в цитотоксической клетке, полученной от субъекта, для создания генетически сконструированной цитотоксической клетки; и введение генетически сконструированной цитотоксической клетки субъекту.
Определения
Для того чтобы облегчить понимание примеров, обеспеченных в настоящем документе, в настоящем описании будут определены некоторые часто встречающиеся методики и/или термины.
Как применен в настоящем документе в связи с измеряемой величиной, термин «примерно» относится к нормальной вариации данной измеряемой величины, которую можно было бы ожидать специалисту в данной области техники, производящему измерения, и контролирующему уровень соизмерности с задачей измерения и точностью используемого измерительного оборудования. Если не указано другое, то «примерно» относится к вариации, равной +/-10% от указанного значения.
Термин «средство» применяют в настоящем документе для обозначения химического соединения, смеси химических соединений, массива пространственно локализованных соединений (например, микроматрица пептидов VLSIPS, микроматрица полинуклеотидов и/или комбинаторная микроматрица малых молекул), биологической макромолекулы, дисплейной бактериофаговой библиотеки пептидов, дисплейной бактериофаговой библиотеки антител (например, scFv), полисомной дисплейной библиотеки пептидов или экстракта, полученного из биологических материалов, таких как бактерии, клетки или ткани растений, грибов или животных (в особенности, млекопитающих). Средства оценивают на потенциальную ферментативную активность путем включения в скрининговые анализы, описанные ниже в настоящем документе. Средства оценивают на потенциальную энзиматическую активность в качестве условно активных биологических терапевтических ферментов путем включения в скрининговые анализы, описанные ниже в настоящем документе.
Термин «аминокислота», как применен в настоящем документе, относится к любому органическому соединению, которое содержит аминогруппу (~NH2) и карбоксильную группу (-COOH); предпочтительно либо в виде свободных групп, или альтернативно после конденсации в составе пептидных связей. Термин «двадцать кодируемых природно полипептид-формирующих альфа-аминокислот» понимают в данной области техники как относящихся к: аланину (ala или A), аргинину (arg или R), аспарагину (asn или N), аспарагиновой кислоте (asp или D), цистеину (cys или C), глутаминовой кислоте (glu или E), глутамину (gin или Q), глицину (gly или G), гистидину (his или H), изолейцину (ile или I), лейцину (leu или L), лизину (lys или K), метионину (met или M), фенилаланину (phe или F), пролину (pro или P), серину (ser или S), треонину (thr или T), триптофану (tip или W), тирозину (tyr или Y) и валину (val или V).
Термин «амплификация», как применен в настоящем документе, означает, что число копий полинуклеотида увеличивается.
Термин «антитело», как применен в настоящем документе, относится к интактным молекулам иммуноглобулина, а также к фрагментам молекул иммуноглобулина, таким как фрагменты Fab, Fab', (Fab')2, Fv и SCA, которые способны связываться с эпитопом антигена. Данные фрагменты антитела, которые сохраняют некоторую способность селективно связываться с антигеном (например, с полипептидным антигеном) антитела, из которого они были получены, могут быть получены с помощью хорошо известных в данной области техники способов (смотри, например, Harlow и Lane, supra), и описаны далее, следующим образом. Антитела могут быть применены для выделения препаративных количеств антигена с помощью иммуноаффинной хроматографии. Различные другие применения таких антител заключаются в диагностировании и/или определении стадии заболевания (например, неоплазии) и для терапевтического применения в лечении таких заболеваний, как, например: неоплазия, аутоиммунное заболевание, СПИД, сердечнососудистое заболевание, инфекции и тому подобное. Химерный, подобные человеческим, гуманизированные или полностью человеческие антитела особенно полезны для введения пациентам-людям.
Fab-фрагмент состоит из моновалентного антиген-связывающего фрагмента молекулы антитела, и может быть получен путем расщепления целой молекулы антитела ферментом папаином, с получением фрагмента, состоящего из интактной легкой цепи и части тяжелой цепи.
Fab'-фрагмент молекулы антитела может быть получен путем обработки целой молекулы антитела пепсином, с последующим восстановлением, с получением молекулы, состоящей из интактной легкой цепи и части тяжелой цепи. На одну молекулу антитела, обработанную таким образом, получают два Fab'-фрагмента.
(Fab')2-фрагмент антитела может быть получен при обработке всей молекулы антитела ферментом пепсином, без последующего восстановления. (Fab')2-фрагмент представляет собой димер двух Fab'-фрагментов, скрепленных двумя дисульфидными связями.
Fv-фрагмент определяют как генно-инженерный фрагмент, содержащий вариабельную область легкой цепи и вариабельную область тяжелой цепи, экспрессированные как две цепи.
Термином «антиген» или «Ag», как применен в настоящем документе, определяют как молекулу, которая вызывает иммунный ответ. Данный иммунный ответ может включать или продукцию антитела, или активацию специфических иммунологически компетентных клеток, или и то и другое. Специалисту в данной области техники понятно, что любая макромолекула, включая практически все белки или пептиды, может служить в качестве антигена. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалисту в данной области техники понятно, что любая ДНК, включающая нуклеотидную последовательность или частичную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, таким образом, кодирует «антиген», как этот термин применяют в настоящем документе. Кроме того, специалисту в данной области техники понятно, что антиген не обязательно должен быть закодирован исключительно полноразмерной нуклеотидной последовательностью гена. Совершенно очевидно, что настоящее изобретение включает, но не ограничивается, применение частичных нуклеотидных последовательностей более чем одного гена, и что данные нуклеотидные последовательности расположены в различных комбинациях, чтобы вызвать желаемый иммунный ответ. Кроме того, специалисту понятно, что антиген совершенно не обязательно закодирован с помощью «гена». Совершенно очевидно, что антиген может быть создан, синтезирован или может быть получен из биологического образца. Такой биологический образец может включать, но не ограничивается, образец ткани, образец опухоли, клетку или биологическую жидкость.
Термин «варианты ускользания от иммунологического надзора потерей антигена», как применен в настоящем документе, относится к клеткам, которые проявляют сниженную экспрессию или потерю экспрессии целевого антигена, где эти антигены представляют собой мишень для CAR изобретения.
«Аутоиммунное заболевание», как применено в настоящем документе, определяют как расстройство, которое возникает в результате аутоиммунного ответа. Аутоиммунное заболевание представляет собой результат несоответствующего ответа и гиперреакции на аутоантиген. Примеры аутоиммунных заболеваний среди прочего включают, без ограничений, болезнь Аддисона, очаговую алопецию, анкилозирующий спондилит, аутоиммунный гепатит, аутоиммунный паротит, болезнь Крона, сахарный диабет (тип 1), дистрофический буллезный эпидермолиз, эпидидимит, гломерулонефрит, болезнь Грейвса, синдром Гийена-Барре, болезнь Хашимото, гемолитическую анемию, системную красную волчанку, рассеянный склероз, злокачественную миастению, пузырчатку обыкновенную, псориаз, ревматический полиартрит, ревматоидный артрит, саркоидоз, склеродермию, синдром Шегрена, спондилоартропатии, тиреоидит, васкулит, витилиго, микседему, пернициозную анемию, язвенный колит.
Термин «аутологичный», как применен в настоящем документе, относится к любому материалу, полученному от того же индивидуума, которому он затем повторно будет введен. Например, T-клетки могут быть выделены от пациента, изменены генно-инженерными способами для экспрессии CAR и затем повторно введены пациенту.
Термин «заболевания, связанные с B-клетками», как применен в настоящем документе, включает иммунодефициты B-клеток, аутоиммунные заболевания и/или избыточную/неконтролируемую пролиферацию клеток, связанных с B-клетками (включая лимфомы и/или лейкемии). Примеры таких заболеваний, в которых для терапевтических подходов могут быть применены биспецифические CAR изобретения, включают без ограничений, системную красную волчанку (SLE), диабеты, ревматоидный артрит (RA), реактивный артрит, рассеянный склероз (MS), пузырчатку обыкновенную, целиакию, болезнь Крона, воспалительное заболевание кишечника, неспецифический язвенный колит, аутоиммунное заболевание щитовидной железы, сцепленную с Х-хромосомой агаммаглобулинемию, пре-B форму острого лимфобластного лейкоза, системную красную волчанку, вариабельный неклассифицируемый иммунодефицит, хронический лимфолейкоз, заболевания, связанные с изолированной недостаточностью IgA-типа и/или изолированной недостаточностью подклассов IgG-типа, В-клеточные лимфомы (лимфому Ходжкина и/или неходжкинскую лимфому), иммунодефицит с тимомой, транзиторную гипогаммаглобулинемию и/или гипер-IgМ-синдром, а также вирусно-опосредованные B-клеточные заболевания, такие как EBV-опосредованное лимфопролиферативное заболевание, и хронические инфекции, в патофизиологии которых принимают участие B-клетки.
Термин «гематоэнцефалический барьер» или «BBB» относится к физиологическому барьеру между периферическим кровообращением и мозгом и спинным мозгом, который образован плотными контактами в пределах плазматических мембран мозгового капиллярного эндотелия, создающего плотный барьер, что ограничивает транспорт молекул в мозг, даже очень маленьких молекул, таких как мочевина (60 дальтон). Гематоэнцефалический барьер в мозгу, барьер между кровью и спинным мозгом в спинном мозге и гематоретинальный барьер в сетчатке представляют собой смежные капиллярные барьеры в рамках центральной нервной системы (CNS), и в настоящем документе совместно называются «гематоэнцефалический барьер» или «BBB». BBB также охватывает барьер между кровью и спинномозговой жидкостью (сосудистое сплетение), где барьер скорее включает эпендимные клетки, а не капиллярные эндотелиальные клетки.
Термины «рак» и «раковый», как применен в настоящем документе, относятся к физиологическому состоянию или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Примеры рака включают, без ограничений B-клеточные лимфомы (лимфомы Ходжкина и/или неходжкинские лимфомы), опухоль мозга, рак молочной железы, рак толстой кишки, рак легких, гепатоцеллюлярный рак, рак желудка, рак поджелудочной железы, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, рак мочевыводящих путей, рак щитовидной железы, рак почки, карциному, меланому, рак головы и шеи, рак мозга и рак предстательной железы, включая без ограничений андроген-зависимый рак предстательной железы и андроген-независимый рак предстательной железы.
Термин «химерный антигенный рецептор» или «CAR» или «CARs», как применен в настоящем документе, относится к рекомбинантным рецепторам, которые привносят антиген-специфичность в цитотоксическую клетку, например, в T-клетки, NK-клетки и макрофаги. CARs изобретения могут включать, по меньшей мере, одну антиген-специфическую нацеливающую область (ASTR), внеклеточный спейсерный домен (ESD), трансмембранный домен (TM), один или несколько ко-стимулирующих доменов (CSD) и внутриклеточный сигнальный домен (ISD). В одном из воплощений, ESD и/или CSD не обязательны. В другом воплощении, CAR представляет собой биспецифический CAR, который специфичен к двум различным антигенам или эпитопам. После того как ASTR связывается специфически с целевым антигеном, ISD активирует внутриклеточный сигнал. Например, ISD может перенаправить специфичность и реактивность T-клетки в направлении выбранной цели неограниченным MHC образом, использую антиген-связывающие свойства антител. Неограниченное MHC распознавание антигена приводит к возникновению T-клеток, экспрессирующих CAR, способных распознавать антиген независимо от процессинга антигена, таким образом, обходя главный механизм ускользания опухоли от иммунологического надзора. Кроме того, при экспрессии в T-клетках, CARs преимущественно не димеризуются с альфа-и бета-цепями эндогенных рецепторов Т-клеток (TCR).
Термин «совместное экспрессирование», как применен в настоящем документе, относится к одновременной экспрессии двух или нескольких генов. Гены могут представлять собой нуклеиновые кислоты, кодирующие, например, один белок или химерный белок в виде одной полипептидной цепи. Например, CARs изобретения могут быть совместно экспрессированы с терапевтическим контролем (например, укороченным эпидермальным фактором роста (EGFRt)), в котором CAR кодируется первой полинуклеотидной цепью, а терапевтический контроль кодируется второй полинуклеотидной цепью. В одном воплощении, первая и вторая полинуклеотидные цепи связаны последовательностью нуклеиновой кислоты, которая кодирует расщепляемый линкер. В качестве альтернативы, CAR и терапевтический контроль кодируются двумя различным полинуклеотидами, которые не связаны между собой через линкер, но вместо этого кодируются, например, двумя различными векторами.
Термин «родственный», как применен в настоящем документе, относится к последовательности гена, которая эволюционно и функционально родственна между видами. Например, без ограничений, в геноме человека ген CD4 человека представляет собой ген, родственный 3d4 гену мыши, поскольку последовательности и структуры данных двух генов показывают, что они высоко гомологичны и оба гена кодируют белок, который функционирует в активации сигнальной T-клетки через ограниченное по MHC класс II распознавание антигена.
Термин «условно активный биологический белок» относится к варианту, или к мутанту, белка дикого типа, который будет в большей или в меньшей степени активен, чем родительский белок дикого типа, в одном или нескольких нормальных физиологических условиях. Данный условно активный белок также проявляет активность в отдельных участках организма и/или проявляет повышенную или сниженную активность в аномальных, или пермиссивных, физиологических условиях. Термин «нормальное физиологическое условие» как применен в настоящем документе относится к одному из следующего: температура, рН, осмотическое давление, осмоляльность, окислительный стресс, концентрация электролитов, концентрация небольших органических молекул, таких как глюкоза, молочная кислота, пируват, питательные компоненты, другие метаболиты и тому подобное, концентрация других молекул, таких как кислород, карбонат, фосфат и двуокись углерода, а также типы клеток и доступность питательных веществ, которые будут рассматриваться в пределах нормального диапазона в месте введения субъекту или в месте действия в ткани или органе субъекта
Термин «аномальное условие», как применен в настоящем документе, относится к условию, которое отличается от нормального допустимого диапазона для данного условия. В одном из аспектов, условно активный биологический белок практически неактивен при нормальном физиологическом условии, но активен при аномальном условии на уровне, который равен уровну или лучше уровня белка дикого типа, из которого он получен. Например, в одном из аспектов, эволюционировавший условно активный биологический белок практически неактивен при температуре тела, но активен при более низких температурах. В другом аспекте, условно активный биологический белок обратимо или необратимо инактивируется при нормальном физиологическом условии. В еще одном аспекте, белок дикого типа представляет собой терапевтический белок. В другом аспекте, условно активный биологический белок применяют в качестве лекарственного средства или терапевтического средства. В еще одном аспекте, белок более или менее активны в сильно оксигенированной крови, как, например, после прохождения через легкие, или в средах с более низким рН, обнаруженных в почках.
Термин «консервативные аминокислотные замены» относится к взаимозаменяемости остатков, имеющих сходные боковые цепи. Например, группа аминокислот, имеющих алифатические боковые цепи, - это глицин, аланин, валин, лейцин и изолейцин; группа аминокислот, имеющих алифатические-гидроксильные боковые цепи, - это серин и треонин; группа аминокислот, имеющих амид-содержащие боковые цепи, - это аспарагин и глутамин; группа аминокислот, имеющих ароматические боковые цепи, - это фенилаланин, тирозин и триптофан; группа аминокислот, имеющих основные боковые цепи, - это лизин, аргинин и гистидин; и группа аминокислот, имеющих серо-содержащие боковые цепи, - это цистеин и метионин. Предпочтительные консервативные замещаемые группы аминокислот: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин.
Термин «соответствует» применяют в настоящем документе для обозначения того, что полинуклеотидная последовательность гомологична (то есть идентична, не строго эволюционно родственна) всей или части полинуклеотидной последовательности сравнения, или, что полипептидная последовательность идентична полипептидной последовательности сравнения. В противоположность, термин «комплементарна» применяют в настоящем документе для обозначения того, что комплементарная последовательность гомологична всей или части полинуклеотидной последовательности сравнения. Для иллюстрации, нуклеотидная последовательность «TATAC» соответствует последовательности сравнения «TATAC» и комплементарна последовательности сравнения «GTATA».
Термин «ко-стимулирующий лиганд», как применен в настоящем документе, включает молекулу на антиген-презентирующей клетке (например, дендритная клетка, B-клетка и тому подобное), которая специфически связывается с родственной ко-стимулирующей молекулой на T-клетке, тем самым, обеспечивая сигнал, который, помимо обеспечения первичного сигнала, например, путем связывания комплекса TCR/CD3 с молекулой MHC, нагруженной пептидом, опосредует ответ T-клетки, включая, без ограничений, пролиферацию, активацию, дифференциацию и тому подобное. Ко-стимулирующий лиганд может включать, без ограничений, CD7, B7-1 (CD80), B7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцируемый ко-стимулирующий лиганд (ICOS-L), молекулу межклеточный адгезии (ICAM), CD30L, CD40, CD70, CD83, HLA-G, MICA, MICB, HVEM, бета-рецептор лимфотоксина, 3/TR6, ILT3, ILT4, HVEM, агонист или антитело, которое связывается с рецептором Toll-лиганда, и лиганд, который специфически связывается с B7-H3. Ко-стимулирующий лиганд также охватывает, в числе прочего, антитело, которое специфически связывается с ко-стимулирующей молекулой, презентируемой на T-клетке, такой как, без ограничений, CD27, CD28, 4-IBB, OX40, CD30, CD40, PD-1, ICOS, функционально-связанный антиген лимфоцитов-1 (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3 и лиганд, который специфически связывается с CD83.
Термин «ко-стимулирующая молекула», как применен в настоящем документе, относится к родственному партнеру по связыванию на T-клетке, который специфически связывается с ко-стимулирующим лигандом, тем самым опосредуя ко-стимулирующий ответ T-клеткой, такой как, без ограничений, пролиферацию. Ко-стимулирующие молекулы включают, без ограничений, молекулу MHC класса 1, BTLA и рецептор лиганда Toll.
Термин «ко-стимулирующий сигнал», как применен в настоящем документе, относится к сигналу, который в комбинации с первичным сигналом, таким как лигирование TCR/CD3, приводит к пролиферации T-клеток и/или к повышающей регуляции или понижающей регуляции ключевых молекул.
Термин «цитотоксическая клетка», как применен в настоящем документе, означает клетку, которая может повредить или уничтожить вторгшиеся микроорганизмы, опухолевые клетки или другие клетки пораженной ткани. Данный термин предназначен для включения природных клеток-киллеров (NK), активированных NK-клеток, нейтрофилов, T-клеток, эозинофилов, базофилов, B-клеток, макрофагов и лимфокин-активированных клеток-киллеров (LAK) в числе клеток других типов. Цитотоксическая клетка, через антитело, рецептор, лиганд или их фрагменты/производные, связывается с клеткой-мишенью с образованием стабильного комплекса, и стимулирует уничтожение цитотоксической клеткой клетки-мишени.
Цитотоксические клетки также могут включать другие иммунные клетки, обладающие литическими способностями в отношении опухоли, включая без ограничений естественные киллерные T-клетки (Heczey et al., “Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy,” Blood, vol. 124, pp.2824-2833, 2014) и гранулоциты. Кроме того, цитотоксические клетки могут включать иммунные клетки с фагоцитирующей способностью, включая без ограничений макрофаги и гранулоциты, клетки со свойствами стволовой клетки и/или клетки-предшественники, включая, без ограничений, гемопоэтические стволовые клетки/клетки-предшественники (Zhen et al., “HIV-specific Immunity Derived From Chimeric Antigen Receptor-engineered Stem Cells,” Mol Ther., vol. 23, pp.1358-1367, 2015), эмбриональные стволовых клетки (ESCs), стволовых клетки пуповинной крови и индуцированные плюрипотентные стволовых клетки (iPSCs) (Themeli et al. “New cell sources for T cell engineering and adoptive immunotherapy,” Cell Stem Cell. vol. 16, pp.357-366, 2015). Кроме того, цитотоксический клетки включают «синтетические клетки», такие как полученные из iPSC T-клетки (TiPSCs) (Themeli et al. “Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy,” Nat Biotechnol. vol.31, pp.928-933, 2013) или полученные из iPSC клетки NK.
Термин «эффективное для разрушения» количество относится к количеству фермента, которое необходимо для превращения, по меньшей мере, 50% субстрата, по сравнению с субстратом, не приводимым в контакт с ферментом.
Термин «направленое лигирование» относится к лигированию, в котором 5'-конец и 3'-конец полинуклеотида достаточно отличаются для того, чтобы ориентация предпочтительного лигирования была специфической. Например, в противном случае, необработанный и нерасщепленный ПЦР-продукт, который имеет два тупых конца, как правило, не будет иметь ориентации предпочтительного лигирования, при лигировании в вектор клонирования, расщепленный с получением тупых концов в своем сайте множественного клонирования; таким образом, направленное лигирование, как правило, не будут отображаться в данных обстоятельствах. Напротив, направленное лигирование, как правило, будет отображаться, если расщепленный ПЦР-продукт, имеющий 5' EcoR I-обработанный конец и 3' BamH I лигируют в вектор клонирования, который имеет сайт множественного клонирования, расщепленный с помощью EcoR I и BamH I.
Термин «заболевание, на которое направлены генетически модифицированные цитотоксические клетки», как применен в настоящем документе, охватывает нацеливание на любую клетку, вовлеченную каким-либо образом в любое заболевание, с помощью генетически модифицированных клеток изобретения, независимо от того, нацелены ли генетически модифицированные клетки на пораженные клетки или здоровые клетки для осуществления терапевтически благотворного результата. Генетически модифицированные клетки включают без ограничений генетически модифицированные T-клетки, NK-клетки и макрофаги. Генетически модифицированные клетки экспрессируют CARs изобретения, данные CARs могут быть направлены на любые антигены, которые экспрессируются на поверхности клеток-мишеней. Примеры антигенов, которые могут представлять собой мишени, включают без ограничений антигены, экспрессирующиеся на B-клетках; антигены, экспрессирующиеся на карциноме, саркоме, лимфомах, лейкемии, эмбрионально-клеточной опухоли и бластоме; антигены, экспрессирующиеся на различных иммунных клетках; и антигены, экспрессирующиеся на клетках, связанных с различными гематологическими заболеваниями, аутоиммунными заболеваниями и/или воспалительными заболеваниями. Другие антигены, которые могут представлять собой мишени, будут очевидны специалистам в данной области техники и к ним могут быть направлены CARs изобретения в связи с его альтернативными воплощениями.
Термины «генетически модифицированные клетки», «перенаправленные клетки», «генно-инженерные клетки» или «модифицированные клетки», как применены в настоящем документе, относятся к клеткам, которые экспрессируют CARs изобретения.
Термин «перетасовка ДНК» применяют в настоящем документе для обозначения рекомбинации между существенно гомологичными, но неидентичными, последовательностями, в некоторых воплощениях перетасовка ДНК может включать кроссовер посредством негомологичной рекомбинации, такую как через системы cer/lox и/или flp/frt и тому подобные. Перетасовка ДНК может быть случайной или неслучайной.
Термин «лекарственное средство» или «молекула лекарственного средства» относится к терапевтическому средству, включающему вещество, которое имеет благоприятный эффект на организм человека или животного, при введении в организм человека или животного. Предпочтительно, терапевтическое средство включает вещество, которое может лечить, вылечить или облегчить один или несколько симптомов, расстройств или аномальных состояний в организме человека или животного или улучшить самочувствие организма человека или животного.
«Эффективное количество» представляет собой количество условно активного биологического белка или фрагмента, которое эффективно в лечении или предупреждении состояния в живом организме, в который его вводят в течение некоторого периода времени, например, обеспечивая терапевтический эффект в течение требуемого интервала дозирования.
Термин «электролит», как применен в настоящем документе, определяет минерал в крови или в других жидкостях организма, который несет заряд. Например, в одном из аспектов, нормальное физиологическое условие и аномальное условие могут представлять собой условия «концентрации электролита». В одном из аспектов, концентрацию тестируемого электролита выбирают из одной или нескольких концентраций ионизированного кальция, натрия, калия, магния, хлорида, бикарбоната и фосфата. Например, в одном из аспектов, нормальный диапазон сывороточного кальция был равен от 8,5 до 10,2 мг/дл. В данном аспекте, аномальная концентрация сывороточного кальция может быть выбрана или из превышающей нормальный диапазон, или из недостигающей нормального диапазона, в другом примере, в одном из аспектов, нормальный диапазон сывороточного хлорида был равен 96-106 милиэквивалентов на литр (мэкв/л). В данном аспекте, аномальная концентрация сывороточного хлорида может быть выбрана или из превышающей нормальный диапазон, или из недостигающей нормального диапазона, в другом примере, в одном из аспектов, нормальный диапазон сывороточного магния был равен от 1,7-2,2 мг/дл. В данном аспекте, аномальная концентрация сывороточного магния может быть выбрана или из превышающей нормальный диапазон, или из недостигающей нормального диапазона, в другом примере, в одном из аспектов, нормальный диапазон сывороточного фосфора равен от 2,4 до 4,1 мг/дл. В данном аспекте, аномальная концентрация сывороточного фосфора может быть выбрана или из превышающей нормальный диапазон, или из недостигающей нормального диапазона. В другом примере, в одном из аспектов, нормальный диапазон натрия в сыворотке или в крови был равен от 135 до 145 мэкв/л. В данном аспекте, аномальная концентрация натрия в сыворотке или в крови может быть выбрана или из превышающей нормальный диапазон, или из недостигающей нормального диапазона. В другом примере, в одном из аспектов, нормальный диапазон калия в сыворотке или в крови был равен от 3,7 до 5,2 мэкв/л. В данном аспекте, аномальная концентрация в сыворотке или в крови калия может быть выбрана из или из превышающей нормальный диапазон, или из недостигающей нормального диапазона. В дополнительном аспекте, нормальный диапазон сывороточного бикарбоната был равен от 20 до 29 мэкв/л. В данном аспекте, аномальная концентрация бикарбоната в сыворотке или в крови может быть выбрана или из превышающей нормальный диапазон, или из недостигающей нормального диапазона. В другом аспекте, уровни бикарбоната могут быть применены для указания на нормальные уровни кислотности (pH), в крови. Термин «концентрация электролита» также может быть применен для обозначения условия, в особенности, электролита в жидкости ткани или организма, отличной от крови или плазмы. В этом случае, нормальное физиологическое условие считается клинически нормальным диапазоном для данной ткани или жидкости. В данном аспекте, аномальная концентрация электролита в ткани или жидкости может быть выбрана или из превышающей нормальный диапазон, или из недостигающей нормального диапазона.
Термин «эпитоп», как применен в настоящем документе, относится к антигенной детерминанте на антигене, таком как фермент-полипептид, с которой паратоп антитела, такого как фермент-специфического антитела, связывается. Антигенные детерминанты, как правило, состоят из химически активных поверхностных группировок молекул, таких как боковые цепи аминокислот или сахаров, и могут иметь специфические трехмерные структурные особенности, а также специфические характеристики заряда. Как применен в настоящем документе, термин «эпитоп» относится к той части антигена или другой макромолекулы, способной образовывать связывающее взаимодействие, которая взаимодействует с вариабельной областью связывающей части антитела. Как правило, такое связывающее взаимодействие проявляется в виде межмолекулярного контакта с одним или несколькими аминокислотными остатками в CDR.
Как применен в настоящем документе, термин «эволюция» или «эволюционирование», относится к одному или нескольким способам мутагенеза, используемым для создания нового полинуклеотида, кодирующего новый полипептид, данный новый полипептид сам по себе представляет собой усовершенствованную биологическую молекулу и/или способствует образования другой усовершенствованной биологической молекулы. В конкретном неограничивающем аспекте, настоящее раскрытие относится к формированию условно активных биологических белков из родительского белка дикого типа. В одном из аспектов, например, генетическое изменение относится к способу выполнения как нестохастической полинуклеотидной химеризации, так и нестохастического сайт-специфического точечного мутагенеза, раскрытого в публикации заявки на патент США 2009/0130718.В частности, настоящее раскрытие обеспечивает способы изменения условно активных биологических ферментов, которые демонстрируют сниженную активность в нормальных физиологических условиях по сравнению с родительской молекулой фермента дикого типа, но повышенную активность в одном или нескольких аномальных условиях по сравнению с антиген-специфической нацеливающей областью фермента дикого типа.
Термины «фрагмент», «производное» и «аналог», когда речь идет о полипептиде сравнения, включают полипептид, который сохраняет, по меньшей мере, одну биологическую функцию или активность, которая, по меньшей мере, по существу, такая же как функция полипептида сравнения. Кроме того, термины «фрагмент», «производное» или «аналог» иллюстрируются «про-формой» молекулы, такой как пробелок с низкой активностью, который может быть модифицирован расщеплением с получением зрелого фермента со значительно более высокой активностью.
Термин «ген», как применен в настоящем документе, означает сегмент ДНК, вовлеченный в продуцирование полипептидной цепи; он включает области, предшествующие и следующие за кодирующей областью (лидерная и трейлерная), а также промежуточные последовательности (интроны) между индивидуальными кодирующими сегментами (экзонами).
Термин «гетерологичный», как применен в настоящем документе, означает, что одна одноцепочечная последовательность нуклеиновой кислоты не способна гибридизоваться с другой одноцепочечной последовательностью нуклеиновой кислоты или ее комплементом. Таким образом, области гетерологии означают, что области полинуклеотидов или полинуклеотиды имеют области или участки в пределах их последовательности, которые не способны гибридизоваться с другой нуклеиновой кислотой или полинуклеотидом. Такие участки или области представляют собой, например, области мутаций.
Термин «гомологичные» или «гомеологичные», как применен в настоящем документе, означает, что одна одноцепочечная последовательность нуклеиновой кислоты может гибридизоваться с комплементарной одноцепочечной последовательностью нуклеиновой кислоты. Степень гибридизации может зависеть от ряда факторов, включая степень идентичности между последовательностями и условия гибридизации, такие как температура и концентрации солей, как будет обсуждаться в дальнейшем. Предпочтительно, область идентичности должна быть больше примерно 5 п.н. более предпочтительно, область идентичности больше должна быть больше 10 п.н.
Преимущества данного раскрытия распространяются на «промышленные применения» (или производственные процессы), термин, который применяют для включения применения собственно в коммерческой промышленности (или просто в промышленности), а также некоммерческих промышленных применений (например, медико-биологические исследования в некоммерческой организации). Соответствующие применения включают применения в областях диагностики, медицины, сельского хозяйства, производство и в научно-исследовательской деятельности.
Термин «иммунная клетка», как применен в настоящем документе, относится к клеткам иммунной системы млекопитающего, включая без ограничений антиген-презентирующие клетки, B-клетки, базофилы, цитотоксические T-клетки, дендритные клетки, эозинофилы, гранулоциты, хелперные T-клетки, лейкоциты, лимфоциты, макрофаги, тучные клетки, клетки памяти, моноциты, естественные клетки-киллеры, нейтрофилы, фагоциты, плазматические клетки и T-клетки.
Термин «иммунный ответ», как применен в настоящем документе, относится к иммунитету, включая без ограничений врожденный иммунитет, гуморальный иммунитет, клеточный иммунитет, иммунитет, воспалительный ответ, приобретенный (адаптивный) иммунитет, аутоиммунитет и/или гиперактивный иммунитет.
Термин «изолированный», как применен в настоящем документе, означает, что материал извлекают из его первоначального окружения (например, природное окружения, если это был природный материал). Например, природный полинуклеотид или фермент, присутствующий в живом животном не представляет собой изолированный материал, но тот же самый полинуклеотид или фермент, отделенный от некоторых или всех материалов, сосуществующих в природной системе, представляет собой изолированный материал. Такие полинуклеотиды могут представлять собой часть вектора и/или такие полинуклеотиды или ферменты могут представлять собой часть композиции, и по-прежнему оставаться изолированными в таком векторе или композиции, не представляя собой часть их природного окружения.
Термин «изолированная нуклеиновая кислота», как применен в настоящем документе, для определения нуклеиновой кислоты, например, молекулы ДНК или РНК, которая непосредственно не граничит с 5' и 3' фланкирующими последовательностями, с которыми она в норме непосредственно граничит, если присутствует в природном геноме организма, из которого была получена. Термин, таким образом, описывает, например, нуклеиновую кислоту, которая была встроена в вектор, такой как плазмидный или вирусный вектор; нуклеиновую кислоту, которая была встроена в геном гетерологичной клетки (или геном гомологичной клетки, но в сайте отличном от того, в котором она встречается в природе); и нуклеиновую кислоту, которая существует как отдельная молекула, например, фрагмент ДНК, полученный с помощью ПЦР-амплификации или рестрикции путем ферментативного расщепления, или молекула РНК, полученная с помощью in vitro транскрипции. Термин также описывает рекомбинантную нуклеиновую кислоту, которая образует часть гибридного гена, кодирующего дополнительные полипептидные последовательности, которые могут быть применены, например, при получении слитого белка.
Термин «лентивирус», как применен в настоящем документе, относится к роду семейства Retroviridae. Лентивирусы уникальны среди прочих ретровирусов, поскольку способны заражать непролиферирующие клетки; они могут доставлять значительное количество генетической информации в ДНК клеток-хозяев, поэтому они представляют собой один из наиболее эффективных способов доставки вектора, доставляющего ген. HIV, SIV и FIV представляют собой все примеры лентивирусов. Векторы, полученные из лентивирусов, представляют собой средства достижения значительных уровней переноса генов in vivo.
Термин «лиганд», как применен в настоящем документе, относится к молекуле, такой как случайный пептид или последовательность вариабельного сегмента, которая распознается определенным рецептором. Специалисту в данной области техники понятно, что молекула (или макромолекулярная комплекс) может представлять собой и рецептор, и лиганд. В общем, партнер по связыванию, имеющий меньшую молекулярную массу, обозначают как лиганд и партнер по связыванию, имеющий большую молекулярную массу, обозначают как рецептор.
Термин «лигирование», как применен в настоящем документе, относится к способу образования фосфодиэфирных связей между двумя двухцепочечными фрагментами нуклеиновой кислоты (Sambrook et al. (1982). Molecular Cloning: A Laboratory Manual. Cold Spring Harbour Laboratory, Cold Spring Harbor, NY. p. 146; Sambrook et al. Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor Laboratory Press, 1989). Если иное не предусмотрено, то лигирование может быть осуществлено с применением известных буферов и условий с 10 единицами T4 ДНК-лигазы («лигазы») на 0,5 микрограмм приблизительно эквимолярных количеств фрагментов ДНК, которые требуется лигировать.
Термины «линкер» или «спейсер», как применен в настоящем документе, относится к молекуле или группе молекул, которая соединяет две молекулы, такие как ДНК-связывающий белок и случайный пептид, и служит для того, чтобы расположить две молекулы в предпочтительной конфигурации, например, так чтобы случайный пептид мог бы связываться с рецептором с минимальными стерическими помехам со стороны ДНК-связывающего белка. Термин «линкер» (L) или «линкерный домен» или «линкерная область», как применен в настоящем документе, относится к олиго-или полипептидной области, равной от примерно 1 до 100 аминокислот в длину, которая соединяет любые домены/области CARs изобретения. Линкеры могут состоять из гибких остатков, таких как глицин и серин, таким образом, что прилегающие домены белка могут свободно перемещаться относительно друг друга. Более длинные линкеры могут быть применены, если желательно гарантировать то, что два прилегающих домена стерически не мешают друг другу. Линкеры могут быть расщепляемыми или нерасщепляемыми. Примеры расщепляемых линкеров включают 2 A линкеры (например, T2A), 2A-подобные линкеры или функционально им эквивалентные и их комбинации. В некоторых воплощениях, линкеры включают пикорнавирусный 2A-подобный линкер, последовательности CHYSEL свиного тешовируса (P2A), вирус Thosea asigna (T2A) или их комбинации, варианты и функциональные эквиваленты. Другие линкеры будут очевидны специалистам в данной области техники и могут быть применены в связи с альтернативными воплощениями изобретения.
Термин «дисплей на поверхности клеток млекопитающих», как применен в настоящем документе, относится к методике, посредством которой белок или антитело, или часть антитела, экспрессируется и представлено на поверхности клеток-хозяев млекопитающих для целей скрининга; например, с помощью скрининга на специфический антиген, связывающийся с помощью комбинации магнитных бусин и сортировки клеток с активированной флуоресценцией. В одном из аспектов, векторы экспрессии млекопитающих применяют для одновременной экспрессии иммуноглобулинов и как секретируемую, и как связанную с клеточной поверхностью форму, как описано у DuBridge et al. US 2009/0136950. В другом аспекте, применяют методики для скрининга вирусного вектора, кодирующего библиотеку антител или фрагменты антитела, который обнаруживается на клеточных мембранах при экспрессии в клетках как описано у Gao et al. US 2007/0111260. Известен полный дисплей IgG на поверхности клеток млекопитающих. Например, Akamatsuu et al. разработали вектор для дисплея на поверхности клеток млекопитающих, подходящий для прямого выделения молекул IgG на основе аффинности связывания их антигенов и биологической активности. Применяя эписомальный вектор, полученный из вируса Эпштейна-Барр, библиотеки антител были представлены в виде полных молекул IgG на поверхности клеток, и был проведен скрининг на связывание специфического антигена с помощью комбинации магнитных бусин и сортировки клеток с активированной флуоресценцией. Плазмиды, кодирующие антитела с требуемыми характеристиками связывания, извлекали из отсортированных клеток и переводили в форму, пригодную для производства растворимых IgG. Смотри, работу Akamatsuu et al. J. Immunol. Methods, vol. 327, pages 40-52, 2007. Ho et al. применял 293T-клетки почек эмбрионов человека, которые широко применяют для временной экспрессии белка для дисплея на поверхности клеток одноцепочечного Fv антитела для созревания аффинности. Клетки, экспрессирующие редкое мутантное антитело с более высоким сродством, были обогащены в 240 раз за один проход клеточной сортировки из большого избытка клеток, экспрессирующих WT-антитело с немного меньшей аффинностью. Кроме того, высоко обогащенный мутант получали с повышенной аффинностью связывания для CD22 после однократного отбора комбинаторной библиотеки, рандомизируя по внутренним точкам доступа антител. Смотри работу Ho et al. Ho et al. “Isolation of anti-CD22 Fv with high affinity by Fv display on human cells,” Proc Natl Acad Sci U S A, vol. 103, pages 9637-9642, 2006.
Также могут быть применены B-клетки, специфические на антиген. Такие B-клетки могут быть непосредственно изолированы из мононуклеарных клеток периферической крови (PBMC) людей-доноров. Из данного пула B-клеток создают библиотеки рекомбинантных, антиген-специфических одноцепочечних Fv (scFv), и проводят скрининг с помощью дисплея на поверхности клеток млекопитающих с применением системы экспрессии вируса Синдбис. Вариабельные области (VRs) тяжелых цепей (HCs) и легких цепей (LCs) могут быть изолированы из положительных клонов и рекомбинантных полностью человеческих антител, полученных в виде полных IgG или Fab-фрагментов. Таким образом, могут быть изолированы несколько гипермутированных высокоаффинных антител, связывающих вирусоподобную частицу (VLP) QP, модельный вирусный антиген, а также антитела, специфические для никотина. Смотри работу Beerli et al. “Isolation of human monoclonal antibodies by mammalian cell display,” Proc Natl Acad Sci U S A, vol. 105, pages 14336-14341, 2008.
В настоящем изобретении также может быть применен дрожжевой дисплей на поверхности клеток, например, смотри работу Kondo and Ueda, “Yeast cell-surface display-applications of molecular display,” Appl. Microbiol. Biotechnol. vol. 64, pages 28-40, 2004, в которой описана, например, система конструирования клеточной поверхности с помощью дрожжей Saccharomyces cerevisiae. Несколько типичных диплейных систем для экспрессии в дрожжах S. cerevisiae описаны в работе Lee et al, “Microbial cell-surface display,” TRENDS in Bitechnol. vol. 21, pages 45-52, 2003, а также в работе Boder and Wittrup, "Yeast surface display for screening combinatorial polypeptide libraries,” Nature Biotechnol. vol. 15, pages 553, 1997.
Термин «производство», как применен в настоящем документе, относится к получению белка в количестве, достаточном для проведения тестирования терапевтического белка, по меньшей мере, в Фазе I клинических испытаний, или в достаточном количестве для получения разрешения для диагностического белка от надзорного органа.
Как применен в настоящем документе, термин «микроокружение» означает любую часть или область ткани или организма, которая имеет постоянное или временное, физическое или химическое отличие от других областей ткани или других областей организма.
Как применен в настоящем документе, термин «молекулярная характеристика, которая будет эволюционирована» включает отсылку к молекулам, включающим полинуклеотидную последовательность, молекулам, включающим полипептидную последовательность, и молекулам, включающим частично полинуклеотидную последовательность и частично полипептидную последовательность. В особенности соответствующие - но никаким образом не ограничивающие - примеры молекулярных характеристик, которые будут изменены, включают активности белка в конкретных условиях, таких как относящихся к температуре; солености; осмотическому давлению; pH; окислительному стрессу и к концентрации глицерола, DMSO, детергента и/или любых других молекулярных частиц, с которыми осуществляется контакт в реакционной среде. Дополнительные в особенности соответствующие - но никаким образом не ограничивающие - примеры молекулярных характеристик, которая будут изменены, включают стабильность - например, количество остаточной молекулярной характеристики, которое присутствует по истечении заданного времени воздействия в указанной среде, такой как может возникнуть в процессе хранения.
Термин «мутации», как применен в настоящем документе, означает изменения в последовательности дикого типа последовательности нуклеиновой кислоты или изменения в последовательности пептида. Такие мутации могут представлять собой точечные мутации, такие как транзиции или трансверсии. Мутации могут представлять собой делеции, вставки или дупликации.
Термин «мультиспецифическое антитело», как применен в настоящем документе, представляет собой антитело, имеющее аффинности связывания, по меньшей мере, для двух различных эпитопов. Мультиспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, F(ab')2-биспецифические антитела). Сконструированные антитела могут связываться с двумя, тремя или с несколькими (например, с четырьмя) антигенами (смотри, например, US 2002/0004587 Al). Одно условно активное антитело может быть сконструировано как мультиспецифическое, или две антитела могут быть сконструированы так, что будут включать гетеродимер, который связывается с двумя антигенами. Мультиспецифические антитела также могут быть мультифункциональными.
Как применена в настоящем документе, вырожденная «N,N,G/T» нуклеотидная последовательность представляет 32 возможных триплета, где «N» может быть A, C, G или T.
Термин «природный», как применен в настоящем документе применительно к объекту, относится к тому факту, что объект может быть найден в природе. Например, полипептидная или полинуклеотидная последовательность, которая присутствует в организме (включая вирусы), которая может быть изолирована из источника в природе и которая не была намеренно модифицирована человеком в лаборатории, представляет собой природную последовательность. В общем, термин природный относится к объекту, как присутствует в непатологическом (не имеющем заболевания) индивидууме, таком, какой будет типичным для данного вида.
Как применено в настоящем документе, «нормальные физиологические условия», или «рабочие условия в диком типе», - это такие условия температуры, pH, осмотического давления, осмоляльности, окислительного стресса и концентрации электролита, которые будут рассматриваться в рамках нормального диапазона в месте введения, или в месте действия, у субъекта.
Как применен в настоящем документе, термин «молекула нуклеиновой кислоты» включает, по меньшей мере, одно основание или одну пару оснований, в зависимости от того, является ли она одноцепочечной или двухцепочечной, соответственно. Кроме того, молекула нуклеиновой кислоты может принадлежать исключительно или в составе химеры к любой группе нуклеотид-содержащих молекул, примером чему служат, без ограничений, следующие группы молекул нуклеиновой кислоты: РНК, ДНК, геномные нуклеиновые кислоты, негеномные нуклеиновые кислоты, природные и неприродные нуклеиновые кислоты и синтетические нуклеиновые кислоты. Это включает, путем не ограничивающего примера, нуклеиновые кислоты, связанных с любой органеллой, такой как митохондрии, рибосомальную РНК и молекулы нуклеиновой кислоты, включающие в составе химеры один или несколько компонентов, которые не представляют собой природные компоненты, вместе с природными компонентами.
Кроме того, «молекула нуклеиновой кислоты» может содержать частично один или несколько ненуклеотидных компонентов, примером чему служат, без ограничений, аминокислоты и сахара. Таким образом, путем примеров, но без ограничений, рибозим, который частично представляет собой нуклеотид, а частично белок, рассматривают как «молекулу нуклеиновой кислоты».
Термины «последовательность нуклеиновой кислоты, кодирующая» или «ДНК, кодирующая последовательность» или «нуклеотидная последовательность, кодирующая», как применен в настоящем документе, относится к последовательности ДНК, которая транскрибируется и транслируется в фермент при помещении под контроль соответствующих регуляторных последовательностей, таких как промоторы. «Промотор» представляет собой регуляторную область ДНК, способную к связыванию РНК-полимеразы в клетке и инициации транскрипции последовательности, кодируемой по ходу транскрипции (в 3'-направлении). Промоторы представляют собой часть последовательности ДНК. Данная область последовательности имеет старт-кодон на своем 3'-конце. Последовательности промоторов включают минимальное число оснований, где элементы, необходимые для инициирования транскрипции, находятся на уровнях выше фона. Однако после связывания последовательности с РНК-полимеразой, и инициации транскрипции на старт-кодоне (3'-конец с промотором), транскрипция протекает ниже по ходу в 3'-направлении. В рамках последовательности промотора был обнаружен сайт инициации транскрипции (обычно определяемый путем картирования с нуклеазой SI), а также белок-связывающие домены (консенсусные последовательности), ответственные за связывание РНК-полимеразы.
Термин «олигонуклеотид» (или в качестве синонима «олиго») относится или к одноцепочечному полидезоксинуклеотиду, или к двум комплементарным полидезоксинуклеотидным нитям, которые могут быть синтезированы химически. Такие синтетические олигонуклеотиды могут иметь или могут не иметь 5'-фосфат. Такие олигонуклеотиды не могут быть лигированы с другим олигонуклеотидом без добавления фосфата с ATP в присутствии киназы. Синтетический олигонуклеотид будет лигироваться с фрагментом, который не был дефосфорилирован.
Как применен в настоящем документе, термин «функционально связанный» относится к увязыванию полинуклеотидных элементов в функциональные взаимоотношения. Нуклеиновая кислота «функционально связана», когда она помещена в функциональные взаимоотношения с другой последовательностью нуклеиновой кислоты. Например, промотор или энхансер функционально связаны с кодирующей последовательностью, если это влияет на транскрипцию кодирующей последовательности. Функционально связанный означает, что, будучи связанными, последовательности ДНК обычно представляют собой непрерывные последовательности, и, где, это необходимо, соединяют две кодирующие области белка, непрерывно и в рамке считывания.
Кодирующая последовательность «функционально связана с» другой кодирующей последовательностью, если РНК-полимераза будет транскрибировать две кодирующие последовательности в единую мРНК, которая затем будет транслирована в полипептид, имеющий аминокислоты, полученные из обеих кодирующих последовательностей. Кодирующие последовательности не должны быть смежными друг с другом, до тех пор, пока экспрессированные последовательности, в конечном счете, не будут процессированы для получения требуемого белка.
Как применен в настоящем документе, термин «родительский набор полинуклеотидов» представляет собой набор, включающий один или несколько различных видов полинуклеотидов. Как правило, данный термин применяют по отношению к набору полинуклеотидов потомства, который предпочтительно получают с помощью мутагенеза родительского набора, в случае которого термины «родительский», «стартовый» и «матрица» применяют взаимозаменяемо.
Термин «пациент» или «субъект», относится к животному, например, к млекопитающему, такому как человек, который представляет собой объект лечения. Субъект, или пациент, может быть как мужчиной, так и женщиной.
Как применен в настоящем документе, термин «физиологические условия» относится к температуре, pH, осмотическому давлению, ионной силе, вязкости и подобным биохимическим параметрам, которые совместимы с жизнеспособным организмом, и/или, которые, как правило, существуют внутриклеточно в жизнеспособной культивируемой дрожжевой клетке или клетке млекопитающего. Например, внутриклеточные условия в дрожжевой клетке, выращенной в типичных условиях лабораторного культивирования, представляют собой физиологические условия. Подходящие in vitro реакционные условия для in vitro транскрипционных коктейлей, в общем, представляют собой физиологические условия. В общем, in vitro физиологические условия включают 50-200 мМ NaCl или KC1, pH 6,5-8,5, 20-45 градусов C и 0,001-10 мМ двухвалентный катион (например, Mg++, Ca++); предпочтительно, примерно 150 мМ NaCl или KC1, pH 7,2-7,6, 5 мМ двухвалентный катион, и часто включают 0,01-1,0 процент неспецифического белка (например, бычий сывороточный альбумин (BSA)). Часто может быть представлен неионогенный детергент (Tween, NP-40, Triton X-100), как правило, примерно от 0,001 до 2%, как правило, 0,05-0,2% (объем/объем). Конкретные водные условия могут быть выбраны практиком в соответствии с общепринятыми способами. Для общего руководства, следующие буферные водные условия могут быть применимы: 10-250 мМ NaCl, 5-50 мМ Tris HC1, pH 5-8, с необязательным добавлением двухвалентного катиона(двухвалентных катионов) и/или хелаторов металлов и/или неионных детергентов и/или мембранных фракций и/или противовспенивающих средств и/или сцинтилляторов. Нормальные физиологические условия относится к условиям температуры, pH, осмотического давления, осмоляльности, окислительного стресса и концентрации электролита in vivo у пациента или субъекта в месте введения, или месте действия, которые будут рассматриваться в рамках нормального диапазона у пациента.
Стандартное соглашение (от 5' к 3') применяют в настоящем документе для описания последовательности двухцепочечных полинуклеотидов.
Термин «популяция», как применен в настоящем документе, означает набор компонентов, таких как полинуклеотиды, части полинуклеотидов или белки. «Смешанная популяция» означает набор компонентов, которые принадлежат к тому же семейству нуклеиновых кислот или белков (то есть, родственные), но которые различаются по своей последовательности (то есть, не идентичные) и, следовательно, по своей биологический активности.
Молекула, имеющая «про-форму», относится к молекуле, которая претерпевает любое сочетание из одной или нескольких ковалентных и нековалентных химических модификаций (например, гликозилирование, протеолитическое расщепление, димеризация или олигомеризация, индуцированное температурой или pH-индуцированное конформационное изменение, ассоциация с кофактором и т.п.) на пути к достижению более зрелой молекулярной формы, имеющей отличие в свойствах (например, увеличение в активности) по сравнению с исходной про-формой молекулы. Если две или несколько химических модификаций (например, два протеолитических расщепления или протеолитическое расщепление и дегликозилирование) можно отличить на пути к получению зрелой молекулы, то исходная молекула-предшественник может быть названа «пре-про-форма» молекулы.
Как применен в настоящем документе, термин «рецептор» относится к молекуле, которая обладает аффинностью в отношении данного лиганда. Рецепторы могут представлять собой природные или синтетические молекулы. Рецепторы могут быть применены в неизмененном условии или в виде агрегатов с другими видами молекул. Рецепторы могут быть связаны, ковалентно или нековалентно, со связывающимся участником, либо непосредственно, или через специфическое связывающее вещество. Примеры рецепторов включают, без ограничений, антитела, включая моноклональные антитела и антисыворотки, взаимодействующие со специфическими антигенными детерминантами (такими как на вирусах, клетках или других материалах), клеточные мембранные рецепторы, сложные углеводы и гликопротеины, ферменты и рецепторы гормонов.
Термин «восстановительная реассортация», как применен в настоящем документе, относится к увеличению молекулярного разнообразия, которое нарастает в результате делеции (и/или вставки), событий, опосредованных повторными последовательностями.
Термин «сайт рестрикции», как применен в настоящем документе, относится к распознаванию последовательности, что необходимо для проявления действия фермента рестрикции, и включает сайт каталитического расщепления. Следует понимать, что сайт расщепления может или не может содержаться в рамках части сайта рестрикции, которая включает последовательность с низкой неопределенностью (то есть последовательность, содержащую основную детерминанту частоты встречаемости сайта рестрикции). Если говорят, что фермент (например, фермент рестрикции) «расщепляет» полинуклеотид, то подразумевается, что фермент рестрикции катализирует или способствует расщеплению полинуклеотида.
Как применен в настоящем документе, термин «одноцепочечное антитело» относится к полипептиду, включающему VH-домен и VL-домен, связанные полипептидной связью, в общем, связанные через спейсерный пептид, и, который может включать дополнительные аминокислотные последовательности амино-и/или карбокси-концах. Например, одноцепочечное антитело может включать привязывающий сегмент для присоединения к кодирующему полинуклеотиду. В качестве примера, scFv представляет собой одноцепочечное антитело. Одноцепочечные антитела, в общем, представляют собой белки, состоящие из одного или нескольких полипептидных сегментов, по меньшей мере, из 10 непрерывных аминокислот, в основном кодируемых генами суперсемейства иммуноглобулинов (например, смотри, The Immunoglobulin Gene Superfamily, A. F. Williams and A. N. Barclay, in Immunoglobulin Genes, T. Honjo, F. W. Alt, and THE. Rabbits, eds. (1989) Academic press: San Diego, Calif. pp. 361-368) чаще всего кодируется геном последовательности тяжелой цепи или легкой цепи грызуна, примата, не представляющего собой человека, птиц, свиней, коров, овец, коз или человека. Функциональное одноцепочечное антитело, в общем, содержит существенную часть продукта гена суперсемейства иммуноглобулинов с тем, чтобы сохранить свойство связывания со специфической молекулой-мишенью, как правило, с рецептором или антигеном (эпитопом).
Члены пары молекул (например, пара антитело-антиген и пара лиганд-рецептор) называют «специфически связанными» друг с другом, если они связываются друг с другом с большей аффинностью, чем с другими, неспецифическими молекулами. Например, антитело, выработанное против антигена, с которым оно связывается более эффективно, чем с неспецифическим белком, может быть описано как специфически связывающееся с антигеном.
Термин «стимуляция», как применен в настоящем документе, означает первичный ответ, индуцированный путем связывания стимулирующей молекулы (например, комплекса TCR/CD3) с его родственным лигандом, тем самым опосредующий событие трансдукции сигнала, такого как, без ограничений, сигнала трансдукции через комплекс TCR/CD3. Стимуляция может опосредовать измененную экспрессию определенных молекул, таких как понижающая регуляция TGF-β и/или реорганизация структуры цитоскелета и тому подобное.
Термин «стимулирующая молекула», как применен в настоящем документе, означает молекулу на T-клетке, которая специфически связывается с родственным стимулирующим лигандом, присутствующим на антиген-презентирующей клетке.
Термин «стимулирующий лиганд», как применен в настоящем документе, означает лиганд, который если присутствует на антиген-презентирующей клетке (например, дендритной клетке, B-клетке и тому подобном), может специфически связываться с родственным связывающим партнером (обозначенным в настоящем документе как «стимулирующая молекула») на T-клетке, тем самым опосредуя первичный ответ T-клеткой, включающий, без ограничений, активацию, инициация иммунного ответа, пролиферацию и тому подобное. Стимулирующие лиганды хорошо известны в данной области техники и охватывают, в числе прочего, молекулу MHC класса I, нагруженную пептидом, анти-CD3 антитело, суперагонист анти-CD28 антитела и суперагонист анти-CD2 антитела.
Термин «клетка-мишень», как применен в настоящем документе, относится к клеткам, которые вовлечены в заболевание и на которые могут быть нацелены генетически модифицированные цитотоксические клетки изобретения (включая без ограничений, генетически модифицированные T-клетки, NK-клетки и макрофаги). Другие клетки-мишени будут очевидны специалистам в данной области техники и могут быть применены в связи с альтернативными воплощениями изобретения.
Термины «T-клетка» и «T-лимфоцит» взаимозаменяемы, и в настоящем документе их применяют в качестве синонимов. Примеры включают, без ограничений, наивные T-клетки, центральные T-клетки памяти, эффекторные T-клетка памяти и их комбинации.
Термин «трансдукция», как применен в настоящем документе, относится к введению чужеродной нуклеиновой кислоты в клетку с помощью вирусного вектора. Термин «трансфекция», как применен в настоящем документе, относится к введению чужеродной нуклеиновой кислоты в клетку с помощью технологии рекомбинантных ДНК. Термин «трансформация» означает введение «чужеродного» (то есть внешнего или экстраклеточного) гена, последовательности ДНК или РНК в клетку-хозяина, таким образом, что клетка-хозяин будет экспрессировать введенные ген или последовательность с получением требуемые вещество, таких как белок или фермент, кодируемый введенным геном или последовательностью. Введенный ген или последовательность также могут быть названы «клонированным» или «чужеродным» геном или последовательностью, могут включать регуляторную или контрольную последовательности, такие как старт-, стоп-, промоторная, сигнальная, секреторная или другие последовательности, используемые генетическим механизмом клетки. Ген или последовательность могут включать нефункциональные последовательности или последовательности с неизвестной функцией. Клетка-хозяин, который получает и экспрессирует введенную ДНК или РНК «трансформируется» и представляет собой «трансформант» или «клон». ДНК или РНК, введенная в клетку-хозяина, может поступить из любого источника, включая клетки того же рода или вида, к которым принадлежат клетки-хозяева, или клетки другого рода или вида.
Термин «лечение» включает: (1) предупреждение или задержку появления клинических симптомов статуса, расстройства или состояния, развивающегося в животном, которые могут быть затронуты или предрасположены к статусу, расстройству или состоянию, но еще не испытывает или проявляют клинических или субклинических симптомов статуса, расстройства или состояния; (2) ингибирование статуса, расстройства или состояния (то есть, купирование, ослабление или задержка развития заболевания, или их рецидива в случае поддерживающего лечения, по меньшей мере, одного их клинического или субклинического симптома); и/или (3) облегчение состояния (то есть, приведение к ремиссии статуса, расстройства или состояния или, по меньшей мере, одного из их клинических или субклинических симптомов). Польза пациенту, получающему лечение, должна быть либо была статистически значимой или, по меньшей мере, заметной для пациента или лечащего врача.
Термин «опухоль», как применен в настоящем документе, относится ко всякому неопластическому росту и пролиферации клеток, как злокачественных, так и доброкачественных, и ко всем предраковым и раковым клеткам и тканям.
Как применен в настоящем документе, термин «микроокружение опухоли» относится к любому и ко всем элементам окружения опухоли, включая элементы, которые создают структурное и/или функциональное окружение, позволяющее злокачественному процессу выживать и/или расширяться и/или распространяться.
Как применен в настоящем документе, термин «вариабельный сегмент» относится к части образующегося пептида, которая включает случайную, псевдослучайную последовательность или определенную кернал (kernel) последовательность. Термин «вариабельный сегмент» относится к части возникающего пептида, которая включает случайную псевдослучайную последовательность или определенную кернал последовательность. Вариабельный сегмент может включать как вариантные и инвариантные положения остатков, и степень вариации остатков в вариантных положениях остатка может быть ограничена: Оба варианта выбирают по усмотрению практика. Как правило, вариабельные сегменты имеют в длину примерно от 5 до 20 аминокислотных остатков (например, от 8 до 10), хотя вариабельные сегменты могут быть длиннее и могут включать части антител или белки-рецепторы, таких как фрагмент антитела, белок, связывающий нуклеиновую кислоту, белок-рецептор и тому подобное.
Термин «вектор», «клонирующий вектор» и «вектор экспрессии», как применен в настоящем документе, относится к носителю, с помощью которого полинуклеотидную последовательность (например, чужеродный ген) можно ввести в клетку-хозяина, для того чтобы трансформировать хозяина и вызвать экспрессию (например, транскрипцию и трансляцию) введенной последовательности. Векторы включают плазмиды, фаги, вирусы и т.п.
Как применен в настоящем документе, термин «дикого типа» означает, что полинуклеотид не включает никаких мутаций. «Белок дикого типа», «дикого типа белок», «биологический белок дикого типа» или «дикого типа биологический белок», относится к белку, который может быть изолирован из природы, который будет активен на уровне активности, обнаруживаемой в природе, и будет включать аминокислотную последовательность, обнаруживаемую в природе. Термины «родительская молекула» и «целевой белок» также относятся к белку дикого типа. «Белок дикого типа» предпочтительно обладает некоторыми требуемыми свойствами, такими как более высокая аффинность связывания, или энзиматическая активность, который может быть получен с помощью скрининга библиотеки белков на требуемые свойства, включая лучшую стабильность при различных температурах или pH окружения, или усовершенствованные селективность и/или растворимость.
Термин «рабочий», как применен, например, в словосочетнии «рабочий образец» - это просто образец, с которым работают. Аналогично, например, «рабочая молекула» представляет собой молекулу, с которой работают.
Осуществление изобретения
Для иллюстративных целей, принципы настоящего изобретения будут описаны с отсылками к различным типичным воплощениям. Хотя определенные воплощения изобретения конкретно описаны в настоящем документе, специалист в данной области техники легко поймет, что одинаковые принципы в равной степени применимы к другим системам и способам и могут быть применены в других системах и способах. Прежде чем подробно объяснять раскрытые воплощения настоящего изобретения, следует понимать, что изобретение не ограничено в своем приложении деталями любого, в особенности, приведенного воплощения. Кроме того, терминология, примененная в настоящем документе, предназначена для целей описания, а не ограничения. Кроме того, хотя определенные способы описаны с отсылкой к стадиям, которые присутствуют в настоящем документе в определенном порядке, во многих случаях, данные стадии могут быть выполнены в любом порядке, как может быть оценено специалистом в этой области техники; поэтому новый способ не ограничен, в особенности, последовательностью стадий, раскрытых в настоящем документе.
Следует отметить, что, как применено в настоящем документе, и в прилагаемой формуле изобретения, формы единственного числа включают отсылки на множественное число, если контекст ясно не указывает на обратное. Кроме того, в настоящем документе термины «один или нескольких» и «по меньшей мере, один» могут быть применены взаимозаменяемо. Термины «включающий», «включая», «имеющий» и «сконструированный из» также могут быть применены взаимозаменяемо.
Настоящее раскрытие направлено на химерный антигенный рецептор (CAR) для связывания с целевым антигеном, включающий, по меньшей мере, одну антиген-специфическую нацеливающую область, полученную в результате эволюционирования белка дикого типа или его домена и имеющую, по меньшей мере, одно из следующего: (a) снижение в активности при анализе в нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена, и (b) увеличение в активности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена; трансмембранный домен; и внутриклеточный сигнальный домен. В некоторых воплощениях, химерный антигенный рецептор дополнительно включает внеклеточный спейсерный домен или, по меньшей мере, один ко-стимулирующий домен.
CARs настоящего изобретения имеют, по меньшей мере, одно из следующего: (1) их аффинность с целевым антигеном обратимо или необратимо снижена при нормальном физиологическом условии, и (2) повышенную аффинность, по сравнению с тем же CAR без условно активной антиген-специфической нацеливающей области. Данные CARs могут направлять цитотоксические клетки в участок заболевания, где имеет место аномальное условие, такой как микроокружение опухоли или синовиальная жидкость. В результате данных свойства, CARs может преимущественно направлять цитотоксические клетки в участок заболевания, из-за их низкой аффинности для нормальной ткани. Такие CARs могут значительно уменьшать побочные эффекты и позволяют применять более высокие дозы терапевтических средств, которые предполагается применять для увеличения терапевтической эффективности. CARs в особенности ценны для разработки новых терапевтических средств, которые должны находится внутри субъекта в течение коротких или ограниченных периодов времени. Примеры полезных приложений включают систематические лечения высокими дозами, а также локализованные лечения в высоких концентрациях.
Химерный антигенный рецептор может включать антиген-специфическую нацеливающую область, у которой снижена аффинность связывания с целевым антигеном в нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена.
Химерный антигенный рецептор может включать антиген-специфическую нацеливающую область, у которой увеличена активность при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена и снижена аффинность связывания с целевым антигеном в нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена.
В любом из вышеперечисленных химерных антигенных рецепторов антиген-специфическая нацеливающая область также может иметь увеличение в селективности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена.
Молекула CAR включает линкер для соединения двух антиген-специфических нацеливающих областей (фиг. 1). Линкер ориентирует две антиген-специфические нацеливающие области таким образом, чтобы две антиген-специфические нацеливающие области на CAR-T-клетках демонстрировали улучшенные или оптимальные активности при связывании с целевым антигеном (Jensen et al. “Design and implementation of adoptive therapy with chimeric antigen receptor-modified T cells,” Immunol Rev. vol. 257, pp. 127-144, 2014). Линкер, таким образом, предпочтительно способен принимать специфическую конформацию, которая обеспечивает улучшенное или оптимальное связывание двух антиген-специфических нацеливающих областей с целевым антигеном, тем самым повышая эффективность CAR-T клеток.
В некоторых воплощениях, линкер может представлять собой тандемные повторы Gly-Ser длиной в 18-25 аминокислот (Grada, “TanCAR: A Novel Bispecific Chimeric Antigen Receptor for Cancer Immunotherapy,”Molecular Therapy Nucleic Acids, vol. 2, e105, 2013). Этот гибкий линкер способен принимать множество различных конформаций для улучшенной или оптимальной презентации двух антиген-специфических нацеливающих областей связывания с целевым антигеном.
В некоторых воплощениях, линкер способен принимать различные конформации при нормальном физиологическом условии и при аномальном условии. В особенности, линкер имеет первую конформацию при аномальном условии, которая представляет собой улучшенную или оптимальную конформацию для презентации двух антиген-специфических нацеливающих областей связывания с целевым антигеном, в то время как тот же линкер имеет вторую конформацию при нормальном физиологическом условии, которая менее эффективна для презентации двух антиген-специфических нацеливающих областей для связывания с целевым антигеном, чем первая конформация линкера в аномальном условии. Такой линкер может быть назван «условным линкером», который позволяет двум антиген-специфическим нацеливающим областям связываться с целевым антигеном с более высокой связывающей активностью при аномальном условии по сравнению с нормальным физиологическим условием. Следовательно, CAR-T-клетки, включающие такой условный линкер более активны при аномальном условии, по сравнению с теми же CAR-T-клетками при нормальном физиологическом условии.
Белки, которые изменяют конформацию при разных значениях рН, были описаны ранее, например, в работе Di Russo et al. (“pH-Dependent conformational changes in proteins and their effect on experimental pK(a)s: the case of Nitrophorin 4,” PLoS Comput Biol. vol. 8, e1002761, 2012). Кроме того, белки с различными конформациями при разных температурах были описаны в работе Caldwell, “Temperature-induced protein conformational changes in barley root plasma membrane-enriched microsomes,”Plant Physiol. vol. 84, pp. 924-929, 1989. Конформация антител, находящихся под влиянием рН и/или температуры, обсуждается в работе в Gandhi, “Effect of pH and temperature on conformational changes of a humanized monoclonal antibody,” Master’s thesis from University of Rhode Island, U.S.
Выбор условного линкера для применения в молекуле CAR входит в объем настоящего изобретения. Условный линкер может принимать первую конформацию при аномальном условии, представляющую собой улучшенную или оптимальную конформацию для презентации двух антиген-специфических нацеливающих областей для связывания с целевым антигеном, и принимать вторую конформацию при нормальном физиологическом условии, представляющую собой субоптимальную конформацию для презентации двух антиген-специфических нацеливающих областей для связывания с целевым антигеном. В некоторых воплощениях, субоптимальная конформация линкера при нормальном физиологическом условии производит молекулу CAR, имеющую связывающие активности к целевому антигену, которые меньше, чем примерно 90%, или примерно 80%, или примерно 70%, или примерно 60%, или примерно 50%, или примерно 40%, или примерно 30%, или примерно 20%, или примерно 10%, или примерно 5% от связывающих активностей молекулы CAR с улучшенной или оптимальной конформацией линкера при аномальном условии.
Условный линкер может быть получен из исходного линкера, выбираемого из 2А линкеров, 2A-подобных линкеров, пикорнавирусных 2A-подобных линкеров, 2A пептида свиного теховируса (P2A) и 2A пептида вируса Thosea asigna (T2A), а также их вариантов и их функциональных эквивалентов. Исходный линкер изменяют для получения мутантных белков; мутантные белки затем подвергают анализу при нормальном физиологическом условии и анализу при аномальном условии. Белки, имеющие условный линкер, выбирают из мутантных белков на основе того, что выбранные белки проявляют (a) условный линкер, имеющий первую конформацию при аномальном условии, которая представляет собой улучшенную или оптимальную конформацию для презентации двух антиген-специфических нацеливающих областей для связывания с целевым антигеном, и (b) вторую конформацию условного линкера при нормальном физиологическом условии, которая представляет собой субоптимальную конформацию для презентации двух антиген-специфических нацеливающих областей для связывания с целевым антигеном.
Молекула CAR также включает внеклеточный спейсерный домен, который соединяет две антиген-специфические нацеливающие области с трансмембранным доменом, который, в свою очередь, соединяется с ко-стимулирующим доменом и внутриклеточным сигнальным доменом внутри Т-клеток (фиг. 1). Внеклеточный спейсерный домен предпочтительно способен поддерживать антиген-специфические нацеливающие области для распознавания и связывания с целевым антигеном на целевых клетках (Hudecek et al. “The non-signaling extracellular spacer domain of chimeric antigen receptors is decisive for in vivo antitumor activity,” Cancer Immunol Res.vol. 3, pp. 125-135, 2015). В некоторых воплощениях, внеклеточный спейсерный домен представляет собой гибкий домен, что позволяет антиген-специфическим нацеливающим областям иметь структуру для оптимального распознавания специфической структуры и плотности целевых антигенов на клетке, такой как клетка опухоли (Hudecek et al. “The non-signaling extracellular spacer domain of chimeric antigen receptors is decisive for in vivo antitumor activity,” Cancer Immunol Res.vol. 3, pp. 125-135, 2015). Гибкость внеклеточного спейсерного домена позволяет внеклеточному спейсерному домену принимать множество различных конформаций.
В некоторых воплощениях, внеклеточный спейсерный домен способен принимать различные конформации при нормальном физиологическом условии и аномальном условии. В особенности, внеклеточный спейсерный домен имеет первую конформацию при аномальном условии, которая представляет собой улучшенную или оптимальную конформацию для презентации двух антиген-специфических нацеливающих областей для связывания с целевым антигеном, в то время как тот же внеклеточный спейсерный домен имеет вторую конформацию при нормальном физиологическом условии, которая представляет собой субоптимальную конформацию для презентации двух антиген-специфических нацеливающих областей для связывания с целевым антигеном. Такой внеклеточный спейсерный домен может быть назван «условным внеклеточным спейсерным доменом», поскольку он позволяет двум антиген-специфическим нацеливающим областям связаться с целевым антигеном при более высокой связывающий активности при аномальном условии, чем при нормальном физиологическом условии. Следовательно, с условным внеклеточным спейсерным доменом, CAR-T-клетки могут быть более активными при аномальном условии, чем те же CAR-T-клетки при нормальном физиологическом условии.
Выбор условного внеклеточного спейсерного домена для применения в молекуле CAR входит в объем настоящего изобретения. В некоторых воплощениях, субоптимальная конформация внеклеточного спейсерного домена при нормальном физиологическом условии производит молекулу CAR, имеющую связывающие активности к целевому антигену, которые меньше, чем примерно 90%, или примерно 80%, или примерно 70%, или примерно 60%, или примерно 50%, или примерно 40%, или примерно 30%, или примерно 20%, или примерно 10%, или примерно 5% активности молекулы CAR с оптимальной конформацией для того же внеклеточного спейсерного домена при аномальном условии.
Было обнаружено, что устойчивая к убиквитинилированию форма для области, включающей внеклеточный спейсерный домен и трансмембранный домен, может усилить сигнализацию CAR-T-клеток и, таким образом, увеличить противоопухолевые активности (Kunii et la. “Enhanced function of redirected human t cells expressing linker for activation of t cells that is resistant to ubiquitylation,” Human Gene Therapy, vol. 24, pp. 27-37, 2013). Внутри этой области, внеклеточный спейсерный домен находится снаружи CAR-T клеток, и, таким образом, подвергается воздействию различных условий и потенциально может быть сделан условно устойчивым к убиквитинилированию.
Условная устойчивость внеклеточного спейсерного домена к убиквитинилированию входит в объем настоящего изобретения. В особенности, молекулы внеклеточного спейсерного домена в CAR более устойчивы к убиквитинилированию при аномальном условии по сравнению с нормальным физиологическим условием. Следовательно, CAR-T-клетки, имеющие условно устойчивый к убиквитинилированию внеклеточный спейсерный домен, будут иметь повышенную цитотоксичность при аномальном условии, по отношению к их цитотоксичности при нормальном физиологическом условии.
Условно устойчивый к убиквитинилированию внеклеточный спейсерный домен может быть выбран так, чтобы быть более устойчивым к убиквитинилированию при аномальном pH или аномальной температуре, и менее устойчивым к убиквитинилированию при нормальном физиологическом pH или нормальной физиологической температуре. В одном из воплощений, условно устойчивый к убиквитинилированию внеклеточный спейсерный домен был более устойчив к убиквитинилированию при рН микроокружения опухоли, и менее устойчив к убиквитинилированию при нормальном физиологическом pH, таком как рН в плазме крови человека при рН 7,2-7,6.
Для получения условного внеклеточного спейсерного домена, исходный фрагмент белка, выбираемый из Fc-фрагмента антитела, шарнирной области антитела, области CH2 антитела и области CH3 антитела, изменяют для получения мутантных белков. Мутантные белки подвергают анализу при нормальном физиологическом условии и анализу при аномальном условии. Условный внеклеточный спейсерный домен выбирают из мутантных белков, которые обладают (a) условным внеклеточным спейсерным доменом, который имеет первую конформацию при аномальном условии для связывания антиген-специфической нацеливающей области с целевым антигеном при более высоких связывающих активностях и вторую конформацию условного внеклеточного связывающего домена при нормальном физиологическом условии для связывания антиген-специфической нацеливающей области с целевым антигеном при сниженных по сравнению с аномальным условием связывающих активностях, или белков, которые (b) более устойчивы к убиквитинилированию при аномальном условии, чем при нормальном физиологическом условии.
Любой из вышеперечисленных химерных антигенных рецепторов может получить такую конфигурацию, что белок, содержащий антигенный рецептор, получит увеличение в уровне экспрессии по сравнению с белком дикого типа или его доменом.
В альтернативном воплощении, настоящее изобретение обеспечивает химерный антигенный рецептор (CAR) для связывания с целевым антигеном, включающий, по меньшей мере, одну антиген-специфическую нацеливающую область, полученную в результате генетической модификации белка дикого типа или его домена и имеющую увеличение в селективности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена; трансмембранный домен; и внутриклеточный сигнальный домен. В некоторых воплощениях, химерный антигенный рецептор дополнительно включает внеклеточный спейсерный домен или, по меньшей мере, один ко-стимулирующий домен.
Настоящее раскрытие также направлено на способы эволюционирования белка дикого типа или его домена, для создания условно активного белка, который имеет, по меньшей мере, одно из следующего: (a) снижение в активности при анализе в нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена, и (b) увеличение в активности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена. Условно активный белок может быть сконструирован в форме CAR.
Химерный антигенный рецептор, полученный по способу, может включать антиген-специфическую нацеливающую область, которая имеет снижение в аффинности связывания с целевым антигеном в нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена.
Химерный антигенный рецептор, полученный по способу, может включать антиген-специфическую нацеливающую область, которая имеет увеличение в активности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена и снижение в аффинности связывания с целевым антигеном в нормальном физиологическом условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена.
В любом из вышеперечисленных химерных антигенных рецепторов, полученных по способу, антиген-специфическая нацеливающая область также может иметь увеличение в селективности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена.
Любой из вышеперечисленных химерных антигенных рецепторов, полученных по способу, может иметь такую конфигурацию, что белок, содержащий антигенный рецептор, имеет увеличение в уровне экспрессии по сравнению с белком дикого типа или его доменом.
В альтернативном воплощении способа, химерный антигенный рецептор (CAR), полученный по способу, для связывания с целевым антигеном, включает, по меньшей мере, одну антиген-специфическую нацеливающую область, полученную в результате эволюционирования белка дикого типа или его домена и имеющую увеличение в селективности при анализе в аномальном условии по сравнению с антиген-специфической нацеливающей областью белка дикого типа или его домена; трансмембранный домен; и внутриклеточный сигнальный домен. В некоторых воплощениях, химерный антигенный рецептор дополнительно включает внеклеточный спейсерный домен или, по меньшей мере, один ко-стимулирующий домен.
ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ
Иммунная система млекопитающих, в особенности, у людей, имеет цитотоксические клетки для нацеливания на пораженные клетки и/или патогены и их уничтожения. Удаление с помощью данных цитотоксических клеток нежелательной ткани (то есть, ткани-мишени), такой как опухоли, представляет собой многообещающий терапевтических подход. Другие ткани, которые могут служить мишенями для удаления, включают железистую гиперплазию (например, предстательной железы), бородавки и нежелательную жировую ткань. Однако этот относительно новый терапевтический подход достиг до сих пор только ограниченного успеха. Например, применение T-клеток для нацеливания на опухоли и их уничтожения имеет относительно низкие долговременные преимущества, поскольку раковые клетки могут адаптироваться к новой терапии, снижая экспрессию поверхностных антигенов для снижения эффективности данной терапии. Раковые клетки могут даже дедифференцироваться, чтобы избежать обнаружения в ответ опухоль-специфические T-клетки. Смотри, Maher, “Immunotherapy of Malignant Disease Using Chimeric Antigen Receptor Engrafted T Cells,” ISRN Oncology, vol. 2012, article ID 278093, 2012.
Цитотоксические клетки, экспрессирующие химерные антигенные рецепторы, могут значительно улучшить специфичность и чувствительность данных цитотоксических клеток. Например, T-клетки, экспрессирующие CAR (CAR-T-клетки) способны с помощью CAR направлять T-клетки к целевым опухолевым клеткам, экспрессирующим поверхностный клеточный антиген, который специфически связывается с CAR. Такие CAR-T-клетки могут доставлять цитотоксическое средство более селективно к опухолевым клеткам. CAR-T-клетки могут непосредственно распознавать молекулу-мишень и, таким образом, как правило, не ограничены полиморфными презентирующими элементами, такими как антигены лейкоцитов человека (HLAs). У данной стратегии нацеливания CAR есть тройное преимущество. Во-первых, поскольку функция CAR-T-клетки не зависит от статуса HLA, такой же основанный на CAR подход может в принципе быть применен у всех пациентов с опухолями, которые экспрессируют такой же целевой поверхностный антиген. Во-вторых, нарушение процессинга антигена и презентирующего механизма представляет собой общее свойство опухолевых клеток и может способствовать ускользанию от иммунологического надзора. Однако это не дает никакой защиты против CAR-T-клеток. В-третьих, диапазон макромолекул, которые могут служить мишенями при применении данной системы, включает белки, углеводы и гликолипиды.
Химерный антигенный рецептор настоящего изобретения представляет собой химерный искусственный белок, включающий, по меньшей мере, одну антиген-специфическую нацеливающую область (ASTR), трансмембранный домен (TM) и внутриклеточный сигнальный домен (ISD). В некоторых воплощениях, CAR может дополнительно включать внеклеточный спейсерный домен (ESD) и/или ко-стимулирующий домен (CSD). Смотри фигуру 1.
ASTR представляет собой внеклеточную область в CAR для связывания со специфическим целевым антигеном, включая белки, углеводы и гликолипиды. В некоторых воплощениях, ASTR включает антитело, в особенности, одноцепочечное антитело, или его фрагмент. ASTR может включать полноразмерную тяжелую цепь, Fab-фрагмент, одноцепочечный фрагмент Fv (scFv), двухвалентное одноцепочечное антитело или диатело, каждое из которых будет специфическим к целевому антигену.
ASTR также может включать функциональный домен другого белка для распознавания и связывания с целевым антигеном. Поскольку целевой антиген может иметь другие биологический функции, например, действовать в качестве рецептора или лиганда, ASTR может альтернативно включать функциональный домен для специфического связывания с антигеном. Некоторые примеры белков с функциональными доменами включают связанные цитокины (что приводит к распознаванию клеток, несущих рецептор цитокинов), аффитела, лиганд-связывающие домены из природных рецепторов, растворимые лиганды белка/пептида для рецептора, например, на опухолевой клетке. Фактически, почти любая молекула, которая способна связываться с данным антигеном с высокой аффинностью может быть применена в ASTR, как должно быть понятно специалистам в этой области техники.
В одном из воплощений, CAR изобретения включает, по меньшей мере, две ASTR, которая нацелена, по меньшей мере, на два различных антигена или два эпитопа на том же антигене. В одном воплощении, CAR включает три или более ASTR, которые нацелены, по меньшей мере, на три или более различных антигена или эпитопа. Если на CAR присутствует множество ASTR, то ASTR могут быть организованы в тандем и могут быть разделены линкерными пептидами (фигура 1).
В одном из воплощений, ASTR включает полноразмерную тяжелую цепь IgG, которая специфична для целевого антигена и имеет VH, CHI, шарнирный участок и домены CH2 и CH3 (Fc) Ig, если одного VH-домена достаточно для придания антиген-специфичности («антитела с одиночным доменом»). Если оба, VH-и VL-домены необходимы для создания полностью активной ASTR, то как VH-содержаший CAR, так и полноразмерную лямбда легкой цепи (IgL) вводят в ту же цитотоксическую клетку для создания активной ASTR. В другим воплощении, каждая ASTR в CAR включает, по меньшей мере, два одноцепочечных вариабельных фрагмента антитела (scFv), каждый специфичный для разных целевых антигенов. scFvs, в котором C-конец одного вариабельного домена (VH или VL) присоединен к N-концу другого вариабельного домена (VL или VH, соответственно) через полипептидный линкер, был разработан без существенно нарушения связывания антигена или специфичности связывания (Chaudhary et al. “A recombinant single-chain immunotoxin composed of anti-Tac variable regions and a truncated diphtheria toxin”, Proc. Natl. Acad. Sci. vol. 87, page 9491, 1990; Bedzyk et al.”, “Immunological and structural characterization of a high affinity anti-fluorescein single-chain antibody”, J. Biol. Chem. vol. 265, page 18615, 1990). Данный scFvs утратил постоянные области (Fc), присутствующие в тяжелых и легких цепях нативного антитела. scFvs, специфичный, по меньшей мере, для двух различных антигенов, располагают в тандеме. В воплощении, экстраклеточный спейсерный домен может быть встроен между ASTR и трансмембранным доменом.
В другом воплощении, scFv-фрагмент может быть слит со всеми или c частью постоянных доменов тяжелой цепи. В дополнительном воплощении, ASTR в CAR включает двухвалентный (или бивалентный) одноцепочечный вариабельный фрагмент (di-scFvs, bi-scFvs). В CAR, включающем di-scFVs, две scFvs, каждая специфическая для антигена, связаны друг с другом с образованием единственной пептидной цепи с двумя VH и двумя VL областями (Xiong et al. "Development of tumor targeting anti-MUC-1 multimer: effects of di-scFv unpaired cysteine location on PEGylation and tumor binding," Protein Engineering Design and Selection, vol. 19, pages 359-367, 2006; Kufer et al. "A revival of bispecific antibodies," Trends in Biotechnology, vol. 22, pages 238-244, 2004).
Еще в одном воплощении, ASTR включает диатело. В диателе, scFvs создают с помощью линкерных пептидов, которые слишком коротки для двух вариабельных областей, чтобы свернуться вместе, подталкивая scFvs к димеризации. Еще более короткие линкеры (одна или две аминокислоты) приводят к образованию тримеров, так называемых триател или трител. Тетратела также могут быть применены в ASTR.
Если в CAR присутствуют две или несколько ASTR, то ASTR соединяют друг с другом ковалентно в единую полипептидную цепь, через олиго-или полипептидный линкер, шарнирный участок Fc или мембранные шарнирные области.
Антигены, на которые нацелены CAR, присутствуют на поверхности или внутри клеток в ткани, которые предназначены для удаления, такие как опухоли, железистая гиперплазия (например, предстательной железы), бородавки и нежелательная жировая ткань. Пока поверхностные антигены более эффективно распознают и связываются с помощью ASTR в CARs, внутриклеточные антигены также могут служить мишенями для CARs. В некоторых воплощениях, целевые антигены предпочтительно специфичны для рака, воспалительных заболеваний, нейрональных нарушений, диабетов, сердечнососудистых заболеваний или инфекционных заболеваний. Примеры целевых антигенов включают антигены, экспрессируемые различными иммунными клетками, карциномой, саркомой, лимфомами, лейкемией, герминогенными опухолями, бластомой и клетками, связанными с различными гематологическими заболеваниями, аутоиммунными заболеваниями и/или воспалительными заболеваниями.
Антигены, специфические для рака, к которым могут быть направлены ASTR, включают одно или несколько из следующего: 4-IBB, 5T4, антиген аденокарциномы, альфа-фетопротеин, BAFF, клетки B-лимфомы, антиген C242, CA-125, карбоангидразу 9 (CA-IX), C-MET, CCR4, CD152, CD19, CD20, CD200, CD22, CD221, CD23 (IgE-рецептор), CD28, CD30 (TNFRSF8), CD33, CD4, CD40, CD44 v6, CD51, CD52, CD56, CD74, CD80, CEA, CNT0888, CTLA-4, DR5, EGFR, EpCAM, CD3, FAP, экстра домен-B фибронектина, рецептор фолата 1, GD2, GD3 ганглиозид, гликопротеин 75, GPNMB, HER2/neu, HGF, рецептор гепатоцитокиназы фактора роста человека, рецептор IGF-1, IGF-I, IgGl, LI-CAM, IL-13, IL-6, рецептор инсулиноподобного фактора роста I, интегрин α5β1, интегрин ανβ3, MORAb-009, MS4A1, MUC1, муцин CanAg, N-гликолилнейраминовую кислоту, NPC-1C, PDGF-R a, PDL192, фосфатидилсерин, клетки карциномы предстательной железы, RANKL, RON, ROR1, SCH 900105, SDC1, SLAMF7, TAG-72, тенасцин C, TGF бета 2, TGF-β, TRAIL-R1, TRAIL-R2, опухолевый антиген CTAA16.88, VEGF-A, VEGFR-1, VEGFR2 или виментин.
Антигены, специфические для воспалительных заболеваний, к которым могут быть направлены ASTR, включают одно или несколько из следующего: AOC3 (VAP-1), CAM-3001, CCL11 (эотаксин-1), CD125, CD147 (батигин), CD154 (CD40L), CD2, CD20, CD23 (IgE-рецептор), CD25 (цепь в рецепторе IL-2), CD3, CD4, CD5, IFN-a, IFN-γ, IgE, Fc-область IgE, IL-1, IL-12, IL-23, IL-13, IL-17, IL-17A, IL-22, IL-4, IL-5, IL-5, IL-6, рецептор IL-6, интегрин a4, интегрин α4β7, Lama glama, LFA-1 (CD1 la), MEDI-528, миостатин, OX-40, rhuMAb β7, склероцин, SOST, TGF бета 1, TNF-α или VEGF-A.
Антигены, специфические для нейрональных нарушений, к которым могут быть направлены ASTR изобретения, включают одно или несколько из следующего: бета-амилоид или MABT5102A. Антигены, специфические для диабетов, к которым могут быть направлены ASTR изобретения, включают одно или несколько из следующего: L-Ιβ или CD3. Антигены, специфические для сердечнососудистых заболеваний, к которым могут быть направлены ASTR изобретения, включают одно или несколько из следующего: C5, сердечный миозин, CD41 (интегрин альфа-lib), фибрин II, бета-цепь, ITGB2 (CD 18) и сфингазин-1-фосфат.
Антигены, специфические для инфекционных заболеваний, к которым могут быть направлены ASTR изобретения, включают одно или несколько из следующего: токсин сибирской язвы, CCR5, CD4, агглютинирующий фактор A, цитомегаловирус, гликопротеин B цитомегаловируса, эндотоксин, Escherichia coli, поверхностный антиген гепатита B, вирус гепатита B, HIV-1, Hsp90, гриппа A гемагглютинин, липотейхоевую кислоту, Pseudomonas aeruginosa, гликопротеин вируса бешенства, респираторно-синцитиальный вирус и TNF-α.
Дополнительные примеры целевых антигенов включают поверхностные белки, обнаруженные на раковых клетках в специфическом или амплифицированном виде, например, рецептор IL-14, CD19, CD20 и CD40 для B-клеточной лимфомы, антиген Ley и антигены CEA для различных карцином, антиген Tag72 для рака молочной железы и колоректального рака, EGF-R для рака легких, фолат-связывающий белок и белок HER-2, который часто амплифицируется в молочной железе человека и карциноме яичников, или вирусный белки, например gpl20 и gp41 белки оболочки в HIV, белки оболочки из вирусов гепатита B и C, гликобелок B и другие гликопротеины оболочки цитомегаловируса человека, и белки оболочки из онковирусов, таких как ассоциированный с саркомой Капоши вирус герпеса. Другие потенциальные целевые антигены включают CD4, где лиганд представляет собой гликопротеин gpl20 оболочки HIV, и другие вирусные рецепторы, например, ICAM, который представляет собой рецептор для риновируса человека, и родственная молекула рецептора для полиовируса.
В другом воплощении, CAR может быть нацелен на антигены, которые включены в лечащие рак клетки, таких как NK-клетки и другие клетки, упомянутые в настоящем документе, для активации лечащих рак клеток, действуя в качестве иммунного эффектора клетки. Один из таких примеров представляет собой CAR, который нацелен на антиген CD16A для вовлечения NK-клеток в борьбу против CD30-экспрессирующих злокачественных опухолей. Биспецифическое, тетравалентное антитело AFM13 представляет собой пример антитела, которое может доставлять данный эффект. Дополнительные сведения о воплощении этого типа можно найти, например, в работе Rothe, A. et al. “A phase 1 study of the bispecific anti-CD30/CD16A antibody construct AFM13 in patients with relapsed or refractory Hodgkin lymphoma,” Blood, 25 June 2015, Vl. 125, no. 26, pp. 4024-4031.
Внеклеточный спейсерный домен в CAR представляет собой гидрофильную область, которая локализована между ASTR и трансмембранным доменом. В некоторых воплощениях, данный домен облегчает правильное свертывание белка для CAR. Внеклеточный спейсерный домен представляет собой необязательный компонент для CAR. Внеклеточный спейсерный домен может включать домен, выбираемый из Fc-фрагментов антител, шарнирных областей антител, CH2-областей антител, CH3-областей антител, искусственных спейсерных последовательностей или их комбинаций. Примеры внеклеточных спейсерных доменов включают шарнирный участок CD8a, искусственные спейсеры, сделанные из полипептидов, которые могут быть настолько малы, как три глицина (Gly), а также CHI и CH3 домены из IgGs (такого как IgG4 человека).
Трансмембранный домен в CAR представляет собой область, которая способна перекрывать плазматические мембраны цитотоксических клеток. Трансмембранный домен выбирают из трансмембранной области трансмембранного белка, такого как, например, трансмембранные белки типа I, искусственные гидрофобные последовательности или их комбинация. Примеры трансмембранного домена включают трансмембранные области альфа-, бета-или зета-цепи рецептора Т-клеток, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. Синтетические трансмембранные домены могут включать триплет из фенилаланина, триптофана и валина. Необязательно, короткий олиго-или полипептидный линкер, предпочтительно, от 2 до 10 аминокислоты в длину, может образовывать связку между трансмембранным доменом и внутриклеточным сигнальным доменом в CAR. Дублет глицин-серин обеспечивает особенно подходящий линкер между трансмембранным доменом и внутриклеточным сигнальным доменом.
CAR изобретения также включает внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен преображает эффекторную функцию сигнала и направляет цитотоксическую клетку для выполнения своей специализированной функции, то есть, для нанесения вреда и/или уничтожения клетки-мишени. Примеры внутриклеточного сигнального домена включают ζ-цепь рецептора Т-клеточного комплекса или любого из его гомологов, например, η-цепь, FcsRly и β-цепи, MB 1 (Iga) цепь, B29 (Ig) цепь и т.п. зета-цепь CD3 человека, CD3 полипептиды (Δ, δ и ε), тирозинкиназы syk-семейства (Syk, ZAP 70, и т.п.), тирозинкиназы src-семейства (Lck, Fyn, Lyn, и т.п.) и другие молекулы, вовлеченный в трансдукцию T-клеток, такие как CD2, CD5 и CD28. Конкретно, внутриклеточный сигнальный домен может представлять собой зета-цепь CD3 человека, FcyRIII, FcsRI, цитоплазматические хвосты Fc-рецепторов, цитоплазматические рецепторы, несущие тирозиновый активирующий мотив иммунорецептора (ITAM), и их комбинации.
Внутриклеточные сигнальные домены, примененные в CAR, могут включать внутриклеточные сигнальные домены нескольких типов из других различных иммунных сигнальных рецепторов, включая, без ограничений, первую, вторую и третью генерацию T-клеточных сигнальных белков, включая CD3, B7 семейства ко-стимулирующий и суперсемейство рецепторов рецептора фактора некроза опухоли (TNFR) (Park et al. “Are all chimeric antigen receptors created equal?” J Clin Oncol. vol. 33, pp.651-653, 2015). Дополнительные внутриклеточные сигнальные домены включают сигнальные домены, используемые NK и NKT-клетками (Hermanson, et al. «Utilizing chimeric antigen receptors to direct natural killer cell activity,” Front Immunol. vol. 6, p.195, 2015), такие как сигнальные домены из NKp30 (B7-H6) (Zhang et al. “An NKp30-based chimeric antigen receptor promotes T cell effector functions and antitumor efficacy in vivo,” J Immunol. vol. 189, pp.2290-2299, 2012) и DAP12 (Topfer et al. “DAP12-based activating chimeric antigen receptor for NK cell tumor immunotherapy,” J Immunol. vol. 194, pp.3201-3212, 2015), NKG2D, NKp44, NKp46, DAP10 и CD3z. Дополнительные внутриклеточные сигнальные домены также включают сигнальные домены иммуноглобулиновых рецепторов человека, которые содержат тирозиновый мотив активации иммунорецептора (ITAM), такой как FcgammaRI, FcgammaRIIA, FcgammaRIIC, FcgammaRIIIA, FcRL5 (Gillis et al. “Contribution of Human FcγRs to Disease with Evidence from Human Polymorphisms and Transgenic Animal Studies,” Front Immunol. vol. 5, p.254, 2014).
В некоторых воплощениях, внутриклеточный сигнальный домен включает цитоплазматический сигнальный домен TCR-зета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b или CD66d. В особенности предпочтительно, чтобы внутриклеточный сигнальный домен в CAR включал цитоплазматический сигнальный домен человека CD3-зета.
CAR настоящего изобретения может включать ко-стимулирующий домен, который имеет функцию усиления клеточной пролиферации, выживания клеток и развития клеточной памяти для цитотоксических клеток, которые экспрессируют CAR. CAR изобретения может включать один или несколько ко-стимулирующих доменов, выбираемых из ко-стимулирующих доменов белков в TNFR-иммуноглобулинах, CD28, CD137 (4-1BB), CD134 (OX40), DaplO, CD27, CD2, CD7, CD5, ICAM-1, LFA-1(CD1 la/CD18), Lck, TNFR-I, PD-1, TNFR-II, Fas, CD30, CD40, ICOS LIGHT, NKG2C, B7-H3 или их комбинаций. Если CAR включает более чем один ко-стимулирующий домен, то данные домены могут быть организованы в тандеме, необязательно разделенном линкером. Ко-стимулирующий домен представляет собой внутриклеточный домен, который может быть локализован между трансмембранным доменом и внутриклеточным сигнальным доменом в CAR.
В некоторых воплощениях, два или более компонентов в CAR изобретения отделяют одним или несколькими линкерами. Например, в CAR, включающем, по меньшей мере, две ASTR, эти две ASTR могут быть разделены линкером. Линкеры представляют олиго-или полипептидными областями, размером примерно от 1 до 100 аминокислот в длину. В некоторых воплощениях, линкеры могут быть, например, 5-12 аминокислот в длину, 5-15 аминокислот в длину или от 5 до 20 аминокислот в длину. Линкеры могут состоять из гибких остатков, таких как глицин и серин, таким образом, что прилегающие домены белка могут свободно перемещаться относительно друг друга. Более длинные линкеры, например, те, что длиннее 100 аминокислот, могут быть применены в связи с альтернативными воплощениями изобретения, и могут быть отбраны, например, для обеспечения того, чтобы два прилегающих домена стерически не мешали друг другу. Примеры линкеров, которые могут быть применены в настоящем изобретении, включают без ограничений 2A линкеры (например, T2A), 2A-подобные линкеры или их функциональные эквиваленты.
УСЛОВНО АКТИВНАЯ АНТИГЕН-СПЕЦИФИЧЕСКАЯ НАЦЕЛИВАЮЩАЯ ОБЛАСТЬ
CARs представляют собой химерные белки, которые создают путем слияния вместе всех различных обсуждаемые выше доменов для формирования слитого белка. CAR как правило создают с помощью вектора экспрессии, включающего полинуклеотидные последовательности, кодирующие различные домены CAR. ASTR настоящего изобретения, функция которой заключается в распознавании и связывании с антигеном на клетках-мишенях, условно активны. Конкретно, ASTR менее активна или неактивна в нормальном физиологическом условии и активны в аномальном условии для связывания с целевым антигеном, по сравнению с ASTR соответствующего белка дикого типа. Настоящее изобретение обеспечивает способ создания условно активных ASTR из белка дикого типа или его связывающего домена (ASTR дикого типа).
Белок дикого типа, подходящий для применения в целом или частично, по меньшей мере, для его связывающего домена для целевого антигена, в качестве ASTR в настоящем изобретении может быть обнаружен путем создания белковой библиотеки и скрининга библиотеки на белок с требуемой аффинностью связывания с целевым антигеном. Белок дикого типа может быть обнаружен с помощью скрининга библиотеки кДНК. Библиотека кДНК представляет собой комбинацию клонированных фрагментов кДНК (комплементарной ДНК), вставленных в коллекцию клеток-хозяев, которые вместе составляют некоторую часть транскриптома организма. кДНК получают из полностью транскрибированной мРНК и, следовательно, она содержит кодирующую последовательность для экспрессированных белков организма. Информация в библиотеках кДНК представляет собой мощный и полезный инструмент для обнаружения белков с требуемыми свойства с помощью скрининга библиотеки на белки с требуемой аффинностью связывания с целевым антигеном.
В некоторых воплощениях, в которых белки дикого типа представляют собой антитела, антитела дикого типа могут быть обнаружены путем создания и скрининга библиотеки антител. Библиотеки антител могут быть или библиотеками поликлональных антител или библиотеками моноклональных антител. Библиотека поликлональных антител против целевого антигенаа может быть создана с помощью прямого введения антигена в животное или введения антигена животному, не представляющему собой человека. Антитела, полученные таким способом, представляют собой библиотеку поликлональных антител, которые связываются с антигеном. Для получения библиотеки моноклональных антител, может быть применена любая методика, которая обеспечивает антитела, полученные с помощью непрерывного культивирования клеточной линии. Примеры включают методику получения гибридомы, методику получения триомы, методику получения гибридомы B-клеток человека и методику получения EBV-гибридомы (смотри, например, Cole (1985) in Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. pp. 77-96). Методики, описанные для создания одноцепочечного антитела (смотри, например, патент США № 4,946,778), могут быть адаптированы для получения библиотеки одноцепочечных антител.
Существуют другие способы генерации и скрининга библиотеки антител для обнаружения антитела дикого типа. Например, могут быть применены библиотеки дисплея полностью человеческих антител. Такая библиотека представляет собой популяцию антител, представленных на поверхности клетки-хозяина(клеток-хозяев). Предпочтительно, библиотека антител представляет собой типичный репертуар антител человека, в котором они обладают способностью связываться с широким диапазоном антигенов. Поскольку антитела представлены на поверхности клеток, то эффективная аффинность (благодаря авидности) каждого антитела в библиотеке повышена. В отличие от других популярных типов библиотек, таких как библиотеки фаговых диплеев, в которых авидность антител для целей скрининга и идентификация менее желательна, суперавидность, обеспечиваемая дисплеем на поверхности клеток в настоящем изобретении, желательна. Дисплей на поверхности клеток библиотеки позволяет идентифицировать антитела с низкой, средней и высокой аффинностью связывания, а также идентифицировать неиммуногенные и слабые эпитопы на стадии скрининга или отбора.
ПОЛУЧЕНИЕ ЭВОЛЮЦИОНИРОВАВШИХ МОЛЕКУЛ ИЗ РОДИТЕЛЬСКОЙ МОЛЕКУЛЫ
Белок дикого типа, или его связывающий домен, (ASTR дикого типа) подвергают мутагенезу с получением популяции мутантных полипептидов, с которыми затем может быть проведен скрининг для идентификации мутантной ASTR с увеличенной аффинностью связывания с целевым антигеном в аномальных условиях, и необязательно, существенно такой же или со снижением в аффинности связывания с целевым антигеном в нормальном физиологическом условии, по сравнению с ASTR дикого типа.
Любой способ мутагенеза, химического синтеза или рекомбинантный, может быть применен для создания популяции мутантных полипептидов. Если не указано другое, на практике настоящего изобретения можно применять общепринятые методики клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в рамках компетентности в данной области техники. Такие методики полностью рассмотрены в литературе. Смотри, например, Molecular Cloning A Laboratory Manual, 2nd Ed. ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989); DNA Cloning, Volumes I and II (D. N. Glover ed. 1985); Oligonucleotide Synthesis (M. J. Gait ed. 1984); Mullis et al. U.S. Patent No: 4,683, 195; Nucleic Acid Hybridization (B. D. Hames & S. J. Higgins eds. 1984); Transcription And Translation (B. D. Hames & S. J. Higgins eds. 1984); Culture Of Animal Cells (R. I. Freshney, Alan R. Liss, Inc. 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); the treatise, Methods In Enzymology (Academic Press, Inc. N.Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Cabs eds. 1987, Cold Spring Harbor Laboratory); Methods In Enzymnology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds. Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes l-IV (D. M. Weir and C. C. Blackwell, eds. 1986); Manipulating the Mouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. 1986).
Раскрытие обеспечивает способ получения мутантной нуклеиновой кислоты, кодирующей мутантный полипептид, представляющий собой условно активный полипептид, способ, включающий модифицирование нуклеиновой кислоты путем (i) замещения одного или нескольких нуклеотидов различными нуклеотидами, в котором нуклеотид включает природный или неприродный нуклеотид; (ii) делеции одного или нескольких нуклеотидов, (iii) добавления одного или нескольких нуклеотидов или (iv) любой их комбинации. В одном из аспектов, неприродный нуклеотид включает инозин. В другом аспекте, способ дополнительно включает анализ полипептидов, кодирующих модифицированные нуклеиновые кислоты для изменения ферментативной активности, тем самым для идентификации модифицированной нуклеиновой кислоты (модифицированных нуклеиновых кислот), кодирующих полипептид, имеющий измененную ферментативную активность. В одном из аспектов, модификации стадии (a) выполняют с помощью ПЦР, ПЦР с внесением ошибок, перетасовки, олигонуклеотид-направленного мутагенеза, ПЦР-сборки, мутагенеза с помощью ПЦР с имитацией полового размножения, in vivo мутагенеза, кассетного мутагенеза, рекурсивного множественного мутагенеза, экспоненциального множественного мутагенеза, сайт-специфического мутагенеза, повторной сборки гена, насыщающего мутагенеза участка гена, лигазной цепной реакции, in vitro мутагенеза, лигазной цепной реакции, синтеза олигонуклеотидов, любой ДНК-генерирующей методики и любых их комбинаций. В другом аспекте, способ дополнительно включает, по меньшей мере, один повтор стадии модифицирования.
Раскрытие дополнительно обеспечивает способ изготовления полинуклеотида из двух или нескольких нуклеиновые кислоты, способ включающий: (a) идентификацию областей идентичности и областей различий между двумя или несколькими нуклеиновыми кислотами, в которой, по меньшей мере, одна из нуклеиновых кислот включает нуклеиновую кислоту раскрытия; (b) обеспечение набора олигонуклеотидов, которые соответствуют по последовательности, по меньшей мере, двум из двух или более нуклеиновых кислот; и (c) удлинение олигонуклеотидов с помощью полимеразы, тем самым изготовление полинуклеотида.
Любая методика мутагенеза может быть применена в различных воплощениях раскрытия. Стохастический или случайный мутагенез может быть проиллюстрирован ситуацией, в которой родительскую молекулу мутируют (модифицируют или изменяют) с получением набора молекул потомства, имеющих мутацию(мутации), которые не были предопределены. Таким образом, в реакции in vitro стохастического мутагенеза, например, не существует особенно предетерминированного продукта, который намерены были получить; скорее существует неопределенность - в связи с этим случайность - в отношении точной природы достигнутых мутаций, и, таким образом, также в отношении полученных продуктов. Стохастический мутагенез проявляется в таких способах, как ПЦР с внесением ошибок и стохастические перетасовки, в которых мутация(мутации) достигаются случайно или непредетерминировано. Вариантные формы могут быть созданы с помощью подверженной ошибкам транскрипции, такой как ПЦР с внесением ошибок, или с применением полимеразы, которая утратила активность по коррекции ошибок (смотри, Liao (1990) Gene 88: 107-111), первой формы варианта, или, путем репликации первой формы в мутаторном штамме (мутаторные клетки-хозяева будут обсуждаться подробнее ниже, и, в общем, хорошо известны). Мутаторный штамм может включать любых мутантов в любом организме, ослабленном в отношении функции репарации ошибочно спаренных оснований. Это включает продукты мутантного гена из mutS, mutT, mutH, mutL, ovrD, dcm, vsr, umuC, umuD, sbcB, recJ и т.п. Нарушение функции достигается с помощью генетической мутации, аллельной замены, избирательным ингибированием добавленным реагентом, таким как небольшое соединение, или экспрессированием антисмысловой РНК или с помощью других методик. Нарушения могут быть в указанных генах или в гомологичных генах в любом организме.
Другие способы мутагенеза включают технологии олигонуклеотид-направленного мутагенеза, допускающие ошибки полимеразные цепные реакции (ПЦР с внесением ошибок) и кассетного мутагенеза, в котором специфическую область родительского полинуклеотида заменяют на синтетически мутированный олигонуклеотид. В данных случаях, вокруг определенных сайтов в родительской последовательности создают ряд мутантных сайтов.
В олигонуклеотид-направленном мутагенезе, короткую последовательность заменяют на синтетически мутированный олигонуклеотид. В олигонуклеотид-направленном мутагенезе, короткую последовательность полинуклеотида удаляют из полинуклеотида, применяя расщепление рестрикционными ферментами и заменяют синтетическими полинуклеотидами, в которых различные основания исходной последовательности были изменены. Полинуклеотидная последовательность также может быть изменена с помощью химического мутагенеза. Химические мутагены включают, например, натрия бисульфит, азотистую кислоту, гидроксиламин, гидразин или муравьиную кислоту. Другие средства, которые представляют собой аналоги предшественников нуклеотидов, включают нитрозогуанидин, 5-бромурацил, 2-аминопурин или акридин. В общем, данные средства добавляют к ПЦР-реакции вместо предшественников нуклеотидов, тем самым внося мутации в последовательность. Интеркалирующие средства, такие как профлавин, акрифлавин, хинакрин и им подобные также могут быть применены. Случайный мутагенез полинуклеотидной последовательности также может быть достигнут облучением рентгеновскими лучами или ультрафиолетовым светом. В общем, плазмидные полинуклеотиды, мутированные таким способом, вводят в E. coli и размножают как пул или как библиотеку гибридных плазмид.
В ПЦР с внесением ошибок применяют условия полимеризация с низкой точностью для введения низкого уровня точечных мутаций случайно на протяжении длинной последовательности. В смеси фрагментов неизвестной последовательности, ПЦР с внесением ошибок может быть применена для мутагенеза смеси.
В кассетном мутагенезе, блок последовательностей единственной матрицы, как правило, заменяют (частично) рандомизированной последовательностью. Reidhaar-Olson J F and Sauer R T: Combinatorial cassette mutagenesis as a probe of the informational content of protein sequences. Science 241(4861):53-57, 1988.
Альтернативно, любая методика нестохастического или неслучайного мутагенеза может быть применена в различных воплощениях раскрытия. Нестохастический мутагенез может быть проиллюстрирован ситуацией, в которой родительскую молекулу мутируют (модифицируют или изменяют) с получением молекул потомства, имеющих одну или несколько предетерминированных мутаций. Следует понимать, что присутствие фоновых продуктов в некотором количестве представляет собой реальность во многих реакциях, в которых имеет место молекулярный процессинг, и присутствие данных фоновых продуктов не умаляет нестохастическую природу способа мутагенеза, имеющего предетерминированный продукт. Сайт-насыщающий мутагенез и повторная сборка с помощью синтетического лигирования, представляют собой примеры методик мутагенеза, в которых точная химическая структура(точные химические структуры) предполагаемого продукта(предполагаемых продуктов) предетерминирована(предетерминированы).
Один из способов сайт-насыщающего мутагенеза раскрыт в публикации заявки на патент США 2009/0130718. Данный способ обеспечивает набор вырожденных праймеров, соответствующих кодонам матричного полинуклеотида, и осуществляет полимеразную элонгацию для получения полинуклеотидов потомства, которые содержат последовательности, соответствующие вырожденным праймерам. Потомство полинуклеотидов может быть экспрессировано и может быть проведен скрининг на направленное изменение. Конкретно, это способ получения набора потомства полинуклеотидов, включающий следующие стадии (a), обеспечение копий матричного полинуклеотида, каждая включающая множество кодонов, кодирующих последовательность матричного полипептида; и (b) для каждого кодона матричного полинуклеотида, выполнение следующих стадий (1), обеспечение набора вырожденных праймеров, в котором каждый праймер включает вырожденный кодон, соответствующий кодону матричного полинуклеотида и по меньшей мере одну прилегающую последовательность, которая гомологична последовательности, прилегающей к кодону матричного полинуклеотида; (2), обеспечение условий, позволяющих праймерам отжигать копии матричного полинуклеотида; и (3) выполнение полимеразной реакции элонгации от праймеров вдоль матрицы; тем самым получая потомство полинуклеотидов, каждое из которых содержит последовательность, соответствующую вырожденному кодону отожженного праймера; тем самым получая набор полинуклеотидов потомства. Сайт-насыщающий мутагенез относится к направленному изменению нуклеиновых кислот и скринингу клонов, содержащих измененные нуклеиновые кислоты для представляющей интерес результирующей связывающей активности.
Сайт-насыщающий мутагенез относится, в общем, к способу: 1) получения поколения потомства молекулы (молекул) (включая молекулу, состоящую из полинуклеотидной последовательности, молекулу, состоящую из полипептидной последовательности и молекулу, частично состоящую из полинуклеотидной последовательности и частично из полипептидной последовательности), то есть мутированную для достижения, по меньшей мере, одной точечной мутации, вставки, делеции и/или химеризации, от матрицы (матриц) одной или нескольких предковых или родительских генераций; 2) скрининга молекулы (молекул) поколения потомства - предпочтительно с помощью способа с высокой пропускной способностью - для требуемой аффинности связывания с целевым антигеном; 3) необязательно, получения и/или каталогизации структурной и/или и функциональной информации в отношении поколения родительских молекул и/или молекул потомства; и 4) необязательно, повторения любой из стадий от 1) до 3).
В сайт-насыщающем мутагенезе, создают генерацию потомства полинуклеотидов (например, из родительской полинуклеотидной матрицы) - в так называемом «сайт-насыщающем мутагенезе кодона» - каждый, имеющий, по меньшей мере, один набор из вплоть до трех непрерывных точечных мутаций (то есть различных оснований, включающих новый кодон), так что каждый кодон (или каждое семейство вырожденных кодонов, кодирующее такую же аминокислоту) представлен в каждом положении кодона. В соответствии с данной генерацией потомства полинуклеотидов - и кодируемый данной генерацией потомства полинуклеотидов - создают также набор полипептидов потомства, каждый, имеющий, по меньшей мере, одну единственную аминокислотную точечную мутацию. В предпочтительном аспекте, создают - в так называемом «сайт-насыщающем мутагенезе аминокислоты» - один такой мутантный полипептид для каждой из 19 природно кодируемых полипептид-формирующих альфа-аминокислотных замен во всех без исключения положениях аминокислоты вдоль полипептида. Это дает - для всех без исключения положений аминокислоты вдоль родительского полипептида - всего 20 отличающихся полипептидов потомства, включая исходную аминокислоту, или потенциально более чем 21 отличающийся полипептид потомства, если применяют дополнительные аминокислоты, либо вместо, либо помимо 20 природно кодируемых аминокислот.
Также может быть применены другие методики мутагенеза, в которые вовлечена рекомбинация и, более конкретно, способ получения полинуклеотидов, кодирующих полипептид способом in vivo рекомбинации полинуклеотидных последовательностей, содержащих области частичной гомологии, сборку полинуклеотидов для образования, по меньшей мере, одного полинуклеотида и скрининг полинуклеотидов для получения полипептида (полипептидов), имеющих полезное свойство.
В другом аспекте, в методиках мутагенеза применяют природную способность клеток к рекомбинации молекул и/или к опосредованию восстановительных процессов, которые снижают сложность последовательности и степень повторяемости или следующих друг за другом последовательностей, обладающих областями гомологии.
Различные методики мутагенеза могут быть применены по одиночке или в комбинации для обеспечения способа получения гибридных полинуклеотидов, кодирующих биологически активные гибридные полипептиды. При осуществлении данных и другие целей, был обеспечен, в соответствии с одним из аспектов раскрытия, способ введения полинуклеотидов в подходящие клетки-хозяева и культивирования клеток-хозяев в условиях, в которых получают гибридные полипептиды.
Химерные гены создавали, объединяя 2 полинуклеотидных фрагмента, с помощью совместимых липких концов, полученных с помощью фермента(ферментов) рестрикции, в котором каждый фрагмент получают из отдельной молекулы-предшественника (или родительской молекулы). Другой пример представляет собой мутагенез единственного положения кодона (то есть для достижения замены, вставки или делеции в кодоне) в родительском полинуклеотиде для создания единственного полинуклеотида потомства, кодирующего полипептид, мутированный по единственному сайту.
Кроме того, для создания гибридов генов применяли системы in vivo сайт-специфической рекомбинации, а также способы случайной in vivo рекомбинации, и рекомбинации между гомологичными, но укороченными генами на плазмиде. Также сообщали о мутагенезе, выполняемом с помощью удлинения и ПЦР с перекрывающимися праймерами.
Неслучайные способы применяют для достижения большего числа точечных мутаций и/или химеризаций, например, комплексные или всесторонние подходы применяют для создания всех молекулярных разновидностей, в внутри определенной группировки мутаций, для приписывания функциональности специфическим структурным группам в молекуле матрицы (например, специфическое единственное положение аминокислоты или последовательность, включающая две или несколько положений аминокислот), и для категоризации и сравнения специфических группировок мутаций.
Любые данные или другие способы генетического изменения могут быть применены в настоящем раскрытии для создания новой популяции мутантных полипептидов (библиотеки) из белка дикого типа.
ЭКСПРЕССИЯ ЭВОЛЮЦИОНИРОВАВШИХ МОЛЕКУЛ
Мутантные полинуклеотиды, созданные на стадии эволюционирования, могут быть фракционированы по размеру в агарозном геле в соответствии с опубликованными протоколами, встроены в вектор экспрессии и трансфицированы в соответствующие клетки-хозяева для получения мутантных полипептидов (экспрессии), или могут не подвергаться данным процедурам. Для экспрессии могут быть применены общепринятые молекулярно-биологические методики. Таким образом, на стадии экспрессии можно применять различные известные способы.
Например, коротко, мутантные полинуклеотиды, созданные на стадии эволюционирования затем расщепляют и лигируют в вектор экспрессии, такой как плазмидная ДНК, применяя стандартные молекулярно-биологические методики. Вектор затем трансформируют в бактерии или другие клетки, применяя стандартные протоколы. Это может быть выполнено в отдельной лунке многолуночного планшета, такого как 96-луночный планшет для экспрессии и скрининга высокой производительности. Способ повторяют для каждая мутантного полинуклеотида.
Полинуклеотиды, отобранные и изолированные, как описано, вводят в подходящие клетки-хозяева. Подходящие клетки-хозяева представляют собой любую клетку, которая способна способствовать рекомбинации и/или восстановительной реассортации. Отобранные полинуклеотиды предпочтительно находятся уже в векторе, который включает подходящие контрольные последовательности. Клетки-хозяева могут представлять собой высшую эукариотическую клетку, такую как клетка млекопитающего, или низшую эукариотическую клетку, такую как дрожжевая клетка, или предпочтительно, клетки-хозяева могут представлять собой прокариотическую клетку, такую как бактериальная клетка. Введение конструкции в клетки-хозяева может быть осуществлено трансфекцией кальцием фосфата, опосредованной DEAE-декстраном трансфекцией или электропорацией (например, Ecker and Davis, 1986, Inhibition of gene expression in plant cells by expression of antisens RNA. Proc Natl Acad Sci USA 83:5372–5376).
В качестве типичных примеров вектора экспрессии, которые могут быть применены, можно упомянуть вирусные частицы, бакуловирус, фаг, плазмиды, фагмиды, космиды, фосмиды, бактериальные искусственные хромосомы, вирусную ДНК (например, вируса осповакцины, аденовируса, вируса оспы птиц, вируса ложного бешенства и производных SV40), искусственные хромосомы на основе PI, дрожжевых плазмид, дрожжевых искусственных хромосом, и любые другие векторы, специфические для конкретных представляющих интерес хозяев (таких как бациллы, аспергиллы и дрожжи). Таким образом, например, ДНК может быть включена в любой из множества векторов экспрессии для экспрессии полипептида. Такие векторы включают хромосомные, нехромосомные и синтетические последовательности ДНК. Большое количество подходящих векторов известны специалистам в этой области техники, и коммерчески доступны. Следующие векторы обеспечивают в качестве примера; бактериальные: pQE-векторы («Qiagen»), pBluescript-плазмиды, pNH-векторы, (лямбда-ZAP векторы («Stratagene»); ptrc99a, pKK223-3, pDR540, pRIT2T («Pharmacia»); эукариотические: pXTl, pSG5 («Stratagene»), pSVK3, pBPV, pMSG, pSVLSV40 («Pharmacia»). Однако любой другой плазмидный или любой другой вектор может быть применен до тех пор, пока они способны к репликации и жизнеспособны в хозяине. В настоящем раскрытии могут быть применены векторы с низким числом копий или с высоким числом копий.
Мутантная полинуклеотидная последовательность в векторе экспрессии функционально связана с подходящей последовательностью (подходящими последовательностями) контроля экспрессии (промоторами) для направления синтеза РНК. В особенности, названные бактериальные промоторы включают lad, lacZ, T3, T7, gpt, лямбда PR, PL и trp. Эукариотические промоторы включают немедленный ранний CMV, тимидинкиназу HSV, ранний и поздний SV40, LTRs из ретровируса и мышинный металлотионеин-1. Отбор подходящего вектора и промоторов находится в пределах обычной квалификации специалиста в этой области техники. Вектор экспрессии также содержит сайт связывания рибосомы для инициации трансляции и терминатор транскрипции. Вектор также может включать подходящие последовательности усиления экспрессии. Области промоторов могут быть выбраны из любого требуемого гена с помощью хлорамфеникол-трансферазных (CAT) векторов или других векторов с селективными маркерами. Кроме того, векторы экспрессии предпочтительно содержат один или несколько селектируемых маркерных генов для обеспечения фенотипического признака для отбора трансформированных клеток-хозяев, таких как дигидрофтолат-редуктаза или устойчивость к неомицину, для культивирования эукариотических клеток, или таких как устойчивость к тетрациклину или ампициллину у E. coli.
Транскрипция эукариотической ДНК может быть повышена включением энхансерной последовательности в вектор экспрессии. Энхансеры представляют собой действующие в цис-положении последовательности размером от 10 до 300 п.н. которые увеличивают транскрипцию под действием промотора. Энхансеры могут эффективно увеличивать транскрипцию, когда или 5', или 3' к единице транскрипции. Они также эффективны, если расположены в пределах интрона или в пределах самой кодирующей последовательности. Как правило, применяют вирусные энхансеры, включая энхансеры SV40, цитомегаловирусные энхансеры, полиомные энхансеры и аденовирусные энхансеры. Также широко применяют энхансерные последовательности для системы млекопитающих, такие как энхансер тяжелой цепи мышиного иммуноглобулина.
Системы вектора экспрессии млекопитающих, как правило, также включают селектируемый маркерный ген. Примеры подходящих маркеров включают, ген дигидрофолат-редуктазы (DHFR), ген тимидинкиназы (TK) или прокариотические гены, несущие устойчивость к лекарственным средствам. Первый два маркерных гена предпочтительно применяют в линиях мутантных клеток, которые утратили способность расти без введения тимидина в среду роста. Трансформированные клетки затем могут быть идентифицированы по их способности расти на среде без добавок. Примеры прокариотических генов лекарственной устойчивости, применяемых в качестве маркеров, включают гены, несущие устойчивость к G418, микофеноловой кислоте и гигромицину.
Векторы экспрессии, содержащие сегменты представляющей интерес ДНК, могут быть трансфицированны в клетки-хозяева хорошо известными способами, в зависимости от типа хозяина, производящего клетки. Например, трансфекцию хлоридом кальция обычно применяют для прокариотических клеток-хозяев, в то время как обработка фосфатом кальция, липофекция или электропорация могут быть применены для эукариотических клеток-хозяев. Другие способы, применяемые для трансформации организмов, производящих клетки млекопитающих, включают применение полибренов, слияние протопластов, липосомы, электропорацю и микроинъекцию (смотри, в общем, Sambrook et al. supra).
После введения вектора экспрессии в подходящего хозяина, хозяина поддерживают в условиях, подходящих для экспрессии на высоком уровне введенных мутантных полинуклеотидных последовательностей для получения мутантных полипептидов. Вектор экспрессии, как правило, способен к репликации в организмах хозяина или в виде эписомы, или в виде интергральной части хромосомной ДНК хозяина. Обычно, векторы экспрессии содержат селективные маркеры, например, тетрациклин или неомицин, для обеспечения детекции тех клеток, которые были трансформированы требуемыми последовательностями ДНК (смотри, например, патент США № 4,704,362).
Следовательно, в другом аспекте раскрытия, мутантные полинуклеотиды могут быть созданы с помощью способа восстановительной реассортации. Способ включает генерацию конструкций, содержащих следующие друг за другом последовательности (исходные, кодирующие последовательности), их вставку в подходящий вектор, и их последующее введение в подходящие клетки-хозяева. Реассортация индивидуальных молекулярных идентичностей происходит за счет комбинаторных процессов между следующими друг за другом в конструкции последовательностями, обладающими областями гомологии, или между квази-повторяющимися единицами. Способ реассортация рекомбинирует и/или снижает сложность и степень повторных последовательностей, и что приводит к продукции новых молекулярных типов. Различные обработки могут быть применены для повышения скорости реассортации. Это может включать обработку ультрафиолетовым светом или повреждающими ДНК химическими реагентами и/или применение линий клеток-хозяев, демонстрирующих повышенные уровни «генетической нестабильности». Таким образом, способ реассортации может включать гомологичную рекомбинация или природное свойство квази-повторяющихся последовательностей для направления их собственной эволюции.
Клетки затем размножают, и осуществляется «восстановительная реассортация». Скорость способа восстановительной реассортации может быть повышена введением повреждения в ДНК, если необходимо, in vivo реассортация ориентирована на «интер-молекулярные» процессы, совместно обозначаемые как «рекомбинация», которая у бактерий, в общем, рассматривается как «RecA-зависимое» явление. Настоящее раскрытие может ссылаться на процессы рекомбинации клеток-хозяев для рекомбинации и реассортации последовательностей, или способность клеток опосредовать восстановительные процессы для снижения сложности квази-повторяющихся последовательностей в клетке путем делеции. Данный способ «восстановительной реассортации» происходит с помощью «интра-молекулярного», RecA-независимого процесса. Конечный результат представляет собой реассортацию молекул во всех возможных комбинациях.
В одном из аспектов, организм-или клетка-хозяин включает грамотрицательную бактерию, грамположительную бактерию или эукариотический организм. В другом аспекте раскрытия, грамотрицательная бактерия включает Escherichia coli, или Pseudomonas fluorescens. В другом аспекте раскрытия, грамположительная бактерия включает Streptomyces diversa, Lactobacillus gasseri, Lactococcus lactis, Lactococcus cremoris или Bacillus subtilis. В другом аспекте раскрытия, эукариотический организм включает Saccharomyces cerevisiae, Schizosaccharomyces pombe, Pichia pastoris, Kluyveromyces lactis, Hansenula plymorpha, или Aspergillus niger. В качестве типичных примеров подходящих хозяев, можно отметить: бактериальные клетки, такие как E. coli, Streptomyces, Salmonella typhimurium; клетки грибов, таких как дрожжи; клетки насекомых, такие как Drosophila S2 и Spodoptera Sf9; клетки животных, такие как CHO, COS или меланомы Боуэса; аденовирусы; и растительные клетки. Отбор подходящего хозяина считается относящимся к компетенции специалистов в данной области техники на основе идей настоящего документа.
Кроме того, эукариотические микроорганизмы, такие как дрожжи, культивируемые клетки ткани млекопитающих, также могут быть применены для экспрессии мутантных полипептидов настоящего изобретения (смотри работу Winnacker, “From Genes to Clones,” VCH Publishers, N.Y. N.Y. (1987)). Эукариотические клетки предпочтительны, поскольку ряд подходящих линий клеток-хозяев, способных секретировать интактные иммуноглобулины, были разработаны в этой области техники, и включают линии клеток CHO, различные линии клеток COS, клетки HeLa, линии клетка миеломы, B-клетки или гибридомы. Векторы экспрессии для данных клеток могут включать последовательности контроля экспрессии, такие как начало репликации, промоторы, энхансер (Queen et al. Immunol. Rev. vol. 89, page 49, 1986), и необходимые информационные сайты процессинга, такие как сайты связывания рибосомы, сайты сплайсинга РНК, сайты полиаденилирования и последовательности терминатора транскрипции. Предпочтительные последовательности контроля экспрессии представляют собой промоторы, полученные из генов иммуноглобулинов, цитомегаловируса, SV40, аденовируса, вирус папилломы крупного рогатого скота и тому подобного.
В одном из воплощений, эукариотические клетки-хозяева выбирают из клеточных линий CHO, HEK293, IM9, DS-1, THP-1, Hep G2, COS, NIH 3T3, C33a, A549, A375, SK-MEL-28, DU 145, PC-3, HCT 116, Mia PACA-2, ACHN, Jurkat, MM1, Ovcar 3, HT 1080, Panc-1, U266, 769P, BT-474, Caco-2, HCC 1954, MDA-MB-468, LnCAP, NRK-49F и SP2/0; и мышиных спленоцитов и PBMC кролика. В одном из аспектов, клетку-хозяина из млекопитающего выбирают из линии клеток CHO или HEK293. В одном из специфических аспектов, клетка-хозяин из млекопитающего представляет собой линию клеток CHO-S. В другом специфическом аспекте, система млекопитающих представляет собой линию клеток HEK293. В других воплощениях, эукариотический хозяин представляет собой система дрожжевых клеток. В одном из аспектов, эукариотического хозяина выбирают из дрожжевых клеток S. cerevisiae или дрожжевых клеток picchia.
В других воплощениях, клетки-хозяева из млекопитающих могут быть созданы на коммерческой основе по контракту в исследовательской организации или в организации заказного производства. Например, для рекомбинантных антител или других белков, Lonza (Lonza Group Ltd, Basel, Switzerland) может создавать векторы для экспрессии данных продуктов, применяя технологию GS Gene Expression System™ с продуцирующими клетками-хозяевами CHOKISV или NSO. Клетки-хозяева, содержащие представляющие интерес полинуклеотиды, могут быть культивированы в стандартных питательных средах, модифицированных, чтобы подходить для активации промоторов, отбора трансформантов или амплификации генов. Условия культивирования, такие как температура, pH и тому подобное, были такими как примененные ранее при отборе клеток-хозяев для экспрессии, и будут очевидны специалисту среднего уровня в данной области.
Как было обсуждено выше, оптимизация экспрессии для условно активных ASTR может быть достигнута путем оптимизации примененных векторов (компонентов векторов, таких как промоторы, сайты сплайсинга, 5'-и 3'-концы и фланкирующие последовательности), модификации генов клеток-хозяев для снижения генных делеций и перестроек, изменения активности генов клеток-хозяев in vivo или in vitro способами эволюционирования соответствующих генов, оптимизации ферментов гликозилирования хозяина путем эволюции соответствующих генов, и/или расширенным мутагенезом хромосом клеток-хозяев и выбора стратегий отбора клеток с улучшенными возможностями экспрессии.
Экспрессия белка может быть индуцирована с помощью различных известных способов, и много генетических систем было опубликовано для индукции экспрессии белка. Например, с подходящими системами, введение индуцирующего средства будет индуцировать экспрессию белка. Клетки затем осаждают центрифугированием и супернатант отбрасывают. Периплазматический белок может быть обогащен путем инкубирования клеток с ДНКазой, РНКазой и лизоцимом. После центрифугирования, супернатант, содержащий новый белок, переносят в новый многолуночный планшет и хранят до проведения анализа.
Клетки, как правило, собирают центрифугированием, разрушают физическими или химическими способами, и полученный неочищенный экстракт сохраняют для дополнительной очистки. Микробные клетки, примененные для экспрессии белков, могут быть разрушены любым общепринятым способом, включая циклы замораживания-оттаивания, обработку ультразвуком, механическое разрушение или применение средства лизирования клеток. Такие способы хорошо известны специалистам в этой области техники. Экспрессированный полипептид или его фрагмент могут быть извлечены и очищены из культуры рекомбинантных клеток способами, включающими осаждение сульфатом аммония или этанолом, экстракцию кислотой, анион-или катион-обменную хроматографию, хроматографию на фосфоцеллюлозе, гидрофобную хроматографию, аффинную хроматографию, хроматографию на гидроксиаппатите и лектиновую хроматографию. При необходимости, в завершении конфигурации полипептида могут быть применены стадии рефолдинга белка. Если необходимо, может быть применена высокоэффективная жидкостная хроматография (HPLC) для окончательных стадий очистки. Доступность удобных способов скрининга или отбора с высокой пропускной способностью может способствовать скринингу условно активной ASTR. Экспрессия посредством дисплея на поверхности клеток и технология скрининга (например, как определена выше) может быть применена скрининга мутантных белов для условно активной ASTR.
СКРИНИНГ МУТАНТОВ ДЛЯ ИДЕНТИФИКАЦИИ ОБРАТИМЫХ ИЛИ НЕОБРАТИМЫХ МУТАНТОВ
Идентификацию желаемых молекул наиболее прямым путем осуществляют измерением активности белка в пермиссивном условии и в условии дикого типа. Затем могут быть отобраны мутанты с наибольшим соотношением активностей (пермиссивной/дикого типа), и пермутации точечных мутаций создают, комбинируя индивидуальные мутации стандартными способами. В библиотеке комбинированных пермутированных белков затем проводят скрининг на те белки, которые показывают самую большую дифференциальную активность между пермиссивным состоянием и состоянием дикого типа.
Скрининг активности супернатанов может быть проведен с помощью множества способов, например, с применением анализов активности с высокой пропускной способностью, таких как флуоресцентные анализы, для идентификации белковых мутантов, которые чувствительны по какой-либо желаемой характеристике (температура, pH и т.п.). Например, для проведения скрининга на временно чувствительных мутантов, энзиматическую активность или активность антител каждого индивидуального мутанта определяют при пониженных температурах (таких как 25 градусов Цельсия) и при температурах, при которых функционирует исходный белок (таких как 37 градусов Цельсия), применяя коммерчески доступные субстраты. Скрининг может быть проведен в разнообразных средах, таких как сыворотка и БСА, среди прочего. Реакции первоначально могут быть выполнены в формате многолуночного анализа, таком как 96-луночный анализ, и подтверждены с помощью различных форматов, таких как формат 14-миллилитровых пробирок.
В одном из аспектов, способ дополнительно включает модификацию по меньшей мере нуклеиновых кислот или полипептидов перед тестированием кандидатов на зависящую от условий биологическую активность, в другом аспекте, стадия тестирования (c) дополнительно включает тестирование на улучшенную экспрессию полипептида в клетке-хозяине или организме-хозяине, в дополнительном аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность в рамках pH-диапазона от примерно pH 3 до примерно pH 12. В дополнительном аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность в рамках pH-диапазона от примерно pH 5 до примерно pH 10. В дополнительном аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность в рамках pH-диапазона от примерно pH 6 до примерно pH 8. В дополнительном аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность при pH 6,7 и pH 7,5. В другом аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность в рамках температурного диапазона от примерно 4 градусов C до примерно 55 градусов C. В другом аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность в рамках температурного диапазона от примерно 15 градусов C до примерно 47 градусов C. В другом аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность в рамках температурного диапазона от примерно 20 градусов C до примерно 40 градусов C. В другом аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность при температурах, равных 25 градусов C и 37 градусов C. В другом аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность при нормальном осмотическом давлении, и аномальном (положительном или отрицательном) осмотическом давлении. В другом аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность при нормальной концентрации электролита, и аномальной (положительной или отрицательной) концентрации электролитов. Концентрацию тестируемого электролита выбирают из концентрации кальция, натрия, калия, магния, хлорида, бикарбоната и фосфата, в другом аспекте, стадия тестирования (c) дополнительно включает тестирование на ферментативную активность, которая приводит к стабилизированному продукту реакции.
В другом аспекте, раскрытие обеспечивает очищенное антитело, которое специфически связывается с полипептидом раскрытия или его фрагментом, имеющим ферментативную активность. В одном из аспектов, раскрытие обеспечивает фрагмент антитела, который специфически связывается с полипептидом, имеющим ферментативную активность.
Антитела и основанные на антителах способы скрининга
Раскрытие обеспечивает изолированные или рекомбинантные антитела, которые специфически связываются с ферментом раскрытия. Данные антитела могут быть применены для выделения, идентификации или количественной оценки ферментов раскрытия или родственных полипептидов. Данные антитела могут быть применены для выделения других полипептидов в пределах объёма раскрытия или других родственных ферментов. Антитела могут быть разработаны для связывания с активным сайтом фермента. Таким образом, раскрытие обеспечивает способы ингибирования ферментов с применением антител раскрытия.
Антитела могут быть применены в иммунопреципитации, окрашивании, иммуноаффинных колонках и тому подобном. Если необходимо, то последовательности нуклеиновой кислоты, кодирующие специфические антигены, могут быть созданы с помощью иммунизации с последующим выделением полипептида или нуклеиновой кислоты, амплификации или клонирования и иммобилизации полипептида на матрице раскрытия. Альтернативно, способы раскрытия могут быть применены для модификации структуры антитела, производимого модифицированной клеткой, например, аффинность антитела может быть повышена или снижена. Кроме того, способность создавать или модифицировать антитела может представлять собой фенотип, приданный генно-инженерными способами клетке с помощью способов раскрытия.
Способы иммунизации, получения и выделения антитела (поликлональных и моноклональных) известны специалистам в данной области техники и описаны в научной и патентной литературе, смотри, например, Coligan, CURRENT PROTOCOLS IN IMMUNOLOGY, Wiley/Greene, NY (1991); Stites (eds.) BASIC AND CLINICAL IMMUNOLOGY (7th ed.) Lange Medical Publications, Los Altos, Calif. ("Stites"); Goding, MONOCLONAL ANTIBODIES: PRINCIPLES AND PRACTICE (2d ed.) Academic Press, New York, N. Y. (1986); Kohler (1975) "Continuous cultures of fused cells secreting antibody of predefined specificity", Nature 256:495; Harlow (1988) ANTIBODIES, A LABORATORY MANUAL, Cold Spring Harbor Publications, New York. Помимо традиционных in vivo способов, с применением животных, антитела также могут быть созданы in vitro, например, с применением библиотеки фагового диплея, экспрессирующей рекомбинантный сайт связывания антител. Смотри, например, Hoogenboom (1997) "Designing and optimizing library selection strategies for generating high-affinity antibodies", Trends Biotechnol. 15:62-70; и Katz (1997) "Structural and mechanistic determinants of affinity and specificity of ligands discovered or engineered by phage display", Annu. Rev. Biophys. Biomol. Struct. 26:27-45.
Полипептиды или пептиды могут быть применены для создания антител, которые специфически связываются с полипептидами, например, с ферментами раскрытия. Полученные антитела могут быть применены в процедурах иммуноаффинной хроматографии для выделения или очистки полипептида или чтобы определить, присутствует ли полипептид в биологическом образце. В таких процедурах, белковый препарат, такой как экстракт, или биологический образец контактирует с антителом, способным специфически связываться с одним из полипептидов раскрытия.
В иммуноаффинных процедурах, антитело прикрепляют к твердой подложке, такой как бусина или другой матрикс колонки. Белковый препарат находится в контакте с антителом в условиях, в которых антитело специфически связывается с одним из полипептидов раскрытия. После промывки для удаления неспецифически связанных белков, специфически связавшиеся полипептиды элюируют.
Способность белков в биологическом образце связываться с антителом может быть определена с помощью любой из множества процедур, знакомых специалистам в этой области техники. Например, связывание может быть определено путем мечения антитела обнаруживаемой меткой, такой как флуоресцентный агент, энзиматическая метка или радиоактивный изотоп. Альтернативно, связывание антител с образцом может быть обнаружено с помощью вторичных антител, имеющих на себе такую обнаруживаемую метку. В особенности, анализы включают ELISA анализы, сэндвич-анализы, радиоиммуноанализы и Вестерн-блоттинг.
Поликлональные антитела, созданные против полипептидов раскрытия, могут быть получены путем прямой инъекции полипептидов животному или введения полипептидов животному, не представляющему собой человека. Антитело, полученное таким способом, затем связывается с самим полипептидом. Таким образом, даже последовательность, кодирующая только фрагмент полипептида, может быть применена для создания антитела, которое может связываться с целым нативным полипептидом. Такие антитела затем могут быть применены для выделения полипептидов из клеток, экспрессирующих данный полипептид.
Для получения моноклональных антител, любая методика, которая обеспечивает антитела, получаемые с помощью стабильных культур линии клеток, может быть применена. Примеры включают гибридомную методику, триомную методику, гибридомную методику B-клеток человека и EBV-гибридомную методику (смотри, например, Cole (1985) in Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. pp. 77-96).
Методики, описанные для получения одноцепочечного антитела (смотри, например, патент США № 4,946,778) могут быть адаптированы для получения одноцепочечного антитела с полипептидами раскрытия. Альтернативно, трансгенные мыши могут быть применены для экспрессии гуманизированных антител к данным полипептидам или их фрагментам. Антитела, созданные против полипептидов раскрытия, могут быть применены в скрининге для похожих полипептидов (например, ферментов) из других организмов и образцов. В такой методике, полипептиды из организма контактируют с антителом, и те полипептиды, которые специфически связываются с антителом, детектируют. Любая из описанных выше процедур может быть применена для детекции связывания антител.
МЕТОДИКИ СКРИНИНГА И УСТРОЙСТВА ДЛЯ «ОНЛАЙН» МОНИТОРИНГА
При применении на практике способов раскрытия, множество приборов и методик могут быть применены в сочетании с полипептидами и нуклеиновыми кислотами раскрытия, например, для проведения скрининга полипептидов на ферментативную активность, для проведения скрининга соединений в качестве потенциальных модуляторов, например, активаторов или ингибиторов, ферментативной активности, для антител, которые связываются с полипептидом раскрытия, для нуклеиновых кислоты, которые гибридизуются с нуклеиновой кислотой раскрытия, для проведения скрининга клеток, экспрессирующих полипептид раскрытия и тому подобное.
Матрицы или «биочипы»
Нуклеиновые кислоты или полипептиды раскрытия могут быть иммобилизованы на матрице или нанесены на матрицу. Матрицы могут быть применены для скрининга или мониторинга библиотеки композиций (например, малых молекул, антител, нуклеиновых кислот и т.п.) на их способность к связыванию с нуклеиновой кислотой или полипептидом раскрытия или к модулированию их активности. Например, в одном из аспектов раскрытия, отслеживаемый параметр представляет собой экспрессию транскрипта гена фермента. Один или несколько, или все транскрипты клетки могут быть измерены гибридизацией образца, включающего транскрипты клетки, или, нуклеиновые кислоты, представляющих транскрипты или комплементарные транскриптам из клетки, гибридизацией с иммобилизованными нуклеиновыми кислотами на матрице или «биочипе». Путем применения «комплекта» нуклеиновых кислот на микрочипе, некоторые или все транскрипты клетки могут быть одновременно количественно оценены. Альтернативно, матрицы, включающие геномную нуклеиновую кислоту, также могут быть применены для определения генотипа вновь сконструированного штамма, выполненного способами раскрытия. «Матрицы полипептидов» также могут быть применены для одновременной количественной оценки множества белков. Настоящее раскрытие может быть применено на практике с любой известной «матрицей», также обозначаемой как «микроматрица» или «матрица нуклеиновых кислот» или «микроматрица полипептидов» или «матрица антител» или «биочип» или их вариациями. Матрицы, в общем, представляют собой множество «пятен» или «целевых элементов», каждый целевой элемент включает определенное количество одной или нескольких биологических молекул, например, олигонуклеотидов, иммобилизованных на определенной площади поверхности подложки для специфического связывания с образцом молекулы, например, транскриптов мРНК.
При применении на практике способов раскрытия, любая известная матрица и/или способ изготовления и применения матрицы могут быть включены в целом или частично, или их вариации, как описано, например, в патентах США №№ 6,277,628; 6,277,489; 6,261,776; 6,258,606; 6,054,270; 6,048,695; 6,045,996; 6,022,963; 6,013,440; 5,965,452; 5,959,098; 5,856,174; 5,830,645; 5,770,456; 5,632,957; 5,556,752; 5,143,854; 5,807,522; 5,800,992; 5,744,305; 5,700,637; 5,556,752; 5,434,049; смотри, также, например, WO 99/51773; WO 99/09217; WO 97/46313; WO 96/17958; смотри, также, например, Johnston (1998) "Gene chips: Array of hope for understanding gene regulation", Curr. Biol. 8:R171-R174; Schummer (1997) "Inexpensive Handheld Device for the Construction of High-Density Nucleic Acid Arrays", Biotechniques 23:1087-1092; Kern (1997) "Direct hybridization of large-insert genomic clones on high-density gridded cDNA filter arrays", Biotechniques 23:120-124; Solinas-Toldo (1997) "Matrix-Based Comparative Genomic Hybridization: Biochips to Screen for Genomic Imbalances", Genes, Chromosomes & Cancer 20:399-407; Bowtell (1999) "Options Available-From Start to Finish~for Obtaining Expression Data by Microarray", Nature Genetics Supp. 21:25-32. Смотри также опубликованные заявки на патенты США №№ 20010018642; 20010019827; 20010016322; 20010014449; 20010014448; 20010012537; 20010008765.
КАПИЛЛЯРНЫЕ МАТРИЦЫ
Капиллярные матрицы, такие как GIGAMATRIX™ от Diversa Corporation, Сан Диего, Калифорния, могут быть применены в способах раскрытия. Нуклеиновые кислоты или полипептиды раскрытия могут быть иммобилизованы на матрице или нанесены на матрицу, включая капиллярные матрицы. Матрицы могут быть применены для скрининга или мониторинга библиотеки композиций (например, малых молекул, антител, нуклеиновых кислот и т.п.) на их способность к связыванию с нуклеиновой кислотой или полипептидом раскрытия или к модулированию их активности. Капиллярные матрицы обеспечивают другую систему для удерживания и скрининга образцов. Например, прибор для скрининга образцов может включать множество капилляров, сформированных в матрицу из прилегающих капилляров, в которой каждый капилляр включает, по меньшей мере, одну стенку, определяющую просвет для удерживания образца. Прибор может дополнительно включать промежуточный материал, расположенный между прилегающими капиллярами в матрице, и один или несколько референсных устройств индикации, сформированных в промежуточном материале. Капилляр для скрининга образца, в котором капилляр приспособлен для связывания в матрице капилляров, может включать первую стенку, определяющую просвет для удерживания образца, и вторую стенку, сформированную из фильтрующих материалов, для фильтрации энергии возбуждения, обеспечиваемой в просвет для возбуждения образца. Полипептид или нуклеиновая кислота, например, лиганд, могут быть введены в первый компонент, по меньшей мере, в часть капилляра матрицы капилляров. Каждый капилляр матрицы капилляров может включать, по меньшей мере, одну стенку, определяющую просвет для удерживания первого компонента. Пузырек воздуха может быть введен в капилляр позади первого компонента. Второй компонент может быть введен в капилляр, в котором второй компонент отделен от первого компонента пузырьком воздуха. Представляющей интерес образец может быть введен в качестве первой жидкости, меченной детектируемой частицей, в капилляр матрицы капилляров, в которой каждый капилляр матрицы капилляров включает, по меньшей мере, одну стенку, определяющую просвет для удерживания первой жидкости и детектируемой частицы, и в котором, по меньшей мере, одну стенку покрывают связывающим материалом для связывания детектируемых частицы по меньшей мере с одной стенкой. Способ может дополнительно включать удаление первой жидкости из капиллярной трубки, в которой связана детектируемая частица, поддерживаемая внутри капилляра, и введение второй жидкости в капиллярную трубку. Матрица капилляров может включать множество индивидуальных капилляров, включающих, по меньшей мере, одну внешнюю стенку, определяющую просвет. Внешняя стенка капилляра может представлять собой одну или несколько стенок, слитых вместе. Аналогично, стенка может определять просвет, который имеет цилиндрическую, квадратную, шестиугольную или любую другую геометрическую форму до тех пор, как стенки образуют просвет для удержания жидкости или образца. Капилляры матрицы капилляров могут удерживаться вместе в непосредственной близости с образованием плоской структуры. Капилляры могут быть связаны друг с другом, будучи сплавлены (например, если капилляры выполнены из стекла), склеены, связаны или зажаты бок о бок. Капиллярная матрица может быть сформирована из любого числа индивидуальных капилляров, например, в диапазоне от 100 до 4000000 капилляров. Капиллярная матрица может формировать титровальный микропланшет, имеющий примерно 100000 или более индивидуальных капилляров, связанных друг с другом.
КОНСТРУИРОВАНИЕ УСЛОВНО АКТИВНЫХ АНТИТЕЛ
Условно активные антитела могут быть сконструированы для создания мультиспецифических условно активных антител. Мультиспецифическое антитело может представлять собой антитело с полиэпитопной специфичностью, как описано в WO 2013/170168, включенной в настоящий документ путем отсылки во всей своей полноте. Мультиспецифические антитела включают, без ограничений, антитело, включающее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где единица VHVL имеет полиэпитопную специфичность, антитела, имеющие две или несколько VL-и VH-доменов, где каждая единица VHVL связывается с различным эпитопом, антитела, имеющие две или несколько единичных вариабельных доменов с каждым единичным вариабельным доменом, связывающимся с различным эпитопом, и антитела, включающие один или несколько фрагментов антитела, а также антитела включающие фрагменты антитела, которые связаны ковалентно или нековалентно.
Для конструирования мультиспецифических антител, включая биспецифические антитела, получают фрагменты антител, имеющие, по меньшей мере, одну свободную сульфгидрильную группу. Фрагменты антител могут быть получены из полноразмерных условно активных антител. Условно активные антитела можно расщеплять ферментами для получения фрагментов антитела. Типичные способы ферментативного расщепления включают, без ограничений, пепсин, папаин и Lys-C. Типичные фрагменты антитела включают, без ограничений, Fab, Fab', F(ab')2, Fv, диатела (Db); тандемные диатела (taDb), линейные антитела (смотри, патент США № 5,641,870, пример 2; Zapata et al. Protein Eng. vol. 8, pages 1057-1062 (1995)); неполные антитела, антитела с одиночным вариабельным доменом, миниантитела (Olafsen et al (2004) Protein Eng. Design & Sel. vol. 17, pages 315-323), одноцепочечные молекулы антитела, фрагменты, полученный с помощью Fab-экспрессирующей библиотеки, антиантиидиотипические (анти-Id) антитела, области, определяющие комплементарность (CDRs) и эпитоп-связывающий фрагменты. Фрагменты антител также могут быть получены с применением технологии рекомбинантной ДНК. ДНК, кодирующая фрагменты антител, может быть клонирована в плазмидные векторы экспрессии или фагмидные векторы и экспрессирована непосредственно в E. coli. Способы ферментативного расщепления антител, клонирования ДНК и рекомбинантной экспрессии белка хорошо известны специалистам в этой области техники.
Фрагменты антител могут быть очищены с применением общепринятых методик и могут быть подвергнуты восстановлению для создания свободной тиоловой группы. Фрагменты антитела, имеющие свободную тиоловую группу, могут вступать в реакцию с кросс-линкером, например, бисмалеимидом. Такие перекрёстно сшитые фрагменты антител очищают и затем вводят в реакцию со вторым фрагментом антитела, имеющим свободную тиоловую группу. Конечный продукт, в котором два фрагмента антитела перекрёстно сшиты, очищают. В некоторых воплощениях, каждый фрагмент антитела представляет собой Fab и конечный продукт, в котором два Fabs связаны через бисмалеимид, его обозначают в настоящем документе как бисмалеимидо-(тио-Fab)2, или бис-Fab. Такие мультиспецифические антитела и аналоги антител, включая бис-Fabs, могут быть применены для быстрого синтеза большого числа комбинации фрагментов антител, или структурных вариантов нативных антител или, в особенности, комбинаций антитело/фрагмент.
Мультиспецифические антитела могут быть синтезированы с модифицированными кросс-линкерами, такими, что их дополнительные функциональные группировки могут быть присоединены к мультиспецифическим антителам. Модифицированные кросс-линкеры позволяют прикреплять любую сульфгидрил-реактивную группировку. В одном из воплощений, N-сукцинимидил-S-ацетилтиоацетат (SATA) прикрепляют к бисмалеимиду с образованием бисмалеимидо-ацетилтиоацетата (BMata). После снятия защиты с маскированной тиоловой группы, любая функциональная группа, имеющая сульфгидрил-реактивную (или тиол-реактивную) группировку, может быть присоединена к мультиспецифическим антителам.
Типичные тиол-реактивные реагенты включают мультифункциональный линкерный реагент, захват, то есть аффинный метящий реагент (например, биотин-линкерный реагент), метку для детекции (например, реагент-флуорофор), реагент для твердофазной иммобилизации (например, SEPHAROSE™, полистирол или стекло), или интермедиат лекарственное средство-линкер. N-этилмалеимид (NEM) представляет собой один из примеров тиол-реактивного реагента. Такие мультиспецифические антитела или аналоги антител, имеющие модифицированные кросс-линкеры, могут дополнительно вступать в реакцию с реагентом, представляющим собой группировку лекарственного средства, или с другой меткой. Реакция мультиспецифического антитела или аналога антитела с интермедиатом лекарственное средство-линкер обеспечивает конъюгат мультиспецифическое антитело-лекарственное средство или конъюгат аналог антитела-лекарственное средство, соответственно.
Другие методики изготовления мультиспецифических антител также могут быть применены в настоящем изобретении. Ссылки, описывающие данные методики, включают Milstein and Cuello, Nature, vol. 305, page 537 (1983)), WO 93/08829, and Traunecker et al. EMBO J. vol. 10, page 3655 (1991) по рекомбинантной co-экспрессия двух пар тяжелая цепь-легкая цепь иммуноглобулина, имеющих различные специфичности; (2) патент США № 5,731,168 по конструированию «выступ-во-впадину (knob-in-hole)»; (3) WO 2009/089004A1 по конструированию электростатических эффектов в изготовлении молекул гетеродимерных антител Fc; (4) патент США № 4,676,980 и Brennan et al. Science, vol. 229, page 81 (1985) по кросс-сшивкам двух или нескольких антител или фрагментов; (5) Kostelny et al. J. Immunol. vol. 148, pages 1547-1553 (1992) по применению лейциновых молний для получения биспецифических антител; (6) Hollinger et al. Proc. Natl. Acad. Sci. USA, vol. 90, pages 6444-6448 (1993) по применению технологии изготовления биспецифических фрагментов антител «диатело»; (7) Gruber et al. J. Immunol. vol. 152, page 5368 (1994) по применению одноцепочечных димеров Fv (sFv); (8) Tutt et al. J. Immunol. 147: 60 (1991) по получению триспецифических антител; и (9) US 2006/0025576A1 and Wu et al. Nature Biotechnology, vol. 25, pages 1290-1297 (2007) по конструированию антител с тремя или более функциональными антиген-связывающими сайтами, включая «антитела-осминоги» или «иммуноглобулины с двойным вариабельным доменом» (DVDs).
Мультиспецифические антитела настоящего изобретения также могут быть созданы, как описано в WO/2011/109726.
В одном из воплощений, условно активное антитело для пересечения гематоэнцефалического барьера (BBB) сконструировали для изготовления мультиспецифического антитела (например, биспецифического антитела). Данное мультиспецифическое антитело включает первый антиген-связывающий сайт, который связывается с BBB-R, и второй антиген-связывающий сайт, который связывается с мозговым антигеном. По меньшей мере, первый антиген-связывающий сайт для BBB-R условно активен. Мозговой антиген представляет собой антиген, экспрессированный в мозге, на который могут быть нацелены антитела или малые молекулы. Примеры таких антигенов включают, без ограничения: бета-секретазу 1 (BACEl), амилоид-бета (Aбета), рецептор эпидермального фактора роста (EGFR), рецептор эпидермального фактора роста человека 2 (HER2), Tau, аполипобелок E4 (ApoE4), альфа-синуклеин, CD20, гентингтин, прионовый белок (PrP), обогащенную лейциновыми повторами киназу 2 (LRRK2), паркин, пресенилин 1, пресенилин 2, гамма-секретазу, рецептор смерти 6 (DR6), предшественник бета-амилоида (APP), рецептор нейротрофина p75 (p75NTR) и каспазу 6. В одном из воплощений антиген представляет собой BACEl.
BBB обладает эндогенной транспортной системой, которая опосредуется рецептором BBB (BBB-R), представляющим собой специфический рецептор, благодаря которому осуществляется транспорт макромолекул через BBB. Например, антитело, которое может связываться с BBB-R, может быть перенесено через BBB с помощью эндогенной транспортной системы. Такое антитело может служить в качестве носителя для транспорта лекарственных средств или других агентов через BBB с применением транспортной системы, опосредуемой эндогенным рецепторов BBB, которая пересекает BBB. Такие антитела не нуждаются в высокой аффинности к BBB-R. Сообщается, что антитела, которые не представляют собой условно активные антитела с низкой аффинностью к BBB-R, пересекают BBB более эффективно, чем антитело с высокой аффинностью, как описано в US 2012/0171120
Другой способ конструирования антитела для проникновения в мозг заключается в разработке антител для доставки в мозг через систему лимфатических сосудов центральной нервной системы. Таким образом, антитела могут быть сконструированы для связывания с иммунными клетками или для имитации иммунных клеток, таких как Т-клетки, или с синовиальной или спинномозговой жидкостями, которые перемещаются к центральной нервной системе через лимфатические сосуды. Подробно лимфатические сосуды центральной нервной система описаны, например, в работе Louveau, A. et al. “Structural and functional features of central nervous system lymphatic vessels,” Nature 523, pp. 337-341, 16 July 2015 и в статьях, ссылающихся на эту статью, которые находятся в открытом доступе по состоянию на дату подачи данной заявки.
В отличие от традиционных антител, условно активным антителам не требуется иметь низкую аффинность для BBB-R для пересечения BBB и для того, чтобы остаться внутри мозга. Условно активные антитела могут иметь высокую аффинность для BBB-R на стороне крови в BBB, и могут иметь небольшую аффинность или не иметь аффинность на стороне мозга в BBB. Лекарственные средства, такие как конъюгаты лекарственных средств, могут быть соединены с условно активными антителами для транспортировки с антителом через BBB в мозг.
BBB-R представляет собой трансмембранный белок-рецептор, экспрессируемый на эндотелиальных клетках мозга, которые способны транспортировать молекулы через гематоэнцефалический барьер. Примеры BBB-R включают рецептор трансферррина (TfR), инсулиновый рецептор, рецептор инсулиноподобного фактора роста (IGF-R), рецепторы липопротеина низкой плотности, включая без ограничения белок 1, родственный рецептору липопротеинов низкой плотности (LRP1), и белок 8, родственный рецептору липопротеинов низкой плотности (LRP8), и гепарин-связывающий фактор роста, подобный эпидермальному фактору роста (HB-EGF). Типичный BBB-R в настоящем документе представляет собой рецептор трансферррина (TfR). TfR представляет собой трансмембранный гликобелок (с молекулярной массой, равной примерно 180000) состоящий из двух дисульфид-связанных субъединиц (каждая с кажущейся молекулярной массой, равной примерно 90000), вовлеченный в поглощение железа у позвоночных.
В некоторых воплощениях, настоящее изобретение обеспечивает условно активное антитело, созданное из родительского антитела или антитела дикого типа против BBB-R. Условно активное антитело связывается с BBB-R на стороне крови в BBB, и имеет сниженную аффинность к BBB-R по сравнению с родительским антителом или антителом дикого типа на стороне мозга в BBB. В некоторых других воплощениях, условно активное антитело имеет аффинность к BBB-R в сравнении с антителом дикого типа или родительским антителом на стороне крови в BBB, и не имеет аффинности к BBB-R на стороне мозга в BBB.
Плазма крови представляет собой жидкость организма, которая сильно отличается от мозговой внеклеточной жидкости (ECF). Как обсуждается в работах Somjen (“Ions in the Brain: Normal Function, Seizures, and Stroke,” Oxford University Press, 2004, pages 16 and 33) и Redzic (“Molecular biology of the blood-brain and the blood-cerebrospinal fluid barriers: similarities and differences,” Fluids and Barriers of the CNS, vol. 8:3, 2011), внеклеточная жидкость мозга имеет значительно меньше K+, больше Mg2+ и H+, чем плазма крови. Различия в концентрациях ионов между плазмой крови и ECF мозга приводят к значительным различиям в осмотическом давлении и осмоляльности между этими двумя жидкостями. Таблица 1 показывает концентрации общих ионов в миллимолях для плазмы крови и ECF мозга.
Таблица 1. Общие ионы в плазме (артериальной плазме) и во внеклеточной жидкости мозга (CSF)
Мозговая ECF также содержит значительно больше лактата, по сравнению с плазмой крови, и значительно меньше глюкозы по сравнению с плазмой крови (Abi-Saab et al. “Striking Differences in Glucose and Lactate Levels Between Brain Extracellular Fluid and Plasma in Conscious Human Subjects: Effects of Hyperglycemia and Hypoglycemia”, Journal of Cerebral Blood Flow & Metabolism, vol. 22, pages 271-279, 2002).
Таким образом, существует несколько физиологических условий, которые различаются между двумя сторонами в BBB, таких как pH, концентрации различных веществ (таких как лактоза, глюкоза, K+, Mg2+), осмотическое давление и осмоляльность. Для физиологического состояния pH, плазма крови человека имеет повышенный pH по сравнению с ECF мозга человека. Для физиологического состояния концентрации K+, мозг ECF имеет концентрацию K+ ниже, чем в плазме крови человека. Что касается концентрации Mg2+ при физиологическом состоянии, ECF мозга человека имеет значительно более высокий Mg2+, чем человека плазма крови. Что касается осмотического давления при физиологическом состоянии, ECF мозга человека имеет осмотическое давление, которое отличается от такового плазмы крови человека. В некоторых воплощениях, к физиологическим условиям ECF мозга можно отнести состав, pH, осмотическое давление и осмоляльность ECF мозга пациентов, в особенности, с неврологическим расстройством, которые могут отличаться от физиологического состояния ECF мозга всей популяции.
Настоящее изобретение, таким образом, обеспечивает способ эволюционирования ДНК, которая кодирует матричное антитело против BBB-R для создания библиотеки мутантных ДНК. Библиотеку мутантных ДНК затем экспрессируют для получения мутантных антител. Для мутантных антител проводят скрининг на условно активное антитело, которое связывается с BBB-R, по меньшей мере, в одном физиологическом условии плазмы крови и имеет низкую аффинность или не имеет аффинности к BBB-R по меньшей мере в одном физиологическом условии ECF по сравнению с исходным антителом. Таким образом, отобранное мутантное антитело имеет низкую или высокую аффинность к BBB-R на стороне плазмы крови и имеет низкую аффинность или не имеет аффинности к BBB-R на стороне ECF мозга. Данное отобранное мутантное антитело полезно в качестве условно активного антитела для транспорта через BBB.
Такое условно активное антитело представляет собой преимущественное антитело для пересечения BBB и пребывания в ECF мозга. Низкая аффинность к BBB-R на стороне мозга снижает скорость (или удаляет), условно активное антитело транспортируется обратно через BBB из мозга и обратно в кровь относительно исходного антитела.
В некоторых других воплощениях, настоящее изобретение обеспечивает способ эволюционирования ДНК, которая кодирует исходное антитело против BBB-R, для создания библиотека мутантных ДНК. Библиотеку мутантных ДНК затем экспрессируют для получения мутантных антител. Для мутантных антител проводят скрининг на условно активное антитело, которое связывается с BBB-R, по меньшей мере, в одном физиологическом условии плазмы крови и имеет низкую аффинность или не имеет аффинности к BBB-R, по меньшей мере, в одном физиологическом условии мозга. Таким образом, отобранное мутантное антитело имеет аффинность к BBB-R на стороне плазмы и имеет низкую аффинность или не имеет аффинности к BBB-R на стороне ECF мозга. Такое отобранное мутантное антитело представляет собой условно активное антитело.
Такое условно активное антитело имеет преимущество при пересечении BBB и пребывании в ECF мозга. После связывания с BBB-R на стороне плазмы крови условно активное антитело транспортируется через BBB, а пределы аффинности к BBB-R на стороне ECF мозга от небольшой до отсутствующей подразумевает, что существует низкая вероятность того, что условно активное антитело будет вынесено из мозга.
Аффинность условно активного антитела к BBB-R может быть измерена по его концентрации полумаксимального ингибирования (IC50), которая представляет собой меру того, как много антитела необходимо для ингибирования на 50% связывания известного лиганда BBB-R с BBB-R. Обычный подход заключается в проведении анализа по конкурентному связыванию, такого как конкурентный анализ ELISA. Типичный конкурентный анализ ELISA для измерения IC50 на TfR (BBB-R) - это анализ, при котором возрастающие концентрации анти-TfR антител конкурируют с биотинилированным TfRA за связывание с TfR. Конкурентный ELISA с анти-TfR антителами может быть проведен на планшетах Maxisorp («Neptune», N.J.), покрытых 2,5 мкг/мл очищенного внеклеточного домена мышиного TfR в PBS при 4°C в течение ночи. Планшеты промывали PBS/0,05% Tween 20 и блокировали, применяя блокирующий буфер Superblock PBS («Thermo Scientific», Hudson, N.H.). Титрование каждого индивидуального анти-TfR антитела (серийное разведение 1:3) комбинировали с биотинилированным анти-TfRA (конечная концентрация - 0,5 нМ) и добавляли к планшету в течение 1-го часа при комнатной температуре. Планшеты промывали PBS/0,05% Tween 20, и к планшету добавляли HRP-стрептавидин («Southern Biotech», Бирмингем) и инкубировали в течение 1-го часа при комнатной температуре. Планшеты промывали PBS/0,05% Tween 20, и определяли биотинилированный анти-TfRA, связавшийся с планшетом, применяя субстрат TMB («BioFX Laboratories», Owings Mills).
Высокая IC50 указывает на то, что больше условно активного антитела требуется для ингибирования связывания известного лиганда BBB-R, и, таким образом, что аффинность антитела для этого BBB-R относительно низка. Наоборот, низкая IC50 указывает на то, что меньше условно активного антитела требуется для ингибирования связывания известного лиганда, и, таким образом, что аффинность антитела для этого BBB-R относительно высока.
В некоторых воплощениях, IC50 условно активных антител из BBB-R в плазме крови может составлять от примерно 1 нМ до примерно 100 мкΜ, или от примерно 5 нМ до примерно 100 мкΜ, или от примерно 50 нМ до примерно 100 мкΜ, или от примерно 100 нМ до примерно 100 мкΜ, или от примерно 5 нМ до примерно 10 мкΜ, или от примерно 30 нМ до примерно 1 мкΜ, или от примерно 50 нМ до примерно 1 мкΜ.
УСЛОВНО АКТИВНЫЕ БИОЛОГИЧЕСКИЕ БЕЛКИ ДЛЯ СИНОВИАЛЬНОЙ ЖИДКОСТИ
Заболевания суставов представляют собой одну из основных причин инвалидизации и раннего выхода на пенсию в промышленно развитых странах. Заболевания суставов часто приводят к повреждению сустава, который бывает трудно восстановить. Синовиальная жидкость представляет собой жидкость организма, которую обнаруживают в синовиальной полости суставов (например, колена, бедра, плеча) организма человека или животного между хрящом и синовиальной оболочкой, покрывающей шарнирные поверхности. Синовиальная жидкость обеспечивает питание хряща, а также служит в качестве смазочного материала для суставов. Клетки хряща и секретируемая синовиальной оболочкой жидкость, которая служит в качестве смазочного материала для соприкасающихся поверхностей. Синовиальная жидкость человека включает приблизительно 85% воды. Ее получают из диализата плазмы крови, который сам состоит из воды, растворенных белков, глюкозы, факторов свертывания крови, ионов минеральных компонентов, гормонов и т.п. Белки, такие как альбумин и глобулины присутствуют в синовиальной жидкости и как полагают, играют важную роль в смазывании области соединения. Некоторые другие белки также были обнаружены в синовиальной жидкости человека, включая такие гликопротеины, как альфа-1-кислый гликобелок (AGP), альфа-1-антитрипсин (A1AT) и любрицин.
Синовиальная жидкость имеет композицию, сильно отличающуюся от других частей организма. Таким образом, синовиальная жидкость имеет физиологические условия, которые отличаются от других частей организма, таких как плазма крови. Например, синовиальная жидкость имеет менее чем примерно 10 мг/дл глюкозы, тогда как средний нормальный уровень глюкозы в плазме крови человека равен примерно 100 мг/дл, колеблясь в пределах диапазона между 70 и 100 мг/дл в течение дня. Кроме того, общий уровень белка в синовиальной жидкости равен примерно одной третьей от уровня белка в плазме крови, поскольку большие молекулы, такие как белки, не могут легко проходить через синовиальные мембраны в синовиальную жидкость. Также был обнаружено, что pH синовиальной жидкости человека выше по сравнению с pH в плазме человека (Jebens et al. “On the viscosity and pH of synovial fluid and the pH of blood,” The Journal of Bone and Joint Surgery, vol. 41 B, pages 388-400, 1959; Farr et al. “Significance of the hydrogen ion concentration in synovial fluid in Rheumatoid Arthritis,” Clinical and Experimental Rheumatology, vol. 3, pages 99-104, 1985).
Таким образом, синовиальная жидкость имеет несколько физиологических условий, которые отличаются от условий в других частях организма, таких как физиологические условия в плазме крови. Синовиальная жидкость имеет pH выше, чем в других частях организма, в особенности, в плазме крови. Синовиальная жидкость имеет концентрацию глюкозы ниже, чем в других частях организма, таких как плазма крови. Синовиальная жидкость также имеет концентрацию белка ниже, чем в других организма, таких как плазма крови.
Несколько антител применяли для лечения заболевания суставов путем введения антител в синовиальную жидкость. Например, известно, что синовиальная жидкость в поврежденном суставе содержит много факторов, которые оказывают влияние на прогрессирование остеоартрита (смотри, например, Fernandes, et al. "The Role of Cytokines in Osteoarthritis Pathophysiology", Biorheology, vol. 39, pages 237-246, 2002). Известно, что цитокины, такие как интерлейкин-1 (IL-I) и фактор некроза опухолей-α (TNF-α), которые получают с помощью активированных синовиоцитов, активируют ген экспрессии матриксной металлопротеиназы (MMP). Повышающая регуляция MMP приводит к деградации матриксных и нематриксных белков в суставах. Антитела, которые нейтрализуют цитокины, могут остановить прогрессирование остеоартрита.
Применение антител в качестве лекарственного средства представляет собой многообещающую стратегию для лечения заболеваний суставов. Например, антитела (такие как антитело против аггрекана или аггреканазы) были разработаны для лечения остеоартрита, который на сегодняшний день наиболее распространен среди заболеваний суставов (WO1993/022429A1). Антитело против ацетилированного белка группы с высокой подвижностью box 1 (HMGB1) было разработано для диагностики или лечения заболеваний суставов, представляющих собой воспалительные, аутоиммунные, нейродегенеративные или злокачественные заболевания/нарушения, такие как артрит. Данное антитело может быть применено для детекции ацетилированной формы HMGB1 в синовиальной жидкости (WO 2011/157905A1). Другое антитело (антитело CD20) также было разработано для лечения повреждения соединительной ткани и хряща суставов.
Однако антигены данных антител, часто экспрессируемые в других частях организма, выполняют важные физиологические функции. Антитела против данных антигенов, хотя и эффективны в лечении заболеваний суставов, также могут существенно вмешиваться в нормальные физиологические функции данных антигенов в других частях организма. Следовательно, у пациентов могут возникнуть серьезные побочные эффекты. Таким образом, желательно разработать терапевтические средства, такие как антитела против цитокинов или других антигенов, которые могут предпочтительно связываться с их антигенами (белками или другими макромолекулами) с более высокой аффинностью в синовиальной жидкости, в тоже время не связываться или только слабо связываться с такими же антигенами в других частях организма с целью для снижения побочных эффектов.
Такие условно активные биологические белки могут представлять собой условно активные антитела. В некоторых воплощениях, настоящее изобретение также обеспечивает условно активные биологические белки, которые представляют собой белки, отличные от антител. Например, условно активный иммунный регулятор может быть разработан с помощью настоящего изобретения для предпочтительного регулирования иммунного ответа в синовиальной жидкости, который может иметь меньший эффект или не иметь эффекта на иммунный ответ в других частях организма.
Условно активные биологические белки могут представлять собой условно активные супрессоры сигнала цитокина (SOCS). Многие из данных SOCS вовлечены в ингибирование сигнального пути JAK-STAT. Условно активные супрессоры сигнала цитокина могут предпочтительно подавлять сигнал цитокина в синовиальной жидкости, в то же время не подавлять или подавлять в меньшей степени сигнал цитокина в других частях организма.
В некоторых воплощениях, настоящее изобретение обеспечивает условно активный биологический белок, полученный из биологического белка дикого типа. Условно активный биологический белок имеет пониженную активность, по меньшей мере, в одном физиологическом условии в определенных частях организма, таких как в плазме крови по сравнению с биологическим белком дикого типа, и имеет повышенную активность по сравнению с биологическим белком дикого типа по меньшей мере в одном физиологическом условии в синовиальной жидкости. Такие условно активные биологические белки могут предпочтительно функционировать в синовиальной жидкости, но не действовать или действовать в меньшей степени в других частях организма. Следовательно, такие условно активные биологические белки могут иметь сниженные побочные эффекты.
В некоторых воплощениях, условно активные биологические белки представляют собой антитела против антигена в синовиальной жидкости или экспонированного в синовиальную жидкость. Такие антигены могут представлять собой любые белки, вовлеченные в иммунный ответ/воспаление при заболевании сустава, хотя антиген часто представляет собой цитокин. Условно активное антитело имеет сниженную аффинность с антигеном по сравнению с антителом дикого типа для такого же антигена по меньшей мере в одном физиологическом условии в других частях организма (таких как плазма крови), в то же время имеет более высокую аффинность для антигена по сравнению с антителом дикого типа по меньшей мере в одном физиологическом условии синовиальной жидкости. Такие условно активные антитела могут связываться слабо или совсем не связываться с антигеном в других частях организма, но связываться, например, сильно и прочно или связываются сильнее с антигеном в синовиальной жидкости.
УСЛОВНО АКТИВНЫЕ БИОЛОГИЧЕСКИЕ БЕЛКИ ДЛЯ ОПУХОЛЕЙ
Раковые клетки в солидной опухоли способны формировать микроокружение опухоли вокруг себя для поддержки роста и метастазирования раковых клеток. Микроокружение опухоли представляет собой клеточное окружение, в котором существует опухоль, включая окружающие кровеносные сосуды, иммунные клетки, фибробласты, другие клетки, растворимые факторы, сигнальные молекулы, внеклеточный матрикс и механические сигналы, которые могут способствовать неопластической трансформации, поддерживать рост и инвазию опухоли, защищать опухоль от иммунитета хозяина, содействовать терапевтической устойчивости и обеспечивать ниши для разрастания спящих метастазов. Опухоль и окружающие ее микроокружение близко связаны и постоянно взаимодействуют. Опухоли могут влиять на свое микроокружение, высвобождая внеклеточные сигналы, способствуя ангиогенезу опухоли и индуцируя периферическую устойчивость к иммунитету, в то же время иммунные клетки в микроокружении могут влиять на рост и изменение раковых клеток. Смотри, Swarts et al. “Tumor Microenvironment Complexity: Emerging Roles in Cancer Therapy,” Cancer Res, vol. 72, pages 2473-2480, 2012.
Микроокружение опухоли часто бывает гипоксическим. Поскольку масса опухоли увеличивается, внутренняя часть опухоли продолжает расти ввиду существующего кровоснабжения, что приводит к сложностям в полноценной доставке кислорода к микроокружению опухоли. Парциальное давление кислорода в окружении опухоли в более чем 50% местнораспространенных солидных опухолей ниже 5 мм Hg, по сравнению с парциальным давлением кислорода, равным примерно 40 мм Hg, в плазме крови. Напротив, другие части организма не бывают гипоксическими. Гипоксическое окружение приводит к генетической нестабильности, которая связана с прогрессированием рака, путем ингибирования репарации нуклеотида путём выщепления и ингибирования путей репарации ошибочно спаренных оснований. Гипоксия также вызывает активацию индуцируемого гипоксией фактора 1 альфа (HIFl-a), который индуцирует ангиогенез, и связан с неблагоприятным прогнозом и активацией генов, связанных с метастазированием. Смотри, Weber et al. “The tumor microenvironment,” Surgical Oncology, vol. 21, pages 172-177, 2012 and Blagosklonny, “Antiangiogenic therapy and tumor progression,” Cancer Cell, vol. 5, pages 13-17, 2004.
Кроме того, опухолевые клетки, как правило, зависят от энергии, поступающей от ферментации молочной кислоты, которая не требует кислорода. Таким образом, опухолевые клетки менее склонны пользоваться нормальным аэробным дыханием, которое требует кислорода. Вследствие применения ферментации молочной кислоты микроокружение опухоли становится кислым (pH 6,5-6,9), в отличие от других частей организма, которые, как правило, бывают или нейтральными, или слабощелочными. Например, плазма крови человека имеет pH, равный примерно 7,4. Смотри, Estrella et al. “Acidity Generated by the Tumor Microenvironment Drives Local Invasion,” Cancer Research, vol. 73, pages 1524-1535, 2013. Питательные вещества в микроокружении опухоли также низки из-за относительно высокой потребности в питательных веществах раковых клеток, по сравнению с клетками, локализованными в других частях организма.
Кроме того, микроокружение опухоли также содержит много отчетливых клеточных типов обычно не обнаруживаемых в других частях организма. Данные типы клеток включают эндотелиальные клетки и их предшественников, перициты, гладкомышечные клетки, фибробласты, карцинома-ассоциированные фибробласты, миофибробласты, нейтрофилы, эозинофилы, базофилы, тучные клетки, T-и B-лимфоциты, естественные клетки-киллеры и антиген-презентирующие клетки (APC), таких как макрофаги и дендритные клетки (Lorusso et al. “The tumor microenvironment and its contribution to tumor evolution toward metastasis”, Histochem Cell Biol, vol. 130, pages 1091-1103, 2008).
Соответственно, микроокружение опухоли имеет, по меньшей мере, несколько физиологических условий, которые отличаются от условий в других частях организма, таких как физиологические условия в плазме крови. Микроокружение опухоли имеет pH (кислый), который ниже чем в других частях организма, в особенности, в плазме крови (pH 7,4). Микроокружение опухоли имеет пониженную концентрацию кислорода, по сравнению с другими частями организма, такими как плазма крови. Также микроокружение опухоли имеет пониженную доступность питательных веществ по сравнению с другими частями организма, в особенности, с плазмой крови. Микроокружение опухоли также имеет некоторые отчетливые типы клеток, которые обычно не обнаруживают в другие частях организма, в особенности, в плазме крови.
Некоторые противораковые лекарственные средства включают антитела, которые могут проникать в микроокружение опухоли и действовать в нем в отношении раковых клеток. Противораковая терапия, основанная на применении антител, хорошо разработана и стала одним из самых успешных и важных стратегий лечения пациентов с гематологическими злокачественными опухолями и солидными опухолями. Существует широкая панель антигенов клеточной поверхности, экспрессируемых раковыми клетками человека, которые сверхэкспрессируются, мутированы или селективно экспрессируются в раковых клетках по сравнению с нормальной тканью. Данные антигены клеточной поверхности представляют собой отличные мишени для терапии рака с помощью антител.
Антигены поверхности раковых клеток, к которым могут быть направлены антитела, попадают в несколько различных категорий. Антигены гематопоэтической дифференциации представляют собой гликопротеины, которые, как правило, связаны с группировками кластеров дифференциации (CD) и включают CD20, CD30, CD33 и CD52. Поверхностные антигены клеточной дифференциации представляют собой разнообразную группу гликопротеинов и углеводов, которые обнаруживаются на поверхности как нормальных, так и опухолевых клеток. Антигены, которые вовлечены в проведение сигналов роста и дифференциации часто представляют собой факторы роста и рецепторы факторов роста. Факторы роста, которые представляют собой мишени для антител у пациентов с раком, включают CEA2, рецептор эпидермального фактора роста (EGFR; также известный как ERBB1)12, ERBB2 (также известный как HER2)13, ERBB3 (REF. 18), MET (также известный как HGFR) 19, рецептор инсулиноподобного фактора роста 1 (IGF1R)20, рецептор эфрина A3 (EPHA3) 21, рецептор 1 родственного фактору некроза опухолей (TNF)-апоптоз-индуцирующего лиганда (TRAILR1; также известный как TNFRSF10A), TRAILR2 (также известный как TNFRSF10B) и лиганд рецептора-активатора ядерного фактора-κΒ (RANKL; также известный как TNFSF11) 22. Антигены, вовлеченные в ангиогенез, как правило, представляют собой белки или факторы роста, которые поддерживают формирование новой микроциркуляторной части сосудистого русла, включая фактор роста эндотелия сосудов (VEGF), VEGF-рецептор (VEGFR), интегрин ανβ3 и интегрин α5β1 (REF. 10). Внеклеточный матрикс опухолевой стромы незаменим для поддержания структуры для опухоли. Антигены стромального и внеклеточного матрикса, которые представляют собой терапевтических мишени, включают белок активации фибробластов (FAP) и тенасцин. Смотри, Scott et al. “Antibody therapy of cancer,” Nature Reviews Cancer, vol. 12, pages 278-287, 2012.
Помимо антител, другие биологические белки также подают надежды в лечении раков. Примеры включают опухолевые супрессоры, такие как белок ретинобластомы (pRb), p53, pVHL, APC, CD95, ST5, YPEL3, ST7 и ST14. Некоторые белки, которые индуцируют апоптоз в раковых клетках, также могут быть введены в опухоли для сокращения размера опухолей. Существует, по меньшей мере, два механизма, которые могут индуцировать апоптоз в опухоли: механизм, индуцируемый фактором некроза, и механизм, опосредуемый лигандом Fas-Fas. По меньшей мере, некоторые белки, вовлеченные в любой из двух апоптических механизмов, могут быть введены в опухоли для лечения.
Раковые стволовые клетки представляют собой раковые клетки, которые обладают способностью давать начало клеткам всех типов, обнаруживаемых, в особенности, в раковом образце, и, следовательно, представляют собой формирующие опухоль клетки. Они могут создавать опухоли в процессах формирования стволовых клеток при самообновлении и дифференциации во множество типов клеток. Считается, что раковые стволовые клетки сохраняются в опухоли в виде отдельной популяции и вызывают рецидив и метастазы, давая начало новым опухолям. Развитие специфических терапий, нацеленных на раковые стволовые клетки, может улучшить выживание и качество жизни онкологических пациентов, в особенности, страдающих метастатическими заболеваниями.
Данные лекарственные средства для лечения опухоли часто мешают нормальным физиологическим функциям в других частях организма помимо опухоли. Например, белки, индуцирующие апоптоз в опухоли, также может индуцировать апоптоз в некоторых других частях организма, таким образом, вызывая побочные эффекты. В воплощениях, где антитело применяют для лечения опухоли, антиген антитела также может быть экспрессирован в других частях организма, где они выполняют нормальные физиологические функции. Например, моноклональные антитело бевацизумаб (нацеленное на фактор роста эндотелия сосудов) для остановки роста опухолевых кровеносных сосудов. Данное антитело также может предупреждать рост или репарацию кровеносных сосудов в других частях организма, таким образом, вызывая кровотечение, плохое заживление ран, тромбы и поражение почек. Разработка условно активного биологического белка, который фокусируется на нацеливание главным образом или исключительно на опухоли крайне желательно для более эффективной противоопухолевой терапии.
В некоторых воплощениях, настоящее изобретение обеспечивает условно активный биологический белок, созданный из биологического белка дикого типа, который может представлять собой кандидата для лечения опухоли. Условно активный биологический белок имеет сниженную активность, по меньшей мере, в одном физиологическом условии в частях организма, отличных от микроокружения опухоли, таких как плазма крови, по сравнению с биологическим белком дикого типа, в то же время он имеет повышенную активность, по меньшей мере, в одном физиологическом условии в микроокружении опухоли по сравнению с биологическим белком дикого типа. Такие условно активные биологические белки могут предпочтительно действовать на раковые клетки в микроокружении опухоли для лечения опухоли, и, таким образом, с меньшей вероятностью будут вызывать побочные эффекты. В воплощениях, в которых биологический белок представляет собой антитело против поверхностного антигена опухолевых клеток, где антиген экспонирован в микроокружение опухоли, условно активное антитело имеет сниженную аффинность с антигеном по сравнению с антителом дикого типа в других частях организма, например, не в микроокружении опухоли, в то же время оно имеет более высокую аффинность с антигеном по сравнению с антителом дикого типа в микроокружении опухоли. Такие условно активные антитела могут связываться слабо или совсем не связываться с антигеном в других частях организма, но имеют более сильное связывание, или связываются сильно и прочно, с антигеном в микроокружении опухоли.
В некоторых воплощениях, условно активное антитело представляет собой антитело против белка иммунных контрольных точек, полученное в ингибировании контрольных точек иммунного ответа. Такие условно активные антитела имеют, по меньшей мере, одно из следующего: (1) повышенную аффинность связывания с белком иммунных контрольных точек в микроокружении опухоли по сравнению с антителом дикого типа, из которого получают условно активное антитело, и, (2) сниженную аффинность связывания с белком иммунных контрольных точек не в микроокружении опухоли по сравнению с антителом дикого типа, из которого получают условно активное антитело.
Функция контрольных точек иммунного ответа в качестве эндогенных ингибиторных путей для иммунной системы заключается в поддержании аутотолерантности и модулировании продолжительности и степени иммунного ответа на антигенную стимуляцию, то есть, на чужеродные молекулы, клетки и ткани. Смотри, Pardoll, Nature Reviews Cancer, vol. 12, pages 252-264, 2012. Ингибирование контрольных точек иммунного ответа путем подавления одного или нескольких белков контрольных точек может вызвать суперактивацию иммунной системы, в особенности, Т-клеток, таким образом, индуцируя иммунную систему атаковать опухоли. Белки контрольных точек, подходящие для настоящего изобретения, включают CTLA4 и его лиганды CD80 и CD86, PD1 и его лиганды PDL1 и PDL2, T-клеточный иммуноглобулин и белок муцин-3 (TIM3) и его лиганд GAL9, аттенюатор B-и T-лимфоцитов (BTLA) и его лиганд HVEM (медиатор входа вируса герпеса), рецепторы, такие как иммуноглобулин-подобный рецептор клеток-киллеров (KIR), ген-3 активации лимфоцитов (LAG3) и аденозиновый A2 рецептор (A2aR), а также лиганды B7-H3 и B7-H4. Дополнительные подходящие белки иммунных контрольных точек описаны в работе Pardoll, Nature Reviews Cancer, vol. 12, pages 252-264, 2012 и Nirschl & Drake, Clin Cancer Res, vol. 19, pages 4917-4924, 2013.
CTLA-4 и PD1 представляют собой два наиболее известных белка иммунных контрольных точек. CTLA-4 может ингибировать пути активации Т-клеток (Fong et al. Cancer Res. 69(2):609-615, 2009; и Weber, Cancer Immunol. Immunother, 58:823-830, 2009). Блокада CTLA-4, как было показано, приводит к увеличению активации и пролиферации Т-клеток. Ингибиторы CTLA-4 включают анти-CTLA-4 антитела. Анти-CTLA-4 антитела связываются с CTLA-4 и блокируют взаимодействие CTLA-4 со своими лигандами CD80 или CD86, тем самым блокируя ингибирование иммунных ответов, вызываемых взаимодействием CTLA-4 со своим лигандом.
Известно, что белок контрольной точки PD1 подавляет активность T-клеток в периферической ткани во время воспалительного ответа на инфекцию и ограничивает аутоиммунитет. In vitro блокада PD1 может усилить пролиферацию Т-клеток и продукцию цитокина в ответ на стимуляцию специфическими антигенными мишенями или аллогенными клетками в смешанных реакциях лимфоцитов. Было показано, что сильная корреляция между экспрессией PD1 и снижением иммунного ответа возникает как следствие ингибиторной функции PD1, то есть, индуцированием контрольных точек иммунного ответа (Pardoll, Nature Reviews Cancer, 12: 252-264, 2012). Блокада PD1 может достигаться с помощью множества механизмов, включая антитела, которые связываются с PD1 или с его лигандами, PDL1 или PDL2.
В прошлых исследованиях были обнаружены антитела против нескольких белков контрольных точек (CTLA4, PD1, PD-L1). Данные антитела эффективны в лечении опухоли путем ингибирования контрольных точки иммунного ответа, тем самым суперактивируя иммунную систему, в особенности, Т-клетки, для атаки на опухоли (Pardoll, Nature Reviews Cancer, vol. 12, pages 252-264, 2012). Однако суперактивированные Т-клетки также могут атаковать клетки-хозяева и/или ткани, что приведет к сопутствующему ущербу организму пациента. Таким образом, терапией, основанной на применении данных известных антител для ингибирования контрольных точек иммунного ответа, трудно управлять, и риск для пациента вызывает серьезную озабоченность. Например, одобренное FDA антитело против CTLA-4 несет особое предупреждение из-за его высокой токсичности.
Настоящее изобретение решает проблему сопутствующего ущерба, вызываемого суперактивированными Т-клетками, путем обеспечения условно активных антител против белков иммунных контрольных точек. Данные условно активные антитела преимущественно активируют контрольные точки иммунного ответа в микроокружении опухоли. В то же время, контрольные точки иммунного ответа не в опухолевом микроокружении (микроокружениях), например, в нормальной ткани организма, не ингибируются или ингибируются в меньшей степени условно активными антителами, так что в неопухолевом микроокружении возможность сопутствующего ущерба организму снижается. Эту цель достигают таким конструированием условно активных антител, чтобы они были более активны в микроокружении опухоли, по сравнению с неопухолевым микроокружением.
В некоторых воплощениях, условно активное антитело против белка иммунных контрольных точек может иметь отношение связывающей активности с белком иммунных контрольных точек в микроокружении опухоли к связывающей активности с таким же белком контрольной точки иммунного ответа в неопухолевом микроокружении равное, по меньшей мере, примерно 1,1, или по меньшей мере примерно 1,2, или по меньшей мере примерно 1,4, или по меньшей мере примерно 1,6, или по меньшей мере примерно 1,8, или по меньшей мере примерно 2, или по меньшей мере примерно 2,5, или по меньшей мере примерно 3, или по меньшей мере примерно 5, или по меньшей мере примерно 7, или по меньшей мере примерно 8, или по меньшей мере примерно 9, или по меньшей мере примерно 10, или по меньшей мере примерно 15, или по меньшей мере примерно 20. Типичный анализ для измерения связывающей активности антитела представляет собой анализ ELISA.
Высоко иммуногенные опухоли, такие как злокачественная меланома, представляют собой наиболее уязвимые опухоли для супер-активированной иммунной системы, достигаемой манипулированием иммунной системы. Таким образом, условно активные антитела против белков иммунных контрольных точек могут быть, в особенности, эффективны для лечения таких высоко иммуногенных опухолей. Однако другие типы опухолей также уязвимы для супер-активированной иммунной системы.
В некоторых воплощениях, условно активные антитела против белков иммунных контрольных точек могут быть применены в комбинационной терапии. Например, комбинационная терапия может включать условно активное антитело против молекул поверхности клеток опухоли (опухолевый специфический антиген) и условно активное антитело против белка иммунных контрольных точек. В одном из воплощений, как связывающая активность условно активного антитела с молекулой поверхности клеток опухоли, так и связывающая активность условно активного антитела с белком иммунных контрольных точек могут находиться в единственном белке, то есть, в биспецифическом условно активном антителе, как раскрыто в настоящем документе. В некоторых дополнительных воплощениях, комбинационная терапия может включать условно активное антитело против молекулы поверхности клеток опухоли (опухолевого специфического антигена) и два или нескольких условно активных антитела против двух или нескольких различных белков иммунных контрольных точек. В одном из воплощений, все данные связывающие активности могут находиться в единственном белке, то есть в мультиспецифическом антителе, как раскрыто в настоящем документе.
Поскольку условно активные антитела более активны в микроокружении опухоли по сравнению с активностью антитела дикого типа против такой же молекулы поверхности клеток опухоли или белка контрольных точек, из которого условно активное антитело получают, данные комбинационные терапии могут обеспечивать как увеличенную эффективность, так и значительное снижение в токсичности. Сниженная токсичность данных условно активных антител, в особенности, антител против белков иммунных контрольных точек, может обеспечить безопасное применение мощных антител, таких как антитела ADC, как описано в настоящем документе, а также безопасное применение повышенной дозы антител.
В некоторых воплощениях, условно активные антитела против белков контрольных точек могут находиться в форме пролекарственного средства. Например, условно активные антитела могут представлять собой пролекарственные средства, которые не имеют требуемой активности лекарственного средства до расщепления и превращения в форму лекарственного средства. Пролекарственные средства могут быть расщеплены преимущественно в микроокружении опухоли, или потому что фермент, катализирующий такое расщепление существует преимущественно в микроокружении опухоли или потому что условно активные антитела делают сайт расщепления более доступным в микроокружении опухоли, по сравнению с доступностью сайта расщепления в неопухолевом микроокружении.
УСЛОВНО АКТИВНЫЕ БИОЛОГИЧЕСКИЕ БЕЛКИ В НИШАХ ДЛЯ СТВОЛОВЫХ КЛЕТОК, ВКЛЮЧАЯ ОПУХОЛЕВЫЕ СТВОЛОВЫЕ КЛЕТКИ
Стволовых клетки существуют в организме в окружении, называемом ниша для стволовых клеток, которое представляет собой основную единицу физиологии ткани, объединяющей сигналы, которые опосредуют ответ стволовых клеток на нужды организмов. Тем не менее, ниша также может индуцировать патологии, навязывая аномальные функции стволовым клеткам или другим мишениям. Взаимодействие между стволовыми клетками и их нишами создает динамическую систему, необходимую для поддержания ткани, и для окончательного дизайна терапевтических средств для стволовых клеток (Scadden, “The stem-cell niche as an entity of action”, Nature, vol. 441, pages 1075-1079, 2006). Обычные ниши для стволовых клеток у позвоночных включают нишу для зародышевых стволовых клеток, нишу для гематопоэтических стволовых клеток, нишу для стволовых клеток волосяных фолликулов, нишу для кишечных стволовых клеток и нишу для сердечнососудистых стволовых клеток.
Ниша для стволовых клеток представляет собой специализированное окружение, которое отличается от других частей организма (например, плазмы крови) (Drummond-Barbosa, “Stem Cells, Their Niches and the Systemic Environment: An Aging Network,” Genetics, vol. 180, pages 1787-1797, 2008; Fuchs, “Socializing with the Neighbors: Stem Cells and Their Niche,” Cell, vol. 116, pages 769-778, 2004). Ниша для стволовых клеток представляет собой гипоксический участок, в котором снижено окислительное повреждение ДНК. Прямые измерения уровней кислорода показали, что костный мозг, в общем, представляет собой довольно гипоксический участок (~ l%-2% 02), по сравнению с плазмой крови (Keith et al. “Hypoxia-Inducible Factors, Stem Cells, and Cancer,” Cell, vol. 129, pages 465-472, 2007; Mohyeldin et al. “Oxygen in Stem Cell Biology: A Critical Component of the Stem Cell Niche,” Cell Stem Cell, vol. 7, pages 150-161, 2010). Кроме того, ниши для стволовых клеток нуждаются в некоторых других факторах для регуляции характеристик стволовых клеток внутри ниши: компоненты внеклеточного матрикса, факторы роста, цитокины и факторы физиохимической природы окружения, включая pH, ионную силу (например, концентрация Ca2+) и метаболиты.
Соответственно, ниша для стволовых клеток имеет, по меньшей мере, несколько физиологических условий, которые отличаются от условий в других частях организма, таких как физиологические условия в плазме крови. Ниша для стволовых клеток имеет пониженную концентрацию кислорода (1-2%) по сравнению с другими частями организма, в особенности, с плазмой крови. Другие физиологические условия для ниши для стволовых клеток, включая pH и ионную силу, также могут отличаться от других частей организма.
Терапия стволовыми клетками представляет собой интервенционную стратегию, которая вводит новые стволовые клетки взрослого человека в поврежденную ткань с целью лечения заболевания или повреждения. Данная стратегия зависит от способности стволовых клеток к самообновлению и способности давать начало последующему потомству с различными возможностями для дифференциации. Терапия стволовыми клетками предлагает значительный потенциал для регенерации тканей, которые могут потенциально заменить пораженные и поврежденные области в организме, с минимальным риском отторжения и побочных эффектов. Следовательно, доставка лекарственного средства (биологического белка (например, антитела) или химического соединения) в нишу для стволовых клеток для воздействия на обновление и дифференциацию стволовых клеток представляет собой важную часть терапии стволовыми клетками.
Существует несколько примеров того, как ниши для стволовых клеток влияют на обновление и/или дифференциацию стволовых клеток в млекопитающих. Первая находится в коже, в которой, как известно, β-1 интегрин различно экспрессируется на зародышевых клетках и участвует в ограниченной локализации популяции стволовых клеток через взаимодействие с лигандами гликопротеина матрикса. Вторая находится в нервной системе, где отсутствие тенасцина C изменяет число и функцию нейронных стволовых клеток в субвентрикулярной зоне. Похоже, что тенасцин C модулирует чувствительность стволовых клеток к фактору роста фибробластов 2 (FGF2) и костному морфогенетическому белку 4 (BMP4), что приводит к повышенной предрасположенности стволовых клеток. Для третьей, недавно было показано, что другой матриксный белок, Arg-Gly-Asp-содержащий сиалопротеин, остеопонтин (OPN), вносит вклад в регуляцию гематопоэтических стволовых клеток. OPN взаимодействует с несколькими рецепторами, о которых известно, что они расположены на гематопоэтических стволовых клетках, интегрины CD44 и a4 и α5β1. Продукция OPN может заметно варьировать, в особенности, с активацией остеобластов. Животные, дефицитные по OPN, имеют повышенное число HS-клеток, потому что отсутствие OPN приводит к сверхфизиологической экспансии стволовых клеток в стимулирующих условиях. Следовательно, похоже, что OPN служит ограничением числа гематопоэтических стволовых клеток, лимитируя число стволовых клеток в условиях гомеостаза или при стимуляции. Смотри работу Scadden, “The stem-cell niche as an entity of action,” Nature, vol. 441, pages 1075-1079, 2006.
В работе Xie et al. «Autocrine signaling based selection of combinatorial antibodies that transdifferentiate human stem cells,” Proc Natl Acad Sci U S A, vol. 110, pages 8099-8104, 2013) раскрывают способ применения антитела для воздействия на дифференциацию стволовых клеток. Антитела представляют собой агонистов для рецептора колониестимулирующего фактора гранулоцитов. В отличие от природного колониестимулирующего фактора гранулоцитов, который активирует клетки к дифференциации по предетерминированному пути, изолированный агонист антитела трансдифференцирует клетки миелоидной линии CD34+ костного мозга человека в нейронные предшественники. Melidoni et al. (“Selecting antagonistic antibodies that control differentiation through inducible expression in embryonic stem cells,” Proc Natl Acad Sci U S A, vol. 110, pages 17802-17807, 2013) также раскрывает способ применения антител для вмешательства во взаимодействие между FGF4 и его рецептором FGFR1β, следовательно, блокируют аутокринную FGF4-опосредуемую дифференциацию эмбриональных стволовых клеток.
Знание о функциях лигандов/рецепторов в дифференциации стволовых клеток позволяет разработать стратегию применения биологических белков для нарушения функций данных лигандов/рецепторов с целью регуляции или даже направления дифференциации стволовых клеток. Способность к контролированию дифференциации генетически немодифицированных стволовых клеток человека путем введения антител в нишу для стволовых клеток может обеспечить новые ex vivo или in vivo подходы для терапевтических средств на основе стволовых клеток. В некоторых воплощениях, настоящее изобретение обеспечивает условно активный биологический белок, созданный из биологического белка дикого типа, который способен входить в ниши для стволовых клеток, включая раковые стволовые клетки, для регуляции стволовых клеток или развития опухоли. Условно активный биологический белок имеет сниженную активность по сравнению с биологическим белком дикого типа, по меньшей мере, в одном физиологическом условии в других частях организма, в то же время он имеет повышенную активность по сравнению с биологическим белком дикого типа, по меньшей мере, в одном физиологическом условии в нише для стволовых клеток, например, в окружении раковых стволовых клеток. Такие условно активные биологические белки с меньшей вероятностью будут вызывать побочные эффекты и преимущественно будут действовать в нише для стволовых клеток для регулирования обновления и дифференциации стволовых клеток. В некоторых воплощениях, условно активные биологические белки представляют собой антитела. Такие условно активные антитела могут связываться слабо или совсем не связываться со своими антигенами в других частях организма, но связываться сильно и прочно с антигенами в нише для стволовых клеток.
Условно активные белки для синовиальной жидкости, микроокружения опухоли и ниш для стволовых клеток настоящего изобретения создают способом эволюционирования ДНК, которая кодирует биологический белок дикого типа, для создания библиотеки мутантных ДНК. Библиотеку мутантных ДНК затем экспрессируют для получения мутантных белков. Для мутантных белков проводят скрининг на условно активный биологический белок, который имеет повышенную активность по сравнению с биологическим белком дикого типа, по меньшей мере, в одном физиологическом условии первой части организма, выбираемой из группы, состоящей из синовиальной жидкости, микроокружения опухоли и ниш для стволовых клеток, и имеет сниженную активность по сравнению с биологическим белком дикого типа, по меньшей мере, в одном физиологическом условии во второй части организма, которая отлично от первой части организма. Вторая часть организма может представлять собой плазму крови. Такие отобранные мутантные биологические белки представляют собой условно активные биологические белки, которые имеют высокую активность в первой части организма, но низкую активность во второй части организма.
Такие условно активные биологические белки имеют преимущество в снижении побочных эффектов белка дикого типа, поскольку условно активный биологический белок имеет сниженную активность в других частях организма, где условно активный биологический белок не намерен действовать. Например, если условно активный биологический белок предназначен для введения в микроокружение опухоли, то тот факт, что условно активный биологический белок имеет низкую активность в частях организма, отличных от микроокружения опухоли, означает, что такой условно активный биологический белок с меньшей вероятностью будет вмешиваться в нормальные физиологические функции в частях организма, отличных от микроокружения опухоли. В тоже время, условно активный биологический белок имеет высокую активность в микроокружении опухоли, что придает условно активному биологическому белку повышенную эффективность в лечении опухоли.
Вследствие снижения побочных эффектов, условно активный биологический белок позволяет более безопасно применять значительно более высокие, по сравнению с биологическим белком дикого типа, дозы. В особенности, это выгодно для антитела против цитокина или фактора роста, поскольку антитела против цитокина или фактора роста могут вмешиваться в нормальные физиологические функции цитокина или фактора роста в других частях организма. С помощью условно активного биологического белка, со сниженными побочными эффектами, более высокие дозы могут быть применены для достижения более высокой эффективности.
Условно активные биологические белки для действия в синовиальной жидкости, микроокружении опухоли или нише для стволовых клеток также могут позволить применить новые мишени для лекарственных средств. Применение традиционных биологических белков в качестве терапевтических средств может привести к неприемлемым побочным эффектам. Например, ингибирование рецептора эпидермального фактора роста (EGFR) может очень эффективно подавлять рост опухоли. Однако ингибирование EGFR лекарственными средствами также будет подавлять рост в коже и желудочно-кишечном (GI) тракте. Побочные эффекты делают EGFR неподходящей мишенью для противоопухолевых лекарственных средств. Применение условно активного антитела, которое связывается с EGFR с высокой аффинностью только в микроокружении опухоли, но не связывается или связывается с очень низкой аффинностью в любых других частях организма, позволяет значительно снизить побочные эффекты и в тоже время подавить рост опухоли. В этом случае, путем применения условно активных антител, EGFR может стать эффективной новой мишенью для противоопухолевых лекарственных средств.
В другом примере, подавление цитокинов часто бывает полезным при репарации поврежденного сустава. Однако подавление цитокинов в других частях организма также может подавлять иммунный ответ организма, вызывая иммунноодефицит. Таким образом, цитокины в синовиальной жидкости не представляют собой идеальные мишени для разработки традиционных лекарственных средств на основе антител для лечения повреждения сустава. Однако при применении условно активных антител, которые преимущественно связываются с цитокинами в синовиальной жидкости и в то же время не связываются или только слабо связываются с такими же цитокинами в других частях организма, побочный эффект иммунодефицита может быть резко снижен. Следовательно, цитокины в синовиальной жидкости могут стать подходящими мишенями для репарации повреждения сустава путем применения условно активных антител.
УСЛОВНО АКТИВНЫЕ БИОЛОГИЧЕСКИЕ БЕЛКИ ДЛЯ ОРГАНОВ/ТКАНЕЙ, ВОСПРИИМЧИВЫХ К ВОСПАЛЕНИЮ
В некоторых воплощениях, условно активные биологические белки предназначены для преимущественного воздействия на органы или ткани, которые восприимчивы к воспалению, такие как лимфатический узел, миндалина, аденоид и синус. Дополнительные органы и ткани, которые восприимчивы к воспалению, можно найти в учебниках по анатомии, таких как Gray’s Anatomy by Henry Gray, 41st edition, 2015, опубликованных издательством Elsevier.
Данные органы и ткани обычно демонстрируют, по меньшей мере, одно аномальное условие, когда они воспалены. Например, эти воспаленные органы и ткани могут иметь более высокое осмотическое давление и/или более низкую концентрацию одного или нескольких ионов, по сравнению, например, с нормальными физиологическими условиями других частей организма, таких как плазма крови человека. Кроме того, в таких воспаленных органах и тканях могут быть более высокие концентрации малых молекул молочной кислоты, цитокинов и лейкоцитов по сравнению с нормальными физиологическими условиями в других частях организма, таких как плазма крови человека.
В некоторых воплощениях, условно активные биологические белки могут быть получены с помощью настоящего изобретения с применением аномального условия, выбираемого из одного или нескольких аномальных условий, встречающихся в области воспаления и нормального физиологического условия в плазме крови человека. Такие условно активные биологические белки, таким образом, будет иметь более высокие активности в органах/ткани в воспалительном состоянии, чем активности биологического белка дикого типа, и сниженные активности в плазме крови человека по сравнению с активностями биологического белка дикого типа. Такие условно активные биологические белки могут действовать преимущественно в воспаленной области тела, но будет иметь мало активности или не будут иметь активности в области тела, которая не воспалена.
УСЛОВНО АКТИВНЫЕ ВИРУСНЫЕ ЧАСТИЦЫ
Вирусные частицы давно применяют в качестве средств доставки для транспортировки белков, молекул нуклеиновых кислот, химических соединений или радиоактивных изотопов к клеткам- или тканям-мишеням. Вирусные частицы, которые обычно применяют в качестве средств доставки, включают ретровирусы, аденовирусы, лентивирус, вирус герпеса и аденоассоциированные вирусы. Вирусные частицы распознают свои целевые клетки через белок поверхности, который служит в качестве распознающего белка для специфического связывания с клеточным белком, который служит в качестве целевого белка клеток-мишеней, часто в лиганд-рецептор связывающей системе (работа Lentz, «The reognition event between virus and host cell receptor: a target for antiviral agents,” J. of Gen. Virol. vol. 71, pages 751-765, 1990). Например, вирусный распознающий белок может представлять собой лиганд рецептора целевых клеток. Специфичность между лигандом и рецептором позволяет вирусным частицам специфически распознавать и доставить свое содержимое к клетке-мишени.
Методики разработки искусственных вирусных частиц из вирусов дикого типа хорошо известны специалисту в этой области техники. Известные искусственные вирусные частицы, применяемые в качестве средств доставки, включают частицы на основе ретровирусов (смотри, например, WO 90/07936; WO 94/03622; WO 93/25698; WO 93/25234; патент США № 5,219,740; WO 93/11230; WO 93/10218; патент США № 4,777,127; патент Великобритании № 2,200,651; EP 0 345 242; и WO 91/02805), альфавирусов (например, векторы на основе вируса синдбис, вируса леса Семлики (ATCC VR-67; ATCC VR-1247), вирусов Росс-Ривер (ATCC VR-373; ATCC VR-1246), вирусов венесуэльского энцефалита лошадей (ATCC VR-923; ATCC VR-1250; ATCC VR 1249; ATCC VR-532)) и аденоассоциированных вирусов (смотри, например, WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/1 1984 и WO 95/00655).
В общем, искусственные вирусные частицы конструируют путем вставки чужеродного распознающего белка в вирусную частицу, часто заменяя нативный распознающий белок с помощью рекомбинантной технологии. Чужеродный распознающий белок может представлять собой, например, антитело, рецептор, лиганд или коллаген-связывающий домен. Настоящее изобретение обеспечивает условно активный распознающий белок, который неактивен или менее активен в связывании с клеткой в нормальном физиологическом условии, и который активен или более активен в связывании с клеткой в аномальных условиях. Условно активный распознающий белок может, тем самым, преимущественно связываться с клетками-мишенями пораженной ткани и/или в участке заболевания на основании наличия аномального условия в этом участке и избегает связываться или только минимально связывается с клетками нормальной ткани, где существует нормальное физиологическое условие. Условно активный распознающий белок может быть экспрессирован и представлен на поверхности вирусной частицы.
В некоторых воплощениях, настоящее изобретение обеспечивает способ эволюционирования распознающего белка дикого типа и скрининг на условно активный распознающий белок. Условно активный распознающий белок менее активен в связывании с клеткой по сравнению с распознающим белком дикого типа в нормальном физиологическом условии, и более активен в связывании с клеткой по сравнению с распознающим белком дикого типа в аномальном условии. Такой условно активный распознающий белок может быть вставлен в вирусную частицу с помощью хорошо известной рекомбинантной технологии для создания условно активной вирусной частицы.
В другом воплощении, настоящее изобретение обеспечивает условно активную вирусную частицу, включающую условно активный распознающий белок, который позволяет условно активной вирусной частице распознавать и связываться с целевыми клетками пораженной ткани или в участке заболевания, но не связываться с клетками нормальной ткани. Такая условно активная вирусная частица может предпочтительно доставлять терапевтические средства в вирусной частице к пораженной ткани или в участок заболевания, в то же время условно активная вирусная частица доставляет меньше терапевтических средств или не доставляет терапевтические средства к клеткам нормальной ткани.
В некоторых воплощениях, клетки-мишени в участке заболевания находятся внутри зоны или микроокружения с аномальным pH (например, pH 6,5) или аномальной температурой, по сравнению с pH или температурой в других частях организма, которые здоровы или не страдают от конкретного заболевания или болезненного состояния. В данном воплощении, условно активный распознающий белок, менее активен, чем распознающий белок дикого типа, в связывании с целевым белком клетки-мишени при нормальных физиологических pH или температуре, и более активен, чем распознающий белок дикого типа, в связывании с целевым белком клетки-мишени при аномальных pH или температуре. Таким образом, распознающий белок будем преимущественно связываться в участке, где встречаются аномальные pH или температура, тем самым доставляя лечение к сайту заболевания.
В одном из воплощений, вирусная частица может включать условно активное антитело настоящего изобретения, и в особенности, вариабельную область антитела (например, Fab, Fab', Fv). Такое условно активное антитело может связываться с целевым белком (как антиген) клетки-мишени со сниженной аффинностью, по сравнению с антителом дикого типа в нормальном физиологическом условии, которое может встречаться в месте с нормальной тканью, и с более высокой аффинностью по сравнению с антителом дикого типа в аномальном условии, которое может встречаться в участке заболевания или пораженной ткани. Условно активное антитело может быть получено из антитела дикого типа в соответствии со способом настоящего изобретения.
В воплощении, целевой белок на клетке-мишени включает тирозинкиназные рецепторы фактора роста, которые сверхэкспрессируются на поверхности клеток, например, во многих опухолях. Типичные тирозинкиназные факторы роста представляют собой рецепторы VEGF, рецепторы FGF, рецепторы PDGF, рецепторы IGF, рецепторы EGF, рецепторы TGF-альфа, рецепторы TGF-бета, рецепторы HB-EGF, рецепторы ErbB2, рецепторы ErbB3 и рецепторы ErbB4.
Условно активные ДНК/РНК-модифицирующие белки
ДНК/РНК модифицирующие белки были обнаружены как форма новых инструментов конструирования генома, в особенности, один из них, названный CRISPR, который может позволить исследователям осуществлять микрохирургию на генах, точно и легко изменяя последовательность ДНК в точных местоположениях на хромосомах (редактирование генома, Mali et al. "Cas9 as a versatile tool for engineering biology," Nature Methods, vol. 10, pages 957-963, 2013). Например, серповидноклеточная анемия вызывается мутацией единственного основания, которая потенциально может быть скорректирована с помощью ДНК/РНК-модифицирующих белков. Технология может точно удалять или редактировать частички хромосом, даже путем изменения единственной пары (Makarova et al. “Evolution and classification of the CRISPR-Cas systems,” Nature Reviews Microbiology, vol. 9, pages 467-477, 2011).
Редактирование генома с помощью CRISPR способно быстро и одновременно совершать множество генетических изменений в клетке. Многие расстройств человека, включая сердечные заболевания, диабеты и неврологические заболевания, затронуты мутациями во множестве генов. Данная, основанная на CRISPR, технология имеет потенциал обращать мутации, вызывавшие заболевание, и лечить данные заболевания или по меньшей мере снижать тяжесть данных заболеваний. Редактирование генома опирается на CRISPR-ассоциированные (Cas) белки (семейства ферментов) для разрезания геномной ДНК. Как правило, Cas белок направляется к целевой области в геноме небольшой направляющей РНК, где направляющая РНК соответствует целевой области. Поскольку белок Cas имеет незначительную специфичность последовательности или не имеет специфичности последовательности, то направляющая РНК служит в качестве указателя для белка Cas для достижения точного редактирования генома. В одном из воплощений, один белок Cas может быть применен с множеством направляющих РНК для одновременной коррекции множества генных мутации.
Существует много белков Cas. Примеры включают Cas1, Cas2, Cas3', Cas3'', Cas4, Cas5, Cas6, Cas6e, Cas6f, Cas7, Cas8al, Cas8a2, Cas8b, Cas8c, Cas9, Casl0, Casl0d, Csy1, Csy2, Csy3, Csel, Cse2, Cscl, Csc2, Csa5, Csn2, Csm2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, Csxl4, Csx10, Csxl6, CsaX, Csx3, Csx1, Csxl5, Csf1, Csf2, Csf3, и Csf4 (Makarova et al. “Evolution and classification of the CRISPR-Cas systems,” Nature Reviews Microbiology, vol. 9, pages 467-477, 2011).
Для проведения геномного редактирования, белок Cas должен проникнуть в клетку-мишень. Клетки у субъекта могут иметь различный внутриклеточный pH внутри клеток. Некоторые клетки в пораженной ткани имеют аномальной внутриклеточный pH. Например, некоторые опухолевые клетки склонны иметь щелочной внутриклеточный pH, равный примерно 7,12-7,65, в то же время клетки в нормальной ткани имеют нейтральный внутриклеточный pH в диапазоне 6,99-7,20. Смотри, Cardone et al. “The role of disturbed pH dynamics and the Na(+)/H(+) exchanger in metatasis,” Nat. Rev. Cancer, vol. 5, pages 786-795, 2005. При хронической гипоксии, клетки в пораженной ткани имеют внутриклеточный pH, равный примерно 7,2-7,5, также более высокий, чем внутриклеточный pH нормальной ткани (Rios et al. “Chronic hypoxia elevates intracellular pH and activates Na+/H+ exchange in pulmonary arterial smooth muscle cells,” American Journal of Physiology-Lung Cellular and Molecular Physiology, vol. 289, pages L867-L874, 2005). Кроме того, в ишемических клетках, внутриклеточный pH обычно находится в диапазоне 6,55-6,65, который ниже, чем внутриклеточный pH нормальной ткани (Haqberg, “Intracellular pH during ischemia in skeletal muscle: relationship to membrane potential, extracellular pH, tissue lactic acid and ATP,” Pflugers Arch. vol. 404, pages 342-347, 1985). Больше примеров аномального внутриклеточного pH в пораженной ткани обсуждают в работе Han et al. “Fluorescent Indicators for Intracellular pH,” Chem Rev. vol. 110, pages 2709-2728, 2010.
Настоящее изобретение обеспечивает способ получения условно активного белка Cas из белка Cas дикого типа, в котором условно активный белок Cas имеет, по меньшей мере, одно из следующего: (1) сниженную энзиматическую активность по отношению к активности белка Cas дикого типа в нормальном физиологическом условии внутри нормальной клетки, и (2) повышенную энзиматическая активность по отношению к активности Cas дикого типа в аномальном условии внутри клетки-мишени, такой как одна из пораженных клеток, обсужденных выше. В некоторых воплощениях, нормальное физиологическое условие представляет собой примерно нейтральный внутриклеточный pH, и аномальное условие представляет собой различный внутриклеточный pH, который выше или ниже нейтрального. В одном воплощении, аномальное условие представляет собой внутриклеточный pH, равный от 7,2 до 7,65 или внутриклеточный pH, равный 6,5-6,8.
В некоторых воплощениях, условно активный белок Cas может доставляться к клетке-мишени с помощью условно активной вирусной частицы настоящего изобретения. Условно активная вирусная частица содержит условно активный белок Cas и по меньшей мере одну направляющую РНК для проведения белка Cas в местоположение, в котором белок Cas будет редактировать геномную ДНК.
Мультиспецифические антитела имеют высокую селективность в преимущественном нацеливании ткани, содержащей все или большинство мишеней (антигенов), с которыми может связываться мультиспецифическое антитело. Например, биспецифическое антитело обеспечивает селективность для клетки-мишени, оказывая большее предпочтение клеткам-мишеням, которые экспрессируют как антигены, распознаваемые биспецифическим антителом, по сравнению с клетками, не представляющими собой мишени, которые могут экспрессировать только один из антигенов. Следовательно, благодаря динамизму системы, в равновесии с клетками-мишенями свяжется больше биспецифических антител по сравнению с клетками, непредставляющими собой мишени.
Мультиспецифические антитела, сконструированные в настоящем документе, или их антиген-распознающие фрагменты, могут быть применены в качестве ASTR в химерном антигенном рецепторе настоящего изобретения.
КОНСТРУИРОВАНИЕ ЦИТОТОКСИЧЕСКИХ КЛЕТОК
Как только условно активная ASTR будет идентифицирована на стадии скрининга, химерный антигенный рецептор может быть собран путем лигирования полинуклеотидной последовательности, кодирующей индивидуальные домены для формирования единственной полинуклеотидной последовательности (ген CAR, который кодирует условно активные CAR). Индивидуальные домены включают условно активную ASTR, TM и ISD. В некоторых воплощениях, другие домены также могут быть введены в CARs, включая ab ESD и CSD (фигура 1). Если условно активный CAR представляет собой биспецифический CAR, то ген CAR может быть, например, в следующих конфигурациях в направлении от N-конца к C-концу: N-концевая сигнальная последовательность - ASTR 1 - линкер - ASTR 2 - внеклеточный спейсерный домен - трансмембранный домен - ко-стимулирующий домен - внутриклеточный сигнальный домен. В одном из воплощений, такой ген CAR может включать два или несколько ко-стимулирующих домена.
Альтернативно, полинуклеотидная последовательность, кодирующая условно активные CAR, может быть в следующей конфигурации в направлении от N-конца к C-концу: N-концевая сигнальная последовательность - ASTR 1 - линкер - ASTR 2 - трансмембранный домен - ко-стимулирующий домен - внутриклеточный сигнальный домен. В воплощении, такой CAR может включать два или нескольких ко-стимулирующих домена. Если CAR включает более чем две ASTR, то полинуклеотидная последовательность, кодирующая CAR, может быть в следующей конфигурации в направлении от N-конца к C-концу: N-концевая сигнальная последовательность - ASTR 1 - линкер - ASTR 2 - линкер - (антиген-специфическая нацеливающая область)n - трансмембранный домен - ко-стимулирующий домен - внутриклеточный сигнальный домен. Такой CAR может дополнительно включать внеклеточный спейсерный домен. Каждая ASTR может быть разделена линкером. В воплощении, такой CAR может включать два или нескольких ко-стимулирующих доменов.
Условно активные CAR вводят в цитотоксические клетки с помощью вектора экспрессии. Векторы экспрессии, включающие полинуклеотидную последовательность, кодирующую условно активную CAR изобретения, также обеспечивают в настоящем документе. Подходящие векторы экспрессии включают лентивирусные векторы, гамма ретровирусные векторы, векторов пенящих вируса, векторы аденоассоциированного вируса (AAV), аденовирусные векторов, сконструированные гибридные вирусы, голую ДНК, включая без ограничений опосредованные транспозонами векторы, такие как Sleeping Beauty, Piggybak и интегразы, такие как Phi31. Некоторые другие подходящие векторы экспрессии включают вирус простого герпеса (HSV) и ретровирусные векторы экспрессии.
Аденовирусные векторы экспрессии созданы на основе аденовирусов, которые имеют низкую способность к интеграции в геномную ДНК, но высокую эффективность в транфекции клеток-хозяев. Аденовирусные векторы экспрессии содержат аденовирусные последовательности существенные для: (a) поддержания упаковки вектора экспрессии и (b) в конечном счете, для экспрессии гена CAR в клетке-хозяине. Аденовирусный геном равен 36 т.н. линейной, двухцепочечной ДНК, в котором последовательность чужеродной ДНК (такой как гены CAR) может быть встроена для замены больших кусков аденовирусной ДНК с целью создания вектора экспрессии настоящего изобретения (Grunhaus and Horwitz, “Adenoviruses as cloning vectors,” Seminars Virol. vol. 3, pages 237-252, 1992).
Другой вектор экспрессии основан на аденоассоциированном вирусе, который использует преимущества аденовирусной сопряженной системы. Данный вектор экспрессии AAV имеет высокую частоту интеграции в геном хозяина. Он даже может заразить неделящиеся клетки, что, таким образом, делает его полезным для доставки генов в клетки млекопитающих, например, в культуры ткани или in vivo. Вектор AAV способен заражать широкий диапазон хозяев. Подробная информация о генерации и применении векторов AAV приведена в патентах США №№ 5,139,941 и 4,797,368.
Ретровирусные векторы экспрессии способны интегрироваться в геном хозяина, доставляя большие количество чужеродного генетического материала, инфицируя широкий спектр видов и типов клеток и упаковываясь в специальных линиях клеток. Ретровирусный вектор конструируют путем вставки нуклеиновой кислоты (например, нуклеиновой кислоты, кодирующей CAR) в вирусный геном в определенных положениях с получением вируса с дефектной репликацией. Хотя ретровирусные векторы способны инфицировать огромное множество типов клеток, для интеграции и стабильной экспрессии в гене CAR требуется деление клеток-хозяев.
Лентивирусные векторы получают из лентивирусов, которые представляют собой сложные ретровирусы, которые, помимо обычных ретровирусных генов gag, pol и env, содержат другие гены с регуляторной или структурной функцией (патенты США №№ 6,013,516 и 5,994,136). Некоторые примеры лентивирусов включают вирусы иммунодефицита человека (HIV-1, HIV-2) и вирус иммунодефицита обезьян (SIV). Лентивирусные векторы были созданы с помощью множественной аттенюации вирулентности генов HIV, например, гены env, vif, vpr, vpu и nef были удалены, что сделало вектор биологически безопасным. Лентивирусные векторы способны инфицировать неделящиеся клетки и могут быть применены как для in vivo, так и для ex vivo переноса генов и экспрессии в гене CAR (патент США № 5,994,136).
Векторы экспрессии, включающие ген условно активных CAR, могут быть введены в клетку-хозяина любым способом, известным специалисту в этой области техники. Векторы экспрессии могут включать вирусные последовательности для трансфекции, если необходимо. Альтернативно, векторы экспрессии могут быть введены путем слияния, электропорации, баллистической трансфекции, трансфекции, липофекции или тому подобного. Клетки-хозяева можно растить и размножать в культуре перед введением вектора экспрессии, с последующей подходящей обработкой для введения и интеграции векторов. Клетки-хозяева затем размножают и проводят скрининг благодаря маркеру, присутствующему в векторах. Различные маркеры, которые могут быть применены, включают hprt, устойчивость к неомицину, тимидинкиназу, устойчивость к гигромицину и т.п. Как применены в настоящем документе, термины «клетка», «линия клеток» и «культура клеток» могут быть применены взаимозаменяемо. В некоторых воплощениях, клетки-хозяева представляют собой T-клетку, NK-клетку и NKT-клетку.
В другом аспекте, настоящее изобретение также обеспечивает генно-инженерные цитотоксические клетки, которое включают и стабильно экспрессируют условно активные CAR изобретения. В одном из воплощений, генно-инженерные клетки включают T-лимфоциты (T-клетки), наивные T-клетки (TN), T-клетки памяти (например, центральные T-клетки памяти (TCM), эффекторные клетки памяти (TEM)), естественные клетки-киллеры и макрофаги, способные давать начало терапевтически соответствующему потомству. В другом воплощении, генно-инженерные клетки представляют собой аутологичные клетки. Примеры подходящих T-клеток включают CD4+/CD8-, CD4-/CD8+, CD4-/CD8-или CD4+/CD8+ T-клетки. T-клетки могут представлять собой смешанную популяцию клеток CD4+/CD8+ и CD4-/CD8+ или популяцию единственного клона. T-клетки CD4+ изобретения также могут продуцировать IL-2, IFN-гамма, TNF-альфа и другие T-клеточные эффекторные цитокины, при совместном культивировании in vitro с клетками, экспрессирующими целевые антигены (например, опухолевые клетки CD20+ и/или CD 19+). T-клетки CD8+ изобретения могут лизировать клетки, экспрессирующие целевой антиген. В некоторых воплощениях, T-клетки может представлять собой любые одну или несколько из наивных клеток CD45RA+ CD62L+, центральных клеток памяти CD45RO CD62I7, эффекторных клеток памяти CD62L или их комбинаций (Berger et al. “Adoptive transfer of virus-specific and tumor-specific T cell immunity,” Curr. Opin. Immunol. vol. 21, pages 224-232, 2009).
Генно-инженерные цитотоксические клетки могут быть получены с помощью стабильно трансфецируемых клеток-хозяев с вектором экспрессии, включающим ген CAR изобретения. Дополнительные способы получения генно-инженерных цитотоксических клеток с применением вектора экспрессии включают способы химической трансформации (например, с помощью кальция фосфата, дендримеров, липосом и/или катионных полимеров), способы нехимической трансформации (например, электропорация, оптическая трансформация, электроперенос генов и/или гидродинамическая доставка) и/или способы, основанные на частицах (например, импалефекция, с помощью гена gun и/или магнитофекция). Трансфицированные клетки, демонстрирующие присутствие единственного интегрированного неперестроенного вектора и экспрессирующие условно активные CAR, могут быть размножены ex vivo.
Физические способы введения вектора экспрессии в клетки-хозяева включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и тому подобное. Способы получения клеток, включающих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в этой области техники. Смотри, например, Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York). Химические способы введения вектора экспрессии в клетку-хозяина включают системы коллоидной дисперсии, такие как макромолекулярные комплексы, нанокапсулы, микросферы, бусины и липидные системы, включая эмульсии масло в воде, мицеллы, смешанные мицеллы и липосомы.
После того, как вектор экспрессии, содержащий ген CAR, вводят в клетки-хозяева, ген CAR экспрессируют, получая, таким образом, молекулу CAR, которая может связываться с целевым антигеном. Полученная молекула CAR превращается в трансмембранный белок в силу наличия трансмембранного домена. Затем клетки-хозяева будут преобразованы в клетки CAR, такие как CAR-T-клетки. Способ получения сконструированных цитотоксических клеток с молекулой CAR, например, CAR-T клеток, описан, например, в следующих работах (Cartellieri et al. “Chimeric antigen receptor-engineered T cells for immunotherapy of cancer,” Journal of Biomedicine and Biotechnology, vol. 2010, Article ID 956304, 2010; и Ma et al. «Versatile strategy for controlling the specificity and activity of engineered T cells,” PNAS, vol. 113, E450-E458, 2016).
Независимо от того, до или после генетической модификации цитотоксических клеток для экспрессии желаемых условно активных CAR, клетки могут быть активированы и размножены с помощью таких способов, как описаны, например, в патентах США №№ 6,352,694; 6,534,055; 6,905,680; 6,692,964; 5,858,358; 6,887,466; 6,905,681; 7,144,575; 7,067,318; 7,172,869; 7,232,566; 7,175,843; 5,883,223; 6,905,874; 6,797,514; 6,867,041; и в US 20060121005. Например, T-клетки изобретения могут быть размножены путем контакта с поверхностью, к которой прикреплено средство, стимулирующее ассоциированный с комплексом CD3/TCR сигнал, и лиганд, стимулирующий ко-стимулирующую молекулу на поверхности T-клеток. В особенности, популяции T-клеток могут быть стимулированы путем контакта с анти-CD3 антителом или его антиген-связывающий фрагментом, или анти-CD2 антителом, иммобилизованным на поверхности, или путем контакта с активатором протеинкиназы C (например, бриостатином) в сочетании с кальциевым ионофором. Для совместной стимуляции вспомогательной молекулы на поверхности T-клеток, применяют лиганд, который связывается со вспомогательной молекулой. Например, T-клетки могут контактировать с анти-CD3 антителом и анти-CD28 антителом, в условиях подходящих для стимуляции пролиферации T-клеток. Для стимуляции пролиферации или CD4+ T-клеток, или CD8+ T-клеток, анти-CD3 антитела и анти-CD28 антитела. Примеры анти-CD28 антител включают 9.3, B-T3, XR-CD28 («Diaclone», Besançon, Франция) и данные антитела могут быть применены в изобретении, как и другие способы, хорошо известные в данной области техники (Berg et al. Transplant Proc. 30(8):3975-3977, 1998; Haanen et al. J. Exp. Med. 190(9):13191328, 1999; Garland et al. J. Immunol. Meth. 227(1-2):53-63, 1999).
В различных воплощениях, настоящее изобретение обеспечивает фармацевтические композиции, включающие фармацевтически приемлемое вспомогательное вещество и терапевтическии эффективное количество условно активных CAR изобретения. Условно активные CAR в композиции могут представлять собой любой один или несколько полинуклеотидов, кодирующих CAR, белок, включающий CAR, или генетически модифицированные клетки, экспрессирующие белок CAR. Белок CAR может быть представлен в форме фармацевтически приемлемой соли. Фармацевтически приемлемые соли относится к солям, которое могут быть применены как соли терапевтического белка в фармацевтической промышленности, включая например, соли натрия, калия, кальция и тому подобное, и аминные соли прокаина, дибензиламина, этилендиамина, этаноламина, метилглюкамина, таурина и тому подобное, а также кислотно-аддитивные соли, такие как гидрохлориды, и основные аминокислоты и тому подобное.
Фармацевтически приемлемое вспомогательное вещество может включать любое вспомогательное вещество, которое полезно при получении фармацевтической композиции, которое, в общем, безопасно, нетоксично и соответствует пожеланиям, и включает вспомогательные вещества, которые приемлемы для применения в ветеринарии, а также для фармацевтического применения у людей. Такие вспомогательные вещества могут быть твердыми, жидкими, мягкими или, в случае аэрозольной композиции, газообразными. Один тип вспомогательного вещества включает фармацевтически приемлемые носители, которые могут быть добавлены для усиления или стабилизации композиции, или способствуют получению композиции. Жидкие носители включают сироп, арахисовое масло, оливковое масло, глицерин, солевой раствор, спирты и воду. Твердые носители включают крахмал, лактоза, кальция сульфат дигидрат, каолин, магния стеарат или стеариновую кислоту, тальк, пектин, гуммиарабик, агар и желатин. Носитель также может включать материал с замедленным высвобождением, такой как глицерилмоностеарат или глицерилдистеарат, один или с воском.
Фармацевтически приемлемые носители определяют, частично, особенностями вводимой композиции, а также особенностями способа, применяемого для введения композиции. Соответственно, существует огромное множество подходящих составов фармацевтических композиций настоящего изобретения. Множество водных носителей может быть применено, например, буферный солевой раствор и тому подобное. Данные растворы стерильны и, в общем, свободны от нежелаемых веществ. Данные композиции могут быть стерилизованы с помощью общепринятых, хорошо известных способов стерилизации. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, как требуется для приближения к физиологическим условиям, таким как средства для регулировки pH и буферы, средства для регулировки токсичности и тому подобное, например, натрия ацетат, натрия хлорид, калия хлорид, кальция хлорид, натрия лактат и тому подобное. Концентрация в CAR в данных составах может изменяться в широких пределах, и будет отобрана, в первую очередь, на основе объемов жидкости, вязкости и массы организма в соответствии с особенностями, выбранном способом введения и потребностями пациента.
В различных воплощениях, фармацевтические композиции в соответствии с изобретением могут быть составлены для доставки с помощью любого подходящего пути введения. «Путь введения» может относиться к любому пути введения, известному в этой области техники, включая без ограничений аэрозольный, назальный, пероральный, внутривенный, внутримышечный, внутрибрюшинный, ингаляцию, чрезслизистый, трансдермальный, парентеральный, имплантируемый насос, непрерывную инфузию, местное применение, капсулы и/или инъекции.
Фармацевтические композиции в соответствии с изобретением могут быть инкапсулированы, таблетированы или получены в виде эмульсии или сиропа для перорального введения. Фармацевтические композиции изготовляют в соответствии с общепринятыми в фармацевтике методиками, включая измельчение, смешивание, гранулирование и прессование, при необходимости, для форм в виде таблеток; или измельчение, смешивание и заполнение для форм в виде твердых желатиновых капсул. Если применяют жидкий носитель, то препарат может находиться в форме сиропа, эликсира, эмульсии или водной или неводной суспензии. Такая жидкая композиция может быть введена непосредственно п.o. или помещена в мягкую желатиновую капсулу.
Фармацевтические композиции могут быть составлены как: (a) жидкие растворы, как такие, в которых эффективное количество упакованной нуклеиновой кислоты суспендировано в растворителях, таких как вода, солевой раствор или PEG 400; (b) капсулы, пакетики-саше или таблетки, каждый содержащий заранее установленное количество активного ингредиента, в виде жидкостей, твердых веществ, гранул или желатина; (c) суспензии в подходящих жидкостях; и (d) подходящие эмульсии. В особенности, подходящие лекарственные формы включают, без ограничений, таблетки, пилюли, порошок, драже, капсулы, жидкости, пастилки, гели, сиропы, пасты, суспензии и т.п.
Твердые композиции включают подходящие твердые вспомогательные вещества, такие как углеводные или белковые наполнители, включая, например, сахара, такие как лактоза, сахароза, маннитол, или сорбитол; крахмал из кукурузы, пшеницы, риса, картофеля или из других растений; целлюлозу, такую как метилцеллюлоза, гидроксипропилметилцеллюлоза и натрия карбоксиметилцеллюлоза; и камеди, включая гуммиарабик и трагакант; и белки, например, желатин и коллаген. Средства для улучшения распадаемости таблеток или солюбилизирующие средства могут быть добавлены, такие как поперечносшитый поливинилпирролидон, агар, альгиновая кислота или их соль, такая как натрия альгинат. Формы таблетки могут включать одно или несколько из следующего: лактоза, сахароза, маннитол, сорбитол, кальция фосфаты, кукурузный крахмал, картофельный крахмал, трагакант, микрокристаллическая целлюлоза, камедь, желатин, коллоидный диоксид кремния, кроскармеллоза натрия, тальк, магния стеарат, стеариновая кислота и другие вспомогательные вещества, окрашивающие вещества, наполнители, связующие, разбавители, буферы, увлажняющие средство, консерванты, ароматизаторы, красители, средства для улучшения распадаемости таблеток и фармацевтически приемлемые носители.
Жидкие суспензии включают условно активные CAR, в смеси с вспомогательными веществами, подходящими для производства водных суспензий. Такие вспомогательные вещества включают суспендирующее средство, такое как натрия карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрия альгинат, поливинилпирролидон, трагакантовую камедь и аравийскую камедь, и диспергирующие или смачивающие средства, таких как природный фосфолипид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтилен-оксицетанолом), продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и гекситола (например, полиоксиэтилен сорбит моноолеат), или продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и ангидрида гекситола (например, полиоксиэтилен сорбитан моноолеат). Жидкие суспензии также могут содержать один или несколько консерванты таких как этил или н-пропил п-гидроксибензоат, одно или несколько красящих средств, один или несколько ароматизаторов и один или несколько подсластителей, таких как сахароза, аспартам или сахарин. Осмоляльность композиций может быть отрегулирована.
Формы в виде пастилок могут включать активный ингредиент в ароматизаторе, как правило, сахарозе и камеди или трагаканте, а также пастилки, включающие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и эмульсии камеди, гели и тому подобное, содержащие, помимо активного ингредиента, известные в этой области техники носители. Признано, что условно активные CAR, при пероральном введении, должны быть защищены от расщепления. Как правило, этого достигают либо путем объединения условно активных CAR с композицией, чтобы сделать их устойчивыми к кислому и энзиматическому гидролизу или путем упаковки условно активных CAR в подходящий стойкий носитель, такой как липосома. Средства защиты белков от расщепления хорошо известны в этой области техники. Фармацевтические композиции могут быть инкапсулированы, например, в липосомы, или в композицию, которая обеспечивает медленное высвобождение активного ингредиента.
Фармацевтическая композиция может быть составлена как аэрозольные композиции (например, они могут быть «распыляемыми») для введения с помощью ингаляции. Аэрозольные композиции могут быть помещены в находящиеся под давлением приемлемые пропелленты, такие как дихлордифторметан, пропан, азот и тому подобное. Подходящие составы для ректального введения включают, например, суппозитории, которые состоят из упакованной нуклеиновой кислоты с основой суппозитория. Подходящие основы для суппозитория включают природные или синтетические триглицериды или парафиновые углеводороды, кроме того, также возможно применять желатиновые ректальные капсулы, которые состоят из комбинации упакованной нуклеиновой кислоты с основой, включая, например, жидкие триглицириды, полиэтиленгликоли и парафиновые углеводороды.
Фармацевтическая композиция может быть составлена для парентерального введения, такого, например, как с помощью внутрисуставной (в суставы), внутривенного, внутримышечного, внутрикожного, внутрибрюшинного и подкожного путей, включая водные и неводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические факторы и растворенные вещества, которые делают композицию изотонической с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства, солюбилизаторы, загустители, стабилизаторы и консерванты, в практике настоящего изобретения, композиции могут быть введены, например, с помощью внутривенной инфузии, перорально, местно, внутрибрюшинно, интравезикально или интратекально. В одном из аспектов, парентеральные способы введения представляют собой предпочтительные способы введения для композиций, включающих белок CAR или генно-инженерные цитотоксические клетки. Композиции может быть удобно вводить в стандартной лекарственной форме, и они могут быть получены любыми способами, хорошо известными в области фармацевтики, например, как описано в руководстве Remington's Pharmaceutical Sciences, Mack Publishing Co. Easton Pa. 18th Ed. 1990. Композиции для внутривенного введения могут содержать фармацевтически приемлемый носитель, такой как стерильная вода или солевой раствор, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения, гидрогенизированные нафталены и тому подобное.
Фармацевтическая композиция может быть введена с помощью, по меньшей мере, одного способа, выбираемого из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, внутрикапсулярного, внутрихрящевого, внутриполостного, внутрижелудочкового, внутримозжечкового, интрацеребровентрикулярного, внутрь толстой кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиальной, внутрикостного, внутритазового, внутриперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинномозгового, внутрисуставного, интраторакального, внутриматочного, интравезикального, болюсного, вагинального, ректального, буккального, подъязычного, интраназального или трансдермального. Способ необязательно может дополнительно включать введение, перед, одновременно или после условно активных CAR, по меньшей мере, одной композиции, включающей эффективное количество, по меньшей мере, одного соединения или белка, выбранного из, по меньшей мере, одного из следующего: детектируемая метка или репортер, антагонист TNF, противоревматическое средство, мышечный релаксант, наркотик, нестероидное противовоспалительное лекарственное средство (NSAK), анальгетик, анестетик, седативное средство, местный анестетик, нейромышечный блокатор, противомикробное средство, антипсориазное средство, кортикостероид, анаболическое стероидное средство, эритропоэтин, иммунизация, иммуноглобулин, иммуносупрессор, гормон роста, гормон-замещающее лекарственное средство, радиофармацевтическое средство, антидепрессант, антипсихотик, стимулятор, противоастматические средства, бета-агонист, ингаляционное стероидное средство, эпинефрин или его аналог, цитотоксическое или другое противораковое средство, анти-метаболит, такой как метотрексат, или антипролиферативное средство.
Типы раков, которые можно лечить с помощью генно-инженерных цитотоксических клеток или фармацевтических композиций изобретения включают, карциному, бластому и саркому, и определенные лейкемии или лимфоидные злокачественные опухоли, доброкачественные и злокачественные опухоли, и злокачественные опухоли, например, саркому, карциному и меланомы. Раки могут представлять собой нетвердые опухоли (такие как гематологические опухоли) или твердые опухоли. Также включены опухоли/раки взрослых и опухоли /раки детей.
Гематологические раки представляют собой раки крови или костного мозга. Примеры гематологических (или гематогенных) раков включают лейкемии, включая острую лейкемию (такую как острая лимфоцитарная лейкемия, острая миелоцитарная лейкемия, острая миелогенная лейкемия и миелобластная, примиелоцитарная, миеломоноцитарная, моноцитарная и эритролейкемия), хронические лейкемии (такие как хроническая миелоцитарная (гранулоцитарная) лейкемия, хроническая миелогенная лейкемия и хроническая лимфоцитарная лейкемия), истинную полицитемию, лимфому, болезнь Ходжкина, неходжкинскую лимфому (медленно растущую и высокой степени злокачественности формы), множественные миеломы, макроглобулинемию Вальденстрема, болезнь тяжелых цепей, миелодиспластический синдром, лейкоз ворсистых клеток и миелодисплазию.
Твердые опухоли представляют собой ткани с аномальными массами, которые, как правило, не содержат цист или жидких областей. Твердые опухоли могут быть доброкачественными или злокачественными. Различные типы твердых опухолей называют по типу клеток, которые их формируют (такие как саркома, карцинома и лимфомы). Примеры твердых опухолей, таких как саркома и карцинома, включают фибросаркомы, миксосаркому, липосаркому, хондросаркому, остеосаркому и другие саркомы, синовиому, мезотелиомы, опухоль Юинга, леймиосаркому, рабдомиосаркому, карциному толстой кишки, лимфоидные злокачественные опухоли, рак поджелудочной железы, рак молочной железы, рак легкого, рак яичников, рак предстательной железы, гепатоцеллюлярную карциному, плоскоклеточный рак, базально-клеточную карциному, аденокарциному, карциному потовых желез, медуллярную карциному щитовидной железы, папиллярную карциному щитовидной железы, феохромоцитому сальной железы карциному, папиллярную карциному, папиллярные аденокарциномы, медуллярную карциному, бронхогенную карциному, почечно-клеточную карциному, гепатому, карциному желчных протоков, хориокарциному, опухоль Вильмса, рак шейки матки, опухоль яичка, семиному, карциному мочевого пузыря, меланому и опухоли ЦНС (такие как глиома (такие как глиома мозгового ствола и смешанные глиомы), глиобластома (также известную как мультиформная глиобластома), астроцитома, лимфома ЦНС, герминому, медуллобластома, шваннома краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, менингиома, нейробластома, ретинобластома и метастазы головного мозга).
Настоящее изобретение также обеспечивает медицинское устройство, включающее, по меньшей мере, один белок CAR, полинуклеотидную последовательность, кодирующую CAR, или клетку-хозяин, экспрессирующую CAR, в котором устройство подходит для введения, по меньшей мере, одного условно активного CAR с помощью, по меньшей мере, одного способа, выбираемого из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, внутрикапсулярного, внутрихрящевого, внутриполостной, внутрижелудочкового, внутримозжечкового, интрацеребровентрикулярного, внутрь толстой кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиальной, внутрикостного, внутритазового, внутриперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинномозгового, внутрисуставной, интраторакального, внутриматочного, интравезикального, болюсного, вагинального, ректального, буккального, подъязычного, интраназального или трансдермального.
В дополнительном аспекте, изобретение обеспечивает набор, включающий, по меньшей мере, один белок CAR, полинуклеотидную последовательность, кодирующую CAR, или клетку-хозяина, экспрессирующую CAR, в лиофилизированной форме в первом контейнере, и необязательно, второй контейнер, включающий стерильную воду, стерильную забуференную воду, или, по меньшей мере, один консервант, выбираемый из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, фенилртути нитрита, феноксиэтанола, формальдегида, хлорбутанола, магния хлорида, алкилпарабена, бензалкония хлорида, бензетония хлорида, натрия дигидроацетата и тимеросала, или их смесей в водном разбавителе. В одном из аспектов, в наборе, концентрацию условно активных CAR или предусмотренной части или варианта в первом контейнере восстанавливают содержимым второго контейнера до концентрации, равной от примерно 0,1 мг/мл до примерно 500 мг/мл. В другом аспекте, второй контейнер дополнительно включает изотоноческое средство. В другом аспекте, второй контейнер дополнительно включает физиологически приемлемый буфер. В одном из аспектов, раскрытие обеспечивает способ лечения, по меньшей мере, одного состояния, опосредуемого белком дикого типа, включающий введение нуждающемуся в этом пациенту композиции, обеспеченной в наборе и восстановленной перед введением.
Также обеспечивают промышленное изделие для фармацевтического или диагностического применения у человека, включающее упаковочный материал и контейнер, включающий раствор или лиофилизированную форму, по меньшей мере, одного белка CAR, полинуклеотидной последовательности, кодирующей CAR или клетки-хозяина, экспрессирующей CAR. Промышленное изделие необязательно может включать контейнер в качестве компонента устройства или системы для парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интрацеребровентрикулярного, внутрь толстой кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, внутриперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинномозгового, внутрисуставного, интраторакального, внутриматочного, интравезикального, болюсного, вагинального, ректального, буккального, подъязычного, интраназального или трансдермального способа доставки.
В некоторых воплощениях, настоящее изобретение обеспечивает способ, включающий получение цитотоксических клеток от субъекта, генетическое конструирование цитотоксических клеток путем введения гена CAR настоящего изобретения в цитотоксические клетки, и введения генно-инженерных цитотоксических клеток субъекту. В некоторых воплощениях, цитотоксические клетки выбирают из T-клеток, наивных T-клеток, T-клеток, памяти, эффекторных T-клеток, естественных клеток-киллеров и макрофагов. В одном из воплощений, цитотоксические клетки представляют собой T-клетки.
В одном из воплощений, T-клетки получают от субъекта. T-клетки могут быть получены из ряда источников, включая периферическую кровь, мононуклеарные клетки, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из участка инфекции, асциты, плевральный выпот, ткань селезенки и опухоли. В определенных воплощениях настоящего изобретения, любое число T-клеточных линий, доступных в этой области техники, могут быть применены. В определенных воплощениях настоящего изобретения, T-клетки могут быть получены из крови, собранной от субъекта с помощью любого числа методик, известных квалифицированному специалисту, таких как разделение на Ficoll™.
В одном из предпочтительных воплощений, клетки из циркулирующей крови индивидуума получают с помощью афереза. Продукт афереза, как правило, содержит лимфоциты, включая T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. В одном из воплощений, клетки, собранные аферезом, могут быть промыты для удаления фракции плазмы и для помещения клеток в подходящий буфер или среду для последующих стадий обработки. В одном из воплощений изобретения, клетки промывали фосфатным буферным солевым раствором (PBS). В альтернативном воплощении, в растворе для промывки отсутствовует кальций и может отсутствовать магний или могут отсутствовать многие, если не все, двухвалентные катионы. Опять же, на удивление, проведение начальных стадий активации в отсутствии кальция приводили к усиленной активации. Как будет легко оценить обычному специалисту в данной области техники, стадия промывания может быть выполнена способами, известными специалистам в этой области техники, такими как с помощью полуавтоматического «проточного» центрифугирования (например, клеточный процессор Cobe 2991, Baxter CytoMate или аппарат для реинфузии крови Cell Saver 5) в соответствии с инструкцией производителя. После промывания, клетки могут быть ресуспендированы во множестве биосовместимых буферов, таких как, например, свободный от Ca2+, свободный от Mg2+ PBS, PlasmaLyte A или другой солевой раствор с буфером или без него. Альтернативно, нежелаемые компоненты образца афереза могут быть отброшены, и клетки непосредственно ресуспендированы в культуральной среде.
В другом воплощении, T-клетки изолируют из периферической крови путем лизиса красных кровяных клеток и обеднения моноцитов, например, центрифугированием в градиенте PERCOLL™ или проточного элютриационного центрифугирования. Специфическая субпопуляция T-клеток, таких как CD3+, CD28+, CD4+, CD8+, CD45RA+ и CD45RO+ T-клетки, могут быть дополнительно изолированы с применением методик положительного или отрицательного отбора. Например, обогащение популяции T-клеток путем отрицательного отбора может быть выполнено с комбинацией антител, направленных на маркеры поверхности, уникальных для отрицательно отбираемых клеток. Один из способов представляет собой сортировку клеток и/или отбор посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, в которых применяют коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, подвергаемых отрицательному отбору. Для обогащения CD4+ клеток путем отрицательного отбора, коктейль моноклональных антител, как правило, включает антитела к CD 14, CD20, CDl lb, CD 16, HLA-DR и CD8. В определенных воплощениях, может быть желательно обогащать или положительно отбирать регуляторные T-клетки, которые, как правило, экспрессируют CD4+, CD25+, CD62Lhi, GITR+ и FoxP3+.
Например, в одном из воплощений, T-клетки изолируют инкубацией с анти-CD3/анти-CD28 (то есть, 3x28)-конъюгированными бусинами, такими как DYNABEADS® M-450 CD3/CD28 T, в течение периода времени, существенного для положительного отбора требуемых T-клеток. В одном из воплощений, период времени равен примерно 30 минутам. В дополнительном воплощении, период времени варьирует от 30 минут до 36 часов или дольше и все целые значения между ними. В дополнительном воплощении, период времени равен, по меньшей мере, 1, 2, 3, 4, 5, или 6 часам. Еще в одном предпочтительном воплощении, период времени равен от 10 до 24 часов. В одном из предпочтительных воплощений, период времени инкубации равен 24 часам. Для выделения T-клеток от пациентов с лейкемией, применение более длительного времени инкубации, такого как 24 часа, может увеличить выход клеток. Более длительные времена инкубации могут быть применены для выделения T-клеток в любой ситуации, где существует мало T-клеток по сравнению с другими типами клеток, так как при выделении лимфоцитов опухолевых инфильтраций (TIL) из опухолевой ткани или из индивидуумов с ослабленной иммунной системой. Кроме того, применение более длительных периодов инкубации может увеличить эффективность захвата T-клеток CD8+. Таким образом, просто сокращая или продлевая время, T-клеткам позволяют связываться с бусинами CD3/CD28, и/или увеличивая или снижая отношение бусин к T-клеткам (как описано дополнительно в настоящем документе), субпопуляции T-клеток могут быть преимущественно отобраны для или против при начале культивирования или в другие временные точки в ходе способа. Кроме того, увеличивая или снижая отношение анти-CD3 и/или анти-CD28 антител на бусинах или другой поверхности, субпопуляции T-клеток могут быть преимущественно отобраны для или против при начале культивирования или в другие требуемые временные точки. Специалисту понятно, что множество раундов отбора также может быть применено в контексте настоящего изобретения. В определенных воплощениях, может быть желательно выполнять процедуру отбора и применять «неотобранные» клетки в процессе активации и размножения. «Неотобранные» клетки также могут быть подвергнуты дополнительным раундам отбора.
Затем из цитотоксических клеток получают генно-инженерные клетки, как описано в настоящем документе. Полинуклеотид, кодирующий CAR, и, как правило, локализованный в векторе экспрессии, вводят в цитотоксические клетки, так чтобы цитотоксические клетки экспрессировали, предпочтительно, стабильно, CAR. Полинуклеотиды, кодирующие CAR, как правило, интегрированы в геном цитотоксической клетки-хозяина. В некоторых воплощениях, введение полинуклеотида не должно приводить к интеграции, но скорее может быть достаточно только временного поддержания введенного полинуклеотида. В этом случае, можно получить кратковременный эффект, при котором цитотоксические клетки могут быть введены в хозяина и затем включены после заранее обусловленного времени, например, после того как клетки будут способны мигрировать в конкретный участок обработки.
В зависимости от природы цитотоксических клеток и заболевания, которое предстоит лечить, генно-инженерные цитотоксические клетки могут быть введены в субъекта, например, в млекопитающего, множеством различных путей. Генно-инженерные цитотоксические клетки могут быть введены в участок опухоли. В одном из воплощений, генно-инженерные цитотоксические клетки направляют к раку или модифицируют так, чтобы они направлялись к раку. Число генно-инженерных применяемых цитотоксических клеток будет зависеть от ряда факторов, таких как обстоятельства, цель введения, время жизни клеток, применяемый протокол. Например, число введений, способность клеток к размножению и стабильности рекомбинантной конструкции. Генно-инженерные цитотоксические клетки могут быть применены в виде дисперсии, введены с помощью инъекции в участок или рядом с участком, представляющим интерес. Клетки могут находиться в физиологически приемлемой среде.
Следует принять во внимание, что в способ обработки может быть внесено много изменений, поскольку клеточный ответ на CAR, эффективность экспрессии CAR в цитотоксических клетках и, соответственно, уровень секреции, активность экспрессированных CAR, особенности потребностей субъекта, которые могут изменяться со временем и обстоятельствами, скорость потери клеточной активности как результат потери генно-инженерных цитотоксических клеток или экспрессионной активности индивидуальных клеток и тому подобное. Следовательно, ожидается, что для каждого индивидуального пациента, даже если существовали бы универсальные клетки, которые можно было ввести в популяцию в целом, каждого пациента следует контролировать для правильной дозировки для индивидуума, и такой мониторинг пациент представляет собой общепринятую в этой области техники практику.
Следующие примеры предназначены для целей иллюстрации, а не для ограничения способов настоящего раскрытия. Другие подходящей модификации и адаптации множества условий и параметров, в норме встречающиеся в этой области и очевидные специалистам в этой области техники, находятся в пределах объёма данного раскрытия.
ПРИМЕРЫ
Пример 1. Генерация условно активных антител scFv
Два условно активных антитела (CAB-scFv-63.9-4 и CAB-scFv-63.9-6) для мишени лекарственного средства антигена X1 экспрессировали в виде гомодимеров с IgGl Fc человека дикого типа (были получены бивалентные антитела CAB-scFv-63.9-4-01 и CAB-scFv-63.9-6-01, представленные на фиг. 2-3), а также в виде гетеродимеров в системе выступ-во-впадину, полученные в виде моновалентных scFv (были получены моновалентные антитела scFv CAB-scFv-63.9-4-02 и CAB-scFv-63.9-6-02, представленные на фиг. 2-3).
Аффинности по связыванию данных антител с мишенью лекарственного средства антиген X1 при pH 6,0 и pH 7,4 измеряли с помощью анализа ELISA. Как показано на фиг. 2, scFv антитела демонстрировали аффинности к мишени лекарственного средства антигену X1 при обоих pH 6,0 и pH 7,4, что было сопоставимо с полными бивалентными антителами. Кроме того, селективность данных scFv-антител при pH 6,0 была выше, чем при pH 7,4, как показано на фиг. 3, что также было сопоставимо с полными бивалентными антителами. Данный пример показал, что условно активные антитела настоящего изобретения имеют сопоставимую аффинность и селективность или как scFv-антитела, или как полные бивалентные антитела. Таким образом, условно активные антитела настоящего изобретения могут быть встроены в качестве единственной цепи ДНК в молекулу ДНК, которая кодирует CAR на платформе CAR-T настоящего изобретения.
Пример 2: Антитела scFv против целевого антигена X1 для конструирования CAR-T-клеток
Условно активные антитела для мишени лекарственного средства антигена X1 создавали с помощью одновременного скрининга на селективность и аффинность, а также на уровень экспрессии при pH 6,0 и pH 7,4, в соответствии с одним из воплощений настоящего изобретения. Скрининг проводили в сыворотке с помощью FLAG-метки, поскольку в сыворотке присутствовали антитела человека, которые могли привести к ложным положительным результатам для скрининга. Буфер скрининга представлял собой карбонатный буфер (буфер Кребса-Рингера - стандартный буфер, но отличный от PBS). Было показано, что созданные условно активные антитела имели более высокую аффинность к мишени лекарственного средства антигену X1 при pH 6,0, но сниженную аффинность к той же мишени лекарственного средства антигену X1 при pH 7,4, оба по сравнению с антителом дикого типа. Кроме того, все данные условно активные антитела имели высокий уровень экспрессии, как показано ниже в таблице 2, в колонке «Клон», показывающей антитела, и уровень экспрессии «мг/мл», приведенный во второй колонке.
Клоны этих антител были направлены к поставщику услуг с требуемым уровнем экспрессии («требуемое количество», ожидаемый уровень экспрессий). Однако фактический уровень экспрессий данных антитела («полученное количество») был очень высоким и превысил ожидаемый уровень экспрессий.
Таблица 2. Условно активные антитела с высокими уровнями экспрессии
Условно активные антитела не демонстрировали агрегации в буфере как показано на фиг. 4, где антитело BAP063.9-13-1 применяли в качестве примера. Антитело BAP063.9-13-1 анализировали с помощью гель-хроматографии. На фиг. 4, был обнаружен только один пик, что свидетельствует о незначительной агрегации антитела или ее отсутствии.
Условно активные антитела также анализировали, применяя поверхностный плазмонный резонанс (SPR) для измерения скоростей их ассоциации и диссоциации с мишенью лекарственного средства антиген X1 . Известно, что анализ SPR применяют для измерения скоростей ассоциации и диссоциации условно активных антител. Анализ SPR проводили в присутствии бикарбоната. Скорость ассоциации и диссоциации in vivo условно активных антител (у животных и людей) представляет собой очень важную характеристику для условно активных антител.
Было отмечено, что условно активные антитела имеют высокие скорости ассоциации при pH 6,0 и пониженные скорости ассоциации при pH 7,4, по сравнению с отрицательным контролем (BAP063 10F10, которое имеет одинаковые скорости ассоциации при pH 6,0 и pH 7,4) (фиг. 5). Кроме того, повышение температуры от комнатной температуры до 60°C существенно не меняет результаты анализа SPR (фиг. 5). Анализ SPR также показал, что данные условно активные антитела были высокоселективны при pH 6,0 по сравнению с pH 7 (на фиг. 6A-6B показано одно антитело в качестве примера).
Условно активные биологические антитела суммированы в таблице 3. Два антитела экспрессировали как scFv (BAP063.9-13.3 и BAP063.9-48.3), который был готов к встраиванию в CAR на платформе CAR-T. Инкубация антител при 60°C в течение одного часа не изменила аффинности большинства антител («Термостабильность»). В двух колонках представлены отчетные данные, полученные с помощью SPR для измерения связывающей активности при pH 6,0 и pH 7,4 (последние две колонки таблицы 3), было сделано сравнение с «BAP063.6-humlOF10-FLAG» (отрицательный контроль, вторая дорожка в таблице 3). Селективность данных антител может быть определена по разнице между данными в двух последних колонках. Два scFv-антитела имели очень высокую селективность (75% и 50% при pH 6 по сравнению с 0% при pH 7,4).
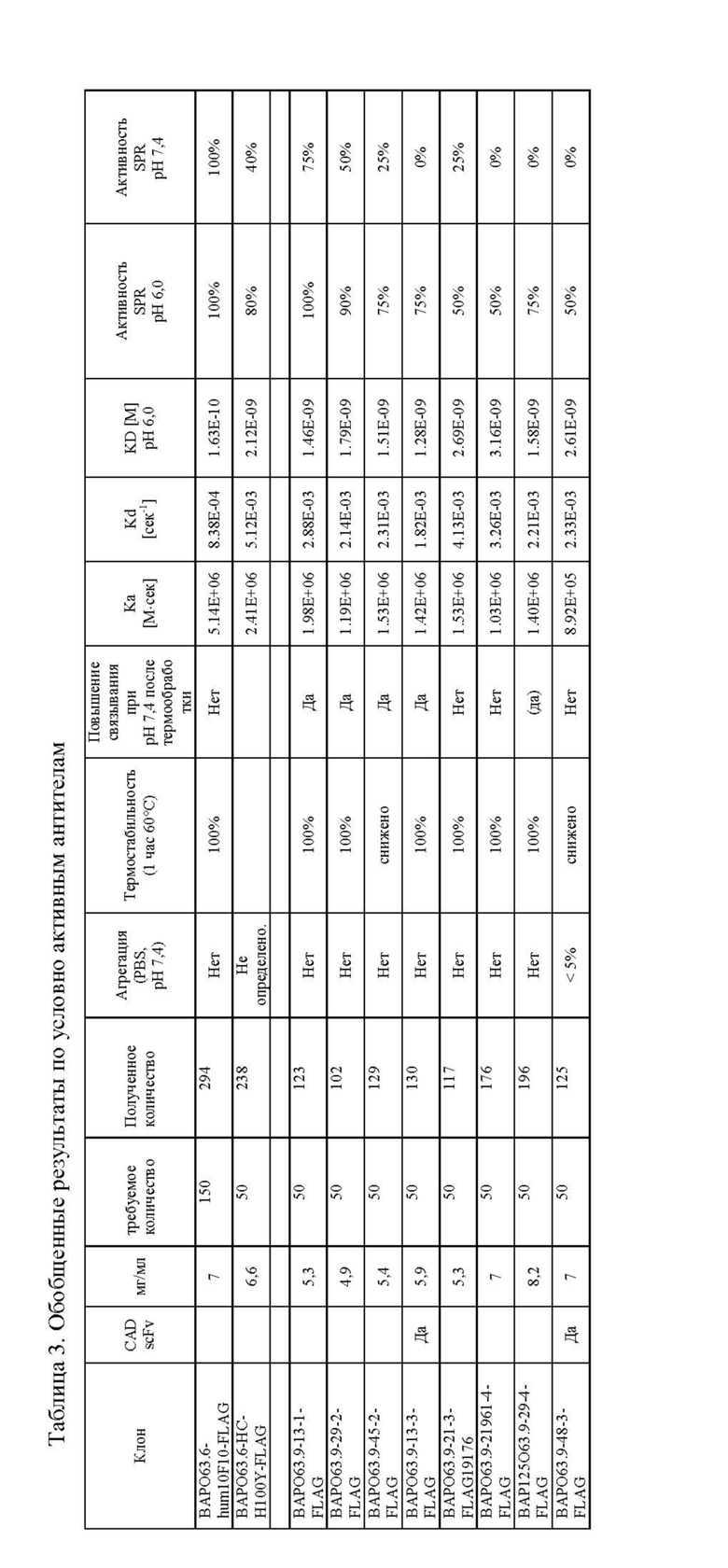
Сравнительный пример A: CAR-T-клетки с неусловно активным антителом против целевого антигена X1
Неусловно активное антитело scFv против целевого антигена X1 применяли для конструирования CAR-T-клеток, которые связываются с целевым антигеном X1 или клеток CHO, экспрессирующих целевой антиген X1 на клеточной поверхности (CHO-X1), фиг.7A-7B. Неусловное активное антитело применяли в качестве ASTR молекулы CAR, которую вставляли в Т-клетки для построения CAR-T-клеток, которые могут связываться с целевым антигеном X1.
В качестве сравнения, клетки CHO, которые не экспрессируют целевой антиген X1, обрабатывали: (1) Т-клетками, не трансдуцированными молекулой CAR, (2) Т-клетками, трансдуцированными молекулой CAR, которая не связывается с целевым антигеном X1, и (3) Т-клетками, трансдуцированными молекулой CAR с неусловно активным антителом против целевого антигена X1 (фиг. 7A). Популяцию клеток СНО обозначали клеточным индексом (ось Y на фиг.7A), снижение в клеточном индексе указывало на цитотоксичность (гибель клеток) под действием CAR-T-клеток.
Обращаясь к фиг. 7A, перед добавлением Т-клеток, клетки CHO показали рост. После добавления CAR-T-клеток, которые связываются с целевым антигеном X1, клеточный индекс первоначально снижался, что указывает на неспецифическую цитотоксичность Т-клеток. Однако вскоре после этого клетки CHO возобновляли рост. Что еще более важно, различия между тремя обработками были незначительными, что указывало на отсутствие значительной цитотоксичности в отношении клеток CHO, которые не экспрессируют целевой антиген X1 CAR-T-клеток с неусловно активным антителом против целевого антигена X1.
Клетки CHO, которые экспрессируют целевой антиген X1, затем обрабатывали таким же образом, как описано выше: (1) T-клетками, не трансдуцированными молекулой CAR, (2) T-клетками, трансдуцированными молекулой CAR, которая не связывается с целевым антигеном X1, и (3) T-клетками, трансдуцированными CAR с неусловно активным антителом против целевого антигена X1 (фиг. 7B). После добавления Т-клеток, клеточный индекс значительно уменьшался при обработке CAR-T-клетками с неусловно активным антителом против целевого антигена X1, но после двух других обработок, что указывает на цитотоксичность по отношению к клеткам CHO-X1, которые экспрессируют целевой антиген X1 под действием CAR-T-клеток с неусловно активным антителом против целевого антигена X1.
Пример 3: CAR-T-клетки с условно активным антителом scFv против целевого антигена X1
Условно активное антитело scFv против целевого антигена X1 применяли для конструирования молекулы CAR. T-клетки трансдуцировали молекулой CAR так, чтобы T-клетки экспрессировали молекулу CAR (клетки CAR-T). Клетки CHO, экспрессирующих целевой антиген X1 (клетки CHO-63), или обычные клетки CHO, которые не экспрессируют целевой антиген X1 (клетки CHO), отдельно обрабатывали клетками CAR-T. Нетрансдуцированные T-клетки (без молекулы CAR) применяли в качестве контроля (фиг. 8A-8B).
Обращаясь к фиг. 8A, клетки CHO, которые не экспрессируют целевой антиген X1, обрабатывали CAR-T-клетками и нетрансдуцированными T-клетками. Не было существенной разницы между этими двумя обработками, что указывало на отсутствие цитотоксичности CAR-T клеток по отношению к клеткам CHO. Обращаясь к фиг. 8B, где клетки CHO, экспрессирующие целевой антиген X1 (CHO-63), обрабатывали аналогичным образом CAR-T-клетками с условно активным антителом против целевого антигена X1, что значительно снижало популяцию клеток CHO-63, по сравнению с нетрансдуцированными T-клетками. Это указывает на то, что CAR-T-клетки с условно активным антителом против целевого антигена X1 были цитотоксичными по отношению к клеткам CHO-63.
Клетки CAR-T, однажды связавшись с целевым антигеном X1, индуцировали цитотоксичность. Этот эффект был подтвержден измерением уровней цитокинов, интерферона гамма (INFg) и IL2. Данные для цитокинов показаны на фиг.9A-9B. На фиг. 9A, связывание CAR-T-клеток с целевым антигеном X1 на клетках CHO-63 вызывало значительное высвобождение INFg, по сравнению с нетрансдуцированными T-клетками, как было показано наблюдаемыми повышенными уровнями цитокинов. Аналогично, на фиг. 9B, связывание CAR-T-клеток с целевым антигеном X1 на клетках CHO-63 вызывало значительное высвобождение IL2, по сравнению с нетрансдуцированными T-клетками, как было показано наблюдаемыми повышенными уровнями цитокинов.
Пример 4: CAR-T-клетки с условно активным антителом scFv против целевого антигена X2
Получали условно активные антитела scFv против целевого антигена X2. Их связывающие активности к целевому антигену X2 измеряли, применяя анализ ELISA (фиг. 10).
Одно из антител scFv, показанное на фиг. 10, scFv-116101, применяли для конструирования молекулы CARs для получения CAR-T-клеток (116101 CAR-T). Сконструированные CAR-T-клеток применяли для направления к клеткам Дауди, которые экспрессировали целевой антиген X2. Отрицательные контроли T-клеток представляли собой не трансдуцированные молекулой CAR (нетрансдуцированные T-клетки) и CAR-T-клетки, трансдуцированные молекулой CAR и не способные к связыванию с целевым антигеном X2 (не-X2 scFv CAR-T). Результаты показаны на фиг. 11A. Отношение числа T-клеток к числу клеток Дауди в этой обработке было равно 10:1. CAR-T-клетки с антителом scFv, нацеленные на целевой антиген X2 на клетках Дауди (116101 CAR-T) индуцировали значительную гибель клеток для клеток Дауди, как видно из более высокого соотношения мертвые/живые клетки на фиг. 11A.
Клетки HEK293 обрабатывали теми же T-клетками, которыми были применены для обработки клеток Дауди. Результаты показаны на фиг. 11B. Поскольку клетки HEK293 не экспрессируют целевой антиген X2 на клеточной поверхности, CAR-T-клетки с антителом scFv, нацеленным на целевой антиген X2(116101 CAR-T), не вызывали значительной гибели клеток в клетках HEK293, по сравнению с отрицательными контролями (фиг. 11B).
Пример 5: Высвобождение цитокинов CAR-T-клетками с антителами против целевых антигенов X1 и X2
В данном примере измеряли выделение цитокинов, индуцированное связыванием CAR-T-клеток с целевыми антигенами. Фиг.12A-12B показывают высвобождение INFg и IL2 после связывания CAR-T-клеток, содержащих условно активное антитело scFv против целевого антигена X1, с клетками CHO-63, экспрессирующими целевой антиген X1. После обработки CAR-T-клеток данными клетками CHO-63 в течение 24-х часов, наблюдали значительное увеличение в уровне как цитокина INFg, так и IL2, что указывает на высвобождение обоих цитокинов INFg и IL2, по сравнению с контролями, где те же самые CAR-T-клетки применяли для обработки CHO клеток, которые не экспрессировали целевой антиген X1. Кроме того, T-клетки, не трансдуцированные молекулой CAR, и CAR-T-клетки, которые не связываются с целевым антигеном X1, не приводили к значительному высвобождению цитокинов INFg и IL2.
Фиг. 13A-13B показывают уровни цитокинов INFg и IL после связывания CAR-T-клеток, содержащих условно активное антитело scFv против целевого антигена X2, с клетками Rajib и клетками Дауди, и те и другие экспрессируют целевой антиген X2. После обработки клеток Rajib и клеток Дауди CAR-T-клетками в течение 24-х часов, наблюдали значительное увеличение уровней цитокинов IFNg и IL 2, по сравнению с контролями, где те же самые CAR-T-клетки применяли для обработки клеток HEK293, которые не экспрессируют целевой антиген X2. Кроме того, T-клетки, не трансдуцированные молекулой CAR, и CAR-T-клетки, которые не связываются с целевым антигеном X2, значительно не повышали уровни цитокинов, тем самым указывая на неспособность вызывать значительное высвобождение цитокинов INFg и IL2.
Пример 6: Условно активные антитела scFv против целевого антигена X3
Отобрали пять условно активных антител scFv против целевого антигена X3. Отобранные условно активные антитела scFv были более активны при pH 6,0, чем при pH 7,4. Данные условно активные антитела scFv могут быть применены для конструирования CAR-T-клеток, связывающихся с клетками, экспрессирующими целевой антиген X3.
Следует, однако, понимать, что хотя даже многочисленные характеристики и преимущества настоящего изобретения изложены в приведенном выше описании вместе с подробным описанием структуры и функций изобретения, раскрытие носит лишь иллюстративный характер, и могут быть сделаны изменения в деталях, в особенности, в вопросах формы, размера и расположения частей изобретения в рамках принципов изобретения в полном объеме указанных широких общих значений терминов, в которых выражена прилагаемая формула изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСЛОВНО АКТИВНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ МОДИФИЦИРОВАННЫХ Т-КЛЕТОК | 2015 |
|
RU2764074C2 |
| СПОСОБЫ И СОСТАВЫ ДЛЯ ПРОИЗВОДСТВА ЛИМФОЦИТОВ И ИХ РЕГУЛИРУЕМОГО УВЕЛИЧЕНИЯ | 2017 |
|
RU2755059C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С МУТИРОВАННЫМИ КОСТИМУЛЯТОРНЫМИ ДОМЕНАМИ CD28 | 2018 |
|
RU2800922C2 |
| ИММУННЫЕ КЛЕТКИ, ДЕФЕКТНЫЕ ПО Suv39h1 | 2018 |
|
RU2784531C2 |
| Модифицированные клетки с химерным антигеновым рецептором для лечения рака, экспрессирующего CLDN6 | 2020 |
|
RU2826058C2 |
| УЛУЧШЕННЫЕ КОМПОЗИЦИИ НА ОСНОВЕ T-КЛЕТОК | 2015 |
|
RU2719030C2 |
| АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2792042C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С MND-ПРОМОТОРОМ | 2015 |
|
RU2708311C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЙ ОНКОЛИТИЧЕСКИЙ ВИРУС ПРОСТОГО ГЕРПЕСА, ДОСТАВЛЯЮЩИЙ ХЕМОКИН И ОПУХОЛЬ-АССОЦИИРОВАННЫЙ/СПЕЦИФИЧЕСКИЙ АНТИГЕН | 2022 |
|
RU2827338C1 |
| МЕЧЕНЫЕ ХИМЕРНЫЕ ЭФФЕКТОРНЫЕ МОЛЕКУЛЫ И ИХ РЕЦЕПТОРЫ | 2014 |
|
RU2729463C2 |
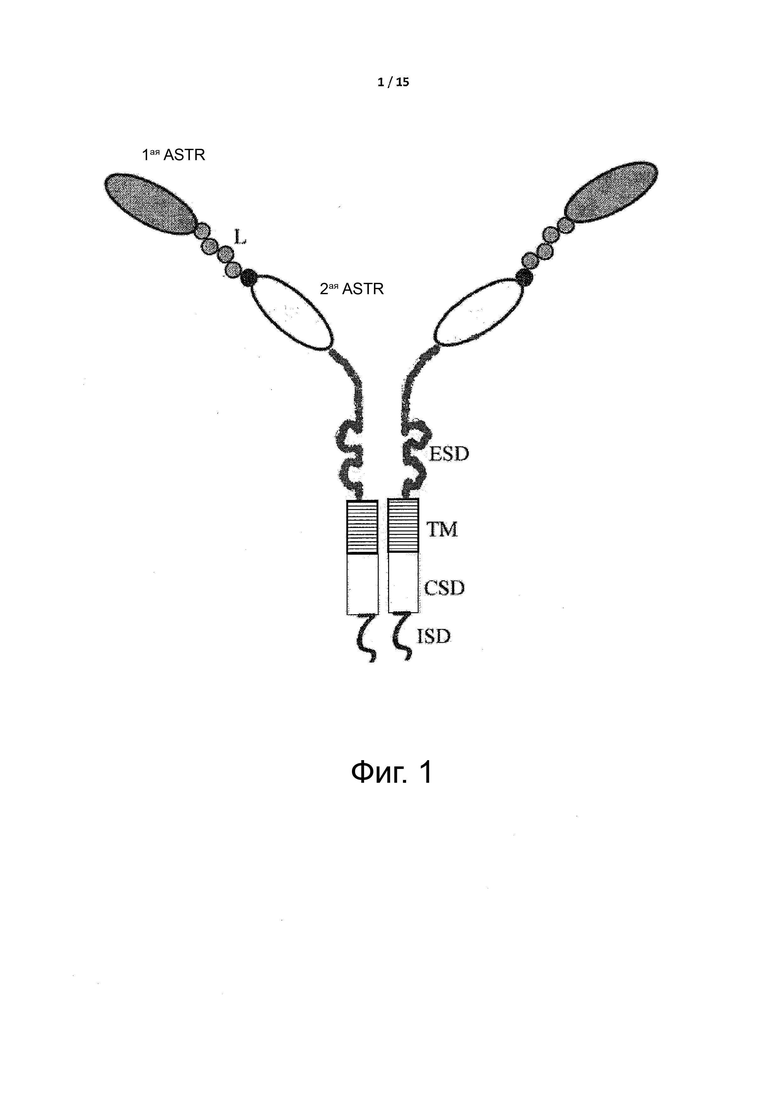
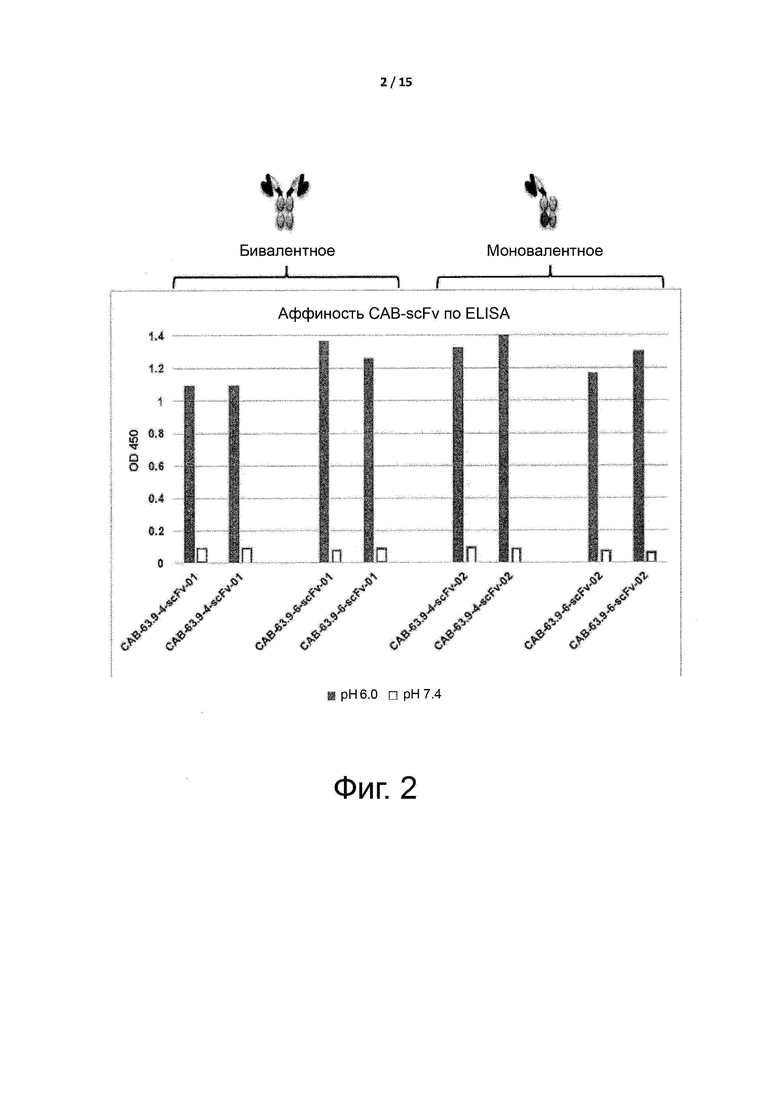
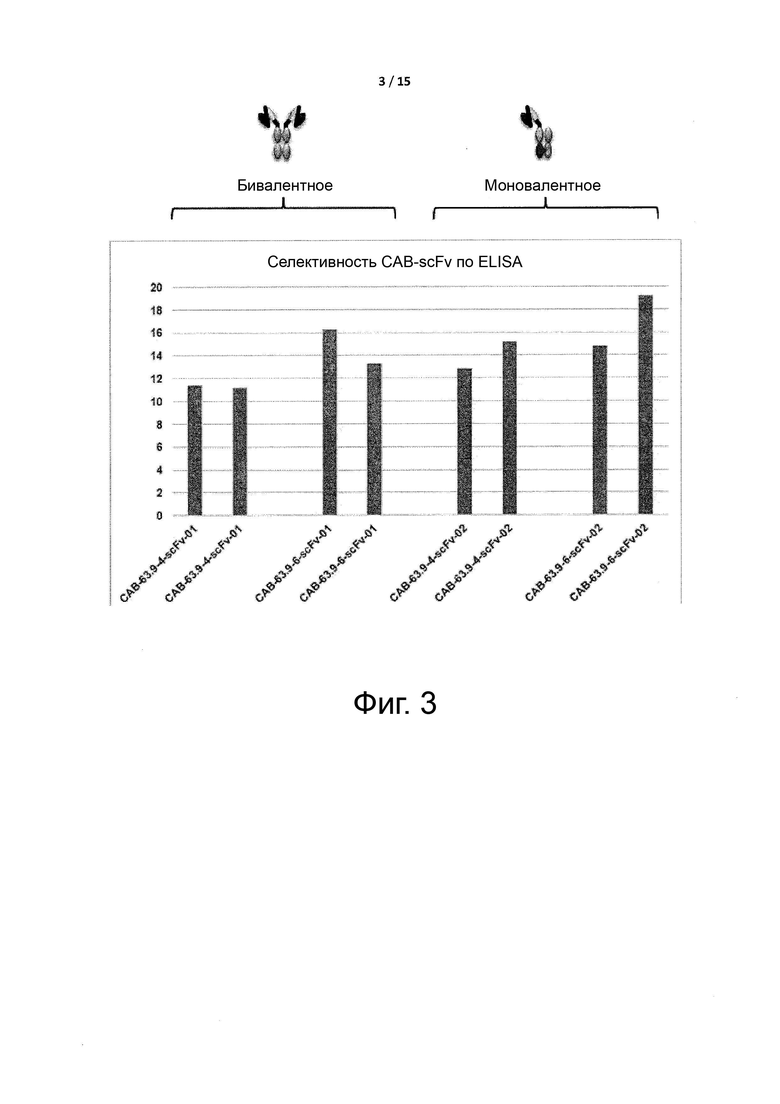
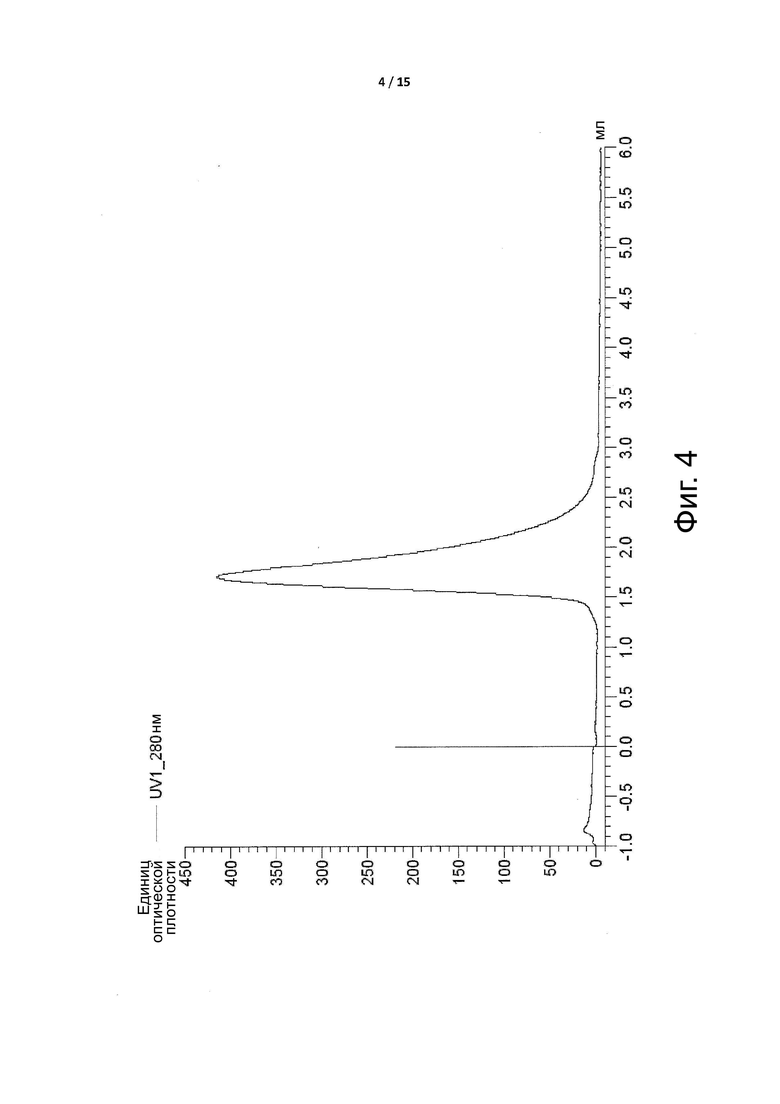
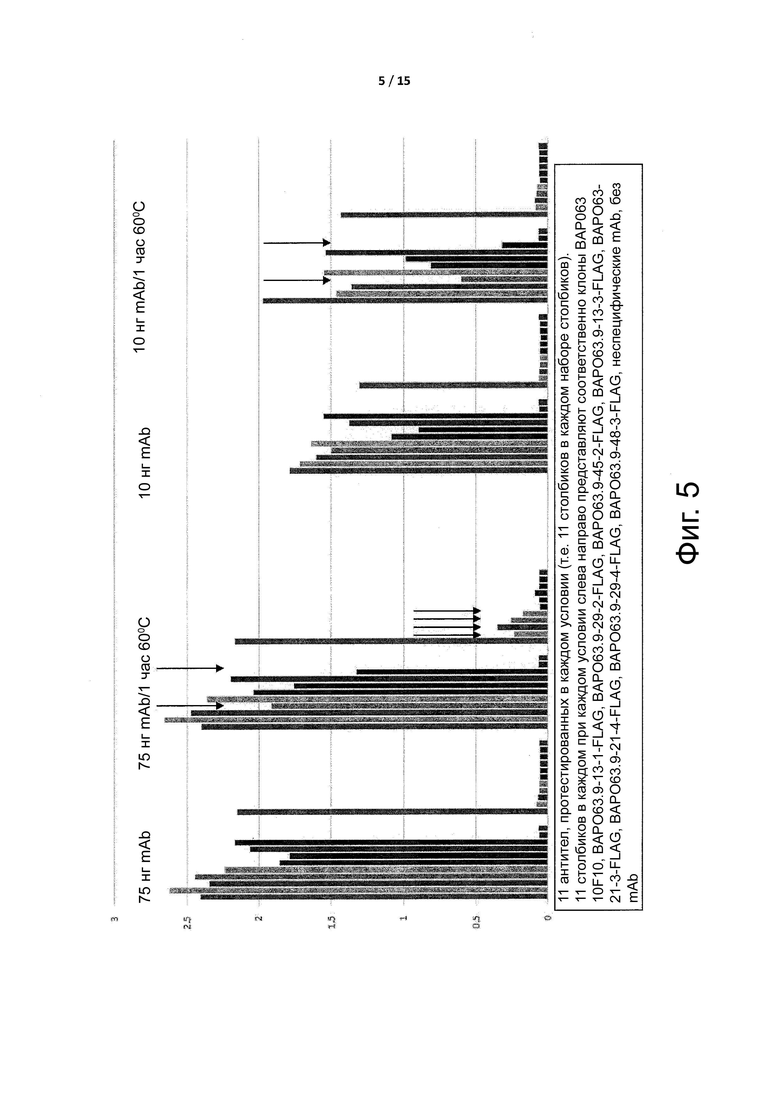
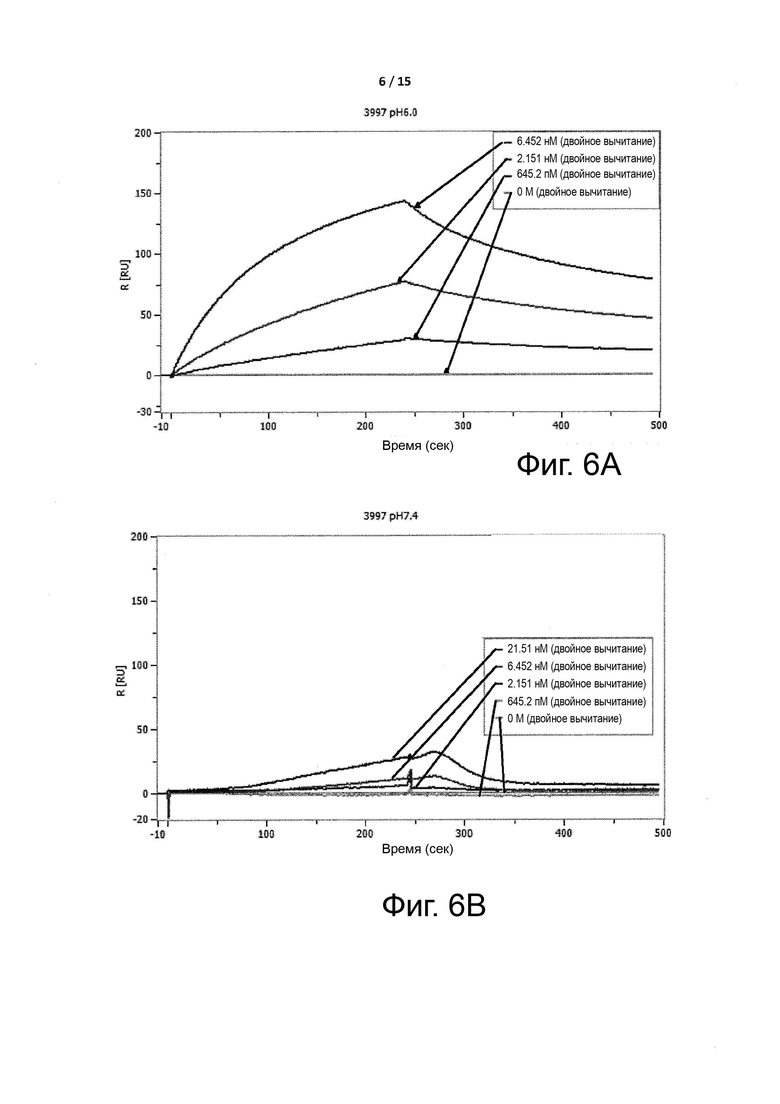
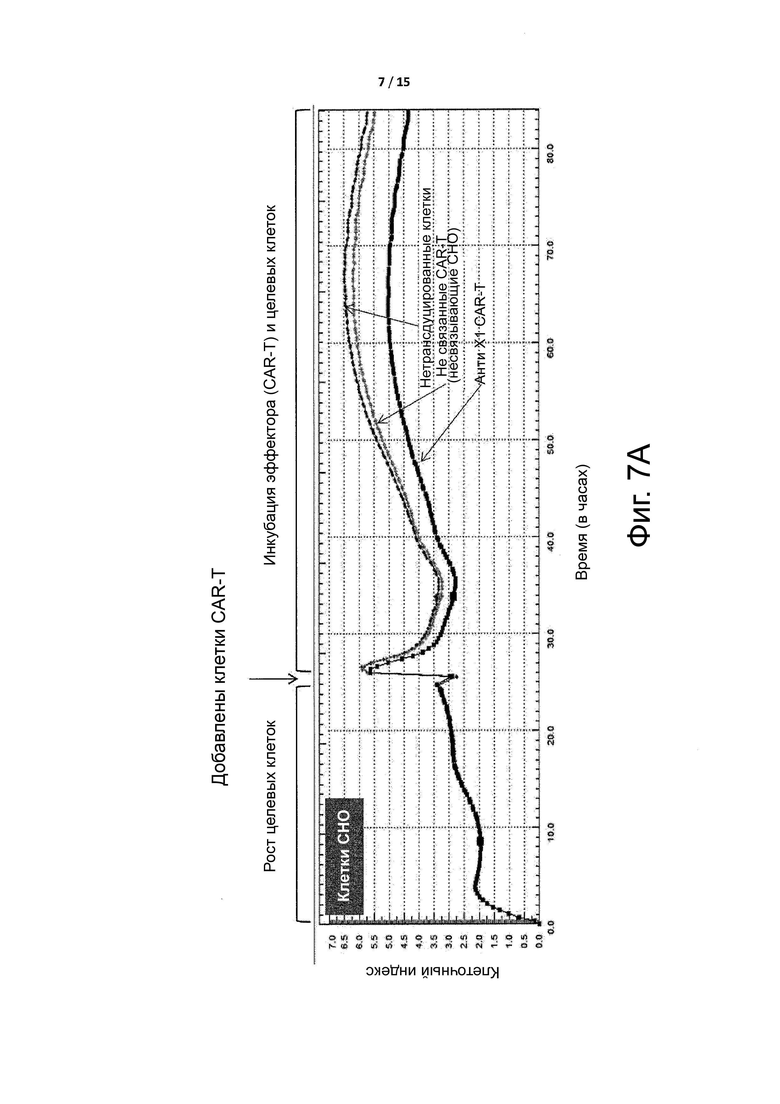
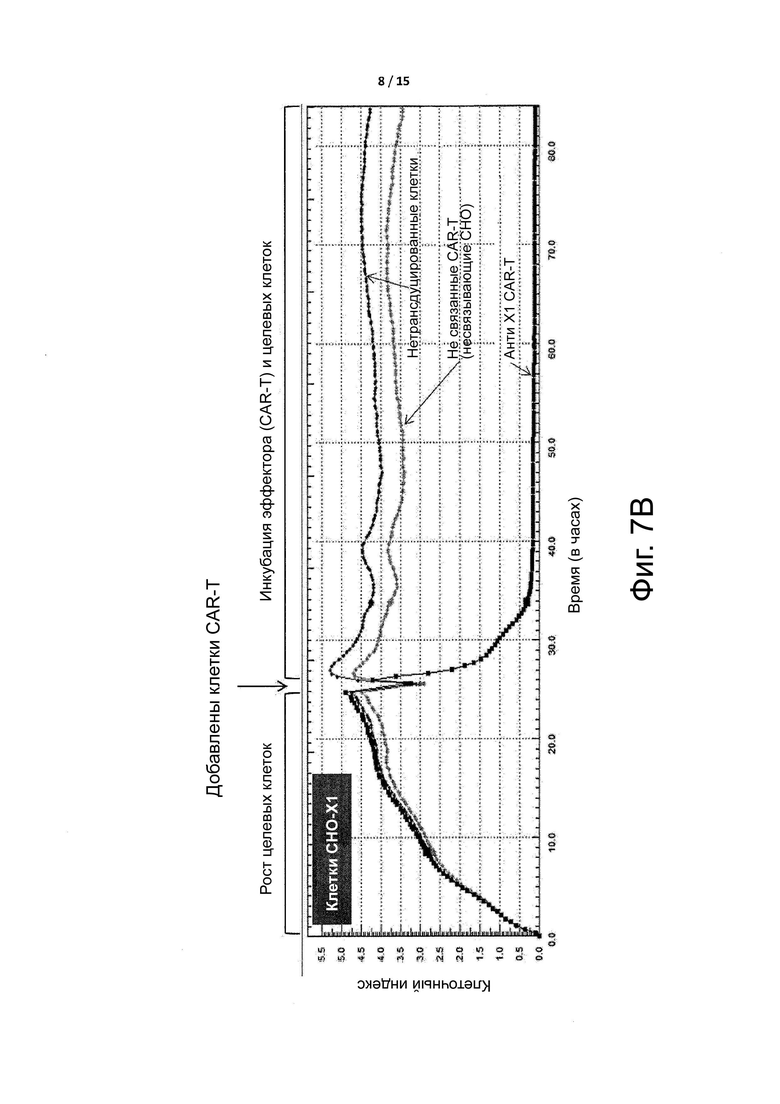
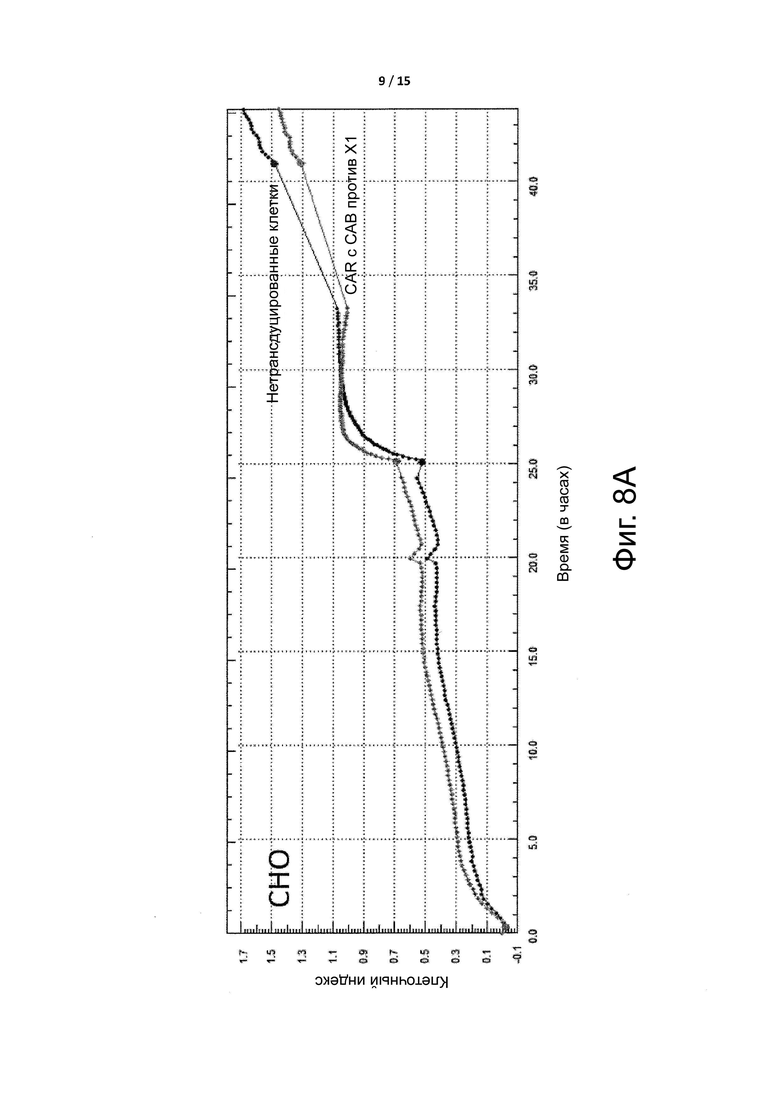
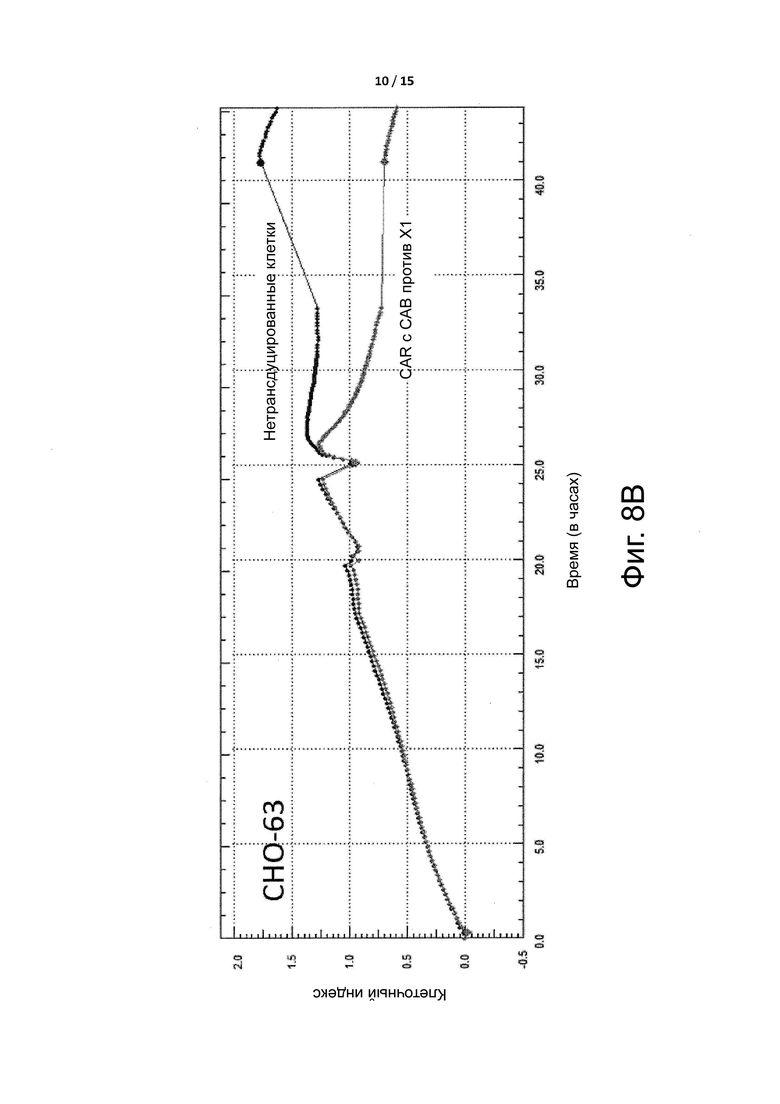
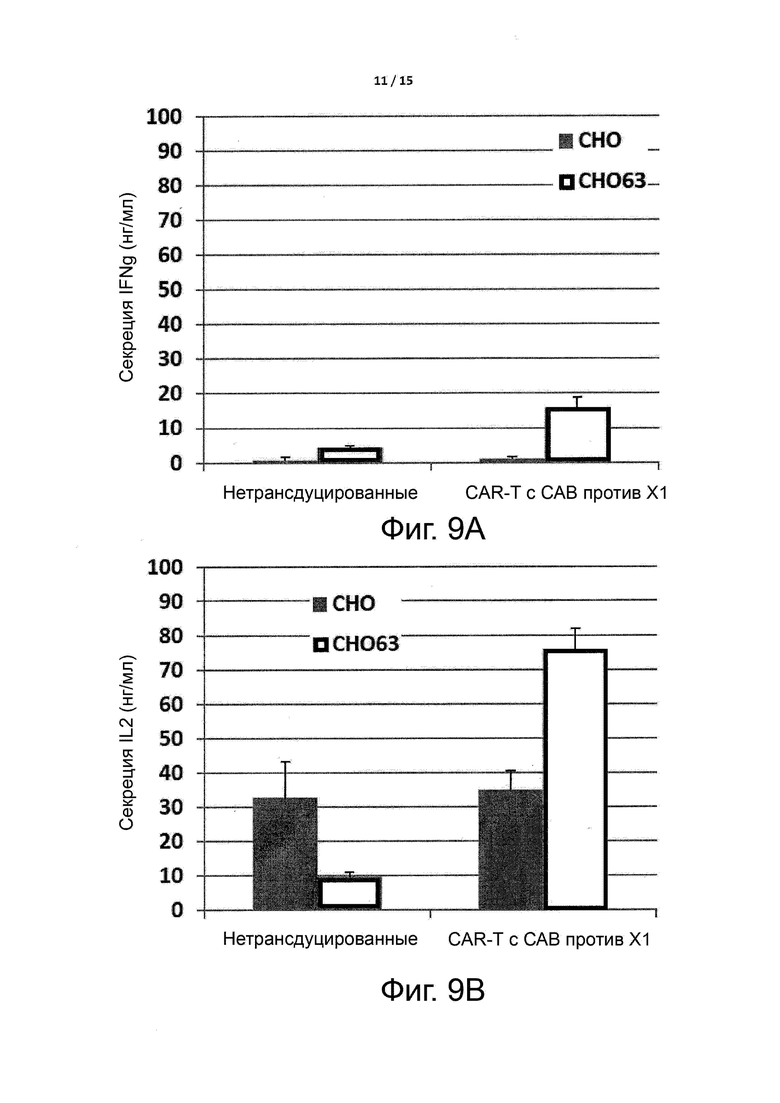
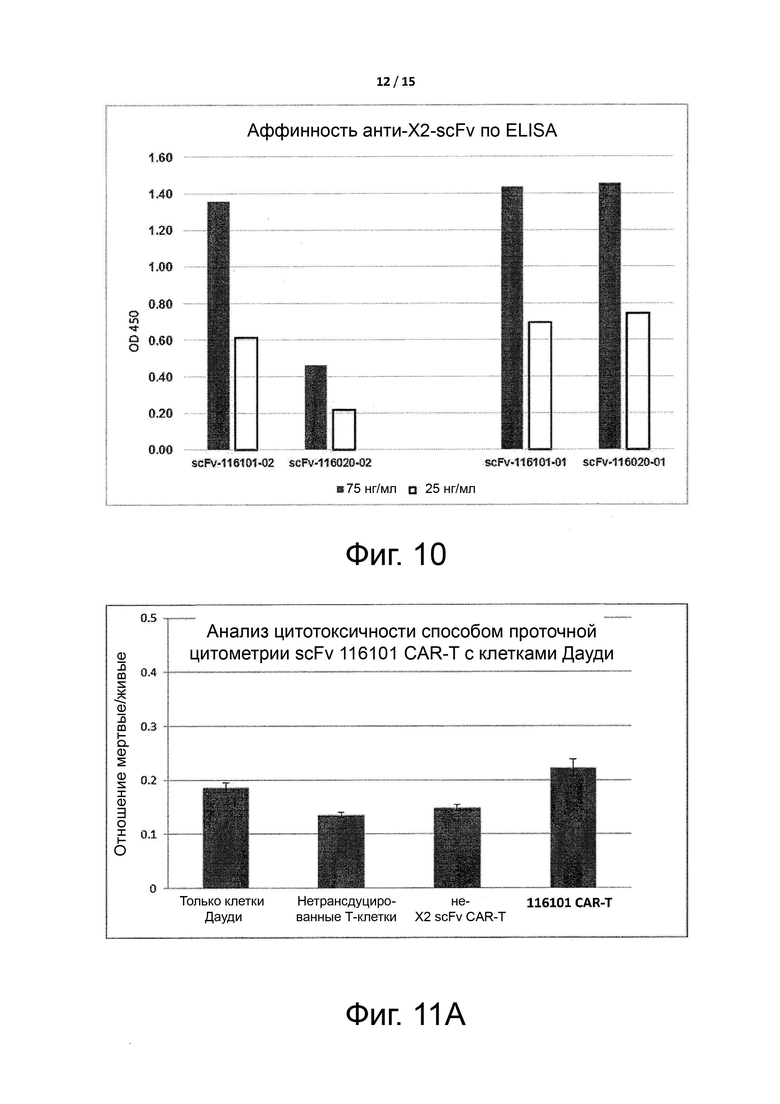
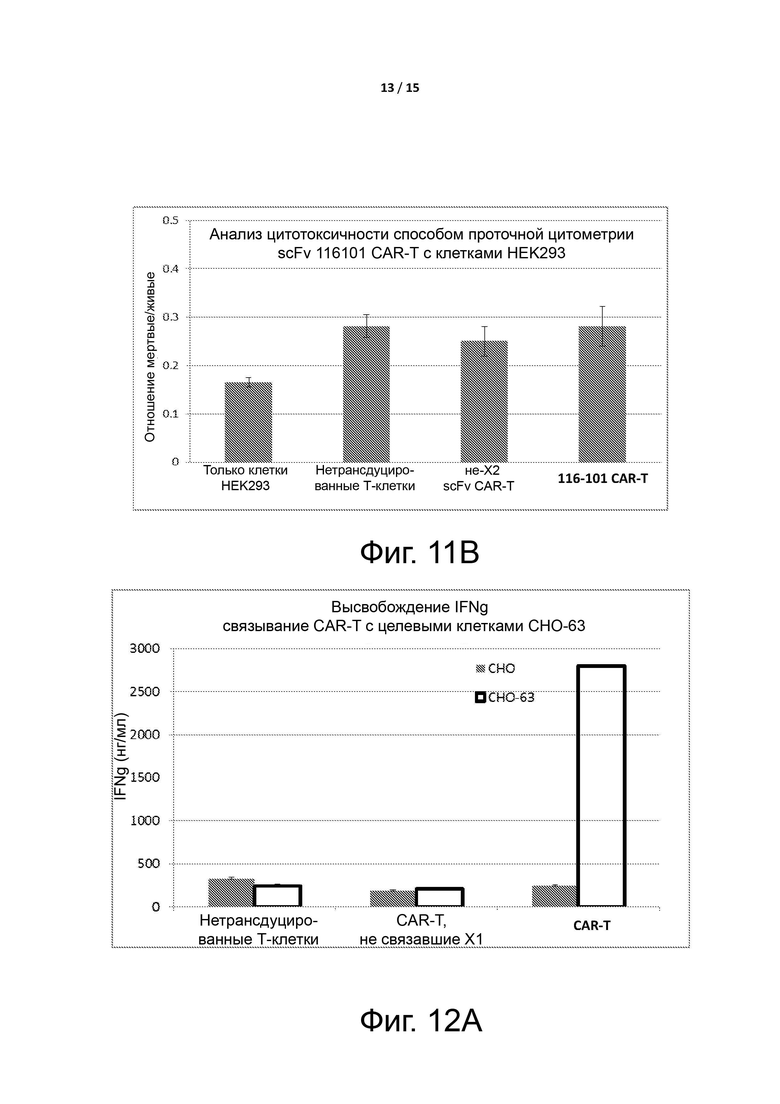
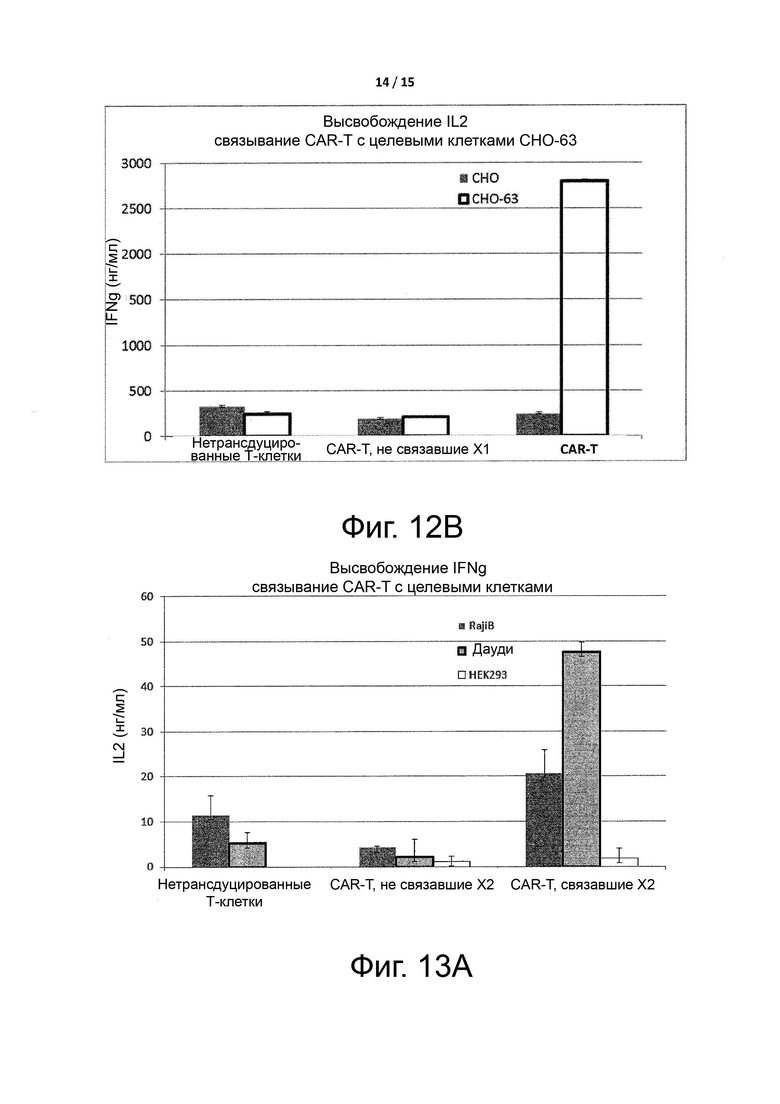
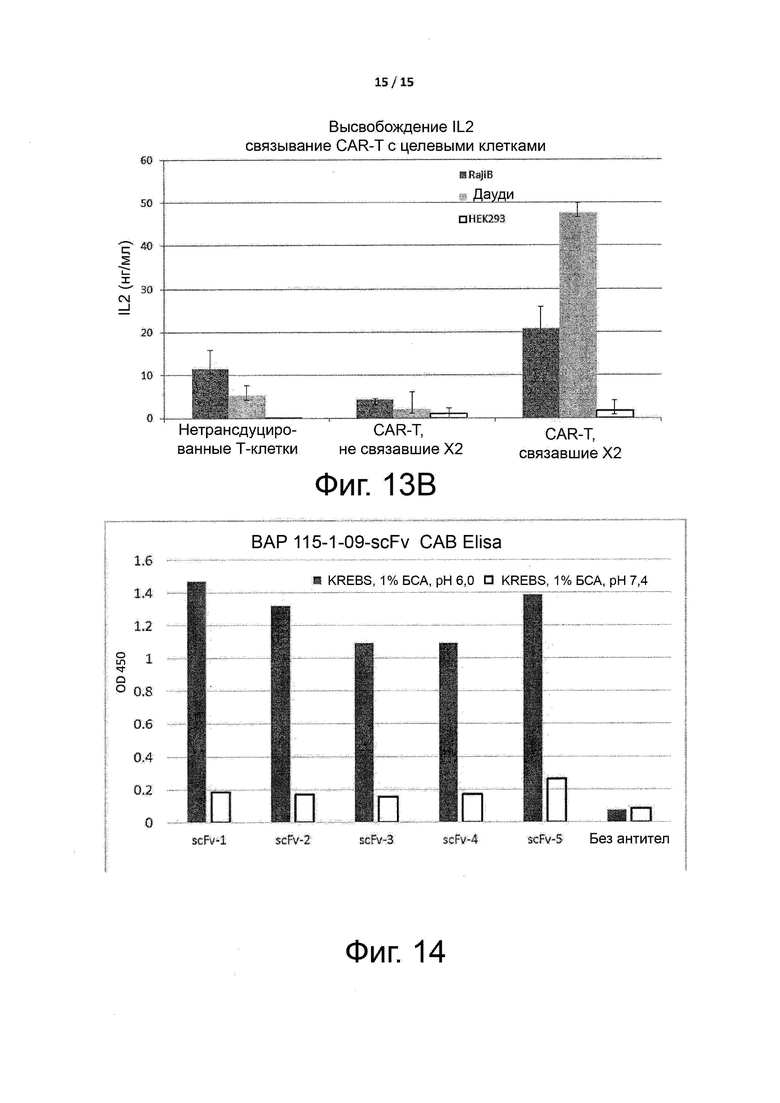
Группа изобретений относится к способам создания условно активного химерного антигенного рецептора для связывания с целевым антигеном, выбранным из тирозинкиназного рецептора фактора роста, расположенного на поверхности раковой клетки твердой опухоли. Способы включают эволюционирование антиген-специфической нацеливающей области для создания условно активной антиген-специфической нацеливающей области, которая имеет снижение в активности связывания целевого антигена при нормальном физиологическом pH по сравнению с активностью связывания того же целевого антигена при аномальном pH в микроокружении опухоли; и связывание условно активной антиген-специфической нацеливающей области с трансмембранным доменом и с внутриклеточным сигнальным доменом для образования химерного антигенного рецептора. Условно активная антиген-специфическая нацеливающая область представляет собой мультиспецифическое антитело, эволюционировавшее из родительского антитела или его фрагмента, или условно активную антиген-специфическую нацеливающую область, эволюционировавшую из родительского белка или его домена. Условно активный химерный антигенный рецептор обратимо или необратимо инактивирован в нормальном для дикого типа физиологическом условии, но активен в аномальных условиях в микроокружении опухоли. 2 н. и 17 з.п. ф-лы, 14 ил., 3 табл., 6 пр.
1. Способ получения химерного антигенного рецептора для связывания с целевым антигеном, выбранным из тирозинкиназного рецептора фактора роста, расположенного на поверхности раковой клетки твердой опухоли, где указанный химерный антигенный рецептор включает:
i. по меньшей мере одну условно активную антиген-специфическую нацеливающую область, которая представляет собой мультиспецифическое антитело, эволюционировавшее из родительского антитела или его фрагмента, которые связываются с целевым антигеном, и имеющее снижение в активности связывания целевого антигена в анализе при нормальном физиологическом pH по сравнению с активностью связывания с тем же целевым антигеном в анализе при отличном аномальном pH в микроокружении опухоли;
ii. трансмембранный домен; и
iii. внутриклеточный сигнальный домен;
указанный способ включает стадии:
эволюционирование антиген-специфической нацеливающей области родительского антитела или его фрагмента для создания условно активной антиген-специфической нацеливающей области, которая имеет снижение в активности связывания целевого антигена в анализе при нормальном физиологическом pH по сравнению с активностью связывания того же целевого антигена в анализе при отличном аномальном pH в микроокружении опухоли; и
связывание условно активной антиген-специфической нацеливающей области с трансмембранным доменом и с внутриклеточным сигнальным доменом для образования химерного антигенного рецептора.
2. Способ по п. 1, где химерный антигенный рецептор, содержащий условно активную антиген-специфическую нацеливающую область, имеет увеличение в уровне экспрессии по сравнению с идентичным химерным антигенным рецептором, содержащим антиген-специфическую нацеливающую область родительского антитела или его фрагмента.
3. Способ по любому из пп. 1, 2, где мультиспецифическое антитело выбирают из полноразмерного антитела, одноцепочечного антитела, Fab-фрагмента, Fab'-фрагмента, (Fab')2-фрагмента, Fv-фрагмента и двухвалентного одноцепочечного антитела или диатела.
4. Способ по любому из пп. 1, 2, дополнительно включающий стадию связывания условно активной антиген-специфической нацеливающей области с внеклеточным спейсерным доменом или по меньшей мере одним ко-стимулирующим доменом.
5. Способ по п. 4, где внеклеточный спейсерный домен выбирают из фрагмента Fc антитела, шарнирной области антитела, CH2-области антитела, CH3-области антитела, искусственной спейсерной последовательности и их комбинаций.
6. Способ по любому из пп. 1-5, где трансмембранный домен выбирают из искусственной гидрофобной последовательности и трансмембранных доменов из трансмембранного белка типа I, альфа-, бета- или дзета-цепи рецептора Т-клеток, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154 и их комбинаций.
7. Способ по любому из пп. 4-6, где ко-стимулирующий домен выбирают из ко-стимулирующих доменов белков в надсемействе TNFR, CD28, CD137, CD134, DaplO, CD27, CD2, CD5, ICAM-1, LFA-1, Lck, TNFR-I, TNFR-II, Fas, CD30, CD40, ICOS LIGHT, NKG2C, B7-H3 и их комбинаций.
8. Способ по любому из пп. 1-7, где внутриклеточный сигнальный домен выбирают из цитоплазматических сигнальных доменов дзета-цепи CD3 человека, FcyRIII, FcsRI, цитоплазматического хвоста Fc-рецептора, тирозинового активирующего мотива иммунорецептора (ITAM) несущего цитоплазматические рецепторы, TCR-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b, CD66d и их комбинаций.
9. Способ получения химерного антигенного рецептора для связывания с целевым антигеном, выбранным из тирозинкиназного рецептора фактора роста, расположенного на поверхности раковой клетки твердой опухоли, указанный химерный антигенный рецептор включает:
i. по меньшей мере одну условно активную антиген-специфическую нацеливающую область, эволюционировавшую из родительского белка или его домена, которые связываются с целевым антигеном, и имеющую снижение в активности связывания с целевым антигеном в анализе при нормальном физиологическом pH по сравнению с активностью связывания с тем же целевым антигеном в анализе в ином аномальном pH в микроокружении опухоли;
ii. трансмембранный домен; и
iii. внутриклеточный сигнальный домен;
указанный способ включает стадии:
эволюционирование антиген-специфической нацеливающей области родительского белка или его фрагмента для создания условно активной антиген-специфической нацеливающей области, которая имеет снижение в активности связывания целевого антигена в анализе при нормальном физиологическом pH по сравнению с активностью связывания того же целевого антигена в анализе при отличном аномальном pH в микроокружении опухоли; и
связывание условно активной антиген-специфической нацеливающей области с трансмембранным доменом и с внутриклеточным сигнальным доменом для образования химерного антигенного рецептора.
10. Способ по п. 9, где по меньшей мере одна условно-активная антиген-специфическая нацеливающая область имеет снижение в аффинности связывания целевого антигена в анализе при нормальном физиологическом pH по сравнению с активностью связывания в условии при нормальном физиологическом pH антиген-специфической нацеливающей области родительского белка или его домена.
11. Способ по любому из пп. 9, 10, где химерный антигенный рецептор, содержащий по меньшей мере одну условно-активную антиген-специфическую нацеливающую область, имеет увеличение в уровне экспрессии по сравнению с идентичным химерным антигенным рецептором, содержащим антиген-специфическую нацеливающую область родительского белка или его домена.
12. Способ по любому из пп. 9-11, дополнительно включающий стадию связывания условно активной антиген-специфической нацеливающей области с внеклеточным спейсерным доменом или по меньшей мере одним ко-стимулирующим доменом.
13. Способ по любому из пп. 9-12, где по меньшей мере одна условно-активная антиген-специфическая нацеливающая область включает две антиген-специфические целевые области, и каждая антиген-специфическая нацеливающая область связывается с разными целевыми антигенами или разными эпитопами одного и того же целевого антигена.
14. Способ по любому из пп. 9-13, в котором по меньшей мере одну условно-активную антиген-специфическую нацеливающую область выбирают из антитела, лиганда, рецептор-связывающего домена лиганда, рецептора, лиганд-связывающего домена рецептора, аффитела и их комбинаций.
15. Способ по п. 14, где по меньшей мере одна условно-активная антиген-специфическая нацеливающая область является антителом, выбранным из полноразмерного антитела, одноцепочечного антитела, Fab-фрагмента, Fab'-фрагмента, (Fab')2-фрагмента, Fv-фрагмента и двухвалентного одноцепочечного антитела или диатела.
16. Способ по любому из пп. 12-15, где внеклеточный спейсерный домен выбирают из Fc-фрагмента антитела, шарнирной области антитела, CH2-области антитела, CH3-области антитела, искусственной спейсерной последовательности и их комбинаций.
17. Способ по любому из пп. 9-16, где трансмембранный домен выбирают из искусственной гидрофобной последовательности и трансмембранных доменов трансмембранного белка типа I, альфа-, бета- или зета-цепи рецептора Т-клеток, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154 и их комбинаций.
18. Способ по любому из пп. 9-17, где ко-стимулирующий домен выбирают из ко-стимулирующих доменов белков в надсемействе TNFR, CD28, CD137, CD134, DaplO, CD27, CD2, CD5, ICAM-1, LFA-1, Lck, TNFR-I, TNFR-II, Fas, CD30, CD40, ICOS LIGHT, NKG2C, B7-H3 и их комбинаций.
19. Способ по любому из пп. 9-18, где внутриклеточный сигнальный домен выбирают из цитоплазматических сигнальных доменов дзета-цепи CD3 человека, FcyRIII, FcsRI, цитоплазматического хвоста Fc-рецептора, тирозинового активирующего мотива иммунорецептора (ITAM) несущего цитоплазматические рецепторы, TCR-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b и CD66d.
| WO 2010025177 А1, 04.03.2010 | |||
| KONG S | |||
| et al | |||
| Насос | 1917 |
|
SU13A1 |
| Clinical Cancer Research, 2012, 18(21), 5949-5960 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| US 2015038684 A1, 05.02.2015 | |||
| KUNII N | |||
| et al | |||
| "Enhanced function of redirected human T cells | |||
Авторы
Даты
2021-11-19—Публикация
2016-02-24—Подача