ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области иммунотерапии рака, а также относится к способу лечения рака, в том числе к способу лечения солидной опухоли, причем указанный способ включает применение антитела к CD25.
УРОВЕНЬ ТЕХНИКИ
Иммунотерапия рака включает применение собственной иммунной системы субъекта для лечения или профилактики рака. Иммунотерапия применяет тот факт, что раковые клетки часто имеют на их поверхности молекулы с незначительными отклонениями, которые могут быть обнаружены иммунной системой. Эти молекулы, или раковые антигены, чаще всего представляют собой белки, но также включают такие молекулы, как углеводы. Таким образом, иммунотерапия включает провокацию иммунной системы на атаку опухолевых клеток посредством этих целевых антигенов. Однако злокачественные опухоли, в частности, солидные опухоли, могут избегать иммунологического надзора с помощью различных механизмов, присущих опухолевой клетке и опосредованных компонентами микроокружения опухоли. Среди последних было показано, что инфильтрация опухоли регуляторными Т-клетками (клетками Treg или Treg) и, более конкретно, неблагоприятный баланс эффекторных Т-клеток (Teff) по отношению к Treg (то есть низкое соотношение Teff к Treg), были предложены в качестве критических факторов (Smyth М et al., 2014, Immunol Cell Biol. 92, 473-4).
С тех пор, как они были обнаружены, Treg имеют решающее значение для опосредования иммунного гомеостаза и промотирования установления и поддержания периферической толерантности. Однако в контексте рака их роль более сложна. Поскольку раковые клетки экспрессируют как свои, так и опухоль-ассоциированные антигены, присутствие Treg, которые стремятся ослабить реакции эффекторных клеток, может способствовать прогрессированию опухоли. Инфильтрация Treg в развившихся опухолях, следовательно, является одним из основных препятствий для эффективных противоопухолевых ответов и для лечения раковых заболеваний в общем. Считается, что механизмы супрессии, применяемые Treg, вносят значительный вклад в ограничение или даже неэффективность текущих терапий, в частности, иммунотерапии, которые основаны на индуцировании или потенцировании противоопухолевых ответов (Onishi Н et al;, 2012 Anticanc. Res. 32, 997-1003).
Элиминация Treg в качестве терапевтического подхода к лечению рака представляет собой подход, который подтверждается исследованиями, в которых показан вклад Treg в установление и прогрессирование опухоли в мышиных моделях. Более того, инфильтрация опухоли с помощью Treg также была связана с худшим прогнозом в случае нескольких раковых заболеваний человека (Shang В et al., 2015, Sci Rep. 5:15179). Однако, элиминация Treg в опухолях является комплексной, а результаты исследований в этой области были противоречивыми. Таким образом, в данной области техники существует потребность в способе лечения рака, включающем элиминацию Treg.
Среди потенциальных молекулярных целей для достижения элиминации Treg, взаимодействие IL-2/CD25 являлось предметом нескольких исследований в мышиных моделях, некоторые из которых связаны с применением РС61, антимышиного антитела CD25 крысы (Setiady Y et al., 2010. Eur J Immunol. 40: 780-6). Связывание CD25 и функциональная активность этого антитела были сопоставлены с таковыми из панели моноклональных антител, полученных разными авторами (Lowenthal J. Wet al., 1985. J. Immunol., 135, 3988-3994; Moreau, J.-L et al., 1987. Eur. J. Immunol. 17,929-935; Volk HD et al., 1989 Clin. exp. Immunol. 76, 121-5; Dantal J et al., 1991, Transplantation 52:110-5).
Таким образом, были охарактеризованы три эпитопа антимышиного CD25 в пределах такой мишени, которые являются отличающимися или общими с сайтом связывания IL-2 мыши. РС61 (имеющий изотоп IgG1 мыши) блокирует или ингибирует связывание IL-2 с CD25, как и многие другие гибридомы в случае антимышиных антител к CD25 (и большинство из которых раскрыты в качестве античеловеческих антител к CD25; смотри, например, WO 2004/045512, WO 2006/108670, WO 1993/011238 и WO 1990/007861). Более того, на связывание РС61 с CD25 мыши не влияет, как и в случае других антимышиных антител к CD25, таких как 7D4, ADP-рибозилирование CD25 на сайте связывания IL-2 (Teege S et al., 2015, Sci Rep 5: 8959).
В некоторой литературе упоминается применение анти-CD25, отдельно или в комбинации, при раке или в связи с деплецией Treg. (WO 2004/074437; WO 2006/108670; WO 2006/050172; WO 2011/077245; WO 2016/021720; WO 2004/045512; Grauer О et al., 2007 Int. J. Cancer: 121: 95-105). Однако при исследовании на мышиных моделях рака, антимышиный РС61 CD25 крысы не продемонстрировал противоопухолевую активность при доставке после формирования опухоли.
В контексте мышиной модели аутоиммунитета, анти-CD25 антитело РС61 реконструируют для оценки влияния сильно неоднородной функции эффектора Fc в пределах анти-CD25 антитела на блокирование и деплецию рецептора IL-2 периферического Treg (Huss D et al., 2016. Immunol. 148: 276-86). Однако способность элиминировать Treg в опухолях или опосредовать противоопухолевую терапевтическую активность никогда не оценивали в случае РС61 (по существу, в качестве сконструированного антитела, или в качестве анти-человеческого CD25, сконструированного или охарактеризованного как имеющего признаки связывания CD25, аналогичные таковым у РС61 в случае CD25 мыши) отдельно или в сочетании с другими антителами или противораковыми соединениями.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает новые анти-CD25 антитела и новые применения анти-CD25 антител, которые характеризуют с помощью структурных элементов, которые позволяют эффективно элиминировать Treg, в частности, в опухолях. С этой целью структурные и функциональные признаки РС-61 IgG1 крысы (как описано в отношении CD25 мыши) были модифицированы для предоставления антител, которые представляют неожиданно улучшенные признаки с точки зрения применения для элиминации (деплеции) Treg и эффективности против опухолей, отдельно или в сочетании с другими противораковыми средствами. Эти результаты могут быть применены для определения и генерации новых анти-человеческих CD25, которые предлагают сравнимые эффекты против опухолей у субъектов-людей.
Следовательно, ключевым открытием авторов настоящего изобретения является неожиданное обнаружение того, что анти-мышиный анти-CD25 РС61 способен только элиминировать Treg в лимфатических узлах и кровотоке, при невозможности достижения подобного результата в опухоли. Отсутствие элиминации Treg в опухоли коррелирует с отсутствием противоопухолевой активности. Эти новые и неожиданные данные побудили авторов настоящего изобретения увеличить элиминирующую активность антимышиного CD25 посредством конструирования Fc, что приводит к потенциальной элиминации внутриопухолевого Treg и противоопухолевой активности.
В главном аспекте, настоящее изобретение предлагает способ лечения субъекта-человека, который имеет рак, включающий этап введения анти-CD25 антитела субъекту, где указанный субъект имеет опухоль (предпочтительно, солидную опухоль), причем указанное анти-CD25 антитело представляет собой антитело IgG1, которое с высокой аффинностью связывается с по меньшей мере одним активирующим рецептором Fcγ (предпочтительно, выбранным из FcγRI, FcγRIIc и FcγRIIIa) и элиминирует инфильтрирующие опухоль регуляторные Т-клетки.
Такое антитело, предпочтительно, имеет константу диссоциации (Kd) в случае CD25 менее 10-8 М и/или константу диссоциации в случае по меньшей мере одного активирующего рецептора Fcγ менее около 10-6 М. Наиболее предпочтительно, анти-CD25 антитело характеризуется другими признаками, связанными с рецепторами Fcγ, в частности:
(a) связывается с рецепторами Fcγ с коэффициентом активации-ингибирования (А/I), который превышает 1; и/или
(b) связывается с по меньшей мере одним из FcγRI, FcγRIIc и FcγRIIIa с более высокой аффинностью, чем он связывается с FcγRIIb.
Учитывая применение анти-CD25 антитела в терапевтических способах, оно может представлять дополнительные предпочтительные признаки. Анти-CD25 антитело представляет собой, предпочтительно, моноклональное антитело, в частности, человеческое или гуманизированное антитело. Более того, ввиду его взаимодействий с иммунными клетками и/или другими компонентами компонента иммунной системы для осуществления его функций, анти-CD25 антитело может дополнительно вызывать усиленный ответ CDC, ADCC (и/или ADCP, предпочтительно, повышенный ответ ADCC и/или ADCP, более предпочтительно, повышенный ответ ADCC.
Анти-CD25 антитело по настоящему изобретению (как в общем определено выше, и более подробно в Подробном описании настоящего изобретения) может быть применено в способах лечения человека, где указанное анти-CD25 антитело вводят субъекту, который имеет развившуюся солидную опухоль (предпочтительно, в способе, дополнительно включающем этап идентификации субъекта, который имеет солидную опухоль). Такие способы могут дополнительно включать введение ингибитора контрольных точек иммунного ответа указанному субъекту, например, в форме антитела, связывающего и ингибирующего белок контрольных точек иммунного ответа. Предпочтительный ингибитор контрольных точек иммунного ответа представляет собой антагонист PD-1, который может быть анти-PD-1 антителом или анти-PD-L1 антителом. В целом, анти-CD25 антитело может быть применено в способах элиминации регуляторных Т-клеток в солидной опухоли у субъекта, включающих этап введения указанного анти-CD25 антитела указанному субъекту.
В дополнительном аспекте, анти-CD25 антитело по изобретению может быть применено для производства лекарственного препарата для лечения рака у субъекта-человека, где указанный субъект имеет солидную опухоль. В данном объеме указанное антитело предназначено для введения в комбинации с ингибитором контрольных точек иммунного ответа, предпочтительно, антагонистом PD-1.
В дополнительном аспекте, настоящее изобретение предлагает комбинацию анти-CD25 антитела, как определено выше, с другим противораковым соединением (предпочтительно, ингибитором контрольных точек иммунного ответа или другими соединениями, как указано в подробном описании сущности изобретения) для применения при лечении рака у субъекта-человека, где указанный субъект имеет солидную опухоль, и анти-CD25 антитело и противораковое соединение (например, ингибитор контрольных точек иммунного ответа, такой как антагонист PD-1) вводят одновременно, отдельно или последовательно. В данном объеме настоящее изобретение также предлагает набор для применения при лечении рака, содержащий анти-CD25 антитело, как определено выше, и противораковое соединение (например, ингибитор контрольных точек иммунного ответа, такой как антагонист PD-1),
В дополнительном аспекте, настоящее изобретение также предлагает фармацевтическую композицию, содержащую анти-CD25 антитело, как определено выше, в фармацевтически приемлемой среде. Подобная композиция может также содержать противораковое соединение (например, ингибитор контрольных точек иммунного ответа, такой как антагонист PD-1).
В еще одном дополнительном аспекте, настоящее изобретение также предлагает биспецифическое антитело, содержащее:
(a) первую антигенсвязывающую функциональную группу, которая связывается с CD25; и
(b) вторую антигенсвязывающую функциональную группу, которая связывается с другим антигеном;
где биспецифическое антитело представляет собой антитело IgG1, которое связывается с по меньшей мере одним активационным рецептором Fcγ с высокой аффинностью и элиминирует инфильтрирующие опухоль регуляторные Т-клетки. Предпочтительно, подобная вторая антигенсвязывающая функциональная группа связывается с антигеном, выбранным из белка контрольных точек иммунного ответа, опухоле-ассоциированного антигена, или представляющим собой (или основанным на) античеловеческое антитело к активационному рецептору Fc (анти-FcγRI, анти-FcγRIIc или анти-FcγRIIIa антитело) или представляющим собой (или основанным на) антагонистическое античеловеческое антитело FcγRIIb.
Предпочтительно, подобное биспецифическое антитело содержит вторую антигенсвязывающую функциональную группу, которая связывает белок контрольных точек иммунного ответа, который выбирают из группы, состоящей из PD-1, CTLA-4, BTLA, KIR, LAG3, VISTA, TIGIT, TIM3, PD-L1, В7Н3, В7Н4, PD-L2, CD80, CD86, HVEM, LLT1, GAL9, GITR, ОХ40, CD137 и ICOS. Подобный белок контрольных точек иммунного ответа, предпочтительно, экспрессируется на опухолевой клетке, и, наиболее предпочтительно, выбран из PD-1, PD-L1 и CTLA-4. Вторая антигенсвязывающая функциональная группа, которая связывается с белком контрольных точек иммунного ответа, может быть включена или основана на коммерчески доступном антителе, которое действует в качестве ингибитора контрольных точек иммунного ответа, например:
(a) в случае PD-1, анти-PD-1 антитело может представлять собой ниволумаб или пембролизумаб.
(b) В случае PD-L1, анти-PD-L1 представляет собой атезолизумаб;
(c) В случае CTLA-4, анти-СТLА-4 представляет собой ипилимумаб.
Подобное биспецифическое антитело могут быть предложено в любом коммерчески доступном формате, в том числе Duobody, BiTE DART, CrossMab,
Knobs-in-holes, Triomab или другом приемлемом молекулярном формате биспецифического антитела и его фрагментов.
В качестве альтернативы, подобное биспецифическое антитело содержит вторую антигенсвязывающую функциональную группу, которая связывается с опухоле-ассоциированным антигеном. В таком альтернативном варианте реализации, подобные антигены и соответствующие антитела включают, без ограничения этим, CD22 (блинатумомаб), CD20 (ритуксимаб, тоситумомаб), CD56 (лорвотузумаб), CD66e/CEA (лабетузумаб), CD152/CTLA-4 (ипилимумаб), CD221/IGF1R (МK-0646), CD326/Epcam (эдреколомаб), CD340/HER2 (трастузумаб, пертузумаб) и EGFR (цетуксимаб, панитумумаб).
Комбинация анти-CD25 антитела по изобретению с другим противораковым соединением или биспецифическими антителами, как определено выше, может быть применена в способе лечения рака, включающем этап введения указанной комбинации или указанного биспецифического антитела субъекту, в частности, при условии, что субъект имеет солидную опухоль, и для применения при лечении рака у субъекта.
Дополнительные объекты по изобретению, в том числе, дополнительные определения анти-человеческого антитела CD25 по изобретению и его применения в способах для лечения рака, в фармацевтических композициях, в комбинациях с другими противораковыми соединениями, в биспецифических антителах, предлагают в подробном описании сущности изобретения и в примерах.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способ лечения или профилактики рака, в частности, солидной опухоли, у субъекта, включающий этап введения антитела, которое связывается с CD25 указанного субъекта, на основании чего анти-CD25 антитела характеризуют с помощью структурных элементов, которые позволяют эффективно элиминировать Treg, в частности, в опухолях. Настоящее изобретение также предлагает антитело, которое связывается с CD25, как определено в настоящем изобретении, для применения при лечении или профилактике рака, в частности, солидной опухоли. Альтернативно, настоящее изобретение предлагает применение антитела, которое связывается с CD25 и которое позволяет эффективно элиминировать Treg для производства лекарственного препарата для лечения или профилактики рака, в частности, солидной опухоли. Изобретение также предлагает применение антитела, которое связывает CD25 и которое позволяет эффективно элиминировать Treg при лечении или профилактике рака, в частности, солидной опухоли.
Настоящее изобретение раскрывает, каким образом замена изотипа анти-CD25 антитела (проиллюстрированного с помощью РС61 антимышиного антитела CD25 крысы) на элиминирующий изотип (IgG2 мыши в случае РС61, но эквивалентный IgG1 у человека) приводит к улучшенной элиминации регуляторных Т-клеток в контексте солидной опухоли. Более того, авторы настоящего изобретения впервые обнаружили, что CD25 могут быть нацелены на элиминацию регуляторных Т-клеток в терапевтическом контексте, например, в развившейся солидной опухоли, и что CD25 предпочтительно экспрессируется в регуляторных Т-клетках. Авторы настоящего изобретения обнаружили, что сконструированное анти-CD25 антитело с усиленным связыванием с активационными гамма рецепторами Fc приводит к эффективной элиминации инфильтрирующих опухоль регуляторных Т-клеток, терапевтическому подходу, который мог бы, например, быть связан (в комбинации с или в биспецифических антителах) с другими таргетирующими рак соединениями, такими как те, которые таргетируют белок контрольных точек иммунного ответа, опухоле-ассоциированным антигеном или ингибирующим рецептором Fcγ.
Авторы настоящего изобретения также впервые обнаружили, что ингибирующий гамма рецептор Fc IIb повышающе регулируется на месте опухоли, таким образом препятствуя эффективной интратуморальной элиминации регуляторных Т клеток с помощью исходного антимышиного антитела CD25 РС61. Таким образом, изобретение охватывает терапевтические применения, включающие комбинационный подход, включающий таргетирование гамма рецептор IIb CD25 и Fc.
CD25 представляет собой альфа цепь рецептора IL-2 и находится на активированных Т клетках, регуляторных Т-клетках, активированных В клетках, некоторых тимоцитах, миелоидных клетках-предшественниках и олигодендроцитах. CD25 ассоциируются с CD122 и CD132 с образованием гетеротримерного комплекса, который действует в качестве высокоаффинного рецептора для IL-2. Консенсусная последовательность CD25 человека показана ниже в SEQ ID NO: 1 (учетный номер Uniprot Р01589; внеклеточный домен зрелого человеческого CD25, соответствующий аминокислотам 22-240, подчеркнут и представлен в SEQ ID NO: 2):

Как применяют в данном документе, «антитело, которое связывает CD25» соответствует антителу, которое способно связываться с субъединицей CD25 рецептора IL-2. Эта субъединица также известна как альфа субъединица рецептора IL-2. Такое антитело также упоминается в данном документе как «анти-CD25 антитело».
Анти-CD25 антитело представляет собой антитело, способное к специфическому связыванию с субъединицей CD25 (антигена) рецептора IL-2. Термины «специфическое связывание», «связывает специфически» и «специфически связывать» понимаются как означающие, что антитело имеет константу диссоциации (Kd) в отношении представляющего интерес антигена менее около 10-6 М, 10-7 М, 10-8 М, 10-9 М, 10-10 М, 10-11 М или 10-12 М. В предпочтительном варианте реализации, константа диссоциации составляет менее 10-8 М, например, в диапазоне 10-9 М, 10-10 М, 10-11 М или 10-12 М.
Как применяют в данном документе, термин «антитело» соответствует и интактным иммуноглобулиновым молекулам и их фрагментам, которые включают антиген-связывающий сайт, и включают поликлональные, моноклональные, генетически сконструированные и другим способом модифицированные формы антител, в том числе, без ограничения, химерные антитела, гуманизированные антитела, гетероконъюгатные и/или мультиспецифические антитела (например, биспецифические антитела, диатела, триотела и тетратела) и антигенсвязывающие фрагменты антител, в том числе, например, Fab', F(ab')2, Fab, Fv, rIgG, слитые молекулы полипептида-Fc, одноцепочечные варианты (фрагменты scFv, VHH, Trans-bodies®, Affibodies®, однодоменные антитела акулы, одноцепочечные или тандемные диатела (TandAb®), VHH, Anticalins®, Nanobodies®, миниантитела, BiTE®, бициклические пептиды и другие альтернативные белковые каркасы иммуноглобулина). В некоторых вариантах реализации антитело может не иметь ковалентную модификацию (например, присоединение гликана), которую он имел бы, если бы был получен естественным образом. В некоторых вариантах реализации антитело может иметь ковалентную модификацию (например, присоединение гликана, детектируемую функциональную группу, терапевтическую функциональную группу, каталитическую функциональную группу или другую химическую группу, обеспечивающую улучшенную стабильность или введение антитела, такого как полиэтиленгликоль). «Антитело» могут также относиться к антителам верблюдовых (антителам, содержащим только тяжелую цепь) и антителоподобным молекулам, таким как антикалины (Skerra (2008) FEBS J 275, 2677-83). В некоторых вариантах реализации антитело является поликлональным или олигоклональным, которое является полученным в качестве панели антител, каждое из которых связано с одной последовательностью антитела и связывают более или менее различимые эпитопы в пределах антигена (такие как различные эпитопы в пределах внеклеточного домена CD25 человека, которые связаны с различными контрольными античеловеческими антителами CD25). Поликлональные или олигоклональные антитела могут быть предложены в одном препарате для медицинских применений, как описано в литературе (Kearns JD et al., 2015. Mol Cancer Ther. 14:1625-36).
В одном аспекте по изобретению антитело является моноклональном. Антитело может дополнительно или альтернативно быть гуманизированным или человеческим. В дополнительном аспекте, антитело является человеческим, или в любом случае антитело, которое имеет формат и признаки, позволяющие применять его и вводить людям.
Антитела (Ab) и иммуноглобулины (Igs) представляют собой гликопротеины, имеющие аналогичные структурные характеристики. Иммуноглобулины может быть из любого класса, такого как IgA, IgD, IgG, IgE или IgM. Иммуноглобулины может быть из любого подкласса, такого как IgG1, IgG2, IgG3 или IgG4. В предпочтительном аспекте по изобретению анти-CD25 антитело относится к классу IgG, предпочтительно, подклассу IgG1. В одном аспекте анти-CD25 антитело относится к подклассу IgG1 человека.
Область Fc антител IgG взаимодействует с несколькими клеточными рецепторами Fcγ (FcγR) для стимулирования и регулирования нижестоящих эффекторных механизмов. Существует пять активирующих рецепторов, а именно FcγRI (CD64), FcγRIIa (CD32a), FcγRIIc (CD32c), FcγRIIIa (CD16a) и FcγRIIIb (CD16b) и один ингибирующий рецептор FcγRIIb (CD32b). Связь антител IgG с иммунной системой контролируют и опосредуют с помощью FcγR, которые передают информацию, обнаруженную и собранную антителами, иммунной системе, обеспечивая связь между врожденной и адаптивной иммунными системами и, в частности, в контексте биотерапии (Hayes J et al., 2016. J Inflamm Res 9: 209-219).
Субклассы IgG различаются по их способности связываться с FcγR, и это дифференциальное связывание определяет их способность вызывать диапазон функциональных ответов. Например, у людей, FcγRIIIa является основным рецептором, участвующим в активации антителозависимой клеточно-опосредованной цитотоксичности (ADCC) и IgG3, который тесно связан с IgG1, демонстрирует самые высокие аффинности к этому рецептору, что отражает их способность активно индуцировать ADCC.
В предпочтительном варианте реализации, по изобретению, антитело связывает FcγR с высокой аффинностью, предпочтительно, активирующий рецептор с высокой аффинностью. Предпочтительно антитело связывает FcγRI и/или FcγRIIa и/или FcγRIIIa с высокой аффинностью. В конкретном варианте реализации, антитело связывается с FcγR с константой диссоциации менее около 10-6 М, 10-7 М, 10-8 М, 10-9 М или 10-10 М.
В одном аспекте антитело представляет собой антитело IgG1, предпочтительно, антитело IgG1 человека, который способен связываться с по меньшей мере одним активирующим рецептором Fc. Например, антитело может связываться с одним или более рецепторами, выбранными из FcγRI, FcγRIIa, FcγRIIc, FcγRIIIa и FcγRIIIb. В одном аспекте антитело способно связываться с FcγRIIIa. В одном аспекте антитело способно связываться с FcγRIIIa и FcγRIIa и, необязательно, с FcγRI. В одном аспекте антитело способно связываться с этими рецепторами с высокой аффинностью, например, с константой диссоциации менее около 10-7 М, 10-8 М, 10-9 М или 10-10 М,
В одном аспекте антитело связывает ингибирующий рецептор, FcγRIIb, с низкой аффинностью. В одном аспекте антитело связывает FcγRIIb с константой диссоциации выше 10-7 М, выше 10-6 М или выше 10-5 М.
В предпочтительном варианте реализации изобретения, античеловеческое антитело CD25 из подкласса IgG1 человека, и, предпочтительно, имеет активность ADCC и/или ADCP, как обсуждалось в данном документе, в частности, по отношению к клеткам человеческого происхождения. Действительно, как описано ранее (Nimmerjahn F et al., 2005. Science, 310:1510-2), изотип mIgG2a (который соответствует изотипу IgG1 человека) связывается со всеми подтипами FcγR с высоким коэффициентом активации-ингибирования (A/I), который, по меньшей мере, превышает 1. Напротив, другие изотипы (такие как изотип rIgG1) связываются с аналогичной аффинностью только с одним активационным FcγR (FcγRIII), а также ингибирующим FcγRIIb, что приводит к низкому коэффициенту A/I (<1). Как показано в Примерах, этот более низкий коэффициент A/I коррелирует с более низкой элиминации внутриопухолевых Treg и более низкой анти-опухолевой терапевтической активности изотипа.
В предпочтительном варианте реализации, анти-CD25 антитело, как описано в данном документе, связывает CD25 человека, предпочтительно, с высокой аффинностью. Тем не менее предпочтительно, анти-CD25 антитело связывается с внеклеточной областью CD25 человека, как показано выше. В одном аспекте изобретение предлагает анти-CD25 антитело, как описано в данном документе. В частности, в примерах предложены экспериментальные данные, полученные с помощью антитела, которое секретируется гибридомой РС-61.5.3 и которое обычно определяют как РС61 или РС-61. Анализы, связанные с РС-61 и CD25 мыши в литературе (например, Setiady Y et al., 2010. Eur. J. Immunol. 40: 780-6; McNeill A et al., 2007. Scand J Immunol. 65:63-9; Teege S et al., 2015, Sci Rep 5: 8959), вместе с раскрытыми в Примерах (в том числе рекомбинантные антитела, включающие CD25-связывающий домен РС61), могут быть адаптированы для исследования тех человеческих антител, которые распознают CD25 человека, имеющий те же функциональные признаки, что и РС61, и на уровне взаимодействия с CD25 (в частности, блокирования связывания IL-2), и с рецепторами Fcγ (в частности, с помощью, предпочтительно, связывания активирующих Fcγ рецепторов человека и эффективной элиминации Treg), когда соответствующий изотип связан таким образом, как описано в Примерах. Подходящие способы для достижения требуемых функциональных признаков антитела, как описано в данном документе, будут известны специалисту в данной области техники.
В предпочтительном варианте реализации, способ лечения человека, у которого есть рак, включает этап введения анти-CD25 антитела субъекту, где указанный субъект, предпочтительно, имеет солидную опухоль, и при этом анти-CD25 антитело представляет собой, предпочтительно, антитело IgG1 человека, которое связывается с по меньшей мере одним активирующим рецептором Fcγ, выбранным из FcγRI (CD64), FcγRIIc (CD32c) и FcγRIIIa (CD16a) с высокой аффинностью и элиминирует инфильтрирующие опухоль регуляторные Т-клетки. Предпочтительно, анти-CD25 антитело имеет константу диссоциации (Kd) в случае CD25 менее 10-8 М. Более предпочтительно, анти-CD25 антитело связывает CD25 человека, обеспечивая эффекты на IL-2 связывание и элиминацию Treg, подобные таковым в случае CD25 мыши. В дополнительном варианте реализации, анти-CD25 антитело связывается с рецепторами Fcγ с коэффициентом активации-ингибирования (A/I) превышающим 1 и/или связывается с FcγRI (CD64), FcγRIIc (CD32c), FcγRIIIa (CD16a) с более высокой аффинностью, чем оно связывается с FcγRIIb (CD32b).
Связывающий домен CD25 антитела РС-61 был клонирован и экспрессируется в виде рекомбинантного белка при слиянии с соответствующей константной областью. Последовательность связывающего домена CD25 антитела РС-61, а также его специфичность в случае отдельных эпитопов в пределах внеклеточного домена CD25 и/или его другие функциональные активности, могут быть применены для сравнения потенциального анти-CD25 антитела, которые генерируют и скринируют с помощью любой подходящей методики (например путем поднятия панелей гибридом от CD25-иммунизированных грызунов или генерации библиотек рекомбинантных антител, а затем скрининга этих спектров антител с фрагментами CD25 для функционального исследования, как описано в данном документе). Анти-CD25 антитела, которые, следовательно, могут быть получены также в качестве рекомбинантных антител, в частности, в качестве полноразмерных антител или в качестве фрагментов или вариантов, которые описаны в данном документе.
Нативные антитела и иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины около 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая тяжелая цепь имеет вариабельный домен (VH) на аминоконце, за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен (VL) на аминоконце и константный домен на карбоксиконце.
Вариабельные области способны взаимодействовать со структурно комплементарной антигенной мишенью и характеризуются отличиями в аминокислотной последовательности от антител различной антигенной специфичности. Вариабельные области либо Н, либо L цепей содержат аминокислотные последовательности, способные специфически связываться с антигенными мишенями. В пределах этих последовательностей расположены меньшие последовательности, называемые «гипервариабельными» из-за их крайней вариабельности между антителами различной специфичности. Такие гипервариабельные области также называют «областями, определяющими комплементарность» или областями «CDR».
Эти области CDR составляют основную специфичность антитела по отношению к конкретной структуры антигенной детерминанты. CDR представляют собой несмежные удлиненные участки аминокислот в вариабельных областях, но независимо от видов, позиционные положения этих критических аминокислотных последовательностей в вариабельных областях тяжелой и легкой цепей, как было обнаружено, имеют сходные положения в аминокислотных последовательностях вариабельных цепей. Переменные тяжелые и легкие цепи всех антител имеют 3 CDR-области, каждая из которых является несмежной с другими (называемыми L1, L2, L3, Н1, Н2, Н3) в случае соответствующих легких (L) и тяжелых (Н) цепей. Принятые области CDR были описаны ранее (Kabat et аl., 1977. J Biol Chem 252, 6609-6616).
Антитела по настоящему изобретению могут функционировать через комплементарно-зависимую цитотоксичность (CDC) и/или антителозависимую клеточно-опосредованную цитотоксичность (ADCC) и/или антителозависимый клеточно-опосредованный фагоцитоз (ADCP), а также любой другой механизм, который позволяет таргетировать, блокировать пролиферацию и/или элиминировать клетки Treg.
«Комплементарно-зависимая цитотоксичность» (CDC) соответствует лизису антиген-экспрессирующих клеток с помощью антитела по изобретению в присутствии комплемента.
«Антителозависимая клеточно-опосредованная цитотоксичность» (ADCC) соответствует опосредованной клетками реакции, в которой неспецифические цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, клетки Natural Killer (NK), нейтрофилы и макрофаги), распознают связанное антитело на целевой клетке и, таким образом, приводят к лизису клетки-мишени.
«Антителозависимый клеточно-опосредованный фагоцитоз» (ADCP) соответствует опосредованной клетками реакции, в которой фагоциты (такие как макрофаги), которые экспрессируют рецепторы Fc (FcR), распознают связанное антитело на клетке-мишени и тем самым приводят к фагоцитозу клетки-мишени.
CDC, ADCC и ADCP могут быть измерены с применением анализов, которые известны и доступны в данной области техники (Clynes et al. (1998) Proc Natl Acad Sci USA 95, 652-6). Константная область антитела важна в способности антитела к фиксированию комплемента и опосредует клеточно-зависимую цитотоксичность и фагоцитоз. Таким образом, как обсуждалось в данном документе, изотип антитела может быть выбран на основе того, является ли желательным, чтобы антитело опосредовало цитотоксичность/фагоцитоз.
Как обсуждалось в данном документе, в варианте реализации изобретения применяют анти-CD25 антитело, которое приводит к элиминации клеток Treg. Например, может быть применено анти-CD25 антитело, которое вызывает сильный ответ CDC и/или сильный ADCC и/или сильный ответ ADCP. Способы увеличения CDC, ADCC и/или ADCP известны в данной области. Например, ответ CDC может быть повышен с мутациями в антителе, которые увеличивают аффинность связывания C1q (Idusogie et al. (2001) J Immunol 166, 2571-5).
ADCC может быть повышена способами, которые устраняют функциональную группу фукозы из гликана антитела, например, путем продуцирования антитела в клеточной линии YB2/0 или введением определенных мутаций на части Fc IgG1 человека (например, S298A/E333A/K334A, S239D/I332E/A330L, G236A/S239D/A330L/I332E) (Lazar et al. (2006) Proc Natl Acad Sci USA 103, 2005-2010; Smith et al. (2012) Proc Natl Acad Sci USA 109, 6181-6). ADCP может также быть повышен путем введения специфических мутаций на части Fc IgG1 человека (Richards et al. (2008) Mol Cancer Ther 7, 2517-27).
В предпочтительном варианте реализации, по настоящему изобретению антитело оптимизировано для получения ответа ADCC, то есть ответ ADCC является усиленным, повышенным или улучшенным по отношению к другим анти-CD25 антителам или приводимым в качестве примера немодифицированным анти-CD25 моноклональным антителам.
Как применяют в данном документе, «химерное антитело» может относиться к антителу, имеющему вариабельные последовательности, полученные из иммуноглобулина от одних видов, таких как антитело крысы или мыши, и константные области иммуноглобулина от других видов, например, от антитела человека. В некоторых вариантах реализации химерное антитело может иметь константную область, которая является усиленной для индуцирования ADCC.
Антитела по изобретению могут также быть частично или полностью синтетическими, причем по крайней мере часть полипептидных цепей антител синтезируют и, возможно, оптимизируют для связывания их распознанного антигена. Такие антитела могут представлять собой химерные или гуманизированные антитела и могут быть полностью тетрамерными по своей структуре или могут быть димерными и содержать только одну тяжелую и одну легкую цепь.
Антитела по настоящему изобретению могут также быть моноклональными антителами. Как применяют в данном документе, «моноклональное антитело» не ограничивается антителами, полученными с помощью гибридомной технологии. Термин «моноклональное антитело» соответствует антителу, которое получено из одного клона, в том числе любого эукариотического, прокариотического или фагового клона, а не способу, с помощью которого его получают.
Антитела по настоящему изобретению могут также быть антителами человека. Как применяют в данном документе, «антитело человека» соответствует антителам, имеющим вариабельные области, в которых как каркасная, так и CDR области получены из последовательностей иммуноглобулина зародышевой линии человека. Кроме того, если антитело содержит константную область, константную область также получают из последовательностей иммуноглобулина зародышевой линии человека. Антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина человека зародышевой линии (например, мутации, введенные случайным или специфичным для сайта мутагенезом in vitro или с помощью соматической мутации in vivo).
Анти-CD25 антитело, представляющее признаки, как описано в данном документе, представляет дополнительный объект по изобретению. В дополнительном варианте реализации, настоящее изобретение предлагает молекулы нуклеиновых кислот, кодирующие анти-CD25 антитела, как определено в данном документе. В некоторых вариантах реализации такие предложенные молекулы нуклеиновой кислоты могут содержать кодон-оптимизированные последовательности нуклеиновой кислоты и/или могут быть включены в экспрессирующие кассеты в пределах соответствующих векторов нуклеиновых кислот для экспрессии в клетках-хозяевах, таких как, например, бактериальные, дрожжевые, насекомых, рыб, мышиные, обезьяньи или человеческие клетки. В некоторых вариантах реализации настоящее изобретение предлагает клетки-хозяева, содержащие гетерологичные молекулы нуклеиновой кислоты (например, ДНК-векторы), которые экспрессируют желаемое антитело.
В некоторых вариантах реализации настоящее изобретение предлагает способы получения выделенного анти-CD25 антитела, как определено выше. В некоторых вариантах реализации такие способы могут включать культивирование клетки-хозяина, которая включает нуклеиновые кислоты (например, гетерологичные нуклеиновые кислоты, которые могут содержаться и/или доставляться в клетку-хозяина посредством векторов). Предпочтительно, клетка-хозяин (и/или гетерологичные последовательности нуклеиновой кислоты) расположена и сконструирована таким образом, что антитело или ее антигенсвязывающий фрагмент секретируется из клетки-хозяина и выделяется из супернатантов клеточной культуры
Антитела по настоящему изобретению могут быть моноспецифическими, биспецифическими или мультиспецифическими. «Мультиспецифические антитела» могут быть специфичными для разных эпитопов одного целевого антигена или полипептида или могут содержать антиген-связывающие домены, специфичные для более, чем одного целевого антигена или полипептида (Kufer et al. (2004) Trends Biotechnol 22, 238-44).
В одном аспекте по изобретению антитело представляет собой моноспецифическое антитело. Как обсуждают дополнительно ниже, в альтернативном аспекте антитело представляет собой биспецифическое антитело.
Как применяют в данном документе, «биспецифическое антитело» соответствует антителу, обладающему способностью связываться с двумя различными эпитопами либо на одном антигене или полипептиде, либо на двух разных антигенах или полипептидах.
Биспецифические антитела по настоящему изобретению, как обсуждают в данном документе, могут быть получены с помощью таких биологических способов, как соматическая гибридизация; или генетических способов, таких как экспрессия ненативной последовательности ДНК, кодирующей желаемую структуру антитела в клеточной линии или в организме; химических способов (например, путем химического сочетания, сплайсинга, нековалентной ассоциации или иным образом с одним или более молекулярными объектами, такими как другое антитело или фрагмент антитела); или их комбинацией.
Технологии и продукты, которые делают возможным получение моноспецифических или биспецифических, известных в данной области техники, как широко рассмотрены в литературе, также применительно к альтернативным форматам, конъюгатам антитело-лекарственное средство, способам построения антител, способам скрининга in vitro, константным областям, посттрансляционным и химическим модификациям, улучшенному признаку для запуска гибели раковых клеток, таких как конструирование Fc (Tiller K and Tessier Р, 2015 Annu Rev Biomed Eng. 17: 191-216; Speiss С et al., 2015. Molecular Immunology 67: 95-106; Weiner G, 2015. Nat Rev Cancer, 15: 361-370; Fan G et al., 2015. J Hematol Oncol 8:130).
Как применяют в данном документе, «эпитоп» или «антигенная детерминанта» соответствует сайту на антигене, с которым антитело связывается. Как хорошо известно в данной области техники, эпитопы могут быть образованы как из смежных аминокислот (линейный эпитоп), так и из несмежных аминокислот, сопоставленных третичным сгибанием белка (конформационные эпитопы). Эпитопы, образованные из смежных аминокислот, обычно сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, образованные третичным сгибанием, обычно теряются при обработке денатурирующими растворителями. Эпитоп обычно включает по меньшей мере 3 и более, обычно, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Способы определения пространственной конформации эпитопов хорошо известны в данной области техники и включают, например, рентгеноструктурную кристаллографию и 2-D ядерный магнитный резонанс. Смотри, например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed (1996).
В некоторых вариантах реализации анти-CD25 антитело может быть включено в средство, которое дополнительно содержит конъюгированную полезную нагрузку, такую как терапевтическое или диагностическое средство, в частности, для терапии или диагностики рака. Могут быть использованы конъюгаты анти-CD25 антител с радионуклидами или токсинами. Примерами широко применяемых радионуклидов являются, например, 90Y, 131I и 67Cu, среди прочего, а примерами обычно применяемых токсинов являются доксорубицин и калихеамицин. В дополнительном варианте реализации, анти-CD25 антитело может быть изменено, чтобы иметь измененный период полувыведения. Способы достижения измененного периода полувыведения известны в данной области техники.
В одном варианте реализации антитело может блокировать функцию CD25 человека, предпочтительно, в дополнение к промотированию элиминации (через ADCC, ADCP и/или CDC) CD25-экспрессирующих клеток. Предпочтительно, оно также блокирует связывание IL-2 человека с CD25 человека, и, наиболее предпочтительно, блокирует передачу сигнала IL-2 человека в CD25-экспрессирующие клетки.
В предпочтительном варианте реализации, по настоящему изобретению, субъект любого из аспектов изобретения, описанного в данном документе, представляет собой млекопитающее, предпочтительно, кошку, собаку, лошадь, осла, овцу, свинью, козу, корову, хомяка, мышь, крысу, кролика или морскую свинку, но, наиболее предпочтительно, представляет собой человека. Таким образом, во всех аспектах изобретения, как описано в данном документе, субъект представляет собой человека.
Как применяют в данном документе, термины «рак», «раковый», или «злокачественный» соответствуют или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток.
Примеры рака включают, но без ограничения этим, карциному, лимфому, лейкемию, бластому и саркому. Более конкретными примерами таких раковых заболеваний являются плоскоклеточный рак, миелома, мелкоклеточный рак легких, немелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (НСС), лимфома Ходжкина, неходжкинская лимфома, острый миелоидный лейкоз (AML), множественная миелома, гастроинтестинальный рак (желудочно-кишечного тракта), почечный рак, рак яичников, рак печени, лимфобластный лейкоз, лимфоцитарный лейкоз, колоректальный рак, рак эндометрия, рак почек, рак предстательной железы, рак щитовидной железы, меланома, хондросаркома, нейробластома, рак поджелудочной железы, мультиформная глиобластома, рак шейки матки, рак головного мозга, рак желудка, рак мочевого пузыря, гепатома, рак молочной железы, карцинома толстой кишки и рак головы и шеи.
В одном аспекте рак включает солидную опухоль. Примеры солидных опухолей представляют собой саркомы (в том числе раковые заболевания, возникающие из трансформированных клеток мезенхимального происхождения в тканях, таких как губчатая костная, хрящевая, жировая, мышечная, сосудистая, кроветворная или волокнистая соединительная ткань), карциномы (в том числе опухоли, возникающие из эпителиальных клеток), мезотелиомы, нейробластомы, ретинобластомы и т. д. Виды рака, включающие солидные опухоли, включают, без ограничения этим, рак головного мозга, рак легких, рак желудка, рак двенадцатиперстной кишки, рак пищевода, рак молочной железы, рак толстой кишки и прямой кишки, рак почки, рак мочевого пузыря, рак почки, рак поджелудочной железы, рак предстательной железы, рак яичников, меланому, рак полости рта, саркому, рак глаз, рак щитовидной железы, рак уретры, рак влагалища, рак шеи, лимфому и тому подобное.
В одном аспекте по изобретению рак выбран из меланомы, немелкоклеточного рака легких, рака почки, рака яичников, рака мочевого пузыря, саркомы и рака толстой кишки. В предпочтительном аспекте по изобретению рак выбран из меланомы, рака яичников, немелкоклеточного рака легких и рака почки. В одном варианте реализации рак не является меланомой, раком яичников или раком молочной железы. В предпочтительном аспекте, рак представляет собой саркому, рак толстой кишки, меланому или колоректальный рак или, в более общем случае, любой рак человека, для которого клеточная линия МСА205, СТ26, В16 или МС38 (как указано в примерах) может представлять собой доклинические модели для валидации соединений как полезных для проведения терапии.
Как применяют в данном документе, термин «опухоль», как он применяется по отношению к субъекту, которому диагностировали или которого подозревают в наличии, рак соответствует злокачественному или потенциально злокачественному новообразованию или массе ткани любого размера и включает первичные опухоли и вторичные новообразования. Термины «рак», «злокачественность», «новообразование», «опухоль» и «карцинома» могут быть также применены взаимозаменяемо в данном документе для обозначения опухолей и опухолевых клеток, которые проявляют относительно ненормальный, неконтролируемый и/или автономный рост, так что они проявляют фенотип с аберрантным ростом, характеризующийся значительной потерей контроля над пролиферацией клеток. В общем, клетки, представляющие интерес для обнаружения или лечения, включают предраковые (например, доброкачественные), злокачественные, предметастатические, метастатические и неметастатические клетки. Идеи настоящего раскрытия могут иметь отношение к любому из раковых заболеваниях.
Как применяют в данном документе, «солидные опухоли» представляют собой аномальным рост или массу ткани, которая обычно не содержит цисты или жидкие области, в частности, опухоли и/или метастазы (где бы они ни находились), кроме лейкемии или несолидных лимфатических раковых заболеваний. Солидные опухоли могут быть доброкачественными или злокачественными. Различные типы солидных опухолей названы по типу клеток, которые образуют их, и/или ткани или органа, в котором они локализованы. Примеры солидных опухолей представляют собой саркомы (в том числе раковые заболевания, возникающие из трансформированных клеток мезенхимного происхождения в тканях, таких как губчатое вещество кости, хрящевая, жировая, мышечная, сосудистая, кроветворная или волокнистая соединительная ткань), карциномы (в том числе опухоли, возникающие из эпителиальных клеток) меланомы, лимфомы, мезотелиомы, нейробластомы и ретинобластомы.
Особенно предпочтительными раковыми заболеваниями в соответствии с настоящим изобретением являются те, которые характеризуются наличием солидной опухоли, то есть у субъекта нет несолидной опухоли. Во всех аспектах по изобретению как обсуждалось в данном документе, является предпочтительным, чтобы рак представлял собой солидную опухоль, т. е. что субъект имеет солидную опухоль (и не имеет несолидную опухоль).
Ссылка на «лечить» или «лечение» рака, как применяют в данном документе, определяет достижение по меньшей мере одного положительного терапевтического эффекта, такого как, например, уменьшенное число раковых клеток, уменьшенный размер опухоли, сниженная скорость инфильтрации клеток в периферические органы или снижение скорости метастазирования опухоли или роста опухоли.
Положительные терапевтические эффекты при раке могут быть измерены несколькими способами (например, Weber (2009) J Nucl Med 50, 1S-10S). В качестве примера, в отношении ингибирования роста опухоли, согласно стандартам Национального института рака (NCl), Т/С ≤ 42 % является минимальным уровнем антиопухолевой активности. Т/С < 10 % считают высоким уровнем анти-опухолевой активности, с Т/С (%) = Средний объем опухоли обработанного/медианного объема опухоли контроля × 100. В некоторых вариантах реализации лечение, достигаемое терапевтически эффективным количеством, представляет собой любое из выживаемости без прогрессирования заболевания (PFS), выживаемости без признаков заболевания (DFS) или общей выживаемости (ОС). PFS, также называемая «время до прогрессирования опухоли», указывает продолжительность времени на протяжении и после лечения, в течение которого рак не растет, и включает количество времени, которое пациенты испытывали полный ответ или частичный ответ, а также количество пациентов, испытывавших стабильное заболевание. DFS соответствует длительности времени на протяжении и после лечения, в течение которого пациент остается свободным от болезни. OS соответствует увеличению продолжительности жизни по сравнению с наивными или необработанными индивидуумами или пациентами.
Ссылка на «профилактику» (или предупреждение), как применяют в данном документе, соответствует задержке или профилактике возникновения симптомов рака. Профилактика может быть абсолютной (такой, что никакая болезнь не возникает) или может быть эффективной только у некоторых людей или в течение ограниченного времени.
В предпочтительном аспекте по изобретению, субъект имеет развившуюся опухоль, то есть субъект уже имеет опухоль, например, такую, которая классифицируется как солидная опухоль. Таким образом, изобретение, как описано в данном документе, может быть применено, когда субъект уже имеет такую опухоль, как солидная опухоль. Таким образом, изобретение предлагает терапевтический вариант, который может быть применен для лечения существующей опухоли. В одном аспекте по изобретению, субъект имеет существующую солидную опухоль. Изобретение может быть применено в качестве профилактики или, предпочтительно, в качестве лечения у субъектов, у которых уже есть солидная опухоль. В одном аспекте изобретение не применяют в качестве профилактического или профилактического средства.
В одном аспекте регрессия опухоли может быть усиленной, рост опухоли может быть нарушен или снижен и/или время жизни может быть увеличено с применением изобретения, как описано в данном документе, например, по сравнению с другими способами лечения рака (например, лечения в соответствии со стандартами ухода в случае данного рака).
В одном аспекте по изобретению способ лечения или профилактики рака, как описано в данном документе, дополнительно включает этап идентификации субъекта, который имеет рак, в частности, идентификации субъекта, который имеет опухоль, такую как солидная опухоль.
Режим дозирования терапии, описанный в данном документе, который эффективен для лечения рака, у пациента может варьироваться в зависимости от таких факторов, как стадия болезни, возраст и масса пациента, а также способность терапии вызывать противораковый ответ у субъекта. Выбор подходящей дозы будет в пределах возможностей специалиста в данной области техники. Например, 0,01, 0,1, 0,3, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40 или 50 мг/кг. В некоторых вариантах реализации подобное количество представляет собой величину единичной дозы (или ее целую фракцию), подходящую для введения в соответствии с режимом дозирования, который был определен для корреляции с желаемым или полезным результатом при введении соответствующей популяции (то есть с терапевтическим режимом дозирования).
Антитело по любому аспекту изобретения, как описано в данном документе, может быть в форме фармацевтической композиции, которая дополнительно содержит фармацевтически приемлемый носитель, разбавитель или эксципиент. Эти композиции включают, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, инъекционные и инфузионные растворы), дисперсии или суспензии, таблетки, пилюли или липосомы. В некоторых вариантах реализации предпочтительная форма может зависеть от предполагаемого способа введения и/или терапевтического применения. Фармацевтические композиции, содержащие антитело, могут быть введены с помощью любого подходящего способа, известного в данной области техники, в том числе, без ограничения этим, перорального, мукозального, с помощью ингаляции, местного, буккального, назального, ректального или парентерального (например, внутривенного, инфузионного, интратуморального, внутриузлового, подкожного, внутрибрюшинного, внутримышечного, внутрикожного, трансдермального или других видов введения, включающих физическое нарушение ткани субъекта и введение фармацевтической композиции через нарушение целостности в ткани). Такая композиция может, например, быть в форме инъекционного или инфузионного раствора, который подходит для внутрикожного, внутриопухолевого или подкожного введения или для внутривенной инфузии. Введение может включать прерывистое введение. В качестве альтернативы, введение может включать непрерывное дозирование (например, перфузию) в течение по меньшей мере выбранного периода времени, одновременно или между введением других соединений.
В некоторых вариантах реализации антитело может быть получено с носителями, которые защищают его от быстрого высвобождения и/или деградации, такими как композиция с контролируемым высвобождением, такими как имплантаты, трансдермальные пластыри и микрокапсулированные системы доставки. Могут быть применены биоразлагаемые, биосовместимые полимеры.
Специалистам в данной области техники будет понятно, например, что способ доставки (например, пероральный против внутривенного против подкожного против интратуморального и т. д.) может влиять на количество дозы и/или требуемое количество дозы может влиять на путь доставки. Например, при условии, что особенно высокие концентрации средства в пределах определенного сайта или положения (например, в пределах опухоли) представляют интерес, целенаправленная доставка (например, в этом примере, внутриопухолевая доставка) может быть желаемой и/или полезной. Другие факторы, которые следует учитывать при оптимизации путей и/или графика дозирования для данного терапевтического режима, могут включать, например, конкретный рак, который подвергают лечению (например, тип, стадию, положение и т.д.), клиническое состояние субъекта (например, возраст, общее состояние здоровья и т.д.), наличие или отсутствие комбинационной терапии и другие факторы, известные врачам.
Фармацевтические композиции обычно должны быть стерильными и стабильными при условиях производства и хранения. Композиция может быть составлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные растворы для инъекций могут быть получены путем включения антитела в требуемом количестве в подходящем растворителе с одной или с комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Составы для парентерального введения включают, без ограничения этим, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые препараты с замедленным высвобождением или биоразлагаемые составы, как обсуждалось в данном документе. Стерильные инъекционные составы могут быть получены с применением нетоксичного парентерально приемлемого разбавителя или растворителя. Каждая фармацевтическая композиция для применения в соответствии с настоящим изобретением может включать фармацевтически приемлемые диспергирующие средства, смачивающие средства, суспендирующие средства, изотонические средства, покрытия, антибактериальные и противогрибковые средства, носители, эксципиенты, соли, или стабилизаторы, являющиеся не токсичными для субъектов при применяемых дозировках и концентрациях. Предпочтительно, такая композиция может дополнительно содержать фармацевтически приемлемый носитель или эксципиент для применения при лечении рака, который совместим с данным способом и/или сайтом введения, например, в случае парентерального (например, подкожного, внутрикожного или внутривенного введения), интратуморального или перитуморального введения.
Тогда как вариант реализации способа лечения или композиций для применения согласно настоящему изобретению может оказаться неэффективным для достижения положительного терапевтического эффекта у каждого субъекта, он должен делать это при применении фармацевтических композиций и схем дозирования, которые последовательно соответствуют хорошей медицинской практике и статистически значимому числу субъектов, что определяют любым статистическим исследованием, известным в данной области техники, таким как t-критерий Стьюдента, критерий согласия χ2 U-критерий по Манну-Уитни, критерий Крускала-Уоллиса (Н-тест), критерий Джонкхиера-Терпстра и критерий Уилкоксона.
В тех случаях, когда выше и далее упоминают опухоль, опухолевое заболевание, карциному или рак, также подразумевают метастазы в исходном органе или ткани и/или в любом другом положении, альтернативно или, кроме того, независимо от местоположения, опухоли и/или метастазы.
Как обсуждалось в данном документе, настоящее изобретение относится к элиминации регуляторных Т-клеток (Treg). Таким образом, в одном аспекте по изобретению, анти-CD25 антитело элиминирует или снижает количество инфильтрирующих опухоль регуляторных Т-клеток. В одном аспекте указанная элиминация осуществляется посредством ADCC. В другом аспекте указанная элиминация осуществляется посредством ADCP. Анти-антитело CD25 может также элиминировать или уменьшить циркулирующие регуляторные Т-клетки. В одном аспекте указанная элиминация осуществляется посредством ADCC. В другом аспекте указанная элиминация осуществляется посредством ADCP.
По существу, изобретение предлагает способ элиминации регуляторных Т-клеток в опухоли у субъекта, включающий введение указанному субъекту анти-CD25 антитела. В предпочтительном варианте реализации, Treg элиминируют в солидной опухоли. Под «элиминированным» подразумевается, что число, отношение или процент Treg уменьшается относительно такового, когда анти-CD25 антитело не вводят. В конкретных вариантах реализации изобретения, как описано в данном документе, элиминируют выше около 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 99% инфильтрирующих опухоль регуляторных Т-клеток.
Как применяют в данном документе, «регуляторные Т-клетки» («Treg», «клетки Treg» или «Tregs») относятся к линии CD4+ Т-лимфоцитов, приспособленных к контролю аутоиммунитета, аллергии и инфекции. Как правило, они регулируют активность популяций Т-клеток, но также могут влиять на определенные типы клеток врожденной иммунной системы. Tregs обычно идентифицируют с помощью экспрессии биомаркеров CD4, CD25 и Foxp3. Встречающиеся в природе клетки Treg обычно составляют около 5-10% периферических CD4+ Т-лимфоцитов. Однако, в микроокружении опухоли (то есть в инфильтрирующих опухолевых клетках Treg), они могут составлять до 20-30 % от общей популяции CD4+ Т-лимфоцитов.
Активированные человеческие клетки Treg могут убивать, непосредственно, такие клетки-мишени, как эффекторные Т-клетки и АРС, через перфорин- или гранзим В-зависимые пути; клетки Treg антиген 4 цитотоксических Т лимфоцитов (CTLA4+) индуцируют экспрессию индоламина 2,3-диоксигеназы (IDO) с помощью АРС и они, в свою очередь, подавляют активацию Т-клеток путем снижения уровня триптофана; клетки Treg, могут высвобождать интерлейкин-10 (IL-10) и трансформирующий фактор роста (TGFβ) in vivo, и, таким образом, непосредственно ингибируют активацию Т-клетки и супрессируют функцию АРС путем ингибирования экспрессии молекул МНС, CD80, CD86 и IL-12. Клетки Treg также могут супрессировать иммунитет путем экспрессирования высоких уровней CTLA4, который может связываться с CD80 и CD86 на антиген-презентирующих клетках и предотвращают правильную активацию эффекторных Т-клеток.
В предпочтительном варианте реализации, по настоящему изобретению соотношение эффекторных Т-клеток к регуляторным Т-клеткам в солидной опухоли является повышенным. В некоторых вариантах реализации соотношение эффекторных Т-клеток к регуляторным Т-клеткам в солидной опухоли является повышенным до более 5, 10, 15, 20, 40 или 80.
Иммунная эффекторная клетка соответствует иммунной клетке, которая участвует в эффекторной фазе иммунного ответа. Приводимые к качестве примера иммунные клетки включают клетки миелоидного или лимфоидного происхождения, например, лимфоциты (например, В-клетки и Т-клетки, в том числе цитотоксические Т-клетки (CTL)), киллерные клетки, естественные киллерные клетки, макрофаги, моноциты, эозинофилы, нейтрофилы, полиморфноядерные клетки, гранулоциты, тучные клетки и базофилы.
Иммунные эффекторные клетки, участвующие в эффекторной фазе иммунного ответа, экспрессируют специфические рецепторы Fc и выполняют специфические иммунные функции. Эффекторная клетка может индуцировать антителозависимую клеточно-опосредованную цитотоксичность (ADCC), например, нейтрофил способен индуцировать ADCC. Например, моноциты, макрофаги, нейтрофилы, эозинофилы и лимфоциты, которые экспрессируют FcαR, участвуют в специфическом уничтожении клеток-мишеней и представлении антигенов другим компонентам иммунной системы или связываются с клетками, которые представляют антигены. Эффекторная клетка может также фагоцитировать целевой антиген, клетку-мишень или микроорганизм. Как обсуждалось в данном документе, антитела по настоящему изобретению могут быть оптимизированы для способности индуцировать ADCC.
В некоторых вариантах реализации другое средство против рака может быть введено в комбинации с антителом посредством таких же или различных путей доставки и/или в соответствии с различными графиками. В качестве альтернативы или дополнительно, в некоторых вариантах реализации, одну или более доз первого активного средства вводят по существу одновременно с, а в некоторых вариантах реализации посредством обычного пути и/или в качестве части одной композиции с, одним или более другими активными средствами. Специалистам в данной области техники также будет понятно, что некоторые варианты реализации комбинационных терапий, предлагаемых в соответствии с настоящим изобретением, обеспечивают синергические эффекты; в некоторых подобных вариантах реализации доза одного или более средств, применяемых в комбинации, может быть существенно разной (например, ниже) и/или может быть доставлена по пути, альтернативному стандартному, предпочтительному или необходимому, при применении данного средства в ином терапевтическом режиме (например, в качестве монотерапии и/или в качестве части отличной комбинационной терапии).
В некоторых вариантах реализации где применяют два или более активных средств в соответствии с настоящим изобретением, такие средства могут быть введены одновременно или последовательно. В некоторых вариантах реализации введение одного средства специально согласовано по времени относительно введения другого средства. Например, в некоторых вариантах реализации первое средство вводят так, чтобы наблюдался определенный эффект (или ожидается, что они будут наблюдаться, например, основанные на демографических исследованиях, показывающих корреляцию между данным режимом дозирования и конкретным представляющим интерес эффектом). В некоторых вариантах реализации желаемые связанные режимы дозирования в случае средств, вводимых в комбинации, могут быть оценены или определены эмпирически, например, с применением моделей ex vivo, in vivo и/или in vitro; в некоторых вариантах реализации, такая оценка или эмпирическое определение делают in vivo, в популяции пациентов (например, таким образом, что устанавливают корреляцию) или, альтернативно, у конкретного представляющего интерес пациента.
В другом аспекте по изобретению, авторы настоящего изобретения показали, что анти-CD25 антитело показывает улучшенные терапевтические эффекты в сочетании с ингибитором контрольных точек иммунного ответа. Как показано в настоящих Примерах, комбинационная терапия с анти-CD25 антителом и ингибитором контрольных точек иммунного ответа могут иметь синергические эффекты при лечении развившихся опухолей. Данные в отношении PD-1/PD-L1 в настоящих Примерах связаны с вмешательством во взаимодействие PD-1/PD-L1. По существу, взаимодействие между рецептором PD-1 и лигандом PD-L1 может быть заблокировано, что приведет к «блокаде PD-1». В одном аспекте комбинация может привести к усиленной регрессии опухоли, усиленному ухудшению или редукции роста опухоли и/или время жизни может быть увеличено с применением изобретения, как описано в данном документе, например, по сравнению либо с анти-CD25 антителами, либо с блокадой PD-1/PD-L1 отдельно (прямо, с применением анти-PD1 антитела, или косвенно, с применением анти-PD-L1 антитела).
Как применяют в данном документе, «контрольная точка иммунного ответа» или «белок контрольных точек иммунного ответа» относятся к белкам, относящимся к ингибирующим путям в иммунной системе, в частности, для модуляции ответов Т-клеток. В нормальных физиологических условиях иммунные контрольные точки имеют решающее значение для профилактики аутоиммунитета, особенно во время ответа на патоген. Раковые клетки способны изменять регуляцию экспрессии белков контрольных точек иммунного ответа чтобы избежать иммунного надзора.
Примеры белков контрольных точек иммунного ответа включают, без ограничения этим, PD-1, CTLA-4, BTLA, KIR, LAG3, TIGIT, CD155, В7Н3, В7Н4, VISTA и TIM3, а также ОХ40, GITR, ICOS, 4-1ВВ и HVEM. Белки контрольных точек иммунного ответа могут также относиться к белкам, которые связываются с другими белками контрольных точек иммунного ответа, которые модулируют иммунный ответ в ингибирующей манере. Такие белки включают PD-L1, PD-L2, CD80, CD86, HVEM, LLT1 и GAL9.
«Ингибиторы белков контрольных точек иммунного ответа» относятся к любому белку, который может мешать передаче сигнала и/или взаимодействиям белок-белок, опосредованных белком контрольных точек иммунного ответа. В одном аспекте по изобретению белок контрольных точек иммунного ответа представляет собой PD-1 или PD-L1. В предпочтительном аспекте по изобретению, как описано в данном документе, ингибитор контрольных точек иммунного ответа мешает взаимодействиям PD-1/PD-L1 посредством анти-PD-1 или анти-PD-L1 антител.
По существу, настоящее изобретение также предлагает способ лечения рака, включающий введение субъекту анти-CD25 антитела и ингибитора контрольных точек. Изобретение также предлагает анти-CD25 антитело и ингибитор контрольных точек иммунного ответа для применения при лечении рака.
Настоящее изобретение дополнительно предлагает применение анти-CD25 антитела и ингибитора контрольных точек иммунного ответа для производства лекарственного препарата для лечения рака. Введение анти-CD25 антитела и ингибитора контрольных точек иммунного ответа может быть одновременным, раздельным или последовательным.
Настоящее изобретение предлагают комбинацию анти-CD25 антитела и ингибитора контрольных точек иммунного ответа для применения при лечении рака у субъекта, где анти-CD25 антитело и ингибитор контрольных точек иммунного ответа вводят одновременно, раздельно или последовательно. Такое античеловеческое антитело CD25, предпочтительно, представляет собой IgG1 человека и может быть специфически применено в комбинации с антителом, таргетирующим контрольные точки иммунного ответа, в которых либо присутствуют, либо отсутствуют последовательности, которые делают возможными ADCC, ADCP и/или CDC.
В альтернативном аспекте, изобретение предлагает анти-CD25 антитело для применения при лечении рака, отличающийся тем, что указанное антитело предназначено для введения в комбинации с ингибитором контрольных точек иммунного ответа. Изобретение также предлагает применение анти-CD25 антитела в производстве лекарственного препарата для лечения рака, отличающийся тем, что указанный лекарственный препарат предназначен для введения в комбинации с ингибитором контрольных точек иммунного ответа.
Настоящее изобретение предлагает фармацевтическую композицию, содержащую анти-CD25 антитело и ингибитор контрольных точек иммунного ответа в фармацевтически приемлемой среде. Как обсуждалось выше, ингибитор контрольных точек иммунного ответа может быть ингибитором PD-1, т.е. антагонистом PD-1.
PD-1 (белок запрограммированной смерти клетки 1), также известный как CD279, представляет собой рецептор клеточной поверхности, экспрессируемый на активированных Т-клетках и В-клетках. Было показано, что взаимодействие со своими лигандами ослабляет ответы Т-клеток и in vitro, и in vivo. PD-1 связывает два лиганда, PD-L1 и PD-L2. PD-1 относится к суперсемейству иммуноглобулина. Передача сигнала PD-1 требует связывание с лигандом PD-1 в непосредственной близости от пептидного антигена, представленного основным комплексом гистосовместимости (МНС) (Freeman (2008) Proc Natl Acad Sci USA 105, 10275-6). Поэтому белки, антитела или малые молекулы, которые препятствуют совместному лигированию PD-1 и TCR на мембране Т-клетки представляют собой применяемые антагонисты PD-1.
В одном варианте реализации, антагонист рецептора PD-1 представляет собой анти-PD-1 антитело или его связывающий антиген фрагмент, который специфически связывается с PD-1 и блокирует связывание PD-L1 с PD-1. Анти-PD-1 антитело может быть моноклональным антителом. Анти-PD-1 антитело может быть человеческим или гуманизированным антителом. Анти-PD-1 антитело представляет собой антитело, способное специфически связываться с рецептором PD-1. Анти-PD-1 антитела, известные в данной области техники, включают Nivolumab и Pembrolizumab.
Антагонисты PD-1 по настоящему изобретению также включают соединения или средства, которые либо связываются с и/либо блокируют лиганд PD-1, чтобы мешать связыванию или ингибировать связывание лиганда с рецептором PD-1, или непосредственно связываться с и блокировать рецептор PD-1 без индуцирующей передачи ингибирующего сигнала через рецептор PD-1. В качестве альтернативы, антагонист рецептора PD-1 может связываться непосредственно с рецептором PD-1 без запуска передачи ингибирующего сигнала, а также связывается с лигандом рецептора PD-1 для снижения или ингибирования лиганда от инициирования передачи сигнала через рецептор PD-1. Путем снижения числа и/или количества лигандов, которые связываются с рецептором PD-1 и запускают передачи ингибирующего сигнала, меньше клеток ослабляют с помощью отрицательного сигнала, доставляемого передачей сигнала PD-1 и может быть достигнут более надежный иммунный ответ.
В одном варианте реализации, антагонист рецептора PD-1 представляет собой анти-PD-L1 антитело или его связывающий антиген фрагмент, который специфически связывается с PD-L1 и блокирует связывание PD-L1 с PD-1. Анти-PD-L1 антитело может быть моноклональным антителом. Анти-PD-L1 антитело может быть человеческим или гуманизированным антителом, таким как Atezolizumab (MPDL3280A).
Настоящее изобретение также предлагает способ лечения рака, включающий введение субъекту анти-CD25 антитела и антитела, которое является агонистом костимулирующего пути активации Т-клеток. Агонисты антитела костимулирующего пути активации Т-клеток включают, без ограничения этим, агониста антитела против ICOS, GITR, ОХ40, CD40, LIGHT и 4-1ВВ.
Авторы настоящего изобретения обнаружили, что, на удивление, уровень активационного рецептора Fc, FcγRIIb (CD32b), может быть повышен в солидных опухолях. Таким образом, дополнительный способ лечения рака включает введение анти-CD25 антитела и соединения, которое уменьшает, блокирует, ингибирует и/или антагонизирует FcγRIIb (CD32b). Такой антагонист FcγRIIb может быть малой молекулой, мешающей FcγRIIb-индуцированной внутриклеточной передаче сигнала, модифицированными антителами, которые не входят в контакт с ингибирующим рецептором FcγRIIb или античеловеческим (анти-CD32b антителом FcγRIIb. Например, для антагонистических античеловеческих антител FcγRIIb были охарактеризованы их анти-опухолевые свойства (Roghanian A et al., 2015, Cancer Cell. 27, 473-488; Rozan С et al., 2013, Mol Cancer Ther. 12:1481-91; WO 2015173384; WO 2008002933).
В дополнительном аспекте, настоящее изобретение предлагает биспецифическое антитело, содержащее:
(a) первую антигенсвязывающую функциональную группу, которая связывается с CD25; и
(b) вторую антигенсвязывающую функциональную группу, которая связывается с белком контрольных точек иммунного ответа, опухоль-ассоциированным антигеном, представляет собой (или основан на) антитело против активационного рецептора Fc человека (например, анти-FcgRI, анти-FcgRIIa, анти-FcgRIII), или представляет собой (или основан на) антагонистическое античеловеческое антитело FcγRIIb;
отличающееся тем, что биспецифическое антитело предпочтительно представляет собой антитело IgG1, которое связывается с по меньшей мере одним активационным рецептором Fcγ с высокой аффинностью и элиминирует инфильтрирующие опухоль регуляторные Т-клетки.
Как применяют в данном документе, «опухоль-ассоциированный антиген» соответствует антигенам, экспрессируемым на опухолевых клетках, что делает их различимыми от соседних с ними не раковыми клетками, и включают, без ограничения этим, CD20, CD38, PD-L1, EGFR, EGFRV3, СЕА, TYRP1 и HER2. Были опубликованы различные обзорные статьи, в которых описываются соответствующие опухоль-ассоциированные антигены и соответствующие терапевтически полезные противоопухолевые средства на основе антител (смотри, например, Sliwkowski & Mellman (2013) Science 341, 192-8). Такие антигены и соответствующие антитела включают, без ограничения этим, CD22 (Blinatumomab), CD20 (Rituximab, Tositumomab), CD56 (Lorvotuzumab), CD66e/CEA (Labetuzumab), CD152/CTLA-4 (Ipilimumab), CD221/IGF1R (MK-0646), CD326/Epcam (Edrecolomab), CD340/HER2 (Trastuzumab, Pertuzumab) и EGFR (Cetuximab, Panitumumab).
В одном аспекте, биспецифическое антитело в соответствии с изобретением, как описано в данном документе, приводит к ADCC или, в одном аспекте, усиленной ADCC.
Биспецифическое антитело может связываться с определенным эпитопом на CD25 и специфическим эпитопом на белке контрольных точек иммунного ответа или опухоль-ассоциированным антигеном, как определено в данном документе. В предпочтительном варианте реализации, вторая антигенсвязывающая функциональная группа связывается с PD-L1. В предпочтительном аспекте, настоящее изобретение предлагает биспецифическое антитело содержащее:
(a) первую антигенсвязывающую функциональную группу, которая связывается с CD25; и
(b) вторую антигенсвязывающую функциональную группу, которая связывается с белком контрольных точек иммунного ответа, экспрессируемым на клетке опухоли.
В конкретном варианте реализации, белок контрольных точек иммунного ответа, экспрессируемый на опухолевой клетке, представляет собой PD-L1, VISTA, GAL9, В7Н3 или В7Н4. Тем не менее предпочтительно, анти-CD25 антитело представляет собой антитело IgG1, которое связывается с рецепторами Fcγ с высокой аффинностью и элиминирует инфильтрирующие опухоль регуляторные Т-клетки.
Специалист в данной области техники может получить биспецифическое антитело с применением известных способов. Биспецифическое антитело в соответствии с изобретением может быть применено в любом из аспектов изобретения, как описано в данном документе. Предпочтительно, вторая антигенсвязывающая функциональная группа в пределах биспецифического антитела в соответствии с изобретением связывается с PD-1 человека, PD-L1 человека или CTLA-4 человека.
В одном аспекте биспецифическое антитело может связываться с CD25 и с иммуномодуляторными рецепторами, экспрессируемыми на высоких уровнях на инфильтрирующих опухоль Treg, например, CTLA4, ICOS, GITR, 4-1ВВ или ОХ40.
Настоящее изобретение также предлагает набор, который содержит анти-CD25 антитело, как описано в данном документе, и ингибитор контрольных точек иммунного ответа, предпочтительно, антагонист PD-1 (прямо, с применением анти-PD1 антитела, или косвенно, с применением анти-PD-L1 антитела), как обсуждалось в данном документе. В одном аспекте ингибитор контрольных точек иммунного ответа представляет собой анти-PD-L1. В альтернативном варианте реализации набор содержит анти-CD25 антитело, как описано в данном документе, и антитело которое представляет собой агониста костимулирующего пути активации Т-клеток. Набор может содержать инструкции для применения.
В дополнительном аспекте набор может содержать анти-CD25 антитело, как описано в данном документе, и соединение, которое уменьшает, блокирует, ингибирует и/или антагонизирует FcγRIIb (CD32b) или, в качестве альтернативы, анти-CD25 антитело, как описано в данном документе, и античеловеческое антитело активационного рецептора Fc (анти-FcγRI, анти-FcγRIIc или анти-FcγRIIIa).
Любой аспект по изобретению, как описано в данном документе, может быть осуществлен в комбинации с дополнительными терапиями рака. В частности, анти-CD25 антитело и, необязательно, ингибитор контрольных точек иммунного ответа (или любая другая комбинационная терапия) по настоящему изобретению могут быть введены в комбинации с костимулирующими антителами, химиотерапией и/или радиотерапией, таргетной терапией или терапией моноклональными антителами.
Химиотерапевтическое соединение, как применяют в данном документе, соответствует объекту, который является разрушающим для клетки, то есть соединение снижает жизнеспособность клетки. Химиотерапевтическое соединение может быть цитотоксическим лекарственным средством. Предполагаемое химиотерапевтическое средство включает, без ограничения этим, алкилирующие средства, антрациклины, эпотилоны, нитрозомочевины, этиленимины/метилмеламин, алкилсульфонаты, алкилирующие средства, антиметаболиты, пиримидиновые аналоги, эпиподофилотоксины, ферменты, такие как L-аспарагиназа; модификаторы биологического ответа, такие как IFNα, IFN-γ, IL-2, IL-12, G-CSF и GM-CSF; платиновые координационные комплексы, такие как цисплатин, оксалиплатин и карбоплатин, антрацендионы, замещенная мочевина, такая как гидроксимочевина, производные метилгидразина, в том числе N-метилгидразин (MIH) и прокарбазин, адренокортикальные супрессивные средства, такие как митотан (o,p'-DDD) и аминоглютетимид; гормоны и антагонисты, в том числе адренокортикостероидные антагонисты, такие как преднизон и эквиваленты, дексаметазон и аминоглютетимид; прогестин, такой как капроат гидроксипрогестерона, ацетат медроксипрогестерона и ацетат мегестрола; эстроген, такой как диэтилстильбэстрол и эквиваленты этинилэстрадиола; антиэстроген, такой как тамоксифен; андрогены, в том числе пропионат тестостерона и флуоксиместерон/эквиваленты; антиандрогены, такие как флутамид, аналоги гонадотропин-высвобождающих гормонов и лейпролид; и нестероидные антиандрогены, такие как флутамид.
Дополнительная терапия рака может также включать введение противораковой вакцины. «Противораковые вакцины», как применяют в данном документе, относятся к терапевтическим противораковым вакцинам, назначаемым раковым пациентам, и предназначены для уничтожения раковых клеток путем укрепления собственных иммунных ответов пациента. Раковые вакцины включают опухолевые клеточные вакцины (аутологичные и аллогенные), вакцины на основе дендритных клеток (полученные ex vivo и активированные пептидами), противобелковые вакцины на основе белка/пептида и генетические вакцины (DNA, RNA и вакцины на основе вируса). Соответственно, терапевтические противораковые вакцины, в принципе, могут быть применены для ингибирования дальнейшего роста злокачественных раковых заболеваний и/или рецидивирующих опухолей, которые не поддаются обычным терапиям, таким как хирургическое вмешательство, лучевая терапия и химиотерапия. К вакцинам на основе опухолевых клеток (аутологичных и аллогенных) относятся те, которые генетически модифицированы для секретирования растворимых иммуностимулирующих средств, таких как цитокины (IL2, IFN-g, IL12, GMCSF, FLT3L), одноцепочечные антитела Fv против иммуномодуляторных рецепторов (PD-1, CTLA-4, GITR, ICOS, ОХ40, 4-1ВВ) и/или для экспрессирования на их мембране лиганда для иммуностимулирующих рецепторов, таких как ICOS-лиганд, лиганд 4-1ВВ, GITR-лиганд и/или лиганд ОХ40, среди прочих.
Дополнительной терапией рака могут быть другие антитела или низкомолекулярные реагенты, которые снижают иммунную регуляцию на периферии и в пределах микроокружения опухоли, например, молекулами, которые таргетируют пути TGFb, IDO (индоламиндиоксигеназы), аргиназы и/или CSF1R.
«В комбинации» может относиться к назначению дополнительной терапии перед, одновременно с или после введения любого аспекта по настоящему изобретению.
Изобретение теперь будет дополнительно описано с помощью следующих Примеров, которые предназначены для оказания помощи специалисту в данной области техники в реализации изобретения и никоим образом не предназначены для ограничения объема изобретения со ссылкой на графические материалы, в которых:
Фигура 1 - показывает экспрессию регуляторных Т-клеток CD25pos в крови и лимфатическом узле (А) Экспрессия CD25 (клон идентифицирующего антитела 7D4; антимышиный CD25, изотип IgM) на поверхности подмножеств Т-клеток, присутствующих в лимфатических узлах (LN), и инфильтрирующих опухоль лимфоцитах (TIL) различных опухолевых моделей. Гистограммы являются типовыми для одной мыши для каждой модели опухоли. (В) Процентное содержание CD25-позитивных клеток и MFI CD25 в МКПК и подмножестве Т-клеток из объединенных данных (n=10) индивидуальных экспериментов с применением модели опухоли МСА205. Была проведена та же оценка (ограниченная подмножествами Т-клеток) в моделях опухоли МС38, В16 и СТ26 в (С) и (D). Столбики ошибок представляют стандартную ошибку (SE) среднего значения. Показана статистическая значимость различий между CD4-позитивными, Foxp3-позитивными клетками и CD8-позитивными или CD4-позитивными/FoxpЗ-негативными клетками.
Фигура 2 - показывает ограничение анти-CD25 (αCD25)-опосредованной элиминации CD25-позитивных, регуляторных Т-клеток в крови и лимфатическом узле в модели опухоли МСА205. (А) Экспрессия CD25 (клон идентифицирующего антитела 7D4; антимышиный CD25, изотип IgM) и FoxP3 в CD4-положительных Т-клетках. (В) Средняя интенсивность флуоресценции CD25 на Treg (дающих сигнал выше порогового значения на CD4-положительных, FoxP3-положительных Т-клеток). Мышам-опухоленосителям инъектируют 200 мкг анти-CD25-r1 (αCD25-r1; анти-CD25 крысы IgG1), анти-CD25-m2а (αCD25-m2a; анти-CD25 мышиный IgG2a), анти-СТLА-4 (αCTLA-4; клон В56 анти-СТLА4) или не обрабатывают (без м/о) в дни 5 и 7 после п/к инокуляции 5×105 клеток МСА205. Мононуклеарные клетки периферической крови (МКПК), лимфатические узлы (LN) и инфильтрирующие опухоли лимфоциты (TIL) собирают в день 9, обрабатывают и окрашивают для анализа с помощью проточной цитометрии.
Фигура 3 - показывает анти-CD25 (αCD25)-опосредованные эффекты на подгруппы Т-клеток в модели опухоли МСА205 Фиг. 2. (А) Процентное содержание FохР3-положительных клеток от всех CD4-положительных Т-клеток и (В) абсолютное число CD4-положительных, FохР3-положительных Т-клеток в МКПК (число клеток/мл), LN (общее число клеток в трех дренирующих лимфатических узлах) и TIL (число клеток/г опухоли) показаны параллельно с CD4-положительными, FохР3-негативными Т-клетками (С) соотношение эффекторных CD4-положительных, FохР3-положительных Т-клеток (клеток Treg) и (D) соотношение эффекторных CD8-положительных Т-клеток)/клеток Treg, дающих сигнал выше порогового значения на CD4-положительные FoxP3-негативные и CD8-положительные Т-клетки.
Фигура 4 - показывает типовые гистограммы экспрессии FcγR на В-клетках (CD19-положительных), Т-клетках (CD3-положительных, CD5-положительных), клетках NK (NK1.1-положительных), гранулоцитах (CD11b+ Ly6G+), обычных дендритных клетках (cDC; CD11c-высоких МНСII-положительных) и моноцитов/макрофагов (Моно/Мф; CD11b-положительных, Ly6G-негативных, NK1.1-негативных, CD11c-низких/негативных), при оценке с помощью проточной цитометрии в необработанной модели опухоли МСА205 (смотри фиг. 2) спустя 10 дней после провоцирующей стимуляции опухоли. Столбики ошибок представляют SEM (n=3); данные соответствуют одному из трех отдельных экспериментов, по которым результаты были последовательными.
Фигура 5 - показывает каким образом элиминация Treg зависит от экспрессии активационных Fc-гамма рецепторов. Мыши дикого типа C57BL/6 (д/т) и мыши Fcer1g-/- инъектируют подкожно 5×105 клеток МСА205 в день 0, а затем вводят 200 μг анти-CD25 в дни 5 и 7. Опухоли, дренирующие лимфатические узлы и кровь собирают в день 9, обрабатывают и окрашивают для анализа проточной цитометрии. Регуляторные Т-клетки определяют с помощью экспрессии CD4 и FoxP3 в МКПК, LN в TIL. Показано процентное содержание Foxp3+ от общего количества клеток CD4+ (А). Тот же подход применяют в диких типах (д/т), Fcgr3-/-, Fcgr4-/- или Fcgr2b-/-, демонстрируя ингибирование αCD25-r1-опосредованной элиминации Treg в опухолях с помощью FcγRIIb. На графиках показана количественная оценка процентного содержания Treg (Foxp3+ CD4+) от общего количества CD4+ Т-клеток только в TIL (В).
Фигура 6 - показывает, что синергетический эффект комбинации анти-CD25-m2а и анти-PD-1 приводит к уничтожению развившихся опухолей. Показаны кривые роста отдельных мышей (А) и среднего объема опухоли МСА205 для каждой терапевтической группы в течение времени (В). Число выживших без опухоли спустя 100 дней или статистическая значимость указана на каждом графике. Столбики ошибок представляют SE среднего значения. Также показаны кривые выживаемости Каплана-Мейера с кумулятивными данными двух отдельных экспериментов. Также показаны кривые выживаемости мышей, которым инъектируют клетки опухоли МС38 (С) или СТ26 (D) и обрабатывают таким образом, как описано в модели МСА205 (n=10 на патологию). Мышам вводят подкожно 5×105 клеток МСА205, МС38 или СТ26 и затем обрабатывают с помощью указанного анти-CD25 (200 мкг в/п) в день 5, с последующим (или нет) введением анти-PD-1 (αPD-1, анти-PD1, клон RMP1-14; 100 мкг и/п) в дни 6, 9 и 12. Размер опухоли измеряют два раза в неделю, а мышей подвергают эвтаназии, когда любой ортогональный диаметр достигает 150 мм.
Фигура 7 - показывает функциональные анализы модели опухоли МСА205, которые развиваются таким образом, как описано на Фиг. 6, с применением иммунных клеток, собирают в день 14. Пропорция (%) Ki67+ клеток в инфильтрирующих опухоль CD4+Foxp3- и в CD8+ Т-клетках в опухолях МСА205 (А) и соотношение CD4-положительных, FохР3-негативных Teff/Treg и соотношение CD8-положительных/Treg (В) в опухоли показано для каждой терапевтической группы. Внутриклеточное окрашивание инфильтрирующих опухоль лимфоцитов в случае экспрессии IFNg с последующей ex vivo рестимуляцией РМА и иономицином (С) и частота интерферон гамма (IFNγ)-продуцирующих эффекторных Т-клеток (D), также показаны для тех же терапевтических групп в CD4-положительных и CD8-положительных клетках. Гистограммы в (В) соответствуют типовой мыши на терапевтическую группу. Типовые графики из двух отдельных экспериментов (n=10) и статистическая значимость предложены в (А), (В) и (D).
Фигура 8 - показывает, что элиминация опухоли с помощью анти-CD25-m2а/анти-PD1 является зависимой от CD8+ Т-клетки. Кривые роста опухоли МСА205 у отдельных мышей, не обработанных (без м/о, А), обработанных с помощью комбинации анти-CD25-m2а с анти-PD-1 (αPD-1 + αCD25-m2a; В) или той же комбинации, дополнительно, в том числе анти-CD8 (αPD-1 + αCD25-m2a + αCD8; С). Число выживших спустя 40 дней для каждой терапевтической группы (n=7) указывают на каждом графике. Также были сгенерированы соответствующие кривые выживаемости Каплана-Мейера (D). Мышам инъектируют п/к 5×105 клеток МСА205 и обрабатывают с помощью 200 мкг анти-CD25-m2a (αCD25-m2a, клон РС61, изотип IgG2a мыши) в день 5, после чего с помощью 100 мкг анти-PD-1 (αPD-1, клон RMP1-14) и/п в дни 6, 9 и 12. В указанной группе мышей, CD8-положительные клетки элиминируют с помощью инъектирования 200 мкг анти-CD8 (αCD8, клон 2.43) и/п в дни 4, 9, 12 и 17. Размер опухоли измеряют два раза в неделю, а мышей подвергают эвтаназии, когда любой ортогональный диаметр достигает 150 мм.
Фигура 9 - показывает, что анти-CD25-m2а/анти-РD-1 терапия индуцирует по меньшей мере частичный контроль опухоли против опухолей меланомы В16. Кривые роста опухоли В16 у отдельных мышей, обработанных отдельно с помощью Gvax или в комбинации с указанными антителами, как определено на фигуре 6 (А). Также были сгенерированы соответствующие кривые выживаемости Каплана-Мейера (В). Мышам инъектируют 5×104 клеток меланомы В16 внутрикожно (в/к) и затем обрабатывают 200 мкг анти-CD25 (αCD25-r1, клон РС61 изотипа IgG1 крысы или αCD25-m2a, клон РС61 изотипа IgG2a мыши) в день 5, с последующими 200 мкг анти-PD-1 (αPD-1, клон RMP1-14) и/п и 1×106 облученных (150 грей) B16-Gvax в/к в дни 6, 9 и 12. Наблюдают рост опухоли и эвтаназируют мышей, когда любой ортогональный диаметр достигал 150 мм или в день 80 исследования, в зависимости от того, что наступает раньше. Средняя выживаемость в течение дней для разных групп (n, число мышей) составляет: 21 день в случае только Gvax (n=14), 27 дней в случае Gvax + αPD-1 (n =15), 21 день в случае Gvax + αCD25-r1 (n=7), 33 дня в случае Gvax + αCD25-m2a (n=8), 29 дней в случае Gvax + αPD-1 + αCD25-r1 (n =13) и 39 дней в случае Gvax + αPD-1 + αCD25-m2a (n =12).
Фигура 10 - показывает кривые роста опухоли СТ26 отдельных мышей, не обработанных (PBS, только носитель), обработанных с помощью антимышиного CD25, имеющего либо IgG1 (PC61m1; изотип IgG1 мыши, таким образом, с низкой опосредованной рецептором Fc лизисной активностью, низкой активностью ADCC и CDC), либо IgG2a (PC61m2; IgG2a мыши, таким образом, с высокой опосредованной рецептором Fc активностью, высокой активностью ADCC и CDC) и дополнительно объединяют или нет с антимышиным PD1 (RMP1-14 αPD1). Клетки СТ26, применяемые для имплантации, собирают при росте экспоненциальной фазы и повторно суспендируют в холодном PBS. В День 1 исследования каждой мыши инъектируют подкожно в правый бок 3×105 клеток в 0,1 мл взвеси отмытых клеток. Антимышиный CD25 инъектируют и/п (10 мг/кг) в День 6 (при обнаружении пальпируемых опухолей). Антимышиный PD1 инъектируют и/п (100 μг/инъекцию) в День 7, День 10, День 14 и День 17. Опухоли измеряют штангенциркулем в двух измерениях два раза в неделю для мониторинга роста. Размер опухоли, в мм3, рассчитывают следующим образом: Объем опухоли = (w2 х l)/2, где w = ширина и l = длина, в мм, опухоли. Конечной точкой исследования был объем опухоли 2000 мм3 или 60 дней, в зависимости от того, что наступает раньше.
Фигура 11 - показывает кривые роста опухоли СТ26 отдельных мышей, не обработанных (PBS, только носитель), обработанных с помощью антимышиного CD25, имеющего либо IgG1, либо IgG2a (PC61m1 и PC61m2 с, соответственно), и дополнительно объединяют или нет с антимышиным клоном 10F.9G2 PD-L1 (10F.9G2 aPDL1). Модель, режим и анализ осуществляют таким образом, как в случае эксперимента на основе комбинации αPD1 на Фиг. 10.
Фигура 12 - показывает кривые роста опухоли МС38 отдельных мышей, не обработанных (PBS, только носитель), обработанных с помощью антимышиного CD25, имеющего либо IgG1, либо gG2a (PC61m1 и PC61m2, соответственно) и дополнительно объединяют или нет с антимышиным клоном PD1 RMP1-14 (RMP1-14 aPD1), как описано в случае модели опухоли СТ26 на Фиг. 10. Клетки карциномы толстой кишки МС38, применяемые для имплантации, собирают при росте экспоненциальной фазы и повторно суспендируют в холодном PBS. Каждой мыши инъектируют подкожно в правый бок 5×105 клеток в 0,1 мл взвеси клеток. Наблюдают опухоли, когда их объемы приближались к целевому диапазону от 100 до 150 мм3. Через двадцать два дня после имплантации опухоли, в День 1 исследования животных с индивидуальными объемами опухолей, варьирующихся от 63 до 196 мм3, сортируют по девяти группам (n = 10) с групповыми средними объемами опухоли от 104 до 108 мм3. Лечение начали с D1 у мышей, несущих развившиеся опухоли МС38. Эффекты каждого лечения сравнивали с контрольной группой, обработанной носителем, которая получала PBS внутрибрюшинно (и/п) в День 1, День 2, День 5, День 9 и День 12. Анти-PD1 вводят и/п при 100 мкг/животное, два раза в неделю в течение двух недель, начиная со Дня 2. РС61-m1 и РС61-m2а вводят и/п один раз в День 1 при 200 мкг/животное. Измерения опухоли брали два раза в неделю до Дня 45 с отдельными животными, выходящими из исследования, после достижения конечной точки опухоли 1000 мм3.
Фигура 13 - показывает кривые роста опухоли МС38 отдельных мышей, не обработанных (PBS, только носитель), обработанных с помощью антимышиного CD25, имеющего либо IgG1, либо IgG2a (PC61m1 и PC61m2 с, соответственно) и дополнительно в комбинации или нет с антимышиным клоном PD-L1 10F.9G2 (10F.9G2 aPDL1). Модель, режим и анализ осуществляют таким образом, как в случае эксперимента на основе комбинации αPD1 Фиг. 12.
Фигура 14 - показывает экспрессию CD25 в периферических опухоль-локализованных иммунных клетках в образцах из отдельных видов раковых заболеваниях человека. Типовые гистограммы демонстрируют экспрессию CD25 в подгруппах TIL с этапа IV карциномы яичника человека (перитонеальный метастаз, А) и рака мочевого пузыря человека (В). Типовые гистограммы также получают для отдельных CD8-положительных, CD4-положительных, FoxP3-негативных и CD4-положительных, FохР3-положительных подмножеств Т-клеток в пределах МКПКи TIL, которые выделены от других типов рака (С). Также показаны количественная оценка экспрессии CD25 в процентном содержании (%) и средняя интенсивность флуоресценции (MFI) отдельных подмножеств Т-клеток в каждой изученной когорте пациентов в случае меланомы (верхняя панель), NSCLC (средняя панель) и RCC (нижняя панель) (D).
Фигура 15 - показывает данные экспрессии CD25 у пациентов, которым был проведен анти-PD-1 мультиплексный иммуногистохимический анализ (IHC) метастазирования подкожной меланомы перед анти-PD-1 терапией («Исходный уровень») и с последующими двумя инфузиями («Неделя 6»), показанными параллельно с количественной оценкой IHC окрашивания CD8 и FoxP3 при исходном уровне и неделе 6 у двух пациентов, одного реагирующего и одного не реагирующего на терапию на неделе 6 (В; отображают среднее количество на поле зрения под большим увеличением ×40). Процентное содержание (%) CD8-положительных, CD25-положительных и FoхР3-положительных, CD25-положительных, дважды окрашенных клеток на исходном уровне и во время терапии (на неделе 6) показывают для пациентов с Melanoma и RCC, обработанных с помощью анти-PD1 (С).
Фигура 16 - показывает структуру и связывающую активность биспецифического Duobody на основе анти-IgG1-, анти-PD-L1 (bs CD25/PD-L1), которые были сгенерированы с применением антигенсвязывающей области антимышиного CD25 (РС61) и антимышиного/человеческого PD-L1 (клон S70), оба из которых имеют изотип человека lgG1 и мутированы по определенной аминокислоте (K409R в случае PC61-IgG1 и F405L в случае S70-IgG1; А). Специфичность bs CD25/PD-L1 в случае CD25 были исследованы с применением клеточной линии (клеток SUP-T1, Т-лимфобластов человека; SUP-T1 [VB] АТСС® от CRL-1942™), которая была трансфицирована вектором, экспрессирующим либо CD25 мыши (клеточная линия CD25+), либо PD-L1 мыши (клеточная линия PD-L1+). Исходная клеточная линия и две другие полученные клеточные линии были применены для сравнения способности связывания bs CD25/PD-L1 со связыванием связанного моноспецифического антитела (aCD25, клон РС61; aPD-L1, клон S70). Клеточную линию CD25+ и клеточные линии PD-L1+ перемешивают при соотношении 1:1 друг с другом (или каждый по отдельности с нетрансфецированными, контрольными клетками), а затем инкубируют с bs CD25/PD-L1, aCD25, aPD-L1 или без какого-либо антитела (БЕЗ антитела) в течение 30 минут. После инкубации три группы образцов клеток анализируют в проточной цитометрии для расчета процентного содержания двойных положительных клеток в разных образцах клеток (В). Специфичность bs CD25/PD-L1 (BsAb) была подтверждена с применением клеточной линии CD25+ и клеточных линий PD-L1+ раздельно. Каждая клеточная линия была помечена либо с помощью bs CD25/PDL1, либо с помощью соответствующего моноспецифического антитела (MsAb, антимышиного CD25 IgG1 в случае клеток CD25+ и антимышиного PD-L1 в случае клеток PD-L1+) в качестве первичного антитела, либо только с помощью буфера. Затем клетки инкубируют с помощью aHuman AF647 (aHuman) в качестве первичного антитела в FACS-буфере в течение 30 минут, а также с помощью фиксируемого жизнеспособного красителя. В качестве отрицательных контролей применяют клетки, инкубированные только с вторичным антителом (aHuman AF647), или клетки, инкубированные ни с первичным, ни с вторичным антителом (неокрашенными). Затем клетки анализируют с помощью проточной цитометрии для расчета процентного содержания положительных клеток, полученных с помощью BsAb, по сравнению с MsAb (показаны справа в каждой панели; С).
Фигура 17 - показывает влияние биспецифического Duobody на основе IgG1 (Bs PD-L1 CD25), антимышиного IgG1 CD25 (aCD25) и антимышиного IgG1 PD-L1 (aPD-L1) моноспецифических антител, по отдельности или в смеси друг с другом (aCD25&aPD-L1) или контроля изотипом IgG1, как описано на Фиг. 16, на эффекторные и регуляторные Т-клетки в LN и опухоль в модели опухоли мыши МСА205 (развившаяся таким образом, как описано на Фиг. 3; с четырьмя или пятью мышами для каждой группы). Образцы применяют для выделения опухолевых инфильтрирующих лимфоцитов (TIL) или в клетках лимфатического узла (LN) выделяют и анализируют на наличие эффекторных и регуляторных Т-клеток в каждой терапевтической группе на основе положительной пробы на FoxP3, CD3 и CD4 (А) или соотношении положительной пробы на CD8/Treg (FохР3-положительных, CD4-положительных) (В). Также оценивают in vivo эффект каждого лечения на способность инфильтрирующих опухоль CD4-положительных Т-клеток реагировать на стимуляцию. TIL повторно стимулируют in vitro с применением РМА и иономицина, в присутствии ингибитора белка макромолекулярного комплекса, формирующего поры в клеточной мембране аппарата Гольджи, а затем окрашивают внеклеточно в случае CD5 и CD4 и внутриклеточно после фиксации в случае Interferon-γ (IFNg). Процентное содержание CD5-положительных и CD4-положительных Т-клеток, также положительных по отношению к IFNg, анализируют с помощью проточной цитометрии (С).
ПРИМЕРЫ
МАТЕРИАЛЫ И СПОСОБЫ
Мыши
Мышей C57BL/6 и BALB/c получали от Charles River Laboratories. Мыши Fcer1g-/- и Fcgr3-/- были любезно предложены S. Beers (University of Southampton, Великобритания). Мыши Fcgr4-/- и Fcgr2b-/- были любезным подарком от J.V. Ravetch (The Rockefeller University, Нью-Йорк, США). Все исследования на животных проводились в рамках и этических норм, и правил University College of London и Министерства внутренних дел Великобритании.
Клеточные линии и тканевая культура
Клетки опухоли МС38, В16, СТ26 и МСА205 (3-метилхолантрен-индуцированные слабо иммуногенные клетки фибросаркомы; от G. Kroemer, Gustave Roussy Cancer Institute) и 293Т-клетки применяли для производства ретровирусов культивировали в среде Игла, модифицированной по способу Дульбекко (DMEM, Sigma), с добавлением 10% фетальной телячьей сыворотки (FCS, Sigma), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 2 мМ L-глутамина (все от Gibco). Клетки К562, применяемые для получения антитела, культивировали в среде Дульбекко, модифицированной по способу Исков без фенолового красного (IMDM) с добавлением 10%-ной IgG-элиминированной FCS (Life Technologies). Клетки В16 (клетки меланомы кожи мыши) и СТ26 (N-нитрозо-N-метилуретан -индуцированная, недифференцированная клеточная линия карциномы толстой кишки) и соответствующие условия культивирования доступны через АТСС.
Получение антитела
Последовательность вариабельных областей тяжелой и легкой цепей анти-CD25 получали из гибридомы РС-61.5.3 путем быстрой амплификации концов cDNA (RACE), а затем клонировали в константные области IgG2a мыши и κ-цепочек из плазмид pFUSEss-CHIg-mG2A и pFUSE2ss-CLIg-mk (Invivogen). Затем каждую цепь антител субклонировали в полученный из вируса лейкемии мыши (MLV) ретровирусный вектор. Для предварительных экспериментов антитело получали с применением клеток K562, трансдуцированных векторами, кодирующими как тяжелую, так и легкую цепи.
Повторно клонированная, тяжелая вариабельная анти-CD25 последовательность DNA от антитела РС-61.5.3 кодирует следующую последовательность белка:

Повторно клонированная, легкая вариабельная анти-CD25 последовательность DNA от антитела РС-61.5.3 кодирует следующую последовательность белка:

Антитело очищали из супернатантов с применением колонки HiTrap MabSelect с G-белком (GE Healthcare), диализовали в забуференном фосфатом физиологическом растворе (PBS), концентрировали и стерилизовали фильтрованием. Для дальнейших экспериментов, получение антитела передавали стороннему исполнителю Evitria AG. Коммерчески доступный анти-CD25 клон РС-61 приобретали у BioXcell.
Опубликованные анти-PDL1 (MPDL3280A/RG7446) вариабельные тяжелые и легкие последовательности DNA были реклонированы и экспрессированы в качестве рекомбинантных антител.
Эксперименты с опухолями in vivo
Культивируемые опухолевые клетки трипсинизировали, промывали и ресуспендировали в PBS и вводили подкожно (п/к) в бок (5×105 клеток в случае моделей МСА205 и МС38 мышей C57BL/6; 2,5×105 клеток в случае модели В16 мышей C57BL/6, 5×105 клеток в случае моделей СТ26 мышей BALB/c) клетки). Антитела инъектировали внутрибрюшинно (в/б) в моменты времени, описанные в условных обозначениях фигур. Для функциональных экспериментов, через 10 дней опухоли, дренирующие лимфатические узлы и ткани собирали и обрабатывали для анализа с помощью проточной цитометриеи, как описано у Simpson et al. (2013) J Exp Med 210, 1695-710. Для терапевтических экспериментов, опухоли измеряли два раза в неделю, а объемы рассчитывали как произведение трех ортогональных диаметров. Мышей гуманно усыпляли, когда любой диаметр достигал 150 мм. Мышей-опухоленосителей обрабатывали с помощью 200 мкг анти-CD25-r1 (αCD25-r1), анти-CD25-m2а (αCD25-m2a) или анти-СТLА-4 (αCTLA-4) в дни 5 и 7 и 100 мкг анти-PD-1 в дни 6, 9 и 12. Для терапевтических экспериментов, мышей лечили только в день 5, для фенотипирования и элиминации в день 5 и 7. Размер опухоли измеряли два раза в неделю, а мышей подвергали эвтаназии, когда размер опухоли достигал 150 мм. Мононуклеарные клетки периферической крови (МКПК), лимфатические узлы (LN) и опухоли (TIL) собирали в день 9, обрабатывали и окрашивали для анализа с помощью проточной цитометрии.
Проточная цитометрия
Сбор осуществляли с помощью BD LSR II Fortessa (BD Biosciences). Применяли следующие непосредственно конъюгированные антитела: анти-CD25 (7D4)-FITC, CD4 (RM4-5)-v500 (BD Biosciences); анти-IFNγ (XMG1.2)-AlexaFluor488, анти-PD-1 (J43)-PerCP-Cy5.5, анти-Foxp3 (FJK-16s)-PE, анти-CD3 (145-2C11)-PE-Cy7, анти-Ki67 (SolA15)-eFluor450, анти-CD5 (53-7.3)-eFluor450, фиксируемый жизнеспособный краситель-еFluor780 (eBioscience); анти-CD8 (53-6.7)-BrilliantViolet650 (BioLegend); и анти-гранзим В (GB11)-APC (Invitrogen). Для окрашивания клеток человека применяли следующие антитела: анти-CD25 (BC96)-BrilliantViolet650 (Biolegend), анти-CD4 (OKT4)-AlexaFluor700 (eBioscience), анти-CD8 (SK1)-V500, анти-Ki67 (B56)-FITC (BD Biosciences); анти-FoxP3 (PCH101)-PerCP-Cy5.5 (eBioscience); анти-CD3 (OKT3)-BrilliantViolet785 (Biolegend). Внутриядерное окрашивание Foxp3 выполняли с применением набора Foxp3 Transcription Factor Staining Buffer Set (eBioscience). Для внутриклеточного окрашивания цитокинов, клетки повторно стимулировали добавлением 13-ацетата форбол-12-миристата (РМА, 20 нг/мл) и иономицина (500 нг/мл) (Sigma Aldrich) в течение 4 часов при 37°С в присутствие GolgiPlug (BD Biosciences) и затем окрашивали с применением буферного набора Cytofix/Cytoperm (BD Biosciences). Для количественного определения абсолютного числа клеток, определенное число флуоресцирующих гранул (Cell Sorting Set-up Beads for UV Lasers, ThermoFisher) добавляли к каждому образцу перед исследованием и применяли в качестве контроля для подсчета.
Ткани человека
Периферическую кровь (МКПК) и инфильтрирующие опухоль лимфоциты (TIL) изучали в трех отдельных когортах пациентов со злокачественной меланомой (n=10, 12 очагов), немелкоклеточным раком легких на ранних стадиях (NSCLC) (n=8) и почечно-клеточной карциномой (RCC) (n=5). Представленные данные человека основаны на трех отдельных, этически одобренных, поступательных исследованиях трансляции (меланома REC №11/LO/0003, NSCLC - REC №13/LO/1546, RCC-REC №11/LO/1996). Во всех случаях получали письменное информированное согласие.
Выделение инфильтрирующих опухоль лимфоцитов (TIL)
Опухоли брали непосредственно из операционной в отделении патологии, где выделяли характеристические зоны опухоли. Образцы впоследствии измельчали в стерильных условиях, после чего с помощью ферментативного расщепления (RPMI-1640 (Sigma) с помощью Liberase TL высокой чистоты (Roche) и DNAse I (Roche)) при 37°С в течение 30 минут перед механической диссоциацией с применением gentleMACS (Miltenyi Biotech). Полученные суспензии единичных клеток фильтровали и обогащали в случае лейкоцитов путем прохождения через градиент плотности фиколл-пака (GE Healthcare). Живые клетки подсчитывали и замораживали в антисыворотке человека (Sigma) с 10% диметилсульфоксидом при -80°С перед переносом в жидкий азот.
Фенотипический анализ TIL и МКПК способом многопараметрической проточной цитометрии
Образцы опухолей и МКПК размораживали, промывали в полном RPMI, ресуспендировали в буфере FACS (500 мл PBS, 2% FCS, 2 нМ EDTA) и помещали в круглодонные 96-луночные планшеты. При рекомендуемом разбавлении изготовителя готовили мастер-смесь антител поверхности клетки: CD8-V500, клон SK1 (BD Biosciences), PD-1-BV605, клон ЕН12.2Н7 (Biolegend), CD3-BV785. Фиксируемый краситель на жизнеспособность (eFlour780, eBioscience) также был включен в мастер-микс поверхности клетки. После пермеабилизации в течение 20 минут с применением внутриклеточной фиксации и буферного набора пермеабилизации (eBioscience) применяли внутриклеточную окрашивающую панель, состоящую из следующих антител, применяемых при рекомендованных производителем разбавлениях: гранзим B-V450, клон GB11 (BD Biosciences), FoxP3-PerCP-Cy5.5, клон РСН101 (eBioscience), Ki67-FITC, клон В56 (BD Biosciences) и CTLA-4- АРС, клон L3D10 (Biolegend).
Мультиплексная иммуногистохимия
Образцы опухолей фиксировали в забуференном формалине и погружали в парафин. 2-5 мкм срезы тканей разрезали и окрашивали следующими антителами для иммуногистохимии: анти-CD8 (SP239), анти-CD4 (SP35) (Spring Biosciences Inc.), анти-FохР3 (236А/Е7) (подарок от Dr. G. Roncador CNIO, Мадрид, Испания) и анти-CD25 (4С9) (Leica Biosystems). Для многократного окрашивания, срезы тканей, помещенные в парафин, инкубировали с первичными антителами в течение 30 мин. после демаскировки антигена с помощью применения реагента для демаскировки антигенов 1 (Ventana Medical Systems, Inc.) и перекиси водорода для инактивации эндогенной пероксидазы. Обнаружение проводили с применением реагента для обнаружения на основе пероксидазы (OptiView DAB IHC Detection Kit Ventana Medical Systems, Inc.) и реагента для обнаружения на основе щелочной фосфатазы (UltraView Universal Alkaline Phosphatase Red Detection Kit, Ventana Medical Systems, Inc.). Дополнительный цикл иммуно-щелочной фосфатазы осуществляли с применением альтернативного субстрата (Fast Blue, если раньше применяли Fast Red, или наоборот). Оценивали иммуногистохимию и паттерны реакционной способности белка. Также осуществляли подсчет множественного иммуноокрашивания. Утверждение данного исследования получали от National Research Ethics Service, Research Ethics Committee 4 (REC номер для ссылок 09/H0715/64).
Конструирование и валидация биспеиифического Duobodv на основе анти-CD25- и анти-PD-L1
Duobody Bs PD-L1 CD25 был сгенерирован и получен в соответствии с технологией, описанной в литературе, начиная из двух родительских IgG1, содержащих согласующиеся одноточечные мутации в домене СН3, которые позволяют обмен Fab (Labrijn AF et al., Nat Protoc. 2014, 9:2450-63). Вкратце, каждый из антимышиного CD25 (РС61; изотип IgG1 мыши, как описано выше) и антимышиного/человеческого PD-L1 (клон S70, также известный как Atezolizumab, MPDL3280A, RG7446 или клон YW243.55.S70; смотри WO 2010077634 и Herbst R et al., 2014, Nature 515:563-7) клонировали в векторах экспрессии млекопитающих (504865 | UCOE® Expression Vector - Mouse 3.2 kb Puro Set - Novagen) с мутацией K409R (в случае PC61-IgG1) и мутацией F405L (в случае S70-IgG1) в домене СН3, тогда как легкие цепи поддерживали одинаковыми и получали в качестве отдельных рекомбинантных белков в клетках млекопитающих. Эти родительские IgG1 смешивали in vitro в эквимолярных количествах, в разрешенных окислительно-восстановительных условиях (например 75 мМ 2-МЕА; 5 ч. инкубирования), чтобы обеспечить рекомбинацию полумолекул. После удаления восстановителя для повторного окисления межцепочечных дисульфидных связей, получаемые гетеромерные белки анализировали на эффективность обмена с применением способов на основе SDS-PAGE хроматографии или масс-спектрометрии. В случае Bs PD-L1 CD25, масс-спектрометрия подтвердила, что молекулярная масса гетеродимерных белков составляла 151 кДа, что соответствует добавлению молекулярной массы единичной тяжелой цепи и легкой цепи клона S70 (74 кДа) и единичной тяжелой цепи и легкой цепи PD61-IgG1 (77 кДа) и показано, что половина каждого родительского IgG1 была объединена в одну молекулу.
Специфичность Bs PD-L1 CD25 была дополнительно подтверждена с помощью проточной цитометрии, как описано в Примере 5, с применением родительского антитела в качестве контроля и IgG1-распознающих антител для обнаружения (aHuman, 647 от Alexa Fluor®, античеловеческий IgG козы AffiniPure, специфический фрагмент Fcγ; Jackson Labs 109-605-098), которые применяли в соответствии с литературой и инструкциями изготовителя, разбавленными в буфере FACS (PBS + 2% FCS + 2 мМ EDTA). Дополнительные материалы для проточной цитометрии и клеточной биологии представляют собой фиксируемый краситель на жизнеспособность eFluor780 (Ebioscience 65086514), РМА (50 нг/мл; Santa Cruz Biotechnology, sc-3576) и иономицин (400 нг/мл; Sigma I0634) и ингибитор белка макромолекулярного комплекса, формирующего поры в клеточной мембране аппарата Гольджи (BD Bioscience, 512301KZ).
Валидация Bs PD-L1 CD25 в моделях МСА205 была выполнена с применением того же подхода, который показан в предыдущих примерах, причем контрольный изотип, моноспецифические антитела (100 μг каждый) или биспецифическое Duobody (200 μг каждый) вводили в день 7 после инъекции МСА205, и ткани мыши получали и готовили в день 10.
ПРИМЕР 1 - Высокая экспрессия CD2S в Treg делает его подходящей целью для их элиминации
Высокоаффинный альфа-рецептор интерлейкина-2 (IL2Rα), CD25, как исторически сложилось, был применим в качестве полноценного маркера клеточной поверхности Treg и является мишенью для антитело-опосредованной элиминации Treg. Так как есть разногласия относительно того, что анти-CD25 (aCD25) может также привести к элиминации активированных эффекторных Т-клеток, экспрессию CD25 анализировали в субпопуляциях лимфоцитов в опухолях и периферических лимфоидных органах.
Мышам в бок инъектировали подкожно (п/к) МСА205 (5×105 клеток, мыши C57BL/6), В16 (2,5×105 клеток, мыши C7BL/6) или клетки СТ26 (5×105 клеток, мыши BALB/c) и через 10 дней опухоли (TIL) и дренирующие лимфатические узлы собирали и обрабатывали для анализа с помощью проточной цитометрией.
Стремились оценить относительную экспрессия CD25 с помощью отдельных субпопуляций Т лимфоцитов в пределах опухолей, дренирующих лимфатических узлов и крови мышей-опухоленосителей 10 дней после провоцирующей стимуляции опухоли. Результаты проиллюстрированы на Фигуре 1. В разных моделях трансплантируемых линий опухолевых клеток (в том числе саркомы МСА205, аденокарциномы толстой кишки МС38, меланомы В16 и колоректальной карциномы СТ26) экспрессия CD25 была неизменно высокой в CD4-положительных, Fохр3-положительных Т-клетках (Treg) и минимальной в CD4+Foxp3- и CD8+ Т-клетках (Фиг. 1 (А)), как было описано ранее (Sakaguchi et al. 1995. J Immunol; Shimizu et al. 1999. J Immunol). Из-за своей иммуногенности и более высокой инфильтрации Т-клеток, более подробно изучали эффекты на элиминацию Treg в модели опухоли МСА205 (Фиг. 1 (В-С)). Вопреки исследованиям in vitro, минимальную экспрессию CD25 на эффекторном компартменте (CD4+FoxP3- и CD8+ Т-клетки) наблюдали in vivo. Хотя CD25 незначительно повышающе регулируется на инфильтрирующих опухоль CD8+ и CD4+FoxP3- Т эффекторных клетках (Teff). Процентное содержание CD25-положительных клеток (3,08%-8,35% CD8+, 14,11-26,87 % CD4-положительных, Fохр3-негативных клеток) и уровни экспрессии в расчете на каждую клетку (средняя интенсивность флуоресценции (MFI) 166,6 в CD8-положительных и 134 в CD4-положительных, Fохр3-негативных клетках) были значительно ниже, чем в Treg (83,66-90,23%, MFI 1051,9; р<0,001). В заключение, CD25 также экспрессировались на Treg, присутствующей в дренирующих лимфатических узлах и крови, хотя уровень экспрессии на основе средней интенсивности флуоресценции (MFI) был выше на инфильтрирующей опухоль Treg. Значительно меньшая экспрессия CD25 на клетках Teff, по сравнению с клетками Treg, указывает на то, что CD25 является подходящей и привлекательной мишенью для элиминации Treg в опухоли, где уровни экспрессии на Treg являются значительно более высокими.
ПРИМЕР 2 - Замена изотипа является необходимой для эффективной и безопасной внутриопухолевой элиминации Treg с помощью анти-CD25
Традиционно, клон РС-61 анти-CD25 антитела (αCD25) (IgG1, κ крысы) (αCD25-r1) применяли для элиминации Treg в моделях мыши, в которых неоднократно было показано, что это приводит к элиминации Treg в периферических лимфоидных органах. Чтобы избежать межвидовых различий во взаимодействии FcγR, константные области РС-61 заменяли мышиным IgG2a, κ (αCD25-m2a) -классическим элиминирующим изотипом мышей - а число Treg как на периферии, так и в опухоли определяли количественно и сопоставляли с эффектом анти-CTLA4 (αCTLA4, клон 9Н10), который, как известно, приводит к элиминации инфильтрирующей опухоль Treg.
На основании предыдущих доказательств, свидетельствующих о важности внутриопухолевой элиминации Treg при совместном определении активности иммуномодулирующих антител, пытались сравнить эффект αCD25-r1 на частоту Teff и Treg в крови, дренирующих лимфатических узлах (LN) и инфильтрирующих опухоль лимфоцитах (TIL) в модели МСА205 мыши, ввиду ее более высокой иммуногенности и для оценки любого потенциального отрицательного влияния анти-CD25 на активированную Teff в пределах опухолей.
Мышам-опухоленосителям инъектировали 200 мкг анти-CD25-r1 (αCD25-r1), анти-CD25-m2а (αCD25-m2a) или анти-CTLA-4 (αCTLA-4) в дни 5 и 7 после п/к инокуляции 5×105 клеток МСА205. Одноядерные клетки периферической крови (МКПК), лимфатические узлы (LN) и опухоли (TIL) собирали в день 9, обрабатывали и окрашивали для анализа с помощью проточной цитометрии. Результаты показаны на Фигурах 2 и 3.
Введение in vivo αCD25 уменьшает число клеток CD25+ в лимфатических узлах и особенно в крови, независимо от изотипа антитела. При количественном определении числа Treg с помощью экспрессии их сигнатурного фактора транскрипции, Foxp3, оба изотипа снова были одинаково эффективны на периферии, но, что удивительно, только изотип IgG2a мыши приводил к значительной редукции в частоте и абсолютном числе инфильтрирующих опухоль Treg к уровням, сравнимых с теми, которые наблюдаются при αCTLA4. Хотя экспрессию CD25 повышающе регулировали в малой пропорции инфильтрирующих опухоль эффекторных Т-клеток (смотри Пример 1), не наблюдали никакой существенной редукции в числе CD8+ и CD4+Foxp3- на периферии или в опухоли. Как следствие, оба изотипа αCD25 приводили к повышенному соотношению Teff/Treg на периферии. Однако только αCD25-m2a повышает это соотношение аналогично анти-CTLA4, который, как известно, преимущественно элиминирует Treg в опухоли, но не на периферии. Это потенциально объясняет отсутствие эффективности, наблюдаемой против развившихся опухолей в предыдущих исследованиях. Таким образом, только анти-CD25 (IgG2a мыши) снижает число Treg в лимфатическом узле и крови и элиминирует инфильтрирующую опухоль Treg. Важно отметить, что, несмотря на снижение числа циркулирующих и LN-резидентных Treg в коже, легких и печени, не наблюдали никаких макроскопических признаков токсичности после нескольких доз αCD25-m2a. Этот тип анти-CD25 терапии не связан с другими серьезными проблемами из-за его токсичности у мышей во время таких экспериментов, поскольку статистически значимые различия в общем состоянии здоровья и общей массе тела, а также уровни лактатдегидрогеназы (LDH) и ферментов печени (AST, аспартатаминотрансфераза; ALT, аланинаминотрансфераза) в сыворотке, измеряли среди различных терапевтических групп.
Также определяли уровни экспрессии как активационного, так и ингибирующего FcγR на разных субпопуляциях лейкоцитов в крови, селезенке, LN и опухоли мышей, несущих подкожные опухоли МСА205 (Фиг. 4). FcγRs оказались более высокоэкспрессируемыми на инфильтрирующих опухолевых миелоидных клетках (гранулоцитарных клетках, обычных дендритных клетках и моноцитах/макрофагах), по сравнению со всеми другими изученными органами. Аффинность связывания двух вариантов Fc анти-CD25 с FcγR также определяли с применением поверхностного плазмонного резонанса (Таблица 1).

Эти данные показывают, что изотип mIgG2a связывается со всеми подтипами FcγR с высоким коэффициентом активации-ингибирования (А/I). Напротив, изотип rIgG1 связывается с аналогичной аффинностью с одним активационным FcγR (FcγRIII), а также ингибирующим FcγRIIb, что приводит к низкому коэффициенту А/I (<1).
Число инфильтрирующих опухоль Treg у мышей, лишенных экспрессии различных FcγR, развивалось в различных моделях мыши, чтобы определить, какие конкретные FcγR были вовлечены в анти-CD25-опосредованную элиминацию Treg (Фиг. 5). C57BL/6 контрольным мышам и Fcer1g-/- мышам инъектировали подкожно клетки МСА205 и опухоли, дренирующие лимфатические узлы, а кровь собирали и обрабатывали для анализа с помощью проточной цитометриеи. Регуляторные Т-клетки определяли с помощью экспрессии CD4 и FoxP3. Процентное содержание FохрЗ-положительных от всех CD4-положительных клеток показывает, каким образом анти-CD25 эффект обусловлен экспрессией гена Fcer1g. Анализ Fcer1g-/- мышей, которые не экспрессируют ни одного из активирующих FcγR (I, III и IV), демонстрировал полное отсутствие элиминации Treg. Элиминация Treg с помощью αCD25-r1 на периферии и αCD25-m2a на периферии и в опухоли, следовательно, происходит из FcγR-опосредованной ADCC и не блокирует связывание IL-2 с CD25. Элиминация с помощью αCD25-m2a не зависела ни от какого отдельного активационного FcγR, с элиминацией Treg, поддерживаемой как у Fcgr3-/-, так и у Fcgr4-/- мышей. Таким образом, элиминация периферических Treg с помощью αCD25-r1 не способна элиминировать в опухоли, несмотря на высокую внутриопухолевую экспрессию этого рецептора. Внутриопухолевая элиминация Treg все равно эффективно восстанавливается у мышей, у которых отсутствует экспрессия ингибирующего рецептора FcγRIIb. В этой ситуации, внутриопухолевая элиминация Treg сопоставима между αCD25-r1 и αCD25-m2a. Следовательно, отсутствие элиминации Treg с помощью αCD25-r1 в опухоли может быть объяснено путем его низкого коэффициента связывания А/I и высокой внутриопухолевой экспрессии FcγRllb, которая ингибирует ADCC, опосредованную одним активационным рецептором, входящим в контакт с этим изотипом.
ПРИМЕР 3 - Анти-CD25 терапия действует синергически с анти-PD-1, уничтожает развившуюся опухоль и увеличивает выживаемость мышей-опухоленосителей
Было высказано предположение, что, благодаря своей лучшей эффективности в интратуморальной элиминации Treg, αCD25-m2a может иметь лучший терапевтический результат при лечении развившихся опухолей. Противоопухолевая активность αCD25-m2a и -r1 против развившихся опухолей оценивали путем введения однократной дозы αCD25 через пять дней после подкожной имплантации клеток МСА205, когда опухоли развились. Результаты предоставлены на Фигуре 6.
В соответствии с наблюдаемым отсутствием способности элиминировать внутриопухолевые Treg, однократная доза αCD25 у мышей с развившейся опухолью (день 5) не приводила к защите с помощью αCD25-r1. С другой стороны, наблюдали задержку роста и долгосрочную выживаемость мышей, учитывая αCD25-m2a (15,4%). Из-за клинической значимости средств, таргетирующих коингибирующий рецептор PD-1 в качестве иммунотерапевтической мишени, и ключевой роли PD-1 в контроле регуляции Т-клеток в пределах микроокружения опухоли, предполагают, что элиминация CD25+ клеток Treg и блокада PD-1 могут быть синергетическими в комбинации. На той же модели исследовали комбинацию αCD25 с блокадой PD-1 с применением анти-PD-1 (αPD-1, клон RMP1-14; при дозе 100 мкг каждые три дня). αPD-1 в качестве монотерапии является не эффективным при лечении развившейся модели опухоли МСА205, а комбинация с αCD25-r1 не улучшала ее эффект. Однако однократная доза αCD25-m2a с последующей терапией αPD-1 искореняла развившиеся опухоли у 78,5 % мышей, что приводило к длительному выживанию более 100 дней. Аналогичный результат наблюдали в моделях опухолей МС38 и СТ26, где αCD25-m2a имел частичный терапевтический эффект, который действует синергически с терапией αPD-1, в отличие от комбинации с αCD25-r1, которая не смогла элиминировать инфильтрирующие опухоль Treg в таких опухолях. Таким образом, подобное комбинированное введение позволяло эффективной опухолевой элиминации резко улучшать долгосрочную выживаемость различных моделей опухоли мыши.
Чтобы понять механизм действия, лежащий в основе синергизма с комбинацией αCD25-m2a и αPD-1, оценивали фенотип и функцию инфильтрирующих опухоль лимфоцитов (TIL), присутствующих в микроокружении опухоли МСА205 в конце протокола лечения, через 24 часа после третьей дозы αPD-1 (Фигура 7). Монотерапия αPD-1 не влияла на пролиферацию Teff или на величину инфильтрации Teff в опухоли, где также наблюдали постоянную высокую частоту Treg (данные не показаны) и низкое отношение Teff/Treg, согласуясь с отсутствием терапевтической активности. В противовес этому, внутриопухолевая элиминация Treg после применения αCD25-m2a приводила к увеличению доли пролиферирующих и интерферон-γ (IFN-γ)-продуцирующих CD4+FoxP3- Т-клеток в опухоли, что соответствует высокому коэффициенту Teff/Treg и антиопухолевому ответу. Этот эффект дополнительно усиливался в комбинации с анти-PD-1, что приводило к еще большей пролиферации и 1,6-кратному увеличению числа IFN-γ-продуцирующих CD4-положительных, FoxP3 негативных Т-клеток, по сравнению с монотерапией с анти-CD25-m2а. В отличие от этого, наблюдаемое отсутствие элиминации Treg с анти-CD25-r1 не приводило к изменению пролиферации Teff или получению IFN-γ, при применении в качестве монотерапии или в комбинации с анти-PD-1.
Данные, которые были сгенерированы с помощью РС61, имеющего либо исходный изотип IgG1 мыши или изотип IgG2a мыши, которые позволяют эффективно элиминировать Treg, указывают на то, что такой анти-CD25, отдельно или в комбинации анти-раковых антител, может быть эффективным при отторжении развившихся опухолей, особенно в случае тех опухолей, которые требуют эффективной интратуморальной элиминации Treg.
Как показано выше, введение однократной дозы αCD25-m2a, с последующей терапией αPD-1, оказало положительное влияние на размер опухоли и выживаемость модели МСА205 мыши. Этот терапевтический эффект, обусловленный анти-CD25-m2а/анти-PD1, зависит от активности CD8-положительной Т-клетки, поскольку дополнительное введение анти-CD8-антитела приводило к увеличению размера опухоли и выживаемости мышей до уровней, наблюдаемых у необработанных животных (Фиг. 8). Таким образом, элиминация опухоли МСА205 зависит от влияния синергизма αPD-1/αCD25 как на CD8-положительные, так и на популяции клеток Treg, и что общие ответы эффекторных Т-клеток не подвергаются отрицательному влиянию со стороны элиминирующего анти-CD25 антитела.
Такая синергия также наблюдалась в отношении модели слабо иммуногенной опухоли меланомы В16, когда αCD25-m2a и αPD-1 объединяли с Gvax, вакциной GM-CSF-экспрессирующих цельных опухолевых клеток (Фиг. 9). В этой системе ни терапия с помощью Gvax отдельно, ни комбинация Gvax с αPD-1 или αCD25-r1 не способны блокировать рост опухоли или удлинять выживаемость мышей-опухоленосителей. В этих условиях, только комбинация Gvax с αCD25-m2a (отдельно или вместе с αPD-1). Такое улучшение не наблюдали ни в одной группе лечения, где вводили αCD25-r1.
Аналогичный результат синергизма ингибитора контрольных точек иммунного ответа с αCD25-m2a наблюдали в модели опухоли МС38 в обоих случаях, когда вводили αPD-1 (Фиг. 10) или αPD-L1 (Фиг. 11). Также модели опухолей СТ26 подтверждали терапевтический эффект этих комбинаций (Фиг. 12 and 13). Таким образом, когда αCD25-m2a уже оказывал частичный терапевтический эффект благодаря элиминации Treg, это выгодное свойство дает возможность неожиданно улучшить реакцию на терапии, основанные на ингибиторах контрольных точек иммунного ответа.
ПРИМЕР 4 - CD25 экспрессируется на высоком уровне на Treg-инфильтрирующих опухолях человека и терапия анти-PD-1 индуцирует инфильтрацию CD25-экспрессирующих Treg в опухолях человека
CD25 кажется привлекательной целью для элиминации Treg и комбинации иммунотерапевтических подходов на основе моделей мыши. Чтобы валидировать CD25 в качестве возможной цели для элиминации Treg у людей, его уровни экспрессии в периферической крови и инфильтрирующих опухоль лимфоцитов сравнивали с применением биологических образцов, полученных от пациентов с раком яичников, раком мочевого пузыря, меланомой, немелкоклеточной карциномой (NSCS) и почечно-клеточной карциномой (RCC), с помощью проточной цитометрии и иммуногистохимии (IHC). Число Treg и экспрессия CD25 в образцах опухолей от пациентов с RCC до и после получения терапии с αPD-1 с помощью Pembrolizumab также определяли количественно. Результаты показаны на Фигурах 14 и 15.
Независимо от анатомического положения, типа опухоли или стадии, было отмечено, что экспрессия CD25 в Treg значительно выше (50-85%), чем в CD4+Foxp3- (10-15%) и CD8+ (<5 %) Т-клетках. Подобно мышиным моделям, уровень экспрессии CD25, по оценке с помощью MFI, был значительно выше на CD4+FoxP3+ Treg, по сравнению с CD4+FoxP3- и CD8+ Teff в пределах всех изученных подтипов опухоли.
Эти наблюдения дополнительно поддерживали с помощью мультиплексной иммуногистохимии (IHC). Анализ опухоли меланомы, NSCLC и RCC от одних и тех же когорт пациентов показал, что даже в областях с плотным инфильтратом CD8-положительных Т-клеток экспрессия CD25 оставалась ограниченной до FoxP3-положительных клеток. Поразительно, что этот профиль экспрессии оставался неизменным, независимо от подтипа опухоли, стадии, места резекции, текущей или предшествующей терапии, и соответствует данным, полученным на мышах.
Кроме того, в отличие от высокой доли Treg, наблюдаемой в подкожных опухолях мыши, образцы RCC показали ограниченное число Treg в необработанных опухолях. Однако терапия анти-PD-1 приводила к значительной инфильтрации как CD8+ Т-клеток, так и Treg (Fохр3-положительных клеток). Более того, данные, полученные из образцов меланомы и RCC, подтверждают, что CD25 экспрессировался на высоком уровне Fохр3-положительными клетками, в то время как его экспрессия была минимальной в Fохр3-негативных, CD8-положительных клетках.
Когда экспрессию CD25 оценивали в контексте терапевтической иммунной модуляции. Толстоигольные биопсии осуществляли на одном и том же очаге на исходном уровне и с последующими либо 4 циклами Nivolumab, либо 2 циклами Pembrolizumab пембролизумаба у пациентов с развившемся раком почки и меланомой, соответственно. Несмотря на системную иммунную модуляцию, экспрессия CD25 оставалась ограниченной FохР3-положительными Treg, даже в областях плотного инфильтрата CD8-положительных Т-клеток, оцененного с помощью мультиплексной IHC.
Эти данные подтверждают трансляционную ценность описанных доклинических данных и дают дополнительную поддержку концепции селективного терапевтического таргетирования Treg посредством CD25 в раковых заболеваниях человека. Более того, профили экспрессии CD25 в солидных раковых опухолях человека в связи с анти-PD1 лечением предлагает обоснование для терапевтической комбинации античеловеческих CD25 антител, имеющих связывание CD25 и специфичность гамма рецепторов Fc сравнимые с теми, которые показаны в случае антимышиного CD25 PC61(IgG2a) с ингибиторами контрольных точек иммунного ответа, таким как антагонист PD-1.
ПРИМЕР 5 - биспецифическое антитела на основе анти-CD25- и анти-PD-L1 и комбинация антител представляют эффективную элиминацию Treg и свойства индуцирования цитокина
Предыдущие примеры показали, что свойства элиминации Treg, свойства CD25-связывания антител на основе РС61 и с соответствующим изотипом, могут быть применены в комбинации с другими антираковыми соединениями, такими как антитела, таргетирующими белки контрольных точек иммунного ответа, такие как антагонист PD-1 (являясь анти-PD-1 или анти-PD-L1-антителом). Эти результаты показывают, что конструкция биспецифических антител сочетает два свойства связывания антигена и соответствующий изотип (например, IgG1).
Этот подход был подтвержден с применением технологии Duobody, которая позволяет эффективно связывать одну тяжелую и легкую цепь из двух отдельных моноспецифических антител, которые производятся отдельно, в пределах одного гетеромерного белка, который назван Bs CD25 PD-L1 (Фиг. 16А). Специфичность связывание этого антитела была подтверждена с применением двух генетически модифицированных клеточных линий человека, каждая из которых экспрессирует либо CD25 мыши, либо PD-L1 мыши, и по сравнению с исходными моноспецифическими антителами (Фиг. 16В и С). Эти клеточные линии были исследованы с помощью проточной цитометрии отдельно или в смеси в эквивалентных количествах, показывая, что Bs PD-L1 CD25 сохраняет свою двойную специфичность CD25, PD-L1, даже позволяя распознавать комплекс двойных положительных клеточных комплексов, которые образованы с помощью связывания Bs PD-L1 CD25 как с CD25-положительными, так и PD-L1-положительными клетками, одновременно.
Функциональные свойства BsAb PD-L1 CD25 оценивали in vivo с помощью применения моделей взаимодействия и элиминации клеток, которые были применены для валидации РС61 в предыдущих Примерах. Модель МСА205 применяли для оценки влияния BsAb на эффекторные и регуляторные Т-клетки в опухоли и LN. В этой модели, BsAb PD-L1 CD25 может распознавать и элиминировать CD4-положительные, Fохр3-положительные регуляторные Т-клетки и увеличивать соотношение CD8-положительных, Gохр3-положительных регуляторных Т-клеток в опухолях и LN с эффективностью, эквивалентной анти-CD25 (РС61-m2а) или комбинации моноспецифических анти-CD25 и анти-PD-L1 антител (Фиг. 17 АВ). Более того, BsAb PD-L1 CD25 увеличивает число экспрессирующих интерферон гамма, CD4-положительных, CD5-положительных клеток на уровне, который по своей мере аналогичен комбинации моноспецифических анти-CD25 и анти-PD-L1, и, возможно, превышает одно из анти-CD25 m2a антител отдельно (Фиг. 17С).
Данные показывают, каким образом применение элиминирующего Treg античеловеческого антитела CD25 на основе РС61 для лечения рака может быть не только улучшено путем выбора подходящего изотипа, но и эффективно сочетаться с другим противораковым лекарственным средством, в частности, с противораковыми антителами, которые связываются с другим антигеном клеточной поверхности. Этот подход может быть продолжен путем создания и введения двух продуктов в виде новой смеси моноспецифических антител или в виде новых биспецифических антител, которые ассоциированы и произведены для поддержания элиминации Treg, связывания CD25 или других свойств связывания родительского моноклонального антитела.
Все документы, упомянутые в данном документе, включены в настоящее описание посредством ссылки в полном объеме с уделением особого внимания предмету, для которого они указаны. Различные модификации и варианты описанных способов и системы изобретения будут очевидны для специалистов в данной области техники без отхода от объема и сущности изобретения. Хотя изобретение было описано в связи с конкретными предпочтительными вариантами реализации, следует понимать, что заявляемое изобретение не должно быть чрезмерно ограничено такими конкретными вариантами реализации. Действительно, различные модификации описанных режимов для реализации изобретения, которые очевидны специалисту в области молекулярной биологии, клеточной иммунологии или смежных областей, предназначены для охвата следующими пунктами формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| FC-ОПТИМИЗИРОВАННЫЕ АНТИТЕЛА К CD25 ДЛЯ ИСТОЩЕНИЯ ОПУХОЛЕСПЕЦИФИЧЕСКИХ КЛЕТОК | 2018 |
|
RU2839380C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2730984C1 |
| НОВЫЕ МОЛЕКУЛЫ АНТАГОНИСТИЧЕСКИХ АНТИ-TNFR2-АНТИТЕЛ | 2019 |
|
RU2829587C2 |
| АНТИ-ICOS АНТИТЕЛА | 2017 |
|
RU2764548C2 |
| КОМБИНАЦИЯ ПОКСВИРУСА, КОДИРУЮЩЕГО ПОЛИПЕПТИДЫ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА, И IL-2 С АНТИТЕЛОМ К PD-L1 | 2020 |
|
RU2824962C1 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2702108C2 |
| СОХРАНЕНИЕ ИММУННОГО ОТВЕТА ВО ВРЕМЯ ХИМИОТЕРАПЕВТИЧЕСКИХ СХЕМ | 2017 |
|
RU2779478C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2825390C2 |
| СПОСОБЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ИММУННОГО ОТВЕТА | 2015 |
|
RU2689162C2 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |











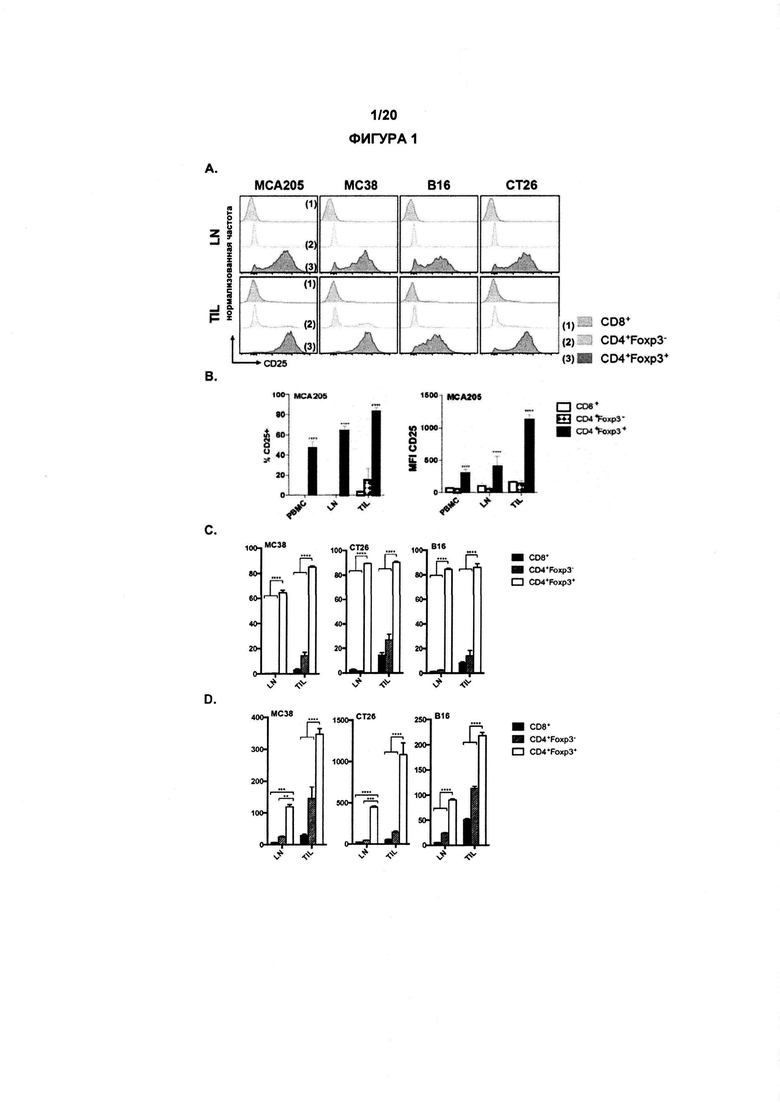
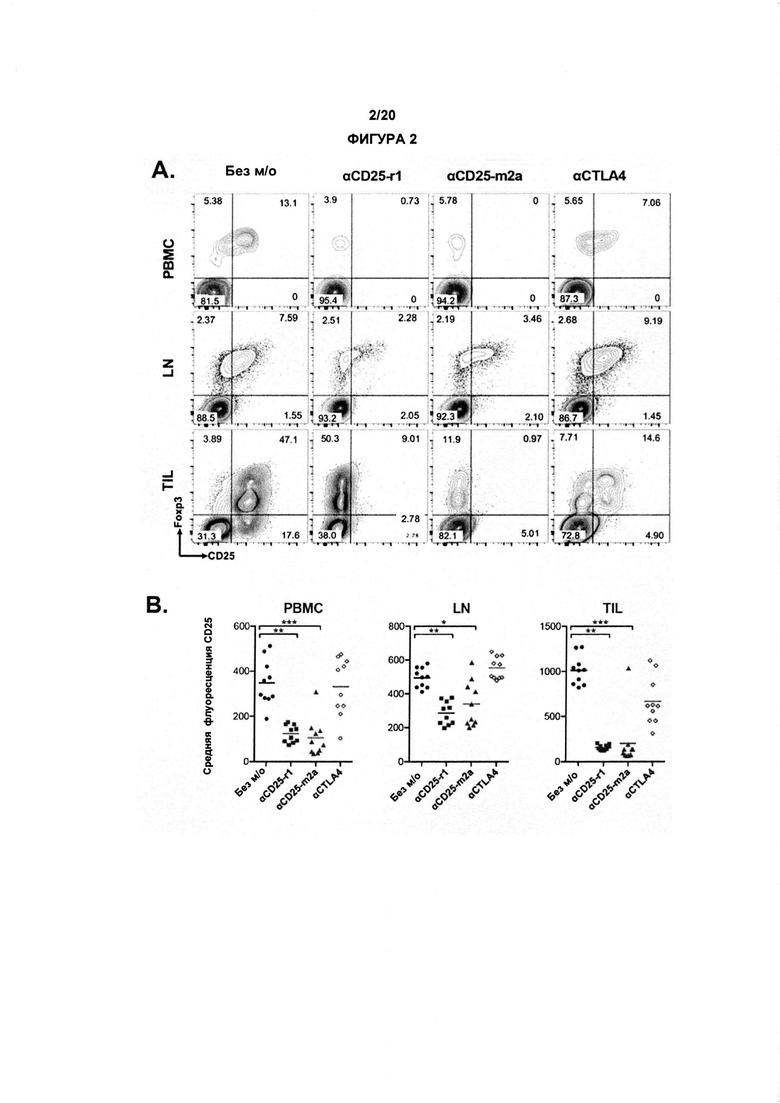
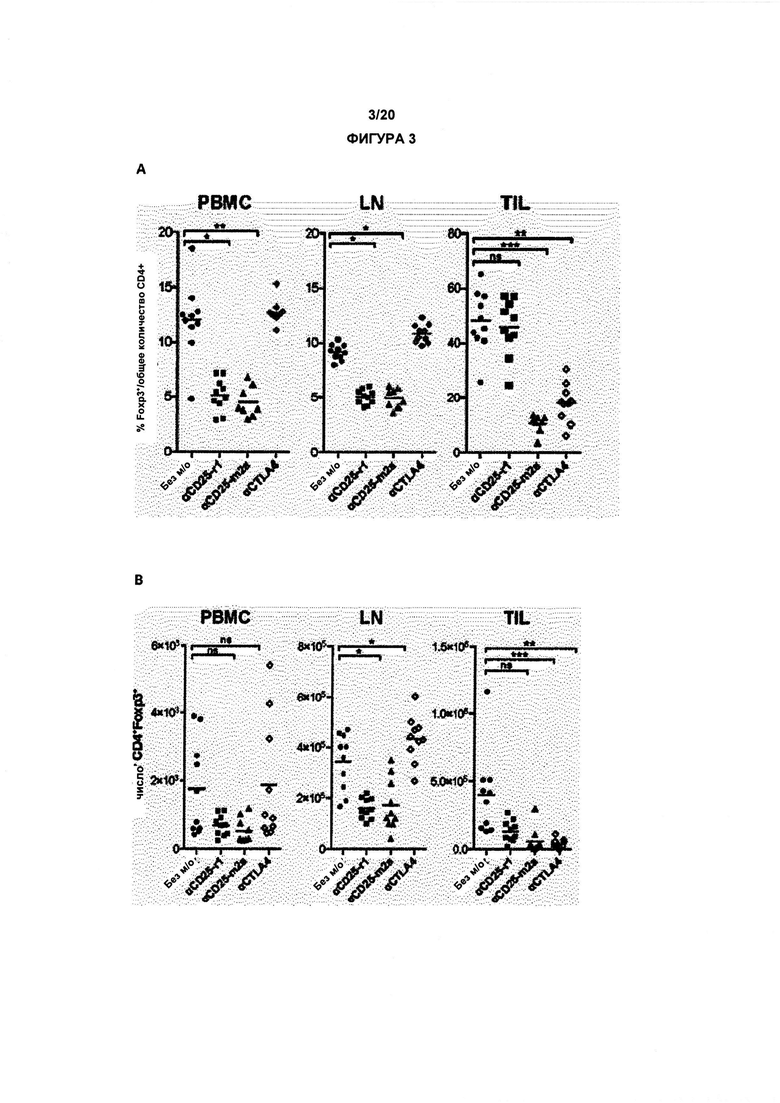
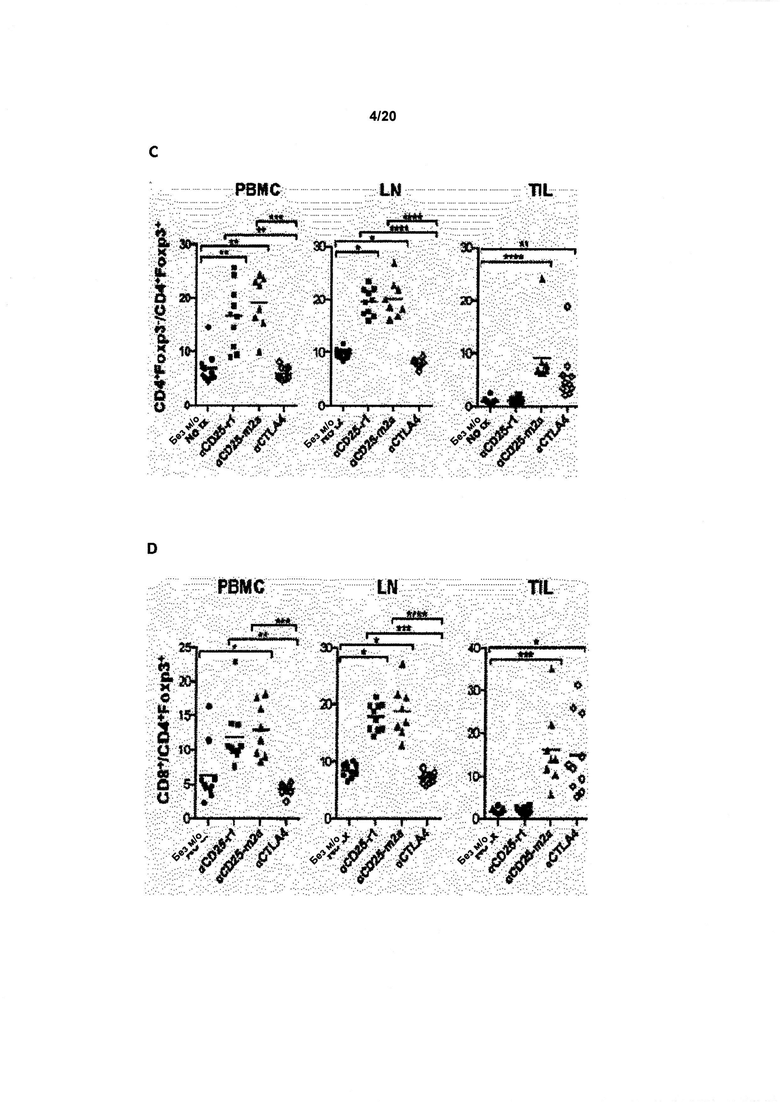
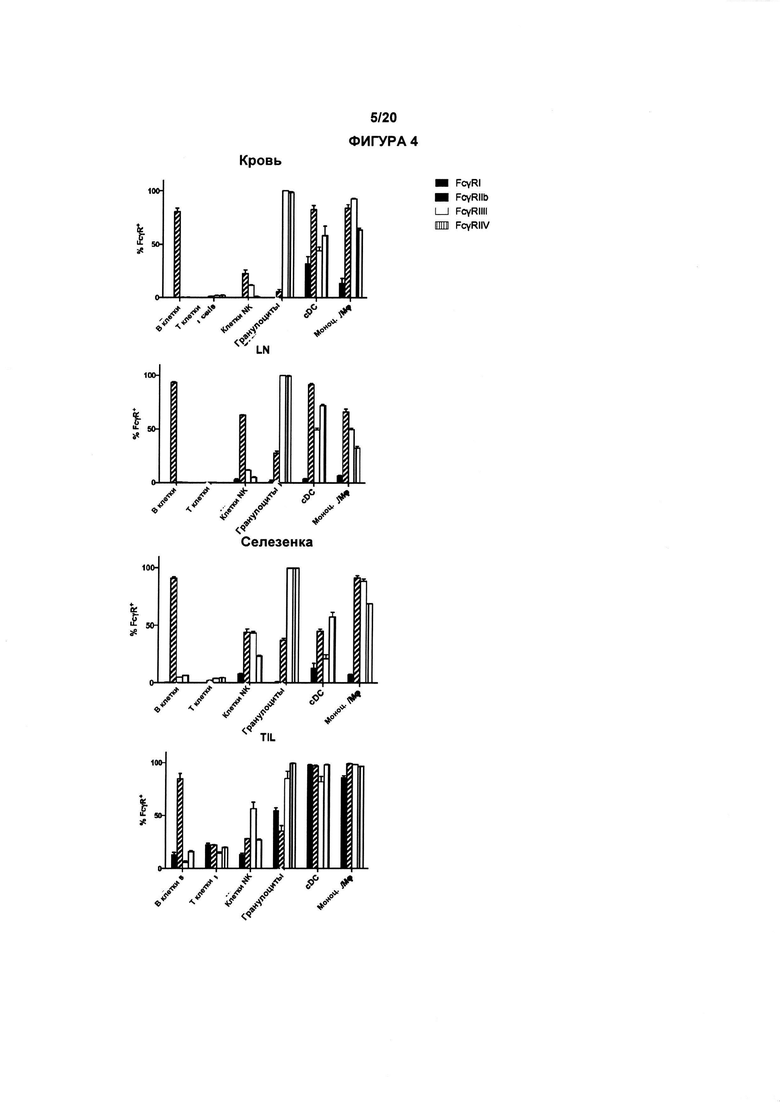
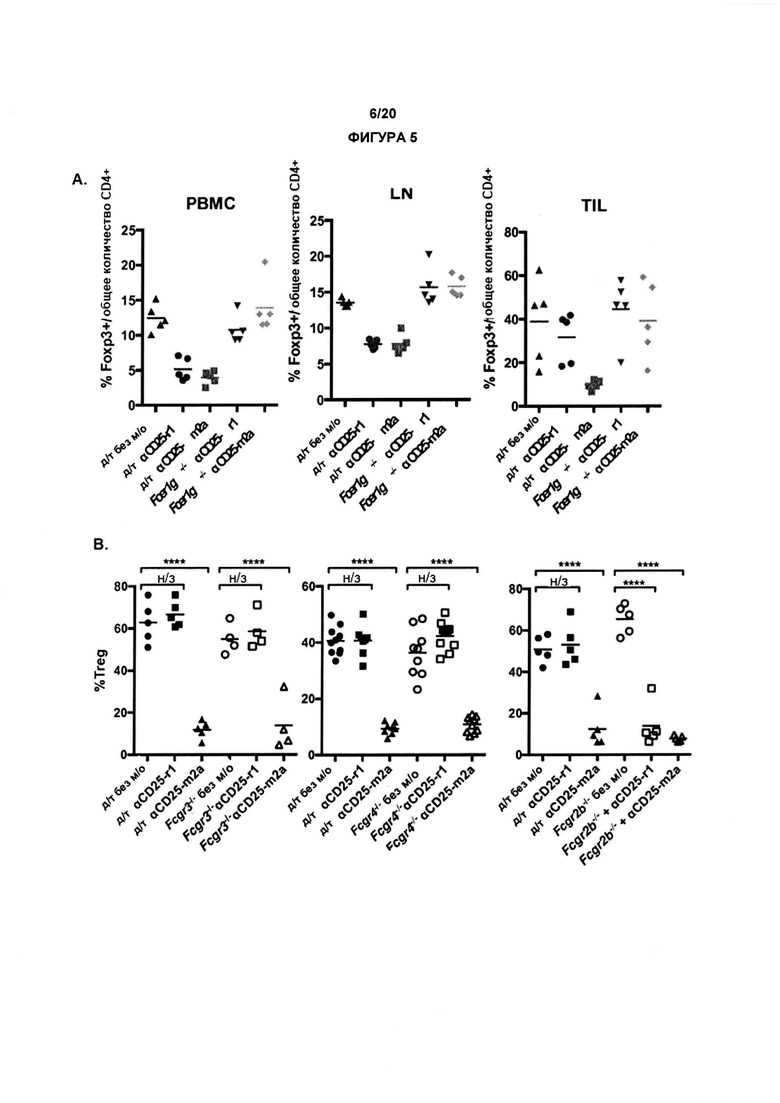
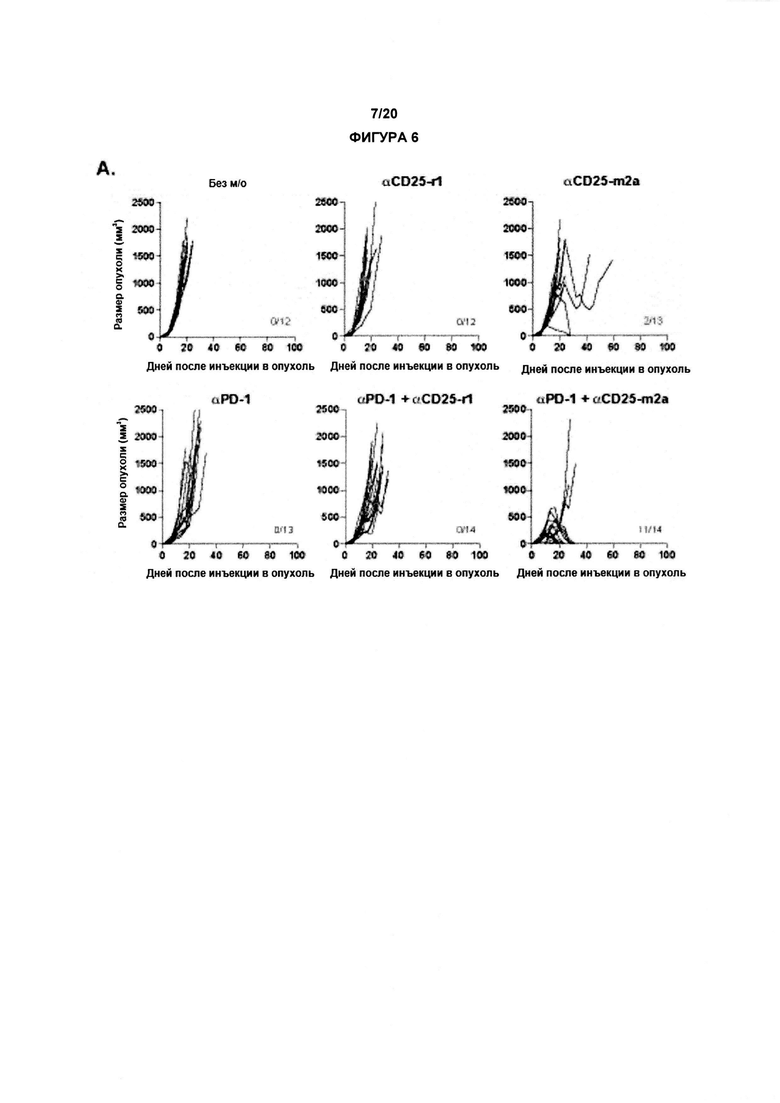
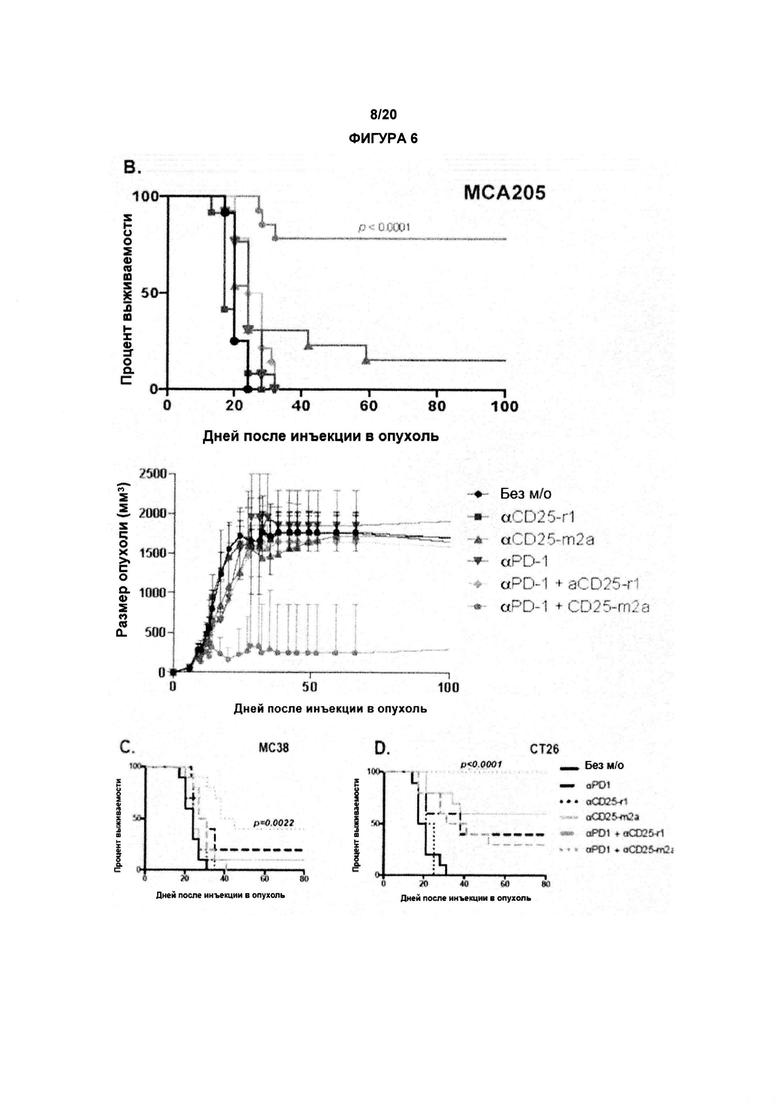
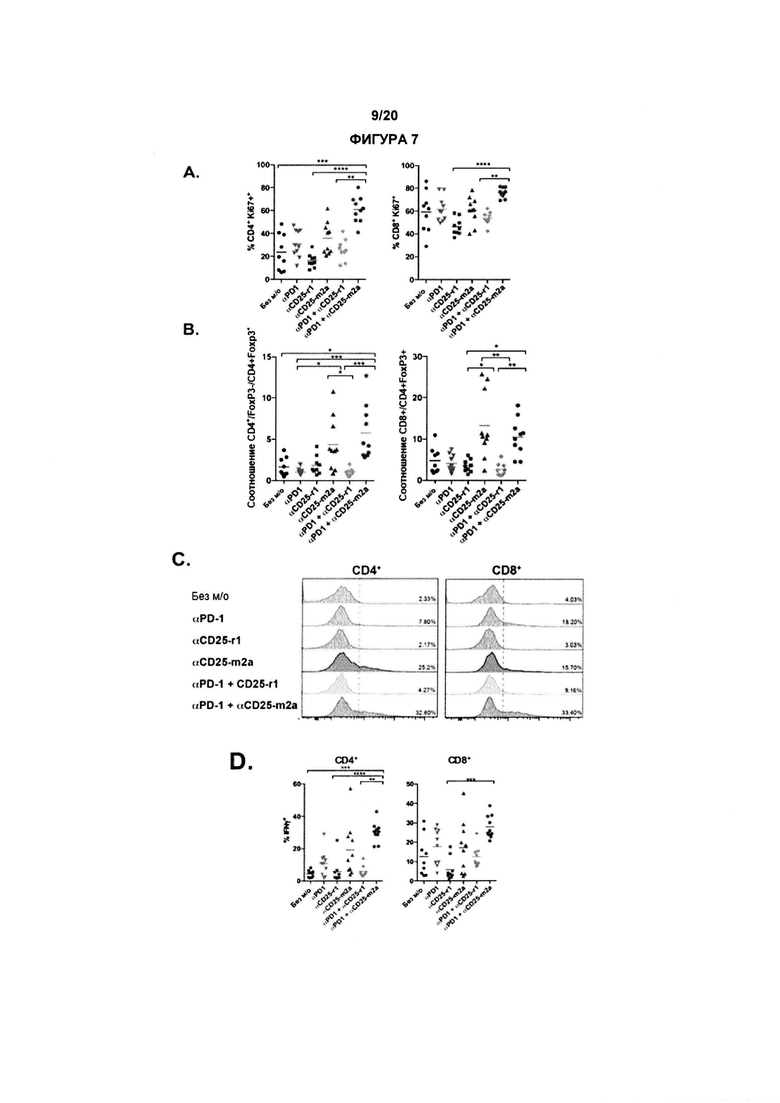
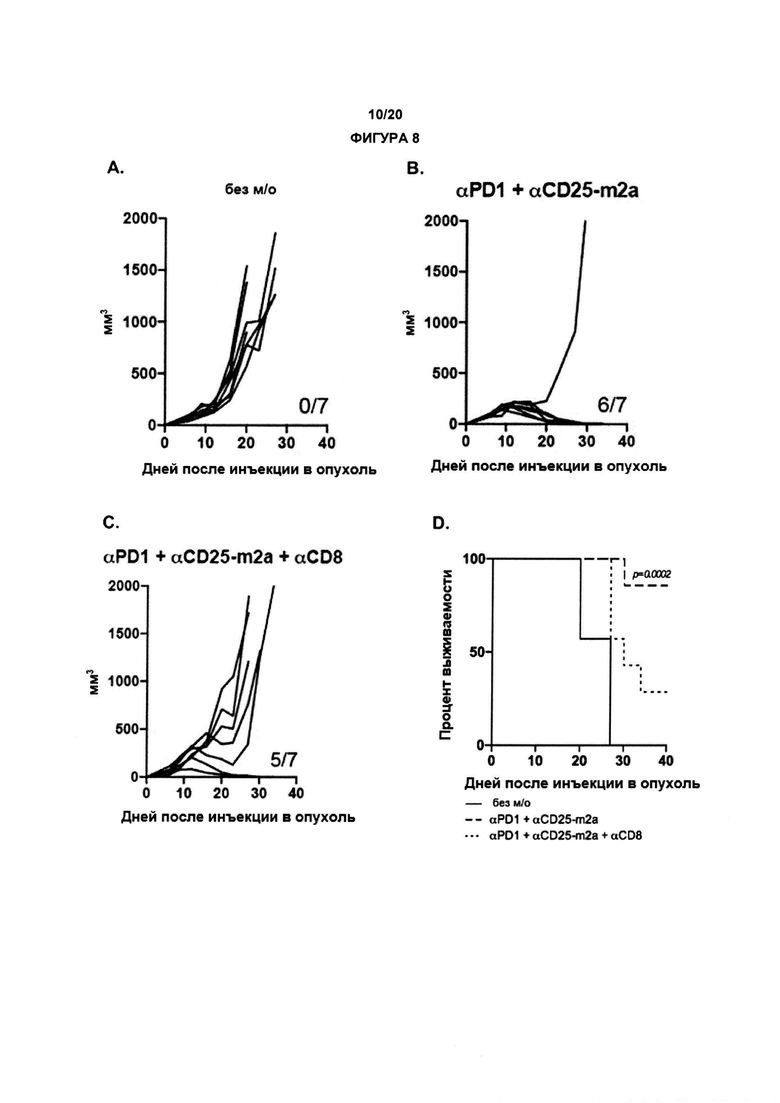
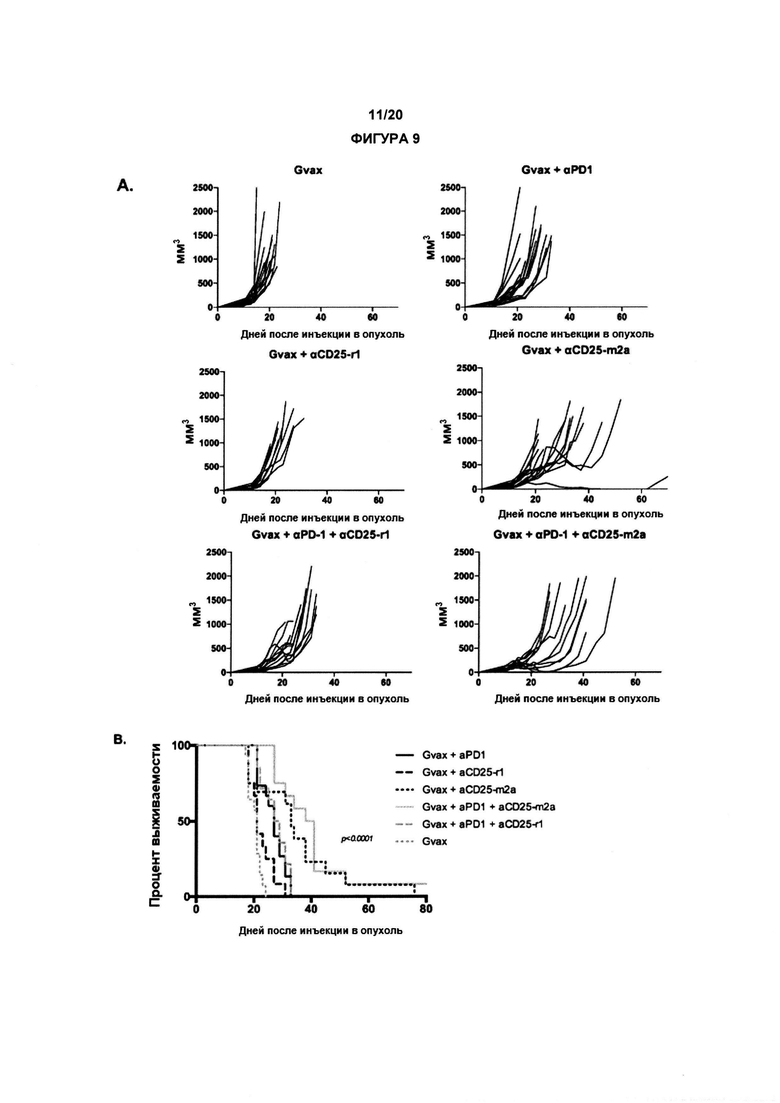
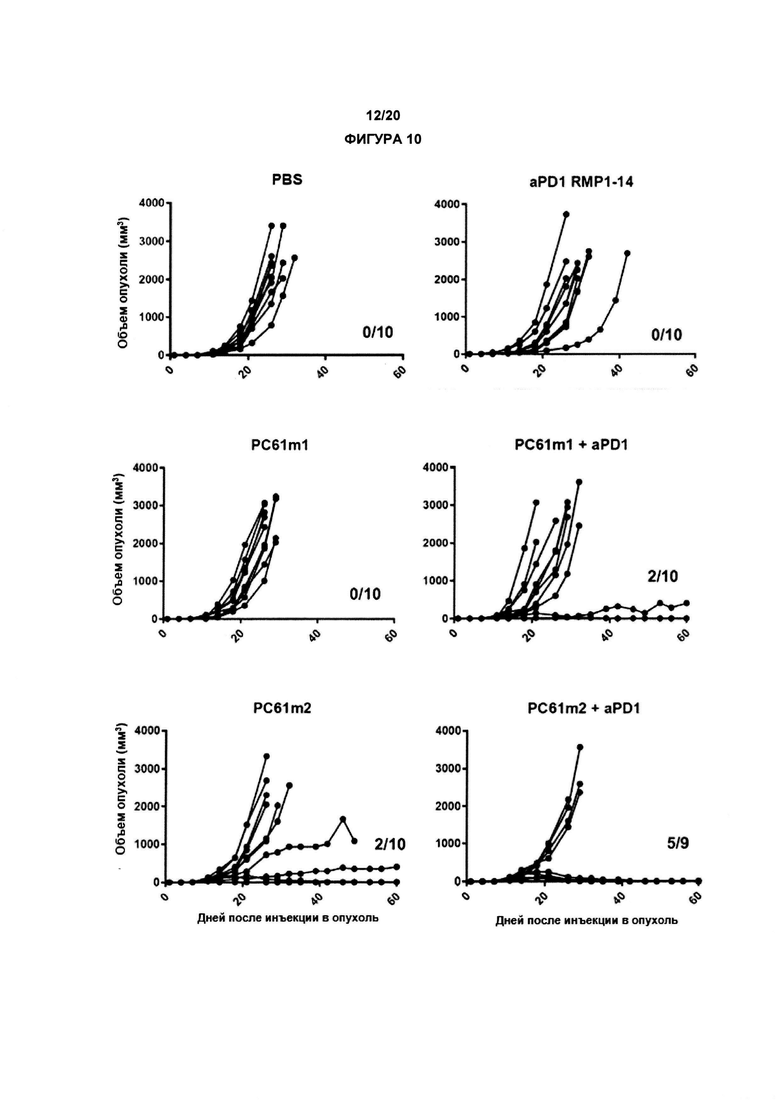
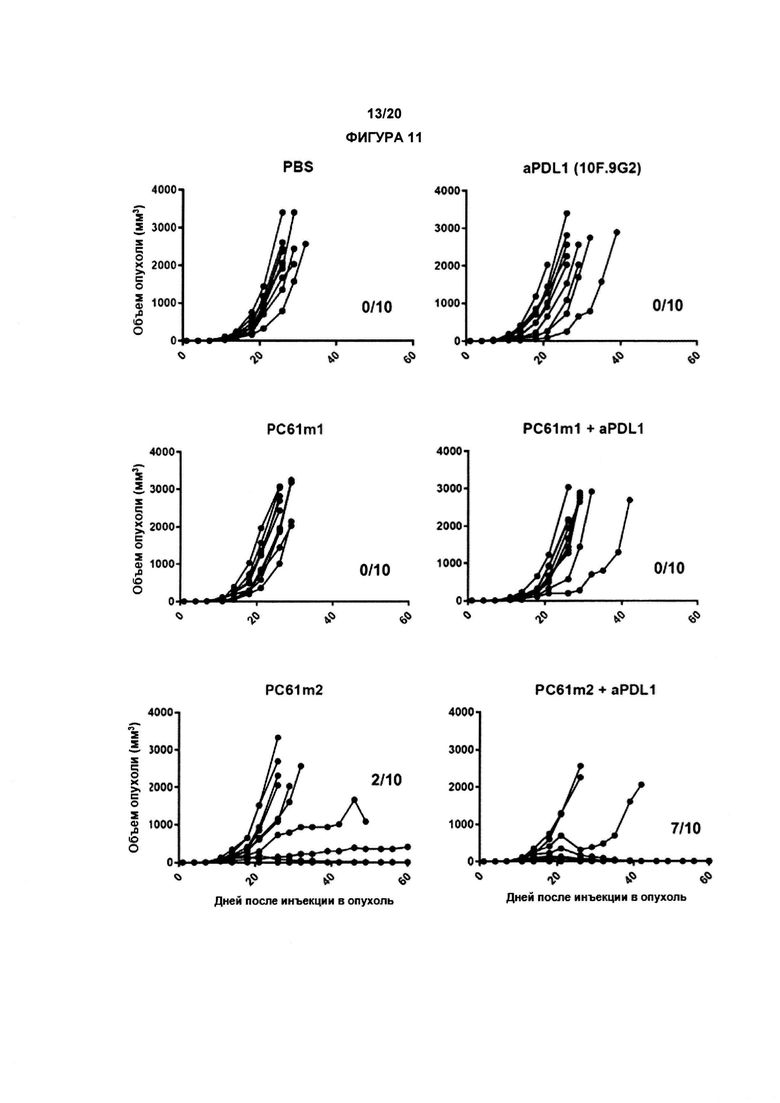
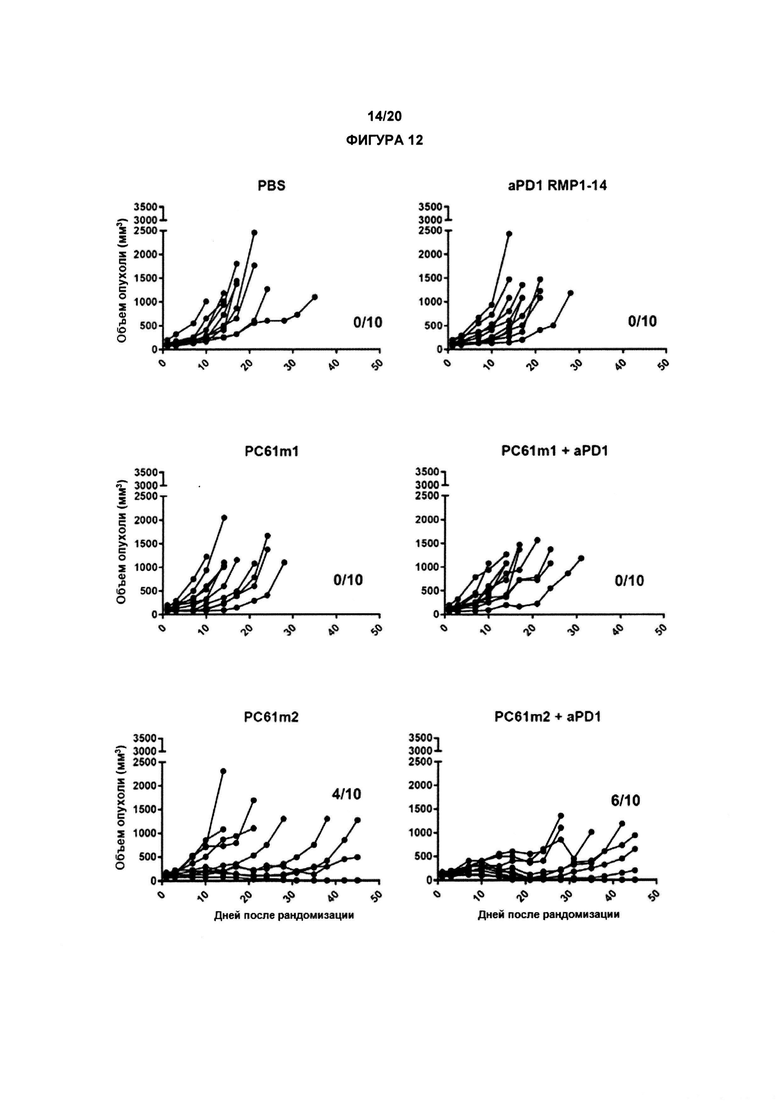
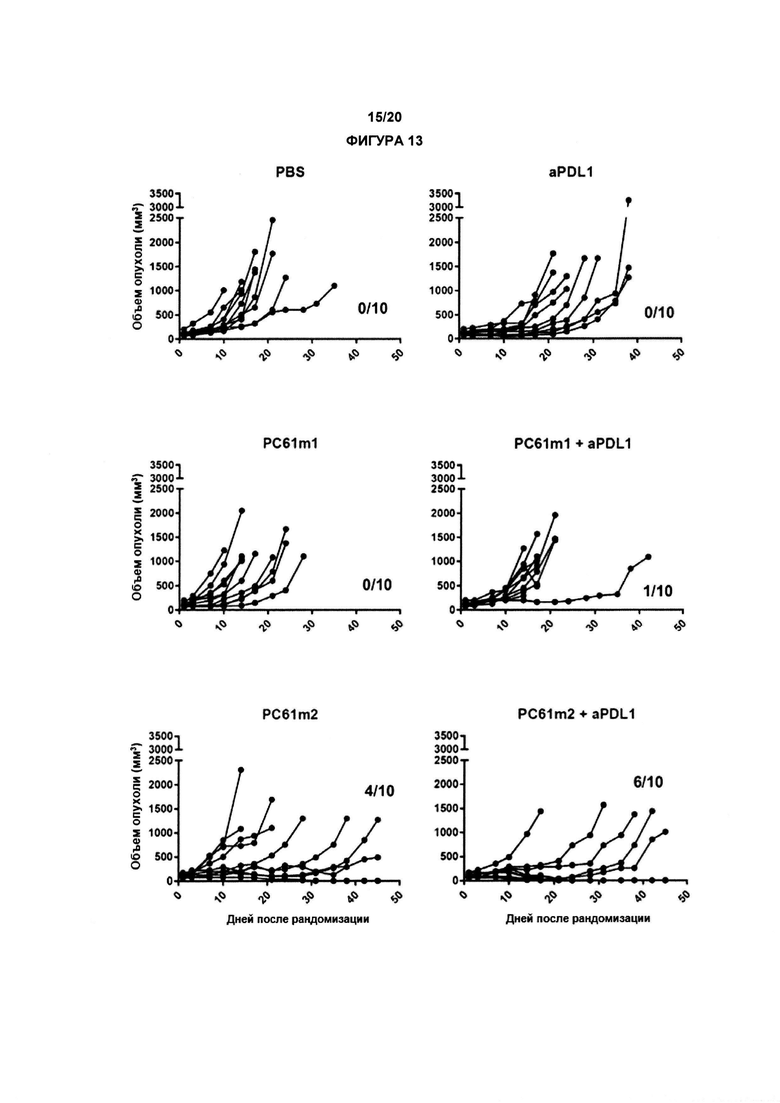
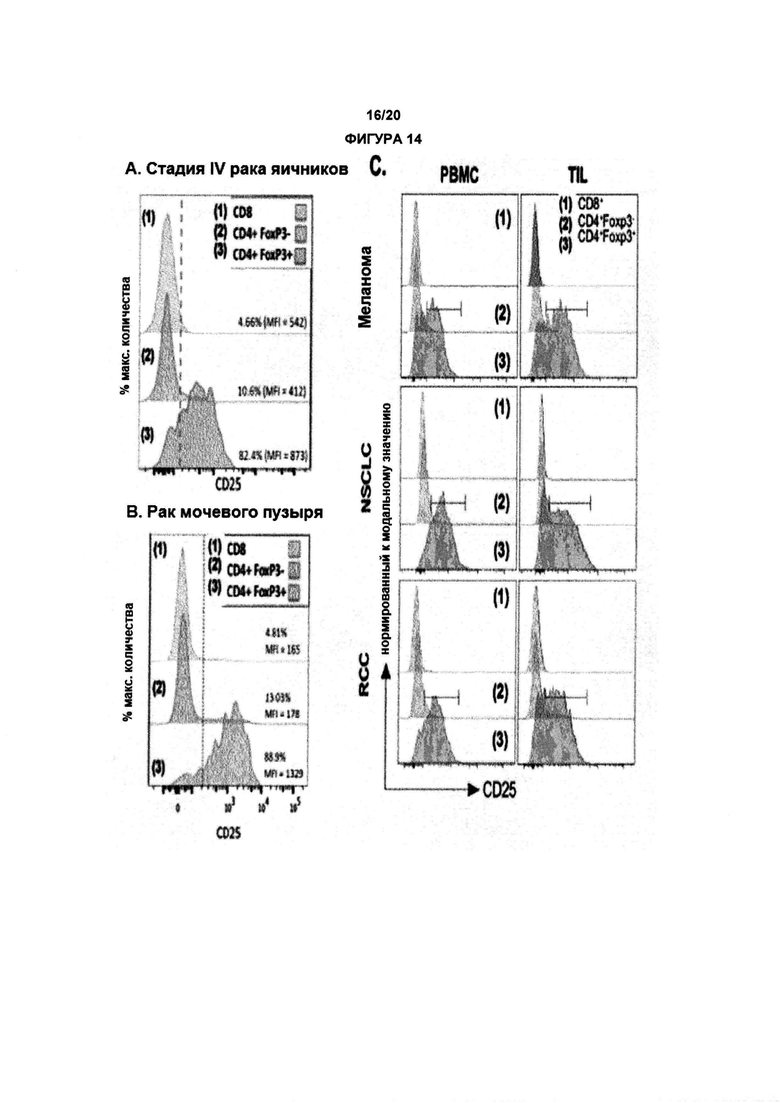
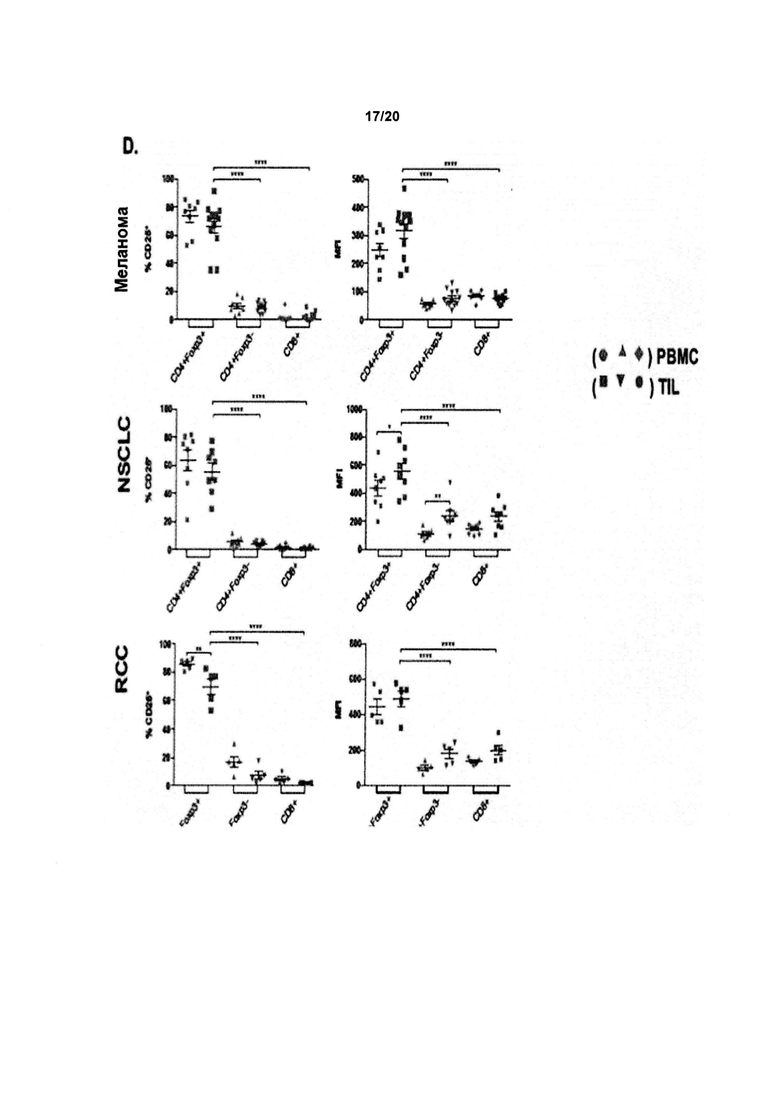
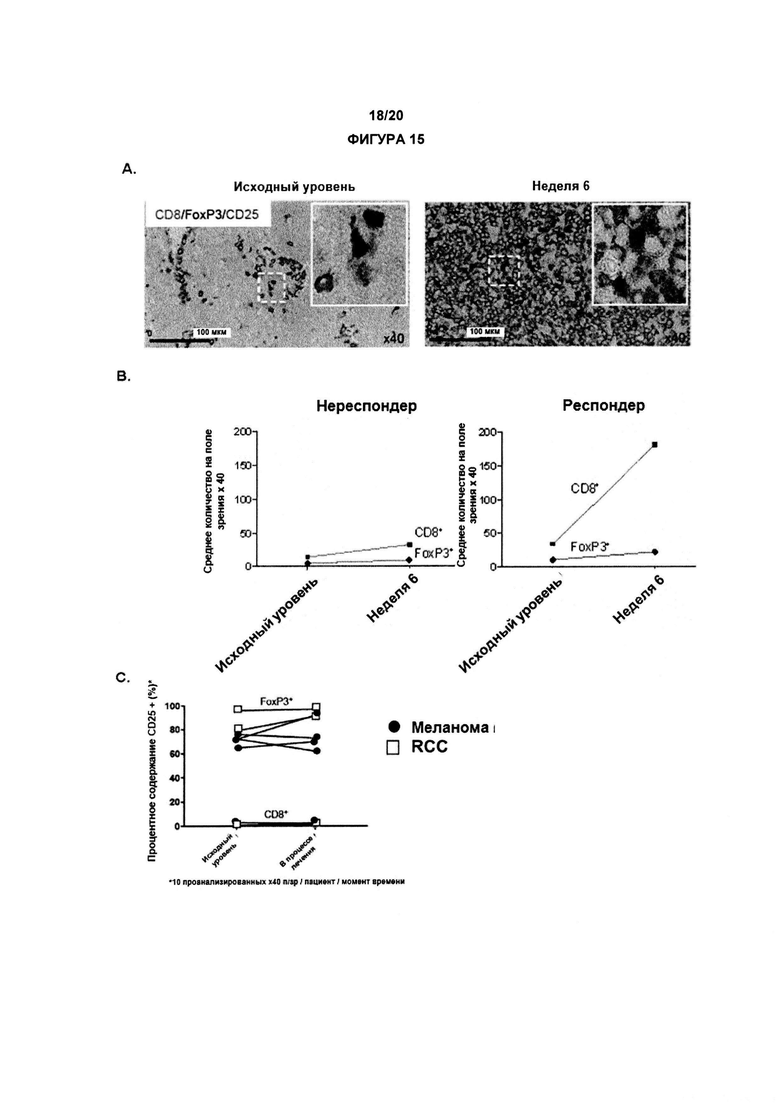
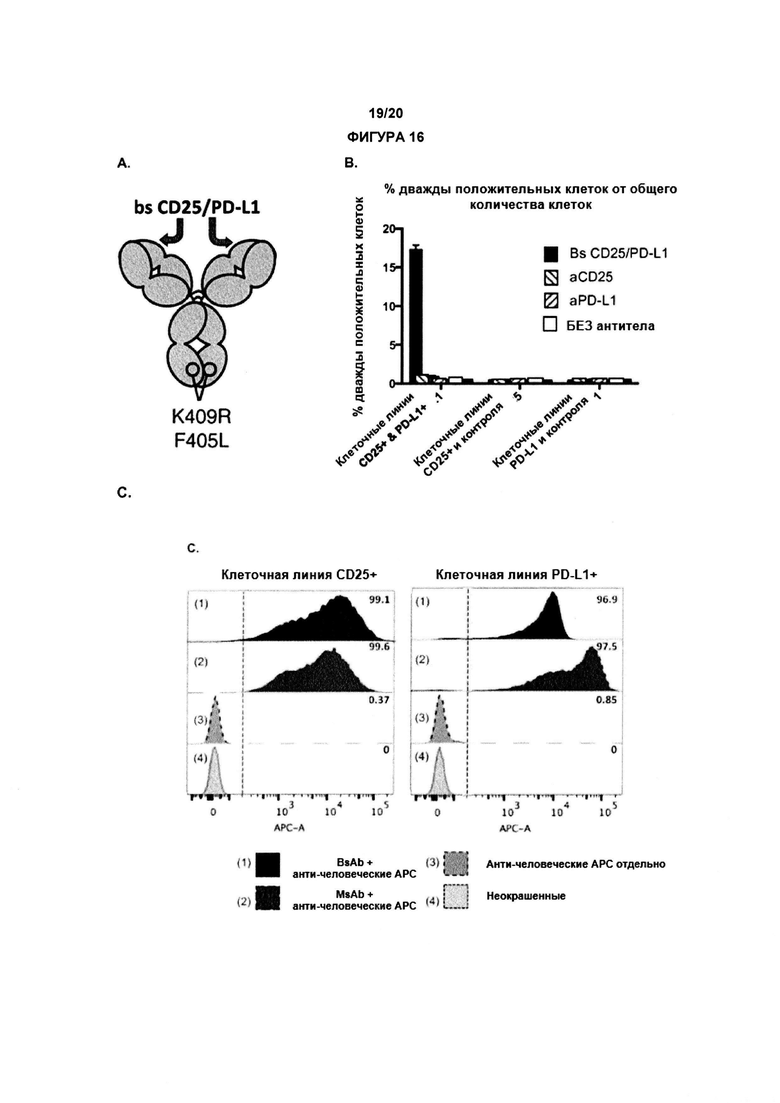
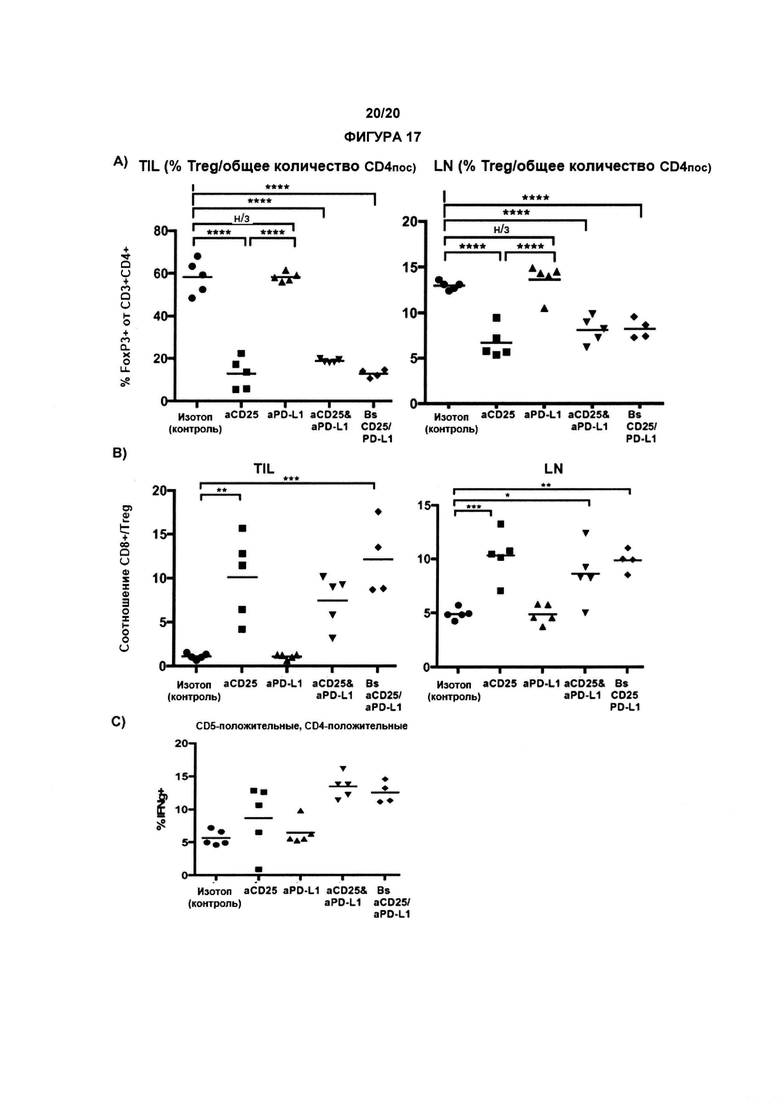
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ лечения субъекта, представляющего собой человека, имеющего рак, включающий этап введения анти-CD25 антитела субъекту и применение анти-CD25 антитела для лечения солидной опухоли у субъекта, при этом указанное анти-CD25 антитело представляет собой антитело IgG1 человека, которое связывается с высокой аффинностью с по меньшей мере одним активирующим рецептором Fcγ, выбранным из FcγRI, FcγRIIc и FcγRIIIa, и элиминирует инфильтрирующие опухоль регуляторные Т-клетки. В одном из вариантов реализации анти-CD25 антитело имеет константу диссоциации (Kd) для CD25 менее 10-8 M и/или константу диссоциации для по меньшей мере одного активирующего рецептора Fcγ менее приблизительно 10-6 M. Изобретение расширяет арсенал средств для лечения солидной опухоли у субъекта с использованием анти-CD25 антител. 2 н. и 15 з.п. ф-лы, 17 ил., 1 табл., 5 пр.
1. Способ лечения субъекта, представляющего собой человека, имеющего рак, включающий этап введения анти-CD25 антитела субъекту, где указанный субъект имеет солидную опухоль, и при этом указанное анти-CD25 антитело представляет собой антитело IgG1 человека, которое связывается с высокой аффинностью с по меньшей мере одним активирующим рецептором Fcγ, выбранным из FcγRI, FcγRIIc и FcγRIIIa, и элиминирует инфильтрирующие опухоль регуляторные Т-клетки.
2. Способ по п. 1, отличающийся тем, что указанное анти-CD25 антитело имеет константу диссоциации (Kd) для CD25 менее 10-8 M и/или константу диссоциации для по меньшей мере одного активирующего рецептора Fcγ менее приблизительно 10-6 M.
3. Способ по п. 1 или 2, отличающийся тем, что указанное анти-CD25 антитело:
(a) связывается с рецепторами Fcγ с коэффициентом активации-ингибирования (A/I), который превышает 1; и/или
(b) связывается с по меньшей мере одним из FcγRI, FcγRIIc и FcγRIIIa с более высокой аффинностью, чем оно связывается с FcγRIIb.
4. Способ по любому из пп. 1-3, отличающийся тем, что указанное анти-CD25 антитело представляет собой моноклональное антитело.
5. Способ по любому из пп. 1-4, отличающийся тем, что указанное анти-CD25 антитело представляет собой человеческое, химерное или гуманизированное антитело.
6. Способ по любому из пп. 1-5, отличающийся тем, что указанное анти-CD25 антитело вызывает усиленный CDC, ADCC и/или ADCP ответ, предпочтительно, повышенный ADCC и/или ADCP ответ, более предпочтительно, повышенный ADCC ответ.
7. Способ по любому из пп. 1-6, отличающийся тем, что указанное анти-CD25 антитело вводят субъекту, который имеет развившуюся опухоль.
8. Способ по любому из пп. 1-7, отличающийся тем, что указанный способ дополнительно включает этап идентификации субъекта, который имеет солидную опухоль.
9. Способ по любому из пп. 1-8, отличающийся тем, что указанный способ дополнительно включает введение указанному субъекту ингибитора контрольных точек иммунного ответа.
10. Способ по п. 9, отличающийся тем, что указанный ингибитор контрольных точек иммунного ответа представляет собой антагонист PD-1.
11. Способ по п. 10, отличающийся тем, что указанный антагонист PD-1 представляет собой анти-PD-1 антитело или анти-PD-L1 антитело.
12. Применение анти-CD25 антитела для лечения солидной опухоли у субъекта, представляющего собой человека,
при этом указанное анти-CD25 антитело представляет собой антитело IgG1 человека, которое связывается с высокой аффинностью с по меньшей мере одним активирующим рецептором Fcγ, выбранным из FcγRI, FcγRIIc и FcγRIIIa, и элиминирует инфильтрирующие опухоль регуляторные Т-клетки.
13. Применение по п. 12, отличающееся тем, что указанное анти-CD25 антитело имеет константу диссоциации (Kd) для CD25 менее 10-8 M и/или константу диссоциации для по меньшей мере одного активирующего рецептора Fcγ менее приблизительно 10-6 M.
14. Применение по п. 12 или 13, отличающееся тем, что указанное анти-CD25 антитело:
(a) связывается с рецепторами Fcγ с коэффициентом активации-ингибирования (A/I), который превышает 1; и/или
(b) связывается с по меньшей мере одним из FcγRI, FcγRIIc и FcγRIIIa с более высокой аффинностью, чем оно связывается с FcγRIIb.
15. Применение по любому из пп. 12-14, отличающееся тем, что указанное анти-CD25 антитело представляет собой моноклональное антитело.
16. Применение по любому из пп. 12-15, отличающееся тем, что указанное анти-CD25 антитело представляет собой человеческое, химерное или гуманизированное антитело.
17. Применение по любому из пп. 12-16, отличающееся тем, что указанное анти-CD25 антитело вызывает усиленный CDC, ADCC и/или ADCP ответ, предпочтительно, повышенный ADCC и/или ADCP ответ, более предпочтительно, повышенный ADCC ответ.
| RECH A | |||
| J., et al | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| BTUHNS P | |||
| et al | |||
| "Specificity and affinity of human Fcy receptors and their polymorphic variants for human IgG subclasses", Blood, 2009, Vol | |||
Авторы
Даты
2021-11-19—Публикация
2017-03-17—Подача