Настоящее изобретение относится к комбинации лизобактина с аминогликозидным антибиотиком для применения при лечении заболеваний, вызванных грамположительными и грамотрицательными бактериями, у животных, не относящихся к человеку. Настоящее изобретение оказалось особенно полезным в отношении лечения мастита у животных, не относящихся к человеку. В частности, настоящее изобретение относится к коровьему маститу.
Мастит является воспалением ткани вымени и продолжает оставаться наиболее частым и дорогостоящим заболеванием молочного скота. Финансовые потери от мастита происходят как на преклинической, так и на клинической стадиях заболевания. Потери, вызванные преклиническим маститом, хорошо документированы. Каждое увеличение вдвое количества соматических клеток (SCC) выше 50 000 клеток/мл приводит к потере 0,4 кг и 0,6 кг молока в день у коров первой лактации и более старых коров соответственно (Hortet P, H. Seegers. 1998. Calculated milk production losses associated with elevated somatic cell counts in dairy cows: review and critical discussion. Vet Res. 29(6):497-510). Убытки, вызванные клиническим маститом, включают забракованное молоко, временные сокращения продуктивности молока и преждевременное отбраковывание. Лечение мастита должно быть нацелено на причинные бактерии, когда это возможно.
Pyörälä S в журнале Irish Veterinary Journal, Volume 62 Supplement 40-44 2009 раскрывает следующие рекомендации по противомикробному лечению клинического мастита, вызванного различными патогенами:
Streptococcus dysgalacticae
Streptococcus uberis
Enterococci
согласно тестированию противомикробной чувствительности
коагулазонегативные стафилококки
β-лактамаза -ve
Staphylococcus aureus
коагулазонегативные стафилококки
β-лактамаза +ve
нет противомикробных препаратов
линкозамиды
Klebsiella spp.
цефалоспорины
Применяемой в недавнее время фармацевтической композицией для лечения мастита у молочных коров является Ubrolexin®, антибиотик широкого спектра действия против как грамположительных, так и грамотрицательных бактерий, вызывающих мастит. Ubrolexin® представляет собой комбинацию цефалексина и канамицина и показана для лечения клинического мастита, вызванного Staphylococcus aureus, Streptococcus dysgalacticae, Streptococcus uberis и Escherichia coli. Способом действия цефалексина, который является антибиотиком цефалоспориновой группы веществ, является необратимое связывание с D-аланинтранспептидазой, которое нарушает синтез клеточной стенки бактерий. Канамицин, который является аминогликозидным антибиотиком, действует путем присоединения к 30S субъединице связанных с мембраной рибосом и ингибирует или вмешивается в синтез бактериальных белков.
Соответственно комбинация антибиотиков, и в частности аминогликозидов с другими антибиотическими вещества известна сама по себе.
Постоянно возникающая проблема с антибиотиками в уровне техники заключается в том, что патогены могут развивать резистентность к лекарственным средствам, применяемым при лечении вызываемых ими заболеваний. Поэтому постоянно ищут новые активные фармацевтические ингредиенты. Проблема развития резистентности даже усугубляется, когда осуществляют комбинированное использование антибиотических веществ, которое не обеспечивает синергизм, а лишь направлено на разные патогены. В этих случаях патогены, которые не являются основной мишенью первого антибиотика, могут последовательно развить полную резистентность к такому первому антибиотику.
Лизобактин был впервые выделен из ферментативного бульона Lysobacter sp. SC-14076 (ATCC 53042). Независимо, ученые обнаружили катанозин А и В из почвенной бактерии, относящейся к роду Cytophaga (штамм-продуцент PBJ-5356). Катанозин B оказался идентичным лизобактину. Биосинтез бактериальной клеточной стенки является основной целью этих антибиотиков; однако механизм действия отличается от механизма действия ванкомицина. Лизобактины представляют собой циклические депсипитиды, содержащие несколько непротеиногенных D- и L-аминокислот.
Природный продукт лизобактин и некоторые производные описаны как имеющие противобактериальную активность в патенте US 4,754,018. Выделение и противобактериальная активность лизобактина также описаны в EP 196 042 A1 и JP 01-132600.
Противобактериальная активность лизобактина и катанозина A, кроме того, описана в O'Sullivan, J. et al., J. Antibiot. (1988) 41 :1740-1744, Bonner, D. P. et al., J. Antibiot. (1988) 41:1745-1751, Shoji, J. et al., J. Antibiot. (1988) 41:713-718 и Tymiak, A. A. et al., J. Org. Chem. (1989) 54:1149-1157.
В отличие от способов действия цефалексина и канамицина, лизобактин, как предполагают, непосредственно взаимодействует с липидом II предшественником клеточной стенки бактерий (Lee, W. et al, Am. Chem. Soc. (2016) 138(1):100-113 и Breukink E. and de Kruijff B., Nat. Rev. Drug Disc. (2006) 5:321-323). Производные лизобактина являются объектом заявок на патент WO 2004/099239 A1, WO 2006/042653 A1, WO 2006/042654 A1, WO 2006/042655 A1, WO 2006/048139 A1, WO 2006/048140 A1, WO 2006/048156 A1, WO 2007/085456 A1, WO 2007/118691 A1 и WO 2007/118693 A1.
Ни в одном из перечисленных документов предшествующего уровня техники не рассматривается лечение коровьего мастита с использованием лизобактина. В частности, не существует предшествующего уровня техники по комбинированному применению лизобактина с другими антибиотическими веществами для лечения мастита. В частности, лечение коровьего мастита, являющегося основной причиной коммерческих потерь в сельском хозяйстве, не имеет подходящих вариантов в данной области техники.
Хотя в международной заявке на патент № PCT/EP2016/069380 недавно было обнаружено, что использование лизобактина самого по себе удивительно является очень полезным при лечении коровьего мастита, который в основном вызван грамположительными патогенами, в частности бактериями Staphylococcus, бактериями Streptococcus, бактериями Trueperella и/или бактериями Corynebacterium, из-за его свойств разрушения резистентности, остаются вопросы относительно эффективности лизобактина как потенциального средства против грамотрицательных патогенов и потенциального синергизма с другими антибиотическими веществами.
Соответственно, в данной области техники остается потребность в лечении - в частности коровьего - мастита, которое не страдает недостатком бактериальной резистентности к активным ингредиентам и которое может синергетически воздействовать на грамположительные и грамотрицательные патогены. Задача настоящего изобретения состоит в обеспечении решения этой проблемы. Соответственно, настоящее изобретение, в частности, направлено на комбинацию лизобактина с по меньшей мере одним аминогликозидным антибиотиком для применения для лечения мастита. В частности, задачей настоящего изобретения является лечение коровьего мастита как наиболее релевантного заболевания этого типа с коммерческой точки зрения. Неожиданно было обнаружено, что лизобактин в сочетании с аминогликозидными антибиотиками синергетически приводит к расширению антибактериальных свойств в отношении как грамположительных, так и грамотрицательных патогенов, связанных с заболеваниями, вызываемыми этими патогенами у животных, не относящихся к человеку. Эффект такого синергизма особенно очевиден у самок животных, страдающих от мастита, вызванного такими патогенами, в то время как коровий мастит оказался наиболее коммерчески значимым применением описанного в настоящей заявке изобретения.
В контексте настоящего изобретения термин “лизобактин” относится к веществу с номером CAS 118374-47-3 и его физиологически приемлемым солям. Лизобактин имеет следующую структуру:
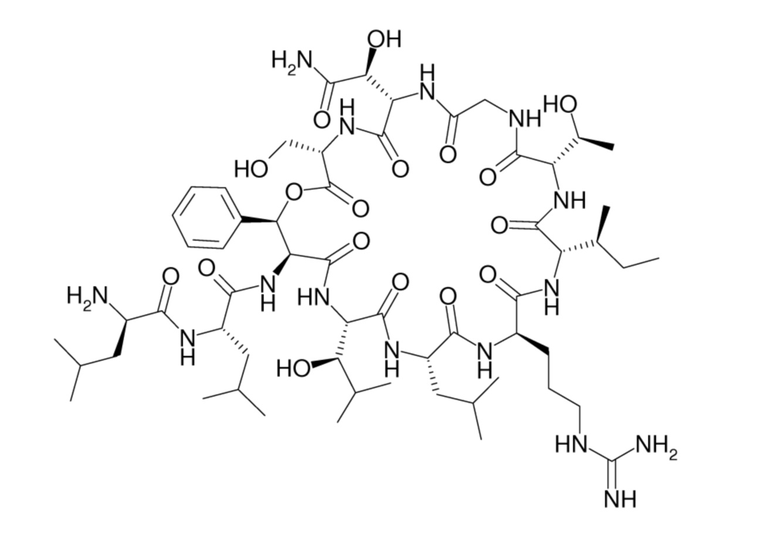
К коровьему маститу относится в частности мастит у молочного скота.
Физиологически приемлемые соли лизобактина включают кислотно-аддитивные соли минеральных кислот, карбоновых кислот и сульфоновых кислот, например, соли соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, нафталиндисульфоновой кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты и бензойной кислоты.
Физиологически приемлемые соли лизобактина также включают соли обычных оснований, такие как, например и предпочтительно, соли щелочных металлов (например, соли натрия и калия), соли щелочноземельных металлов (например, соли кальция и магния) и соли аммония, полученные из аммиака или органических аминов, имеющих от 1 до 16 атомов углерода, таких как, в качестве примера и предпочтительно этиламина, диэтиламина, триэтиламина, этилдиизопропиламина, моноэтаноламина, диэтаноламина, триэтаноламина, дициклогексиламина, диметиламиноэтанола, прокаина, дибензиламина, N-метилморфолина, аргинина, лизина, этилендиамина и N-метилпиперидина.
В контексте настоящего изобретения термин «аминогликозидный антибиотик» или «аминогликозид» относится к олигосахаридным веществам, которые состоят из циклогексан-сахарных групп и аминосахарных групп и которые функционально имеют общую функцию присоединения к субъединице 30S мембраносвязанных рибосом, чтобы тем самым вмешиваться в биосинтез белка (особенно) бактериальных клеток. Неограничивающими и неисчерпывающими членами группы аминогликозидов согласно настоящему изобретению являются те, которые выбраны из списка, состоящего из амикацина, апрамицина, фрамицетина, генетицина (G418), гентамицина, канамицина, нетилмицина, неомицина, паромомицина, сизомицина, спектиномицина, стрептомицина и тобрамицина.
Как и в случае лизобактина, «аминогликозидный антибиотик» или «аминогликозид» также охватывает его физиологически приемлемые соли. Следовательно, физиологически приемлемые соли аминогликозидов включают кислотно-аддитивные соли минеральных кислот, карбоновых кислот и сульфокислот, а также соли обычных оснований, как перечислено с лизобактином в контексте настоящего изобретения.
Лизобактин и аминогликозиды могут действовать системно и/или локально. С этой целью его можно вводить подходящим способом, таким как, например, пероральный, парентеральный, легочный, назальный, сублингвальный, лингвальный, буккальный, ректальный, интрааурикулярный, дермальный или трансдермальный путь или в виде имплантата или стента.
Лизобактин и аминогликозиды могут вводиться в формах введения, подходящих для этих путей введения.
Подходящими для перорального введения являются формы введения, которые действуют в соответствии с предшествующим уровнем техники и доставляют лизобактин и аминогликозиды быстро и/или модифицирированным образом, и которые содержат лизобактин и аминогликозиды в кристаллической и/или аморфизированной и/или растворенной форме, такие как, например, таблетки (без покрытия или покрытые таблетки, например, имеющие энтеросолюбильные покрытия или покрытия, которые нерастворимы или растворяются с задержкой и контролируют высвобождение лизобактин), таблетки, которые быстро распадаются во рту, или пленки/пластины, пленки/лиофилизаты, капсулы (например, твердые или мягкие желатиновые капсулы), таблетки с сахарным покрытием, гранулы, пеллеты, порошки, эмульсии, суспензии, аэрозоли или растворы.
Парентеральное введение может происходить с предотвращением стадии абсорбции (например, интрамаммарной, внутривенной, внутриартериальной, внутрисердечной, интраспинальной или интралюмбарной) или с включением абсорбции (например, внутримышечной, подкожной, внутрикожной, чрескожной или внутрибрюшинной). Формы введения, подходящие для парентерального введения, включают, среди прочего, препараты для инъекций и инфузии в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков.
Подходящими для других путей введения являются, например, фармацевтические формы для водных суспензий (лосьоны, встряхиваемые смеси), липофильные суспензии, мази, кремы, трансдермальные терапевтические системы (такие как, например, пластыри), молоко, пасты, пены, опудривающие порошки, импланты или стенты.
Лизобактин и аминогликозиды могут быть преобразован в указанные формы введения. Это может происходить по существу известным способом путем смешивания с инертными, нетоксичными, фармацевтически приемлемыми эксципиентами. Эти эксципиенты включают, среди прочего, носители (например, микрокристаллическую целлюлозу, лактозу, маннит), растворители (например, жидкие полиэтиленгликоли), эмульгаторы и диспергирующие средства или смачивающие агенты (например, додецилсульфат натрия, полиоксисорбитан олеат), связующие вещества (например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (например, антиоксиданты, такие как, например, аскорбиновая кислота), красители (например, неорганические пигменты, такие как, например, оксиды железа) и маскирующие ароматизаторы и/или ароматные вещества.
Настоящее изобретение далее описано со ссылкой на следующие объекты настоящего изобретения и варианты выполнения настоящего изобретения. Их можно свободно комбинировать, если из контекста ясно не следует иное.
Один вариант выполнения настоящего изобретения касается комбинации лизобактина с по меньшей мере одним аминогликозидным антибиотиком для применения для лечения мастита, где лизобактин и по меньшей мере один аминогликозидный антибиотик вводят интрамаммарно. Предпочтительно аминогликозидный антибиотик представляет собой неомицин или канамицин. Более предпочтительно маститом является коровий мастит.
Другой вариант выполнения настоящего изобретения касается комбинации лизобактина с по меньшей мере одним аминогликозидным антибиотиком для применения для лечения мастита, где маститом является клинически подтвержденный мастит. Предпочтительно аминогликозидный антибиотик представляет собой неомицин или канамицин. Более предпочтительно маститом является коровий мастит.
Другой вариант выполнения настоящего изобретения касается комбинации лизобактина с по меньшей мере одним аминогликозидным антибиотиком для применения для лечения мастита, где маститом является субклинический коровий мастит. Предпочтительно аминогликозидный антибиотик представляет собой неомицин или канамицин. Более предпочтительно маститом является коровий мастит.
Другой вариант выполнения настоящего изобретения касается комбинации лизобактина с аминогликозидным антибиотиком для применения для лечения мастита, в котором лизобактин обеспечивают при дозе от 25 до 1000 мг на четверть вымени, предпочтительно при дозе от 50 до 500 мг на четверть вымени и более предпочтительно при дозе от 100 до 300 мг на четверть вымени. Наиболее предпочтительно маститом является коровий мастит.
В предпочтительном варианте выполнения этого варианта выполнения настоящего изобретения комбинацию лизобактина получают с неомицином или канамицином, предпочтительно с неомицином.
При необходимости также может потребоваться отклонение от указанных количеств; в частности, в зависимости от массы тела, пути введения, индивидуального ответа на активный ингредиент, природы препарата и времени или промежутка времени, в течение которого происходит введение. Таким образом, в некоторых случаях может быть достаточным количество меньшее чем вышеуказанное минимальное количество, тогда как в других случаях вышеуказанный верхний предел должен быть превышен. В случае введения более больших количеств целесообразно разделить их на несколько отдельных доз в течение дня.
В зависимости от фактического аминогликозидного антибиотика, фактически используемого в соответствии с настоящим изобретением, указанные выше его дозы могут варьироваться и, таким образом, его соотношение с лизобактином.
Достигнуты очень положительные результаты как для грамотрицательных, так и для грамположительных патогенов, и поэтому предпочтительно, чтобы соотношение лизобактина и аминогликозидного антибиотика составляло по меньшей мере 0.1. Соотношение, равное по меньшей мере 0.2, обеспечивает даже более хорошие результаты, тогда как более предпочтительным является соотношение, равное по меньшей мере 1:1, и даже более предпочтительным является соотношение, равное по меньшей мере 2:1. Наиболее предпочтительное соотношение составляет по меньшей мере 4:1.
Другой вариант выполнения настоящего изобретения касается комбинации лизобактина с по меньшей мере одним аминогликозидным антибиотиком для применения для лечения мастита, где мастит вызван грамположительными и грамотрицательными бактериями. Предпочтительно маститом является коровий мастит.
Более предпочтительно настоящее изобретение касается комбинации лизобактина с по меньшей мере одним аминогликозидным антибиотиком для применения для лечения коровьего мастита, где коровий мастит вызван бактериями Staphylococcus, бактериями Streptococcus, бактериями Trueperella, бактериями Corynebacterium и/или бактериями Escherichia.
В частности, коровий мастит вызван Staphylococcus aureus, коагулазонегативными стафилококками, Streptococcus uberis, Streptococcus dysgalacticae Streptococcus agalacticae и/или бактериями E. coli.
Кроме того, коровий мастит может быть вызван Trueperella pyogenes и/или E. coli. Также коровий мастит может быть вызван Corynebacterium bovis и/или E. coli. Staphylococcus aureus, коагулазонегативные стафилококки, Streptococcus uberis, Streptococcus dysgalacticae Streptococcus agalacticae, Trueperella pyogenes, и Corynebacterium bovis являются наиболее распространенными патогенами, обнаруживаемыми в случаях коровьего мастита, тогда как суперинфекция с Escherichia является такой же распространенной, и было установлено, что они в целом особенно восприимчивы к лечению комбинацией лизобактина с по меньшей мере одним аминогликозидным антибиотиком согласно настоящему изобретению. Мастит также может стать клинически значимым только благодаря наличию бактерий Escherichia.
Другим объектом настоящего изобретения является фармацевтическая композиция в препаративной форме для интрамаммарного введения в молочные железы, где композиция содержит лизобактин и по меньшей мере один аминогликозидный антибиотик. Предпочтительно композиция составлена для введения в коровьи молочные железы. Более предпочтительно, композиция дополнительно содержит фармацевтически приемлемый эксципиент и в частности фармацевтически приемлемый носитель.
Эти эксципиенты включают, среди прочего, носители (например, микрокристаллическую целлюлозу, лактозу, маннит), растворители (например, жидкие полиэтиленгликоли), эмульгаторы и диспергирующие средства или смачивающие агенты (например, додецилсульфат натрия, полиоксисорбитан олеат), связующие вещества (например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (например, антиоксиданты, такие как, например, аскорбиновая кислота), красители (например, неорганические пигменты, такие как, например, оксиды железа) и маскирующие ароматизаторы и/или ароматные вещества.
Другим объектом настоящего изобретения является применение лизобактина и по меньшей мере одного аминогликозидного антибиотика для получения фармацевтических средств для лечения мастита. Применение для получения фармацевтических средств для лечения коровьего мастита является предпочтительным.
В одном варианте выполнения настоящего изобретения коровий мастит является клинически выраженным коровьим маститом.
В другом варианте выполнения настоящего изобретения коровий мастит является преклинический коровий мастит.
В другом варианте выполнения настоящего изобретения коровий мастит вызван бактериями Staphylococcus, бактериями Streptococcus, бактериями Trueperella bacteria, бактериями Corynebacterium и/или бактериями Escherichia.
В частности, коровий мастит может быть вызван Staphylococcus aureus, коагулазонегативными стафилококками, Streptococcus uberis, Streptococcus dysgalacticae, Streptococcus agalacticae, и/или бактериями E. coli.
Кроме того, коровий мастит может быть вызван Trueperella pyogenes и/или E.coli. Также, коровий мастит может быть вызван Corynebacterium bovis и/или E.coli.
Настоящее изобретение также относится к способу лечения мастита, причем способ включает стадию введения самке животного, не относящегося к человеку, имеющей вымя и нуждающейся в этом, терапевтически эффективного количества лизобактина и по меньшей мере одного аминогликозидного антибиотика. Предпочтительно самкой животного, не относящегося к человеку, имеющей вымя, является корова.
Наконец, даже несмотря на то, что основные аспекты настоящего изобретения направлены на лечение - в частности коровьего - мастита по причинам коммерческой применимости, синергизм, неожиданно обнаруженный в настоящем изобретении, как обнаружено, не может быть ограничен этим конкретным лечением - в частности коровьего - вымени. Представленные в настоящей заявке экспериментальные данные показывают, что вышеупомянутый синергизм относится к любому лечению животных, не относящихся к человеку, страдающих от любого заболевания, вызванного грамотрицательными и грамположительными бактериями.
Поэтому всеобъемлющий вариант выполнения настоящего изобретения, в общем, касается комбинации лизобактина и по меньшей мере одного аминогликозидного антибиотика для применения для лечения млекопитающего животного, не относящегося к человеку, от заболевания, вызванного грамотрицательными и грамположительными бактериями.
Примеры:
Настоящее изобретение будет дополнительно разъяснено со ссылкой на следующие примеры и чертежи, без ограничения ими.
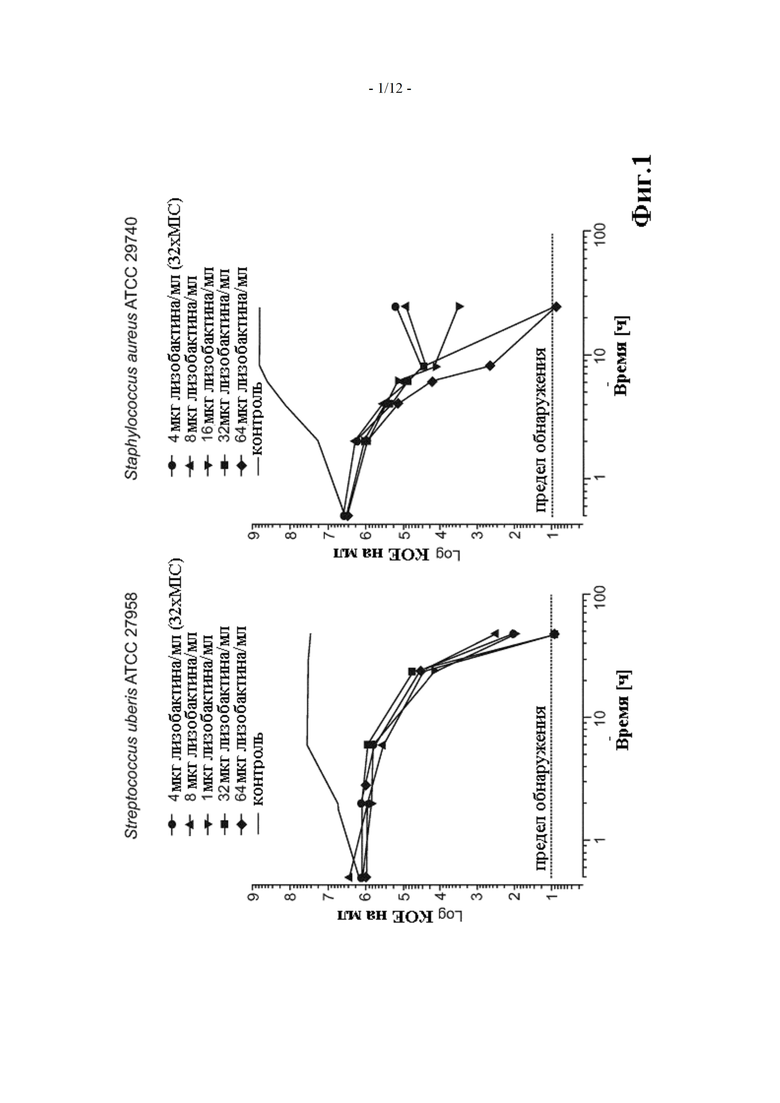
Фиг. 1 показывает кинетика уничтожения лизобактином в отношении Staphylococcus aureus и Streptococcus uberis (пример 2)
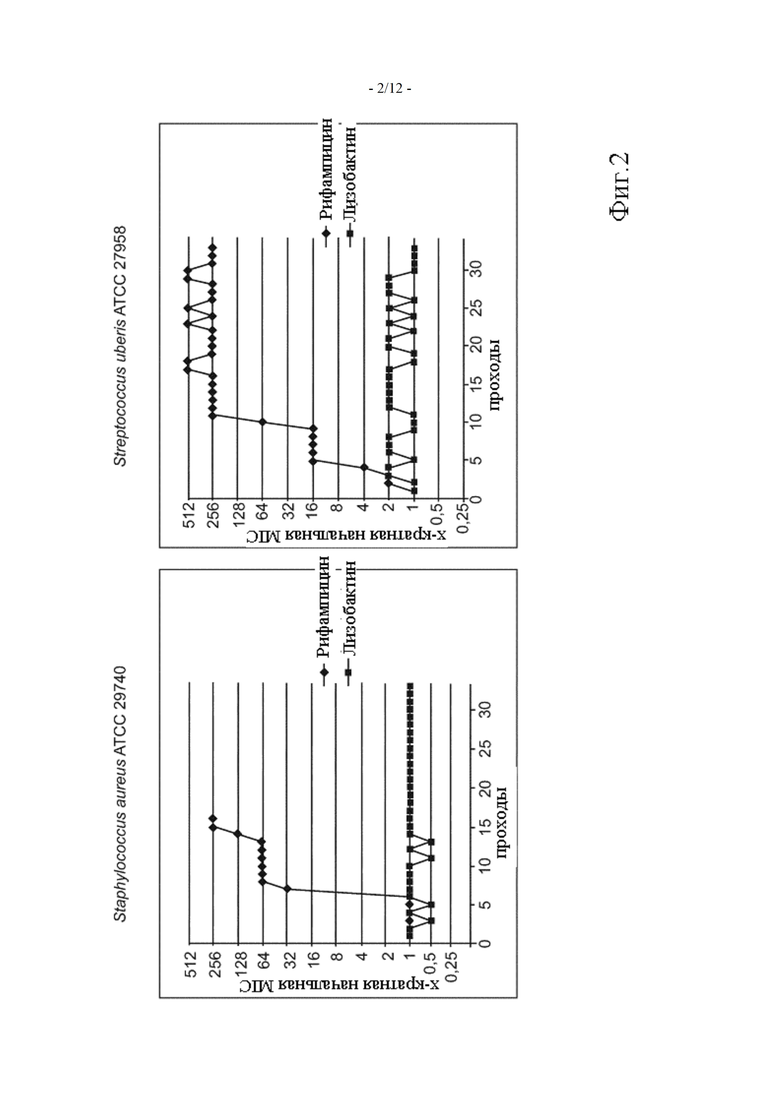
Фиг. 2 показывает изменения MIC лизобактина в отношении Staphylococcus aureus и Streptococcus uberis в ходе серийного пассирования (пример 4)
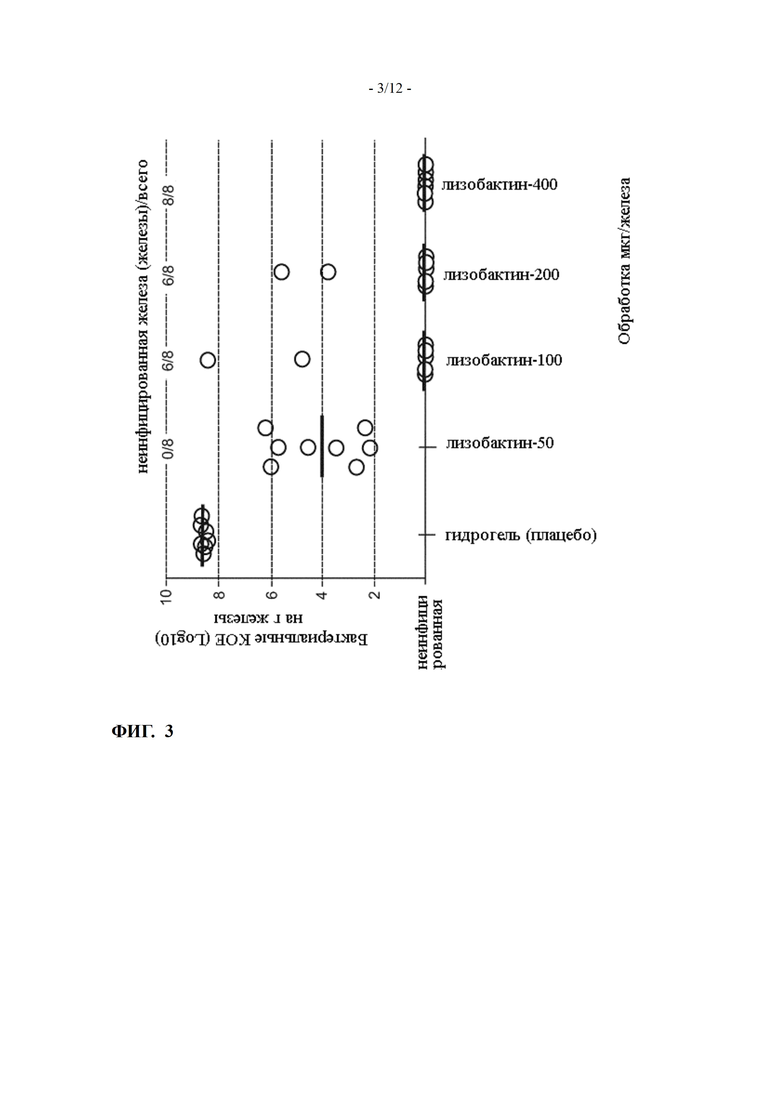
Фиг. 3 показывает эффективность лизобактина на мышиной модели острого мастита, вызванной Staphylococcus aureus (пример 5)
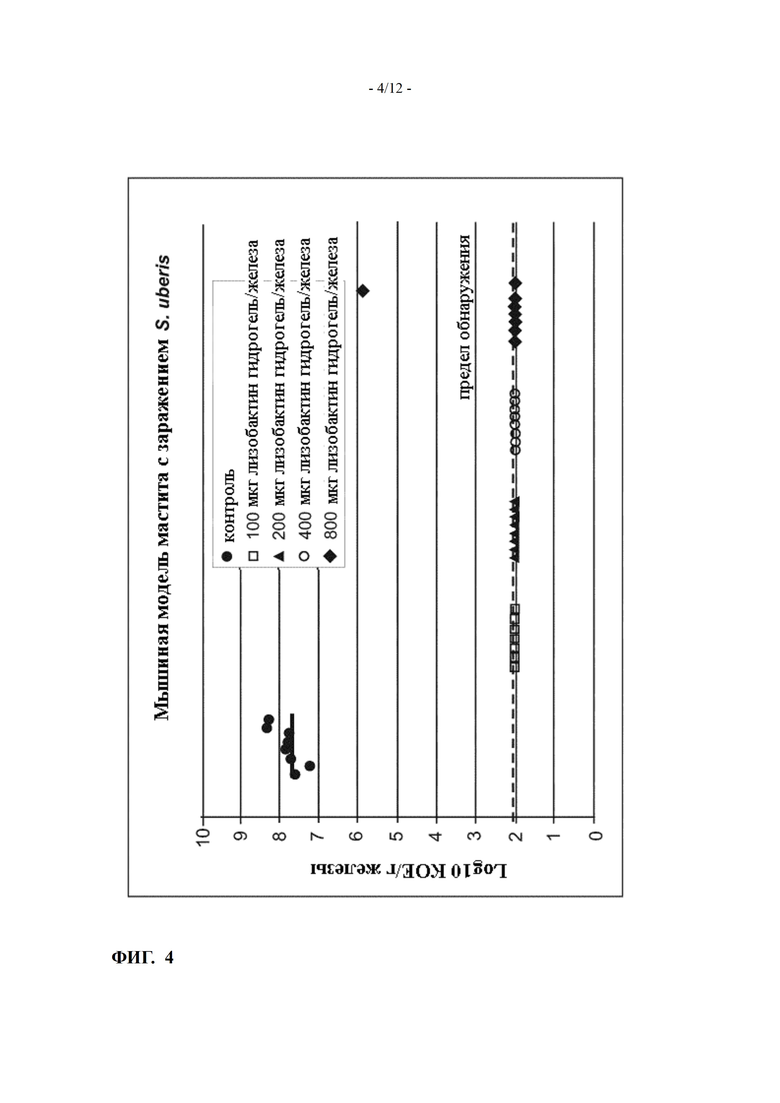
Фиг. 4 показывает эффективность лизобактина на мышиной модели острого мастита, вызванной Streptococcus uberis (пример 6)
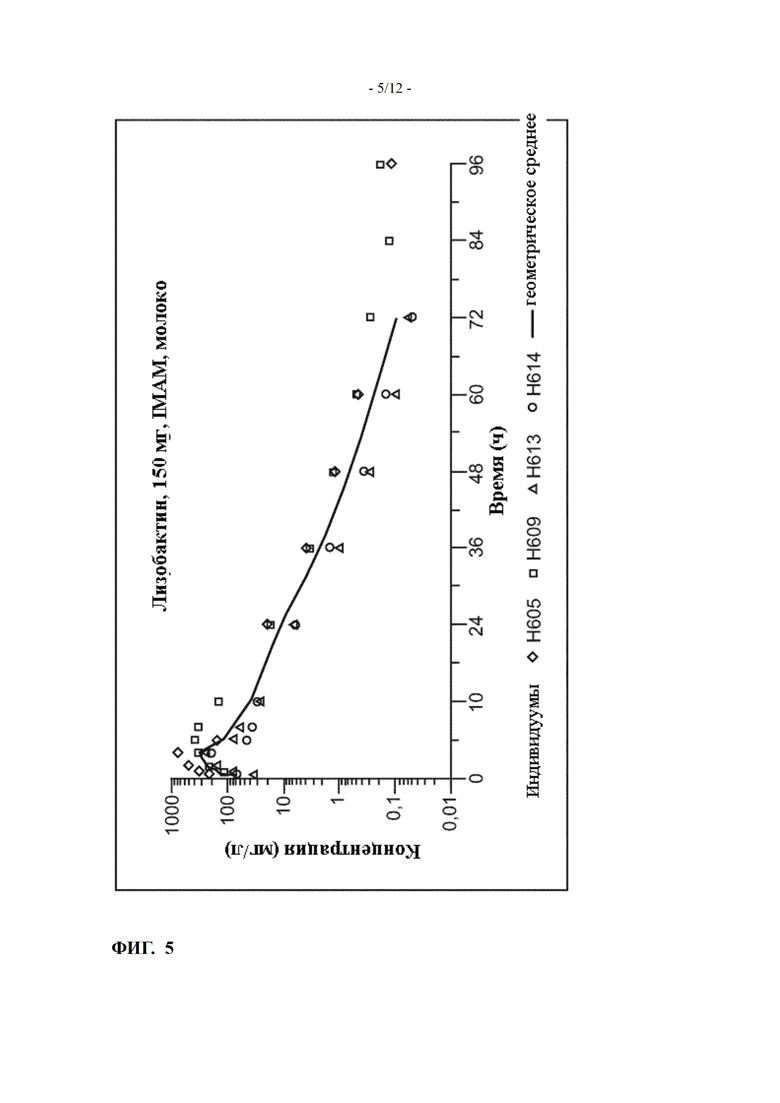
Фиг. 5 показывает профиль зависимости концентрации от времени лизобактина в молоке после интрамаммарного (IMAM) применения на кормящих голштинских коровах (пример 7)
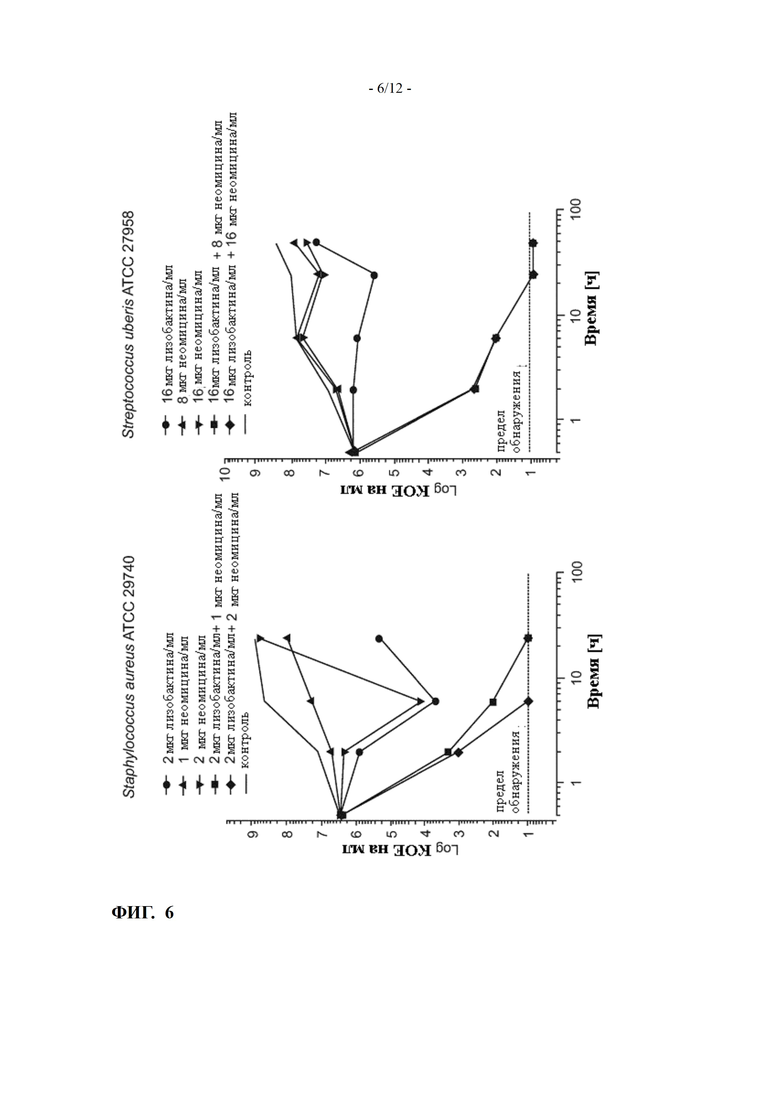
ФИГ. 6 показывает кинетику уничтожения в молоке лизобактина и неомицина, самих по себе или в комбинации при соотношениях доз 1:1 и 2:1, против Staphylococcus aureus и Streptococcus uberis (пример 10)
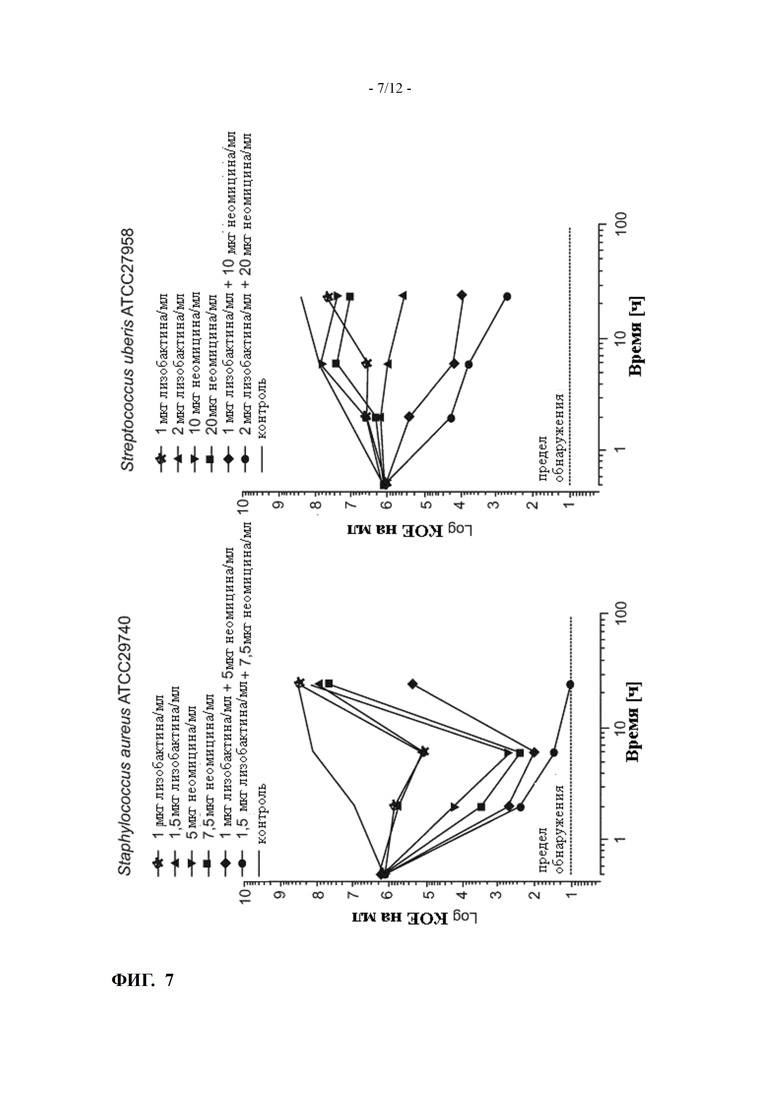
ФИГ. 7 показывает кинетику уничтожения в молоке лизобактина и неомицина, самих по себе или в комбинации при соотношениях доз 1:5 и 1:10, против Staphylococcus aureus и Streptococcus uberis (пример 10)
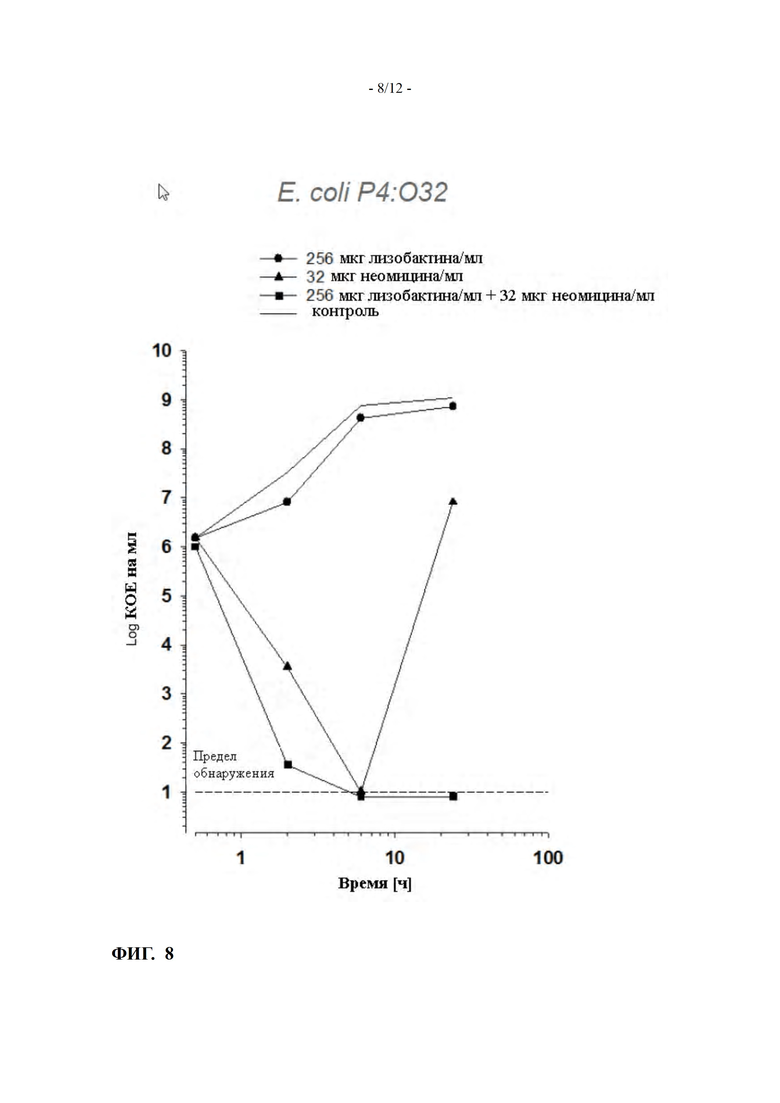
ФИГ. 8 показывает кинетику уничтожения в молоке лизобактина и неомицина, либо самих по себе, либо в комбинации, против E. coli (пример 10)
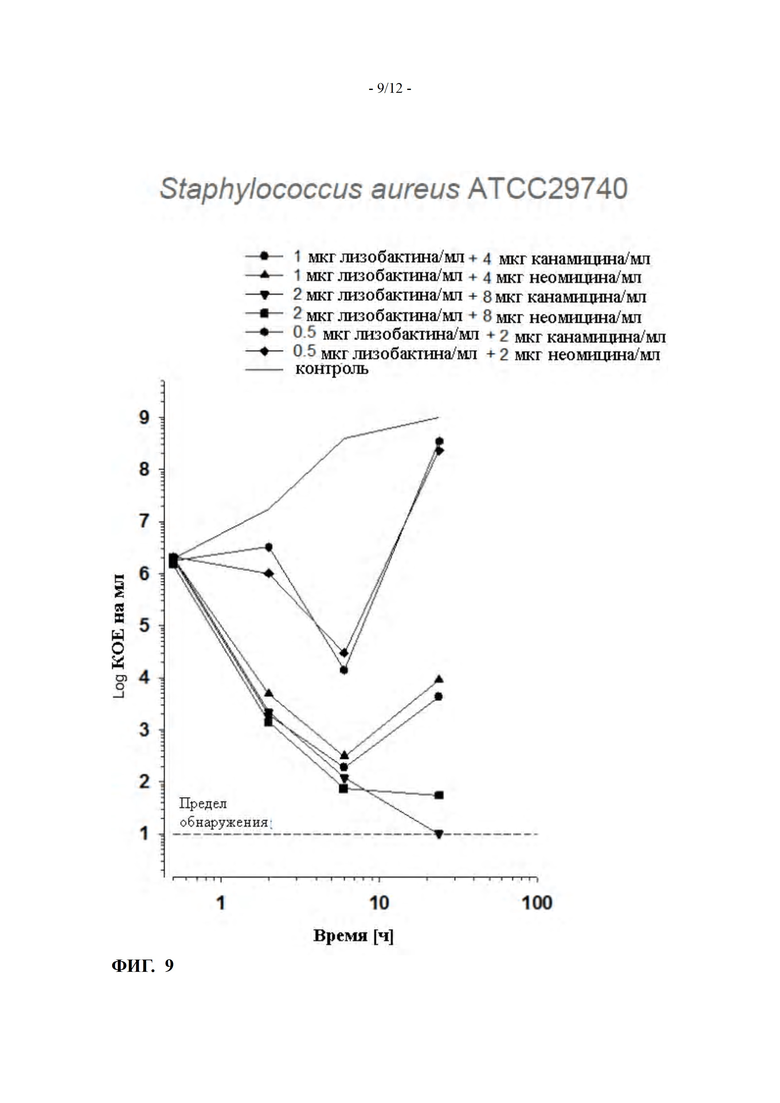
ФИГ. 9 показывает кинетику уничтожения комбинаций лизобактина, либо с неомицином, либо с канамицином, против Staphylococcus aureus (пример 11)
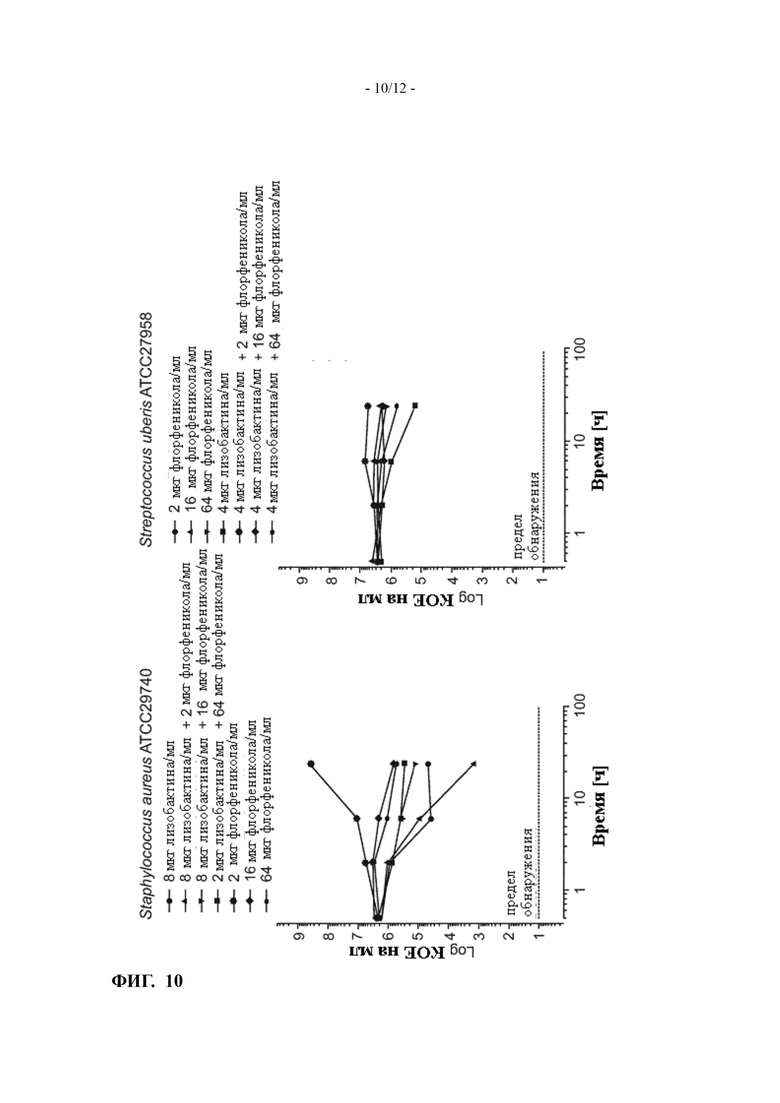
ФИГ. 10 показывает кинетику уничтожения комбинаций лизобактина с флорфениколом для Staphylococcus aureus и Streptococcus uberis (пример 12)
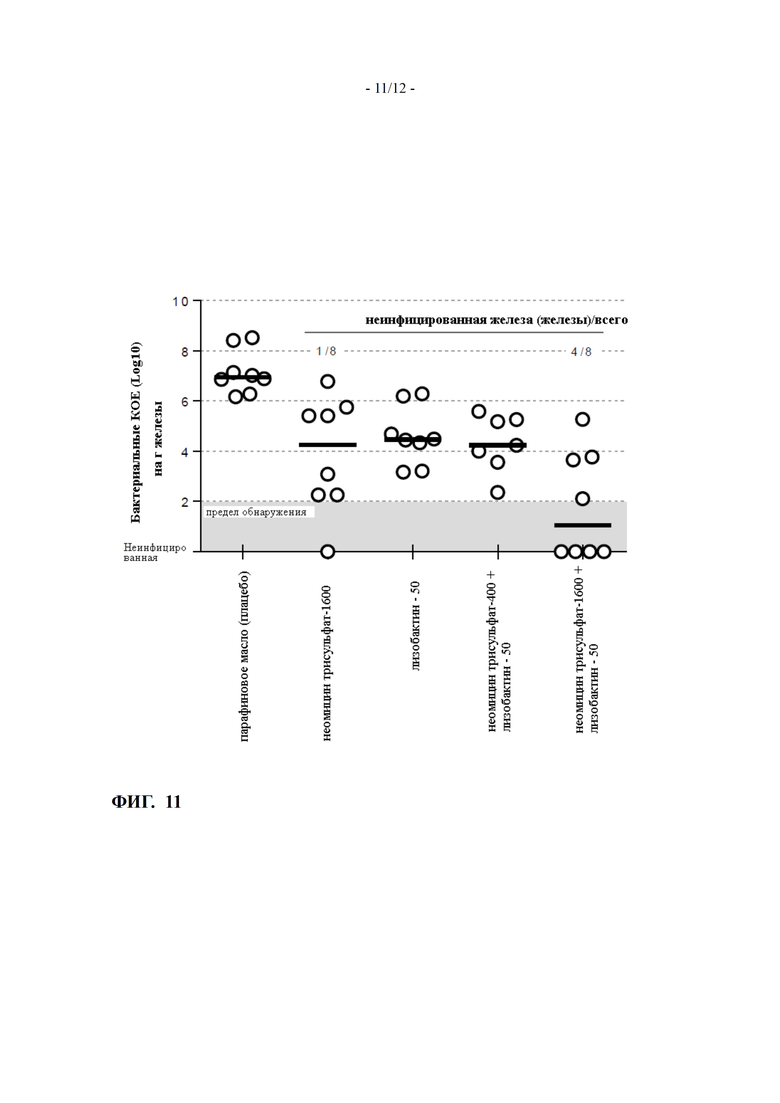
ФИГ. 11 показывает эффективность лизобактина и неомицина, либо в комбинации, либо самих по себе, на Staphylococcus aureus точной модели мышиного мастита (пример 13)
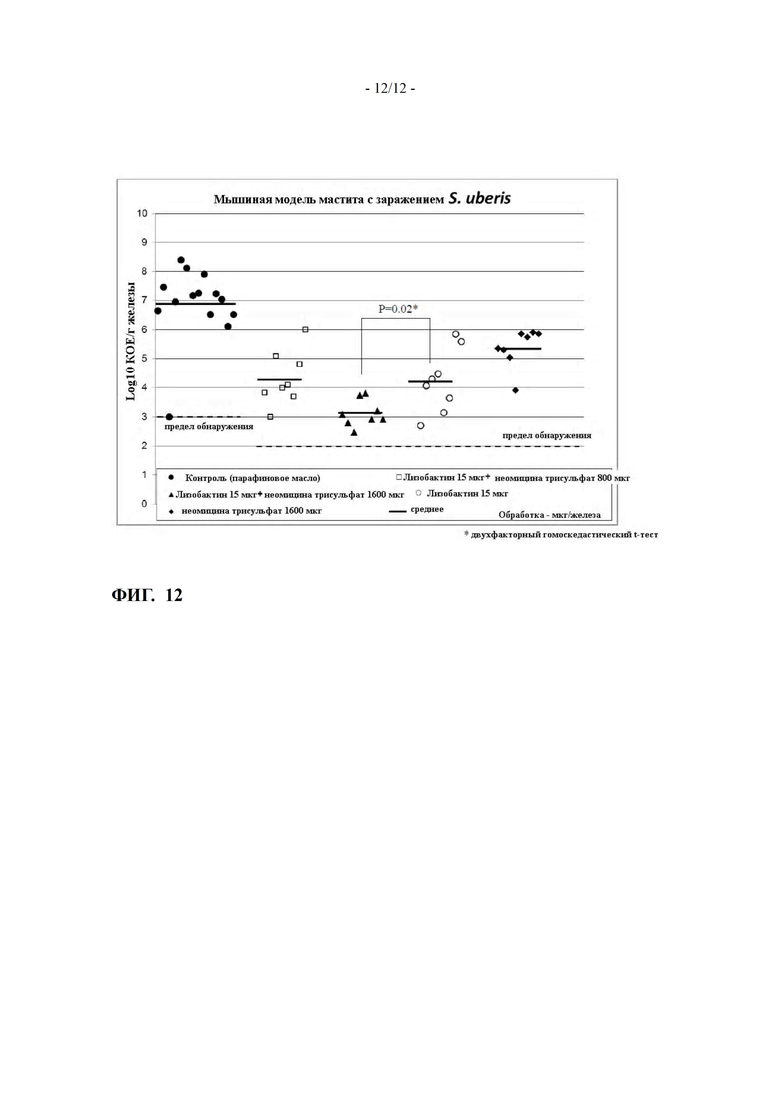
ФИГ. 12 показывает эффективность лизобактина и неомицина, либо в комбинации, либо самих по себе, на Streptococcus uberis точной модели мышиного мастита (пример 14)
Пример 1: In vitro противобактериальная активность лизобактина самого по себе против патогенов, вызывающих мастит
in vitro противобактериальная активность лизобактина против распространенных патогенов, вызывающих мастит, таких как Staphylococcus aureus, коагулазонегативные стафилококки, Streptococcus uberis, Streptococcus dysgalactiae, Streptococcus agalactiae, Trueperella pyogenes, Escherichia coli, или Klebsiella pneumoniae оценивали методом микроразведений в бульоне MIC, как описано Институтом клинических и лабораторных стандартов (CLSI), чтобы получить минимальную подавляющую концентрацию (MIC), которая определяется как самая низкая концентрация вещества, которая предотвращает видимый рост бактерии. Результаты, выраженные как MIC90, суммированы в следующей таблице, где MIC90 определяется как концентрация, при которой ингибируется рост по меньшей мере 90% штаммов данного вида.
Пример 2: In vitro кинетика уничтожения патогенов, вызывающих мастит, лизобактина самого по себе
Чтобы оценить способность лизобактина уничтожать бактерии в молоке, колбы, содержащие разные концентрации лизобактина, в покупном полножирном молоке инокулировали 1-2×106 колониеобразующих единиц/мл типичного штамма либо Staphyloccus aureus, либо Streptococcus uberis. Колбы инкубировали в течение 24-48 часов на встряхивающей водяной бане при температуре 35 +/- 2°C, и количества жизнеспособных бактерий в каждой колбе определяли в нескольких временных точках путем разбавления и нанесения покрытия на агаровые пластины. Сокращение числа жизнеспособных бактерий в исходном инокуляте по меньшей мере на 99,9% определяется как бактерицидная активность.
Кинетика уничтожения лизобактина против Staphylococcus aureus ATCC 29740 и Streptococcus uberis ATCC 27958 в молоке определялась для концентраций лизобактина 4, 8, 16, 32 и 64 мкг/мл. Результаты показаны на Фиг. 1 (КОЕ: колониеобразующие единицы). Летальный эффект через 24 ч и 48 ч, соответственно, может быть постулирован для S. aureus и S. uberis.
Пример 3: In vitro оценка развития спонтанной резистентности против лизобактина самого по себе:
Частоту развития спонтанной резистентности оценивали путем нанесения по меньшей мере 1×109 колониеобразующих единиц соответствующего бактериального штамма на агаровые пластины, содержащие лизобактин, при либо 4х, либо 8х MIC, и инкубации пластин при 35 +/- 2°С. Через 48 ч количество колоний, которые выросли на пластинах при концентрации лизобактина выше MIC, было поделено на количество бактерий, которые изначально были нанесены. Полученное число определяется как частота спонтанной резистентности и является показателем вероятности появления резистентных изолятов во время инфекции.
В заключении, лизобактин при 4- и 8-кратной MIC проявляет очень хороший профиль резистетности: резистентные изоляты не были обнаружены. Результаты приведены в следующих таблицах:
Staphylococcus aureus ATCC 29740:
Streptococcus uberis ATCC 27958:
Пример 4: In vitro оценка развития резистентности против лизобактина самого по себе в ходе серийного пассирования
Появление изменений MIC в ходе постоянного воздействия бактерий на суб-MIC концентрации лизобактина оценивали с помощью экспериментов серийного пассирования. В первый день концентрации MIC S. aureus и S. uberis оценивали методом микроразведений в бульоне MIC, как описано Институтом клинических и лабораторных стандартов (CLSI). Каждый день в течение следующих 33 последовательных дней бактерии из лунки, содержащей самые высокие концентрации, обеспечивающие полное развитие, собирали и использовали для инокуляции новых 96-луночных планшетов и для оценки MIC при постоянном воздействии лизобактина. MIC, полученную в каждый день, нанесли на график зависимости от времени. Результаты показаны на Фиг. 2. Рифампицин, который, как известно, приводит к быстрым изменениям MIC, использовался в качестве положительного контроля.
Результаты показывают очень хороший профиль лизобактина в отношении развития резистентности при постоянном воздействии, поскольку концентрации MIC для S. aureus и S. uberis остаются постоянными в течение 33 дней.
Пример 5: Эффективность лизобактина самого по себе на мышиной модели острого мастита, вызванного S. aureus
Эффективность лизобактина (полученного в форме гидрогеля при рН 4,7) была протестирована на мышиной модели острого мастита, вызванного Staphylococcus aureus, созданной в Университете Шербрука, Канада (Brouillette et al, Vet. Microbiol. (2004) 4:253-262), который включен в настоящую заявку посредством ссылки. Обе абдоминальные молочные железы (L4 и R4) кормящих CD-1 мышей были интрамаммарно инфицированы 100 КОЕ (колониеобразующими единицами) S. aureus. Мышей обрабатывали интрамаммарно лизобактином через четыре часа после заражения. Каждая группа лечения содержала по меньшей мере 3 мыши (6 четвертей), через 14 часов (через 18 часов после инокуляции) мышей умерщвляли, молочные железы собирали, и оценивали содержание КОЕ путем нанесения 10-кратных серийных разведений гомогенатов молочной железы. Количество КОЕ было выражено как log10. Предел обнаружения составлял 200 КОЕ/г железа. Железы с менее чем 200 КОЕ/г считались очищенными. Результаты показаны на Фиг. 3.
Интрамаммарное введение 50 мкг лизобактина уменьшает среднее содержание КОЕ на около 4 log10, 400 мкг лизобактина устраняет инфекцию от всех инфицированных железах.
Пример 6: Эффективность лизобактина самого по себе на мышиной модели острого мастита, вызванного S. uberis
Эффективность лизобактина (получен в форме гидрогеля при pH 4.7) протестировали на мышиной модели мастита, вызванного Streptococcus uberis. Результаты показаны на Фиг. 4.
Двадцать кормящих мышей были экспериментально инфицированы в четверть пары молочных желез посредством S. uberis примерно через 12-15 дней после рождения потомства. Через четыре часа после инокуляции группы из четырех мышей обрабатывали на тех же железах лизобактином при 100, 200, 400 или 800 мкг/железа, полученном в виде гидрогеля. Пятая группа была обработана исключительно с помощью гидрогелевого носителя в качестве отрицательного контроля. Через 18 часов после заражения животных подвергали эвтаназии, железы удаляли, гомогенизировали, и колониеобразующие единицы (КОЕ) определяли установленными микробиологическими методами. Затем рассчитывали КОЕ /мл гомогената, а также КОЕ/г железы. Предел обнаружения составлял около 100 КОЕ/г железы. Противомикробную активность лизобактина против Strep uberis определяли путем сравнения средних КОЕ/железа групп различного дозирования и группы отрицательного контроля.
Железы всех животных контрольной группы показали оптимальную зараженность (≥107 КОЕ/г железы) через 18 часов после заражения. За одним исключением в группе самой высокой дозы все железы в группах, получавших лизобактин, имели количество бактерий ниже предела обнаружения (102 КОЕ/г). Можно сделать вывод, что лизобактин, полученный в форме гидрогеля, обладает выдающейся противобактериальной эффективностью против S. uberis при интрамаммарно вводимых дозах от 100 до 800 мкг/железа.
Пример 7: in vivo данные для лизобактина самого по себе для крупного рогатого скота - исследование фармакокинетики в молоке на кормящих голштинских коровах
Исследование было разработано как неосновное исследование, подходящее для исследования фармакокинетики в молоке активного вещества лизобактин после однократного интрацистернального введения кормящим молочным коровам.
Активное вещество было получено в виде рабочей композиции на основе парафина, подходящей для интрацистернального применения, содержащей 150 мг лизобактина B в 10 г масляной суспензии.
Испытуемый образец вводили как однократное интрацистернальное лечение при дозе 150 мг лизобактина в одну заднюю четверть каждой из четырех кормящих молочных коров.
Молочные коровы в исследовании (голштинские коровы) представляли целевую популяцию по возрасту, количеству лактации, стадии лактации, производительности молока и породе. Животных помещали в коровник и кормили стандартным кормом для молочных коров, состоящим из силоса из кукурузы и корма для производительности молока. Доение было два раза в день с интервалом в 12 часов, используя ковшеобразное доильное устройство.
Частый отбор молока проводили из обработанной и соответственно контрольных четвертей до (0 ч) и после периода 168 ч после обработки (0,5, 1, 2, 4, 6, 8, 12, 24, 36, 48, 60, 72, 84, 96, 120, 144 и 168 часов) путем ручного выдаивания соответствующих четвертей вымени. Образцы молока в обычное время доения были собраны до начала доения.
Концентрации активного вещества лизобактина в молоке анализировали посредством ВЭЖХ при обнаружении посредством тандемной масс-спектрометрии. Предел количественного обнаружения составлял 0.05 мг/л.
Фармакокинетическая оценка данных концентрации молока была основана на модельно-независимых методах и содержала PK-параметры для адекватного описания профиля абсорбции, распределения и элиминации активного вещества в молоке.
Обобщенные результаты, полученные из обработанных четвертей вымени приведены в следующей таблице. Лизобактин не был обнаружен в контрольных образцах (необработанные четверти вымени).
Значения приведены как 1) среднее геометрическое, 2) срединное значение
Кривая зависимости концентрации от времени лизобактина показана на Фиг. 5.
Пример 8: in vivo данные для лизобактина самого по себе для крупного рогатого скота - модель заражения вымени кормящих коров с S. aureus
Пятнадцать здоровых кормящих молочных коров экспериментально инфицировали патогенном, вызывающим мастит Staphylococcus aureus во всех четырех четвертях вымени. Как только в четверти вымени были выявлены клинические симптомы мастита, такие как отек, боль, аномальная консистенция молока, ее обрабатывали либо мазью лизобактина на основе парафина при двух различных концентрациях, либо Ubrolexin® (цефалексин + канамицин, Boehringer Ingelheim), либо физиологическим раствором в качестве отрицательного контроля. Обработки были рандомизированно назначены для 42 четвертей вымени в общей сложности, либо 50 мг лизобактина на четверть (для 11 четвертей), либо 150 мг лизобактина (для 11 четвертей), либо Ubrolexin® (для 9 четвертей), либо физиологический раствор (для 11 четвертей). Только четверти вымени, которые были бактериологически положительными в отношении заражающего организма непосредственно перед лечением (n = 42) подлежали оценке микробиологического и клинического лечения. Больные четверти обрабатывались этими интрамаммарными составами два раза с интервалом в 24 часа между ними. Вымя клинически исследовали, и образцы молока брали до обработки и несколько раз после нее, вплоть до трех недель после второго введения. Молоко оценивали визуально на отклонения в его консистенции, и образцы оценивали на присутствии заражающего организма и на количество соматических клеток для подтверждения диагноза мастит. Больные четверти вымени рассматривали как микробиологически излеченные, когда Staphylococcus aureus, обнаруженные в образцах молока незадолго до обработки, не могли быть выделены из образца молока, взятого в течение периода времени между третьим и двадцать первым днем после второго введения. Клиническое излечение достигалось, когда локальные симптомы мастита полностью исчезали, и истощение количества соматических клеток (SCC) в качестве параметра воспаления вымени достигалось, когда все количества оставались ниже 500.000 клеток на мл молока в указанный выше период.
Показатель эффективности микробиологического лечения на день 3 и день 21 после второй обработки составлял 73% и 27% для 50 мг лизобактина, 73% и 45% для 150 мг лизобактина, 78% и 44% для Ubrolexin®, и 0% и 0% для физиологического раствора, соответственно. Локальная частота клинического лечения на день 3 и день 21 после второй обработки составляла 45% и 73% для 50 мг лизобактина, 37% и 82% для 150 мг лизобактина, 33% и 67% для Ubrolexin®, и 55% и 73% для физиологического раствора, соответственно. Степень истощения SCC на день 3 и день 21 после второй обработки составлял 36% и 45% для 50 мг лизобактина, 36% и 91% для 150 мг лизобактина, 56% и 67% для Ubrolexin®, и 36% и 27% для физиологического раствора, соответственно.
Можно сделать заключение, что 150 мг лизобактина показывают подобную или даже более высокую эффективность по сравнению с положительным контролем продуктом Ubrolexin® и более высокую, чем у 50 мг лизобактина и физиологического раствора с точки зрения параметров микробиологического и клинического излечения и истощения SCC.
Пример 9: in vivo данные для лизобактина самого по себе для крупного рогатого скота - модель заражения вымени кормящих коров с S. uberis
Семьдесят две здоровых кормящих молочных коров экспериментально инфицировали патогенном, вызывающим мастит Streptococcus uberis в две четверти вымени на корову. Как только в четверти вымени были выявлены клинические симптомы мастита (например, повышенная температура, опухание, покраснение, боль, аномальная консистенция молока), ее обрабатывали либо мазью лизобактина на основе парафина при двух различных концентрациях, либо Ubrolexin® (цефалексин + канамицин, Boehringer Ingelheim).
Обработки были рандомизированно назначены для 41 (клинические) или 37 (микробиологические) четвертей вымени, либо 50 мг лизобактина на четверть (для 15/13 четвертей), либо 150 мг лизобактина (для 15/14 четвертей), либо Ubrolexin® (для 11/10 четвертей) в качестве положительного контроля. Больные четверти обрабатывались этими интрамаммарными составами два раза с интервалом в 24 часа между ними. Вымя клинически исследовали, и образцы молока брали до обработки и несколько раз после нее, вплоть до трех недель после второго введения. Молоко оценивали визуально на отклонения в его консистенции, и образцы оценивали на присутствии заражающего организма и на количество соматических клеток для подтверждения диагноза мастит. Больные четверти вымени рассматривали как микробиологически излеченные, когда Streptococcus uberis, обнаруженные в образцах молока незадолго до обработки, не могли быть выделены из образца молока, взятого в течение периода времени между седьмым и двадцать первым днем после второй обработки. Клиническое излечение достигалось, когда локальные симптомы мастита полностью исчезали или имели намного более легкую природу.
Показатель эффективности микробиологического лечения на день 7 и день 21 после второй обработки составлял 84.6% и 92.31% для 50 мг лизобактина, 71.4% и 85.71% для 150 мг лизобактина, и 30% и 30% для Ubrolexin®, соответственно. Локальная частота клинического лечения на день 7 после второй обработки составлял 86.7% как для 50 мг лизобактина, так и для 150 мг лизобактина, и 36.4% для Ubrolexin®, соответственно.
Можно сделать заключение, что лизобактин при концентрации 50 и 150 мг очевидно намного более эффективен по сравнению с положительным контролем Ubrolexin® с точки зрения основных параметров микробиологического и клинического излечения.
Пример 10: In vitro кинетика уничтожения комбинаций лизобактина с неомицином для патогенов мастита
Чтобы оценить синергетическую активность лизобактина и неомицина в приобретенном в магазине молоке полной жирности in vitro, колбы, содержащие различные концентрации лизобактина и неомицина, либо самих по себе, либо в комбинации, инокулировали с 1-2×106 колониеобразующих единиц/мл соответствующего штамма Staphyloccus aureus, Streptococcus uberis или E. coli.
Колбы инкубировали в течение 24-48 часов на водяной бане при встряхивании при 35 +/- 2°C, и количество жизнеспособных бактерий в каждой колбе определяли в несколько моментов времени путем разведения и высевания образцов на чашки с агаром.
Снижение количества жизнеспособных бактерий, достигаемое комбинацией, по сравнению с наиболее активным отдельным соединением по меньшей мере на 99% через 24 часа, определяется как синергетическая активность (NCCLS/CLSI M26-A Vol.19, No.18).
Кинетика уничтожения лизобактина и неомицина, либо самих по себе, либо в комбинации, против Staphylococcus aureus ATCC 29740 в молоке, была определена для соотношений концентраций лизобактин:неомицин, равных 1:1 (2 мкг/мл каждого) и 2:1 (2 мкг/мл лизобактина и 1 мкг/мл неомицина).
Результаты приведены на ФИГ. 6.
Через 24 часа наблюдается синергетическая активность комбинаций лизобактин: неомицин. Синергизм чрезвычайно заметен при соотношениях по меньшей мере 2:1, особенно при соотношении 1:1.
Кинетика уничтожения лизобактина и неомицина, либо самих по себе, либо в комбинации, против Streptococcus uberis ATCC 27958, в молоке была определена для соотношений концентраций лизобактин:неомицин, равных 1:1 (16 мкг/мл каждый) и 2:1 (16 мкг/мл лизобактина и 8 мкг/мл неомицина).
Результаты также приведены на ФИГ. 6.
Через 24 часа синергетическая активность комбинаций лизобактин:неомицин может наблюдаться для обоих соотношений.
Кинетика уничтожения лизобактина и неомицина, либо самих по себе, либо в комбинации, против Staphylococcus aureus ATCC 29740, в молоке была определена для соотношений концентраций лизобактин:неомицин, равных 1:5 (1 мкг/мл лизобактина плюс 5 мкг/мл неомицина и 1.5 мкг/мл лизобактина плюс 7.5 мкг/мл неомицина, соответственно).
Результаты приведены на ФИГ. 7.
Через 24 часа синергетическая активность может наблюдаться. Синергизм чрезвычайно заметен уже при соотношениях лизобактин: неомицин, по меньшей мере, 1: 5 (то есть 0,2). Указанный синергизм не зависит от абсолютного количества использованных лизобактина и неомицина, о чем свидетельствует ФИГ. 7.
Кинетика уничтожения лизобактина и неомицина, либо самих по себе, либо в комбинации, против Streptococcus uberis ATCC 27958, в молоке была определена для соотношений концентраций лизобактин:неомицин, равных 1:10 (1 мкг/мл лизобактина плюс 10 мкг/мл неомицина и 2 мкг/мл лизобактина плюс 20 мкг/мл неомицина, соответственно).
Результаты также приведены на ФИГ. 7.
Через 24 часа синергетическая активность может наблюдаться. При соотношении лизобактин:неомицин, равном 1:10 (0.1), синергизм является весьма очевидным с точки зрения абсолютного количества лизобактина и неомицина.
Взятые вместе, синергетическая активность комбинации лизобактин: неомицин может быть показана. Указанная синергетическая активность была очень заметна при соотношениях в интервале от 2:1 до 1:5 (0,2) и от 2:1 до 1:10 (0,1) для Staphylococcus aureus ATCC 29740 и Streptococcus uberis ATCC 27958 соответственно.
Кинетика уничтожения лизобактина и неомицина, либо самих по себе, либо в комбинации, против E. coli P4:O32 в молоке была определена для соотношения концентрации лизобактин:неомицин, равного 4:1 (256 мкг/мл лизобактина и 32 мкг/мл неомицина).
Результаты приведены на ФИГ. 8.
Хотя неомицин, а также комбинация лизобактин:неомицин смогли были способны снижать количество бактериальных клеток ниже предела обнаружения через 8 ч, комбинация показала более быстрое начало уничтожения.
Кроме того, комбинация существенно предотвратила повторный рост бактерий через 24 часа, чего не могут достичь соответствующие активные вещества сами по себе.
Поэтому, синергическая активность наблюдалась в настоящей заявке и в отношении грамотрицательных бактерий E. coli.
Пример 11: In vitro кинетика уничтожения комбинаций лизобактина либо с неомицином, либо с канамицином для Staphylococcus aureus ATCC 29740
Чтобы выяснить, относится ли вышеупомянутый синергизм к большему количеству аминогликозидных антибиотиков, помимо неомицина в комбинации с лизобактином, была также протестирована кинетика уничтожения канамицина как партнера по комбинации.
Кинетика уничтожения была проведена, как описано в примере 10.
Кинетика уничтожения лизобактина либо с неомицином, либо с канамицином против Staphylococcus aureus ATCC 29740 в молоке, была определена для соотношения концентрации лизобактин:неомицин или лизобактин:канамицин, равного 1:4 (0.5 мкг/мл лизобактина плюс 2 мкг/мл неомицина или канамицина; 1 мкг/мл лизобактина плюс 4 мкг/мл неомицина или канамицина и 2 мкг/мл лизобактина плюс 8 мкг/мл неомицина или канамицина, соответственно).
Результаты приведены на ФИГ. 9.
Для всех оцененных концентраций комбинация лизобактин:канамицин показала подобную активность по сравнению с комбинаций лизобактин:неомицин.
Из этого можно сделать вывод, что комбинация лизобактина с аминогликозидными антибиотиками сама по себе обеспечивает неожиданный синергизм.
Сравнительный Пример 12: In vitro кинетика уничтожения комбинаций лизобактина с флорфениколом для Staphylococcus aureus ATCC 29740 и Streptococcus uberis ATCC 27958
Синергетическая активность двух разных антибиотиков не является достоверно предсказуемой, как показано ниже.
Например, комбинация лизобактина с флорфениколом не выявила синергетической активности ни для Staphylococcus aureus ATCC 29740, ни для Streptococcus uberis ATCC 27958 в молоке в условиях теста, как показано на ФИГ. 10.
Пример 13: Эффективность комбинации лизобактина и неомицина трисульфата на точной мышиной модели мастита с S. aureus
Эффективность лизобактина и неомицина трисульфата, либо самих по себе, либо в комбинации, протестировали Staphylococcus aureus точной мышиной модели мастита, как установлено University of Sherbrooke, Canada (Brouillette et al, Vet. Microbiol. (2004) 4:253-262), как описано в примере 5. Образцы получили в парафине.
Результаты показаны на ФИГ. 11.
Интрамаммарное внедрение 50 мкг лизобактин, 1600 мкг неомицина трисульфата и комбинации 50 мкг лизобактина плюс 1600 мкг неомицина трисульфата уменьшает среднее содержание КЛЕ на около 2.7, 2.5 и 5.9 log10, соответственно.
Пример 14: Эффективность комбинации лизобактина с неомицина трисульфатом на точной мышиной модели мастита с S. uberis
Двадцать три лактирующих CD-1 мыши были экспериментально инфицированы через 10-15 дней после рождения потомства возбудителем мастита Streptococcus uberis (ATCC 27958) на левой и правой четверти молочных железах.
Через четыре часа после заражения животных обрабатывали интрамаммарно тестируемыми веществами. Исследование включало четыре группы лечения с четырьмя мышами в каждой и контрольную группу с семью мышами.
Мыши групп лечения получали композиции в парафине лизобактина при 15 мкг/железа или неомицина трисульфата при 1600 мкг/ железа, или две комбинации обоих с лизобактином при 15 мкг плюс неомицина трисульфатом при 800 мкг или 1600 мкг на железу.
Через восемнадцать часов после заражения мышей убивали и молочные железы удаляли, а КОЕ бактерий оценивали микробиологически.
Результаты показаны на ФИГ. 12.
Контрольная группа, получавшая парафин в качестве плацебо, находилась в ожидаемом диапазоне с КОЕ около 7 log10/г ткани. Интрамаммарное введение 15 мкг лизобактина, 1600 мкг неомицина трисульфата и комбинированных 15 мкг лизобактина плюс 1600 мкг неомицина трисульфата снижает среднее содержание КОЕ на около 2.6, 1.5 и 3.8 log10, соответственно.
Можно сделать вывод, что комбинация лизобактин/неомицина трисульфат, дозированная в дозе 15/1600 мкг/железа, превосходила по своей эффективности против S. uberis ATCC27958, по сравнению с ее отдельными компонентами в той же дозе.
Пример 15: in vivo данные для лизобактина и неомицина трисульфата у крупного рогатого скота - модель инфицирования вымени молочных желез с S. aureus
Пятнадцать здоровых лактирующих молочных коров были экспериментально заражены возбудителем мастита Staphylococcus aureus во всех четырех четвертях вымени. Как только четверть вымени показала клинические симптомы мастита, такие как отек, боль, аномальная консистенция молока, ее обрабатывали либо суспензией на основе лизобактин и миглиола при дозе 50 мг, либо суспензией на основе неомицина трисульфа и миглиола в дозе 400 мг или комбинацией обоих, т.е. 50 мг лизобактина и 400 мг неомицина трисульфата.
Кроме того, четвертая группа четвертей вымени получила миглиол в качестве отрицательного контроля. Обработка была случайным образом распределена на 60 четвертей вымени в общем. Только четверти вымени, которые были бактериологически положительными для заражающего организма непосредственно перед лечением (n = 49), имели право на оценку микробиологического и клинического излечения. Пораженные четверти обрабатывали этими интрамаммарными составами два раза с интервалом 24 часа между ними. Вымя были клинически исследованы, и образцы молока были взяты до лечения, и несколько раз после него, до тех пор, пока через три недели после второго введения исследователи уже не могли определить лечение.
Молоко проверяли визуально на предмет отклонений в его консистенции, и образцы оценивали на наличие заражающего организма и количество соматических клеток для подтверждения диагноза мастит. Заболевшие четверти вымени считались микробиологически излеченными, когда Staphylococcus aureus, обнаруженный в образцах молока незадолго до лечения, не мог быть выделен из образца молока, взятого в период между третьим и двадцать первым днями после второй обработки. Клиническое излечение было достигнуто, когда местные симптомы мастита полностью исчезли, и излечение на основании количества соматических клеток (SCC) в качестве параметра воспаления вымени было достигнуто, когда все показатели оставались ниже 200 000 клеток на мл молока в указанный период времени.
Микробиологический показатель эффективности излечения на день 3 и день 21 после второй обработки составлял 71% и 14% для лизобактина 50 мг, 100% и 42% для неомицина трисульфата 400 мг, 69% и 54% для комбинации лизобактина 50 мг плюс неомицина трисульфата 400 мг, и 10% и 30% для отрицательного контроля миглиола, соответственно.
Локальный клинический показатель эффективности излечения на день 3 и день 21 после второй обработки составлял 71% и 71% для лизобактина 50 мг, 67% и 100% для неомицина трисульфата 400 мг, 77% и 85% для комбинации лизобактина 50 мг плюс неомицина трисульфата 400 мг, и 80% и 70% для отрицательного контроля миглиола, соответственно.
SCC показатель излечения на день 3 и день 21 после второй обработки составлял 35% и 36% для лизобактина 50 мг, 17% и 50% для неомицина трисульфата 400 мг, 46% и 69% для комбинации лизобактина 50 мг плюс неомицина трисульфата 400 мг, и 30% и 30% для отрицательного контроля миглиола, соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИЗОБАКТИН ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ КОРОВЬЕГО МАСТИТА | 2016 |
|
RU2741764C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МИКРОБНЫХ ИНФЕКЦИЙ, В ТОМ ЧИСЛЕ МАСТИТА | 2014 |
|
RU2662300C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ МАСТИТОВ | 2013 |
|
RU2659430C2 |
| Способ снижения частоты возникновения маститов у продуктивных сельскохозяйственных животных молочного направления за счет применения биотехнологических методов | 2022 |
|
RU2835531C2 |
| Способ получения суспоэмульсии примицина | 1989 |
|
SU1837870A3 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ МАСТИТА У КОРОВ В ПЕРИОД ЛАКТАЦИИ | 2010 |
|
RU2432943C1 |
| КОМПОЗИЦИИ И СПОСОБ КОНТРОЛЯ ИНФЕКЦИЙ У МЛЕКОПИТАЮЩИХ, НЕ ОТНОСЯЩИХСЯ К ЧЕЛОВЕКУ, С ПРИМЕНЕНИЕМ БЕЛКОВ ОСТРОЙ ФАЗЫ | 2014 |
|
RU2725841C2 |
| Препарат для лечения мастита у коров в период лактации | 2019 |
|
RU2698820C1 |
| Препарат для лечения мастита у коров в период лактации | 2024 |
|
RU2827450C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННЫХ МАСТИТОВ И ЭНДОМЕТРИТОВ КОРОВ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2024 |
|
RU2840041C1 |
Группа изобретений относится к фармацевтической промышленности, а именно к применению лизобактина в фармацевтической композиции для лечения коровьего мастита. Применение комбинации лизобактина и по меньшей мере одного аминогликозидного антибиотика, выбранного из списка, состоящего из канамицина и неомицина, для лечения мастита у коров и где отношение лизобактина к аминогликозидному антибиотику составляет от 0,1 до 8. Фармацевтическая композиция для лечения коровьего мастита приготовлена для интрамаммарного введения в коровьи молочные железы. Вышеописанное решение позволяет эффективно лечить мастит у коров. 2 н. и. 8 з.п. ф-лы, 12 ил., 4 табл., 15 пр.
1. Применение комбинации лизобактина и по меньшей мере одного аминогликозидного антибиотика, выбранного из списка, состоящего из канамицина и неомицина, для лечения у млекопитающего животного, не относящегося к человеку, заболевания, вызванного грамотрицательными и/или грамположительными бактериями, где млекопитающее животное, не относящееся к человеку, представляет собой корову, и заболевание представляет собой коровий мастит и где отношение лизобактина к аминогликозидному антибиотику составляет от 0,1 до 8.
2. Применение комбинации для лечения по п. 1, где комбинацию вводят интрамаммарно.
3. Применение комбинации для лечения по п. 1, где коровий мастит представляет собой клинически подтвержденный коровий мастит.
4. Применение комбинации для лечения по п. 1, где коровий мастит представляет собой субклинический коровий мастит.
5. Применение комбинации для лечения по п. 2, где лизобактин обеспечивают в дозе от 25 до 1000 мг на четверть вымени.
6. Применение комбинации для лечения по любому из пп. 1-5, где коровий мастит вызван бактериями Staphylococcus, бактериями Streptococcus, бактериями Trueperella, бактериями Corynebacterium и/или бактериями Escherichia.
7. Применение комбинации для лечения по п. 6, где коровий мастит вызван Staphylococcus aureus, коагулазонегативным стафилококком, Streptococcus uberis, Streptococcus dysgalacticae, Streptococcus agalacticae и/или бактериями E. coli.
8. Применение комбинации для лечения по п. 6, где коровий мастит вызван Trueperella pyogenes и/или бактериями E. coli.
9. Применение комбинации для лечения по п. 6, где коровий мастит вызван Corynebacterium bovis и/или бактериями E. coli.
10. Фармацевтическая композиция для лечения коровьего мастита, приготовленная для интрамаммарного введения в коровьи молочные железы, характеризующаяся тем, что она содержит лизобактин и по меньшей мере один аминогликозидный антибиотик, выбранный из списка, состоящего из канамицина и неомицина; где отношение лизобактина к аминогликозидному антибиотику составляет от 0,1 до 8.
| J.P | |||
| GANIÈRE ET AL, "Synergistic interactions between cefalexin and kanamycin in Mueller-Hinton broth medium and in milk", JOURNAL OF APPLIED MICROBIOLOGY., GB, 2009, vol | |||
| Счетный сектор | 1919 |
|
SU107A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 2006264358 A1, 23.11.2006 | |||
| ПРОТИВОИНФЕКЦИОННЫЕ КОМПОЗИЦИИ В ВИДЕ ГИДРОГЕЛЯ | 2005 |
|
RU2379025C2 |
Авторы
Даты
2021-11-22—Публикация
2018-02-14—Подача